Область техники, к которой относится изобретение
Настоящее изобретение относится к применению гормона D (витамина D) и его производных для лечения и профилактики рака.
Уровень техники
Поскольку старение снижает способность кожи человека вырабатывать витамин D, те, кто не получает достаточного количества витамина D в результате воздействия на кожу солнечного света окружающей среды, должны получать этот важный гормон из своего рациона (MacLaughlin & Holick, 1985).
Существует, по меньшей мере, восемь стадий, на которых ферментам, активирующим витамин D, требуется магний. Если поступающий с пищей магний истощается, то необходима добавка, поскольку магний регулирует уровни витамина D и кальция (Rosanoff et al., 2016). Хуже того, дефицит магния может лишить организм способности использовать витамин D. Вот почему настоятельно рекомендуется принимать добавки магния при приеме витамина D. Люди, принимающие магний и витамин K2 с витамином D3, как правило, имеют более высокий уровень витамина D, чем те, кто принимает только высокие дозы витамина D. Витамин K2 и витамин D3 действуют синергетически (Ballegooijen et al., 2017). Как магний и его соли, так и витамин К2 и витамин D3 уравновешивают уровень кальция в крови.
Обе дозы, как витамина К2, так и магния, при необходимости в качестве эталона применяют 100 мкг (мкг) витамина К2, а также 420 и 320 мг для мужчин и женщин, соответственно, обе ежедневно, могут считаться адекватными.
Птичий 1α,25(OH)2D3 (вероятно, 1β,25(OH)2D3) клонировали, и было показано, что он представляет собой члена семейства ядерных трансактивирующих рецепторов, которое включает эстроген, прогестерон, глюкокортикоид, тирозин (T3), альдостерон и рецепторы ретиноевой кислоты. Биологически активная форма 1β,25(OH)2D3 принадлежит к семейству стероидных гормонов со сходными механизмами действия. Согласно рекомендациям IUPAC (Nomenclature of vitamin D. Pure &ApplChem 54, 8: 1511-16, 1982) применение форм, подобных 1,25-(OH)2D3, настоятельно не рекомендуется.
В 1650 году Фрэнсис Глиссон опубликовал первый официальный медицинский трактат о рахите. Глиссон заявил, что он изучал рахит в течение пяти лет, и что это была «...абсолютно новая болезнь, которая никогда не описывалась ни древними, ни современными авторами в их практических книгах о детских болезнях, дошедших до наших дней. Но об этой болезни впервые стало известно около 30 лет тому назад в местностях Дорсет и Сомерсет» (Glisson, 1650).
Однако врач Арнольд де Бут опубликовал весьма заслуживающую одобрения работу о рахите в 1649 году. Де Бут родился в Горкуме в Нидерландах в 1604 году. Около 1630 года он отправился в Лондон, чтобы заниматься медициной, и в 1636 году поселился в Дублине (de Boot, 1649).
В 1822 г. Снядецкий сообщил о связи рахита с недостатком солнечного света (Sniadecki, 1840). МакКоллум и его коллеги опубликовали в 1922 году, что фактор, который они назвали витамином D, излечивает рахит, хотя неправильно был назван витамином, потому что он представляет собой гормон, как мы говорили ранее (McCollum et al., 1922).
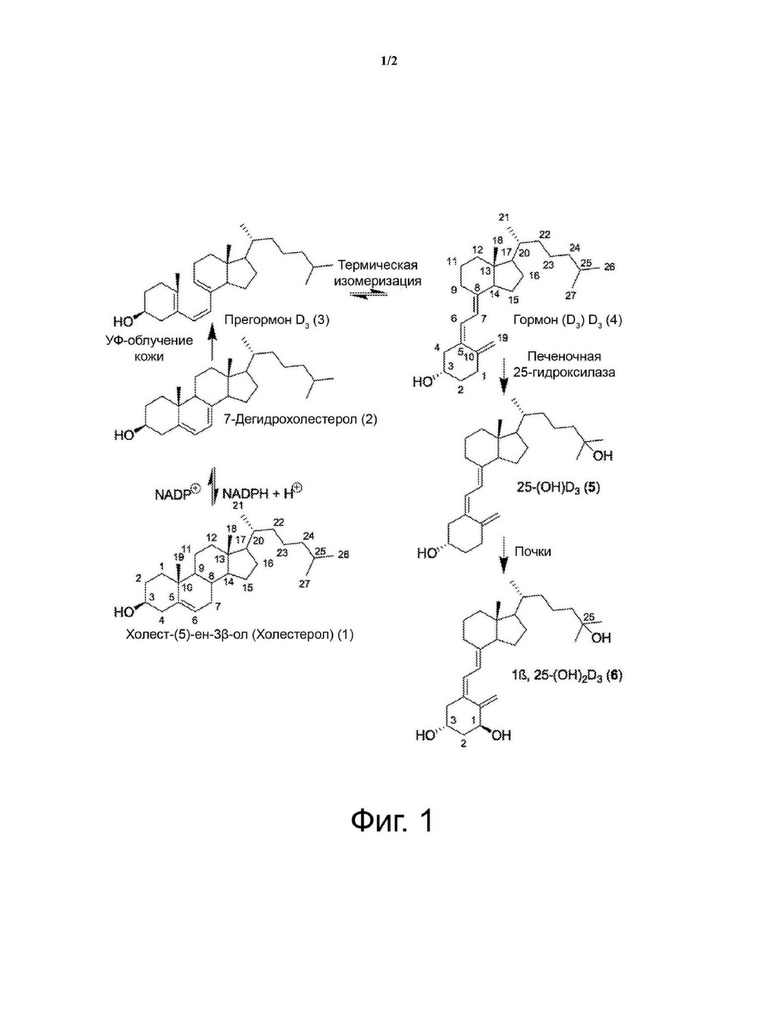
Мияура и коллеги сообщили в 1981 г., что 1α,25-дигидроксивитамин D3 [1α,25(OH)2D3] (вероятно, 1β) индуцирует дифференцировку HL-60 в клетки, подобные макрофагам и моноцитам (Miyaura, 1981). Однако, как показано на фиг. 1, конфигурация гидроксила в положении С-1 биологически активного метаболита витамина D3 представляет собой β, будучи α-гидроксилом в положении С-3 вследствие термической изомеризации, часто встречающейся в химии и биохимии стероидных соединений. Многие исследователи применяли модификации тривиальных названий, пытаясь показать взаимосвязь между соединениями. Согласно IUPAC, если не указано иное, то конфигурация 3-гидроксильной группы остается неизменной по сравнению с 3β-гидроксильной группой исходного тетрациклического стероида. Мы сообщили о кислотной эпимеризации 20-кетопрегнангликозидов, хотя и в другом положении (García, 2011). Для IUPAC основная путаница в применении правил стероидов к производным витамина D заключается в том, что описание «α» и «β» применимо только тогда, когда кольцо А ориентировано, как в исходном стероиде. Может быть, нам нужна актуализация некоторых правил.
Обзор литературы показывает, что витамин D3 играет центральную роль в наших фундаментальных и популяционных исследованиях в поисках панацеи от всех болезней человека, включая рак, однако как подчеркнуто в отчете о справочном потреблении диетического питания Института медицины Национальной академии наук (Dietary Reference Intakes for Calcium and Vitamin D, 2011 (Справочное потребление кальция и витамина D, 2011 г.) достаточные доказательства полезной роли существуют только для здоровья скелета и предупреждения остеопороза. Что касается перспектив лечения заболеваний, не относящихся к скелету, в том числе рака, сердечно-сосудистых заболеваний, диабета и аутоиммунных расстройств, то доказательства были непоследовательными, неубедительными в отношении причинно-следственной связи и недостаточными для отражения в национальных требованиях (Albanes, 2015).
Пять исследований сывороточного 25(OH)D3 в связи с риском колоректального рака были обнаружены в обзоре по результатам метаанализа путем поиска по базе данных PubMed, проведенного за период с января 1966 года по декабрь 2005 года. Все исследования представляли собой вложенные исследования случай-контроль, за которыми наблюдали в течение 2-25 лет на предмет заболеваемости. Уровень 25(OH)D3 в сыворотке ≥ 33 нг/мл (85 нмоль/л) был связан с 50% заболеваемостью колоректальным раком по сравнению с <12 нг/мл (Gorham et al., 2007).
В исследовании Women's Health Initiative (WHI) Wactawski-Wande и коллеги не обнаружили существенного взаимодействия между риском развития колоректального рака и приемом 1000 мг элементарного кальция в виде карбоната кальция и 400 МЕ витамина D3 в среднем в течение семи лет наблюдения, вероятно, из-за низкой дозы (Wactawski-Wende et al. 2006).
В 2008 году Международное агентство по изучению рака рассмотрело связь между сывороточным 25(OH)D3 и риском развития колоректального рака, рака молочной железы и предстательной железы, а также колоректальных аденом. На основании полученных результатов были получены доказательства повышенного риска развития колоректального рака и колоректальной аденомы при низком уровне 25-гидроксивитамина D3 в сыворотке, в то время как доказательства рака молочной железы были ограничены, а доказательства рака простаты не были получены (International Agency for research on Cancer, 2008).
Когортное исследование случай-контроль, проведенное среди финских курильщиков-мужчин, показало, что концентрация 25(OH)D3 >65,5 нмоль/л (>25,2 нг/мл) была связана со значительным 3-кратным увеличением риска рака поджелудочной железы по сравнению с концентрациями <32,0 нмоль/л (<12,4 нг/мл). Авторы сообщили, что эти данные отражают северную широту Финляндии с меньшим воздействием солнечных УФ В-фотонов и меньшим биосинтезом витамина D3 в коже. Приблизительно 40% контролей в исследовании находились в диапазоне недостаточности 25(OH)D3 (Stolzenberg-Solomon et al., 2006).
В крупном рандомизированном многоцентровом исследовании, проведенном в когорте скрининговых исследований простаты, легких, толстой кишки и яичников среди мужчин и женщин в американской популяции, авторы не наблюдали снижения риска между преддиагностическими концентрациями 25(OH)D3 и риском рака поджелудочной железы. Кроме того, сообщалось, что самый высокий квинтиль статуса 25(OH)D3 был связан с незначительным увеличением риска рака поджелудочной железы на 45% по сравнению с более низкими уровнями 25(OH)D3. Диапазон концентраций 25(OH)D3 в случаях составлял от 13,2 до 135,5 нмоль/л, в контроле – от 16,2 до 126,0 нмоль/л. В моделях совместных эффектов у субъектов с более низкими концентрациями 25(OH)D3 была положительная связь с раком поджелудочной железы, тогда как среди субъектов с умеренным или высоким воздействием UBV в местах проживания концентрации 25(OH)D3 не были связаны с раком поджелудочной железы (Stolzenberg-Solomon et al., 2009).
В объединенном проекте по редким видам рака Ассоциации исследователей витамина D не нашли доказательств связи между статусом витамина D3, измеряемым по концентрации 25-гидроксивитамина D3 (25(OH)D3) в сыворотке крови, и снижением риска менее распространенных видов рака, включая рак эндометрия, пищевода, рак желудка, почек, яичников и поджелудочной железы и неходжкинская лимфома. Кроме того, сообщалось о повышенном риске рака поджелудочной железы при уровнях в сыворотке ≥40 нг/мл (≥100 нмоль/л). Сниженный риск развития рака верхних отделов желудочно-кишечного тракта также наблюдали среди лиц азиатского происхождения с низким уровнем 25(OH)D3 (Helzlsouer, 2010).
Значительная обратная связь между уровнем витамина D3 в плазме до диагностики и колоректальным раком у женщин была зарегистрирована в ходе последующего наблюдения в течение 16 лет. Самое сильное снижение заболеваемости колоректальным раком и смертности от колоректального рака наблюдали при уровнях 25(OH)D3 выше 29 нг/мл. Скорректированная модель с несколькими переменными показала, что связь имеет лишь пограничное значение. Однако исходный уровень 25(OH)D3 в плазме был значительно ниже у пациентов с колоректальным раком, чем у контрольной группы (21,9 нг/мл против 23,9 нг/мл). Ограничения этого исследования включают проведение только измерения только 25(OH)D3, а уровни холекальциферола (витамина D3) и 1β,25(OH)2D3, активной формы, не определяли (Chandler et al. 2015).
В большом объединенном анализе мужчин европейского происхождения авторы обнаружили для генетических вариантов витамина D3 прямую связь с агрессивным раком простаты для шести категорий снижения витамина D3 со средней концентрацией 25(OH)D3 в сыворотке 65, 61, 58, 54, 53 и 43 нмоль/л (25,22–16,68 нг/мл), соответственно (Mondul et al., 2016), с 40-50% более высоким риском для самого высокого уровня 25(OH)D3 в сыворотке (Albanes et al., 2011), который оказался выше у мужчин с более высокими концентрациями циркулирующего белка, связывающего витамин D3 (DBP) (Weinstein et al., 2013; Yuan et al., 2018). Когда они изучили додиагностические уровни 25(OH)D3 в сыворотке и выживаемость при раке простаты, они обнаружили, что мужчины с более высоким уровнем 25(OH)D3 в сыворотке реже умирают от рака простаты (Mondul et al., 2016).
В рандомизированном клиническом исследовании сообщалось о пероральном приеме витамина D3 в начальной болюсной дозе 200 000 МЕ с последующим ежемесячным приемом доз 100 000 МЕ или плацебо на срок до 4 лет без приема кальция. Первичный исход рака включал 328 случаев рака (259 инвазивных и 69 злокачественных новообразований in situ, за исключением немеланомного рака кожи) и возник у 105 из 2558 участников (6,5%) в группе витамина D и у 163 из 2550 (6,4%) в группе плацебо. Авторы пришли к выводу, что назначение высоких доз витамина D ежемесячно не может предотвратить рак (Scrogg et al., 2018).
Мэнсон и его коллеги провели рандомизированное плацебо-контролируемое исследование витамина D3 в дозе 2000 МЕ в день и омега-3 жирных кислот в дозе 1 г в день для предупреждения рака и сердечно-сосудистых заболеваний в течение 5 лет. Авторы пришли к выводу, что ежедневный прием высоких доз витамина D в течение 5 лет среди изначально здоровых взрослых людей в Соединенных Штатах не снижает заболеваемость раком или частоту серьезных сердечно-сосудистых событий (инфаркт миокарда, инсульт и смерть от сердечно-сосудистых заболеваний) (Manson et al. 2019).
У людей статус витамина D3 не определяли напрямую, что представляет собой самое большое ограничением этих исследований. Биологически активная форма 1β,25(OH)2D3 (с β-конфигурацией при С-1), а не 1α,25(OH)2D3 (с α-конфигурацией при С-1), служит иммуномодулирующим гормоном и гормоном дифференцировки, помимо его классической роли в минеральном гомеостазе.
Рецептор витамина D3 (VDR) представляет собой член суперсемейства ядерных рецепторов и играет центральную роль в биологическом действии витамина D (Wang et al., 2012a). VDR влияет на транскрипцию почти 1000 генов из-за его присутствия в клетках-мишенях энтероцитов (Boos et al., 2007), остеобластах (Peppel and van Leeuwen, 2014), дистальных и проксимальных клетках почечных канальцев, плотном пятне юкстагломерулярного аппарата гломерулярных париетальных клеток и подоцитах (Wang et al. 2012b). Сообщалось о внутриклеточном распределении рецептора витамина D в головном мозге (Prufer et al., 1999). Существует множество доказательств присутствия этого рецептора в мозге млекопитающих, полученных в исследованиях с применением иммуногистохимии, вестерн-блоттинга или количественного анализа РНК и протеомных методов (Eyles et al., 2005). VDR демонстрирует высокую экспрессию в непаренхиматозных клетках, клетках Купфера, синусоидальных эндотелиальных клетках и, в особенности, в звездчатых клетках печени (Ding et al., 2013), незлокачественной, злокачественной и нормальной ткани щитовидной железы (Clinskspoor et al., 2012; Clinskspoor & Hauben, 2012), в иммунной системе (промиелоциты, В- и Т-лимфоциты), клетках миокарда (Tishop et al., 2008), жировой ткани (для обзора см. в Narvaez CJ et al., 2018), костном мозге (Bellido et al., 1993), клетках гипофиза (Pérez-Fernandez et al., 1997), семенниках человека, простате и в сперматозоидах человека (Corbet et al., 2006). Ядерный рецептор гормона D был обнаружен в тканях паращитовидной железы, поджелудочной железы, гипофиза и плаценты (Pike et al., 1979). мРНК и белок VDR обнаружены в эндометрии, миометрии, яичниках, шейке матки и тканях молочной железы человека (Friedrich et al., 2003; Vienonen et al., 2004). Рецептор гормона D был обнаружен в волосяных фолликулах и кератиноцитах кожи, он регулирует как минимум два центральных процесса в коже: межфолликулярную эпидермальную дифференцировку (IFE) и цикличность волосяных фолликулов (HFC) (Bikle et al., 2015; Bikle, 2015). Гормон D и кальций являются хорошо зарекомендовавшими себя регуляторами пролиферации и дифференцировки кератиноцитов (Bikle, 2015). VDR также экспрессируется в раковых клетках (Norman, 2006; Sandgran et al., 1991; Lorentzon et al., 2000; d’Alesio et al., 2005).
Сообщалось также о VDR в печени (Segura et al., 1999; Garcon Barre et al., 2003), хотя другие группы (Pike et al., 1979; DeLuka et al., 1991) не смогли подтвердить эти сообщения в исследованиях с применением специфических моноклональных антител и других методов. Однако Han и Chiang сообщили об экспрессии белка VDR и мРНК в HepG2 и первичных гепатоцитах человека. Гепатоциты составляют более 90% массы печени (Han and Chiang, 2009). Также сообщалось об индуцированной лигандом внутриклеточной транслокации VDR из цитозоля как в ядро, так и в плазматическую мембрану, где VDR локализовался совместно с белком кавеолином-1. Как и в других тканях и клетках, VDR оказывает как геномное, так и негеномное действие на клетки печени человека. Негеномное действие мембранной передачи сигналов VDR представляет собой очень быстрый ответ (вероятно, за миллисекунды) на клеточные стимулы для активации клеточных сигнальных путей, тогда как геномное действие VDR представляет собой относительно более медленный ответ, от минут до часов, на гормональные лиганды путем димеризации VDR с RXR и рекрутированием коактиваторов и/или корепрессоров на промоторы генов для модуляции скорости транскрипции генов-мишеней (Han et al., 2010; Mizwicki et al., 2009).
Немногочисленные типы клеток или тканей с очень низким уровнем экспрессии VDR или его отсутствием включают фибробласты, клубочковые мезангиальные клетки и юкстагломерулярные клетки (Wang et al., 2012b), интерстициальные сердечные (O'Connel & Simpson, 1996; Fraga et al., 2002), эритроциты, такие как примитивные эритроидные предшественники или эритробласты (Barmincko et al., 2018; Isern et al., 2011), интерстициальные сердечные и скелетные мышцы (Bischoff et al., 2001) и гладкие мышцы (Bouillon et al., 2008; Wang and DeLuka, 2011), а также некоторые высокодифференцированные клетки головного мозга, такие как клетки Пуркинье мозжечка (Eyles et al., 2005).
Существенным открытием стала идентификация во многих типах клеток рецептора гормона D3 как в ядре, так и в кавеолах плазматической мембраны, специализированных субмикроскопических везикулярных органеллах, обогащенных холестерином, гликосфинголипидами, мембранными рецепторами, развившимися в клеточные сигнальные и мембранные переносчики, включая кальциевые насосы, которые в изобилии присутствуют во многих типах клеток позвоночных. Кавеолы были впервые идентифицированы Palade в 1953 году и в настоящее время рассматриваются как клеточные сенсоры, связанные с экспрессией кавеолинов, которые работают вместе с белками оболочки, чтобы регулировать образование кавеол и передачу сигналов, возникающих в кавеолах, к нескольким клеточным адресатам. Однако биофизические характеристики кавеолина, такие как его структура, топология и олигомерное поведение, только начинают прояснять. Сообщалось о связи между дисфункцией кавеол и заболеваниями человека, такими как мышечная дистрофия и рак (Parton, 2013).
Растущее количество наблюдений указывает на роль передачи сигналов 1,25(OH)2D3 в возникновении и прогрессировании рака щитовидной железы, а также на возможность применения структурных аналогов в мультимодальном лечении дедифференцированного йодорезистентного рака щитовидной железы (Clickspoor et al., 2013). Измененная передача сигналов 1,25(OH)2D3-VDR не влияет на нормальное развитие и функцию щитовидной железы, но влияет на функцию с-клеток, по крайней мере, у грызунов.
Рак щитовидной железы – это наиболее распространенное злокачественное новообразование эндокринной системы, составляющее примерно 1% всех новообразований. Среди них дифференцированный рак щитовидной железы (DTC) включает папиллярный (85% случаев) и фолликулярный (10%) подтипы как наиболее часто встречающиеся. Сообщалось о более высоком риске DTC из-за гаплотипов в гене CYP24A1, низких уровнях циркулирующего 1,25(OH)2D3 (дефицит) и пониженной конверсии в 1,25(OH)2D3. Экспрессия VDR, CYP27B1 и CYP24A1 была увеличена при фолликулярной аденоме (FA) и DTC по сравнению с нормальной щитовидной железой, в то время как при папиллярном подтипе (PTC) с метастазами в лимфатические узлы VDR и CYP24A1 были снижены по сравнению с неметастазированным PTC. Кроме того, при анапластическом раке щитовидной железы (ATC) часто отсутствует экспрессия VDR, тогда как экспрессия CYP27B1/CYP24A1 аналогична экспрессии DTC. Авторы пришли к выводу, что наблюдается увеличение факторов, связанных с передачей сигналов 1,25(OH)2D3, как при доброкачественных, так и при дифференцированных злокачественных опухолях щитовидной железы, тогда как при локальном узловом и особенно отдаленном метастазировании было продемонстрировано снижение. Сильная сторона этой работы заключалась в том, что как 25(OH)D3, так и 1,25(OH)2D3 измеряли как у пациентов, так и у контрольной групп (Clinskspoor&Hauben, 2012).
Сходство механизма действия ретиноидов по отношению к стероидным и тиреоидным гормонам было продемонстрировано открытием ядерного рецептора ретиноевой кислоты, который принадлежит к суперсемейству рецепторов стероидных/тиреоидных гормонов (DeLuka, 1991).
Андрогены, которые опосредуют свою функцию, взаимодействуя с внутриклеточным рецептором андрогенов, играют существенную роль во многих физиологических процессах. Рецептор андрогена представляет собой член суперсемейства модификаторов транскрипции, чувствительных к лигандам, которое включает рецепторы стероидных гормонов, такие как рецептор гормона D3, рецептор гормона щитовидной железы и рецептор ретиноевой кислоты. Все они имеют схожую функциональную структуру (Evans, 1988).
Экологические исследования связывают воздействие солнца с меньшей смертностью от рака груди, толстой кишки, простаты и поджелудочной железы, а также от неходжкинской лимфомы (Lorentzon et al., 2000; d'Alesio et al., 2005; Wang et al., 2012; Норман, 2006). Кроме того, экологические исследования показали сниженные показатели смертности от рака и сердечно-сосудистых заболеваний в регионах с большим воздействием солнца, чем в регионах с меньшим воздействием солнца (Institute of Medicine, 2011, Manson et al., 2012). Однако у чернокожих африканского происхождения уровень витамина D3 ниже установленного диапазона для других групп населения, несмотря на то, что у них нет дефицита витамина D3. Поскольку эндогенное производство витамина D3 зависит как от широты, так и от содержания мелатонина, поэтому, когда содержание мелатонина в коже высокое, для биосинтеза витамина D3 необходимы более длительные периоды пребывания на солнце (O’Connor et al., 2013; Giovanucci et al. , 2006). Было показано снижение риска рака среди женщин с нормальным весом и увеличение риска при избыточном весе или ожирении по сравнению в целом с населением, получавшем добавки с гормоном D, кроме того, паратиреоидный гормон (ПТГ), по-видимому, подавляется при сниженных уровнях 25-гидроксигормона D у лиц с ожирением. Шепсес и коллеги показали, что точка почти максимального подавления ПТГ приходится на 21,7 нг/мл и 11,1 нг/мл для населения в целом и женщин с ожирением, соответственно, что могло бы объяснить связанную с ожирением гормональную дисрегуляцию, приводящую к снижению пользы от пищевых добавок.
Аналоги 1β,25(OH)2D3 ингибируют пролиферацию раковых клеток поджелудочной железы, индуцируют дифференцировку и способствуют апоптозу in vitro (Zugmaier et al. 1996; Petterson et al. 2000; Segura et al., 1999; Fraga et al., 2002). Кроме того, на основании результатов рандомизированного клинического исследования эффектов 6-месячного приема добавок кальция (2000 мг/день) и витамина D3 (800 МЕ/день) в течение шести месяцев можно предположить, что кальций и витамин D3 могут усиливать апоптоз в нормальной слизистой оболочке толстой кишки, что было определено по изменениям в молекулярных маркерах апоптоза (Golden et al., 2012). Стероиды обладают противораковым действием за счет индукции апоптоза. В предыдущей работе мы сообщали о цитостатической активности фускастатина, прегнанового стероидного соединения, в отношении клеток меланомы человека SK-MEL-1 (данные не показаны) и клеток человека HL-60. Фускастатин продемонстрировал цитотоксичность в отношении клеток линии HL-60 миелоидного лейкоза человека, что было вызвано индукцией апоптоза, как определено с помощью проточной цитометрии (García et al., 2011). Мы также изучили основные механизмы индукции апоптоза цитостатическим стероидным соединением фускастатином (неопубликованные результаты).
Литохолевая кислота (LCA), высокогидрофобная и токсичная желчная кислота, полученная из хенодезоксихолевой кислоты желчных кислот (CDCA) под действием кишечных бактерий, является эффективным эндогенным лигандом рецептора гормона D (VDR, NR111) (Makishima M, 1996) и рецептора прегнана X (NR 112) (Standinger et al., 2001).
Раскрытие изобретения
Цель настоящего изобретения заключается в предложении применять соединение D3; и/или его производные 25-(OH)D3 и 1β,25-(OH)2D3; в производстве средств для лечения и профилактики рака.
Дополнительная цель настоящего изобретения заключается в предложении применять соединение D2; и/или его производные 25-(OH)D2 и 1β,25-(OH)2D2; в производстве средств для лечения и профилактики рака.
Настоящее изобретение также относится к фармацевтической композиции, включающей синергические количества соединения D3; и/или его производных 25-(OH)D3 и 1β,25-(OH)2D3; и/или соединения D2 и/или его производных 25-(OH)D2 и 1β,25-(OH)2D2; для лечения и предупреждения рака.
Указанная композиция может также включать магний или его соль, или витамин К2, или их обоих.
Рак предпочтительно выбирают из немеланомных раков кожи.
Краткое описание чертежей
Фиг. 1. Биосинтез гормона D3.
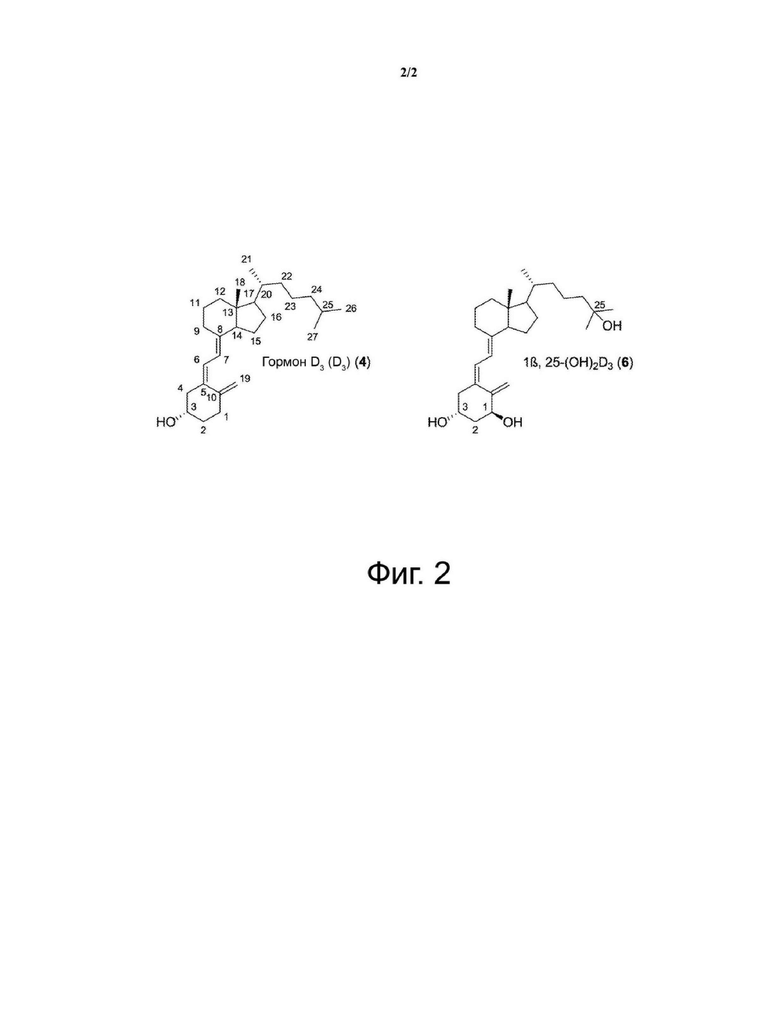
Фиг. 2. Гормон D3 с гидроксильной группой в конфигурации 3α (4, фиг. 1) и его производное 1β,25-дигидрокси-гормон D3 (6, фиг. 1).
Раскрытие изобретения
Терминология витамина D очень запутана и даже неверна. Человек вырабатывает витамин D в коже путем фотосинтеза, при воздействии солнечного света, испускающего ультрафиолетовое излучение в узкой полосе от 290 до 315 нм, из 7-дегидрохолестерина и, следовательно, витамин D представляет собой стероидный гормон, а не истинный витамин. 7-Дегидрохолестерин находится в дермальных фибробластах и эпидермальных кератиноцитах.
Существуют две формы витамина D, витамин D2 и витамин D3, также называемые эргокальциферолом и холекальциферолом, соответственно. Витамин D2 получают в результате облучения эргостерола, который в той или иной степени встречается в планктоне в естественных условиях и для его производства применяют плесень спорынью (которая содержит до 2% эргостерола). Витамин D2 производят путем ультрафиолетового облучения эргостерола из дрожжей и грибков (то есть грибов). Он не содержится в растительном материале (например, в овощах, фруктах и зерновых) и присутствует в небольшом количестве в мясе и других источниках пищи животного происхождения, за исключением редких случаев, таких как жир из печени рыб и токсичный паслен восковолистный (Solanum glaucophyllum). Витамин D3 содержится в жирной рыбе (например, сардине, лососе и скумбрии), яйцах и печени теленка. Под действием фермента семейства цитохрома P450, 25-гидроксилазы (CYP2R1), витамин D3 гидроксилируется в печени до 25-гидроксивитамина D3 (25(OH)D3), также называемого кальцидиолом, основной циркулирующей в крови формы витамина D. Он гидроксилируется до активного метаболита, 1β,25-дигидроксивитамина D3 (1,25(OH)2D3) или кальцитриола в клетках проксимальных канальцев почек. D3 (1,25(OH)2D3) связывается с ядерным рецептором витамина D (VDR) в органах-мишенях, образуя затем гетеродимеры вместе с ретиноидным X-рецептором и рекрутируя другие транскрипционные кофакторы, которые регулируют транскрипцию генов-мишеней, в том числе участвующих в пролиферации клеток, дифференцировки и апоптозе. Наконец, другой фермент, 25-гидроксивитамин D 24-гидроксилаза (CYP24A1), инактивирует как 25(OH)D3), так и (1,25(OH)2D3) соответственно до биологически неактивных метаболитов 24,25(OH)D3 и 24,25(ОН)2D3. Как и другие гормоны, 1β,25-дигидроксивитамин D3 циркулирует в пикограммовых концентрациях, тогда как его предшественник циркулирует в нанограммовых концентрациях. Отчасти это может быть причиной того, что 25(OH)D3, который также более стабилен, чем 1β,25(OH)2D3, в настоящее время применяют для оценки клинического статуса витамина D, хотя 1β,25(OH)2D3 обладает гораздо большей аффинностью для рецептора витамина D и представляет собой более мощную и, вероятно, единственную биологически активную форму витамина D3 (фигура 1).
Мы применяем термин гормон, помимо термина витамин, и термины D3, 25-гидроксиD3 и 1β,25-дигидроксиD3, помимо термина холекальциферол (согласно IUPAC, термин холекальциферол все еще может быть применен, помимо термина кальциол, но не должен применяться для обозначения метаболитов), кальцидиол и кальцитриол, соответственно, потому что гормон D3 имеет широкий спектр функций, связанных не только с метаболизмом кальция, а с такими, как пролиферация, дифференцировка и апоптоз клеток. Стероидные гормоны связываются с высокоаффинным внутриклеточным рецептором (Evans, 1988; Minghetti & Norman, 1988). Биосинтез кальцитриолина приводит к повышению уровня паратиреоидного гормона (ПТГ), который повышается, когда уровни кальция или фосфата в сыворотке ниже.
В соответствии с настоящим изобретением предлагают применять соединение D3; и/или его производные 25-(OH)D3 и 1β,25-(OH)2D3; в производстве средств для лечения и профилактики рака.
В соответствии с настоящим изобретением предлагают применять соединение D2; и/или его производные 25-(OH)D2 и 1β,25-(OH)2D2; в производстве средств для лечения и профилактики рака.
В контексте настоящего изобретения фармацевтическая композиция, включающая синергические количества соединения D3; и/или его производных 25-(OH)D3 и 1β,25-(OH)2D3; и/или соединения D2 и/или его производных 25-(OH)D2 и 1β,25-(OH)2D2, может быть применена для лечения и предупреждения рака.
Фармацевтическая композиция по настоящему изобретению может включать синергические количества соединения D3; и/или его производных 25-(OH)D3 и 1β,25-(OH)2D3; и/или соединения D2 и/или его производных 25-(OH)D2 и 1β,25-(OH)2D2; и магний или его соль.
Фармацевтическая композиция по настоящему изобретению может включать синергические количества соединения D3; и/или его производных 25-(OH)D3 и 1β,25-(OH)2D3; и/или соединения D2 и/или его производных 25-(OH)D2 и 1β,25-(OH)2D2; и витамин K2.
Альтернативно, фармацевтическая композиция по настоящему изобретению может включать синергические количества, по меньшей мере, соединения D3; и/или его производных 25-(OH)D3 и 1β,25-(OH)2D3; и/или соединения D2 и/или его производных 25-(OH)D2 и 1β,25-(OH)2D2; и магний или его соль; и витамин K2.
Рак может представлять собой немеланомный рак кожи.
Пример
Мы лечили двенадцать немеланомных видов рака кожи пероральным приемом гормона D3 (витамина D3) в умеренной суточной дозе 466 МЕ в течение 6–8 месяцев, и все они были полностью разрешены.
References
Albanes D, Mondul AM, Yu K, Parisi D, Horst RL, Virtamo J, Weinstein SJ. Circulating 25-hydroxyvitamin D and prostate cancer risk in a large nest case-control study. Cancer Epidemiol Biomarkers Prev 2011;20:1850-60.
Albanes, D. Vitamin D and cancer: diversity, complexity, and still a way to go. Cancer Prev Res (Phila) 2015;8:657-61.
Ballegooijen AJ, Pilz S, Tomaschitz A, Grübler MR, Verheyen N. The synergistic interplay between vitamins D and K for bone and cardiovascular health: a narrative review. In J Endocrinol vol. 2017, Article ID 7454376, 12 pages, 2017. https://doi.org/10.1155/2017/7454376
Barminko J, Reinholt BM, Emmanuelli A, Lejeuni AN, Baron MH. Activation of the vitamin D receptor transcription factor stimulates the growth of definitive erythroid progenitors. Blood Adv2018;2:1207-19.
Bellido T, Girasole G, Passeri G, Yu XP, Mocharla H, Jilka RL, Notides A, Manolagas SC. Demonstration of estrogen и витамина D receptors in bone marrow-derived stromal cells: up-regulation of the estrogen receptor by1,25-dihydroxyvitamin-D3. Endocrinology 1993;133:553-62.
Bikle DD, Oda Y, Tu CL, Jiang Y. Novel mechanisms for the vitamin D receptor (VDR) in the skin and in skin cancer. J Steroid BiochemMolBiol 2015;148:47:51.
Bikle DD. Vitamin D receptor, a tumor suppressor in skin. Can J PhysiolPharmacol 2015;93:349-51.
Bischoff HA, Borchers M, Gudat F, Duermueller U, Theiler R, Stähelin HB, Dick W. In situ detection of 1,25-dihydroxyvitamin D3 receptor in human skeletal muscle tissue. Histochem J 2001;33:19-24.
Boos A, Riner K, Hässig M, Liesegang A. Immunohistochemical demonstration of vitamin D receptor distribution in goat intestines. Cells Tissues Organs 2007;186:121-128.
Bouillon R, Carmeliet G, Verlinden L, van Etten E, Verstuyf A, Luderer H, Lieben L, Mathieu C, Demay M. Vitamin D and human health: lessons from vitamin D receptor null mice. Endocr Rev 2008;29:726-76.
Chandler PD, Buring JE, Manson JE, Giovannucci EL, Moorthy MV, Zhang S, Lee IM, Lui JH. Circulating vitamin D levels and risk of colorectal cancer in women. Cancer Prev Res 2015;8:675-82.
Clinskspoor I, Gerard A-C, Saude JV, Many M-C, Verlinden L, Bouillon R, Carmeliet G, Mathieu C, Verstuyf A, Decallonne B. The vitamin D receptor thyroid development and function. EurThyroid J 2012;1:168-75.
Clinskspoor I, Hauben E. Altered expression of key players in vitamin D metabolism and signling in malignant and benign thyroid tumors. J HistochemCytochem 2012;60:502-11.
Clinckspoor I, Verlinden L, Mathieu C. Vitamin D in thyroid tumorigenesis and development. ProgHistochemCytochem2013;48:65-98.
Corbett ST, Hill O, Nangia AK. Vitamin D receptor found in human sperm. Urology 2006;68:1345:49.
d’Alesio A, Garabedian M, Sabatier JP, Guadyer-Souquiéres G, Marcelli C, Lemacon A, Walrautr-Debray O, Jehan F. Two single-nucleotide polymorphisms in the human vitamin D receptor prometer change protein DNA complex formation and are associated with high и витамина D status in adolescent girls. Hum Mol Genet 2005;14:3539-48.
de Boot A. Observationesmedicae de affectibus a veteribusomissis. London, 1649
DeLuka LM. Retinoids and their receptors in differentiation, embryogenesis, and neoplasia. FASEB 1991;5:2924-33).
Ding N, Evans RM, Downes M. Hepatic action of vitamin D receptor ligands: a sunshine option for chronic liver disease? Expert Rev ClinPharmacol2013;6(6):597-9.
Evans RM. The steroid and thyroid hormone receptor superfamily. Science 1988;240:889-95.
Friedrich M, Rafi L, Mitschele T, Tilgen W, Schmidt W, Reichrath J. Analysis of the vitamin D system in cervical carcinomas, breast cancer and ovarian cancer. Recent Results. Cancer Res 2003;164:239-246.
Eyles DW, Smith S, Kinobe R, Hewison M, McGrath JJ. Distribution of the vitamin D receptor and 1α-hydroxylase in human brain. J ChemNeuroanat 2005;29:21-30.
Fraga C, Blanco M, Vigo E, Segura C, García-Caballero T, Pérez-Fernández R. Ontogenesis of the vitamin D receptor in rat heart. Histochem Cell Biol 2002;117:547-50.
García VP, Bermejo J, Rubio S, Quintana J, Estévez E. Pregnane steroidal glycosides and their cytostatic activities. Glycobiology 2011;21;619-24.
García VP. Acid epimerization of 20-keto pregnanglycosides is determined by 2D-NMR spectroscopy. J Biomol NMR 2011;50:91-7.
Garcon Barre M, Demers C, Mirshahi A, Néron S, Zaizal S, Nanci A. The normal liver harbours the vitamin D nuclear receptor in nonparenchymal and biliary epithelial cells. Hepatology 2003;37:1034-42.
Giovanucci E, Lyn Y, Rimm EB, Hollis BW, Fuchs CS, Stampfer MJ, Willett WC. Prospective study of predictors of vitamin D status and cancer incidence and mortality in man. J Natl Cancer Inst 2006;98:451-9.
Glisson F. De rachitidesivemorbopuerili, qui vulgó the ricketsdicitur, tractatus. London, 1650.
Golden SH, Brown A, Cauley JA, Chin MH, Gary-Webb TL, Kim C, Sosa JA, Summer AE, Anton B. Health disparities in endocrine disorders: biological, clinical, ad nonclinical factors-an endocrine society scientific statement. J ClinEndocrinolMetab 2012;97:E1579-639.
Gorham ED, Garland CF, Garland FC, Grant WB, Mohr SB, Lipkin M, Newmark HL, Giovannucci E, Wei M, Holick MF. Optimal vitamin D status for colorectal cancer prevention. A quantitative metaanalysis. Am J Prev Med. 2007;32:210-16.
Han S, Chiang JY. Mechanism of vitamin D receptor inhibition of cholesterol 7α-hydroxylase gene transcription in human hepatocytes. Drug MetabDispos 2009;37:469-78.
Han S, Li T, Ellis E, Strom S, Chiang YS 2010. A novel bile acid-activated vitamin D receptor signaling in human hepatocytes. MolEndocrinol24:1151-64.
Helzlsouer KJ. Overview of the Cohort Consortium Vitamin D Pooling Project of Rarer Cancers. Am J Epidemiol 2010;172:4-9.
International Agency for research on Cancer (IARC). Vitamin D and cancer. IARC Working Group Reports Vol 5, International Agency for research on Cancer, Lyon, France, 2008.
Institute of Medicine (IOM). Dietary reference intakes for calcium и витамина D. The National Academic Press, Washington DC: 2011.
Isern J, Fraser ST, Nowotschin S, Ferrer-Vaquer A, Moore R, Hadjantonakis AK, Schulz V, Tuck D, Gallagher PG, Baron MH. Single-lineage transcriptome analysis reveals key regulatory pathways in primitive erythroid progenitors in the mouse embryo. Blood 2011;117:4924-34.
Lorentzon M, Norstrom P. Vitamin D receptor gene polymorphism is associated with bierth, height, growth to adolescence, and adult stature in healthy caucasian men: a cross-sectional and longitudinal study. J ClinEndocrinolMetab 2000;85:1666-70.
MacLaughlin J, Holick M. Aging decreases the capacity of human skin to produce vitamin D3. J Clin Invest 1985;76:1536-8.
McCollum EV, Simmonds N, Becker JE, Shipley PG. An experimental demonstration of the existence of a vitamin which promotes calcium deposition. J ChemBiol1922;53:203-8.
Makishima M, Lu TT, Xie W, Whotfield GK, Domoto H, Evans RM, Hanssler MR, Mangelsdord DJ 2002. Vitamin D receptor as an intestinal bile acid sensor. Science296:1313-16.
Manson JE, Bassuk SS, Lee IM, Cook NR, Albert MA, Gordon D, Azhanis E, Macfadyen JG, Danielson E, Lin J, Zhang SM, Buring JE. The VITamin D and omega-3 trial. (VITAL): rationale and design of a large randomized controlled trial of vitamin D and marine omega-3 fatty acid supplements for the primary prevention of cancer and cardiovascular disease. ComtempClin Trials 2012;33:159-71.
Manson JE, Cook NR, Lee IM, Christen W, Bassuk SS, Mora S, Gibson H, Gordon D, Copeland I, D’Agostino D, Friedenberg G, Ridge C, et al., for the VITAL research group. Vitamin D supplements and prevention of cancer and cardiovascular disease. N Engl J Med 2019;380:33-44.
Minghetti PP, Norman AW. 1,25(OH)2-vitamin D3 receptors: gene regulation and genetic circuitry. FASEB J 1988;2:3043-53.
Miyaura C, Abe E, Kuribayshi T, Tanaka H, Konno K, Nishii Y, Suda T. 1α,25-dihydroxyvitamin D3 induces differentiation of human myeloid leukemia cells. BiochemBiophys Res Commun 1981;102:937-43.
Mizwicki MT, Norman AW 2009. The vitamin D sterol-vitamin D receptor ensemble model offers unique insight into both genomic and rapid response signaling. Sci Signal2:re4.
Mondul AM, Shui IM, Yu K, Travis C, Stevens VL, Campa D, Schumacher FR, Ziegler RG, Bueno-de-Mesquita HB, Berndt S, Cawford ED, Gapstur SM, Gaziano JM, Giovannucci E, Haiman CA, Henderson BE, Hunter DJ, Johansson M, Key TJ, Le Marchand L, Lindströms S, McCullough ML, Navano C, Overvad K, Palli D, Purdue M, Stampfer MJ, Weinstein SJ, Willett WC, Yeager M, Chacnock SJ, Trichopoulos D, Kolonel LN, Kraft P, Albanes D. Genetic variation in the vitamin D pathway in relation to risk of prostate cancer-resultsfrom the Breast and Prostate Cancer Cohort Consortium. Cancer Epidemiol Biomarkers Prev 2013;22:688-96.
Mondul AM, Weinstein SJ, Moy KA, Männistö S, Albanes D. Circulating 25-hydroxyvitamin D and prostate cancer survival. Cancer Epidemiol Biomarkers Prev 2016;25:665-9.
Narvaez CJ, Matthews DG, Welsh J. Vitamin D, vitamin D receptor, and adipose tissue: focus on cellular mechanisms. Vitamin D (fourth edition) 2018:583-596.
Nomenclature of vitamin D. Pure &ApplChem 1982;54,:1511-16.
Norman AW. Minireview: vitamin D receptor: new assignments for an already busy receptor. Endocrinology 2006;147:5542-8.
O’Connell T, Simpson RU. Immunochemical identification of the 1,25-dihydroxyvitamin D3 receptor protein in human heart. Cell Bio Int 1996;20:621-4.
O’Connor MY, Thoreson, Summers AE. The uncertain significance of low vitamin D levels in African descendent populations: a review of the bone and cardiometabolic literature. ProgCardiovasc Dis 2013;56:261-9.
Parton GR, delPozo MA. Caveolae as plasma membrane sensors, protectors and organizers. Nat Rev Mol Cell Biol2013;14:98-112.
Peppel J, Leewen P. Vitamin D gene networks in human osteoblasts. Front Physiol 2014;5:137.
Pérez-Fernández R, Alonso M, Segura C, Muñoz I, García-Caballero T, Diguez C. Vitamin D receptor gene expression in human pituitary gland. Life Sci 1997;60:35-42.
Petterson F, Colston KW, Dalgleish AG. Differential and antagonistic effects of 9-cis-retinoic acid и витамина D analogues on pancreatic cancer cells in vitro. Br J Cancer 2000;83:239-45.
Pike JW, Goozé LL, Haussler MR. Biochemical evidence for 1,25-dihydroxyvitamin D receptor macromolecules in parathyroid, pancreatic pituitary and placental tissues. Life Sci 1979;26:407-14.
Prufer K, Veenstra TD, Jirikowski GF, Kumar R. Distribution of 1,25-dihydroxyvitamin D3 receptor immunoreactivity in the rat brain and spinal cord. J ChemNeuroanat 1999;16:135-45.
Rosanoff A, Dai Q, Shapses SA. Essential Nutrient Interactions: Does Low or Suboptimal Magnesium Status Interact with Vitamin D и/или Calcium Status? Adv Nutr 2016; 7(1): 25–43.
Sandgren ME, Bronnegard M, DeLuka HE. Tissue distribution of the 1,25-dihydroxyvitamin D3 receptor in the male rat. BiochemBiophys Res Comm 1991;181:611-6.
Segura C, Alonso M, Fraga C, García-Caballero T, Diéguez C, Pérez-Fernández R. Vitamin D receptor ontogenesis in ratliver. HistochemCellBiol1999;112:163-7.
Sniadecki J. Dziela, vol 1, 273-274, Warzawa, 1840.
Standinger JL, Goodwin B, Jones SA, Hawkin-Brown D, Mackenzie KI, LaTour A, Liu Y, Klaasen CD, Brown KK, Reinhard J, Willson TM, Koller HB, Kliever SA. The nuclear receptor PXR is a lithocholic acid sensor that protects against live toxicity. Proc Natl AcadSciUSA 2001; 98:3369-74.
Stolzenberg-Solomon RZ, Vieth R, Azad A, Pietinen P, Taylor PR, Virtamo J, Albanes D. A prospective nested case-control study of vitamin D status and pancreatic cancer risk in male smokers. Cancer Res 2006;66:10213-9.
Stolzenberg-Solomon RZ, Hayes RB, Horst RL, Anderson KE, Hollis BW, Silverman DT. Serum vitamin D and risk of pancreatic cancer in the Prostate, Lung, Colorectal, and Ovarian screening trial. Cancer Res 2009;69:1439-47.
Tishkoff DX, Nibbelink KA, Holmberg KH, Dandu L, Simpson RU. Functional vitamin D receptor (VDR) in the T-Tubules of cardiac myocytes: VDR knockout cardiomyocyte contractility. Endocrinology 2008;149:558-564.
Vienonen A, Miettinen S, Bläuer M, Martikainen PM, Tomás E, Heinonen PK, Yikomi T. Expression of nuclear receptors and cofactors in human endometrium and myometrium. J SocGynecolInvestg 2004;11:104-112.
Wactawski-Wende J, Kotchen JM, Anderson GL, Assat AR, Brunner RL, Osullivan MJ, Margolis KL, Ockene JK, Phillips L, Pottern L, Prentice RL, Robbins J, Rohan TE, Sarto GE, Sharma S, Stefanick ML, Van Hom L, Wallace RB, Whitlock E, Basford T, Beresford SA, Blaok HR, Bonds DE, Brzyski RG, Caan B, Chlebouski RT, Cochrane B, Garland C, Gass M, Hays J, Hendrix SL, Howard BV, Hsia J, Hubbel FAS, Jackson RD, Johson KC, Judd H, Kooperberg CL, Kuller HI, Lacroix AZ, Lane DS, Langer RD, Laser NL, Lewis CE, Limacher MC, Manson JE; Women’s Health Initiative Investigators. Calcium plus vitamin D supplementation and the risk of colorectal cancer N Engl J Med 2006;354:684-96.
Wang Y, DeLuka HF. Is the vitamin d receptor found in muscle? Endocrinology 2011;152:354-63.
Wang Y, Zhu J, DeLuca HF. Where is the vitamin D receptor? Arch BiochemBiophys2012a; 523:123-33.
Wang Y, Borchert M, DeLuka FH,. Identification of the vitamin D receptor in various cells of the mouse kidney. Kidney Int 2012b;81:993-1001.
Weinstein SJ, Mondul AM, Kopp W, Rager H, Virtamo J, Albanes D. Circulating 25-hydroxyvitamin D, vitamin D binding protein, and risk of prostate cancer. Int J Cancer 2013;132:2940-7.
Yuan C, Shui IM, Wilson KM, Stamfer MJ, Mucci LA, Giovannucci EL. Circulating 25-hydroxyvitamin D, vitamin D binding protein and risk of advanced and lethal prostate cancer. Int J Cancer 2018; 10.1002/ijc.31966.
Zugmaier D, Jager R, Grage B, Gottardis MM, Havermann K, Knabbe C. Growth-inhibitory effects of vitamin D analogues and retinoids on human pancreatic cancer cells. Br J Cancer 1996;73:1341-6.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЕ БИОМАРКЕРОВ ДЛЯ ОЦЕНКИ ЭФФЕКТИВНОСТИ КОМПОЗИЦИИ В СНИЖЕНИИ ВОЗДЕЙСТВИЯ ПРОТИВОРАКОВЫХ ТЕРАПЕВТИЧЕСКИХ СРЕДСТВ НА КОЖУ | 2020 |
|
RU2836055C1 |
| ПРИМЕНЕНИЕ 2-МЕТИЛЕН-19-НОР-(20S)-1α,25-ДИГИДРОКСИВИТАМИНА D ДЛЯ ЛЕЧЕНИЯ ВТОРИЧНОГО ГИПЕРПАРАТИРЕОЗА | 2013 |
|
RU2666995C2 |
| ПРИМЕНЕНИЕ ЛИПОПОЛИСАХАРИДА ФОТОТРОФНОЙ БАКТЕРИИ RHODOBACTER CAPSULATUS PG В КАЧЕСТВЕ ФАКТОРА, УСИЛИВАЮЩЕГО ДИФФЕРЕНЦИРУЮЩУЮ АКТИВНОСТЬ 1α,25-ДИГИДРОКСИВИТАМИНА D | 2016 |
|
RU2642309C1 |
| Способ получения и определения специфической активности фактора активации макрофагов GcMAF | 2023 |
|
RU2823530C1 |
| СПОСОБ ПРОФИЛАКТИКИ ОБОСТРЕНИЙ РЕЦИДИВИРУЮЩЕГО РИНОСИНУСИТА | 2013 |
|
RU2562537C2 |
| СПОСОБ ЛЕЧЕНИЯ (ТЕРАПИИ) КОМПЕНСИРОВАННОЙ ФОРМЫ НЕСПЕЦИФИЧЕСКОГО ХРОНИЧЕСКОГО ТОНЗИЛЛИТА | 2012 |
|
RU2510749C1 |
| МЕТАДИХОЛ - ЖИДКИЕ И ГЕЛЕВЫЕ НАНОЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ | 2014 |
|
RU2736752C2 |
| СПОСОБ КОМПЛЕКСНОЙ ПАТОГЕНЕТИЧЕСКОЙ ТЕРАПИИ ОСТРЫХ ФОРМ ВИРУСНОГО ГЕПАТИТА В И МИКСТ-ГЕПАТИТОВ (В+С, В+D, В+С+D) | 2010 |
|
RU2440128C1 |
| МЕТАДИХОЛ® - ЖИДКИЕ И ГЕЛЕВЫЕ НАНОЛЕКАРСТВЕННЫЕ ПРЕПАРАТЫ | 2014 |
|
RU2631600C2 |
| ПРОИЗВОДНЫЕ ВИТАМИНА D | 1993 |
|
RU2114825C1 |
Группа изобретений относится к области медицины, а именно к терапии и онкологии, и предназначена для лечения или предупреждения немеланомного рака кожи. Для производства пероральной фармацевтической композиции применяют холекальциферол (соединение D3) и/или его производные. Пероральную фармацевтическую композицию, содержащую синергические количества соединения D3 и/или его производные, применяют для лечения или предупреждения немеланомного рака кожи. Указанная композиция также может содержать витамин K2 и/или магний или его соли. Использование группы изобретений обеспечивает эффективное лечение или предупреждение немеланомного рака кожи. 3 н.п. ф-лы, 2 ил., 1 пр.
1. Применение холекальциферола (соединение D3) и/или его производных: кальцидиола (25-(OH)D3) и кальцитриола (1α,25-(OH)2D3 или 1β,25-(OH)2D3) - в производстве пероральной фармацевтической композиции для лечения и предупреждения рака, где рак представляет собой немеланомный рак кожи.
2. Применение пероральной фармацевтической композиции, содержащей синергические количества соединения D3 и/или его производных: 25-(OH)D3 и 1β,25-(OH)2D3 - для лечения и предупреждения рака, где рак представляет собой немеланомный рак кожи.
3. Применение пероральной фармацевтической композиции, содержащей синергические количества соединения D3 и/или его производных: 25-(OH)D3 и 1β,25-(OH)2D3 - для лечения или предупреждения рака, где указанная фармацевтическая композиция также содержит витамин K2 и/или магний или его соли, где рак представляет собой немеланомный рак кожи.
| US 2009098065 A1, 16.04.2009 | |||
| US 2002128239 A1, 12.09.2002 | |||
| US 2006073107 A1, 06.04.2006 | |||
| WO 2014207317 A1, 31.12.2014 | |||
| Жаропрочная сталь | 1958 |
|
SU115745A1 |
Авторы
Даты
2023-04-17—Публикация
2019-08-22—Подача