Класс каротиноидов содержит в себе более 600 представителей, относится к группе соединений тетратерпенов и тетратерпеноидов - полимеров с низкой степенью полимеризации мономера изопрена. Каротиноиды являются ценными молекулами, выступая в качестве предшественников витамина А1, веществ с антиоксидантными свойствами, красителей от желтого до красного цвета, а также пищевых добавок [1]. В частности, такие востребованные каротиноиды как ликопин, лютеин и астаксантин обладают противоопухолевыми свойствами, ликопин и лютеин предотвращают сердечно-сосудистые заболевания, лютеин предотвращает катаракту и дегенерацию желтого пятна, астаксантин проявляет противовоспалительное действие и сильные антиоксидантные свойства, β-каротин предотвращает куриную слепоту и фиброз печени [2].
Каротиноиды в природе вырабатываются растениями, водорослями, красными дрожжами и фототрофными бактериями. Главный недостаток производства каротиноидов из растительного сырья - это высокая стоимость, географические факторы и сезонная зависимость. В связи с этим существует интерес к производству каротиноидов с использованием микроорганизмов [3].
На фиг. 1 приведена схема синтеза каротиноидов рекомбинантными дрожжами Y. lipolytica. Из приведенной схемы видно, что биосинтез каротиноидов основан на последовательной конденсации пятиуглеродного мономера изопентинилдифосфата (IPP) и его изомера диметилаллилдифосфата (DMAPP) с образованием 10, 15 и 20 углеродных молекул геранилпирофосфата, фарнезилпирофосфата и геранилгеранилпирофосфата, соответственно, посредством двух реакций, катализируемых ферментами фарнезилпирофосфат синтазы и геранилгеранилпирофосфат синтазы. Конденсация двух молекул геранилгеранилпирофосфата с образованием молекулы фитоена катализируется ферментом фитоен синтазой. Далее фитоен превращается в ликопин с помощью дегидрогеназной реакции, осуществляемой ферментом фитоен дегидрогеназы. На последнем этапе синтезируется β-каротин с помощью фермента ликопин β-циклазы [4]. Реакции синтеза фитоена и β-каротина может катализировать один бифункциональный фермент фитоен синтаза/ликопин β-циклаза [5]. Синтез астаксантина осуществляется из β-каротина путем введения кето-групп с помощью фермента β-каротин кетолазы и гидрокси-групп с помощью фермента β-каротин-3-гидроксилазы [6] либо посредством окисления β-каротина ферментом астаксантин синтазой, работающим в сопряженной реакции с цитохром Р450 редуктазой [7].
Разработаны подходы для конструирования рекомбинантных штаммов бактерий Escherichia coli, дрожжей Saccharomyces cerevisiae и Yarrowia lipolytica, способных накапливать каротиноиды [8, 9, 10]. Путем усиления синтеза молекул IPP и DMAPP, а также гетерологичной экспрессии генов crtB, crtI и crtY Erwinia herbicola, кодирующих фитоен синтазу, фитоен дегидрогеназу и ликопин β-циклазу, соответственно, сконструирован рекомбинантный штамм Е. coli, продуцирующий 256,8 мг/л β-каротина при культивировании в колбах и 3,2 г/л при ферментации в оптимальных условиях в биореакторе [8]. P. Coussement с соавторами получили штамм бактерий Е. coli, продуцирующий 448 мг/г сухого ликопина используя комбинаторные инженерные подходы для сборки хорошо охарактеризованных и готовых к использованию генетических частей, таких как промотеры, терминаторы и гены crtE, кодирующую геранилгеранилдифосфат синтазу, crtI и crtB Erwinia herbicola [11].
Рекомбинантные дрожжи S. cerevisiae, характеризующиеся продукцией β-каротина 772,8 мг/л при ферментации в биореакторе, получены путем гетерологичной экспрессии генов crtYB, crtI, и crtE Xanthophyllomyces dendrorhous, кодирующих фитоен синтазу, фитоен дегидрогеназу и ликопин β-циклазу, соответственно, совместно с повышением пула цитоплазматического ацетил-КоА и усилением синтеза молекул IPP и DMAPP [12]. Разработаны рекомбинантные дрожжи S. cerevisiae, способные накапливать 217,9 мг/л и 13,8 мг/г сухого веса астаксантина в условиях культивирования в 5 литровом ферментере [13]. Такой уровень продукции был достигнут благодаря введению в рекомбинантный штамм дрожжей, несущий гены crtE, crtI crtYB, BTS1 ERG20, tHMGR1, гена CrtW Brevundimonas vesicularis, кодирующего β-каротин кетолазу, гена CrtZ Agrobacterium aurantiacum, кодирующего β-каротин-3-гидроксилазу, и мутагенезу гена CSS1, кодирующего секретируемый белок CSS1.
Многокопийная интеграция генов CarRP и CarB Mucor circinelloides, кодирующих бифункциональный фермент фитоен синтазу/ликопин β-циклазу (carRP) и фитоен дегидрогеназу (carB), в геном дрожжей Y. lipolytica, повышение экспрессии нативного гена GGS1 Y. lipolytica, кодирующего геранилгеранилпирофосфат синтазу и усиление мевалонатного пути позволили достичь продукции β-каротина рекомбинантными дрожжами Y. lipolytica, равной 408,0 мг/л при культивировании в колбах и 4,5 г/л при ферментации в 5-литровом биореакторе с непрерывной подачей глюкозы в качестве источника углерода [4]. В работе [6] в рекомбинантный штамм дрожжей Y. lipolytica, несущий одну дополнительную копию нативного HMGR1, гены crtE, crtYB и crtI X. dendrorhous и скваленсинтазу SQS1 с подавленной активностью за счет укорочения нативного промотора до 50 пар оснований, введены гены GGPPs7 Synechococcus sp., кодирующего фермент геранилгеранилпирофосфат синтазу, HpBKT Н. pluvialis, кодирующего фермент β-каротин кетолазу и HpcrtZ Н. pluvialis, кодирующего фермент β-каротин-3-гидроксилазу, что позволило получить 6 мг/г сухого веса и 285 мг/л астаксантина в биореакторе.
В настоящее время остается актуальной задачей создание рекомбинантных микроорганизмов с повышенным уровнем биосинтеза каротиноидов.
Краткое описание изобретения
Технической задачей, на решение которой направлено представленное изобретение является расширение арсенала микроорганизмов, продуцирующих каротиноиды.
Техническим результатом заявляемого изобретения является полинуклеотид, кодирующий полипептид, обладающий активностью фитоен синтазы и геранилгеранилпирофосфат синтазы, имеющий нуклеотидную последовательность, приведенную в перечне последовательностей под номером SEQ ID NO: 1, или последовательность, обладающую, по меньшей мере, 70% гомологией к ней, при условии сохранения указанной активности. Кодируемый полипептид может быть получен в результате объединения бифункционального фермента фитоен синтазы/ликопин β-циклазы carRP Mucor circinelloides и геранилгеранилпирофосфат синтазы GGPPs7 Synechococcus sp, связанных расположенным между ними глицин-сериновым мотивом. Заявляемый полинуклеотид при интегрировании в штамм-реципиент дрожжей Yarrowia lipolytica приводит к увеличению продукции каротиноидов.
Техническим результатом заявляемого изобретения является также полинуклеотид, кодирующий полипептид, обладающий активностью фитоен синтазы и геранилгеранилпирофосфат синтазы, имеющий нуклеотидную последовательность, приведенную в перечне последовательностей под номером SEQ ID NO: 1, или последовательность, обладающую, по меньшей мере, 70% гомологией к ней, при условии сохранения указанной активности. Кодируемый полипептид может быть получен в результате объединения бифункционального фермента фитоен синтазы/ликопин β-циклазы carRP Mucor circinelloides и модифицированного варианта фарнезилпирофосфатсинтазы ERG20F88C Yarrowia lipolytica, обладающего геранилгеранилпирофосфатсинтазной активностью, связанных расположенным между ними глицин-сериновым мотивом. Заявляемый полинуклеотид при интегрировании в штамм-реципиент дрожжей Y. lipolytica приводит к увеличению продукции каротиноидов.
Техническим результатом заявляемого изобретения является также способ получения трансформанта дрожжей Yarrowia lipolytica, продуцирующего (3-каротин, включающий введение в штамм-реципиент, относящийся к линии штамма дрожжей Yarrowia lipolytica W29, гена CarB Mucor circinelloides, кодирующего фитоендегидрогеназу, гена CarRP Mucor circinelloides, кодирующего бифункциональный фермент фитоен синтазу/ликопин β-циклазу, гена HMGR1 Yarrowia lipolytica, кодирующего фермент 3-гидрокси-3-метилглютарил-кофермент А редуктазу, гена ERG20 Yarrowia lipolytica, кодирующего фарнезилпирофосфатсинтазу, гена ERG12 Yarrowia lipolytica, кодирующего мевалонаткиназу, а также полинуклеотида, с нуклеотидной последовательностью SEQ ID NO: 1 и/или полинуклеотида с нуклеотидной последовательностью SEQ ID NO: 2.
Здесь и далее под «нуклеотидной последовательность SEQ ID NO: 1 или SEQ ID NO: 2» понимается как непосредственно сама последовательность, приведенная в перечне последовательностей под этим номером, так и любая нуклеотидная последовательность, обладающая, по меньшей мере, 70% гомологией к данной последовательности и кодирующая полипептид, обладающий активностью фитоен синтазы и геранилгеранилпирофосфат синтазы.
Техническим результатом заявляемого изобретения является также способ получения трансформанта дрожжей Yarrowia lipolytica, продуцирующего кантаксантин, включающий введение в штамм-реципиент, относящийся к линии штамма дрожжей Yarrowia lipolytica W29, гена CarB Mucor circinelloides, кодирующего фитоендегидрогеназу, гена CarRP Mucor circinelloides, кодирующего бифункциональный фермент фитоен синтазу/ликопин β-циклазу, гена HMGR1 Yarrowia. lipolytica, кодирующего фермент 3-гидрокси-3-метилглютарил-кофермент А редуктазу, гена ERG20 Yarrowia lipolytica, кодирующего фарнезилпирофосфатсинтазу, гена ERG 12 Yarrowia lipolytica, кодирующего мевалонаткиназу, гена HpBKT Haematococcus pluvialis, кодирующего бета-каротин кетолазу, а также полинуклеотида, с нуклеотидной последовательностью SEQ ID NO: 1 и/или полинуклеотида с нуклеотидной последовательностью SEQ ID NO: 2.
Техническим результатом заявляемого изобретения является также способ получения трансформанта дрожжей Yarrowia lipolytica, продуцирующего астаксантин, включающий введение в штамм-реципиент, относящийся к линии штамма дрожжей Yarrowia lipolytica W29, гена CarB Mucor circinelloides, кодирующего фитоендегидрогеназу, гена CarRP Mucor circinelloides, кодирующего бифункциональный фермент фитоен синтазу/ликопин β-циклазу, гена HMGR1 Yarrowia lipolytica, кодирующего фермент 3-гидрокси-3-метилглютарил-кофермент А редуктазу, гена ERG20 Yarrowia lipolytica, кодирующего фарнезилпирофосфатсинтазу, гена ERG 12 Yarrowia lipolytica, кодирующего мевалонаткиназу, гена HpBKT Haematococcus pluvialis, кодирующего бета-каротин кетолазу, гена HpCrtZ Haematococcus pluvialis, кодирующего бета-каротин гидроксилазу, а также полинуклеотида, с нуклеотидной последовательностью SEQ ID NO: 1 и/или полинуклеотида с нуклеотидной последовательностью SEQ ID NO: 2.
Техническим результатом заявляемого изобретения является также трансформант дрожжей Yarrowia lipolytica, продуцирующий каротиноид β-каротин, содержащий в составе хромосомы, по крайней мере, по одной копии каждого из следующих генов, ген CarB М. circinelloides, кодирующий фитоендегидрогеназу, ген CarRP М. circinelloides, кодирующий бифункциональный фермент фитоен синтазу/ликопин β-циклазу, ген HMGR1 Y. lipolytica, кодирующий фермент 3-гидрокси-3-метилглютарил-кофермент А редуктазу, ген ERG20 Y. lipolytica, кодирующий фарнезилпирофосфатсинтазу, ген ERG 12 Y. lipolytica, кодирующий мевалонаткиназу, а также полинуклеотид, с нуклеотидной последовательностью SEQ ID NO: 1 и/или полинуклеотид с нуклеотидной последовательностью SEQ ID NO: 2.
Техническим результатом заявляемого изобретения является также трансформант дрожжей Y. lipolytica, продуцирующий каротиноид кантаксантин, содержащий в составе хромосомы, по крайней мере, по одной копии каждого из следующих генов, ген CarB М. circinelloides, кодирующий фитоендегидрогеназу, ген CarRP М. circinelloides, кодирующий бифункциональный фермент фитоен синтазу/ликопин β-циклазу, ген HMGR1 Y. lipolytica, кодирующий фермент 3-гидрокси-3-метилглютарил-кофермент А редуктазу, ген ERG20 Y. lipolytica, кодирующий фарнезилпирофосфатсинтазу, ген ERG12 Y. lipolytica, кодирующий мевалонаткиназу, ген HpBKT Haematococcus pluvialis, кодирующий β-каротин кетолазу, а также полинуклеотид, с нуклеотидной последовательностью SEQ ID NO: 1 и/или полинуклеотид с нуклеотидной последовательностью SEQ ID NO: 2.
Техническим результатом заявляемого изобретения является также трансформант дрожжей Y. lipolytica, продуцирующий каротиноид астаксантин, содержащий в составе хромосомы, по крайней мере, по одной копии каждого из следующих генов, ген CarB М. circinelloides, кодирующий фитоендегидрогеназу, ген CarRP М. circinelloides, кодирующий бифункциональный фермент фитоен синтазу/ликопин β-циклазу, ген HMGR1 Y. lipolytica, кодирующий фермент 3-гидрокси-3-метилглютарил-кофермент А редуктазу, ген ERG20 Y. lipolytica, кодирующий фарнезилпирофосфатсинтазу, ген ERG12 Y. lipolytica, кодирующий мевалонаткиназу, полинуклеотид, с нуклеотидной последовательностью SEQ ID NO: 1 и/или полинуклеотид с нуклеотидной последовательностью SEQ ID NO: 2, ген HpBKT Haematococcuspluvialis, кодирующий β-каротин кетолазу, ген HpcrtZ Haematococcus pluvialis, кодирующий β-каротин-3-гидроксилазу
Техническим результатом заявляемого изобретения является также рекомбинантный штамм дрожжей Y. lipolytica ВКПМ Y-4950 - продуцент β-каротина.
Техническим результатом заявляемого изобретения является также рекомбинантный штамм дрожжей Y. lipolytica ВКПМ Y-4871 - продуцент астаксантина
Полинуклеотид с нуклеотидной последовательностью, приведенной в перечне последовательностей под номером SEQ ID NO: 1, получают путем
- синтеза последовательностей генов CarRP М. circinelloides и GGPPs7 Synechococcus sp,;
- амплификации двух фрагментов с полученных последовательностей по праймерам, содержащим в своей последовательности глицин-сериновый мотив,
- и лигировании двух полученных фрагментов в единую последовательность.
Полинуклеотид с нуклеотидной последовательностью, приведенной в перечне последовательностей под номером SEQ ID NO: 2, получают путем
- синтеза последовательности гена CarRP М. circinelloides,
- амплификации фрагмента с полученной последовательности по праймерам, содержащим в своей последовательности глицин-сериновый мотив,
- амплификации фрагмента ERG20(F88C) с геномной ДНК штамма дрожжей Y. lipolytica линии W29 с помощью двух пар праймеров, содержащих в своей последовательности глицин-сериновый мотив,
- и лигировании двух полученных фрагментов в единую последовательность.
Конструирование экспрессионных кассет при получении трансформанта дрожжей осуществляют стандартными методами генетической инженерии [14] с использованием генетических элементов, подходящих для работы с дрожжами рода Yarrowia. В качестве промоторов могут быть использованы АСС1, ACL2, DGA1, GAPDH, GAPDHin, GPAT, GPD1, GPM1, ЕХР1, EYD1, EYK1, FBA1, FBAlin, FASα, FASβ, HP4D, ICL1, IDH2, IDP2, ILV5, LEU2, LEUm, POT1, POX2, POX4, RPS7, TDH1, TEF1, TEFin, XPR2, YAT1, ZWF [15, 16, 17, 18, 19, 20].
В качестве терминаторов транскрипции могут быть использованы Асо3, CYC1, Guo, LIP1, LIP2, РЕХ3, РЕХ16, РЕХ20, PHO5, TEF1, Tsynth2, Tsynth7, Tsynth8, Tsynth10, Tsynth22, Tsynth27, Tsynth30, XPR2 [20, 21, 22, 23].
Введение генов может быть осуществлено как хромосомальной, так и эписомальной интеграцией, в качестве сайтов для гомологичной интеграции могут быть использованы последовательности, гомологичные участкам хромосомы дрожжей рода Yarrowia. В целях повышения эффективности экспрессии мРНК с интегрированных последовательностей при трансляции предпочтительно использовать гетерологичные гены, кодон-оптимизированные для дрожжей Y. lipolytica.
Трансформацию экспрессионной кассеты в клетки дрожжей Y. lipolytica осуществляют любым подходящим способом, в частности, методом электоропорации [24] или методом с использованием ацетата лития [25].
Краткое описание рисунков:
фиг. 1 Схема синтеза каротиноидов рекомбинантными дрожжами Y. lipolytica
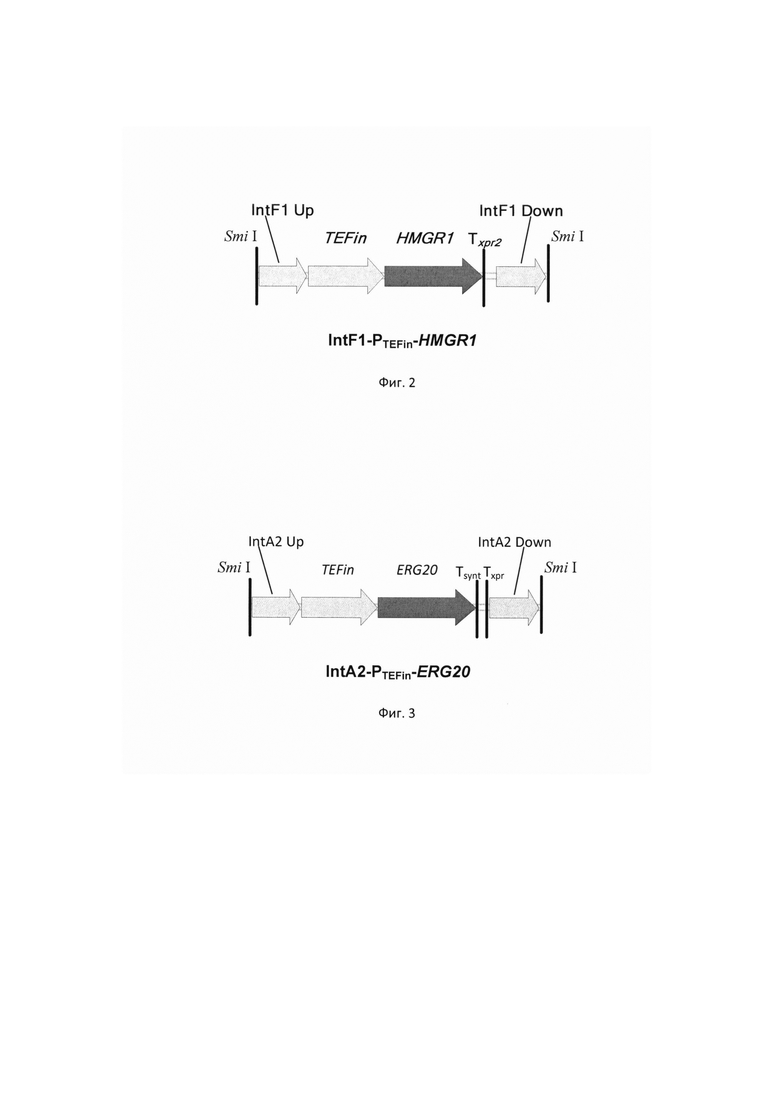
фиг. 2 Схема экспрессионной кассеты IntF1-PTEFin-HMGR1
фиг. 3 Схема экспрессионной кассеты IntA2-PTEFin-ERG20
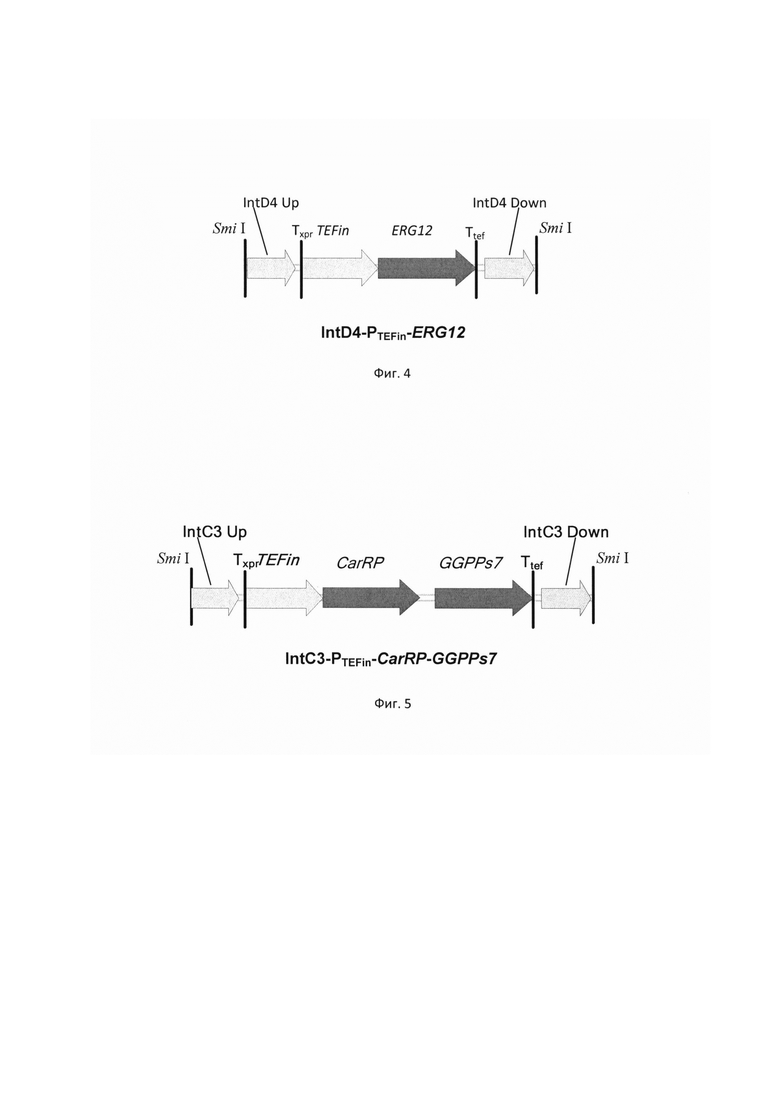
фиг. 4 Схема экспрессионной кассеты IntD4-PTEFin-ERG12
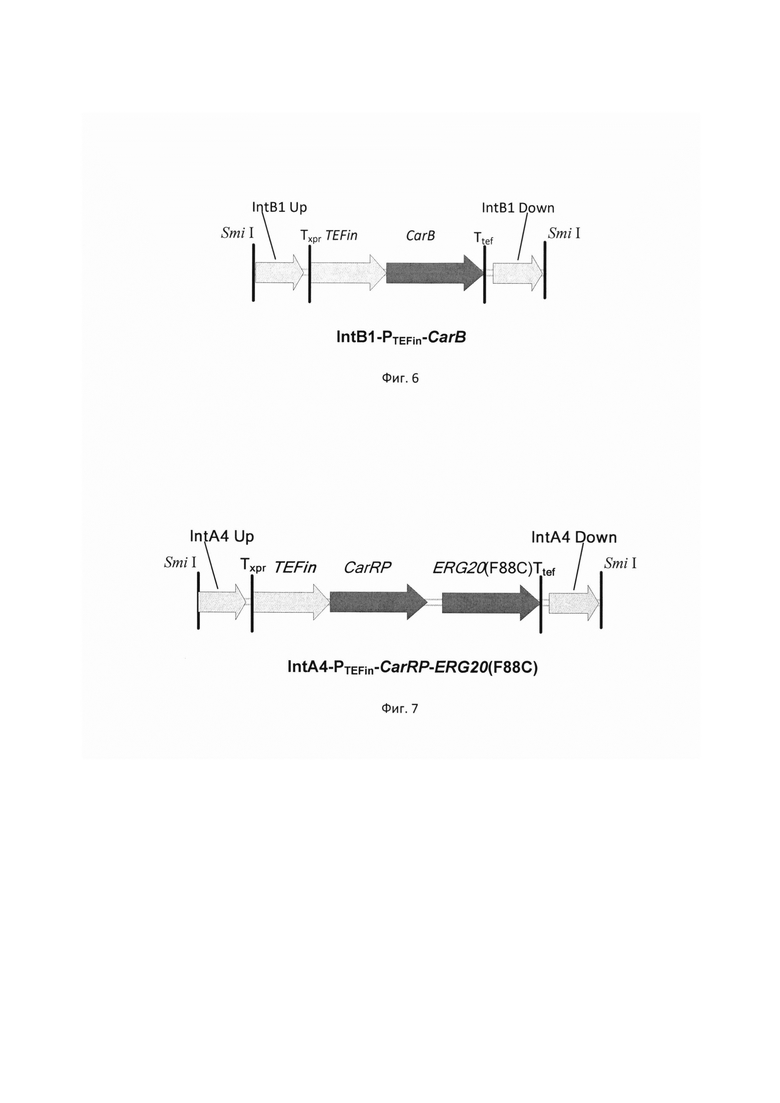
фиг. 5 Схема экспрессионной кассеты IntC3-PTEFin-CarRP-GGPPs7
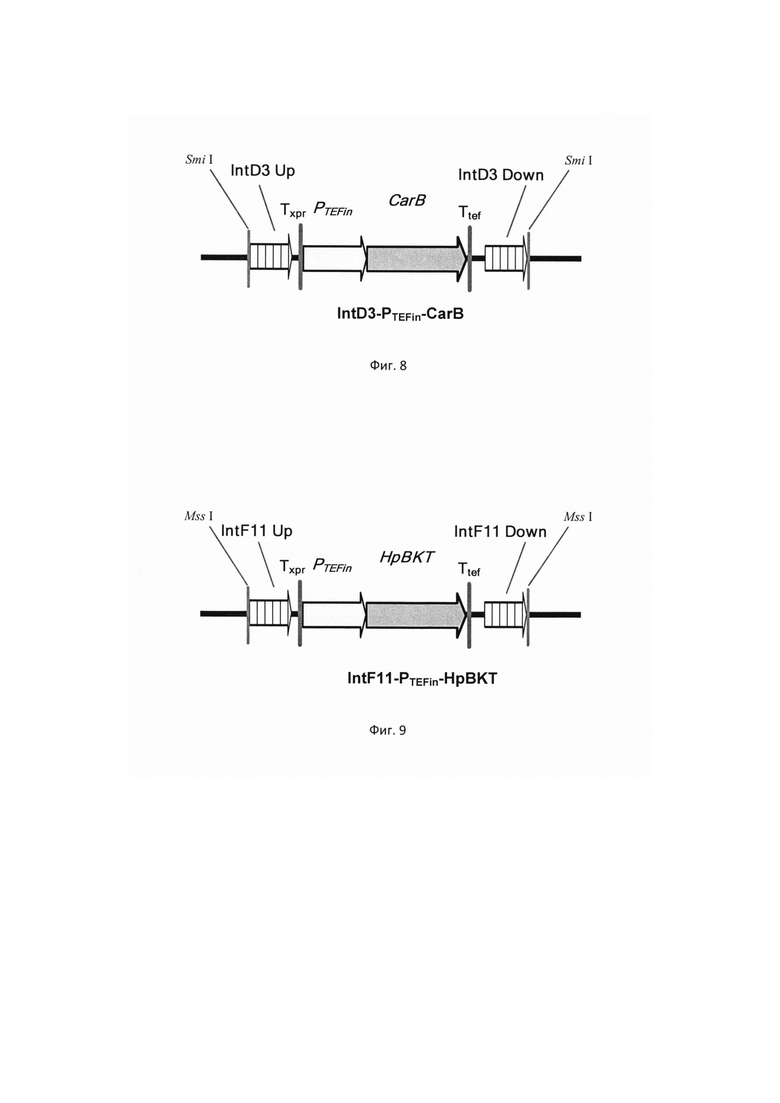
фиг. 6 Схема экспрессионной кассеты IntB1-PTEFin-CarB
фиг. 7 Схема экспрессионной кассеты IntA4-PTEFin-CarRP-ERG20(F88C)
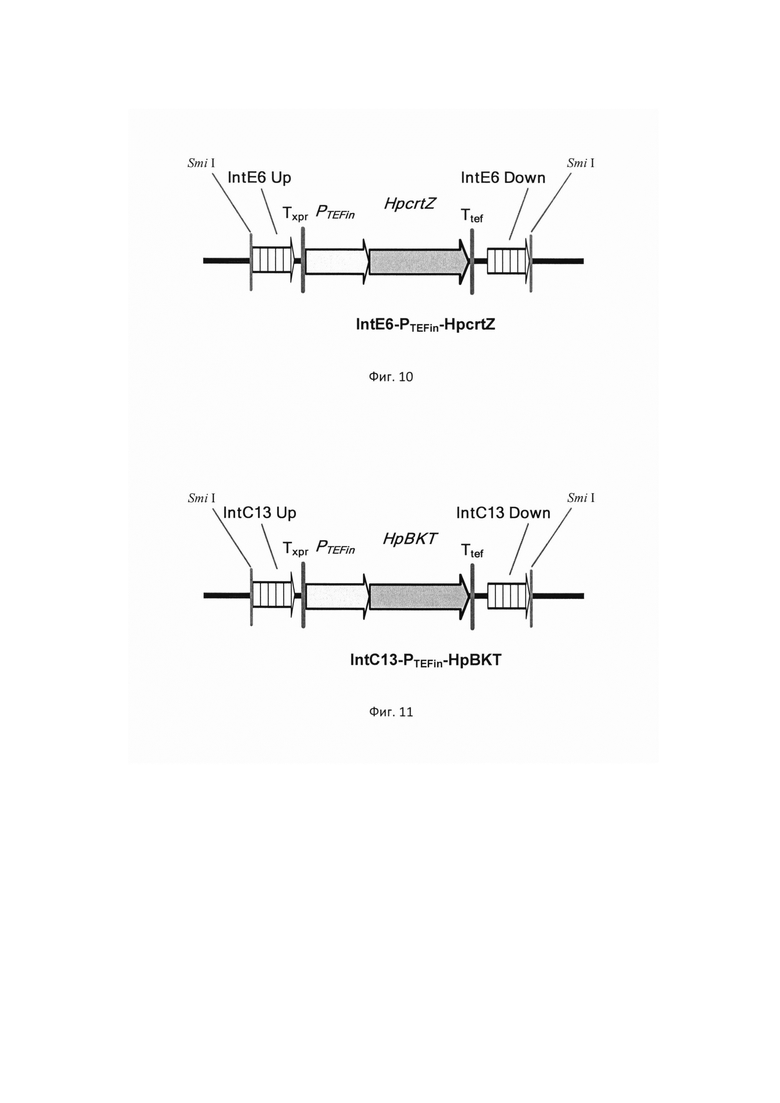
фиг. 8 Схема экспрессионной кассеты IntD3-PTEFin-CarB
фиг. 9 Схема экспрессионной кассеты IntF11-PTEFin-HpBKT
фиг. 10 Схема экспрессионной кассеты IntE6-PTEFin-HpcrtZ
фиг. 11 Схема экспрессионной кассеты IntC13-PTEFin-HpBKT
фиг. 12 Схема экспрессионной кассеты IntC14-PTEFin-HpBKT
фиг. 13 Схема экспрессионной кассеты IntB11-PTEFin-HpcrtZ
фиг. 14 Схема экспрессионной кассеты IntE12-PTEFin-HpcrtZ
Пример 1 Получение полинуклеотида с последовательностью SEQ ID NO: 1
Гены CarRP М. circinelloides и GGPPs7 Synechococcus sp. кодон-оптимизируют для Y. lipolytica. Здесь и далее все гетерологичные гены кодон-оптимизируют для Y. lipolytica с помощью онлайн программы GenSmart™ (https://www.genscript.com/gensmart-free-gene-codon-optimization.html) и синтезируют в виде фрагментов ДНК (синтез осуществлен компанией «Twist Bioscience Corporation» (США).
Нуклеотидные последовательности генов CarRP М. circinelloides и GGPPs7 Synechococcus sp. кодон-оптимизированных для Y. lipolytica приведены в [26 и 6], соответственно.
Фрагмент CarRP амплифицируют по праймерам с синтезированного фрагмента гена CarRP:
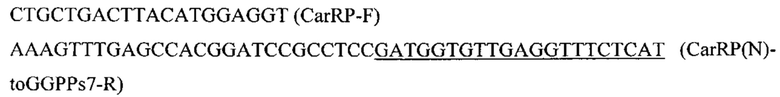
Фрагмент GGPPs7 амплифицируют по праймерам с синтезированного фрагмента гена GGPPs7:

По методу Гибсона [27] ПЦР-фрагменты CarRP и GGPPs7 собирают и получают нуклеотидную последовательность, которая приведена в перечне последовательностей под номером SEQ ID NO: 1. Полученный полинуклеотид кодирует полипептид, полученный в результате объединения бифункционального фермента фитоен синтазы/ликопин β-циклазы carRP М. circinelloides и геранилгеранилпирофосфат синтазы GGPPs7 Synechococcus sp, связанных расположенным между ними глицин-сериновым мотивом (GSsh).
Пример 2 Получение полинуклеотида с последовательностью SEQ ID NO: 2
Фрагмента гена CarRP синтезируют по примеру 1. Фрагмент CarRP амплифицируют с синтезированного фрагмента гена CarRP с помощью праймеров:
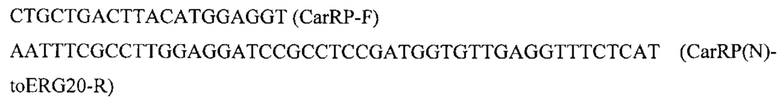
Для получения ERG20(F88C) амплифицируют два фрагмента гена ERG20 (ERG20-1 и ERG20-2) с геномной ДНК штамма Y. lipolytica W29 (ВКПМ Y-3178) с помощью пар праймеров:
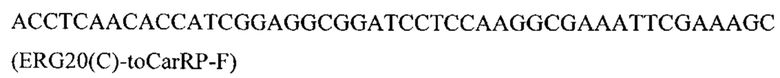
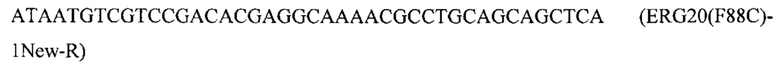
и
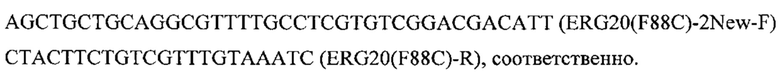
По методу Гибсона ПЦР-фрагменты CarRP и ERG20-1 и ERG20-2 собирают с получением нуклеотидной последовательности, которая приведена в перечне последовательностей под номером SEQ ID NO: 2. Данная нуклеотидная последовательность кодирует полипептид, полученный в результате объединения бифункционального фермента фитоен синтазы/ликопин β-циклазы carRP М. circinelloides и мутантного варианта фарнезилпирофосфат синтазы ERG20(F88C) Y. lipolytica, связанных расположенным между ними глицин-сериновым мотивом (GSsh).
Пример 3 Получение трансформанта, продуцирующего β-каротин
Получение трансформанта осуществляют путем поэтапного направленного введения генетических модификаций.
3.1 Интеграция гена Y. lipolytica HMGR1, кодирующего фермент 3-гидрокси-3-метилглютарил-кофермент А редуктазу, в геном штамма-реципиента.
В качестве штамма-реципиента используют штамм линии W29 Y. lipolytica ВКПМ Y-4854 [28 С.34]
Конструируют экспрессионную плазмиду pARS-IntF1-TEFin-HMGR1, содержащую ген HMGR1 для интеграции в локус IntF1 на хромосоме F (положение 3863884-3865837 пн) с помощью CRISPR-Cas9 системы. Плазмиду pARS-IntF1-TEFin-HMGR1 получают на базе вспомогательной плазмиды pARS-IntF1-PromTerm-Cm, которую получают путем сборки 7 фрагментов по методу Гибсона.
Фрагмент 1 с фланком Up к локусу IntF1 (IntF1-Up) амплифицируют с геномной ДНК штамма Y. lipolytica W29 с помощью праймеров:

Фрагмент 2 с терминатором xpr2 (Txpr2) амплифицируют с геномной ДНК штамма Y. lipolytica W29 с помощью праймеров:
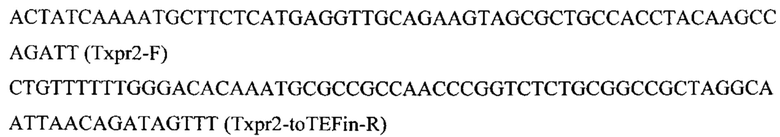
Фрагмент 3 с промотером TEFin (PromTEFin) получают путем обработки вектора pTEFin-uno (RU2713124) эндонуклеазами рестрикции NheI и BpiI и очищают после электрофореза в 1% агарозном геле.
Фрагмент 4 с геном устойчивости к хлорамфениколу (Cm) амплифицируют с плазмиды pMW-att-Cm [28 С.39] с помощью праймеров:
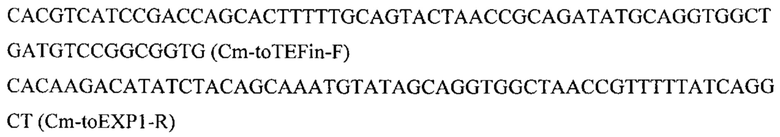
Фрагмент 5 с терминатором tef (Ttef) амплифицируют с геномной ДНК штамма Y. lipolytica W29 с помощью праймеров:
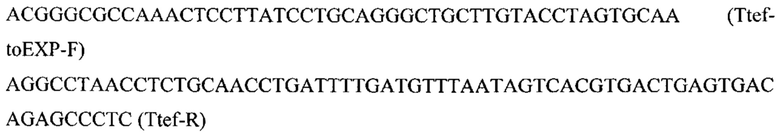
Фрагмент 6 с фланком Down к локусу IntF1 (IntF1-Down) амплифицируют с геномной ДНК штамма Y. lipolytica W29 с помощью праймеров:
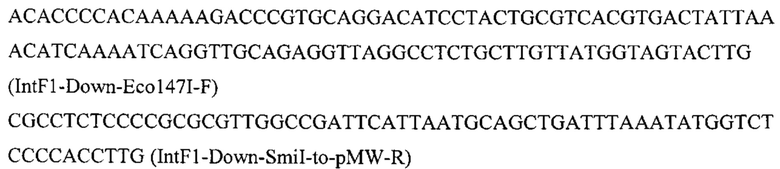
Фрагмент 7 получают обработкой вектора pARS-Cre-reverse (RU2539744) эндонуклеазами рестрикции SacI и PvuII, очищают после электрофореза в 1% агарозном геле, обрабатывают Pfu-полимеразой для получения тупых концов.
После реакции сборки по Гибсону, смесь фрагментов трансформируют в Е. coli XL 1 (Blue). Плазмидную ДНК, выделенную из полученных клонов, проверяют рестрикционным анализом.
Для получения экспрессионной плазмиды pARS-IntF1-TEFin-HMGR1 фрагмент HMGR1 амплифицируют с геномной ДНК штамма Y. lipolytica W29 с помощью праймеров:
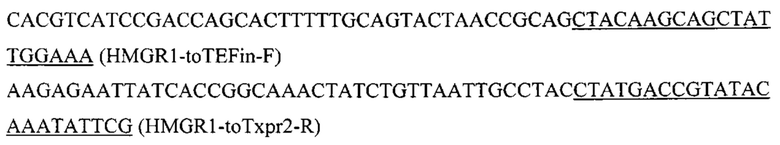
Вспомогательную плазмиду pARS-IntF1-PromTerm обрабатывают эндонуклеазой рестрикции AarI, очищают после электрофореза в 1% агарозном геле, обрабатывают щелочной фосфатазой для удаления 5'- и 3'-фосфатных групп с концов ДНК. Полученный фрагмент собирают методом Гибсона с ПЦР-фрагментом HMGR1 с получением плазмиды pARS-IntF1-TEFin-HMGR1.
Вспомогательную плазмиду pCNR-sgIntF1 для осуществления интеграции гена HMGR1 посредством CRJSPR-Cas9 системы редактирования генома конструируют с помощью олигонуклеотида
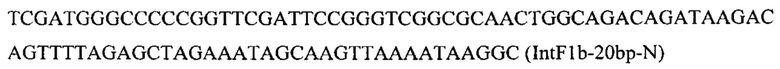
на базе разработанной эписомальной плазмиды pCNR-RK методом рекомбиниринга [28 С.33].
Плазмида pCNR-sgIntF1 содержит ген Cas9 под регуляцией сильного гибридного промотора UAS1B8-TEF (136) [29] и характеризуется оптимизированными кодонами для Y. lipolytica и С-терминальным сигналом ядерной локализации. Плазмида pCNR-sgIntF1 также содержит промотор полимеразы III типа SCR1, слитый с тРНК-глицином для экспрессии sgRNA, структурную часть sgRNA [30], 20 пн ДНК мишени к локусу IntF1 и маркер Nat, кодирующий ген устойчивости к нурсеотрицину. 20 нуклеотидов ДНК-мишени были выбраны с помощью программы СНОРСНОР как описано [31].
Экспрессионный фрагмент ДНК IntF1-PTEFin-HMGR1 (фиг. 2) получают путем обработки плазмиды pARS-IntF1-TEFin-HMGR1 эндонуклеазой рестрикции SmiI и используют совместно со вспомогательной кольцевой плазмидой pCNR-sgIntF1 для ко-трансформации штамма-реципиента Y. lipolytica_ВКПМ Y-4854.
Трансформанты отбирают на среде YPSuc Nat (мас. %: дрожжевой экстракт - 1, пептон - 2, сахароза - 1, агар - 1, вода - остальное) с добавлением нурсеотрицина (0,025 мас. %) по устойчивости к антибиотику нурсеотрицину. У трансформантов изолируют геномную ДНК и проводят ПЦР-анализ на правильность интеграции генетической кассеты по праймерам:
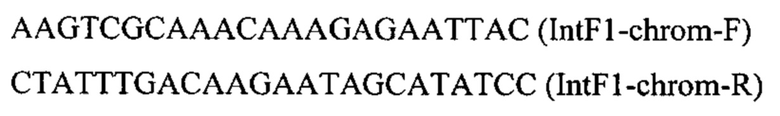
Получают трансформанты с кассетой интегрированной в локус IntF1 на хромосоме F. Полученные трансформанты культивируют в жидкой среде YPSuc9 (мас. %: дрожжевой экстракт - 1, пептон - 2, сахароза - 9, вода - остальное) в пробирках (50 мл) с рабочим объемом 10 мл при 30°С и постоянном перемешивании (250 об/мин) в течение 5 суток. Отбирают трансформант 3.1.3 с лучшей продукцией β-каротина (таблица 1) как описано в [28 С.35].

3.2 Интеграция гена Y. lipolytica ERG20, кодирующего фарнезилпирофосфатсинтазу.
Интеграцию гена осуществляют в трансформант 3.1.3, полученный в примере 3.1.
Для этого конструируют экспрессионную плазмиду pARS-IntA2-TEFin-YlERG20, содержащую ген ERG20 для интеграции в локус IntA2 на хромосоме А (положение 221472 -222858 пн) с помощью CRISPR-Cas9 системы. Плазмиду pARS-IntA2-TEFin-YlERG20 получают на базе вспомогательной плазмиды pARS-IntA2-PromTerm-Cm.
Плазмиду pARS-IntA2-PromTerm-Cm получают как описано в примере 3.1, но с использованием в качестве фрагментов 1 и 6 ПЦР-продуктов IntA2-Up с фланком Up к локусу IntA2 и IntA2-Down с фланком Down к локусу IntA2, которые амплифицируют с геномной ДНК штамма Y. lipolytica W29 с помощью пар праймеров:
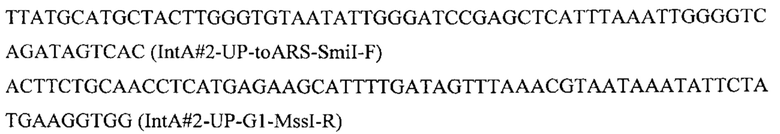
И
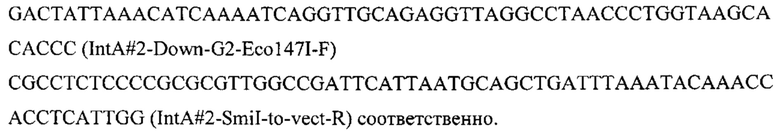
Фрагмент ERG20 амплифицируют с геномной ДНК штамма Y. lipolytica W29 с помощью праймеров:
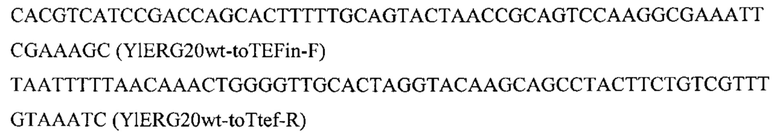
Плазмиду pARS-IntA2-PromTerm-Cm обрабатывают эндонуклеазой рестрикции AarI, очищают после электрофореза в 1% агарозном геле, обрабатывают щелочной фосфатазой для удаления 5'- и 3'-фосфатных групп с концов ДНК. Полученный фрагмент собирают по методу Гибсона с ПЦР-фрагментом ERG20 с получением плазмиды pARS-IntA2-ERG20.
Вспомогательную плазмиду pCNR-sgIntA2 для осуществления интеграции гена ERG20 с помощью CRISPR-Cas9 системы конструируют с помощью олигонуклеотида

на базе разработанной эписомальной плазмиды pCNR-RK методом рекомбиниринга.
Фрагмент ДНК IntA2-PTEFin-ERG20 (фиг.3) получают путем обработки плазмиды pARS-IntA2-YlERG20 эндонуклеазой рестрикции SmiI и используют совместно со вспомогательной кольцевой плазмидой pCNR-sgIntA2 для ко-трансформации трансформанта 3.1.3. Трансформанты отбирают на среде YPSuc Nat по устойчивости к антибиотику нурсеотрицину. У трансформантов изолируют геномную ДНК и проводят ПЦР-анализ на правильность интеграции генетической кассеты по праймерам:
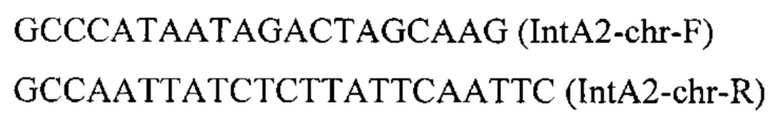
Получают трансформанты с касетой, интегрированной в локус IntA2 на хромосоме А. Полученные трансформанты культивируют как в примере 3.1. Отбирают трансформант 3.2.1 с лучшей продукцией β-каротина как описано в примере 3.1 (таблица 2).

3.3 Интеграция гена Y. lipolytica ERG12, кодирующего мевалонаткиназу
Интеграцию гена осуществляют в трансформант 3.2.1, полученный в примере 3.2.
Конструируют экспрессионную плазмиду pARS-IntD4-TEFin-ERG12, содержащую ген ERG12 для интеграции в локус IntD4 на хромосоме D (положение 1038596 - 1039926 пн) с помощью CRISPR-Cas9 системы. Плазмиду pARS-IntD4-TEFin-ERG12 получают на базе вспомогательной плазмиды pARS-IntD4-PromTerm-Cm, собранной как описано в примерах 3.1, но с использованием в качестве фрагментов 1 и 6 ПЦР-продуктов IntD4-Up с фланком Up к локусу IntD4 и IntD4-Down с фланком Down к локусу IntD4, которые амплифицируют с геномной ДНК штамма Y. lipolytica_W29 с помощью пар праймеров:
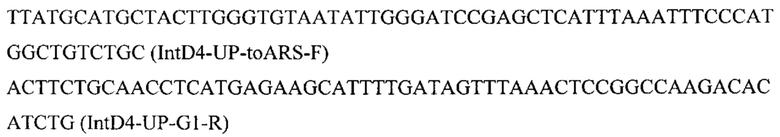
и
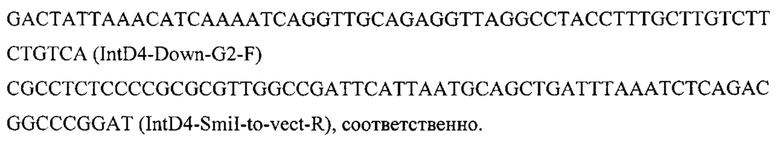
Ген ERG12 амплифицируют с геномной ДНК штамма Y. lipolytica W29 с помощью праймеров:

Плазмиду pARS-IntD4-PromTerm-Cm обрабатывают эндонуклеазой рестрикции AarI, очищают после электрофореза в 1% агарозном геле, обрабатывают щелочной фосфатазой для удаления 5'- и 3'-фосфатных групп с концов ДНК. Полученный фрагмент собирают по методу Гибсона с ПЦР-фрагментом ERG12 с получением плазмиды pARS-IntD4-TEFin-ERG12.
Вспомогательную плазмиду pCNR-sgIntD4 для осуществления интеграции гена ERG12 с помощью CRISPR-Cas9 системы конструируют с помощью олигонуклеотида
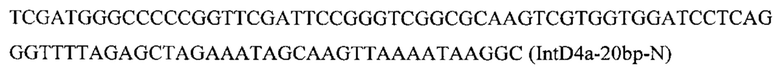
на базе разработанной эписомальной плазмиды pCNR-RK методом рекомбиниринга
Фрагмент ДНК IntD4-PTEFin-ERG12 (фиг.4) получают путем обработки плазмиды pARS-IntD4-TEFin-ERG12 эндонуклеазой рестрикции SmiI и используют совместно со вспомогательной кольцевой плазмидой pCNR-sgIntD4 для ко-трансформации трансформанта 3.2.1. Трансформанты отбирают на среде YPSuc Nat по устойчивости к антибиотику нурсеотрицину. У трансформантов изолируют геномную ДНК и проводят ПЦР-анализ на правильность интеграции генетической кассеты по праймерам:
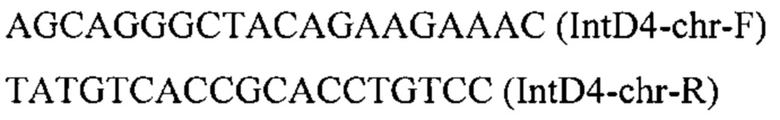
Получают трансформанты с кассетой, интегрированной в локус IntD4 на хромосоме D. Полученные трансформанты культивируют как в примере 3.1. Отбирают трансформант 3.3.3 с лучшей продукцией β-каротина (таблица 3)

3.4 Интеграция полинуклеотида с нуклеотидной последовательностью SEQ ID NO: 1
Интеграцию полинуклеотида с нуклеотидной последовательностью SEQ ID NO: 1 осуществляют в трансформант 3.3.3, полученный в примере 3.3.
Конструируют экспрессионную плазмиду pARS-IntC3-CarRP-GGPPs7 для интеграции нуклеотидной последовательности SEQ ID NO: 1 в локус IntC3 на хромосоме С (положение 565623 - 567106 пн) с помощью CRISPR-Cas9 системы. Плазмиду pARS-IntC3-CarRP-GGPPs7 получают на базе вспомогательной плазмиды pARS-IntC3-PromTerm-Cm, собранной как описано в примере 3.1, но с использованием в качестве фрагментов 1 и 6 ПЦР-продуктов IntC3-Up с фланком Up к локусу IntC3 и IntC3-Down с фланком Down к локусу IntC3, которые амплифицируют с геномной ДНК штамма Y. lipolytica W29 с помощью праймеров:

Фрагмент CarRP амплифицируют по праймерам с синтезированного фрагмента гена CarRP, полученного по примеру 1

Фрагмент GGPPs7 амплифицируют по праймерам с синтезированного фрагмента гена GGPPs7:
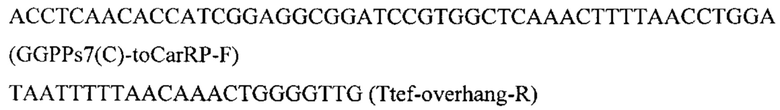
Плазмиду pARS-IntC3-PromTerm-Cm обрабатывают эндонуклеазой рестрикции AarI, очищают после электрофореза в 1% агарозном геле, обрабатывают щелочной фосфатазой для удаления 5'- и 3'-фосфатных групп с концов ДНК. Полученный фрагмент собирают по методу Гибсона с ПЦР-фрагментами CarRP и GGPPs7 с получением плазмиды pARS-IntC3-TEFin-CarRP-GGPPs7.
Вспомогательную плазмиду pCNR-sgIntC3 для осуществления интеграции гибридной нуклеотидной последовательности CarRP-GGPPs7 с помощью CRISPR-Cas9 системы конструируют с помощью олигонуклеотида
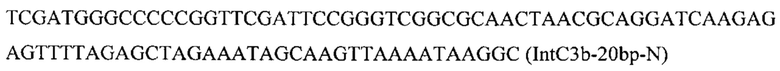
на базе разработанной эписомальной плазмиды pCNR-RK методом рекомбиниринга. ДНК кассеу IntC3-PTEFin-CarRP-GGPPs7 (фиг. 5) получают путем обработки плазмиды pARS-IntC3-CarRP-GGPPs7 эндонуклеазой рестрикции SmiI и используют совместно со вспомогательной кольцевой плазмидой pCNR-sgIntC3 для ко-трансформации трансформанта 3.3.3. Трансформантов отбирают на среде YPSuc Nat по устойчивости к антибиотику нурсеотрицину. У трансформантов изолируют геномную ДНК и проводят ПЦР-анализ на правильность интеграции генетической кассеты по праймерам:
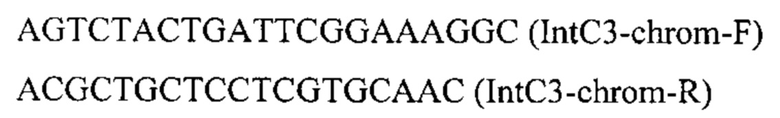
Получают трансформанты с касетой интегрированной в локус IntC3 на хромосоме С. Полученные трансформанты культивируют как в примере 3.1. Отбирают трансформант 3.4.1 с лучшей продукцией β-каротина (таблица 4)


3.5 Интеграция гена CarB М. circinelloides, кодирующего фитоендегидрогеназу
Интеграцию гена осуществляют в трансформант 3.4.1, полученный в примере 3.4.
Конструируют экспрессионную плазмиду pARS-IntB1-CarB, содержащую ген CarB для интеграции в локус IntB1 на хромосоме В (положение 118362 - 119703 пн) с помощью CRISPR-Cas9 системы. Плазмиду pARS-IntB1 -CarB получают на базе вспомогательной плазмиды pARS-IntB1-PromTerm-Cm, собранной как описано в примере 3.1, но с использованием в качестве фрагментов 1 и 6 ПЦР-продуктов IntB1-Up с фланком Up к локусу IntB1 и IntB1-Down с фланком Down к локусу IntB1, которые амплифицируют с геномной ДНК штамма Y. lipolytica W29 с помощью праймеров:

и
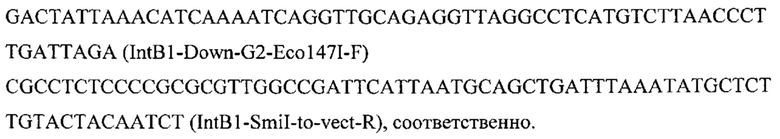
Кодон-оптимизированная для Y. lipolytica последовательность гена CarB Mucor circinelloides приведена в [26].
Фрагмент CarB амплифицируют по праймерам с синтезированного фрагмента гена CarB:

Плазмиду pARS-IntB1-PromTerm обрабатывают эндонуклеазой рестрикции AarI, очищают после электрофореза в 1% агарозном геле, обрабатывают щелочной фосфатазой для удаления 5'- и 3'-фосфатных групп с концов ДНК. Полученный фрагмент собирают по методу Гибсона с ПЦР-фрагментом CarB с помощью метода Гибсона с получением плазмиды pARS-IntB1-CarB.
Вспомогательную плазмиду pCNR-sgIntB1 для осуществления интеграции гена CarB с помощью CRISPR-Cas9 системы конструируют с помощью олигонуклеотида
на базе разработанной эписомальной плазмиды pCNR-RK методом рекомбиниринга.
ДНК кассеу IntB1-PTEFin-CarB (фиг. 6) получают путем обработки плазмиды pARS-IntB1-CarB эндонуклеазой рестрикции SmiI и используют совместно со вспомогательной кольцевой плазмидой pCNR-sgIntB1 для ко-трансформации трансформанта 3.4.1.
Трансформанты отбирают на среде YPSuc Nat по устойчивости к антибиотику нурсеотрицину. У трансформантов изолируют геномную ДНК и проводят ПЦР-анализ на правильность интеграции генетической кассеты по праймерам:

Получают трансформанты с кассетой, интегрированной в локус IntB1 на хромосоме В.
Полученные трансформанты культивируют как в примере 3.1. Отбирают трансформант 3.5.2 с лучшей продукцией β-каротина (таблица 5).

3.6 Интеграция полинуклеотида с нуклеотидной последовательностью SEQ ID NO: 2
Интеграцию полинуклеотида с нуклеотидной последовательностью SEQ ID NO: 2 осуществляют в трансформант 3.5.2, полученный в примере 3.5.
Конструируют экспрессионную плазмиду pUC-IntA4-CarRP-ERG20(F88C) для интеграции нуклеотидной последовательности SEQ ID NO: 2 в локус IntA4 на хромосоме А (положение 929717 - 931055 пн) с помощью CRISPR-Cas9 системы. Плазмиду pUC-IntA4-CarRP-ERG20(F88C) получают на базе вспомогательной плазмиды pUC-IntA4-PromTerm-Cm, собранной как описано в примере 3.1, но с использованием в качестве фрагмента 7 вектора pUC19 (Кат. номер SD0061, ThermoFisher Scientific), обработанного эндонуклеазами рестрикции EheI и HindIII, а в качестве фрагментов 1 и 6 ПЦР-продуктов IntA4-Up с фланком Up к локусу IntA4 и IntA4-Down с фланком Down к локусу IntA4, амплифицируют с геномной ДНК штамма Y. lipolytica W29 с помощью пар праймеров:

и
Фрагмент CarRP амплифицируют с синтезированного фрагмента гена CarRP (пример 3.4) с помощью праймеров:
Для получения ERG20(F88C) амплифицируют два фрагмента гена ERG20 (ERG20-1 и ERG20-2) с геномной ДНК штамма Y. lipolytica W29 с помощью пар праймеров:

и

Плазмиду pUC-IntA4-PromTerm-Cm обрабатывают эндонуклеазой рестрикции AarI, очищают после электрофореза в 1% агарозном геле, обрабатывают щелочной фосфатазой для удаления 5'- и 3'-фосфатных групп с концов ДНК. Полученный фрагмент собирают по методу Гибсона с ПЦР-фрагментами CarRP, ERG20-1 и ERG20-2 с получением плазмиды pUC-IntA4-CarRP-ERG20(F88C).
Вспомогательную плазмиду pCNR-sgIntA4 для осуществления интеграции гибридной нуклеотидной последовательности CarRP-ERG20(F88C) с помощью CRISPR-Cas9 системы конструируют с помощью олигонуклеотида
на базе разработанной эписомальной плазмиды pCNR-RK методом рекомбиниринга.
Фрагмент ДНК IntA4-PTEFin-CarRP-ERG20(F88C) (фиг. 7) получают путем обработки плазмиды pUC-IntA4-CarRP-ERG20(F88C) эндонуклеазой рестрикции SmiI и используют совместно со вспомогательной кольцевой плазмидой pCNR-sgIntA4 для ко-трансформации трансформанта 3.5.2. Трансформанты отбирают на среде YPSuc Nat по устойчивости к антибиотику нурсеотрицину. У трансформантов изолируют геномную ДНК и проводят ПЦР-анализ на правильность интеграции генетической кассеты по праймерам:

Получают трансформанты с кассетой, интегрированной в локус IntA4 на хромосоме А. Полученные трансформанты культивируют как в примере 3.1. Отбирают трансформант 3.6.1 с лучшей продукцией β-каротина (таблица 6). Отобранный трансформант депонируют в БРЦ ВКПМ НИЦ «Курчатовский институт» - ГосНИИ Генетика (117545 Москва, 1-ый Дорожный пр-д, д.1) как штамм дрожжей Y. lipolytica ВКПМ Y-4950.

Пример 4. Получение трансформанта, продуцирующего кантаксантин
Получение трансформанта осуществляют на основе штамма Y. lipolytica ВКПМ Y-4950 путем поэтапного направленного введения генетических модификаций.
4.1 Интеграция гена CarB Mucor circinelloides, кодирующего фитоендегидрогеназу
Интеграцию гена осуществляют в трансформант 3.6.1, полученный в примере 3.6.
Конструируют экспрессионную плазмиду pARS-IntD3-CarB, содержащую ген CarB для интеграции в локус IntD3 на хромосоме D (положение 784674 - 786321 пн) с помощью CRJSPR-Cas9 системы. Плазмиду pARS-IntD3-Car5 получают на базе вспомогательной плазмиды pARS-IntD3-PromTerm-Cm, собранной как описано в примере 3.1, но с использованием в качестве фрагментов 1 и 6 ПЦР-продуктов IntD3-Up с фланком Up к локусу IntD3 и IntD3-Down с фланком Down к локусу IntD3, которые амплифицируют с геномной ДНК штамма дрожжей Y. lipolytica W29 с помощью праймеров:

и
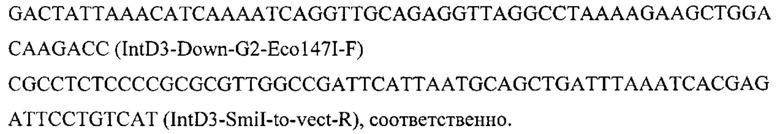
Фрагмент CarB амплифицируют по праймерам с синтезированного как в примере 3.5. фрагмента гена CarB:
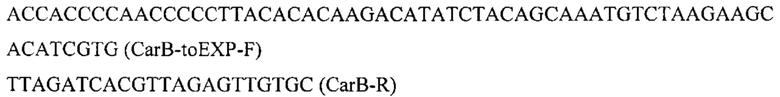
Плазмиду pARS-IntD3-PromTerm обрабатывают эндонуклеазой рестрикции AarI, очищают после электрофореза в 1% агарозном геле, обрабатывают щелочной фосфатазой для удаления 5'- и 3'-фосфатных групп с концов ДНК. Полученный фрагмент собирают по методу Гибсона с ПЦР-фрагментом CarB с помощью метода Гибсона с получением плазмиды pARS-IntD3-CarB.
Вспомогательную плазмиду pCNR-sgIntD3 для осуществления интеграции гена CarB с помощью CRJSPR-Cas9 системы конструируют с помощью олигонуклеотида
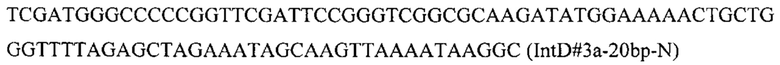
на базе разработанной эписомальной плазмиды pCNR-RK методом рекомбиниринга. ДНК кассеу IntD3-PTEFin-CarB (фиг. 8) получают путем обработки плазмиды pARS-IntD3-CarB эндонуклеазой рестрикции SmiI и используют совместно со вспомогательной кольцевой плазмидой pCNR-sgIntD3 для ко-трансформации штамма дрожжей Y. lipolytica ВКПМ Y-4950. Трансформанты отбирают на среде YPSuc Nat по устойчивости к антибиотику нурсеотрицину. У трансформантов изолируют геномную ДНК и проводят ПЦР-анализ на правильность интеграции генетической кассеты по праймерам:
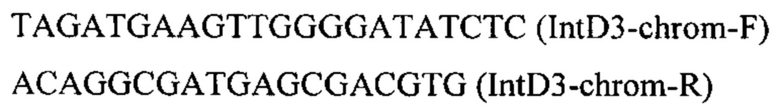
Получают трансформанты с кассетой, интегрированной в локус IntD3 на хромосоме D.
Полученные трансформанты культивируют как в примере 3.1. Отбирают трансформант 4.1.2 с лучшей продукцией β-каротина (таблица 7).

4.2 Интеграция гена HpBKT Haematococcus pluvialis, кодирующего β-каротин кетолазу
Конструируют экспрессионную плазмиду pBR-IntF11-HpBKT, содержащую ген HpBKT для интеграции в локус IntF1l на хромосоме F (положение 3458258 - 3459592 пн) с помощью CRISPR-Cas9 системы. Плазмиду pBR-IntF11-HpBKT получают на базе вспомогательной синтезированной плазмиды pBR-IntF11-PromTerm-GFP, несущей фланки Up и Down к локусу IntF11, промотер TEFin и терминаторы xpr и tef (здесь и далее синтез плазмид осуществлен компанией «Twist Bioscience Corporation)) (США). Фрагмент HpBKT амплифицируют с синтезированной нуклеотидной последовательности SEQ ID NO: 3 по праймерам:
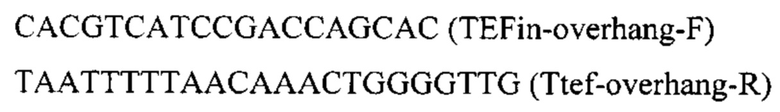
Плазмиду pBR-IntF1l-PromTerm обрабатывают эндонуклеазами рестрикции SfaAI, KspAI, PaeI, очищают после электрофореза в 1% агарозном геле, обрабатывают щелочной фосфатазой для удаления 5'- и 3'-фосфатных групп с концов ДНК. Полученный фрагмент собирают по методу Гибсона с ПЦР-фрагментом HpBKT с получением плазмиды pBR-IntF11-HpBKT.
Вспомогательную плазмиду pCNR-sgIntF11 для осуществления интеграции гена HpBKT с помощью CRISPR-Cas9 системы конструируют с помощью олигонуклеотида

ДНК кассеу IntF11-PTEFin-HpBKT (фиг. 9) получают путем обработки плазмиды pBR-IntF11-HpBKT эндонуклеазой рестрикции MssI и используют совместно со вспомогательной кольцевой плазмидой pCNR-sgIntF11 для ко-трансформации трансформанта 4.1.2 (пример 4.1). Трансформанты отбирают на среде YPSuc Nat по устойчивости к антибиотику нурсеотрицину. У трансформантов изолируют геномную ДНК и проводят ПЦР-анализ на правильность интеграции генетической кассеты по праймерам:
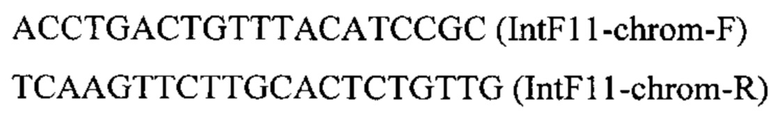
Получают трансформанты с кассетой, интегрированной в локус IntF11 на хромосоме F.
Полученные трансформанты культивируют как в примере 3.1. После экстракции из лиофилизированной биомассы (как описано в примере 3.1.) по результатам ВЭЖХ по сравнению со стандартом кантаксантина отбирают трансформант 4.2.2 с лучшей продукцией кантаксантина (таблица 8).

Пример 5. Получение трансформанта, продуцирующего астаксантин
5.1 Интеграция гена HpcrtZ Н. pluvialis, кодирующего β-каротин-3-гидроксилазу
Интеграцию гена осуществляют в трансформант 4.2.2, полученный в примере 4.2.
Конструируют экспрессионную плазмиду pBR-IntE6-HpcrtZ, содержащую ген HpcrtZ для интеграции в локус IntE6 на хромосоме Е (положение 895599 - 896990 пн) с помощью CRISPR-Cas9 системы. Плазмиду pBR-IntE6-HpcrtZ получают на базе вспомогательной синтезированной плазмиды pBR-IntE6-PromTerm-GFP, несущей фланки Up и Down к локусу IntE6, промотер TEFin и терминаторы xpr и tef.
Фрагмент HpcrtZ амплифицируют с синтезированной нуклеотидной последовательности SEQ ID NO: 4 по праймерам:
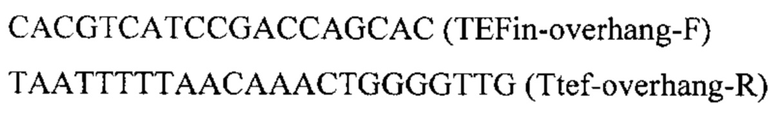
Плазмиду pBR-IntE6-PromTerm обрабатывают эндонуклеазами рестрикции SfaAI, KspAI, очищают после электрофореза в 1% агарозном геле, обрабатывают щелочной фосфатазой для удаления 5'- и 3'-фосфатных групп с концов ДНК. Полученный фрагмент собирают по методу Гибсона с ПЦР-фрагментом HpcrtZ с получением плазмиды pBR-IntE6-HpcrtZ.
Вспомогательную плазмиду pCNR-sgIntE6 для осуществления интеграции гена HpcrtZ с помощью CRISPR-Cas9 системы конструируют с помощью олигонуклеотида
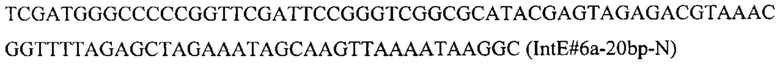
ДНК кассету IntE6-PTEFin-HpcrtZ (фиг. 10) получают путем обработки плазмиды pBR-IntE6-HpcrtZ эндонуклеазой рестрикции SmiI и используют совместно со вспомогательной кольцевой плазмидой pCNR-sgIntE6 - для ко-трансформации трансформанта 4.2.2. Трансформанты отбирают на среде YPSuc Nat по устойчивости к антибиотику нурсеотрицину. У трансформантов изолируют геномную ДНК и проводят ПЦР-анализ на правильность интеграции генетической кассеты по праймерам:
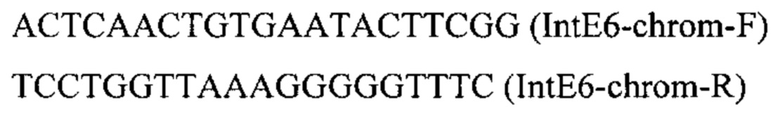
Получают трансформанты с кассетой, интегрированной в локус IntE6 на хромосоме Е.
Полученные трансформанты культивируют как описано в примере 3.1. После экстракции из лиофилизированной биомассы (как описано в примере 3.1.) по результатам ВЭЖХ по сравнению со стандартом астаксантина отбирают трансформант 5.1.2 с лучшей продукцией астаксантина (таблица 9).

5.2 Интеграция гена HpBKTH pluvialis
Интеграцию гена осуществляют в трансформант 5.1.2, полученный в примере 5.1.
Для этого конструируют экспрессионную плазмиду pUC-IntC13-HpBKT, содержащую ген HpBKT для интеграции в локус IntC13 на хромосоме С (положение 2646315 - 2648077 пн) с помощью CRISPR-Cas9 системы. Плазмиду pUC-IntC13-HpBKT получают на базе синтезированной вспомогательной плазмиды pUC-IntC13-GFP, несущей фланки Up и Down к локусу IntC13, промотер TEFin и терминаторы xpr и tef.
Плазмиду pBR-IntF11-HpBKT обрабатывают эндонуклеазой рестрикции SgsI, очищают после электрофореза в 1% агарозном геле с получением фрагмента Prom-HpBKT-term. Плазмиду pUC-flIntC#13-GFP обрабатывают эндонуклеазой рестрикции SgsI, очищают после электрофореза в 1% агарозном геле, обрабатывают щелочной фосфатазой для удаления 5'- и 3'-фосфатных групп с концов ДНК. Полученный фрагмент лигируют с фрагментом Prom-HpBKT-term в единую плазмиду pUC-IntC13 -HpBKT.
Вспомогательную плазмиду pCNR-sgIntC13 для осуществления интеграции гена HpBKT с помощью CRISPR-Cas9 системы конструируют с помощью олигонуклеотида
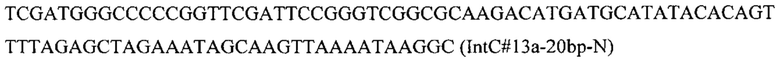
ДНК кассету IntC13-PTEFin-HpBKT (фиг. 11) получают путем обработки плазмиды pUC-IntC13-HpBKT эндонуклеазой рестрикции SmiI и используют совместно со вспомогательной кольцевой плазмидой pCNR-sgIntC13 для ко-трансформации трансформанта 5.1.2. Трансформантов отбирают на среде YPSuc Nat по устойчивости к антибиотику нурсеотрицину. У трансформантов изолируют геномную ДНК и проводят ПЦР-анализ на правильность интеграции генетической кассеты по праймерам:

Получают трансформанты с кассетой, интегрированной в локус IntC13 на хромосоме С.
Полученные трансформанты культивируют как описано в примере 3.1. По примеру 5.1 отбирают трансформант 5.2.1 с лучшей продукцией астаксантина.
5.3 Интеграция гена HpBKTH. pluvialis
Интеграцию гена осуществляют в трансформант 5.2.1, полученный в примере 5.2.
Для этого конструируют экспрессионную плазмиду рТ-IntC14-HpBKT, содержащую ген HpBKT для интеграции в локус IntC14 на хромосоме С (положение 3133312 - 3135244 пн) с помощью CRISPR-Cas9 системы. Плазмиду pT-IntC14-HpBKT получают на базе вспомогательной синтезированной плазмиды pT-IntC#14-Lis, несущей фланки Up и Down к локусу IntC14, промотер TEFin и терминаторы xpr и tef.
Плазмиду pBR-IntF11-HpBKT обрабатывают эндонуклеазой рестрикции SgsI, очищают после электрофореза в 1% агарозном геле с получением фрагмента Prom-HpBKT-term. Плазмиду pT-IntC#14-Lis обрабатывают эндонуклеазами рестрикции SgsI / HincII, очищают после электрофореза в 1% агарозном геле, обрабатывают щелочной фосфатазой для удаления 5'- и 3'-фосфатных групп с концов ДНК. Полученный фрагмент лигируют с фрагментом Prom-HpBKT-term в единую плазмиду pT-IntC14-HpBKT.
Вспомогательную плазмиду pCNR-sgIntC14 для осуществления интеграции гена HpBKT с помощью CRISPR-Cas9 системы конструируют с помощью олигонуклеотида
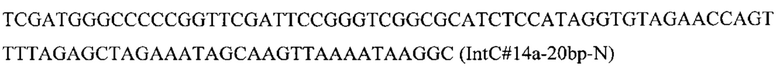
ДНК кассеу IntC14-PTEFin-HpBKT (фиг. 12) получают путем обработки плазмиды pT-IntCT4-HpBKT эндонуклеазой рестрикции SmiI и используют совместно со вспомогательной кольцевой плазмидой pCNR-sgIntC14 для ко-трансформации трансформанта 5.2.1. Трансформанты отбирают на среде YPSuc Nat по устойчивости к антибиотику нурсеотрицину. У трансформантов изолируют геномную ДНК и проводят ПЦР-анализ на правильность интеграции генетической кассеты по праймерам:
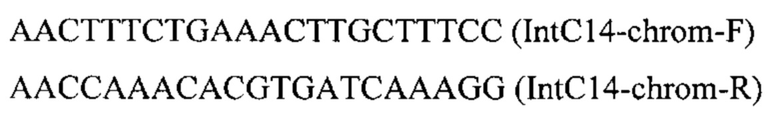
Получают трансформанты с кассетой, интегрированной в локус IntC14 на хромосоме С.
Полученные трансформанты культивируют как описано в примере 3.1. По примеру 5.1 отбирают трансформант 5.3.1 с лучшей продукцией астаксантина.
5.4 Интеграция гена HpcrtZH. pluvialis
Интеграцию гена осуществляют в трансформант 5.3.1, полученный в примере 5.3.
Для этого конструируют экспрессионную плазмиду pUC-IntB11-HpcrtZ, содержащую ген HpcrtZ для интеграции в локус IntB11 на хромосоме В (положение 2408220 - 2410434 пн) с помощью CRISPR-Cas9 системы. Плазмиду pUC-IntB11-HpcrtZ получают на базе вспомогательной синтезированной плазмиды pUC-IntB11-GFP, несущей фланки Up и Down к локусу IntB11, промотер TEFin и терминаторы xpr и tef..
Плазмиду pBR-IntE6-HpcrtZ обрабатывают эндонуклеазой рестрикции SgsI, очищают после электрофореза в 1% агарозном геле с получением фрагмента Prom-HpcrtZ-term.
Плазмиду pUC-IntB11-GFP обрабатывают эндонуклеазами рестрикции SgsI / HincII / BglII, очищают после электрофореза в 1% агарозном геле, обрабатывают щелочной фосфатазой для удаления 5'- и 3'-фосфатных групп с концов ДНК. Полученный фрагмент лигируют с фрагментом Prom-HpcrtZ-term в единую плазмиду pUC-IntB11-HpcrtZ.
Вспомогательную плазмиду pCNR-sgIntB11 для осуществления интеграции гена HpcrtZ с помощью CRISPR-Cas9 системы конструируют с помощью олигонуклеотида
ДНК кассету IntB11-PTEFin-HpcrtZ (фиг. 13) получают путем обработки плазмиды pUC-IntB11-HpcrtZ эндонуклеазой рестрикции SmiI и используют совместно со вспомогательной кольцевой плазмидой pCNR-sgIntB11 - для ко-трансформации трансформанта 5.3.1.
Трансформанты отбирают на среде YPSuc Nat по устойчивости к антибиотику нурсеотрицину. У трансформантов изолируют геномную ДНК и проводят ПЦР-анализ на правильность интеграции генетической кассеты по праймерам:

Получают трансформанты с кассетой, интегрированной в локус IntB11 на хромосоме С.
Полученные трансформанты культивируют как описано в примере 3.1. По примеру 5.1 отбирают трансформант 5.4.1 с лучшей продукцией астаксантина.
5.5 Интеграция гена HpcrtZ Н. pluvialis
Интеграцию гена осуществляют в трансформант 5.4.1, полученный в примере 5.4.
Для этого конструируют экспрессионную плазмиду pT-IntE12-HpcrtZ, содержащую ген HpcrtZ для интеграции в локус IntE12 на хромосоме Е (положение 2831926 - 2833196 пн) с помощью CRISPR-Cas9 системы. Плазмиду pT-IntE12-HpcrtZ получают на базе вспомогательной синтезированной плазмиды flIntE#12-Lis, несущей фланки Up и Down к локусу IntE12, промотер TEFin и терминаторы xpr и tef.
Плазмиду pBR-IntE6-HpcrtZ обрабатывают эндонуклеазой рестрикции SgsI, очищают после электрофореза в 1% агарозном геле с получением фрагмента Prom-HpcrtZ-term.
Плазмиду flIntE#12-Lis обрабатывают эндонуклеазой рестрикции SgsI, очищают после электрофореза в 1% агарозном геле, обрабатывают щелочной фосфатазой для удаления 5'-и 3'-фосфатных групп с концов ДНК. Полученный фрагмент лигируют с фрагментом Prom-HpcrtZ-term в единую плазмиду pT-IntE12-HpcrtZ.
Вспомогательную плазмиду pCNR-sgIntE12 для осуществления интеграции гена HpcrtZ с помощью CRISPR-Cas9 системы конструируют с помощью олигонуклеотида
ДНК кассету IntE12-PTEFin-HpcrtZ (фиг. 14) получают путем обработки плазмиды рТ-IniE12-HpcrtZ эндонуклеазой рестрикции SmiI и используют совместно со вспомогательной кольцевой плазмидой pCNR-sgIntE12 - для ко-трансформации трансформанта 5.4.1.
Трансформанты отбирают на среде YPSuc Nat по устойчивости к антибиотику нурсеотрицину. У трансформантов изолируют геномную ДНК и проводят ПЦР-анализ на правильность интеграции генетической кассеты по праймерам:
Получают трансформанты с кассетой, интегрированной в локус IntE12 на хромосоме С.
Полученные трансформанты культивируют как описано в примере 3.1. По примеру 5.1 отбирают трансформант 5.5.1 с лучшей продукцией астаксантина.
Отобранный трансформант депонируют в БРЦ ВКПМ НИЦ «Курчатовский институт» - ГосНИИ Генетика (117545 Москва, 1-ый Дорожный пр-д, д.1) как штамм дрожжей Y. lipolytica ВКПМ Y-4871
Признаки штамма дрожжей Y. lipolytica ВКПМ Y-4950.
Культурально-морфологические признаки.
Суточная культура в жидкой YPD среде (мас. %: дрожжевой экстракт - 1, пептон -2, глюкоза - 1, вода - остальное) представлена овальными, удлиненно-овальными, округлыми клетками размером 4,6-6,0×4,5-12,5 мкм. Почкование полярное или латеральное, на узком основании. К третьим суткам большинство клеток почкуются и образуют истинный и псевдомицелий.
При росте в жидкой среде YPD при 28°С в течение 24 ч культивирования -жидкость мутная, осадок оранжевый, коагуляции не наблюдается, пристеночных пленок не образует.
Клетки хорошо растут на простых питательных средах. Колонии на мальтоагаре [32] (возраст 1 неделя) оранжевого цвета, пастообразные, слегка приподнятые в центре, морщинистые, с фестончатым краем. Штрих на мальтоагаре непрерывный, плоский, блестящий, оранжевого цвета, пастообразный, края ровные, со временем становится складчатым. Спор не образует.
Физиолого-биохимические признаки.
Облигатный аэроб. Сахара не сбраживает. Ассимилирует: сахарозу, глюкозу, D-галактозу (медленно), L-сорбозу, D-рибозу, этанол, глицерин, эритрит, адонит, D-маннит, сорбит и молочную, янтарную, лимонную, глюконовую кислоты. Не ассимилирует: мальтозу, лактозу, целлобиозу, трегалозу, мелибиозу, раффинозу, мелицитозу, инулин, крахмал, D-ксилозу, L- и D-арабинозу, раммозу, дульцит, инозит, D-глюкозамин и глюкуроновую, 2-кетоглюконовую, 5-кетоглюконовую кислоты. Не ассимилирует нитраты, жирные кислоты и алканы. Не растет в безвитаминной среде, требует присутствия в среде тиамина, не требует биотина.
Оптимальное значение рН для роста 5,5-7,0. Не растет при 37°С. Максимальная температура роста 35°С. Разжижает желатин. Гидролизует мочевину.
Пример 6. Культивирование штамма дрожжей Y. lipolytica ВКПМ Y-4950 в пробирках на средах, содержащих глицерин и сахарозу в качестве единственного источника углерода.
Культивирование штамма дрожжей Y. lipolytica ВКПМ Y-4950 проводят в пробирках (50 мл) с рабочим объемом 10 мл при 30°С и постоянном перемешивании (250 об/мин) в течение 5 суток в средах следующего состава:
YPGlyc(2+2+1) - мас. %: дрожжевой экстракт - 2, пептон - 4, глицерин - 2, вода - остальное. Порционная подача глицерина 2 мас. % на третьи сутки и 1 мас. % на четвертые сутки.
YPSuc(2+2+1) - мас. %: дрожжевой экстракт - 2, пептон - 4, сахароза - 2, вода - остальное. Порционная подача сахарозы 2 мас. % на третьи сутки и 1 мас. % на четвертые сутки. YPSuc(9) - мас. %: дрожжевой экстракт - 2, пептон - 4, сахароза - 9, вода - остальное.
В качестве контроля используют штамм Y. lipolytica ВКПМ Y-4854
Для измерения сухого веса биомассы, клетки из 1 мл клеточной суспензии собирают, промывают и лиофилизируют в течение 24 часов с помощью системы FreeZone 6 Plus (Labconco, США). β-каротин экстрагируют из лиофилизированных клеток как описано в [28]. Экстракцию проводят три раза. Полученный объединенный экстракт анализируют методом ВЭЖХ на системе Waters (Waters, Милфорд, Массачусетс, США), оснащенной колонкой WAT086344 С18 (3,9×150 мм, 4 мкм, 60а, 1/рк Nova-Pak, Украина) и работающей со скоростью 1,0 мл / мин. Детектирование проводят при 470 нм. Образцы идентифицируют путем сравнения времени удерживания со стандартом β-каротин (Supelco, США). Результаты представлены в табл. 10.
Полученные результаты показывают, что сконструированный штамм дрожжей Y. lipolytica ВКПМ Y-4950 накапливает 602,1 мг/л и 828,0 мг/л β-каротина при культивировании на средах с порционной подачей глицерина и сахарозы, что в 1,5 и в 2,0 раза, соответственно, превышает продукцию родительского штамма Y. lipolytica ВКПМ Y-4854.

При культивировании на среде, содержащей 9 мас. % сахарозы, полученный штамм продуцирует 1606,9 мг/л β-каротина, что превосходит лучшие опубликованные в научной литературе данные по уровням продукции β-каротина при культивировании в малых объемах (164 мг/л в глубоколуночных планшетах [33] и 408 мг/л [4] и 1500 мг/л [34] в колбах).
Пример 7. Культивирование штамма дрожжей Y. lipolytica ВКПМ Y-4950 в ферментере на среде, содержащей глюкозу в качестве единственного источника углерода.
Культивирование штамма дрожжей Y. lipolytica ВКПМ Y-4950 проводят в 3-л ферментере модель КФ-103 производства ООО-фирма "Проинтех" (Пущино, РФ) с рабочим объемом 1 л при температуре 29°С в среде следующего состава (мас. %): глюкоза 1, дрожжевой экстракт 2, пептон 4. Концентрированный раствор, содержащий (мас. %): глюкоза 35, гидрофосфат аммония 1,9 и дигидрофосфат аммония 0,06, готовится отдельно и вносится со скоростью 8,5 г/(л*ч) начиная с 16 часа культивирования. В качестве пеногасителя используют адеканоль (0.1% v/v). Раствор 12,5% водного аммиака используют для поддержания значения рН среды равного 5,5. Уровень растворенного в среде кислорода составляет не менее 20%.
Подготовку посевной культуры проводят в два этапа:
- пересев штамма на агаризованную среду YPD;
- посев в жидкую среду YPD в колбы с общим объемом 750 мл и рабочим объемом 75 мл и инкубация в течение 24 ч при 30°С и постоянном перемешивании (250 об/мин).
Посевная культура вносится в ферментер в количестве 10% от рабочего объема. Отбор проб осуществляется каждые 24 ч.
Сконструированный штамм дрожжей Y. lipolytica ВКПМ Y-4950 накапливает 2,38 г/л β-каротина за 89 час культивирования на среде, содержащей глюкозу в качестве единственного источника углерода.
Таким образом, полученные результаты показывают, что заявляемый штамм дрожжей Y. lipolytica ВКПМ Y-4950 продуцирует целевой продукт β-каротин при культивировании на широком спектре субстратов, таких как глюкоза, глицерин и сахароза.
Признаки штамма дрожжей Y. lipolytica ВКПМ Y-4871
Культурально-морфологические признаки
Суточная культура в жидкой YPD среде представлена овальными, удлиненно-овальными, округлыми клетками размером 4,6-6,0×4,5-12,5 мкм. Почкование полярное или латеральное, на узком основании. К третьим суткам большинство клеток почкуются и образуют истинный и псевдомицелий.
При росте в жидкой среде YPD при 28°С в течение 24 ч культивирования -жидкость мутная, осадок красный, коагуляции не наблюдается, пристеночных пленок не образует.
Клетки хорошо растут на простых питательных средах. Колонии на мальтоагаре (возраст 1 неделя) красного цвета, пастообразные, слегка приподнятые в центре, морщинистые, с фестончатым краем. Штрих на мальтоагаре непрерывный, плоский, блестящий, красного цвета, пастообразный, края ровные, со временем становится складчатым. Спор не образует.
Физиолого-биохимические признаки.
Облигатный аэроб. Сахара не сбраживает.Ассимилирует: сахарозу, глюкозу, D-галактозу (медленно), L-сорбозу, D-рибозу, этанол, глицерин, эритрит, адонит, D-маннит, сорбит и молочную, янтарную, лимонную, глюконовую кислоты. Не ассимилирует: мальтозу, лактозу, целлобиозу, трегалозу, мелибиозу, раффинозу, мелицитозу, инулин, крахмал, D-ксилозу, L- и D-арабинозу, раммозу, дульцит, инозит, D-глюкозамин и глюкуроновую, 2-кетоглюконовую, 5-кетоглюконовую кислоты. Не ассимилирует нитраты, жирные кислоты и алканы. Не растет в безвитаминной среде, требует присутствия в среде тиамина, не требует биотина.
Оптимальное значение рН для роста 5,5-7,0. Не растет при 37°С. Максимальная температура роста 35°С. Разжижает желатин. Гидролизует мочевину.
Пример 8. Культивирование штамма дрожжей Y. lipolytica ВКПМ Y-4871 в пробирках
Культивирование проводят в пробирках (50 мл) с рабочим объемом 10 мл в жидкой среде YPSuc2 (мас. %: дрожжевой экстракт - 1, пептон - 2, сахароза - 2, вода -остальное) с порционной подачей сахарозы 2 мас. % на третьи сутки и 1 мас. % на четвертые сутки в пробирках (50 мл) при 30°С и постоянном перемешивании (250 об/мин) в течение 5 суток. В данных условиях штамм дрожжей Y. lipolytica ВКПМ Y-4871 характеризуется накоплением астаксантина до 132 мг/л.
Пример 9. Культивирование штамма дрожжей Y. lipolytica ВКПМ Y-4871 в ферментере на среде, содержащей глюкозу в качестве единственного источника углерода. Культивирование штамма дрожжей Y. lipolytica ВКПМ Y-4871 проводят в 3-л ферментере модель КФ-103 производства ООО-фирма "Проинтех" (Пущино, РФ) с рабочим объемом 1 л при температуре 29°С в среде следующего состава (мас. %): глюкоза 1, дрожжевой экстракт 2, соевый пептон 4. Концентрированный раствор, содержащий (мас. %): глюкоза 5, гидрофосфат аммония 1,9 и дигидрофосфат аммония 0,06, готовится отдельно и вносится со скоростью 6,5 г/(л*ч) начиная с 16 часа культивирования. В качестве пеногасителя используют адеканоль (0.1% v/v). Раствор 12,5% водного аммиака используют для поддержания значения рН среды равного 5,5. Уровень растворенного в среде кислорода составляет не менее 20%.
Подготовку посевной культуры проводят в два этапа:
- пересев штамма на агаризованную среду YPD
- посев в жидкую среду YPD в колбы с общим объемом 750 мл и рабочим объемом 75 мл и инкубация в течение 24 ч при 30°С и постоянном перемешивании (250 об/мин).
Посевная культура вносится в ферментер в количестве 10% от рабочего объема. Отбор проб осуществляется каждые 24 ч.
Сконструированный штамм дрожжей Y. lipolytica ВКПМ Y-4871 в ферментере накапливает 8,8 мг/г сухого веса или 395,5 мг/л астаксантина за 70 час культивирования на среде, содержащей глюкозу в качестве единственного источника углерода.
1. Gellenbeck K.W. (1998). Asia Pacific J Clin Nutr, 7(3/4), 277-281.
2. Langi P., Kiokias S. et al. (2018). Methods MolBiol, 1852, 57-71. doi: 10.1007/978-1-4939-8742-9_3
3. Zhang Y., Nielsen J., et al. (2017). FEMS Yeast Res, 17(8). doi:10.1093/femsyr/fox080
4. Zhang X.K., Wang D.N., et al. (2020). Biotechnol Lett, 42(6), 945-956. doi: 10.1007/s 10529-020-02844-x
5. Velayos A., Eslava A.P. et al. (2000). Eur J Biochem, 267(17), 5509-5519. doi:10.1046/j.l432-1327.2000.01612.x
6. Tramontin L.R.R., Kildegaard K.R. et al. (2019). Microorganisms, 7(10). doi: 10.3 390/microorgani sms7100472
7. Kildegaard K.R., Adiego-Perez B. et al. (2017). Synth Syst Biotechnol, 2(4), 287-294. doi: 10.1016/j.synbio.2017.10.002
8. Yang J., Guo L. (2014). Microb Cell Fact, 13, 160. doi:10.1186/s12934-014-0160-x
9. Misawa N., Shimada H. (1997) J Biotechnol, 59(3), 169-181. doi:10.1016/s0168-1656(97)00154-5
10. Li Z.J., Wang Y.Z. et al. (2021). J Agric Food Chem, 69(8), 2367-2381. doi:10.1021/acs.jafc.1c00350
11. Coussement P., Bauwens D. et al. (2017). ACS Synth Biol, 6(2), 224-232. doi: 10.1021 /acssynbio.6b00122
12. Sun L., Atkinson C.A. et al. (2020). Biotechnol Bioeng, 117(11), 3522-3532. doi:10.1002/bit.27508
13. Jin J., Wang Y. et al. (2018). Biotechnol Boxfuls, 11, 230. doi: 10.1186/s 13068-018-1227-4
14. Sambrook J., Maniatis Т., Fritsch E. Molecular Cloning: Laboratory Mannual, 2nd edition. New York: Cold Spring Harbor Laboratory Press, 1989
15. Park Y-K, Korpys P. et al. (2019). FEMS Yeast Research, 19(1). doi: 10.1093/femsyr/foy105
16. Kamineni A., Chen Sh. et al. (2020). FEMS Yeast Research, 20(5) doi: 10.1093/femsyr/foaa035
17. US20060115881
18. Madzak C, Tréton B. et al. (2000) Journal of Molecular Microbiology and Biotechnology 2(2), 207-16
19. Tai M., Stephanopoulos G. (2013) Metab Eng. 15,1-9 doi: 10.1016/j.ymben.2012.08.007
20. Darvishi F., Ariana M. et al. (2018). Appl Microbiol Biotechnol, 102(14), 5925-5938. doi: 10.1007/s00253-018-9099-x
21. Curran K.A., Morse N.J. et al. (2015). ACS Synth Biol, 4(7), 824-832. doi:10.1021/sb5003357
22. Larroude M., Park Y.K. et al. (2019). Microb Biotechnol, 12(6), 1249-1259. doi:10.1111/1751-7915.13427
23. EP 2 649 887 B1
24. Yeast Metabolic Engineering: Methods and Protocols, Methods in Molecular Biology. 2014, 1152, 43-62. doi:10.1007/978-1-4939-0563-8_3
25. Berardi E., Thomas D.Y. (1990) Current Genetics 18, 169-170. doi:10.1007/BF00312606
26 http://www.biotech-jr.ru/suppI/Suppl_37_3_Taratynova_ru.doc
27. Gibson D.G. (2011). Enzymatic assembly of overlapping DNA fragments. Methods Enzymol, 498, 349-361. doi:10.1016/B978-0-12-385120-8.00015-2
28. Taratynova M.O., Kosikhina Y.M. et al. (2021). Biotekhnologiya, 37, 29-41. doi: 10.21519/0234-2758-2021-37-3-29-41
29. Blazeck J., Liu L. et al. (2011). Appl Environ Microbiol, 77(22), 7905-7914. doi:10.1128/AEM.05763-11
30. Schwartz С.M., Hussain M.S. et al. (2016). ACS Synth Biol, 5(4), 356-359. doi: 10.1021/acssynbio.5b00162
31. Labun K., Montague T.G. et al. (2016). CHOPCHOP v2: a web tool for the next generation of CRISPR genome engineering. Nucleic Acids Res, 44(W1), W272-276. doi:10.1093/nar/gkw398
32. Barnett J.A. et al. "Yeasts characteristics and identification", Cambridge, 1983
33. Arnesen J.A., Kildegaard K.R. et al. (2020). Front Bioeng Biotechnol, 8, 945. doi: 10.33 89/fbioe.2020.00945
34. Larroude M., Celinska E. et al. (2018). Biotechnol Bioeng, 115(2), 464-472. doi:10.1002/bit.26473
| название | год | авторы | номер документа |
|---|---|---|---|
| Трансформант дрожжей Yarrowia lipolytica, продуцирующий кантаксантин | 2023 |
|
RU2827562C1 |
| Трансформант дрожжей Yarrowia lipolytica, продуцирующий линалоол | 2022 |
|
RU2809554C1 |
| Штамм дрожжей Yarrowia lipolytica - продуцент линалоола | 2023 |
|
RU2819537C1 |
| Промотор для экспрессии генов и его использование при конструировании трансформанта дрожжей Yarrowia lipolytica, продуцирующего β-каротин | 2022 |
|
RU2819535C1 |
| Способ повышения продукции изолимонной кислоты у дрожжей Yarrowia lipolytica, дрожжи вида Yarrowia lipolytica, обладающие способностью к продукции изолимонной кислоты | 2018 |
|
RU2713124C2 |
| ДРОЖЖИ РОДА YARROWIA, ОБЛАДАЮЩИЕ СПОСОБНОСТЬЮ ВНУТРИКЛЕТОЧНО НАКАПЛИВАТЬ СЛОЖНЫЕ ЭФИРЫ ЖИРНЫХ КИСЛОТ, И СПОСОБ МИКРОБИОЛОГИЧЕСКОГО СИНТЕЗА ТАКИХ ЭФИРОВ | 2013 |
|
RU2539744C1 |
| МУЛЬТИЗИМЫ И ИХ ИСПОЛЬЗОВАНИЕ В ПОЛУЧЕНИИ ПОЛИНЕНАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ | 2008 |
|
RU2517608C2 |
| ИНТЕГРАТИВНЫЙ ВЕКТОР Random-URA3-RPT ДЛЯ ПОСЛЕДОВАТЕЛЬНОГО ВВЕДЕНИЯ МНОЖЕСТВЕННЫХ КОПИЙ ГЕНЕТИЧЕСКИХ ЭЛЕМЕНТОВ В ДРОЖЖИ Yarrowia lipolytica | 2006 |
|
RU2376376C2 |
| НУКЛЕОТИДНАЯ ПОСЛЕДОВАТЕЛЬНОСТЬ ГЕНА XPR 2 YARROWIA LIPOLYTICA (ВАРИАНТЫ), ШТАММ ДРОЖЖЕЙ YARROWIA LIPOLYTICA (ВАРИАНТЫ) | 1986 |
|
RU2157845C2 |
| РЕКОМБИНАНТНЫЙ ШТАММ ДРОЖЖЕЙ YARROWIA-LIPOLYTICA - ПРОДУЦЕНТ ЛИПАЗЫ | 2011 |
|
RU2451075C1 |








Изобретение относится к области биотехнологии и может быть использовано для получения каротиноидов. Предложены варианты полинуклеотида, обладающие активностью фитоен синтазы и геранилгеранилпирофосфат синтазы. Указанные полинуклеотиды используют для получения трансформантов дрожжей Yarrowia lipolytica, продуцирующих β-каротин, кантаксантин или астаксантин. Изобретение обеспечивает увеличение продукции каротиноидов. 10 н.п. ф-лы, 14 ил., 10 табл., 9 пр.
1. Полинуклеотид, кодирующий полипептид, обладающий активностью фитоен синтазы и геранилгеранилпирофосфат синтазы, имеющий нуклеотидную последовательность, приведенную в перечне последовательностей под номером SEQ ID NO: 1, или последовательность, обладающую, по меньшей мере, 70% гомологией к ней, при условии сохранения указанной активности.
2. Полинуклеотид, кодирующий полипептид, обладающий активностью фитоен синтазы и геранилгеранилпирофосфат синтазы, имеющий нуклеотидную последовательность, приведенную в перечне последовательностей под номером SEQ ID NO: 2, или последовательность, обладающую, по меньшей мере, 70% гомологией к ней, при условии сохранения указанной активности.
3. Способ получения трансформанта дрожжей Yarrowia lipolytica, продуцирующего β-каротин, включающий введение в штамм-реципиент, относящийся к линии штамма дрожжей Yarrowia lipolytica W29, гена CarB Mucor circinelloides, кодирующего фитоендегидрогеназу, гена CarRP Mucor circinelloides, кодирующего бифункциональный фермент фитоен синтазу/ликопин β-циклазу, гена HMGR1 Yarrowia lipolytica, кодирующего фермент 3-гидрокси-3-метилглютарил-кофермент А редуктазу, гена ERG20 Yarrowia lipolytica, кодирующего фарнезилпирофосфатсинтазу, гена ERG12 Yarrowia lipolytica, кодирующего мевалонаткиназу, а также полинуклеотида по п. 1 и/или полинуклеотида по п. 2.
4. Способ получения трансформанта дрожжей Yarrowia lipolytica, продуцирующего кантаксантин, включающий введение в штамм-реципиент, относящийся к линии штамма дрожжей Yarrowia lipolytica W29, гена CarB Mucor circinelloides, кодирующего фитоендегидрогеназу, гена CarRP Mucor circinelloides, кодирующего бифункциональный фермент фитоен синтазу/ликопин β-циклазу, гена HMGR1 Yarrowia. lipolytica, кодирующего фермент 3-гидрокси-3-метилглютарил-кофермент А редуктазу, гена ERG20 Yarrowia lipolytica, кодирующего фарнезилпирофосфатсинтазу, гена ERG12 Yarrowia lipolytica, кодирующего мевалонаткиназу, гена НрВКТ Haematococcus pluvialis, кодирующего бета-каротин кетолазу, а также полинуклеотида по п. 1 и/или полинуклеотида по п. 2.
5. Способ получения трансформанта дрожжей Yarrowia lipolytica, продуцирующего астаксантин, включающий введение в штамм-реципиент, относящийся к линии штамма дрожжей Yarrowia lipolytica W29, гена CarB Mucor circinelloides, кодирующего фитоендегидрогеназу, гена CarRP Mucor circinelloides, кодирующего бифункциональный фермент фитоен синтазу/ликопин β-циклазу, гена HMGR1 Yarrowia lipolytica, кодирующего фермент 3-гидрокси-3-метилглютарил-кофермент А редуктазу, гена ERG20 Yarrowia lipolytica, кодирующего фарнезилпирофосфатсинтазу, гена ERG12 Yarrowia lipolytica, кодирующего мевалонаткиназу, гена HpBKT Haematococcus pluvialis, кодирующего бета-каротин кетолазу, гена HpCrtZ Haematococcus pluvialis, кодирующего бета-каротин гидроксилазу, а также полинуклеотида по п. 1 и/или полинуклеотида по п. 2.
6. Трансформант дрожжей Yarrowia lipolytica, продуцирующий каротиноид β-каротин, содержащий в составе хромосомы, по крайней мере, по одной копии каждого из следующих генов, ген CarB Mucor circinelloides, кодирующий фитоендегидрогеназу, ген CarRP Mucor circinelloides, кодирующий бифункциональный фермент фитоен синтазу/ликопин β-циклазу, ген HMGR1 Yarrowia lipolytica, кодирующий фермент 3-гидрокси-3-метилглютарил-кофермент А редуктазу, ген ERG20 Yarrowia lipolytica, кодирующий фарнезилпирофосфатсинтазу, ген ERG12 Yarrowia lipolytica, кодирующий мевалонаткиназу, а также полинуклеотида по п. 1 и/или полинуклеотида по п. 2.
7. Трансформант дрожжей Yarrowia lipolytica, продуцирующий каротиноид кантаксантин, содержащий в составе хромосомы, по крайней мере, по одной копии каждого из следующих генов, ген НрВКТ Haematococcus pluvialis, кодирующий β-каротин кетолазу, ген CarB Mucor circinelloides, кодирующий фитоендегидрогеназу, ген CarRP Mucor circinelloides, кодирующий бифункциональный фермент фитоен синтазу/ликопин β-циклазу, ген HMGR1 Yarrowia lipolytica, кодирующий фермент 3-гидрокси-3-метилглютарил-кофермент А редуктазу, ген ERG20 Yarrowia lipolytica, кодирующий фарнезилпирофосфатсинтазу, ген ERG12 Yarrowia lipolytica, кодирующий мевалонаткиназу, а также полинуклеотида по п. 1 и/или полинуклеотида по п. 2.
8. Трансформант дрожжей Yarrowia lipolytica, продуцирующий каротиноид астаксантин, содержащий в составе хромосомы, по крайней мере, по одной копии каждого из следующих генов, ген HpBKT Haematococcus pluvialis, кодирующий β-каротин кетолазу, ген HpcrtZ Haematococcus pluvialis, кодирующий β-каротин-3-гидроксилазу, ген CarB Mucor circinelloides, кодирующий фитоендегидрогеназу, ген CarRP Mucor circinelloides, кодирующий бифункциональный фермент фитоен синтазу/ликопин β-циклазу, ген HMGR1 Yarrowia lipolytica, кодирующий фермент 3-гидрокси-3-метилглютарил-кофермент А редуктазу, ген ERG20 Yarrowia lipolytica, кодирующий фарнезилпирофосфатсинтазу, ген ERG12 Yarrowia lipolytica, кодирующий мевалонаткиназу, а также полинуклеотида по п. 1 и/или полинуклеотида по п. 2.
9. Рекомбинантный штамм дрожжей Yarrowia lipolytica ВКПМ Y-4950 - продуцент β-каротина.
10. Рекомбинантный штамм дрожжей Yarrowia lipolytica ВКПМ Y-4871 - продуцент астаксантина.
| TRAMONTIN L.R.R | |||
| ET AL | |||
| Enhancement of Astaxanthin Biosynthesis in Oleaginous Yeast Yarrowia lipolytica via Microalgal Pathway | |||
| Microorganisms | |||
| Станок для придания концам круглых радиаторных трубок шестигранного сечения | 1924 |
|
SU2019A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Найдено онлайн: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6843682/ Дата обращения 13.09.2022 | |||
| ZHANG X.K | |||
| ET AL | |||
| Metabolic engineering of | |||
Авторы
Даты
2023-04-26—Публикация
2021-12-15—Подача