Область техники
Настоящее изобретение относится к микробиологической промышленности, а именно к способу получения изолимонной кислоты с использованием в качестве продуцента дрожжей вида Yarrowia lipolytica, модифицированных методами генной инженерии.
Предшествующий уровень техники
Возрастающий интерес к продукции природного изомера изолимонной кислоты (трео-Ds(+)-изолимонная кислота) связан с использованием данной органической кислоты в фармацевтической и пищевой промышленностях [1]. Было показано, что изолимонная кислота является регулятором энергетического обмена, благодаря чему проявляет антигипоксические, антиоксидантные и антистрессовые свойства, и может быть использована для профилактики и лечения гипоксии [2]. Изолимонная кислота является одним из маркеров, используемых для определения подлинности и качества фруктовых продуктов [3].
В результате химического синтеза получается смесь из четырех стереоизомеров изолимонной кислоты, включая природный изомер трео-Ds(+)-изолимонная кислота, при этом, стереоизомеры представляют собой ингибиторы клеточных ферментов. На настоящий момент развития технологии разделить синтезированную смесь стереоизомеров нельзя, поэтому химический синтез не может быть использован для фармацевтических и пищевых целей.
Существуют способы получения исключительно природного изомера изолимонной кислоты из растительного сырья. Однако данный подход имеет следующие ограничения: зависимость от урожайности сырья, необходимость в обширных территориях для посева, зависимость от климатических факторов. С 1980 года фирма «Sigma-Aldrich» производит изолимонную кислоту, выделяя ее из сока специально культивируемого растения Sedum spectabile (Очиток удивительный). Однако, цена на полученный таким образом продукт слишком высока (704 доллара за 1 г монокалиевой соли изолимонной кислоты), что делает биосинтез на базе растений не доступным для широкого применения [4].
В настоящее время перспективной является разработка технологии получения изолимонной кислоты с использованием микроорганизмов. Микробиологический синтез также позволяет получить исключительно природный изомер, является сравнительно быстрым и простым способом, что снижает себестоимость изолимонной кислоты и делает продукт доступным и рентабельным для дальнейшего использования.
Способность продуцировать изолимонную кислоту была продемонстрирована у мицелиального гриба вида Penicillium purpurogenum, представителей дрожжей Candida ravautii, Candida catenulate, а также Yarrowia lipolytica [4]. Среди указанных микроорганизмов дрожжи Y. lipolytica являются наиболее физиологически и генетически изученными, для них разработаны технологии промышленной ферментации, системы генетической трансформации, подходы для экспрессии и инактивации генов, секвенирован геном [5].
В условиях избытка источника углерода и лимита по азоту дрожжи Y. lipolytica секретируют в среду культивирования смесь лимонной (ЛК) и изолимонной кислот (ИЛК). Следует отметить, что источник углерода определяет соотношение концентраций изолимонной и лимонной кислоты (ИЛК/ЛК) в их смеси. Так, при культивировании на глюкозе Y. lipolytica продуцируют преимущественно лимонную кислоту с концентрацией до 62 г/л, при этом концентрация изолимонной кислоты не превышает 7 г/л [6]. При культивировании на растительных маслах разные природные изоляты дрожжей Y. lipolytica продуцируют органические кислоты с соотношением ИЛК/ЛК в диапазоне от 0.43:1 до 1.59:1 [4]. Оптимизируя параметры культивирования в ферментере, удалось подобрать условия, позволяющие повысить данное соотношение до 2.1:1 [4]. Добавление итаконовой кислоты в качестве ингибитора глиоксилатного цикла при культивировании в ферментере с рапсовым маслом позволило повысить продукцию изолимонной кислоты до 82.7 г/л при культивировании, а соотношение ИЛК/ЛК до 4.9:1 [7].
В настоящее время актуальной задачей является расширение арсенала биотехнологических способов повышения продукции изолимонной кислоты методами генной инженерии в дрожжах Y. lipolytica.
Краткое описание изобретения
Предложен способ повышения продукции изолимонной кислоты у дрожжей вида Y. lipolytica путем увеличения пула митохондриального транспортера изоцитрата за счет усиления уровня экспрессии гена Y. lipolytica YALI0E34672g, кодирующего митохондриальный транспортер YALI0E34672p, участвующий в экспорте изоцитрата из митохондрии.
Суть данного изобретения заключается в следующем.
Изоцитрат синтезируется в митохондрии в цикле Кребса посредством реакции изомеризации цитрата в изоцитрат, катализируемой ферментом аконитазой. В условиях избытка источника углерода и лимита по азоту происходит частичное торможение следующего этапа цикла Кребса - окислительного декарбоксилирования изоцитрата, катализируемого ферментом изоцитратдегидрогеназой (Idh), что приводит к накоплению интермедиантов цикла Кребса изоцитрата и цитрата в митохондрии (фиг. 1) [8]. Внутренняя мембрана митохондрии непроницаема для крупных молекул, таких как органические кислоты, аминокислоты, нуклеотиды, коферменты и кофакторы. Транспортную функцию данных молекул через мембрану осуществляет особая группа белков - митохондриальные транспортеры [9]. Нами установлено, что митохондриальным транспортером, обладающим сродством к изоцитрату, является белок YALI0E34672p.Так как данный белок имеет 65% гомологии к митохондриальному транспортеру S. cerevisiae Sfc1p [9, 10], то в соответствие с принятой международной номенклатурой он назван YlSfc1p, а кодирующий его ген YALI0E34672g назван YISFC1.
Показано, что, повышая уровень экспрессии данного гена, можно добиться повышения продукции изолимонной кислоты и соотношения ИЛК/ЛК дрожжами вида Y. lipolytica.
Из литературных данных известно, что повысить уровень экспрессии гена можно как посредством увеличения числа копий гена [11], так и посредством замены нативного промотора гена на более сильный промотор [11, 12]. Однако лучшего результата можно добиться путем совместного использования обоих подходов [11].
Таким образом, технической задачей, на решение которой направлено представленное изобретение является расширение арсенала способов повышения продукции изолимонной кислоты у дрожжей вида Yarrowia lipolytica, а также расширение арсенала дрожжей вида Yarrowia lipolytica, обладающих способностью к продукции изолимонной кислоты в условиях избытка источника углерода и лимита по азоту.
Поставленная задача решена тем, что предложен способ повышения продукции изолимонной кислоты у дрожжей вида Y. lipolytica в условиях избытка источника углерода и лимита по азоту путем повышения уровня экспрессии гена Y. lipolytica YALI0E34672g за счет увеличения числа копий гена и/или замены нативного промотора указанного гена на более сильный промотор.Поставленная задача решена также тем, что получены дрожжи вида Y. lipolytica, продуцирующие изолимонную кислоту в условиях избытка источника углерода и лимита по азоту, модифицированные таким образом, что в них увеличено число копий гена Y. lipolytica YALI0E34672g и/или усилена промоторная область указанного гена.
Показано, что дрожжи, полученные заявленным способом, обладают повышенной продукцией изолимонной кислоты и более высоким уровнем соотношения концентраций изолимонной кислоты к лимонной кислоте по сравнению с исходной культурой.
Краткое описание рисунков
Изобретение проиллюстрировано следующими фигурами графического изображения:
Фиг. 1 Схема синтеза изолимонной и лимонной кислот в дрожжах Yarrowia lipolytica
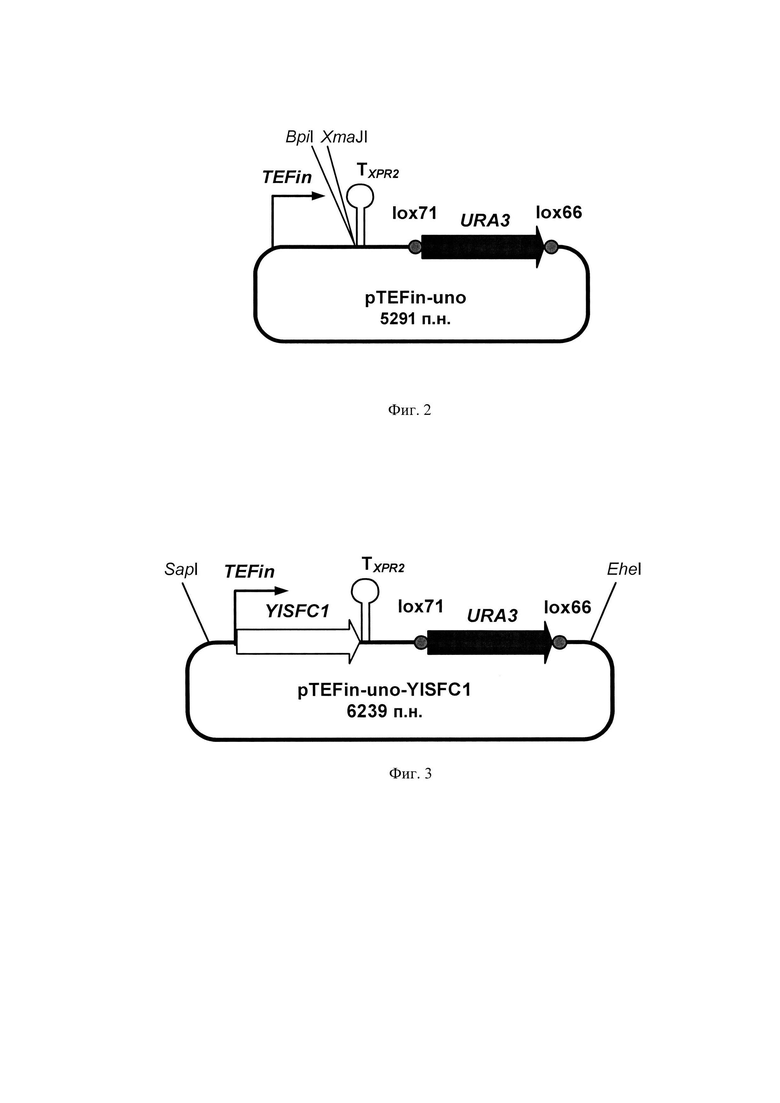
Фиг. 2 Схема экспрессионного вектора pTEFin-uno
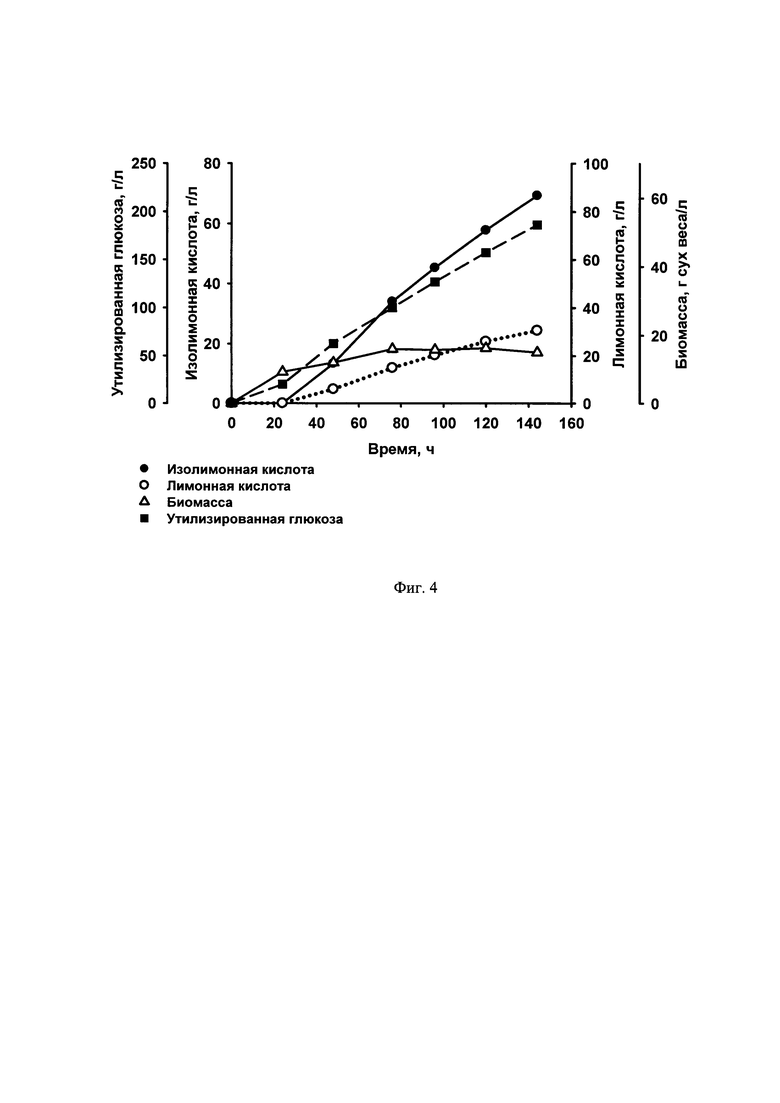
Фиг. 3 Схема генетической конструкции pTEFin-uno-YlSFC1
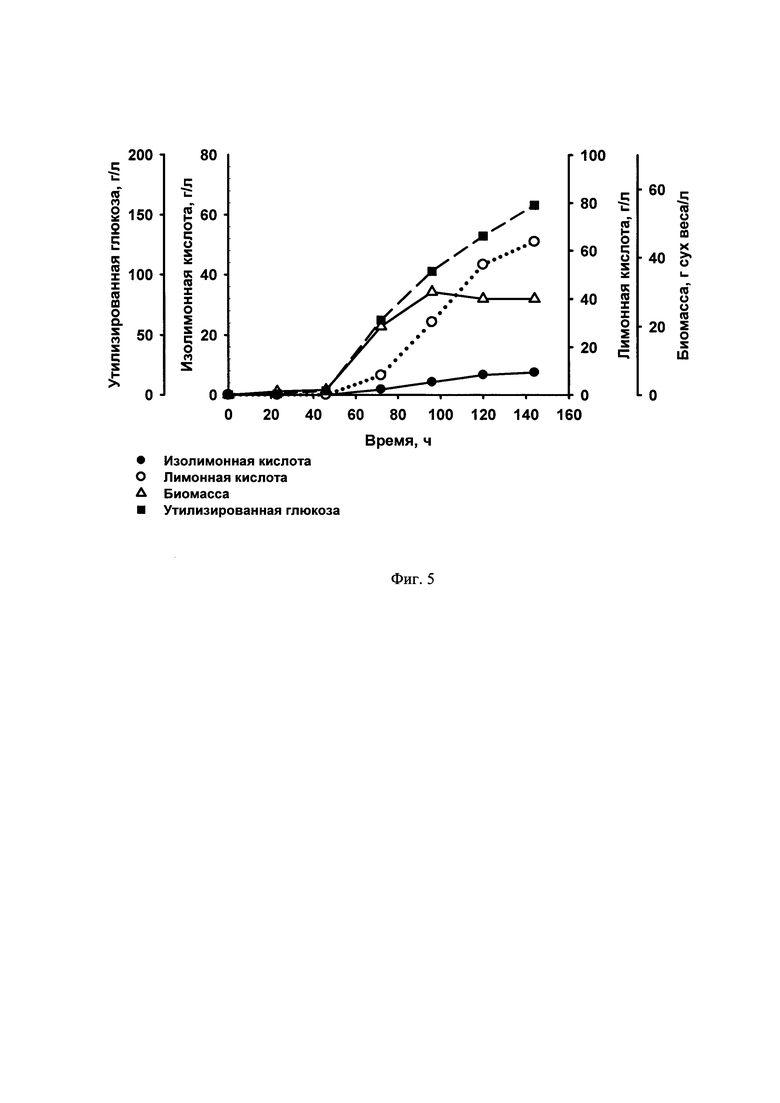
Фиг. 4 Утилизация глюкозы, накопление биомассы и продукция изолимонной и лимонной кислот при культивировании в 1-л ферментере штамма ВКПМ Y-4395.
Фиг. 5 Утилизация глюкозы, накопление биомассы и продукция изолимонной и лимонной кислот при культивировании в 1-л ферментере дикого штамма ВКПМ Y-3178.
Примеры.
Пример 1. Получение дрожжей Y. lipolytica с усиленной экспрессией гена 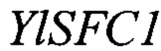
Для проведения экспериментов использовали дикий штамм Yarrowia lipolytica W29, депонированный в БРЦ ВКПМ НИЦ «Курчатовский институт» - ГосНИИ Генетика под регистрационным номером ВКПМ Y-3178.
1.1 Конструирование экспрессионного вектора pTEF-uno
Промотор гена TEF, кодирующего фактор элонгации трансляции Y. lipolytica, содержащий интрон (TEFin), амплифицируют с геномной ДНК природного изолята Y. lipolytica БРЦ ВКПМ Y-3178 с помощью метода ПЦР с использованием Pfu-полимеразы (#ЕР0502, Thermo Scientific) и праймеров:
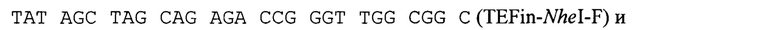
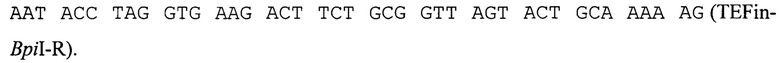
ПЦР-продукт TEFin размером 560 п. н. очищают после электрофореза в 1% агарозном геле методом экстракции ДНК (Kit #K0513, Thermo Scientific) и лигируют на вектор pUC19, обработанный эндонуклеазой рестрикции 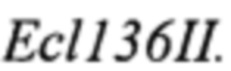 Лигазную смесь трансформируют в штамм Е. coli XL1 (Blue). Белые клоны, содержащие необходимую вставку амплифицированной ДНК, отбирают на чашках с добавлением Xgal и IPTG по стандартному тесту на отсутствие активности β-галактозидазы и по устойчивости к ампициллину. Плазмидную ДНК, выделенную из полученных клонов, проверяют рестрикционным анализом и секвенируют (стандартные праймеры M13F, M13R). Полученная плазмида размером 3238 п. н. названа pUC-TEFin.
Лигазную смесь трансформируют в штамм Е. coli XL1 (Blue). Белые клоны, содержащие необходимую вставку амплифицированной ДНК, отбирают на чашках с добавлением Xgal и IPTG по стандартному тесту на отсутствие активности β-галактозидазы и по устойчивости к ампициллину. Плазмидную ДНК, выделенную из полученных клонов, проверяют рестрикционным анализом и секвенируют (стандартные праймеры M13F, M13R). Полученная плазмида размером 3238 п. н. названа pUC-TEFin.
Терминатор Txpr получают путем обработки вектора pUC-Txpr (RU 2355754) эндонуклеазами рестрикции XbaI и XmaJI, очищают после электрофореза в 1% агарозном геле и лигируют на вектор pUC-TEFin, обработанный эндонуклеазой рестрикции XmaJI и щелочной фосфатазой (#EF0651, Thermo Scientific). Лигазную смесь трансформируют в Е. coli XL1 (Blue). Клоны, содержащие необходимую вставку, отбирают на чашках по устойчивости к ампициллину. Плазмидную ДНК, выделенную из полученных клонов, проверяют рестрикционным анализом. Полученная плазмида размером 3378 п. н. названа pUC-TEFin-Txpr.
Ген, кодирующий оротидин-5-фосфат-декарбоксилазу URA3, экранированный сайтами узнавания рекомбиназы Cre фага Р1 (lox66, lox71) амплифицируют методом ПЦР с использованием праймеров


ПЦР-продукт очищают после электрофореза в 1% агарозном геле и лигируют на вектор pUC19, обработанный эндонуклеазой рестрикции 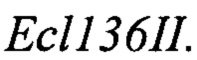 Лигазную смесь трансформируют в Е. coli XL1 (Blue). Белые клоны, содержащие необходимую вставку амплифицированной ДНК, отбирают на чашках с добавлением Xgal и IPTG. Плазмидную ДНК, выделенную из полученных клонов, проверяют рестрикционным анализом и секвенируют (стандартные праймеры M13F, M13R). Полученную плазмиду pUC-URAlox, размером 4162 п. н. обрабатывают эндонуклеазами рестрикции XbaI и EcoO109I. Полученный в результате ДНК-фрагмент lox66-URA3-lox71 выделяют после электрофореза в 1% агарозном геле, обрабатывают Pfu-полимеразой для получения тупых концов и лигируют на вектор pUC-TEFin-Txpr, обработанный эндонуклеазой рестрикции EcoO109I, Pfu-полимеразой и щелочной фосфатазой. Лигазную смесь трансформируют в Е. coli XL1(Blue). Плазмидную ДНК, выделенную из полученных клонов, проверяют рестрикционным анализом. Полученная плазмида, размером 5291 п. н. названа pTEFin-uno (фиг. 2).
Лигазную смесь трансформируют в Е. coli XL1 (Blue). Белые клоны, содержащие необходимую вставку амплифицированной ДНК, отбирают на чашках с добавлением Xgal и IPTG. Плазмидную ДНК, выделенную из полученных клонов, проверяют рестрикционным анализом и секвенируют (стандартные праймеры M13F, M13R). Полученную плазмиду pUC-URAlox, размером 4162 п. н. обрабатывают эндонуклеазами рестрикции XbaI и EcoO109I. Полученный в результате ДНК-фрагмент lox66-URA3-lox71 выделяют после электрофореза в 1% агарозном геле, обрабатывают Pfu-полимеразой для получения тупых концов и лигируют на вектор pUC-TEFin-Txpr, обработанный эндонуклеазой рестрикции EcoO109I, Pfu-полимеразой и щелочной фосфатазой. Лигазную смесь трансформируют в Е. coli XL1(Blue). Плазмидную ДНК, выделенную из полученных клонов, проверяют рестрикционным анализом. Полученная плазмида, размером 5291 п. н. названа pTEFin-uno (фиг. 2).
1.2 Получение генетической конструкции pTEF-uno-YlSFC1
Ген 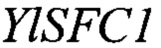 амплифицируют методом ПЦР с геномной ДНК штамма БРЦ ВКПМ Y-3178 по праймерам:
амплифицируют методом ПЦР с геномной ДНК штамма БРЦ ВКПМ Y-3178 по праймерам:
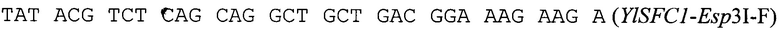 и
и
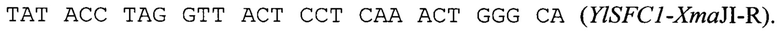
ПЦР-продукт размером 977 п. н. обрабатывают эндонуклеазами рестрикции Esp3I и XmaJI, очищают после электрофореза в 1% агарозном геле методом экстракции ДНК и лигируют на вектор pTEFin-uno, обработанный эндонуклеазами рестрикции BpiI и XmaJI. Лигазную смесь трансформируют в Е. coli XL1(Blue). Плазмидную ДНК, выделенную из полученных клонов, проверяют рестрикционным анализом и секвенируют. Полученная плазмида размером 6239 п. н. названа pTEFin-uno-YlSFC1 (фиг. 3).
1.3 Получение дрожжей Y. lipolytica с усиленным уровнем экспрессии гомологичного гена 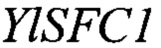
Методом, описанным в [11] на базе штамма ВКПМ Y-3178 получают ауксотрофный по урацилу штамм ВКПМ Y-3178 URA3-, депонированный в БРЦ ВКПМ под регистрационным номером ВКПМ Y-3372.
Генетическую конструкцию pTEFin-uno-YlSFC1 обрабатывают эндонуклеазами рестрикции SapI и EheI и 2 мкг полученной экспрессионной кассеты TEFin-uno-YlSFC1 используют для трансформации штамма Y. lipolytica БРЦ ВКПМ Y-3372 метод электропорации [12]. Трансформанты отбирают на минимальной среде YNBD (Himedia G091 с добавлением глюкозы 20 г/л) по прототрофности к урацилу. Полученные дрожжи обладают усиленным уровнем экспрессии гена Y. lipolytica 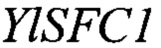 .
.
Культивирование отобранных трансформантов проводят в трех независимых повторностях в пробирках (50 мл) с рабочим объемом 10 мл при 30°С и постоянном перемешивании (250 об/мин) в течение 5 суток в среде YNBD9N0.2 (Himedia M151 с добавлением глюкозы 90 г/л, (NH4)2SO4 2 г/л, 100мМ калий фосфатного буфера рН=6.8). В качестве контроля используют исходный родительский дикий штамм ВКПМ Y-3178. На 2 сутки культивирования для поддержания рН добавляют мел 200 мг. Пробы отбирают на 5 сутки культивирования. К культуральной жидкости добавляют равный объем 1М HCl, центрифугируют 1 мин 14500 об/мин, супернатант переносят в новый эппендорф и делают необходимые разведения. Количество продуцируемых изолимонной и лимонной кислот в супернатанте определяют с помощью высокоэффективной жидкостной хроматографии. В результате культивирования выявлено, что полученные дрожжи, обладающие усиленным уровнем экспрессии гена Y. lipolytica 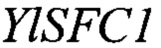 , способны к продукции изолимонной кислоты.
, способны к продукции изолимонной кислоты.
Исходя из уровня продукции изолимонной кислоты, отбирают лучший трансформант W29 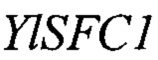 №19, который продуцирует 33.9 г/л изолимонной кислоты, что в 4 раза выше уровня продукции изолимонной кислоты диким штаммом ВКПМ Y-3178 (табл. 1).
№19, который продуцирует 33.9 г/л изолимонной кислоты, что в 4 раза выше уровня продукции изолимонной кислоты диким штаммом ВКПМ Y-3178 (табл. 1).
Соотношение ИЛК/ЛК, продуцируемых штаммом W29  при культивировании на глюкозе в качестве единственного источника углерода, составляет 2.2:1, тогда как данный параметр для дикого штамма равен 0.3:1 (табл. 1). Следует отметить, что данные результаты впервые демонстрируют продукцию изолимонной кислоты как основную органическую кислоту при культивировании на глюкозе дрожжами Y. lipolytica.
при культивировании на глюкозе в качестве единственного источника углерода, составляет 2.2:1, тогда как данный параметр для дикого штамма равен 0.3:1 (табл. 1). Следует отметить, что данные результаты впервые демонстрируют продукцию изолимонной кислоты как основную органическую кислоту при культивировании на глюкозе дрожжами Y. lipolytica.
Сконструированный штамм W29 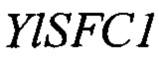 №19 депонирован в БРЦ ВКПМ НИЦ «Курчатовский институт» - ГосНИИ Генетика (117545 Москва, 1-ый Дорожный пр-д, д.1) и имеет регистрационный номер ВКПМ Y-4395.
№19 депонирован в БРЦ ВКПМ НИЦ «Курчатовский институт» - ГосНИИ Генетика (117545 Москва, 1-ый Дорожный пр-д, д.1) и имеет регистрационный номер ВКПМ Y-4395.
Сконструированный штамм Y. lipolytica ВКПМ Y- характеризуется следующими признаками:
1. Культурально-морфологические признаки
Суточная культура в жидкой среде YPD (мас. %: дрожжевой экстракт 1, пептон 2, глюкоза 2) представлена овальными, удлиненно-овальными, округлыми клетками размером 4.6-6.0×4.5-12.5 мкм. Почкование полярное или латеральное, на узком основании. К третьим суткам большинство клеток почкуются и образуют псевдомицелий. Колонии на агаризованной среде YPD кремового цвета, пастообразные, слегка приподнятые в центре, морщинистые, с фестончатым краем. Штрих на агаризованной среде YPD непрерывный, плоский, блестящий, кремово-белого цвета, пастообразный, края ровные, со временем становится складчатым. Спор не образует.
2. Физиолого-биохимические признаки
Облигатный аэроб. Сахара не сбраживает. Ассимилирует глюкозу, глицерин, этанол, ацетат, гидрофобные субстраты. Не ассимилирует: мальтозу, лактозу, целлобиозу, трегалозу, мелибиозу, раффинозу, мелицитозу, инулин, крахмал, D-ксилозу, L- и D-арабинозу, раммозу, дульцит, инозит, D-глюкозамин и глюкуроновую, 2-кетоглюконовую, 5-кетоглюконовую кислоты. Не ассимилирует нитраты. Не растет в безвитаминной среде, требует тиамин, не требует биотин. Оптимальное значение рН для роста 5,5-7,0. Не растет при 37°С. Максимальная температура роста 35°С.
Пример 2. Культивирование штамма Y. lipolytica ВКПМ Y-4395 в малом объеме с разными источниками углерода
Штамм ВКПМ Y-4395 культивируют в пробирках (50 мл) как описано в примере 1.3 в средах следующего состава:
YNBOo9N0.2 - Himedia M151, с добавлением эмульсии оливкового масла до конечной концентрации 9% (v/v), (NH4)2SO4 0.2%, 100 мМ калий фосфатного буфера рН=6.8. Оливковое масло эмульгируют с водой с помощью твина 40 (50% v/v оливкового масла, 1% v/v твина 40);
YNBG9N0.2 - Himedia M151 с добавлением глицерина 9%, (NH4)2SO4 0.2%, 100 мМ калий фосфатного буфера рН=6.8.
Подготовка проб и анализ ведут как описано в примере 1.3.
Результаты представлены в табл. 1. Как видно из табл. 1 при культивировании с оливковым маслом в качестве источника углерода штамм ВКПМ Y-4395 продуцирует 32.0 г/л изолимонной кислоты, что превосходит продукцию изолимонной кислоты контрольным диким штаммом ВКПМ Y-3178 в 1.7. Соотношение ИЛК/ЛК при культивировании на оливковом масле составляет 2.3:1. Данный параметр для контрольного штамма ВКПМ Y-3178 равен 1:1.
При культивировании с глицерином в качестве источника углерода штамм ВКПМ Y-4395 продуцирует 43.3 изолимонной кислоты, соответственно, что превосходит продукцию изолимонной кислоты диким штаммом ВКПМ Y-3178 в 6.3 раза, соответственно (табл. 1). Соотношение ИЛК/ЛК при культивировании на глицерине составляет 3.7:1 для штамма ВКПМ Y-4395, тогда как данный параметр для дикого штамма равен 0.2:1 (Табл. 1).
Пример 3. Культивирование штамма Y. lipolytica ВКПМ Y-4395 в ферментере
Культивирование штамма ВКПМ Y-4395 проводят в 1-л ферментере Applikon BioBundle 1L с рабочим объемом 500 мл при температуре 29°С в минеральной среде следующего состава (мас. %): глюкоза 4, (NH4)2SO4 0.3, MgSO4⋅7H2O 0.14, NaCl 0.05, Ca(NO3)2 0.08, KH2PO4 0.2, K2HPO4 0.02, биотин 0.00005, тиамин 0.001. Концентрированный раствор микроэлементов следующего состава (мас. %): CuSO4⋅5H2O 0.6, KI 0.0088, MnSO4⋅5H2O 0.3, Н3ВО3 0.02, CoCl2⋅6H2O 0.0955, ZnSO4⋅7H2O 4.2, FeSO4⋅7H2O 6.5, H2SO4 0.5, готовится отдельно и вносится в количестве 4.6 мл на 1 л рабочего объема. В качестве пеногасителя используют адеканоль (0.1% v/v). Каждые 24 ч в ферментер вносится подпитка глюкозы (30 г/л). Раствор 5М NaOH используют для поддержания значения рН среды равного 5 на протяжении первых суток культивирования, затем значение рН=6 до конца культивирования. Уровень растворенного в среде кислорода составляет не менее 50%.
Подготовку посевной культуры проводят в два этапа:
- пересев штамма на агаризованную среду YPD;
- посев в жидкую среду YNBDbuf (YNBD с добавлением 100 мМ К-фостатного буфера) в колбы с общим объемом 750 мл и рабочим объемом 70 мл и инкубация в течение 24 ч при 30°С и постоянном перемешивании (250 об/мин).
Посевная культура вносится в ферментер в количестве 10% от рабочего объема. Отбор проб осуществляется каждые 24 ч.
В качестве контроля в аналогичных условиях проводят культивирование дикого штамма ВКПМ Y-3178.
Сконструированный штамм ВКПМ Y-4395 накапливает 69.4 г/л изолимонной кислоты за 144 ч культивирования, при этом соотношение концентраций изолимонной кислоты к лимонной кислоте составляет 2.3:1 (фиг. 4).
Контрольный дикий штамм БРЦ ВКПМ Y-3178 накапливает всего 7.5 г/л изолимонной кислоты на 144 ч культивирования, тогда как основным продуктом ферментации является лимонная кислота, концентрация которой составляет 63.8 г/л (фиг. 5). Соотношение концентраций изолимонной кислоты к лимонной кислоте составляет 0.1:1.
Представленное изобретение позволяет повысить продукцию изолимонной кислоты дрожжами Y. lipolytica на средах, содержащих широкий спектр субстратов, включая глюкозу, а также повысить соотношение концентраций изолимонной кислоты к лимонной кислоте, секретируемых в среду культивирования.
Список литературы
1. Aurich, A., et al., Microbiologically produced carboxylic acids used as building blocks in organic synthesis. Subcell Biochem, 2012. 64: p. 391-423.
2. Kamzolova, S.V., et al., The effect of oxalic and itaconic acids on threo-Ds-isocitric acid production from rapeseed oil by Yarrowia lipolytica. Bioresour Technol, 2016. 206: p. 128-133.
3. Karovicova, J., et al., Using capillary isotachophoresis for the determination of biogenic amines and D-isocitric acid in food products. Nahrung, 2003. 47(3): p. 188-90.
4. Kamzolova, S.V., et al., Isocitric acid production from rapeseed oil by Yarrowia lipolytica yeast. Appl Microbiol Biotechnol, 2013. 97(20): p. 9133-44.
5. Nicaud, J.M., Yarrowia lipolytica. Yeast, 2012. 29(10): p. 409-18.
6. Cavallo, E., et al., Yarrowia lipolytica: a model yeast for citric acid production. FEMS Yeast Res, 2017.17(8).
7. Kamzolova, S.V., et al., Fermentation Conditions and Media Optimization for Isocitric Acid Production from Ethanol by Yarrowia lipolytica. Biomed Res Int, 2018. 2018: p. 2543210.
8. Beopoulos, A., J.M. Nicaud, and C. Gaillardin, An overview of lipid metabolism in yeasts and its impact on biotechnological processes. Appl Microbiol Biotechnol, 2011. 90(4): p. 1193-206.
9. Palmieri, F., et al., Identification of mitochondrial carriers in Saccharomyces cerevisiae by transport assay of reconstituted recombinant proteins. Biochim Biophys Acta, 2006. 1757(9-10): p. 1249-62.
10. Bojunga, N., P. Kotter, and K.D. Entian, The succinate/fumarate transporter Acrlp of Saccharomyces cerevisiae is part of the gluconeogenic pathway and its expression is regulated by Cat8p. Mol Gen Genet, 1998. 260(5): p. 453-61.
11. Yuzbasheva, E.Y., et al., Co-expression of glucose-6-phosphate dehydrogenase and acyl-CoA binding protein enhances lipid accumulation in the yeast Yarrowia lipolytica. N Biotechnol, 2017.
12. Wang, J.-H., W. Hung, and S.-H. Tsai, High efficiency transformation by electroporation of Yarrowia lipolytica. The Journal of Microbiology, 2011. 49(3): p. 469-472.
| название | год | авторы | номер документа |
|---|---|---|---|
| Штамм дрожжей Yarrowia lipolytica, продуцирующий изолимонную кислоту | 2021 |
|
RU2757603C1 |
| Штамм дрожжей Yarrowia lipolytica - продуцент линалоола | 2023 |
|
RU2819537C1 |
| Трансформант дрожжей Yarrowia lipolytica, продуцирующий линалоол | 2022 |
|
RU2809554C1 |
| Модифицированная нуклеотидная последовательность, кодирующая полипептид, обладающий активностью фитоен синтазы и геранилгеранилпирофосфат синтазы (варианты), ее использование при конструировании трансформантов дрожжей Yarrowia lipolytica, продуцирующих каротиноиды | 2021 |
|
RU2794980C1 |
| Трансформант дрожжей Yarrowia lipolytica, продуцирующий кантаксантин | 2023 |
|
RU2827562C1 |
| ШТАММ ДРОЖЖЕЙ Yarrowia lipolytica - ПРОДУЦЕНТ ЛИПАЗЫ | 2007 |
|
RU2355754C1 |
| РЕКОМБИНАНТНЫЙ ШТАММ ДРОЖЖЕЙ YARROWIA-LIPOLYTICA - ПРОДУЦЕНТ ЛИПАЗЫ | 2011 |
|
RU2451075C1 |
| Промотор для экспрессии генов и его использование при конструировании трансформанта дрожжей Yarrowia lipolytica, продуцирующего β-каротин | 2022 |
|
RU2819535C1 |
| ШТАММ ДРОЖЖЕЙ Yarrowia lipolytica - ПРОДУЦЕНТ КЛЕТОЧНО-СВЯЗАННОЙ ЛИПАЗЫ | 2012 |
|
RU2475532C1 |
| РЕКОМБИНАНТНЫЙ ШТАММ ДРОЖЖЕЙ Yarrowia lipolytica - ПРОДУЦЕНТ ФИТАЗЫ | 2012 |
|
RU2504579C2 |
Группа изобретений относится к микробиологической промышленности. Предложен способ повышения продукции изолимонной кислоты в условиях избытка источника углерода и лимита по азоту с использованием дрожжей Yarrowia lipolytica, в которых усилен уровень экспрессии гена Y. lipolytica YALI0E34672g, кодирующий митохондриальный транспортер YALI0E34672p, участвующий в экспорте изоцитрата из митохондрии. Предложены также дрожжи вида Yarrowia lipolytica, продуцирующие изолимонную кислоту в условиях избытка источника углерода и лимита по азоту, у которых увеличено число копий гена Y. lipolytica YALI0E34672g и/или усилена промоторная область указанного гена. Группа изобретений обеспечивает повышение продукции изолимонной кислоты у дрожжей Yarrowia lipolytica. 2 н.п. ф-лы, 5 ил., 1 табл., 3 пр.
1. Способ повышения продукции изолимонной кислоты у дрожжей Yarrowia lipolytica в условиях избытка источника углерода и лимита по азоту путем повышения уровня экспрессии гена Y. lipolytica YALI0E34672g за счет увеличения числа копий гена и/или замены нативного промотора указанного гена на более сильный промотор.
2. Дрожжи вида Yarrowia lipolytica, продуцирующие изолимонную кислоту в условиях избытка источника углерода и лимита по азоту, отличающиеся тем, что в них увеличено число копий гена Y. lipolytica YALI0E34672g и/или усилена промоторная область указанного гена.
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| HOLZ M | |||
| ET AL | |||
| Aconitase overexpression changes the product ratio of citric acid production by Yarrowia lipolytica | |||
| Appl Microbiol Biotechnol | |||
| Колосоуборка | 1923 |
|
SU2009A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| PALMIERI L | |||
| ET AL | |||
| Identification of the Yeast Mitochondrial Transporter | |||
Авторы
Даты
2020-02-03—Публикация
2018-07-18—Подача