ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к фармацевтическим средствам, пригодным для терапии и/или профилактики у млекопитающего, к фармацевтической композиции, содержащей такие соединения, и к их применению в качестве ингибиторов белок-белковых взаимодействий менин-MLL, пригодных для лечения заболеваний, таких как рак, миелодиспластический синдром (MDS) и диабет.
ПРЕДПОСЫЛКИ К СОЗДАНИЮ ИЗОБРЕТЕНИЯ
Хромосомные перегруппировки, влияющие на ген, ассоциированный с лейкозом смешанного происхождения (MLL; MLL1; KMT2A), приводят в результате к агрессивным видам острого лейкоза среди всех возрастных групп, и все еще представляют собой практически неизлечимые заболевания, что подчеркивает срочную необходимость в новых терапевтических подходах. Виды острого лейкоза, предусматривающие такие хромосомные транслокации MLL, представляют собой лимфоидное, миелоидное или бифенотипное заболевание и составляют от 5 до 10% видов острого лейкоза у взрослых людей и примерно 70% у детей (Marschalek, Br J Haematol 2011. 152(2), 141-54; Tomizawa et al., Pediatr Blood Cancer 2007. 49(2), 127-32).
MLL представляет собой гистон-метилтрансферазу, которая метилирует гистон H3 по лизину 4 (H3K4) и выполняет функции в мультибелковых комплексах. Применение индуцибельных аллелей с потерей функции Mll1 продемонстрировало, что Mll1 играет важную роль в поддержании гемопоэтических стволовых клеток (HSC) и развитии B-клеток, хотя его гистон-метилтрансферазная активность является не существенной для кроветворения (Mishra et al., Cell Rep 2011. 7(4), 1239-47).
На сегодняшний день сообщалось о слиянии MLL с более 60 различными партнерами, и оно было ассоциировано с образованием/прогрессированием лейкоза (Meyer et al., Leukemia 2013. 27, 2165-2176). Интересно, что домен SET (Su(var)3-9, энхансер zeste и trithorax) MLL не сохраняется в химерных белках, но заменяется партнером по слиянию (Thiel et al., Bioessays 2012. 34, 771-80). Рекрутирование ферментов, модифицирующих хроматин, таких как Dot1L и/или комплекс pTEFb, партнером по слиянию приводит к усиленной транскрипции и транскрипционной элонгации генов-мишеней MLL, в том числе генов HOXA (например, HOXA9) и кофактора HOX MEIS1, как наиболее значимых. Аберрантная экспрессия данных генов, в свою очередь, блокирует дифференциацию гемопоэтических клеток и усиливает пролиферацию.
Менин, который кодируется геном, ассоциированным с множественной эндокринной неоплазией 1 типа (MEN1), экспрессируется повсеместно и преимущественно локализуется в ядре. Было показано, что он взаимодействует с многочисленными белками и, следовательно, вовлекается во множество клеточных процессов. Наиболее изученной функцией менина является его роль в качестве онкогенного кофактора белков слияния на основе MLL. Менин взаимодействует с двумя мотивами в N-концевом фрагменте MLL, который сохраняется во всех белках слияния, MBM1 (связывающий менин мотив 1) и MBM2 (Thiel et al., Bioessays 2012. 34, 771-80). Взаимодействие менин-MLL приводит к образованию новой поверхности взаимодействия для фактора роста эпителия хрусталика глаза (LEDGF). Хотя MLL непосредственно связывается с LEDGF, присутствие менина является обязательным для стабильного взаимодействия между MLL и LEDGF и ген-специфичного рекрутирования на хроматин комплекса MLL посредством домена PWWP LEDGF (Cermakova et al., Cancer Res 2014. 15, 5139-51; Yokoyama & Cleary, Cancer Cell 2008. 8, 36-46). Кроме того, многочисленные генетические исследования показали, что менин явно необходим для онкогенной трансформации с помощью белков слияния на основе MLL, что указывает на взаимодействие менин-MLL как на привлекательную терапевтическую мишень. Например, условная делеция Men1 предупреждает лейкомогенез в клетках-предшественниках костного мозга, эктопически экспрессирующих продукты слияния MLL (Chen et al., Proc Natl Acad Sci 2006. 103, 1018-23). Подобным образом, генетическое нарушение взаимодействия менин-продукт слияния MLL посредством мутаций с потерей функции подавляет онкогенные свойства белков слияния на основе MLL, блокирует развитие лейкоза in vivo и снимает блок дифференциации MLL-трансформированных лейкозных бластных клеток. Данные исследования также показали, что менин необходим для поддержания экспрессии гена HOX с помощью белков слияния на основе MLL (Yokoyama et al., Cell 2005. 123, 207-18). Кроме того, были разработаны низкомолекулярные ингибиторы взаимодействия менин-MLL, демонстрирующие, что данное белок-белковое взаимодействие является применимым в качестве мишени лекарственного средства, а также была продемонстрирована эффективность в доклинических моделях AML (Borkin et al., Cancer Cell 2015. 27, 589-602; Cierpicki and Grembecka, Future Med Chem 2014. 6, 447-462). Вместе с наблюдением, что менин не является необходимым кофактором MLL1 во время нормального кроветворения (Li et al., Blood 2013. 122, 2039-2046), такие данные обосновывают нарушение взаимодействия менин-MLL как перспективный новый терапевтический подход для лечения лейкоза с перестройкой MLL и других видов рака с активным профилем экспрессии гена HOX/MEIS1. Например, внутренняя частичная тандемная дупликация (PTD) в 5'-области гена MLL представляет собой другую основную аберрацию, которую обнаруживают преимущественно de novo и при вторичном AML, а также миелодиспластических синдромах. Хотя молекулярный механизм и биологическая функция MLL-PTD недостаточно хорошо понятны, новые терапевтические стратегии целенаправленного воздействия, влияющие на взаимодействие менин-MLL также могут оказаться эффективными в лечении связанных с MLL-PTD видов лейкоза. Кроме того, было показано, что кастрационно-резистентный рак предстательной железы зависит от взаимодействия менин-MLL (Malik et al., Nat Med 2015. 21, 344-52).
В нескольких литературных источниках описаны ингибиторы, целенаправленно воздействующие на взаимодействие менин-MLL: в WO 2011029054, J Med Chem 2016, 59, 892-913 описано получение производных тиенопиримидина и бензодиазепина; в WO 2014164543 описаны производные тиенопиримидина и тиенопиридина; в Nature Chemical Biology март 2012, 8, 277-284 и Ren, J.; et al. Bioorg Med Chem Lett (2016), 26(18), 4472-4476 описаны производные тиенопиримидина; в J Med Chem 2014, 57, 1543-1556 описаны производные гидрокси- и аминометилпиперидина; в Future Med Chem 2014, 6, 447-462 рассмотрены низкомолекулярные и пептидомиметические соединения; в WO 2016/195776 описаны производные фуро[2,3-d]пиримидина, 9H-пурина, [1,3]оксазоло[5,4-d]пиримидина, [1,3]оксазоло[4,5-d]пиримидина, [1,3]тиазоло[5,4-d]пиримидина, тиено[2,3-b]пиридина и тиено[2,3-d]пиримидина; и в WO 2016/197027 описаны производные 5,6,7,8-тетрагидропиридо[3,4-d]пиримидина, 5,6,7,8-тетрагидропиридо[4,3-d]пиримидина, пиридо[2,3-d]пиримидина и хинолина; и в WO 2016040330 описаны соединения тиенопиримидина и тиенопиридина. В WO 2017192543 описаны пиперидины в качестве ингибиторов менина. В WO 2017112768, WO 2017207387, WO 2017214367, WO 2018053267 и WO 2018024602 описаны ингибиторы взаимодействия менин-MLL. В WO 2017161002 и WO 2017161028 описаны ингибиторы взаимодействия менин-MLL. В WO 2018050686, WO 2018050684 и WO 2018109088 описаны ингибиторы взаимодействия менин-MLL.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым соединениям формулы (I),
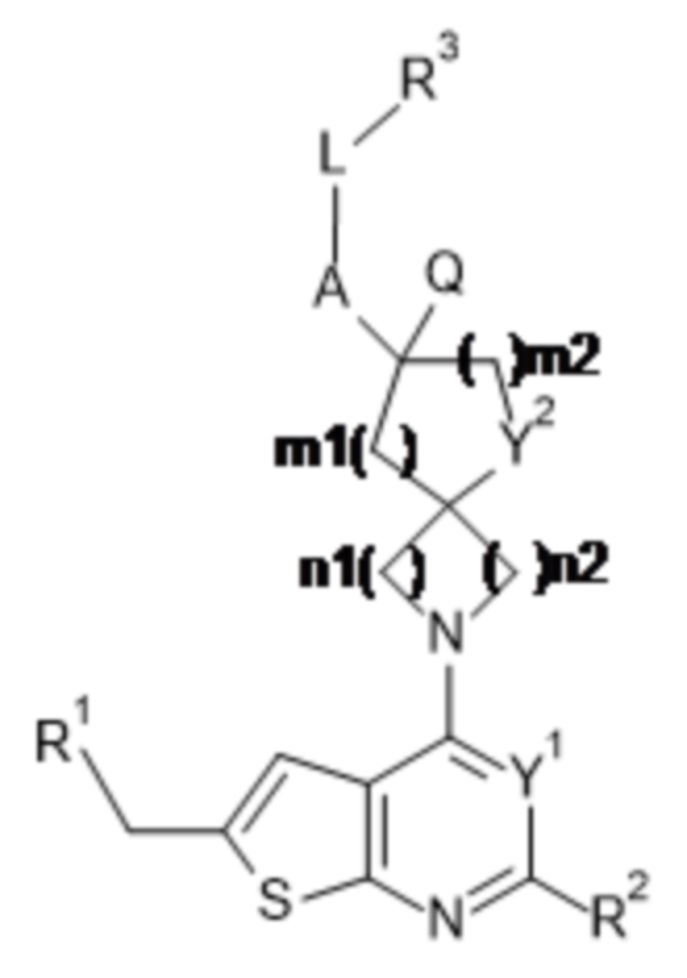 (I),
(I),
и к их таутомерам и стереоизомерным формам, где
R1 выбран из группы, состоящей из CH3, CH2F, CHF2 и CF3;
Y1 представляет собой N или CRy;
если Y1 представляет собой N, то R2 выбран из группы, состоящей из водорода, CH3,
-OCH3, -NH2 и -NH-CH3;
если Y1 представляет собой CRy, то R2 представляет собой водород;
Ry выбран из группы, состоящей из водорода, циано и C1-4алкила, необязательно замещенного гидрокси, -O-C1-4алкилом или -O-C3-6циклоалкилом;
Y2 представляет собой CH2 или O;
A представляет собой ковалентную связь или -CR15aR15b-;
каждый из R15a и R15b независимо выбран из группы, состоящей из водорода или C1-4алкила;
Q представляет собой водород или C1-4алкил, необязательно замещенный фенилом;
--L-R3 выбран из (a), (b), (c), (d), (e) или (f):
(a) --L-R3 представляет собой -NRAR1A, где
RA выбран из группы, состоящей из водорода; циклопропила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора и -CN; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR3a и -NR4aR4aa;
R1A выбран из группы, состоящей из C1-6алкила, необязательно замещенного одним, двумя или тремя заместителями, представляющими собой атом фтора; и C2-6алкила, замещенного заместителем, выбранным из группы, состоящей из -OR1a и -NR2aR2aa,
где каждый из R1a, R2a, R2aa, R3a, R4a и R4aa независимо выбран из группы, состоящей из водорода, C1-4алкила и циклопропила;
или
(b) L выбран из группы, состоящей из -N(RB)-, -N(RB)-CR1BR1BB- и
-(NRB)-CHR1B-CHR2B-; и R3 выбран из группы, состоящей из Ar; Het1; Het2; Het3; R17 и 7-10-членной насыщенной спирокарбобициклической системы; где
RB выбран из группы, состоящей из водорода; циклопропила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора и -CN; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR1b и -NR2bR2bb; при условии, что если R3 представляет собой R17, то RB представляет собой водород;
где
каждый из R1b, R2b и R2bb независимо выбран из группы, состоящей из водорода, C1-4алкила и циклопропила;
R1B выбран из группы, состоящей из водорода; галогена; C3-6циклоалкила;
C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, гидрокси и -CN; C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR4B и -NR5BR5BB; и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы; и R1BB выбран из группы, состоящей из водорода и метила; или R1B и R1BB вместе с углеродом, к которому они присоединены, образуют C3-6циклоалкил или
связанный посредством C 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом азота, кислорода или серы;
R2B выбран из группы, состоящей из водорода; -OR6B; -NR7BR7BB; CF3,
C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN, -OR4B и -NR5BR5BB; и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы; где
каждый из R4B, R5B, R5BB, R6B, R7B и R7BB независимо выбран из группы, состоящей из водорода; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN и
-C(=O)NR9BR9BB, и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR10B и -NR11BR11BB; где
каждый из R9B, R9BB, R10B, R11B и R11BB независимо выбран из группы, состоящей из водорода; C1-4алкила и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы;
или
(c) --L-R3 выбран из группы, состоящей из -N(RC)-COR5C и
-N(RC)-SO2-R13C, где
RC выбран из группы, состоящей из водорода; циклопропила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора и -CN; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR1c и -NR2cR2cc;
каждый из R5C и R13C независимо выбран из группы, состоящей из водорода; Ar; Het1; Het2; Het3; R17; 7-10-членной насыщенной спирокарбобициклической системы и C1-4алкила, необязательно замещенного -NR2cR2cc, Ar, Het1 или Het2; где
каждый из R1c, R2c и R2cc независимо выбран из группы, состоящей из водорода и C1-4алкила;
или
(d) L выбран из -N(RD)-CR1DR1DD- и -N(RD)-CR1DR1DD-CR2DR2DD-; где
RD выбран из группы, состоящей из водорода; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора и -CN; и C2-4алкила, замещенного заместителем, выбранным из -OR1d и
-NR2dR2dd; где
каждый из R1d, R2d и R2dd независимо выбран из группы, состоящей из водорода и C1-4алкила;
каждый из R1D, R1DD, R2D и R2DD независимо выбран из группы, состоящей из водорода и C1-4алкила; и
R3 выбран из группы, состоящей из 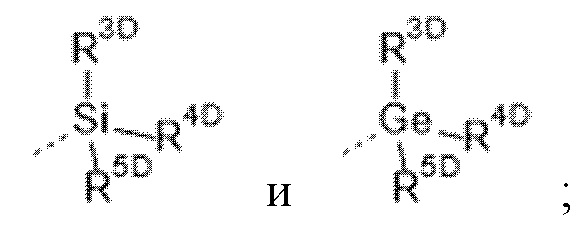 где
где
каждый из R3D, R4D и R5D независимо выбран из группы, состоящей из
C1-6алкила, необязательно замещенного заместителем, представляющим собой -OH, -OC1-6алкил или -NH2;
или
(e) --L-R3 представляет собой 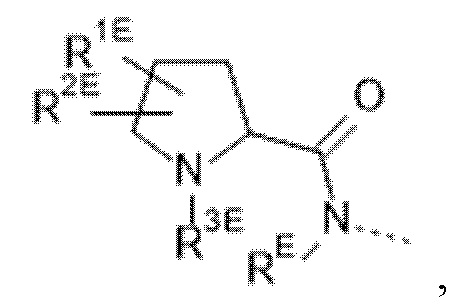 где
где
RE выбран из группы, состоящей из водорода и C1-4алкила;
R1E выбран из группы, состоящей из водорода, фтора и C1-4алкила; и
R2E выбран из группы, состоящей из фтора, -OC1-4алкила и C1-4алкила, необязательно замещенного 1, 2 или 3 заместителями, представляющими собой атом фтора; или R1E и R2E связаны с одним и тем же атомом углерода и вместе образуют C3-5циклоалкил или связанный посредством C 4-6-членный гетероциклил, содержащий атом кислорода; и
R3E выбран из группы, состоящей из водорода; C1-4алкила, необязательно замещенного заместителем, представляющим собой атом фтора или -CN; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR4E и -NR5ER5EE; где
каждый из R4E, R5E и R5EE независимо выбран из группы, состоящей из водорода; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN и -C(=O)NR6ER6EE; C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR7E и
-NR8ER8EE; и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы; где
каждый из R6E, R6EE, R7E, R8E и R8EE независимо выбран из группы, состоящей из водорода и C1-4алкила;
или
(f) --L-R3 представляет собой радикал
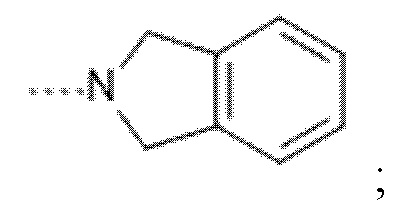
Ar представляет собой фенил, необязательно замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN, -OR4, -NR5R5',
-C(=O)NR5R5', Het4, -O-Het4, -NR5-Het4, -C(=O)-Het4, -S(=O)2-Het4, -S(=O)2-NR5R5', -S(=O)2-C1-4алкила, R14, CF3, C3-5циклоалкила, необязательно замещенного -CN, и
C1-4алкила, необязательно замещенного одним или двумя заместителями, каждый из которых независимо выбран из группы, состоящей из фтора, Het4, -CN, -OR6, -NR7R7',
-S(=O)2-C1-4алкила и -C(=O)NR8R8';
Het1 представляет собой моноциклический гетероарил, выбранный из группы, состоящей из пиридила, 2-, 4-, 5- или 6-пиримидинила, пиразинила, пиридазинила, фуранила, тиенила, пирролила, пиразолила, имидазолила, 4- или 5-тиазолила, изотиазолила и изоксазолила; каждый из которых может быть необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN, -OR4, -NR5R5', -C(=O)NR5R5', -C(=O)-Het4 и C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN, -OR6, Het2, -NR7R7' и -C(=O)NR8R8'; и
Het2 представляет собой неароматический гетероциклил, необязательно замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN,
-C(=O)-C1-6алкила, -C(=O)Ar, -C(=O)Het1, -C(=O)Het2, -OR4, -NR5R5' и C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора,
-CN, -OR6, -NR7R7', R12 и -C(=O)NR8R8';
где
R12 представляет собой связанный посредством C 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом азота, кислорода или серы;
каждый из R4, R5, R5', R6, R7, R7', R8 и R8' независимо выбран из группы, состоящей из водорода; -C(=O)-C1-4алкила; -S(=O)2-C1-4алкила;
C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN, -C(=O)-C1-4алкила, -S(=O)2-C1-4алкила, R11'', R16 и -C(=O)NR9R9';
C1-4алкила, замещенного тремя атомами фтора; и
C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR10 и -NR11R11'; где
каждый из R9, R9', R10, R11, R11' и R11'' независимо выбран из группы, состоящей из водорода; C1-4алкила; -S(=O)2-C1-4алкила и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы, где указанный гетероциклил необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из
-S(=O)2-C1-4алкила, галогена, циано и C1-4алкила, необязательно замещенного
-O-C1-4алкилом;
R16 представляет собой связанный посредством N 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом N и необязательно один дополнительный гетероатом, выбранный из азота, кислорода и серы, где указанный гетероциклил необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из -S(=O)2-C1-4алкила, галогена, циано и C1-4алкила, необязательно замещенного
-O-C1-4алкилом;
R14 представляет собой 5-членный моноциклический гетероарил, содержащий по меньшей мере один атом азота и необязательно 1, 2 или 3 дополнительных гетероатома, каждый из которых независимо выбран из азота, кислорода и серы;
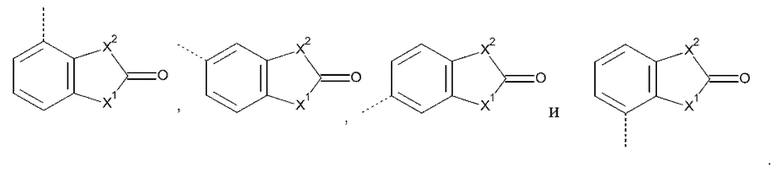
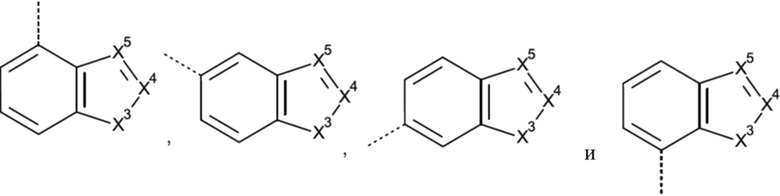
Het3 выбран из группы, состоящей из заместителей, соответствующих формулам (b-1) и (b-2):
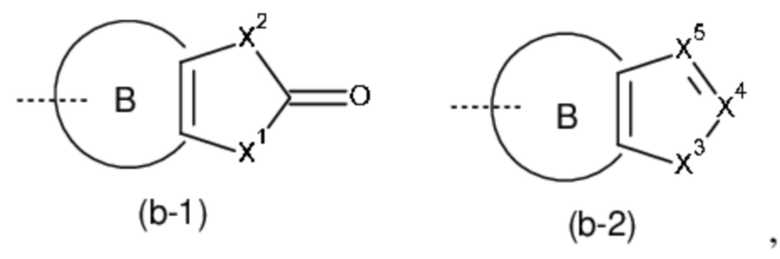
где кольцо B представляет собой фенил;
X1 представляет собой CH2, O или NH;
X2 представляет собой NH или O;
X3 представляет собой NH или O;
X4 представляет собой CH или N;
X5 представляет собой CH или N;
где один атом C или один атом N в 5-членном кольце (b-1) или (b-2), включая подходящие атомы C и атомы N в определении X1, X2, X3, X4 и X5, могут быть замещены одной или, если возможно, двумя C1-4алкильными группами, необязательно замещенными одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, циано, -C(=O)NR5R5' и Het4;
Het4 представляет собой 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом азота, кислорода или серы, где указанный гетероциклил необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN, оксо, -C(=O)NR5R5', -O-C1-4алкила, -S(=O)2-C1-4алкила и C1-4алкила, необязательно замещенного -O-C1-4алкилом;
R17 представляет собой C3-6циклоалкил, необязательно замещенный одним или несколькими заместителями, выбранными из группы, состоящей из галогена, -CN, -OR4, -NR5R5', -C(=O)NR5R5' и C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора,
-CN, -OR6, -NR7R7' и -C(=O)NR8R8';
каждый из n1, n2 и m1 независимо выбран из 1 и 2;
m2 равняется 0 или 1;
и к их фармацевтически приемлемым солям и сольватам.
Настоящее изобретение также относится к фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы (I), его фармацевтически приемлемой соли или сольвата и фармацевтически приемлемый носитель или наполнитель.
Кроме того, настоящее изобретение относится к соединению формулы (I), его фармацевтически приемлемой соли или сольвату для применения в качестве лекарственного препарата и к соединению формулы (I), его фармацевтически приемлемой соли или сольвату для применения в лечении или предупреждении рака, миелодиспластического синдрома (MDS) и диабета.
В конкретном варианте осуществления настоящее изобретение относится к соединению формулы (I), его фармацевтически приемлемой соли или сольвату для применения в лечении или в предупреждении рака.
В конкретном варианте осуществления указанный рак выбран из видов лейкоза, миеломы или рака, представляющего собой солидную опухоль (например, рака предстательной железы, рака легкого, рака молочной железы, рака поджелудочной железы, рака толстой кишки, рак печени, меланомы и глиобластомы и т.д.). В некоторых вариантах осуществления виды лейкоза включают виды острого лейкоза, виды хронического лейкоза, виды миелоидного лейкоза, виды миелогенного лейкоза, виды лимфобластного лейкоза, виды лимфоцитарного лейкоза, виды острого миелогенного лейкоза (AML), виды хронического миелогенного лейкоза (CML), виды острого лимфобластного лейкоза (ALL), виды хронического лимфоцитарного лейкоза (CLL), виды T-клеточного пролимфоцитарного лейкоза (T-PLL), лейкоз из больших гранулярных лимфоцитов, волосатоклеточный лейкоз (HCL), виды лейкоза с перестройкой MLL, виды лейкоза, ассоциированные с MLL-PTD, виды лейкоза с амплификацией MLL, виды MLL-положительного лейкоза, виды лейкоза, характеризующиеся профилями экспрессии генов HOX/MEIS1 и т.д.
Настоящее изобретение также относится к применению соединения формулы (I), его фармацевтически приемлемой соли или сольвата в комбинации с дополнительным фармацевтическим средством для применения в лечении или предупреждении рака, миелодиспластического синдрома (MDS) и диабета.
Дополнительно, настоящее изобретение относится к способу получения фармацевтической композиции в соответствии с настоящим изобретением, который характеризуется тем, что фармацевтически приемлемый носитель тщательно перемешивают с терапевтически эффективным количеством соединения формулы (I), его фармацевтически приемлемой соли или сольвата.
Настоящее изобретение также относится к продукту, содержащему соединение формулы (I), его фармацевтически приемлемую соль или сольват и дополнительное фармацевтическое средство, в виде объединенного препарата для одновременного, раздельного или последовательного применения в лечении или предупреждении рака, миелодиспластического синдрома (MDS) и диабета.
Кроме того, настоящее изобретение относится к способу лечения или предупреждения заболевания, обусловленного пролиферацией клеток, у теплокровного животного, который предусматривает введение указанному животному эффективного количества соединения формулы (I), его фармацевтически приемлемой соли или сольвата, определенных в данном документе, или фармацевтической композиции или комбинации, определенных в данном документе.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Термины "галогено" или "галоген", используемые в данном документе, означают фтор, хлор, бром и йод.
Приставка "Cx-y" (где x и y представляют собой целые числа), используемая в данном документе, означает число атомов углерода в данной группе. Таким образом, C1-6алкильная группа содержит от 1 до 6 атомов углерода и т.д.
Термин "C1-4алкил", используемый в данном документе в качестве группы или части группы, означает насыщенный углеводородный радикал с прямой или разветвленной цепью, содержащий от 1 до 4 атомов углерода, такой как метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил и т.п.
Термин "C2-4алкил", используемый в данном документе в качестве группы или части группы, означает насыщенный углеводородный радикал с прямой или разветвленной цепью, содержащий от 2 до 4 атомов углерода, такой как этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил и т.п.
Термин "C1-6алкил", используемый в данном документе в качестве группы или части группы, означает насыщенный углеводородный радикал с прямой или разветвленной цепью, содержащий от 1 до 6 атомов углерода, такой как группы, определенные для C1-4алкила, и н-пентил, н-гексил, 2-метилбутил и т.п.
Термин "C2-6алкил", используемый в данном документе в качестве группы или части группы, означает насыщенный углеводородный радикал с прямой или разветвленной цепью, содержащий от 2 до 6 атомов углерода, такой как группы, определенные для C2-4алкила, и н-пентил, н-гексил, 2-метилбутил и т.п.
Термин "C3-5циклоалкил" используемый в данном документе в качестве группы или части группы, означает насыщенный циклический углеводородный радикал, содержащий от 3 до 5 атомов углерода, такой как циклопропил, циклобутил и циклопентил. Термин "C3-6циклоалкил", используемый в данном документе в качестве группы или части группы, означает насыщенный циклический углеводородный радикал, содержащий от 3 до 6 атомов углерода, такой как циклопропил, циклобутил, циклопентил и циклогексил.
Специалисту в данной области техники будет очевидно, что S(=O)2, (SO2) или SO2 представляет собой сульфонильный фрагмент.
Специалисту в данной области техники будет очевидно, что CO или C(=O) представляет собой карбонильный фрагмент.
Специалисту в данной области техники будет очевидно, что -N(RB)- или -(NRB)- представляет собой

Используемое в данном документе выражение "спирокарбобициклические" системы означает циклические системы на основе углерода, где два цикла соединены при одном атоме. Примеры 7-10-членных насыщенных спироскарбобициклических систем включают без ограничения
 ,
, ,
, ,
,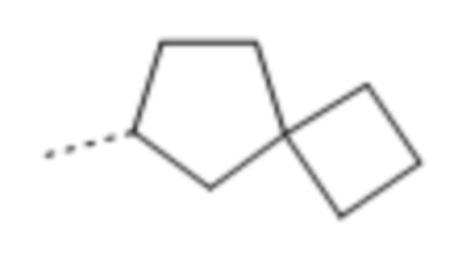 ,
,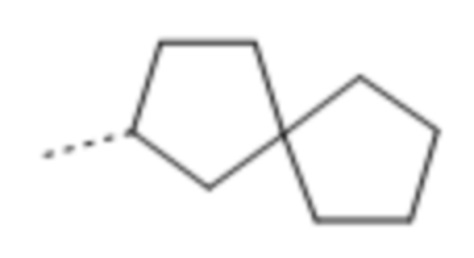 ,
,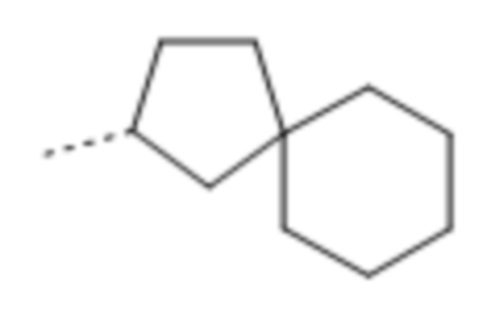 ,
,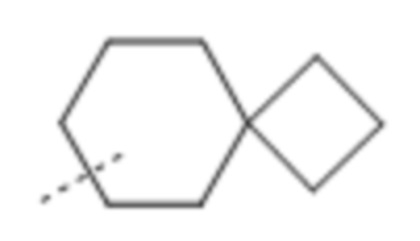 ,
,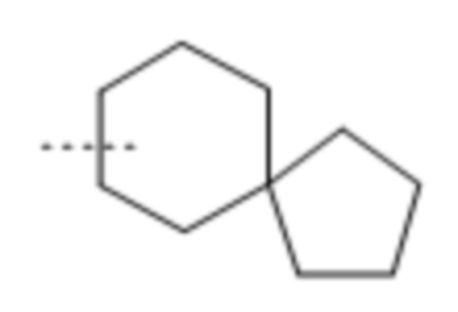 ,
,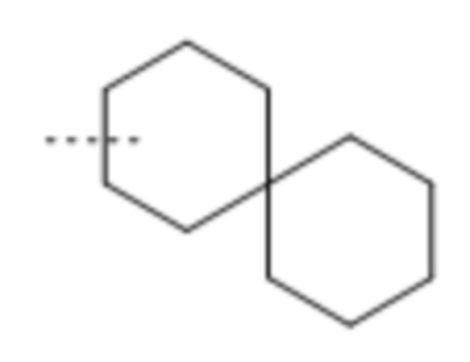 ,
,
и т.п.
В целом, во всех случаях использования в настоящем изобретении термин "замещенный" предназначен для обозначения, если иное не указано или четко не следует из контекста, что один или несколько атомов водорода, в частности, от 1 до 4 атомов водорода, более конкретно от 1 до 3 атомов водорода, предпочтительно 1 или 2 атома водорода, более предпочтительно 1 атом водорода, при атоме или радикале, обозначенном выражением с применением "замещенный", заменены выбранным из указанной группы, при условии, что не превышается нормальная валентность, и что в результате замещения образуется химически стабильное соединение, т.е. соединение, которое является достаточно устойчивым, чтобы выдержать выделение до пригодной степени чистоты из реакционной смеси.
Во всех случаях, когда один атом C или один атом N в 5-членном кольце (b-1) или (b-2) замещен одним или, если возможно, двумя заместителями, эти заместители могут замещать любой атом водорода, связанный с атомом углерода или азота, включая группы NH, CH и CH2 в определении X1, X2, X3, X4 и X5.
Специалисту в данной области техники будет понятно, что если, например, L представляет собой -N(RB)-CR1BR1BB- в варианте (b) --L-R3, это означает, что атом азота, замещенный RB, присоединен к переменной A. Это аналогично для других определений L, таких как, например, -(NRB)-CHR1B-CHR2B- (атом азота, замещенный RB, присоединен к переменной A), -N(RD)-CR1DR1DD- (атом азота, замещенный RD, присоединен к переменной A), -N(RD)-CR1DR1DD-CR2DR2DD- (атом азота, замещенный RD, присоединен к переменной A) или другие подобные определения L, включенные в объем настоящего изобретения.
Специалисту в данной области техники будет понятно, что если A представляет собой ковалентную связь, то формула (I) ограничена формулой (I-x), где все переменные определены в данном документе:
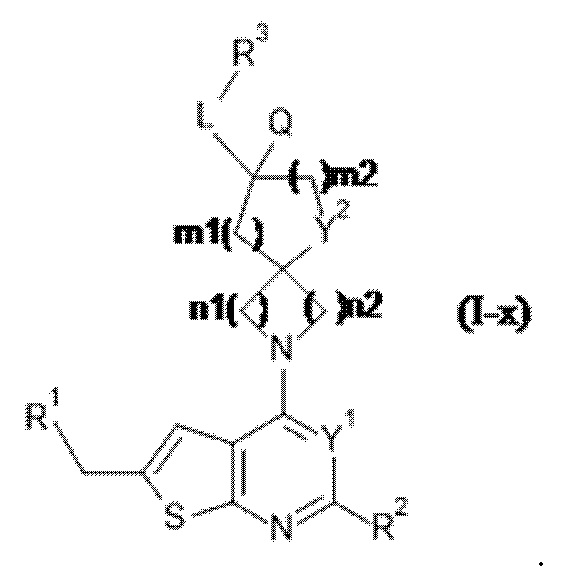
Комбинации заместителей и/или переменных допустимы только в случае, если такие комбинации приводят в результате к получению химически стабильных соединений. Подразумевается, что "стабильное соединение" означает соединение, которое является достаточно устойчивым, чтобы выдержать выделение до пригодной степени чистоты из реакционной смеси.
Специалисту в данной области техники будет понятно, что если атом или радикал замещен "заместителем", то подразумевается, что указанные атом или радикал замещены одним заместителем, выбранным из указанной группы.
Специалисту в данной области техники будет понятно, что термин "необязательно замещенный" означает, что атом или радикал, обозначенный с использованием выражения "необязательно замещенный", может быть замещен или не замещен (это означает соответственно замещенный или незамещенный).
Если при фрагменте находятся два или более заместителей, то они могут, если возможно и если иное не указано или четко не следует из контекста, замещать атомы водорода при одном и том же атоме, или они могут замещать атомы водорода при разных атомах во фрагменте.
Специалисту в данной области техники будет очевидно, что, если иное не указано или четко не следует из контекста, заместитель при гетероциклильной группе может заменять любой атом водорода при атоме углерода кольца или при гетероатоме кольца (например, водород при атоме азота можно заменять заместителем).
В контексте настоящего изобретения "насыщенный" означает "полностью насыщенный", если не указано иное.
"Неароматическая группа" охватывает ненасыщенные кольцевые системы не ароматического характера, частично насыщенные и полностью насыщенные карбоциклические и гетероциклические кольцевые системы. Термин "частично насыщенный" относится к кольцам, где кольцевая(кольцевые) структура(структуры) содержит(содержат) по меньшей мере одну кратную связь, например, связь C=C, N=C. Термин "полностью насыщенный" относится к кольцам, где кратные связи между атомами кольца отсутствуют. Таким образом, "неароматический гетероциклил" представляет собой неароматическую моноциклическую или бициклическую систему, если не указано иное, содержащую, например, 3-12 членов кольца, в более типичном случае 5-10 членов кольца. Примерами моноциклических групп являются группы, содержащие 4-7 членов кольца, в более типичном случае 5 или 6 членов кольца. Примерами бициклических групп являются группы, содержащие 7-12, 8-12, в более типичном случае 9 или 10 членов кольца.
Специалисту в данной области техники будет понятно, что "неароматический гетероциклил" содержит по меньшей мере один гетероатом, такой как N, O или S, если иное не указано или ясно не следует из контекста.
Неограничивающие примеры моноциклических гетероциклильных систем, содержащих по меньшей мере один гетероатом, выбранный из азота, кислорода или серы (N, O, S), включают без ограничения 4-7-членные гетероциклильные системы, такие как азетидинил, оксетанил, пирролидинил, тетрагидрофуранил, пиперидинил, пиперазинил, пиранил, дигидропиранил, тетрагидропиранил, морфолинил, тиоморфолинил и тетрагидро-2H-тиопиранил-1,1-диоксид, в частности, азетидинил, оксетанил, пирролидинил, тетрагидрофуранил, пиперидинил, пиперазинил, пиранил, дигидропиранил, тетрагидропиранил, морфолинил и тиоморфолинил.
Неограничивающие примеры бициклических гетероциклильных систем, содержащих по меньшей мере один гетероатом, выбранный из азота, кислорода или серы (N, O, S), включают без ограничения октагидро-1H-индолил, индолинил, 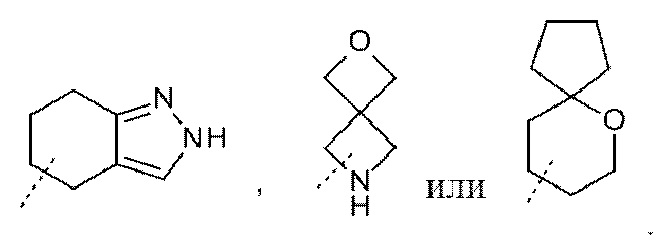 Если не указано иное, каждый может быть связан с остальной частью молекулы формулы (I) посредством любого доступного атома углерода в кольце (связанный с C) или атома азота (связанный с N), и необязательно они могут быть замещены, если возможно, по атомам углерода и/или азота в соответствии с вариантами осуществления. Например, Het2 и Het4 могут быть связанны посредством C или посредством N с остальной частью молекулы формулы (I).
Если не указано иное, каждый может быть связан с остальной частью молекулы формулы (I) посредством любого доступного атома углерода в кольце (связанный с C) или атома азота (связанный с N), и необязательно они могут быть замещены, если возможно, по атомам углерода и/или азота в соответствии с вариантами осуществления. Например, Het2 и Het4 могут быть связанны посредством C или посредством N с остальной частью молекулы формулы (I).
Термин "связанный посредством C 4-7-членный гетероциклил, содержащий по меньшей мере один атом азота, кислорода или серы", используемый в данном документе отдельно или в качестве части другой группы, означает насыщенный циклический углеводородный радикал, содержащий по меньшей мере один атом азота, кислорода или серы, который содержит от 4 до 7 членов кольца, определенных выше, связанный посредством доступного атома углерода. Будет очевидно, что аналогичный термин "связанный посредством C 4-6-членный гетероциклил, содержащий атом кислорода", используемый в данном документе отдельно или в качестве части другой группы, означает насыщенный циклический углеводородный радикал, содержащий один атом кислорода, который содержит от 4 до 6 членов кольца, определенных выше, связанный посредством доступного атома углерода (такой как, например, оксетанил, тетрагидрофуранил и тетрагидропиранил).
Подобным образом, будет очевидно, что термин "связанный посредством C 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом азота, кислорода или серы", используемый в данном документе отдельно или в качестве части другой группы, означает неароматический циклический углеводородный радикал, содержащий по меньшей мере один атом азота, кислорода или серы, который содержит от 4 до 7 членов кольца, определенных выше, связанный посредством доступного атома углерода. Будет очевидно, что аналогичный термин "связанный посредством C 4-6-членный неароматический гетероциклил, содержащий атом кислорода", используемый в данном документе отдельно или в качестве части другой группы, означает неароматический циклический углеводородный радикал, содержащий один атом кислорода, который содержит от 4 до 6 членов кольца, определенных выше, связанный посредством доступного атома углерода (такого как, например, оксетанил, тетрагидрофуранил, пиперидинил и тетрагидропиранил).
Подобным образом, будет очевидно, что термин "связанный посредством C 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом N и необязательно один дополнительный гетероатом, выбранный из азота, кислорода и серы", используемый в данном документе отдельно или как часть другой группы, означает неароматический циклический углеводородный радикал, содержащий по меньшей мере один атом N и необязательно один дополнительный гетероатом, выбранный из азота, кислорода и серы, содержащий от 4 до 7 членов кольца, определенных выше, связанный посредством доступного атома N. Следует понимать, что 5-членные моноциклические гетероарильные группы (как в определении R14) являются ароматическими и, при необходимости, могут быть присоединены к остальной части молекулы формулы (I) посредством любого доступного атома углерода или азота кольца, если не указанно иное. Предпочтительно - с помощью атома углерода. Неограничивающие примеры 5-членного моноциклического гетероарила, содержащего по меньшей мере один атом азота и необязательно 1, 2 или 3 дополнительных гетероатома, каждый из которых независимо выбран из азота, кислорода и серы, включают без ограничения пиразолил, имидазолил, триазолил, оксазолил, изотиазолил или тиазолил.
Во всех случаях, когда заместители представлены химической структурой, "---" означает связь для присоединения к остатку молекулы формулы (I).
Линии (такие как "---"), проведенные к кольцевым системам, указывают на то, что связь может быть присоединена к любому из подходящих атомов кольца.
Например, если Het3 представляет собой (b-1), где кольцо B представляет собой фенил
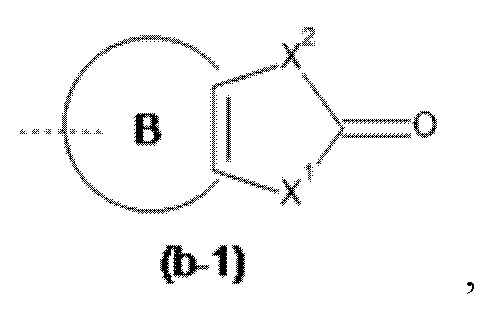
это охватывает любую из следующих кольцевых систем
Например, если Het3 представляет собой (b-2), где кольцо B представляет собой фенил
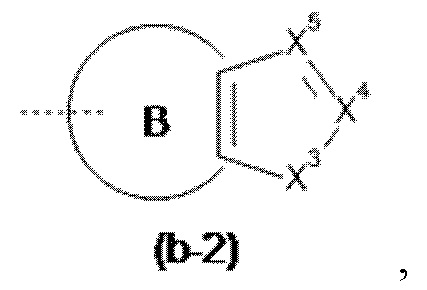
это охватывает любую из следующих кольцевых систем
 .
.
Het1, Het2 и Het4, при необходимости, могут быть присоединены к остальной части молекулы формулы (I) посредством любого доступного атома углерода или азота в кольце, если не указано иное.
Будет очевидно, что насыщенный циклический фрагмент, если возможно, может содержать заместители при атомах как углерода, так и азота, если иное не указано или четко не следует из контекста.
Если какая-либо переменная встречается более одного раза в любой составной части, то каждая определяется независимо.
Если какая-либо переменная встречается более одного раза в любой формуле (например, формуле (I)), то каждая определяется независимо.
Термин "субъект", используемый в данном документе, означает животное, предпочтительно млекопитающее (например, кошку, собаку, примата или человека), более предпочтительно человека, которое является или являлось объектом лечения, наблюдения или эксперимента.
Термин "терапевтически эффективное количество", используемый в данном документе, означает такое количество активного соединения или фармацевтического средства, которое вызывает биологический или медицинский ответ в системе тканей у животного или человека, который стремится получить исследователь, ветеринар, врач или другой клиницист, который включает облегчение или купирование симптомов заболевания или нарушения, подлежащего лечению.
Предполагается, что термин "композиция" охватывает продукт, содержащий определенные ингредиенты в определенных количествах, а также любой продукт, который получают, непосредственно или опосредованно, из комбинаций определенных ингредиентов в определенных количествах.
Предполагается, что термин "лечение", используемый в данном документе, означает все способы, которые могут предусматривать замедление, нарушение, подавление или прекращение развития заболевания, но не обязательно означает полное устранение всех симптомов.
Подразумевается, что термины "соединение(соединения) по (настоящему) изобретению" или "соединение(соединения) в соответствии с (настоящим) изобретением", используемые в данном документе, включают соединения формулы (I) и их фармацевтически приемлемые соли и сольваты.
Любая химическая формула, используемая в данном документе, связи в которой показаны только в виде сплошных линий, а не в виде сплошных клиновидных или пунктирных клиновидных связей, или иным образом показанная как имеющая конкретную конфигурацию (например, R, S) относительно одного или нескольких атомов, предусматривает каждый возможный стереоизомер или смесь двух или более стереоизомеров.
Выше и ниже в данном документе подразумевается, что термин "соединение (соединения) формулы (I)" включает его(их) таутомеры и его(их) стереоизомерные формы.
Термины "стереоизомеры", "стереоизомерные формы" или "стереохимически изомерные формы" выше или ниже в данном документе применяются взаимозаменяемо.
Настоящее изобретение включает все стереоизомеры соединений по настоящему изобретению либо в виде чистого стереоизомера, либо в виде смеси двух или более стереоизомеров.
Энантиомеры представляют собой стереоизомеры, которые являются не совпадающими при наложении зеркальными отображениями друг друга. Смесь 1:1 пары энантиомеров представляет собой рацемат или рацемическую смесь.
Атропизомеры (или атропоизомеры) представляют собой стереоизомеры, которые имеют конкретную пространственную конфигурацию, образованную в результате ограниченного вращения вокруг одинарной связи вследствие значительного стерического затруднения. Предполагается, что все атропизомерные формы соединений формулы (I) включены в объем настоящего изобретения.
Диастереомеры (или диастереоизомеры) представляют собой стереоизомеры, которые не представляют собой энантиомеры, т.е. они не соотносятся как зеркальные отображения. Если соединение содержит двойную связь, то заместители могут находиться в E- или Z-конфигурации.
Заместители при двухвалентных циклических насыщенных или частично насыщенных радикалах могут находиться либо в цис-, либо в транс-конфигурации; например, если соединение содержит двузамещенную циклоалкильную группу, то заместители могут находиться в цис- или транс-конфигурации.
Таким образом, настоящее изобретение включает энантиомеры, атропизомеры, диастереомеры, рацематы, E-изомеры, Z-изомеры, цис-изомеры, транс-изомеры и их смеси, в случаях, когда это возможно с химической точки зрения.
Значения всех этих терминов, т.е. энантиомеров, атропизомеров, диастереомеров, рацематов, E-изомеров, Z-изомеров, цис-изомеров, транс-изомеров и их смесей, известны специалисту в данной области техники.
Абсолютную конфигурацию определяют в соответствии с системой Кана-Ингольда-Прелога. Конфигурацию при асимметрическом атоме определяют либо как R, либо как S. Выделенные стереоизомеры, абсолютная конфигурация которых неизвестна, могут обозначаться как (+) или
(-) в зависимости от направления, в котором они вращают плоскость поляризации света. Например, выделенные энантиомеры, абсолютная конфигурация которых неизвестна, могут обозначаться как (+) или (-) в зависимости от направления, в котором они вращают плоскость поляризации света.
Если идентифицирован конкретный стереоизомер, это означает, что указанный стереоизомер практически не содержит других стереоизомеров, т.е. связан с менее 50%, предпочтительно с менее 20%, более предпочтительно с менее 10%, еще более предпочтительно с менее 5%, в частности, с менее 2% и наиболее предпочтительно с менее 1% других стереоизомеров. Таким образом, если соединение формулы (I), например, указано как (R), то это означает, что соединение практически не содержит (S)-изомера; если соединение формулы (I), например, указано как E, то это означает, что соединение практически не содержит Z-изомера; если соединение формулы (I), например, указано как цис-, то это означает, что соединение практически не содержит транс-изомера.
Некоторые соединения в соответствии с формулой (I) также могут существовать в их таутомерной форме. Предполагается, что такие формы, ввиду того, что они могут существовать, хотя явно и не показаны в вышеприведенной формуле (I), включены в объем настоящего изобретения. Из этого следует, что одно соединение может существовать как в стереоизомерной, так и в таутомерной форме.
Фармацевтически приемлемые соли включают соли присоединения кислоты и соли присоединения основания. Такие соли можно получать с помощью традиционных способов, например, при реакции формы свободной кислоты или свободного основания с одним или несколькими эквивалентами соответствующего основания или кислоты, необязательно в растворителе или в среде, в которой соль является нерастворимой, с последующим удалением указанного растворителя или указанной среды с применением стандартных методик (например, in vacuo, с помощью сублимационной сушки или фильтрации). Соли также можно получать путем обмена противоиона соединения по настоящему изобретению в форме соли с другим противоионом, например, с применением подходящей ионообменной смолы.
Предполагается, что фармацевтически приемлемые соли, упоминаемые выше или ниже в данном документе, включают терапевтически активные нетоксичные формы солей с кислотами и основаниями, которые могут образовывать соединения формулы (I) и их сольваты.
Соответствующие кислоты включают, например, неорганические кислоты, такие как галогенводородные кислоты, например, хлористоводородная или бромистоводородная кислота, серная, азотная, фосфорная и подобные кислоты; или органические кислоты, такие как, например, уксусная, пропановая, гидроксиуксусная, молочная, пировиноградная, щавелевая (т.е. этандиовая), малоновая, янтарная (т.е. бутандиовая кислота), малеиновая, фумаровая, яблочная, винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламовая, салициловая, п-аминосалициловая, памовая и подобные кислоты. И наоборот, указанные формы солей можно превращать путем обработки соответствующим основанием в форму свободного основания.
Соединения формулы (I) и их сольваты, содержащие кислотный протон, также можно превращать в формы их нетоксичных солей с металлами или аминами путем обработки соответствующими органическими и неорганическими основаниями.
Соответствующие основные формы солей включают, например, соли аммония, соли щелочных и щелочноземельных металлов, например, соли лития, натрия, калия, цезия, магния, кальция и т.п., соли с органическими основаниями, например, первичными, вторичными и третичными алифатическими и ароматическими аминами, такими как метиламин, этиламин, пропиламин, изопропиламин, четыре изомера бутиламина, диметиламин, диэтиламин, диэтаноламин, дипропиламин, диизопропиламин, ди-н-бутиламин, пирролидин, пиперидин, морфолин, триметиламин, триэтиламин, трипропиламин, хинуклидин, пиридин, хинолин и изохинолин; соли бензатина, N-метил-D-глюкамина, гидрабамина и соли с аминокислотами, такими как, например, аргинин, лизин и т.п. И наоборот, форму соли можно превращать путем обработки кислотой в форму свободной кислоты.
Термин ‘сольват’ включает формы присоединения растворителя, а также их соли, которые могут образовывать соединения формулы (I). Примерами таких форм присоединения растворителя являются, например, гидраты, алкоголяты и т.п.
Соединения по настоящему изобретению, полученные в описанных ниже способах, можно синтезировать в виде смесей энантиомеров, в частности, рацемических смесей энантиомеров, которые можно отделить друг от друга, следуя известным из уровня техники процедурам разделения. Способ разделения энантиомерных форм соединений формулы (I) и их фармацевтически приемлемых солей и сольватов включает жидкостную хроматографию с применением хиральной неподвижной фазы. Указанные чистые стереохимически изомерные формы также можно получать из соответствующих чистых стереохимически изомерных форм соответствующих исходных веществ при условии, что реакция протекает стереоспецифически. Если необходим конкретный стереоизомер, то предпочтительно, чтобы указанное соединение синтезировали с помощью стереоспецифических способов получения. В данных способах будут преимущественно применять энантиомерно чистые исходные вещества.
Настоящее изобретение также охватывает меченные изотопами соединения по настоящему изобретению, которые идентичны приведенным в данном документе, за исключением того, что один или несколько атомов заменены атомом с атомной массой или массовым числом, отличными от атомной массы или массового числа, обычно встречающихся в природе (или наиболее распространенных из встречающихся в природе).
Все изотопы и изотопные смеси любого конкретного атома или элемента, как определено в данном документе, рассматриваются в рамках соединений по настоящему изобретению, как встречающиеся в природе, так и полученные синтетическим путем, как с природным изотопным составом, так и в изотопно-обогащенной форме. Иллюстративные изотопы, которые могут быть включены в соединения по настоящему изобретению, включают изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора, хлора и йода, такие как 2H, 3H, 11C, 13C, 14C, 13N, 15O, 17O, 18O, 32P, 33P, 35S, 18F, 36Cl, 122I, 123I, 125I, 131I, 75Br, 76Br, 77Br и 82Br. Предпочтительно радиоактивный изотоп выбран из группы, состоящей из 2H, 3H, 11C и 18F. Более предпочтительно, радиоактивный изотоп представляет собой 2H. В частности, предполагается, что дейтерированные соединения включены в объем настоящего изобретения.
Определенные меченные изотопами соединения по настоящему изобретению (например, меченные 3H и 14C) могут быть пригодными, например, в анализах распределения субстрата в тканях. Изотопы тритий (3H) и углерод-14 (14C) являются пригодными благодаря простоте их получения и возможности выявления. Кроме того, замена более тяжелыми изотопами, такими как дейтерий (т.е. 2H), может обеспечивать определенные терапевтические преимущества вследствие более высокой метаболической стабильности (например, увеличение периода полувыведения in vivo или уменьшение необходимой дозы) и, следовательно, может быть предпочтительной в некоторых случаях. Таким образом, в конкретном варианте осуществления настоящего изобретения R2 выбран из водорода или дейтерия, в частности дейтерия. Позитронно-активные изотопы, такие как 15O, 13N, 11C и 18F, пригодны для исследований с помощью позитронно-эмиссионной томографии (PET). Визуализация посредством PET при раке находит применимость, помогая локализовать и идентифицировать опухоли, стадию заболевания и определять подходящее лечение. Раковые клетки человека сверхэкспрессируют множество рецепторов или белков, которые являются потенциальными молекулярными мишенями для конкретного заболевания. Меченные радиоактивным изотопом метки, которые связываются с высокой аффинностью и специфичностью с такими рецепторами или белками на опухолевых клетках, обладают большим потенциалом для диагностической визуализации и целенаправленной радионуклидной терапии (Charron, Carlie L. et al. Tetrahedron Lett. 2016, 57(37), 4119-4127). Дополнительно, мишень-специфические радиоактивные метки для PET можно применять в качестве биомаркеров для изучения и оценки патологии, например, посредством измерения экспрессии мишени и ответа на лечение (Austin R. et al. Cancer Letters (2016), doi: 10.1016/j.canlet.2016.05.008).
В частности, настоящее изобретение относится к соединениям формулы (I), определенным в данном документе, и к их таутомерам и стереоизомерным формам, где
R1 выбран из группы, состоящей из CH3, CH2F, CHF2 и CF3;
Y1 представляет собой N или CRy;
если Y1 представляет собой N, то R2 выбран из группы, состоящей из водорода, CH3,
-OCH3, -NH2 и -NH-CH3;
если Y1 представляет собой CRy, то R2 представляет собой водород;
Ry выбран из группы, состоящей из водорода, циано и C1-4алкила, необязательно замещенного гидрокси, -O-C1-4алкилом или -O-C3-6циклоалкилом;
Y2 представляет собой CH2 или O;
A представляет собой ковалентную связь или -CR15aR15b-;
каждый из R15a и R15b независимо выбран из группы, состоящей из водорода или C1-4алкила;
Q представляет собой водород или C1-4алкил, необязательно замещенный фенилом;
--L-R3 выбран из (a), (b), (c), (d), (e) или (f):
(a) --L-R3 представляет собой -NRAR1A, где
RA выбран из группы, состоящей из водорода; циклопропила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора и -CN; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR3a и -NR4aR4aa;
R1A выбран из группы, состоящей из C1-6алкила, необязательно замещенного одним, двумя или тремя заместителями, представляющими собой атом фтора; и C2-6алкила, замещенного заместителем, выбранным из группы, состоящей из -OR1a и -NR2aR2aa,
где каждый из R1a, R2a, R2aa, R3a, R4a и R4aa независимо выбран из группы, состоящей из водорода, C1-4алкила и циклопропила;
или
(b) L выбран из группы, состоящей из -N(RB)-, -N(RB)-CR1BR1BB- и
-(NRB)-CHR1B-CHR2B-; и R3 выбран из группы, состоящей из Ar; Het1; Het2; Het3; R17 и 7-10-членной насыщенной спирокарбобициклической системы; где
RB выбран из группы, состоящей из водорода; циклопропила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора и -CN; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR1b и -NR2bR2bb; при условии, что если R3 представляет собой R17, то RB представляет собой водород;
где
каждый из R1b, R2b и R2bb независимо выбран из группы, состоящей из водорода, C1-4алкила и циклопропила;
R1B выбран из группы, состоящей из водорода; галогена; C3-6циклоалкила;
C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, гидрокси и -CN; C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR4B и -NR5BR5BB; и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы; и R1BB выбран из группы, состоящей из водорода и метила; или R1B и R1BB вместе с углеродом, к которому они присоединены, образуют C3-6циклоалкил или
связанный посредством C 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом азота, кислорода или серы;
R2B выбран из группы, состоящей из водорода; -OR6B; -NR7BR7BB; CF3,
C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN, -OR4B и -NR5BR5BB; и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы; где
каждый из R4B, R5B, R5BB, R6B, R7B и R7BB независимо выбран из группы, состоящей из водорода; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN и
-C(=O)NR9BR9BB, и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR10B и -NR11BR11BB; где
каждый из R9B, R9BB, R10B, R11B и R11BB независимо выбран из группы, состоящей из водорода; C1-4алкила и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы;
или
(c) --L-R3 выбран из группы, состоящей из -N(RC)-COR5C и
-N(RC)-SO2-R13C, где
RC выбран из группы, состоящей из водорода; циклопропила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора и -CN; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR1c и -NR2cR2cc;
каждый из R5C и R13C независимо выбран из группы, состоящей из водорода; Ar; Het1; Het2; Het3; R17; 7-10-членной насыщенной спирокарбобициклической системы и C1-4алкила, необязательно замещенного -NR2cR2cc, Ar, Het1 или Het2; где
каждый из R1c, R2c и R2cc независимо выбран из группы, состоящей из водорода и C1-4алкила;
или
(d) L выбран из -N(RD)-CR1DR1DD- и -N(RD)-CR1DR1DD-CR2DR2DD-; где
RD выбран из группы, состоящей из водорода; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора и -CN; и C2-4алкила, замещенного заместителем, выбранным из -OR1d и
-NR2dR2dd; где
каждый из R1d, R2d и R2dd независимо выбран из группы, состоящей из водорода и C1-4алкила;
каждый из R1D, R1DD, R2D и R2DD независимо выбран из группы, состоящей из водорода и C1-4алкила; и
R3 выбран из группы, состоящей из 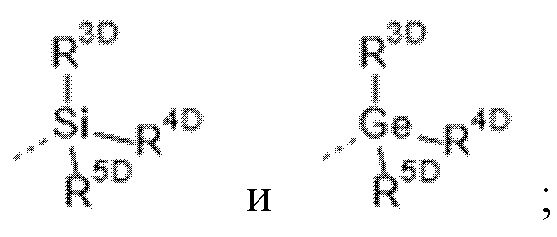 где
где
каждый из R3D, R4D и R5D независимо выбран из группы, состоящей из
C1-6алкила, необязательно замещенного заместителем, представляющим собой -OH, -OC1-6алкил или -NH2;
или
(e) --L-R3 представляет собой 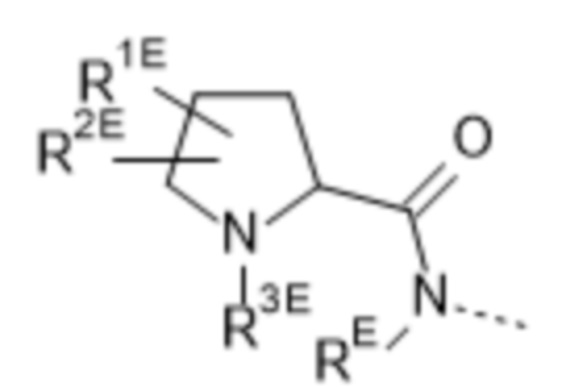 , где
, где
RE выбран из группы, состоящей из водорода и C1-4алкила;
R1E выбран из группы, состоящей из водорода, фтора и C1-4алкила; и
R2E выбран из группы, состоящей из фтора, -OC1-4алкила и C1-4алкила, необязательно замещенного 1, 2 или 3 заместителями, представляющими собой атом фтора; или R1E и R2E связаны с одним и тем же атомом углерода и вместе образуют C3-5циклоалкил или связанный посредством C 4-6-членный гетероциклил, содержащий атом кислорода; и
R3E выбран из группы, состоящей из водорода; C1-4алкила, необязательно замещенного заместителем, представляющим собой атом фтора или -CN; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR4E и -NR5ER5EE; где
каждый из R4E, R5E и R5EE независимо выбран из группы, состоящей из водорода; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN и -C(=O)NR6ER6EE; C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR7E и
-NR8ER8EE; и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы; где
каждый из R6E, R6EE, R7E, R8E и R8EE независимо выбран из группы, состоящей из водорода и C1-4алкила;
или
(f) --L-R3 представляет собой радикал
 ;
;
Ar представляет собой фенил, необязательно замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN, -OR4, -NR5R5',
-C(=O)NR5R5', Het4, -O-Het4, -NR5-Het4, -C(=O)-Het4, -S(=O)2-Het4, -S(=O)2-NR5R5', -S(=O)2-C1-4алкила, R14, CF3, C3-5циклоалкила, необязательно замещенного -CN, и
C1-4алкила, необязательно замещенного одним или двумя заместителями, каждый из которых независимо выбран из группы, состоящей из фтора, Het4, -CN, -OR6, -NR7R7',
-S(=O)2-C1-4алкила и -C(=O)NR8R8';
Het1 представляет собой моноциклический гетероарил, выбранный из группы, состоящей из пиридила, 2-, 4-, 5- или 6-пиримидинила, пиразинила, пиридазинила, фуранила, тиенила, пирролила, пиразолила, имидазолила, 4- или 5-тиазолила, изотиазолила и изоксазолила; каждый из которых может быть необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN, -OR4, -NR5R5', -C(=O)NR5R5', -C(=O)-Het4 и C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN, -OR6, Het2, -NR7R7' и -C(=O)NR8R8'; и
Het2 представляет собой неароматический гетероциклил, необязательно замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN,
-C(=O)-C1-6алкила, -C(=O)Ar, -C(=O)Het1, -C(=O)Het2, -OR4, -NR5R5' и C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора,
-CN, -OR6, -NR7R7', R12 и -C(=O)NR8R8';
где
R12 представляет собой связанный посредством C 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом азота, кислорода или серы;
каждый из R4, R5, R5', R6, R7, R7', R8 и R8' независимо выбран из группы, состоящей из водорода; -C(=O)-C1-4алкила; -S(=O)2-C1-4алкила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора,
-C(=O)-C1-4алкила, -S(=O)2-C1-4алкила, R11'', R16 и -C(=O)NR9R9'; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR10 и
-NR11R11'; где
каждый из R9, R9', R10, R11, R11' и R11'' независимо выбран из группы, состоящей из водорода; C1-4алкила; -S(=O)2-C1-4алкила и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы, где указанный гетероциклил необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из
-S(=O)2-C1-4алкила, галогена, циано и C1-4алкила, необязательно замещенного
-O-C1-4алкилом;
R16 представляет собой связанный посредством N 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом N и необязательно один дополнительный гетероатом, выбранный из азота, кислорода и серы, где указанный гетероциклил необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из -S(=O)2-C1-4алкила, галогена, циано и C1-4алкила, необязательно замещенного
-O-C1-4алкилом;
R14 представляет собой 5-членный моноциклический гетероарил, содержащий по меньшей мере один атом азота и необязательно 1, 2 или 3 дополнительных гетероатома, каждый из которых независимо выбран из азота, кислорода и серы;
Het3 выбран из группы, состоящей из заместителей, соответствующих формулам (b-1) и (b-2):

где кольцо B представляет собой фенил;
X1 представляет собой CH2, O или NH;
X2 представляет собой NH или O;
X3 представляет собой NH или O;
X4 представляет собой CH или N;
X5 представляет собой CH или N;
где один атом C или один атом N в 5-членном кольце (b-1) или (b-2), включая подходящие атомы C и атомы N в определении X1, X2, X3, X4 и X5, могут быть замещены одной или, если возможно, двумя C1-4алкильными группами, необязательно замещенными одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, циано, -C(=O)NR5R5' и Het4;
Het4 представляет собой 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом азота, кислорода или серы, где указанный гетероциклил необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN, оксо, -C(=O)NR5R5', -O-C1-4алкила, -S(=O)2-C1-4алкила и C1-4алкила, необязательно замещенного -O-C1-4алкилом;
R17 представляет собой C3-6циклоалкил, необязательно замещенный одним или несколькими заместителями, выбранными из группы, состоящей из галогена, -CN, -OR4, -NR5R5', -C(=O)NR5R5' и C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора,
-CN, -OR6, -NR7R7' и -C(=O)NR8R8';
каждый из n1, n2 и m1 независимо выбран из 1 и 2;
m2 равняется 0 или 1;
и к их фармацевтически приемлемым солям и сольватам.
В частности, настоящее изобретение относится к соединениям формулы (I), определенным в данном документе, и к их таутомерам и стереоизомерным формам, где
R1 представляет собой CF3;
Y1 представляет собой N;
если Y1 представляет собой N, то R2 выбран из группы, состоящей из водорода, CH3,
-OCH3, -NH2 и -NH-CH3;
Y2 представляет собой CH2;
A представляет собой ковалентную связь или -CR15aR15b-;
R15a и R15b представляют собой водород;
Q представляет собой водород;
--L-R3 выбран из (a), (b), (c), (d), (e) или (f):
(a) --L-R3 представляет собой -NRAR1A, где
RA выбран из группы, состоящей из водорода и C1-4алкила;
R1A представляет собой C1-6алкил;
или
(b) L выбран из группы, состоящей из -N(RB)- и -N(RB)-CR1BR1BB; и R3 выбран из группы, состоящей из Ar; Het1; Het2; Het3 и R17; в частности, R3 выбран из группы, состоящей из Ar; Het1; Het3 и R17; где
RB выбран из группы, состоящей из водорода и C1-4алкила;
R1B выбран из группы, состоящей из водорода и C1-4алкила; и
R1BB выбран из группы, состоящей из водорода и метила; или R1B и R1BB вместе с углеродом, к которому они присоединены, образуют C3-6циклоалкил;
или
(c) --L-R3 выбран из группы, состоящей из -N(RC)-COR5C и
-N(RC)-SO2-R13C, где
RC выбран из группы, состоящей из водорода и C1-4алкила;
каждый из R5C и R13C независимо выбран из группы, состоящей из Ar; и
C1-4алкила, необязательно замещенного Het2;
Ar представляет собой фенил, необязательно замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN, -OR4, -NR5R5',
-C(=O)NR5R5', Het4, -O-Het4, -C(=O)-Het4, -S(=O)2-Het4, -S(=O)2-NR5R5',
-S(=O)2-C1-4алкила, R14, CF3, C3-5циклоалкила, необязательно замещенного -CN, и
C1-4алкила, необязательно замещенного одним или двумя заместителями, каждый из которых независимо выбран из группы, состоящей из Het4, -CN, -OR6, -NR7R7',
-S(=O)2-C1-4алкила и -C(=O)NR8R8';
Het1 представляет собой моноциклический гетероарил, выбранный из группы, состоящей из пиридила, 2-, 4-, 5- или 6-пиримидинила, пиразинила, пиридазинила, пиразолила и имидазолила; каждый из которых может быть необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из -CN, -OR4, -C(=O)NR5R5', -C(=O)-Het4; и
C1-4алкила, необязательно замещенного -C(=O)NR8R8'; и
Het2 представляет собой неароматический гетероциклил;
где
каждый из R4, R5, R5', R6, R7, R7', R8 и R8' независимо выбран из группы, состоящей из водорода; -C(=O)-C1-4алкила; -S(=O)2-C1-4алкила;
C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из -CN, R11'' и R16;
C1-4алкила, замещенного тремя атомами фтора; и
C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR10 и -NR11R11'; где
каждый из R10, R11, R11' и R11'' независимо выбран из группы, состоящей из водорода; C1-4алкила; -S(=O)2-C1-4алкила и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы, где указанный гетероциклил необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из
-S(=O)2-C1-4алкила и C1-4алкила;
R16 представляет собой связанный посредством N 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом N и необязательно один дополнительный гетероатом, выбранный из азота, кислорода и серы, где указанный гетероциклил необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из -S(=O)2-C1-4алкила;
R14 представляет собой 5-членный моноциклический гетероарил, содержащий по меньшей мере один атом азота и необязательно 1, 2 или 3 дополнительных гетероатома, каждый из которых независимо выбран из азота, кислорода и серы;
Het3 выбран из группы, состоящей из заместителей, соответствующих формулам (b-1) и (b-2):

где кольцо B представляет собой фенил;
X1 представляет собой CH2, O или NH;
X2 представляет собой NH или O;
X3 представляет собой NH или O;
X4 представляет собой CH или N;
X5 представляет собой CH или N;
где один атом C или один атом N в 5-членном кольце (b-1) или (b-2), включая подходящие атомы C и атомы N в определении X1, X2, X3, X4 и X5, могут быть замещены одной или, если возможно, двумя C1-4алкильными группами, необязательно замещенными одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, циано, -C(=O)NR5R5' и Het4;
Het4 представляет собой 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом азота, кислорода или серы, где указанный гетероциклил необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из
-CN, оксо, -C(=O)NR5R5', -O-C1-4алкила, -S(=O)2-C1-4алкила и C1-4алкила, необязательно замещенного -O-C1-4алкилом;
R17 представляет собой С3-6циклоалкил, необязательно замещенный одним или несколькими заместителями, выбранными из группы, состоящей из -NR5R5';
каждый из n1, n2 и m1 независимо выбран из 1 и 2;
m2 равняется 0 или 1;
и к их фармацевтически приемлемым солям и сольватам.
В частности, настоящее изобретение относится к соединениям формулы (I), определенным в данном документе, и к их таутомерам и стереоизомерным формам, где
R1 выбран из группы, состоящей из CH3, CH2F, CHF2 и CF3;
Y1 представляет собой N или CRy;
если Y1 представляет собой N, то R2 выбран из группы, состоящей из водорода, CH3,
-OCH3, -NH2 и -NH-CH3;
если Y1 представляет собой CRy, то R2 представляет собой водород;
Ry выбран из группы, состоящей из водорода, циано и C1-4алкила, необязательно замещенного гидрокси, -O-C1-4алкилом или -O-C3-6циклоалкилом;
Y2 представляет собой CH2 или O;
A представляет собой ковалентную связь;
Q представляет собой водород или C1-4алкил, необязательно замещенный фенилом;
--L-R3 выбран из (a), (b), (c), (d), (e) или (f):
(a) --L-R3 представляет собой -NRAR1A, где
RA выбран из группы, состоящей из водорода; циклопропила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора и -CN; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR3a и -NR4aR4aa;
R1A выбран из группы, состоящей из C1-6алкила, необязательно замещенного одним, двумя или тремя заместителями, представляющими собой атом фтора; и C2-6алкила, замещенного заместителем, выбранным из группы, состоящей из -OR1a и -NR2aR2aa,
где каждый из R1a, R2a, R2aa, R3a, R4a и R4aa независимо выбран из группы, состоящей из водорода, C1-4алкила и циклопропила;
или
(b) L выбран из группы, состоящей из -N(RB)-, -N(RB)-CR1BR1BB- и
-(NRB)-CHR1B-CHR2B-; и R3 выбран из группы, состоящей из Ar; Het1; Het2; Het3; R17 и 7-10-членной насыщенной спирокарбобициклической системы; где
RB выбран из группы, состоящей из водорода; циклопропила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора и -CN; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR1b и -NR2bR2bb; при условии, что если R3 представляет собой R17, то RB представляет собой водород;
где
каждый из R1b, R2b и R2bb независимо выбран из группы, состоящей из водорода, C1-4алкила и циклопропила;
R1B выбран из группы, состоящей из водорода; галогена; C3-6циклоалкила;
C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, гидрокси и -CN; C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR4B и -NR5BR5BB; и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы; и R1BB выбран из группы, состоящей из водорода и метила; или R1B и R1BB вместе с углеродом, к которому они присоединены, образуют C3-6циклоалкил или связанный посредством C 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом азота, кислорода или серы;
R2B выбран из группы, состоящей из водорода; -OR6B; -NR7BR7BB; CF3,
C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN, -OR4B и -NR5BR5BB; и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы; где
каждый из R4B, R5B, R5BB, R6B, R7B и R7BB независимо выбран из группы, состоящей из водорода; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN и
-C(=O)NR9BR9BB, и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR10B и -NR11BR11BB; где
каждый из R9B, R9BB, R10B, R11B и R11BB независимо выбран из группы, состоящей из водорода; C1-4алкила и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы;
или
(c) --L-R3 выбран из группы, состоящей из -N(RC)-COR5C и
-N(RC)-SO2-R13C, где
RC выбран из группы, состоящей из водорода; циклопропила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора и -CN; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR1c и -NR2cR2cc;
каждый из R5C и R13C независимо выбран из группы, состоящей из водорода; Ar; Het1; Het2; Het3; R17; 7-10-членной насыщенной спирокарбобициклической системы и C1-4алкила, необязательно замещенного -NR2cR2cc, Ar, Het1 или Het2; где
каждый из R1c, R2c и R2cc независимо выбран из группы, состоящей из водорода и C1-4алкила;
или
(d) L выбран из -N(RD)-CR1DR1DD- и -N(RD)-CR1DR1DD-CR2DR2DD-; где
RD выбран из группы, состоящей из водорода; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора и -CN; и C2-4алкила, замещенного заместителем, выбранным из -OR1d и
-NR2dR2dd; где
каждый из R1d, R2d и R2dd независимо выбран из группы, состоящей из водорода и C1-4алкила;
каждый из R1D, R1DD, R2D и R2DD независимо выбран из группы, состоящей из водорода и C1-4алкила; и
R3 выбран из группы, состоящей из 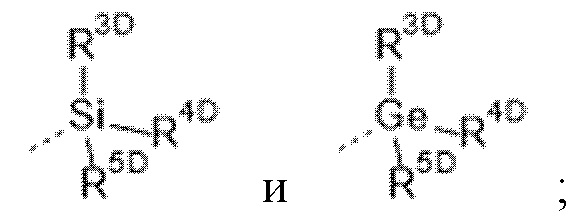 где
где
каждый из R3D, R4D и R5D независимо выбран из группы, состоящей из
C1-6алкила, необязательно замещенного заместителем, представляющим собой -OH, -OC1-6алкил или -NH2;
или
(e) --L-R3 представляет собой 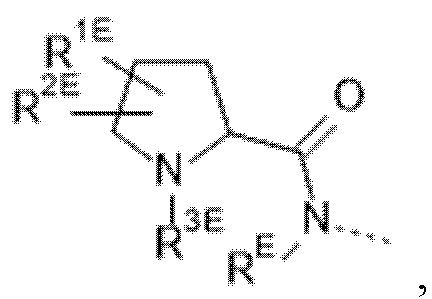 , где
, где
RE выбран из группы, состоящей из водорода и C1-4алкила;
R1E выбран из группы, состоящей из водорода, фтора и C1-4алкила; и
R2E выбран из группы, состоящей из фтора, -OC1-4алкила и C1-4алкила, необязательно замещенного 1, 2 или 3 заместителями, представляющими собой атом фтора; или R1E и R2E связаны с одним и тем же атомом углерода и вместе образуют C3-5циклоалкил или связанный посредством C 4-6-членный гетероциклил, содержащий атом кислорода; и
R3E выбран из группы, состоящей из водорода; C1-4алкила, необязательно замещенного заместителем, представляющим собой атом фтора или -CN; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR4E и -NR5ER5EE; где
каждый из R4E, R5E и R5EE независимо выбран из группы, состоящей из водорода; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN и -C(=O)NR6ER6EE; C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR7E и
-NR8ER8EE; и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы; где
каждый из R6E, R6EE, R7E, R8E и R8EE независимо выбран из группы, состоящей из водорода и C1-4алкила;
или
(f) --L-R3 представляет собой радикал
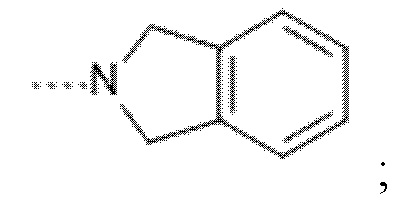
Ar представляет собой фенил, необязательно замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN, -OR4, -NR5R5',
-C(=O)NR5R5', Het4, -O-Het4, -NR5-Het4, -C(=O)-Het4, -S(=O)2-Het4, -S(=O)2-NR5R5', -S(=O)2-C1-4алкила, R14, CF3, C3-5циклоалкила, необязательно замещенного -CN, и
C1-4алкила, необязательно замещенного одним или двумя заместителями, каждый из которых независимо выбран из группы, состоящей из фтора, Het4, -CN, -OR6, -NR7R7',
-S(=O)2-C1-4алкила и -C(=O)NR8R8';
Het1 представляет собой моноциклический гетероарил, выбранный из группы, состоящей из пиридила, 2-, 4-, 5- или 6-пиримидинила, пиразинила, пиридазинила, фуранила, тиенила, пирролила, пиразолила, имидазолила, 4- или 5-тиазолила, изотиазолила и изоксазолила; каждый из которых может быть необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN, -OR4, -NR5R5', -C(=O)NR5R5', -C(=O)-Het4 и C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN, -OR6, Het2, -NR7R7' и -C(=O)NR8R8'; и
Het2 представляет собой неароматический гетероциклил, необязательно замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN,
-C(=O)-C1-6алкила, -C(=O)Ar, -C(=O)Het1, -C(=O)Het2, -OR4, -NR5R5' и C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора,
-CN, -OR6, -NR7R7', R12 и -C(=O)NR8R8';
где
R12 представляет собой связанный посредством C 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом азота, кислорода или серы;
каждый из R4, R5, R5', R6, R7, R7', R8 и R8' независимо выбран из группы, состоящей из водорода; -C(=O)-C1-4алкила; -S(=O)2-C1-4алкила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -C(=O)-C1-4алкила, -S(=O)2-C1-4алкила, R11'', R16 и -C(=O)NR9R9'; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR10 и -NR11R11'; где
каждый из R9, R9', R10, R11, R11' и R11'' независимо выбран из группы, состоящей из водорода; C1-4алкила; -S(=O)2-C1-4алкила; и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы, где указанный гетероциклил необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из -S(=O)2-C1-4алкила, галогена, циано и C1-4алкила, необязательно замещенного -O-C1-4алкилом;
R16 представляет собой связанный посредством N 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом N и необязательно один дополнительный гетероатом, выбранный из азота, кислорода и серы, где указанный гетероциклил необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из -S(=O)2-C1-4алкила, галогена, циано и C1-4алкила, необязательно замещенного -O-C1-4алкилом;
R14 представляет собой 5-членный моноциклический гетероарил, содержащий по меньшей мере один атом азота и необязательно 1, 2 или 3 дополнительных гетероатома, каждый из которых независимо выбран из азота, кислорода и серы;
Het3 выбран из группы, состоящей из заместителей, соответствующих формулам (b-1) и (b-2):

где кольцо B представляет собой фенил;
X1 представляет собой CH2, O или NH;
X2 представляет собой NH или O;
X3 представляет собой NH или O;
X4 представляет собой CH или N;
X5 представляет собой CH или N;
где один атом C или один атом N в 5-членном кольце (b-1) или (b-2), включая подходящие атомы C и атомы N в определении X1, X2, X3, X4 и X5, могут быть замещены одной или, если возможно, двумя C1-4алкильными группами, необязательно замещенными одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, циано, -C(=O)NR5R5' и Het4;
Het4 представляет собой 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом азота, кислорода или серы, где указанный гетероциклил необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN, оксо, -C(=O)NR5R5', -O-C1-4алкила, -S(=O)2-C1-4алкила и C1-4алкила, необязательно замещенного -O-C1-4алкилом;
R17 представляет собой C3-6циклоалкил, необязательно замещенный одним или несколькими заместителями, выбранными из группы, состоящей из галогена, -CN, -OR4, -NR5R5', -C(=O)NR5R5' и C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора,
-CN, -OR6, -NR7R7' и -C(=O)NR8R8';
каждый из n1, n2 и m1 независимо выбран из 1 и 2;
m2 равняется 0 или 1;
и к их фармацевтически приемлемым солям и сольватам.
В частности, настоящее изобретение относится к соединениям формулы (I), определенным в данном документе, и к их таутомерам и стереоизомерным формам, где
R1 выбран из группы, состоящей из CH3, CH2F, CHF2 и CF3;
Y1 представляет собой N или CRy;
если Y1 представляет собой N, то R2 выбран из группы, состоящей из водорода, CH3,
-OCH3, -NH2 и -NH-CH3;
если Y1 представляет собой CRy, то R2 представляет собой водород;
Ry выбран из группы, состоящей из водорода, циано и C1-4алкила, необязательно замещенного гидрокси, -O-C1-4алкилом или -O-C3-6циклоалкилом;
Y2 представляет собой CH2 или O;
A представляет собой -CR15aR15b-;
каждый из R15a и R15b независимо выбран из группы, состоящей из водорода или C1-4алкила;
Q представляет собой водород или C1-4алкил, необязательно замещенный фенилом;
--L-R3 выбран из (a), (b), (c), (d), (e) или (f):
(a) --L-R3 представляет собой -NRAR1A, где
RA выбран из группы, состоящей из водорода; циклопропила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора и -CN; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR3a и -NR4aR4aa;
R1A выбран из группы, состоящей из C1-6алкила, необязательно замещенного одним, двумя или тремя заместителями, представляющими собой атом фтора; и C2-6алкила, замещенного заместителем, выбранным из группы, состоящей из -OR1a и -NR2aR2aa,
где каждый из R1a, R2a, R2aa, R3a, R4a и R4aa независимо выбран из группы, состоящей из водорода, C1-4алкила и циклопропила;
или
(b) L выбран из группы, состоящей из -N(RB)-, -N(RB)-CR1BR1BB- и
-(NRB)-CHR1B-CHR2B-; и R3 выбран из группы, состоящей из Ar; Het1; Het2; Het3; R17 и 7-10-членной насыщенной спирокарбобициклической системы; где
RB выбран из группы, состоящей из водорода; циклопропила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора и -CN; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR1b и -NR2bR2bb; при условии, что если R3 представляет собой R17, то RB представляет собой водород;
где
каждый из R1b, R2b и R2bb независимо выбран из группы, состоящей из водорода, C1-4алкила и циклопропила;
R1B выбран из группы, состоящей из водорода; галогена; C3-6циклоалкила;
C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, гидрокси и -CN; C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR4B и -NR5BR5BB; и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы; и R1BB выбран из группы, состоящей из водорода и метила; или R1B и R1BB вместе с углеродом, к которому они присоединены, образуют C3-6циклоалкил или связанный посредством C 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом азота, кислорода или серы;
R2B выбран из группы, состоящей из водорода; -OR6B; -NR7BR7BB; CF3,
C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN, -OR4B и -NR5BR5BB; и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы; где
каждый из R4B, R5B, R5BB, R6B, R7B и R7BB независимо выбран из группы, состоящей из водорода; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN и
-C(=O)NR9BR9BB, и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR10B и -NR11BR11BB; где
каждый из R9B, R9BB, R10B, R11B и R11BB независимо выбран из группы, состоящей из водорода; C1-4алкила и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы;
или
(c) --L-R3 выбран из группы, состоящей из -N(RC)-COR5C и
-N(RC)-SO2-R13C, где
RC выбран из группы, состоящей из водорода; циклопропила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора и -CN; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR1c и -NR2cR2cc;
каждый из R5C и R13C независимо выбран из группы, состоящей из водорода; Ar; Het1; Het2; Het3; R17; 7-10-членной насыщенной спирокарбобициклической системы и C1-4алкила, необязательно замещенного -NR2cR2cc, Ar, Het1 или Het2; где
каждый из R1c, R2c и R2cc независимо выбран из группы, состоящей из водорода и C1-4алкила;
или
(d) L выбран из -N(RD)-CR1DR1DD- и -N(RD)-CR1DR1DD-CR2DR2DD-; где
RD выбран из группы, состоящей из водорода; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора и -CN; и C2-4алкила, замещенного заместителем, выбранным из -OR1d и
-NR2dR2dd; где
каждый из R1d, R2d и R2dd независимо выбран из группы, состоящей из водорода и C1-4алкила;
каждый из R1D, R1DD, R2D и R2DD независимо выбран из группы, состоящей из водорода и C1-4алкила; и
R3 выбран из группы, состоящей из  и
и  ; где
; где
каждый из R3D, R4D и R5D независимо выбран из группы, состоящей из
C1-6алкила, необязательно замещенного заместителем, представляющим собой -OH, -OC1-6алкил или -NH2;
или
(e) --L-R3 представляет собой  , где
, где
RE выбран из группы, состоящей из водорода и C1-4алкила;
R1E выбран из группы, состоящей из водорода, фтора и C1-4алкила; и
R2E выбран из группы, состоящей из фтора, -OC1-4алкила и C1-4алкила, необязательно замещенного 1, 2 или 3 заместителями, представляющими собой атом фтора; или R1E и R2E связаны с одним и тем же атомом углерода и вместе образуют C3-5циклоалкил или связанный посредством C 4-6-членный гетероциклил, содержащий атом кислорода; и
R3E выбран из группы, состоящей из водорода; C1-4алкила, необязательно замещенного заместителем, представляющим собой атом фтора или -CN; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR4E и -NR5ER5EE; где
каждый из R4E, R5E и R5EE независимо выбран из группы, состоящей из водорода; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN и -C(=O)NR6ER6EE; C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR7E и
-NR8ER8EE; и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы; где
каждый из R6E, R6EE, R7E, R8E и R8EE независимо выбран из группы, состоящей из водорода и C1-4алкила;
или
(f) --L-R3 представляет собой радикал
 ;
;
Ar представляет собой фенил, необязательно замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN, -OR4, -NR5R5',
-C(=O)NR5R5', Het4, -O-Het4, -NR5-Het4, -C(=O)-Het4, -S(=O)2-Het4, -S(=O)2-NR5R5', -S(=O)2-C1-4алкила, R14, CF3, C3-5циклоалкила, необязательно замещенного -CN, и
C1-4алкила, необязательно замещенного одним или двумя заместителями, каждый из которых независимо выбран из группы, состоящей из фтора, Het4, -CN, -OR6, -NR7R7',
-S(=O)2-C1-4алкила и -C(=O)NR8R8';
Het1 представляет собой моноциклический гетероарил, выбранный из группы, состоящей из пиридила, 2-, 4-, 5- или 6-пиримидинила, пиразинила, пиридазинила, фуранила, тиенила, пирролила, пиразолила, имидазолила, 4- или 5-тиазолила, изотиазолила и изоксазолила; каждый из которых может быть необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN, -OR4, -NR5R5', -C(=O)NR5R5', -C(=O)-Het4 и C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN, -OR6, Het2, -NR7R7' и -C(=O)NR8R8'; и
Het2 представляет собой неароматический гетероциклил, необязательно замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN,
-C(=O)-C1-6алкила, -C(=O)Ar, -C(=O)Het1, -C(=O)Het2, -OR4, -NR5R5' и C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора,
-CN, -OR6, -NR7R7', R12 и -C(=O)NR8R8';
где
R12 представляет собой связанный посредством C 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом азота, кислорода или серы;
каждый из R4, R5, R5', R6, R7, R7', R8 и R8' независимо выбран из группы, состоящей из водорода; -C(=O)-C1-4алкила; -S(=O)2-C1-4алкила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -C(=O)-C1-4алкила, -S(=O)2-C1-4алкила, R11'', R16 и -C(=O)NR9R9'; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR10 и -NR11R11'; где
каждый из R9, R9', R10, R11, R11' и R11'' независимо выбран из группы, состоящей из водорода; C1-4алкила; -S(=O)2-C1-4алкила; и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы, где указанный гетероциклил необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из -S(=O)2-C1-4алкила, галогена, циано и C1-4алкила, необязательно замещенного -O-C1-4алкилом;
R16 представляет собой связанный посредством N 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом N и необязательно один дополнительный гетероатом, выбранный из азота, кислорода и серы, где указанный гетероциклил необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из -S(=O)2-C1-4алкила, галогена, циано и C1-4алкила, необязательно замещенного -O-C1-4алкилом;
R14 представляет собой 5-членный моноциклический гетероарил, содержащий по меньшей мере один атом азота и необязательно 1, 2 или 3 дополнительных гетероатома, каждый из которых независимо выбран из азота, кислорода и серы;
Het3 выбран из группы, состоящей из заместителей, соответствующих формулам (b-1) и (b-2):

где кольцо B представляет собой фенил;
X1 представляет собой CH2, O или NH;
X2 представляет собой NH или O;
X3 представляет собой NH или O;
X4 представляет собой CH или N;
X5 представляет собой CH или N;
где один атом C или один атом N в 5-членном кольце (b-1) или (b-2), включая подходящие атомы C и атомы N в определении X1, X2, X3, X4 и X5, могут быть замещены одной или, если возможно, двумя C1-4алкильными группами, необязательно замещенными одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, циано, -C(=O)NR5R5' и Het4;
Het4 представляет собой 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом азота, кислорода или серы, где указанный гетероциклил необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN, оксо, -C(=O)NR5R5', -O-C1-4алкила, -S(=O)2-C1-4алкила и C1-4алкила, необязательно замещенного -O-C1-4алкилом;
R17 представляет собой C3-6циклоалкил, необязательно замещенный одним или несколькими заместителями, выбранными из группы, состоящей из галогена, -CN, -OR4, -NR5R5', -C(=O)NR5R5' и C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора,
-CN, -OR6, -NR7R7' и -C(=O)NR8R8';
каждый из n1, n2 и m1 независимо выбран из 1 и 2;
m2 равняется 0 или 1;
и к их фармацевтически приемлемым солям и сольватам.
В частности, настоящее изобретение относится к соединениям формулы (I), определенным в данном документе, и к их таутомерам и стереоизомерным формам, где
R1 выбран из группы, состоящей из CH3, CH2F, CHF2 и CF3;
Y1 представляет собой N;
R2 выбран из группы, состоящей из водорода, CH3, -OCH3, -NH2 и -NH-CH3;
Y2 представляет собой CH2;
A представляет собой ковалентную связь или -CR15aR15b-;
каждый из R15a и R15b независимо выбран из группы, состоящей из водорода или C1-4алкила;
Q представляет собой водород;
--L-R3 выбран из (a), (b) или (c):
(a) --L-R3 представляет собой -NRAR1A, где
RA выбран из группы, состоящей из водорода; циклопропила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора и -CN; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR3a и -NR4aR4aa;
R1A выбран из группы, состоящей из C1-6алкила, необязательно замещенного одним, двумя или тремя заместителями, представляющими собой атом фтора; и C2-6алкила, замещенного заместителем, выбранным из группы, состоящей из -OR1a и -NR2aR2aa,
где каждый из R1a, R2a, R2aa, R3a, R4a и R4aa независимо выбран из группы, состоящей из водорода, C1-4алкила и циклопропила;
или
(b) L выбран из группы, состоящей из -N(RB)-, -N(RB)-CR1BR1BB- и
-(NRB)-CHR1B-CHR2B-; и R3 выбран из группы, состоящей из Ar; Het1; Het2; Het3; R17 и 7-10-членной насыщенной спирокарбобициклической системы; где
RB выбран из группы, состоящей из водорода; циклопропила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора и -CN; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR1b и -NR2bR2bb; при условии, что если R3 представляет собой R17, то RB представляет собой водород;
где
каждый из R1b, R2b и R2bb независимо выбран из группы, состоящей из водорода, C1-4алкила и циклопропила;
R1B выбран из группы, состоящей из водорода; галогена; C3-6циклоалкила;
C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, гидрокси и -CN; C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR4B и -NR5BR5BB; и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы; и R1BB выбран из группы, состоящей из водорода и метила; или R1B и R1BB вместе с углеродом, к которому они присоединены, образуют C3-6циклоалкил или связанный посредством C 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом азота, кислорода или серы;
R2B выбран из группы, состоящей из водорода; -OR6B; -NR7BR7BB; CF3,
C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN, -OR4B и -NR5BR5BB; и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы; где
каждый из R4B, R5B, R5BB, R6B, R7B и R7BB независимо выбран из группы, состоящей из водорода; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN и
-C(=O)NR9BR9BB, и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR10B и -NR11BR11BB; где
каждый из R9B, R9BB, R10B, R11B и R11BB независимо выбран из группы, состоящей из водорода; C1-4алкила и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы;
или
(c) --L-R3 выбран из группы, состоящей из -N(RC)-COR5C и
-N(RC)-SO2-R13C, где
RC выбран из группы, состоящей из водорода; циклопропила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора и -CN; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR1c и -NR2cR2cc;
каждый из R5C и R13C независимо выбран из группы, состоящей из водорода; Ar; Het1; Het2; Het3; R17; 7-10-членной насыщенной спирокарбобициклической системы и C1-4алкила, необязательно замещенного -NR2cR2cc, Ar, Het1 или Het2; где
каждый из R1c, R2c и R2cc независимо выбран из группы, состоящей из водорода и C1-4алкила;
Ar представляет собой фенил, необязательно замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN, -OR4, -NR5R5',
-C(=O)NR5R5', Het4, -O-Het4, -NR5-Het4, -C(=O)-Het4, -S(=O)2-Het4, -S(=O)2-NR5R5', -S(=O)2-C1-4алкила, R14, CF3, C3-5циклоалкила, необязательно замещенного -CN, и
C1-4алкила, необязательно замещенного одним или двумя заместителями, каждый из которых независимо выбран из группы, состоящей из фтора, Het4, -CN, -OR6, -NR7R7',
-S(=O)2-C1-4алкила и -C(=O)NR8R8';
Het1 представляет собой моноциклический гетероарил, выбранный из группы, состоящей из пиридила, 2-, 4-, 5- или 6-пиримидинила, пиразинила, пиридазинила, фуранила, тиенила, пирролила, пиразолила, имидазолила, 4- или 5-тиазолила, изотиазолила и изоксазолила; каждый из которых может быть необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN, -OR4, -NR5R5', -C(=O)NR5R5', -C(=O)-Het4 и C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN, -OR6, Het2, -NR7R7' и -C(=O)NR8R8'; и
Het2 представляет собой неароматический гетероциклил, необязательно замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN,
-C(=O)-C1-6алкила, -C(=O)Ar, -C(=O)Het1, -C(=O)Het2, -OR4, -NR5R5' и C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора,
-CN, -OR6, -NR7R7', R12 и -C(=O)NR8R8';
где
R12 представляет собой связанный посредством C 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом азота, кислорода или серы;
каждый из R4, R5, R5', R6, R7, R7', R8 и R8' независимо выбран из группы, состоящей из водорода; -C(=O)-C1-4алкила; -S(=O)2-C1-4алкила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -C(=O)-C1-4алкила, -S(=O)2-C1-4алкила, R11'', R16 и -C(=O)NR9R9'; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR10 и -NR11R11'; где
каждый из R9, R9', R10, R11, R11' и R11'' независимо выбран из группы, состоящей из водорода; C1-4алкила; -S(=O)2-C1-4алкила; и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы, где указанный гетероциклил необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из -S(=O)2-C1-4алкила, галогена, циано и C1-4алкила, необязательно замещенного -O-C1-4алкилом;
R16 представляет собой связанный посредством N 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом N и необязательно один дополнительный гетероатом, выбранный из азота, кислорода и серы, где указанный гетероциклил необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из -S(=O)2-C1-4алкила, галогена, циано и C1-4алкила, необязательно замещенного -O-C1-4алкилом;
R14 представляет собой 5-членный моноциклический гетероарил, содержащий по меньшей мере один атом азота и необязательно 1, 2 или 3 дополнительных гетероатома, каждый из которых независимо выбран из азота, кислорода и серы;
Het3 выбран из группы, состоящей из заместителей, соответствующих формулам (b-1) и (b-2):

где кольцо B представляет собой фенил;
X1 представляет собой CH2, O или NH;
X2 представляет собой NH или O;
X3 представляет собой NH или O;
X4 представляет собой CH или N;
X5 представляет собой CH или N;
где один атом C или один атом N в 5-членном кольце (b-1) или (b-2), включая подходящие атомы C и атомы N в определении X1, X2, X3, X4 и X5, могут быть замещены одной или, если возможно, двумя C1-4алкильными группами, необязательно замещенными одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, циано, -C(=O)NR5R5' и Het4;
Het4 представляет собой 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом азота, кислорода или серы, где указанный гетероциклил необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN, оксо, -C(=O)NR5R5', -O-C1-4алкила, -S(=O)2-C1-4алкила и C1-4алкила, необязательно замещенного -O-C1-4алкилом;
R17 представляет собой C3-6циклоалкил, необязательно замещенный одним или несколькими заместителями, выбранными из группы, состоящей из галогена, -CN, -OR4, -NR5R5', -C(=O)NR5R5' и C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN, -OR6, -NR7R7' и -C(=O)NR8R8';
каждый из n1, n2 и m1 независимо выбран из 1 и 2;
m2 равняется 0 или 1;
и к их фармацевтически приемлемым солям и сольватам.
В частности, настоящее изобретение относится к соединениям формулы (I), определенным в данном документе, и к их таутомерам и стереоизомерным формам, где
R1 выбран из группы, состоящей из CH3, CH2F, CHF2 и CF3;
Y1 представляет собой N;
R2 выбран из группы, состоящей из водорода, CH3, -OCH3, -NH2 и
-NH-CH3;
Y2 представляет собой CH2;
A представляет собой ковалентную связь;
Q представляет собой водород;
--L-R3 выбран из (a), (b) или (c):
(a) --L-R3 представляет собой -NRAR1A, где
RA выбран из группы, состоящей из водорода; циклопропила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора и -CN; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR3a и -NR4aR4aa;
R1A выбран из группы, состоящей из C1-6алкила, необязательно замещенного одним, двумя или тремя заместителями, представляющими собой атом фтора; и C2-6алкила, замещенного заместителем, выбранным из группы, состоящей из -OR1a и -NR2aR2aa,
где каждый из R1a, R2a, R2aa, R3a, R4a и R4aa независимо выбран из группы, состоящей из водорода, C1-4алкила и циклопропила;
или
(b) L выбран из группы, состоящей из -N(RB)-, -N(RB)-CR1BR1BB- и
-(NRB)-CHR1B-CHR2B-; и R3 выбран из группы, состоящей из Ar; Het1; Het2; Het3; R17 и 7-10-членной насыщенной спирокарбобициклической системы; где
RB выбран из группы, состоящей из водорода; циклопропила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора и -CN; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR1b и -NR2bR2bb; при условии, что если R3 представляет собой R17, то RB представляет собой водород;
где
каждый из R1b, R2b и R2bb независимо выбран из группы, состоящей из водорода, C1-4алкила и циклопропила;
R1B выбран из группы, состоящей из водорода; галогена; C3-6циклоалкила;
C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, гидрокси и -CN; C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR4B и -NR5BR5BB; и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы; и R1BB выбран из группы, состоящей из водорода и метила; или R1B и R1BB вместе с углеродом, к которому они присоединены, образуют C3-6циклоалкил или связанный посредством C 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом азота, кислорода или серы;
R2B выбран из группы, состоящей из водорода; -OR6B; -NR7BR7BB; CF3,
C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN, -OR4B и -NR5BR5BB; и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы; где
каждый из R4B, R5B, R5BB, R6B, R7B и R7BB независимо выбран из группы, состоящей из водорода; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN и
-C(=O)NR9BR9BB, и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR10B и -NR11BR11BB; где
каждый из R9B, R9BB, R10B, R11B и R11BB независимо выбран из группы, состоящей из водорода; C1-4алкила и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы;
или
(c) --L-R3 выбран из группы, состоящей из -N(RC)-COR5C и
-N(RC)-SO2-R13C, где
RC выбран из группы, состоящей из водорода; циклопропила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора и -CN; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR1c и -NR2cR2cc;
каждый из R5C и R13C независимо выбран из группы, состоящей из водорода; Ar; Het1; Het2; Het3; R17; 7-10-членной насыщенной спирокарбобициклической системы и C1-4алкила, необязательно замещенного -NR2cR2cc, Ar, Het1 или Het2; где
каждый из R1c, R2c и R2cc независимо выбран из группы, состоящей из водорода и C1-4алкила;
Ar представляет собой фенил, необязательно замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN, -OR4, -NR5R5',
-C(=O)NR5R5', Het4, -O-Het4, -NR5-Het4, -C(=O)-Het4, -S(=O)2-Het4, -S(=O)2-NR5R5', -S(=O)2-C1-4алкила, R14, CF3, C3-5циклоалкила, необязательно замещенного -CN, и
C1-4алкила, необязательно замещенного одним или двумя заместителями, каждый из которых независимо выбран из группы, состоящей из фтора, Het4, -CN, -OR6, -NR7R7',
-S(=O)2-C1-4алкила и -C(=O)NR8R8';
Het1 представляет собой моноциклический гетероарил, выбранный из группы, состоящей из пиридила, 2-, 4-, 5- или 6-пиримидинила, пиразинила, пиридазинила, фуранила, тиенила, пирролила, пиразолила, имидазолила, 4- или 5-тиазолила, изотиазолила и изоксазолила; каждый из которых может быть необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN, -OR4, -NR5R5', -C(=O)NR5R5', -C(=O)-Het4 и C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN, -OR6, Het2, -NR7R7' и -C(=O)NR8R8'; и
Het2 представляет собой неароматический гетероциклил, необязательно замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN,
-C(=O)-C1-6алкила, -C(=O)Ar, -C(=O)Het1, -C(=O)Het2, -OR4, -NR5R5' и C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора,
-CN, -OR6, -NR7R7', R12 и -C(=O)NR8R8';
где
R12 представляет собой связанный посредством C 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом азота, кислорода или серы;
каждый из R4, R5, R5', R6, R7, R7', R8 и R8' независимо выбран из группы, состоящей из водорода; -C(=O)-C1-4алкила; -S(=O)2-C1-4алкила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -C(=O)-C1-4алкила, -S(=O)2-C1-4алкила, R11'', R16 и -C(=O)NR9R9'; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR10 и -NR11R11'; где
каждый из R9, R9', R10, R11, R11' и R11'' независимо выбран из группы, состоящей из водорода; C1-4алкила; -S(=O)2-C1-4алкила; и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы, где указанный гетероциклил необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из -S(=O)2-C1-4алкила, галогена, циано и C1-4алкила, необязательно замещенного -O-C1-4алкилом;
R16 представляет собой связанный посредством N 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом N и необязательно один дополнительный гетероатом, выбранный из азота, кислорода и серы, где указанный гетероциклил необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из -S(=O)2-C1-4алкила, галогена, циано и C1-4алкила, необязательно замещенного -O-C1-4алкилом;
R14 представляет собой 5-членный моноциклический гетероарил, содержащий по меньшей мере один атом азота и необязательно 1, 2 или 3 дополнительных гетероатома, каждый из которых независимо выбран из азота, кислорода и серы;
Het3 выбран из группы, состоящей из заместителей, соответствующих формулам (b-1) и (b-2):

где кольцо B представляет собой фенил;
X1 представляет собой CH2, O или NH;
X2 представляет собой NH или O;
X3 представляет собой NH или O;
X4 представляет собой CH или N;
X5 представляет собой CH или N;
где один атом C или один атом N в 5-членном кольце (b-1) или (b-2), включая подходящие атомы C и атомы N в определении X1, X2, X3, X4 и X5, могут быть замещены одной или, если возможно, двумя C1-4алкильными группами, необязательно замещенными одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, циано, -C(=O)NR5R5' и Het4;
Het4 представляет собой 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом азота, кислорода или серы, где указанный гетероциклил необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN, оксо, -C(=O)NR5R5', -O-C1-4алкила, -S(=O)2-C1-4алкила и C1-4алкила, необязательно замещенного -O-C1-4алкилом;
R17 представляет собой C3-6циклоалкил, необязательно замещенный одним или несколькими заместителями, выбранными из группы, состоящей из галогена, -CN, -OR4, -NR5R5', -C(=O)NR5R5' и C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN, -OR6, -NR7R7' и -C(=O)NR8R8';
каждый из n1, n2 и m1 независимо выбран из 1 и 2;
m2 равняется 0 или 1;
и к их фармацевтически приемлемым солям и сольватам.
В частности, настоящее изобретение относится к соединениям формулы (I), определенным в данном документе, и к их таутомерам и стереоизомерным формам, где
R1 выбран из группы, состоящей из CF3;
Y1 представляет собой N;
R2 выбран из группы, состоящей из водорода, -OCH3, -NH2 и -NH-CH3;
Y2 представляет собой CH2;
A представляет собой ковалентную связь или -CR15aR15b-;
R15a и R15b представляют собой водород;
Q представляет собой водород;
--L-R3 выбран из (a), (b) или (c):
(a) --L-R3 представляет собой -NRAR1A, где
RA выбран из группы, состоящей из водорода или C1-4алкила;
R1A представляет собой C1-6алкил;
или
(b) L выбран из группы, состоящей из -N(RB)- и -N(RB)-CR1BR1BB-; и R3 выбран из группы, состоящей из Ar; Het1; Het2; Het3 и R17; где
RB представляет собой водород;
R1B выбран из группы, состоящей из водорода и C1-4алкила; и
R1BB выбран из группы, состоящей из водорода и метила; или R1B и R1BB вместе с углеродом, к которому они присоединены, образуют C3-6циклоалкил;
или
(c) --L-R3 выбран из группы, состоящей из -N(RC)-COR5C и
-N(RC)-SO2-R13C, где
RC выбран из группы, состоящей из водорода и C1-4алкила;
каждый из R5C и R13C независимо выбран из группы, состоящей из водорода; Ar; Het3 и C1-4алкила, необязательно замещенного Het2;
Ar представляет собой фенил, необязательно замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN, -OR4, -NR5R5',
-C(=O)NR5R5', Het4, -O-Het4, -NR5-Het4, -C(=O)-Het4, -S(=O)2-Het4, -S(=O)2-NR5R5', -S(=O)2-C1-4алкила, R14, CF3, C3-5циклоалкила, необязательно замещенного -CN, и
C1-4алкила, необязательно замещенного одним или двумя заместителями, каждый из которых независимо выбран из группы, состоящей из Het4, -CN, -OR6, -S(=O)2-C1-4алкила и
-C(=O)NR8R8';
Het1 представляет собой моноциклический гетероарил, выбранный из группы, состоящей из пиридила,
2-пиримидинила, пиразинила, пиридазинила и пиразолила; каждый из которых может быть необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из -CN, -OR4, -C(=O)NR5R5', -C(=O)-Het4 и C1-4алкила; и
Het2 представляет собой неароматический гетероциклил, необязательно замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора;
где
каждый из R4, R5, R5', R6, R8 и R8' независимо выбран из группы, состоящей из водорода; -C(=O)-C1-4алкила; -S(=O)2-C1-4алкила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из -S(=O)2-C1-4алкила и R16; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR10 и -NR11R11'; где
каждый из R10, R11 и R11' независимо выбран из группы, состоящей из водорода; C1-4алкила; -S(=O)2-C1-4алкила и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы, где указанный гетероциклил необязательно замещен одним, двумя или тремя заместителями, представляющими собой -S(=O)2-C1-4алкил;
R16 представляет собой связанный посредством N 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом N и необязательно один дополнительный гетероатом, выбранный из азота, кислорода и серы, где указанный гетероциклил необязательно замещен одним, двумя или тремя
заместителями, представляющими собой -S(=O)2-C1-4алкил;
R14 представляет собой 5-членный моноциклический гетероарил, содержащий по меньшей мере один атом азота и необязательно 1, 2 или 3 дополнительных гетероатома, каждый из которых независимо выбран из азота, кислорода и серы;
Het3 выбран из группы, состоящей из заместителей, соответствующих формулам (b-1) и (b-2):

где кольцо B представляет собой фенил;
X1 представляет собой CH2, O или NH;
X2 представляет собой NH или O;
X3 представляет собой NH или O;
X4 представляет собой CH или N;
X5 представляет собой CH или N;
где один атом C или один атом N в 5-членном кольце (b-1) или (b-2), включая подходящие атомы C и атомы N в определении X1, X2, X3, X4 и X5, могут быть замещены одной или, если возможно, двумя C1-4алкильными группами, необязательно замещенными одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, циано, -C(=O)NR5R5' и Het4;
Het4 представляет собой 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом азота, кислорода или серы, где указанный гетероциклил необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из
-CN, оксо, -C(=O)NR5R5', -O-C1-4алкила, -S(=O)2-C1-4алкила и C1-4алкила, необязательно замещенного -O-C1-4алкилом;
R17 представляет собой C3-6циклоалкил, необязательно замещенный одним или несколькими заместителями -NR5R5';
каждый из n1, n2 и m1 независимо выбран из 1 и 2;
m2 равняется 0 или 1;
и к их фармацевтически приемлемым солям и сольватам.
В частности, настоящее изобретение относится к соединениям формулы (I), определенным в данном документе, и к их таутомерам и стереоизомерным формам, где
R1 выбран из группы, состоящей из CF3;
Y1 представляет собой N;
R2 выбран из группы, состоящей из водорода, -OCH3 и -NH-CH3;
Y2 представляет собой CH2;
A представляет собой ковалентную связь или -CR15aR15b-;
R15a и R15b представляют собой водород;
Q представляет собой водород;
--L-R3 выбран из (a), (b) или (c):
(a) --L-R3 представляет собой -NRAR1A, где
RA представляет собой C1-4алкил;
R1A представляет собой C1-6алкил;
или
(b) L выбран из группы, состоящей из -N(RB)- и -N(RB)-CR1BR1BB-; и R3 выбран из группы, состоящей из Ar; Het1; Het3 и R17; где
RB представляет собой водород;
R1B представляет собой водород; и
R1BB выбран из группы, состоящей из водорода и метила;
или
(c) --L-R3 выбран из группы, состоящей из -N(RC)-COR5C и
-N(RC)-SO2-R13C, где
RC выбран из группы, состоящей из водорода и C1-4алкила;
каждый из R5C и R13C независимо выбран из группы, состоящей из водорода; Ar; Het3 и C1-4алкила, необязательно замещенного Het2;
Ar представляет собой фенил, необязательно замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN, -OR4, -NR5R5',
-C(=O)NR5R5', Het4, -O-Het4, -NR5-Het4, -C(=O)-Het4, R14, CF3 и
C1-4алкила, необязательно замещенного одним или двумя заместителями, представляющими собой -CN;
Het1 представляет собой моноциклический гетероарил, выбранный из группы, состоящей из пиридила и пиразолила; каждый из которых может быть необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из -C(=O)NR5R5' и C1-4алкила; и
Het2 представляет собой неароматический гетероциклил;
где
каждый из R4, R5 и R5' независимо выбран из группы, состоящей из водорода; -S(=O)2-C1-4алкила; C1-4алкила, необязательно замещенного заместителем, представляющим собой R16; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR10 и -NR11R11'; где
каждый из R10, R11 и R11' независимо выбран из группы, состоящей из водорода и C1-4алкила;
R16 представляет собой связанный посредством N 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом N и необязательно один дополнительный гетероатом, выбранный из азота, кислорода и серы;
R14 представляет собой 5-членный моноциклический гетероарил, содержащий по меньшей мере один атом азота и необязательно 1, 2 или 3 дополнительных гетероатома, каждый из которых независимо выбран из азота, кислорода и серы;
Het3 выбран из группы, состоящей из заместителей, соответствующих формулам (b-1) и (b-2):

где кольцо B представляет собой фенил;
X1 представляет собой O или NH;
X2 представляет собой NH;
X3 представляет собой NH;
X4 представляет собой N;
X5 представляет собой CH;
где один атом C или один атом N в 5-членном кольце (b-1) или (b-2), включая подходящие атомы C и атомы N в определении X1, X2, X3, X4 и X5, могут быть замещены одной или, если возможно, двумя C1-4алкильными группами, необязательно замещенными одним, двумя или тремя заместителями, представляющими собой циано;
Het4 представляет собой 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом азота, кислорода или серы, где указанный гетероциклил необязательно замещен одним, двумя или тремя заместителями, представляющими собой C1-4алкил;
R17 представляет собой C3-6циклоалкил, необязательно замещенный одним или несколькими заместителями -NR5R5';
каждый из n1, n2 и m1 независимо выбран из 1 и 2;
m2 равняется 0 или 1;
и к их фармацевтически приемлемым солям и сольватам.
В частности, настоящее изобретение относится к соединениям формулы (I), определенным в данном документе, и к их таутомерам и стереоизомерным формам, где
R1 представляет собой CF3;
Y1 представляет собой N;
R2 выбран из группы, состоящей из водорода, -OCH3 и -NH-CH3;
Y2 представляет собой CH2;
A представляет собой ковалентную связь;
Q представляет собой водород;
--L-R3 выбран из (a), (b) или (c):
(a) --L-R3 представляет собой -NRAR1A, где
RA представляет собой C1-4алкил;
R1A представляет собой C1-6алкил;
или
(b) L выбран из группы, состоящей из -N(RB)- и -N(RB)-CR1BR1BB-; и R3 выбран из группы, состоящей из Ar; Het3 и R17; где
RB представляет собой водород;
R1B представляет собой водород; и
R1BB выбран из группы, состоящей из водорода и метила;
или
(c) --L-R3 выбран из группы, состоящей из -N(RC)-COR5C и
-N(RC)-SO2-R13C, где
RC выбран из группы, состоящей из водорода и C1-4алкила;
каждый из R5C и R13C независимо выбран из группы, состоящей из водорода; Ar; Het3 и C1-4алкила, необязательно замещенного Het2;
Ar представляет собой фенил, необязательно замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN, -OR4, -NR5R5',
-C(=O)NR5R5', Het4, -O-Het4, -NR5-Het4, R14, CF3 и
C1-4алкила, необязательно замещенного одним или двумя заместителями, представляющими собой -CN;
где
каждый из R4, R5 и R5' независимо выбран из группы, состоящей из водорода; -S(=O)2-C1-4алкила и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR10, -NR11R11' и R16;
где
каждый из R10, R11 и R11' независимо выбран из группы, состоящей из водорода и C1-4алкила;
R16 представляет собой связанный посредством N 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом N и необязательно один дополнительный гетероатом, выбранный из азота, кислорода и серы;
R14 представляет собой 5-членный моноциклический гетероарил, содержащий по меньшей мере один атом азота и необязательно 1, 2 или 3 дополнительных гетероатома, каждый из которых независимо выбран из азота, кислорода и серы;
Het3 выбран из группы, состоящей из заместителя, соответствующего формуле (b-1):
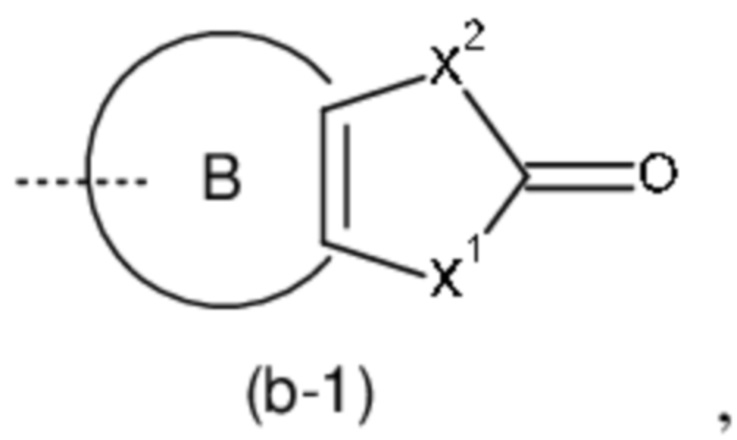
где кольцо B представляет собой фенил;
X1 представляет собой O или NH;
X2 представляет собой NH;
где один из атомов N в 5-членном кольце (b-1), включая подходящие атомы N в определении X1 и X2, может быть замещен одной C1-4алкильной группой;
Het4 представляет собой 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом азота, кислорода или серы, где указанный гетероциклил необязательно замещен одним, двумя или тремя заместителями, представляющими собой C1-4алкил;
R17 представляет собой C3-6циклоалкил, необязательно замещенный одним или несколькими заместителями -NR5R5';
каждый из n1, n2 и m1 независимо выбран из 1 и 2;
m2 равняется 0 или 1;
и к их фармацевтически приемлемым солям и сольватам.
В частности, настоящее изобретение относится к соединениям формулы (I), определенным в данном документе, и к их таутомерам и стереоизомерным формам, где
R1 представляет собой CF3;
Y1 представляет собой N;
R2 выбран из группы, состоящей из водорода, -OCH3 и -NH-CH3;
Y2 представляет собой CH2;
A представляет собой ковалентную связь;
Q представляет собой водород;
--L-R3 представляет собой (b):
(b) L выбран из группы, состоящей из -N(RB)- и -N(RB)-CR1BR1BB-; и R3 выбран из группы, состоящей из Ar и Het3; где
RB представляет собой водород;
R1B представляет собой водород; и
R1BB выбран из группы, состоящей из водорода;
Ar представляет собой фенил, необязательно замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -OR4, -C(=O)NR5R5', Het4,
-O-Het4, -NR5-Het4, R14 и C1-4алкила, необязательно замещенного одним или двумя заместителями, представляющими собой -CN;
где
каждый из R4, R5 и R5' независимо выбран из группы, состоящей из водорода; -S(=O)2-C1-4алкила и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR10, -NR11R11' и R16;
где
каждый из R10, R11 и R11' независимо выбран из группы, состоящей из водорода и C1-4алкила;
где R16 представляет собой связанный посредством N 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом N и необязательно один дополнительный гетероатом, выбранный из азота, кислорода и серы;
R14 представляет собой 5-членный моноциклический гетероарил, содержащий по меньшей мере один атом азота и необязательно 1, 2 или 3 дополнительных гетероатома, каждый из которых независимо выбран из азота, кислорода и серы;
Het3 выбран из группы, состоящей из заместителя, соответствующего формуле (b-1):

где кольцо B представляет собой фенил;
X1 представляет собой O или NH;
X2 представляет собой NH;
где один из атомов N в 5-членном кольце (b-1), включая подходящие атомы N в определении X1 и X2, может быть замещен одной C1-4алкильной группой;
Het4 представляет собой 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом азота, кислорода или серы, где указанный гетероциклил замещен одним, двумя или тремя заместителями, представляющими собой C1-4алкил;
каждый из n1, n2 и m1 независимо выбран из 1 и 2;
m2 равняется 0 или 1;
и к их фармацевтически приемлемым солям и сольватам.
В частности, настоящее изобретение относится к соединениям формулы (I), определенным в данном документе, и к их таутомерам и стереоизомерным формам, где
R1 выбран из группы, состоящей из CH3, CH2F, CHF2 и CF3;
Y1 представляет собой N или CRy;
если Y1 представляет собой N, то R2 выбран из группы, состоящей из водорода, CH3,
-OCH3, -NH2 и -NH-CH3;
если Y1 представляет собой CRy, то R2 представляет собой водород;
Ry выбран из группы, состоящей из водорода, циано и C1-4алкила, необязательно замещенного гидрокси, -O-C1-4алкилом или -O-C3-6циклоалкилом;
Y2 представляет собой CH2 или O;
A представляет собой ковалентную связь или -CR15aR15b-;
каждый из R15a и R15b независимо выбран из группы, состоящей из водорода или C1-4алкила;
Q представляет собой водород или C1-4алкил, необязательно замещенный фенилом;
--L-R3 выбран из (a), (b), (c), (d), (e) или (f):
(a) --L-R3 представляет собой -NRAR1A, где
RA выбран из группы, состоящей из водорода; циклопропила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора и -CN; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR3a и -NR4aR4aa;
R1A выбран из группы, состоящей из C1-6алкила, необязательно замещенного одним, двумя или тремя заместителями, представляющими собой атом фтора; и C2-6алкила, замещенного заместителем, выбранным из группы, состоящей из -OR1a и -NR2aR2aa,
где каждый из R1a, R2a, R2aa, R3a, R4a и R4aa независимо выбран из группы, состоящей из водорода, C1-4алкила и циклопропила;
или
(b) L выбран из группы, состоящей из -N(RB)-, -N(RB)-CR1BR1BB- и
-(NRB)-CHR1B-CHR2B-; и R3 выбран из группы, состоящей из Ar; Het1; Het2; Het3 и 7-10-членной насыщенной спирокарбобициклической системы; где
RB выбран из группы, состоящей из водорода; циклопропила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора и -CN; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR1b и -NR2bR2bb;
где
каждый из R1b, R2b и R2bb независимо выбран из группы, состоящей из водорода, C1-4алкила и циклопропила;
R1B выбран из группы, состоящей из водорода; галогена; C3-6циклоалкила;
C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, гидрокси и -CN; C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR4B и -NR5BR5BB; и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы; и R1BB выбран из группы, состоящей из водорода и метила; или R1B и R1BB вместе с углеродом, к которому они присоединены, образуют C3-6циклоалкил или связанный посредством C 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом азота, кислорода или серы;
R2B выбран из группы, состоящей из водорода; -OR6B; -NR7BR7BB; CF3,
C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN, -OR4B и -NR5BR5BB; и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы; где
каждый из R4B, R5B, R5BB, R6B, R7B и R7BB независимо выбран из группы, состоящей из водорода; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN и
-C(=O)NR9BR9BB, и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR10B и -NR11BR11BB; где
каждый из R9B, R9BB, R10B, R11B и R11BB независимо выбран из группы, состоящей из водорода; C1-4алкила и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы;
или
(c) --L-R3 выбран из группы, состоящей из -N(RC)-COR5C и
-N(RC)-SO2-R13C, где
RC выбран из группы, состоящей из водорода; циклопропила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора и -CN; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR1c и -NR2cR2cc;
каждый из R5C и R13C независимо выбран из группы, состоящей из водорода; Ar; Het1; Het2; Het3; 7-10-членной насыщенной спирокарбобициклической системы и C1-4алкила, необязательно замещенного -NR2cR2cc, Ar, Het1 или Het2; где
каждый из R1c, R2c и R2cc независимо выбран из группы, состоящей из водорода и C1-4алкила;
или
(d) L выбран из -N(RD)-CR1DR1DD- и -N(RD)-CR1DR1DD-CR2DR2DD-; где
RD выбран из группы, состоящей из водорода; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора и -CN; и C2-4алкила, замещенного заместителем, выбранным из -OR1d и
-NR2dR2dd; где
каждый из R1d, R2d и R2dd независимо выбран из группы, состоящей из водорода и C1-4алкила;
каждый из R1D, R1DD, R2D и R2DD независимо выбран из группы, состоящей из водорода и C1-4алкила; и
R3 выбран из группы, состоящей из  и
и  ; где
; где
каждый из R3D, R4D и R5D независимо выбран из группы, состоящей из
C1-6алкила, необязательно замещенного заместителем, представляющим собой -OH, -OC1-6алкил или -NH2;
или
(e) --L-R3 представляет собой  , где
, где
RE выбран из группы, состоящей из водорода и C1-4алкила;
R1E выбран из группы, состоящей из водорода, фтора и C1-4алкила; и
R2E выбран из группы, состоящей из фтора, -OC1-4алкила и C1-4алкила, необязательно замещенного 1, 2 или 3 заместителями, представляющими собой атом фтора; или R1E и R2E связаны с одним и тем же атомом углерода и вместе образуют C3-5циклоалкил или связанный посредством C 4-6-членный гетероциклил, содержащий атом кислорода; и
R3E выбран из группы, состоящей из водорода; C1-4алкила, необязательно замещенного заместителем, представляющим собой атом фтора или -CN; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR4E и -NR5ER5EE; где
каждый из R4E, R5E и R5EE независимо выбран из группы, состоящей из водорода; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN и -C(=O)NR6ER6EE; C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR7E и
-NR8ER8EE; и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы; где
каждый из R6E, R6EE, R7E, R8E и R8EE независимо выбран из группы, состоящей из водорода и C1-4алкила;
или
(f) --L-R3 представляет собой радикал
 ;
;
Ar представляет собой фенил, необязательно замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN, -OR4, -NR5R5',
-C(=O)NR5R5', -S(=O)2-NR5R5', -S(=O)2-C1-4алкил, R14, CF3, C3-5циклоалкила, необязательно замещенного -CN, и
C1-4алкила, необязательно замещенного одним или двумя заместителями, каждый из которых независимо выбран из группы, состоящей из фтора, -CN, -OR6, -NR7R7',
-S(=O)2-C1-4алкила и -C(=O)NR8R8';
Het1 представляет собой моноциклический гетероарил, выбранный из группы, состоящей из пиридила, 2-, 4-, 5- или 6-пиримидинила, пиразинила, пиридазинила, фуранила, тиенила, пирролила, пиразолила, имидазолила, 4- или 5-тиазолила, изотиазолила и изоксазолила; каждый из которых может быть необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN, -OR4, -NR5R5', -C(=O)NR5R5' и C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN, -OR6, Het2, -NR7R7' и -C(=O)NR8R8'; и
Het2 представляет собой неароматический гетероциклил, необязательно замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN,
-C(=O)-C1-6алкила, -C(=O)Ar, -C(=O)Het1, -C(=O)Het2, -OR4, -NR5R5' и C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора,
-CN, -OR6, -NR7R7', R12 и -C(=O)NR8R8';
где
R12 представляет собой связанный посредством C 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом азота, кислорода или серы;
каждый из R4, R5, R5', R6, R7, R7', R8 и R8' независимо выбран из группы, состоящей из водорода; -C(=O)-C1-4алкила; -S(=O)2-C1-4алкила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -C(=O)-C1-4алкила, -S(=O)2-C1-4алкила, R11'', R16 и -C(=O)NR9R9'; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR10 и -NR11R11'; где
каждый из R9, R9', R10, R11, R11' и R11'' независимо выбран из группы, состоящей из водорода; C1-4алкила; -S(=O)2-C1-4алкила; и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы, где указанный гетероциклил необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из -S(=O)2-C1-4алкила, галогена, циано и C1-4алкила, необязательно замещенного -O-C1-4алкилом;
R16 представляет собой связанный посредством N 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом N и необязательно один дополнительный гетероатом, выбранный из азота, кислорода и серы, где указанный гетероциклил необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из -S(=O)2-C1-4алкила, галогена, циано и C1-4алкила, необязательно замещенного -O-C1-4алкилом;
R14 представляет собой 5-членный моноциклический гетероарил, содержащий по меньшей мере один атом азота и необязательно 1, 2 или 3 дополнительных гетероатома, каждый из которых независимо выбран из азота, кислорода и серы;
Het3 выбран из группы, состоящей из заместителей, соответствующих формулам (b-1) и (b-2):

где кольцо B представляет собой фенил;
X1 представляет собой CH2, O или NH;
X2 представляет собой NH или O;
X3 представляет собой NH или O;
X4 представляет собой CH или N;
X5 представляет собой CH или N;
где один атом C или один атом N в 5-членном кольце (b-1) или (b-2), включая подходящие атомы C и атомы N в определении X1, X2, X3, X4 и X5, могут быть замещены одной или, если возможно, двумя C1-4алкильными группами, необязательно замещенными одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, циано и -C(=O)NR5R5';
каждый из n1, n2 и m1 независимо выбран из 1 и 2;
m2 равняется 0 или 1;
и к их фармацевтически приемлемым солям и сольватам.
В частности, настоящее изобретение относится к соединениям формулы (I), определенным в данном документе, и к их таутомерам и стереоизомерным формам, где
R1 выбран из группы, состоящей из CH3, CH2F, CHF2 и CF3;
Y1 представляет собой N или CRy;
если Y1 представляет собой N, то R2 выбран из группы, состоящей из водорода, CH3,
-OCH3, -NH2 и -NH-CH3;
если Y1 представляет собой CRy, то R2 представляет собой водород;
Ry выбран из группы, состоящей из водорода, циано и C1-4алкила, необязательно замещенного гидрокси, -O-C1-4алкилом или -O-C3-6циклоалкилом;
Y2 представляет собой CH2 или O;
A представляет собой ковалентную связь или -CR15aR15b-;
каждый из R15a и R15b независимо выбран из группы, состоящей из водорода или C1-4алкила;
Q представляет собой водород или C1-4алкил, необязательно замещенный фенилом;
--L-R3 выбран из (a), (b), (c), (d), (e) или (f):
(a) --L-R3 представляет собой -NRAR1A, где
RA выбран из группы, состоящей из водорода; циклопропила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора и -CN; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR3a и -NR4aR4aa;
R1A выбран из группы, состоящей из C1-6алкила, необязательно замещенного одним, двумя или тремя заместителями, представляющими собой атом фтора; и C2-6алкила, замещенного заместителем, выбранным из группы, состоящей из -OR1a и -NR2aR2aa,
где каждый из R1a, R2a, R2aa, R3a, R4a и R4aa независимо выбран из группы, состоящей из водорода, C1-4алкила и циклопропила;
или
(b) L выбран из группы, состоящей из -N(RB)-, -N(RB)-CR1BR1BB- и
-(NRB)-CHR1B-CHR2B-; и R3 выбран из группы, состоящей из Ar; Het1; Het2; Het3 и 7-10-членной насыщенной спирокарбобициклической системы; где
RB выбран из группы, состоящей из водорода; циклопропила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора и -CN; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR1b и -NR2bR2bb; где
каждый из R1b, R2b и R2bb независимо выбран из группы, состоящей из водорода, C1-4алкила и циклопропила;
R1B выбран из группы, состоящей из водорода; галогена; C3-6циклоалкила;
C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, гидрокси и -CN; C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR4B и -NR5BR5BB; и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы; и R1BB выбран из группы, состоящей из водорода и метила; или R1B и R1BB вместе с углеродом, к которому они присоединены, образуют C3-6циклоалкил или связанный посредством C 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом азота, кислорода или серы;
R2B выбран из группы, состоящей из водорода; -OR6B; -NR7BR7BB; CF3,
C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN, -OR4B и -NR5BR5BB; и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы; где
каждый из R4B, R5B, R5BB, R6B, R7B и R7BB независимо выбран из группы, состоящей из водорода; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN и
-C(=O)NR9BR9BB, и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR10B и -NR11BR11BB; где
каждый из R9B, R9BB, R10B, R11B и R11BB независимо выбран из группы, состоящей из водорода; C1-4алкила и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы;
или
(c) --L-R3 выбран из группы, состоящей из -N(RC)-COR5C и
-N(RC)-SO2-R13C, где
RC выбран из группы, состоящей из водорода; циклопропила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора и -CN; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR1c и -NR2cR2cc;
каждый из R5C и R13C независимо выбран из группы, состоящей из водорода; Ar; Het1; Het2; Het3; 7-10-членной насыщенной спирокарбобициклической системы и C1-4алкила, необязательно замещенного -NR2cR2cc, Ar, Het1 или Het2; где
каждый из R1c, R2c и R2cc независимо выбран из группы, состоящей из водорода и C1-4алкила;
или
(d) L выбран из -N(RD)-CR1DR1DD- и -N(RD)-CR1DR1DD-CR2DR2DD-; где
RD выбран из группы, состоящей из водорода; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора и -CN; и C2-4алкила, замещенного заместителем, выбранным из -OR1d и
-NR2dR2dd; где
каждый из R1d, R2d и R2dd независимо выбран из группы, состоящей из водорода и C1-4алкила;
каждый из R1D, R1DD, R2D и R2DD независимо выбран из группы, состоящей из водорода и C1-4алкила; и
R3 выбран из группы, состоящей из  и
и  ; где
; где
каждый из R3D, R4D и R5D независимо выбран из группы, состоящей из
C1-6алкила, необязательно замещенного заместителем, представляющим собой -OH, -OC1-6алкил или -NH2;
или
(e) --L-R3 представляет собой  , где
, где
RE выбран из группы, состоящей из водорода и C1-4алкила;
R1E выбран из группы, состоящей из водорода, фтора и C1-4алкила; и
R2E выбран из группы, состоящей из фтора, -OC1-4алкила и C1-4алкила, необязательно замещенного 1, 2 или 3 заместителями, представляющими собой атом фтора; или R1E и R2E связаны с одним и тем же атомом углерода и вместе образуют C3-5циклоалкил или связанный посредством C 4-6-членный гетероциклил, содержащий атом кислорода; и
R3E выбран из группы, состоящей из водорода; C1-4алкила, необязательно замещенного заместителем, представляющим собой атом фтора или -CN; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR4E и -NR5ER5EE; где
каждый из R4E, R5E и R5EE независимо выбран из группы, состоящей из водорода; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN и -C(=O)NR6ER6EE; C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR7E и
-NR8ER8EE; и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы; где
каждый из R6E, R6EE, R7E, R8E и R8EE независимо выбран из группы, состоящей из водорода и C1-4алкила;
или
(f) --L-R3 представляет собой радикал
 ;
;
Ar представляет собой фенил, необязательно замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN, -OR4, -NR5R5',
-C(=O)NR5R5', -S(=O)2-NR5R5', R14, CF3 и C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN, -OR6, -NR7R7' и
-C(=O)NR8R8';
Het1 представляет собой моноциклический гетероарил, выбранный из группы, состоящей из пиридила, 4-, 5- или 6-пиримидинила, пиразинила, пиридазинила, фуранила, тиенила, пирролила, пиразолила, имидазолила, 4- или 5-тиазолила, изотиазолила и изоксазолила; каждый из которых может быть необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN, -OR4, -NR5R5' и C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN, -OR6, Het2,
-NR7R7' и -C(=O)NR8R8'; и
Het2 представляет собой неароматический гетероциклил, необязательно замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN,
-C(=O)-C1-6алкила, -C(=O)Ar, -C(=O)Het1, -C(=O)Het2, -OR4, -NR5R5' и C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора,
-CN, -OR6, -NR7R7', R12 и -C(=O)NR8R8';
где
R12 представляет собой связанный посредством C 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом азота, кислорода или серы;
каждый из R4, R5, R5', R6, R7, R7', R8 и R8' независимо выбран из группы, состоящей из водорода; -S(=O)2-C1-4алкила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -C(=O)-C1-4алкила,
-S(=O)2-C1-4алкила, R11'' и -C(=O)NR9R9'; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR10 и -NR11R11'; где
каждый из R9, R9', R10, R11, R11' и R11'' независимо выбран из группы, состоящей из водорода; C1-4алкила и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы;
R14 представляет собой 5-членный моноциклический гетероарил, содержащий по меньшей мере один атом азота и необязательно 1, 2 или 3 дополнительных гетероатома, каждый из которых независимо выбран из азота, кислорода и серы;
Het3 выбран из группы, состоящей из заместителей, соответствующих формулам (b-1) и (b-2):

где кольцо B представляет собой фенил;
X1 представляет собой CH2, O или NH;
X2 представляет собой NH или O;
X3 представляет собой NH или O;
X4 представляет собой CH или N;
X5 представляет собой CH или N;
где один атом C или один атом N в 5-членном кольце (b-1) или (b-2), включая подходящие атомы C и атомы N в определении X1, X2, X3, X4 и X5, могут быть замещены одной или, если возможно, двумя C1-4алкильными группами, необязательно замещенными одним, двумя или тремя атомами галогена;
каждый из n1, n2 и m1 независимо выбран из 1 и 2;
m2 равняется 0 или 1;
и к их фармацевтически приемлемым солям и сольватам.
В частности, настоящее изобретение относится к соединениям формулы (I), определенным в данном документе, и к их таутомерам и стереоизомерным формам, где
R1 выбран из группы, состоящей из CH3, CH2F, CHF2 и CF3;
Y1 представляет собой N или CRy;
если Y1 представляет собой N, то R2 выбран из группы, состоящей из водорода, CH3,
-OCH3, -NH2 и -NH-CH3;
если Y1 представляет собой CRy, то R2 представляет собой водород;
Ry выбран из группы, состоящей из водорода, циано и C1-4алкила, необязательно замещенного гидрокси, -O-C1-4алкилом или -O-C3-6циклоалкилом;
Y2 представляет собой CH2 или O;
A представляет собой ковалентную связь;
Q представляет собой водород или C1-4алкил, необязательно замещенный фенилом;
--L-R3 выбран из (a), (b), (c), (d), (e) или (f):
(a) --L-R3 представляет собой -NRAR1A, где
RA выбран из группы, состоящей из водорода; циклопропила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора и -CN; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR3a и -NR4aR4aa;
R1A выбран из группы, состоящей из C1-6алкила, необязательно замещенного одним, двумя или тремя заместителями, представляющими собой атом фтора; и C2-6алкила, замещенного заместителем, выбранным из группы, состоящей из -OR1a и -NR2aR2aa,
где каждый из R1a, R2a, R2aa, R3a, R4a и R4aa независимо выбран из группы, состоящей из водорода, C1-4алкила и циклопропила;
или
(b) L выбран из группы, состоящей из -N(RB)-, -N(RB)-CR1BR1BB- и
-(NRB)-CHR1B-CHR2B-; и R3 выбран из группы, состоящей из Ar; Het1; Het2; Het3 и 7-10-членной насыщенной спирокарбобициклической системы; где
RB выбран из группы, состоящей из водорода; циклопропила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора и -CN; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR1b и -NR2bR2bb; где
каждый из R1b, R2b и R2bb независимо выбран из группы, состоящей из водорода, C1-4алкила и циклопропила;
R1B выбран из группы, состоящей из водорода; галогена; C3-6циклоалкила;
C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, гидрокси и -CN; C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR4B и -NR5BR5BB; и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы; и R1BB выбран из группы, состоящей из водорода и метила; или R1B и R1BB вместе с углеродом, к которому они присоединены, образуют C3-6циклоалкил или связанный посредством C 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом азота, кислорода или серы;
R2B выбран из группы, состоящей из водорода; -OR6B; -NR7BR7BB; CF3,
C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN, -OR4B и -NR5BR5BB; и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы; где
каждый из R4B, R5B, R5BB, R6B, R7B и R7BB независимо выбран из группы, состоящей из водорода; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN и
-C(=O)NR9BR9BB, и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR10B и -NR11BR11BB; где
каждый из R9B, R9BB, R10B, R11B и R11BB независимо выбран из группы, состоящей из водорода; C1-4алкила и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы;
или
(c) --L-R3 выбран из группы, состоящей из -N(RC)-COR5C и -N(RC)-SO2-R13C, где
RC выбран из группы, состоящей из водорода; циклопропила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора и -CN; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR1c и -NR2cR2cc;
каждый из R5C и R13C независимо выбран из группы, состоящей из водорода; Ar; Het1; Het2; Het3; 7-10-членной насыщенной спирокарбобициклической системы и
C1-4алкила, необязательно замещенного -NR2cR2cc, Ar, Het1 или Het2; где
каждый из R1c, R2c и R2cc независимо выбран из группы, состоящей из водорода и C1-4алкила;
или
(d) L выбран из -N(RD)-CR1DR1DD- и -N(RD)-CR1DR1DD-CR2DR2DD-; где
RD выбран из группы, состоящей из водорода; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора и -CN; и C2-4алкила, замещенного заместителем, выбранным из -OR1d и
-NR2dR2dd; где
каждый из R1d, R2d и R2dd независимо выбран из группы, состоящей из водорода и C1-4алкила;
каждый из R1D, R1DD, R2D и R2DD независимо выбран из группы, состоящей из водорода и C1-4алкила; и
R3 выбран из группы, состоящей из  и
и  ; где
; где
каждый из R3D, R4D и R5D независимо выбран из группы, состоящей из
C1-6алкила, необязательно замещенного заместителем, представляющим собой -OH, -OC1-6алкил или -NH2;
или
(e) --L-R3 представляет собой  , где
, где
RE выбран из группы, состоящей из водорода и C1-4алкила;
R1E выбран из группы, состоящей из водорода, фтора и C1-4алкила; и
R2E выбран из группы, состоящей из фтора, -OC1-4алкила и C1-4алкила, необязательно замещенного 1, 2 или 3 заместителями, представляющими собой атом фтора; или R1E и R2E связаны с одним и тем же атомом углерода и вместе образуют C3-5циклоалкил или связанный посредством C 4-6-членный гетероциклил, содержащий атом кислорода; и
R3E выбран из группы, состоящей из водорода; C1-4алкила, необязательно замещенного заместителем, представляющим собой атом фтора или -CN; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR4E и -NR5ER5EE; где
каждый из R4E, R5E и R5EE независимо выбран из группы, состоящей из водорода; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN и -C(=O)NR6ER6EE; C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR7E и
-NR8ER8EE; и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы; где
каждый из R6E, R6EE, R7E, R8E и R8EE независимо выбран из группы, состоящей из водорода и C1-4алкила;
или
(f) --L-R3 представляет собой радикал
 ;
;
Ar представляет собой фенил, необязательно замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN, -OR4, -NR5R5',
-C(=O)NR5R5', -S(=O)2-NR5R5', R14, CF3 и C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN, -OR6, -NR7R7' и
-C(=O)NR8R8';
Het1 представляет собой моноциклический гетероарил, выбранный из группы, состоящей из пиридила, 4-, 5- или 6-пиримидинила, пиразинила, пиридазинила, фуранила, тиенила, пирролила, пиразолила, имидазолила, 4- или 5-тиазолила, изотиазолила и изоксазолила; каждый из которых может быть необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN, -OR4, -NR5R5' и C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN, -OR6, Het2,
-NR7R7' и -C(=O)NR8R8'; и
Het2 представляет собой неароматический гетероциклил, необязательно замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN,
-C(=O)-C1-6алкила, -C(=O)Ar, -C(=O)Het1, -C(=O)Het2, -OR4, -NR5R5' и C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN, -OR6, -NR7R7', R12 и -C(=O)NR8R8';
где
R12 представляет собой связанный посредством C 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом азота, кислорода или серы;
каждый из R4, R5, R5', R6, R7, R7', R8 и R8' независимо выбран из группы, состоящей из водорода; -S(=O)2-C1-4алкила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -C(=O)-C1-4алкила, -S(=O)2-C1-4алкила, R11'' и -C(=O)NR9R9'; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR10 и -NR11R11'; где
каждый из R9, R9', R10, R11, R11' и R11'' независимо выбран из группы, состоящей из водорода; C1-4алкила и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы;
R14 представляет собой 5-членный моноциклический гетероарил, содержащий по меньшей мере один атом азота и необязательно 1, 2 или 3 дополнительных гетероатома, каждый из которых независимо выбран из азота, кислорода и серы;
Het3 выбран из группы, состоящей из заместителей, соответствующих формулам (b-1) и (b-2):

где кольцо B представляет собой фенил;
X1 представляет собой CH2, O или NH;
X2 представляет собой NH или O;
X3 представляет собой NH или O;
X4 представляет собой CH или N;
X5 представляет собой CH или N;
где один атом C или один атом N в 5-членном кольце (b-1) или (b-2), включая подходящие атомы C и атомы N в определении X1, X2, X3, X4 и X5, могут быть замещены одной или, если возможно, двумя C1-4алкильными группами, необязательно замещенными одним, двумя или тремя атомами галогена;
каждый из n1, n2 и m1 независимо выбран из 1 и 2;
m2 равняется 0 или 1;
и к их фармацевтически приемлемым солям и сольватам.
В частности, настоящее изобретение относится к соединениям формулы (I), определенным в данном документе, и к их таутомерам и стереоизомерным формам, где
R1 выбран из группы, состоящей из CH3, CH2F, CHF2 и CF3;
Y1 представляет собой N или CRy;
если Y1 представляет собой N, то R2 выбран из группы, состоящей из водорода, CH3,
-OCH3, -NH2 и -NH-CH3;
если Y1 представляет собой CRy, то R2 представляет собой водород;
Ry выбран из группы, состоящей из водорода, циано и C1-4алкила, необязательно замещенного гидрокси, -O-C1-4алкилом или -O-C3-6циклоалкилом;
Y2 представляет собой CH2 или O;
A представляет собой -CR15aR15b-;
каждый из R15a и R15b независимо выбран из группы, состоящей из водорода или C1-4алкила; в частности, R15a и R15b представляют собой водород;
Q представляет собой водород или C1-4алкил, необязательно замещенный фенилом;
--L-R3 выбран из (a), (b), (c), (d), (e) или (f):
(a) --L-R3 представляет собой -NRAR1A, где
RA выбран из группы, состоящей из водорода; циклопропила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора и -CN; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR3a и -NR4aR4aa;
R1A выбран из группы, состоящей из C1-6алкила, необязательно замещенного одним, двумя или тремя заместителями, представляющими собой атом фтора; и C2-6алкила, замещенного заместителем, выбранным из группы, состоящей из -OR1a и -NR2aR2aa,
где каждый из R1a, R2a, R2aa, R3a, R4a и R4aa независимо выбран из группы, состоящей из водорода, C1-4алкила и циклопропила;
или
(b) L выбран из группы, состоящей из -N(RB)-,
-N(RB)-CR1BR1BB- и -(NRB)-CHR1B-CHR2B-; и R3 выбран из группы, состоящей из Ar; Het1; Het2; Het3 и 7-10-членной насыщенной спирокарбобициклической системы; где
RB выбран из группы, состоящей из водорода; циклопропила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора и -CN; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR1b и -NR2bR2bb; где
каждый из R1b, R2b и R2bb независимо выбран из группы, состоящей из водорода, C1-4алкила и циклопропила;
R1B выбран из группы, состоящей из водорода; галогена; C3-6циклоалкила;
C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, гидрокси и -CN; C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR4B и -NR5BR5BB; и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы; и R1BB выбран из группы, состоящей из водорода и метила; или R1B и R1BB вместе с углеродом, к которому они присоединены, образуют C3-6циклоалкил или связанный посредством C 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом азота, кислорода или серы;
R2B выбран из группы, состоящей из водорода; -OR6B; -NR7BR7BB; CF3,
C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN, -OR4B и -NR5BR5BB; и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы; где
каждый из R4B, R5B, R5BB, R6B, R7B и R7BB независимо выбран из группы, состоящей из водорода; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN и
-C(=O)NR9BR9BB, и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR10B и -NR11BR11BB; где
каждый из R9B, R9BB, R10B, R11B и R11BB независимо выбран из группы, состоящей из водорода; C1-4алкила и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы;
или
(c) --L-R3 выбран из группы, состоящей из -N(RC)-COR5C и
-N(RC)-SO2-R13C, где
RC выбран из группы, состоящей из водорода; циклопропила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора и -CN; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR1c и -NR2cR2cc;
каждый из R5C и R13C независимо выбран из группы, состоящей из водорода; Ar; Het1; Het2; Het3; 7-10-членной насыщенной спирокарбобициклической системы и
C1-4алкила, необязательно замещенного -NR2cR2cc, Ar, Het1 или Het2; где
каждый из R1c, R2c и R2cc независимо выбран из группы, состоящей из водорода и C1-4алкила;
или
(d) L выбран из -N(RD)-CR1DR1DD- и -N(RD)-CR1DR1DD-CR2DR2DD-; где
RD выбран из группы, состоящей из водорода; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора и -CN; и C2-4алкила, замещенного заместителем, выбранным из -OR1d и
-NR2dR2dd; где
каждый из R1d, R2d и R2dd независимо выбран из группы, состоящей из водорода и C1-4алкила;
каждый из R1D, R1DD, R2D и R2DD независимо выбран из группы, состоящей из водорода и C1-4алкила; и
R3 выбран из группы, состоящей из  и
и  ; где
; где
каждый из R3D, R4D и R5D независимо выбран из группы, состоящей из
C1-6алкила, необязательно замещенного заместителем, представляющим собой -OH, -OC1-6алкил или -NH2;
или
(e) --L-R3 представляет собой  , где
, где
RE выбран из группы, состоящей из водорода и C1-4алкила;
R1E выбран из группы, состоящей из водорода, фтора и C1-4алкила; и
R2E выбран из группы, состоящей из фтора, -OC1-4алкила и C1-4алкила, необязательно замещенного 1, 2 или 3 заместителями, представляющими собой атом фтора; или R1E и R2E связаны с одним и тем же атомом углерода и вместе образуют C3-5циклоалкил или связанный посредством C 4-6-членный гетероциклил, содержащий атом кислорода; и
R3E выбран из группы, состоящей из водорода; C1-4алкила, необязательно замещенного заместителем, представляющим собой атом фтора или -CN; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR4E и -NR5ER5EE; где
каждый из R4E, R5E и R5EE независимо выбран из группы, состоящей из водорода; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN и -C(=O)NR6ER6EE; C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR7E и
-NR8ER8EE; и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы; где
каждый из R6E, R6EE, R7E, R8E и R8EE независимо выбран из группы, состоящей из водорода и C1-4алкила;
или
(f) --L-R3 представляет собой радикал
 ;
;
Ar представляет собой фенил, необязательно замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN, -OR4, -NR5R5',
-C(=O)NR5R5', -S(=O)2-NR5R5', R14, CF3 и C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN, -OR6, -NR7R7' и
-C(=O)NR8R8';
Het1 представляет собой моноциклический гетероарил, выбранный из группы, состоящей из пиридила, 4-, 5- или 6-пиримидинила, пиразинила, пиридазинила, фуранила, тиенила, пирролила, пиразолила, имидазолила, 4- или 5-тиазолила, изотиазолила и изоксазолила; каждый из которых может быть необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN, -OR4, -NR5R5' и C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN, -OR6, Het2,
-NR7R7' и -C(=O)NR8R8'; и
Het2 представляет собой неароматический гетероциклил, необязательно замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN,
-C(=O)-C1-6алкила, -C(=O)Ar, -C(=O)Het1, -C(=O)Het2, -OR4, -NR5R5' и C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора,
-CN, -OR6, -NR7R7', R12 и -C(=O)NR8R8';
где
R12 представляет собой связанный посредством C 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом азота, кислорода или серы;
каждый из R4, R5, R5', R6, R7, R7', R8 и R8' независимо выбран из группы, состоящей из водорода; -S(=O)2-C1-4алкила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -C(=O)-C1-4алкила,
-S(=O)2-C1-4алкила, R11'' и -C(=O)NR9R9'; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR10 и -NR11R11'; где
каждый из R9, R9', R10, R11, R11' и R11'' независимо выбран из группы, состоящей из водорода; C1-4алкила и связанного посредством C 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы;
R14 представляет собой 5-членный моноциклический гетероарил, содержащий по меньшей мере один атом азота и необязательно 1, 2 или 3 дополнительных гетероатома, каждый из которых независимо выбран из азота, кислорода и серы;
Het3 выбран из группы, состоящей из заместителей, соответствующих формулам (b-1) и (b-2):

где кольцо B представляет собой фенил;
X1 представляет собой CH2, O или NH;
X2 представляет собой NH или O;
X3 представляет собой NH или O;
X4 представляет собой CH или N;
X5 представляет собой CH или N;
где один атом C или один атом N в 5-членном кольце (b-1) или (b-2), включая подходящие атомы C и атомы N в определении X1, X2, X3, X4 и X5, могут быть замещены одной или, если возможно, двумя C1-4алкильными группами, необязательно замещенными одним, двумя или тремя атомами галогена;
каждый из n1, n2 и m1 независимо выбран из 1 и 2;
m2 равняется 0 или 1;
и к их фармацевтически приемлемым солям и сольватам.
В частности, настоящее изобретение относится к соединениям формулы (I), определенным в данном документе, и к их таутомерам и стереоизомерным формам, где
R1 представляет собой CF3;
Y1 представляет собой N;
R2 выбран из группы, состоящей из водорода, CH3 и -NH2;
Y2 представляет собой CH2;
A представляет собой ковалентную связь или -CR15aR15b-;
R15a и R15b представляют собой водород;
Q представляет собой водород;
--L-R3 выбран из (a), (b), (c):
(a) --L-R3 представляет собой -NRAR1A, где
RA представляет собой водород;
R1A представляет собой C1-6алкил;
или
(b) L выбран из группы, состоящей из -N(RB)- и -N(RB)-CR1BR1BB-; и
R3 выбран из группы, состоящей из Ar; Het1; и Het3; где
RB представляет собой водород;
R1B выбран из группы, состоящей из водорода и C1-4алкила; и
R1BB выбран из группы, состоящей из водорода и метила;
или R1B и R1BB вместе с атомом углерода, к которому они присоединены, образуют
C3-6циклоалкил;
или
(c) --L-R3 выбран из группы, состоящей из -N(RC)-COR5C и
-N(RC)-SO2-R13C, где
RC выбран из группы, состоящей из водорода и C1-4алкила;
каждый из R5C и R13C независимо выбран из группы, состоящей из Ar; Het3 и C1-4алкила, необязательно замещенного Het2;
Ar представляет собой фенил, необязательно замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN, -NR5R5',
-C(=O)NR5R5', R14, CF3 и C1-4алкила, необязательно замещенного заместителем, представляющим собой -CN;
Het1 представляет собой пиразолил, необязательно замещенный одним, двумя или тремя заместителями, представляющими собой C1-4алкил; и
Het2 представляет собой неароматический гетероциклил;
где
каждый из R5 и R5' независимо выбран из группы, состоящей из водорода;
-S(=O)2-C1-4алкила и C1-4алкила;
R14 представляет собой пиразолил, в частности, пиразолил, присоединенный к остальной части молекулы посредством атома C;
Het3 выбран из группы, состоящей из заместителей, соответствующих формулам (b-1) и (b-2):

где кольцо B представляет собой фенил;
X1 представляет собой O или NH;
X2 представляет собой NH;
X3 представляет собой NH или O;
X4 представляет собой CH или N;
X5 представляет собой CH или N;
где один атом C или один атом N в 5-членном кольце (b-1) или (b-2), включая подходящие атомы C и атомы N в определении X1, X2, X3, X4 и X5, могут быть замещены одной или, если возможно, двумя C1-4алкильными группами, необязательно замещенными одним, двумя или тремя атомами галогена;
каждый из n1, n2 и m1 независимо выбран из 1 и 2;
m2 равняется 0 или 1;
и к их фармацевтически приемлемым солям и сольватам.
В частности, настоящее изобретение относится к соединениям формулы (I), определенным в данном документе, и к их таутомерам и стереоизомерным формам, где
R1 представляет собой CF3;
Y1 представляет собой N;
R2 представляет собой водород;
Y2 представляет собой CH2;
A представляет собой ковалентную связь или -CR15aR15b-;
R15a и R15b представляют собой водород;
Q представляет собой водород;
--L-R3 выбран из (a), (b), (c):
(a) --L-R3 представляет собой -NRAR1A, где
RA представляет собой водород;
R1A представляет собой C1-6алкил;
или
(b) L выбран из группы, состоящей из -N(RB)- и -N(RB)-CR1BR1BB-; и
R3 выбран из группы, состоящей из Ar; Het1; и Het3; где
RB представляет собой водород;
R1B представляет собой водород; и
R1BB выбран из группы, состоящей из водорода и метила;
или
(c) --L-R3 выбран из группы, состоящей из -N(RC)-COR5C и
-N(RC)-SO2-R13C, где
RC выбран из группы, состоящей из водорода и C1-4алкила;
каждый из R5C и R13C независимо выбран из группы, состоящей из Ar; Het3 и C1-4алкила, необязательно замещенного Het2;
Ar представляет собой фенил, необязательно замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN, -NR5R5',
-C(=O)NR5R5', R14, CF3 и C1-4алкила, необязательно замещенного заместителем, представляющим собой -CN;
Het1 представляет собой пиразолил, необязательно замещенный одним, двумя или тремя заместителями, представляющими собой C1-4алкил; и
Het2 представляет собой неароматический гетероциклил;
где
каждый из R5 и R5' независимо выбран из группы, состоящей из водорода;
-S(=O)2-C1-4алкила и C1-4алкила;
R14 представляет собой пиразолил, в частности, пиразолил, присоединенный к остальной части молекулы посредством атома C;
Het3 выбран из группы, состоящей из заместителей, соответствующих формулам (b-1) и (b-2):

где кольцо B представляет собой фенил;
X1 представляет собой O или NH;
X2 представляет собой NH;
X3 представляет собой NH;
X4 представляет собой N;
X5 представляет собой CH;
каждый из n1, n2 и m1 независимо выбран из 1 и 2;
m2 равняется 0 или 1;
и к их фармацевтически приемлемым солям и сольватам.
В частности, настоящее изобретение относится к соединениям формулы (I), определенным в данном документе, и к их таутомерам и стереоизомерным формам, где
R1 представляет собой CF3;
Y1 представляет собой N;
R2 представляет собой водород;
Y2 представляет собой CH2;
A представляет собой ковалентную связь;
Q представляет собой водород;
--L-R3 представляет собой (b):
(b) L выбран из группы, состоящей из -N(RB)- и -N(RB)-CR1BR1BB-; и
R3 выбран из группы, состоящей из Ar и Het3; где
RB представляет собой водород;
R1B представляет собой водород; и
R1BB представляет собой водород;
Ar представляет собой фенил, необязательно замещенный C1-4алкилом, который необязательно замещен заместителем, представляющим собой -CN;
Het3 представляет собой (b-1):

где кольцо B представляет собой фенил;
X1 представляет собой O;
X2 представляет собой NH;
n1 равняется 1;
каждый из n2 и m1 независимо выбран из 1 и 2;
m2 равняется 0 или 1;
и к их фармацевтически приемлемым солям и сольватам.
В частности, настоящее изобретение относится к соединениям формулы (I), определенным в данном документе, и к их таутомерам и стереоизомерным формам, где
R1 представляет собой CF3;
Y1 представляет собой CRy;
R2 выбран из группы, состоящей из водорода, -OCH3 и -NH-CH3;
Ry представляет собой водород;
Y2 представляет собой CH2;
A представляет собой ковалентную связь;
Q представляет собой водород;
--L-R3 представляет собой (b):
(b) L выбран из группы, состоящей из -N(RB)- и -N(RB)-CR1BR1BB-;
и R3 выбран из группы, состоящей из Ar; Het1 и Het3; где
RB представляет собой водород;
R1B представляет собой водород; и
R1BB представляет собой водород;
Ar представляет собой фенил, необязательно замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -OR4, -C(=O)NR5R5', Het4,
-O-Het4, -NR5-Het4 и C1-4алкила, необязательно замещенного одним или двумя заместителями, представляющими собой -CN;
Het1 представляет собой пиридил, который может быть необязательно замещен одним, двумя или тремя
заместителями, представляющими собой -C(=O)NR5R5';
где
каждый из R4, R5 и R5' независимо выбран из группы, состоящей из водорода; C1-4алкила, замещенного заместителем, представляющим собой R16; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR10 и -NR11R11'; где
каждый из R10, R11 и R11' независимо выбран из группы, состоящей из водорода и C1-4алкила;
R16 представляет собой связанный посредством N 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом N и необязательно один дополнительный гетероатом, выбранный из азота, кислорода и серы;
R14 представляет собой 5-членный моноциклический гетероарил, содержащий по меньшей мере один атом азота и необязательно 1, 2 или 3 дополнительных гетероатома, каждый из которых независимо выбран из азота, кислорода и серы;
Het3 выбран из группы, состоящей из заместителя, соответствующего формуле (b-1):

где кольцо B представляет собой фенил;
X1 представляет собой O или NH;
X2 представляет собой NH;
где один атом C или один атом N в 5-членном кольце (b-1), включая подходящие атомы C и атомы N в определении X1 и X2, могут быть замещены одной или, если возможно, двумя C1-4алкильными группами, необязательно замещенными одним, двумя или тремя заместителями, представляющими собой циано;
Het4 представляет собой 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом азота, кислорода или серы, где указанный гетероциклил необязательно замещен одним, двумя или тремя заместителями, представляющими собой C1-4алкил;
каждый из n1, n2 и m1 независимо выбран из 1 и 2;
m2 равняется 0 или 1;
и к их фармацевтически приемлемым солям и сольватам.
Другой вариант осуществления настоящего изобретения относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, указанным в каком-либо из других вариантов осуществления, где
R1 представляет собой CF3;
R2 представляет собой водород;
Y1 представляет собой N;
Y2 представляет собой CH2.
Другой вариант осуществления настоящего изобретения относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, указанным в каком-либо из других вариантов осуществления, где
R1 представляет собой CF3;
R2 представляет собой водород;
Y1 представляет собой N.
Другой вариант осуществления настоящего изобретения относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, указанным в каком-либо из других вариантов осуществления, где A представляет собой ковалентную связь.
Другой вариант осуществления настоящего изобретения относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, указанным в каком-либо из других вариантов осуществления, где A представляет собой -CR15aR15b-.
Другой вариант осуществления настоящего изобретения относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, указанным в каком-либо из других вариантов осуществления, где A представляет собой -CR15aR15b-;
R15a и R15b представляют собой водород.
Другой вариант осуществления настоящего изобретения относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, указанным в каком-либо из других вариантов осуществления, где R15a и R15b представляют собой водород.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, указанным в каком-либо из других вариантов осуществления, где
--L-R3 выбран из (a), (b), (c), (d) или (e).
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, указанным в каком-либо из других вариантов осуществления, где --L-R3 представляет собой (a).
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, указанным в каком-либо из других вариантов осуществления, где --L-R3 представляет собой (b).
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, указанным в каком-либо из других вариантов осуществления, где --L-R3 представляет собой (c).
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, указанным в каком-либо из других вариантов осуществления, где --L-R3 представляет собой (d).
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, указанным в каком-либо из других вариантов осуществления, где --L-R3 представляет собой (e).
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, указанным в каком-либо из других вариантов осуществления, где --L-R3 представляет собой (f).
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, указанным в каком-либо из других вариантов осуществления, где --L-R3 представляет собой (b);
R3 выбран из группы, состоящей из Ar; Het3; R17 и 7-10-членной насыщенной спирокарбобициклической системы;
Ar представляет собой фенил, необязательно замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN, -OR4, -NR5R5',
-C(=O)NR5R5', Het4, -O-Het4, -NR5-Het4, -C(=O)-Het4, -S(=O)2-Het4, -S(=O)2-NR5R5', -S(=O)2-C1-4алкила, R14, CF3 и C1-4алкила, необязательно замещенного одним или двумя заместителями, каждый из которых независимо выбран из группы, состоящей из фтора, -CN,
-OR6, -NR7R7', -S(=O)2-C1-4алкила и -C(=O)NR8R8';
каждый из R4, R5, R5', R6, R7, R7', R8 и R8' независимо выбран из группы, состоящей из водорода; -C(=O)-C1-4алкила; -S(=O)2-C1-4алкила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -C(=O)-C1-4алкила, -S(=O)2-C1-4алкила, R11'' и -C(=O)NR9R9'; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR10, -NR11R11' и R16;
где
каждый из R9, R9', R10, R11, R11' и R11" независимо выбран из группы, состоящей из водорода; C1-4алкила и -S(=O)2-C1-4алкила;
R16 представляет собой связанный посредством N 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом N и необязательно один дополнительный гетероатом, выбранный из азота, кислорода и серы;
R14 представляет собой 5-членный моноциклический гетероарил, содержащий по меньшей мере один атом азота и необязательно 1, 2 или 3 дополнительных гетероатома, каждый из которых независимо выбран из азота, кислорода и серы;
Het3 выбран из группы, состоящей из заместителя, соответствующего формуле (b-1):
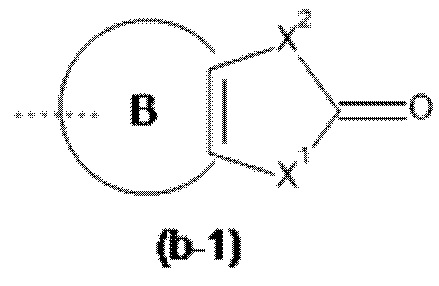
где кольцо B представляет собой фенил;
X1 представляет собой O или NH;
X2 представляет собой NH;
где один из атомов N в 5-членном кольце (b-1) или (b-2), включая подходящие атомы N в определении X1 и X2, может быть замещен одной или, если возможно, двумя C1-4алкильными группами;
Het4 представляет собой 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом азота, кислорода или серы, где указанный гетероциклил необязательно замещен одним, двумя или тремя заместителями, представляющими собой C1-4алкил;
R17 представляет собой C3-6циклоалкил, необязательно замещенный одним или несколькими заместителями, выбранными из группы, состоящей из галогена, -CN, -OR4, -NR5R5', -C(=O)NR5R5' и C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN, -OR6, -NR7R7' и -C(=O)NR8R8'.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, указанным в каком-либо из других вариантов осуществления, где --L-R3 представляет собой (b);
R3 выбран из группы, состоящей из Ar; Het3; R17 и 7-10-членной насыщенной спирокарбобициклической системы;
Ar представляет собой фенил, необязательно замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN, -OR4, -NR5R5',
-C(=O)NR5R5', Het4, -O-Het4, -NR5-Het4, -C(=O)-Het4, -S(=O)2-Het4, -S(=O)2-NR5R5', -S(=O)2-C1-4алкила, R14, CF3 и C1-4алкила, необязательно замещенного одним или двумя заместителями, каждый из которых независимо выбран из группы, состоящей из фтора, -CN,
-OR6, -NR7R7', -S(=O)2-C1-4алкила и -C(=O)NR8R8';
каждый из R4, R5, R5', R6, R7, R7', R8 и R8' независимо выбран из группы, состоящей из водорода; -C(=O)-C1-4алкила; -S(=O)2-C1-4алкила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -C(=O)-C1-4алкила, -S(=O)2-C1-4алкила, R11'' и -C(=O)NR9R9'; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR10, -NR11R11' и R16;
где
каждый из R9, R9', R10, R11, R11' и R11" независимо выбран из группы, состоящей из водорода; C1-4алкила и -S(=O)2-C1-4алкила;
R16 представляет собой связанный посредством N 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом N и необязательно один дополнительный гетероатом, выбранный из азота, кислорода и серы;
R14 представляет собой 5-членный моноциклический гетероарил, содержащий по меньшей мере один атом азота и необязательно 1, 2 или 3 дополнительных гетероатома, каждый из которых независимо выбран из азота, кислорода и серы;
Het3 выбран из группы, состоящей из заместителя, соответствующего формуле (b-1):

где кольцо B представляет собой фенил;
X1 представляет собой O или NH;
X2 представляет собой NH;
где один из атомов N в 5-членном кольце (b-1) или (b-2), включая подходящие атомы N в определении X1 и X2, может быть замещен одной или, если возможно, двумя C1-4алкильными группами;
Het4 представляет собой 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом азота, кислорода или серы, где указанный гетероциклил замещен одним, двумя или тремя заместителями, представляющими собой C1-4алкил;
R17 представляет собой C3-6циклоалкил, необязательно замещенный одним или несколькими заместителями, выбранными из группы, состоящей из галогена, -CN, -OR4, -NR5R5', -C(=O)NR5R5' и C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN, -OR6, -NR7R7' и -C(=O)NR8R8'.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, указанным в каком-либо из других вариантов осуществления, где --L-R3 представляет собой (b);
R3 выбран из группы, состоящей из Ar и 7-10-членной насыщенной спирокарбобициклической системы.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, указанным в каком-либо из других вариантов осуществления, где --L-R3 представляет собой (b);
R3 представляет собой Ar.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, указанным в каком-либо из других вариантов осуществления, где --L-R3 представляет собой (b);
R3 представляет собой Ar;
Ar представляет собой фенил, необязательно замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN, -OR4, -NR5R5',
-C(=O)NR5R5', -S(=O)2-NR5R5', -S(=O)2-C1-4алкила, CF3 и
C1-4алкила, необязательно замещенного одним или двумя заместителями, каждый из которых независимо выбран из группы, состоящей из фтора, -CN, -OR6, -NR7R7', -S(=O)2-C1-4алкила и -C(=O)NR8R8'.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, указанным в каком-либо из других вариантов осуществления, где --L-R3 представляет собой (b);
R3 представляет собой Ar;
Ar представляет собой фенил, необязательно замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN, -OR4, -NR5R5',
-C(=O)NR5R5', -S(=O)2-NR5R5', -S(=O)2-C1-4алкила, CF3 и
C1-4алкила, необязательно замещенного одним или двумя заместителями, каждый из которых независимо выбран из группы, состоящей из фтора, -CN, -OR6, -NR7R7', -S(=O)2-C1-4алкила и -C(=O)NR8R8';
каждый из R4, R5, R5', R6, R7, R7', R8 и R8' независимо выбран из группы, состоящей из водорода; -C(=O)-C1-4алкила; -S(=O)2-C1-4алкила; C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -C(=O)-C1-4алкила, -S(=O)2-C1-4алкила, R11'' и -C(=O)NR9R9'; и C2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR10 и -NR11R11'; где
каждый из R9, R9', R10, R11, R11' и R11" независимо выбран из группы, состоящей из водорода; C1-4алкила и -S(=O)2-C1-4алкила.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, указанным в каком-либо из других вариантов осуществления, где n1 равняется 2, n2 равняется 1, m1 равняется 1, и m2 равняется 0.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, указанным в каком-либо из других вариантов осуществления, где n1 равняется 1, n2 равняется 1, m1 равняется 1, и m2 равняется 1.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, которые указаны в каком-либо из других вариантов осуществления, где Het2 представляет собой морфолинил, в частности, 1-морфонилил.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, которые указаны в каком-либо из других вариантов осуществления, где Het2 представляет собой морфолинил, в частности, 1-морфонилил;
необязательно замещенный, как определено в любом из других вариантов осуществления.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, которые указаны в каком-либо из других вариантов осуществления, где Het2 представляет собой моноциклический неароматический гетероциклил.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, которые указаны в каком-либо из других вариантов осуществления, где Het2 представляет собой моноциклический неароматический гетероциклил, необязательно замещенный, как определено в каком-либо из других вариантов осуществления.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, которые указаны в каком-либо из других вариантов осуществления, где Het2 представляет собой бициклический неароматический гетероциклил.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, которые указаны в каком-либо из других вариантов осуществления, где Het2 представляет собой бициклический неароматический гетероциклил, необязательно замещенный, как определено в каком-либо из других вариантов осуществления.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, которые указаны в каком-либо из других вариантов осуществления, где Het3 выбран из
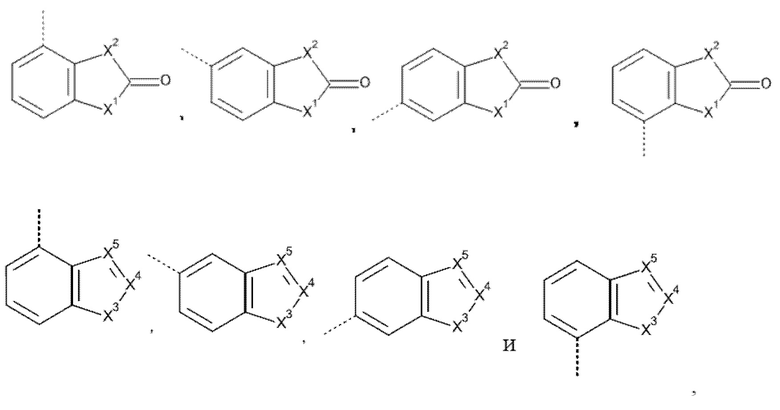
где X1, X2, X3, X4 и X5 определены в любом из других вариантов осуществления, и которые могут быть замещены, как определено в любом из других вариантов осуществления.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, которые указаны в каком-либо из других вариантов осуществления, где Het3 выбран из
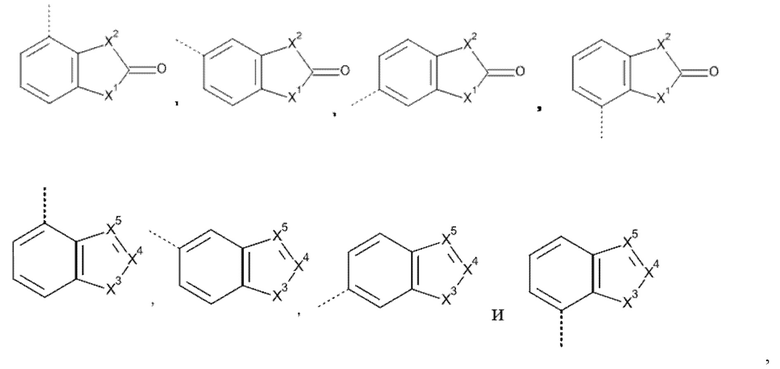
X1 представляет собой CH2, O или NH;
X2 представляет собой NH или O;
X3 представляет собой NH или O;
X4 представляет собой CH или N;
X5 представляет собой CH или N;
где один атом C или один атом N в 5-членном кольце, включая подходящие атомы C и атомы N в определении X1, X2, X3, X4 и X5, могут быть замещены одной или, если возможно, двумя C1-4алкильными группами, необязательно замещенными одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, циано,
-C(=O)NR5R5' и Het4.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, которые указаны в каком-либо из других вариантов осуществления, где Het3 выбран из
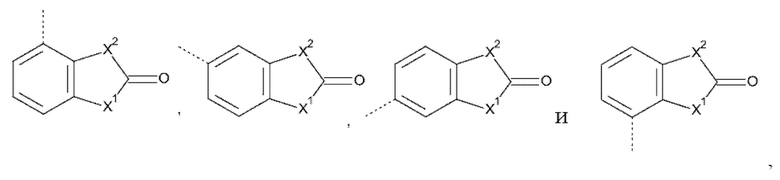
где X1 и X2 определены в любом из других вариантов осуществления, и которые могут быть замещены, как определено в любом из других вариантов осуществления.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, которые указаны в каком-либо из других вариантов осуществления, где Het3 выбран из

X1 представляет собой CH2, O или NH;
X2 представляет собой NH или O;
где один атом C или один атом N в 5-членном кольце, включая подходящие атомы C и атомы N в определении X1 и X2, могут быть замещены одной или, если возможно, двумя C1-4алкильными группами, необязательно замещенными одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, циано, -C(=O)NR5R5' и Het4.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, которые указаны в каком-либо из других вариантов осуществления, где Het3 выбран из
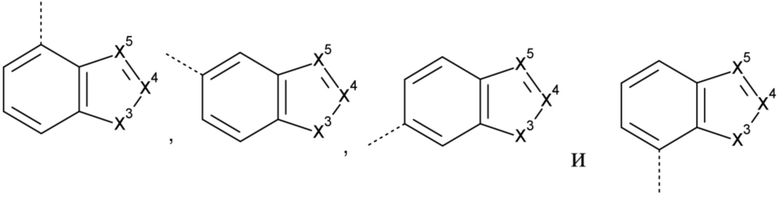 ,
,
где X3, X4 и X5 определены в любом из других вариантов осуществления, и которые могут быть замещены, как определено в любом из других вариантов осуществления.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, которые указаны в каком-либо из других вариантов осуществления, где Het3 выбран из

X3 представляет собой NH или O;
X4 представляет собой CH или N;
X5 представляет собой CH или N;
где один атом C или один атом N в 5-членном кольце, включая подходящие атомы C и атомы N в определении X3, X4 и X5, могут быть замещены одной или, если возможно, двумя C1-4алкильными группами, необязательно замещенными одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, циано, -C(=O)NR5R5' и Het4.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, которые указаны в каком-либо из других вариантов осуществления, где Het4 всегда замещен.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, которые указаны в каком-либо из других вариантов осуществления, где Het4 представляет собой 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом азота, кислорода или серы, где указанный гетероциклил замещен одним, двумя или тремя заместителями, представляющими собой C1-4алкил.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, которые указаны в каком-либо из других вариантов осуществления, где Het4 представляет собой морфолинил, имидазолидинил, пиперидинил, морфолинил или оксазолидинил, в частности, 1-морфонилил, 1-имидазолидинил, 1-пиперидинил, 1-морфолинил или 3-оксазолидинил.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, которые указаны в каком-либо из других вариантов осуществления, где Het4 представляет собой морфолинил, имидазолидинил, пиперидинил, морфолинил или оксазолидинил, в частности, 1-морфонилил, 1-имидазолидинил, 1-пиперидинил, 1-морфолинил или 3-оксазолидинил;
каждый из которых может быть необязательно замещен, как определено в каком-либо из других вариантов осуществления.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, которые указаны в каком-либо из других вариантов осуществления, где Het4 представляет собой морфолинил, имидазолидинил, пиперидинил, морфолинил или оксазолидинил, в частности, 1-морфонилил, 1-имидазолидинил, 1-пиперидинил, 1-морфолинил или 3-оксазолидинил;
каждый из которых замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN, оксо, -C(=O)NR5R5', -O-C1-4алкила, -S(=O)2-C1-4алкила и C1-4алкила, необязательно замещенного -O-C1-4алкилом.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, указанным в каком-либо из других вариантов осуществления, где
Ar представляет собой фенил, необязательно замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN, -OR4, -NR5R5',
-C(=O)NR5R5', -S(=O)2-NR5R5', -S(=O)2-C1-4алкил, R14, CF3, C3-5циклоалкила, необязательно замещенного -CN, и
C1-4алкила, необязательно замещенного одним или двумя заместителями, каждый из которых независимо выбран из группы, состоящей из фтора, -CN, -OR6, -NR7R7',
-S(=O)2-C1-4алкила и -C(=O)NR8R8';
Het1 представляет собой моноциклический гетероарил, выбранный из группы, состоящей из пиридила, 2-, 4-, 5- или 6-пиримидинила, пиразинила, пиридазинила, фуранила, тиенила, пирролила, пиразолила, имидазолила, 4- или 5-тиазолила, изотиазолила и изоксазолила; каждый из которых может быть необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN, -OR4, -NR5R5', -C(=O)NR5R5', и C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN, -OR6, Het2, -NR7R7' и -C(=O)NR8R8'.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, указанным в каком-либо из других вариантов осуществления, где Q представляет собой водород.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, указанным в каком-либо из других вариантов осуществления, где
Q представляет собой водород, если A представляет собой -CR15aR15b-;
Q представляет собой водород или C1-4алкил, необязательно замещенный фенилом, если A представляет собой ковалентную связь.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, указанным в каком-либо из других вариантов осуществления, где
Het1 представляет собой моноциклический гетероарил, выбранный из группы, состоящей из пиридила, 2-, 4-, 5- или 6-пиримидинила, пиразинила, пиридазинила, фуранила, тиенила, пирролила, пиразолила, имидазолила, 4- или 5-тиазолила, изотиазолила и изоксазолила; каждый из которых может быть необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN, -OR4, -NR5R5', -C(=O)NR5R5', -C(=O)-Het4 и C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN, -OR6, Het2a, -NR7R7' и -C(=O)NR8R8'; и
Het2 представляет собой неароматический гетероциклил, необязательно замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN,
-C(=O)-C1-6алкила, -C(=O)Ar, -C(=O)Het1a, -C(=O)Het2a, -OR4, -NR5R5' и C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора,
-CN, -OR6, -NR7R7', R12 и -C(=O)NR8R8';
Het1a представляет собой моноциклический гетероарил, выбранный из группы, состоящей из пиридила, 2-, 4-, 5- или 6-пиримидинила, пиразинила, пиридазинила, фуранила, тиенила, пирролила, пиразолила, имидазолила, 4- или 5-тиазолила, изотиазолила и изоксазолила;
Het2a представляет собой неароматический гетероциклил.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, указанным в каком-либо из других вариантов осуществления, где
Het1 представляет собой моноциклический гетероарил, выбранный из группы, состоящей из пиридила, 2-, 4-, 5- или 6-пиримидинила, пиразинила, пиридазинила, фуранила, тиенила, пирролила, пиразолила, имидазолила, 4- или 5-тиазолила, изотиазолила и изоксазолила; каждый из которых может быть необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN, -OR4, -NR5R5', -C(=O)NR5R5', -C(=O)-Het4 и C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора, -CN, -OR6, -NR7R7' и -C(=O)NR8R8'; и
Het2 представляет собой неароматический гетероциклил, необязательно замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN,
-C(=O)-C1-6алкила, -C(=O)Ar, -OR4, -NR5R5' и C1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из фтора,
-CN, -OR6, -NR7R7', R12 и -C(=O)NR8R8'.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, указанным в каком-либо из других вариантов осуществления, где
Q представляет собой водород, если R15a и R15b представляют собой C1-4алкил.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, которые указаны в каком-либо из других вариантов осуществления, где если --L-R3 представляет собой (b); то R3 выбран из группы, состоящей из Ar; Het1; Het3; R17 и 7-10-членной насыщенной спирокарбобициклической системы.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, которые указаны в каком-либо из других вариантов осуществления, где если --L-R3 представляет собой (b); то R3 выбран из группы, состоящей из Ar; Het1; Het2; Het3 и 7-10-членной насыщенной спирокарбобициклической системы.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, которые указаны в каком-либо из других вариантов осуществления, где если --L-R3 представляет собой (b); то R3 выбран из группы, состоящей из Ar; Het1; Het3 и 7-10-членной насыщенной спирокарбобициклической системы.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, которые указаны в каком-либо из других вариантов осуществления, где если --L-R3 представляет собой (b); то R3 выбран из группы, состоящей из Ar; Het1; Het2; R17 и 7-10-членной насыщенной спирокарбобициклической системы.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, которые указаны в каком-либо из других вариантов осуществления, где если --L-R3 представляет собой (b); то R3 выбран из группы, состоящей из Ar; Het1; Het2 и 7-10-членной насыщенной спирокарбобициклической системы.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, которые указаны в каком-либо из других вариантов осуществления, где --L-R3 представляет собой (b); и R3 выбран из группы, состоящей из Ar; Het1; Het3; R17 и 7-10-членной насыщенной спирокарбобициклической системы.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, которые указаны в каком-либо из других вариантов осуществления, где --L-R3 представляет собой (b); R3 выбран из группы, состоящей из Ar; Het1; Het2; Het3 и 7-10-членной насыщенной спирокарбобициклической системы.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, которые указаны в каком-либо из других вариантов осуществления, где --L-R3 представляет собой (b); и R3 выбран из группы, состоящей из Ar; Het1; Het3 и 7-10-членной насыщенной спирокарбобициклической системы.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, которые указаны в каком-либо из других вариантов осуществления, где R14 представляет собой 5-членный моноциклический гетероарил, содержащий по меньшей мере один атом азота и необязательно 1 дополнительный гетероатом, выбранный из азота, кислорода и серы.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, указанным в каком-либо из других вариантов осуществления, где
X1 представляет собой O или NH;
X2 представляет собой NH;
X3 представляет собой NH;
X4 представляет собой N;
X5 представляет собой CH.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, указанным в каком-либо из других вариантов осуществления, где
X1 представляет собой O или NH.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, указанным в каком-либо из других вариантов осуществления, где
A представляет собой ковалентную связь;
--L-R3 выбран из (a), (b) или (c).
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, указанным в каком-либо из других вариантов осуществления, где
A представляет собой -CR15aR15b-;
каждый из R15a и R15b независимо выбран из группы, состоящей из водорода или C1-4алкила;
--L-R3 выбран из (a), (b) или (c).
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, которые указаны в каком-либо из других вариантов осуществления, где A ограничен ковалентной связью, называемым в данном документе соединениями формулы (I-x):
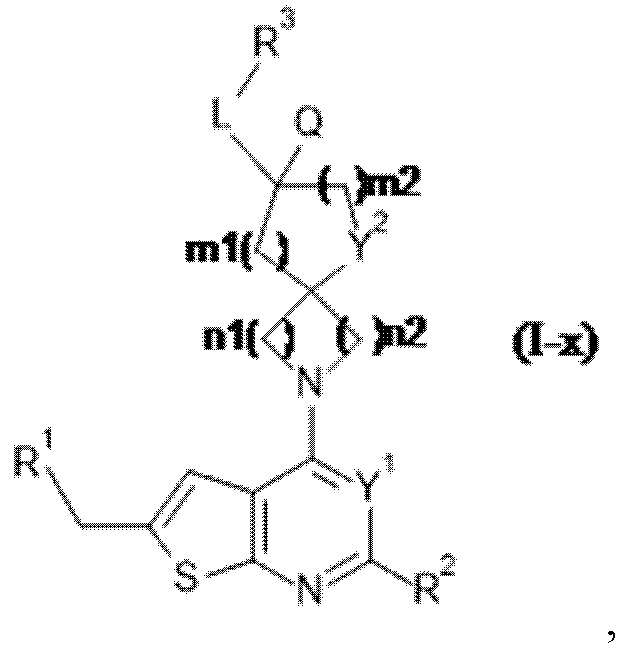
где все переменные определены для соединений формулы (I) или какой-либо их подгруппы, которые указаны в каком-либо из других вариантов осуществления.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, которые указаны в каком-либо из других вариантов осуществления, где A ограничен -CR15aR15b-, называемым в данном документе соединениями формулы (I-xx):
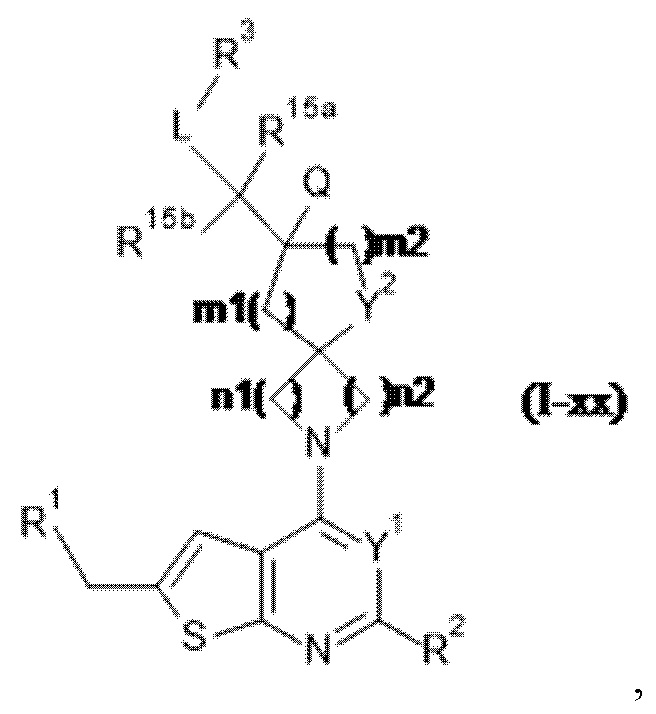
где все переменные определены для соединений формулы (I) или какой-либо их подгруппы, которые указаны в каком-либо из других вариантов осуществления.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, которые указаны в каком-либо из других вариантов осуществления, где соединения формулы (I) ограничены соединениями формулы (I-y):
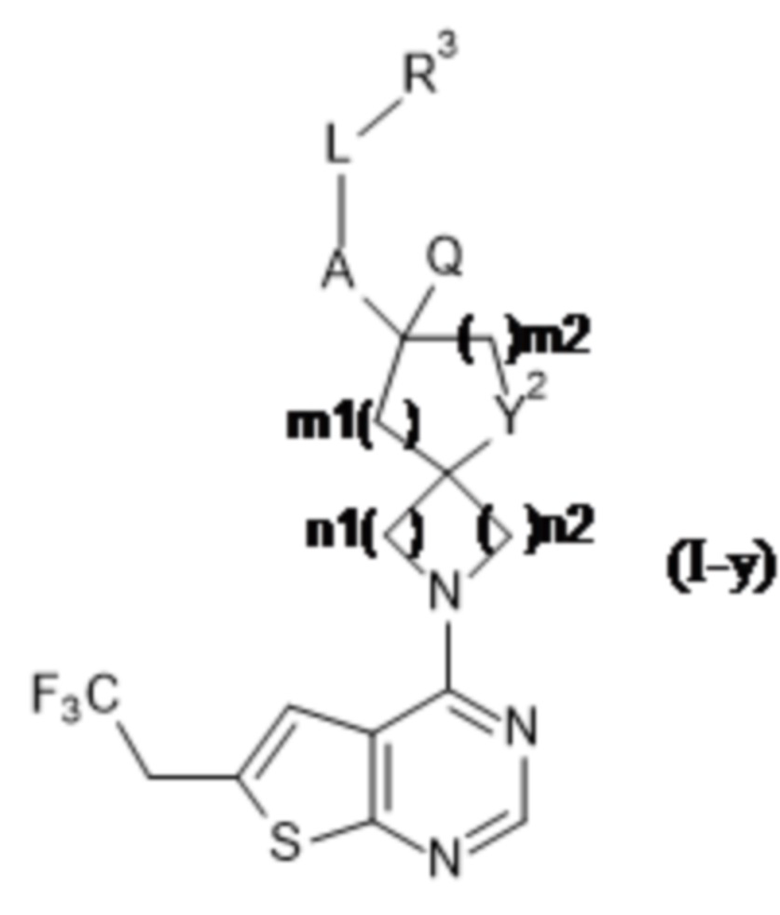 ,
,
где все переменные определены для соединений формулы (I) или какой-либо их подгруппы, которые указаны в каком-либо из других вариантов осуществления.
В одном варианте осуществления настоящее изобретение относится к таким соединениям формулы (I) и их фармацевтически приемлемым солям и сольватам или к какой-либо их подгруппе, которые указаны в каком-либо из других вариантов осуществления, где соединения формулы (I) ограничены соединениями формулы (I-z):
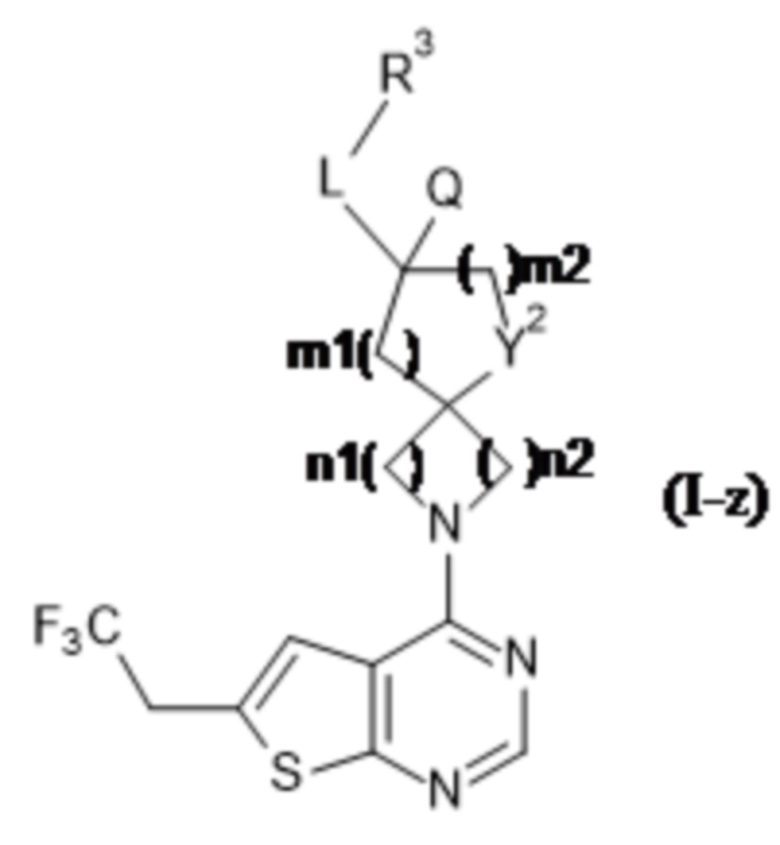 ,
,
где все переменные определены для соединений формулы (I) или какой-либо их подгруппы, которые указаны в каком-либо из других вариантов осуществления.
В одном варианте осуществления соединение формулы (I) выбрано из группы, состоящей из любых приведенных в качестве примера соединений,
их таутомеров и стереоизомерных форм
и их свободных оснований, любых фармацевтически приемлемых солей присоединения и сольватов.
Предполагается, что все возможные комбинации вышеуказанных вариантов осуществления попадают в объем настоящего изобретения.
Способы получения соединений формулы (I)
В этом разделе, как и во всех других разделах, если контекст не указывает на иное, ссылки к формуле (I) также включают все другие подгруппы и их примеры, как определено в данном документе.
Общие способы получения некоторых типичных примеров соединений формулы (I) описаны в данном документе и в конкретных примерах, и, как правило, их получают из исходных веществ, являющихся либо коммерчески доступными, либо получаемыми с помощью стандартных способов синтеза, обычно применяемых специалистами в данной области техники. Подразумевается, что следующие схемы только представляют примеры настоящего изобретения и ни в коей мере не ограничивают настоящее изобретение.
В качестве альтернативы, соединения по настоящему изобретению можно также получать с помощью протоколов реакций, аналогичных описанным на общих схемах, приведенных ниже, в комбинации со стандартными способами синтеза, обычно применяемыми специалистами в области органической химии.
Специалисту в данной области техники будет понятно, что в реакциях, описанных на схемах, хотя это не всегда явно показано, может потребоваться защита реакционноспособных функциональных групп (например гидрокси-, амино- или карбоксигрупп), если они необходимы в конечном продукте, для того, чтобы избежать их нежелательного участия в реакциях. Например, на схеме 1 фрагмент NH в промежуточном соединении (III) может быть защищен с помощью трет-бутоксикарбонильной защитной группы. В целом, можно применять традиционные защитные группы в соответствии со стандартной практикой. Защитные группы можно удалять на подходящей последующей стадии с применением способов, известных из уровня техники. Это проиллюстрировано в конкретных примерах.
Специалисту в данной области техники будет понятно, что в реакциях, описанных на схемах, возможно, будет целесообразно или необходимо проводить реакцию в инертной атмосфере, такой как, например, атмосфера газообразного N2.
Специалисту в данной области техники будет очевидно, что может быть необходимым охлаждать реакционную смесь перед выделением продукта реакции (касается ряда манипуляций, необходимых для выделения и очистки продукта(продуктов) химической реакции, таких как, например, гашение, колоночная хроматография, экстракция).
Специалисту в данной области техники будет понятно, что нагревание реакционной смеси при перемешивании может увеличить выход реакции. В некоторых реакциях можно применять нагревание с помощью микроволнового излучения вместо традиционного нагревания для сокращения общего времени реакции.
Специалисту в данной области техники будет понятно, что другая последовательность химических реакций, показанная на схемах ниже, может также обеспечивать в результате необходимое соединение формулы (I).
Специалисту в данной области техники будет понятно, что промежуточные соединения и конечные соединения, показанные на схемах ниже, можно дополнительно функционализировать в соответствии со способами, хорошо известными специалисту в данной области техники. Промежуточные соединения и соединения, описанные в данном документе, можно выделять в свободной форме или в виде соли.
Схемы 1-16 относятся, в частности, к соединениям/промежуточным соединениям, где переменная "A" представляет собой ковалентную связь.
СХЕМА 1
В целом, соединения формулы (I), где R2 ограничен H или Me (метилом), и Y1 ограничен N и C-CN, где R1A' выбран из группы, состоящей из C0-5алкила, необязательно замещенного одним, двумя или тремя заместителями, представляющими собой фтор; и C1-5алкила, замещенного заместителем, выбранным из группы, состоящей из -OR1a и -NR2aR2aa, и где все другие переменные определены в соответствии с объемом настоящего изобретения, называемые в данном документе соединениями формулы (I-a), можно получать в соответствии со следующей реакционной схемой 1. На схеме 1 каждый из LG1 и LG2 представляет собой подходящую уходящую группу, такую как, например, галоген (подходящий галоген) или метансульфонил; PG1 представляет собой подходящую защитную группу, такую как, например, трет-бутилоксикарбонил; R1A-PG2 представляет собой R1A, определенный в формуле (I), с подходящей защитной группой, такой как, например, трет-бутилоксикарбонил, все другие переменные на схеме 1 определены в соответствии с объемом настоящего изобретения.
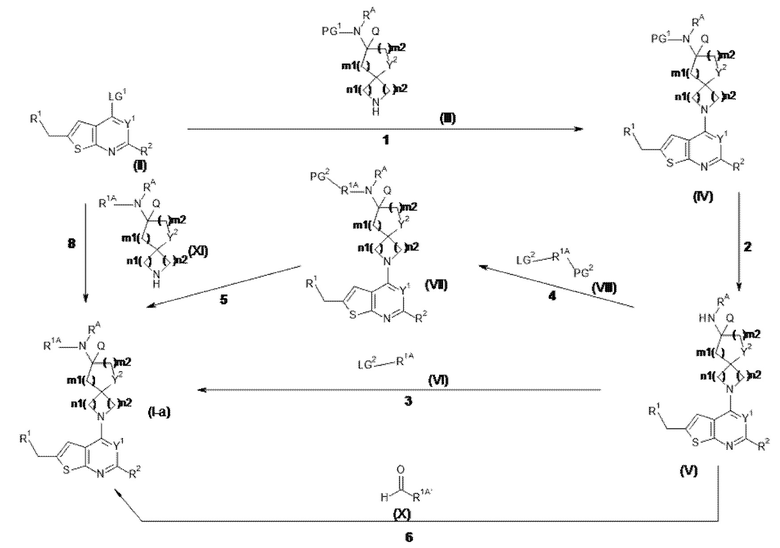
На схеме 1 применены следующие условия реакции:
1: при подходящей температуре, такой как в диапазоне от к.т. до 90°C, в присутствии подходящего основания, такого как, например, диизопропилэтиламин или триэтиламин, в подходящем растворителе, таком как, например, ацетонитрил, или изопропанол, или этанол (EtOH), или дихлорметан (DCM);
2: если PG1 представляет собой трет-бутилоксикарбонил - в подходящем температурном диапазоне, таком как, например, от 0°C до комнатной температуры, в присутствии подходящих условий расщепления, таких как, например, кислота, такая как HCl или трифторуксусная кислота, в подходящем растворителе, таком как ацетонитрил, или DCM, или метанол (MeOH);
в качестве альтернативы, при подходящей температуре, такой как, например, комнатная температура, в подходящем растворителе, таком как уксусная кислота;
3: при подходящей температуре, такой как, например, комнатная температура или 90°C, в присутствии подходящего основания, такого как, например, карбонат калия или 1,8-диазабицикло[5.4.0]ундец-7-ен, в подходящем растворителе, таком как, например, ацетонитрил или диметилсульфоксид (DMSO);
4: при подходящей температуре, такой как, например, комнатная температура или 90°C, в присутствии подходящего основания, такого как, например, карбонат калия или 1,8-диазабицикло[5.4.0]ундец-7-ен, в подходящем растворителе, таком как, например, ацетонитрил или DMSO;
5: в подходящем температурном диапазоне, таком как, например, от 0°C до комнатной температуры, в присутствии подходящих условий расщепления, таких как, например, кислота, такая как HCl или трифторуксусная кислота, в подходящем растворителе, таком как ацетонитрил или DCM, если PG2 представляет собой трет-бутилоксикарбонил;
6: при подходящей температуре, например, комнатной температуре, в присутствии подходящего восстановителя, такого как, например, триацетоксиборогидрид натрия (NaBH(OAc)3), декаборан или борогидрид натрия, в подходящем растворителе, таком как DCM, DCE, метанол или тетрагидропиран, с подходящей кислотой, такой как, например, уксусная кислота, или без нее;
8: при подходящей температуре, такой как, например, при 90°C, в присутствии подходящего основания, такого как, например, диизопропилэтиламин или триэтиламин, в подходящем растворителе, таком как, например, ацетонитрил, или изопропанол, или DCM. На стадии 8 реагенты формулы (XI) являются либо коммерчески доступными, либо получены в соответствии со схемой 3 посредством способов, известных специалисту в данной области техники, из коммерчески доступных исходных веществ, например, посредством соответствующих стадий введения защитной группы/удаления защитной группы и взаимопревращения функциональных групп, из исходных веществ, таких как 2-азаспиро[4.5]декан-2-карбоновая кислота, 8-амино-1,1-диметилэтиловый сложный эфир (CAS[1363381-61-6]).
СХЕМА 2
Промежуточные соединения формулы (II), где R2 представляет собой метил, и Y1 представляет собой N, называемые в данном документе промежуточным соединением формулы (XIII), можно получать в соответствии со следующей реакционной схемой 2, где LG1 представляет собой подходящую уходящую группу, такую как, например, галоген или метансульфонил. Все остальные переменные на схеме 2 определены в соответствии с объемом настоящего изобретения.
На схеме 2 применены следующие условия реакции:
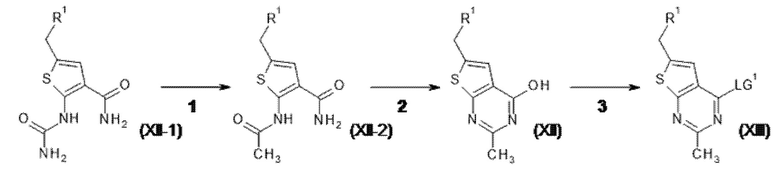
1: при подходящей температуре, такой как, например, температура образования флегмы, в присутствии уксусного ангидрида и подходящего основания, такого как, например, триметиламин, в подходящем растворителе, таком как, например, толуол;
2: при подходящей температуре, такой как, например, температура образования флегмы, в присутствии
подходящего основания, такого как гидроксид калия, в подходящем растворителе, таком как, например, EtOH;
3: при подходящих условиях реакции для образования уходящей группы, такой как, например, хлор, например, путем проведения реакции с трихлоридом фосфора при подходящей температуре, такой как 110°C.
СХЕМА 3
Промежуточные соединения формулы (III) и (XI), где PG3 представляет собой подходящую защитную группу, ортогональную к PG1, такую как, например, бензилоксикарбонил, можно получать в соответствии со следующей реакционной схемой 3. Все остальные переменные на схеме 3 определены выше или в соответствии с объемом настоящего изобретения.
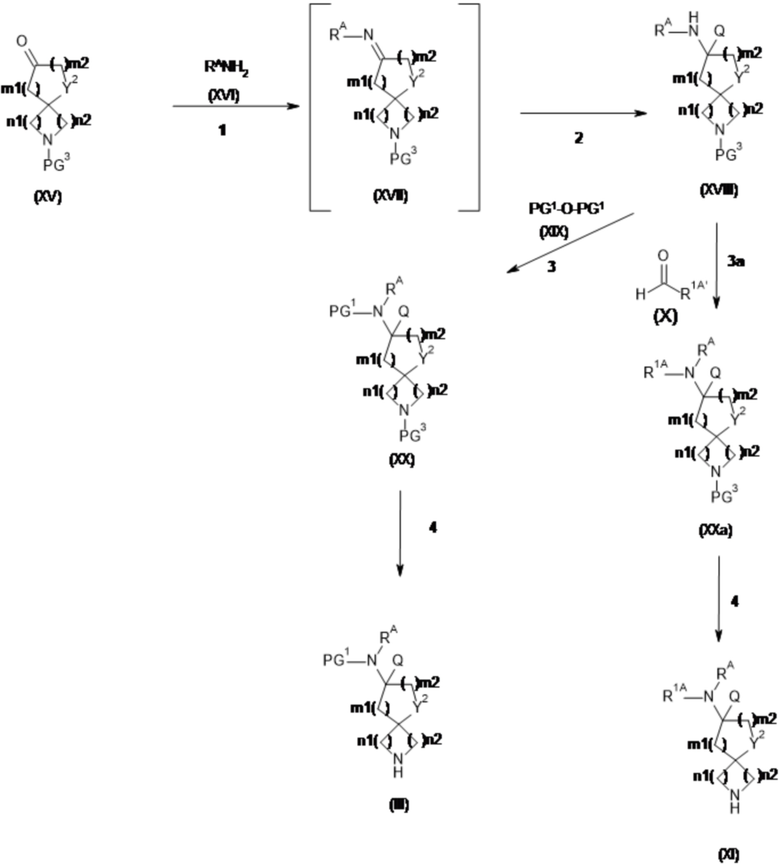
На схеме 3 применены следующие условия реакции:
1: при подходящей температуре, например, 80°C, в подходящем растворителе, таком как EtOH или тетрагидрофуран (THF);
2: в случае если Q отличается от водорода, при подходящей температуре, такой как, например, 0°C, в присутствии подходящих литийорганических (Q-Li) реагентов или реагентов Гриньяра (Q-Mg-галоген), которые либо являются коммерчески доступными, либо их можно получать посредством способов, известных специалисту в данной области техники, в подходящем растворителе, таком как, например, THF;
в качестве альтернативы, в случае если Q представляет собой водород, при подходящей температуре, такой как, например, комнатная температура, в присутствии подходящего восстановителя, такого как, например, триацетоксиборогидрид натрия, в подходящем растворителе, таком как, например, THF или MeOH;
в случае если Q представляет собой водород, то стадию 1 и 2 можно проводить в одно и то же время;
3a: при подходящей температуре, например, комнатной температуре, в присутствии подходящего восстановителя, такого как, например, триацетоксиборогидрид натрия (NaBH(OAc)3), декаборан или борогидрид натрия, в подходящем растворителе, таком как DCM, DCE, метанол или тетрагидропиран, с подходящей кислотой, такой как, например, уксусная кислота, или без нее;
3: при подходящей температуре, такой как комнатная температура, в присутствии подходящего основания, такого как, например, диизопропиламин, в подходящем растворителе, таком как DCM;
4: при подходящей температуре, такой как, например, комнатная температура, в присутствии подходящего катализатора, такого как, например, палладий на угле (Pd/C), в присутствии подходящей атмосферы водорода, в подходящем растворителе, таком как, например, EtOH или смесь EtOH и THF.
СХЕМА 4
В качестве альтернативы, если Q ограничен водородом, то промежуточные соединения формулы (III) и (XI), называемые в данном документе промежуточными соединениями формулы (IIIa) и (XIa), можно также получать в соответствии со схемой 4.
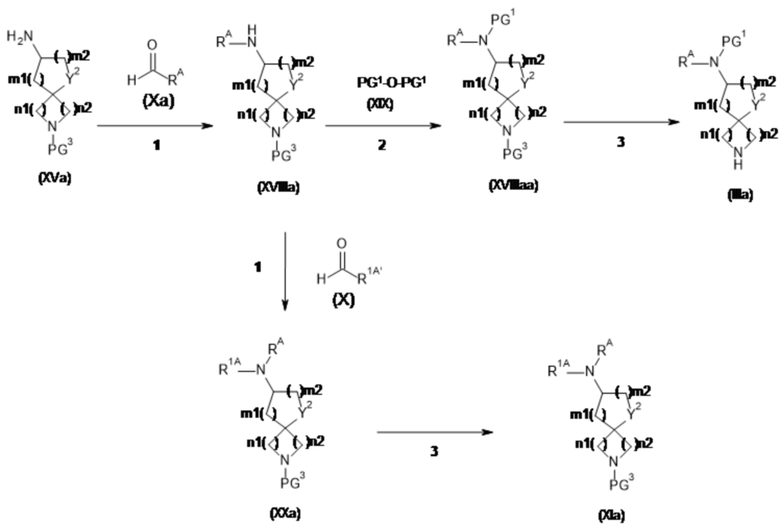
На схеме 4 применены следующие условия реакции:
1: при подходящей температуре, например, комнатной температуре, в присутствии подходящего восстановителя, такого как, например, триацетоксиборогидрид натрия (NaBH(OAc)3), декаборан или борогидрид натрия, в подходящем растворителе, таком как, например, DCM, DCE, метанол или тетрагидропиран, с подходящей кислотой, такой как, например, уксусная кислота, или без нее;
2: при подходящей температуре, такой как комнатная температура, в присутствии подходящего основания, такого как, например, диизопропиламин, в подходящем растворителе, таком как DCM;
3: при подходящей температуре, такой как, например, комнатная температура, в присутствии подходящего катализатора, такого как, например, Pd/C, в присутствии подходящей атмосферы водорода, в подходящем растворителе, таком как, например, EtOH или смесь EtOH и THF.
Схема 5
Промежуточные соединения формулы (II), где R2 представляет собой H, и Y1 представляет собой C-CN, называемые в данном документе промежуточным соединением формулы (XXVIII), можно получать в соответствии со следующей реакционной схемой 5.
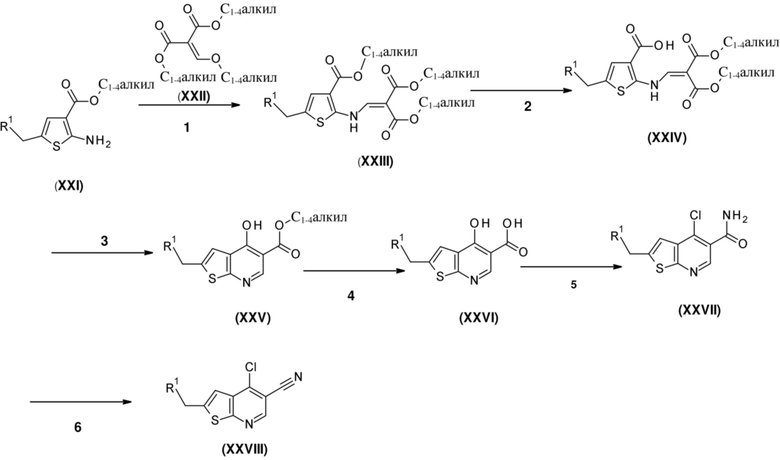
На схеме 5 применены следующие условия реакции:
1: при подходящей температуре, такой как, например, 135°C;
2: при подходящей температуре, такой как, например, 40°C, в присутствии подходящего основания, такого как, например, гидроксид лития, в подходящем растворителе, таком как, например, смесь THF и воды;
3: при подходящей температуре, такой как, например, 135%, в подходящей кислоте, такой как полифосфорная кислота (PPA);
4: при подходящей температуре, такой как, например, 40°C, в присутствии подходящего основания, такого как, например, гидроксид натрия, в подходящем растворителе, таком как, например, смесь MeOH и воды;
5: a) при подходящей температуре, такой как, например, 70°C, в присутствии подходящего хлорирующего реагента, такого как, например, оксалилхлорид, каталитического количества диметилформамида, в подходящем растворителе, таком как, например, хлороформ;
b) при подходящей температуре, такой как, например, 25°C, в присутствии аммиака, в подходящем растворителе, таком как, например, DCM;
6: при подходящей температуре, такой как, например, 0°C, в присутствии подходящего реагента, такого как, например, трифторуксусный ангидрид, подходящего основания, такого как, например, триэтиламин, в подходящем растворителе, таком как, например, DCM.
СХЕМА 6
В целом, соединения формулы (I), где R2 ограничен H или Me, и Y1 ограничен N и C-CN, где R1A' выбран из группы, состоящей из C0-5алкила, необязательно замещенного одним, двумя или тремя заместителями, представляющими собой фтор; и C1-5алкила, замещенного заместителем, выбранным из группы, состоящей из -OR1a и -NR2aR2aa и где все другие переменные определены в соответствии с объемом настоящего изобретения, называемые в данном документе соединениями формулы (Ib), (Ica) и (Icb), можно получать в соответствии со следующей реакционной схемой 1. В схеме 6 LG2 в каждом случае представляет собой подходящую уходящую группу, такую как, например, галоген или метансульфонил; PG1 представляет собой подходящую защитную группу, такую как, например, трет-бутилоксикарбонил; все другие переменные в схеме 1 определены в соответствии с объемом настоящего изобретения.
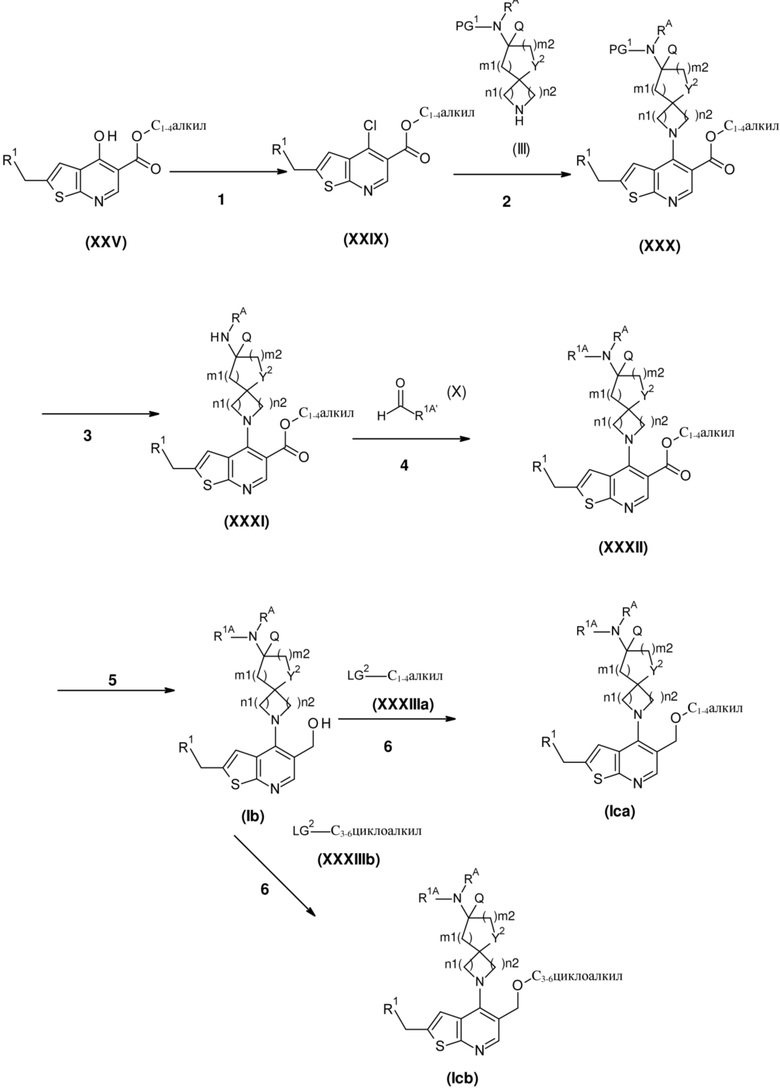
На схеме 6 применены следующие условия реакции:
1: при подходящей температуре, такой как, например, 70°C, в присутствии подходящего хлорирующего реагента, такого как, например, оксалилхлорид, каталитического количества диметилформамида, в подходящем растворителе, таком как, например, хлороформ;
2: при подходящей температуре, такой как в диапазоне от к.т. до 90°C, в присутствии подходящего основания, такого как, например, диизопропилэтиламин или триэтиламин, в подходящем растворителе, таком как, например, ацетонитрил, или изопропанол, или EtOH, или DCM.
3: при подходящей температуре, такой как, например, комнатная температура, в присутствии подходящей кислоты, такой как, например, трифторуксусная кислота, в подходящем растворителе, таком как, например, DCM.
4: при подходящей температуре, например, комнатной температуре, в присутствии подходящего восстановителя, такого как, например, NaBH(OAc)3, декаборан или борогидрид натрия, в подходящем растворителе, таком как DCM, DCE, метанол или тетрагидропиран, с подходящей кислотой, такой как, например, уксусная кислота, или без нее;
5: при подходящей температуре, такой как, например, -78°C, в присутствии подходящего восстановителя, такого как, например, гидрид диизобутилалюминия, в подходящем растворителе, таком как, например, DCM;
6: при подходящей температуре, такой как, например, 0°C, в присутствии подходящего депротонирующего средства, такого как, например, гидрид натрия, в подходящем растворителе, таком как, например, THF или диметилформамид.
Схема 7
В целом, соединения формулы, (I) где R2 ограничен H или Me, и Y1 ограничен N и C-CN, и где все другие переменные определены в соответствии с объемом настоящего изобретения, называемые в данном документе соединениями формулы (Id), (Ie) и (If), можно получать в соответствии со следующей реакционной схемой 7. На схеме 7 LG2 представляет собой подходящую уходящую группу, такую как, например, галоген или метансульфонил;

Специалисту в данной области техники будет очевидно, что промежуточное соединение (Vc) можно получать, следуя пути, подобному тому, который применялся для получения промежуточного соединения (V) и указан на схеме 1.
На схеме 7 применены следующие условия реакции:
1: при подходящей температуре, например, комнатной температуре, в присутствии подходящего восстановителя, такого как, например, NaBH(OAc)3, декаборан или борогидрид натрия, в подходящем растворителе, таком как DCM, DCE, метанол или тетрагидропиран, с подходящей кислотой, такой как, например, уксусная кислота, или без нее;
или в качестве альтернативы и последовательно
а) при подходящей температуре, такой как, например, комнатная температура или 45°C, в присутствии этоксида титана(IV) или изопропоксида титана(IV), в подходящем растворителе, таком как, например, тетрагидропиран, DCE или смесь DCE и MeOH;
b) при подходящей температуре, такой как, например, комнатная температура, в присутствии подходящего восстановителя, такого как, например, борогидрид натрия, триацетоксиборогидрид натрия или цианоборогидрид натрия, в подходящем растворителе, таком как, например, тетрагидропиран, DCE или смесь DCE и MeOH;
стадии a и b можно осуществлять в виде процедуры, осуществляемой в одном реакторе;
2: при подходящей температуре, такой как, например, комнатная температура или 90°C, в присутствии подходящего основания, такого как, например, карбонат калия или 1,8-диазабицикло[5.4.0]ундец-7-ен, в подходящем растворителе, таком как, например, ацетонитрил или DMSO.
Схема 8
В целом, соединения формулы (I), где R2 ограничен H или Me, и Y1 ограничен N и C-CN, Q ограничен водородом, и где все другие переменные определены в соответствии с объемом настоящего изобретения, называемые в данном документе соединениями формулы (Ih) и (Ii), можно получать в соответствии со следующей реакционной схемой 8. На схеме 8 LG1 представляет собой подходящую уходящую группу, такую как, например, галоген или метансульфонил;
s
На схеме 8 применены следующие условия реакции:
1: при подходящей температуре, такой как в диапазоне от к. т. до 90°C, в присутствии подходящего основания, такого как, например, диизопропилэтиламин или триэтиламин, в подходящем растворителе, таком как, например, ацетонитрил, или изопропанол, или EtOH, или DCM.
2: при подходящей температуре, например, комнатной температуре, в присутствии подходящего восстановителя, такого как, например, NaBH(OAc)3, декаборан или борогидрид натрия, в подходящем растворителе, таком как DCM, DCE, метанол или тетрагидропиран, с подходящей кислотой, такой как, например, уксусная кислота, или без нее;
или в качестве альтернативы и последовательно
а) при подходящей температуре, такой как, например, комнатная температура или 45°C, в присутствии этоксида титана(IV) или изопропоксида титана(IV), в подходящем растворителе, таком как, например, тетрагидропиран, DCE или смесь DCE и MeOH;
b) при подходящей температуре, такой как, например, комнатная температура, в присутствии подходящего восстановителя, такого как, например, борогидрид натрия, триацетоксиборогидрид натрия или цианоборогидрид натрия, в подходящем растворителе, таком как, например, тетрагидропиран, DCE или смесь DCE и MeOH;
стадии a и b можно осуществлять в виде процедуры, осуществляемой в одном реакторе.
Схема 9
В целом, соединения формулы (I), где R2 ограничен H или Me, Y1 ограничен N и C-CN, R3aa ограничен Ar; Het1 или Het3, R3b ограничен Het2 и R17, и R3c ограничен Het1, называемые в данном документе соединениями формулы (Ij), (Ik) и (Ika), можно получать в соответствии со следующей реакционной схемой 9. На схеме 9 галоген представляет собой подходящий атом галогена, такой как, например, хлор, бром или йод, галоген1 представляет собой подходящий атом галогена, такой как, например, хлор или фтор, и все другие переменные определены в соответствии с объемом настоящего изобретения.
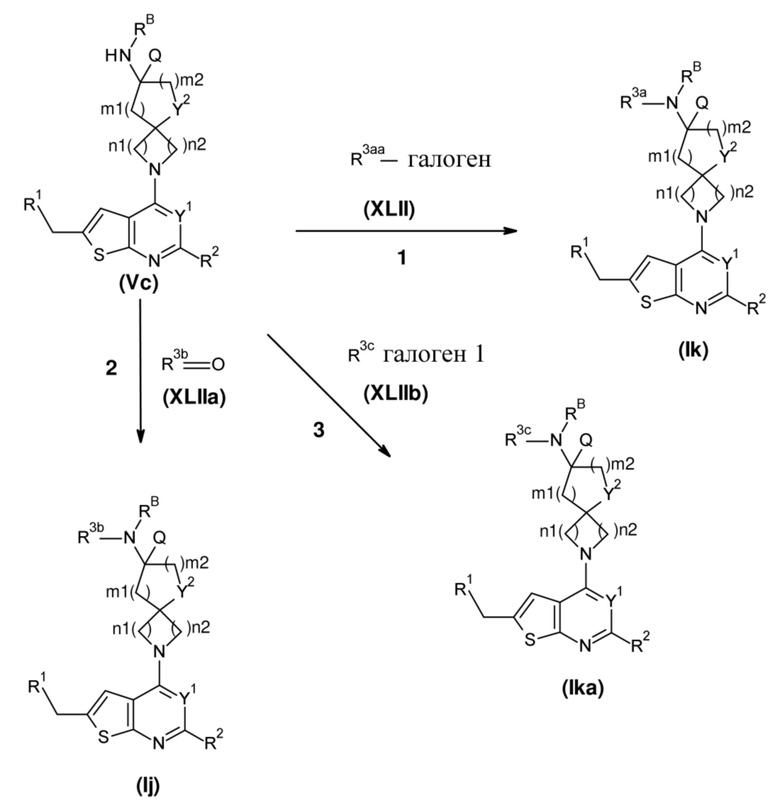
На схеме 9 применены следующие условия реакции:
1: при микроволновом излучении, при подходящей температуре, такой как, например, 130°C, в присутствии подходящего катализатора, такого как, например, трис(дибензилиденацетон)дипалладий(0), подходящего лиганда, такого как, например, 2-(дициклогексилфосфино)-3,6-диметокси-2',4',6'-триизопропил-1,1'-бифенил, подходящего основания, такого как, например, трет-бутилат натрия, в подходящем растворителе, таком как, например, диоксан;
2: при подходящей температуре, например, комнатной температуре, в присутствии подходящего восстановителя, такого как, например, NaBH(OAc)3, декаборан или борогидрид натрия, в подходящем растворителе, таком как DCM, DCE, метанол или тетрагидропиран, с подходящей кислотой, такой как, например, уксусная кислота, или без нее;
или в качестве альтернативы и последовательно
а) при подходящей температуре, такой как, например, комнатная температура или 45°C, в присутствии этоксида титана(IV) или изопропоксида титана(IV), в подходящем растворителе, таком как, например, тетрагидропиран, DCE или смесь DCE и MeOH;
b) при подходящей температуре, такой как, например, комнатная температура, в присутствии подходящего восстановителя, такого как, например, борогидрид натрия, триацетоксиборогидрид натрия или цианоборогидрид натрия, в подходящем растворителе, таком как, например, тетрагидропиран, DCE или смесь DCE и MeOH;
стадии a и b можно осуществлять в виде процедуры, осуществляемой в одном реакторе;
3: при подходящей температуре, такой как, например, 100°C, в присутствии подходящего основания, такого как, например, диизопропилэтиламин, в подходящем растворителе, таком как, например, изопропанол.
Схема 10
В целом, соединения формулы (I), где R2 ограничен H или Me, Y1 ограничен N и C-CN, и Q ограничен водородом, называемые в данном документе соединениями формулы (Im), можно получать в соответствии со следующей реакционной схемой 10. На схеме 10 все переменные определены в соответствии с вышеуказанным или в соответствии с объемом настоящего изобретения.
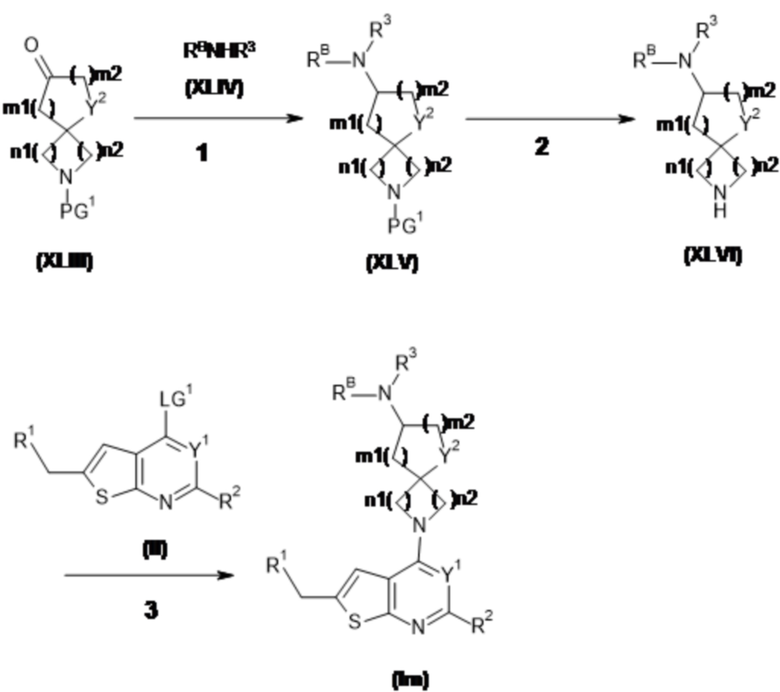
На схеме 10 применены следующие условия реакции:
1: при подходящей температуре, например, комнатной температуре, в присутствии подходящего восстановителя, такого как, например, NaBH(OAc)3, декаборан или борогидрид натрия, в подходящем растворителе, таком как DCM, DCE, метанол или тетрагидропиран, с подходящей кислотой, такой как, например, уксусная кислота, или без нее;
или в качестве альтернативы и последовательно
а) при подходящей температуре, такой как, например, комнатная температура или 45°C, в присутствии этоксида титана(IV) или изопропоксида титана(IV), в подходящем растворителе, таком как, например, тетрагидропиран, DCE или смесь DCE и MeOH;
b) при подходящей температуре, такой как, например, комнатная температура, в присутствии подходящего восстановителя, такого как, например, борогидрид натрия, триацетоксиборогидрид натрия или цианоборогидрид натрия, в подходящем растворителе, таком как, например, тетрагидропиран, DCE или смесь DCE и MeOH;
стадии a и b можно осуществлять в виде процедуры, осуществляемой в одном реакторе;
2: в подходящем температурном диапазоне, таком как, например, от 0°C до комнатной температуры, в присутствии подходящих условий расщепления, таких как, например, кислота, такая как HCl или трифторуксусная кислота, в подходящем растворителе, таком как ацетонитрил, или DCM, или MeOH, или этилацетат;
3: при подходящей температуре, такой как в диапазоне от к. т. до 90°C, в присутствии подходящего основания, такого как, например, диизопропилэтиламин или триэтиламин, в подходящем растворителе, таком как, например, ацетонитрил, или изопропанол, или EtOH, или DCM.
Схема 11
В целом, соединения формулы (I), где R2 ограничен NH2, и Y1 ограничен N, называемые в данном документе соединениями формулы (In), можно получать в соответствии со следующей реакционной схемой 11. На схеме 11 все переменные определены в соответствии с вышеуказанным или в соответствии с объемом настоящего изобретения.
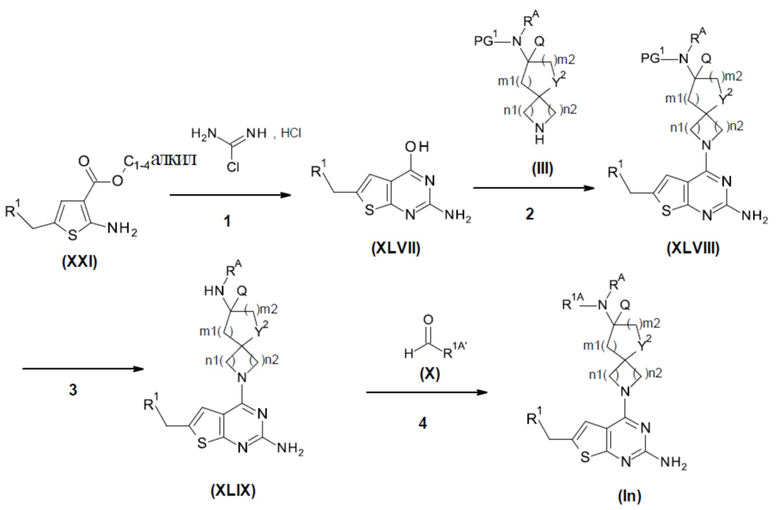
На схеме 11 применены следующие условия реакции:
1: при микроволновом излучении, при подходящей температуре, такой как, например, 160°C, в подходящем растворителе, таком как, например, диглим;
2: при подходящей температуре, такой как, например, 40°C, в присутствии подходящего средства для реакции сочетания, такого как, например, (бензотриазол-1-илокси)трис(диметиламино)фосфония гексафторфосфат (BOP), подходящего основания, такого как, например, 1,8-диазабицикло[5.4.0]ундец-7-ен (DBU), в подходящем растворителе, таком как, например, DMF;
3: если PG1 представляет собой трет-бутилоксикарбонил - в подходящем температурном диапазоне, таком как, например, от 0°C до комнатной температуры, в присутствии подходящих условий расщепления, таких как, например, кислота, такая как HCl или трифторуксусная кислота, в подходящем растворителе, таком как ацетонитрил, или DCM, или MeOH;
в качестве альтернативы, при подходящей температуре, такой как, например, комнатная температура, в подходящем растворителе, таком как уксусная кислота;
4: при подходящей температуре, например, при комнатной температуре, в присутствии подходящего восстановителя, такого как, например, NaBH(OAc)3 или борогидрид натрия, в подходящем растворителе, таком как DCM, DCE или тетрагидропиран, с подходящей кислотой, такой как, например, уксусная кислота, или без нее.
Схема 12
В целом, соединения формулы (I), где R2 ограничен NHMe, и Y1 ограничен N, называемые в данном документе соединениями формулы (Io), можно получать в соответствии со следующей реакционной схемой 12. На схеме 12 все переменные определены в соответствии с вышеуказанным или в соответствии с объемом настоящего изобретения.
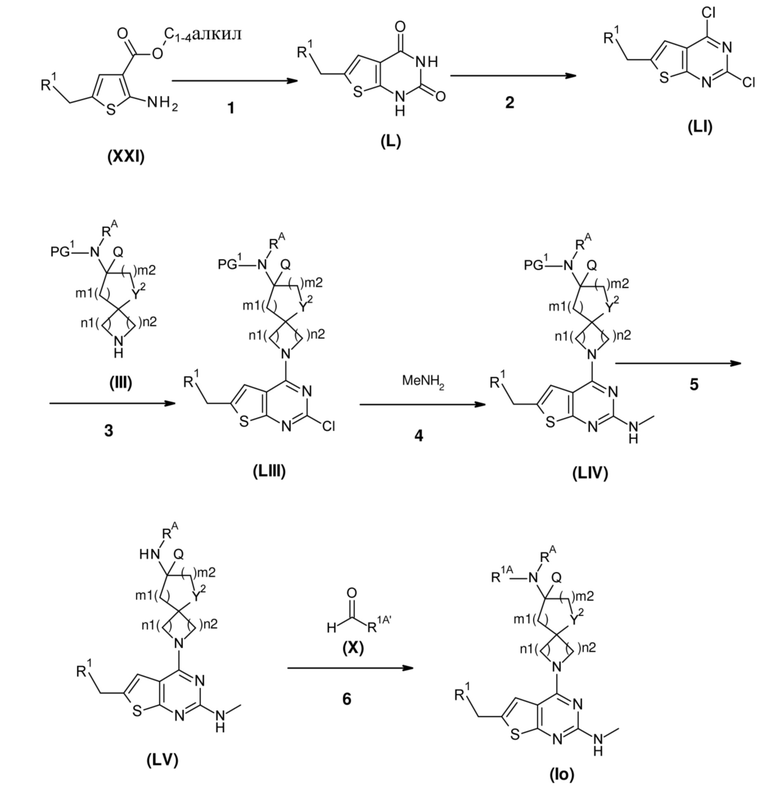
На схеме 12 применены следующие условия реакции:
1: при подходящей температуре в диапазоне от -60°C до 180°C, в присутствии подходящего реагента, такого как, например, изоцианат хлорсульфурила или мочевина;
2: при подходящей температуре, такой как 115°C, в подходящем хлорирующем реагенте, таком как, например, фосфонилтрихлорид;
3: при подходящей температуре, такой как в диапазоне от к. т. до 90°C, в присутствии подходящего основания, такого как, например, диизопропилэтиламин или триэтиламин, в подходящем растворителе, таком как, например, ацетонитрил, или изопропанол, или EtOH, или DCM.
4: при микроволновом излучении или без него, при подходящей температуре, такой как, например, 100°C, в подходящем растворителе, таком как, например, THF или диметилформамид;
5: если PG1 представляет собой трет-бутилоксикарбонил - в подходящем температурном диапазоне, таком как, например, от 0°C до комнатной температуры, в присутствии подходящих условий расщепления, таких как, например, кислота, такая как HCl или трифторуксусная кислота, в подходящем растворителе, таком как ацетонитрил, или DCM, или MeOH;
в качестве альтернативы, при подходящей температуре, такой как, например, комнатная температура, в подходящем растворителе, таком как уксусная кислота;
6: при подходящей температуре, например, комнатной температуре, в присутствии подходящего восстановителя, такого как, например, NaBH(OAc)3 или борогидрид натрия, в подходящем растворителе, таком как DCM, DCE или тетрагидропиран, с подходящей кислотой, такой как, например, уксусная кислота, или без нее.
Схема 13
В целом, соединения формулы (I), где R2 ограничен OMe, и Y1 ограничен N, где R1A' выбран из группы, состоящей из C0-5алкила, необязательно замещенного одним, двумя или тремя заместителями, представляющими собой фтор; и C1-5алкила, замещенного заместителем, выбранным из группы, состоящей из -OR1a и -NR2aR2aa, называемые в данном документе соединениями формулы (Ip), можно получать в соответствии со следующей реакционной схемой 13. На схеме 13 все переменные определены в соответствии с вышеуказанным или в соответствии с объемом настоящего изобретения.
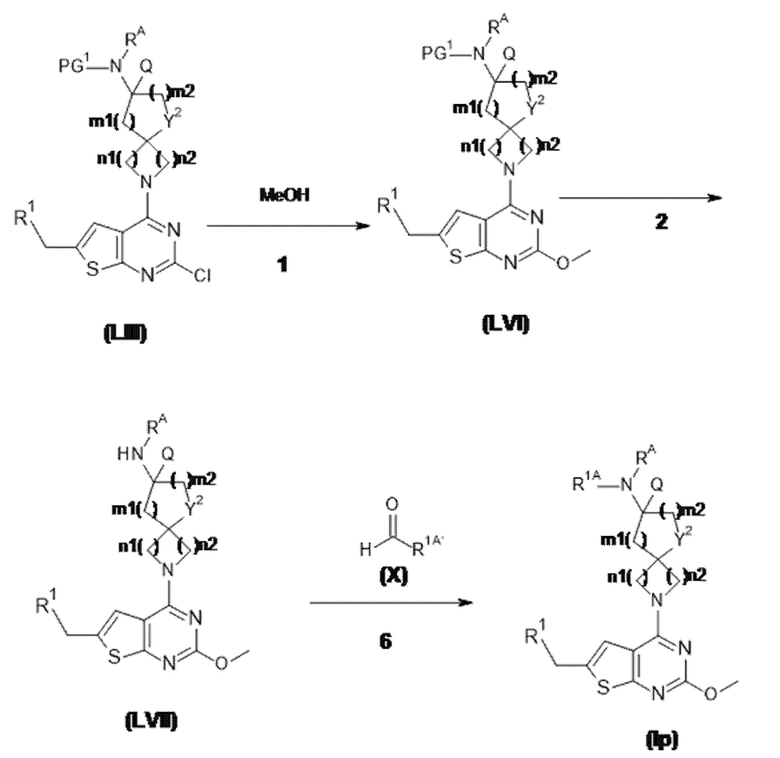
На схеме 13 применены следующие условия реакции:
1: при подходящей температуре, такой как, например, 100°C или 110°C, в присутствии подходящего катализатора, такого как, например, ацетат палладия, подходящего лиганда, такого как, например, 2,2'-бис(дифенилфосфино)-1,1'-бинафтил, подходящего основания, такого как, например, карбонат цезия, в подходящем растворителе, таком как, например, толуол;
2: если PG1 представляет собой трет-бутилоксикарбонил - в подходящем температурном диапазоне, таком как, например, от 0°C до комнатной температуры, в присутствии подходящих условий расщепления, таких как, например, кислота, такая как HCl или трифторуксусная кислота, в подходящем растворителе, таком как ацетонитрил, или DCM, или MeOH;
в качестве альтернативы, при подходящей температуре, такой как, например, комнатная температура, в подходящем растворителе, таком как уксусная кислота;
3: при подходящей температуре, например, при комнатной температуре, в присутствии подходящего восстановителя, такого как, например, NaBH(OAc)3 или борогидрид натрия, в подходящем растворителе, таком как DCM, DCE или тетрагидропиран, с подходящей кислотой, такой как, например, уксусная кислота, или без нее.
СХЕМА 14
В целом, соединения формулы (I), где R2 ограничен H или Me, и Y1 ограничен N и C-CN, и где R3 ограничен
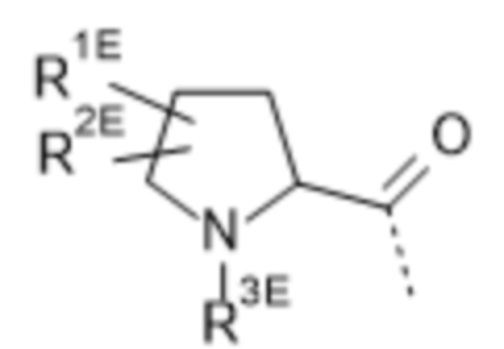 , называемые в данном документе соединениями формулы (Iq), можно получать в соответствии со следующей реакционной схемой 14. На схеме 14 все переменные определены в соответствии с вышеуказанным или в соответствии с объемом настоящего изобретения.
, называемые в данном документе соединениями формулы (Iq), можно получать в соответствии со следующей реакционной схемой 14. На схеме 14 все переменные определены в соответствии с вышеуказанным или в соответствии с объемом настоящего изобретения.
Специалисту в данной области техники будет очевидно, что промежуточное соединение (Va) можно получать, следуя пути, подобному тому, который применялся для получения промежуточного соединения V и указан на схеме 1.
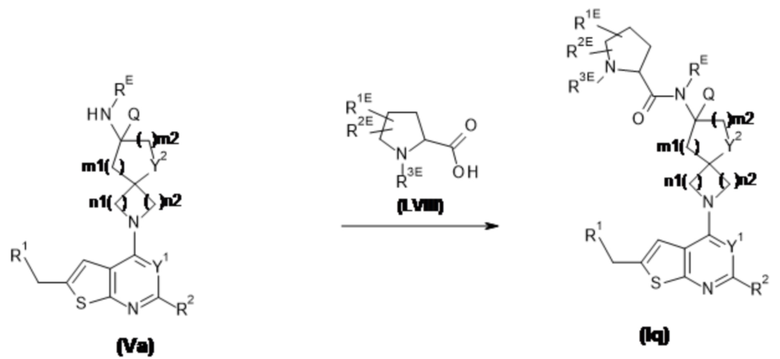
На схеме 14 применены следующие условия реакции:
1: при подходящей температуре, такой как, например, комнатная температура, в присутствии подходящего средства для кислотного сочетания, такого как, например, 1-[бис(диметиламино)метилен]-1H-бензотриазолия гексафторфосфат-(1-)3-оксид (HBTU) или 1-[бис(диметиламино)метилен]-1H-1,2,3-триазоло[4,5-b]пиридиний-3-оксида гексафторфосфат (HATU), в присутствии подходящего основания, такого как, например, N-этил-N-(1-метилэтил)-2-пропанамин (DIPEA), в подходящем растворителе, таком как N, N-диметилформамид (DMF).
СХЕМА 15
В целом, соединения формулы (I), где R2 ограничен H или Me, и Y1 ограничен N и C-CN, называемые в данном документе соединениями формулы (Iv), можно получать в соответствии со следующей реакционной схемой 15. На схеме 15 все переменные определены в соответствии с вышеуказанным или в соответствии с объемом настоящего изобретения.
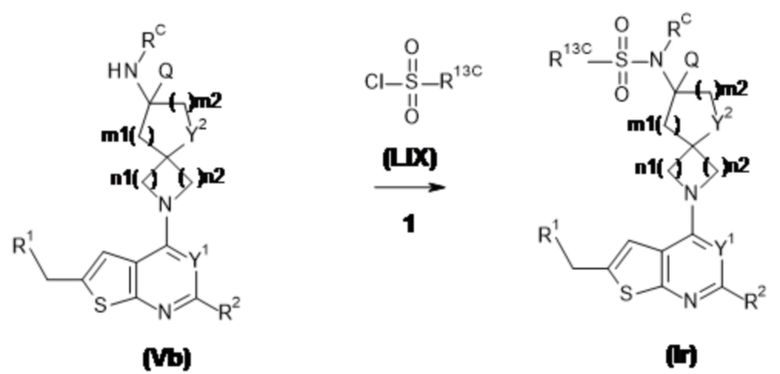
На схеме 15 применены следующие условия реакции:
1: при подходящей температуре, например, при комнатной температуре, в присутствии подходящего основания, такого как, например, карбонат калия или триэтиламин, в подходящем растворителе, таком как, например, ацетонитрил или DCM.
Специалисту в данной области техники будет очевидно, что промежуточное соединение (Vb) можно получать, следуя пути, подобному тому, который применялся для получения промежуточного соединения V и указан на схеме 1.
СХЕМА 16
В целом, соединения формулы (I), где R2 ограничен H или Me, и Y1 ограничен N и C-CN, называемые в данном документе соединениями формулы (Is), можно получать в соответствии со следующей реакционной схемой 16. На схеме 16 все переменные определены в соответствии с вышеуказанным или в соответствии с объемом настоящего изобретения.
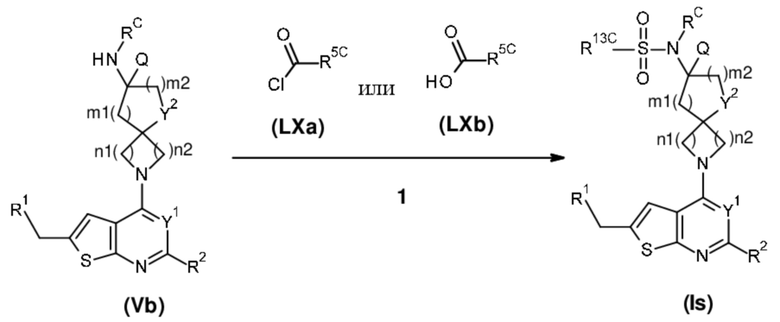
На схеме 16 применены следующие условия реакции:
1: в случае с (LXa) - при подходящей температуре, в присутствии подходящего основания, такого как, например, триэтиламин, в подходящем растворителе, таком как, например, DCM;
в случае (LXb) - при подходящей температуре, такой как, например, комнатная температура, в присутствии подходящего средства для реакции кислотного сочетания, такого как, например, 1-[бис(диметиламино)метилен]-1H-бензотриазолия гексафторфосфат-(1-)3-оксид (HBTU), или 1-[бис(диметиламино)метилен]-1H-1,2,3-триазоло[4,5-b]пиридиний-3-оксида гексафторфосфат (HATU), или N-(3-диметиламинопропил)-N′-этилкарбодиимида гидрохлорид (EDCI), необязательно в присутствии подходящего реагента, такого как, например, 1-гидроксибензотриазол, в присутствии подходящего основания, такого как, например, N-этил-N-(1-метилэтил)-2-пропанамин (DIPEA) или триэтиламин, в подходящем растворителе, таком как N, N-диметилформамид (DMF) или DCM.
Специалисту в данной области техники будет очевидно, что превращение, изображенное на схеме 15 и 16, может применяться к другим промежуточным соединениям, таким как, например, промежуточные соединения (LVII), изображенные на схеме 13.
Схемы 17-19 относятся, в частности, к соединениям/промежуточным соединениям, где переменная "A" представляет собой
-CR15aR15b-.
СХЕМА 17
В целом, соединения формулы (I), где Q, R15a и R15b ограничены H, и Y1 ограничен N и C-CN, называемые в данном документе соединениями формулы (It), можно получать в соответствии со следующей реакционной схемой 17. На схеме 17 все переменные определены в соответствии с вышеуказанным или в соответствии с объемом настоящего изобретения.
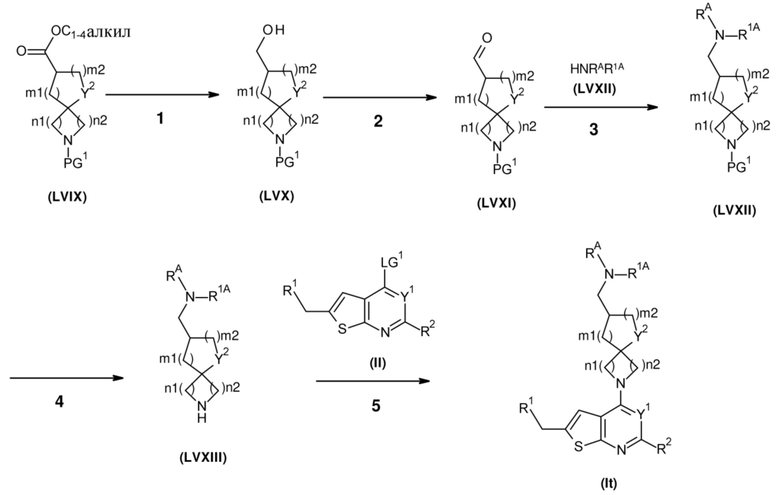
На схеме 17 применены следующие условия реакции:
1: при подходящей температуре, такой как в диапазоне от 0°C до комнатной температуры, в присутствии подходящего восстановителя, такого как, например, алюмогидрид лития, в подходящем растворителе, таком как, например, тетрагидрофуран;
2: при подходящей температуре, такой как, например, -78°C, в присутствии подходящих реагентов, таких как, например, оксалилхлорид, диметилсульфоксид, в присутствии подходящего основания, такого как, например, триэтиламин, в подходящем растворителе, таком как, например, дихлорметан;
3: при подходящей температуре, такой как, например, комнатная температура, в присутствии подходящего восстановителя, такого как, например, цианоборогидрид натрия, с подходящей кислотой, такой как, например, уксусная кислота, или без нее, в подходящем растворителе, таком как, например, метанол;
4: при подходящей температуре, такой как, например, комнатная температура, в присутствии подходящей кислоты, такой как, например, трифторуксусная кислота, в подходящем растворителе, таком как, например, дихлорметан или этилацетат;
5: при подходящей температуре, такой как в диапазоне от к. т. до 90°C, в присутствии подходящего основания, такого как, например, диизопропилэтиламин или триэтиламин, в подходящем растворителе, таком как, например, ацетонитрил, или изопропанол, или этанол (EtOH), или дихлорметан (DCM).
СХЕМА 18
В целом, соединения формулы (I), где R15a и R15b ограничены H, и Y1 ограничен N и C-CN, называемые в данном документе соединениями формулы (Iu), можно получать в соответствии со следующей реакционной схемой 18. На схеме 18 все переменные определены в соответствии с вышеуказанным или в соответствии с объемом настоящего изобретения.
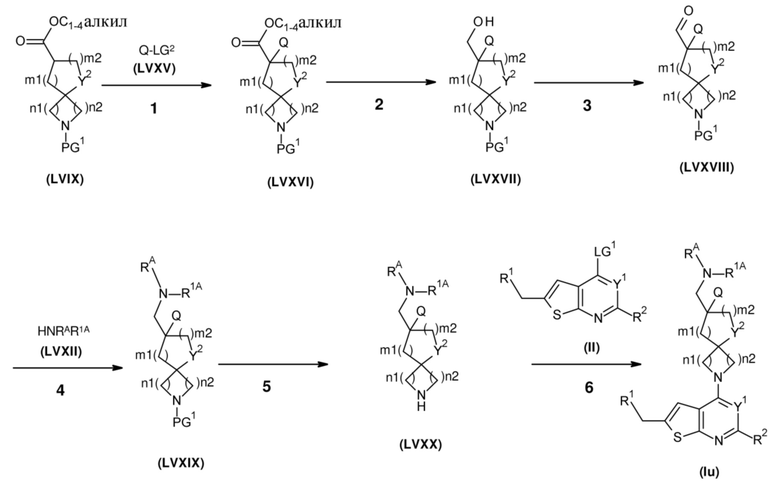
На схеме 18 применены следующие условия реакции:
1: при подходящей температуре в диапазоне от -78°C до комнатной температуры, в присутствии подходящего депротонирующего средства, такого как, например, гидрид натрия или диизопропиламид лития, в подходящем растворителе, таком как, например, тетрагидрофуран;
2: при подходящей температуре, такой как в диапазоне от 0°C до комнатной температуры, в присутствии подходящего восстановителя, такого как, например, алюмогидрид лития, в подходящем растворителе, таком как, например, тетрагидрофуран;
3: при подходящей температуре, такой как, например, -78°C, в присутствии подходящих реагентов, таких как, например, оксалилхлорид, диметилсульфоксид, в присутствии подходящего основания, такого как, например, триэтиламин, в подходящем растворителе, таком как, например, дихлорметан;
4: при подходящей температуре, такой как, например, комнатная температура, в присутствии подходящего восстановителя, такого как, например, цианоборогидрид натрия, с подходящей кислотой, такой как, например, уксусная кислота, или без нее, в подходящем растворителе, таком как, например, метанол;
5: при подходящей температуре, такой как, например, комнатная температура, в присутствии подходящей кислоты, такой как, например, трифторуксусная кислота, в подходящем растворителе, таком как, например, дихлорметан или этилацетат;
6: при подходящей температуре, такой как в диапазоне от к.т. до 90°C, в присутствии подходящего основания, такого как, например, диизопропилэтиламин или триэтиламин, в подходящем растворителе, таком как, например, ацетонитрил, или изопропанол, или этанол (EtOH), или дихлорметан (DCM).
СХЕМА 19
В целом, соединения формулы (I), где Q ограничен H, и Y1 ограничен N и C-CN, называемые в данном документе соединениями формулы (Iv), можно получать в соответствии со следующей реакционной схемой 19. На схеме 19 галоген представляет собой подходящий галоген, LG3 представляет собой подходящую уходящую группу, такую как, например, метансульфонил или 4-толуолсульфонил, и все другие переменные определены в соответствии с вышеуказанным или в соответствии с объемом настоящего изобретения,
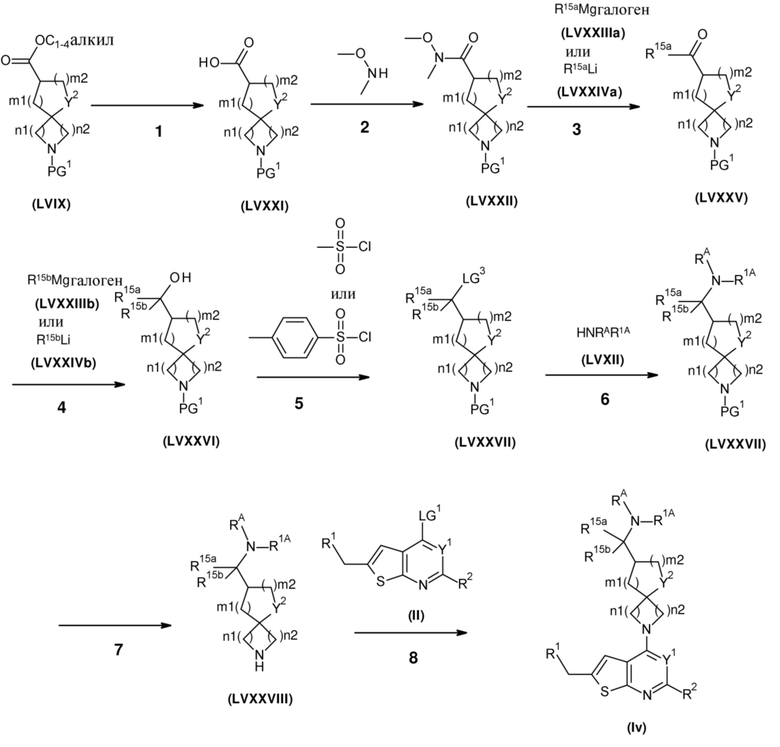
На схеме 19 применены следующие условия реакции:
1: при подходящей температуре в диапазоне, например, от комнатной температуры до 60°C, в присутствии подходящего основания, такого как, например, гидроксид лития или гидроксид натрия; в подходящем растворителе, таком как, например, смесь тетрагидрофурана и воды;
2: при подходящей температуре, такой как, например, комнатная температура, в присутствии подходящего средства для кислотного сочетания, такого как, например, 1-[бис(диметиламино)метилен]-1H-бензотриазолия гексафторфосфат-(1-)3-оксид (HBTU) или 1-[бис(диметиламино)метилен]-1H-1,2,3-триазоло[4,5-b]пиридиний-3-оксида гексафторфосфат (HATU), в присутствии подходящего основания, такого как, например, N-этил-N-(1-метилэтил)-2-пропанамин (DIPEA), в подходящем растворителе, таком как N, N-диметилформамид (DMF);
3: при подходящей температуре, такой как, например, -78°C, 0°C или комнатная температура, в подходящем растворителе, таком как, например, тетрагидрофуран;
4: при подходящей температуре, такой как, например, -78°C, 0°C или комнатная температура, в подходящем растворителе, таком как, например, тетрагидрофуран;
5: при подходящей температуре, такой как, например, комнатная температура, в присутствии подходящего основания, такого как, например, триэтиламин или диизопропиламин, в подходящем растворителе, таком как, например, тетрагидрофуран или дихлорметан;
6: при подходящей температуре, такой как, например, комнатная температура, в присутствии подходящего восстановителя, такого как, например, цианоборогидрид натрия, с подходящей кислотой, такой как, например, уксусная кислота, или без нее, в подходящем растворителе, таком как, например, метанол;
7: при подходящей температуре, такой как, например, комнатная температура, в присутствии подходящей кислоты, такой как, например, трифторуксусная кислота, в подходящем растворителе, таком как, например, дихлорметан или этилацетат;
8: при подходящей температуре, такой как в диапазоне от к. т. до 90°C, в присутствии подходящего основания, такого как, например, диизопропилэтиламин или триэтиламин, в подходящем растворителе, таком как, например, ацетонитрил, или изопропанол, или этанол (EtOH), или дихлорметан (DCM).
Специалисту в данной области техники будет очевидно, что химия схем 1-16 может также применяться в отношении промежуточных соединений, изображенных на схемах 17-19.
Следует понимать, что если имеются соответствующие функциональные группы, соединения различных формул или какие-либо промежуточные соединения, используемые для их получения, можно дополнительно дериватизировать с помощью одного или нескольких стандартных способов синтеза с применением реакций конденсации, замещения, окисления, восстановления или расщепления. Определенные подходы относительно замещения включают традиционные процедуры алкилирования, арилирования, гетероарилирования, ацилирования, сульфонилирования, галогенирования, нитрования, формилирования и сочетания.
Соединения формулы (I) можно синтезировать в виде рацемических смесей энантиомеров, которые можно отделить друг от друга, следуя известным из уровня техники процедурам разделения. Рацемические соединения формулы (I), содержащие основный атом азота, можно превращать в соответствующие формы диастереомерных солей посредством реакции с подходящей хиральной кислотой. Указанные формы диастереомерных солей затем разделяют, например, с помощью селективной или фракционной кристаллизации, а энантиомеры выделяют оттуда с помощью щелочи. Альтернативный способ разделения энантиомерных форм соединений формулы (I) включает жидкостную хроматографию с применением хиральной неподвижной фазы. Указанные чистые стереохимически изомерные формы также можно получать из соответствующих чистых стереохимически изомерных форм соответствующих исходных веществ при условии, что реакция протекает стереоспецифически.
При получении соединений по настоящему изобретению может быть необходимым обеспечение защиты удаленной функциональной группы (например, первичного или вторичного амина) промежуточных соединений. Потребность в обеспечении такой защиты будет изменяться в зависимости от природы отдельной функциональной группы и от условий способов получения. Подходящие защитные группы для аминогруппы (NH-Pg) включают ацетил, трифторацетил, трет-бутоксикарбонил (Boc), бензилоксикарбонил (CBz) и 9-флуоренилметиленоксикарбонил (Fmoc). Необходимость такой защиты легко определит специалист в данной области техники. Для общего описания защитных групп и их применения см. T.W. Greene and P.G.M. Wuts, Protective Groups in Organic Synthesis, 4th ed., Wiley, Hoboken, New Jersey, 2007.
Фармакология
Было обнаружено, что соединения по настоящему изобретению блокируют взаимодействие менина с белками MLL и онкогенными белками слияния на основе MLL. Следовательно, соединения в соответствии с настоящим изобретением и фармацевтические композиции, содержащие данные соединения, могут быть пригодными для лечения или предупреждения, в частности лечения, заболеваний, таких как рак, миелодиспластический синдром (MDS) и диабет.
В частности, соединения в соответствии с настоящим изобретением и фармацевтические композиции на их основе могут быть пригодными в лечении или предупреждении рака. В соответствии с одним вариантом осуществления виды рака, для которых лечение с помощью ингибиторов менин-MLL по настоящему изобретению может быть целесообразным, включают виды лейкоза, миелому или рак, представляющий собой солидную опухоль (например, рак предстательной железы, рак легкого, рак молочной железы, рак поджелудочной железы, рак толстой кишки, рак печени, меланому и глиобластому и т.д.). В некоторых вариантах осуществления виды лейкоза включают виды острого лейкоза, виды хронического лейкоза, виды миелоидного лейкоза, виды миелогенного лейкоза, виды лимфобластного лейкоза, виды лимфоцитарного лейкоза, виды острого миелогенного лейкоза (AML), виды хронического миелогенного лейкоза (CML), виды острого лимфобластного лейкоза (ALL), виды хронического лимфоцитарного лейкоза (CLL), виды T-клеточного пролимфоцитарного лейкоза (T-PLL), лейкоз из больших гранулярных лимфоцитов, волосатоклеточный лейкоз (HCL), виды лейкоза с перестройкой MLL, виды лейкоза, ассоциированные с MLL-PTD, виды лейкоза с амплификацией MLL, виды MLL-положительного лейкоза, виды лейкоза, характеризующиеся профилями экспрессии генов HOX/MEIS1 и т.д.
Следовательно, настоящее изобретение относится к соединениям формулы (I), их таутомерам и стереоизомерным формам, а также к их фармацевтически приемлемым солям и сольватам для применения в качестве лекарственного препарата.
Настоящее изобретение также относится к применению соединения формулы (I), его таутомера или стереоизомерной формы, или его фармацевтически приемлемой соли или сольвата, или фармацевтической композиции в соответствии с настоящим изобретением для изготовления лекарственного препарата.
Настоящее изобретение также относится к соединению формулы (I), его таутомеру или стереоизомерной форме, или его фармацевтически приемлемой соли или сольвату, или к фармацевтической композиции в соответствии с настоящим изобретением для применения в лечении, предупреждении, уменьшении интенсивности, контроле или снижении риска развития нарушений, ассоциированных с взаимодействием менина с белками MLL и онкогенными белками слияния на основе MLL, у млекопитающего, в том числе у человека, лечение или предупреждение которых зависит от блокирования взаимодействия менина с белками MLL и онкогенными белками слияния на основе MLL или облегчается им.
Также, настоящее изобретение относится к применению соединения формулы (I), его таутомера или стереоизомерной формы, или его фармацевтически приемлемой соли или сольвата, или фармацевтической композиции в соответствии с настоящим изобретением для изготовления лекарственного препарата для лечения, предупреждения, уменьшения интенсивности, контроля или снижения риска развития нарушений, ассоциированных с взаимодействием менина с белками MLL и онкогенных белков слияния на основе MLL, у млекопитающего, в том числе человека, лечение или предупреждение которых зависит от блокирования взаимодействия менина с белками MLL и онкогенными белками на основе MLL или облегчается им.
Настоящее изобретение также относится к соединению формулы (I), его таутомеру или стереоизомерной форме или к его фармацевтически приемлемой соли или сольвату для применения в лечении или предупреждении какого-либо из заболеваний, упомянутых в данном документе выше.
Настоящее изобретение также относится к соединению формулы (I), его таутомеру или стереоизомерной форме или к его фармацевтически приемлемой соли или сольвату для применения в лечении или предупреждении какого-либо из заболеваний, упомянутых в данном документе выше.
Настоящее изобретение также относится к применению соединения формулы (I), его таутомера или стереоизомерной формы или его фармацевтически приемлемой соли или сольвата для изготовления лекарственного препарата для лечения или предупреждения какого-либо из болезненных состояний, упомянутых в данном документе выше.
Соединения по настоящему изобретению можно вводить млекопитающим, предпочтительно людям, для лечения или предупреждения любого из заболеваний, упомянутых выше в данном документе.
С учетом применимости соединений формулы (I), их таутомеров и стереоизомерных форм и их фармацевтически приемлемых солей и сольватов, предусмотрен способ лечения теплокровных животных, в том числе людей, страдающих каким-либо из заболеваний, упомянутых выше в данном документе.
Указанный способ включает введение, т.е. системное или местное введение, предпочтительно пероральное введение, терапевтически эффективного количества соединения формулы (I), его таутомера или стереоизомерной формы или его фармацевтически приемлемой соли или сольвата теплокровным животным, в том числе людям.
Вследствие этого настоящее изобретение также относится к способу лечения или предупреждения какого-либо из заболеваний, упомянутых в данном документе выше, включающему введение терапевтически эффективного количества соединения в соответствии с настоящим изобретением нуждающемуся в этом пациенту.
Специалисту в данной области техники будет понятно, что терапевтически эффективным количеством соединений по настоящему изобретению является количество, достаточное для обладания терапевтической активностью, и что это количество изменяется inter alias в зависимости от типа заболевания, концентрации соединения в терапевтическом составе и состояния пациента. Как правило, количество соединения по настоящему изобретению, подлежащего введению в качестве терапевтического средства для лечения нарушений, указанных в данном документе, будет определяться в каждом конкретном случае лечащим врачом.
Специалисты в области лечения таких заболеваний смогут определить эффективное терапевтическое суточное количество из результатов испытаний, представленных ниже в данном документе. Эффективное суточное терапевтическое количество будет составлять от приблизительно 0,005 мг/кг до 100 мг/кг, в частности, от 0,005 мг/кг до 50 мг/кг, в частности, от 0,01 мг/кг до 50 мг/кг веса тела, более конкретно от 0,01 мг/кг до 25 мг/кг веса тела, предпочтительно от приблизительно 0,01 мг/кг до приблизительно 15 мг/кг, более предпочтительно от приблизительно 0,01 мг/кг до приблизительно 10 мг/кг, еще более предпочтительно от приблизительно 0,01 мг/кг до приблизительно 1 мг/кг, наиболее предпочтительно от приблизительно 0,05 мг/кг до приблизительно 1 мг/кг веса тела. Конкретное эффективное суточное терапевтическое количество может составлять 1 мг/кг веса тела, 2 мг/кг веса тела, 4 мг/кг веса тела или 8 мг/кг веса тела. Количество соединения в соответствии с настоящим изобретением, также называемого в данном документе как активный ингредиент, которое необходимо для достижения терапевтического эффекта, может изменяться в каждом конкретном случае, например, для определенного соединения, пути введения, возраста и состояния реципиента, а также конкретного нарушения или заболевания, подлежащего лечению. Способ лечения может также включать введение активного ингредиента согласно схеме от одного до четырех введений в сутки. В данных способах лечения соединения в соответствии с настоящим изобретением предпочтительно составляют перед введением. Как описано в данном документе ниже, подходящие фармацевтические составы получают с помощью известных процедур с применением хорошо известных и общедоступных ингредиентов.
В настоящем изобретении также предусмотрены композиции для предупреждения или лечения нарушений, указанных в настоящем документе. Указанные композиции содержат терапевтически эффективное количество соединения формулы (I), его таутомера или стереоизомерной формы или его фармацевтически приемлемой соли или сольвата и фармацевтически приемлемый носитель или разбавитель.
Хотя активный ингредиент можно вводить отдельно, предпочтительно, если он представлен в виде фармацевтической композиции. Следовательно, в настоящем изобретении дополнительно предусмотрена фармацевтическая композиция, содержащая соединение в соответствии с настоящим изобретением вместе с фармацевтически приемлемым носителем или разбавителем. Носитель или разбавитель должны быть "приемлемыми" с точки зрения совместимости с остальными ингредиентами композиции и не должны являться вредными для получающих их пациентов.
Фармацевтические композиции по настоящему изобретению можно получать любыми способами, хорошо известными в области фармации, например с помощью таких способов, как описанные в Gennaro et al. Remington’s Pharmaceutical Sciences (18th ed., Mack Publishing Company, 1990, см. в особенности Part 8: Pharmaceutical preparations and their Manufacture). Терапевтически эффективное количество конкретного соединения, в форме основания или в форме соли, в качестве активного ингредиента объединяют в однородную смесь с фармацевтически приемлемым носителем, который может принимать ряд форм в зависимости от формы препарата, необходимого для введения. Желательно, чтобы данные фармацевтические композиции находились в стандартной лекарственной форме, предпочтительно подходящей для системного введения, такого как пероральное, чрескожное или парентеральное введение; или для местного введения, как, например, с помощью ингаляции, назального спрея, глазных капель или с помощью крема, геля, шампуня и т.п. Например, при получении композиций в виде лекарственной формы для перорального введения можно использовать любые обычные фармацевтические среды, такие как, например, вода, гликоли, масла, спирты и т.п., в случае жидких препаратов для перорального введения, таких как суспензии, сиропы, настойки и растворы; или твердые носители, такие как крахмалы, сахара, каолин, смазывающие вещества, связующие вещества, разрыхлители и т.п., в случае порошков, пилюль, капсул и таблеток. Благодаря своей простоте введения таблетки и капсулы представляют собой наиболее преимущественные стандартные лекарственные формы для перорального введения, в случае которых, несомненно, используют твердые фармацевтические носители. В случае композиций для парентерального введения носитель обычно будет содержать стерильную воду, по меньшей мере в значительной степени, хотя может включать и другие ингредиенты, например, для улучшения растворимости. Например, можно получать растворы для инъекций, в которых носитель содержит физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Также можно получать суспензии для инъекций, в случае которых можно использовать соответствующие жидкие носители, суспендирующие средства и т.п. В композициях, подходящих для чрескожного введения, носитель необязательно содержит средство, улучшающее проникновение, и/или подходящее смачивающее средство, необязательно в комбинации с подходящими добавками любой природы в минимальных пропорциях, при этом добавки не оказывают никаких существенных вредных воздействий на кожу. Указанные добавки могут облегчать введение в кожу и/или могут быть полезными для получения требуемых композиций. Данные композиции можно вводить различными путями, например, посредством трансдермального пластыря, путем точечного нанесения или в виде мази.
Особенно преимущественно для простоты введения и однородности дозирования составлять вышеупомянутые фармацевтические композиции в виде стандартной лекарственной формы. Стандартные лекарственные формы в контексте данного описания и формулы изобретения относятся к физически дискретным единицам, подходящим в качестве единиц дозирования, при этом каждая единица содержит заранее определенное количество активного ингредиента, рассчитанное для получения необходимого терапевтического эффекта, совместно с требуемым фармацевтическим носителем. Примерами таких стандартных лекарственных форм являются таблетки (в том числе делимые таблетки или таблетки, покрытые оболочкой), капсулы, пилюли, пакеты с порошкообразным продуктом, пластинки, растворы или суспензии для инъекций, чайные ложки с верхом, столовые ложки с верхом и т.п., а также их отдельные кратные количества.
Соединения по настоящему изобретению можно применять для системного введения, такого как пероральное, чрескожное или парентеральное введение; или для местного введения, как, например, с помощью ингаляции, назального спрея, глазных капель или с помощью крема, геля, шампуня или т.п. Соединения предпочтительно вводят перорально. Точная доза и частота введения зависят от конкретного применяемого соединения формулы (I), конкретного состояния, подлежащего лечению, тяжести состояния, подлежащего лечению, возраста, массы, пола, степени тяжести нарушения и общего физического состояния конкретного пациента, а также от другого медикаментозного лечения, которое индивидуум может получать, что хорошо известно специалистам в данной области. Более того, очевидно, что указанное эффективное суточное количество может быть снижено или увеличено в зависимости от реакции подвергаемого лечению субъекта и/или в зависимости от оценки врача, назначающего соединения по настоящему изобретению.
Соединения по настоящему изобретению можно вводить сами по себе или в комбинации с одним или несколькими дополнительными терапевтическими средствами. Комбинированная терапия включает введение единого дозированного фармацевтического состава, который содержит соединение в соответствии с настоящим изобретением и одно или несколько дополнительных терапевтических средств, а также введение соединения в соответствии с настоящим изобретением и каждого дополнительного терапевтического средства в своем собственном отдельном дозированном фармацевтическом составе. Например, соединение в соответствии с настоящим изобретением и терапевтическое средство можно вводить пациенту вместе, в единой пероральной дозированной композиции, такой как таблетка или капсула, или каждое средство можно вводить по отдельности в дозированных составах для перорального введения.
Следовательно, вариант осуществления настоящего изобретения относится к продукту, содержащему в качестве первого активного ингредиента соединение в соответствии с настоящим изобретением, а в качестве дополнительного активного ингредиента - одно или несколько противораковых средств, в виде комбинированного препарата для одновременного, раздельного или последовательного применения в лечении пациентов, страдающих раком.
Одно или несколько других медицинских средств и соединение в соответствии с настоящим изобретением можно вводить одновременно (например, в отдельных или единичных композициях) или последовательно в произвольном порядке. В последнем случае, два или более соединений будут введены на протяжении периода и в количестве и способом, которые являются достаточными для гарантирования того, что достигнут преимущественный или синергический эффект. Следует понимать, что предпочтительный способ и порядок введения и соответствующие величины доз и режимы для каждого компонента комбинации будут зависеть от конкретного другого медицинского средства и соединения по настоящему изобретению, подлежащих введению, их пути введения, конкретного состояния, в частности опухоли, подлежащего лечению, и конкретного хозяина, подлежащего лечению. Оптимальный способ и порядок введения, а также величины доз и схема могут быть легко определены специалистами в данной области техники с применением стандартных способов и с учетом информации, изложенной в данном документе.
Весовое соотношение соединения в соответствии с настоящим изобретением и одного противоракового средства или нескольких других противораковых средств, вводимых в виде комбинации, может быть определено специалистом в данной области техники. Указанное соотношение, точная дозировка и частота введения зависят от конкретного применяемого соединения в соответствии с настоящим изобретением и другого противоракового(противораковых) средства(средств), конкретного состояния, подлежащего лечению, тяжести состояния, подлежащего лечению, возраста, массы тела, пола, рациона, времени введения и общего физического состояния конкретного пациента, способа введения, а также от другого медикаментозного лечения, которые индивидуум может получать, что хорошо известно специалистам в данной области. Более того, очевидно, что эффективное суточное количество можно уменьшать или увеличивать в зависимости от реакции субъекта, подвергаемого лечению, и/или в зависимости от оценки лечащего врача, назначающего соединения по настоящему изобретению. Конкретное весовое соотношение для данного соединения формулы (I) и другого противоракового средства может находиться в диапазоне от 1/10 до 10/1, более конкретно, от 1/5 до 5/1, еще более конкретно, от 1/3 до 3/1.
Следующие примеры дополнительно иллюстрируют настоящее изобретение.
Примеры
Некоторые способы получения соединений по настоящему изобретению проиллюстрированы в следующих примерах. Если не указано иное, все исходные вещества получали от коммерческих поставщиков и применяли без дополнительной очистки, или, в качестве альтернативы, они могут быть синтезированы специалистом в данной области техники с применением общеизвестных способов.
Далее в данном документе термины: "ACN", "MeCN" или "AcCN" означает ацетонитрил, "DCM" означает дихлорметан, "DEA" означает диэтиламин, "DIPEA" или "DIEA" означает N, N-диизопропилэтиламин, "ч" означает час (часы), "мин" означает минуту(минуты), "DMF" означает диметилформамид, "TEA" или "Et3N" означает триэтиламин, "EtOAc" или "EA" означает этилацетат, "EtOH" означает этанол, "HPLC" означает высокоэффективную жидкостную хроматографию, "преп. HPLC" означает препаративную HPLC, "преп. TLC" означает препаративную TLC, "iPrOH", "IPA", "iPA", "i-PrOH" или "iPrOH" означает изопропиловый спирт, "LC/MS" означает жидкостную хроматографию/масс-спектрометрию, "MeOH" означает метанол, "MeNH2" означает метиламин, "ЯМР" означает ядерный магнитный резонанс, "к.т." или "К.Т." означает комнатную температуру, "SFC" означает сверхкритическую флюидную хроматографию, "AcOH" означает уксусную кислоту, "BOC" или "Boc" означает трет-бутилоксикарбонил, "EDCI" или "EDCi" означает 1-(3-диметиламинопропил)-3-этилкарбодиимида гидрохлорид, "экв." означает эквивалент(эквиваленты), "HOBT" или "HOBt" означает N-гидроксибензотриазола моногидрат, "iPrNH2" означает изопропиламин, "PE" означает петролейный эфир, "NaBH(OAc)3" означает триацетоксиборогидрид натрия, "Rt" означает время удерживания, "SFC" означает сверхкритическую флюидную хроматографию, "T" означает температуру, "FA" означает муравьиную кислоту, "TFA" означает трифторуксусную кислоту, "TFAA" означает трифторуксусный ангидрид, "THF" означает тетрагидрофуран, "BrettPhos" означает 2-(дициклогексилфосфино)-3,6-диметокси-2′,4′,6′-триизопропил-1,1′-бифенил, "tBuONa" или "t-BuONa" означает трет-бутоксид натрия, "Ts" означает тозил; "Pd2(dba)3" означает трис(дибензилиденацетон)дипалладий(0), "TLC" означает тонкослойную хроматографию, "преп. TLC" означает препаративную TLC, "DCE" означает дихлорэтан, "Et2O" означает диэтиловый эфир, "HBTU" означает 1-[бис(диметиламино)метилен]-1H-бензотриазолия гексафторфосфат-(1-)3-оксид, "SFC" означает сверхкритическую флюидную хроматографию, "(Boc)2O" означает ангидрид трет-бутоксикарбонила, "ee" означает энантиомерный избыток, "Pd2(dba)3" означает трис(дибензилиденацетон)дипалладий, "Pd(dppf)Cl2" означает [1,1′-бис(дифенилфосфино)ферроцен]дихлорпалладий(II), "Pd(OAc)2" означает ацетат палладия(II), "BINAP" означает [1,1'-бинафталин]-2,2'-диилбис[дифенилфосфин] (рацемический),
"Ti(i-PrO)4" означает изопропоксид титана, "DMA" означает N, N-диметилацетамид, "18-краун-6" означает 1,4,7,10,13,16-гексаоксациклооктадекан, "CDI" означает 1,1'-карбонилдиимидазол, "HATU" означает 1-[бис(диметиламино)метилен]-1H-[1,2,3]триазоло[4,5-b]пиридин-1-ий-3-оксида гексафторфосфат, "DMSO" означает диметилсульфоксид, "FCC" означает колоночную флэш-хроматографию, "DBU" означает 1,8-диазабицикло[5.4.0]ундец-7-ен, "NMP" означает 1-метил-2-пирролидинон, "MW" означает обработку микроволнами или молекулярную массу (ясно из контекста), "T3P" означает пропилфосфоновый ангидрид, "DME" означает 1,2-диметоксиэтан, "перйодинан Десса-Мартина" или "DMP" означает 1,1,1-триацетокси-1,1-дигидро-1,2-бензйодоксол-3(1H)-он, "BPR" означает противодавление, "DIBAL-H" означает гидрид диизобутилалюминия, "фунты/кв. дюйм" означает фунт-силу на квадратный дюйм, "об./об." означает отношение объема к объему, "конц." означает концентрированный, "Ph3P" означает трифенилфосфин, "DEAD" означает диэтилазодикарбоксилат, "DEGDME" означает диметиловый простой эфир диэтиленгликоля, "BOP" означает бензотриазол-1-ил-N-окси-трис(пирролидино)фосфония гексафторфосфат, "Hep" означает н-гептан, "MsCl" означает мезилхлорид, "Zn(OAc)2⋅2H2O" означает дигидрат ацетата цинка, "TMSCN" означает триметилсилилцианид, "сложный эфир Ганча" означает диэтил-1,4-дигидро-2,6-диметил-3,5-пиридиндикарбоксилат.
Специалисту в данной области техники будет понятно, что соединения, синтезируемые с использованием указанных протоколов, могут существовать в виде сольвата, например, гидрата, и/или могут содержать остаточный растворитель или незначительные примеси. Соединения, выделенные в форме соли, могут иметь целочисленную стехиометрию, т.е. моно- или дисоли, или промежуточную стехиометрию. Если промежуточное соединение или соединение в экспериментальной части ниже указано как "соль HCl", "формиатная соль" или "соль TFA" без указания числа эквивалентов HCl, формиата или TFA, это означает, что число эквивалентов HCl, формиата или TFA не определяли.
Стереохимическую конфигурацию для центров в некоторых соединениях можно обозначать "R" или "S", если смесь (смеси) разделяли; для некоторых соединений стереохимическая конфигурация при указанных центрах была обозначена как "*R" (элюированное первым из колонки в случае описанных в протоколе синтеза условий для колонки, и если присутствует или указан только один стереоцентр) или "*S" (элюированное вторым из колонки в случае описанных в протоколе синтеза условий для колонки, и если присутствует или указан только один стереоцентр), если абсолютная стереохимия не определена (даже если связи нарисованы стереоспецифично), хотя соединение само по себе было выделено в виде одного стереоизомера и является энантиомерно чистым.
Например, будет понятно, что соединение 46
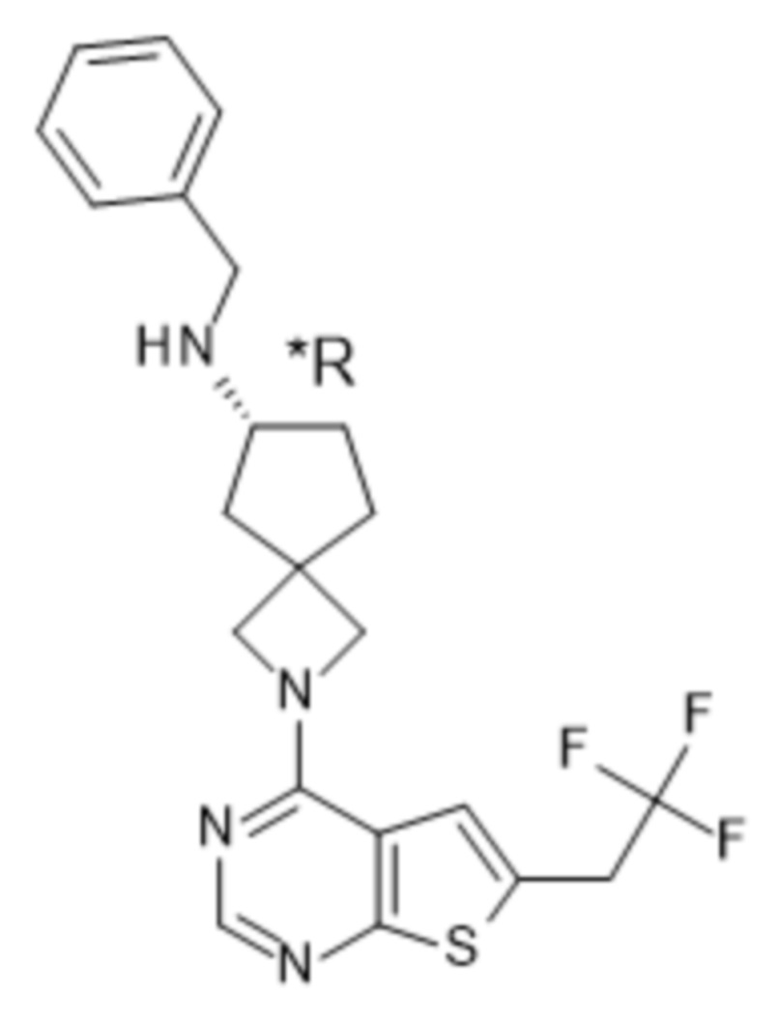 , представляет собой
, представляет собой
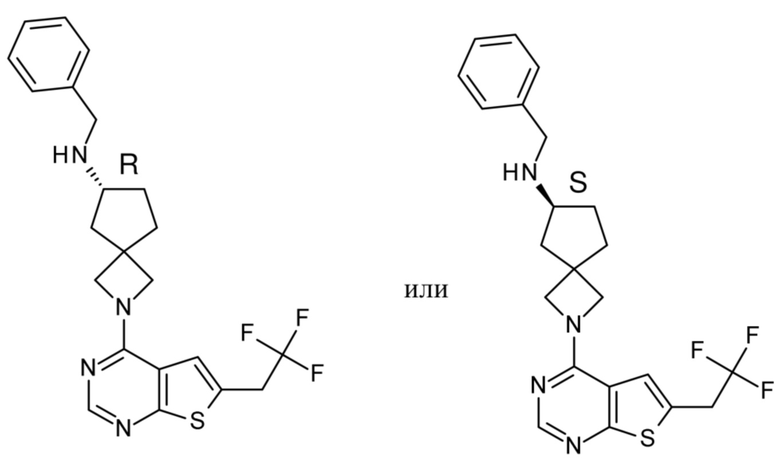 .
.
Для соединений, где стереохимическая конфигурация двух стереоцентров указана с помощью * (например, *R или *S), абсолютная стереохимия стереоцентров не определена (даже если связи нарисованы стереоспецифично), хотя соединение само по себе было выделено в виде одного стереоизомера и является энантиомерно чистым. В данном случае конфигурация первого стереоцентра не зависит от конфигурации второго стереоцентра в том же соединении.
Например, для соединения 3,
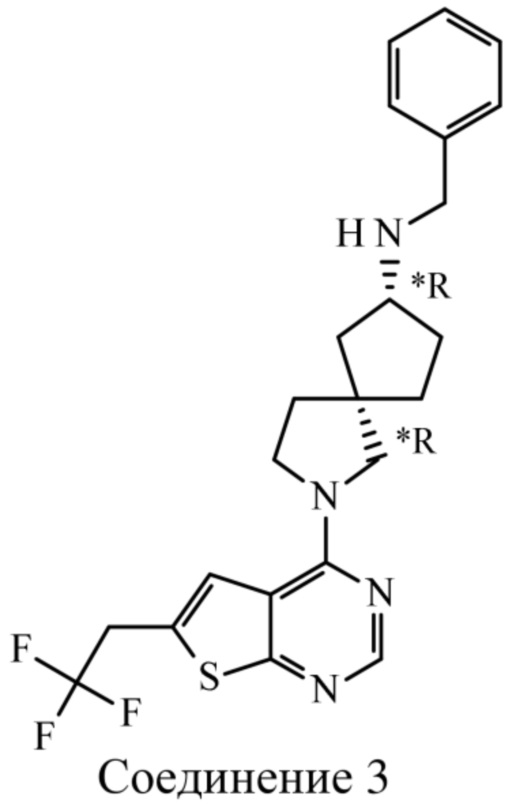
это означает, что соединение представляет собой
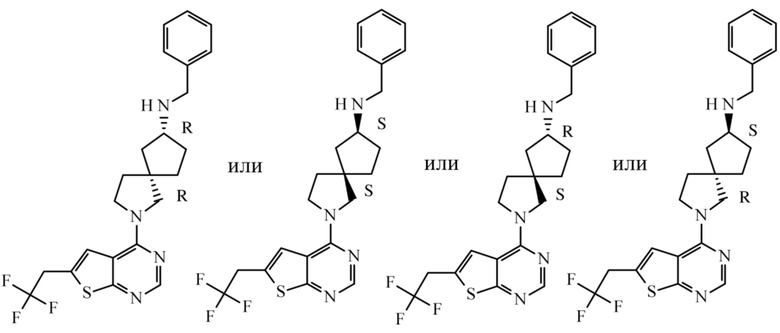
Как указано выше, заместители при двухвалентных циклических насыщенных или частично насыщенных радикалах могут находиться либо в цис-, либо в транс-конфигурации; например, если соединение содержит двузамещенную циклоалкильную группу, то заместители могут находиться в цис- или транс-конфигурации.
Для некоторых соединений формулы (I) кольцо, содержащее Y2, представляет собой циклобутил (Y2 представляет собой CH2, m1 равняется 1, m2 равняется 0) или циклогексил (Y2 представляет собой CH2, m1 равняется 2, m2 равняется 1). Стереохимическая конфигурация спиро-фрагмента такого соединения может быть указана как "цис или транс" либо "транс или цис". Это означает, что абсолютная стереохимическая конфигурация спиро-фрагмента не определена, хотя соединение само по себе было выделено в виде одного изомера.
Например, соединение ниже
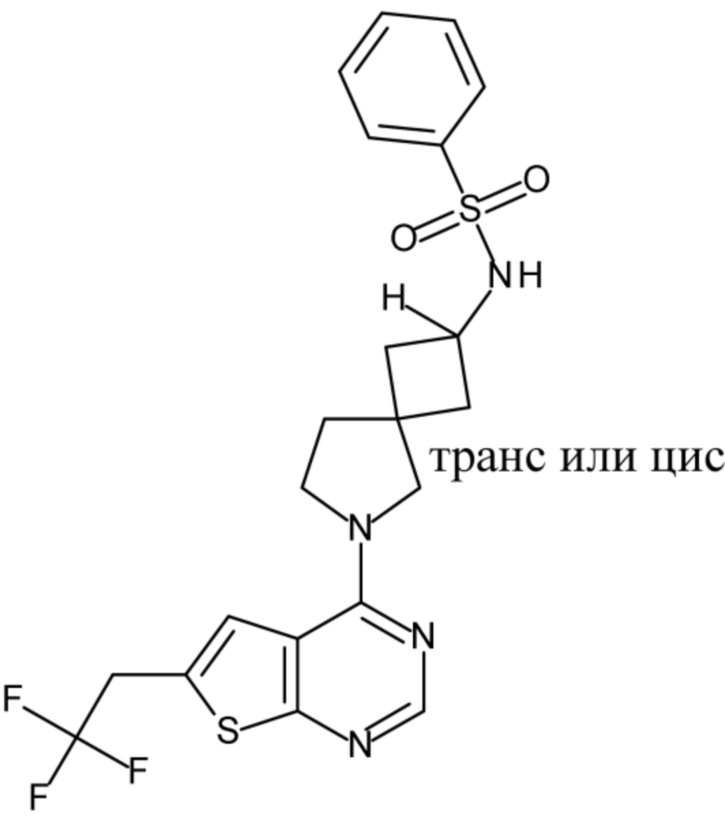 , представляет собой
, представляет собой
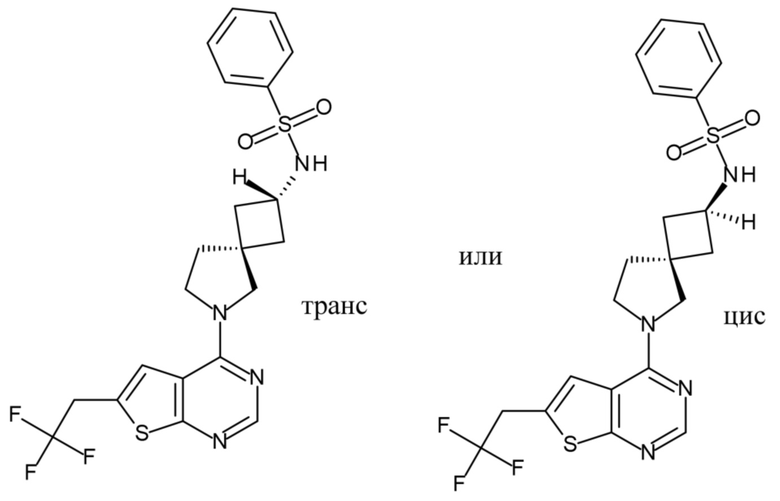 .
.
Абзацы выше про стереохимические конфигурации также применимы к промежуточным соединениям.
Термин "энантиомерно чистый", применяемый в данном документе, означает, что продукт содержит по меньшей мере 80% по весу одного энантиомера и 20% по весу или меньше другого энантиомера. Предпочтительно продукт содержит по меньшей мере 90% по весу одного энантиомера и 10% по весу или меньше другого энантиомера. В наиболее предпочтительном варианте осуществления термин "энантиомерно чистый" означает, что композиция содержит по меньшей мере 99% по весу одного энантиомера и 1% или меньше другого энантиомера.
Специалисту в данной области техники будет понятно, что, даже если это не указано явно в экспериментальных протоколах ниже, как правило, после очистки посредством колоночной хроматографии необходимые фракции собирали и растворитель выпаривали.
В случае если не указывается стереохимия для спироцикла, обозначаемого как L1, то это означает, что он представляет собой смесь стереоизомеров, если иное не указано или четко не следует из контекста.
Если стереоцентр обозначается "RS", то это означает, что получали рацемическую смесь (или рацемат) при указанном центре, если не указано иное. В контексте данной экспериментальной части "рацемическая смесь" (или "рацемат") означает смесь в соотношении, определенном с помощью способов аналитической хиральной HPLC, описанных в данном документе, как правило, в диапазоне соотношений от 40/60 до 60/40, предпочтительно в диапазоне соотношений от 45/55 до 55/45, более предпочтительно в диапазоне соотношений от 48/52 до 52/48, наиболее предпочтительно в соотношении 50/50.
Значения чистоты, указанные в экспериментальной части ниже, основаны на результате HPLC (254 нм или 214 нм).
A. Получение промежуточных соединений
Что касается промежуточных соединений, которые применяли на следующей стадии реакции в виде неочищенного или частично очищенного промежуточного соединения, в некоторых случаях для такого промежуточного соединения мольные количества не указаны на следующей стадии реакции, или, в качестве альтернативы, рассчитанные мольные количества или теоретические мольные количества для такого промежуточного соединения указаны в протоколах реакции, описанных ниже.
Пример A1
Получение промежуточного соединения 1
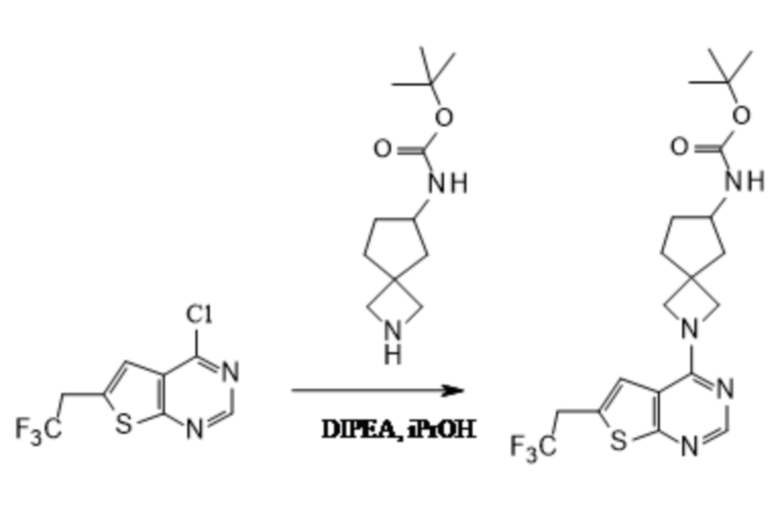
В раствор трет-бутил-(2-азаспиро[3.4]октан-6-ил)карбамата (2,70 г, 11,9 ммоль) в изопропаноле (20 мл) добавляли DIPEA (4,60 г, 35,8 ммоль) и 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (3,00 г, 11,9 ммоль). После перемешивания при комнатной температуре в течение 5 ч реакционную смесь разбавляли водой (50 мл) и экстрагировали с помощью EtOAc (50 мл × 3). Органическую фазу промывали солевым раствором, высушивали над Na2SO4 и концентрировали. Неочищенный продукт очищали с помощью колоночной хроматографии с получением промежуточного соединения 1 (4,30 г).
Получение промежуточного соединения 2
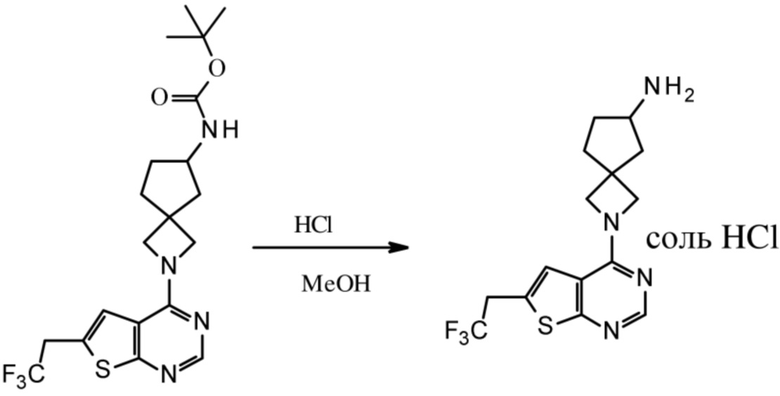
В раствор промежуточного соединения 1 (4,60 г, 10,4 ммоль) в MeOH (10 мл) добавляли конц. HCl (5,0 мл). После перемешивания при комнатной температуре в течение 1 ч смесь концентрировали с получением промежуточного соединения 2 (3,0 г) в виде соли HCl, которую применяли непосредственно на следующей стадии без дополнительной очистки.
Промежуточные соединения, приведенные в таблице ниже, получали с помощью протокола реакции, аналогичного описанному для получения промежуточного соединения 2, начиная с соответствующих исходных веществ.
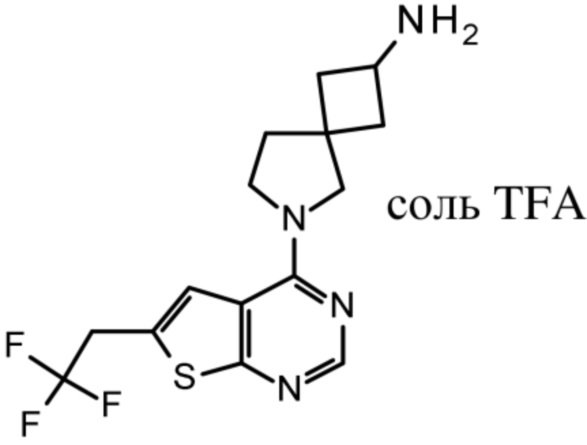
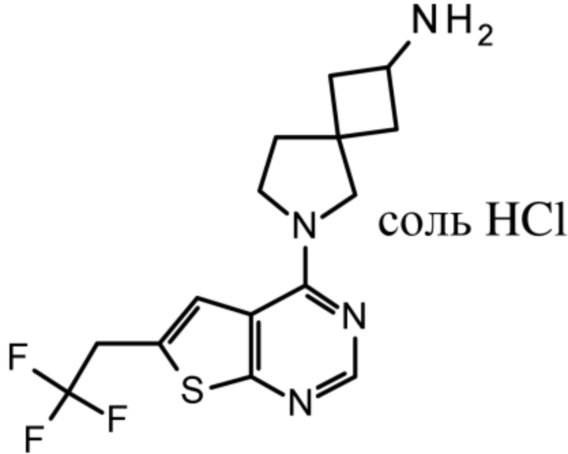
Пример A2
Получение промежуточного соединения 4
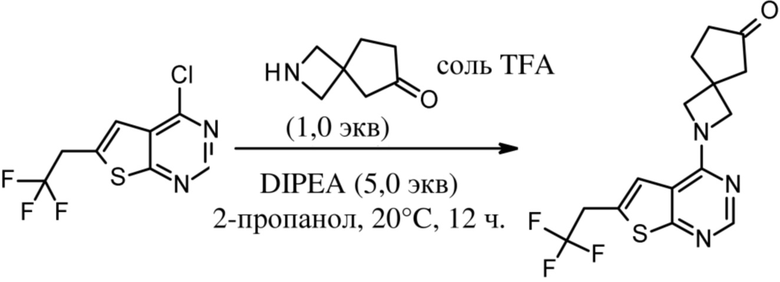
Добавляли трифторацетат 2-азаспиро[3.4]октан-6-она (промежуточное соединение 16b) (180 мг), DIPEA (486 мг, 3,76 ммоль) и 2-пропанол (5 мл) в круглодонную колбу объемом 50 мл. Реакционную смесь обрабатывали 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидином (190 мг, 0,752 ммоль), после чего перемешивали при 20°C в течение 12 ч Затем смесь выливали в воду (10 мл) и экстрагировали этилацетатом (10 мл × 2). Органические экстракты промывали солевым раствором (10 мл), высушивали над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении с получением неочищенного продукта, который очищали с помощью колоночной флэш-хроматографии (элюент: петролейный эфир:этилацетат, от 1:0 до 0:1) с получением промежуточного соединения 4 (140 мг, выход 49,1%) в виде желтого масла.
Промежуточное соединение, приведенное в таблице ниже, получали с помощью протокола реакции, аналогичного описанному выше для получения промежуточного соединения 4, начиная с соответствующих исходных веществ.
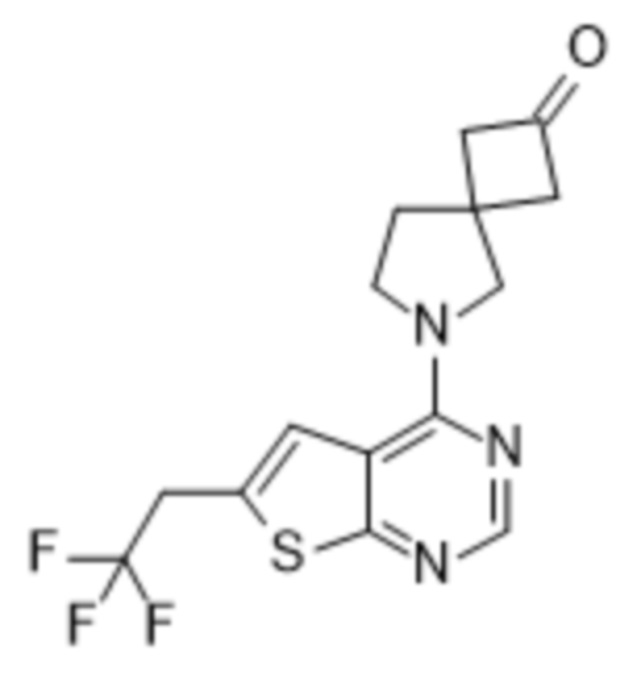
Альтернативное получение промежуточного соединения 4
Разбавляли промежуточное соединение 16 (215 мг; 1,33 ммоль), 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (269 мг; 1,07 ммоль) и DIPEA (516,5 мг; 4,0 ммоль) в изопропаноле (10 мл). Реакционную смесь перемешивали в течение 12 ч при 80°C. Растворитель удаляли с получением желтого твердого вещества, которое очищали с помощью колоночной хроматографии на силикагеле (градиент элюента: DCM/MeOH, от 100/0 до 10:1) с получением 200 мг (43%) промежуточного соединения 4 в виде желтого твердого вещества.
Промежуточное соединение 5, в качестве альтернативы, также получали с помощью протокола реакции, аналогичного альтернативному получению промежуточного соединения 4, начиная с соответствующих исходных веществ.
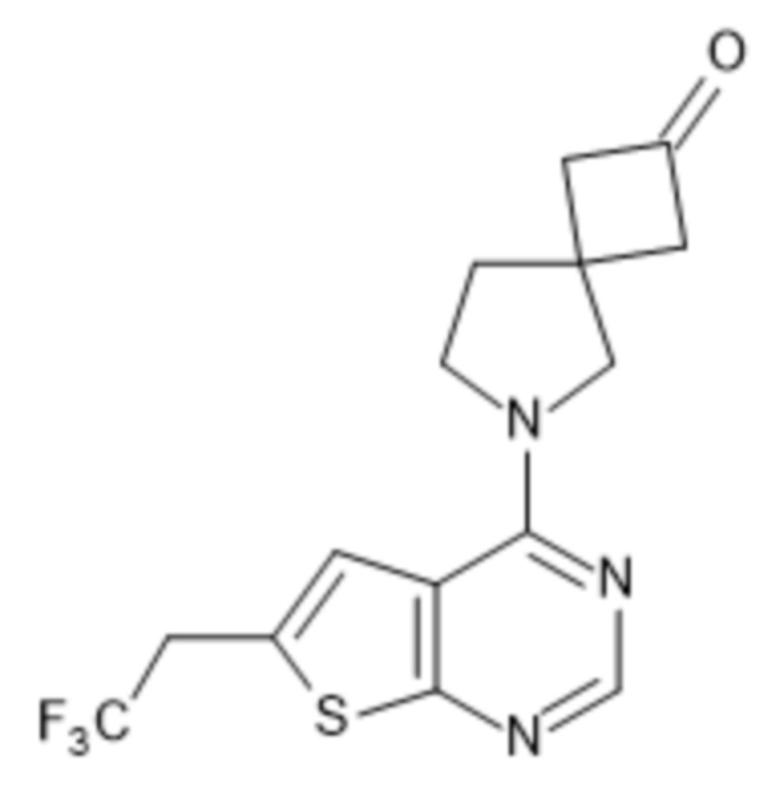
Получение промежуточного соединения 16
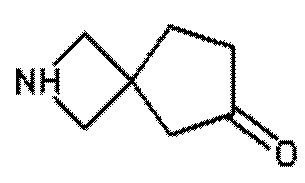
Добавляли 2-Boc-6-оксо-2-азаспиро[3.4]октан (300 мг, 1,33 ммоль) в 4 н. HCl в диоксане (4 мл). Реакционную смесь перемешивали в течение 1 ч при комнатной температуре. Растворитель выпаривали до сухого состояния с получением 280 мг промежуточного соединения 16 и соли HCl.
Специалисту в данной области техники будет понятно, что соль TFA и промежуточного соединения 16 также можно получить аналогичным способом (соль TFA представляет собой промежуточное соединение 16b).
Пример A3
Получение промежуточного соединения 6
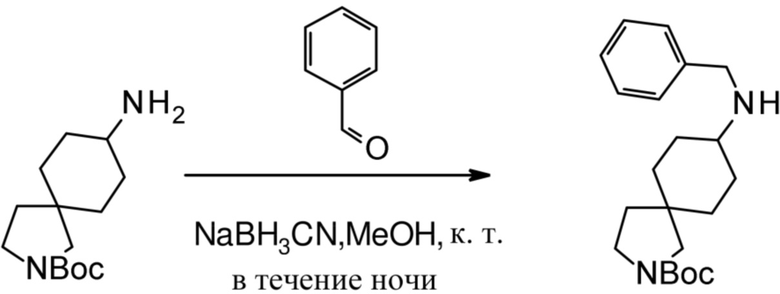
В раствор трет-бутил-8-амино-2-азаспиро[4.5]декан-2-карбоксилата (300 мг, 1,18 ммоль) в MeOH (10 мл) добавляли бензальдегид (125 мг, 1,18 ммоль) и смесь перемешивали при комнатной температуре в течение 2 ч Затем в смесь добавляли NaBH3CN (148 мг, 2,36 ммоль) и ее перемешивали в течение ночи при комнатной температуре. Смесь концентрировали, разбавляли с помощью EtOAc и H2O, разделяли и дважды экстрагировали с помощью EtOAc. Объединенные экстракты концентрировали in vacuo с получением промежуточного соединения 6 (360 мг, выход 88,6%), которое применяли как таковое на следующей стадии без дополнительной очистки.
Получение промежуточного соединения 7
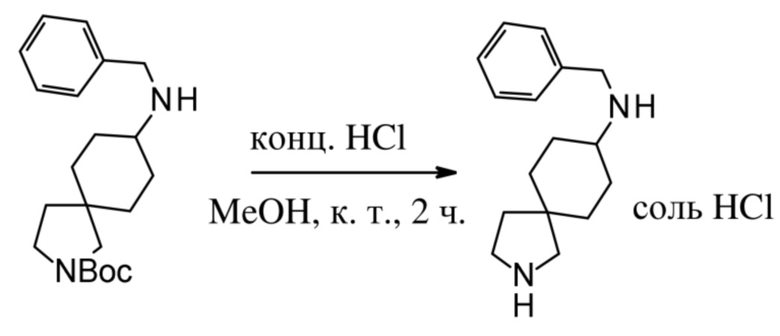
В раствор промежуточного соединения 6 (360 мг, 1,05 ммоль) в MeOH (5 мл) добавляли конц. HCl (3 мл). После перемешивания при комнатной температуре в течение 1 ч смесь концентрировали, разбавляли с помощью EtOAc и промывали с помощью H2O, экстракты объединяли и концентрировали с получением промежуточного соединения 7 в виде соли HCl (216 мг), которую применяли как таковую на следующей стадии без дополнительной очистки.
Промежуточное соединение, приведенное в таблице ниже, получали с помощью протокола реакции, аналогичного описанному для получения промежуточного соединения 7, начиная с соответствующих исходных веществ.
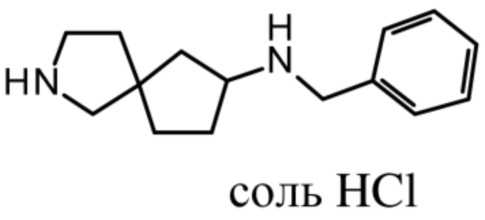
Пример A4
Получение промежуточного соединения 9
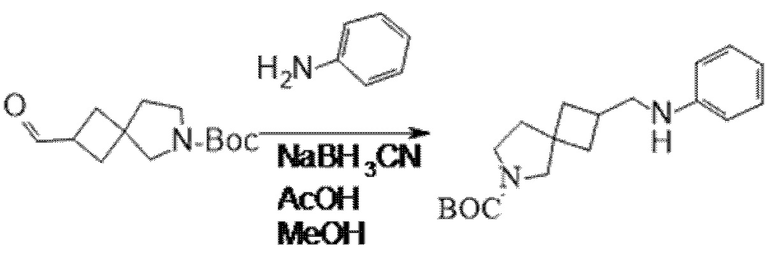
В раствор трет-бутил-2-формил-6-азаспиро[3.4]октан-6-карбоксилата (200 мг, 0,836 ммоль) и анилина (78 мг, 0,836 ммоль) в MeOH (5 мл) добавляли CH3COOH (5 мг) и NaBH3CN (158 мг, 2,51 ммоль) при 0°C. Смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли раствором NH4Cl, экстрагировали с помощью EA, промывали солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью колоночной хроматографии (PE/EA=10/1) с получением промежуточного соединения 9 (230 мг, выход 76%).
Получение промежуточного соединения 10
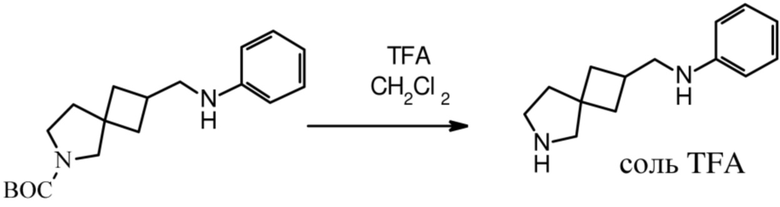
В раствор промежуточного соединения 9 (230 мг, 0,727 ммоль) в DCM (3 мл) добавляли TFA (1 мл). Полученную смесь перемешивали при комнатной температуре в течение 1,5 ч и затем смесь концентрировали с получением промежуточного соединения 10 в виде соли TFA (157 мг, неочищенное вещество), которую применяли как таковую на следующей стадии без дополнительной очистки.
Промежуточные соединения, приведенные в таблице ниже, получали с помощью протокола реакции, аналогичного описанному для получения промежуточного соединения 10, начиная с соответствующих исходных веществ. Для промежуточных соединений 11-12-13 применяли HCl для удаления защитной Boc-группы. Исходные вещества для промежуточных соединений 11, 12 и 13 получали с помощью протокола реакции, аналогичного применяемому для промежуточного соединения 9.
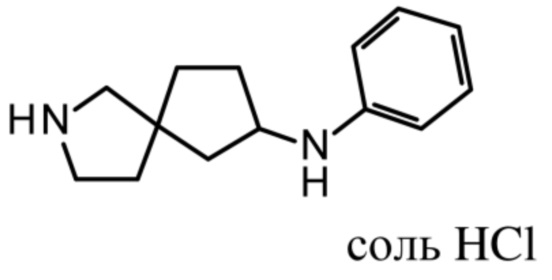
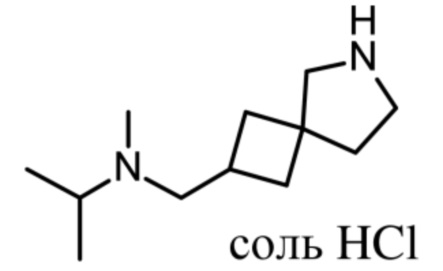
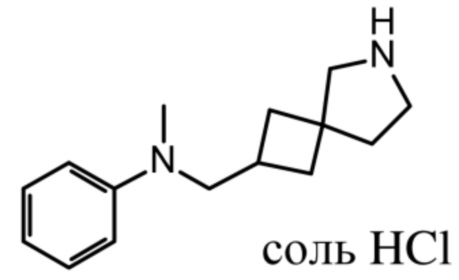
Пример A5
Получение промежуточного соединения 14
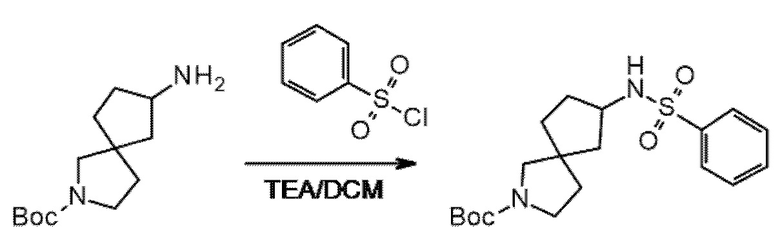
В раствор трет-бутил-7-амино-2-азаспиро[4.4]нонан-2-карбоксилата (50,0 мг, 0,208 ммоль) и TEA (63,0 мг, 0,624 ммоль) в DCM (20 мл) добавляли бензолсульфонилхлорид (48,0 мг, 0,271 ммоль). После перемешивания при 0°C в течение 5 ч в реакционную смесь добавляли воду (20 мл) и ее экстрагировали с помощью EtOAc (50 мл × 3). Органическую фазу промывали солевым раствором, высушивали над Na2SO4 и концентрировали с получением неочищенного промежуточного соединения 14 (60 мг), которое применяли как таковое на следующей стадии без дополнительной очистки.
Получение промежуточного соединения 15
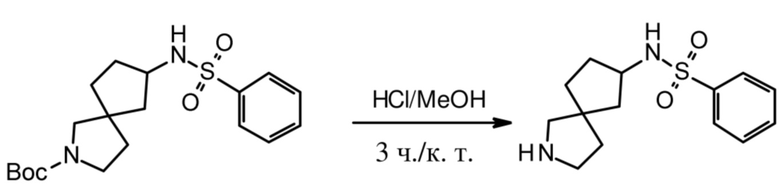
В раствор неочищенного промежуточного соединения 14 (60 мг) в MeOH (5 мл) добавляли конц. HCl (3 мл). После перемешивания при комнатной температуре в течение 1 ч смесь концентрировали с получением промежуточного соединения 15 (35 мг), которое применяли как таковое на следующей стадии без дополнительной очистки.
Пример A6
Получение промежуточного соединения 17
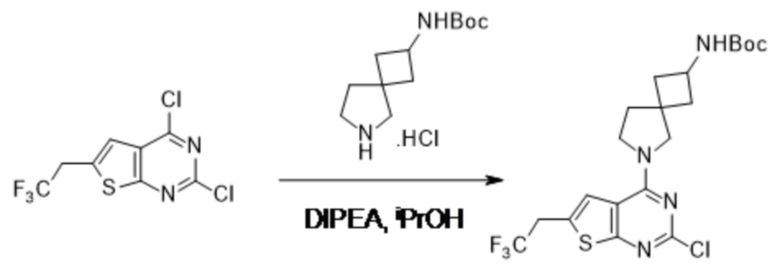
Перемешивали смесь 2,4-дихлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидина и трет-бутил-6-азаспиро[3.4]октан-2-илкарбамата гидрохлорида (2,63 г, 10 ммоль) и DIPEA (3,87 г, 30 ммоль) в изопропаноле (30 мл) при комнатной температуре в течение 2 часов. После завершения реакции реакционную смесь концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (петролейный эфир/EtOAc=1/1) с получением промежуточного соединения 17 (4,7 г, выход 100%) в виде светло-оранжевого твердого вещества.
Получение промежуточного соединения 18
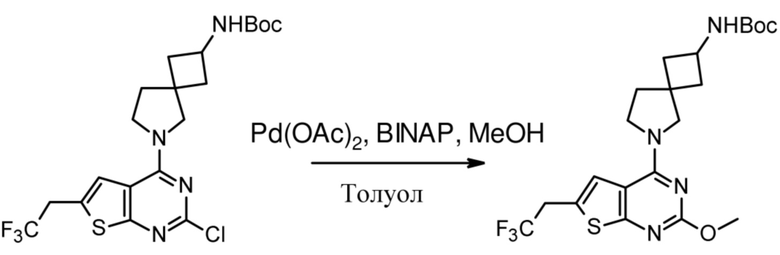
В смесь промежуточного соединения 17 (954 мг, 2,0 ммоль), Pd(OAc)2 (56,0 мг, 0,20 ммоль), BINAP (150 мг, 0,24 ммоль) и Cs2CO3 (978 мг, 3,0 ммоль) в толуоле (20 мл) добавляли MeOH (384 мг, 12 ммоль). После перемешивания при 110°C в течение ночи в атмосфере Ar смесь разбавляли с помощью H2O (20 мл) и экстрагировали с помощью EtOAc (20 мл × 3). Объединенные органические слои промывали солевым раствором (40 мл), высушивали над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (петролейный эфир/EtOAc=3/1) с получением промежуточного соединения 18 (810 мг, выход 86%) в виде желтого твердого вещества.
Получение промежуточного соединения 19
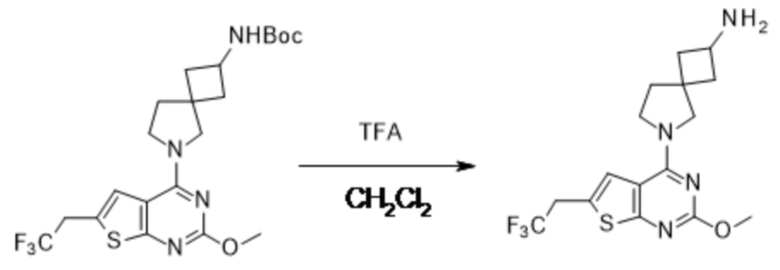
Добавляли TFA (2 мл) в смесь промежуточного соединения 18 (трет-бутил-(6-(2-метокси-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин-4-ил)-6-азаспиро[3.4]октан-2-ил)карбамата) (400 мг, 0,88 ммоль) в DCM (2 мл). После перемешивания при комнатной температуре в течение 2 ч реакционную смесь концентрировали при пониженном давлении. Остаток обрабатывали с помощью ионообменной смолы Amberlyst A-21 в MeOH (5 мл) в течение 10 минут, фильтровали и концентрировали с получением промежуточного соединения 19 (300 мг, выход 96%) в виде белого твердого вещества, которое применяли на следующей стадии без дополнительной очистки.
Получение промежуточного соединения 20
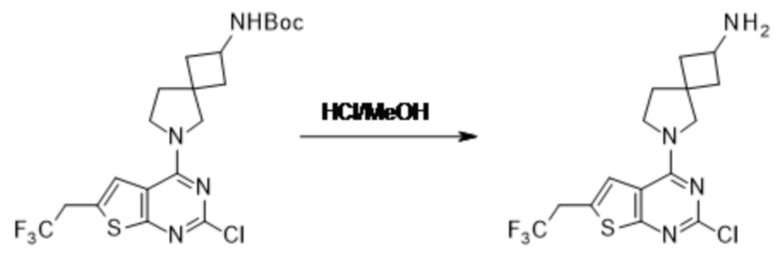
Перемешивали раствор промежуточного соединения 17 (трет-бутил-(6-(2-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин-4-ил)-6-азаспиро[3.4]октан-2-ил)карбамата) (200 мг, 0,419 ммоль) в HCl/MeOH (4 мл) при комнатной температуре в течение 2 ч Реакционную смесь концентрировали при пониженном давлении. Остаток обрабатывали с помощью ионообменной смолы (Amberlyst A-21) с получением промежуточного соединения 20 (150 мг), которое применяли на следующей стадии без дополнительной очистки.
Получение промежуточного соединения 21
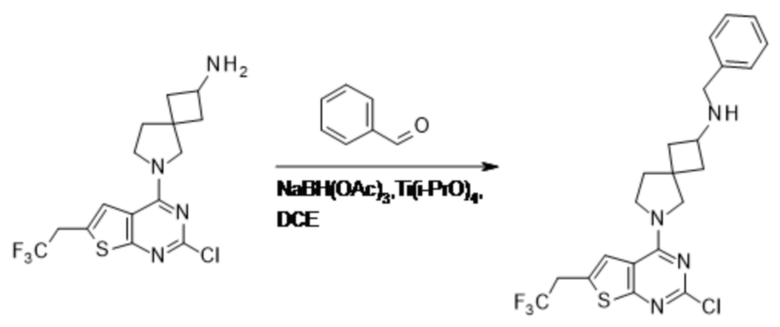
В раствор промежуточного соединения 20 (6-(2-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин-4-ил)-6-азаспиро[3.4]октан-2-амина) (169 мг, 0,448 ммоль), бензальдегида (95 мг, 0,895 ммоль) и тетраизопропанолата титана (127 мг, 0,448 ммоль) в DCE (5 мл) добавляли порциями NaBH(OAc)3 (285 мг, 1,34 ммоль) при комнатной температуре. После перемешивания при комнатной температуре в течение ночи реакционную смесь гасили водным раствором NaHCO3 и экстрагировали с помощью DCM (20 мл × 3). Объединенные органические слои промывали солевым раствором и высушивали над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (PE/EtOAc=3:1~1:1) с получением промежуточного соединения 21 (250 мг) в виде белого твердого вещества.
Пример A7
Получение промежуточного соединения 22
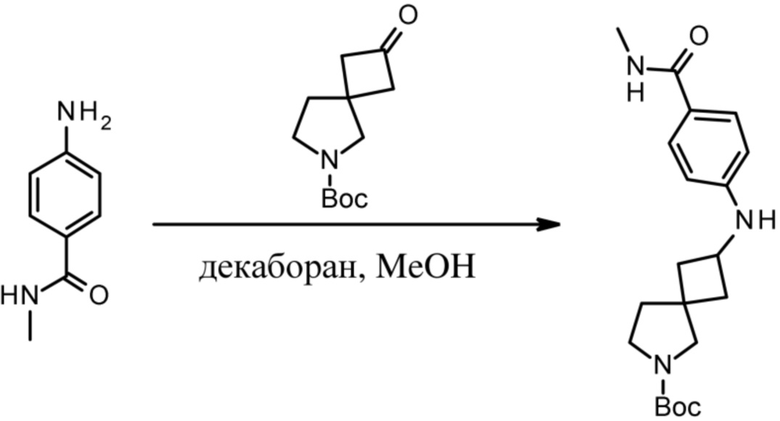
В раствор 4-амино-N-метилбензамида (150 мг, 1,00 ммоль) в MeOH (4 мл) добавляли трет-бутил-2-оксо-6-азаспиро[3.4]октан-6-карбоксилат (292 мг, 1,3 ммоль) и декаборан (42,7 мг, 0,35 ммоль). После перемешивания при комнатной температуре в течение ночи полученную смесь концентрировали при пониженном давлении с получением промежуточного соединения 22 (350 мг, неочищенное вещество, выход 95%), которое применяли на следующей стадии без дополнительной очистки.
Получение промежуточного соединения 23
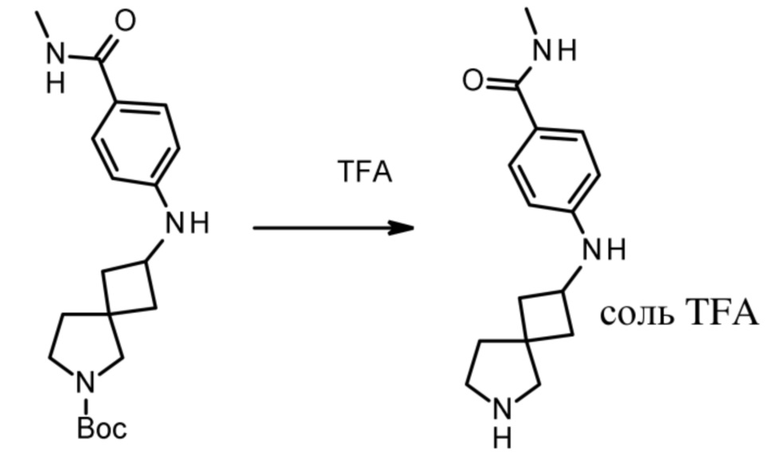
В раствор промежуточного соединения 22 (трет-бутил-2-((4-(метилкарбамоил)фенил)амино)-6-азаспиро[3.4]октан-6-карбоксилата) (350 мг, неочищенное вещество) в DCM (10 мл) добавляли TFA (2 мл). После перемешивания при комнатной температуре в течение 3 ч полученную смесь концентрировали при пониженном давлении с получением промежуточного соединения 23 (250 мг, неочищенная соль TFA, выход 98%), которое применяли на следующей стадии без дополнительной очистки.
Получение промежуточного соединения 24
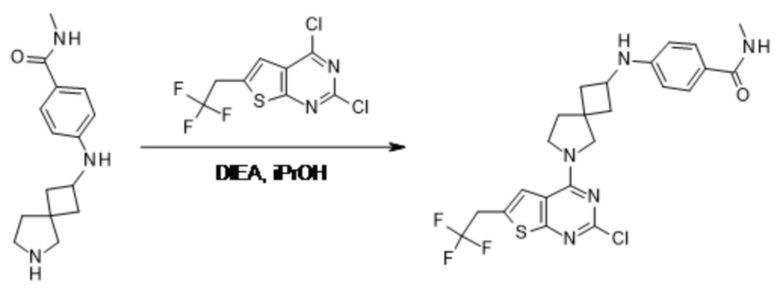
В смесь 2,4-дихлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидина (300 мг, 1,04 ммоль) и промежуточного соединения 23 (250 мг, неочищенное вещество) в iPrOH (5 мл) добавляли DIPEA (404 мг, 3,12 ммоль). После перемешивания при комнатной температуре в течение ночи полученную смесь концентрировали при пониженном давлении. Остаток очищали с помощью преп. TLC (DCM: MeOH=20:1) с получением промежуточного соединения 24 (200 мг, выход 39% за 3 стадии).
Пример A8
Получение промежуточного соединения 25
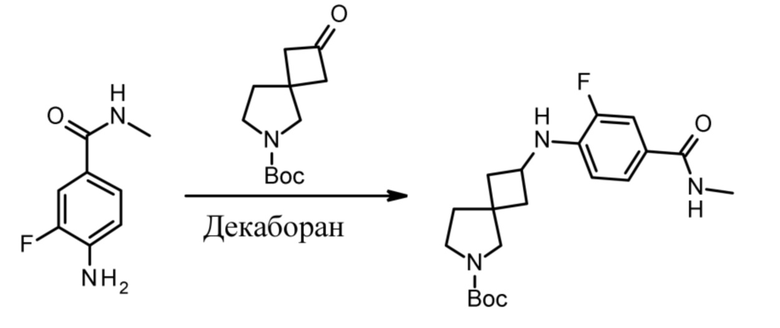
В раствор метил-4-амино-3-фтор-N-метилбензамида (200 мг, 1,19 ммоль) и трет-бутил-2-оксо-6-азаспиро[3.4]октан-6-карбоксилата (268 мг, 1,19 ммоль) в MeOH (10 мл) добавляли декаборан (44 мг, 0,357 ммоль). После перемешивания при комнатной температуре в течение 3 дней смесь разбавляли водой (20 мл) и экстрагировали с помощью EtOAc (50 мл × 3). Органическую фазу промывали солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (PE/EA=5/1) с получением промежуточного соединения 25 (400 мг, выход 89%) в виде белого твердого вещества.
Получение промежуточного соединения 26
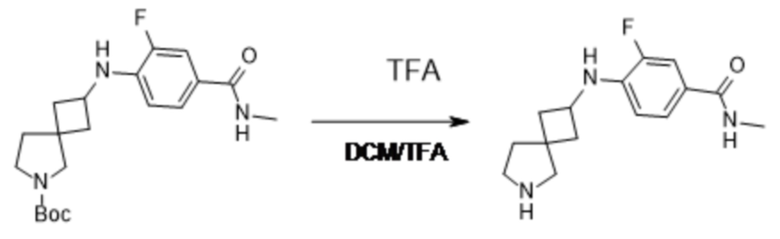
В раствор промежуточного соединения 25 (трет-бутил-2-((2-фтор-4-(метилкарбамоил)фенил)амино)-6-азаспиро[3.4]октан-6-карбоксилата) (400 мг, 1,06 ммоль) в DCM (5 мл) добавляли TFA (2 мл). После перемешивания при комнатной температуре в течение 3 ч смесь регулировали до pH>7 с помощью NaHCO3 и экстрагировали этилацетатом (100 мл × 3). Объединенные органические слои промывали солевым раствором (50 мл × 2) и высушивали над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (PE:EA=10:1) с получением промежуточного соединения 26 (200 мг, выход 68%) в виде масла.
Пример A9
Получение промежуточного соединения 27
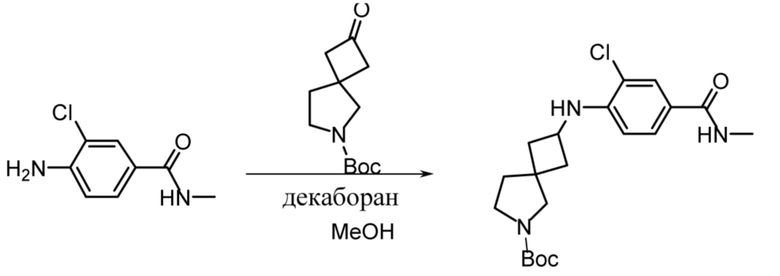
В раствор 4-амино-3-хлор-N-метилбензамида (485 мг, 2,635 ммоль) и трет-бутил-2-оксо-6-азаспиро[3.4]октан-6-карбоксилата (592 мг, 2,635 ммоль) в MeOH (10 мл) добавляли декаборан (112 мг, 0,922 ммоль). После перемешивания при комнатной температуре в течение 12 ч смесь разбавляли водой (20 мл) и экстрагировали с помощью EtOAc (50 мл × 3). Органическую фазу промывали солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали с получением неочищенного промежуточного соединения 27 в виде желтого масла.
Получение промежуточного соединения 28
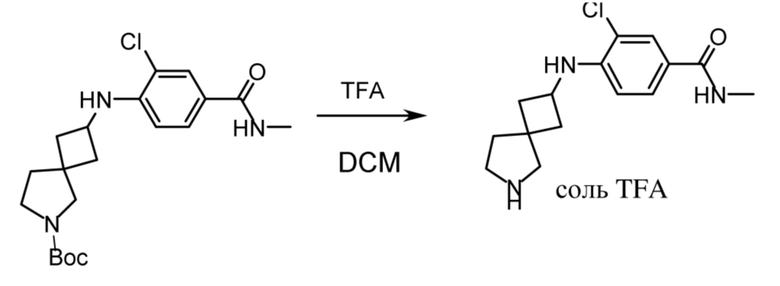
В раствор промежуточного соединения 27 (трет-бутил-2-((2-хлор-4-(метилкарбамоил)фенил)амино)-6-азаспиро[3.4]октан-6-карбоксилата) (350 мг, 0,890 ммоль) в CH2Cl2 (5 мл) добавляли TFA (5 мл). После перемешивания при комнатной температуре в течение 3 ч смесь концентрировали при пониженном давлении с получением промежуточного соединения 28 (260 мг, неочищенное вещество), которое применяли на следующей стадии без дополнительной очистки.
Пример A10
Получение промежуточного соединения 29
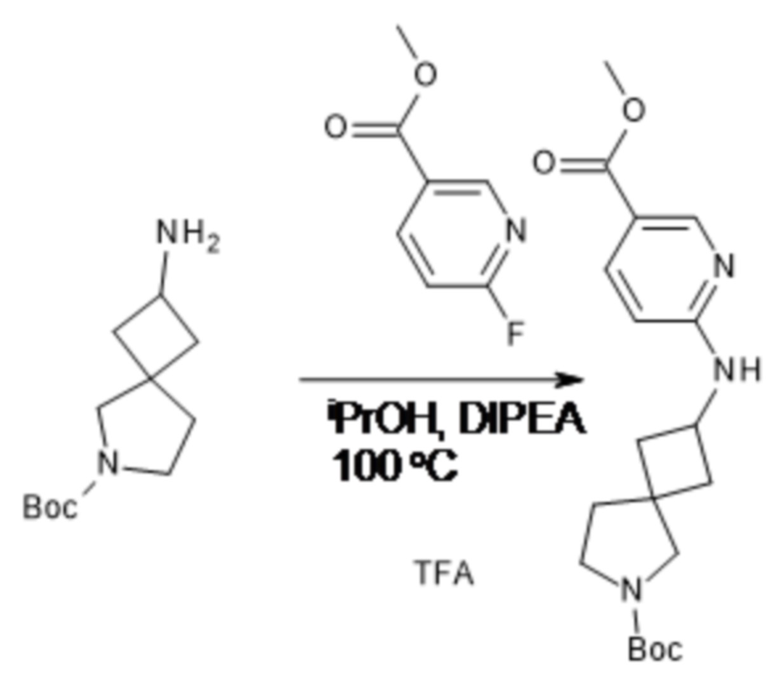
В раствор трет-бутил-2-амино-6-азаспиро[3.4]октан-6-карбоксилата (200 мг, 0,88 ммоль) и метил-6-фторникотината (178 мг, 1,15 ммоль) в i-PrOH (2 мл) добавляли DIPEA (342 мг, 2,65 ммоль). После перемешивания при 100°C в течение 12 ч смесь разбавляли водой (20 мл) и экстрагировали с помощью EtOAc (50 мл × 3). Объединенную органическую фазу промывали солевым раствором и высушивали над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью преп. TLC (DCM: MeOH=30:1) с получением промежуточного соединения 29 (220 мг, выход 69%).
Получение промежуточного соединения 30
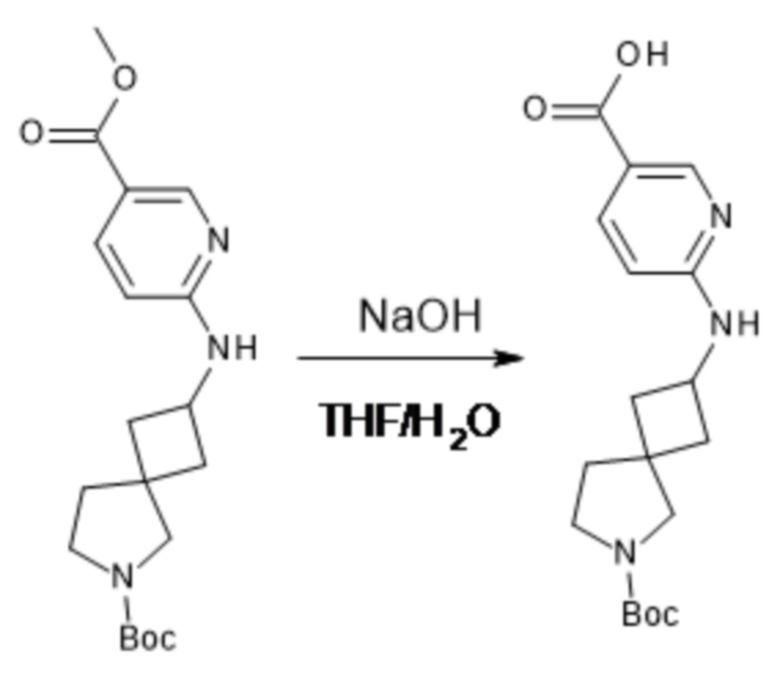
В раствор промежуточного соединения 29 (трет-бутил-2-((5-(метоксикарбонил)пиридин-2-ил)амино)-6-азаспиро[3.4]октан-6-карбоксилата) (200 мг, 0,55 ммоль) в THF (4 мл) добавляли водн. раствор NaOH (2 н., 2 мл). После перемешивания при 80°C в течение 2 ч полученную смесь охлаждали до комнатной температуры, регулировали до pH~4 с помощью 1 н. HCl и экстрагировали с помощью EtOAc (50 мл × 3). Органическую фазу промывали солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали с получением промежуточного соединения 30 (150 мг, выход 78%).
Получение промежуточного соединения 31
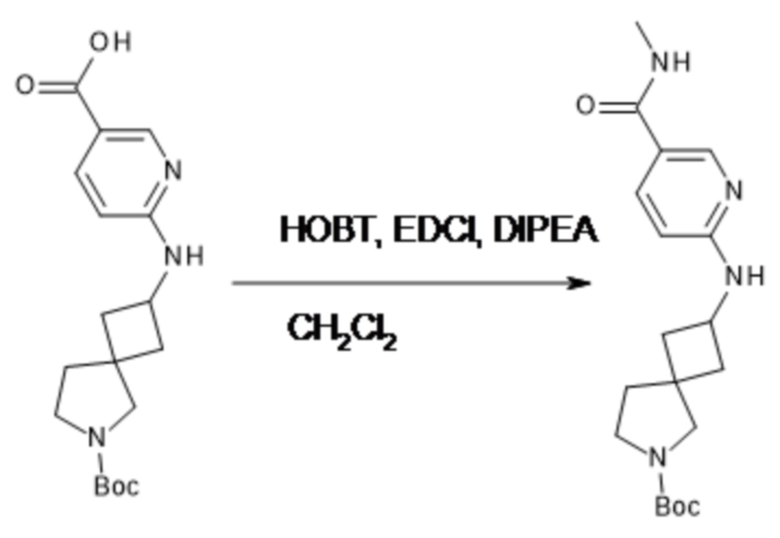
Перемешивали раствор промежуточного соединения 30 (6-((6-(трет-бутоксикарбонил)-6-азаспиро[3.4]октан-2-ил)амино)никотиновой кислоты) (100 мг, 0,288 ммоль), CH3NH2.HCl (29 мг, 0,432 ммоль), HOBT (78 мг, 0,576 ммоль), EDCI (110 мг, 0,576 ммоль) и DIPEA (111 мг, 0,864 ммоль) в DCM (5 мл) при комнатной температуре в течение 12 ч Смесь разбавляли водой (20 мл) и экстрагировали с помощью EtOAc (50 мл × 3). Органическую фазу промывали солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали. Неочищенное вещество очищали с помощью преп. TLC (DCM: MeOH=20:1) с получением промежуточного соединения 31 (100 мг, выход 97%).
Получение промежуточного соединения 32
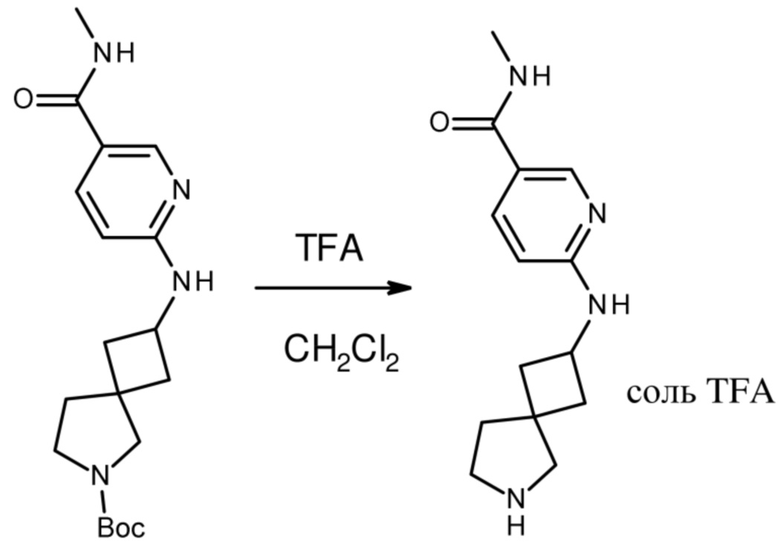
Раствор промежуточного соединения 31 (трет-бутил-2-((5-(метилкарбамоил)пиридин-2-ил)амино)-6-азаспиро[3.4]октан-6-карбоксилата) (100 мг, 0,277 ммоль) и TFA (2 мл) в DCM (4 мл) перемешивали при комнатной температуре в течение 12 ч. Смесь концентрировали при пониженном давлении с получением промежуточного соединения 32 (100 мг, неочищенная соль TFA), которое применяли на следующей стадии без дополнительной очистки.
Пример A11
Получение промежуточного соединения 33
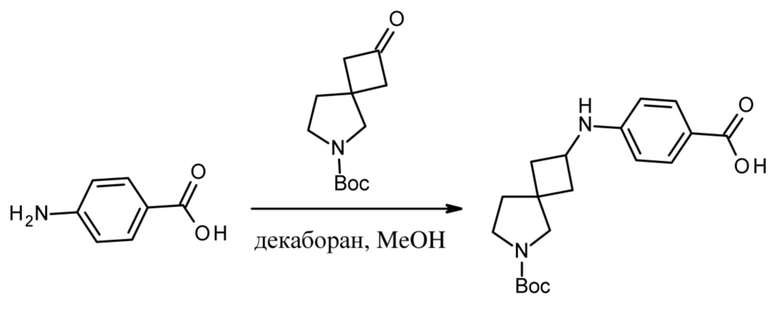
В раствор трет-бутил-2-оксо-6-азаспиро[3.4]октан-6-карбоксилата (2,00 г, 8,89 ммоль) в MeOH (20 мл) добавляли 4-аминобензойную кислоту (1,20 г, 8,89 ммоль) и декаборан (380 мг, 3,11 ммоль). После перемешивания при комнатной температуре в течение ночи смесь концентрировали при пониженном давлении с получением промежуточного соединения 33 (3,10 г, выход 100%) в виде бесцветного масла, которое применяли на следующей стадии непосредственно без дополнительной очистки.
Получение промежуточного соединения 34
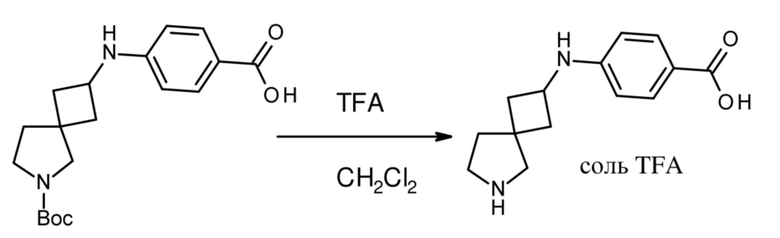
В раствор промежуточного соединения 33 (4-((6-(трет-бутоксикарбонил)-6-азаспиро[3.4]октан-2-ил)амино)бензойной кислоты) (3,10 г, 8,89 ммоль) в DCM (20 мл) добавляли TFA (10 мл). После перемешивания при комнатной температуре в течение 1 часа смесь концентрировали при пониженном давлении с получением промежуточного соединения 34 (2,20 г, соль TFA) в виде коричневого масла, которое применяли на следующей стадии непосредственно без дополнительной очистки.
Получение промежуточного соединения 35

В раствор промежуточного соединения 34 (соли TFA и (4-((6-азаспиро[3.4]октан-2-ил)амино)бензойной кислоты) (2,20 г, 8,89 ммоль) в i-PrOH (20 мл) добавляли по каплям 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (2,20 г, 8,89 ммоль) и DIPEA (5,70 г, 44,45 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении. Полученное желтое масло разбавляли в водном растворе NH4Cl при перемешивании в течение ночи. Суспензию фильтровали и высушивали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле, с элюированием смесью DCM/MeOH (от 30/1 до 20/1), с получением промежуточного соединения 35 (2,30 г, выход 56%) в виде желтого твердого вещества.
Пример A12
Получение промежуточного соединения 36
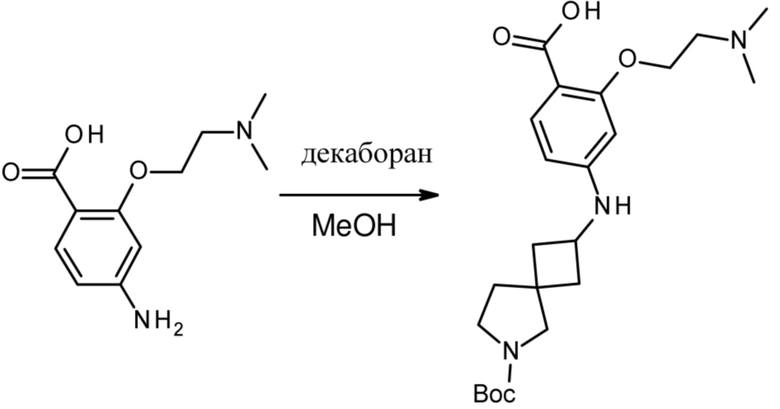
В раствор 4-амино-2-(2-(диметиламино)этокси)бензойной кислоты (450 мг, неочищенное вещество) в MeOH (5 мл) добавляли трет-бутил-2-оксо-6-азаспиро[3.4]октан-6-карбоксилат (398 мг, 1,77 ммоль) и декаборан (75,58 мг, 0,62 ммоль). После перемешивания при комнатной температуре в течение 12 ч смесь концентрировали, разбавляли водой (30 мл) и экстрагировали этилацетатом (30 мл × 3). Объединенные органические слои промывали солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением промежуточного соединения 36 (800 мг, неочищенное вещество) в виде желтого твердого вещества, которое применяли на следующей стадии без дополнительной очистки.
Получение промежуточного соединения 37
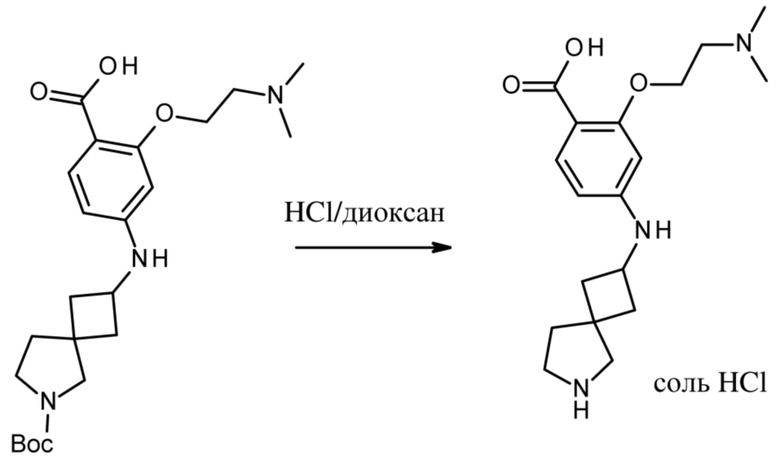
В раствор промежуточного соединения 36 (4-((6-(трет-бутоксикарбонил)-6-азаспиро[3.4]октан-2-ил)амино)-2-(2-(диметиламино)этокси)бензойной кислоты) (800 мг, неочищенное вещество) в MeOH (5 мл) добавляли HCl/диоксан (10 мл, 4 М). После перемешивания при комнатной температуре в течение 3 ч смесь концентрировали при пониженном давлении с получением промежуточного соединения 37 (700 мг, неочищенная соль HCl) в виде желтого твердого вещества, которое применяли на следующей стадии без дополнительной очистки.
Получение промежуточного соединения 38

В раствор промежуточного соединения 37 (соли HCl и 4-(6-азаспиро[3.4]октан-2-иламино)-2-(2-(диметиламино)этокси)бензойной кислоты) (700 мг, неочищенное вещество) в iPrOH (10 мл) добавляли 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (480 мг, 1,89 ммоль) и DIEA (5 мл). После перемешивания при комнатной температуре в течение 3 часов полученную смесь разбавляли с помощью EA (30 мл), промывали солевым раствором (15 мл × 2), высушивали над Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью преп. TLC (DCM: MeOH=10:1) с получением промежуточного соединения 38 (250 мг, выход 23% за 4 стадии) в виде белого твердого вещества.
Пример A13
Получение промежуточного соединения 39
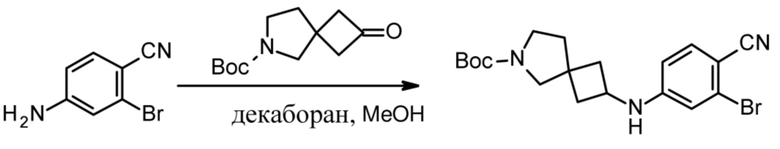
Перемешивали смесь 4-амино-2-бромбензонитрила (440 мг, 2,2 ммоль), трет-бутил-2-оксо-6-азаспиро[3.4]октан-6-карбоксилата (495 мг, 2,2 ммоль) и декаборана (43 мг, 0,35 ммоль) в MeOH (20 мл) при 50°C в течение ночи в атмосфере Ar. Реакционную смесь концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (петролейный эфир/EtOAc=3/1) с получением промежуточного соединения 39 (406 мг, выход 45%) в виде белого твердого вещества.
Получение промежуточного соединения 40
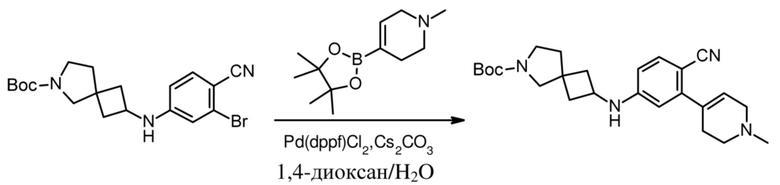
Перемешивали смесь промежуточного соединения 39 (трет-бутил-2-((3-бром-4-цианофенил)амино)-6-азаспиро[3.4]октан-6-карбоксилата) (406 мг, 1,0 ммоль), 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,2,3,6-тетрагидропиридина (335 мг, 1,5 ммоль), Pd(dppf)Cl2 (73 мг, 0,1 ммоль) и Cs2CO3 (489 мг, 1,5 ммоль) в 1,4-диоксане (20 мл) и H2O (4 мл) при 110°C в течение ночи. Реакционную смесь фильтровали и фильтрат концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (DCM/MeOH=20/1) с получением промежуточного соединения 40 (380 мг, выход 90%) в виде коричневого твердого вещества.
Получение промежуточного соединения 41
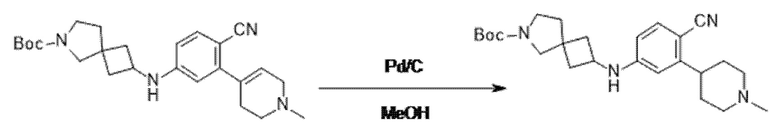
Перемешивали смесь промежуточного соединения 40, представляющего собой трет-бутил-2-((4-циано-3-(1-метил-1,2,3,6-тетрагидропиридин-4-ил)фенил)амино)-6-азаспиро[3.4]октан-6-карбоксилат (380 мг, 0,9 ммоль), и Pd/C (380 мг) в MeOH (20 мл) при 50°C в течение 4 ч в атмосфере H2. Реакционную смесь фильтровали и фильтрат концентрировали с получением промежуточного соединения 41 (340 мг, неочищенное вещество) в виде оранжевого масла.
Получение промежуточного соединения 42
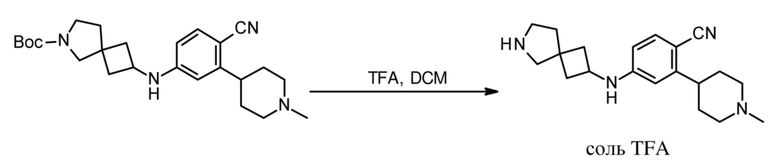
Перемешивали смесь промежуточного соединения 41 (трет-бутил-2-((4-циано-3-(1-метилпиперидин-4-ил)фенил)амино)-6-азаспиро[3.4]октан-6-карбоксилата) (340 мг, неочищенное вещество) и TFA (2 мл) в DCM (2 мл) при комнатной температуре в течение 2 ч Смесь концентрировали под давлением с получением промежуточного соединения 42 (280 мг, соль TFA) в виде оранжевого масла, которое применяли на следующей стадии без дополнительной очистки.
Пример A14
Получение промежуточного соединения 43
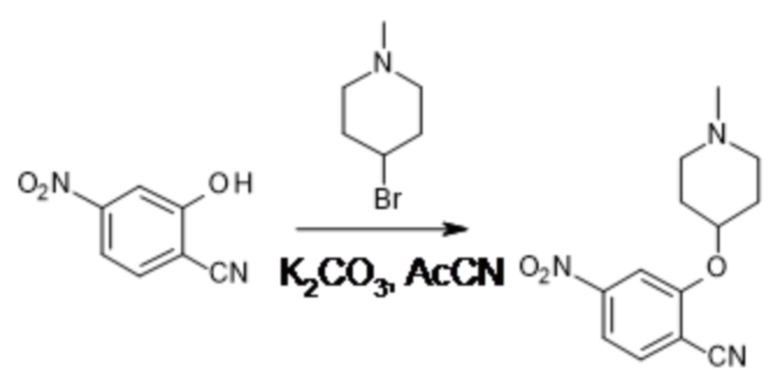
В раствор 2-гидрокси-4-нитробензонитрила (500 мг, 3,05 ммоль) в 50 мл CH3CN добавляли K2CO3 (1,30 г, 9,15 ммоль) и 4-бром-1-метилпиперидин (2,20 г, 12,2 ммоль). После перемешивания при 80°C в течение ночи реакционную смесь концентрировали и остаток фильтровали через слой силикагеля (DCM/MeOH=15:1). Фильтрат концентрировали при пониженном давлении с получением промежуточного соединения 43 (400 мг; неочищенное вещество), которое применяли на следующей стадии без дополнительной очистки.
Получение промежуточного соединения 44
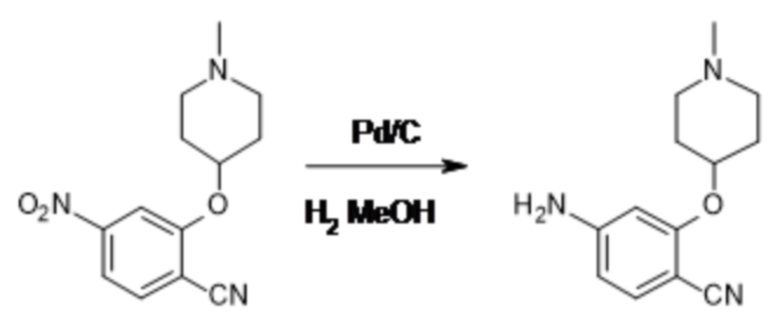
В раствор промежуточного соединения 43 (2-((1-метилпиперидин-4-ил)окси)-4-нитробензонитрила) (400 мг, неочищенное вещество) в MeOH (3 мл) добавляли Pd/C (40 мг). После перемешивания при 50°C в течение 2 ч в атмосфере H2 реакционную смесь фильтровали через слой целита и промывали с помощью MeOH. Фильтрат концентрировали при пониженном давлении с получением промежуточного соединения 44 (500 мг, выход 70% за 2 стадии), которое применяли на следующей стадии без дополнительной очистки.
Получение промежуточного соединения 45
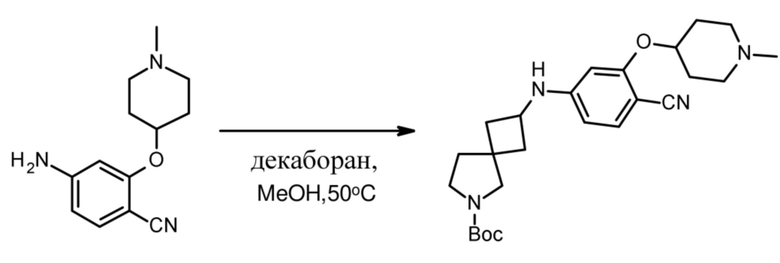
В раствор промежуточного соединения 44 (4-амино-2-((1-метилпиперидин-4-ил)окси)бензонитрила) (500 мг, неочищенное вещество, чистота примерно 90%) в MeOH (10 мл) добавляли трет-бутил-2-оксо-6-азаспиро[3.4]октан-6-карбоксилат (300 мг, 1,33 ммоль) и декаборан (56 мг, 0,46 ммоль). После перемешивания при 50°C в течение ночи смесь концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (DCM/MeOH=10/1) с получением промежуточного соединения 45 (500 мг).
Получение промежуточного соединения 46
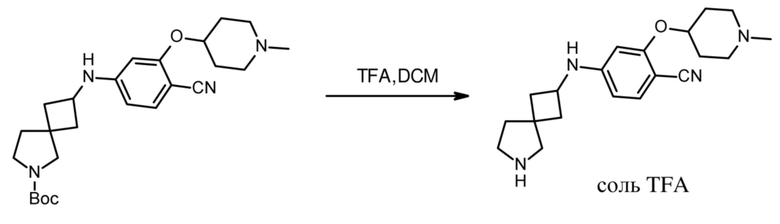
В раствор промежуточного соединения 45 (трет-бутил-2-((4-циано-3-((1-метилпиперидин-4-ил)окси)фенил)амино)-6-азаспиро[3.4]октан-6-карбоксилата) (500 мг, неочищенное вещество) в DCM (10 мл) добавляли TFA (2 мл). После перемешивания при комнатной температуре в течение 2 ч смесь концентрировали при пониженном давлении с получением промежуточного соединения 46 (500 мг, неочищенная соль TFA) в виде масла.
Пример A15
Получение промежуточного соединения 47
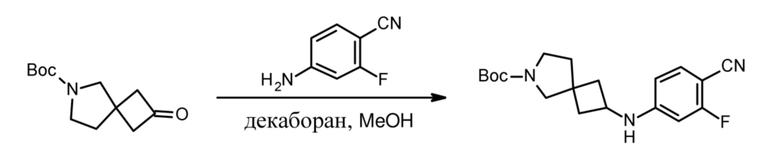
Перемешивали смесь трет-бутил-2-оксо-6-азаспиро[3.4]октан-6-карбоксилата (№ по CAS: 203661-71-6) (675 мг, 3,0 ммоль), 4-амино-2-фторбензонитрила (408 мг, 3,0 ммоль) и декаборана (128 мг, 1,05 ммоль) в MeOH (10 мл) при 50°C в течение ночи. После завершения реакции реакционную смесь концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (петролейный эфир/EtOAc=3/1) с получением промежуточного соединения 47 (500 мг, выход 48%) в виде белого твердого вещества.
Получение промежуточного соединения 48
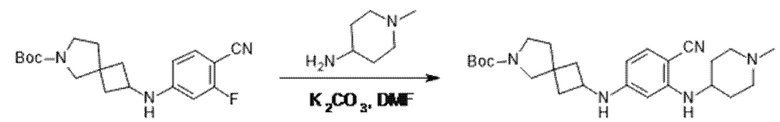
Перемешивали смесь промежуточного соединения 47 (трет-бутил-2-((4-циано-3-фторфенил)амино)-6-азаспиро[3.4]октан-6-карбоксилата) (345 мг, 1,0 ммоль), 1-метилпиперидин-4-амина (570 мг, 5,0 ммоль) и K2CO3 (690 мг, 5,0 ммоль) в DMF (5 мл) при 120°C в течение 12 ч в закрытой пробирке в атмосфере Ar. После завершения реакции реакционную смесь концентрировали и остаток очищали с помощью колоночной хроматографии на силикагеле (DCM/MeOH=10/1) с получением промежуточного соединения 48 (50 мг, выход 11%) в виде желтого масла.
Получение промежуточного соединения 49
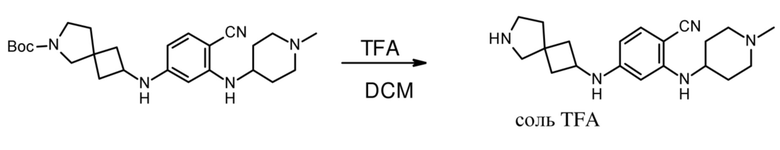
Перемешивали смесь промежуточного соединения 48 (трет-бутил-2-((4-циано-3-((1-метилпиперидин-4-ил)амино)фенил)амино)-6-азаспиро[3.4]октан-6-карбоксилата) (50 мг, 0,11 ммоль) и TFA (2 мл) в DCM (0,5 мл) при комнатной температуре в течение 2 ч. После завершения реакции смесь концентрировали с получением промежуточного соединения 49 (60 мг, соль TFA), которое применяли на следующей стадии без дополнительной очистки.
Пример A16
Получение промежуточного соединения 50
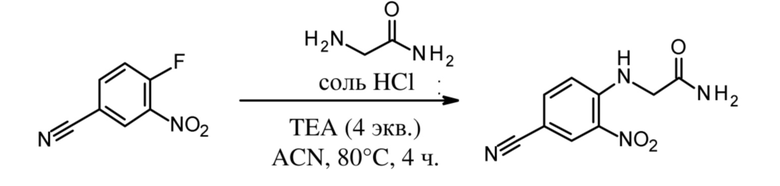
В раствор 3-фтор-4-нитробензонитрила (3,00 г, 18,1 ммоль) и ACN (40 мл) добавляли TEA (10,0 мл, 72,2 ммоль) и гидрохлорид глицинамида (2,00 г, 18,1 ммоль). После перемешивания при 80°C в течение 4 ч смесь охлаждали до комнатной температуры и смесь фильтровали с получением желтого твердого вещества, которое промывали водой (10 мл × 3). Желтое твердое вещество концентрировали до сухого состояния при пониженном давлении с получением неочищенного промежуточного соединения 50 (4,30 г, выход 92%) в виде желтого твердого вещества.
Получение промежуточного соединения 51

В раствор промежуточного соединения 50 (2-((4-циано-2-нитрофенил)амино)ацетамида) (3,00 г, 11,6 ммоль), DMF (124 мл) и воды (50 мл) добавляли FeCl3 (1,77 г, 10,9 ммоль) и цинк (17,8 г, 272 ммоль). После перемешивания при 50°C в течение 4 ч реакционную смесь фильтровали и фильтрат разбавляли с помощью EtOAc (1000 мл). Органический слой промывали водой (400 мл), высушивали над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением промежуточного соединения 51 (3,00 г, выход 82%) в виде желтого твердого вещества.
Получение промежуточного соединения 52
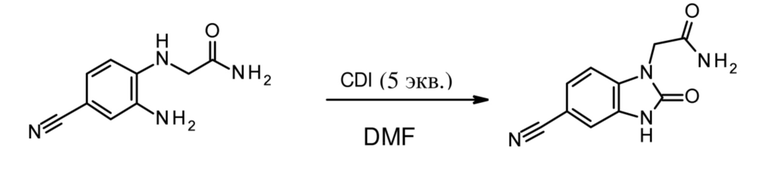
Перемешивали раствор промежуточного соединения 51 (2-((2-амино-4-цианофенил)амино)ацетамида) (1,50 г, 4,73 ммоль), CDI (3,83 г, 23,6 ммоль) и DMF (15 мл) при 20°C в течение 2 ч. Затем реакционную смесь разбавляли водой (15 мл) и экстрагировали этилацетатом (60 мл × 3). Объединенные органические фазы концентрировали до сухого состояния при пониженном давлении с получением неочищенного продукта, который очищали с помощью преп. HPLC (Gilson 281, колонка Xtimate C18 150 × 25 мм × 5 мкм (элюент: от 8% до 38% (об./об.) вода (0,225% FA)-ACN)). Чистые фракции собирали и выпаривали при пониженном давлении с получением остатка, который лиофилизировали до сухого состояния с получением промежуточного соединения 52 (400 мг, выход 35%) в виде белого твердого вещества.
Получение промежуточного соединения 53
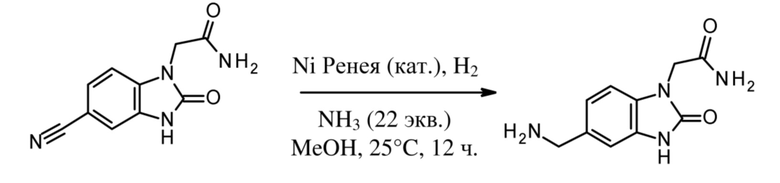
Перемешивали смесь промежуточного соединения 52 (2-(5-циано-2-оксо-2,3-дигидро-1H-бензо[d]имидазол-1-ил)ацетамида) (200 мг, 0,833 ммоль), Ni Ренея (100 мг), аммиака (2,6 мл, 7 М в MeOH) и MeOH (30 мл) при 25°C в течение 12 ч в атмосфере H2 (40-50 фунтов/кв. дюйм). Смесь фильтровали через Celite® и фильтрат концентрировали при пониженном давлении с получением промежуточного соединения 53 (200 мг, выход 93%) в виде коричневого твердого вещества.
Пример A17
Получение промежуточного соединения 54
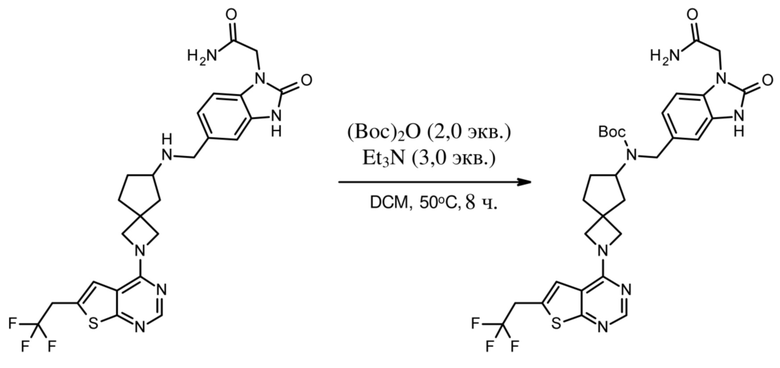
В раствор соединения 53 (2-(2-оксо-5-(((2-(6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин-4-ил)-2-азаспиро[3.4]октан-6-ил)амино)метил)-2,3-дигидро-1H-бензо[d]имидазол-1-ил)ацетамида) (70,0 мг, 0,128 ммоль) в DCM (3 мл) добавляли Et3N (39,0 мг, 0,385 ммоль) и (Boc)2O (56,0 мг, 0,257 ммоль) при 0°C. Затем смесь нагревали и перемешивали при 50°C в течение 8 ч. Реакционную смесь концентрировали при пониженном давлении с получением промежуточного соединения 54 (70 мг, неочищенное вещество), которое применяли на следующей стадии без очистки.
Получение промежуточного соединения 55
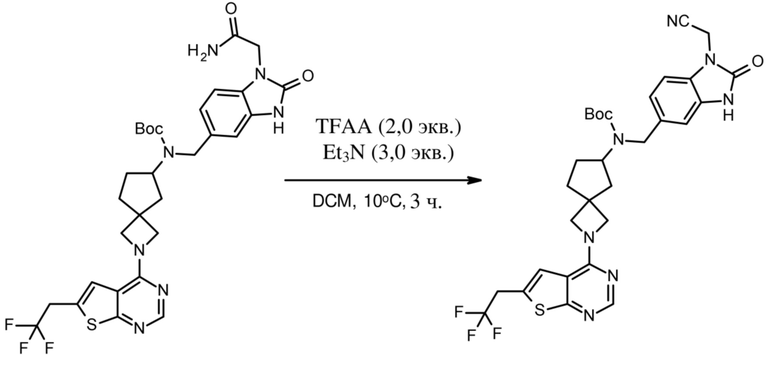
В раствор промежуточного соединения 54 (трет-бутил-((1-(2-амино-2-оксоэтил)-2-оксо-2,3-дигидро-1H-бензо[d]имидазол-5-ил)метил)-(2-(6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин-4-ил)-2-азаспиро[3.4]октан-6-ил)карбамата) (70,0 мг, неочищенное вещество) в DCM (1,5 мл) добавляли Et3N (33,0 мг, 0,325 ммоль) при 0°C. Затем в раствор добавляли по каплям раствор TFAA (46,0 мг, 0,217 ммоль) в DCM (0,5 мл) при 0°C. Реакционную смесь перемешивали при 10°C в течение 3 ч и концентрировали при пониженном давлении с получением промежуточного соединения 55 (60 мг, неочищенное вещество) в виде белого твердого вещества, которое применяли на следующей стадии без дополнительной очистки.
Пример A19
Получение промежуточного соединения 58
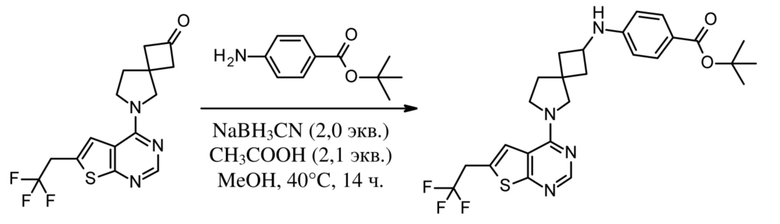
В раствор промежуточного соединения 5 (6-(6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин-4-ил)-6-азаспиро[3.4]октан-2-она) (1000 мг, 2,93 ммоль), трет-бутил-4-аминобензоата (750 мг, 3,88 ммоль), цианоборогидрида натрия (365 мг, 5,81 ммоль) и MeOH (28,0 мл) добавляли раствор уксусной кислоты (365 мг, 6,08 ммоль) в MeOH (2,0 мл). После перемешивания при 40°C в течение 14 ч смесь концентрировали при пониженном давлении, затем разбавляли водой (30 мл) и экстрагировали с помощью EtOAc (20 мл × 3). Объединенные органические слои высушивали над безводным Na2SO4, фильтровали и концентрировали in vacuo с получением неочищенного остатка, который очищали с помощью колоночной флэш-хроматографии (PE:EA от 100:0 до 50:50) с получением промежуточного соединения 58 (680 мг, выход 43%) в виде оранжевого твердого вещества.
Получение промежуточного соединения 59 (соли TFA и промежуточного соединения 35)
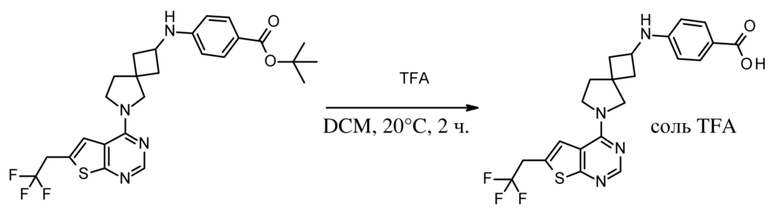
Перемешивали раствор промежуточного соединения 58 (трет-бутил-4-((6-(6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин-4-ил)-6-азаспиро[3.4]октан-2-ил)амино)бензоата) (100 мг, 0,193 ммоль), TFA (1 мл) и CH2Cl2 (1 мл) при 20°C в течение 2 ч. Затем реакционную смесь концентрировали до сухого состояния при пониженном давлении с получением неочищенного промежуточного соединения 59 (180 мг, выход 97%) в виде желтого твердого вещества.
Пример A20
Получение промежуточных соединений 60, 61 и 62
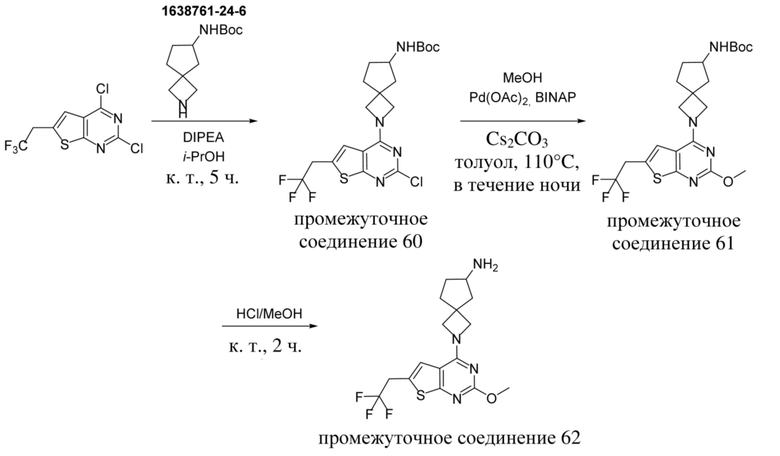
Промежуточное соединение 60, промежуточное соединение 61 и промежуточное соединение 62 получали соответственно с помощью протокола реакции, аналогичного описанному для получения промежуточного соединения 17, промежуточного соединения 18 и промежуточного соединения 20 соответственно, начиная с соответствующих исходных веществ.
Пример A21
Получение промежуточных соединений 63, 64 и 65
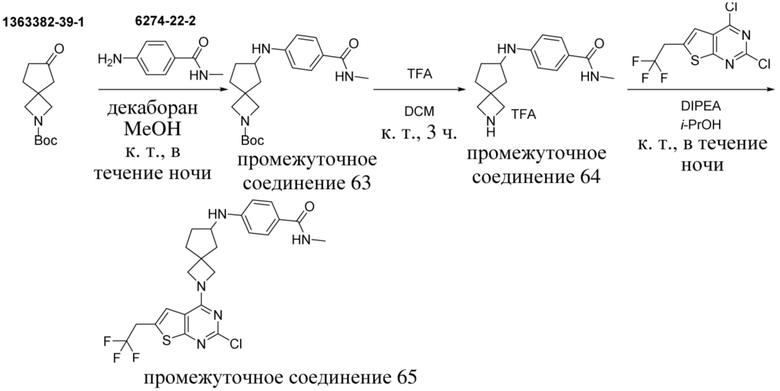
Промежуточное соединение 63, промежуточное соединение 64 и промежуточное соединение 65 получали соответственно с помощью протокола реакции, аналогичного описанному для получения промежуточного соединения 79, промежуточного соединения 80 и промежуточного соединения 17 соответственно, начиная с соответствующих исходных веществ.
(из трет-бутил-6-оксо-2-азаспиро[3.4]октан-2-карбоксилата, № по CAS: 1363382-39-1, и 4-амино-N-метилбензамида, № по CAS: 6274-22-2)
(из промежуточного соединения 63)
(из промежуточного соединения 64)
Пример A23
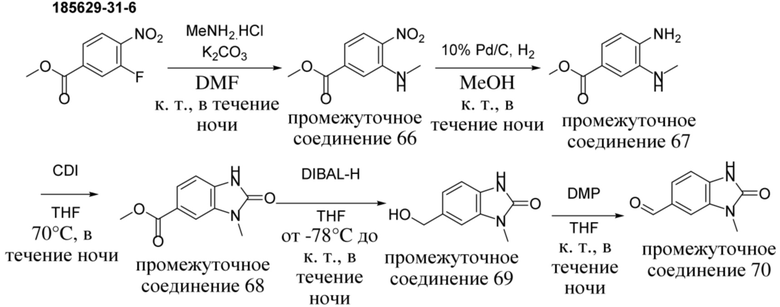
Получение промежуточного соединения 66
В перемешиваемый раствор метил-3-фтор-4-нитробензоата (№ по CAS: 185629-31-6) (3,00 г, 15,1 ммоль) в DMF (30 мл) при комнатной температуре добавляли гидрохлорид метиламина (1,20 г, 18,1 ммоль) и K2CO3 (2,70 г, 19,6 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли с помощью EtOAc (200 мл), промывали водн. раствором HCl (1 М) (100 мл), солевым раствором, высушивали над безводным Na2SO4, фильтровали и концентрировали с получением промежуточного соединения 66 (3,20 г, неочищенное вещество), которое применяли для следующей стадии без дополнительной очистки.
Получение промежуточного соединения 67
В раствор промежуточного соединения 66 (3,20 г, примерно 15,2 ммоль) в MeOH (32 мл) добавляли 10% Pd/C (320 мг). После перемешивания в атмосфере H2 при комнатной температуре в течение ночи смесь фильтровали через слой SiO2 и осадок на фильтре промывали с помощью MeOH. Объединенный фильтрат концентрировали при пониженном давлении с получением промежуточного соединения 67 (2,70 г, неочищенное вещество), которое применяли для следующей стадии без дополнительной очистки.
Получение промежуточного соединения 68
В перемешиваемый раствор промежуточного соединения 67 (2,70 г, примерно 15,0 ммоль) в THF (65 мл) при комнатной температуре добавляли CDI (3,60 г, 22,5 ммоль). После перемешивания при 70°C в течение ночи охлажденную реакционную смесь фильтровали и осадок на фильтре промывали с помощью THF и петролейного эфира. Осадок на фильтре высушивали в вакууме с получением промежуточного соединения 68 (1,80 г, неочищенное вещество), которое применяли для следующей стадии без дополнительной очистки.
Получение промежуточного соединения 69
В перемешиваемый раствор промежуточного соединения 68 (1,80 г, примерно 8,74 ммоль) в сухом THF (180 мл) в атмосфере Ar при -78°C добавляли по каплям DIBAL-H (1,5 М в толуоле) (35 мл, 52,5 ммоль). После добавления обеспечивали нагревание реакционной смеси до комнатной температуры и ее перемешивали в течение ночи. Реакционную смесь охлаждали до 0°C и гасили по каплям с помощью MeOH. После перемешивания при комнатной температуре в течение еще 15 минут смесь фильтровали и осадок на фильтре промывали с помощью MeOH. Объединенный фильтрат экстрагировали с помощью EtOAc (100 мл × 2), промывали солевым раствором, высушивали над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении с получением промежуточного соединения 69 (1,10 г, неочищенное вещество), которое применяли для следующей стадии без дополнительной очистки.
Получение промежуточного соединения 70
В перемешиваемый раствор промежуточного соединения 69 (1,10 г, примерно 6,18 ммоль) в сухом THF (110 мл) добавляли перйодинан Десса-Мартина (5,20 г, 12,4 ммоль). После перемешивания при комнатной температуре в течение ночи реакционную смесь разбавляли водой и экстрагировали с помощью EtOAc (50 мл × 3). Объединенные органические экстракты промывали солевым раствором, высушивали над безводным Na2SO4 и концентрировали при пониженном давлении. Неочищенный продукт промывали с помощью EtOAc (50 мл × 3), фильтровали и высушивали при пониженном давлении с получением промежуточного соединения 70 (400 мг, выход примерно 37%) в виде коричневого твердого вещества.
Пример A24
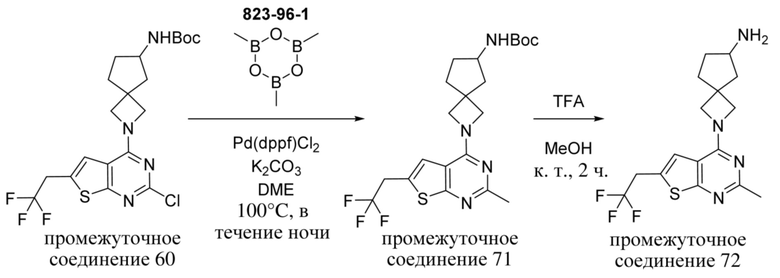
Получение промежуточного соединения 71
В раствор промежуточного соединения 60 (600 мг, 1,26 ммоль) в DME (15 мл) в атмосфере Ar при комнатной температуре добавляли триметилбороксин (№ по CAS: 823-96-1) (1,26 г, 5,03 ммоль), K2CO3 (522 мг, 0,38 ммоль) и Pd(dppf)Cl2 (93 мг, 0,13 ммоль). Реакционную смесь перемешивали в атмосфере Ar при 100°C в течение ночи. Охлажденную реакционную смесь разбавляли водой (60 мл) и экстрагировали с помощью EtOAc (60 мл × 3). Объединенные органические экстракты промывали водой (60 мл × 3), высушивали над безводным Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью хроматографии на силикагеле, с элюированием смесью PE/EA (2/1, об./об.), с получением промежуточного соединения 71 (390 мг, выход 68%).
Получение промежуточного соединения 72
В перемешиваемый раствор промежуточного соединения 71 (390 мг, 0,86 ммоль) в MeOH (4 мл) при комнатной температуре добавляли TFA (4 мл). После перемешивания при комнатной температуре в течение 2 ч реакционную смесь концентрировали при пониженном давлении и остаток обрабатывали ионообменной смолой с получением указанного в заголовке соединения, представляющего собой промежуточное соединение 72 (304 мг, выход 100%), которое применяли непосредственно для следующей стадии без дополнительной очистки.
Пример A25
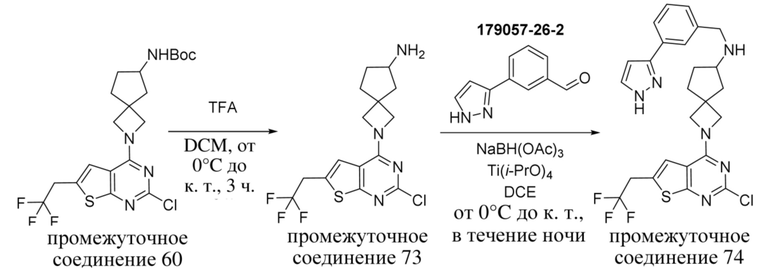
Получение промежуточного соединения 73
В перемешиваемый раствор промежуточного соединения 60 (500 мг, 1,05 ммоль) в DCM (9 мл) при 0°C медленно добавляли TFA (3 мл). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь концентрировали. Соль TFA и необходимого промежуточного соединения обрабатывали ионообменной смолой с получением промежуточного соединения 73 в виде желтого твердого вещества (400 мг, неочищенное вещество), которое применяли для следующей стадии непосредственно без дополнительной очистки.
Получение промежуточного соединения 74
В перемешиваемую смесь промежуточного соединения 73 (400 мг, 1,05 ммоль), 3-(1H-пиразол-3-ил)бензальдегида (№ по CAS: 179057-26-2) (235 мг, 1,36 ммоль) и Ti(i-PrO)4 (300 мг, 1,05 ммоль) в DCE (10 мл) при 0°C добавляли порциями NaBH(OAc)3 (668 мг, 3,15 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Затем реакционную смесь гасили с помощью NaHCO3 и полученное вещество экстрагировали с помощью DCM. Объединенные органические экстракты промывали солевым раствором, высушивали над безводным Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью колоночной хроматографии, с элюированием смесью DCM/MeOH (от 50:1 до 30:1, об./об.), с получением промежуточного соединения 74 (380 мг, выход: 68%) в виде белого твердого вещества.
Пример A26
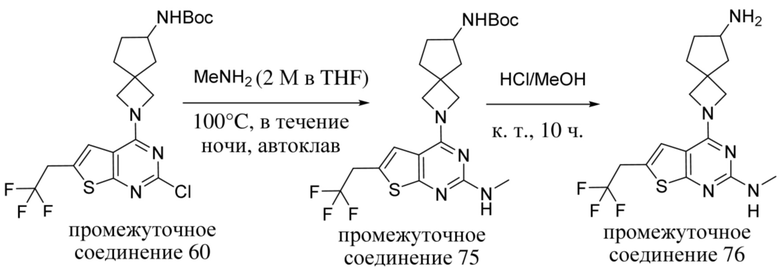
Получение промежуточного соединения 75
Перемешивали раствор промежуточного соединения 60 (700 мг, 1,47 ммоль) в метанамине (2 М в THF) (10 мл) в автоклаве при 100°C в течение ночи. Охлажденную реакционную смесь концентрировали с получением неочищенного необходимого промежуточного соединения 75 (800 мг), которое применяли для следующей стадии непосредственно без дополнительной очистки.
Получение промежуточного соединения 76
Перемешивали раствор промежуточного соединения 75 (800 мг, неочищенный продукт, примерно 1,70 ммоль) в HCl/MeOH (12 мл) при комнатной температуре в течение 10 ч Реакционную смесь концентрировали. Неочищенный продукт обрабатывали ионообменной смолой с получением необходимого промежуточного соединения 76 в виде желтого твердого вещества (700 мг, неочищенный продукт), которое применяли для следующей стадии непосредственно без дополнительной очистки.
Пример A27
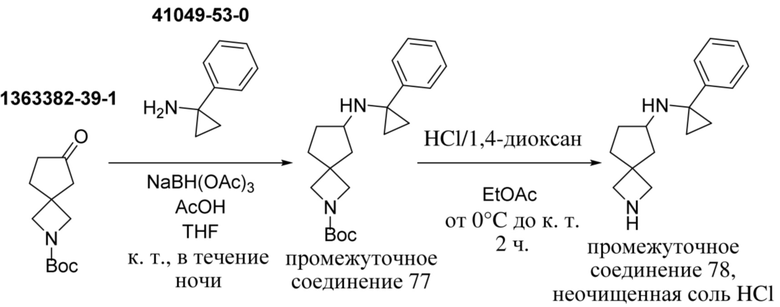
Получение промежуточного соединения 77
В перемешиваемую смесь 1-фенилциклопропан-1-амина (№ по CAS: 41049-53-0) (400 мг, 3 ммоль) и трет-бутил-6-оксо-2-азаспиро[3.4]октан-2-карбоксилата (№ по CAS: 1363382-39-1) (1,0 г, 4,5 ммоль) в THF (10 мл) при комнатной температуре добавляли AcOH (180 мг, 3 ммоль). После перемешивания при комнатной температуре в течение 4 ч добавляли порциями NaBH(OAc)3 (1,91 г, 9,01 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли с помощью H2O (20 мл) и экстрагировали с помощью EtOAc (20 мл × 3). Объединенные органические экстракты промывали солевым раствором (20 мл), высушивали над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (элюент: PE/EA=3/1, об./об.) с получением промежуточного соединения 77 (240 мг, выход 23%) в виде желтой смолы.
Получение промежуточного соединения 78
В перемешиваемый раствор промежуточного соединения 77 (240 мг, 0,7 ммоль) в EtOAc (3 мл) при 0°C добавляли HCl (4 М в 1,4-диоксане) (10 мл). После перемешивания при комнатной температуре в течение 2 ч реакционную смесь концентрировали при пониженном давлении с получением промежуточного соединения 78 (330 мг, неочищенная соль HCl) в виде желтой смолы, которую применяли непосредственно для следующей стадии без дополнительной очистки.
Пример A28
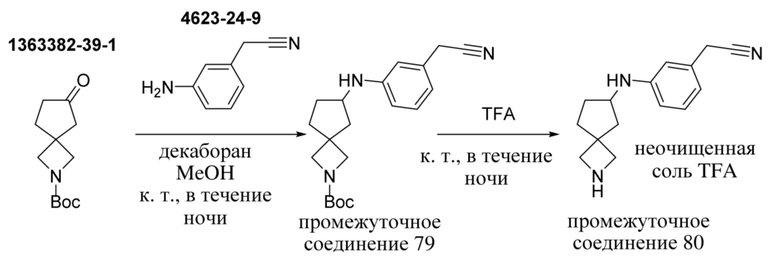
Получение промежуточного соединения 79
В перемешиваемый раствор трет-бутил-6-оксо-2-азаспиро[3.4]октан-2-карбоксилата (№ по CAS: 1363382-39-1) (225 мг, 1,0 ммоль) и 2-(3-аминофенил)ацетонитрила (№ по CAS: 4623-24-9) (136 мг, 1,03 ммоль) в MeOH (10 мл) добавляли декаборан (№ по CAS: 17702-41-9) (43 мг, 0,35 ммоль). После перемешивания при комнатной температуре в течение ночи реакционную смесь концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (элюент: PE/EtOAc=3/1, об./об.) с получением промежуточного соединения 79 (340 мг, выход 99%) в виде белого твердого вещества.
Получение промежуточного соединения 80
В раствор промежуточного соединения 79 (340 мг, 1,0 ммоль) в DCM (2 мл) добавляли TFA (2 мл). После перемешивания при комнатной температуре в течение ночи смесь концентрировали с получением промежуточного соединения 80 (300 мг, неочищенная соль TFA), которое применяли для следующей стадии без дополнительной очистки.
Пример A30
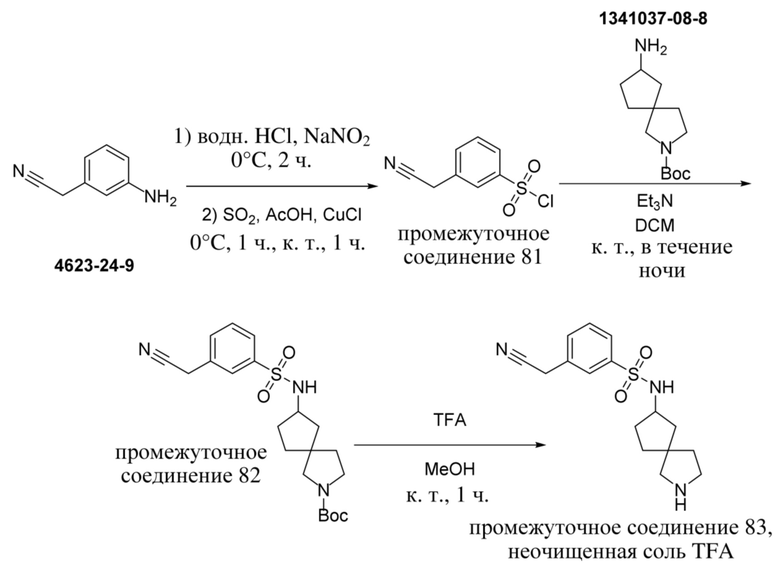
Получение промежуточного соединения 81
В перемешиваемую суспензию 2-(3-аминофенил)ацетонитрила (№ по CAS: 4623-24-9) (300 мг, 2,28 ммоль) в 20 вес. % водн. растворе HCl (3 мл), охлажденную с помощью ледяной бани, добавляли по каплям раствор NaNO2 (156 мг, 2,28 ммоль) в H2O (3 мл). Смесь перемешивали при охлаждении на ледяной бане в течение 2 ч с получением раствора соли диазония.
Перемешиваемый раствор AcOH (9 мл) и H2O (2 мл), охлажденный с помощью ледяной бани, барботировали с помощью SO2 (1,16 г, 18,2 ммоль). В полученный перемешиваемый раствор медленно добавляли CuCl (57 мг, 0,57 ммоль) и раствор соли диазония. Реакционную смесь перемешивали и охлаждали с помощью ледяной бани в течение 1 ч и при комнатной температуре в течение еще 1 ч Реакционную смесь выливали в ледяную воду и экстрагировали с помощью DCM (100 мл × 3). Объединенные органические экстракты промывали насыщенным водн. раствором NaHCO3, высушивали над безводным Na2SO4, фильтровали и концентрировали с получением промежуточного соединения 81 (70 мг, выход 14%), которое применяли непосредственно для следующей стадии без дополнительной очистки.
Получение промежуточного соединения 82
В перемешиваемый раствор трет-бутил-7-амино-2-азаспиро[4.4]нонан-2-карбоксилата (№ по CAS: 1341037-08-8) (75 мг, 0,32 ммоль) в DCM (1 мл) добавляли промежуточное соединение 81 (70 мг, 0,32 ммоль) и Et3N (65 мг, 0,64 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали с получением промежуточного соединения 82 (130 мг, неочищенное вещество), которое применяли непосредственно для следующей стадии без дополнительной очистки.
Получение промежуточного соединения 83
В перемешиваемый раствор промежуточного соединения 82 (130 мг, неочищенный продукт, примерно 0,31 ммоль) в MeOH (2 мл) добавляли TFA (1 мл). После перемешивания при комнатной температуре в течение 1 ч смесь концентрировали при пониженном давлении с получением промежуточного соединения 83 (150 мг, неочищенная соль TFA) в виде коричневого масла, которое применяли непосредственно для следующей стадии без дополнительной очистки.
Пример A31
Получение промежуточных соединений 84 и 85
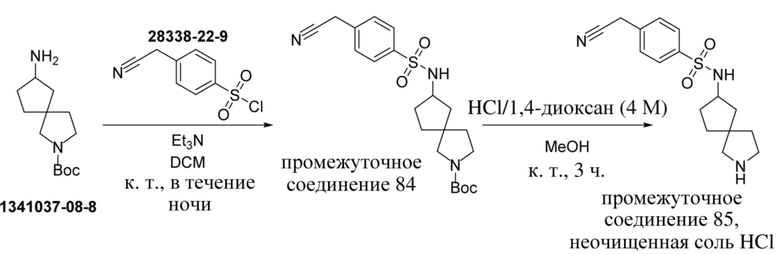
Промежуточное соединение 84 и промежуточное соединение 85 (соль HCl) получали соответственно с помощью протокола реакции, аналогичного описанному для получения промежуточного соединения 82 и промежуточного соединения 83 соответственно, начиная с соответствующих исходных веществ. Для получения промежуточного соединения 85 в качестве кислоты применяли HCl вместо TFA.
Пример A32
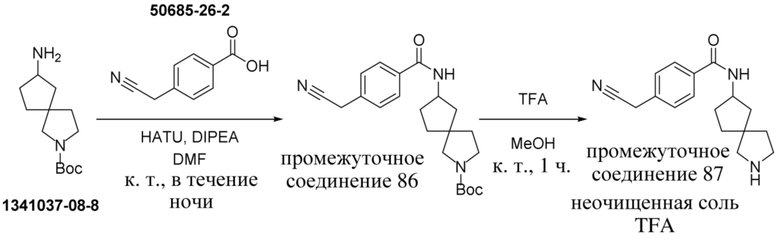
Получение промежуточного соединения 86
В перемешиваемый раствор трет-бутил-7-амино-2-азаспиро[4.4]нонан-2-карбоксилата (№ по CAS: 1341037-08-8) (50 мг, 0,21 ммоль) в DMF (1 мл) добавляли 4-(цианометил)бензойную кислоту (№ по CAS: 50685-26-2) (34 мг, 0,21 ммоль), HATU (119 мг, 0,31 ммоль) и DIPEA (54 мг, 0,42 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли водой (50 мл) и экстрагировали с помощью EtOAc (50 мл × 3). Объединенные органические экстракты промывали водой (50 мл × 3), высушивали над безводным Na2SO4, фильтровали и концентрировали с получением промежуточного соединения 86 (70 мг, выход 86%), которое применяли непосредственно для следующей стадии без дополнительной очистки.
Получение промежуточного соединения 87
В перемешиваемый раствор промежуточного соединения 86 (70 мг, 0,183 ммоль) в MeOH (2 мл) добавляли TFA (1 мл). После перемешивания при комнатной температуре в течение 1 ч реакционную смесь концентрировали при пониженном давлении с получением промежуточного соединения 87 (90 мг, неочищенная соль TFA) в виде коричневого масла, которое применяли непосредственно для следующей стадии без дополнительной очистки.
Пример A33
Получение промежуточных соединений 88 и 89
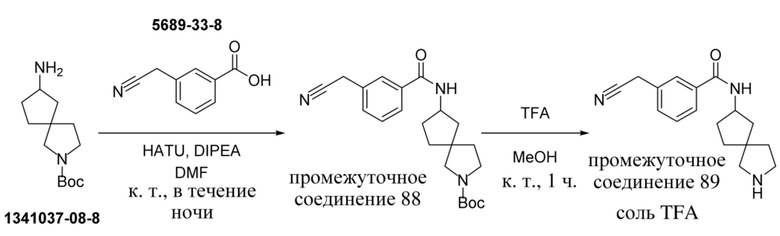
Промежуточное соединение 88 и промежуточное соединение 89 (соль TFA) получали соответственно с помощью протокола реакции, аналогичного описанному для получения промежуточного соединения 86 и промежуточного соединения 87 соответственно, начиная с соответствующих исходных веществ.
Пример A34
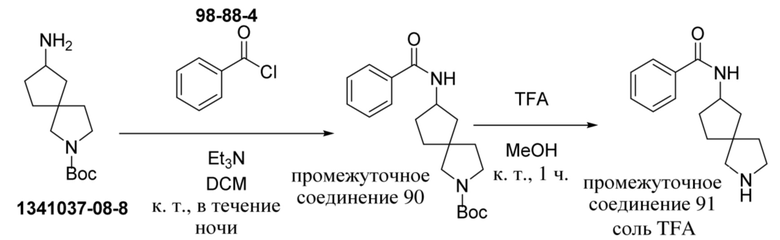
Получение промежуточного соединения 90
В перемешиваемый раствор трет-бутил-7-амино-2-азаспиро[4.4]нонан-2-карбоксилата (№ по CAS: 1341037-08-8) (50 мг, 0,21 ммоль) в DCM (1 мл) добавляли бензоилхлорид (44 мг, 0,31 ммоль) и Et3N (42 мг, 0,42 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали с получением промежуточного соединения 90 (70 мг, неочищенный продукт, выход 100%) в виде коричневого масла, которое применяли непосредственно для следующей стадии без дополнительной очистки.
Получение промежуточного соединения 91
Промежуточное соединение 91 (соль TFA) получали с помощью протокола реакции, аналогичного описанному для получения промежуточного соединения 87, начиная с соответствующих исходных веществ.
Пример A35
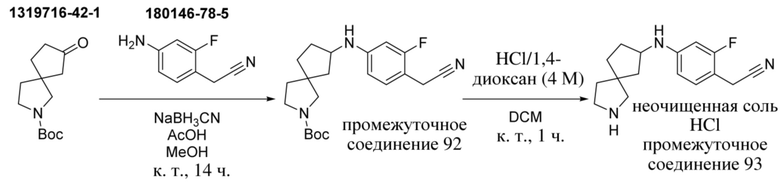
Получение промежуточного соединения 92
В перемешиваемый раствор трет-бутил-7-оксо-2-азаспиро[4.4]нонан-2-карбоксилата (№ по CAS: 1319716-42-1) (60 мг, 0,251 ммоль) и 2-(4-амино-2-фторфенил)ацетонитрила (№ по CAS: 180146-78-5) (38 мг, 0,251 ммоль) в MeOH (10 мл) добавляли AcOH (одну каплю). Реакционную смесь перемешивали при комнатной температуре в течение 12 ч. Добавляли NaBH3CN (32 мг, 0,502 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение еще 2 ч. Реакционную смесь разбавляли водой (20 мл) и экстрагировали с помощью EtOAc (50 мл × 3). Объединенные органические экстракты промывали солевым раствором, высушивали над безводным Na2SO4, фильтровали и фильтрат концентрировали. Остаток очищали с помощью хроматографии на силикагеле, с элюированием смесью PE/EA (4/1, об./об.), с получением промежуточного соединения 92 (56 мг, 60%) в виде желтого масла.
Получение промежуточного соединения 93
В перемешиваемый раствор промежуточного соединения 92 (56 мг, 0,150 ммоль) в DCM (5 мл) добавляли смесь HCl/1,4-диоксан (4 М) (5 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь концентрировали с получением промежуточного соединения 93 (40 мг, неочищенная соль HCl), которое применяли для следующей стадии без дополнительной очистки.
Пример A36
Получение промежуточных соединений 94, 95, 96, 97, 98 и 99
Промежуточные соединения 94, 95, 96, 97, 98 и 99 получали из их соответствующих исходных веществ за 2 стадии с применением протоколов реакций, аналогичных описанным для получения промежуточного соединения 93 (с помощью промежуточного соединения 92), начиная с трет-бутил-7-оксо-2-азаспиро[4.4]нонан-2-карбоксилата (№ по CAS: 1319716-42-1) и соответствующих аминов.
(из 2-(4-аминофенил)-2-метилпропаннитрила, № по CAS: 115279-57-7)
промежуточное соединение 92
Стадия 2:
промежуточное соединение 93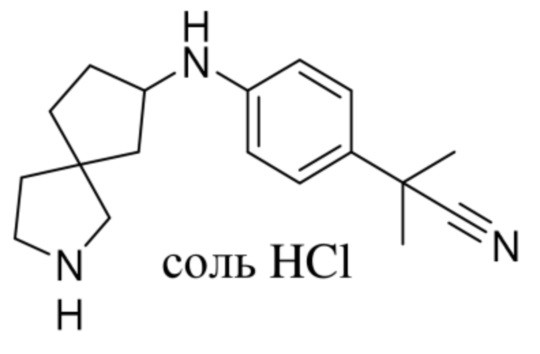
(из 1-(4-аминофенил)циклопропан-1-карбонитрила, № по CAS: 108858-86-2)
промежуточное соединение 92
Стадия 2:
промежуточное соединение 93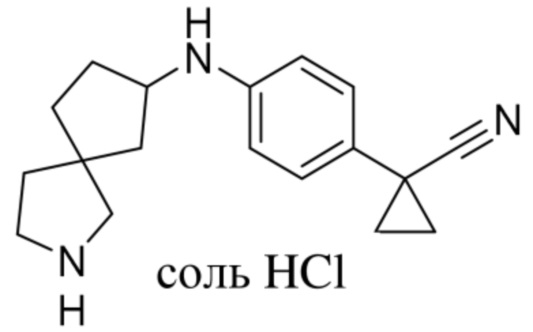
(из 3-аминобензонитрила, № по CAS: 2237-30-1)
промежуточное соединение 92
Стадия 2:
промежуточное соединение 93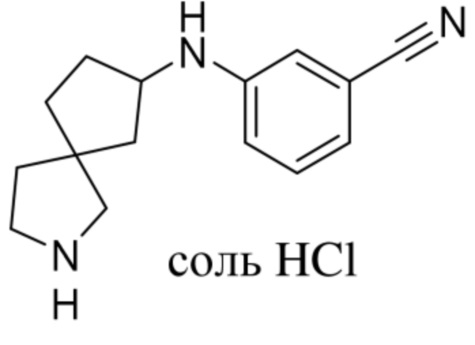
(из 4-амино-N-метилбензамида, № по CAS: 6274-22-2)
промежуточное соединение 92
Стадия 2:
промежуточное соединение 93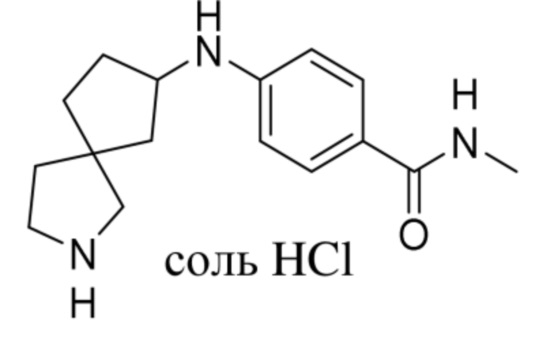
промежуточное соединение 92
Стадия 2:
промежуточное соединение 93 (в качестве кислоты применяли TFA) 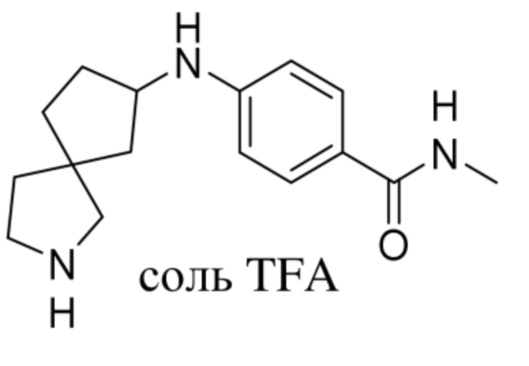
(из 4-(1H-пиразол-3-ил)анилина, № по CAS: 89260-45-7)
промежуточное соединение 92
Стадия 2:
промежуточное соединение 93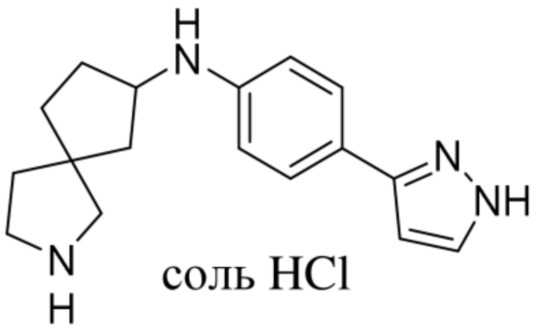
промежуточное соединение 92
Стадия 2:
промежуточное соединение 93
(в качестве кислоты применяли TFA)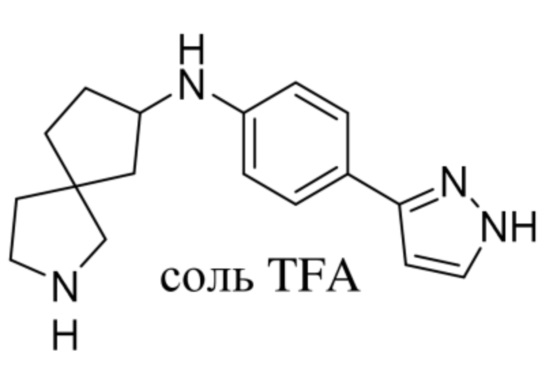
(из 2-(4-аминофенил)ацетонитрила, № по CAS: 3544-25-0)
промежуточное соединение 92
Стадия 2:
промежуточное соединение 93 с применением TFA для удаления защитной Boc-группы
Пример A37
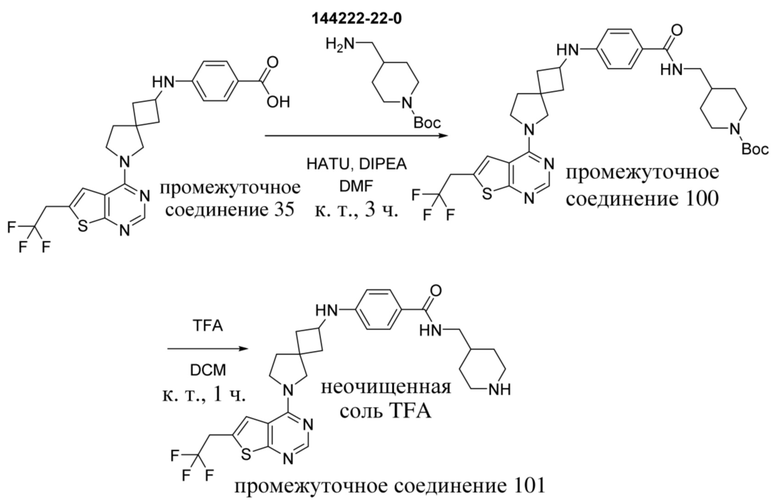
Получение промежуточного соединения 100
В перемешиваемый раствор промежуточного соединения 35 (200 мг, 0,43 ммоль) в DMF (2 мл) добавляли трет-бутил-4-(аминометил)пиперидин-1-карбоксилат (№ по CAS: 144222-22-0) (92 мг, 0,43 ммоль), HATU (196 мг, 0,52 ммоль) и DIPEA (168 мг, 1,29 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь разбавляли водой (20 мл) и экстрагировали с помощью EtOAc (20 мл × 3). Объединенные органические экстракты промывали водой (20 мл × 3), высушивали над безводным Na2SO4, фильтровали и фильтрат концентрировали. Остаток очищали с помощью хроматографии на силикагеле, с элюированием смесью DCM/MeOH (20/1, об./об.), с получением промежуточного соединения 100 (238 мг, выход 84%).
Получение промежуточного соединения 101
В перемешиваемый раствор промежуточного соединения 100 (238 мг, 0,36 ммоль) в DCM (2 мл) добавляли TFA (1 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь концентрировали с получением промежуточного соединения 101 (218 мг, неочищенная соль TFA, выход 100%) в виде коричневого масла, которое применяли непосредственно для следующей стадии без дополнительной очистки.
Пример A38
Получение промежуточного соединения 102
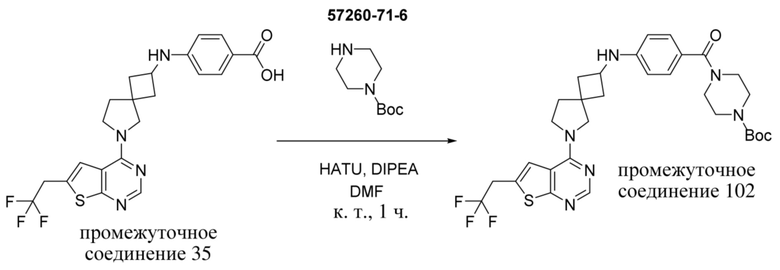
В перемешиваемый раствор промежуточного соединения 35 (300 мг, 0,65 ммоль) в DMF (10 мл) при комнатной температуре добавляли HATU (247 мг, 0,65 ммоль) и DIPEA (251 мг, 1,95 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 5 минут и добавляли трет-бутилпиперазин-1-карбоксилат (№ по CAS: 57260-71-6) (145 мг, 0,78 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 1 ч. Смесь выливали в H2O (50 мл) и экстрагировали с помощью EtOAc (50 мл × 3). Объединенные органические экстракты промывали с помощью H2O, солевым раствором, высушивали над безводным Na2SO4, фильтровали и фильтрат концентрировали с получением промежуточного соединения 102 (279 мг, выход 68%) в виде желтого масла.
Пример A39
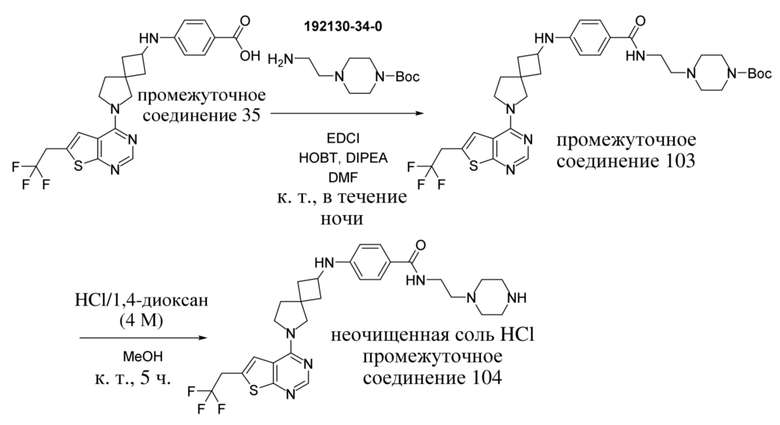
Получение промежуточного соединения 103
В перемешиваемую суспензию трет-бутил-4-(2-аминоэтил)пиперазин-1-карбоксилата (№ по CAS: 192130-34-0) (297 мг, 1,68 ммоль) и промежуточного соединения 35 (600 мг, 1,29 ммоль) в DMF (4 мл) при комнатной температуре добавляли HOBT (350 мг, 2,59 ммоль), EDCI (498 мг, 2,59 ммоль) и DIPEA (502 мг, 3,89 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли с помощью насыщенного водного раствора NH4Cl (50 мл), при этом осаждалось твердое вещество. Полученную смесь фильтровали. Осадок на фильтре собирали и высушивали с получением промежуточного соединения 103 (600 мг, выход 68%).
Получение промежуточного соединения 104
В перемешиваемый раствор промежуточного соединения 103 (600 мг, 0,89 ммоль) в MeOH (12 мл) добавляли HCl/1,4-диоксан (4 М) (4 мл). Реакционную смесь перемешивали при комнатной температуре в течение 5 ч. Реакционную смесь концентрировали с получением промежуточного соединения 104 (600 мг, неочищенная соль HCl), которое применяли для следующей стадии без дополнительной очистки.
Пример A40
Получение промежуточных соединений 105 и 106
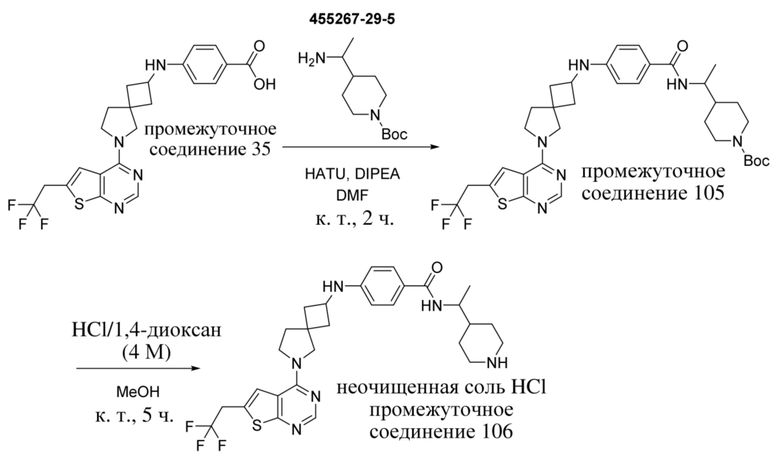
Промежуточное соединение 105 и промежуточное соединение 106 (соль HCl) получали соответственно с помощью протокола реакции, аналогичного описанному для получения промежуточного соединения 100 и промежуточного соединения 104 соответственно, начиная с соответствующих исходных веществ.
Пример A41
Получение промежуточных соединений 107 и 108
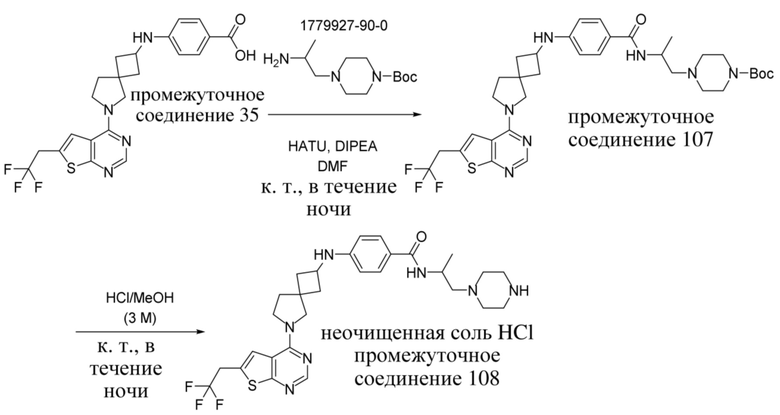
Промежуточное соединение 107 и промежуточное соединение 108 (соль HCl) получали соответственно с помощью протокола реакции, аналогичного описанному для получения промежуточного соединения 100 и промежуточного соединения 104 соответственно, с применением смеси HCl/MeOH (3 М) вместо смеси HCl/1,4-диоксан (4 М) для удаления защитной Boc-группы, начиная с соответствующих исходных веществ.
Пример A42
Получение промежуточных соединений 109 и 110
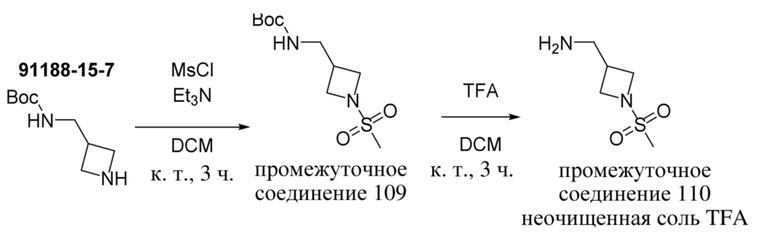
Получение промежуточного соединения 109
Перемешивали раствор 3-(N-Boc-аминометил)азетидина (№ по CAS: 91188-15-7) (300 мг, 1,612 ммоль), метансульфонилхлорида (202 мг, 1,774 ммоль) и Et3N (488 мг, 4,836 ммоль) в DCM (10 мл) при комнатной температуре в течение 3 ч. Реакционную смесь разбавляли водой (20 мл) и экстрагировали с помощью EtOAc (50 мл × 3). Объединенные органические экстракты промывали солевым раствором, высушивали над безводным Na2SO4 и фильтровали. Фильтрат концентрировали и остаток очищали с помощью хроматографии на силикагеле, элюировали с помощью CH2Cl2/MeOH (20/1, об./об.) с получением промежуточного соединения 109 (357 мг, выход 84%) в виде желтого твердого вещества.
Получение промежуточного соединения 110
В перемешиваемый раствор промежуточного соединения 109 (357 мг, 1,352 ммоль) в DCM (10 мл) добавляли TFA (10 мл). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч и затем концентрировали с получением промежуточного соединения 110 (220 мг, неочищенная соль TFA), которое применяли для следующей стадии без дополнительной очистки.
Пример A43
Получение промежуточных соединений 111 и 112
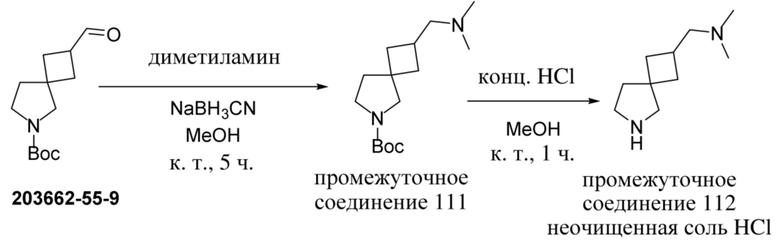
Получение промежуточного соединения 111
В перемешиваемый раствор трет-бутил-2-формил-6-азаспиро[3.4]октан-6-карбоксилата (№ по CAS: 203662-55-9) (150 мг, 0,627 ммоль) и диметиламина (2 М в MeOH) (0,63 мл, 1,26 ммоль) в MeOH (4 мл) при комнатной температуре добавляли NaBH3CN (118 мг, 1,88 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 5 ч. Реакционную смесь разбавляли водой (20 мл) и экстрагировали с помощью EtOAc (50 мл × 3). Объединенные органические экстракты промывали солевым раствором, высушивали над безводным Na2SO4, фильтровали и концентрировали с получением неочищенного промежуточного соединения 111 (120 мг), которое применяли для следующей стадии без дополнительной очистки.
Получение промежуточного соединения 112
В перемешиваемый раствор неочищенного промежуточного соединения 111 (120 мг, примерно 0,627 ммоль) в MeOH (5 мл) при комнатной температуре добавляли конц. HCl (12 М, 3 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь концентрировали до сухого состояния с получением промежуточного соединения 112 (100 мг, неочищенная соль HCl), которое применяли для следующей стадии без дополнительной очистки.
Пример A44
Получение промежуточных соединений 113 и 114
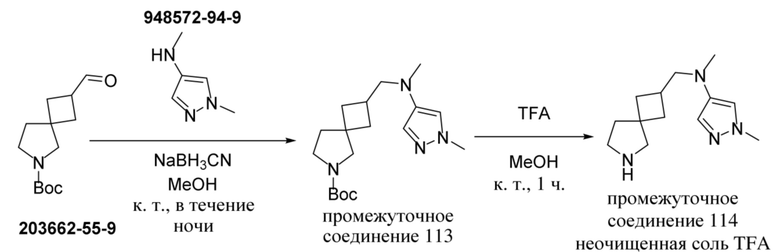
Получение промежуточного соединения 113
В перемешиваемый раствор N,1-диметил-1H-пиразол-4-амина (№ по CAS: 948572-94-9) (50 мг, 0,450 ммоль) в MeOH (1 мл) при комнатной температуре добавляли трет-бутил-2-формил-6-азаспиро[3.4]октан-6-карбоксилат (№ по CAS: 203662-55-9) (162 мг, 0,68 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 30 минут. Добавляли NaBH3CN (57 мг, 0,90 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли водой (50 мл) и экстрагировали с помощью EtOAc (50 мл × 3). Объединенные органические экстракты промывали водой (50 мл × 3), высушивали над безводным Na2SO4, фильтровали и фильтрат концентрировали с получением неочищенного промежуточного соединения 113 (150 мг), которое применяли непосредственно для следующей стадии без дополнительной очистки.
Получение промежуточного соединения 114
В перемешиваемый раствор промежуточного соединения 113 (150 мг, неочищенный продукт, примерно 0,450 ммоль) в MeOH (2 мл) при комнатной температуре добавляли TFA (1 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь концентрировали с получением промежуточного соединения 114 (160 мг, неочищенная соль TFA) в виде коричневого масла, которое применяли непосредственно для следующей стадии без дополнительной очистки.
Пример A45
Получение промежуточных соединений 115 и 116
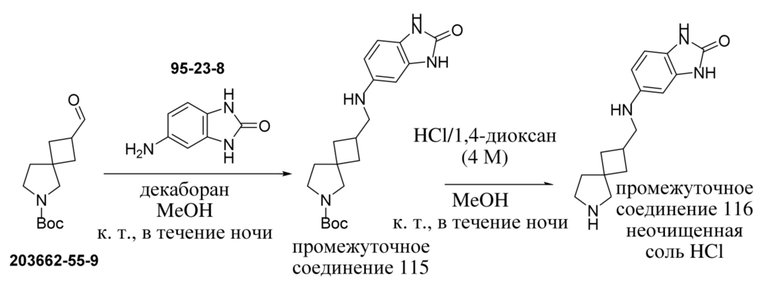
Получение промежуточного соединения 115
В перемешиваемый раствор трет-бутил-2-формил-6-азаспиро[3.4]октан-6-карбоксилата (№ по CAS: 203662-55-9) (120 мг, 0,501 ммоль) в MeOH (3,0 мл) при комнатной температуре добавляли 5-амино-1,3-дигидро-2H-бензо[d]имидазол-2-он (№ по CAS: 95-23-8) (85 мг, 1,0 ммоль) и декаборан (11 мг, 0,1 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли водой (10 мл) и экстрагировали с помощью CH2Cl2 (20 мл × 3). Объединенные органические экстракты промывали солевым раствором, высушивали над безводным Na2SO4 и фильтровали. Фильтрат концентрировали in vacuo с получением неочищенного промежуточного соединения 115 (220 мг), которое применяли для следующей стадии без дополнительной очистки.
Получение промежуточного соединения 116
В перемешиваемый раствор промежуточного соединения 115 (220 мг, неочищенный продукт, примерно 0,501 ммоль) в MeOH (4,0 мл) добавляли смесь HCl/1,4-диоксан (4 М) (4,0 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали in vacuo с получением необходимого промежуточного соединения 116 (250 мг, неочищенная соль HCl), которое применяли для следующей стадии без дополнительной очистки.
Пример A46
Получение промежуточных соединений 117 и 118
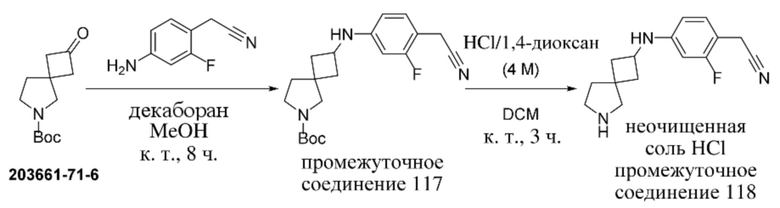
Получение промежуточного соединения 117
В перемешиваемый раствор 2-(4-амино-2-фторфенил)ацетонитрила (№ по CAS: 180146-78-5) (220 мг, 1,47 ммоль) и трет-бутил-2-формил-6-азаспиро[3.4]октан-6-карбоксилата (№ по CAS: 203662-55-9) (330 мг, 1,46 ммоль) в MeOH (4 мл) при комнатной температуре добавляли декаборан (53 мг, 0,44 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 8 ч. Реакционную смесь разбавляли водой (20 мл) и экстрагировали с помощью EtOAc (50 мл × 3). Объединенные органические экстракты промывали солевым раствором, высушивали над безводным Na2SO4 и фильтровали. Фильтрат концентрировали и остаток очищали с помощью хроматографии на силикагеле, элюировали с помощью PE/EA (10/1, об./об.) с получением промежуточного соединения 117 (380 мг, выход 72%) в виде белого твердого вещества.
Получение промежуточного соединения 118
В перемешиваемый раствор промежуточного соединения 117 (380 мг, 1,06 ммоль) в DCM (2 мл) при комнатной температуре добавляли смесь HCl/1,4-диоксан (4 М) (2 мл). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь концентрировали с получением промежуточного соединения 118 (250 мг, неочищенная соль HCl, выход 91%) в виде белого твердого вещества.
Пример A47
Получение промежуточных соединений 119 и 120
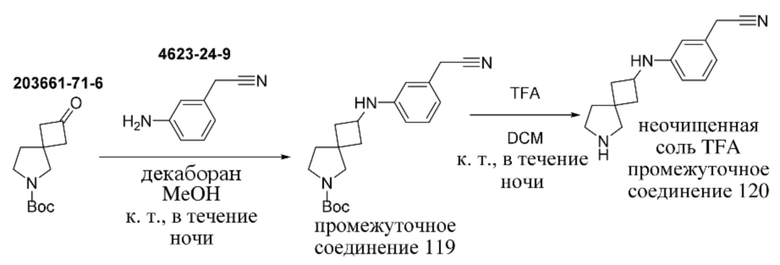
Получение промежуточного соединения 119
В перемешиваемый раствор трет-бутил-2-формил-6-азаспиро[3.4]октан-6-карбоксилата (№ по CAS: 203662-55-9) (225 мг, 1,0 ммоль) и 2-(3-аминофенил)ацетонитрила (№ по CAS: 4623-24-9) (136 мг, 1,03 ммоль) в MeOH (10 мл) при комнатной температуре добавляли декаборан (43 мг, 0,35 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали. Остаток очищали с помощью хроматографии на силикагеле, с элюированием смесью PE/EtOAc (3/1, об./об.), с получением промежуточного соединения 119 (340 мг, выход 99%) в виде желтого твердого вещества.
Получение промежуточного соединения 120
В перемешиваемый раствор промежуточного соединения 119 (340 мг, 1,0 ммоль) в DCM (2 мл) при комнатной температуре добавляли TFA (2 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали с получением промежуточного соединения 120 (400 мг, неочищенная соль TFA), которое применяли для следующей стадии без дополнительной очистки.
Пример A48
Получение промежуточных соединений 121 и 122

Промежуточное соединение 121 и промежуточное соединение 122 получали соответственно с помощью протокола реакции, аналогичного описанному для получения промежуточного соединения 119 и промежуточного соединения 120 соответственно, начиная с соответствующих исходных веществ. Промежуточное соединение 122 получали в виде свободного основания (повышали основность реакционной смеси с помощью водного раствора NaHCO3).
Пример A49
Получение промежуточных соединений 123 и 124
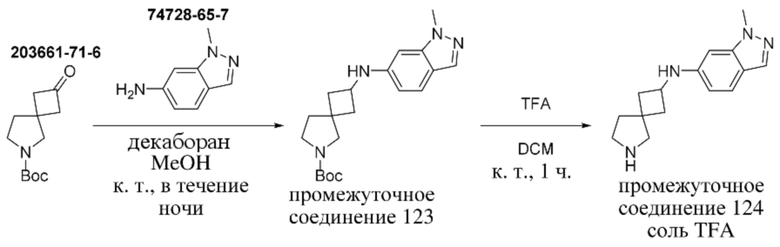
Промежуточное соединение 123 и промежуточное соединение 124 (соль TFA) получали соответственно с помощью протокола реакции, аналогичного описанному для получения промежуточного соединения 119 и промежуточного соединения 120 соответственно, начиная с соответствующих исходных веществ.
Пример A50
Получение промежуточных соединений 125 и 126
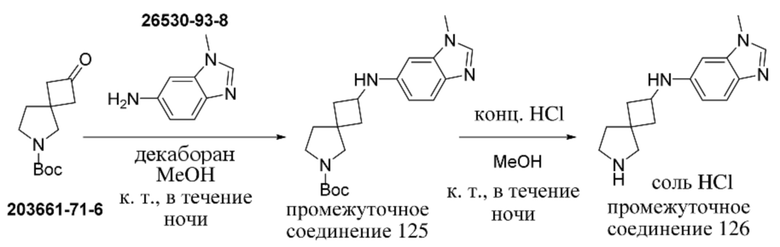
Промежуточное соединение 125 и промежуточное соединение 126 (соль HCl) получали соответственно с помощью протокола реакции, аналогичного описанному для получения промежуточного соединения 119 и промежуточного соединения 112 соответственно, начиная с соответствующих исходных веществ.
Пример A51
Получение промежуточных соединений 127, 128, 129, 130, 131, 132, 133 и 134
Промежуточные соединения 127, 128, 129, 130, 131, 132, 133 и 134 получали из их соответствующих исходных веществ за 2 стадии (восстановительное аминирование и затем удаление защитной группы) с применением протоколов реакций, аналогичных описанным для получения промежуточного соединения 120 или промежуточного соединения 116, начиная с соответствующих исходных веществ.
(из трет-бутил-2-оксо-6-азаспиро[3.4]октан-6-карбоксилата, № по CAS: 203661-71-6, и 2-(4-амино-3-хлорфенил)ацетонитрила, № по CAS: 80199-02-6)
промежуточное соединение 119
Стадия 2:
промежуточное соединение 120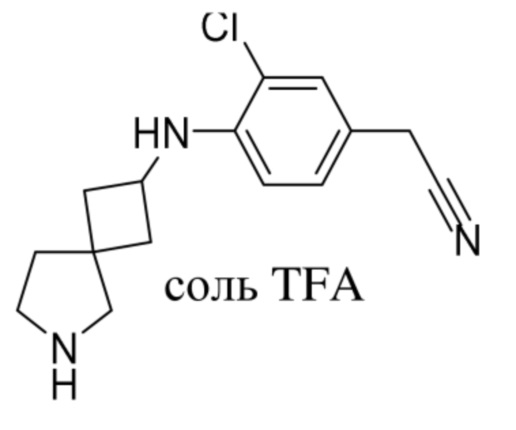
(из трет-бутил-2-оксо-6-азаспиро[3.4]октан-6-карбоксилата, № по CAS: 203661-71-6, и 2-(4-амино-2-хлорфенил)ацетонитрила, № по CAS: 180150-18-9)
Стадия 2: промежуточное соединение 116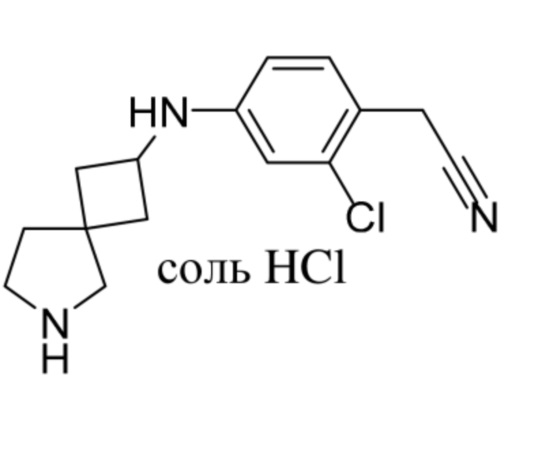
(из трет-бутил-2-оксо-6-азаспиро[3.4]октан-6-карбоксилата, № по CAS: 203661-71-6, и 4-амино-N,3-диметилбензамида, № по CAS: 926263-13-0)
Стадия 2: промежуточное соединение 116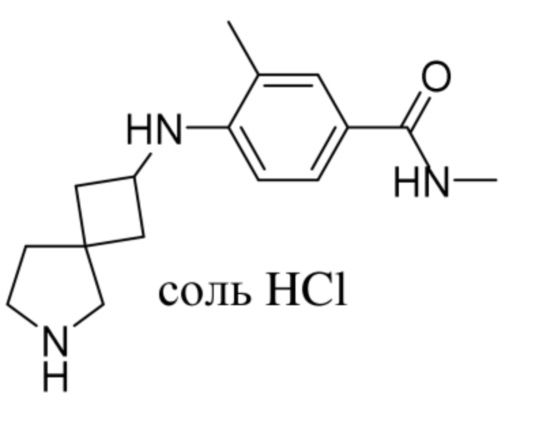
(из трет-бутил-2-оксо-6-азаспиро[3.4]октан-6-карбоксилата, № по CAS: 203661-71-6, и 4-амино-2-хлор-N-метилбензамида, № по CAS: 926203-17-0)
Стадия 2: промежуточное соединение 116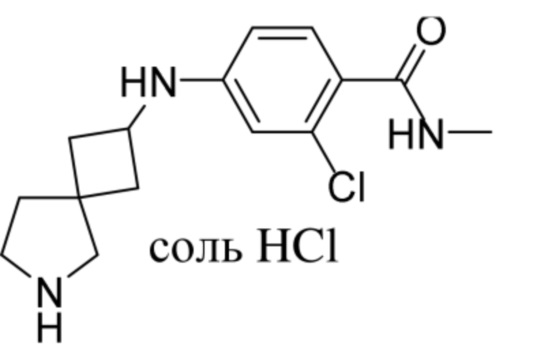
(из трет-бутил-2-оксо-6-азаспиро[3.4]октан-6-карбоксилата, № по CAS: 203661-71-6, и 3-метилбензо[d]изоксазол-6-амина, № по CAS: 157640-14-7)
промежуточное соединение 119
Стадия 2:
промежуточное соединение 120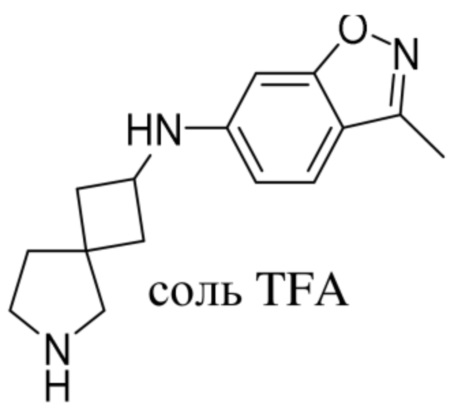
(из трет-бутил-2-оксо-6-азаспиро[3.4]октан-6-карбоксилата, № по CAS: 203661-71-6, и 1-метил-1H-бензо[d][1,2,3]триазол-6-амина, № по CAS: 26861-23-4)
промежуточное соединение 119
Стадия 2:
промежуточное соединение 120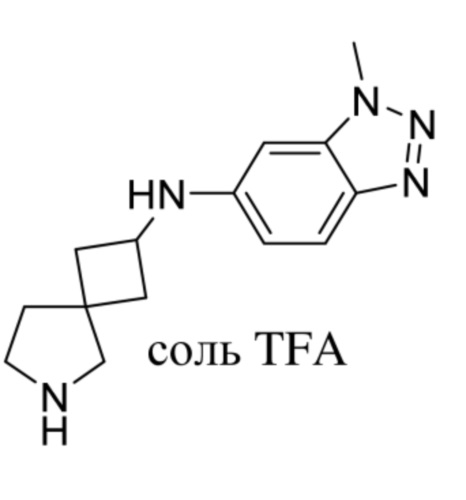
(из трет-бутил-2-оксо-6-азаспиро[3.4]октан-6-карбоксилата, № по CAS: 203661-71-6, и 5-амино-N-метилпиколинамида, № по CAS: 941284-74-8)
Стадия 2: промежуточное соединение 116
(из трет-бутил-2-оксо-6-азаспиро[3.4]октан-6-карбоксилата, № по CAS: 203661-71-6, и 4-(морфолиносульфонил)анилина, № по CAS: 21626-70-0)
промежуточное соединение 119
Стадия 2:
промежуточное соединение 120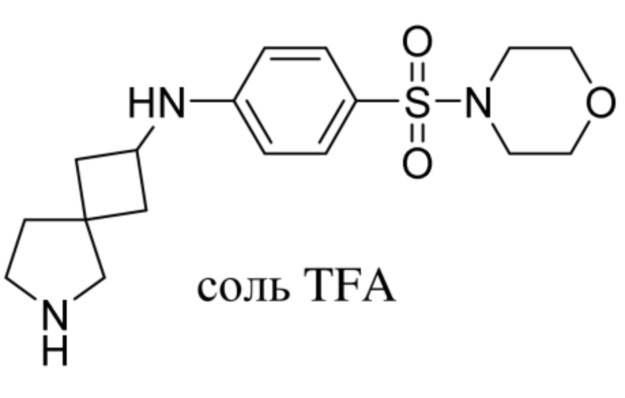
Пример A52
Получение промежуточных соединений 135, 136, 137 и 138
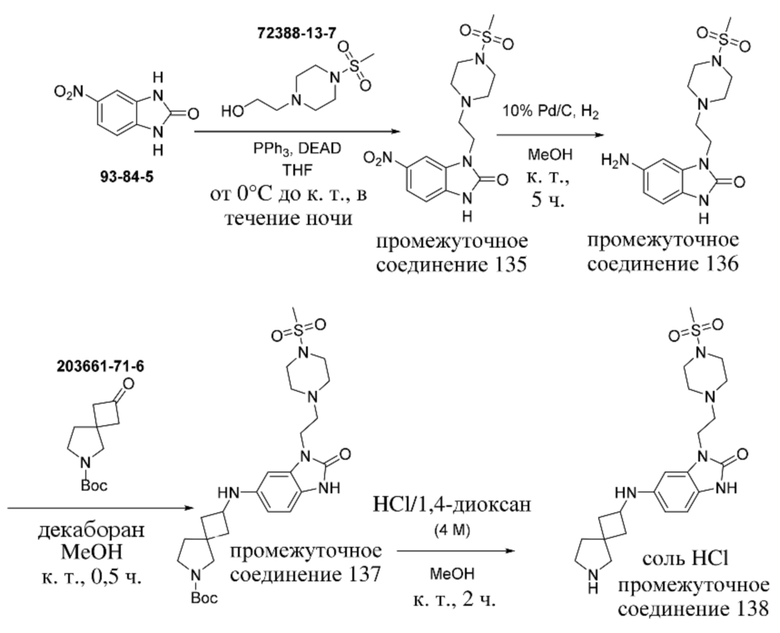
Получение промежуточного соединения 135
В перемешиваемый раствор 5-нитро-1,3-дигидро-2H-бензо[d]имидазол-2-она (№ по CAS: 93-84-5) (1,00 г, 5,58 ммоль), 2-(4-(метилсульфонил)пиперазин-1-ил)этанола (CAS: 72388-13-7) (1,16 г, 5,58 ммоль) и Ph3P (2,93 г, 11,16 ммоль) в THF (20 мл) в атмосфере Ar при 0°C добавляли DEAD (1,94 г, 11,16 ммоль). Реакционную смесь перемешивали в атмосфере Ar при комнатной температуре в течение 16 ч. Полученную смесь концентрировали и остаток очищали с помощью хроматографии на силикагеле (PE/EA=5/1, об./об.) с получением неочищенного необходимого продукта (500 мг), который дополнительно очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% TFA/H2O, B: ACN). Повышали основность полученных фракций с помощью NaHCO3 (твердое вещество), их экстрагировали с помощью ErOAc (10 мл × 3). Объединенные органические экстракты промывали солевым раствором (20 мл), высушивали над безводным Na2SO4, фильтровали и концентрировали с получением необходимого продукта (смесь двух изомеров, примерно 180 мг) в виде белого твердого вещества. Затем продукт разделяли с помощью SFC (SFC80, Waters; IA-H (2,5 × 25 см, 2,5 × 25 см, 10 мкм; A: сверхкритический CO2, подвижная фаза B: MeOH/NH3 (100/0,1); A:B=67/33; расход: 60 мл/мин ; температура колонки (T): 25°C; противодавление (BPR): 100 бар) с получением промежуточного соединения 135 (86 мг, выход 4%, пик 2) в виде белого твердого вещества.
Получение промежуточного соединения 136
В раствор промежуточного соединения 135 (86 мг, 0,233 ммоль) в MeOH (5 мл) при комнатной температуре добавляли 10% Pd/C (10 мг). Реакционную смесь перемешивали в атмосфере H2 при комнатной температуре в течение 5 ч. Смесь фильтровали и фильтрат концентрировали с получением промежуточного соединения 136 (65 мг) в виде бледно-желтого твердого вещества.
Промежуточное соединение 137 и промежуточное соединение 138 (соль HCl) получали соответственно с помощью протокола реакции, аналогичного описанному для получения промежуточного соединения 119 и промежуточного соединения 116 соответственно, начиная с соответствующих исходных веществ.
Пример A53
Получение промежуточных соединений 139, 140, 141 и 142
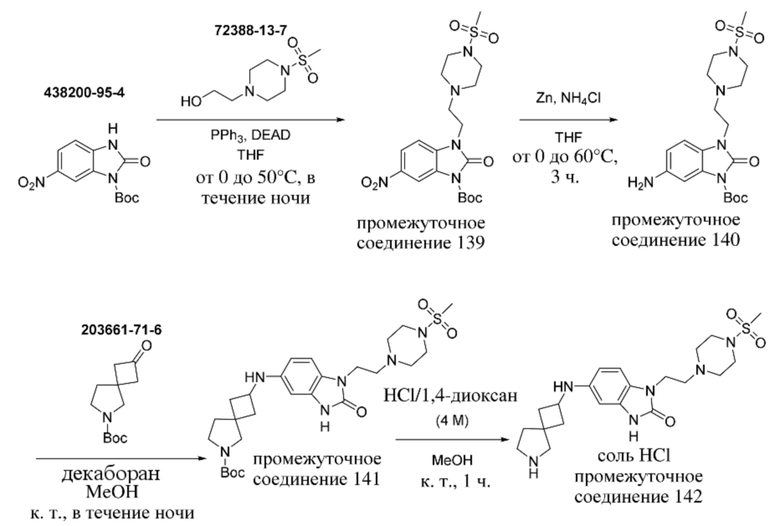
Получение промежуточного соединения 139
В перемешиваемый раствор трет-бутил-6-нитро-2-оксо-2,3-дигидро-1H-бензо[d]имидазол-1-карбоксилата (№ по CAS: 438200-95-4) (630 мг, 2,26 ммоль), 2-(4-(метилсульфонил)пиперазин-1-ил)этанола (№ по CAS: 72388-13-7) (940 мг, 4,52 ммоль) и PPh3 (11186 мг, 4,52 ммоль) в THF (30 мл) в атмосфере Ar при 0°C добавляли DEAD (984 мг, 5,65 ммоль). Реакционную смесь перемешивали в атмосфере Ar при 50°C в течение ночи. Реакционную смесь разбавляли с помощью H2O (50 мл) и экстрагировали с помощью EtOAc (3 × 50 мл). Объединенные органические экстракты промывали солевым раствором (50 мл), высушивали над безводным Na2SO4, фильтровали и фильтрат концентрировали. Остаток очищали с помощью хроматографии на силикагеле (PE: EA=1:1, об./об.). Фракции концентрировали. Остаток растворяли в смеси PE/EA (3/1, об./об., 20 мл), перемешивали при комнатной температуре в течение 16 ч, и в это время образовывался белый осадок. Смесь фильтровали и осадок на фильтре собирали с получением промежуточного соединения 139 (1,36 г, выход 59%) в виде белого твердого вещества.
Получение промежуточного соединения 140
В перемешиваемый раствор промежуточного соединения 139 (600 мг, 1,28 ммоль) в THF (10 мл) при комнатной температуре добавляли NH4Cl (410 мг, 7,68 ммоль) и Zn (498 мг, 7,68 ммоль). Реакционную смесь перемешивали при 60°C в течение 3 ч. Реакционную смесь фильтровали и фильтрат концентрировали. Остаток очищали с помощью хроматографии на силикагеле (PE: EA=1:1) с получением промежуточного соединения 140 (230 мг, выход 40%) в виде белого твердого вещества.
Промежуточное соединение 141 и промежуточное соединение 142 (соль HCl) получали соответственно с помощью протокола реакции, аналогичного описанному для получения промежуточного соединения 119 и промежуточного соединения 116 соответственно, начиная с соответствующих исходных веществ.
Пример A55
Получение промежуточных соединений 146, 147, 148 и 149

Получение промежуточного соединения 146
Перемешивали смесь 2-(бромметил)-4-нитробензонитрила (№ по CAS: 852203-01-1) (310 мг, 1,29 ммоль), морфолина (336 мг, 3,86 ммоль) и K2CO3 (532 мг, 3,86 ммоль) в CH3CN (6 мл) в атмосфере Ar при 80°C в течение ночи. Охлажденную реакционную смесь фильтровали и фильтрат концентрировали. Остаток очищали с помощью хроматографии на силикагеле, с элюированием смесью PE/EtOAc (от 10:1 до 5:1, об./об.), с получением промежуточного соединения 146 (300 мг, выход 94%) в виде желтого твердого вещества.
Получение промежуточного соединения 147
Суспензию промежуточного соединения 146 (300 мг, 1,21 ммоль) и 10% Pd/C (30 мг) в MeOH (10 мл) перемешивали в атмосфере H2 при 30°C в течение 2 ч. Реакционную смесь фильтровали через Celite и фильтрат концентрировали с получением неочищенного промежуточного соединения 147 в виде белого твердого вещества (250 мг, выход: 95%), которое применяли для следующей стадии непосредственно.
Промежуточное соединение 148 и промежуточное соединение 149 (соль TFA) получали соответственно с помощью протокола реакции, аналогичного описанному для получения промежуточного соединения 119 и промежуточного соединения 120 соответственно, начиная с соответствующих исходных веществ.
Пример A56
Получение промежуточных соединений 150, 151, 152 и 153
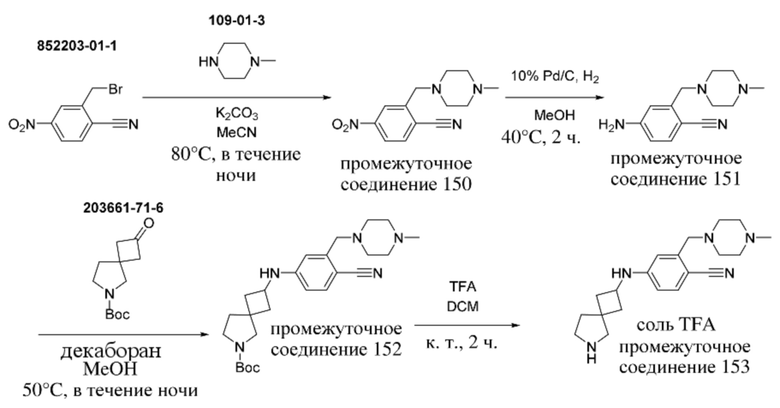
Промежуточное соединение 150, промежуточное соединение 151, промежуточное соединение 152 и промежуточное соединение 153 (соль TFA) получали соответственно с помощью протокола реакции, аналогичного описанному для получения промежуточного соединения 146, промежуточного соединения 147, промежуточного соединения 119 и промежуточного соединения 120 соответственно, начиная с соответствующих исходных веществ.
Пример A57
Получение промежуточных соединений 154, 155 и 156
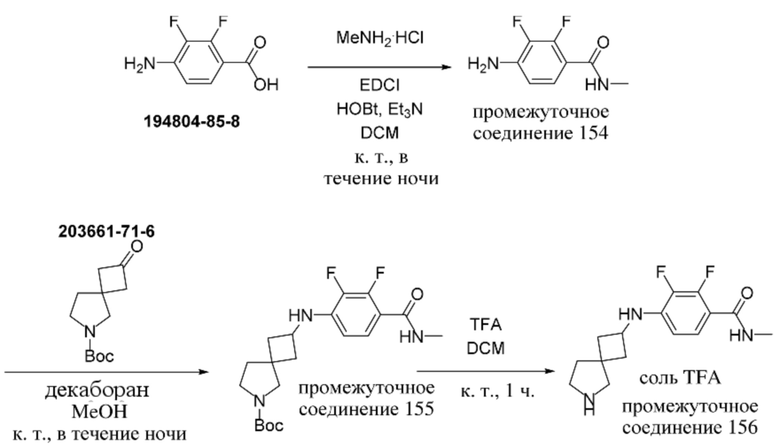
Получение промежуточного соединения 154
В перемешиваемый раствор 4-амино-2,3-дифторбензойной кислоты (№ по CAS: 194804-85-8) (500 мг, 2,89 ммоль) в DMF (10 мл) при комнатной температуре добавляли HOBt (585 мг, 4,34 ммоль), EDCI (832 мг, 4,34 ммоль), Et3N (1,2 г, 11,56 ммоль) и гидрохлорид метиламина (MeNH2·HCl) (390 мг, 5,78 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли водой (50 мл) и экстрагировали с помощью EtOAc (50 мл × 3). Объединенные органические слои промывали водой (50 мл × 3), высушивали над безводным Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью колоночной хроматографии на силикагеле, с элюированием смесью DCM/MeOH (от 30/1 до 20/1, об./об.), с получением промежуточного соединения 154 (360 мг, выход 67%) в виде коричневого твердого вещества.
Промежуточное соединение 155 и промежуточное соединение 156 (соль TFA) получали соответственно с помощью протокола реакции, аналогичного описанному для получения промежуточного соединения 119 и промежуточного соединения 120 соответственно, начиная с соответствующих исходных веществ.
Пример A58
Получение промежуточных соединений 157, 158 и 159
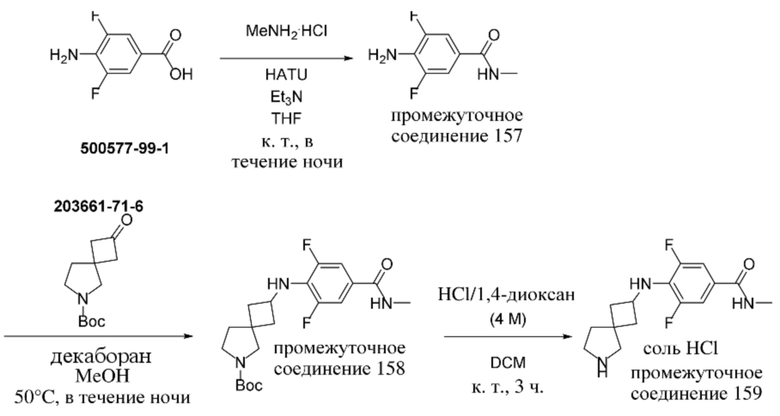
Получение промежуточного соединения 157
Перемешивали смесь 4-амино-3,5-дифторбензойной кислоты (№ по CAS: 500577-99-1) (500 мг, 2,89 ммоль), гидрохлорида метиламина (393 мг, 5,78 ммоль), HATU (1098 мг, 2,89 ммоль) и Et3N (875 мг, 8,67 ммоль) в THF (10 мл) при комнатной температуре в течение ночи. Реакционную смесь разбавляли водой (20 мл) и экстрагировали с помощью EtOAc (50 мл × 3). Объединенные органические экстракты промывали солевым раствором, высушивали над безводным Na2SO4 и фильтровали. Фильтрат концентрировали и остаток очищали с помощью хроматографии на силикагеле, элюировали с помощью PE/EtOAc (3/1, об./об.) с получением промежуточного соединения 157 (400 мг, 74%) в виде белого твердого вещества.
Промежуточное соединение 158 и промежуточное соединение 159 (соль HCl) получали соответственно с помощью протокола реакции, аналогичного описанному для получения промежуточного соединения 119 и промежуточного соединения 116 соответственно, начиная с соответствующих исходных веществ.
Пример A59
Получение промежуточных соединений 160, 161, 162, 163, 164 и 165
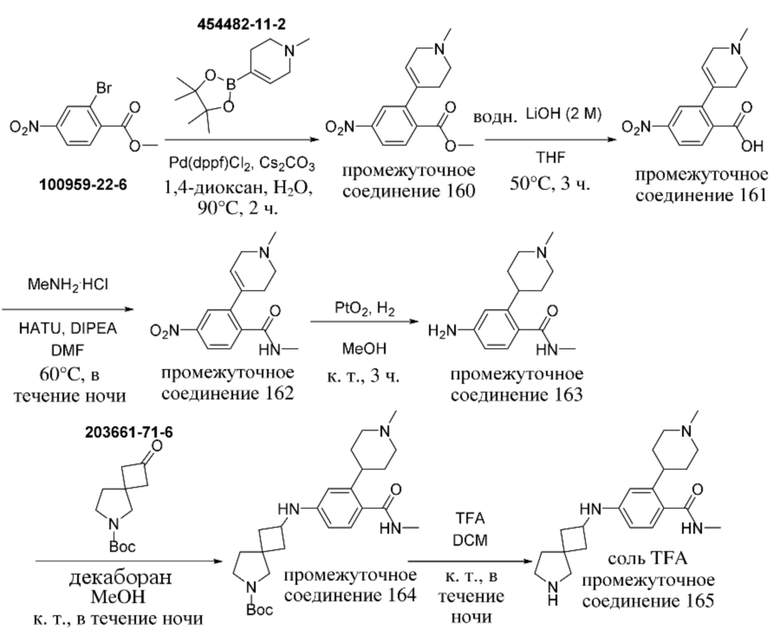
Получение промежуточного соединения 160
В раствор метил-2-бром-4-нитробензоата (№ по CAS: 100959-22-6) (2,00 г, 7,69 ммоль) в 1,4-диоксане (20 мл) добавляли H2O (10 мл), Cs2CO3 (5,00 г, 15,38 ммоль), 1-метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,2,3,6-тетрагидропиридин (№ по CAS: 454482-11-2) (2,60 г, 11,54 ммоль) и Pd(dppf)Cl2 (562 мг, 0,77 ммоль). Реакционную смесь перемешивали в атмосфере Ar при 90°C в течение 2 ч. Охлажденную реакционную смесь разбавляли водой (200 мл) и экстрагировали с помощью EtOAc (200 мл × 3). Объединенные органические экстракты промывали водой (200 мл × 3), высушивали над безводным Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью хроматографии на силикагеле (элюент: DCM/MeOH, от 40/1 до 30/1, об./об.) с получением промежуточного соединения 160 (2,1 г, выход 99%) в виде коричневого масла.
Получение промежуточного соединения 161
В перемешиваемый раствор промежуточного соединения 160 (2,10 г, 7,61 ммоль) в THF (14 мл) добавляли водный раствор LiOH (2 М, 7 мл). Реакционную смесь перемешивали при 50°C в течение 3 ч Реакционную смесь концентрировали. Остаток суспендировали в воде (20 мл) и подкисляли с помощью водного раствора HCl (5 М) до значения pH, равного 4. Полученный осадок собирали путем фильтрации и высушивали при пониженном давлении с получением промежуточного соединения 161 (1,10 г, выход 55%) в виде коричневого твердого вещества.
Получение промежуточного соединения 162
В перемешиваемый раствор промежуточного соединения 161 (500 мг, 1,91 ммоль) в DMF (20 мл) добавляли гидрохлорид метиламина (644 мг, 9,54 ммоль), HATU (1,50 г, 3,82 ммоль) и DIPEA (4 мл). Реакционную смесь перемешивали при 60°C в течение ночи. Охлажденную реакционную смесь разбавляли водой (50 мл) и экстрагировали с помощью EtOAc (50 мл × 3). Объединенные органические слои промывали водой (50 мл × 3), высушивали над безводным Na2SO4, фильтровали и концентрировали с получением промежуточного соединения 162 (524 мг, выход 100%) в виде коричневого твердого вещества, которое применяли непосредственно для следующей стадии без дополнительной очистки.
Получение промежуточного соединения 163
В раствор промежуточного соединения 162 (715 мг, 2,60 ммоль) в MeOH (7 мл) добавляли PtO2 (70 мг). Реакционную смесь перемешивали в атмосфере H2 при комнатной температуре в течение 3 ч. Реакционную смесь фильтровали и осадок на фильтре промывали с помощью MeOH. Объединенный фильтрат концентрировали с получением промежуточного соединения 163 (642 мг, выход 100%), которое применяли непосредственно для следующей стадии без дополнительной очистки.
Промежуточное соединение 164 и промежуточное соединение 165 (соль TFA) получали соответственно с помощью протокола реакции, аналогичного описанному для получения промежуточного соединения 119 и промежуточного соединения 120 соответственно, начиная с соответствующих исходных веществ.
Пример A60
Получение промежуточных соединений 166, 167, 168 и 169
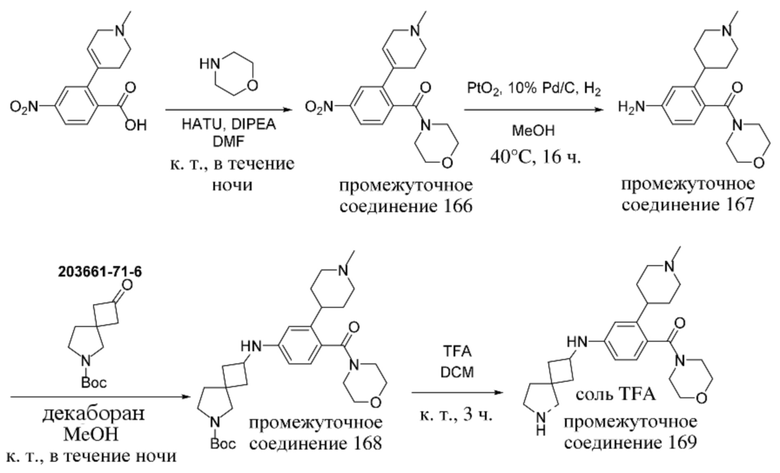
Получение промежуточного соединения 166
В суспензию промежуточного соединения 161 (310 мг, 1,34 ммоль) и морфолина (349 мг, 4,00 ммоль) в DMF (5 мл) при комнатной температуре добавляли HATU (1,05 г, 2,67 ммоль) и DIPEA (861 мг, 6,68 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли насыщенным водным раствором хлорида аммония (50 мл). Осажденное твердое вещество собирали путем фильтрации и высушивали с получением промежуточного соединения 166 (450 мг, чистота 75%).
Получение промежуточного соединения 167
В раствор промежуточного соединения 166 (300 мг, неочищенный продукт, примерно 0,89 ммоль) в MeOH (50 мл) добавляли 10% Pd/C (30 мг) и PtO2 (30 мг, 10%). Реакционную смесь перемешивали в атмосфере H2 при 40°C в течение 16 ч. Реакционную смесь фильтровали и фильтрат концентрировали с получением промежуточного соединения 167 (400 мг, неочищенное вещество), которое применяли для следующей стадии без дополнительной очистки.
Промежуточное соединение 168 и промежуточное соединение 169 (соль TFA) получали соответственно с помощью протокола реакции, аналогичного описанному для получения промежуточного соединения 119 и промежуточного соединения 120 соответственно, начиная с соответствующих исходных веществ.
Пример A61
Получение промежуточных соединений 170, 171 и 172
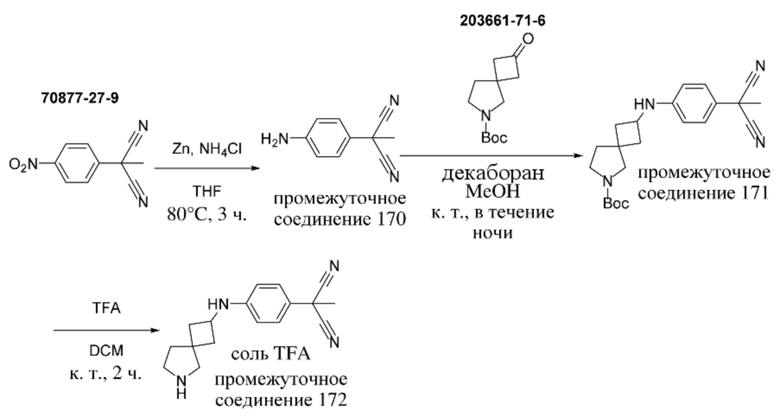
Получение промежуточного соединения 170
В раствор 2-метил-2-(4-нитрофенил)малононитрила (№ по CAS: 70877-27-9) (350 мг, неочищенный продукт) в THF (5 мл) добавляли NH4Cl (932 мг, 17,41 ммоль) и Zn (1,1 г, 17,41 ммоль). Реакционную смесь перемешивали при 80°C в течение 3 ч Реакционную смесь фильтровали и фильтрат концентрировали. Остаток в виде темного масла очищали с помощью преп. TLC (PE: EA=1:1, об./об.) с получением промежуточного соединения 170 (150 мг) в виде белого твердого вещества.
Промежуточное соединение 171 и промежуточное соединение 172 (соль TFA) получали соответственно с помощью протокола реакции, аналогичного описанному для получения промежуточного соединения 119 и промежуточного соединения 120 соответственно, начиная с соответствующих исходных веществ.
Пример A62
Получение промежуточного соединения 173, 174, 175, 176 и 177
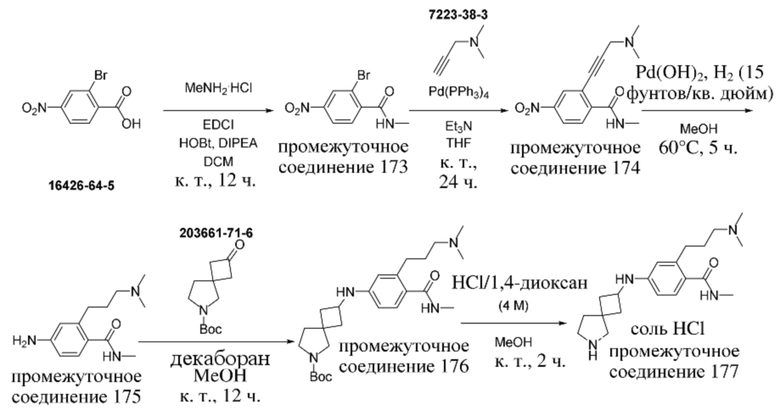
Получение промежуточного соединения 173
В перемешиваемый раствор 2-бром-4-нитробензойной кислоты (№ по CAS: 16426-64-5) (1,23 г, 5 ммоль) в DCM (15 мл) при комнатной температуре добавляли EDCI (1,43 г, 7,5 ммоль), HOBt (1,02 г, 7,5 ммоль), DIPEA (1,9 г, 15 ммоль) и гидрохлорид метанамина (502 мг, 7,5 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 12 ч. Реакционную смесь концентрировали. Остаток растворяли в EtOAc (20 мл), промывали с помощью H2O (10 мл) и солевым раствором (10 мл), высушивали над безводным Na2SO4 и фильтровали. Фильтрат концентрировали и остаток очищали с помощью хроматографии на силикагеле (элюент: PE: EA=4:1, об./об.) с получением промежуточного соединения 173 (1,1 г, выход 84%) в виде желтого твердого вещества.
Получение промежуточного соединения 174
В перемешиваемый раствор промежуточного соединения 173 (1,1 г, 4,24 ммоль) в THF (10 мл) в атмосфере Ar при комнатной температуре добавляли Et3N (10 мл), Pd(PPh3)4 (300 мг) и N, N-диметилпроп-2-ин-1-амин (№ по CAS: 7223-38-3) (527 мг, 6,36 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 24 ч. Реакционную смесь концентрировали. Остаток растворяли в EtOAc (20 мл), промывали с помощью H2O (10 мл) и солевым раствором (10 мл), высушивали над безводным Na2SO4 и фильтровали. Фильтрат концентрировали и остаток очищали с помощью хроматографии на силикагеле с получением промежуточного соединения 174 (600 мг, выход 54%) в виде белого твердого вещества.
Получение промежуточного соединения 175
В раствор промежуточного соединения 174 (600 мг, 2 ммоль) в MeOH (20 мл) при комнатной температуре добавляли Pd(OH)2 (100 мг). Реакционную смесь перемешивали в атмосфере H2 (15 фунтов/кв. дюйм) при 60°C в течение 5 ч. Охлажденную реакционную смесь фильтровали. Фильтрат концентрировали с получением промежуточного соединения 175 (400 мг, выход 85%).
Промежуточное соединение 176 и промежуточное соединение 177 (соль HCl) получали соответственно с помощью протокола реакции, аналогичного описанному для получения промежуточного соединения 119 и промежуточного соединения 116 соответственно, начиная с соответствующих исходных веществ.
Пример A63
Получение промежуточных соединений 178, 179, 180 и 181

Промежуточное соединение 178 получали с помощью протокола реакции, аналогичного описанному для получения промежуточного соединения 119, начиная с соответствующих исходных веществ.
Получение промежуточного соединения 179
Перемешивали смесь промежуточного соединения 178 (561 мг, 1,5 ммоль) и NaOH (1,20 г, 30 ммоль) в THF (10 мл), H2O (10 мл) и MeOH (10 мл) при 50°C в течение ночи. Реакционную смесь концентрировали и подкисляли с помощью конц. HCl, пока значение pH не становилось равным 2. Полученную смесь экстрагировали с помощью EtOAc (30 мл × 3). Объединенные органические экстракты промывали солевым раствором (50 мл), высушивали над безводным Na2SO4, фильтровали и концентрировали с получением промежуточного соединения 179 (480 мг, выход 89%) в виде желтого твердого вещества.
Получение промежуточного соединения 180
Перемешивали смесь промежуточного соединения 179 (480 мг, 1,3 ммоль), гидрохлорида метанамина (174 мг, 2,6 ммоль), HOBT (270 мг, 1,95 ммоль), EDCI (384 мг. 1,95 ммоль) и Et3N (525 мг, 5,2 ммоль) в DMF (20 мл) при 50°C в течение ночи. Охлажденную реакционную смесь разбавляли с помощью H2O (60 мл) и экстрагировали с помощью EtOAc (30 мл × 3). Объединенные органические экстракты промывали солевым раствором (50 мл), высушивали над безводным Na2SO4, фильтровали и концентрировали с получением промежуточного соединения 180 (410 мг, выход 84%) в виде бесцветного масла.
описано для получения промежуточного соединения 120, начиная с соответствующих исходных веществ.
Пример A64
Получение промежуточных соединений 182, 183 и 184
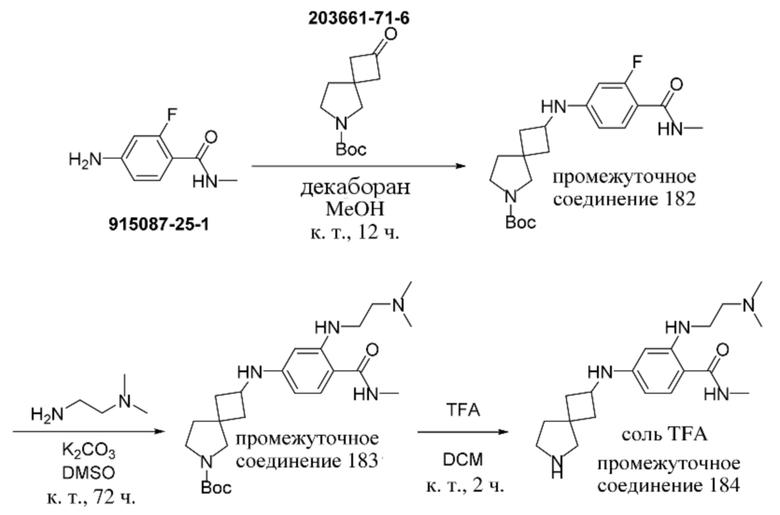
Промежуточное соединение 182 получали с помощью протокола реакции, аналогичного описанному для получения промежуточного соединения 119, начиная с соответствующих исходных веществ.
Получение промежуточного соединения 183
Смесь промежуточного соединения 182 (300 мг, 0,796 ммоль), N1,N1-диметилэтан-1,2-диамина (700 мг, 7,96 ммоль) и K2CO3 (329 мг, 2,387 ммоль) в DMSO (10 мл) перемешивали при комнатной температуре в течение 72 ч. Реакционную смесь концентрировали. Остаток очищали с помощью хроматографии на силикагеле, с элюированием смесью CH2Cl2/MeOH (3/1), с получением промежуточного соединения 183 (328 мг, выход 92%) в виде желтого масла.
Промежуточное соединение 184 (соль TFA) получали с помощью протокола реакции, аналогичного описанному для получения промежуточного соединения 120, начиная с соответствующих исходных веществ.
Пример A65
Получение промежуточных соединений 185, 186 и 187
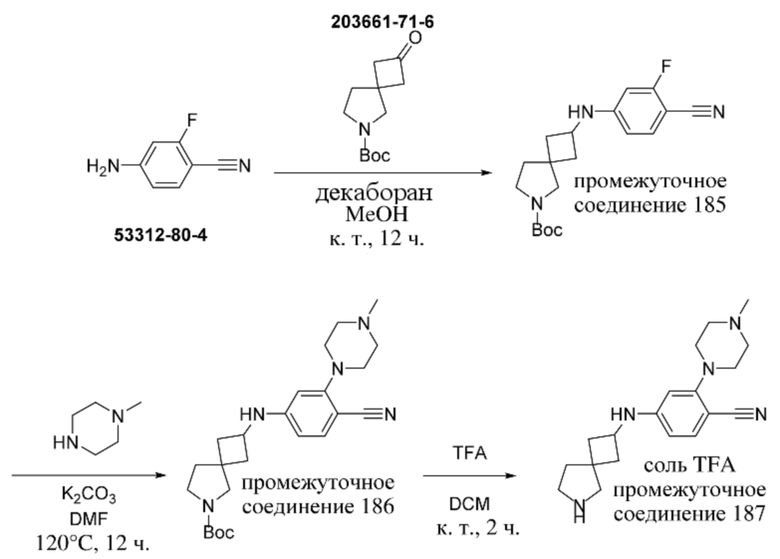
Промежуточное соединение 185 получали с помощью протокола реакции, аналогичного описанному для получения промежуточного соединения 119, начиная с соответствующих исходных веществ.
Получение промежуточного соединения 186
Перемешивали смесь промежуточного соединения 185 (345 мг, 1,0 ммоль), 1-метилпиперазина (500 мг, 5,0 ммоль) и K2CO3 (690 мг, 5,0 ммоль) в DMF (5 мл) при 120°C в течение 12 ч в закрытой пробирке в атмосфере Ar. Реакционную смесь концентрировали и остаток очищали с помощью хроматографии на силикагеле (DCM/MeOH=10/1, об./об.) с получением промежуточного соединения 186 (60 мг, выход 14%) в виде желтого масла.
Промежуточное соединение 187 (соль TFA) получали с помощью протокола реакции, аналогичного описанному для получения промежуточного соединения 120, начиная с соответствующих исходных веществ.
Пример A66
Получение промежуточных соединений 188, 189, 190, 191, 192 и 193
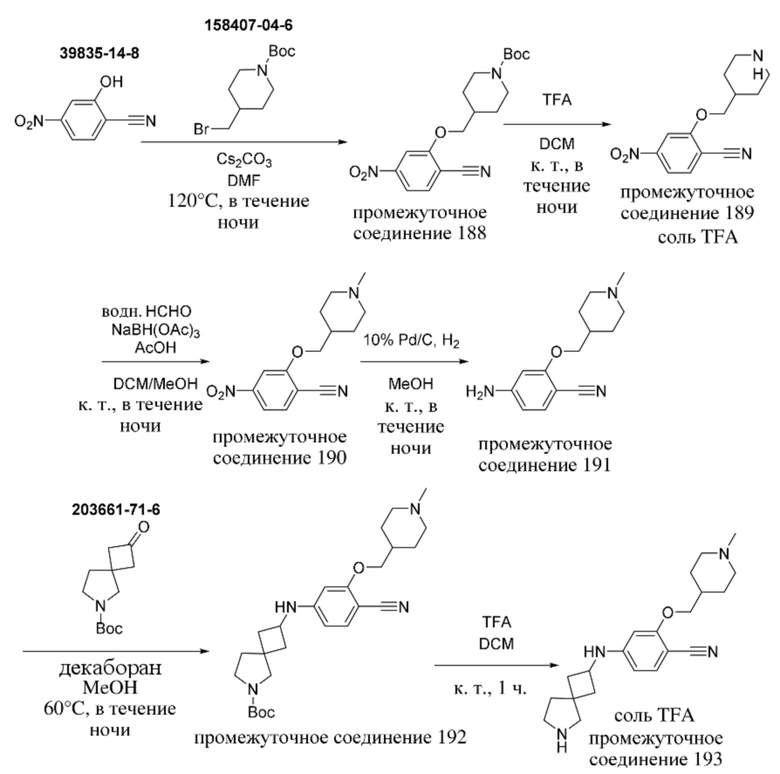
Получение промежуточного соединения 188
В перемешиваемый раствор 2-гидрокси-4-нитробензонитрила (№ по CAS: 39835-14-8) (500 мг, 3,05 ммоль) в DMF (50 мл) добавляли Cs2CO3 (1,5 г, 4,57 ммоль) и трет-бутил-4-(бромметил)пиперидин-1-карбоксилат (№ по CAS: 158407-04-6) (1,0 г, 3,66 ммоль). Реакционную смесь перемешивали при 120°C в течение ночи. Охлажденную реакционную смесь разбавляли водой (50 мл) и экстрагировали с помощью EtOAc (50 мл × 3). Объединенные органические экстракты промывали водой (50 мл × 3), высушивали над безводным Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью хроматографии на силикагеле, с элюированием смесью PE/EtOAc (от 5/1 до 3/1, об./об.), с получением промежуточного соединения 188 (364 мг, выход 33%) в виде желтого твердого вещества.
Промежуточное соединение 189 (соль TFA) получали с помощью протокола реакции, аналогичного описанному для получения промежуточного соединения 120, начиная с соответствующих исходных веществ.
Получение промежуточного соединения 190
В перемешиваемый раствор промежуточного соединения 189 (312 мг, 1,20 ммоль) в MeOH (5 мл) и DCM (5 мл) добавляли HCHO (37% в H2O, 485 мг, 5,98 ммоль) и AcOH (108 мг, 1,79 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 1 ч с последующим добавлением NaBH(OAc)3 (507 мг, 2,39 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли водой (50 мл) и экстрагировали с помощью DCM (50 мл × 3). Объединенные органические экстракты высушивали над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении с получением промежуточного соединения 190 (329 мг, выход 100%).
Промежуточное соединение 191, промежуточное соединение 192 и промежуточное соединение 193 (соль TFA) получали соответственно с помощью протокола реакции, аналогичного описанному для получения промежуточного соединения 44, промежуточного соединения 119 и промежуточного соединения 120 соответственно, начиная с соответствующих исходных веществ.
Пример A67
Получение промежуточных соединений 194, 195, 196 и 197
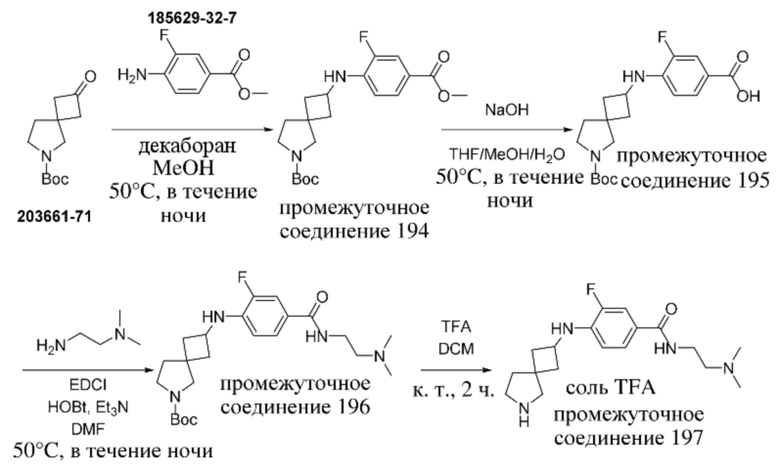
Промежуточные соединения 194, 195, 196 и 197 (соль TFA) получали соответственно с помощью протокола реакции, аналогичного описанному для получения промежуточных соединений 119, 179, 180 и промежуточного соединения 120 соответственно, начиная с соответствующих исходных веществ.
Пример A68
Получение промежуточных соединений 198, 199, 200 и 201
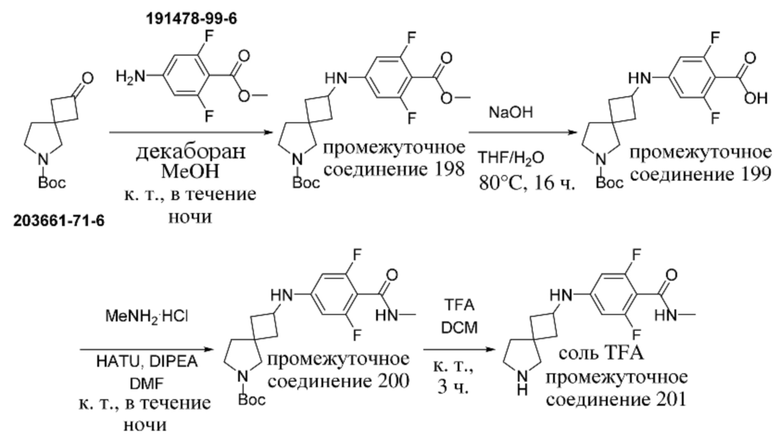
Промежуточное соединение 198 получали с помощью протокола реакции, аналогичного описанному для получения промежуточного соединения 119, начиная с соответствующих исходных веществ.
Получение промежуточного соединения 199
В перемешиваемый раствор промежуточного соединения 198 (800 мг, 2,02 ммоль) в THF (10 мл) при комнатной температуре добавляли водный раствор NaOH (2 М, 6,0 мл). Реакционную смесь перемешивали при 80°C в течение 16 ч. Реакционную смесь концентрировали. Полученное вещество подкисляли с помощью водного раствора HCl (1 М), пока значение pH не становилось равным 4. Полученную смесь фильтровали и осадок на фильтре высушивали с получением промежуточного соединения 199 в виде белого твердого вещества (600 мг, выход 77%), которое применяли для следующей стадии без дополнительной очистки.
Промежуточное соединение 200 и промежуточное соединение 201 (соль TFA) получали соответственно с помощью протокола реакции, аналогичного описанному для получения промежуточного соединения 166 и промежуточного соединения 120 соответственно, начиная с соответствующих исходных веществ.
Пример A69
Получение промежуточных соединений 202, 203, 204, 205, 206 и 207
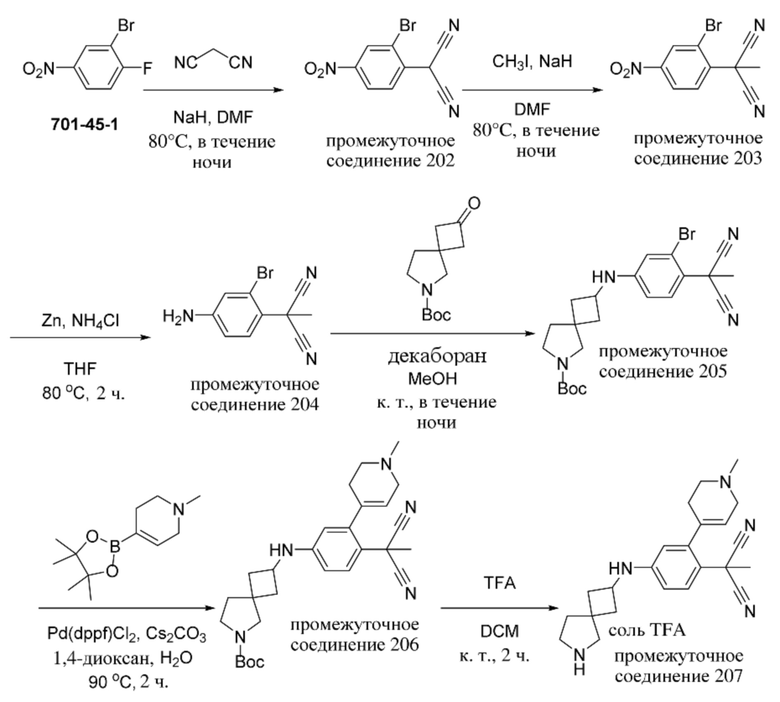
Получение промежуточного соединения 202
В перемешиваемый раствор малононитрила (3,0 г, 45,45 ммоль) в DMF (40 мл) в атмосфере Ar при 0°C добавляли порциями NaH (2,6 г, 68,18 ммоль). После того, как газ не образовывался, и цвет изменился с розового на желтый, в смесь добавляли 2-бром-1-фтор-4-нитробензол (№ по CAS: 701-45-1) (5,0 г, 22,73 ммоль) и смесь перемешивали при 80°C в течение ночи. Реакционную смесь охлаждали и медленно добавляли водный раствор HCl (5~6 М). Полученную смесь экстрагировали с помощью EtOAc (500 мл × 3). Объединенные органические экстракты промывали солевым раствором, высушивали над безводным Na2SO4, фильтровали и фильтрат концентрировали in vacuo с получением неочищенного промежуточного соединения 202 (6,2 г) в виде коричневого масла. Продукт применяли для следующей стадии без дополнительной очистки.
Получение промежуточного соединения 203
В перемешиваемый раствор промежуточного соединения 202 (6,2 г, неочищенный продукт) в DMF (4 мл) при 0°C добавляли порциями NaH (1,3 г, 34,05 ммоль). После перемешивания в течение 0,5 ч в смесь добавляли CH3I (3,2 г, 22,70 ммоль) и реакционную смесь перемешивали при 80°C в течение ночи. Смесь охлаждали и разбавляли водн. раствором HCl (6 М, 100 мл). Полученное вещество экстрагировали с помощью EtOAc (500 мл × 3). Объединенные органические экстракты промывали солевым раствором, высушивали над безводным Na2SO4, фильтровали и концентрировали in vacuo с получением необходимого продукта в виде коричневого масла. Масло очищали с помощью колоночной хроматографии на силикагеле (DCM: MeOH=10:1, об./об.) с получением промежуточного соединения 203 (4,1 г, выход 64% за 2 стадии) в виде желтого масла.
Промежуточные соединения 204, 205, 206 и 207 (соль TFA) получали соответственно с помощью протокола реакции, аналогичного описанному для получения промежуточных соединений 170, 119, 160 и 120 соответственно, начиная с соответствующих исходных веществ.
Пример A70
Получение промежуточных соединений 208, 209, 210 и 211
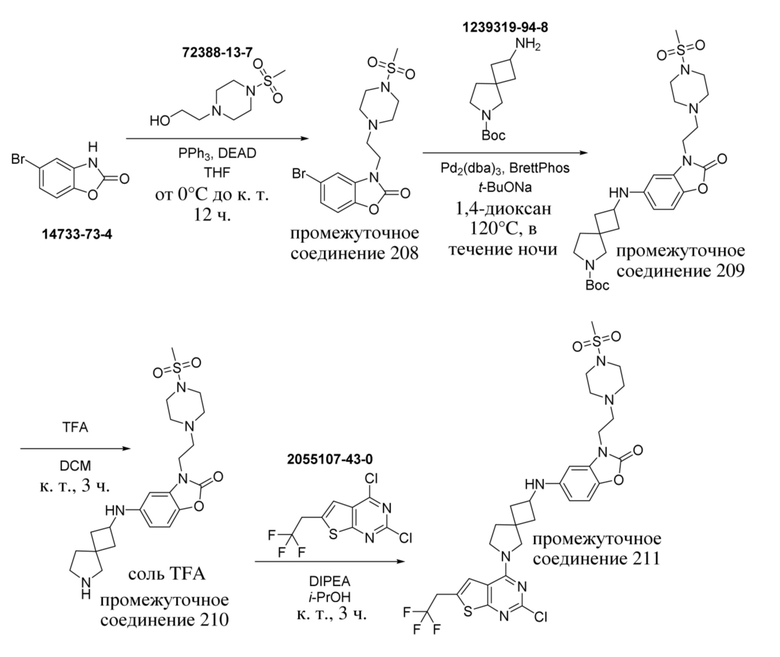
Промежуточные соединения 208, 209, 210 (соль TFA) и 211 получали соответственно с помощью протокола реакции, аналогичного описанному для получения следующих промежуточных соединений в колонке "Применяемый способ", начиная с соответствующих исходных веществ.
Пример A71
Получение промежуточных соединений 212, 213 и 214

Промежуточные соединения 212, 213 и 214 (соль HCl) получали соответственно с помощью протокола реакции, аналогичного описанному для получения следующих промежуточных соединений в колонке "Применяемый способ".
Пример A72
Получение промежуточного соединения 215
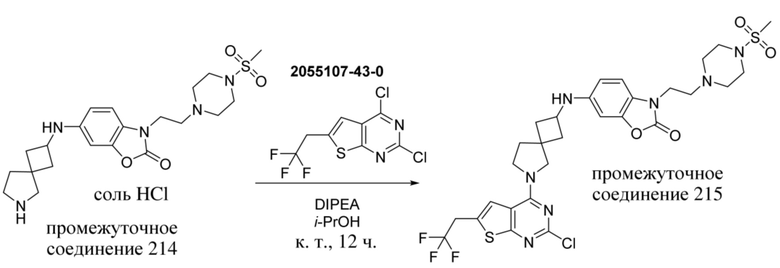
Промежуточное соединение 215 получали с помощью протокола реакции, аналогичного описанному для получения соединения 249, начиная с соответствующих исходных веществ.
Пример A73
Получение промежуточных соединений 216, 217, 218, 219 и 220
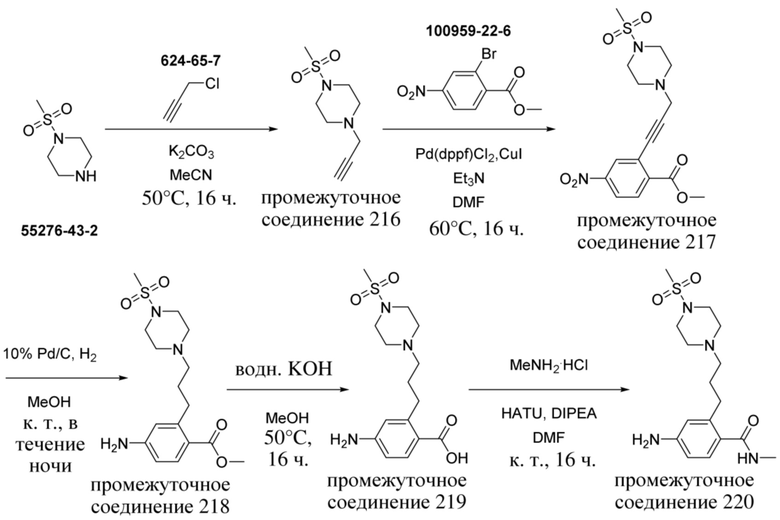
Получение промежуточного соединения 216
В перемешиваемый раствор 3-хлорпроп-1-ина (№ по CAS: 624-65-7) (500 мг, 6,7 ммоль) в MeCN (10 мл) при комнатной температуре добавляли 1-(метилсульфонил)пиперазин (№ по CAS: 55276-43-2) (1,1 г, 6,7 ммоль) и K2CO3 (2,8 г, 20,1 ммоль). Реакционную смесь перемешивали при 50°C в течение 16 ч и охлаждали до комнатной температуры. Затем реакционную смесь разбавляли водой (100 мл) и экстрагировали с помощью EA (100 мл × 3). Объединенные органические экстракты промывали солевым раствором (100 мл), высушивали над безводным Na2SO4, фильтровали и фильтрат концентрировали. Остаток очищали с помощью хроматографии на силикагеле (DCM:MeOH=от 20:1 до 10:1, об./об.) с получением промежуточного соединения 216 (1,1 г, выход 81%) в виде белого твердого вещества.
Получение промежуточного соединения 217
Перемешивали смесь промежуточного соединения 216 (1,6 г, 8,1 ммоль), метил-2-бром-4-нитробензоата (№ по CAS: 100959-22-6) (2,1 г, 8,1 ммоль), CuI (308 мг, 1,62 ммоль), Pd(dppf)Cl2 (592 мг, 0,81 ммоль) и Et3N (2,46 г, 24,3 ммоль) в DMF (60 мл) при 60°C в течение 16 ч и охлаждали до комнатной температуры. Затем реакционную смесь фильтровали и фильтрат концентрировали. Остаток разбавляли водой (20 мл) и экстрагировали с помощью EA (50 мл × 3). Объединенные органические экстракты промывали солевым раствором (50 мл), высушивали над безводным Na2SO4, фильтровали и фильтрат концентрировали. Остаток очищали с помощью хроматографии на силикагеле (элюент: PE:EA, от 5:1 до 1:1, об./об.) с получением промежуточного соединения 217 (2,6 г, выход 84%) в виде белого твердого вещества.
Получение промежуточного соединения 218
В раствор промежуточного соединения 217 (200 мг, 0,52 ммоль) в MeOH (5 мл) при комнатной температуре добавляли 10% Pd/C (50 мг). Реакционную смесь перемешивали в атмосфере H2 при комнатной температуре в течение ночи. Реакционную смесь фильтровали и фильтрат концентрировали с получением неочищенного промежуточного соединения 218 (200 мг) в виде белого твердого вещества, которое применяли непосредственно для следующей стадии без дополнительной очистки.
Получение промежуточного соединения 219
В перемешиваемый раствор промежуточного соединения 218 (100 мг, 0,28 ммоль) в MeOH (10 мл) при комнатной температуре добавляли водн. раствор KOH (5 М) (10 мл). Реакционную смесь перемешивали при 50°C в течение 16 ч. Охлажденную реакционную смесь непосредственно очищали с помощью хроматографии с обращенной фазой (C18, 100% H2O об./об.) с получением промежуточного соединения 219 (100 мг, неочищенное вещество) в виде бесцветного масла.
Получение промежуточного соединения 220
Перемешивали смесь промежуточного соединения 219 (100 мг, примерно 0,3 ммоль), гидрохлорида метиламина (102 мг, 1,5 ммоль), HATU (171 мг, 0,45 ммоль) и DIPEA (232 мг, 1,8 ммоль) в DMF (5 мл) при комнатной температуре в течение 16 ч. Реакционную смесь разбавляли водой (50 мл) и экстрагировали с помощью EA (10 мл × 3). Объединенные органические экстракты промывали солевым раствором (50 мл), высушивали над безводным Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью преп. TLC (DCM:MeOH=10:1) с получением промежуточного соединения 220 (30 мг) в виде белого твердого вещества.
Пример A75
Получение промежуточных соединений 226, 227, 228 и 229
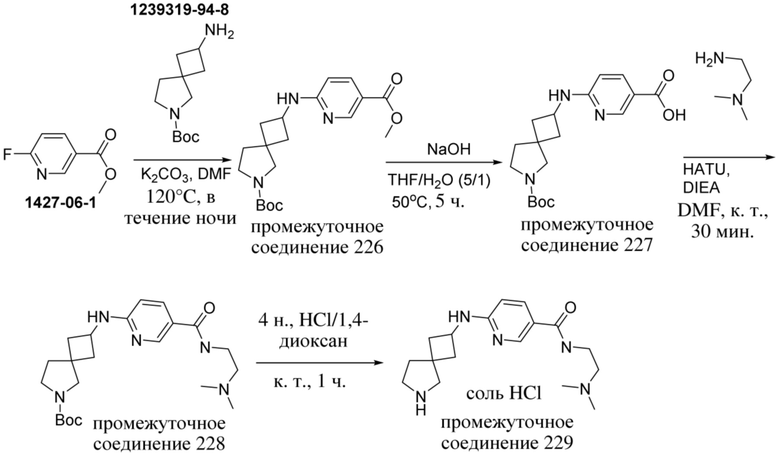
Получение промежуточного соединения 226
Перемешивали смесь метил-6-фторникотината (№ по CAS: 1427-06-1) (106 мг, 0,69 ммоль), трет-бутил-2-амино-6-азаспиро[3.4]октан-6-карбоксилата (№ по CAS: 1239319-94-8) (155 мг, 0,69 ммоль) и K2CO3 (283 мг, 2,06 ммоль) в DMF (2 мл) при 120°C в течение ночи. Смесь выливали в воду и экстрагировали с помощью EtOAc (15 мл × 3). Объединенные органические слои промывали солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали с получением промежуточного соединения 226 (453 мг, выход 84%) в виде светло-желтого твердого вещества.
Получение промежуточного соединения 227
Перемешивали смесь промежуточного соединения 226 (200 мг, 0,55 ммоль), NaOH (90 мг, 1,66 ммоль) и THF/H2O (5:1, 6 мл) при 50°C в течение 5 часов. Смесь разбавляли водой (5 мл) и регулировали до pH=4~5 с помощью 1 н. водного раствора HCl, экстрагировали с помощью EtOAc (15 мл × 3). Объединенные органические слои промывали солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали с получением промежуточного соединения 227 (188 мг, выход 98%) в виде белого твердого вещества.
Получение промежуточного соединения 228
В раствор промежуточного соединения 227 (190 мг, 0,55 ммоль) в DMF (2,5 мл) добавляли HATU (481 мг, 1,1 ммоль) и DIPEA (245 мг, 1,64 ммоль) в атмосфере Ar. После перемешивания при комнатной температуре в течение 20 мин добавляли N1,N1-диметилэтан-1,2-диамин (56 мг, 0,55 ммоль). Полученную смесь перемешивали при комнатной температуре в течение еще 30 мин. Смесь выливали в воду и экстрагировали с помощью EtOAc (15 мл × 3). Объединенные органические слои промывали солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали с получением промежуточного соединения 228 (200 мг, выход 88%) в виде коричневого твердого вещества.
Получение промежуточного соединения 229
Перемешивали смесь промежуточного соединения 228 (200 мг, 0,48 ммоль) в 4 М смеси HCl/диоксан (2 мл) при комнатной температуре в течение 1 часа. Растворитель удаляли с помощью вакуума с получением указанного в заголовке соединения, представляющего собой промежуточное соединение 229 в виде соли HCl (160 мг, выход 95%), которую применяли на следующей стадии без дополнительной очистки.
Пример A77
Получение промежуточных соединений 236, 237, 238 и 239
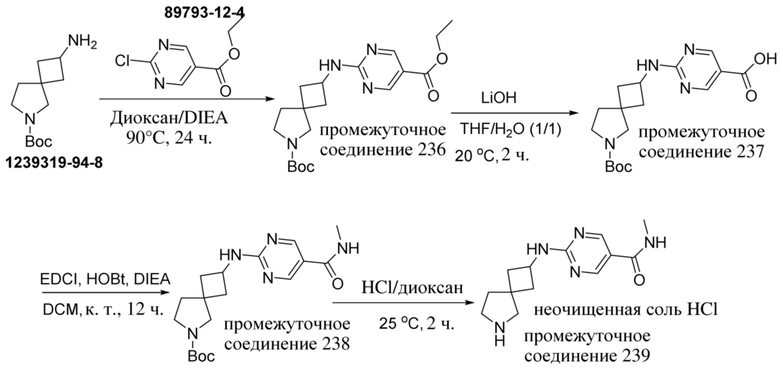
Получение промежуточного соединения 236
В раствор трет-бутил-2-амино-6-азаспиро[3.4]октан-6-карбоксилата (№ по CAS: 1239319-94-8) (1,86 г, 10 ммоль) в диоксане (15 мл) добавляли 2-хлорпиримидин-5-карбоксилат (№ по CAS: 89793-12-4) (2,26 г, 10 ммоль) и DIEA (2,52 г, 20 ммоль) при комнатной температуре. После перемешивания при 90°C в течение 24 ч реакционную смесь концентрировали, промывали с помощью H2O (30 мл), экстрагировали с помощью EA (3 × 10 мл). Объединенный органический слой концентрировали с получением остатка, который очищали с помощью хроматографии на силикагеле (PE: EA=4:1) с получением промежуточного соединения 236 (1,2 г, 46,10%) в виде белого твердого вещества.
Получение промежуточного соединения 237
В раствор промежуточного соединения 236, представляющего собой трет-бутил-2-((5-(этоксикарбонил)пиримидин-2-ил)амино)-6-азаспиро[3.4]октан-6-карбоксилат (1,2 г, 3,19 ммоль), в THF (10 мл) и H2O (10 мл) добавляли LiOH.H2O (2,30 г, 9,57 ммоль). После перемешивания при 20°C в течение 2 ч смесь концентрировали. Полученное вещество подкисляли с помощью водн. HCl (1 М), пока значение pH не становилось равным 4. Осадок собирали и высушивали с получением промежуточного соединения 237 (1,0 г, выход 90%) в виде белого твердого вещества.
Получение промежуточного соединения 238
В раствор промежуточного соединения 237, представляющего собой 2-((6-(трет-бутоксикарбонил)-6-азаспиро[3.4]октан-2-ил)амино)пиримидин-5-карбоновую кислоту (720 мг, 3 ммоль), в DCM (3 мл) добавляли EDCI (859 мг, 4,5 ммоль), HOBt (612 мг, 4,5 ммоль) и DIEA (1,16 г, 9 ммоль). После перемешивания при комнатной температуре в течение 12 ч смесь концентрировали, остаток разбавляли с помощью EA (20 мл), промывали с помощью H2O (10 мл) и солевого раствора (10 мл), высушивали над безводным Na2SO4, фильтровали и концентрировали с получением промежуточного соединения 238 (500 мг, выход 69%).
Получение промежуточного соединения 239
Перемешивали раствор промежуточного соединения 238 (500 мг, 1,21 ммоль) в смеси HCl/1,4-диоксан (4 М, 10 мл) при 25°C в течение 2 ч Реакционную смесь концентрировали с получением промежуточного соединения 239 (400 мг, неочищенная соль HCl) в виде желтого твердого вещества, которое применяли на следующей стадии без дополнительной очистки.
Пример A78
Получение промежуточных соединений 240 и 241
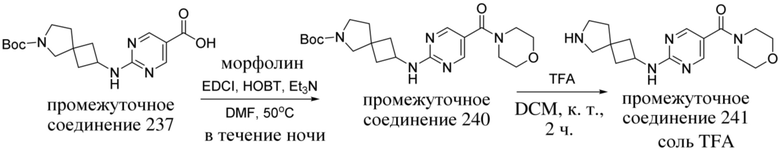
Получение промежуточного соединения 240
Перемешивали смесь промежуточного соединения 237 (348 мг, 1,0 ммоль), морфолина (344 мг, 4,0 ммоль), HOBT (203 мг, 1,5 ммоль), EDCI (288 мг, 1,5 ммоль) и Et3N (202 мг, 2,0 ммоль) в DMF (20 мл) при 50°C в течение ночи. Охлажденную реакционную смесь разбавляли с помощью H2O (60 мл) и экстрагировали с помощью EtOAc (30 мл × 3). Объединенные органические экстракты промывали солевым раствором (50 мл), высушивали над безводным Na2SO4, фильтровали и концентрировали с получением промежуточного соединения 240 (410 мг, выход 98%) в виде желтого масла.
Получение промежуточного соединения 241
Перемешивали смесь промежуточного соединения 240, представляющего собой трет-бутил-2-((5-(морфолин-4-карбонил)пиримидин-2-ил)амино)-6-азаспиро[3.4]октан-6-карбоксилат (410 мг, 0,98 ммоль), и TFA (2 мл) в DCM (2 мл) при комнатной температуре в течение 2 часов. После завершения реакции смесь концентрировали с получением промежуточного соединения 241 (430 мг, соль TFA) в виде оранжевого масла, которое применяли на следующей стадии без дополнительной очистки.
Пример A80
Получение промежуточных соединений 243 и 244
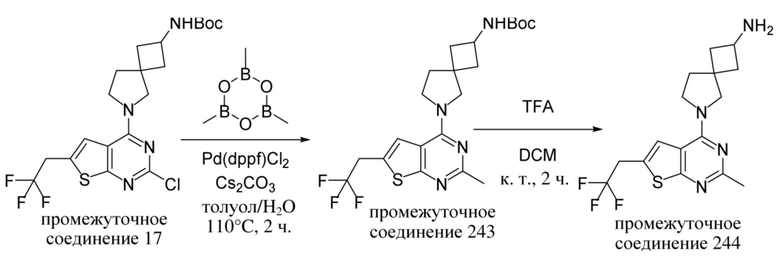
Получение промежуточного соединения 243
Перемешивали смесь промежуточного соединения 17 (600 мг, 1,26 ммоль), 2,4,6-триметил-1,3,5,2,4,6-триоксатриборинана (790 мг, 6,30 ммоль), Pd(dppf)Cl2 (88 мг, 0,12 ммоль) и Cs2CO3 (822 мг, 2,52 ммоль) в толуоле (20 мл) и H2O (4 мл) в атмосфере Ar при 110°C в течение 2 ч Охлажденную реакционную смесь разбавляли с помощью H2O (20 мл) и экстрагировали с помощью EtOAc (20 мл × 3). Объединенные органические экстракты промывали солевым раствором (40 мл), высушивали над безводным Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью хроматографии на силикагеле (петролейный эфир/EtOAc=3/1, об./об.) с получением промежуточного соединения 243 (400 мг, выход 70%) в виде белого твердого вещества.
Получение промежуточного соединения 244
Добавляли TFA (2 мл) в смесь промежуточного соединения 243 (400 мг, 0,88 ммоль) в DCM (2 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч Реакционную смесь концентрировали. Остаток обрабатывали с помощью ионообменной смолы Amberlyst A-21 в MeOH (5 мл) в течение 10 минут, фильтровали и концентрировали с получением промежуточного соединения 244 (300 мг, выход 96%) в виде белого твердого вещества.
Пример A81
Получение промежуточных соединений 245, 246, 247 и 248
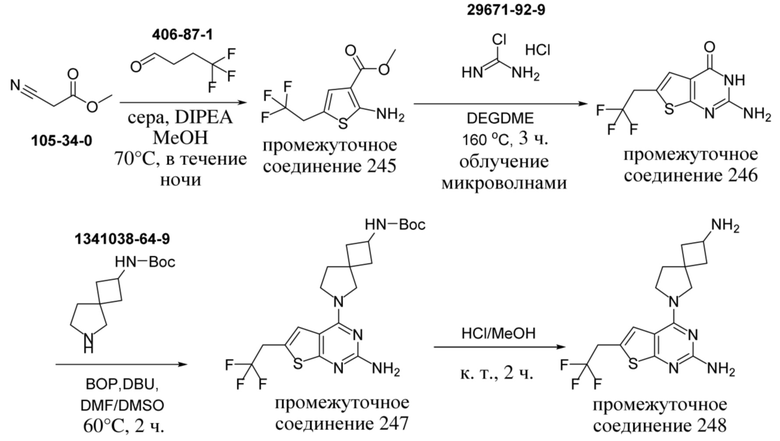
Получение промежуточного соединения 245
В перемешиваемый раствор метил-2-цианоацетата (№ по CAS: 105-34-0) (22,0 г, 220 ммоль) и 4,4,4-трифторбутаналя (№ по CAS: 406-87-1) (25,0 г, 200 ммоль) в MeOH (16 мл) добавляли DIPEA (42,0 г, 340 ммоль) и серу (7,1 г, 220 ммоль). Реакционную смесь перемешивали при 70°C в течение ночи. Охлажденную реакционную смесь концентрировали при пониженном давлении. Остаток очищали с помощью хроматографии на силикагеле (элюент: PE: EA=10:1, об./об.) с получением промежуточного соединения 245 (31,0 г, выход 64%) в виде светло-желтого твердого вещества.
Получение промежуточного соединения 246
Перемешивали суспензию промежуточного соединения 245 (200 мг, 0,84 ммоль) и карбамимидхлорида (№ по CAS: 29671-92-9) (106 мг, 0,92 ммоль) в диметиловом эфире диэтиленгликоля (DGEDME) (2 мл) при 160°C в течение 3 ч при микроволновом облучении. Затем охлажденную реакционную смесь разбавляли водой и фильтровали с получением промежуточного соединения 246 (110 мг) в виде белого твердого вещества.
Получение промежуточного соединения 247
Перемешивали раствор промежуточного соединения 246 (110 мг, 0,441 ммоль), трет-бутил-6-азаспиро[3.4]октан-2-илкарбамата (№ по CAS: 1341038-64-9) (200 мг, 0,882 ммоль), BOP (293 мг, 0,661 ммоль) и DBU (201 мг, 1,32 ммоль) в DMF/DMSO (2 мл/2 мл) при 60°C в течение 2 ч. Затем охлажденную реакционную смесь разбавляли водой и экстрагировали с помощью EtOAc. Объединенные органические экстракты промывали солевым раствором, высушивали над безводным Na2SO4, фильтровали и фильтрат концентрировали. Остаток очищали с помощью хроматографии на силикагеле, с элюированием смесью DCM/MeOH (от 100:1 до 50:1), с получением промежуточного соединения 247 (200 мг, выход 68%) в виде желтого твердого вещества.
Получение промежуточного соединения 248
Раствор промежуточного соединения 247 (200 мг, 0,437 ммоль) в HCl/MeOH (3 М) (4 мл) перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь концентрировали. Остаток обрабатывали с помощью ионообменной смолы Amberlyst A-21 с получением промежуточного соединения 248 в виде желтого твердого вещества (160 мг), которое применяли для следующей стадии без дополнительной очистки.
Пример A82
Получение промежуточных соединений 249, 250 и 251
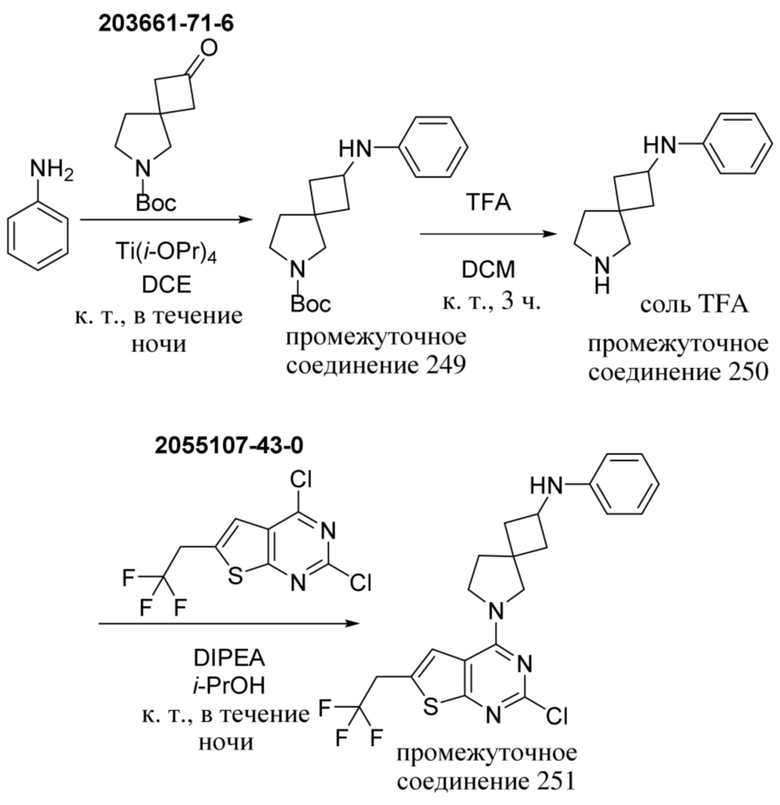
Получение промежуточного соединения 249
Растворяли смесь анилина (100 мг, 1,07 ммоль) и трет-бутил-2-оксо-6-азаспиро[3.4]октан-6-карбоксилата (№ по CAS: 203661-71-6) (242 мг, 1,07 ммоль) в DCE (4 мл) и добавляли Ti(i-PrO)4 (305 мг, 1,07 ммоль). Смесь перемешивали при комнатной температуре в течение 2 ч. Добавляли NaBH(OAc)3 (684 мг, 3,21 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи. Смесь разбавляли водой и экстрагировали с помощью EA (20 мл × 3). Объединенные органические экстракты концентрировали при пониженном давлении с получением неочищенного промежуточного соединения 249, которое применяли для следующей стадии без дополнительной очистки.
Получение промежуточного соединения 250
Промежуточное соединение 250 (соль TFA) и промежуточное соединение 251 получали соответственно с помощью протокола реакции, аналогичного описанному для получения промежуточного соединения 120 и промежуточного соединения 24 соответственно, начиная с соответствующих исходных веществ.
Пример A83
Получение промежуточных соединений 252, 253 и 254
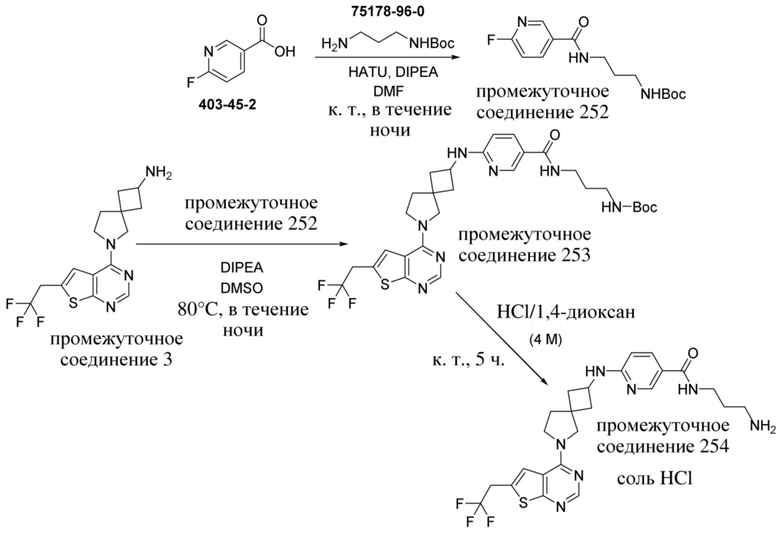
Получение промежуточного соединения 252
Перемешивали смесь 6-фторникотиновой кислоты (№ по CAS: 403-45-2) (200 мг, 1,41 ммоль), DIPEA (364 мг, 2,82 ммоль), трет-бутил-(3-аминопропил)карбамата (№ по CAS: 75178-96-0) (246 мг, 1,41 ммоль) и HATU (643 мг, 1,68 ммоль) в DMF (2 мл) при комнатной температуре в течение ночи. Смесь выливали в воду и экстрагировали этилацетатом (5 мл × 3). Объединенные органические экстракты промывали солевым раствором, высушивали над безводным Na2SO4, фильтровали и концентрировали с получением промежуточного соединения 252 (250 мг, выход 60%) в виде белого твердого вещества, которое применяли на следующей стадии без дополнительной очистки.
Получение промежуточного соединения 253
Перемешивали смесь промежуточного соединения 3 (482 мг, 1,41 ммоль; соль TFA), DIPEA (546 мг, 4,23ммоль) и промежуточного соединения 252 (419 мг, 1,41 ммоль) в DMSO (10 мл) при 80°C в течение ночи. Охлажденную реакционную смесь выливали в воду и суспензию фильтровали. Осадок на фильтре промывали водой, высушивали в вакууме с получением промежуточного соединения 253 (448 мг, выход 51%) в виде белого твердого вещества.
Промежуточное соединение 254 (соль HCl) получали с помощью протокола реакции, аналогичного описанному для получения промежуточного соединения 116, начиная с соответствующих исходных веществ.
Пример A84
Получение промежуточного соединения 255
Промежуточное соединение 255 получали с помощью способа, указанного на схеме ниже.
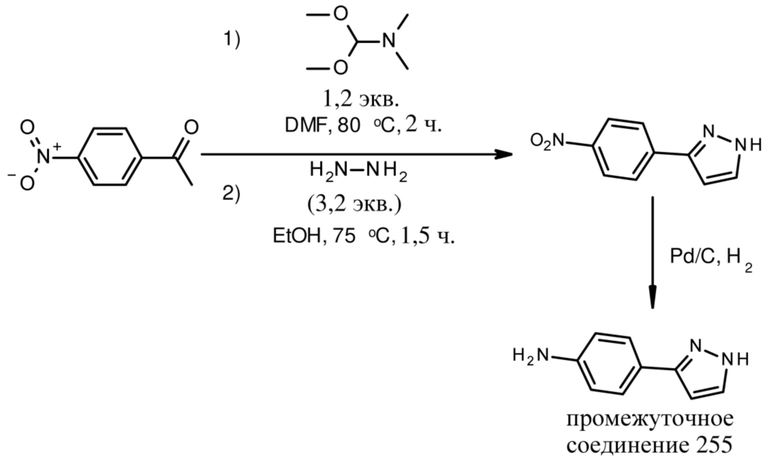
Пример A85
Промежуточное соединение 256 получали с помощью способа, указанного на схеме ниже.
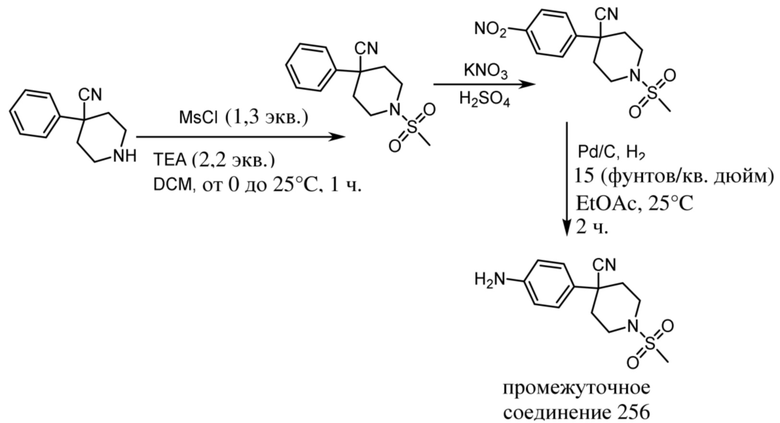
Пример A85
Получение промежуточного соединения 258
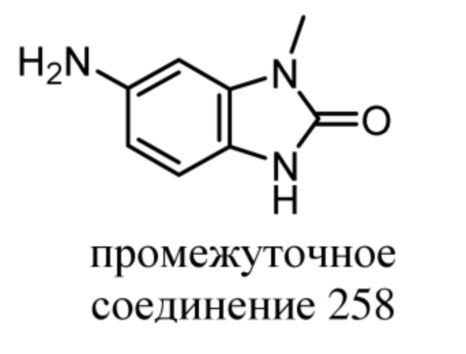
Промежуточное соединение 258 соответствует № по CAS: 73778-92-4.
Пример A86
Получение промежуточных соединений 259 и 260

Промежуточное соединение 259 соответствует № по CAS: 114474-26-9. В результате гидрогенизации нитрогруппы в соответствии с общеизвестными способами получали промежуточное соединение 260.
Пример A87
Получение промежуточного соединения 261
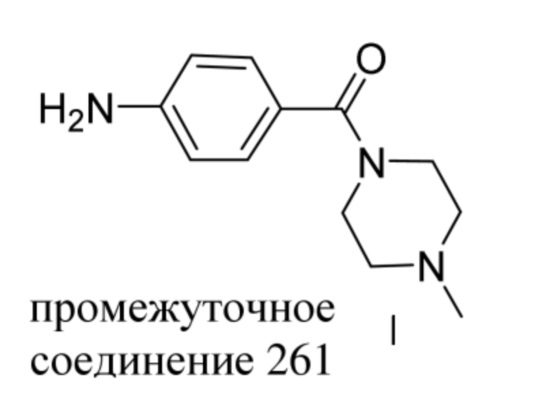
Промежуточное соединение 261 получали аналогично процедуре, описанной в European Journal of Medicinal Chemistry, 2011, 46(7), 2917-2929.
Пример A88
Получение промежуточного соединения 262
Промежуточное соединение 262 получали с помощью способа, указанного на схеме ниже.
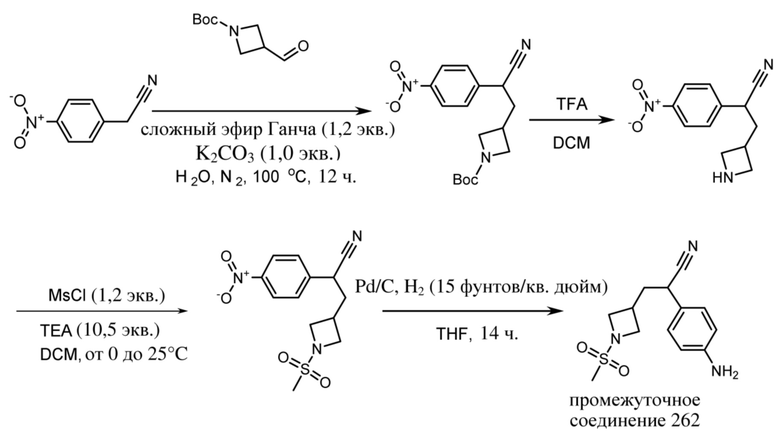
Пример A89
Получение промежуточного соединения 263
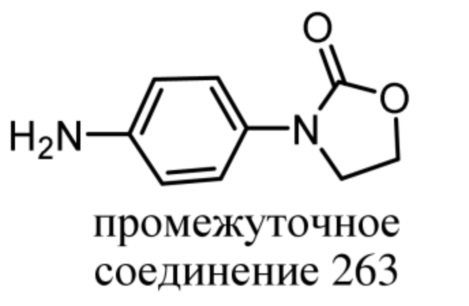
Промежуточное соединение 263 получали аналогично процедуре, описанной в European Journal of Medicinal Chemistry, 2016, 117, 197-211.
Пример A90
Получение промежуточного соединения 264
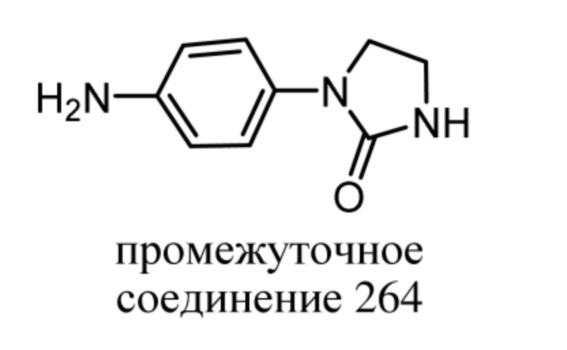
Промежуточное соединение 264 получали аналогично процедуре, описанной в Tetrahedron Letters, 2010, 51(24), 3232-3235.
Пример A91
Получение промежуточного соединения 265
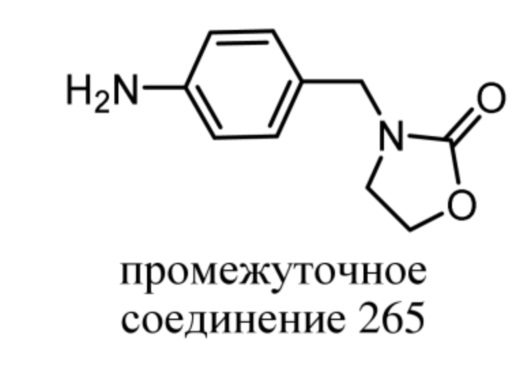
Промежуточное соединение 265 соответствует № по CAS: 99068-33-4.
Пример A92
Получение промежуточного соединения 266
Промежуточное соединение 266 получали с помощью способа, указанного на схеме ниже, с применением общеизвестных процедур синтеза.
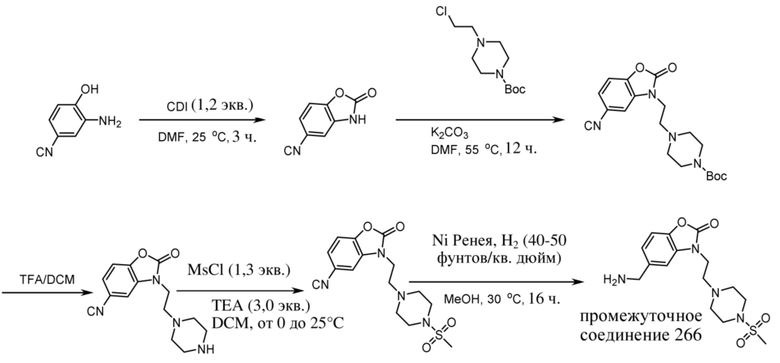
Пример A93
Получение промежуточного соединения 267
Промежуточное соединение 267 получали с помощью способа, указанного на схеме ниже.
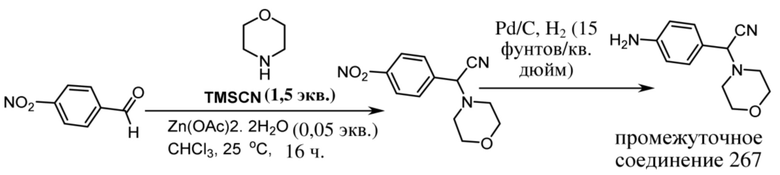
Пример A94
Получение промежуточного соединения 268
Промежуточное соединение 268 получали с помощью способа, указанного на схеме ниже.
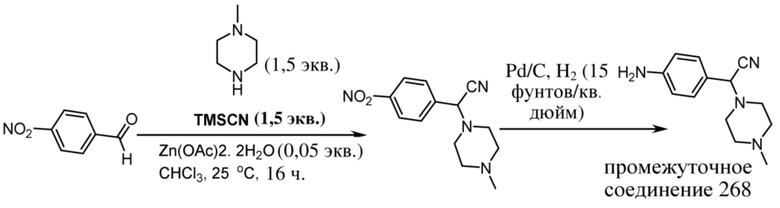
Пример A95
Получение промежуточного соединения 269
Промежуточное соединение 269 получали с помощью способа, указанного на схеме ниже.

Пример A96
Получение промежуточного соединения 270
Промежуточное соединение 270 получали с помощью способа, указанного на схеме ниже.
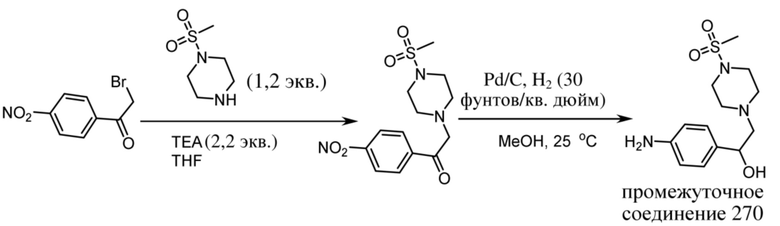
Пример A97
Получение промежуточного соединения 271

Промежуточное соединение 271 получали аналогично процедуре, описанной в WO 201314162.
Пример A98
Получение промежуточных соединений 301, 302 и 272
Промежуточное соединение 301 получали из 5-нитро-1,3-дигидро-2H-бензо[d]имидазол-2-она (№ по CAS: 984-5) и бромацетамида (№ по CAS: 683-57-8) с помощью способа, указанного на схеме ниже.
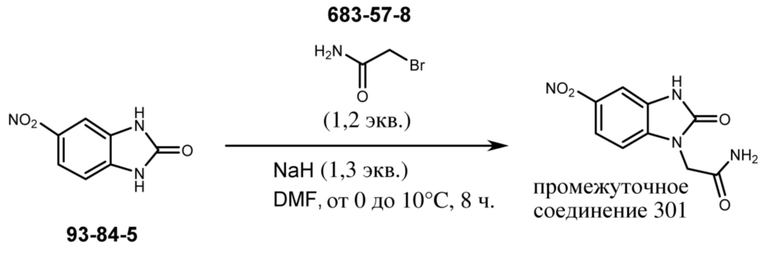
Промежуточное соединение 272 получали из промежуточного соединения 301 с помощью способа, указанного на схеме ниже.
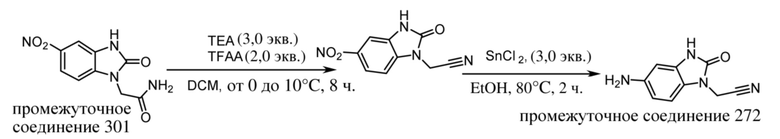
Промежуточное соединение 302 получали из промежуточного соединения 301 с помощью способа, указанного на схеме ниже.
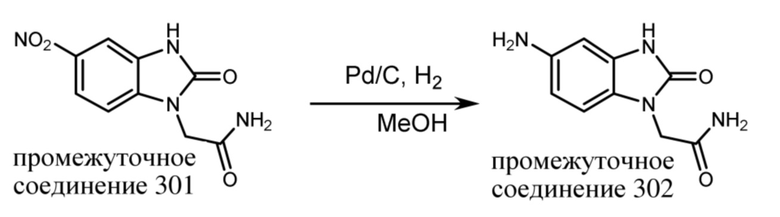
Пример A99
Получение промежуточного соединения 273
Промежуточное соединение 273 получали с помощью способа, указанного на схеме ниже.
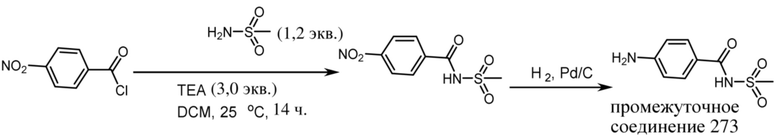
Пример A100
Получение промежуточного соединения 274
Промежуточное соединение 274 получали с помощью способа, указанного на схеме ниже.
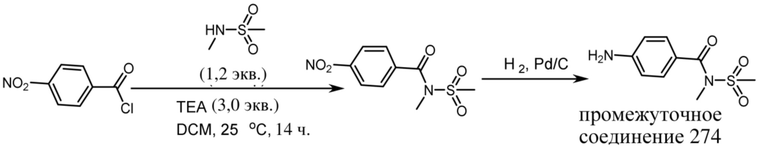
Пример A101
Получение промежуточного соединения 275
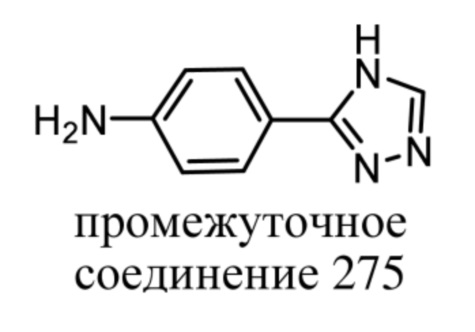
Промежуточное соединение 275 получали аналогично процедуре, описанной в WO 201657834.
Пример A102
Получение промежуточных соединений 276 и 277
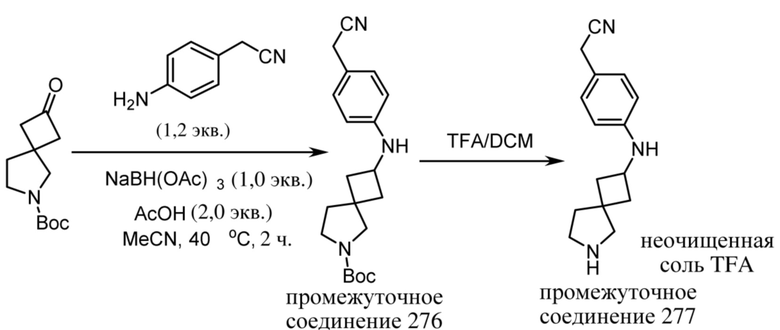
Получение промежуточного соединения 276
Добавляли трет-бутил-2-оксо-6-азаспиро[3.4]октан-6-карбоксилат (800 мг, 3,55 ммоль), 2-(4-аминофенил)ацетонитрил (563 мг, 4,26 ммоль), уксусную кислоту (426 мг, 7,09 ммоль) и ацетонитрил (20 мл) в стеклянный сосуд объемом 40 мл. Полученную смесь перемешивали при 40°C в течение 1 часа и затем добавляли триацетоксиборогидрид натрия (3,01 г, 14,2 ммоль). Полученную смесь перемешивали при 40°C в течение еще 1 часа. Реакционную смесь выливали в DCM (100 мл), после чего промывали водой (50 мл × 3). Органические экстракты высушивали над безводным Na2SO4, фильтровали и концентрировали до сухого состояния при пониженном давлении с получением остатка, который очищали с помощью FCC (элюент: петролейный эфир:этилацетат, от 1:0 до 0:1) с получением промежуточного соединения 276 (800 мг, выход 64,5%) в виде желтого масла.
Получение промежуточного соединения 277
Добавляли промежуточное соединение 276, представляющее собой трет-бутил-2-((4-(цианометил)фенил)амино)-6-азаспиро[3.4]октан-6-карбоксилат (400 мг, 1,17 ммоль), трифторуксусную кислоту (2 мл) и сухой дихлорметан (5 мл) в круглодонную колбу объемом 100 мл. Полученную смесь перемешивали при 25°C в течение 2 часов. Смесь концентрировали при пониженном давлении с получением промежуточного соединения 277 (500 мг, неочищенная соль TFA) в виде желтого масла.
Пример A103-a
Получение промежуточного соединения 279
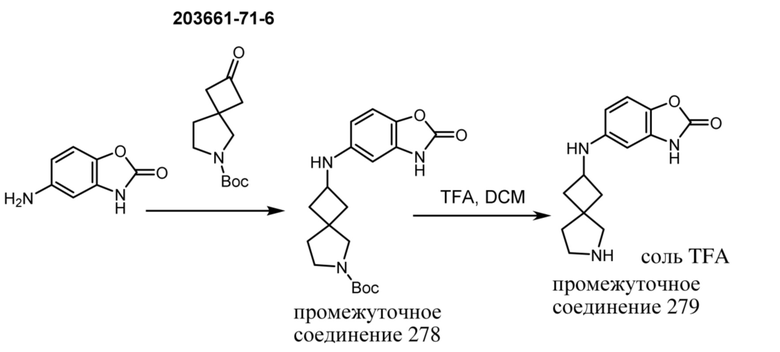
Промежуточное соединение 278 и промежуточное соединение 279 (соль TFA) получали соответственно с помощью протокола реакции, аналогичного описанному для получения соединения 277 и промежуточного соединения 120 соответственно, начиная с соответствующих исходных веществ.
Пример A103-b
Получение промежуточных соединений 280 и 281
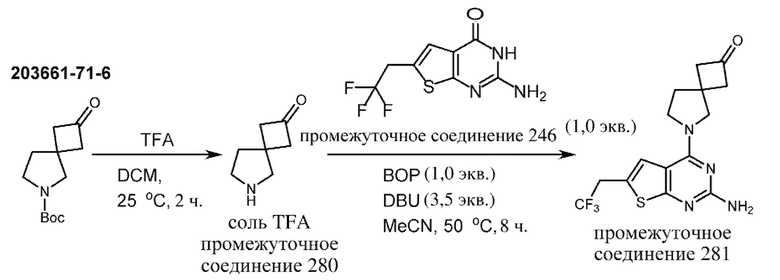
Промежуточное соединение 280 (соль TFA) и промежуточное соединение 281 получали соответственно с помощью протокола реакции, аналогичного описанному для получения промежуточного соединения 120 и соединения 377 соответственно, начиная с соответствующих исходных веществ.
Пример A104-a
Получение промежуточных соединений 282 и 283
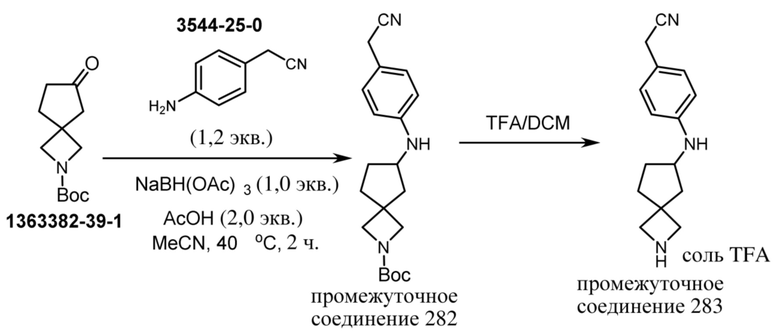
Промежуточное соединение 282 и промежуточное соединение 283 (соль TFA) получали соответственно с помощью протокола реакции, аналогичного описанному для получения промежуточного соединения 276 и промежуточного соединения 80 соответственно, начиная с соответствующих исходных веществ.
Пример A104-b
Получение промежуточных соединений 284 и 285
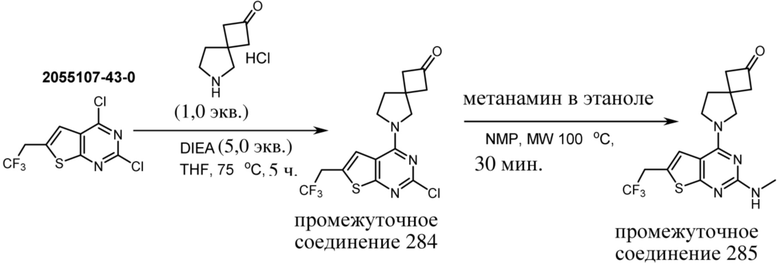
Получение промежуточного соединения 284
Добавляли 2,4-дихлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (№ по CAS: 2055107-43-0) (850 мг, 2,96 ммоль), 6-азаспиро[3.4]октан-2-она гидрохлорид (479 мг, 2,96 ммоль), N, N-диизопропилэтиламин (1,92 г, 14,9 ммоль) и сухой THF (10 мл) в круглодонную колбу объемом 50 мл, в которой обеспечивали перемешивание при 75°C в течение 5 ч Смесь охлаждали до 25°C и разбавляли в дихлорметане (50 мл), промывали водой (20 мл × 3), высушивали над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении с получением неочищенного продукта, который очищали с помощью FCC (этилацетат/петролейный эфир=от 0% до 70%) с получением промежуточного соединения 284 (1,20 г, чистота 90,0% в соответствии с 1H ЯМР, выход 97,0%) в виде белого порошка.
Получение промежуточного соединения 285
Добавляли промежуточное соединение 284 (1,20 г, 3,19 ммоль) и N-метил-2-пирролидон (5 мл) в пробирку для микроволновой обработки, после чего в смесь добавляли метанамин (1,98 г, 63,8 ммоль, 30-40% в этаноле). Закрытую пробирку нагревали при 100°C в течение 30 мин при микроволновом облучении. Смесь охлаждали до 25°C и разбавляли в дихлорметане (40 мл), промывали водой (20 мл × 3), высушивали над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении с получением неочищенного вещества, которое очищали с помощью FCC (этилацетат/петролейный эфир=от 0% до 70%) с получением промежуточного соединения 285 (500 мг, выход 40,2%) в виде светло-желтого порошка.
Пример A105
Получение промежуточных соединений 286 и 287
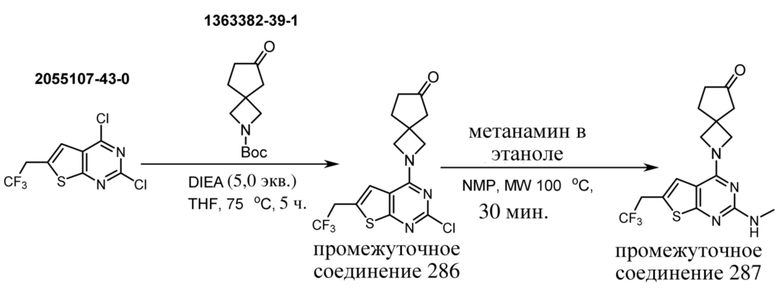
Промежуточное соединение 286 и промежуточное соединение 287 получали соответственно с помощью протокола реакции, аналогичного описанному для получения промежуточного соединения 284 и промежуточного соединения 285 соответственно, начиная с соответствующих исходных веществ.
Пример A106
Получение промежуточных соединений 288 и 289
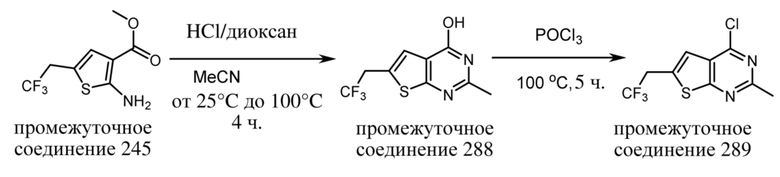
Получение промежуточного соединения 288
Растворяли промежуточное соединение 245 (3 г, 12,54 ммоль) в MeCN (75 мл). Добавляли HCl (в 1,4-диоксане) (75 мл, 300 ммоль) при 25°C и перемешивали при к.т. в течение 1,5 часа. Затем смесь перемешивали при 100°C в течение 4 часов. Смесь концентрировали при пониженном давлении с получением неочищенного промежуточного соединения 288, которое применяли непосредственно для следующей стадии без дополнительной очистки.
Получение промежуточного соединения 289
Добавляли промежуточное соединение 288 (4,5 г, 18,129 ммоль) в круглодонную колбу объемом 250 мл. В колбу добавляли порциями фосфорилхлорид (40 г,260,872 ммоль). Смесь перемешивали при 100°C в течение 5 ч. Смесь концентрировали при пониженном давлении с получением остатка, который растворяли в EtOAc (200 мл). Слой на основе EtOAc выливали на лед и pH регулировали до 10-11 с помощью NaHCO3 (насыщ. водн.). Органический слой промывали водой (100 мл × 3), солевым раствором (100 мл), высушивали над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением остатка, который очищали с помощью FCC (EA:PE=от 0 до 5%) с получением промежуточного соединения 289 в виде желтого твердого вещества.
Пример A107
Получение промежуточных соединений 290 и 291
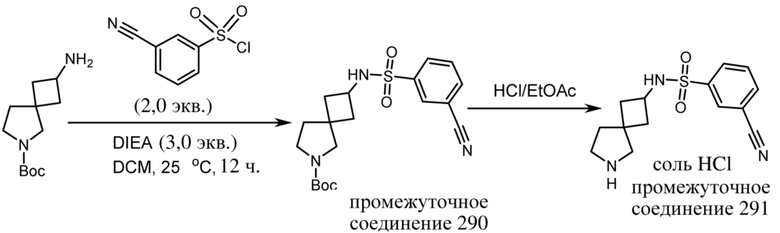
Получение промежуточного соединения 290
Добавляли трет-бутил-2-амино-6-азаспиро[3.4]октан-6-карбоксилат (№ по CAS: 1239319-94-8) (100 мг, 0,442 ммоль), 3-цианобензол-1-сульфонилхлорид (178 мг, 0,883 ммоль), N, N-диизопропилэтиламин (172 мг, 1,33 ммоль) и сухой дихлорметан (4 мл) в стеклянный флакон объемом 40 мл, полученную смесь перемешивали при 25°C в течение 12 ч Смесь разбавляли в дихлорметане (50 мл). Органическое вещество промывали водой (20 мл × 3), высушивали над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении с получением неочищенного вещества, которое очищали с помощью преп. TLC (петролейный эфир/этилацетат=1/1, Rf=0,2) с получением промежуточного соединения 290 (150 мг, чистота 90,0%, выход 78,0%) в виде светло-желтого порошка.
Получение промежуточного соединения 291
Добавляли промежуточное соединение 290 (150 мг, 0,383 ммоль), ацетонитрил (4 мл) и смесь хлористоводородная кислота/этилацетат (10,0 мл, 40,0 ммоль) в круглодонную колбу объемом 100 мл, в которой перемешивали при 25°C в течение 1 ч Смесь концентрировали при пониженном давлении с получением промежуточного соединения 291 (120 мг, соль HCl, чистота 90,0%, выход 86,0%) в виде белого порошка.
Пример A108
Получение промежуточного соединения 292 и промежуточного соединения 293
Промежуточные соединения 292 (соль HCl) и 293 (соль HCl) получали из их соответствующих исходных веществ за 2 стадии с применением протоколов реакций, аналогичных описанным для получения промежуточного соединения 291 (с помощью промежуточного соединения 290), начиная с трет-бутил-2-амино-6-азаспиро[3.4]октан-6-карбоксилата (№ по CAS: 1239319-94-8) и соответствующих сульфонилхлоридов.
Стадия 2: промежуточное соединение 291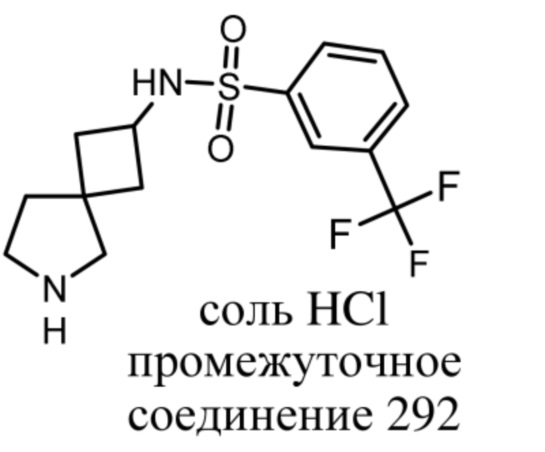
(из 4-(трифторметил)бензолсульфонилхлорида, № по CAS: 2991-42-6)
Стадия 2: промежуточное соединение 291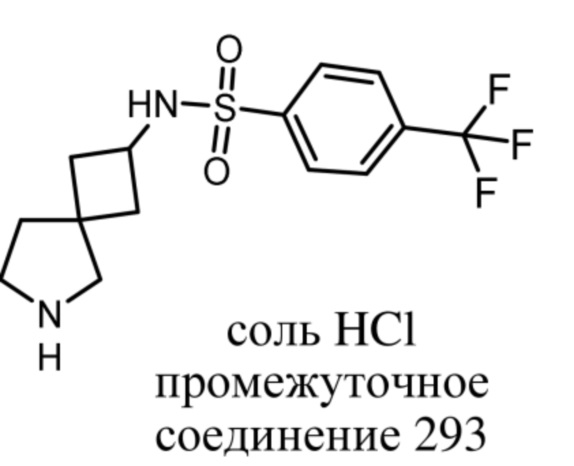
Пример A109
Получение промежуточного соединения 294
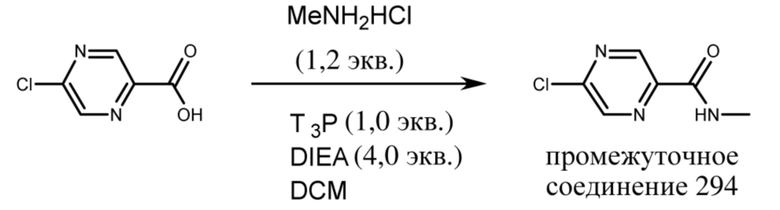
Добавляли якорь магнитной мешалки, 5-хлорпиразин-2-карбоновую кислоту (800 мг, 5,05 ммоль), гидрохлорид метиламина (409 мг, 6,06 ммоль), DIEA (2,61 г, 20,2 ммоль) и CH2Cl2 (40 мл) в круглодонную колбу объемом 50 мл. Смесь охлаждали до 0°C. В смесь добавляли T3P (3,21 г, 5,05 ммоль, 50% в EtOAc). Смесь перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь концентрировали до сухого состояния при пониженном давлении с получением неочищенного продукта, который очищали с помощью колоночной флэш-хроматографии (элюент: петролейный эфир:этилацетат=от 1:0 до 4:6) с получением промежуточного соединения 294 в виде желтого твердого вещества.
Пример A110
Получение промежуточного соединения 295
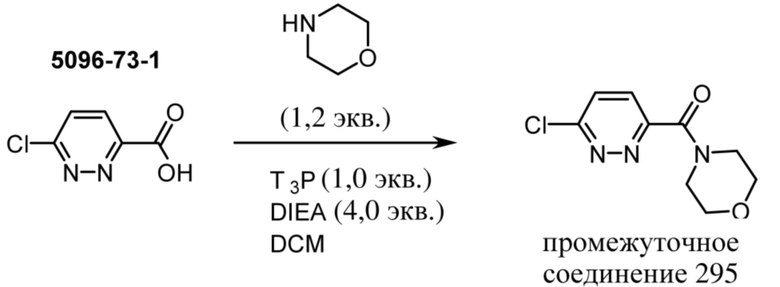
Промежуточное соединение 295 получали с помощью протокола реакции, аналогичного описанному для получения промежуточного соединения 294, начиная с 6-хлорпиридазин-3-карбоновой кислоты (№ по CAS: 5096-73-1) и морфолина.
Пример A111
Получение промежуточного соединения 296
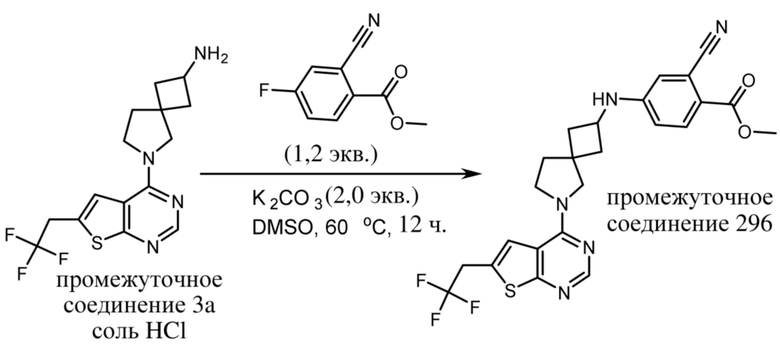
Добавляли якорь магнитной мешалки, 6-(6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин-4-ил)-6-азаспиро[3.4]октан-2-амина гидрохлорид (промежуточное соединение 3a) (500 мг, соль HCl, 1,32 ммоль), метил-2-циано-4-фторбензоат (284 мг, 1,59 ммоль), карбонат калия (365 мг, 2,64 ммоль) и диметилсульфоксид (6 мл) в круглодонную колбу объемом 25 мл, полученную смесь нагревали и перемешивали при 60°C в течение 12 ч Смесь охлаждали до комнатной температуры и суспендировали в дихлорметане (40 мл) и промывали водой (20 мл × 3). Объединенные органические слои высушивали над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении с получением неочищенного вещества, которое очищали с помощью преп. HPLC (колонка: Xtimate C18 150 × 25 мм × 5 мкм, подвижная фаза A: вода (0,04% NH3H2O+10 мМ NH4HCO3), подвижная фаза B: ацетонитрил, расход: 30 мл/мин , при условии градиента от 40% B до 70%). Чистые фракции собирали и растворитель выпаривали в вакууме с получением остатка. Остаток разделяли между ацетонитрилом (2 мл) и водой (10 мл). Раствор лиофилизировали до сухого состояния с получением промежуточного соединения 296 в виде белого порошка.
Пример A112
Получение промежуточных соединений 297 и 298
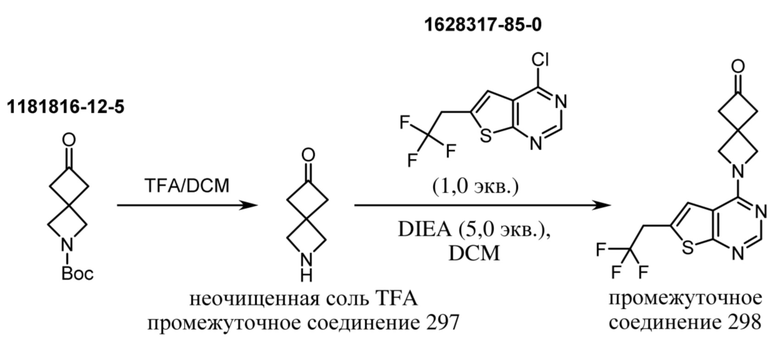
Получение промежуточного соединения 297
Добавляли трет-бутил-6-оксо-2-азаспиро[3.3]гептан-2-карбоксилат (№ по CAS: 1181816-12-5) (250 мг, 1,18 ммоль), трифторуксусную кислоту (2 мл) и сухой дихлорметан (2 мл) в круглодонную колбу объемом 100 мл. Реакционную смесь перемешивали при 25°C в течение 1 часа. Смесь концентрировали при пониженном давлении с получением промежуточного соединения 297 (300 мг, неочищенная соль TFA) в виде желтого масла.
Получение промежуточного соединения 298
Добавляли промежуточное соединение 297 (200 мг, 0,89 ммоль), 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (№ по CAS: 1628317-85-0) (224 мг, 0,89 ммоль) и сухой дихлорметан (8 мл) в стеклянный флакон объемом 40 мл. В реакционный раствор добавляли N, N-диизопропилэтиламин (574 мг, 4,44 ммоль). Реакционную смесь перемешивали при 25°C в течение 8 часов. Реакционную смесь выливали в DCM (30 мл), после чего промывали водой (20 мл × 3). Органические экстракты высушивали над безводным Na2SO4, фильтровали и концентрировали до сухого состояния при пониженном давлении с получением остатка, который очищали с помощью препаративной TLC (SiO2, PE: EtOAc=1:1, Rf=0,6) с получением промежуточного соединения 298 (250 мг, чистота 91,1%, выход 78,3%) в виде желтого твердого вещества.
Пример A113
Получение промежуточных соединений 299 и 300
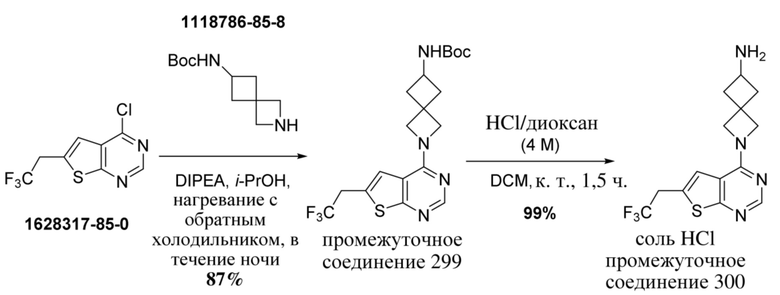
Промежуточное соединение 299 и промежуточное соединение 300 (соль HCl) получали соответственно с помощью протокола реакции, аналогичного описанному для получения промежуточного соединения 4 и промежуточного соединения 16 соответственно, начиная с соответствующих исходных веществ.
B. Получение соединений
Пример B1
Получение соединений 1 и 2
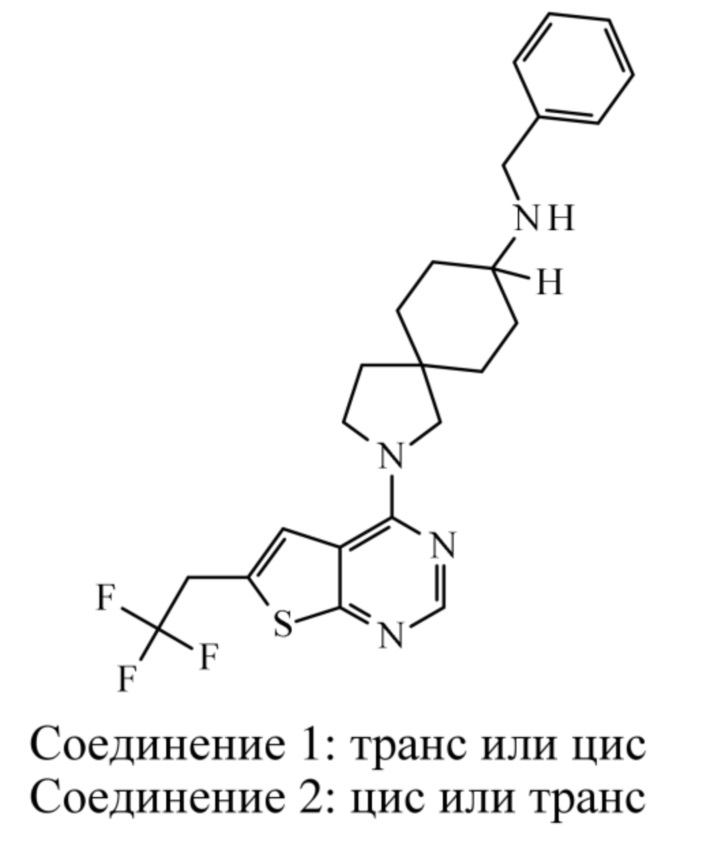
В раствор промежуточного соединения 7 (216 мг) в iPrOH (10 мл) добавляли 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (233 мг, 0,88 ммоль) и DIPEA (457 мг, 3,54 ммоль). После перемешивания при комнатной температуре в течение 2 ч смесь концентрировали, разбавляли с помощью EtOAc и H2O, водный слой дважды экстрагировали с помощью EtOAc. Объединенные экстракты концентрировали in vacuo и очищали с помощью преп. HPLC (Waters 2767, колонка: Xbridge C18 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (10 ммоль NH4HCO3), B: ACN) с получением соединения 1 (61,9 мг) в виде белого твердого вещества и соединения 2 (99,0 мг) в виде белого твердого вещества.
Соединение 1: 1H ЯМР MeOD-d4 (400 МГц): δ 8,25 (s, 1H), 7,61 (s, 1H), 7,36-7,30 (m, 4H), 7,26-7,23 (m, 1H), 3,90-3,80 (m, 6H), 3,58 (s, 2H), 2,62-2,60 (m, 1H), 2,10-2,00 (m, 2H), 1,95-1,92 (m, 2H), 1,75-1,72 (m, 2H), 1,53-1,35 (m, 4H).
Соединение 2: 1H ЯМР MeOD-d4 (400 МГц): δ 8,27 (s, 1H), 7,64 (s, 1H), 7,36-7,26 (m, 4H), 7,26-7,25 (m, 1H), 3,92-3,83 (m, 4H), 3,83-3,78 (m, 2H), 3,74 (s, 2H), 2,60-2,56 (m, 1H), 1,98-1,95 (m, 2H), 1,95-1,88 (m, 2H), 1,77-1,74 (m, 2H), 1,50-1,43 (m, 2H), 1,37-1,28 (m, 2H).
Пример B2
Получение соединений 3, 4, 5 и 6
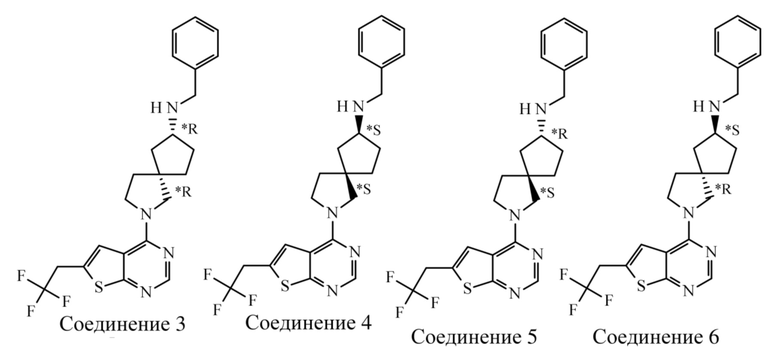
В раствор неочищенного промежуточного соединения 8 (550 мг) в изопропаноле (6 мл) добавляли DIPEA (806 мг, 6,25ммоль) и 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (525 мг, 2,08 ммоль). После перемешивания при комнатной температуре в течение 5 ч в реакционную смесь добавляли воду (20 мл) и ее экстрагировали с помощью EtOAc (50 мл × 3). Органическую фазу промывали солевым раствором, высушивали над Na2SO4 и концентрировали. Неочищенный продукт очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge, 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением двух диастереоизомеров. Два диастереоизомера разделяли с помощью SFC (условие: Waters, неподвижная фаза: AD 2,5 × 25 см, 10 мкм, подвижная фаза: CO2/EtOH (40% ACN, 0,2% DEA) = 60/40), условие 2: Waters, неподвижная фаза: IA 2,5 × 25 см, 10 мкм, подвижная фаза: CO2/IPA (15% ACN, 0,2% DEA) = 50/50)
с получением соединения 3 (59,8 мг), соединения 4 (54,9 мг), соединения 5 (105,9 мг) и соединения 6 (103,6 мг).
Соединение 3: 1H ЯМР: MeOD-d4 (400 МГц): δ 8,30 (s, 1H), 7,69 (s, 1H), 7,33-7,27 (m, 4H), 7,22-7,20 (m, 1H), 4,05 (q, J=11,2Гц, 2H), 3,83-3,67 (m, 2H), 3,66 (s, 2H), 3,64-3,58 (m, 2H), 3,16-3,13 (m, 1H), 2,02-1,98 (m, 1H), 1,95-1,86 (m, 2H), 1,75-1,70 (m, 1H), 1,60-1,44 (m, 4H).
Соединение 4: 1HЯМР MeOD-d4 (400 МГц): δ 8,28 (s, 1H), 7,63 (s, 1H), 7,37-7,30 (m, 4H), 7,27-7,25 (m, 1H), 3,92-3,84 (m, 4H), 3,76 (s, 2H), 3,76-3,66 (m, 2H), 3,29-3,25 (m, 1H), 2,11-2,06 (m, 4H), 1,86-1,83 (m, 1H), 1,74-1,72 (m, 1H), 1,66-1,62 (m, 1H), 1,57-1,51 (m, 2H).
Соединение 5: 1H ЯМР MeOD-d4 (400 МГц): δ 8,26 (s, 1H), 7,62 (s, 1H), 7,35-7,29 (m, 4H), 7,26-7,24 (m, 1H), 3,89-3,84 (m, 4H), 3,81-3,77 (m, 2H), 3,74 (s, 2H), 3,28-3,26 (m, 1H), 2,09-2,03 (m, 2H), 1,93-1,88 (m, 2H), 1,86-1,83 (m, 1H), 1,67-1,55 (m, 3H).
Соединение 6: 1H ЯМР MeOD-d4 (400 МГц): δ 8,26 (s, 1H), 7,62 (s, 1H), 7,35-7,29 (m, 4H), 7,25-7,22 (m, 1H), 3,89-3,84 (m, 4H), 3,81-3,78 (m, 2H) 3,74 (s, 2H), 3,28-3,26 (m, 1H), 2,11-2,03 (m, 2H), 1,94-1,89 (m, 2H), 1,86-1,83 (m, 1H), 1,67-1,55 (m, 3H).
Пример B3
Получение соединения 7
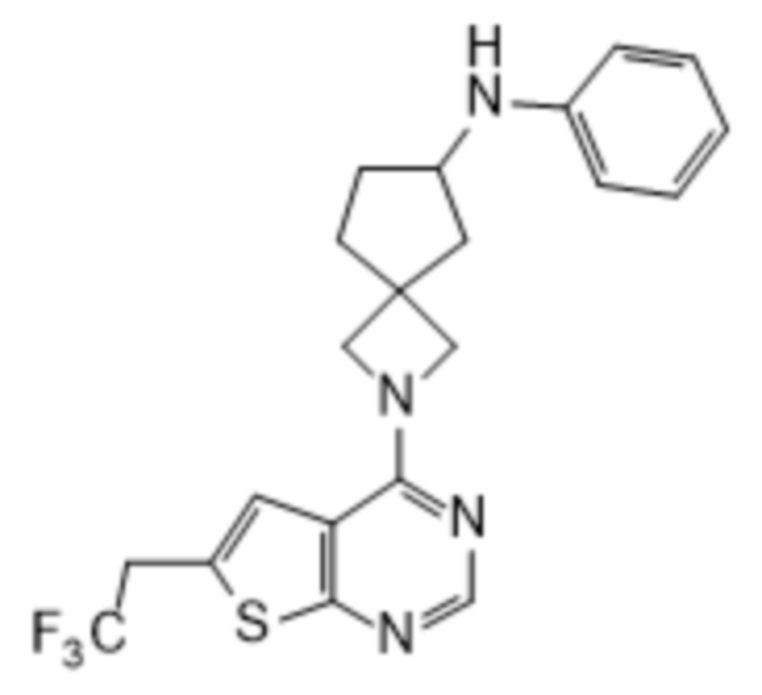
В раствор промежуточного соединения 2 (130 мг) в диоксане (3 мл) добавляли бромбензол (50,0 мг, 0,32 ммоль), tBuONa (88,3 мг, 0,64 ммоль), Brettphos (5 мг), Pd2(dba)3 (5 мг). Смесь перемешивали при 130°C при микроволновом облучении в течение 2 ч. Смесь промывали с помощью H2O, дважды экстрагировали с помощью EtOAc и органические слои объединяли. Экстракты концентрировали in vacuo и очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge, 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением соединения 7 (28,7 мг) в виде белого твердого вещества.
Соединение 7: 1H ЯМР MeOD-d4 (400 МГц): δ 8,25 (s, 1H), 7,36 (s, 1H), 7,14-7,06 (m, 2H), 6,70-6,58 (m, 3H), 4,50-4,20 (m, 4H), 3,96-3,80 (m, 3H), 2,44-2,34 (m, 1H), 2,24-2,10 (m, 2H), 2,08-1,88 (m, 2H), 1,72-1,58 (m, 1H)
Пример B4
Получение соединения 8
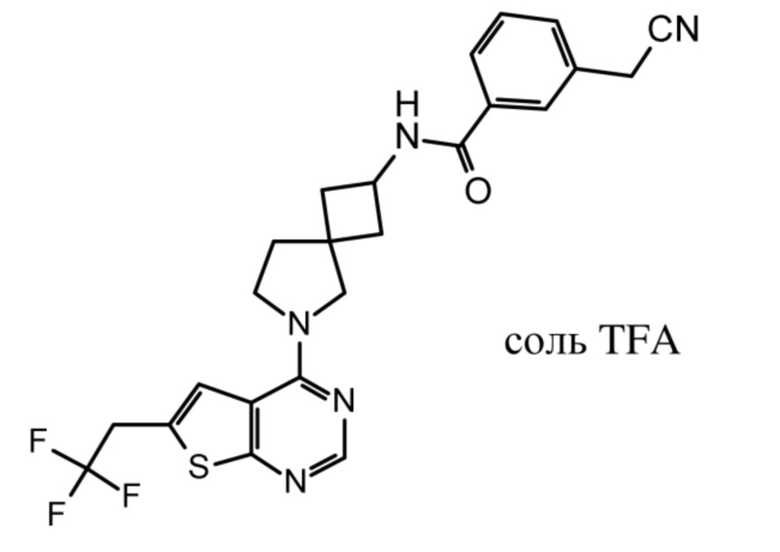
В раствор промежуточного соединения 3 (200 мг) в DCM (10 мл) добавляли 3-(цианометил)бензойную кислоту (47,0 мг, 0,292 ммоль) и EDCI (84 мг, 0,438 ммоль), HOBT (67,4 мг, 0,438 ммоль), TEA (88,5 мг, 0,876 ммоль) при комнатной температуре. После перемешивания при комнатной температуре в течение 16 ч смесь концентрировали с получением остатка, который очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% TFA/H2O, B: ACN) с получением соединения 8 (110 мг) в виде светло-желтого твердого вещества (соли TFA).
Соединение 8: 1H ЯМР MeOD-d4 (400 МГц): δ 8,45 (d, 1H, J=8,8 Гц), 7,82 (s, 1H), 7,78-7,75 (m, 2H), 7,51-7,43 (m, 2H), 4,59-4,55 (m, 1H), 4,00-3,90 (m, 8H), 2,56-2,47 (m, 2H), 2,36-2,18 (m, 4H).
Пример B5
Получение соединения 9
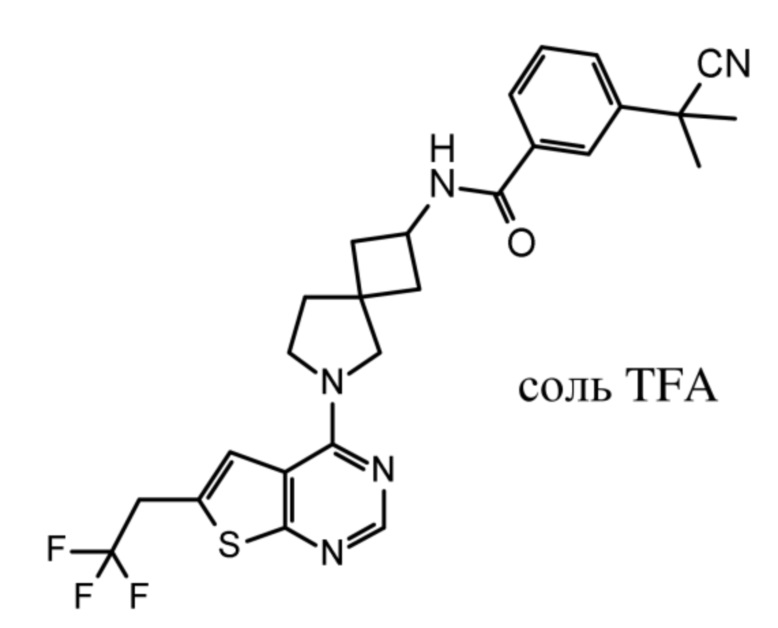
В раствор промежуточного соединения 3 (200 мг) в DCM (10 мл) добавляли 3-(2-цианопропан-2-ил)бензойную кислоту (55,2 мг, 0,292 ммоль) и EDCI (84 мг, 0,438 ммоль), HOBT (67,4 мг, 0,438 ммоль), TEA (88,5 мг, 0,876 ммоль) при комнатной температуре. После перемешивания при комнатной температуре в течение 16 ч смесь концентрировали с получением остатка, который очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% TFA/H2O, B: ACN) с получением соединения 9 (105 мг) в виде светло-желтого твердого вещества (соли TFA).
Соединение 9: 1H ЯМР MeOD-d4 (400 МГц): δ 8,43 (d, 1H, J=11,2 Гц), 7,99 (s, 1H), 7,81-7,70 (m, 3H), 7,54-7,50 (m, 1H), 4,62-4,58 (m, 1H), 4,04-3,90 (m, 6H), 2,60-2,50 (m, 2H), 2,36-2,18 (m, 4H), 1,76 (s, 6H).
Пример B6
Получение соединений 10, 11 и 12
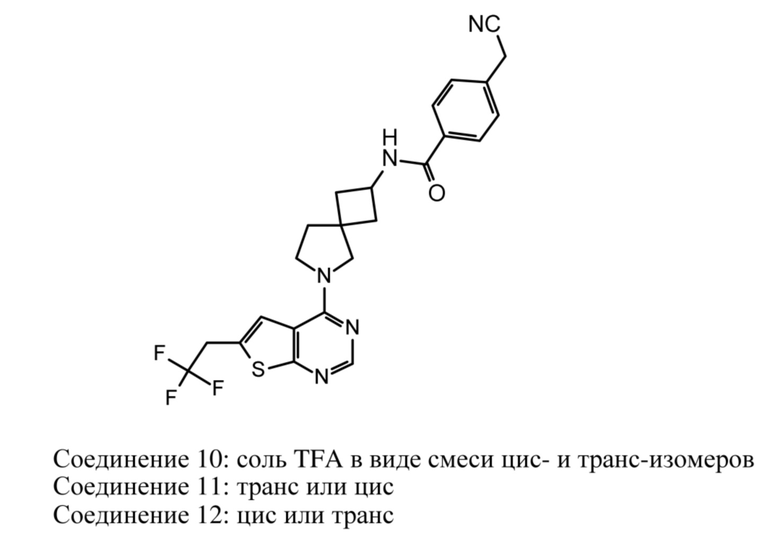
В раствор промежуточного соединения 3 (200 мг) в DCM (10 мл) добавляли 4-(цианометил)бензойную кислоту (47,0 мг, 0,292 ммоль) и EDCI (84 мг, 0,438 ммоль), HOBT (67,4 мг, 0,438 ммоль), TEA (88,5 мг, 0,876 ммоль) при комнатной температуре. После перемешивания при комнатной температуре в течение 16 ч смесь концентрировали с получением остатка, который очищали с помощью преп. HPLC (Waters® 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% TFA/H2O, B: ACN) с получением соединения 10 (65 мг) (в виде соли TFA) в виде светло-желтого твердого вещества (соли TFA), которое разделяли с помощью SFC (условие: UPC2 ™ (Waters®), неподвижная фаза: AS, 3 мкм, 3 × 100, подвижная фаза: CO2/MeOH (0,3% DEA) = 70/30) с получением соединения 11 (транс или цис) (10,7 мг) (свободное основание) в виде розового твердого вещества и соединения 12 (цис или транс) (9,9 мг) в виде белого твердого вещества (свободное основание).
Соединение 10: 1H ЯМР MeOD-d4 (400 МГц): δ 8,47 (d, J=9,6 Гц 1H,), 7,88-7,79 (m, 3H), 7,78 (d, J=7,6 Гц 2H,), 4,61-4,59 (m, 1H), 4,03-3,93 (m, 8H), 2,58-2,50 (m, 2H), 2,36-2,20 (m, 4H).
Пример B8
Получение соединения 14
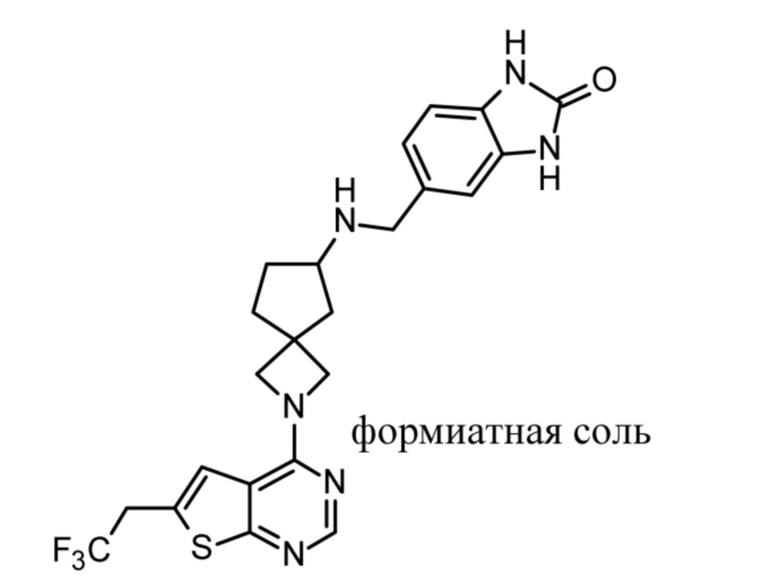
В раствор промежуточного соединения 2 (100 мг) в MeOH (2 мл) добавляли 2-оксо-1,3-дигидробензимидазол-5-карбальдегид (71 мг, 0,44 ммоль). Смесь перемешивали при комнатной температуре в течение 2 ч. Затем в смесь добавляли NaBH3CN (37 мг, 0,58 ммоль) и ее перемешивали в течение ночи при комнатной температуре. Смесь концентрировали, разбавляли с помощью EtOAc и H2O, разделяли и дважды экстрагировали с помощью EtOAc. Объединенные экстракты концентрировали in vacuo и очищали с помощью преп. HPLC (Waters® 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% формиата/H2O, B: ACN) с получением соединения 14 (49,1 мг) (формиатная соль).
Соединение 14: 1H ЯМР MeOD-d4 (400 МГц): δ 8,50 (s, 1H, формиат CHO), 8,29 (s, 1H), 7,35 (s, 1H), 7,20-7,16 (m, 2H), 7,12-7,10 (m, 1H), 4,39-4,30 (m, 4H), 4,19 (s, 2H), 3,87 (q, J=10,4 Гц, 2H), 3,71-3,61 (m, 1H), 2,62-2,57 (m, 1H), 2,30-2,15 (m, 2H), 2,12-2,01 (m, 2H), 1,86-1,80 (m, 1H).
Пример B9
Получение соединений 15, 55 и 56
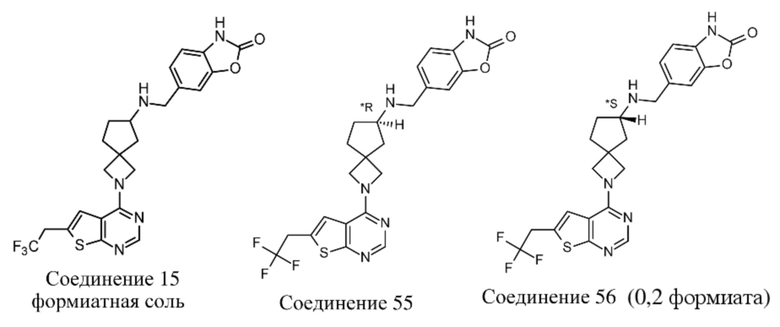
В раствор 2-оксо-3H-1,3-бензоксазол-6-карбальдегида (300 мг, неочищенное вещество) в MeOH (4 мл) добавляли промежуточное соединение 2 (200 мг), AcOH (3 капли). Раствор перемешивали при комнатной температуре в течение 1 ч, затем обеспечивали добавление NaBH3CN (115,6 мг, 1,84 ммоль) в раствор при 0°C и смесь перемешивали при комнатной температуре в течение ночи. Смесь промывали с помощью H2O, дважды экстрагировали с помощью EA и объединяли. Органические слои концентрировали in vacuo и очищали с помощью преп. HPLC (Waters® 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% формиата/H2O, B: ACN) с получением соединения 15 (184,6 мг) (формиатная соль) в виде белого твердого вещества. Соединение 15 разделяли с помощью SFC (OJ, 2,5 × 25 см, 10 мкм, подвижная фаза: CO2/MeOH (0,03% DEA) = 70/30, 70 мл/мин ) с получением соединения 55 (36,54 мг, RT=1,836 мин , выход 13%) и соединения 56 (52,05 мг, 0,2 формиата, RT=2,175 мин , выход 18%).
Соединение 15: 1H ЯМР MeOD-d4 (400 МГц): δ 8,50 (s, 1H, формиат CHO), 8,28 (s, 1H), 7,40 (s, 1H), 7,35-7,31 (m, 2H), 7,17-7,15 (m, 1H), 4,44-4,31 (m, 4H), 4,22 (s, 2H), 3,87 (q, J=10,4 Гц, 2H), 3,73-3,69 (m, 1H), 2,63-2,57 (m, 1H), 2,30-2,17 (m, 2H), 2,16-2,03 (m, 2H), 1,87-1,82 (m,1H).
Соединение 55: 1H ЯМР MeOD-d4 (400 МГц): δ 8,47 (brs, 1H), 8,28 (s, 1H), 7,40 (s, 1H), 7,35-7,31 (m, 2H), 7,16 (d, J=7,6 Гц, 1H), 4,40-4,31 (m, 4H), 4,22 (s, 2H), 3,87 (q, J=10,4 Гц, 2H), 3,73-3,69 (m, 1H), 2,63-2,57 (m, 1H), 2,30-2,17 (m, 2H), 2,12-2,03 (m, 2H), 1,87-1,82 (m, 1H).
Соединение 56: 1H ЯМР DMSO-d6 (400 МГц): δ 8,33 (s, 1H), 7,39-7,37 (m, 2H), 7,20 (d, J=8,0 Гц, 1H), 7,08 (d, J=7,6 Гц, 1H), 4,31-4,12 (m, 5H), 4,06 (q, J=11,2 Гц, 2H), 2,24-2,20 (m, 1H), 2,08-2,02 (m, 1H), 1,96-1,86 (m, 3H), 1,64-1,59 (m,1H).
Пример B10
Получение соединений 16, 57 и 58
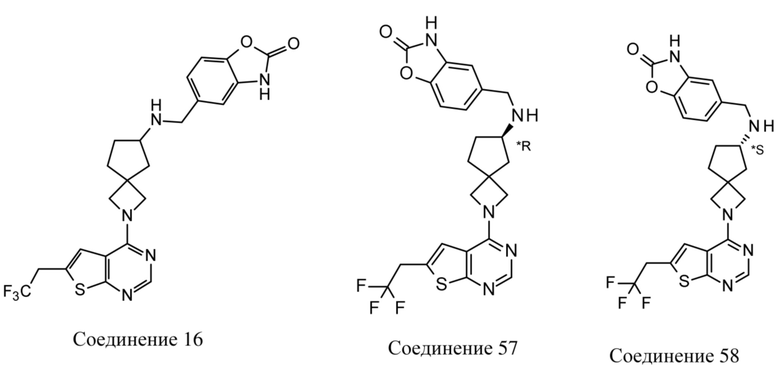
В раствор 2-оксо-3H-1,3-бензоксазол-5-карбальдегида (200,0 мг, 1,23 ммоль) в MeOH (4 мл) добавляли промежуточное соединение 2 (419 мг), AcOH (3 капли). Раствор перемешивали при комнатной температуре в течение 1 ч, затем в раствор добавляли NaBH3CN (115,60 мг, 1,84 ммоль) при 0°C и смесь перемешивали при комнатной температуре в течение ночи. Смесь промывали с помощью H2O, дважды экстрагировали с помощью EtOAc и органические слои объединяли. Экстракты концентрировали in vacuo и очищали с помощью преп. HPLC (Waters® 2767/Qda, колонка: Waters® Xbridge, 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением соединения 16 (55,9 мг) в виде белого твердого вещества.
Альтернативный синтез соединения 16
В раствор 2-оксо-2,3-дигидробензо[d]оксазол-5-карбальдегида (200 мг, 1,23 ммоль) в MeOH (5 мл) добавляли промежуточное соединение 2 (503 мг, 1,47 ммоль) и AcOH (2 капли) при комнатной температуре. После перемешивания в течение 2 часов в раствор добавляли NaBH(OAc)3 (522 мг, 2,46 ммоль) и полученную смесь перемешивали при комнатной температуре в течение ночи. Смесь концентрировали при пониженном давлении и очищали с помощью преп. HPLC (Waters® 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% NH4OH/H2O, B: ACN) с получением соединения 16.
Соединение 16 разделяли с помощью SFC (IE, 2,5 × 25 см, 10 мкм, подвижная фаза: CO2/MeOH=65/35, 60 мл/мин ) с получением соединения 57 (41,81 мг, 6,97%, RT=6,248) в виде белого твердого вещества и соединения 58 (37,71 мг, 6,28%, RT=6,683) в виде белого твердого вещества.
Соединение 16: 1H ЯМР MeOD-d4 (400 МГц): ): δ 8,26 (s, 1H), 7,35 (s, 1H), 7,19-7,08 (m, 3H), 4,50-4,10 (m, 3H), 3,86 (q, J=10,8 Гц, 2H), 3,79 (s, 2H), 3,28-3,20 (m, 2H), 2,38-2,28 (m, 1H), 2,16-1,90 (m, 3H), 1,85-1,77 (m, 1H), 1,64-1,52 (m, 1H)
Соединение 57: 1H ЯМР MeOH-d4 (400 МГц): δ 8,29 (s, 1H), 7,36 (s, 1H), 7,28-7,21 (m, 3H), 4,42-4,29 (m, 4H), 4,11 (s, 2H), 3,87 (q, J=10,4Гц, 2H), 3,61-3,58 (m, 1H), 2,56-2,51 (m, 1H), 2,24-2,14 (m, 2H), 2,08-1,96 (m, 2H), 1,80-1,75 (m, 1H)
Соединение 58: 1H ЯМР MeOH-d4 (400 МГц): δ 8,29 (s, 1H), 7,37 (s, 1H), 7,31-7,24 (m, 3H), 4,43-4,27 (m, 4H), 4,20 (s, 2H), 3,88 (q, J=10,4Гц, 2H), 3,71-3,67 (m, 1H), 2,62-2,57 (m, 1H), 2,30-2,16 (m, 2H), 2,12-2,01 (m, 2H), 1,88-1,80 (m, 1H)
Пример B11
Получение соединения 17
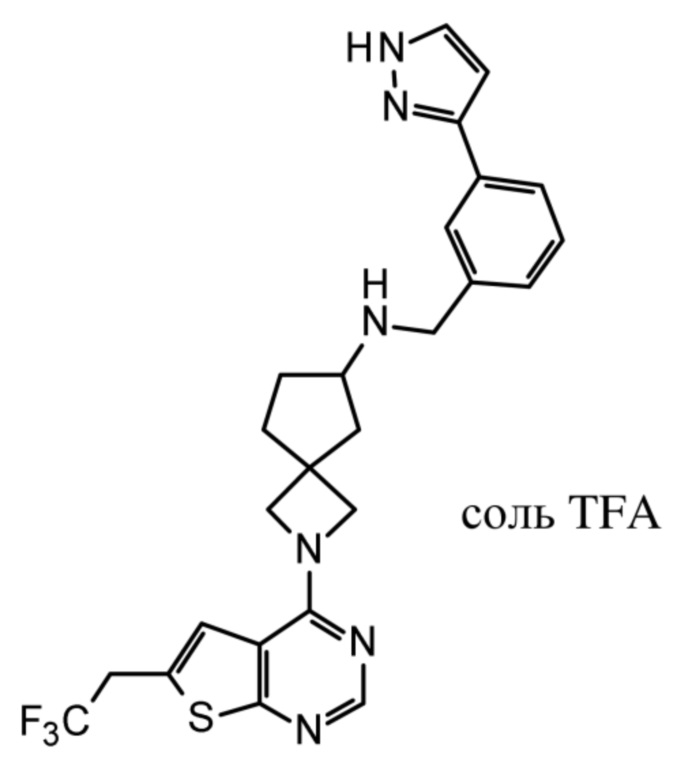
В раствор 3-(1H-пиразол-3-ил)бензальдегида (200 мг, 1,16 ммоль) в 1,2-дихлорэтане (4 мл) добавляли промежуточное соединение 2 (419 мг), AcOH (3 капли) и раствор перемешивали при комнатной температуре в течение 1 ч, затем в раствор добавляли NaBH(OAc)3 (390 мг, 1,84 ммоль) при 0°C и смесь перемешивали при комнатной температуре в течение ночи. Смесь промывали с помощью H2O, дважды экстрагировали с помощью EtOAc и органические слои объединяли. Экстракты концентрировали in vacuo и очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge, 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% TFA), B: ACN) с получением соединения 17 (84,0 мг, соль TFA) в виде белого твердого вещества.
Соединение 17: 1H ЯМР DMSO-d6 (400 МГц): δ 9,06 (brs, 2H), 8,36 (s, 1H), 8,00 (s, 1H), 7,86 (d, J=8,0 Гц, 1H),7,79 (d, J=2,0 Гц, 1), 7,50 (t, J=3,2 Гц, 1H), 7,43 (d, J=7,6 Гц, 1H), 7,39 (s, 1H), 6,73 (d, J=2,54 Гц, 1H), 4,30-4,20 (m, 5H), 4,02-4,08 (m, 2H), 3,64-3,67 (m, 1H), 2,12(m, 2H), 2,11-1,96 (m, 4H), 1,81-1,79 (m, 1H)
Пример B12
Получение соединения 18
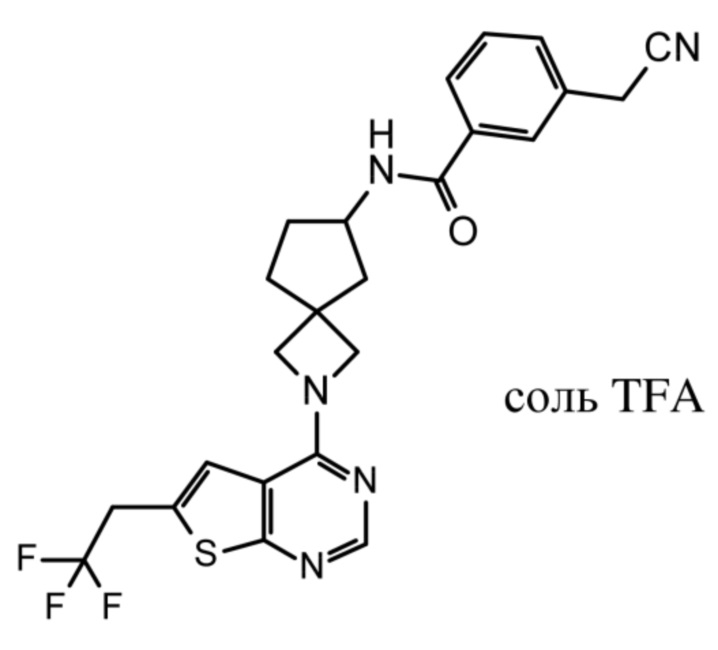
В раствор промежуточного соединения 2 (200 мг) в DCM (10 мл) добавляли 3-(цианометил)бензойную кислоту (47,0 мг, 0,292 ммоль) и EDCI (84 мг, 0,438 ммоль), HOBT (67,4 мг, 0,438 ммоль), TEA (88,5 мг, 0,876 ммоль) при комнатной температуре. После перемешивания при комнатной температуре в течение 16 ч смесь концентрировали с получением остатка, который очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% TFA/H2O, B: ACN) с получением соединения 18 (106 мг) (соль TFA) в виде желтого масла.
Соединение 18: 1H ЯМР MeOD-d4 (400 МГц): δ 8,41 (s, 1H), 7,82 (s, 1H), 7,79-7,77 (d, J=7,6Гц, 1H), 7,56-7,47 (m, 3H), 4,73-4,40 (m, 5H), 3,98-3,91 (m, 4H), 2,56-2,49 (m, 1H), 2,24-2,03 (m, 4H), 1,83-1,80 (m, 1H).
Пример B13
Получение соединения 19
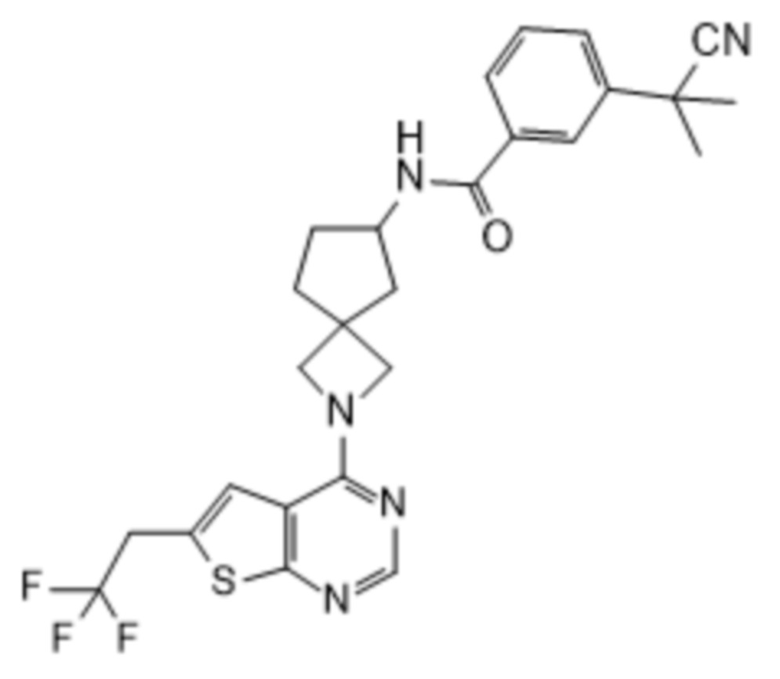
В раствор промежуточного соединения 2 (200 мг) в DCM (10 мл) добавляли 4-(цианометил)бензойную кислоту (55,2 мг, 0,292 ммоль) и EDCI (84 мг, 0,438 ммоль), HOBT (67,4 мг, 0,438 ммоль), TEA (88,5 мг, 0,876 ммоль) при комнатной температуре. После перемешивания при комнатной температуре в течение 16 ч смесь концентрировали с получением остатка, который очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge, 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением соединения 19 (50 мг) в виде светло-желтого твердого вещества.
Соединение 19: 1H ЯМР MeOH-d4 (400 МГц): δ 8,27(s, 1H), 7,97 (s, 1H), 7,78 (d, J=7,6 Гц, 1H), 7,71 (d, J=8,0 Гц, 1H), 7,54-7,50 (m, 1H), 7,38 (s, 1H), 4,47-4,41 (m, 5H), 3,91-3,83 (m, 2H), 2,51-2,46 (m, 1H), 2,22-2,17 (m, 2H), 2,07-2,01 (m, 2H), 1,81-1,76 (m, 7H).
Пример B14
Получение соединения 20
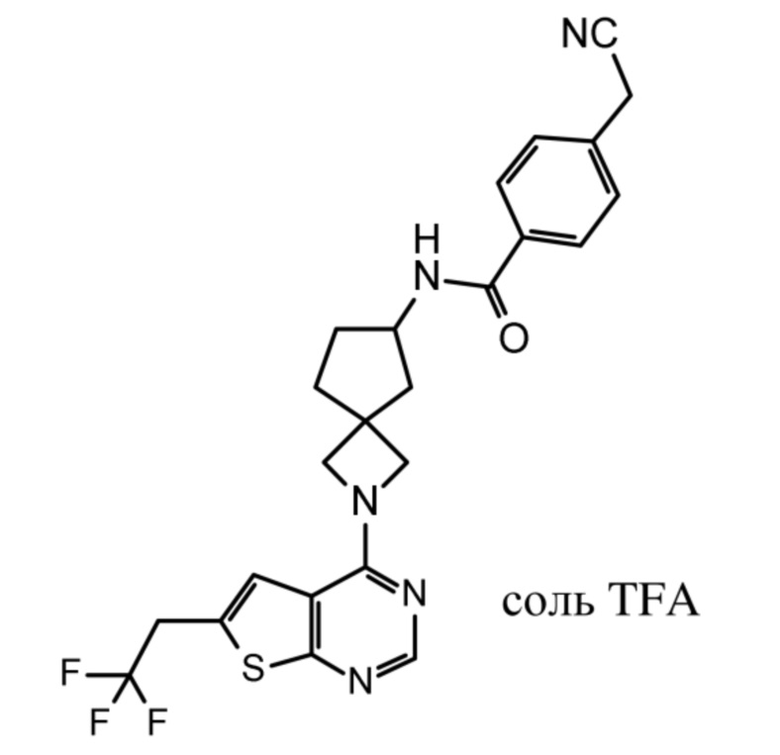
В раствор промежуточного соединения 2 (200 мг) в DCM (10 мл) добавляли 4-(цианометил)бензойную кислоту (47,0 мг, 0,292 ммоль) и EDCI (84 мг, 0,438 ммоль), HOBT (67,4 мг, 0,438 ммоль), TEA (88,5 мг, 0,876 ммоль) при комнатной температуре. После перемешивания при комнатной температуре в течение 16 ч смесь концентрировали с получением остатка, который очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% TFA/H2O, B: ACN) с получением соединения 20 (65 мг) (соль TFA) в виде желтого масла.
Соединение 20: 1H ЯМР MeOH-d4 (400 МГц): δ 8,42 (s, 1H), 7,85 (d, J=8,0 Гц, 2H), 7,51 (s, 1H), 7,46 (d, J=8,4Гц, 2H), 4,45-4,41 (m, 5H), 4,00-3,91 (m, 4H), 2,54-2,48 (m, 1H), 2,22-2,03 (m, 4H), 1,83-1,77 (m, 1H).
Пример B16
Получение соединений 22, 23 и 24
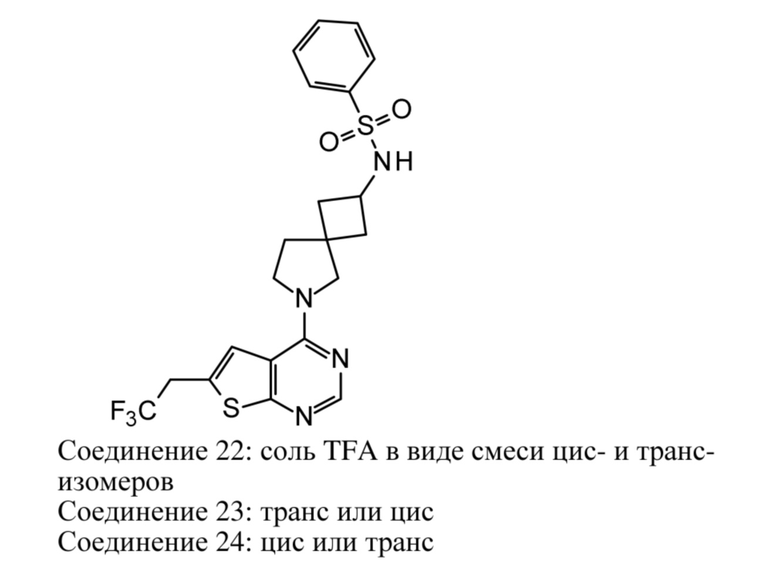
В раствор промежуточного соединения 3 (200 мг) в DCM (8 мл) добавляли бензолсульфонилхлорид (52,0 мг, 0,292 ммоль) и TEA (88,5 мг, 0,876 ммоль) при комнатной температуре. После перемешивания при комнатной температуре в течение 16 ч смесь концентрировали с получением остатка, который очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% TFA/H2O, B: ACN) с получением соединения 22 (50 мг, выход 35,48% (соль TFA)) в виде желтого твердого вещества. Соединение 22 разделяли с помощью SFC (условие: SFC80 (Waters), неподвижная фаза: OJ, 2,5 × 25 см, 10 мкм, подвижная фаза: CO2/MeOH (0,1% DEA) = 75/25) с получением соединения 23 (транс или цис) (свободное основание) (3,99 мг) в виде розового твердого вещества и соединения 24 (цис или транс) (свободное основание) (8,26 мг) в виде белого твердого вещества.
Соединение 22: 1H ЯМР MeOH-d4 (400 МГц): δ 8,43 (d, J=6,0 Гц, 1H), 7,87-7,84 (m, 2H), 7,77-7,71 (m, 1H), 7,63-7,52 (m, 3H), 3,98-3,75 (m, 7H), 2,29-1,91 (m, 6H).
Пример B17
Альтернативное получение соединения 22 и его превращение в соединения 25 и 26
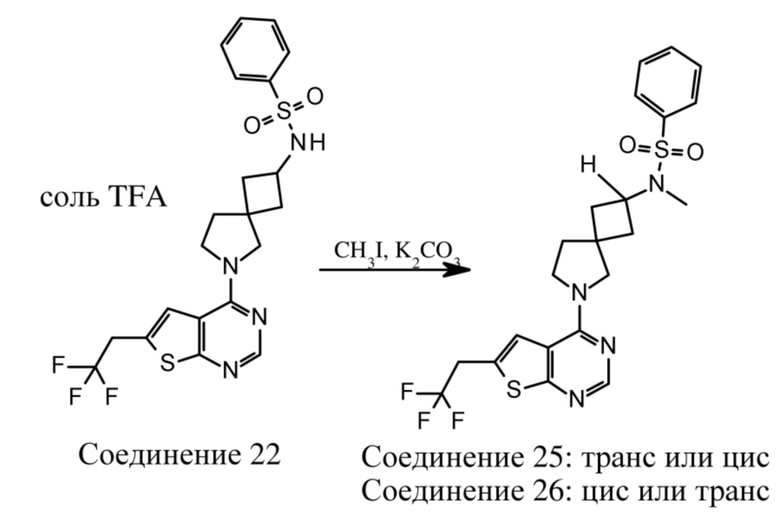
В раствор промежуточного соединения 3 (400 мг) и TEA (177 мг, 1,75 ммоль) в DCM (20 мл) добавляли бензолсульфонилхлорид (133 мг, 0,76 ммоль) при 0°C. После перемешивания при 0°C в течение 2 ч в реакционную смесь добавляли воду (20 мл) и ее экстрагировали с помощью DCM (50 мл × 3). Органическую фазу промывали солевым раствором, высушивали над Na2SO4 и концентрировали. Неочищенный продукт очищали с помощью преп. TLC с получением соединения 22 (280 мг).
В раствор соединения 22 (280 мг) и K2CO3 (240 мг, 1,74 ммоль) в DMF (20 мл) добавляли йодметан (247 мг, 1,74 ммоль) при 0°C. После перемешивания при 0°C в течение 2 ч в реакционную смесь добавляли воду (20 мл) и ее экстрагировали с помощью EA (50 мл × 3). Органическую фазу промывали солевым раствором, высушивали над Na2SO4 и концентрировали. Неочищенный продукт очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% TFA/H2O, B: ACN) с получением 100 мг рацемического продукта. Рацемический продукт разделяли с помощью SFC (условие: SFC80 (Waters), неподвижная фаза: AS, 2,5 × 25 см, 10 мкм, подвижная фаза: CO2/MeOH (0,3% DEA) = 60/40) с получением соединения 25 (транс или цис) (45,50 мг, чистота 97,5%) в виде белого твердого вещества и соединения 26 (цис или транс) (48,52 мг, чистота 99,3%) в виде белого твердого вещества.
Соединение 25: 1H ЯМР MeOD-d4 (400 МГц): δ 8,27 (s, 1H), 7,81-7,79 (m, 2H), 7,65-7,63 (m, 2H), 7,60-7,57 (m, 2H), 4,12 (m, 1H), 3,91-3,86 (m, 3H), 3,83-3,79 (m, 3H), 2,71 (s, 3H), 2,24-2,19 (m, 4H), 2,03(m, 2H).
Соединение 26: 1H ЯМР MeOD-d4 (400 МГц): δ 8,25 (s, 1H), 7,82-7,79 (m, 2H), 7,65-7,64 (m, 1H), 7,62-7,58 (m, 3H), 4,10-4,08 (m, 1H), 3,89-3,81 (m, 4H), 3,73 (m, 2H), 2,72 (s, 3H), 2,31-2,26 (m, 2H), 2,15-2,10 (m, 4H).
Пример B18
Получение соединений 27, 28 и 29

В раствор 4-(метансульфонамидо)бензойной кислоты (100 мг, 0,292 ммоль) в DCM (10 мл) добавляли промежуточное соединение 3 (63 мг) и EDCI (84 мг, 0,438 ммоль), HOBT (67,4 мг, 0,438 ммоль), TEA (88,5 мг, 0,876 ммоль) при комнатной температуре. После перемешивания при комнатной температуре в течение 16 ч смесь концентрировали с получением остатка, который очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge, 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением соединения 27 (55 мг) в виде светло-желтого твердого вещества. Часть соединения 27 (26,4 мг) разделяли с помощью SFC (условие: SFC80 (Waters), неподвижная фаза: OJ, 2,5 × 25 см, 10 мкм, подвижная фаза: CO2/MeOH (0,3% DEA) = 70/30) с получением соединения 28 (транс или цис) (6,88 мг) в виде розового твердого вещества и соединения 29 (цис или транс) (9,91 мг) в виде белого твердого вещества.
Соединение 27: 1H ЯМР meOH-d4 (400 МГц): δ 8,29 (d, J=6,4 Гц, 1H), 7,82 (d, J=6,4 Гц, 2H), 7,68-7,62 (m, 1H), 7,30 (d, J=8,4 Гц, 2H), 4,60-4,56 (m, 1H), 3,96-3,83 (m, 6H), 3,02 (s, 3H), 2,54-2,46 (m, 2H), 2,30-2,12 (m, 4H).
Пример B19
Получение соединения 30
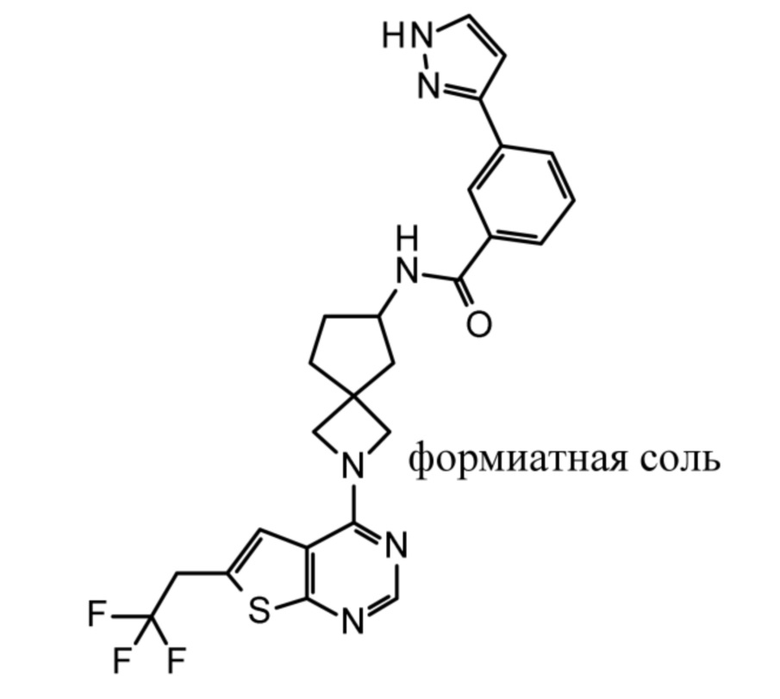
В раствор 3-(1H-пиразол-3-ил)бензойной кислоты (130 мг, 0,69 ммоль) в DCM (10 мл) добавляли промежуточное соединение 2 (340 мг) и EDCI (197 мг, 1,0 ммоль), HOBT (139 мг, 1,0 ммоль), DIPEA (267 мг, 2,07 ммоль). После перемешивания при комнатной температуре в течение 12 ч смесь концентрировали, разбавляли с помощью EtOAc и H2O, водный слой дважды экстрагировали с помощью EA. Объединенные экстракты концентрировали и очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge, 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% HCOOH), B: ACN) с получением соединения 30 (50,1 мг) (формиатная соль) в виде белого твердого вещества.
Соединение 30: 1H ЯМР DMSO-d6 (400 МГц): δ 13,0 (brs, 1H), 8,51-8,48 (m, 2H, формиат CHO), 8,25 (s, 1H), 7,93-7,91 (m, 1H), 7,81-7,74 (m, 2H), 7,50-7,43 (m, 2H), 6,77 (s, 1H), 4,38-4,20 (m, 4H), 4,09-4,01 (m, 2H), 2,38-2,31 (m, 1H), 2,11-1,91(m, 5H), 1,73-1,63 (m, 1H)
Пример B20
Получение соединений 31, 32, 33 и 34
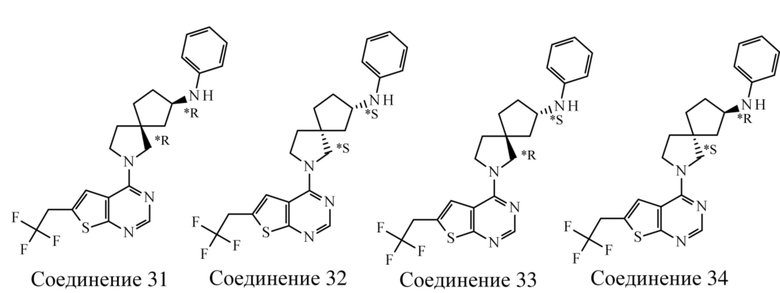
В раствор промежуточного соединения 11 (517 мг (неочищенное вещество)) в изопропаноле (15 мл) добавляли 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (369 мг, 1,459 ммоль) и DIPEA (753 мг, 5,836 ммоль). После перемешивания при комнатной температуре в течение 2 ч смесь концентрировали и остаток очищали с помощью колоночной хроматографии (PE/EA=1/1) с получением нерацемического продукта (418 мг), который разделяли с помощью SFC (условие: SFC80 (Waters), неподвижная фаза: IE 2,5 × 25 см, 10 мкм, подвижная фаза: CO2/EtOH (15% ACN) = 65/35) с получением соединения 31 (81,7 мг), соединения 32 (52,8 мг), соединения 33 (60,8 мг) и соединения 34 (60,8 мг).
Соединение 31: 1H ЯМР MeOD-d4 (400 МГц): δ 8,27 (s, 1H),7,64 (s, 1H), 7,10-7,06 (m, 2H), 6,65-6,57 (m, 3H), 4,00-3,85 (m, 5H), 3,72-3,50 (m, 2H), 2,24-2,19 (m, 2H), 2,09-2,04 (m, 2H), 1,80-1,73 (m, 1H), 1,70-1,59 (m, 3H).
Соединение 32: 1H ЯМР MeOD-d4 (400 МГц): δ 8,27 (s, 1H),7,64 (s, 1H), 7,10-7,06 (m, 2H), 6,65-6,57 (m, 3H), 4,00-3,85 (m, 5H), 3,72-3,50 (m, 2H), 2,24-2,19 (m, 2H), 2,09-2,04 (m, 2H), 1,80-1,73 (m, 1H), 1,70-1,59 (m, 3H).
Соединение 33: 1H ЯМР MeOD-d4 (400 МГц): δ 8,26 (s, 1H),7,61 (s, 1H), 7,11-7,07 (m, 2H), 6,66-6,58 (m, 3H), 3,96-3,82 (m, 7H), 2,24-2,19 (m, 2H), 2,09-2,04 (m, 2H), 1,80-1,73 (m, 1H), 1,70-1,59 (m, 3H).
Соединение 34: 1H ЯМР MeOD-d4 (400 МГц): δ 8,26 (s, 1H),7,61 (s, 1H), 7,10-7,06 (m, 2H), 6,66-6,58 (m, 3H), 3,98-3,82 (m, 7H), 2,24-2,19 (m, 2H), 2,09-2,04 (m, 2H), 1,80-1,73 (m, 1H), 1,70-1,59 (m, 3H).
Пример B21
Получение соединения 35
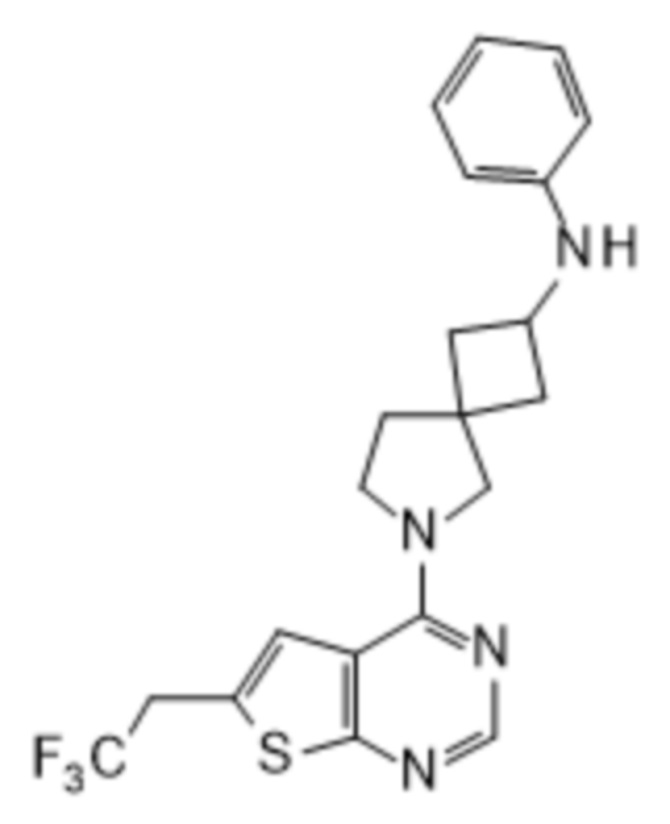
Перемешивали смесь промежуточного соединения 3 (131 мг), бромбензола (50 мг, 0,32 ммоль), Pd2(dba)3 (5 мг, 10%), BrettPhos (5 мг, 10%) и tBuONa (92 мг, 0,95 ммоль) в диоксане (3 мл) при микроволновом облучении при 130°C в течение 2 ч. Реакционную смесь разбавляли водой и экстрагировали с помощью EtOAc (50 мл × 3). Органическую фазу промывали солевым раствором, высушивали над Na2SO4 и концентрировали. Неочищенный продукт очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge, 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением соединения 35 (42,26 мг) в виде желтого твердого вещества.
Соединение 35 1H ЯМР DMSO-d6 (400 МГц): δ 8,32 (d, J=4,8 Гц, 1H), 7,72 (d, J=14,8 Гц, 1H), 7,08-7,03 (m, 2H), 6,52-6,50 (m, 3H), 5,89-5,85 (m, 1H), 4,05 (q, J=10,8 Гц, 2H), 3,92-3,87 (m, 2H), 3,80-3,75 (m, 2H), 3,25 (m, 1H), 2,46-2,41 (m, 2H), 211-2,09 (m, 1H), 2,07-2,02 (m, 1H), 1,96-1,87 (m, 2H).
Пример B22
Получение соединений 36 и 37
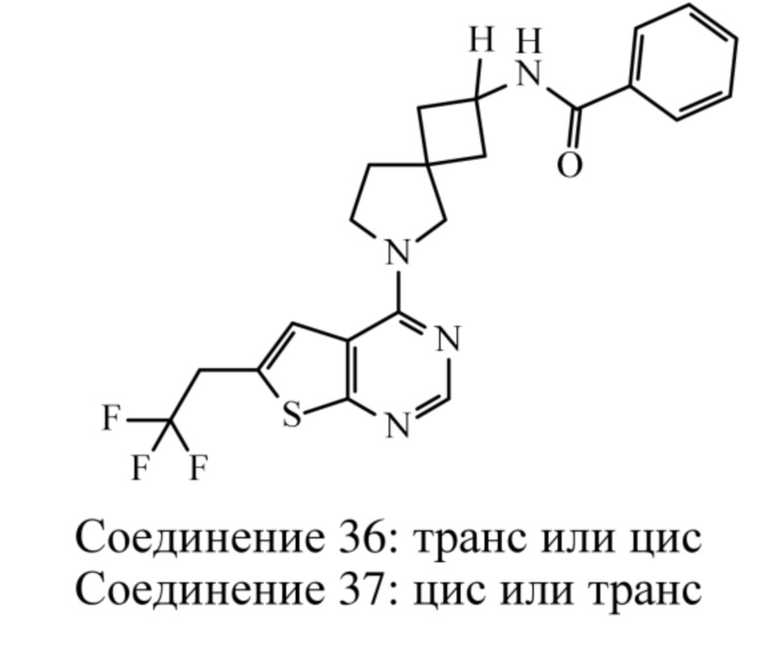
В раствор промежуточного соединения 3 (400 мг) и TEA (354 мг, 3,50 ммоль) в DCM (20 мл) добавляли бензоилхлорид (163 мг, 1,17 ммоль) при 0°C. После перемешивания при 0°C в течение 2 ч в реакционную смесь добавляли воду (20 мл) и ее экстрагировали с помощью DCM (50 мл × 3). Органическую фазу промывали солевым раствором, высушивали над Na2SO4 и концентрировали. Неочищенный продукт очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge, 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением 120 мг остатка, который разделяли с помощью SFC (условие: SFC80 (Waters), неподвижная фаза: OJ, 2,5 × 25 см, 10 мкм, подвижная фаза: CO2/MeOH (0,3% DEA) = 60/40) с получением соединения 36 (30,92 мг, чистота 98,8%) в виде белого твердого вещества и соединения 37 (43,84 мг, чистота 99,5%) в виде белого твердого вещества.
Соединение 36: 1H ЯМР MeOD-d4 (400 МГц): δ 8,29 (s, 1H), 7,83-7,81 (m, 2H), 7,67 (s, 1H), 7,54-7,51 (m, 1H), 7,47-7,43 (m, 2H), 4,61-4,57 (m, 1H), 3,96-3,93 (m, 2H), 3,90-3,85 (m, 4H), 2,56-2,51 (m, 2H), 2,27-2,22 (m, 2H), 2,16-2,08 (m, 2H).
Соединение 37: 1H ЯМР MeOD-d4 (400 МГц): δ 8,27 (s, 1H), 7,83-7,81 (m, 2H), 7,62 (s, 1H), 7,54-7,51 (m, 1H), 7,47-7,43 (m, 2H), 4,61-4,57 (m, 1H), 3,91-3,88 (m, 3H), 3,86-3,83 (m, 3H), 2,52-2,47 (m, 2H), 2,30-2,28 (m, 2H), 2,27-2,25 (m, 2H).
Пример B23
Получение соединения 38
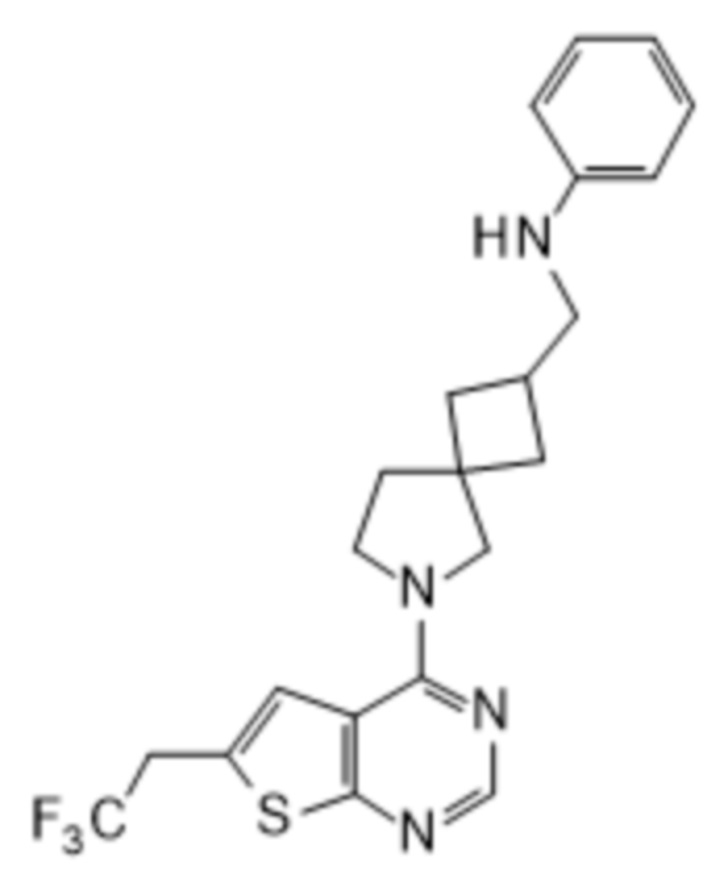
В раствор промежуточного соединения 10 (157 мг (неочищенное вещество)) в изопропаноле (5 мл) добавляли 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (184 мг, 0,727 ммоль) и DIPEA (0,48 мл, 2,91 ммоль). После перемешивания при комнатной температуре в течение 2 ч смесь концентрировали, остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge, 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN). Необходимую фракцию собирали и растворитель выпаривали с получением соединения 38 (109,5 мг, чистота 99,2%).
Соединение 38: 1H ЯМР CDCl3 (400 МГц): δ 8,42 (d, J=3,2 Гц, 1H), 7,34 (d, J=4,0 Гц, 1H), 7,19-7,16 (m, 2H), 6,72-6,69 (m, 1H), 6,62-6,59 (m, 2H), 3,84-3,80 (m, 3H), 3,72 (s, 1H), 3,62 (q, J=10,4 Гц, 2H), 3,21-3,18 (m, 2H), 2,66-2,60 (m, 1H), 2,27-2,01 (m, 4H), 1,91-1,83(m, 2H)
Пример B24
Получение соединения 39
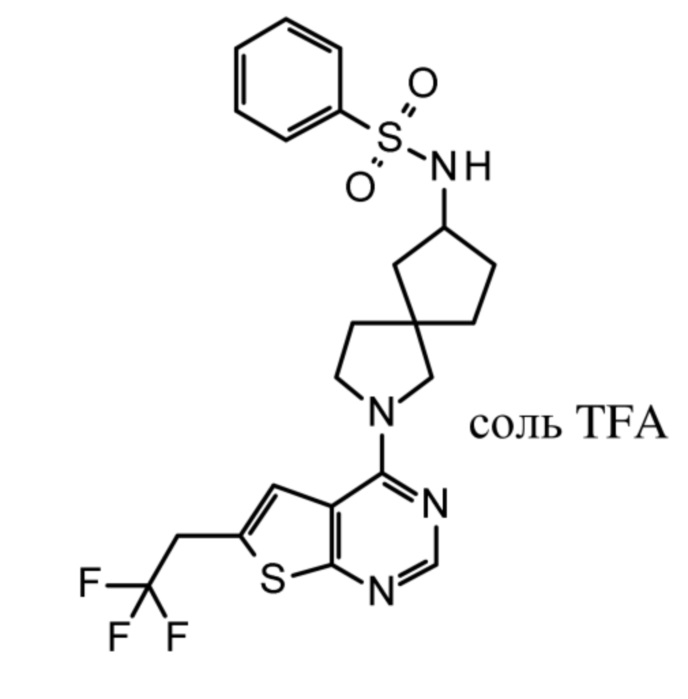
В раствор неочищенного промежуточного соединения 15 (35 мг, 0,125 ммоль) в изопропаноле (6 мл) добавляли DIPEA (48 мг, 0,375 ммоль) и 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (32 мг, 0,125 ммоль). После перемешивания при комнатной температуре в течение 5 ч в реакционную смесь добавляли воду (20 мл) и ее экстрагировали с помощью EtOAc (50 мл × 3). Органическую фазу промывали солевым раствором, высушивали над Na2SO4 и концентрировали. Неочищенный продукт очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% TFA/H2O, B: ACN). Необходимую фракцию собирали и растворитель выпаривали с получением соединения 39 (35,1 мг, чистота 98,70%).
Соединение 39: 1H ЯМР DMSO-d6 (400 МГц): δ 8,36 (s, 1H), 7,82-7,80 (m, 3H), 7,70 (s, 1H), 7,62-7,56 (m, 3H), 4,07 (q, J=10,8 Гц, 2H), 3,63-3,60 (m, 3H), 3,58-3,55 (m, 2H), 2,37 (m, 1H), 1,84-1,72 (m, 3H), 1,68-1,64 (m, 1H), 1,54-1,44 (m, 3H).
Пример B25
Получение соединения 40
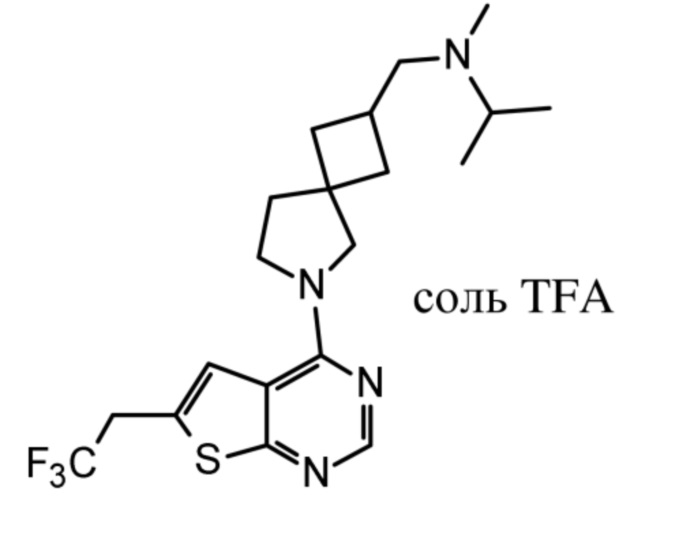
В раствор неочищенного промежуточного соединения 12 (120 мг) в изопропаноле (6 мл) добавляли DIPEA (129 мг, 1,004 ммоль) и 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (84 мг, 0,334 ммоль). После перемешивания при комнатной температуре в течение 5 ч в реакционную смесь добавляли воду (20 мл) и ее экстрагировали с помощью EtOAc (50 мл × 3). Органическую фазу промывали солевым раствором, высушивали над Na2SO4 и концентрировали. Неочищенный продукт очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% TFA/H2O, B: ACN) с получением соединения 40 (66,8 мг).
Соединение 40: 1H ЯМР DMSO-d6 (400 МГц): δ 9,06 (brs, 1H), 8,34 (d, J=3,6 Гц, 1H), 7,69 (d, J=13,6 Гц, 1H), 4,06 (q, J=10,8 Гц, 2H), 3,87-3,67 (m, 4H), 3,52-3,44 (m, 1H), 3,26-3,19 (m, 1H), 3,13-3,03 (m, 1H), 2,76-2,66 (m, 1H), 2,63-2,61 (m, 3H), 2,26-2,05 (m, 3H), 2,00-1,81 (m, 3H), 1,23-1,1 (m, 6H).
Пример B26
Получение соединения 41
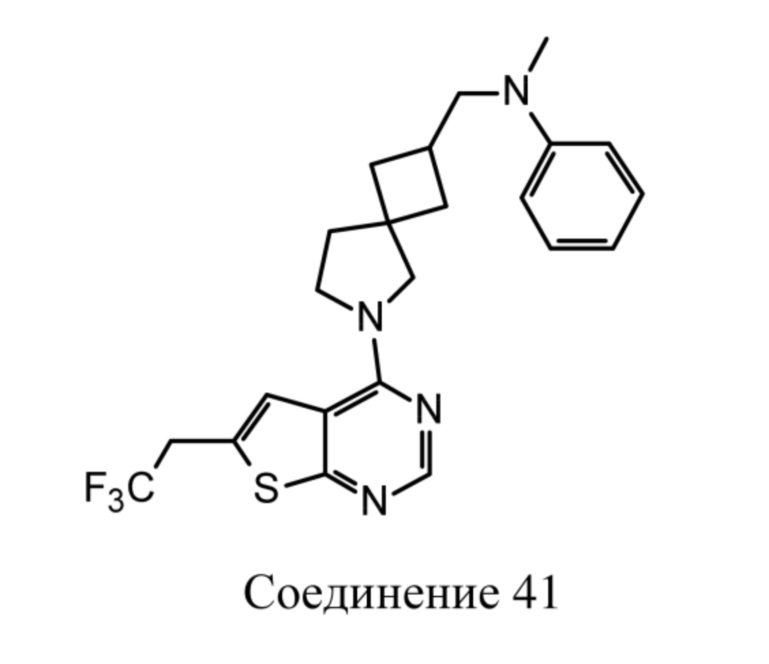
В раствор неочищенного промежуточного соединения 13 (50 мг) в изопропаноле (6 мл) добавляли DIPEA (84 мг, 0,652 ммоль) и 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (55 мг, 0,217 ммоль). После перемешивания при комнатной температуре в течение 5 ч в реакционную смесь добавляли воду (20 мл) и ее экстрагировали с помощью EtOAc (50 мл × 3). Органическую фазу промывали солевым раствором, высушивали над Na2SO4 и концентрировали. Неочищенный продукт очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge, 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением соединения 41 (50 мг, чистота 98,71%).
Соединение 41: 1H ЯМР MeOD-d4 (400 МГц): δ 8,25 (s, 1H), 7,61 (s, 1H), 7,17-7,13 (m, 2H), 6,75-6,72 (m, 2H), 6,65-6,61 (m, 1H), 3,90-3,78 (m, 5H), 3,78-3,73 (m, 1H), 3,42-3,39 (m, 2H), 2,92 (s, 3H), 2,80-2,72 (m, 1H), 2,16-2,08 (m, 3H), 2,07-1,98 (m, 1H), 1,97-1,90 (m, 2H).
Пример B27
Получение соединения 42
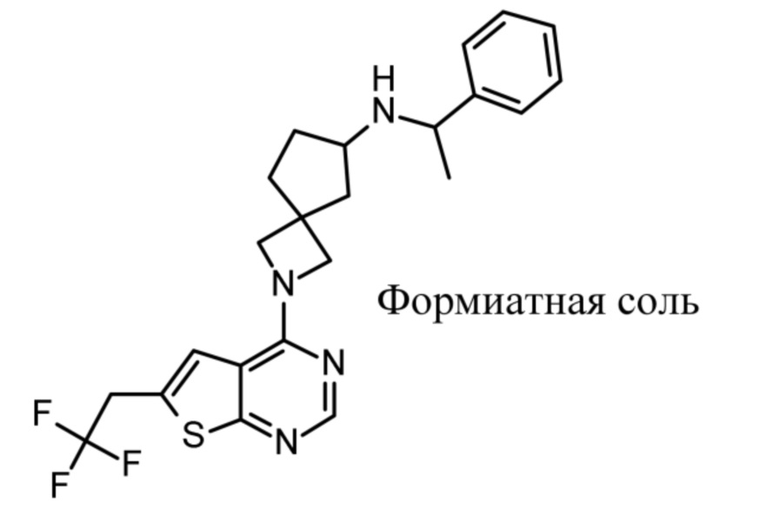
Добавляли промежуточное соединение 4 (70,0 мг, 0,205 ммоль), DL-альфа-метилбензиламин (62,1 мг, 0,512 ммоль), CH3COOH (0,1 мл) и DCM (5 мл) в круглодонную колбу объемом 50 мл. Реакционную смесь обрабатывали триацетоксиборогидридом натрия (174 мг, 0,821 ммоль) и перемешивали при 20°C в течение 2 часов. Реакционную смесь разбавляли водой (20 мл), экстрагировали с помощью DCM (20 мл × 2), промывали солевым раствором и высушивали над Na2SO4. Органический слой фильтровали и концентрировали при пониженном давлении с получением неочищенного продукта, который очищали с помощью преп. HPLC, условие: (Xtimate C18 150 × 25 мм × 5 мкм, расход: 22 мл/мин, подвижная фаза A: вода (0,225% FA)-ACN, подвижная фаза B: ацетонитрил, градиент: от 23 до 53% (%B)). Необходимую фракцию собирали и выпаривали с удалением CH3CN в вакууме. Остаток лиофилизировали с получением соединения 42 (формиатной соли) (34,1 мг, белые твердые вещества).
Соединение 41: 1H ЯМР DMSO-d6 (400 МГц): δ 8,32-8,29 (m,1H), 7,40-7,30 (m, 5H), 7,26-7,20 (m, 1H), 4,40-3,90 (m, 6H), 3,84-3,75 (m, 1H), 2,94-2,87 (m, 1H), 2,06-1,94 (m, 2H), 1,84-1,65 (m, 3H), 1,54-1,35 (m, 1H), 1,30-1,25 (m, 3H)
Пример B28
Получение соединения 43
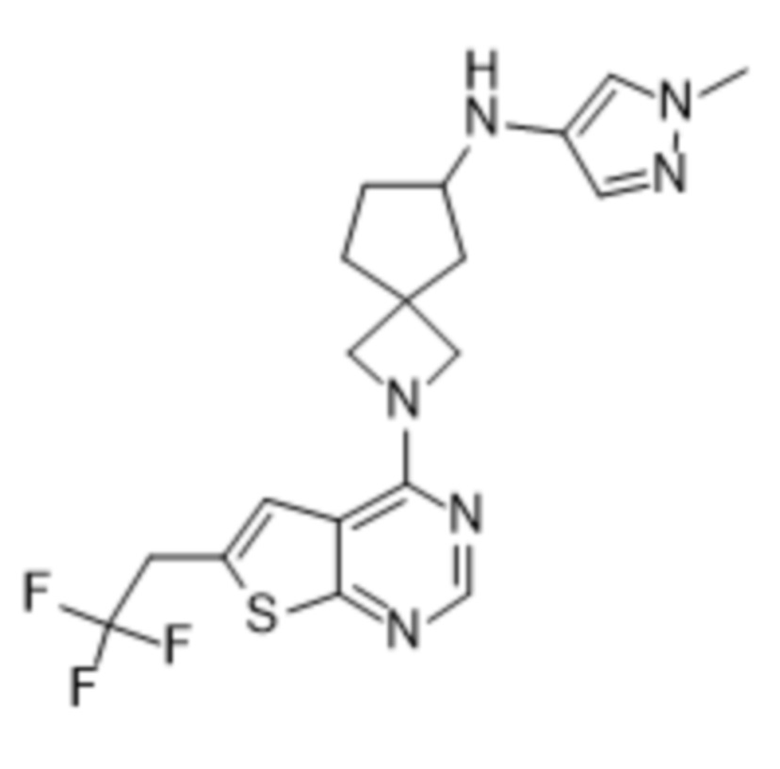
Добавляли промежуточное соединение 4 (70,0 мг, 0,205 ммоль), 1-метил-1H-пиразол-4-амин (49,8 мг, 0,513 ммоль), CH3COOH (0,1 мл) и DCM (5 мл) в круглодонную колбу объемом 50 мл. Реакционную смесь обрабатывали триацетоксиборогидридом натрия (174 мг, 0,821 ммоль) и перемешивали при 20°C в течение 2 часов. Реакционную смесь разбавляли водой (20 мл), экстрагировали с помощью DCM (20 мл × 2), промывали солевым раствором и высушивали над Na2SO4. Органический слой фильтровали и концентрировали при пониженном давлении с получением неочищенного продукта, который очищали с помощью преп. HPLC, условие: (Xtimate C18 150 × 25 мм × 5 мкм, расход: 22 мл/мин , подвижная фаза A: вода (0,225% FA)-ACN, подвижная фаза B: ацетонитрил, градиент: от 18 до 48% (%B)). Необходимую фракцию собирали и выпаривали с удалением CH3CN в вакууме. Остаток лиофилизировали с получением соединения 43 (28,6 мг, выход 31,5%, белые твердые вещества).
Соединение 43: 1H ЯМР DMSO-d6 (400 МГц): δ 8,32 (s, 1H), 7,41 (s, 1H), 7,06 (s, 1H), 6,93 (s, 1H), 4,41-3,96 (m, 6H), 3,69 (s, 3H), 3,47-3,46 (m, 1H), 2,28-2,17 (m, 1H), 2,09-1,85 (m, 3H), 1,83-1,74 (m, 1H), 1,56-1,46 (m, 1H).
Пример B29
Получение соединения 44
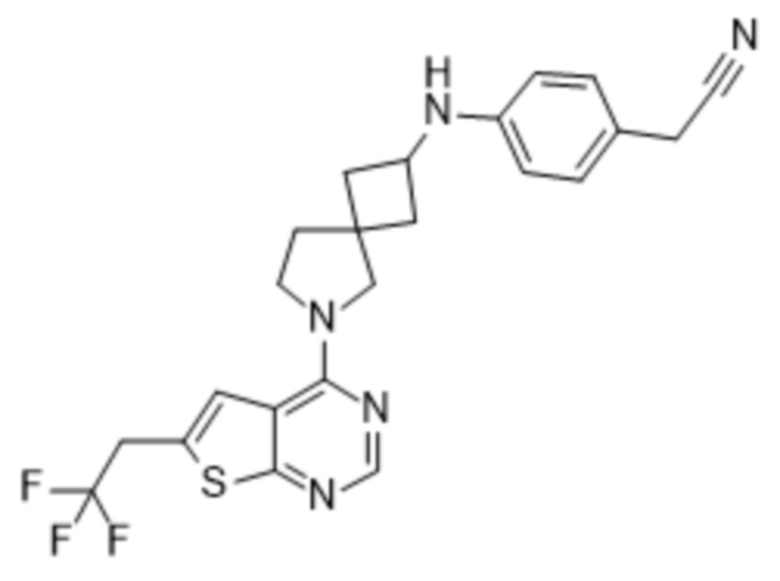
Добавляли якорь магнитной мешалки, промежуточное соединение 5 (110 мг, 0,322 ммоль), 2-(4-аминофенил)ацетонитрил (51,1 мг, 0,387 ммоль), уксусную кислоту (одну каплю), триацетоксиборогидрид натрия (342 мг, 1,61 ммоль) и сухой дихлорметан (5 мл) в стеклянный флакон объемом 40 мл, в котором обеспечивали перемешивание при 40°C в течение 12 часов. Смесь обрабатывали водой (50 мл) и водный слой экстрагировали дихлорметаном (20 мл × 3). Объединенные органические слои высушивали над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении с получением неочищенного продукта, который очищали с помощью преп. TLC (элюент: этилацетат) с получением остатка. Остаток разделяли между ацетонитрилом (2 мл) и водой (10 мл). Раствор лиофилизировали до сухого состояния с получением соединения 44 (54,2 мг, выход 35,7%) в виде светло-желтого порошка.
Соединение 44: 1H ЯМР DMSO-d6 (400 МГц): δ 8,36-8,30 (m, 1H), 7,77-7,66 (m, 1H), 7,07-7,00 (m, 2H), 6,57-6,50 (m, 2H), 6,03 (t, J=7,2 Гц, 1H), 4,12-4,02 (m, 2H), 3,96-3,67 (m, 7H), 2,50-2,40 (m, 2H), 2,17-1,84 (m, 4H).
Пример B30
Получение соединений 45, 46 и 47
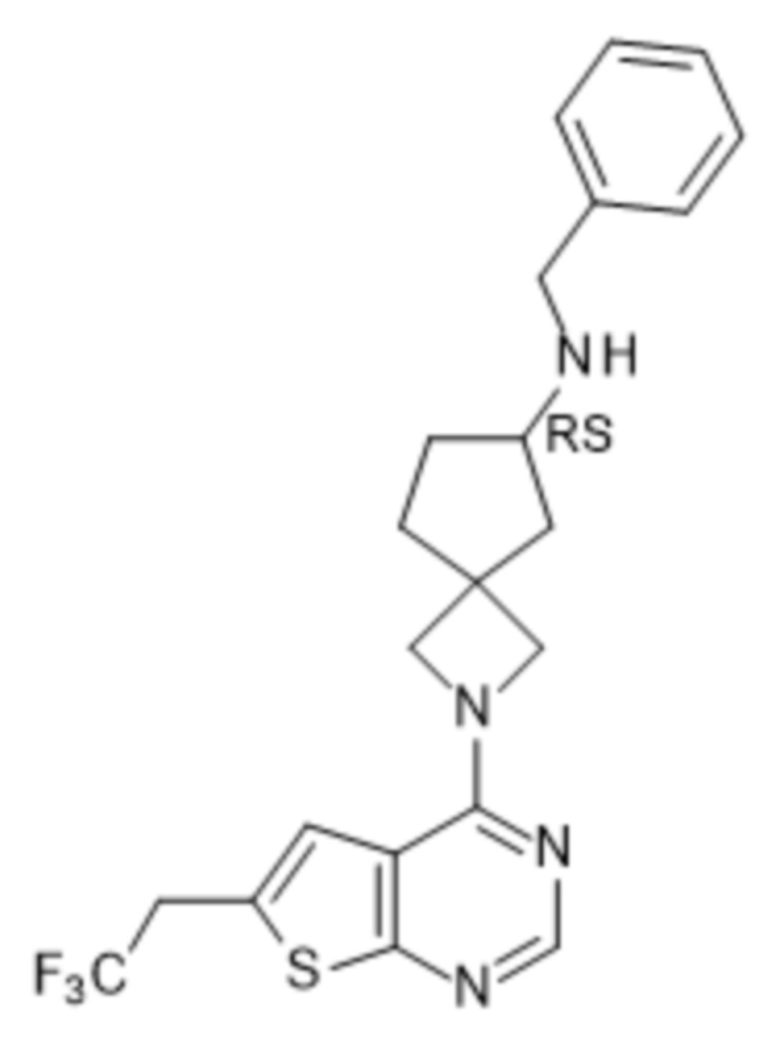
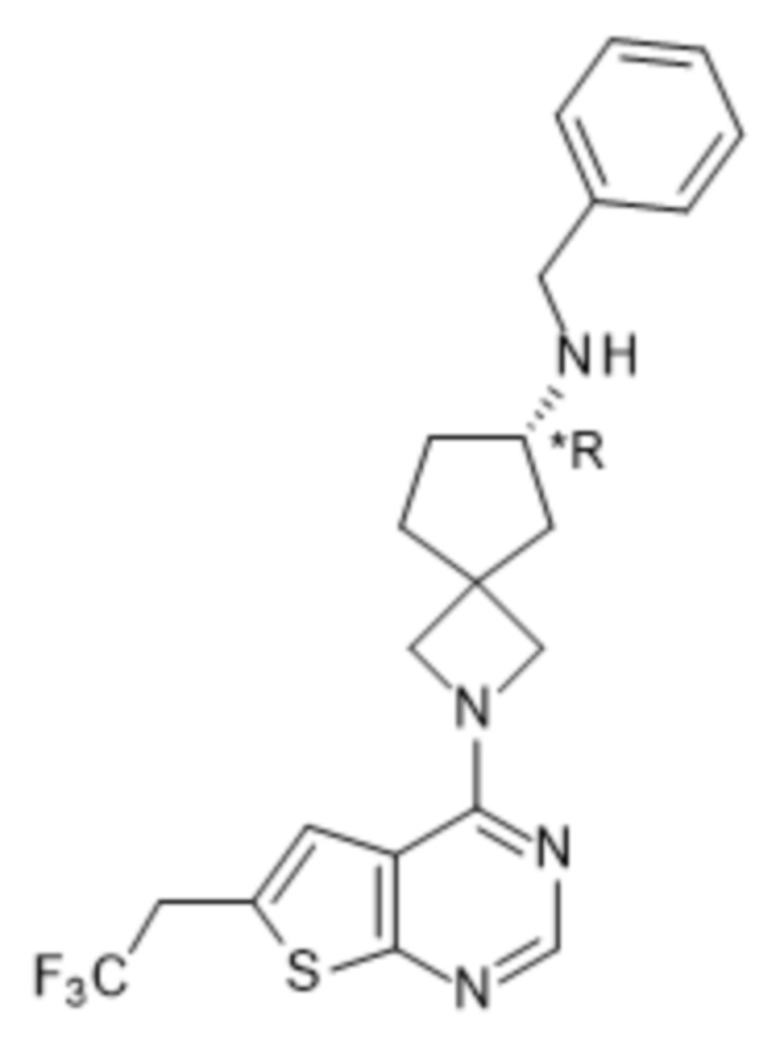
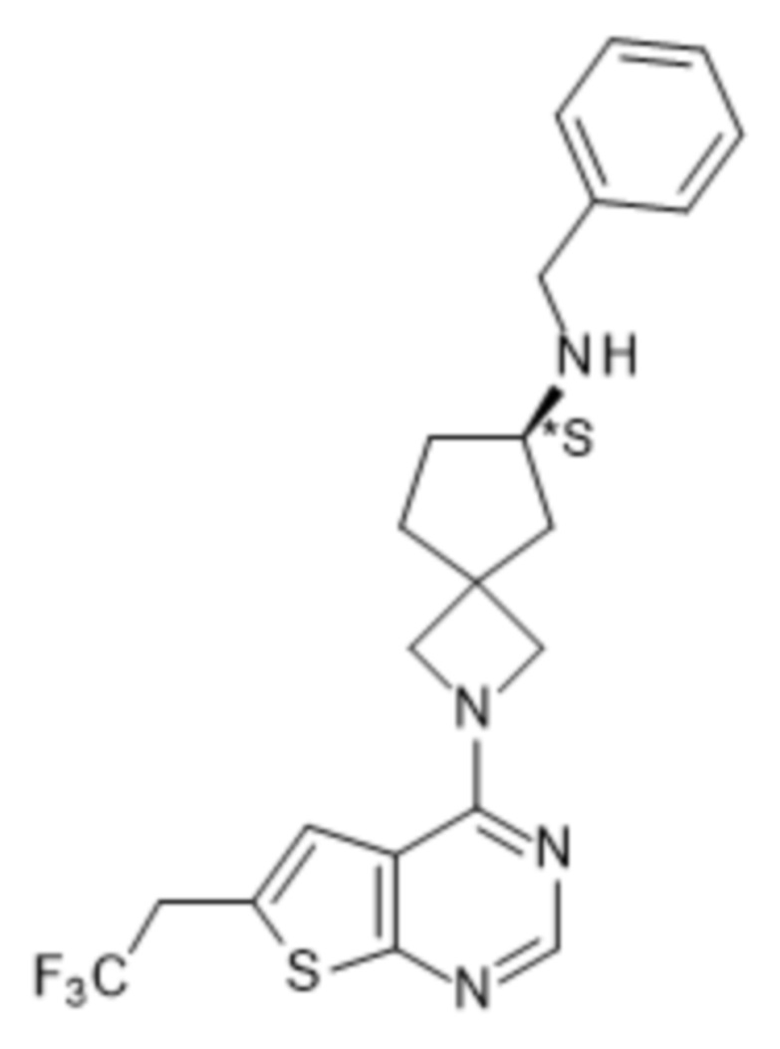
Соединение 45 Соединение 46 Соединение 47
(соль HCl) (соль HCl)
Добавляли промежуточное соединение 4 (200 мг, 0,575 ммоль), бензиламин (62 мг, 0,575 ммоль), DIPEA (175 мг, 1,73 ммоль) и NaBH(OAc)3 (609 мг, 2,48 ммоль) в DCE (8 мл). Реакционную смесь перемешивали при к.т. в течение ночи. Растворитель удаляли с получением прозрачного масла. Данное масло очищали с помощью препаративной высокоэффективной жидкостной хроматографии (колонка: Xtimate C18 150 × 25 мм × 5 мкм, условие: вода (0,05% гидроксида аммиака, об./об.)/ACN, от 60/40 до 30/70). Чистые фракции собирали и растворитель выпаривали в вакууме с получением прозрачного масла. В данное масло добавляли 15 мл 12 н. HCl и 5 мл ACN. Растворитель лиофилизировали с получением 75 мг соединения 45 (соли HCl). Соединение 45 (60,5 мг) разделяли с помощью хроматографии с помощью хиральной SFC (неподвижная фаза: Chiralpak Ad-H 5 мкм 250 × 30 мм, подвижная фаза: CO2/MeOH (0,3% iPrNH2): 60/40). Чистые фракции собирали и растворитель выпаривали в вакууме с получением 20 мг энантиомера A и 24 мг энантиомера B (с недостаточной чистотой). Энантиомер A растворяли в 2 мл ACN и добавляли по каплям 3 эквивалента 4 н. HCl (15 мкл, 0,18 ммоль) при 10°C. Затем добавляли Et2O и через 30 мин раствор выпаривали до сухого состояния. Добавляли Et2O и осадок фильтровали и высушивали с получением 15 мг соединения 46 (соли HCl). Энантиомер B (24 мг) очищали с помощью хроматографии на силикагеле с обращенной фазой (неподвижная фаза: YMC-actus Triart C18 10 мкм 30 × 150 мм, подвижная фаза: 0,2% NH4HCO3/ACN: градиент от 60/40 до 0/100). Остаток поглощали с помощью Et2O и выпаривали до сухого состояния с получением 12 мг соединения 47 (свободного основания).
Соединение 47: 1H ЯМР (500 МГц, DMSO-d6): δ ppm 8,31 (s, 1H) 7,41 (s, 1H) 7,28-7,37 (m, 4H) 7,18-7,25 (m, 1H) 4,05 (q, J=11,0 Гц, 2H) 3,68 (br s, 2H) 3,11 (br s, 1H) 2,43-2,48 (m, 4H) 1,98-2,13 (m, 3H) 1,75-1,89 (m, 3H) 1,44-1,54 (m, 1H)
Пример B31
Получение соединения 48
Добавляли промежуточное соединение 5 (400 мг, 0,791), бензиламин (85 мг, 0,791 ммоль), DIPEA (240 мг, 2,37 ммоль) и NaBH(OAc)3 (838 мг, 3,96 ммоль) добавляли к DCE (15 мл). Реакционную смесь перемешивали при к.т. в течение ночи. Растворитель удаляли с получением прозрачного масла. Данное масло очищали с помощью препаративной высокоэффективной жидкостной хроматографии (колонка Xtimate C18 150 × 25 мм × 5 мкм, условие: вода (0,05% гидроксида аммиака, об./об.)/ACN: градиент от 50/50 до 40/60). Чистые фракции собирали и растворитель выпаривали в вакууме. Водный слой лиофилизировали с помощью смеси ацетонитрил/вода, 20/80, с получением 75 мг соединения 48 (выход 28%).
Пример B32
Получение соединений 49 и 50
Перемешивали смесь промежуточного соединения 5 (558 мг; 1,63 ммоль), изобутиламина (151 мкл; 1,76 ммоль) и AcOH (33,5 мкл; 0,586 ммоль) в DCE (5 мл) при 50°C в течение 2 часов. Реакционную смесь охлаждали до комнатной температуры и добавляли NaBH(OAc)3 (372 мг; 1,76 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи, выливали в 10% водный раствор K2CO3 и экстрагировали с помощью DCM. Органический слой декантировали, высушивали над MgSO4, фильтровали и выпаривали до сухого состояния. Остаток очищали с помощью хроматографии на силикагеле (SiOH с частицами неправильной формы, 24 г; подвижная фаза: градиент от 0% MeOH, 100% DCM до 10% MeOH, 90% DCM). Чистые фракции собирали и выпаривали до сухого состояния с получением 550 мг (84%) соединения 49 в виде смеси изомеров 60/40. Хлористоводородную соль получали путем растворения 50 мг соединения 49 в Et2O и путем добавления 4 н. HCl в 1,4-диоксане. В результате фильтрации осадка получали 56 мг соединения 50 (соль HCl) в виде смеси изомеров 60/40.
Соединение 51 получали с применением способа, аналогичного описанному для получения соединения 50, начиная с соответствующих исходных веществ.
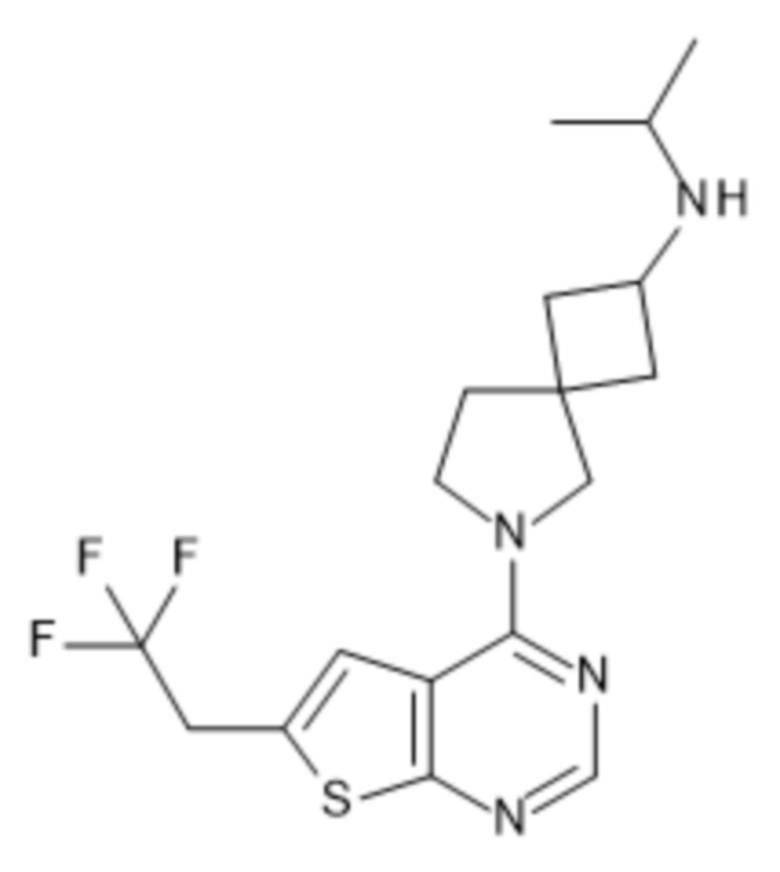
в виде хлористоводородной соли
Пример B33
Получение соединения 53
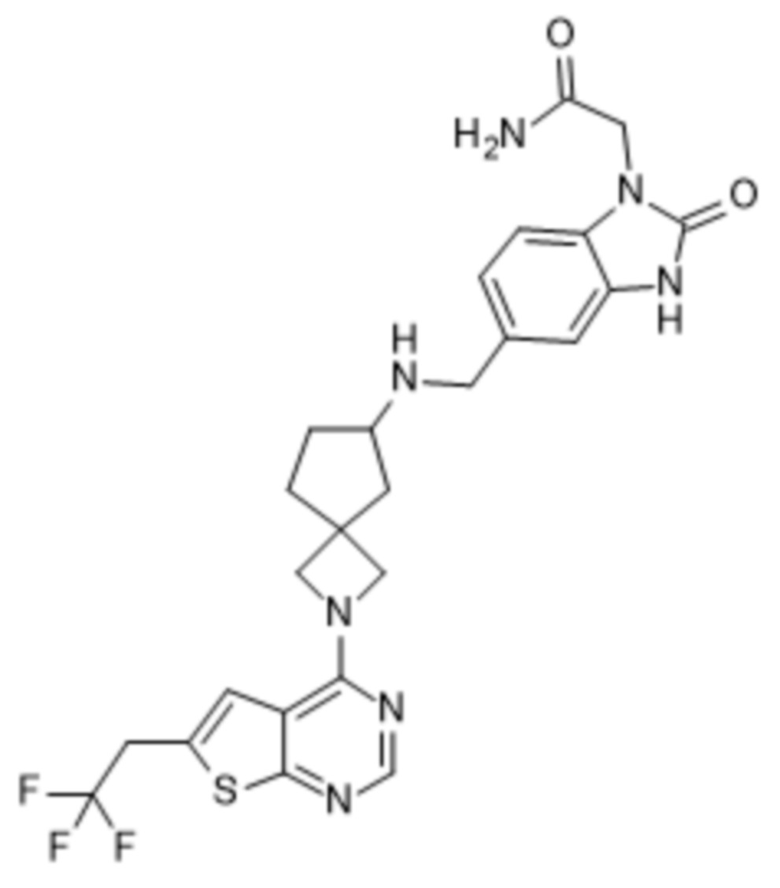
В раствор промежуточного соединения 4 (2-(6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин-4-ил)-2-азаспиро[3.4]октан-6-она) (165 мг, 0,435 ммоль), промежуточного соединения 53 (2-(5-(аминометил)-2-оксо-2,3-дигидро-1H-бензо[d]имидазол-1-ил)ацетамида) (170 мг, 0,656 ммоль), цианоборогидрида натрия (60,6 мг, 0,964 ммоль) и MeOH (12 мл) добавляли раствор CH3COOH (57,9 мг, 0,964 ммоль) в MeOH (3 мл). После перемешивания при 45°C в течение 12 часов реакционную смесь концентрировали до сухого состояния при пониженном давлении с получением неочищенного продукта, который очищали с помощью преп. HPLC (Gilson 281, колонка Xtimate C18 150 × 25 мм × 5 мкм, подвижная фаза A: вода (0,225% FA), B: ACN). Чистые фракции собирали и выпаривали при пониженном давлении с получением остатка, который лиофилизировали до сухого состояния с получением соединения 53 (200 мг, выход 84,3%) в виде белого порошка.
.1H ЯМР MeOD-d4 (400 МГц): δ 8,40 (br s, 1H), 8,29 (s, 1H), 7,35 (s, 1H), 7,25 (s, 1H), 7,22 (d, J=8,4 Гц, 1H), 7,10 (d, J=8,0 Гц, 1H), 4,58 (s, 2H), 4,51-4,25 (m, 4H), 4,23 (s, 2H), 3,88 (q, J=11,6 Гц, 2H), 3,77-3,66 (m, 1H), 2,60 (dd, J=8,4, 13,6 Гц, 1H), 2,35-2,14 (m, 2H), 2,13-2,02 (m, 2H), 1,95-1,74 (m, 1H).
Пример B34
Получение соединения 54
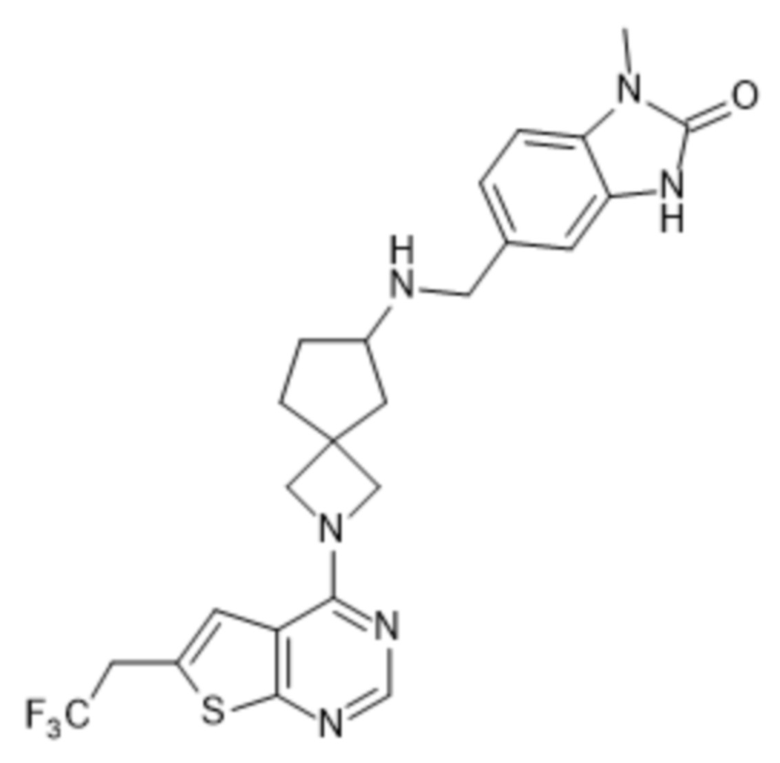
В раствор промежуточного соединения 2 (соли HCl и 2-(6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин-4-ил)-2-азаспиро[3.4]октан-6-амина) (200 мг) в MeOH (6 мл) добавляли 1-метил-2-оксо-2,3-дигидро-1H-бензо[d]имидазол-5-карбальдегид (134 мг, 0,76 ммоль) и AcOH (3 капли) при комнатной температуре. Смесь перемешивали при комнатной температуре в течение 2 часов, затем добавляли NaBH3CN (73 мг, 1,16 ммоль) и смесь перемешивали при комнатной температуре в течение ночи. Смесь концентрировали с получением остатка и очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 20 × 150 мм, 10 мкм, подвижная фаза A: 0,1% NH3·H2O, B: ACN) с получением соединения 54 (78,71 мг) в виде светло-желтого твердого вещества.
1H ЯМР MeOD-d4 (400 МГц): δ 8,29 (s, 1H), 7,36 (s, 1H), 7,27-7,25 (m, 2H), 7,19 (d, J=8,8 Гц, 1H), 4,40-4,31 (m, 4H), 4,22 (s, 2H), 3,88 (q, J=10,4 Гц, 2H), 3,73-3,69 (m, 1H), 3,40 (s, 3H), 2,63-2,58 (m, 1H), 2,29-2,16 (m, 2H), 2,12-2,02 (m, 2H), 1,87-1,83 (m, 1H)
Пример B35
Получение соединений 59 и 60
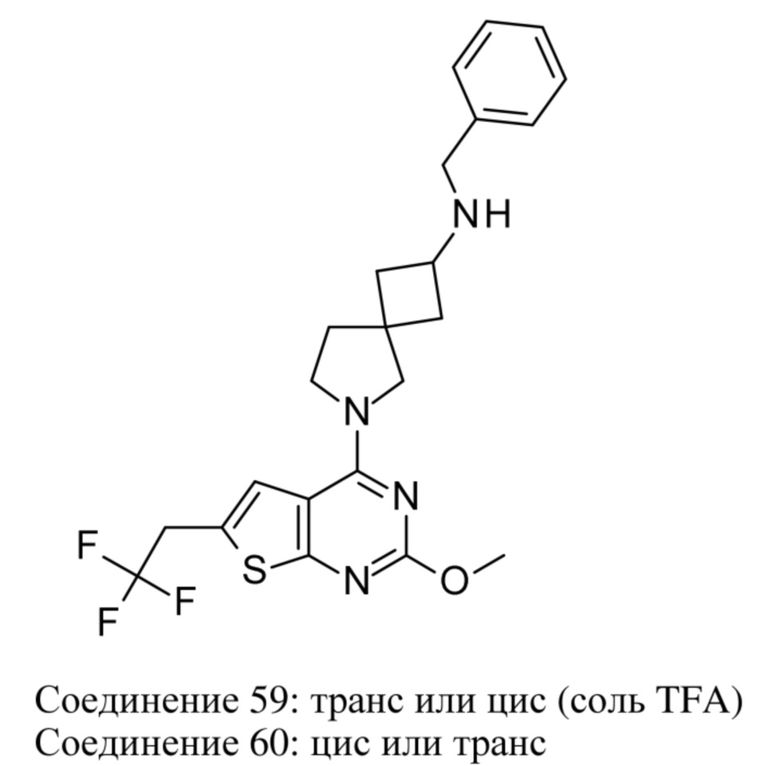
В раствор промежуточного соединения 19 (6-(2-метокси-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин-4-ил)-6-азаспиро[3.4]октан-2-амина) (150 мг, 0,42 ммоль), бензальдегида (58 мг, 1,3 ммоль) и тетраизопропанолата титана (488 мг, 1,72 ммоль) в MeOH (5 мл) добавляли NaBH(OAc)3 (267 мг, 1,26 ммоль). После перемешивания при комнатной температуре в течение 1 часа реакционную смесь гасили с помощью H2O (5 мл) и экстрагировали с помощью DCM (10 мл × 2). Объединенные органические слои промывали солевым раствором (20 мл), высушивали над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% TFA/H2O, B: ACN) с получением смеси цис- и транс-изомеров (120 мг, выход 62%). Смесь разделяли с помощью SFC (OJ, 3 × 100 см, 3 мкм, подвижная фаза: CO2/MeOH (0,02% DEA) = 80/20, 1,8 мл/мин). Необходимые фракции собирали и растворитель выпаривали с получением соединения 59 (35 мг, RT=1,107 мин, соль TFA, транс или цис) и соединения 60 (48 мг, RT=1,377 мин, цис или транс, выход 40,0%).
Соединение 59: 1H ЯМР MeOD-d4 (400 МГц): δ 7,54 (s, 1H), 7,50-7,48 (m, 5H), 4,13 (s, 2H), 4,00 (s, 3H), 3,98-3,94 (m, 5H), 3,81 (q, J=10,4 Гц, 2H), 2,55-2,49 (m, 2H), 2,34-2,28 (m, 2H), 2,19-2,15 (m, 2H).
Соединение 60: 1H ЯМР MeOD-d4 (400 МГц): δ 7,46 (s, 1H), 7,35-7,24 (m, 5H), 3,94 (s, 3H), 3,80-03,69 (m, 8H), 3,38-3,36 (m, 1H), 2,31-2,26 (m, 2H), 2,12-1,92 (m, 4H).
Пример B36
Получение соединений 61 и 62
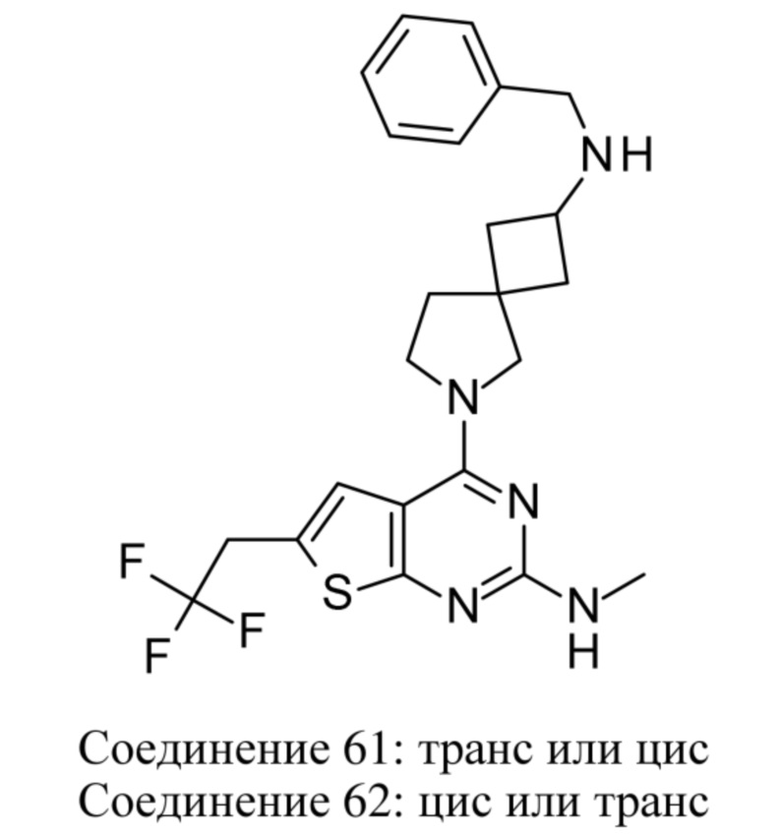
Перемешивали раствор промежуточного соединения 21 (N-бензил-6-(2-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин-4-ил)-6-азаспиро[3.4]октан-2-амина) (250 мг, 0,535 ммоль) в смеси метанамин/THF (4 мл) в закрытой пробирке при 100°C в течение 16 часов. Реакционную смесь концентрировали и очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge, 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением смеси цис- и транс-изомеров (100 мг) в виде белого твердого вещества. Смесь разделяли с помощью SFC (OJ-H, 2,5 × 25 см, 10 мкм, подвижная фаза: CO2/MeOH (NH3) = 80/20, 70 мл/мин). Необходимые фракции собирали и растворитель выпаривали с получением соединения 61 (32,20 мг, RT=1,083 мин, выход 13%, транс или цис) и соединения 62 (37,8 мг, RT=1,559 мин , выход 15%, цис или транс).
Соединение 61: 1H ЯМР MeOD-d4 (400 МГц): δ 7,34-7,25 (m, 6H), 3,76-3,65 (m, 8H), 3,40-3,35 (m, 1H), 2,90 (s, 3H), 2,33-2,28 (m, 2H), 2,02-1,94 (m, 2H), 1,93-1,88 (m, 2H).
Соединение 62: 1H ЯМР MeOD-d4 (400 МГц): δ 7,35-7,24 (m, 6H), 3,78-3,72 (m, 2H), 3,69-3,64 (m, 6H), 3,38-3,34 (m, 1H), 2,90 (s, 3H), 2,30-2,25 (m, 2H), 2,04-2,02 (m, 2H), 1,96-1,91 (m, 2H).
Пример B37
Получение соединения 63
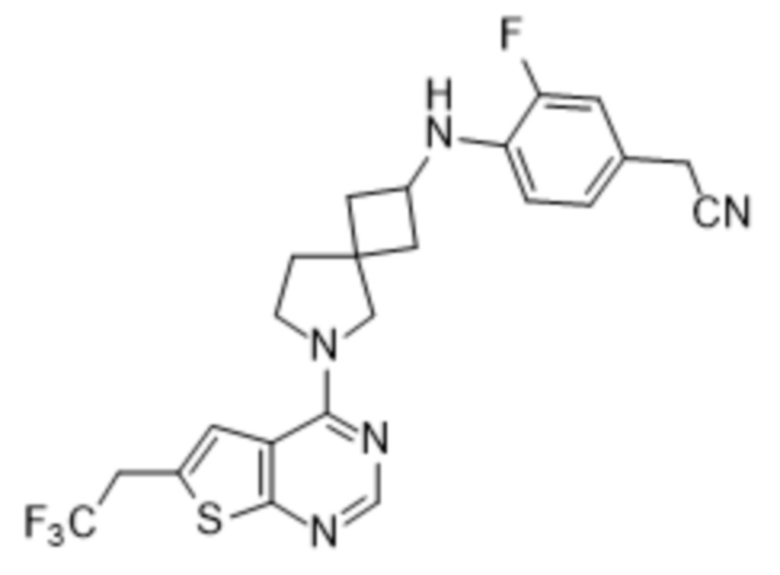
В раствор промежуточного соединения 3 (соли TFA и 6-(6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин-4-ил)-6-азаспиро[3.4]октан-2-амина) (200 мг) в 1,4-диоксане (2 мл) добавляли
2-(4-бром-3-фторфенил)ацетонитрил (250 мг, 1,170 ммоль), трет-бутилат натрия (168 мг, 1,775 ммоль), BrettPhos (30 мг, 0,056 ммоль) и Pd2(dba)3 (53 мг, 0,056 ммоль). Полученную смесь барботировали с помощью Ar и закрывали в пробирке для микроволновой обработки. Затем полученное нагревали при 140°C в течение 2 часов при микроволновом облучении. Смесь охлаждали до комнатной температуры, выливали в воду (100 мл) и экстрагировали этилацетатом (100 мл × 3). Объединенные органические слои промывали солевым раствором (50 мл × 2), высушивали над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 20 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH3·H2O), B: ACN). Необходимые фракции собирали и растворитель выпаривали с получением соединения 63 (23,45 мг).
Соединение 63:1H ЯМР MeOD-d4 (400 МГц): δ 8,29 (d, J=7,6 Гц, 1H), 7,67-7,63 (m, 1H), 6,98-6,96 (m, 2H), 6,70-6,64 (m, 1H), 4,07-3,99 (m, 1H), 3,94-3,83 (m, 6H), 3,74 (s, 2H), 2,61-2,53 (m, 2H), 2,20-2,03 (m, 4H).
Пример B38
Получение соединений 64 и 65
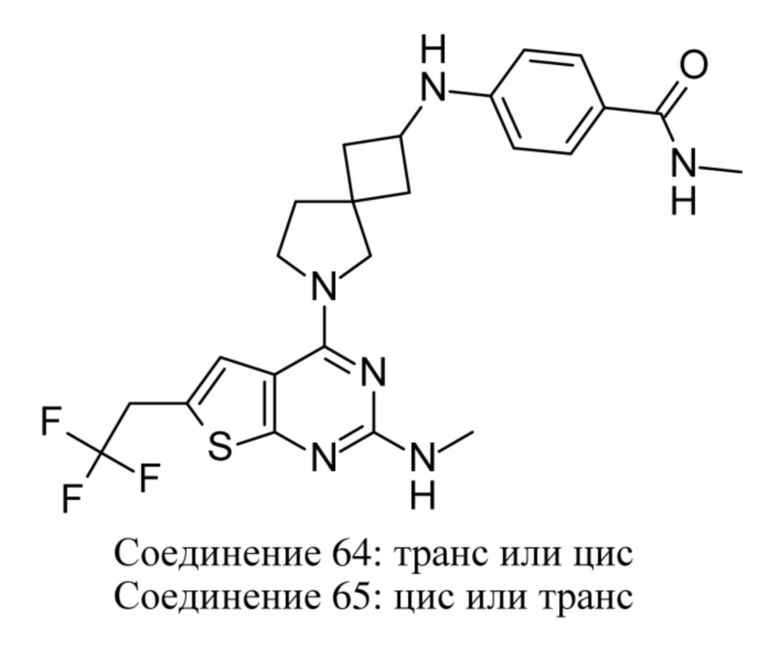
Перемешивали раствор промежуточного соединения 24 ((6-(2-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин-4-ил)-6-азаспиро[3.4]октан-2-ил)амино)-N-метилбензамида) (200 мг, 0,393 ммоль) в CH3NH2 (5 мл, 2 н. в THF) при 100°C в течение 16 часов. После концентрирования при пониженном давлении остаток очищали с помощью преп. TLC (DCM: MeOH=15:1) с получением смеси транс- и цис-изомеров (150 мг). Смесь разделяли с помощью SFC (OJ-H, 2,5 × 25 см, 10 мкм, подвижная фаза: CO2/MeOH=65/35, 50 мл/мин) с получением соединения 64 (52,16 мг, 26%, транс- или цис-) в виде белого твердого вещества и соединения 65 (45,70 мг, 23%, цис- или транс-) в виде белого твердого вещества.
Соединение 64:1H ЯМР MeOD-d4 (400 МГц): δ 7,61 (d, J=8,4 Гц, 2H), 7,33 (s, 1H), 6,57 (d, J=8,4 Гц, 2H), 4,05-4,01 (m, 1H), 3,84-3,82 (m, 2H), 3,74-3,65 (m, 4H), 2,91 (s, 3H), 2,87 (s, 3H), 2,55-2,51 (m, 2H), 2,16-2,13 (m, 2H), 2,04-1,99 (m, 2H).
Соединение 65: 1H ЯМР DMSO-d6 (400 МГц): δ 7,96 (d, J=4,4 Гц, 1H), 7,59 (d, J=8,4 Гц 2H), 7,43 (s, 1H), 6,52-6,44 (m, 4H), 4,09-3,68 (s, 7H), 3,17 (d, J=5,2 Гц, 2H), 2,79-2,71 (m, 6H), 1,98-1,89 (m, 4H).
Пример B39
Получение соединений 66 и 67
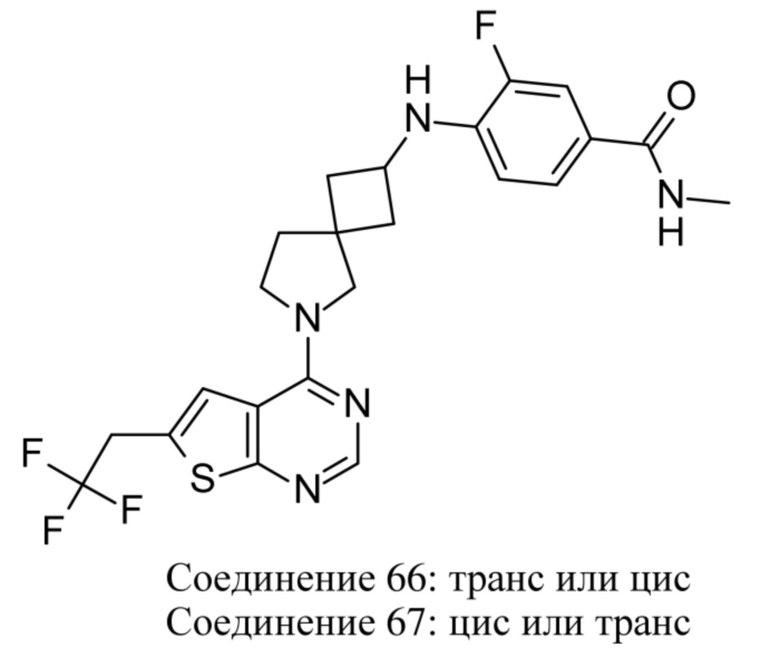
В раствор промежуточного соединения 26 (4-((6-азаспиро[3.4]октан-2-ил)амино)-3-фтор-N-метилбензамида) (200 мг, 0,722 ммоль) в iPrOH (4 мл) добавляли DIPEA (279 мг, 2,17 ммоль) и 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (182 мг, 0,722 ммоль). После перемешивания при комнатной температуре в течение 12 часов смесь концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge, 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) и обрабатывали с помощью ионообменной смолы с получением смеси цис- и транс-изомеров. Смесь разделяли с помощью SFC (AD-H, 3 × 25 см, 5 мкм, подвижная фаза: CO2/iPrOH (0,1% DEA) = 60/40, 50 мл/мин ) с получением соединения 66 (143 мг, выход 40%, транс или цис) в виде белого твердого вещества и соединения 67 (44 мг, выход 12%, цис или транс) в виде белого твердого вещества.
Соединение 66: 1H ЯМР (400 МГц, MeOD-d4): δ 8,30 (s, 1H), 7,68 (s, 1H), 7,52-7,45 (m, 2H), 6,68 (t, J=8,6 Гц, 1H), 4,16-4,08 (m, 1H), 3,96-3,80 (m, 6H), 2,88 (s, 3H), 2,65-2,60 (m, 2H), 2,14-2,09 (m, 4H).
Соединение 67: 1H ЯМР (400 МГц, MeOD-d4): δ 8,28 (s, 1H), 7,63 (s, 1H), 7,53-7,44 (m, 2H), 6,70 (t, J=8,4 Гц, 1H), 4,17-4,07 (m, 1H), 3,92-3,84 (m, 6H), 2,88 (s, 3H), 2,60-2,55 (m, 2H), 2,23-2,12 (m, 4H).
Пример B40
Получение соединений 68 и 69
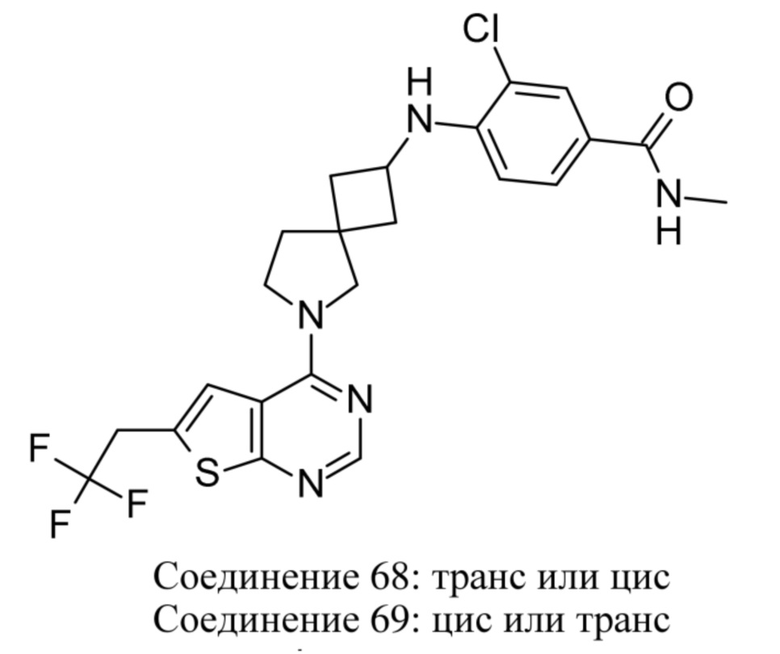
В раствор промежуточного соединения 28 (260 мг, неочищенное вещество) в изопропаноле (10 мл) добавляли 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (224 мг, 0,887 ммоль) и DIPEA (343 мг, 2,662 ммоль). После перемешивания при комнатной температуре в течение 12 часов смесь выливали в воду (30 мл) и экстрагировали с помощью EtOAc (30 мл × 3). Объединенные органические слои высушивали над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью колоночной хроматографии на силикагеле (PE/EA=3/1). Необходимые фракции собирали и растворитель выпаривали с получением смеси цис- и транс-изомеров (260 мг). Смесь разделяли с помощью SFC (AD-H, 3 × 25 см, 5 мкм, подвижная фаза: CO2/iPrOH (0,1% DEA) = 60/40, 50 мл/мин) с получением соединения 68 (95,75 мг, транс или цис) и соединения 69 (40,27 мг, цис или транс).
Соединение 68:1H ЯМР DMSO-d6 (400 МГц): δ 8,33 (s, 1H), 8,19-8,16 (m, 1H), 7,77-7,73 (m, 2H), 7,65-7,62 (m, 1H), 6,69 (d, J=8,8Гц, 1H), 5,92 (d, J=6,4Гц, 1H), 4,12-4,02 (m, 3H), 3,89-3,73 (m, 4H), 2,73 (d, J=4,4Гц, 3H), 2,53-2,50 (m, 2H), 2,14-2,03 (m, 4H).
Соединение 69: 1H ЯМР DMSO-d6 (400 МГц): δ 8,32 (s, 1H), 8,19-8,16 (m, 1H), 7,77 (d, J=1,6Гц, 1H), 7,69-7,65 (m, 2H), 6,70 (d, J=8,8Гц, 1H), 5,90 (d, J=6,4Гц, 1H), 4,09-4,02 (m, 3H), 3,77 (br s, 4H), 2,73 (d, J=4,4Гц, 3H), 2,46-2,44 (m, 2H), 2,19-2,14 (m, 4H).
Пример B41
Получение соединений 70, 71 и 72

В раствор промежуточного соединения 32 (соли TFA и 6-(6-азаспиро[3.4]октан-2-иламино)-N-метилникотинамида) (100 мг) в изопропаноле (5 мл) добавляли DIPEA (230 мг, 1,78 ммоль) и 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (90 мг, 0,357 ммоль). После перемешивания при комнатной температуре в течение 12 часов смесь концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge, 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% TFA), B: ACN) и затем обрабатывали с помощью ионообменной смолы. Необходимую фракцию собирали и растворитель выпаривали с получением соединения 70 (123,82 мг, соль TFA; смесь транс- и цис-изомеров) в виде белого твердого вещества. Смесь разделяли с помощью SFC (AD-H, 2,5 × 25 см, 10 мкм, подвижная фаза: CO2/MeOH=60/40, 60 мл/мин ). Необходимые фракции собирали и растворитель выпаривали с получением соединения 71 (16,02 мг, транс или цис) и соединения 72 (20,2 мг, цис или транс).
Соединение 70: 1H ЯМР MeOD-d4 (400 МГц): δ 8,47 (d, J=6,4 Гц, 1H), 8,38-8,36 (m, 1H), 8,25 (d, J=9,6 Гц, 1H), 7,80-7,78 (m, 1H), 7,08-7,05 (m, 1H), 4,43-4,39 (m, 1H), 4,07-3,93 (m, 6H), 2,93 (s, 3H), 2,75-2,67 (m, 2H), 2,35-2,25 (m, 4H).
Соединение 71: 1H ЯМР MeOD-d4 (400 МГц): δ 8,45 (d, J=2,0 Гц, 1H), 8,29 (s, 1H), 7,84-7,81 (m, 1H), 7,66 (s, 1H), 6,50 (d, J=8,4 Гц, 1H), 4,43-4,41 (m, 1H), 3,95-3,84 (m, 6H), 2,87 (s, 3H), 2,61-2,56 (m, 2H), 2,11-2,04 (m, 4H).
Соединение 72: 1H ЯМР MeOD-d4 (400 МГц): δ 8,46 (d, J=2,4 Гц, 1H), 8,27 (s, 1H), 7,84-7,81(m, 1H), 7,62 (s, 1H), 6,50 (d, J=8,8 Гц, 1H), 4,47-4,39 (m, 1H), 3,91-3,81 (m, 6H), 2,87 (s, 3H), 2,57-2,52 (m, 2H), 2,22-2,20 (m, 2H), 2,12-2,07 (m, 2H).
Пример B42
Получение соединений 73, 74 и 75

В раствор промежуточного соединения 35 (4-((6-(6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин-4-ил)-6-азаспиро[3.4]октан-2-ил)амино)бензойной кислоты) (500 мг, 1,08 ммоль) в THF (5 мл) добавляли N1,N1-диметилэтан-1,2-диамин (143 мг, 1,62 ммоль), HOBT (219 мг, 1,62 ммоль), EDCI (311 мг, 1,62 ммоль) и Et3N (163 мг, 1,62 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи. После концентрирования при пониженном давлении остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge, 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN). Необходимые фракции собирали и растворитель выпаривали с получением соединения 73 в виде смеси цис- и транс-изомеров (170 мг), которую разделяли с помощью SFC (AD-H, 3 × 25 см, 5 мкм, подвижная фаза: CO2/ iPrOH (0,1% DEA) = 60/40, 50 мл/мин) с получением соединения 74 (70 мг, выход 12%, транс или цис) и соединения 75 (38 мг, выход 7%, цис или транс).
Соединение 74: 1H ЯМР MeOD-d4 (400 МГц): δ 8,29 (s, 1H), 7,67-7,63 (m, 3H), 6,58 (d, J=8,4 Гц, 2H), 4,09-4,02 (m, 1H), 3,94-3,84 (m, 6H), 3,50 (t, J=6,4 Гц, 2H), 2,64-2,58 (m, 4H), 2,37 (s, 6H), 2,11 (br s, 2H), 2,04-1,99 (m, 2H).
Соединение 75: 1H ЯМР MeOD-d4 (400 МГц): δ 8,27 (s, 1H), 7,66-7,63 (m, 3H), 6,58 (d, J=8,4 Гц, 2H), 4,07-4,03 (m, 1H), 3,91-3,82 (m, 6H), 3,52 (t, J=6,4 Гц, 2H), 2,70 (t, J=6,4 Гц, 2H), 2,59-2,54 (m, 2H), 2,43 (s, 6H), 2,20 (br s, 2H), 2,08-2,03 (m, 2H).
Пример B43
Получение соединений 76 и 77
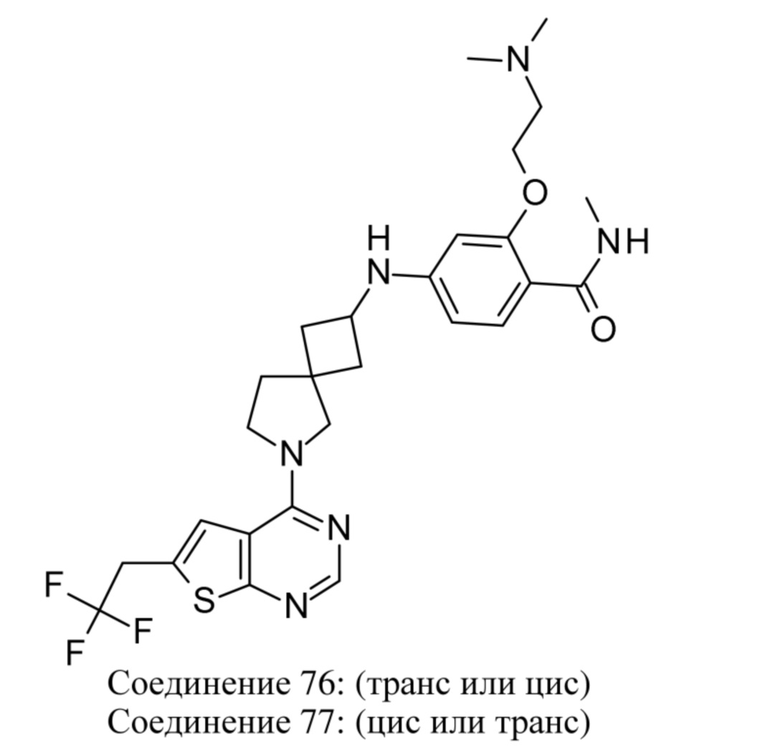
В раствор промежуточного соединения 38 (250 мг, 0,45 ммоль) в DMF (10 мл) добавляли метанамин (соль HCl, 30,4 мг), DIPEA (1 мл) и HATU (205 мг, 0,54 ммоль). После перемешивания при комнатной температуре в течение 3 часов раствор концентрировали и разбавляли с помощью EA (15 мл). Органический слой промывали солевым раствором (15 мл × 2), высушивали над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% TFA/H2O, B: ACN), затем разделяли с помощью SFC (OJ, 2,5 × 25 см, 10 мкм, подвижная фаза: CO2/MeOH (0,1% NH3) = 70/30, 50 мл/мин) с получением соединения 76 (13,08 мг; транс или цис) в виде белого твердого вещества и соединения 77 (11,17 мг; цис или транс) в виде белого твердого вещества.
Соединение 76: 1H ЯМР MeOD-d4 (400 МГц): δ 8,29 (s, 1H), 7,72 (d, J=8,8 Гц, 1H), 7,67 (s, 1H), 6,27-6,24 (m, 1H), 6,19 (d, J=2,0 Гц, 1H), 4,19 (t, J=5,2 Гц, 2H), 4,07-4,06 (m, 1H), 3,95-3,85 (m, 6H), 2,88 (s, 3H), 2,79-2,77 (m, 2H), 2,64-2,59 (m, 2H), 2,35 (s, 6H), 2,12 (br s, 2H), 2,05-2,00 (m, 2H)
Соединение 77: 1H ЯМР MeOD-d4 (400 МГц): δ 8,27 (s, 1H), 7,71 (d, J=8,8 Гц, 1H), 7,63 (s, 1H), 6,27-6,25 (m, 1H), 6,20 (d, J=2,0 Гц, 1H), 4,22 (t, J=5,2 Гц, 2H), 4,08-4,04 (m, 1H), 3,91-3,82 (m, 6H), 2,88 (s, 3H), 2,81 (br s, 2H), 2,60-2,54 (m, 2H), 2,39(s, 6 H), 2,08 (br s, 2H), 2,06-2,02 (m, 2H)
Пример B44
Получение соединений 78, 79 и 80
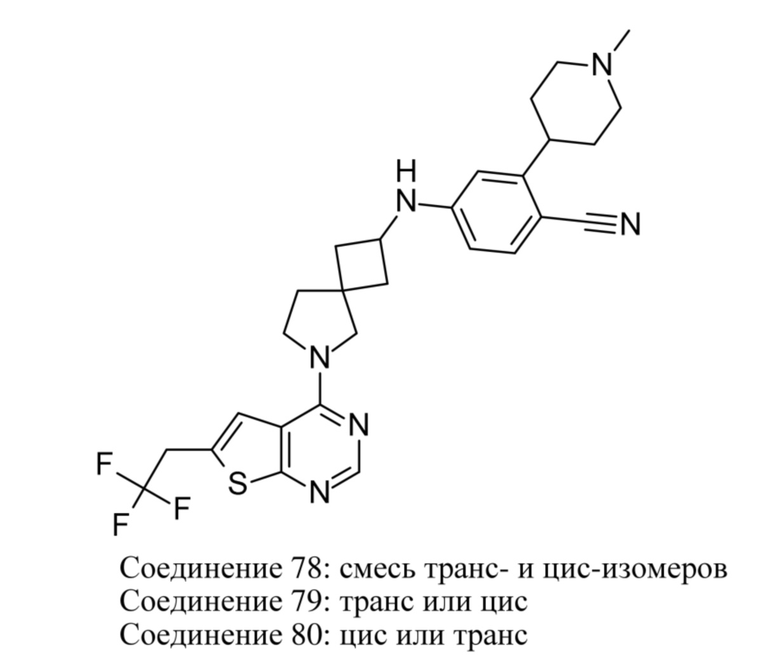
Перемешивали смесь промежуточного соединения 42 (соли TFA и 4-(6-азаспиро[3.4]октан-2-иламино)-2-(1-метилпиперидин-4-ил)бензонитрила) (280 мг), 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидина (227 мг, 0,9 ммоль) и DIPEA (387 мг, 3,0 ммоль) в iPrOH (10 мл) при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали и остаток очищали с помощью преп. HPLC (Agilent G6120B, детектор G1315D DADVL и G4260B ELSD, Xbridge C18 5 мм 150 × 4,6 мм, подвижная фаза A: 0,1% NH4OH в воде, B: 0,1% NH4OH в CH3CN). Необходимые фракции собирали и растворитель выпаривали с получением соединения 78 в виде смеси цис- и транс-изомеров (87 мг) в виде белого твердого вещества. Соединение 78 разделяли с помощью SFC (IA, 2,5 × 25 см, 10 мкм, подвижная фаза: CO2/EtOH (0,05% DEA) = 75/25, 50 мл/мин) с получением соединения 79 (16 мг; транс или цис) в виде белого твердого вещества и соединения 80 (20 мг; цис или транс) в виде белого твердого вещества.
Соединение 79: 1H ЯМР MeOD-d4 (400 МГц): δ 8,30 (s, 1H), 7,68 (s, 1H), 7,35 (d, J=8,8 Гц, 1H), 6,52-6,45 (m, 2H), 4,09-3,80 (m, 7H), 3,04-3,01 (m, 2H), 2,85-2,75 (m, 1H), 2,63-2,58 (m, 2H), 2,34 (s, 3H), 2,27-2,00 (m, 6H), 1,87-1,75 (m, 4H).
Соединение 80: 1H ЯМР MeOD-d4 (400 МГц): δ 8,27 (s, 1H), 7,63 (s, 1H), 7,36 (d, J=8,8 Гц, 1H), 6,53-6,46 (m, 2H), 4,07-3,79 (m, 7H), 3,05-3,02 (m, 2H), 2,84-2,76 (m, 1H), 2,59-2,54 (m, 2H), 2,36 (s, 3H), 2,24-2,18 (m, 4H), 2,08-2,03 (m, 2H), 1,85-1,78 (m, 4H).
Пример B45
Получение соединения 81
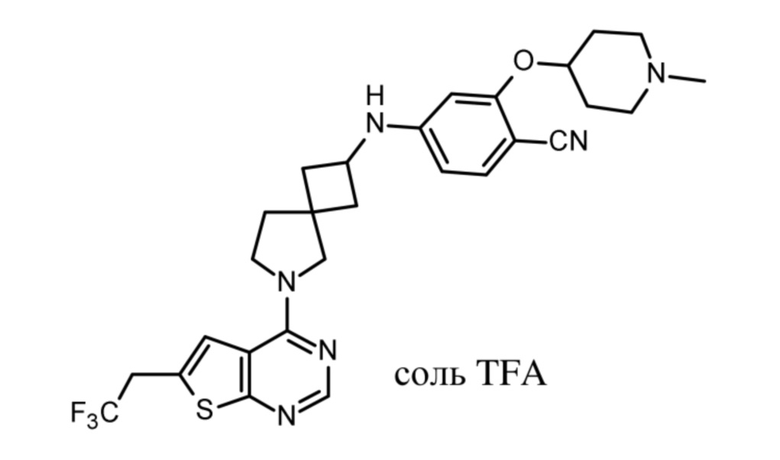
В смесь промежуточного соединения 46 (соли TFA и 4-((6-азаспиро[3.4]октан-2-ил)амино)-2-((1-метилпиперидин-4-ил)окси)бензонитрила) (500 мг) и 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидина (300 мг, 1,19 ммоль) в iPrOH (10 мл) добавляли DIPEA (767 мг, 5,95 ммоль). После перемешивания при комнатной температуре в течение ночи смесь концентрировали при пониженном давлении. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge, 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% TFA), B: ACN). Необходимые фракции собирали и растворитель выпаривали с получением (142 мг) в виде соли TFA.
Соединение 81: 1H ЯМР MeOD-d4 (400 МГц): δ 8,46-8,43 (m, 1H), 7,78-7,76 (m, 1H), 7,33-7,30 (m, 1H), 6,30-6,20 (m, 2H), 4,92-4,88 (m, 0,5H), 4,54-4,48 (m, 0,5H), 4,24-3,74 (m, 9H), 3,55-2,98 (m, 4H), 2,92-2,90 (m, 1H), 2,65-2,59 (m, 2H), 2,28-2,02 (m, 8H).
Пример B46
Получение соединения 82
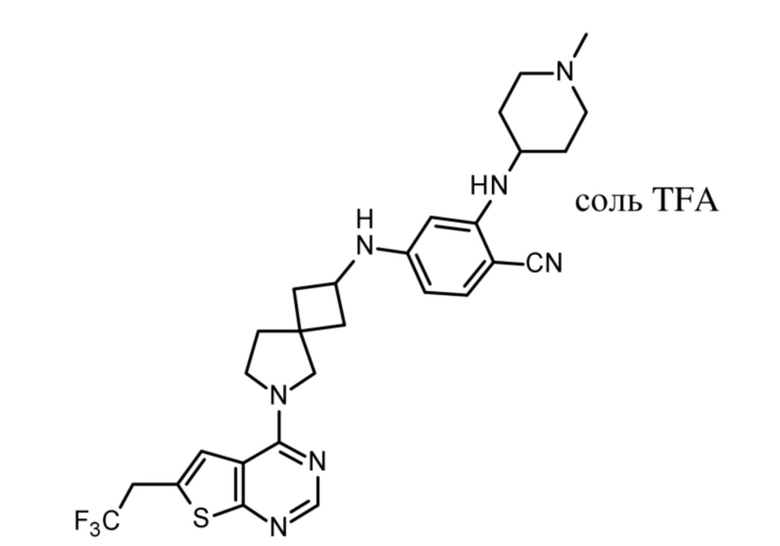
Перемешивали смесь промежуточного соединения 49 (соли TFA и 4-(6-азаспиро[3.4]октан-2-иламино)-2-((1-метилпиперидин-4-ил)амино)бензонитрила) (60 мг), 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидина (28 мг, 0,11 ммоль) и DIPEA (43 мг, 0,33 ммоль) в iPrOH (5 мл) при комнатной температуре в течение 2 часов. После завершения реакции реакционную смесь концентрировали и остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% TFA/H2O, B: ACN). Необходимые фракции собирали и растворитель выпаривали с получением соединения 82 (34 мг; соль TFA) в виде желтого твердого вещества.
Соединение 82: 1H ЯМР MeOD-d4 (400 МГц): δ 8,29-8,27 (m, 1H), 7,67-7,63 (m, 1H), 7,15-7,12 (m, 1H), 6,03-6,00 (m, 1H), 5,88-5,86 (m, 1H), 3,93-3,70 (m, 8H), 3,50-3,38 (m, 2H), 3,16-3,04 (m, 2H), 2,84-2,82 (m, 3H), 2,63-2,51 (m, 2H), 2,27-2,03 (m, 6H), 1,86-1,72 (m, 2H).
Пример B47
Получение соединений 83 и 84

В раствор промежуточного соединения 35 (4-((6-(6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин-4-ил)-6-азаспиро[3.4]октан-2-ил)амино)бензойной кислоты) (300 мг, 0,65 ммоль), 2-аминоэтан-1-ола (74 мг, 1,3 ммоль) в DMF (5 мл) добавляли HATU (246 мг, 0,65 ммоль) и DIPEA (251 мг, 1,95 ммоль). После перемешивания при комнатной температуре в течение 3 часов реакционную смесь очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge, 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN). Необходимые фракции собирали и растворитель выпаривали с получением смеси цис- и транс-изомеров (100 мг, выход 40%) в виде белого твердого вещества. Данную смесь цис- и транс-изомеров разделяли с помощью SFC (AD-H, 2,5 × 25 см, 10 мкм, подвижная фаза: CO2/EtOH (15% ACN) = 60/40, 50 мл/мин) с получением соединения 83 (40 мг, выход 80%; транс или цис) в виде белого твердого вещества и соединения 84 (37 мг, выход 74%; цис или транс) в виде белого твердого вещества.
Соединение 83: 1H ЯМР MeOD-d4 (400 МГц): δ 8,29 (s, 1H), 7,67-7,63 (m, 3H), 6,58 (d, J=8,8 Гц, 2H), 4,13-4,01 (m, 1H), 3,93-3,88 (m, 6H), 3,68 (t, J=5,9 Гц, 2H), 3,46 (t, J=5,9 Гц, 2H), 2,63-2,57 (m, 2H), 2,11 (br s, 2H), 2,04-1,99 (m, 2H).
Соединение 84: 1H ЯМР MeOD-d4 (400 МГц): δ 8,29 (s, 1H), 7,67-7,64 (m, 3H), 6,59 (d, J=8,8 Гц, 2H), 4,13-4,01 (m, 1H), 3,94-3,88 (m, 6H), 3,69 (t, J=6,0 Гц, 2H), 3,47 (t, J=6,0 Гц, 2H), 2,59-2,55 (m, 2H), 2,22 (br s, 2H), 2,08-2,03 (m, 2H).
Пример B48
Получение соединений 85 и 86
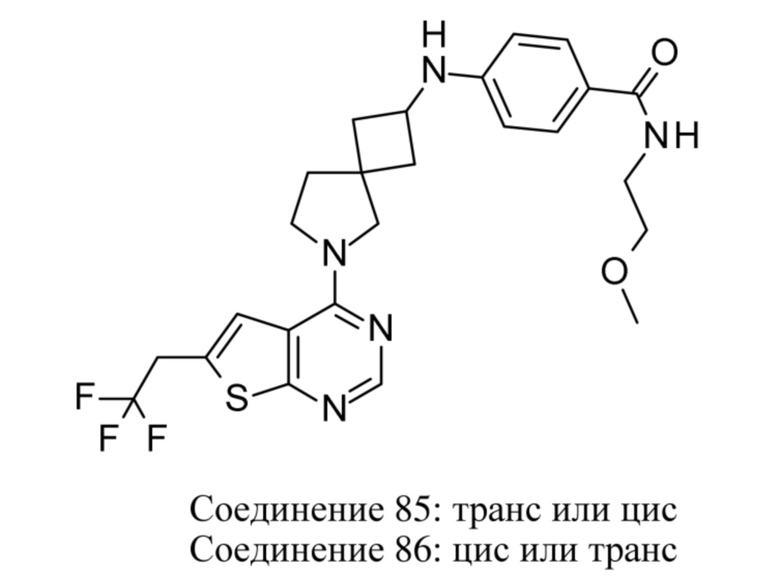
В раствор промежуточного соединения 35 (4-((6-(6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин-4-ил)-6-азаспиро[3.4]октан-2-ил)амино)бензойной кислоты) (300 мг, 0,65 ммоль), 2-метоксиэтан-1-амина (197 мг, 1,3 ммоль) в DMF (5 мл) добавляли HATU (246 мг, 0,65 ммоль) и DIPEA (251 мг, 1,95 ммоль). После перемешивания при комнатной температуре в течение 3 часов реакционную смесь очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge, 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN). Необходимые фракции собирали и растворитель выпаривали с получением смеси цис- и транс-изомеров (100 мг, выход 30%) в виде белого твердого вещества. Данную смесь цис- и транс-изомеров разделяли с помощью SFC (AD-H, 3 × 25 см, 5 мкм, подвижная фаза: CO2/iPrOH (0,1% DEA) = 60/40, 50 мл/мин ) с получением соединения 85 (35 мг, выход 70%; транс или цис) в виде белого твердого вещества и соединения 86 (33,67 мг, выход 67%; цис или транс) в виде белого твердого вещества.
Соединение 85: 1H ЯМР MeOD-d4 (400 МГц): δ 8,27 (s, 1H), 7,64-7,62 (m, 3H), 6,58 (d, J=8,4 Гц, 2H), 4,09-4,01 (m, 1H), 3,91-3,83 (m, 6H), 3,58-3,48 (m, 4H), 3,37 (s, 3H), 2,59-2,54 (m, 2H), 2,21 (br s, 2H), 2,102-2,03 (m, 2H).
Соединение 86: 1H ЯМР MeOD-d4 (400 МГц): δ 8,29 (s, 1H), 7,67-7,62 (m, 3H), 6,58 (d, J=8,4 Гц, 2H), 4,09-4,00 (m, 1H), 3,94-3,84 (m, 6H), 3,57-3,44 (m, 4H), 3,37 (s, 3H), 2,62-2,57 (m, 2H), 2,11 (br s, 2H), 2,04-1,99 (m, 2H).
Пример B49
Получение соединений 87 и 88
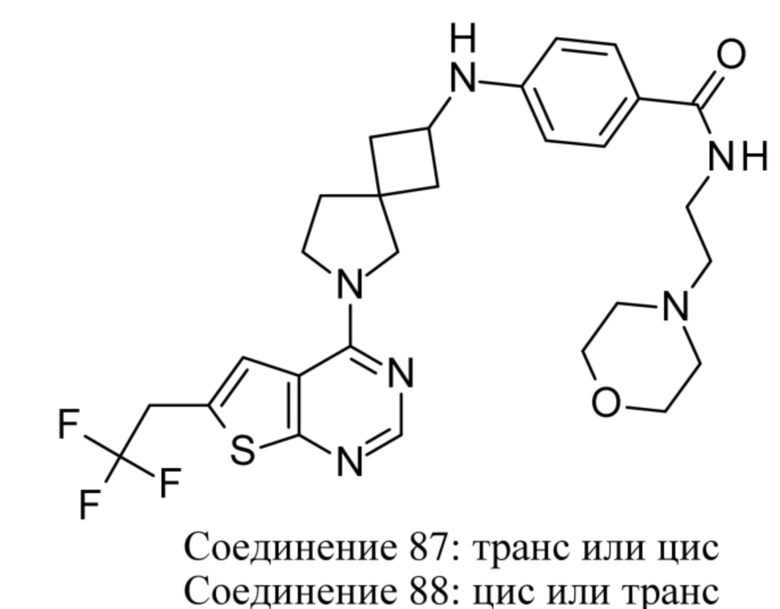
Перемешивали раствор промежуточного соединения 35 (4-((6-(6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин-4-ил)-6-азаспиро[3.4]октан-2-ил)амино)бензойной кислоты) (300 мг, 0,649 ммоль), 2-морфолиноэтан-1-амина (85 мг, 0,649 ммоль), EDCI (125 мг, 0,649 ммоль), HOBT (88 мг, 0,649 ммоль) и TEA (197 мг, 0,195 ммоль) в DCM (5 мл) при комнатной температуре в течение 8 часов. Раствор концентрировали и разбавляли с помощью EA (15 мл). Органический слой промывали солевым раствором (15 мл × 2), высушивали над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge, 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) и обрабатывали с помощью ионообменной смолы с получением смеси цис- и транс-изомеров (200 мг), которую разделяли с помощью SFC (AD-H, 2,5 × 25 см, 10 мкм, подвижная фаза: CO2/EtOH (0,1% DEA) = 60/40, 50 мл/мин ) с получением соединения 87 (60 мг, выход 16%; транс или цис) в виде белого твердого вещества и соединения 88 (6 мг, выход 2%; цис или транс) в виде белого твердого вещества.
Соединение 87: 1H ЯМР MeOD-d4 (400 МГц): δ 8,29 (s, 1H), 7,67 (s, 1H), 7,62 (d, J=8,8 Гц, 2H), 6,58 (d, J=8,4 Гц, 2H), 4,08-4,04 (m, 1H), 3,94-3,84 (m, 6H), 3,71 (t, J =4,6 Гц, 4H), 3,51 (t, J =6,8 Гц, 2H), 2,62-2,57 (m, 8H), 2,12 (br s, 2H), 2,05-2,00 (m, 2H)
Соединение 88: 1H ЯМР MeOD-d4 (400 МГц): δ 8,27 (s, 1H), 7,64-7,62 (m, 3H), 6,59 (d, J=8,8 Гц, 2H), 4,07-4,03 (m, 1H), 3,91-3,83 (m, 6H), 3,70 (t, J=4,6 Гц, 4H), 3,50 (t, J =6,8 Гц, 2H), 2,60-2,54 (m, 8H), 2,21 (br s, 2H), 2,06-2,03 (m, 2H)
Пример B50
Получение соединений 89, 90 и 91
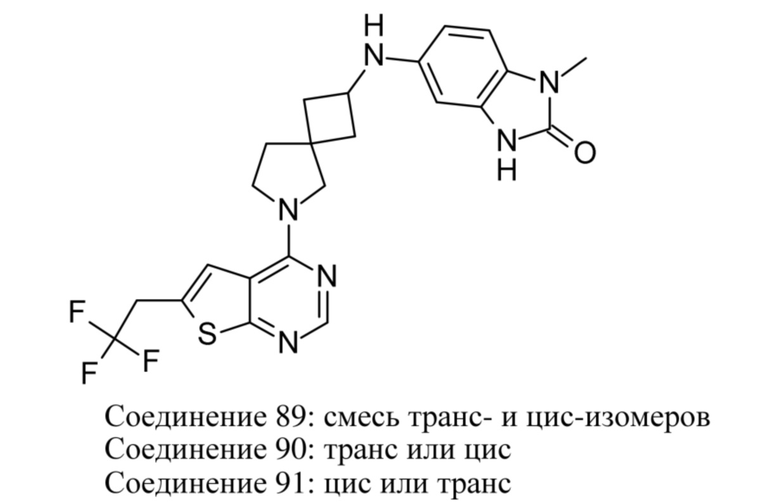
В раствор промежуточного соединения 5 (160 мг, 0,469 ммоль), 5-амино-1-метил-1H-бензо[d]имидазол-2(3H)-она (122 мг, 0,750 ммоль), цианоборогидрида натрия (58,9 мг, 0,937 ммоль) и MeOH (12 мл) добавляли раствор AcOH (56,3 мг, 0,937 ммоль) в MeOH (4 мл). После перемешивания при 45°C в течение 12 часов реакционную смесь концентрировали до сухого состояния при пониженном давлении с получением неочищенного продукта, который разбавляли водой (5 мл) и экстрагировали этилацетатом (20 мл × 3). Объединенные органические слои концентрировали до сухого состояния при пониженном давлении с получением неочищенного продукта, который очищали с помощью преп. HPLC (Gilson 281, Xtimate C18 150 × 25 мм × 5 мкм, подвижная фаза A: вода (0,225% муравьиной кислоты), B: ACN). Чистые фракции собирали и выпаривали в вакууме с получением остатка, который лиофилизировали до сухого состояния с получением соединения 89 в виде белого твердого вещества (73,2 мг, выход 30%). Соединение 89 дополнительно разделяли с помощью SFC (Amylose-C, 3 × 25 см, 10 мкм, подвижная фаза: CO2/IPA (0,1% NH3.H2O) = 45/55, 70 мл/мин). Чистые фракции собирали и выпаривали в вакууме. Полученные остатки лиофилизировали до сухого состояния с получением соединения 90 (21,64 мг, выход 35%; транс или цис) в виде белого порошка и соединения 91 (19,69 мг, выход 32%; цис или транс) в виде белого порошка.
Соединение 89: 1H ЯМР DMSO-d6 (400 МГц): δ 10,45 (s, 1H), 8,38-8,31 (m, 1H), 7,75-7,70 (m, 1H), 6,80-6,77 (m, 1H), 6,24-6,22 (m, 2H), 5,59 (br s, 1H), 4,11-4,03 (m, 2H), 3,87-3,75 (m, 5H), 3,17 (s, 3H), 2,47-2,36 (m, 2H), 2,11-1,86 (m, 4H).
Соединение 90:
1H ЯМР DMSO-d6 (400 МГц): δ 10,46 (s, 1H), 8,32 (s, 1H), 7,70 (s, 1H), 6,79 (d, J=8,8 Гц, 1H), 6,24-6,22 (m, 2H), 5,60-5,58 (m, 1H), 4,07 (q, J=11,2 Гц, 2H), 3,89-3,76 (m, 5H), 3,17 (s, 3H), 2,44-2,37 (m, 2H), 2,33 (br s, 2H), 1,94-1,89 (m, 2H)
Соединение 91: 1H ЯМР DMSO-d6 (400 МГц): δ 10,46 (s, 1H), 8,33 (s, 1H), 7,75 (br s., 1H), 6,78 (d, J=8,8 Гц, 1H), 6,24-6,22 (m, 2H), 5,61 (d, J=6,4 Гц1H), 4,07 (q, J=10,8 Гц, 2H), 3,91-3,78 (m, 5H), 3,17 (s, 3H), 2,47-2,40 (m, 2H), 2,01 (br s, 2H), 1,90-1,86 (m, 2H)
Пример B51
Получение соединения 92
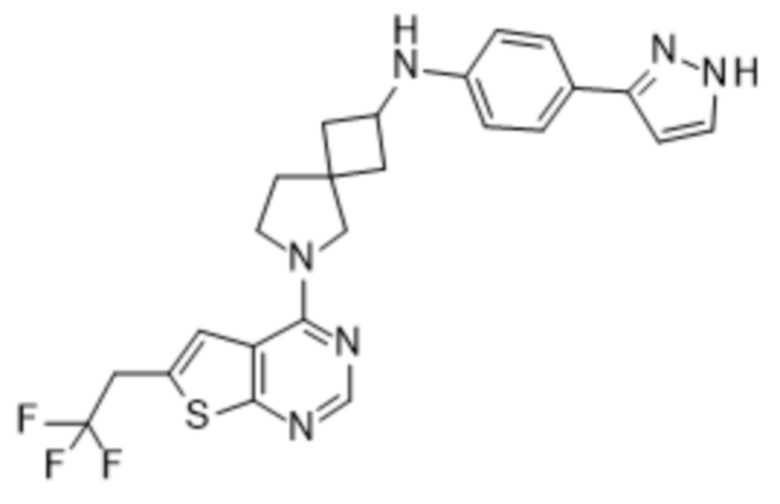
В раствор промежуточного соединения 5 (150 мг, 0,439 ммоль), 4-(1H-пиразол-3-ил)анилина (105 мг, 0,660 ммоль), цианотригидробората натрия (55,2 мг, 0,878 ммоль) и сухого метанола (10 мл) добавляли раствор уксусной кислоты (52,8 мг, 0,879 ммоль) в метаноле (2 мл). После перемешивания при 45°C в течение 6 ч смесь охлаждали до комнатной температуры и разбавляли водой (20 мл). Смесь регулировали до получения pH=8 с помощью насыщенного раствора бикарбоната натрия и экстрагировали с помощью DCM (20 мл × 3). Объединенные органические слои высушивали над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении с получением неочищенного продукта, который очищали с помощью преп. HPLC (Gilson 281, колонка: Phenomenex Gemini 150 × 25 мм × 10 мкм, подвижная фаза A: вода (0,05% гидроксида аммиака, об./об.), подвижная фаза B: ACN). Чистые фракции собирали и выпаривали в вакууме с получением остатка, который лиофилизировали до сухого состояния с получением соединения 92 (99,0 мг, выход 46%) в виде светло-желтого порошка.
Соединение 92: 1H ЯМР DMSO-d6 (400 МГц): δ 12,93 (br s., 0,5H), 12,59 (br s., 0,5H), 8,34 (d, J=6,0 Гц, 1H), 7,75-7,51 (m, 4H), 6,57 (d, J=8,0 Гц, 2H), 6,46 (br s., 1H), 6,19-6,03 (m, 1H), 4,11-3,77 (m, 7H), 2,49-2,46 (m, 2H), 2,08-1,93 (m, 4H).
Пример B52
Получение соединений 93, 94 и 95
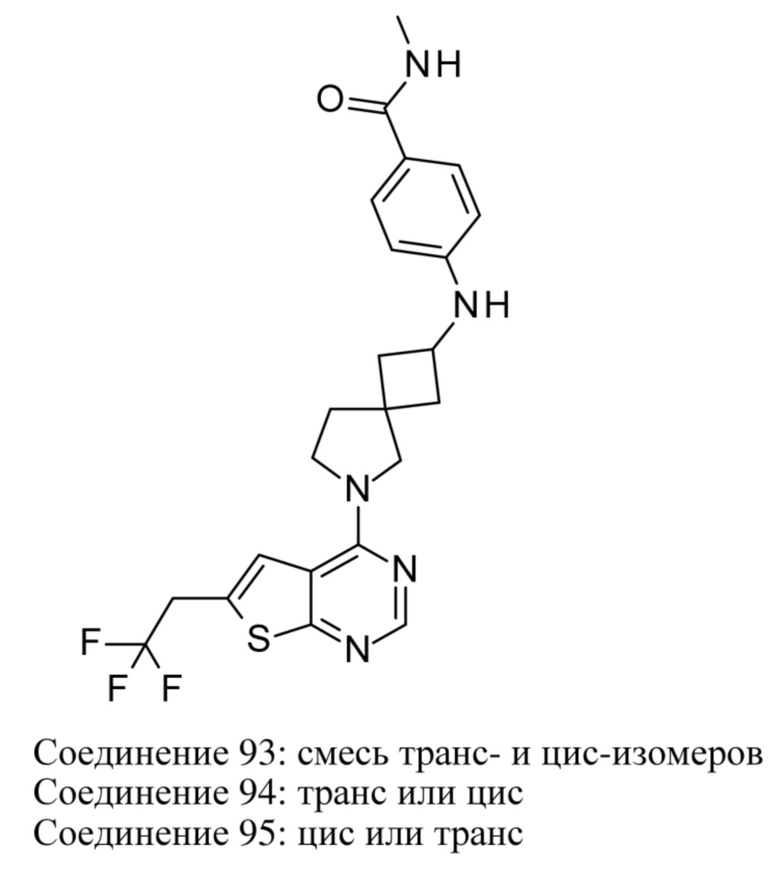
В раствор промежуточного соединения 5 (6-(6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин-4-ил)-6-азаспиро[3.4]октан-2-она) (200 мг, 0,586 ммоль), 4-амино-N-метилбензамида (132 мг, 0,879 ммоль), цианоборогидрида натрия (73,6 мг, 1,17 ммоль) и MeOH (20 мл) добавляли раствор AcOH (70,4 мг, 1,17 ммоль) в MeOH (5 мл). После перемешивания при 45°C в течение 12 ч реакционную смесь концентрировали до сухого состояния при пониженном давлении с получением неочищенного продукта, который очищали с помощью преп. HPLC (Gilson 281, колонка: колонка Agela ASB 150 × 25 мм × 5 мкм, подвижная фаза A: вода (0,05% HCl), B: ACN). Чистые фракции собирали и выпаривали в вакууме с получением остатка, который лиофилизировали до сухого состояния с получением соединения 93 в виде смеси цис- и транс-изомеров (173,9 мг, выход 61%). Смесь разделяли с помощью SFC (AS-H, 3 × 25 см, 5 мкм, подвижная фаза: CO2/EtOH (0,1% NH3.H2O) = 55/45, 40 мл/мин). Чистые фракции собирали и выпаривали в вакууме с получением остатков, которые лиофилизировали до сухого состояния с получением соединения 94 (36,83 мг, выход 23%; транс или цис) в виде белого твердого вещества и соединения 95 (48,21 мг, выход 30%; цис или транс) в виде белого твердого вещества.
Соединение 93: 1H ЯМР (400МГц, метол-d4) δ 8,65-8,55 (m, 1H), 8,04-7,86 (m, 3H), 7,55-7,33 (m, 2H), 4,46-4,13 (m, 3H), 4,12-3,82 (m, 4H), 2,93 (s, 3H), 2,71-2,42 (m, 4H), 2,39-2,31 (m, 1H), 2,28-2,19 (m, 1H).
Соединение 94: 1H ЯМР DMSO-d6 (400 МГц): δ 8,32 (s, 1H), 7,99-7,96 (m, 1H), 7,70 (s, 1H), 7,60 (d, J=8,8 Гц, 2H), 6,51 (d, J=8,8 Гц, 2H), 6,45 (d, J=6,4 Гц, 1H), 4,36-3,75 (m, 7H), 2,72 (d, J=4,4 Гц, 3H), 2,47-2,44 (m, 2H), 2,12 (br s, 2H), 1,99-1,95 (m, 2H).
Соединение 95: 1H ЯМР DMSO-d6 (400 МГц): δ 8,33 (d, J=5,6 Гц, 1H), 7,99-7,97 (m, 1H), 7,74 (s, 1H), 7,60 (d, J=8,8 Гц, 2H), 6,53-6,47 (m, 2H), 4,11-3,76 (m, 7H), 2,72 (d, J=4,4 Гц, 3H), 2,58-2,51 (m, 2H), 2,02 (br s, 2H), 1,95-1,90 (m, 2H).
Пример B53
Получение соединений 96, 97 и 98
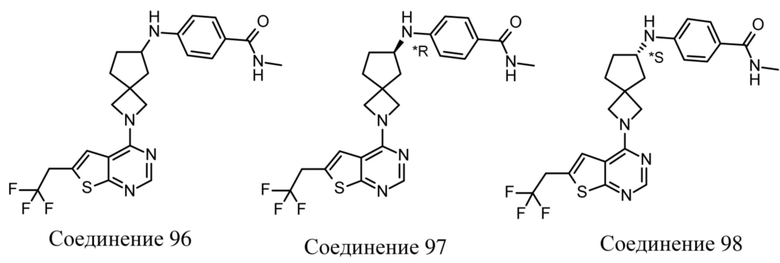
В раствор промежуточного соединения 4 (200 мг, 0,586 ммоль), 4-амино-N-метилбензамида (132 мг, 0,879 ммоль), цианоборогидрида натрия (73,6 мг, 1,17 ммоль) и MeOH (20 мл) добавляли раствор CH3COOH (70,4 мг, 1,17 ммоль) в MeOH (6 мл). После перемешивания при 45°C в течение 12 часов реакционную смесь концентрировали до сухого состояния при пониженном давлении с получением неочищенного продукта, который очищали с помощью преп. HPLC (Gilson 281, колонка Xtimate C18 150 × 25 мм × 5 мкм (элюент: от 30% до 60% (об./об.) вода (0,225% FA)-ACN)). Чистые фракции собирали и выпаривали при пониженном давлении с получением остатка, который лиофилизировали до сухого состояния с получением соединения 96 (150 мг) (белое твердое вещество). Соединение 96 дополнительно разделяли с помощью SFC (Amylose-C, 3 × 25 см, 10 мкм, подвижная фаза: CO2/EtOH (0,1% NH3.H2O) = 45/55, 80 мл/мин). Чистые фракции собирали и летучие вещества удаляли при пониженном давлении с получением остатков, которые затем лиофилизировали до сухого состояния с получением соединения 97 (38,8 мг, выход 14%) в виде белого твердого вещества и соединения 98 (41,2 мг, выход 15%) в виде белого твердого вещества.
Соединение 96: 1H ЯМР (400МГц, метол-d4) δ 8,26 (s, 1H), 7,65-7,59 (m, 2H), 7,37 (s, 1H), 6,65-6,60 (m, 2H), 4,54,12-4,15 (m, 4H), 4,00-3,90 (m, 1H), 3,90-3,81 (m, 2H), 2,87 (s, 3H), 2,47-2,37 (m, 1H), 2,28-2,12 (m, 2H), 2,08-1,90 (m, 2H), 1,73-1,61 (m, 1H).
Соединение 97: 1H ЯМР DMSO-d6 (400 МГц): δ 8,26 (s, 1H), 7,65-7,58 (m, 2H), 7,37 (s, 1H), 6,68-6,55 (m, 2H), 4,53-4,06 (m, 4H), 4,01-3,90 (m, 1H), 3,90-3,78 (m, 2H), 2,87 (s, 3H), 2,48-2,36 (m, 1H), 2,28-2,10 (m, 2H), 2,08-1,90 (m, 2H), 1,73-1,59 (m, 1H).
Соединение 98: 1H ЯМР DMSO-d6 (400 МГц): δ 8,26 (s, 1H), 7,66-7,56 (m, 2H), 7,37 (s, 1H), 6,66-6,57 (m, 2H), 4,58-4,03 (m, 4H), 3,99-3,90 (m, 1H), 3,90-3,81 (m, 2H), 2,87 (s, 3H), 2,49-2,35 (m, 1H), 2,30-2,11 (m, 2H), 2,09-1,89 (m, 2H), 1,76-1,51 (m, 1H).
Пример B54
Получение соединения 99
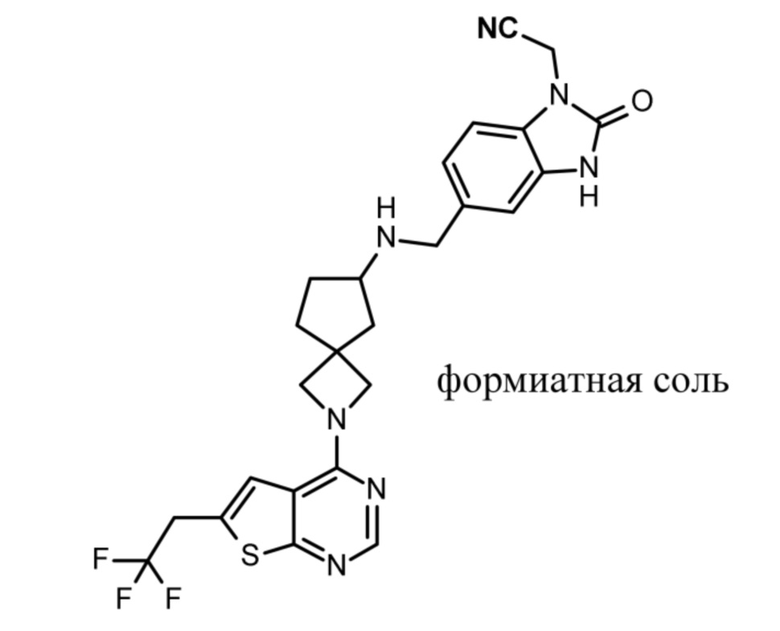
В раствор промежуточного соединения 55 (40,0 мг, неочищенное вещество) в DCM (0,5 мл) добавляли TFA (0,1 мл, 1,35 ммоль). После перемешивания при 10°C в течение 2 часов реакционную смесь регулировали до pH=6-7 с помощью насыщенного NaHCO3 (5 мл), после чего разбавляли водой (10 мл) и экстрагировали с помощью DCM (15 мл × 3). Объединенные органические слои высушивали над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением неочищенного продукта, который очищали с помощью преп. HPLC (Gilson 281, колонка: Xtimate C18 150 × 25 мм × 5 мкм, подвижная фаза A: вода (0,225% муравьиной кислоты), B: ACN). Необходимые фракции собирали и растворитель выпаривали с получением соединения 99 (8,35 мг; формиатная соль) в виде белого твердого вещества.
Соединение 99: 1H ЯМР DMSO-d6 (400 МГц): δ 11,18 (br s, 1H), 8,28 (s, 1H), 8,23 (s, 1H), 7,37 (s, 1H), 7,19 (d, J=8,4 Гц, 1H), 7,07-7,05 (m, 2H), 5,03 (s, 2H), 4,07-3,98 (m, 6H), 3,75 (s, 2H), 3,17-3,14 (m, 1H), 2,14-2,09 (m, 1H), 2,05-1,97 (m, 1H), 1,84-1,78 (m, 3H), 1,53-1,47 (m, 1H).
Пример B56
Получение соединений 102 и 103
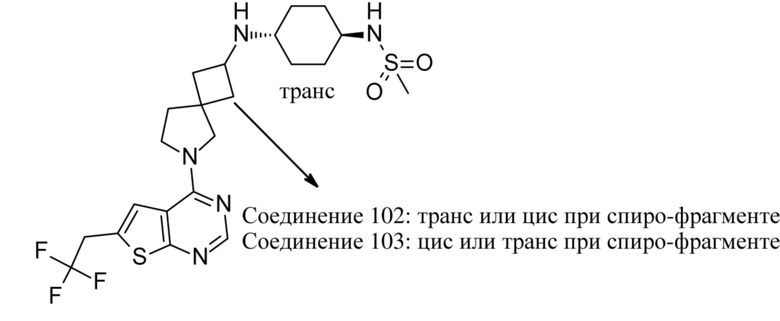
Перемешивали раствор промежуточного соединения 5 (6-(6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин-4-ил)-6-азаспиро[3.4]октан-2-она) (300 мг, 0,880 ммоль), N-((1R,4R)-4-аминоциклогексил)метансульфонамида (169 мг, 0,880 ммоль) и тетраизопропанолата титана (1,25 г, 4,40 ммоль) в MeOH (5 мл) при 50°C в течение 3 ч Затем смесь охлаждали до комнатной температуры и добавляли NaBH3CN (110 мг, 1,76 ммоль). Смесь перемешивали при комнатной температуре в течение еще 3 ч и затем выливали в воду (10 мл) и регулировали до pH<7 с помощью HCl (1 М). Смесь экстрагировали с помощью EtOAc (50 мл × 3). Объединенные органические слои промывали солевым раствором (50 мл × 2), высушивали над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали с помощью флэш-хроматографии (DCM:MeOH=10:1, об./об.) с получением смеси цис- и транс-изомеров (при спиро-фрагменте) (180 мг, свободное основание). Смесь разделяли с помощью SFC (AD-H, 2,5 × 25 см, 10 мкм, подвижная фаза: CO2/MeOH (0,03% DEA) = 80/20, 50 мл/мин ) с получением соединения 102 (50,0 мг) в виде белого твердого вещества и соединения 103 (16,8 мг) в виде белого твердого вещества.
Соединение 102: 1H ЯМР MeOD-d4 (400 МГц): δ 8,27 (s, 1H), 7,64 (s, 1H), 3,91-3,83 (m, 6H), 3,55-3,50 (m, 1H), 3,20-3,14 (m, 1H), 2,93 (s, 3H), 2,53-2,48 (m, 1H), 2,41-2,35 (m, 2H), 2,05-1,92 (m, 8H), 1,37-1,22( m, 4H)
Соединение 103: 1H ЯМР MeOD-d4 (400 МГц): δ 8,27 (s, 1H), 7,61 (s, 1H), 3,86 (q, J=10,8 Гц, 4H), 3,75 (br s, 2H), 3,48-3,44 (m, 1H), 3,20-3,14 (m, 1H), 2,93 (s, 3H), 2,48-2,45 (m, 1H), 2,11 (br s, 2H), 2,04-2,01 (m, 2H), 1,97-1,92 (m, 4H), 1,37-1,16 (m, 4H)
Пример B57
Получение соединений 104 и 105
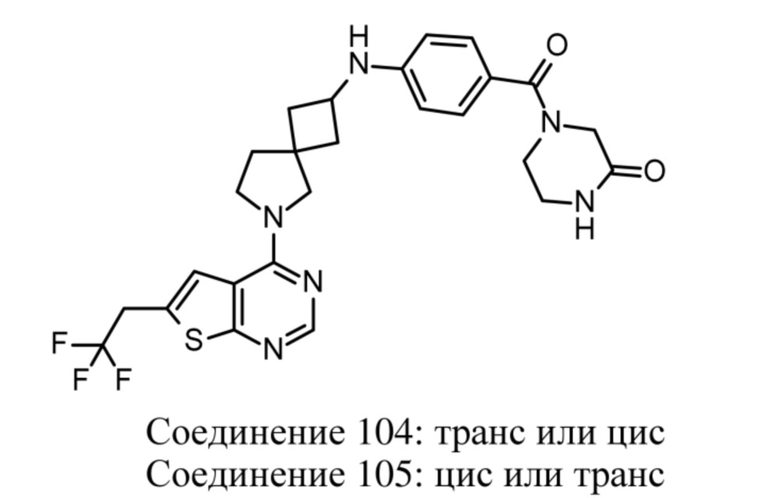
В раствор промежуточного соединения 59 (соли TFA и 4-((6-(6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин-4-ил)-6-азаспиро[3.4]октан-2-ил)амино)бензойной кислоты) (160 мг) и DMF (8 мл) добавляли пиперазин-2-она гидрохлорид (56,7 мг, 0,415 ммоль), DIEA (179 мг, 1,39 ммоль) и HATU (158 мг, 0,416 ммоль) при 0°C. Реакционную смесь нагревали до комнатной температуры и перемешивали в течение 2 ч. Реакционную смесь затем концентрировали до сухого состояния при пониженном давлении с получением неочищенного продукта, который очищали с помощью преп. HPLC (Gilson 281, колонка: колонка Xtimate C18 150 × 25 мм × 5 мкм, подвижная фаза A: вода (0,225% FA), B: ACN). Чистые фракции лиофилизировали до сухого состояния с получением смеси цис- и транс-изомеров (70 мг, выход 77%) в виде белого твердого вещества, которое разделяли с помощью SFC (AS, 3 × 25 см, 10 мкм, подвижная фаза: CO2/MeOH (0,1% NH3·H2O) = 55/45, 70 мл/мин). Чистые фракции собирали и летучие вещества удаляли при пониженном давлении с получением двух остатков, которые лиофилизировали до сухого состояния с получением соединения 104 (4,76 мг, выход 6,77%) в виде белого твердого вещества и соединения 105 (4,36 мг) в виде белого твердого вещества.
Соединение 104: 1H ЯМР DMSO-d6 (400 МГц): δ 8,32 (s, 1H), 8,08 (s, 1H), 7,71 (s, 1H), 7,24 (d, J=8,4 Гц, 2H), 6,55 (d, J=8,4 Гц, 2H), 6,49 (d, J=6,0 Гц, 1H), 4,13-3,92 (m, 6H), 3,92-3,67 (m, 3H), 3,67-3,61 (m, 2H), 3,25-3,19 (m, 2H), 2,47-2,43 (m, 2H), 2,19-2,07 (m, 2H), 2,02-1,93 (m, 2H)
Соединение 105: 1H ЯМР DMSO-d6 (400 МГц): δ 8,33 (s, 1H), 8,08 (s, 1H), 7,74 (s, 1H), 7,23 (d, J=8,8 Гц, 2H), 6,54 (d, J=8,4 Гц, 2H), 6,51 (d, J=6,4 Гц, 1H), 4,13-3,93 (m, 6H), 3,93-3,67 (m, 3H), 3,67-3,58 (m, 2H), 3,25-3,18 (m, 2H), 2,56-2,52 (m, 2H), 2,06-1,99 (m, 2H), 1,96-1,88 (m, 2H)
Пример B58
Получение соединения 106
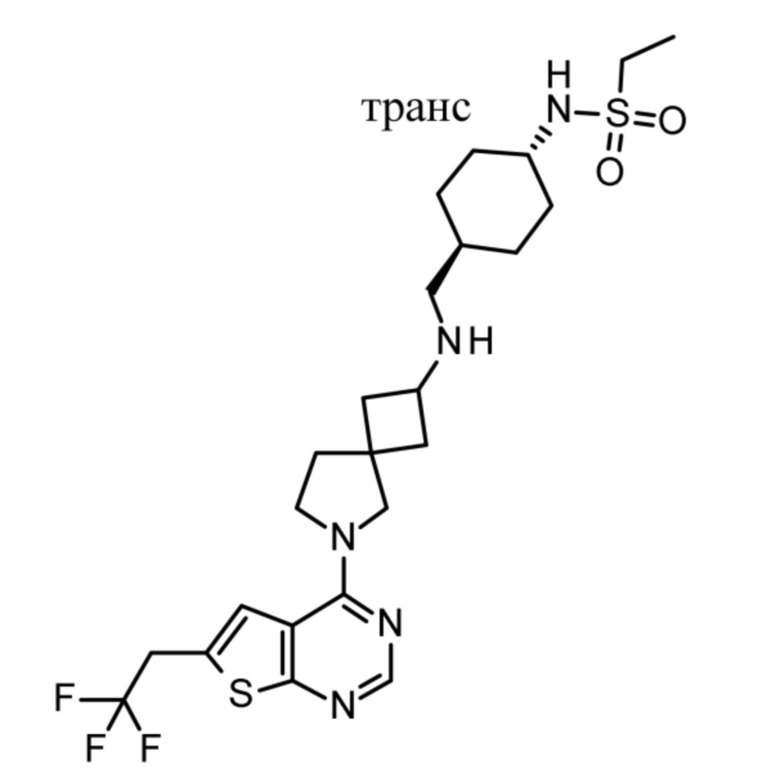
Перемешивали раствор промежуточного соединения 5 (6-(6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин-4-ил)-6-азаспиро[3.4]октан-2-она) (136 мг, 0,398 ммоль), N-((1R,4R)-4-(аминометил)циклогексил)этансульфонамида трифторацетата (200 мг, 0,598 ммоль), N, N-диизопропилэтиламина (155 мг, 1,20 ммоль) и сухого DCM (10 мл) при 25°C в течение 2 ч и затем добавляли триацетоксиборогидрид натрия (338 мг, 1,60 ммоль). После перемешивания при 25°C в течение 8 ч реакционную смесь разбавляли с помощью DCM (30 мл) и промывали водой (20 мл × 3). Органический слой высушивали над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении с получением остатка, который очищали с помощью преп. HPLC (Gilson 281, колонка: колонка Xtimate C18 150 × 25 мм × 5 мкм, подвижная фаза A: вода (0,225% муравьиной кислоты), B: ACN). Чистые фракции собирали и растворитель выпаривали в вакууме с получением остатка, который лиофилизировали с получением соединения 106 (163,08 мг, выход 73,8%) в виде белого порошка.
Соединение 106: 1H ЯМР DMSO-d6 (400 МГц): δ 8,32 (s, 1H), 7,74-7,65 (m, 1H), 7,06-6,99 (m, 1H), 4,06 (q, J=10,8 Гц, 2H), 3,95-3,43 (m, 8H), 3,07-2,92 (m, 3H), 2,36-2,15 (m, 4H), 2,10-1,97 (m, 2H), 1,93-1,84 (m, 2H), 1,84-1,75 (m, 2H), 1,54-1,40 (m, 1H), 1,27-1,14 (m, 5H), 1,06-0,90 (m, 2H).
Пример B59
Получение соединения 107
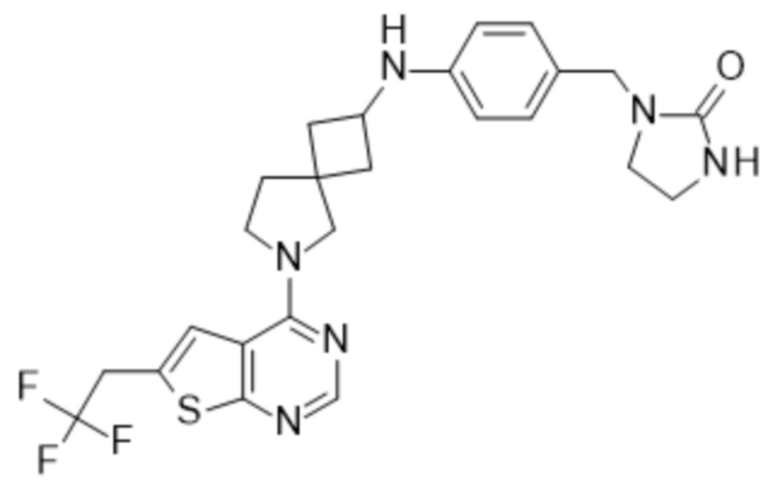
В раствор промежуточного соединения 5 (6-(6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин-4-ил)-6-азаспиро[3.4]октан-2-она) (250 мг, 0,549 ммоль), 1-(4-аминобензил)имидазолидин-2-она (100 мг, 0,523 ммоль), цианоборогидрида натрия (70,0 мг, 1,11 ммоль) и MeOH (18,0 мл) добавляли раствор уксусной кислоты (70,0 мг, 1,17 ммоль) в MeOH (2,0 мл). После перемешивания при 40°C в течение 14 ч смесь выливали в воду (15 мл) и экстрагировали с помощью DCM (10 мл × 3). Объединенный органический слой высушивали над безводным Na2SO4, фильтровали и концентрировали in vacuo с получением неочищенного остатка, который очищали с помощью преп. HPLC (Gilson 281, колонка: колонка Xtimate C18 150 × 25 мм × 5 мкм, подвижная фаза A: вода (0,225% FA), B: ACN). Чистые фракции собирали и лиофилизировали до сухого состояния с получением соединения 107 (46,2 мг, выход 16%) в виде белого порошка.
Соединение 107: 1H ЯМР DMSO-d6 (400 МГц): δ 8,36-8,27 (m, 1H), 7,78-7,64 (m, 1H), 7,01-6,86 (m, 2H), 6,54-6,42 (m, 2H), 6,36-6,25 (m, 1H), 5,94-5,83 (m, 1H), 4,18-3,97 (m, 4H), 3,95-3,58 (m, 5H), 3,21-2,99 (m, 4H), 2,60-2,56 (m, 2H), 2,16-1,86 (m, 4H).
Пример B60
Получение соединения 108 и соединения 109
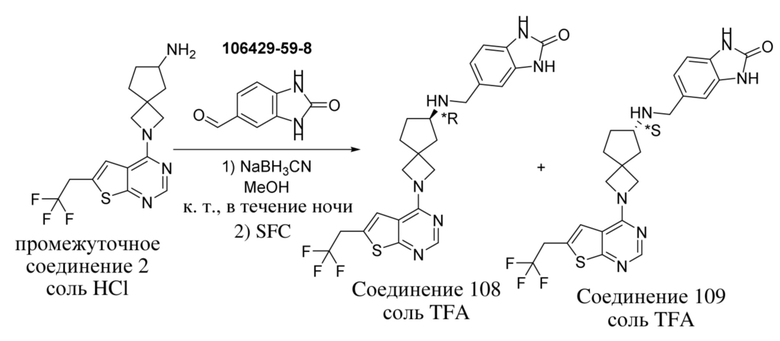
Перемешивали раствор промежуточного соединения 2 (100 мг, неочищенная соль HCl, 0,29 ммоль) и 2-оксо-2,3-дигидро-1H-бензо[d]имидазол-5-карбальдегида (№ по CAS: 106429-59-8) (71 мг, 0,44 ммоль) в MeOH (2 мл) при комнатной температуре в течение 2 ч. Добавляли NaBH3CN (37 мг, 0,58 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли с помощью H2O и экстрагировали с помощью EtOAc. Объединенные органические экстракты промывали солевым раствором, высушивали над безводным Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% TFA), B: ACN) с получением рацемического соединения 14 (49 мг, соль TFA). Полученное рацемическое соединение 14 разделяли с помощью SFC (SFC80, Waters, IC 2,5 × 25 см, 10 мкм, A: сверхкритический CO2, B: MeOH/DEA=100/0,03; A:B=70/30; расход: 70 мл/мин; температура колонки (T): 25°C; противодавление (BPR): 100 бар) с получением соединения 108 (12 мг в виде соли TFA, выход 6,8%) в виде белого твердого вещества и соединения 109 (13 мг в виде соли TFA, выход 7,3%) в виде белого твердого вещества.
Пример B61
Получение соединения 110 и соединения 111
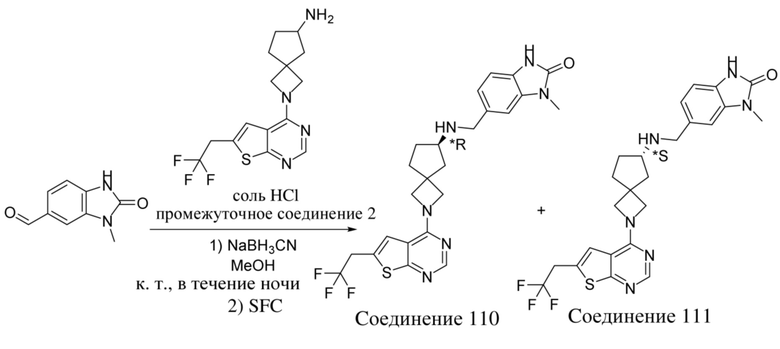
В перемешиваемый раствор промежуточного соединения 2 (150 мг, неочищенная соль HCl, примерно 0,44 ммоль) в MeOH (3 мл) при комнатной температуре добавляли промежуточное соединение 70 (185 мг, чистота: примерно 50%, примерно 0,53 ммоль) и AcOH (3 капли). После перемешивания в течение 2 ч добавляли NaBH3CN (55,30 мг, 0,88 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали и остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% TFA/H2O, B: ACN) и полученный рацемат разделяли с помощью SFC (SFC80, Waters; AD 2,5 × 25 см, 10 мкм; A: сверхкритический CO2, подвижная фаза B: MeOH; A:B=70/30; расход: 60 мл/мин; температура колонки (T): 25°C; противодавление (BPR): 100 бар) с получением соединения 110 (38,78 мг, выход 17%) в виде белого твердого вещества и соединения 111 (24,88 мг, выход 11%) в виде белого твердого вещества.
Пример B62
Получение соединения 112 и соединения 113
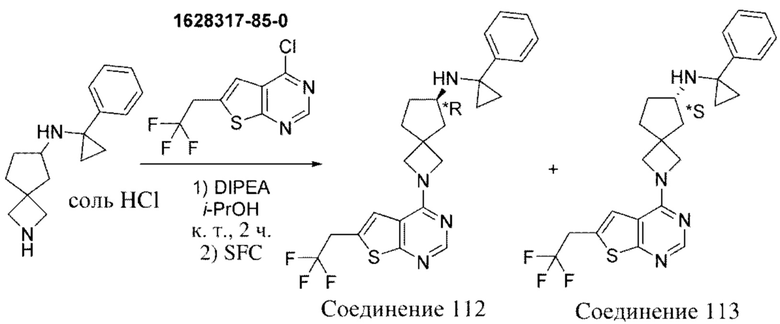
Перемешивали смесь промежуточного соединения 78 (330 мг, неочищенная соль HCl), 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидина (№ по CAS: 1628317-85-0) (212 мг, 0,84 ммоль) и DIPEA (271 мг, 2,10 ммоль) в i-PrOH (10 мл) при комнатной температуре в течение 2 ч. Реакционную смесь концентрировали при пониженном давлении. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% TFA/H2O, B: ACN) с получением рацемического необходимого продукта. Рацемат разделяли с помощью SFC (SFC80, Waters; OJ-H 2,5 × 25 см, 10 мкм; A: сверхкритический CO2, подвижная фаза B: MeOH; A:B=70/30; расход: 70 мл/мин; температура колонки (T): 25°C; противодавление (BPR): 100 бар) с получением соединения 112 (63,38 мг, выход 19%) в виде белого твердого вещества и соединения 113 (46,77 мг, выход 14%) в виде белого твердого вещества.
Пример B63
Получение соединения 114
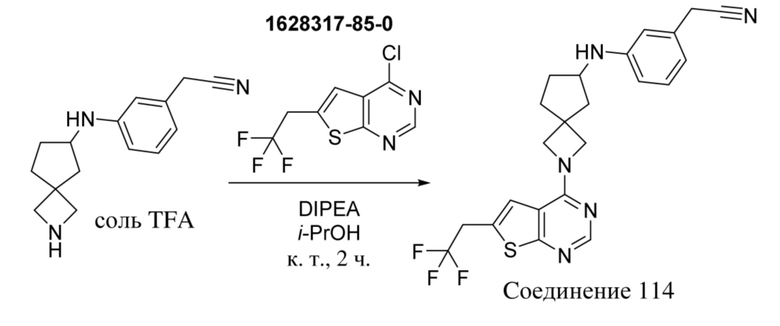
В перемешиваемый раствор промежуточного соединения 80 (300 мг, неочищенная соль TFA, примерно 0,84 ммоль) и 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидина (№ по CAS: 1628317-85-0) (252 мг, 1,0 ммоль) в i-PrOH (10 мл) добавляли DIPEA (387 мг, 3,0 ммоль). После перемешивания при комнатной температуре в течение 2 ч реакционную смесь обрабатывали с помощью H2O (5 мл), фильтровали. Осадок на фильтре очищали с помощью преп. HPLC (Agilent G6120B, детектор G1315D DADVL и G4260B ELSD, Xbridge C18 5 мм 150 × 4,6 мм, подвижная фаза A: 0,1% NH4OH в воде, B: 0,1% NH4OH в CH3CN) с получением соединения 114 (200 мг, выход 52%) в виде белого твердого вещества.
Пример B64
Получение соединения 115 и соединения 116
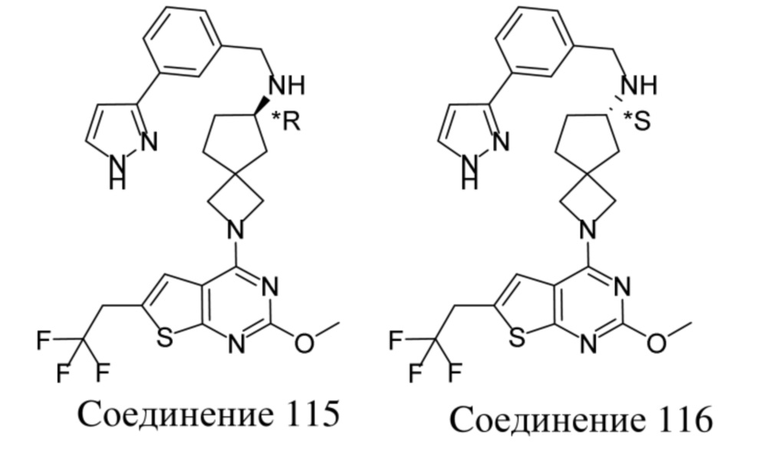
В перемешиваемую смесь промежуточного соединения 62 (100 мг, 0,268 ммоль), 3-(1H-пиразол-3-ил)бензальдегида (№ по CAS: 179057-26-2) (56 мг, 0,32 ммоль) и Ti(i-PrO)4 (76 мг, 0,27 ммоль) в DCE (5 мл) при комнатной температуре добавляли порциями NaBH(OAc)3 (171 мг, 0,81 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь гасили с помощью водн. NaHCO3 и полученное вещество экстрагировали с помощью DCM. Объединенные органические экстракты промывали солевым раствором, высушивали над безводным Na2SO4, фильтровали и концентрировали. Неочищенный продукт очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением рацемата (80 мг) в виде белого твердого вещества. Рацемат разделяли с помощью SFC (прибор: Waters-SFC80; колонка: IA-H (2,5 × 25 см, 10 мкм); подвижная фаза A: сверхкритический CO2, подвижная фаза B: MeOH; A:B=60/40 при 70 мл/мин; время цикла: 18 мин; объем впрыска: 3,5 мл; длина волны детектора: 214 нм; температура колонки (T): 25°C; BPR: 100 бар) с получением соединения 115 (25,8 мг, выход 18%) и соединения 116 (27,90 мг, выход 19%).
Пример B65
Получение соединения 117
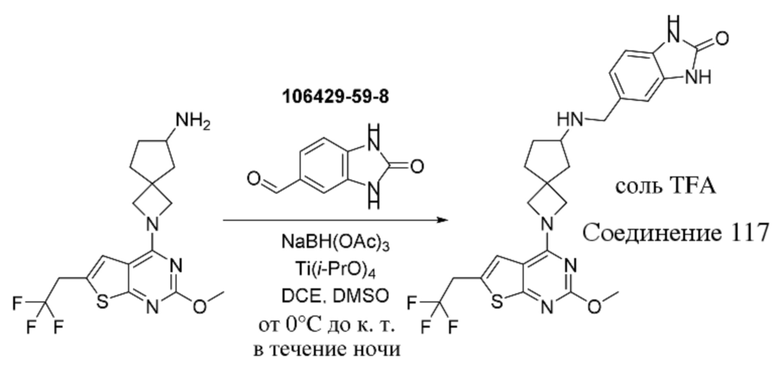
В перемешиваемую смесь промежуточного соединения 62 (120 мг, 0,32 ммоль), 2-оксо-2,3-дигидро-1H-бензо[d]имидазол-5-карбальдегида (№ по CAS: 106429-59-8) (104 мг, 0,64 ммоль) и Ti(i-PrO)4 (92 мг, 0,32 ммоль) в DCE/DMSO (6 мл/2 мл) при 0°C добавляли порциями NaBH(OAc)3 (205 мг, 0,97 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь гасили с помощью водн. NaHCO3 и полученное вещество экстрагировали с помощью DCM. Объединенные органические экстракты промывали солевым раствором, высушивали над безводным Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% TFA), B: ACN) с получением соединения 117 (22 мг, соль TFA, выход: 13%) в виде белого твердого вещества.
Пример B66
Получение соединения 118
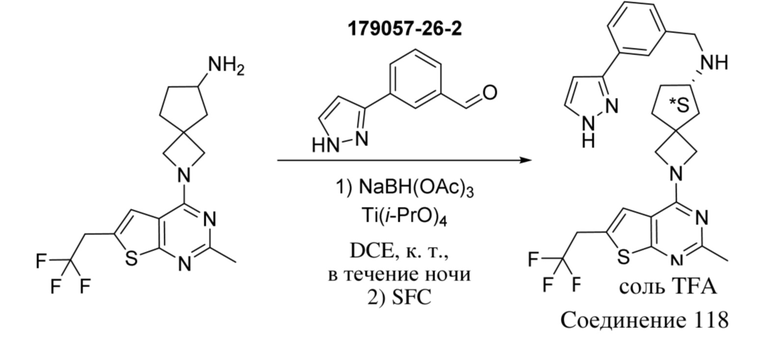
В перемешиваемый раствор промежуточного соединения 72 (150 мг, 0,421 ммоль) в DCE (2 мл) при комнатной температуре добавляли 3-(1H-пиразол-3-ил)бензальдегид (№ по CAS: 179057-26-2) (108 мг, 0,63 ммоль) и Ti(i-PrO)4 (120 мг, 0,42 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 30 минут. Добавляли NaBH3CN (54 мг, 0,84 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% TFA), B: ACN) с получением рацемического необходимого продукта (120 мг, соль TFA). Рацемат разделяли с помощью SFC (SFC80, Waters, AD-H 2,5 × 25 см, 10 мкм, A: сверхкритический CO2, B: EtOH/ACN=85/15; A:B=55/45; расход: 50 мл/мин; температура колонки (T): 25°C; BPR: 100 бар) с получением соединения 118 (28 мг, соль TFA, выход 10%).
Пример B67
Получение соединения 119
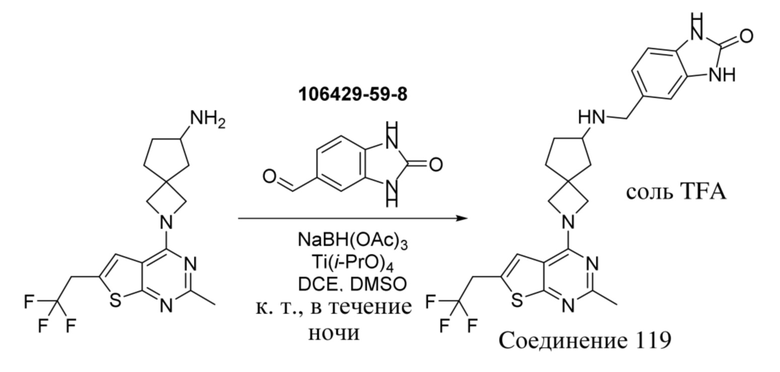
В перемешиваемый раствор промежуточного соединения 72 (250 мг, 0,70 ммоль) в DCE (2,5 мл) добавляли 2-оксо-2,3-дигидро-1H-бензо[d]имидазол-5-карбальдегид (№ по CAS: 106429-59-8) (170 мг, 1,06 ммоль), DMSO (0,5 мл) и Ti(i-PrO)4 (200 мг, 0,70 ммоль). Смесь перемешивали в течение 30 минут. Добавляли NaBH(OAc)3 (295 мг, 1,40 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали при пониженном давлении и остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% TFA), B: ACN) с получением соединения 119 (156 мг, соль TFA, выход 44%).
Пример B68
Получение соединения 120
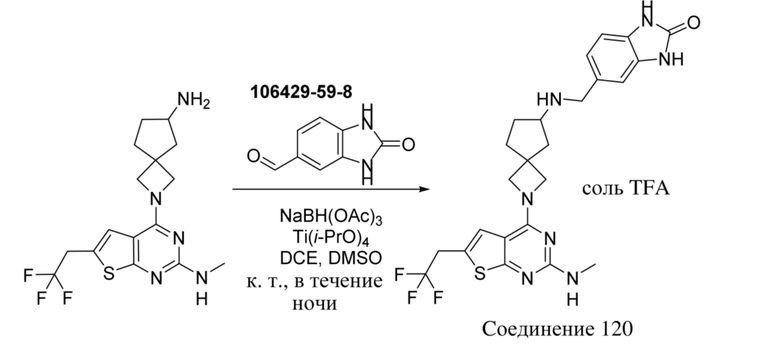
В перемешиваемую смесь промежуточного соединения 76 (250 мг, 0,67 ммоль), 2-оксо-2,3-дигидро-1H-бензо[d]имидазол-5-карбальдегида (№ по CAS: 106429-59-8) (218 мг, 1,35 ммоль) и Ti(i-PrO)4 (192 мг, 0,67 ммоль) в DCE/DMSO (6 мл/2 мл) при 0°C добавляли порциями NaBH(OAc)3 (428 мг, 2,02 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь гасили с помощью водн. NaHCO3 и полученное вещество экстрагировали с помощью DCM. Объединенные органические экстракты промывали солевым раствором, высушивали над безводным Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% TFA), B: ACN) с получением соединения 120 (60 мг, соль TFA, выход: 17%) в виде белого твердого вещества.
Пример B69
Получение соединения 121 и соединения 122
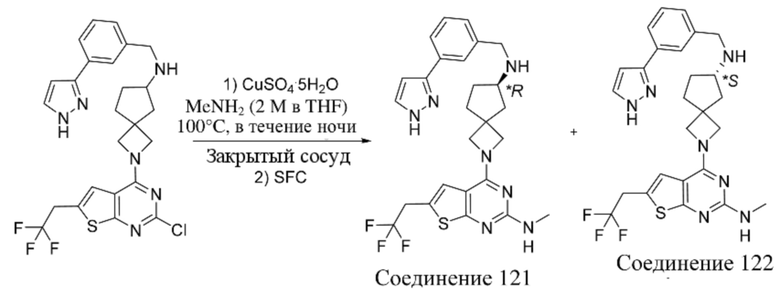
Перемешивали суспензию промежуточного соединения 74 (160 мг, 0,300 ммоль) и CuSO4.5H2O (8 мг, 0,030 ммоль) в метанамине (2 М в THF) (2 мл) в закрытом сосуде при 100°C в течение ночи. Реакционную смесь концентрировали. Остаток очищали с помощью колоночной хроматографии, с элюированием смесью DCM/MeOH (от 50:1 до 15:1, об./об.), с получением рацемата необходимого продукта в виде желтого твердого вещества. Рацемат разделяли с помощью SFC (прибор: Waters-SFC80; колонка: OJ-H (2,5 × 25 см, 10 мкм); подвижная фаза A: сверхкритический CO2, подвижная фаза B: MeOH; A:B=80/20 при 80 мл/мин; время цикла: 8,5 мин; объем впрыска: 1,3 мл; длина волны детектора: 214 нм; температура колонки (T): 25°C; BPR: 100 бар) с получением соединения 121 (32,9 мг, выход 20%) и соединения 122 (31,3 мг, выход 19%).
Пример B70
Получение соединения 123
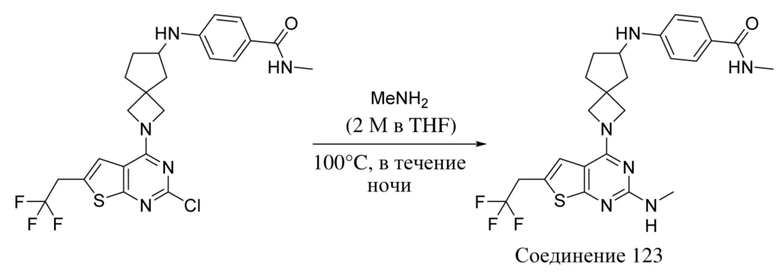
Перемешивали раствор промежуточного соединения 65 (400 мг, 0,786 ммоль) в MeNH2 (2 М в THF) (10 мл) при 100°C в течение ночи. Охлажденную реакционную смесь концентрировали. Остаток очищали с помощью преп. TLC (DCM: MeOH=15:1, об./об.) с получением соединения 123 (180 мг, выход 45%).
Пример B71
Получение соединения 124
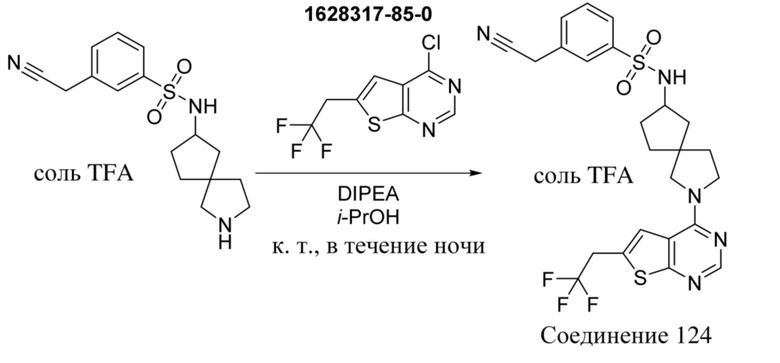
В перемешиваемый раствор промежуточного соединения 83 (150 мг, неочищенная соль TFA, примерно 0,31 ммоль) в i-PrOH (1 мл) добавляли 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (№ по CAS: 1628317-85-0) (79 мг, 0,31 ммоль) и DIPEA (202 мг, 1,57 ммоль). После перемешивания при комнатной температуре в течение ночи реакционную смесь концентрировали при пониженном давлении. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% TFA), B: ACN) с получением соединения 124 (85 мг, соль TFA, выход примерно 42% за 2 стадии) в виде белого твердого вещества.
Пример B72
Получение соединения 125
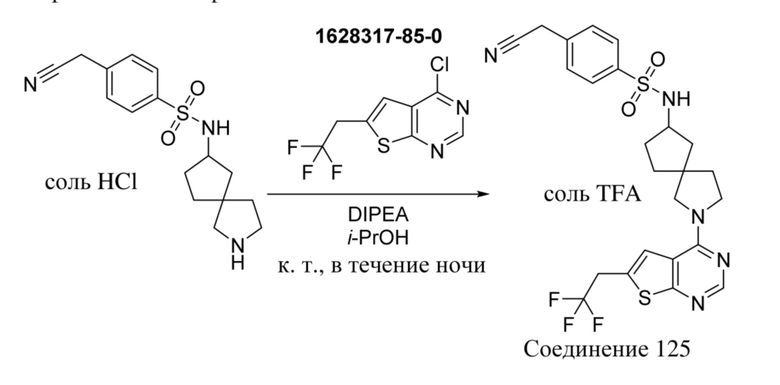
Перемешивали раствор промежуточного соединения 85 (50 мг, неочищенная соль HCl, примерно 0,107 ммоль), DIPEA (70 мг, 0,55 ммоль) и 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидина (№ по CAS: 1628317-85-0) (27 мг, 0,11 ммоль) в сухом i-PrOH (1 мл) при комнатной температуре в течение ночи. Реакционную смесь концентрировали и остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% TFA), B: ACN) с получением соединения 125 (28 мг в виде соли TFA, выход примерно 40% за 2 стадии) в виде белого твердого вещества.
Пример B73
Получение соединения 126
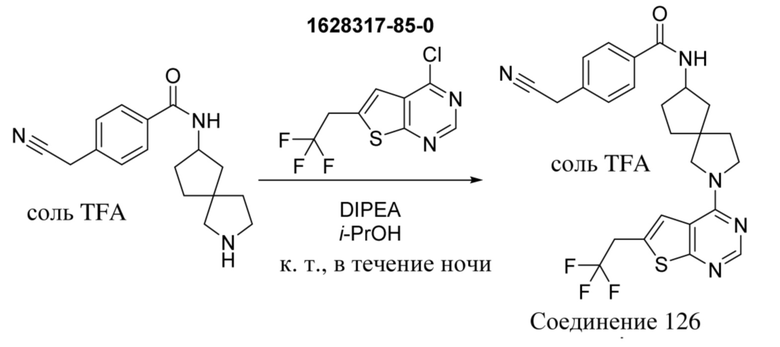
В перемешиваемый раствор промежуточного соединения 87 (90 мг, неочищенная соль TFA, примерно 0,183 ммоль) в i-PrOH (1 мл) добавляли 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (№ по CAS: 1628317-85-0) (46 мг, 0,18 ммоль) и DIPEA (202 мг, 1,57 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% TFA), B: ACN) с получением соединения 126 (66 мг, соль TFA, выход 58% за 2 стадии) в виде белого твердого вещества.
Пример B74
Получение соединения 127
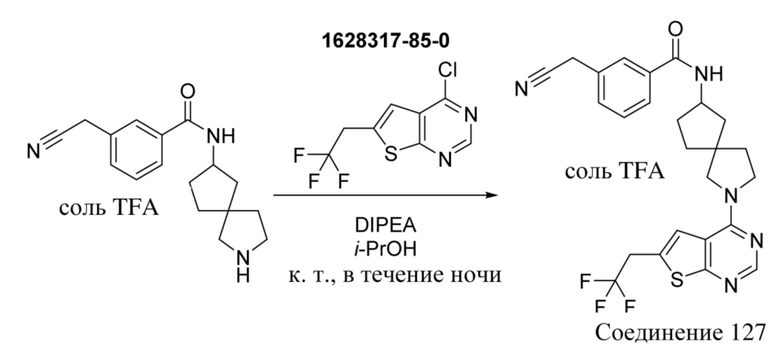
В перемешиваемый раствор промежуточного соединения 89 (80 мг, неочищенная соль TFA, 0,175 ммоль) в i-PrOH (2 мл) добавляли 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (№ по CAS: 1628317-85-0) (45 мг, 0,18 ммоль) и DIPEA (114 мг, 0,89 ммоль). Реакционную смесь перемешивали при комнатной температуре. Реакционную смесь концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% TFA), B: ACN) с получением соединения 127 (61 мг, соль TFA, выход 56% за 2 стадии) в виде белого твердого вещества.
Пример B75
Получение соединения 128
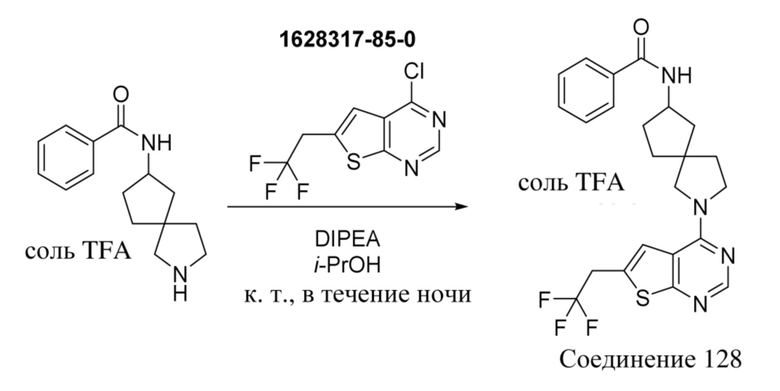
В перемешиваемый раствор промежуточного соединения 91 (100 мг, неочищенная соль TFA, примерно 0,203 ммоль) в i-PrOH (1 мл) добавляли 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (№ по CAS: 1628317-85-0) (53 мг, 0,21 ммоль) и DIPEA (135 мг, 1,05 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% TFA), B: ACN) с получением соединения 128 (69 мг, соль TFA, выход 59% за 2 стадии) в виде белого твердого вещества.
Пример B76
Получение соединения 129
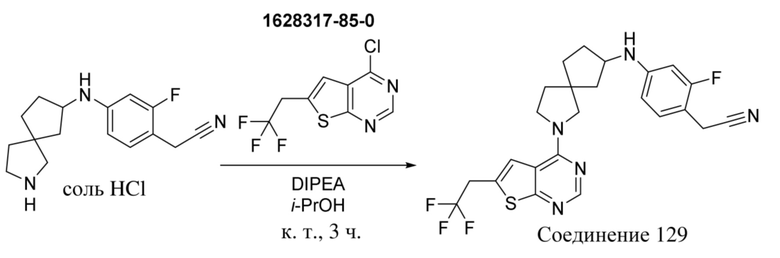
В раствор промежуточного соединения 93 (40 мг, неочищенная соль HCl, примерно 0,146 ммоль) в i-PrOH (10 мл) добавляли DIPEA (56 мг, 0,438 ммоль) и 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (№ по CAS: 1628317-85-0) (36 мг, 0,146 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% TFA/H2O, B: ACN) с получением соединения 129 (18 мг, выход 25%).
Пример B77
Получение соединения 130
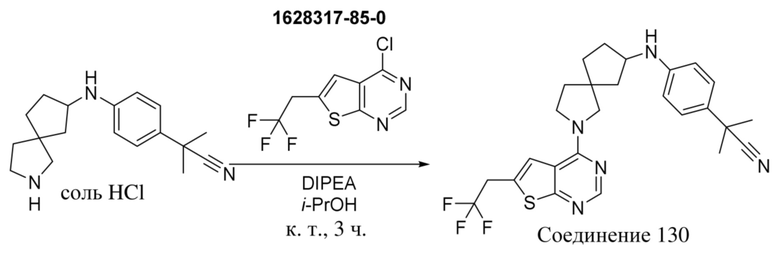
В перемешиваемый раствор промежуточного соединения 94 (88 мг, неочищенная соль HCl, примерно 0,310 ммоль) в i-PrOH (5 мл) добавляли DIPEA (80 мг, 0,930 ммоль) и 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (№ по CAS: 1628317-85-0) (78 мг, 0,310 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) и полученный продукт дополнительно обрабатывали с помощью ионообменной смолы с получением соединения 130 (95,53 мг, выход 61%).
Пример B78
Получение соединения 131
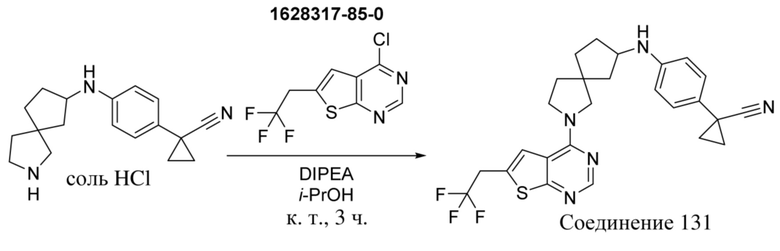
В перемешиваемый раствор промежуточного соединения 95 (44 мг, неочищенная соль HCl, примерно 0,156 ммоль) в i-PrOH (10 мл) добавляли DIPEA (60 мг, 0,409 ммоль) и 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (№ по CAS: 1628317-85-0) (39 мг, 0,154 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) и полученный продукт обрабатывали ионообменной смолой с получением соединения 131 (43,22 мг, выход 75%).
Пример B79
Получение соединения 132
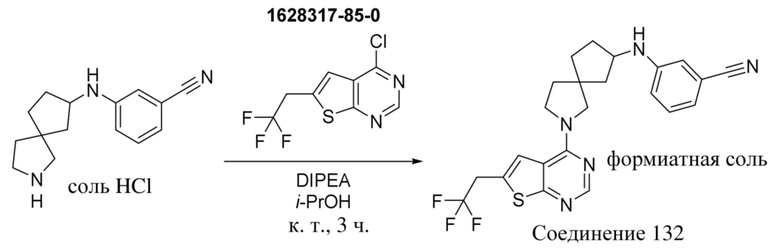
В перемешиваемый раствор промежуточного соединения 96 (35 мг, неочищенная соль HCl, примерно 0,145 ммоль) в i-PrOH (5 мл) добавляли DIPEA (56 мг, 0,435 ммоль) и 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (№ по CAS: 1628317-85-0) (37 мг, 0,145 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) и полученный продукт обрабатывали ионообменной смолой с получением соединения 132 (27,8 мг, выход 40%, формиатная соль).
Пример B80
Получение соединения 133
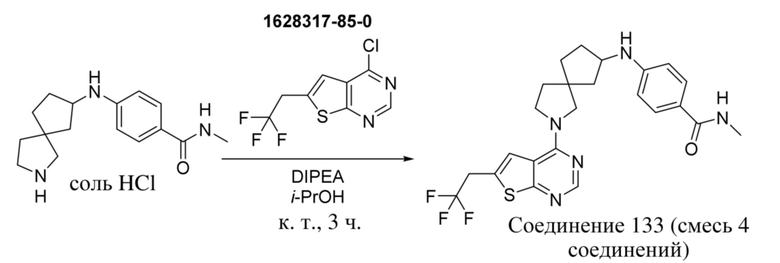
В раствор промежуточного соединения 97 (58 мг, неочищенная соль HCl, примерно 0,212 ммоль) в i-PrOH (5 мл) добавляли DIPEA (82 мг, 0,634 ммоль) и 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (53 мг, 0,212 ммоль). Реакционную смесь перемешивали при к.т. в течение 3 ч. Затем реакционную смесь концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) и полученный продукт обрабатывали ионообменной смолой с получением соединения 133 (32,5 мг, выход 31%).
Пример B81
Получение соединения 134, соединения 135, соединения 136 и соединения 137
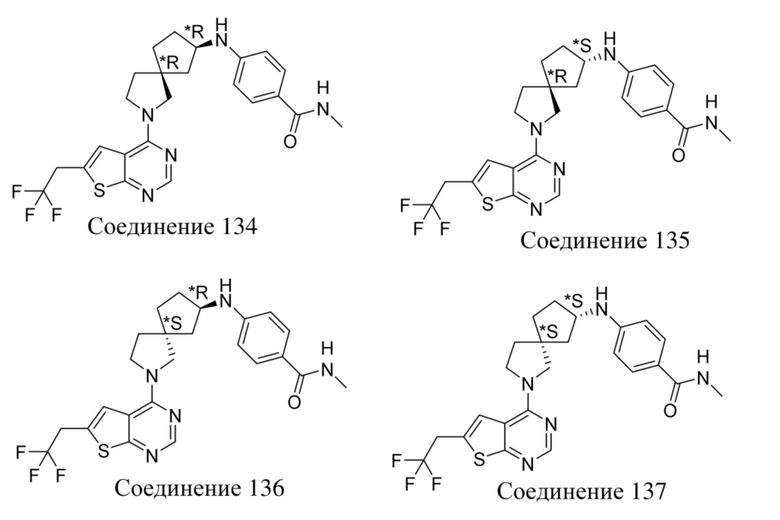
В перемешиваемый раствор промежуточного соединения 97a (1,3 г, неочищенная соль TFA, примерно 3,202 ммоль) в i-PrOH (10 мл) добавляли DIPEA (1,24 г, 9,615 ммоль) и 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (№ по CAS: 1628317-85-0) (808 мг, 3,205 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь концентрировали. Остаток очищали с помощью хроматографии на силикагеле, с элюированием смесью PE/EA (5/1, об./об.), с получением соединения 133 (701 мг). Рацемат разделяли с помощью SFC (SFC80, Waters; IA-H, 2,5 × 25 см, 10 мкм; A: сверхкритический CO2, подвижная фаза B: EtOH/ACN=85/15; A:B=63/37; расход: 50 мл/мин; температура колонки (T): 25°C; BPR: 100 бар) с получением соединения 134 (105,15 мг, выход 6,7%), соединения 135 (76,2 мг, выход 4,8%), соединения 136 (79,30 мг, выход 5,0%) и соединения 137 (84,5 мг, выход 5,3%).
Пример B82
Получение соединения 138
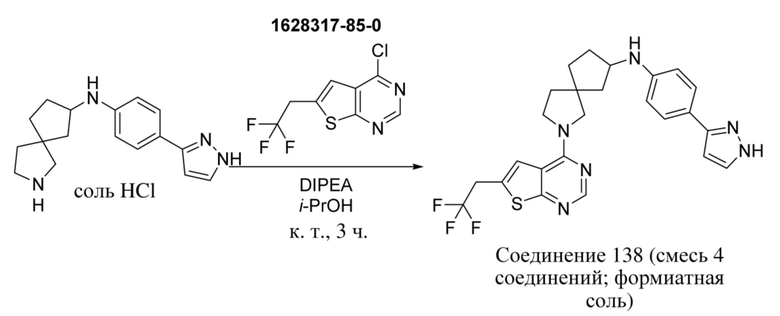
В перемешиваемый раствор промежуточного соединения 98 (88 мг, неочищенная соль HCl, примерно 0,312 ммоль) в i-PrOH (10 мл) добавляли DIPEA (120 мг, 0,936 ммоль) и 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (№ по CAS: 1628317-85-0) (78 мг, 0,312 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Реакционную смесь концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) и полученный продукт обрабатывали ионообменной смолой с получением соединения 138 (70,1 мг, выход 45%, формиатная соль).
Пример B83
Получение соединения 139, соединения 140, соединения 141 и соединения 142
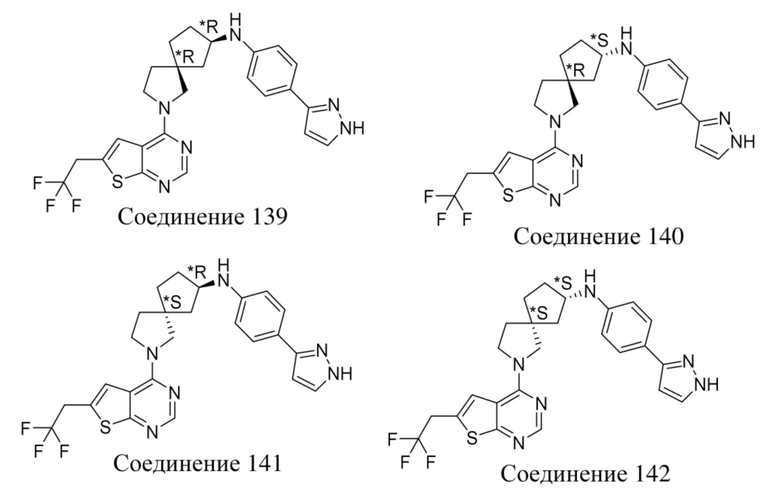
В перемешиваемый раствор промежуточного соединения 98a (1,0 г, неочищенная соль TFA, примерно 2,395 ммоль) в i-PrOH (10 мл) добавляли DIPEA (928 мг, 7,191 ммоль) и 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (№ по CAS: 1628317-85-0) (604 мг, 2,397 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 12 ч. Реакционную смесь концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением рацемического соединения 138 (488 мг). Рацемат разделяли с помощью SFC (SFC80, Waters; OJ-H, 0,46 × 15 см, 2 мкл; HEP: EtOH (0,05% DEA) = 60/40; расход: 70 г/мин; температура колонки (T): 25°C; BPR: 100 бар) с получением соединения 139 (48,2 мг, выход 4,0%), соединения 140 (25,3 мг, выход 2,1%), соединения 141 (92,6 мг, выход 7,7%) и соединения 142 (126,2 мг, выход 10%).
Пример B84
Получение соединения 143
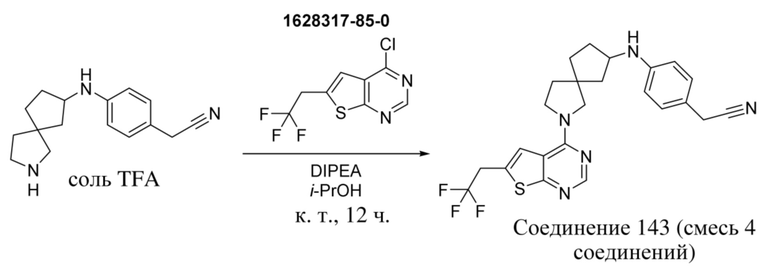
В перемешиваемый раствор промежуточного соединения 99 (120 мг, неочищенная соль TFA, примерно 0,338 ммоль) в i-PrOH (10 мл) добавляли DIPEA (182 мг, 1,41 ммоль) и 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (№ по CAS: 1628317-85-0) (118 мг, 0,47 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 12 ч. Реакционную смесь концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) и полученный продукт дополнительно обрабатывали с помощью ионообменной смолы с получением соединения 143 (34,16 мг, выход 15%).
Пример B85
Получение соединений 144, 145, 146 и 147

В перемешиваемый раствор промежуточного соединения 99 (287 мг, неочищенная соль TFA, 1,125 ммоль) в i-PrOH (10 мл) добавляли DIPEA (435 мг, 3,376 ммоль) и 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (№ по CAS: 1628317-85-0) (283 мг, 1,125 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 12 ч. Реакционную смесь концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением рацемического соединения 143 (280 мг). Рацемат разделяли с помощью SFC (SFC80, Waters; IA-H, 2,5 × 25 см, 10 мкм; A: сверхкритический CO2, подвижная фаза B: EtOH/IPA=38,3/61,7; A:B=60/40; расход: 70 г/мин; температура колонки (T): 25°C; BPR: 100 бар) с получением соединения 144 (18,9 мг, выход 14%), соединения 145 (16,2 мг, выход 11%), соединения 146 (21,7 мг, выход 16%), соединения 147 (17,0 мг, выход 12%).
Пример B86
Получение соединений 35, 149 и 150
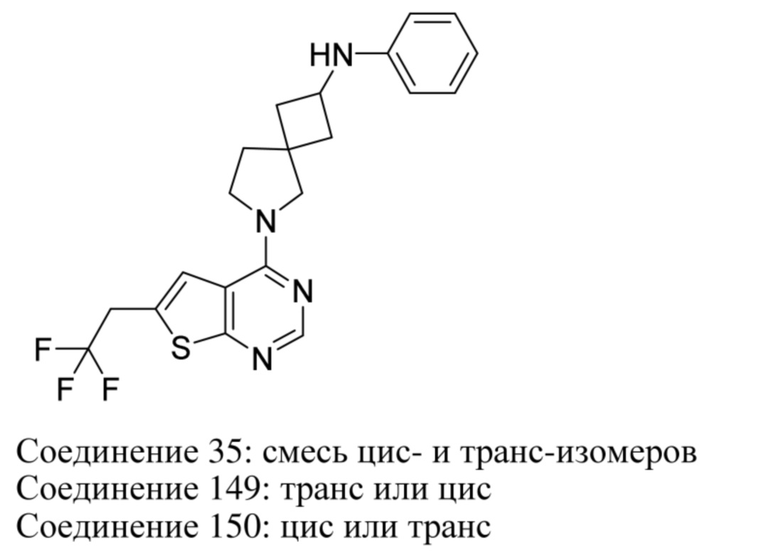
Перемешивали смесь промежуточного соединения 3 (131 мг, 0,38 ммоль), бромбензола (№ по CAS: 108-86-1) (50 мг, 0,32 ммоль), Pd2(dba)3 (5 мг), BrettPhos (5 мг) и t-BuONa (92 мг, 0,95 ммоль) в 1,4-диоксане (3 мл) при 130°C в течение 2 ч при микроволновом облучении. Охлажденную реакционную смесь разбавляли водой и экстрагировали с помощью EtOAc (50 мл × 3). Объединенные органические экстракты промывали солевым раствором, высушивали над безводным Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением соединения 35 (смеси цис- и транс-изомеров) (42,3 мг, выход 23%) в виде желтого твердого вещества. Соединение 35 (смесь цис- и транс-изомеров) (18 мг) разделяли с помощью SFC (ChiralCel OJ-H Daicel Chemical Industries, Ltd, I.D. 250 × 30 мм, 5 мкм, A: сверхкритический CO2, B: MeOH (0,1% DEA); A:B=60/40; расход: 50 мл/мин ; температура колонки (T): 38°C; давление в сопле: 100 бар; температура сопла: 60°C; температура испарителя: 20°C; температура триммера: 25°C; длина волны: 220 нм) с получением соединения 149 (транс или цис) (5 мг, выход 27%) в виде белого твердого вещества и соединения 150 (цис или транс) (6 мг, выход 33%) в виде белого твердого вещества.
Пример B87
Получение соединения 151
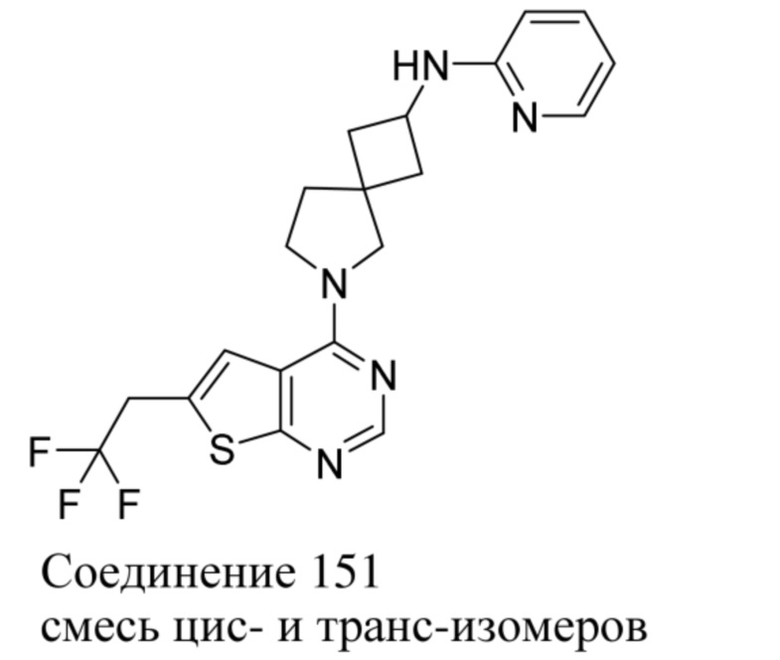
В раствор промежуточного соединения 3 (300 мг, 0,88 ммоль, соль TFA) в 1,4-диоксане (3 мл) в атмосфере Ar при комнатной температуре добавляли 2-бромпиридин (№ по CAS: 109-04-6) (157 мг, 1,0 ммоль), t-BuONa (192 мг, 2,00 ммоль), BrettPhos (48 мг, 0,09 ммоль) и Pd2(dba)3 (82 мг, 0,09 ммоль). Реакционную смесь перемешивали в атмосфере Ar при 110°C в течение 12 ч. Реакционную смесь охлаждали до комнатной температуры, разбавляли водой и экстрагировали с помощью EtOAc (100 мл × 3). Объединенные органические экстракты промывали солевым раствором (50 мл × 2), высушивали над безводным Na2SO4, фильтровали и фильтрат концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% NH3 H2O, B: ACN) с получением соединения 151 (25,06 мг, выход 6,7%).
Пример B88
Получение соединения 152 и соединения 153
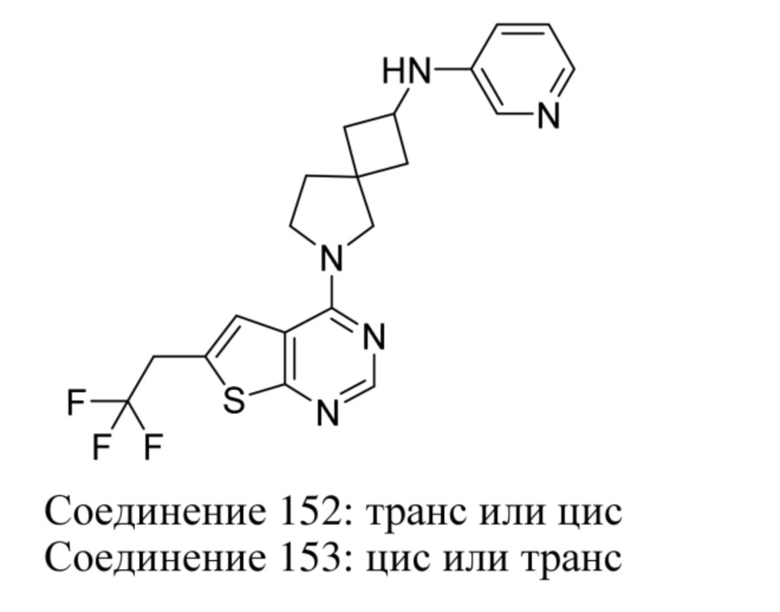
В раствор промежуточного соединения 3 (300 мг, 0,88 ммоль, соль TFA) в 1,4-диоксане (3 мл) в атмосфере Ar при комнатной температуре добавляли 3-бромпиридин (№ по CAS: 626-55-1) (158 мг, 1,0 ммоль), t-BuONa (192 мг, 2,00 ммоль), BrettPhos (48 мг, 0,09 ммоль) и Pd2(dba)3 (82 мг, 0,09 ммоль). Реакционную смесь перемешивали в атмосфере Ar при 110°C в течение 12 ч. Реакционную смесь охлаждали до комнатной температуры, разбавляли водой и экстрагировали с помощью EtOAc (10 мл × 3). Объединенные органические экстракты промывали солевым раствором (25 мл × 2), высушивали над безводным Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% TFA/H2O, B: ACN) с получением необходимого продукта (смеси цис- и транс-изомеров). Полученный продукт разделяли с помощью SFC (SFC80, Waters; OJ, 2,5 × 25 см, 10 мкм; A: сверхкритический CO2, подвижная фаза B: EtOH/ACN=85/15; A:B=60/40; расход: 70 мл/мин; температура колонки (T): 25°C; BPR: 100 бар) с получением соединения 152 (транс или цис) (8,8 мг, выход 2,3%) и соединения 153 (цис или транс) (19,8 мг, выход 5,3%).
Пример B89
Получение соединения 154 и соединения 155
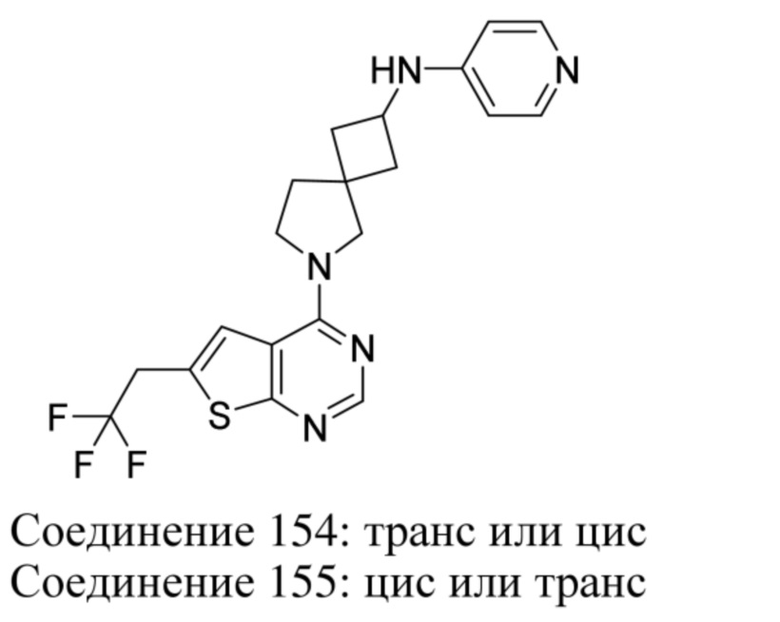
В раствор промежуточного соединения 3 (300 мг, 0,88 ммоль, соль TFA) в 1,4-диоксане (3 мл) в атмосфере Ar при комнатной температуре добавляли 4-бромпиридин (№ по CAS: 1120-87-2) (157 мг, 1,0 ммоль), t-BuONa (192 мг, 2,00 ммоль), BrettPhos (48 мг, 0,09 ммоль) и Pd2(dba)3 (82 мг, 0,09 ммоль). Реакционную смесь перемешивали в атмосфере Ar при 110°C в течение 12 ч. Реакционную смесь охлаждали до комнатной температуры, выливали в воду (10 мл) и экстрагировали с помощью EtOAc (20 мл × 3). Объединенные органические экстракты промывали солевым раствором (50 мл × 2), высушивали над безводным Na2SO4, фильтровали и фильтрат концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% TFA/H2O, B: ACN) с получением необходимого продукта (смеси цис- и транс-изомеров). Полученный продукт разделяли с помощью SFC (SFC80, Waters; OJ, 2,5 × 25 см, 10 мкм; A: сверхкритический CO2, подвижная фаза B: EtOH/ACN=85/15; A:B=60/40; расход: 80 мл/мин; температура колонки (T): 25°C; BPR: 100 бар) с получением соединения 154 (транс или цис) (14,19 мг, выход 3,8%) и соединения 155 (цис или транс) (14,95 мг, выход 4,0%).
Пример B90
Получение соединения 156
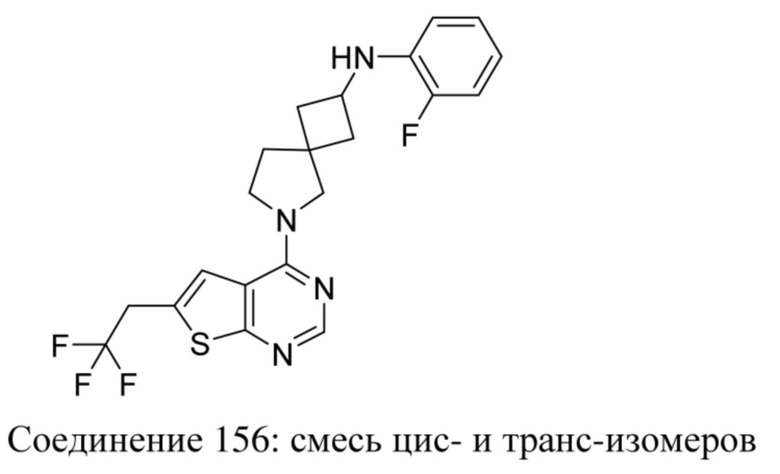
В раствор промежуточного соединения 3 (300 мг, 0,88 ммоль, соль TFA) в 1,4-диоксане (3 мл) в атмосфере Ar при комнатной температуре добавляли 1-бром-2-фторбензол (№ по CAS: 1072-85-1) (175 мг, 1,0 ммоль), t-BuONa (192 мг, 2,00 ммоль), BrettPhos (48 мг, 0,09 ммоль) и Pd2(dba)3 (82 мг, 0,09 ммоль). Реакционную смесь перемешивали в атмосфере Ar при 130°C в течение 12 ч. Реакционную смесь охлаждали до комнатной температуры, разбавляли водой (20 мл) и экстрагировали с помощью EtOAc (20 мл × 3). Объединенные органические экстракты промывали солевым раствором (10 мл × 2), высушивали над безводным Na2SO4, фильтровали и фильтрат концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% NH3/H2O, B: ACN) с получением соединения 156 (смеси цис- и транс-изомеров) (65,00 мг, выход 97%).
Пример B91
Получение соединения 157
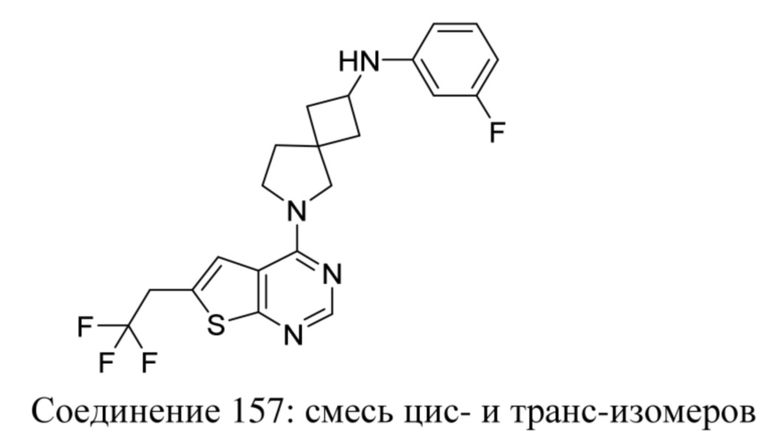
В раствор промежуточного соединения 3 (300 мг, 0,88 ммоль, соль TFA) в 1,4-диоксане (3 мл) в атмосфере Ar при комнатной температуре добавляли 1-бром-3-фторбензол (№ по CAS: 1073-06-9) (175 мг, 1,0 ммоль), t-BuONa (192 мг, 2,00 ммоль), BrettPhos (48 мг, 0,09 ммоль) и Pd2(dba)3 (82 мг, 0,09 ммоль). Реакционную смесь перемешивали в атмосфере Ar при 110°C в течение 2 ч. Реакционную смесь охлаждали до комнатной температуры, выливали в воду (50 мл) и экстрагировали с помощью EtOAc (50 мл × 3). Объединенные органические экстракты промывали солевым раствором (50 мл × 2), высушивали над безводным Na2SO4, фильтровали и фильтрат концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% NH3 H2O, B: ACN) с получением соединения 157 (смеси цис- и транс-изомеров) (45,8 мг, 96%) в виде белого твердого вещества.
Пример B92
Получение соединения 158
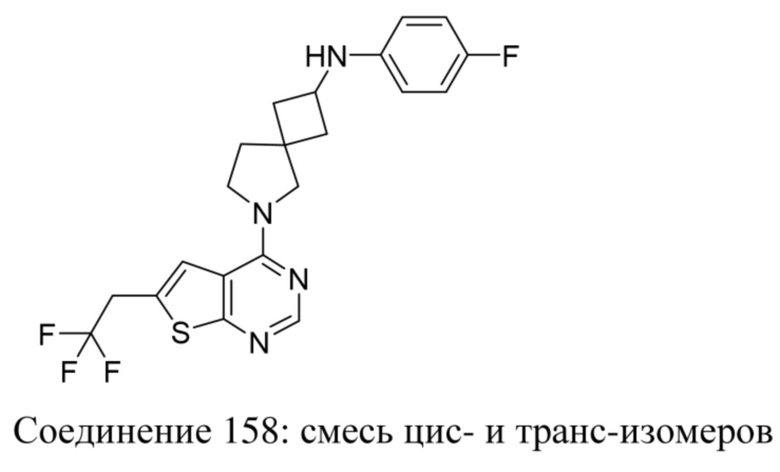
В раствор промежуточного соединения 3 (300 мг, 0,88 ммоль, соль TFA) в 1,4-диоксане (3 мл) в атмосфере Ar при комнатной температуре добавляли 1-бром-4-фторбензол (№ по CAS: 460-00-4) (175 мг, 1,0 ммоль), t-BuONa (192 мг, 2,00 ммоль), BrettPhos (48 мг, 0,09 ммоль) и Pd2(dba)3 (82 мг, 0,09 ммоль). Реакционную смесь перемешивали в атмосфере Ar при 110°C в течение 12 ч. Реакционную смесь охлаждали до комнатной температуры, разбавляли водой (50 мл) и экстрагировали с помощью EtOAc (50 мл × 3). Объединенные органические экстракты промывали солевым раствором (50 мл × 2), высушивали над безводным Na2SO4, фильтровали и фильтрат концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% NH3.H2O, B: ACN) с получением соединения 158 (смеси цис- и транс-изомеров) (58,7 мг, выход 15%).
Пример B93
Получение соединения 159
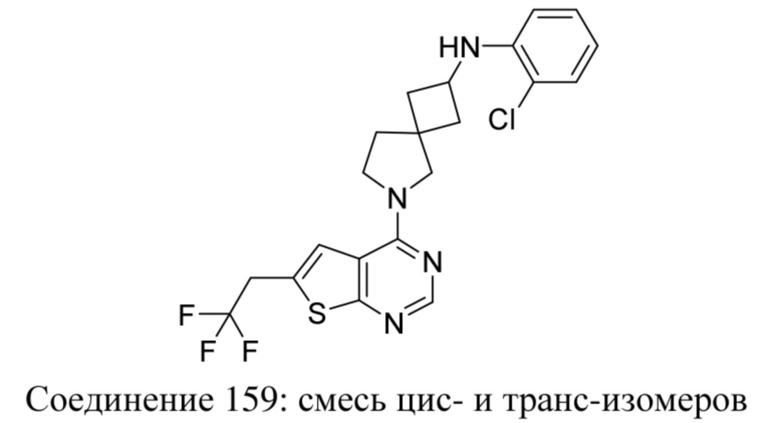
Перемешивали смесь промежуточного соединения 3 (200 мг, 0,584 ммоль, соль TFA), 1-бром-2-хлорбензола (112 мг, 0,584 ммоль), Pd2(dba)3 (53 мг, 0,058 ммоль), BrettPhos (31 мг, 0,058 ммоль) и t-BuONa (168 мг, 1,754 ммоль) в 1,4-диоксане (10 мл) при 120°C в течение 2 ч при микроволновом облучении. Охлажденную реакционную смесь концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением соединения 159 (смеси цис- и транс-изомеров) (46,9 мг, 17%).
Пример B94
Получение соединения 160
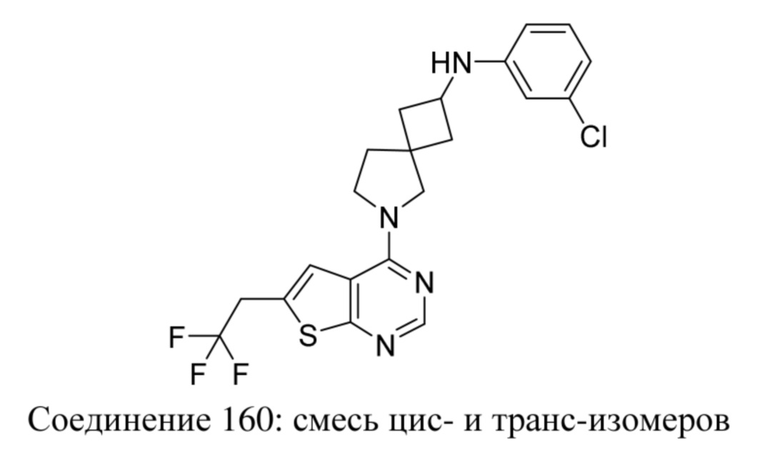
Перемешивали смесь промежуточного соединения 3 (200 мг, 0,584 ммоль, соль TFA), 1-бром-3-хлорбензола (112 мг, 0,584 ммоль), Pd2(dba)3 (53 мг, 0,058 ммоль), BrettPhos (31 мг, 0,058 ммоль) и t-BuONa (168 мг, 1,754 ммоль) в 1,4-диоксане (10 мл) при 120°C в течение 2 ч при микроволновом облучении. Охлажденную реакционную смесь концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением соединения 160 (смеси цис- и транс-изомеров) (53,8 мг, выход 20%).
Пример B95
Получение соединения 161
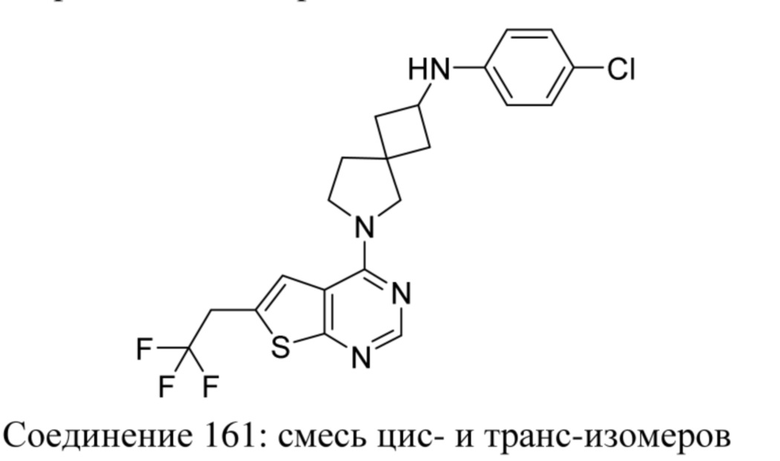
Перемешивали смесь промежуточного соединения 3 (300 мг, 0,877 ммоль, соль TFA), 1-бром-4-хлорбензола (№ по CAS: 106-39-8) (168 мг, 0,877 ммоль), Pd2(dba)3 (80 мг, 0,088 ммоль), Brettphos (47 мг, 0,088 ммоль) и K2CO3 (363 мг, 2,631 ммоль) в 1,4-диоксане (10 мл) в атмосфере Ar при 80°C в течение ночи. Охлажденную реакционную смесь концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением соединения 161 (смеси цис- и транс-изомеров) (39,7 мг, выход 10%).
Пример B96
Получение соединения 162
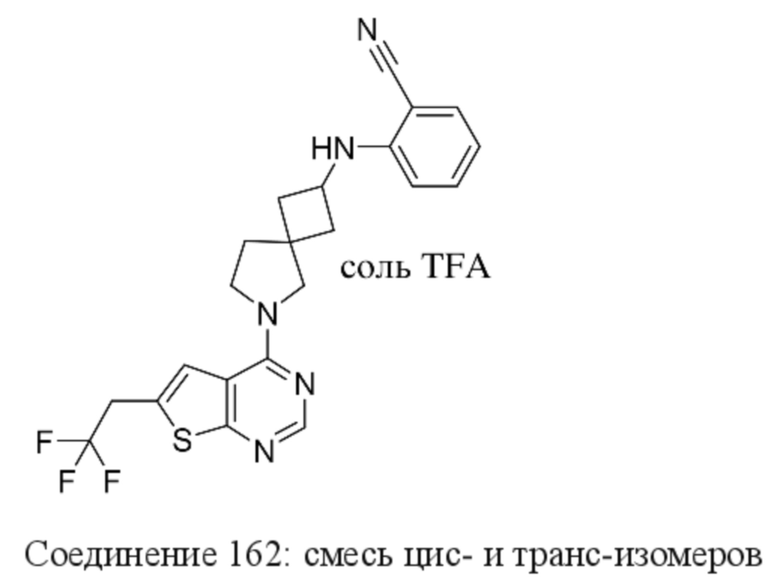
В раствор промежуточного соединения 3 (220 мг, 0,64 ммоль, соль TFA) в 1,4-диоксане (2 мл) в пробирке для микроволновой обработки добавляли 2-бромбензонитрил (№ по CAS: 2042-37-7) (351 мг, 1,93 ммоль), Cs2CO3 (629 мг, 1,93 ммоль), BrettPhos (34 мг, 0,06 ммоль) и Pd2(dba)3 (59 мг, 0,06 ммоль). Реакционную смесь барботировали с помощью Ar и затем реакционную смесь перемешивали при 100°C в течение 2 ч при микроволновом облучении. Охлажденную реакционную смесь разбавляли водой (20 мл) и экстрагировали с помощью EtOAc (20 мл × 3). Объединенные органические экстракты промывали водой (20 мл × 3), высушивали над безводным Na2SO4, фильтровали и фильтрат концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% TFA), B: ACN) с получением соединения 162 (смеси цис- и транс-изомеров) (72 мг, соль TFA, выход 25%).
Пример B97
Получение соединения 163
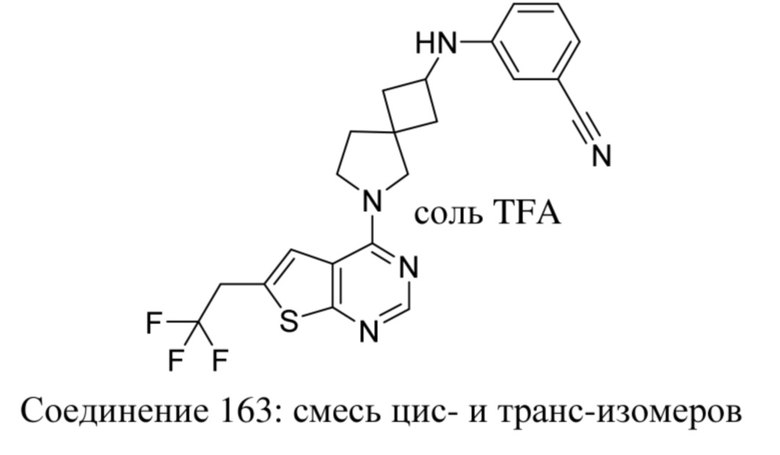
В раствор промежуточного соединения 3 (200 мг, 0,584 ммоль, соль TFA) в 1,4-диоксане (2 мл) в пробирке для микроволновой обработки добавляли 3-бромбензонитрил (№ по CAS: 6952-59-6) (319 мг, 1,75 ммоль), Cs2CO3 (572 мг, 1,75 ммоль), BrettPhos (50 мг, 0,06 ммоль) и Pd2(dba)3 (50 мг, 0,09 ммоль). Реакционную смесь барботировали с помощью Ar и затем реакционную смесь перемешивали при 100°C в течение 2 ч при микроволновом облучении. Охлажденную реакционную смесь разбавляли водой (20 мл) и экстрагировали с помощью EtOAc (20 мл × 3). Объединенные органические экстракты промывали водой (20 мл × 3), высушивали над безводным Na2SO4, фильтровали и фильтрат концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% TFA), B: ACN) с получением соединения 163 (смеси цис- и транс-изомеров) (206 мг, соль TFA, выход 63%).
Пример B98
Получение соединения 164
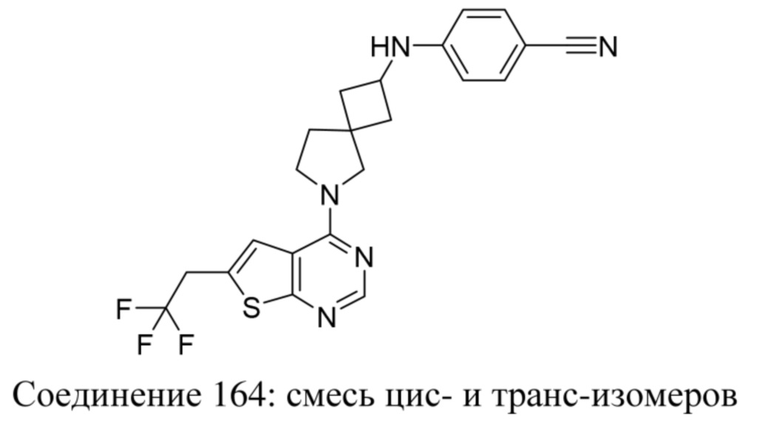
В раствор промежуточного соединения 3 (300 мг, 0,88 ммоль, соль TFA) в 1,4-диоксане (3 мл) в атмосфере Ar при комнатной температуре добавляли 4-бромбензонитрил (№ по CAS: 623-00-7) (479 мг, 2,63 ммоль), Cs2CO3 (858 мг, 2,63 ммоль), BrettPhos (75 мг, 0,08 ммоль) и Pd2(dba)3 (76 мг, 0,14 ммоль). Реакционную смесь перемешивали в атмосфере Ar при 80°C в течение 2 ч. Охлажденную реакционную смесь разбавляли водой (30 мл) и экстрагировали с помощью EtOAc (30 мл × 3). Объединенные органические экстракты промывали водой (30 мл × 3), высушивали над безводным Na2SO4, фильтровали и фильтрат концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением соединения 164 (смеси цис- и транс-изомеров) (266 мг, выход 68%).
Пример B99
Получение соединения 165
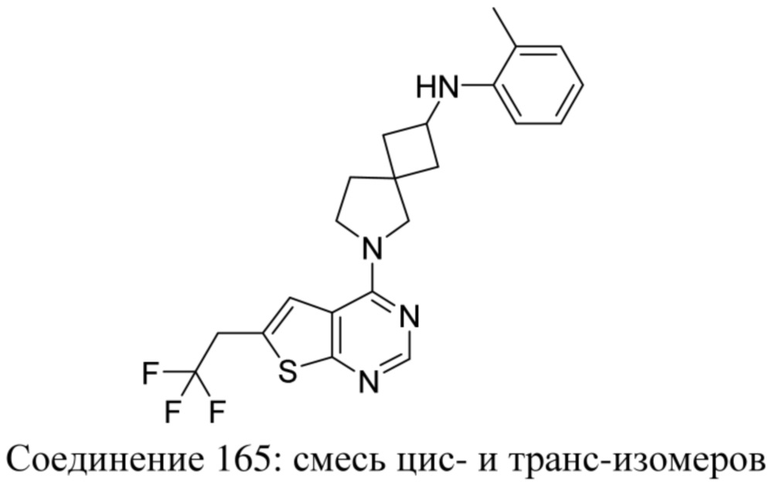
Перемешивали смесь промежуточного соединения 3 (200 мг, 0,58 ммоль, соль TFA), 1-бром-2-метилбензола (№ по CAS: 95-46-5) (300 мг, 1,75 ммоль), Pd2(dba)3 (30 мг), BrettPhos (30 мг) и t-BuONa (168 мг, 1,75 ммоль) в 1,4-диоксане (5 мл) при 110°C в течение 2 ч при микроволновом облучении. Охлажденную реакционную смесь разбавляли водой и экстрагировали с помощью EtOAc (50 мл × 3). Объединенные органические экстракты промывали солевым раствором, высушивали над безводным Na2SO4, фильтровали и фильтрат концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 20 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением соединения 165 (смеси цис- и транс-изомеров) (33,3 мг, выход 13%) в виде белого твердого вещества.
Пример B100
Получение соединения 166
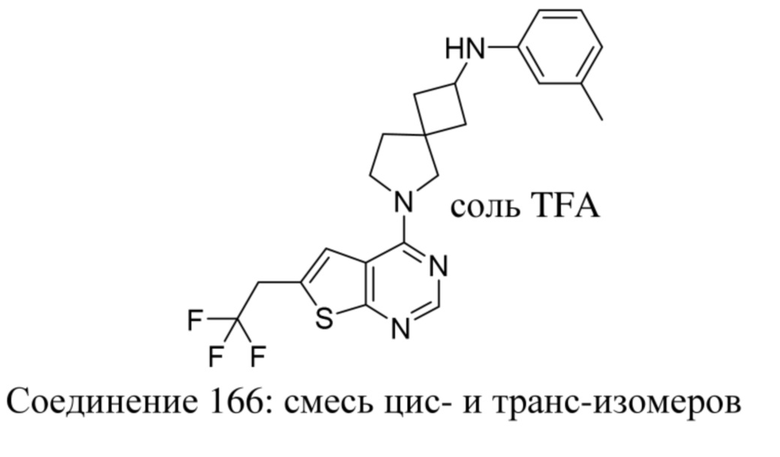
Перемешивали смесь промежуточного соединения 3 (200 мг, 0,584 ммоль, соль TFA), 1-бром-3-метилбензола (№ по CAS: 591-17-3) (300 мг, 1,75 ммоль), Pd2(dba)3 (30 мг), BrettPhos (30 мг) и t-BuONa (168 мг, 1,75 ммоль) в 1,4-диоксане (5 мл) при 110°C в течение 2 ч при микроволновом облучении. Охлажденную реакционную смесь разбавляли водой и экстрагировали с помощью EtOAc (50 мл × 3). Объединенные органические экстракты промывали солевым раствором, высушивали над безводным Na2SO4, фильтровали и фильтрат концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Prep C18 OBD 19 × 250 мм, 10 мкм, подвижная фаза A: H2O (0,1% TFA), B: ACN) с получением соединения 166 (смеси цис- и транс-изомеров) (101,0 мг, соль TFA, выход 31%) в виде бесцветного масла.
Пример B101
Получение соединения 167
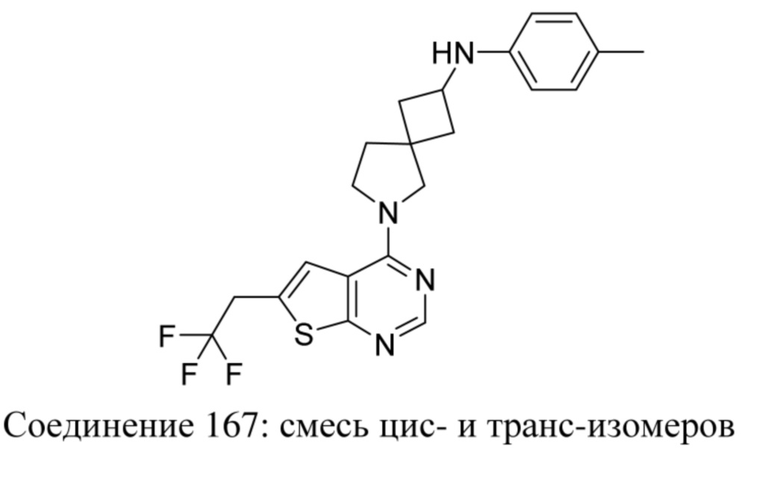
Перемешивали смесь промежуточного соединения 3 (200 мг, 0,58 ммоль, соль TFA), 1-бром-4-метилбензола (№ по CAS: 106-38-7) (300 мг, 1,75 ммоль), Pd2(dba)3 (30 мг), BrettPhos (30 мг) и t-BuONa (168 мг, 1,75 ммоль) в 1,4-диоксане (5 мл) при 110°C в течение 2 ч при микроволновом облучении. Реакционную смесь разбавляли водой и экстрагировали с помощью EA (50 мл × 3). Охлажденную реакционную смесь разбавляли водой и экстрагировали с помощью EtOAc (50 мл × 3). Объединенные органические экстракты промывали солевым раствором, высушивали над безводным Na2SO4, фильтровали и фильтрат концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 20 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением соединения 167 (смеси цис- и транс-изомеров) (45,9 мг, выход 18%) в виде белого твердого вещества.
Пример B102
Получение соединения 168
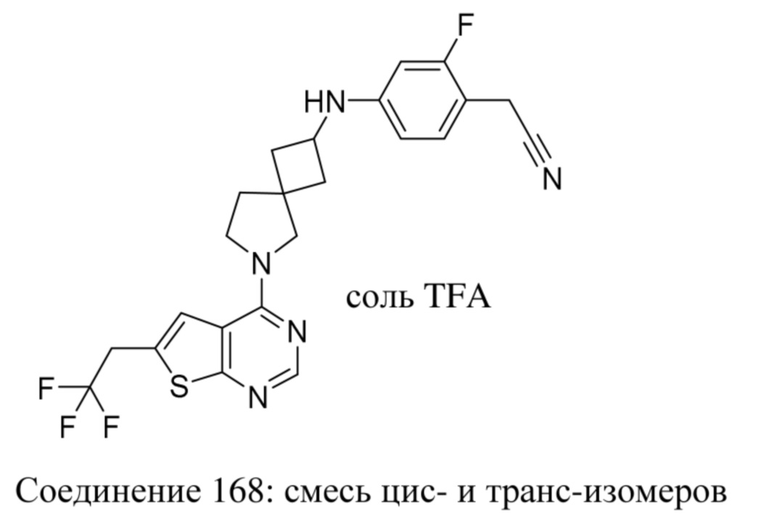
В раствор промежуточного соединения 3 (200 мг, 0,584 ммоль, соль TFA) в 1,4-диоксане (2 мл) в пробирке для микроволновой обработки добавляли 2-(4-бром-2-фторфенил)ацетонитрил (№ по CAS: 114897-91-5) (250 мг, 1,170 ммоль), t-BuONa (168 мг, 1,775 ммоль), BrettPhos (30 мг, 0,056 ммоль) и Pd2(dba)3 (53 мг, 0,056 ммоль). Полученную смесь барботировали с помощью Ar и реакционную смесь перемешивали при 140°C в течение 2 ч при микроволновом облучении. Охлажденную реакционную смесь разбавляли водой и экстрагировали с помощью EtOAc (100 мл × 3). Объединенные органические экстракты промывали солевым раствором (50 мл × 2), высушивали над безводным Na2SO4, фильтровали и фильтрат концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% TFA/H2O, B: ACN) с получением соединения 168 (смеси цис- и транс-изомеров) (9,5 мг, соль TFA, выход 2,7%).
Пример B103
Получение соединения 169 и соединения 170
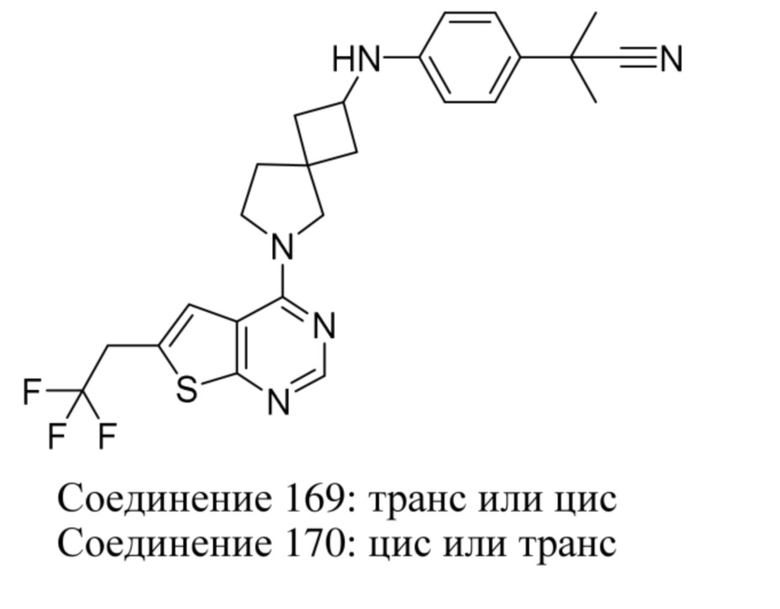
Перемешивали смесь промежуточного соединения 3 (300 мг, 0,877 ммоль, соль TFA), 2-(4-бромфенил)-2-метилпропаннитрила (№ по CAS: 101184-73-0) (196 мг, 0,877 ммоль), Pd2(dba)3 (80 мг, 0,087 ммоль), BrettPhos (47 мг, 0,087 ммоль) и K2CO3 (363 мг, 2,632 ммоль) в 1,4-диоксане (10 мл) при 100°C в течение 2 ч при микроволновом облучении. Охлажденную реакционную смесь концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением необходимого продукта (смеси цис- и транс-изомеров) (90 мг). Полученный продукт разделяли с помощью SFC (SFC80, Waters; OD-H, 2,5 × 25 см, 10 мкм; A: сверхкритический CO2, подвижная фаза B: MeOH=100; A:B=70/30; расход: 60 мл/мин; температура колонки (T): 25°C; противодавление (BPR): 100 бар) с получением соединения 169 (23,6 мг, выход 11%) и соединения 170 (цис или транс) (39,1 мг, выход 18%).
Пример B104
Получение соединения 171 и соединения 172

Перемешивали смесь промежуточного соединения 3 (300 мг, 0,877 ммоль, соль TFA), 1-(4-бромфенил)циклопропанкарбонитрила (№ по CAS: 124276-67-1) (195 мг, 0,877 ммоль), Pd2(dba)3 (80 мг, 0,087 ммоль), BrettPhos (47 мг, 0,087 ммоль) и K2CO3 (363 мг, 2,631 ммоль) в 1,4-диоксане (5 мл) в атмосфере Ar при 70°C в течение 12 ч. Охлажденную реакционную смесь концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением необходимого продукта (смеси цис- и транс-изомеров) (188 мг). Полученный продукт разделяли с помощью SFC (SFC80, Waters; OD-H, 2,5 × 25 см, 10 мкм; A: сверхкритический CO2, подвижная фаза B: MeOH=100; A:B=67/33; расход: 70 г/мин; температура колонки (T): 25°C; противодавление (BPR): 100 бар) с получением соединения 171 (транс или цис) (36,7 мг, выход 17%) и соединения 172 (цис или транс) (23,3 мг, выход 11%).
Пример B105
Получение соединения 173
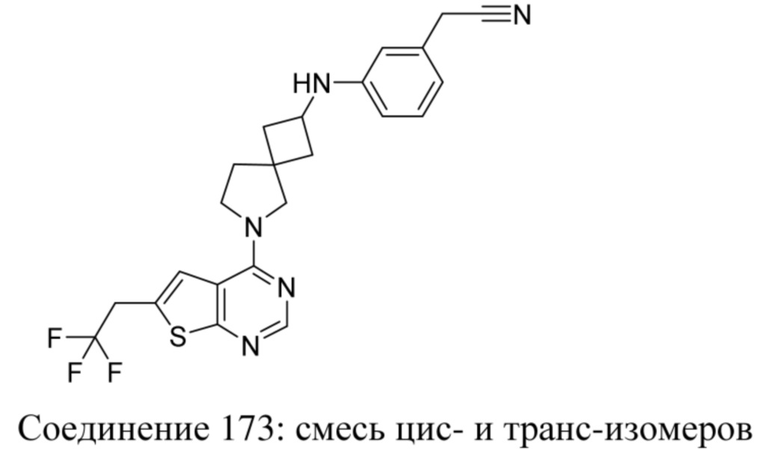
В раствор промежуточного соединения 3 (200 мг, 0,584 ммоль, соль TFA) в 1,4-диоксане (2 мл) в закрываемом сосуде при комнатной температуре добавляли 2-(3-бромфенил)ацетонитрил (№ по CAS: 31938-07-5) (230 мг, 1,170 ммоль), t-BuONa (168 мг, 1,775 ммоль), BrettPhos (30 мг, 0,056 ммоль) и Pd2(dba)3 (53 мг, 0,056 ммоль). Сосуд барботировали с помощью Ar, закрывали и реакционную смесь перемешивали при 130°C в течение ночи. Охлажденную реакционную смесь разбавляли водой и экстрагировали с помощью EtOAc (100 мл × 3). Объединенные органические экстракты промывали солевым раствором (50 мл × 2), высушивали над безводным Na2SO4, фильтровали и фильтрат концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 20 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH3.H2O), B: ACN) с получением соединения 173 (смеси цис- и транс-изомеров) (9,9 мг, выход 3,7%).
Пример B106
Получение соединения 174 и соединения 175
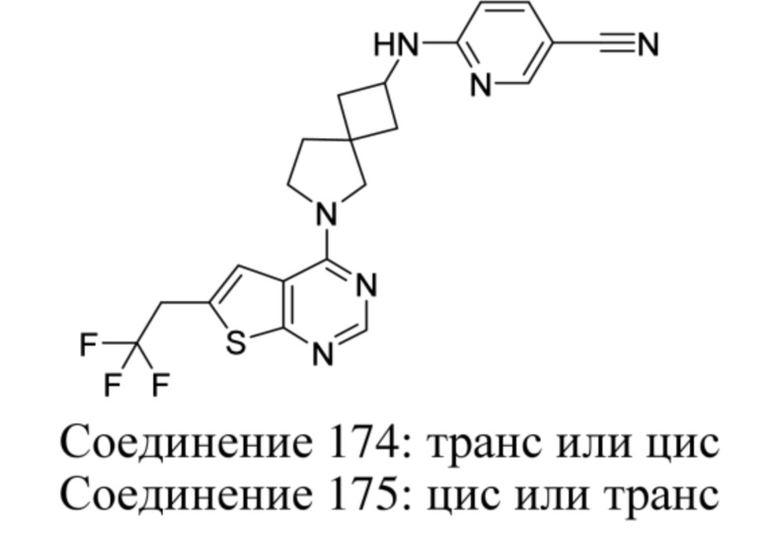
Перемешивали смесь промежуточного соединения 3 (300 мг, 0,876 ммоль, соль TFA), 5-циано-2-фторпиридина (№ по CAS: 3939-12-6) (107 мг, 0,88 ммоль) и DIPEA (341 мг, 2,64 ммоль) в i-PrOH (10 мл) при 90°C в течение 16 ч. Охлажденную реакционную смесь концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% TFA/H2O, B: ACN) с получением необходимого продукта (смеси цис- и транс-изомеров). Полученный продукт разделяли с помощью SFC (SFC80, Waters; AD-H, 2,5 × 25 см, 10 мкм; A: сверхкритический CO2, подвижная фаза B: MeOH; A:B=60/40; расход: 60 мл/мин; температура колонки (T): 25°C; противодавление (BPR): 100 бар) с получением соединения 174 (транс или цис) (58 мг, выход 14%) в виде белого твердого вещества и соединения 175 (цис или транс) (55 мг, выход 14%) в виде белого твердого вещества.
Пример B107
Получение соединения 176
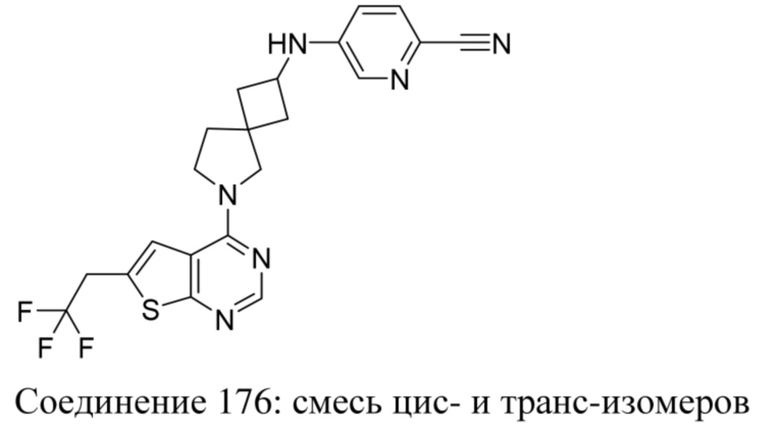
Перемешивали смесь промежуточного соединения 3 (300 мг, 0,88 ммоль, соль TFA), 2-циано-5-фторпиридина (№ по CAS: 327056-62-2) (107 мг, 0,88 ммоль) и DIPEA (341 мг, 2,64 ммоль) в n-BuOH (10 мл) при 120°C в течение 16 ч Охлажденную реакционную смесь концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% TFA/H2O, B: ACN). Повышали основность фракций с помощью NaHCO3 (твердое вещество), их экстрагировали с помощью EtOAc (30 мл × 3). Объединенные органические экстракты промывали солевым раствором (20 мл × 2), высушивали над безводным Na2SO4, фильтровали и фильтрат концентрировали. Остаток лиофилизировали с получением соединения 176 (смеси цис- и транс-изомеров) (55 мг, выход 14%) в виде белого твердого вещества.
Пример B108
Получение соединения 177
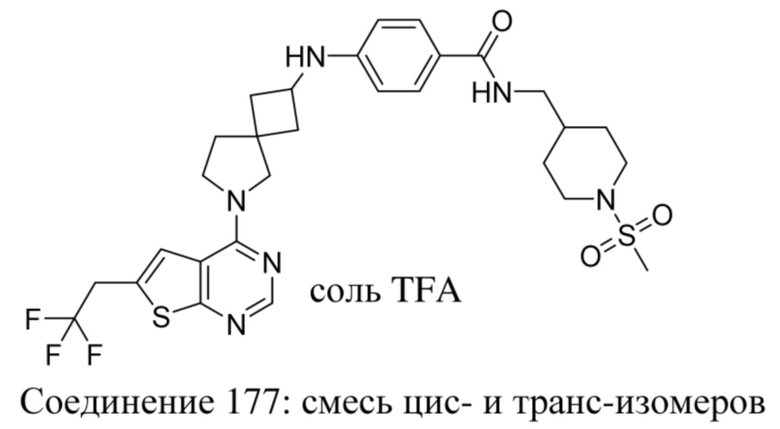
В перемешиваемый раствор промежуточного соединения 101 (152 мг, неочищенная соль TFA, примерно 0,27 ммоль) в DCM (2 мл) добавляли Et3N (110 мг, 1,09 ммоль). Полученную смесь охлаждали с помощью ледяной бани и медленно добавляли метансульфонилхлорид (38 мг, 0,33 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч Реакционную смесь концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% TFA), B: ACN) с получением соединения 177 (смеси цис- и транс-изомеров) (23 мг, соль TFA, выход 13%) в виде белого твердого вещества.
Пример B109
Получение соединения 178 и соединения 179
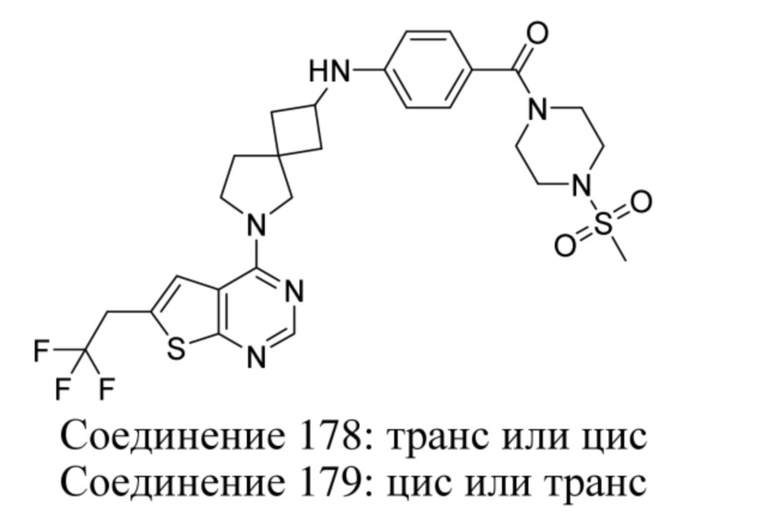
Перемешивали раствор промежуточного соединения 35 (400 мг, 0,86 ммоль), DIPEA (210 мг, 1,7 ммоль), 1-(метилсульфонил)пиперазина (№ по CAS: 55276-43-2) (200 мг, 1,2 ммоль) и HATU (460 мг, 1,2 ммоль) в DMF (5 мл) при комнатной температуре в течение ночи. Неочищенный продукт непосредственно очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением необходимого продукта (смеси цис- и транс-изомеров) (90 мг). Полученный продукт разделяли с помощью SFC (SFC80, Waters, AS-H, 2,5 × 25 см, 10 мкм, A: сверхкритический CO2, B: MeOH/0,1% NH3; A:B=65/35; расход: 50 мл/мин ; температура колонки (T): 25°C; BPR: 100 бар) с получением соединения 178 (транс или цис) (20 мг, выход 3,8%) в виде белого твердого вещества и соединения 179 (цис или транс) (70 мг, выход 13%) в виде белого твердого вещества.
Пример B110
Получение соединения 180
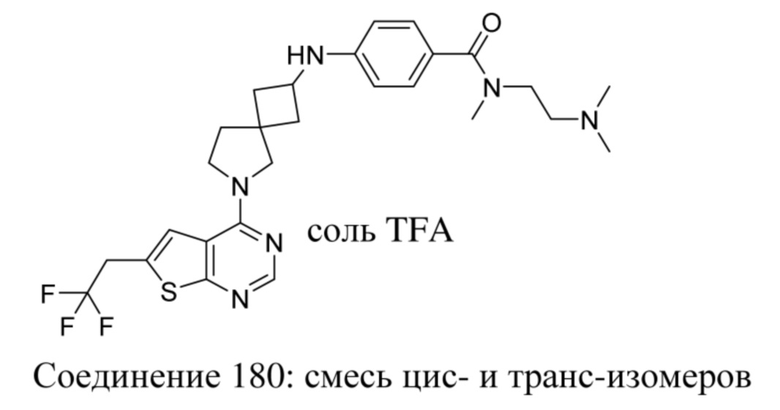
В перемешиваемый раствор промежуточного соединения 35 (150 мг, 0,32 ммоль) в THF (2 мл) добавляли N, N,N'-триметилэтилендиамин (№ по CAS: 142-25-6) (50 мг, 0,49 ммоль), HOBt (66 мг, 0,49 ммоль), EDCI (93 мг, 0,49 ммоль) и Et3N (49 мг, 0,49 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% TFA), B: ACN) с получением соединения 180 (смеси цис- и транс-изомеров) (65 мг, соль TFA, выход 36%) в виде белого твердого вещества.
Пример B111
Получение соединения 181 и соединения 182
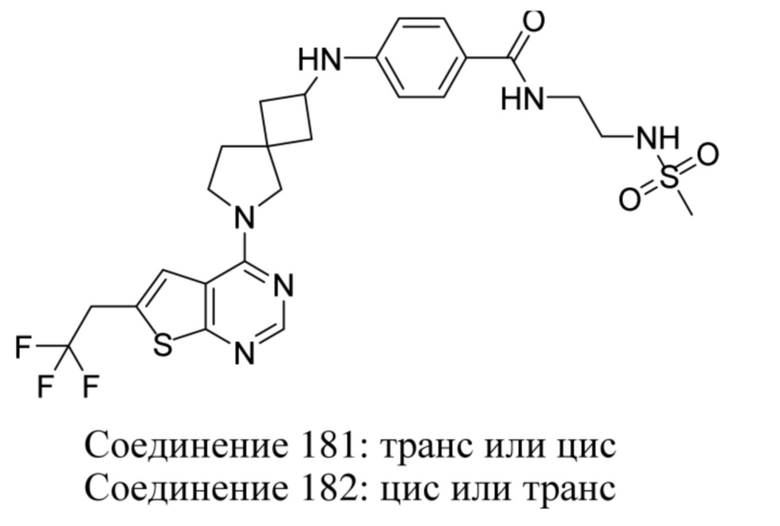
В перемешиваемый раствор промежуточного соединения 35 (300 мг, 0,65 ммоль) и N-(2-аминоэтил)метансульфонамида (№ по CAS: 83019-89-0) (180 мг, 1,3 ммоль) в DMF (5 мл) добавляли HATU (246 мг, 0,65 ммоль) и DIPEA (251 мг, 1,95 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Полученную смесь непосредственно очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением необходимого продукта (смеси цис- и транс-изомеров) (60 мг, выход 13%) в виде белого твердого вещества. Полученный продукт разделяли с помощью SFC (условие разделения: колонка: AD-H Daicel Chemical Industries, Ltd, 250 × 30 мм I.D., 5 мкм; подвижная фаза A: сверхкритический CO2, подвижная фаза B: EtOH (0,1% DEA) = 60/40, при 50 мл/мин; длина волны детектора: 254 нм; температура колонки: 25°C) с получением соединения 181 (транс или цис) (17,8 мг, выход 4,7%) в виде белого твердого вещества и соединения 182 (цис или транс) (13,5 мг, выход 3,6%) в виде белого твердого вещества.
Пример B112
Получение соединения 183 и соединения 184
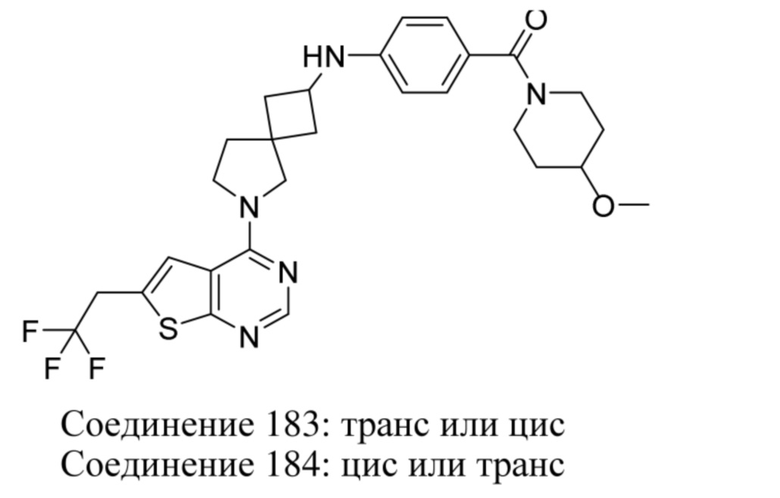
В перемешиваемый раствор промежуточного соединения 35 (300 мг, 0,65 ммоль) и 4-метоксипиперидина (№ по CAS: 4045-24-3) (150 мг, 1,3 ммоль) в DMF (5 мл) добавляли HATU (246 мг, 0,65 ммоль) и DIPEA (251 мг, 1,95 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Полученную смесь непосредственно очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением необходимого продукта (смеси цис- и транс-изомеров) (122 мг, выход 32%) в виде желтого масла. Полученный продукт разделяли с помощью SFC (SFC80, Waters; OJ-H (2,5 × 25 см, 10 мкм); A: сверхкритический CO2, подвижная фаза B: MeOH; A:B=80/20; расход: 60 мл/мин; температура колонки (T): 25°C; противодавление (BPR): 100 бар) с получением соединения 183 (транс или цис) (63,7 мг, выход 17%) в виде белого твердого вещества и соединения 184 (цис или транс) (36,7 мг, выход 10%) в виде белого твердого вещества.
Пример B113
Получение соединения 185 и соединения 186
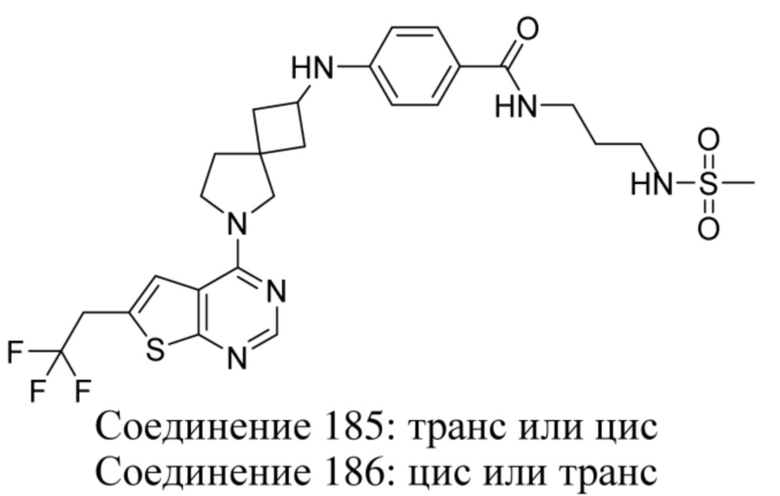
В перемешиваемый раствор промежуточного соединения 35 (300 мг, 0,65 ммоль) и N-(3-аминопропил)метансульфонамида (№ по CAS: 88334-76-3) (197 мг, 1,3 ммоль) в DMF (5 мл) добавляли HATU (246 мг, 0,65 ммоль) и DIPEA (251 мг, 1,95 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 ч. Полученную смесь непосредственно очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением необходимого продукта (смеси цис- и транс-изомеров) (100 мг, выход 26%) в виде желтого масла. Полученный продукт разделяли с помощью SFC (условие разделения: колонка: AD-H Daicel Chemical Industries, Ltd, 250 × 30 мм I.D., 5 мкм; подвижная фаза A: сверхкритический CO2, подвижная фаза B: EtOH (0,1% DEA) = 60/40, при 50 мл/мин; длина волны детектора: 254 нм; температура колонки: 25°C) с получением соединения 185 (транс или цис) (40,6 мг, выход 11%) в виде белого твердого вещества и соединения 186 (цис или транс) (12,2 мг, выход 3,2%) в виде белого твердого вещества.
Пример B114
Получение соединения 187 и соединения 188
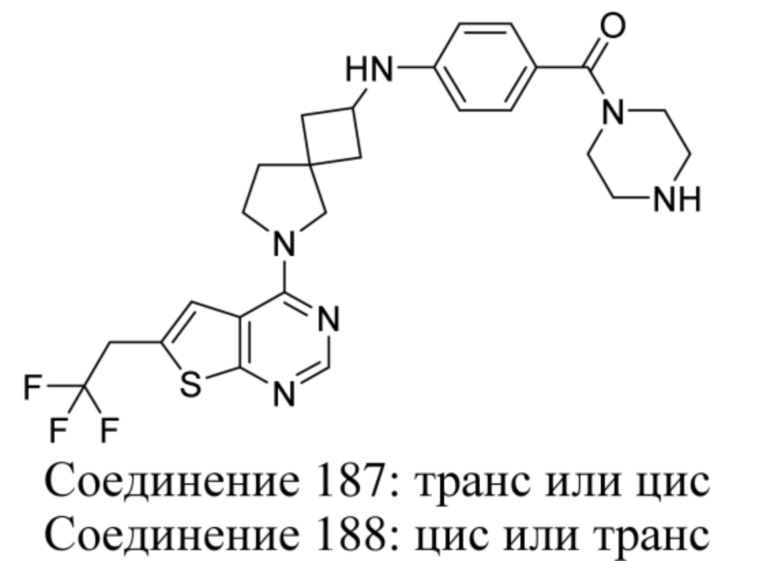
Перемешивали раствор промежуточного соединения 102 (279 мг, 0,44 ммоль) в HCl/MeOH (3 М) (3 мл) при комнатной температуре в течение 16 ч Растворитель удаляли путем концентрирования. Остаток суспендировали в H2O (50 мл) и повышали основность полученного с помощью насыщенного водного раствора NaHCO3, пока значение pH не становилось равным 8. Полученное вещество экстрагировали с помощью EtOAc (50 мл × 3). Объединенные органические экстракты высушивали над безводным Na2SO4, фильтровали и фильтрат концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% TFA/H2O, B: ACN) с получением необходимого продукта (смеси цис- и транс-изомеров) в виде желтого масла (61 мг). Полученный продукт разделяли с помощью SFC (SFC80, Waters; AD-H, 2,5 × 25 см, 10 мкм; A: сверхкритический CO2, подвижная фаза B: EtOH/ACN=85/15; A:B=60/40; расход: 50 мл/мин ; температура колонки (T): 25°C; противодавление (BPR): 100 бар) с получением соединения 187 (транс или цис) (18,9 мг, выход 8,0%) в виде светло-желтого твердого вещества и соединения 188 (цис или транс) (2,0 мг, выход 0,86%) в виде желтого масла.
Пример B115
Получение соединения 189 и соединения 190
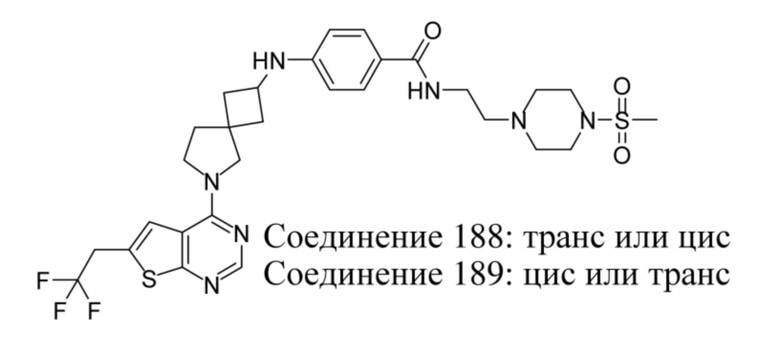
В суспензию промежуточного соединения 104 (600 мг, неочищенная соль HCl, примерно 0,89 ммоль) и Et3N (2 мл) в DCM (4 мл) при 0°C добавляли по каплям метансульфонилхлорид (2 мл). Полученную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь концентрировали при пониженном давлении. Остаток очищали с помощью преп. TLC (DCM/MeOH=15:1, об./об.) с получением необходимого продукта (смеси цис- и транс-изомеров). Полученный продукт разделяли с помощью SFC (SFC80, Waters, OD-H (2,5 × 25 см, 10 мкм) A: сверхкритический CO2, B: MeOH (0,1% NH3); A:B=65/35; расход: 50 мл/мин; температура колонки (T): 25°C; BPR: 100 бар) с получением соединения 189 (транс или цис) (9,6 мг, выход 1,6%) и соединения 190 (цис или транс) (72,6 мг, выход 12%).
Пример B116
Получение соединения 191
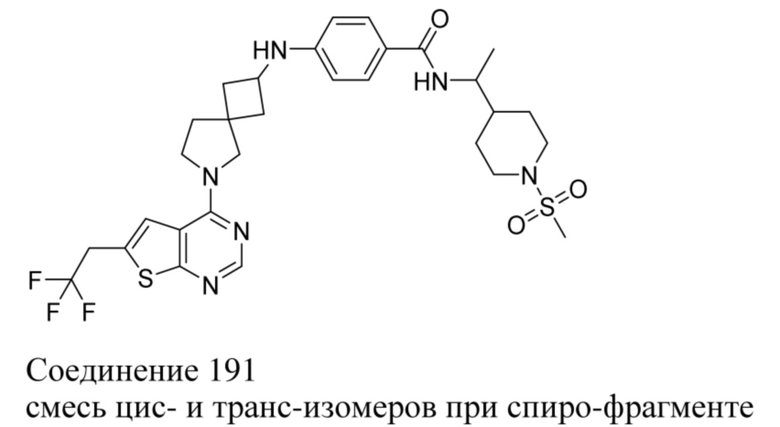
В перемешиваемый раствор промежуточного соединения 106 (100 мг, неочищенная соль HCl, примерно 0,174 ммоль) в DCM (4 мл) при 0°C добавляли метансульфонилхлорид (20 мг, 0,174 ммоль) и DIPEA (0,1 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Полученную смесь концентрировали и остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% NH3.H2O/H2O, B: ACN) с получением соединения 191 (смеси цис- и транс-изомеров при спиро-фрагменте) (75 мг, выход: 66%) в виде белого твердого вещества.
Пример B117
Получение соединения 192
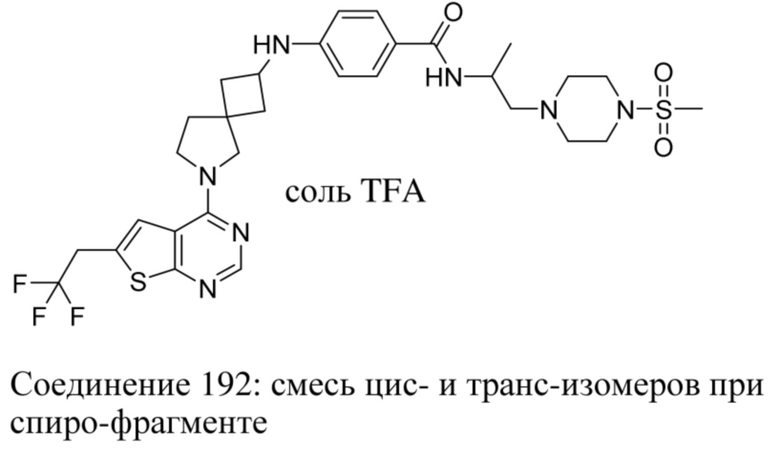
В перемешиваемую смесь промежуточного соединения 108 (190 мг, неочищенная соль HCl, примерно 0,32 ммоль) и Et3N (97 мг, 0,96 ммоль) в DCM (5 мл) при 0°C добавляли метансульфонилхлорид (36 мг, 0,32 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь гасили с помощью воды (20 мл) и экстрагировали с помощью DCM (20 мл × 3). Объединенные органические экстракты промывали солевым раствором, высушивали над безводным Na2SO4, фильтровали и фильтрат концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% TFA/H2O, B: ACN) с получением соединения 192 (смеси цис- и транс-изомеров при спиро-фрагменте) (43,1 мг, соль TFA, выход 12%) в виде белого твердого вещества.
Пример B118
Получение соединения 193
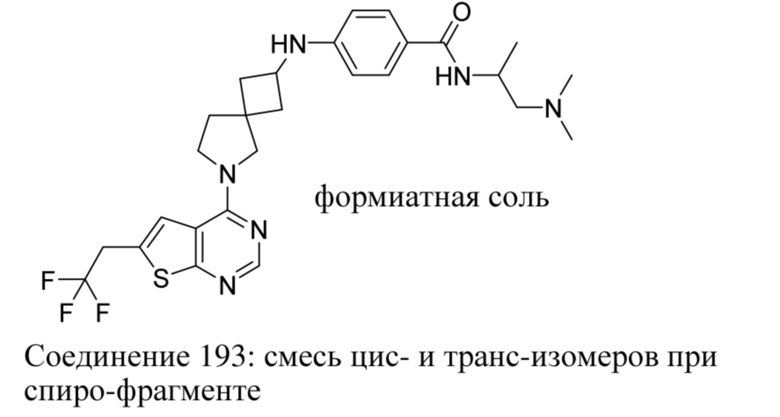
Перемешивали смесь промежуточного соединения 35 (150 мг, 0,32 ммоль), 1-диметиламино-2-пропиламина (№ по CAS: 108-15-6) (40 мг, 0,39 ммоль), EDCI (92 мг, 0,48 ммоль), HOBT (65 мг, 0,48 ммоль) и DIPEA (124 мг, 0,0,96 ммоль) в DMF (2 мл) при комнатной температуре в течение 16 ч. Затем реакционную смесь очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% FA/H2O, B: ACN) с получением соединения 193 (смеси цис- и транс-изомеров при спиро-фрагменте) (43,59 мг, формиатная соль, выход 23%) в виде белого твердого вещества.
Пример B119
Получение соединения 194 и соединения 195
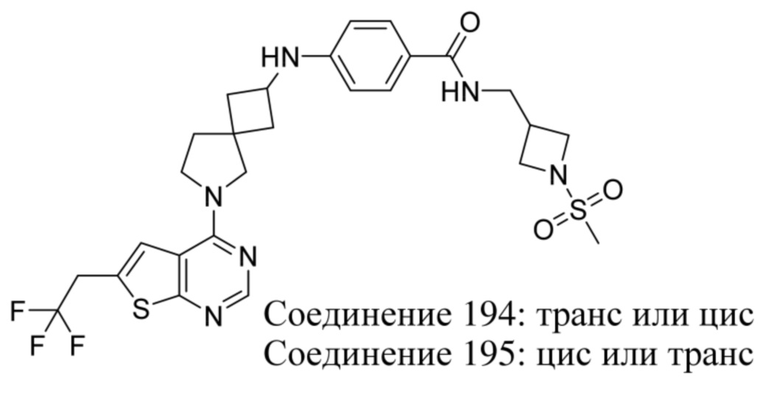
Перемешивали смесь промежуточного соединения 110 (220 мг, 1,341 ммоль), промежуточного соединения 35 (619 мг, 1,341 ммоль), HATU (509 мг, 1,341 ммоль) и Et3N (406 мг, 4,024 ммоль) в THF (10 мл) при комнатной температуре в течение 3 ч и концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением необходимого продукта (смеси цис- и транс-изомеров) (200 мг). Полученный продукт разделяли с помощью SFC (SFC80, Waters; AD-H (2,5 × 25 см, 10 мкм); A: сверхкритический CO2, подвижная фаза B: EtOH/ACN=85/15; A:B=60/40; расход: 50 г/мин ; температура колонки (T): 25°C; противодавление (BPR): 100 бар) с получением соединения 194 (транс или цис) (79,5 мг, выход 19%) и соединения 195 (цис или транс) (21,1 мг, выход 5,1%).
Пример B120
Получение соединения 196
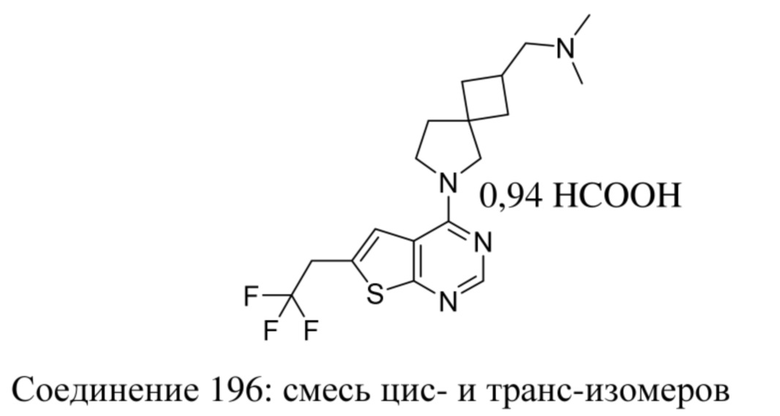
В перемешиваемый раствор неочищенного промежуточного соединения 112 (100 мг, неочищенная соль HCl, примерно 0,627 ммоль) в i-PrOH (6 мл) при комнатной температуре добавляли DIPEA (243 мг, 1,88 ммоль) и 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (№ по CAS: 1628317-85-0) (158 мг, 0,62 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 5 ч. Реакционную смесь выливали в воду (20 мл) и экстрагировали с помощью EtOAc (50 мл × 3). Органическую фазу промывали солевым раствором, высушивали над безводным Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 20 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% FA), B: ACN) с получением соединения 196 (смеси цис- и транс-изомеров) (33,61 мг, 0,94 эквивалента формиатной соли, выход 12% за 3 стадии) (эквиваленты муравьиной кислоты определяли с помощью 1H ЯМР).
Пример B121
Получение соединения 197
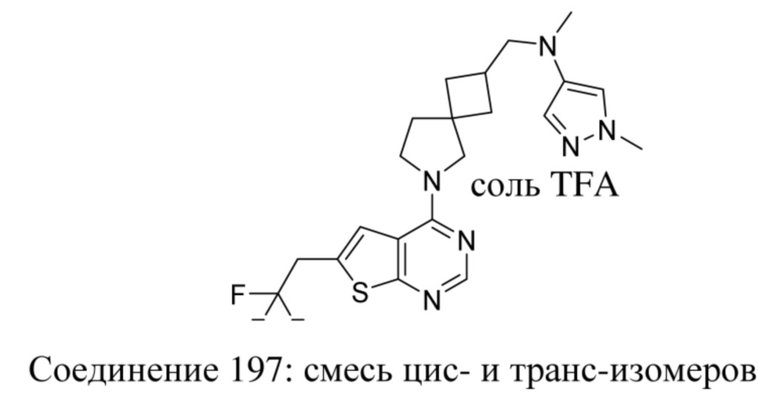
В перемешиваемый раствор промежуточного соединения 114 (160 мг, неочищенная соль TFA, примерно 0,450 ммоль) в i-PrOH (2 мл) при комнатной температуре добавляли 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (№ по CAS: 1628317-85-0) (113 мг, 0,45 ммоль) и DIPEA (290 мг, 2,25 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% TFA), B: ACN) с получением соединения 197 (смеси цис- и транс-изомеров) (132 мг, соль TFA, выход 51% за 3 стадии) в виде белого твердого вещества.
Пример B122
Получение соединения 198
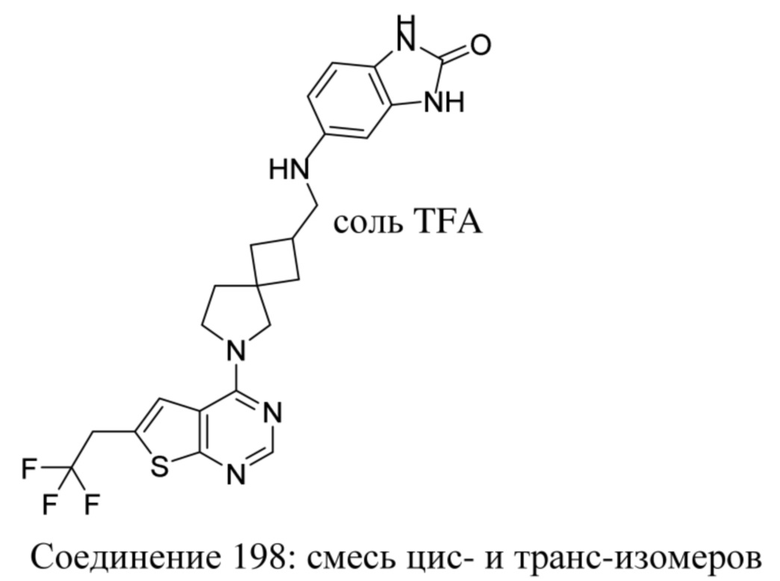
В перемешиваемый раствор промежуточного соединения 116 (250 мг, неочищенная соль HCl, примерно 0,501 ммоль) в i-PrOH (5,0 мл) при комнатной температуре добавляли DIPEA (260 мг, 2,0 ммоль) и 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (№ по CAS: 1628317-85-0) (100 мг, 0,4 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали и остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% TFA), B: ACN) с получением соединения 198 (смеси цис- и транс-изомеров) (71 мг, соль TFA, выход 23% за 3 стадии) в виде белого твердого вещества.
Пример B123
Получение соединения 199 и соединения 200
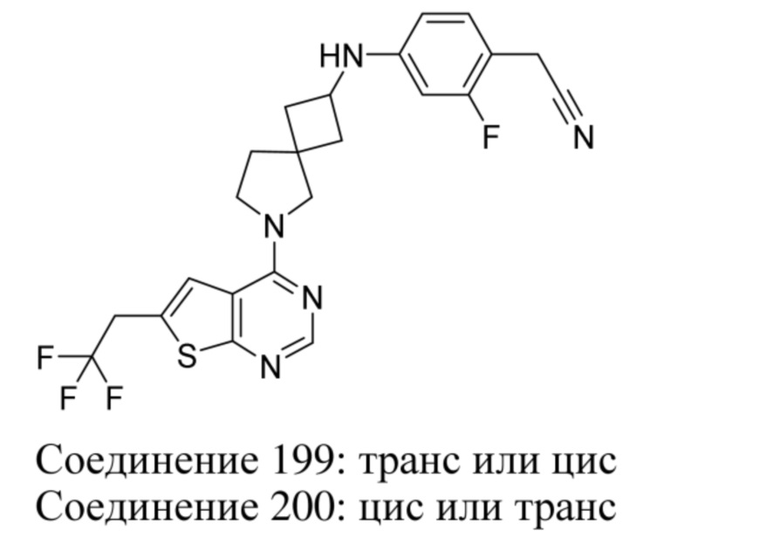
В перемешиваемый раствор промежуточного соединения 118 (250 мг, неочищенная соль HCl, примерно 0,965 ммоль) в i-PrOH (5 мл) при комнатной температуре добавляли DIPEA (373 мг, 2,896 ммоль) и 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (№ по CAS: 1628317-85-0) (243 мг, 0,965 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали. Остаток очищали с помощью флэш-хроматографии (элюент: PE/EA=3:1, об./об.) с получением формы свободного основания соединения 168 (смеси цис- и транс-изомеров) (220 мг). Полученный продукт разделяли с помощью SFC (SFC80, Waters; AD-H, 2,5 × 25 см, 10 мкл; сверхкритический CO2: MeOH=60/40; расход: 60 мл/мин ; температура колонки (T): 35°C; BPR: 100 бар) с получением соединения 199 (90 мг, выход 19%) и соединения 200 (67 мг, выход 14%) в виде белого твердого вещества.
Пример B124
Получение соединения 201 и соединения 202
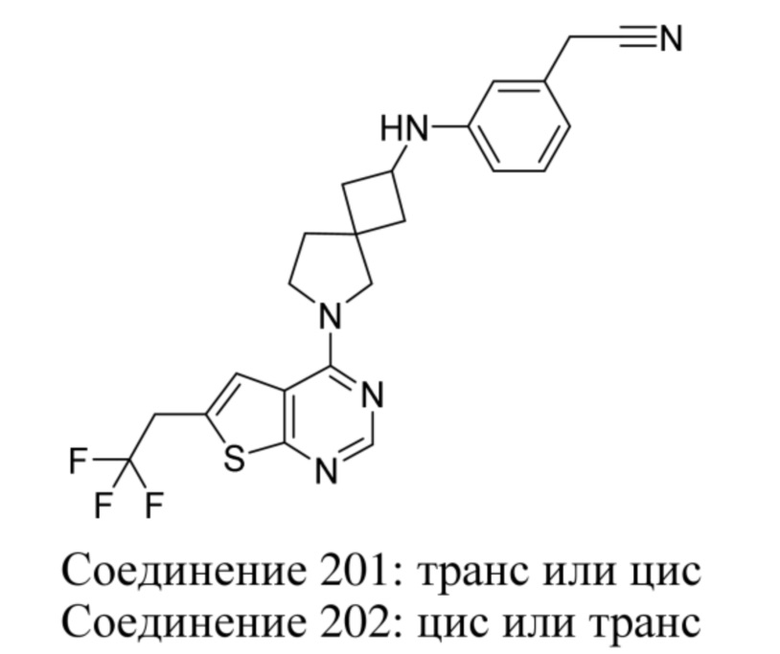
В перемешиваемый раствор промежуточного соединения 120 (400 мг, неочищенная соль TFA, примерно 1,0 ммоль) и 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидина (№ по CAS: 1628317-85-0) (252 мг, 1,0 ммоль) в i-PrOH (5 мл) при комнатной температуре добавляли DIPEA (387 мг, 3,0 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь разбавляли с помощью H2O (5 мл) и фильтровали. Осадок на фильтре очищали с помощью преп. HPLC (Xbridge C18 5 мм 150 × 4,6 мм, подвижная фаза A: 0,1% NH4OH в воде, B: 0,1% NH4OH в CH3CN) с получением соединения 173 (смеси цис- и транс-изомеров) (300 мг, выход 66% за 3 стадии) в виде белого твердого вещества. Полученный продукт разделяли с помощью SFC (Waters-SFC80; AD-H, 10 мкм, 2,5 × 25 см; подвижная фаза A: сверхкритический CO2, подвижная фаза B: MeOH/NH3; A:B=60/40; расход: 50 мл/мин; температура колонки (T): 25°C; BPR: 100 бар) с получением соединения 201 (транс или цис) (92 мг, выход 30%) в виде белого твердого вещества и соединения 202 (цис или транс) (90 мг, выход 30%) в виде белого твердого вещества.
Пример B125
Получение соединения 203, соединения 204 и соединения 205
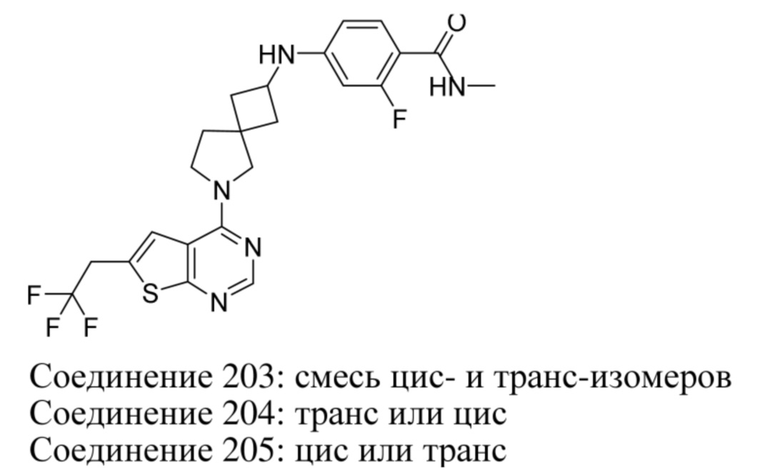
В перемешиваемый раствор промежуточного соединения 122 (140 мг, 0,505 ммоль) в i-PrOH (5 мл) добавляли DIPEA (195 мг, 1,51 ммоль) и 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (№ по CAS: 1628317-85-0) (127 мг, 0,505 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением соединения 203 (смеси цис- и транс-изомеров) (206 мг, выход 81%).
Полученное соединение 203 (смесь цис- и транс-изомеров) (80 мг) разделяли с помощью SFC (SFC80, Waters; AD-H, 2,5 × 25 см, 10 мкл; сверхкритический CO2: MeOH=60/40; расход: 60 мл/мин; температура колонки (T): 25°C; BPR: 100 бар) с получением соединения 204 (транс или цис) (19,2 мг, выход 24%) и соединения 205 (цис или транс) (15,3 мг, выход 19%) в виде белого твердого вещества.
Пример B126
Получение соединения 206
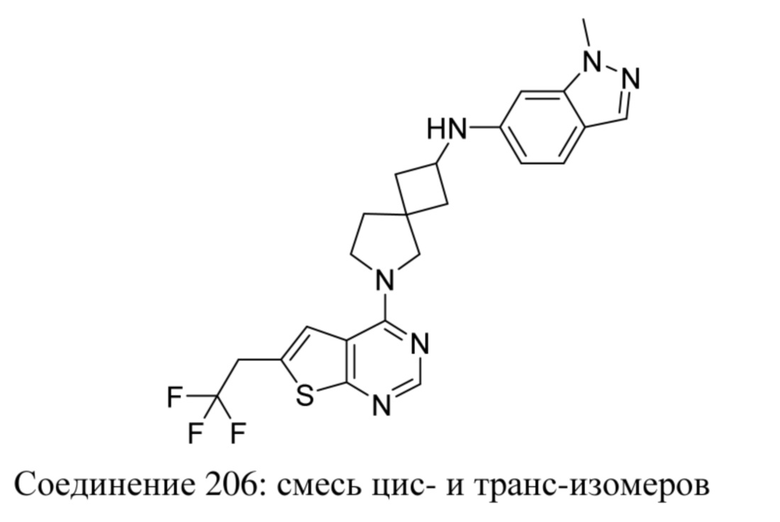
В перемешиваемый раствор промежуточного соединения 124 (226 мг, 0,89 ммоль) и 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидина (№ по CAS: 1628317-85-0) (252 мг, 1,0 ммоль) (224 мг, 0,89 ммоль) в i-PrOH (4 мл) при комнатной температуре добавляли DIPEA (574 мг, 4,45 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением соединения 206 (смеси цис- и транс-изомеров) (157 мг, выход 37%) в виде белого твердого вещества.
Пример B127
Получение соединения 207
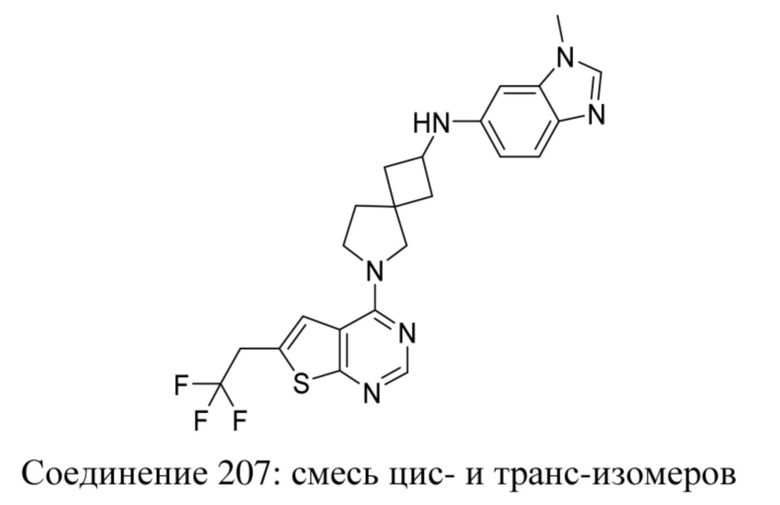
В перемешиваемый раствор промежуточного соединения 126 (450 мг, неочищенное вещество) в i-PrOH (5 мл) при комнатной температуре добавляли 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (№ по CAS: 1628317-85-0) (252 мг, 1,0 ммоль) (254 мг, 1,00 ммоль) и DIPEA (217 мг, 1,68 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь концентрировали и остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% NH4OH/H2O, B: ACN) с получением соединения 207 (смеси цис- и транс-изомеров) (52,8 мг, выход 11% за 3 стадии) в виде белого твердого вещества.
Пример B128
Получение соединения 208 и соединения 209
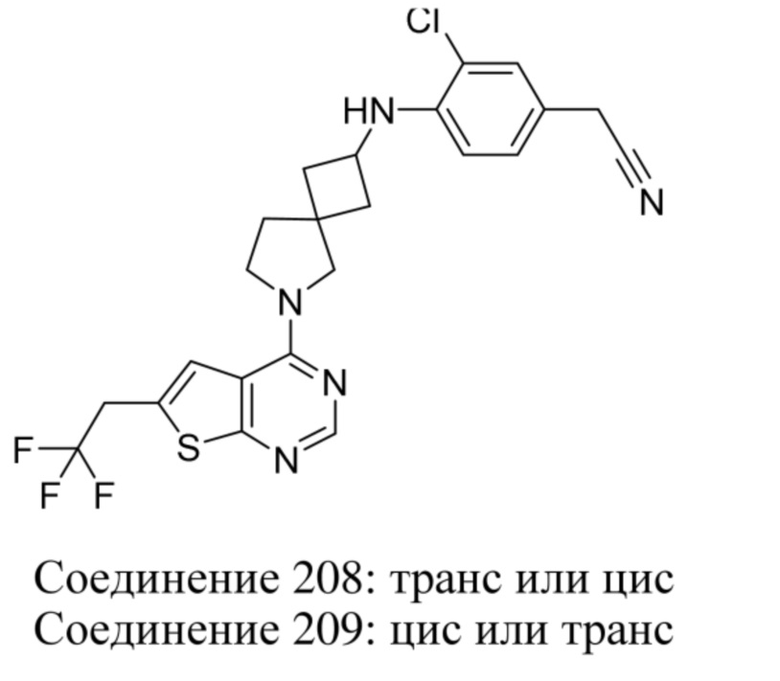
В перемешиваемый раствор промежуточного соединения 127 (161 мг, неочищенная соль TFA, примерно 0,59 ммоль) в i-PrOH (2 мл) при комнатной температуре добавляли по каплям 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (№ по CAS: 1628317-85-0) (148 мг, 0,59 ммоль) и DIPEA (381 мг, 2,95 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением необходимого продукта (смеси цис- и транс-изомеров) (160 мг). Полученный продукт разделяли с помощью SFC (SFC80, Waters, IE-H, 2,5 × 25 см, 10 мкм, A: сверхкритический CO2, B: EtOH/ETOH/DEA=75/25/0,1; A:B=60/40; расход: 70 мл/мин; температура колонки (T): 25°C; противодавление (BPR): 100 бар) с получением соединения 208 (транс или цис) (38 мг, выход 13%) и соединения 209 (цис или транс) (83 мг, выход 28%).
Пример B129
Получение соединения 210 и соединения 211
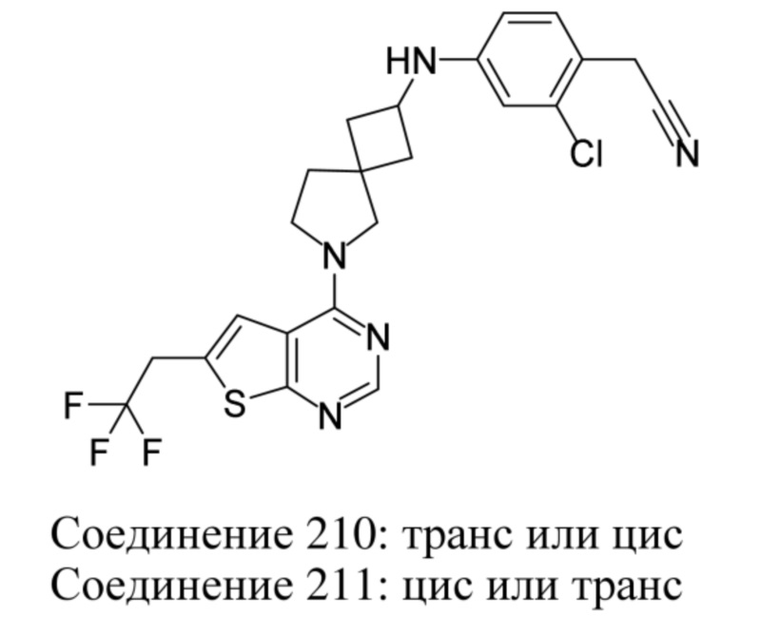
В перемешиваемый раствор промежуточного соединения 128 (300 мг, неочищенная соль HCl, примерно 2,25 ммоль) в i-PrOH (5 мл) при комнатной температуре добавляли 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (№ по CAS: 1628317-85-0) (274,9 мг, 1,09 ммоль) и DIPEA (3 мл). Смесь перемешивали при комнатной температуре в течение 3 ч и концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% TFA/H2O, B: ACN) с получением смеси цис- и транс-изомеров. Полученный продукт разделяли с помощью SFC (SFC80, Waters; OJ, 2,5 × 25 см, 10 мкм; A: сверхкритический CO2, подвижная фаза B: MeOH; A:B=70/30; расход: 70 мл/мин; температура колонки (T): 25°C; BPR: 100 бар) с получением соединения 210 (транс или цис) (76,0 мг, выход 16%) и соединения 211 (цис или транс) (73,0 мг, выход 15%).
Пример B130
Получение соединения 212 и соединения 213
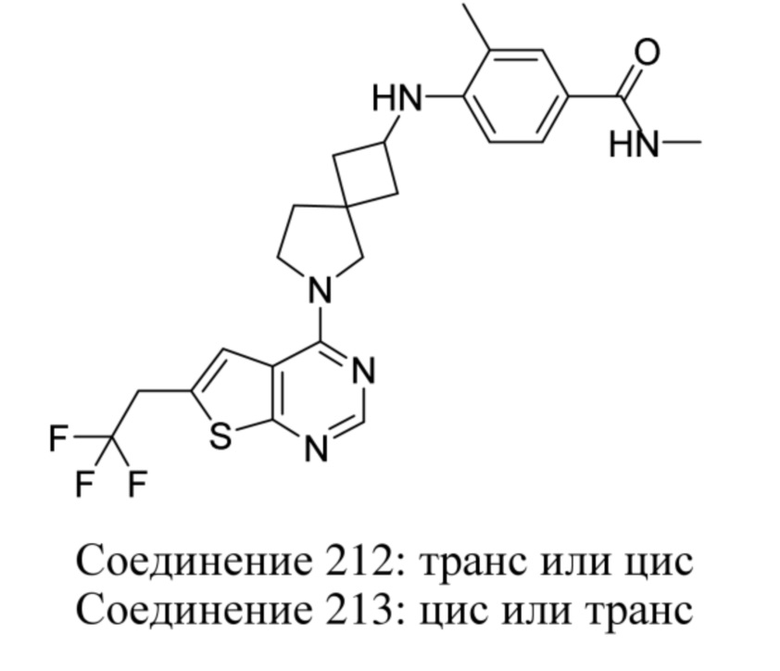
В перемешиваемый раствор промежуточного соединения 129 (300 мг, неочищенная соль HCl, примерно 1,09 ммоль) в i-PrOH (15 мл) при комнатной температуре добавляли DIPEA (1 мл) и 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (№ по CAS: 1628317-85-0) (274 мг, 1,09 ммоль). Реакционную смесь перемешивали при 50°C в течение 1 ч. Полученную смесь концентрировали и остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% NH3.H2O/H2O, B: ACN) с получением смеси цис- и транс-изомеров (50 мг, выход 9,3%) в виде белого твердого вещества. Полученный продукт разделяли с помощью SFC (SFC80, Waters; IA-H, 2,5 × 25 см, 10 мкм; A: сверхкритический CO2, подвижная фаза B: MeOH; A: B=65/35; расход: 50 мл/мин; температура колонки (T): 25°C; BPR: 100 бар) с получением соединения 212 (транс или цис) (24 мг, выход 48%) в виде белого твердого вещества и соединения 213 (цис или транс) (24 мг, выход 48%) в виде белого твердого вещества.
Пример B131
Получение соединения 214
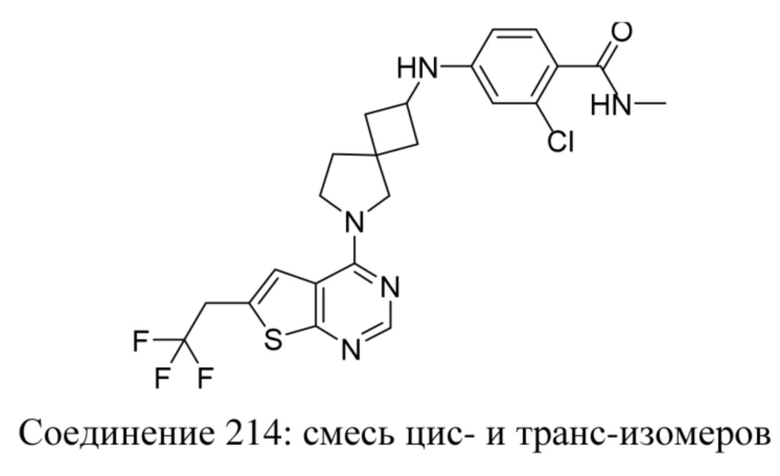
В перемешиваемый раствор промежуточного соединения 130 (586 мг, неочищенная соль HCl, примерно 2,0 ммоль) в i-PrOH (5 мл) при комнатной температуре добавляли 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (№ по CAS: 1628317-85-0) (310 мг, 2,0 ммоль), DIPEA (1 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч и затем концентрировали и остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% TFA/H2O, B: ACN) с получением соединения 214 (смеси цис- и транс-изомеров) (297 мг, выход 29%).
Пример B132
Получение соединения 215
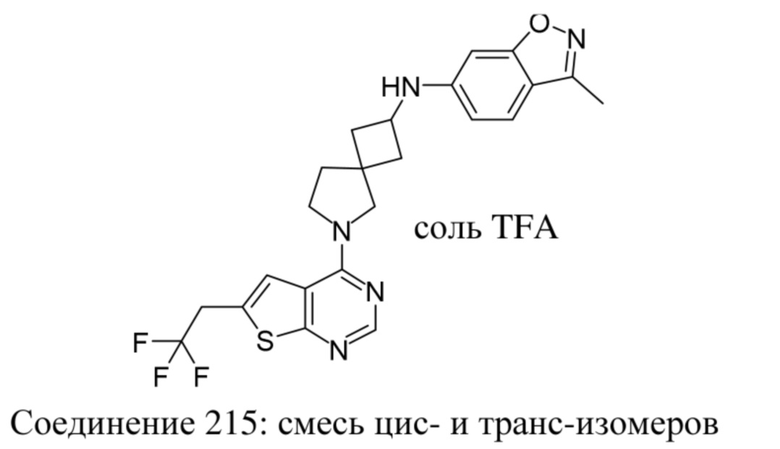
В перемешиваемый раствор промежуточного соединения 131 (80 мг, неочищенная соль TFA, примерно 0,42 ммоль) в i-PrOH (3 мл) при комнатной температуре добавляли 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (№ по CAS: 1628317-85-0) (86 мг, 0,34 ммоль) и DIPEA (80 мг, 0,62 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь концентрировали и остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% TFA/H2O, B: ACN) с получением соединения 215 (смеси цис- и транс-изомеров) (33,84 мг, соль TFA, выход 17%) в виде белого твердого вещества.
Пример B133
Получение соединения 216
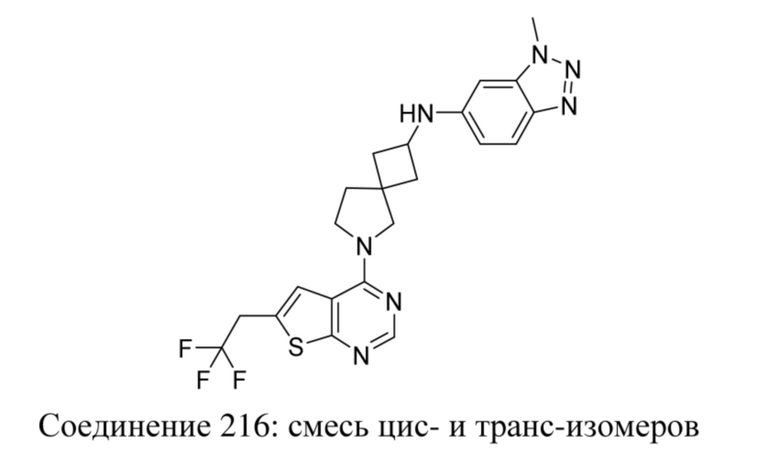
В перемешиваемый раствор промежуточного соединения 132 (129 мг, неочищенная соль TFA, примерно 0,501 ммоль) в i-PrOH (10 мл) при комнатной температуре добавляли DIPEA (194 мг, 1,505 ммоль) и 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (№ по CAS: 1628317-85-0) (126 мг, 0,501 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 12 ч. Реакционную смесь концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением соединения 216 (смеси цис- и транс-изомеров) (67,20 мг, выход 28%) в виде желтого твердого вещества.
Пример B134
Получение соединения 217 и соединения 218
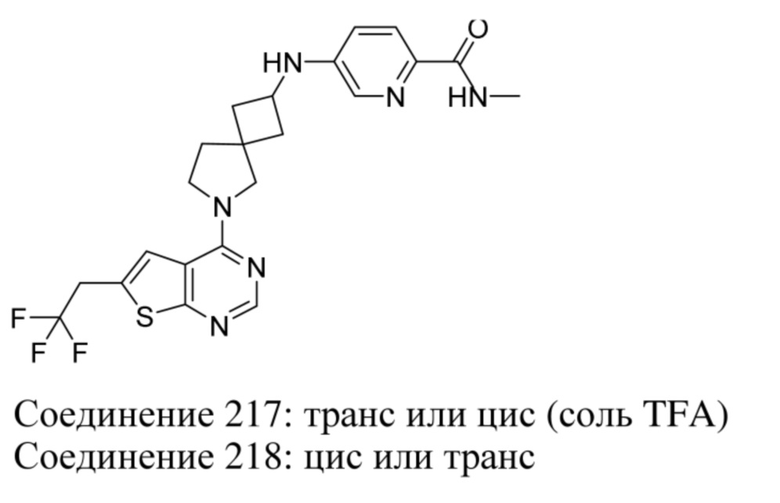
Перемешивали смесь промежуточного соединения 133 (450 мг, неочищенная соль HCl, примерно 1,65 ммоль), 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидина (№ по CAS: 1628317-85-0) (543 мг, 2,15 ммоль) и DIPEA (925 мг, 7,16 ммоль) в i-PrOH (5 мл) при комнатной температуре в течение 16 ч. Реакционную смесь концентрировали и остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% TFA/H2O, B: ACN) с получением необходимого продукта (смеси цис- и транс-изомеров). Полученный продукт разделяли с помощью SFC (SFC80, Waters; OJ-H, 2,5 × 25 см, 10 мкм; A: сверхкритический CO2, подвижная фаза B: MeOH; A:B=70/30; расход: 50 мл/мин; температура колонки (T): 25°C; BPR: 100 бар) с получением соединения 217 (транс или цис) (11,95 мг, соль TFA, выход 1,3% за 3 стадии) в виде белого твердого вещества и соединения 218 (цис или транс) (8,83 мг, выход 1,0% за 3 стадии) в виде белого твердого вещества.
Пример B135
Получение соединения 219 и соединения 220
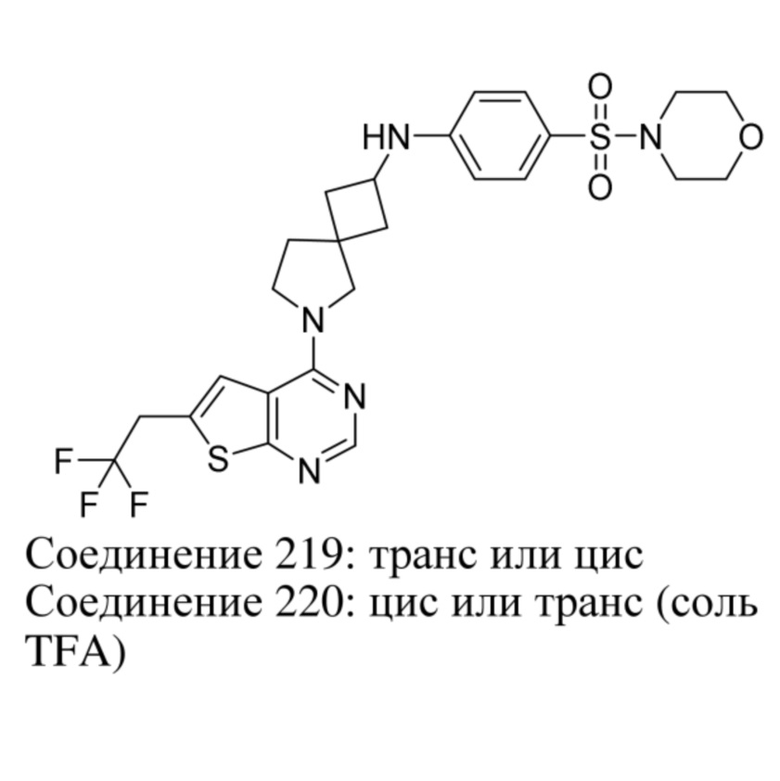
В перемешиваемый раствор промежуточного соединения 134 (380 мг, 1,08 ммоль) и 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидина (№ по CAS: 1628317-85-0) (273 мг, 1,08 ммоль) в i-PrOH (5 мл) добавляли DIPEA (698 мг, 5,41 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% TFA), B: ACN) с получением необходимого продукта (смеси цис- и транс-изомеров) (247 мг, соль TFA). Полученный продукт разделяли с помощью SFC (SFC80, Waters, OJ-H, 2,5 × 25 см, 10 мкм, A: сверхкритический CO2, B: MeOH; A:B=75/25; расход: 70 мл/мин; температура колонки (T): 25°C; противодавление (BPR): 100 бар) с получением соединения 219 (транс или цис) (79 мг, выход 12%) и соединения 220 (цис или транс) (97 мг, соль TFA, выход 15%).
Пример B136
Получение соединения 221
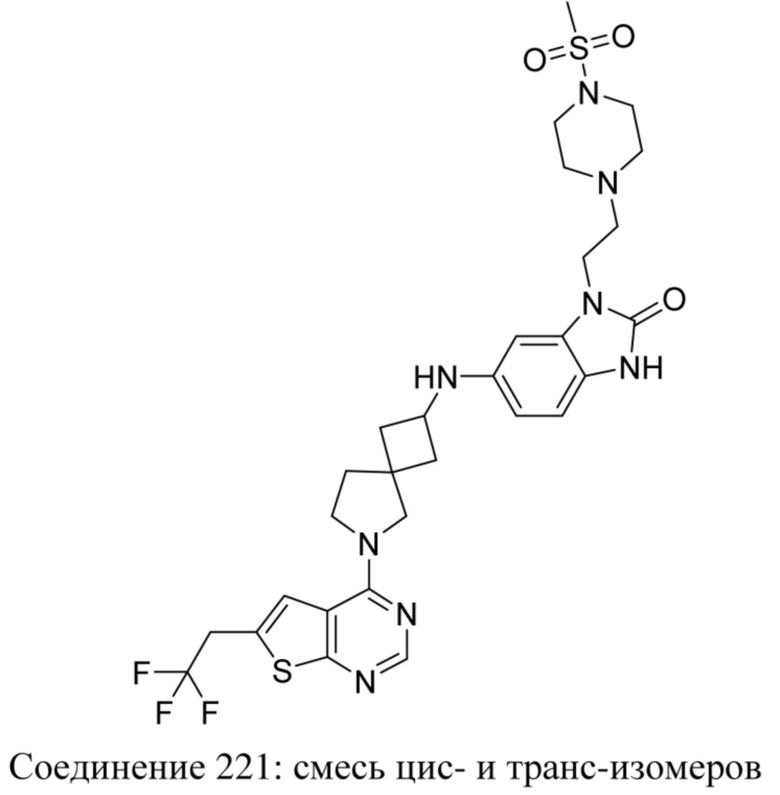
В перемешиваемый раствор промежуточного соединения 138 (55 мг, неочищенная соль HCl, примерно 0,12 ммоль) в i-PrOH (3 мл) добавляли 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (№ по CAS: 1628317-85-0) (30,24 мг, 0,12 ммоль) и DIPEA (0,05 мл). Реакционную смесь перемешивали при 50°C в течение 5 ч. Реакционную смесь концентрировали и остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% NH3.H2O/H2O, B: ACN) с получением соединения 221 (смеси цис- и транс-изомеров) (8 мг, выход 10%) в виде белого твердого вещества.
Пример B137
Получение соединения 222
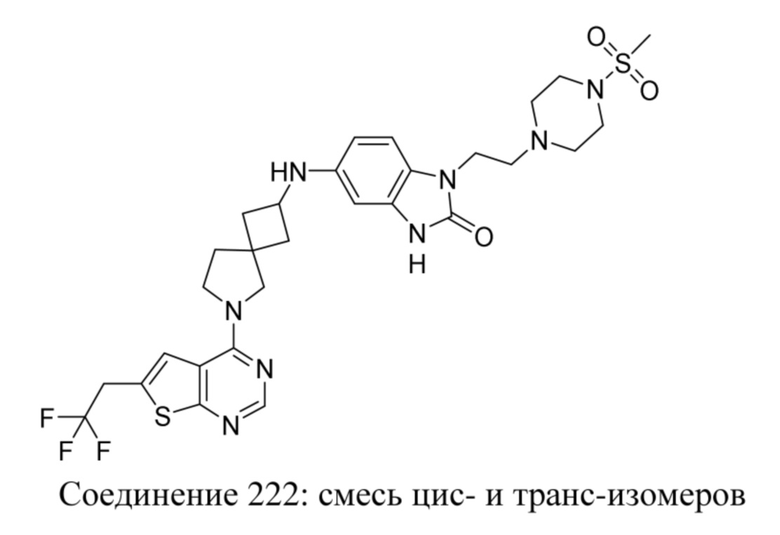
В перемешиваемый раствор промежуточного соединения 142 (220 мг, неочищенная соль HCl, примерно 0,28 ммоль) в i-PrOH (3 мл) при комнатной температуре добавляли 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (№ по CAS: 1628317-85-0) (135 мг, 0,54 ммоль) и DIPEA (126 мг, 0,98 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь концентрировали и остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% NH4OH/H2O, B: ACN) с получением соединения 222 (смеси цис- и транс-изомеров) (34,1 мг, выход 18% за 2 стадии) в виде белого твердого вещества.
Пример B138
Получение соединения 223
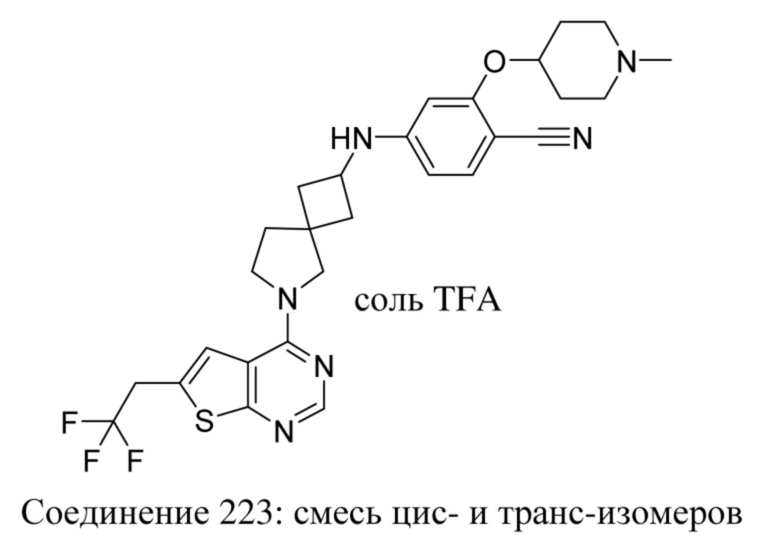
В перемешиваемую смесь промежуточного соединения 145 (500 мг, неочищенная соль TFA, примерно 1,53 ммоль) и 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидина (№ по CAS: 1628317-85-0) (300 мг, 1,19 ммоль) в i-PrOH (10 мл) добавляли DIPEA (767 мг, 5,95 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% TFA), B: ACN) с получением соединения 223 (смеси цис- и транс-изомеров) (142 мг, соль TFA, выход примерно 13% за 4 стадии).
Пример B139
Получение соединения 224
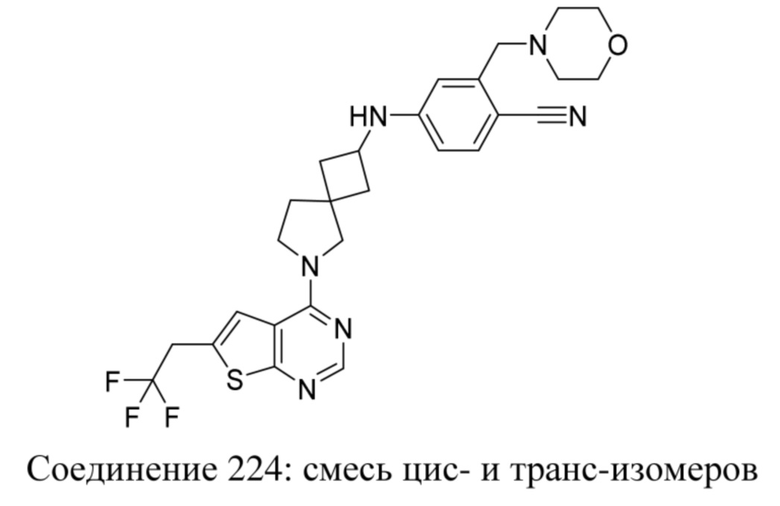
Перемешивали смесь промежуточного соединения 149 (380 мг, 1,17 ммоль), 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидина (№ по CAS: 1628317-85-0) (265 мг, 1,05 ммоль) и DIPEA (604 мг, 4,68 ммоль) в i-PrOH (6 мл) при 55°C в течение 3 ч. С помощью LC-MS показывали, что образовался необходимый массовый пик. Реакционную смесь концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением соединения 224 (смеси цис- и транс-изомеров) (45 мг, выход 7,1%) в виде белого твердого вещества.
Пример B140
Получение соединения 225
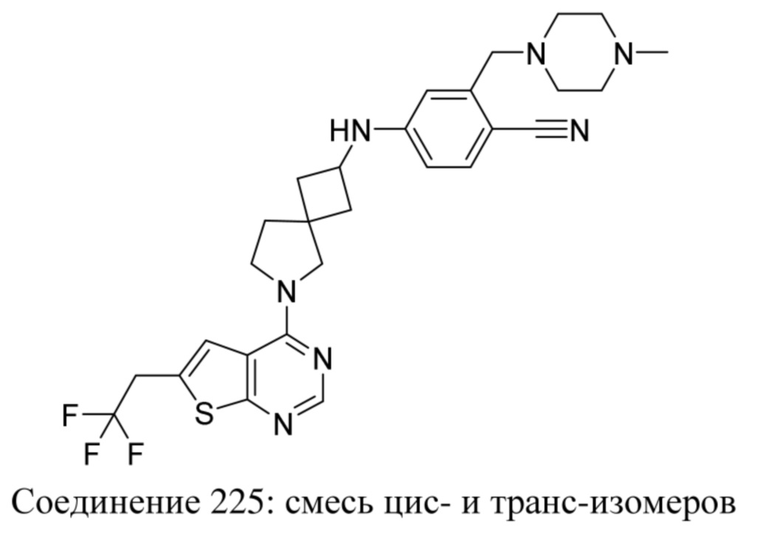
В смесь промежуточного соединения 153 (250 мг, неочищенная соль TFA, примерно 0,341 ммоль) и 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидина (№ по CAS: 1628317-85-0) (150 мг, 0,595 ммоль) в i-PrOH (10 мл) при комнатной температуре добавляли DIPEA (230 мг, 1,78 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением соединения 225 (смеси цис- и транс-изомеров) (36 мг, выход 18% за 2 стадии) в виде белого твердого вещества.
Пример B141
Получение соединения 226 и соединения 227
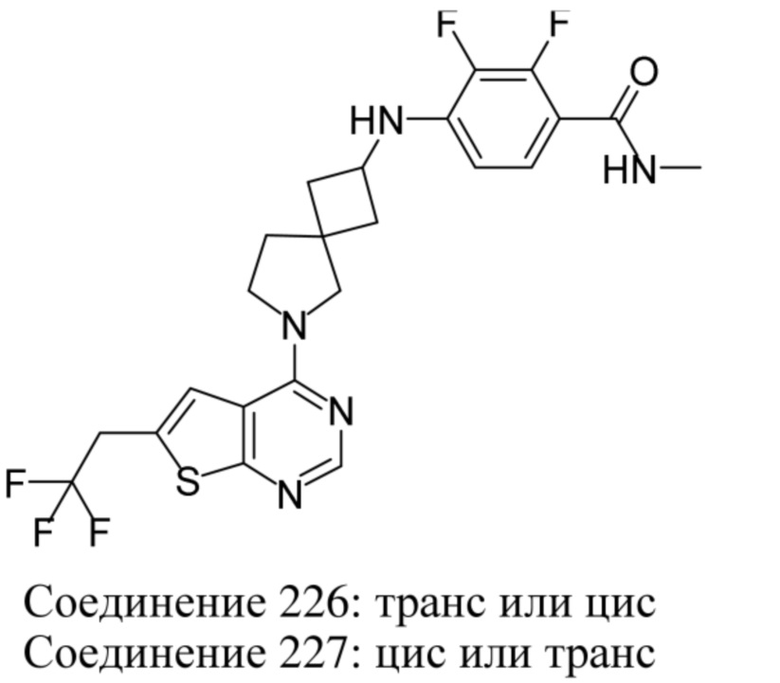
В перемешиваемый раствор промежуточного соединения 156 (286 мг, неочищенная соль TFA, примерно 0,97 ммоль) и 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидина (№ по CAS: 1628317-85-0) (244 мг, 0,97 ммоль) в i-PrOH (5 мл) при комнатной температуре добавляли DIPEA (624 мг, 4,84 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением необходимого продукта (смеси цис- и транс-изомеров) (270 мг). Полученный продукт разделяли с помощью SFC (SFC80, Waters, IC, 2,5 × 25 см, 10 мкм, A: сверхкритический CO2, B: MeOH; A:B=75/25; расход: 50 мл/мин; температура колонки (T): 25°C; противодавление (BPR): 100 бар) с получением соединения 226 (транс или цис) (86 мг, выход 17%) и соединения 227 (цис или транс) (114 мг, выход 23%).
Пример B142
Получение соединения 228 и соединения 229
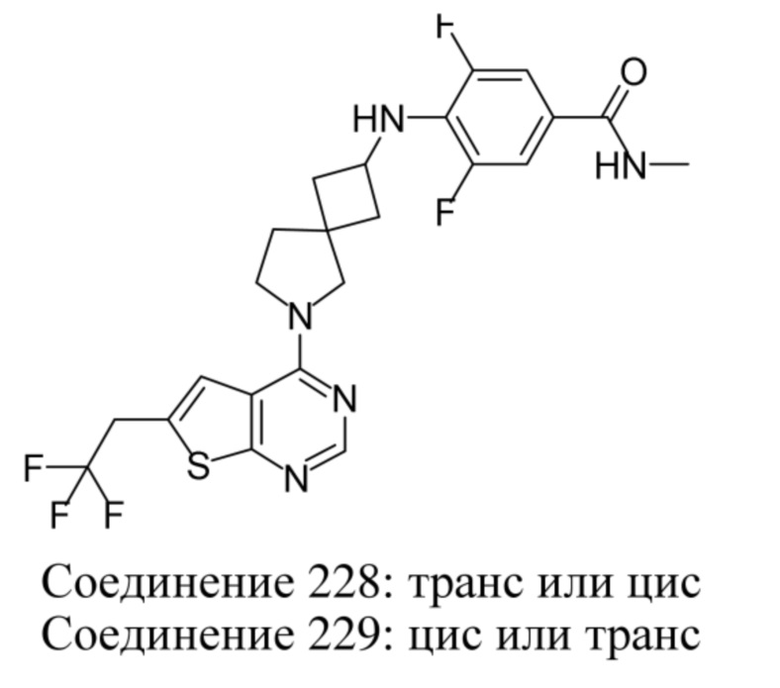
В перемешиваемый раствор промежуточного соединения 159 (200 мг, неочищенная соль HCl, 0,678 ммоль) в i-PrOH (4 мл) добавляли DIPEA (262 мг, 2,03 ммоль) и 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (№ по CAS: 1628317-85-0) (171 мг, 0,678 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 12 ч. Реакционную смесь концентрировали. Остаток очищали с помощью флэш-хроматографии (PE/EtOAc=1:1, об./об.) с получением смеси цис- и транс-изомеров) (300 мг). Полученный продукт разделяли с помощью SFC (SFC80, Waters; OJ-H, 2,5 × 25 см, 10 мкл; сверхкритический CO2:MeOH=75/25; расход: 65 мл/мин; температура колонки (T): 25°C; BPR: 100 бар) с получением соединения 228 (транс или цис) (110 мг, выход 31%) и соединения 229 (цис или транс) (82 мг, выход 23%) в виде белого твердого вещества.
Пример B143
Получение соединения 230 и соединения 231
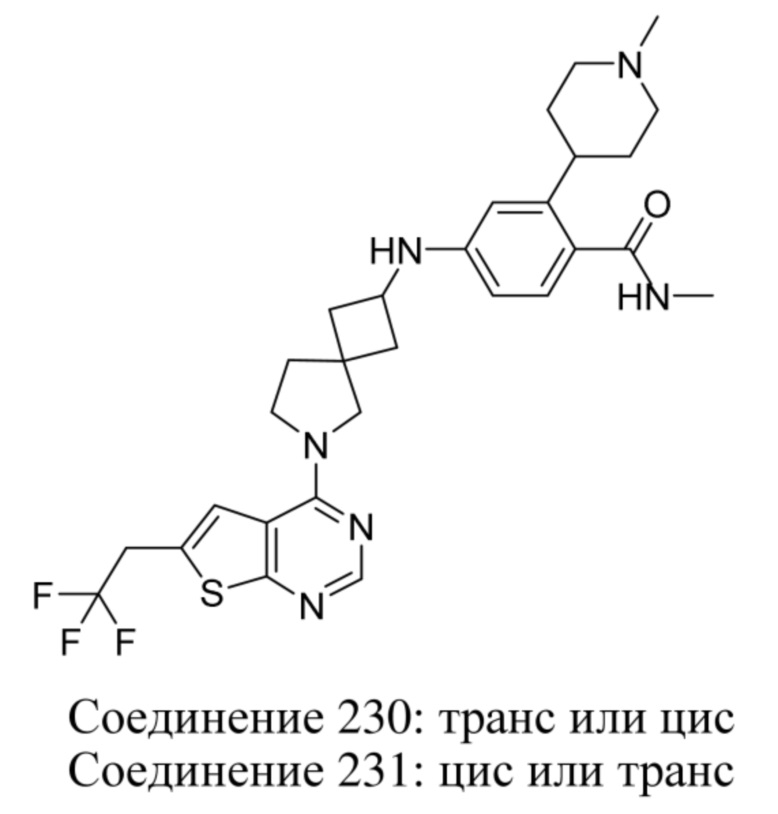
В перемешиваемый раствор промежуточного соединения 165 (117 мг, 0,44 ммоль) и 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидина (№ по CAS: 1628317-85-0) (83 мг, 0,44 ммоль) в i-PrOH (2 мл) добавляли DIPEA (212 мг, 2,20 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением необходимого продукта (смеси цис- и транс-изомеров) (70 мг). Полученный продукт разделяли с помощью SFC (SFC80, Waters, IC, 2,5 × 25 см, 10 мкм, A: сверхкритический CO2, B: EtOH/ACN=84:16 (0,1% NH3); A:B=75/25; расход: 70 мл/мин; температура колонки (T): 25°C; противодавление (BPR): 100 бар) с получением соединения 230 (транс или цис) (29 мг, выход 11%) и соединения 231 (цис или транс) (24 мг, выход 9,5%).
Пример B144
Получение соединения 232 и соединения 233
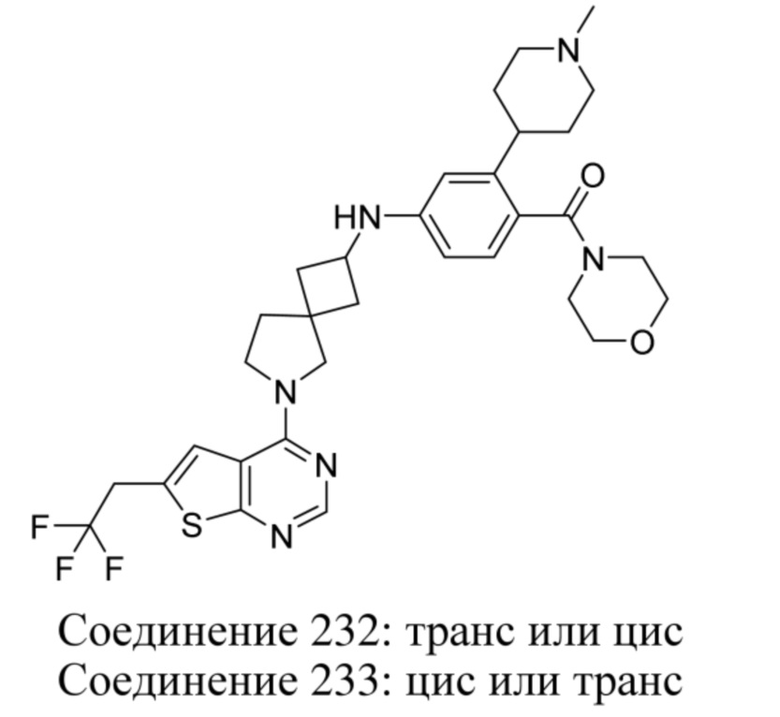
В перемешиваемую смесь промежуточного соединения 169 (130 мг, 0,317 ммоль) и 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидина (№ по CAS: 1628317-85-0) (80 мг, 0,317 ммоль) в i-PrOH (5 мл) добавляли DIPEA (123 мг, 0,952 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали. Остаток очищали с помощью преп. TLC (DCM/MeOH=15:1, об./об.) с получением необходимого продукта (смеси цис- и транс-изомеров). Полученный продукт разделяли с помощью SFC (прибор: Waters-SFC80; колонка: AD-H (2,5 × 25 см, 10 мкм); подвижная фаза A: сверхкритический CO2, подвижная фаза B: EtOH/ACN=85/15 (0,1% NH3); A:B=70/30 при 60 мл/мин; длина волны детектора: 214 нм; температура колонки (T): 25°C; противодавление (BPR): 100 бар) с получением соединения 232 (транс или цис) (13,6 мг) и соединения 233 (цис или транс) (12,9 мг).
Пример B145
Получение соединения 234 и соединения 235
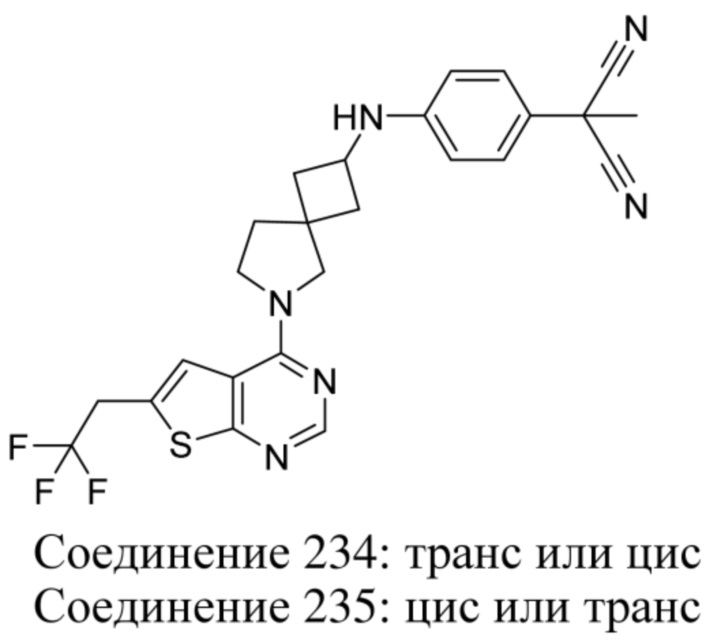
В перемешиваемый раствор промежуточного соединения 172 (200 мг, неочищенная соль TFA, примерно 0,736 ммоль) в i-PrOH (3 мл) добавляли DIPEA (275 мг, 2,13 ммоль) и 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (№ по CAS: 1628317-85-0) (198 мг, 0,79 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением необходимого продукта (смеси цис- и транс-изомеров) (90 мг). Полученный продукт разделяли с помощью SFC (SFC80, Waters, AD-H, 2,5 × 25 см, 10 мкм, A: сверхкритический CO2, B: MeOH/NH3; A:B=70/30; расход: 55 мл/мин; температура колонки (T): 25°C; BPR: 100 бар) с получением соединения 234 (транс или цис) (42,9 мг, выход 11% за 2 стадии) в виде белого твердого вещества и соединения 235 (цис или транс) (39,3 мг, выход 10% за 2 стадии) в виде белого твердого вещества.
Пример B146
Получение соединения 236

В перемешиваемый раствор промежуточного соединения 177 (50 мг, неочищенная соль HCl, примерно 0,67 ммоль) в i-PrOH (5 мл) при комнатной температуре добавляли 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (№ по CAS: 1628317-85-0) (37 мг, 0,15 ммоль) и DIPEA (1 мл). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь концентрировали и остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% TFA/H2O, B: ACN). Повышали основность остатка с получением соединения 236 в виде свободного основания (смеси цис- и транс-изомеров) (11,5 мг, выход 15% за 2 стадии).
Пример B147
Получение соединения 237 и соединения 238
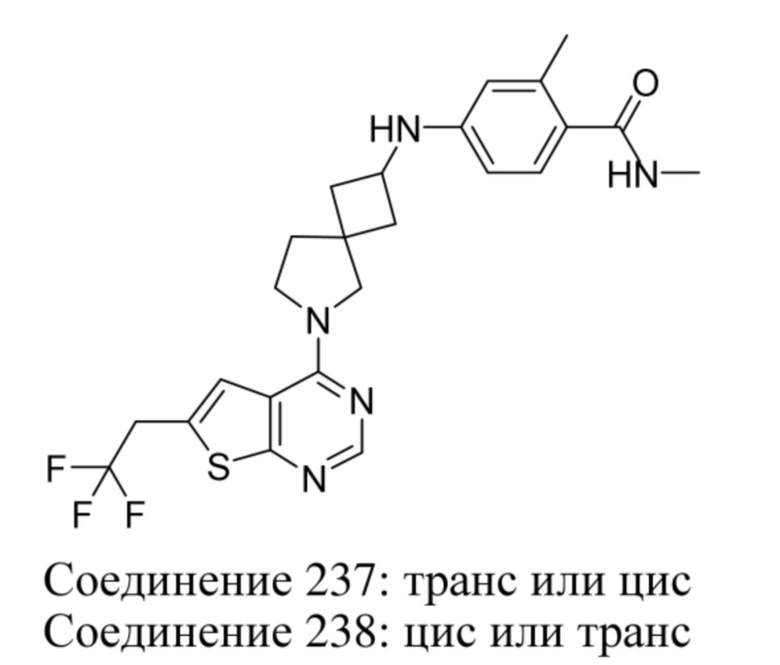
Перемешивали смесь промежуточного соединения 181 (200 мг, неочищенная соль TFA, примерно 0,55 ммоль), 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидина (№ по CAS: 1628317-85-0) (139 мг, 0,55 ммоль) и DIPEA (213 мг, 1,65 ммоль) в i-PrOH (10 мл) при комнатной температуре в течение 2 ч. Реакционную смесь концентрировали и остаток очищали с помощью преп. HPLC (Xbridge C18 5 мм 150 × 4,6 мм, подвижная фаза A: 0,1% NH4OH в воде, B: 0,1% NH4OH в CH3CN) с получением необходимого продукта (смеси цис- и транс-изомеров) (210 мг, выход 78%) в виде белого твердого вещества. Полученный продукт разделяли с помощью SFC (SFC80, Waters; OD-H (2,5 × 25 см, 10 мкм); A: сверхкритический CO2, подвижная фаза B: MeOH; A:B=75/25; расход: 60 мл/мин; температура колонки (T): 25°C; противодавление (BPR): 100 бар) с получением соединения 237 (транс или цис) (94 мг) в виде белого твердого вещества и соединения 238 (цис или транс) (98 мг) в виде белого твердого вещества.
Пример B148
Получение соединения 239
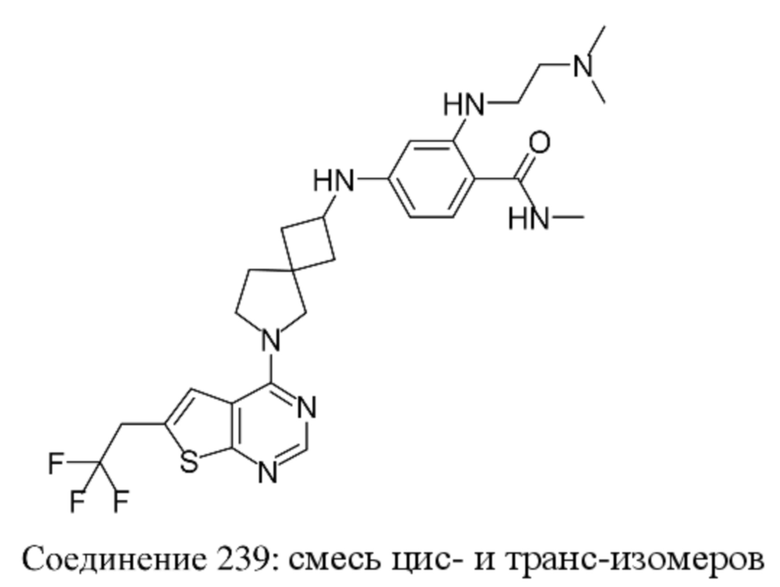
В перемешиваемый раствор промежуточного соединения 184 (131 мг, неочищенная соль TFA, примерно 0,379 ммоль) в i-PrOH (10 мл) при комнатной температуре добавляли DIPEA (147 мг, 1,139 ммоль) и 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (№ по CAS: 1628317-85-0) (95,5 мг, 0,379 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 12 ч. Реакционную смесь концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением соединения 239 (смеси цис- и транс-изомеров) (14,3 мг, 6,7%) в виде желтого твердого вещества.
Пример B149
Получение соединения 240
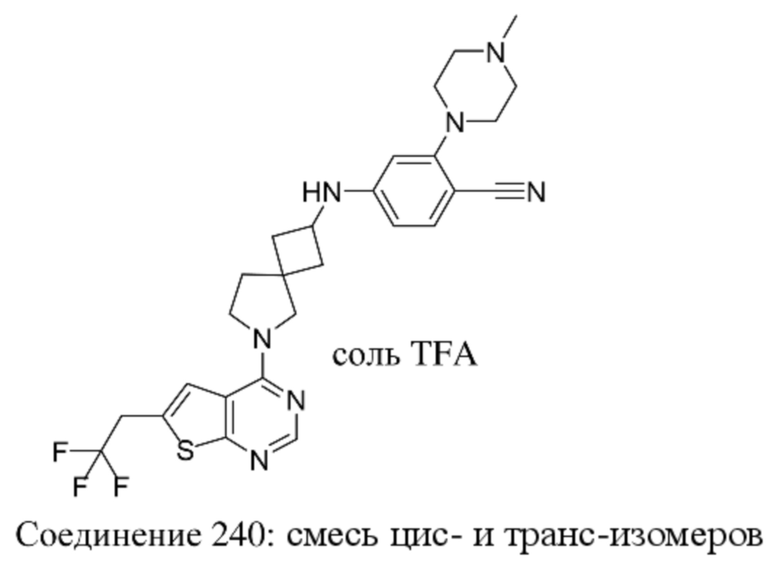
Перемешивали смесь промежуточного соединения 187 (80 мг, неочищенная соль TFA, примерно 0,14 ммоль), 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидина (№ по CAS: 1628317-85-0) (35 мг, 0,14 ммоль) и DIPEA (54 мг, 0,42 ммоль) в i-PrOH (5 мл) при комнатной температуре в течение 2 ч. После завершения реакции реакционную смесь концентрировали и остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% TFA/H2O, B: ACN) с получением соединения 240 (смеси цис- и транс-изомеров) (41 мг, соль TFA, выход 54%) в виде грязно-белого твердого вещества.
Пример B150
Получение соединения 241
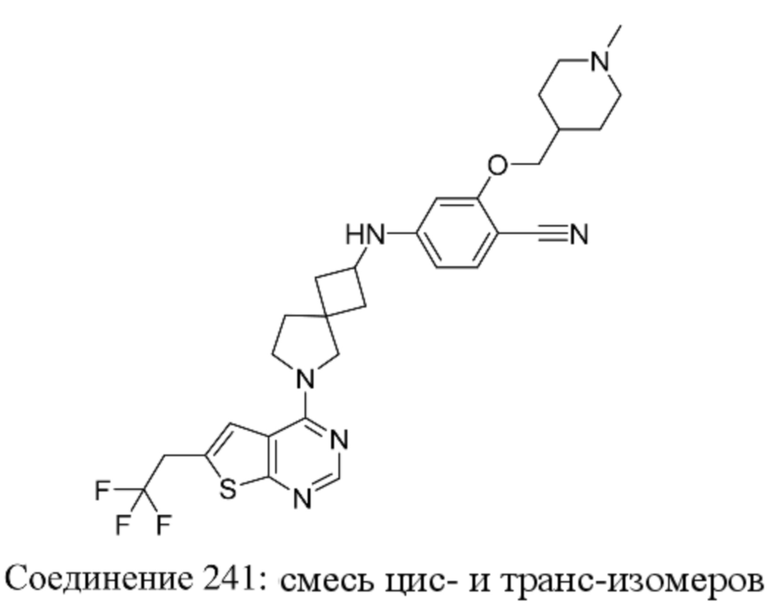
В перемешиваемый раствор промежуточного соединения 193 (97 мг, неочищенная соль TFA, примерно 0,28 ммоль) и 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидина (№ по CAS: 1628317-85-0) (69 мг, 0,28 ммоль) в i-PrOH (3 мл) добавляли DIPEA (177 мг, 1,38 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи. Смесь концентрировали при пониженном давлении. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением соединения 241 (смеси цис- и транс-изомеров) (40 мг, выход 25%) в виде белого твердого вещества.
Пример B151
Получение соединения 242 и соединения 243
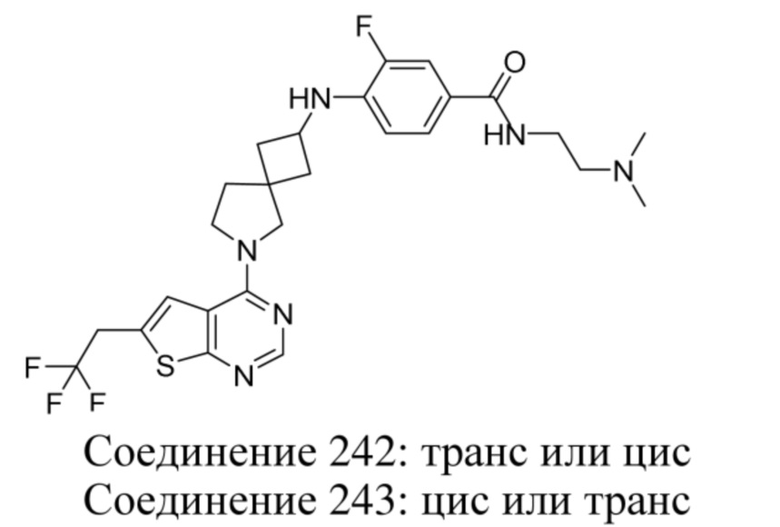
Перемешивали смесь промежуточного соединения 197 (200 мг, неочищенная соль TFA, примерно 0,435 ммоль), 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидина (№ по CAS: 1628317-85-0) (124 мг, 0,49 ммоль) и DIPEA (213 мг, 1,65 ммоль) в i-PrOH (10 мл) при комнатной температуре в течение 2 ч. Реакционную смесь концентрировали и остаток очищали с помощью преп. HPLC (Agilent G6120B, детектор G1315D DADVL и G4260B ELSD, Xbridge C18 5 мм 150 × 4,6 мм, подвижная фаза A: 0,1% NH4OH в воде, B: 0,1% NH4OH в CH3CN) с получением необходимого продукта (смеси цис- и транс-изомеров) (200 мг, выход 74%) в виде белого твердого вещества. Полученный продукт разделяли с помощью SFC (SFC80, Waters; OJ-H (2,5 × 25 см, 10 мкм); A: сверхкритический CO2, подвижная фаза B: EtOH/ACN/NH3=85/15/0,1; A:B=80/20; расход: 50 мл/мин; температура колонки (T): 25°C; противодавление (BPR): 100 бар) с получением соединения 242 (транс или цис) (76 мг, выход 38,0%) в виде белого твердого вещества и соединения 243 (цис или транс) (68 мг, выход 34,0%) в виде белого твердого вещества.
Пример B152
Получение соединения 244 и соединения 245
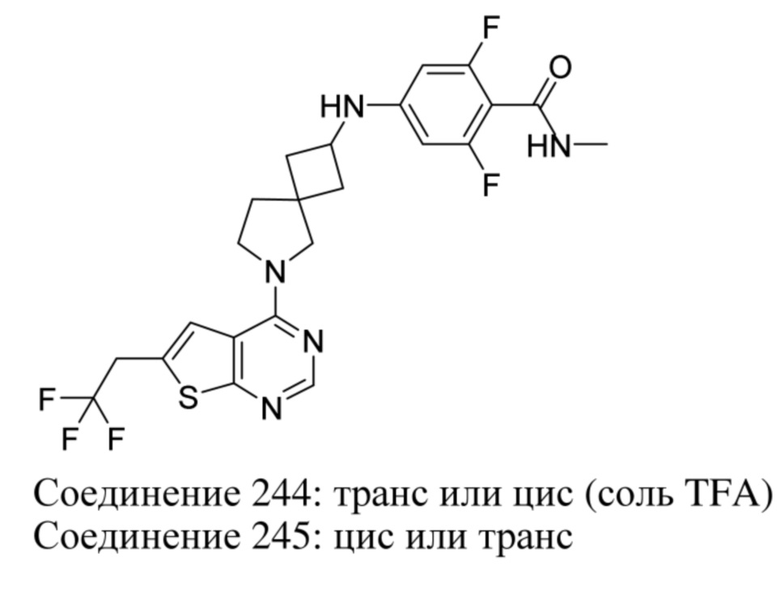
В перемешиваемый раствор промежуточного соединения 201 (500 мг, неочищенная соль TFA, примерно 0,886 ммоль) и 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидина (№ по CAS: 1628317-85-0) (223 мг, 0,886 ммоль) в i-PrOH (5 мл) при комнатной температуре добавляли DIPEA (343 мг, 2,65 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь концентрировали. Остаток очищали с помощью преп. TLC (DCM/MeOH=20:1, об./об.) с получением необходимого продукта (смеси цис- и транс-изомеров). Полученный продукт разделяли с помощью SFC (SFC80, Waters, IA, 2,5 × 25 см, 10 мкм, A: сверхкритический CO2, B: MeOH; A:B=60/40; расход: 40 мл/мин; температура колонки (T): 25°C; противодавление (BPR): 100 бар) с получением соединения 244 (транс или цис) (113 мг после преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% TFA/H2O, B: ACN), соль TFA) и соединения 245 (цис или транс) (115 мг).
Пример B153
Получение соединения 246 и соединения 247
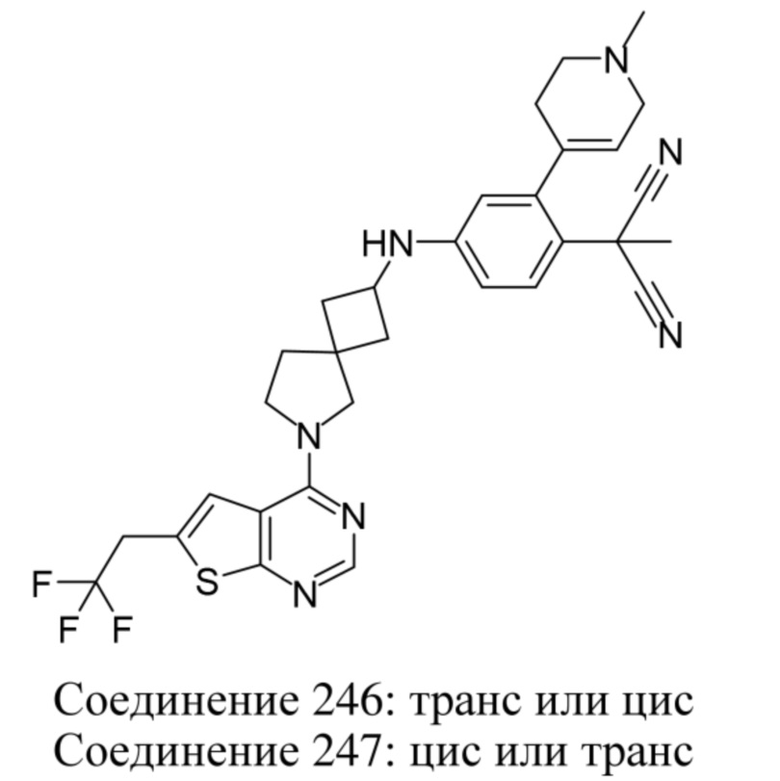
В перемешиваемый раствор промежуточного соединения 207 (200 мг, неочищенная соль TFA, примерно 0,409 ммоль) в i-PrOH (3 мл) добавляли DIPEA (137 мг, 0,11 ммоль) и 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (№ по CAS: 1628317-85-0) (148 мг, 0,59 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Реакционную смесь концентрировали и остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением смеси цис- и транс-изомеров (100 мг). Полученный продукт разделяли с помощью SFC (SFC80, Waters, IA-H, 2,5 × 25 см, 10 мкм, A: сверхкритический CO2, B: EtOH/NH3; A: B=70/30; расход: 50 мл/мин; температура колонки (T): 25°C; противодавление (BPR): 100 бар) с получением соединения 246 (транс или цис) (43,8 мг, выход 8,5% за 3 стадии) в виде белого твердого вещества и соединения 247 (цис или транс) (45,2 мг, выход 8,7% за 3 стадии) в виде белого твердого вещества.
Пример B154
Получение соединения 248
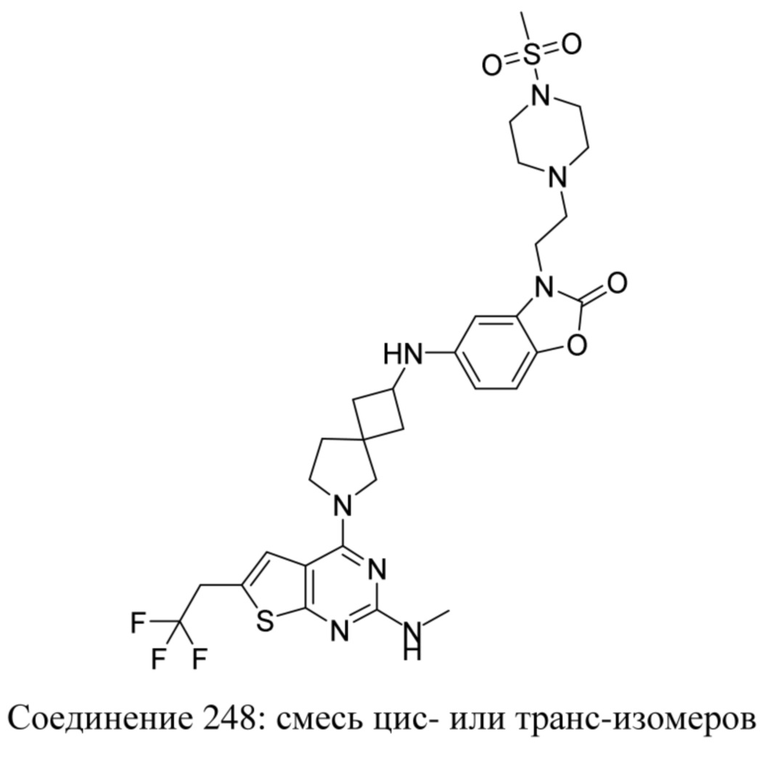
Перемешивали раствор промежуточного соединения 211 (225 мг, 0,322 ммоль) в MeNH2 (2 М в THF) (5 мл) при 100°C в течение 24 ч при микроволновом облучении. Охлажденную реакционную смесь концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением соединения 248 (смеси цис- и транс-изомеров) (73,1 мг, выход 32%) в виде розового твердого вещества.
Пример B155
Получение соединения 249

В перемешиваемый раствор 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидина (№ по CAS: 1628317-85-0) (300 мг, 1,82 ммоль) и промежуточного соединения 214 (100 мг, неочищенная соль HCl, примерно 0,182 ммоль) в i-PrOH (3 мл) добавляли DIPEA (60 мг, 0,468 ммоль). Реакционную смесь перемешивали при к.т. в течение 12 ч. Реакционную смесь концентрировали и остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 250 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением соединения 249 (смеси цис- и транс-изомеров) (42,6 мг, выход 41%, соль TFA).
Пример B156
Получение соединения 250
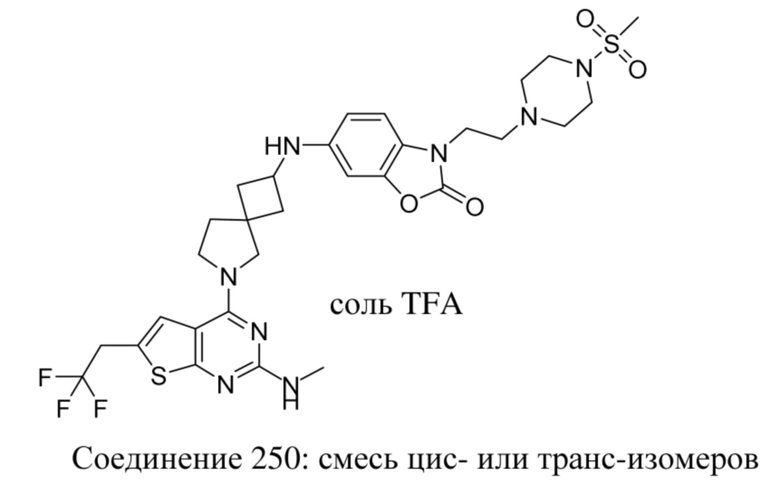
Перемешивали раствор промежуточного соединения 215 (160 мг, 228 ммоль) в метанамине (2,0 М в THF) (4 мл) при 100°C в закрытом сосуде в течение ночи. Охлажденную реакционную смесь концентрировали и остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 250 мм, 10 мкм, подвижная фаза A: H2O (0,1% TFA), B: ACN) с получением соединения 250 (смеси цис- и транс-изомеров) (14 мг, выход 8,8%, соль TFA).
Пример B157
Получение соединения 251
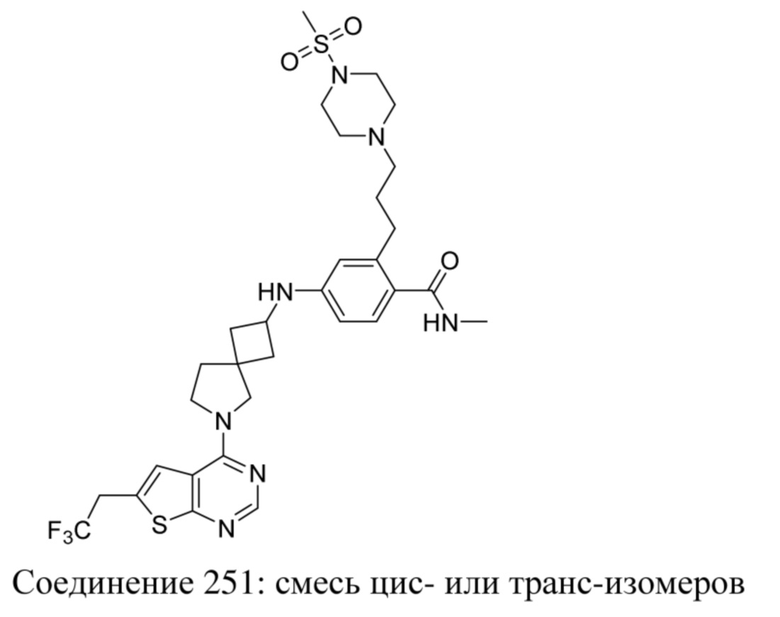
В перемешиваемый раствор промежуточного соединения 220 (30 мг, 0,08 ммоль) и промежуточного соединения 5 (27 мг, 0,08 ммоль) в MeOH (5 мл) при комнатной температуре добавляли декаборан (5 мг, 0,04 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь концентрировали и остаток очищали с помощью преп. HPLC с получением соединения 251 (смеси цис- и транс-изомеров) (9,2 мг, выход 16%) в виде белого твердого вещества.
Пример B159
Получение соединения 253 и соединения 254
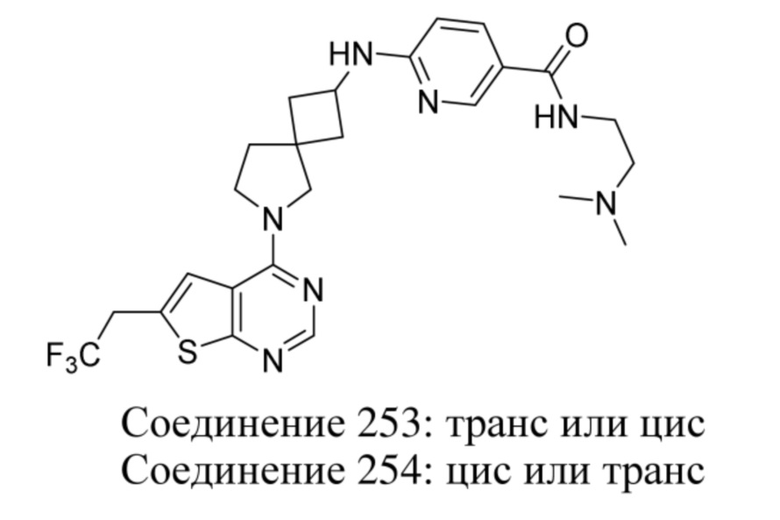
Перемешивали смесь соединения 229 (150 мг, 0,47 ммоль), 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидина (119 мг, 0,47 ммоль) и DIPEA (121 мг, 0,94 ммоль) в i-PrOH (3 мл) при комнатной температуре в течение 40 мин Реакционную смесь концентрировали при пониженном давлении. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 20 × 150 мм, 10 мкм, подвижная фаза A: 0,1% NH3 H2O, B: ACN) с получением смеси цис- и транс-изомеров (90 мг, выход 36%) в виде белого твердого вещества. Полученный продукт разделяли с помощью SFC (условие разделения: прибор: Waters-SFC80, колонка: AD-H (2,5 × 25 см, 10 мкм), подвижная фаза A: сверхкритический CO2, подвижная фаза B: MeOH/0,1% NH3, A:B=60/40 при 50 мл/мин, время цикла: 15 мин, объем впрыска: 3 мл, длина волны детектора: 254 нм, температура колонки: 25 градусов Цельсия, противодавление: 100 бар) с получением соединения 253 (35 мг, транс или цис) в виде белого твердого вещества и соединения 254 (53 мг, цис или транс) в виде белого твердого вещества.
Пример B161
Получение соединения 257
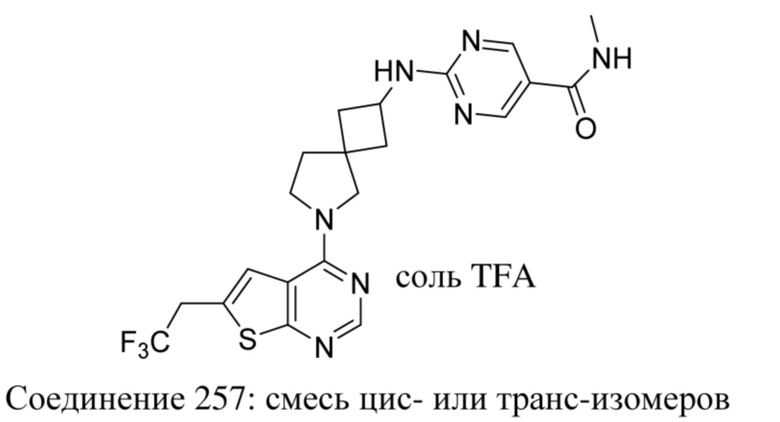
В раствор промежуточного соединения 239, представляющего собой 2-(6-азаспиро[3.4]октан-2-иламино)-N-метилпиримидин-5-карбоксамид (40 мг, неочищенное вещество), в IPA (10 мл) добавляли 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (38,6 мг, 0,15 ммоль), Et3N (30,9 мг, 0,30 ммоль). После перемешивания при к.т. в течение 3 ч смесь концентрировали и остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% TFA/H2O, B: ACN) с получением соединения 257 (смеси цис- и транс-изомеров) (15,72 мг, соль TFA, выход 22% за 2 стадии).
Пример B162
Получение соединения 258 и соединения 259
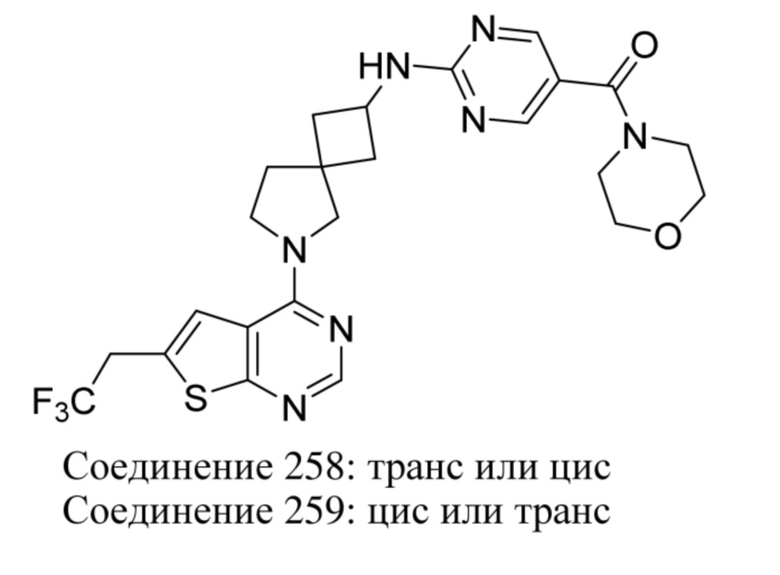
Перемешивали смесь промежуточного соединения 241 (430 мг, неочищенная соль TFA), 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидина (247 мг, 0,98 ммоль) и DIEA (379 мг, 2,94 ммоль) в i-PrOH (10 мл) при к.т. в течение 2 ч. После завершения реакции реакционную смесь концентрировали и остаток очищали с помощью преп. HPLC (Agilent G6120B, детектор G1315D DADVL и G4260B ELSD, Xbridge C18 5 мм 150 × 4,6 мм, подвижная фаза A: 0,1% NH4OH в воде, B: 0,1% NH4OH в CH3CN) с получением смеси цис- и транс-изомеров (350 мг, выход 67%) в виде белого твердого вещества. Смесь цис- и транс-изомеров разделяли с помощью SFC (SFC80, Waters; AS-H (2,5 × 25 см, 10 мкм); A: сверхкритический CO2, подвижная фаза B: MeOH; A:B=80/20; расход: 50 мл/мин; температура колонки (T): 25°C; BPR: 100 бар) с получением соединения 258 (транс или цис) (120 мг, Rt=2,654 мин) в виде белого твердого вещества и соединения 259 (цис или транс) (130 мг, Rt=3,371 мин в виде белого твердого вещества.
Пример B163
Получение соединения 260a
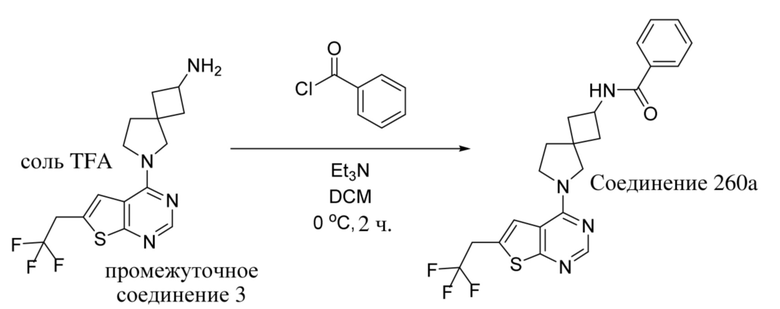
В перемешиваемый раствор промежуточного соединения 3 (400 мг, неочищенная соль TFA, примерно 1,17 ммоль) и Et3N (354 мг, 3,50 ммоль) в DCM (20 мл) при 0°C добавляли бензоилхлорид (163 мг, 1,17 ммоль). Реакционную смесь перемешивали при 0°C в течение 2 ч. Реакционную смесь разбавляли водой (20 мл) и экстрагировали с помощью DCM (50 мл × 3). Объединенные органические экстракты промывали солевым раствором, высушивали над безводным Na2SO4 и концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением необходимого соединения 260a (120 мг, выход 22%) в виде белого твердого вещества.
Пример B164
Получение соединения 261 и соединения 262
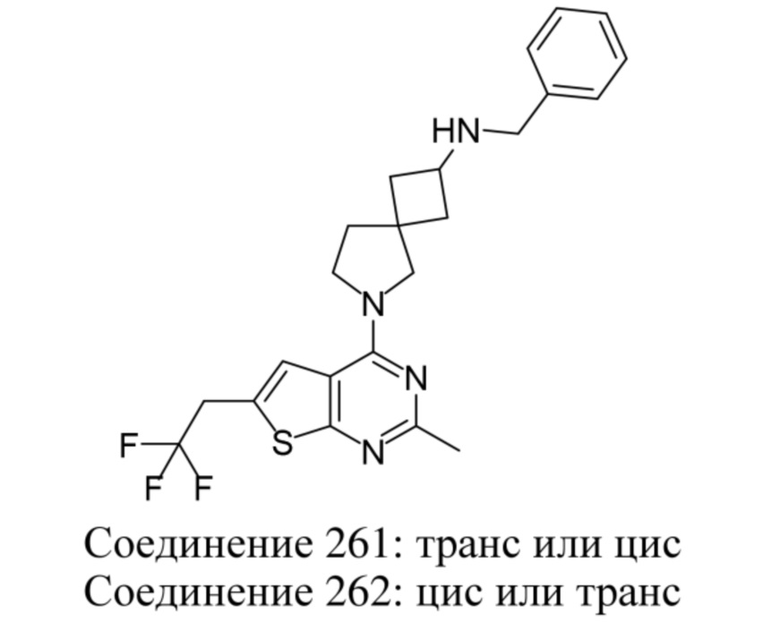
В перемешиваемый раствор промежуточного соединения 244 (150 мг, 0,42 ммоль), бензальдегида (58 мг, 1,3 ммоль) и Ti(i-PrO)4 (488 мг, 1,72 ммоль) в MeOH (5 мл) добавляли NaBH(OAc)3 (267 мг, 1,26 ммоль). Реакционную смесь перемешивали при к. т. в течение 1 ч Реакционную смесь гасили с помощью H2O (5 мл) и экстрагировали с помощью DCM (10 мл × 2). Объединенные органические слои промывали солевым раствором (20 мл), высушивали (с помощью безводного Na2SO4), фильтровали и концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% TFA/H2O, B: ACN) и полученный продукт обрабатывали с помощью ионообменной смолы Amberlyst A-21 в MeOH (5 мл) в течение 10 мин и фильтровали. Фильтрат концентрировали с получением необходимого продукта (смеси цис- и транс-изомеров) (120 мг). Полученный продукт разделяли с помощью SFC (SFC80, Waters; AD (2,5 × 25 см, 10 мкм); A: сверхкритический CO2, подвижная фаза B: EtOH/ACN=85/15; A:B=60/40; расход: 70 мл/мин; температура колонки (T) в 25°C; BPR: 100 бар) с получением соединения 261 (транс или цис) (46 мг, выход 38%) и соединения 262 (цис или транс) (32 мг, выход 26%).
Пример B165
Получение соединения 263
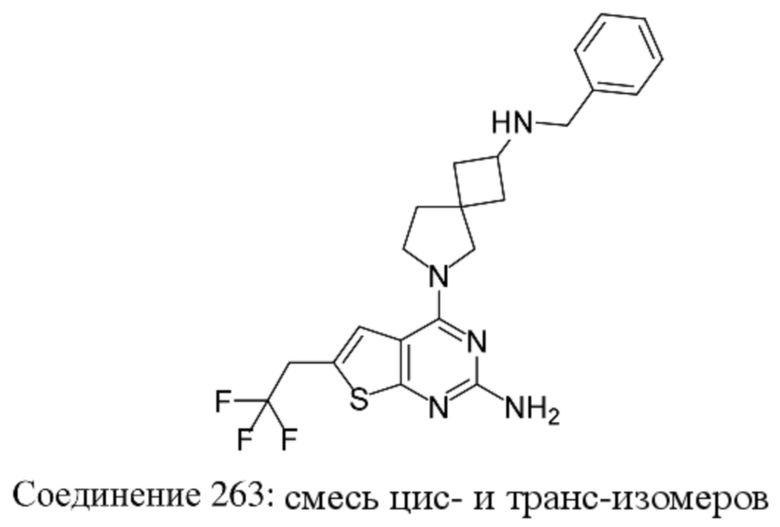
В перемешиваемую смесь промежуточного соединения 248 (160 мг, 0,448 ммоль), бензальдегида (95 мг, 0,895 ммоль) и Ti(i-PrO)4 (127 мг, 0,448 ммоль) в DCE/DMSO (6 мл/1 мл) при комнатной температуре добавляли порциями NaBH(OAc)3 (285 мг, 1,34 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь гасили с помощью водн. NaHCO3 и экстрагировали с помощью DCM. Объединенные органические экстракты промывали солевым раствором, высушивали над безводным Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением соединения 263 (смеси цис- и транс-изомеров) (20 мг) в виде белого твердого вещества.
Пример B166
Получение соединения 264 и соединения 265
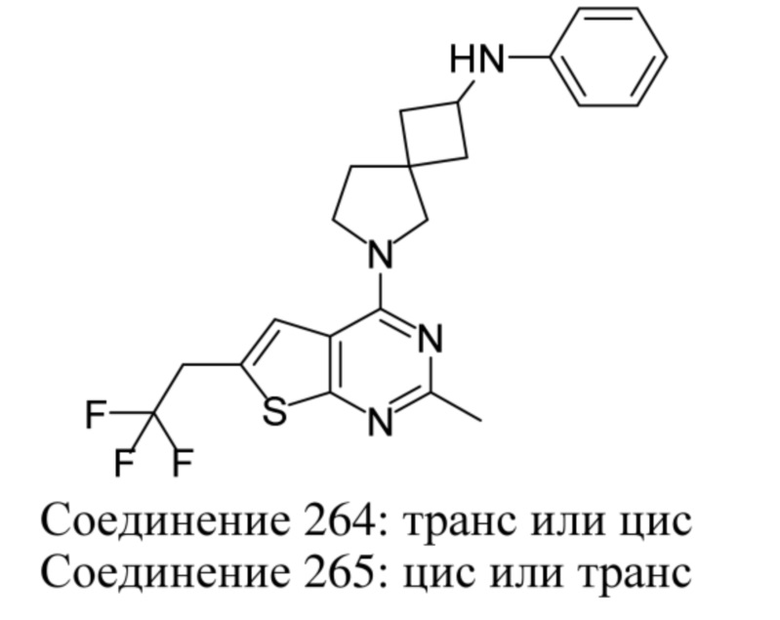
Перемешивали смесь промежуточного соединения 244 (150 мг, 0,42 ммоль), бромбензола (198 мг, 1,26 ммоль), BrettPhos (30 мг, 0,06 ммоль), Pd2(dba)3 (30 мг, 0,03 ммоль) и t-BuONa (161 мг, 0,84 ммоль) в 1,4-диоксане (4 мл) при 130°C в течение 2 ч при микроволновом облучении. Охлажденную реакционную смесь разбавляли с помощью H2O (10 мл) и экстрагировали с помощью EtOAc (20 мл × 3). Объединенные органические экстракты промывали солевым раствором (20 мл × 2), высушивали над безводным Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью преп. HPLC (Xbridge C18 5 мм 150 × 4,6 мм, подвижная фаза A: 0,1% NH4OH в воде, B: 0,1% NH4OH в CH3CN) с получением необходимого продукта (смеси цис- и транс-изомеров) (115 мг). Полученный продукт разделяли с помощью SFC (UPC2, Waters; IE, 5 мкм, 4,6 × 250 (Daicel); подвижная фаза: CO2/EtOH/ACN/DEA, 60/34/6/0,08; расход составляет 2,8 мл/мин; T колонки - 35°C; BPR в 100 бар) с получением соединения 264 (транс или цис) (9 мг, выход 7,8%) и соединения 265 (цис или транс) (20 мг, выход 17%).
Пример B167
Получение соединения 266 и соединения 267
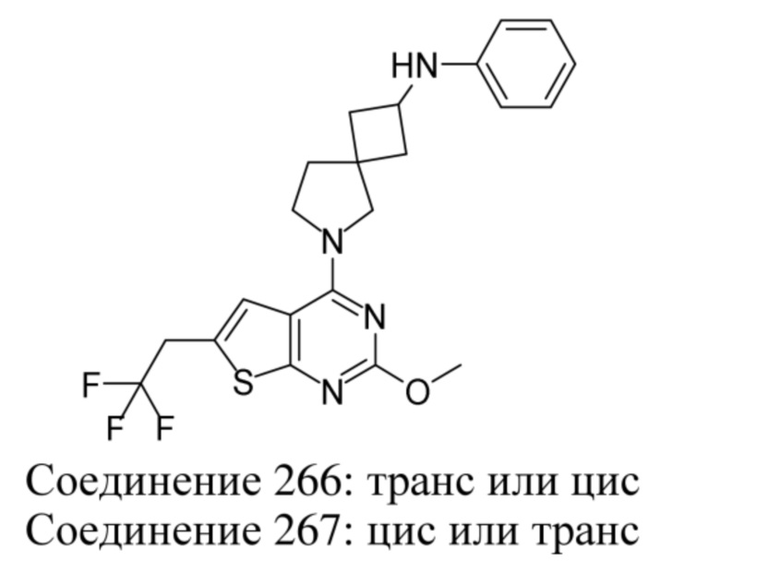
Перемешивали смесь промежуточного соединения 19 (150 мг, 0,40 ммоль), бромбензола (198 мг, 1,26 ммоль), BrettPhos (30 мг, 0,06 ммоль), Pd2(dba)3 (30 мг, 0,03 ммоль) и t-BuONa (161 мг, 0,84 ммоль) в 1,4-диоксане (4 мл) при 130°C в течение 2 ч при микроволновом облучении. Охлажденную реакционную смесь разбавляли водой (10 мл) и экстрагировали с помощью EtOAc (20 мл × 3). Объединенные органические экстракты промывали солевым раствором (20 мл × 2), высушивали над безводным Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью преп. HPLC (Xbridge C18 5 мм 150 × 4,6 мм, подвижная фаза A: 0,1% NH4OH в воде, B: 0,1% NH4OH в CH3CN) с получением необходимого продукта (смеси цис- и транс-изомеров) (150 мг). Полученный продукт разделяли с помощью SFC (SFC80, Waters, IE-H, 2,5 × 25 см, 10 мкм, A: сверхкритический CO2, B: MeOH; A:B=60/40; расход: 80 мл/мин; температура колонки (T): 25°C; BPR: 100 бар) с получением соединения 266 (транс или цис) (75 мг, выход 50%) и соединения 267 (цис или транс) (20 мг, выход 13%).
Пример B168
Получение соединения 268 и соединения 269
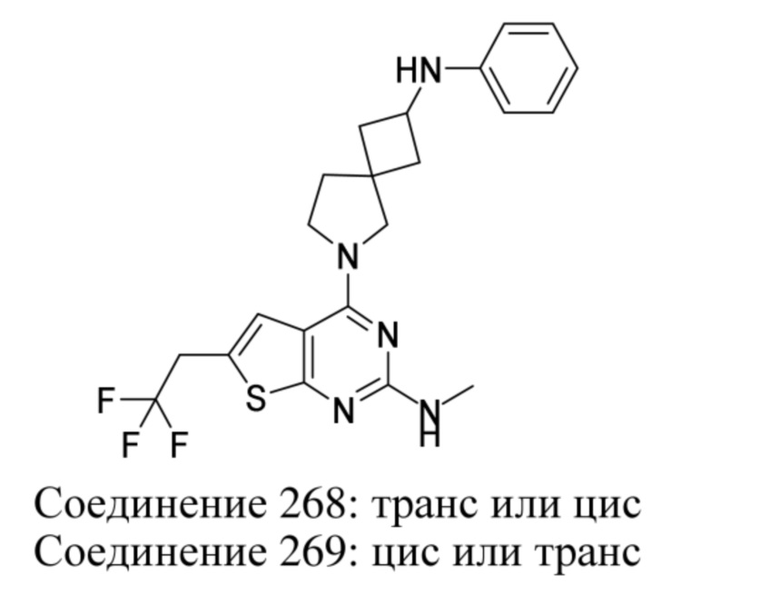
Закрывали смесь промежуточного соединения 251 (400 мг, 0,883 ммоль) в CH3NH2 (2 М в THF (10 мл)) и перемешивали при 100°C в течение ночи. Смесь концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% TFA), B: ACN) с получением необходимого продукта (смеси цис- и транс-изомеров). Полученный продукт разделяли с помощью SFC (SFC80, Waters; OD, 2,5 × 25 см, 10 мкм; A: сверхкритический CO2, подвижная фаза B: EtOH/ACN=85/15; A:B=60/40; расход: 50 г/мин; температура колонки (T): 35°C; противодавление (BPR): 100 бар) с получением соединения 268 (транс или цис) (61,1 мг, выход 15%) в виде белого твердого вещества и соединения 269 (цис или транс) (82,9 мг, выход 20%) в виде белого твердого вещества.
Пример B169
Получение соединения 270
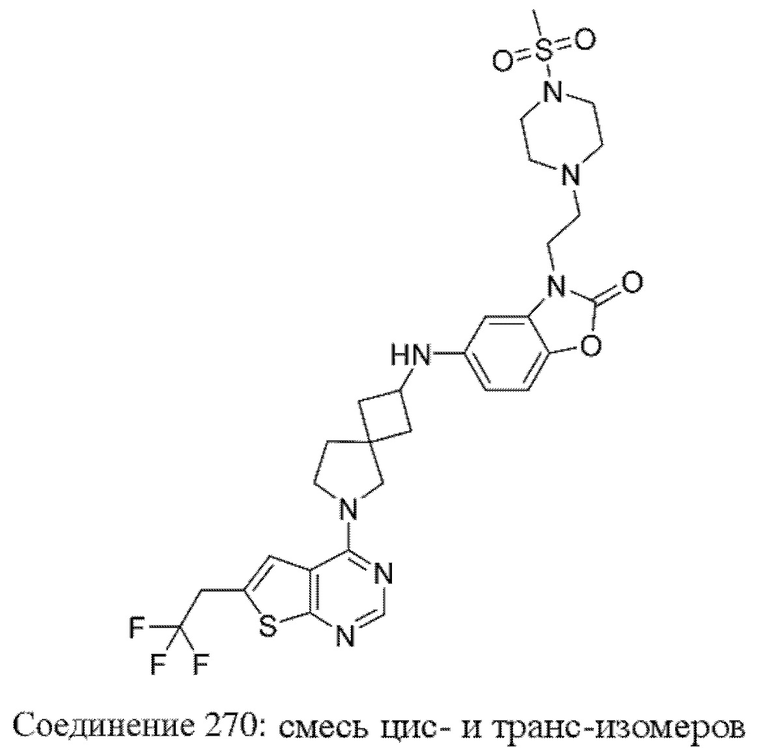
В смесь промежуточного соединения 208 (270 мг, 0,67 ммоль), промежуточного соединения 3 (230 мг, 0,67 ммоль, соль TFA), Cs2CO3 (655 мг, 2,0 ммоль) и BrettPhos (72 мг, 0,13 ммоль) в 1,4-диоксане (5 мл) в атмосфере Ar при комнатной температуре добавляли Pd(dba)2 (61 мг, 0,06 ммоль). Смесь перемешивали в атмосфере Ar при 90°C в течение 16 ч. Охлажденную реакционную смесь фильтровали и фильтрат концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 19 × 150 мм, 10 мкм, подвижная фаза A: H2O (0,1% NH4OH), B: ACN) с получением соединения 270 (смеси цис- и транс-изомеров) (60 мг, выход 13%) в виде белого твердого вещества.
Пример B170
Получение соединения 271
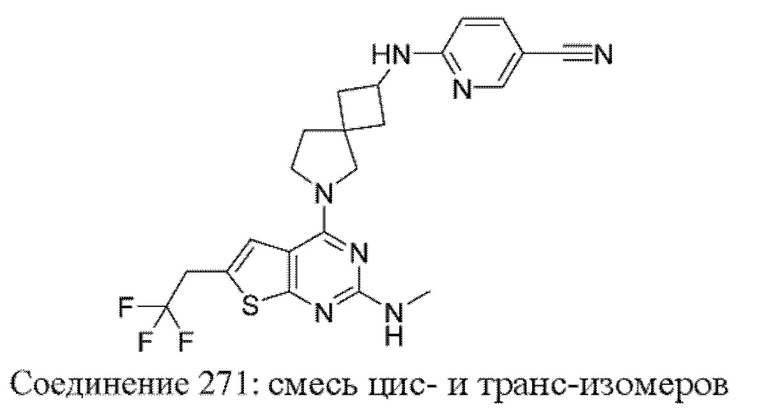
В перемешиваемый раствор промежуточного соединения 20 (200 мг, 0,54 ммоль) в i-PrOH (3 мл) при к.т. добавляли 6-фторникотинонитрил (№ по CAS: 3939-12-6) (65 мг, 0,54 ммоль) и DIPEA (208 мг, 1,62 ммоль). Реакционную смесь перемешивали при 80°C в течение ночи. Охлажденную реакционную смесь концентрировали и остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% NH4OH/H2O, B: ACN) с получением соединения 271 (смеси цис- и транс-изомеров) (36,5 мг, выход 21% за 4 стадии) в виде белого твердого вещества.
Пример B171
Получение соединения 272 и соединения 273
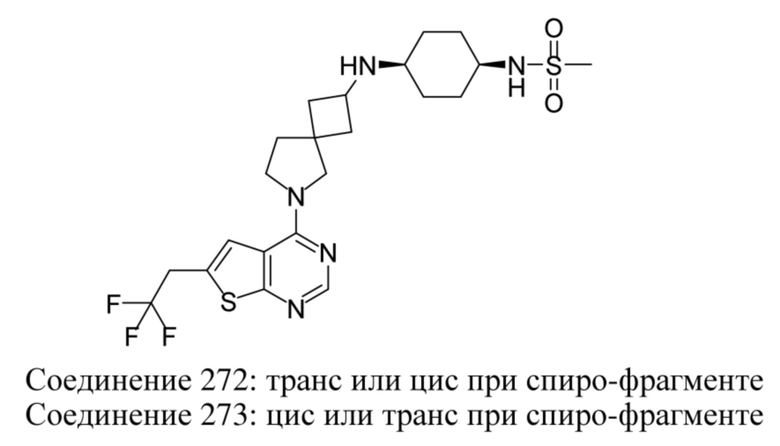
Перемешивали смесь промежуточного соединения 5 (300 мг, 0,880 ммоль), цис-N-4-аминоциклогексил)метансульфонамида (№ по CAS: 1259021-50-5) (169 мг, 0,880 ммоль) и Ti(i-PrO)4 (1250 мг, 4,40 ммоль) в MeOH (5 мл) перемешивали при 50°C в течение 3 ч. Затем добавляли NaBH3CN (110 мг, 1,76 ммоль) при к. т. Реакционную смесь перемешивали при к. т. в течение 3 ч. Добавляли водн. раствор HCl (1 М) до pH < 7. Полученное вещество экстрагировали с помощью EtOAc (50 мл × 3). Объединенные органические экстракты промывали солевым раствором (50 мл × 2), высушивали над безводным Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью флэш-хроматографии на силикагеле (элюент: DCM:MeOH=10:1, об./об.) с получением необходимого продукта (смеси цис- и транс-изомеров при спиро-фрагменте) (180 мг). Полученный продукт разделяли с помощью SFC (SFC80, Waters; AD-H 0,46 × 15 см, 2 мкм; HEP:ETOH (0,1% DEA) = 60:40; расход: 50 мл/мин; температура колонки (T): 25°C; BPR=100 бар) с получением соединения 272 (транс или цис при спиро-фрагменте) (40 мг, выход 8,8%) и соединения 273 (цис или транс при спиро-фрагменте) (35 мг, выход 7,7%) в виде белого твердого вещества.
Пример B172
Получение соединения 274 и соединения 275
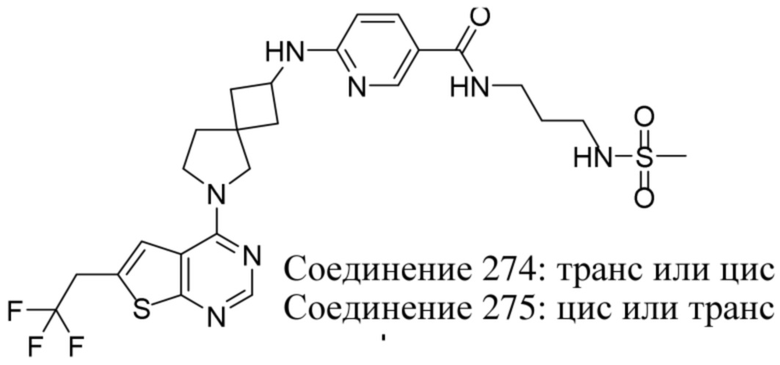
В перемешиваемую смесь промежуточного соединения 254 (414 мг, 0,80 ммоль) в DCM (20 мл) при 0°C добавляли по каплям Et3N (1,5 мл) и MsCl (183 мг, 1,6 ммоль). Полученную смесь перемешивали при к. т. в течение 4 ч Реакционную смесь разбавляли водой (40 мл) и экстрагировали с помощью EA (30 мл × 2). Объединенные органические экстракты промывали солевым раствором дважды, высушивали над безводным Na2SO4, фильтровали и концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: Waters Xbridge 20 × 150 мм, 10 мкм, подвижная фаза A: 0,1% NH3 H2O, B: ACN) с получением необходимого продукта (смеси цис- и транс-изомеров) (130 мг) в виде белого твердого вещества. Полученный продукт разделяли с помощью SFC (Waters-SFC80, колонка: OJ (2,5 × 25 см, 10 мкм) подвижная фаза A: сверхкритический CO2, подвижная фаза B: MeOH/0,01% NH3, A:B=80/20 при 60 мл/мин, длина волны детектора: 214 нм, температура колонки (T): 25°C; BPR: 100 бар) с получением соединения 274 (транс или цис) (35 мг, выход 7%) в виде белого твердого вещества и соединения 275 (цис или транс) (60 мг, выход 12%) в виде белого твердого вещества.
Пример B173
Получение соединения 276
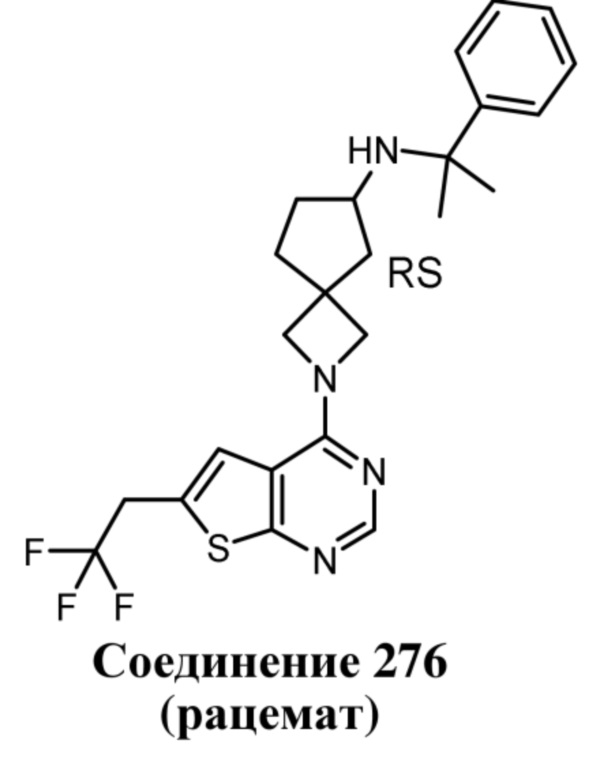
В пробирку для микроволновой обработки добавляли промежуточное соединение 4, представляющее собой 2-(6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин-4-ил)-2-азаспиро[3.4]октан-6-он (180 мг, 0,53 ммоль), 2-фенилпропан-2-амин (85,6 мг, 0,63 ммоль), уксусную кислоту (95,0 мг, 1,58 ммоль) и 1,2-дихлорэтан (10 мл). Полученную смесь нагревали при 100°C в течение 20 минут с помощью микроволнового облучения и охлаждали до приблизительно 25°C, затем добавляли триацетоксиборогидрид натрия (335 мг, 1,58 ммоль). Полученную смесь нагревали при 100°C в течение еще 20 минут с помощью микроволнового облучения. Реакционную смесь охлаждали до 25°C и выливали в дихлорметан (30 мл), после чего промывали водой (20 мл × 3). Органические экстракты высушивали над безводным Na2SO4, фильтровали и концентрировали до сухого состояния при пониженном давлении с получением остатка, который очищали с помощью хроматографии с обращенной фазой (колонка: Phenomenex Gemini 150 × 25 мм × 10 мкм, подвижная фаза A: вода (0,05% гидроксида аммиака, об./об.)-ACN, подвижная фаза B: ацетонитрил, расход: 25 мл/мин, при условии градиента от 50% B до 80%). Чистые фракции собирали и растворитель выпаривали в вакууме. Остаток разделяли между ацетонитрилом (2 мл) и водой (10 мл). Смесь лиофилизировали до сухого состояния с получением соединения 276 (рацемат) (8,3 мг, выход 3,39%) в виде желтого липкого масла.
Пример B174
Получение соединения 277
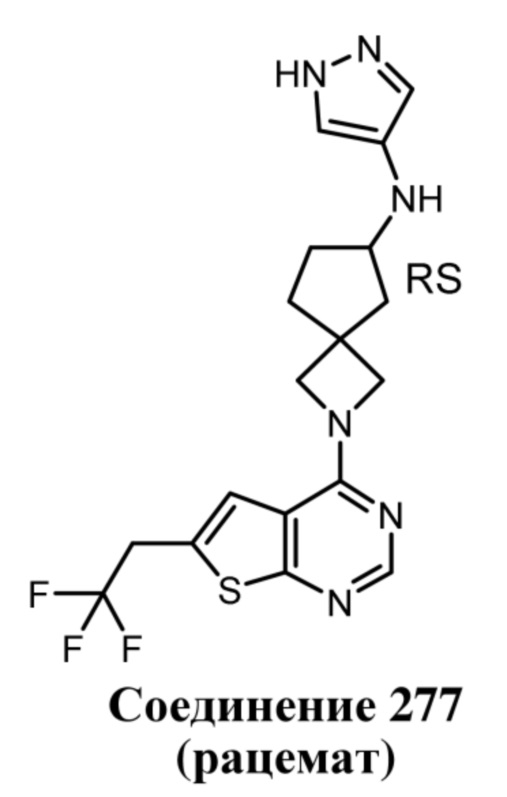
Добавляли промежуточное соединение 4, представляющее собой 2-(6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин-4-ил)-2-азаспиро[3.4]октан-6-он (110 мг, 0,32 ммоль), 1H-пиразол-4-амин (32,1 мг, 0,39 ммоль), уксусную кислоту (0,1 мл) и сухой DCM (5 мл) в круглодонную колбу объемом 100 мл. Полученную смесь перемешивали при 40°C в течение 1 ч. Затем в смесь добавляли триацетоксиборогидрид натрия (273 мг, 1,29 ммоль). Полученную смесь перемешивали при 40°C в течение еще 1 ч. Реакционную смесь выливали в DCM (30 мл), после чего промывали водой (20 мл × 3). Органические экстракты высушивали над безводным Na2SO4, фильтровали и концентрировали до сухого состояния при пониженном давлении с получением остатка, который очищали с помощью преп. TLC (SiO2, дихлорметан:метанол=10:1, Rf=0,5) с получением соединения 277 (рацемат) (34,6 мг, выход 25,2%) в виде белых твердых веществ.
Пример B175
Получение соединения 278
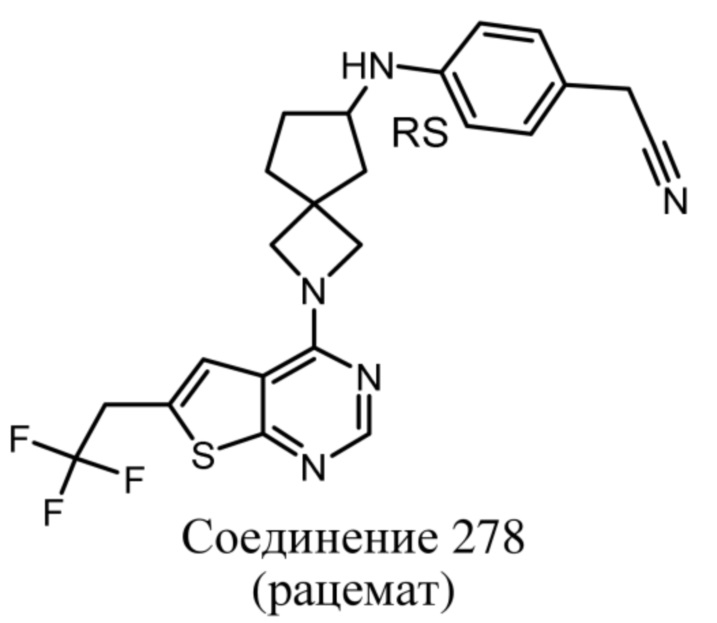
Добавляли промежуточное соединение 4, представляющее собой 2-(6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин-4-ил)-2-азаспиро[3.4]октан-6-он (100 мг, 0,293 ммоль), 2-(4-аминофенил)ацетонитрил (58,1 мг, 0,440 ммоль), молекулярное сито, уксусную кислоту (0,1 мл) и ацетонитрил (5 мл) в стеклянный флакон объемом 40 мл, полученную смесь перемешивали при 40°C в течение 2 ч. Затем добавляли триацетоксиборогидрид натрия (248 мг, 1,17 ммоль) в смесь, которую перемешивали при 40°C в течение еще 2 ч. Смесь суспендировали в воде (50 мл) и водный слой экстрагировали с помощью DCM (20 мл × 3). Объединенные органические слои высушивали (с помощью безводного Na2SO4), фильтровали и концентрировали при пониженном давлении с получением неочищенного продукта, который очищали с помощью преп. HPLC (колонка: DuraShell 150 × 25 мм × 5 мкм, подвижная фаза A: вода (10 мМ NH4HCO3), подвижная фаза B: ацетонитрил, расход: 25 мл/мин, при условии градиента от 40% B до 70%). Чистые фракции собирали и растворитель выпаривали в вакууме. Остаток разделяли между ацетонитрилом (2 мл) и водой (10 мл). Раствор лиофилизировали до сухого состояния с получением соединения 278 (рацемат) (36,8 мг, выход 26,6%) в виде желтого порошка.
Пример B176
Получение соединения 279
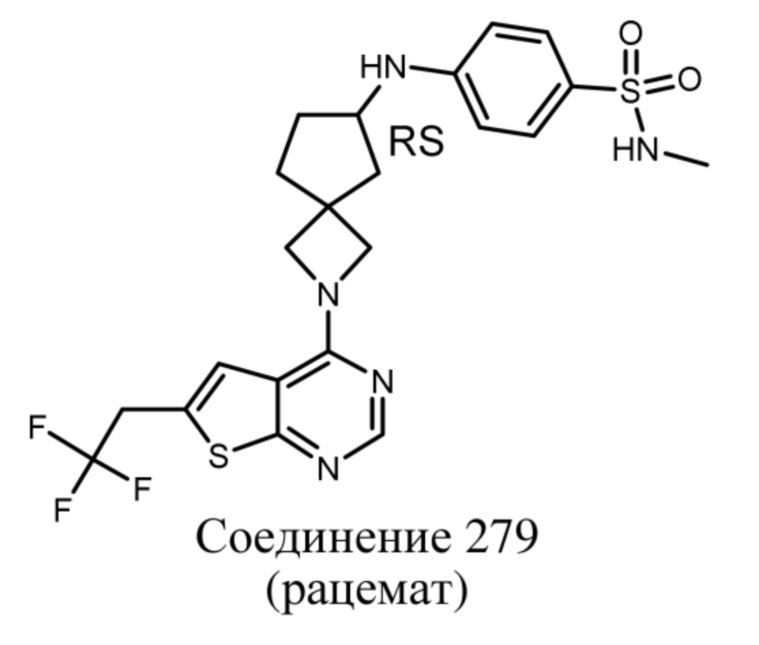
Добавляли промежуточное соединение 4, представляющее собой 2-(6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин-4-ил)-2-азаспиро[3.4]октан-6-он (244 мг, 0,72 ммоль), 4-амино-N-метилбензолсульфонамид (200 мг, 1,07 ммоль), цианоборогидрид натрия (90 мг, 1,43 ммоль) и сухой метанол (9,5 мл) в стеклянный флакон объемом 40 мл и затем добавляли уксусную кислоту (86,0 мг, 1,43 ммоль) в сухом метаноле (0,5 мл). Полученную смесь перемешивали при 45°C в течение 8 ч. Смесь концентрировали при пониженном давлении с получением остатка, который растворяли в DCM (30 мл), после чего промывали водой (20 мл × 3). Органические экстракты высушивали над безводным Na2SO4, фильтровали и концентрировали до сухого состояния при пониженном давлении с получением остатка, который очищали с помощью преп. HPLC (колонка: Xbridge 150 × 30 мм × 10 мкм, подвижная фаза A: вода (0,05% гидроксида аммиака, об./об.)-ACN, подвижная фаза B: ацетонитрил, расход: 25 мл/мин, при условии градиента от 35% B до 65%). Чистые фракции собирали и растворитель выпаривали в вакууме. Остаток разделяли между CH3CN (2 мл) и водой (10 мл). Смесь лиофилизировали до сухого состояния с получением соединения 279 (рацемат) (115,0 мг, выход 29,9%) в виде белого порошка.
Следующие соединения получали, начиная с промежуточного соединения 4 и соответствующего амина, с применением способа восстановительного аминирования, аналогичного применяемому для получения соединения 276, соединения 277 или соединения 279, указанных в таблице ниже; при этом применяли один из следующих 4 растворителей: DCM, DCE, MeOH, MeCN.
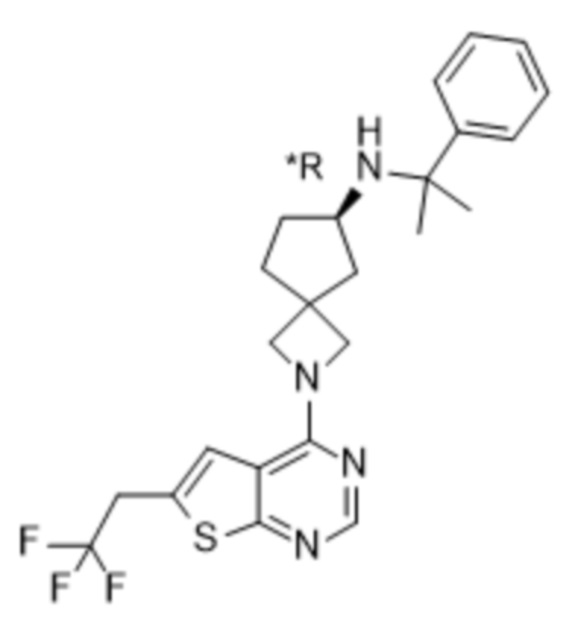
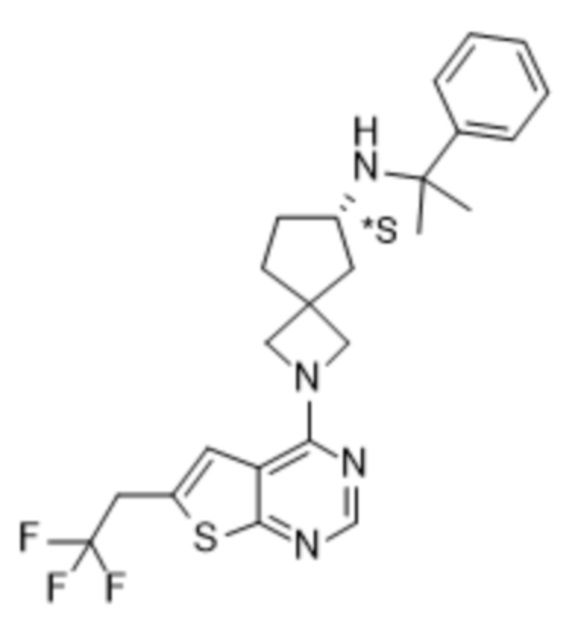
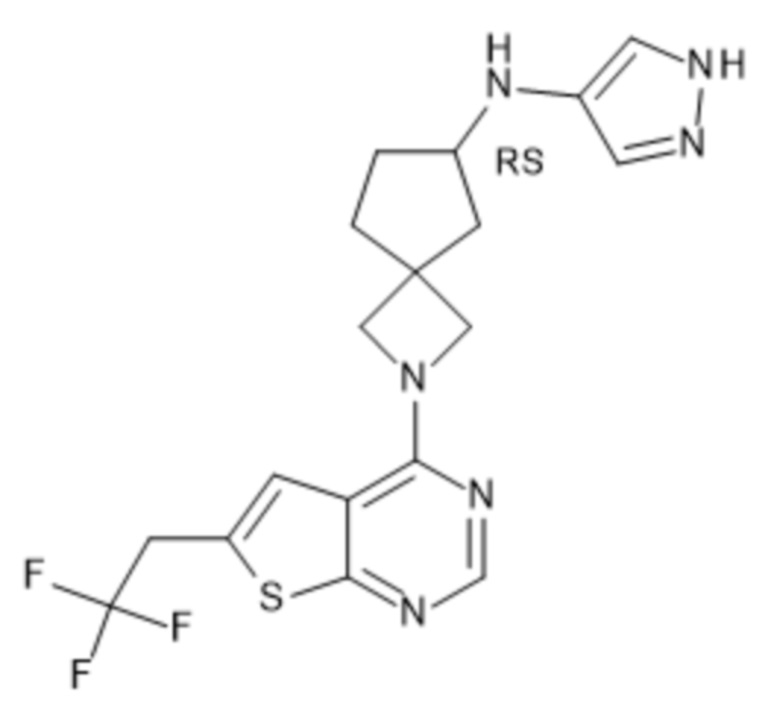
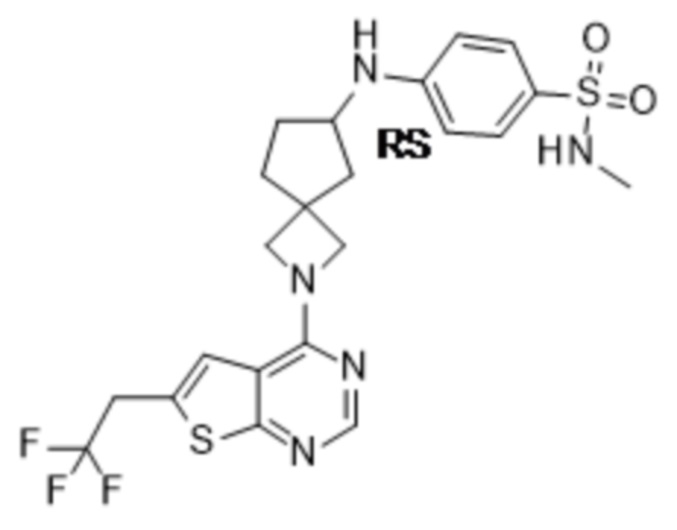
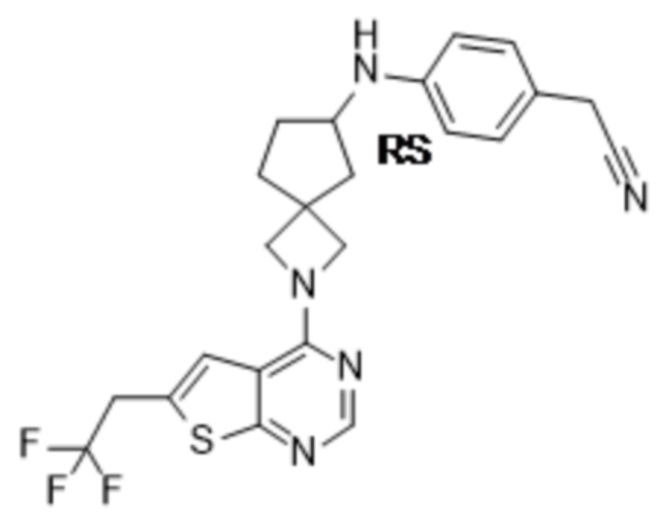
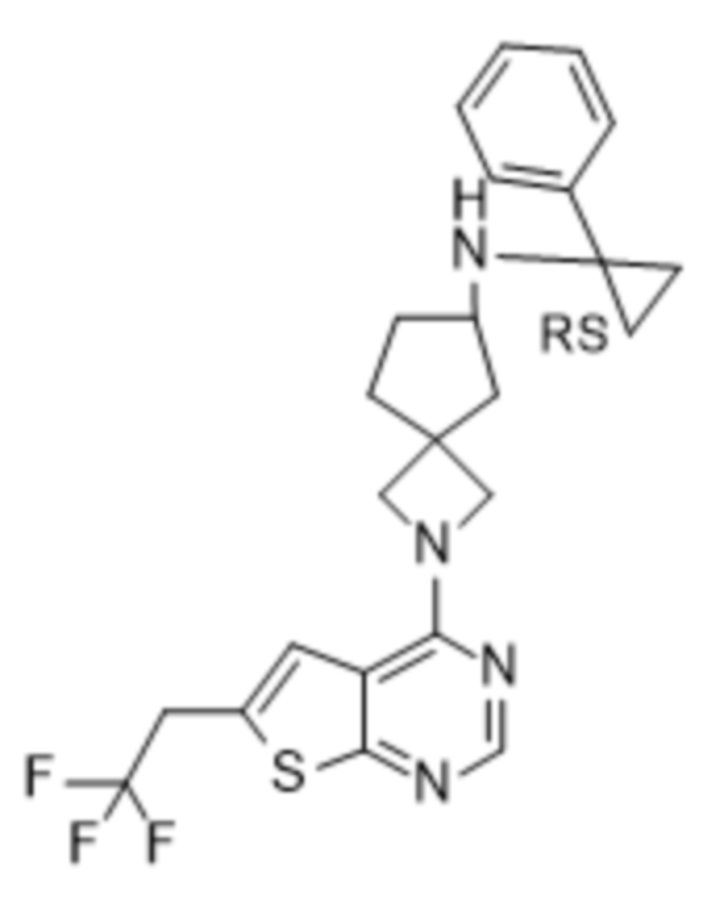
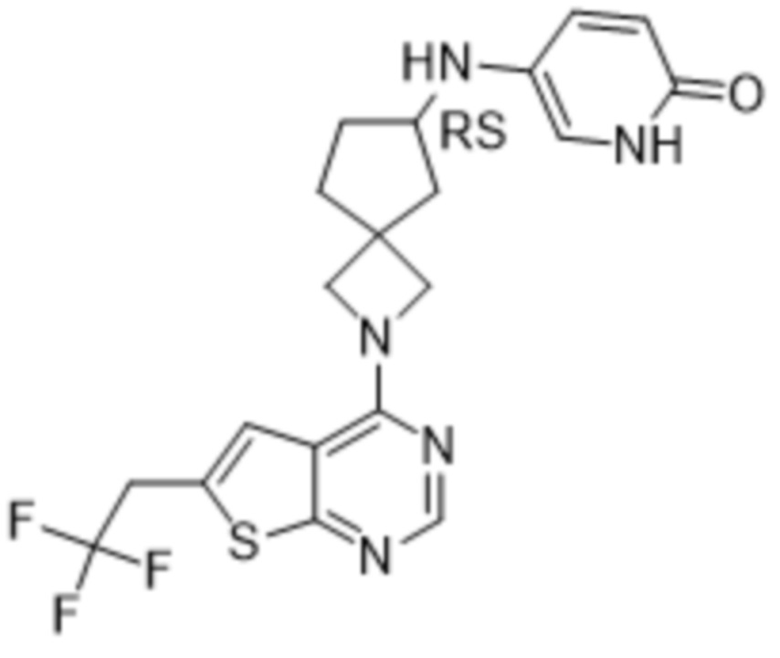
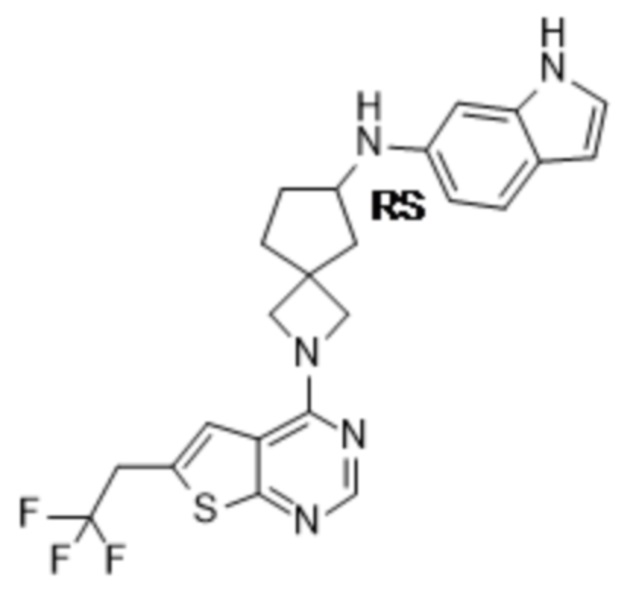
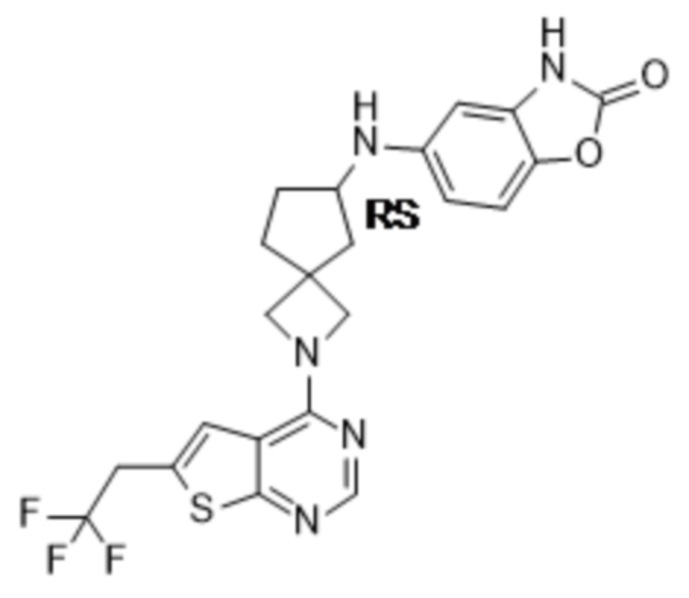
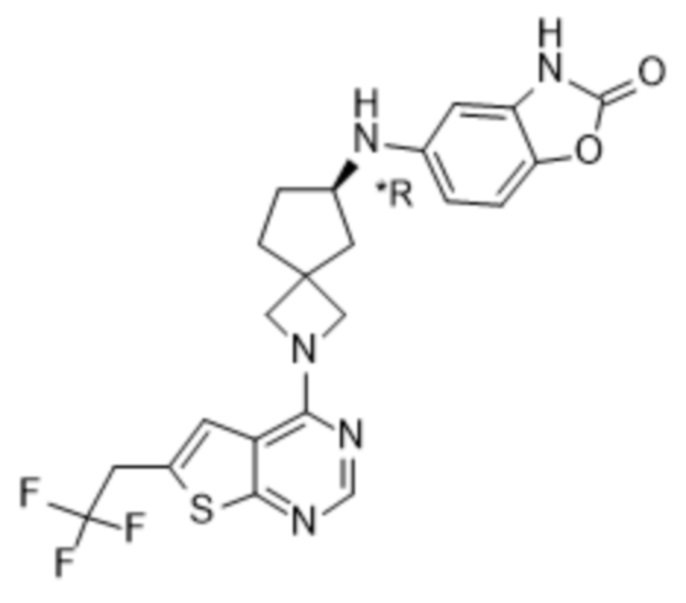
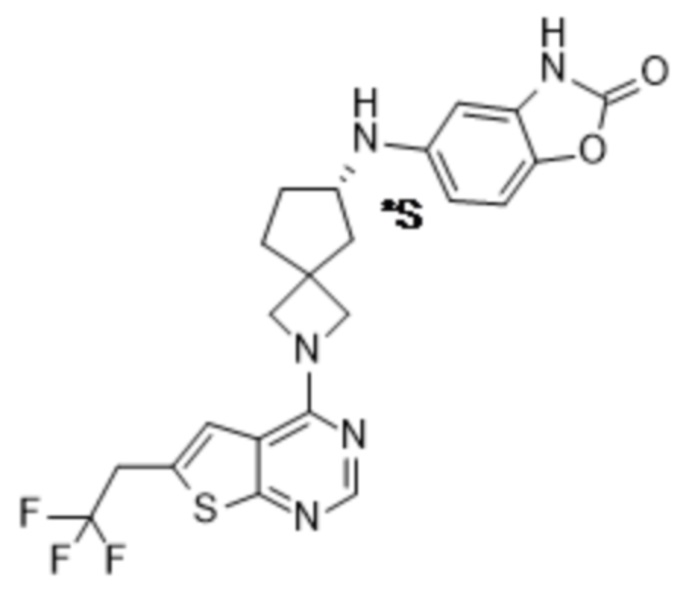
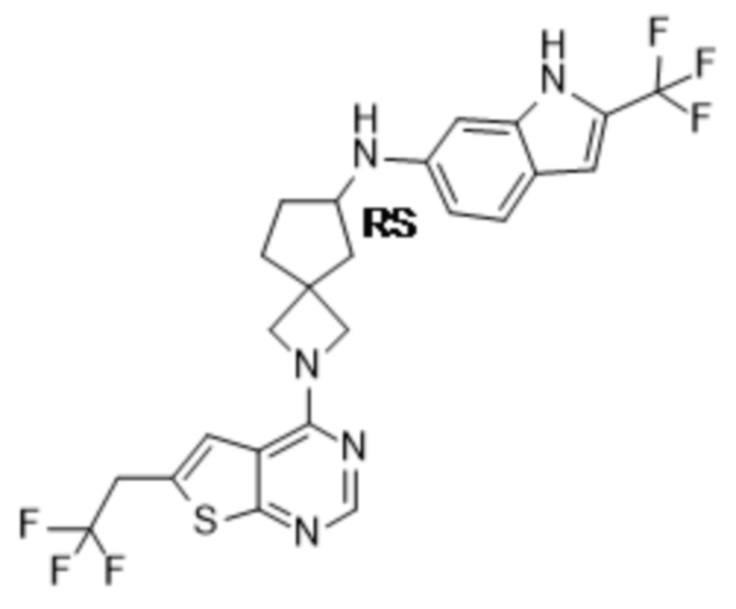
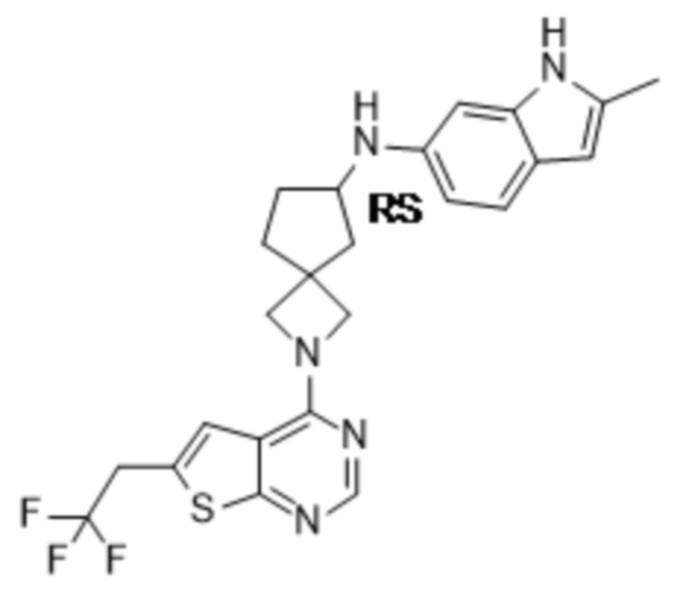

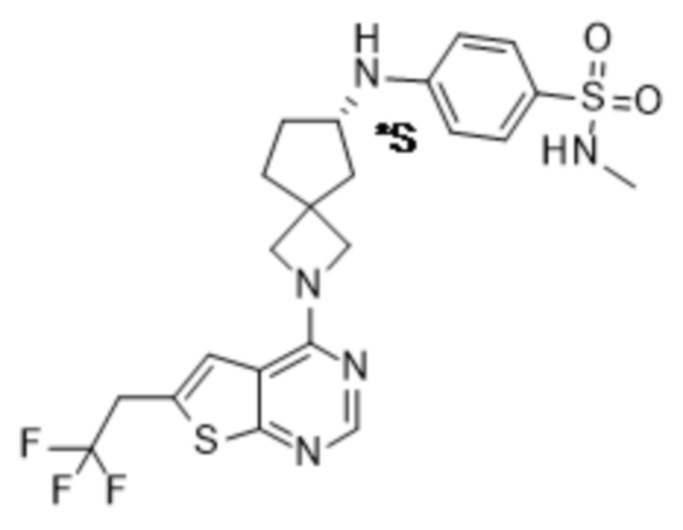

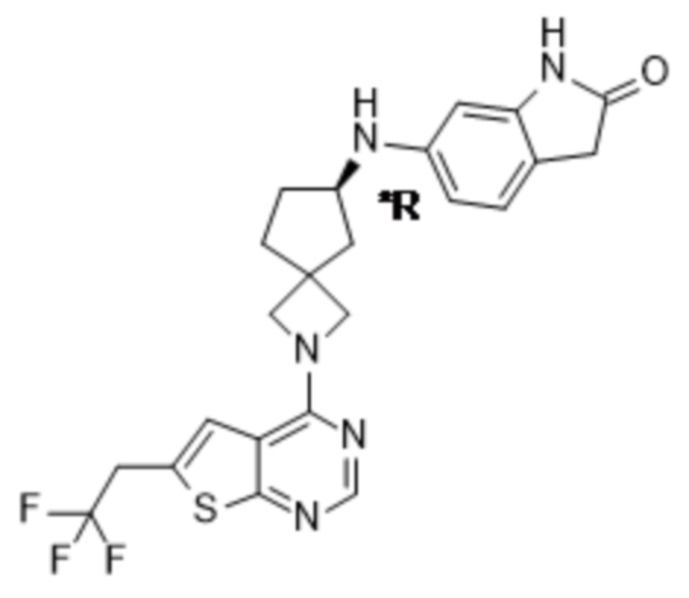
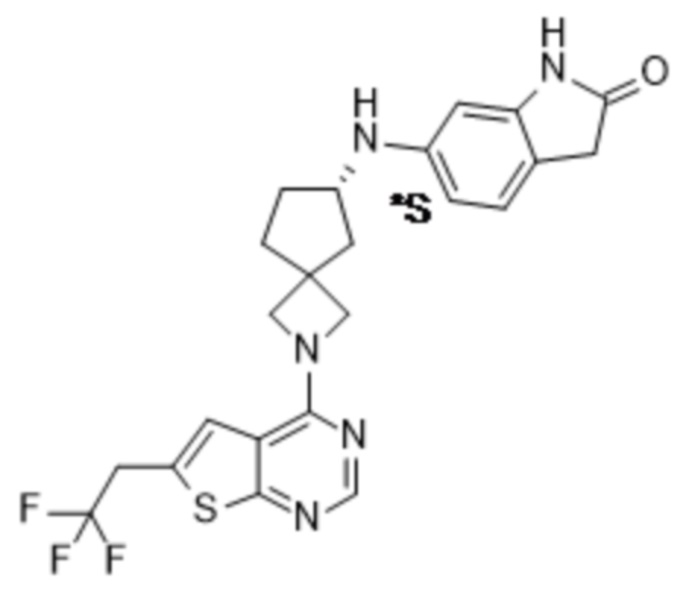
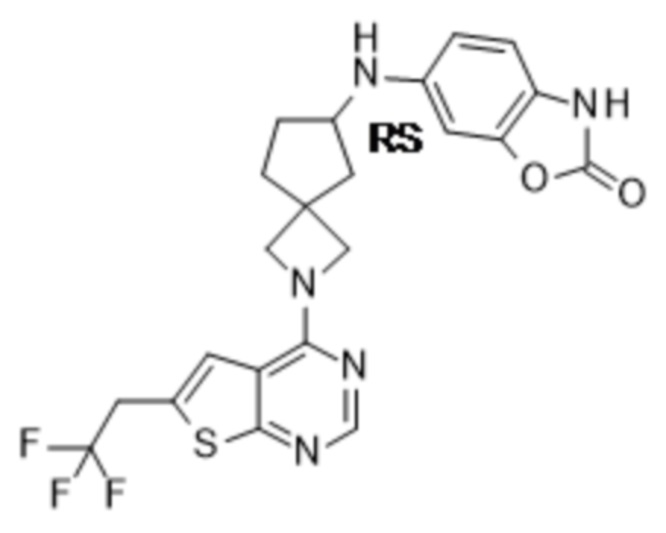
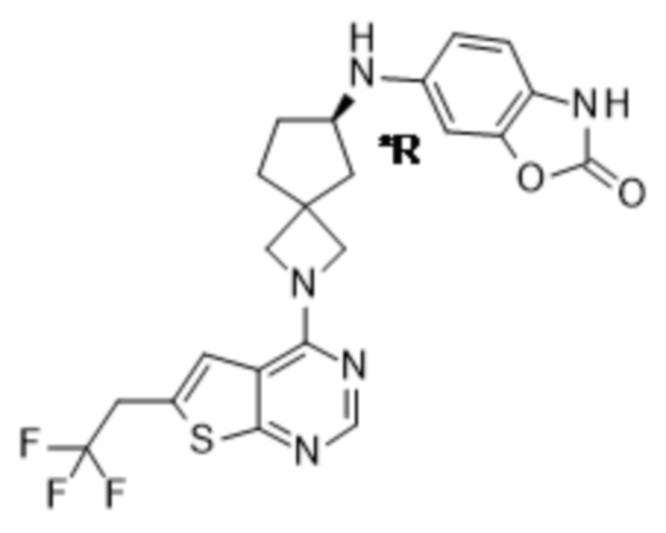
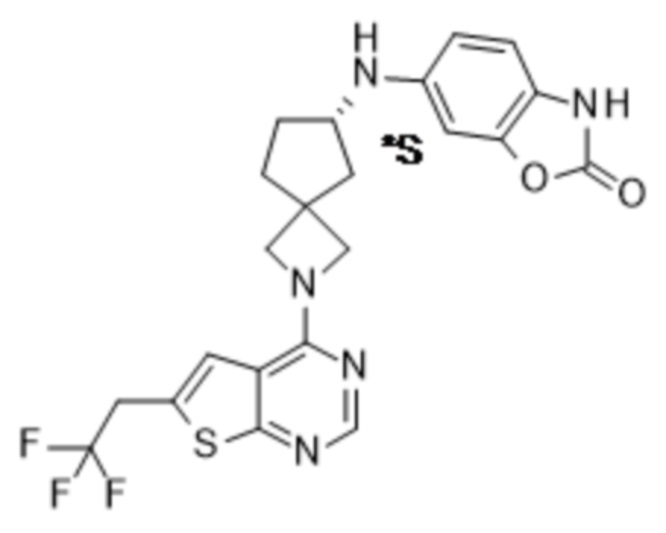
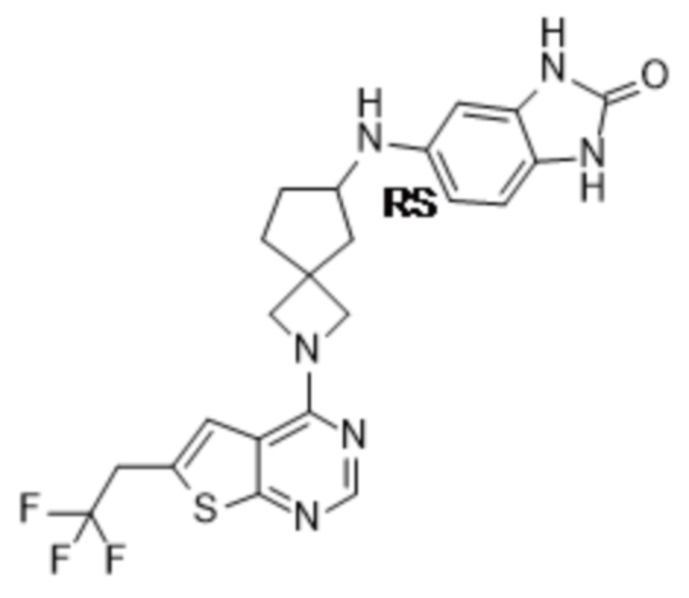
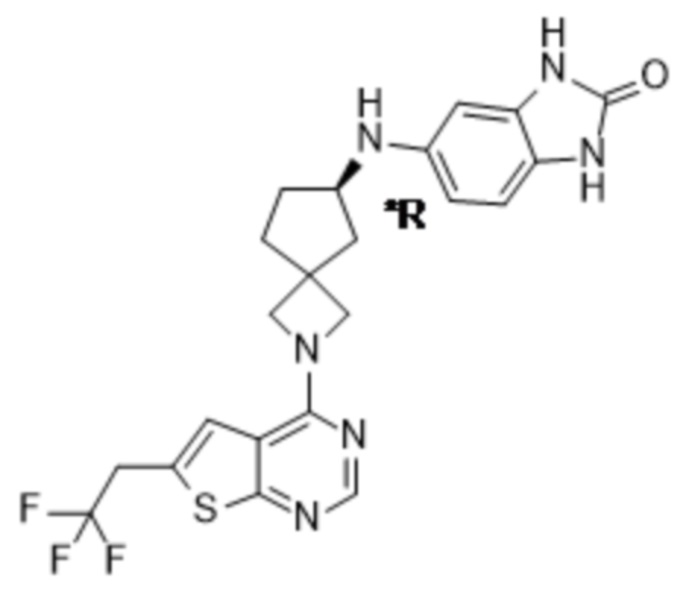

(из промежуточного соединения 4 и промежуточного соединения 255)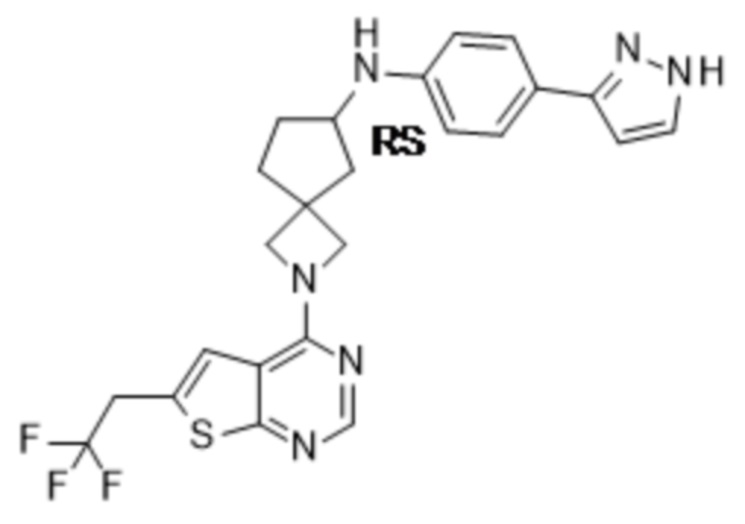
(из промежуточного соединения 4 и промежуточного соединения 260)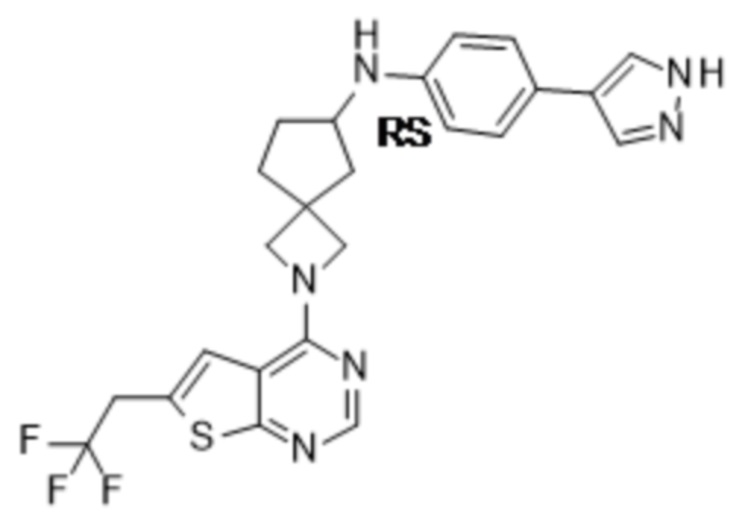
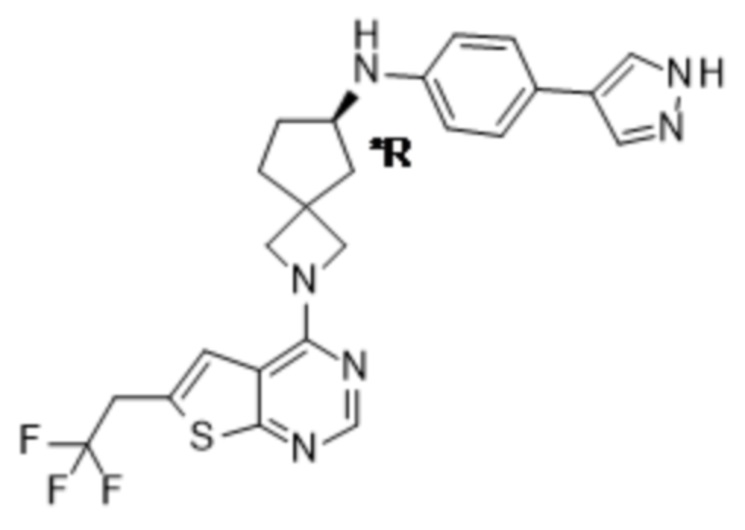
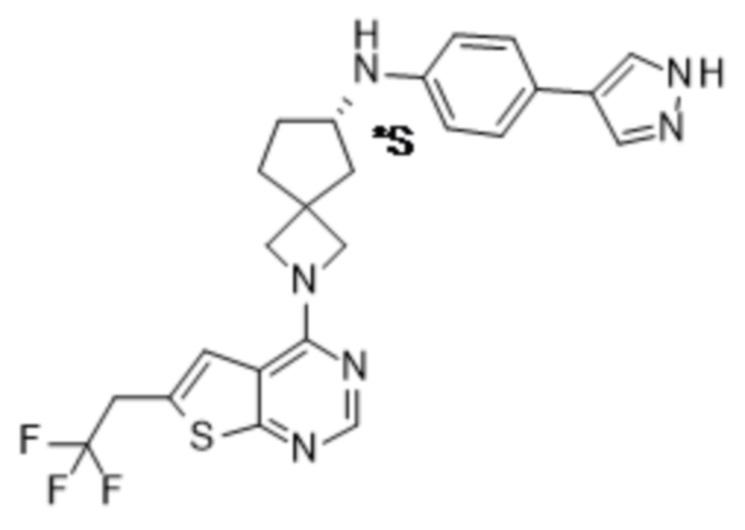
Пример B177
Получение соединения 305
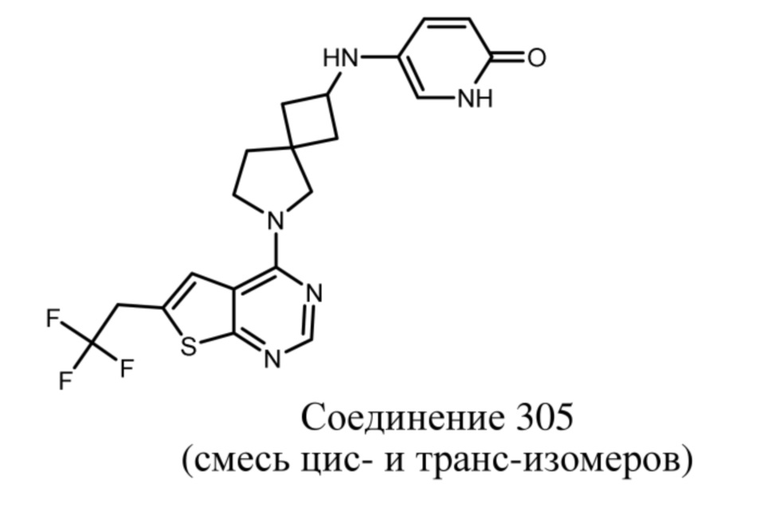
Обрабатывали смесь растворов, состоящую из промежуточного соединения 5, представляющего собой 6-(6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин-4-ил)-6-азаспиро[3.4]октан-2-он (160 мг, 0,469 ммоль), 5-аминопиридин-2(1H)-она (82,6 мг, 0,750 ммоль), цианоборогидрида натрия (58,9 мг, 0,937 ммоль) и MeOH (17 мл) с помощью раствора AcOH (56,3 мг, 0,937 ммоль) в MeOH (3 мл) и раствор перемешивали в течение 12 ч при 45°C. Реакционный раствор охлаждали до к.т. и концентрировали до сухого состояния при пониженном давлении с получением неочищенного продукта, который очищали с помощью препаративной HPLC (колонка Xtimate C18 150 × 25 мм × 5 мкм (элюент: от 16% до 46% (об./об.) вода (0,225% FA)-ACN)). Чистые фракции концентрировали при пониженном давлении и затем суспендировали в воде (10 мл). Смесь лиофилизировали до сухого состояния с получением неочищенного продукта. Затем неочищенный продукт очищали с помощью препаративной HPLC (колонка Agela ASB 150 × 25 мм × 5 мкм (элюент: от 25% до 50% (об./об.) вода (0,05%HCl)-ACN)). Чистые фракции концентрировали при пониженном давлении и затем суспендировали в воде (10 мл). Смесь лиофилизировали до сухого состояния с получением соединения 305 (смеси цис- и транс-изомеров) в виде белого твердого вещества (16,2 мг, выход 7,8%).
Следующие соединения получали, начиная с промежуточного соединения 5 и соответствующего амина, с применением способа восстановительного аминирования, аналогичного применяемому для получения соединения 276, соединения 277 или соединения 279, указанных в таблице ниже; при этом применяли один из следующих 4 растворителей: DCM, DCE, MeOH, MeCN.
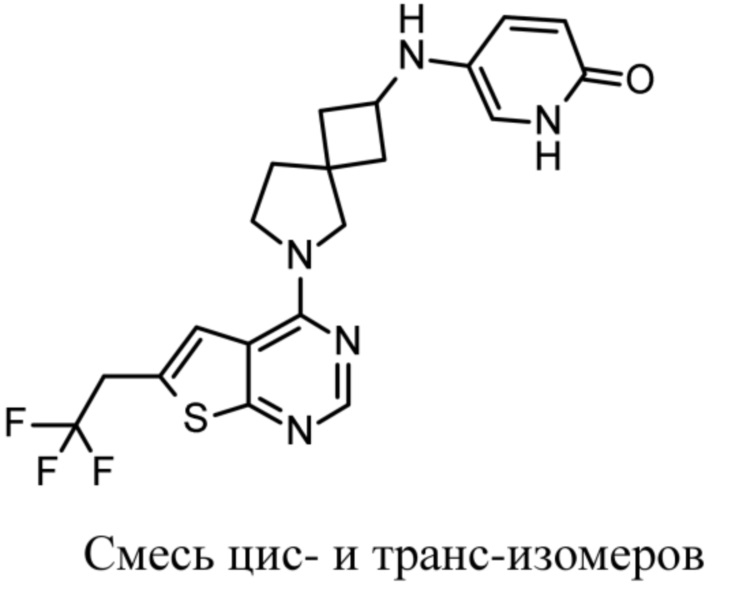
Соединение 307 (цис или транс)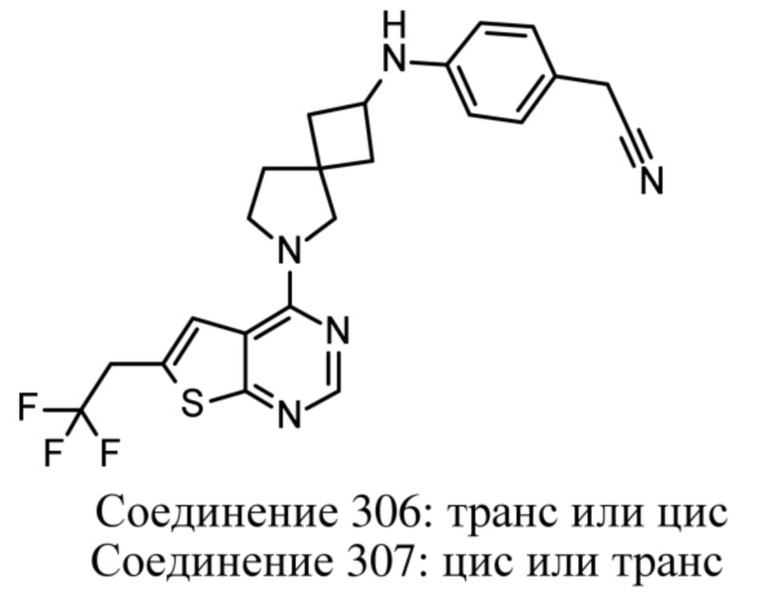
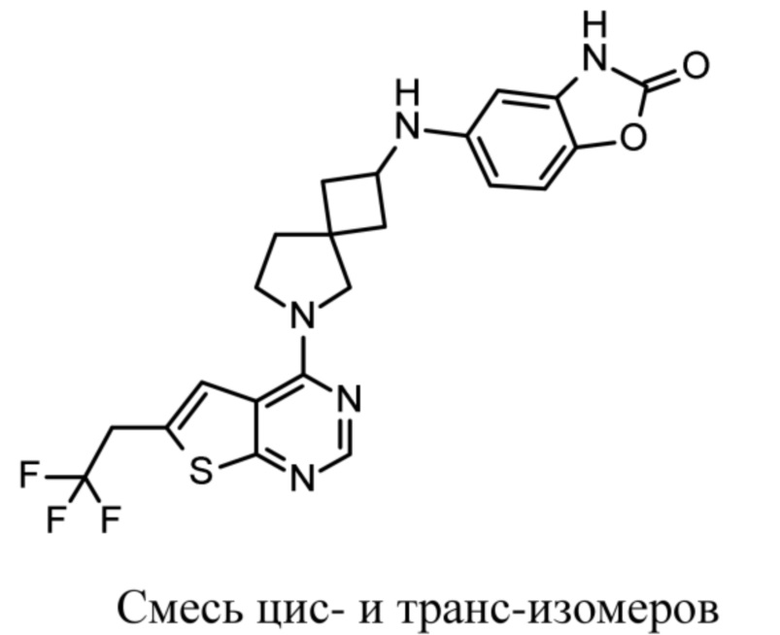
(0,3 HCOOH; определяли по остаточному сигналу группы CHO в HCOOH в H-ЯМР)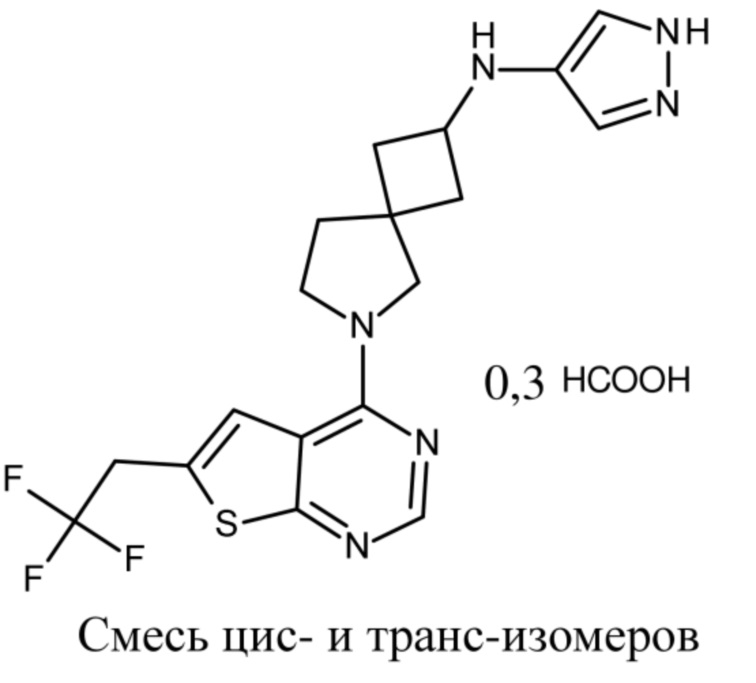
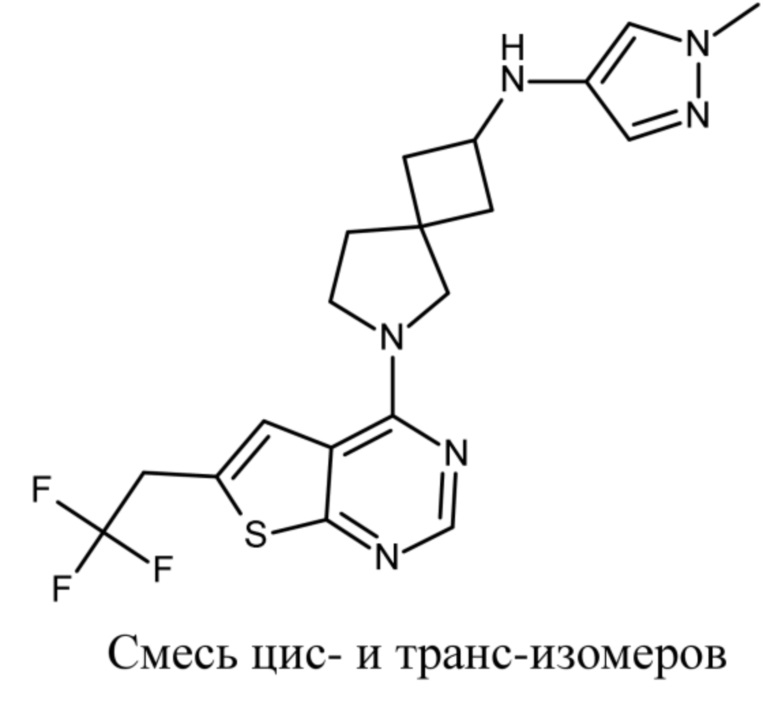
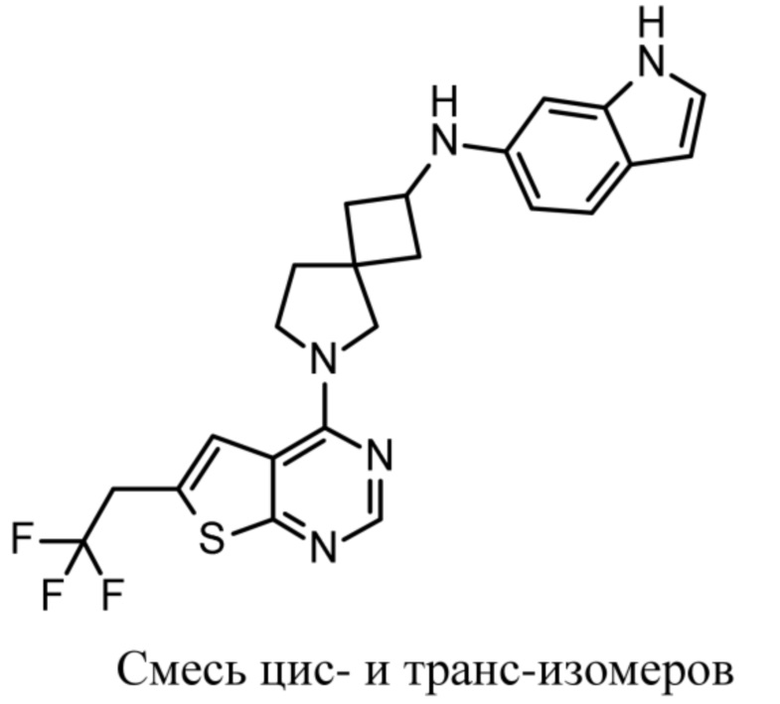
Соединение 313 (цис или транс)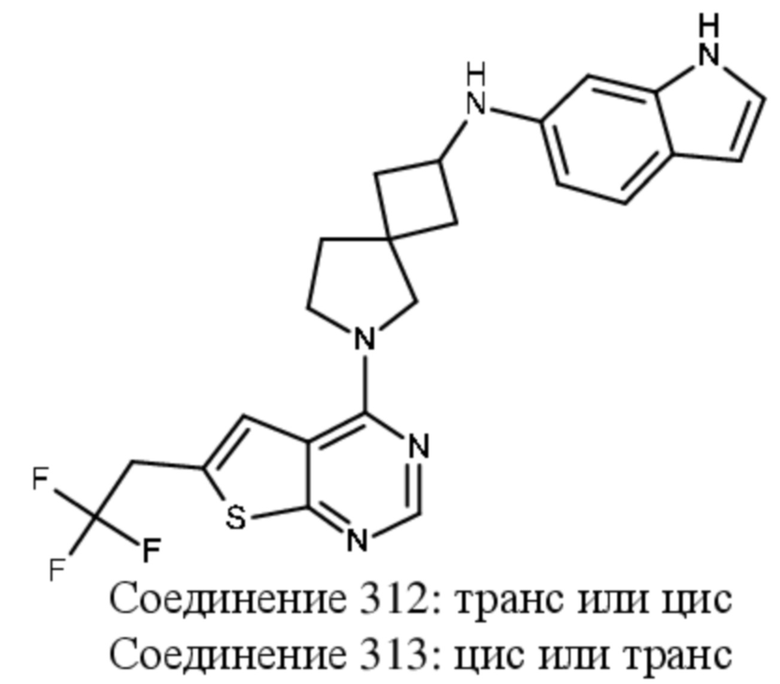
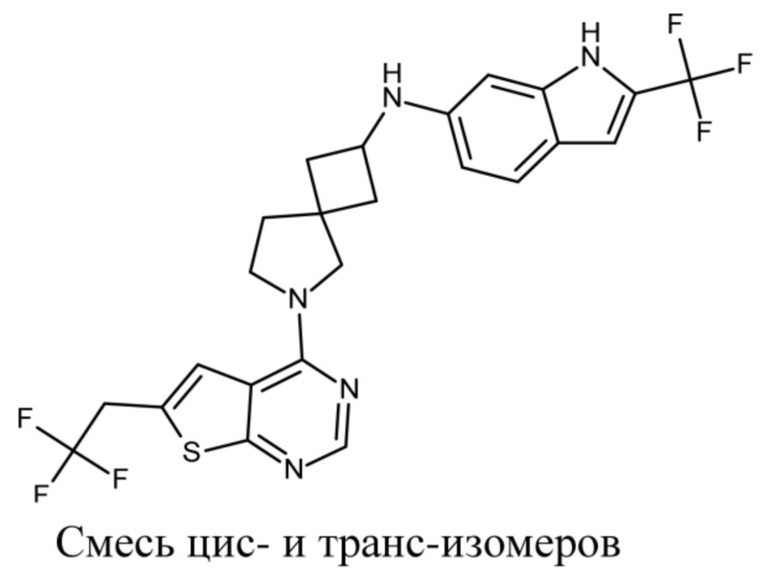
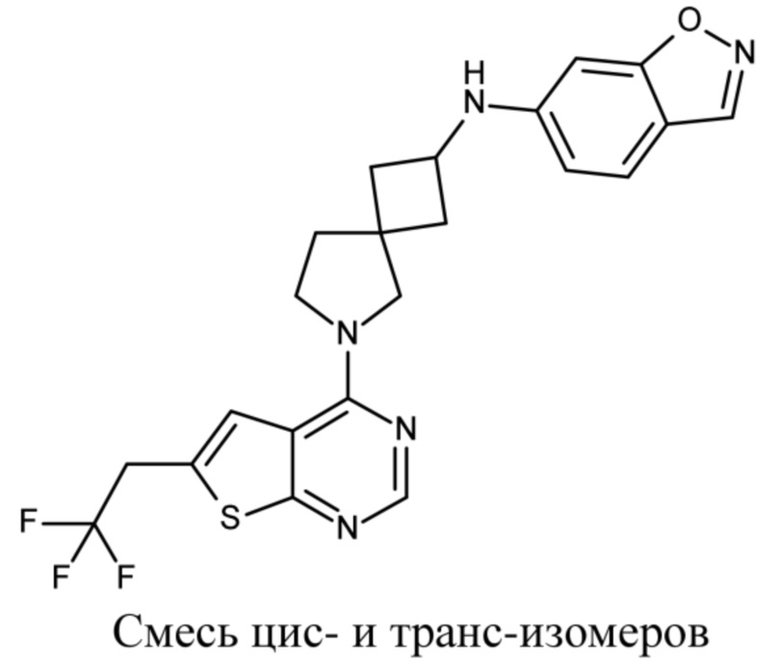
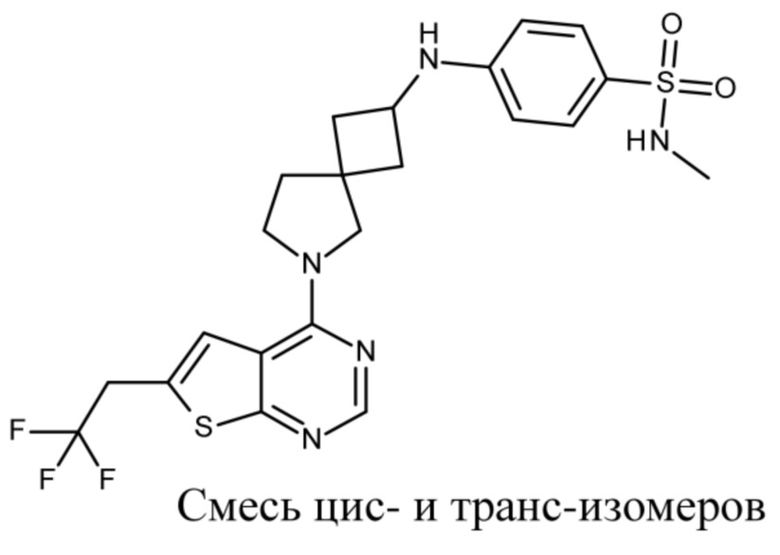
Соединение 318 (цис или транс)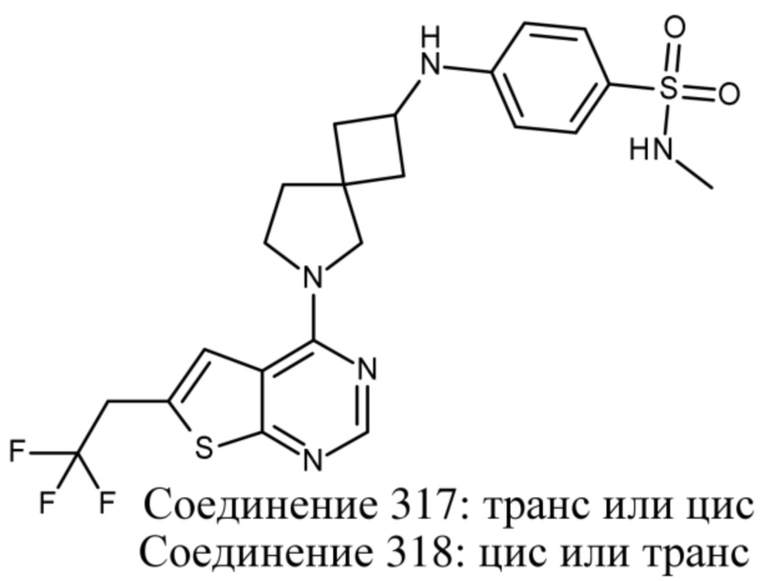
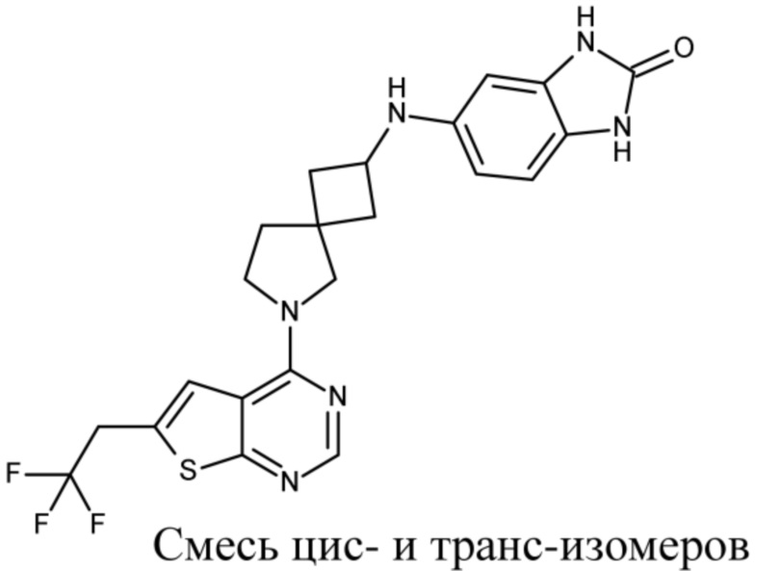
Соединение 321 (цис или транс)
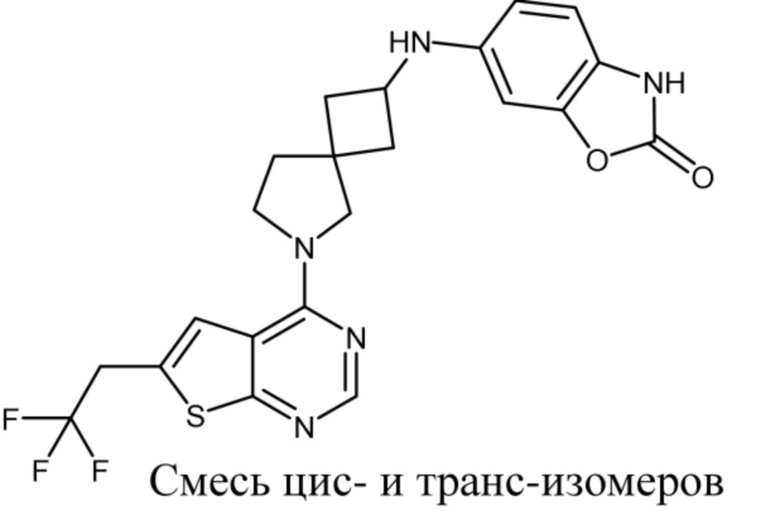
Соединение 324 (цис или транс)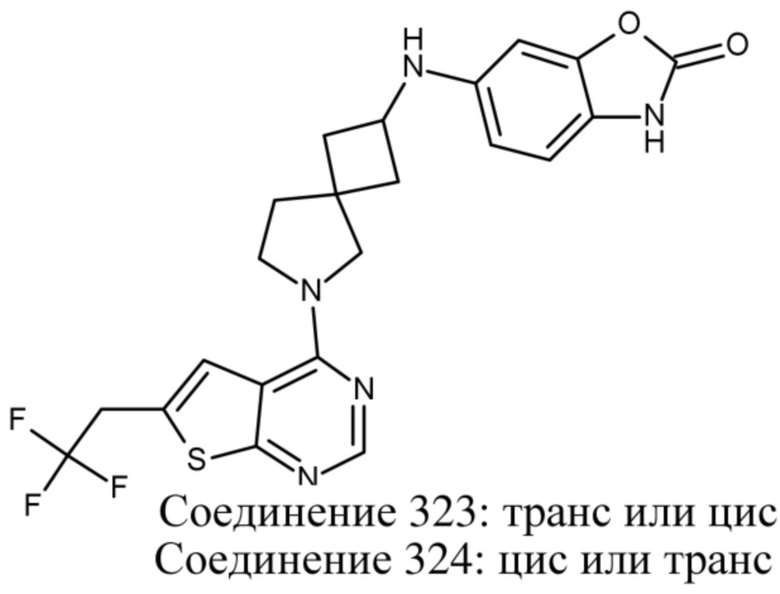
(из промежуточного соединения 5 и промежуточного соединения 258)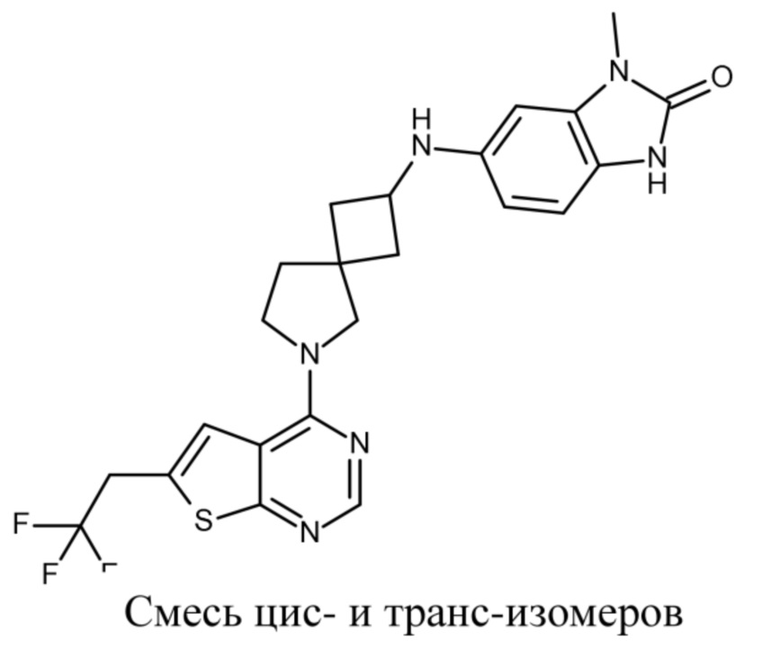
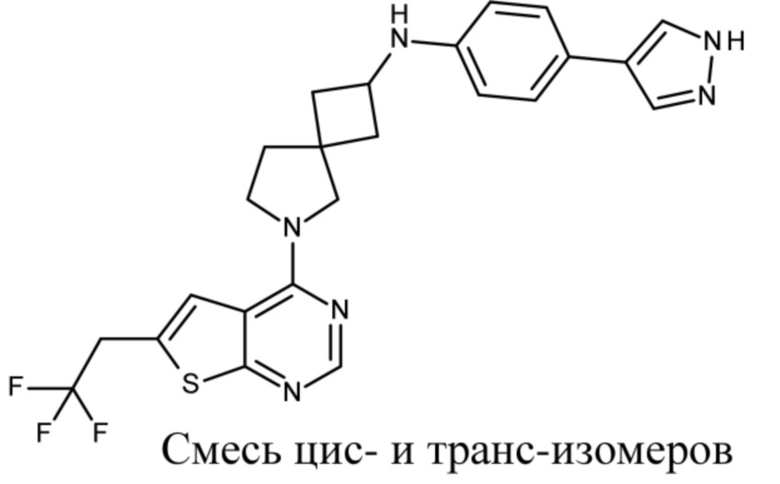
Соединение 328 (цис или транс)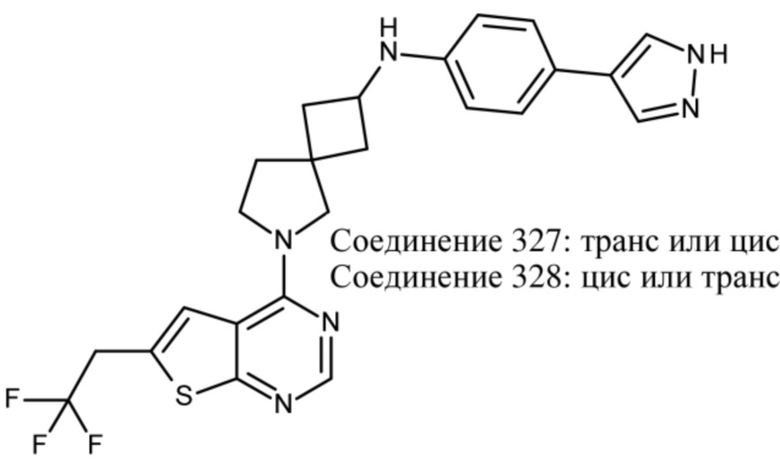
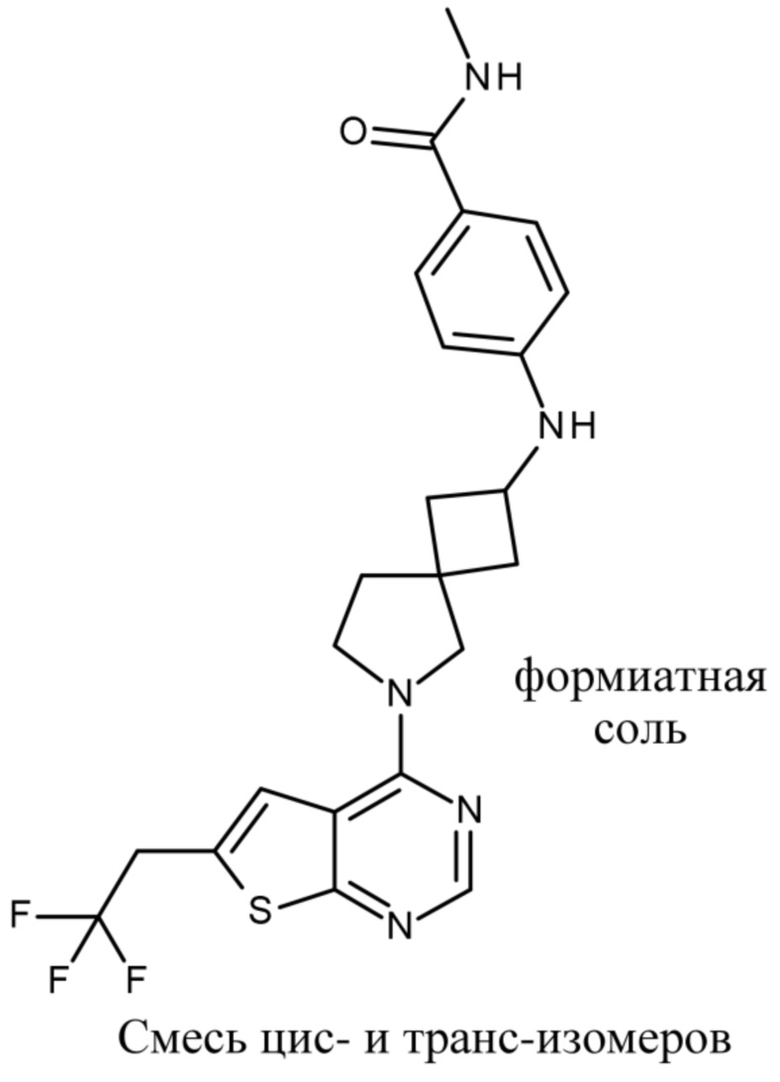
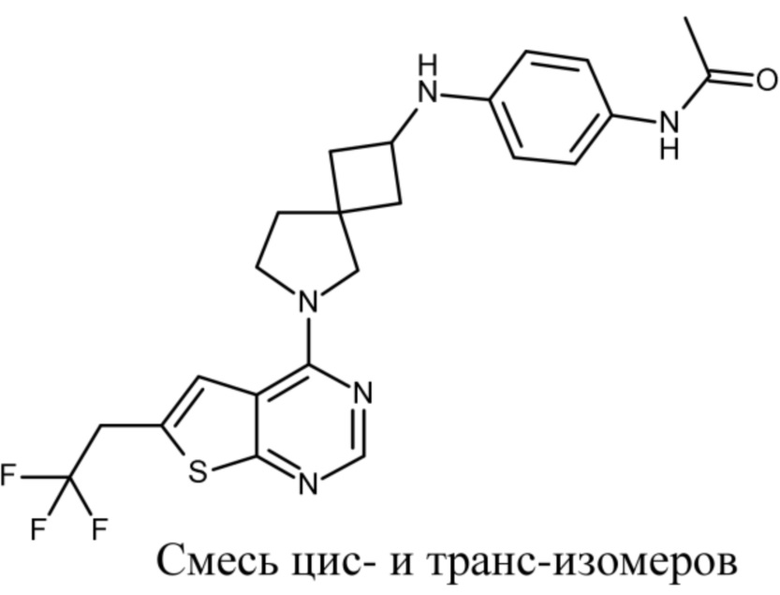
Соединение 332 (цис или транс)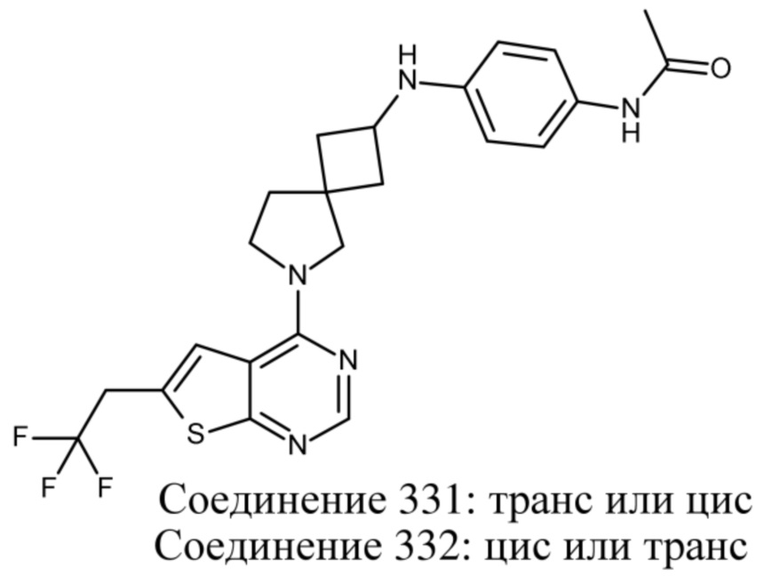
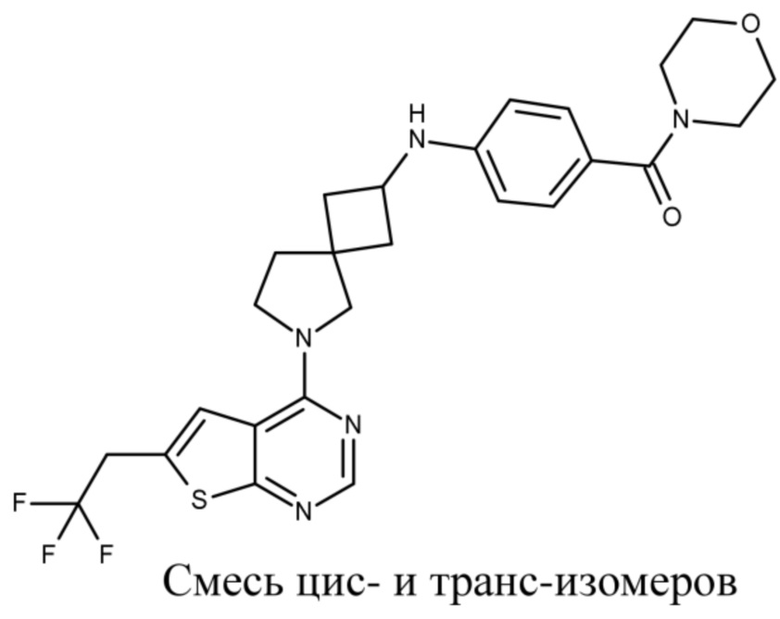
Соединение 335 (цис или транс)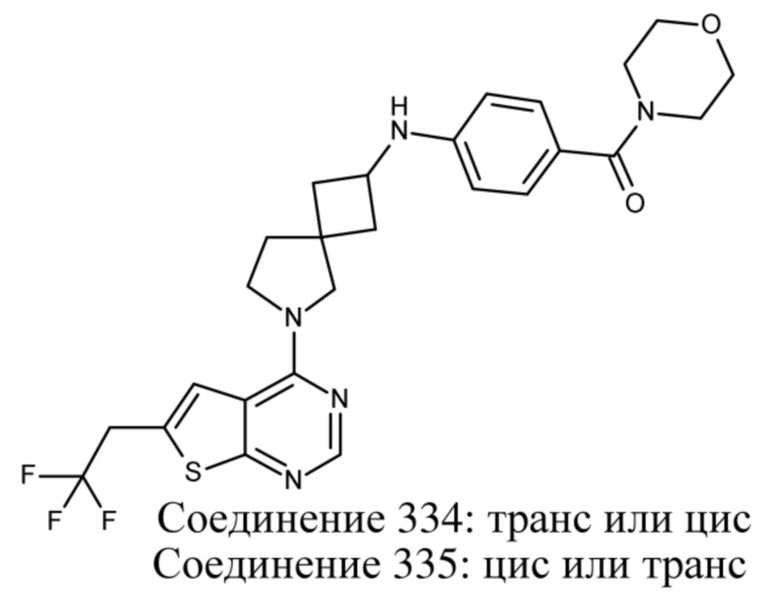
(из промежуточного соединения 5 и промежуточного соединения 261)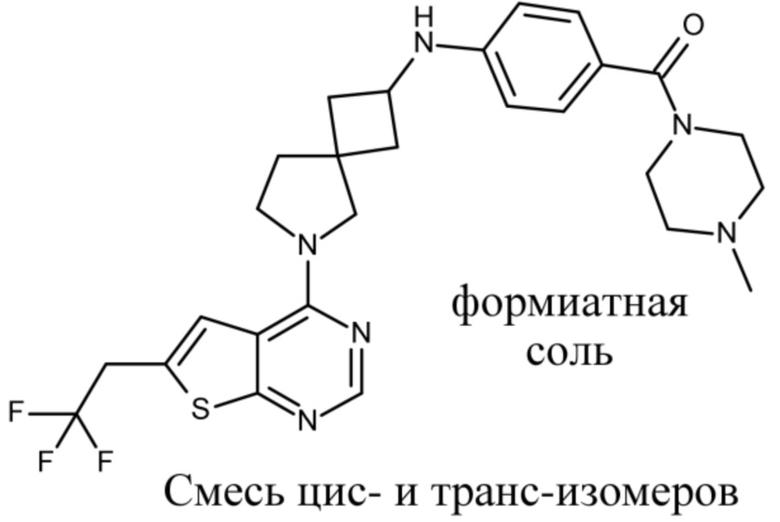
Соединение 338 (цис или транс; формиатная соль)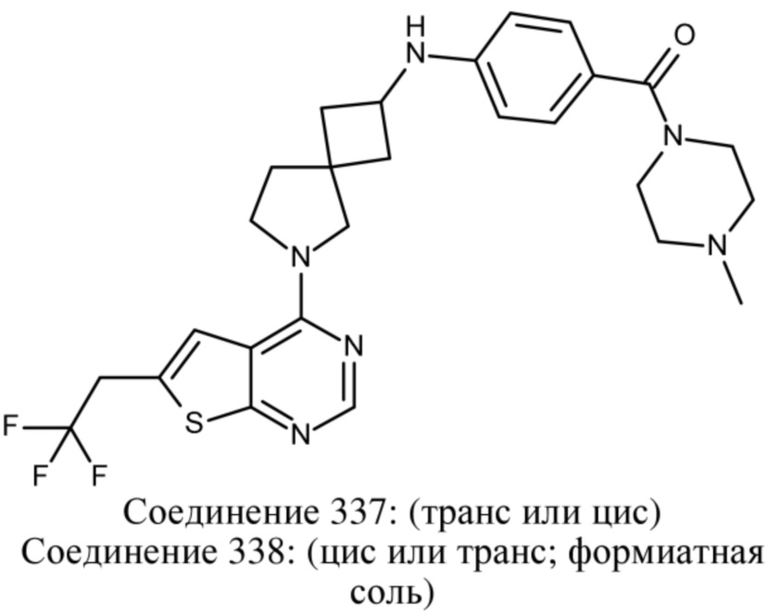
(из промежуточного соединения 5 и промежуточного соединения 262)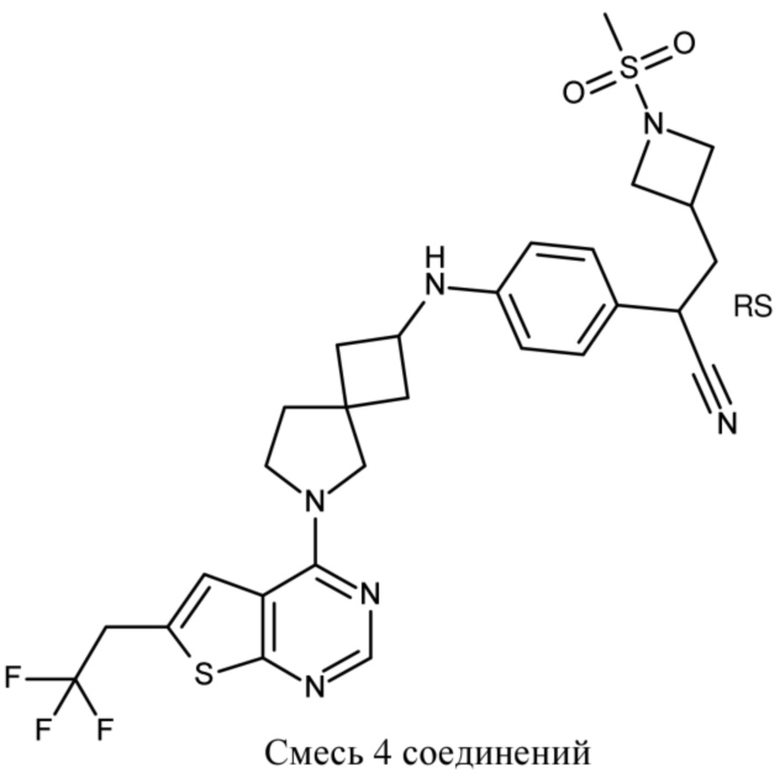
(из промежуточного соединения 5 и промежуточного соединения 256)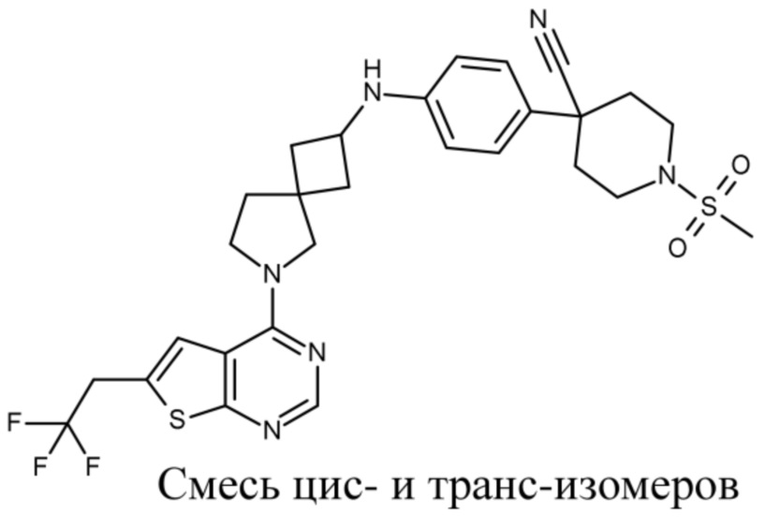
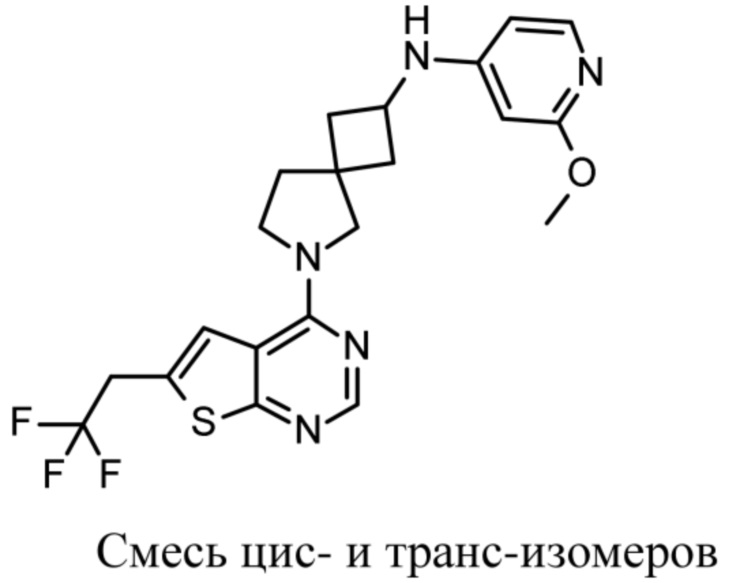
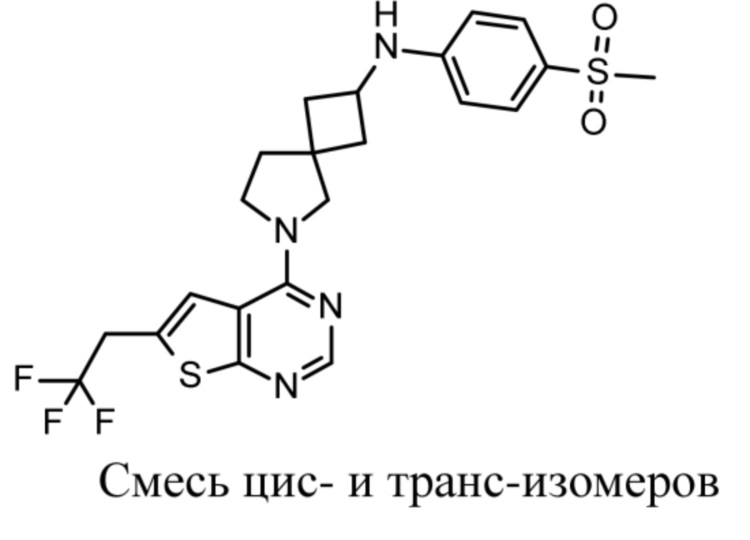
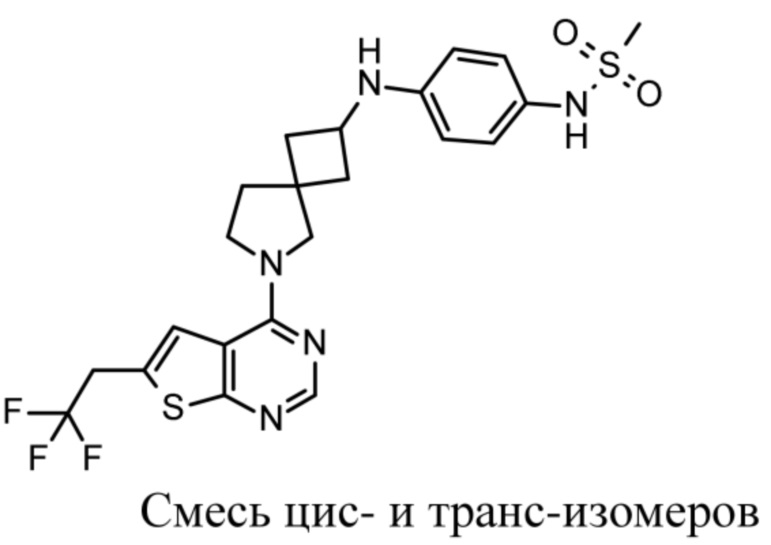
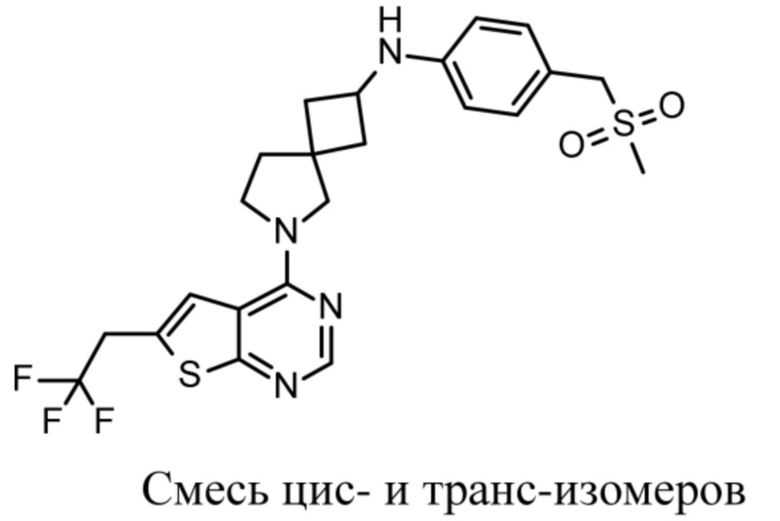
(из промежуточного соединения 5 и промежуточного соединения 263)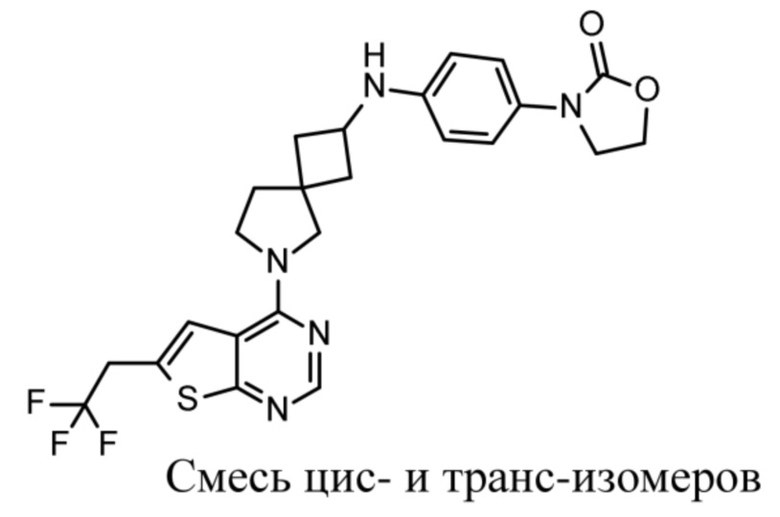
(из промежуточного соединения 5 и промежуточного соединения 264)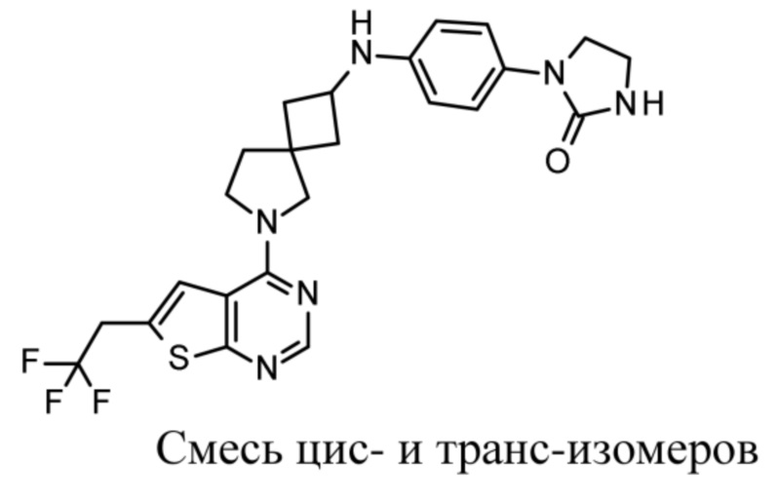
(из промежуточного соединения 5 и промежуточного соединения 265)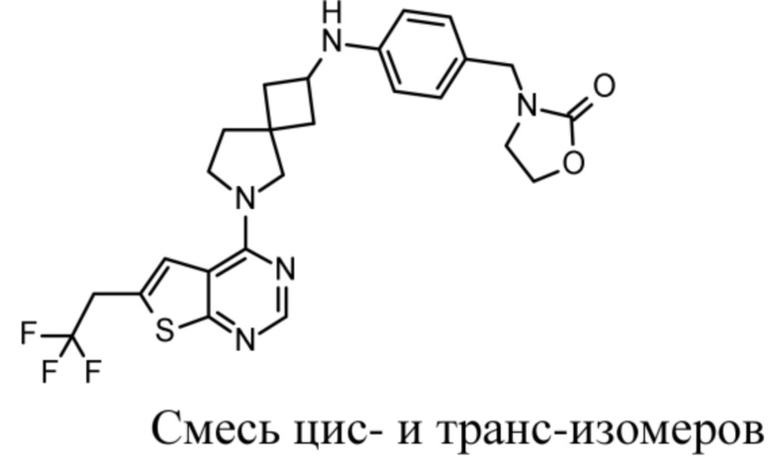
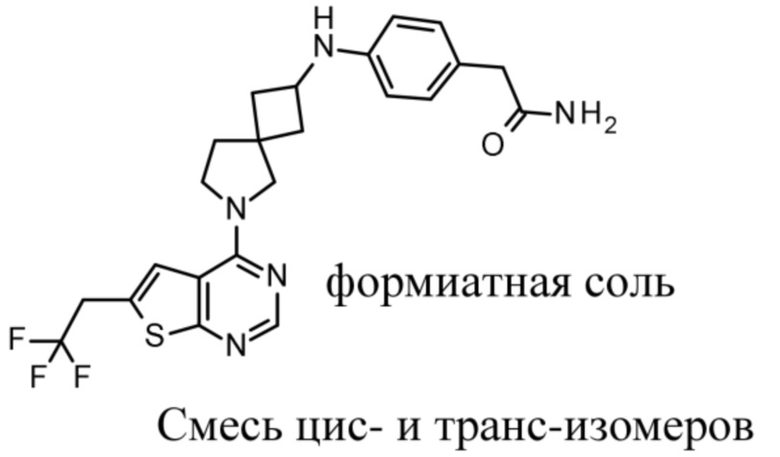
(из промежуточного соединения 5 и промежуточного соединения 266)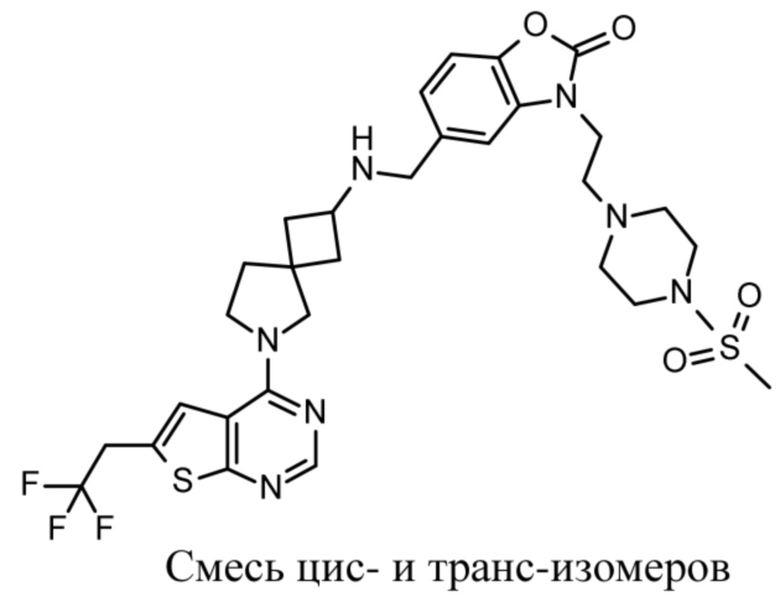
(из промежуточного соединения 5 и промежуточного соединения 267)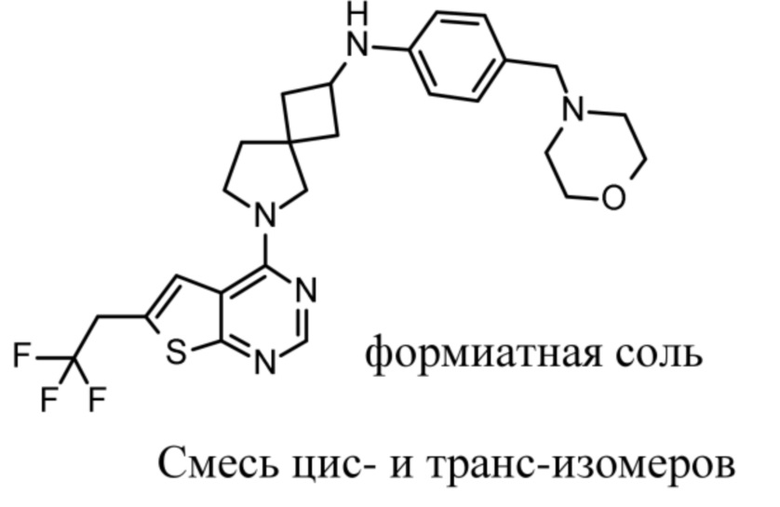
(из промежуточного соединения 5 и промежуточного соединения 268)
Соединение 353 (цис или транс)
(из промежуточного соединения 5 и промежуточного соединения 269)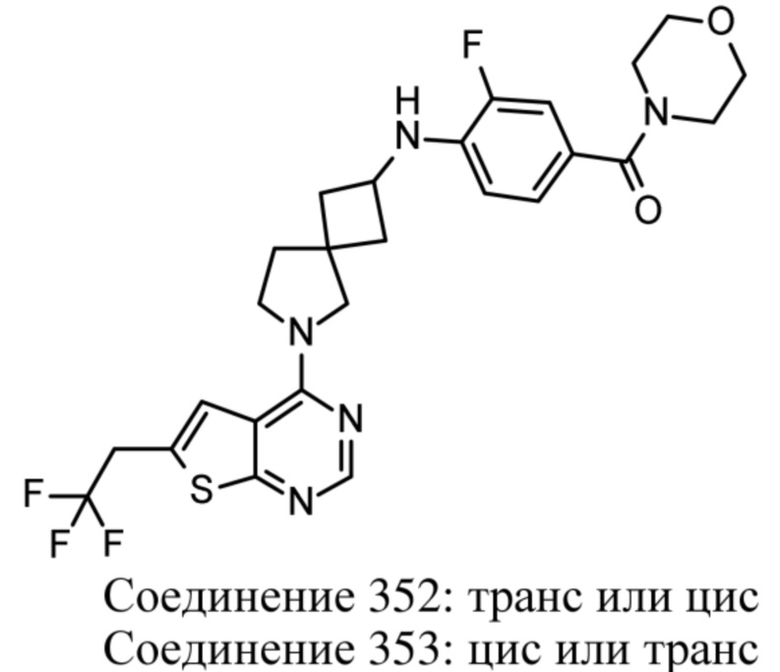
(из промежуточного соединения 5 и промежуточного соединения 270)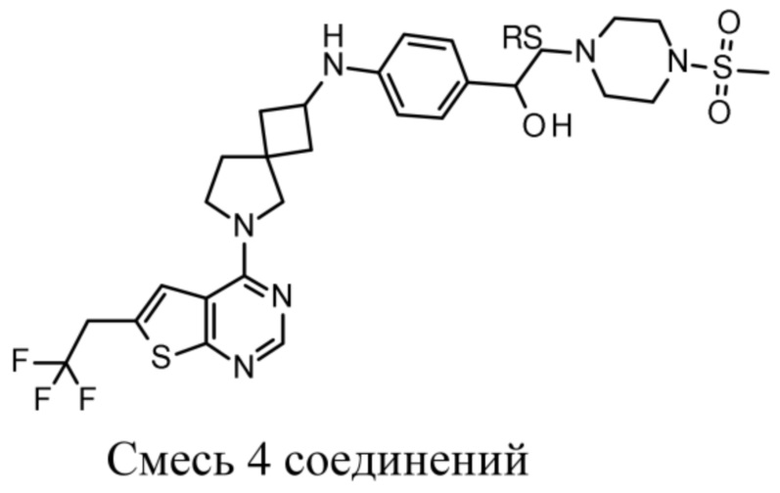
Соединение 356 (цис или транс)
(из промежуточного соединения 5 и промежуточного соединения 271)
Соединение 358 (цис или транс)
(из промежуточного соединения 5 и промежуточного соединения 272)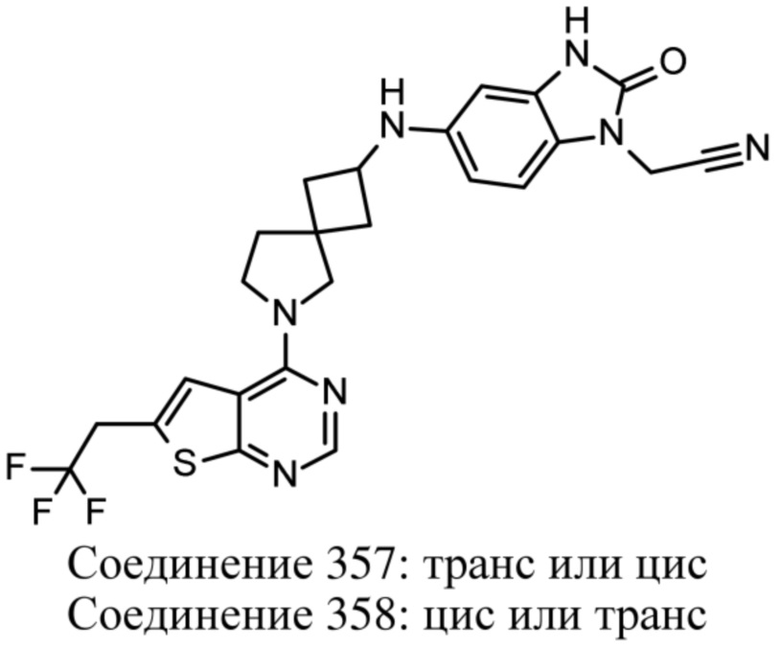
Соединение 360 (цис или транс)
(из промежуточного соединения 5 и промежуточного соединения 302)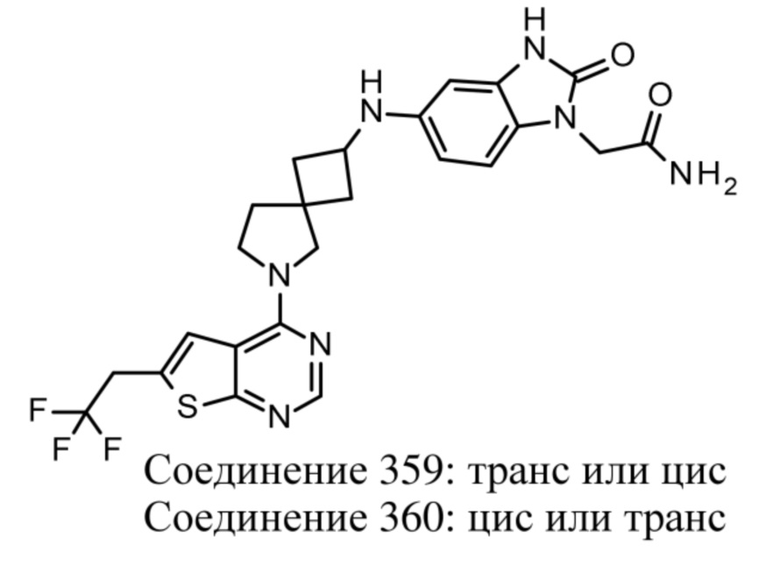
Соединение 362 (цис или транс)
(из промежуточного соединения 5 и промежуточного соединения 273)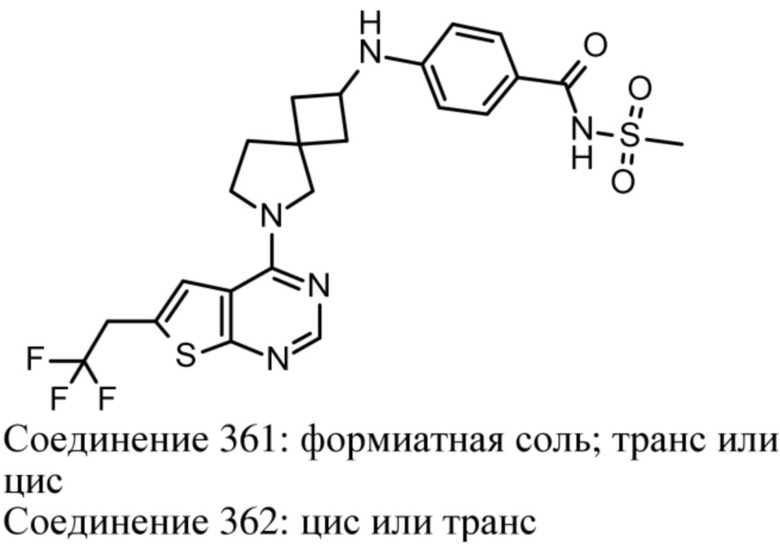
Соединение 364 (цис или транс)
(из промежуточного соединения 5 и промежуточного соединения 274)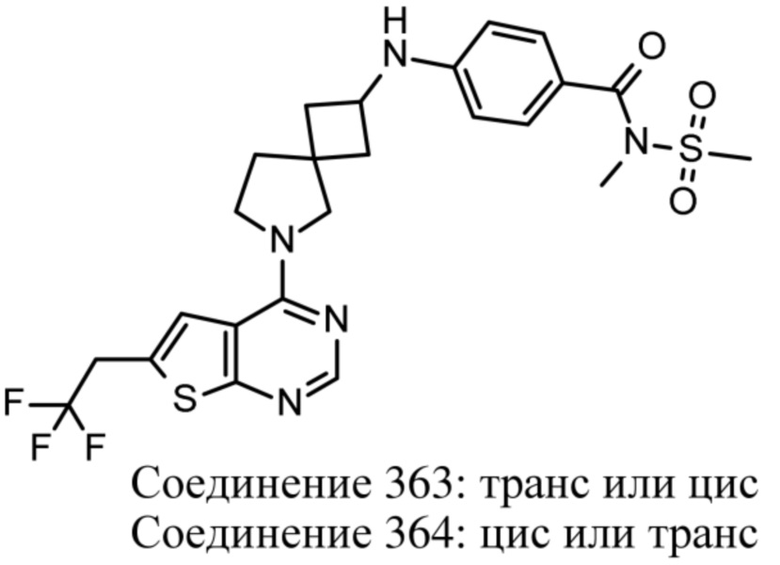
Соединение 368 (цис или транс)
(из промежуточного соединения 5 и N-(4-аминобензил)метансульфонамида, № по CAS: 81880-95-7)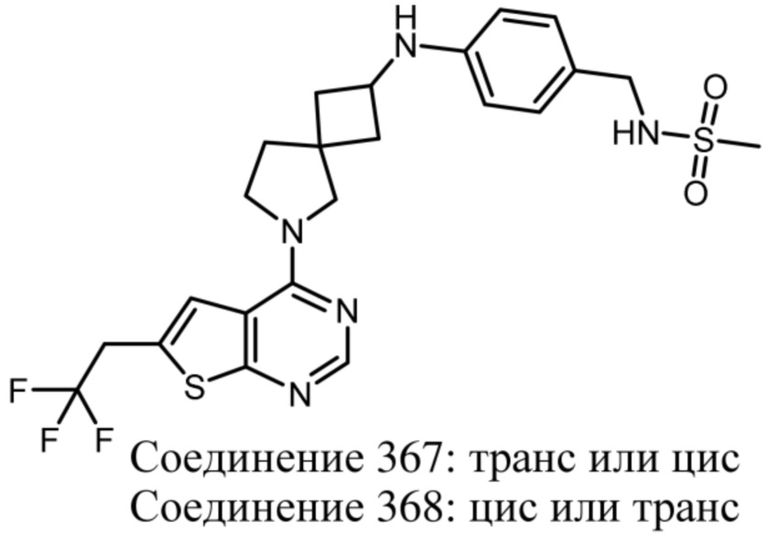
Соединение 370 (цис или транс)
(из промежуточного соединения 5 и промежуточного соединения 275)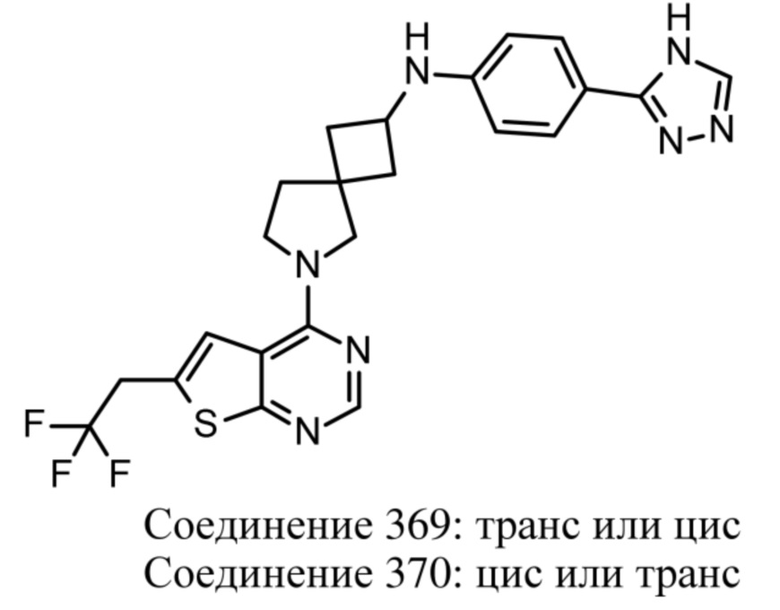
Соединение 372 (цис или транс)
(из промежуточного соединения 5 и 4-амино-N-(2,2,2-трифторэтил)бензамида, № по CAS: 934524-28-4)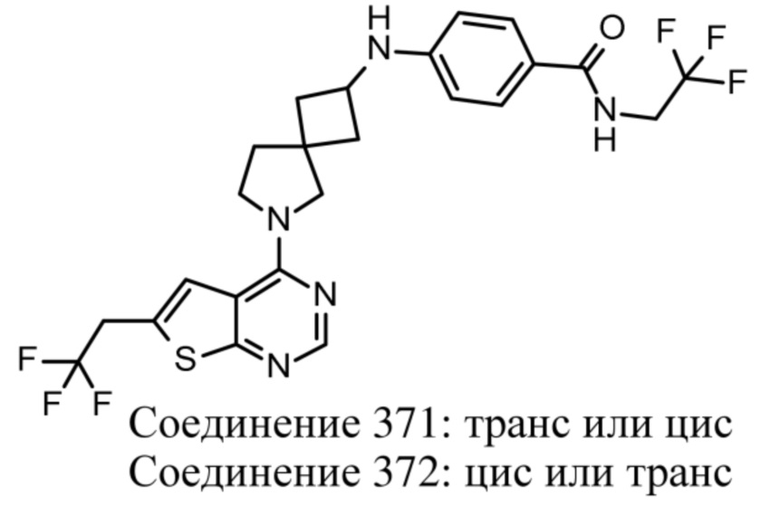
(из промежуточного соединения 5 и 4-амино-N-(цианометил)бензамида, № по CAS: 20855-56-5)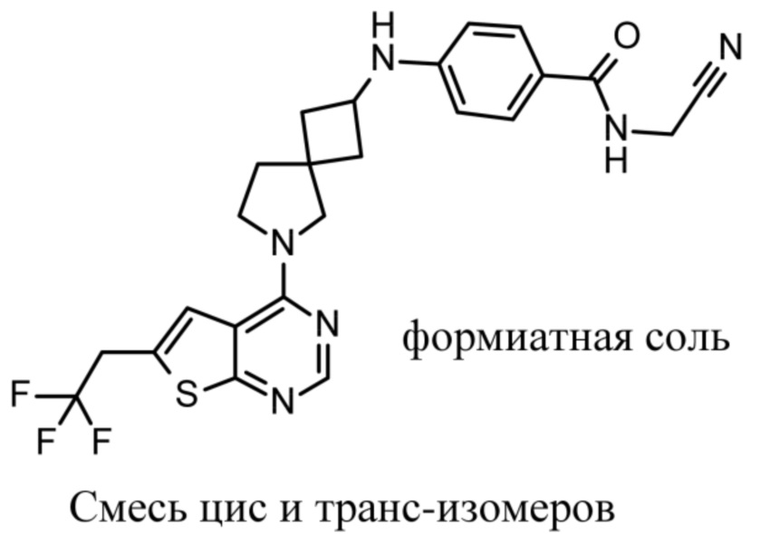
Соединение 375 (цис или транс)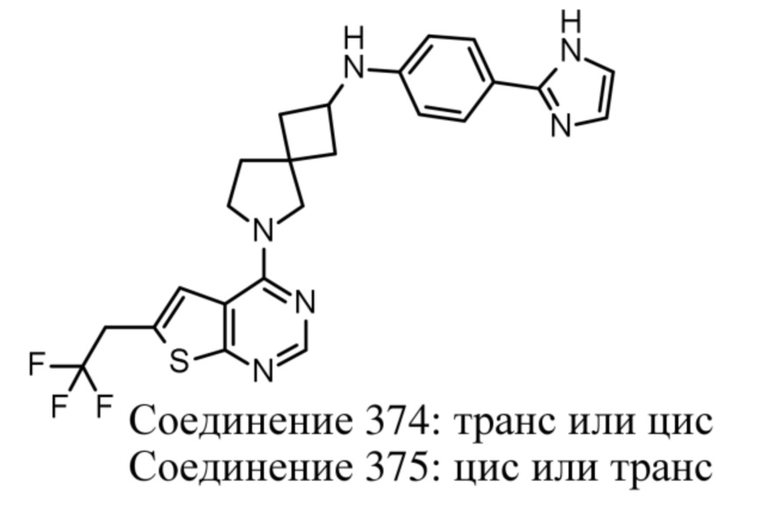
Пример B179
Получение соединения 377, соединения 378 и соединения 379
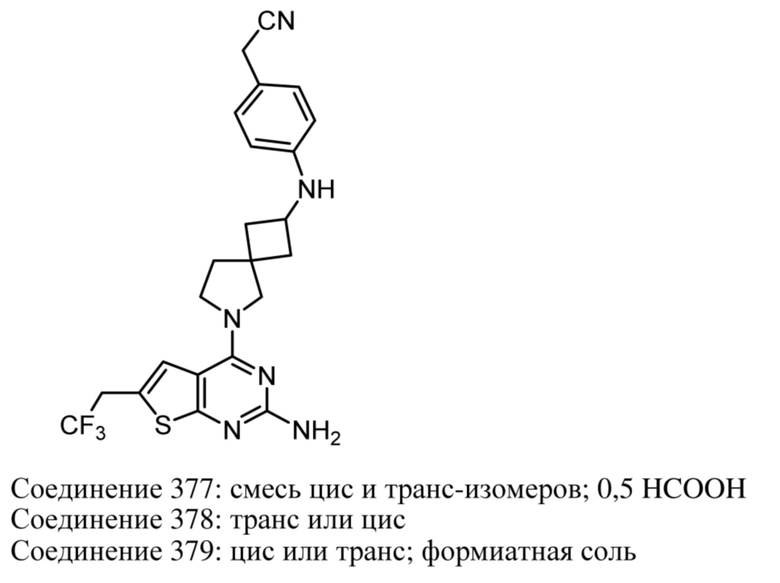
Растворяли промежуточное соединение 246 (100 мг, 0,40 ммоль) и 1,8-диазабицикло[5.4.0]ундец-7-ен (214 мг, 1,41 ммоль) в ацетонитриле (8 мл) в стеклянном сосуде объемом 40 мл. Через 5 минут добавляли BOP (177 мг, 0,40 ммоль). Полученную смесь перемешивали в течение 5 минут и затем добавляли промежуточное соединение 277 (297 мг, неочищенная соль TFA, 0,63 ммоль). Полученную смесь перемешивали при 50°C в течение 8 часов. Реакционную смесь выливали в DCM (30 мл), после чего промывали водой (20 мл × 3). Органические экстракты высушивали над безводным Na2SO4, фильтровали и концентрировали до сухого состояния при пониженном давлении с получением остатка, который очищали с помощью преп. HPLC (колонка: Xtimate C18, 150 × 25 мм × 5 мкм, подвижная фаза A: вода (0,225% FA)-ACN, подвижная фаза B: ацетонитрил, расход: 22 мл/мин, при условии градиента от 32% B до 62%). Чистые фракции собирали и растворитель выпаривали в вакууме. Остаток разделяли между ацетонитрилом (2 мл) и водой (10 мл). Смесь лиофилизировали до сухого состояния с получением соединения 377 (смеси цис- и транс-изомеров; 0,5 HCOOH определяли по остаточному сигналу группы CHO в HCOOH в H-ЯМР) (13,4 мг, 6,79%) в виде желтых твердых веществ.
Соединение 377 (100 мг, 0,19 ммоль) разделяли с помощью сверхкритической флюидной хроматографии (условие разделения: YMC CHIRAL Amylose-C(250 мм × 30 мм, 10 мкм); подвижная фаза: A: сверхкритический CO2, B: 0,1% NH3H2O EtOH, A:B=50:50 при 70 мл/мин; температура колонки: 38°C; давление в сопле: 100 бар; температура сопла: 60°C; температура испарителя: 20°C; температура триммера: 25°C; длина волны: 220 нм). Чистую фракцию собирали и растворитель выпаривали в вакууме. Остаток разделяли между CH3CN (2 мл) и водой (10 мл). Раствор лиофилизировали до сухого состояния с получением соединения 378 (транс или цис) (35,8 мг, выход 38,0%) в виде белого порошка и неочищенного соединения 379.
Неочищенное соединение 379 очищали с помощью преп. HPLC (колонка: Xtimate C18, 150 × 25 мм × 5 мкм, подвижная фаза A: вода (0,225% муравьиная кислота)-ACN, подвижная фаза B: ацетонитрил, расход: 25 мл/мин, при условии градиента от 28% B до 58%). Чистые фракции собирали и растворитель выпаривали в вакууме. Остаток разделяли между CH3CN (2 мл) и водой (10 мл). Смесь лиофилизировали до сухого состояния с получением соединения 379 (цис или транс; формиатная соль) (17,12 мг, выход 17,0%) в виде белого порошка.
Пример B180
Получение соединения 380
Соединение 380 получали с помощью протокола реакции, аналогичного описанному выше для получения соединения 377, начиная с соответствующих исходных веществ.
(из промежуточного соединения 279 и промежуточного соединения 246)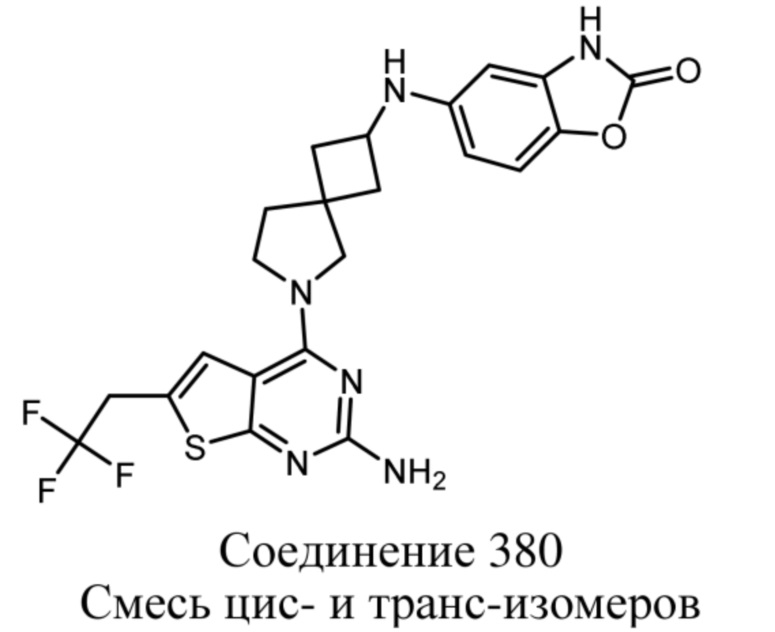
Пример B181
Получение соединения 381, соединения 382 и соединения 383
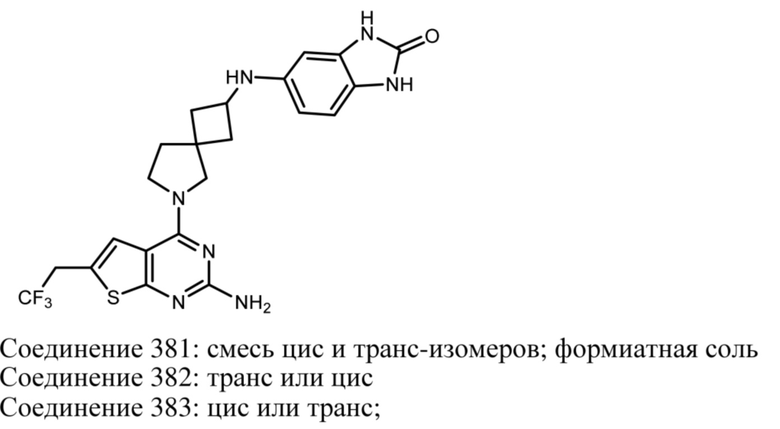
Добавляли промежуточное соединение 281 (250 мг, 0,700 ммоль), 5-амино-1H-бензо[d]имидазол-2(3H)-он (№ по CAS: 95-23-8) (157 мг, 1,05 ммоль), цианоборогидрид натрия (88,2 мг, 1,40 ммоль) и сухой метиловый спирт (9,5 мл) в стеклянный флакон объемом 40 мл и затем добавляли уксусную кислоту (84,3 мг, 1,40 ммоль) в сухом метиловом спирте (0,5 мл). Полученную смесь нагревали и перемешивали при 45°C в течение 8 часов. Смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении с получением остатка, который растворяли в дихлорметане (30 мл), после чего промывали водой (20 мл × 3). Органические экстракты высушивали над безводным Na2SO4, фильтровали и концентрировали до сухого состояния при пониженном давлении с получением остатка, который очищали с помощью преп. HPLC (колонка: Xtimate C18, 150 × 25 мм × 5 мкм, подвижная фаза A: вода (0,225% FA)-ACN), подвижная фаза B: ацетонитрил, расход: 25 мл/мин, при условии градиента от 15% B до 45%). Чистые фракции собирали и растворитель выпаривали в вакууме. Остаток разделяли между CH3CN (2 мл) и водой (10 мл). Смесь лиофилизировали до сухого состояния с получением необходимого соединения 381 (смеси цис- и транс-изомеров; формиатная соль) (62,4 мг, выход 16,1%) в виде белого порошка. В результате дополнительного разделения полученного соединения 381 с помощью SFC получали соединение 382 (транс или цис) и соединение 383 (цис или транс).
Пример B182
Получение соединения 384, соединения 385 и соединения 386
Соединение 384 (формиатную соль) получали с помощью протокола реакции, аналогичного описанному выше для получения соединения 381, начиная с соответствующих исходных веществ.
(из промежуточного соединения 281 и 6-аминобензо[d]оксазол-2(3H)-она, № по CAS: 22876-17-1)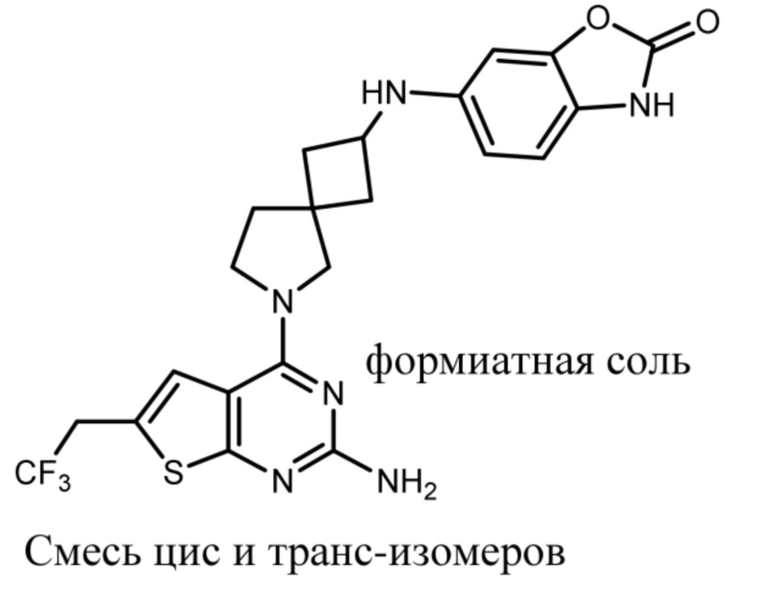
В результате дополнительного разделения полученного соединения 384 (смеси цис- и транс-изомеров) с помощью SFC получали соединение 385 (транс или цис) и соединение 386 (цис или транс).
Пример B183
Получение соединения 387, соединения 388 и соединения 389
Соединение 387 получали с помощью протокола реакции, аналогичного описанному выше для получения соединения 377, начиная с соответствующих исходных веществ.
(из промежуточного соединения 283 и 246)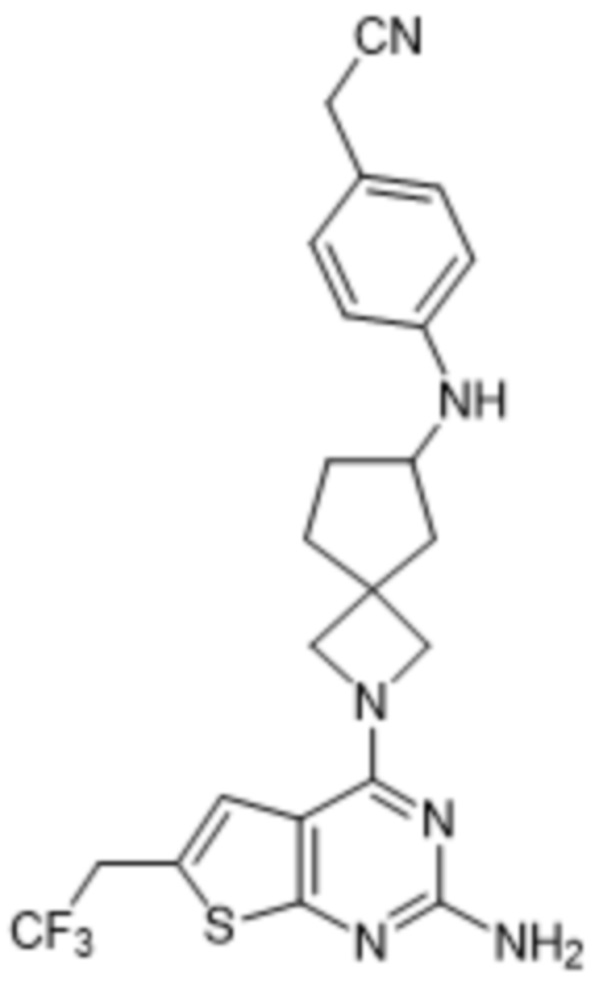
В результате дополнительного разделения полученного соединения 387 (смеси цис- и транс-изомеров) с помощью SFC получали соединение 388 (транс или цис) и соединение 389 (цис или транс).
Пример B184
Получение соединения 390, соединения 391 и соединения 392
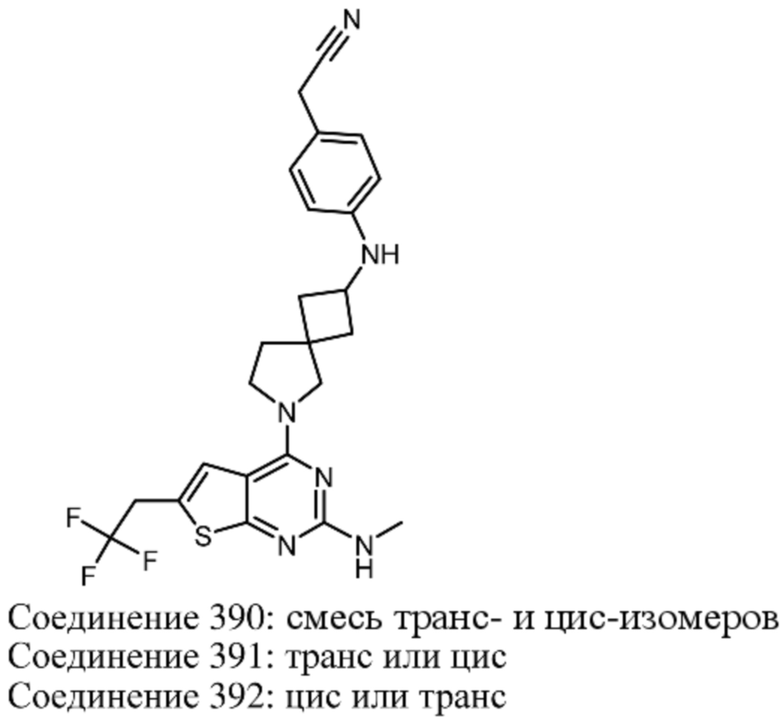
Добавляли промежуточное соединение 285 (150 мг, 0,405 ммоль), 2-(4-аминофенил)ацетонитрил (№ по CAS: 3544-25-0) (80,8 мг, 0,611 ммоль), цианоборогидрид натрия (51,0 мг, 0,812 ммоль) и сухой метанол (12 мл) в стеклянный флакон объемом 40 мл, после чего в смесь добавляли уксусную кислоту (50,0 мг, 0,833 ммоль) в метаноле (1 мл). Полученную смесь перемешивали при 45°C в течение 36 ч Смесь суспендировали в воде (20 мл), водный слой регулировали до pH=8 путем добавления насыщенного раствора бикарбоната натрия, экстрагировали дихлорметаном (20 мл × 3). Объединенные органические слои высушивали над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении с получением неочищенного вещества, которое очищали с помощью преп. HPLC (колонка: Phenomenex Gemini 150 × 25 мм × 10 мкм, подвижная фаза A: вода (0,05% гидроксида аммиака, об./об.), подвижная фаза B: ацетонитрил, расход: 25 мл/мин, при условии градиента от 50% B до 80%). Чистые фракции собирали и растворитель выпаривали в вакууме с получением остатка. Остаток разделяли между ацетонитрилом (2 мл) и водой (10 мл). Раствор лиофилизировали до сухого состояния с получением соединения 390 (смеси цис- и транс-изомеров) (123,7 мг, выход 62,5%) в виде светлого порошка.
В результате дополнительного разделения полученного соединения 390 с помощью SFC получали соединение 391 (транс или цис) и соединение 392 (цис или транс).
Следующие соединения получали, начиная с промежуточного соединения 285, промежуточного соединения 287 и соответствующего амина, с применением способа восстановительного аминирования, аналогичного применяемому для получения соединения 279; при этом применяли один из следующих 4 растворителей: DCM, DCE, MeOH, MeCN.
(из промежуточного соединения 285 и 5-амино-1,3-дигидро-2H-бензо[d]имидазол-2-она, № по CAS: 95-23-8) 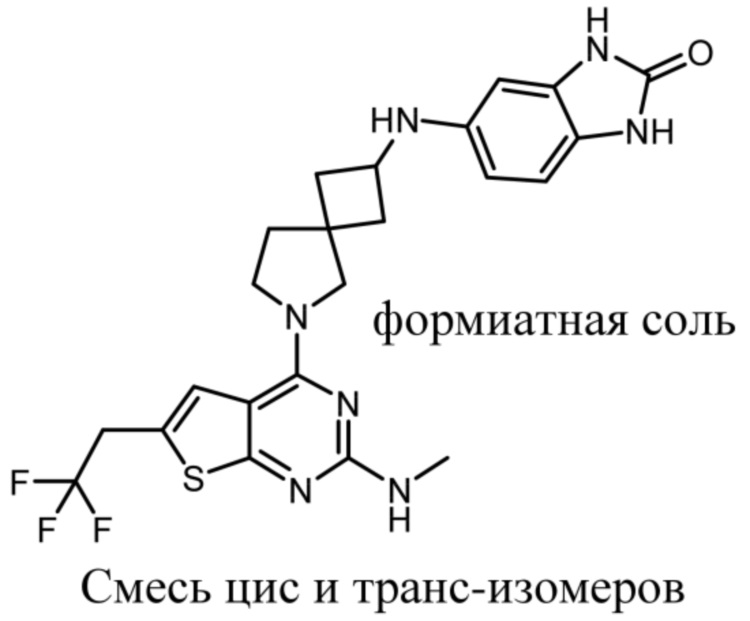
Соединение 395 (цис или транс)
(из промежуточного соединения 285 и 5-амино-1,3-дигидро-2H-бензо[d]имидазол-2-она, № по CAS: 95-23-8) 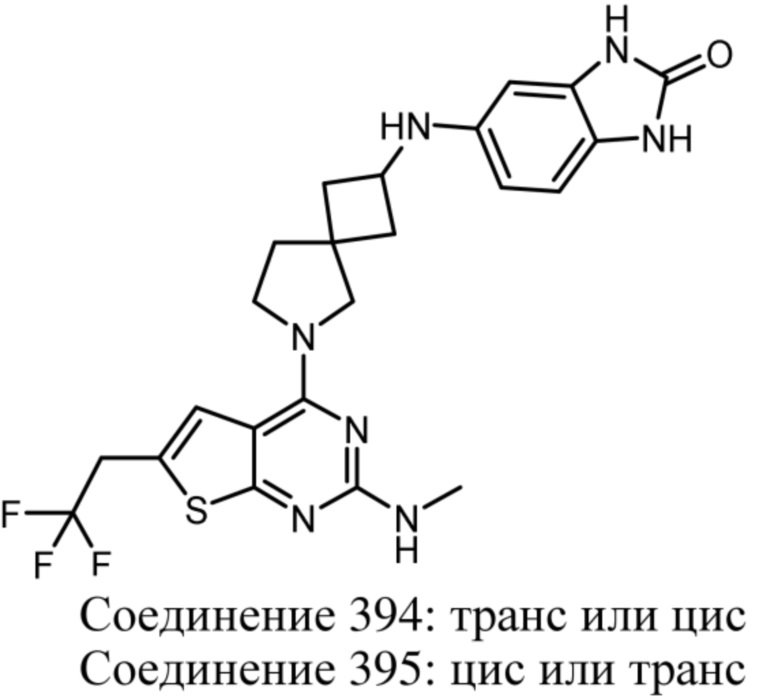
(из промежуточного соединения 285 и 5-аминобензо[d]оксазол-2(3H)-она, № по CAS: 14733-77-8) 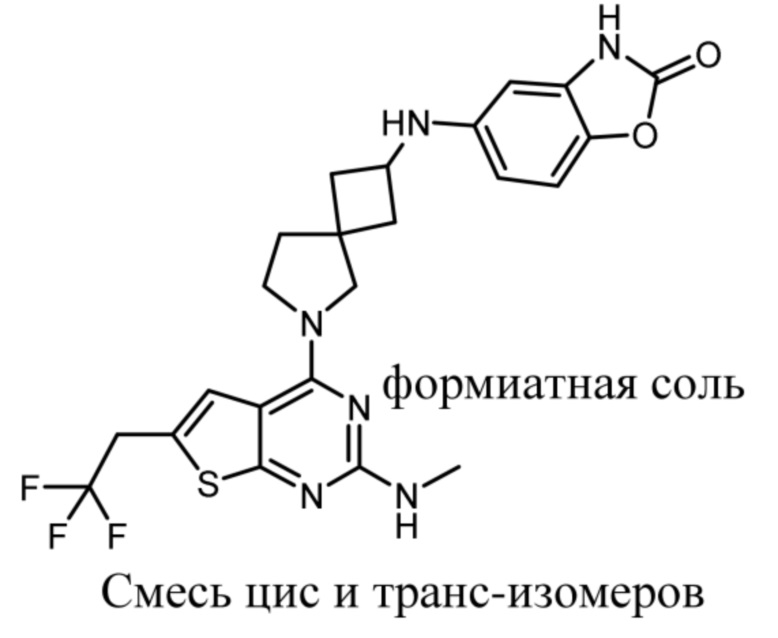
Соединение 398 (цис или транс)
(из промежуточного соединения 285 и 5-аминобензо[d]оксазол-2(3H)-она, № по CAS: 14733-77-8) 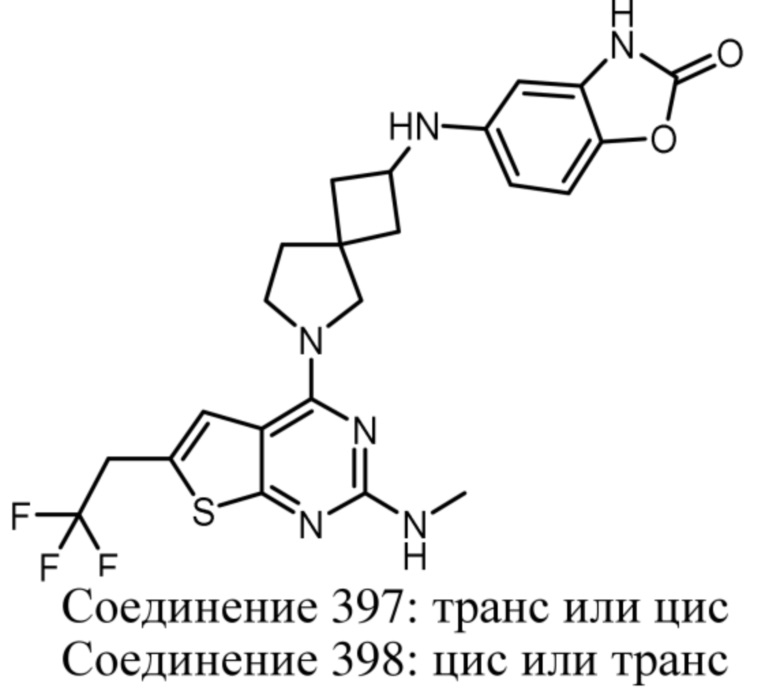
(из промежуточного соединения 285 и 6-аминобензо[d]оксазол-2(3H)-она, № по CAS: 22876-17-1)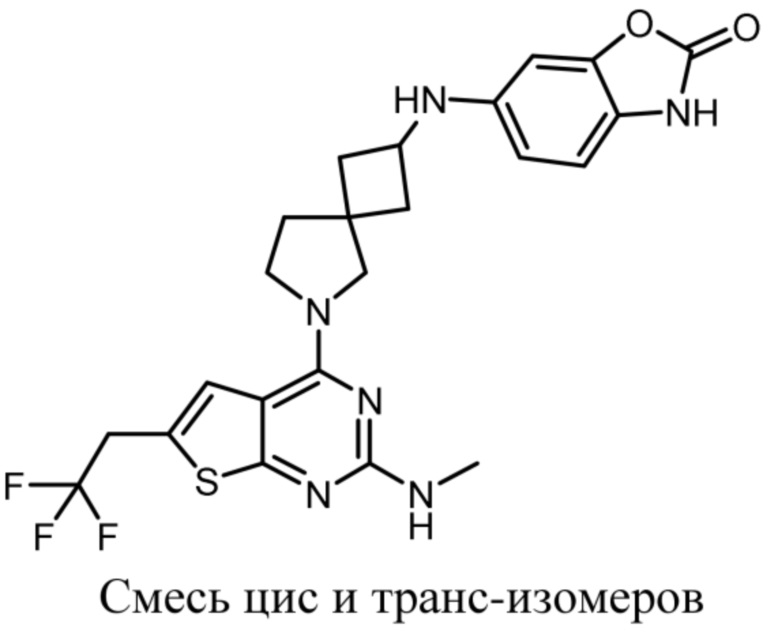
(из промежуточного соединения 287 и 2-(4-аминофенил)ацетонитрила, № по CAS: 3544-25-0)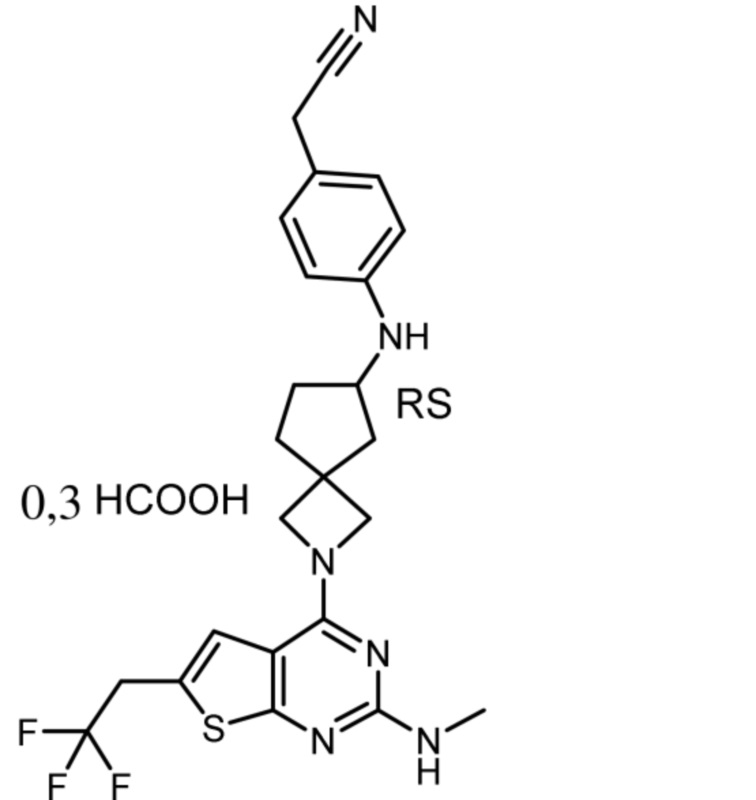
(из промежуточного соединения 287 и 5-аминобензо[d]оксазол-2(3H)-она, № по CAS: 14733-77-8)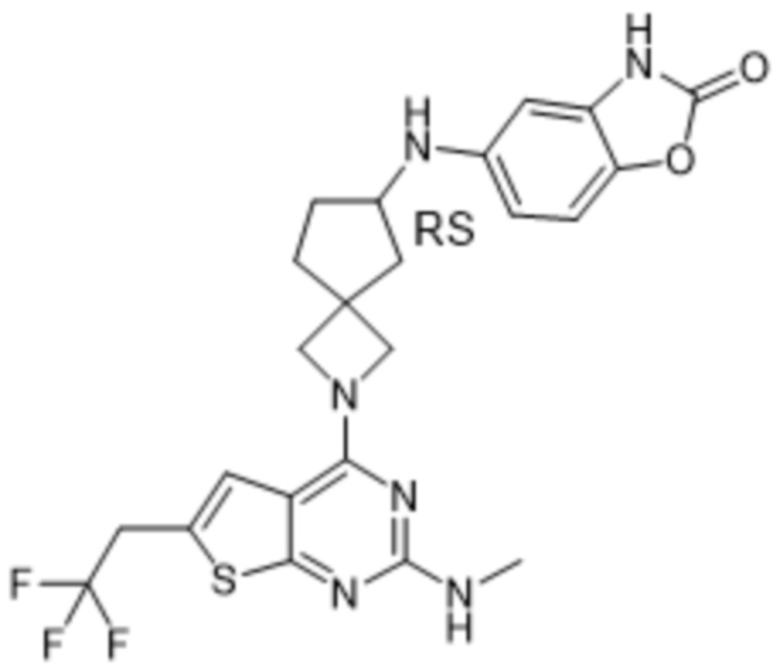
(из промежуточного соединения 287 и 5-амино-1,3-дигидро-2H-бензо[d]имидазол-2-она, № по CAS: 95-23-8)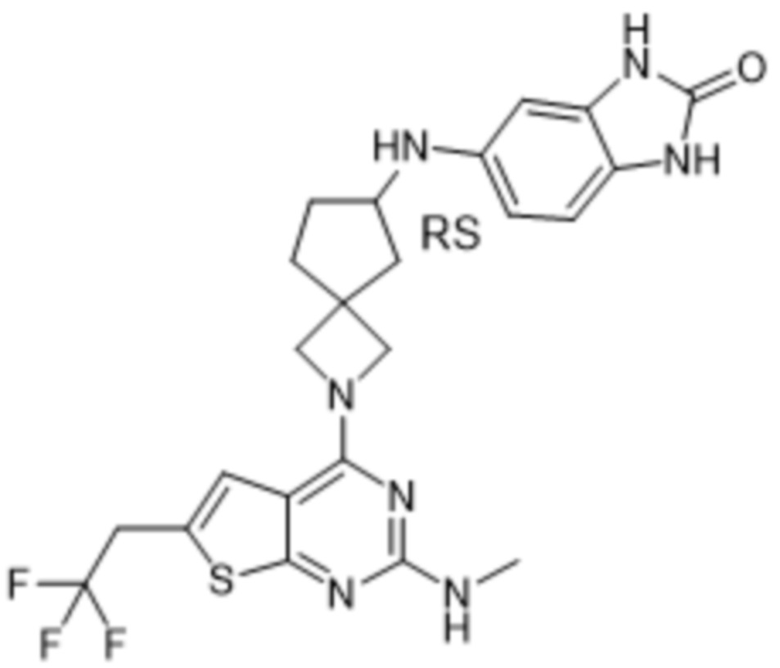
Пример B185
Получение соединения 403
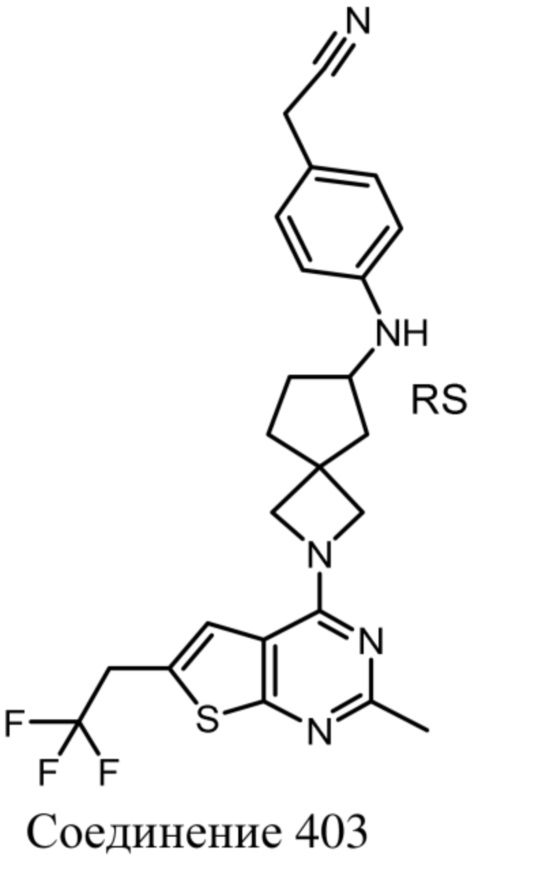
Добавляли якорь магнитной мешалки, промежуточное соединение 289 (67,2 мг, 0,252 ммоль), промежуточное соединение 283 (100 мг, 0,360 ммоль), N, N-диизопропилэтиламин (233 мг, 1,80 ммоль) и ацетонитрил (5 мл) в стеклянный флакон объемом 40 мл, в котором обеспечивали перемешивание при 25°C в течение 2 ч. Смесь разбавляли в DCM (50 мл) и экстрагировали водой (20 мл × 3), высушивали над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении с получением неочищенного продукта, который очищали с помощью преп. TLC (этилацетат/метанол=25/1, Rf=0,3) с получением соединения 403 (рацемат) (25,1 мг, чистота 95,1%, выход 14,1%) в виде белого порошка.
Пример B186
Получение соединения 404
Соединение 404 (смесь цис- и транс-изомеров) получали с помощью протокола реакции, аналогичного описанному выше для получения соединения 403, начиная с соответствующих исходных веществ.
(из промежуточного соединения 289 и промежуточного соединения 277) 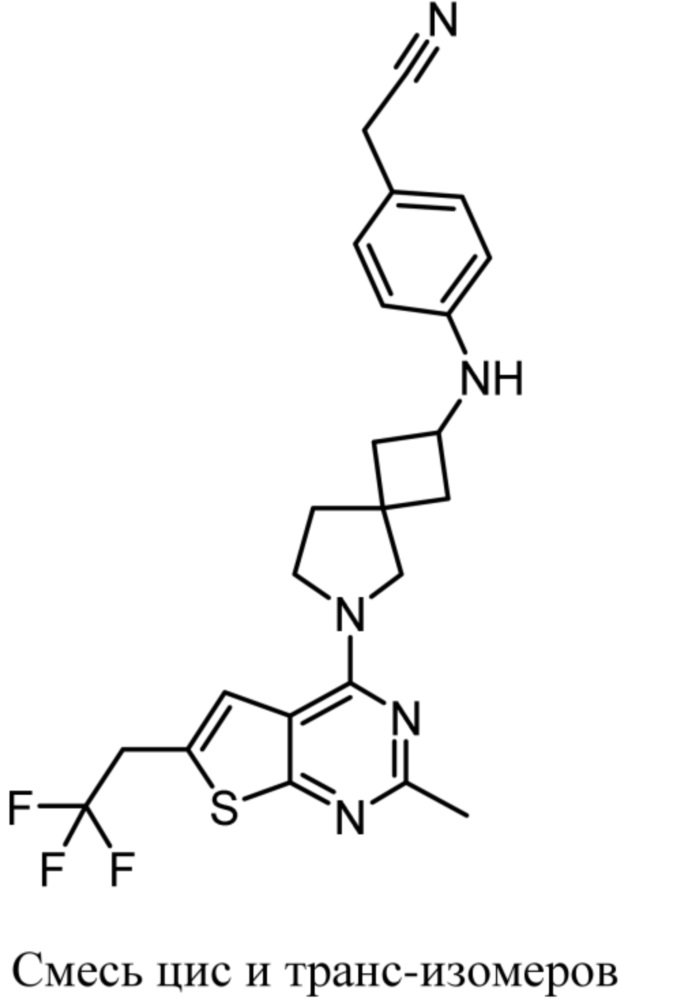
Пример B187
Получение соединения 405 и соединения 406
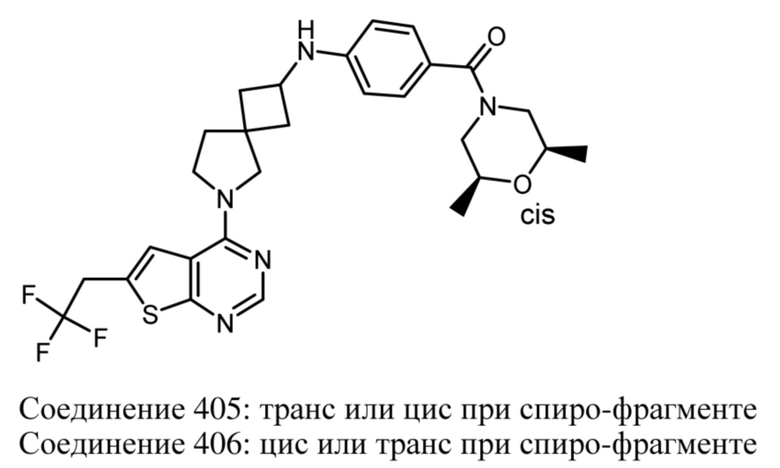
Добавляли цис-2,6-диметилморфолин (25,0 мг, 0,217 ммоль) в смесь, состоящую из промежуточного соединения 59 (50,0 мг, 0,087ммоль), HATU (60,0 мг, 0,158 ммоль), DIEA (45,0 мг, 0,348 ммоль) и DCM (4,0 мл). Полученную смесь перемешивали при 25°C в течение 16 часов. Смесь выливали в воду (15 мл) и экстрагировали с помощью DCM (10 мл × 3). Объединенные органические слои высушивали над безводным Na2SO4, фильтровали и концентрировали in vacuo. Неочищенный остаток очищали с помощью преп. HPLC с применением Phenomenex Gemini 150 × 25 мм × 10 мкм (элюент: вода (0,05% гидроксида аммиака, об./об.)-ACN, от 45% до 75%). Продукт суспендировали в воде (50 мл) и затем лиофилизировали до сухого состояния с получением продукта в виде смеси цис- и транс-изомеров при спиро-фрагменте в виде белого порошка (18,0 мг, выход 37%).
Две партии продукта в виде смеси цис- и транс-изомеров при спиро-фрагменте объединяли и дополнительно разделяли с помощью SFC (условие разделения: YMC CHIRAL Amylose-C (250 мм × 30 мм, 10 мкм), подвижная фаза: A: сверхкритический CO2, B: 0,1% NH3H2O IPA, A:B=60:40 при 50 мл/мин; температура колонки: 38°C; давление в сопле: 100 бар; температура сопла: 60°C; температура испарителя: 20°C; температура триммера: 25°C; длина волны: 220 нм). Две чистые фракции собирали и растворитель выпаривали в вакууме. Два остатка соответственно повторно суспендировали в воде (10 мл) и полученные смеси лиофилизировали до сухого состояния с получением соединения 405 (транс или цис при спиро-фрагменте) в виде белого твердого вещества (9,2 мг, выход 23%) и
соединения 406 (цис или транс при спиро-фрагменте) в виде белого твердого вещества (17,5 мг, выход 44%).
Следующие соединения получали, начиная с промежуточного соединения 59 и соответствующего амина, с применением способа, аналогичного применяемому для получения соединения 405.
Соединение 408 (цис или транс при спиро-фрагменте)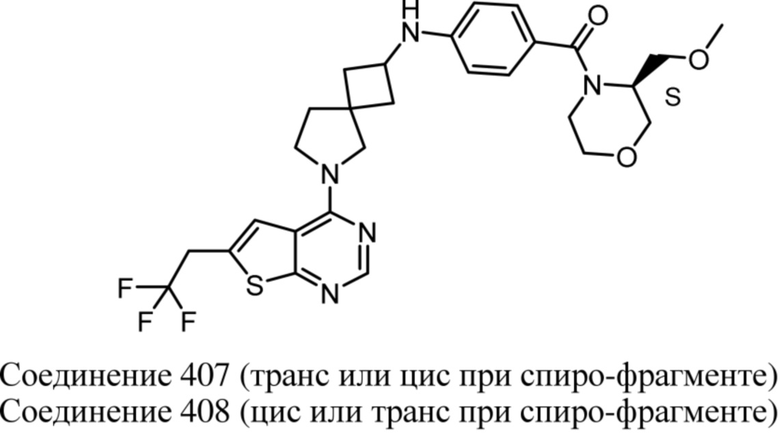
Соединение 410 (цис или транс при спиро-фрагменте) 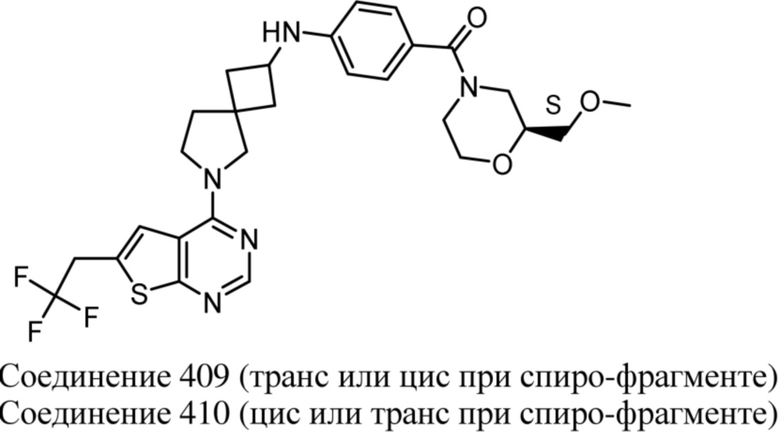
Соединение 412 (цис или транс при спиро-фрагменте) 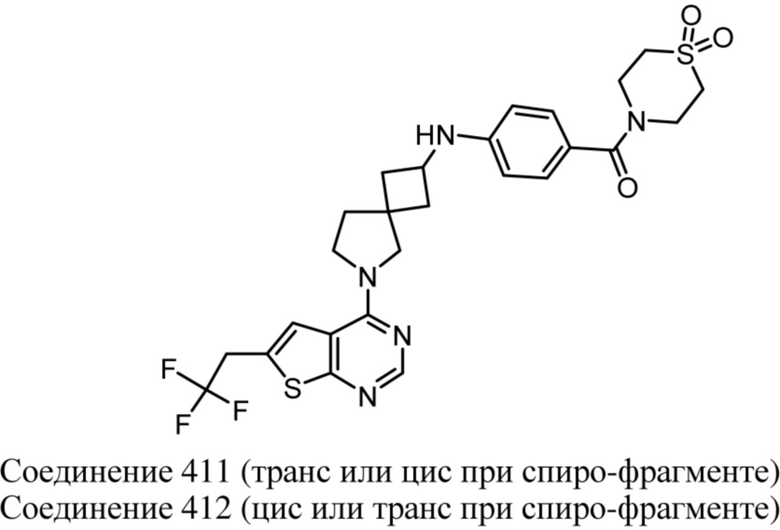
Соединение 414 (цис или транс при спиро-фрагменте)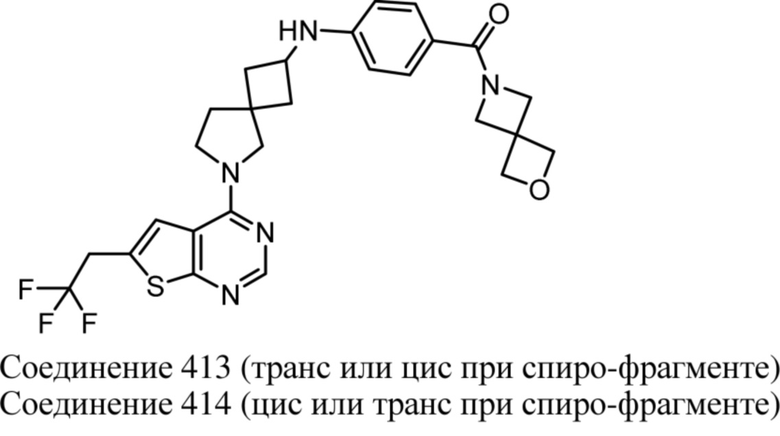
Пример B188
Получение соединения 415
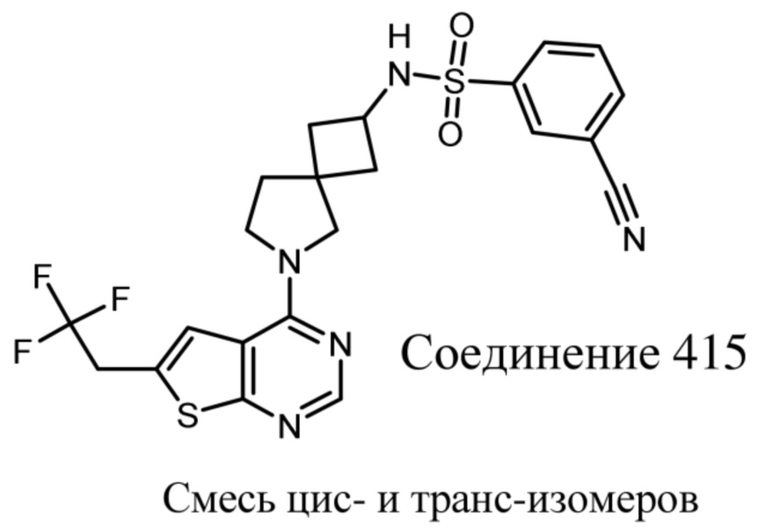
Добавляли 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин (№ по CAS: 1628317-85-0) (92,5 мг, 0,366 ммоль), промежуточное соединение 291 (120 мг, неочищенная соль HCl, 0,366 ммоль), N, N-диизопропилэтиламин (238 мг, 1,84 ммоль) и ацетонитрил (5 мл) в стеклянный флакон объемом 40 мл, в котором обеспечивали перемешивание при 25°C в течение 2 ч. Смесь разбавляли в DCM (50 мл) и экстрагировали водой (20 мл × 3), органический слой высушивали над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении с получением неочищенного продукта, который очищали с помощью преп. TLC (этилацетат/метанол=25/1, Rf=0,3) с получением остатка. Остаток разделяли между ацетонитрилом (2 мл) и водой (10 мл). Раствор лиофилизировали до сухого состояния с получением соединения 415 (смеси цис- и транс-изомеров) (145,6 мг, выход 77,3%) в виде белого порошка.
Соединение 416 и соединение 417 получали, начиная с 4-хлор-6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидина (№ по CAS: 1628317-85-0) и соответствующего амина, с помощью способа, аналогичного применяемому для получения соединения 415.
(из промежуточного соединения 292) 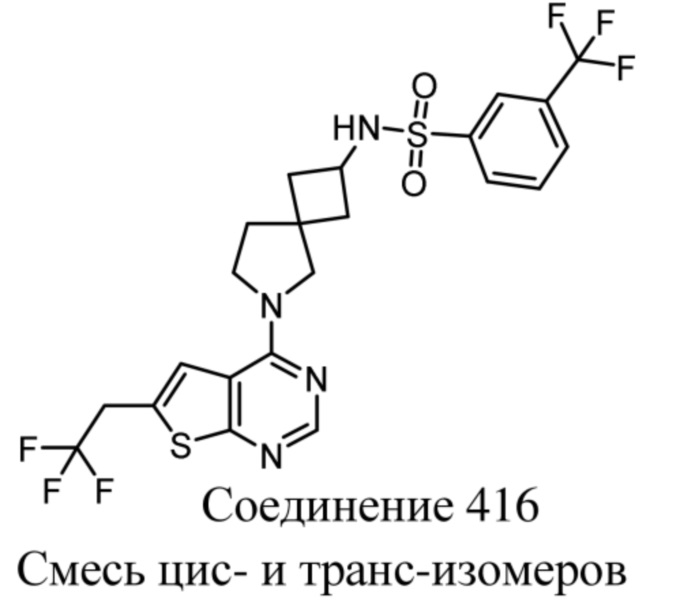
(из промежуточного соединения 293) 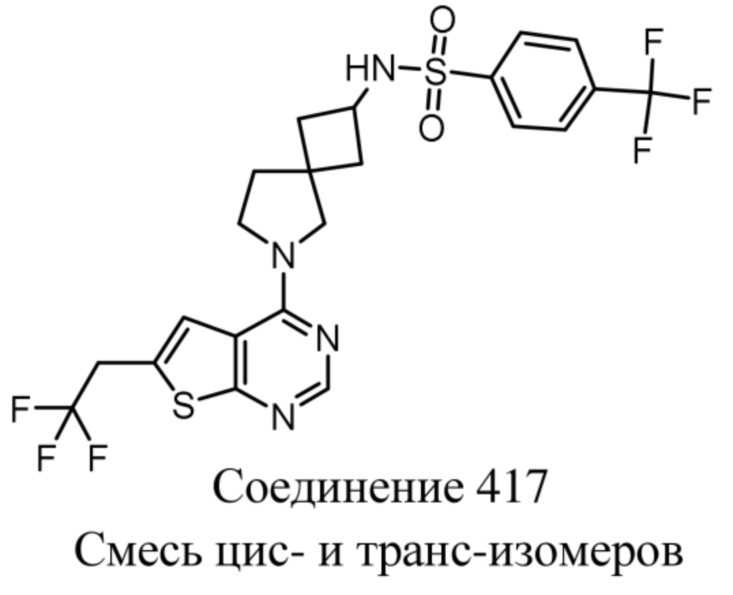
Пример B189
Получение соединения 418 и соединения 419
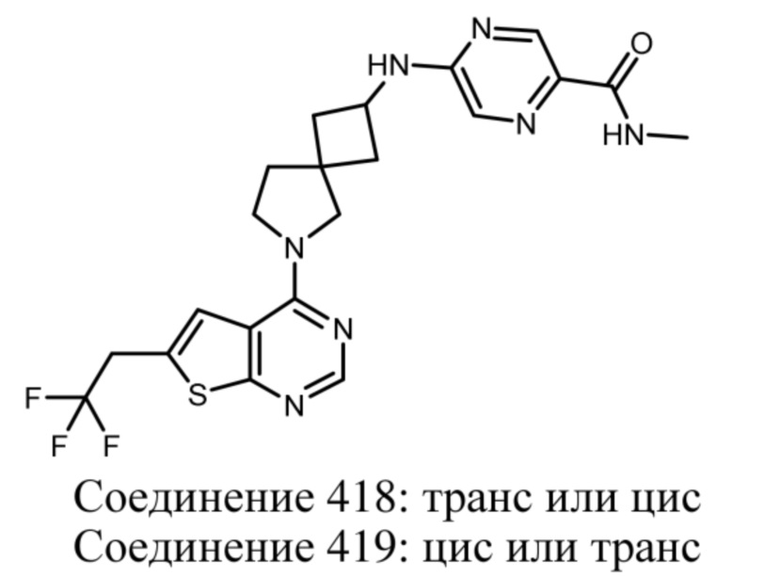
Добавляли промежуточное соединение 294 (200 мг, 1,16 ммоль), промежуточное соединение 3a, представляющее собой 6-(6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин-4-ил)-6-азаспиро[3.4]октан-2-амин (395 мг, соль HCl, 0,730 ммоль), N, N-диизопропилэтиламин (746 мг, 5,77 ммоль) и n-BuOH (2 мл) в сосуд объемом 10 мл. Смесь подвергали микроволновому облучению в течение 5 ч при 140°C. Смесь охлаждали до комнатной температуры, очищали с помощью препаративной HPLC с применением колонки Boston Prime C18 150 × 30 мм × 5 мкм (элюент: от 32% до 62% (об./об.) вода (0,05% гидроксида аммиака, об./об.)-ACN) с получением чистого продукта. Продукт суспендировали в воде (10 мл) и ACN (5 мл), смесь замораживали с применением смеси сухой лед/этанол и затем лиофилизировали до сухого состояния с получением смеси цис- и транс-изомеров) в виде белого твердого вещества.
Полученную смесь цис- и транс-изомеров (200 мг, 0,419 ммоль) разделяли с помощью SFC (условие разделения: колонка: DAICEL CHIRALPAK AD 250 × 30 мм, 10 мкм; подвижная фаза: A: сверхкритический CO2, B: EtOH (0,1% NH3·H2O), A:B=60:40 при 70 мл/мин). Чистые фракции собирали и летучие вещества удаляли при пониженном давлении. Остаток разделяли между CH3CN (2 мл) и водой (8 мл). Смесь замораживали с применением смеси сухой лед/этанол и затем лиофилизировали до сухого состояния с получением соединения 418 и соединения 419 в виде двух белых твердых веществ.
Соединение 420 и соединение 421 получали, начиная с промежуточного соединения 3 и промежуточного соединения 295, с помощью способа, аналогичного применяемому для получения соединений 418 и 419.
Соединение 421 (цис или транс)
(из промежуточного соединения 3a и промежуточного соединения 295) 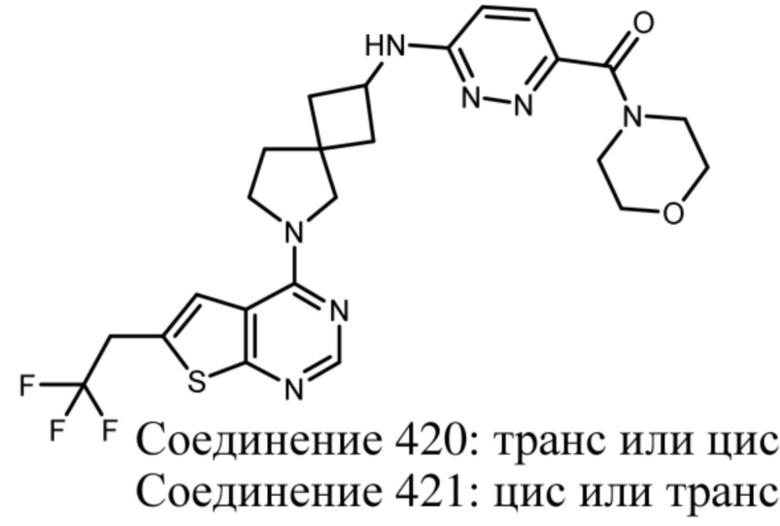
Пример B190
Получение соединения 422
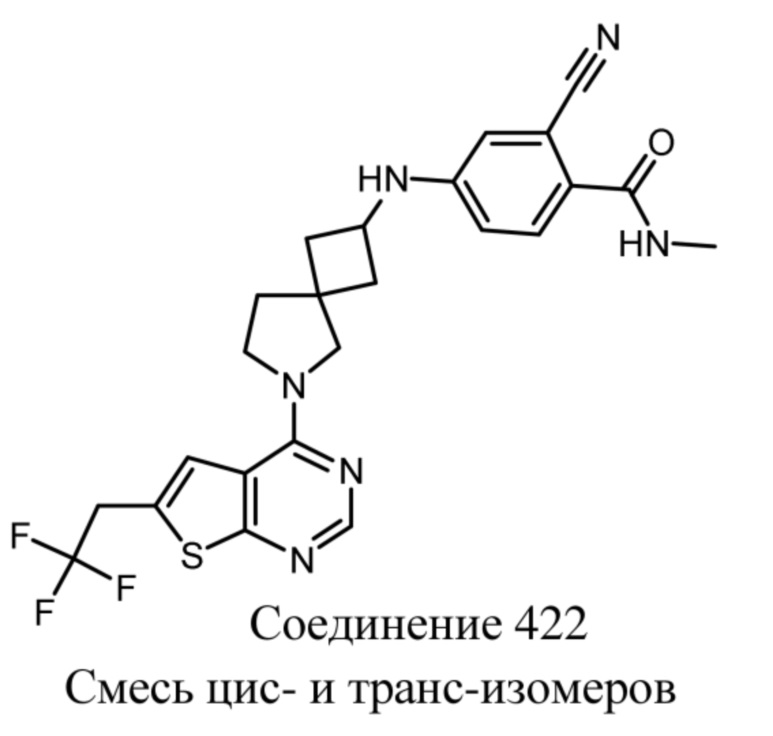
Добавляли якорь магнитной мешалки, промежуточное соединение 296, представляющее собой метил-2-циано-4-((6-(6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин-4-ил)-6-азаспиро[3.4]октан-2-ил)амино)бензоат (60,0 мг, 0,120 ммоль), и метанамин в этаноле (4,0 мл, 30% в этаноле) в стеклянный флакон объемом 8 мл, полученную смесь нагревали и перемешивали при 45°C в течение 8 ч. Смесь охлаждали до комнатной температуры и концентрировали при пониженном давлении с получением неочищенного вещества, которое очищали с помощью преп. HPLC (колонка: Boston Prime C18 150 × 30 мм, 5 мкм, подвижная фаза A: вода (0,04% NH3H2O+10 мМ NH4HCO3), подвижная фаза B: ацетонитрил, расход: 25 мл/мин, при условии градиента от 43% B до 73%). Чистые фракции собирали и растворитель выпаривали в вакууме с получением остатка. Остаток разделяли между ацетонитрилом (2 мл) и водой (10 мл). Раствор лиофилизировали до сухого состояния с получением соединения 422 (RS-смеси цис- и транс-изомеров) (5,43 мг, чистота 93,68% в соответствии с LCMS, выход 8,50%) в виде желтого порошка.
Пример B191
Получение соединения 423
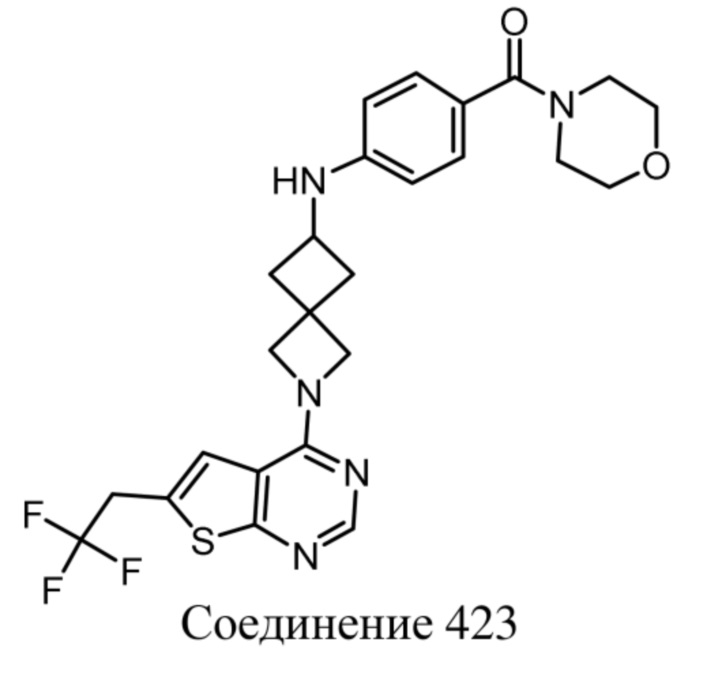
Добавляли якорь магнитной мешалки, промежуточное соединение 298, представляющее собой 2-(6-(2,2,2-трифторэтил)тиено[2,3-d]пиримидин-4-ил)-2-азаспиро[3.3]гептан-6-он (150 мг, 0,46 ммоль), (4-аминофенил)(морфолино)метанон (№ по CAS: 51207-86-4) (142 мг, 0,69 ммоль), цианоборогидрид натрия (57,6 мг, 0,92 ммоль) и сухой метанол (9,5 мл) в стеклянный флакон объемом 40 мл и затем добавляли уксусную кислоту (55,0 мг, 0,92 ммоль) в сухом метаноле (0,5 мл). Реакционную смесь нагревали до 45°C и перемешивали в течение 8 часов. Реакционную смесь разбавляли с помощью DCM (50 мл) и промывали водой (20 мл × 3). Органический слой высушивали над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении с получением остатка, который очищали с помощью препаративной HPLC (колонка: Xtimate C18 150 × 25 мм × 5 мкм, подвижная фаза A: вода (0,225% FA), подвижная фаза B: ацетонитрил, расход: 25 мл/мин, при условии градиента от 28% B до 58%). Чистые фракции собирали и растворитель выпаривали в вакууме. Остаток разделяли между CH3CN (2 мл) и водой (10 мл). Смесь лиофилизировали до сухого состояния с получением соединения 423 () (94,35 мг, чистота 98,7%, выход 39,3%) в виде белого порошка.
Пример B192
Получение соединения 428
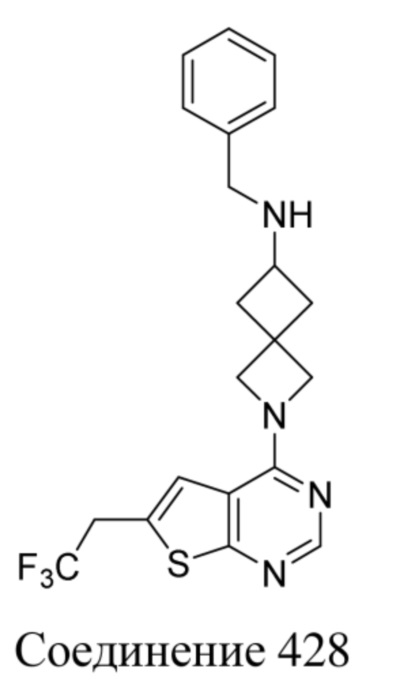
Соединение 428 получали, начиная с промежуточного соединения 300 и бензальдегида, с помощью способа, аналогичного применяемому для получения соединения 48, указанного в таблице ниже.
C. Превращение соединений
Пример C1
Получение соединения 52
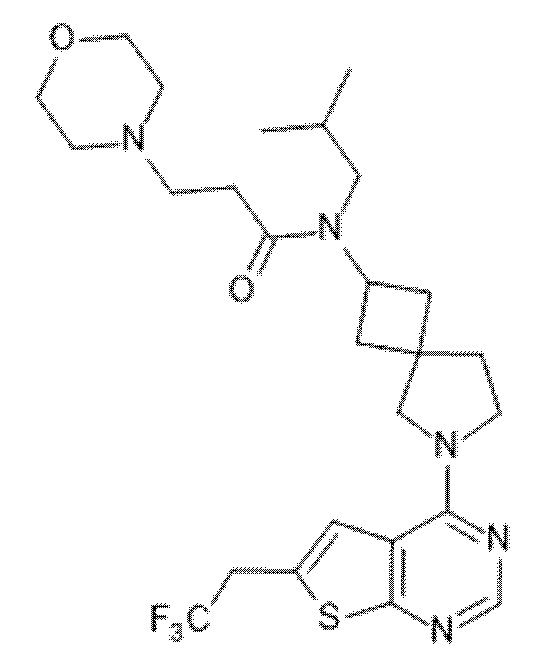
Перемешивали смесь соединения 50 (100 мг; 0,251 ммоль), 3-морфолинопропановой кислоты и бромистоводородной кислоты (72 мг; 0,3 ммоль), HBTU (95 мг; 0,251 ммоль) и DIPEA (216 мкл; 1,255 ммоль) в DMF (4 мл) при комнатной температуре в течение ночи. Реакционную смесь выливали в 10% водный раствор K2CO3 и экстрагировали с помощью EtOAc. Органический слой декантировали, промывали водой, затем солевым раствором, высушивали над MgSO4, фильтровали и выпаривали до сухого состояния. Остаток очищали с помощью хроматографии на силикагеле (SiOH с частицами неправильной формы, 10 г; подвижная фаза: градиент от 0% NH4OH, 0% MeOH, 100% DCM до 1% NH4OH, 10% MeOH, 90% DCM). Фракции, содержащие продукт, собирали и выпаривали до сухого состояния с получением 110 мг неочищенного остатка. Вторую очистку проводили с помощью хроматографии на силикагеле (SiOH с частицами неправильной формы, 10 г; подвижная фаза: градиент от 0% NH4OH, 0% MeOH, 100% DCM до 0,7% NH4OH, 7% MeOH, 93% DCM). Чистые фракции собирали и выпаривали до сухого состояния. Остаток лиофилизировали из смеси вода/ACN (80/20; 10 мл) с получением 82 мг (60%) соединения 52 в виде смеси изомеров 70/30.
Пример C2
Получение соединений 25 и 26
См. превращение соединения 22 в соединения 25 и 26 в примере B17.
Пример C3
Получение соединения 424

Нагревали смесь соединения 341 (80 мг, 0,178 ммоль) и гидрохлорида пиридина (800 мг, 6,923 ммоль) в грушевидной колбе при 200°C в течение 1 ч. Смесь охлаждали до 25°C и добавляли DCM (50 мл). Органический слой промывали водой (30 мл × 3), солевым раствором (30 мл), высушивали над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением остатка, который очищали с помощью преп. HPLC (колонка: Phenomenex Gemini 150 × 25 мм × 10 мкм, подвижная фаза A: вода (0,05% гидроксида аммиака, об./об.), подвижная фаза B: ацетонитрил, расход: 22 мл/мин, при условии градиента от 25% B до 55%). Чистые фракции собирали и растворитель выпаривали в вакууме с получением соединения 424 (смеси цис- и транс-изомеров) в виде белых твердых веществ.
Пример C4
Получение соединения 425
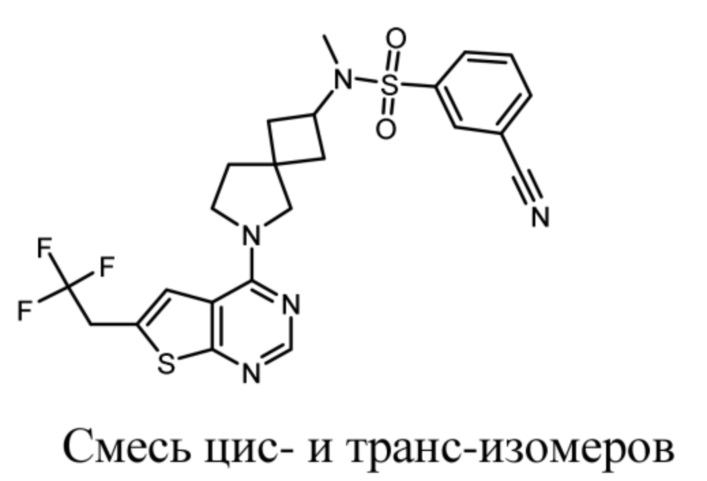
Добавляли якорь магнитной мешалки, соединение 415 (смесь цис- и транс-изомеров) (100 мг, 0,197 ммоль), карбонат калия (273 мг, 1,98 ммоль) и сухой диметилформамид (4 мл) в круглодонную колбу объемом 10 мл, после чего в смесь добавляли по каплям йодметан (20,0 г, 141 ммоль), при этом полученную смесь перемешивали при 25°C в течение 18 ч Смесь суспендировали в воде (50 мл), водный слой экстрагировали с помощью DCM (20 мл × 3). Объединенные органические слои высушивали над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении с получением неочищенного вещества, которое очищали с помощью преп. TLC (петролейный эфир/этилацетат=1/1, Rf=0,4) с получением остатка. Остаток разделяли между ацетонитрилом (2 мл) и водой (10 мл). Раствор лиофилизировали до сухого состояния с получением соединения 425 (смеси цис- и транс-изомеров) (33,2 мг, чистота 98,7%, выход 31,9%) в виде белого порошка.
Пример C5
Получение соединения 426 и соединения 427
Соединения 426 и 427 соответственно получали, начиная с соединений 416 и 417 соответственно, с помощью способа, аналогичного применяемому для получения соединения 425.
(из соединения 416) 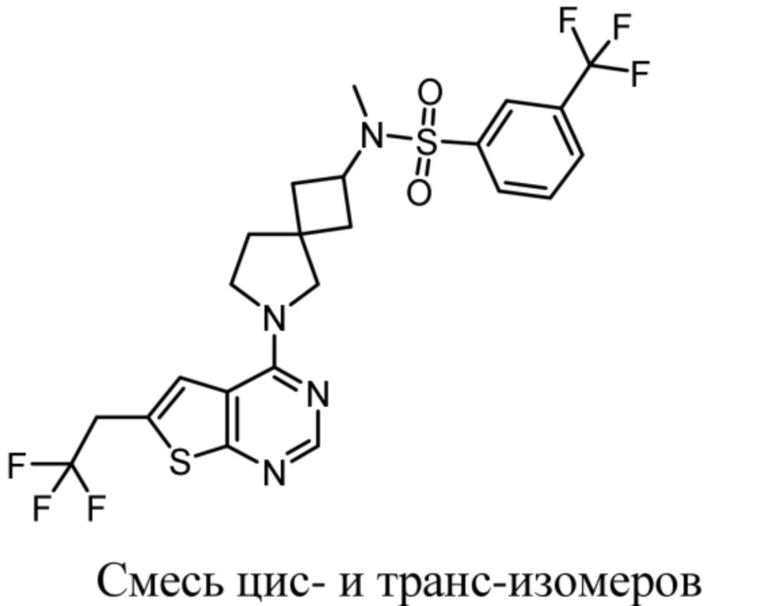
(из соединения 417)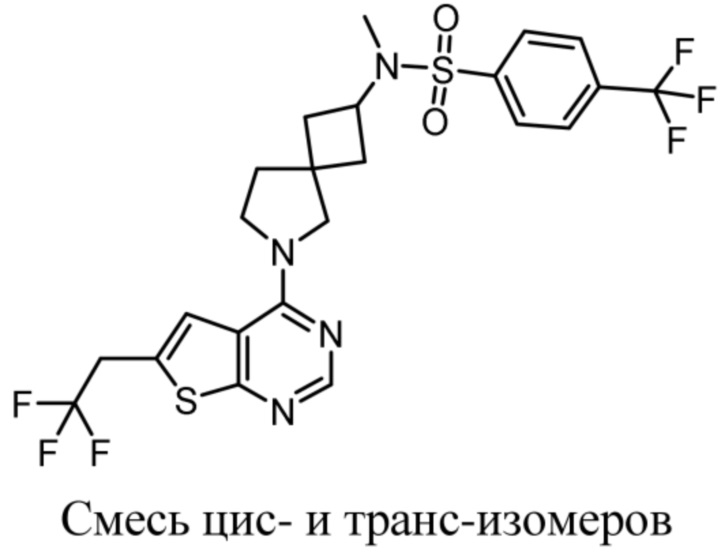
Пример C6
Получение соединения 376
Соединение 376 получали из соединения 340 с помощью способа, указанного на схеме ниже.
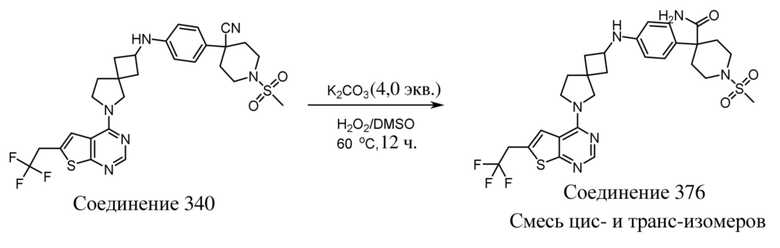
Пример C7
Получение соединения 260
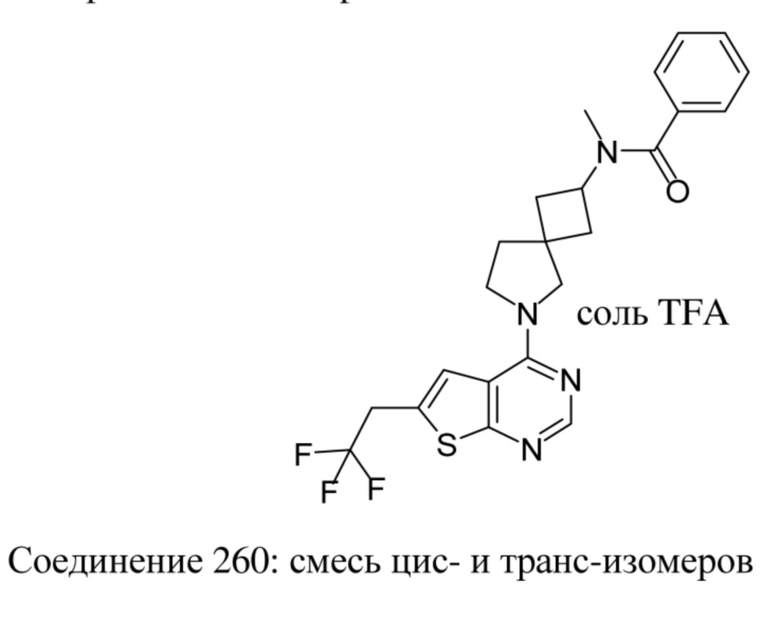
В перемешиваемый раствор соединения 260a (350 мг, 0,78 ммоль) и K2CO3 (269 мг, 1,95 ммоль) в DMF (4 мл) при 0°C добавляли по каплям CH3I (167 мг, 1,18 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь фильтровали и концентрировали. Остаток очищали с помощью преп. HPLC (Waters 2767/Qda, колонка: SunFire 19 × 250 мм, 10 мкм, подвижная фаза A: 0,1% TFA/H2O, B: ACN) с получением необходимого соединения 260 (смеси цис- и транс-изомеров) (63,9 мг, соль TFA, выход 17%) в виде желтого твердого вещества.
Аналитическая часть
LCMS (жидкостная хроматография/масс-спектрометрия)
Общая процедура
Измерения в ходе высокоэффективной жидкостной хроматографии (HPLC) осуществляли с применением насоса для LC, детектора на диодной матрице (DAD) или УФ-детектора и колонки, как описано в соответствующих способах. При необходимости включали дополнительные детекторы (см. приведенную ниже таблицу способов).
Поток из колонки направляли в масс-спектрометр (МС), который был оснащен источником ионизации при атмосферном давлении. В компетенции специалиста в данной области техники находится установка настраиваемых параметров (например, диапазона сканирования, времени выдержки и т.п.) с целью получения ионов, позволяющих определить номинальную моноизотопную молекулярную массу (MW) соединения. Сбор данных осуществляли с помощью соответствующего программного обеспечения.
Соединения описывали по их значениям экспериментального времени удерживания (Rt) и ионам. Если в таблице данных не указано иное, то указанный молекулярный ион соответствует [M+H]+ (протонированной молекуле) и/или [M-H]- (депротонированной молекуле). В случае, если соединение не было непосредственно способно к ионизации, указывали тип аддукта (т.е. [M+NH4]+, [M+HCOO]- и т.д.). Для молекул со сложными изотопными распределениями (Br, Cl и т.п.) указанное значение является таким значением, которое получено для наименьшей массы изотопа. Все результаты получали с экспериментальными погрешностями, которые обычно связаны с применяемым способом.
Далее в данном документе "SQD" означает одиночный квадрупольный детектор, "КТ" означает комнатную температуру, "BEH" означает мостиковый гибрид этилсилоксана/диоксида кремния, "HSS" означает диоксид кремния повышенной прочности, "DAD" означает детектор на диодной матрице.
Таблица 1a. Коды способов LCMS (расход выражен в мл/мин; температура колонки (T) - в °C; время анализа - в минутах). "TFA" означает трифторуксусную кислоту
----
T колонки
----
50
----
50
----
50
----
40
----
40
----
40
----
40
----
40
----
40
----
40
----
40
----
40
----
50
----
40
B:
ацетонитрил с 0,02% TFA
----
50
B: ацетонитрил
----
40
ацетонитрил (4 л) +
TFA (0,75 мл)
----
50
Таблица 1a (продолжение)
----
T колонки
----
40
----
40
----
40
----
40
----
40
----
40
----
40
----
40
----
40
----
50
Таблица 1b. Данные о LCMS и точках плавления. "№ соед." означает номер соединения; "Rt" означает время удерживания в мин
[M-H]−
Таблица 1b (продолжение)
Таблица 1b (продолжение)
Аналитическая хиральная HPLC
Общая процедура для способов SFC
Измерения в ходе SFC проводили с применением аналитической системы для сверхкритической жидкостной хроматографии, укомплектованной насосом для двухкомпонентных смесей для доставки диоксида углерода (CO2) и модификатора, автоматическим дозатором, термостатом для колонок, детектором на диодной матрице, оснащенным проточной кюветой для работы под высоким давлением, выдерживающей значения до 400 бар. В случае оснащения масс-спектрометром (MS) поток из колонки направлялся в (MS). В компетенции специалиста в данной области техники находится установка настраиваемых параметров (например, диапазона сканирования, времени выдержки и т.п.) с целью получения ионов, позволяющих определить номинальную моноизотопную молекулярную массу (MW) соединения. Сбор данных осуществляли с помощью соответствующего программного обеспечения.
Способы хиральной HPLC
Общая процедура для способов хиральной HPLC
Измерения в ходе хиральной HPLC проводили с применением системы для хиральной высокоэффективной жидкостной хроматографии (хиральной HPLC), состоящей из насоса для LC, детектора на диодной матрице (DAD) или УФ-детектора и хиральной колонки, как указано в соответствующих способах. Сбор данных осуществляли с помощью соответствующего программного обеспечения.
Коды способов 15, 18, 39 и 57, приведенные в таблице ниже, относятся к способам хиральной HPLC.
Таблица 2a. Аналитические способы SFC и хиральная HPLC (коды способов 15 и 18) (расход выражен в мл/мин ; температура колонки (T) - в °C; время анализа - в минутах, противодавление (BPR) - в барах (если не указано иное). "ACN" означает ацетонитрил; "MeOH" означает метанол; "EtOH" означает этанол; "DEA" означает диэтиламин Все другие сокращения, используемые в таблице ниже, определены ранее)
в течение 2,5 мин , затем 5% B в течение 1 мин
B: MeOH (+0,3% iPrNH2)
-------
35
--------103
(Хиральная HPLC)
(Хиральная HPLC)
за 3,5 мин и удерживание 40% в течение 2,5 мин , затем 5% B в течение
1,5 мин
(Lux Cellulose-2 150 × 4,6 мм)
за 3,5 мин и удерживание 40% в течение 2,5 мин , затем 5% B в течение
1,5 мин
Таблица 2a (продолжение)
60/34/6/0,08
60/32/8/0,08
(Хиральная HPLC)
80/20
60/34/6/0,08
60/40
70/30
75/21/4/0,05
(Хиральная HPLC)
Таблица 2a (продолжение)
в течение 2,5 мин, затем 5% B в течение 1 мин
в течение 2,5 мин, затем 5% B в течение 1 мин
(Waters)
(PSI)
(Berger)
(Waters)
(PSI)
(Berger)
за 3,5 мин и удерживание 40% в течение 2,5 мин, затем 5% B в течение
1,5 мин
(Berger)
в течение 3 мин, затем 5% B в течение 1,5 мин
(Waters)
(PSI)
(Berger)
в течение 0,35 мин, затем от 40% до 5% B в течение 0,15 мин
(Berger)
за 1,4 мин и удерживание 40% в течение 1,05 мин, затем 5% B в течение
0,35 мин
(Berger)
(Berger)
(Berger)
(Berger)
(Waters)
(PSI)
Таблица 2a (продолжение)
(Berger)
(Berger)
(Waters)
(PSI)
Таблица 2b. Данные SFC. (Порядок элюирования изомеров: "A" происходит до элюирования "B", "B" происходит до элюирования "C", "C" происходит до элюирования "D" при описываемых условиях)
Способ
2,919,
3,094,
3,242
24,332,
26,343,
23,773
B
C
D
B
B
Таблица 2b (продолжение)
Способ
72,2
B
46,5
B
59,08
B
49,15
B
54
B
52,1
B
33,4
B
Таблица 2b (продолжение)
Способ
Таблица 2b (продолжение)
Способ
Оптическое вращение (OR)
Величину оптического вращения измеряли с помощью поляриметра Perkin Elmer 341. Поляризованный свет пропускали через образец при длине пробега 1 дециметр и концентрации образца 0,2-0,4 грамма на 100 миллилитров. Взвешивали 2-4 мг продукта в сосуде, затем растворяли в 1-1,2 мл растворителя для спектроскопии (например, DMF). Кювету наполняли раствором и помещали в поляриметр при температуре 20°C. Величину OR считывали с точностью до 0,004°.
Расчет концентрации: вес в граммах x 100/объем в мл.
[α] d20: (считанная величина вращения x 100)/(1,000 дм x концентрация).
d означает D-линию натрия (589 нанометров).
Таблица: данные OR: температура: 20°C; "конц." означает концентрацию (г/100 мл); "OR" означает вращение плоскости поляризации света; "DMF" означает N, N-диметилформамид
Способы ЯМР
Для некоторых соединений ЯМР-эксперименты проводили с применением спектрометра Bruker Avance 500, оснащенного головкой датчика Bruker на 5 мм BBFO с z-градиентами и работающего при 500 МГц для протонов и 125 МГц для атомов углерода, или с применением спектрометра Bruker Avance DRX 400, в котором применяется внутренняя дейтериевая стабилизация, и оснащенного головкой датчика обратного двойного резонанса (1H, 13C, SEI) с z-градиентами и работающего при 400 МГц для протонов и 100 МГц для атомов углерода. Химические сдвиги (δ) приведены в частях на миллион (ppm). Величины J выражены в Гц.
В качестве альтернативы, некоторые ЯМР-эксперименты выполняли с применением спектрометра Bruker Avance III 400 при температуре окружающей среды (298,6 K), в котором применяется внутренняя дейтериевая стабилизация, оснащенного головкой датчика PABBO BB на 5 мм с z-градиентами и работающего при 400 МГц для протонов и 100 МГц для атомов углерода. Химические сдвиги (δ) приведены в частях на миллион (ppm). Величины J выражены в Гц.
Фармакологическая часть
1) Флуоресцентный поляризационный анализ взаимодействия менин-MLL
В черный 384-луночный титрационный микропланшет с несвязывающей поверхностью добавляли 50 нл 160X тестируемого соединения в DMSO и 4 мкл 2X менина в аналитическом буфере (40 мМ Трис-HCl, pH 7,5, 50 мМ NaCl, 1 мМ DTT (дитиотреитол) и 0,001% Tween 20). После инкубирования тестируемого соединения и менина в течение 10 мин при температуре окружающей среды добавляли 4 мкл 2X пептида MBM1, меченного FITC (FITC-β-аланин-SARWRFPARPGT-NH2), в аналитическом буфере, титрационный микропланшет центрифугировали при 1000 об./мин в течение 1 мин , и анализируемые смеси инкубировали в течение 15 мин при температуре окружающей среды. Относительное количество комплекса менин·FITC-MBM1, присутствующего в анализируемой смеси, определяли путем измерения поляризации флуоресценции (FP) FITC-метки с помощью планшет-ридера BMG PHERAstar (возбуждение при 485 нм/испускание при 520 нм) при температуре окружающей среды. Конечные концентрации реагентов в анализе связывания составляют 100 нМ менина, 5 нМ пептида MBM1, меченного FITC, и 0,625% DMSO в аналитическом буфере. Процедуры титрования тестируемых соединений для исследования их дозозависимого эффекта проводили с использованием схемы трехкратных серийных разведений с 11 точками, начиная с 31 мкМ.
Действенность соединений определяли путем первоначального расчета % ингибирования для каждой концентрации соединения в соответствии с уравнением 1:
% ингибирования = ((HC - LC) - (FPсоединение − LC)) / (HC - LC)) × 100 (уравн. 1),
где LC и HC представляют собой значения FP в анализе в присутствии или в отсутствие насыщающей концентрации соединения, которое конкурирует с FITC-MBM1 за связывание с менином, и FPсоединение представляет собой измеренное значение FP в присутствии тестируемого соединения. Значения FP HC и LC представляют собой средние значения для по меньшей мере 16 повторностей на планшет. Для каждого тестируемого соединения значения % ингибирования откладывали на графике в зависимости от логарифма концентрации тестируемого соединения, и значение IC50 получали в результате аппроксимации этих данных в соответствии с уравнением 2:
% ингибирования=Нижнее значение + (Верхнее значение - Нижнее значение)/(1+10^((logIC50 - log[cmpd]) × h)) (уравн. 2),
где Нижнее значение и Верхнее значение представляют собой соответственно нижнюю и верхнюю асимптоты кривой зависимости доза-эффект, IC50 представляет собой концентрацию соединения, которая обеспечивает 50% ингибирование сигнала, и h представляет собой коэффициент Хилла.
2) Анализ взаимодействия менин-MLL методом гомогенной флуоресценции с временным разрешением (HTRF)
В необработанный белый 384-луночный титрационный микропланшет добавляли 40 нл 200X тестируемого соединения в DMSO и 4 мкл 2X менина, меченного хелатом тербия (см. ниже получение), в аналитическом буфере (40 мМ Трис-HCl, pH 7,5, 50 мМ NaCl, 1 мМ DTT и 0,05% Pluronic F-127). После инкубирования тестируемого соединения и менина, меченного хелатом тербия, в течение 5 мин при температуре окружающей среды добавляли 4 мкл 2X пептида MBM1, меченного FITC (FITC-β-аланин-SARWRFPARPGT-NH2), в аналитическом буфере, титрационный микропланшет центрифугировали при 1000 об./мин в течение 1 мин , и анализируемые смеси инкубировали в течение 15 мин при температуре окружающей среды. Относительное количество комплекса менин·FITC-MBM1, присутствующего в анализируемой смеси, определяли путем измерения гомогенной флуоресценции с временным разрешением (HTRF) для донорно-акцепторной пары флуорофоров тербий/FITC с помощью планшет-ридера BMG PHERAstar (возбуждение при 337 нм/испускание тербия при 490 нм/испускание FITC при 520 нм) при температуре окружающей среды. Степень резонансного переноса энергии флуоресценции (значение HTRF) выражается в виде соотношения значений интенсивности испускания флуоресценции для флуорофоров FITC и тербия (Fem 520 нм/Fem 490 нм). Конечные концентрации реагентов в анализе связывания составляют 100 пМ менина, меченного хелатом тербия (положение 1), или 600 пМ менина, меченного хелатом тербия (положение 2), 75 нМ пептида MBM1, меченного FITC, и 0,5% DMSO в аналитическом буфере. Процедуры титрования тестируемых соединений для исследования зависимости их эффекта от дозы проводили с использованием схемы трехкратных серийных разведений с 11 точками, как правило, начиная с 25 мкМ (положение 1) или, как правило, начиная с 10 мкМ (положение 2).
Действенность соединений определяли путем первоначального расчета % ингибирования для каждой концентрации соединения в соответствии с уравнением 1:
% ингибирования = ((HC - LC) - (FPсоединение - LC)) / (HC - LC)) × 100 (уравн. 1),
где LC и HC представляют собой значения HTRF в анализе в присутствии или в отсутствие насыщающей концентрации соединения, которое конкурирует с FITC-MBM1 за связывание с менином, и HTRFсоединение представляет собой измеренное значение HTRF в присутствии тестируемого соединения. Значения HTRF HC и LC представляют собой средние значения для по меньшей мере 16 повторностей на планшет. Для каждого тестируемого соединения значения % ингибирования откладывали на графике в зависимости от логарифма концентрации тестируемого соединения, и значение IC50 получали в результате аппроксимации этих данных в соответствии с уравнением 2:
% ингибирования=Нижнее значение + (Верхнее значение - Нижнее значение)/(1+10^((logIC50 - log[cmpd]) × h)) (уравн. 2),
где Нижнее значение и Верхнее значение представляют собой соответственно нижнюю и верхнюю асимптоты кривой зависимости доза-эффект, IC50 представляет собой концентрацию соединения, которая обеспечивает 50% ингибирование сигнала, и h представляет собой коэффициент Хилла.
Получение менина, меченного криптатом тербия. Менин (аминокислоты 1-610-6xHis-метка) метили криптатом тербия следующим образом. Буфер для 2 мг менина заменяли на 1x фосфатно-солевой буферный раствор. Инкубировали 16 мкМ менина с NHS-криптат тербия (Cisbio Bioassays, Бедфорд, Массачусетс) в 4-кратном молярном избытке в течение 2 часов при комнатной температуре. Меченый белок очищали от свободной метки путем прогона реакционной смеси через колонку Superdex 200 Increase 10/300 GL при 0,75 мл/мин Пиковые фракции собирали, разделяли на аликвоты и замораживали при -80°C.
Последовательность белка менина (SEQ ID NO: 1)
MGLKAAQKTLFPLRSIDDVVRLFAAELGREEPDLVLLSLVLGFVEHFLAVNRVIPTNVPELTFQPSPAPDPPGGLTYFPVADLSIIAALYARFTAQIRGAVDLSLYPREGGVSSRELVKKVSDVIWNSLSRSYFKDRAHIQSLFSFITGTKLDSSGVAFAVVGACQALGLRDVHLALSEDHAWVVFGPNGEQTAEVTWHGKGNEDRRGQTVNAGVAERSWLYLKGSYMRCDRKMEVAFMVCAINPSIDLHTDSLELLQLQQKLLWLLYDLGHLERYPMALGNLADLEELEPTPGRPDPLTLYHKGIASAKTYYRDEHIYPYMYLAGYHCRNRNVREALQAWADTATVIQDYNYCREDEEIYKEFFEVANDVIPNLLKEAASLLEAGEERPGEQSQGTQSQGSALQDPECFAHLLRFYDGICKWEEGSPTPVLHVGWATFLVQSLGRFEGQVRQKVRIVSREAEAAEAEEPWGEEAREGRRRGPRRESKPEEPPPPKKPALDKGLGTGQGAVSGPPRKPPGTVAGTARGPEGGSTAQVPAPAASPPPEGPVLTFQSEKMKGMKELLVATKINSSAIKLQLTAQSQVQMKKQKVSTPSDYTLSFLKRQRKGLHHHHHH
3a) Анализ пролиферации A
Антипролиферативный эффект тестируемых соединений, ингибирующих белок-белковое взаимодействие менин-MLL, оценивали в линиях лейкозных клеток человека. Линии клеток MV-4-11 и MOLM14 содержат транслокации MLL и экспрессируют слитые белки на основе MLL MLL-AF4 и MLL-AF9 соответственно, а также белок дикого типа со второго аллеля. Следовательно, линии клеток MV-4-11 и MOLM14 с перестройкой MLL характеризуются профилями экспрессии генов HOXA/MEIS1, сходными с таковыми в стволовых клетках. K562 применяли в качестве контрольной линии клеток, содержащей два аллеля MLL дикого типа, с целью исключения соединений, демонстрирующих общие цитотоксические эффекты.
MV-4-11 и MOLM14 культивировали в RPMI-1640 (Sigma Aldrich), дополненной 10% фетальной бычьей сывороткой (HyClone), 2 мМ L-глутамина (Sigma Aldrich) и 50 мкг/мл гентамицина (Gibco). K562 размножали в RPMI-1640 (Sigma Aldrich), дополненной 20% фетальной бычьей сывороткой (HyClone), 2 мМ L-глутамина (Sigma Aldrich) и 50 мкг/мл гентамицина (Gibco). Клетки поддерживали на уровне 0,3-2,5 миллиона клеток на мл во время культивирования, и количество пассажей не превышало 25.
С целью оценки антипролиферативных эффектов 1500 клеток MV-4-11, 300 клеток MOLM14 или 750 клеток K562 высевали в 200 мкл среды на лунку в 96-луночные круглодонные планшеты со сверхнизкой адгезией (Costar, номер по каталогу 7007). Количество клеток для посева выбирали с учетом кривых роста для обеспечения линейного роста на протяжении эксперимента. Добавляли тестируемые соединения в различных концентрациях, и содержание DMSO нормализовали до 0,3%. Клетки инкубировали в течение 8 дней при 37°C и 5% CO2. Рост сфероидоподобных структур отслеживали в режиме реального времени путем визуализации живых клеток (IncuCyteZOOM, Essenbio, объектив с увеличением 4x) с получением одного изображения каждые четыре часа в течение 8 дней. Конфлюэнтность (%) в качестве показателя размера сфероидов определяли с помощью инструмента комплексного анализа.
С целью определения кумулятивного эффекта тестируемых соединений с течением времени рассчитывали площадь под кривой (AUC) на графике зависимости конфлюэнтности от времени. Конфлюэнтность в начале эксперимента (t=0) использовали в качестве исходного уровня для расчета AUC.
Абсолютные значения IC50 рассчитывали в соответствии со следующей процедурой:
% от контроля = (AUC образца/AUC контроля) × 100
AUC контроля=среднее значение AUC для контрольных образцов (клетки без соединения/с DMSO в качестве контроля среды-носителя)
В отношении графика зависимости % от контроля от концентрации соединения применяли подбор нелинейной кривой, используя для подбора (обычный) метод наименьших квадратов. На основании этого рассчитывали абсолютное значение IC50 (полумаксимальную ингибирующую концентрацию тестируемого соединения, обуславливающую 50% антипролиферативный эффект относительно контроля растворителя).
3b) Анализ пролиферации B
Антипролиферативный эффект тестируемых соединений, ингибирующих белок-белковое взаимодействие менин-MLL, оценивали в линиях лейкозных клеток человека. Линии клеток MV-4-11 и MOLM14 содержат транслокации MLL и экспрессируют слитые белки на основе MLL MLL-AF4 и MLL-AF9 соответственно, а также белок дикого типа со второго аллеля. Следовательно, линии клеток MV-4-11 и MOLM14 с перестройкой MLL характеризуются профилями экспрессии генов HOXA/MEIS1, сходными с таковыми в стволовых клетках. K562 применяли в качестве контрольной линии клеток, содержащей два аллеля MLL дикого типа, с целью исключения соединений, демонстрирующих общие цитотоксические эффекты.
MV-4-11 и MOLM14 культивировали в RPMI-1640 (Sigma Aldrich), дополненной 10% фетальной бычьей сывороткой (HyClone), 2 мМ L-глутамина (Sigma Aldrich) и 50 мкг/мл гентамицина (Gibco). K562 размножали в RPMI-1640 (Sigma Aldrich), дополненной 20% фетальной бычьей сывороткой (HyClone), 2 мМ L-глутамина (Sigma Aldrich) и 50 мкг/мл гентамицина (Gibco). Клетки поддерживали на уровне 0,3-2,5 миллиона клеток на мл во время культивирования, и количество пассажей не превышало 25.
С целью оценки антипролиферативных эффектов 1500 клеток MV-4-11, 300 клеток MOLM14 или 750 клеток K562 высевали в 200 мкл среды на лунку в 96-луночные круглодонные планшеты со сверхнизкой адгезией (Costar, номер по каталогу 7007). Количество клеток для посева выбирали с учетом кривых роста для обеспечения линейного роста на протяжении эксперимента. Добавляли тестируемые соединения в различных концентрациях, и содержание DMSO нормализовали до 0,3%. Клетки инкубировали в течение 8 дней при 37°C и 5% CO2. Рост сфероидоподобных структур измеряли в режиме реального времени путем визуализации живых клеток (IncuCyteZOOM, Essenbio, объектив с увеличением 4x) с получением изображений на 8 день. Конфлюэнтность (%) в качестве показателя размера сфероидов определяли с помощью инструмента комплексного анализа.
С целью определения эффекта тестируемых соединений с течением времени рассчитывали конфлюэнтность в каждой лунке в качестве показателя размера сфероидов. Конфлюэнтность наиболее высокой дозы эталонного соединения применяли в качестве исходного уровня для начала эксперимента, (t=0) применяли в качестве исходного уровня для расчета.
Абсолютные значения IC50 рассчитывали как процентное изменение конфлюэнтности следующим образом.
LC=Низкий контроль: клетки, обработанные 1 мкМ цитотоксическим средством, представляющим собой стауроспорин
HC=Высокий контроль: средняя конфлюэнтность (%) (клетки, обработанные DMSO)
% эффекта=100 - (100 × (образец - LC)/(HC - LC))
Для определения IC50 строили кривую на графике зависимости % эффекта от log10 концентрации соединения с применением сигмоидальной аппроксимации с переменным угловым коэффициентом и установлением максимума, соответствующего 100%, и минимума, соответствующего 0%.
Таблица 4a. Биологические данные в анализе взаимодействия менин-MLL методом гомогенной флуоресценции с временным разрешением (HTRF) (2).
NT: не тестировали
Таблица 4b. Биологические данные в анализе пролиферации (3).
MV-4-11
(IC50 (мкМ))
Анализ A
Анализ A
Анализ сфероидов
K562
Анализ A
Анализ сфероидов
MV-4-11
(IC50 (мкМ))
Анализ B
Анализ сфероидов MOLM14 (IC50 (мкМ))
Анализ B
Анализ сфероидов
K562
Анализ B
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Janssen Pharmaceutica NV
Джонсон енд Джонсон (Чайна) Инвестмент. Лтд.
<120> ЭКЗО-АЗАСПИРО-ИНГИБИТОРЫ ВЗАИМОДЕЙСТВИЯ МЕНИН-MLL
<130> P2018TC623
<160> 1
<170> PatentIn версия 3.5
<210> 1
<211> 616
<212> БЕЛОК
<213> Искусственная последовательность
<400> 1
Met Gly Leu Lys Ala Ala Gln Lys Thr Leu Phe Pro Leu Arg Ser Ile
1 5 10 15
Asp Asp Val Val Arg Leu Phe Ala Ala Glu Leu Gly Arg Glu Glu Pro
20 25 30
Asp Leu Val Leu Leu Ser Leu Val Leu Gly Phe Val Glu His Phe Leu
35 40 45
Ala Val Asn Arg Val Ile Pro Thr Asn Val Pro Glu Leu Thr Phe Gln
50 55 60
Pro Ser Pro Ala Pro Asp Pro Pro Gly Gly Leu Thr Tyr Phe Pro Val
65 70 75 80
Ala Asp Leu Ser Ile Ile Ala Ala Leu Tyr Ala Arg Phe Thr Ala Gln
85 90 95
Ile Arg Gly Ala Val Asp Leu Ser Leu Tyr Pro Arg Glu Gly Gly Val
100 105 110
Ser Ser Arg Glu Leu Val Lys Lys Val Ser Asp Val Ile Trp Asn Ser
115 120 125
Leu Ser Arg Ser Tyr Phe Lys Asp Arg Ala His Ile Gln Ser Leu Phe
130 135 140
Ser Phe Ile Thr Gly Thr Lys Leu Asp Ser Ser Gly Val Ala Phe Ala
145 150 155 160
Val Val Gly Ala Cys Gln Ala Leu Gly Leu Arg Asp Val His Leu Ala
165 170 175
Leu Ser Glu Asp His Ala Trp Val Val Phe Gly Pro Asn Gly Glu Gln
180 185 190
Thr Ala Glu Val Thr Trp His Gly Lys Gly Asn Glu Asp Arg Arg Gly
195 200 205
Gln Thr Val Asn Ala Gly Val Ala Glu Arg Ser Trp Leu Tyr Leu Lys
210 215 220
Gly Ser Tyr Met Arg Cys Asp Arg Lys Met Glu Val Ala Phe Met Val
225 230 235 240
Cys Ala Ile Asn Pro Ser Ile Asp Leu His Thr Asp Ser Leu Glu Leu
245 250 255
Leu Gln Leu Gln Gln Lys Leu Leu Trp Leu Leu Tyr Asp Leu Gly His
260 265 270
Leu Glu Arg Tyr Pro Met Ala Leu Gly Asn Leu Ala Asp Leu Glu Glu
275 280 285
Leu Glu Pro Thr Pro Gly Arg Pro Asp Pro Leu Thr Leu Tyr His Lys
290 295 300
Gly Ile Ala Ser Ala Lys Thr Tyr Tyr Arg Asp Glu His Ile Tyr Pro
305 310 315 320
Tyr Met Tyr Leu Ala Gly Tyr His Cys Arg Asn Arg Asn Val Arg Glu
325 330 335
Ala Leu Gln Ala Trp Ala Asp Thr Ala Thr Val Ile Gln Asp Tyr Asn
340 345 350
Tyr Cys Arg Glu Asp Glu Glu Ile Tyr Lys Glu Phe Phe Glu Val Ala
355 360 365
Asn Asp Val Ile Pro Asn Leu Leu Lys Glu Ala Ala Ser Leu Leu Glu
370 375 380
Ala Gly Glu Glu Arg Pro Gly Glu Gln Ser Gln Gly Thr Gln Ser Gln
385 390 395 400
Gly Ser Ala Leu Gln Asp Pro Glu Cys Phe Ala His Leu Leu Arg Phe
405 410 415
Tyr Asp Gly Ile Cys Lys Trp Glu Glu Gly Ser Pro Thr Pro Val Leu
420 425 430
His Val Gly Trp Ala Thr Phe Leu Val Gln Ser Leu Gly Arg Phe Glu
435 440 445
Gly Gln Val Arg Gln Lys Val Arg Ile Val Ser Arg Glu Ala Glu Ala
450 455 460
Ala Glu Ala Glu Glu Pro Trp Gly Glu Glu Ala Arg Glu Gly Arg Arg
465 470 475 480
Arg Gly Pro Arg Arg Glu Ser Lys Pro Glu Glu Pro Pro Pro Pro Lys
485 490 495
Lys Pro Ala Leu Asp Lys Gly Leu Gly Thr Gly Gln Gly Ala Val Ser
500 505 510
Gly Pro Pro Arg Lys Pro Pro Gly Thr Val Ala Gly Thr Ala Arg Gly
515 520 525
Pro Glu Gly Gly Ser Thr Ala Gln Val Pro Ala Pro Ala Ala Ser Pro
530 535 540
Pro Pro Glu Gly Pro Val Leu Thr Phe Gln Ser Glu Lys Met Lys Gly
545 550 555 560
Met Lys Glu Leu Leu Val Ala Thr Lys Ile Asn Ser Ser Ala Ile Lys
565 570 575
Leu Gln Leu Thr Ala Gln Ser Gln Val Gln Met Lys Lys Gln Lys Val
580 585 590
Ser Thr Pro Ser Asp Tyr Thr Leu Ser Phe Leu Lys Arg Gln Arg Lys
595 600 605
Gly Leu His His His His His His
610 615
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ СОЕДИНЕНИЯ | 2013 |
|
RU2654857C2 |
| ПИРРОЛОПИРРОЛОВЫЕ КОМПОЗИЦИИ В КАЧЕСТВЕ АКТИВАТОРОВ ПИРУВАТКИНАЗЫ (PKR) | 2018 |
|
RU2736217C2 |
| ЗАМЕЩЕННЫЕ ГЕТЕРОАРИЛОМ ПИРИДИНЫ И СПОСОБЫ ПРИМЕНЕНИЯ | 2017 |
|
RU2756743C2 |
| ПТЕРИДИНЫ В КАЧЕСТВЕ FGFR ИНГИБИТОРОВ | 2013 |
|
RU2702906C2 |
| ПРОИЗВОДНЫЕ 1,5- И 1,7-НАФТИРИДИНА, ПОЛЕЗНЫЕ ПРИ ЛЕЧЕНИИ ЗАБОЛЕВАНИЙ, ОПОСРЕДОВАННЫХ FGFR | 2012 |
|
RU2629194C2 |
| СОЕДИНЕНИЯ НА ОСНОВЕ ПИРАЗОЛОПИРИДИНОНА | 2018 |
|
RU2806751C2 |
| СОЕДИНЕНИЯ НА ОСНОВЕ ПИРАЗОЛОПИРИДИНОНА | 2018 |
|
RU2806625C2 |
| НОВЫЕ ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ АЗАИНДОЛИНА В КАЧЕСТВЕ ИНГИБИТОРОВ NIK | 2018 |
|
RU2780577C2 |
| БЕНЗОКСАЗИНИЛ-АМИДОЦИКЛОПЕНТИЛ-ГЕТЕРОЦИКЛИЧЕСКИЕ МОДУЛЯТОРЫ ХЕМОКИНОВЫХ РЕЦЕПТОРОВ | 2004 |
|
RU2301802C2 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ ИММУНОМОДУЛЯТОРЫ В КАЧЕСТВЕ ИНГИБИТОРА КОНТРОЛЬНЫХ ТОЧЕК ИММУННОГО ОТВЕТА PDL1 | 2020 |
|
RU2824127C2 |
Изобретение относится к новым соединениям формулы (I), где значения A, L, Y1, Y2, R1-R3, n1, n2, m1, m2 определены в формуле изобретения, к фармацевтической композиции, содержащей такие соединения, и к их применению в качестве ингибиторов белок-белковых взаимодействий менин-MLL, пригодных для лечения заболеваний, таких как рак, миелодиспластический синдром (MDS) и диабет. 4 н. и 6 з.п. ф-лы, 4 табл., 198 пр.
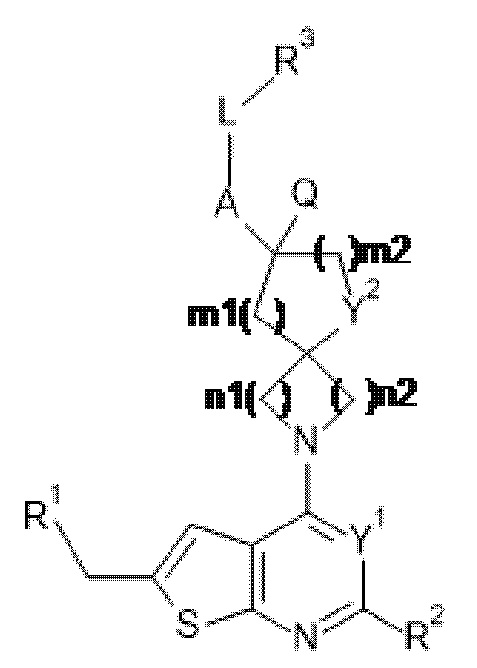
1. Соединение формулы (I),
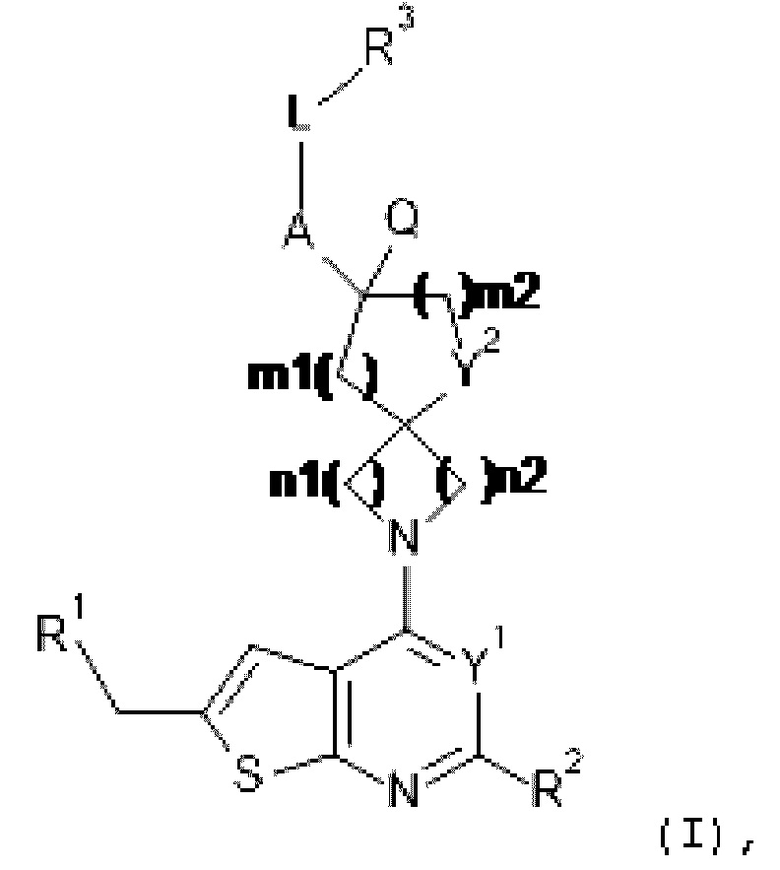
или его таутомер или стереоизомерная форма, где
R1 представляет собой CF3;
Y1 представляет собой N;
R2 выбран из группы, состоящей из водорода, CH2, -OCH3, -NH2 и -NH-CH3;
Y2 представляет собой CH2;
А представляет собой ковалентную связь или -CR15aR15b-;
R15a и R15b представляют собой водород;
Q представляет собой водород;
-L-R3 выбран из (а), (b) или (с):
(a) --L-R3 представляет собой -NRAR1A, где
RA выбран из группы, состоящей из водорода и С1-4алкила;
R1A представляют собой С1-6алкил;
или
(b) L выбран из группы, состоящей из -N(RB)- и -N(RB)-CR1BR1BB-; и
R3 выбран из группы, состоящей из Ar; Het1; Het3 и R17;
где
RB выбран из группы, состоящей из водорода и С1-4алкила;
R1B выбран из группы, состоящей из водорода и C1-4алкила; и
R1BB выбран из группы, состоящей из водорода и метила; или R1B и R1BB с углеродом, к которому они присоединены, образуют С3-6циклоалкил;
или
(с) --L-R3 выбран из группы, состоящей из -N(Rc)-COR5c и
-N(RC)-SO2-R13c, где
RC выбран из группы, состоящей из водорода и С1-4алкила;
каждый из R5C и R13C независимо выбран из группы, состоящей из Ar; и С1-4алкила, необязательно замещенного Het2;
Ar представляет собой фенил, необязательно замещенный одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, -CN, -OR4, -NR5R5', -С(=O)NR5R5', Het4, -O-Het4, -C(=O)-Het4, -S(=O)2-Het4, -S(=O)2-NR5R5', -S(=O)2-С1-4алкила, R14, CF3, С3-5циклоалкила, необязательно замещенного -CN, и
С1-4алкила, необязательно замещенного одним или двумя заместителями, каждый из которых независимо выбран из группы, состоящей из Het4, -CN, -OR6, -NR7R7', -S(=O)2-С1-4алкила и -C(=O)NR8R8';
Het1 представляет собой моноциклический гетероарил, выбранный из группы, состоящей из пиридила, 2-, 4-, 5- или 6-пиримидинила, пиразинила, пиридазинила, пиразолила и имидазолила; каждый из которых может быть необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из -CN, -OR4, -C(=O)NR5R5', -C(=O)-Het4 и С1-4алкила, необязательно замещенного -C(=O)NR8R8'; и
Het2 представляет собой морфолинил;
где
каждый из R4, R5, R5', R6, R7, R7', R8 и R8' независимо выбран из группы, состоящей из водорода; -С(=O)-С1-4алкила; S(=O)2-С1-4алкила;
С1-4алкила, необязательно замещенного заместителем, выбранным из группы, состоящей из -CN, R11'' и R16;
С1-4алкила, замещенного тремя атомами фтора; и
С2-4алкила, замещенного заместителем, выбранным из группы, состоящей из -OR10 и -NR11R11'; где
каждый из R10, R11, R11' и R11'' независимо выбран из группы, состоящей из водорода; С1-4алкила; -S(=O)2-С1-4алкила и связанного посредством С 4-7-членного неароматического гетероциклила, содержащего по меньшей мере один атом азота, кислорода или серы, где указанный гетероциклил необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из -S(=O)2-C1-4алкила и С1-4алкила;
R16 представляет собой связанный посредством N 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом N и необязательно один дополнительный гетероатом, выбранный из азота, кислорода и серы, где указанный гетероциклил необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из -S (=O)2-С1-4алкила;
R14 представляет собой 5-членный моноциклический гетероарил, содержащий по меньшей мере один атом азота и необязательно 1, 2 или 3 дополнительный гетероатома, каждый из который независимо выбран из азота, кислорода и серы;
Het3 выбран из группы, состоящей из заместителей, соответствующий формулам (b-1) и (b-2):
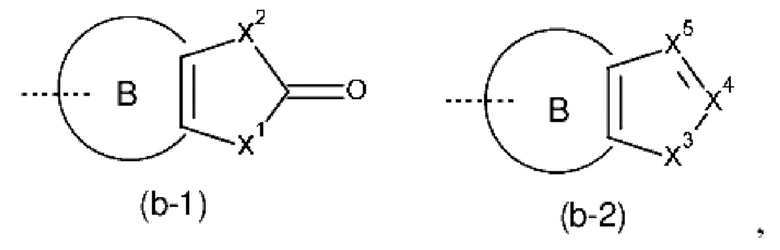
где кольцо B представляет собой фенил;
X1 представляет собой СН2, О или NH;
X2 представляет собой NH или О;
X3 представляет собой NH или О;
X4 представляет собой СН или N;
X5 представляет собой СН или N;
где один атом С или один атом N в 5-членном кольце (b-1) или (b-2), включая подходящие атомы С и атомы N в определении X1, X2, X3, X4 и X5, могут быть замещены одной или, если возможно, двумя С1-4алкильными группами, необязательно замещенными одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из галогена, циано, -C(=O)NR5R5' и Het4;
Het4 представляет собой 4-7-членный неароматический гетероциклил, содержащий по меньшей мере один атом азота, кислорода или серы, где указанный гетероциклил необязательно замещен одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из -CN, оксо, -C(=O)NR5R5', -O-С1-4алкила, -S(=O)2-С1-4алкила и С1-4алкила, необязательно замещенного -О-С1-4алкилом;
R17 представляет собой С3-6циклоалкил, необязательно замещенный одним или несколькими заместителями, выбранными из группы, состоящей из -NR5R5';
n1 равняется 2, n2 равняется 1, m1 равняется 1, и m2 равняется 0; или n1 равняется 1, n2 равняется 1, m1 равняется 1, и m2 равняется 1;
или его фармацевтически приемлемая соль.
2. Соединение по п. 1, где А представляет собой ковалентную связь.
3. Соединение по п. 1, где А представляет собой -CR15aR15b-.
4. Фармацевтическая композиция для ингибирования белок-белкового взаимодействия менин-MLL, содержащая терапевтически эффективное количество соединения по любому из пп. 1-3 и фармацевтически приемлемый носитель или разбавитель.
5. Способ получения фармацевтической композиции по п. 4, предусматривающий смешивание фармацевтически приемлемого носителя с терапевтически эффективным количеством соединения по любому из пп. 1-3.
6. Соединение по любому из пп. 1-3 или фармацевтическая композиция по п. 4 для применения в качестве лекарственного препарата.
7. Соединение по любому из пп. 1-3 или фармацевтическая композиция по п. 4 для применения в предупреждении или лечении лейкоза.
8. Соединение или фармацевтическая композиция для применения по п. 7, где лейкоз выбран из видов острого лейкоза, видов хронического лейкоза, видов миелоидного лейкоза, видов миелогенного лейкоза, видов лимфобластного лейкоза, видов лимфоцитарного лейкоза, видов острого миелогенного лейкоза (AML), видов хронического миелогенного лейкоза (CML), видов острого лимфобластного лейкоза (ALL), видов хронического лимфоцитарного лейкоза (CLL), видов Т-клеточного пролимфоцитарного лейкоза (T-PLL), лейкоза из больших гранулярных лимфоцитов, волосатоклеточного лейкоза (HCL), видов лейкоза с перестройкой MLL, видов лейкоза, ассоциированных с MLL-PTD, видов лейкоза с амплификацией MLL, видов MLL-положительного лейкоза и видов лейкоза, характеризующихся профилями экспрессии генов HOX/MEIS1.
9. Способ лечения или предупреждения лейкоза предусматривающий введение субъекту, нуждающемуся в этом, терапевтически эффективного количества соединения по любому из пп. 1-3 или фармацевтической композиции по п. 4.
10. Способ по п. 9, где лейкоз выбран из видов острого лейкоза, видов хронического лейкоза, видов миелоидного лейкоза, видов миелогенного лейкоза, видов лимфобластного лейкоза, видов лимфоцитарного лейкоза, видов острого миелогенного лейкоза (AML), видов хронического миелогенного лейкоза (CML), видов острого лимфобластного лейкоза (ALL), видов хронического лимфоцитарного лейкоза (CLL), видов Т-клеточного пролимфоцитарного лейкоза (T-PLL), лейкоза из больших гранулярных лимфоцитов, волосатоклеточного лейкоза (HCL), видов лейкоза с перестройкой MLL, видов лейкоза, ассоциированных с MLL-PTD, видов лейкоза с амплификацией MLL, видов MLL-положительного лейкоза и видов лейкоза, характеризующихся профилями экспрессии генов HOX/MEIS1.
| WO 2017112768 A129.06.2017 | |||
| WO 2017161028 A1, 21.09.2017 | |||
| WO 2016195776 A1, 08.12.2016 | |||
| WO 2017214367 A1, 14.12.2017 | |||
| WO 2017207387 A1, 07.12.2017 | |||
| WO 2014164543 A1, 09.10.2014. |
Авторы
Даты
2023-04-28—Публикация
2018-12-19—Подача