Изобретение относится к медицине, а именно к криохирургии и онкологии, и может быть использовано для выполнения чрескожной пункционной криоаблации при опухолях костей.
Скелет является одной из основных мишеней метастазирования, располагаясь на третьем месте после легких и печени [Macedo F., Ladeira K., Pinho F., et al. Bone metastases: an overview // Oncology Reviews. - 2017. - Vol. 11, №1. - P. 43-49.]. Метастазирование солидных опухолей в кости обнаруживаются у 65-80% пациентов с распространенным раком предстательной и молочной железы, у 40-50% больных раком легкого и, примерно, у 10% пациентов, страдающих от рака желудочно-кишечного тракта [Kong PY, Yan JL, Liu DH, Ji Y, Wang YF, Zhuang JP, Wang JC, Hu XW, Yue XL. Skeletal-related events and overall survival of patients with bone metastasis from nonsmall cell lung cancer - A retrospective analysis. Medicine. 2017; 96(51):e9327. https://doi.org/10.1097/MD.0000000000009327. Portales F, Thezenas S, Samalin E, Assenat E, Mazard T, Ychou M. Bone metastases in gastrointestinal cancer. Clinical & Experimental Metastasis. 2015;32(1):7-14. https://doi.org/10.1007/s10585-014-9686-x]. Ежегодно в мире выявляется примерно 280 000 новых случаев метастатического поражения костей [Cheung F.Н. The Practicing orthopedic surgeon's guide to managing long bone metastases // Orthopedic Clinics of North America. - 2014. - Vol. 45, №1. - 109-+.]. При этом ожидается увеличение этого числа в связи с ростом продолжительности жизни онкологических больных [Weber K.L., Randall R.L., Grossman S., Parvizi J. Management of lower-extremity bone metastasis // Journal of Bone and Joint Surgery-American Volume. - 2006. - Vol. 88A. - P. 11-19.].
В целом примерно у половины пациентов данной когорты отмечается значительное снижение качества жизни за счет таких симптомов и осложнений опухолевой деструкции, как боль, патологические переломы, компрессия спинного мозга и нервов, миелосупрессия, гиперкальциемия [Jehn С.F., Diel I.J., Overkamp F., et al. Management of metastatic bone disease algorithms for diagnostics and treatment // Anticancer Research. - 2016. - Vol. 36, №6. - P. 2631-2637.].
В настоящее время лечение пациентов с метастазами в кости в основном носит паллиативный характер и включает локальную терапию (лучевая терапия (ЛТ), миниинвазивные вмешательства, хирургическое пособие), системное лечение (химиотерапия, гормонотерапия, иммунотерапия, радиофармпрепараты и бисфосфонаты) и непосредственно медикаментозное обезболивание (неопиоидные и опиоидные анальгетики) [Kurup A.N., Morris J.М., Callstrom М.R. Ablation of musculoskeletal metastases // American Journal of Roentgenology. - 2017. - Vol. 209, №4. - P. 713-721].
Дистанционная ЛТ считается стандартом локального лечения первой линии у пациентов с олигометастатическим поражением костей, сопровождающимся болевым синдромом [Zeng L., Chow Е., Bedard G., et al. Quality of life after palliative radiation therapy for patients with painful bone metastases: results of an international study validating the EORTC QLQ-BM22 // International Journal of Radiation Oncology Biology Physics. - 2012. - Vol. 84, №3. - E. 337-342.]. Однако, в последние годы на фоне совершенствования стабилизирующих и реконструктивных операций все большее применение находят миниинвазивные хирургические технологии, включающие различные виды аблации [Kurup AN, Morris JM, Callstrom MR. Ablation of Musculoskeletal Metastases. AJR Am J Roentgenol. 2017;209(4):713-21. https://doi.org/10.2214/AJR.17.18527].
Преимущества криогенной аблации перед другими методами термического (радиочастотного или микроволнового) воздействия заключаются в возможности прямой визуализации зоны вмешательства с контролем размера и формы ледяной сферы, а также оценкой ее соответствия контурам опухолевого очага. Небольшая скорость продвижения зоны охлаждения в тканях обеспечивает высокую управляемость процессом распространения ледяного фронта, что важно при работе в условиях гетерогенных структур, имеющих различную теплопроводность. Кроме того, криогенное воздействие малоболезненное, что делает возможным выполнение процедуры с использованием местного обезболивания. Последующее эффективное купирование болевого синдрома, связанного с опухолевым поражением, и минимальная травматичность процедуры позволяют сократить период госпитализации [Prologo JD, Passalacqua М, Patel I, Bohnert N, Corn DJ. Image-guided cryoablation for the treatment of painful musculoskeletal metastatic disease: a single-center experience. Skeletal Radiol. 2014;43(11): 1551-9. https://doi.org/10.1007/s00256-014-1939-x. Беляев А., Прохоров Г., Буровик И., Оконечникова Д. Технология пункционной криоаблации метастатических поражений костей. Вопросы онкологии. 2021;67(4):554-8.].
Известен способ пункционной криоаблации метастатических поражений костей, реализуемый следующим образом (Беляев А., Прохоров Г., Буровик И., Оконечникова Д. Технология пункционной криоаблации метастатических поражений костей. Вопросы онкологии. 2021;67(4):554-8.). Под контролем лучевых методов исследования через выбранную точку прокола кожи устанавливают пилотный стилет с надетым на него интродьюсером и продвигают стилет к поверхности кости в точке предстоящей перфорации. Если прочность кости не позволяла пройти компактную пластинку стилетом, его извлекают, в индродьюсер вводят сверло и трепанируют кость с помощью дрели, в образовавшийся канал через индродьюсер вводят криозонд, подключенный к криогенному аппарату. Выполняют два цикла охлаждения до температуры от минус 10°С на границе ледяной сферы до минус 190°С - в ее центре. Длительность экспозиции в каждом цикле составляет не менее 5 минут. Между циклами применяют пассивное оттаивание опухоли в течение 15 минут. После второго цикла охлаждения также прибегают к пассивному оттаиванию. Расчет зоны аблации производят эмпирически на основе хладопроизводительности криозондов.
Недостатком прототипа является то, что в некоторых клинических ситуациях прохождение кости стилетом и установка криозонда сопряжена с риском повреждения, находящихся за костью или около нее органов, сосудов и нервов. Это повреждение может быть обусловлено или непосредственно механической травматизацией, или вовлечением соответствующих анатомических структур в ледяную сферу. Кроме того, в отдельных случаях при введении инструментов в зону опухолевой деструкции по данным лучевых методов исследования может быть установлено неудовлетворительное положение стелетов/зондов, из-за чего может возникнуть необходимость репозиционирования. Извлечение и повторное введение инструментов в очаг опухолевого поражения потенциально может быть причиной диссеминации опухоли в окружающие ткани и по ходу пункционного канала. Также определение размеров ледяной сферы эмпирически на основе данных о холодопроизводительности криозондов не всегда обосновано, что обусловлено особенностями термодинамики в каждом конкретном случае вследствие различий теплопроводности и перфузии в опухолевых очагах.
Технический результат изобретения заключается в снижении риска интраоперационных и послеоперационных осложнений при выполнении пункционной чрескожной криоаблации опухолей костей и снижении риска рецидива опухоли.
Указанный технический результат достигается в способе чрескожной пункционной криоблации при опухолях костей под контролем лучевых методов исследования, характеризующийся тем, что в мягкие ткани, находящиеся в непосредственной близости от опухоли кости, вводят один или более криозондов по запланированной траектории, прилегающей к зоне опухоли на всем ее протяжении; выполняют криодеструкцию опухоли путем двух циклов охлаждения опухоли с длительностью экспозиции не менее 8 минут с пассивным оттаиванием зоны воздействия между циклами и после окончания процедуры; начало длительности экспозиции определяют от момента формирования ледяной сферы, распространяющейся за пределы наиболее удаленного от криозонда полюса опухоли не менее, чем на 5мм; после выполнения второго цикла криодеструкции криозонды извлекают.
Целесообразно в случае неудовлетворительной визуализации ледяной сферы внутри кости, ее границы достраивать с учетом видимой части сферы в мягких тканях.
Выполняют криодеструкцию опухоли путем двух циклов охлаждения опухоли с экспозицией 8-10 минут. Начало периода экспозиции определяют от момента формирования ледяной сферы, распространяющейся за пределы наиболее удаленного от криозонда полюса опухоли не менее, чем на 5 мм. Контроль размеров и формы ледяной сферы осуществляют лучевым методом исследования. При неудовлетворительном отображении ледяной сферы внутри кости, ее границы достраивают с учетом видимой части сферы в мягких тканях. Между циклами охлаждения и после второго цикла замораживания производят пассивное оттаивание зоны криовоздействия. После этого криозонд извлекают.
Способ обеспечивает снижение риска повреждения органов и анатомических структур и риска опухолевого обсеменения пункционного канала за счет отсутствия необходимости выполненные трепанации кости в зоне опухолевой деструкции при установке криозонда(ов).
В заявляемом способе пункционной криоаблации опухоли кости, также как в способе, выбранном в качестве прототипа, для локального охлаждения очага поражения применяется криозонд, с помощью которого выполняют двухцикловую криодеструкцию опухоли, при этом каждый цикл включает охлаждение опухоли до заданного уровня температуры на границе опухоли с последующим отогревом области замораживания, после чего криозонд извлекают из зоны криовоздействия. При этом, в отличие от прототипа, криозонд устанавливают не в очаг опухолевой деструкции кости, а в мягкие ткани в непосредственной близости к зоне поражения, без трепанации кости. Так же при выполнении двухцикловой криоаблации добиваются формирования ледяной сферы, не менее, чем на 5 мм распространяющейся за край опухоли по данным методов лучевой визуализации, а не на основе эмпирических данных о холодопроизводительности криозондов.
Способ иллюстрируется фиг. 1-6, где:
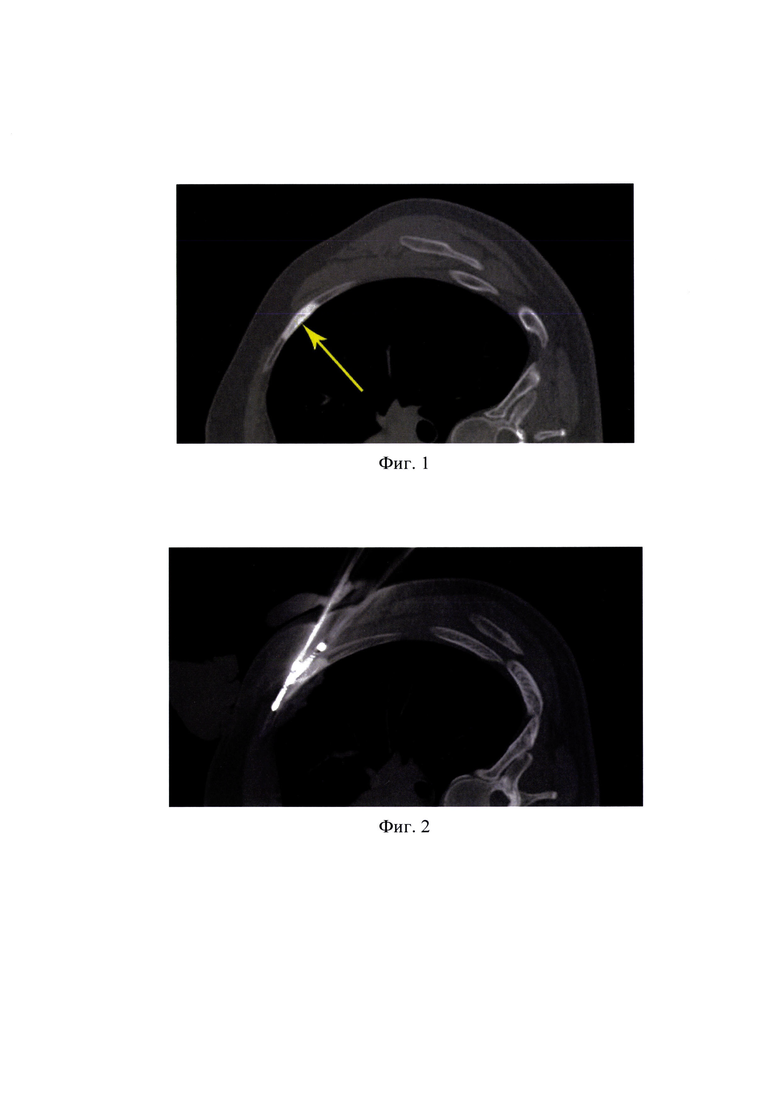
На фиг. 1 - на предоперационном КТ-сканировании определяется бластический очаг (стрелка) в переднебоковом отрезке 4 правого ребра;
На фиг. 2 - через интродьюсеры введены два криозонда, таким образом, чтобы криокамеры прилегали к зоне опухолевых изменений на всем ее протяжении;
На фиг. 3 - ледяная сфера вовлекает мягкие ткани на уровне очага опухолевой деструкции, распространяясь за края зоны поражения (головки стрелок);
На фиг. 4 - в ледяную сферу вовлечен участок легкого, прилежащий к внутренней поверхности очага костной деструкции (головка стрелки);
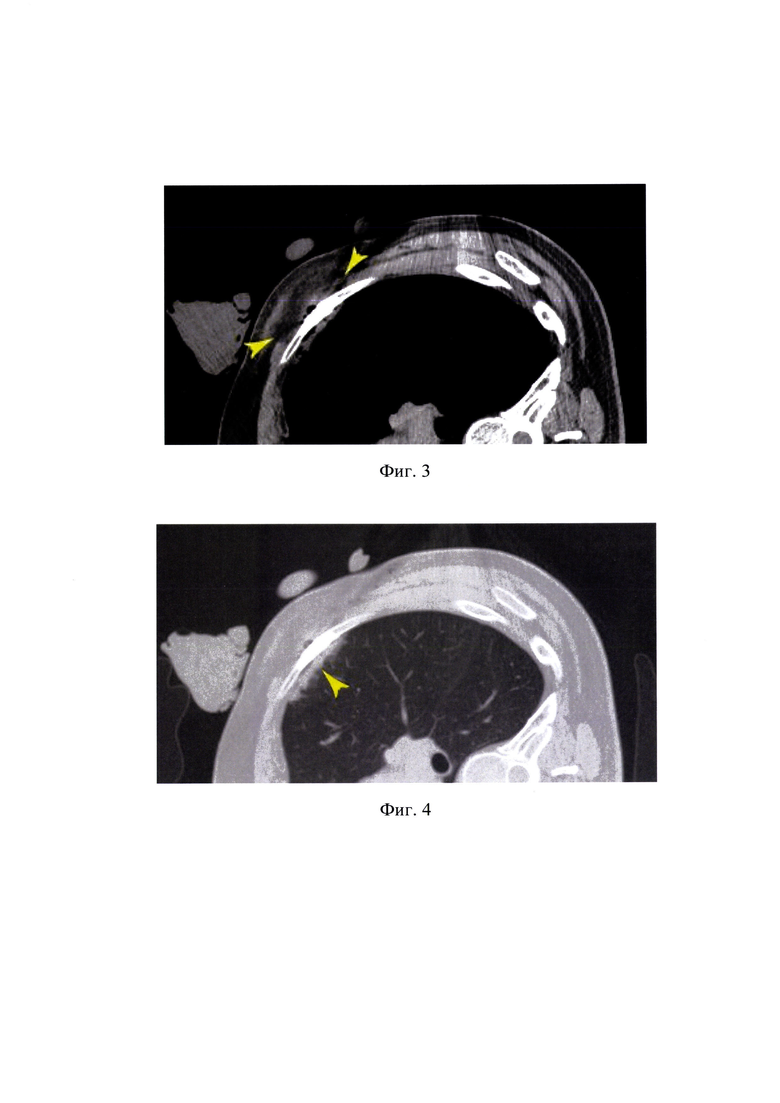
На фиг. 5 - очаг опухолевой деструкции в седалищной кости, локализующийся преимущественно в кортикальном слое (тонкая стрелка), рядом виден сосудисто-нервный пучок (толстая стрелка);
На фиг. 6 - часть ледяной сферы определяется в мягких тканях на уровне очага костной деструкции (головки стрелок), что позволяет смоделировать и соответствующие границы ледяного фронта внутри кости (пунктир).
Способ осуществляют следующим образом.
На основе данных лучевых методов исследования (КТ, МРТ, ПЭТ-КТ) выполняется стереотаксическое планирование операции: оценивается локализация, форма и размеры очага опухолевого поражения кости, его синтопия и доступность для пункционного чрескожного доступа, определяется оптимальное положения пациента, количество и виды криозондов, намечаются варианты безопасных пункционных доступов.
Процедура криоаблации выполняется в гибридной операционной, оснащенной компьютерным или магниторезонансным томографом. Предпочтительно использование компьютерного томографа с большой апертурой гентри. При MP контроле криоаблации применяют низкопольный томограф с открытым контуром и амагнитные инструменты.
Перед процедурой криоаблации пациента располагают на столе томографа в оптимальном положении (на спине, на боку или на животе). Больного вводят в наркоз или выполняют местную или проводниковую анестезию. Производят предоперационное сканирование необходимой анатомической области. На поверхности тела пациента определяют оптимальную точку вкола инструмента и траекторию пункционного доступа. Обрабатывают операционное поле антисептическим раствором. В точку вкола под необходимым углом устанавливают пилотную инъекционную иглу. Выполняют контрольный скан для проверки траектории пункционного доступа, при необходимости осуществляют корректирующие действия. В случае наличия показаний производят трепано- или аспирационную биопсию опухоли. Далее по ранее определенной безопасной траектории вводят криозонд, таким образом, чтобы его криокамера располагалась вдоль кости в мягких тканях в непосредственной близости от очага опухолевого поражения; трепанации кости в зоне очага опухолевой деструкции при этом не выполняется. При необходимости в соответствии с предоперационным планом аналогичным образом производят установку необходимого количества криозондов. Положение инструментов проверяют с помощью метода лучевого контроля.
После этого выполняют два цикла криоаблации с экспозицией 10 и 8 минут от момента формирования ледяной сферы с целевыми параметрами. Контроль размера, формы ледяной сферы и ее соотношения с очагом деструкции производят с помощью лучевого мониторинга.
Исследования показали, что ледяная сфера должна не менее, чем на 5 мм распространяться за границы опухолевого поражения, что обеспечивает изотерму на периферии очага -40°С. В случае неудовлетворительной визуализации ледяного фронта внутри кости, границы ледяной сферы достраивают с учетом видимой его части в мягких тканях. Между циклами криоаблации и после ее окончания производят пассивный отогрев опухоли до достижения положительных значений температуры на концах криозондов. В зависимости от объема опухоли период оттаивания может продолжаться 10-30 минут. После этого криозонды извлекают. При необходимости выполняют контрольное сканирование для оценки области криовоздействия. Места проколов кожи закрывают антисептическими наклейками. Пациента доставляют в палату пробуждения.
Способ подтверждается следующими клиническими примерами.
Пример 1. Пациент С., 70 лет. Диагноз: ацинарная аденокарцинома предстательной железы pT3bN0M0, Глисон 9 (4+5). Состояние после лапароскопической радикальной простатэктомии, расширенной тазовой лимфодиссекции. Прогрессирование с поражением 4 правого ребра и тазовых лимфоузлов. Состояние на фоне гормонотерапии.
Учитывая олигометастатический характер поражения скелета и наличие болевого синдрома в области пораженного ребра, принято решение о выполнении стереотаксической миниинвазивной пункционной криоаблации.
Операция проводилась под общей анестезией, в положении пациента на левом боку. Для аблации использовалась «Медицинская криотерапевтическая система МКС» с зондами диаметром 3,0 мм. Контроль процедуры осуществлялся методом компьютерной томографии.
При предоперационном КТ сканировании определяется бластический очаг в переднебоковом отрезке 4 правого ребра протяжностью 30 мм (фиг. 1, стрелка). В подобной клинической ситуации попытка установки криозонда в очаг деструкции неминуемо приведет к проникновению инструмента в плевральную полость и, с высокой вероятностью, к повреждению легкого, что может сопровождаться развитием пневмоторакса и внутриплеврального кровотечения. В связи с этим целесообразно применение предлагаемого пункционного доступа для установки криозондов, исключающего риск повреждения легкого и межреберных сосудов.
Тангенциально к ребру на уровне пораженного участка через интродьюсеры введены два криозонда, таким образом, чтобы криокамеры прилегали к зоне опухолевых изменений на всем ее протяжении (фиг. 2). Выполнена двухцикловая криоаблация при температуре на концах криозондов -190°С с экспозицией 10 и 8 минут. Для контроля зоны воздействия производилось периодическое КТ сканирование. Как видно на изображении фиг. 3 (головки стрелок), ледяная сфера вовлекает мягкие ткани на уровне очага деструкции, распространяясь за передний и задний края зоны опухолевого поражения. Фиг. 4 (головка стрелки) демонстрирует вовлечение в ледяную сферу участка легкого, прилежащего к внутренней поверхности очага костной деструкции. Визуальный контроль распространения ледяного фронта на легочную ткань на глубину 5 мм свидетельствует об адекватности криотерапевтического воздействия. Между циклами аблации и после окончания охлаждения оттаивание проводилось в пассивном режиме. После достижения положительных значений температуры криозонды были извлечены.
После пробуждения пациент отметил полное купирование болевого синдрома. При последующих плановых осмотрах возобновления болевого синдрома отмечено не было. По данным лучевых методов исследования признаков прогрессирования опухолевого процесса в зоне аблации не выявлялось.
Пример 2. Пациентка Б., 70 лет. Диагноз: рак левой молочной железы pT2N1M0. Состояние после комплексного лечения. Прогрессирование с метастатическим поражением нижней доли правого легкого. Состояние после видеоторакоскопической резекции нижней доли правого легкого. Прогрессирование с метастатическим поражением печени, правых подвздошной и седалищной костей.
При КТ у пациентки выявлено 3 костных метастаза, не превышающих 2 см в большем измерении. Учитывая олигометастатический характер поражения скелета, принято решение о выполнении стереотаксической миниинвазивной пункционной криоаблации.
Операция проводилась под общей анестезией, в положении пациентки на левом боку. Для аблации использовалась «Медицинская криотерапевтическая система МКС» с зондами диаметром 3,0 мм и 1, 5 мм. Контроль процедуры осуществлялся методом компьютерной томографии.
После предоперационного КТ сканирования с учетом локализации и размеров очагов деструкции определены оптимальные траектории для установки криозондов. Для очагов в подвздошной кости выбран интраоссальный способ позиционирования криозондов диаметром 3,0 мм. Очаг в седалищной кости локализовался преимущественно в кортикальном слое (фиг. 5, тонкая стрелка). Очевидно, что при введении криозонда перпендикулярно к кости в зону деструкции высок риск как механического повреждения рядом расположенного сосудисто-нервного пучка (фиг. 5, толстая стрелка), так и развития неврологических нарушений в послеоперационном периоде, обусловленных Холодовым повреждением соответствующего нерва. В связи с этим в подобной ситуации целесообразно было прибегнуть к предлагаемому способу введения криозонда, что и было выполнено. Криозонд диаметром 1,5 мм был установлен из заднего доступа. Точность позиционирования была подтверждена контрольными КТ-сканами. Произведена двухцикловая криоаблация при температуре на концах криозондов -190°С с экспозицией 10 и 8 минут. При выполнении лучевого контроля ледяная сфера четко визуализировался в мягких тканях на уровне чага костной деструкции (фиг. 6, головки стрелок), что позволяло смоделировать и соответствующие границы ледяного фронта внутри кости (фиг. 6, пунктир) и убедиться в полноте аблации. Сосудисто-нервный пучок оставался интактным.
Между циклами аблации и после окончания охлаждения оттаивание проводилось в пассивном режиме. После достижения положительных значений температуры криозонды были извлечены.
После пробуждения пациентка отмечала незначительную боль в области операции, которая регрессировала к третьим суткам послеоперационного периода. Неврологические нарушения в зоне иннервации седалищного нерва отсутствовали. По данным контрольного КТ сканирования через 3 месяца после процедуры признаков местного прогрессирования опухолевого процесса в зоне аблации не отмечалось.
Процедура двухцикловой криоаблации с применением предлагаемого способа установки криозондов была выполнена 17 пациентам с метастатическими поражениями костей. Во всех случаях использование предлагаемого способа криоаблации позволило избежать интра- и послеоперационных осложнений и обеспечить полноту девитализации опухоли.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ КОМПЬЮТЕРНО-ТОМОГРАФИЧЕСКОГО МОНИТОРИНГА ЛЕДЯНОЙ СФЕРЫ ПРИ ВЫПОЛНЕНИИ ЧРЕСКОЖНОЙ ПУНКЦИОННОЙ КРИОАБЛАЦИИ ОПУХОЛЕЙ КОСТЕЙ | 2023 |
|
RU2810270C1 |
| СПОСОБ КОМБИНИРОВАННОГО ЛЕЧЕНИЯ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ | 2017 |
|
RU2655297C1 |
| СПОСОБ ЛОКАЛЬНОЙ ДЕСТРУКЦИИ ПЕРВИЧНЫХ И МЕТАСТАТИЧЕСКИХ НОВООБРАЗОВАНИЙ ОРГАНОВ БРЮШНОЙ ПОЛОСТИ И ЗАБРЮШИННОГО ПРОСТРАНСТВА С ЛАПАРОСКОПИЧЕСКИМ ДОСТУПОМ | 2021 |
|
RU2770279C1 |
| СПОСОБ ЛЕЧЕНИЯ МЕСТНО-РАСПРОСТРАНЕННЫХ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ ПОЛОСТИ РТА И РОТОГЛОТКИ | 2018 |
|
RU2709549C1 |
| СПОСОБ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ ПЕЧЕНИ | 2021 |
|
RU2774029C1 |
| Способ чрескожной криодеструкции гинекомастии | 2018 |
|
RU2690911C1 |
| СПОСОБ ОБРАБОТКИ ПУНКЦИОННО-ДРЕНАЖНОГО КАНАЛА У БОЛЬНЫХ С ПАРАЗИТАРНЫМ ПОРАЖЕНИЕМ ПЕЧЕНИ ПОСЛЕ ДРЕНИРОВАНИЯ ПОЛОСТИ РАСПАДА | 2023 |
|
RU2811279C1 |
| СПОСОБ КОНТАКТНОГО СВЕРХНИЗКОТЕМПЕРАТУРНОГО ЛЕЧЕНИЯ ОПУХОЛЕЙ И ОПУХОЛЕПОДОБНЫХ ПОРАЖЕНИЙ КОСТЕЙ | 2007 |
|
RU2331382C1 |
| СПОСОБ ЛЕЧЕНИЯ ПАЦИЕНТОВ С МЕТАСТАТИЧЕСКИМ РАКОМ ПЕЧЕНИ | 2013 |
|
RU2554794C1 |
| СПОСОБ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ОПУХОЛЕЙ ПЕЧЕНИ ЦЕНТРАЛЬНОЙ ЛОКАЛИЗАЦИИ С ИНВАЗИЕЙ В АРТЕРИИ ВОРОТ ПЕЧЕНИ И НЕРАВНОМЕРНОМ ПОРАЖЕНИИ ИХ ОБОЛОЧЕК, ОСЛОЖНЕННЫХ МЕХАНИЧЕСКОЙ ЖЕЛТУХОЙ | 2011 |
|
RU2456933C1 |
Изобретение относится к медицине, а именно к криохирургии и онкологии, и может быть использовано для чрескожной пункционной криоаблации при опухолях костей. В мягкие ткани, находящиеся в непосредственной близости от опухоли кости, вводят один или более криозондов по запланированной траектории, прилегающей к зоне опухоли на всем ее протяжении. Выполняют криодеструкцию опухоли путем двух циклов охлаждения опухоли с длительностью экспозиции не менее 8 минут с пассивным оттаиванием зоны воздействия между циклами и после окончания процедуры. Начало длительности экспозиции определяют от момента формирования ледяной сферы, распространяющейся за пределы наиболее удаленного от криозонда полюса опухоли не менее чем на 5 мм. После выполнения второго цикла криодеструкции криозонды извлекают. В случае неудовлетворительной визуализации ледяной сферы внутри кости, ее границы достраивают с учетом видимой части сферы в мягких тканях. Способ обеспечивает снижение риска повреждения органов и анатомических структур и риска опухолевого обсеменения пункционного канала за счет отсутствия необходимости выполнения трепанации кости в зоне опухолевой деструкции при установке криозонда(ов). 1 з.п. ф-лы, 6 ил., 2 пр.
1. Способ чрескожной пункционной криоблации при опухолях костей под контролем лучевых методов исследования, характеризующийся тем, что в мягкие ткани, находящиеся в непосредственной близости от опухоли кости, вводят один или более криозондов по запланированной траектории, прилегающей к зоне опухоли на всем ее протяжении; выполняют криодеструкцию опухоли путем двух циклов охлаждения опухоли с длительностью экспозиции не менее 8 минут с пассивным оттаиванием зоны воздействия между циклами и после окончания процедуры; начало длительности экспозиции определяют от момента формирования ледяной сферы, распространяющейся за пределы наиболее удаленного от криозонда полюса опухоли не менее чем на 5 мм; после выполнения второго цикла криодеструкции криозонды извлекают.
2. Способ по п. 1, отличающийся тем, что в случае неудовлетворительной визуализации ледяной сферы внутри кости, ее границы достраивают с учетом видимой части сферы в мягких тканях.
| Беляев А., Прохоров Г., Буровик И., Оконечникова Д | |||
| Технология пункционной криоаблации метастатических поражений костей | |||
| Вопросы онкологии | |||
| Способ регенерирования сульфо-кислот, употребленных при гидролизе жиров | 1924 |
|
SU2021A1 |
| СПОСОБ КОМБИНИРОВАННОГО ЛЕЧЕНИЯ ОПУХОЛЕВЫХ ЗАБОЛЕВАНИЙ | 2017 |
|
RU2655297C1 |
| СПОСОБ КОНТАКТНОГО СВЕРХНИЗКОТЕМПЕРАТУРНОГО ЛЕЧЕНИЯ ОПУХОЛЕЙ И ОПУХОЛЕПОДОБНЫХ ПОРАЖЕНИЙ КОСТЕЙ | 2007 |
|
RU2331382C1 |
| СПОСОБ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ВОРОНКООБРАЗНОЙ ДЕФОРМАЦИИ ГРУДНОЙ КЛЕТКИ У ВЗРОСЛЫХ С КРИОАБЛЯЦИЕЙ МЕЖРЕБЕРНЫХ НЕРВОВ | 2020 |
|
RU2754388C1 |
| Callstrom MR, Dupuy DE, Solomon SB, Beres RA, Littrup PJ, Davis KW, Paz-Fumagalli R, Hoffman C, Atwell TD, | |||
Авторы
Даты
2023-05-02—Публикация
2022-06-14—Подача