Предлагаемое изобретение относится к медицине, в частности к клеточным технологиям, биотехнологии и регенеративной медицине и может быть использовано для контроля пролиферативной активности клеток непосредственно во время культивирования, в том числе при создании биомедицинских клеточных продуктов (БМКП).
Клиническое применение мезенхимальных стромальных клеток осложняется тем, что клетки от разных доноров обладают различной пролиферативной активностью (Phinney D.G., Kopen G., Isaacson R.L., Prockop D.J. Plastic adherent stromal cells from the bone marrow of commonly used strains of inbred mice: variations in yield, growth, and differentiation // J. Cell Biochem., 1999. - V. 72, № 4. - P. 570-585). При обосновании стратегии контроля качества и состава спецификации необходимо учитывать сложность стандартизации клеточного компонента БМКП (учитывая вариабельность донорского материала) и отсутствие соответствующих референс-препаратов, поэтому спецификация должна содержать диапазон приемлемых значений интенсивности пролиферации клеток, определяемых во время культивирования, в том числе на ранних этапах культивирования.
Не взывает сомнения, что культура с низкой пролиферативной активностью не может использоваться для подготовки биомедицинских клеточных продуктов (БМКП), так как один из ключевых регенеративных эффектов БМКП реализуется именно за счет деятельности клеток. Если клеточный компонент, вводимый в БМКП, изначально низкого качества (клетки с низкой пролиферативной активностью, стареющие и т.д.), то ожидать хорошего терапевтического эффекта от такого продукта невозможно.
В настоящее время существует общеизвестный рутинный способ оценки пролиферативной активности клеток, основанный на подсчете количества клеток с последующим определением скорости удвоения популяции (Фрешни Р.Я. Культура животных клеток. 2010; Москва, БИНОМ; С. 691).
Известный способ осуществляют следующим образом.
Сравнивают количество клеток до начала культивирования и через определенное время после пересева. Через контрольное время культивированные клетки снимают с поверхности пластика с помощью 0,25% раствора трипсина в Версене (ПанЭко, Россия), подсчитывают концентрацию клеток с помощью автоматического счетчика клеток COUNTES (Invitrogen) или с помощью камеры Горяева, затем определяют среднее время удвоения по формуле:
DT = t × ln(2)/ ln(y) - ln(x)
где DT - среднее время удвоения (в часах).
где t - время культивирования между пассажами (в часах),
х - исходная посевная концентрация клеток
y - концентрация клеток после культивирования.
Основным недостатком этого способа является необходимость снятия клеток с поверхности культурального пластика с помощью ферментов для последующего анализа. При переходе в суспензию часть клеток культуры может разрушаться под действием ферментов, кроме того, приходится проводить подсчет в нескольких камерах или на нескольких слайдах для автоматического счетчика клеток для минимизации ошибок при подсчете.
Известен способ определения пролиферативной активности клеток, включающий проведение комплексного исследования биологического клеточного материала, в том числе гистохимическое исследование (Dimri G.P., Lee X., Basile G., Acosta M., Scott G., Roskelley C., Medrano E.E., Linskens M., Rubelj I., Pereira-Smith O., Peacocke M., Campisi J. A biomarker that identifies senescent human cells in culture and in aging skin in vivo // Proc. Natl. Acad. Sci. USA, 1995.- V. 92, № 20.- P. 9363-9367).
Известный способ осуществляют следующим образом.
Проводят комплексное исследование, включающее:
- фиксацию клеточного мазка при рН=6 на предметном стекле с нанесением раствора хромогенного субстратного красителя X-gal (органическое соединение, состоящее из галактозы, соединенной с индолом, субстрат для β-галактозидазы) и последующим наложением сверху второго предметного стекла;
- инкубацию в течение 24 часов при 37°С во влажной камере мазка с последующей промывкой в восходящих концентрациях этанола (24, 48 и 96%) и высушивании на воздухе;
- оценку клеточных имиджей с помощью компьютерного видеокомплекса.
После проведения исследования осуществляют гистохимическую оценку активности β-галактозидазы и при увеличении активность β-галактозидазы констатируют снижение скорости пролиферации клеток.
Способ, представленный в данном аналоге, требует дорогостоящих расходных материалов и оборудования. Еще одним недостатком является длительность и трудоемкость способа. Кроме того, отмечают, что зачастую, активность фермента зависела от метода исследования и от возраста клеточных культур (Yegorov Y.E., Akimov S.S., Hass R., Zelenin A.V., Prudovsky I.A. Endogenous beta-galactosidase activity in continuously nonproliferating cells // Exp. Cell Res., 1998.- V. 243, № 1.- P. 207-211; Severino J., Allen R.G., Balin S., Balin A., Cristofalo V.J. Is beta-galactosidase staining a marker of senescence in vitro and in vivo? // Exp. Cell Res., 2000. - V. 257, № 1.- P. 162-171).
Существенным недостатком вышеприведенного способа является то, что для его применения необходима фиксация культуры, поэтому для оценки пролиферативной активности клеток, культивируемых, в частности, для использования в составе БМКП, применение данного способа не целесообразно или невозможно.
Таким образом, для использования клеточной культуры в целях клеточной терапии, регенеративной медицины, реализации различных биотехнологий наиболее востребованным стал бы метод, позволяющий оценить пролиферативную активность в процессе роста культуры, без вмешательства в процесс культивирования. Использование такого метода в качестве скринингового, позволило бы оценить не только пролиферативную активность культуры, но и на основании этого дать дальнейший прогноз о целесообразности культивирования и использования клеток в качестве компонента БМКП.
Задачей предлагаемого изобретения является усовершенствование способа оценки выраженности пролиферативной активности клеток в культуре без их разрушения и фиксации в процессе культивирования.
Технический результат предлагаемого способа заключается в расширении арсенала технических средств для оценки интенсивности пролиферации культур клеток, оценке пролиферативной активности клеток в процессе роста в культуре без их разрушения и фиксации.
Технический результат достигается тем, что проводят комплексное исследование образца кондиционной среды, полученной после культивирования клеток в полной ростовой среде в течение 72 часов в СО2 инкубаторе, и контрольной среды, фотометрически определяют концентрацию глюкозы и лактата в кондиционированной и контрольной средах, определяют отношение абсолютного значения разности концентрации глюкозы в кондиционированной и контрольной средах к абсолютному значению разности концентрации лактата в кондиционированной и контрольной средах, и при значении больше 0,87 пролиферативную активность считают высокой.
Способ скрининговой оценки пролиферативной активности клеток в процессе роста осуществляют следующим образом.
Забор кондиционной среды, для проведения комплексного обследования, осуществляют через 72 часа после посева клеток в культуральные флаконы и культивирования в полной ростовой среде в условиях СО2 инкубатора. Кондиционную и контрольную среды для исследования забирают в количестве 5,0 мл стерильной пипеткой или шприцем из культурального флакона и определяют в них концентрацию глюкозы и лактата. Концентрацию глюкозы в средах определяют орто-толуидиновым методом (набор реагентов КлиниТест-ГОТ НПЦ «Эко-Сервис», Россия). Метод основан на реакции образования в кислой среде при повышенной температуре комплексного соединения глюкозы с орто-толуидином сине-зелёного цвета, концентрацию которого регистрируют фотометрически. Интенсивность окраски раствора пропорциональна концентрации глюкозы в исследуемой пробе.
Ход определения концентрации глюкозы в средах
Производят расчет концентрации глюкозы С по формуле:
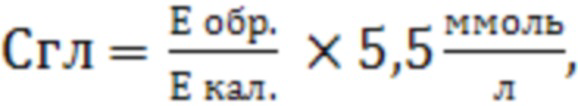 где
где
5,55 - концентрация глюкозы в калибраторе, ммоль/л;
Е обр. - оптическая плотность опытной пробы;
Е кал. - оптическая плотность калибровочной пробы.
Концентрацию лактата определяют энзиматическим (пероксидазным) методом (набор «Молочная кислота-Ольвекс» ООО «ОЛЬВЕКС ДИАГНОСТИКУМ», Россия). Метод основан на проведении сопряжённых реакций, катализируемых лактатоксидазой и пероксидазой. Молочная кислота под действием фермента лактатоксидазы окисляется до аллантоина, перекиси водорода и двуокиси углерода. Образующаяся в данной реакции перекись водорода при участии фермента пероксидазы способствует окислительному азосочетанию хлорфенола и 4-аминоантипирина (4-ААП) с образованием окрашенного соединения (хинонимин), концентрацию которого регистрируют фотометрически. Интенсивность окраски раствора пропорциональна концентрации лактата в исследуемой пробе.
Ход определения концентрации лактата в средах
(мл)
(мл)
(мл)
Расчёт концентрации лактата (С, ммоль/л) рассчитывают по формуле:
Сл=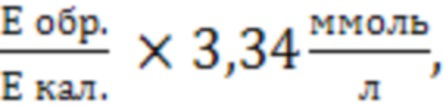 где
где
3,34 - концентрация лактата в калибраторе, ммоль/л,
Е обр. - оптическая плотность опытной пробы;
Е кал. - оптическая плотность калибровочной пробы.
Рассчитывают абсолютное значение разности концентрации глюкозы (|ΔCгл|) и абсолютное значение разности концентрации лактата (|ΔCл|) в кондиционной и контрольной средах. Определяют отношение абсолютного значения разности концентрации глюкозы к абсолютному значению разности концентрации лактата |ΔCгл|/|ΔCл| и при его значении более 0,87 пролиферативную активность считают высокой.
Примеры конкретного исполнения.
Пример №1: донор женского пола 26 лет, европеоидной расы, сопутствующие заболевания не указаны. Проведено исследование по предлагаемому способу. Отбирали 5 мл контрольной среды (до культивирования клеток), в которой фотометрически определяли концентрацию глюкозы и лактата. После культивирования клеток в полной ростовой среде в течение 72 ч в СО2 инкубаторе отбирали 5 мл кондиционной среды и фотометрически определяли в ней концентрацию глюкозы и лактата.
Концентрация глюкозы в кондиционной среде 7,64 мМ/л, в контрольной среде - 10,85 мМ/л. Концентрация лактата в кондиционной среде - 21,69 мМ/л, в контрольной (интактной) среде - 3,36 мМ/л. Определили отношение абсолютного значения разности концентрации глюкозы к абсолютному значению разности концентрации лактата |7,64-10,85|/|21,69-3,36|= 3,21/18,33=0,175, что менее 0,87, в связи с чем пролиферативную активность в культуре клеток оценили как низкую.
Для оценки точности предлагаемого метода был проведен подсчет среднего времени удвоения клеток культуры, полученных от донора №1 рутинным способом: после 72 часов культивирования клетки снимали с поверхности пластика с помощью 0,25% раствора трипсина в Версене (ПанЭко, Россия), подсчитывали концентрацию клеток с помощью автоматического счетчика клеток COUNTES (Invitrogen) или с помощью камеры Горяева, определяли среднее время удвоения по формуле:
DT = t × ln(2)/ ln(y) - ln(x)
где DT - среднее время удвоения (в часах).
где t - время культивирования между пассажами (в часах),
х - исходная посевная концентрация клеток
y - концентрация клеток после культивирования.
Скорость удвоения МСК-ЖТ, полученных от донора №1 составила 58,2 часов, что превышает 48 часов.
В случае если время удвоения более 48 часов - пролиферативная активность клеток характеризуется как низкая, а культура как не пригодная для дальнейшего культивирования.
Таким образом, подтверждается вывод о низкой пролиферативной активности клеток, сделанный по предложенному способу.
Пример № 2. Донор женского пола 27 лет, европеоидной расы. Проведено исследование по предлагаемому способу. Отбирали 5 мл контрольной среды (до культивирования клеток), в которой фотометрически определяли концентрацию глюкозы и лактата. После культивирования клеток в полной ростовой среде в течение 72 ч в СО2 инкубаторе отбирали 5 мл кондиционной среды и фотометрически определяли в ней концентрацию глюкозы и лактата.
Концентрация глюкозы в кондиционной среде 11,63 мМ/л, в контрольной (интактной) среде - 16,15 мМ/л. Концентрация лактата в кондиционной среде - 8,3 мМ/л, в контрольной (интактной) среде - 3,16 мМ/л. Определили отношение абсолютного значения разности концентрации глюкозы к абсолютному значению разности концентрации лактата |11,63-16,15|/|8,3-3,16|=4,52/5,14=0,879, что более 0,87, в связи с чем пролиферативную активность в культуре клеток оценили как высокую.
Для оценки точности предлагаемого метода был проведен подсчет среднего времени удвоения клеток аналогично описанному в примере 1.
Скорость удвоения МСК-ЖТ, полученных от донора №2 составила 42,83 часов, что менее 48 часов и подтверждает корректность вывода, сделанного по предложенному способу, о высокой пролиферативной активности клеток в культуре.
Пример №3: Донор женского пола 33 года, европеоидной расы, сопутствующие заболевания не указаны. Проведено исследование по предлагаемому способу. Отбирали 5 мл контрольной среды (до культивирования клеток), в которой фотометрически определяли концентрацию глюкозы и лактата. После культивирования клеток в полной ростовой среде в течение 72 ч в СО2 инкубаторе отбирали 5 мл кондиционной среды и фотометрически определяли в ней концентрацию глюкозы и лактата.
Концентрация глюкозы в кондиционной среде 7,40 мМ/л, в контрольной среде - 11,07 мМ/л. Концентрация лактата в кондиционной среде - 17,28 мМ/л, в контрольной среде - 3,92 мМ/л. Определили отношение абсолютного значения разности концентрации глюкозы к абсолютному значению разности концентрации лактата |7,40-11,07|/|17,28-3,92|=3,67/13,36=0,275, что менее 0,87, в связи с чем пролиферативную активность в культуре клеток оценили как низкую.
Для оценки точности предлагаемого метода был проведен подсчет среднего времени удвоения клеток аналогично описанному в примере 1.
Скорость удвоения МСК-ЖТ, полученных от донора №3 составила 77,63 часов, что превышает 48 часов и подтверждает корректность вывода, сделанного по предложенному способу, о низкой пролиферативной активности культуры.
Пример № 4. Донор женского пола 44 лет, европеоидной расы. Проведено исследование по предлагаемому способу. Отбирали 5 мл контрольной среды (до культивирования клеток), в которой фотометрически определяли концентрацию глюкозы и лактата. После культивирования клеток в полной ростовой среде в течение 72 ч в СО2 инкубаторе отбирали 5 мл кондиционной среды и фотометрически определяли в ней концентрацию глюкозы и лактата.
Концентрация глюкозы в кондиционной среде 3,38 мМ/л, в контрольной среде - 11,14 мМ/л. Концентрация лактата в кондиционной среде - 8,4 мМ/л, в контрольной среде - 2,82 мМ/л.
Определили отношение абсолютного значения разности концентрации глюкозы к абсолютному значению разности концентрации лактата |3,38-11,14|/|8,4-2,82|=7,76/5,58=1,39, что более 0,87, в связи с чем пролиферативную активность в культуре клеток оценили как высокую.
Для оценки точности предлагаемого метода был проведен подсчет среднего времени удвоения клеток аналогично описанному в примере 1.
Скорость удвоения МСК-ЖТ, полученных от донора №4 составила 32,26 часов, что менее 48 часов и подтверждает корректность вывода, сделанного по предложенному способу, о высокой пролиферативной активности клеток.
Таким образом, предложенный способ позволяет получить объективные данные, позволяющие оценить скорость пролиферации клеток в культуре в процессе роста с использованием стандартных и достаточно простых биохимических методов. Способ не требует дорогостоящих расходных материалов, а реализуется с использованием стандартных реактивов, что значительно удешевляет реализацию и повышает доступность представленного способа. Несомненным преимуществом способа является то, что он не требует длительных, сложных и трудоемких подготовок, требующих больших временных затрат, а реализуется методами, доступными многим биотехнологическим лабораториям. Основным преимуществом предложенного способа является возможность оценки пролиферативной активности клеток в процессе роста в культуре без их разрушения и фиксации, без снятия клеток с поверхности пластика или подложки, что обеспечит возможность их последующего культивирования и/или использования для формирования БМКП. Причем анализ интенсивности пролиферации клеток в культуре осуществляется в режиме реального времени за счет анализа метаболитов кондиционной среды.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ прогнозирования скорости роста культуры по количеству альдегиддегидрогеназа-положительных мезенхимальных клеток костного мозга доноров | 2019 |
|
RU2722173C1 |
| Способ определения жизнеспособности клеток в биомедицинских клеточных продуктах в процессе регенерации | 2021 |
|
RU2777257C1 |
| Способ модификации пролиферативной активности клеточных культур млекопитающих | 2019 |
|
RU2710718C1 |
| ДОБАВКА ДЛЯ КУЛЬТИВИРОВАНИЯ ЭПИТЕЛИАЛЬНЫХ КЛЕТОК | 2019 |
|
RU2711920C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ОЖОГОВ И РАН НА ОСНОВЕ ЦИТОКИНОВ И ФАКТОРОВ РОСТА, СЕКРЕТИРУЕМЫХ МЕЗЕНХИМНЫМИ КЛЕТКАМИ ЧЕЛОВЕКА, СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА И СПОСОБ ЛЕЧЕНИЯ ОЖОГОВ И РАН | 2014 |
|
RU2574017C1 |
| КОСМЕТИЧЕСКОЕ СРЕДСТВО НА ОСНОВЕ ПРОДУКТОВ СЕКРЕЦИИ МЕЗЕНХИМНЫХ СТВОЛОВЫХ/СТРОМАЛЬНЫХ КЛЕТОК ЖИРОВОЙ ТКАНИ ЧЕЛОВЕКА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2016 |
|
RU2620342C1 |
| СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА ДЛЯ СТИМУЛЯЦИИ РЕГЕНЕРАЦИИ НА ОСНОВЕ ПРОДУКТОВ СЕКРЕЦИИ МУЛЬТИПОТЕНТНЫХ МЕЗЕНХИМНЫХ СТРОМАЛЬНЫХ КЛЕТОК ЧЕЛОВЕКА | 2015 |
|
RU2620167C1 |
| СПОСОБ ПОЛУЧЕНИЯ КУЛЬТУР МЕЗЕНХИМАЛЬНЫХ СТРОМАЛЬНЫХ КЛЕТОК ЧЕЛОВЕКА, ВЫДЕЛЕННЫХ ИЗ ЛИПОАСПИРАТА | 2007 |
|
RU2351649C1 |
| Способ оценки дифференцировки мезенхимальных стволовых клеток в трёхмерных скаффолдах | 2023 |
|
RU2818354C1 |
| СРЕДСТВО ДЛЯ КОШЕК, ОБЛАДАЮЩЕЕ РЕГЕНЕРАТИВНОЙ АКТИВНОСТЬЮ | 2016 |
|
RU2646791C1 |
Настоящее изобретение относится к биотехнологии, клеточной биологии и медицине, в частности к способу скрининговой оценки пролиферативной активности мезенхимальных стромальных клеток жировой ткани в процессе роста. Для осуществления указанного способа проводят комплексное исследование образца кондиционной среды, полученной после культивирования клеток в полной ростовой среде в течение 72 часов в СО2 инкубаторе, и контрольной среды, представляющей собой полную ростовую среду до культивирования клеток. Для этого сначала фотометрически определяют концентрацию глюкозы и лактата в кондиционированной и контрольной средах. Затем определяют отношение абсолютного значения разности концентрации глюкозы в кондиционированной и контрольной средах к абсолютному значению разности концентрации лактата в кондиционированной и контрольной средах. Причём при значении больше 0,87 пролиферативную активность считают высокой. Настоящее изобретение позволяет производить раннюю скрининговую оценку интенсивности пролиферации культур клеток в режиме реального времени без их разрушения и фиксации. 2 табл., 4 пр.
Способ скрининговой оценки пролиферативной активности мезенхимальных стромальных клеток жировой ткани в процессе роста, включающий комплексное исследование образца кондиционной среды, полученной после культивирования клеток в полной ростовой среде в течение 72 часов в СО2 инкубаторе, и контрольной среды, представляющей собой полную ростовую среду до культивирования клеток, отличающийся тем, что фотометрически определяют концентрацию глюкозы и лактата в кондиционированной и контрольной средах, определяют отношение абсолютного значения разности концентрации глюкозы в кондиционированной и контрольной средах к абсолютному значению разности концентрации лактата в кондиционированной и контрольной средах и при значении больше 0,87 пролиферативную активность считают высокой.
| ГИЛЬМУТДИНОВА И.Р., Оценка биопластического материала гиаматрикс in vitro на культуре мезенхимальных стромальных клеток костного мозга человека, Аспирантский вестник Поволжья Медицина, 2015, No | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| КОКОРЕВ О.В., Соногенетическое обоснование применения тканеинженерных конструкций на основе пористого никелида титана при патологии | |||
Авторы
Даты
2023-05-02—Публикация
2022-04-04—Подача