Область техники, к которой относится изобретение
Изобретение относится к области медицины и фармакологии и может быть использовано для получения лекарственных средств и биоматериалов для стимуляции регенерации тканей после повреждения, в том числе для реконструктивной хирургии, при лечении острых и хронических ран и ожогов различного генеза и тяжести, а также других заболеваний человека, связанных с нарушениями ангиогенеза и нейрогенеза, таких как трофические язвы, в том числе у больных диабетом, при заболеваниях пародонта, ишемии нижних конечностей, алопециях, при повреждениях нервной системы.
Уровень техники
Из уровня техники известен способ лечения ожогов с помощью лекарственного средства на основе кондиционированной среды, полученной при культивировании МСК костного мозга человека (RU 2292212 C1). Кондиционированная среда содержит солевой состав и аминокислоты, пенициллин, амфотерицин, L-глутамин и эмбриональную бычью сыворотку (ЭБС), достаточные для поддержания жизнеспособности и роста МСК костного мозга человека. При этом кондиционированную среду получают на стадии стационарного роста культуры стабильной клеточной линии МСК, находящихся в Go периоде клеточного цикла. Показано, что полученная среда обладает лечебным эффектом при термических ожогах. Однако следует отметить, что кондиционированная среда, приготовленная данным способом, содержит ЭБС, являющуюся потенциально опасным агентом при терапевтическом применении.
Из уровня техники также известна композиция, предназначенная для регенерации кожи и слизистых оболочек, содержащая культуральную питательную среду, включающую биологически активные соединения на основе низкомолекулярных пептидов и цитокинов, используемая для культивирования in vitro эукариотических клеток и кондиционированная продуктами жизнедеятельности и ростовыми факторами эукариотических клеток, выделяемыми ими в питательную среду в процессе их культивирования (RU 2455354 C1). Данная композиция также содержит костномозговые МСК человека в количестве, по меньшей мере, 105 клеток/мл, а в качестве кондиционированной среды содержит культуральную питательную среду, кондиционированную продуктами жизнедеятельности и ростовыми факторами МСК, полученную на стадиях логарифмической фазы и стационарной фазы роста стабильной клеточной культуры клеток, содержащую биологически активные соединения на основе низкомолекулярных пептидов с молекулярной массой 6-8 кДа и низкомолекулярных веществ с молекулярной массой 2-3 кДа, соответствующих активным цитокинам. Стоит отметить, что культуральная питательная среда содержит ЭБС.
Кроме того, из уровня техники известны способ и композиция для предотвращения или лечения кожных дефектов, включающий нанесение на кожный дефект композиции, содержащей МСК костного мозга или кондиционную среду, полученную от МСК, или их комбинацию (WO 2008155659 А2). К числу кожных дефектов, для лечения которых может быть использована композиция, относятся морщины, рубец, возрастное пятно, порез или язва. Следует отметить, что и данном изобретении использована среда роста, содержащая ЭБС.
В указанных выше изобретениях для получения кондиционированной среды использованы МСК костного мозга. Однако по данным различных авторов МСК жировой ткани обладают более выраженными паракринными эффектами в отношении стимуляции роста кровеносных сосудов и нервов по сравнению с МСК костного мозга, использованными в данных изобретениях. Кроме того, в данных изобретениях кондиционированная среда включает в себя потенциально опасные животные компоненты в виде ЭБС.
Из уровня техники также известен способ получения обработанной среды, согласно которому проводят культивирование стволовых клеток в среде без факторов роста, содержащей десферроксамин, при этом стволовые клетки предварительно культивируют в ростовой среде, что обеспечивает получение кондиционированной среды, которая включает факторы, секретируемые данными стволовыми клетками (WO 2011127090 А1). Затем полученную кондиционированную среду отбирают и фильтруют с целью получения обработанной кондиционированной среды. Полученная таким способом среда может использоваться в составе композиции, дополнительно содержащей полимер, для лечения кожных ожогов.
Однако в данном изобретении для получения кондиционированной среды используется среда, не предназначенная специально для поддержания функционального состояния стволовых клеток.
Из уровня техники также известна кондиционированная культуральная среда, полученная при культивировании МСК, их потомства или клеточной линии, полученной из них, в культуральной среде. При этом МСК получают путем культивирования клеточной колонии эмбриональных стволовых клеток или их потомства, в отсутствие со-культуры и в бессывороточной среде, содержащей FGF2 (fibroblast growth factor 2) (US 2010323027 A1). Указанная среда может быть использована в составе композиции для лечения сердечной недостаточности, заболеваний костного мозга, заболеваний кожи, ожогов и дегенеративных заболеваний, таких как диабет, болезнь Альцгеймера, болезнь Паркинсона и рак.
Однако для поддержания МСК в функциональном состоянии при культивировании в бессывороточной среде добавления только одного ростового фактора - FGF2 может быть недостаточно, что оказывает негативное влияние на состав продуктов, секретируемых МСК в среду культивирования, и снижает регенеративный потенциал кондиционированной среды.
Из уровня техники также известен способ, включающий добавление регенеративных клеток в культуральную среду, при этом культуральная среда подобрана таким образом, чтобы обеспечивать рост и поддержание регенеративных клеток (в частности, МСК), и позволить секрецию благоприятствующих факторов из регенеративных клеток в культуральную среду так, чтобы образовывать кондиционированную среду. Затем из полученной кондиционированной среды выделяют экстракт, который не содержит целых клеток. Полученный экстракт и/или его компоненты используют для местного нанесения на участок кожи человека с целью стимулирования роста клеток кожи (WO 2010038232 А1). В заявке предлагается использование композиции, содержащей полученный экстракт, для лечения дерматологических нарушений и/или нарушений роста волос, но нет экспериментальных данных, подтверждающих возможность и эффективность лечения ожогов и ран предлагаемым средством.
Другим направлением в лечении заболеваний с помощью регенеративной терапии является использование частиц, секретируемых МСК. В частности, для лечения кожных заболеваний и ожогов могут быть использованы частицы, включающие везикулы или эксзосомы (WO 2009105044 А1). Описан способ получения частицы, включающий: получение среды, кондиционированной МСК; концентрирование полученной среды, кондиционированной МСК; обработку сконцентрированной среды, кондиционированной МСК, путем гель-фильтрации; отбор фракции, которая демонстрирует динамическое рассеяние света, путем УФ-детектирования при 220 нм. При этом этап отбора фракции включает сбор фракций, которые элюируют со временем удерживания 11-13 минут. Полученная частица может быть использована в составе фармацевтической композиции, применяемой для лечения заболеваний с помощью подходов регенеративной медицины.
Однако, несмотря на то, что в последнее время получено значительное количество данных, указывающих на важную роль экзосом в реализации паракринных эффектов МСК, нет доказательств того, что именно фракция, описанная в изобретении, является ключевой для регенеративного действия этих клеток. Помимо этого использование представленной в изобретении технологии значительно усложняет процесс производства конечного продукта.
Кроме того, недостатком указанных выше изобретений является отсутствие указаний на количественное содержание факторов, обеспечивающих эффективность изобретений.
Из уровня техники известен также препарат «Солкосерил», содержащий депротеинизированный диализат из крови здоровых молочных телят, стандартизированный химически и биологически и обладающий регенеративным действием. Однако этот препарат представляет собой комплекс пептидов неизвестного состава, полученных из тканей животных, потенциально способный вызывать иммунные реакции и содержать инфекционные агенты животного происхождения.
Из уровня техники также известно, что в качестве материалов для закрытия дефектов кожи используют коммерческие продукты на основе живых кожных заменителей дермального, эпидермального или двойного типа:
1) Dermagraft (криоконсервированные аллогенные фибробласты человека из кожи крайней плоти новорожденных, выращенные на биосорбирующей сетчатой подложке из полиглактина);
2) OrCel (двухслойный матрикс из бычьего коллагена типа 1, на поверхности и в пористом слое которого культивируются аллогенные дермальные фибробласты, а на непористом слое - эпидермальные кератиноциты от того же донора);
3) Epicel (искусственно полученный эпидермальный аутотрансплантат, представляющий собой слой (от 2 до 8 слоев клеток) аутологичных кератиноцитов, культивированных ex vivo в присутствии мышиных фибробластов);
4) Invitrx CSS (Composite Skin Substitute), представляет собой 3-мерный кожный эквивалент, состоящий из дермальных аутологичных фибробластов, помещенных на коллаген/викриловую сетку, и верхнего слоя кератиноцитов.
Кроме того, среди таких решений стоит отметить перевязочное средство, которое может быть использовано для лечения нарушений кожного покрова различного генеза, в том числе ожогов (RU 103474 U1). Перевязочное средство включает биосовместимую прозрачную полимерную пленку толщиной 3-100 мкм со сквозными отверстиями диаметром 0,01-3,00 мкм, на одной из поверхностей которой выращен слой диплоидных клеток фибробластов легкого эмбриона человека, взятых от 6-20 пассажа и выращенных на пленке в бессывороточной среде в присутствии кондиционной среды от аналогичной культуры. Средство эффективно при лечении обширных трофических поражений кожи.
Помимо этого известно двухслойное раневое покрытие с использованием клеточного материала человека, которое применяется для заживления ран разной площади и содержит гидратированную микробную целлюлозу с наслоенным на нее коллагеновым гелем (RU 94151 U1). В слоях или на их границе присутствует, по крайней мере, один источник ростовых факторов, ускоряющий эпителизацию раны. В качестве источников ростовых факторов применяют клетки мезодермального и/или эктодермального типа и/или тромбоциты крови. Описаны комбинации клеточного материала, дающие высокий лечебный эффект заявляемого лекарственного раневого покрытия. Сочетание бактериальной целлюлозы и коллагенового геля в двухслойном покрытии для ран создает оптимальные условия для проявления свойств ростовых факторов.
Однако все указанные выше продукты содержат живые клетки человека, что увеличивает риски, связанные с биобезопасностью препаратов, усложняет процессы их производства, стандартизации и контроля качества, кроме того, с учетом отсутствия в РФ законов, регулирующих использование клеточных технологий, коммерциализация подобных продуктов в России затруднена.
Наиболее близким к заявляемому решению является средство для изменения скорости роста или репродукции клеток и для лечения, в том числе ран и ожогов, содержащее кондиционированную клеточную культуральную среду, полученную при культивировании эукариотических клеток в трех измерениях, и способ его получения (RU 2280459 C1). Клеточные культуры, культивированные в трех измерениях, могут включать различные типы клеток, в том числе МСК, нервные стволовые клетки, фибробласты, эмбриональные стволовые клетки и др. Способ получения указанного средства предполагает получение кондиционированной культуральной среды, из которой отделены клеточные культуры, включающей такие внеклеточные продукты, как факторы роста, противовоспалительные медиаторы, ферменты, цитокины, гормоны, факторы свертывания крови, регуляторные факторы, ангиогенные факторы или антиангиогенные факторы.
Однако в описании данного изобретения не представлено количественное содержание в кондиционированной среде факторов, обеспечивающих эффективность средства для лечения ран и ожогов, не раскрыты способы ее очистки, не подтверждено сохранение фармакологических свойств среды после процедуры лиофилизации.
Раскрытие изобретения
Задачей изобретения является создание нового лекарственного средства для стимуляции регенерации поврежденных тканей, обладающего комплексным воздействием на различные этапы раневого процесса.
Техническим результатом, на достижение которого направлено заявленное изобретение, является получение средства, эффективно стимулирующего регенерацию тканей за счет комплексного сбалансированного действия факторов роста и других биологически активных молекул, секретируемых мезенхимными стволовыми/стромальными клетками (МСК) человека в культуральную среду, не содержащую ксеногенных компонентов. Эффективность средства обеспечивается за счет подобранного содержания в среде ключевых факторов роста, необходимых для реализации регенеративного действия МСК, концентрацию которых измеряют с помощью иммуноферментного анализа (ELISA), а именно фактора роста эндотелия сосудов (VEGF), фактора роста гепатоцитов (HGF), основного фактора роста фибробластов (bFGF) и ангиопоэтина 1 типа (Angpt-1), а также антиангиогенного фактора, полученного из клеток пигментного эпителия (PEDF), отражающего сбалансированность эффектов данного средства.
Поставленная задача решается тем, что способ получения средства для регенерации тканей включает культивирование мезенхимных стромальных клеток жировой ткани (МСК ЖТ) человека 4-5 пассажей в бессывороточной и лишенной продуктов животного происхождения среде роста, поддерживающей жизнеспособность клеток не менее 70% и пригодной для терапевтического применения, отбор среды культивирования, содержащей продукты секреции МСК ЖТ человека, и удаление из нее остатков клеток, ее очистку от низкомолекулярных компонентов методом ультрафильтрации с последующей лиофилизацией для получения средства, содержащего продукты секреции МСК человека, включающие ключевые факторы роста: VEGF в концентрации не менее 200 пкг/мл, HGF в концентрации не менее 150 пкг/мл, FGF basic в концентрации не менее 0,29 пкг/мл, ангиопоэтин-1 в концентрации не менее 145 пкг/мл, PEDF в концентрации не менее 500 пкг/мл, определяемые методом иммуноферментного анализа при восстановлении лиофилизата в стерильном физиологическом растворе. При этом МСК ЖТ наращивают в специфической среде, поддерживающей рост недифференцированных мезенхимных клеток человека (AdvanceSTEM Cell Culture Media, содержащей 9-11% добавки к среде роста AdvanceSTEM Stem Cell Growth Supplement, HyClone, USA), но для получения кондиционированной среды клетки тщательно отмывают от компонентов среды раствором Хэнкса (фирмы ПанЭко или аналогичным) и помещают в бессывороточную и лишенную продуктов животного происхождения среду роста, в качестве последней используют DMEM с низким содержанием глюкозы (HyClone, USA) или другую среду роста, поддерживающую жизнеспособность МСК человека (не ниже 70%) в течение всего срока кондиционирования и пригодную для терапевтического применения.
Культивирование может быть осуществлено в культуральных флаконах или чашках Петри (фирмы Corning или аналогичные), при этом клетки выращивают на плоской подложке с плотностью 5-15*103/см2 в среде роста в объеме 0,1-0,2 мл/см2 в условиях СО2 инкубатора при 37±1°С, 5%-ном содержании СО2 и относительной влажности ≥95% в течение 7±1 дней. Удаление из среды культивирования остатков клеток (клеточного дебриса) может быть реализовано центрифугированием, например, при 5000±10 об/мин, температуре 6±2°С в течение 10 минут. Очистку среды культивирования осуществляют посредством ее ультрафильтрации с удалением низкомолекулярных соединений массой менее 5 кДа, при этом для получения стерильного продукта дополнительно осуществляют микрофильтрацию полученного раствора через фильтры с диаметром пор 0,22 мкм. Очистка может быть осуществлена с использованием системы фильтрации в тангенциальном потоке Minim II (Life Sciences, США) или аналогичной с использованием ультрафильтрационных кассет (Minimate TFF capsule, PALL) или аналогичных. Лиофилизация может быть осуществлена в 8-14 стадий при давлении 0,013 кПа, температуре от -40°С до -5°С, время лиофилизации не более 36 часов при максимальной загрузке лиофильной сушки.
Поставленная задача решается также тем, что средство для регенерации тканей включает среду роста в виде лиофилизата, полученного по способу, описанному выше, который содержит ключевые биологически активные факторы роста: VEGF в концентрации не менее 200 пкг/мл, HGF в концентрации не менее 150 пкг/мл, FGF basic в концентрации не менее 0,29 пкг/мл, ангиопоэтин-1 в концентрации не менее 145 пкг/мл, PEDF в концентрации не менее 500 пкг/мл, определяемые методом иммуноферментного анализа при восстановлении 0,1±0,005 г лиофилизата в 10 мл стерильного физиологического раствора.
Таким образом, технический результат достигается за счет того, что средство для регенерации тканей получают при культивировании МСК человека в бессывороточной среде, лишенной животных компонентов, с потенциально безопасным для клинического применения составом, поддерживающей жизнеспособность клеток в течение подобранного срока кондиционирования, путем сбора кондиционированной среды, содержащей биологически активные факторы, секретируемые клетками в культуральную среду, очистки полученной среды с помощью центрифугирования и ультрафильтрации и ее стабилизации путем лиофилизации. Полученный лиофилизат, разведенный в стерильном физиологическом растворе, можно использовать как лекарственное средство или как компонент биоматериалов при комбинировании с биосовместимыми носителями для стимуляции регенерации тканей после повреждения.
Эффективность разрабатываемого средства предполагает наличие целого комплекса воздействий, направленных на стимулирование пролиферации и миграции специализированных клеток, участвующих в процессах репарации и регенерации, таких как эндотелиальные клетки, фибробласты и др., регуляцию процессов воспаления и, наконец, формирование стабильной сети сосудов и подрастание нервов. При этом необходимость адекватного восстановления сосудистой сети и нервных окончаний в зоне регенерации поврежденной ткани является актуальной задачей. Использование среды культивирования, кондиционированной МСК человека, позволит обеспечить комплексное решение проблем, возникающих при регенерации тканей после повреждения. Предполагается, что ускоренное заживление различных повреждений, в том числе за счет стимуляции васкуляризации и реиннервации, может быть осуществлено с помощью бессывороточной среды, содержащей комбинацию цитокинов и факторов роста и других биологически активных компонентов, секретированных МСК человека. Данное решение позволяет получить оптимальное сочетание факторов роста, секретированных клетками человека, т.е. прошедших необходимые модификации и способствующее ангиогенезу и нейрогенезу в среде, не содержащей белков животного происхождения и бактериальных фрагментов, а также обеспечить сбалансированный эффект секретируемых клетками продуктов за счет наличия разнонаправленных по механизму действия факторов, среди которых для разрабатываемого средства контролируется содержание антиангиогенного фактора PEDF.
Для получения кондиционированной среды нами использованы мультипотентные мезенхимные стволовые/стромальные клетки (МСК) человека, отвечающие за репарацию и регенерацию тканей и органов как в норме, так и при повреждениях. Одним из наиболее богатых источников МСК у человека является жировая ткань. МСК могут быть легко выделены в результате ферментативной обработки образцов жировой ткани, полученной в результате косметической липосакции или в ходе хирургического удаления жирового отложения. Культивирование изолированных МСК ЖТ приводит к получению относительно гомогенной популяции мультипотентных стромальных фибробластоподобных клеток.
В заявляемом изобретении могут быть использованы МСК, полученные самостоятельно по любому известному из уровня техники способу (см. Пример 1), так и в виде коммерческих препаратов МСК, имеющих сертификат качества и предназначенных, в том числе, для клинического применения, например, такие как продукт АТСС (АТСС® PCS-500-011), представляющий собой МСК человека, выделенные из липоаспирата, культивированные до 2 пассажа и подвергнутые криоконсервации, или аналогичные.
Ранее на моделях ишемии конечности и инфаркта миокарда и подкожно имплантированного матригеля у животных нами было показано, что локальное и системное введение МСК ЖТ способствует увеличению количества сосудов в тканях с нарушенным кровоснабжением, приводит к улучшению кровотока в этих тканях и уменьшению или исчезновению симптомов ишемии. Кроме того, нами было выявлено, что введение МСК ЖТ способствует прорастанию нервных окончаний в подкожно имплантированный матригель и улучшает восстановление периферических нервов после травматического повреждения. Согласно данным наших исследований и работ других научных коллективов основным механизмом, лежащим в основе регенеративного эффекта МСК ЖТ, является продукция этими клетками широкого спектра биологически активных цитокинов и факторов роста, ускоряющих процессы заживления и восстановления тканей после повреждения.
В большинстве протоколов выделения и культивирования МСК ЖТ используется среда с добавлением эмбриональной телячьей сыворотки (ЭТС) или фетальной бычьей сыворотки (ФБС). Эти сыворотки содержат необходимый коктейль факторов роста, гормонов и витаминов, стимулирующих клеточную адгезию и пролиферацию в условиях культивирования in vitro. В то же время накапливается все больше сведений о том, что клетки, выращенные с использованием сывороток животных, потенциально небезопасны, в частности, существует риск заражения прионами или вирусами культуры клеток при культивировании с использованием сывороток животных, а также возможность иммунной реакции со стороны организма реципиента. Кроме того, было показано, что длительное культивирование в присутствии ФБС значительно изменяет свойства клеток различного происхождения. Так, мезенхимные клетки костного мозга, культивированные в присутствии ФБС, характеризуются нестабильностью транскриптома, включая изменение экспрессии генов, ответственных за регуляцию клеточного цикла, апоптоз и клеточную адгезию.
Отличительной особенностью данного изобретения является использование специализированной среды, поддерживающей рост и функциональные свойства недифференцированных МСК человека, на этапах, предшествующих кондиционированию МСК: AdvanceSTEM Cell Culture Media (HyClone, USA) с добавлением раствора антибиотиков Penicillin-Streptomycin (HyClone, USA) и добавки к среде роста AdvanceSTEM Stem Cell Growth Supplement (HyClone, USA), которые берут при следующем соотношении компонентов, об. %:
AdvanceSTEM Cell Culture Media - 89-91;
Раствор антибиотиков Penicillin-Streptomycin - 0,95-1,05;
Добавки к среде роста AdvanceSTEM Stem Cell Growth Supplement - 9,5-10,5.
МСК выделяют из подкожной жировой ткани человека и культивируют в приготовленной по указанной выше схеме среде роста до 4-5 пассажа. Затем клетки тщательно отмывают от компонентов среды роста раствором Хэнкса (фирмы ПанЭко или аналогичным) и помещают в бессывороточную и лишенную продуктов животного происхождения среду роста, в качестве последней используют DMEM с низким содержанием глюкозы (HyClone, USA) или другую среду роста, поддерживающую жизнеспособность МСК человека (не ниже 70%) в течение всего срока кондиционирования и пригодную для терапевтического применения. Указанную среду для кондиционирования клеткам добавляют в объеме 0,1-0,2 мл/см2 и культивируют в условиях СО2 инкубатора при 37±1°С, 5%-ном содержании СО2 и относительной влажности ≥95% в течение 7±1 дней. Кондиционированную среду, содержащую все продукты секреции МСК человека, собирают в стерильные емкости для центрифугирования, удаляют путем центрифугирования остатки клеток и полученный супернатант подвергают очистке с помощью процедуры ультрафильтрации, удаляя все низкомолекулярные соединения массой менее 5 кДа. На этапе ультрафильтрации при использовании соответствующего оборудования и соблюдении асептических условий можно получить стерильный продукт. Если невозможно обеспечить стерильность продукта при процедуре ультрафильтрации, то добавляют этап микрофильтрации. Для этого концентрированную среду фильтруют через одноразовые стерильные фильтры с диаметром пор 0,22 мкм, достаточным для очистки от потенциально содержащихся в продукте микроорганизмов, а затем подвергают процедуре лиофилизации для получения итогового продукта (лиофилизат кондиционированной среды, содержащей продукты секреции МСК человека), содержащего в том числе ключевые биологически активные факторы, по которым проводится стандартизация конечного продукта. Так, при восстановлении 0,1±0,005 г лиофилизата в 10 мл стерильного физиологического раствора методом иммуноферментного анализа в растворе должны определяться VEGF в концентрации не менее 200 пкг/мл, HGF в концентрации не менее 150 пкг/мл, FGF basic в концентрации не менее 0,29 пкг/мл, ангиопоэтин-1 в концентрации не менее 145 пкг/мл, PEDF в концентрации не менее 500 пкг/мл.
Другой технической особенностью данного изобретения является возможность очищать, а при необходимости и одновременно концентрировать кондиционированную среду с использованием системы фильтрации в тангенциальном потоке Minim II (Life Sciences, США) или аналогичной, используя ультрафильтрационные кассеты (Minimate TFF capsule, PALL) или аналогичные, что позволяет значительно ускорить процесс очистки и/или концентрирования и способствует лучшему сохранению биологически активных веществ в кондиционированной среде.
В результате осуществления данного изобретения получают средство на основе продуктов секреции МСК человека, которое может быть использовано как лекарственное средство или как компонент биоматериала для стимуляции регенерации тканей.
Краткое описание чертежей
Изобретение поясняется чертежами, где на фигурах представлены:
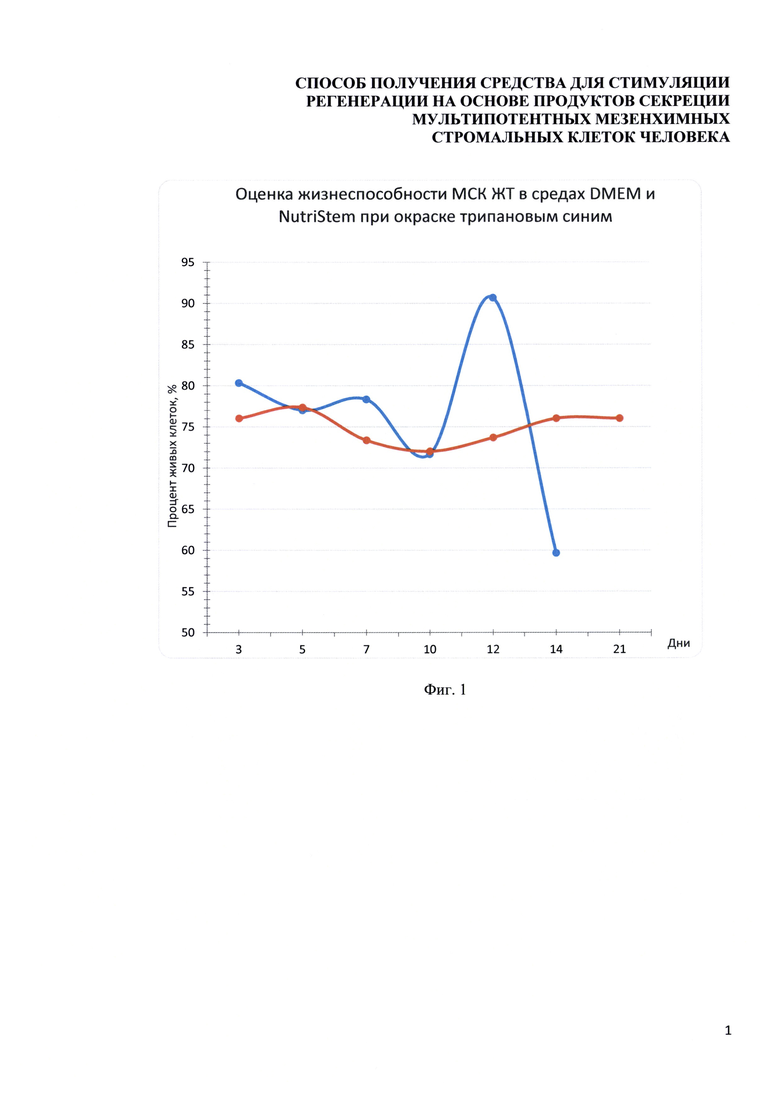
Фигура 1. Диаграмма, отражающая оценку жизнеспособности МСК-ЖТ человека при длительном кондиционировании сред без питательных добавок. Синяя кривая - процент живых клеток при кондиционировании среды DMEM-LG. Оранжевая кривая - процент живых клеток при кондиционировании среды NutriStem. Статистическая оценка жизнеспособности проводилась с использованием критерия Краскела-Уоллиса с последующим применением критерия Данна. Использованы критические значения для сравнения групп с контрольной (3 дня). Статистически значимых различий не выявлено; n=3 для каждой временной точки.
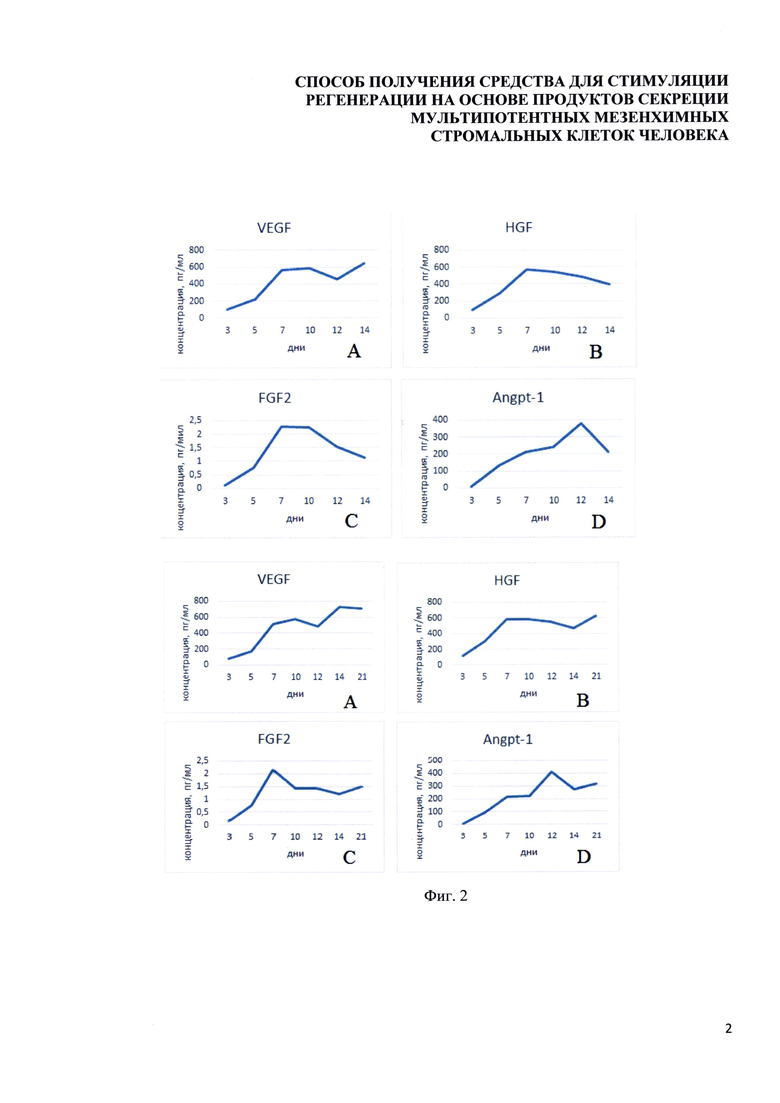
Фигура 2. Диаграмма, отражающая динамику изменения содержания ключевых факторов при кондиционировании МСК-ЖТ человека среды DMEM-LG. По горизонтальной оси указана продолжительность кондиционирования среды в днях, по вертикальной - концентрация факторов в пг/мл. Число выборок для каждой временной точки - 3. A. VEGF. В. HGF Концентрации факторов на 7 день значимо выше концентраций при меньшей длительности кондиционирования, но не отличается от концентраций при более длительном кондиционировании С. FGF2. Пиковая концентрация достигается на 7 день кондиционирования. Разница концентраций 3- и 7-дневного кондиционирования статистически не значима (р=0,072). D. Angpt-1. Концентрация фактора на 7 день кондиционирования выше, чем на 3. Концентрация фактора в продукте 12-дневного кондиционирования значимо больше 7-дневного (p<0,004). Анализ проводили с помощью ПО Statistica 10 методом ANOVA с последующим использованием критерия Даннета. Различия считали значимыми при p<0,05.
Фигура 3. Диаграмма, отражающая динамику изменения содержания ключевых факторов при кондиционировании МСК-ЖТ человека среды NutriStem. По горизонтальной оси указана продолжительность кондиционирования среды в днях, по вертикальной - концентрация факторов в кондиционированной среде, пг/мл. Выборка для каждой временной точки - 3. A. VEGF. В. HGF. С. FGF2. Концентрации факторов на 7 день значимо выше концентраций при меньшей длительности кондиционирования, но не отличается от концентраций при более длительном кондиционировании. D. Angpt-1. Концентрация фактора на 7 день кондиционирования значимо выше, чем на 3. Концентрация фактора в продукте 12-дневного кондиционирования значимо больше 7-дневного (p<0,0030). Анализ проводили с помощью ПО Statistica 10 методом ANOVA с последующим использованием критерия Даннета. Различия считали значимыми при p<0,05.
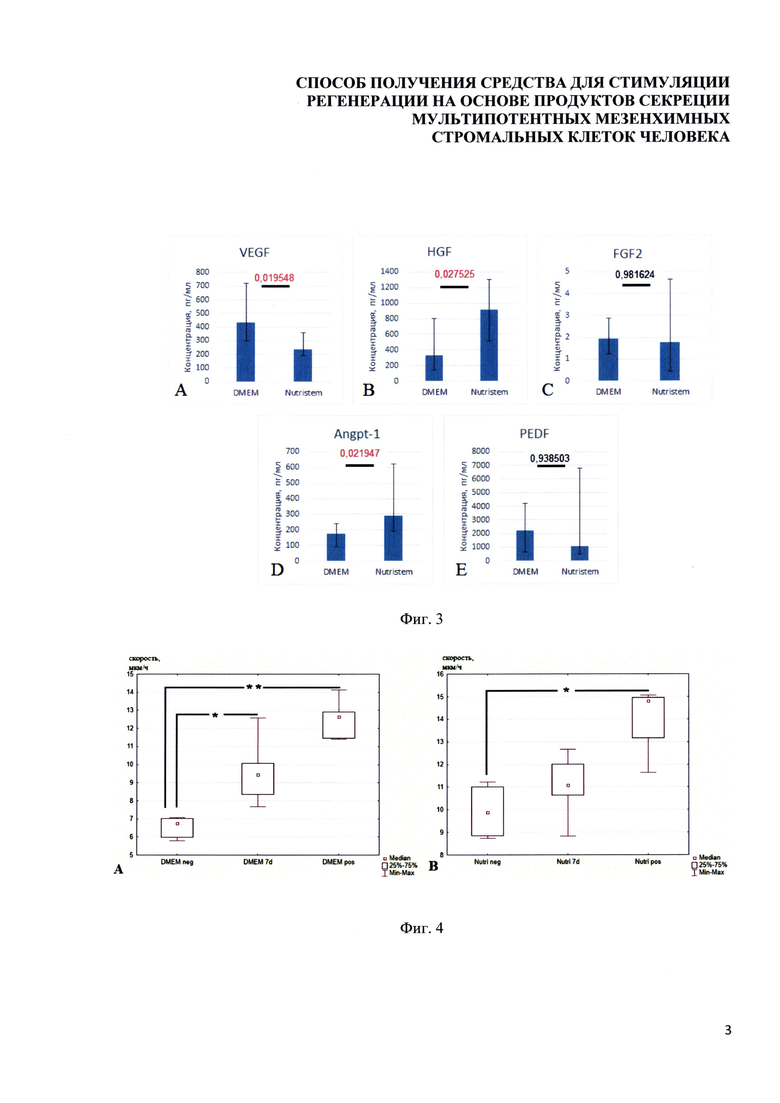
Фигура 4. Диаграмма, отражающая сравнение количественного содержания ключевых активных факторов в средах DMEM-LG и NutriStem через 7 дней кондиционирования. Столбиками отмечены значения медиан по каждому фактору. Планками ограничиваются 25-тые и 75-тые процентили. Над планками показан уровень значимости различий. А. Сравнение концентраций фактора VEGF. В. Сравнение концентраций фактора HGF. С. Сравнение концентраций фактора FGF2. D. Сравнение концентраций фактора Angpt-1. Е. Сравнение концентраций фактора PEDF. Различия устанавливали с помощью критерия Манна-Уитни. Различия считали статистически значимыми при p<0,05.
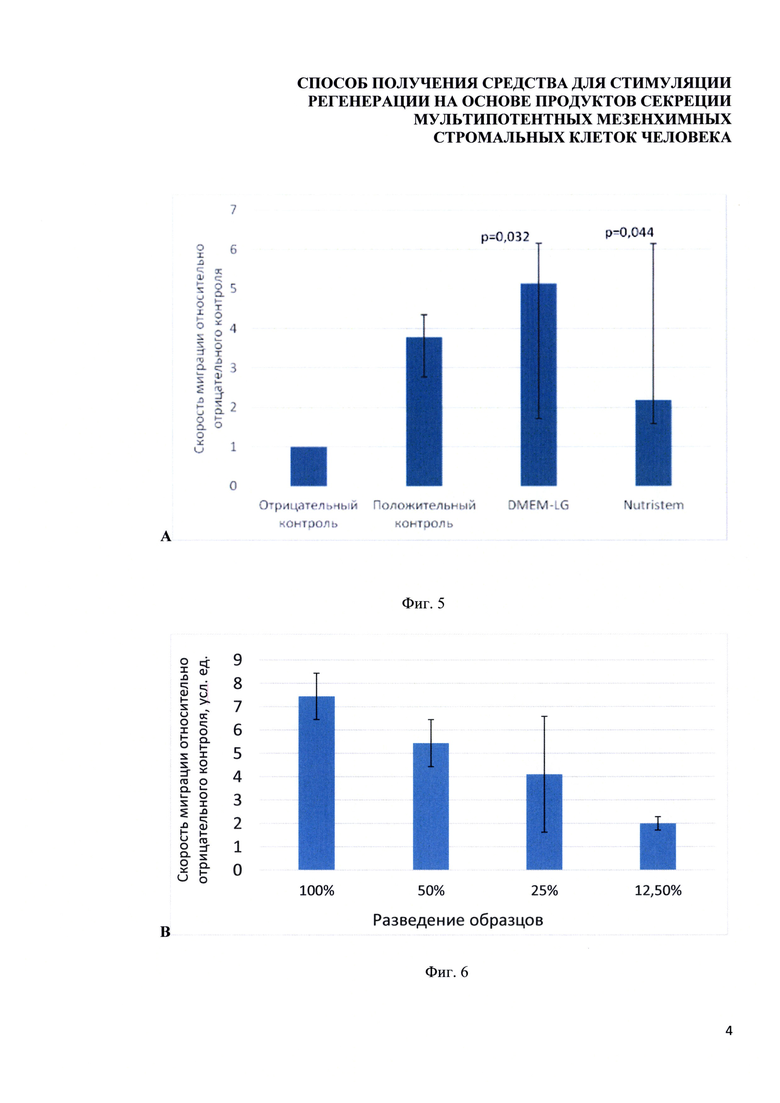
Фигура 5. Диаграммы, отражающие результаты оценки специфической активности разрабатываемого средства на модели миграции фибробластов в клеточную рану. А. Скорость миграции фибробластов (модель клеточной раны) при стимуляции базовой средой DMEM-LG (отрицательный контроль; DMEMneg; n=6), образцами кондиционирования МСК ЖТ человека в среде DMEM-LG (DMEM 7d), DMEM-LG + 10% ФБС (положит. контроль; DMEMpos, n=5). В. Скорость миграции фибробластов при стимуляции базовой средой NutriStem (Nutrineg; n=4), образцами кондиционирования МСК-ЖТ человека в среде NutriStem (Nutri 7d), NutriStem с добавлением 10% добавки «NutriStem supplement» (положительный контроль; Nutripos, n=5). Квадратными точками отмечены медианы, прямоугольными блоками - значения 25-75 процентилей, планки отмечают максимальные и минимальные значения выборок. Статистическую оценку проводили с использованием критерия Краскела-Уоллиса с последующим применением критерия Данна. Использованы критические значения для сравнения групп с контрольной (DMEMneg для A; Nutrineg для В). * - p<0,05. ** - p<0,01.
Фигура 6. Диаграммы, отражающие результаты оценки специфической активности разрабатываемого средства на модели направленной миграции эндотелиальных клеток. А. Оценка относительной средней скорости эндотелиальных клеток человека (EA.hy926) за первые 4 часа миграции при стимуляции образцами кондиционированной среды, полученной при культивировании МСК-ЖТ человека в средах DMEM-LG и NutriStem в течение 7 дней по сравнению с базовой средой DMEM-LG (отрицательный контроль, n=4) и DMEM-LG + 10% FBS (положительный контроль, n=4). Представлена скорость миграции относительно отрицательного контроля. На диаграмме представлены медианы по выборкам. Планки ограничивают 25 и 75 процентили. Статистическую оценку проводили с использованием критерия Манна-Уитни с помощью ПО Statistica 10. В. Оценка относительной средней скорости эндотелиальных клеток человека (EA.hy926) за первые 4 часа миграции при стимуляции образцами кондиционированной среды, полученной при культивировании МСК-ЖТ человека, разведенными в 2, 4 и 8 раз.
Осуществление изобретения
Ниже представлено подробное описание изобретения на примерах конкретного выполнения, которые демонстрируют практическую осуществимость изобретения, но не ограничивают возможность осуществления изобретения с помощью иных средств и методов.
Пример 1. Получение МСК жировой ткани человека.
МСК выделяют из подкожного жирового отложения здоровых доноров обоих полов. Клетки выделяют из материала, полученного при проведении малого хирургического вмешательства под местной анестезией или в ходе плановых хирургических операций. Хирургический материал (15 г жировой ткани, взятой из околопупочной области или другой области локализации подкожного жира) помещают в одноразовую пробирку с буфером HBSS (HyClone), содержащим 5-кратную концентрацию антибиотика 500 ед/мл (HyClone).
В стерильных условиях культурального бокса биоптат фрагментируют до однородной массы, используя стерильные инструменты, после чего подвергают его ферментативной обработке в растворе, содержащем среду AdvanceSTEM™ (HyClone)/500 ед/мл антибиотика (HyClone), 200 ед/мл коллагеназы I типа и диспазы (40 ед/ml) (Worthington Biochemical) (соотношение объема ферментов и жира должно быть 1:1:1), при 37°С в течение 30-45 минут при постоянном помешивании. По окончании инкубации к образцу добавляют равный объем среды с сывороткой и фильтруют через нейлоновые мембраны с размером пор 100 мкм (BD). Профильтрованную суспензию центрифугируют в течение 5 мин при 200 g, после чего супернатант полностью удаляют. Осадок клеток подвергают обработке буфером для лизиса эритроцитов (BD) до покраснения раствора, после чего центрифугируют в течение 5 мин при 200 g. Супернатант полностью удаляют, а осажденные клетки ресуспендируют в среде роста МСК. Для культивирования мезенхимных клеток используют среду AdvanceSTEM™ support expansion and maintenance of undifferentiated human MSCs (HyClone) в сочетании с добавлением 10% раствора добавок AdvanceSTEM™ Stem Cell Growth Supplement (HyClone) и 100 ед/мл антибиотика (HyClone). Эта среда была разработана фирмой-производителем (HyClone) для культивирования недифференцированных МСК, в частности клеток, происходящих из жировой ткани, без добавления сыворотки (http://www.thermo.com).
Выделенные МСК высевают в концентрации 200 тыс. в мл в чашках Петри и культивируют в среде роста в инкубаторе при 37°С и при 5%-ной концентрации СО2. При достижении 80% монослоя МСК ЖТ (0 пассаж) замораживают в жидком азоте и хранят в мастер-банке для дальнейшего использования с целью наработки среды.
Для наработки среды МСК ЖТ масштабируют. Перед снятием с поверхности культурального пластика клетки трехкратно промывают раствором Версена. Затем наносят в каждую чашку по 1 мл реагента для диссоциации клеток HyQTase (HyClone). При приобретении клетками округлой формы и откреплении их от подложки в каждую культуральную емкость вносят по 9 мл среды роста и интенсивно пипетируют клеточную суспензию. Затем клетки рассевают в соотношении 1:4.
Пример 2. Получение кондиционированной среды, содержащей продукты секреции МСК жировой ткани человека.
Для получения кондиционированной среды МСК ЖТ наращивают до 2-5 пассажа. МСК ЖТ человека добавляют в количестве 5-15*103/см2 в культуральные емкости для выращивания эукариотических клеток, после прикрепления промывают культуральные сосуды с клетками солевым раствором Хэнкса (Панэко, Россия) (в количестве 0,1-0,2 мл/см2 трижды по 10 минут) и заполняют их свежей средой роста для кондиционирования в количестве 0,1-0,2 мл/см2. В качестве последней используют универсальную среду роста для разных типов клеток DMEM with Low Glucose (HyClone, USA) или среду роста для поддержания роста МСК человека MSC NutriStem® XF Basal Medium (Biological Industries, Israel), с добавлением раствора антибиотиков Penicillin-Streptomycin (HyClone, USA) (1,00±0,05 мл на 100±5 мл среды). Затем клетки культивируют в условиях СО2 инкубатора при 37±1°С, 5%-ном содержании СО2 и относительной влажности ≥95% в течение 7 суток.
В качестве культуральных емкостей для выращивания эукариотических клеток используют культуральные флаконы или чашки Петри (фирмы Corning или аналогичные), при этом клетки выращивают на плоской подложке плотностью 5-15*103/см2.
Пример 3. Очистка кондиционированной среды, содержащей продукты секреции МСК жировой ткани человека, методом ультрафильтрации.
Кондиционированную среду, содержащую все продукты секреции МСК ЖТ человека, собирают в стерильные емкости для центрифугирования, центрифугируют при (5000±10) об/мин, температуре (6±2)°С, в течение 10 минут для удаления клеточного дебриса. Полученный супернатант отбирают в новые стерильные емкости объемом 250-500 мл.
Очистку среды от низкомолекулярных компонентов проводят с помощью системы фильтрации в тангенциальном потоке Minim II (Life Sciences), используя ультрафильтрационные кассеты (Minimate TFF capsule, PALL, 5 кДа) или аналогичные. Для этого питающий резервуар заполняют 100 мл кондиционированной среды. Производительность насоса устанавливают на уровне 90-120 мл/мин, давление не более 2 атмосфер, скорость потока фильтрата не более 20-30 мл/мин. Проводят 5-6 раундов очистки, восполняя объем добавлением раствора Хэнкса в питающий резервуар. После этого выключают насос, переносят возвращающий шланг в сосуд для сбора очищенного раствора, включают насос и дожидаются осушения питающего резервуара. Для вытеснения остатков очищенной среды в питающий резервуар добавляют раствор Хэнкса, включают насос и под визуальным контролем собирают очищенную среду до момента выхода из системы всего раствора.
При невозможности соблюсти стерильность при проведении ультрафильтрации очищенную среду подвергают микрофильтрации. Фильтрацию очищенной среды осуществляют через одноразовые стерильные фильтры с диаметром пор 0,22 мкм, обеспечивающие стерилизацию продукта. Среду подают на фильтры перистальтическим насосом. Фильтрат собирают в стерильную полипропиленовую емкость.
Пример 4. Лиофилизация очищенной кондиционированной среды, содержащей продукты секреции МСК жировой ткани человека.
Очищенную фильтрованную среду подвергают процедуре лиофилизации для получения итогового продукта (лиофилизат кондиционированной среды, содержащей продукты секреции МСК человека). Для этого разливают очищенную фильтрованную среду по (10,0±0,1) мл в стерильные стеклянные флаконы емкостью 100 мл. Флаконы укупоривают бутиловыми резиновыми пробками для лиофилизации. Затем флаконы помещают в лиофильную сушку. Охлаждают до -45°C с контролем по температуре продукта, затем 1 час выдерживают при указанной температуре. После этого включают конденсор, охлаждают его до -45°С, включают вакуумный насос и доводят давление до 0,027 кПа. Проводят следующие шаги:
1) Ступенчатое охлаждение до 10°С за 20 минут при давлении 66,6 кПа;
2) Плавное охлаждение до -15°С за 25 минут при давлении 66,6 кПа;
3) Выдерживание на -15°С за 120 минут при давлении 66,6 кПа;
4) Плавное охлаждение до -40°С за 25 минут при давлении 66,6 кПа;
5) Выдерживание на -40°С за 150 минут при давлении 0,013 кПа;
6) Плавный нагрев до -30°С за 150 минут при давлении 0,013 кПа;
7) Плавный нагрев до -20°С за 150 минут при давлении 0,013 кПа;
8) Плавный нагрев до -10°С за 150 минут при давлении 0,013 кПа;
9) Плавный нагрев до -5°С за 150 минут при давлении 0,013 кПа;
10) Выдерживание на -5°С (в течение 20 часов до отключения оператором) при давлении 0,066 кПа;
11) Девакуумирование до 66,6 кПа;
12) Полная автоматическая укупорка резиновыми пробками;
13) Сброс вакуума;
14) Выгрузка флаконов.
Общая продолжительность процедуры лиофилизации не превышает 36 часов при полной загрузке лиофильной сушки. После выгрузки на флаконы надевают алюминиевые колпачки и завальцовывают их с помощью ручной машины для обжима колпачков.
Пример 5. Определение жизнеспособности МСК жировой ткани при длительном культивировании в среде без добавления сыворотки.
Для выбора оптимального срока кондиционирования клеток была проведена оценка выживаемости клеток при культивировании в бессывороточных средах методом окраски раствором трипанового синего (HyClone, USA). Процент жизнеспособных клеток определяли на 3, 5, 7, 10, 12, 14 и 21 сутки после начала культивирования (Фигура 1). Статистический анализ показателей выживаемости клеток в среде DMEM не выявил значимых различий между сроком в 3 суток и другими временными точками, при этом уровень жизнеспособности клеток составлял не ниже 70%. На 21 день опыта клетки в среде DMEM погибли. Данные по выживаемости МСК-ЖТ человека в среде NutriStem при коротком и длительном периодах кондиционирования также не отличаются друг от друга. После 21 дня опыты по оценке жизнеспособности МСК в среде NutriStem были закончены. Таким образом, длительность кондиционирования среды может варьировать по крайней мере от 3 до 14 дней при сохранении жизнеспособности клеток не менее 70%.
Пример 6. Метод оценки концентрации ключевых факторов, опосредующих регенеративные эффекты среды, кондиционированной МСК жировой ткани человека.
Оценку содержания VEGF, HGF, FGF basic (FGFb), Angpt-1 и PEDF в восстановленном в 10 мл стерильного физиологического раствора лиофилизате кондиционированной среды, содержащей продукты секреции МСК ЖТ человека, проводят методом иммуноферментного анализа (ELISA). В растворе должны определяться VEGF в концентрации не менее 200 пкг/мл, HGF в концентрации не менее 150 пкг/мл, FGF basic в концентрации не менее 0,29 пкг/мл, ангиопоэтин-1 в концентрации не менее 145 пкг/мл, PEDF в концентрации не менее 500 пкг/мл.
Оценка содержания FGFb с использованием набора фирмы R&D Systems Human FGF basic Quantikine ELISA Kit.
Для определения концентрации FGFb методом ELISA используют коммерческий набор фирмы R&D Systems (Human FGF basic Quantikine ELISA Kit, cat#DFB50) или аналогичный.
Используя стандартизированный раствор FGFb, готовят калибровочные пробы известной концентрации так, чтобы проба №1 содержала 500 пг/мл FGFb, каждая последующая содержала FGFb в 2 раза меньше. Проба №0 должна содержать только раствор Sample Diluent. Исследуемые образцы в количестве 100 мкл, а также стандартизированные образцы раствора FGFb троекратно наносят в лунки 96-луночного планшета и инкубируют на шейкере в течение 12 часов при 4°С. Планшет отмывают буфером Wash Buffer, и в каждую из лунок добавляют по 100 мкл биотинилированных мышиных моноклональных антител против FGFb человека. Через 3 часа инкубации планшет отмывают, как описано выше. В каждую лунку наносят по 100 мкл раствора комплекса стрептавидин-пероксидаза хрена. Через 1 час планшет тщательно промывают и вносят в каждую лунку по 100 мкл прилагаемого к набору раствора субстрата ТМВ/Е. Планшет инкубируют при комнатной температуре в течение 15 минут, затем в каждую из лунок добавляют по 100 мкл стоп-буфера, и оценивают реакцию на спектрофотометре ELISA READER MICROPLATE READER Spectro при длине волны 450 нм. В качестве референсного используют уровень оптической плотности при длине волны 570 нм. Работу на аппарате осуществляют в соответствии с инструкцией.
Оценка содержания HGF с использованием набора фирмы R&D Systems Human HGF Quantikine ELISA Kit.
Для определения концентрации HGF методом ELISA используют коммерческий набор фирмы R&D Systems (Human HGF Quantikine ELISA Kit, cat#DHG00) или аналогичный.
Используя стандартизированный раствор HGF, готовят калибровочные пробы известной концентрации так, чтобы проба №1 содержала 500 пг/мл HGF, каждая последующая содержала HGF в 2 раза меньше. Проба №0 должна содержать только раствор Sample Diluent. Исследуемые образцы в количестве 100 мкл, а также стандартизированные образцы раствора HGF троекратно наносят в лунки 96-ти луночного планшета и инкубируют на шейкере в течение 12 часов при 4°С. Планшет отмывают буфером Wash Buffer, и в каждую из лунок добавляют по 100 мкл биотинилированных мышиных моноклональных антител против HGF человека. Через 3 часа инкубации планшет отмывают, как описано выше. В каждую лунку наносят по 100 мкл раствора комплекса стрептавидин-пероксидаза хрена. Через 1 час планшет тщательно промывают и вносят в каждую лунку по 100 мкл прилагаемого к набору раствора субстрата ТМВ/Е. Планшет инкубируют при комнатной температуре в течение 15 минут, затем в каждую из лунок добавляют по 100 мкл стоп-буфера и оценивают реакцию на спектрофотометре ELISA READER MICROPLATE READER Spectra при длине волны 450 нм. В качестве референсного используют уровень оптической плотности при длине волны 570 нм. Работу на аппарате осуществляют в соответствии с инструкцией.
Оценка содержания ангиопоэтина-1 с использованием набора фирмы R&D Systems Human Angiopoietin-1 Quantikine ELISA Kit.
Для определения концентрации ангиопоэтина-1 методом ELISA используют коммерческий набор фирмы R&D Systems (Human Angiopoietin-1 Quantikine ELISA Kit, cat#DANG10) или аналогичный.
Используя стандартизированный раствор ангиопоэтина-1, готовят калибровочные пробы известной концентрации так, чтобы проба №1 содержала 500 пг/мл ангиопоэтина-1, каждая последующая содержала ангиопоэтина-1 в 2 раза меньше. Проба №0 должна содержать только раствор Sample Diluent. Исследуемые образцы в количестве 100 мкл, а также стандартизированные образцы раствора ангиопоэтина-1 троекратно наносят в лунки 96-луночного планшета и инкубируют на шейкере в течение 12 часов при 4°С. Планшет отмывают буфером Wash Buffer, и в каждую из лунок добавляют по 100 мкл биотинилированных мышиных моноклональных антител против ангиопоэтина-1 человека. Через 3 часа инкубации планшет отмывают, как описано выше. В каждую лунку наносят по 100 мкл раствора комплекса стрептавидин-пероксидаза хрена. Через 1 час планшет тщательно промывают и вносят в каждую лунку по 100 мкл прилагаемого к набору раствора субстрата ТМВ/Е. Планшет инкубируют при комнатной температуре в течение 15 минут, затем в каждую из лунок добавляют по 100 мкл стоп-буфера и оценивают реакцию на спектрофотометре ELISA READER MICROPLATE READER Spectra при длине волны 450 нм. В качестве референсного используют уровень оптической плотности при длине волны 570 нм. Работу на аппарате осуществляют в соответствии с инструкцией.
Оценка содержания VEGF с использованием набора фирмы R&D Systems Human VEGF Quantikine ELISA Kit
Для определения концентрации VEGF методом ELISA используют коммерческий набор фирмы R&D Systems (Human VEGF Quantikine ELISA Kit, cat#DVE00) или аналогичный.
Используя стандартизированный раствор VEGF, готовят калибровочные пробы известной концентрации так, чтобы проба №1 содержала 500 пг/мл VEGF, каждая последующая содержала VEGF в 2 раза меньше. Проба №0 должна содержать только раствор Sample Diluent. Исследуемые образцы в количестве 100 мкл, а также стандартизированные образцы раствора VEGF троекратно наносят в лунки 96-ти луночного планшета и инкубируют на шейкере в течение 12 часов при 4°С. Планшет отмывают буфером Wash Buffer, и в каждую из лунок добавляют по 100 мкл биотинилированных мышиных моноклональных антител против VEGF человека. Через 3 часа инкубации планшеты отмывают, как описано выше. В каждую лунку наносят по 100 мкл раствора комплекса стрептавидин-пероксидаза хрена. Через 1 час планшет тщательно промывают и вносят в каждую лунку по 100 мкл прилагаемого к набору раствора субстрата ТМВ/Е. Планшет инкубируют при комнатной температуре в течение 15 минут, затем в каждую из лунок добавляют по 100 мкл стоп-буфера и оценивают реакцию на спектрофотометре ELISA READER MICROPLATE READER Spectro при длине волны 450 нм. В качестве референсного используют уровень оптической плотности при длине волны 570 нм. Работу на аппарате осуществляют в соответствии с инструкцией.
Оценка содержания PEDF с использованием набора фирмы Cusabio Human PEDF ELISA Kit.
Для определения концентрации PEDF методом ELISA используют коммерческий набор фирмы Cusabio (Human PEDF ELISA Kit) или аналогичный.
Готовят серийные разведения стандарта PEDF согласно инструкции, приложенной к набору. Готовят раствор биотинилированных антител к человеческому PEDF и 1х раствор пероксидазы хрена, конъюгированной с авидином. Наносят на каждую лунку микропланшета по 100 мкл стандартного раствора или образца. Накрывают клейкой пленкой и оставляют при 37°С на 2 часа. После двух часов инкубации аккуратно отклеивают липкую пленку и удаляют жидкость из всех лунок без промывания. К каждой лунке добавляют 100 мкл 1х раствора биотинилированных антител. Накрывают липкой пленкой и оставляют микропланшет на 1 час при 37°С. После повторной инкубации убирают все содержимое из лунок. 4х-кратно промывают лунки путем добавления к каждой из них 200 мкл буфера для промывки. Оставляют буфер для промывки в лунке в течение двух минут и тщательно отбирают жидкость после каждого этапа промывки. В конце промывки переворачивают микропланшет вверх дном и промакивают листом фильтровальной бумаги. Добавляют к лункам 100 мкл 1х раствора пероксидазы хрена, конъюгированной с авидином. Накрывают микропланшет клейкой лентой и оставляют на инкубацию на 1 час при 37°С. После инкубации шестикратно промывают лунки по описанной ранее процедуре. Добавляют 90 мкл субстрата «ТМВ Substrate» к каждой лунке. Инкубируют лунки при 37°С в течение 15-30 мин. Добавляют к лункам 50 мкл раствора «Stop Solution», хорошо перемешивают содержимое каждой лунки. Не позднее 5 мин после добавления раствора «Stop Solution» определяют оптическую плотность раствора в каждой лунке при длине волны 450 нм. В качестве референсного используют уровень оптической плотности при длине волны 540 нм.
Пример 7. Определение срока кондиционирования на основании динамики накопления факторов роста в среде.
Проверка содержания производимых биоактивных факторов (VEGF, bFGF, HGF, Angpt-1) на различных сроках кондиционирования (3, 5, 7, 10, 12, 14 суток) проводили с помощью метода ELISA. Полученные данные показали, что количественное содержание большинства ключевых факторов статистически значимо повышается к 7 дню кондиционирования, после чего выходит на плато или снижается. На основании полученных результатов оптимальным сроком кондиционирования среды МСК ЖТ человека был выбран 7-дневный срок (Фигуры 2, 3).
Пример 8. Сравнение концентрации ростовых факторов в кондиционированной среде при культивировании в средах DMEM и NutriStem.
Образцы, полученные при кондиционировании среды МСК ЖТ человека в течение 7 дней, были проверены на содержание ключевых биоактивных факторов методом ELISA. Количество VEGF, секретированного МСК-ЖТ, было значимо больше в среде DMEM-LG. Напротив, содержание в кондиционированной среде HGF и Angpt-1 оказалось выше при использовании для кондиционирования среды NutriStem (Фигура 4). Таким образом, для кондиционирования могут быть использованы различные базовые среды, как специфичные для культивирования МСК человека, так и универсальные.
Пример 9. Специфическая активность средства на основе продуктов секреции МСК жировой ткани человека на моделях in vitro.
Для оценки способности разрабатываемого средства эффективно стимулировать регенерацию тканей использовали два типа клеток - линейные эндотелиальные клетки EA.hy926 и первичные дермальные фибробласты человека 4-5 пассажа, полученные от здоровых доноров.
Влияние кондиционированной среды от МСК жировой ткани человека на скорость миграции фибробластов в модели клеточной раны.
Фибробласты кожи человека культивировали в среде DMEM с добавлением 10% эмбриональной телячьей сыворотки. Для моделирования условий зарастания раны использовали модель клеточной раны (scratch assay), воспроизводящую условия зарастания раны после повреждения. Для этого фибробласты высаживали на чашки Петри в концентрации 100 тыс. кл./мл и культивировали в стандартных условиях до достижения субконфлюентного монослоя. Затем клетки депривировали 12 часов.
Стерильным наконечником 1000 мкл на монослое клеток наносили стандартную по ширине царапину длиной 2 см и заливали клетки концентрированной кондиционированной средой, содержащей продукты секреции МСК ЖТ человека. В качестве отрицательного контроля использовали среду DMEM без сыворотки. В качестве положительного контроля использовали среду DMEM с добавлением 10% эмбриональной телячьей сыворотки. Планшет с фибробластами помещали в CO2-камеру автоматического инвертированного микроскопа Nikon Ti для прижизненных наблюдений, использовали режим съемки в фазовом контрасте с помощью объектива 5х в течение 24 часов с шагом съемки 15 минут. Получившиеся серии изображений анализировали с помощью программного обеспечения ImajeJ, подсчитывая скорость миграции 50 случайных клеток в каждом поле зрения в мкм/час. С образцами, полученными при кондиционировании МСК-ЖТ в течение 7 дней в средах DMEM и NutriStem, были проведены функциональные тесты. Образцы, полученные при семидневном кондиционировании среды DMEM-LG, продемонстрировали значимую специфическую активность (Фигура 5, А). Показатели специфической активности образцов кондиционирования среды NutriStem не достигли статистической значимости различий с отрицательным контролем, хотя эффект стимуляции миграции фибробластов наблюдался на уровне тенденции (р=0,08) (Фигура 5, В).
Влияние кондиционированной среды от МСК жировой ткани человека на скорость направленной миграции клеток эндотелия человека в системе xCELLigence.
Ангиогенез является необходимым для успешной регенерации тканей. Миграция эндотелиальных клеток является ключевым процессом для ангиогенеза. Поэтому для оценки специфической активности была выбрана также модель, отражающая регенераторный эффект разрабатываемого средства на основе продуктов секреции МСК ЖТ человека в контексте стимуляции направленной миграции эндотелиальных клеток человека в область повреждения. Для оценки направленной миграции использовали CIM-plate (16-луночные планшеты) для прибора xCELLigence (ACEA Biosciences, USA), которые представляют собой автоматизированные камеры Бойдена, позволяющие наблюдать клеточную миграцию в режиме реального времени. Камера делится на верхнюю и нижнюю части, которые разделены мембраной с диаметром пор 8 мкм. В нижнюю камеру помещали исследуемые образцы кондиционированной среды от МСК ЖТ. На нижней части мембраны располагается золотой электрод, показания сопротивления которого прибор фиксировал через заданные промежутки времени. В нулевой момент времени снимали базовое значение показания сопротивления электрода в лунке, которое изменялось по мере того, как мигрирующие эндотелиальные клетки человека (линия EA.hy926) из верхней камеры перемещались на нижнюю сторону мембраны и распластывались на ней (увеличивали площадь). На основании показаний сопротивления рассчитывали клеточный индекс (cell index, CI), который связан прямой зависимостью с числом мигрировавших через мембрану клеток. Скорость миграции клеток рассчитывали как отношение изменения CI за заданный промежуток времени к величине этого промежутка в единицах CI/час. Исследовали изменение скорости направленной миграции эндотелиальных клеток линии EA.hy926 в системе xCELLigence, предварительно депривированных в течение 6-8 часов. Клетки снимали с чашек Петри путем обработки раствором HyQTase (HyClone, США), проводили их подсчет с помощью прибора CellCounter (Invitrogen). Клетки разводили до конечной концентрации 600 тыс. кл./мл в среде DMEM (HyClone, США) без добавления сыворотки. В качестве положительного контроля миграции в нижнюю камеру добавляли среду культивирования DMEM с 10% ФБС, в качестве отрицательного - DMEM без сыворотки. Для оценки миграции эндотелиальных клеток в нижнюю камеру добавляли по 160 мкл образцов кондиционированной среды от МСК ЖТ. В верхнюю камеру добавляли 100 мкл среды без клеток, начинали измерения. Через 30 минут снимали фоновые значения клеточного индекса с лунок. Затем в верхнюю камеру добавляли 50 мкл суспензии EA.hy296 до конечной концентрации 30*104 кл. в лунке. Значения клеточного индекса (cell index) регистрировали помощью прибора в течение последующих 4 часов с интервалом 15 минут. Полученные данные были проанализированы с помощью программного обеспечения RTCASoftware (ACEA Biosciences, USA). Образцы кондиционированной среды, полученной при культивировании МСК-ЖТ человека в среде DMEM-LG и NutriStem в течение 7 дней, статистически значимо стимулируют миграцию клеток EA.hy926 в течение первых 4 часов миграции, демонстрируя свою специфическую активность на этой модели (Фигура 6, А). Эффект стимуляции миграции снижался при разведении образцов (Фигура 6, В). Аналогичные результаты были получены при использовании эндотелиальных клеток пупочной вены человека (HUVEC).
| название | год | авторы | номер документа |
|---|---|---|---|
| КОСМЕТИЧЕСКОЕ СРЕДСТВО НА ОСНОВЕ ПРОДУКТОВ СЕКРЕЦИИ МЕЗЕНХИМНЫХ СТВОЛОВЫХ/СТРОМАЛЬНЫХ КЛЕТОК ЖИРОВОЙ ТКАНИ ЧЕЛОВЕКА И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2016 |
|
RU2620342C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ОЖОГОВ И РАН НА ОСНОВЕ ЦИТОКИНОВ И ФАКТОРОВ РОСТА, СЕКРЕТИРУЕМЫХ МЕЗЕНХИМНЫМИ КЛЕТКАМИ ЧЕЛОВЕКА, СПОСОБ ПОЛУЧЕНИЯ СРЕДСТВА И СПОСОБ ЛЕЧЕНИЯ ОЖОГОВ И РАН | 2014 |
|
RU2574017C1 |
| СПОСОБ СТИМУЛЯЦИИ СПЕРМАТОГЕНЕЗА | 2016 |
|
RU2652902C1 |
| СПОСОБ СТИМУЛЯЦИИ СПЕРМАТОГЕНЕЗА | 2016 |
|
RU2653779C1 |
| СПОСОБ СТИМУЛЯЦИИ РЕГЕНЕРАТИВНЫХ ПРОЦЕССОВ В ИШЕМИЗИРОВАННЫХ ТКАНЯХ | 2011 |
|
RU2497529C2 |
| СПОСОБ ОЦЕНКИ АНГИОГЕННОГО ПОТЕНЦИАЛА ПРОГЕНИТОРНЫХ КЛЕТОК У БОЛЬНЫХ СЕРДЕЧНО-СОСУДИСТЫМИ ЗАБОЛЕВАНИЯМИ | 2011 |
|
RU2548801C2 |
| КОМПОЗИЦИЯ ДЛЯ НЕЙРОПРОТЕКЦИИ И СТИМУЛЯЦИИ НЕЙРОРЕГЕНЕРАЦИИ ГОЛОВНОГО МОЗГА ПОСЛЕ ПОВРЕЖДЕНИЯ, СРЕДСТВО НА ЕЕ ОСНОВЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2022 |
|
RU2803286C1 |
| ТЕСТ-СИСТЕМА ДЛЯ ОЦЕНКИ СТИМУЛЯЦИИ СЕКРЕТОРНОЙ АКТИВНОСТИ МОДЕЛЬНЫХ КЛЕТОК ТЕРАПЕВТИЧЕСКИМИ АГЕНТАМИ, НАПРАВЛЕННЫМИ НА ВОССТАНОВЛЕНИЕ СПЕРМАТОГЕНЕЗА | 2023 |
|
RU2825785C2 |
| Бесклеточные терапевтические средства для регенеративной медицины и способы их получения | 2018 |
|
RU2742034C2 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ФИБРОЗА ТКАНЕЙ НА ОСНОВЕ КОМПОНЕНТОВ СЕКРЕТОМА МЕЗЕНХИМНЫХ СТРОМАЛЬНЫХ КЛЕТОК, СПОСОБ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ СРЕДСТВА | 2020 |
|
RU2766707C1 |
Группа изобретений относится к медицине и может быть использована для получения биоматериалов для стимуляции регенерации тканей после повреждения. Способ получения средства включает культивирование мезенхимных стромальных клеток жировой ткани (МСК ЖТ) человека до 4-5 пассажа в среде, поддерживающей рост недифференцированных мезенхимных клеток человека. Проводят отмывку клеток буферным раствором, кондиционирование МСК ЖТ в бессывороточной и лишенной продуктов животного происхождения среде роста, поддерживающей жизнеспособность клеток не менее 70% и пригодной для терапевтического применения. После отбора среды культивирования, содержащей продукты секреции МСК ЖТ человека, удаляют из нее остатки клеток и очищают от низкомолекулярных компонентов с последующей лиофилизацией очищенной среды культивирования. Средство содержит продукты секреции МСК человека, включающие ключевые факторы роста: VEGF в концентрации не менее 200 пкг/мл, HGF в концентрации не менее 150 пкг/мл, FGF basic в концентрации не менее 0,29 пкг/мл, ангиопоэтин-1 в концентрации не менее 145 пкг/мл, PEDF в концентрации не менее 500 пкг/мл, определяемые методом иммуноферментного анализа при восстановлении лиофилизата в стерильном физиологическом растворе. Использование полученного средства позволяет эффективно стимулировать регенерацию тканей за счет комплексного сбалансированного действия факторов роста и других биологически активных молекул, секретируемых мезенхимными стволовыми/стромальными клетками (МСК) человека в культуральную среду, не содержащую ксеногенных компонентов. Эффективность средства обеспечивается за счет подобранного содержания в среде ключевых факторов роста, необходимых для реализации регенеративного действия МСК, а именно фактора роста эндотелия сосудов (VEGF), фактора роста гепатоцитов (HGF), основного фактора роста фибробластов (bFGF) и ангиопоэтина 1 типа (Angpt-1), а также антиангиогенного фактора, полученного из клеток пигментного эпителия (PEDF). 2 н. и 10 з.п. ф-лы, 9 пр., 6 ил.
1. Способ получения средства для стимуляции регенерации поврежденных тканей, включающий культивирование мезенхимных стромальных клеток жировой ткани (МСК ЖТ) человека до 4-5 пассажа в среде, поддерживающей рост недифференцированных мезенхимных клеток человека, отмывку клеток буферным раствором, кондиционирование МСК ЖТ в бессывороточной и лишенной продуктов животного происхождения среде роста, поддерживающей жизнеспособность клеток не менее 70% и пригодной для терапевтического применения, отбор среды культивирования, содержащей продукты секреции МСК ЖТ человека, удаление из нее остатков клеток и очистку от низкомолекулярных компонентов с последующей лиофилизацией очищенной среды культивирования для получения средства, содержащего продукты секреции МСК человека, включающие ключевые факторы роста: VEGF в концентрации не менее 200 пкг/мл, HGF в концентрации не менее 150 пкг/мл, FGF basic в концентрации не менее 0,29 пкг/мл, ангиопоэтин-1 в концентрации не менее 145 пкг/мл, PEDF в концентрации не менее 500 пкг/мл, определяемые методом иммуноферментного анализа при восстановлении лиофилизата в стерильном физиологическом растворе.
2. Способ по п. 1, характеризующийся тем, что среда, поддерживающая рост недифференцированных мезенхимных клеток человека, представляет собой раствор, содержащий базовую среду - AdvanceSTEM Cell Culture Media, и добавку - AdvanceSTEM Stem Cell Growth Supplement (HyClone, USA), при этом добавку берут в объеме 9-11% на 100% объема базовой среды.
3. Способ по п. 1, характеризующийся тем, что кондиционирование осуществляют в культуральных флаконах или чашках Петри (фирмы Corning или аналогичные), при этом МСК ЖТ человека размещают на плоской подложке плотностью 5-15*103/см2 в среде для кондиционирования в объеме 0,1-0,2 мл/см2, затем культуральные емкости с клетками помещают на 6-8 дней в CO2 инкубатор при 37±1°C, 5%-ном содержании CO2 и относительной влажности ≥ 95%.
4. Способ по п. 1, характеризующийся тем, что в качестве буферного раствора для отмывки клеток от компонентов среды роста используют раствор Хэнкса (фирмы ПанЭко или аналогичный), при этом отмывку клеток осуществляют трех-пятикратным размещением клеток в упомянутый раствор из расчета 0,1-0,2 мл раствора на см2 клеток на 5-10 минут.
5. Способ по п. 1, характеризующийся тем, что в качестве среды для кондиционирования используют DMEM с низким содержанием глюкозы (HyClone, USA)
или другую среду роста, поддерживающую жизнеспособность МСК человека в течение всего срока кондиционирования.
6. Способ по п. 1, характеризующийся тем, что удаление из среды культивирования остатков клеток осуществляют центрифугированием.
7. Способ по п. 1, характеризующийся тем, что очистку среды культивирования осуществляют посредством ее ультрафильтрации с удалением низкомолекулярных соединений массой менее 5 кДа.
8. Способ по п. 1, характеризующийся тем, что после очистки среды культивирования от низкомолекулярных соединений дополнительно осуществляют микрофильтрацию полученного концентрата через фильтры с диаметром пор 0,22 мкм.
9. Способ по п. 1, характеризующийся тем, что лиофилизацию осуществляют в 8-14 стадий при давлении 0,013-0,027 кПа, температуре от -40°C до -5°C, время лиофилизации не более 36 часов при максимальной загрузке лиофильной сушки.
10. Способ по п. 6, характеризующийся тем, что центрифугирование осуществляют при 5000±10 об/мин, температуре 6±2°C в течение 10 минут для очистки от клеточного дебриса.
11. Способ по п. 1, характеризующийся тем, что очистку от низкомолекулярных компонентов осуществляют с использованием системы фильтрации в тангенциальном потоке Minim II (Life Sciences, США) или аналогичной с использованием ультрафильтрационных кассет (Minimate TFF capsule, PALL) или аналогичных.
12. Средство для стимуляции регенерации поврежденных тканей в виде лиофилизата, полученного по п. 1, содержащее продукты секреции МСК человека, включающие ключевые факторы роста: VEGF в концентрации не менее 200 пкг/мл, HGF в концентрации не менее 150 пкг/мл, FGF basic в концентрации не менее 0,29 пкг/мл, ангиопоэтин-1 в концентрации не менее 145 пкг/мл, PEDF в концентрации не менее 500 пкг/мл, определяемые методом иммуноферментного анализа при восстановлении лиофилизата в стерильном физиологическом растворе.
| КОМПОЗИЦИЯ ДЛЯ РЕГЕНЕРАЦИИ КЛЕТОК КОЖИ И СЛИЗИСТЫХ ОБОЛОЧЕК | 2010 |
|
RU2455354C1 |
| КОМПОЗИЦИЯ ДЛЯ СТИМУЛИРОВАНИЯ РОСТА И РЕГЕНЕРАЦИИ КЛЕТОК, А ТАКЖЕ СПОСОБЫ ЕЕ ПОЛУЧЕНИЯ | 2006 |
|
RU2341270C2 |
| КОМПОЗИЦИЯ ДЛЯ КЛЕТОЧНО-ЗАМЕСТИТЕЛЬНОЙ ТЕРАПИИ ДЕФЕКТОВ МЯГКИХ ТКАНЕЙ | 2013 |
|
RU2522816C1 |
| Способ электрической стыковой сварки | 1943 |
|
SU69449A1 |
| WO 2010038232 A1, 08.04.2010. | |||
Авторы
Даты
2017-05-23—Публикация
2015-12-21—Подача