Область изобретения
[0001] Настоящее изобретение в общем относится к области онкологии, в частности к видам рака, характеризующимся микросателлитной нестабильностью (MSI) и/или дефицитом репарации ошибочно спаренных оснований (MMR-). Примеры таких видов рака включают многие колоректальные опухоли, опухоли желудка и опухоли эндометрия. Таким образом, в настоящем изобретении представлена новая диагностическая панель маркеров для анализа локусов MSI вместе со способами и наборами для применения указанной панели в выявлении видов рака, характеризующихся микросателлитной нестабильностью (MSI) и/или дефицитом репарации ошибочно спаренных оснований (MMR-).
Предпосылки изобретения
[0002] Ежегодно в Европе и США колоректальный рак (CRC) диагностируют у примерно 440000 пациентов. В новейших руководствах, таких как руководства NCCN для пациентов: рак толстой кишки, версия 1.2017, и клинические практические руководства ESMO по колоректальному раку с отягощенным семейным анамнезом рекомендуется проверка опухоли в отношении дефицита репарации ошибочно спаренных оснований (MMR) ДНК и/или статуса MSI у всех пациентов с CRC. Тем не менее, в настоящее время такие исследования по-прежнему недостаточно используются из-за технической сложности, лежащей их в основе. В частности, трудность заключается в проведении тестирования в отношении всех возможных мутаций, лежащих в основе дефицита MMR, и хотя имеются альтернативные подходы для их скрининга, существующие анализы по-прежнему требуют длительного времени для проведения манипуляций в лаборатории и, следовательно, не подходят для того, чтобы стать рутинными в диагностике.
[0003] Вышеуказанные препятствия закономерно оказывают влияние на ведение и таким образом потенциально также на показатели выживаемости многих больных раком. И действительно, в значительной доле случаев колоректальной карциномы (CRC) установлено, что дефекты в генах MMR являются ключевыми в онкогенезе и прогрессировании заболевания. Например, эпигенетический сайленсинг гена MLH1, вовлеченного в MMR, является причиной около 12% CRC. Дополнительные 2-5% случаев обусловлены аутосомными доминантно наследуемыми мутациями с потерей функции в одном из генов MLH1, MSH2, PMS2 или MSH6, вовлеченных в MMR. Данное наследственное нарушение предрасположенности к раку известно как синдром Линча или наследуемый неполипозный CRC (HNPCC), который дополнительно приводит к повышенному риску возникновения карциномы желудка и эндометрия (среди прочего).
[0004] В путь MMR вовлечена значительная часть генов, при этом было идентифицировано множество различных генетических и эпигенетических нарушений, оказывающих влияние на этот путь. Вероятно, еще предстоит выявить ряд других нарушений. Таким образом, более практичным является диагностирование дефектов в аппарате MMR посредством скрининга в отношении оказываемого ими прямого результата. Последние являются результатом накопления ошибок репликации ДНК во всем геноме, которое может наблюдаться в виде изменений количества нуклеотидов вследствие делеции или вставки в последовательностях одно- и двухнуклеотидных повторов, например (A)n или (CA)n. Данное явление известно как микросателлитная нестабильность или MSI. Если дефицит MMR приводит к MSI в кодирующих участках, то наиболее частым результатом этого являются мутации промотора или мутации со сдвигом рамки считывания, что приводит к отсутствию экспрессии, экспрессии усеченных белков и/или белков, содержащих крупные новые последовательности, содержащие неоантигены. Кроме того, было показано, что MSI в граничных областях интрон-экзон воздействует на механизмы сплайсинга РНК и, следовательно, также препятствует трансляции белка. В целом фенотип MSI коррелирует с геномной нестабильностью, более высокой частотой мутаций и, как следствие, с различным характером роста опухоли и прогнозом.
[0005] Опухоли с высокой MSI (MSI-H) в целом характеризуются лучшим прогнозом и сниженной вероятностью метастазирования по сравнению с микросателлитно-стабильными опухолями (MSS). Более того, эти два типа опухоли также по-разному реагируют на разные виды лечения. Например, CRC на ранней стадии с MSI обычно не отвечает на химиотерапию, основанную на 5-фторурациле, которая в настоящее время является золотым стандартом в лечении CRC (например, Webber et al., 2015). С другой стороны, опухоли c MSI проявляют повышенные уровни по меньшей мере пяти молекул контрольных точек иммунного ответа, которые представляют собой мишени для терапевтических ингибиторов, клинически тестируемых в настоящее время (Llosa et al. 2014). Например, ожидается, что пациенты с колоректальным раком с дефицитом репарации ошибочно спаренных оснований будут особенно хорошо отвечать на иммунотерапию антителами к PD-1, действие которых основано на блокировании взаимодействия рецепторов PD-1 на Т-клетках и рецепторов PD-L1 и PD-L2 на опухолевых клетках, выключая их механизмы уклонения от иммунной системы (Le et al., 2015). Множество других соединений и биологически активных веществ, таких как камптотецин или иринотекан, в настоящее время также проходят испытания в отношении целенаправленно воздействующих видов противоопухолевой терапии на основе уникального молекулярного следа MSI.
[0006] Таким образом, уже признано, что идентификация статуса MSI в опухолях может оказывать огромное влияние на исход лечения и, как следствие, также на качество жизни и среднюю продолжительность жизни многих пациентов с раком. Это лучше всего демонстрируется тем фактом, что во множестве официальных руководств уже настоятельно рекомендуется тестирование в отношении MSI при раке толстой кишки и синдроме Линча. Такие руководства включают, например, руководства NCCN по раку толстой кишки, клинические практические руководства ESMO по колоректальному раку с отягощенным семейным анамнезом, пересмотренные руководства Bethesda, клинические критерии Amsterdam II, общую целевую группу США по колоректальному раку и т. д.
[0007] В настоящее время для тестирования MSI наиболее часто используются две методики: иммуногистохимический анализ (IHC) и капиллярный электрофорез. IHC представляет собой дорогостоящую, трудоемкую и времязатратную методику с высоким показателем ложноотрицательньных результатов. При капиллярном электрофорезе флуоресцентную ПЦР используют для амплификации специфических геномных участков, содержащих нуклеотидные повторы, в опухолевых клетках и нормальных клетках, а затем определяют присутствие нестабильности путем сравнения длины продуктов амплификации. Во всем геноме существует сотни тысяч микросателлитных локусов, которые потенциально можно использовать в анализе MSI (Ellegren, Nat Rev Genet. 2004).
[0008] Например, консенсусная панель MSI, разработанная в 1997, и известная как панель Bethesda включает 5 микросателлитных маркеров, включающих 2 моно- или гомонуклеотидных повтора длиной в 25 и 26 нуклеотидов (BAT25 и BAT26 соответственно) и 3 двухнуклеотидных повтора (D2S123, D5S346, D17S250) (Boland et al, 1998). Образец, тестируемый с помощью панели Bethesda, определяют как имеющий высокую частоту MSI или фенотип «MSI-H» в том случае, если 30% или больше маркеров (т. е. по меньшей мере 2 в 5-маркерной панели) определили как нестабильные. Если один маркер из пяти (или <30% опухолевых маркеров) оценивают как MSI-положительный, то образец обозначают как имеющий низкую частоту MSI или «MSI-L». И наконец, если не обнаруживают измененных маркеров, то образец считается MSI-стабильным или «MSS» (Boland et al, 1998).
[0009] Однако, несмотря на то что панель Bethesda является существующим стандартом тестирования MSI, она имеет ряд недостатков, таких как неравномерная распространенность локусов в разных этнических популяциях и разных типах опухолей. В частности, она проявляет низкую чувствительность, особенно в отношении видов рака, отличных от колоректального рака, для которого ее исходно разработали (Boland et al, 1998). Эти и другие факторы привели к ее расширению и/или диверсификации отдельными врачами и исследовательскими лабораториями за счет дополнительных маркеров, что впоследствии привело к потере стандартизации и плохой воспроизводимости. Примеры вышесказанного включают, например, Murphy et al, 2006 и WO2006047412 (Promega). В качестве альтернативы абсолютно новые микросателлитные маркеры, которые не перекрываются с любым из панели Bethesda, были также описаны, например в WO2013153130 (VIB) и Zhao et al, 2014 (eLife).
[0010] Другим недостатком известных в настоящее время подходов является их уровень сложности, необходимость в специализированных приборах, термоциклерах, выходящих за рамки стандартных лабораторных, а также их ограниченные технические возможности в плане автоматизации. Тестирование с помощью классической панели Bethesda, собственно, представляет собой тест в открытой пробирке, что повышает вероятность перекрестного контаминирования. Кроме того, тестирование требует квалифицированного лабораторного персонала и является времязатратным, дорогостоящим и трудоемким. Как правило, в существующих в настоящее время методиках выявления MSI используется один из следующих принципов: (i) применение флуоресцентно-меченых праймеров для выявления маркеров панели Bethesda с последующим капиллярным электрофорезом; (ii) анализ кривой плавления высокого разрешения 5 маркеров из панели Bethesda с использованием dsDNA-интеркалирующего красителя; (iii) масс-спектрометрическое выявление аллелей различной длины и (iv) секвенирование нового поколения (NGS) крупных участков ДНК (например, экзома) с последующим подсчетом количества мутаций или количества гомополимерных участков в настройке с несовпадением (Campbell et al., 2017, Cell).
[0011] Например, в (i) исходной стратегии скрининга Bethesda на основе ПЦР требуется интерпретация экспертом, что препятствует эффективной и простой автоматизации. Далее, что касается (ii), то анализ кривой плавления высокого разрешения с использованием dsDNA-интеркалирующих красителей имеет недостаток, заключающийся в весьма ограниченных возможностях мультиплексирования для скрининга нескольких разных маркеров MSI в одном цикле, поскольку температура плавления для каждого ампликона соответствующего маркера должна в достаточной степени отличаться, чтобы не получать перекрывающиеся сигналы. Более того, поскольку данная стратегия основана на образовании гетеродуплексов между аллелями с нормальной и мутантной длиной, она также является менее чувствительной в сравнении с другими альтернативами. Далее, что касается (iii), то способ на основе масс-спектрометрии (Zhao et al, 2014), по сути, также поддается автоматизации, но требует специализированного приборного оснащения и высококвалифицированного персонала для интерпретации данных. И в заключение, что касается (iv), то хотя NGS, несомненно, обладает преимуществом в анализе очень большого количества положений, указывающих на MSI, в геноме или экзоме, а не только в селективных маркерах и хотя данный способ, в принципе, также поддается по меньшей мере частичной автоматизации, в настоящее время он является дорогостоящим и требует специализированного оборудования для NGS. Что касается балльной оценки гомополимеров, то NGS все еще недостаточно надежен для многократной оценки отдельных гомополимерных повторов, поскольку он по-прежнему склонен к потере информации об однонуклеотидных вставках/делециях в нити повторяющихся нуклеотидов. Кроме того, в связи с получением большого количества данных он остается времязатратным, сложным и требует высококвалифицированного специалиста-аналитика.
[0012] И в заключение, тестирование MSI является высоко востребованным в медицине, потребность в котором в настоящее время лишь частично удовлетворена существующими диагностическими способами из-за их технических ограничений. К ним, в частности, относятся ограниченные возможности выявления, высокая стоимость и/или время выполнения, потребность в специализированном оборудовании и/или интерпретация результатов высококвалифицированным экспертом. В настоящем изобретении преодолены вышеперечисленные недостатки путем обеспечения высокочувствительного набора лишь из нескольких коротких гомополимерных маркеров MSI такого типа, который описан в WO2013153130, вместе с исключительно надежным способом выявления гомонуклеотидных вставок или делеций (вставок/делеций) в их последовательностях. Данный способ является весьма удобным для автоматизации, не требует специфических молекулярных инфраструктур и может проводиться с использованием стандартного лабораторного оборудования, такого как обычный термоциклер, подключенный к компьютеру. Кроме того, он обеспечивает легкое дуплексирование или даже мультиплексирование более высокого уровня выбранных маркеров, что предоставляет преимущество в еще большем ограничении требуемого лабораторного материала, и, таким образом, упрощает внедрение в существующие платформы на основе ПЦР. Важно отметить, что данный способ обеспечивает получение весьма надежных результатов и позволяет проводить легкую и полностью автоматизированную интерпретацию с получением прямого отчета в качестве выходных данных. Авторы настоящего изобретения демонстрируют, что в настоящих условиях после получения образца ткани такие полные показатели статусов вставок/делеций могут быть получены менее чем за 3 часа. Таким образом, представленная в данном документе новая панель маркеров и способ их выявления предоставляют новую весьма выгодную альтернативу для выявления MSI в CRC даже на его ранних стадиях (как будет показано ниже) и в других образцах раковых тканей, таких как рак яичника, рак эндометрия и рак желудка, а также для прогностических и долговременных исследований в контексте иммунотерапии. Эти и другие преимущества и варианты применения настоящего изобретения представлены ниже.
Краткое описание изобретения
[0013] Настоящее изобретение определено в независимых пунктах прилагаемой формулы изобретения. Предпочтительные варианты осуществления определены в зависимых пунктах формулы изобретения. В частности, настоящее изобретение относится к панели биомаркеров для анализа локусов MSI в биологическом образце, при этом панель содержит следующие участки гомополимерных повторов, которые картированы на референтный геном человека GRCh38/hg38:
гомополимерный повтор, содержащий 11 последовательных аденинов, локализованный в гене DIDO1 человека и начинающийся с положения chr20:62905340;
гомополимерный повтор, содержащий 11 последовательных аденинов, локализованный в гене MRE11 человека и начинающийся с положения chr11:94479765;
гомополимерный повтор, содержащий 10 последовательных аденинов, локализованный в гене SULF2 человека и начинающийся с положения chr20:47657577; и
гомополимерный повтор, содержащий 8 последовательных аденинов, локализованный в гене ACVR2A человека и начинающийся с положения chr2:147926117.
[0014] Также важно, что настоящее изобретение относится к способу анализа локусов MSI в биологическом образце, предусматривающему стадию:
- определения количества нуклеотидов в следующих гомополимерных повторах, которые картированы на референтный геном человека GRCh38/hg38:
гомополимерном повторе, содержащем 11 последовательных аденинов, локализованном в гене DIDO1 человека и начинающемся с положения chr20:62905340;
гомополимерном повторе, содержащем 11 последовательных аденинов, локализованном в гене MRE11 человека и начинающемся с положения chr11:94479765;
гомополимерном повторе, содержащем 10 последовательных аденинов, локализованном в гене SULF2 человека и начинающемся с положения chr20:47657577; и
гомополимерном повторе, содержащем 8 последовательных аденинов, локализованном в гене ACVR2A человека и начинающемся с положения chr2:147926117.
[0015] В рамках вышеизложенного настоящее изобретение также относится к набору для анализа локусов MSI в биологическом образце, при этом набор содержит средства для амплифицирования участков нуклеиновой кислоты, содержащих по меньшей мере указанные выше гомополимерные повторы.
[0016] И наконец, в то же время важно, что настоящее изобретение также касается клетки или любого другого материала, в частности генетического материала, полученного из клеточной линии HTC116 cl.110268743, которая предусматривает одну гомонуклеотидную делецию в каждом из указанных выше гомополимерных повторов и в нескольких других преимущественных гомополимерных повторах. Клеточную линию HTC116 cl.110268743 успешно депонировали в соответствии с Будапештским договором в депозитарии BCCM/GeneCorner в Бельгии под номером доступа LMBP 12278CB.
Краткое описание графических материалов
[0017] Для более полного понимания сущности настоящего изобретения ссылаются на следующее подробное описание, рассматриваемое в сочетании с прилагаемыми графическими материалами, на которых:
на фигуре 1 показан статус MSI по 7 микросателлитным маркерам (BTBD7, RYR3, SEC31A, ACVR2A, DIDO1, MRE11 и SULF2) в 128 образцах колоректального рака с MSI-H. Разные панели демонстрируют статус MSI (белый, MSS; темно-серый, MSI-H), когда образцы оценивают в отношении минимального набора из A) 4 маркеров, и B), C) и D) - последовательно добавляя маркер к минимальному набору из 4 маркеров. Статус маркера для отдельных образцов указан как дикий тип (светло-серый) или мутантный (серый);
на фигуре 2 показан статус MSI по 7 микросателлитным маркерам (BTBD7, RYR3, SEC31A, ACVR2A, DIDO1, MRE11 и SULF2) в 15 образцах рака желудка с MSI-H и 19 образцах рака эндометрия. Разные панели демонстрируют статус MSI (белый, MSS; темно-серый, MSI-H), когда образцы оценивают в отношении минимального набора из A) 4 маркеров, и B), C) и D) - последовательно добавляя маркер к минимальному набору из 4 маркеров. Статус маркера для отдельных образцов указан как дикий тип (светло-серый), или мутантный (серый), или без результата (диагональная линия).
Фигура 3: мутационная нагрузка (измеренная по количеству замен (левая панель), количеству вставок/делеций (средняя панель) или по всем мутациям (правая панель)) в 33 с MSI-H относительно 89 образцов с MSS.
Фигура 4: мутационная нагрузка (измеренная по количеству соматических событий (замен и вставок/делеций) в MSI-H по сравнению с образцами с MSS в зависимости от типа рака. EM - эндометриальный, CRC - колоректальный.
Фигура 5A: диаграмма корреляции между количеством мутантных микросателлитных маркеров от 1 до 6 (BTBD7, RYR3, SEC31A, ACVR2A, DIDO1 и MRE11) и мутационной нагрузкой в образцах с MSI, измеренной по (A) количеству соматических замен (при этом корректирование с помощью количества вставок/делеций, количества замен и количества мутантных маркеров коррелируют с p-значением = 1,92e-07) или по (B) количеству соматических вставок/делеций (при этом корректирование с помощью замен, количества вставок/делеций и количества мутантных маркеров коррелируют с p-значением = 7,1e-07), (C) корреляция между соматическими заменами и вставками/делециями в опухоли c MSI, показывающая высокую корреляцию между соматическими заменами и вставками/делециями в образцах с MSI-H. Корреляция является последовательной для обоих типов опухолей EM c MSI и опухолей CRC c MSI, но не для опухолей с MSS.
Фигура 5B: диаграммы корреляции между количеством мутантных микросателлитных маркеров и мутационной нагрузкой, как показано на фиг. 5A выше, но дополненные данными по еще одному маркеру (SULF2). В (A) показана корреляция с количеством соматических замен, при этом добавление еще одного маркера изменило p-значение до 6,5e-05). В (B) показана корреляция с количеством соматических вставок/делеций, при этом добавление еще одного маркера изменило p-значение до 2e-16. В (C) показана корреляция между соматическими заменами и вставками/делециями, при этом можно видеть, что добавление еще одного маркера дополнительно улучшает значимость корреляции в образцах с MSI-H.
Фигура 6: количество положительных маркеров в качестве прогностического фактора для мутационной нагрузки опухоли (TMB). В среднем наблюдали более 348 замен и более 119 вставок/делеций с увеличением на один положительный маркер (данные показаны для 7 маркеров, как это представлено на фигуре 5B).
Фигура 7: обзор стадирования опухоли CRC, связанного с подходящими, неподходящими, ошибочными и несовпадающими результатами при способе тестирования MSI в соответствии с настоящим изобретением, реализованного в платформе Biocartis Idylla, по сравнению с IHC-анализом.
Подробное описание изобретения
[0018] Настоящее изобретение в целом относится к новой панели биомаркеров MSI, способам использования данной панели, автоматизированным системам и наборам для проведения указанных способов, при этом наборы могут предпочтительно содержать или могут быть представлены в виде картриджа, совместимого с указанными автоматизированными системами, и содержать средства, а также предпочтительно положительный контрольный материал для выявления вставок/делеций в указанной панели.
[0019] В предпочтительном варианте осуществления по настоящему изобретению представлена панель биомаркеров для анализа локусов MSI в биологическом образце, при этом панель содержит по меньшей мере следующие участки гомополимерных повторов или их мутантных форм (причем мутация представляет собой присутствие по меньшей мере одной вставки/делеции в последовательности гомополимерного повтора), которые картированы на референтный геном человека GRCh38/hg38:
гомополимерный повтор, содержащий 11 последовательных аденинов, локализованный в гене DIDO1 человека и начинающийся с положения chr20:62905340;
гомополимерный повтор, содержащий 11 последовательных аденинов, локализованный в гене MRE11 человека и начинающийся с положения chr11:94479765;
гомополимерный повтор, содержащий 10 последовательных аденинов, локализованный в гене SULF2 человека и начинающийся с положения chr20:47657577; и
гомополимерный повтор, содержащий 8 последовательных аденинов, локализованный в гене ACVR2A человека и начинающийся с положения chr2:147926117.
[0020] Авторы настоящего изобретения осуществили проверку множества выбранных произвольным образом маркеров типа, раскрытого в WO2013153130 (VIB), которые являются гомополимерами, существенно более короткими, чем маркеры в панели Bethesda. Произвольный отбор меньшего количества маркеров из раскрытого в том документе предпочтительного набора из 56 маркеров не привел к получению надежного анализа, способного к многократному выявлению фенотипа MSI-H в широком диапазоне образцов рака человека с помощью минимального количества и наиболее основных лабораторных ресурсов. Маркеры либо не поддавались выявлению в мультиплексной или даже в дуплексной реакции, либо имело место варьирование по количеству нуклеотидов среди разных этнических групп людей. Случайный выбор экзонного гомополимерного повтора, содержащего 8 последовательных аденинов, локализованного в гене ACVR2A человека и начинающегося с положения chr2:147926117, который не раскрыт в предпочтительном наборе из 56 в WO2013153130, и экзонного гомополимерного повтора, содержащего 11 последовательных аденинов, локализованного в гене MRE11 человека и начинающегося с положения chr11:94479765, который вообще не раскрыт в WO2013153130, неожиданно привел к получению высокоэффективной панели для выявления MSI в опухолях человека с дефицитом MMR.
[0021] Выявили, что эффективность минимальной панели из всего лишь 4 маркеров, представленной в данном документе, превышает минимально приемлемую эффективность, заданную на уровне 95%, для корректной идентификации образцов колоректального рака человека с подтвержденной MSI-H. В разделе «Примеры» ниже авторы настоящего изобретения демонстрируют, что вышеприведенная минимальная панель по настоящему изобретению способна успешно выявлять 123 положительных образца с MSI-H в пуле из 128 образцов CRC с MSI-H, что составляет 96% образцов, корректно идентифицированных как MSI-H. Таким образом, в предпочтительном варианте осуществления представлена панель, характеризующаяся показателем корректной идентификации, составляющим по меньшей мере 90%, предпочтительно по меньшей мере 95% образцов опухолей с MSI-H.
[0022] Логично, что при добавлении дополнительных маркеров можно постепенно повысить эту эффективность. Таким образом, в предпочтительном варианте осуществления настоящего изобретения представлена панель в соответствии с предыдущим вариантом осуществления, дополнительно содержащая любой один, два или все из следующих трех участков гомополимерных повторов или их мутантных форм, которые картированы на референтный геном человека GRCh38/hg38:
гомополимерного повтора, содержащего 10 последовательных аденинов, локализованного в гене BTBD7 человека и начинающегося с положения chr14:93241685;
гомополимерного повтора, содержащего 9 последовательных тиминов, локализованного в гене SEC31A человека и начинающегося с положения chr4:82864412;
гомополимерного повтора, содержащего 10 последовательных аденинов, локализованного в гене RYR3 человека и начинающегося с положения chr15:33865341.
[0023] Представленные в данном документе маркеры гомополимерных повторов, которые составляют панель биомаркеров по настоящему изобретению, представляют собой лишь короткие нити из не более 11 повторяющихся гомонуклеотидов, например, 11 последовательных аденинов в 3'UTR DIDO1. Любому специалисту в данной области техники будет понятно, что комплементарные им последовательности, например, 11 последовательных тиминов, комплементарных 11 последовательным аденинам в последовательности 3'UTR DIDO1, также должны истолковываться как подпадающие в объем используемых в данном документе упомянутых выше терминов.
[0024] В особенно предпочтительном варианте осуществления представлена панель, содержащая пять следующих участков гомополимерных повторов или их мутантных форм, которые картированы на референтный геном человека GRCh38/hg38:
гомополимерный повтор, содержащий 11 последовательных аденинов, локализованный в гене DIDO1 человека и начинающийся с положения chr20:62905340;
гомополимерный повтор, содержащий 11 последовательных аденинов, локализованный в гене MRE11 человека и начинающийся с положения chr11:94479765;
гомополимерный повтор, содержащий 10 последовательных аденинов, локализованный в гене SULF2 человека и начинающийся с положения chr20:47657577;
гомополимерный повтор, содержащий 8 последовательных аденинов, локализованный в гене ACVR2A человека и начинающийся с положения chr2:147926117; и
гомополимерный повтор, содержащий 10 последовательных аденинов, локализованный в гене BTBD7 человека и начинающийся с положения chr14:93241685.
Используя данный основной набор из пяти маркеров, 124 из 128, т. е. 97% образцов опухолей могут быть идентифицированы как MSI-H.
[0025] В другом предпочтительном варианте осуществления представлена панель, содержащая шесть следующих участков гомополимерных повторов или их мутантных форм, которые картированы на референтный геном человека GRCh38/hg38:
гомополимерный повтор, содержащий 11 последовательных аденинов, локализованный в гене DIDO1 человека и начинающийся с положения chr20:62905340;
гомополимерный повтор, содержащий 11 последовательных аденинов, локализованный в гене MRE11 человека и начинающийся с положения chr11:94479765;
гомополимерный повтор, содержащий 10 последовательных аденинов, локализованный в гене SULF2 человека и начинающийся с положения chr20:47657577;
гомополимерный повтор, содержащий 8 последовательных аденинов, локализованный в гене ACVR2A человека и начинающийся с положения chr2:147926117;
гомополимерный повтор, содержащий 10 последовательных аденинов, локализованный в гене BTBD7 человека и начинающийся с положения chr14:93241685; и
гомополимерный повтор, содержащий 9 последовательных тиминов, локализованный в гене SEC31A человека и начинающийся с положения chr4:82864412.
За счет дальнейшего добавления дополнительного маркера, локализованного в гене SEC31A, к основному набору маркеров все 128 образцов могут быть оценены как MSI-H, что делает панель еще более эффективной в определении статуса MSI.
[0026] В еще одном предпочтительном варианте осуществления представлена панель, содержащая семь следующих участков гомополимерных повторов или их мутантных форм, которые картированы на референтный геном человека GRCh38/hg38:
гомополимерный повтор, содержащий 11 последовательных аденинов, локализованный в гене DIDO1 человека и начинающийся с положения chr20:62905340;
гомополимерный повтор, содержащий 11 последовательных аденинов, локализованный в гене MRE11 человека и начинающийся с положения chr11:94479765;
гомополимерный повтор, содержащий 10 последовательных аденинов, локализованный в гене SULF2 человека и начинающийся с положения chr20:47657577;
гомополимерный повтор, содержащий 8 последовательных аденинов, локализованный в гене ACVR2A человека и начинающийся с положения chr2:147926117;
гомополимерный повтор, содержащий 10 последовательных аденинов, локализованный в гене BTBD7 человека и начинающийся с положения chr14:93241685;
гомополимерный повтор, содержащий 9 последовательных тиминов, локализованный в гене SEC31A человека и начинающийся с положения chr4:82864412; и
гомополимерный повтор, содержащий 10 последовательных аденинов, локализованный в гене RYR3 человека и начинающийся с положения chr15:33865341.
Набор из вышеуказанных семи маркеров рассчитан для уменьшения показателя потенциальной вероятности ложноотрицательньных результатов до ~ 1/1900. Таким образом, добавление еще одного маркера, совместимого с панелями из предыдущих вариантов осуществления, предоставляет дополнительную гарантию эффективности, в частности в реализации панели в выявлении MSI в разных видах рака, отличных от колоректального, например, в раке яичника, раке эндометрия и раке желудка.
[0027] В предпочтительном варианте осуществления биологический образец получен от индивидуума с подозрением на опухоль. В другом варианте осуществления биологический образец представляет собой образец опухоли, предположительно свежую ткань или фиксированный образец опухоли, например, замороженный образец или образец FFPE. В особенно предпочтительном варианте опухоль выбрана из колоректальной опухоли, опухоли яичника, опухоли эндометрия или опухоли желудка. В другом возможном варианте осуществления образец представляет собой жидкий биоптат. В другом возможном варианте осуществления образец представляет собой любой образец ткани, как, например, мононуклеарные клетки периферической крови (PBMC) или другие лейкоциты или ткань кожи пациента, предположительно страдающего синдромом Линча.
[0028] Дополнительной целью настоящего изобретения является обеспечение способа анализа локусов MSI в биологическом образце, при этом способ предусматривает стадию определения количества нуклеотидов в панели биомаркеров согласно описанным выше вариантам осуществления.
[0029] Следовательно, в одном варианте осуществления по настоящему изобретению представлен способ анализа локусов MSI в биологическом образце, предусматривающий стадию:
- определения количества нуклеотидов в следующих гомополимерных повторах, которые картированы на референтный геном человека GRCh38/hg38:
гомополимерном повторе, содержащем 11 последовательных аденинов, локализованном в гене DIDO1 человека и начинающемся с положения chr20:62905340;
гомополимерном повторе, содержащем 11 последовательных аденинов, локализованном в гене MRE11 человека и начинающемся с положения chr11:94479765;
гомополимерном повторе, содержащем 10 последовательных аденинов, локализованном в гене SULF2 человека и начинающемся с положения chr20:47657577; и
гомополимерном повторе, содержащем 8 последовательных аденинов, локализованном в гене ACVR2A человека и начинающемся с положения chr2:147926117.
[0030] По тем же описанным выше причинам в предпочтительном варианте осуществления способ по настоящему изобретению также дополнительно предусматривает определение количества нуклеотидов в любом одном, двух или всех из следующих участков гомополимерных повторов, которые картированы на референтный геном человека GRCh38/hg38:
гомополимерного повтора, содержащего 10 последовательных аденинов, локализованного в гене BTBD7 человека и начинающегося с положения chr14:93241685;
гомополимерного повтора, содержащего 9 последовательных тиминов, локализованного в гене SEC31A человека и начинающегося с положения chr4:82864412;
гомополимерного повтора, содержащего 10 последовательных аденинов, локализованного в гене RYR3 человека и начинающегося с положения chr15:33865341.
[0031] В конкретном варианте осуществления представлен способ, предусматривающий стадию:
- определения количества нуклеотидов в пяти следующих гомополимерных повторах, которые картированы на референтный геном человека GRCh38/hg38:
гомополимерном повторе, содержащем 11 последовательных аденинов, локализованном в гене DIDO1 человека и начинающемся с положения chr20:62905340;
гомополимерном повторе, содержащем 11 последовательных аденинов, локализованном в гене MRE11 человека и начинающемся с положения chr11:94479765;
гомополимерном повторе, содержащем 10 последовательных аденинов, локализованном в гене SULF2 человека и начинающемся с положения chr20:47657577; гомополимерном повторе, содержащем 8 последовательных аденинов, локализованном в гене ACVR2A человека и начинающемся с положения chr2:147926117; и
гомополимерном повторе, содержащем 10 последовательных аденинов, локализованном в гене BTBD7 человека и начинающемся с положения chr14:93241685.
[0032] В более конкретном варианте осуществления представлен способ, предусматривающий стадию:
- определения количества нуклеотидов в шести следующих гомополимерных повторах, которые картированы на референтный геном человека GRCh38/hg38:
гомополимерном повторе, содержащем 11 последовательных аденинов, локализованном в гене DIDO1 человека и начинающемся в положении chr20:62905340;
гомополимерном повторе, содержащем 11 последовательных аденинов, локализованном в гене MRE11 человека и начинающемся в положении chr11:94479765;
гомополимерном повторе, содержащем 10 последовательных аденинов, локализованном в гене SULF2 человека и начинающемся в положении chr20:47657577;
гомополимерном повторе, содержащем 8 последовательных аденинов, локализованном в гене ACVR2A человека и начинающемся в положении chr2:147926117;
гомополимерном повторе, содержащем 10 последовательных аденинов, локализованном в гене BTBD7 человека и начинающемся в положении chr14:93241685; и
гомополимерном повторе, содержащем 9 последовательных тиминов, локализованном в гене SEC31A человека и начинающемся в положении chr4:82864412.
[0033] В другом конкретном варианте осуществления представлен способ, предусматривающий стадию:
- определения количества нуклеотидов в семи следующих гомополимерных повторах, которые картированы на референтный геном человека GRCh38/hg38:
гомополимерном повторе, содержащем 11 последовательных аденинов, локализованном в гене DIDO1 человека и начинающемся в положении chr20:62905340;
гомополимерном повторе, содержащем 11 последовательных аденинов, локализованном в гене MRE11 человека и начинающемся в положении chr11:94479765;
гомополимерном повторе, содержащем 10 последовательных аденинов, локализованном в гене SULF2 человека и начинающемся в положении chr20:47657577;
гомополимерном повторе, содержащем 8 последовательных аденинов, локализованном в гене ACVR2A человека и начинающемся в положении chr2:147926117;
гомополимерном повторе, содержащем 10 последовательных аденинов, локализованном в гене BTBD7 человека и начинающемся в положении chr14:93241685;
гомополимерном повторе, содержащем 9 последовательных тиминов, локализованном в гене SEC31A человека и начинающемся в положении chr4:82864412; и
гомополимерном повторе, содержащем 10 последовательных аденинов, локализованном в гене RYR3 человека и начинающемся в положении chr15:33865341.
[0034] В возможных вариантах осуществления способ по настоящему изобретению может дополнительно предусматривать стадию диагностирования статуса MSI у биологического образца, если вставка/делеция выявлена в по меньшей мере двух гомополимерных повторах.
[0035] Предпочтительно представлены способы по настоящему изобретению, где биологический образец, полученный от субъекта, представляет собой опухоль или образец предполагаемой опухоли. В принципе, раскрытые в данном документе способы могут проводиться с применением любого подтвержденного образца или образца предполагаемой опухоли. В предпочтительном варианте осуществления опухоль представляет собой колоректальную опухоль, опухоль желудка, опухоль яичника или опухоль эндометрия.
[0036] Специалистам в данной области техники будет понятно, что свойства панели маркеров гомополимерного повтора по настоящему изобретению определяют, что способы по настоящему изобретению будут предпочтительно осуществляться с применением геномной ДНК, присутствующей в биологических образцах. В зависимости от типа образца в предпочтительном варианте осуществления способу по настоящему изобретению предшествовали какие-либо из следующих стадий:
- экстрагирования и/или выделения нуклеиновой кислоты, потенциально содержащей целевую последовательность, из источника нуклеиновой кислоты;
- обеспечения указанной экстрагированной и/или очищенной нуклеиновой кислоты, потенциально содержащей мишень, для стадии амплификации указанной нуклеиновой кислоты.
[0037] Поскольку геномная ДНК представляет собой богатый и сложный материал на основе нуклеиновой кислоты, преимущественно, чтобы последовательности, фланкирующие участки гомополимерных повторов, определенные выше, амплифицировались до стадии определения в них количества нуклеотидов. Таким образом, в предпочтительном варианте осуществления представлен способ, дополнительно предусматривающий стадию:
- амплифицирования участков нуклеиновой кислоты, содержащих гомополимерные повторы, перечисленные выше. Любому специалисту в данной области техники будет очевидно, что такое амплифицирование будет давать продукты амплификации, содержащие последовательность гомополимерного повтора независимо от ее статуса по MSI. То есть такие продукты амплификации могут содержать вариант дикого типа (WT) указанного гомополимерного повтора или его MSI-вариант, т. е. мутант, содержащий вставку/делецию по меньшей мере одного гомонуклеотида в последовательности гомополимерного повтора.
[0038] Естественно, что в очевидном варианте осуществления амплификацию предпочтительно выполняют посредством полимеразной цепной реакции (ПЦР), например, с использованием средств для выполнения ПЦР, таких как подходящие реагенты и/или устройство, представляющее собой термоциклер. Однако также могут использоваться другие методики амплификации, известные в данной области техники. Они включают без ограничения изотермическую амплификацию с образованием петель (LAMP), амплификацию, основанную на последовательности нуклеиновых кислот (NASBA), амплификацию с замещением цепей (SDA), амплификацию с множественным замещением цепей (MDA), амплификацию по типу катящегося кольца (RCA), лигазную цепную реакцию (LCR), хеликазно-зависимую амплификацию (HDA) или амплификацию по методу рамификации (RAM).
[0039] В предпочтительном варианте осуществления представлен способ, где стадия амплифицирования предусматривает применение по меньшей мере одного праймера, имеющего последовательность, идентифицированную с помощью любого из следующих SEQ ID NO:1-14:
для маркера DIDO1:
SEQ ID NO: 1 - TAGCGTGTGAATCGGACAT
SEQ ID NO: 2 - TTGACTGGGCAGATAGGGGA
Для маркера MRE11:
SEQ ID NO: 3 - ATAGTTCACCCATGGAAACC
SEQ ID NO: 4 - GGAGGAGAATCTTAGGGAAA
Для маркера BTBD7:
SEQ ID NO: 5 - ACTGGACTCCCGCTGG
SEQ ID NO: 6 - CGCTCAGCCTCCATAAATC
Для маркера SULF2:
SEQ ID NO: 7 - CAACTTCATTTCTTTTCAGTACCTT
SEQ ID NO: 8 - CTGTCCAGATACCATTTCTC
Для маркера ACVR2A:
SEQ ID NO: 9 - AGCATCCATCTCTTGAAGACAT
SEQ ID NO: 10 - GCATGTTTCTGCCAATAATCTCT
Для маркера SEC31A:
SEQ ID NO: 11 - CAACTTCAGCAGGCTGT
SEQ ID NO: 12 - AGTCTGAGAAGCATCAATTTT
Для маркера RYR3:
SEQ ID NO: 13 - CATTTTCTAAATGCCTCCCTTAAA
SEQ ID NO: 14 - GTCCATTAGGCACAAAAAG
[0040] В более конкретном варианте осуществления стадия амплифицирования предусматривает применение по меньшей мере одной пары праймеров, выбранной из следующих: SEQ ID NO: 1 и SEQ ID NO: 2; SEQ ID NO: 3 и SEQ ID NO: 4; SEQ ID NO: 5 и SEQ ID NO: 6; SEQ ID NO: 7 и SEQ ID NO: 8; SEQ ID NO: 9 и SEQ ID NO: 10; SEQ ID NO: 11 и SEQ ID NO: 12 или SEQ ID NO: 13 и SEQ ID NO: 14.
[0041] Любому специалисту в данной области техники будет понятно, что в зависимости от условий амплификации, вышеперечисленные последовательности праймера будут, вероятно, работать также в том случае, если 1, 2 или в некоторых случаях даже, возможно, 3 нуклеотида в них изменены, т. е. добавлены, удалены или замещены другим нуклеотидом или модифицированным нуклеотидом. Таким образом, в возможном варианте осуществления настоящего изобретения также представлена по меньшей мере одна последовательность праймера, с помощью любого из вышеуказанных SEQ ID NO: 1-14, где 1, 2 или 3 нуклеотида подвергнуты изменению. В альтернативном варианте осуществления настоящего изобретения также представлена по меньшей мере одна последовательность праймера, которая на по меньшей мере 80%, предпочтительно на по меньшей мере 85%, более предпочтительно на по меньшей мере 90% или наиболее предпочтительно на по меньшей мере 95% идентична любой из вышеуказанных последовательностей под SEQ ID NO: 1-14. Специалистам в данной области техники будет понятно, что с целью получения ампликонов, охватывающих представляющие интерес участки гомополимерных повторов, можно сконструировать альтернативные праймеры из 5, 10, 20, 50 или 100 нуклеотидов, охватывающие участки выше или ниже относительно положений вышеописанных пар праймеров. Таким образом, такие пары альтернативных праймеров следует также рассматривать в качестве альтернативного очевидного варианта осуществления по настоящему изобретению.
[0042] Преимущество представленного в данном документе способа заключается в том, что он полностью поддается автоматизации и адаптации к любому стандартному термоциклеру для количественной ПЦР, что позволяет выполнять его обычным лабораторным персоналом без необходимости специального обучения. В дополнение к вышесказанному способ является высокочувствительным, подходящим для мультиплексирования, может обеспечивать оценку относительных количеств выявляемых последовательностей гомополимерных нуклеотидных повторов и их вариантов. Следовательно, в возможном варианте осуществления ПЦР может быть количественной или полуколичественной ПЦР
[0043] Поскольку способы по настоящему изобретению касаются выявления изменений в количестве гомонуклеотидов в нити очень коротких (т. е. < 12 нт.) последовательностей гомонуклеотидных повторов, предпочтительно, чтобы они были высокоспецифичными. Например, в ходе амплификации участков гомополимерных повторов, происходит проскальзывание полимеразы. Это приводит к ошибкам в копировании исходного количества повторяющихся нуклеотидов, что обуславливает накопление искусственных делеций или вставок в амплифицированном ПЦР-продукте. Следовательно, в предпочтительном варианте осуществления стадию амплифицирования проводят с применением корректирующей полимеразы, т. е. полимеразы, обладающей 3'-5'-экзонуклеазной активностью. Многие такие полимеразы, предназначенные для ПЦР, известны и доступны для коммерческой реализации. Примеры включают без ограничения такие полимеразы, как Q5, Pfx, Pfu, Ex Taq и т. д.
[0044] В более предпочтительных вариантах осуществления анализ кривой плавления продуктов амплификации нуклеиновой кислоты используют на стадии определения количества нуклеотидов. Следовательно, в особенно преимущественном варианте осуществления способов по настоящему изобретению стадия амплифицирования обеспечивает данные кривой плавления.
[0045] Плавление или анализ кривой плавления представляет собой оценку характеристик диссоциации или ассоциации молекулы двухнитевой нуклеиновой кислоты в ходе изменений температуры. Следовательно, данные кривой плавления необходимо понимать как любые данные, представляющие собой либо характеристики диссоциации, либо характеристики ассоциации молекулы нуклеиновой кислоты, полученные в ходе исследования, например, целевого продукта амплификации нуклеиновой кислоты. Данные кривой плавления можно получить посредством встраивания подходящих флюоресцентных фрагментов в исследуемые образцы, которые обрабатывают с помощью любого прибора или способа проведения амплификации, например посредством термоциклирования, ПЦР, количественной ПЦР и т. д. Эти данные можно получить с помощью любого аппарата, который оснащен средствами доведения температуры образца до температуры, превышающей температуру плавления образца ДНК, и который оснащен известными флюорометрическими или спектрофотометрическими средствами. Примеры таких приборов включают без ограничения стандартные оптические термоциклеры, обычно используемые для qPCR, или флуорометры с контролем температуры и т. д.
[0046] Анализ кривой плавления и анализ плавления высокого разрешения (HRM) представляют собой способы, обычно используемые для выявления и анализа присутствия последовательностей нуклеиновой кислоты в образце. Один способ контроля характеристик диссоциации и ассоциации нуклеиновой кислоты проводят с помощью красителей. Химические реакции для выявления, используемые для qPCR и анализа кривой плавления, основаны на (a) химических реакциях, которые обычно выявляют флуоресценцию красителя, связывающегося с мишенью, например, флуорофора, связывающего ДНК, такого как LC Green, LC Green+, Eva Green, SYTO9 CYBR Green, или на (b) целевых химических реакциях, в которые обычно используются ДНК-зонды, меченные флуорофором, как, например, зонды типа «маяк», и/или праймеры, как, например, праймеры типа «скорпион». В данной области техники хорошо известно, что другие химические реакции для выявления можно использовать в анализе кривой плавления.
[0047] В одном варианте осуществления по настоящему изобретению продукты амплификации нагревают в присутствии одного или более интеркалирующих красителей в ходе процедуры исследования кривой плавления. Диссоциация ДНК в ходе нагревания может быть измерена посредством значительного снижения получаемой в результате флуоресценции. В другом конкретном варианте осуществления продукты амплификации нагревают в присутствии одной или более нуклеиновых кислот, меченых красителем, например одного или более зондов, в ходе процедуры исследования кривой плавления. В случае флуоресцентного анализа кривой плавления, основанного на использовании зонда, вариабельность выявления нуклеиновых кислот основана на температуре плавления, полученной в результате термической денатурации гибрида зонд-мишень. По мере продолжения нагревания образовавшихся ампликонов изменения в силе сигнала выявляют в зависимости от температуры, как правило, в пределах температурного интервала с получением исходных данных кривой плавления.
[0048] В предпочтительных вариантах осуществления способов по настоящему изобретению амплифицирование предусматривает использование зонда. В принципе, в возможных вариантах осуществления можно использовать любой мишень-специфический олигонуклеотидный зонд, подходящий для проведения анализа кривой плавления. Предпочтительные известные зонды могут включать пару, состоящую из флуорофора и гасителя, а также могут преимущественно образовывать вторичные структуры, такие как петли или шпильки.
[0049] В частности, предпочтительными являются зонды типа «молекулярный маяк» или «молекулярные маяки», которые представляют собой молекулы в форме шпильки с внутренне гашенным флуорофором, флуоресценция которых восстанавливается, когда они связываются с целевой последовательностью нуклеиновой кислоты. В связи с этим «молекулярные маяки» не разрушаются под действием полимеразы и могут использоваться в исследовании кинетики гибридизации с их мишенью посредством определения кривой плавления. Длина типичного зонда типа «молекулярный маяк» составляет приблизительно 20, предпочтительно 25 нуклеотидов или больше. Как правило, длина участка, который является комплементарным целевой последовательности и связывается с ней, составляет 18-30 пар оснований. Структура и механизм действия «молекулярных маяков» широко известны в данной области техники.
[0050] Следовательно, в особенно предпочтительном варианте осуществления представлен способ, где стадия амплифицирования предусматривает применение по меньшей мере одного зонда типа «молекулярный маяк».
[0051] В предпочтительном варианте осуществления из вышеуказанных вариантов осуществления зонд типа «молекулярный маяк» содержит последовательность, идентичную или комплементарную мутантной последовательности гомополимерных нуклеотидных повторов, характеризующуюся делецией по меньшей мере одного гомонуклеотида в целевой последовательности гомополимерных повторов. Такая структура «молекулярного маяка» обеспечивает высокочувствительное и специфическое выявление выбранного мутантного маркера MSI, оставаясь при этом достаточно чувствительным к маркеру дикого типа (т. е. предполагаемому). Следует отметить, что под термином «целевая последовательность гомополимерных нуклеотидных повторов» понимают последовательность гомополимерных повторов дикого типа или референтную последовательность гомополимерных повторов, ожидаемую в условиях отсутствия MSI. И, наоборот, под «мутантной последовательностью гомополимерных нуклеотидных повторов» понимают последовательность гомополимерных нуклеотидных повторов, характеризующуюся вставкой или делецией по меньшей мере одного гомонуклеотида в последовательности гомополимерных повторов. Затем будет измеряться разница между исходными данными плавления для дикого типа и для мутантной формы, что будет представлять собой характеристику исходных данных кривой плавления.
[0052] В конкретном варианте осуществления представлен способ, где по меньшей мере один зонд типа «молекулярный маяк» имеет последовательность, идентифицированную в любом из следующих SEQ ID NO:

[0053] В возможном варианте осуществления представлен по меньшей мере один зонд типа «молекулярный маяк», характеризующийся определенной степенью вариабельности последовательности по отношению к указанным выше последовательностям под SEQ ID NO. 15-21. Причиной такой вариабельности может быть применение другой последовательности типа «стебель» «молекулярного маяка» (выделена подчеркиванием и курсивом выше) или удаление или добавление нуклеотидов к гибридизирующей части «маяка», которая является специфичной в отношении подлежащей выявлению последовательности (указана жирным выше). Последнее может включать добавление или удаление 1 или 2 нуклеотидов в последовательностях гомополимерных повторов или включать большее или меньшее количество нуклеотидов в указанной фланкирующей последовательности повтора.
[0054] Вследствие таким образом приданной специфичности указанному зонду типа «молекулярный маяк» к одному маркеру гомополимерных повторов и его нестабильным (мутантным) вариантам, также обеспечивается возможность разработки мультиплексного анализа, при котором по меньшей мере два зонда, а предположительно и больше, типа «молекулярный маяк» используют в одной реакционной пробирке или в одном отсеке.
[0055] Таким образом, в другом предпочтительном варианте осуществления представлен способ, где стадия амплифицирования предусматривает по меньшей мере одну дуплексную амплификацию пары гомополимерных повторов, при этом указанная пара выбрана из следующих комбинаций:
- дуплексной амплификации гомополимерного повтора, содержащего 11 последовательных аденинов, локализованного в гене DIDO1 человека и начинающегося с положения chr20:62905340, вместе с гомополимерным повтором, содержащим 11 последовательных аденинов, локализованным в гене MRE11 человека и начинающимся с положения chr11:94479765;
- дуплексной амплификации гомополимерного повтора, содержащего 8 последовательных аденинов, локализованного в гене ACVR2A человека и начинающегося с положения chr2:147926117, вместе с гомополимерным повтором, содержащим 9 последовательных тиминов, локализованным в гене SEC31A человека и начинающимся с положения chr4:82864412; и
- дуплексной амплификации гомополимерного повтора, содержащего 10 последовательных аденинов, локализованного в гене BTBD7 человека и начинающегося с положения chr14:93241685, вместе с гомополимерным повтором, содержащим 10 последовательных аденинов, локализованным в гене SULF2 человека и начинающимся с положения chr20:47657577.
[0056] В особенно преимущественном варианте осуществления, который значительно улучшает надежность способов по настоящему изобретению, в частности при использовании мультиплексирования, применяют новый подход, при котором используется функция вейвлет-преобразования в отношении исходных данных кривой плавления.
[0057] Вейвлеты представляют собой математические функции, которые разделяют данные на разные частотные составляющие, а затем каждый компонент анализируют с разрешением, сопоставимым с его масштабом. Такие базисные функции представляют собой короткие волны с ограниченной продолжительностью. Базисные функции вейвлет-преобразования приводят к частоте. Существует множество различных вейвлетов, которые могут использоваться в качестве базисных функций. Базисная функция ~(t), которую также называют материнский вейвлет, представляет собой функцию преобразования. Термин «материнский» подразумевает, что функции с другим участком носителя функции, который используют в способе преобразования, получают из одной главной функции или материнского вейвлета. Иными словами, материнский вейвлет представляет собой прототип для создания других функций-окон. В целом вейвлет ψ(t) представляет собой комплекснозначную функцию. Общую вейвлет-функцию определяют как:
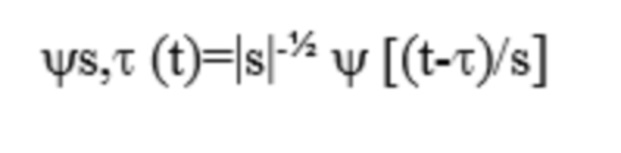
Данный параметр сдвига 'τ' определяет положение окна во времени, и, таким образом, он определяет, какая часть сигнала x(t) анализируется. В анализе вейвлет-преобразования переменную частоты 'ω' заменяют переменной масштаба 's', а переменную сдвига во времени представляют с помощью 'τ'.
[0058] Вейвлет-преобразование использует эти функции материнского вейвлета и производит разложение сигнала x(t) на взвешенный набор масштабированных вейвлет-функций ψ(t). Основное преимущество использования вейвлетов заключается в том, что они позволяют регистрировать характеристику и уникальную сигнатуру данного более крупного и более сложного набора данных без потери в результате данных.
[0059] Например, два больших исходных набора данных кривой плавления, полученные для двух продуктов амплификации, отличающихся по длине только одним нуклеотидом, являются в высокой степени подобными, но после использования вейвлет-преобразования будут получены две разные сигнатуры. Такие сигнатуры затем будет легче сравнить друг с другом с целью логического заключения, что в одном из продуктов амплификации присутствовала вставка или делеция. И в заключение, использование вейвлет-функции приводит к уменьшению шумов и увеличению вычислительной эффективности и скорости при работе с большими и аналогичными наборами данных. Следовательно, обработанные с помощью вейвлет данные являются особенно подходящими для классификации образцов с использованием составного анализа нескольких мультиплексных мишеней в пределах одного эксперимента, особенно когда имеются полученные большие исходные наборы данных, которые требуют выделения незначительного разброса данных.
[0060] Существующие в настоящее время способы выявления MSI характеризуются следующими недостатками:
(a) для определения длины повторов требуется дополнительное специализированное оборудование для выполнения анализа после ПЦР, и/или этот анализ обычно требует интерпретации высококвалифицированным специалистом; или (b) в случае анализа кривой плавления высокого разрешения с использованием dsDNA-интеркалирующих красителей недостаток заключается в очень ограниченной возможности мультиплексирования, чтобы избежать перекрывания сигналов плавления от разных ампликонов, и кроме того, он не обеспечивает возможность количественной оценки нестабильных (мутантных) последовательностей по сравнению со стабильными (дикого типа) последовательностями. Авторы настоящего изобретения выявили, что использование дискретного вейвлет-преобразования в отношении данных кривой плавления приводит к надежной и корректной интерпретации результатов в полностью автоматизированном режиме, за счет чего преодолеваются эти недостатки.
[0061] Таким образом, в предпочтительном варианте осуществления способ по настоящему изобретению дополнительно предусматривает стадии:
(a) применения вейвлет-преобразования в отношении данных кривой плавления и
(b) применение результатов, полученных на (a), в определении количества нуклеотидов в любом из гомополимерных повторов, перечисленных выше. Другими словами, в одном варианте осуществления представлены способы, в которых применяют функцию вейвлет-преобразований для анализа данных кривой плавления нуклеиновых кислот из тестируемого образца для определения присутствия или отсутствия вставки/делеции в каждом из гомополимерных повторов из выбранной панели биомаркеров, затем эту информацию можно использовать для определения указанного тестируемого образца, как характеризующегося или не характеризующегося MSI.
[0062] В предпочтительном варианте осуществления данные кривой плавления являются исходными данными кривой плавления, т. е. данными, представляющими собой исходные параметры сигнала, полученного в исследовании диссоциации или ассоциации нуклеиновой кислоты. Иными словами, такие исходные параметры не подвергают математической обработке путем, например, использования первой или второй производной анализа кривой плавления, как это часто осуществляют в данной области техники, но после получения с помощью детектора их передают в компьютер, где в отношении них используют функцию вейвлет-преобразования.
[0063] В наиболее предпочтительном варианте осуществления вейвлет-преобразование представляет собой дискретное вейвлет-преобразование или «DWT». DWT представляет собой любое вейвлет-преобразование, для которого вейвлеты отбирают дискретно. Как и в случае других вейвлет-преобразований, ключевым преимуществом, которым оно обладает перед преобразованиями Фурье, является разрешающая способность во времени: оно охватывает частоту и положение информации (положение во времени). Использование дискретного вейвлет-преобразования в отношении исходных параметров дает набор преобразованных выходных вейвлет-коэффициентов в разных масштабах: (a) один является результатом аппроксимирования выходящего сигнала, который представляет собой низкочастотный состав компонента входящего сигнала и (b) другой является комплексным результатом, который дает высокочастотные компоненты, являющиеся элементами входного сигнала на разных уровнях. Данные коэффициенты далее упоминаются как дискретные коэффициенты вейвлет-преобразования или коэффициенты dwt. Разделение характеристик на различные масштабы (или частоты) позволяет оператору или компьютерному алгоритму выбирать наиболее подходящие коэффициенты dwt для некоторых решений или анализа, то есть осуществлять процесс, который часто называется вейвлет-фильтрованием. Данный процесс может быть использован повторно, разделяя сигнал на множество диапазонов частот. При использовании в отношении данных кривой плавления наивысшая частота вейвлет-коэффициентов преимущественно является шумом, при этом наиболее низкие коэффициенты разрешения охватывают информацию, связанную с усилением прибором или эффективностью амплификации в предыдущей реакции амплификации. Оба характеризуются отсутствием или низкой применимостью для идентификации специфического олигонуклеотида в образце, который подвергнут анализу кривой плавления, но обладают потенциальной применимостью с учетом надежности такой идентификации. Пакеты, содержащие все функции, необходимые для обработки данных и нанесения на график DWT, уже описаны (Aldrich, 2015) и известны опытным программистам и математикам.
[0064] В предпочтительном варианте осуществления способа на стадии проведения дискретного вейвлет-преобразования в отношении данных кривой плавления для получения коэффициентов dwt при конкретных настройках будет рассчитано одномерное (1D) вейвлет-преобразование по исходным данным или обработанным данным с применением материнского вейвлета из семейства Добеши. Материнский вейвлет представляет собой немодифицированный вейвлет, выбранный в качестве основы для дискретного вейвлет-преобразования (Daubechies, 1992). Хорошие результаты получали при использовании материнского вейвлета DB8. Дополнительные тесты с материнскими вейвлетами DB4 и Хаара также обеспечивали весьма хорошую эффективность, результаты которой могут быть предоставлены по запросу. Исходя из последнего, авторы настоящего изобретения считают, что другие существующие материнские вейвлеты также могут являться подходящими. Материнский вейвлет может быть и предпочтительно является последовательно увеличенным, сдвинутым и масштабированным, используя алгоритм пирамиды dwt, для создания набора дочерних вейвлетов, которые наилучшим образом представляют собой анализируемый сигнал флуоресценции кривой плавления; при этом набор вейвлетов и коэффициенты масштаба, полученные из алгоритма, представляют собой результат дискретного вейвлет-преобразования. В указанном примере граничные условия для DWT являются периодическими. Ввод исходных данных для преобразования может быть для всех измеренных данных или их подгруппы, которая покрывает все значимые события указанного эксперимент.
[0065] В соответствии с вышесказанным с целью получения коэффициентов dwt в способах по настоящему изобретению может использоваться дискретное вейвлет-преобразование исходных данных кривых плавления или математически трансформированных или обработанных данных кривых плавления, т. е. только на выбранных исходных данных.
[0066] Кроме того, не всегда требуется использовать все коэффициенты dwt для конечного определения количества нуклеотидов. Для увеличения скорости вычисления вполне достаточно лишь отбора коэффициентов dwt. Предпочтительно дискретное вейвлет-преобразование проводят c исходными данными кривой плавления. Однако необязательно проводить обработку исходных данных в соответствии с любым математическим способом, известным в данной области техники, для получения выборки исходных данных. В последнем случае дискретное вейвлет-преобразование будет использоваться в отношении указанной выборки исходных данных также для получения коэффициентов dwt. Таким образом, в конкретном варианте осуществления результаты, полученные на (a), могут представлять собой коэффициенты dwt, полученные из исходных данных кривой плавления. В альтернативном варианте осуществления результаты, полученные на (a), могут представлять собой коэффициенты dwt, полученные из выборки исходных данных кривой плавления. В еще одном конкретном варианте осуществления результаты, полученные на (a), могут представлять собой выборку коэффициента dwt, полученного из вышеуказанных альтернативных вариантов осуществления.
[0067] В одном конкретном варианте осуществления дискретное вейвлет-преобразование представляет собой 1D дискретное вейвлет-преобразование. В еще более конкретном варианте осуществления 1D дискретное вейвлет-преобразование представляет собой 1D вейвлет-преобразование Добеши.
[0068] Для использования дискретного вейвлет-преобразования должен быть выбран материнский вейвлет. В дополнительном предпочтительном варианте осуществления используют дискретное вейвлет-преобразование Добеши, в котором используется материнский вейвлет из семейства Добеши, наиболее предпочтительно, представляющий собой материнский вейвлет DB8 или материнский вейвлет DB4 или Хаара.
[0069] В принципе, в альтернативном возможном варианте осуществления в способе по настоящему изобретению может использоваться любая функция вейвлет-преобразования, подходящая для генерирования значимых коэффициентов, которые охватывают информацию, позволяющую определить отличия на уровне одного нуклеотида. Примеры могут включать вейвлет Хаара (который также может считаться частью семейства Добеши), наименее асимметричный, вейвлет Койфлет или наилучшим образом локализованный. В альтернативных вариантах осуществления могут использоваться альтернативные алгоритмы для вычисления dwt, в том числе алгоритм лифтинга или дуальное разложение с применением комплексного вейвлет-преобразования. Другие формы дискретного вейвлет-преобразования включают вейвлет-преобразование без децимирования или недецимированное вейвлет-преобразование, где исключено понижение выборки, или преобразование Ньюленда, где ортонормированный базис вейвлетов формируется из соответствующим образом сконструированных фильтров «верх шляпы» в диапазоне частот. Возможно, существуют другие примеры, и они будут легко применимы к раскрытым в данном документе способам соответствующим специалистом.
[0070] Одним из основных преимуществ способов по настоящему изобретению является их непосредственная автоматизация и адаптация, в частности, к известным стандартным системам для qPCR. Следовательно, в конкретном варианте осуществления представлен способ, где определение количества нуклеотидов в вышеперечисленных гомополимерных повторах проводят в автоматизированном режиме, например, с помощью программного обеспечения. Это может быть проведено в автоматизированной системе, например, оснащенной подходящим оборудованием и программными средствами, которая может считывать сигналы, полученные с помощью способов по настоящему изобретению, анализировать их и представить вывод, исходя из присутствия или отсутствия вставок/делеций в выбранном маркере из указанного образца. Особенно подходящей системой для такой автоматизации является платформа Biocartis Idylla™, которая помимо выполнения ПЦР и обеспечения интерпретации ее результатов, также полностью автоматизирует всю последовательность технологических операций обработки образца и выделения нуклеиновой кислоты. Следовательно, в возможном варианте осуществления по настоящему изобретению представлен полностью автоматизированный, начиная от образца и заканчивая результатом, способ анализа локусов MSI.
[0071] В еще одном перспективном варианте осуществления по настоящему изобретению выполняют способ, где определение количества нуклеотидов в любом из вышеперечисленных гомополимерных повторов также дополнительно осуществляют в контрольном биологическом образце. Данный контрольный или референтный образец может быть, например, материалом, полученным из опухоли с MSI-H с подтвержденным присутствием вставки/делеции в любом из вышеперечисленных выбранных гомополимерных повторах, или конструкцией на основе синтетической или выделенной нуклеиновой кислоты, например плазмидой. Особенно предпочтительный референтный образец может быть, например, одним из стандартов Acrometrix, который содержит смесь как синтетической, так и геномной ДНК. В технологии используется подробно охарактеризованная и секвенированная клеточная линия GM2438 в качестве геномного фона ДНК, в которую введены секвенированные синтетические мишени. В подходе Acrometrix такие мишени представляют собой линейные синтетические молекулы ДНК, содержащие последовательность, имитирующую изменение, ассоциированное, например, с выбранным биомаркером, который в контексте настоящего изобретения может быть последовательностью из любых из описанных выше гомополимерных повторов, содержащих вставку/делецию, предпочтительно для целей ПЦР вместе с их фланкирующими последовательностями. Мишени дополнительно содержат «хвостовую» последовательность, связанную с описанной выше последовательностью, имитирующей изменение, которая дополнительно служит для идентификации и количественного определения мишеней. Полученная в результате последовательность считается гибридной последовательностью, содержащей последовательность, имитирующую изменение, и хвостовую последовательность. Например, хвост может имитировать такое известное изменение в гене, как SNP, для которого доступны анализы для выявления, и, следовательно, может обеспечить дополнительные средства для непрямого абсолютного количественного определения последовательности, имитирующей изменение, как в данном случае вставку/делецию в выбранных маркере или маркерах. Такой стандарт, например, может быть применим для целей верификации и валидации, например, он может быть предусмотрен в случае дополнительного исследования посредством NGS, в частности, из-за того, что существующие подходы на основе NGS по-прежнему склонны к потере информации о вставках/делециях в последовательностях гомополимерных повторов.
[0072] В качестве альтернативы в предпочтительном варианте осуществления по настоящему изобретению контрольный биологический образец содержит материал, полученный из клеточной линии HTC116 cl.110268743, которую создавали для целей настоящего изобретения и депонировали в соответствии с Будапештским договором 28 ноября 2017 г. в депозитарии BCCM/GeneCorner в Бельгии под номером доступа LMBP 12278CB. Клеточная линия содержит одну гомонуклеотидную делецию в каждом из указанных выше гомополимерных повторов. Это означает, что геном клеточной линии содержит следующие мутантные (т. е. MSI-вариант) гомополимерные повторы:
10 аденинов, локализованных в гене DIDO1 человека и начинающихся с положения chr20:62905340;
10 аденинов, локализованных в гене MRE11 человека и начинающихся с положения chr11:94479765;
9 аденинов, локализованных в гене SULF2 человека и начинающихся с положения chr20:47657577;
7 аденинов, локализованных в гене ACVR2A человека и начинающихся с положения chr2:147926117;
9 аденинов, локализованных в гене BTBD7 человека и начинающихся с положения chr14:93241685;
8 тиминов, локализованных в гене SEC31A человека и начинающихся с положения chr4:82864412; и
9 аденинов, локализованных в гене RYR3 человека и начинающихся с положения chr15:33865341.
Кроме того, клеточная линия также характеризуется вставкой/делецией нескольких других повторов, ассоциированных с MSI, например, BAT25 и BAT26 из панели Bethesda, которые могут использоваться в сравнительных исследованиях.
[0073] В связанном аспекте настоящего изобретения также представлены клетка или любой другой материал, в частности генетический материал, который получен из клеточной линии HTC116 cl.110268743. Таким материалом может быть выделенная геномная ДНК или клеточный лизат. Другие подходящие формы такого материала будут очевидны специалисту в данной области техники в зависимости от конечного назначения представленных в данном документе способов и наборов на основе указанных способов.
[0074] В дополнительном аспекте настоящего изобретения также представлены наборы для выявления вставок/делеций в панели биомаркеров MSI по настоящему изобретению или для проведения способа в соответствии с настоящим изобретением. В конкретном варианте осуществления настоящего изобретения представлен набор для анализа локусов MSI в биологическом образце, при этом набор содержит средства для выявления участков нуклеиновой кислоты, содержащих описанные выше гомополимерные повторы, представленные в панели биомаркеров по настоящему изобретению. Предпочтительно указанные средства являются специфичными в отношении последовательности, т. е. сконструированы для специфического распознавания в последовательности указанных гомополимерных повторов с их фланкирующими участками выбранной длины. В предпочтительном варианте осуществления специфичные в отношении последовательности средства предусматривают праймер, или пару праймеров, или зонд, способные к гибридизации с участком, содержащим гомополимерный повтор. Например, такие средства могут предпочтительно предусматривать праймер, гибридизирующийся с участком выше или ниже повтора, и сконструированный для получения в реакции амплификации продукта амплификации, содержащего по меньшей мере один из указанных гомополимерных повторов или их мутантных вариантов, например, содержащие на один или два гомонуклеотида меньше или больше по сравнению с вариантом гомополимерного повтора дикого типа. В другом примере средства могут предусматривать зонд, способный к гибридизации с любой из указанных последовательностей гомополимерных повторов (или их мутантных вариантов, содержащих вставку/делецию) и с по меньшей мере одним непосредственно фланкирующим участком (т. е. выше или ниже, но предпочтительно оба варианта) указанной последовательности повтора. В конкретном варианте осуществления средства предусматривают по меньшей мере один праймер или пару праймеров, выбранные из SEQ ID NO: 1-14. В альтернативном конкретном варианте осуществления средства предусматривают по меньшей мере один зонд типа «молекулярный маяк», выбранный из SEQ ID NO: 15-21. В возможном варианте осуществления средства предусматривают по меньшей мере один праймер или пару праймеров, выбранные из SEQ ID NO: 1-14, и по меньшей мере один зонд типа «молекулярный маяк», выбранный из SEQ ID NO: 15-21. Средства могут дополнительно предусматривать, например, корректирующую полимеразу, подходящие буферные системы, dNTP, выбранные красители, необязательно с совместимыми гасителями и т. д. В дополнительном варианте осуществления представлен набор, содержащий материал, представляющий собой контрольный биологический образец, предпочтительно представляющий собой материал, полученный из клеточной линии HTC116 cl.110268743
[0075] В предпочтительном варианте осуществления представлен набор, дополнительно содержащий картридж. Необязательно набор может быть представлен в форме картриджа. Таким образом, преимущественно в настоящем изобретении представлен набор, где указанные средства для выявления участков нуклеиновой кислоты, содержащие описанную выше панель биомаркеров гомополимерных повторов, представлены в картридже, выполненном с возможностью взаимодействия с автоматизированной системой. Как описано выше, подходящий пример картриджа и автоматизированной системы, выполненной с возможностью взаимодействия с ним, представляет собой платформу Biocartis Idylla™. Дополнительные подробности в отношении этой и аналогично применимых в настоящем изобретении систем можно найти в WO2007004103, EP1896180, EP1904234 и EP2419705. Из документов, цитируемых в данном документе, можно понять, что предпочтительные картриджи содержат не только средства для проведения ПЦР, но также могут быть выполнены с возможностью непосредственного приема источника нуклеиновой кислоты или образца, проведения выделения или экстрагирования нуклеиновых кислот из указанного источника нуклеиновой кислоты и предоставления (например, посредством перекачивания) экстрагированной таким образом нуклеиновой кислоты для последующего анализа на основе ПЦР.
[0076] В предпочтительном варианте осуществления такие средства, как праймеры, зонды и/или другие реагенты, в том числе корректирующая полимераза могут быть предоставлены в указанном картридже в нанесенном формате, что способствует увеличенному сроку хранения.
[0077] В дополнительном связанном аспекте настоящего изобретения также представлены автоматизированные системы для выявления вставок/делеций в панели биомаркеров MSI в соответствии со способами по настоящему изобретению и/или для проведения анализа с помощью наборов в соответствии с настоящим изобретением.
[0078] В возможном варианте осуществления такая автоматизированная система может содержать панель управления и прибор, совместимые с картриджами многоразового применения по настоящему изобретению. Прибор содержит контрольные модули для проведения анализов. Пульт управления представляет собой компьютер для контроля и наблюдения за действиями прибора и за статусом картриджа в ходе анализов. Предпочтительно анализ будет полностью проводиться внутри картриджа и может включать, например, ПЦР в режиме реального времени. После введения образца в такой картридж по настоящему изобретению, который предварительно заполнен реагентами, описанными выше, картридж вставляют в прибор и прибор контролирует анализ, который автоматически проводится в картридже. После проведения анализа программное обеспечение пульта управления обрабатывает результаты и генерирует отчет, доступный конечному пользователю автоматизированной системы.
[0079] Автоматизированная система может быть автоматизированной системой открытого или закрытого типа. После внесения или помещения образца в картридж, картридж вставляют в систему, которую затем закрывают и оставляют закрытой в ходе осуществления эксплуатации системы. В системе закрытого типа все необходимые реагенты встроены, поэтому закрытая конфигурация обеспечивает преимущество, которое заключается в проведении выявления без контаминации. В качестве альтернативы в автоматизированной системе может использоваться открытый доступный картридж. Необходимые реагенты добавляют в открытый картридж при необходимости, после чего образец может быть помещен в открытый картридж и картридж может быть введен в анализ в закрытой автоматизированной системе.
[0080] Предпочтительно используют системы, основанные на применении картриджа, содержащие одну или более реакционных камер и одну или несколько жидкостных камер. Некоторые жидкостные камеры могут содержать жидкость, которую используют для получения лизата образца. Другие камеры могут содержать жидкости, такие как реакционные буферы, промывочные жидкости и растворы для амплификации. Реакционные камеры используются для проведения разных стадий выявления, как, например, промывание, лизис и амплификация.
[0081] В особенно желательном варианте осуществления в соответствии с вышеперечисленными вариантами осуществления для упрощения и облегчения интерпретации результатов способа в соответствии с настоящим изобретением также проводят анализ кривой плавления в автоматизированном режиме посредством компьютеризованного способа.
[0082] И наконец, также целью настоящего изобретения является обеспечение применения панелей биомаркеров, способов, наборов, включающих картриджи, и автоматизированных систем в соответствии с настоящим изобретением для анализа локусов MSI в образце опухоли или биологическом образце, которые, как предполагается, содержат опухолевый материал.
[0083] В предпочтительном варианте осуществления опухоль представляет собой колоректальный рак (CRC). В альтернативном варианте осуществления, опухоль представляет собой рак яичника или рак эндометрия. В еще одном варианте осуществления опухоль представляет собой рак желудка.
[0084] В возможном варианте осуществления по настоящему изобретению также представлено применение панелей биомаркеров, способов, наборов, включающих картриджи, и автоматизированных систем в соответствии с настоящим изобретением для анализа локусов MSI в образце опухоли и для прогнозирования ответа субъекта на иммунотерапию, от которого получили образец опухоли, исходя из анализа. Последнее применение может быть предусмотрено с учетом недавних сообщений из литературных источников, в частности, Turajlic et al., 2017, Lancet Oncology, где было показано, что повышенное накопление вставок/делеций в геноме коррелирует с образованием новых открытых рамок считывания, кодирующих большое количество неоантигенных последовательностей. Наряду с этим в дальнейшем авторы настоящего изобретения демонстрируют, что выявление по меньшей мере 2 или 3 вставок/делеций в панели биомаркеров по настоящему изобретению в значительной степени коррелирует с общим количеством вставок/делеций и неоантигенов при оценке каждого образца. Данные авторов настоящего изобретения дополнительно показывают, что отличающийся иммуногенный фенотип опухоли может быть спрогнозирован с помощью способов и/или наборов по настоящему изобретению. Последнее является многообещающим по следующим причинам. Блокирование контрольных точек иммунного ответа было ранее одобрено для лечения неоперабельных или метастатических опухолей с высокой микросателлитной нестабильностью (MSI-H) независимо от участка их локализации или гистологической характеристики. Наблюдаемый показатель ответа составил ~40%. В настоящее время отсутствует одобренный FDA тест для выявления статуса MSI. Опухоль с MSI-H характеризуется такими гистопатологическими характеристиками, как высокая инфильтрация лимфоцитами и высокая мутационная нагрузка опухоли. В частности, такие опухоли характеризуются высоким количеством мутаций типа «вставка/делеция», которые известны высокой иммуногенностью, приводящей к избытку неоантигенов. Из результатов исследования авторов настоящего изобретения следует, что опухоли с MSI-H, характеризующиеся высоким показателем вставок/делеций, очевидно, будут высоко восприимчивы к иммунотерапии антителами, нацеливающимися на молекулы контрольных точек иммунного ответа, например, PD-1, PD-L1 или PD-L2. Следовательно, в другом возможном варианте осуществления представлен способ анализа локусов MSI в соответствии с настоящим изобретением, который предусматривает стадию применения полученной информации о количестве гомополимерных повторов для принятия решения о проведении иммунотерапии у субъекта, от которого получен биологический образец. В возможных вариантах осуществления способ может предусматривать стадию применения полученной информации о количестве гомополимерных повторов для установления мутационной нагрузки опухоли или нагрузки опухоли вставками/делециями. В предпочтительных вариантах осуществления установленная мутационная нагрузка опухоли или нагрузка опухоли вставками/делециями представлена в виде оценки общего количества мутаций или представлена в виде балльной оценки. В конкретном варианте осуществления способы по настоящему изобретению могут предусматривать стадию применения полученной информации о количестве гомополимерных повторов, или о мутационной нагрузке опухоли, или о нагрузке опухоли вставками/делециями, или об оценке общего количества мутаций, или о балльной оценке для принятия решения о проведении иммунотерапии у субъекта, от которого получен биологический образец. Как поясняется выше, в предпочтительных вариантах осуществления таких способов иммунотерапия предусматривает лечение с помощью антитела, нацеливающегося на фактор, представляющий собой контрольную точку иммунного ответа, причем наиболее предпочтительно указанное антитело представляет собой антитело, специфичное к любой из следующих мишеней: PD-1, PD-L1 или PD-L2. В дополнительном аспекте данные авторов настоящего изобретения также указывают на то, что опухоли с высоким содержанием неоантигенов также будут восприимчивы к подходам специфического нацеливания на образовавшиеся неоантигены посредством Т-клеток с химерным антигенами или средств терапевтической вакцинотерапии. Таким образом, также могут быть представлены возможные варианты осуществления способов по настоящему изобретению, в которых реализуются указанные способы. Кроме того, эти и другие варианты применения настоящего изобретения в диагностике, прогнозировании и клиническом наблюдении субъектов будут легко доступны специалистам в данной области техники.
Примеры
1. Выявление микросателлитной нестабильности (MSI) в образцах рака с помощью нового набора высокочувствительных маркеров
[0085] Получение минимального набора из 4 маркеров из любого указанного набора маркеров не является простым. Например, описанный Zhao et al, 2014, eLife анализ с помощью Sequenom 18 образцов с MSI-H с использованием панели из 59 маркеров показал, что маркер в среднем определяется как мутантный в 44,26% образцов. Хотя данная большая панель маркеров является высокоэффективной в выявлении статуса MSI, произвольно полученные из нее наборы из 4 выбранных маркеров показывают значительно более низкую теоретическую эффективность по сравнению с предложенным в данном документе основным набором, содержащим ACRV2A, DIDO1, MRE11, SULF2. Кроме того, эти произвольно выбранные панели обладают рядом недостатков, заключающихся в том, что они могут содержать маркеры, демонстрирующие этнически зависимые отличия в гомополимерном участке, например, такие, которые наблюдали в случае маркера TMEM65 для субпопуляций Карибского бассейна. Данные отличия делают исключительно сложным конструирование надежной и эффективной панели с низким количеством маркеров, поскольку они могут понижать точность интерпретации изменений, внесенных MSI. Последнее становится особенно важным при определении небольшого количества различных маркеров и/или при отсутствии соответствующего контроля, что обычно наблюдается в случае, например, классического набора биомаркеров MSI Bethesda, имеющего широкий диапазон индивидуальной изменчивости и множественные вариантные аллели, особенно в африканских популяциях (Buhard et al., 2006).
Определение профиля MSI при CRC, раке желудка и раке эндометрия
[0086] Определяли профиль статуса по 7 микросателлитным маркерам (BTBD7, RYR3, SEC31A, ACVR2A, DIDO1, MRE11 и SULF2) в 128 образцах колоректального рака с MSI-H. Несколько клинических баз и разных этнических групп включали для оценки надежности выбора маркеров. Кроме того, статус по 7 маркерам проверяли в 15 образцах рака желудка с MSI-H и 19 образцах рака эндометрия с MSI-H. Длину повтора определяли по ДНК из FFPE с помощью ПЦР и с последующим определением характеристик продукта амплификации с помощью «молекулярных маяков».
Материалы и способы
[0087] Образцы. В общей сложности 128 FFPE образцов CRC человека с MSI-H получали из различных источников, включая Кембриджский университет, Португальский институт онкологии в Порту, Cureline, Boca Biolistics, Trans-Hit, Geneticist Inc, Righshospitalet, Origene и Asterand. 15 образцов желудка человека с MSI-H получили от Cureline и Trans-Hit и 19 образцов эндометрия человека с MSI-H получили от IDIBELL.
[0088] Обработка образцов. Каждый образец FFPE с MSI-H помещали в струйный картридж, являющийся разработкой Biocartis Idylla™. Картриджи закрывали и загружали в платформу Idylla™, предназначенную для автоматизированных генетических анализов на основе ПЦР, после чего начинали полностью автоматизированную пробоподготовку. Если вкратце, то ДНК извлекали из образцов FFPE в соответствии с протоколом разжижения FFPE Biocartis, а затем ее закачивали в отсеки для ПЦР в картриджах в соответствии со стандартным протоколом для Idylla™.
[0089] ПЦР. Отсеки для ПЦР картриджа загружали так, чтобы они содержали следующие смеси ПЦР на пару праймеров или дуплекс пары праймеров, как указано ниже:
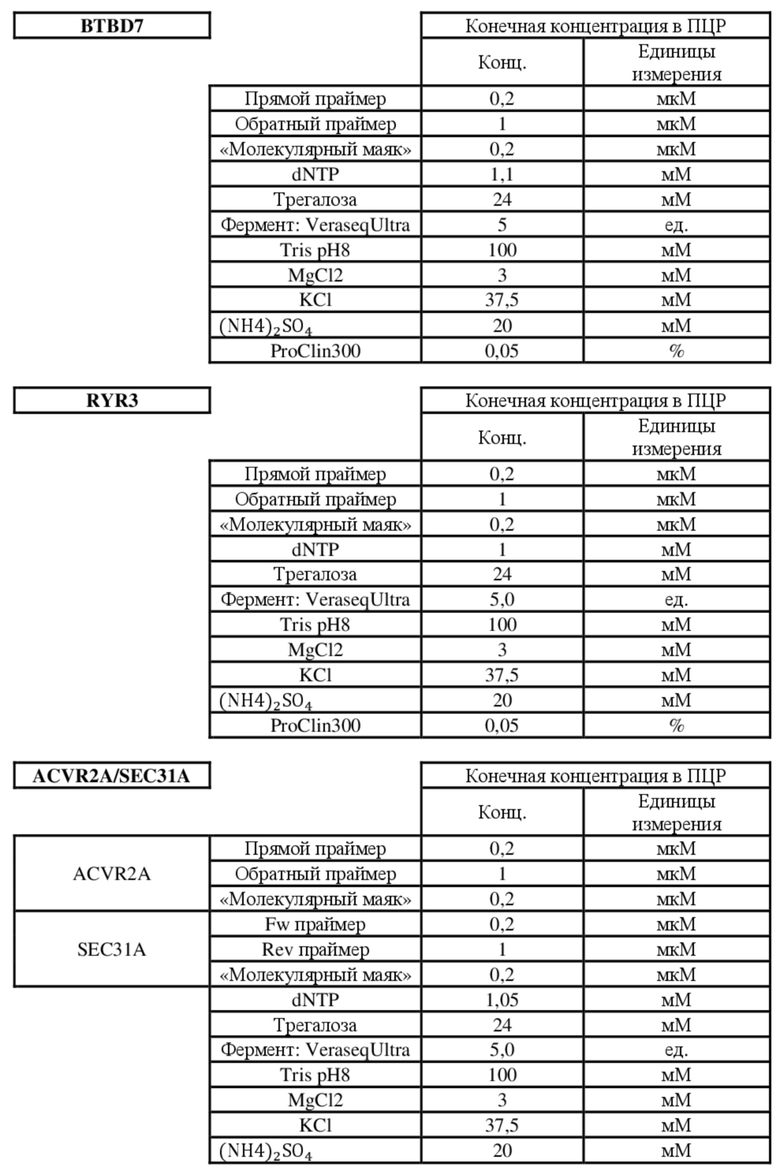
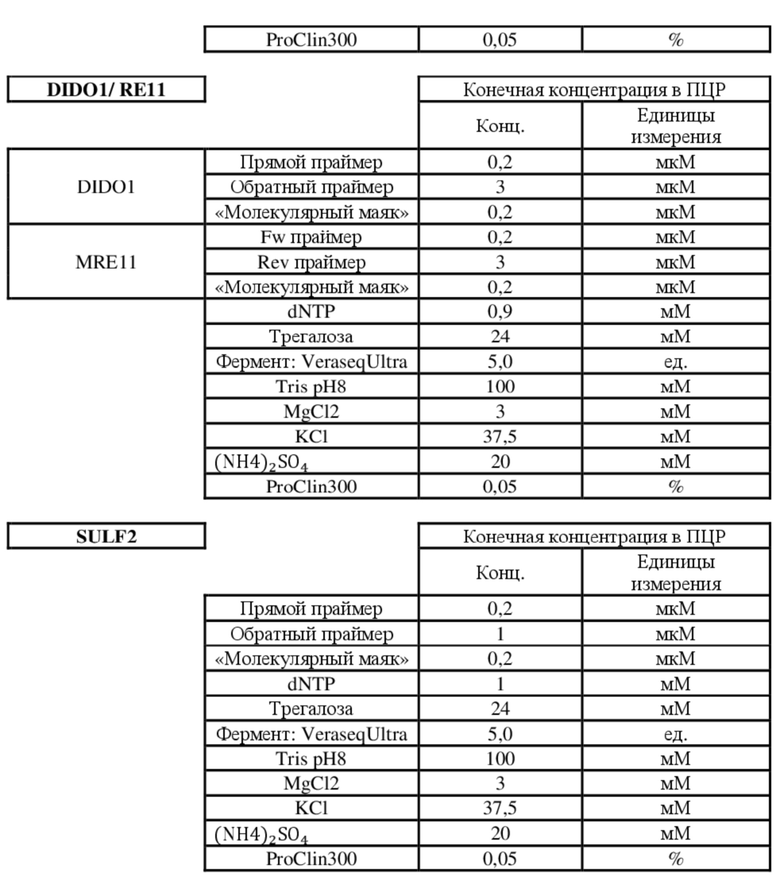
Последовательности пар праймеров и зонды для каждого маркера представлены ниже:
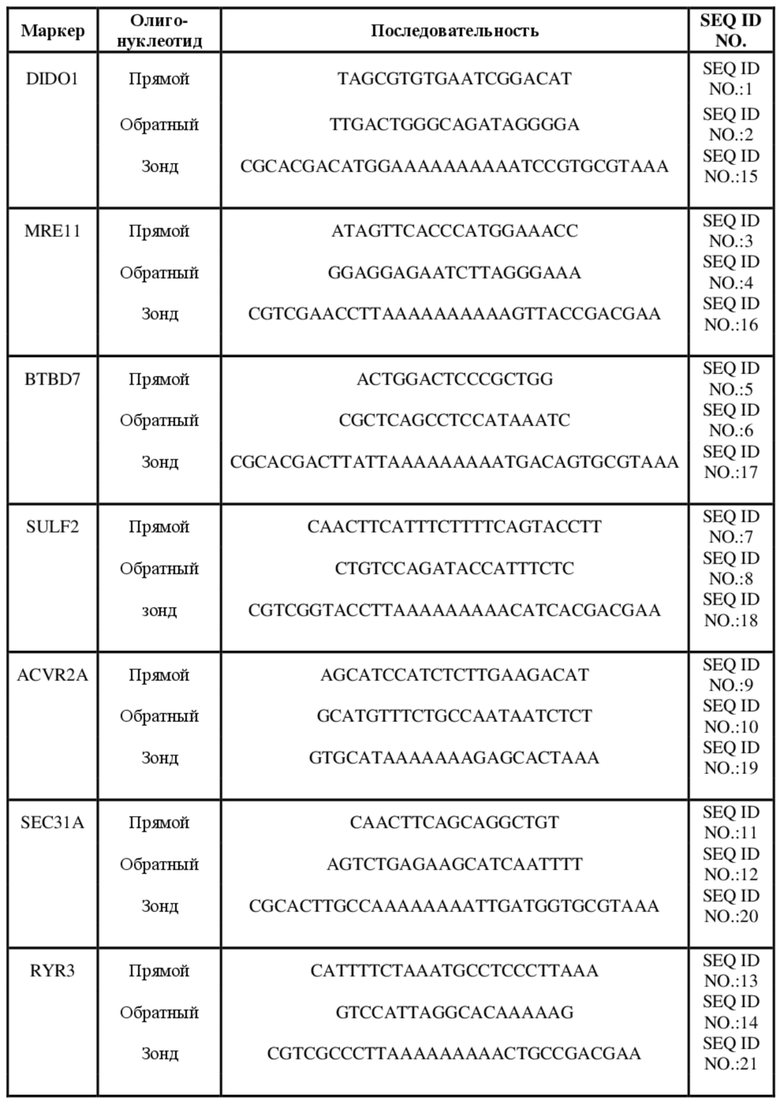
Условия для ПЦР представлены ниже:

[0090] Плавление ампликона. Продукты ПЦР подвергали денатурации в картриджах в течение 2 минут при 92°. Затем получали данные кривой плавления по интенсивности флуоресценции при нагревании смеси от 40 C до 76,6 C с шагом 0,3 C (12 сек на цикл), при этом сигналы флуоресценции контролировали после каждого повышения на 0,3 C.
[0091] Постобработка. На первой стадии анализа данных исходные значения измерения флуоресценции для кривой плавления загружали из прибора Idylla™. На следующей стадии только первые 64 цикла сохраняли из вектора измеренных значений. Данная подгруппа называется «участок, представляющий интерес» или ROI, поскольку наиболее важные изменения сигнала наблюдают в пределах данного окна. В более поздних циклах в основном наблюдают плавление «маяков». Следующей стадией в алгоритме постобработки является применение дискретного вейвлет-преобразования (DWT) по отношению к вектору измерения (ROI). Вейвлеты особенно хорошо подходят для анализа кривых плавления, поскольку они представляют собой низкочастотное явление, которое возникает в конкретной температурной зоне. Вейвлеты способны одновременно выполнять временной и частотный анализ. Это значит, что они могут интерпретировать и то, что происходит в плане низкочастотных изменений, и то, когда это происходит. Таким образом, вейвлеты кратко обобщают способ анализа кривой плавления. В данном конкретном случае используют вейвлет DB8 и сохраняют коэффициенты третьего уровня. После данного преобразования, и масштаб, и вейвлет-коэффициенты сохраняются, что дает два набора из 8 коэффициентов. Один набор из 16 вейвлет-коэффициентов рассчитывают для каждого маркера, представленного в данном анализе. Данный набор вейвлет-коэффициентов на маркер называют результатами постобработки для каждого маркера.
[0092] Дерево принятия решений. Вторая стадия анализа данных кривой плавления называется деревом принятия решений. На данной стадии алгоритм распознавания образов используется с целью классификации валидных образцов на основе результатов постобработки. Для этого алгоритм классификации, являющийся нейронной сетью, задействуют по отношению к результатам постобработки каждого маркера. Данную сеть обучали с помощью меченных данных, для которых известен введенный генотип. В случае эталонных данных такое мечение основывается на введенном генотипе, который был представлен. В случае клинических данных данное мечение получают в результате визуальной балльной оценки профилей плавления специалистами по кривой плавления. Посредством итеративной оптимизации весов в составе нейронной сети алгоритм может научиться распознавать отличия между кривой для дикого типа (WT) и кривой для мутантного типа. Алгоритм предоставляет балльную оценку вероятности в качестве результата для каждого маркерного гена, которая отражает достоверность решения (1 для мутантного типа и 0 для WT). Образец оценивают как MSI-H, если по меньшей мере два маркера имеют балльную оценку вероятности, превышающую 0,5.
Результаты
1. Определение профиля MSI при CRC
[0093] Первый анализ. Основной набор из четырех маркеров, включающий ACVR2A, DIDO1, MRE11 и SULF2, оценивали в отношении их способности выявлять положительные образцы MSI-H в пуле из 128 образцов с MSI-H. Образец оценивали как положительный, когда дерево принятия решений по данным кривой плавления, подвергнутым постобработке, дает по меньшей мере два маркера, выявленных как характеризующиеся вставкой/делецией. При использовании данного основного набора из четырех маркеров 96% образцов могут быть идентифицированы как MSI-H. Поскольку минимальная приемлемая эффективность была задана как определяющая по меньшей мере 95% образцов, выборку, осуществленную выше, приняли за основной набор маркеров MSI.
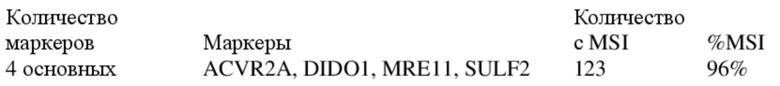
[0094] Для обеспечения дополнительной оценки эффективности этих маркеров все возможные пермутации 3 маркеров из основной панели из 4 подвергали такому же анализу эффективности. Результаты указывают на то, что эффективность ухудшается для каждой возможной подвыборки, при этом она находится в диапазоне от 83% до 93%. С целью придания анализу большей надежности среди разных типов рака предпочтительной является схема с по меньшей мере четырьмя маркерами.

[0095] Второй анализ. Путем добавления дополнительного маркера (BTBD7) к основному набору из четырех маркеров еще один образец может быть оценен как MSI-H, что обеспечивает 97% корректно оцененных образцов, делая тем самым панель более эффективной в определении статуса MSI.
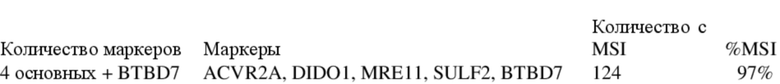
[0096] Третий анализ. Путем добавления дополнительного маркера (SEC31A) к набору из пяти маркеров все образцы в тестируемом ограниченном наборе образцов можно оценить как MSI-H, что обеспечивает еще большую эффективность.

[0097] Четвертый анализ. Путем добавления дополнительного маркера (RYR3) к набору из шести маркеров, как и следовало ожидать, все образцы также оценивают как MSI-H. Хотя это и не сразу становится очевидным из представленных данных, теоретически добавление 7-го маркера, по-видимому, все же повышает эффективность анализа в случае анализа больших наборов образцов. В теории, учитывая наблюдаемые частоты мутаций этих маркеров в образцах с MSI-H, для 7 маркеров показатель ложноотрицательных результатов прогнозируется как не превышающий ~1/1900, который для более крупных наборов образцов может стать значимым.

[0098] Результаты анализа образца CRC показаны на фигуре 1.
2. Определение профиля MSI при раке желудка и раке эндометрия
[0099] Первый анализ. Затем также оценивали основной набор из четырех наиболее эффективных маркеров для CRC (ACVR2A, DIDO1, MRE11 и SULF2) в пуле из 34 образцов рака, в частности 15 образцов рака желудка и 19 образцов рака эндометрия (EN).
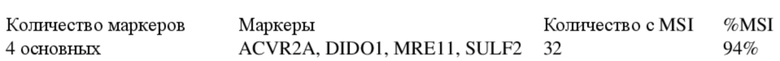
Результаты указывают на то, что гомополимерный повтор в ACVR2A является намного более эффективным маркером для CRC, чем для других типов рака. Однако, несмотря на очень маленький пул образцов, результаты для основного набора при раке желудка и раке EN вплотную приближаются к приемлемому пороговому уровню, составляющему 95%, что является хорошим показателем того, что в случае более крупного пула образцов набор из 4 основных маркеров, представленный в данном документе, в целом может применяться по отношению к другим типам опухолей, а не только к CRC, с дефицитом по MMR или к типам опухолей с микросателлитной нестабильностью. С целью получения лучшего представления об эффективности основной панели определению профиля следует подвергнуть большее количество.
[0100] Второй анализ. Путем добавления дополнительного маркера (BTBD7) к основному набору из четырех маркеров еще один образец может быть оценен как MSI-H, что при таком небольшом наборе образцов уже доводит эффективность такой панели из пяти маркеров к наиболее оптимальному значению, составляющему 97% корректно оцененных образцов.
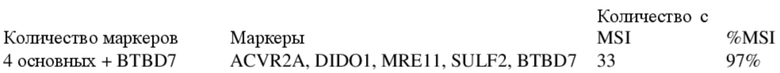
[0101] Третий анализ. Путем добавления дополнительного маркера (SEC31A) к набору из пяти маркеров все образцы могут быть оценены как MSI-H.

1. Автоматизированное определение профиля MSI по 7 маркерам с помощью MSI-теста Idylla™
[0102] Предпосылки: выявление микросателлитной нестабильности (MSI) рекомендовали для всех пациентов с колоректальным раком (CRC). В настоящее время клиническим золотым стандартом является иммуногистохимическое окрашивание белков, вовлеченных в репарацию ошибочно спаренных оснований, и/или ПЦР-анализ часто мутирующих участков с короткими тандемными повторами в ДНК. MSI-тест Idylla™, разработанный с применением нового набора коротких гомополимеров, выбранных из данных о полной экзомной последовательности посредством способа без смещения (Zhao et al. 2014; eLife), способен к более быстрому выявлению с более высокой специфичностью и селективносью по сравнению с существующими способами.
[0103] Способы: прототип картриджей для MSI-теста Idylla™ разрабатывали до окончательного варианта конструкции. Длину повтора при новом наборе из 7 биомаркеров определяли на 348 образцах CRC, фиксированных в формалине и залитых в парафин (FFPE), с использованием таких опытных тестов, которые обеспечивают возможность полностью автоматизированной последовательности выполняемых действий, в том числе получение образца, амплификацию ДНК с последующим анализом кривой плавления и автоматизированную интерпретацию данных. Несколько клинических баз и разных этнических групп образцов пациентов включали для оценки надежности выбора маркеров. Все образцы дополнительно подвергали скринингу с помощью референтной методики выявления MSI (система анализа MSI Promega).
[0104] Результаты: сто двадцать семь (36,5%) и 116 (33,3%) образцов классифицировали как характеризующиеся высокой MSI (MSI-H), а 209 (60,1%) и 220 (57,3%) образцов классифицировали как микросателлитно-стабильные (MSS) с помощью Idylla™ и Promega соответственно, в то время как 12 образцов (3,4%) не удалось классифицировать с помощью какой-либо методики. Анализ соответствия выявил общее совпадение, составляющее 96,1% (93,4% - 97,7%, 95% CI). 14 случаев классифицировали как MSI-H с помощью Idylla™, но с MSS (11) или недействительные (3) с помощью Promega; при этом медианный показатель положительных маркеров на основании Idylla™ составил 3/7.
[0105] Выводы: в данном исследовании проводили валидацию новых биомаркеров MSI в отношении их способности различать статус MSI-H и MSS в больших и разнообразных наборах образцов CRC. Также продемонстрировали возможность полностью автоматизированного анализа для тестирования MSI. Опытный MSI-тест Idylla™ совместим с полностью интегрированной платформой Idylla™, обеспечивая точные и надежные результаты в течение 150 минут с использованием лишь одного FFPE-среза опухоли (референтный образец не требовался).
Общие выводы
[0106] Представленная в данном документе панель лишь из четырех основных маркеров, включающих гомополимерные повторы в генах ACVR2A, DIDO1, MRE11 и SULF2, демонстрирует надлежащую эффективность в анализе образцов CRC. Также показана высокая эффективность в случае с образцами рака желудка и эндометрия, несмотря на тот факт, что у авторов настоящего изобретения была возможность доступа и определения профиля лишь в небольшом количестве из этих образцов. Определение профиля большего количества образцов с MSI-H, отличных по происхождению от CRC, с большой вероятностью подтверждает применимость минимальной основной панели из двух маркеров для более широкого спектра видов рака. В настоящее время очевидно, что гомополимер в гене ACVR2A представляет собой особенно эффективный и достаточно специфичный маркер MSI для CRC. Следовательно, в отношении других типов рака в качестве альтернативного варианта осуществления настоящего изобретения могут быть предложены и протестированы другие минимальные основные панели. Из представленных в данном документе предварительных данных видно, что могут быть предложены следующие три панели - из 4 основных маркеров: (1) DIDO1, SULF2, BTBD7 и SEC31A; (2) DIDO1, SULF2, BTBD7 и ACVR2A; и (3) DIDO1, SULF2, SEC31A и RYR3. Независимо от типов образцов с дефицитом MMR, для панели из 5 основных маркеров, содержащей ACVR2A, DIDO1, MRE11, SULF2 и BTBD7, было показано, что она в целом является подходящей для диагностирования в случае образцов разного происхождения и, следовательно, составляет особенно привлекательный вариант осуществления настоящего изобретения.
2. Новый набор из 7 вставок/делеций гомополимера для выявления MSI, ассоциированной с высокой мутационной нагрузкой опухоли и общей нагрузкой вставками/делециями, при раке эндометрия и колоректального рака
[0107] Предпосылки: блокирование контрольных точек иммунного ответа было ранее одобрено для лечения неоперабельных или метастатических опухолей с высокой микросателлитной нестабильностью (MSI-H) независимо от участка их локализации или гистологической характеристики. Наблюдаемый показатель ответа составил ~40%. В настоящее время отсутствует одобренный FDA тест для выявления статуса MSI. Опухоль с MSI-H характеризуется такими гистопатологическими характеристиками, как высокая инфильтрация лимфоцитами и высокая мутационная нагрузка опухоли. В частности, такие опухоли характеризуются высоким количеством мутаций типа «вставка/делеция», которые известны тем, что по сравнению с однонуклеотидными вариантами обуславливают сдвиг рамки считывания и, как следствие, приводят к избытку неоантигенов, которые являются высокоиммуногенными. Следовательно, высокий показатель вставок/делеций в опухолях с MSI-H может быть прогностическим фактором ответа на терапию антителом к PD1.
[0108] Способы. Авторы настоящего изобретения выбрали опухоли с MSI и MSS, для которых данные полного секвенирования экзома были доступны из предыдущего сообщения авторов настоящего изобретения (Zhao et al., eLife 2014). Они включают 11 образцов рака эндометрия с MSI, 22 образца колоректального рака с MSI и 89 образцов с MSS. Затем авторы настоящего изобретения определяли стратифицированную мутационную нагрузку по замещениям и вставкам/делециям исходя из данных полного секвенирования экзома. Семь маркеров, описанных в данном документе, амплифицировали и проводили секвенирование ампликонов по парным концевым тегам с помощью Illumina HiSeq 4000. Ампликоны секвенировали при минимальном охвате 5000x и среднем охвате 87000x. Образцы с MSS использовали для расчета средней процентной доли ридов с делециями. Маркер считался положительным, если процентная доля мутантных ридов была больше 6 SD (что соответствует P-значению <1,0e-5). Ряд маркеров дали высокие показатели фоновых мутаций из-за проскальзывания полимеразы в гомополимерном участке. Эти показатели находились в диапазоне от 6,6% (для ACVR2A) до 36,0% (для BTBD7).
[0109] Результаты. Девятнадцать опухолей с MSI-H были положительными по вставкам/делециям в по меньшей мере 2 из 6 маркерах, исходно подвергнутых скринингу, из-за технической сложности (показано на фиг. 5A), а затем полностью в 7 (показано на фиг. 5B) маркерах, тогда как опухоли с MSS не были положительными ни по одной из них. Дополнительно авторы настоящего изобретения определили корреляцию между количеством положительных вставок/делеций во всех доступных опухолях с MSI-H (n=19+14) с мутационной нагрузкой. Это выявило положительную корреляцию для как несинонимичной мутационной нагрузки, так и для мутационной нагрузки вставками/делециями (значения для всех 7 вставок/делеций взаимосвязаны: r=0,68, p<6,5e-05, и r=0,75, p<2e-16 соответственно). Что касается дополнительных маркеров вставок/делеций, которые были положительными, то авторы настоящего изобретения выявили повышение частоты мутаций вставок/делеций, составляющее 119 вставок/делеций, начиная с медианного показателя ~250 вставок/делеций на 3 положительных маркера. Результаты показаны на прилагаемых фигурах 3-6.
[0110] Вывод. Выборка из 7 вставок/делеций достоверно выявляет MSI-H в случае рака эндометрия и колоректального рака, в то время как количество положительных вставок/делеций служит в качестве показателя мутационной нагрузки опухоли, а также общей нагрузки опухоли вставками/делециями, и, таким образом, может использоваться в качестве теста нагрузки опухоли неоантигенами, которая является прогностическим фактором ответа опухолей с MSI-H на терапию в антителом к PD-1. Эти 7 маркеров будут доступны в качестве полностью автоматизированного MSI-теста Idylla™ для выявления статуса MSI и могут использоваться в качестве сопутствующей диагностики для прогнозирования исхода иммунотерапии опухолей с MSI-H.
3. Обзор стадирования опухоли CRC, связанного с подходящими, неподходящими, ошибочными и несовпадающими результатами при MSI-тесте Idylla™ и IHC-анализе
[0111] Материалы. Исследование проводили с 330 оставшимися образцами FFPE, полученными в результате рутинной диагностики в двух университетских клиниках: в университетской клинике Орхуса (клиническая база 1) и университетской клинике Антверпена (клиническая база 2). Образцы получили от пациентов с CRC, и они являлись репрезентативными для всех стадий CRC, включая стадию I. Данные IHC по MSI были предоставлены обеими исследовательскими центрами, и они основывались на результатах IHC-анализа ретроспективных FFPE-срезов (ретроспективных гистопатологических данных) согласно стандарту клинической практики (SoC). В обеих клинических базах проводили тестирование на MSI с использованием MSI-теста Idylla™, включающего 7 маркеров, описанных в данном документе. Тесты проводили по месту нахождения обоих клинических баз на наборах из 150 и 180 образцов соответственно. В информационных целях определяли соответствие данных MSI-теста Idylla™ и ретроспективных данных иммуногистохимического (IHC) анализа MSI. Из 330 образцов информация о стадии была недоступна для 16 образцов (см. также таблицу на фигуре 7), и она основывалась на данных, доступных в отчете о гистопатологическом анализе. В ряде случаев результаты стадирования Опухоль, узлы и метастазы (TNM) (в соответствии с требованиями 7-й редакции Американского объединенного комитета по онкологическим заболеваниям) были получены из параметров T и N только из-за ограниченности источника в отчете о гистопатологическом исследовании. В данном случае в исследуемой популяции 6,7% (N=22), 19,4% (N=64), 43,3% (N=143) и 25,8% (N=85) имели стадию I, стадию II, стадию III и стадию IV соответственно, что показано в первой колонке на фигуре 7.
[0112] Способы. MSI-тест Idylla™ проводили с образцами FFPE автоматизированным способом с использованием разработанной Biocartis системы на основе картриджа и платформы Idylla™. Образцы FFPE помещали в отдельные картриджи, содержащие реагенты, описанные выше, после чего проводили технологические операции с картриджами и анализ с помощью автоматизированной платформы в соответствии с описанными выше протоколами. Затем результаты, полученные после проведения MSI-теста Idylla™, объединяли с оценкой статуса MSI FFPE-образцов, которые оценивали с помощью IHC. Недействительный результат для двух FFPE-образцов подтверждали посредством перекрестного тестирования с помощью системы анализа MSI Analysis System v 1.2, основанной на панели Bethesda Promega, в соответствии с утвержденным производителем протоколом.
[0113] Результаты. Сравнение данных MSI-теста Idylla™ и ретроспективных данных иммуногистохимического анализа (IHC) MSI предоставлено только для информационных целей и показано на фигуре 7. Данные результаты показывают, что только два из в общей сложности 330 образцах были оценены как недействительные в MSI-тесте Idylla™, и что тест является надежным, поскольку во всех 330 проведенных тестах ошибки отсутствовали. Недействительность результата теста для двух образцов, вероятно, была обусловлена их низким качеством, что было подтверждено Promega MSI Analysis System v 1.2, которая также не смогла провести анализ указанных образцов (данные не показаны). Данные результаты в целом показывают надлежащее соответствие между результатами MSI-теста Idylla™ и результатами IHC-анализа. Важно отметить, что наряду с результатами IHC, MSI-тест Idylla™ также корректно идентифицировал фенотип MSI-H в двух образцах CRC стадии I. Это демонстрирует то, что для идентификации ранней стадии опухолей с MSI-H необходимо не только проводить тестирование на присутствие нарушений в пути MMR на уровне белка, но также можно выявлять сигнатуру микросателлитной нестабильности на уровне ДНК.
[0114] Вывод. Результаты подтвердили надежность способов анализа MSI в соответствии с настоящим изобретением и предоставили первое, насколько это известно авторам настоящего изобретения, клиническое доказательство того, что тест молекулярной сигнатуры MSI может корректно определить статус MSI-H при CRC стадии I. Это также указывает на то, что тест наиболее вероятно будет способен корректно идентифицировать статус MSI-H также при других типах рака стадии I.
Определения
[0115] Используемый в данном документе термин «биологический образец» или просто «образец» предназначен для включения ряда биологических источников, которые содержат нуклеиновую кислоту и/или клеточный материал, независимо от того, был он сразу получен из организма (т. е. свежий образец ткани) или законсервирован посредством любого способа, известного в данной области техники (например, замороженный образец или образец FFPE). Примеры биологических образцов включают культуры клеток, такие как клетки млекопитающих, а также клетки эукариотических организмов, биологические жидкости, осадки биологических жидкостей, образцы лаважа, образцы, полученные тонкоигольной аспирационной биопсией, биоптаты, образцы тканей, раковые клетки, другие типы клеток, полученные от пациента, клетки из культуры тканей или выращенные in vitro клетки от индивидуума, тестируемого в отношении заболевания или инфекции и/или проходящего лечение в отношении их, или образцы для криминалистического исследования. Неограничивающие примеры образцов биологической жидкости включают цельную кровь, костный мозг, цереброспинальную жидкость (CSF), перитонеальную жидкость, плевральную жидкость, лимфатическую жидкость, сыворотку крови, плазму крови, мочу, хилус, стул, эякулят, мокроту, аспират грудного соска, слюну, образцы мазков, жидкие образцы, полученные смывом или промыванием, и/или образцы, полученные с помощью щетки.
[0116] Используемый в данном документе термин «нуклеиновая кислота» и его эквивалент «полинуклеотид» означает полимер из рибонуклеотидов или дезоксирибонуклеотидов, связанных вместе фосфодиэфирными связями между нуклеотидными мономерами. (Дезокси)нуклеотиды являются фосфорилированными формами (дезокси)нуклеозидов, которые наиболее часто включают аденозин, гуанозин, цитидин, тимидин или уридин. Такие нуклеозиды состоят из сахара пентозы, представляющего собой рибозу или дезоксирибозу, и азотистого основания («нуклеинового основания» или просто «основания»), представляющего собой либо аденин, гуанин (которые относятся к пуринам), цитозин, тимин, либо урацил (которые относятся к пиримидинам). Последовательность, с которой такие основания (или их нуклеозиды, или нуклеотиды последних) расположены в нити нуклеиновой кислоты, называют «последовательностью нуклеиновой кислоты», и их традиционно приводят в направлении от так называемого 5'-конца к 3'-концу, ссылаясь на химическую ориентацию нити нуклеиновой кислоты. «5'» берет начало от 5'-углерода первого (дезокси)рибозного кольца, с которого начинается чтение последовательности нуклеиновой кислоты, и «3'» берет начало от 3'-углерода последнего (дезокси)рибозного кольца, на котором чтение последовательности нуклеиновой кислоты заканчивается. Последовательности нуклеиновой кислоты могут, например, представлять собой ATATGCC, что следует интерпретировать в данном документе как 5'-ATATGCC-3' последовательность нуклеиновой кислоты. По такому же правилу последняя последовательность будет комплементарна последовательности 5'-GGCATAT-3' или просто GGCATAT. Последовательность нуклеиновой кислоты может быть последовательностью гомополимерного повтора, т. е. последовательностью, полученной из определенного количества последовательных нуклеотидов, которые содержат одно и то же азотистое основание, которое также называют в данном документе «гомонуклеотидом». Например, термин «гомополимерный повтор, содержащий 8 последовательных аденинов» следует толковать как относящийся к по меньшей мере части нуклеиновой кислоты, при этом указанная часть состоит из цепи, содержащей 8 последовательных нуклеотидов, где каждый из указанных нуклеотидов содержит аденин в качестве азотистого основания. Такая последовательность будет обозначена как 5'-AAAAAAAA-3' (или просто AAAAAAAA), тогда как комплементарная ей последовательность будет обозначена как 5'-TTTTTTTT-3' (или TTTTTTTT). Термины «мутантная форма гомополимерного повтора» или «их мутантные формы» должны толковаться в данном документе как относящиеся к вариантам MSI указанного гомополимерного повтора, которые предусматривают вставку или делецию (то есть «вставкой/делецией») по меньшей мере одного гомонуклеотида. Например, мутантная форма гомополимерного повтора, содержащая 8 последовательных аденинов, будет гомополимерным повтором, содержащим 7 последовательных аденинов, или гомополимерным повтором, содержащим 9 последовательных аденинов. Нуклеиновые кислоты включают без ограничения ДНК и РНК, в том числе, например, геномную ДНК, митохондриальную или мтДНК, кДНК, мРНК, рРНК, тРНК, гетерогенную ядерную РНК, микроРНК, длинную некодирующую РНК, миРНК и их различные модифицированные варианты. Нуклеиновые кислоты, как правило, можно получить из природных источников, таких как биологические образцы, полученные от разных типов организмов. С другой стороны, нуклеиновые кислоты можно также синтезировать, получать с помощью рекомбинации или других любых из известных разработанных человеком способов (например, ПЦР).
[0117] Термином «количественная ПЦР» или просто «qPCR» в данном документе определяется лабораторная методика, основанная на полимеразной цепной реакции (ПЦР), которую применяют для амплификации и одновременного выявления или количественной оценки целевой молекулы ДНК. В отличие от стандартной ПЦР, где продукт реакции выявляют при ее завершении, т. е. после окончания термоциклирования, ключевой характеристикой qPCR является то, что ДНК-продукт выявляют в ходе термоциклирования по мере прохождения реакции «в режиме реального времени»; поэтому альтернативным названием qPCR является «ПЦР в режиме реального времени». В настоящее время существует много разных типов qPCR. Например, если начинать со стадии обратной транскрипции (RT), то qPCR можно использовать для количественной оценки числа матричных РНК, и в таком случае ее называют qPCR с обратной транскрипцией или RT-qPCR. Используемые в данном документе термины «количественная ПЦР» или просто «qPCR» будут использоваться с предпочтением перед терминами «ПЦР в режиме реального времени» или «RT-PCR», чтобы избежать путаницы с «ПЦР с обратной транскрипцией», которую также часто сокращают как RT-PCR. В большинстве анализов qPCR используют одну из двух наиболее распространенных методик выявления продукта амплификации в режиме реального времени: (a) интеркаляцию неспецифических флуоресцентных красителей с любой двухнитевой ДНК или (b) использование специфичных в отношении последовательности ДНК-зондов, состоящих из олигонуклеотидов, которые мечены флуоресцентным репортером, который обеспечивает возможность выявления только после гибридизации зонда с комплементарной ему целевой последовательностью. Флуоресцентные сигналы, генерируемые в ходе термоциклирования, выявляют с помощью соответствующей оптической системы для выявления и отслеживают, начиная с того момента, когда они проходят фоновый пороговый уровень, и до тех пор, пока реакция не достигнет плато. Количество копий целевых последовательностей можно оценивать с помощью стратегий относительного или абсолютного количественного определения, обычно путем проведения анализа формы полученной кривой амплификации (стратегия стандартной кривой) или путем определения момента, когда сигнал превышает некоторое пороговое значение (часто называемое значением Ct, но иногда также значением Cp или значением Cq). При относительном количественном определении уровни целевой нуклеиновой кислоты, оцениваемые в конкретном образце с использованием Ct или анализа стандартной кривой, выражают относительно значений, полученных для той же мишени в другом референтном образце, например, необработанном контрольном образце. И наоборот, при абсолютном количественном определении сигнал qPCR сопоставляют с исходным количеством копий с использованием стандартной кривой, или его также можно вычислять в соответствии с более современной методикой цифровой ПЦР. В настоящее время первая стратегия по-прежнему является более употребительной, и она основана на оценке количества целевой ДНК путем сравнения полученных значений с предварительно построенной стандартной кривой. Эти и другие стратегии количественного определения qPCR широко известны в данной области техники, и характерное для них вычисление может различаться в большей или меньшей степени в зависимости от конкретного применения и системы qPCR.
[0118] Используемый в данном документе термин «средства для проведения количественной ПЦР» следует понимать как минимальную необходимую совокупность реагентов и элементов для проведения qPCR. Обычно они включают любые реагенты, обеспечивающие поддающееся выявлению при ПЦР в режиме реального времени термоциклирование матрицы, представляющую собой нуклеиновую кислоту, полученной из источника нуклеиновой кислоты. В зависимости от типа qPCR такие реагенты включают без ограничения полимеразу, предназначенную для ПЦР, по меньшей мере один набор праймеров, поддающийся выявлению краситель или зонд, dNTP, буфер для ПЦР и т. д. Кроме того, «средства для проведения количественной ПЦР» обычно также будут включать любую стандартную известную в данной области техники минимальную сборочную единицу из частей, которая обычно без ограничения включает следующее: (1) подходящий отсек (далее называемый «отсеком для термоциклирования в рамках qPCR»), где происходит поддающееся выявлению в режиме реального времени термоциклирование. Такие отсеки могут, например, быть образованы камерой, подходящей для амплификации нуклеиновых кислот, т. е. изготовленной из соответствующего материала и обеспечивающей возможность достаточной регуляции внутренней температуры, а также содержащей по меньшей мере одну перегородку, позволяющую выявлять в режиме реального времени сигналы, генерируемые в ходе такой амплификации, например, светопроницаемую перегородку. Кроме того, (2) средства для изменения температуры в данной камере или другом отсеке широко известны из различных существующих установок для термоциклирования. Затем (3) средства для выявления сигналов, генерируемых в ходе термоциклирования при qPCR, такие как оптический детектор, соединенный с компьютером и т. д. Если вкратце, то такая минимальная сборочная единица обычно будет включать любую известную в данной области техники систему или системы, способные к инициации и поддержанию реакции термоциклирования в отсеке для термоциклирования при qPCR, настраивая и регулируя температуру для обеспечения стабильных условий термоциклирования в нем и т. п. Кроме того, она также будет предусматривать любое соответствующее устройство или устройства для выявления, средства для обработки данных (например, компьютер, альтернативно соединенный с базой данных) и системы вывода, позволяющие считывать и контролировать термоциклирование в ходе реакции qPCR в режиме реального времени (с использованием компьютерного экрана, на котором отображается ход реакции в соответствующем графическом пользовательском интерфейсе). Дополнительно она также будет содержать любые пакеты программного обеспечения, подходящие для эксплуатации аппарата и/или отображения полученных результатов, и которые при необходимости содействуют их интерпретации.
[0119] Под используемым в данном документе термином «картридж» следует понимать замкнутую сборочную единицу из камер и/или каналов, которая сформирована в виде единого объекта, который можно переносить или передвигать как таковой, прикрепленный к внутренней или внешней части более крупного прибора, подходящего для приема такого картриджа или соединения с ним. Некоторые части, содержащиеся в картридже, могут быть прочно соединены, в то время как другие могут быть гибко соединены и могут перемещаться относительно других компонентов картриджа. Аналогично под используемым в данном документе термином «струйный картридж» следует понимать картридж, включающий по меньшей мере одну камеру или один канал, подходящие для обработки, подготовки, выпуска или осуществления анализа текучей среды, предпочтительно жидкости. Пример такого картриджа представлен в WO2007004103. Предпочтительно струйный картридж может представлять собой микроструйный картридж. В контексте струйных картриджей выражения «выше» и «ниже» могут быть определены как относящиеся к направлению, в котором текучие среды текут в таком картридже. А именно, отрезок струйного пути в картридже, из которого текучая среда течет перетекает во второй отрезок в том же картридже, следует интерпретировать как установленный выше в отношении последнего. Аналогично отрезок, к которому текучая среда прибывает позже, расположен ниже отрезка, который пройден указанной текучей средой ранее.
[0120] В целом используемые в данном документе термины «струйный» или иногда «микроструйный» относятся к системам и конструкциям, имеющим отношение к характеру, контролю и манипулированию в отношении текучих сред, которые геометрически ограничены в маленьком, обычно меньше миллиметра, масштабе в по меньшей мере одном или двух измерениях (например, ширина и высота или канал). Такие малообъемные текучие среды перемещают, смешивают, разделяют или иным образом обрабатывают в микромасштабе, требующем малого размера и низкого потребления энергии. Микроструйные системы включают такие структуры, как микропневматические системы (источники давления, насосы для перекачки жидкостей, микроклапаны и т. д.) и микроструйные структуры для манипуляций в микро-, нано- и пиколитровых объемах (микроструйные каналы и т. д.). Иллюстративные струйные системы были описаны в EP1896180, EP1904234 и EP2419705, и, соответственно, могут использоваться в определенных вариантах осуществления представленного в данном документе изобретения.
[0121] Применяемый в данном документе термин «DWT» обозначает дискретное вейвлет-преобразование; термин «коэффициент dwt» обозначает коэффициент дискретного вейвлет-преобразования. Вейвлет-преобразование означает расчет с применением программы или подпрограммы с использованием исходных данных. Таким образом, набор коэффициентов dwt представляет собой преобразованный с помощью вейвлет-преобразования набор величин. Наиболее подходящими коэффициентами dwt для анализа нуклеиновой кислоты являются те коэффициенты, которые охватывают значимые события эксперимента, например, в случае эксперимента с плавлением молекулы двухнитевой нуклеиновой кислоты наиболее подходящими коэффициентами dwt могут быть пики или сдвиги пиков в исходных данных кривой плавления.
[0122] Применяемые в данном документе термины «исходные данные кривой плавления», «исходные данные по кривой плавления» и «исходные данные для кривой плавления» эквивалентны и используются взаимозаменяемо. Они обозначают характеристики, полученные в результате экспериментов по диссоциации или ассоциации нуклеиновых кислот.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Биокартис НВ
<120> ПАНЕЛЬ БИОМАРКЕРОВ И СПОСОБЫ ВЫЯВЛЕНИЯ МИКРОСАТЕЛЛИТНОЙ НЕСТАБИЛЬНОСТИ
ПРИ РАЗНЫХ ВИДАХ РАКА
<130> BCT-094
<150> EP18168304.6
<151> 2018-04-19
<150> EP18153059.9
<151> 2018-01-23
<160> 21
<170> BiSSAP 1.3.6
<210> 1
<211> 19
<212> ДНК
<213> Homo sapiens
<400> 1
tagcgtgtga atcggacat 19
<210> 2
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 2
ttgactgggc agatagggga 20
<210> 3
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 3
atagttcacc catggaaacc 20
<210> 4
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 4
ggaggagaat cttagggaaa 20
<210> 5
<211> 16
<212> ДНК
<213> Homo sapiens
<400> 5
actggactcc cgctgg 16
<210> 6
<211> 19
<212> ДНК
<213> Homo sapiens
<400> 6
cgctcagcct ccataaatc 19
<210> 7
<211> 25
<212> ДНК
<213> Homo sapiens
<400> 7
caacttcatt tcttttcagt acctt 25
<210> 8
<211> 20
<212> ДНК
<213> Homo sapiens
<400> 8
ctgtccagat accatttctc 20
<210> 9
<211> 22
<212> ДНК
<213> Homo sapiens
<400> 9
agcatccatc tcttgaagac at 22
<210> 10
<211> 23
<212> ДНК
<213> Homo sapiens
<400> 10
gcatgtttct gccaataatc tct 23
<210> 11
<211> 17
<212> ДНК
<213> Homo sapiens
<400> 11
caacttcagc aggctgt 17
<210> 12
<211> 21
<212> ДНК
<213> Homo sapiens
<400> 12
agtctgagaa gcatcaattt t 21
<210> 13
<211> 24
<212> ДНК
<213> Homo sapiens
<400> 13
cattttctaa atgcctccct taaa 24
<210> 14
<211> 19
<212> ДНК
<213> Homo sapiens
<400> 14
gtccattagg cacaaaaag 19
<210> 15
<211> 34
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая ДНК
<400> 15
cgcacgacat ggaaaaaaaa aatccgtgcg taaa 34
<210> 16
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая последовательность
<400> 16
cgtcgaacct taaaaaaaaa agttaccgac gaa 33
<210> 17
<211> 36
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая ДНК
<400> 17
cgcacgactt attaaaaaaa aatgacagtg cgtaaa 36
<210> 18
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая ДНК
<400> 18
cgtcggtacc ttaaaaaaaa acatcacgac gaa 33
<210> 19
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая ДНК
<400> 19
gtgcataaaa aaagagcact aaa 23
<210> 20
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая ДНК
<400> 20
cgcacttgcc aaaaaaaatt gatggtgcgt aaa 33
<210> 21
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Синтетическая ДНК
<400> 21
cgtcgccctt aaaaaaaaac tgccgacgaa 30
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| УЛУЧШЕННОЕ ВЫЯВЛЕНИЕ КОРОТКИХ ГОМОПОЛИМЕРНЫХ ПОВТОРОВ | 2016 |
|
RU2730622C2 |
| Способ создания таргетной панели для исследования геномных регионов для выявления терапевтических биомаркеров ингибиторов иммунных контрольных точек (ИКТ) | 2023 |
|
RU2818360C1 |
| СПОСОБ IN VITRO ДИАГНОСТИКИ ИЛИ ПРОГНОЗИРОВАНИЯ КОЛОРЕКТАЛЬНОГО РАКА ИЛИ ЕГО ПРЕДРАКОВОЙ СТАДИИ | 2020 |
|
RU2831090C2 |
| ГЕН MTS, МУТАЦИИ ДАННОГО ГЕНА И СПОСОБЫ ДИАГНОСТИКИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ С ИСПОЛЬЗОВАНИЕМ ПОСЛЕДОВАТЕЛЬНОСТИ ГЕНА MTS | 1995 |
|
RU2164419C2 |
| МУТАЦИИ ГЕНА МТS В ЗАРОДЫШЕВОЙ ЛИНИИ И СПОСОБ ВЫЯВЛЕНИЯ ПРЕДРАСПОЛОЖЕННОСТИ К ЗЛОКАЧЕСТВЕННЫМ ОПУХОЛЯМ В ГЕНЕ МТS | 1995 |
|
RU2161309C2 |
| ИММУННЫЕ КЛЕТКИ, ДЕФЕКТНЫЕ ПО Suv39h1 | 2018 |
|
RU2784531C2 |
| СПОСОБЫ КЛАССИФИКАЦИИ ПАЦИЕНТОВ С СОЛИДНЫМ РАКОМ | 2017 |
|
RU2745730C2 |
| УЛАВЛИВАНИЕ И ХАРАКТЕРИСТИКА СОВМЕСТНО ЛОКАЛИЗОВАННОГО ХРОМАТИНА | 2006 |
|
RU2478716C2 |
| СПОСОБЫ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ РАКА ПОЧКИ | 2017 |
|
RU2752322C2 |
| СПОСОБ АНАЛИЗА ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ МОЛОЧНОЙ ЖЕЛЕЗЫ | 2008 |
|
RU2492243C2 |
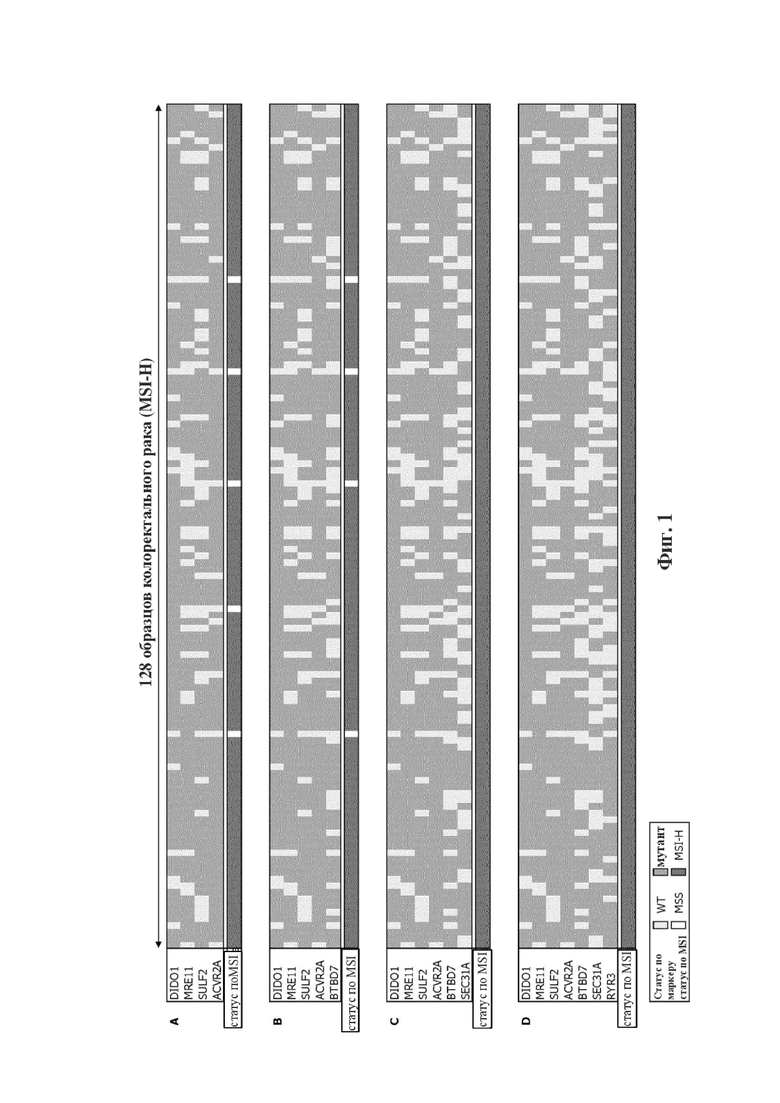

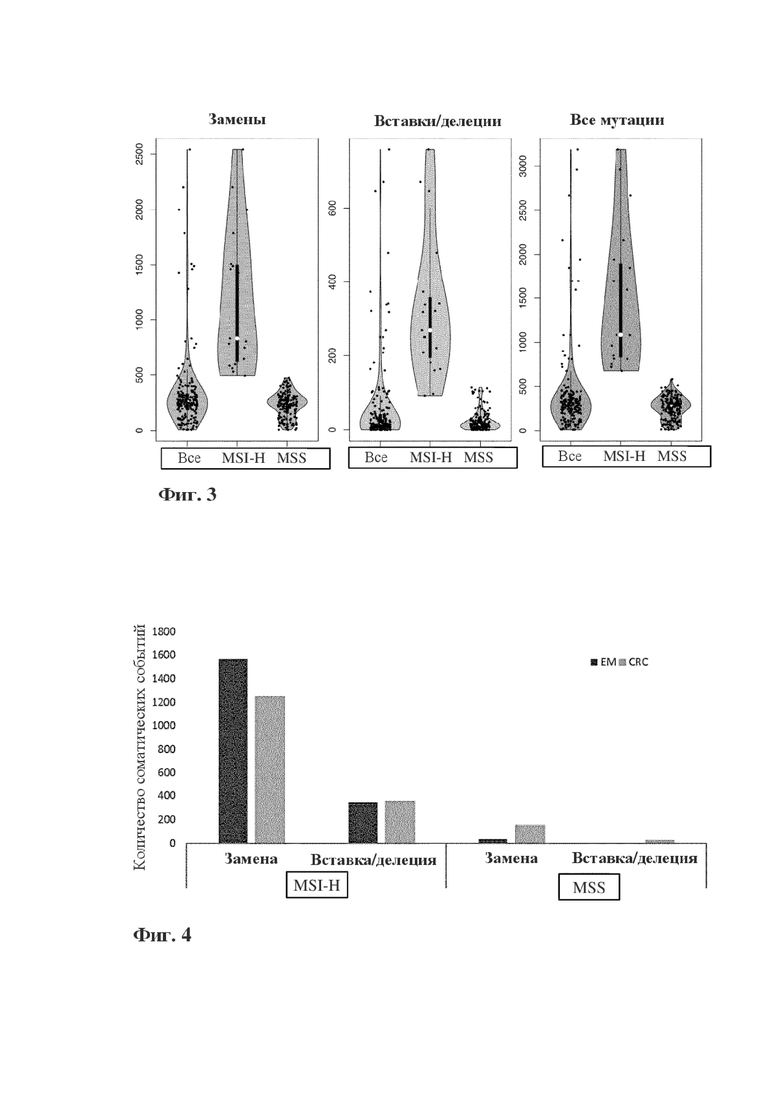
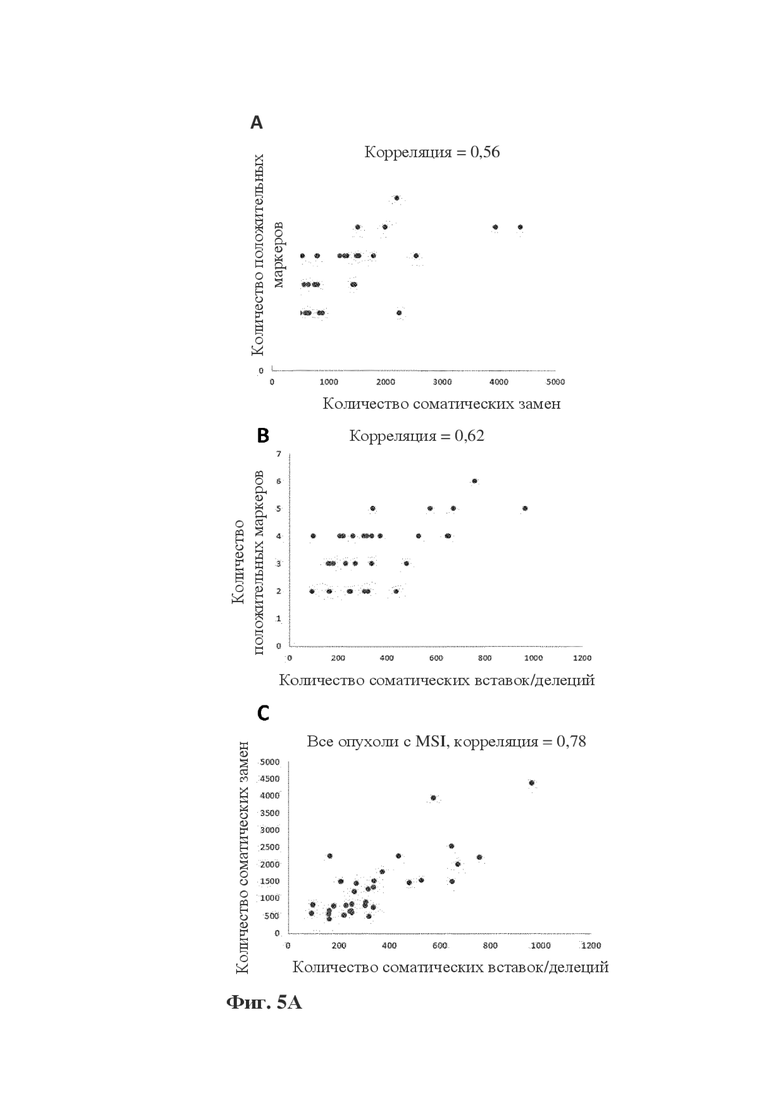
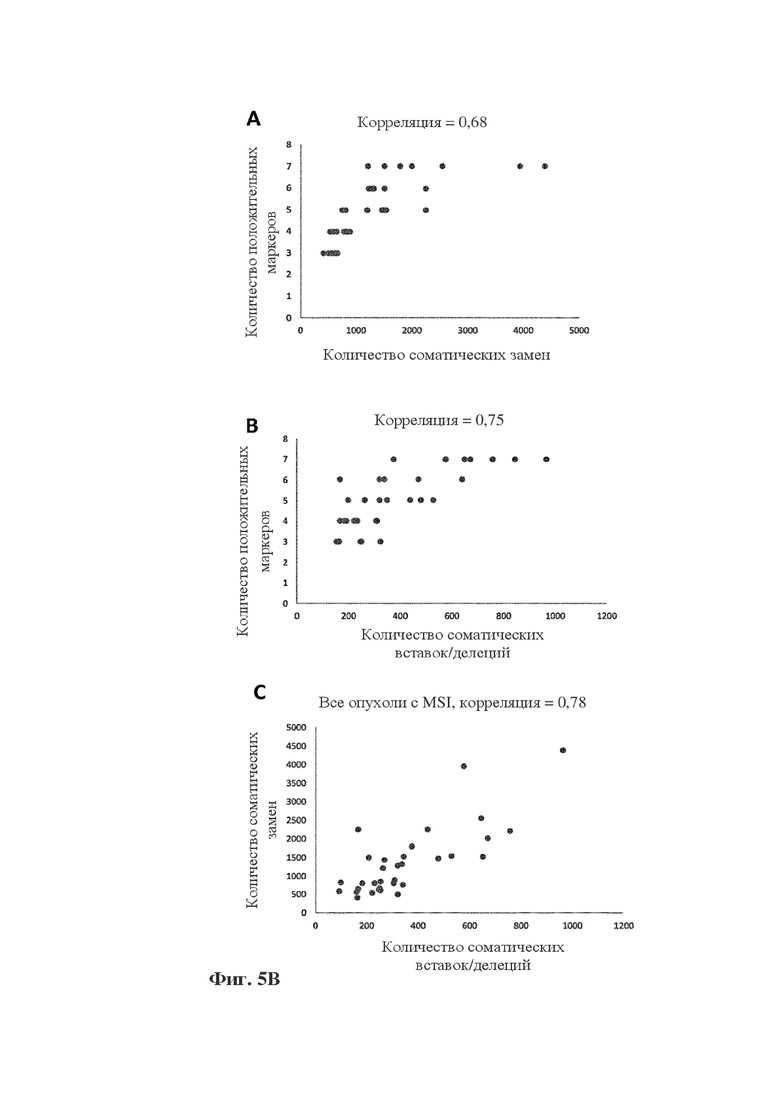
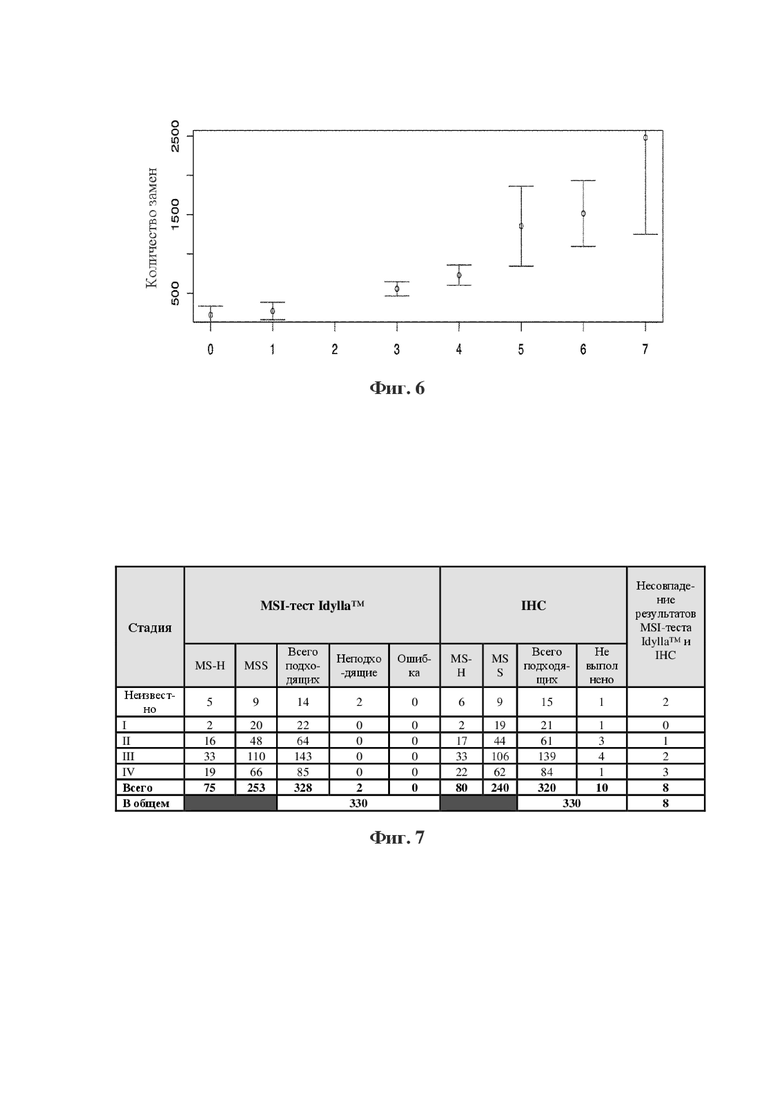
Настоящее изобретение относится к медицинской биотехнологии, а именно к онкологии, в частности к видам рака, характеризующимся микросателлитной нестабильностью (MSI) и/или дефицитом репарации ошибочно спаренных оснований (MMR−). Представлена диагностическая панель маркеров для анализа локусов MSI вместе со способом и набором для применения указанной панели в выявлении видов рака, характеризующихся микросателлитной нестабильностью (MSI) и/или дефицитом репарации ошибочно спаренных оснований (MMR−). Представлена клетка, полученная из клеточной линии НТС116 c1.110268743, для применения в качестве контрольного биологического образца. Изобретение позволяет выявлять MSI в CRC даже на его ранних стадиях в образцах раковых тканей, таких как рак яичника, рак эндометрия и рак желудка, а также для прогностических и долговременных исследований в контексте иммунотерапии. 4 н. и 19 з.п. ф-лы, 7 ил.
1. Панель биомаркеров для анализа локусов MSI в биологическом образце колоректальной опухоли, опухоли эндометрия или желудка, при этом панель содержит следующие участки гомополимерных повторов, которые картированы на референтный геном человека GRCh38/hg38:
гомополимерный повтор, содержащий 11 последовательных аденинов, локализованный в гене DIDO1 человека и начинающийся с положения chr20:62905340;
гомополимерный повтор, содержащий 11 последовательных аденинов, локализованный в гене MRE11 человека и начинающийся с положения chr11:94479765;
гомополимерный повтор, содержащий 10 последовательных аденинов, локализованный в гене SULF2 человека и начинающийся с положения chr20:47657577; и
гомополимерный повтор, содержащий 8 последовательных аденинов, локализованный в гене ACVR2A человека и начинающийся с положения chr2:147926117.
2. Панель по п. 1, дополнительно содержащая любой один, два или все из следующих участков гомополимерных повторов, которые картированы на референтный геном человека GRCh38/hg38:
гомополимерного повтора, содержащего 9 последовательных тиминов, локализованного в гене SEC31A человека и начинающегося с положения chr4:82864412;
гомополимерного повтора, содержащего 10 последовательных аденинов, локализованного в гене BTBD7 человека и начинающегося с положения chr14:93241685;
гомополимерного повтора, содержащего 10 последовательных аденинов, локализованного в гене RYR3 человека и начинающегося с положения chr15:33865341.
3. Способ анализа локусов MSI в биологическом образце колоректальной опухоли, опухоли эндометрия или желудка, предусматривающий стадии:
- амплифицирования участков нуклеиновой кислоты, содержащих гомополимерные повторы, которые картированы на референтный геном человека GRCh38/hg38:
гомополимерный повтор, содержащий 11 последовательных аденинов, локализованный в гене DIDO1 человека и начинающийся с положения chr20:62905340;
гомополимерный повтор, содержащий 11 последовательных аденинов, локализованный в гене MRE11 человека и начинающийся с положения chr11:94479765;
гомополимерный повтор, содержащий 10 последовательных аденинов, локализованный в гене SULF2 человека и начинающийся с положения chr20:47657577; и
гомополимерный повтор, содержащий 8 последовательных аденинов, локализованный в гене ACVR2A человека и начинающийся с положения chr2:147926117; и
- определения количества нуклеотидов в указанных гомополимерных повторах.
4. Способ по п. 3, дополнительно предусматривающий определение количества нуклеотидов в любом одном, двух или всех из следующих участков гомополимерных повторов, которые картированы на GRCh38/hg38:
гомополимерного повтора, содержащего 9 последовательных тиминов, локализованного в гене SEC31A человека и начинающегося с положения chr4:82864412;
гомополимерного повтора, содержащего 10 последовательных аденинов, локализованного в гене BTBD7 человека и начинающегося с положения chr14:93241685;
гомополимерного повтора, содержащего 10 последовательных аденинов, локализованного в гене RYR3 человека и начинающегося с положения chr15:33865341.
5. Способ по любому из пп. 3, 4, где результатом стадии амплифицирования является получение данных кривой плавления.
6. Способ по п. 5, дополнительно предусматривающий стадии:
(a) применения вейвлет-преобразования в отношении данных кривой плавления и
(b) применения результатов, полученных на (а), в определении количества нуклеотидов в любом из гомополимерных повторов, перечисленных в пп. 3-4.
7. Способ по любому из пп. 3-6, где стадия амплифицирования предусматривает применение по меньшей мере одного зонда типа «молекулярный маяк», где зонд типа «молекулярный маяк» выбран из SEQ ID NO: 15-21.
8. Способ по любому из пп. 3-7, где стадия амплифицирования предусматривает применение по меньшей мере одного праймера, имеющего последовательность, идентифицированную с помощью любого из следующих SEQ ID NO: 1-14.
9. Способ по любому из пп. 3-8, где стадия амплифицирования предусматривает по меньшей мере одну дуплексную амплификацию пары гомополимерных повторов, при этом указанная пара выбрана из следующих комбинаций:
- дуплексной амплификации гомополимерного повтора, содержащего 11 последовательных аденинов, локализованного в гене DIDO1 человека и начинающегося с положения chr20:62905340, вместе с гомополимерным повтором, содержащим 11 последовательных аденинов, локализованным в гене MRE11 человека и начинающимся с положения chr11:94479765;
- дуплексной амплификации гомополимерного повтора, содержащего 8 последовательных аденинов, локализованного в гене ACVR2A человека и начинающегося с положения chr2:147926117, вместе с гомополимерным повтором, содержащим 9 последовательных тиминов, локализованным в гене SEC31A человека и начинающимся с положения chr4:82864412; и
- дуплексной амплификации гомополимерного повтора, содержащего 10 последовательных аденинов, локализованного в гене BTBD7 человека и начинающегося с положения chr14:93241685, вместе с гомополимерным повтором, содержащим 10 последовательных аденинов, локализованным в гене SULF2 человека и начинающимся с положения chr20:47657577.
10. Способ по любому из пп. 3-9, где определение количества нуклеотидов в любом из гомополимерных повторов, перечисленных в пп. 3-4, также дополнительно выполняют в контрольном биологическом образце, содержащем материал, полученный из клеточной линии НТС116 c1.110268743.
11. Способ по любому из пп. 3-10, где образец опухоли представляет собой опухоль I стадии, предпочтительно представляющую собой колоректальную опухоль I стадии.
12. Способ по любому из пп. 3-11, дополнительно предусматривающий стадию применения полученной информации о количестве гомополимерных повторов для установления мутационной нагрузки опухоли или нагрузки опухоли вставками/делециями.
13. Способ по п. 12, где установленная мутационная нагрузка опухоли или нагрузка опухоли вставками/делециями представлена в виде оценки общего количества мутаций или представлена в виде балльной оценки.
14. Способ по любому из пп. 3-13, дополнительно предусматривающий стадию применения полученной информации о количестве гомополимерных повторов, или о мутационной нагрузке опухоли, или о нагрузке опухоли вставками/делециями, или об оценке общего количества мутаций, или о балльной оценке для принятия решения о проведении иммунотерапии у субъекта, от которого получен биологический образец.
15. Набор для анализа локусов MSI в биологическом образце колоректальной опухоли, опухоли эндометрия или желудка, при этом набор содержит праймеры или зонды, выполненные с возможностью специфически гибридизироваться с участками нуклеиновой кислоты или амплифицировать их, при этом участки нуклеиновой кислоты содержат следующие участки гомополимерных повторов, которые картированы на референтный геном человека GRCh38/hg38:
гомополимерный повтор, содержащий 11 последовательных аденинов, локализованный в гене DIDO1 человека и начинающийся с положения chr20:62905340;
гомополимерный повтор, содержащий 11 последовательных аденинов, локализованный в гене MRE11 человека и начинающийся с положения chr11:94479765;
гомополимерный повтор, содержащий 10 последовательных аденинов, локализованный в гене SULF2 человека и начинающийся с положения chr20:47657577; и
гомополимерный повтор, содержащий 8 последовательных аденинов, локализованный в гене ACVR2A человека и начинающийся с положения chr2:147926117.
16. Набор по п. 15, дополнительно содержащий праймеры или зонды, выполненные с возможностью специфически гибридизироваться с участками нуклеиновой кислоты или амплифицировать их, при этом участки нуклеиновой кислоты содержат один, два или все из следующих гомополимерных повторов, которые картированы на референтный геном человека GRCh38/hg38:
гомополимерного повтора, содержащего 9 последовательных тиминов, локализованного в гене SEC31A человека и начинающегося с положения chr4:82864412;
гомополимерного повтора, содержащего 10 последовательных аденинов, локализованного в гене BTBD7 человека и начинающегося с положения chr14:93241685;
гомополимерного повтора, содержащего 10 последовательных аденинов, локализованного в гене RYR3 человека и начинающегося с положения chr15:33865341.
17. Набор по п. 15 или 16, где праймеры содержат по меньшей мере один праймер или пару праймеров, выбранных из SEQ ID NO: 14.
18. Набор по п. 15 или 16, где зонды содержат зонд типа «молекулярный маяк».
19. Набор по п. 18, где зонд типа «молекулярный маяк» выбран из SEQ ID NO: 15-21.
20. Набор по любому из пп. 15-19, дополнительно содержащий материал, полученный из клеточной линии НТС116 c1.110268743.
21. Набор по любому из пп. 15-20, дополнительно содержащий картридж.
22. Клетка, полученная из клеточной линии НТС116 c1.110268743, для применения в качестве контрольного биологического образца в способе по любому из пп. 3-14, содержащая участки нуклеиновой кислоты, содержащие следующие участки гомополимерных повторов, которые картированы на референтный геном человека GRCh38/hg38:
гомополимерный повтор, содержащий 10 последовательных аденинов, локализованный в гене DIDO1 человека и начинающийся с положения chr20:62905340;
гомополимерный повтор, содержащий 10 последовательных аденинов, локализованный в гене MRE11 человека и начинающийся с положения chr11:94479765;
гомополимерный повтор, содержащий 9 последовательных аденинов, локализованный в гене SULF2 человека и начинающийся с положения chr20:47657577; и
гомополимерный повтор, содержащий 7 последовательных аденинов, локализованный в гене ACVR2A человека и начинающийся с положения chr2:147926117.
23. Клетка по п. 22, дополнительно содержащая участки нуклеиновой кислоты, содержащие один, два или все из следующих участков гомополимерных повторов, которые картированы на референтный геном человека GRCh38/hg38:
гомополимерного повтора, содержащего 8 последовательных тиминов, локализованного в гене SEC31A человека и начинающегося с положения chr4:82864412;
гомополимерного повтора, содержащего 9 последовательных аденинов, локализованного в гене BTBD7 человека и начинающегося с положения chr14:93241685;
гомополимерного повтора, содержащего 9 последовательных аденинов, локализованного в гене RYR3 человека и начинающегося с положения chr15:33865341.
| WO 2013153130 A1, 17.10.2013 | |||
| СПОСОБЫ ЛЕЧЕНИЯ РАКА, ВКЛЮЧАЮЩИЕ СВЯЗЫВАЮЩИЕ TIGIT АГЕНТЫ | 2017 |
|
RU2765410C2 |
| YOSEF E MARUVKA et al | |||
| Analysis of somatic microsatellite indels identifies driver events in human tumors, NATURBIOTECHNOLOGY, vol | |||
| Скоропечатный станок для печатания со стеклянных пластинок | 1922 |
|
SU35A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
Авторы
Даты
2023-05-03—Публикация
2019-01-22—Подача