ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
В настоящей заявке испрашивается приоритет и преимущества Европейских патентных заявок №№ЕР17207740.6, ЕР17207746.3, и ЕР17207750.5, каждая была подана 15 декабря 2017 г., раскрытие которых полностью включено в настоящую заявку в качестве ссылки.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Настоящая заявка содержит перечень последовательностей, который был подан электронно в ASCII формате и, таким образом, полностью включен в качестве ссылки. Указанная ASCII копия, созданная 30 ноября 2018 г., называется BHC_168028_SL.txt и имеет размер 78795 байт.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
В настоящей заявке описаны иммуностимулирующие олигонуклеотиды и композиции и способы их применения. Более специфически, описаны иммуностимулирующие олигонуклеотиды, способы оптимизации
иммуностимулирующих свойств олигонуклеотидов, и способы применения иммуностимулирующих олигонуклеотидов для вызывания иммунного ответа, опосредованного толл-подобным рецептором 21 (TLR21).
Предпосылки создания изобретения
Некоторые определяющие молекулярные структуры микроорганизмов, включая и другие антигены на поверхности микроорганизмов, а также внутренние составы, такие как определенные мотивы, содержащиеся в геноме микроорганизмов (например, неметилированные CpG мотивы), могут быть распознаны иммунной системой организма-хозяина и вызывать иммунные ответы. Взаимодействие между этими определяющими молекулярными структурами или ассоциированными с патогеном характерными молекулярными структурами (РАМР) и рецепторами хозяина, распознающими когнатный антиген, может инициировать каскады передачи сигналов в клетках, задействованные в иммунные ответы. Толл-подобный рецептор 21 (TLR21) представляет собой куриный функциональный гомолог толл-подобного рецептора 9 (TLR9) млекопитающих и РАМР рецептора, способного распознавать неметилированные CpG мотивы. Было показано, что активация TLR21 с помощью нуклеиновых кислот, имеющих эти CpG мотивы, активирует клеточные сигналы, вовлеченные в иммунные ответы на микробную инфекцию.
Понимание роли TLR21 в иммунном ответе у кур не приводило к сдвигу в предотвращении или лечении заболевания в птицеводческой промышленности. Большие популяции птиц в брудерных предприятиях имеют повышенный риск инфицирования микроорганизмами на всех стадиях жизни вследствие чрезвычайной густонаселенности и нестерильных условий окружающей среды, но доступные в настоящее время профилактические композиции и лечения после инфицирования, как правило, не вызывают РАМР-опосредованные иммунные ответы. Наоборот, крупномасштабные производственные предприятия полагаются только на коммерчески доступные вакцины и антибиотики для предотвращения или лечения инфекционных вспышек. Несмотря на то, что антибиотики становятся неблагоприятными в связи с проблемами устойчивости и нежелательными последствиями потребления обработанного мяса, введение антибиотиков остается стандартной методикой работы во многих сельскохозяйственных производствах, включая крупномасштабные брудерные птицефабрики, и внедрение новых методов может быть недопустимо дорогим и обременительным. Одним из препятствий внедрения TLR21 агонистов в качестве профилактического средства или для лечения инфекции являются неэффективности, связанные со скринингом большого количества кандидатных соединений, которые эффективно тормозят поиски для идентификации таких агонистов.
Таким образом, существует потребность в TLR21 стимулирующих композициях, способах их идентификации и оптимизации иммуностимулирующих свойств композиций. Описанные способы и композиции направлены на эти и другие чрезвычайно важные потребности.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В настоящей заявке описаны олигонуклеотиды, содержащие по меньшей мере один CpG мотив и обогащенную гуаниновыми нуклеотидами ("гуанин-обогащенная") последовательность, начинающиеся на или в пределах четырех нуклеотидов от 5'-конца олигонуклеотида.
Также в настоящей заявке описаны олигонуклеотиды, содержащие 5'-холестерильную модификацию с по меньшей мере одним CpG мотивом и с обогащенной гуаниновыми нуклеотидами последовательностью или без нее в пределах четырех нуклеотидов от 5'-конца олигонуклеотида.
Также обеспечиваются способы стимуляции толл-подобного рецептора 21 (TLR21), включающие введение субъекту, который в этом нуждается, иммуностимулирующего олигонуклеотида, имеющего по меньшей мере один CpG мотив и обогащенную гуаниновыми нуклеотидами последовательность, начинающиеся на или в пределах четырех нуклеотидов от 5'-конца олигонуклеотида.
Также описаны способы увеличения TLR21-стимулирующей активности олигонуклеотида, имеющего по меньшей мере один CpG мотив, включающий слияние 5'-конца олигонуклеотида с обогащенной гуаниновыми нуклеотидами последовательностью.
В настоящем изобретении раскрыты способы вызывания иммунного ответа у субъекта, включающие введение субъекту олигонуклеотид, имеющий по меньшей мере один CpG динуклеотидный мотив и обогащенную гуаниновыми нуклеотидами последовательность, начинающиеся на или в пределах четырех нуклеотидов от 5'-конца олигонуклеотида, субъекту.
КРАТКОЕ ОПИСАНИЕ ФИГУР
Сущность изобретения, а также последующее подробное описание, становится более понятным в системной связи с приложенными фигурами. Для целей иллюстрации раскрытых композиций и способов, на фигурах представлены иллюстративные варианты осуществления композиций и способов; тем не менее, композиции и способы не ограничиваются специфическими раскрытыми вариантами осуществления изобретения. На фигурах:
На Фиг. 1 представлена карта плазмиды pcDNA™3.1(+).
На Фиг. 2 сравниваются кривые зависимости «доза-эффект» стимулированных ФНО-α- HEK293-NFκB клеток и HEK293-NFκB-bsd-cTLR21.
Ha Фиг. 3А и Фиг. 3В графически представлены стимулирующие эффекты 2006-РТО и 2006-PDE на HEK293-bsd и HEK293-bsd-cTLR21 клетках.
На Фиг. 4А и Фиг. 4В графически представлены стимулирующие эффекты увеличенного количества гуаниновых остатков на 3'-конце 2006-PDE олигонуклеотида.
На Фиг. 5А и Фиг. 5В графически представлены стимулирующие эффекты увеличенного числа гуаниновых остатков на 5'-конце 2006-PDE олигонуклеотида.
На Фиг. 6 проиллюстрирован отрицательный логарифм (log10) полумаксимальной эффективной концентрации (pEC50) 2006-PDE олигонуклеотидов, имеющих увеличенное число гуаниновых остатков на их 3'-или 5' - концах.
На Фиг. 7А и Фиг. 7В проиллюстрирована агрегация 2006-PDE олигонуклеотидов, имеющих увеличенное число гуанинов на их 3'- или 5'-концах, соответственно.
На Фиг. 8А и Фиг. 8В графически представлены стимулирующие эффекты 2006-PDE олигонуклеотида с шестью последовательными гуаниновыми (5dG6), адениновыми (5dA6), цитозиновыми (5dC6) или тиминовыми (5dT6) остатки на его 5'-конце.
На Фиг. 9А и Фиг. 9В графически представлено влияние разрушения CpG мотива (ов) на стимуляцию TLR21 с помощью олигонуклеотидов.
На Фиг. 10А и Фиг. 10В графически представлены стимулирующие эффекты гуаниновых остатков на 3' и 5'-конце, соответственно, олигонуклеотидов, имеющих фосфодиэфирный или фосфоротиоатный остовы.
На Фиг. 11А и Фиг. 11В иллюстрируются эффекты на TLR21 стимуляцию единичной адениновой замены в пределах шести гуаниновых остатков на 5'-конце олигонуклеотида, имеющего множественные CpG мотивы, в то время как на Фиг. 11С и Фиг. 11D иллюстрируются эффекты на TLR21 стимуляцию двух адениновых замен в пределах шести гуаниновых остатков на 5'-конце олигонуклеотида, имеющего множественные CpG мотивы.
На Фиг. 12А и Фиг. 12В иллюстрируются эффекты на TLR21 стимуляцию единичной цитозиновой замены в пределах шести гуаниновых остатков на 5'-конце олигонуклеотида, имеющего множественные CpG мотивы, в то время как на Фиг. 12С и Фиг. 12D иллюстрируются эффекты на TLR21 стимуляцию двух цитозиновых замен в пределах шести гуаниновых остатков на 5'-конце олигонуклеотида, имеющего множественные CpG мотивы.
На Фиг. 13А и Фиг. 13В иллюстрируются эффекты на TLR21 стимуляцию единичной тиминовой замены в пределах шести гуаниновых остатков на 5'-конце олигонуклеотида, имеющего множественные CpG мотивы, в то время как на Фиг. 13С и Фиг. 13D иллюстрируются эффекты на TLR21 стимуляцию двух тиминовых замен в пределах шести гуаниновых остатков на 5'-конце олигонуклеотида, имеющего множественные CpG мотивы.
На Фиг. 14 продемонстрирован эффект положения гена на TLR21 стимуляцию единичных нуклеотидных замен в участке из шести гуанинов на 5'-конце олигонуклеотида, имеющего множественные CpG мотивы (SEQ ID NO: 272).
На Фиг. 15 продемонстрирован эффект положения гена на TLR21 стимуляцию двойных нуклеотидных замен в участке из шести гуанинов на 5'-конце олигонуклеотида, имеющего множественные CpG мотивы (SEQ ID NO: 272).
На Фиг. 16А и Фиг. 16В иллюстрируются эффекты на TLR21 стимуляцию единичной адениновой замены в пределах участка из четырех гуанинов на 5'-конце олигонуклеотида, имеющего множественные CpG мотивы.
На Фиг. 17А и Фиг. 17В иллюстрируются эффекты на TLR21 стимуляцию единичной цитозиновой замены в пределах участка из четырех гуанинов на 5'-конце олигонуклеотида, имеющего множественные CpG мотивы.
На Фиг. 18А и Фиг. 18В иллюстрируются эффекты на TLR21 стимуляцию единичной тиминовой замены в пределах участка из четырех гуанинов на 5'-конце олигонуклеотида, имеющего множественные CpG мотивы.
На Фиг. 19 продемонстрирован эффект положения гена на TLR21 стимуляцию единичных нуклеотидных замен в участке из четырех гуанинов на 5'-конце олигонуклеотида, имеющего множественные CpG мотивы (SEQ ID NO: 273).
На Фиг. 20А - 20K иллюстрируются эффекты пяти гуаниновых остатков на 3'-конце, четырех гуаниновых остатков на пять-праймерном конце, и шести гуаниновых остатков на 5'-конце CpG-содержащих олигодезоксинуклеотидных последовательностей, описанных в литературе. На Фиг. 20А графически проиллюстрировано TLR21 стимулирующую активность ОДН 1668, 1668-3dG5, 1668-5dG4, и 1668-5dG6. На Фиг. 20В графически проиллюстрировано TLR21 стимулирующую активность ОДН 1826-3dG5, 1826-5dG4, и 1826-5dG6. На Фиг. 20С графически проиллюстрировано TLR21 стимулирующую активность ОДН BW006, BW006-3dG5, BW00-65dG4, и BW006-5dG6. На Фиг. 20D графически проиллюстрировано TLR21 стимулирующую активность ОДН D-SLO1, D-SLO1-3dG5, D-SLO1-5dG4, и D-SLO1-5dG6. На Фиг. 20E графически проиллюстрировано TLR21 стимулирующую активность ОДН М362, M362-3dG5, M362-5dG4, и M362-5dG6. На Фиг. 20F графически проиллюстрировано TLR21 стимулирующую активность ОДН 2395, 2395-5dG4, и 2395-5dG6. На Фиг. 20G графически проиллюстрировано TLR21 стимулирующую активность ОДН 2007-PDE, 2007-PDE -3dG5, 2007-PDE -5dG4, и 2007-PDE -5dG6. На Фиг. 20Н графически проиллюстрировано TLR21 стимулирующую активность ОДН CPG-685 и CPG-685-5dG6. На Фиг. 201 графически проиллюстрировано TLR21 стимулирующую активность ОДН CPG-202 и CPG-202-5dG6. На Фиг. 20J графически проиллюстрировано TLR21 стимулирующую активность ОДН CPG-2000 и CPG-2000-5dG6. На Фиг. 20K графически проиллюстрировано TLR21 стимулирующую активность ОДН CPG-2002 и CPG-2002-5dG6.
На Фиг. 21А графически представлены воздействия слияния известных теломерных последовательностей с 2006-PDE и 2006-PDE-T4; Фиг. 21В и Фиг. 21С графически представлены воздействия слияния теломерных или промоторных последовательностей с 2006-PDE-T4.
На Фиг. 22А и Фиг. 22В иллюстрируются воздействия слияния известных теломерных последовательностей с 2006-PDE.
На Фиг. 23А и Фиг. 23В показано расположение спаренных оснований тетрамерных олигонуклеотидов, имеющих G-квартетные последовательности и ориентация олигонуклеотидов, содержащих тетрамер, соответственно ("TGGGGT" раскрыт как SEQ ID NO: 265); Фиг. 23С проиллюстрированы взаимодействия олигонуклеотидов при образовании конформации G-квартета или G-проволоки (SEQ ID NO: 257); На Фиг. 23D представлено изображение конформации G-проволоки (SEQ ID NO: 257).
На Фиг. 24А и Фиг. 24В показан эффект на TLR21 стимуляцию путем добавления обогащенных гуаниновыми нуклеотидами последовательностей к 5'-концу олигонуклеотида, имеющего CpG мотивы.
На Фиг. 25 показаны проценты агрегированных олигодезоксинуклеотидов, имеющих последовательность G-проволоки.
На Фиг. 26А, Фиг. 26В и Фиг. 26С графически представлено стимулирующее влияние нуклеотидов, непосредственно прилегающих к CpGpA мотиву. На Фиг. 26А представлена TLR21 стимулирующую активность базальных олигонуклеотидов. На Фиг. 26В представлены аналогичные олигонуклеотиды с дополнительной 5' dG6 последовательностью. На Фиг. 26С представлены базальные олигонуклеотиды с дополнительной последовательностью 5' G проволока2.
На Фиг. 27А, Фиг. 27В, и Фиг. 27С графически представлено стимулирующее влияние нуклеотидов, непосредственно прилегающих к CpGpG мотиву. На Фиг. 27А представлена TLR21 стимулирующую активность базальных олигонуклеотидов. На Фиг. 27В представлены аналогичные олигонуклеотиды с дополнительной 5' dG6 последовательностью. На Фиг. 27С представлены аналогичные олигонуклеотиды с дополнительной последовательностью 5' G проволока 2.
На Фиг. 28А, Фиг. 28В, и Фиг. 28С графически представлено стимулирующее влияние нуклеотидов, непосредственно прилегающих к CpGpC мотиву. На Фиг. 28А представлена TLR21 стимулирующую активность базальных олигонуклеотидов. На Фиг. 28В представлены аналогичные олигонуклеотиды с дополнительной 5' dG6 последовательностью. На Фиг. 28С представлены аналогичные олигонуклеотиды с дополнительной последовательностью 5' G проволока 2.
На Фиг. 29А, Фиг. 29В, Фиг. 29С, и Фиг. 29D графически представлено стимулирующее влияние нуклеотидов, непосредственно прилегающих к CpGpT мотиву. На Фиг. 29А представлена TLR21 стимулирующую активность базальных олигонуклеотидов. На Фиг. 29В представлены аналогичные олигонуклеотиды с дополнительной 5' dG6 последовательностью. На Фиг. 29С и Фиг. 29D представлены аналогичные олигонуклеотиды с дополнительной последовательностью 5' G проволока 2.
На Фиг. 30 проиллюстрировано стимулирующее влияние разрушения только CpG мотива в олигонуклеотиде, имеющем 5' последовательность G проволоки.
На Фиг. 31 проиллюстрировано стимулирующее влияние расстояния между 5' последовательностью G проволоки и CpG мотив.
На Фиг. 32 проиллюстрировано стимулирующее влияние модификации числа нуклеотидов тимидин 5'-монофосфата на 3'-конце олигонуклеотида, имеющего 5' последовательность G проволока 2 и CpG мотив.
На Фиг. 33А и Фиг. 33В сравниваются иммуностимулирующие свойства олигонуклеотидов, имеющих различные последовательности 5' последовательность G-проволоки.
На Фиг. 34 представлена структура-активность олигонуклеотида, имеющего 5' последовательность G проволока 2. Фигура раскрывает SEQ ID NOS 189, 269, и 270, соответственно, в порядке встречаемости.
На Фиг. 35А и Фиг. 35В сравниваются иммуностимулирующие способности олигонуклеотидов, имеющих единичный, двойной или тройной элемент GCGT последовательности возле 3' олигонуклеотида с 5' последовательностью G проволока 2 и CpG мотивами.
На Фиг. 36А и Фиг. 36В сравниваются иммуностимулирующие способности олигонуклеотидов, имеющих единичный, двойной или тройной элемент GCGA последовательности возле 3' олигонуклеотида с 5' последовательностью G проволока 2 и CpG мотивами.
На Фиг. 37А и Фиг. 37В сравниваются иммуностимулирующие способности олигонуклеотидов, имеющих единичный, двойной или тройной элемент ACGC последовательности возле 3' олигонуклеотида с 5' последовательностью G проволока 2 и CpG мотивами.
На Фиг. 38А и Фиг. 38В сравниваются иммуностимулирующие способности олигонуклеотидов, имеющих единичный, двойной или тройной элемент TCGC последовательности возле 3' олигонуклеотида с 5' последовательностью G проволока 2 и CpG мотивами.
На Фиг. 39А и Фиг. 39В сравниваются иммуностимулирующие способности олигонуклеотидов, имеющих единичный, двойной или тройной элемент CCGC последовательности возле 3' олигонуклеотида с 5' последовательностью G проволока 2 и CpG мотивами.
На Фиг. 40 сравниваются иммуностимулирующие способности олигонуклеотидов, имеющих единичный, двойной или тройной элемент GCGG последовательности возле 3' олигонуклеотида с последовательностью G проволока 2 и CpG мотивами.
На Фиг. 41А и Фиг. 41В сравниваются иммуностимулирующие эффекты инсерции одного - четырех тиминовых нуклеотида между двумя CpG мотивами в олигонуклеотиде.
На Фиг. 42А и Фиг. 42В иллюстрируется стимулирующий эффект единичного нуклеотидного разделения между двумя CpG мотивами или безосновного спейсера между двумя CpG мотивами.
На Фиг. 43А - 43Е представлены различные структурные мостики между CpG элементами в олигонуклеотиде. Фиг. 43А представлена структура Т1 спейсера. На Фиг. 43В представлена структура Т3 спейсера. На Фиг. 43С представлена структура безосновного спейсера. На Фиг. 43D представлена структура 1,3-пропандиольного спейсера. На Фиг. 43Е представлена структура гексаэтиленгликольного спейсера.
На Фиг. 44А и Фиг. 44В показано стимулирующее влияние инсерции С3 и С18 спейсера между CpG мотивами.
На Фиг. 45А и Фиг. 45В показано иммуностимулирующее влияние увеличенного количества CpG мотивов в олигонуклеотиде, содержащем 5'-мотив G проволока 2, CpG мотивы, которые разделены С3 спейсером.
На Фиг. 46А и Фиг. 46В графически иллюстрируется иммуностимуляция TLR21 посредством олигонуклеотидов с TGGGGT-последовательностью (SEQ ID NO: 265) на 5'-конце и от одного до пяти CpG мотивов, каждый из которых разделен С3 спейсерами.
На Фиг. 47 показаны безосновные спейсеры на основе диола.
На Фиг. 48 показан С8 спейсер, базальный спейсер, и безосновный дезоксирибозный мостик спейсер.
На Фиг. 49А и Фиг. 49В графически представлена TLR21 стимуляция с помощью олигонуклеотидов, имеющих GGGGTTGGGG (SEQ ID NO: 257) 5' концевые последовательности и CpG мотивы, и где CpG мотивы разделены пропандиолом или безосновным дезоксирибозным мостиком.
На Фиг. 50А и Фиг. 50В иллюстрируется TLR21 стимуляция способности олигонуклеотидов, имеющих CpG мотивы и последовательность G-проволоки, где CpG мотивы разделены этандиолом, пропандиолом, бутандиолом, пентандиолом и гександиолом.
На Фиг. 51 проиллюстрировано влияние различных спейсеров на основе диола между CpG элементами на стимуляцию TLR21.
На Фиг. 52А и Фиг. 52В показана TLR21 стимуляция после воздействия олигонуклеотидов, имеющих либо элементы ACGC или CCGC CpG последовательности, разделенные пропандиолом или гексаэтиленгликолем, и 5'-концевую последовательность G-проволоки.
На Фиг. 53А и Фиг. 53В показана TLR21 стимуляция после воздействия олигонуклеотидов, имеющих либо элементы ACGC или CCGC CpG последовательности, разделенные пропандиолом, и TGGGGT (SEQ ID NO: 265) 5'-концевую последовательность.
На Фиг. 54А и Фиг. 54В показана TLR21 стимуляция после воздействия олигонуклеотидов, имеющих 5'-концевую последовательность G-проволоки и CpG мотивы, разделенные либо пропандиолом или гексаэтиленгликолем.
На Фиг. 55 проиллюстрирована химическая структура холестерольного компонента, соединенного 3' дезоксирибозным компонентом с помощью гександиольного линкера.
На Фиг. 56А и Фиг. 56В сравнивается TLR21 стимуляция для олигонуклеотида, имеющего множественные CpG мотивы, и 5' последовательность G проволока 2, с такой же стимуляцией аналогичного олигонуклеотида, имеющего 3'-холестерильную группу.
На Фиг. 57А и Фиг. 57В сравниваются два олигонуклеотида, имеющих TGGGGT (SEQ ID NO: 265) 5'-концевую последовательность, множественные CpG мотивы, и 3'-холестерильную группу.
На Фиг. 58А и Фиг. 58В представлены 5'-холестерольные модификации на двух различных дезкосинуклеотидах.
На Фиг. 59А и Фиг. 59В иллюстрируется TLR21 стимуляция, вызываемая олигонуклеотидами, имеющими TGGGGT-5'-концевую последовательность (SEQ ID NO: 265), множественные CpG мотивы, и с 5'-холестерольной модификацией или без нее.
На Фиг. 60А и Фиг. 60В иллюстрируется TLR21 стимуляция олигонуклеотидами с 5'-холестерольными модификациями или без них, где производное холестерола получено от другого поставщика (Sigma Aldrich).
На Фиг. 61А и Фиг. 61В иллюстрируется TLR21 стимуляция олигонуклеотидами с 5'-холестерольными модификациями или без них.
На Фиг. 62А и Фиг. 62В иллюстрируется TLR21 стимуляция олигонуклеотидами с 5'-холестерольными модификациями или без них.
На Фиг. 63А и Фиг. 63В иллюстрируется TLR21 стимуляция олигонуклеотидами с 5'-холестерольными модификациями или без них.
На Фиг. 64 проиллюстрирована TLR21 стимуляция олигонуклеотидами с 5'-холестерольными модификациями или без них.
На Фиг. 65А и Фиг. 65В иллюстрируется TLR21 стимуляция олигонуклеотидами с 5'-холестерольными модификациями или без них.
На Фиг. 66А и Фиг. 66В иллюстрируется TLR21 стимуляция олигонуклеотидами с 5'-холестерольными модификациями или без них.
На Фиг. 67 проиллюстрирована TLR21 стимуляция олигонуклеотидами с 5'-холестерольными модификациями или без них.
На Фиг. 68А и Фиг. 68В графически представлены иммуностимулирующие эффекты олигонуклеотидов, модифицированных увеличенным количеством гуаниновых нуклеотидов на 5'-конце олигонуклеотида на клетках мышей и человека, соответственно.
На Фиг. 69А и Фиг. 69В графически представлены иммуностимулирующие эффекты олигонуклеотидов, модифицированных увеличенным количеством гуаниновых нуклеотидов на 3'-конце олигонуклеотида на клетках мышей и человека, соответственно.
На Фиг. 70 представлены результаты средних титров ингибирования гемагглютинации (HI) (Log2) (со стандартным отклонением) результаты для ОДН1 (GCGT3-TG4T-5Chol) в дни 14 (верхняя панель) и 21 (нижняя панель) после вакцинации (пв). Звездочки указывают уровень значимости (*=значимый до ****=высоко значимый).
На Фиг. 71 представлены результаты средних титров (HI) (Log2) (со стандартным отклонением) результаты для ОДН1 (GCGT3-TG4T-5Chol) на протяжении всего исследования.
На Фиг. 72 представлены результаты средних титров (HI) (Log2) (со стандартным отклонением) результаты для ОДН2 (GCGT3-TG4T) в дни 14 (верхняя панель) и 21 (нижняя панель) после вакцинации. Звездочки указывают уровень значимости (*=значимый до ****=высокозначимый).
На Фиг. 73 представлены результаты средних титров (HI) (Log2) (со стандартным отклонением) результаты для ОДН2 (GCGT3-TG4T) на протяжении всего исследования.
На Фиг. 74 представлены результаты средних титров (HI) (Log2) (со стандартным отклонением) результаты для ОДН3 (2006-РТО) в дни 14 (верхняя панель) и 21 (нижняя панель) после вакцинации. Звездочки указывают уровень значимости (*=значимый до ****=высоко значимый).
На Фиг. 75 представлены результаты средних титров (HI) (Log2) (со стандартным отклонением) результаты для ОДН3 (2006-РТО) на протяжении всего исследования.
На Фиг. 76 представлены результаты средних титров (HI) (Log2) (со стандартным отклонением) результаты для положительных и отрицательных контролей тестируемых образцов в дни 14 (верхняя панель) и 21 (нижняя панель) после вакцинации. Звездочки указывают уровень значимости (*=значимый до ****=высоко значимый).
На Фиг. 77 представлены результаты средних титров (HI) (Log2) (со стандартным отклонением) результаты для положительных и отрицательных контролей тестируемых образцов на протяжении всего исследования.
На Фиг. 78 представлены результаты средних титров (HI) (Log2) (со стандартным отклонением) результаты при наиболее оптимальных концентрациях ОДН на протяжении всего исследования по сравнению с NDV вакциной отдельно.
На Фиг. 79 представлены результаты средних титров (HI) (Log2) (со стандартным отклонением) результаты при наиболее оптимальных концентрациях ОДН в день 14 (верхняя панель) и 21 (нижняя панель) по сравнению с NDV вакциной отдельно.
ПОДРОБНОЕ ОПИСАНИЕ ИЛЛЮСТРАТИВНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Раскрытые композиции и способы могут пониматься более легко со ссылкой на последующее подробное описание, принимая во внимание приложенные фигуры, которые составляют часть описания. Подразумевается, что раскрытые композиции и способы не ограничиваются специфическими композициями и способами, описанными и/или представленными в настоящей заявке, и что терминология, используемая в настоящей заявке, предназначена для описания предпочтительных вариантов осуществления только в качестве примеров и не предназначена для ограничения заявленных композиций и способов.
Если специально не указано иначе, то любое описание как возможный механизм или способ действия или причина для улучшения рассматривается только как иллюстративное, и описанные композиции и способы не ограничиваются точностью или неточностью любого такого предложенного механизма или способа действия или причины для улучшения.
Для всей настоящей заявки, описания относятся к композициям и способам применения указанных композиций. Если раскрытие описывает или заявляет характерный признак или вариант осуществления, связанный с композицией, то такой характерный признак или вариант осуществления аналогичным образом применим к способам применения указанных композиций. Подобно этому, если раскрытие описывает или заявляет характерный признак или вариант осуществления, связанный со способом применения композиции, то такой характерный признак или вариант осуществления аналогичным образом применим к композиции.
Если задан диапазон значений, то другой вариант осуществления включает от одного предпочтительного значения и/или до другого предпочтительного значения. Дополнительно, ссылки на значения, указанные в диапазонах, включают все и каждое значение в пределах указанного диапазона. Все диапазоны являются включительными и комбинируемыми. Если значения выражены как приблизительные, путем применения предшествующего "приблизительно", то это подразумевает, что конкретное значения составляет другой вариант осуществления. Ссылка на конкретное числовое значение включает по меньшей мере это конкретное значение, если из контекста очевидно не следует иное.
Следует принять во внимание, что определенные характерные признаки описанных композиций и способов, которые, для лучшего понимания, описаны в настоящей заявке в контексте отдельных вариантов осуществления, также могут обеспечиваться в комбинации в одном варианте осуществления. И наоборот, различные характерные признаки описанных композиций и способов, которые, для краткости, описаны в контексте одного варианта осуществления, также могут быть обеспечены раздельно или в любой подкомбинации.
Как используется в настоящей заявке, формы единственного числа включают множественное число.
Как используется в настоящей заявке, "слитый" или "слияние" относится к созданию химической связи между химически реакционно способными видами. В контексте настоящей заявки, слияние наиболее часто относится к инкорпорации специфических элементов в олигонуклеотид. Например, серии тиминовых нуклеотидов могут быть слиты с 3'-концом олигонуклеотида.
Как используется в настоящей заявке, "G-квартетная последовательность" относится к участку последовательных гуаниновых остатков возле 5'-конца олигонуклеотида, который предоставляет возможность олигонуклеотиду взаимодействовать с другими G-квартетными последовательностями с образованием G-квартета. G-квартет усиливает иммуностимулирующие свойства нуклеиновой кислоты. Например, олигонуклеотиды, содержащие G-квартетные последовательности, могут взаимодействовать, образуя G-квартеты. G-квартетные последовательности, встречающиеся в составе промоторного участка гена, могут образовывать четвертичные структуры, задействованные в регуляцию экспрессии гена. В то время как G-квартетная последовательность не ограничивается какой-либо конкретной последовательностью, примером G-квартетной последовательности является TGGGGT (SEQ ID NO: 265).
Как используется в настоящей заявке, "последовательность G-проволоки," "последовательность G проволоки," "последовательность G проволок," и родственные термины, относятся к множеству, наиболее часто двум, из по меньшей мере четырех последовательных гуаниновых нуклеотидов. Множества гуаниновых нуклеотидов, расположенные на или возле 5'-конца олигонуклеотида, разделены двумя или более негуаниновыми нуклеотидами (то есть, тиминовыми нуклеотидами). Последовательности G-проволоки способны взаимодействовать с другими последовательностями G-проволоки с образованием структуры G-проволока. Структура G-проволоки может усиливать иммуностимулирующие свойства нуклеиновой кислоты. Типичным примером последовательность G-проволоки является GGGGTTGGGG (SEQ ID NO: 257) или GGGGTTGGGGTTTT (SEQ ID NO: 258).
Как используется в настоящей заявке, термины "обогащенная гуаниновыми нуклеотидами последовательность", "гуанин-обогащенная последовательность", и другие, относятся к последовательностям нуклеиновым кислот, содержащим либо отрезок последовательных гуаниновых нуклеотидов, обычно от четырех до шести гуаниновых нуклеотидов, или участок нуклеиновой кислоты, типично на или возле 5'-конца олигонуклеотида, имеющий больше гуаниновых нуклеотидов, чем адениновых, цитозиновых или тиминовых нуклеотидов. Обогащенная гуаниновыми нуклеотидами последовательность, как описано в настоящей заявке, может усиливать иммуностимулирующие свойства олигонуклеотида. G-квартетные последовательности и последовательности G-проволоки обе представляют собой типы обогащенных гуаниновыми нуклеотидами последовательностей.
Как используется в настоящей заявке, "инсерция" относится к добавлению специфического (их) нуклеотида (ов) в специфических положениях при синтезе олигонуклеотида.
Как используется в настоящей заявке, "параллельная ориентация" относится к направленному взаимодействию между различными олигонуклеотидами. Например, круговая иллюстрация на Фиг. 23В демонстрирует четыре олигонуклеотида, имеющих параллельную ориентацию, поскольку тетрамер олигонуклеотидов расположен параллельно друг другу. В некоторых аспектах, индивидуальные олигонуклеотиды могут быть ориентированы в идентичном 5' → 3' направлении.
Термин "субъект", как используется в настоящей заявке, обозначает любое животное, включая любые типы птиц, млекопитающих или водные виды, и в особенности куры. Субъекты могут быть подвержены лечению с применением раскрытых способов и раскрытых композиций.
Термин "TLR21 тестирование" или его вариации, относится к введению олигонуклеотидов в HEK293-NFκB-bsd-cTLR21 клеточную линию, описанную в Примере 2, для определения, будет ли олигонуклеотид стимулировать TLR21.
Различные термины, относящиеся к аспектам описания, применяются во всем описании и пунктах приложенной формулы изобретения. Такие термины имеют их общепринятые значения в данной области техники, если не указано иное. Другие специфически определенные термины истолковываются образом, согласующимся с определениями, представленными в настоящей заявке.
В настоящей заявке описаны рекомбинантные HEK293 клеточные линии, содержащие ген устойчивости к бластицидину и синтетическую SEAP репортерную генную конструкцию ("NFκB-SEAP"), а также стабильную клеточную линию, совместно трансфектированную с применением NFκB-SEAP конструкции и куриной TLR21 конструкции (HEK293-NFκB-bsd-cTLR21). Эта последняя клеточная линия может применяться для тестирования TLR21-опосредованных иммуностимулирующих свойств кандидатных соединений. Как показано в Примерах, HEK293-NFκB-bsd-cTLR21 клеточная линия может использоваться для идентификации олигонуклеотидов, способных вызывать TLR21-опосредованный иммунный ответ.
Также в настоящей заявке описаны олигонуклеотиды и способы их применения для активации или другим образом стимуляции TLR21. В некоторых вариантах осуществления, олигонуклеотиды включают по меньшей мере один ассоциированный с патогеном молекулярный маркер (РАМР), специфически неметилированный динуклеотидный CpG мотив, который взаимодействует с рецепторами распознавания патогенов, экспрессируемыми в организме-хозяине. В некоторых вариантах осуществления, олигонуклеотиды также имеют обогащенную гуаниновыми нуклеотидами последовательность. Эти последовательности могут облегчать укладку цепи ДНК в четвертичную структуру или, в случае олигонуклеотидов, способствовать агрегации одного или нескольких олигонуклеотидов, содержащие последовательность. В настоящей заявке показано, что иммуногенность олигонуклеотидов, имеющих CpG динуклеотидные мотивы, может быть усилена, если олигонуклеотид дополнительно содержит обогащенную гуаниновыми нуклеотидами последовательность. Обогащенная гуаниновыми нуклеотидами
последовательность не обязательно должна состоять исключительно из гуаниновых нуклеотидов, но должна быть ими обогащена. Гуанин-обогащенная последовательность, как описано выше и как иллюстрируется на примерах в вариантах осуществления, представляет собой сегмент олигонуклеотида, содержащий больше гуаниновых нуклеотидов по сравнению с любым другим остатком (то есть, адениновых, цитозиновых, тиминовых нуклеотидов). В некоторых вариантах осуществления, дополнительные манипуляции олигонуклеотидной последовательности и структуры могут еще больше усиливать способность олигонуклеотида стимулировать TLR21. Таким образом, один вариант осуществления настоящего раскрытия охватывает олигонуклеотид, содержащий по меньшей мере один CpG мотив и обогащенную гуаниновыми нуклеотидами последовательность, начинающиеся на или в пределах четырех нуклеотидов от 5'-конца олигонуклеотида.
Ранее было показано, что добавление дезоксигуаниновых (dG) нуклеотидов к 3'-концу CpG-содержащего олигонуклеотида усиливает активацию TLR9 in vitro. Поскольку TLR9 представляет собой функциональный эквивалент млекопитающих для куриного TLR21, то полагают, что 3' dG участки также будут улучшать иммуногенность олигонуклеотидов, созданных для активации TLR21. Неожиданно было обнаружено, что этого нельзя сказать об 3' обогащенных гуаниновыми нуклеотидами последовательности при TLR21 активации. Олигонуклеотиды, имеющие 3' участки из двух или более dG, не могут активировать TLR21 (Фиг. 4А и 4В), в то время как добавление dG участков к 5'-концу CpG-содержащего олигонуклеотида существенно улучшает иммуногенность олигонуклеотида.
Не только положение обогащенной гуаниновыми нуклеотидами последовательности в олигонуклеотиде оказывает влияние на активацию TLR21, но также существенно влияет и содержание последовательности. В связи с этим, в некоторых вариантах осуществления настоящей заявки, обогащенная гуаниновыми нуклеотидами последовательность содержит первое множество последовательных гуаниновых нуклеотидов. В некоторых аспектах, первое множество гуаниновых нуклеотидов содержит от двух до восьми гуаниновых нуклеотидов. В некоторых аспектах, первое множество гуаниновых нуклеотидов содержит два гуаниновые нуклеотиды. В некоторых аспектах, первое множество гуаниновых нуклеотидов содержит три гуаниновых нуклеотида. В некоторых аспектах, первое множество гуаниновых нуклеотидов содержит четыре гуаниновых нуклеотида. В некоторых аспектах, первое множество гуаниновых нуклеотидов содержит пять гуаниновых нуклеотидов. В некоторых аспектах, первое множество гуаниновых нуклеотидов содержит шесть гуаниновых нуклеотидов. В некоторых аспектах, первое множество гуаниновых нуклеотидов содержит семь гуаниновых нуклеотидов. В некоторых аспектах, первое множество гуаниновых нуклеотидов содержит восемь гуаниновых нуклеотидов. В еще других аспектах, первое множество гуаниновых нуклеотидов содержит больше восьми гуаниновых нуклеотидов.
В некоторых вариантах осуществления настоящего изобретения, олигонуклеотид содержит SEQ ID NO: 16, 17, 18, 19, 20, 21, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 77, 78, 81, 82, 85, 86, 89, 90, 92, 93, 96, 97, 100, 102, 104, 106, 108 или 143. В некоторых вариантах осуществления, обогащенная гуаниновыми нуклеотидами последовательность содержит TTAGGG, TTAGGGTTAGGG (SEQ ID NO: 261), TTTTGGGG, GGGGTTTT, GGGGTTTTGGGG (SEQ ID NO: 262), TTAGGG, TTAGGGTTAGGGTTTT (SEQ ID NO: 263), TGTGGGTGTGTGTGGG (SEQ ID NO: 268), GGAGG, TGGAGGC или TGGAGGCTGGAGGC (SEQ ID NO: 264). В еще других вариантах осуществления, олигонуклеотид содержит SEQ ID NO: 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 124, 125, 126, 127, 129, 130, 131, 134, 136, 137 или 138.
Единственный участок dG представляет собой не только 5' модификацию, которая может усиливать TLR21 стимуляцию. Например, последовательности, обогащенные адениновыми, цитозиновыми и тиминовыми нуклеотидами, также могут быть добавлены к 5'-концу олигонуклеотида, имеющему по меньшей мере один CpG мотив, и приводить к увеличенной TLR21 стимуляции, хоть и менее выраженной, чем вызванная обогащенными гуанинами последовательностями на 5'-конце олигонуклеотида (см. Фиг. 8А и 8В). В то время как единственное множество гуаниновых остатков на 5'-конце олигонуклеотида может вызывать TLR21 стимуляцию, то добавление множеств гуаниновых нуклеотидов в обогащенную гуаниновыми нуклеотидами последовательность может дополнительно увеличивать стимулирующие свойства олигонуклеотида. Таким образом, в некоторых аспектах, олигонуклеотид согласно настоящему изобретению содержит второе множество гуаниновых нуклеотидов между первым множеством гуаниновых нуклеотидов и по меньшей мере одним CpG мотивом.
В некоторых аспектах, множество гуаниновых нуклеотидов содержит G-квартетную последовательность. В некоторых вариантах осуществления, первое множество гуаниновых нуклеотидов, второе множество гуаниновых нуклеотидов, или оба включают G-квартетную последовательность. G-квартетные последовательности, как определено выше, предоставляют возможность взаимодействия между олигонуклеотидами. Не желая ограничиваться какой-либо теорией, взаимодействие олигонуклеотидов посредством G-квартетных последовательностей предоставляет возможность концентрирования CpG динуклеотидных мотивов и соответствующей увеличенной вероятности распознавания с помощью TRL21. G-квартетные последовательности также предоставляют возможность взаимодействий множеств TLR21 рецепторов (увеличенная авидность) и перекрестного связывания рецепторов. В некоторых вариантах осуществления, иммуностимулирующая композиция дополнительно содержит по меньшей мере один дополнительный олигонуклеотид, имеющий G-квартетную последовательность, где олигонуклеотид и по меньшей мере один дополнительный олигонуклеотид имеют параллельную ориентацию в четвертичной структуре. В некоторых аспектах, G-квартетная последовательность содержит TGGGGT (SEQ ID NO: 265).
Последовательность G-проволоки представляет собой другую обогащенную гуаниновыми нуклеотидами последовательность, которая может быть добавлена к 5' олигонуклеотиду, имеющему CpG мотивы. В некоторых аспектах настоящей заявки, первое и второе множества гуаниновых нуклеотидов включают I последовательность G-проволоки. В некоторых аспектах, последовательность G-проволоки содержит SEQ ID NO: 257 или 258. В еще других аспектах, последовательность G-проволоки содержит SEQ ID NO: 141, 142, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203 или GCGT-G проволока 3. Два множества гуаниновых нуклеотидов могут быть разделены негуаниновыми нуклеотидами, аналогами нуклеотидов или любым другим спейсером или линкером. Например, в некоторых аспектах настоящей заявки, первое множество гуаниновых нуклеотидов и второе множество гуаниновых нуклеотидов разделены по меньшей мере одним нуклеотидом. Как используется в настоящей заявке, термин "спейсер" относится к химической связи между сходными нуклеотидными мотивами, то есть, между двумя CpG мотивами или между двумя мотивами обогащенной гуаниновыми нуклеотидами последовательности, в то время как термин "линкер " относится к химической связи между различными нуклеотидными мотивами, то есть, между обогащенной гуаниновыми нуклеотидами последовательностью и другим нуклеотидным мотивом, например, CpG мотивом. Термины "спейсер" и "линкер" используются для ясности при описании того, какой обсуждается аспект олигонуклеотида. Тем не менее, для квалифицированных специалистов в данной области техники понятно, что структуры, описанные в настоящей заявке для спейсеров, могут быть взаимозаменяемыми со структурами, описанными в настоящей заявке для линкеров, и наоборот.
Не желая ограничиваться какой-либо конкретной теорией, представляется возможным, что последовательность G-проволоки предоставляет возможность олигонуклеотиду взаимодействовать и агрегировать с другими олигонуклеотидами, имеющими последовательности G-проволоки. Это накопление олигонуклеотидов и их CpG мотивов может приводить к усиленной стимуляции TLR21.
Обогащенные гуаниновыми нуклеотидами последовательности в пределах олигонуклеотида могут быть отделены от CpG нуклеотидных мотивов нуклеотидыами, аналогами нуклеотидов или другими линкерами. Таким образом, в некоторых вариантах осуществления настоящей заявки, олигонуклеотид дополнительно содержит линкер между обогащенной гуаниновыми нуклеотидами последовательностью и по меньшей мере одним CpG мотивом по ходу транскрипции. Линкер не обязательно должен быть смежным либо с обогащенной гуаниновыми нуклеотидами последовательностью или CpG мотивом, но линкер должен быть расположен между двумя мотивами последовательностей, независимо от интронных последовательностей между обогащенной гуаниновыми нуклеотидами последовательностью и линкером, а также между CpG мотивом и линкером. В некоторых вариантах осуществления настоящей заявки, линкер содержит по меньшей мере три нуклеотида. В некоторых вариантах осуществления, линкер может не включать азотистые основания. Например, в некоторых аспектах, линкер представляет собой гексаэтиленгликоль, пропандиол, триэтиленгликоль или их производные. В других примерах, олигонуклеотид, имеющий линкер, содержит 2006-PDE5dG4-X1 или 2006-PDE5dG4-X3.
Полагают, что динуклеотидные CpG мотивы, присутствующие в олигонуклеотидах согласно настоящему изобретению, представляют собой РАМР, распознаваемые TLR21 у кур. В то время как даже единственный CpG мотив может стимулировать TLR21, множество CpG, представленных на олигонуклеотиде, могут усиленно стимулировать интенсивность сигнала TLR21. В связи с этим, в некоторых аспектах настоящего изобретения, по меньшей мере один CpG мотив содержит два, три, четыре или пять CpG мотивов. В некоторых аспектах, по меньшей мере один CpG мотив содержит шесть или больше CpG мотивов. В некоторых аспектах, по меньшей мере один CpG мотив содержит два CpG мотива. В некоторых аспектах, по меньшей мере один CpG мотив содержит три CpG мотива. В некоторых аспектах, по меньшей мере один CpG мотив содержит четыре CpG мотива. В некоторых вариантах осуществления, по меньшей мере один CpG мотив содержит четыре CpG мотива.
В некоторых вариантах осуществления раскрытых в настоящем изобретении олигонуклеотидов, каждый CpG мотив может быть отделен от других CpG мотивов по меньшей мере одним нуклеотидом или аналогом нуклеотида. В некоторых аспектах, по меньшей мере один нуклеотид представляет собой два или три тиминовых нуклеотида. В других аспектах, по меньшей мере один нуклеотид представляет собой от одного до четырех нуклеотидов, хотя число вставочных нуклеотидов может отличаться в зависимости от последовательности вставочных нуклеотидов. В некоторых аспектах, олигонуклеотид содержит SEQ ID NO: 217, 218, 219 или 220. Нуклеотиды, смежные с CpG мотивом - вместе с самим CpG мотивом -составляют элемент CpG последовательности (например, XCGX, где X = любой нуклеотид). В некоторых вариантах осуществления, олигонуклеотиды согласно настоящему изобретению, включают элементы CpG последовательности, которые представляют собой GCGA, GCGG, ACGC, CCGC, GCGT, TCGC или любую их комбинацию.
В некоторых вариантах осуществления настоящей заявки, CpG мотив содержит элемент CpG последовательности, имеющий четыре нуклеотида. В некоторых аспектах, олигонуклеотид содержит по меньшей мере два элемента CpG последовательности. В некоторых аспектах, олигонуклеотид содержит по меньшей мере три элемента CpG последовательности. В некоторых аспектах, олигонуклеотид содержит по меньшей мере четыре элемента CpG последовательности. В некоторых аспектах, олигонуклеотид содержит по меньшей мере пять элементов CpG последовательности. В некоторых аспектах, олигонуклеотид содержит по меньшей мере шесть элементов CpG последовательности. В некоторых аспектах, олигонуклеотид содержит более чем восемь, десять, пятнадцать или даже двадцать элементов CpG последовательности.
В других вариантах осуществления раскрытых в настоящем изобретении олигонуклеотидов, каждый из CpG мотивы разделены от каждого другого CpG мотива спейсером или комбинацией спейсера и по меньшей мере одного нуклеотида. В некоторых аспектах, по меньшей мере один CpG мотив разделен от самого близкого другого CpG мотива спейсером или комбинацией спейсера и по меньшей мере одного нуклеотида, в то время как по меньшей мере два других CpG мотива смежны друг с другом. Хотя разделенные CpG мотивы могут усиливать иммуностимулирующие способности созданных олигонуклеотидов, принято считать, что CpG мотивы, смежные друг с другом, могут еще стимулировать TLR21.
Спейсер, применяемый для линейного разделения CpG мотивов, может представлять собой любую связь, которая связывает мостиком по меньшей мере часть олигонуклеотида между CpG мотивами. Спейсер может состоять из, но не обязательно ограничиваясь только ими, дезоксирибозофосфатного мостика, множественной углеродной цепи или повторяемой химической единицы. Одним из существенных свойств спейсера является способность образовывать химическую связь с нуклеотидным остовом олигонуклеотида. Таким образом, в некоторых вариантах осуществления спейсер представляет собой дезоксирибозофосфатный мостик. Дезоксирибозофосфатный мостик может включать азотистые основания в некоторых аспектах, в то время как в других вариантах дезоксирибозофосфатный мостик является безосновным. В некоторых аспектах, олигонуклеотид содержит SEQ ID NO: 221, которая содержит безосновный дезоксирибозофосфатный мостик.
В других вариантах осуществления настоящей заявки, спейсер содержит углеродную цепь. Углеродная цепь может включать от двух до двенадцати атомов углерода. Диолы, содержащие углеродную цепь, могут использоваться в качестве концевых спиртовых групп, могут реагировать с концевыми спиртовыми и/или фосфатными группами олигонуклеотида. В некоторых вариантах осуществления, углеродная цепь содержит два атома углерода, и в некоторых аспектах, углеродная цепь имеет происхождение из этандиола. В некоторых вариантах осуществления, олигонуклеотид содержит ОДН-Х2, где Х2 представляет собой этандиол.
Другие варианты осуществления настоящего изобретения обеспечивают углеродную цепь, содержащую три атома углерода. В некоторых аспектах этих вариантов осуществления, углеродная цепь имеет происхождение из 1,3-пропандиола. В некоторых вариантах осуществления, олигонуклеотид содержит CG-Gw2X2, CG-Gw2X2-2, или ОДН-Х3, CG-Gw2X2-1, CG-Gw2X2-3, CG-Gw2X2-4, CG-Gw2X2-5, CG-G4T16X2-1, CG-G4T16X2-2, CG-G4T16X2-3, CG-G4T16X2-4, или CG-G4T16X2-5, где X2 представляет собой трехуглеродную цепь; 2006-PDE5dG4-X2, где Х2 представляет собой трехуглеродную цепь, имеющую происхождение из 1,3-пропандиола; или 2006-PDE5dG4-X4, где Х4 представляет собой трехуглеродную цепь, имеющую происхождение из 1,3-пропандиола.
В еще других вариантах осуществления настоящего изобретения, олигонуклеотид содержит спейсер из углеродной цепи, где углеродная цепь содержит четыре атомов углерода. В некоторых аспектах этих вариантов осуществления, углеродная цепь имеет происхождение из 1,4-бутандиола. В некоторых вариантах осуществления, олигонуклеотид содержит ОДН-Х4, где Х4 представляет собой четырехуглеродную цепь, имеющую происхождение из 1,4-бутандиола.
В еще других вариантах осуществления настоящей заявки, олигонуклеотид содержит спейсер, имеющий повторяемую химическую единицу. Например, в некоторых вариантах осуществления, повторяемая химическая единица представляет собой этиленгликоль. Повторяемая химическая единица может повторяться от двух до двенадцати раз. В некоторых вариантах осуществления, этиленгликоль повторяется шесть раз. Таким образом, в некоторых аспектах, олигонуклеотид содержит CCGC-Gw2X1, где X1 представляет собой спейсер, имеющий происхождение из гексаэтиленгликоля.
Несмотря на то, что dG участки на 3'-конце олигонуклеотида, приводят к незначительной TLR21 стимуляции или такая стимуляция отсутствует, другие нуклеотидные участки могут оказывать влияние на иммуногенность для олигонуклеотида. Специфически, в некоторых аспектах настоящей заявки, олигонуклеотид дополнительно может включать тритиминовый нуклеотид на 3'-конце. В некоторых аспектах, олигонуклеотид содержит SEQ ID NO: 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214 или 215.
Для каждого олигонуклеотида, описанного в настоящей заявке, квалифицированный специалист в данной области техники будет знать, что нуклеотид может быть заменен на аналог нуклеотида. Олигонуклеотиды в некоторых вариантах осуществления включают фосфодиэфирный остов, хотя другие варианты осуществления олигонуклеотидов, описанных в настоящей заявке, включают фосфоротиоатный остов.
В некоторых вариантах осуществления настоящей заявки, олигонуклеотид может включать липидный компонент, который может приводить к повышению иммуногенности олигонуклеотида. Одним из возможных объяснений для повышенной иммуногенности является тот факт, что липидный компонент может действовать путем усиления биодоступности олигонуклеотида. В некоторых вариантах осуществления липидный компонент находится на или возле 5'-конца олигонуклеотида. Этот липидный "колпачок" может предотвращать разложение, увеличивать растворимость, улучшать стабильность олигонуклеотида в фармацевтической композиции, может приводить к полидентатным лигандам посредством образования мицелл или других агрегатов или любой их комбинации. В некоторых аспектах, липидный компонент представляет собой холестерол.
Поскольку описанные олигонуклеотиды стимулируют увеличенный иммунный ответ посредством TLR21, другие варианты осуществления настоящей заявки включают способы предотвращения или лечения заболевания путем введения субъекту, который в этом нуждается, раскрытого в настоящей заявке иммуностимулирующего олигонуклеотида.
Также обеспечивается иммуностимулирующие композиции, содержащая раскрытый в настоящей заявке иммуностимулирующий олигонуклеотид. В то время как эти иммуностимулирующие композиции включают олигонуклеотид, как описано в настоящей заявке, композиции также могут включать другие компоненты, которые оказывают влияние на иммуногенность, эффективность и результативность композиции. Например, в некоторых аспектах иммуностимулирующая композиция содержит фармацевтически приемлемый наполнитель. Фармацевтически приемлемый наполнитель адаптирует композицию для введения путем, выбранным из внутривенного, внутримышечного, интрамаммарного, внутрикожного, внутрибрюшинного, подкожного, путем распыления, с помощью аэрозоля, «в яйцо», слизистого, чрескожного, путем погружения, перорального, внутриглазного, интратрахеального, интраназального, легочного, ректального или других путей, известных квалифицированному специалисту в данной области техники. Фармацевтически приемлемый (е) наполнитель (и) может (гут) представлять собой разбавитель, адъювант, наполнитель или вспомогательное вещество, с которым вводится иммуностимулирующая композиция. Такие наполнители могут являться жидкостями, такими как вода и масла, включая нефтепродукты, вещества животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и другие. Например, можно использовать 0,4% физиологический раствор и 0,3% глицин. Эти растворы являются стерильными и практически не содержат твердых примесей. Их можно стерилизовать с помощью общепринятых, хорошо известных методик стерилизации (например, фильтрации). Композиции могут содержать фармацевтически приемлемые вспомогательные вещества, что необходимо для приближения к физиологическим условиям, такие как вещества, корригирующие значение рН, и буферные агенты, стабилизаторы, загустители, смазывающие вещества и красители и др. Концентрация молекул согласно изобретению в таком фармацевтическом препарате может изменяться в широких пределах, то есть от менее чем приблизительно 0,5%, обычно до по меньшей мере приблизительно 1% вплоть до 15 или 20% по весу и будет выбираться главным образом на основании требуемой дозы, объема жидкостей, вязкостей и т.д., в соответствии с конкретным выбранным путем введения. Подходящие наполнители и препараты, в том числе и для других белков человека, например, сывороточного альбумина человека, описаны, например, в Remington: The Science and Practice of Pharmacy, 21oe изд, под ред. Troy, D.B., Lipincott Williams and Wilkins, Philadelphia, PA 2006, часть 5, Pharmaceutical Manufacturing, cc. 691-1092 (см., в особенности, cc. 958-989).
В некоторых вариантах осуществления, олигонуклеотид и носитель связаны. Как используется для описания взаимосвязи между олигонуклеотидом и носителем, "связанные" относится к физической ассоциации олигонуклеотида и носителя. Когда олигонуклеотид и носитель связаны друг с другом, взаимодействуют друг с другом, или объединены, слиты, или другим способом соединены, то они могут рассматриваться как связанные.
Иммуностимулирующие композиции, описанные в настоящей заявке, дополнительно включают гаптен в некоторых вариантах осуществления. В некоторых аспектах, иммуностимулирующий олигонуклеотид связан с гаптеном. Гаптен может вызывать иммунологический ответ на специфический микроорганизм, такой как, но не ограничиваясь только ими, Е. coli или Salmonella, в то время как иммуностимулирующий олигонуклеотид вызывает неспецифический иммунологический ответ, опосредованный взаимодействием TLR21 с олигонуклеотидом. Эти и другие инфекционные микроорганизмы вызывает очень большие проблемы в крупномасштабных брудерных птичниках, в которых обитатели имеют повышенный риск инфицирования.
Некоторые варианты осуществления иммуностимулирующих композиций обеспечивают вакцину для предотвращения или лечения инфекционного заболевания, включающую по меньшей мере один из иммуностимулирующих олигонуклеотидов, описанных в настоящей заявке. Для того, чтобы олигонуклеотид вызвал любой иммунный ответ, он должен быть эффективно доставлен к его мишени, независимо от того, представляет ли собой мишень клеточную культуру, курицу или другое позвоночное. Таким образом, один аспект настоящей заявки обеспечивает вектор, содержащий иммуностимулирующий олигонуклеотид, описанный в настоящей заявке.
Эффективность иммуностимулирующего олигонуклеотида, и, следовательно, иммуностимулирующей композиции, содержащей только олигонуклеотид в качестве активного компонента, может быть измерена с помощью его полумаксимальной эффективной концентрации (ЕС50). ЕС50 представляет собой величину концентрации иммуностимулирующей композиции, которая индуцирует ответ, составляющий половину максимального ответа, который может быть достигнут путем введения композиции. Чем более низкой является концентрация, тем более эффективен олигонуклеотид. В некоторых аспектах настоящей заявки, иммуностимулирующая композиция может иметь ЕС50 в пМ диапазоне. В некоторых аспектах, ЕС50 составляет от приблизительно 0,1 до 100 пМ. В некоторых аспектах, ЕС50 составляет от приблизительно 100 до 200 пМ. В некоторых аспектах ЕС50 составляет от приблизительно 200 до 300 пМ. В некоторых аспектах, ЕС50 составляет от приблизительно 300 до 400 пМ. В некоторых аспектах ЕС50 составляет от приблизительно 400 до 500 пМ. В некоторых аспектах ЕС50 составляет от приблизительно 500 до 600 пМ. В некоторых аспектах ЕС50 составляет от приблизительно 600 до 700 пМ. В некоторых аспектах ЕС50 составляет от приблизительно 700 до 800 пМ. В некоторых аспектах ЕС50 составляет от приблизительно 800 до 900 пМ. В некоторых аспектах ЕС50 составляет от приблизительно 900 пМ и 1 нМ. В еще других аспектах, ЕС50 составляет меньше, чем приблизительно 100 пМ.
Что касается концентрации олигонуклеотида в иммуностимулирующей композиции, в некоторых аспектах концентрация олигонуклеотида составляет от приблизительно 0,1 до 10 нМ. В некоторых аспектах, концентрация олигонуклеотида составляет от приблизительно 10 до 20 нМ. В некоторых аспектах концентрация олигонуклеотида составляет от приблизительно 20 до 30 нМ. В некоторых аспектах, концентрация олигонуклеотида составляет от приблизительно 30 до 40 нМ. В некоторых аспектах концентрация олигонуклеотида составляет от приблизительно 40 до 50 нМ. В некоторых аспектах концентрация олигонуклеотида составляет от приблизительно 50 до 60 нМ. В некоторых аспектах концентрация олигонуклеотида составляет от приблизительно 60 до 70 нМ. В некоторых аспектах концентрация олигонуклеотида составляет от приблизительно 70 до 80 нМ. В некоторых аспектах концентрация олигонуклеотида составляет от приблизительно 80 до 90 нМ. В некоторых аспектах концентрация олигонуклеотида составляет от приблизительно 90 до 1 мкМ. В еще других аспектах, концентрация олигонуклеотида составляет меньше, чем приблизительно 20 нМ.
Иммуностимулирующая композиция дополнительно может включать по меньшей мере один дополнительный олигонуклеотид, имеющий последовательность G-проволоки в некоторых вариантах осуществления настоящей заявки. Поскольку последовательность G-проволоки облегчает агрегацию других олигонуклеотидов, имеющих аналогичную, или сходную, последовательность G-проволоки, то один аспект иммуностимулирующей композиции дополнительно содержит по меньшей мере один дополнительный олигонуклеотид, имеющий последовательность G-проволоки. В некоторых аспектах, в которых иммуностимулирующая композиция содержит множество олигонуклеотидов, имеющих последовательности G-проволоки, олигонуклеотид и по меньшей мере один дополнительный олигонуклеотид имеют конформацию G-проволоки.
Также в настоящей заявке обеспечиваются способы стимуляции толл-подобного рецептора 21 (TLR21), включающие введение субъекту, который в этом нуждается, олигонуклеотида, имеющего по меньшей мере один CpG мотив и обогащенную гуаниновыми нуклеотидами последовательность, начинающиеся на или в пределах четырех нуклеотидов от 5'-конца олигонуклеотида. Также обеспечиваются способы вызывания иммунного ответа у субъекта, включающие введение субъекту, который в этом нуждается, иммуностимулирующего олигонуклеотида, имеющего по меньшей мере один CpG динуклеотидный мотив и по меньшей мере одну обогащенную гуаниновыми нуклеотидами последовательность, начинающиеся на или в пределах четырех нуклеотидов от 5'-конца олигонуклеотида.
Олигонуклеотид может вводиться в форме иммуностимулирующей композиции, как описано выше. Иммуностимулирующая композиция дополнительно может включать гаптен, фармацевтически приемлемый наполнитель, или оба компонента, как описано выше. Введение иммуностимулирующей композиции, в некоторых аспектах, может осуществляться внутривенно, внутримышечно, интрамаммарно, внутрикожно, внутрибрюшинно, подкожно, путем распыления, с помощью аэрозоля, «в яйцо», слизисто, чрескожно, путем погружения, перорально, внутрь глаза, интратрахеально или интраназально. Субъект, который нуждается во введении, представляет собой животное. В некоторых аспектах, субъект представляет собой представителя видов птиц. Например, иммуностимулирующая композиция, описанная в настоящей заявке, может вводиться «в яйцо» в оплодотворенное куриное яйцо или внутримышечно вылупившимся цыплятам или даже взрослым птицам.
Также в настоящей заявке обеспечиваются способы увеличения TLR21-стимулирующей активности олигонуклеотида, имеющего по меньшей мере один CpG мотив, включающий слияние 5'-конца олигонуклеотида с обогащенной гуаниновыми нуклеотидами последовательностью. В некоторых аспектах, обогащенная гуаниновыми нуклеотидами последовательность представляет собой G-квартетную последовательность. В некоторых аспектах, G-квартетная последовательность содержит первое множество гуаниновых нуклеотидов. Это первое множество гуаниновых нуклеотидов может включать часть TGGGGT последовательности (SEQ ID NO: 265). В некоторых аспектах, первое множество гуаниновых нуклеотидов содержит три - восемь гуаниновых нуклеотидов. В еще других аспектах, G-квартетная последовательность содержит TTAGGG, TTAGGGTTAGGG (SEQ ID NO: 261), TTTTGGGG, GGGGTTTT, GGGGTTTTGGGG (SEQ ID NO: 262), TTAGGG, TTAGGGTTAGGGTTTT (SEQ ID NO: 263), TGTGGGTGTGTGTGGG (SEQ ID NO: 268), GGAGG, TGGAGGC или TGGAGGCTGGAGGC (SEQ ID NO: 264).
Другие варианты осуществления настоящего изобретения обеспечивают обогащенную гуаниновыми нуклеотидами последовательность, которая включает первое и второе множество гуаниновых нуклеотидов. В других аспектах, обогащенная гуаниновыми нуклеотидами последовательность содержит последовательность G-проволоки. В некоторых аспектах, последовательность G-проволоки содержит SEQ ID NO: 257 или 258. В еще других аспектах осуществления способа, первое множество гуаниновых нуклеотидов и второе множество гуаниновых нуклеотидов разделены по меньшей мере одним нуклеотидом.
Способ, как описано в настоящей заявке, может дополнительно включать, в некоторых вариантах осуществления, инсертированный линкер между первым множеством гуаниновых нуклеотидов и по меньшей мере одним CpG мотивом. Линкер был описан выше и может включать, но не ограничиваясь только ими, по меньшей мере три нуклеотида или гексаэтиленгликоль.
Способность олигонуклеотида стимулировать TLR21 может быть дополнительно усилена в соответствии с некоторыми аспектами изобретения путем увеличения числа CpG мотивов в олигонуклеотиде. В некоторых аспектах, по меньшей мере один CpG мотив представляет собой множество CpG мотивов, и множество CpG мотивов содержит два, три, четыре или пять CpG мотивов. Расстояние между CpG мотивами может оказывать влияние на свойства олигонуклеотида стимулировать TLR21. В связи с этим, некоторые аспекты раскрытого способа обеспечивают инсертирование по меньшей мере одного нуклеотида или аналога нуклеотида между CpG мотивами. По меньшей мере один нуклеотид может представлять собой два или три тиминовых нуклеотида.
Другие варианты осуществления способа обеспечивают инсертирование спейсера между каждым из CpG мотивов. Спейсер должен быть способен связываться с 3'-концом одной смежной нуклеотидной цепи и с 5'-концом другой нуклеотидной цепи. В некоторых аспектах, спейсер представляет собой дезоксирибозофосфатный мостик, который может быть безосновным в некоторых аспектах.
Спейсер, в некоторых аспектах, может включать углеродную цепь. В некоторых вариантах осуществления углеродная цепь содержит два атома углерода. В некоторых аспектах углеродная цепь имеет происхождение из этандиола. Другие варианты осуществления обеспечивают углеродную цепь, содержащую три атома углерода. В некоторых аспектах, углеродная цепь имеет происхождение из 1,3-пропандиола. В некоторых вариантах осуществления, углеродная цепь содержит четыре атомов углерода, и в некоторых аспектах углеродная цепь имеет происхождение из 1,4-бутандиола. В еще других вариантах осуществления, спейсер содержит повторяемую химическую единицу. В некоторых аспектах, повторяемая химическая единица представляет собой этиленгликоль, и в некоторых аспектах спейсер представляет собой имеющий происхождение из гексаэтиленгликоля.
Также охватывается способ усиления TLR21 стимулирующих свойств олигонуклеотида, в котором инкорпорируют по меньшей мере один аналог нуклеотида или липидный компонент в олигонуклеотид. В некоторых аспектах, липидный компонент находится на или возле 5'-конца олигонуклеотида. Еще другие варианты осуществления способа включают модифицированные нуклеотиды, смежные с CpG мотивом.
ПРИМЕРЫ
Следующие примеры представлены для дальнейшего описания некоторых их вариантов осуществления, раскрытых в настоящей заявке. Примеры предназначены для иллюстрации, но не для ограничения описанных вариантов осуществления.
Пример 1: Создание HEK293 клеточной линии с репортерным геном NFκB пути
pNifTy2-SEAP (Invivogen) и другие коммерчески доступные плазмидные векторы широко используются для создания клеточных линий с репортерным геном NFκB пути. Коммерчески доступная форма pNifTy2-SEAP содержит ген устойчивости к зеоцину для бактериальной селекции и селекции у млекопитающих, для которой необходимы большие количества этого цитостатика (вплоть до 400 мкг/мл), и селекция в некоторых случаях становится ненадежной. Следовательно, было инициировано создание репортерной плазмиды с лучшими селективными маркерами, предпочтительно устойчивостью к бластицидину.
Синтезировали открытую рамку считывания, кодирующую pNifty2-SEAP-кодируемый (секретируемую эмбриональную щелочную фосфатазу) SEAP ген в кодон-оптимизированной форме для человека. Также синтезировали участок из 284 по в pNifty2-SEAP против хода транскрипции ATG старт-кодон, который охватывает пять сайтов распознавания NFκB и промоторный сайт эндотелиальной молекулы адгезии лейкоцитов (ELAM), со следующей модификацией: KpnI сайт конструировали сразу против хода транскрипции ATG старт-кодона (инсерция последовательности "GGTA"), и дополнительно против хода транскрипции, интродуцировали последовательность, состоящую из в 5'→3' EcoRV, MluI и NdeI сайт. Кроме того, по ходу транскрипции от стоп-кодона, интродуцировали NheI сайт и второй EcoRV сайт. Особое внимание обращали на то, чтобы избежать присутствия этих сайтов в SEAP открытой рамке считывания.
NFκB-SEAP (кодон-оптимизированная для человека) (SEQ ID NO: 1)
(Подчеркнутым показано сайты рестрикционных ферментов, используемые для субклонирования (MluI и NdeI). Старт ATG и стоп ТАА кодоны выделены жирным шрифтом.)


Эту синтезированную SEAP генную конструкцию ("NFκB-SEAP") высекали из клонирующего вектора с помощью двойного расщепления MluI/NheI и интродуцировали путем лигирования в pcDNA3.1(+) вектор (Фиг. 1), предварительно разрезали с помощью MluI/NheI и очищали на геле для удаления участка CMV промотора. Версии собственного изготовления pcDNA3.1(+), где ген устойчивости к неомицину (NeoR/KanR) заменяли на ген устойчивости к бластицидину (bsd → pcDNA3. 1(+)-bsd) или ген устойчивости к пуромицину (puro → pcDNA3.1(+)-puro) процессировали аналогично и лигировали с помощью NFκB-SEAP конструкции.
Из этого набора конструкций, выбирали для HEK293 трансфекции bsd-содержащую плазмиду pcDNA3. 1(+)-bsd-NFκB-SEAP. Для этого, PvuI-линеаризованную форму интродуцировали в клетки с помощью стандартных методов трансфекции и клетки с интегрированной в геном конструкцией селектировали с помощью 10 мкг/мл бластицидина. Устойчивые популяции клеток тестировали относительно индуцированной фактором некроза опухоли альфа (TNF-α) продукции SEAP, и путем клонирования из одной клетки, выбирали одну клеточную линию (HEK293-NFκB-SEAP-bsd или HEK293-NFκB-bsd) с особенно благоприятным отношением сигнала к шуму выбирали для дальнейших исследований. ЕС50 для ФНО-α человека для этой клеточной линии составляло 3,2 нг/мл (Фиг. 2).
Пример 2: Создание куриной TLR21 трансгенной клеточной линии
Куриный толл-подобный рецептор 21 (TLR21) представляет собой неметилированный CpG ДНК рецептор, который является функционально гомологичным, но не ортологичным, TLR9 млекопитающих (Brownlie и др. 2009, Keestra и др. 2010). Синтезировали ген, кодирующий куриный TLR21, на основании выведенной белковой последовательности с номером доступа Genbank NM_001030558 и путем оптимизирования в отношении частоты использования кодонов людей. Против хода транскрипции от старт-кодона ATG, интродуцировали KpnI сайт, включая последовательность Козака, в то время как по ходу транскрипции от стоп-кодона добавляли NotI сайт и EcoRV сайт. TLR21 ген вырезали из клонирующего вектора с помощью двойного расщепления KpnI/NotI, очищали на геле и лигировали в KpnI/NotI-вырезанный экспрессионный вектор млекопитающих pcDNA3.1(+). Этот pcDNA3.1(+)-cTLR21 линеаризировали с PvuI и трансфектировали совместно с PvuI-линеаризованной pcDNA3.1(+)-bsd-NFκB-SEAP в HEK293, что приводило к получению HEK293-NFκB-bsd-cTLR21 или HEK293-bsd-cTLR21.
Отбирали клеточную популяцию путем одновременного применения бластицидина и G418, тестировали для определения функционального NFκB пути с помощью ФНО-α и для активного cTLR21 с помощью фосфоротиоатного олигонуклеотида 2006-РТО (SEQ ID NO: 3). Клонирование на основе одной клетке приводило к получению клональной клеточной линии с чрезвычайно хорошим отношением сигнала к шуму в ответ на 2006-РТО. Клональная HEK293-NFκB-bsd-cTLR21 клеточная линия продемонстрировала чрезвычайно хорошую ФНО-α чувствительность (ЕС50=1,4 нг/мл), сходную с той, которая наблюдалась для HEK293-NFκB-bsd (Фиг. 2).
TLR21-Ген Gallus gallus (на основании NM_001030558) (SEQ ID NO: 2) (Старт ATG и стоп TAG кодоны выделены подчеркиванием.):


Известно, что фосфоротиоатный (PTO) олигодезоксинуклеотид (ОДН) 2006-РТО (ОДН 2006) активирует TLR21. Keestra, A.M., de Zoete, M.R., Bouwman, L.I., van Putten, J.P., 2010. Куриный TLR21 является генетически детерминированным CpG ДНК рецептором, отличающимся от TLR9 млекопитающих. J. Immunol. 185, 460-467. В клональной TLR21 клеточной линии согласно настоящему исследованию (HEK293-NFκB-bsd-cTLR21), 2006-РТО также является активным, cEC50 активации ~ 8,5 нМ. В отличие от этого HEK293-NFκB-bsd не проявляет какую-либо SEAP секрецию (Фиг. 3А). Это демонстрирует специфическое взаимодействие этого ОДН, специфически на TLR21. 2006-PDE, связанная фосфодиэфирной связью версия 2006-РТО, является намного более слабой в этой стимулирующей активности на TLR21. Оценка для его ЕС50 составляет > 250 нМ, которая намного ниже максимальной стимуляции по сравнению с 2006-РТО (Фиг. 3В).
Пример 3: ОДН, содержащий 5' G-квартетные образующие последовательности, усиливает TLR21 активность Влияние добавлений 3'дезоксигуанина (dG) на TLR21 распознавание 2006-PDE (ODN2006, фосфодиэфирная форма)
Связанную фосфодиэфирной связью версию 2006-РТО, 2006-PDE, использовали в качестве основы для исследования влияния 3'-dG модификации на TLR21-стимулирующую активность в HEK293-NFκB-bsd-cTLR21 клеточной линии, описанной в Примере 2. Для этого, осуществляли титрационные эксперименты, начиная при концентрации 20 нМ с 15 этапами разбавления (1:2), достигая приблизительно 1 пМ в качестве финального разбавления. Специфически, HEK293-NFκB-bsd-cTLR21 клетки высевали в планшеты на 384 лунки в количестве 10 тыс. клеток/лунку в 45 мкл ростовой среды. Эти клетки подвергали воздействию олигонуклеотида, растворенного в ростовой среде, и инкубировали при 37° в течение 3-4 дней. 10 мкл культурального супернатанта на лунку переносили в планшет на 384 лунки и добавляли 90 мкл 50 мМ NaHCO3/Na2CO3, 2 мМ MgCl2, 5 мМ пара-нитрофенилфосфата (pNP) рН 9,6 и определяли скорость реакции путем кинетического измерения изменений в динамике оптической плотности при 405 нМ (мОП 405 нм/мин).

Наряду с тем, что, как предполагалось, 2006-РТО стимулирует TLR21 в наномолярном диапазоне, 2006-PDE не проявляет существенной TLR21-стимулирующей активности. Добавление одного dG на 3'-конце приводило к некоторой заметной TLR21-стимулирующей активности в нМ диапазоне, которое все еще присутствует при втором (dG2) и третьем (dG3) dG добавлении, пусть даже и намного слабее. Добавление четвертого, пятого, шестого, седьмого и восьмого dG (dG4-dG8) приводит к TLR21 неактивному ОДН (Фиг. 4А). При концентрации в диапазоне вплоть до 0,33 нМ (330 пМ), ни один из ОДН не проявил TLR21 активность (Фиг. 4В).
Влияние 5'dG добавлений на TLR21 распознавание 2006-PDE (ODN2006, фосфодиэфирная форма)
Связанную фосфодиэфирной связью версию 2006-РТО, 2006-PDE, использовали в качестве основы для исследования влияния 5'-dG модификации на TLR21-стимулирующую активность. Для этого, осуществляли титрационные эксперименты, начиная при концентрации 20 нМ с 15 этапами разбавления (1:2), достигая приблизительно 1 пМ в качестве финального разбавления.

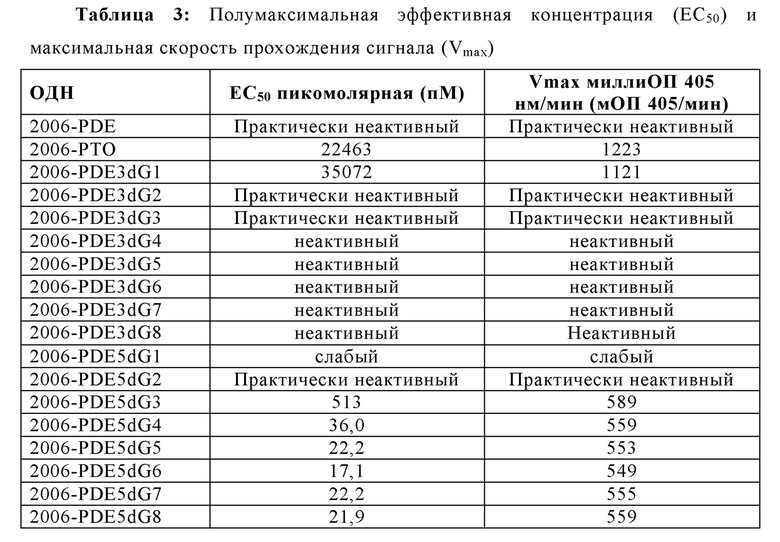
2006-РТО стимулирует TLR21 в наномолярном диапазоне и 2006-PDE не проявляет существенной TLR21-стимулирующей активности. Добавление одного dG и двух G на 5'-конце 2006-PDE приводило к некоторой незначительной TLR21-стимулирующей активности в двузначном нМ диапазоне. Третий dG (dG3) приводил к резко выраженному повышению TLR21 активности, с рассчитанной ЕС50 513 пикомоль (пМ) (Таблица 3). Добавление четвертого dG дополнительно в 14 раз увеличило активность (рассчитанная ЕС50 36 пМ, Таблица 3), в то время как пятый, шестой, седьмой и восьмой dG (dG4-dG8) приводили к дальнейшему ЕС50 увеличению и TLR21 стимулирующему плато с ЕС50 в интервале от 17,1 до 22,2 пМ. Проанализировав данные в совокупности, полагают, что после добавления 3dG, но не после еще двух dG, на 5'-конце, происходят определенные фундаментальные изменения в структуре ОДН, которые приводят к массивному увеличению TLR21 активности, от практически неактивности до сильной пикомолярной активности, которая дополнительно повышается с помощью дополнительных 5' dG. Эквивалентные добавления dG на 3'-конце не приводят к высокой активности, соответствующие ОДН производные являются практически неактивными (сравн. Фиг. 4А-В, 5А-В, и 6, а также Таблицу 3).
Для исследования поведения электрофоретической подвижности ОДН, тестируемых на TLR21, осуществляли электрофорез в 16% ТВЕ полиакриламидном геле, с последующим окрашиванием метиленовым синим. В случае 2006-PDE-5dG0-8, существует четкая корреляция между появлением структур высших порядков (Фиг. 7А, 7В) и высокой TLR21 стимулирующей активностью. Вероятно, это происходит вследствие того, что структуры высших порядков образуются путем создания G-квартетных структур, для которых известно, что они часто образованы последовательными G, и потенциально задействуют одну и ту же цепь ('внутримолекулярные G-квартеты') или различные цепи ('межмолекулярные G-квартеты') ДНК. Williamson JR, G-Quartet Structures in Telomeric DNA, Ann. Rev. Biophys. Biomol. Struct., 23: 703-730 (1994); Simonsson T, G-Quadruplex DNA Structures - Variations on a Theme, Biol. Chem. 382: 621-628 (2001). Тем не менее, такая же агрегация наблюдается в 2006-PDE-3dG0-8 олигонуклеотидах, которые являются плохо активными или неактивными на TLR21. Это свидетельствует о том, что агрегация отдельно не является достаточной для сильной TLR21 стимулирующей активности. Полагают, что позиционирование последовательных гуанинов на 5'-конце оказывает влияние на TLR21 стимулирующую активность.
Дальнейшее исследование зависимости гуаниновых остатков на 5'-конце потенциальной TLR21 стимуляции, используя пример 2006-PDE-5dG6.
2006-PDE-5dG6 выбирали в качестве примера, поскольку выяснилось, что он образует плато TLR21 стимулирующей активности в 5'dGn сканировании для 2006-PDE (см. Фиг. 5А, 5В, 6, и Таблица 3). 5'-dG6 остатки заменяли на dA6, dT6 или dC6 (Таблица 4).
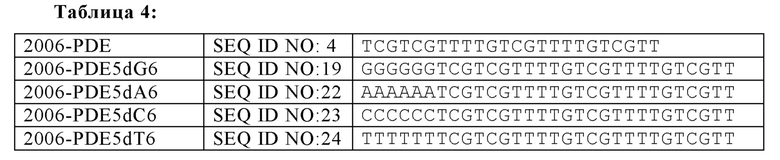
Когда 2006-PDE модифицировали с помощью dN6 на 5'-конце, каждый гомомер основания приводит к некоторому увеличению TLR21 активности в порядке улучшения: dA6 < dC6 < dT6 <<<<<<<< dG6 (Фиг. 8А) Улучшение для 5'-dG6 очевидно по величине на несколько порядков выше, чем для других оснований (видимое в особенности при низких концентрациях, Фиг. 8В), свидетельствуя о специальном качественном свойстве, придаваемой этой модификацией с потенциалом образования G-квартета.
Исследование зависимости присутствия CpG элементов на потенциальную TLR21 стимуляцию с помощью 5'-dG-модифицированных 2006-PDE, используя пример 2006-PDE-5dG6.
2006-PDE-5dG6 выбирали в качестве примера, поскольку выяснилось, что он образует плато TLR21 стимулирующей активности в 5'dGn сканировании для 2006-PDE (см. Фиг. 5А, 5В, 6, и Таблица 3). Исследовали влияния CpG мотивов на TLR21 стимулирующую активность путем 1) синтезирования этого ОДН с 5-метил-цитидином, заменяющий каждый цитидин в четырех CpG мотивах, путем 2) инвертирования каждого CpG мотива на GpC, и путем 3) замены каждого гуанина в CpG мотивах на аденин, путем замены каждого цитозина на тимин, и путем одновременной замены цитозина и гуанина на тимин и аденин, соответственно. Полученные олигонуклеотиды тестировали для определения их способности стимулировать TLR21, используя HEK293-NFκB-bsd-cTLR21 клетки, как описано в Примере 3.

В настоящей заявке исследовали каждую модификацию, которая препятствует целостности CpG мотивов в 2006-PDE-5dG6, что приводит к массивной потере активности (Фиг. 9А), что становится особенно заметным при низких ОДН концентрациях (Фиг. 9В).
Исследование влияния 3'- и 5'-dG6 модификаций 2006-РТО на TLR21 стимулирующую активность и сравнение с эквивалентными изменениями в 2006-PDE.
Для исследования, будет ли улучшение TLR21-стимулирующей активности путем добавления dG остатков также распространяться на олигодезоксинуклеотиды с фосфоротиоатным остовом (РТО-ОДН), синтезировали РТО родственные структуры для 2006-PDE, 2006-PDE-3dG5 и 2006-PDE-5dG6 были синтезированы (Таблица 6), и их способность стимулировать TLR21, используя HEK293-NFκB-bsd-cTLR21 клетки, как описано в Примере 3, сравнивали друг с другом и их PDE-версиями (Таблица 7, Фиг. 10А и 10В).

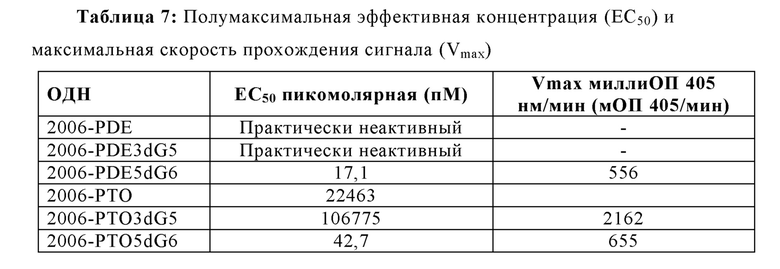
При отсутствии 5'dG остатков, РТО модификация придает значительно более высокую активность для ОДН по сравнению с PDE версиями (Таблица 7, Фиг. 10А и 10В). Это отличается для 5'dG6-модифицированного 2006-PDE по сравнению с его РТО версией. В данном случае, PDE придает даже еще незначительно более высокую активность (ЕС50), что является неожиданным (Таблица 7, Фиг. 10А и 10В).
Исследование влияния dA замен в 5dG6 участке 2006-PDE-5dG6 на TLR21 стимулирующую активность.
На основании гипотезы о том, что последовательные dG последовательности на 5'-конце для 2006-PDE образуют G-квартеты, придающие TLR21-стимулирующую активность, было спрогнозировано, что dA замены в dG6 участке, как предполагается, разрушающие образование G-квартета, будут иметь, в зависимости от положения, отрицательное влияние на TLR21 стимулирующую активность. Для этого, были синтезированы единичная и двойная dA замена 2006-PDE-5dG6 ОДН, используя методы, известные квалифицированному специалисту в данной области техники, и тестировали в HEK293-NFκB-bsd-cTLR21 клетках для определения их способности стимулировать TLR21, как описано в Примере 3 (Таблицы 8 и 9, Фиг. 11A-D).


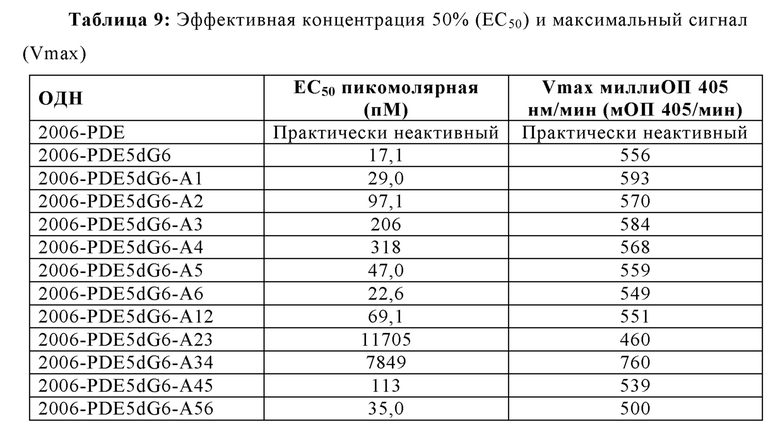
В целом, все dA замены в пределах dG6 участка приводят к незначительным изменениям в Vmax (то есть, максимальное считывание данных репортерного гена, полученное в сравнительных экспериментах), в то время как ЕС50 изменяется значительно вплоть до больше, чем на два порядка величин (Таблица 9 и Фиг. 11А и 11В). Единичные замены в 1-м и 6-м положениях были очень слабыми на ЕС50, в то время как 2-е и 5-е положение приводили к более заметному увеличению. Наиболее сильные изменения наблюдали для 3-го и 4-го положений, которые приводили более чем к 10-кратному увеличению для ЕС50. В случае двойных dA замен (Таблица 9, Фиг. 11С и 11D), последовательные в 1-м и 2-м, так же, как и в 5-м и 6-м приводят к относительно слабым ЕС50 увеличениям, в то время как 4-е и 5-е приводят к более сильному увеличению. Двойная dA замена во 2-м и 3-м, так же, как и в 3-м и 4-м положений приводит к увеличениям ЕС50 в 685-раз и 459-раз, соответственно. Принимая во внимание тот факт, что 3 последовательные dG были идентифицированы ранее в настоящем исследовании как минимальное число для потенциальной TLR21 активности и ЕС50 увеличения были отмечены в порядке dG3, dG4 - dG5, после которого ЕС50 плато наблюдалось от dG5 - dG8 (сравн. Фиг 5А, 5В, 6, и Таблица 3), эти данные дополнительно подтверждают идею о том, что ненарушенное образование G-квартетов на 5'-конце для 2006-PDE является предварительным условием для сильной TLR21 стимуляции.
Исследование влияния dC замен в 5dG6 участке 2006-PDE-5dG6 на TLR21 стимулирующую активность.
На основании гипотезы о том, что последовательные dG последовательности на 5'-конце для 2006-PDE образуют G-квартеты, придающие TLR21-стимулирующую активность, было спрогнозировано, что dC замены в dG6 участке, как предполагается, разрушающие образование G-квартета, будут иметь, в зависимости от положения, отрицательное влияние на TLR21 стимулирующую активность. Для этого, были синтезированы единичная и двойная dC замена 2006-PDE-5dG6 ОДН и тестировали для определения их способности стимулировать TLR21, как поясняется в Примере 3. (Таблица 10, Таблица 11, Фиг. 12A-D).
В целом, все dC замены в пределах dG6 участка приводят к незначительным изменениям в Vmax (то есть, максимальное считывание данных репортерного гена, полученное в сравнительных экспериментах), в то время как ЕС50 изменяется значительно вплоть до больше, чем на два порядка величин (Таблица 11 и Фиг. 12А и 12В). Единичные замены в 1-м и 6-м положениях олигонуклеотида были очень слабыми на ЕС50, как были в 2-м и 5-м положении олигонуклеотида. Наиболее сильные изменения наблюдали для 3-го и 4-го положений олигонуклеотида, которые приводят к более чем в 10-раз увеличению для ЕС50. В случае двойных dC замен (Таблица 11 и Фиг. 12С и 12D), последовательные в 1-ми 2-м, так же, как и в 5-м и 6-м положения олигонуклеотида приводят к относительно слабым ЕС50 увеличениям, в то время как 4-е и 5-е положения приводят к более сильному увеличению. Двойная dC замена 2-го и 3-го положения, так же, как и 3-го и 4-го положения олигонуклеотида приводит к массивным увеличениям ЕС50 в 160-раз и 303-раз, соответственно. Принимая во внимание тот факт, что 3 последовательные dG были идентифицированы в настоящем исследовании как минимальное число для потенциальной TLR21 активности и ЕС50 увеличения были отмечены в порядке dG3, dG4 до dG5, после которого ЕС50 плато наблюдалось от dG5-dG8 (сравн. Фиг. 5А-В, 6, и Таблица 3), эти данные дополнительно подтверждают идею о том, что ненарушенное образование G-квартетов на 5'-конце для 2006-PDE является предварительным условием для сильной TLR21 стимуляции.
Исследование влияния dT замен в 5dG6 участке 2006-PDE-5dG6 на TLR21 стимулирующую активность.
На основании гипотезы о том, что последовательные dG последовательности на 5'-конце для 2006-PDE образуют G-квартеты, придающие TLR21-стимулирующую активность, было спрогнозировано, что dT замены в dG6 участке, как предполагается, разрушающие образование G-квартета, будут иметь, в зависимости от положения, отрицательное влияние на TLR21 стимулирующую активность. Для этого, были синтезированы единичная и двойная dT замена 2006-PDE-5dG6 ОДН и тестировали в HEK293-NFκB-bsd-cTLR21 клетках для определения их способности стимулировать TLR21, как описано в Примере 3 (Таблица 12, Таблица 13, Фиг. 13A-D).
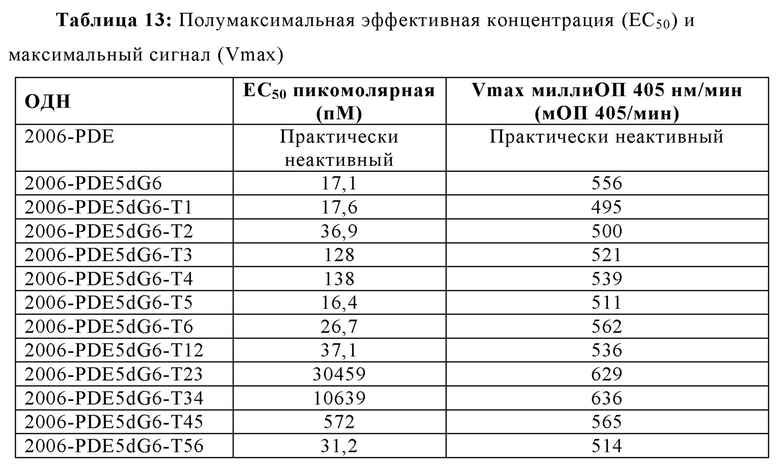
В целом, все dT замены в пределах dG6 участка приводят к незначительным изменениям в Vmax, в то время как ЕС50 значительно изменяются, вплоть до больше, чем на три порядка величин (Таблица 13 и Фиг. 13А и 13В). Единичные замены в 1-м и 6-м положениях олигонуклеотида были очень слабыми на ЕС50, как были 2-е и 5-е положение олигонуклеотида. Наиболее сильные изменения наблюдали для 3-го и 4-го положений олигонуклеотида, которые приводят к более чем в 6-раз увеличению для ЕС50. В случае двойных dT замены (Таблица 13 и Фиг. 13С и 13D), последовательные в 1-м и 2-м, так же, как и в 5-м и 6-м положения олигонуклеотида приводят к относительно слабым ЕС50 увеличениям, в то время как 4-е и 5-е положения приводят к более сильному увеличению. Двойная dT замена 2-го и 3-го положения олигонуклеотида, так же, как и 3-го и 4-го положения, приводит к массивным увеличениям ЕС50 в 1781-раз и 622-раз, соответственно. Принимая во внимание тот факт, что три последовательные dG были идентифицированы в настоящем исследовании как минимальное число для потенциальной TLR21 активности и что ЕС50 увеличения были отмечены в порядке dG3, dG4 до dG5, после которого ЕС50 плато наблюдалось от dG5-dG8 (сравн. Фиг. 5А, 5В, 6, и Таблица 3), эти данные дополнительно подтверждают идею о том, что ненарушенное образование G-квартетов на 5'-конце для 2006-PDE является предварительным условием для сильной TLR21 стимуляции.
На Фиг. 14 проиллюстрировано, что dG замены в положениях 1 и 6 олигонуклеотида являются, скорее всего, благоприятными. В отличие от этого, любая замена в положениях 3 и 4 олигонуклеотида не оказывает заметных отрицательных влияний на TLR21 стимулирующий потенциал. Также полагают, что смежные dGdG двойные замены в положениях 1 и 2, в также в 5 и 6, олигонуклеотида являются благоприятными. В отличие от этого, на Фиг. 15 проиллюстрировано, что в положениях 2 и 3, а также в 3 и 4 олигонуклеотида, замена смежного dGdG на любой гомодинуклеотид (dCdC, dAdA, и в особенности dTdT) приводит к драматической потере TLR21 стимулирующей активности. Смежные dGdG двойные замены в положениях 4 и 5 олигонуклеотида являются более умеренными, но также приводят к потере активности.
Эти данные указывают на то, что последовательные остатки четырех dG являются существенно важными для высокой TLR21 стимулирующей активности и разрушения участка из четырех dG остатков с помощью любого другого нуклеотида приводит к драматической потере активности.
Исследование влияния dA замен в 5dG4 участке для 2006-PDE-5dG4 на TLR21 стимулирующую активность.
Для более точного тестирования гипотезы о том, что 5'-dG4 является необходимым и достаточным для придания высокого уровня стимулирующей активности для 2006-PDE, dG компоненты в 2006-PDE-5dG4 были системно заменены на dA и различные производные тестировали в HEK293-NFκB-bsd-cTLR21 клетках для определения их способности стимулировать TLR21, как описано в Примере 3 (Таблица 14, Таблица 15, Фиг. 16А и 16В).



Все dA замены в пределах dG4 участка приводили к потерям TLR21 стимулирующей активности. Несколько неожиданно, драматическое изменение в TLR21 стимулирующей активности отмечали в положении 1, до такой степени, что ЕС50 не могла быть рассчитана (Таблица 15 и Фиг. 16А и 16В). Единичные dA замены во 2-м и 3-м положениях для 2006-PDE5dG4 также приводили к массивным увеличениям ЕС50, в 342 и 471 раз, соответственно. Наиболее слабую потерю активности наблюдали при dA замене в положении 4 в dG4 участке, с ЕС50 увеличением в 16 раз (Таблица 15 и Фиг. 16А и 16В). Эти данные дополнительно подтверждают идею о том, что ненарушенное образование G-квартетов на 5'-конце для 2006-PDE является предварительным условием для сильной TLR21 стимуляции.
Исследование влияния dC замен в 5dG4 участке для 2006-PDE-5dG4 на TLR21 стимулирующую активность.
Для более точного тестирования гипотезы о том, что 5'-dG4 является необходимым и достаточным для придания высокого уровня стимулирующей активности для 2006-PDE, dG компоненты в 2006-PDE-5dG4 были системно заменены на dC и различные производные тестировали в HEK293-NFκB-bsd-cTLR21 клетках для определения их способности стимулировать TLR21, как описано в Примере 3 (Таблица 16, Таблица 17, Фиг. 17А и 17В).
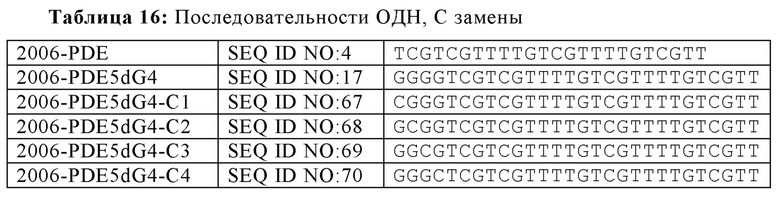

Все dC замены в пределах dG4 участка приводили к потерям TLR21 стимулирующей активности. Заметную потерю TLR21 стимулирующей активности отмечали в положении 1, с ЕС50 увеличением в 89 раз (Таблица 17 и Фиг. 17А и 17В). Единичные dC замены во 2-м и 3-м положениях также приводили к массивным увеличениям ЕС50, в 831 и 545 раз, соответственно. Наиболее слабую потерю активности наблюдали при dC замене в положении 4 в dG4 участке, с ЕС50 увеличением в 15 раз (Таблица 17 и Фиг. 17А и 17В). Эти данные дополнительно подтверждают идею о том, что ненарушенное образование G-квартетов на 5'-конце для 2006-PDE является предварительным условием для сильной TLR21 стимуляции.
Исследование влияния dT замен в 5dG4 участке для 2006-PDE-5dG4 на TLR21 стимулирующую активность.
Для более точного тестирования гипотезы о том, что 5'-dG4 мотив является необходимым и достаточным для придания высокого уровня стимулирующей активности для 2006-PDE, dG компоненты в 2006-PDE-5dG4 были системно заменены на dT и различные производные тестировали в HEK293-NFκB-bsd-cTLR21 клетках для определения их способности стимулировать TLR21, как описано в Примере 3 (Таблица 18, Таблица 19, Фиг. 18А и 18В).


Все dT замены в пределах dG4 участка приводили к потерям TLR21 стимулирующей активности. Несколько неожиданное и драматическое изменение в TLR21 стимулирующей активности наблюдали для положения 1, до такой степени, что ЕС50 не могла быть рассчитана (Таблица 19 и Фиг. 18А и 18В). Единичные dA замены во 2-м и 3-м положениях также приводили к массивным увеличениям ЕС50, в 92 и 265 раз, соответственно. Наиболее слабую потерю активности наблюдали при dT замене в положении 4 в dG4 участке, с ЕС50 увеличением в 5 раз (Таблица 19 и Фиг. 18А и 18В). Эти данные дополнительно подтверждают идею о том, что ненарушенное образование G-квартетов на 5'-конце для 2006-PDE является предварительным условием для сильной TLR21 стимуляции.
Как проиллюстрировано на Фиг. 19, любые dG замены в dG4 участке являются вредными для TLR21 стимулирующей активности, что согласуется с предположением о том, что четыре последовательные dG необходимы для высокой активности. Интересным является тот факт, что любая замена в положении 1 элиминирует TLR21 активность, несмотря на сохранение трех последовательных dG, в то время как замена в положении 4 dG, которая также сохраняет четыре последовательные dG, является сравнительно благоприятной. Замена dG2 или dG3 равным образом оказывает разрушающее воздействие на TLR21 активность.
Влияние 5'-dG4 и 5'-dG6 добавления к CpG-содержащему PDE-ОДН на обеспечение TLR21 стимулирующей активности.
Одиннадцать CpG-содержащих олигодезоксинуклеотидных последовательностей, указанных в литературе как стимулирующие для TLR9 млекопитающих (но большинство описаны как РТО версии) были выбраны для синтеза в качестве PDE производных (Таблица 20). TLR21 взаимодействие неизвестно для всех этих PDE ОДН. Для пяти из этих PDE ОДН, также были синтезированы их 3'-dG5-, 5'-dG4- и 5'-dG6-версии. Для одного ОДН, его 5'-dG4- и 5'-dG6-версии были синтезированы; для другого, его 3'-dG5- и 5'-dG6-версии были синтезированы; в то время как для 4 других, только соответствующие 5'-dG6-версии были синтезированы (Таблица 20). Эти ОДН подвергали тестированию для определения TLR21 стимуляции, как описано в Примере 3 (Таблица 21, Фиг. 20A-I).
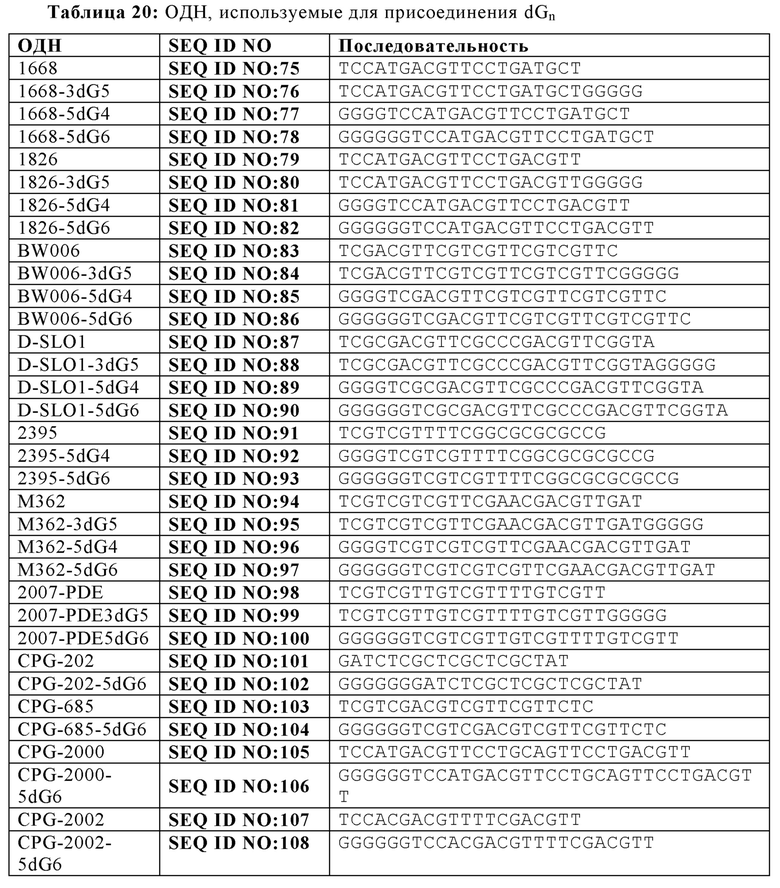

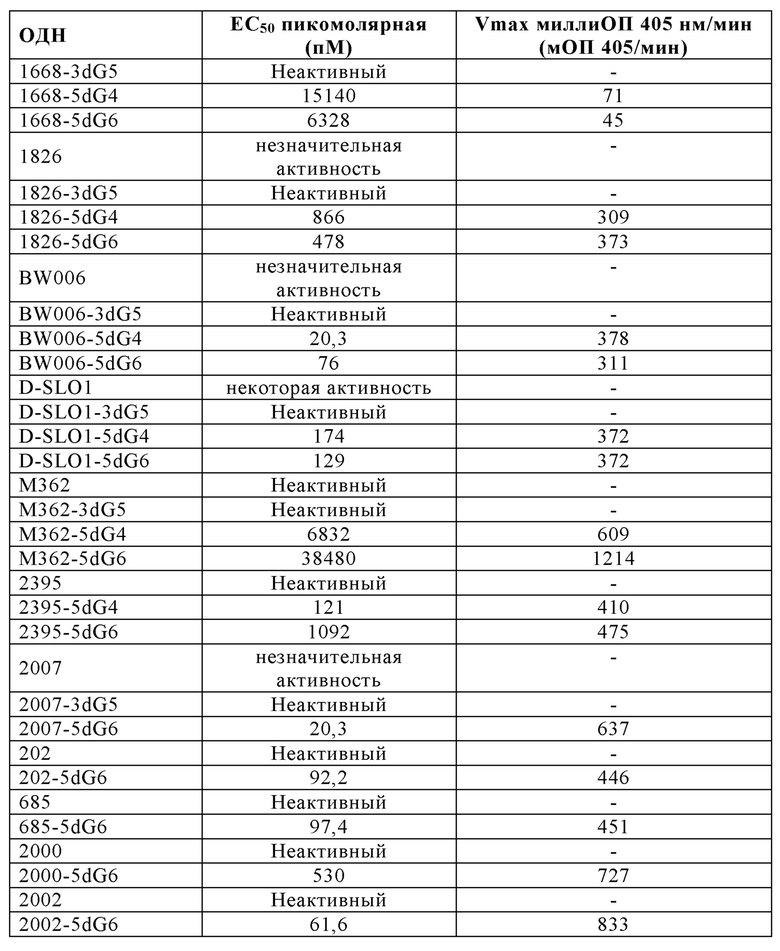
В тестах активации TLR21 немодифицированных PDE ОДН (Таблица 20), только 1826, BW006, D-SL01 и 2007 продемонстрировали некоторую незначительную активность (Таблица 21, Фиг. 20В, 20С, 20D, 20G). Все другие PDE ОДН не проявили TLR21 стимулирующей активности при тестируемой концентрации (Таблица 21, Фиг. 20А, 20Е, 20F, 20Н, 20I, 20J и 20K). Шесть ОДН производных, имеющих добавление 3'dG5, не проявили TLR21 активности (Таблица 21). Это согласуется с более ранними наблюдениями для 2006-PDE. Для четырех ОДН с незначительным TLR21 стимулирующим сигналом (1826, BW006, D-SL01, и 2007), добавление 3'dG5 убивало их активность (Фиг. 20В, 20С, 20D, 20G).
В отличие от этого, добавление 5'dG4 (шесть ОДН) или 5'dG6 (одиннадцать ОДН) приводило к увеличению TLR21 стимулирующей активности, в каждом случае включая наномолярные ЕС50, в пяти случаях, пикомолярные (пМ) ЕС50 в тринадцати других случаях (Таблица 21). Еще шесть имело двухзначные пМ ЕС50 (всего лишь 20 пМ), что является очень замечательным, если учитывать, что исходная точка была практически нулевой. Взятые в совокупности, эти свидетельствует о том, что потенциальная TLR21 активность может достигаться путем присоединения dG остатков к 5'-концу (но НЕ к 3'-концу) ранее плохо активных или неактивных CpG-содержащих PDE-ОДН.
Данные, представленные в настоящей заявке, также свидетельствует о том, что приобретенная активность связана с внутримолекулярным образованием G-квартетной ДНК суперструктуры с помощью 5'dGn-модифицированных ОДН.
Влияние 5'dG добавлений на распознавание 2006-PDE мышиного TLR9
Версию 2006-РТО с фосфодиэфирной связью, 2006-PDE, использовали в качестве основы для исследования влияния 5'-dG модификации на стимулирующую активность на TLR9 мыши и TLR9 человека. Осуществляли титрационные эксперименты, начиная при концентрации 2000 нМ или 5000 нМ ОДН концентрация с 15 этапами разбавления (1:2), достигая приблизительно 100 пМ или 500 пМ в качестве конечных разведении. Производные ОДН для 2006-РТЕ описаны в Таблице 21-2.

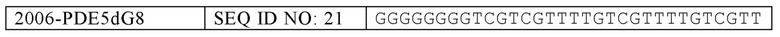
2006-РТО стимулирует TLR9 мыши и человека в наномолярном диапазоне. 2006-PDE проявляет только незначительную стимулирующую активность на TLR9 мыши или человека (Фиг. 68А и 68В). Добавление от одного до восьми dG на 5'-конце для 2006-PDE не приводит к повышению активности или только незначительно повышает активность на TLR9 мыши (Фиг. 68А). В HEKBlue клетках человека, добавление от одного до шести dG на 5'-конце для 2006-PDE не приводит к повышению активности или даже снижает стимулирующую активность. Добавление dG7 и dG8 на 5'-конце олигонуклеотида, имеющего CpG мотивы, приводит к некоторому незначительному повышению активности для TLR9 человека (Фиг. 68 В). Взятые в совокупности, эти данные кардинально отличаются от наблюдения, что стимулирующая активность на куриный TLR21 для 2006-PDE очень сильно стимулируется путем добавления от трех до восьми dG на 5'-конце олигонуклеотида.
Влияние 3' dG добавлений на распознавание 2006-PDE для TLR9 мыши и человека
Добавление от одного до трех dG на 3'-конце 2006-PDE приводит к незначительным прогрессирующим повышениям активности на мышином TLR9 (Фиг. 69А). Добавление четвертого dG на 3'-конце олигонуклеотида приводит к сильному увеличению стимулирующей активности на TLR9 мыши, что незначительно улучшается или сохраняется при добавление 5-го, 6-го, 7-го или 8-го 3' dG к 3'-концу олигонуклеотида (Фиг. 69А).
Для стимуляции TLR9 человека, добавление от одного до трех dG на 3'-конце 2006-PDE приводит к заметному прогрессирующему повышению стимулирующей активности по сравнению с родительским 2006-PDE. Добавление четвертого dG на 3'-конце олигонуклеотида приводит к сильному повышению стимулирующей активности TLR9 человека. Этот стимулирующий эффект незначительно улучшается или сохраняется при добавлении 5-го, 6-го, 7-го или 8-го 3' dG (Фиг. 69В).
Взятые в совокупности, эти данные кардинально отличаются от наблюдения, что стимулирующая активность 2006-PDE на куриный TLR21 не стимулируется или даже снижается при добавление 3-8 dG к 3'-концу. В целом, взаимосвязи структура-активность для 5'-dG и 3'-dG добавлений на 2006-PDE по отношению к TLR стимулирующей активности фундаментально отличаются для мышиного и человеческого (и по всей видимости млекопитающих) TLR9 по сравнению с куриным (и по всей видимости птиц) TLR21. Это может отображать тот факт, что TLR21 является только функциональным, но не действительно генетическим, ортологом TLR9 у птиц.
Пример 4: Последовательности, для которых известно или предполагается образование G-квартетных структур, придают TLR21 стимулирующую активность, когда связаны к 5'-концом практически неактивного 2006-PDE.
Фаза тестирования I. Разные элементы теломерных и промоторных последовательностей с предполагаемым потенциалом образования G-квартетов добавляли к 5'-концу 2006-PDE. Дополнительно, 5' Т4-модифицированный 2006-PDE (2006-PDE-T4) использовали для определения способности HEK293-NFκB-bsd-cTLR21 клеток стимулировать TLR21, как описано в Примере 3 (Таблица 22).
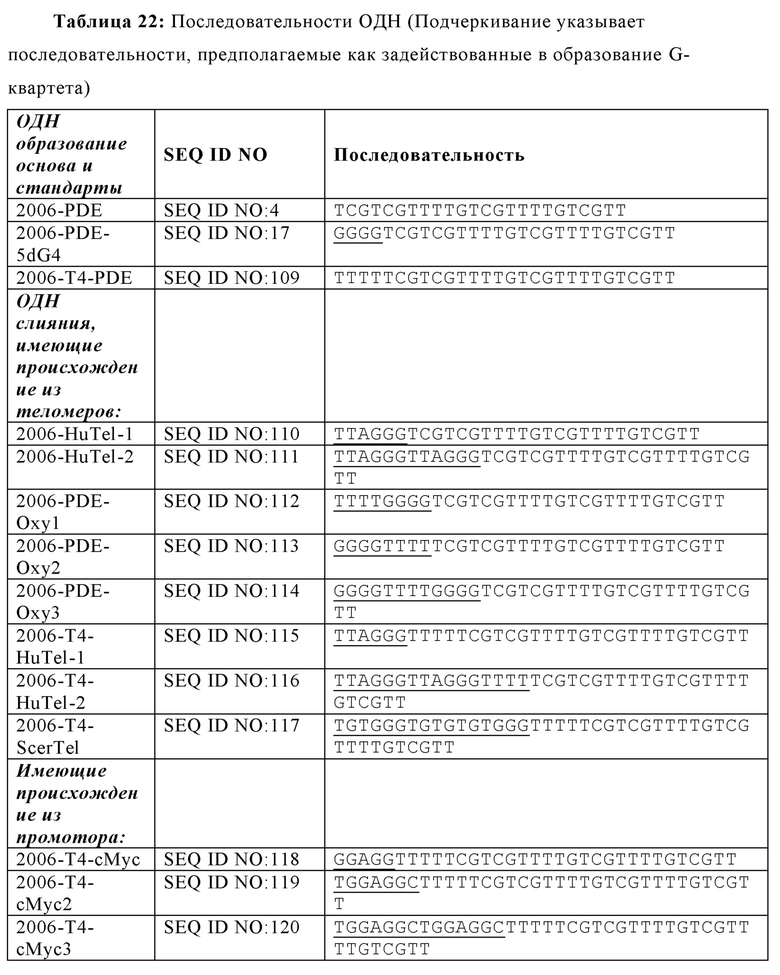

Слияние теломерных последовательностей человека с 2006-PDE и 2006-PDE-T4 приводило к получению ОДН, способных активировать TLR21 с наномолярной (нМ) ЕС50 или даже пикомолярной (пМ) активностью (Таблица 23, Фиг. 21А). Теломерная последовательность дрожжей придает высокую TLR21 активность, с ЕС50 всего лишь 152 пМ. Тестируемые последовательности, имеющие происхождение из с-myc-промотора, также способны активировать 2006-PDE-T4 для TLR21 стимуляции, одно производное обеспечивает двухзначную пМ активность (Таблица 23, Фиг. 21В и 21С).
2006-PDE слияния с элементами последовательностей теломеров Oxytricha spp.(предпочтительно ранние виды моделей для поиска теломеров, и для поиска структуры G-квартета) были синтезированы (Таблица 22) и тестировали для определения их TLR21 стимулирующего потенциала (Таблица 24, Фиг. 22А и 22В). В этом исследовании, слитые последовательности содержали следующие: TTAGGG, TTAGGGTTAGGG (SEQ ID NO: 261), TTTTGGGG, GGGGTTTT, GGGGTTTTGGGG (SEQ ID NO: 262), TTAGGG, TTAGGGTTAGGGTTTT (SEQ ID NO: 263), TGTGGGTGTGTGTGGG (SEQ ID NO: 268), GGAGG, TGGAGGC или TGGAGGCTGGAGGC (SEQ ID NO: 264).

Элементы теломерных последовательностей Oxytricha spp.придавали сильнодействующую TLR21 активность неактивному 2006-PDE. Полученные производные были среди наиболее эффективных производных, идентифицированных на этом этапе.
Фаза тестирования II. Выбрано 20 различных промоторных элементов, для которых показано или предсказано задействование в образование G-квартета, и были синтезированы 5' слитие конструкции, содержащие 2006-PDE и промоторные элементы (Таблица 25) для тестирования в HEK293-NFκB-bsd-cTLR21 клетках для определения их способности стимулировать TLR21.
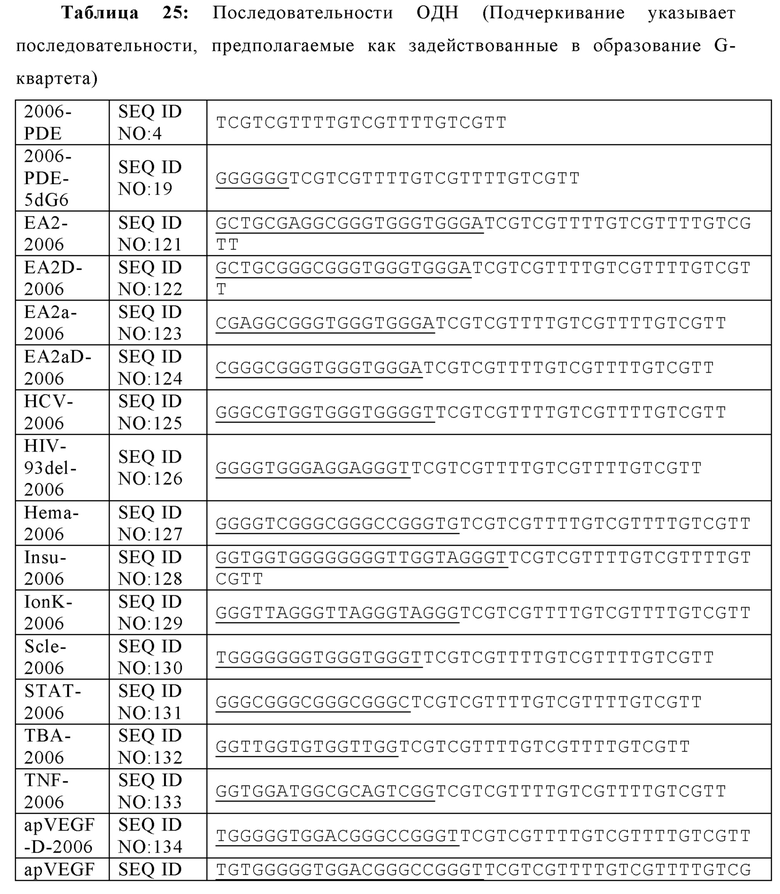
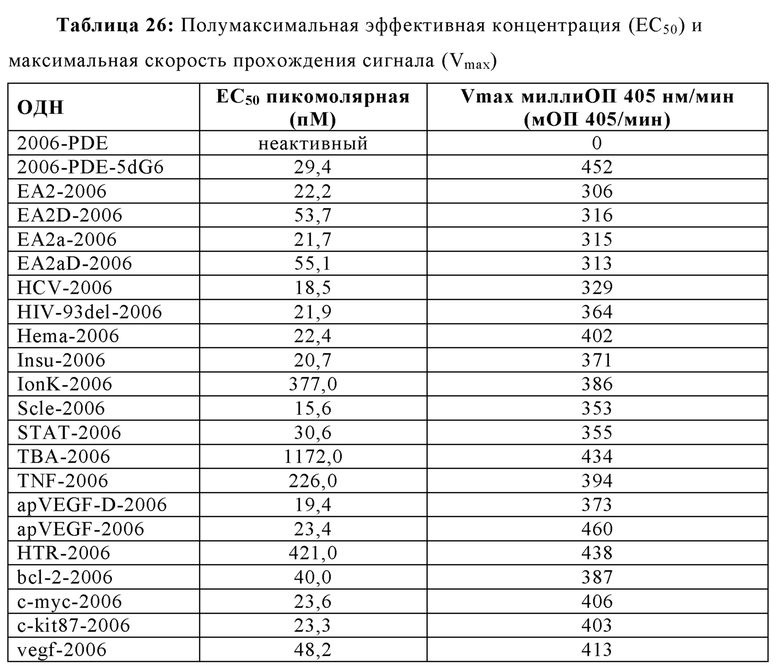
TLR21 анализ показал, что тестируемые элементы придают активность неактивному 2006-PDE. Одиннадцать из двенадцати тестируемых элементов продемонстрировали эффективности, превышающие такие для TLR21 агониста, 2006-5dG6, со значениями ЕС50 ниже 30 пМ, и всего лишь 15,6 пМ (Таблица 26).
Пример 5: Идентификация, применение и оптимизация новых элементов последовательностей и биофизических принципов, придающих TLR21 стимулирующую активность для CpG-ОДН.
G-квартеты (Фиг. 23А) могут быть образованы внутримолекулярно или межмолекулярно и в параллельной или антипараллельной ориентации (Фиг. 23В, 23С). На основании гипотезы о том, что G-квартет-опосредованная агрегация ОДН приводит к повышенной TLR21 стимулирующей активности путем создания варианта лиганда с множественными связывающими сайтами для TLR21 (что приводит к росту авидности взаимодействия и образованию кластеров рецепторов), была выдвинута еще гипотеза о том, что оптимизация ориентации и множественность сайтов связывания будет дополнительно увеличивать активность.
Фаза тестирования I. Различные элементы теломерных и промоторных последовательностей с предполагаемым потенциалом образования G-квартета сливали с 5'-концом 2006-PDE и 2006-PDE-T4 для тестирования в HEK293-NFκB-bsd-cTLR21 клетках для определения их способности стимулировать TLR21 (Таблица 27).
Особенный интерес в этом отношении представляло образование полимерной G-квартетной структуры из ОДН мономеров, называемой G-проволока (Фиг. 23С и 23D), так как она имеет потенциал генерировать полимерный TLR21 лиганд. Marsh TC, Vesenka J, Henderson E, A New DNA Nanostructure, the G-wire, Imaged by Scanning Probe Microscopy, Nucl. Acid Res., 23: 696-700 (1995). Специфически, полагают, что 2006-PDE, имеющий последовательность GGGGTTGGGG (SEQ ID NO: 257), слитую с его 5'-концом, имеет предрасположенность к образованию таких структур (Таблица 27). Поскольку расположение CpG-ОДН "активов" слишком близкое к такому полимеру, образованному 5' GGGGTTGGGG (SEQ ID NO: 257), вероятно, приводит к стерическим проблемам, таким как рецепторное взаимодействие, то также были синтезированы производные с dT4 спейсером (Таблица 27).
Ранее было описано, что G-обогащенный гексануклеотид TGGGGT (SEQ ID NO: 265) преимущественно образует параллельно-ориентированные тетрамерные G-квартетные структуры (Phillips K, Dauter Z, Murchie AI, Lilley DM, Luisi BJ, The Crystal Structure of a Parallel-Stranded Guanine Tetraplex at 0,95  Resolution, J. Mol Biol. 273: 171-182 (1997)), (Фиг. 23 В). Такое тетрамерное расположение CpG-содержащих ОДН, связанных с помощью 5'-параллельного G-квартета, как предполагается, обеспечивает благоприятное расположение лиганда для TLR21. Было синтезировано такое производное 2006-PDE (Таблица 27), и тестировалось, совместно с вышеописанными производными для сравнения 2006-PDE-5dG4 и 2006-PDE-5dG6 (Таблица 28, Фиг. 24А и 24В).
Resolution, J. Mol Biol. 273: 171-182 (1997)), (Фиг. 23 В). Такое тетрамерное расположение CpG-содержащих ОДН, связанных с помощью 5'-параллельного G-квартета, как предполагается, обеспечивает благоприятное расположение лиганда для TLR21. Было синтезировано такое производное 2006-PDE (Таблица 27), и тестировалось, совместно с вышеописанными производными для сравнения 2006-PDE-5dG4 и 2006-PDE-5dG6 (Таблица 28, Фиг. 24А и 24В).

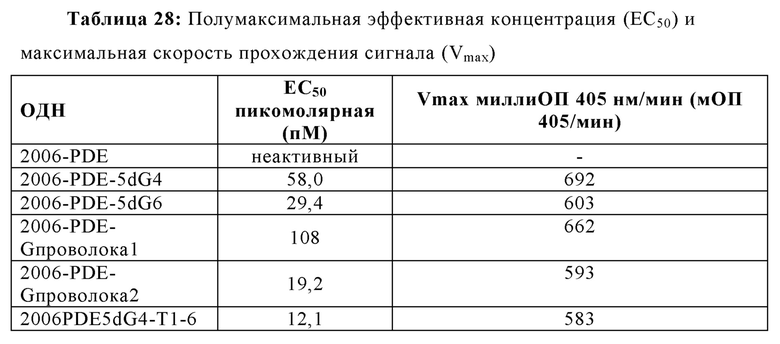
Добавление GGGGTTGGGG (SEQ ID NO: 257) к 5'-концу TLR21-неактивного 2006-PDE (2006-PDE-Gпроволока1) приводит к ОДН с пМ ЕС50 но его активность не дотягивает до ЕС50 для 2006-PDE-5dG4 и 2006-PDE-5dG6, которые использовали в качестве ориентиров в этом исследовании (Таблица 28, Фиг. 24А и 24В). Тем не менее, интродукция 4 dT нуклеотидов между последовательностью G-проволоки и 2006-PDE (2006-PDE-Gпроволка2) улучшает ЕС50 в 5 раз и обеспечивает активность, превышающую активность эталонных показателей (Таблица 28, Фиг. 24А и 24В). Добавление TGGGGT (SEQ ID NO: 265) к 5'-концу 2006-PDE приводит к ОДН с наиболее низкой ЕС50 для TLR21 до сих пор (Таблица 28, Фиг. 24А и 24В). Образование структур высших порядков с помощью 5'G-проволочной модификации было показано с помощью электрофореза в полиакриламидном геле (Фиг. 25).
Взятые в совокупности, в этом исследовании было идентифицировано два лучших, предположительных элемента G-квартетной последовательности, приводящие к сильной TLR21 стимулирующей активности 2006-PDE. Не желая ограничиваться какой-либо теорией, полагают, что, вероятно, эффективная TLR21 активирующая способность GGGGTTGGGG (SEQ ID NO: 257) связана с его известными потенциалом образовывать так называемые структуры G-проволока (Фиг. 23С и 23D), обеспечивая полидентатный лиганд с благоприятной ориентацией. Также вероятно, что эффективная TLR21 активирующая способность TGGGGT (SEQ ID NO: 265) связана с его известным потенциалом образовывать параллельные тетрамерные межмолекулярные G-квартеты, обеспечивая тетрадентатный лиганд с благоприятной ориентацией (Фиг. 23В).
Фаза тестирования II. Тестировали потенциал для усиления активности TLR21 стимуляции эталонной последовательности GGGGGG и сравнивали с последовательностью G-проволоки GGGGTTGGGGTTTT (SEQ ID NO: 258), которая была превосходящей, как доказано в предшествующем исследовании. Для этого, создавали 16 олигонуклеотидов, которые представляли собой общую последовательность TTTTTTTXCGXTTT (SEQ ID NO: 259), где Х представляет собой любое основание (Таблица 29). Использовали dT для создания олигонуклеотида приемлемой длины (14 оснований), для упаковывания тетрануклеотидного CpG "наконечника" в ОДН контекст, поскольку он не создает проблем при синтезе и поскольку у него низкая предрасположенность к образованию нежелательных вторичных структур. Такие короткие ОДН только с одним CpG элементом и с PDE связями, как предполагается, имеют низкую TLR21 стимулирующую активность. В данном случае, исходную концентрацию для тестирования на TLR21 повышали в 50-раз от 20 нМ до 1000 нМ. Эти 16 ОДН также были синтезированы, как имеющие 5'-GGGGGG концы и 5'-GGGGTTGGGGTTTT (Gпроволока 2; SEQ ID NO: 258) концы (Таблица 29) и тестировали в HEK293-NFκB-bsd-cTLR21 клетках для определения их способности стимулировать TLR21.
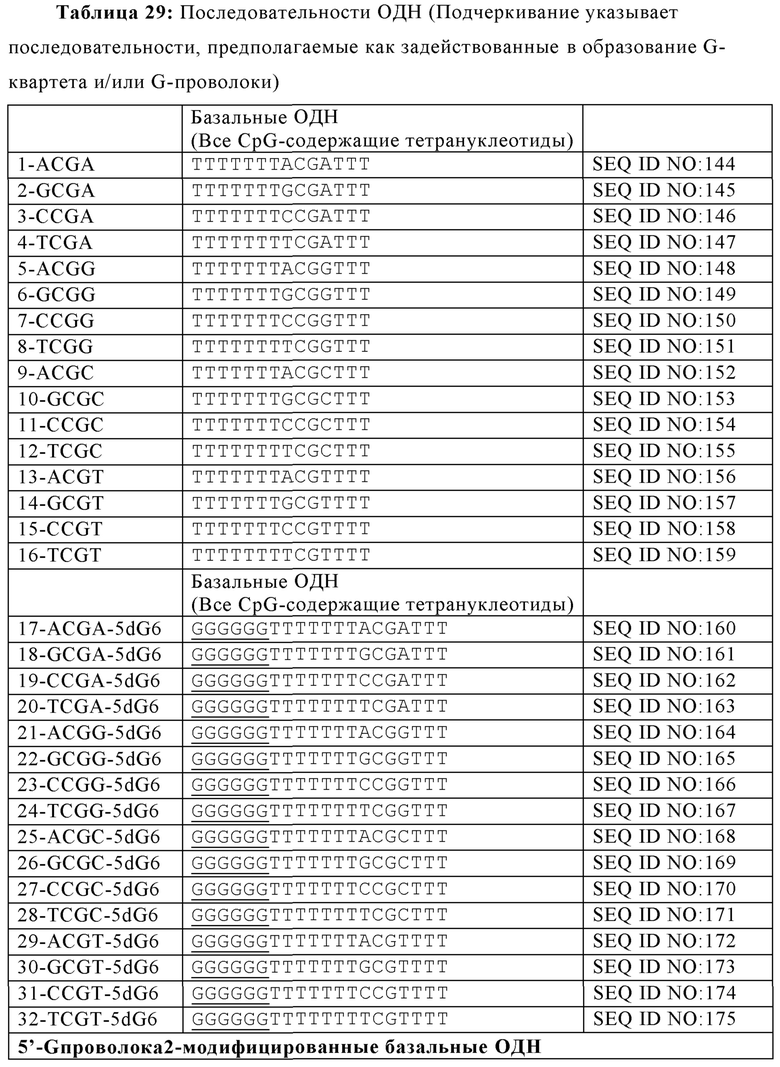
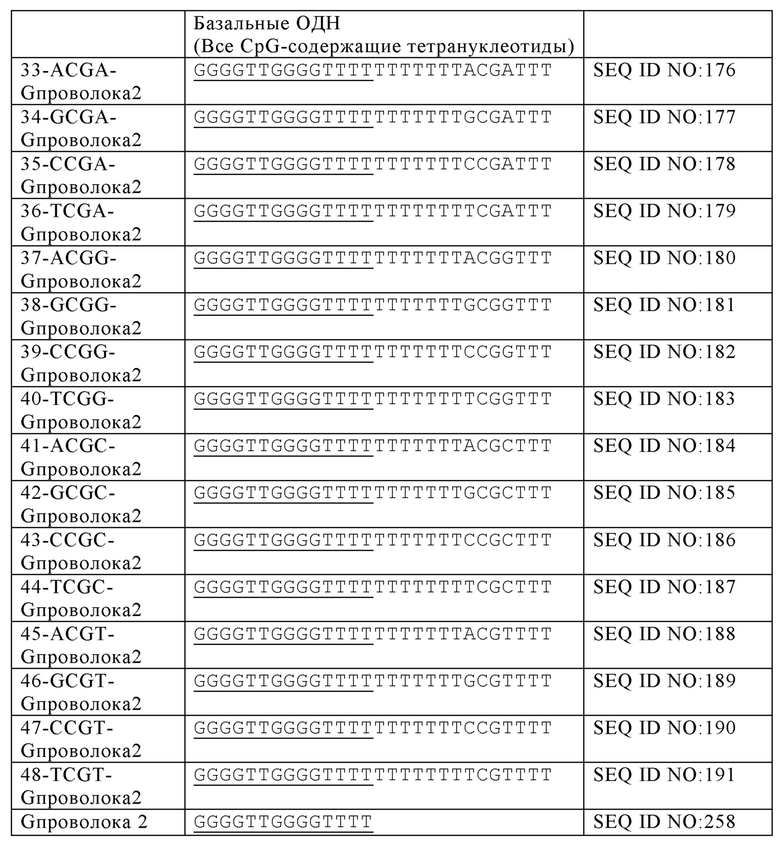
Шестнадцать 14-мерных ОДН, содержащие все потенциальные перестановки тетрануклеотидов с центральным CpG были практически неактивными на TLR21 вплоть до 1000 нМ концентрации, за исключением ACGC-содержащих и CCGC-содержащих серий (ОДН 9 и 11, соответственно), которые проявляли обнаруживаемый сигнал при наиболее высокой концентрации.
Добавление dG6 (GGGGGG) к 5'-концу базальных ОДН (SEQ ID NO: 144-159) приводило к некоторой TLR21 стимулирующей активности в большинстве случаев, за исключением CCGA (ОДН 19), CCGG (ОДН 23), GCGC (ОДН 26), и CCGT (ОДН 31) (Фиг. 26В, 27В, 28В, и 29В). Это подтверждает потенциал 5'-GGGGGG для придания TLR21 активности для CpG ОДН, кроме, за исключением GCGG (ОДН 22), ACGA (ОДН 25) и TCGC (ОДН 28), интенсивность сигнала для каждого из них была слабой (Фиг. 27 В и 28 В).
Добавление Gпроволоки 2 (GGGGTTGGGGTTTT (SEQ ID NO: 258)) к 5'-концу базальных ОДН (SEQ ID NO: 144-159) приводила к TLR21 стимулирующей активности во всех случаях, где 5dG6 был успешным, и, дополнительно для CCGA (ОДН 35), CCGG (ОДН 39) и GCGC (ОДН 42), в то время как CCGT (ОДН 47) оставался рефракторным (Фиг. 26С, 27С, 28С, и 29С и 29D). Тем не менее, интенсивность сигнала, полученная с присоединением Gпроволока 2, была намного выше, чем такая наблюдалась с 5dG6. Это было особенно заметным для GCGA (ОДН 18 по сравнению с ОДН 34 (Фиг. 26В и 26С, соответственно), GCGG (ОДН 22 по сравнению с ОДН 38 (Фиг. 27В и 27С, соответственно)), ACGC (ОДН 25 по сравнению с ОДН 41 (Фиг. 28В и 28С, соответственно)), CCGC (ОДН 27 по сравнению с ОДН 43 (Фиг. 28В и 28С, соответственно)), TCGC (ОДН 28 по сравнению с ОДН 44 (Фиг. 28В и 28С, соответственно)), и GCGT (ОДН 30 по сравнению с ОДН 46 (Фиг. 29В и 29С, соответственно)). Последний ОДН, 46, GCGT-Gпроволока2 был наиболее благоприятного типа: он проявлял чрезвычайно хорошую TLR21 стимулирующую активность уже при пикомолярных концентрациях, и ЕС50 можно было определить как можно ближе к 2 нМ (Фиг. 29D).
Элементы CpG-содержащих последовательностей GCGA, GCGG, ACGC, CCGC GCGT, и, возможно, также TCGC, не были ранее описаны в контексте TLR21 активации.
XCGA серии. Ни один из 14-меров из XCGA серий не продемонстрировал какой-либо TLR21 активности вплоть до 1000 нМ. Добавление 5'-dG6 приводило к некоторой активности GCGA>ACGA>TCGA, в то время как CCGA оставался неактивным. Наиболее ярко выражение, добавление 5'-Gпроволока2 приводило к TLR21 активности для всех четырех производных. Драматическое увеличение TLR21 активности отмечали для GCGA, в то время как другие имели увеличенную активность в относительном порядке TCGA>ACGA>CCGA (Фиг. 26А-С).
XCGG серии. Два из 14-меров из XCGG серий продемонстрировали незначительную, или не продемонстрировали вообще, TLR21 активности при 1000 нМ (GCGG, TCGG), в то время как другие два олигонуклеотида были неактивными. Добавление 5'-dG6 приводило к некоторой активности GCGG>ACGG>=TCGG, в то время как CCGG оставался неактивным. Наиболее ярко выражение, добавление 5'-Gпроволока2 приводило к TLR21 активности для всех четырех производных. Драматическое увеличение TLR21 активности отмечали для GCGG, в то время как другие имели увеличенную активность в относительном порядке TCGG>ACGG>CCGG (Фиг. 27А-С).
XCGC серии. Два из 14-меров из XCGC серий продемонстрировали незначительную, или не продемонстрировали вообще, TLR21 активности при 1000 и 500 нМ (ACGC, CCGC), в то время как другие два были неактивными. Добавление 5'-dG6 приводило к сильной активности TCGC>ACGC>CCGC, в то время как GCGC оставался неактивным. Наиболее ярко выражение, добавление 5'-Gпроволока2 и в этот раз приводило к TLR21 активности для всех четырех производных. Массивное увеличение TLR21 активности отмечали для TCGC>ACGC>CCGC, в таком порядке активности, в то время как GCGC оставался слабым (Фиг. 28А-С).
XCGT серии. Ни один из 14-меров из XCGT серий не продемонстрировал какой-либо TLR21 активности вплоть до 1000 нМ (Фиг. 29А). Добавление 5'-dG6 приводило к некоторой активности всех четырех, в порядке активности order TCGT>GCGT>ACGT>CCGT (Фиг. 29 В). Наиболее ярко выражение, добавление 5'-Gпроволока2 приводило к драматическому увеличению TLR21 активности для GCGT и активность TCGT также больше, чем отмечалось для TCGT-5dG6 (Фиг. 29С). Активность Gпроволока 2-модифицированного ACGT и CCGT была не больше, чем такая активность для 5dG6 производных (Фиг. 29С и 29D). Gпроволока 2 14-мер ОДН отдельно (GGGGTTGGGGTTTT (SEQ ID NO: 258)), который был присоединен к базальным ОДН, был неактивным на TLR21 (см. Таблицу 49, Фиг. 29).
Пример 6: Остов наиболее эффективной последовательности представляет собой GCGT-Gпроволока2: Взаимосвязи структура-активность (SAR)
Исследования SAR GCGT-Gпроволока2 включали модификацию центрального CpG элемента путем инверсии (GC), и обмена пиримидин-пиримидин (TG), а также пурин-пурин (СА) (Таблица 30). Тестирование этих производных в HEK293-NFκB-bsd-cTLR21 клетках для определения их способности стимулировать TLR21, как описано в Примере 3, продемонстрировало полную потерю активности после этих манипуляций (Таблица 31, Фиг. 30), подтверждая тот факт, что эффективная TLR21 стимулирующая активность GCGT-Gпроволока2 очень сильно зависит от присутствия единичного CpG элемента.
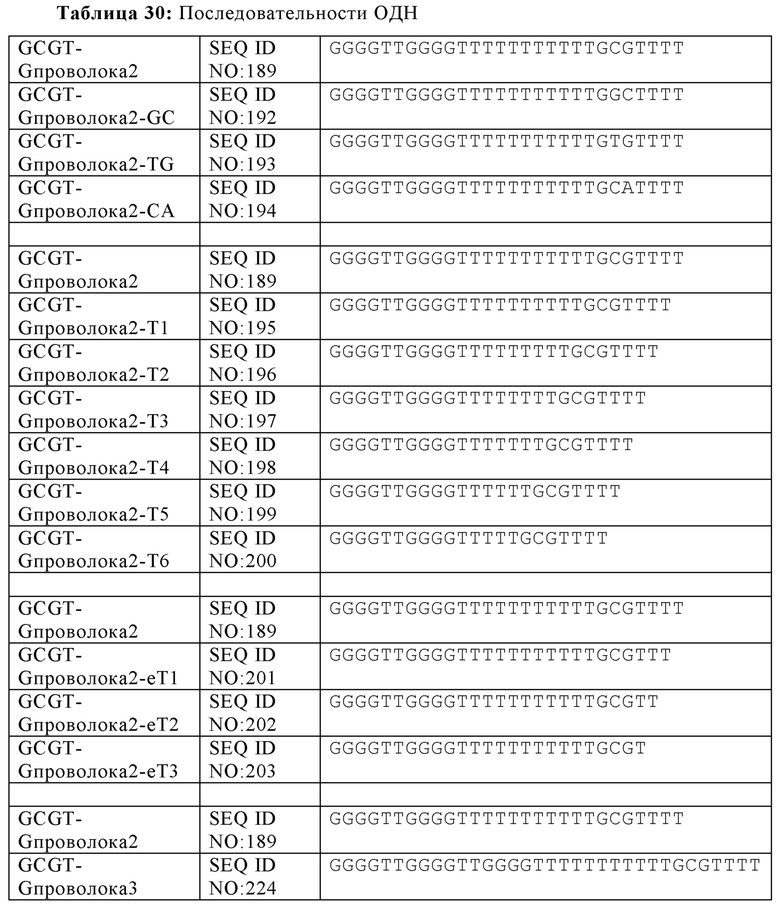
Число dT между элементом Gпроволока 2 и GCGT элементом также снижали (Таблица 30), и тестировали соответствующие ОДН:
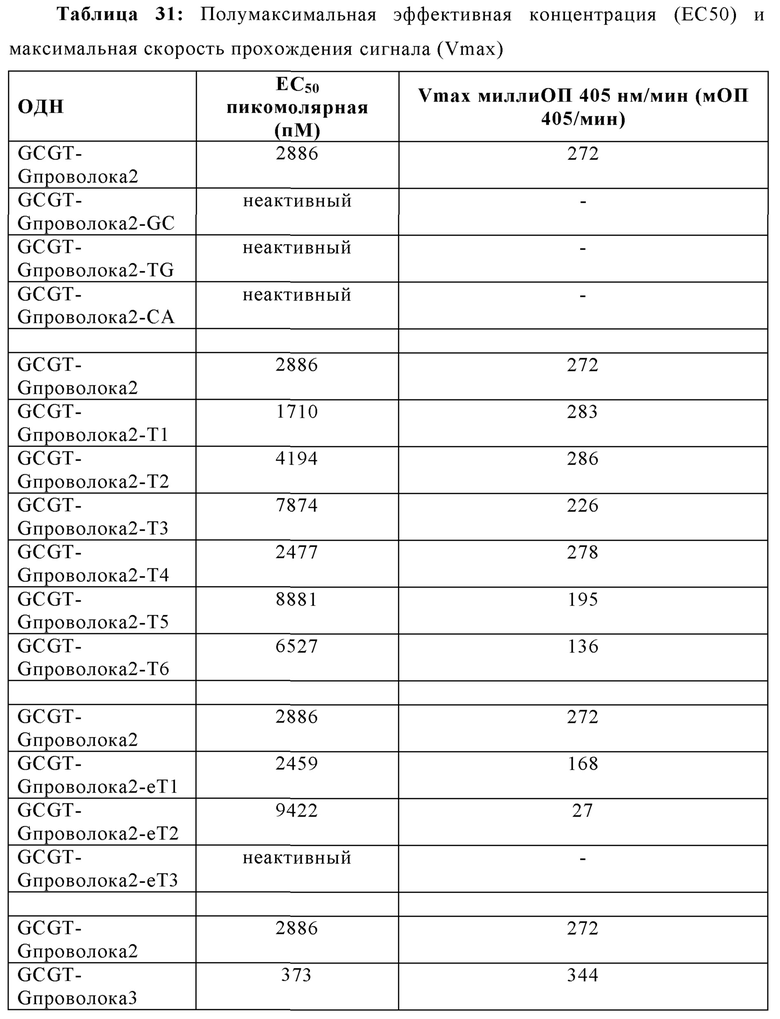
Результаты от делеции Т1-Т4 на GCGT-Gпроволока2 приводят к незначительным изменениям в Vmax, и, за исключением для Т3, значительно сходные ЕС50 значения. Тем не менее, Т5 и Т6 делеции приводят к увеличению ЕС50, и, в особенности, снижают Vmax, свидетельствуя о низкой истинной активности (Таблица 31, Фиг. 31).
Для третьего SAR исследования, число Т, фланкирующих GCGT элемент на 3'-конце ОДН, снижали (Таблица 30), и тестировали соответствующие ОДН. Эффекты были сразу же заметными. В то время как потеря одного Т (еТ1) приводила к снижению Vmax при сохранении ЕС50, потеря двух Т (еТ2) увеличивала ЕС50 и драматически уменьшала Vmax, потеря трех dT совсем элиминировала активность (Таблица 31, Фиг. 32).
В четвертом эксперименте, исследовали влияние инкорпорации дополнительного GGGGTT мотива (СССТ-Gпроволока3, Таблица 30) на истинную TLR21-стимулирующую активность GCGT-Gпроволока2. Активность GCGT-Gпроволока3 была выше, чем такая активность родственной GCGT-Gпроволока2 (Таблица 31, Фиг. 33А и 33В). ЕС50 была в 8-раз ниже и Vmax также увеличивался (Таблица 31). Предварительные SAR результаты иммуностимулирующих GCGT-Gпроволока2 олигонуклеотидов проиллюстрированы на Фиг. 34.
Пример 7: Влияние числа копий CpG элемента на TLR21 стимулирующую активность выбранных видов XCGX-Gпроволока2

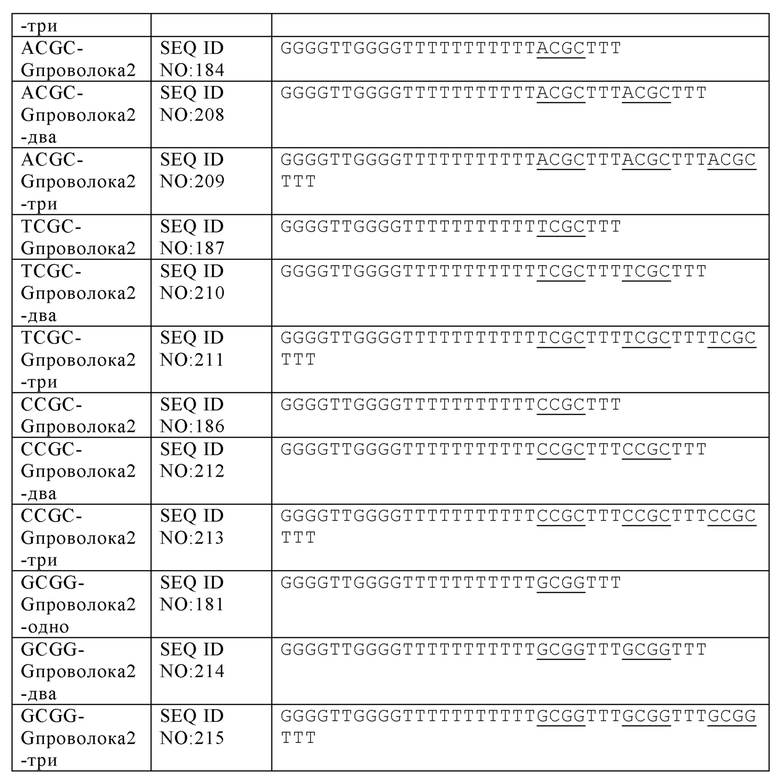
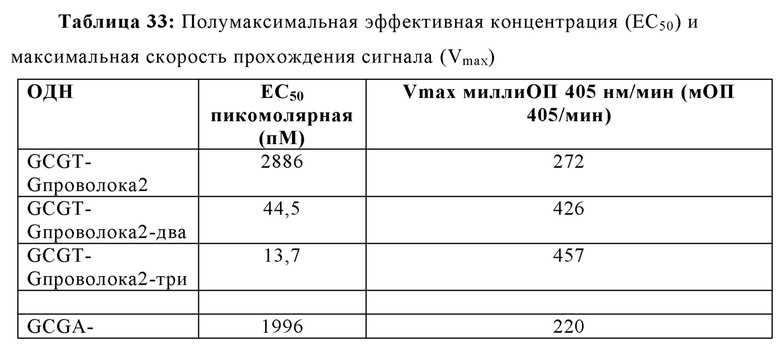
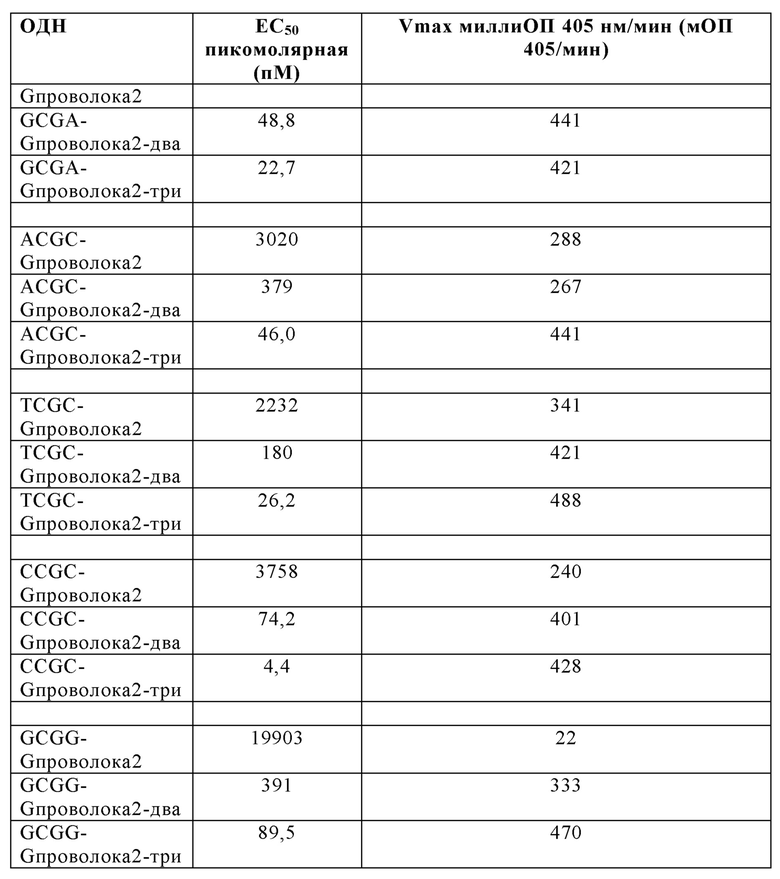
GCGT-Gпроволока2 продемонстрировала ожидаемые наномолярные ЕС50. Добавление второго GCGTTTT элемента (GCGT-Gпроволока2-два, Таблица 32) на 3'-конце приводило к массивному улучшению ЕС50 (в ~65 раз) и увеличению Vmax (Таблица 33, Фиг. 35А и 35В). Дальнейшее добавление GCGTTTT элемента (GCGT-Gпроволока2-три, Таблица 32) приводило к другому снижению ЕС50 в 3 раз (135 в совокупности) и незначительному увеличению Vmax (Таблица 33, Фиг. 35А и 35В).
GCGA-Gпроволока2 продемонстрировала ожидаемые наномолярные ЕС50. Добавление второго GCGATTT элемента (GCGA-Gпроволока2-два, Таблица 32) на 3'-конце приводило к сильному улучшению ЕС50 (в ~24 раз) и увеличению Vmax (Таблица 33, Фиг. 36А и 36В). Дальнейшее добавление GCGATTT элемента (GCGT-Gпроволока2-три, Таблица 32) приводило к другому снижению ЕС50 в 2 раза (48 в совокупности) и незначительному увеличению Vmax (Таблица 33 Фиг. 36А и 36В).
ACGC-Gпроволока2 продемонстрировала ожидаемые наномолярные ЕС50. Добавление второго ACGCTTT элемента (ACGC-Gпроволока2-два, Таблица 32) на 3'-конце приводило к умеренному улучшению ЕС50 (в ~8 раз) и увеличению Vmax (Таблица 33, Фиг. 37А и 37В). Дальнейшее добавление ACGCTTT элемента (ACGC-Gпроволока2-три, Таблица 32) приводило к другому снижению ЕС50 в 8 раз (64 в совокупности) и незначительному увеличению Vmax (Таблица 33, Фиг. 37А и 37В).
TCGC-Gпроволока2 продемонстрировала ожидаемые наномолярные ЕС50. Добавление второго TCGCTTT элемента (TCGC-Gпроволока2-два, Таблица 32) на 3'-конце приводило к сильному улучшению ЕС50 (в ~12 раз) и увеличению Vmax (Таблица 33, Фиг. 38А и 38В). Дальнейшее добавление TCGCTTT элемента (TCGC-Gпроволока2-три, Таблица 32) приводило к другому снижению ЕС50 в 7 раз (84 в совокупности) и незначительному увеличению Vmax (Таблица 33, Фиг. 38А и 38В).
CCGC-Gпроволока2 продемонстрировала ожидаемые наномолярные ЕС50. Добавление второго CCGCTTT элемента (CCGC-Gпроволока2-два, Таблица 32) на 3'-конце приводило к массивному улучшению ЕС50 (в ~50 раз), равно как и Vmax (Таблица 33, Фиг. 39А и 39В). Дальнейшее добавление CCGCTTT элемента (CCGC-Gпроволока2-три, Таблица 32) приводило к другому снижению ЕС50 в 17 раз (850 в совокупности) и незначительному увеличению Vmax (Таблица 33, Фиг. 39А и 39В)
GCGG-Gпроволока2 продемонстрировала только слабые сигналы в рассматриваемом диапазоне низких концентраций. Добавление второго GCGGTTT элемента (GСGG-Gпроволока2-два, Таблица 32) на З'-конце приводило к массивному улучшению ЕС50, равно как и Vmax (в ~51 раз) (Таблица 33, Фиг. 40). Дальнейшее добавление GCGGTTT элемента (GCGG-Gпроволока2-три, Таблица 32) приводило к другому снижению ЕС50 в 4 раза (204 в совокупности) и незначительному увеличению Vmax (Таблица 33 Фиг. 40).
В заключение, было показано, что добавление дополнительных элементов CpG-содержащих TLR21-стимулирующих последовательностей к олигонуклеотидам, имеющим последовательность Gпроволока 2 и единичный CpG элемент, приводит к улучшениям ЕС50 от 8 раз до 55 раз, в то время как Vmax типично удваивается. Добавление третьего элемента также однородно дополнительно улучшает TLR21 стимулирующую активность. Полагают, что это представляет собой универсальный метод создания высоких активностей из изначальной простой низкой активности попаданий.
Пример 8: Достижение высокой активности TLR21-стимулирующих ОДН с преимуществом синтеза /стоимости товара: добавление или замена нуклеотида на алкильный и этиленгликольные спейсеры а) между элементами CpG-содержащих последовательностей, и б) в пределах компонента, образующего G-квартет, и на его границе с элементом CpG-содержащей последовательности
Технологию 5'-Gпроволока2 (GGGGTTGGGGTTTT (SEQ ID NO: 258)) использовали для исследования TLR21 стимулирующей эффективности концептуально простой потенциально стимулирующей последовательности: три последовательные CpG, упакованные четырьмя dT на 5'-конце и тремя dT на 3'-конце (Таблица 34 CG-Gw2-TO). Исследовали влияние разделения CpG элементов на TLR21 стимулирующую активность путем поэтапной инсерции одного, двух, трех и четырех dT между тремя CpG элементами (что приводило к получению CG-Gw2-T1 - CG-Gw2-T4, Таблица 34). Осуществляли исследование TLR21 стимуляции в HEK293-NFκB-bsd-cTLR21 клетках для определения способности ОДН в Таблице 34 стимулировать TLR21, как описано в Примере 3, и рассчитывали значения ЕС50 и Vmax (Таблица 35, Фиг. 41А и 41В).
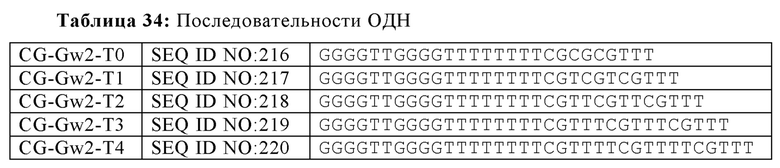

Примечательно, что CG-Gw2-TO был полностью неактивным на TLR21 в исследуемом диапазоне концентраций (вплоть до 20 нМ), в то время как одно разделение dT между CpG уже приводило к сильному стимулирующему ОДН с ЕС50 в пикомолярном диапазоне. Второй dT между CpG не улучшал активность, но dT3 и dT4 приводили к 16,6 и 11,3 пМ, соответственно (Таблица 35, Фиг. 41А и 41В). Это свидетельствует о том, что присутствие кривизны CpG элементов недостаточно для активности; они должны быть в правильном окружении.
Нужно ли основание в спейсерной группе для TLR21 стимулирующей активности?
Синтезировали ОДН с дезоксирибозофосфатными мостиками ("безосновные сайты") между CpG, вместо dT (CG-Gw2-безосновный). Это ОДН и родительский CG-Gw2-T1 тестировали в HEK293-NFκB-bsd-cTLR21 клетках для определения их способности стимулировать TLR21, как описано в Примере 3 (Таблица 36, Фиг. 42А и 42В).
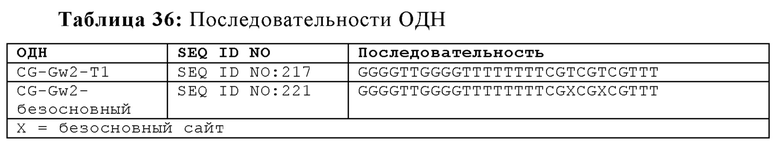

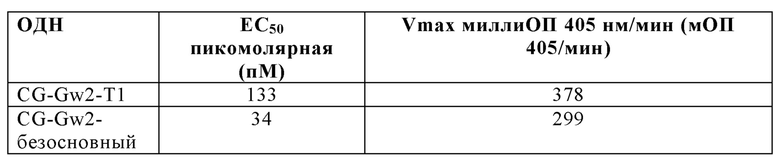
Неожиданно было обнаружено, что CG-Gw2-безосновный (Фиг. 43) проявляет даже немного более высокую эффективность на TLR21 (ЕС50 = 34 пМ) чем CG-Gw2-T1 (ЕС50 = 133 пМ), в то время как Vmax немного ниже (Таблица 37, Фиг. 42А и 42В). Эти результаты указывают на то, что основание в разделяющем нуклеотиде в CG-Gw2-T1 ОДН не только не является необходимым для TLR21 стимуляции, но имеет отрицательное влияние на ЕС50.
Влияние линейных спейсерных групп на TLR21 активность CG-Gw2 ОДН
В этом исследовании, dT нуклеотид, разделяющий два CpG в CG-Gw2-Tl, заменяли либо на "С18" гексаэтиленгликольный линкер, или "С3" пропандиольный линкер (Таблица 38). Эти ОДН тестировали в HEK293-NFκB-bsd-cTLR21 клетках для определения их способности стимулировать TLR21, как описано в Примере 3



В то время как С18 спейсер, образованный гексаэтиленгликолем при инсерции между CpG элементами CG-Gw2 (Таблица 36, Фиг. 43), приводит к TLR21-неактивному ОДН (Таблица 39, Фиг. 44А), аналогичная модификация с помощью С3 спейсера (1,3-пропандиол, CG-Gw2X2, Таблица 38, Фиг. 43) не только сохраняет, но даже незначительно улучшает эффективность родительского CG-Gw2-T1 в отношении ЕС50 (Таблица 39, Фиг. 44В). Принимая во внимание простоту структуры С3 спейсера по сравнению с нуклеотидом (Фиг. 43), это является очень удивительным результатом. Учитывая тот факт, что безосновный сайт, подобно С3 спейсеру, содержит три связанных атома углерода между двумя фосфодиэфирными связями, представляется возможным, что С3 представляет собой упрощенную форму высокоактивной безосновной структуры сайта (см. Фиг. 43), и также эффективно поддерживает активацию TLR21.
Исследования влияний на TLR21 стимулирующую активность G-проволоки и TGGGGT (SEQ ID NO: 265)- активированных С3 спейсер-присоединенных CpG структур
В этом исследовании, либо GGGGTTGGGG (SEQ ID NO: 257) G-проволока (CG-Gw2X2-1) или TGGGGT (SEQ ID NO: 265) элемент (CG-G4T 16Х2-1) соединяли с TTTTTTTTCG-X2-CGTTT (SEQ ID NO. 271) (Таблица 40), и оценивали эффективность стимуляции TLR21. После этого, оба ОДН дополнительно модифицировали путем последовательных добавлений С3-спейсеров, соединенных с CpG мотивами, получая ОДН с тремя, четырьмя и пятью CpG мотивами, каждый разделенный с помощью С3 (Таблица 40). Их эффективность активации TLR21 также оценивали в HEK293-NFκB-bsd-cTLR21 клетках, как поясняется в Примере 3 (Таблица 41, Фиг. 45 и 46).


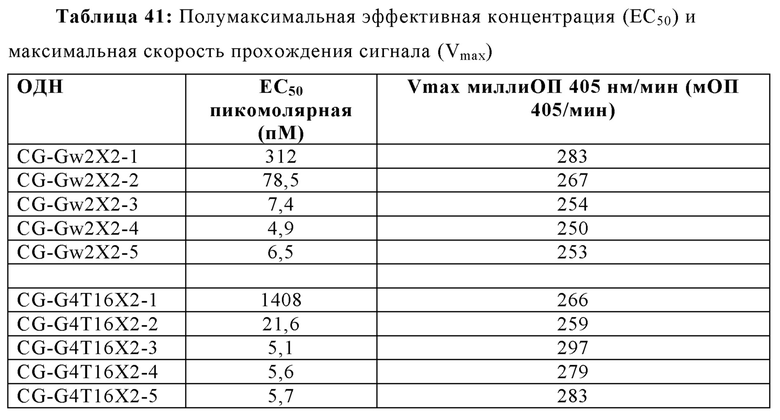
В активации G-проволокой, первый ОДН с двумя CpG мотивами, разделенными С3, продемонстрировал уже пикомолярную активность (ЕС50 = 312 пМ), хотя и в трехзначном диапазоне. Третий С3-разделенный CpG обеспечивал ЕС50 78,5 пМ, что хорошо сравнимо с 96,5 пМ, определенной для второй, отдельно синтезированной партии (см. Таблицу 39). Добавление четвертого С3-разделенного CpG мотива обеспечивает другое повышение эффективности еще в 10 раз (ЕС50 = 7,4 пМ). Добавления пятого и шестого С3-разделенных CpG мотивов сохраняет высокую эффективность и даже приводит к незначительному улучшению. Эти однозначные пикомолярные эффективности является наиболее высокими активностями, до настоящего времени наблюдаемыми на TLR21, удивительным и неожиданным прорывом для таких простых структурных элементов, как разделенные пропандиолфосфатом CpG мотивы (Таблица 41, Фиг. 44А и 44В). Заменяя элемент G-проволоки в Х2-1 - Х2-5 сериях на GTTTTG элемент, который, как известно, способствует параллельным межмолекулярным G-квартетным структурам (Таблица 40), приводит к ОДН со сходной, частично, еще более высокой эффективностью (Таблица 41, Фиг. 46А и 46 В).
Исследования влияния длины спейсера и детализированной химической структуры на TLR21 стимулирующую активность G-проволока -активированных С3 спейсер-присоединенных CpG мотивов
В этом исследовании, GGGGTTGGGG (SEQ ID NO: 257) G-проволоку присоединяли к TTTTTTTTCG-X-CGXCGTTT (SEQ ID NO: 260) (Таблица 42), и оценивали TLR21 стимулирующую эффективность. Х представляет собой серии алкилдиол-фосфатов, используемых для разделения CpG мотивов (Таблица 42, Фиг. 47), из которых ОДН-Х3 представляет собой повторный синтез CG-Gw2X2 (см. Таблицу 38) и CG-Gw2X2-2 (см. Таблицу 40). Кроме того, олигонуклеотид, содержащий безосновный спейсер (Таблица 42, Фиг. 49; см. CG-Gw2-безосновный (SEQ ID NO: 221 в Таблице 36)), равно как и спейсер, производное триэтиленгликоля ("С8" линкер, Фиг. 49), анализировали для определения TLR21-стимуляции в HEK293-NFκB-bsd-cTLR21 клетках, как описано в Примере 3.
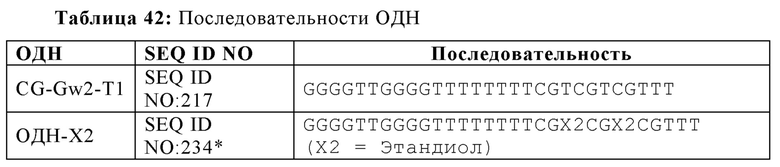

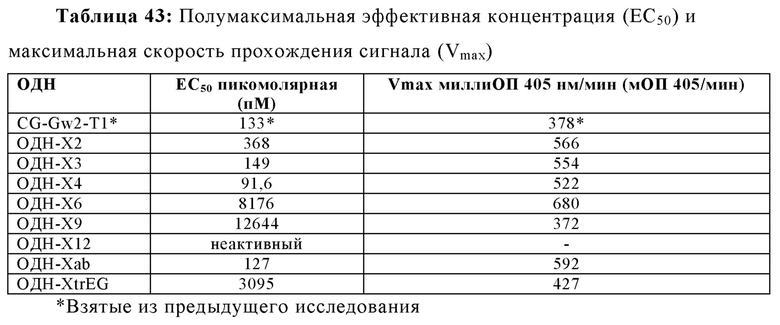
Структурно, разделение между 3'-фосфатом одного CpG элемента до 5'-фосфата следующего CpG элемента в CG-Gw2-T1 осуществляется посредством трех связанных атомов углерода от 5'С до 4'С до 3'С (Фиг. 49). Аналогичное расстояние поддерживается, когда используют безосновный сайт, так как отсутствие основания не изменяет дезоксирибозного компонента. Точно такое же расположение поддерживается в ОДН-Х3, где три метиленовые (-СН2-) группы образуют спейсер между 3'- и 5'-фосфатными группами (Фиг. 47). Интересным является тот факт, что их эффективность на TLR21, как определено с помощью ЕС50, является очень похожей (133 пМ, 127 пМ, и 149 пМ, соответственно; Таблица 43), подтверждая тот факт, что физическое расстояние является более важным, чем детализированная химическая структура (например, присутствие основания, целостность дезоксирибозного компонента), так как наиболее простой потенциальный линкер 1,3-пропандиол, особенно подходящий к геометрии дезоксирибозы, по-видимому, не является неблагоприятным (Таблица 43, Фиг. 49А и 49В).
На основании полученных результатов о том, что 1,3-пропандиол является эквивалентным в качестве спейсера дезокситимину (dT) или безосновному сайту (Таблица 43), что также уже подтверждается более ранними экспериментами (Таблицы 36-39), мы исследовали влияние длины спейсера на TLR21 активность.
Более короткое производное этандиола (ОДН-Х2, Таблица 42, Фиг. 47) было более слабым в отношении TLR21 стимулирующей активности по сравнению с 1,3-пропандиольным производным ОДН-Х3 (Таблица 42, Фиг. 47), больше, чем в два раза (Таблица 43, Фиг. 50А и 50 В). В отличие от этого, спейсер в 1,4-бутандиольном производном ОДН-Х4 (Таблица 42, Фиг. 47) придает немного более высокую активность (Таблица 43, Фиг. 50А и 50 В), в то время как дальнейшее удлинение на две дополнительные метильные группы (1,6-гександиол, ОДН-Х6) или 5 дополнительные метиленовые группы (1,9-нонандиол, ОДН-Х9) (Таблица 42, Фиг. 47) драматически ослабляет TLR21 стимуляционный потенциал в 89 и 138 раз, соответственно (Таблица 43, Фиг. 50А и 50В). Спейсер из 12 метиленовых групп (1,12, додекандиол, ОДН-Х12) (Таблица 42, Фиг. 47) был полностью неактивным в исследуемом диапазоне концентраций Таблица 43, Фиг. 50А и 50В). Также исследовали триэтиленгликольный (TEG) линкер (ОДН-XtrEG, Таблица 42, Фиг. 48). Это производное стерически соответствует С8 линкеру. Таким образом, очень удивительно, что его TLR21 ЕС50 было значительно более низким, чем такое значение для 1,9-нонандиольного производного ОДН-Х9, и еще более низким, чем ЕС50 для 1,6-гександиольного производного ОДН-Х6) (см. Таблицу 43, Фиг. 51)
Будет ли принцип С3 спейсер также функционировать для CpG-содержащих тетрануклеотидных структур?
Исследовали С3 спейсер-(1,3-пропандиол)-содержащий TLR21-активный ОДН, имеющие CpG-содержащие тетрануклеотидные структуры. Для этого, в первом эксперименте были синтезированы содержащие последовательность 5'-G-проволоки ACGC-Gw2X1, ACGC-Gw2X2, CCGC-Gw2X1 и CCGC-Gw2X2 и тестировали в HEK293-NFκB-bsd-cTLR21 клетках для определения их способности стимулировать TLR21, как описано в Примере 3 (Таблица 44). Это осуществляли путем синтеза и TLR21 тестирования 5'-С4Т16-содержащих ACGC-G4T16X2 и CCGC-G4T16X2 (Таблица 44).

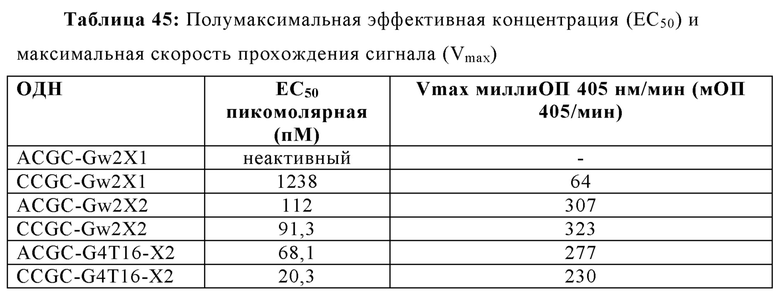
С3 разделение CpG тетрануклеотидных последовательностей отчетливо способно стимулировать TLR21. ACGC-Gw2X2 и CCGC-Gw2X2 (Таблица 44) демонстрируют TLR21 ЕС50 (Таблица 45, Фиг. 52А и 52В) в диапазоне, ранее наблюдаемом для CG-Gw2X2/ОДН-X3 (сравн. Таблицы 39 и 43). Как наблюдали ранее для CG-Gw2X1 (Таблица 39), и как предсказано на основе взаимосвязи структура-активность, гексаэтиленгликольные (HEG, "С18") производные ACGC-Gw2X1 и CCGC-Gw2X1 были неактивными, или очень слабыми, соответственно (Таблица 45, Фиг. 52А и 52В). Замена последовательности 5'-G-проволоки на другую привилегированную 5'-структуру, идентифицированную нами ранее, (TGGGGT (SEQ ID NO: 265), G4T16), приводила к получению двух производных, ACGC-G4T16-X2 и CCGC-G4T16-X2, с дальнейшими улучшенными ЕС50 (Таблица 45, Фиг. 53А и 53В).
Влияние С3 и С18 линкеров в/ на 5'-С-обогащенной последовательности на активацию TLR21 с помощью ОДН
Было исследовано, могут ли С3 спейсеры (1,3-пропандиол) или С18 спейсеры (гексаэтиленгликоль, HEG) улучшать активность TLR21-активных 5'-G-квартет-содержащих ОДН, когда помещают между CpG мотивом и G-квартетной последовательностью, или если расположены в пределах G-квартетной последовательности. Были синтезированы два ОДН на основе 2006-PDE5dG4. Один с С18 линкером 3' по ходу транскрипции dG4 последовательности (2006-PDE5dG4-X1) и один с С3 линкером в аналогичном положении (2006-PDE5dG4-X2) (Таблица 46). Кроме того, 2006-С-проволока 1 была модифицирована путем замены Т в GGGGTTGGGG (SEQ ID NO: 257) последовательности либо на С18 линкер (2006-5dG4-X3) или на С3 линкер (2006-5dG4-X4). Все эти производные тестировали в HEK293-NFκB-bsd-cTLR21 клетках для определения их способности стимулировать TLR21, как описано в Примере 3 (Таблица 47).

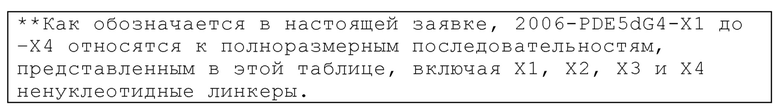
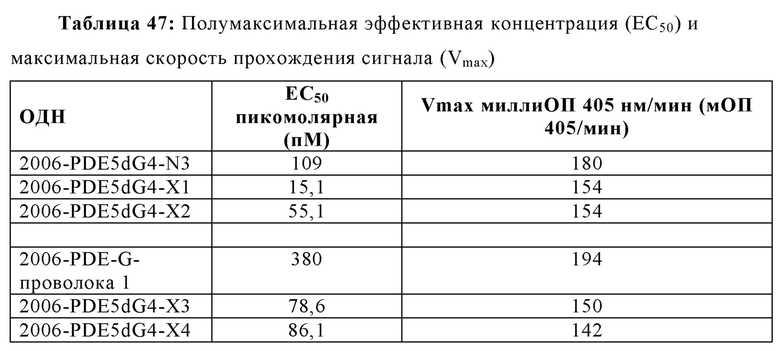
В 2006-PDE5dG4, добавление С18 спейсера между dG4 и 2006-PDE улучшает TLR21 активность, как измерено с помощью ЕС50 более чем в 6 раз (Таблица 47, Фиг. 54А). С3 спейсер в идентичном положении улучшает TLR21 стимуляцию в 2 раза (Таблица 47, Фиг. 54А). В 2006-PDE-G-проволока 1, замена двух Т в последовательности G-проволоки на С18 спейсер улучшает TLR21 активность, как измерено с помощью ЕС50 приблизительно в 5 раз (Таблица 47, Фиг. 54В). С3 спейсер в идентичном положении улучшает TLR21 стимуляцию в 4 раза (Таблица 47, Фиг. 54В). Взятые в совокупности, эти данные свидетельствует о том, что на TLR21 активирующие свойства не оказывает отрицательного влияния присутствие С18 или С3 линкеров и даже они могут приводить к более улучшенным активностям.
Пример 9: 5'-холестерольная, но не 3'-холестерольная, модификация ОДН приводит к сильному увеличению TLR21 стимулирующей активности
Исследовали влияние классической 3'-холестерольньной модификации и более редко используемой 5'-холестерольной модификации на TLR21 стимулирующий потенциал умеренно и высоко активных видов ОДН.
3'- холестерольная модификация
Обычно используемую 3'-холестерольную модификацию (Фиг. 55) применяли на двоих высоко TLR21 активных ОДН, 2006-Gпроволока2 и 2006-T4-5dTG4T (Таблица 48). Более специфически, ОДН, содержащие 3' холестерольный компонент, получали от Eurofins. Структура холестерольного компонента, основанная на 3' Холестерол SynBase™, представлена в www_linktech_co_uk/products/modifiers/hydrophobic_group_cholesterol_palmitate_modification/969_3-cholesterol-synbase-cpg-1000-110. Осуществляли тест TLR21 стимуляции, как поясняется в Примере 3.

Полученные результаты свидетельствуют о том, что TLR21-стимулирующая активность обоих ОДН не улучшается при 3'-холестерольной модификации (Таблица 49, Фиг. 56А, 56В, 57А, 57В). ЕС50 для 3'-холестерол-модифицированных ОДН даже повышается (Таблица 49), что свидетельствует о незначительной потере TLR21 стимулирующей активности.
ОДН, содержащие 3' холестерольный компонент, получали от Eurofins. Структура холестерольного компонента, основанная на 3' Холестерол SynBase™, показана в www_linktech_co_uk/products/modifiers/hydrophobic_group_cholesterol_palmitate_modification/969_3-cholesterol-synbase-cpg-1000-110.
5'- холестерольная модификация (I)
Значительно менее часто применяемую 5'-холестерольную модификацию (Фиг. 58А и 58В) синтезировали на высоко TLR21 активных ОДН, идентифицированных при проведении наших исследований, GCGT3-TG4T (Таблица 50). Более специфически, ОДН, содержащие 5'-холестерольный компонент, заказывали от Genelink, и структура липидного компонента этих ОДН основана на структура, представленной в www_genelink_com/newsite/products/MODPDFFILES/26-6602.pdi. Другие ОДН, содержащие 5'-холестерольный компонент, заказывали от Sigma Aldrich. Структура липидного компонента этих ОДН была основана на структурах, представленных в www_sigmaaldrich_com/content/dam/sigma-aldrich/docs/Sigma-Aldrich/General_Information/l/custom-oligonucleotide-modifications-guide.pdi, pages 85/86. Другие ОДН, содержащие 5'-холестерольный компонент, заказывали от IBA Lifesciences и имели структуру, основанную на той, которая показана в www_iba-liiesciences_com/Services_custom_oligos_custom_DNa_Non-fluorescent_5-modifications.html. Осуществляли тест TLR21 стимуляции в HEK293-NFκB-bsd-cTLR21 клетках, как описано в Примере 3.


Результаты двух независимых измерений свидетельствуют о том, что TLR21-стимулирующая активность GCGT3-TG4T массивно улучшается с помощью 5'-холестерольной модификации (Таблица 51, Фиг. 59А, 59В). По сравнению с его немодифицированной версией, ЕС50 снижается более чем на два порядка величин в обоих исследованиях (в 147 и 152 раз, соответственно, Таблица 51). 5'-холестерил-модифицированный GCGT3-TG4T является одним из наиболее активных TLR21-стимулирующих ОДН, идентифицированных до настоящего времени.
ОДН, содержащие 5'-холестерольный компонент, заказывали от Genelink, и структура липидного компонента этих ОДН основана на структуре, представленной в www_genelink_com/newsite/products/MODPDFFILES/26-6602.pdf. Другие ОДН, содержащие 5'-холестерольный компонент, заказывали от Sigma Aldrich. Структура липидного компонента этих ОДН была основана на структурах, представленных в www_sigmaaldrich_com/content/dam/sigma-aldrich/docs/Sigma-Aldrich/General_Iniormation/l/custom-oligonucleotide-modifications-guide.pdf, pages 85/86. Другие ОДН, содержащие 5'-холестерольный компонент, заказывали от IBA Lifesciences и имели структуру, основанную на той, которая показана в www_iba-liiesciences_com/Services_custom_oligos_custom_DNa_Non-fluorescent_5-modifications.html.
5'- холестерольная модификация (I)
5'-холестерольную модификацию (Фиг. 58А и 58В) синтезировали на двоих высоко TLR21-активных ОДН, идентифицированных при осуществлении наших исследований, GCGT-3-TG4T и GCGT-3-Gw2 (Таблица 52), и осуществляли тест TLR21 стимуляции в HEK293-NFκ-bsd-cTLR21 клетках, как описано в Примере '5
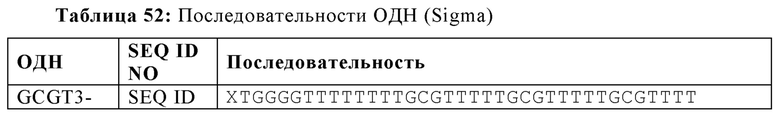
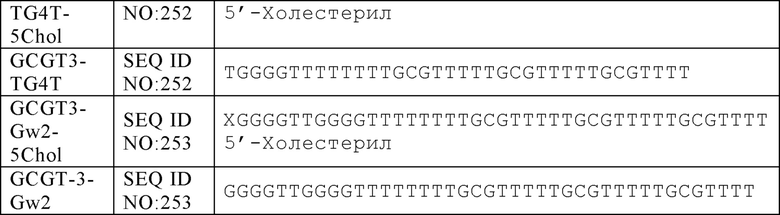
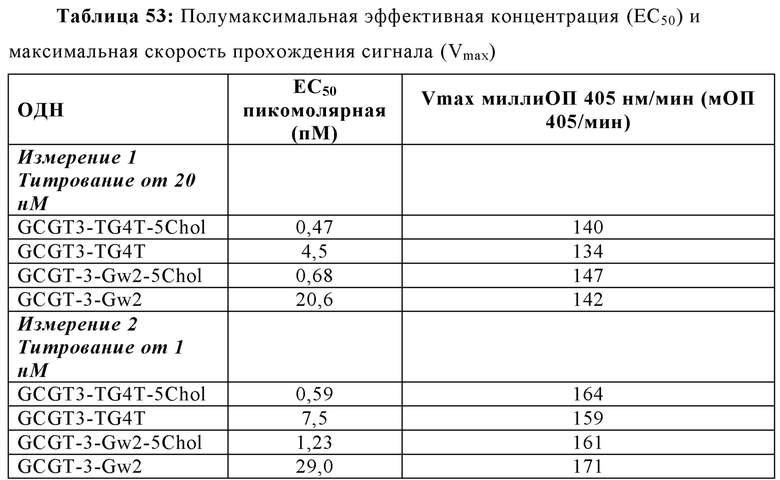
Результаты двух независимых измерений свидетельствуют о том, что TLR21-стимулирующая активность обоих GCGT-3-TG4T и GCGT-3-Gw2 массивно улучшается с помощью 5'-холестерольной модификации (Таблица 53, Фиг. 60А, 60В, 61А, 61В). По сравнению с их немодифицированными версиями, ЕС50 снижается приблизительно на 1 порядок величин в обоих исследованиях (в 10 и 13 раз для GCGT-3-TG4T-5Chol, и в 30 и 24 раз для GCGT-3-Gw2-5Chol, соответственно (Таблица 51). 5'-холестерил-модифицированные ОДН GCGT-3-TG4T и GCGT-3-Gw2 являются наиболее активными TLR21-стимулирующими ОДН, идентифицированными до настоящего времени, проявляющими фемтомолярные ЕС50 значения.
5'-холестерольная модификация (II)
5'-холестерольную модификацию (Фиг. 58А и 58В) синтезировали на двоих высоко TLR21-активных ОДН, идентифицированных при осуществлении наших исследований, GCGT-3-TG4T и GCGT-3-Gw2 (Таблица 54), и осуществляли тест TLR21 стимуляции в HEK293-NFκB-bsd-cTLR21 клетках, как описано в Примере 3.

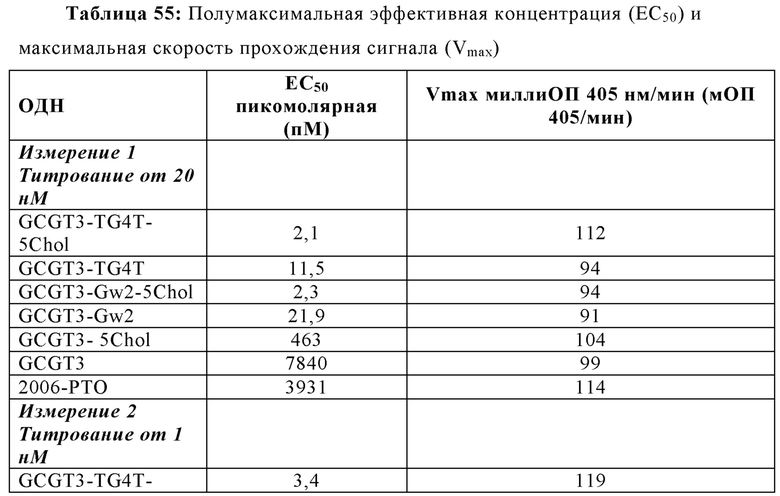
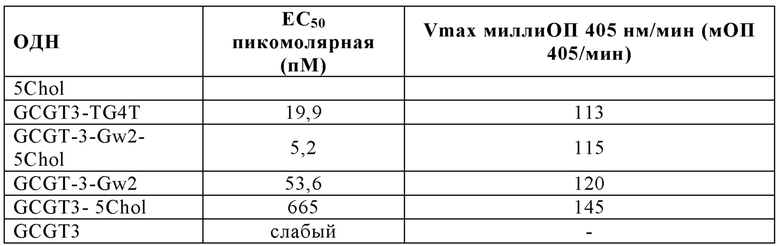
Результаты двух независимых измерений свидетельствуют о том, что TLR21-стимулирующая активность обоих GCGT-3-TG4T и GCGT-3-Gw2 улучшалась с помощью 5'-холестерольной модификации (Таблица 55, Фиг. 62А, 62В, 63А, 63В). По сравнению с их немодифицированными версиями, ЕС50 снижалась приблизительно в 5-10-раз в обоих исследованиях (приблизительно в 5 раз для GCGT3-TG4T-5Chol и приблизительно в 10 раз для GCGT3-Gw2-5Chol (Таблица 55)). Также в этом исследовании было показано, что 5'-dG последовательности не являются необходимыми для усиливающего влияния на активность 5'-холестерола, поскольку GCGT3-5Chol является приблизительно в 17-раз более активным по сравнению с его немодифицированной родственной структурой (Таблица 55, Фиг. 64).
5'-холестерольная модификация (III)
5'-холестерольную модификацию (Фиг. 58А и 58В) синтезировали на GCGT3-TG4T от другого поставщика (Таблица 56), и осуществляли тест TLR21 стимуляции в HEK293-NFκB-bsd-cTLR21 клетках, как описано в Примере 3.


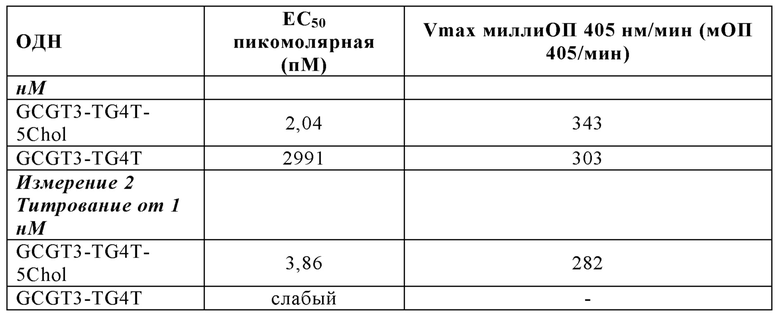
5'-холестерил-модифицированная форма GCGT3-TG4T
продемонстрировала значительно более эффективную TLR21 стимулирующую активность, с однозначными пМ ЕС50 значениями (Таблица 57, Фиг. 65А и 65В). В отличие от этого, GCGT3-TG4T форма, в которой отсутствовал 5'-холестерил, была, что касается ЕС50, практически в 1500 раз менее эффективной, что демонстрирует важность 5'-липидной модификации (Таблица 57, Фиг. 65А и 65В).
5'- холестерольная модификация (IV)
5'-холестерольную модификацию (Фиг. 58А и 58В) синтезировали в другом высоко TLR21-активном ОДН с отличающимся CpG-тетрануклеотидным ядром, идентифицированном при осуществлении наших исследований, CCGC3-Gw2 (Таблица 58), и осуществляли тест TLR21 стимуляции в HEK293-NFκB-bsd- cTLR21 клетках, как описано в Примере 3.
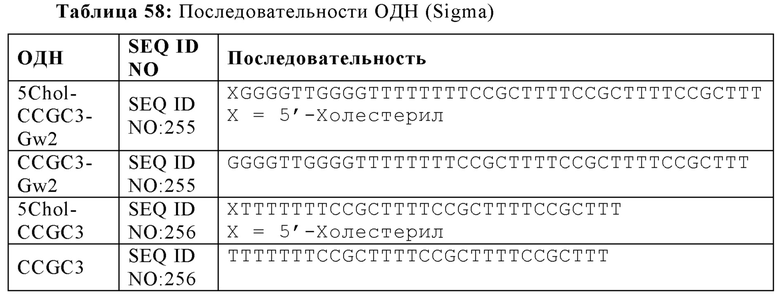
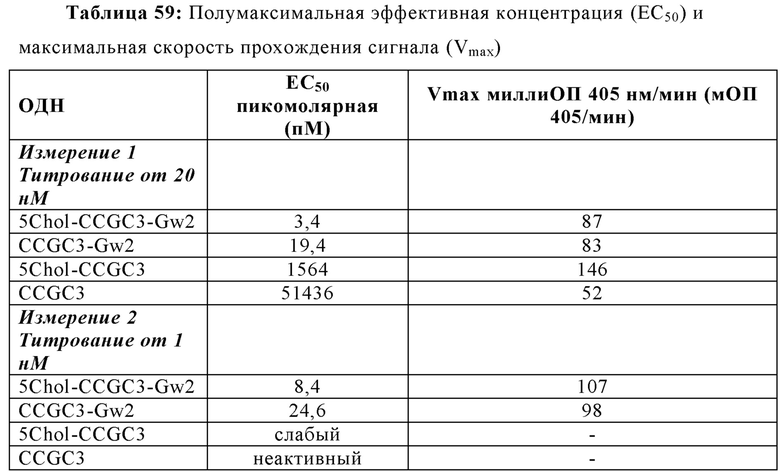
Результаты двух независимых измерений свидетельствуют о том, что TLR21-стимулирующая активность CCGC3-Gw2 улучшалась с помощью 5'-холестерольной модификации (Таблица 59, Фиг. 66А, 66В). По сравнению с немодифицированной версией, ЕС50 снижается приблизительно в 3-5-раз в обоих исследованиях (Таблица 59). Также в этом исследовании было показано, что 5'-dG последовательности не являются необходимыми для усиливающего влияния на активность 5'-холестерола: CCGC3-5Chol является приблизительно в 33 раз более активным по сравнению с его немодифицированной родственной структурой (Таблица 59, Фиг. 67).
Учитывая изложенное выше, полагают, что это был первый отчет об увеличенной собственной активности ОДН на TLR21 благодаря 5'-холестерильной модификации. Это было показано для GCGT3-TG4T (ОДН, впервые идентифицированного в этой серии исследований) в трех различных партиях, синтезированными тремя различными поставщиками. Усиливающее влияние на TLR21 активность осуществлялось дополнительно к активации благодаря последовательностям, образующим S'-G-квартет (таким как Gпроволока 2 или TG4T), но не обязательно нуждалось в них (см. GCGT3). Усиливающее влияние на TLR21 активность также было показано для другого CpG-ОДН, идентифицированного в этой серии исследований: CCGC3-Gпроволока2 и CCGC3. 3'-холестерильная модификация не имеет усиливающего эффекта на TLR21 активность. Полагают, вероятно, что 5'холестерильная дериватизация также имеет стабилизирующий эффект против расщепления нуклеазами. Можно сделать предположение о том, что холестерильная мицелльная сборка способствует образованию полидентатных TLR21 лигандов. 5'-локализация, в противоположность 3'-локализации, вероятно, необходима для правильной ориентации CpG мотивов. Кроме того, представляется возможным, что 5'холестерильная дериватизация имеет модифицирующее влияние на биодоступность in vivo.
Для квалифицированных специалистов в данной области техники будет понятно, что в предпочтительные варианты осуществления изобретения могут быть внесены различные изменения и модификации и что такие изменения и модификации могут быть осуществлены без отклонения от сущности изобретения. Следовательно, предполагается, что пункты приложенной формулы изобретения охватывают все такие эквивалентные вариации как подпадающие под сущность и объем изобретения.
Раскрытие каждого патента, патентной заявки и публикации, процитированной или описанной в данной документе, таким образом полностью включено в настоящую заявку в качестве ссылки.
Пример 10: Исследование эффективности иммуностимуляторов в условиях in vivo на модели вакцинации болезни Ньюкасла у цыплят
Для определения пригодности и эффективности ОДН1, ОДН2 и ОДН3 в качестве иммуностимуляторов, каждый тестировали в трех различных концентрациях.
Исследовали следующие иммуностимуляторы:
ОДН1: [CholTEG]-TGGGGTTTTTTTTGCGTTTTTGCGTTTTTGCGTTTT ("GCGT3-TG4T-5Chol") (SEQ ID NO: 252) ([CholTEG]=5'-триэтиленгликоль-связанная холестерильная модификация),
ОДН2: TGGGGTTTTTTTTGCGTTTTTGCGTTTTTGCGTTTT ("GCGT3-TG4T") (SEQ ID NO: 252),
ОДН3: tcgtcgttttgtcgttttgtcgtt ("2006-РТО") (SEQ ID NO: 3).
Каждый иммуностимулятор добавляли к масляной эмульсии, содержащей субоптимальную концентрацию инактивированного вируса болезни Ньюкасла (NDV) в соответствии с Таблицей 61. Для приготовления субоптимальной NDV вакцины, партию NDV антигена разводили 50 раз в NDV-отрицательной аллантоисной жидкости (AF). Эффективности ОДН1, ОДН2, и ОДН3 в комбинации с субоптимальной дозировкой вакцины болезни Ньюкасла тестировали у SPF куриц-несушек (Leghorn). Измеряли серологическую реакцию и сравнивали со сходной субоптимальной NDV вакциной без иммуностимулятора. Титр антител определяли в различные временные точки после вакцинации для исследования, может ли добавление иммуностимуляторов приводить к более раннему иммунному ответу. Для определения наиболее оптимальных дозировок трех ОДН, каждый дополняли тремя различными дозами 100 нг, 1000 нг и 5000 нг до субоптимальной NDV вакцины, что приводило к получению девяти групп с иммуностимуляторами. Кроме этих девяти групп с иммуностимуляторами, в это исследование включали пять контрольных групп, состоящие из группы субоптимальной NDV вакцины без иммуностимулятора, группы с неразведенной NDV вакциной, отрицательной контрольной группы (иммуностимуляторы в комбинации с адъювантом) и двух положительных контрольных групп с полиинозиновой : полицитидиловой кислотой (Поли И:Ц) в двух различных концентрациях (Таблица 60).
Тестировали следующие параметры: здоровье цыплят (данные не представлены) и серологию путем исследования ингибирования гемагглютинации (HI).
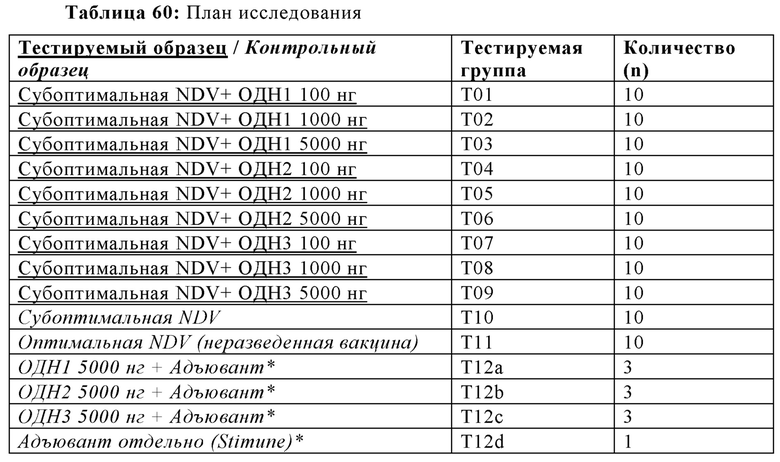

Цыплята, включенные в леченные группы Т01-Т14, получали тестируемый образец или контрольный образец в соответствии с планом исследования. В группах Т13 и Т14, девять вместо десяти цыплят на группу вакцинировали вследствие потери двух животных перед началом исследования.
Цыплят, включенных в леченные группы Т01, Т02, Т03, Т04, Т05, Т06, Т07, Т08 и Т09, вакцинировали с применением субоптимальной NDV суспензии, содержащей 1-3 различных иммуностимулятора (ОДН), каждый в 3 различных концентрациях (100, 1000, 5000 нг/дозу). Для приготовления эмульсий типа вода в масле, суспензию антигена NDV и иммуностимулятор (водная фаза) приготавливали в виде препарата с адъювантом Stimune (масляная фаза) при соотношении 4:5 (Таблица 61).
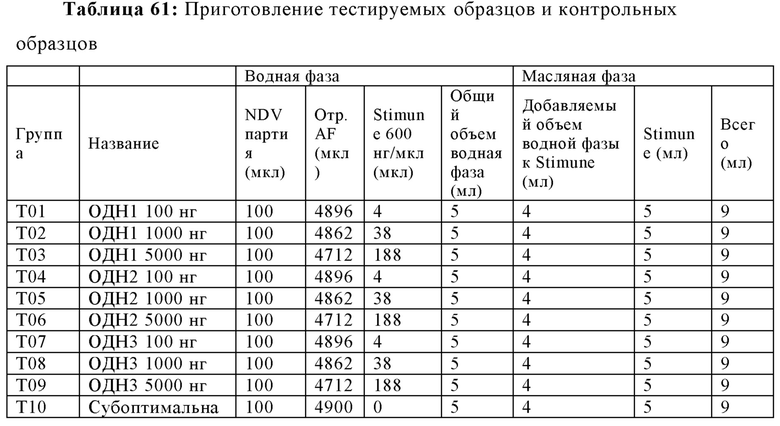
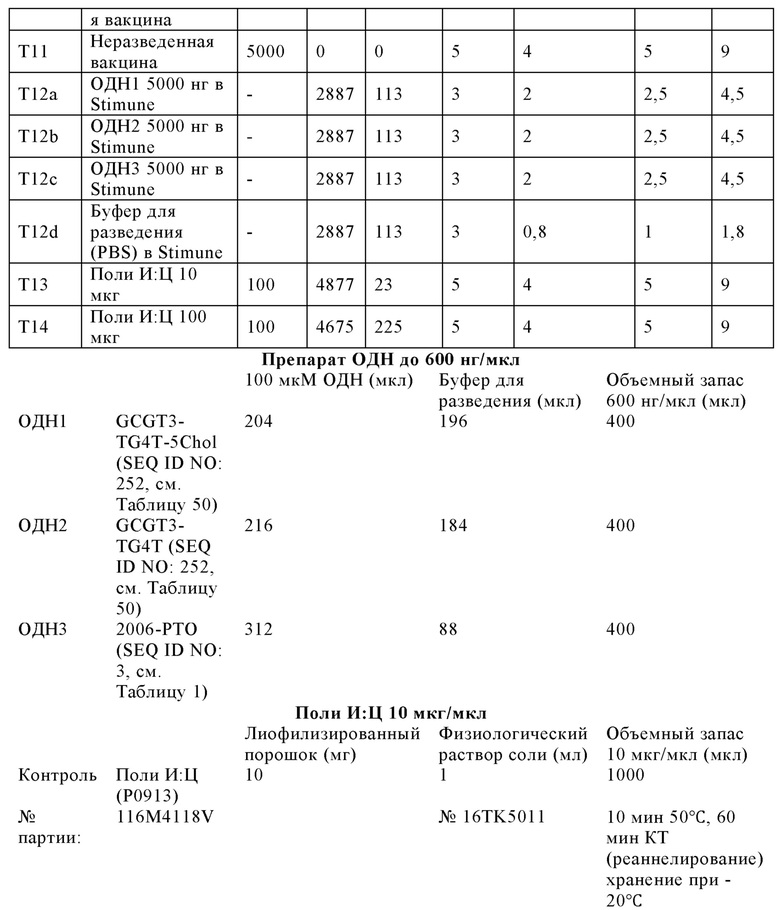
Цыплят, включенных в контрольную группу Т10, вакцинировали с применением субоптимальной NDV суспензии без иммуностимулятора в адъюванте (Stimune) при соотношении 4:5.
Цыплят, включенных в контрольную группу Т11, вакцинировали с применением неразведенной NDV суспензии без иммуностимулятора в адъюванте (Stimune) при соотношении 4:5.
Цыплят, включенных в группу Т12, вакцинировали с применением иммуностимулятора 1 (3 цыпленка), иммуностимулятор 2 (3 цыпленка) или иммуностимулятор 3 (3 цыпленка) в адъюванте (Stimune) при соотношении 4:5. Одного цыпленка вакцинировали с применением буфера для разведения в адъюванте (Stimune).
Цыплят, включенных в контрольные группы Т13 (n=9) и Т14 (n=9), вакцинировали с применением субоптимальной NDV суспензии в комбинации с Поли И:Ц в двух концентрациях (10000 нг и 100 мкг) в адъюванте (Stimune) при соотношении 4:5.
Введение тестируемого образца или контрольного образца
Суспензию инактивированного NDV штамма Ulster, которую хранили при температуре -70°С, размораживали и разводили 50 раз в отрицательной аллантоисной жидкости для создания дозы субоптимальной вакцины. Иммуностимуляторы добавляли в соответствии с планом исследования. Полученные водные фазы смешивали с Stimune при соотношении 4:5 в соответствии со схемой осуществления вакцинации, представленной в Таблице 61. Во время приготовления, все компоненты вакцины за исключением адъюванта Stimune помещали на тающий лед. Приготовленные вакцины инъецировали (0,5 мл, внутримышечно) сразу после приготовления.
За общим состоянием здоровья наблюдали с помощью опытного биотехнолога ежедневно от дня поступления до дня окончания исследования.
Отбор образцов сыворотки крови
Образцы крови для серологии отбирали от всех цыплят в дни исследования 0 (перед вакцинацией), 7, 14 и 21. Образцы крови метили с помощью номера исследования, уникального идентификатора образца и даты сбора. В зависимости от количества отобранного объема крови, сыворотку разделяли на две аликвоты приблизительно по 0,5 мл и хранили при температуре -20±5°С.
Исследование ингибирование гемагглютинации (HI)
Вкратце, серийные разведения сывороток инкубировали с 8 ГАЕ (гемагглютинирующие единицы) NDV штамма Ulster при комнатной температуре в течение 60 минут. ГАЕ титровали перед каждым анализом. После этого, добавляли эритроциты цыплят и агглютинацию оценивали после инкубирования при 4°С в течение 45 минут. Отрицательную контрольную сыворотку и три положительные контрольные сыворотки, с низкими, промежуточными и высокими титрами антител включали в каждое исследование.
Результаты титров HI выражали в виде обратной величины наивысшего разведения сыворотки, которое полностью ингибирует агглютинацию, которые логарифмически трансформировали в конечные Log2 титры.
Статистическая информация
Логарифмически трансформированные результаты HI суммировали на животное (см. Таблицы 62-65). На леченную группу, рассчитывали среднее значение и стандартное отклонение титров антител. Статистический анализ осуществляли с непараметрическим критерием Манна-Уитни критерием Стьюдента.
Результаты
Не наблюдали клинических симптомов или побочных эффектов, связанных с вакцинацией, в любой группе. Все цыплята были здоровыми на протяжении всего периода исследования.
Тем не менее, двоих цыплят оценивали с незначительными травмами вследствие клевательного поведения, которое начиналось за 6 дней до начала исследования. В день вакцинации всех цыплят распределяли в Поли И:Ц группы Т13 (№11658) и Т14 (№11676). Восстановление происходило в течение одной недели после вакцинации.
ОДН1, GCGT3-TG4T-5Chol
Индивидуальные результаты HI, выраженные в виде Log2 титров для групп с дозами 100 нг, 1000 нг и 5000 нг ОДН1 указаны в Таблице 62. Средние титры (HI) и стандартное отклонение этих групп указаны на Фиг. 70 (дни 14 и 21 после вакцинации (пв)) и Фиг. 71 (все данные) по сравнению со средними титрами группы с разведенной NDV вакциной.
GCGT3-TG4T-5Chol группы продемонстрировали существенно более высокие титры HI по сравнению с разведенной NDV вакциной (средний титр HI: 4,8 Log2/CO 1,0). В день 14 пв это происходило для всех трех групп; 100 нг: средний титр HI 6,2 Log2/CO 1,4 (р=0,0214), 1000 нг: средний титр HI 6,9 Log2/CO 1,1 (р=0,0003) и 5000 нг: средняя HI 5,9 Log2/CO 0,7 (р=0,0243).
Тем не менее, в день 21 пв, не наблюдали существенных различий для всех концентраций; 100 нг: средний титр HI 6,9 Log2/СО 0,8 (р=0,1995); 1000 нг: средний титр HI 7,3 Log2/CO 0,9 (р=0,0527); и 5000 нг: средняя HI 6,7 Log2/CO 0,9 (р=0,4523) при сравнении с NDV вакциной; титр HI 6,2 Log2/ SD1,0. (Фиг. 70), хотя концентрация 1000 нг была очень близкой к достоверной.
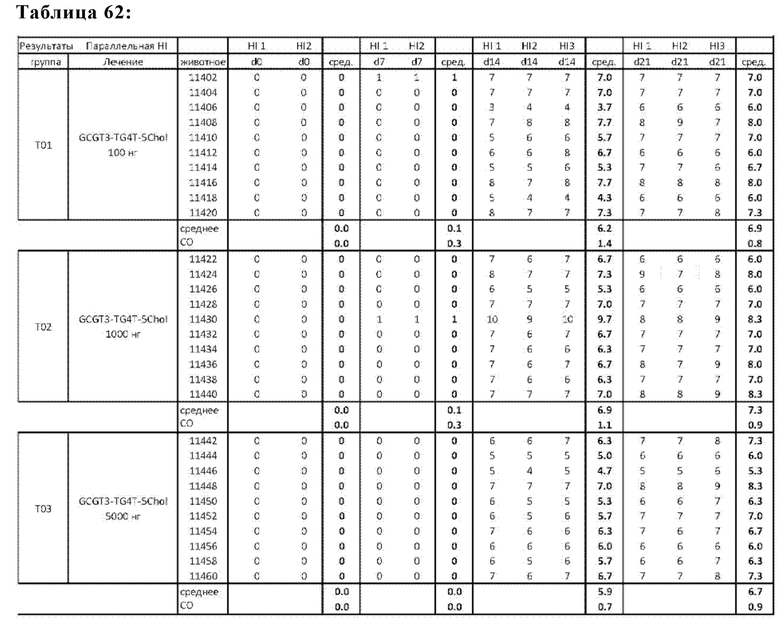
ОДН2, GCGT3-TG4T
Индивидуальные результаты HI, выраженные в виде Log2 титров для групп с дозами 100 нг, 1000 нг и 5000 нг ОДН1 указаны в Таблице 63. Средние титры (HI) и стандартное отклонение этих групп указаны на Фиг. 72 (дни 14 и 21 пв) и Фиг. 73 (все данные) по сравнению со средними титрами группы с разведенной NDV вакциной.
Группы ОДН2, GCGT3-TG4T продемонстрировали существенно более высокие титры HI по сравнению с разведенной NDV вакциной (средний титр HI: 4,8 Log2/CO 1,0). Это происходило в день 14 после вакцинации для всех трех групп; 100 нг: средний титр HI 7,1 Log2/CO 1,2 (р=0,0003), 1000 нг: средний титр HI 6,4 Log2/CO 0,7 (р=0,0027) и 5000 нг: средний титр HI 6,1 Log2/CO 1,1 (р=0,0236). В день 21 существенные различия наблюдали только при дозе 100 нг со средним титром HI 7,6 Log2/CO 0,8 (р=0,0083) по сравнению с NDV вакциной (титр HI 6,2 Log2/CO 1,0). Средние титры (HI) для 1000 нг и 5000 нг составляли 7,1 Log2/0,6 (р=0,0696) и 7,2 Log2/CO 1,0 (р=0,0956) соответственно (Фиг. 72).
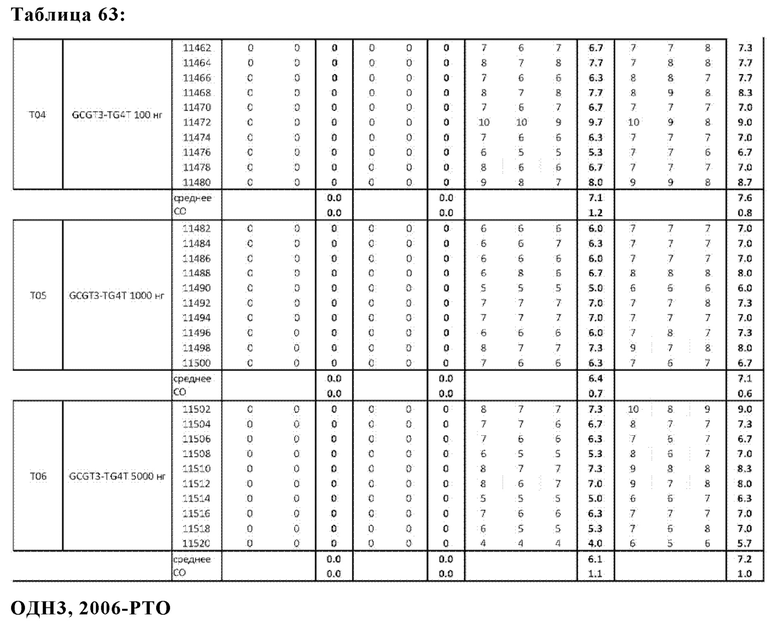
Индивидуальные результаты HI, выраженные в виде Log2 титров, измеренные для групп с дозами 100 нг, 1000 нг и 5000 нг ОДН1, указаны в Таблице 64. Во время осуществления анализа HI в трех повторах резкоотклоняющийся результат наблюдали для животного 11570 в день 21, наиболее вероятно, это было вызвано ошибкой пипетирования (недостаточно добавлено AF) и, следовательно, этот результат не включали в конечный анализ (выделено цветом в Таблице 64). Таким образом, для этого животного и данных средний титр HI основывался на измерения в двух повторах.
Средние титры (HI) и стандартное отклонение этих групп указаны на Фиг. 74 (дни 14 и 21 пв) и Фиг. 75 (все данные) по сравнению со средними титрами группы с разведенной NDV вакциной.
Группы ОДН3, 2006-РТО продемонстрировали существенно более высокие титры HI по сравнению с разведенной NDV вакциной (средний титр HI: 4,8 Log2/CO 1,0). Это происходило в день 14 после вакцинации для двух доз; 1000 нг: средний титр HI: 6,3 Log2/CO 1,2 (р=0,0081) и 5000 нг: средний титр HI: 6,2 Log2/CO 0,8 (р=0,0059).Средний титр HI для дозы 100 нг составил 5,3 Log2/CO 0,5 (р=0,2090). В день 21 пв существенные различия измеряли только для 5000 нг: средний титр HI 7,3 Log2/CO 0,6 (р=0,0296). Не наблюдали существенных различий для доз 100 нг и 1000 нг, со средними титрами (HI) 6,6 Log2/CO 0,5 (р=0,7183) и 6,8 Log2/CO 1,1 (р=0,1685) соответственно, при сравнении с NDV вакциной; титр HI 6,2 Log2/CO 1,0 (Фиг. 74).
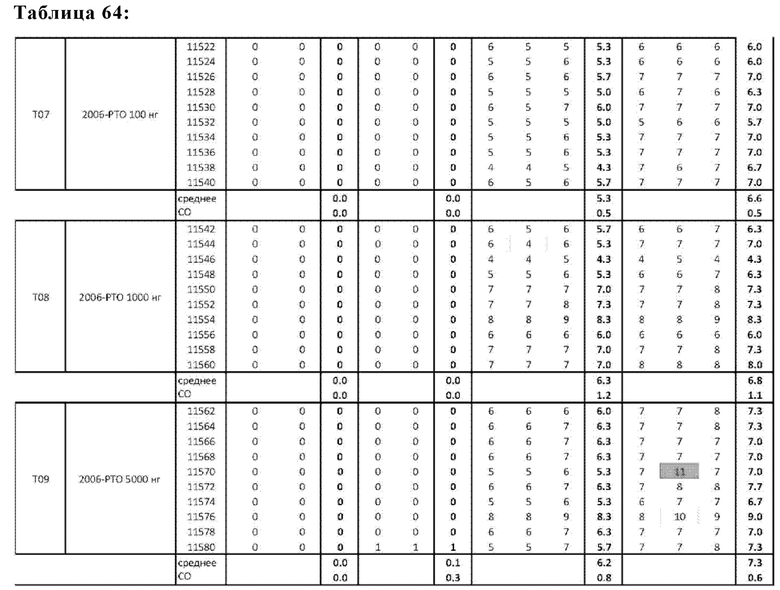
Контрольные группы
Индивидуальные результаты HI, выраженные в виде Log2 титров для групп с дозами 10 мкг и 100 мкг Поли И:Ц, разведенных и неразведенных NDV вакцин и отрицательные контрольные группы указаны в Таблице 65. Средние титры (HI) и стандартное отклонение этих групп указаны на Фиг. 76 (дни 14 и 21 пв) и Фиг. 77 (все данные) по сравнению со средними титрами группы с разведенной NDV вакциной.
Для Поли И:Ц, положительные контрольные группы, существенно более высокие титры HI наблюдали только при дозе 100 мкг: титр HI 7,5 Log2/CO 0,4 в день 21 (р=0,0053) по сравнению с NDV вакциной (6,2 Log2/CO 1,0). Средние титры (HI) в день 14 пв для групп с дозами 10 мкг и 100 мкг составили 5,8 Log2/CO 1,3 (р=0,1859) и 5,5 Log2/CO 0,8 (р=0,1609) соответственно. Средний титр HI для группы с дозой 10 мкг в день 21 пв составил 6,4 Log2/CO 1,3 (р=0,7273). Существенные различия (р<0,0001) наблюдали между группой с неразведенной NDV вакциной (8,3/СО 0,5 и 8,5 Log2/CO 0,7) и отрицательной контрольной группой по сравнению с группой с разведенной NDV в дни 14 и 21 после вакцинации (4,8/СО 1,0 и 6,2 Log2/ СО 1,0, соответственно) (Фиг. 76).
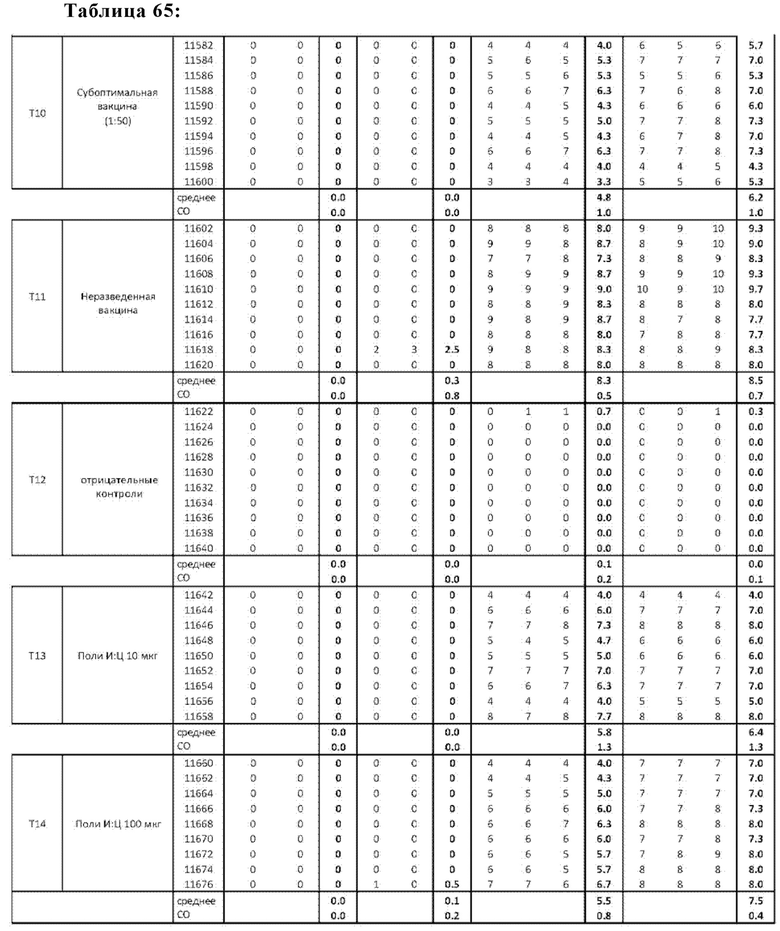
Выводы
Задачей было исследовать активность адъюванта для трех различных иммуностимуляторов. Это тестировали путем измерения серологической реакции после вакцинации с вакцинами на основе масляных эмульсий, содержащими субоптимальную концентрацию инактивированной NDV и различные концентрации одного из трех различных иммуностимуляторов.
Исследовали следующие иммуностимуляторы:
ОДН1: [CholTEG]-TGGGGTTTTTTTTGCGTTTTTGCGTTTTTGCGTTTT ("GCGT3-TG4T-5Chol") (SEQ ID NO: 252) ([CholTEG]=5'-триэтиленгликоль-связанная холестерильная модификация),
ОДН2: TGGGGTTTTTTTTGCGTTTTTGCGTTTTTGCGTTTT ("GCGT3-TG4T") (SEQ ID NO: 252),
ОДН3: tcgtcgttttgtcgttttgtcgtt ("2006-РТО") (SEQ ID NO: 3).
Остовы иммунных ОДН1 и ОДН2 были связаны фосфодиэфирной связью, в то время как остов ОДН3 был связан фосфоротиоатной связью. Эффективность каждого ОДН определяли в трех различных дозах; 100 нг, 1000 нг и 5000 нг, дополнительно к субоптимальной NDV вакцине.
Серологическую реакцию определяли в дни 0 (перед вакцинацией), 7, 14 и 21 после вакцинации для исследования, может ли добавление этих иммуностимуляторов также приводить к более раннему иммунному ответу. В дни 0 и 7 после вакцинации (пв) не обнаруживали уровней антител к NDV, за исключением для одного животного (№11618) в группе с неразведенной NDV вакциной в день 7.
Серологическая реакция, выраженная в виде Log2 титров HI, продемонстрировала существенные различия (р<0,0001) между неразведенными и субоптимальными NDV вакцинами в дни 14 и 21 пв, указывая на то, что коэффициент разведения в 50 раз является достаточным для создания дозы субоптимальной вакцины.
Отрицательная контрольная группа оставалась отрицательной на протяжении всего исследования, указывая на то, что иммуностимуляторы без NDV вакцины не приводили к неспецифическому иммунному ответу.
Положительная контрольная группа с дозой Поли И:Ц 100 мкг продемонстрировала существенно более высокие титры HI по сравнению с наивной NDV вакциной в день 21 (р=0,0053), указывая на то, что эта дозовая группа служит в качестве обоснованной положительной контрольной группы.
Группа GCGT3-TG4T-5Chol (ОДН1) продемонстрировала существенно более высокие титры HI по сравнению с разведенной NDV вакциной в день 14 пв для всех трех групп; 100 нг (р=0,0214), 1000 нг (р=0,0003) и 5000 нг (р=0,0243). Тем не менее, в день 21 пв, не наблюдали существенных различий.
Группа GCGT3-TG4T (ОДН2) продемонстрировала существенно более высокие титры HI по сравнению с разведенной NDV вакциной в день 14 пв для всех трех групп; 100 нг (р=0,0003), 1000 нг (р=0,0027) и 5000 нг (р=0,0236). В день 21 существенные различия (р=0,0083) измеряли только для группы с дозой 100 нг.
Группа 2006-РТО (ОДН3) продемонстрировала существенно более высокие титры HI по сравнению с разведенной NDV вакциной в день 14 пв для двух доз; 1000 нг (р=0,0081) и 5000 нг (р=0,0059). В день 21 пв существенные различия (р=0,0296) измеряли только для группы с дозой 5000 нг.
В заключение необходимо отметить, что, наиболее высокие средние титры (HI) наблюдали для группы с дозой 100 нг GCGT3-TG4T (ОДН2), 7,1 Log2 (14 дни пв) и 7,6 Log2 (21 дни пв), указывая на повышение титров по сравнению с наивной NDV вакциной 2,3 Log2 и 1,4 Log2 в день 14 и 21 пв, соответственно.
Титры для группы с дозой 1000 нг GCGT3-TG4T-5Chol (ОДН1), 6,9 Log2 и 7,3 Log2, в день 14 и 21 пв соответственно были практически сходными с ОДН2 группой. В день 14 пв не наблюдали существенного различия (р=0,7513) между группами ОДН1 и ОДН2.
Титры для группы с дозой 5000 нг 2006-РТО (ОДН3) составили 6,2 Log2 и 7,3 Log2 в день 14 и 21 пв, соответственно. В день 14 пв, группа ОДН3 существенно отличается (р=0,0300) от обеих групп ОДН1 и ОДН2 (Фиг. 78 и Фиг. 79).
В день 21 пв не наблюдали существенных различий между всеми ОДН группами.
Следовательно, эти результаты указывают на то, что все ОДН способны существенно увеличивать серологическую реакцию, в особенности в день 14 после вакцинации, также указывая на более ранее начало иммунитета.
ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ
Для дальнейшей иллюстрации, дополнительные неограничивающие варианты осуществления настоящего изобретения представлены ниже.
Например, вариант осуществления 1 представляет собой иммуностимулирующий олигонуклеотид, содержащий по меньшей мере один CpG мотив и обогащенную гуаниновыми нуклеотидами последовательность, начинающиеся на или в пределах четырех нуклеотидов от 5'-конца олигонуклеотида.
Вариант осуществления 2 представляет собой олигонуклеотид согласно варианту осуществления 1, где обогащенная гуаниновыми нуклеотидами последовательность содержит первое множество гуаниновых нуклеотидов.
Вариант осуществления 3 представляет собой олигонуклеотид согласно варианту осуществления 2, где первое множество гуаниновых нуклеотидов содержит три - восемь гуаниновых нуклеотидов.
Вариант осуществления 4 представляет собой олигонуклеотид согласно варианту осуществления 3, где олигонуклеотид содержит SEQ ID NO: 16, 17, 18, 19, 20, 21, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 77, 78, 81, 82, 85, 86, 89, 90, 92, 93, 96, 97, 100, 102, 104, 106, 108, 143 или 252.
Вариант осуществления 5 представляет собой олигонуклеотид по любому из вариантов осуществления 1-3, где обогащенная гуаниновыми нуклеотидами последовательность содержит TTAGGG, TTAGGGTTAGGG (SEQ ID NO: 261), TTTTGGGG, GGGGTTTT, GGGGTTTTGGGG (SEQ ID NO: 262), TTAGGG, TTAGGGTTAGGGTTTT (SEQ ID NO: 263), TGTGGGTGTGTGTGGG (SEQ ID NO: 268), GGAGG, TGGAGGC, TGGAGGCTGGAGGC (SEQ ID NO: 264), или TGGGGT (SEQ ID NO: 265).
Вариант осуществления 6 представляет собой олигонуклеотид по любому из вариантов осуществления 1-3, где олигонуклеотид содержит SEQ ID NO: 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 124, 125, 126, 127, 129, 130, 131, 134, 136, 137 или 138.
Вариант осуществления 7 представляет собой олигонуклеотид по одному из предшествующих вариантов осуществления 1-6, которая дополнительно содержит второе множество гуаниновых нуклеотидов между первым множеством гуаниновых нуклеотидов и по меньшей мере одним CpG мотивом.
Вариант осуществления 8 представляет собой олигонуклеотид по одному из вариантов осуществления 2-7, где первое множество гуаниновых нуклеотидов, второе множество гуаниновых нуклеотидов, или оба включают G-квартетную последовательность.
Вариант осуществления 9 представляет собой олигонуклеотид согласно варианту осуществления 8, где G-квартетная последовательность представляет собой сайт взаимодействия для других G-квартетных последовательностей.
Вариант осуществления 10 представляет собой олигонуклеотид согласно варианту осуществления 9, где G-квартетная последовательность содержит TGGGGT (SEQ ID NO: 265).
Вариант осуществления 11 представляет собой олигонуклеотид согласно варианту осуществления 7, где первое и второе множества гуаниновых нуклеотидов включают последовательность G-проволоки.
Вариант осуществления 12 представляет собой олигонуклеотид согласно варианту осуществления 11, где последовательность G-проволоки представляет собой сайт взаимодействия для других последовательностей G-проволоки.
Вариант осуществления 13 представляет собой олигонуклеотид согласно варианту осуществления 10 или 11, где последовательность G-проволоки содержит SEQ ID NO: 257 или 258.
Вариант осуществления 14 представляет собой олигонуклеотид согласно варианту осуществления 11 или 12, где олигонуклеотид содержит SEQ ID NO: 141, 142, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 252, или GCGT-Gпроволока3.
Вариант осуществления 15 представляет собой олигонуклеотид по одному из вариантов осуществления 7-14, где первое множество гуаниновых нуклеотидов и второе множество гуаниновых нуклеотидов разделены по меньшей мере одним нуклеотидом.
Вариант осуществления 16 представляет собой олигонуклеотид по любому из вариантов осуществления 1-3, которая дополнительно содержит линкер между первым множеством гуаниновых нуклеотидов и по меньшей мере одним CpG мотивом.
Вариант осуществления 17 представляет собой олигонуклеотид согласно варианту осуществления 16, где линкер содержит по меньшей мере три нуклеотида.
Вариант осуществления 18 представляет собой олигонуклеотид согласно варианту осуществления 16 или 17, где линкер содержит гексаэтиленгликоль, триэтиленгликоль, пропандиол или их производные.
Вариант осуществления 19 представляет собой олигонуклеотиды по одному из вариантов осуществления 16-18, где олигонуклеотид содержит 2006-PDE5dG4-X1 или 2006-PDE5dG4-X3.
Вариант осуществления 20 представляет собой олигонуклеотид по одному из предшествующих вариантов осуществления 1-19, где по меньшей мере один CpG мотив представляет собой множество CpG мотивов.
Вариант осуществления 21 представляет собой олигонуклеотид согласно варианту осуществления 20, где множество CpG мотивов содержит два, три, четыре или пять CpG мотивов.
Вариант осуществления 22 представляет собой олигонуклеотид согласно варианту осуществления 20 или 21, где каждый CpG мотив отделен от других CpG мотивов по меньшей мере одним нуклеотидом или аналогом нуклеотида.
Вариант осуществления 23 представляет собой олигонуклеотид согласно варианту осуществления 22, где по меньшей мере один нуклеотид представляет собой один - четыре тиминовых нуклеотида.
Вариант осуществления 24 представляет собой олигонуклеотид согласно варианту осуществления 22 или 23, где олигонуклеотид содержит SEQ ID NO: 217, 218, 219 или 220.
Вариант осуществления 25 представляет собой олигонуклеотид согласно варианту осуществления 20, где каждый из CpG мотивы отделен от других CpG мотивов спейсером.
Вариант осуществления 26 представляет собой олигонуклеотид согласно варианту осуществления 25, где спейсер представляет собой дезоксирибозофосфатный мостик.
Вариант осуществления 27 представляет собой олигонуклеотид согласно варианту осуществления 26, где дезоксирибозофосфатный мостик является безосновным.
Вариант осуществления 28 представляет собой олигонуклеотид согласно варианту осуществления 27, где олигонуклеотид содержит SEQ ID NO: 221.
Вариант осуществления 29 представляет собой олигонуклеотид согласно варианту осуществления 25, где спейсер содержит углеродную цепь.
Вариант осуществления 30 представляет собой олигонуклеотид согласно варианту осуществления 29, где углеродная цепь содержит два атома углерода.
Вариант осуществления 31 представляет собой олигонуклеотид согласно варианту осуществления 30, где углеродная цепь имеет происхождение из этандиола.
Вариант осуществления 32 представляет собой олигонуклеотид согласно варианту осуществления 31, где олигонуклеотид содержит ОДН-Х2, где Х2 представляет собой этандиол.
Вариант осуществления 33 представляет собой олигонуклеотид согласно варианту осуществления 29, где углеродная цепь содержит три атома углерода.
Вариант осуществления 34 представляет собой олигонуклеотид согласно варианту осуществления 33, где углеродная цепь имеет происхождение из 1,3-пропандиола.
Вариант осуществления 35 представляет собой олигонуклеотид согласно варианту осуществления 33 или 34, где нуклеотид содержит CG-Gw2X2, Gw2X2-2, или ОДН-Х3, CG-Gw2X2-1, CG-Gw2X2-3, CG-Gw2X2-4, CG-Gw2X2-5, CG-G4T16X2-1, CG-G4T16X2-2, CG-G4T16X2-3, CG-G4T16X2-4, или CG-G4T16X2-5, где X2 представляет собой трехуглеродную цепь; 2006-PDE5dG4-X2 где Х2 представляет собой трехуглеродную цепь, имеющую происхождение из пропандиола; или 2006-PDE5dG4-X4, где Х4 представляет собой трехуглеродную цепь, имеющую происхождение из пропандиола.
Вариант осуществления 36 представляет собой олигонуклеотид нуклеотид согласно варианту осуществления 29, где углеродная цепь содержит четыре атомов углерода.
Вариант осуществления 37 представляет собой олигонуклеотид согласно варианту осуществления 36, где углеродная цепь имеет происхождение из 1,4-бутандиола.
Вариант осуществления 38 представляет собой олигонуклеотид согласно варианту осуществления 36 или 37, где олигонуклеотид содержит ОДН-Х4, где Х4 представляет собой четырехуглеродную цепь, имеющую происхождение из 1,4-бутандиола.
Вариант осуществления 39 представляет собой олигонуклеотид согласно варианту осуществления 25, где спейсер содержит повторяемую химическую единицу.
Вариант осуществления 40 представляет собой олигонуклеотид согласно варианту осуществления 39, где повторяемая химическая единица представляет собой этиленгликоль.
Вариант осуществления 41 представляет собой олигонуклеотид согласно варианту осуществления 39 или 40, где олигонуклеотид содержит CCGC-Gw2X1, где X1 представляет собой спейсер, имеющий происхождение из гексаэтиленгликоля.
Вариант осуществления 42 представляет собой олигонуклеотид по одному из предшествующих вариантов осуществления 1-41, которая дополнительно содержит по меньшей мере один аналог нуклеотида.
Вариант осуществления 43 представляет собой олигонуклеотид по одному из предшествующих вариантов осуществления 1-42, которая дополнительно содержит фосфодиэфирный остов.
Вариант осуществления 44 представляет собой олигонуклеотид по одному из предшествующих вариантов осуществления 1-43, которая дополнительно содержит фосфоротиоатный остов.
Вариант осуществления 45 представляет собой олигонуклеотид по одному из предшествующих вариантов осуществления 1-44, которая дополнительно содержит липидный компонент.
Вариант осуществления 46 представляет собой олигонуклеотид согласно варианту осуществления 45, где липидный компонент представляет собой холестерол.
Вариант осуществления 47 представляет собой олигонуклеотид согласно варианту осуществления 45 или 46, где липидный компонент находится на или возле 5'-конца олигонуклеотида.
Вариант осуществления 48 представляет собой олигонуклеотиды по одному из предшествующих вариантов осуществления 1-47, где CpG мотив содержит элемент CpG последовательности, имеющий по меньшей мере четыре нуклеотида.
Вариант осуществления 49 представляет собой олигонуклеотид согласно варианту осуществления 48, включающий по меньшей мере два элемента CpG последовательности.
Вариант осуществления 50 представляет собой олигонуклеотид согласно варианту осуществления 48 или 49, включающий по меньшей мере три элемента CpG последовательности.
Вариант осуществления 51 представляет собой олигонуклеотиды по одному из вариантов осуществления 48-50, где элементы CpG последовательности представляют собой GCGA, GCGG, ACGC, CCGC, GCGT, TCGC или любую их комбинацию.
Вариант осуществления 52 представляет собой олигонуклеотид по одному из предшествующих вариантов осуществления 1-51, которая дополнительно содержит три-тиминовую нуклеотидную 3'-концевую область.
Вариант осуществления 53 представляет собой олигонуклеотид согласно варианту осуществления 55, где олигонуклеотид содержит SEQ ID NO: 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214 или 215.
Вариант осуществления 54 представляет собой вакцину для предотвращения или лечения инфекционного заболевания, содержащую олигонуклеотид по одному из предшествующих вариантов осуществления 1-53.
Вариант осуществления 55 представляет собой вектор, содержащий олигонуклеотид по одному из предшествующих вариантов осуществления 1-54.
Вариант осуществления 56 представляет собой иммуностимулирующую композицию, содержащую олигонуклеотид по одному из предшествующих вариантов осуществления 1-55.
Вариант осуществления 57 представляет собой иммуностимулирующую композицию согласно варианту осуществления 56, которая дополнительно содержит фармацевтически приемлемый наполнитель.
Вариант осуществления 58 представляет собой иммуностимулирующую композицию согласно варианту осуществления 57, где олигонуклеотид и носитель связаны.
Вариант осуществления 59 представляет собой иммуностимулирующую композицию согласно варианту осуществления 56, которая дополнительно содержит гаптен.
Вариант осуществления 60 представляет собой иммуностимулирующую композицию согласно варианту осуществления 57, где олигонуклеотид и гаптен связаны.
Вариант осуществления 61 представляет собой способ стимуляции толл-подобного рецептора 21 (TLR21), включающий:
введение субъекту, который в этом нуждается, иммуностимулирующего олигонуклеотида, имеющего по меньшей мере один CpG мотив и обогащенную гуаниновыми нуклеотидами последовательность, начинающиеся на или в пределах четырех нуклеотидов от 5'-конца олигонуклеотида, где обогащенная гуаниновыми нуклеотидами последовательность содержит первое множество гуаниновых нуклеотидов.
Вариант осуществления 62 представляет собой способ согласно варианту осуществления 61, где концентрация олигонуклеотида составляет меньше чем 20 нМ.
Вариант осуществления 63 представляет собой способ согласно варианту осуществления 61 или 62, где олигонуклеотид дополнительно содержит фармацевтически приемлемый наполнитель.
Вариант осуществления 64 представляет собой способ по одному из вариантов осуществления 61-63, где иммуностимулирующая композиция дополнительно содержит гаптен.
Вариант осуществления 65 представляет собой способ по одному из вариантов осуществления 61-64, где полумаксимальная концентрация (ЕС50) олигонуклеотида составляет меньше чем 100 пМ.
Вариант осуществления 66 представляет собой способ по одному из вариантов осуществления 61-65, где обогащенная гуаниновыми нуклеотидами нуклеотидная последовательность содержит TTAGGG, TTAGGGTTAGGG (SEQ ID NO: 261), TTTTGGGG, GGGGTTTT, GGGGTTTTGGGG (SEQ ID NO: 262), TTAGGG, TTAGGGTTAGGGTTTT (SEQ ID NO: 263), TGTGGGTGTGTGTGGG (SEQ ID NO: 268), GGAGG, TGGAGGC или TGGAGGCTGGAGGC (SEQ ID NO: 264).
Вариант осуществления 67 представляет собой способ по одному из вариантов осуществления 61-66, где олигонуклеотид содержит SEQ ID NO: 110, 111, 112, 113, 114, 115, 116, 117118, 119, 120, 124, 125, 126, 127, 129, 130, 131, 134, 136, 137 или 138.
Вариант осуществления 68 представляет собой способ по одному из вариантов осуществления 61-67, где олигонуклеотид дополнительно содержит последовательность G-проволоки.
Вариант осуществления 69 представляет собой способ согласно варианту осуществления 68, где последовательность G-проволоки содержит SEQ ID NO: 257 или 258.
Вариант осуществления 70 представляет собой способ согласно варианту осуществления 68, где олигонуклеотид содержит SEQ ID NO: 141, 142, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 252, или GCGT-Gпроволока3.
Вариант осуществления 71 представляет собой способ по одному из вариантов осуществления 61-70, включающий второе множество гуаниновых нуклеотидов, где первое множество гуаниновых нуклеотидов и второе множество гуаниновых нуклеотидов разделены по меньшей мере одним нуклеотидом.
Вариант осуществления 72 представляет собой способ по одному из вариантов осуществления 61-71, где олигонуклеотид дополнительно содержит линкер между первым множеством гуаниновых нуклеотидов и по меньшей мере одним CpG мотивом.
Вариант осуществления 73 представляет собой способ согласно варианту осуществления 72, где линкер содержит по меньшей мере три нуклеотида.
Вариант осуществления 74 представляет собой способ согласно варианту осуществления 72, где линкер содержит гексаэтиленгликоль, триэтиленгликоль, пропандиол или их производные.
Вариант осуществления 75 представляет собой способ согласно варианту осуществления 72-74, где олигонуклеотид содержит 2006-PDE5dG4-X1 или 2006-PDE5dG4-X3.
Вариант осуществления 76 представляет собой способ согласно варианту осуществления 72-75, где по меньшей мере один CpG мотив представляет собой множество CpG мотивов.
Вариант осуществления 77 представляет собой способ согласно варианту осуществления 76, где множество CpG мотивов содержит два, три, четыре или пять CpG мотивов.
Вариант осуществления 78 представляет собой способ согласно варианту осуществления 76 или 77, где каждый CpG мотив отделен от других CpG мотивов по меньшей мере одним нуклеотидом или аналогом нуклеотида.
Вариант осуществления 79 представляет собой способ согласно варианту осуществления 78, где по меньшей мере один нуклеотид представляет собой один - четыре тиминовых нуклеотида.
Вариант осуществления 80 представляет собой способ согласно варианту осуществления 78 или 79, где олигонуклеотид содержит SEQ ID NO: 217, 218, 219 или 220.
Вариант осуществления 81 представляет собой способ согласно варианту осуществления 76 или 77, где каждый из CpG мотивы отделен от других CpG мотивов спейсером.
Вариант осуществления 82 представляет собой способ согласно варианту осуществления 81, где спейсер представляет собой дезоксирибозофосфатный мостик.
Вариант осуществления 83 представляет собой способ согласно варианту осуществления 82, где дезоксирибозофосфатный мостик является безосновным.
Вариант осуществления 84 представляет собой способ согласно вариантам осуществления 82 или 83, где олигонуклеотид содержит SEQ ID NO: 221.
Вариант осуществления 85 представляет собой способ согласно варианту осуществления 81, где спейсер содержит углеродную цепь.
Вариант осуществления 86 представляет собой способ согласно варианту осуществления 85, где углеродная цепь содержит два атома углерода.
Вариант осуществления 87 представляет собой способ согласно варианту осуществления 86, где углеродная цепь имеет происхождение из этандиола.
Вариант осуществления 88 представляет собой способ согласно варианту осуществления 86 или 87, где олигонуклеотид содержит ОДН-Х2, где Х2 представляет собой этандиол.
Вариант осуществления 89 представляет собой способ согласно варианту осуществления 85, где углеродная цепь содержит три атома углерода.
Вариант осуществления 90 представляет собой способ согласно варианту осуществления 89, где углеродная цепь имеет происхождение из 1,3-пропандиола.
Вариант осуществления 91 представляет собой способ согласно варианту осуществления 89 или 90, где нуклеотид содержит CG-Gw2X2, Gw2X2-2, или ОДН-Х3, CG-Gw2X2-1, CG-Gw2X2-3, CG-Gw2X2-4, CG-Gw2X2-5, CG-G4T16X2-1, CG-G4T16X2-2, CG-G4T16X2-3, CG-G4T16X2-4, или CG-G4T16X2-5, где Х2 представляет собой трехуглеродную цепь; 2006-PDE5dG4-X2, где Х2 представляет собой трехуглеродную цепь, имеющую происхождение из пропандиола; или 2006-PDE5dG4-X4, где Х4 представляет собой трехуглеродную цепь, имеющую происхождение из пропандиола.
Вариант осуществления 92 представляет собой способ согласно варианту осуществления 85, где углеродная цепь содержит четыре атомов углерода.
Вариант осуществления 93 представляет собой способ согласно варианту осуществления 92, где углеродная цепь имеет происхождение из 1,4-бутандиола.
Вариант осуществления 94 представляет собой способ согласно варианту осуществления 92 или 93, где олигонуклеотид содержит ОДН-Х4, где Х4 представляет собой четырехуглеродную цепь, имеющую происхождение из 1,4-бутандиола.
Вариант осуществления 95 представляет собой способ согласно варианту осуществления 81, где спейсер содержит повторяемую химическую единицу.
Вариант осуществления 96 представляет собой способ согласно варианту осуществления 95, где повторяемая химическая единица представляет собой этиленгликоль.
Вариант осуществления 97 представляет собой способ согласно варианту осуществления 95 или 96, где олигонуклеотид содержит CCGC-Gw2X1, где X1 представляет собой спейсер, имеющий происхождение из гексаэтиленгликоля.
Вариант осуществления 98 представляет собой способ по одному из предшествующих вариантов осуществления 61-97, которая дополнительно содержит по меньшей мере один аналог нуклеотида.
Вариант осуществления 99 представляет собой способ по одному из предшествующих вариантов осуществления 61-98, которая дополнительно содержит липидный компонент.
Вариант осуществления 100 представляет собой способ согласно варианту осуществления 99, где липидный компонент представляет собой холестерол.
Вариант осуществления 101 представляет собой способ согласно варианту осуществления 99 или 100, где липидный компонент находится на или возле 5'- конца олигонуклеотида.
Вариант осуществления 102 представляет собой способ по одному из вариантов осуществления 61-101, где CpG мотив содержит элемент CpG последовательности, имеющий по меньшей мере четыре нуклеотида.
Вариант осуществления 103 представляет собой способ согласно варианту осуществления 102, где олигонуклеотид содержит по меньшей мере два элемента CpG последовательности.
Вариант осуществления 104 представляет собой способ согласно варианту осуществления 102 или 103, где олигонуклеотид содержит по меньшей мере три элемента CpG последовательности.
Вариант осуществления 105 представляет собой способ по одному из вариантов осуществления 101-104, где элементы CpG последовательности представляют собой GCGA, GCGG, ACGC, CCGC, GCGT, TCGC или любую их комбинацию.
Вариант осуществления 106 представляет собой способ согласно варианту осуществления 61, которая дополнительно содержит три-тиминовую нуклеотидную 3'-концевую область.
Вариант осуществления 107 представляет собой способ согласно варианту осуществления 106, где олигонуклеотид содержит SEQ ID NO: 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214 или 215.
Вариант осуществления 108 представляет собой способ по одному из вариантов осуществления 61-107, где иммуностимулирующая композиция содержит вакцина для предотвращения или лечения инфекционного заболевания.
Вариант осуществления 109 представляет собой способ по одному из вариантов осуществления 61-107, где иммуностимулирующая композиция содержит вектор.
Вариант осуществления 110 представляет собой способ по одному из вариантов осуществления 61-109, где иммуностимулирующая композиция дополнительно содержит фармацевтически приемлемый наполнитель.
Вариант осуществления 111 представляет собой способ согласно варианту осуществления 110, где олигонуклеотид и носитель связаны.
Вариант осуществления 112 представляет собой способ по одному из вариантов осуществления 61-111, где иммуностимулирующая композиция дополнительно содержит гаптен.
Вариант осуществления 113 представляет собой способ по одному из вариантов осуществления 112, где олигонуклеотид и гаптен связаны.
Вариант осуществления 114 представляет собой способ по одному из вариантов осуществления 61-113, где введение осуществляют внутривенно, внутримышечно, интрамаммарно, внутрикожно, внутрибрюшинно, подкожно, путем распыления, с помощью аэрозоля, «в яйцо», слизисто, чрескожно, путем погружения, перорально, внутрь глаза, интратрахеально или интраназально.
Вариант осуществления 115 представляет собой способ по одному из вариантов осуществления 61-114, где субъект представляет собой животное.
Вариант осуществления 116 представляет собой способ по одному из вариантов осуществления 61-115, где субъект представляет собой представителя видов птиц.
Вариант осуществления 117 представляет собой способ повышения TLR21- стимулирующей активности олигонуклеотида, имеющего по меньшей мере один CpG мотив, включающий слияние 5'-конца олигонуклеотида с обогащенной гуаниновыми нуклеотидами последовательностью.
Вариант осуществления 118 представляет собой способ согласно варианту осуществления 117, где обогащенная гуаниновыми нуклеотидами последовательность представляет собой G-квартетную последовательность.
Вариант осуществления 119 представляет собой способ согласно варианту осуществления 118, где G-квартетная последовательность содержит первое множество гуаниновых нуклеотидов.
Вариант осуществления 120 представляет собой способ согласно варианту осуществления 119, где первое множество гуаниновых нуклеотидов содержит три - восемь гуаниновых нуклеотидов.
Вариант осуществления 121 представляет собой способ согласно вариантам осуществления 119 или 120, где G-квартетная последовательность содержит TTAGGG, TTAGGGTTAGGG (SEQ ID NO: 261), TTTTGGGG, GGGGTTTT, GGGGTTTTGGGG (SEQ ID NO: 262), TTAGGG, TTAGGGTTAGGGTTTT (SEQ ID NO: 263), TGTGGGTGTGTGTGGG (SEQ ID NO: 268), GGAGG, TGGAGGC или TGGAGGCTGGAGGC (SEQ ID NO: 264).
Вариант осуществления 122 представляет собой способ по одному из вариантов осуществления 117-121, где олигонуклеотид содержит второе множество гуаниновых нуклеотидов.
Вариант осуществления 123 представляет собой способ по одному из вариантов осуществления 117-122, где обогащенная гуаниновыми нуклеотидами последовательность содержит последовательность G-проволоки.
Вариант осуществления 124 представляет собой способ согласно варианту осуществления 123, где последовательность G-проволоки содержит SEQ ID NO: 257 или 258.
Вариант осуществления 125 представляет собой способ по одному из вариантов осуществления 119-124, где первое множество гуаниновых нуклеотидов и второе множество гуаниновых нуклеотидов разделены по меньшей мере одним нуклеотидом.
Вариант осуществления 126 представляет собой способ согласно варианту осуществления 117, которая дополнительно содержит инсертированный линкер между первым множеством гуаниновых нуклеотидов и по меньшей мере одним CpG мотивом.
Вариант осуществления 127 представляет собой способ согласно варианту осуществления 126, где линкер содержит по меньшей мере три нуклеотида.
Вариант осуществления 128 представляет собой способ согласно варианту осуществления 126 или 127, где линкер содержит гексаэтиленгликоль, триэтиленгликоль, пропандиол или их производные.
Вариант осуществления 129 представляет собой способ по одному из вариантов осуществления 126-128, где олигонуклеотид содержит 2006-PDE5dG4-X1 или 2006-PDE5dG4-X3.
Вариант осуществления 130 представляет собой способ согласно варианту осуществления 117, где по меньшей мере один CpG мотив представляет собой множество CpG мотивов.
Вариант осуществления 131 представляет собой способ согласно варианту осуществления 130, где множество CpG мотивов содержит два, три, четыре или пять CpG мотивов.
Вариант осуществления 132 представляет собой способ согласно варианту осуществления 130 или 131, которая дополнительно содержит инсертированный по меньшей мере один нуклеотид или аналог нуклеотида между CpG мотивами.
Вариант осуществления 133 представляет собой способ по пункту 132, где по меньшей мере один нуклеотид представляет собой один - четыре тиминовых нуклеотида.
Вариант осуществления 134 представляет собой способ согласно варианту осуществления 117, которая дополнительно содержит инсертированный спейсер между каждым из CpG мотивов.
Вариант осуществления 135 представляет собой способ согласно варианту осуществления 134, где спейсер представляет собой дезоксирибозофосфатный мостик.
Вариант осуществления 136 представляет собой способ согласно варианту осуществления 135, где дезоксирибозофосфатный мостик является безосновным.
Вариант осуществления 137 представляет собой способ согласно варианту осуществления 134, где спейсер содержит углеродную цепь.
Вариант осуществления 138 представляет собой способ согласно варианту осуществления 137, где углеродная цепь содержит два атома углерода.
Вариант осуществления 139 представляет собой способ согласно вариантам осуществления 137 или 138, где углеродная цепь имеет происхождение из этандиола.
Вариант осуществления 140 представляет собой способ согласно варианту осуществления 137, где углеродная цепь содержит три атома углерода.
Вариант осуществления 141 представляет собой способ согласно варианту осуществления 137 или 140, где углеродная цепь имеет происхождение из 1,3-пропандиола.
Вариант осуществления 142 представляет собой способ согласно варианту осуществления 137, где углеродная цепь содержит четыре атомов углерода.
Вариант осуществления 143 представляет собой способ согласно варианту осуществления 137 или 142, где углеродная цепь имеет происхождение из 1,4-бутандиола.
Вариант осуществления 144 представляет собой способ согласно варианту осуществления 137, где спейсер содержит повторяемую химическую единицу.
Вариант осуществления 145 представляет собой способ согласно варианту осуществления 137 или 144, где повторяемая химическая единица представляет собой этиленгликоль.
Вариант осуществления 146 представляет собой способ по одному из вариантов осуществления 137, 144, или 145, где спейсер представляет собой имеющий происхождение из гексаэтиленгликоля.
Вариант осуществления 147 представляет собой способ по одному из вариантов осуществления 117-146, дополнительно содержащий инсертированный по меньшей мере один аналог нуклеотида.
Вариант осуществления 148 представляет собой способ по одному из вариантов осуществления 117-147, дополнительно содержащий инсертированный липидный компонент.
Вариант осуществления 149 представляет собой способ согласно варианту осуществления 148, где липидный компонент представляет собой холестерол.
Вариант осуществления 150 представляет собой способ согласно варианту осуществления 148 или 149, где липидный компонент находится на или возле 5'-конца олигонуклеотида.
Вариант осуществления 151 представляет собой способ по одному из вариантов осуществления 117-150, дополнительно содержащий модифицированные нуклеотиды, смежные с CpG мотивом.
Вариант осуществления 152 представляет собой способ вызывания иммунного ответа у субъекта, включающий:
введение субъекту, который в этом нуждается, иммуностимулирующей композиции, содержащей олигонуклеотид, имеющий по меньшей мере один CpG динуклеотидный мотив и обогащенную гуаниновыми нуклеотидами последовательность, начинающиеся на или в пределах четырех нуклеотидов от 5'-конца олигонуклеотида.
Вариант осуществления 153 представляет собой способ согласно варианту осуществления 152, где концентрация олигонуклеотида составляет меньше чем 20 нМ.
Вариант осуществления 154 представляет собой способ согласно варианту осуществления 152 или 153, где иммуностимулирующая композиция дополнительно содержит фармацевтически приемлемый наполнитель.
Вариант осуществления 155 представляет собой способ по одному из вариантов осуществления 152-154, где иммуностимулирующая композиция дополнительно содержит гаптен.
Вариант осуществления 156 представляет собой способ по одному из вариантов осуществления 152-155, где полумаксимальная концентрация (ЕС50) иммуностимулирующей композиции составляет меньше чем 100 пМ.
Вариант осуществления 157 представляет собой способ согласно варианту осуществления 152, где обогащенная гуаниновыми нуклеотидами последовательность содержит G-квартетную последовательность.
Вариант осуществления 158 представляет собой способ по одному из вариантов осуществления 152-156, где G-квартетная последовательность содержит TTAGGG, TTAGGGTTAGGG (SEQ ID NO: 261), TTTTGGGG, GGGGTTTT, GGGGTTTTGGGG (SEQ ID NO: 262), TTAGGG, TTAGGGTTAGGGTTTT (SEQ ID NO: 263), TGTGGGTGTGTGTGGG (SEQ ID NO: 268), GGAGG, TGGAGGC, TGGAGGCTGGAGGC (SEQ ID NO: 264), или TGGGGT (SEQ ID NO: 265).
Вариант осуществления 159 представляет собой способ по одному из вариантов осуществления 152-157, где олигонуклеотид содержит SEQ ID NO: 110, 111, 112, 113, 114, 115, 116, 117118, 119, 120, 124, 125, 126, 127, 129, 130, 131, 134, 136, 137 или 138.
Вариант осуществления 160 представляет собой способ согласно варианту осуществления 152, где обогащенная гуаниновыми нуклеотидами последовательность содержит последовательность G-проволоки.
Вариант осуществления 161 представляет собой способ согласно варианту осуществления 160, где последовательность G-проволоки содержит SEQ ID NO: 257 или 258.
Вариант осуществления 162 представляет собой способ согласно варианту осуществления 160, где олигонуклеотид содержит SEQ ID NO: 141, 142, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203, 252, или GCGT-Gпроволока3.
Вариант осуществления 163 представляет собой способ согласно варианту осуществления 152, где обогащенная гуаниновыми нуклеотидами последовательность содержит первое и второе множества гуаниновых нуклеотидов разделено по меньшей мере одним нуклеотидом.
Вариант осуществления 164 представляет собой способ согласно варианту осуществления 152, где олигонуклеотид дополнительно содержит линкер между обогащенной гуаниновыми нуклеотидами последовательностью и по меньшей мере один CpG мотивом.
Вариант осуществления 165 представляет собой способ согласно варианту осуществления 164, где линкер содержит по меньшей мере три нуклеотида.
Вариант осуществления 166 представляет собой способ согласно варианту осуществления 164, где линкер содержит гексаэтиленгликоль, триэтиленгликоль, пропандиол или их производные.
Вариант осуществления 167 представляет собой способ согласно вариантам осуществления 164-166, где олигонуклеотид содержит 2006-PDE5dG4-X1 или 2006-PDE5dG4-X3.
Вариант осуществления 168 представляет собой способ согласно варианту осуществления 152, где по меньшей мере один CpG мотив представляет собой множество CpG мотивов.
Вариант осуществления 169 представляет собой способ согласно варианту осуществления 168, где множество CpG мотивов содержит два, три, четыре или пять CpG мотивов.
Вариант осуществления 170 представляет собой способ согласно варианту осуществления 168 или 169, где каждый CpG мотив отделен от других CpG мотивов по меньшей мере одним нуклеотидом или аналогом нуклеотида.
Вариант осуществления 171 представляет собой способ согласно варианту осуществления 170, где по меньшей мере один аналог нуклеотида представляет собой один - четыре тиминовых нуклеотида.
Вариант осуществления 172 представляет собой способ согласно вариантам осуществления 170 или 171, где олигонуклеотид содержит SEQ ID NO: 217, 218, 219 или 220.
Вариант осуществления 173 представляет собой способ согласно варианту осуществления 168 или 169, где каждый из CpG мотивы отделен от других CpG мотивов спейсером.
Вариант осуществления 174 представляет собой способ согласно варианту осуществления 173, где спейсер представляет собой дезоксирибозофосфатный мостик.
Вариант осуществления 175 представляет собой способ согласно варианту осуществления 174, где дезоксирибозофосфатный мостик является безосновным.
Вариант осуществления 176 представляет собой способ согласно варианту осуществления 174 или 175, где олигонуклеотид содержит SEQ ID NO: 221.
Вариант осуществления 177 представляет собой способ согласно варианту осуществления 173, где спейсер содержит углеродную цепь.
Вариант осуществления 178 представляет собой способ согласно варианту осуществления 177, где углеродная цепь содержит два атома углерода.
Вариант осуществления 179 представляет собой способ согласно варианту осуществления 177 или 178, где углеродная цепь имеет происхождение из этандиола.
Вариант осуществления 180 представляет собой способ по одному из вариантов осуществления 177-179, где олигонуклеотид содержит ОДН-Х2, где Х2 представляет собой этандиол.
Вариант осуществления 181 представляет собой способ согласно варианту осуществления 177, где углеродная цепь содержит три атома углерода.
Вариант осуществления 182 представляет собой способ согласно варианту осуществления 177 или 181, где углеродная цепь имеет происхождение из 1,3-пропандиола.
Вариант осуществления 183 представляет собой способ по одному из вариантов осуществления 177, 181, или 182, где нуклеотид содержит CG-Gw2X2, Gw2X2-2, или ОДН-Х3, CG-Gw2X2-1, CG-Gw2X2-3, CG-Gw2X2-4, CG-Gw2X2-5, CG-G4T16X2-1, CG-G4T16X2-2, CG-G4T16X2-3, CG-G4T16X2-4, или CG-G4T16X2-5, где X2 представляет собой трехуглеродную цепь; 2006-PDE5dG4-Х2, где Х2 представляет собой трехуглеродную цепь, имеющую происхождение из пропандиола; или 2006-PDE5dG4-X4, где Х4 представляет собой трехуглеродную цепь, имеющую происхождение из пропандиола.
Вариант осуществления 184 представляет собой способ согласно варианту осуществления 177, где углеродная цепь содержит четыре атомов углерода.
Вариант осуществления 185 представляет собой способ согласно варианту осуществления 177 или 184, где углеродная цепь имеет происхождение из 1,4-бутандиола.
Вариант осуществления 186 представляет собой способ по одному из вариантов осуществления 177, 184, или 185 где олигонуклеотид содержит ОДН-Х4, где Х4 представляет собой четырехуглеродную цепь, имеющую происхождение из 1,4-бутандиола.
Вариант осуществления 187 представляет собой способ согласно варианту осуществления 173, где спейсер содержит повторяемую химическую единицу.
Вариант осуществления 188 представляет собой способ согласно варианту осуществления 187, где повторяемая химическая единица представляет собой этиленгликоль.
Вариант осуществления 189 представляет собой способ согласно вариантам осуществления 187 или 188, где олигонуклеотид содержит CCGC-Gw2X1 и где X1 представляет собой спейсер, имеющий происхождение из гексаэтиленгликоля.
Вариант осуществления 190 представляет собой способ по одному из вариантов осуществления 152-189, которая дополнительно содержит по меньшей мере один аналог нуклеотида.
Вариант осуществления 191 представляет собой способ согласно вариантам осуществления 152-190, дополнительно содержащий присоединенный липидный компонент в олигонуклеотиде.
Вариант осуществления 192 представляет собой способ согласно варианту осуществления 191, где липидный компонент представляет собой холестерол.
Вариант осуществления 193 представляет собой способ согласно варианту осуществления 191 или 192, где липидный компонент находится на или возле 5'-конца олигонуклеотида.
Вариант осуществления 194 представляет собой способ согласно варианту осуществления 152, где CpG мотив содержит элемент CpG последовательности, имеющий по меньшей мере четыре нуклеотида.
Вариант осуществления 195 представляет собой способ согласно варианту осуществления 194, включающий по меньшей мере два элемента CpG последовательности.
Вариант осуществления 196 представляет собой способ согласно варианту осуществления 194 или 195, включающий по меньшей мере три элемента CpG последовательности.
Вариант осуществления 197 представляет собой способ по одному из вариантов осуществления 194-196, где элементы CpG последовательности представляют собой GCGA, GCGG, ACGC, CCGC, GCGT, TCGC или любую их комбинацию.
Вариант осуществления 198 представляет собой способ согласно варианту осуществления 152, которая дополнительно содержит инсерцию тритиминового нуклеотидного участка в 3' концевую область олигонуклеотида.
Вариант осуществления 199 представляет собой способ согласно варианту осуществления 198, где олигонуклеотид содержит SEQ ID NO: 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214 или 215.
Вариант осуществления 200 представляет собой иммуностимулирующий олигонуклеотид, содержащий SEQ ID NO: 252.
Вариант осуществления 201 представляет собой олигонуклеотид согласно варианту осуществления 200, которая дополнительно содержит 5'-холестерильную модификация.
Вариант осуществления 202 представляет собой олигонуклеотид согласно варианту осуществления 201, где 5'-холестерильная модификация содержит триэтиленгликольный линкер.
При включении элементов согласно настоящему изобретению или его(их) предпочтительному(ым) варианту(ам) осуществления, термины, изложенный в единственном числе, и с предшествующим "указанный" охватывают в данном контексте один или несколько элементов. Термины "содержащий", "включающий" и "имеющий" являются включительными и обозначают, что могут быть дополнительные элементы, отличающиеся от перечисленных элементов.
С учетом вышеизложенного, можно увидеть, что некоторые объекты настоящего раскрытия достигаются и получают другие благоприятные результаты.
Поскольку в вышеуказанные продукты и способы могут быть внесены различные изменения без отклонения от сущности изобретения, то подразумевается, что весь объем, содержащийся в представленном выше описании, следует истолковывать как иллюстративный и без ограничения.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> БАЙЕР ЭНИМАЛ ХЕЛС ГМБХ
<120> ИММУНОСТИМУЛИРУЮЩИЕ ОЛИГОНУКЛЕОТИДЫ
<130> BHC 168028
<140>
<141>
<150> EP 17207750.5
<151> 2017-12-15
<150> EP 17207746.3
<151> 2017-12-15
<150> EP 17207740.6
<151> 2017-12-15
<160> 273
<170> PatentIn версия 3.5
<210> 1
<211> 1887
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 1
gatatcacgc gtcaattggg atctgcgatc gctgaattct ggggactttc cactggggac 60
tttccactgg ggactttcca ctggggactt tccactgggg actttccact cctgcagcag 120
tggatattcc cagaaaactt tttggatgca gttggggatt tcctctttac tggatgtgga 180
caatatcctc ctattattca caggaagcaa tccctcctat aaaagggcct cagcagaagt 240
agtgttcagc tgttcttggc tgacttcaca tcaaagcttc tatactgacc tgagacagag 300
ggtaccatgg tgctgggtcc atgcatgctg ctgctccttc tgctgctggg acttcgattg 360
cagctgtctc tgggcattat acccgttgag gaagagaatc cagacttttg gaacagagaa 420
gcagccgagg cgcttggagc agctaagaaa cttcaaccag ctcagactgc agccaagaac 480
ctgatcatct tcctgggcga tggcatgggt gtgtcaacgg ttactgccgc taggatcctg 540
aaaggccaga agaaagacaa actgggtccc gaaattcctc tcgccatgga caggttcccc 600
tacgttgctc tgagcaagac ctataatgtg gacaagcacg tcccagatag cggagccaca 660
gctaccgcct atctgtgtgg tgtgaagggc aattttcaga caatcggact ctccgctgcc 720
gctcggttca accagtgcaa cacgactagg ggcaatgagg tgatttccgt gatgaatcgc 780
gccaagaagg cggggaaaag cgtaggggtg gtcactacta ctcgggttca gcacgcttct 840
cccgccggca cctacgctca caccgtgaat cgaaactggt actccgacgc tgacgtgccg 900
gcatcagcac ggcaggaagg atgccaagac atcgccacac agctgatcag taacatggac 960
atagacgtaa ttctgggcgg tgggcggaag tacatgtttc ggatggggac tcctgatccc 1020
gagtatcccg acgactactc tcagggtggt acacgactcg acggcaagaa cctggtccag 1080
gaatggcttg ccaagcggca aggggcgaga tacgtctgga atcgcacaga actgatgcaa 1140
gcctccttgg atccttccgt gacccacttg atgggcttgt ttgagcctgg ggatatgaag 1200
tatgagatcc accgcgattc taccctggat ccttctctga tggagatgac cgaagcagcc 1260
ctcaggctgc tgagtcggaa tccaaggggc ttcttcttgt tcgttgaggg aggccgtatt 1320
gaccatgggc accatgagtc aagagcgtat agagccctca ccgaaaccat catgtttgac 1380
gatgccatag agagggcagg acagctgacg agtgaggagg atacactcag cctggtgacc 1440
gcagatcaca gccacgtctt tagcttcggc ggttatccgc ttcgtggaag ctccattttc 1500
ggactggcac cagggaaagc cagagatcgc aaagcttaca cagtcctcct ctatggaaac 1560
ggacccgggt atgtactgaa agatggcgct cgtccggacg tgaccgagag cgaatcagga 1620
agtcccgaat acaggcaaca gtccgcggtt ccccttgatg aagagactca cgccggggag 1680
gacgtggccg tgtttgcgag agggcctcag gcccatctcg tgcatggggt acaggagcag 1740
acattcattg cccatgtcat ggcttttgcc gcctgtctgg aaccatacac ggcatgtgat 1800
ctggctcctc ctgctggcac aaccgatgca gcacatccag gcagatctcg cagcaaacgc 1860
ttggactgac ttaaggctag cgatatc 1887
<210> 2
<211> 2941
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 2
cccggtacca tgatggaaac agctgagaaa gcctggccat ctaccaggat gtgtcctagt 60
cactgctgtc ccctctggct gctgctgctt gttaccgtga cgctgatgcc aatggtacac 120
ccttatggtt tccgcaactg catcgaggat gtcaaggctc ccttgtactt taggtgtatc 180
cagagattcc tgcagagccc agccctcgcg gtgagtgatc ttcctcccca tgccattgcc 240
ttgaacttga gttacaacaa gatgcggtgt ctccagccat cagccttcgc ccacctgacg 300
cagttgcata cgctggacct gacttacaat ctgctcgaaa ccctgagccc tggggccttc 360
aatggcttgg gcgtcctcgt ggtgctcgac ctgtctcaca ataagctgac tactcttgca 420
gaaggggtgt ttaacagtct gggtaatctg tcctccctgc aagtgcagca taaccctctg 480
agcacagtct caccatcagc acttttgcca ctggtcaatc tccgcaggct gagcctgcgg 540
ggaggacggc tgaatggact gggcgctgtt gccgtggcgg ttcagggact tgcacagctt 600
gagctgctgg atctgtgtga aaataatttg acaacactgg gacccggtcc gcctctgccc 660
gctagcctgc tcaccctgca gctgtgcaac aactcactga gggagctggc cggaggaagc 720
cctgaaatgc tgtggcatgt gaagatcctg gatttgtcat acaacagcat ctctcaggct 780
gaagtgttta ctcagctcca cctccgcaat atctcccttc tgcacttgat tggaaatccc 840
ctggatgtgt tccatttgct ggacatatcc gatatacaac ctaggtcact ggacttctca 900
ggtctggttc ttggtgccca agggctggac aaggtgtgtc tgcgtctgca agggccccag 960
gctcttcgcc gtctgcaact tcagagaaac gggctcaaag tcctgcactg caacgccctg 1020
cagctttgcc ccgtgctgcg agagctggat ctgtcttgga accgcctgca gcacgtcggc 1080
tgtgcaggcc gactcctcgg gaagaaacag cgggagaaac tggaagttct gaccgtggaa 1140
cacaatcttc tgaagaaact ccccagttgc ttgggtgccc aagtgctccc tagactgtat 1200
aacgtcagct tccggttcaa tcgaatcctg actgtgggtc cacaggcctt cgcctatgca 1260
cccgcgctcc aggtcctttg gctgaacatt aactcccttg tctggttgga tcgtcaggct 1320
ctttggcgcc tccataatct gaccgagctg agacttgata acaatctgtt gacagatctg 1380
taccacaact ctttcattga ccttcacaga ctgcggaccc tgaatctccg gaacaaccgc 1440
gtgagcgttc tgttttccgg ggttttccag ggcttggccg agctgcagac cctggacctg 1500
ggcggcaaca atctgcgaca cctcacagct cagagtctgc agggcctccc aaagctgagg 1560
aggctgtacc tcgaccggaa tagacttctg gaggtgtcct caactgtatt tgctcccgtt 1620
caagccaccc tcggggtgct ggacctgaga gccaacaatc tgcagtatat ctcccagtgg 1680
cttaggaaac cgccgccatt tagaaacttg agcagcctgt atgacctgaa actgcaggcc 1740
cagcagccgt atgggctgaa gatgctgcct cactacttct ttcagggcct ggttagactg 1800
caacagctct cccttagcca aaacatgctg aggtctatcc caccggacgt gtttgaagat 1860
ctcggacagc tccgtagcct ggctctggct gacagtagca atgggctgca tgatttgccc 1920
gacggcattt tccggaacct cgggaacctg aggtttctcg atcttgagaa tgcggggttg 1980
cactctctca ccctggaggt ctttggaaac ctctcccgcc tgcaagtcct gcatctggca 2040
aggaacgaac tcaaaacctt caatgactct gtggcaagcc ggctgagcag ccttcgctat 2100
ctggacctcc ggaagtgtcc tctgtcttgc acttgcgata atatgtggct gcaggggtgg 2160
ttgaataatt ctcgggtaca ggtagtgtac ccctacaact acacatgcgg atctcaacac 2220
aacgcataca tacacagctt tgacacacat gtctgctttc tggatctggg cttgtacttg 2280
ttcgcaggca ccgctcctgc tgtactgctc ctcctcgtcg tacccgtagt atatcatcgc 2340
gcatactggc ggttgaagta ccactggtat cttctgagat gttgggtgaa tcagcgctgg 2400
agaagggagg aaaagtgcta tctgtatgac tcatttgtct cttacaacag tgcggatgag 2460
tcctgggttt tgcaaaagct cgtcccagag ctcgagcatg gggccttcag attgtgtctc 2520
catcacaggg acttccagcc aggaaggagt attatcgaca atatcgtgga tgcggtttat 2580
aacagtcgta aaacggtgtg cgttgtgtca agatcctacc ttagatccga gtggtgcagc 2640
ctcgaggtgc agctggcatc ctatcgactt ctggatgagc gccgagacat tttggtgctg 2700
gtgctgctgg aggatgtggg tgacgccgag ctgagcgcat atcatcgcat gaggagagtg 2760
ctgctgaggc gcacatacct ccggtggcct ctggatccag ccgctcaacc cctgttttgg 2820
gctagattga aacgagccct tcgatggggc gagggcggag aagaggagga agaagaaggt 2880
ctgggaggcg gcactggccg gcctcgtgaa ggcgacaagc agatgtagcg gccgcgatat 2940
c 2941
<210> 3
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<220>
<221> прочий_признак
<222> (1)..(24)
<223> /примечание="Фосфоротиоатная связь между нуклеотидами"
<400> 3
tcgtcgtttt gtcgttttgt cgtt 24
<210> 4
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 4
tcgtcgtttt gtcgttttgt cgtt 24
<210> 5
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 5
tcgtcgtttt gtcgttttgt cgttg 25
<210> 6
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 6
tcgtcgtttt gtcgttttgt cgttgg 26
<210> 7
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 7
tcgtcgtttt gtcgttttgt cgttggg 27
<210> 8
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 8
tcgtcgtttt gtcgttttgt cgttgggg 28
<210> 9
<211> 29
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 9
tcgtcgtttt gtcgttttgt cgttggggg 29
<210> 10
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 10
tcgtcgtttt gtcgttttgt cgttgggggg 30
<210> 11
<211> 31
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 11
tcgtcgtttt gtcgttttgt cgttgggggg g 31
<210> 12
<211> 32
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 12
tcgtcgtttt gtcgttttgt cgttgggggg gg 32
<210> 13
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 13
tcgtcgtttt gtcgttttgt cgtt 24
<210> 14
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 14
gtcgtcgttt tgtcgttttg tcgtt 25
<210> 15
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 15
ggtcgtcgtt ttgtcgtttt gtcgtt 26
<210> 16
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 16
gggtcgtcgt tttgtcgttt tgtcgtt 27
<210> 17
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 17
ggggtcgtcg ttttgtcgtt ttgtcgtt 28
<210> 18
<211> 29
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 18
gggggtcgtc gttttgtcgt tttgtcgtt 29
<210> 19
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 19
ggggggtcgt cgttttgtcg ttttgtcgtt 30
<210> 20
<211> 31
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 20
gggggggtcg tcgttttgtc gttttgtcgt t 31
<210> 21
<211> 32
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 21
ggggggggtc gtcgttttgt cgttttgtcg tt 32
<210> 22
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 22
aaaaaatcgt cgttttgtcg ttttgtcgtt 30
<210> 23
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 23
cccccctcgt cgttttgtcg ttttgtcgtt 30
<210> 24
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 24
tttttttcgt cgttttgtcg ttttgtcgtt 30
<210> 25
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<220>
<221> модифицированное_основание
<222> (8)..(8)
<223> 5-метил-цитидин
<220>
<221> модифицированное_основание
<222> (11)..(11)
<223> 5-метил-цитидин
<220>
<221> модифицированное_основание
<222> (19)..(19)
<223> 5-метил-цитидин
<220>
<221> модифицированное_основание
<222> (27)..(27)
<223> 5-метил-цитидин
<400> 25
ggggggtcgt cgttttgtcg ttttgtcgtt 30
<210> 26
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 26
ggggggtgct gcttttgtgc ttttgtgctt 30
<210> 27
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 27
ggggggtcat cattttgtca ttttgtcatt 30
<210> 28
<211> 29
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<220>
<221> прочий_признак
<222> (1)..(29)
<223> /примечание="Фосфоротиоатная связь между нуклеотидами"
<400> 28
tcgtcgtttt gtcgttttgt cgttggggg 29
<210> 29
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<220>
<221> прочий_признак
<222> (1)..(30)
<223> /примечание="Фосфоротиоатная связь между нуклеотидами"
<400> 29
ggggggtcgt cgttttgtcg ttttgtcgtt 30
<210> 30
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 30
agggggtcgt cgttttgtcg ttttgtcgtt 30
<210> 31
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 31
gaggggtcgt cgttttgtcg ttttgtcgtt 30
<210> 32
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 32
ggagggtcgt cgttttgtcg ttttgtcgtt 30
<210> 33
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 33
gggaggtcgt cgttttgtcg ttttgtcgtt 30
<210> 34
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 34
ggggagtcgt cgttttgtcg ttttgtcgtt 30
<210> 35
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 35
gggggatcgt cgttttgtcg ttttgtcgtt 30
<210> 36
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 36
aaggggtcgt cgttttgtcg ttttgtcgtt 30
<210> 37
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 37
gaagggtcgt cgttttgtcg ttttgtcgtt 30
<210> 38
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 38
ggaaggtcgt cgttttgtcg ttttgtcgtt 30
<210> 39
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 39
gggaagtcgt cgttttgtcg ttttgtcgtt 30
<210> 40
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 40
ggggaatcgt cgttttgtcg ttttgtcgtt 30
<210> 41
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 41
cgggggtcgt cgttttgtcg ttttgtcgtt 30
<210> 42
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 42
gcggggtcgt cgttttgtcg ttttgtcgtt 30
<210> 43
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 43
ggcgggtcgt cgttttgtcg ttttgtcgtt 30
<210> 44
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 44
gggcggtcgt cgttttgtcg ttttgtcgtt 30
<210> 45
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 45
ggggcgtcgt cgttttgtcg ttttgtcgtt 30
<210> 46
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 46
gggggctcgt cgttttgtcg ttttgtcgtt 30
<210> 47
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 47
ccggggtcgt cgttttgtcg ttttgtcgtt 30
<210> 48
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 48
gccgggtcgt cgttttgtcg ttttgtcgtt 30
<210> 49
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 49
ggccggtcgt cgttttgtcg ttttgtcgtt 30
<210> 50
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 50
gggccgtcgt cgttttgtcg ttttgtcgtt 30
<210> 51
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 51
ggggcctcgt cgttttgtcg ttttgtcgtt 30
<210> 52
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 52
tgggggtcgt cgttttgtcg ttttgtcgtt 30
<210> 53
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 53
gtggggtcgt cgttttgtcg ttttgtcgtt 30
<210> 54
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 54
ggtgggtcgt cgttttgtcg ttttgtcgtt 30
<210> 55
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 55
gggtggtcgt cgttttgtcg ttttgtcgtt 30
<210> 56
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 56
ggggtgtcgt cgttttgtcg ttttgtcgtt 30
<210> 57
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 57
gggggttcgt cgttttgtcg ttttgtcgtt 30
<210> 58
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 58
ttggggtcgt cgttttgtcg ttttgtcgtt 30
<210> 59
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 59
gttgggtcgt cgttttgtcg ttttgtcgtt 30
<210> 60
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 60
ggttggtcgt cgttttgtcg ttttgtcgtt 30
<210> 61
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 61
gggttgtcgt cgttttgtcg ttttgtcgtt 30
<210> 62
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 62
ggggtttcgt cgttttgtcg ttttgtcgtt 30
<210> 63
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 63
agggtcgtcg ttttgtcgtt ttgtcgtt 28
<210> 64
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 64
gaggtcgtcg ttttgtcgtt ttgtcgtt 28
<210> 65
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 65
ggagtcgtcg ttttgtcgtt ttgtcgtt 28
<210> 66
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 66
gggatcgtcg ttttgtcgtt ttgtcgtt 28
<210> 67
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 67
cgggtcgtcg ttttgtcgtt ttgtcgtt 28
<210> 68
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 68
gcggtcgtcg ttttgtcgtt ttgtcgtt 28
<210> 69
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 69
ggcgtcgtcg ttttgtcgtt ttgtcgtt 28
<210> 70
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 70
gggctcgtcg ttttgtcgtt ttgtcgtt 28
<210> 71
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 71
tgggtcgtcg ttttgtcgtt ttgtcgtt 28
<210> 72
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 72
gtggtcgtcg ttttgtcgtt ttgtcgtt 28
<210> 73
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 73
ggtgtcgtcg ttttgtcgtt ttgtcgtt 28
<210> 74
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 74
gggttcgtcg ttttgtcgtt ttgtcgtt 28
<210> 75
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 75
tccatgacgt tcctgatgct 20
<210> 76
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 76
tccatgacgt tcctgatgct ggggg 25
<210> 77
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 77
ggggtccatg acgttcctga tgct 24
<210> 78
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 78
ggggggtcca tgacgttcct gatgct 26
<210> 79
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 79
tccatgacgt tcctgacgtt 20
<210> 80
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 80
tccatgacgt tcctgacgtt ggggg 25
<210> 81
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 81
ggggtccatg acgttcctga cgtt 24
<210> 82
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 82
ggggggtcca tgacgttcct gacgtt 26
<210> 83
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 83
tcgacgttcg tcgttcgtcg ttc 23
<210> 84
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 84
tcgacgttcg tcgttcgtcg ttcggggg 28
<210> 85
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 85
ggggtcgacg ttcgtcgttc gtcgttc 27
<210> 86
<211> 29
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 86
ggggggtcga cgttcgtcgt tcgtcgttc 29
<210> 87
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 87
tcgcgacgtt cgcccgacgt tcggta 26
<210> 88
<211> 31
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 88
tcgcgacgtt cgcccgacgt tcggtagggg g 31
<210> 89
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 89
ggggtcgcga cgttcgcccg acgttcggta 30
<210> 90
<211> 32
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 90
ggggggtcgc gacgttcgcc cgacgttcgg ta 32
<210> 91
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 91
tcgtcgtttt cggcgcgcgc cg 22
<210> 92
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 92
ggggtcgtcg ttttcggcgc gcgccg 26
<210> 93
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 93
ggggggtcgt cgttttcggc gcgcgccg 28
<210> 94
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 94
tcgtcgtcgt tcgaacgacg ttgat 25
<210> 95
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 95
tcgtcgtcgt tcgaacgacg ttgatggggg 30
<210> 96
<211> 29
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 96
ggggtcgtcg tcgttcgaac gacgttgat 29
<210> 97
<211> 31
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 97
ggggggtcgt cgtcgttcga acgacgttga t 31
<210> 98
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 98
tcgtcgttgt cgttttgtcg tt 22
<210> 99
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 99
tcgtcgttgt cgttttgtcg ttggggg 27
<210> 100
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 100
ggggggtcgt cgttgtcgtt ttgtcgtt 28
<210> 101
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 101
gatctcgctc gctcgctat 19
<210> 102
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 102
gggggggatc tcgctcgctc gctat 25
<210> 103
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 103
tcgtcgacgt cgttcgttct c 21
<210> 104
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 104
ggggggtcgt cgacgtcgtt cgttctc 27
<210> 105
<211> 29
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 105
tccatgacgt tcctgcagtt cctgacgtt 29
<210> 106
<211> 35
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 106
ggggggtcca tgacgttcct gcagttcctg acgtt 35
<210> 107
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 107
tccacgacgt tttcgacgtt 20
<210> 108
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 108
ggggggtcca cgacgttttc gacgtt 26
<210> 109
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 109
tttttcgtcg ttttgtcgtt ttgtcgtt 28
<210> 110
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 110
ttagggtcgt cgttttgtcg ttttgtcgtt 30
<210> 111
<211> 36
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 111
ttagggttag ggtcgtcgtt ttgtcgtttt gtcgtt 36
<210> 112
<211> 32
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 112
ttttggggtc gtcgttttgt cgttttgtcg tt 32
<210> 113
<211> 32
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 113
ggggtttttc gtcgttttgt cgttttgtcg tt 32
<210> 114
<211> 36
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 114
ggggttttgg ggtcgtcgtt ttgtcgtttt gtcgtt 36
<210> 115
<211> 34
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 115
ttagggtttt tcgtcgtttt gtcgttttgt cgtt 34
<210> 116
<211> 40
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 116
ttagggttag ggtttttcgt cgttttgtcg ttttgtcgtt 40
<210> 117
<211> 44
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 117
tgtgggtgtg tgtgggtttt tcgtcgtttt gtcgttttgt cgtt 44
<210> 118
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 118
ggaggttttt cgtcgttttg tcgttttgtc gtt 33
<210> 119
<211> 35
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 119
tggaggcttt ttcgtcgttt tgtcgttttg tcgtt 35
<210> 120
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 120
tggaggctgg aggctttttc gtcgttttgt cgttttgtcg tt 42
<210> 121
<211> 46
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 121
gctgcgaggc gggtgggtgg gatcgtcgtt ttgtcgtttt gtcgtt 46
<210> 122
<211> 45
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 122
gctgcgggcg ggtgggtggg atcgtcgttt tgtcgttttg tcgtt 45
<210> 123
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 123
cgaggcgggt gggtgggatc gtcgttttgt cgttttgtcg tt 42
<210> 124
<211> 41
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 124
cgggcgggtg ggtgggatcg tcgttttgtc gttttgtcgt t 41
<210> 125
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 125
gggcgtggtg ggtggggttc gtcgttttgt cgttttgtcg tt 42
<210> 126
<211> 40
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 126
ggggtgggag gagggttcgt cgttttgtcg ttttgtcgtt 40
<210> 127
<211> 44
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 127
ggggtcgggc gggccgggtg tcgtcgtttt gtcgttttgt cgtt 44
<210> 128
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 128
ggtggtgggg ggggttggta gggttcgtcg ttttgtcgtt ttgtcgtt 48
<210> 129
<211> 44
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 129
gggttagggt tagggtaggg tcgtcgtttt gtcgttttgt cgtt 44
<210> 130
<211> 41
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 130
tgggggggtg ggtgggttcg tcgttttgtc gttttgtcgt t 41
<210> 131
<211> 40
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 131
gggcgggcgg gcgggctcgt cgttttgtcg ttttgtcgtt 40
<210> 132
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 132
ggttggtgtg gttggtcgtc gttttgtcgt tttgtcgtt 39
<210> 133
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 133
ggtggatggc gcagtcggtc gtcgttttgt cgttttgtcg tt 42
<210> 134
<211> 44
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 134
tgggggtgga cgggccgggt tcgtcgtttt gtcgttttgt cgtt 44
<210> 135
<211> 46
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 135
tgtgggggtg gacgggccgg gttcgtcgtt ttgtcgtttt gtcgtt 46
<210> 136
<211> 45
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 136
gggttagggt tagggttagg gtcgtcgttt tgtcgttttg tcgtt 45
<210> 137
<211> 47
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 137
gggcgcggga ggaagggggc gggtcgtcgt tttgtcgttt tgtcgtt 47
<210> 138
<211> 43
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 138
agggtgggga gggtggggat cgtcgttttg tcgttttgtc gtt 43
<210> 139
<211> 46
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 139
agggagggcg ctgggaggag ggtcgtcgtt ttgtcgtttt gtcgtt 46
<210> 140
<211> 44
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 140
ggggcgggcc gggggcgggg tcgtcgtttt gtcgttttgt cgtt 44
<210> 141
<211> 34
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 141
ggggttgggg tcgtcgtttt gtcgttttgt cgtt 34
<210> 142
<211> 38
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<220>
<223> /примечание="Может быть модифицирован 3’-холестерилом"
<400> 142
ggggttgggg tttttcgtcg ttttgtcgtt ttgtcgtt 38
<210> 143
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 143
tggggttcgt cgttttgtcg ttttgtcgtt 30
<210> 144
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 144
tttttttacg attt 14
<210> 145
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 145
tttttttgcg attt 14
<210> 146
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 146
tttttttccg attt 14
<210> 147
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 147
ttttttttcg attt 14
<210> 148
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 148
tttttttacg gttt 14
<210> 149
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 149
tttttttgcg gttt 14
<210> 150
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 150
tttttttccg gttt 14
<210> 151
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 151
ttttttttcg gttt 14
<210> 152
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 152
tttttttacg cttt 14
<210> 153
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 153
tttttttgcg cttt 14
<210> 154
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 154
tttttttccg cttt 14
<210> 155
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 155
ttttttttcg cttt 14
<210> 156
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 156
tttttttacg tttt 14
<210> 157
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 157
tttttttgcg tttt 14
<210> 158
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 158
tttttttccg tttt 14
<210> 159
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 159
ttttttttcg tttt 14
<210> 160
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 160
ggggggtttt tttacgattt 20
<210> 161
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 161
ggggggtttt tttgcgattt 20
<210> 162
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 162
ggggggtttt tttccgattt 20
<210> 163
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 163
ggggggtttt ttttcgattt 20
<210> 164
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 164
ggggggtttt tttacggttt 20
<210> 165
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 165
ggggggtttt tttgcggttt 20
<210> 166
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 166
ggggggtttt tttccggttt 20
<210> 167
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 167
ggggggtttt ttttcggttt 20
<210> 168
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 168
ggggggtttt tttacgcttt 20
<210> 169
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 169
ggggggtttt tttgcgcttt 20
<210> 170
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 170
ggggggtttt tttccgcttt 20
<210> 171
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 171
ggggggtttt ttttcgcttt 20
<210> 172
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 172
ggggggtttt tttacgtttt 20
<210> 173
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 173
ggggggtttt tttgcgtttt 20
<210> 174
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 174
ggggggtttt tttccgtttt 20
<210> 175
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 175
ggggggtttt ttttcgtttt 20
<210> 176
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 176
ggggttgggg tttttttttt tacgattt 28
<210> 177
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 177
ggggttgggg tttttttttt tgcgattt 28
<210> 178
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 178
ggggttgggg tttttttttt tccgattt 28
<210> 179
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 179
ggggttgggg tttttttttt ttcgattt 28
<210> 180
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 180
ggggttgggg tttttttttt tacggttt 28
<210> 181
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 181
ggggttgggg tttttttttt tgcggttt 28
<210> 182
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 182
ggggttgggg tttttttttt tccggttt 28
<210> 183
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 183
ggggttgggg tttttttttt ttcggttt 28
<210> 184
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 184
ggggttgggg tttttttttt tacgcttt 28
<210> 185
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 185
ggggttgggg tttttttttt tgcgcttt 28
<210> 186
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 186
ggggttgggg tttttttttt tccgcttt 28
<210> 187
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 187
ggggttgggg tttttttttt ttcgcttt 28
<210> 188
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 188
ggggttgggg tttttttttt tacgtttt 28
<210> 189
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 189
ggggttgggg tttttttttt tgcgtttt 28
<210> 190
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 190
ggggttgggg tttttttttt tccgtttt 28
<210> 191
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 191
ggggttgggg tttttttttt ttcgtttt 28
<210> 192
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 192
ggggttgggg tttttttttt tggctttt 28
<210> 193
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 193
ggggttgggg tttttttttt tgtgtttt 28
<210> 194
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 194
ggggttgggg tttttttttt tgcatttt 28
<210> 195
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 195
ggggttgggg tttttttttt gcgtttt 27
<210> 196
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 196
ggggttgggg tttttttttg cgtttt 26
<210> 197
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 197
ggggttgggg ttttttttgc gtttt 25
<210> 198
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 198
ggggttgggg tttttttgcg tttt 24
<210> 199
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 199
ggggttgggg ttttttgcgt ttt 23
<210> 200
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 200
ggggttgggg tttttgcgtt tt 22
<210> 201
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 201
ggggttgggg tttttttttt tgcgttt 27
<210> 202
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 202
ggggttgggg tttttttttt tgcgtt 26
<210> 203
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 203
ggggttgggg tttttttttt tgcgt 25
<210> 204
<211> 35
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 204
ggggttgggg tttttttttt tgcgttttgc gtttt 35
<210> 205
<211> 43
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 205
ggggttgggg tttttttttt tgcgttttgc gtttttgcgt ttt 43
<210> 206
<211> 35
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 206
ggggttgggg tttttttttt tgcgatttgc gattt 35
<210> 207
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 207
ggggttgggg tttttttttt tgcgatttgc gatttgcgat tt 42
<210> 208
<211> 35
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 208
ggggttgggg tttttttttt tacgctttac gcttt 35
<210> 209
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 209
ggggttgggg tttttttttt tacgctttac gctttacgct tt 42
<210> 210
<211> 35
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 210
ggggttgggg tttttttttt ttcgcttttc gcttt 35
<210> 211
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 211
ggggttgggg tttttttttt ttcgcttttc gcttttcgct tt 42
<210> 212
<211> 35
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 212
ggggttgggg tttttttttt tccgctttcc gcttt 35
<210> 213
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 213
ggggttgggg tttttttttt tccgctttcc gctttccgct tt 42
<210> 214
<211> 35
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 214
ggggttgggg tttttttttt tgcggtttgc ggttt 35
<210> 215
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 215
ggggttgggg tttttttttt tgcggtttgc ggtttgcggt tt 42
<210> 216
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 216
ggggttgggg ttttttttcg cgcgttt 27
<210> 217
<211> 29
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 217
ggggttgggg ttttttttcg tcgtcgttt 29
<210> 218
<211> 31
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 218
ggggttgggg ttttttttcg ttcgttcgtt t 31
<210> 219
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 219
ggggttgggg ttttttttcg tttcgtttcg ttt 33
<210> 220
<211> 35
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 220
ggggttgggg ttttttttcg ttttcgtttt cgttt 35
<210> 221
<211> 29
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<220>
<221> модифицированное_основание
<222> (21)..(21)
<223> Безосновный сайт
<220>
<221> модифицированное_основание
<222> (24)..(24)
<223> Безосновный сайт
<400> 221
ggggttgggg ttttttttcg ncgncgttt 29
<210> 222
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 222
ggggttgggg ttttttttcg 20
<210> 223
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 223
ggggttgggg ttttttttcg 20
<210> 224
<211> 34
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 224
ggggttgggg ttggggtttt tttttttgcg tttt 34
<210> 225
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 225
ggggttgggg ttttttttcg 20
<210> 226
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 226
ggggttgggg ttttttttcg 20
<210> 227
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 227
ggggttgggg ttttttttcg 20
<210> 228
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 228
ggggttgggg ttttttttcg 20
<210> 229
<211> 15
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 229
tggggttttt tttcg 15
<210> 230
<211> 15
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 230
tggggttttt tttcg 15
<210> 231
<211> 15
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 231
tggggttttt tttcg 15
<210> 232
<211> 15
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 232
tggggttttt tttcg 15
<210> 233
<211> 15
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 233
tggggttttt tttcg 15
<210> 234
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 234
ggggttgggg ttttttttcg 20
<210> 235
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 235
ggggttgggg ttttttttcg 20
<210> 236
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 236
ggggttgggg ttttttttcg 20
<210> 237
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 237
ggggttgggg ttttttttcg 20
<210> 238
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 238
ggggttgggg ttttttttcg 20
<210> 239
<211> 29
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<220>
<221> модифицированное_основание
<222> (21)..(21)
<223> Безосновный сайт
<220>
<221> модифицированное_основание
<222> (24)..(24)
<223> Безосновный сайт
<400> 239
ggggttgggg ttttttttcg ncgncgttt 29
<210> 240
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 240
ggggttgggg ttttttttcg 20
<210> 241
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 241
ggggttgggg ttttttttac gc 22
<210> 242
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 242
ggggttgggg ttttttttcc gc 22
<210> 243
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 243
ggggttgggg ttttttttac gc 22
<210> 244
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 244
ggggttgggg ttttttttcc gc 22
<210> 245
<211> 17
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 245
tggggttttt tttacgc 17
<210> 246
<211> 17
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 246
tggggttttt tttccgc 17
<210> 247
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 247
tcgtcgtttt gtcgttttgt cgtt 24
<210> 248
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 248
tcgtcgtttt gtcgttttgt cgtt 24
<210> 249
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 249
ggggtcgtcg ttttgtcgtt ttgtcgtt 28
<210> 250
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 250
ggggtcgtcg ttttgtcgtt ttgtcgtt 28
<210> 251
<211> 34
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<220>
<223> /примечание="Может быть модифицирован 3’-холестерилом"
<400> 251
tggggttttt tcgtcgtttt gtcgttttgt cgtt 34
<210> 252
<211> 36
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<220>
<223> /примечание="Может быть модифицирован 5’-холестерилом"
<400> 252
tggggttttt tttgcgtttt tgcgtttttg cgtttt 36
<210> 253
<211> 41
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<220>
<223> /примечание="Может быть модифицирован 5’-холестерилом"
<400> 253
ggggttgggg ttttttttgc gtttttgcgt ttttgcgttt t 41
<210> 254
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<220>
<223> /примечание="Может быть модифицирован 5’-холестерилом"
<400> 254
tttttttgcg tttttgcgtt tttgcgtttt 30
<210> 255
<211> 41
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<220>
<223> /примечание="Может быть модифицирован 5’-холестерилом"
<400> 255
ggggttgggg ttttttttcc gcttttccgc ttttccgctt t 41
<210> 256
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<220>
<223> /примечание="Может быть модифицирован 5’-холестерилом"
<400> 256
tttttttccg cttttccgct tttccgcttt 30
<210> 257
<211> 10
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 257
ggggttgggg 10
<210> 258
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 258
ggggttgggg tttt 14
<210> 259
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<220>
<221> модифицированное_основание
<222> (8)..(8)
<223> a, c, t, g, неизвестное или другое
<220>
<221> модифицированное_основание
<222> (11)..(11)
<223> a, c, t, g, неизвестное или другое
<400> 259
tttttttncg nttt 14
<210> 260
<211> 10
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 260
ttttttttcg 10
<210> 261
<211> 12
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 261
ttagggttag gg 12
<210> 262
<211> 12
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 262
ggggttttgg gg 12
<210> 263
<211> 16
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 263
ttagggttag ggtttt 16
<210> 264
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 264
tggaggctgg aggc 14
<210> 265
<211> 6
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 265
tggggt 6
<210> 266
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 266
ggggggttgt tgttttgttg ttttgttgtt 30
<210> 267
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 267
ggggggttat tattttgtta ttttgttatt 30
<210> 268
<211> 16
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 268
tgtgggtgtg tgtggg 16
<210> 269
<211> 18
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 269
ggggttgggg ttggggtt 18
<210> 270
<211> 12
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 270
ggggttgggg tt 12
<210> 271
<211> 10
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 271
ttttttttcg 10
<210> 272
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<220>
<221> модифицированное_основание
<222> (1)..(6)
<223> a, c, t или g
<220>
<221> источник
<223> /примечание="См. описание, как подано, для подробного описания
замен и предпочтительных вариантов осуществления"
<400> 272
nnnnnntcgt cgttttgtcg ttttgtcgtt 30
<210> 273
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<220>
<221> модифицированное_основание
<222> (1)..(4)
<223> a, c, t или g
<400> 273
nnnntcgtcg ttttgtcgtt ttgtcgtt 28
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ИММУНОСТИМУЛИРУЮЩИЕ КОМПОЗИЦИИ | 2018 |
|
RU2799523C1 |
| ОБЪЕДИНЕННАЯ ОЧИСТКА И ИЗМЕРЕНИЕ МЕТИЛИРОВАНИЯ ДНК С СОВМЕСТНЫМ ИЗМЕРЕНИЕМ МУТАЦИЙ И/ИЛИ УРОВНЕЙ ЭКСПРЕССИИ мРНК В АВТОМАТИЧЕСКОМ РЕАКЦИОННОМ КАРТРИДЖЕ | 2017 |
|
RU2780660C2 |
| ПОЛНОГЕНОМНЫЕ БИБЛИОТЕКИ ОТДЕЛЬНЫХ КЛЕТОК ДЛЯ БИСУЛЬФИТНОГО СЕКВЕНИРОВАНИЯ | 2018 |
|
RU2770879C2 |
| ДОСТАВКА, ПРИМЕНЕНИЕ И ПРИМЕНЕНИЯ В ТЕРАПИИ СИСТЕМ CRISPR-CAS И КОМПОЗИЦИЙ ДЛЯ ЦЕЛЕНАПРАВЛЕННОГО ВОЗДЕЙСТВИЯ НА НАРУШЕНИЯ И ЗАБОЛЕВАНИЯ С ИСПОЛЬЗОВАНИЕМ ВИРУСНЫХ КОМПОНЕНТОВ | 2014 |
|
RU2716421C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ СНИЖЕНИЯ ЭКСПРЕССИИ TAU | 2016 |
|
RU2747734C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ СНИЖЕНИЯ ЭКСПРЕССИИ TAU | 2016 |
|
RU2777570C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ ГЕМОГЛОБИНОПАТИЙ | 2016 |
|
RU2812491C2 |
| СПОСОБЫ ТЕРАПИИ НА ОСНОВЕ CAR Т-КЛЕТОК С ПОВЫШЕННОЙ ЭФФЕКТИВНОСТЬЮ | 2016 |
|
RU2788131C2 |
| СТРУКТУРЫ МИРНК С ВЫСОКОЙ АКТИВНОСТЬЮ И СНИЖЕННЫМ ВОЗДЕЙСТВИЕМ ВНЕ МИШЕНИ | 2016 |
|
RU2788030C2 |
| МОДИФИЦИРОВАННЫЕ ОЛИГОНУКЛЕОТИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2802836C2 |
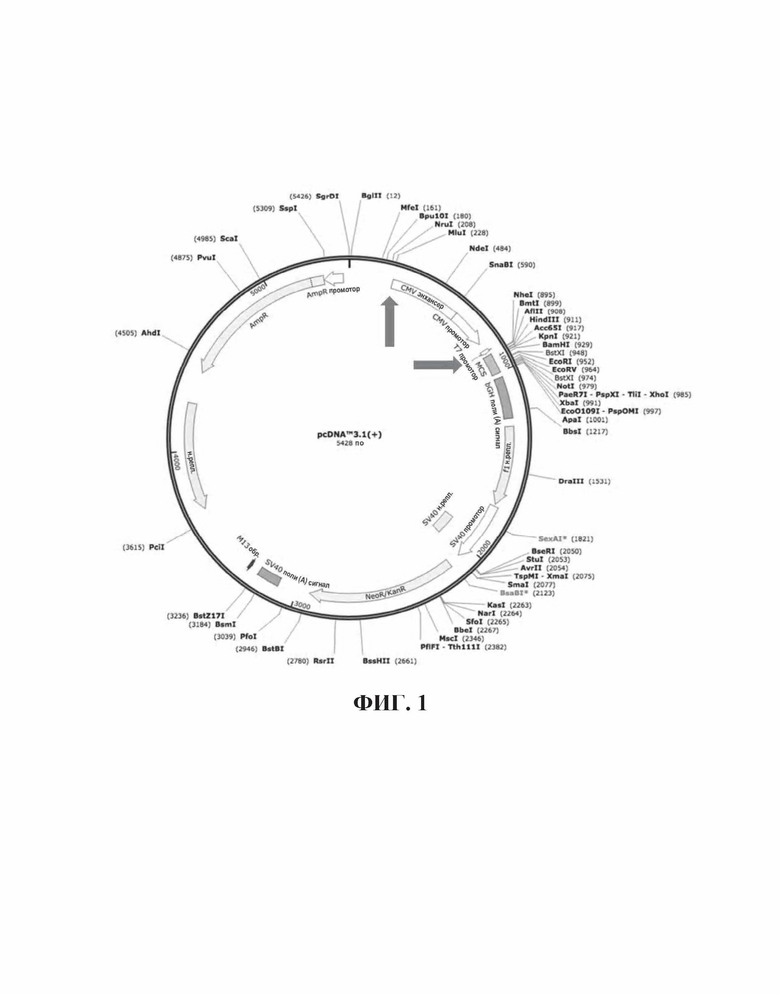
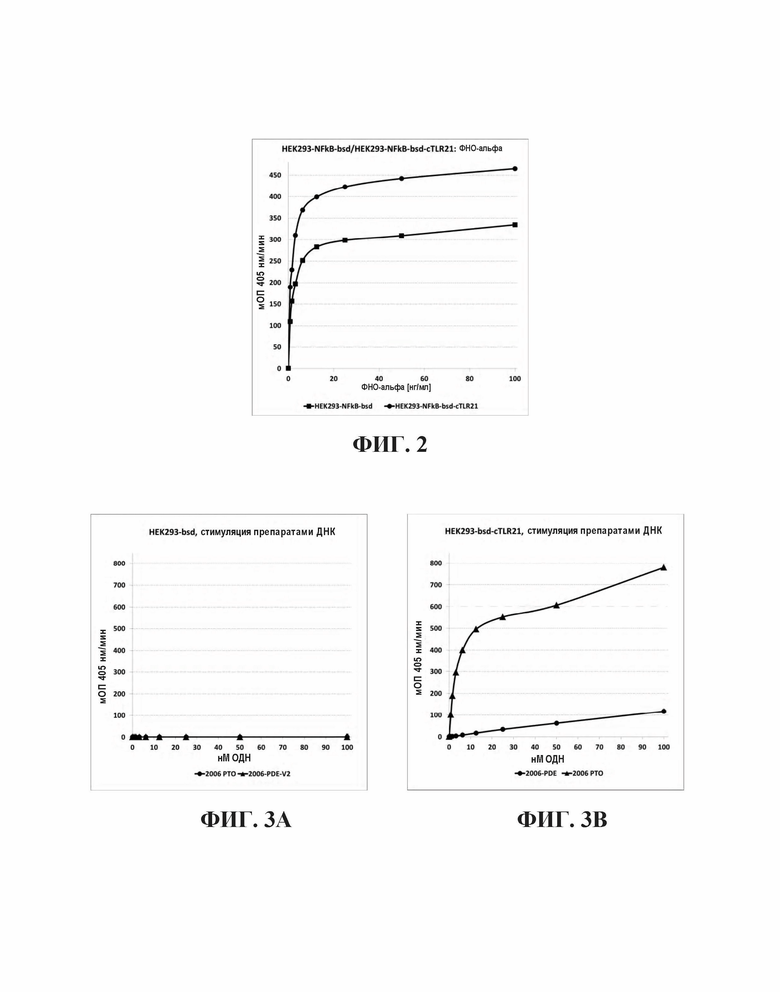

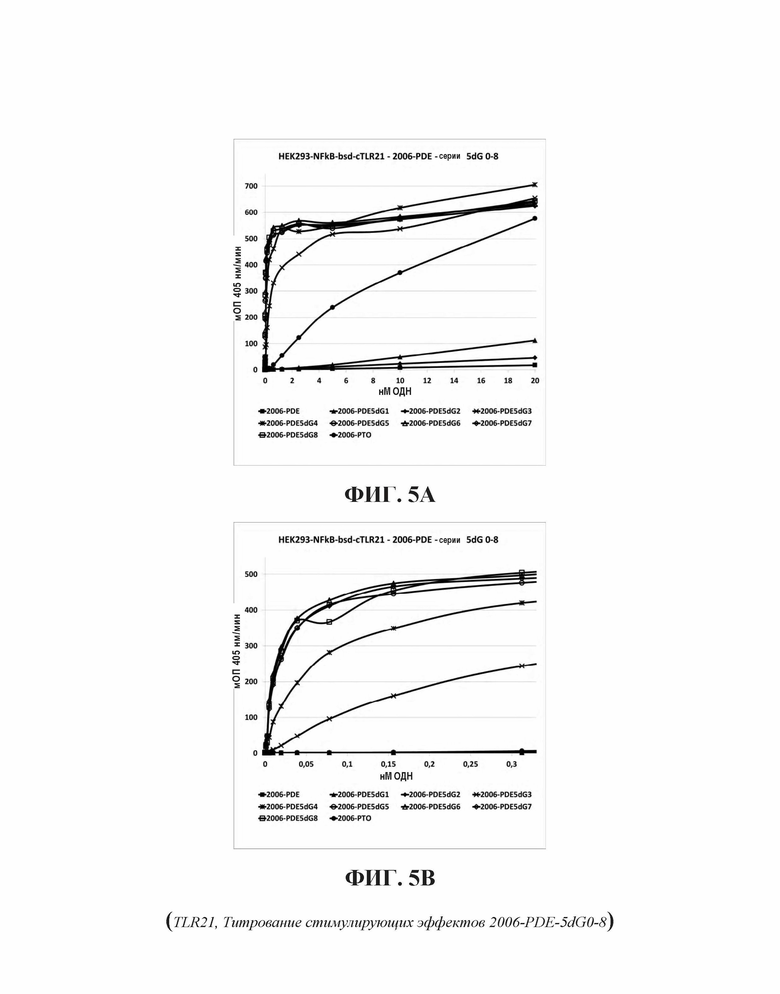
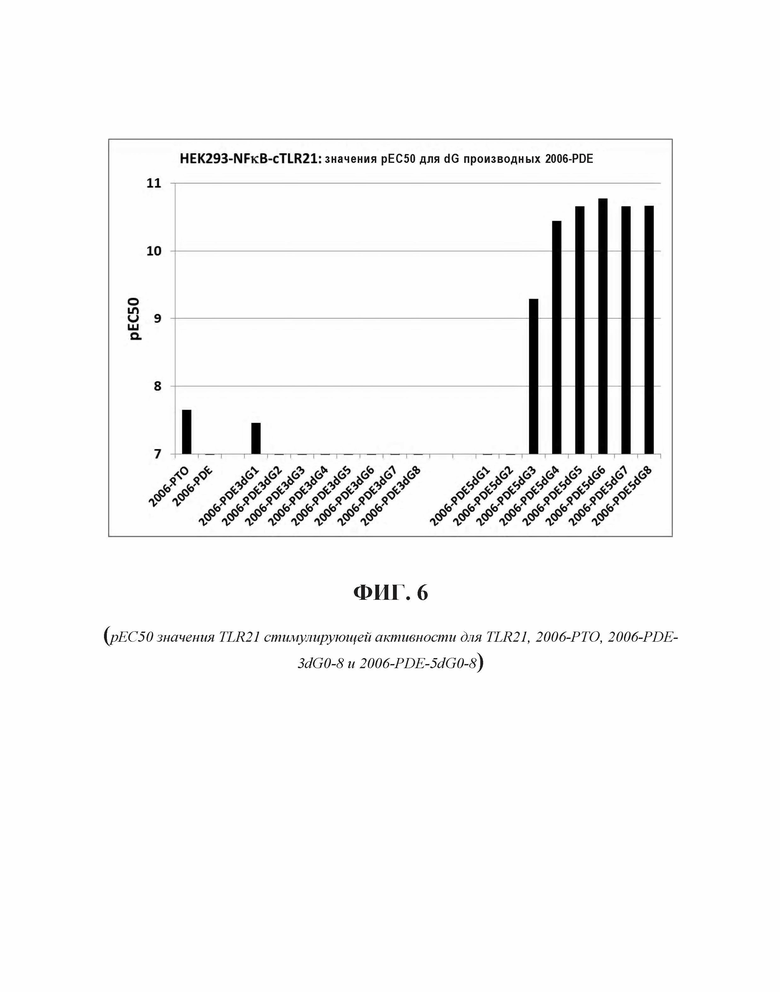
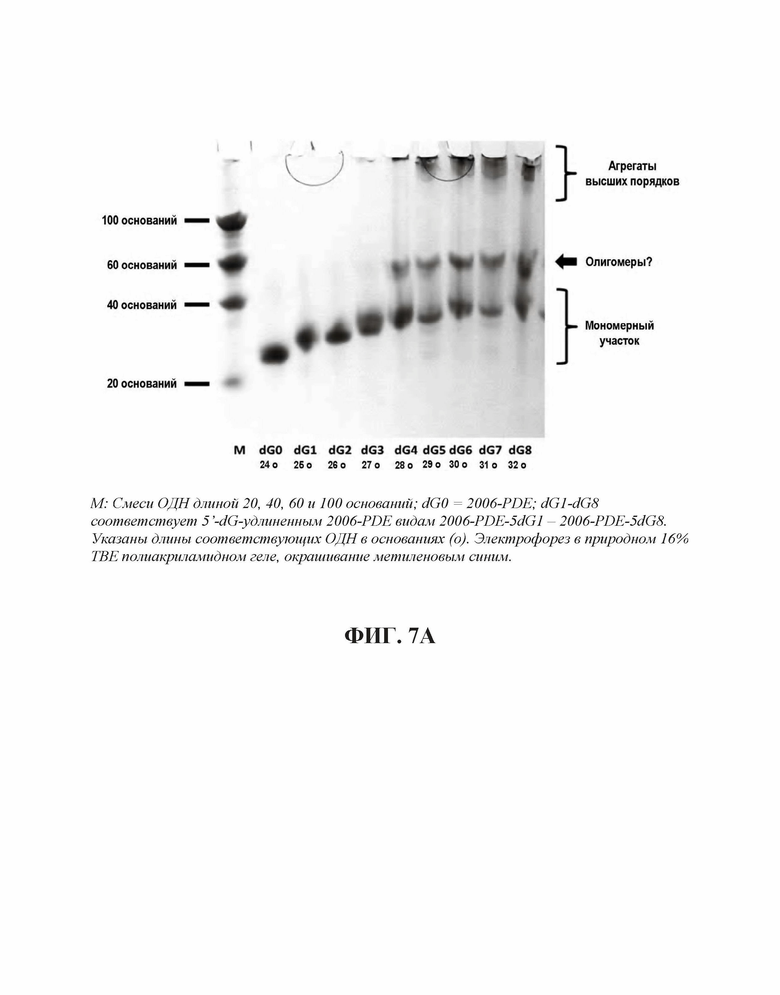
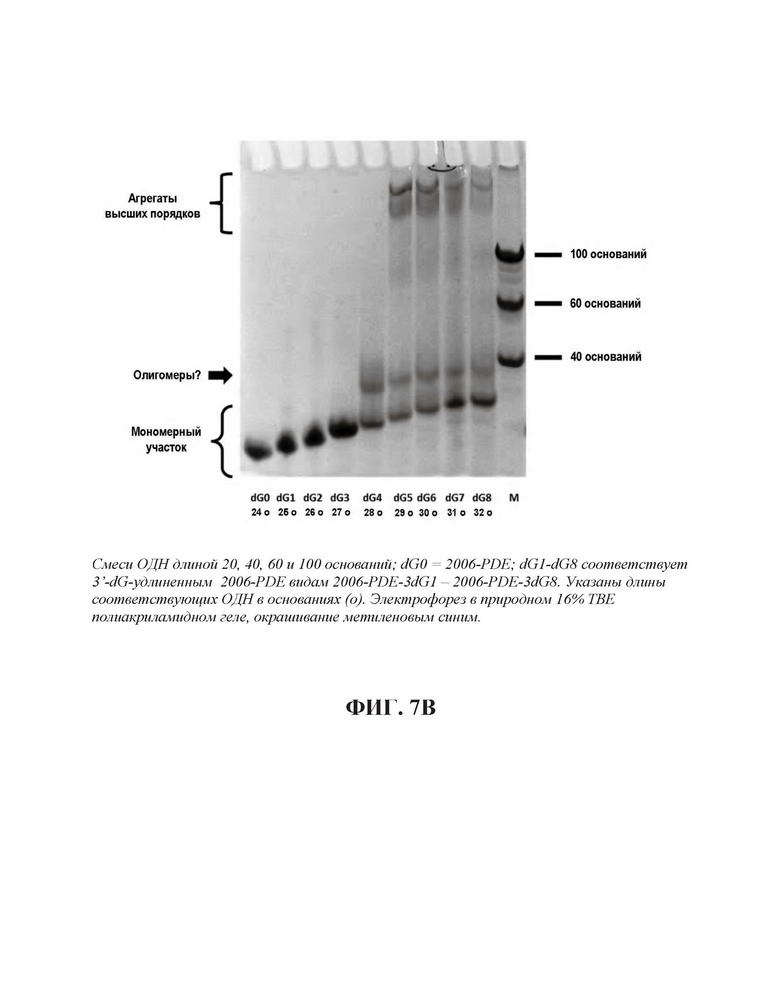
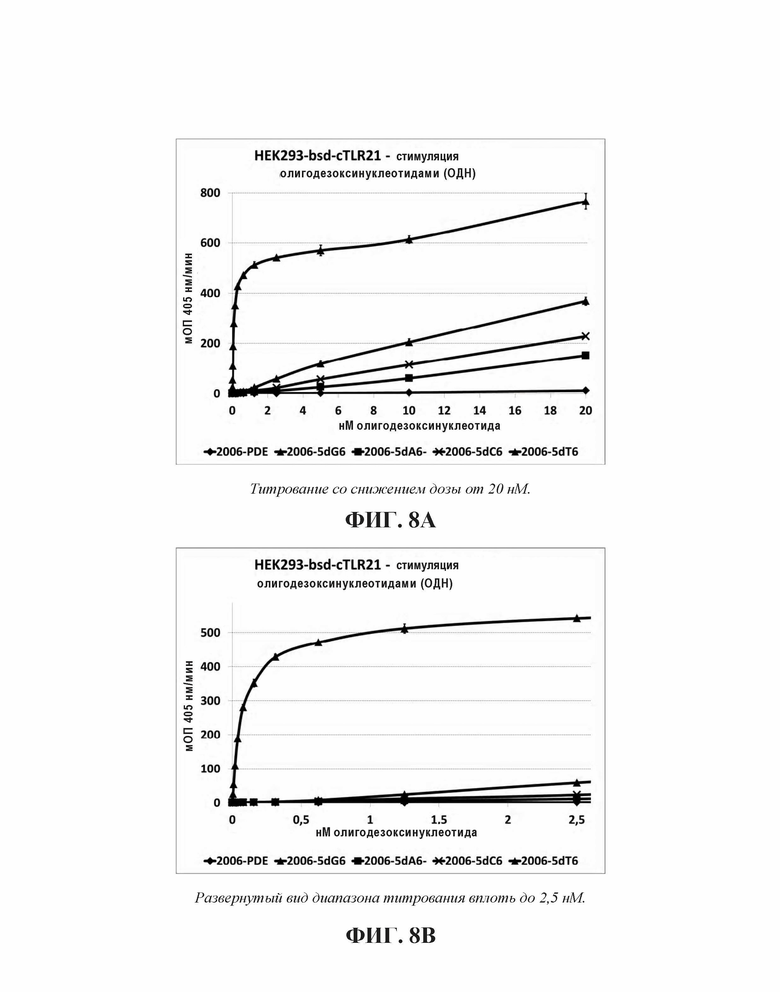
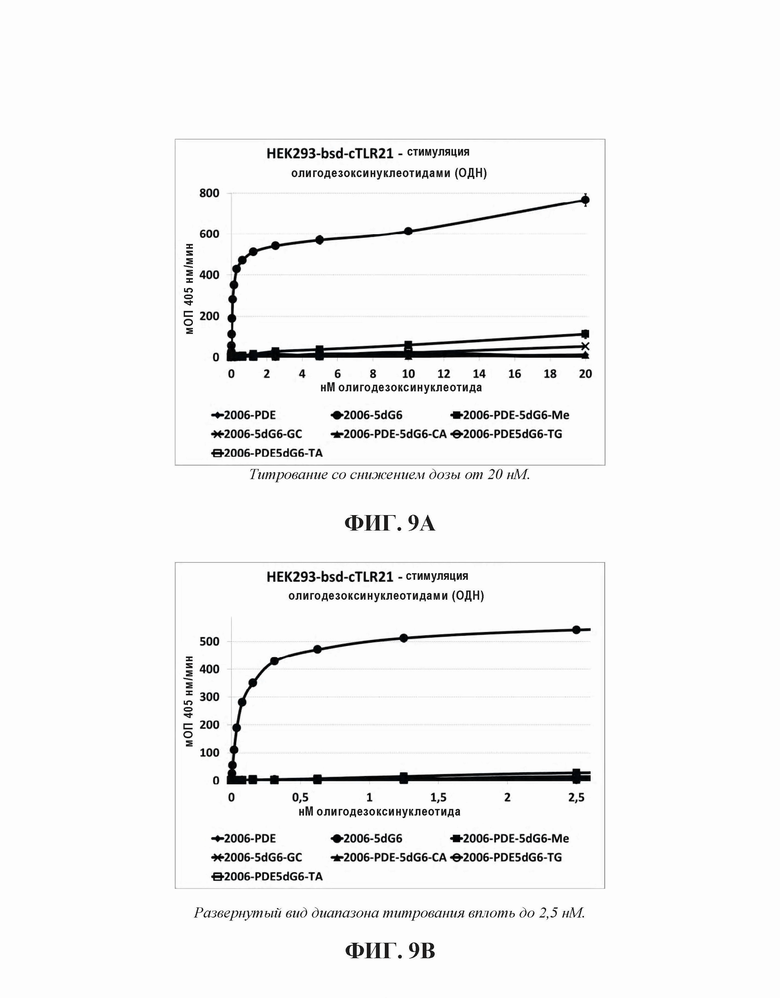
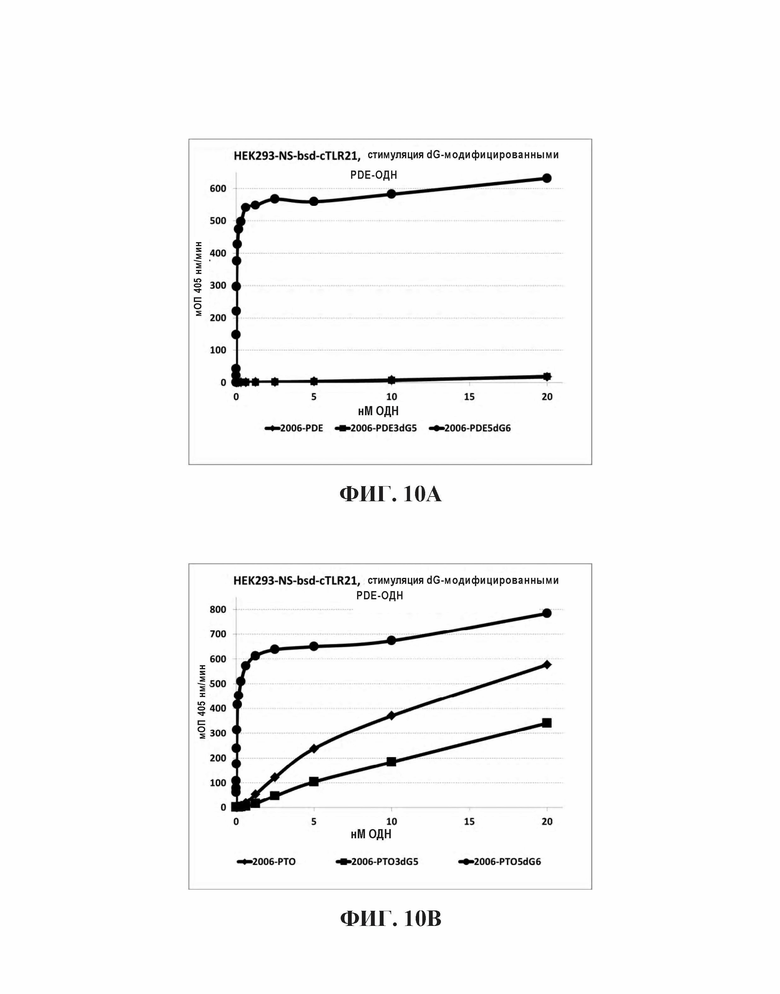
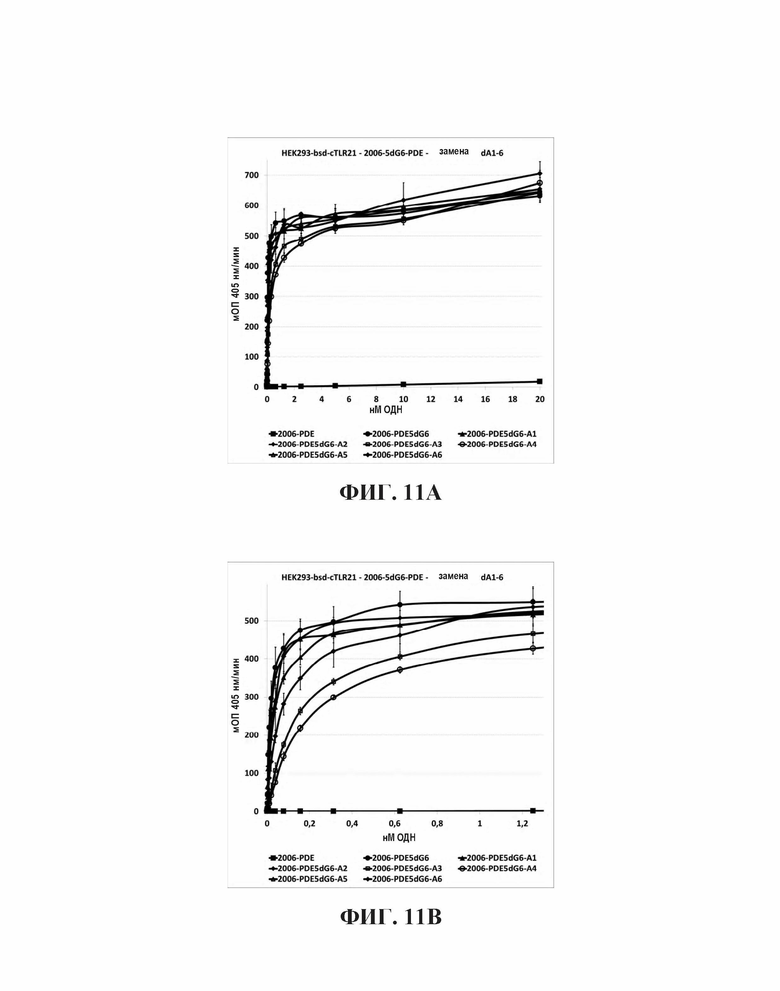
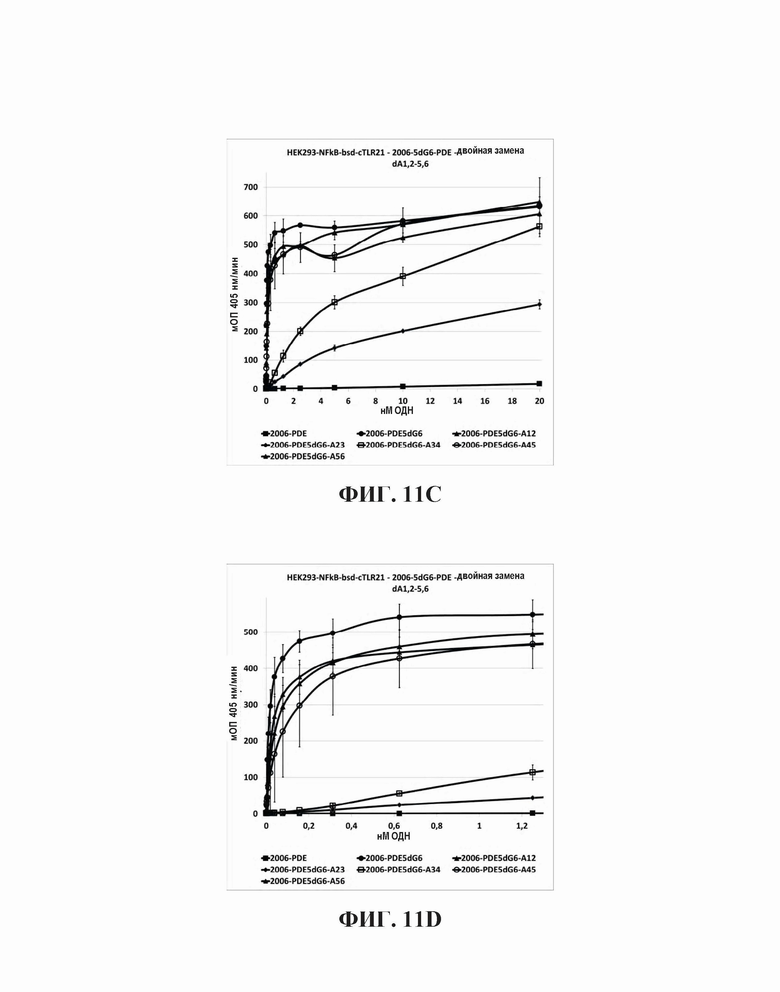
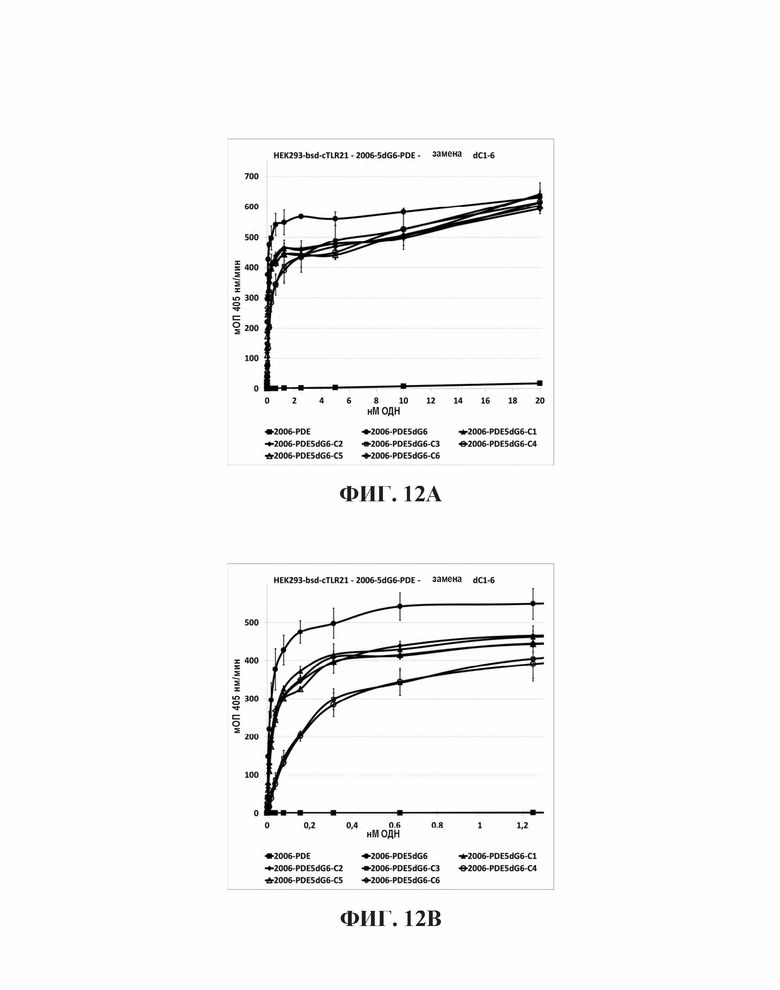
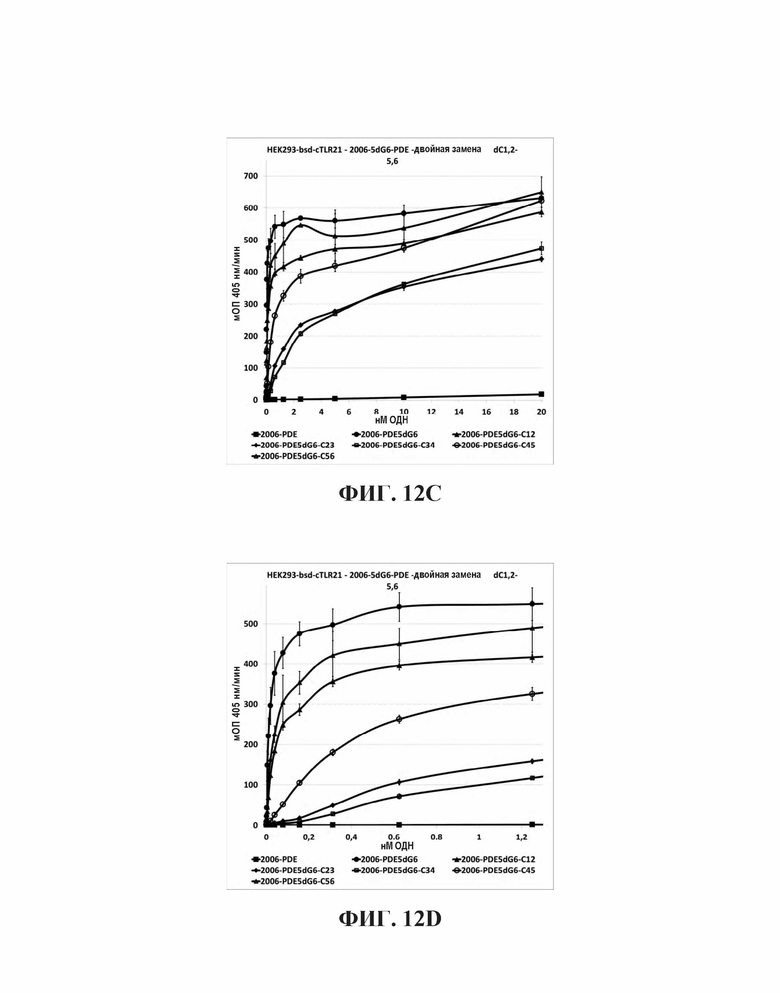
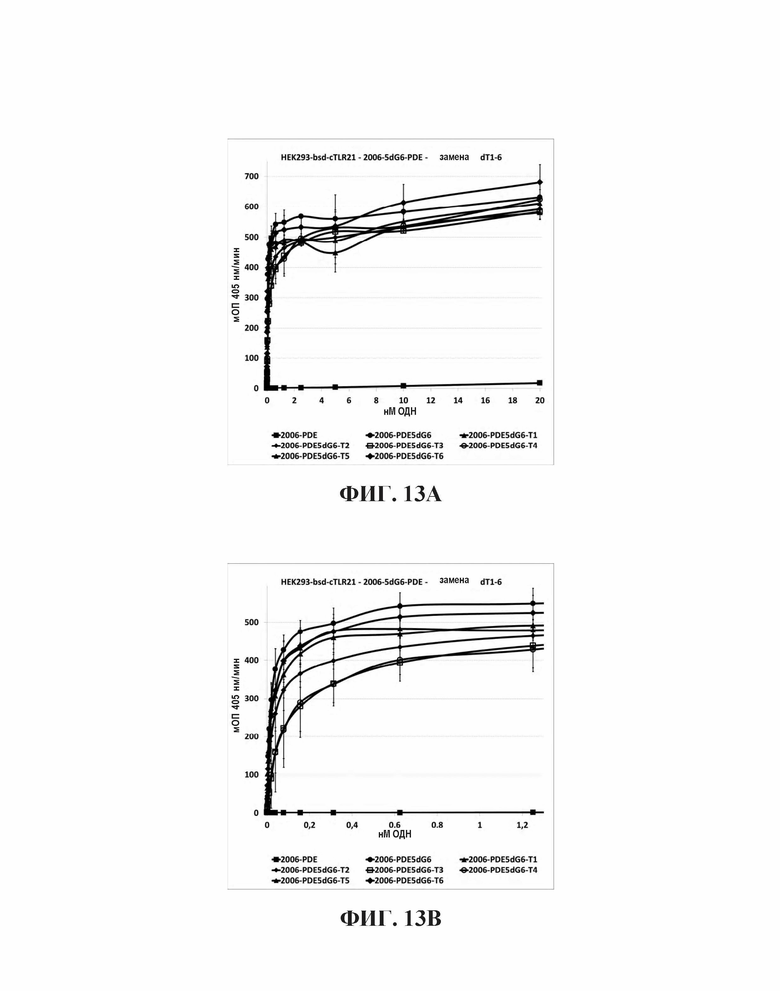
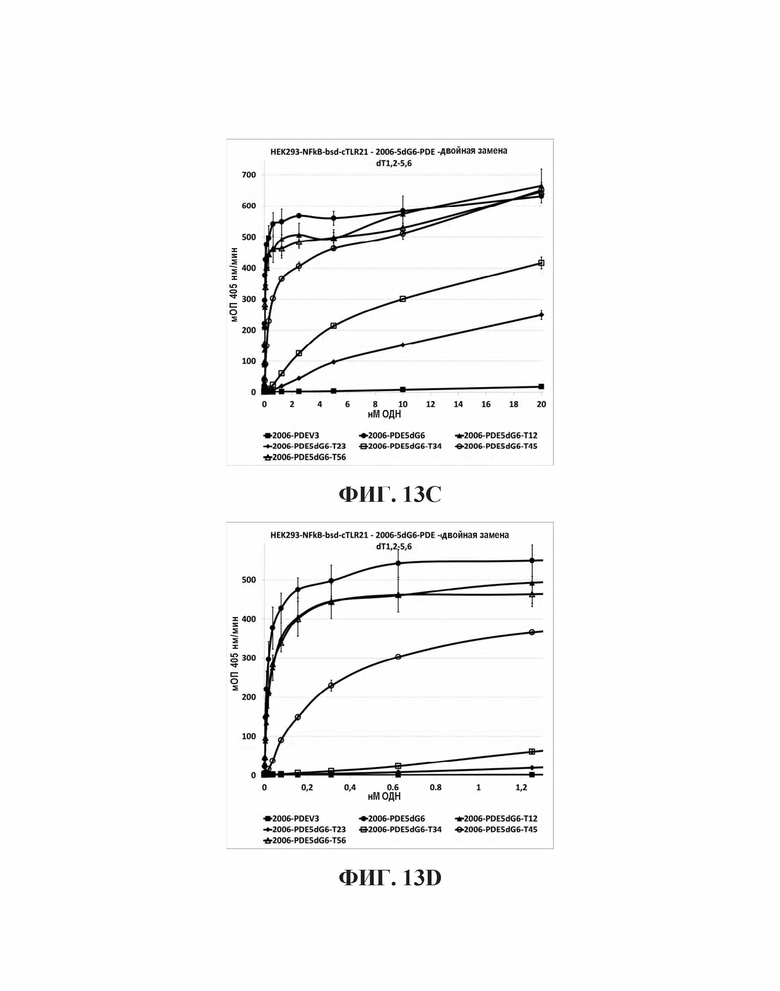
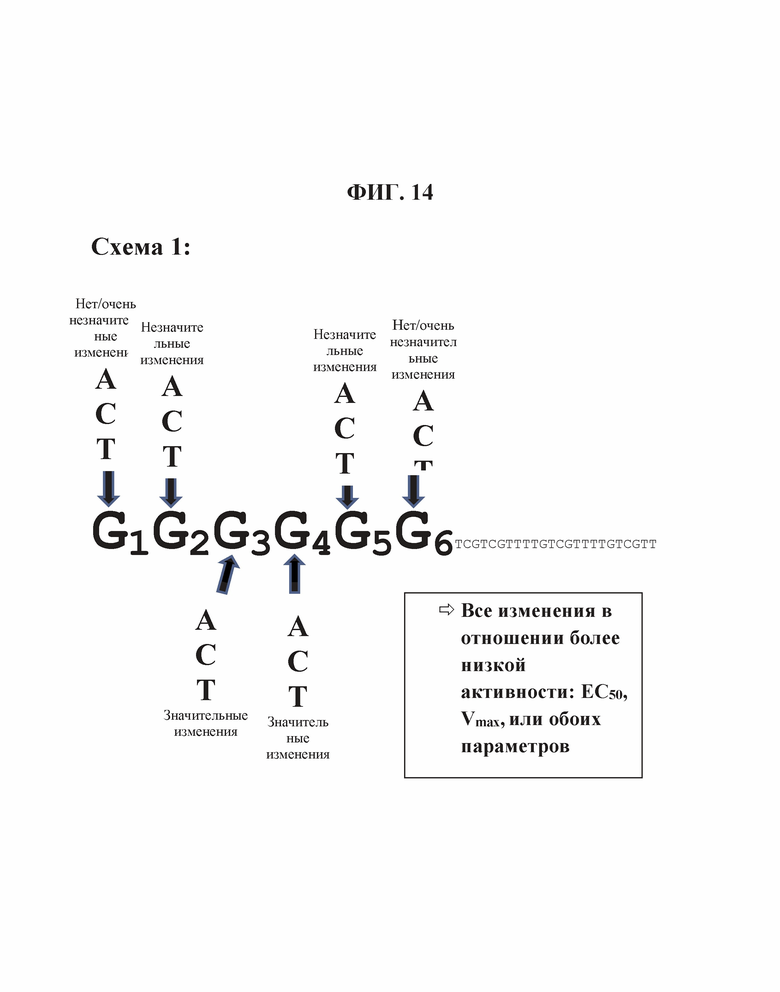
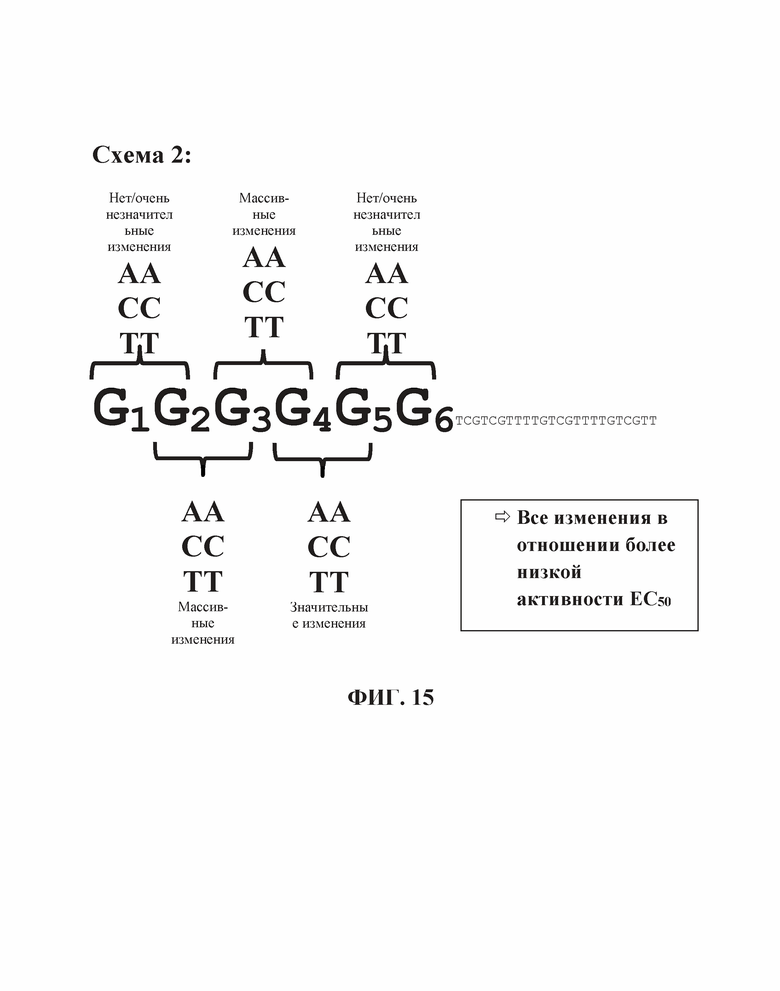
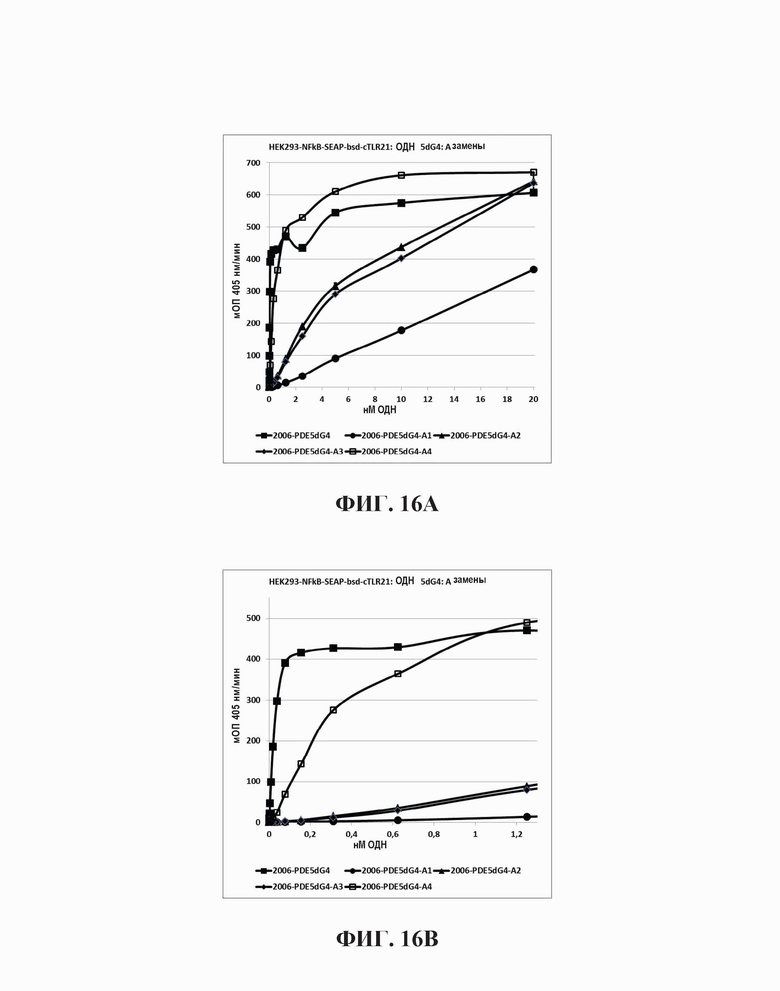

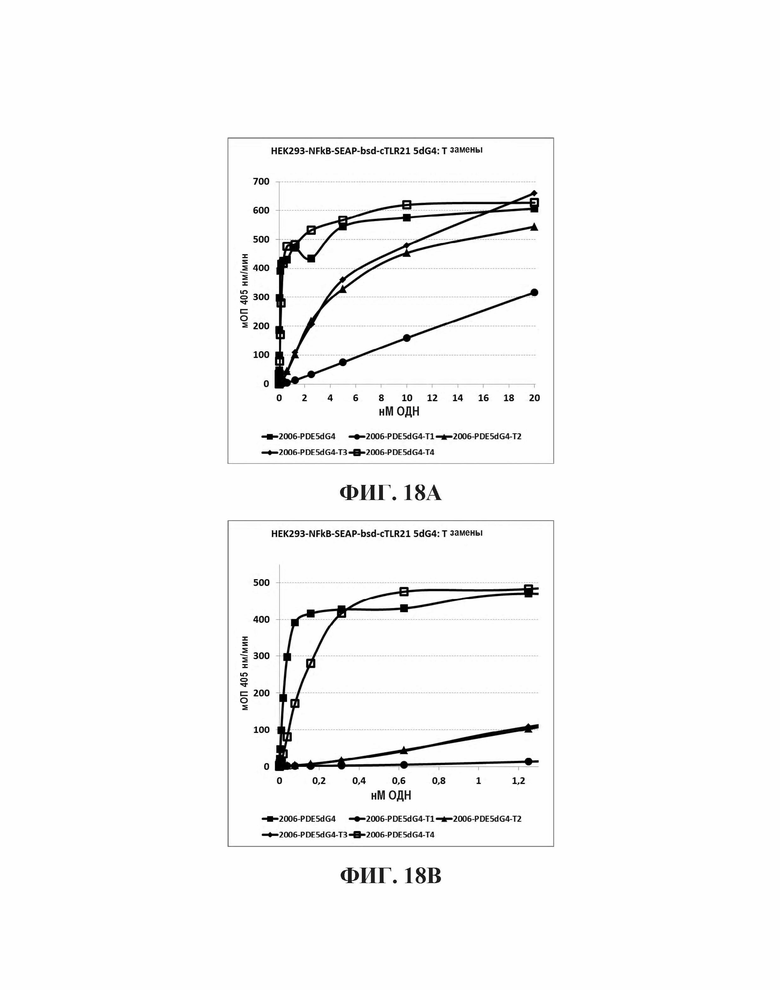
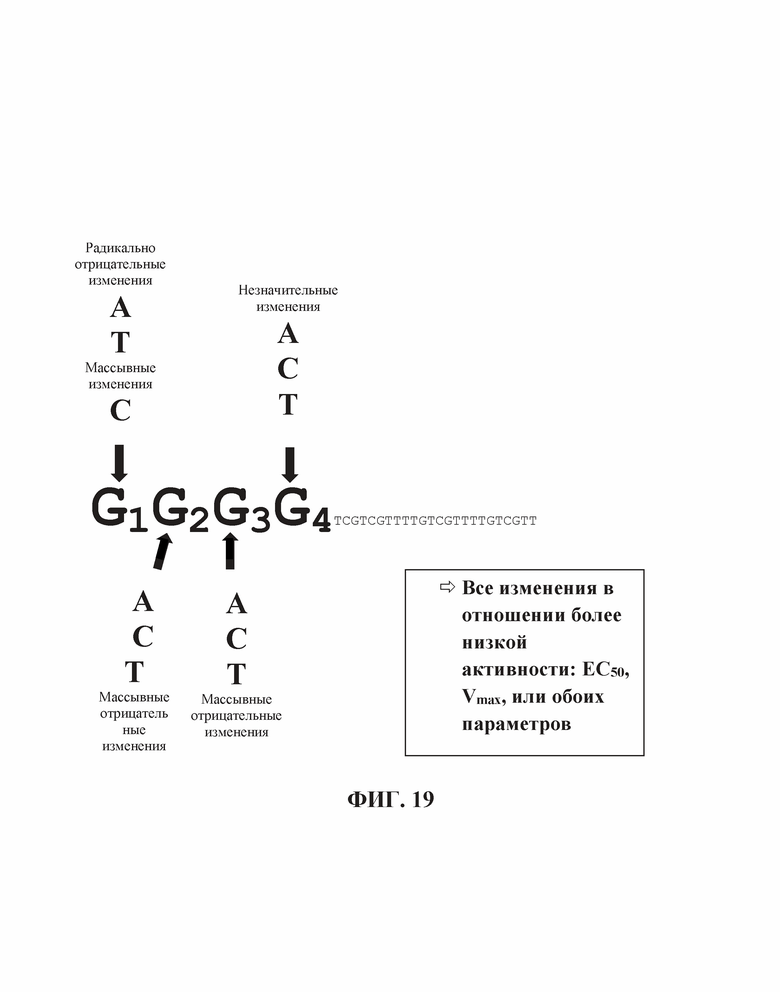


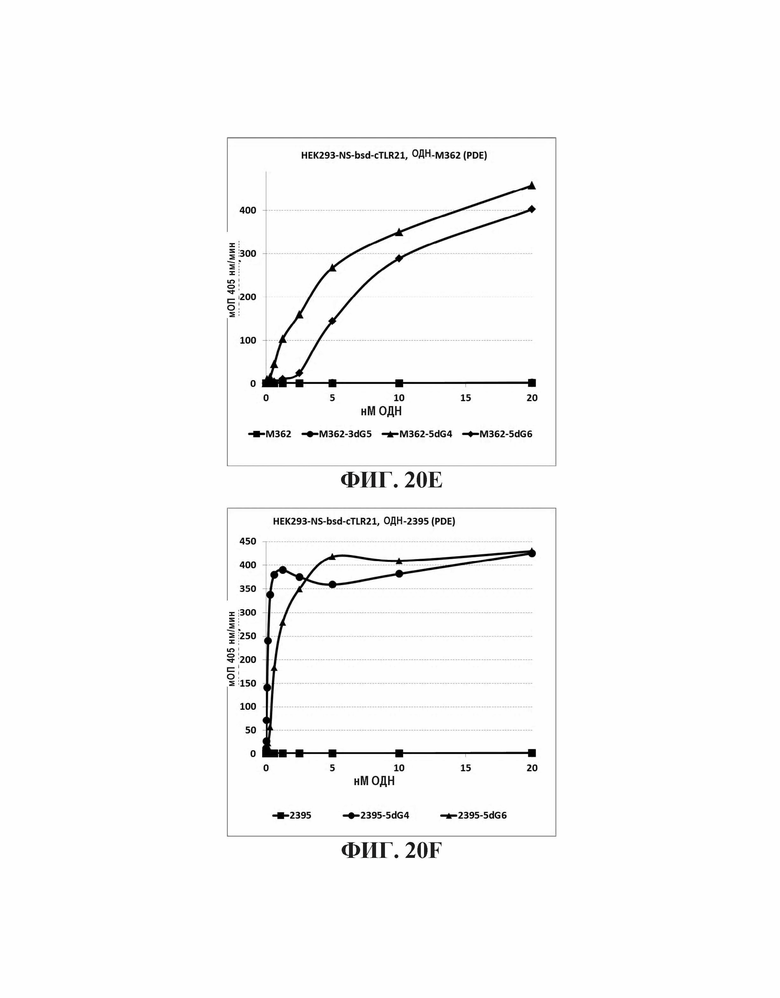
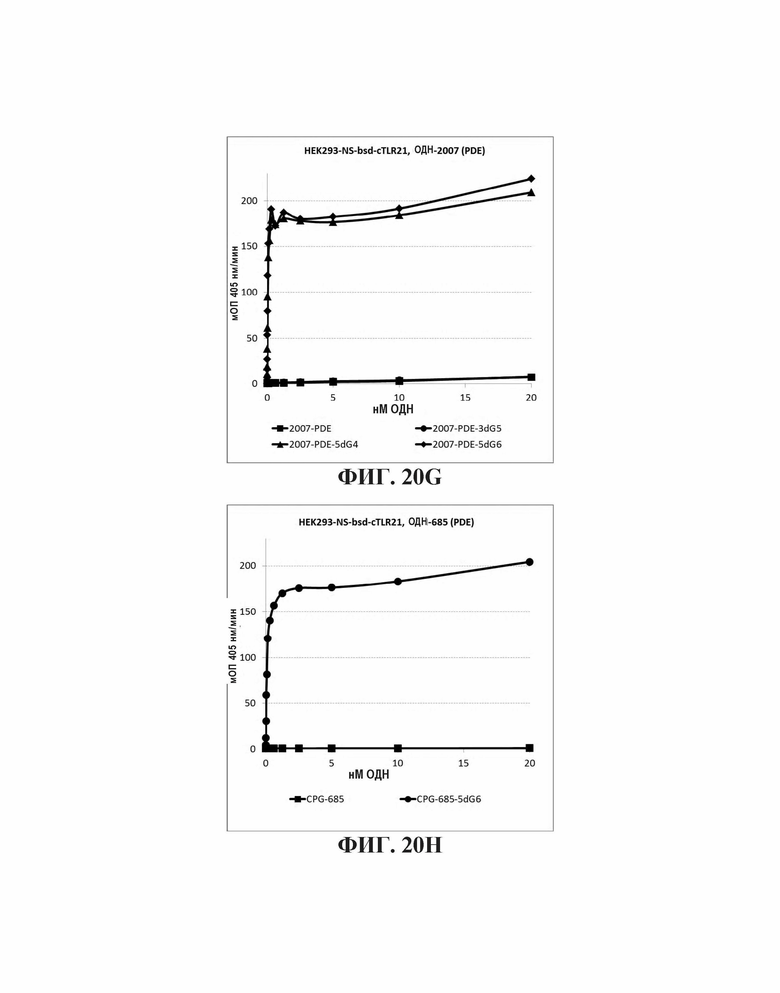
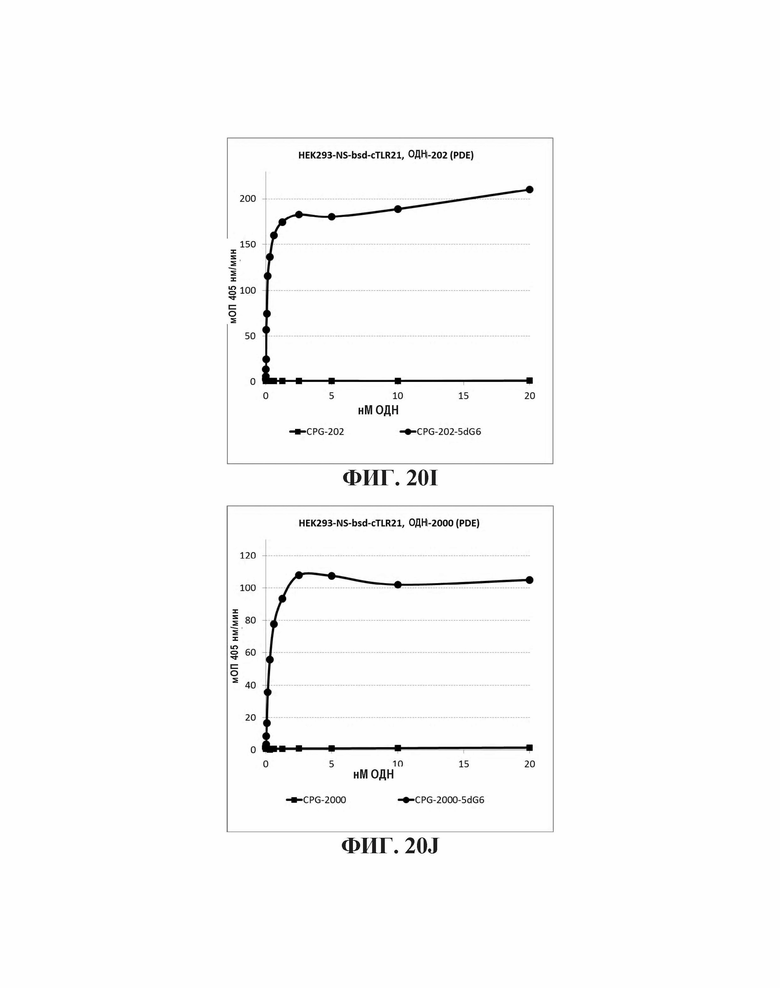
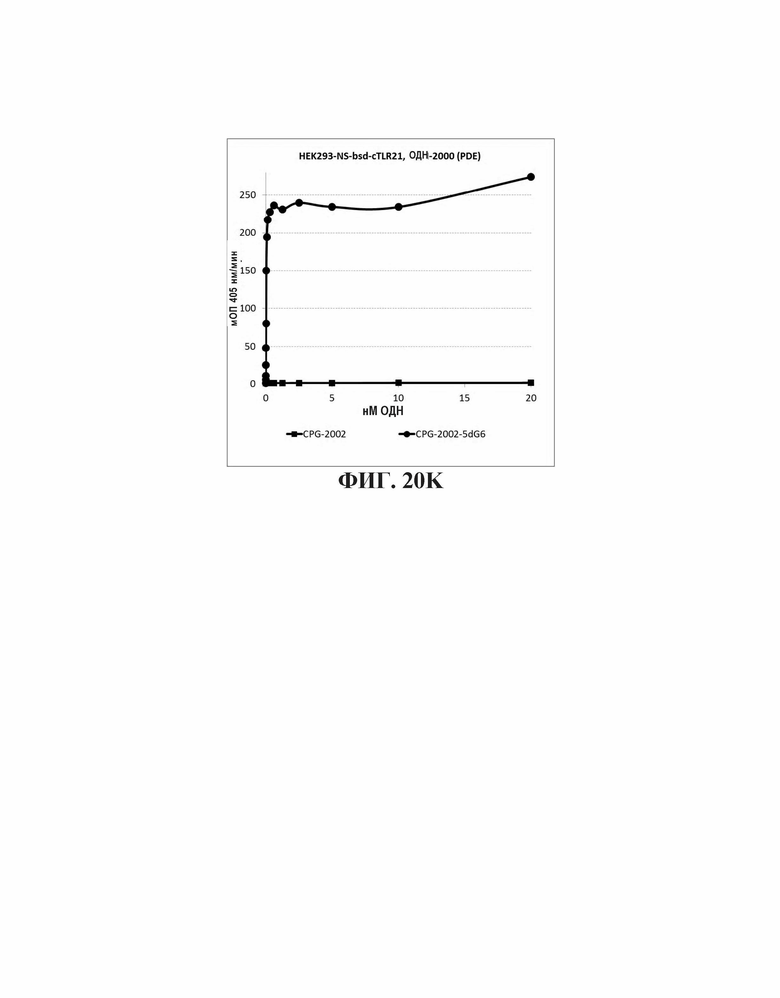
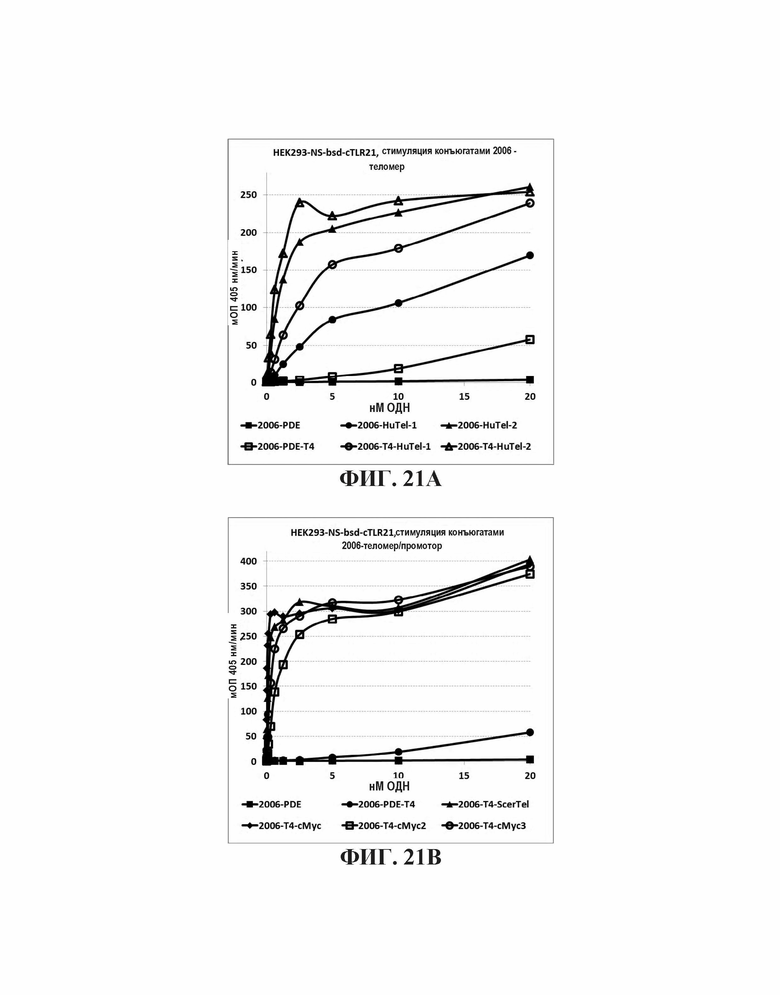
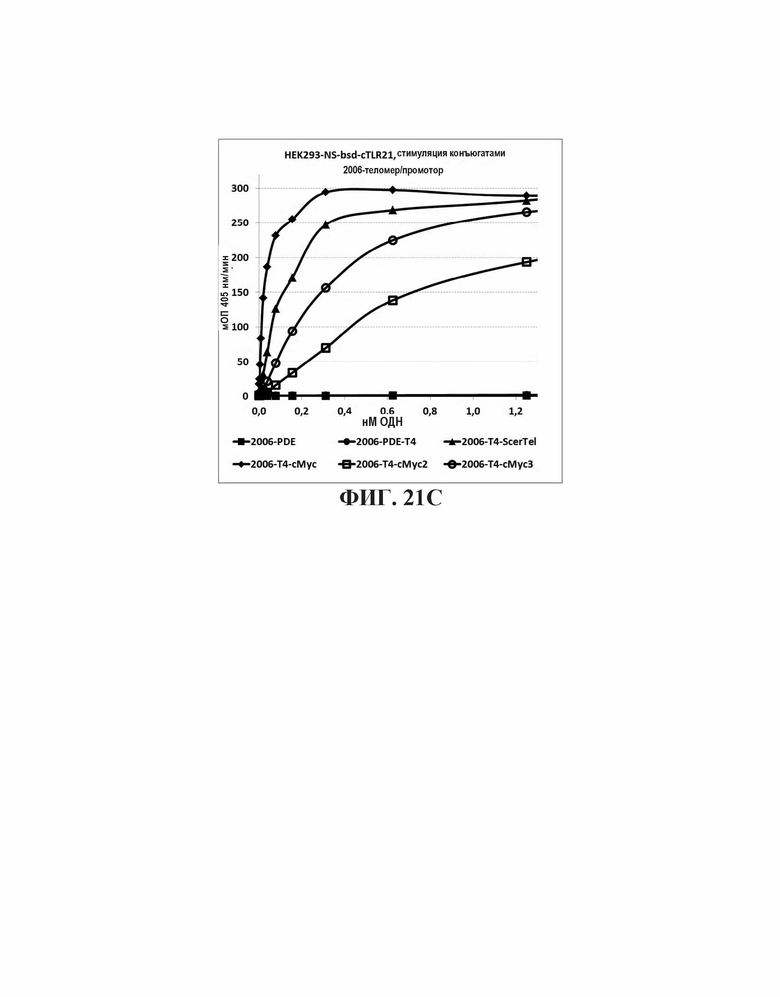
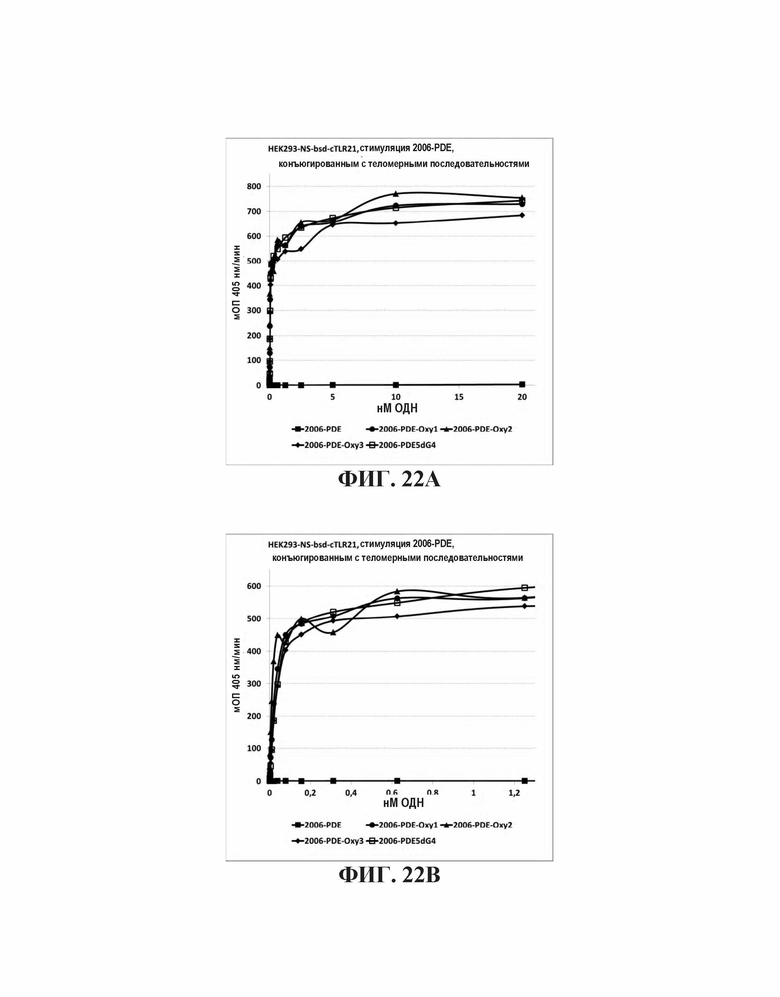
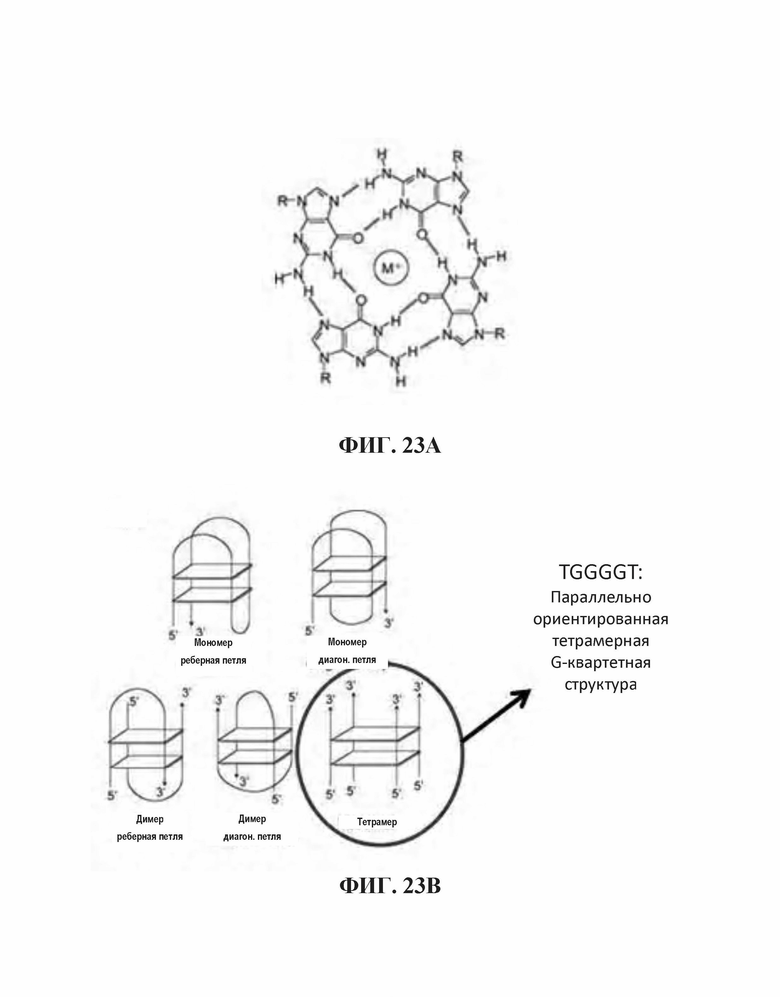
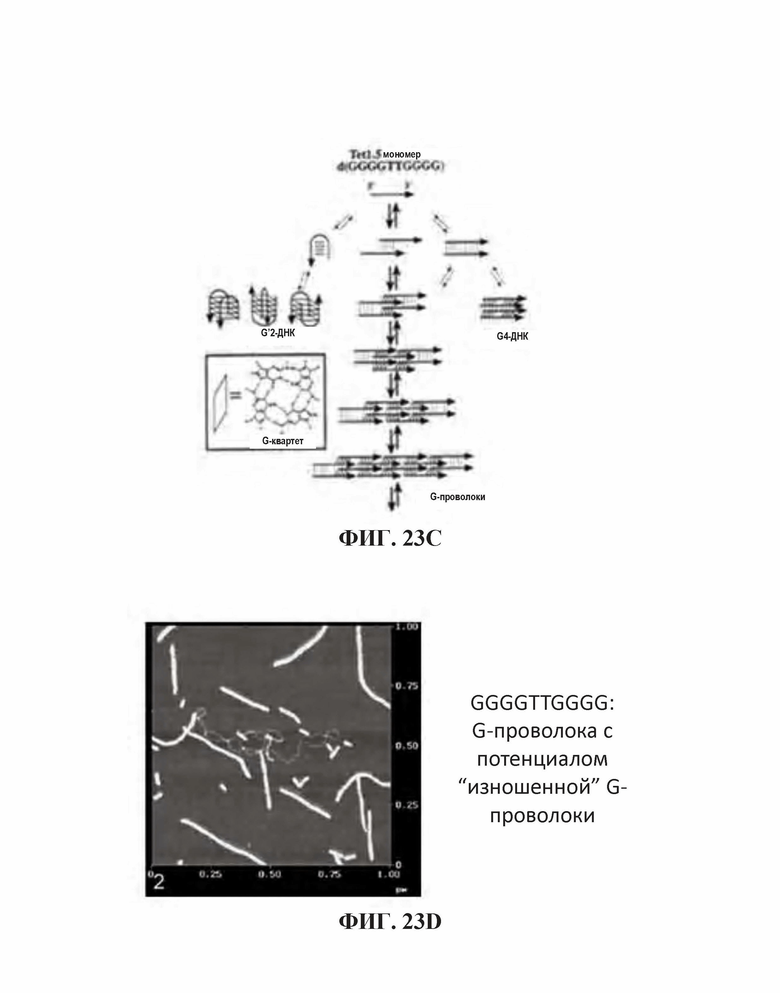
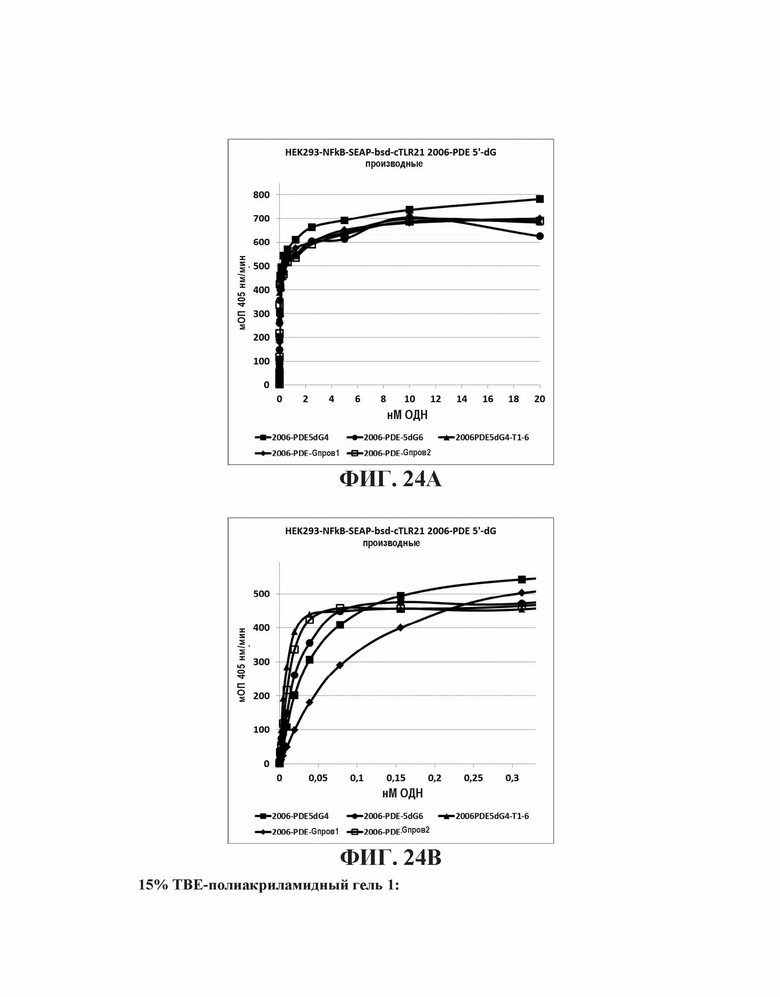
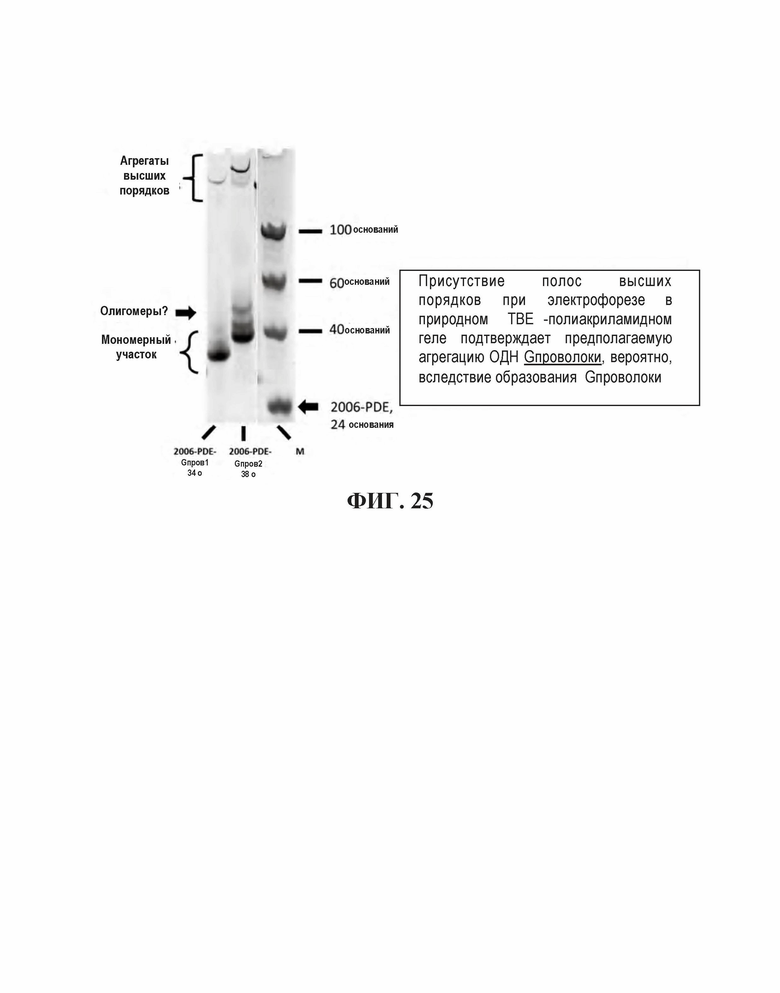
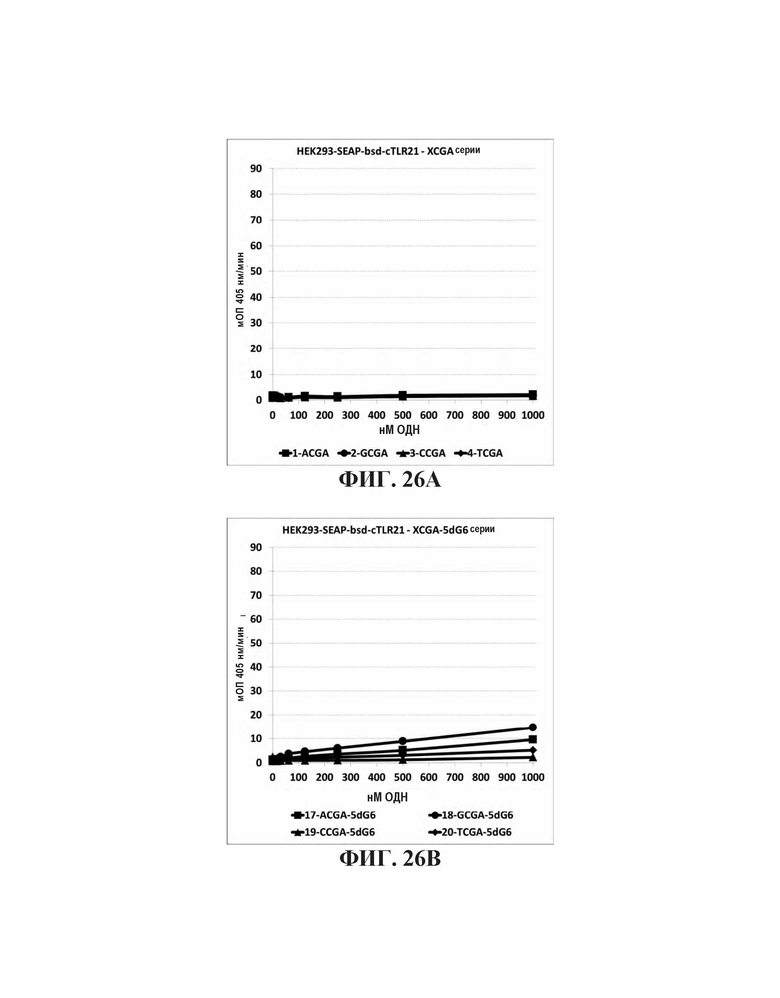

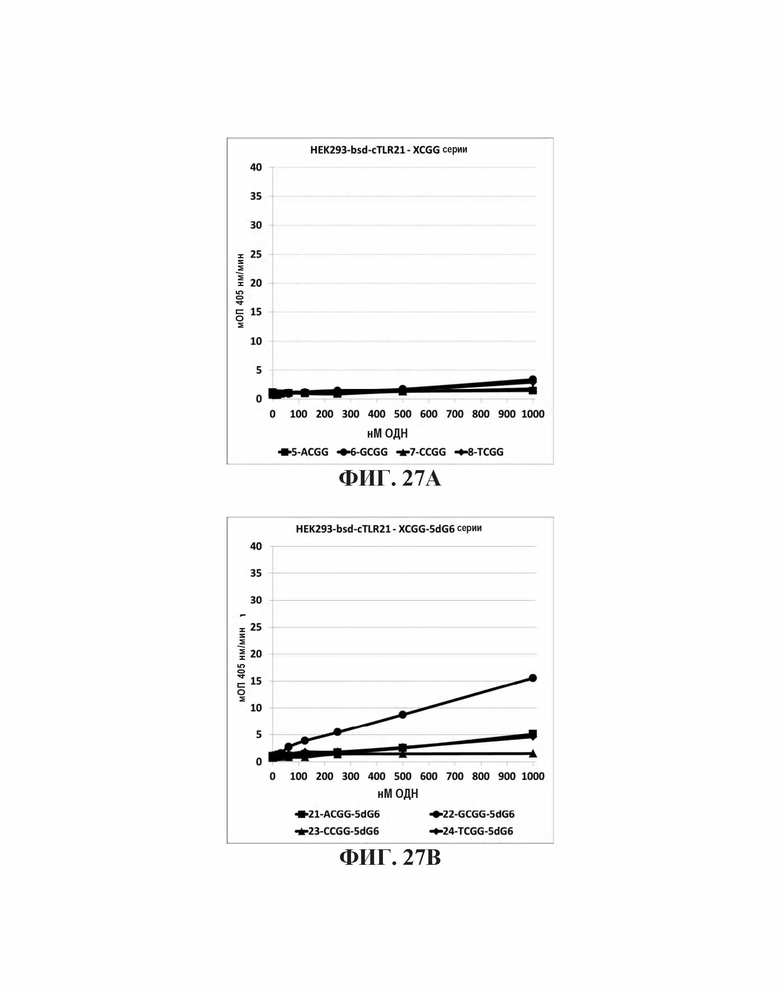

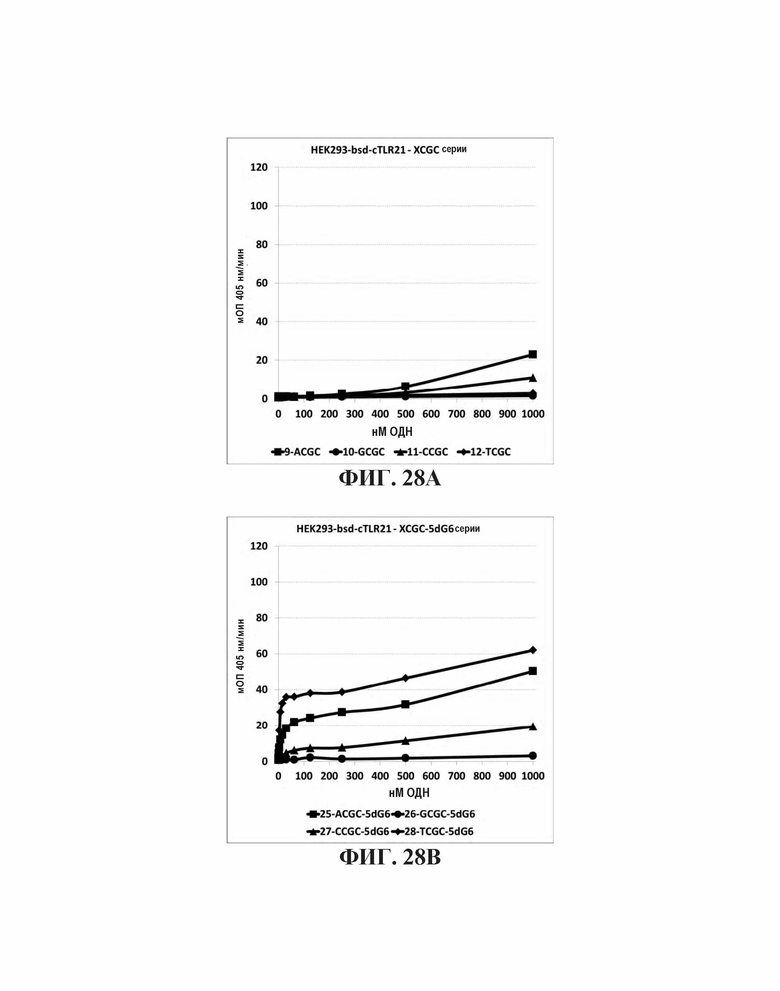

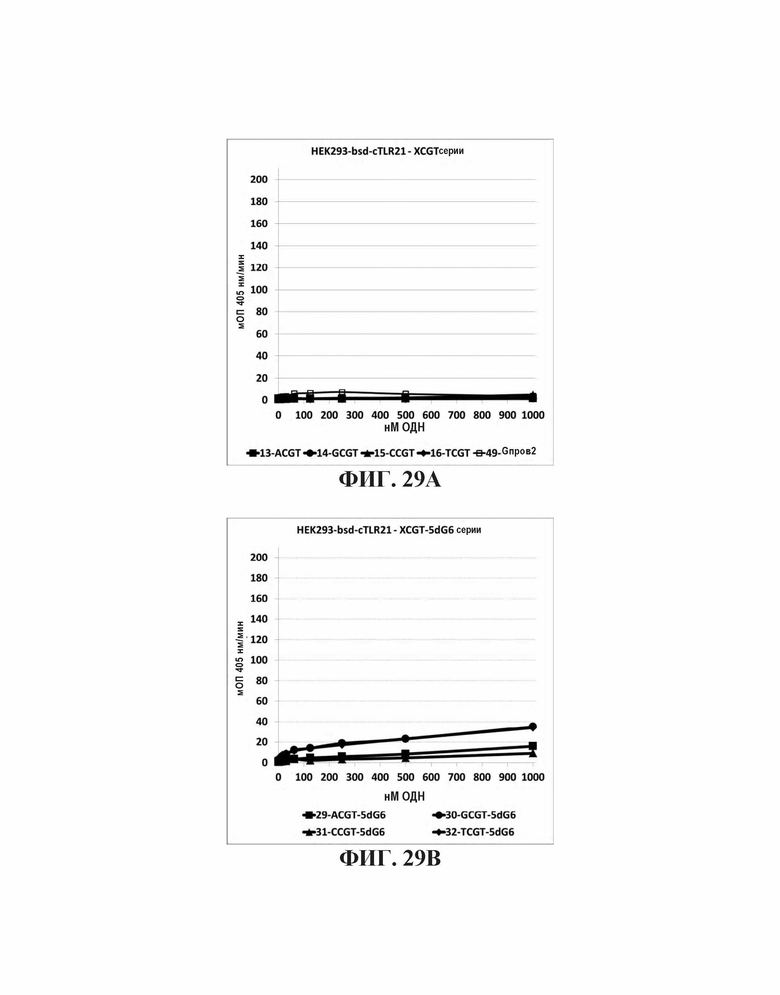
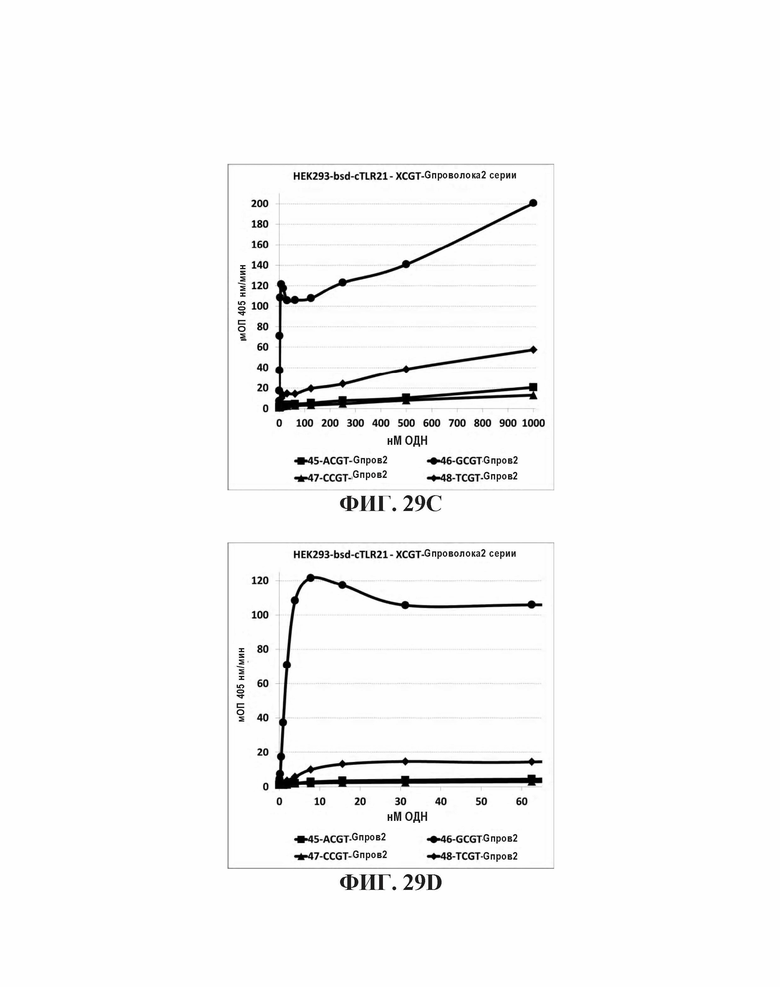
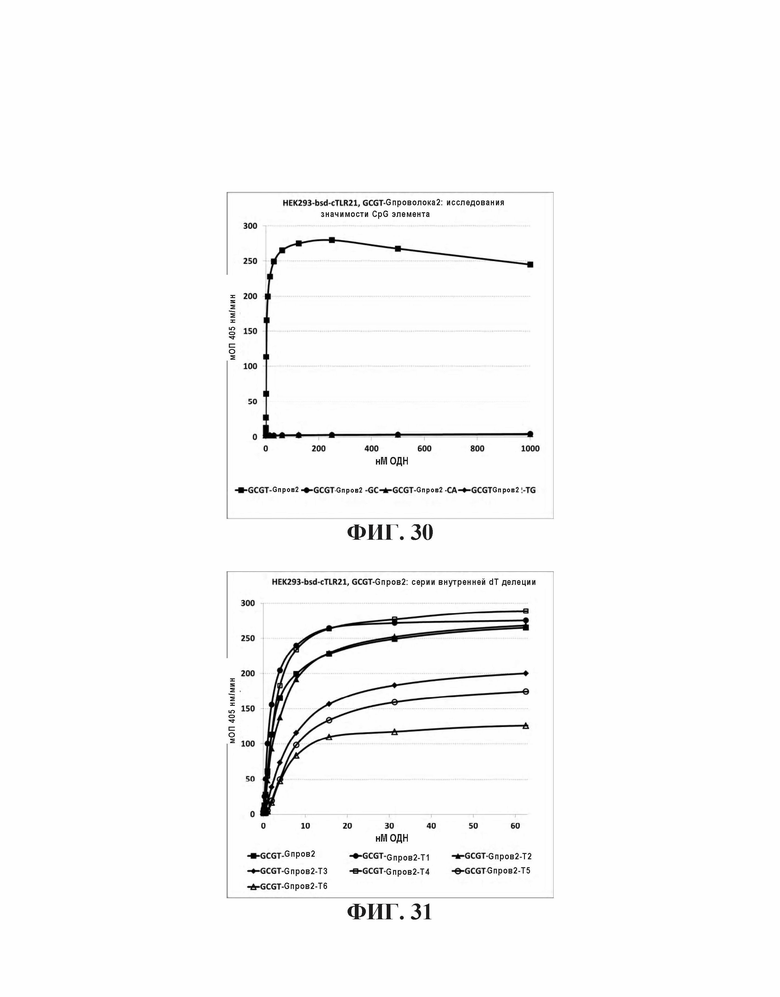

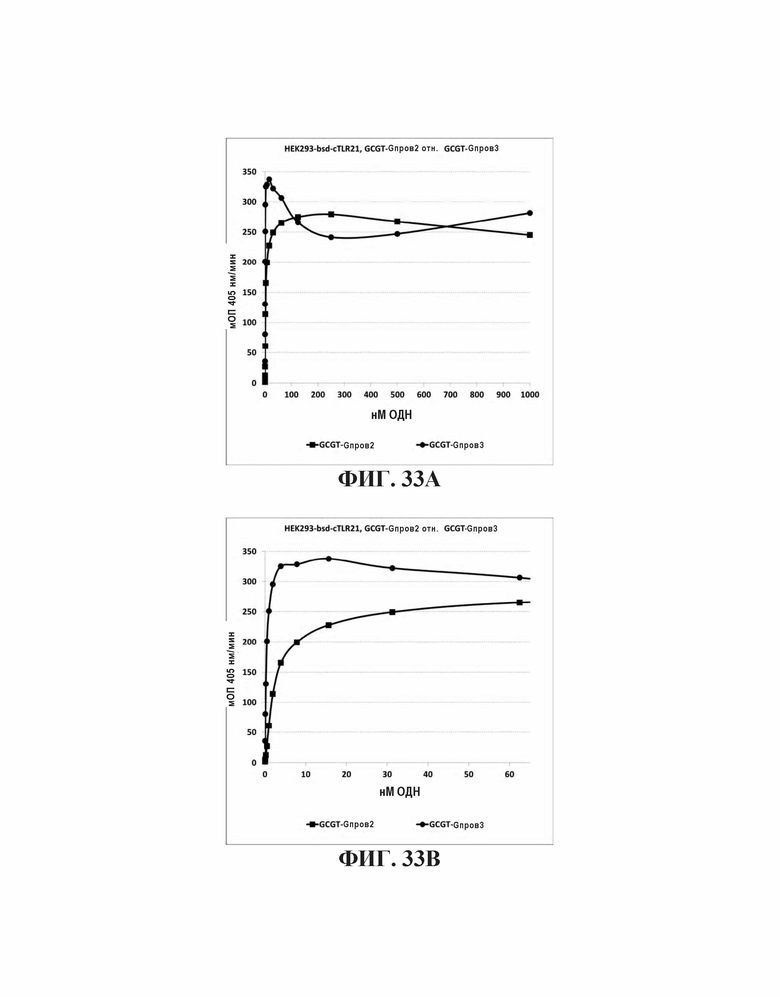

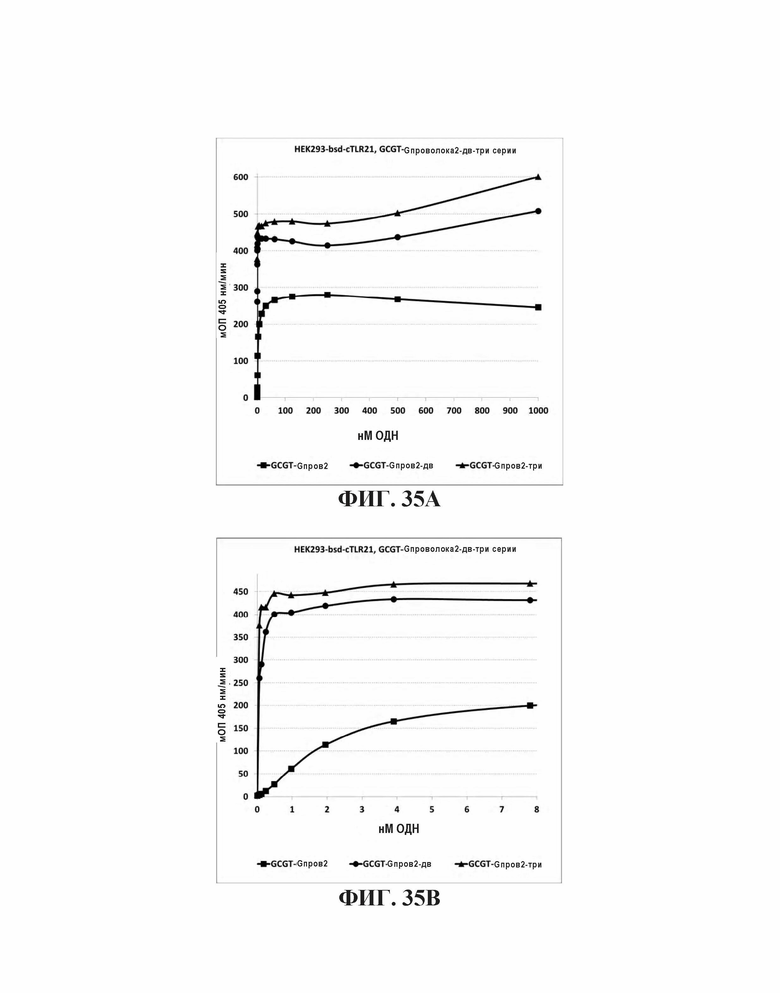
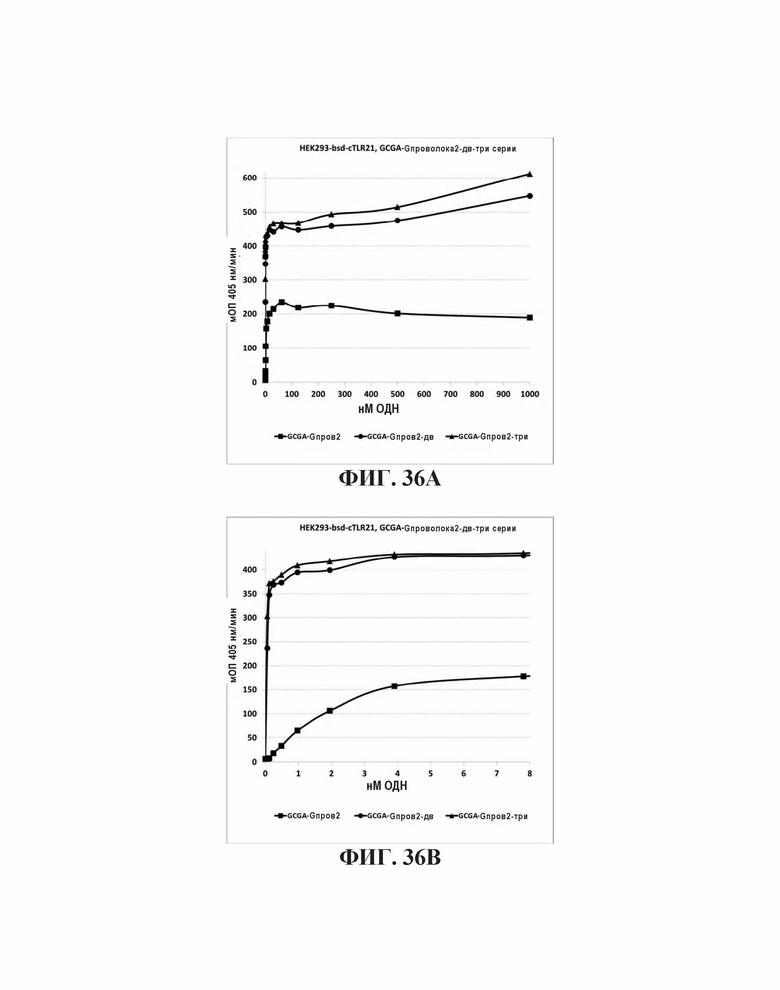
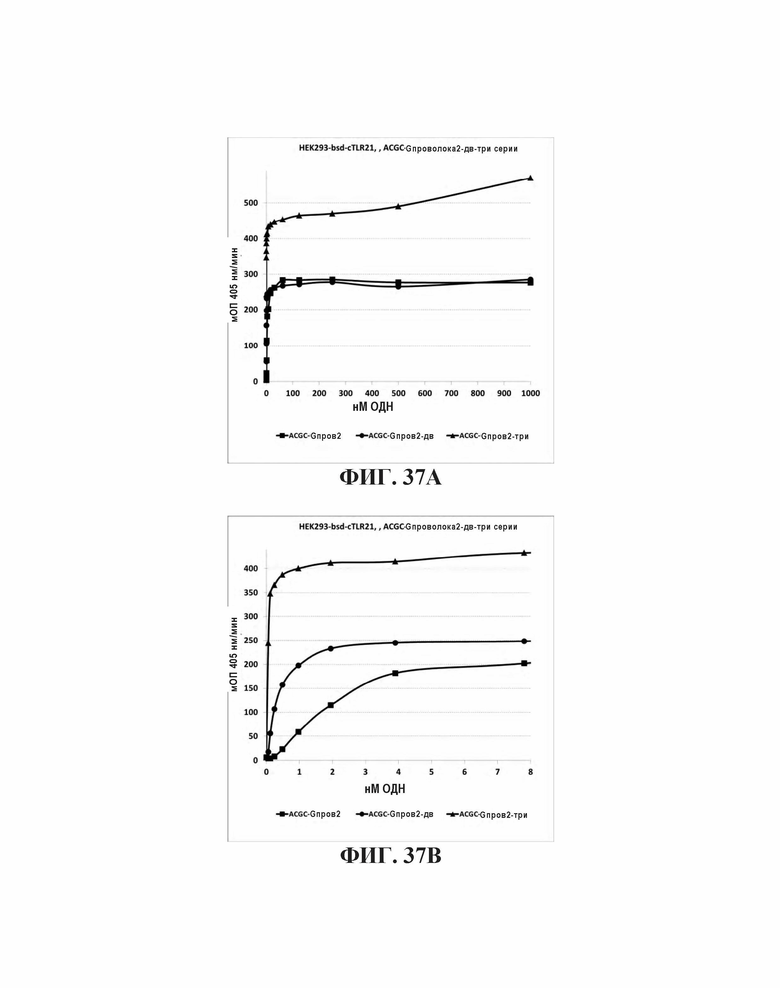
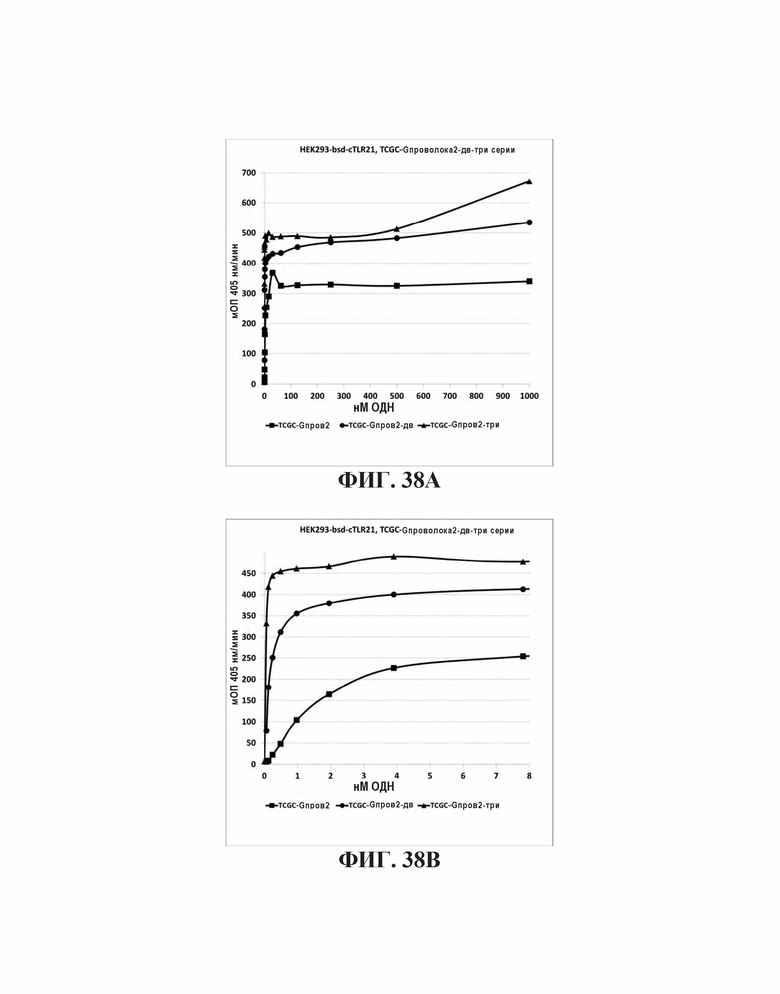
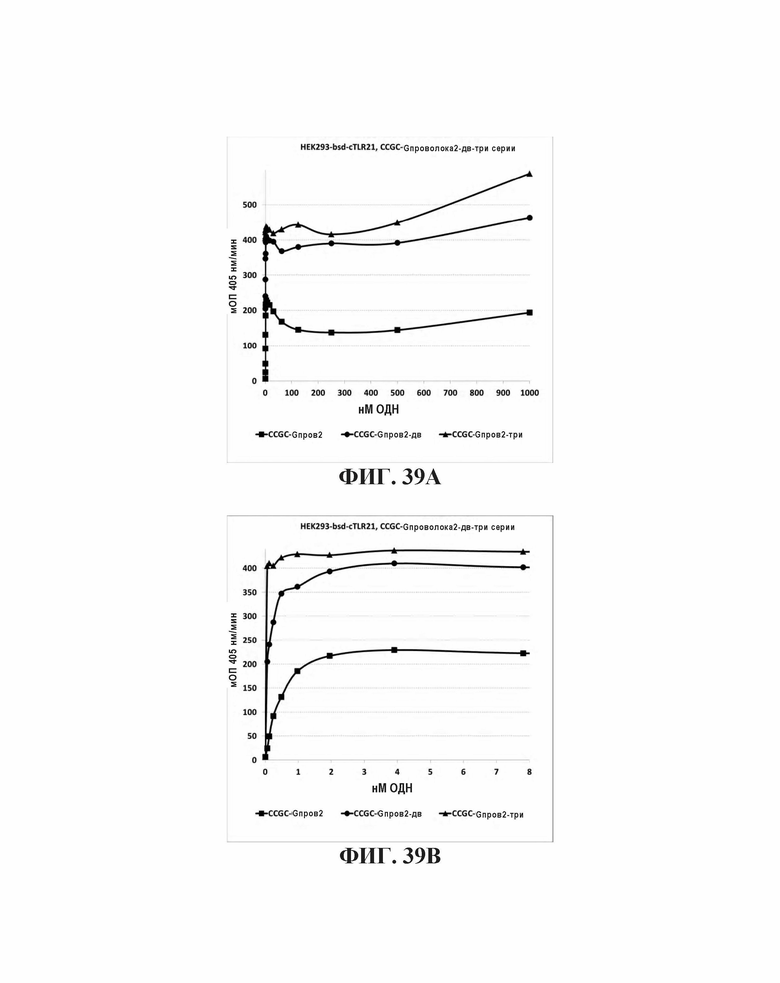

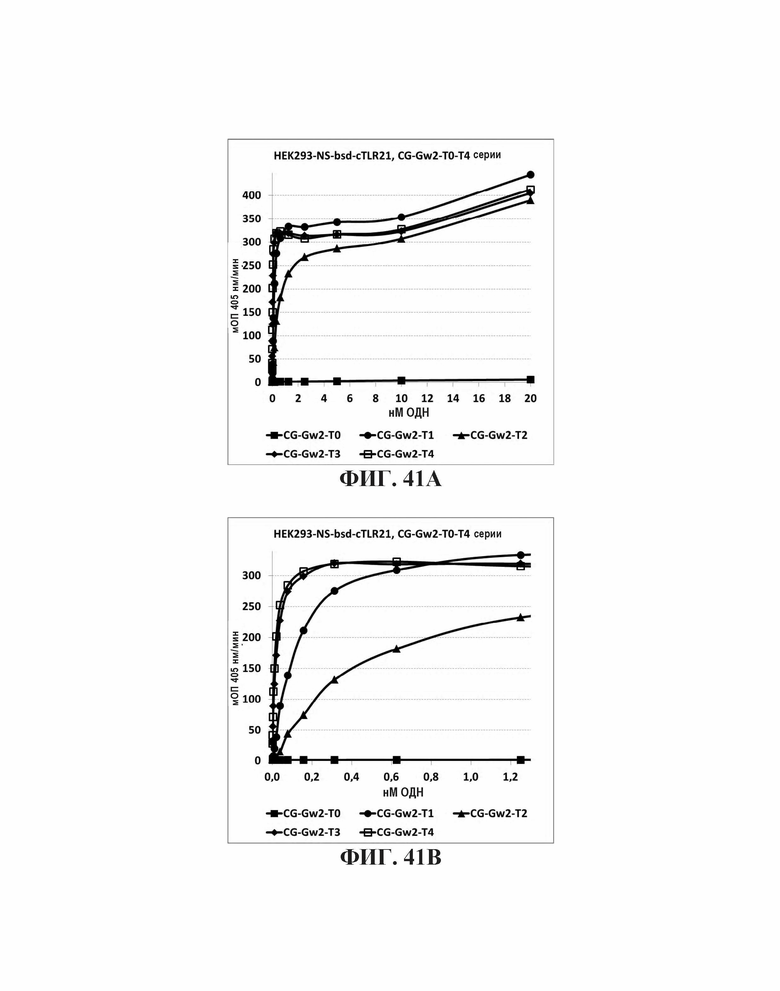
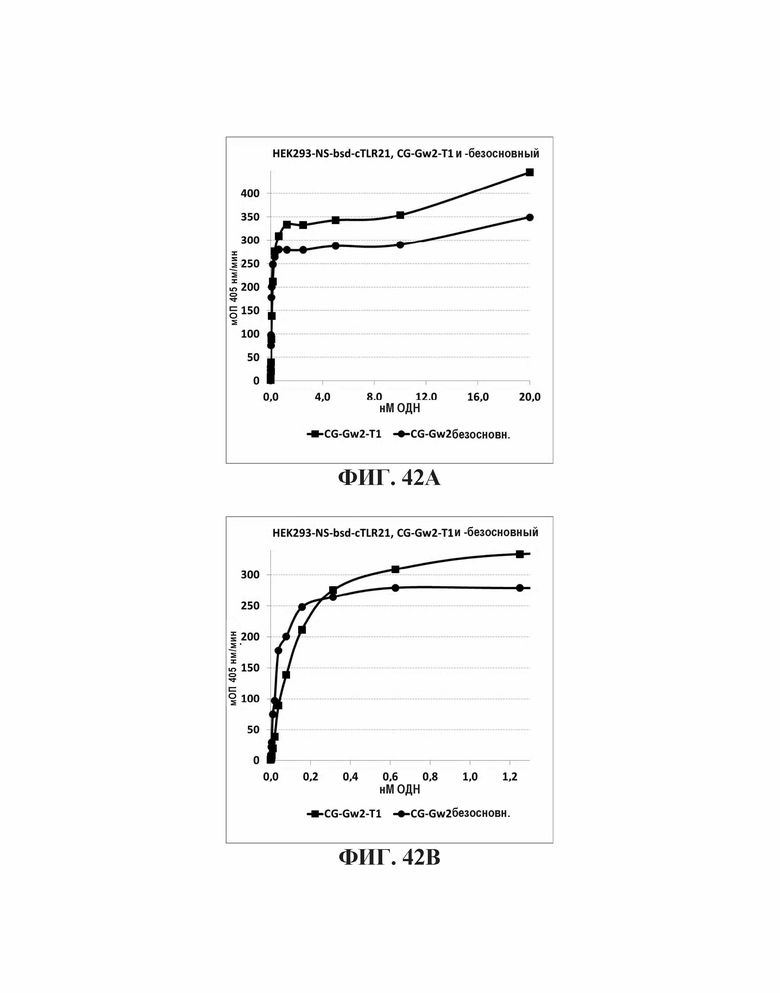
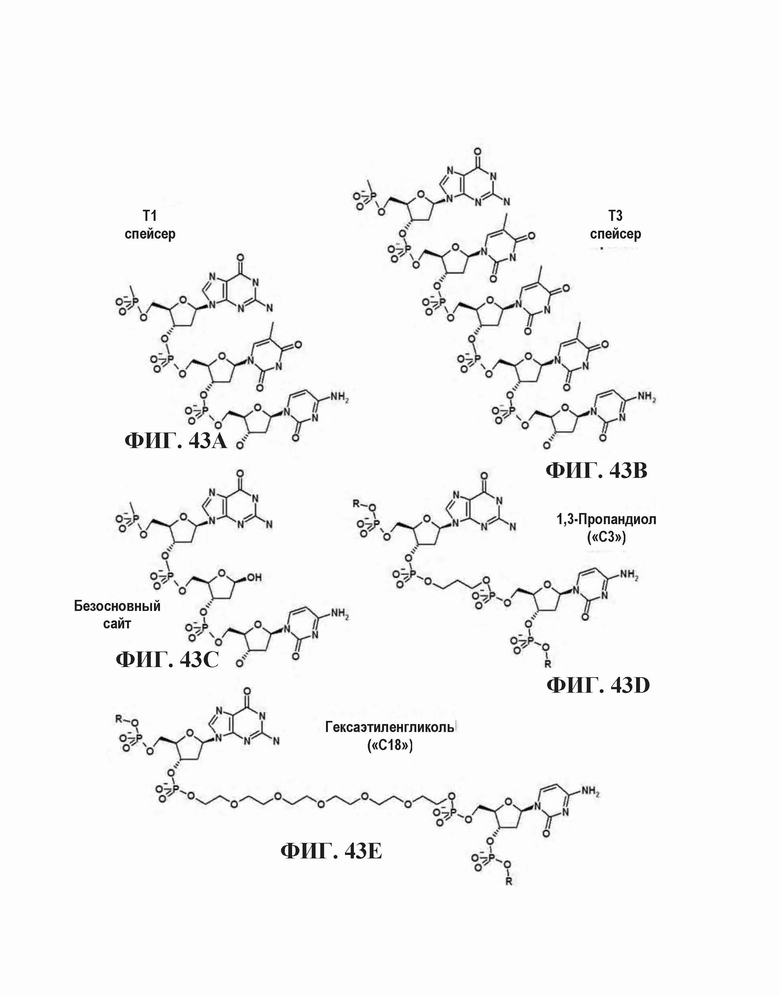
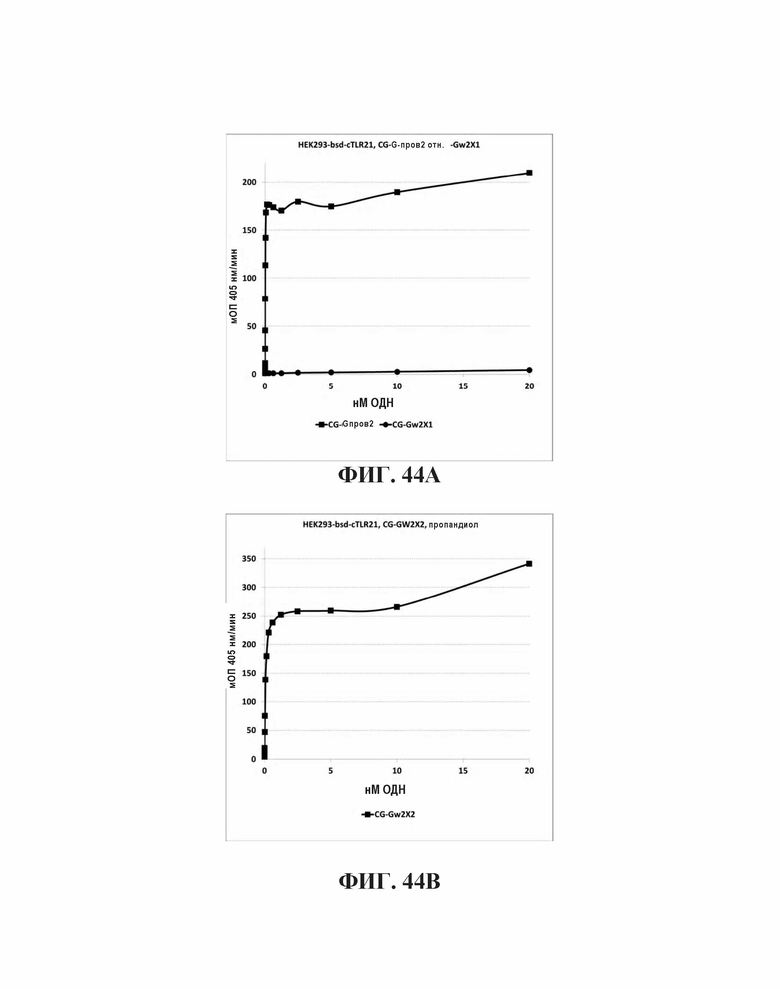
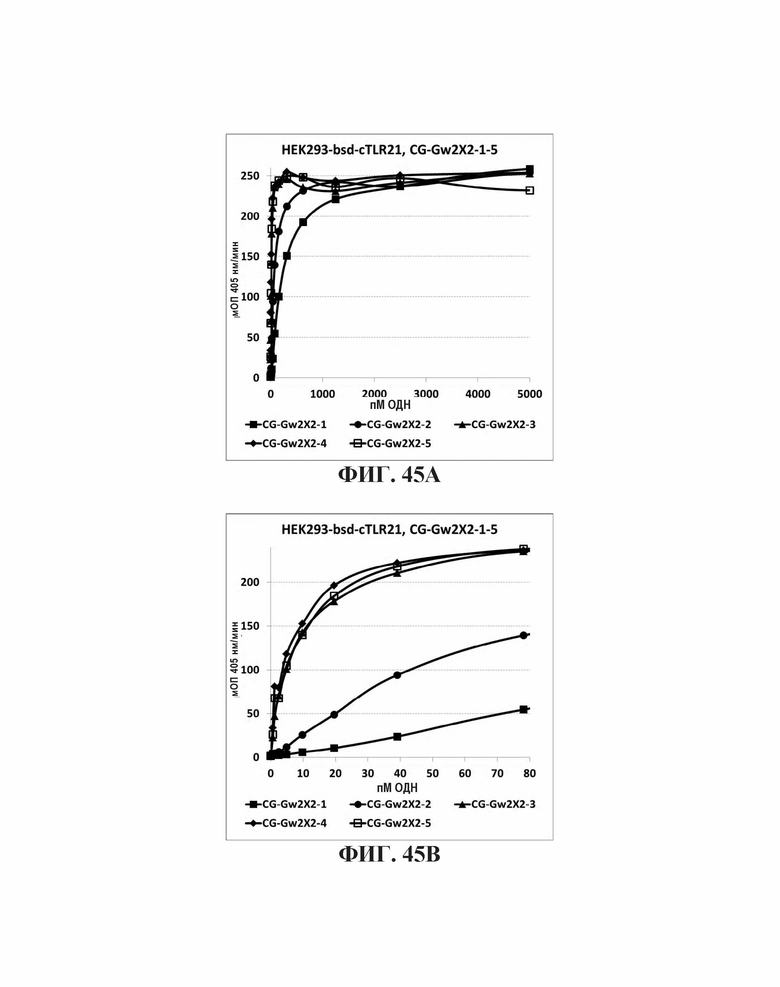
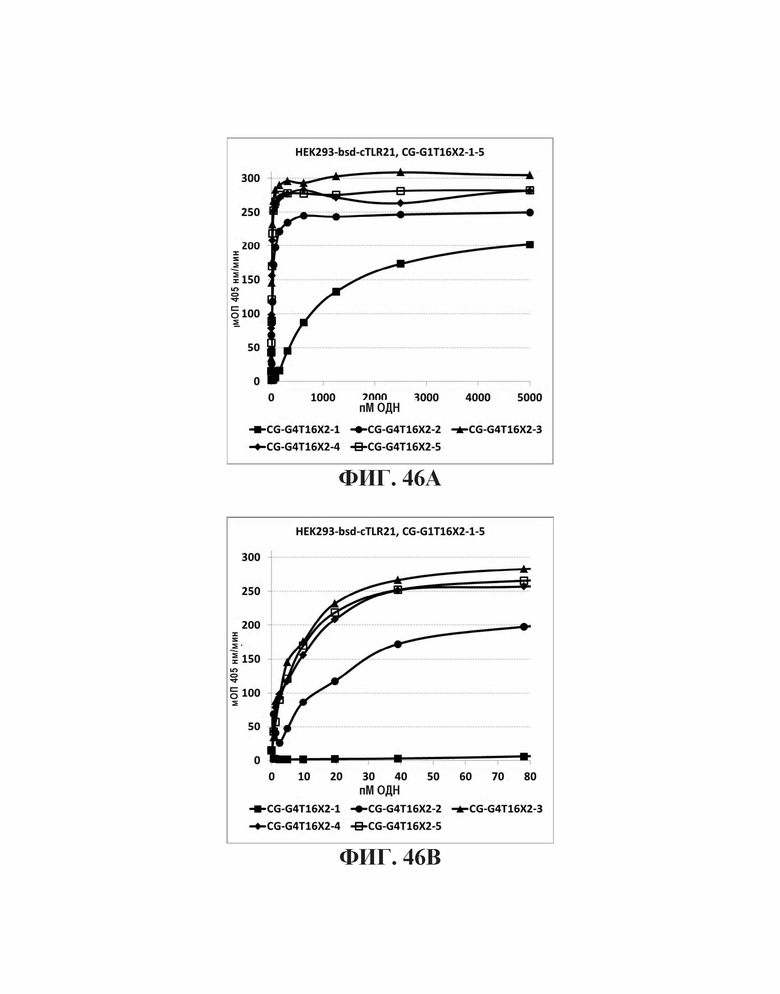
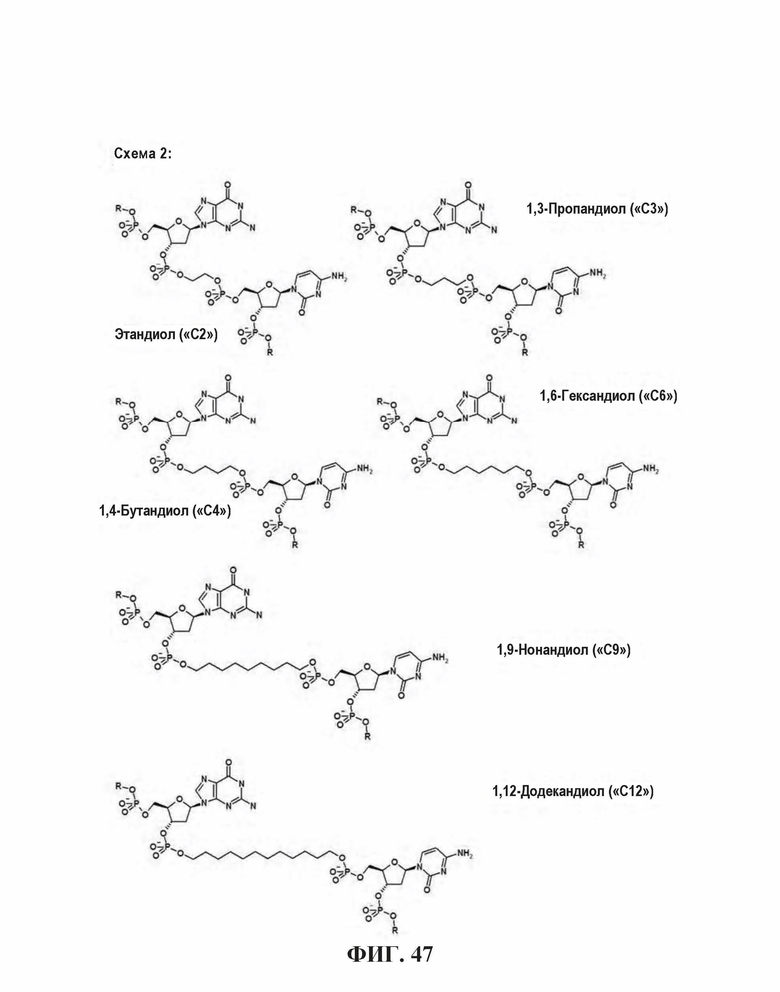
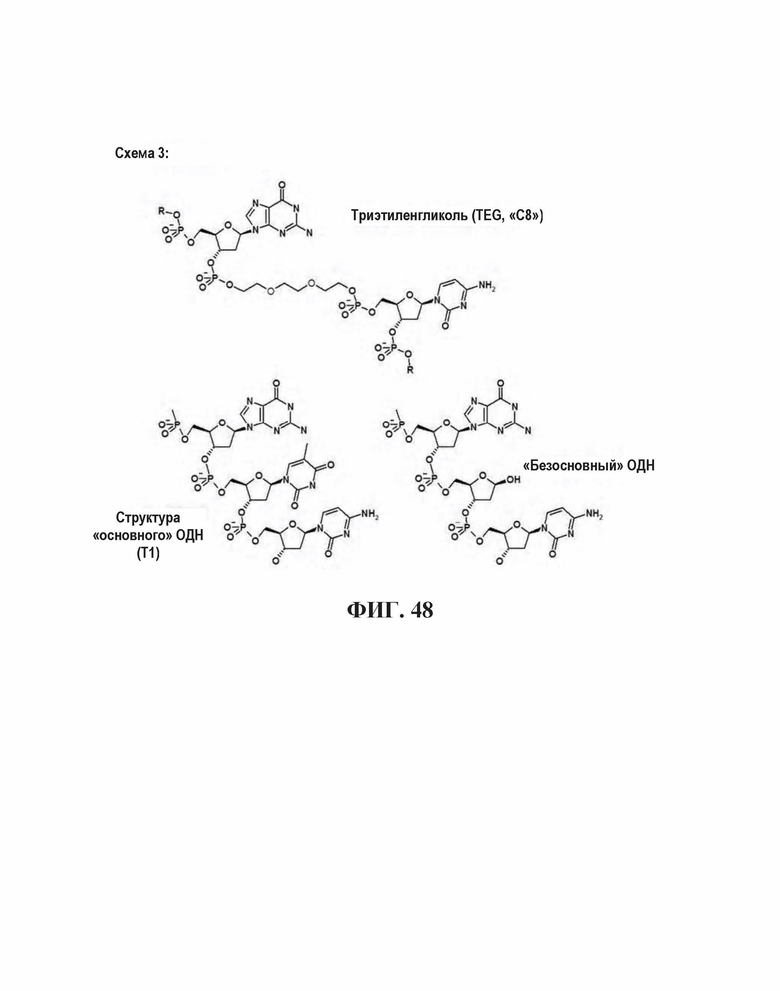
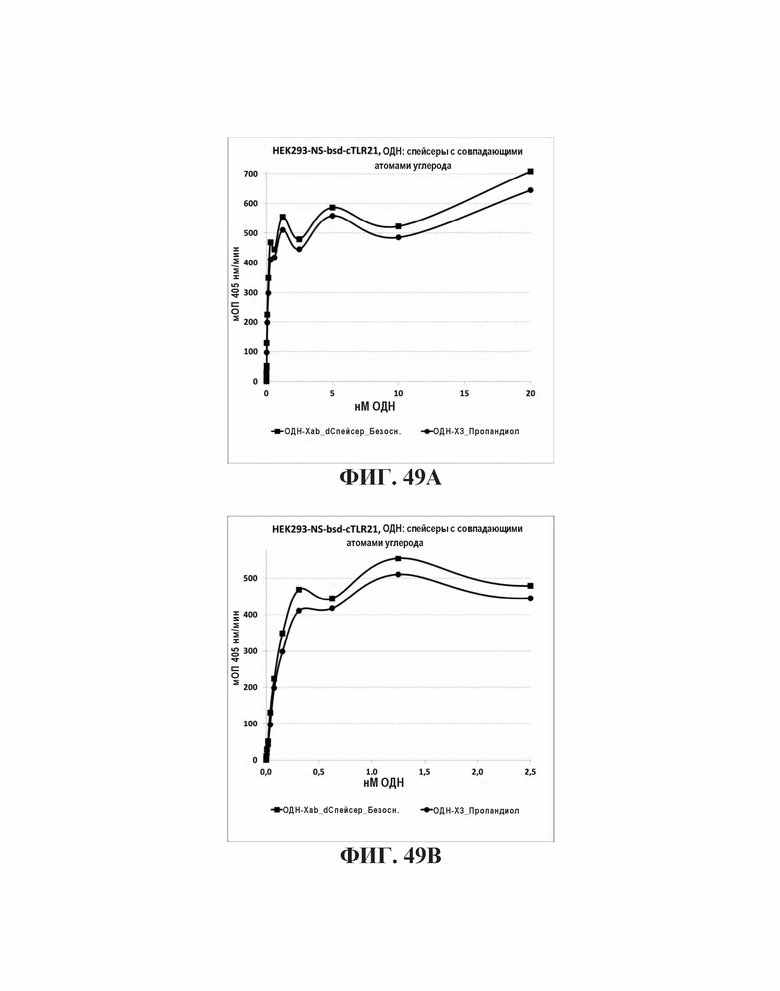
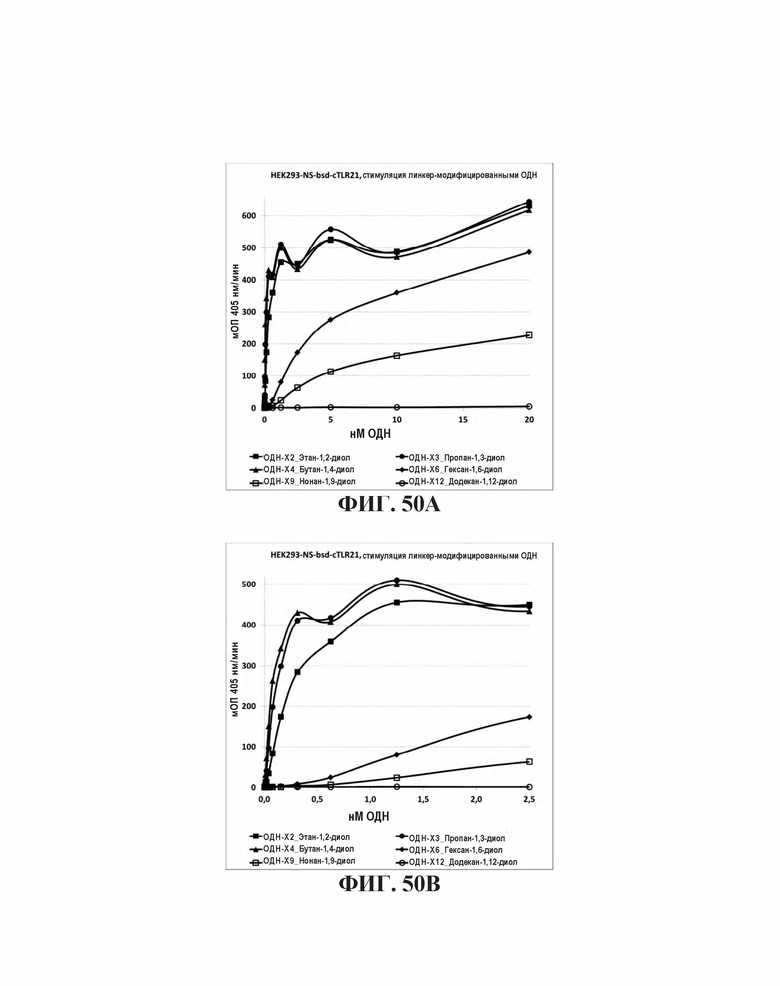
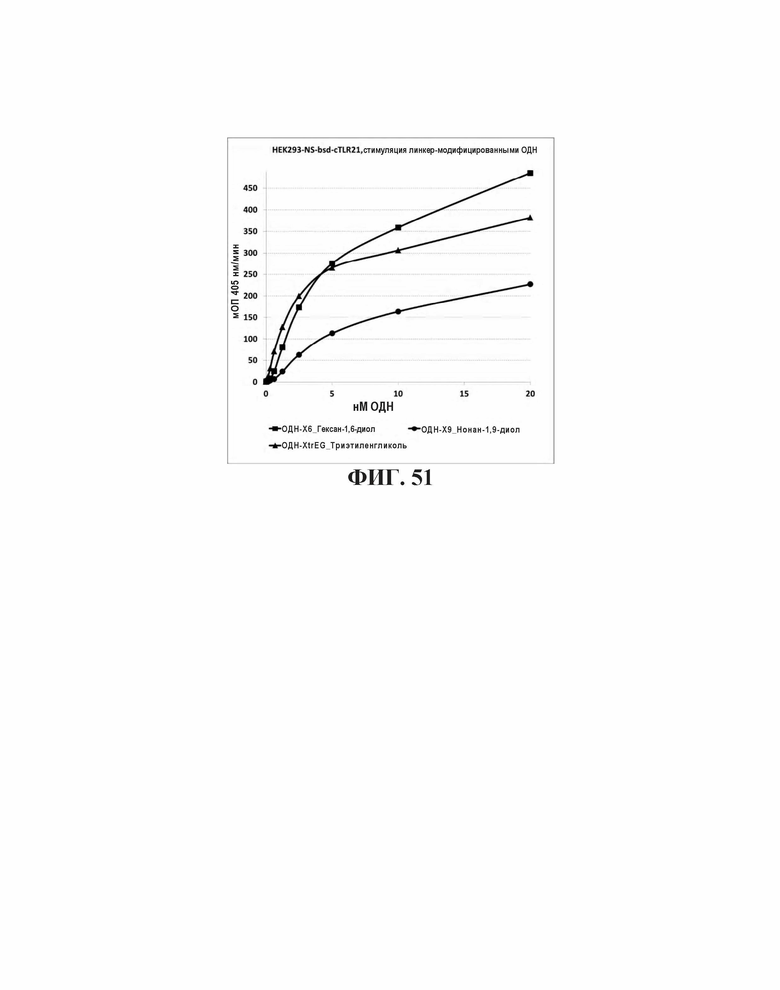
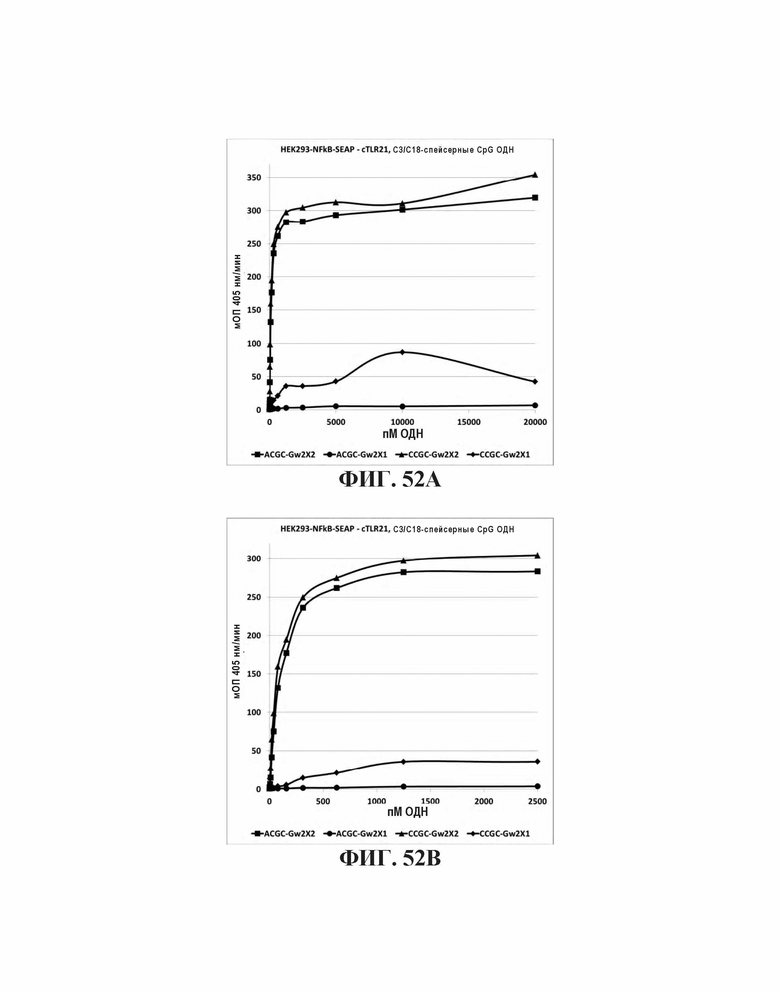
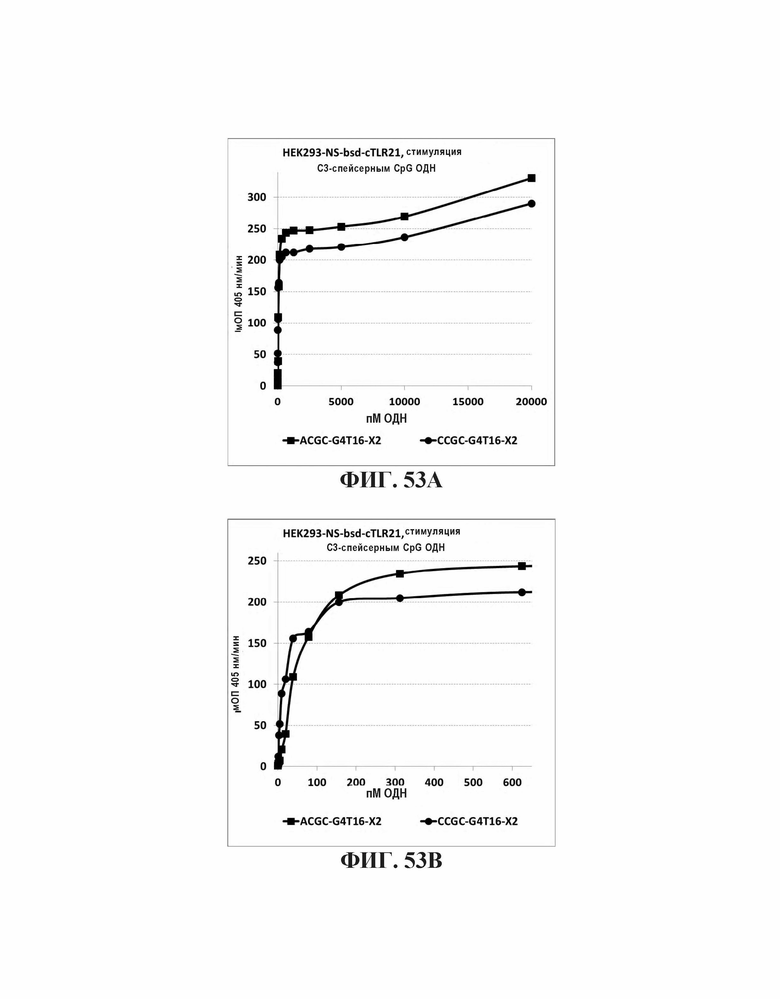
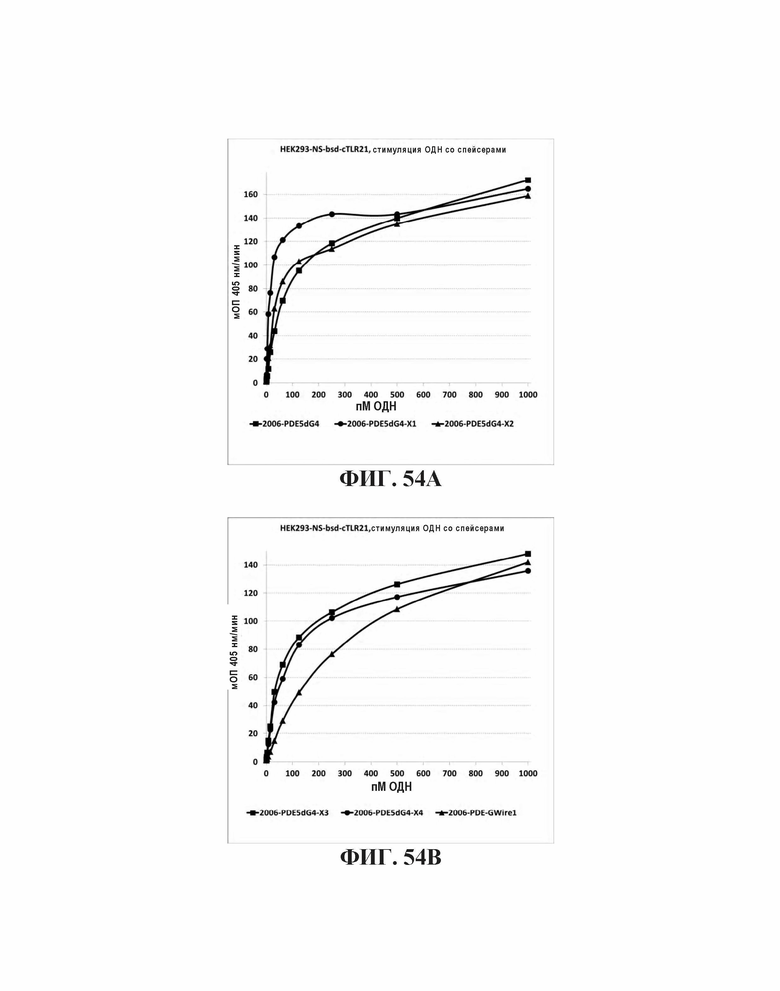
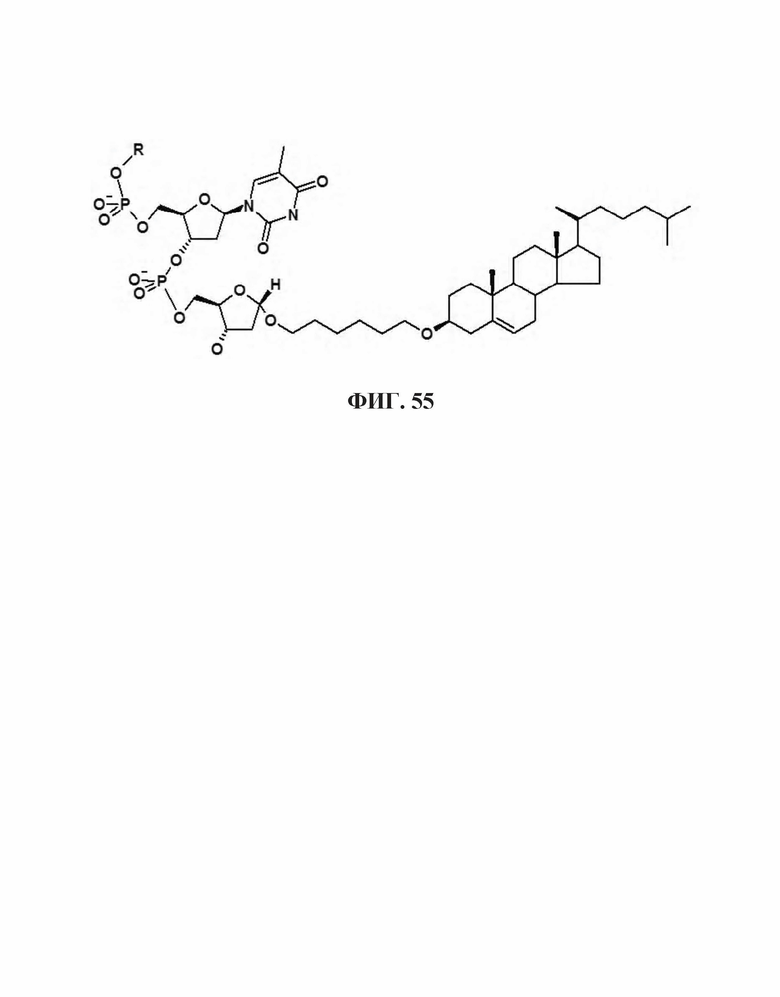
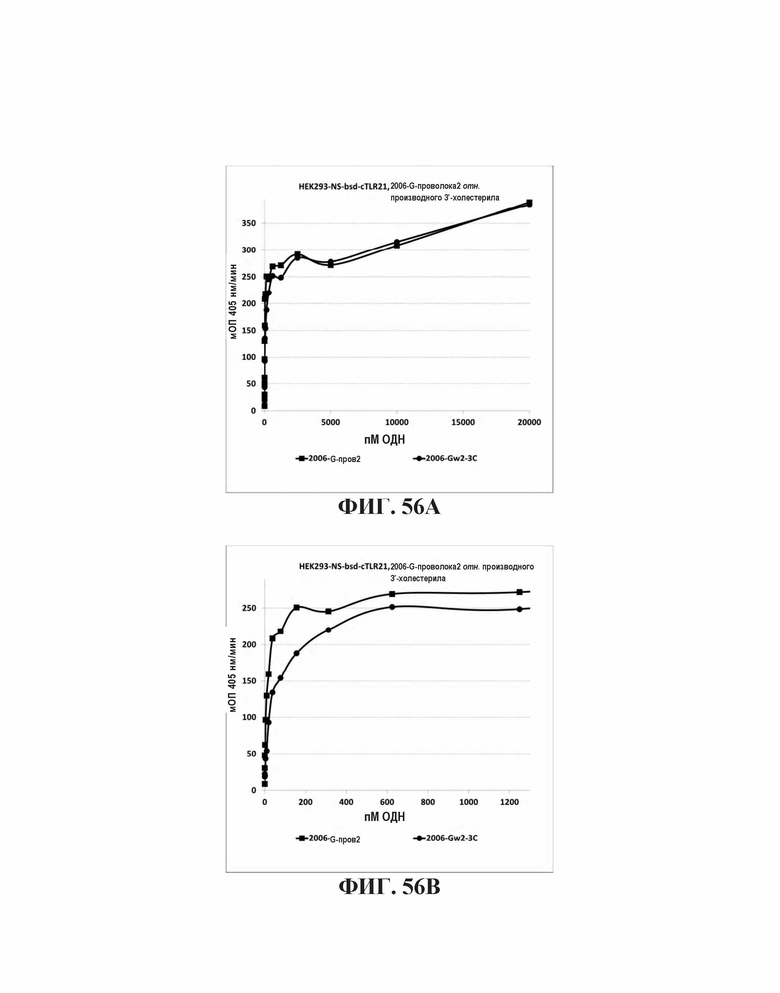

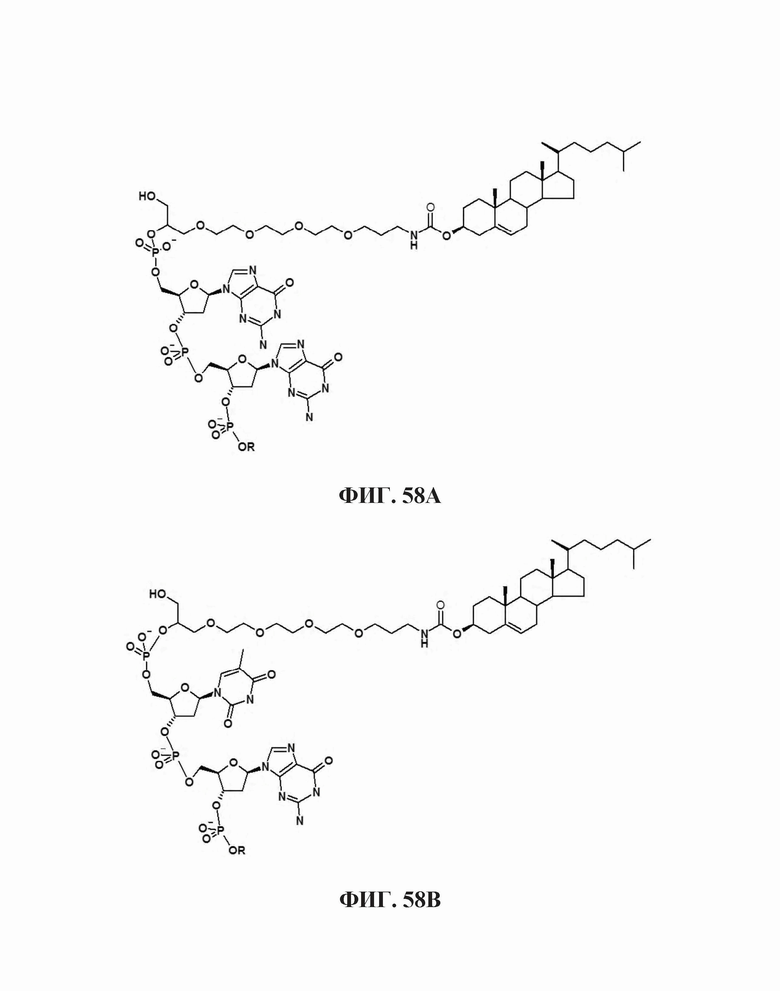
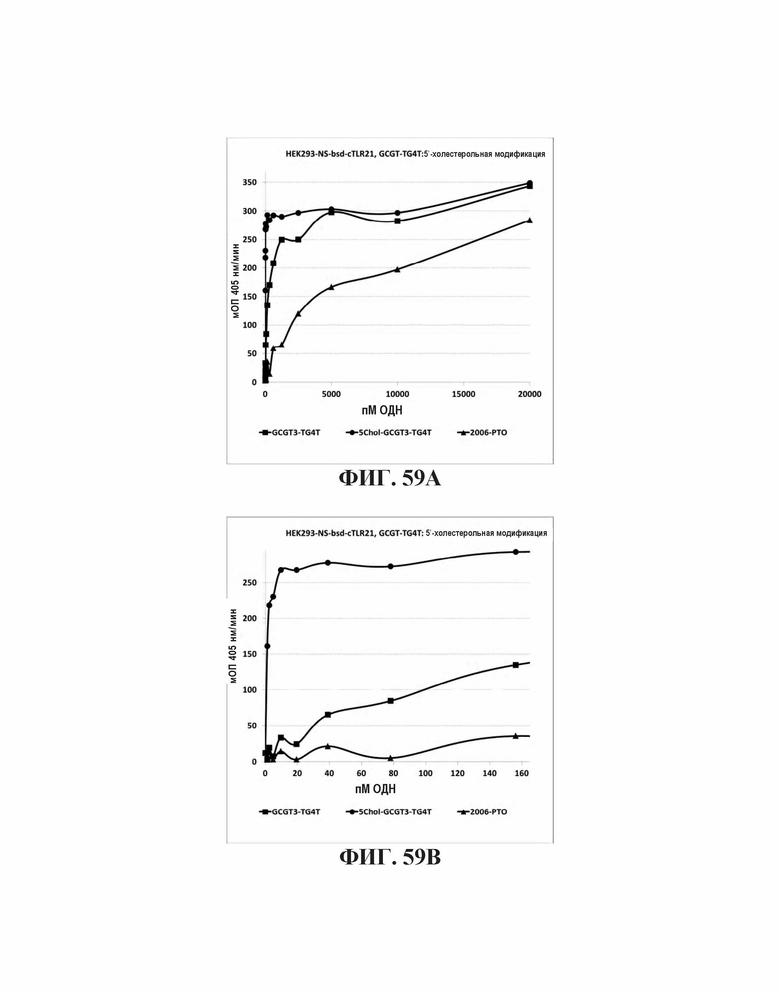
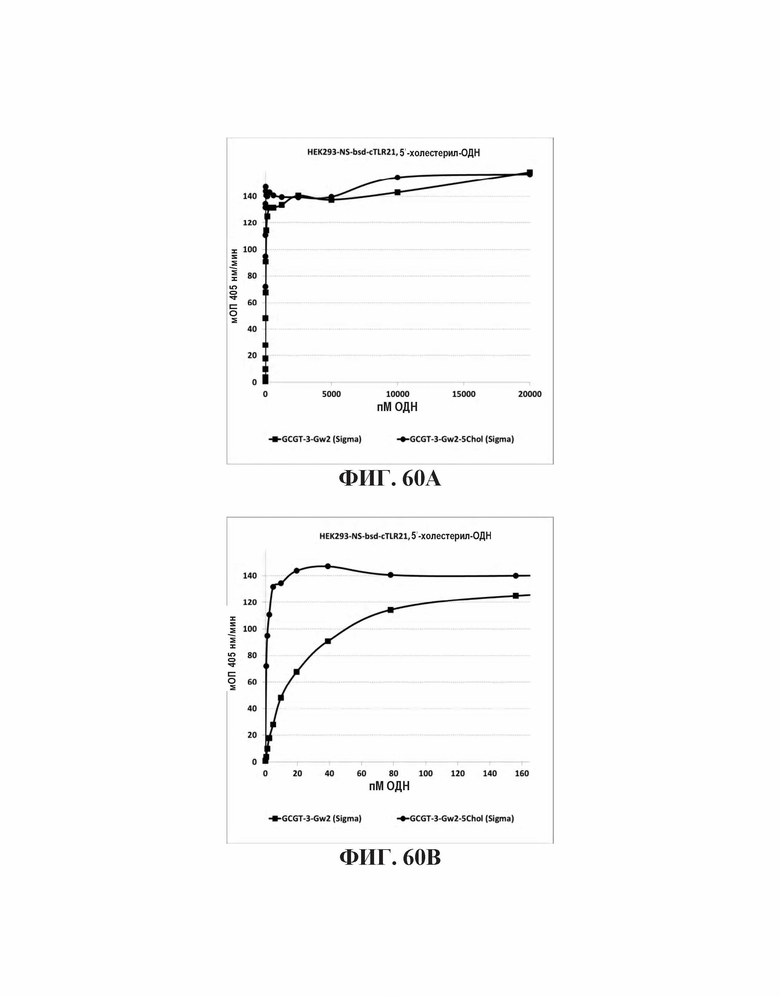
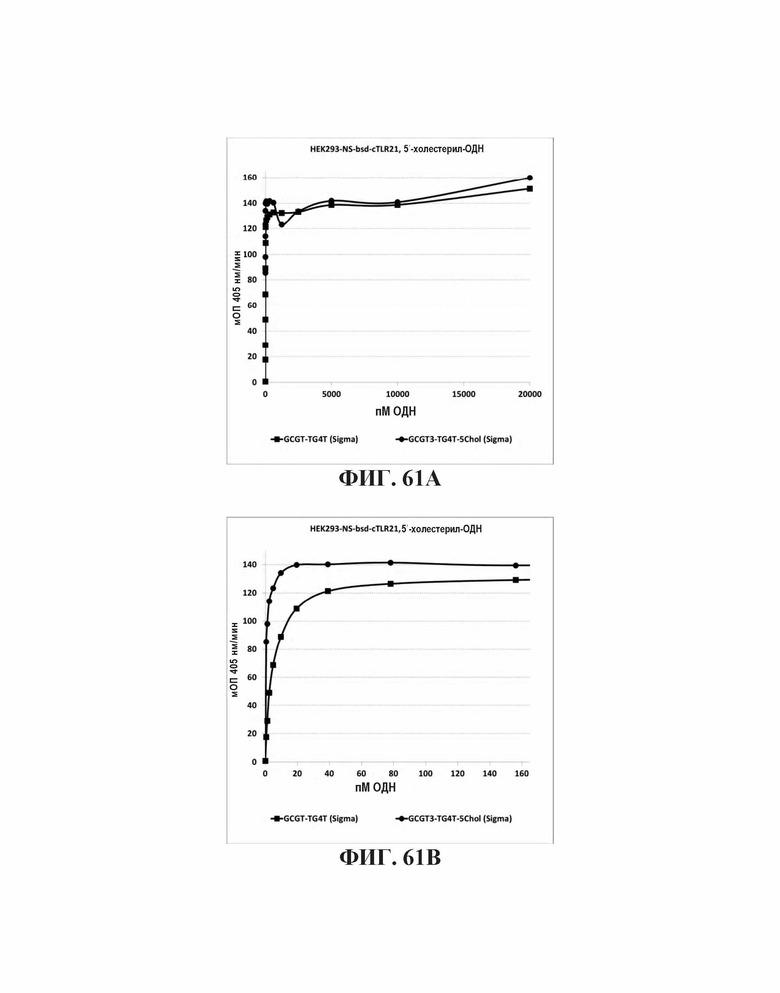
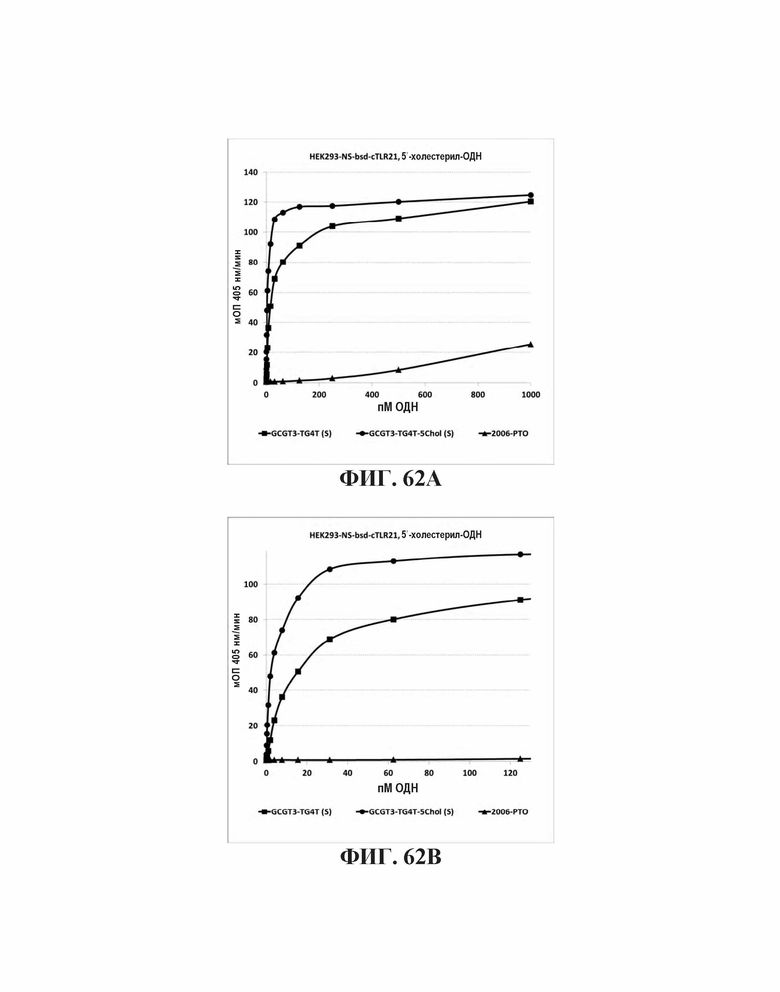
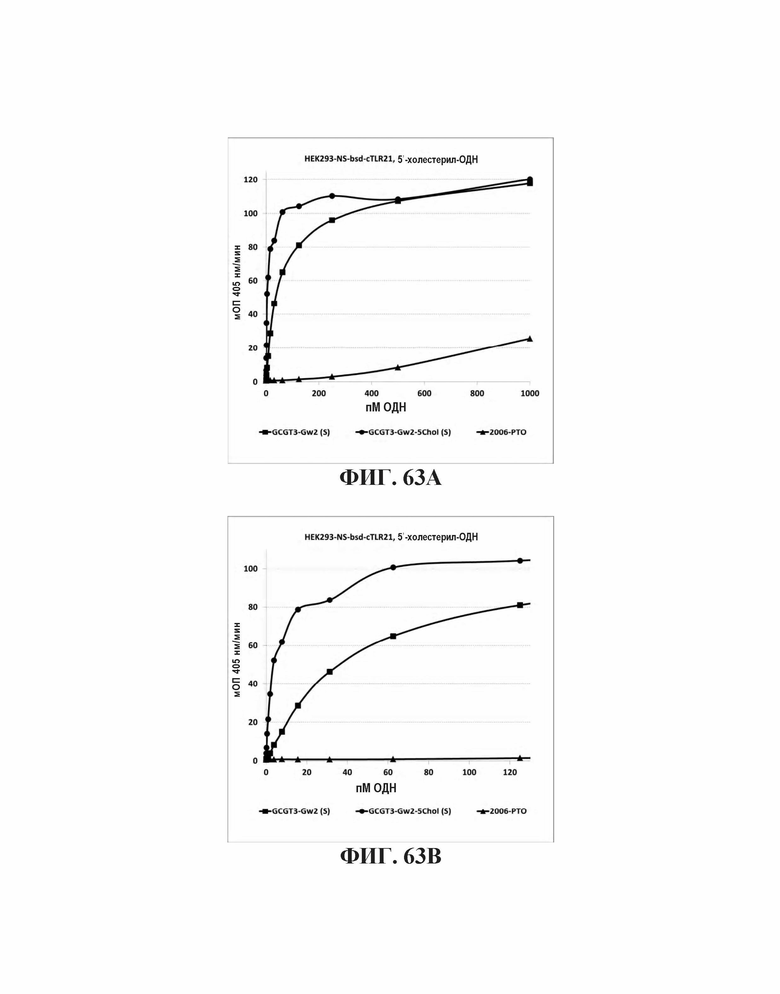


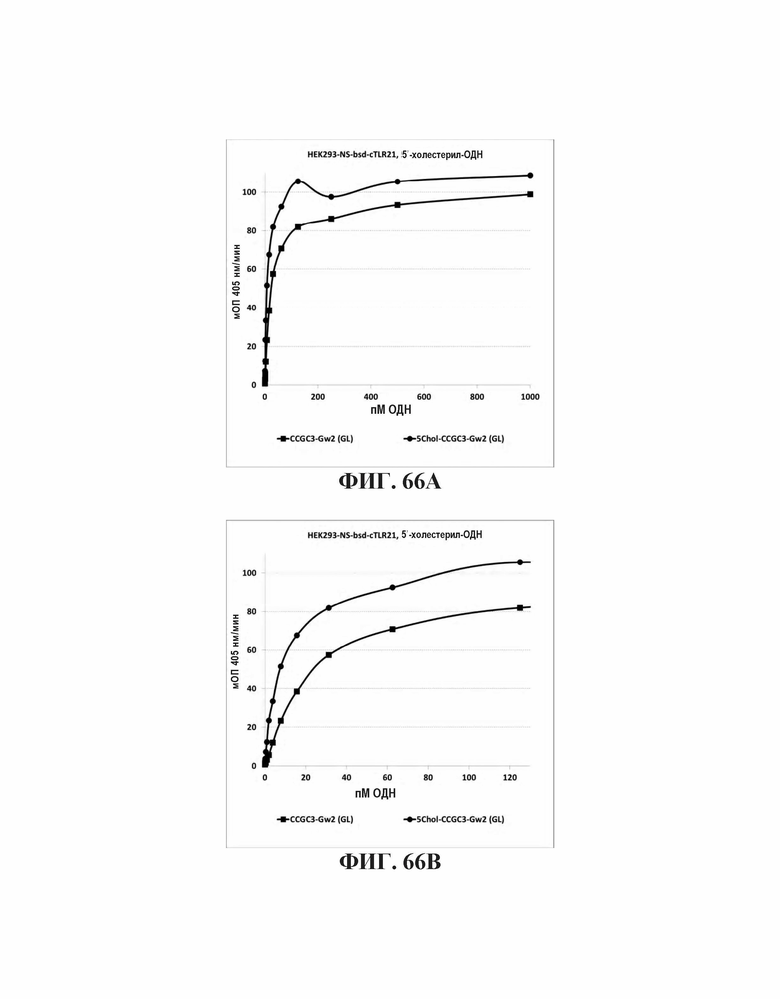
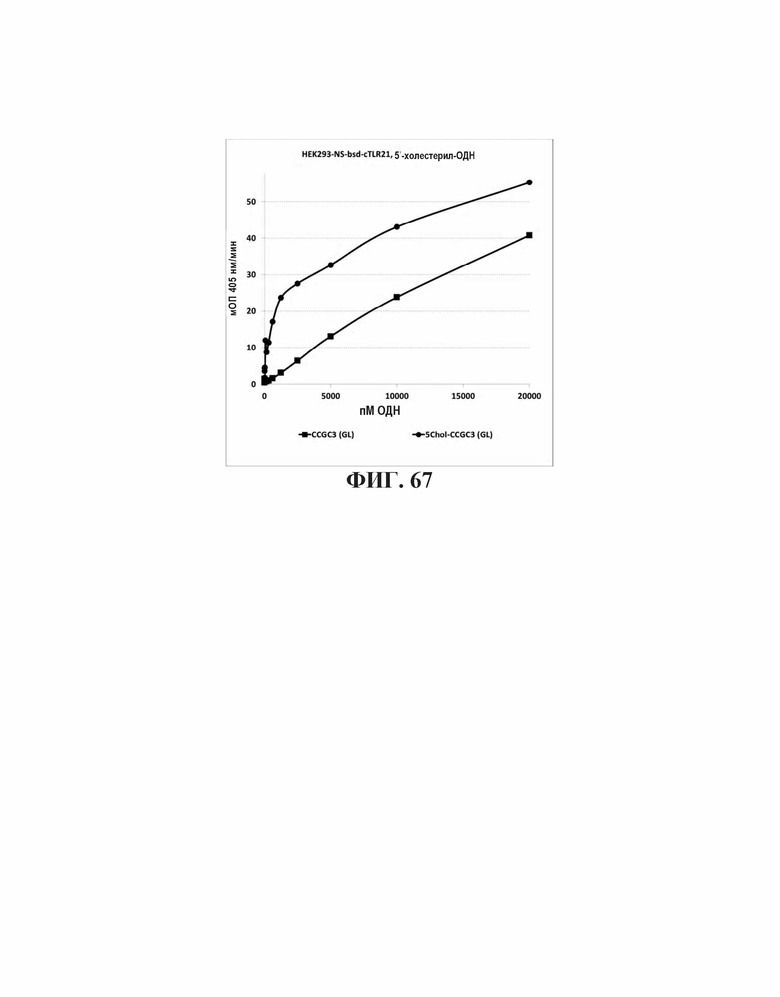
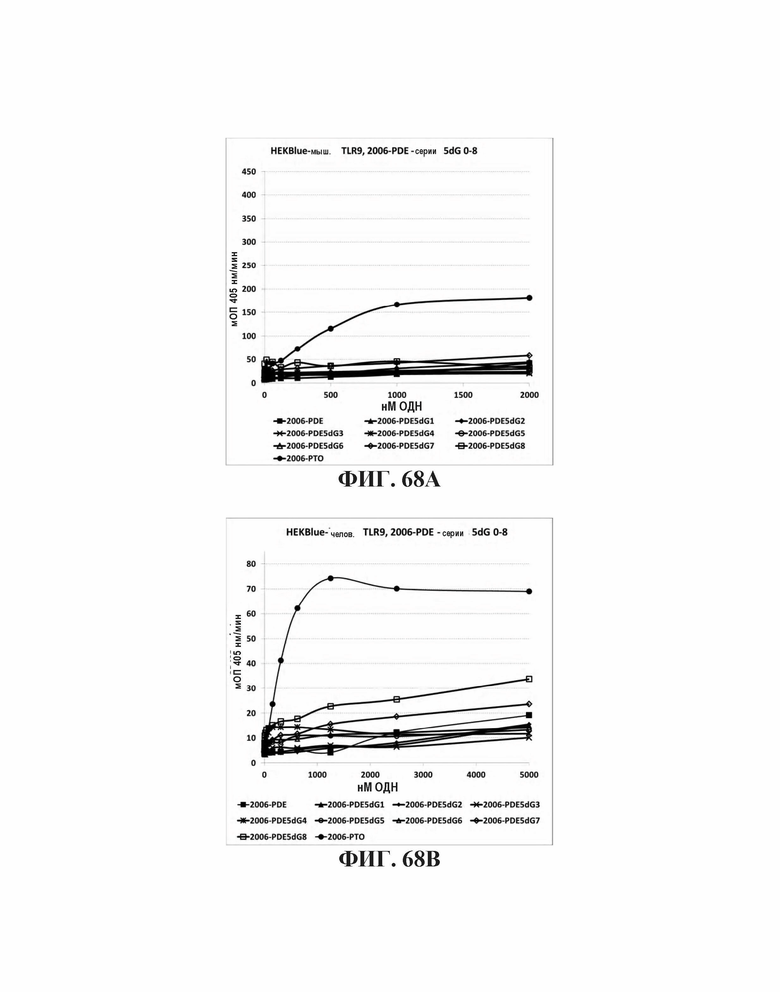
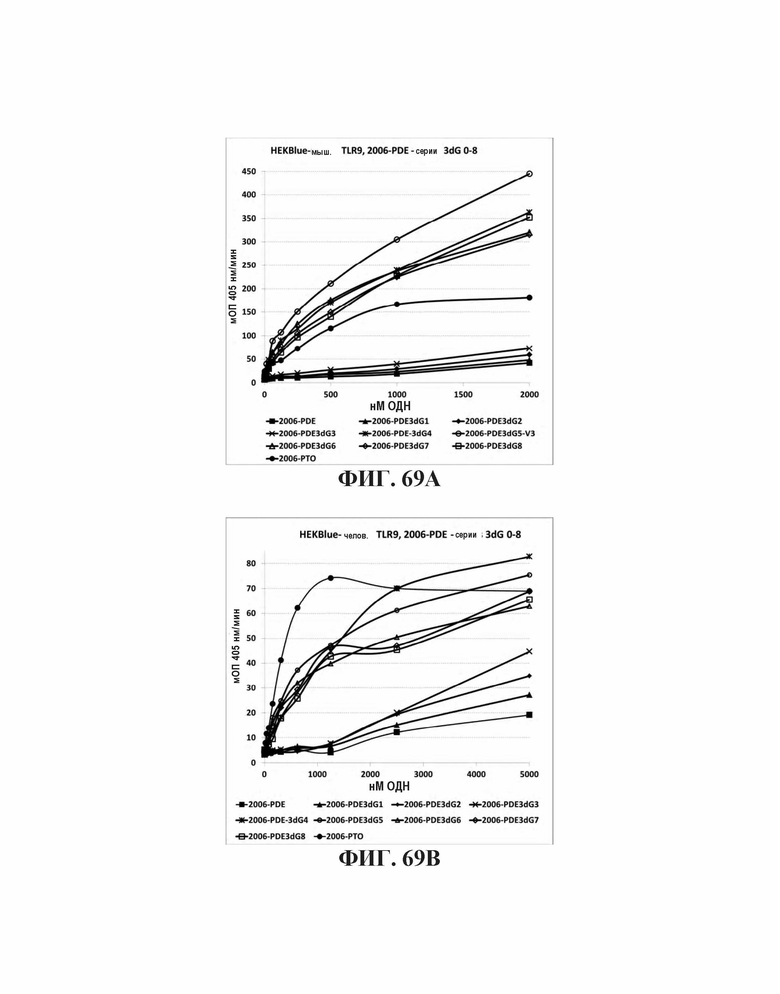
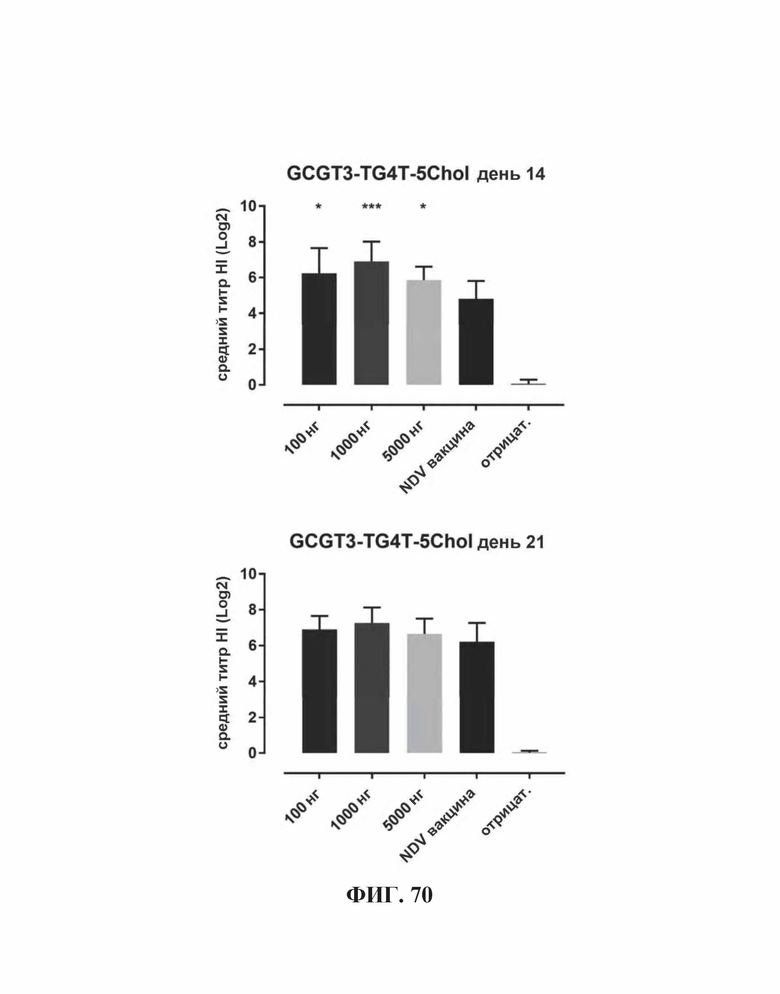
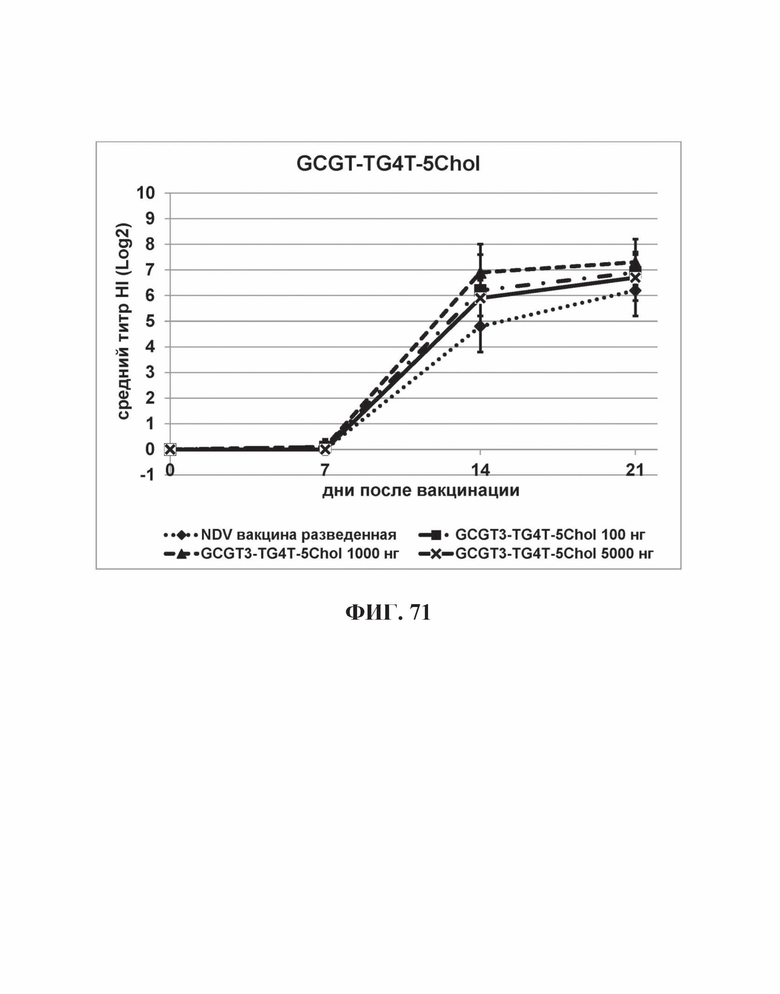
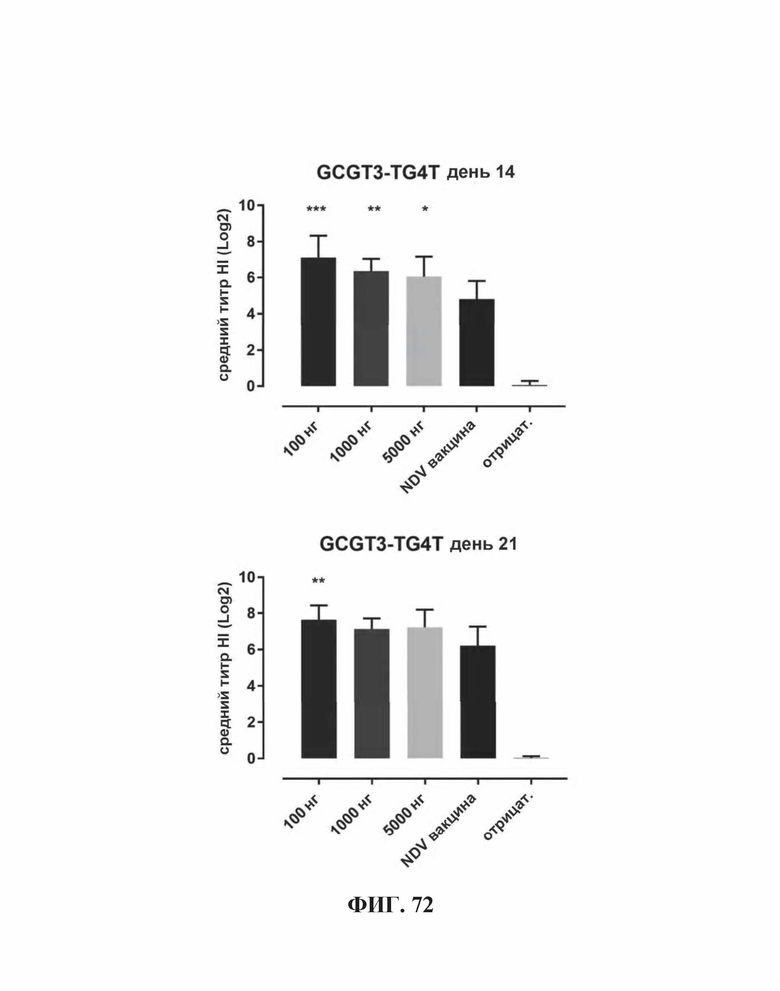
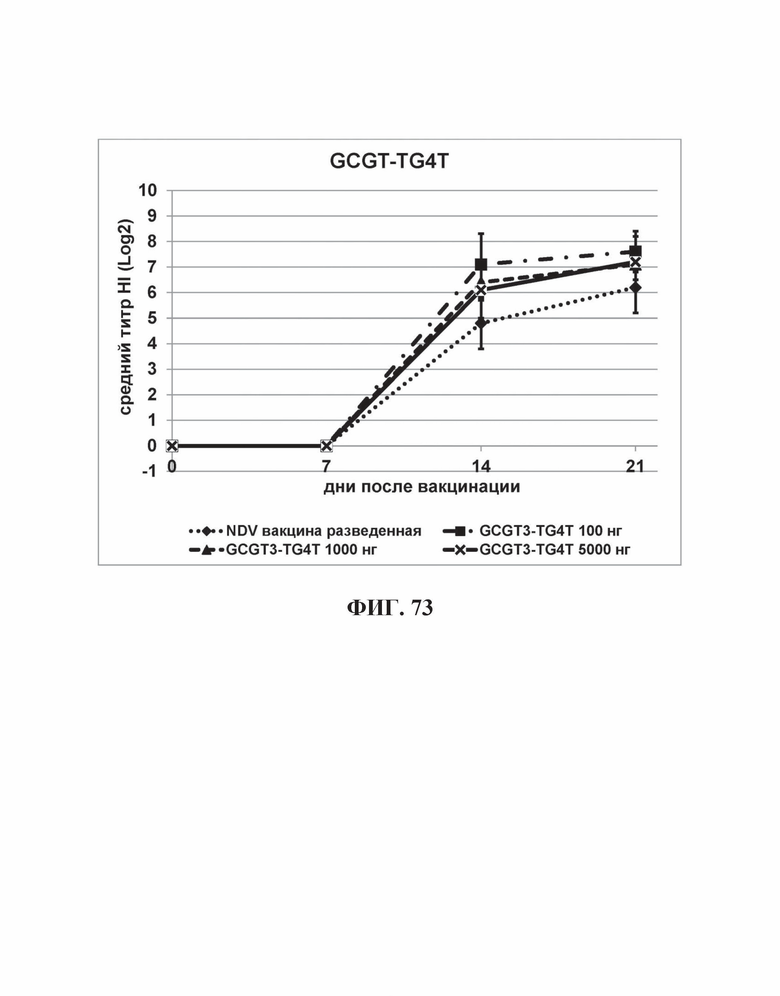
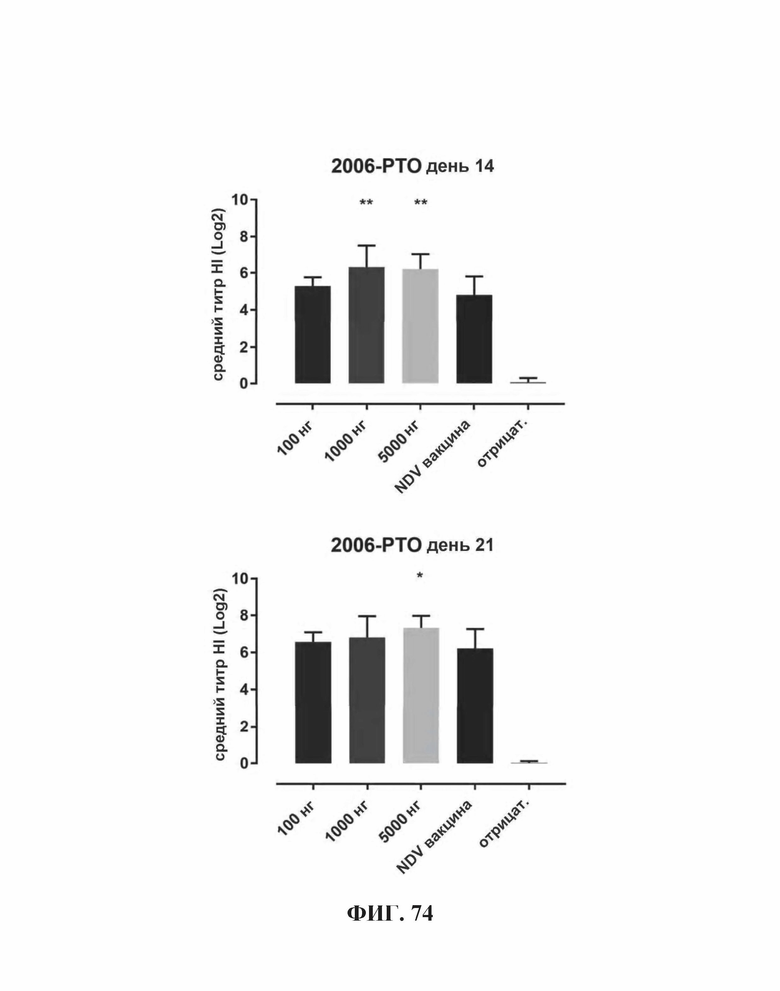
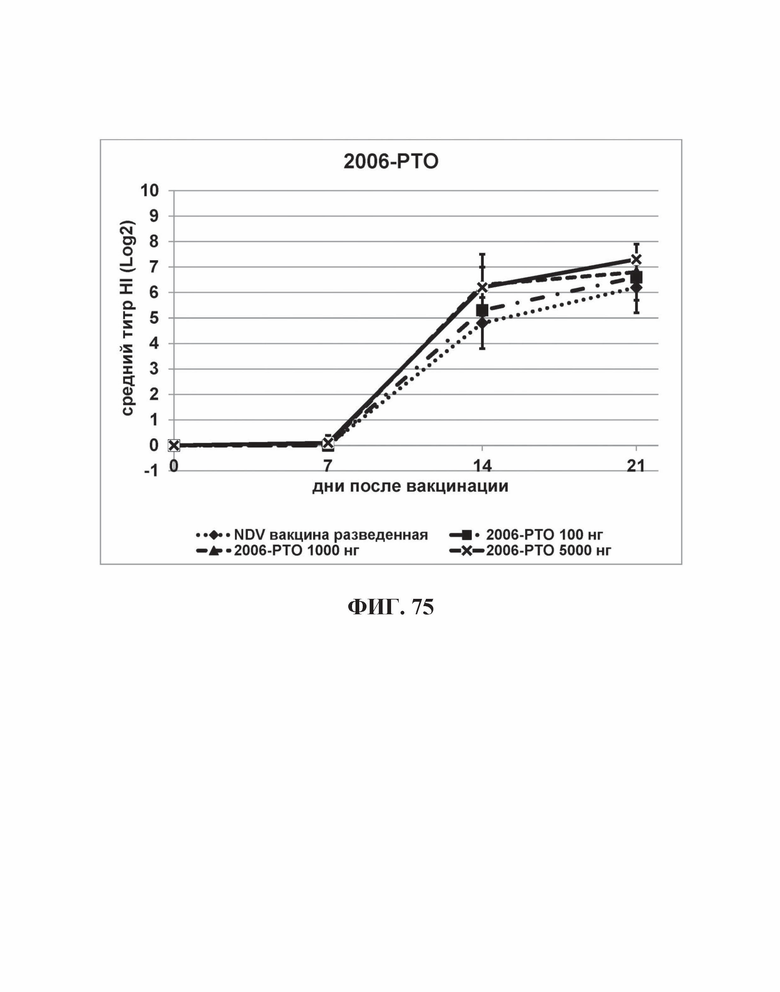
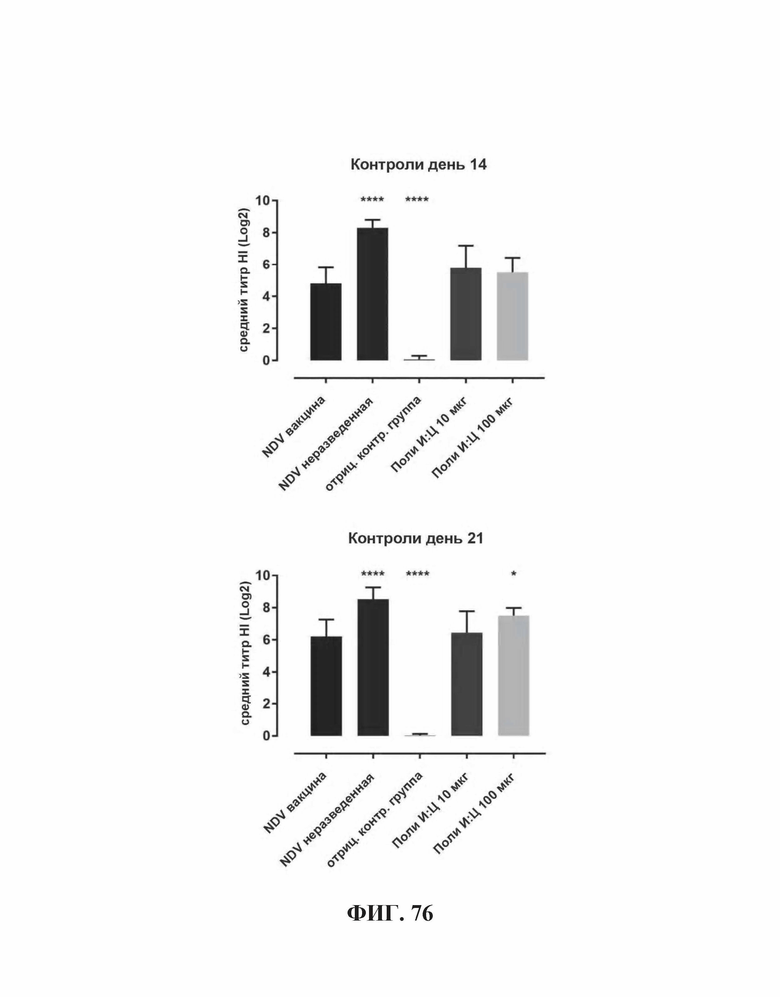
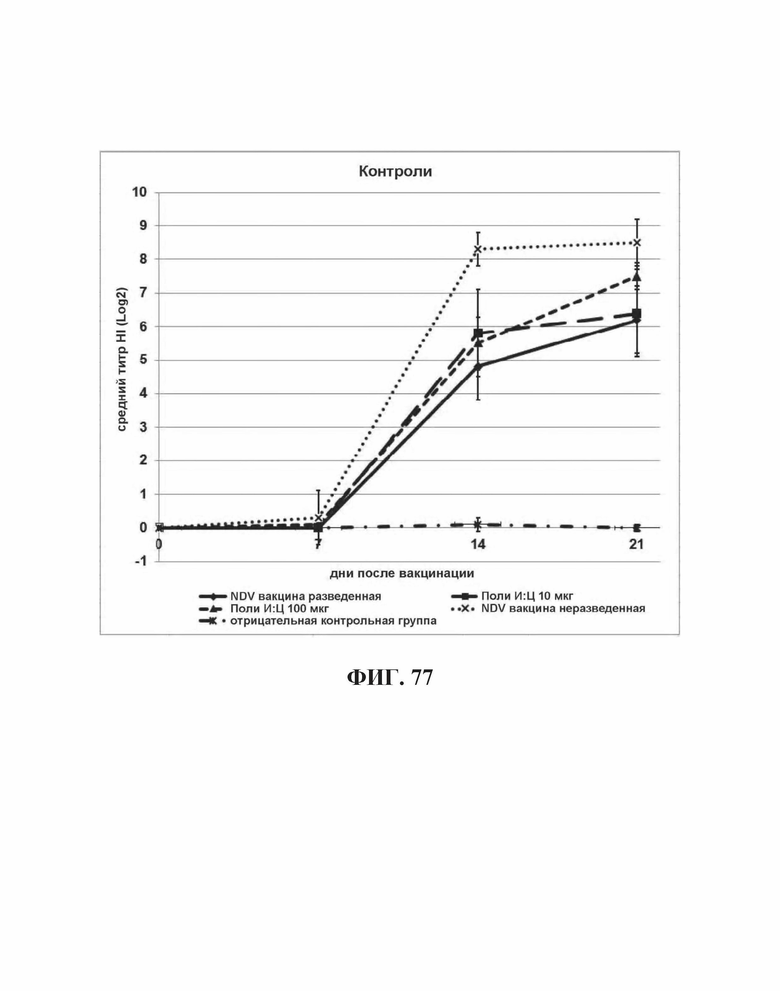
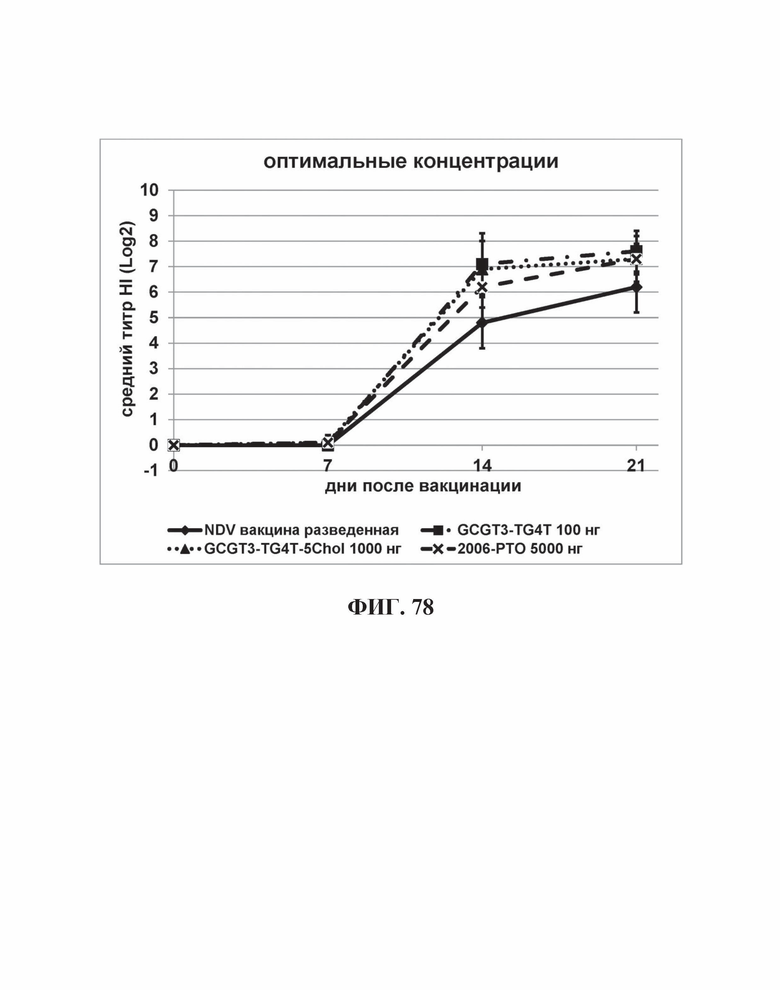
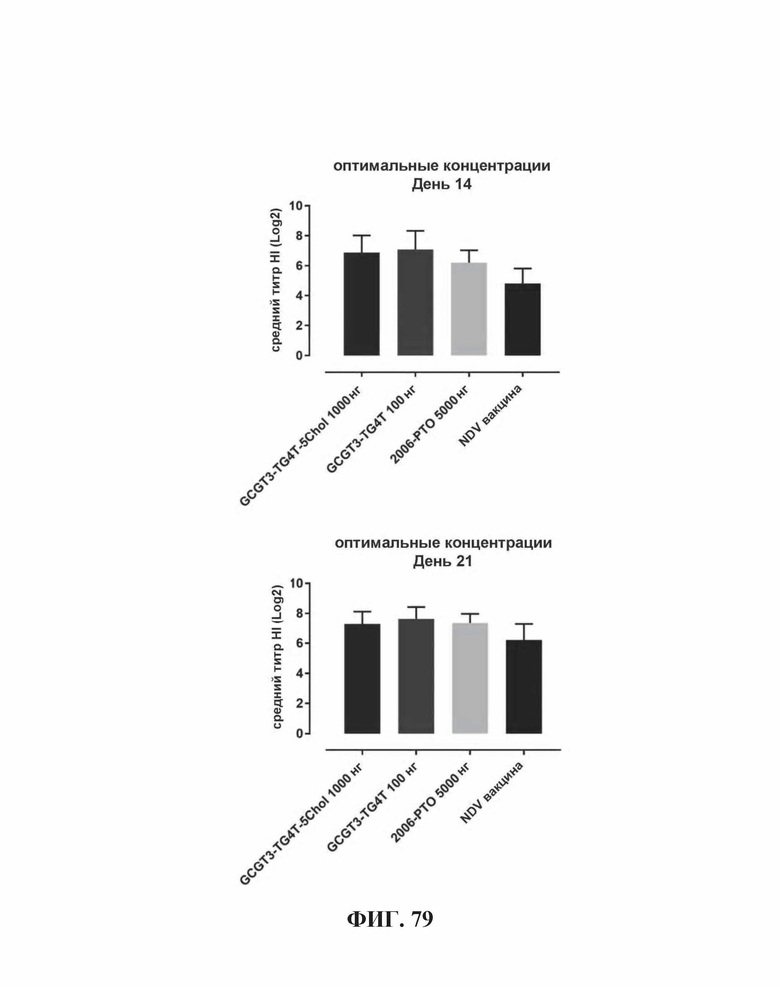
Изобретение относится к области биотехнологии. Описана группа изобретений, включающая иммуностимулирующий олигонуклеотид, стимулирующий толл-подобный рецептор 21 (TLR21), вакцина для предупреждения или лечения болезни Ньюкасла, вектор экспрессии, иммуностимулирующая композиция для стимуляции толл-подобного рецептора 21 (TLR21), способ стимуляции толл-подобного рецептора 21 (TLR21) и способ вызывания иммунного ответа, опосредованный толл-подобным рецептором 21 (TLR21). В одном из вариантов реализации иммуностимулирующий олигонуклеотид содержит по меньшей мере один CpG мотив и обогащенную гуаниновыми нуклеотидами последовательность. Изобретение расширяет арсенал средств, стимулирующих TLR21. 6 н. и 1 з.п. ф-лы, 79 ил., 65 табл., 10 пр.
1. Иммуностимулирующий олигонуклеотид, стимулирующий толл-подобный рецептор 21 (TLR21), содержащий по меньшей мере один CpG мотив и обогащенную гуаниновыми нуклеотидами последовательность, начинающуюся на или в пределах четырех нуклеотидов от 5'-конца олигонуклеотида, где олигонуклеотид содержит нуклеотидную последовательность SEQ ID NO: 16, 17, 18, 19, 20, 21, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 77, 78, 81, 82, 85, 86, 89, 90, 92, 93, 96, 97, 100, 102, 104, 106, 108, 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 124, 125, 126, 127, 129, 130, 131, 134, 136, 137, 138, 143 или 252.
2. Вакцина для предупреждения или лечения болезни Ньюкасла, содержащая эффективное количество олигонуклеотида по п. 1 и фармацевтически приемлемый носитель.
3. Вектор экспрессии, содержащий олигонуклеотид по п. 1.
4. Иммуностимулирующая композиция для стимуляции толл-подобного рецептора 21 (TLR21), содержащая эффективное количество олигонуклеотида по п. 1 и фармацевтически приемлемый носитель.
5. Иммуностимулирующая композиция по п. 4, где олигонуклеотид и носитель связаны.
6. Способ стимуляции толл-подобного рецептора 21 (TLR21), включающий введение субъекту, который в этом нуждается, иммуностимулирующего олигонуклеотида по п. 1.
7. Способ вызывания иммунного ответа, опосредованного толл-подобным рецептором 21 (TLR21), у субъекта, включающий введение субъекту, который в этом нуждается, иммуностимулирующего олигонуклеотида по п. 1.
| Способ травления железа и других металлов | 1928 |
|
SU8741A1 |
| ИММУНОСТИМУЛИРУЮЩИЕ НУКЛЕИНОВЫЕ КИСЛОТЫ | 2000 |
|
RU2245149C2 |
| Иммуностимулирующие олигонуклеотиды | 2012 |
|
RU2610690C2 |
| WO 2008068638 A2, 12.06.2008. | |||
Авторы
Даты
2023-05-11—Публикация
2018-12-07—Подача