ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
В настоящей заявке испрашивается приоритет и преимущества Европейских патентных заявок №№ ЕР17207740.6, ЕР 17207746.3, и ЕР 17207750.5, каждая была подана 15 декабря 2017 г., раскрытие которых полностью включено в настоящую заявку в качестве ссылки. ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Настоящая заявка содержит перечень последовательностей, который был подан электронно в ASCII формате и, таким образом, полностью включен в качестве ссылки. Указанная ASCII копия, созданная 30 ноября 2018 г., называется BHC_168027_SL.txt и имеет размер 92167 байт.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Обеспечиваются композиции и способы стимуляции толл-подобного рецепторного белка 21 (TLR21). Более конкретно, в настоящей заявке описаны иммуностимулирующие олигонуклеотиды и композиции, способы получения иммуностимулирующих олигонуклеотидов и композиций, и способы стимуляции TLR21.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Иммунные системы позвоночных в процессе эволюции сформировали молекулярные механизмы для распознавания инвазивных патогенов и инициации клеточных сигнальных путей для активного противодействия инфекции. Некоторые из молекулярных механизмов являются специфическими для конкретного микроорганизма и задействуют биомолекулы, такие как антитела, которые распознают антигены клеточной поверхности одного единственного из видов патогенов. К сожалению, патоген-специфические защитные механизмы не являются полностью эффективными, так как у некоторых животных не развивается приобретенная резистентность даже после начала развития инфекции, и, в некоторых случаях, патоген в процессе эволюции сформировал скрытие возможности для ускользания от защитных механизмов позвоночных.
Позвоночные также распознают инфекции в более широком смысле и это распознавание приводит к неспецифическим иммунным ответам, таким как увеличение экспрессии цитокинов. Эта защита может быть вызвана, когда клеточные рецепторы связываются с ассоциированными с патогеном характерными молекулярными структурами (РАМР). Это взаимодействие между РАМР и когнатным рецептором хозяина для РАМР может инициировать иммунный ответ. Например, толл-подобный рецепторный белок 21 (TLR21) представляет собой куриный функциональный гомолог TLR9 млекопитающего и способен распознавать неметилированные CpG мотивы, которые имеют более высокое содержание CpG в микроорганизмах по сравнению с позвоночными. Известные методологии используют этот путь неспецифического иммунного ответа путем введения плазмид или олигонуклеотидов, имеющих неметилированные CpG мотивы, и было показано, что активация TLR21 с помощью нуклеиновых кислот, содержащих CpG мотивы, активирует клеточные сигналы, задействованные в иммунные ответы на заражение патогенными микроорганизмами. Тем не менее, введение иммуностимулирующих плазмид или олигонуклеотидов отдельно может быть неспособным вызывать ответ, достаточный для борьбы с инфекцией.
Производители животноводческой продукции в промышленном масштабе очень сильно нуждаются в альтернативе лечению инфекций с применением антибиотиков. Потребители оказывают существенное давление на этих производителей для получения продуктов без применения антибиотиков, и, в то же время, возрастающее количество случаев инфицирования вследствие резистентности патогенов к антибиотикам иллюстрирует опасности профилактического введения антибиотиков большим популяциям. Аналогичным образом, резистентность к антибиотикам становится национальной чрезвычайной ситуацией при медицинском обслуживании людей. Больницы и кабинеты врачей становятся отправной точкой возникновения резистентных к лекарственным средствам бактерий, таких как резистентный ко многим лекарственным средствам Staphylococcus aureus (MRSA).
Таким образом, существует потребность в иммуностимулирующих композициях и способы вызывания неспецифических иммунных ответов по отношению к патогенам. Описанные способы и композиции направлены на эти и другие чрезвычайно важные потребности.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В настоящей заявке описаны иммуностимулирующие композиции, содержащие иммуномодулирующую композицию, содержащую плазмидную нуклеиновую кислоту и липосомный носитель; и иммуностимулирующий олигонуклеотид, имеющий по меньшей мере один CpG мотив и обогащенную гуаниновыми нуклеотидами последовательность на или возле 5'-конца иммуностимулирующего олигонуклеотид а
Также в настоящей заявке описаны способы получения иммуностимулирующей композиции, включающие комбинирование иммуномодулирующей композиции, содержащей плазмидную нуклеиновую кислоту и иммуностимулирующий олигонуклеотид с образованием иммуностимулирующей композиции, центрифугирование иммуностимулирующей композиции для получения супернатанта и осадка; и выделение осадка.
Кроме того, обеспечиваются способы стимуляции TLR21, включающие введение субъекту иммуностимулирующего олигонуклеотида и иммуномодулирующей композиции, где иммуностимулирующий олигонуклеотид содержит по меньшей мере один CpG мотив и обогащенную гуаниновыми нуклеотидами последовательность на или возле 5'-конца иммуностимулирующего олигонуклеотида, и где иммуномодулирующая композиция содержит некодирующую плазмидную нуклеиновую кислоту и катионный липидный носитель.
Также описаны способы вызывания иммунного ответа у субъекта путем введения иммуностимулирующего олигонуклеотида и иммуномодулирующей композиции, или иммуностимулирующей композиции, содержащей иммуностимулирующий олигонуклеотид и иммуномодулирующую композицию, субъекту, где иммуностимулирующий олигонуклеотид имеет по меньшей мере один CpG мотив и обогащенную гуаниновыми нуклеотидами последовательность на или возле 5'-конца иммуностимулирующего олигонуклеотида, и где иммуномодулирующая композиция содержит некодирующую плазмидную нуклеиновую кислоту и катионный липидный носитель
КРАТКОЕ ОПИСАНИЕ ФИГУР
Сущность изобретения, а также последующее подробное описание, становится более понятным в системной связи с приложенными фигурами. Для целей иллюстрации раскрытых композиций и способов, на фигурах представлены иллюстративные варианты осуществления композиций и способов; тем не менее, композиции и способы не ограничиваются специфическими раскрытыми вариантами осуществления изобретения. На фигурах:
На Фиг. 1 представлена химическая структура холестерильного компонента, присоединенного к тетраэтиленгликольному линкеру.
На Фиг. 2А и 2В сравниваются иммуногенности иммуностимулирующей плазмидной ДНК, плазмидной ДНК, связанной в комплекс с катионными липосомами, и иммуностимулирующих олигонуклеотидов. На Фиг. 2А сравниваются иммуногенности иммуностимулирующей плазмидной ДНК ("пДНК") и пДНК, связанной в комплекс с катионными липосомами ("пДНК-F"). На Фиг. 2 В сравниваются иммуногенности пДНК, пДНК-F, и иммуностимулирующего олигонуклеотида GCGT3-TG4T, имеющего 5'-холестерильную модификацию ("5Chol-GCGT3-TG4T").
На Фиг. 3А и 3В сравниваются иммуногенности иммуностимулирующей плазмидной ДНК, иммуностимулирующей плазмидной ДНК, связанной в комплекс с катионными липосомами, иммуностимулирующих олигонуклеотидов и их комбинаций. На Фиг. 3А сравниваются иммуногенности пДНК, пДНК-F, 5Chol-GCGT3-TG4T, пДНК в комбинации с 5'Chol-GCGT3-TG4T ("пДНК-5Chol-GCGT3-TG4T"), и пДНК-F в комбинации с 5Chol-GCGT3-TG4T ("пДНК-F-5Chol-GCGT3-TG4T"), где иммуностимулирующие олигонуклеотиды представлены в нМ концентрациях и пДНК и пДНК-F представлены в концентрациях мкг/мл. На Фиг. 3В представлены различия в иммуногенности между пДНК, пДНК-F, 5Chol-GCGT3-TG4T, пДНК в комбинации с 5'Chol-GCGT3-TG4T ("пДНК-5Chol-GCGT3-TG4T"), и пДНК-F в комбинации с 5Chol-GCGT3-TG4T ("пДНК-Е-5Chol-GCGT3-TG4T"), где иммуностимулирующие олигонуклеотиды представлены пМ концентрациях и пДНК и пДНК-F представлены в концентрациях нг/мл;
На Фиг. 4 иллюстрируется способность пДНК-F фракции стимулировать TLR21-опосредованные иммунные ответы в HEK293-bsd-cTLR21 клетках. Специфически, иммуногенность пДНК-F, которую хранили при температуре 4°С, сравнивается с иммуногенностью пДНК-F, полученной в осадке ("пДНК-F осадок") и супернатанте ("пДНК-F супернатант") центрифугированного образца.
На Фиг. 5А и 5В графически представлена способность генерировать TLR21-опосредованный иммунный ответ в HEK293-bsd-cTLR21 клетках для пДНК-Е-5Chol-GCGT3-TG4T и 5Chol-GCGT3-TG4T при высоких и низких концентрациях, соответственно.
На Фиг. 6А и 6В сравнивается способность высоких и низких концентраций, соответственно, пДНК-Е-5Chol-GCGT3-TG4T генерировать TLR21-опосредованный иммунный ответ в HEK293-bsd-cTLR21 клетках по сравнению с такой способностью для 5Chol-GCGT3-TG4T, полученной в осадке ("пДНК-F 5Chol осадок") и супернатанте ("пДНК-F 5Chol Супернатант") центрифугированного пДНК-F образца.
На Фиг. 7А и 7В сравнивается способность высоких и низких концентраций, соответственно, 5Chol-GCGT3-TG4T генерировать TLR21-опосредованный иммунный ответ в HEK293-bsd-cTLR21 по сравнению с такой способностью для 5Chol-GCGT3-TG4T, полученной в осадке ("5Chol осадок") и супернатанте ("5Chol Супернатант") центрифугированного пДНК-F образца.
На Фиг. 8А и 8В сравнивается способность высоких и низких концентраций, соответственно, 5Chol-GCGT3-TG4T ("5Chol-GCGT3-TG4T 4°С") генерировать TLR21-опосредованный иммунный ответ в HEK293-bsd-cTLR21 по сравнению с такой способностью для пДНК-F в комбинации с 5Chol-GCGT3-TG4T "пДНК-F/5-Chol-GCGT3-TG4T").
На Фиг. 9А и 9В сравнивается способность высоких и низких концентраций, соответственно, пДНК-F в комбинации с 5Chol-GCGT3-TG4T ("пДНК-Е/5-Chol-GCGT3-TG4T") генерировать TLR21-опосредованный иммунный ответ в HEK293-bsd-cTLR21 по сравнению с такой способностью для пДНК-F в комбинации с 5Chol-GCGT3-TG4T, полученной в осадке ("пДНК-Е/5-Chol-GCGT3-TG4T осадок") и супернатанте ("nflHK-F/5-Chol-GCGT3-TG4T супернатант") центрифугированного пДНК-F образца.
На Фиг. 10А и 10В сравнивается способность высоких и низких концентраций, соответственно, пДНК-F в комбинации с 5Chol-GCGT3-TG4T ("пДНК-Е-5-Chol-GCGT3-TG4T") генерировать TLR21-опосредованный иммунный ответ в HEK293-bsd-cTLR21 по сравнению с такой способностью для пДНК-F и иммуностимулирующего олигонуклеотида 5-Chol-GCGT3-TG4T.
На Фиг. 11А и 11В сравнивается способность высоких и низких концентраций, соответственно, пДНК-F в комбинации с 5Chol-GCGT3-TG4T ("пДНК-Р-5-Chol-GCGT3-TG4T") генерировать TLR21-опосредованный иммунный ответ в HEK293-bsd-cTLR21 по сравнению с такой способностью для пДНК-F в комбинации с 5Chol-GCGT3-TG4T, полученной в осадке ("пДНК-Р-5-Chol-GCGT3-TG4T осадок") и супернатанте ("пДНК-F-5-Chol-GCGT3-TG4T") центрифугированного пДНК-F образца.
На Фиг. 12А и 12В сравнивается способность высоких и низких концентраций, соответственно, пДНК-F, иммуностимулирующего олигонуклеотида GCGT3-TG4T, и пДНК-F, связанной в комплекс с GCGT3-TG4T ("пДНК-F-GCGT3-TG4T"), генерировать TLR21-опосредованные иммунные ответы в HEK293-bsd-cTLR21 клетках.
На Фиг. 13А и 13В сравнивается способность высоких и низких концентраций, соответственно, пДНК-F в комбинации с иммуностимулирующим олигонуклеотидом GCGT3-TG4T ("пДНК-F-GCGT3-TG4T") генерировать TLR21-опосредованный иммунный ответ в HEK293-bsd-cTLR21 по сравнению с такой способностью для пДНК-F в комбинации с иммуностимулирующим олигонуклеотидом GCGT3-TG4T, полученной в осадке ("пДНК-Р-GCGT3-TG4T осадок") и супернатанте ("пДНК-Р-GCGT3-TG4T супернатант") центрифугированного пДНК-F образца.
На Фиг. 14 представлены средние титры ингибирования гемагглютинации (HI) (Log2) (со стандартным отклонением) для ОДН1 (GCGT3-TG4T-5Chol) в дни 14 (верхняя панель) и 21 (нижняя панель) после вакцинации (пв). Звездочки указывают уровень значимости (*=значимый до ****=высоко значимый).
На Фиг. 15 представлены результаты средних титров (HI) (Log2) (со стандартным отклонением) для ОДН1 (GCGT3-TG4T-5Chol) на протяжении всего исследования.
На Фиг. 16 представлены результаты средних титров (HI) (Log2) (со стандартным отклонением) для ОДН2 (GCGT3-TG4T) в дни 14 (верхняя панель) и 21 (нижняя панель) после вакцинации. Звездочки указывают уровень значимости (*=значимый до ****=высоко значимый).
На Фиг. 17 представлены результаты средних титров (HI) (Log2) (со стандартным отклонением) для ОДН2 (GCGT3-TG4T) на протяжении всего исследования.
На Фиг. 18 представлены результаты средних титров (HI) (Log2) (со стандартным отклонением) для ОДН3 (2006-РТО) в дни 14 (верхняя панель) и 21 (нижняя панель) после вакцинации. Звездочки указывают уровень значимости (*=значимый до ****=высоко значимый).
На Фиг. 19 представлены результаты средних титров (HI) (Log2) (со стандартным отклонением) для ОДН3 (2006-РТО) на протяжении всего исследования.
На Фиг. 20 представлены результаты средних титров (HI) (Log2) (со стандартным отклонением) для положительных и отрицательных контролей тестируемых образцов в дни 14 (верхняя панель) и 21 (нижняя панель) после вакцинации. Звездочки указывают уровень значимости (*=значимый до ****=высоко значимый).
На Фиг. 21 представлены результаты средних титров (HI) (Log2) (со стандартным отклонением) для положительных и отрицательных контролей тестируемых образцов на протяжении всего исследования.
На Фиг. 22 представлены результаты средних титров (HI) (Log2) (со стандартным отклонением) при наиболее оптимальных концентрациях ОДН на протяжении всего исследования по сравнению с NDV вакциной отдельно.
На Фиг. 23 представлены результаты средних титров (HI) (Log2) (со стандартным отклонением) при наиболее оптимальных концентрациях ОДН в день 14 (верхняя панель) и 21 (нижняя панель) пв по сравнению с NDV вакциной отдельно.
ПОДРОБНОЕ ОПИСАНИЕ ИЛЛЮСТРАТИВНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Раскрытые композиции и способы могут пониматься более легко со ссылкой на последующее подробное описание, принимая во внимание приложенные фигуры, которые составляют часть описания. Подразумевается, что раскрытые композиции и способы не ограничиваются специфическими композициями и способами, описанными и/или представленными в настоящей заявке, и что терминология, используемая в настоящей заявке, предназначена для описания предпочтительных вариантов осуществления только в качестве примеров и не предназначена для ограничения заявленных композиций и способов.
Если специально не указано иначе, то любое описание как возможный механизм или способ действия или причина для улучшения рассматривается только как иллюстративное, и описанные композиции и способы не ограничиваются точностью или неточностью любого такого предложенного механизма или способа действия или причины для улучшения.
Для всей настоящей заявки, описания относятся к композициям и способам применения указанных композиций. Если раскрытие описывает или заявляет характерный признак или вариант осуществления, связанный с композицией, то такой характерный признак или вариант осуществления аналогичным образом применим к способам применения указанных композиций. Подобно этому, если раскрытие описывает или заявляет характерный признак или вариант осуществления, связанный со способом применения композиции, то такой характерный признак или вариант осуществления аналогичным образом применим к композиции.
Если задан диапазон значений, то другой вариант осуществления включает от одного предпочтительного значения и/или до другого предпочтительного значения. Дополнительно, ссылки на значения, указанные в диапазонах, включают все и каждое значение в пределах указанного диапазона. Все диапазоны являются включительными и комбинируемыми. Если значения выражены как приблизительные, путем применения предшествующего "приблизительно", то это подразумевает, что конкретное значения составляет другой вариант осуществления. Ссылка на конкретное числовое значение включает по меньшей мере это конкретное значение, если из контекста очевидно не следует иное.
Следует принять во внимание, что определенные характерные признаки описанных композиций и способов, которые, для лучшего понимания, описаны в настоящей заявке в контексте отдельных вариантов осуществления, также могут обеспечиваться в комбинации в одном варианте осуществления. И наоборот, различные характерные признаки описанных композиций и способов, которые, для краткости, описаны в контексте одного варианта осуществления, также могут быть обеспечены раздельно или в любой подкомбинации.
Как используется в настоящей заявке, формы единственного числа включают множественное число.
"Совместно вводимые", как используется в настоящей заявке, относится к введению иммуномодулирующей композиции в комбинации с иммуностимулирующим олигонуклеотидом для достижения желательного иммуностимулирующего эффекта. Иммуномодулирующая композиция и иммуностимулирующий олигонуклеотид могут совместно вводиться в виде отдельных композиций или совместно в виде одной композиции. Если иммуномодулирующая композиция и иммуностимулирующий олигонуклеотид представляют собой отдельные композиции, то они могут совместно вводиться либо одновременно или последовательно в любом порядке. Для последовательного совместного введения, может быть задержка в минуту, час или даже один или больше дней между введениями иммуномодулирующей композиции и иммуностимулирующего олигонуклеотида.
Как используется в настоящей заявке, "слияние" относится к созданию химической связи между двумя химически реакционноспособными видами. В контексте настоящей заявки, слияние наиболее часто относится к инкорпорации специфических элементов в олигонуклеотид. Например, серии тиминовых нуклеотидов могут быть слиты с 3'-концом олигонуклеотида.
Как используется в настоящей заявке, "G-квартетная последовательность" относится к участку последовательных гуаниновых остатков возле 5'-конца олигонуклеотида, который представляет возможность олигонуклеотиду взаимодействовать с другими G-квартетными последовательностями с образованием G-квартета. G-квартет усиливает иммуностимулирующие свойства нуклеиновой кислоты. Например, олигонуклеотиды, содержащие G-квартетные последовательности, могут взаимодействовать, образуя G-квартеты. G-квартетные последовательности, встречающиеся в составе промоторного участка гена, могут образовывать четвертичные структуры, задействованные в регуляцию экспрессии гена. В то время как G-квартетная последовательность не ограничивается любой конкретной последовательностью, примером G-квартетной последовательности является TGGGGT.
Как используется в настоящей заявке, "последовательность G-проволоки," "последовательность G проволоки," "последовательность Опроволоки" и родственные термины, относится к множеству, наиболее часто двум из по меньшей мере четырех последовательных гуаниновых нуклеотидов. Множества гуаниновых нуклеотидов, расположенных на или возле 5'-конца олигонуклеотида, разделены двумя или более негуаниновыми нуклеотидами (то есть, тимином). G-проволока последовательности способны взаимодействовать с другими G-проволока последовательностями с образованием структуры G-проволоки. Структура G-проволоки может усиливать иммуностимулирующие свойства нуклеиновой кислоты. Типичным примером последовательность G-проволоки является GGGGTTGGGG (SEQ ID NO: 257) или GGGGTTGGGGTTTT (SEQ ID NO: 258).
Как используется в настоящей заявке, термины "обогащенная гуаниновыми нуклеотидами последовательность," "обогащенная гуанином
последовательность," и другие, относится к последовательностям, содержащим либо отрезок последовательных гуаниновых нуклеотидов, обычно от четырех до шести гуаниновых нуклеотидов, или участок нуклеиновой кислоты, типично на или возле 5'-конца олигонуклеотида, имеющая больше гуаниновых нуклеотидов, чем адениновых, цитозиновых или тиминовых нуклеотидов. Обогащенная гуанином последовательность, как описано в настоящей заявке, может усиливать иммуностимулирующие свойства олигонуклеотида. G-квартетные
последовательности и последовательности G-проволоки представляют собой оба типа обогащенных гуаниновыми нуклеотидами последовательностей.
Термин "иммуномодулирующая композиция", как используется в настоящей заявке, относится к композиции, содержащей по меньшей мере иммуногенную плазмидную нуклеиновую кислоту и липосомный носитель. В некоторых аспектах раскрытых в настоящем изобретении композиций и способов, плазмидная нуклеиновая кислота может не кодировать предпочтительный иммуноген и может быть иммуногенной на основании присущих свойств плазмидной нуклеиновой кислоты. В некоторых аспектах, липосомный носитель является катионным.
"Иммуногенная плазмидная нуклеиновая кислота" представляет собой плазмидную нуклеиновую кислоту, которая, при обнаружении иммунной системой позвоночных, вызывает иммунный ответ. Некоторые иммуногенные плазмидные нуклеиновые кислоты содержат увеличенное процентное содержание CpG динуклеотидных мотивов по сравнению с последовательностями плазмидных нуклеиновых кислот плазмид, которые встречаются в природе в организме у некоторых позвоночных. Не желая ограничиваться какой-либо теорией, полагают, что увеличенные CpG динуклеотидные мотивы присутствуют в нуклеиновой кислоте бактериального происхождения и, следовательно, полагают, что такая CpG-обогащенная нуклеиновая кислота является чужеродной к иммунной защите хозяев. Иммуногенная плазмидная нуклеиновая кислота может содержать невстречающиеся в природе нуклеотиды и производные нуклеотидов.
"Иммуностимулирующая композиция", как используется в настоящей заявке, относится к композиции, содержащей иммуномодулирующую композицию и иммуностимулирующий олигонуклеотид. В некоторых аспектах, иммуностимулирующий олигонуклеотид и иммуномодулирующая композиция включают единственный препарат, который представляет собой иммуностимулирующую композицию. В некоторых аспектах,
иммуностимулирующий олигонуклеотид может быть физически ассоциирован с липосомным носителем иммуномодулирующей композиции.
Как используется в настоящей заявке, "инсерция" относится к добавлению специфического (их) нуклеотида (ов) в специфических положениях при синтезе олигонуклеотида.
Как используется в настоящей заявке, "параллельная ориентация" относится к направленному взаимодействию между различными олигонуклеотидами. Например, индивидуальные олигонуклеотиды,
ориентированы в одном и том же 5' → 3' направлении, находятся в параллельной ориентации.
Как используется в настоящей заявке, "процент идентичности" и другие термины используются для описания взаимосвязей последовательностей между двумя или более нуклеиновыми кислотами, полинуклеотидами, белками или полипептидами, и понимаются в контексте и в сочетании с терминами, включающими: (а) эталонную последовательность, (б) окно сравнения, (в) идентичность последовательностей и (г) процент идентичности последовательностей.
(а) "Эталонная последовательность" представляет собой определенную последовательность, используемую в качестве основы для сравнения последовательностей. Эталонная последовательность может представлять собой поднабор или целую указанную последовательность; например, сегмент полноразмерной кДНК или генной последовательности, или полную кДНК или генную последовательность.
(б) "Окно сравнения" включает ссылку на непрерывный и определенный сегмент полинуклеотидной последовательности, где полинуклеотидная последовательность может быть сравнена с эталонной последовательностью и где часть полинуклеотидной последовательности в окне сравнения может содержать добавления, замены или делеции (то есть, гэпы) по сравнению с эталонной последовательностью (которая не содержит добавления, замены или делеции) для оптимального выравнивания двух последовательностей. Квалифицированные специалисты в данной области техники понимают, что для избегания ложного высокого сходства с эталонной последовательностью вследствие включения гэпов в полинуклеотидную последовательность типично вводят штраф за гэп и вычитают из числа совпадений.
(в) Способы выравнивания последовательностей для сравнения хорошо известны в данной области техники. Оптимальное выравнивание последовательностей для сравнения может быть осуществлено с помощью алгоритм поиска локальной гомологии Smith и Waterman, Adv. Appl. Math., 2: 482, 1981; алгоритма выравнивания областей гомологии Needleman и Wunsch, J. Mol. Biol., 48: 443, 1970; способа поиска сходства Pearson и Lipman, Proc. Natl. Acad. Sci. USA, 8: 2444, 1988; с помощью компьютеризованных реализаций этих алгоритмов, включая, но не ограничиваясь только ими: CLUSTAL в PC/Gene программе согласно Intelligenetics, Mountain View, Calif., GAP, BESTFIT, BLAST, FASTA, и TFASTA в Wisconsin Genetics Software Package, Genetics Computer Group (GCG), 7 Science Dr., Madison, Wis., USA; программа CLUSTAL хорошо описана Higgins и Sharp, Gene, 73: 237-244, 1988; Corpet, и др., Nucleic acids Research, 16:881-90, 1988; Huang, и др., Computer Applications in the Biosciences, 8:1-6, 1992; и Pearson, и др., Methods in Molecular Biology, 24:7-331, 1994. Семейство программ BLAST, которое может использоваться для поиска сходств в базах данных, включает: BLASTN для нуклеотидных запрашиваемых последовательностей относительно баз данных нуклеотидных последовательностей; BLASTX для нуклеотидных запрашиваемых последовательностей относительно баз данных белковых последовательностей; TBLASTN для белковых запрашиваемых последовательностей относительно баз данных нуклеотидных последовательностей; и TBLASTX для нуклеотидных запрашиваемых последовательностей относительно баз данных нуклеотидных последовательностей. См., Current Protocols in Molecular Biology, раздел 19, Ausubel, и др., под ред., Greene Publishing и Wiley-Interscience, New York, 1995. В будущем, несомненно, будут доступны новые версии вышеуказанных программ или совершенно новые программы, и они могут использоваться в контексте настоящего раскрытия.
(г) "Процент идентичности" обозначает значение, определяемое путем сравнения двух оптимально выравненных последовательностей в окне сравнения, где часть полинуклеотидной последовательности в окне сравнения может содержать добавления, замены или делеции (то есть, гэпы) по сравнению с эталонной последовательностью (которая не содержит добавлений, замен или делеций) для оптимального выравнивания двух последовательностей. Процентное значение рассчитывается путем определения числа положений, в которых идентичное основание нуклеиновой кислоты встречается в обеих последовательностях, получая число совпавших положений, разделяя число совпавших положений на общее число положений в окне сравнения и умножая результат на 100, получая процент идентичности последовательностей.
"Терапевтически эффективное количество" относится к количеству иммуномодулирующей композиции и/или иммуностимулирующего олигонуклеотида или иммуностимулирующей композиции, которым лечат субъекта.
"Синергетически эффективное количество" относится к количеству иммуномодулирующей композиции и иммуностимулирующего олигонуклеотида, которое обеспечивает синергетический эффект, или эффект, превосходящий аддитивный эффект, при лечении субъекта. Термин "субъект", как используется в настоящей заявке, обозначает любое животное, но, в особенности, виды птиц. "Виды птиц" включают, но не ограничиваясь только ими, куры, домашние индейки, водоплавающую птицу и любой другой вид дичи, являющийся источником пищи.
Как используется в настоящей заявке, "лечение" и другие термины относятся к уменьшению тяжести и/или частоты проявления симптомов инфекции, элиминации симптомов и/или основной причины этих симптомов, уменьшению частоты или вероятности симптомов и/или их основной причины, и/или улучшению или восстановлению повреждения, вызываемого, непосредственно или опосредованно, инфекционным агентом.
Различные термины, относящиеся к аспектам описания, применяются во всем описании и пунктах приложенной формулы изобретения. Такие термины имеют их общепринятые значения в данной области техники, если не указано иное. Другие специфически определенные термины истолковываются образом, согласующимся с определениями, представленными в настоящей заявке.
В настоящей заявке обеспечиваются иммуностимулирующие композиции, содержащие иммуномодулирующую композицию, содержащую плазмидную нуклеиновую кислоту и липосомный носитель и иммуностимулирующий олигонуклеотид, имеющий по меньшей мере один CpG мотив и обогащенную гуаниновыми нуклеотидами последовательность на или возле 5'-конца иммуностимулирующего олигонуклеотида.
Иммуностимулирующие олигонуклеотиды, как описано в настоящей заявке, могут взаимодействовать с TLR21, вызывая иммунный ответ. Иммуностимулирующие олигонуклеотиды содержат по меньшей мере один неметилированный динуклеотидный CpG мотив, который взаимодействует с рецепторами распознавания патогенов, экспрессируемыми в организме-хозяине. Иммуностимулирующие олигонуклеотиды также имеют обогащенную гуаниновыми нуклеотидами последовательность. Эти последовательности могут облегчать укладку цепи ДНК в четвертичную структуру или способствовать агрегации одного или нескольких иммуностимулирующих олигонуклеотидов, которые имеют обогащенную гуанином последовательность. Обогащенная гуанином последовательность не обязательно должна состоять исключительно из гуаниновых нуклеотидов, но должна быть ими обогащена. Обогащенная гуанином последовательность, как описано выше и иллюстрируется на примерах в вариантах осуществления, типично расположена на или возле (в пределах четырех нуклеотидов от) конца олигонуклеотида. Дополнительные манипуляции олигонуклеотидной последовательности и структуры могут еще усиливать иммуностимулирующую способность олигонуклеотида стимулировать TLR21. Таким образом, один вариант осуществления настоящего раскрытия охватывает иммуностимулирующую композицию, содержащую по меньшей мере один иммуностимулирующий олигонуклеотид, имеющий по меньшей мере один CpG мотив и обогащенную гуанином последовательность, начинающиеся на или в пределах четырех нуклеотидов от 5'-конца иммуностимулирующего олигонуклеотида.
В некоторых аспектах настоящей заявки, добавление участка гуаниновых нуклеотидов к 5'-концу содержащего CpG иммуностимулирующего олигонуклеотида может существенно улучшать иммуногенность иммуностимулирующего олигонуклеотида. Не только положение обогащенной гуанином последовательности в иммуностимулирующем олигонуклеотиде оказывает влияние на активацию TLR21, но также существенно влияет и содержание последовательности. В связи с этим, в некоторых аспектах настоящей заявки, обогащенные гуанином последовательности содержат множество последовательных гуаниновых нуклеотидов.
В некоторых вариантах осуществления, обогащенная гуанином последовательность содержит первое множество последовательных гуаниновых нуклеотидов. В некоторых аспектах первое множество гуаниновых нуклеотидов содержит от двух до восьми гуаниновых нуклеотидов. В некоторых аспектах, первое множество гуаниновых нуклеотидов содержит два гуаниновые нуклеотиды. В некоторых аспектах, первое множество гуаниновых нуклеотидов содержит три гуаниновых нуклеотида. В некоторых аспектах, первое множество гуаниновых нуклеотидов содержит четыре гуаниновых нуклеотида. В некоторых аспектах, первое множество гуаниновых нуклеотидов содержит пять гуаниновых нуклеотидов. В некоторых аспектах, первое множество гуаниновых нуклеотидов содержит шесть гуаниновых нуклеотидов. В некоторых аспектах, первое множество гуаниновых нуклеотидов содержит семь гуаниновых нуклеотидов. В некоторых аспектах, первое множество гуаниновых нуклеотидов содержит восемь гуаниновых нуклеотидов. В еще других аспектах, первое множество гуаниновых нуклеотидов содержит больше восьми гуаниновых нуклеотидов.
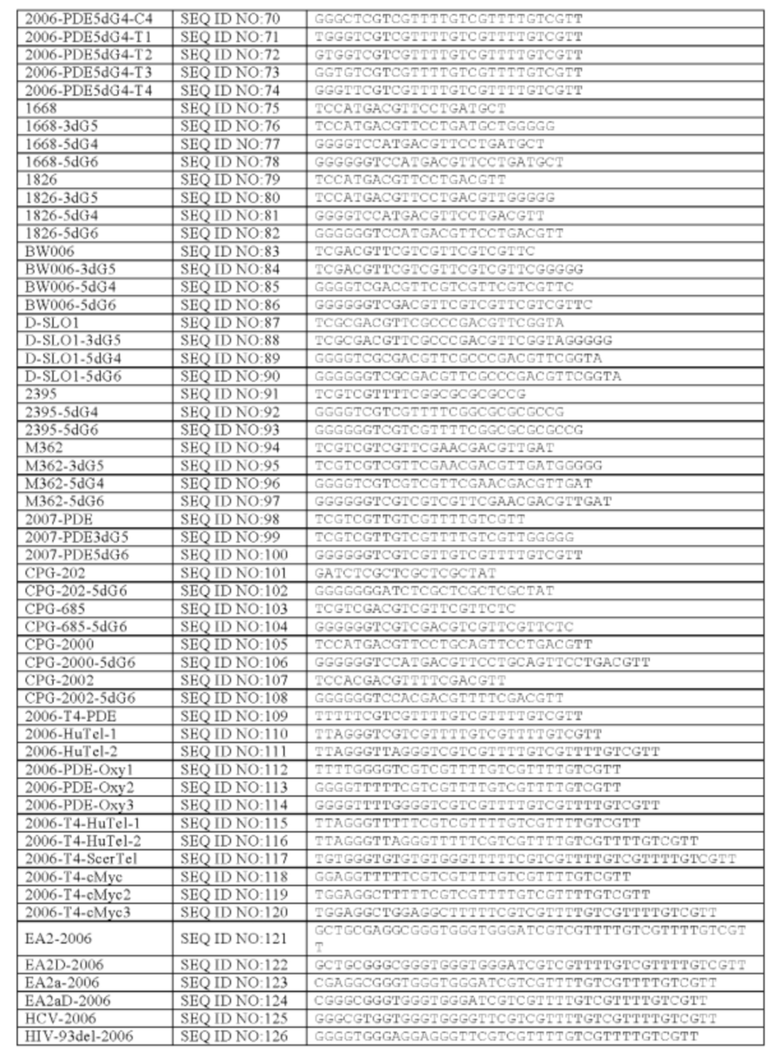
В некоторых вариантах осуществления настоящего изобретения, олигонуклеотид содержит SEQ ID NO: 16, 17, 18, 19, 20, 21, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 77, 78, 81, 82, 85, 86, 89, 90, 92, 93, 96, 97, 100, 102, 104, 106, 108 или 143. В других вариантах осуществления, обогащенная гуанином последовательность содержит TTAGGG, TTAGGGTTAGGG (SEQ ID NO: 261), TTTTGGGG, GGGGTTTT, GGGGTTTTGGGG (SEQ ID NO:262), TTAGGG, TTAGGGTTAGGGTTTT (SEQ ID NO:263), TGTGGGTGTGTGTGGG (SEQ ID NO: 269), GGAGG, TGGAGGC или TGGAGGCTGGAGGC (SEQ ID NO: 264). В еще других вариантах осуществления, олигонуклеотид содержит SEQ ID NO: 110, 111, 112, 113, 114, 115, 116, 117, 118, 119, 120, 124, 125, 126, 127, 129, 130, 131, 134, 136, 137 или 138.
Единственный участок гуаниновых нуклеотидов представляет собой не только 5'-модификацию, которая может усиливать TLR21 стимуляцию. Например, последовательности, обогащенные аденином, цитозином и тимином, также могут быть добавлены к 5'-концу олигонуклеотида, имеющего CpG мотив, и приводить к увеличенной TLR21 стимуляции, хоть и менее выраженной, чем вызванная обогащенными гуанином последовательностями на 5'-конце олигонуклеотида. В то время как единственное множество гуаниновых остатков на 5'-конце олигонуклеотида может вызывать TLR21 стимуляцию, то добавление множеств гуаниновых нуклеотидов в обогащенную гуанином последовательность может дополнительно увеличивать стимулирующие свойства олигонуклеотида. Таким образом, в некоторых аспектах, олигонуклеотид согласно настоящему изобретению содержит второе множество гуаниновых нуклеотидов между первым множеством гуаниновых нуклеотидов и по меньшей мере одним CpG мотивом.
В некоторых аспектах, множество гуаниновых нуклеотидов содержит G-квартетную последовательность. В некоторых вариантах осуществления, первое множество гуаниновых нуклеотидов, второе множество гуаниновых нуклеотидов, или оба содержат G-квартетную последовательность. G-квартетные последовательности, как определено выше, также предоставляют возможность взаимодействия между олигонуклеотидами. Не желая ограничиваться какой-либо теорией, взаимодействие на 5'-конце олигонуклеотидов предоставляет возможность концентрирования CpG динуклеотидных мотивов и соответствующую усиленную возможность для распознавания с помощью TRL21. В некоторых вариантах осуществления, иммуностимулирующая композиция дополнительно содержит по меньшей мере один дополнительный олигонуклеотид, имеющий G-квартетную последовательность, где олигонуклеотид и по меньшей мере один дополнительный олигонуклеотид имеют параллельную ориентацию в четвертичной структуре. В некоторых аспектах, G-квартетная последовательность содержит TGGGGT.
Другая обогащенная гуанином последовательность, которая может быть добавлена на или возле 5'-конца олигонуклеотида, имеющего CpG мотивы, представляет собой последовательность G-проволоки. В некоторых аспектах настоящей заявки, первое и второе множества гуаниновых нуклеотидов содержат последовательность G-проволоки. В некоторых аспектах,
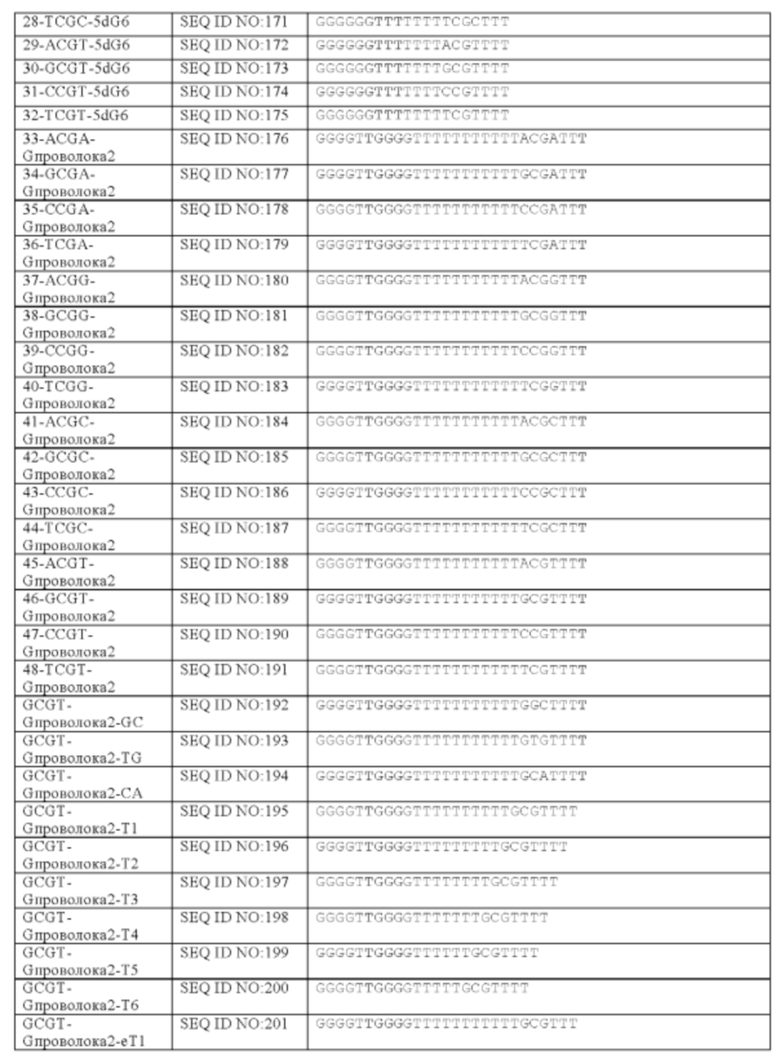
последовательность G-проволоки содержит SEQ ID NO: 257 или 258. В еще других аспектах, последовательность G-проволоки содержит SEQ ID NO: 141, 142, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203 или GCGT-G проволока 3. Два множества гуаниновых нуклеотидов могут быть разделены не-гуаниновыми нуклеотидами, аналогами нуклеотидов, или любым другим спейсером или линкером. Например, в некоторых аспектах настоящей заявки, первое множество гуаниновых нуклеотидов и второе множество гуаниновых нуклеотидов разделены по меньшей мере одним нуклеотидом. Как используется в настоящей заявке, термин "спейсер" относится к химической связи между сходными нуклеотидными мотивами, то есть, между двумя CpG мотивами или между двумя мотивами обогащенной гуаниновыми нуклеотидами последовательности, в то время как термин "линкер" относится к химической связи между различными нуклеотидными мотивами, то есть, между обогащенной гуаниновыми нуклеотидами последовательностью и другим нуклеотидным мотивом, например, CpG мотивом. Термины "спейсер" и "линкер" используются для ясности при описании того, какой аспект олигонуклеотида обсуждается. Тем не менее, для квалифицированных специалистов в данной области техники понятно, что структуры, описанные в настоящей заявке для спейсеров, могут быть взаимозаменяемыми со структурами, описанными в настоящей заявке для линкеров, и наоборот.
Не желая ограничиваться какой-либо конкретной теорией, представляется возможным, что последовательность G-проволоки дает возможность олигонуклеотиду взаимодействовать и агрегировать с другими олигонуклеотидами, имеющими последовательности G-проволоки. Конформация, предполагаемая при агрегации олигонуклеотидов, имеющих последовательности G-проволоки, обозначается как конформация G-проволоки, и это накопление олигонуклеотидов и их CpG мотивов может приводить к усиленной стимуляции TLR21.
Обогащенные гуанином последовательности могут быть отделены от CpG нуклеотидных мотивов с помощью нуклеотидов, аналогов нуклеотидов или других линкеров. Таким образом, в некоторых вариантах осуществления настоящей заявки, олигонуклеотид дополнительно содержит линкер между обогащенной гуанином последовательностью и по меньшей мере одним CpG мотивом по ходу транскрипции. Как используется в настоящей заявке, "по ходу транскрипции" обозначает в 5' → 3' направлении; то есть, нуклеотид или мотив "по ходу транскрипции" обозначает нуклеотид или мотив, который находится в направлении 3' элемента эталонной последовательности. "Против хода транскрипции" обозначает в 3' → 5' направлении; то есть, нуклеотид или мотив "против хода транскрипции" обозначает нуклеотид или мотив, который находится в направлении 5' элемента эталонной последовательности. Линкер не обязательно должен быть смежным с либо обогащенной гуанином последовательностью или CpG мотивом; вместо этого, линкер должен быть расположен между двумя мотивами последовательностей, независимо от интронных последовательностей между обогащенной гуанином последовательностью и линкером, а также между CpG мотивом и линкером. В некоторых вариантах осуществления настоящей заявки, линкер содержит по меньшей мере три нуклеотида. Линкер также может не содержать азотистых оснований. Например, в некоторых аспектах, линкер представляет собой гексаэтиленгликоль, пропандиол, триэтиленгликоль или их производные. В других примерах, олигонуклеотид, имеющий линкер, содержит 2006-PDE5dG4-X1 или 2006-PDE5dG4-X3.
Полагают, что динуклеотидные CpG мотивы, присутствующие в олигонуклеотидах согласно настоящему изобретению, представляют собой РАМР, распознаваемые TLR21 у кур. В то время как даже единственный CpG мотив может стимулировать TLR21, множество CpG, представленных на олигонуклеотиде, могут усиленно стимулировать интенсивность сигнала TLR21. В связи с этим, в некоторых аспектах настоящего изобретения, по меньшей мере один CpG мотив содержит два, три, четыре или пять CpG мотивов. В некоторых аспектах, по меньшей мере один CpG мотив содержит шесть или больше CpG мотивов. В некоторых аспектах, по меньшей мере один CpG мотив содержит два CpG мотива. В некоторых аспектах, по меньшей мере один CpG мотив содержит три CpG мотива. В некоторых аспектах, по меньшей мере один CpG мотив содержит четыре CpG мотива. В некоторых вариантах осуществления, по меньшей мере один CpG мотив содержит четыре CpG мотива.
В некоторых вариантах осуществления раскрытых в настоящем изобретении олигонуклеотидов, каждый CpG мотив может быть отделен от других CpG мотивов по меньшей мере одним нуклеотидом или аналогом нуклеотида. В некоторых аспектах, по меньшей мере один нуклеотид представляет собой два или три тиминовых нуклеотида. В других аспектах, по меньшей мере один нуклеотид представляет собой от одного до четырех нуклеотидов, хотя число вставочных нуклеотидов может отличаться в зависимости от последовательности вставочных нуклеотидов. В некоторых аспектах, олигонуклеотид содержит SEQ ID NO: 217, 218, 219 или 220. Нуклеотиды, смежные с CpG- вместе с самим CpG мотивом - составляют элемент CpG последовательности (например, XCGX, где X = любой нуклеотид). Олигонуклеотиды согласно настоящему изобретению, в некоторых аспектах содержат элементы CpG последовательности, которые представляют собой GCGA, GCGG, ACGC, CCGC, GCGT, TCGC или любую их комбинацию.
В некоторых вариантах осуществления настоящей заявки, CpG мотив содержит элемент CpG последовательности, имеющий четыре нуклеотида. В некоторых аспектах, олигонуклеотид содержит по меньшей мере два элемента CpG последовательности. В некоторых аспектах, олигонуклеотид содержит по меньшей мере три элемента CpG последовательности. В некоторых аспектах, олигонуклеотид содержит по меньшей мере четыре элемента CpG последовательности. В некоторых аспектах, олигонуклеотид содержит по меньшей мере пять элементов CpG последовательности. В некоторых аспектах, олигонуклеотид содержит по меньшей мере шесть элементов CpG последовательности. В некоторых аспектах, олигонуклеотид содержит более чем восемь, десять, пятнадцать или даже двадцать элементов CpG последовательности.
В других вариантах осуществления раскрытых в настоящем изобретении олигонуклеотидов, каждый из CpG мотивов разделены от любого другого CpG мотива спейсером или комбинацией спейсера и по меньшей мере одного нуклеотида. В некоторых аспектах, по меньшей мере один CpG мотив разделен от самого близкого другого CpG мотива спейсером или комбинацией спейсера и по меньшей мере одного нуклеотида, в то время как по меньшей мере два других CpG мотива смежны друг с другом. Хотя разделенные CpG мотивы могут усиливать иммуностимулирующие способности созданных олигонуклеотидов, принято считать, что CpG мотивы, смежные друг с другом, могут еще стимулировать TLR21.
Спейсер, применяемый для линейного разделения CpG мотивов, может представлять собой любую связь, которая связывает мостиком по меньшей мере часть олигонуклеотида между CpG мотивами. Спейсер может состоять из, но не обязательно ограничиваясь только ими, дезоксирибозофосфатного мостика, множественной углеродной цепи или повторяемой химической единицы. Одним из существенных свойств спейсера является способность образовывать химическую связь с нуклеотидным остовом олигонуклеотида. Таким образом, в некоторых вариантах осуществления спейсер представляет собой дезоксирибозофосфатный мостик. Дезоксирибозофосфатный мостик может содержать азотистые основания в некоторых аспектах, в то время как в других вариантах дезоксирибозофосфатный мостик является безосновным. В некоторых аспектах, олигонуклеотид содержит SEQ ID NO: 221, которая содержит безосновный деоксирибозофосфатный мостик.
В других вариантах осуществления настоящей заявки, спейсер содержит углеродную цепь. Углеродная цепь может содержать от двух до двенадцати атомов углерода. Диолы, содержащие углеродную цепь, могут использоваться в качестве концевых спиртовых групп, могут реагировать с концевыми спиртовыми и/или фосфатными группами олигонуклеотида. В некоторых вариантах осуществления, углеродная цепь содержит два атома углерода, и в некоторых аспектах, углеродная цепь имеет происхождение из этандиола. В некоторых вариантах осуществления, олигонуклеотид содержит ОДН-Х2, где Х2 представляет собой этандиол.
Другие варианты осуществления настоящего изобретения обеспечивают углеродную цепь, содержащую три атома углерода. В некоторых аспектах этих вариантов осуществления, углеродная цепь имеет происхождение из 1,3-пропандиола. В некоторых вариантах осуществления, олигонуклеотид содержит CG-Gw2X2, CG-Gw2X2-2, или ОДН-Х3, CG-Gw2X2-l, CG-Gw2X2-3, CG-Gw2X2-4, CG-Gw2X2-5, CG-G4T16X2-1, CG-G4T16X2-2, CG-G4T16X2-3, CG-G4T16X2-4, или CG-G4T16X2-5, где Х2 представляет собой трехуглеродную цепь; 2006-PDE5dG4-X2 где Х2 представляет собой трехуглеродную цепь, имеющую происхождение из пропандиола; или SEQ ID NO: 250, где Х4 представляет собой трехуглеродную цепь, имеющую происхождение из пропандиола.
В еще других вариантах осуществления настоящего изобретения, олигонуклеотид содержит спейсер из углеродной цепи, где углеродная цепь содержит четыре атома углерода. В некоторых аспектах этих вариантов осуществления, углеродная цепь имеет происхождение из 1,4-бутандиола. В некоторых вариантах осуществления, олигонуклеотид содержит ОДН-Х4, где Х4 представляет собой четырехуглеродную цепь, имеющую происхождение из 1,4-бутандиола.
В еще других вариантах осуществления настоящей заявки, олигонуклеотид содержит спейсер, имеющий повторяемую химическую единицу. Например, в некоторых вариантах осуществления, повторяемая химическая единица представляет собой этиленгликоль. Повторяемая химическая единица может повторяться от двух до двенадцати раз. В некоторых вариантах осуществления, этиленгликоль повторяется шесть раз. Таким образом, в некоторых аспектах, олигонуклеотид содержит CCGC-Gw2X1, где X1 представляет собой спейсер, имеющий происхождение из гексаэтиленгликоля.
Несмотря на то, что участки гуаниновых нуклеотидов на 3'-конце олигонуклеотида, приводят к незначительной TLR21 стимуляции или такая стимуляция отсутствует, другие нуклеотидные участки могут придавать олигонуклеотиду увеличенную иммуногенность. Специфически, в некоторых аспектах настоящей заявки, олигонуклеотид может дополнительно содержать три-тиминовую нуклеотидную 3'-концевую область. В некоторых аспектах, олигонуклеотид содержит SEQ ID NO: 204, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214 или 215.
Для каждого олигонуклеотида, описанного в настоящей заявке, квалифицированный специалист в данной области техники будет знать, что нуклеотид может быть заменен на аналог нуклеотида. Олигонуклеотиды в некоторых вариантах осуществления содержат фосфодиэфирный остов, хотя другие варианты осуществления олигонуклеотидов, описанных в настоящей заявке, содержат фосфоротиоатный остов. Фосфоротиоатные остовы, в некоторых случаях, могут быть более простыми и менее затратными при производстве.
В некоторых вариантах осуществления настоящей заявки, олигонуклеотид может содержать липидный компонент, который может приводить к повышению иммуногенности олигонуклеотида. Одним из возможных объяснений повышенной иммуногенности является тот факт, что липидный компонент может действовать путем усиления биодоступности олигонуклеотида. В некоторых вариантах осуществления, липидный компонент находится на или возле 5'-конца олигонуклеотида. Этот липидный "колпачок" может предотвращать разложение, увеличивать растворимость, улучшать стабильность олигонуклеотида в фармацевтической композиции или любую комбинацию этих эффектов. В некоторых аспектах, липидный компонент представляет собой холестерил.
Эффективность иммуностимулирующего олигонуклеотида и иммуностимулирующей композиции может быть охарактеризована с помощью их полумаксимальной эффективной концентрации (ЕС50), которая является показателем концентрации, необходимой для индуцирования ответа, составляющей половину максимального ответа, который может быть достигнут путем введения композиции. Чем более низкой является концентрация, тем более эффективен олигонуклеотид. В некоторых аспектах настоящей заявки, иммуностимулирующая композиция может иметь ЕС50 в пМ диапазоне. В некоторых аспектах, ЕС50 составляет от приблизительно 0,1 до 100 пМ. В некоторых аспектах, ЕС50 составляет от приблизительно 100 до 200 пМ. В некоторых аспектах ЕС50 составляет от приблизительно 200 до 300 пМ. В некоторых аспектах, ЕС50 составляет от приблизительно 300 до 400 пМ. В некоторых аспектах ЕС50 составляет от приблизительно 400 до 500 пМ. В некоторых аспектах ЕС50 составляет от приблизительно 500 до 600 пМ. В некоторых аспектах ЕС50 составляет от приблизительно 600 до 700 пМ. В некоторых аспектах ЕС50 составляет от приблизительно 700 до 800 пМ. В некоторых аспектах ЕС50 составляет от приблизительно 800 до 900 пМ. В некоторых аспектах ЕС50 составляет от приблизительно 900 до 1 нМ. В еще других аспектах, ЕС50 составляет меньше, чем приблизительно 100 пМ.
Что касается концентрации олигонуклеотида в иммуностимулирующей композиции, в некоторых аспектах концентрация олигонуклеотида составляет от приблизительно 0,1 до 10 нМ. В некоторых аспектах, концентрация олигонуклеотида составляет от приблизительно 10 до 20 нМ. В некоторых аспектах концентрация олигонуклеотида составляет от приблизительно 20 до 30 нМ. В некоторых аспектах, концентрация олигонуклеотида составляет от приблизительно 30 до 40 нМ. В некоторых аспектах концентрация олигонуклеотида составляет от приблизительно 40 до 50 нМ. В некоторых аспектах концентрация олигонуклеотида составляет от приблизительно 50 до 60 нМ. В некоторых аспектах концентрация олигонуклеотида составляет от приблизительно 60 до 70 нМ. В некоторых аспектах концентрация олигонуклеотида составляет от приблизительно 70 до 80 нМ. В некоторых аспектах концентрация олигонуклеотида составляет от приблизительно 80 до 90 нМ. В некоторых аспектах концентрация олигонуклеотида составляет от приблизительно 90 до 100 нМ. В еще других аспектах, концентрация олигонуклеотида составляет меньше, чем приблизительно 20 нМ.
Иммуностимулирующая композиция может дополнительно содержать по меньшей мере один дополнительный олигонуклеотид, имеющий последовательность G-проволоки в некоторых вариантах осуществления настоящей заявки. Поскольку последовательность G-проволоки облегчает агрегацию других олигонуклеотидов, имеющих аналогичную, или сходную, последовательность G-проволоки, то один аспект иммуностимулирующей композиции дополнительно содержит по меньшей мере один дополнительный олигонуклеотид, имеющий последовательность G-проволоки. В некоторых аспектах, в которых иммуностимулирующая композиция содержит множество олигонуклеотидов, имеющих последовательности G-проволоки, олигонуклеотид и по меньшей мере один дополнительный олигонуклеотид имеют конформацию G-проволоки.
Способность олигонуклеотида стимулировать TLR21 может быть дополнительно усилена в соответствии с некоторыми аспектами изобретения путем инсерции дополнительных CpG мотивов. В некоторых аспектах, по меньшей мере один CpG мотив представляет собой множество CpG мотивов, и множество CpG мотивов содержит два, три, четыре или пять CpG мотивов. Расстояние между CpG мотивами может оказывать влияние на свойства олигонуклеотида стимулировать TLR21. В связи с этим, некоторые аспекты раскрытых олигонуклеотидов обеспечивают инсерцию по меньшей мере одного нуклеотида или аналога нуклеотида между CpG мотивами. По меньшей мере один нуклеотид может представлять собой два или три тиминовых нуклеотида.
Другие варианты осуществления обеспечивают включение спейсера между каждым из CpG мотивов. Спейсер должен быть способен связываться с 3'-концом одной смежной нуклеотидной цепи и с 5'-концом другой нуклеотидной цепи. В некоторых аспектах, спейсер представляет собой дезоксирибозофосфатный мостик, который может быть безосновным в некоторых аспектах.
Спейсер, в некоторых аспектах, может содержать углеродную цепь. В некоторых вариантах осуществления углеродная цепь содержит два атома углерода. В некоторых аспектах углеродная цепь имеет происхождение из этандиола. Другие варианты осуществления обеспечивают углеродную цепь, содержащую три атома углерода. В некоторых аспектах, углеродная цепь имеет происхождение из 1,3-пропандиола. В некоторых вариантах осуществления, углеродная цепь содержит четыре атома углерода, и в некоторых аспектах углеродная цепь имеет происхождение из 1,4-бутандиола. В еще других вариантах осуществления, спейсер содержит повторяемую химическую единицу. В некоторых аспектах, повторяемая химическая единица представляет собой этиленгликоль, и в некоторых аспектах спейсер представляет собой, имеющий происхождение из гексаэтиленгликоля.
Репрезентативные олигонуклеотиды согласно настоящему изобретению идентифицированы в Таблице 1.






Иммуногенные плазмидные нуклеиновые кислоты, описанные в настоящей заявке, обогащены CpG мотивами. В некоторых аспектах, иммуногенные плазмидные нуклеиновые кислоты содержат более чем 20% CpG мотивов по сравнению со встречаемостью CpG мотивов, обнаруженных в последовательностях нуклеиновых кислот позвоночных.
В некоторых аспектах, настоящее изобретение относится к иммуногенным плазмидным нуклеиновым кислотам, которые не содержат ген устойчивости к антибиотикам. В некоторых аспектах, плазмиды не содержат последовательность нуклеиновой кислоты, кодирующую полноразмерный или функциональный селектируемый или скринируемый маркер. Например, pGCMB75.6 плазмида, описанная в настоящей заявке, не содержит полноразмерных или функциональных селектируемых или скринируемых маркерных генов. Последовательность pGCMB75.6 представлена в SEQ ID NO: 265 (Таблица 1А). В некоторых аспектах, плазмиды, описанные в настоящей заявке, не кодируют иммуноген.
В некоторых аспектах, иммуногенные плазмиды может содержать последовательность нуклеиновой кислоты, кодирующую селектируемый или скринируемый маркерный ген, который не представляет собой ген устойчивости к антибиотикам. Например, pLacZMB75.6 плазмида, описанная в настоящей заявке, содержит LacZ ген в качестве скринируемого маркера. Последовательность pLacZMB75.6 представлена в SEQ ID NO: 268. В еще других аспектах, плазмида будет содержать ген устойчивости к антибиотикам. Например, рМВ75.6 содержит последовательность нуклеиновой кислоты, кодирующую устойчивость к антибиотику канамицину. Последовательность рМВ75.6 представлена в SEQ ID NO: 266.
Следует принять во внимание, что нуклеотидная последовательность рМВ75.6, pGCMB75.6, или pLacZMB75.6 плазмиды могут быть изменены до определенной степени без существенного отрицательного влияния на ее иммуностимулирующие свойства. В некоторых аспектах обеспечиваются иммуногенные плазмидные нуклеиновые кислоты, содержащие или состоящие из последовательности нуклеиновой кислоты, имеющей по меньшей мере 89% идентичность последовательности с последовательностью pGCMB75.6 (SEQ ID NO: 265). В некоторых аспектах, иммуногенная плазмида содержит последовательность нуклеиновой кислоты, имеющую по меньшей мере 75%, по меньшей мере 76%, по меньшей мере 77%, по меньшей мере 78%, по меньшей мере 79%, по меньшей мере 80%, по меньшей мере 81%, по меньшей мере 82%, по меньшей мере 83%, по меньшей мере 84%, по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, или по меньшей мере 99% идентичность последовательности с последовательностью pGCMB75.6 (SEQ ID NO: 265). В некоторых аспектах, иммуногенная плазмидная нуклеиновая кислота содержит последовательность pGCMB75.6 (SEQ ID NO: 265).
В некоторых аспектах обеспечиваются иммуногенные плазмидные нуклеиновые кислоты, содержащие последовательность нуклеиновой кислоты, имеющую по меньшей мере 84% идентичность последовательности с последовательностью pLacZMB75.6 (SEQ ID NO: 268). В некоторых аспектах, иммуногенная плазмида содержит или состоит из последовательности нуклеиновой кислоты, имеющей по меньшей мере 75%, по меньшей мере 76%, по меньшей мере 77%, по меньшей мере 78%, по меньшей мере 79%, по меньшей мере 80%, по меньшей мере 81%, по меньшей мере 82%, по меньшей мере 83%, по меньшей мере 84%, по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, или по меньшей мере 99% идентичность последовательности с последовательностью pLacZMB75.6 (SEQ ID NO: 268). В некоторых аспектах, иммуногенная нуклеиновая кислота содержит плазмиду, имеющую последовательность pLacZMB75.6 (SEQ ID NO: 268).
В некоторых аспектах обеспечиваются иммуногенные плазмидные нуклеиновые кислоты, содержащие последовательность нуклеиновой кислоты, имеющую по меньшей мере 80% идентичность последовательности с последовательностью SEQ ID NO: 266. В некоторых аспектах, иммуногенная плазмида содержит или состоит из последовательности нуклеиновой кислоты, имеющей по меньшей мере 75%, по меньшей мере 76%, по меньшей мере 77%, по меньшей мере 78%, по меньшей мере 79%, по меньшей мере 80%, по меньшей мере 81%, по меньшей мере 82%, по меньшей мере 83%, по меньшей мере 84%, по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, или по меньшей мере 99% идентичность последовательности с последовательностью SEQ ID NO: 266. В некоторых аспектах, иммуногенная плазмидная нуклеиновая кислота содержит последовательность SEQ ID NO: 266.
В некоторых аспектах обеспечиваются иммуногенная плазмидная нуклеиновая кислота, содержащая последовательность нуклеиновой кислоты, имеющую по меньшей мере 80% идентичность последовательности с последовательностью рМВ75.6_AscI (SEQ ID NO: 267). В некоторых аспектах, иммуногенная плазмида содержит или состоит из последовательности нуклеиновой кислоты, имеющей по меньшей мере 75%, по меньшей мере 76%, по меньшей мере 77%, по меньшей мере 78%, по меньшей мере 79%, по меньшей мере 80%, по меньшей мере 81%, по меньшей мере 82%, по меньшей мере 83%, по меньшей мере 84%, по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, или по меньшей мере 99% идентичность последовательности с последовательностью SEQ ID NO: 267. В некоторых аспектах, иммуногенная плазмидная нуклеиновая кислота содержит последовательность SEQ ID NO: 267.





Также в настоящем изобретении обеспечиваются иммуногенные нуклеиновые кислоты или иммуногенные плазмиды, способные стимулировать иммунный ответ, включающие последовательности нуклеиновых кислот, которые гибридизируются в условиях высокой жесткости с SEQ ID NO: 265, SEQ ID NO: 266, SEQ ID NO: 267, или SEQ ID NO: 268. Подходящие последовательности нуклеиновых кислот включают те последовательности, которые являются гомологичными, по существу сходными с или идентичными к нуклеиновым кислотам, описанным в настоящей заявке. В некоторых аспектах, гомологичные последовательности нуклеиновых кислот будут иметь процент идентичности по меньшей мере приблизительно 75%, 76%, 77%, 78%, 79%, 80% 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100% к SEQ ID NO: 265 или соответствующей комплементарной последовательности. В других аспектах, гомологичные последовательности нуклеиновых кислот будут иметь сходство последовательностей по меньшей мере приблизительно 75%, 76%, 77%, 78%, 79%, 80% 81%, 82%, 83%, 84%, 85%, 86%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100% к SEQ ID NO: 268 или соответствующей комплементарной последовательности. В других аспектах, гомологичные последовательности нуклеиновых кислот будут иметь сходство последовательностей по меньшей мере приблизительно 75%, 76%, 77%, 78%, 79%, 80% 81%, 82%, 83%, 84%, 85%, 86%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100% к SEQ ID NO: 266 или соответствующей комплементарной последовательности. В других аспектах, гомологичные последовательности нуклеиновых кислот будут иметь сходство последовательностей по меньшей мере приблизительно 75%, 76%, 77%, 78%, 79%, 80% 81%, 82%, 83%, 84%, 85%, 86%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100% к SEQ ID NO: 267 или соответствующей комплементарной последовательности. Сходство последовательностей может быть рассчитано с помощью различных алгоритмов, известных в данной области техники, таких как BLAST, описанного в Altschul, S. F., и др., J. Mol. Biol. 215:403-10, 1990. Нуклеиновые кислоты могут отличаться своей последовательностью от вышеописанных нуклеиновых кислот вследствие вырожденности генетического кода. Как правило, эталонная последовательность будет состоять из 18 нуклеотидов, более предпочтительно 30 или больше нуклеотидов, и может содержать полноразмерную последовательность нуклеиновой кислоты композиции для сравнения.
В настоящем изобретении охватываются нуклеиновые кислоты, которые могут гибридизоваться с SEQ ID NO: 265, SEQ ID NO: 266, SEQ ID NO: 267 или SEQ ID NO: 268. Жесткие условия гибридизации включают такие условия, как гибридизация при 50°С или выше и 0,1Х SSC (15 мМ хлорид натрия/1,5 мМ цитрат натрия). Другим примером является инкубирование в течение ночи при 42°С в растворе 50% формамида, 5Х SSC (150 мМ NaCl, 15 мМ трицитрат натрия), 50 мМ фосфат натрия (рН 7,6), 5Х раствор Денхардта, 10% сульфат декстрана, и 20 мкг/мл денатурированной, деградированной в результате гидродинамического сдвига ДНК из молок лососевых, с последующим промыванием 0,1Х SSC приблизительно при 65°С. Типичными жесткие условия гибридизации являются условия гибридизации, которые являются по меньшей мере приблизительно на 80%, 85%, 90%, или 95% жесткими, как описанные выше условия. Другие жесткие условия гибридизации известны в данной области техники и также могут применяться для идентификации гомологов нуклеиновых кислот, раскрытых в настоящей заявке (Current Protocols in Molecular Biology, Unit 6, опубл. John Wiley & Sons, N.Y. 1989).
Следует принять во внимание, что нуклеотидные последовательности иммуногенных плазмидных нуклеиновых кислот могут быть изменены до определенной степени без существенно отрицательного влияния на их иммуногенные свойства. Последовательность нуклеиновой кислоты такого варианта молекулы плазмидной нуклеиновой кислоты будет отличаться на один или несколько нуклеотидов. Изменения последовательности могут представлять собой замены, инсерции, делеции или их комбинацию. Методики мутагенеза клонированных генов хорошо известны в данной области техники. Методы сайт-специфического мутагенеза можно найти в Gustin и др., Biotechniques 14:22, 1993; Barany, Gene 37:111-23, 1985; Colicelli и др., Mol. Gen. Genet. 199:537-9, 1985; и Sambrook и др., Molecular Cloning: A Laboratory Manual, CSH Press 1989, cc. 15,3-15,108 и все они включены в данную заявку в качестве ссылки. В заключение, изобретение относится к молекулам плазмидных нуклеиновых кислот, и их вариантам или мутантам, способным стимулировать присущий иммунный ответ у субъекта. Также, изобретение охватывает промежуточные РНК, кодируемые описанными нуклеиновыми кислотами, а также любые полученные аминокислотные последовательности, кодируемыми плазмидными нуклеиновыми кислотами, описанными в настоящей заявке.
В некоторых аспектах, где нуклеотидная последовательность иммуногенной плазмидной нуклеиновой кислоты отличается от последовательности, представленной в SEQ ID NO:265, 266, 267, или 268, CpG динуклеотиды в иммуногенной плазмидной нуклеиновой кислоте предпочтительно остаются интактными. Альтернативно, если нуклеотидная последовательность иммуногенной плазмиды изменяется таким образом, что CpG динуклеотид элиминирован, то последовательность иммуногенной плазмидной нуклеиновой кислоты может быть изменена в другой локализации таким образом, что общее число CpG динуклеотидов в плазмидной нуклеиновой кислоте остается таким же. Также могут быть интродуцированы другие CpG динуклеотиды, дополнительно к тем, которые уже присутствуют в иммуногенной плазмидной нуклеиновой кислоте. Таким образом, например, иммуногенные плазмидные нуклеиновые кислоты, описанные в настоящей заявке, содержат по меньшей мере приблизительно 200, по меньшей мере приблизительно 220, по меньшей мере приблизительно 240, по меньшей мере приблизительно 260, по меньшей мере приблизительно 270, по меньшей мере приблизительно 275, по меньшей мере приблизительно 280, по меньшей мере приблизительно 283, по меньшей мере приблизительно 285, или по меньшей мере приблизительно 288 CpG динуклеотидов. В некоторых вариантах осуществления, иммуногенная плазмидную нуклеиновую кислоту может содержать 283 CpG динуклеотидов. В некоторых вариантах осуществления, в плазмиду интродуцируют CpG динуклеотиды дополнительно к тем, которые уже присутствуют в нуклеотидных последовательностях pGCMB75.6 или pLacZMB75.6.
В некоторых аспектах, где нуклеотидная последовательность иммуногенной плазмидной нуклеиновой кислоты отличается от последовательностей, представленных в настоящей заявке, то типы CpG мотива в иммуногенной нуклеиновой кислоте изменяются для модуляции получаемой активации цитозольной молекулы, контролирующей нуклеиновую кислоту, то есть, TLR21 и/или TLR9. Например, число иммуностимулирующих CpG мотивов может быть увеличено для усиления активации по меньшей мере одной цитозольной молекулы, контролирующей нуклеиновую кислоту, отвечающей на иммуногенную плазмидную нуклеиновую кислоту. Альтернативно, число иммунонестимулирующих CpG мотивов может быть увеличено для уменьшения активации по меньшей мере одной цитозольной молекулы, контролирующей нуклеиновую кислоту. В некоторых аспектах, число стимулирующих и нестимулирующих CpG мотивов может быть модифицировано для усиления активации по меньшей мере одной цитозольной молекулы, контролирующей нуклеиновую кислоту, и уменьшения активации по меньшей мере одной цитозольной молекулы, контролирующей нуклеиновую кислоту.
Подходящая молекула иммуногенной плазмидной нуклеиновой кислоты включает любые из иммуногенных кодирующих и некодирующих нуклеиновых кислот, описанных в настоящей заявке. Кодирующие последовательности нуклеиновых кислот кодируют по меньшей мере часть белка или пептида, в то время как некодирующая последовательность не кодирует никакой части белка или пептида. В соответствии с настоящим изобретением, "некодирующие" нуклеиновые кислоты могут включать регуляторные участки единицы транскрипции, такие как промоторный участок. Термин, "пустой вектор" может использоваться взаимозаменяемо с термином "некодирующая," и предпочтительно относится к последовательности нуклеиновой кислоты при отсутствии участка, кодирующего белок, такой как плазмидный вектор без инсертированого гена. Экспрессия белка, кодируемого плазмидными нуклеиновыми кислотами, описанными в настоящей заявке, не является необходимой для индуцирования иммунного ответа; таким образом, плазмиды не обязательно должны содержать какие-либо кодирующие последовательности, функционально связанные с последовательностью, контролирующей транскрипцию. Тем не менее, могут быть получены дополнительные преимущества (то есть, антигенспецифический и усиленный иммунитет) путем включения в иммуномодулирующую композицию по меньшей мере одной последовательности нуклеиновой кислоты (ДНК или РНК), которая кодирует иммуноген и/или цитокин. Такая последовательность нуклеиновой кислоты, кодирующая иммуноген и/или цитокин, может быть включена в иммуногенные плазмидные нуклеиновые кислоты, описанные в настоящей заявке, или может быть включена в отдельную нуклеиновую кислоту (например, отдельную плазмиду) в композиции.
В некоторых вариантах осуществления иммуномодулирующих композиций, описанных в настоящей заявке, иммуномодулирующая композиция содержит липосомный носитель и по меньшей мере одну из иммуногенных плазмидных нуклеиновых кислот, описанных в настоящей заявке. Подходящие иммуномодулирующие композиции описаны в опубликованных заявках на патент США №№2012/0064151 А1 и 2013/0295167 А1, содержание которых таким образом полностью включено в настоящую заявку в качестве ссылки.
Подходящий липосомный носитель содержит липидную композицию, которая способна доставлять молекулы нуклеиновых кислот в ткани субъекта, подвергаемого лечению. В некоторых вариантах осуществления, липосомный носитель может быть способен оставаться стабильным у субъекта в течение достаточного периода времени для доставки молекулы нуклеиновой кислоты и/или биологического агента. Например, липосомный носитель является стабильным у субъекта-реципиента в течение по меньшей мере приблизительно пяти минут, в течение по меньшей мере приблизительно 1 часа, или в течение по меньшей мере приблизительно 24 часов.
Липосомный носитель, как описано в настоящей заявке, содержит липидную композицию, которая способна сливаться с плазматической мембраной клетки для доставки молекулы нуклеиновой кислоты в клетку. Если молекула нуклеиновой кислоты кодирует один или несколько белков, комплекс нуклеиновая кислота:липосома имеет, в некоторых аспектах, эффективность трансфекции по меньшей мере приблизительно 1 пикограмм (пг) белка, экспрессируемого на миллиграмм (мг) общего тканевого белка на микрограмм (мкг) доставленной нуклеиновой кислоты. Например, эффективность трансфекции комплекса нуклеиновая кислота: липосома может составлять по меньшей мере приблизительно 10 пг белка, экспрессируемого на мг общего тканевого белка на мкг доставленной нуклеиновой кислоты; или по меньшей мере приблизительно 50 пг белка, экспрессируемого на мг общего тканевого белка на мкг доставленной нуклеиновой кислоты. Эффективность трансфекции комплекса может составлять всего лишь 1 фемтограмм (фг) белка, экспрессируемого на мг общего тканевого белка на мкг доставленной нуклеиновой кислоты, где вышеуказанные количества являются более предпочтительными.
В некоторых вариантах осуществления, липосомный носитель согласно настоящему изобретению составляет от приблизительно 100 до 500 нанометров (нм) в диаметре. Например, липосомный носитель может составлять приблизительно от 150 до 450 нм или от приблизительно 200 до 400 нм в диаметре.
Подходящие липосомы включают любую липосому, такую как те, которые обычно используются, например, в способах доставки генов, хорошо известных квалифицированным специалистам в данной области техники. В некоторых вариантах осуществления, липосомные носители содержат многослойные везикулярные (MLV) липиды, экструдированные липиды или липиды обеих типов. В некоторых аспектах, липосомный носитель является катионным. Способы получения MLV хорошо известны в данной области техники. В некоторых аспектах, липосомные носители содержат липосомы, имеющие поликатионную липидную композицию (то есть, катионные липосомы) и/или липосомы, имеющие холестерольный остов, конъюгированный с полиэтиленгликолем. Типичные катионные липосомные композиции включают, но не ограничиваясь только ими, хлорид N-[1-(2,3-диолеилокси)пропил]-N,N,N-триметиламмония (DOTMA) и холестерол, хлорид N-[1-(2,3-диолеоилокси)пропил]-N,N,N-триметиламмония (DOTAP) и холестерол, хлорид 1-[2-(олеоилокси)этил]-2-олеил-3-(2-гидроксиэтил)-имидазолиния (DOTIM) и холестерол, бромид диметилдиоктадециламмония (DDAB) и холестерол, и их комбинации. В некоторых аспектах, липосомный носитель содержит пары липидов, выбранные из группы, включающей хлорид N-[1-(2,3-диолеилокси)пропил]-N,N,N-триметиламмония (DOTMA) и холестерол; хлорид N-[1-(2,3-диолеоилокси)пропил]-N,N,N-триметиламмония (DOTAP) и холестерол; хлорид 1-[2-(олеоилокси)этил]-2-олеил-3-(2-гидроксиэтил)имидазолиния (DOTIM) и холестерол; и бромид диметилдиоктадециламмония (DDAB) и холестерол. В некоторых аспектах, липосомная композиция для применения в качестве носителя включает DOTIM и холестерол.
Образование комплекса липосомы с описанной в настоящей заявке иммуногенной плазмидной нуклеиновой кислотой можно осуществлять, используя методы, стандартные в данной области техники, или как описано в патенте США №6,693,086, содержание которого таким образом полностью включено в настоящую заявку путем ссылки. Подходящая концентрация плазмидной нуклеиновой кислоты для добавления в липосому включает концентрацию, эффективную для доставки достаточного количества иммуногенной плазмидной нуклеиновой кислоты субъекту таким образом, чтобы вызвать системный иммунный ответ. Например, от приблизительно 0,1 мкг до приблизительно 10 мкг иммуногенной плазмидной нуклеиновой кислоты может быть комбинировано с приблизительно 8 нмоль липосом, от приблизительно 0,5 мкг до приблизительно 5 мкг иммуногенной плазмидной нуклеиновой кислоты может быть комбинировано с приблизительно 8 нмоль липосом, или приблизительно 1,0 мкг иммуногенной плазмидной нуклеиновой кислоты может быть комбинировано с приблизительно 8 нмоль липосом. Соотношение иммуногенной плазмидной нуклеиновой кислоты к липиду (мкг иммуногенной плазмидной нуклеиновой кислоты : нмоль липида) в композиции может составлять по меньшей мере приблизительно 1:1 иммуногенная плазмидная нуклеиновая кислота : липид по весу (например, 1 мкг иммуногенной плазмидной нуклеиновой кислоты:1 нмоль липида). Например, соотношение иммуногенной плазмидной нуклеиновой кислоты к липидам может составлять по меньшей мере приблизительно 1:5, по меньшей мере приблизительно 1:10, или по меньшей мере приблизительно 1:20. Соотношения, представленные в настоящей заявке, основаны на количестве липида в композиции, а не на общем количестве липида в композиции. Соотношение иммуногенной плазмидной нуклеиновой кислоты к липидам в композиции согласно изобретению подходяще составляет от приблизительно 1:1 до приблизительно 1:80 иммуногенная плазмидная нуклеиновая кислота : липид по весу; от приблизительно 1:2 до приблизительно 1:40 иммуногенная плазмидная нуклеиновая кислота : липид по весу; от приблизительно 1:3 до приблизительно 1:30 иммуногенная нуклеиновая кислота: липид по весу; или от приблизительно 1:6 до приблизительно 1:15 иммуногенная плазмидная нуклеиновая кислота : липид по весу.
Концентрация иммуномодулирующой композиции, при повышении выше порогового уровня, может быть цитотоксической. В связи с этим, концентрация иммуномодулирующей композиции, как охватывается в настоящем раскрытии, является нецитотоксической, то есть, на уровне ниже этого порогового уровня. "Цитотоксичность", как используется в настоящей заявке, относится к аномальному клеточному состоянию, такому как задержка в развитии, замедленный рост, неоднородный вид под микроскопом, и/или снижение иммунологической реактивности. В некоторых аспектах, концентрация иммуномодулирующей композиции составляет от приблизительно 0,1 до приблизительно 250 нг/мл. В некоторых аспектах концентрация составляет от приблизительно 0,1 до приблизительно 200 нг/мл. В некоторых аспектах, концентрация иммуномодулирующей композиции составляет от приблизительно 0,1 до приблизительно 150 нг/мл. В других аспектах, концентрация иммуномодулирующей композиции составляет от приблизительно 0,1 до приблизительно 100 нг/мл. В еще других аспектах, концентрация иммуномодулирующего комплекса составляет от приблизительно 0,1 до приблизительно 50 нг/мл. В других аспектах, концентрация иммуномодулирующей композиции составляет от приблизительно 1 до приблизительно 250 нг/мл. В некоторых аспектах, концентрация иммуномодулирующей композиции составляет от приблизительно 10 до приблизительно 250 нг/мл. В некоторых аспектах, концентрация иммуномодулирующей композиции составляет от приблизительно 50 до приблизительно 250 нг/мл. В некоторых аспектах, концентрация иммуномодулирующей композиции составляет от приблизительно 100 до приблизительно 250 нг/мл. В некоторых аспектах, концентрация иммуномодулирующей композиции составляет от приблизительно 150 до приблизительно 250 нг/мл. В еще других аспектах, концентрация иммуномодулирующей композиции составляет от приблизительно 200 до приблизительно 250 нг/мл. В некоторых вариантах осуществления, концентрация иммуномодулирующей композиции составляет приблизительно или меньше 120 нг/мл. В некоторых аспектах, концентрация иммуномодулирующей композиции является нецитотоксической.
Также в настоящем изобретении обеспечиваются фармацевтические композиции, содержащие иммуностимулирующую композицию, как описано выше, и фармацевтически приемлемый наполнитель. Иммуномодулирующая композиция может вводиться перед, одновременно с, или после иммуностимулирующего олигонуклеотида. Фармацевтические наполнители для индивидуальной иммуномодулирующей композиции и иммуностимулирующего олигонуклеотида не обязательно должны представлять собой один и тот же наполнитель. Фармацевтически приемлемый наполнитель приспосабливает композицию для введения путем, выбранным из внутривенного, внутримышечного, интрамаммарного, внутрикожного, внутрибрюшинного, подкожного, путем распыления, с помощью аэрозоля, «в яйцо», слизистого, чрескожного, путем погружения, перорального, внутриглазного, интратрахеального, интраназального, легочного, ректального или других путей, известных квалифицированному специалисту в данной области техники. Фармацевтически приемлемый (е) наполнитель (и) может (гут) представлять собой разбавитель, адъювант, наполнитель или вспомогательное вещество, с которым вводится иммуностимулирующая композиция или иммуномодулирующая композиция или иммуностимулирующий олигонуклеотид. Такие наполнители могут являться жидкостями, такими как вода и масла, включая нефтепродукты, вещества животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и другие. Например, можно использовать 0,4% физиологический раствор и 0,3% глицин. Эти растворы являются стерильными и практически не содержат твердых примесей. Их можно стерилизовать с помощью общепринятых, хорошо известных методик стерилизации (например, фильтрации). Композиции могут содержать фармацевтически приемлемые вспомогательные вещества, что необходимо для приближения к физиологическим условиям, такие как вещества, корригирующие значение рН, и буферные агенты, стабилизаторы, загустители, смазывающие вещества и красители и др. Концентрация молекул согласно изобретению в таком фармацевтическом препарате может изменяться в широких пределах, то есть от менее чем приблизительно 0,5%, обычно до по меньшей мере приблизительно 1% вплоть до 15 или 20% по весу и будет выбираться главным образом на основании требуемой дозы, объема жидкостей, вязкостей и т.д., в соответствии с конкретным выбранным путем введения. Подходящие наполнители и препараты, в том числе и для других белков человека, например, сывороточного альбумина человека, описаны, например, в Remington: The Science and Practice of Pharmacy, 21oe изд, под ред. Troy, D.B., Lipincott Williams and Wilkins, Philadelphia, PA 2006, часть 5, Pharmaceutical Manufacturing, cc. 691-1092 (см., в особенности, cc. 958-989).
Также в настоящей заявке обеспечиваются способы приготовления иммуностимулирующей композиции, описанной выше, включающей комбинирование иммуномодулирующей композиции и иммуностимулирующего олигонуклеотида, с образованием иммуностимулирующей композиции; центрифугирование иммуностимулирующей композиции для получения супернатанта и осадка; и выделение осадка.
Центрифугирование иммуностимулирующая композиция будет вызывать седиментацию иммуностимулирующей композиции. Выделение осадка можно осуществлять путем отливания супернатанта, пипетированием супернатанта или удалением супернатанта с помощью других методов, до тех пор, пока остается порция осадка. Полагают, что некоторое количество осадка потеряется во время удаления супернатанта. Также, некоторое количество иммуностимулирующей композиции может оставаться в супернатанте даже после центрифугирования. При таком сценарии, супернатант может сохранять иммуностимулирующие свойства. Если иммуностимулирующая активность вследствие присутствия иммуностимулирующей композиции остается в супернатанте, но является желательным получить практически всю иммуностимулирующую композицию в осадке, то следует использовать более высокие скорости центрифугирования. Например, если супернатант содержит иммуностимулирующую композицию после центрифугирования при 8 тыс. об./мин, то повышение скорости центрифугирования до 14 тыс.об./мин можно осадить оставшуюся иммуностимулирующую композицию.
Также в настоящей заявке обеспечиваются способы стимуляции толл-подобного рецептора 21 (TLR21), включающие введение иммуностимулирующего олигонуклеотида и иммуномодулирующей композиции, где иммуностимулирующий олигонуклеотид содержит по меньшей мере один CpG мотив и обогащенную гуаниновыми нуклеотидами последовательность на или возле 5'-конца иммуностимулирующего олигонуклеотида, и где иммуномодулирующая композиция содержит некодирующую плазмидную нуклеиновую кислоту и катионный липидный носитель.
Иммуностимулирующий олигонуклеотид и иммуномодулирующая композиция может вводиться путем, выбранным из внутривенного, внутримышечного, интрамаммарного, внутрикожного, внутрибрюшинного, подкожного, путем распыления, с помощью аэрозоля, «в яйцо», слизистого, чрескожного, путем погружения, перорального, внутриглазного, интратрахеального, интраназального, легочного, ректального или других путей, известных квалифицированному специалисту в данной области техники. В некоторых аспектах, иммуномодулирующая композиция и иммуностимулирующий олигонуклеотид присутствуют в синергетически эффективных количествах. Введение иммуностимулирующей композиции и иммуномодулирующей композиции может быть последовательным или одновременным.
Концентрация иммуномодулирующей композиции может быть цитотоксической, когда составляет больше 250 мкг/мл, и эта цитотоксичность может больше чем компенсировать любой иммуностимулирующий эффект иммуномодулятора. В некоторых аспектах настоящей заявки, концентрация иммуномодулятора составляет приблизительно 200 мкг/мл. При введении иммуностимулирующего олигонуклеотида, цитотоксические уровни не наблюдаются в диапазоне возле или ниже 10 мкМ. Даже более высокие концентрации иммуностимулирующего олигонуклеотида могут переноситься реципиентом. В некоторых аспектах настоящей заявки концентрация иммуностимулирующего олигонуклеотида находится в диапазоне от приблизительно 10 мкМ до 0,5 мкМ. В некоторых аспектах концентрация иммуностимулирующего олигонуклеотида составляет приблизительно 2 мкМ, и в некоторых аспектах, концентрация иммуномодулирующей композиции больше, чем концентрация иммуностимулирующего олигонуклеотида. Поскольку цитотоксичность является ограничивающим фактором при введении иммуномодулирующей композиции, то в некоторых аспектах, иммуномодулирующая композиция присутствует в нецитотоксических количествах.
В каждом аспекте способов, представленных в настоящей заявке, иммуномодулирующая композиция и иммуностимулирующий олигонуклеотид могут представлять собой любой вариант осуществления или аспект, как описано выше.
Также обеспечиваются способы вызывания иммунного ответа у субъекта, включающие введение иммуностимулирующей композиции согласно любому варианту осуществления, описанному в настоящей заявке. Другие варианты осуществления, включенные в настоящее раскрытие, охватывают способы вызывания иммунного ответа у субъекта, включающие введение иммуностимулирующего олигонуклеотида и иммуномодулирующей композиции, описанных в настоящей заявке.
ПРИМЕРЫ
Следующие примеры представлены для дальнейшего описания некоторых их вариантов осуществления, раскрытых в настоящей заявке. Примеры предназначены для иллюстрации, но не для ограничения описанных вариантов осуществления.
Иммуномодулирующая композиция, используемая в следующих примерах, представляет собой композицию, содержащую катионный липид (DOTIM и холестерол) и некодирующую ДНК (рМВ75.6) (SEQ ID NO: 266). Компоненты катионного липида представляют собой хлорид [1-[2-[9-(Z)-октадецено-илокси]]-2-[8](Z)-гептадеценил]-3-[гидроксиэтил]имидазолиния (DOTIM) и синтетический нейтральный липид холестерол, приготовленные в виде препарата для получения липосом приблизительно 200 нм в диаметре (см. патент США №6,693,086). Компонент некодирующей ДНК представляет собой некодирующую ДНК плазмиду из 4292 пар оснований (рМВ75.6) (SEQ ID NO: 266), продуцируемую в Е. coli, которая, является отрицательно заряженной, ассоциирована с положительно заряженными (катионными) липосомами (см. патент США №6,693,086). В Примерах, термин "иммуностимулирующая плазмидная нуклеиновая кислота" относится к рМВ75.6.
Пример 1: Комбинирование TLR21-активных
олигодезоксинуклеотидов с иммуномодулирующей композицией
Исследовали активность иммуномодулирующей композиции на TLR21. Специфически, HEK293-NFKB-bsd-cTLR21 клетки высевали в планшеты на 384 лунки в количестве 10 тыс.клеток/лунку в 45 мкл ростовой среды. Эти клетки подвергали воздействию олигонуклеотида, растворенного в ростовой среде, и инкубировали при 37° в течение 3-4 дней. 10 мкл культурального супернатанта на лунку переносили в планшет на 384 лунки и добавляли 90 мкл 50 мМ NaHCO3/Na2CO3, 2 мМ MgCl2, 5 мМ пара-нитрофенилфосфата (pNP) рН 9,6 и определяли скорость реакции путем кинетического измерения изменений в динамике оптической плотности при 405 нМ (мОП 405 нм/мин).
Показано, что иммуностимулирующая плазмидная нуклеиновая кислота отдельно является неактивной в исследуемом диапазоне концентраций (2 мкг/мл и ниже), в то время как приготовленная в виде липосомального препарата иммуностимулирующая плазмидная нуклеиновая кислота (пДНК-F) проявляет слабый, но четкий сигнал с колоколообразной кривой, указывая на ее взаимодействие TLR21 (Фиг. 2А). Тем не менее TLR21-стимулирующая активность была на несколько порядков ниже по сравнению с 5-Chol-GCGT3-TG4T (SEQ ID NO: 1) (Фиг. 2A и 2В), олигонуклеотидным лигандом, оптимизированным для взаимодействия с этим рецептором.

Активность иммуномодулирующей композиции пДНК-F на TLR21 свидетельствует о том, что этот рецептор действительно может являться лигандом действия иммуномодулирующей композиции в условиях in vivo, но поскольку иммуномодулирующая композиция является очень слабым лигандом для TLR21, этот рецептор может не являться единственным и доминантным когнатным рецептором.
Пример 2: Комбинация 5-Chol-GCGT3-TG4T с иммуностимулирующей плазмидной нуклеиновой кислотой и иммуномодулирующей композицией
Приготавливали 200 мкг/мл растворов иммуностимулирующей плазмидной нуклеиновой кислоты отдельно и иммуномодулирующей композиции и 2 мкМ растворов 5-Chol-GCGT3-TG4T и инкубировали в течение 2 часов при 4 С.После этого, из этого раствора, приготавливали серийные разведения 1:2 и вводили в HEK293-bsd-cTLR21 клетки, начиная с концентрации плазмиды 20 нМ (и концентрации плазмиды 2 мкг/мл) в соответствии с протоколом в Примере 1 и по сравнению с образцом, содержащим только 5-Chol-GCGT3-TG4T. Все образцы продемонстрировали сильную TLR21 стимулирующую активность, только с одним образцом, показавшим немного более высокие значения пиков и ЕС50 2,44 пМ (Фиг. 3А, Таблица 3). За исключением проявления незначительно более низкой Vmax, комбинация 5-Chol-GCGT3-TG4T с иммуностимулирующей плазмидной нуклеиновой кислотой, которая сама была полностью неактивной, приводит к незначительному изменению ЕС50, по сравнению с 5-Chol-GCGT3-TG4T отдельно (2,11 пМ) (Фиг. 3А, Таблица 3). В отличие от этого, образец, содержащий липосому, (иммуностимулирующий олигонуклеотид 5-Chol-GCGT3-TG4T и иммуномодулирующая композиция) проявил максимальную активность и сильное снижение сигнала при более высоких концентрациях, (Фиг. 3А). Тем не менее, более внимательное рассмотрение низких концентраций (пМ) показало определенное плато активности с рассчитанной ЕС50 1,04 пМ (Фиг. 3В, Таблица 3). В этом диапазоне концентраций, иммуномодулирующая композиция является полностью неактивной (Фиг. 3В) и, отдельно, не отвечает на снижение ЕС50.

Полученные результаты свидетельствуют о том, что комбинация TLR21-стимулирующего ОДН 5-Chol-GCGT3-TG4T и нецитотоксических концентраций либо иммуностимулирующей плазмидной нуклеиновой кислоты или иммуномодулирующей композиции приводит к неактивным смесям. Кроме того, комбинация TLR21-стимулирующего ОДН 5-Chol-GCGT3-TG4T и иммуномодулирующая композиция является синергетической по отношению к ЕС50 для активации TLR21.
Пример 3: Центрифугирование иммуномодулирующей композиции и TLR21 активность
Раствор иммуномодулирующей композиции при концентрации плазмиды 200 мкг/мл центрифугировали в течение 2 часов при 4°С в настольной центрифуге Эппендорфа при 14 тыс.об./мин при 4°С. Для сравнения, нецентрифугируемую аликвоту хранили при температуре 4°С в течение 2 часов. Супернатант удаляли и хранили, в то время как осадок ресуспендировали в эквивалентном объеме. Титрования начинали при содержании плазмиды 2 мг/мл, приготовленной для применения в TLR21 анализе, как описано в Примере 1, так ранее было установлено, что иммуномодулирующая композиция обладает некоторой слабой TLR21 стимулирующей активностью (см. Пример 1).
Центрифугирование иммуномодулирующей композиции приводило к образованию осадка, который было сложно ресуспендировать с помощью пипетки. Вся TLR21 стимулирующая активность иммуномодулирующей композиции была обнаружена в осадке после центрифугирования, и супернатант не имел TLR21 активности (Фиг. 4). Ресуспендированные липосомы проявляли более высокую ЕС50 для TLR21 стимуляции по сравнению с липосомами, которые хранили при температуре 4°С. Этот эффект может быть обусловлен изменениями в липосомах после центрифугирования (например, неполным ресуспендированием/диспергированием).
Пример 4: Комбинация 5-Chol-GCGT3-TG4T с иммуномодулирующей композицией
Приготавливали раствор раствор иммуномодулирующая композиция/5-Chol-GCGT3-TG4T, имеющий концентрацию плазмиды 200 мкг/мл и 2 мкМ 5-Chol-GCGT3-TG4T. Также приготавливали 2 мкМ раствор 5-Chol-GCGT3-TG4T. Оба образца инкубировали в течение 2 часов при 4°С. 100 мкл аликвот этих растворов центрифугировали в настольной центрифуге Эппендорфа при 14 тыс. об./мин при 4°С в течение 2 часов для применения в Примере 5, в то время как остаток после инкубирования хранили при температуре 4°С для анализа в соответствии с этим Примером 4. Оба образца проявили сильную TLR21 стимулирующую активность, но комбинация иммуномодулирующая композиция/5-СЬ.о1-GCGT3-TG4T продемонстрировала сильное снижение сигналов при более высоких концентрациях (Фиг. 5А), вероятно, вследствие цитотоксичности иммуномодулирующей композиции. Соответствующие Vmax значения были сходными, если компонент иммуномодулирующей композиции образца рассматривался при низкотоксичных концентрациях (Фиг. 5В, Таблица 4). Тем не менее, рассчитанные ЕС50 комбинации иммуномодулирующая композиция/5-Chol-GCGT3-TG4T были в 4 раза ниже, чем такие значения для 5-Chol-GCGT3-TG4T отдельно (Фиг. 5В, Таблица 4).
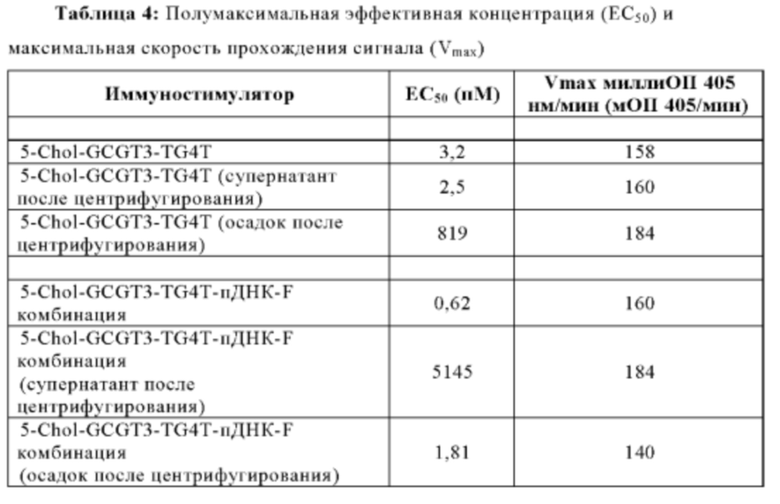
Пример 5: Центрифугирование иммуномодулирующей композиции /5-Chol-GCGT3-TG4T и 5-Chol-GCGT3-TG4T
Приготавливали раствор иммуномодулирующая композиция/5-Chol-GCGT3-TG4T, имеющий концентрацию плазмиды 200 мкг/мл и 2 мкМ 5-Chol-GCGT3-TG4T. Также приготавливали 2 мкМ раствор 5-Chol-GCGT3-TG4T. Оба образца инкубировали в течение 2 часов при 4°С. 100 мкл аликвот этих растворов центрифугировали в настольной центрифуге Эппендорфа при 14 тыс.об./мин при 4°С в течение 2 часов. Супернатанты удаляли и хранили, в то время как осадки ресуспендировали в 100 мкл. После этого, из этих растворов, приготавливали серийные разведения 1:2 и вводили в HEK293-bsd-cTLR21 клетки, начиная с концентрации плазмиды 20 нМ (и концентрации плазмиды 2 мкг/мл) и сравнивали с образцом, содержащим только 5-Chol-GCGT3-TG4T.
Центрифугирование комбинации иммуномодулирующая композиция/5-Chol-GCGT3-TG4T приводила к хорошо видимому осадку, в то время как не наблюдали видимого осадка для 5-Chol-GCGT3-TG4T. Осадок комбинации иммуномодулирующая композиция/5-Chol-GCGT3-TG4T ("пДНК-F 5Chol Осадок") было сложно ресуспендировать, но в TLR21 анализе, как описано в Примере 1, он содержал фактически всю стимулирующую активность (Фиг. 6А и 6 В), с только следами, обнаруженными в супернатанте ("пДНК-F 5Chol Супернатант") (Фиг. 6FJ, Таблица 4), хотя и с более высокими ЕС50, чем в исходном образце ("пДНК-F F-Chol-GCGT3-TG4T") (Таблица 4). Этот результат свидетельствует о том, что после смешивания с иммуномодулирующей композицией, 5-Chol-GCGT3-TG4T количественно физически ассоциирует с липосомальной фракцией. 5-Chol-GCGT3-TG4T отдельно, который, после центрифугирования, остается практически исключительно (по оценкам 99%, Таблица 4) в супернатанте, как и предполагалось, из водорастворимого соединения (Фиг. 7А и 7В).
Пример 6: Комбинация 5-Chol-GCGT3-TG4T и иммуномодулирующей композиции
Приготавливали иммуностимулирующую композицию с концентрацией плазмиды 200 мкг/мл и 2 мкМ 5-Chol-GCGT3-TG4T. Также приготавливали 2 мкМ раствор 5-Chol-GCGT3-TG4T. Оба образца инкубировали в течение 2 часов при 4°С. 100 мкл аликвот этих растворов центрифугировали в настольной центрифуге Эппендорфа при 14 тыс.об./мин при 4°С в течение 2 часов для применения в Примере 7, в то время как остаток после инкубирования хранили при температуре 4°С для анализа в соответствии с этим Примером 6. Супернатанты удаляли и хранили, в то время как осадки ресуспендировали в 200 мкл. После этого, из этих растворов, серийные разведения 1:2 осуществляли и вводили в HEK293-bsd-cTLR21 клетки для TLR21 анализа в соответствии с протоколом в Примере 1. Исходная концентрация плазмиды составляла 20 нМ (и концентрация плазмиды 2 мкг/мл) и сравнивали с образцом, содержащим только 5-Chol-GCGT3-TG4T.
Оба образца ("5-Chol-GCGT3-TG4T" и "пДНК-F/5-Chol-GCGT3-TG4T") проявили сильную TLR21 стимулирующую активность, но комбинация иммуномодулирующая композиция/5-Chol-GCGT3-TG4T ("пДНК-Р/5-Chol-GCGT3-TG4T") продемонстрировала сильное снижение сигналов при более высоких концентрациях (Фиг. 8А), вероятно, вследствие цитотоксичности иммуномодулирующей композиции. Соответствующие Vmax значения были очень сходными, если стимулирующую активность образца, содержащего иммуномодулирующую композицию, рассматривали при низкотоксичных концентрациях (Фиг. 8В, Таблица 5). Тем не менее, рассчитанные ЕС50 комбинации иммуномодулирующая композиция/5-Chol-GCGT3-TG4T были в 2 раза ниже, чем такие значения для 5-Chol-GCGT3-TG4T ("5-Chol-GCGT3-TG4T") отдельно (Фиг. 8 В, Таблица 5).
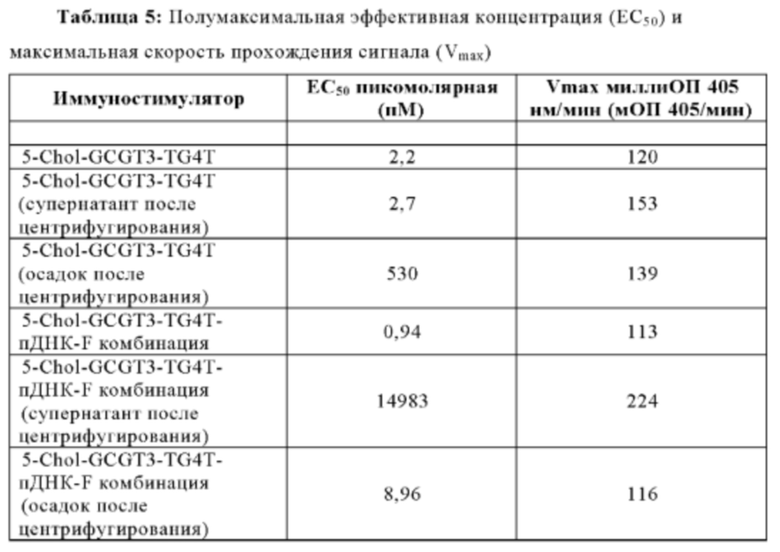
Пример 7: Центрифугирование иммуномодулирующей композиции /5-Chol-GCGT3-TG4T и 5-Chol-GCGT3-TG4T
Центрифугирование комбинации иммуномодулирующая композиция/5-Chol-GCGT3-TG4T приводила к хорошо видимому осадку, в то время как не наблюдали видимого осадка для 5-Chol-GCGT3-TG4T. Осадок комбинации иммуномодулирующая композиция/5-Chol-GCGT3-TG4T было сложно ресуспендировать, но в TLR21 исследовании, как описано в Примере 1, он ("пДНК-Е/5-Chol-GCGT3-TG4T осадок") содержал фактически всю стимулирующую активность (Фиг. 9В), хотя и с более высокими ЕС50, чем в исходном образце (Таблица 5)), с только следами, обнаруженными в супернатанте ("пДНК-Е/5-Chol-GCGT3-TG4T супернатант") (Фиг. 9 В, Таблица 5). Этот результат свидетельствует о том, что после смешивания с иммуномодулирующей композицией, 5-Chol-GCGT3-TG4T физически ассоциирован с липосомальной фракцией. Обе фракции сравнивали с нецентрифугированными иммуномодулирующей композицией/5-Chol-GCGT3-TG4T ("пДНК-F/5-Chol-GCGT3-TG4T")
Пример 8: Комбинация 5-Chol-GCGT3-TG4T с иммуномодулирующей композицией
Приготавливали раствор иммуномодулирующей композиции при концентрации плазмиды 200 мкг/мл и 2 мкМ 5-Chol-GCGT3-TG4T. Также приготавливали образец 2 мкМ 5-Chol-GCGT3-TG4T. Оба образца инкубировали в течение 2 часов при 4°С. 100 мкл аликвот этих растворов центрифугировали в настольной центрифуге Эппендорфа при 14 тыс.об./мин при 4°С в течение 2 часов для применения в Примере 9, в то время как остаток после инкубирования хранили при температуре 4°С для анализа в соответствии с этим Примером 8. Супернатанты удаляли и хранили, в то время как осадки ресуспендировали в 100 мкл. После этого, из этих растворов, приготавливали серийные разведения 1:2 и вводили в HEK293-bsd-cTLR21 клетки в соответствии с протоколом согласно Примеру 1, начиная с концентрации плазмиды 20 нМ (и концентрации плазмиды 2 мкг/мл) и сравнивали с образцом, содержащим только 5-Chol-GCGT3-TG4T.
Оба образца проявили сильную TLR21 стимулирующую активность, но комбинация 5-Chol-GCGT3-TG4T/иммуномодулирующая композиция ("пДНК-F/5-Chol-GCGT3-TG4T") продемонстрировала сильное снижение сигналов при более высоких концентрациях (Фиг. 10А), подобное такому результату для иммуномодулятора самостоятельно ("пДНК-F") и, вероятно, вследствие цитотоксичности иммуномодулирующей композиции. Иммуностимулирующий олигонуклеотид ("5-Chol-GCGT3-TG4T") проявляет большую стимулирующую активность при более высоких концентрациях, чем это осуществляет любой образец, содержащий иммуномодулирующую композицию. Соответствующие Vmax значения были очень сходными, когда стимулирующую активность компонента иммуномодулирующей композиции образца рассматривали при низкотоксичных концентрациях (Фиг. 10В, Таблица 6). Тем не менее, рассчитанные ЕС50 комбинации иммуномодулирующая композиция/5-Chol-GCGT3-TG4T ("пДНК-F/5-Chol-GCGT3-TG4T") были в 4 раза ниже, чем такие значения для 5-Chol-GCGT3-TG4T отдельно ("5-Chol-GCGT3-TG4T") (Фиг. 10В, Таблица 6). Иммуномодулирующая композиция отдельно ("Bay 98-F") проявляла только минимальную активность, этот аддитивный эффект не может быть объяснен повышенной активностью иммуномодулирующей композиции/5-Chol-GCGT3-TG4T по сравнению с 5-Chol-GCGT3-TG4T отдельно.

Пример 9: Центрифугирование иммуномодулирующей композиции
Центрифугирование комбинации иммуномодулирующая композиция/5-Chol-GCGT3-TG4T приводила к хорошо видимому осадку, в то время как для 5-Chol-GCGT3-TG4T, не наблюдали видимого осадка. Осадок комбинации иммуномодулирующая композиция/5-Chol-GCGT3-TG4T ("пДНК-F/5-Chol-GCGT3-TG4T Осадок") было сложно ресуспендировать, но в TLR21 исследовании, как описано в Примере 1, он содержал > 95% стимулирующей активности (Фиг. 11В), хотя и с более высокими ЕС50, чем в исходном образце, с только небольшой фракцией (< 5%), обнаруженной в супернатанте ("пДНК-F/5-Chol-GCGT3-TG4T Супернатант") (Фиг. 11В, Таблица 6) и только незначительно меньше, чем нецентрифугированный образец при низких концентрациях иммуномодулирующей композиции ("пДНК-F/5-Chol-GCGT3-TG4T"). Этот результат свидетельствует о том, что после смешивания с иммуномодулирующей композицией, 5-Chol-GCGT3-TG4T количественно физически ассоциирует с липосомальной фракцией.
Пример 10: Комбинация GCGT3-TG4T с иммуномодулирующей композицией
Приготавливали раствор иммуномодулирующей композиции при концентрации плазмиды 200 мкг/мл и 2 мкМ GCGT3-TG4T (SEQ ID NO:252; аналогичная олигонуклеотидная последовательность, как для 5-Chol- GCGT3-TG4T (SEQ ID NO: 1) но без холестерильной модификации). Также, приготавливали образец 2 мкМ GCGT3-TG4T, и оба образца инкубировали в течение 2 часов при 4°С. 100 мкл аликвот этих растворов центрифугировали в настольной центрифуге Эппендорфа при 14 тыс.об./мин при 4°С в течение 2 часов для применения в Примере 11, в то время как остаток после инкубирования хранили при температуре 4°С для анализа в соответствии с этим Примером 10. Супернатанты удаляли и хранили, в то время как осадки ресуспендировали в 100 мкл. После этого, из этих растворов, приготавливали серийные разведения 1:2 и вводили в HEK293-bsd-cTLR21 клетки в соответствии с протоколом в Примере 1, начиная с концентрации плазмиды 20 нМ (и концентрации плазмиды 2 мкг/мл) и сравнивали с образцом, содержащим только GCGT3-TG4T.
Оба образца проявили сильную TLR21 стимулирующую активность, но комбинация GCGT3-TG4T/иммуномодулирующая композиция ("пДНК-F/5-Chol-GCGT3-TG4T") продемонстрировала сильное снижение сигналов при более высоких концентрациях (Фиг. 12А), вероятно, вследствие цитотоксичности иммуномодулирующей композиции. Соответствующие Vmax значения были очень сходными, когда стимулирующую активность компонента иммуномодулирующей композиции образца рассматривали при низкотоксичных концентрациях (Фиг. 12В, Таблица 7). Тем не менее, рассчитанные ЕС50 комбинации иммуномодулирующая композиция/GCGT3-ТС4Т более чем в 4 раза ниже, чем такие значения для GCGT3-TG4T отдельно (Таблица 7). Иммуномодулирующая композиция отдельно ("пДНК-F") проявляла только минимальную активность, этот аддитивный эффект не может быть объяснен повышенной активностью иммуномодулирующей композиции/GCGT3-TG4T по сравнению с GCGT3-TG4T отдельно.

Пример 11: Центрифугирование иммуномодулирующей композиции/GCGT3-TG4T
Центрифугирование комбинации иммуномодулирующей композиции/GCGT3-TG4T приводила к хорошо видимому осадку. Осадок комбинации иммуномодулирующая композиция/GCGT3-ТС4Т было сложно ресуспендировать, но в TLR21 исследовании, как описано в Примере 1, он ("пДНК-F/GCGT3-TG4T Осадок") содержал > 3 × больше стимулирующей активности (Фиг. 13 В), хотя и с более высокими ЕС50, чем в исходном образце ("пДНК-F/GCGT3-TG4T"), чем супернатант ("пДНК-F/GCGT3-ТС4Т Супернатант") (Фиг. 13В, Таблица 7). Этот результат свидетельствует о том, что после смешивания с иммуномодулирующей композицией, GCGT3-TG4T количественно физически ассоциирует с липосомальной фракцией, хотя, возможно, не настолько эффективно, как холестерил-дериватизированный 5-Chol- GCGT3-TG4T.
Для квалифицированных специалистов в данной области техники будет понятно, что в предпочтительные варианты осуществления изобретения могут быть внесены различные изменения и модификации и что такие изменения и модификации могут быть осуществлены без отклонения от сущности изобретения. Следовательно, предполагается, что пункты приложенной формулы изобретения охватывают все такие эквивалентные вариации как подпадающие под сущность и объем изобретения.
Раскрытие каждого патента, патентной заявки и публикации, процитированной или описанной в данной документе, таким образом полностью включено в настоящую заявку в качестве ссылки.
Пример 12: Исследование эффективности иммуностимуляторов в условиях in vivo на модели вакцинации болезни Пьюкасла у цыплят
Для определения пригодности и эффективности ОДН1, ОДН2 и ОДНЗ в качестве иммуностимуляторов, каждый тестировали в трех различных концентрациях.
Исследовали следующие иммуностимуляторы:



Каждый иммуностимулятор добавляли к масляной эмульсии, содержащей субоптимальную концентрацию инактивированного вируса болезни Ньюкасла (NDV) в соответствии с Таблицей 9. Для приготовления субоптимальной NDV вакцины, партию NDV антигена разводили 50 раз в NDV-отрицательной аллантоисной жидкости (AF). Эффективности ОДН1, ОДН2, и ОДН3 в комбинации с субоптимальной дозировкой вакцины болезни Ньюкасла тестировали у SPF куриц-несушек (Leghorn). Измеряли серологическую реакцию и сравнивали со сходной субоптимальной NDV вакциной без иммуностимулятора. Титр антител определяли в различные временные точки после вакцинации для исследования, может ли добавление иммуностимуляторов приводить к более раннему иммунному ответу. Для определения наиболее оптимальных дозировок трех ОДН, каждый дополняли тремя различными дозами 100 нг, 1000 нг и 5000 нг до субоптимальной NDV вакцины, что приводило к получению девяти групп с иммуностимуляторами. Кроме этих девяти групп с иммуностимуляторами, в это исследование включали пять контрольных групп, состоящие из группы субоптимальной NDV вакцины без иммуностимулятора, группы с неразведенной NDV вакциной, отрицательной контрольной группы (иммуностимуляторы в комбинации с адъювантом) и двух положительных контрольных групп с полиинозиновой: полицитидиловой кислотой (Поли И:Ц) в двух различных концентрациях (Таблица 8).
Тестировали следующие параметры: здоровье цыплят (данные не представлены) и серологию путем исследования ингибирования гемагглютинации (HI).

Цыплята, включенные в леченные группы Т01-Т14, получали тестируемый образец или контрольный образец в соответствии с планом исследования. В группах Т13 и Т14, девять вместо десяти цыплят на группу вакцинировали вследствие потери двух животных перед началом исследования.
Цыплят, включенных в леченные группы Т01, Т02, Т03, Т04, Т05, Т06, Т07, Т08 и Т09, вакцинировали с применением субоптимальной NDV суспензии, содержащей 1-3 различных иммуностимулятора (ОДН), каждый в 3 различных концентрациях (100, 1000, 5000 нг/дозу). Для приготовления эмульсий типа вода в масле, суспензию антигена NDV и иммуностимулятор (водная фаза) приготавливали в виде препарата с адъювантом Stimune (масляная фаза) при соотношении 4:5 (Таблица 9).
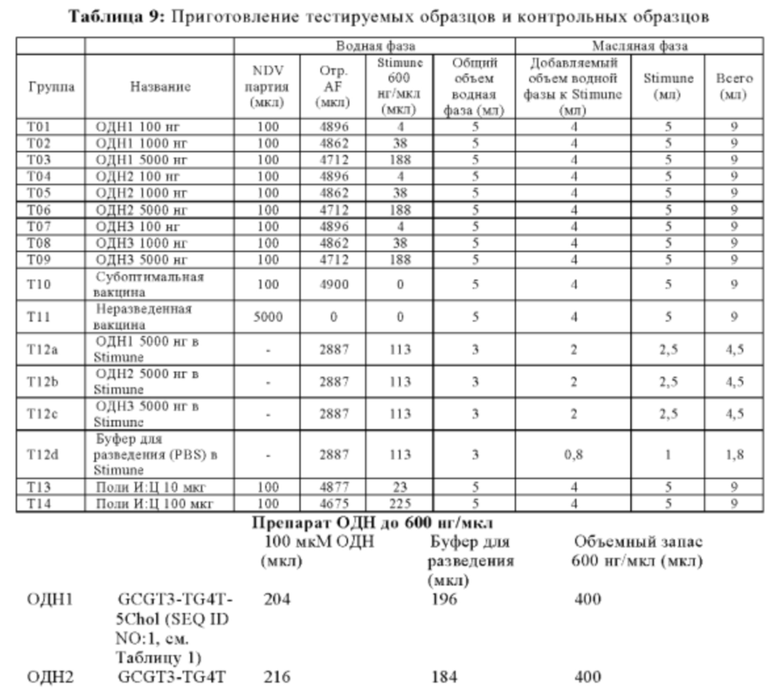

Цыплят, включенных в контрольную группу Т10, вакцинировали с применением субоптимальной NDV суспензии без иммуностимулятора в адъюванте (Stimune) при соотношении 4:5.
Цыплят, включенных в контрольную группу Т11, вакцинировали с применением неразведенной NDV суспензии без иммуностимулятора в адъюванте (Stimune) при соотношении 4:5.
Цыплят, включенных в группу Т12, вакцинировали с применением иммуностимулятора 1 (3 цыпленка), иммуностимулятора 2 (3 цыпленка) и иммуностимулятора 3 (3 цыпленка) в адъюванте (Stimune) при соотношении 4:5. Одного цыпленка вакцинировали с применением буфера для разведения (собственный) в адъюванте (Stimune).
Цыплят, включенных в контрольные группы Т13 (n=9) и Т14 (n=9), вакцинировали с применением субоптимальной NDV суспензии NDV в комбинации с Поли И:Ц в двух концентрациях (10000 нг и 100 мкг) в адъюванте (Stimune) при соотношении 4:5.
Введение тестируемого образца или контрольного образца
Суспензию инактивированного NDV штамма Ulster, которую хранили при температуре -70°С, размораживали и разводили 50 раз в отрицательной аллантоисной жидкости для создания дозы субоптимальной вакцины. Иммуностимуляторы добавляли в соответствии с планом исследования. Полученные водные фазы смешивали с Stimune при соотношении 4:5 в соответствии со схемой осуществления вакцинации, представленной в Таблице 9. Во время приготовления, все компоненты вакцины за исключением адъюванта Stimune помещали на тающий лед. Приготовленные вакцины инъецировали (0,5 мл, внутримышечно) сразу после приготовления.
За общим состоянием здоровья наблюдали с помощью опытного биотехнолога ежедневно от дня поступления до дня окончания исследования.
Отбор образцов сыворотки крови
Образцы крови для серологии отбирали от всех цыплят в дни исследования 0 (перед вакцинацией), 7, 14 и 21. Образцы крови метили с помощью номера исследования, уникального идентификатора образца и даты сбора. В зависимости от количества отобранного объема крови, сыворотку разделяли на две аликвоты приблизительно по 0,5 мл и хранили при температуре -20±5°С.
Исследование ингибирование гемагглютинации (Ш)
Вкратце, серийные разведения сывороток инкубировали с 8 ГАЕ (гемагглютинирующие единицы) NDV штамма Ulster при комнатной температуре в течение 60 минут. ГАЕ титровали перед каждым анализом. После этого, добавляли эритроциты цыплят и агглютинацию оценивали после инкубирования при 4°С в течение 45 минут. Отрицательную контрольную сыворотку и три положительные контрольные сыворотки, с низкими, промежуточными и высокими титрами антител включали в каждое исследование.
Результаты титров HI выражали в виде обратной величины наивысшего разведения сыворотки, которое полностью ингибирует агглютинацию, которые логарифмически трансформировали в конечные Log2 титры.
Статистическая информация
Логарифмически трансформированные результаты HI суммировали на животное (см. Таблицы 62-65). На леченную группу, рассчитывали среднее значение и стандартное отклонение титров антител. Статистический анализ осуществляли с непараметрическим критерием Манна-Уитни критерием Стьюдента.
Результаты
Не наблюдали клинических симптомов или побочных эффектов, связанных с вакцинацией, во всех группах, все цыплята были здоровыми на протяжении всего периода исследования.
Тем не менее, двоих цыплят оценивали с незначительными травмами вследствие клевательного поведения, которое начиналось за 6 дней до начала исследования. В день вакцинации всех цыплят распределяли в Поли И:Ц группы Т13 (№11658) и Т14 (№11676). Восстановление происходило в течение одной недели после вакцинации.
ОДН1, GCGT3-TG4T-5Chol
Индивидуальные результаты HI, выраженные в виде Log2 титров для групп с дозами 100 нг, 1000 нг и 5000 нг ОДН1 указаны в Таблице 10. Средние титры (HI) и стандартное отклонение этих групп указаны на Фиг. 14 (дни 14 и 21 после вакцинации (пв)) и Фиг. 15 (все данные) по сравнению со средними титрами группы с разведенной NDV вакциной.
GCGT3-TG4T-5Chol группы продемонстрировали существенно более высокие титры HI по сравнению с разведенной NDV вакциной (средний титр HI: 4,8 Log2/CO 1,0). В день 14 пв это происходило для всех трех групп; 100 нг: средний титр HI 6,2 Log2/CO 1,4 (р=0,0214), 1000 нг: средний титр HI 6,9 Log2/CO 1,1 (р=0,0003) и 5000 нг: средняя HI 5,9 Log2/CO 0,7 (р=0,0243).
Тем не менее, в день 21 пв, не наблюдали существенных различий для всех концентраций; 100 нг: средний титр HI 6,9 Log2 /СО 0,8 (р=0,1995); 1000 нг: средний титр HI 7,3 Log2/CO 0,9 (р=0,0527); и 5000 нг: средняя HI 6,7 Log2/CO 0,9 (р=0,4523) при сравнении с NDV вакциной; титр HI 6,2 Log2/ SD1,0. (Фиг. 14), хотя концентрация 1000 нг была очень близкой к достоверной.

Индивидуальные результаты HI, выраженные в виде Log2 титров для групп с дозами 100 нг, 1000 нг и 5000 нг ОДН1 указаны в Таблице 11. Средние титры (HI) и стандартное отклонение этих групп указаны на Фиг. 16 (дни 14 и 21 пв) и Фиг. 17 (все данные) по сравнению со средними титрами группы с разведенной NDV вакциной.
Группы ОДН2, GCGT3-TG4T продемонстрировали существенно более высокие титры HI по сравнению с разведенной NDV вакциной (средний титр HI: 4,8 Log2/CO 1,0). Это происходило в день 14 после вакцинации для всех трех групп; 100 нг: средний титр HI 7,1 Log2/CO 1,2 (р=0,0003), 1000 нг: средний титр HI 6,4 Log2/CO 0,7 (р=0,0027) и 5000 нг: средний титр HI 6,1 Log2/CO 1,1 (р=0,0236). В день 21 существенные различия наблюдали только при дозе 100 нг со средним титром HI 7,6 Log2/CO 0,8 (р=0,0083) если сравнивали с NDV вакциной (титр HI 6,2 Log2/CO 1,0). Средние титры (HI) для 1000 нг и 5000 нг составляли 7,1 Log2/0,6 (р=0,0696) и 7,2 Log2/CO 1,0 (р=0,0956) соответственно (Фиг. 16).

Индивидуальные результаты HI, выраженные в виде Log2 титров, измеренные для групп с дозами 100 нг, 1000 нг и 5000 нг ОДН1, указаны в Таблице 12. Во время осуществления анализа HI в трех повторах резко отклоняющийся результат наблюдали для животного 11570 в день 21, наиболее вероятно, это было вызвано ошибкой пипетирования (недостаточно добавлено AF) и, следовательно, этот результат не включали в конечный анализ (выделено цветом в Таблице 12). Таким образом, для этого животного и данных средний титр HI основывался на измерения в двух повторах.
Средние титры (HI) и стандартное отклонение этих групп указаны на Фиг. 18 (дни 14 и 21 пв) и Фиг. 19 (все данные) по сравнению со средними титрами группы с разведенной NDV вакциной.
Группы ОДН3, 2006-РТО продемонстрировали существенно более высокие титры HI по сравнению с разведенной NDV вакциной (средний титр HI: 4,8 Log2/CO 1,0). Это происходило в день 14 после вакцинации для двух доз; 1000 нг: средний титр HI: 6,3 Log2/CO 1,2 (р=0,0081) и 5000 нг: средний титр HI: 6,2 Log2/CO 0,8 (р=0,0059). Средний титр HI для дозы 100 нг составил 5,3 Log2/CO 0,5 (р=0,2090). В день 21 пв существенные различия измеряли только для 5000 нг: средний титр HI 7,3 Log2/CO 0,6 (р=0,0296). Не наблюдали существенных различий для доз 100 нг и 1000 нг, со средними титрами (HI) 6,6 Log2/CO 0,5 (р=0,7183) и 6,8 Log2/CO 1,1 (р=0,1685) соответственно, при сравнении с NDV вакциной; титр HI 6,2 Log2/CO 1,0 (Фиг. 18).
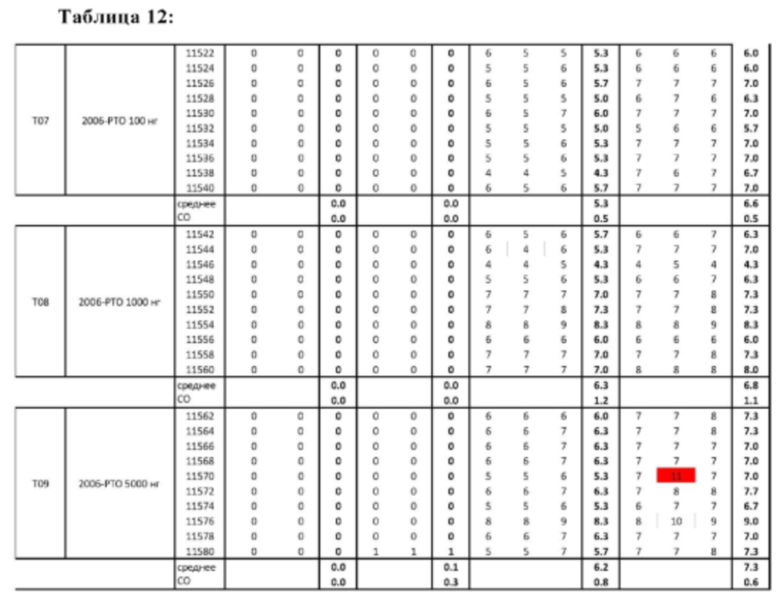
Контрольные группы
Индивидуальные результаты HI, выраженные в виде Log2 титров для групп с дозами 10 мкг и 100 мкг Поли И:Ц, разведенных и неразведенных NDV вакцин и отрицательные контрольные группы указаны в Таблице 13. Средние титры (HI) и стандартное отклонение этих групп указаны на Фиг. 20 (дни 14 и 21 пв) и Фиг.21 (все данные) по сравнению со средними титрами группы с разведенной NDV вакциной.
Для Поли И:Ц, положительные контрольные группы, существенно более высокие титры HI наблюдали только при дозе 100 мкг: титр HI 7,5 Log2/CO 0,4 в 5 день 21 (р=0,0053) по сравнению с NDV вакциной (6,2 Log2/CO 1,0). Средние титры (HI) в день 14 пв для групп с дозами 10 мкг и 100 мкг составили 5,8 Log2/CO 1,3 (р=0,1859) и 5,5 Log2/CO 0,8 (р=0,1609) соответственно. Средний титр HI для группы с дозой 10 мкг в день 21 пв составил 6,4 Log2/CO 1,3 (р=0,7273). Существенные различия (р<0,0001) наблюдали между группой с 10 неразведенной NDV вакциной (8,3/СО 0,5 и 8,5 Log2/CO 0,7) и отрицательной контрольной группой по сравнению с группой с разведенной NDV в дни 14 и 21 после вакцинации (4,8/СО 1,0 и 6,2 Log2/ СО 1,0, соответственно) (Фиг. 20).
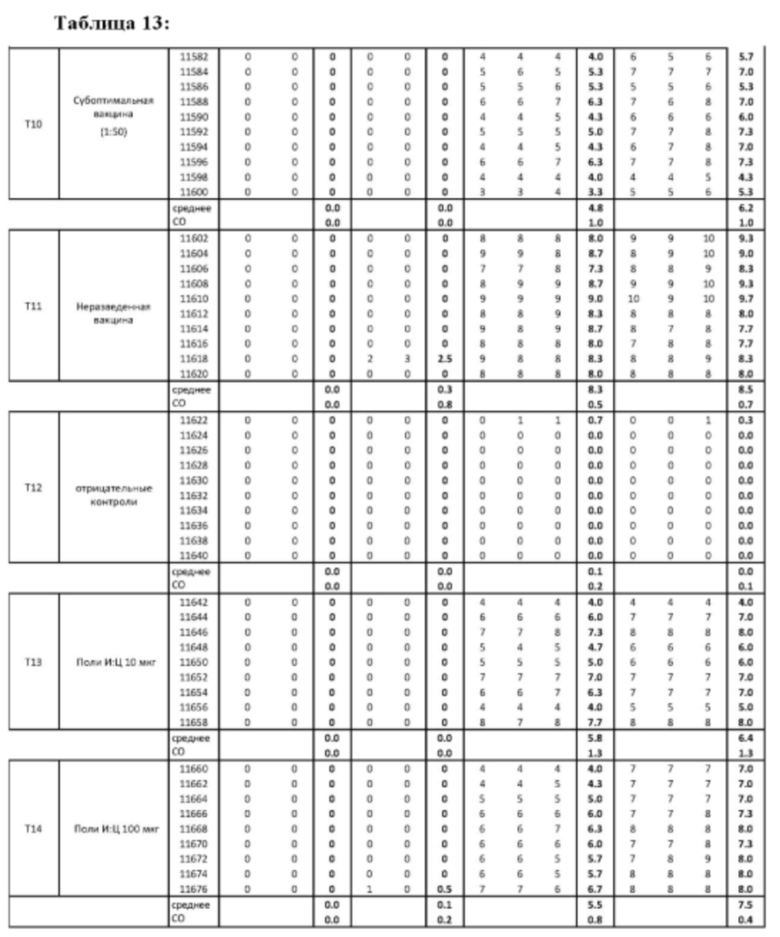
Выводы
Задачей было исследовать активность адъюванта для трех различных иммуностимуляторов. Это тестировали путем измерения серологической реакции после вакцинации с вакцинами на основе масляных эмульсий, содержащими субоптимальную концентрацию инактивированной NDV и различные концентрации одного из трех различных иммуностимуляторов.
Исследовали следующие иммуностимуляторы:

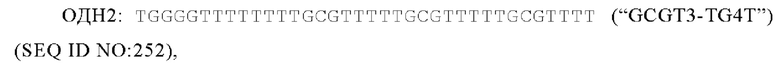

Остовы иммунных ОДН1 и ОДН2 были связаны фосфодиэфирной связью, в то время как остов ОДНЗ был связан фосфоротиоатной связью. Эффективность каждого ОДН определяли в трех различных дозах; 100 нг, 1000 нг и 5000 нг, дополнительно к субоптимальной NDV вакцине.
Серологическую реакцию определяли в дни 0 (перед вакцинацией), 7, 14 и 21 после вакцинации для исследования, может ли добавление этих иммуностимуляторов также приводить к более раннему иммунному ответу. В дни 0 и 7 после вакцинации (пв) не обнаруживали уровней антител к NDV, за исключением для одного животного (№11618) в группе с неразведенной NDV вакциной в день 7.
Серологическая реакция, выраженная в виде Log2 титров HI, продемонстрировала существенные различия (р<0,0001) между неразведенными и субоптимальными NDV вакцинами в дни 14 и 21 пв, указывая на то, что коэффициент разведения в 50 раз является достаточным для создания дозы субоптимальной вакцины.
Отрицательная контрольная группа оставалась отрицательной на протяжении всего исследования, указывая на то, что иммуностимуляторы без NDV вакцины не приводили к неспецифическому иммунному ответу.
Положительная контрольная группа с дозой Поли И:Ц 100 мкг продемонстрировала существенно более высокие титры HI по сравнению с наивной NDV вакциной в день 21 (р=0,0053), указывая на то, что эта дозовая группа служит в качестве обоснованной положительной контрольной группы.
Группа GCGT3-TG4T-5Chol (ОДН1) продемонстрировала существенно более высокие титры HI по сравнению с разведенной NDV вакциной в день 14 пв для всех трех групп; 100 нг (р=0,0214), 1000 нг (р=0,0003) и 5000 нг (р=0,0243). Тем не менее, в день 21 пв, не наблюдали существенных различий.
Группа GCGT3-TG4T (ОДН2) продемонстрировала существенно более высокие титры Ш по сравнению с разведенной NDV вакциной в день 14 пв для всех трех групп; 100 нг (р=0,0003), 1000 нг (р=0,0027) и 5000 нг (р=0,0236). В день 21 существенные различия (р=0,0083) измеряли только для группы с дозой 100 нг.
Группа 2006-РТО (ОДН3) продемонстрировала существенно более высокие титры HI по сравнению с разведенной NDV вакциной в день 14 пв для двух доз; 1000 нг (р=0,0081) и 5000 нг (р=0,0059). В день 21 пв существенные различия (р=0,0296) измеряли только для группы с дозой 5000 нг.
В заключение необходимо отметить, что, наиболее высокие средние титры (HI) наблюдали для группы с дозой 100 нг GCGT3-TG4T (ОДН2), 7,1 Log2 (14 дни пв) и 7,6 Log2 (21 дни пв), указывая на повышение титров по сравнению с наивной NDV вакциной 2,3 Log2 и 1,4 Log2 в день 14 и 21 пв, соответственно.
Титры для группы с дозой 1000 нг GCGT3-TG4T-5Chol (ОДН1), 6,9 Log2 и 7,3 Log2, в день 14 и 21 пв соответственно были практически сходными с ОДН2 группой. В день 14 пв не наблюдали существенного различия (р=0,7513) между группами ОДН1 и ОДН2.
Титры для группы с дозой 5000 нг 2006-РТО (ОДН3) составили 6,2 Log2 и 7,3 Log2 в день 14 и 21 пв, соответственно. В день 14 пв, группа ОДН3 существенно отличается (р=0,0300) от обеих групп ОДН1 и ОДН2 (Фиг. 22 и Фиг. 23).
В день 21 пв не наблюдали существенных различий между всеми ОДН группами.
Следовательно, эти результаты указывают на то, что все ОДН способны существенно увеличивать серологическую реакцию, в особенности в день 14 после вакцинации, также указывая на более ранее начало иммунитета.
Варианты осуществления изобретения
Для дальнейшей иллюстрации, дополнительные неограничивающие варианты осуществления настоящего изобретения представлены ниже.
Например, вариант осуществления 1 представляет собой иммуностимулирующую композицию, содержащую:
иммуномодулирующую композицию, содержащую плазмидную нуклеиновую кислоту и липосомный носитель; и
иммуностимулирующий олигонуклеотид, имеющий по меньшей мере один CpG мотив и обогащенную гуаниновыми нуклеотидами последовательность на или возле 5'-конца иммуностимулирующего олигонуклеотида.
Вариант осуществления 2 представляет собой иммуностимулирующую композицию согласно варианту осуществления 1, где иммуномодулирующая композиция и иммуностимулирующий олигонуклеотид присутствуют в синергетически эффективных количествах.
Вариант осуществления 3 представляет собой иммуностимулирующую композицию согласно варианту осуществления 1 или 2, где иммуностимулирующий олигонуклеотид содержит лиганд для цитозольной молекулы, контролирующей нуклеиновую кислоту.
Вариант осуществления 4 представляет собой иммуностимулирующую композицию согласно варианту осуществления 3, где иммунная цитозольная молекула, контролирующая нуклеиновую кислоту, представляет собой толл-подобный рецептор (TLR).
Вариант осуществления 5 представляет собой иммуностимулирующую композицию согласно варианту осуществления 3 или 4, где цитозольная молекула, контролирующая нуклеиновую кислоту, представляет собой TLR21.
Вариант осуществления 6 представляет собой иммуностимулирующую композицию по одному из предшествующих вариантов осуществления, где иммуномодулирующая композиция имеет концентрацию нуклеиновой кислоты приблизительно 200 мкг/мл.
Вариант осуществления 7 представляет собой иммуностимулирующую композицию по одному из предшествующих вариантов осуществления, где концентрация иммуностимулирующего олигонуклеотида находится в диапазоне от приблизительно 10 мкМ до 0,5 мкМ.
Вариант осуществления 8 представляет собой иммуностимулирующую композицию согласно варианту осуществления 7, где концентрация иммуностимулирующего олигонуклеотида составляет приблизительно 2 мкМ.
Вариант осуществления 9 представляет собой иммуностимулирующую композицию по одному из предшествующих вариантов осуществления, где концентрация плазмидной нуклеиновой кислоты в иммуномодулирующей композиции больше, чем концентрация иммуностимулирующего олигонуклеотида.
Вариант осуществления 10 представляет собой иммуностимулирующую композицию по одному из предшествующих вариантов осуществления, где иммуномодулирующая композиция присутствует в нецитотоксических количествах.
Вариант осуществления 11 представляет собой иммуностимулирующую композицию по одному из предшествующих вариантов осуществления, которая дополнительно содержит фармацевтический наполнитель.
Вариант осуществления 12 представляет собой иммуностимулирующую композицию по одному из предшествующих вариантов осуществления, где липосомный носитель содержит многослойные везикулярные липиды, экструдированные липиды или липиды обеих типов.
Вариант осуществления 13 представляет собой иммуностимулирующую композицию по одному из предшествующих вариантов осуществления, где липосомный носитель является катионным.
Вариант осуществления 14 представляет собой иммуностимулирующую композицию согласно варианту осуществления 13, где катионный липосомный носитель содержит пары липидов, выбранные из группы, включающей хлорид N-[1-(2,3-диолеилокси)пропил]-N,N,N-триметиламмония (DOTMA) и холестерол; хлорид N-[1-(2,3-диолеоилокси)пропил]-N,N,N-триметиламмония (DOTAP) и холестерол; хлорид 1-[2-(олеоилокси)этил]-2-олеил-3-(2-гидроксиэтил)имидазолиния (DOTIM) и холестерол; и бромид диметилдиоктадециламмония (DDAB) и холестерол.
Вариант осуществления 15 представляет собой иммуностимулирующую композицию по одному из предшествующих вариантов осуществления, где плазмидная нуклеиновая кислота является некодирующей.
Вариант осуществления 16 представляет собой иммуностимулирующую композицию по одному из предшествующих вариантов осуществления, где плазмидная нуклеиновая кислота имеет бактериальное происхождение.
Вариант осуществления 17 представляет собой иммуностимулирующую композицию по одному из предшествующих вариантов осуществления, где плазмидная нуклеиновая кислота является иммуногенной.
Вариант осуществления 18 представляет собой иммуностимулирующую композицию по одному из вариантов осуществления 1-17, где плазмидная нуклеиновая кислота имеет по меньшей мере 75% идентичность последовательностей с SEQ ID NO. 265.
Вариант осуществления 19 представляет собой иммуностимулирующую композицию по одному из вариантов осуществления 1-17, где плазмидная нуклеиновая кислота имеет по меньшей мере 75% идентичность последовательностей с SEQ ID NO.: 266.
Вариант осуществления 20 представляет собой иммуностимулирующую композицию по одному из вариантов осуществления 1-17, где плазмидная нуклеиновая кислота имеет по меньшей мере 75% идентичность последовательностей с SEQ ID NO: 268.
Вариант осуществления 21 представляет собой иммуностимулирующую композицию по одному из предшествующих вариантов осуществления, где обогащенная гуаниновыми нуклеотидами последовательность содержит первое множество гуаниновых нуклеотидов.
Вариант осуществления 22 представляет собой иммуностимулирующую композицию согласно варианту осуществления 21, где первое множество гуаниновых нуклеотидов содержит три - восемь гуаниновых нуклеотидов.
Вариант осуществления 23 представляет собой иммуностимулирующую композицию согласно варианту осуществления 21 или 22, где иммуностимулирующий олигонуклеотид содержит SEQ ID NO: 16, 17, 18, 19, 20, 21, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 77, 78, 81, 82, 85, 86, 89, 90, 92, 93, 96, 97, 100, 102, 104, 106, 108, 143 или 1.
Вариант осуществления 24 представляет собой иммуностимулирующую композицию согласно варианту осуществления 21 или 22, которая дополнительно содержит второе множество гуаниновых нуклеотидов, расположенное по ходу транскрипции от первого множества гуаниновых нуклеотидов.
Вариант осуществления 25 представляет собой иммуностимулирующую композицию согласно варианту осуществления 24, где иммуностимулирующий олигонуклеотид содержит SEQ ID NO: 141, 142, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203 или GCGT-G проволока 3.
Вариант осуществления 26 представляет собой иммуностимулирующие композиции согласно варианту осуществления 24 или 25, где первое множество гуаниновых нуклеотидов и второе множество гуаниновых нуклеотидов разделены по меньшей мере двумя нуклеотидами.
Вариант осуществления 27 представляет собой иммуностимулирующие композиции по одному из вариантов осуществления 21 - 26, где первое множество гуаниновых нуклеотидов и по меньшей мере один CpG мотив разделен по меньшей мере 3 нуклеотидами.
Вариант осуществления 28 представляет собой иммуностимулирующие композиции согласно вариантам осуществления 21 - 27, где первое множество гуаниновых нуклеотидов и по меньшей мере один CpG мотив разделен гексаэтиленгликолем, тетраэтиленгликолем, пропандиолом или их производными.
Вариант осуществления 29 представляет собой иммуностимулирующую композицию согласно варианту осуществления 28, где структура гексаэтиленгликоля представляет собой:
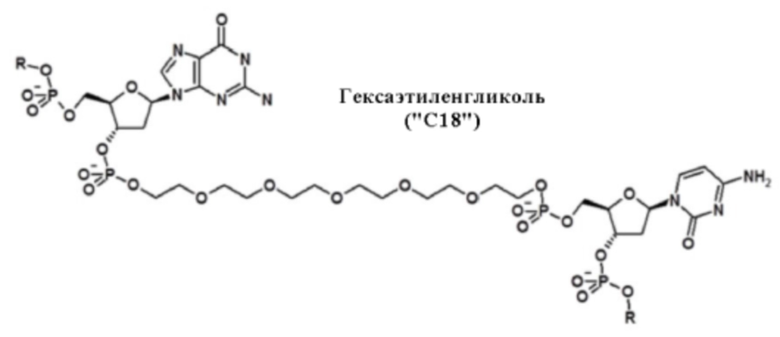
Вариант осуществления 30 представляет собой иммуностимулирующую композицию по одному из предшествующих вариантов осуществления, где иммуностимулирующий олигонуклеотид дополнительно содержит множество CpG мотивов, каждый CpG мотив множества CpG мотивов отделен от других множеств CpG мотивов спейсером.
Вариант осуществления 31 представляет собой иммуностимулирующую композицию согласно варианту осуществления 30, где спейсер содержит по меньшей мере один нуклеотид или аналог нуклеотида.
Вариант осуществления 32 представляет собой иммуностимулирующую композицию согласно варианту осуществления 31, где спейсер содержит дезоксирибозофосфатный мостик.
Вариант осуществления 33 представляет собой иммуностимулирующую композицию согласно варианту осуществления 32, где дезоксирибозофосфатный мостик является безосновным.
Вариант осуществления 34 представляет собой иммуностимулирующую композицию согласно варианту осуществления 31, где спейсер содержит углеродную цепь.
Вариант осуществления 35 представляет собой иммуностимулирующую композицию согласно варианту осуществления 34, где углеродная цепь имеет происхождение из 1,3-пропандиола.
Вариант осуществления 36 представляет собой иммуностимулирующую композицию согласно варианту осуществления 31, где спейсер содержит повторяемую химическую единицу.
Вариант осуществления 37 представляет собой иммуностимулирующую композицию согласно варианту осуществления 36, где повторяемая химическая единица представляет собой этиленгликоль.
Вариант осуществления 38 представляет собой иммуностимулирующую композицию по одному из предшествующих вариантов осуществления, где иммуностимулирующий олигонуклеотид содержит по меньшей мере один аналог нуклеотида.
Вариант осуществления 39 представляет собой иммуностимулирующую композицию по одному из предшествующих вариантов осуществления, где иммуностимулирующий олигонуклеотид дополнительно содержит фосфодиэфирный остов.
Вариант осуществления 40 представляет собой иммуностимулирующую композицию по любому из вариантов осуществления 1-38, где иммуностимулирующий олигонуклеотид дополнительно содержит фосфоротиоатный остов.
Вариант осуществления 41 представляет собой иммуностимулирующую композицию по одному из предшествующих вариантов осуществления, где иммуностимулирующий олигонуклеотид содержит липидный компонент.
Вариант осуществления 42 представляет собой иммуностимулирующую композицию согласно варианту осуществления 41, где липидный компонент представляет собой холестерил.
Вариант осуществления 43 представляет собой иммуностимулирующую композицию по одному из вариантов осуществления 41 - 42, где липидный компонент находится на или возле 5'-конца иммуностимулирующего олигонуклеотида.
Вариант осуществления 44 представляет собой иммуностимулирующую композицию по одному из предшествующих вариантов осуществления, содержащую элемент CpG последовательности на 5'-конце, З'-конце или обоих концах.
Вариант осуществления 45 представляет собой иммуностимулирующую композицию согласно варианту осуществления 44, имеющую по меньшей мере два элемента CpG последовательности.
Вариант осуществления 46 представляет собой иммуностимулирующую композицию согласно варианту осуществления 44 или 45, где элементы CpG последовательности представляют собой GCGA, GCGG, ACGC, CCGC, GCGT или TCGC.
Вариант осуществления 47 представляет собой способ получения иммуностимулирующей композиции по одному из предшествующих пунктов, включающий:
комбинирование иммуномодулирующей композиции и
иммуностимулирующего олигонуклеотида, с образованием иммуностимулирующей композиции;
центрифугирование иммуностимулирующей композиции для получения супернатанта и осадка; и
выделение осадка.
Вариант осуществления 48 представляет собой способ стимуляции толл-подобного рецептора 21 (TLR21), включающий:
введение иммуностимулирующего олигонуклеотида и иммуномодулирующей композиции, где иммуностимулирующий олигонуклеотид имеет по меньшей мере один CpG мотив и обогащенную гуаниновыми нуклеотидами последовательность на или возле 5'-конца иммуностимулирующего олигонуклеотида, и где иммуномодулирующая композиция содержит некодирующую плазмидную нуклеиновую кислоту и липидный носитель.
Вариант осуществления 49 представляет собой способ согласно варианту осуществления 48, где иммуномодулирующая композиция и иммуностимулирующий олигонуклеотид присутствуют в синергетически эффективных количествах.
Вариант осуществления 50 представляет собой способ согласно варианту осуществления 48 или 49, где иммуностимулирующий олигонуклеотид содержит лиганд для TLR21.
Вариант осуществления 51 представляет собой способ по одному из вариантов осуществления 48-50, где концентрация плазмидной нуклеиновой кислоты иммуномодулирующей композиции составляет приблизительно 200 мкг/мл.
Вариант осуществления 52 представляет собой способ по одному из вариантов осуществления 48-51, где концентрация иммуностимулирующего олигонуклеотида находится в диапазоне от приблизительно 10 мкМ до 0,5 мкМ.
Вариант осуществления 53 представляет собой способ согласно варианту осуществления 52, где концентрация иммуностимулирующего олигонуклеотида составляет приблизительно 2 мкМ.
Вариант осуществления 54 представляет собой способ по одному из вариантов осуществления 48-53, где концентрация плазмидной нуклеиновой кислоты в иммуномодулирующей композиции больше, чем концентрация иммуностимулирующего олигонуклеотида.
Вариант осуществления 55 представляет собой способ по одному из вариантов осуществления 48-54, где иммуномодулирующая композиция присутствует в нецитотоксических количествах.
Вариант осуществления 56 представляет собой способ по одному из вариантов осуществления 48-55, где иммуномодулирующая композиция дополнительно содержит фармацевтический наполнитель.
Вариант осуществления 57 представляет собой способ по одному из вариантов осуществления 48-56, где липосомный носитель содержит многослойные везикулярные липиды, экструдированные липиды или липиды обеих типов.
Вариант осуществления 58 представляет собой способ по одному из вариантов осуществления 48-57, где липосомный носитель является катионным.
Вариант осуществления 59 представляет собой способ согласно варианту осуществления 58, где катионный липосомный носитель содержит пары липидов, выбранные из группы, включающей хлорид N-[1-(2,3-диолеилокси)пропил]-N,N,N-триметиламмония (DOTMA) и холестерол; хлорид N-[1-(2,3-диолеоилокси)пропил]-N,N,N-триметиламмония (DOTAP) и холестерол; хлорид 1-[2-(олеоилокси)этил]-2-олеил-3-(2-гидроксиэтил)имидазолиния (DOTIM) и холестерол; и бромид диметилдиоктадециламмония (DDAB) и холестерол.
Вариант осуществления 60 представляет собой способ по любому из вариантов осуществления 48-59, где плазмидная нуклеиновая кислота является некодирующей.
Вариант осуществления 61 представляет собой способ по любому из вариантов осуществления 48-60, где плазмидная нуклеиновая кислота имеет бактериальное происхождение.
Вариант осуществления 62 представляет собой способ по одному из вариантов осуществления 48-61, где плазмидная нуклеиновая кислота является иммуногенной.
Вариант осуществления 63 представляет собой способ по одному из вариантов осуществления 48-62, где плазмидная нуклеиновая кислота имеет по меньшей мере 75% идентичность последовательностей с SEQ ID NO: 265.
Вариант осуществления 64 представляет собой способ по одному из вариантов осуществления 48-62, где плазмидная нуклеиновая кислота имеет по меньшей мере 75% идентичность последовательностей с SEQ ID NO: 266.
Вариант осуществления 65 представляет собой способ по одному из вариантов осуществления 48-62, где плазмидная нуклеиновая кислота имеет по меньшей мере 75% идентичность последовательностей с SEQ ID NO: 268.
Вариант осуществления 66 представляет собой способ по одному из вариантов осуществления 48-65, где обогащенная гуаниновыми нуклеотидами последовательность содержит первое множество гуаниновых нуклеотидов.
Вариант осуществления 67 представляет собой способ согласно варианту осуществления 66, где первое множество гуаниновых нуклеотидов содержит три - восемь гуаниновых нуклеотидов.
Вариант осуществления 68 представляет собой способ согласно варианту осуществления 66 или 67, где иммуностимулирующий олигонуклеотид содержит SEQ ID NO: 1, 16, 17, 18, 19, 20, 21, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 77, 78, 81, 82, 85, 86, 89, 90, 92, 93, 96, 97, 100, 102, 104, 106, 108 или 143.
Вариант осуществления 69 представляет собой способ по одному из вариантов осуществления 48-68, где иммуностимулирующий олигонуклеотид дополнительно содержит второе множество гуаниновых нуклеотидов, расположенное по ходу транскрипции от первого множества гуаниновых нуклеотидов.
Вариант осуществления 70 представляет собой способ согласно варианту осуществления 69, где иммуностимулирующий олигонуклеотид содержит SEQ ID NO: 141, 142, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203 или GCGT-G проволока 3.
Вариант осуществления 71 представляет собой способ согласно варианту осуществления 69 или 70, где первое множество гуаниновых нуклеотидов, второе множество гуаниновых нуклеотидов, или оба облегчают образование четвертичных структур in vitro, in vivo, или в обоих случаях.
Вариант осуществления 72 представляет собой способ согласно варианту осуществления 70 или 71, где первое и второе множества гуаниновых нуклеотидов облегчают образование четвертичных структур, имеющих конформацию G-проволоки.
Вариант осуществления 73 представляет собой способ по одному из вариантов осуществления 70-72, где первое множество гуаниновых нуклеотидов и второе множество гуаниновых нуклеотидов разделены по меньшей мере двумя нуклеотидами.
Вариант осуществления 74 представляет собой способ по одному из вариантов осуществления 67-73, где первое множество гуаниновых нуклеотидов и по меньшей мере один CpG мотив разделены по меньшей мере 3 нуклеотидами.
Вариант осуществления 75 представляет собой способ по одному из вариантов осуществления 67-73, где первое множество гуаниновых нуклеотидов и по меньшей мере один CpG мотив разделены гексаэтиленгликолем.
Вариант осуществления 76 представляет собой способ согласно варианту осуществления 75, где структура гексаэтиленгликоля представляет собой:

Вариант осуществления 77 представляет собой способ по одному из вариантов осуществления 48-76, где иммуностимулирующий олигонуклеотид дополнительно содержит множество CpG мотивов, каждый CpG мотив множества CpG мотивов разделен спейсером.
Вариант осуществления 78 представляет собой способ согласно варианту осуществления 77, где спейсер содержит по меньшей мере один нуклеотид или производное нуклеотида.
Вариант осуществления 79 представляет собой способ согласно варианту осуществления 78, где спейсер представляет собой дезоксирибозофосфатный мостик.
Вариант осуществления 80 представляет собой способ согласно варианту осуществления 79, где дезоксирибозофосфатный мостик является безосновным.
Вариант осуществления 81 представляет собой способ согласно варианту осуществления 78, где спейсер содержит углеродную цепь.
Вариант осуществления 82 представляет собой способ согласно варианту осуществления 81, где углеродная цепь имеет происхождение из 1,3-пропандиола.
Вариант осуществления 83 представляет собой способ согласно варианту осуществления 78, где спейсер содержит повторяемую химическую единицу.
Вариант осуществления 84 представляет собой способ согласно варианту осуществления 83, где повторяемая химическая единица представляет собой этиленгликоль.
Вариант осуществления 85 представляет собой способ по любому из вариантов осуществления 48-84, где иммуномодулирующая композиция, иммуностимулирующий олигонуклеотид, или оба дополнительно содержат по меньшей мере один аналог нуклеотида.
Вариант осуществления 86 представляет собой способ по одному из вариантов осуществления 48-85, где иммуностимулирующий олигонуклеотид содержит фосфодиэфирный остов.
Вариант осуществления 87 представляет собой способ по одному из вариантов осуществления 48-85, где иммуностимулирующий олигонуклеотид содержит фосфоротиоатный остов.
Вариант осуществления 88 представляет собой способ по одному из вариантов осуществления 48-87, где иммуностимулирующий олигонуклеотид дополнительно содержит липидный компонент.
Вариант осуществления 89 представляет собой способ согласно варианту осуществления 88, где липидный компонент усиливает биодоступность иммуностимулирующего олигонуклеотида.
Вариант осуществления 90 представляет собой способ согласно варианту осуществления 88 или 89, где липидный компонент представляет собой холестерил.
Вариант осуществления 91 представляет собой способ по одному из вариантов осуществления 88-90, где липидный компонент находится на или возле 5'-конца иммуностимулирующего олигонуклеотида.
Вариант осуществления 92 представляет собой способ по одному из вариантов осуществления 48-91, включающий элемент CpG последовательности на 5'-конце, 3'-конце или обоих концах.
Вариант осуществления 93 представляет собой способ согласно варианту осуществления 92, имеющий по меньшей мере два элемента CpG последовательности.
Вариант осуществления 94 представляет собой способ согласно варианту осуществления 92 или 93, где элементы CpG последовательности представляют собой GCGA, GCGG, ACGC, CCGC, GCGT или TCGC.
Вариант осуществления 95 представляет собой способы по одному из вариантов осуществления 48-94, где иммуномодулирующую композицию и иммуностимулирующий олигонуклеотид вводят одновременно.
Вариант осуществления 96 представляет собой способ вызывания иммунного ответа у субъекта, включающий введение субъекту иммуностимулирующей композиции по одному из вариантов осуществления 1-46.
Вариант осуществления 97 представляет собой иммуностимулирующую композицию, содержащую:
плазмидную нуклеиновую кислоту и липосомный носитель; и иммуностимулирующий олигонуклеотид, содержащий SEQ ID NO: 1.
Вариант осуществления 98 представляет собой иммуностимулирующую композицию согласно варианту осуществления 97, где плазмидная нуклеиновая кислота имеет по меньшей мере 75% идентичность последовательностей с SEQ ID NO: 265.
Вариант осуществления 99 представляет собой иммуностимулирующую композицию согласно варианту осуществления 97, где плазмидная нуклеиновая кислота имеет по меньшей мере 75% идентичность последовательностей с SEQ ID NO: 266.
Вариант осуществления 100 представляет собой иммуностимулирующую композицию согласно варианту осуществления 97, где плазмидная нуклеиновая кислота имеет по меньшей мере 75% идентичность последовательностей с SEQ ID NO: 268.
Вариант осуществления 101 представляет собой иммуностимулирующую композицию по одному из вариантов осуществления 97-100, где липосомный носитель содержит многослойные везикулярные липиды, экструдированные липиды или липиды обеих типов.
Вариант осуществления 102 представляет собой иммуностимулирующую композицию согласно варианту осуществления 101, где липосомный носитель является катионным.
Вариант осуществления 103 представляет собой иммуностимулирующую композицию согласно варианту осуществления 102, где катионный липосомный носитель содержит пары липидов, выбранные из группы, включающей хлорид N-[1-(2,3-диолеилокси)пропил]-N,N,N-триметиламмония (DOTMA) и холестерол; хлорид N-[1-(2,3-диолеоилокси)пропил]-N,N,N-триметиламмония (DOTAP) и холестерол; хлорид 1-[2-(олеоилокси)этил]-2-олеил-3-(2-гидроксиэтил)имидазолиния (DOTIM) и холестерол; и бромид диметилдиоктадециламмония (DDAB) и холестерол.
Вариант осуществления 104 представляет собой иммуностимулирующую композицию по одному из вариантов осуществления 97-103, где иммуностимулирующий олигонуклеотид дополнительно содержит 5'-холестерильную модификацию.
Вариант осуществления 105 представляет собой иммуностимулирующую композицию согласно варианту осуществления 104, где 5'-холестерильная модификация содержит триэтиленгликольный линкер.
При включении элементов согласно настоящему изобретению или его (их) предпочтительному (ым) варианту (ам) осуществления, термины, изложенный в единственном числе, и с предшествующим "указанный" охватывают в данном контексте один или несколько элементов. Термины "содержащий", "включающий" и "имеющий" являются включительными и обозначают, что могут быть дополнительные элементы, отличающиеся от перечисленных элементов.
С учетом вышеизложенного, можно увидеть, что некоторые объекты настоящего раскрытия достигаются и получают другие благоприятные результаты.
Поскольку в вышеуказанные продукты и способы могут быть внесены различные изменения без отклонения от сущности изобретения, то подразумевается, что весь объем, содержащийся в представленном выше описании, следует истолковывать как иллюстративный и без ограничения.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> БАЙЕР ЭНИМАЛ ХЕЛС ГМБХ
<120> ИММУНОСТИМУЛИРУЮЩИЕ КОМПОЗИЦИИ
<130> BHC 168027
<140>
<141>
<150> EP 17207750.5
<151> 2017-12-15
<150> EP 17207746.3
<151> 2017-12-15
<150> EP 17207740.6
<151> 2017-12-15
<160> 269
<170> PatentIn версия 3.5
<210> 1
<211> 36
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<220>
<223> /примечание="модифицирован 5’-холестерилом"
<400> 1
tggggttttt tttgcgtttt tgcgtttttg cgtttt 36
<210> 2
<400> 2
000
<210> 3
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<220>
<221> прочий_признак
<222> (1)..(24)
<223> /примечание="Фосфоротиоатная связь между нуклеотидами"
<400> 3
tcgtcgtttt gtcgttttgt cgtt 24
<210> 4
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 4
tcgtcgtttt gtcgttttgt cgtt 24
<210> 5
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 5
tcgtcgtttt gtcgttttgt cgttg 25
<210> 6
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 6
tcgtcgtttt gtcgttttgt cgttgg 26
<210> 7
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 7
tcgtcgtttt gtcgttttgt cgttggg 27
<210> 8
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 8
tcgtcgtttt gtcgttttgt cgttgggg 28
<210> 9
<211> 29
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 9
tcgtcgtttt gtcgttttgt cgttggggg 29
<210> 10
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 10
tcgtcgtttt gtcgttttgt cgttgggggg 30
<210> 11
<211> 31
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 11
tcgtcgtttt gtcgttttgt cgttgggggg g 31
<210> 12
<211> 32
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 12
tcgtcgtttt gtcgttttgt cgttgggggg gg 32
<210> 13
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 13
tcgtcgtttt gtcgttttgt cgtt 24
<210> 14
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 14
gtcgtcgttt tgtcgttttg tcgtt 25
<210> 15
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 15
ggtcgtcgtt ttgtcgtttt gtcgtt 26
<210> 16
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 16
gggtcgtcgt tttgtcgttt tgtcgtt 27
<210> 17
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 17
ggggtcgtcg ttttgtcgtt ttgtcgtt 28
<210> 18
<211> 29
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 18
gggggtcgtc gttttgtcgt tttgtcgtt 29
<210> 19
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 19
ggggggtcgt cgttttgtcg ttttgtcgtt 30
<210> 20
<211> 31
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 20
gggggggtcg tcgttttgtc gttttgtcgt t 31
<210> 21
<211> 32
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 21
ggggggggtc gtcgttttgt cgttttgtcg tt 32
<210> 22
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 22
aaaaaatcgt cgttttgtcg ttttgtcgtt 30
<210> 23
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 23
cccccctcgt cgttttgtcg ttttgtcgtt 30
<210> 24
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 24
tttttttcgt cgttttgtcg ttttgtcgtt 30
<210> 25
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<220>
<221> модифицированное_основание
<222> (8)..(8)
<223> 5-метил-цитидин
<220>
<221> модифицированное_основание
<222> (11)..(11)
<223> 5-метил-цитидин
<220>
<221> модифицированное_основание
<222> (19)..(19)
<223> 5-метил-цитидин
<220>
<221> модифицированное_основание
<222> (27)..(27)
<223> 5-метил-цитидин
<400> 25
ggggggtcgt cgttttgtcg ttttgtcgtt 30
<210> 26
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 26
cccccctgct gcttttgtgc ttttgtgctt 30
<210> 27
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 27
tttttttcat cattttgtca ttttgtcatt 30
<210> 28
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<220>
<221> прочий_признак
<222> (1)..(30)
<223> /примечание="Фосфоротиоатная связь между нуклеотидами"
<400> 28
tgggggtcgt cgttttgtcg ttttgtcgtt 30
<210> 29
<211> 29
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<220>
<221> прочий_признак
<222> (1)..(29)
<223> /примечание="Фосфоротиоатная связь между нуклеотидами"
<400> 29
tcgtcgtttt gtcgttttgt cgttggggg 29
<210> 30
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 30
agggggtcgt cgttttgtcg ttttgtcgtt 30
<210> 31
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 31
gaggggtcgt cgttttgtcg ttttgtcgtt 30
<210> 32
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 32
ggagggtcgt cgttttgtcg ttttgtcgtt 30
<210> 33
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 33
gggaggtcgt cgttttgtcg ttttgtcgtt 30
<210> 34
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 34
ggggagtcgt cgttttgtcg ttttgtcgtt 30
<210> 35
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 35
gggggatcgt cgttttgtcg ttttgtcgtt 30
<210> 36
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 36
aaggggtcgt cgttttgtcg ttttgtcgtt 30
<210> 37
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 37
gaagggtcgt cgttttgtcg ttttgtcgtt 30
<210> 38
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 38
ggaaggtcgt cgttttgtcg ttttgtcgtt 30
<210> 39
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 39
gggaagtcgt cgttttgtcg ttttgtcgtt 30
<210> 40
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 40
ggggaatcgt cgttttgtcg ttttgtcgtt 30
<210> 41
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 41
cgggggtcgt cgttttgtcg ttttgtcgtt 30
<210> 42
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 42
gcggggtcgt cgttttgtcg ttttgtcgtt 30
<210> 43
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 43
ggcgggtcgt cgttttgtcg ttttgtcgtt 30
<210> 44
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 44
gggcggtcgt cgttttgtcg ttttgtcgtt 30
<210> 45
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 45
ggggcgtcgt cgttttgtcg ttttgtcgtt 30
<210> 46
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 46
gggggctcgt cgttttgtcg ttttgtcgtt 30
<210> 47
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 47
ccggggtcgt cgttttgtcg ttttgtcgtt 30
<210> 48
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 48
gccgggtcgt cgttttgtcg ttttgtcgtt 30
<210> 49
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 49
ggccggtcgt cgttttgtcg ttttgtcgtt 30
<210> 50
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 50
gggccgtcgt cgttttgtcg ttttgtcgtt 30
<210> 51
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 51
ggggcctcgt cgttttgtcg ttttgtcgtt 30
<210> 52
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 52
tgggggtcgt cgttttgtcg ttttgtcgtt 30
<210> 53
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 53
gtggggtcgt cgttttgtcg ttttgtcgtt 30
<210> 54
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 54
ggtgggtcgt cgttttgtcg ttttgtcgtt 30
<210> 55
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 55
gggtggtcgt cgttttgtcg ttttgtcgtt 30
<210> 56
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 56
ggggtgtcgt cgttttgtcg ttttgtcgtt 30
<210> 57
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 57
gggggttcgt cgttttgtcg ttttgtcgtt 30
<210> 58
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 58
ttggggtcgt cgttttgtcg ttttgtcgtt 30
<210> 59
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 59
gttgggtcgt cgttttgtcg ttttgtcgtt 30
<210> 60
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 60
ggttggtcgt cgttttgtcg ttttgtcgtt 30
<210> 61
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 61
gggttgtcgt cgttttgtcg ttttgtcgtt 30
<210> 62
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 62
ggggtttcgt cgttttgtcg ttttgtcgtt 30
<210> 63
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 63
agggtcgtcg ttttgtcgtt ttgtcgtt 28
<210> 64
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 64
gaggtcgtcg ttttgtcgtt ttgtcgtt 28
<210> 65
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 65
ggagtcgtcg ttttgtcgtt ttgtcgtt 28
<210> 66
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 66
gggatcgtcg ttttgtcgtt ttgtcgtt 28
<210> 67
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 67
cgggtcgtcg ttttgtcgtt ttgtcgtt 28
<210> 68
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 68
gcggtcgtcg ttttgtcgtt ttgtcgtt 28
<210> 69
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 69
ggcgtcgtcg ttttgtcgtt ttgtcgtt 28
<210> 70
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 70
gggctcgtcg ttttgtcgtt ttgtcgtt 28
<210> 71
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 71
tgggtcgtcg ttttgtcgtt ttgtcgtt 28
<210> 72
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 72
gtggtcgtcg ttttgtcgtt ttgtcgtt 28
<210> 73
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 73
ggtgtcgtcg ttttgtcgtt ttgtcgtt 28
<210> 74
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 74
gggttcgtcg ttttgtcgtt ttgtcgtt 28
<210> 75
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 75
tccatgacgt tcctgatgct 20
<210> 76
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 76
tccatgacgt tcctgatgct ggggg 25
<210> 77
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 77
ggggtccatg acgttcctga tgct 24
<210> 78
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 78
ggggggtcca tgacgttcct gatgct 26
<210> 79
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 79
tccatgacgt tcctgacgtt 20
<210> 80
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 80
tccatgacgt tcctgacgtt ggggg 25
<210> 81
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 81
ggggtccatg acgttcctga cgtt 24
<210> 82
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 82
ggggggtcca tgacgttcct gacgtt 26
<210> 83
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 83
tcgacgttcg tcgttcgtcg ttc 23
<210> 84
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 84
tcgacgttcg tcgttcgtcg ttcggggg 28
<210> 85
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 85
ggggtcgacg ttcgtcgttc gtcgttc 27
<210> 86
<211> 29
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 86
ggggggtcga cgttcgtcgt tcgtcgttc 29
<210> 87
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 87
tcgcgacgtt cgcccgacgt tcggta 26
<210> 88
<211> 31
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 88
tcgcgacgtt cgcccgacgt tcggtagggg g 31
<210> 89
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 89
ggggtcgcga cgttcgcccg acgttcggta 30
<210> 90
<211> 32
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 90
ggggggtcgc gacgttcgcc cgacgttcgg ta 32
<210> 91
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 91
tcgtcgtttt cggcgcgcgc cg 22
<210> 92
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 92
ggggtcgtcg ttttcggcgc gcgccg 26
<210> 93
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 93
ggggggtcgt cgttttcggc gcgcgccg 28
<210> 94
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 94
tcgtcgtcgt tcgaacgacg ttgat 25
<210> 95
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 95
tcgtcgtcgt tcgaacgacg ttgatggggg 30
<210> 96
<211> 29
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 96
ggggtcgtcg tcgttcgaac gacgttgat 29
<210> 97
<211> 31
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 97
ggggggtcgt cgtcgttcga acgacgttga t 31
<210> 98
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 98
tcgtcgttgt cgttttgtcg tt 22
<210> 99
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 99
tcgtcgttgt cgttttgtcg ttggggg 27
<210> 100
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 100
ggggggtcgt cgttgtcgtt ttgtcgtt 28
<210> 101
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 101
gatctcgctc gctcgctat 19
<210> 102
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 102
gggggggatc tcgctcgctc gctat 25
<210> 103
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 103
tcgtcgacgt cgttcgttct c 21
<210> 104
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 104
ggggggtcgt cgacgtcgtt cgttctc 27
<210> 105
<211> 29
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 105
tccatgacgt tcctgcagtt cctgacgtt 29
<210> 106
<211> 35
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 106
ggggggtcca tgacgttcct gcagttcctg acgtt 35
<210> 107
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 107
tccacgacgt tttcgacgtt 20
<210> 108
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 108
ggggggtcca cgacgttttc gacgtt 26
<210> 109
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 109
tttttcgtcg ttttgtcgtt ttgtcgtt 28
<210> 110
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 110
ttagggtcgt cgttttgtcg ttttgtcgtt 30
<210> 111
<211> 36
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 111
ttagggttag ggtcgtcgtt ttgtcgtttt gtcgtt 36
<210> 112
<211> 32
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 112
ttttggggtc gtcgttttgt cgttttgtcg tt 32
<210> 113
<211> 32
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 113
ggggtttttc gtcgttttgt cgttttgtcg tt 32
<210> 114
<211> 36
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 114
ggggttttgg ggtcgtcgtt ttgtcgtttt gtcgtt 36
<210> 115
<211> 34
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 115
ttagggtttt tcgtcgtttt gtcgttttgt cgtt 34
<210> 116
<211> 40
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 116
ttagggttag ggtttttcgt cgttttgtcg ttttgtcgtt 40
<210> 117
<211> 44
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 117
tgtgggtgtg tgtgggtttt tcgtcgtttt gtcgttttgt cgtt 44
<210> 118
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 118
ggaggttttt cgtcgttttg tcgttttgtc gtt 33
<210> 119
<211> 35
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 119
tggaggcttt ttcgtcgttt tgtcgttttg tcgtt 35
<210> 120
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 120
tggaggctgg aggctttttc gtcgttttgt cgttttgtcg tt 42
<210> 121
<211> 46
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 121
gctgcgaggc gggtgggtgg gatcgtcgtt ttgtcgtttt gtcgtt 46
<210> 122
<211> 45
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 122
gctgcgggcg ggtgggtggg atcgtcgttt tgtcgttttg tcgtt 45
<210> 123
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 123
cgaggcgggt gggtgggatc gtcgttttgt cgttttgtcg tt 42
<210> 124
<211> 41
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 124
cgggcgggtg ggtgggatcg tcgttttgtc gttttgtcgt t 41
<210> 125
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 125
gggcgtggtg ggtggggttc gtcgttttgt cgttttgtcg tt 42
<210> 126
<211> 40
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 126
ggggtgggag gagggttcgt cgttttgtcg ttttgtcgtt 40
<210> 127
<211> 44
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 127
ggggtcgggc gggccgggtg tcgtcgtttt gtcgttttgt cgtt 44
<210> 128
<211> 48
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 128
ggtggtgggg ggggttggta gggttcgtcg ttttgtcgtt ttgtcgtt 48
<210> 129
<211> 44
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 129
gggttagggt tagggtaggg tcgtcgtttt gtcgttttgt cgtt 44
<210> 130
<211> 41
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 130
tgggggggtg ggtgggttcg tcgttttgtc gttttgtcgt t 41
<210> 131
<211> 40
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 131
gggcgggcgg gcgggctcgt cgttttgtcg ttttgtcgtt 40
<210> 132
<211> 39
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 132
ggttggtgtg gttggtcgtc gttttgtcgt tttgtcgtt 39
<210> 133
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 133
ggtggatggc gcagtcggtc gtcgttttgt cgttttgtcg tt 42
<210> 134
<211> 44
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 134
tgggggtgga cgggccgggt tcgtcgtttt gtcgttttgt cgtt 44
<210> 135
<211> 46
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 135
tgtgggggtg gacgggccgg gttcgtcgtt ttgtcgtttt gtcgtt 46
<210> 136
<211> 45
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 136
gggttagggt tagggttagg gtcgtcgttt tgtcgttttg tcgtt 45
<210> 137
<211> 47
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 137
gggcgcggga ggaagggggc gggtcgtcgt tttgtcgttt tgtcgtt 47
<210> 138
<211> 43
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 138
agggtgggga gggtggggat cgtcgttttg tcgttttgtc gtt 43
<210> 139
<211> 46
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 139
agggagggcg ctgggaggag ggtcgtcgtt ttgtcgtttt gtcgtt 46
<210> 140
<211> 44
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 140
ggggcgggcc gggggcgggg tcgtcgtttt gtcgttttgt cgtt 44
<210> 141
<211> 34
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 141
ggggttgggg tcgtcgtttt gtcgttttgt cgtt 34
<210> 142
<211> 38
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 142
ggggttgggg tttttcgtcg ttttgtcgtt ttgtcgtt 38
<210> 143
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 143
tggggttcgt cgttttgtcg ttttgtcgtt 30
<210> 144
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 144
tttttttacg attt 14
<210> 145
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 145
tttttttgcg attt 14
<210> 146
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 146
tttttttccg attt 14
<210> 147
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 147
ttttttttcg attt 14
<210> 148
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 148
tttttttacg gttt 14
<210> 149
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 149
tttttttgcg gttt 14
<210> 150
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 150
tttttttccg gttt 14
<210> 151
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 151
ttttttttcg gttt 14
<210> 152
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 152
tttttttacg cttt 14
<210> 153
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 153
tttttttgcg cttt 14
<210> 154
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 154
tttttttccg cttt 14
<210> 155
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 155
ttttttttcg cttt 14
<210> 156
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 156
tttttttacg tttt 14
<210> 157
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 157
tttttttgcg tttt 14
<210> 158
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 158
tttttttccg tttt 14
<210> 159
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 159
ttttttttcg tttt 14
<210> 160
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 160
ggggggtttt tttacgattt 20
<210> 161
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 161
ggggggtttt tttgcgattt 20
<210> 162
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 162
ggggggtttt tttccgattt 20
<210> 163
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 163
ggggggtttt ttttcgattt 20
<210> 164
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 164
ggggggtttt tttacggttt 20
<210> 165
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 165
ggggggtttt tttgcggttt 20
<210> 166
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 166
ggggggtttt tttccggttt 20
<210> 167
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 167
ggggggtttt ttttcggttt 20
<210> 168
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 168
ggggggtttt tttacgcttt 20
<210> 169
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 169
ggggggtttt tttgcgcttt 20
<210> 170
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 170
ggggggtttt tttccgcttt 20
<210> 171
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 171
ggggggtttt ttttcgcttt 20
<210> 172
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 172
ggggggtttt tttacgtttt 20
<210> 173
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 173
ggggggtttt tttgcgtttt 20
<210> 174
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 174
ggggggtttt tttccgtttt 20
<210> 175
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 175
ggggggtttt ttttcgtttt 20
<210> 176
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 176
ggggttgggg tttttttttt tacgattt 28
<210> 177
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 177
ggggttgggg tttttttttt tgcgattt 28
<210> 178
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 178
ggggttgggg tttttttttt tccgattt 28
<210> 179
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 179
ggggttgggg tttttttttt ttcgattt 28
<210> 180
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 180
ggggttgggg tttttttttt tacggttt 28
<210> 181
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 181
ggggttgggg tttttttttt tgcggttt 28
<210> 182
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 182
ggggttgggg tttttttttt tccggttt 28
<210> 183
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 183
ggggttgggg tttttttttt ttcggttt 28
<210> 184
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 184
ggggttgggg tttttttttt tacgcttt 28
<210> 185
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 185
ggggttgggg tttttttttt tgcgcttt 28
<210> 186
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 186
ggggttgggg tttttttttt tccgcttt 28
<210> 187
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 187
ggggttgggg tttttttttt ttcgcttt 28
<210> 188
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 188
ggggttgggg tttttttttt tacgtttt 28
<210> 189
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 189
ggggttgggg tttttttttt tgcgtttt 28
<210> 190
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 190
ggggttgggg tttttttttt tccgtttt 28
<210> 191
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 191
ggggttgggg tttttttttt ttcgtttt 28
<210> 192
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 192
ggggttgggg tttttttttt tggctttt 28
<210> 193
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 193
ggggttgggg tttttttttt tgtgtttt 28
<210> 194
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 194
ggggttgggg tttttttttt tgcatttt 28
<210> 195
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 195
ggggttgggg tttttttttt gcgtttt 27
<210> 196
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 196
ggggttgggg tttttttttg cgtttt 26
<210> 197
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 197
ggggttgggg ttttttttgc gtttt 25
<210> 198
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 198
ggggttgggg tttttttgcg tttt 24
<210> 199
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 199
ggggttgggg ttttttgcgt ttt 23
<210> 200
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 200
ggggttgggg tttttgcgtt tt 22
<210> 201
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 201
ggggttgggg tttttttttt tgcgttt 27
<210> 202
<211> 26
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 202
ggggttgggg tttttttttt tgcgtt 26
<210> 203
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 203
ggggttgggg tttttttttt tgcgt 25
<210> 204
<211> 35
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 204
ggggttgggg tttttttttt tgcgttttgc gtttt 35
<210> 205
<211> 43
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 205
ggggttgggg tttttttttt tgcgttttgc gtttttgcgt ttt 43
<210> 206
<211> 35
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 206
ggggttgggg tttttttttt tgcgatttgc gattt 35
<210> 207
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 207
ggggttgggg tttttttttt tgcgatttgc gatttgcgat tt 42
<210> 208
<211> 35
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 208
ggggttgggg tttttttttt tacgctttac gcttt 35
<210> 209
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 209
ggggttgggg tttttttttt tacgctttac gctttacgct tt 42
<210> 210
<211> 35
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 210
ggggttgggg tttttttttt ttcgcttttc gcttt 35
<210> 211
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 211
ggggttgggg tttttttttt ttcgcttttc gcttttcgct tt 42
<210> 212
<211> 35
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 212
ggggttgggg tttttttttt tccgctttcc gcttt 35
<210> 213
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 213
ggggttgggg tttttttttt tccgctttcc gctttccgct tt 42
<210> 214
<211> 35
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 214
ggggttgggg tttttttttt tgcggtttgc ggttt 35
<210> 215
<211> 42
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 215
ggggttgggg tttttttttt tgcggtttgc ggtttgcggt tt 42
<210> 216
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 216
ggggttgggg ttttttttcg cgcgttt 27
<210> 217
<211> 29
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 217
ggggttgggg ttttttttcg tcgtcgttt 29
<210> 218
<211> 31
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 218
ggggttgggg ttttttttcg ttcgttcgtt t 31
<210> 219
<211> 33
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 219
ggggttgggg ttttttttcg tttcgtttcg ttt 33
<210> 220
<211> 35
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 220
ggggttgggg ttttttttcg ttttcgtttt cgttt 35
<210> 221
<211> 29
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<220>
<221> модифицированное_основание
<222> (21)..(21)
<223> Безосновный сайт
<220>
<221> модифицированное_основание
<222> (24)..(24)
<223> Безосновный сайт
<400> 221
ggggttgggg ttttttttcg ncgncgttt 29
<210> 222
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 222
ggggttgggg ttttttttcg 20
<210> 223
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 223
ggggttgggg ttttttttcg 20
<210> 224
<211> 34
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 224
ggggttgggg ttggggtttt tttttttgcg tttt 34
<210> 225
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 225
ggggttgggg ttttttttcg 20
<210> 226
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 226
ggggttgggg ttttttttcg 20
<210> 227
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 227
ggggttgggg ttttttttcg 20
<210> 228
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 228
ggggttgggg ttttttttcg 20
<210> 229
<211> 15
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 229
tggggttttt tttcg 15
<210> 230
<211> 15
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 230
tggggttttt tttcg 15
<210> 231
<211> 15
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 231
tggggttttt tttcg 15
<210> 232
<211> 15
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 232
tggggttttt tttcg 15
<210> 233
<211> 15
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 233
tggggttttt tttcg 15
<210> 234
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 234
ggggttgggg ttttttttcg 20
<210> 235
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 235
ggggttgggg ttttttttcg 20
<210> 236
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 236
ggggttgggg ttttttttcg 20
<210> 237
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 237
ggggttgggg ttttttttcg 20
<210> 238
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 238
ggggttgggg ttttttttcg 20
<210> 239
<211> 29
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<220>
<221> модифицированное_основание
<222> (21)..(21)
<223> Безосновный сайт
<220>
<221> модифицированное_основание
<222> (24)..(24)
<223> Безосновный сайт
<400> 239
ggggttgggg ttttttttcg ncgncgttt 29
<210> 240
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 240
ggggttgggg ttttttttcg 20
<210> 241
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 241
ggggttgggg ttttttttac gc 22
<210> 242
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 242
ggggttgggg ttttttttcc gc 22
<210> 243
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 243
ggggttgggg ttttttttac gc 22
<210> 244
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 244
ggggttgggg ttttttttcc gc 22
<210> 245
<211> 17
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 245
tggggttttt tttacgc 17
<210> 246
<211> 17
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 246
tggggttttt tttccgc 17
<210> 247
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 247
tcgtcgtttt gtcgttttgt cgtt 24
<210> 248
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 248
tcgtcgtttt gtcgttttgt cgtt 24
<210> 249
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 249
ggggtcgtcg ttttgtcgtt ttgtcgtt 28
<210> 250
<211> 28
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 250
ggggtcgtcg ttttgtcgtt ttgtcgtt 28
<210> 251
<211> 34
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<220>
<223> /примечание="Может быть модифицирован 3’-холестерилом"
<400> 251
tggggttttt tcgtcgtttt gtcgttttgt cgtt 34
<210> 252
<211> 36
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 252
tggggttttt tttgcgtttt tgcgtttttg cgtttt 36
<210> 253
<211> 41
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<220>
<223> /примечание="Может быть модифицирован 5’-холестерилом"
<400> 253
ggggttgggg ttttttttgc gtttttgcgt ttttgcgttt t 41
<210> 254
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<220>
<223> /примечание="Может быть модифицирован 5’-холестерилом"
<400> 254
tttttttgcg tttttgcgtt tttgcgtttt 30
<210> 255
<211> 41
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<220>
<223> /примечание="Может быть модифицирован 5’-холестерилом"
<400> 255
ggggttgggg ttttttttcc gcttttccgc ttttccgctt t 41
<210> 256
<211> 30
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<220>
<223> /примечание="Может быть модифицирован 5’-холестерилом"
<400> 256
tttttttccg cttttccgct tttccgcttt 30
<210> 257
<211> 10
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 257
ggggttgggg 10
<210> 258
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 258
ggggttgggg tttt 14
<210> 259
<400> 259
000
<210> 260
<400> 260
000
<210> 261
<211> 12
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 261
ttagggttag gg 12
<210> 262
<211> 12
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 262
ggggttttgg gg 12
<210> 263
<211> 16
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 263
ttagggttag ggtttt 16
<210> 264
<211> 14
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 264
tggaggctgg aggc 14
<210> 265
<211> 4242
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 265
tgaccgccca acgacccccg cccattgacg tcaataatga cgtatgttcc catagtaacg 60
ccaataggga ctttccattg acgtcaatgg gtggagtatt tacggtaaac tgcccacttg 120
gcagtacatc aagtgtatca tatgccaagt ccgcccccta ttgacgtcaa tgacggtaaa 180
tggcccgcct ggcattatgc ccagtacatg accttacggg actttcctac ttggcagtac 240
atctacgtat tagtcatcgc tattaccatg gtgatgcggt tttggcagta catcaatggg 300
cgtggatagc ggtttgactc acggggattt ccaagtctcc accccattga cgtcaatggg 360
agtttgtttt ggcaccaaaa tcaacgggac tttccaaaat gtcgtaacaa ctccgcccca 420
ttgacgcaaa tgggcggtag gcgtgtacgg tgggaggtct atataagcag agctcgttta 480
gtgaaccgtc agatcgcctg gagacgccat ccacgctgtt ttgacctcca tagaagacac 540
cgggaccgat ccagcctccc ctcgaagccg atctgataac ggtaccgata agctggcggc 600
cgattaagct acagaagttg gtcgtgaggc actgggcagg taagtatcaa ggttacaaga 660
caggtttaag gagaccaata gaaactgggc ttgtcgagac agagaagact cttgcgtttc 720
tgataggcac ctattggtct tactgacatc cactttgcct ttctctccac aggtgtccac 780
tcccaggttc aattacagct cttaagcagc cgcaagcttg atatcgaatt cctgcagccc 840
gggggatcca ctagttctag agcggccgcc accgcggtgg agctcgaatt atcagatcga 900
ttaataacta tgctcaaaaa ttgtgtacct ttagcttttt aatttgtaaa ggggttaata 960
aggaatattt gatgtatagt gccttgacta gagatcataa tcagccatac cacatttgta 1020
gaggttttac ttgctttaaa aaacctccca cacctccccc tgaacctgaa acataaaatg 1080
aatgcaattg ttgttgttaa cttgtttatt gcagcttata atggttacaa ataaagcaat 1140
agcatcacaa atttcacaaa taaagcattt ttttcactgc attctagttg tggtttgtcc 1200
aaactcatca atgtatctta tcatgtctgg atcatcagat ctgccggtct ccctatagtg 1260
agtcgtatta atttcgataa gccaggttaa cctgcattaa tgaatcggcc aacgcgcggg 1320
gagaggcggt ttgcgtattg ggcgctcttc cgcttcctcg ctcactgact cgctgcgctc 1380
ggtcgttcgg ctgcggcgag cggtatcagc tcactcaaag gcggtaatac ggttatccac 1440
agaatcaggg gataacgcag gaaagaacat gtgagcaaaa ggccagcaaa aggccaggaa 1500
ccgtaaaaag gccgcgttgc tggcgttttt ccataggctc cgcccccctg acgagcatca 1560
caaaaatcga cgctcaagtc agaggtggcg aaacccgaca ggactataaa gataccaggc 1620
gtttccccct ggaagctccc tcgtgcgctc tcctgttccg accctgccgc ttaccggata 1680
cctgtccgcc tttctccctt cgggaagcgt ggcgctttct catagctcac gctgtaggta 1740
tctcagttcg gtgtaggtcg ttcgctccaa gctgggctgt gtgcacgaac cccccgttca 1800
gcccgaccgc tgcgccttat ccggtaacta tcgtcttgag tccaacccgg taagacacga 1860
cttatcgcca ctggcagcag ccactggtaa caggattagc agagcgaggt atgtaggcgg 1920
tgctacagag ttcttgaagt ggtggcctaa ctacggctac actagaagaa cagtatttgg 1980
tatctgcgct ctgctgaagc cagttacctt cggaaaaaga gttggtagct cttgatccgg 2040
caaacaaacc accgctggta gcggtggttt ttttgtttgc aagcagcaga ttacgcgcag 2100
aaaaaaagga tctcaagaag atcctttgat cttttctacg gggtctgacg ctcagtggaa 2160
cgaaaactca cgttaaggga ttttggtcat gggcgcgcct aggcttttgc aaagatcgat 2220
caagagacag gatgaggatc gtttcgcagc ttttcattct gactgcaacg ggcaataagt 2280
ctctgtgtgg attaaaaaaa gagtgtctga tagcagcttc tgaactggtt acctgccgtg 2340
agtaaattaa aattttattg acttaggtca ctaaggcgcc ttgcgctgag gttgcgtcgt 2400
gatatcatca gggcagaccg gttacatccc cctaacaagc tgtataaaga gaaatactat 2460
ctcattggcg ttgcccgcac ctgacagtgc gacgttgggc tgcgtccgtc gaccaacggt 2520
accgaggtaa cagcccaatc tatccatgat ctcggccagg ccgggtcggc cgttatgcag 2580
cccggctcgg gtatgaagcc attaaggagc cgacccagcg cgaccgggcg gccggtcacg 2640
ctgcctctgc tgaagcctgc ctgtcactcc ctgcgcggcg tacccgccgt tctcatcgag 2700
taggctccgg atcgcgaccc cggacgggcc ctgggcccag gagcggccta tgacaaatgc 2760
cgggtagcga tccggcattc agcattgact gcgcacggat ccagtccttg caggagcctt 2820
atgccgaccg tagcaaaaaa tgagcccgag ccgatcgcga gttgtgatcc ggtcccgccg 2880
attgccggtc gcgatgacgg tcctgtgtaa gcgttatcgt taccaattgt ttaagaagta 2940
tatacgctac gaggtacttg ataacttctg cgtagcatac atgaggtttt gtataaaaat 3000
ggcgggcgat atcaacgcag tgtcagaaat ccgaaacagt ctgcgggact ctggggttcg 3060
aaatgaccga ccaagcgacg cccaacctgc catcacgaga tttcgattcc accgccgcct 3120
tctatgaaag gttgggcttc ggaatcgttt tccgggacgc cggctggatg atcctccagc 3180
gcggggatct catgctggag ttcttcgccc accctaggcg cgctcatgag cggatacata 3240
tttgaatgta tttagaaaaa taaacaaata ggggttccgc gcacatttcc ccgaaaagtg 3300
ccacctaaat tgtaagcgtt aatattttgt taaaattcgc gttaaatttt tgttaaatca 3360
gctcattttt taaccaatag gccgaaatcg gcaaaatccc ttataaatca aaagaataga 3420
ccgagatagg gttgagtgtt gttccagttt ggaacaagag tccactatta aagaacgtgg 3480
actccaacgt caaagggcga aaaaccgtct atcagggcga tggcccacta cgtgaaccat 3540
caccctaatc aagttttttg gggtcgaggt gccgtaaagc actaaatcgg aaccctaaag 3600
ggagcccccg atttagagct tgacggggaa agccggcgaa cgtggcgaga aaggaaggga 3660
agaaagcgaa aggagcgggc gctagggcgc tggcaagtgt agcggtcacg ctgcgcgtaa 3720
ccaccacacc cgccgcgctt aatgcgccgc tacagggcgc gtcccattcg ccattcaggc 3780
tgcgcaactg ttgggaaggg cgatcggtgc gggcctcttc gctattacgc cagctggcga 3840
aagggggatg tgctgcaagg cgattaagtt gggtaacgcc agggttttcc cagtcacgac 3900
gttgtaaaac gacggccagt gagcgcgcgt aatacgactc actatagggc gaattgggta 3960
ccgggccccc cctcgagcag gatctataca ttgaatcaat attggcaatt agccatatta 4020
gtcattggtt atatagcata aatcaatatt ggctattggc cattgcatac gttgtatcta 4080
tatcataata tgtacattta tattggctca tgtccaatat gaccgccatg ttgacattga 4140
ttattgacta gttattaata gtaatcaatt acggggtcat tagttcatag cccatatatg 4200
gagttccgcg ttacataact tacggtaaat ggcccgcctg gc 4242
<210> 266
<211> 4242
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 266
ctaaattgta agcgttaata ttttgttaaa attcgcgtta aatttttgtt aaatcagctc 60
attttttaac caataggccg aaatcggcaa aatcccttat aaatcaaaag aatagaccga 120
gatagggttg agtgttgttc cagtttggaa caagagtcca ctattaaaga acgtggactc 180
caacgtcaaa gggcgaaaaa ccgtctatca gggcgatggc ccactacgtg aaccatcacc 240
ctaatcaagt tttttggggt cgaggtgccg taaagcacta aatcggaacc ctaaagggag 300
cccccgattt agagcttgac ggggaaagcc ggcgaacgtg gcgagaaagg aagggaagaa 360
agcgaaagga gcgggcgcta gggcgctggc aagtgtagcg gtcacgctgc gcgtaaccac 420
cacacccgcc gcgcttaatg cgccgctaca gggcgcgtcc cattcgccat tcaggctgcg 480
caactgttgg gaagggcgat cggtgcgggc ctcttcgcta ttacgccagc tggcgaaagg 540
gggatgtgct gcaaggcgat taagttgggt aacgccaggg ttttcccagt cacgacgttg 600
taaaacgacg gccagtgagc gcgcgtaata cgactcacta tagggcgaat tgggtaccgg 660
gccccccctc gagcaggatc tatacattga atcaatattg gcaattagcc atattagtca 720
ttggttatat agcataaatc aatattggct attggccatt gcatacgttg tatctatatc 780
ataatatgta catttatatt ggctcatgtc caatatgacc gccatgttga cattgattat 840
tgactagtta ttaatagtaa tcaattacgg ggtcattagt tcatagccca tatatggagt 900
tccgcgttac ataacttacg gtaaatggcc cgcctggctg accgcccaac gacccccgcc 960
cattgacgtc aataatgacg tatgttccca tagtaacgcc aatagggact ttccattgac 1020
gtcaatgggt ggagtattta cggtaaactg cccacttggc agtacatcaa gtgtatcata 1080
tgccaagtcc gccccctatt gacgtcaatg acggtaaatg gcccgcctgg cattatgccc 1140
agtacatgac cttacgggac tttcctactt ggcagtacat ctacgtatta gtcatcgcta 1200
ttaccatggt gatgcggttt tggcagtaca tcaatgggcg tggatagcgg tttgactcac 1260
ggggatttcc aagtctccac cccattgacg tcaatgggag tttgttttgg caccaaaatc 1320
aacgggactt tccaaaatgt cgtaacaact ccgccccatt gacgcaaatg ggcggtaggc 1380
gtgtacggtg ggaggtctat ataagcagag ctcgtttagt gaaccgtcag atcgcctgga 1440
gacgccatcc acgctgtttt gacctccata gaagacaccg ggaccgatcc agcctcccct 1500
cgaagccgat ctgataacgg taccgataag ctggcggccg attaagctac agaagttggt 1560
cgtgaggcac tgggcaggta agtatcaagg ttacaagaca ggtttaagga gaccaataga 1620
aactgggctt gtcgagacag agaagactct tgcgtttctg ataggcacct attggtctta 1680
ctgacatcca ctttgccttt ctctccacag gtgtccactc ccaggttcaa ttacagctct 1740
taagcagccg caagcttgat atcgaattcc tgcagcccgg gggatccact agttctagag 1800
cggccgccac cgcggtggag ctcgaattat cagatcgatt aataactatg ctcaaaaatt 1860
gtgtaccttt agctttttaa tttgtaaagg ggttaataag gaatatttga tgtatagtgc 1920
cttgactaga gatcataatc agccatacca catttgtaga ggttttactt gctttaaaaa 1980
acctcccaca cctccccctg aacctgaaac ataaaatgaa tgcaattgtt gttgttaact 2040
tgtttattgc agcttataat ggttacaaat aaagcaatag catcacaaat ttcacaaata 2100
aagcattttt ttcactgcat tctagttgtg gtttgtccaa actcatcaat gtatcttatc 2160
atgtctggat catcagatct gccggtctcc ctatagtgag tcgtattaat ttcgataagc 2220
caggttaacc tgcattaatg aatcggccaa cgcgcgggga gaggcggttt gcgtattggg 2280
cgctcttccg cttcctcgct cactgactcg ctgcgctcgg tcgttcggct gcggcgagcg 2340
gtatcagctc actcaaaggc ggtaatacgg ttatccacag aatcagggga taacgcagga 2400
aagaacatgt gagcaaaagg ccagcaaaag gccaggaacc gtaaaaaggc cgcgttgctg 2460
gcgtttttcc ataggctccg cccccctgac gagcatcaca aaaatcgacg ctcaagtcag 2520
aggtggcgaa acccgacagg actataaaga taccaggcgt ttccccctgg aagctccctc 2580
gtgcgctctc ctgttccgac cctgccgctt accggatacc tgtccgcctt tctcccttcg 2640
ggaagcgtgg cgctttctca tagctcacgc tgtaggtatc tcagttcggt gtaggtcgtt 2700
cgctccaagc tgggctgtgt gcacgaaccc cccgttcagc ccgaccgctg cgccttatcc 2760
ggtaactatc gtcttgagtc caacccggta agacacgact tatcgccact ggcagcagcc 2820
actggtaaca ggattagcag agcgaggtat gtaggcggtg ctacagagtt cttgaagtgg 2880
tggcctaact acggctacac tagaagaaca gtatttggta tctgcgctct gctgaagcca 2940
gttaccttcg gaaaaagagt tggtagctct tgatccggca aacaaaccac cgctggtagc 3000
ggtggttttt ttgtttgcaa gcagcagatt acgcgcagaa aaaaaggatc tcaagaagat 3060
cctttgatct tttctacggg gtctgacgct cagtggaacg aaaactcacg ttaagggatt 3120
ttggtcatga gcgcgcctag gcttttgcaa agatcgatca agagacagga tgaggatcgt 3180
ttcgcatgat tgaacaagat ggattgcacg caggttctcc ggccgcttgg gtggagaggc 3240
tattcggcta tgactgggca caacagacaa tcggctgctc tgatgccgcc gtgttccggc 3300
tgtcagcgca ggggcgcccg gttctttttg tcaagaccga cctgtccggt gccctgaatg 3360
aactgcaaga cgaggcagcg cggctatcgt ggctggccac gacgggcgtt ccttgcgcag 3420
ctgtgctcga cgttgtcact gaagcgggaa gggactggct gctattgggc gaagtgccgg 3480
ggcaggatct cctgtcatct caccttgctc ctgccgagaa agtatccatc atggctgatg 3540
caatgcggcg gctgcatacg cttgatccgg ctacctgccc attcgaccac caagcgaaac 3600
atcgcatcga gcgagcacgt actcggatgg aagccggtct tgtcgatcag gatgatctgg 3660
acgaagagca tcaggggctc gcgccagccg aactgttcgc caggctcaag gcgagcatgc 3720
ccgacggcga ggatctcgtc gtgacccatg gcgatgcctg cttgccgaat atcatggtgg 3780
aaaatggccg cttttctgga ttcatcgact gtggccggct gggtgtggcg gaccgctatc 3840
aggacatagc gttggctacc cgtgatattg ctgaagagct tggcggcgaa tgggctgacc 3900
gcttcctcgt gctttacggt atcgccgctc ccgattcgca gcgcatcgcc ttctatcgcc 3960
ttcttgacga gttcttctga gcgggactct ggggttcgaa atgaccgacc aagcgacgcc 4020
caacctgcca tcacgagatt tcgattccac cgccgccttc tatgaaaggt tgggcttcgg 4080
aatcgttttc cgggacgccg gctggatgat cctccagcgc ggggatctca tgctggagtt 4140
cttcgcccac cctaggcgcg ctcatgagcg gatacatatt tgaatgtatt tagaaaaata 4200
aacaaatagg ggttccgcgc acatttcccc gaaaagtgcc ac 4242
<210> 267
<211> 4242
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 267
tgaccgccca acgacccccg cccattgacg tcaataatga cgtatgttcc catagtaacg 60
ccaataggga ctttccattg acgtcaatgg gtggagtatt tacggtaaac tgcccacttg 120
gcagtacatc aagtgtatca tatgccaagt ccgcccccta ttgacgtcaa tgacggtaaa 180
tggcccgcct ggcattatgc ccagtacatg accttacggg actttcctac ttggcagtac 240
atctacgtat tagtcatcgc tattaccatg gtgatgcggt tttggcagta catcaatggg 300
cgtggatagc ggtttgactc acggggattt ccaagtctcc accccattga cgtcaatggg 360
agtttgtttt ggcaccaaaa tcaacgggac tttccaaaat gtcgtaacaa ctccgcccca 420
ttgacgcaaa tgggcggtag gcgtgtacgg tgggaggtct atataagcag agctcgttta 480
gtgaaccgtc agatcgcctg gagacgccat ccacgctgtt ttgacctcca tagaagacac 540
cgggaccgat ccagcctccc ctcgaagccg atctgataac ggtaccgata agctggcggc 600
cgattaagct acagaagttg gtcgtgaggc actgggcagg taagtatcaa ggttacaaga 660
caggtttaag gagaccaata gaaactgggc ttgtcgagac agagaagact cttgcgtttc 720
tgataggcac ctattggtct tactgacatc cactttgcct ttctctccac aggtgtccac 780
tcccaggttc aattacagct cttaagcagc cgcaagcttg atatcgaatt cctgcagccc 840
gggggatcca ctagttctag agcggccgcc accgcggtgg agctcgaatt atcagatcga 900
ttaataacta tgctcaaaaa ttgtgtacct ttagcttttt aatttgtaaa ggggttaata 960
aggaatattt gatgtatagt gccttgacta gagatcataa tcagccatac cacatttgta 1020
gaggttttac ttgctttaaa aaacctccca cacctccccc tgaacctgaa acataaaatg 1080
aatgcaattg ttgttgttaa cttgtttatt gcagcttata atggttacaa ataaagcaat 1140
agcatcacaa atttcacaaa taaagcattt ttttcactgc attctagttg tggtttgtcc 1200
aaactcatca atgtatctta tcatgtctgg atcatcagat ctgccggtct ccctatagtg 1260
agtcgtatta atttcgataa gccaggttaa cctgcattaa tgaatcggcc aacgcgcggg 1320
gagaggcggt ttgcgtattg ggcgctcttc cgcttcctcg ctcactgact cgctgcgctc 1380
ggtcgttcgg ctgcggcgag cggtatcagc tcactcaaag gcggtaatac ggttatccac 1440
agaatcaggg gataacgcag gaaagaacat gtgagcaaaa ggccagcaaa aggccaggaa 1500
ccgtaaaaag gccgcgttgc tggcgttttt ccataggctc cgcccccctg acgagcatca 1560
caaaaatcga cgctcaagtc agaggtggcg aaacccgaca ggactataaa gataccaggc 1620
gtttccccct ggaagctccc tcgtgcgctc tcctgttccg accctgccgc ttaccggata 1680
cctgtccgcc tttctccctt cgggaagcgt ggcgctttct catagctcac gctgtaggta 1740
tctcagttcg gtgtaggtcg ttcgctccaa gctgggctgt gtgcacgaac cccccgttca 1800
gcccgaccgc tgcgccttat ccggtaacta tcgtcttgag tccaacccgg taagacacga 1860
cttatcgcca ctggcagcag ccactggtaa caggattagc agagcgaggt atgtaggcgg 1920
tgctacagag ttcttgaagt ggtggcctaa ctacggctac actagaagaa cagtatttgg 1980
tatctgcgct ctgctgaagc cagttacctt cggaaaaaga gttggtagct cttgatccgg 2040
caaacaaacc accgctggta gcggtggttt ttttgtttgc aagcagcaga ttacgcgcag 2100
aaaaaaagga tctcaagaag atcctttgat cttttctacg gggtctgacg ctcagtggaa 2160
cgaaaactca cgttaaggga ttttggtcat gggcgcgcct aggcttttgc aaagatcgat 2220
caagagacag gatgaggatc gtttcgcatg attgaacaag atggattgca cgcaggttct 2280
ccggccgctt gggtggagag gctattcggc tatgactggg cacaacagac aatcggctgc 2340
tctgatgccg ccgtgttccg gctgtcagcg caggggcgcc cggttctttt tgtcaagacc 2400
gacctgtccg gtgccctgaa tgaactgcaa gacgaggcag cgcggctatc gtggctggcc 2460
acgacgggcg ttccttgcgc agctgtgctc gacgttgtca ctgaagcggg aagggactgg 2520
ctgctattgg gcgaagtgcc ggggcaggat ctcctgtcat ctcaccttgc tcctgccgag 2580
aaagtatcca tcatggctga tgcaatgcgg cggctgcata cgcttgatcc ggctacctgc 2640
ccattcgacc accaagcgaa acatcgcatc gagcgagcac gtactcggat ggaagccggt 2700
cttgtcgatc aggatgatct ggacgaagag catcaggggc tcgcgccagc cgaactgttc 2760
gccaggctca aggcgagcat gcccgacggc gaggatctcg tcgtgaccca tggcgatgcc 2820
tgcttgccga atatcatggt ggaaaatggc cgcttttctg gattcatcga ctgtggccgg 2880
ctgggtgtgg cggaccgcta tcaggacata gcgttggcta cccgtgatat tgctgaagag 2940
cttggcggcg aatgggctga ccgcttcctc gtgctttacg gtatcgccgc tcccgattcg 3000
cagcgcatcg ccttctatcg ccttcttgac gagttcttct gagcgggact ctggggttcg 3060
aaatgaccga ccaagcgacg cccaacctgc catcacgaga tttcgattcc accgccgcct 3120
tctatgaaag gttgggcttc ggaatcgttt tccgggacgc cggctggatg atcctccagc 3180
gcggggatct catgctggag ttcttcgccc accctaggcg cgctcatgag cggatacata 3240
tttgaatgta tttagaaaaa taaacaaata ggggttccgc gcacatttcc ccgaaaagtg 3300
ccacctaaat tgtaagcgtt aatattttgt taaaattcgc gttaaatttt tgttaaatca 3360
gctcattttt taaccaatag gccgaaatcg gcaaaatccc ttataaatca aaagaataga 3420
ccgagatagg gttgagtgtt gttccagttt ggaacaagag tccactatta aagaacgtgg 3480
actccaacgt caaagggcga aaaaccgtct atcagggcga tggcccacta cgtgaaccat 3540
caccctaatc aagttttttg gggtcgaggt gccgtaaagc actaaatcgg aaccctaaag 3600
ggagcccccg atttagagct tgacggggaa agccggcgaa cgtggcgaga aaggaaggga 3660
agaaagcgaa aggagcgggc gctagggcgc tggcaagtgt agcggtcacg ctgcgcgtaa 3720
ccaccacacc cgccgcgctt aatgcgccgc tacagggcgc gtcccattcg ccattcaggc 3780
tgcgcaactg ttgggaaggg cgatcggtgc gggcctcttc gctattacgc cagctggcga 3840
aagggggatg tgctgcaagg cgattaagtt gggtaacgcc agggttttcc cagtcacgac 3900
gttgtaaaac gacggccagt gagcgcgcgt aatacgactc actatagggc gaattgggta 3960
ccgggccccc cctcgagcag gatctataca ttgaatcaat attggcaatt agccatatta 4020
gtcattggtt atatagcata aatcaatatt ggctattggc cattgcatac gttgtatcta 4080
tatcataata tgtacattta tattggctca tgtccaatat gaccgccatg ttgacattga 4140
ttattgacta gttattaata gtaatcaatt acggggtcat tagttcatag cccatatatg 4200
gagttccgcg ttacataact tacggtaaat ggcccgcctg gc 4242
<210> 268
<211> 4242
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полинуклеотид"
<400> 268
tgaccgccca acgacccccg cccattgacg tcaataatga cgtatgttcc catagtaacg 60
ccaataggga ctttccattg acgtcaatgg gtggagtatt tacggtaaac tgcccacttg 120
gcagtacatc aagtgtatca tatgccaagt ccgcccccta ttgacgtcaa tgacggtaaa 180
tggcccgcct ggcattatgc ccagtacatg accttacggg actttcctac ttggcagtac 240
atctacgtat tagtcatcgc tattaccatg gtgatgcggt tttggcagta catcaatggg 300
cgtggatagc ggtttgactc acggggattt ccaagtctcc accccattga cgtcaatggg 360
agtttgtttt ggcaccaaaa tcaacgggac tttccaaaat gtcgtaacaa ctccgcccca 420
ttgacgcaaa tgggcggtag gcgtgtacgg tgggaggtct atataagcag agctcgttta 480
gtgaaccgtc agatcgcctg gagacgccat ccacgctgtt ttgacctcca tagaagacac 540
cgggaccgat ccagcctccc ctcgaagccg atctgataac ggtaccgata agctggcggc 600
cgattaagct acagaagttg gtcgtgaggc actgggcagg taagtatcaa ggttacaaga 660
caggtttaag gagaccaata gaaactgggc ttgtcgagac agagaagact cttgcgtttc 720
tgataggcac ctattggtct tactgacatc cactttgcct ttctctccac aggtgtccac 780
tcccaggttc aattacagct cttaagcagc cgccaaaaca aaattcctca aaaatcatca 840
tcgaatgaat ggtgaaataa tttccctgaa taactgtagt gttttcaggg cgcggcataa 900
taattaacta tgctcaaaaa ttgtgtacct ttagcttttt aatttgtaaa ggggttaata 960
aggaatattt gatgtatagt gccttgacta gagatcataa tcagccatac cacatttgta 1020
gaggttttac ttgctttaaa aaacctccca cacctccccc tgaacctgaa acataaaatg 1080
aatgcaattg ttgttgttaa cttgtttatt gcagcttata atggttacaa ataaagcaat 1140
agcatcacaa atttcacaaa taaagcattt ttttcactgc attctagttg tggtttgtcc 1200
aaactcatca atgtatctta tcatgtctgg atcatcagat ctgccggtct ccctatagtg 1260
agtcgtatta atttcgataa gccaggttaa cctgcattaa tgaatcggcc aacgcgcggg 1320
gagaggcggt ttgcgtattg ggcgctcttc cgcttcctcg ctcactgact cgctgcgctc 1380
ggtcgttcgg ctgcggcgag cggtatcagc tcactcaaag gcggtaatac ggttatccac 1440
agaatcaggg gataacgcag gaaagaacat gtgagcaaaa ggccagcaaa aggccaggaa 1500
ccgtaaaaag gccgcgttgc tggcgttttt ccataggctc cgcccccctg acgagcatca 1560
caaaaatcga cgctcaagtc agaggtggcg aaacccgaca ggactataaa gataccaggc 1620
gtttccccct ggaagctccc tcgtgcgctc tcctgttccg accctgccgc ttaccggata 1680
cctgtccgcc tttctccctt cgggaagcgt ggcgctttct catagctcac gctgtaggta 1740
tctcagttcg gtgtaggtcg ttcgctccaa gctgggctgt gtgcacgaac cccccgttca 1800
gcccgaccgc tgcgccttat ccggtaacta tcgtcttgag tccaacccgg taagacacga 1860
cttatcgcca ctggcagcag ccactggtaa caggattagc agagcgaggt atgtaggcgg 1920
tgctacagag ttcttgaagt ggtggcctaa ctacggctac actagaagaa cagtatttgg 1980
tatctgcgct ctgctgaagc cagttacctt cggaaaaaga gttggtagct cttgatccgg 2040
caaacaaacc accgctggta gcggtggttt ttttgtttgc aagcagcaga ttacgcgcag 2100
aaaaaaagga tctcaagaag atcctttgat cttttctacg gggtctgacg ctcagtggaa 2160
cgaaaactca cgttaaggga ttttggtcat gggcgcgcct aggcttttgc aaagatcgat 2220
caagagacag gatgaggatc gtttcgcagc ttttcattct gactgcaacg ggcaataagt 2280
ctctgtgtgg attaaaaaaa gagtgtctga tagcagcttc tgaactggtt acctgccgtg 2340
agtaaattaa aattttattg acttaggtca ctaaggcgcc ttgcgctgag gttgcgtcgt 2400
gatatcatca gggcagaccg gttacatccc cctaacaagc tgtataaaga gaaatactat 2460
ctcattggcg ttgcccgcac ctgacagtgc gacgttgggc tgcgtccgtc gaccaacggt 2520
accgaggtaa cagcccaatc tatccatgat ctcggccagg ccgggtcggc cgttatgcag 2580
cccggctcgg gtatgaagcc attaaggagc cgacccagcg cgaccgggcg gccggtcacg 2640
ctgcctctgc tgaagcctgc ctgtcactcc ctgcgcggcg tacccgccgt tctcatcgag 2700
taggctccgg atcgcgaccc cggacgggcc ctgggcccag gagcggccta tgacaaatgc 2760
cgggtagcga tccggcattc agcattgact gcgcacggat ccagtccttg caggagcctt 2820
atgccgaccg tagcaaaaaa tgagcccgag ccgatcgcga gttgtgatcc ggtcccgccg 2880
attgccggtc gcgatgacgg tcctgtgtaa gcgttatcgt taccaattgt ttaagaagta 2940
tatacgctac gaggtacttg ataacttctg cgtagcatac atgaggtttt gtataaaaat 3000
ggcgggcgat atcaacgcag tgtcagaaat ccgaaacagt ctgcgggact ctggggttcg 3060
aaatgaccga ccaagcgacg cccaacctgc catcacgaga tttcgattcc accgccgcct 3120
tctatgaaag gttgggcttc ggaatcgttt tccgggacgc cggctggatg atcctccagc 3180
gcggggatct catgctggag ttcttcgccc accctaggcg cgctcatgag cggatacata 3240
tttgaatgta tttagaaaaa taaacaaata ggggttccgc gcacatttcc ccgaaaagtg 3300
ccacctaaat tgtaagcgtt aatattttgt taaaattcgc gttaaatttt tgttaaatca 3360
gctcattttt taaccaatag gccgaaatcg gcaaaatccc ttataaatca aaagaataga 3420
ccgagatagg gttgagtgtt gttccagttt ggaacaagag tccactatta aagaacgtgg 3480
actccaacgt caaagggcga aaaaccgtct atcagggcga tggcccacta cgtgaaccat 3540
caccctaatc aagttttttg gggtcgaggt gccgtaaagc actaaatcgg aaccctaaag 3600
ggagcccccg atttagagct tgacggggaa agccggcgaa cgtggcgaga aaggaaggga 3660
agaaagcgaa aggagcgggc gctagggcgc tggcaagtgt agcggtcacg ctgcgcgtaa 3720
ccaccacacc cgccgcgctt aatgcgccgc tacagggcgc gtcccattcg ccattcaggc 3780
tgcgcaactg ttgggaaggg cgatcggtgc gggcctcttc gctattacgc cagctggcga 3840
aagggggatg tgctgcaagg cgattaagtt gggtaacgcc agggttttcc cagtcacgac 3900
gttgtaaaac gacggccagt gagcgcgcgt aatacgactc actatagggc gaattgggta 3960
ccgggccccc cctcgaggtc gacggtatcg ataagcttga tatcgaattc ctgcagcccg 4020
ggggatccac tagttctaga gcggccgcca ccgcggtgga gctccagctt ttgttccctt 4080
tagtgagggt taattgcgcg cttggcgtaa tcatggtcat agctgtttcc tgtgtgaaat 4140
tgttatccgc tcacaattcc acacaacata cgagccggaa gcataaagtg taaagcctgg 4200
ggtgcctaat gagtgagcta actcacatta attgcgttgc gc 4242
<210> 269
<211> 16
<212> ДНК
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
олигонуклеотид"
<400> 269
tgtgggtgtg tgtggg 16
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ИММУНОСТИМУЛИРУЮЩИЕ ОЛИГОНУКЛЕОТИДЫ | 2018 |
|
RU2795701C2 |
| ПОЛНОГЕНОМНЫЕ БИБЛИОТЕКИ ОТДЕЛЬНЫХ КЛЕТОК ДЛЯ БИСУЛЬФИТНОГО СЕКВЕНИРОВАНИЯ | 2018 |
|
RU2770879C2 |
| ОБЪЕДИНЕННАЯ ОЧИСТКА И ИЗМЕРЕНИЕ МЕТИЛИРОВАНИЯ ДНК С СОВМЕСТНЫМ ИЗМЕРЕНИЕМ МУТАЦИЙ И/ИЛИ УРОВНЕЙ ЭКСПРЕССИИ мРНК В АВТОМАТИЧЕСКОМ РЕАКЦИОННОМ КАРТРИДЖЕ | 2017 |
|
RU2780660C2 |
| ЛИПОСОМАЛЬНЫЕ АДЪЮВАНТНЫЕ КОМПОЗИЦИИ | 2016 |
|
RU2736642C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ СНИЖЕНИЯ ЭКСПРЕССИИ TAU | 2016 |
|
RU2747734C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ СНИЖЕНИЯ ЭКСПРЕССИИ TAU | 2016 |
|
RU2777570C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ ГЕМОГЛОБИНОПАТИЙ | 2016 |
|
RU2812491C2 |
| ВАКЦИНА ПРОТИВ ИНФЕКЦИОННОГО БРОНХИТА | 2017 |
|
RU2781143C2 |
| СПОСОБЫ ТЕРАПИИ НА ОСНОВЕ CAR Т-КЛЕТОК С ПОВЫШЕННОЙ ЭФФЕКТИВНОСТЬЮ | 2016 |
|
RU2788131C2 |
| ДОСТАВКА, ПРИМЕНЕНИЕ И ПРИМЕНЕНИЯ В ТЕРАПИИ СИСТЕМ CRISPR-CAS И КОМПОЗИЦИЙ ДЛЯ ЦЕЛЕНАПРАВЛЕННОГО ВОЗДЕЙСТВИЯ НА НАРУШЕНИЯ И ЗАБОЛЕВАНИЯ С ИСПОЛЬЗОВАНИЕМ ВИРУСНЫХ КОМПОНЕНТОВ | 2014 |
|
RU2716421C2 |




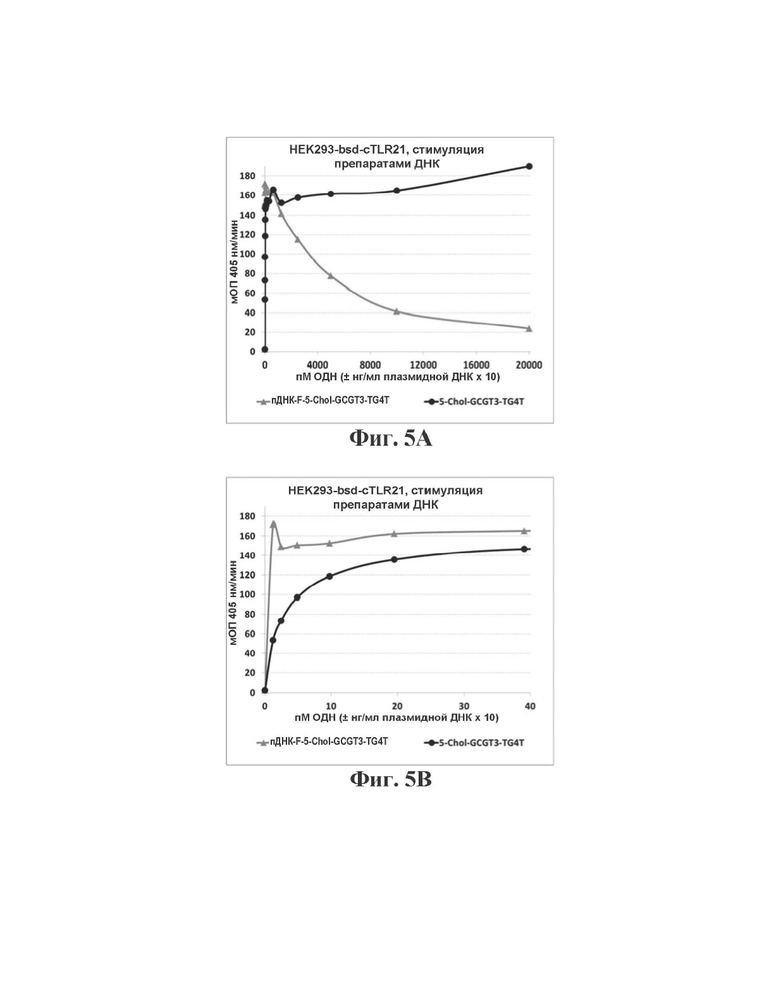



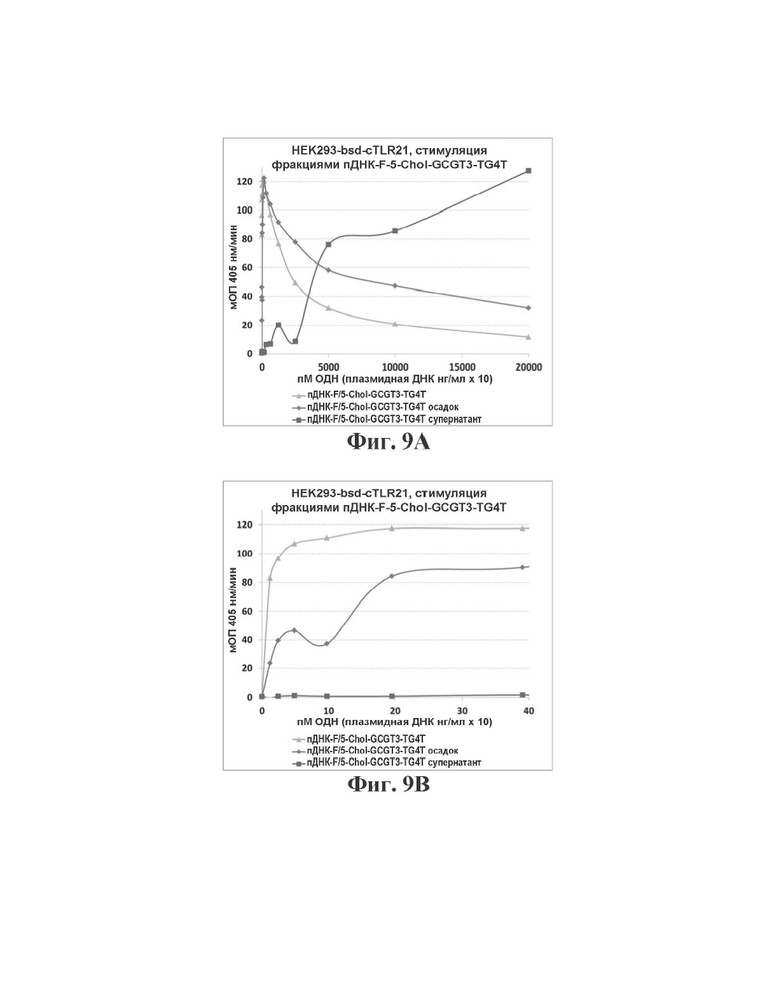
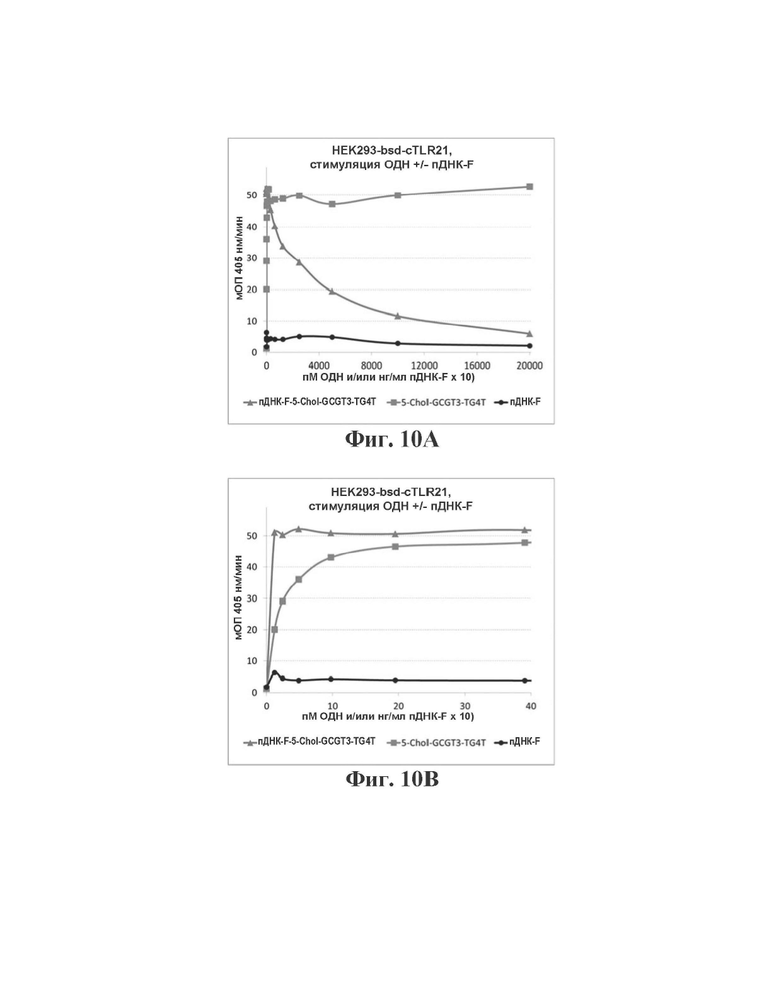






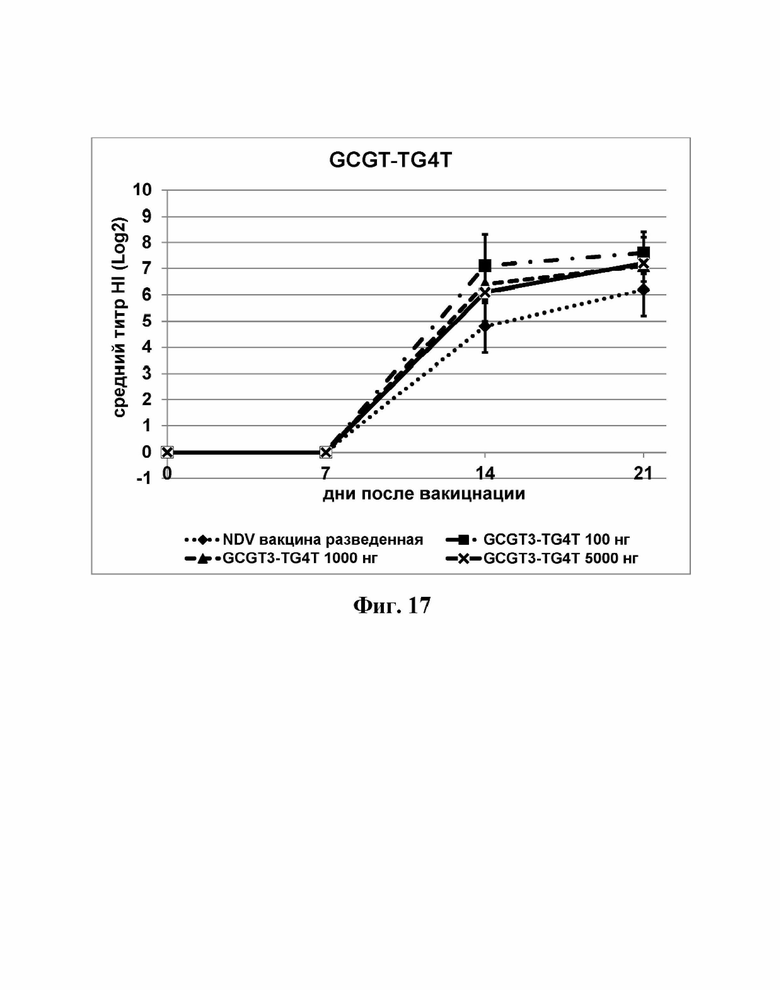
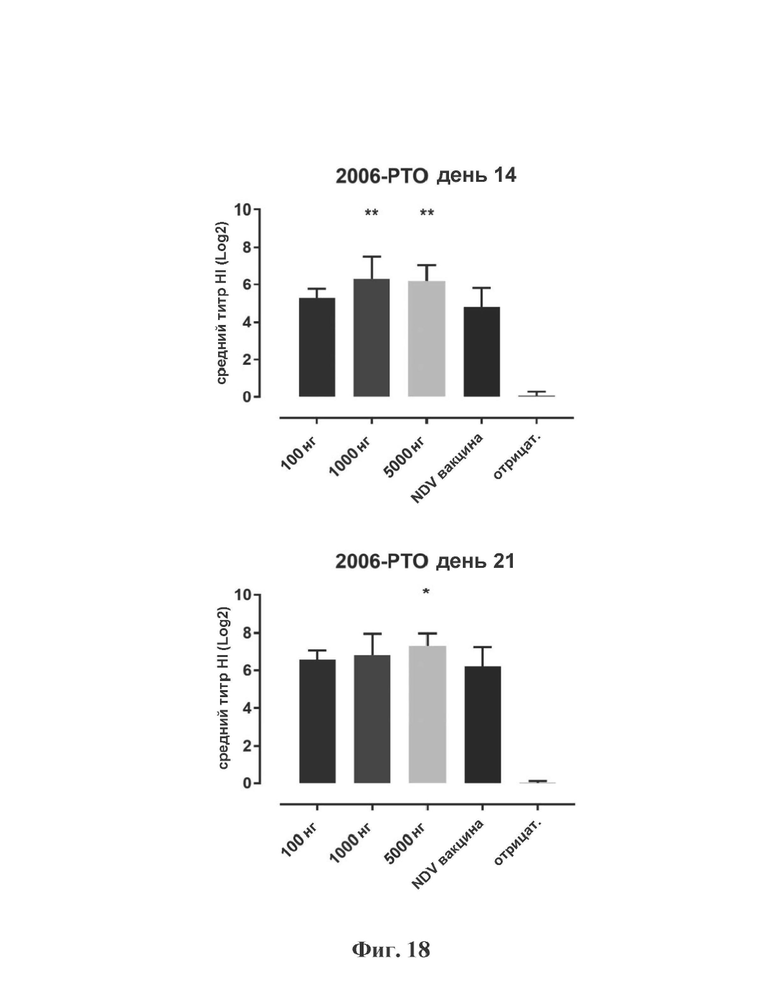
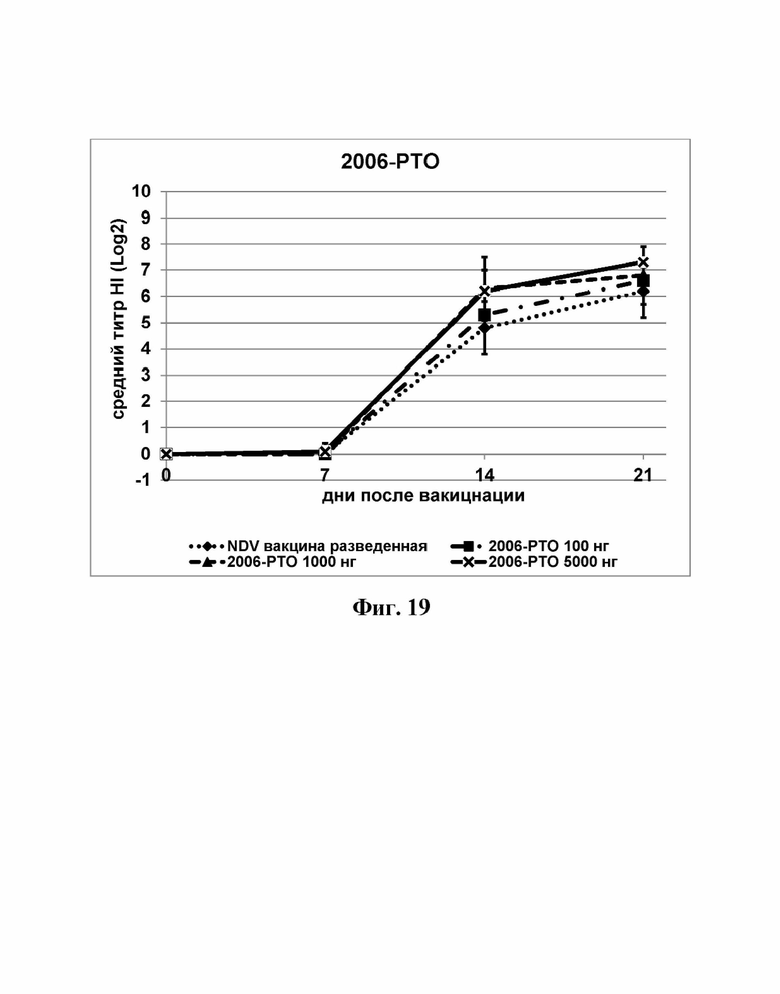


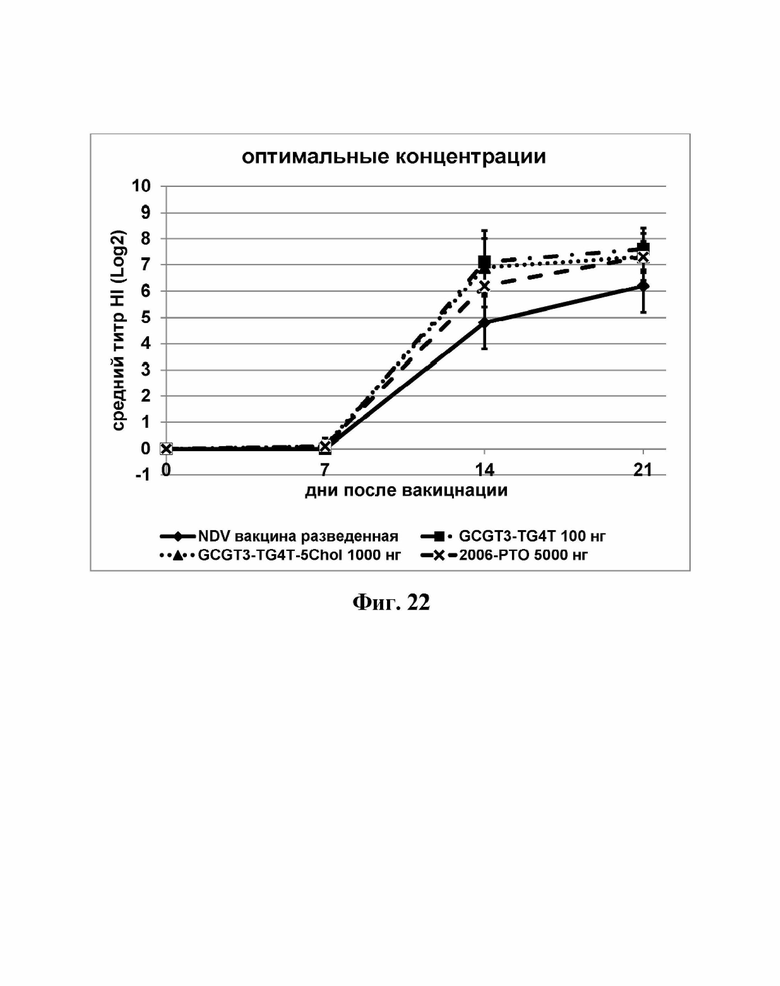
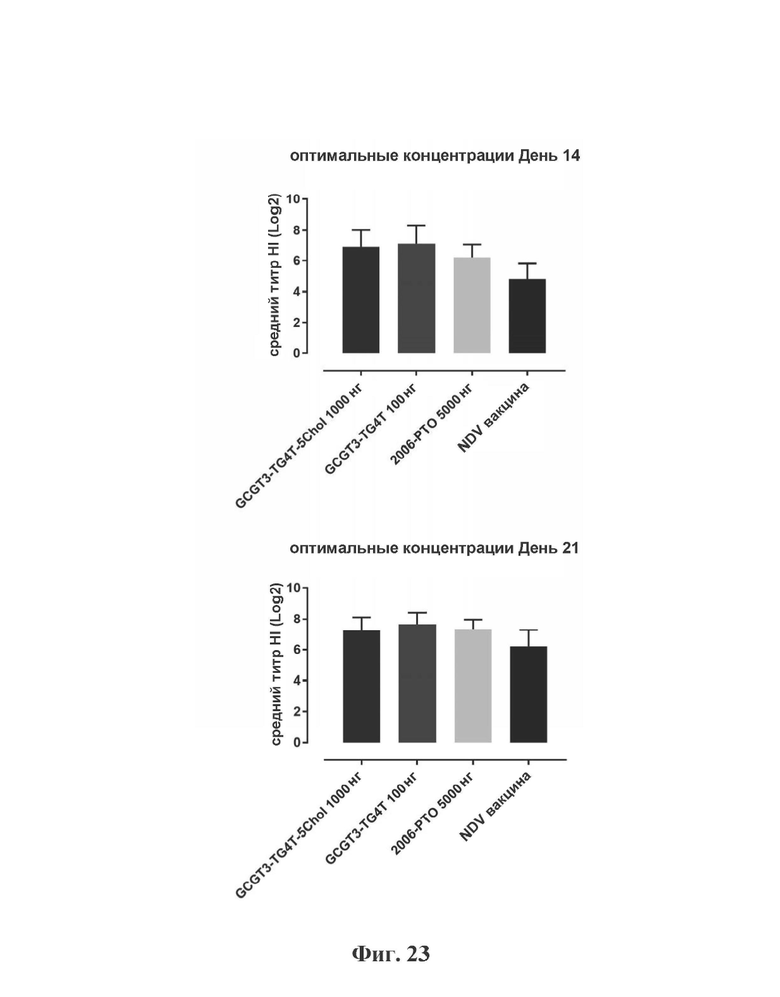
Изобретение относится к области биотехнологии. Описана группа изобретений, включающая иммуностимулирующую композицию для стимуляции толл-подобного рецептора 21 (TLR21) (варианты), способ получения иммуностимулирующей композиции и способ вызывания иммунного ответа против толл-подобного рецептора 21 (TLR21) у субъекта. В одном варианте реализации иммуностимулирующая композиция содержит иммуномодулирующую композицию, содержащую плазмидную нуклеиновую кислоту, липосомный носитель и иммуностимулирующий олигонуклеотид, имеющий по меньшей мере один CpG мотив и обогащенную гуаниновыми нуклеотидами последовательность. Изобретение расширяет арсенал средств для стимуляции толл-подобного рецептора 21. 4 н. и 25 з.п. ф-лы, 34 ил., 13 табл., 11 пр.
1. Иммуностимулирующая композиция для стимуляции толл-подобного рецептора 21 (TLR21), содержащая:
(а) иммуномодулирующую композицию, содержащую плазмидную нуклеиновую кислоту,
где плазмидная нуклеиновая кислота содержит нуклеотидную последовательность SEQ ID NO: 266;
(б) липосомный носитель, содержащий пару липидов, включающую хлорид 1-[2-(олеоилокси)этил]-2-олеил-3-(2-гидроксиэтил)имидазолиния (DOTIM) и холестерол; и
(с) иммуностимулирующий олигонуклеотид, имеющий по меньшей мере один CpG мотив и обогащенную гуаниновыми нуклеотидами последовательность на или возле 5'-конца иммуностимулирующего олигонуклеотида,
где иммуностимулирующий олигонуклеотид содержит нуклеотидную последовательность SEQ ID NO: 16, 17, 18, 19, 20, 21, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 77, 78, 81, 82, 85, 86, 89, 90, 92, 93, 96, 97, 100, 102, 104, 106, 108, 141, 142, 143, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203 или GCGT-Gwire3.
2. Иммуностимулирующая композиция по п. 1, где иммуномодулирующая композиция и иммуностимулирующий олигонуклеотид присутствуют в синергетически эффективных количествах.
3. Иммуностимулирующая композиция по п. 1 или 2, где иммуностимулирующий олигонуклеотид содержит лиганд для цитозольной молекулы, контролирующей нуклеиновую кислоту.
4. Иммуностимулирующая композиция по п. 3, где иммунная цитозольная молекула, контролирующая нуклеиновую кислоту, представляет собой толл-подобный рецептор (TLR).
5. Иммуностимулирующая композиция по п. 3 или 4, где цитозольная молекула, контролирующая нуклеиновую кислоту, представляет собой TLR21.
6. Иммуностимулирующая композиция по одному из предшествующих пунктов, где концентрация плазмидной нуклеиновой кислоты в иммуномодулирующей композиции больше, чем концентрация иммуностимулирующего олигонуклеотида.
7. Иммуностимулирующая композиция по одному из предшествующих пунктов, которая дополнительно содержит фармацевтический наполнитель.
8. Иммуностимулирующая композиция по одному из предшествующих пунктов, где плазмидная нуклеиновая кислота является некодирующей.
9. Иммуностимулирующая композиция по п. 1, где иммуностимулирующий олигонуклеотид содержит SEQ ID NO: 16, 17, 18, 19, 20, 21, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 77, 78, 81, 82, 85, 86, 89, 90, 92, 93, 96, 97, 100, 102, 104, 106, 108 или 143.
10. Иммуностимулирующая композиция по п. 1, где иммуностимулирующий олигонуклеотид содержит SEQ ID NO: 141, 142, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 203 или GCGT-Gwire3.
11. Иммуностимулирующая композиция по одному из предшествующих пп. 9-10, где первое множество гуаниновых нуклеотидов и по меньшей мере один CpG мотив разделен гексаэтиленгликолем, тетраэтиленгликолем, пропандиолом или их производными.
12. Иммуностимулирующая композиция по п. 11, где структура гексаэтиленгликоля представляет собой:

13. Иммуностимулирующая композиция по одному из предшествующих пунктов, где иммуностимулирующий олигонуклеотид дополнительно содержит множество CpG мотивов, каждый CpG мотив множества CpG мотивов отделен от других множеств CpG мотивов спейсером.
14. Иммуностимулирующая композиция по п. 13, где спейсер содержит по меньшей мере один нуклеотид или аналог нуклеотида.
15. Иммуностимулирующая композиция по п. 14, где спейсер содержит дезоксирибозофосфатный мостик.
16. Иммуностимулирующая композиция по п. 15, где дезоксирибозофосфатный мостик является безосновным.
17. Иммуностимулирующая композиция по п. 14, где спейсер содержит углеродную цепь.
18. Иммуностимулирующая композиция по п. 17, где углеродная цепь имеет происхождение из 1,3-пропандиола.
19. Иммуностимулирующая композиция по п. 14, где спейсер содержит повторяемую химическую единицу.
20. Иммуностимулирующая композиция по п. 19, где повторяемая химическая единица представляет собой этиленгликоль.
21. Иммуностимулирующая композиция по любому из пп. 1-20, где иммуностимулирующий олигонуклеотид дополнительно содержит фосфоротиоатный остов.
22. Иммуностимулирующая композиция по одному из предшествующих пунктов, где иммуностимулирующий олигонуклеотид содержит липидный компонент.
23. Иммуностимулирующая композиция по п. 22, где липидный компонент представляет собой холестерил.
24. Иммуностимулирующая композиция по одному из предшествующих пп. 22, 23, где липидный компонент находится на или возле 5'-конца иммуностимулирующего олигонуклеотида.
25. Способ получения иммуностимулирующей композиции по одному из предшествующих пунктов, включающий:
комбинирование иммуномодулирующей композиции и иммуностимулирующего олигонуклеотида с образованием иммуностимулирующей композиции по одному из пп. 1-24;
центрифугирование иммуностимулирующей композиции для получения супернатанта и осадка; и
выделение осадка.
26. Способ вызывания иммунного ответа против толл-подобного рецептора 21 (TLR21) у субъекта, включающий введение субъекту иммуностимулирующей композиции по одному из предшествующих пп. 1-24.
27. Иммуностимулирующая композиция для стимуляции толл-подобного рецептора 21 (TLR21), содержащая:
(а) плазмидную нуклеиновую кислоту, содержащую нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO: 266;
(б) олигонуклеотид, содержащий нуклеотидную последовательность SEQ ID NO: 1.
28. Иммуностимулирующая композиция по п. 27, где иммуностимулирующий олигонуклеотид дополнительно содержит 5'-холестерильную модификацию.
29. Иммуностимулирующая композиция по п. 28, где 5'-холестерильная модификация содержит триэтиленгликольный линкер.
| ИММУНОСТИМУЛИРУЮЩИЕ ОЛИГОДЕЗОКСИНУКЛЕОТИДЫ | 2011 |
|
RU2615457C2 |
| RU 2016106419 A 29.08.2017 | |||
| WO 2014001422 A2 03.01.2014 | |||
| WO 2012084951 A1 28.06.2012 | |||
| WO 2004016805 A2 26.02.2004. | |||
Авторы
Даты
2023-07-05—Публикация
2018-12-07—Подача