Изобретение относится к биотехнологии и медицине, а именно к диагностике инфекционных заболеваний, в частности к проблеме выявления генетических маркеров вируса клещевого энцефалита.
Вирусный клещевой энцефалит - заболевание, вызываемое одноименным вирусом являющегося представителем рода Flavivirus семейства Flaviviridae. Часто при инфицировании вирусом клещевого энцефалита заболевание ограничивается лихорадкой, но может проявляться в более тяжелой форме, выражающейся в поражении центральной нервной системы. Заболевание эндемично в лесистых районах Европы и Северо-Восточной части Азии и вызывается тремя субтипами вируса: Европейским (TBEV-Eu), Сибирским (TBEV-Sib) и Дальневосточным (TBEV-FE). В последнее время принято также выделять два дополнительных субтипа - Байкальский (TBEV-Bkl) и Гималайский (TBEV-Him).
В виду того, что вирусный клещевой энцефалит является эндемичным природно-очаговым заболеванием в ряде регионов Российской Федерации, наличие современных молекулярных средств диагностики необходимо как для целей лабораторной диагностики этого заболевания, так и для целей мониторинга циркуляции вируса в окружающей среде.
Прототипом изобретения является способ выявления вируса клещевого энцефалита методом ОТ-ПЦР в реальном времени, описанный в инструкции по применению диагностической системы «АмплиСенс® TBEV, B.burgdorferi si, A.phagocytophillum, E.chaffeensis/E.muris-FL», производимой ФБУН ЦНИИ эпидемиологии Роспотребнадзора (РУ от 22.02.2019 г № ФСР 2010/09026)
Однако данный способ имеет недостаточную чувствительность, обусловленную нерациональным выбором детектируемого фрагмента генома вируса клещевого энцефалита, что ограничивает возможности применения в клинической практике.
В связи с этим рациональный выбор фрагмента генома вируса клещевого энцефалита в качестве мишени для детекции является одним из самых ответственных этапов при проведении анализа.
Технической задачей изобретения являлась разработка высокочувствительного способа, основанного на методе ОТ-ПЦР в режиме реального времени, для идентификации генетического материала вируса клещевого энцефалита в биологических образцах и других вируссодержащих пробах (культуральная вируссодержащая жидкость, и т.д).
Поставленная задача решалась путем: конструирования диагностических праймеров и флуоресцентно-меченного зонда на консервативную область гена неструктурного белка NS3 вируса клещевого энцефалита; конструирования рекомбинантной плазмидной ДНК и MS2-фага, несущих специфический участок ДНК- и РНК-матрицы; оптимизации концентраций компонентов реакционной смеси и условий проведения ПНР.
Авторами предложен способ, согласно которому выделенную из биологических образцов (кровь и ее производные, ликвор, переносчики (клещи)) РНК анализируют в двухстадийной реакции.
Затем проводят двухстадийную реакцию обратной транскрипции и полимеразной цепной реакции для целевых фрагментов РНК генома вируса клещевого энцефалита с использованием набора олигонуклеотидных праймеров и соответствующего флуоресцентно меченного зонда, комплементарных участку гена NS3 вируса клещевого энцефалита.
Анализ результатов проводят с помощью программного обеспечения используемого прибора для проведения ПНР с гибридизационно-флуоресцентной детекцией в режиме «реального времени». Результаты интерпретируют на основании наличия или отсутствия пересечения кривой флуоресценции, с установленной на соответствующем уровне пороговой линией, что соответствует наличию или отсутствию значения порогового цикла Ct, причем результат считают положительным в случае, если кривая накопления флуоресценции для соответствующего образца имеет характерную «сигмовидную» форму и пересекает пороговую линию.
На начальном этапе были подобраны и синтезированы 2 пары специфических олигонуклеотидных праймеров и зонд для гибридизационно-флуоресцентной детекции продуктов ПНР. Для этого в базе данных NCBI Mega BLAST (http://www.ncbi.nlm.nih.gov/) был выбран наиболее консервативный участок генома штаммов вируса клещевого энцефалита. Были проанализированы все имеющиеся в базе данных последовательности. Последовательности олигонуклеотидных праймеров и флуоресцентного зонда представлены в таблице 1.

Подбор и анализ свойств олигонуклеотидных праймеров и флуоресцентного зонда проводился с использованием программного обеспечения Vector NTI 9.0. (Invitrogene, USA).
Для контроля качества прохождения этапов обратной транскрипции и ПНР в состав методики были введены рекомбинантные положительные контрольные образцы К+ и ПКО, и внутренний контрольный образец (ВКО). Матрицу для создания рекомбинантных положительных контрольных образцов получали синтетическим методом на основе ампликона, включающего в себя диагностическую область-мишень и фланкирующие последовательности нуклеотидов. Ампликон получали методом «степ-аут» ПЦР. Конечный ПЦР-продукт лигировали в плазмидный вектор pGEM-T («Promega», USA) под контролем промотора Т7 РНК полимеразы и трансформировали им Escherichia coli (штамм XL1-Blue). Рекомбинантные плазмиды из индивидуальных клонов проверяли на правильность ориентации целевой последовательности и отсутствие мутаций в области посадки праймеров и зонда. Проверку осуществляли методом секвенирования по-Сэнгеру с помощью прибора для автоматического капиллярного секвенирования ABI PRISM 3500xl («Applied Biosystems», США). Соответствующие заданным критериям рекомбинантные плазмиды использовали для приготовления положительного контрольного образца этапа ПЦР (К+). Для этого определяли концентрацию ДНК в растворе рекомбинантной плазмиды и разводили буфером для хранения ДНК (ФБУН ЦНИИ Эпидемиологии, Россия) до рабочей концентрации 1*106 - 1*107 копий/мл. Также данные рекомбинантные плазмиды использовались для получения рекомбинантного РНК-содержащего положительного контрольного образца с защитной белковой оболочкой MS2-фага (ПКО). Для полученного продукта также производили определение концентрации, затем разводили РНК-буфером (ФБУН ЦНИИ Эпидемиологии, Россия) до рабочей концентрации 1*106 - 5*107 копий/мл, которую использовали в качестве препарата ПКО. Оценку аналитической чувствительности способа производили на разведениях РНК-содержащего рекомбинантного положительного контрольного образца (ПКО), из которых экстрагировали РНК с помощью набора для выделения нуклеиновых кислот «Рибо-Преп» (ФБУН ЦНИИ Эпидемиологии, Россия), а затем с помощью специфических праймеров и флуоресцентных зондов определяли минимальное разведение, детектируемое как положительное в 100% случаев. Определенная таким образом аналитическая чувствительность способа составила 5*103 ГЭ/мл.
Аналитическую специфичность способа оценивали с помощью панели РНК и кДНК 23 видов вирусов, принадлежащих к 10 различным семействам, а также 30 образцов клинического материала (плазма) от клинически здоровых людей. В результате исследования перекрестных реакций не зафиксировано.
Также разработанный способ был протестирован на панели РНК различных штаммов вируса клещевого энцефалита (таблица 2)
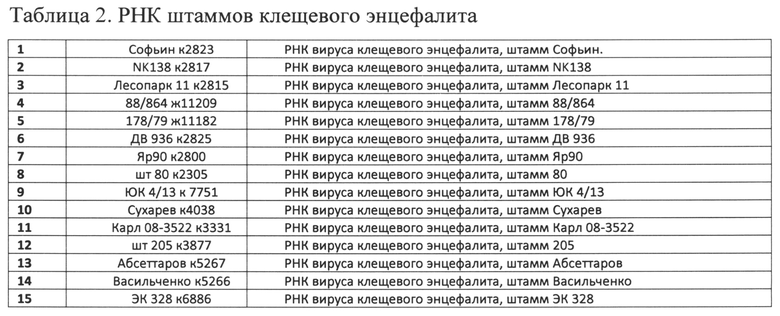
Результаты сравнительного тестирования (с системой сравнения АмплиСенс TBE-FL, производства ЦНИИ эпидемиологии) представлены в Таблице 3.
Таким образом, в результате проведенных исследований был разработан и апробирован способ выявления РНК вируса клещевого энцефалита в различных видах биологического материала, превосходящая по чувствительности существующий аналог АмплиСенс TBE-FL производства ЦНИИ эпидемиологии и сопоставимая с зарегистрированным аналогом РеалБест РНК ВКЭ производства АО «Вектор Бест».
Технический результат достигается способом определения РНК вируса клещевого энцефалита, включающим выделение РНК исследуемой пробы, проведение обратной транскрипции и ПНР с учетом результатов в режиме реального времени, согласно изобретению.
Способ осуществляют следующим образом:
Подготовку проб проводят согласно МУ 1.3.2569-09 «Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I-IV групп патогенности». Материалом для исследования могут служить: клинические и биологические образцы, а также пробы из объектов окружающей среды. Экстракция производится из 100 мкл полученной суспензии образца с лизирующим буфером на основе 6 моль гуанидинизотиоцианата в объеме, указанном в инструкции к набору для выделения РНК, и последующим инкубированием 15 минут при температуре (65±1)°С. Выделение РНК осуществляют с помощью наборов «Рибо-преп» и «Рибо-Сорб» (ФБУН ЦНИИ Эпидемиологии, Россия) в соответствии с инструкциями к наборам. Во все пробирки, включая контроль выделения, на этапе прогревания в лизирующем буфере добавляют 10 мкл внутреннего контрольного образца (ВКО).
После выделения РНК приступают к постановке ОТ-ПЦР. Для упрощения и стандартизации подготовки реактивов, перед началом постановки ПЦР готовят две реакционные смеси. Первая реакционная смесь включает, в расчете на каждую реакцию, диагностические праймеры и праймеры на ВКО в концентрации 0,5 пмоль/мкл, флуоресцентные зонды в концентрации 0,5 пмоль/мкл, смесь дезоксинуклеозидтрифосфатов (дНТФ) дАТФ, дТТФ, дГТФ, дЦТФ в концентрации 0,44 мМ, стерильную воду до объема 10 мкл. Первая реакционная смесь может быть приготовлена заранее и подлежит хранению при температуре не выше -18°С. Вторая реакционная смесь содержит, в расчете на одну реакцию, 5 мкл 5-х реакционного буфера для ферментов с MgCl2 в концентрации 15 мМ, 0,25 мкл обратной транскриптазы, 0,25 мкл дитиотрейтола в концентрации 1 мМ, 0,5 мкл полимеразы TaqF. Вторая реакционная смесь готовится непосредственно перед постановкой ПЦР и хранению не подлежит. Для постановки отбирают необходимое количество микропробирок объемом 0,2 мл, соответствующее числу исследуемых проб, а также по две пробирки для положительных и отрицательных контролей. Далее по числу исследуемых проб смешивают реакционные смеси: 10 мкл первой реакционной смеси и 5 мкл второй реакционной смеси на каждую реакцию. По 15 мкл полученной смеси вносят в подготовленные пробирки, затем добавляют 10 мкл РНК-пробы, экстрагированной из исследуемого материала. Готовят 4 контрольные реакции. Для этого в пробирку для положительного контроля ПЦР вносят 10 мкл К+, в пробирку для положительного контроля обратной транскрипции вносят 10 мкл образца, экстрагированного из ПКО. В пробирку для отрицательного контроля ПЦР вносят 10 мкл стерильной воды, в пробирку для отрицательного контроля экстракции вносят 10 мкл пробы, экстрагированной из ОКО. Конечный объем реакционной смеси составляет 25 мкл. Микропробирки переносят в программируемый амплификатор типа Rotor Gene Q («Qiagen», Германия) или RotorGene 6000 (Corbett Research, Австралия). Режим амплификации представлен в таблице 4.


Детекцию флуоресцентного сигнала производят при 55°С по каналам Green (FAM) и Yellow (JOE).
Учет и анализ результатов проводят с помощью программного обеспечения прибора на основании отсутствия или наличия сигнала флуоресценции в исследуемых пробах по детектируемым каналам. Результаты интерпретируют на основании наличия (или отсутствия) пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией, что соответствует наличию (или отсутствию) значения порогового цикла Ct в соответствующей графе в таблице результатов. Результат считают положительным в случае, если кривая накопления флуоресценции для соответствующего образца имеет характерную «сигмовидную» форму и пересекает пороговую линию. Накопление флуоресцентного сигнала по каналу JOE свидетельствует о наличии в исследуемом материале РНК вируса клещевого энцефалита. При этом результат считается валидным, если параллельно в пробе по каналу FAM регистрируется накопление флуоресцентного сигнала ВКО, а в образцах К+ и ПКО - по каналу JOE. Сигнал по каналу JOE в образцах К- и ОКО должен отсутствовать.
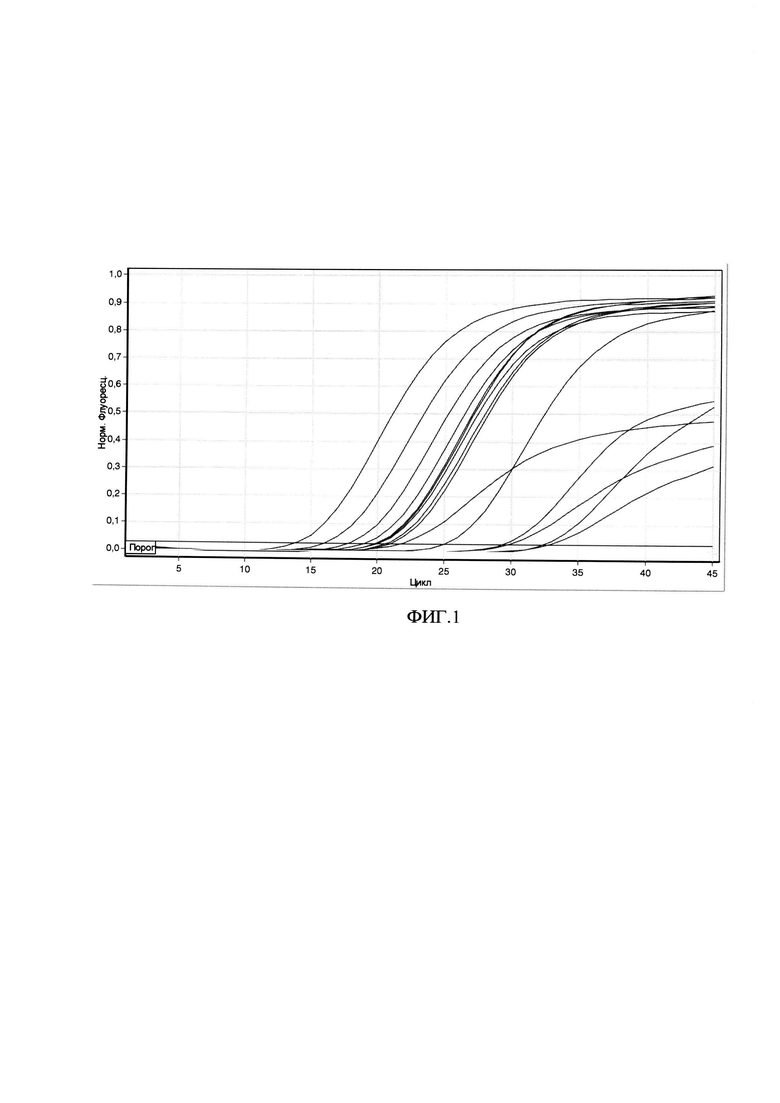
Сущность изобретения поясняется чертежом, где на ФИГ. 1 представлены кривые флуоресценции, отражающие динамику образования продукта реакции при анализе образцов РНК различных штаммов вируса клещевого энцефалита.
Таким образом, заявляемый способ позволяет достоверно выявлять РНК вируса клещевого энцефалита в клинических пробах, а также в материале от животных и из объектов окружающей среды. Предложенный способ отличается от прототипа последовательностями олигонуклеотидных праймеров и флуоресцентного зонда, а также структурой генетических конструкций положительных контрольных образцов.
--->
Перечень последовательностей
<110> НИИ эпидемиологии и микробиологии имени Пастера
Pasteur Institute
<120> Способ выявления вируса клещевого энцефалита методом ОТ-
ПЦР в реальном времени
<140> 2019144134/20(085351)
<141> 26.12.2019
<160> 5
<210> 1
<211> 19
<212> ДНК
<213> Искусственная
<220>
<223> праймер/зонд
<400> 1
ctggacatgc acccaggct 19
<210> 2
<211> 20
<212> ДНК
<213> Искусственная
<220>
<223> праймер/зонд
<400> 2
agtgttggac atgcacccag 20
<210> 3
<211> 20
<212> ДНК
<213> Искусственная
<220>
<223> праймер/зонд
<400> 3
atgcattggc gratgagctc 20
<210> 4
<211> 21
<212> ДНК
<213> Искусственная
<220>
<223> праймер/зонд
<400> 4
ctccatttcc ttgagcacca c 21
<210> 5
<211> 24
<212> ДНК
<213> Искусственная
<220>
<223> праймер/зонд
<400> 5
tgggaagacc cacagagtcc tccc 24
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ выявления вируса Nipah методом ОТ-ПЦР в реальном времени | 2022 |
|
RU2816270C2 |
| Способ выявления вируса кори методом ОТ-ПЦР в реальном времени | 2023 |
|
RU2822430C1 |
| Способ выявления РНК вируса Хендра вида Hendra henipavirus методом ОТ-ПЦР в реальном времени | 2023 |
|
RU2822161C1 |
| Способ выявления РНК вируса Bandavirus dabieense (SFTSV) методом ОТ-ПЦР в реальном времени | 2024 |
|
RU2831410C1 |
| Способ выявления РНК вируса геморрагической лихорадки Крым-Конго методом ОТ-ПЦР в реальном времени | 2024 |
|
RU2834908C1 |
| Способ выявления РНК вируса Хунин методом ОТ-ПЦР в реальном времени | 2023 |
|
RU2822164C1 |
| Набор для выявления вируса SARS-CoV методом ОТ-ПЦР в реальном времени | 2020 |
|
RU2744198C1 |
| СПОСОБ ВЫЯВЛЕНИЯ ВИРУСА ОБЕЗЬЯНЬЕЙ ОСПЫ ВИДА MONKEYPOX МЕТОДОМ ПЦР В РЕАЛЬНОМ ВРЕМЕНИ (MPX AMP PS) | 2023 |
|
RU2803898C1 |
| Способ выявления РНК вируса Mammarenavirus guanaritoense методом ОТ-ПЦР в реальном времени | 2024 |
|
RU2839982C1 |
| Способ выявления РНК модифицированного вакцинного полиовируса типа 2 (nOPV2) методом ОТ-ПЦР в реальном времени | 2022 |
|
RU2795703C1 |
Изобретение относится к способу выявления вируса клещевого энцефалита методом ОТ-ПЦР в реальном времени. Способ предусматривает экстракцию РНК из биологических образцов с последующим проведением двухстадийной реакции обратной транскрипции и полимеразной цепной реакции для целевых фрагментов РНК генома вируса клещевого энцефалита с использованием набора олигонуклеотидных праймеров и соответствующего флуоресцентно меченного зонда, комплементарных участку гена NS3 вируса клещевого энцефалита. При этом анализ результатов проводят с помощью программного обеспечения используемого прибора для проведения ПНР с гибридизационно-флуоресцентной детекцией в режиме «реального времени», результаты интерпретируют на основании наличия или отсутствия пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией, что соответствует наличию или отсутствию значения порогового цикла Ct. Результат считают положительным в случае, если кривая накопления флуоресценции для соответствующего образца имеет характерную «сигмовидную» форму и пересекает пороговую линию. Для детекции используют следующий набор олигонуклеотидных праймеров и флуоресцентно меченного зонда: TBE-fsh CTg gACA TgC ACC CAg gCT, rt-TBEV-f12b AgT gTT ggA CAT gCA CCC Ag, TBE-rsh ATGCATTGGCGRATGAGCTC, rt-TBEV-r12c CTC CAT TTC CTT gAg CAC CAC, TBEv-Prb12 R6G-Tgg gAA gAC CCA CAg AgT CCT CCC-BHQ1. Изобретение обеспечивает повышение чувствительности диагностики. 1 ил., 4 табл.
Способ выявления вируса клещевого энцефалита методом ОТ-ПЦР в реальном времени, предусматривающий экстракцию РНК из биологических образцов с последующим проведением двухстадийной реакции обратной транскрипции и полимеразной цепной реакции для целевых фрагментов РНК генома вируса клещевого энцефалита с использованием набора олигонуклеотидных праймеров и соответствующего флуоресцентно меченного зонда, комплементарных участку гена NS3 вируса клещевого энцефалита, при этом анализ результатов проводят с помощью программного обеспечения используемого прибора для проведения ПНР с гибридизационно-флуоресцентной детекцией в режиме «реального времени», результаты интерпретируют на основании наличия или отсутствия пересечения кривой флуоресценции с установленной на соответствующем уровне пороговой линией, что соответствует наличию или отсутствию значения порогового цикла Ct, причем результат считают положительным в случае, если кривая накопления флуоресценции для соответствующего образца имеет характерную «сигмовидную» форму и пересекает пороговую линию, отличающийся тем, что для детекции используют следующий набор олигонуклеотидных праймеров и флуоресцентно меченного зонда: TBE-fsh CTg gACA TgC ACC CAg gCT, rt-TBEV-f12b AgT gTT ggA CAT gCA CCC Ag, TBE-rsh ATGCATTGGCGRATGAGCTC, rt-TBEV-r12c CTC CAT TTC CTT gAg CAC CAC, TBEv-Prb12 R6G-Tgg gAA gAC CCA CAg AgT CCT CCC-BHQ1.
| Инструкция по применению набора реагентов для выявления РНК/ДНК возбудителей инфекций, передающихся иксодовыми клещами TBEV, Borellia burgdorferi sl, Anaplasma phagocytophilum, Ehrlichia chaffeensis/Ehrlichia muris, в биологическом материале методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией "АмплиСенс TBEV, |
Авторы
Даты
2021-03-03—Публикация
2019-12-26—Подача