ОБЛАСТЬ ТЕХНИКИ
[0001]
Настоящее изобретение относится к ионному проводнику, содержащему высокотемпературную фазу LiCB9H10, и к способу его получения, а также к твердому электролиту для полностью твердотельных аккумуляторов, содержащему указанный ионный проводник.
УРОВЕНЬ ТЕХНИКИ
[0002]
В последние годы растет потребность в перезаряжаемых литиево-ионных аккумуляторах в таких областях применения, как портативные информационные терминалы, портативные электронные устройства, электрические автомобили, гибридные электрические автомобили и, кроме того, стационарные системы хранения энергии. Однако в современных перезаряжаемых литиево-ионных аккумуляторах в качестве электролитического раствора используют горючий органический растворитель, и необходим надежный внешний корпус для предотвращения утечки органического растворителя. Кроме того, конструкция такого устройства также ограничена, например, в портативных персональных компьютерах и т.д. необходима такая конструкция, которая в экстремальной ситуации может выдерживать протечку электролитического раствора.
[0003]
Кроме того, применение перезаряжаемых литиево-ионных аккумуляторов распространяется на подвижные конструкции, такие как автомобили и самолеты, и, следовательно, для стационарных перезаряжаемых литиево-ионных батарей необходима большая емкость. В таких ситуациях, как правило, безопасности уделяется больше внимания, чем раньше, и, следовательно, усилия направлены на разработку полностью твердотельных перезаряжаемых литиево-ионных аккумуляторов, в которых не используются вредные материалы, такие как органический растворитель.
Например, рассматривается применение оксидов, фосфатных соединений, органических полимеров, сульфидов, комплексных гидридов и т.д. в качестве твердого электролита в полностью твердотельных литиево-ионных перезаряжаемых аккумуляторах.
[0004]
Полностью твердотельные аккумуляторы обобщенно классифицируют на батареи тонкопленочного типа и объемного типа. В батареях тонкопленочного типа, несмотря на идеальное образование границы раздела посредством осаждения пленки из паровой фазы, электродный слой имеет толщину лишь несколько мкм и небольшую площадь поверхности электрода, что обусловливает низкий запас энергии на один элемент, а также высокую стоимость. Следовательно, полностью твердотельный аккумулятор тонкопленочного типа не подходит в качестве батареи для крупных устройств для аккумулирования энергии и электрических автомобилей, где необходимо накопление большого количества энергии. С другой стороны, электродный слой батареи объемного типа может иметь толщину от нескольких десятков мкм до 100 мкм и, следовательно, может быть получен полностью твердотельный аккумулятор с высокой плотностью энергии.
[0005]
Среди твердых электролитов сульфиды и комплексные гидриды имеют высокую ионную проводимость и являются относительно мягкими и, следовательно, они имеют такие характеристики, что из них можно без труда формировать границу раздела двух твердых фаз, и в настоящее время продолжается обсуждение их применения для полностью твердотельных аккумуляторов объемного типа (патентные документы 1 и 2).
[0006]
Однако обычный сульфидный твердый электролит обладает свойством взаимодействия с водой и обусловливает следующие проблемы: сульфид образует сероводород; и после взаимодействия с водой снижается ионная проводимость. С другой стороны, комплексный гидридный твердый электролит обычно имеет немного более низкую ионную проводимость по сравнению с сульфидным твердым электролитом и, следовательно, необходимо улучшение ионной проводимости.
[0007]
В патентном документе 3 описан твердый электролит на основе карборана, но не описана его ионная проводимость.
ДОКУМЕНТЫ УРОВНЯ ТЕХНИКИ
ПАТЕНТНЫЕ ДОКУМЕНТЫ
[0008]
Патентный документ 1: Японский патент № 6246816
Патентный документ 2: WO 2017-126416
Патентный документ 3: US 2016/0372786A1
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
ЗАДАЧИ, РЕШАЕМЫЕ НАСТОЯЩИМ ИЗОБРЕТЕНИЕМ
[0009]
Задачей настоящего изобретения является обеспечение ионного проводника, обладающего различными исключительными свойствами, такими как ионная проводимость, способа его получения, а также твердого электролита для полностью твердотельного аккумулятора, содержащего указанный ионный проводник.
СПОСОБЫ РЕШЕНИЯ ЗАДАЧ
[0010]
Авторами настоящего изобретения провели скрупулезные исследования для решения вышеописанных задач и обнаружили, что вышеуказанные задачи могут быть решены с помощью ионного проводника, полученного смешиванием LiCB9H10 и LiCB11H12 в определенном молярном соотношении. В частности, настоящее изобретение описано ниже.
<1> Способ получения ионного проводника, содержащего LiCB9H10 и LiCB11H12, включающий:
стадию смешивания LiCB9H10 и LiCB11H12 в молярном соотношении LiCB9H10/LiCB11H12 = от 1,1 до 20.
<2> Способ получения ионного проводника по п. <1>, отличающийся тем, что смешивание проводят с помощью механического измельчения.
<3> Способ получения ионного проводника по п. <2>, отличающийся тем, что продолжительность проведения механического измельчения составляет от 1 до 48 часов.
<4> Способ получения ионного проводника по любому из пп. <1> - <3>, отличающийся тем, что полученный ионный проводник имеет пики рентгеновской дифракции при по меньшей мере 2θ = 14,9 ± 0,3 град, 16,4 ± 0,3 град и 17,1 ± 0,5 град при измерении рентгеновской дифракции при 25°С, и имеет отношение интенсивностей (B/A) от 1,0 до 20 при расчете на основании A = (интенсивность рентгеновской дифракции при 16,4 ± 0,3 град) - (интенсивность рентгеновской дифракции при 20 град) и B = (интенсивность рентгеновской дифракции при 17,1 ± 0,5 град) - (интенсивность рентгеновской дифракции при 20 град).
<5> Ионный проводник, содержащий литий (Li), углерод (C), бор (B) и водород (H), имеющий пики рентгеновской дифракции при по меньшей мере 2θ = 14,9 ± 0,3 град, 16,4 ± 0,3 град и 17,1 ± 0,5 град при измерении рентгеновской дифракции при 25°С, и имеющий отношение интенсивностей (B/A) от 1,0 до 20 при расчете на основании A = (интенсивность рентгеновской дифракции при 16,4 ± 0,3 град) - (интенсивность рентгеновской дифракции при 20 град) и B = (интенсивность рентгеновской дифракции при 17,1 ± 0,5 град) - (интенсивность рентгеновской дифракции при 20 град).
<6> Ионный проводник по п. <5>, содержащий LiCB9H10.
<7> Ионный проводник по п. <6>, дополнительно содержащий LiCB11H12.
<8> Ионный проводник по любому из пп. <5> - <7>, имеющий пики при 749 см-1 (±5 см-1) и 763 см-1 (±5 см-1), соответственно, при спектроскопии Рамана.
<9> Ионный проводник по любому из пп. <5> - <8>, имеющий ионную проводимость от 1,0 до 10 мСм.см-1 при 25°C.
<10> Твердый электролит для полностью твердотельного аккумулятора, содержащий ионный проводник по любому из пп. <5> - <9>.
<11> Электрод, полученный посредством приведения в контакт твердого электролита по п. <10> с металлическим литием.
<12> Полностью твердотельный аккумулятор, содержащий электрод по п. <11>.
ПОЛЕЗНЫЙ ЭФФЕКТ ИЗОБРЕТЕНИЯ
[0011]
В соответствии с настоящим изобретением может быть обеспечен ионный проводник, обладающий различными исключительными свойствами, такими как ионная проводимость, способ его получения, а также твердый электролит для полностью твердотельного аккумулятора, содержащий указанный ионный проводник.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0012]
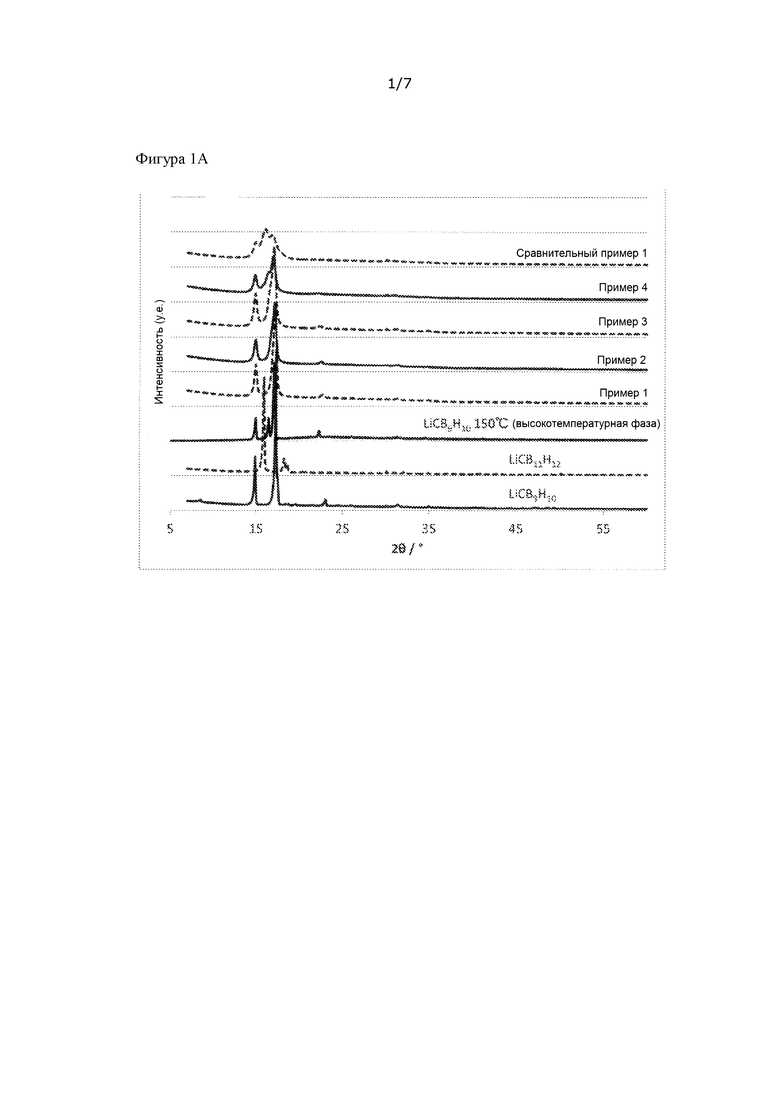
[Фигура 1A] На фиг. 1A представлены пики рентгеновской дифракции порошков ионных проводников, полученных в примерах 1 - 4 и в сравнительном примере 1.
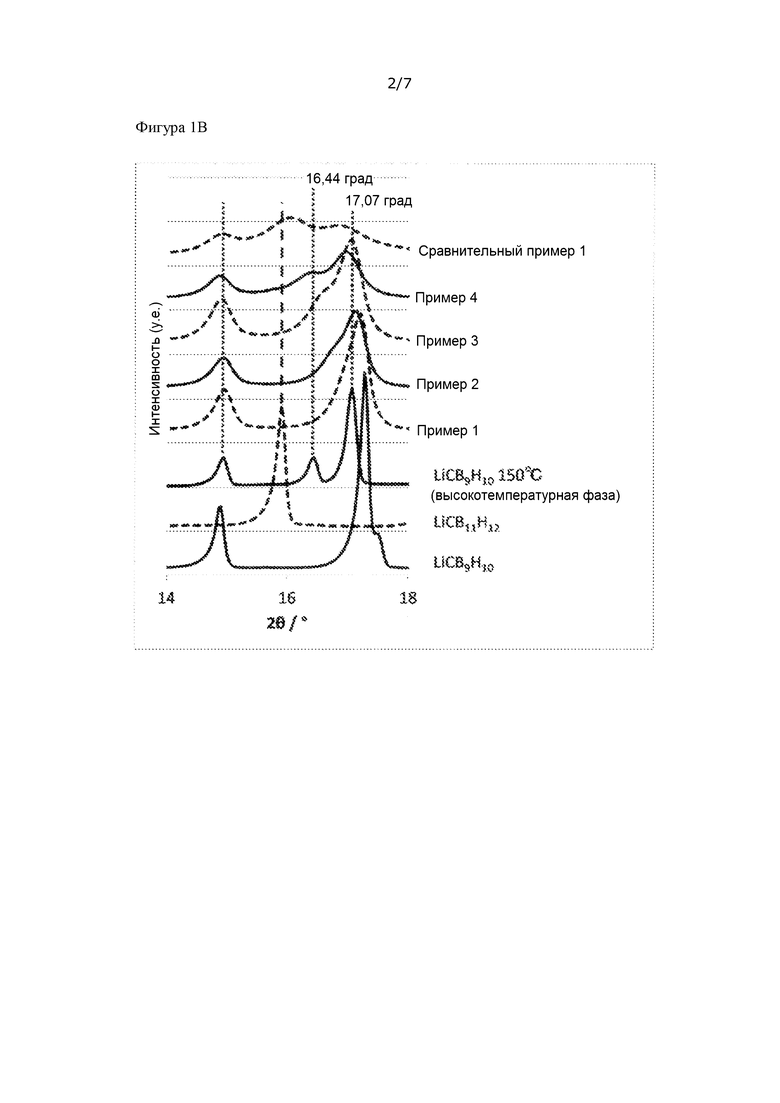
[Фигура 1B] На фиг. 1B показано увеличенное изображение части спектров рентгеновской дифракции, представленных на фиг. 1A.
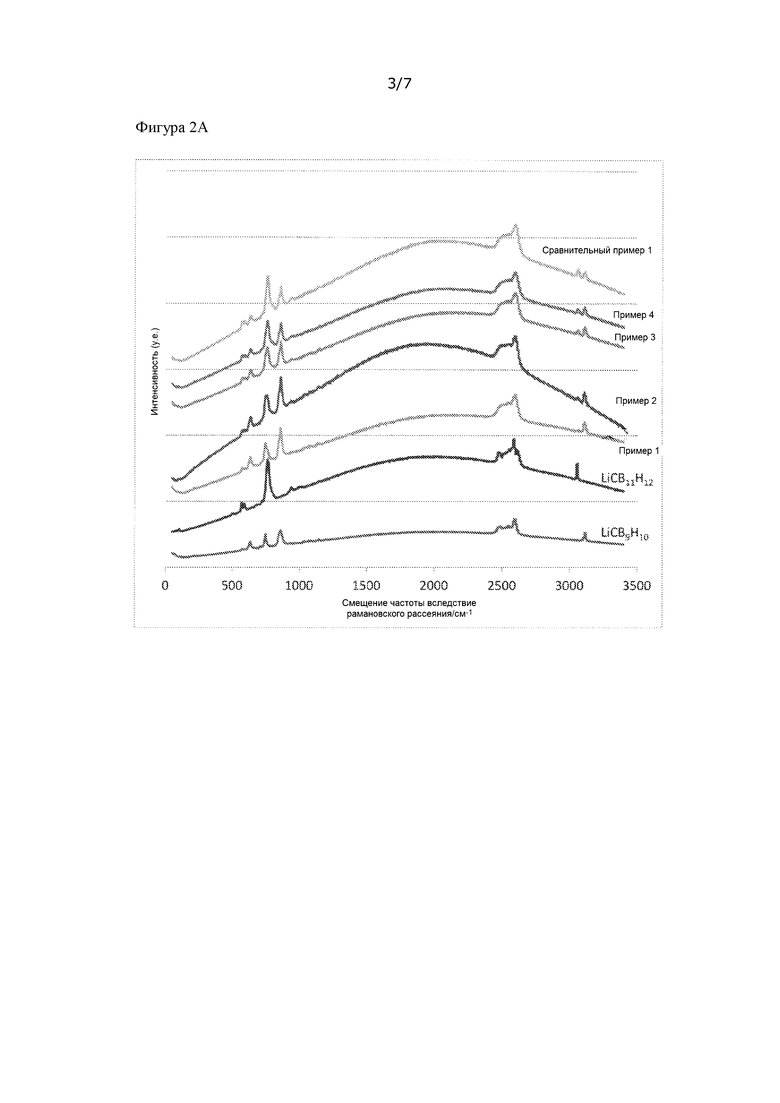
[Фигура 2A] На фиг. 2 представлены спектры Рамана ионных проводников, полученных в примерах 1 - 4 и в сравнительном примере 1.
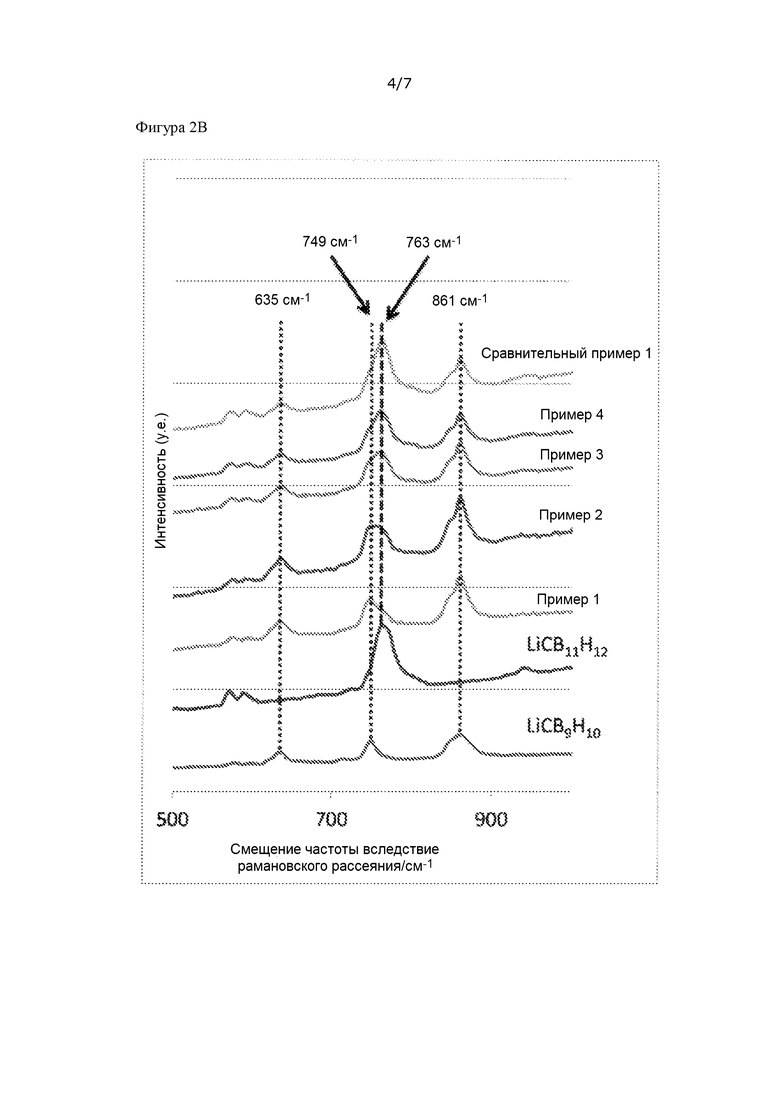
[Фигура 2B] На фиг. 2B показано увеличенное изображение части спектров Рамана, представленных на фиг. 2A.
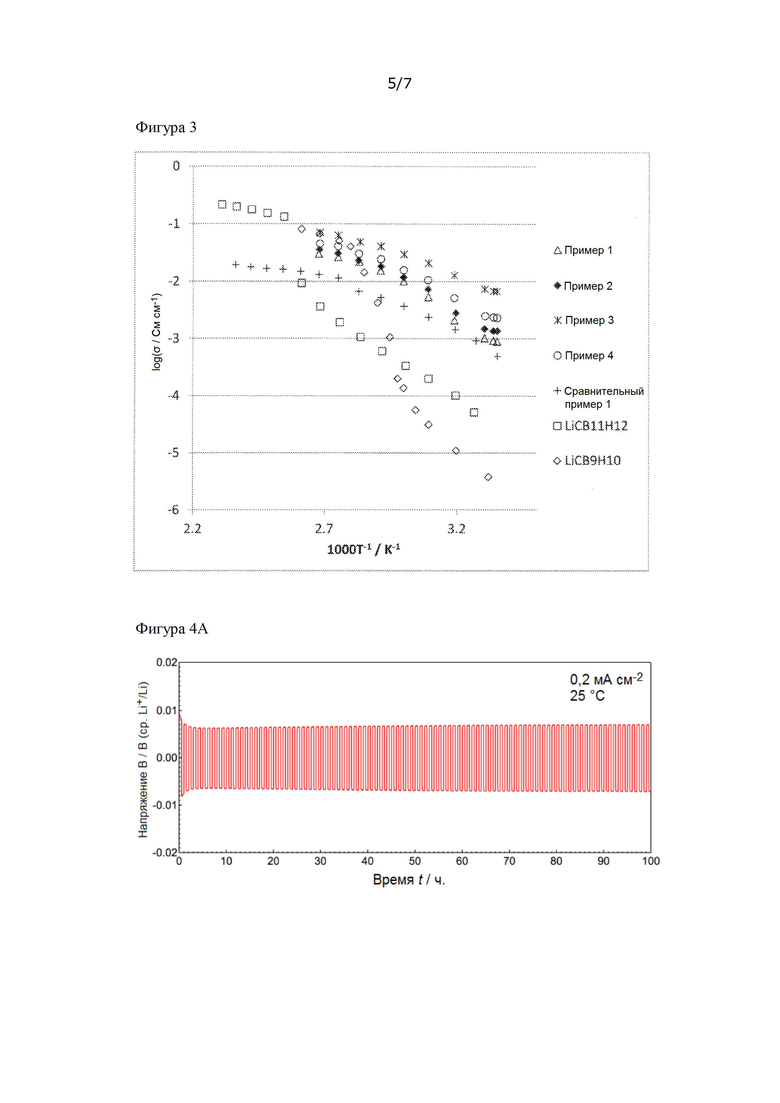
[Фигура 3] На фиг. 3 представлены результаты измерений ионной проводимости ионных проводников, полученных в примерах 1 - 4 и в сравнительном примере 1.
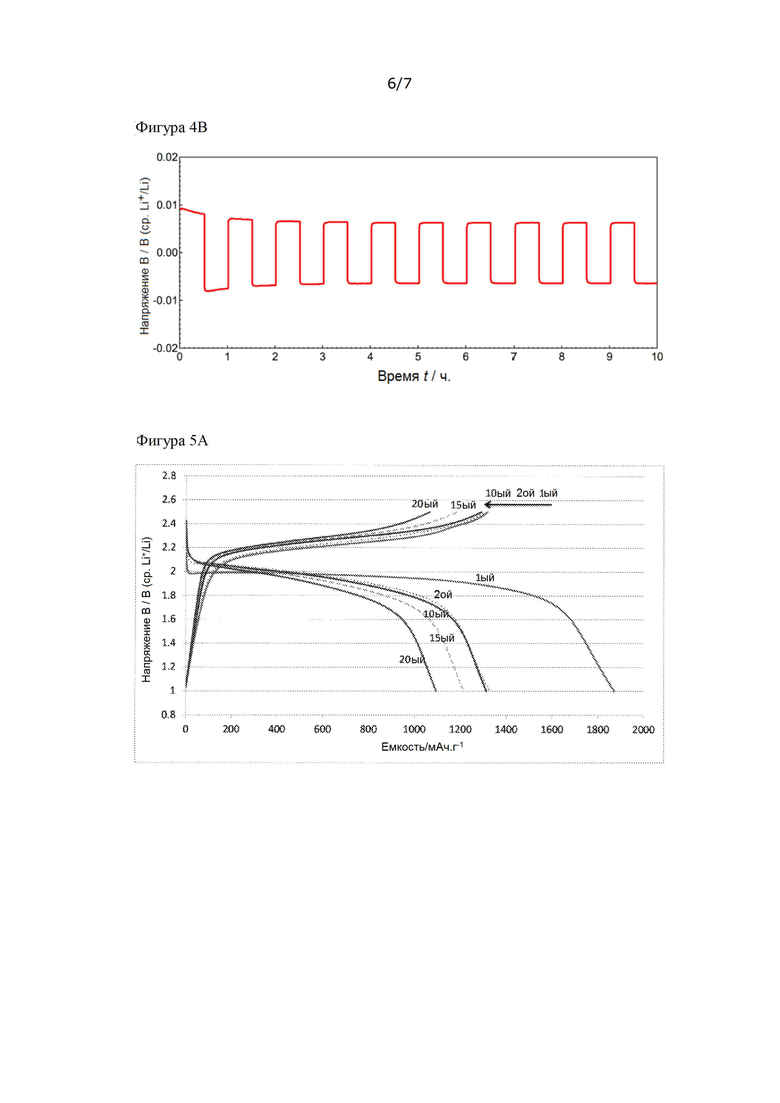
[Фигура 4A] На фиг. 4A представлены результаты измерения напряжения, приложенного между электродами экспериментального элемента, испытанного в примере 5.
[Фигура 4B] На фиг. 4B представлено увеличенное изображение фиг. 4A.
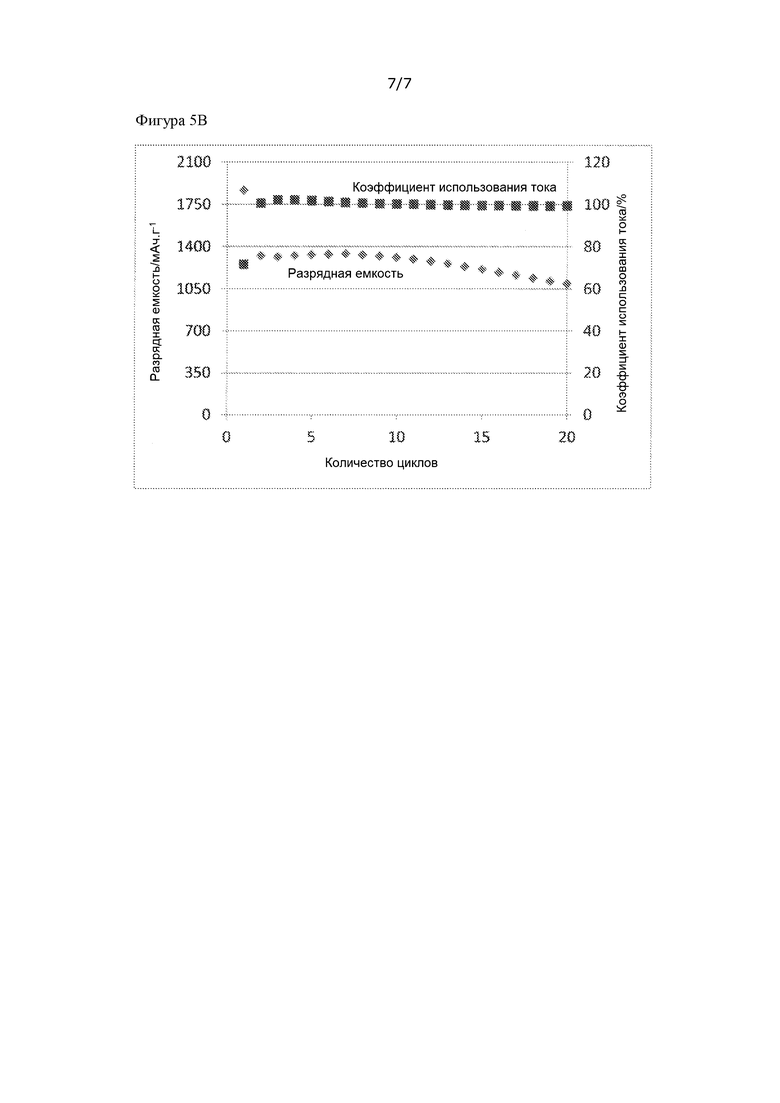
[Фигура 5A] На фиг. 5A представлены результаты испытаний заряда/разряда, проведенных в примере 6.
[Фигура 5B] На фиг. 5B представлены результаты испытаний заряда/разряда, проведенных в примере 6.
ВАРИАНТЫ РЕАЛИЗАЦИИ ИЗОБРЕТЕНИЯ
[0013]
Далее описаны варианты реализации настоящего изобретения. Материалы, конфигурация и т.д., описанные ниже, не ограничивают настоящее изобретение, и могут быть различным образом модифицированы в пределах сущности настоящего изобретения.
[0014]
1. Ионный проводник
В соответствии с одним вариантом реализации настоящего изобретения, предложен ионный проводник, содержащий литий (Li), углерод (C), бор (B) и водород (H). Вышеуказанный вариант реализации предпочтительно содержит высокотемпературную фазу (фазу с высокой ионной проводимостью) LiCB9H10 в качестве кристалла и, более предпочтительно, содержит LiCB9H10 и LiCB11H12.
[0015]
Ионный проводник согласно настоящему изобретению предпочтительно имеет пики при 749 см-1 (±5 см-1) для LiCB9H10 и при 763 см-1 (±5 см-1) для LiCB11H12, соответственно, при спектроскопии Рамана. Он может иметь пики и в других областях, но вышеуказанные пики демонстрируют соответствующие характеристики.
[0016]
Ионный проводник согласно настоящему изобретению предпочтительно содержит высокотемпературную фазу LiCB9H10 в качестве кристалла. LiCB9H10 содержит высокотемпературную фазу и низкотемпературную фазу в зависимости от состояния кристалла, и несмотря на то, что высокотемпературная фаза при высокой температуре (например, примерно 75-150°С) имеет высокую ионную проводимость, она переходит в низкотемпературную фазу примерно при комнатной температуре (например, примерно 20-65°С) и имеет сниженную ионную проводимость.
Ионный проводник согласно настоящему изобретению имеет пики рентгеновской дифракции для высокотемпературной фазы LiCB9H10 при по меньшей мере 2θ = 14,9 ± 0,3 град, 16,4 ± 0,3 град и 17,1 ± 0,5 град при измерении рентгеновской дифракции при 25°C. Соотношение интенсивностей (B/A), рассчитанное на основании A = (интенсивность рентгеновской дифракции при 16,4 ± 0,3 град) - (интенсивность рентгеновской дифракции при 20 град) и B = (интенсивность рентгеновской дифракции при 17,1 ± 0,5 град) - (интенсивность рентгеновской дифракции при 20 град), предпочтительно составляет от 1,0 до 20, более предпочтительно от 1,0 до 15, и особенно предпочтительно от 1,0 до 10. Если соотношение интенсивностей (B/A) составляет от 1,0 до 20, то LiCB11H12 находится в форме твердого раствора в высокотемпературной фазе LiCB9H10, что приводит к снижению температуры фазового перехода и, следовательно, такое состояние высокой ионной проводимости может сохраняться даже при примерно комнатной температуре. Такой твердый раствор получают при молярном соотношении LiCB9H10/LiCB11H12 = 1,1 или более. Предпочтительно, LiCB9H10/LiCB11H12 = от 1,1 до 20, более предпочтительно LiCB9H10/LiCB11H12 = от 1,25 до 10, и особенно предпочтительно LiCB9H10/LiCB11H12 = от 1,5 до 9, и если указанное соотношение находится в данных диапазонах, то достигается высокое значение ионной проводимости.
Кроме того, требуемый эффект может быть достигнут даже если ионный проводник согласно настоящему изобретению имеет пик рентгеновской дифракции, отличный от вышеуказанных пиков.
Ионный проводник согласно настоящему изобретению может содержать компонент, отличный от лития (Li), углерода (С), бора (B) и водорода (H). В качестве других компонентов включают, например, кислород (O), азот (N), серу (S), фтор (F), хлор (Cl), бром (Br), йод (I), кремний (Si), германий (Ge), фосфор (P), щелочные металлы, щелочноземельные металлы и т.д.
[0017]
Описанный выше ионный проводник является мягким, и из него можно формовать слой электрода и слой твердого электролита методом холодного прессования. Полученный таким образом электродный слой и слой твердого электролита обладает повышенной прочностью по сравнению со случаем использования большого количества сульфидного твердого электролита и оксидного твердого электролита. Таким образом, с применением ионного проводника согласно настоящему изобретению может быть получен электродный слой и слой твердого электролита, обладающий высокими свойствами формуемости и с трудом поддающийся разрушению (образованию трещин). Кроме того, поскольку ионный проводник согласно настоящему изобретению имеет низкую плотность, то может быть получен относительно легковесный электродный слой и слой твердого электролита. Это является предпочтительным, поскольку может быть снижена общая масса аккумулятора. Кроме того, если ионный проводник согласно настоящему изобретению использован для слоя твердого электролита, то может быть снижено сопротивление на границе раздела между слоем твердого электролита и слоем электрода.
Кроме того, описанный выше ионный проводник не разрушается даже при приведении в контакт с водой или кислородом и не образует вредные, токсичные газы.
[0018]
Ионная проводимость ионного проводника согласно настоящему изобретению при 25°С предпочтительно составляет от 1,0 до 10 мСм.см-1, и более предпочтительно от 2,0 до 10 мСм⋅см-1.
[0019]
2. Способ получения ионного проводника
В соответствии с другим вариантом реализации настоящего изобретения, предложен способ получения ионного проводника, содержащего LiCB9H10 и LiCB11H12, включающий стадию смешивания LiCB9H10 и LiCB11H12 в молярном соотношении LiCB9H10/LiCB11H12 = от 1,1 до 20.
[0020]
В качестве исходных материалов LiCB9H10 и LiCB11H12 можно использовать продукты, доступные в продаже. Их чистота предпочтительно составляет 95% или более, и более предпочтительно 98% или более. При использовании соединения с чистотой в указанном диапазоне весьма вероятно может быть получен требуемый кристалл.
[0021]
Соотношение смешивания LiCB9H10 и LiCB11H12 должно соответствовать молярному соотношению LiCB9H10/LiCB11H12 = 1,1 или более. Предпочтительно, LiCB9H10/LiCB11H12 = от 1,1 до 20, более предпочтительно LiCB9H10/LiCB11H12 = от 1,25 до 10, и особенно предпочтительно LiCB9H10/LiCB11H12 = от 1,5 до 9. Как описано выше, если указанное соотношение находится в данных диапазонах, то достигается особенно высокое значение ионной проводимости.
[0022]
Смешивание LiCB9H10 и LiCB11H12 предпочтительно осуществляют в атмосфере инертного газа. В качестве инертного газа можно использовать гелий, азот, аргон и т.д., но предпочтительным является аргон. Концентрации влаги и кислорода в инертном газе предпочтительно поддерживают на низком уровне и, более предпочтительно, концентрации влаги и кислорода в инертном газе составляют менее 1 м.д.
[0023]
Способ смешивания не имеет специального ограничения, но можно использовать перемешивание и смешивание в растворителе. Также можно использовать механическое смешивание и, например, можно использовать способ с использованием автоматизированной ступки, шаровой мельницы, планетарной шаровой мельницы, бисерной мельницы, вращающегося/переворачивающегося смесителя, смешивающего устройства с высокой скоростью перемешивания, барабанного смесителя и т.д. Из них более предпочтительной является планетарная шаровая мельница, которая имеет превосходную способность к размолу и смешиванию, и особенно предпочтительно смешивание проводят с помощью механического измельчения с применением планетарной шаровой мельницы. Механическое смешивание предпочтительно проводят в сухих условиях, но также можно проводить в присутствии растворителя. Независимо от описанных выше средств, растворитель не имеет специального ограничения, но можно использовать нитрильный растворитель, такой как ацетонитрил, эфирный растворитель, такой как тетрагидрофуран и диэтиловый эфир, N,N-диметилформамид, N,N-диметилацетамид и спиртовые растворители, такие как метанол и этанол.
[0024]
Время смешивания варьируется в зависимости от способа смешивания, но в случае перемешивания и смешивания в растворителе время смешивания составляет, например, от 1 до 48 часов и предпочтительно от 5 до 24 часов. При использовании растворителя время смешивания может быть сокращено. Время смешивания при механическом смешивании, например, в случае использования планетарной шаровой мельницы, составляет от 1 до 24 часов и предпочтительно от 5 до 20 часов.
[0025]
Реакционное давление обычно составляет от 0,1 Па до 2 МПа абсолютного давления. Предпочтительно от 101 кПа до 1 МПа.
[0026]
Ионный проводник, полученный вышеописанным способом получения согласно настоящему изобретению, предпочтительно имеет пики при 749 см-1 (±5 см-1) для LiCB9H10 и при 763 см-1 (±5 см-1) для LiCB11H12, соответственно, при спектроскопии Рамана. Он имеет пики рентгеновской дифракции для высокотемпературной фазы LiCB9H10 при по меньшей мере 2θ = 14,9 ± 0,3 град, 16,4 ± 0,3 град и 17,1 ± 0,5 град при измерении рентгеновской дифракции при 25°C, и соотношение интенсивностей (B/A) при расчете на основании A = (интенсивность рентгеновской дифракции при 16,4 ± 0,3 град) - (интенсивность рентгеновской дифракции при 20 град) и B=(интенсивность рентгеновской дифракции при 17,1 ± 0,5 град) - (интенсивность рентгеновской дифракции при 20 град) предпочтительно в диапазоне от 1 до 20, более предпочтительно от 1,0 до 15, и особенно предпочтительно от 1,0 до 10.
[0027]
3. Полностью твердотельный аккумулятор
Ионный проводник согласно настоящему изобретению можно использовать в качестве твердого электролита для полностью твердотельных аккумуляторов. Следовательно, в соответствии с одним вариантом реализации настоящего изобретения предложен твердый электролит для полностью твердотельных аккумуляторов, содержащий вышеописанный ионный проводник. В соответствии с дополнительным вариантом реализации настоящего изобретения, предложен полностью твердотельный аккумулятор, содержащий вышеописанный твердый электролит для полностью твердотельных аккумуляторов.
[0028]
В данном контексте полностью твердотельный аккумулятор относится к полностью твердотельному аккумулятору, в котором роль электрического проводника играют ионы лития, и, в частности, относится к полностью твердотельному перезаряжаемому литиево-ионному аккумулятору. Полностью твердотельный аккумулятор имеет структуру, в которой слой твердого электролита расположен между слоем положительного электрода и слоем отрицательного электрода. Ионный проводник согласно настоящему изобретению может содержаться в качестве твердого электролита в любом слое или в любых нескольких слоях положительного электрода, отрицательного электрода и твердого электролита. При использовании для электродного слоя, его более предпочтительно используют для слоя положительного электрода, чем для слоя отрицательного электрода. Это обусловлено тем, что слой положительного электрода вызывает меньше побочных реакций. Если ионный проводник согласно настоящему изобретению содержится в слое положительного электрода или в слое отрицательного электрода, то ионный проводник используют в комбинации с общеизвестным активным материалом положительного электрода или активным материалом отрицательного электрода для литиево-ионных перезаряжаемых аккумуляторов. В качестве слоя положительного электрода предпочтительно используют слой электрода объемного типа, содержащий активный материал и твердый электролит в форме смеси, поскольку он обеспечивает более высокую емкость на единичный элемент.
[0029]
Полностью твердотельный аккумулятор получают формованием и выкладкой каждого из слоев, описанных выше, но способ формования и выкладки слоев не имеет специального ограничения. Например, включен способ, в котором твердый электролит и/или активный материал электрода диспергируют в растворителе с получением суспензии, которую наносят с помощью ножевого устройства, методом центрифугирования и т.д., и раскатывают нанесенную суспензию с получением пленки; газофазный способ, в котором формование пленки и выкладку слоев осуществляют методом вакуумного осаждения из паровой фазы, методом ионного осаждения, методом напыления, методом лазерного выжигания и т.д.; и способ прессования, в котором порошок уплотняют горячим прессованием или холодным прессованием без нагревания и осуществляют выкладку слоя уплотненного продукта. Ионный проводник согласно настоящему изобретению является относительно мягким и, следовательно, его особенно предпочтительно формуют прессованием и выкладкой слоев с получением аккумулятора. Кроме того, твердый электролит может быть внедрен в слой электрода посредством предварительного формования слоя электрода, содержащего активный материал, вспомогательное проводящее вещество и связующее вещество, в который вливают раствор, содержащий твердый электролит, растворенный в растворителе, или суспензию, содержащую твердый электролит, диспергированный в растворителе, и затем удаляют растворитель.
[0030]
Атмосфера для получения полностью твердотельного аккумулятора предпочтительно представляет собой атмосферу инертного газа, имеющего контролируемое содержание влаги, или атмосферу сухого помещения. Содержание влаги поддерживают в пределах диапазона температуры точки росы от -10°С до -100°С, более предпочтительно в пределах диапазона температуры точки росы от -20°С до -80°С, и особенно предпочтительно в пределах диапазона температуры точки росы от -30°С до -75°С. Это обусловлено тем, что снижение ионной проводимости вследствие образования гидрата исключено вследствие чрезвычайно низкой скорости гидролиза ионного проводника согласно настоящему изобретению.
ПРИМЕРЫ
[0031]
Далее настоящее изобретение более подробно описано с помощью примеров, но содержание настоящего изобретения не ограничено ими.
[0032]
<Получение ионного проводника>
(Пример 1)
В перчаточном боксе в атмосфере аргона взвешивали LiCB9H10 (производства компании Katchem Ltd.) и LiCB11H12 (производства компании Katchem Ltd.) в количестве 100 мг, так чтобы было получено молярное соотношение LiCB9H10:LiCB11H12 = 9:1, и предварительно смешивали в агатовой ступке. Затем предварительно смешанный сырьевой материал помещали в тигель из SUJ-2 объемом 45 мл и, помимо этого, добавляли шарики из SUJ-2 (ϕ 7 мм, 20 шариков), и тщательно закрывали тигель. Тигель устанавливали в планетарную шаровую мельницу (P7 производства компании FRITSCH GmbH) и осуществляли механическое измельчение при скорости вращения 400 об./мин. в течение 20 часов с получением ионного проводника. По данным рентгеновской дифракции, полученный ионный проводник содержал высокотемпературную фазу LiCB9H10.
[0033]
(Пример 2)
Ионный проводник получали таким же образом, как пример 1, за исключением того, что отношение смешивания LiCB9H10 к LiCB11H12 изменяли на молярное соотношение LiCB9H10:LiCB11H12 = 8:2.
[0034]
(Пример 3)
Ионный проводник получали таким же образом, как пример 1, за исключением того, что отношение смешивания LiCB9H10 к LiCB11H12 изменяли на молярное соотношение LiCB9H10:LiCB11H12 = 7:3.
[0035]
(Пример 4)
Ионный проводник получали таким же образом, как пример 1, за исключением того, что отношение смешивания LiCB9H10 к LiCB11H12 изменяли на молярное соотношение LiCB9H10:LiCB11H12 = 6:4.
[0036]
(Сравнительный пример 1)
Ионный проводник получали таким же образом, как пример 1, за исключением того, что отношение смешивания LiCB9H10 к LiCB11H12 изменяли на молярное соотношение LiCB9H10:LiCB11H12 = 5:5. По результатам рентгеновской дифракции, полученный ионный проводник представлял собой смешанную фазу LiCB9H10 и LiCB11H12.
[0037]
<Измерение рентгеновской дифракции>
Для порошка каждого из ионных проводников, полученных в примерах 1 - 4 и в сравнительном примере 1, проводили измерение рентгеновской дифракции (X'pert Pro производства компании Malvern PANalytical Ltd, CuKα: λ = 1,5405Å), используя капилляр из линдемановского стекла (внешний диаметр 0,5 мм, толщина 0,01 мм) в атмосфере аргона при комнатной температуре (25°C). Полученные пики рентгеновской дифракции представлены на фиг. 1A и 1B. Для сравнения на фиг. 1A представлены также пики рентгеновской дифракции сырьевых материалов LiCB9H10 и LiCB11H12.
На фиг. 1 - 4 показаны пики рентгеновской дифракции, наблюдаемые при по меньшей мере 2θ = 14,9 ± 0,3 град, 16,4 ± 0,3 град и 17,1 ± 0,5 град. Интенсивности в положениях пиков при 16,44 град и 17,07 град, которые представляют собой положения пиков высокотемпературной фазы LiCB9H10, обозначали как A и B, соответственно, и соотношение интенсивностей (B/A) обобщено в таблице 1. Каждую интенсивность рассчитывали на основании A = (интенсивность рентгеновской дифракции при 16,44 град) - (интенсивность рентгеновской дифракции при 20 град) и B = (интенсивность рентгеновской дифракции при 17,07 град) - (интенсивность рентгеновской дифракции при 20 град), принимая значение при 2θ = 20 град за точку отсчета.
В каждом из примеров 1 – 4, исходя из того факта, что положения пиков совпадают с положениями пиков высокотемпературной фазы LiCB9H10, можно видеть, что получен твердый раствор, но, с другой стороны, в сравнительном примере 1 можно видеть, что получена смешанная фаза из низкотемпературной фазы LiCB9H10 и LiCB11H12 и что сравнительный пример 1 выходит за пределы области твердого раствора.
[0038]
[Таблица 1]
[0039]
<Рамановская спектроскопия>
(1) Получение образца
Образец для измерений получали с использованием герметично закрывающегося контейнера, имеющего в верхней части кварцевое стекло (φ 60 мм, толщина 1 мм) в качестве оптического окна. Образец выдерживали в перчаточном боксе в атмосфере аргона в контакте с кварцевым стеклом, затем закрывали контейнер и вынимали из перчаточного бокса, и проводили рамановскую спектроскопию.
(2) Условия измерения
Измерения проводили с помощью лазерного рамановского спектрометра NRS-5100 (производства компании JASCO Corporation) при длине волны возбуждения 532,15 нм и времени экспозиции 5 секунд. Полученные спектры Рамана представлены на фиг. 2.
LiCB9H10 имеет пик при 749 см-1, а LiCB11H12 имеет пик при 763 см-1. Величина смещения частоты вследствие рамановского рассеяния обусловлена связыванием и практически не зависит от состояния кристалла. В примерах 1 - 2 пик при 763 см-1 является плечевым пиком для 749 см-1, а в примерах 3 – 4 и в сравнительном примере 1 пик при 749 см-1 является плечевым пиком для 763 см-1, но в любом случае можно видеть, что существуют оба LiCB9H10 и LiCB11H12.
[0040]
<Измерение ионной проводимости>
В перчаточном боксе в атмосфере аргона осуществляли одноосное формование (240 МПа) ионного проводника, полученного в примерах 1 - 4 и в сравнительном примере 1, и сырьевых материалов LiCB9H10 и LiCB11H12, с получением диска, имеющего толщину примерно 1 мм и φ 8 мм. Температуру повышали и понижали в пределах температурного диапазона от комнатной температуры до 150°С или 80°С с интервалом 10°С, и проводили измерение импеданса по переменному току (HIOKI 3532-80, химический импедометр) двухполюсным методом с использованием литиевого электрода для расчета ионной проводимости. Частотный диапазон, использованный для измерения, составлял от 4 Гц до 1 МГц, а амплитуда составляла 100 мВ.
[0041]
Результат измерения соответствующей ионной проводимости представлен на фиг. 3. Ионная проводимость при комнатной температуре (25°С) представлена в таблице 2. Во всех примерах 1 - 4 и в сравнительном примере 1 не наблюдали явление быстрого снижения ионной проводимости при низкой температуре, которое наблюдали для исходных материалов LiCB9H10 и LiCB11H12. Однако наблюдали существенное различие ионной проводимости между сравнительным примером 1 и примерами 1 - 4, и можно видеть, что даже в примере 4, имеющем наименьшую ионную проводимость среди примеров 1 - 4, ионная проводимость при комнатной температуре улучшена в два раза по сравнению со сравнительным примером 1.
[0042]
[Таблица 2]
[0043]
(Пример 5)
<Испытание растворения/осаждения с использованием симметричного литиевого элемента>
Порошок ионного проводника, полученного в примере 3, помещали в таблетировочную машину диаметром 8 мм и прессовали под давлением в форму диска при давлении 143 МПа с получением гранулы в форме диска, содержащей слой твердого электролита (300 мкм). По обе стороны полученной гранулы выкладывали фольгу из металлического лития (производства компании Honjo Metal Co., Ltd.), имеющую толщину 200 мкм и φ 8 мм, и помещали гранулу в смыкающуюся испытательную ячейку из SUS 304 для полностью твердотельного аккумулятора (производства компании Hosen Corp.) и плотно закрывали ячейку, и использовали в качестве оценочного элемента. Все вышеуказанные действия проводили в перчаточном боксе в атмосфере аргона. Напряжение, приложенное между электродами полученного оценочного элемента, измеряли посредством повторения цикла (каждый цикл продолжительностью 1 час) подачи тока при инверсии полярности каждые 0,5 часа при температуре измерения 25°С и плотности тока 0,2 мА/см-2, используя потенциостат/гальваностат (VMP3 производства компании Bio-Logic Science Instruments Ltd). Результаты представлены на фиг. 4. Перенапряжение составляло лишь 0,01 В и было ровным, и не наблюдали не соответствующее норме напряжение. Увеличение перенапряжения через 100 циклов было лишь незначительным, и, следовательно, было показано, что многократное растворение/осаждение Li протекает успешно.
[0044]
(Пример 6)
<Испытание зарядки/разрядки>
(Получение активного материала положительного электрода)
Серу (S) (производства компании Sigma-Aldrich Co. LLC., чистота 99,98%), сажу Ketjen (EC600JD производства компании LION SPECIALTY CHEMICALS CO., LTD.) и Maxsorb(R) (MSC30 производства компании Kansai Coke and Chemicals Company, Limited) помещали в тигель из SUJ-2 объемом 45 мл, так чтобы было достигнуто массовое отношение S : сажа Ketjen : Maxsorb(R) = 50:25:25. Помимо этого, добавляли шарики из SUJ-2 (ϕ 7 мм, 20 шариков) и тщательно закрывали тигель. Тигель устанавливали в планетарную шаровую мельницу (P7 производства компании FRITSCH GmbH) и осуществляли механическое измельчение при скорости вращения 400 об./мин. в течение 20 часов с получением S-углеродного композиционного активного материала положительного электрода.
(Получение порошка для слоя положительного электрода)
Порошки взвешивали в перчаточном боксе так, чтобы было получено соотношение S-углеродный композиционный активный материал положительного электрода, полученный выше : ионный проводник, полученный в примере 3 = 1:1 (массовое соотношение), и смешивали в ступке с получением порошка для слоя положительного электрода.
[0045]
(Получение полностью твердотельного аккумулятора)
Порошок ионного проводника, полученного в примере 3, помещали в таблетировочную машину диаметром 10 мм и прессовали под давлением в форму диска при давлении 143 МПа (получение слоя твердого электролита). Порошок для слоя положительного электрода, полученный выше, помещали в таблетировочную машину, не удаляя сформованный продукт, и формовали как одно целое при давлении 285 МПа. Таким образом, получали гранулу в форме диска, содержащую слой положительного электрода (75 мкм) и слой твердого электролита (300 мкм). На одну сторону полученной гранулы, расположенную напротив слоя положительного электрода, выкладывали фольгу из металлического лития (производства компании Honjo Metal Co., Ltd.), имеющую толщину 200 мкм и φ 8 мм, для использования в качестве литиевого слоя отрицательного электрода, и помещали гранулу в смыкающуюся испытательную ячейку из SUS 304 (производства компании Hosen Corp.) для полностью твердотельного аккумулятора, и плотно закрывали ячейку, и использовали в качестве полностью твердотельного перезаряжаемого аккумулятора.
[0046]
(Испытание зарядки/разрядки)
Испытание зарядки/разрядки начинали с зарядки полностью твердотельного перезаряжаемого аккумулятора, полученного так, как описано выше, при температуре измерения 25°С, предельном напряжении заряда 1,0 - 2,5 В и постоянном токе заряда 0,1C, используя потенциостат/гальваностат (VMP3 производства компании Bio-Logic Science Instruments Ltd). Разрядная емкость показана как значение разрядной емкости, полученное для экспериментального аккумулятора, на грамм серосодержащего активного материала электрода. Коэффициент использования тока рассчитывали по уравнению: коэффициент использования тока = зарядная емкость/разрядная емкость. Результаты представлены на фиг. 5.
Несмотря на то, что во время первого разряда наблюдали высокую необратимую емкость, во второй и следующие разы наблюдали коэффициент использования тока 98% или более. Касательно характеристик цикла, несмотря на то, что разрядная емкость в первый раз составила 1900 мАч/г, она существенно снизилась до 1300 мАч/г во втором цикле, но стабилизировалась в третьем и последующих циклах, и на 20-й раз разрядная емкость составляла 1100 мАч/г и, следовательно, удалось достичь высокого значения доставленной емкости.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИОННЫЙ ПРОВОДНИК, СОДЕРЖАЩИЙ ВЫСОКОТЕМПЕРАТУРНУЮ ФАЗУ LICBH, И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2021 |
|
RU2814874C1 |
| ИОННЫЙ ПРОВОДНИК, СОДЕРЖАЩИЙ LiBH И LiBH, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ТВЕРДЫЙ ЭЛЕКТРОЛИТ ДЛЯ ПОЛНОСТЬЮ ТВЕРДОТЕЛЬНЫХ АККУМУЛЯТОРОВ, СОДЕРЖАЩИЙ УКАЗАННЫЙ ИОННЫЙ ПРОВОДНИК | 2019 |
|
RU2772865C2 |
| СПОСОБ ПОЛУЧЕНИЯ ИОННОГО ПРОВОДНИКА | 2017 |
|
RU2714498C1 |
| ИОННЫЙ ПРОВОДНИК И СПОСОБ ЕГО ИЗГОТОВЛЕНИЯ | 2015 |
|
RU2690293C2 |
| СПОСОБ ПОЛУЧЕНИЯ ТВЕРДОГО ЭЛЕКТРОЛИТА, СОДЕРЖАЩЕГО LiPS | 2018 |
|
RU2751545C2 |
| СПОСОБ ПОЛУЧЕНИЯ ТВЕРДОГО ЭЛЕКТРОЛИТА НА ОСНОВЕ LGPS | 2018 |
|
RU2754868C2 |
| ТВЕРДЫЙ ЭЛЕКТРОЛИТ НА ОСНОВЕ LGPS И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2019 |
|
RU2787019C2 |
| СПОСОБ ПОЛУЧЕНИЯ ТВЕРДОГО ЭЛЕКТРОЛИТА НА ОСНОВЕ LGPS | 2018 |
|
RU2766576C2 |
| СПОСОБ ПОЛУЧЕНИЯ СУЛЬФИДНОГО ТВЕРДОГО ЭЛЕКТРОЛИТА, СОДЕРЖАЩЕГО Sn | 2021 |
|
RU2822115C1 |
| ТВЕРДОТЕЛЬНАЯ БАТАРЕЯ | 2014 |
|
RU2665046C2 |
Группа изобретений относится к ионному проводнику, содержащему высокотемпературную фазу LiCB9H10, и к способу его получения, а также к твердому электролиту для полностью твердотельных аккумуляторов, содержащему указанный ионный проводник. Способ получения ионного проводника, содержащего LiCB9H10 и LiCB11H12, включает стадию смешивания LiCB9H10 и LiCB11H12 в молярном соотношении LiCB9H10/LiCB11H12 = 1,25 до 10. Ионный проводник, содержащий литий (Li), углерод (C), бор (B) и водород (H), имеет пики рентгеновской дифракции при по меньшей мере 2θ=14,9±0,3 град, 16,4±0,3 град и 17,1±0,5 град при измерении рентгеновской дифракции при 25°C и имеет соотношение интенсивностей (B/A) от 1,0 до 20 при расчете на основании A=(интенсивность рентгеновской дифракции при 16,4±0,3 град) - (интенсивность рентгеновской дифракции при 20 град) и B=(интенсивность рентгеновской дифракции при 17,1±0,5 град) - (интенсивность рентгеновской дифракции при 20 град). Техническим результатом является улучшение ионной проводимости. 5 н. и 5 з.п. ф-лы, 9 ил., 6 пр., 2 табл.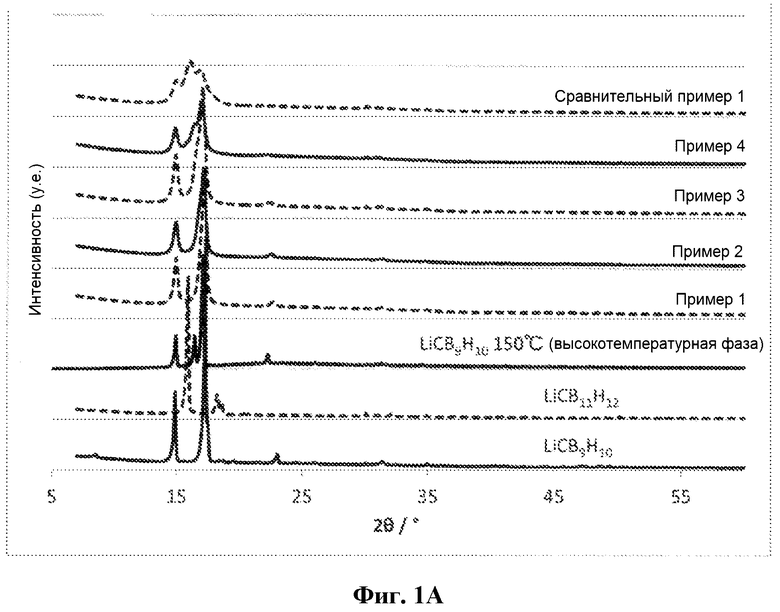
1. Способ получения твердого ионного проводника, содержащего LiCB9H10 и LiCB11H12, включающий:
стадию смешивания LiCB9H10 и LiCB11H12 в молярном соотношении LiCB9H10/LiCB11H12 = от 1,25 до 10.
2. Способ получения твердого ионного проводника по п. 1, отличающийся тем, что смешивание проводят с помощью механического измельчения.
3. Способ получения твердого ионного проводника по п. 2, отличающийся тем, что продолжительность проведения механического измельчения составляет от 1 до 48 часов.
4. Способ получения твердого ионного проводника по любому из пп. 1-3, отличающийся тем, что полученный твердый ионный проводник имеет пики рентгеновской дифракции при по меньшей мере 2θ=14,9±0,3 град, 16,4±0,3 град и 17,1±0,5 град при измерении рентгеновской дифракции при 25°С и имеет отношение интенсивностей (B/A) от 1,0 до 20 при расчете на основании A = (интенсивность рентгеновской дифракции при 16,4±0,3 град) - (интенсивность рентгеновской дифракции при 20 град) и B = (интенсивность рентгеновской дифракции при 17,1±0,5 град) - (интенсивность рентгеновской дифракции при 20 град),
где интенсивность рентгеновской дифракции определяют с помощью измерения рентгеновской дифракции 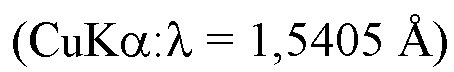 , используя капилляр из линдемановского стекла (внешний диаметр 0,5 мм, толщина 0,01 мм) в атмосфере аргона при комнатной температуре (25°C).
, используя капилляр из линдемановского стекла (внешний диаметр 0,5 мм, толщина 0,01 мм) в атмосфере аргона при комнатной температуре (25°C).
5. Твердый ионный проводник, содержащий литий (Li), углерод (C), бор (B) и водород (H),
где указанный твердый ионный проводник содержит LiCB9H10 и LiCB11H12 в молярном соотношении LiCB9H10/LiCB11H12 = от 1,25 до 10,
где указанный твердый ионный проводник имеет пики рентгеновской дифракции при по меньшей мере 2θ=14,9±0,3 град, 16,4±0,3 град и 17,1±0,5 град при измерении рентгеновской дифракции при 25°С и имеет отношение интенсивностей (B/A) от 1,0 до 20 при расчете на основании A = (интенсивность рентгеновской дифракции при 16,4±0,3 град) - (интенсивность рентгеновской дифракции при 20 град) и B = (интенсивность рентгеновской дифракции при 17,1±0,5 град) - (интенсивность рентгеновской дифракции при 20 град),
где интенсивность рентгеновской дифракции определяют с помощью измерения рентгеновской дифракции 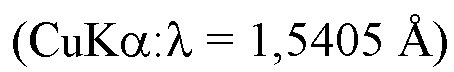 , используя капилляр из линдемановского стекла (внешний диаметр 0,5 мм, толщина 0,01 мм) в атмосфере аргона при комнатной температуре (25°C).
, используя капилляр из линдемановского стекла (внешний диаметр 0,5 мм, толщина 0,01 мм) в атмосфере аргона при комнатной температуре (25°C).
6. Твердый ионный проводник по п. 5, имеющий пики при 749±5 см-1 и 763±5 см-1, соответственно, при спектроскопии Рамана.
7. Твердый ионный проводник по п. 5 или 6, имеющий ионную проводимость от 1,0 до 10 мСм⋅см-1 при 25°C.
8. Твердый электролит для полностью твердотельного аккумулятора, содержащий твердый ионный проводник по любому из пп. 5-7.
9. Электрод, содержащий твердый электролит по п. 8 и металлический литий, где твердый электролит находится в контакте с металлическим литием.
10. Полностью твердотельный аккумулятор, содержащий электрод по п. 9.
| US 2016372786 A1, 22.12.2016 | |||
| "Supporting Information for Stabilizing Superionic-Conducting Structures via Mixed-Anion Solid Solutions of Monocarba-closo-borate Salts", Wan Si Tang, Koji Yoshida, Alexei V | |||
| Soloninin, Roman Skoryunov, Terrence J | |||
| Udovic, September 2016 | |||
| US 10038192 B2, 31.07.2018 | |||
| WO 2017126416 A1, 27.07.2017 | |||
| ТВЕРДОТЕЛЬНЫЙ ВТОРИЧНЫЙ ИСТОЧНИК ТОКА | 2005 |
|
RU2295178C2 |
Авторы
Даты
2023-05-12—Публикация
2019-08-16—Подача