Область техники, к которой относится изобретение
Изобретение относится к области фармацевтической промышленности, и может быть использовано в качестве терапевтического средства для лечения заболеваний, связанных с нарушенной экспрессией катепсина S и/или белками семейства BCL-2.
Уровень техники
Три аспекта отличают опухоли человека различных типов и этиологии от нормальных клеток: способность к более быстрой пролиферации, уклонение от подавления клеточного роста и повышенная чувствительность к цитотоксической терапии [Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell. 2011 Mar 4; 144(5): 646-74. doi: 10.1016/j.cell.2011.02.013. PMID: 21376230]. Кроме того, два очень важных процесса дают опухолевым клеткам преимущество в выживании. Во-первых, клетки проявляют химиотерапевтическую устойчивость к запрограммированному процессу гибели клеток, называемому апоптозом, и, во-вторых, такие клетки развивают уникальное свойство повышенной подвижности, что способствует их распространению во время метастазирования [Norouzi S, Gorgi Valokala М, Mosaffa F, Zirak MR, Zamani P, Behravan J. Crosstalk in cancer resistance and metastasis. Crit Rev Oncol Hematol. 2018 Dec; 132:145-153. doi: 10.1016/j.critrevonc.2018.09.017. Epub 2018 Oct 4. PMID: 30447920; Steeg PS. Targeting metastasis. Nat Rev Cancer. 2016 Apr; 16(4):201-18. doi: 10.1038/nrc.2016.25. PMID: 27009393; PMCID: РМС7055530]. Центральное место в быстрой пролиферации раковых клеток занимает убиквитин-зависимый протеасомный путь и его потребность в таких ключевых клеточных процессах, как регуляция клеточного цикла, клеточная дифференцировка и апоптоз. Так, влияние на протеасомы с целью ингибирования быстрой пролиферации раковых клеток ранее уже рассматривалось в качестве терапевтической стратегии. Важное значение здесь имеет эффект блокирования протеасомной деградации убиквитинированных проапоптотических белков и, по-видимому, усиления апоптоза раковых клеток, предположительно за счет их накопления, как это видно на примере проапоптотического белка ВАХ [Li В, Dou QP. Box degradation by the ubiquitin/proteasome-dependent pathway: involvement in tumor survival and progression. Proc Natl Acad Sci USA. 2000 Apr 11; 97(8):3850-5. doi: 10.1073/pnas.070047997. PMID: 10725400; PMCID: РМС18105]. Несмотря на то, что точные механизмы протеолитического распада убиквитинированного белка ВАХ недостаточно исследованы, они могут представлять альтернативную стратегию терапевтического действия при раке.
Одной из групп внутриклеточных протеиназ, которые отвечают за регулирование гибели и метастазирования опухолевых клеток, являются лизосомальные цистеиновые катепсины, которые относятся к суперсемейству папаин-подобных протеиназ [Turk V, St oka V, Vasiljeva О, Renko M, Sun T, Turk В, Turk D. Cysteine cathepsins: from structure, function and regulation to new frontiers. Biochim Biophys Acta. 2012 Jan; 1824(1):68-88. doi: 10.1016/j.bbapap.2011.10.002. Epub 2011 Oct 12. PMID: 22024571; PMCID: PMC7105208; Soond SM, Kozhevnikova MV, Townsend PA, Zamyatnin AA Jr. Cysteine Cathepsin Protease Inhibition: An update on its Diagnostic, Prognostic and Therapeutic Potential in Cancer. Pharmaceuticals (Basel). 2019 Jun 11; 12(2):87. doi: 10.3390/ph12020087. PMID: 31212661; PMCID: PMC6630828; Soond SM, Kozhevnikova MV, Zamyatnin AA Jr. 'Patchiness' and basic cancer research: unravelling the proteases. Cell Cycle. 2019 Aug; 18(15): 1687-1701. doi: 10.1080/15384101.2019.1632639. Epub 2019 Jun 24. PMID: 31213124; PMCID: РМС6649598]. Хотя они обычно экспрессируются и находятся в лизосомах, в начале заболевания или из-за ряда сигналов, связанных с началом заболевания, некоторые из этих катепсинов секретируются во внеклеточный матрикс (extracellular matrix, ЕСМ) [Rozhin J, Sameni M, Ziegler G, Sloane BF. Pericellular pH affects distribution and secretion of cathepsin В in malignant cells. Cancer Res. 1994 Dec 15; 54(24):6517-25. PMID: 7987851; Kramer L, Turk D, Turk B. The Future of Cysteine Cathepsins in Disease Management. Trends Pharmacol Sci. 2017 Oct; 38(10):873-898. doi: 10.1016/j.tips.2017.06.003. Epub 2017 Jun 28. PMID: 28668224; Reiser J, Adair B, Reinheckel T. Specialized roles for cysteine cathepsins in health and disease. J Clin Invest. 2010 Oct; 120(10):3421-31. doi: 10.1172/JCI42918. Epub 2010 Oct 1. PMID: 20921628; PMCID: PMC2947230], где они могут беспрепятственно расщеплять компоненты ЕСМ и, таким образом, способствовать росту опухолевых клеток и их распространению. Одной из таких протеиназ является катепсин S, который может быть подходящим кандидатом для таргетной терапии [Soond SM, Kozhevnikova MV, Townsend PA, Zamyatnin AA Jr. Cysteine Cathepsin Protease Inhibition: An update on its Diagnostic, Prognostic and Therapeutic Potential in Cancer. Pharmaceuticals (Basel). 2019 Jun 11; 12(2):87. doi: 10.3390/ph12020087. PMID: 31212661; PMCID: PMC6630828; Rudzinska M, ParodiA, Soond SM, Vinarov AZ, Korolev DO, Morozov AO, Daglioglu C, Tutar Y, Zamyatnin AA Jr. The Role of Cysteine Cathepsins in Cancer Progression and Drug Resistance. Int J Mol Sci. 2019 Jul 23; 20(14):3602. doi: 10.3390/ijms20143602. PMID: 31340550; PMCID: РМС6678516]. Хотя экспрессия катепсина S в тканях относительно ограничена, было отмечено, что он экспрессируется под действием ряда физиологических условий, связанных с гипоксией в месте опухоли или в условиях химиотерапевтического воздействия. Следовательно, он может проявлять свою активность в качестве индуцибельного фактора, который, в частности, способствует развитию опухоли и, возможно, устойчивости к химиотерапии (Soond, S.M.; Savvateeva, L.V.; Makarov, V.A.; Gorokhovets, N.V.; Townsend, P.A.; Zamyatnin, A.A., Jr. Cathepsin S Cleaves BAX as a Novel and Therapeutically Important Regulatory Mechanism for Apoptosis. Pharmaceutics 2021, 13, 339). Кроме того, было обнаружено, что экспрессия катепсина S вносит вклад в развитие сердечно-сосудистых заболеваний атеросклеротического генеза [Wu Н, Du Q, Dai Q, Ge J, Cheng X. Cysteine Protease Cathepsins in Atherosclerotic Cardiovascular Diseases. J Atheroscler Thromb. 2018 Feb 1; 25(2):111-123. doi: 10.5551/jat.RV17016. Epub 2017 Oct 5. PMID: 28978867; PMCID: РМС5827079], а также участвует в деградации белков во время опосредованной МНС-II презентации опухолевого антигена и дифференцировки опухолевых макрофагов М1-М2 [Yang M, Liu J, Shao J, Qin Y, Ji Q, Zhang X, Du J. Cathepsin S-mediated autophagic flux in tumor-associated macrophages accelerate tumor development by promoting M2 polarization. Mol Cancer. 2014 Mar 2; 13:43. doi: 10.1186/1476-4598-13-43. PMID: 24580730; PMCID: PMC4015740], что только подчеркивает разнообразную активность катепсина S при различных нормальных и патологических состояниях [Honey K, Rudensky AY. Lysosomal cysteine proteases regulate antigen presentation. Nat Rev Immunol. 2003 Jun; 3(6):472-82. doi: 10.1038/nri1110. PMID: 12776207].
Из уровня техники известны цитотоксические средства, в частности, Таксол и его терапевтические аналоги [Wang LG, Liu ХМ, Kreis W, Budman DR. The effect of antimicrotubule agents on signal transduction pathways of apoptosis: a review. Cancer Chemother Pharmacol. 1999; 44(5):355-61. doi: 10.1007/s002800050989. PMID: 10501907; Weaver BA. How Taxol/paclitaxel kills cancer cells. Mol Biol Cell. 2014 Sep 15; 25(18):2677-81. doi: 10.1091/mbc.E14-04-0916. PMID: 25213191; PMCID: PMC4161504; Martins I, Raza SQ, Voisin L, Dakhli H, Allouch A, Law F, Sabino D, De Jong D, Thoreau M, Mintet E, Dugue D, Piacentini M, Gougeon ML, Jaulin F, Bertrand P, Brenner C, Ojcius DM, Kroemer G, Modjtahedi N, Deutsch E, Perfettini JL. Anticancer chemotherapy and radiotherapy trigger both non-cell-autonomous and cell-autonomous death. Cell Death Dis. 2018 Jun 18; 9(7):716. doi: 10.1038/s41419-018-0747-y. PMID: 29915308; PMCID: PMC6006149], которые действуют путем ингибирования деполимеризации тубулина и таким образом вызывают остановку цикла ряда быстро пролиферирующих раковых клеток и последующую гибель клеток путем апоптоза. Однако некоторые клетки могут проявлять устойчивость к вызывающим гибель свойствам таких соединений, и эта устойчивость обычно связана с поздними стадиями рака, которые обладают повышенной способностью к метастазированию опухоли [Einzig AI, Gorowski Е, Sasloff J, Wiernik PH. Phase II trial of taxol in patients with metastatic renal cell carcinoma. Cancer Invest. 1991;9(2): 133-6. doi: 10.3109/07357909109044223. PMID: 1677827; Sangrajrang S, Fellous A. Taxol resistance. Chemotherapy. 2000 Sep-Oct; 46(5):327-34. doi: 10.1159/000007306. PMID: 10965098].
Для поиска потенциальных катепсин-специфических антагонистов, которые могут быть особенно перспективными для лечения рака, определяют различные пептидные последовательности, на основе которых возможна разработка терапевтических средств [Rudzinska М, Parodi A, Maslova VD, Efremov YM, Gorokhovets NV, Makarov VA, Popkov VA, Golovin AV, Zernii EY, Zamyatnin AA. Cysteine Cathepsins Inhibition Affects Their Expression and Human Renal Cancer Cell Phenotype. Cancers (Basel). 2020 May 21; 12(5):1310. doi: 10.3390/cancers12051310. PMID: 32455715; PMCID: PMC7281206, Soond SM, Kozhevnikova MV, Townsend PA, Zamyatnin AA Jr. Cysteine Cathepsin Protease Inhibition: An update on its Diagnostic, Prognostic and Therapeutic Potential in Cancer. Pharmaceuticals (Basel). 2019 Jun 11; 12(2):87. doi: 10.3390/ph12020087. PMID: 31212661; PMCID: РМС6630828]. В целом, с учетом последних достижений в определении сайтов расщепления субстрата с использованием скрининга пептидных библиотек, появилась более четкая картина механизмов регуляции ингибиторами специфичности и степени взаимодействия катепсин-субстрат. Так, недавно описаны синтетические пептиды (производные фторметилкетонов или хлорметилкетонов тетрапептидов структуры R1-pept-R2, где РЕРТ - одна из аминокислотных последовательностей: PLVE, VLPE; R1 - одна из защитных групп: ацетильная (Ас), бензилоксикарбонильная (Z) или отсутствует; R2 - производные фторметилкетона (FMK) или хлорметилкетона (CMK)), обладающие высокой аффинностью к каталитической триаде цистеиновых катепсинов и способностью специфически ингибировать протеолитическую активность цистеиновых катепсинов [Rudzinska, М.; Parodi, A.; Maslova, V.D.; Efremov, Y.M.; Gorokhovets, N.V.; Makarov, V.A.; Popkov, V.A.; Golovin, A.V.; Zernii, E.Y.; Zamyatnin, A.A. Cysteine Cathepsins Inhibition Affects Their Expression and Human Renal Cancer Cell Phenotype. Cancers 2020, 12 (5), 1310].
Катепсины играют взаимоисключающую роль в развитии, так катепсин S опосредует дифференцировку ассоциированных с опухолью макрофагов M1-М2, в то время как катепсин С требуется для дифференцировки нейтрофилов, индуцированной опухолью N1-N2 [Yang М, Liu J, Shao J, Qin Y, Ji Q, Zhang X, Du J. Cathepsin S-mediated autophagic flux in tumor-associated macrophages accelerate tumor development by promoting M2 polarization. Mol Cancer. 2014 Mar 2; 13:43. doi: 10.1186/1476-4598-13-43. PMID: 24580730; PMCID: РМС4015740]. Следовательно, нацеливание на конкретные субстраты с целью блокирования их способности воздействовать на катепсины может представлять альтернативный подход.
Наиболее близкими к заявляемому пептиду являются «ВН-3 миметики» [Merino D, Kelly GL, Lessene G, Wei AH, Roberts A W, Strasser A. ВН3-Mimetic Drugs: Blazing the Trail for New Cancer Medicines. Cancer Cell. 2018 Dec 10; 34(6):879-891. doi: 10.1016/j.ccell.2018.11.004. PMID: 30537511; Walensky LD. Targeting BAX to drug death directly. Nat Chem Biol. 2019 Jul; 15(7):657-665. doi: 10.1038/s41589-019-0306-6. Epub 2019 Jun 17. PMID: 31209350], где пептидные терапевтические антагонисты определяются из белковых областей взаимодействия между проапоптотическими и антиапоптотическими ВН3-домен-содержащими белками. Например, терапевтический агент АВТ-199 нарушает ингибирующую активность Вс1-2 с белком ВАХ для лечения лейкоза, тем самым позволяя ВАХ олигомеризоваться и индуцировать проницаемость митохондриальной внешней мембраны (МОМР) и гибель клеток через активацию внутреннего пути апоптоза [Souers AJ, Lever son JD, Boghaert ER, Adder SL, Catron ND, Chen J, Dayton BD, Ding H, Enschede SH, Fairbrother WJ, Huang DC, Hymowitz SG, Jin S, Khaw SL, Kovar PJ, Lam LT, Lee J, Maecker HL, Marsh KC, Mason KD, Mitten MJ, Nimmer PM, Oleksijew A, Park CH, Park CM, Phillips DC, Roberts AW, Sampath D, Seymour JF, Smith ML, Sullivan GM, Tahir SK, Tse C, Wendt MD, Xiao Y, Xue JC, Zhang H, Humerickhouse RA, Rosenberg SH, Elmore SW. ABT-199, a potent and selective BCL-2 inhibitor, achieves antitumor activity while sparing platelets. Nat Med. 2013 Feb; 19(2):202-8. doi: 10.1038/nm.3048. Epub 2013 Jan 6. PMID: 23291630].
Однако ABT-199 как селективный ингибитор BCL-2 является доказанно эффективным только в отношении гематологических злокачественных опухолей, тогда как ингибирование определенных катепсинов, расщепляющих проапоптотические белки, например, ВАХ, могут индуцировать гибель злокачественных клеток различного типа и с наибольшим эффектом.
В последнее время возник большой интерес к идентификации катепсинов, способных расщеплять и дезактивировать проапоптотические ВН3-белки, с целью выявления тех ферментов, на которые можно будет терапевтически воздействовать. Некоторые катепсины могут расщеплять цитоплазматические -ВАХ, -BID, -Bcl-xl и -Mcl-xl [Cao X, Deng X, May WS. Cleavage of Box to p18 Box accelerates stress-induced apoptosis, and a cathepsin-like protease may rapidly degrade p18 Box. Blood. 2003 Oct 1; 102(7):2605-14. doi: 10.1182/blood-2003-01-0211. Epub 2003 Jun 19. PMID: 12816867; Appelqvist H, Johansson AC, Linderoth E, Johansson U, Antonsson B, Steinfeld R, Kagedal K, Ollinger K. Lysosome-mediated apoptosis is associated with cathepsin D-specific processing of bid at Phe24, Trp48, and Phe183. Ann Clin Lab Sci. 2012 Summer; 42(3):231-42. PMID: 22964611; Cirman T, Oresic K, Mazovec GD, Turk V, ReedJC, Myers RM, Salvesen GS, Turk В. Selective disruption oflysosomes in HeLa cells triggers apoptosis mediated by cleavage of Bid by multiple papain-like lysosomal cathepsins. J Biol Chem. 2004 Jan 30; 279(5):3578-87. doi: 10.1074/jbc.M308347200. Epub 2003 Oct 27. PMID: 14581476; Cirman T,  Mazovec GD, Turk V, ReedJC, Myers RM, Salvesen GS, Turk B. Selective disruption oflysosomes in HeLa cells triggers apoptosis mediated by cleavage of Bid by multiple papain-like lysosomal cathepsins. J Biol Chem. 2004 Jan 30; 279(5):3578-87. doi: 10.1074/jbc.M308347200. Epub 2003 Oct 27. PMID: 14581476]. Поэтому необходимо обеспечить стабилизацию проапоптотических ВН3-белков (таких как ВАХ) посредством ингибирования катепсина, позволяя этим ВН3-белкам вызывать апоптоз в отсутствие ингибирующего действия антиапоптотических ВН3-белков (таких как Bcl-xl). Как правило для этого может потребоваться разработка, по крайней мере, двух различных терапевтических средств, где первый агент должен быть нацелен на катепсин (что позволяет стабилизировать ВАХ), второй - на ВАХ (или Bcl-2/Bcl-xl), тем самым нарушая их ингибирующее взаимодействие и позволяя преобладать проапоптотической активности ВАХ. Хотя этот подход действительно имеет хороший потенциал для индивидуального нацеливания белок-связывающих партнеров, недостатки заключаются в том, что такой подход потребует значительного количества времени для определения эффективности отдельных терапевтических средств и того, насколько эффективным может быть каждый из них при совместном действии. Следовательно, необходимо изучить альтернативные стратегии для разработки схемы, в которой может быть осуществлено нацеливание не только на катепсин, но и его производные проапоптотические субстраты (путем отделения его от антиапоптотического регулятора), которые в совокупности являются важными посредниками в гибели раковых клеток через апоптоз.
Mazovec GD, Turk V, ReedJC, Myers RM, Salvesen GS, Turk B. Selective disruption oflysosomes in HeLa cells triggers apoptosis mediated by cleavage of Bid by multiple papain-like lysosomal cathepsins. J Biol Chem. 2004 Jan 30; 279(5):3578-87. doi: 10.1074/jbc.M308347200. Epub 2003 Oct 27. PMID: 14581476]. Поэтому необходимо обеспечить стабилизацию проапоптотических ВН3-белков (таких как ВАХ) посредством ингибирования катепсина, позволяя этим ВН3-белкам вызывать апоптоз в отсутствие ингибирующего действия антиапоптотических ВН3-белков (таких как Bcl-xl). Как правило для этого может потребоваться разработка, по крайней мере, двух различных терапевтических средств, где первый агент должен быть нацелен на катепсин (что позволяет стабилизировать ВАХ), второй - на ВАХ (или Bcl-2/Bcl-xl), тем самым нарушая их ингибирующее взаимодействие и позволяя преобладать проапоптотической активности ВАХ. Хотя этот подход действительно имеет хороший потенциал для индивидуального нацеливания белок-связывающих партнеров, недостатки заключаются в том, что такой подход потребует значительного количества времени для определения эффективности отдельных терапевтических средств и того, насколько эффективным может быть каждый из них при совместном действии. Следовательно, необходимо изучить альтернативные стратегии для разработки схемы, в которой может быть осуществлено нацеливание не только на катепсин, но и его производные проапоптотические субстраты (путем отделения его от антиапоптотического регулятора), которые в совокупности являются важными посредниками в гибели раковых клеток через апоптоз.
Технической проблемой, на решение которой направлено изобретение, является поиск пептидной последовательности, способной индуцировать апоптоз в опухолевой клетке, а также ингибировать функциональную (протеолитическую) активность катепсина S, с перспективой использования в разработке противоопухолевых терапевтических средств.
Раскрытие сущности изобретения
Техническим результатом изобретения является подавление активности катепсина S и индуцирование апоптоза за счет ингибирования взаимодействия ингибиторного белка Bcl-xl (или Bcl-2) с ВАХ, стабилизирования мономерного ВАХ, а также ингибирования катепсин S-опосредованный протеолиз полиубиквитинированного производного ВАХ (р120ВАХ).
Технический результат достигается при применении специфического пептидного соединения, содержащего последовательность FFSFGGAL, выбранную из проапоптотических ВН3-домен-содержащих белков, характеризующегося способностью индуцировать апоптоз в опухолевой клетке.
Изобретение также включает фармацевтическую композицию для индукции апоптоза в опухолевой клетке, содержащую указанное пептидное соединение и фармацевтически приемлемый носитель.
Данное соединение может воздействовать не только на катепсин S, но и на его последующий проапоптотический/антиапоптотический белковый комплекс-мишень, т.е. является единым терапевтическим агентом, обладающим двойной специфичностью. Главное преимущество такого агента состоит в том, что он обладает способностью специфически воздействовать на более чем один белковый промежуточный продукт как часть главного регуляторного белкового комплекса, специфичного для пути передачи сигналов, имеющего ключевое значение для развития и прогрессирования рака.
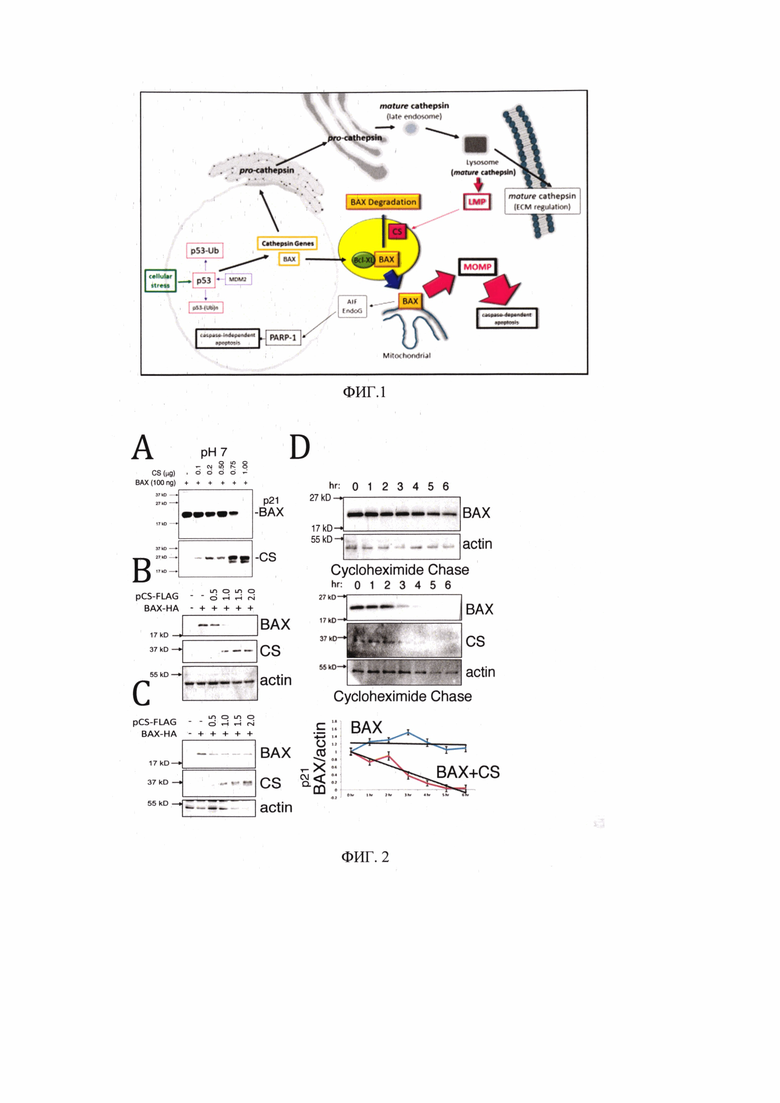
Частный вариант пептида, являющийся производным от Pit2 и имеющий последовательность FFSFGGAL (далее CS-PEP1), а также пептидное производное последовательности ВН3-домен-содержащего белка подходят для любого терапевтического применения, которое включает действие катепсина S (или других катепсинов), проапоптотические белки, содержащие ВН3-домен, или антиапоптотические белки, содержащие ВН3-домен, ответственные за регуляцию апоптоза (Фиг. 1).
Краткое описание чертежей
Изобретение поясняется иллюстрациями, где
на Фиг. 1 представлена схема ингибирующего действия заявляемого пептида (желтый круг). LMP - проницаемость лизосомальной мембраны; МОМР - проницаемость наружной мембраны митохондрий;
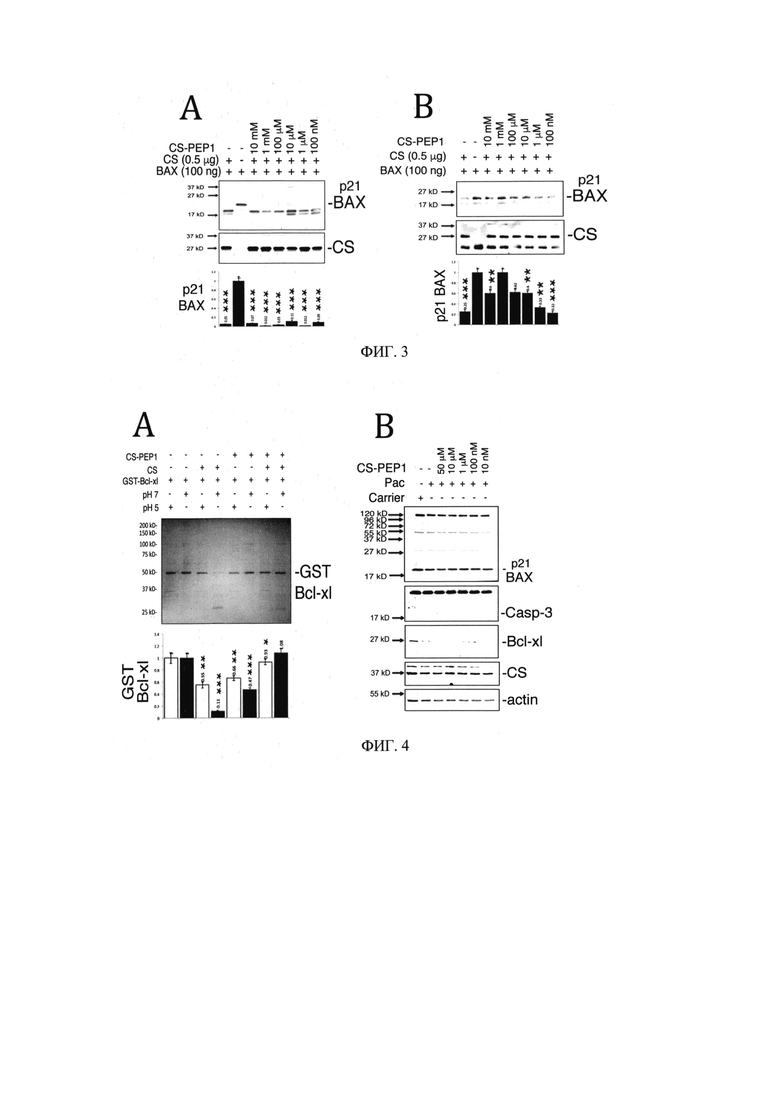
на Фиг. 2 представлены экспериментальные данные, демонстрирующие, что катепсин S опосредует расщепление ВАХ in vitro и в клетках млекопитающих;
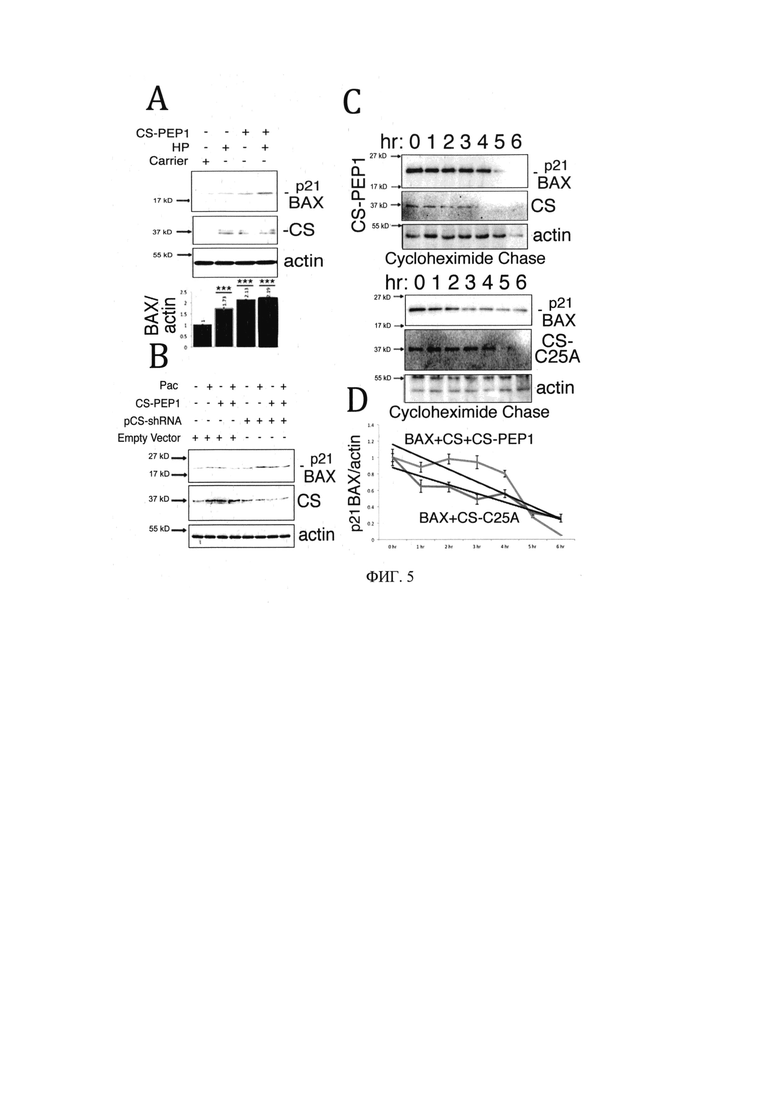
на Фиг. 3 представлены экспериментальные данные, демонстрирующие, что CS-РЕР1 ингибирует опосредованное катепсином S расщепление ВАХ in vitro;
на Фиг. 4 представлены экспериментальные данные, демонстрирующие, что CS-РЕР1 ингибирует расщепление Bcl-xl, но дестабилизирует его in vitro и в клетках млекопитающих;
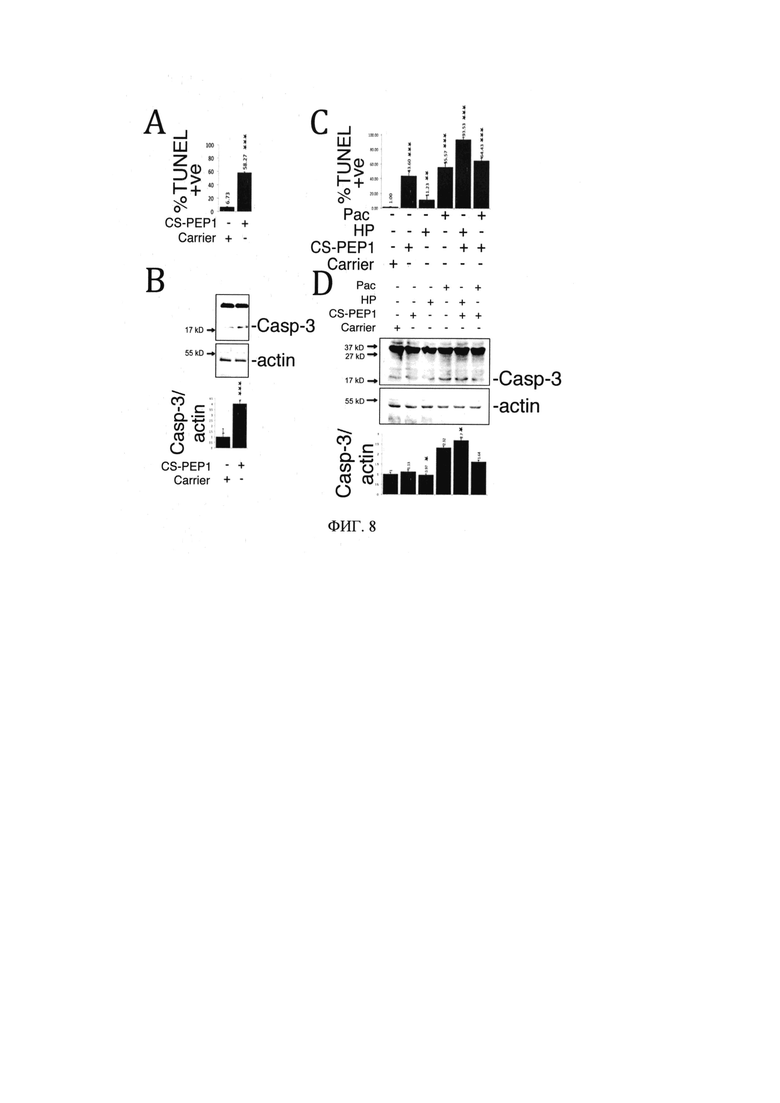
на Фиг. 5 представлены экспериментальные данные, демонстрирующие, что CS-РЕР1 стабилизирует белок ВАХ при экспрессии катепсина S;
на Фиг. 6 представлены экспериментальные данные, демонстрирующие, что CS-РЕР1 стабилизирует уровень эндогенного белка ВАХ в т.ч. в присутствии экспрессии катепсина S;
на Фиг. 7 представлены экспериментальные данные, демонстрирующие, что обработка клеток CS-PEP1 ингибирует опосредованное катепсином S расщепление полиубиквитинированного производного р120ВАХ ВАХ;
на Фиг. 8 представлены экспериментальные данные, демонстрирующие, что CS-РЕР1 вызывает апоптоз и активацию каспазы-3.
Осуществление изобретения
Ниже представлено более детальное описание реализации заявляемого изобретения, которое не ограничивает объем притязаний заявляемого изобретения, а демонстрирует возможность осуществления изобретения с достижением заявляемого технического результата.
Исходно было определено, что проапоптотический белок ВАХ и антиапоптотический белок Bcl-xl являются субстратами для катепсина S. Катепсины также могут регулироваться белками-ингибиторами (цистатинами) человека, которые предотвращают чрезмерную активацию нежелательной протеолитической активности катепсинов [Turk V, Stoka V, Vasiljeva О, Renko М, Sun Т, Turk В, Turk D. Cysteine cathepsins: from structure, function and regulation to new frontiers. Biochim Biophys Acta. 2012 Jan; 1824(1):68-88. doi: 10.1016/j.bbapap.2011.10.002. Epub 2011 Oct 12. PMID: 22024571; PMCID: PMC7105208].
Была идентифицирована пептидная область, которая берет свое начало от ингибитора протеиназы, имеющего сходство с антиапоптотическим белком Bcl-xl. Для этой цели был использован растительный белок-ингибитор папаин-подобных протеиназ с последовательностью Pit2 [Misas Villamil JC, Mueller AN, Demir F, Meyer U, 
 Breuer M, Dauben H, Win J, Huesgen PF, Doehlemann G. A fungal substrate mimicking molecule suppresses plant immunity via an inter-kingdom conserved motif. Nat Commun. 2019 Apr 5; 10(1): 1576. doi: 10.1038/s41467-019-09472-8. PMID: 30952847; PMCID: РМС6450895]. С использованием платформы BLAST при поиске по базе данных NCBI (https://blast.ncbi.nlm.nih.gov/Blast.cgi?PROGRAM=blastp&PAGE_TYPE=BlastSearch&LINK_LOC=blasthome'). был идентифицирован пептид из аминокислотной последовательности ингибитора Pit2, который также присутствует в α-5 спиральной петле Bcl-xl, и имеет последовательность FFSFGGAL (обозначен CS-PEP1);. Эта петля α-5 антиапоптотического белка Bcl-xl взаимодействует с ВН3 доменом проапоптотического ВАХ и это взаимодействие является ключевым этапом, ответственным за Bcl-xl-опосредованное ингибирование белка ВАХ во время активации апоптоза [Renault ТТ, Dejean LM, Мапоп S. A brewing understanding of the regulation of Bax function by Bcl-xL and Bcl-2. Mech Ageing Dev. 2017 Jan; 161 (Pt B):201-210. doi: 10.1016/j.mad.2016.04.007. Epub 2016 Apr 23. PMID: 27112371].
Breuer M, Dauben H, Win J, Huesgen PF, Doehlemann G. A fungal substrate mimicking molecule suppresses plant immunity via an inter-kingdom conserved motif. Nat Commun. 2019 Apr 5; 10(1): 1576. doi: 10.1038/s41467-019-09472-8. PMID: 30952847; PMCID: РМС6450895]. С использованием платформы BLAST при поиске по базе данных NCBI (https://blast.ncbi.nlm.nih.gov/Blast.cgi?PROGRAM=blastp&PAGE_TYPE=BlastSearch&LINK_LOC=blasthome'). был идентифицирован пептид из аминокислотной последовательности ингибитора Pit2, который также присутствует в α-5 спиральной петле Bcl-xl, и имеет последовательность FFSFGGAL (обозначен CS-PEP1);. Эта петля α-5 антиапоптотического белка Bcl-xl взаимодействует с ВН3 доменом проапоптотического ВАХ и это взаимодействие является ключевым этапом, ответственным за Bcl-xl-опосредованное ингибирование белка ВАХ во время активации апоптоза [Renault ТТ, Dejean LM, Мапоп S. A brewing understanding of the regulation of Bax function by Bcl-xL and Bcl-2. Mech Ageing Dev. 2017 Jan; 161 (Pt B):201-210. doi: 10.1016/j.mad.2016.04.007. Epub 2016 Apr 23. PMID: 27112371].
Пептид был синтезирован компанией Peptech Inc (Санкт-Петербург, Российская Федерация) методом твердофазного пептидного синтеза, при котором пептид получают путем соединения различных аминокислот друг с другом с последующей химической модификацией для введения функциональных групп. Способы химического синтеза пептида широко известны и хорошо описаны с помощью известных в данной области техники методов [US 6015881; Mergler и др., Tetrahedron Letters 29, 1988, сс. 4005-4008; Mergler и др., Tetrahedron Letters 29, 1988, сс. 4009-4012; Peptides, Chemistry and Biology, под ред. Kamber и др., изд-во ESCOM, Leiden, 1992, сс. 525-526; Riniker и др., Tetrahedron Letters 49, 1993, сс. 9307-9320; Lloyd-Williams и др., Tetrahedron Letters 49, 1993, сс. 11065-11133, и Andersson и др., Biopolymers 55, 2000, сс. 227-250]. Чистоту продукта определяли, используя MALDI-TOF, после чего пептид лиофилизировали для коммерческого использования.
Для работы с указанным пептидом был приготовлен 10 мМ стоковый раствор пептида в диметилсульфоксиде (ДМСО, со степенью чистоты, пригодной для работы с клеточными культурами (Sigma)), который хранили при 4°С. Последующие разведения выполняли в ДМСО и непосредственно использовали для обработки клеточных линий, выращенных на специальных культуральных средах in vitro, или для добавления к катепсину S в экспериментах по расщеплению белков ВАХ/Bcl-xl in vitro при значениях рН 5 или 7.
Свойства пептида оценивали in vitro биохимическими методами и на опухолевых линиях клеток.
Помимо ВАХ среди проаптотических ВН3-домен-содержащих белков могут быть использованы Bak, Mtd/Bok, Bcl-xs [Kelekar A, Thompson СВ. Bcl-2-family proteins: the role of the BH3 domain in apoptosis. Trends Cell Biol. 1998 Aug; 8(8):324-30. doi: 10.1016/s0962-8924(98)01321-x. PMID: 9704409]. Кроме того, представленная пептидная последовательность может иметь некоторые аминокислотные замены, не приводящие к существенным изменениям физико-химических свойств и проверенных с использованием молекулярного докинга (например, серин/треонин, аланин/валин/лейцин, изолейцин, серин/треонин, лизин/аргинин, аспарагин/глутамин и др.).
Изобретение также включает фармацевтические композиции, в которых использован пептид CS-PEP1, имеющий последовательность FFSFGGAL, или пептиды, имеющие аминокислотные замены в последовательностях CS-PEP1, существенно не влияющие на свойства пептидов. Фармацевтические композиции могут быть применены в отношении заболеваний и нарушений, связанных с нарушенной экспрессией катепсина S и/или белками семейства BCL-2.
Фармацевтическая композиция включает пептид CS-PEP1, или его модификации с заменами аминокислот и любой известный из уровня техники фармацевтически приемлемый носитель в виде инертного нетоксичного материала, который не реагирует с активным ингредиентом, а также обеспечивает доставку и проникновение активного ингредиента в целевую ткань. Носитель подбирают по физико-химическим параметрам (растворимость, реакционная способность по отношению к пептидам, способ и условия введения состава).
Настоящее изобретение поясняется конкретными примерами выполнения, демонстрирующими возможность достижения требуемого технического результата.
Пример 1. Определение способности катепсина S расщеплять ВАХ in vitro и в клетках (Фиг. 2А)
В настоящее время механизмы регуляции катепсина S (CS) при расщеплении ВАХ неизвестны. Чтобы выявить эту взаимосвязь, рекомбинантный (полученный из E.coli) биологически активный CS был коинкубирован с очищенным белком ВАХ (Abeam) и наблюдали дозозависимое расщепление ВАХ (Фиг. 2А). Равные количества экспрессируемого бактериями белка ВАХ р21 подвергали действию активного CS при рН7, и анализировали реакцию расщепления ВАХ путем вестерн-блоттинга с использованием антител против ВАХ (Abeam). Фильтры были затем исследованы для обнаружения CS (нижние панели, SCB). Клетки 769Р и HEK293 котрансфицировали рВАХ-НА и плазмидами экспрессии pCS-FLAG (в возрастающих дозах, μg) в течение 24 часов, предварительно стимулированных носителем (левые панели) или 2 мкМ сирамезином (правые панели) в течение 1 часа; далее в клеточных экстрактах анализировали уровни экспрессии р21 ВАХ, CS и актина. В этом случае также наблюдали дозозависимое расщепление ВАХ (Фиг. 2В и С). Уровни белка р21 ВАХ анализировали в условиях стимуляции циклогексимидом (Фиг. 2D) после того, как клетки в течение 24 часов трансфицировали только рВАХ-НА (0,25 мкг) или pCS-FLAG (0,75 мкг). Уровни экспрессии р21 ВАХ были количественно определены, стандартизованы для уровней экспрессии актина в клетках, стимулированных при Т=0 ч до Т=6 ч. Синяя и красная кривые показывают уровни р21 ВАХ или р21 ВАХ при коэкспрессии с CS (соответственно), а линии тренда показаны черным. Таким образом дестабилизирующие эффекты экспрессии CS-flag на ВАХ-НА были также подтверждены на клетках млекопитающих, где период полужизни белка ВАХ-НА был значительно снижен по сравнению с экспрессией только ВАХ (Фиг 2. D, график).
Как видно из Фиг. 2, экспрессия CS приводит к разрушению белка ВАХ in vitro и в клетках млекопитающих.
Пример 2. Оценка ингибирующей активности CS-PEP1 в отношении опосредованного катепсином S расщепления ВАХ in vitro (Фиг. 3А)
Для того, чтобы оценить ингибирующую активность CS-PEP1 в отношении CS-опосредованного расщепления ВАХ, совместно инкубировали иммунопреципитированный белок ВАХ-НА, полученный из клеток млекопитающих (Фиг. 3А) или бактериально экспрессированный ВАХ (Фиг. 3В) с активным CS и уменьшающимися дозами ингибитора CS-PEP1. Равные количества иммунопреципитированного белка ВАХ-НА р21, полученного из 0,25 мкг экспрессии ВАХ-НА в клетках HEK293, подвергали действию активного CS с уменьшающимся количеством CS-PEP1 при рН 7, а продукты расщепления р21 ВАХ (или CS) детектировали с помощью вестерн-блоттинга с антителами против ВАХ (Abeam) или CS (SCB, верхняя и средняя панель). Уровни субстрата р21 ВАХ были определены количественно, стандартизованы относительно ВАХ (дорожка 2) и отображены на нижней панели (Фиг. 3В). Реакции расщепления ВАХ при рН 7 инкубировали в присутствии уменьшающихся доз CS-PEP1, и реакции анализировали по продуктам расщепления р21 ВАХ (верхняя панель) и уровню CS (средняя панель) с использованием анти-ВАХ (Abcam) или антитела против CS (SCB). Уровни субстрата р21 ВАХ были определены количественно, стандартизованы относительно ВАХ (дорожка 2) и отображены на нижней панели. Количественные данные представлены как ±SEM, и их значимость (где р<0,05) определяется с использованием двустороннего критерия t Стьюдента (*р<0,05, **р<0,01 и ***р<0,001). Реакция расщепления р21 ВАХ может быть значительно замедлена в присутствии 10 мкМ-100 нМ CS-PEP1 или 10 мкМ-1 мМ CS-РЕР1 для р21 ВАХ и ВАХ соответственно in vitro
Как видно из Фиг. 3, CS-PEP1 ингибирует опосредованное катепсином S расщепление ВАХ.
Пример 3. Определение способности CS-PEP1 расщеплять и дестабилизировать Bcl-xl in vitro и в клетках млекопитающих (Фиг. 4А)
Анализы CS-опосредованного расщепления Bcl-xl in vitro проводили при рН 7 и 5 (верхняя панель) с использованием GST-Bcl-xl в качестве субстрата в присутствии 10 мкМ CS-PEP1 (или носителя). Уровни субстрата определяли количественно, как показано на нижней панели (белые столбцы с рН 7 и черные столбцы с рН 5), а продукты расщепления определяли с помощью окрашивания кумасси синим (Фиг. 4В). Клетки HEK293 стимулировали уменьшающимися дозами CS-PEP1 в присутствии носителя или 5 мкг/мл Рас в течение 24 часов и анализировали на р21 ВАХ (Abeam), Caspase-3 (Abeam), Bcl-xl (Abcam), CS (Invitrogen) и актина (Abcam) экспрессии. Количественные данные представлены как ±SEM, и их значимость (где р<0,05) определяется с использованием двустороннего критерия t Стьюдента (*р<0,05, **р<0,01 и ***р<0,001).
Как видно из Фиг. 4, CS-PEP1 проявляет ингибирующую активность в отношении CS-опосредованного расщепления Bcl-xl in vitro при рН 7 (Фиг. 4А, дорожка 8) значительно лучше, чем при рН 5 (Фиг. 4А, дорожка 7). Уровни эндогенного белка Bcl-xl также оставались дестабилизированными в клетках HEK293 при совместной обработке клеток паклитакселом и 50 мкМ-10 нМ, что позволяет предположить, что CS-PEP1 может препятствовать стабилизации Bcl-xl в присутствии обычных химиотерапевтических препаратов, которые демонстрируют низкую эффективность в уничтожении клеток рака почки.
Пример 4. Определение способности CS-PEP1 стабилизировать белок ВАХ при экспрессии катепсина S (Фиг. 5А)
Клетки 769Р совместно стимулировали носителем или 5 мкг/мл Рас, 10 мкМ zVAD-fmk и 10 мкМ CS-PEP1 в течение 24 часов. Растворимые WCL анализировали на экспрессию эндогенного р21 ВАХ (Abeam), CS (Abeam) и актина (Abeam). Уровни белка р21 ВАХ были определены количественно, стандартизованы для экспрессии актина и представлены черными полосами как кратные изменения по сравнению с стимуляциями одним носителем (Фиг. 5 В). Уровни эндогенного р21 ВАХ, CS и актина определяли в лизатах клеток HEK293 с помощью вестерн-блоттинга после 24 часов совместной стимуляции Рас (5 мкг/мл) и CS-PEP1 (10 мкМ) (Фиг. 5С). Клетки HEK293, котрансфицированные рВАХ-НА и pCS-FLAG или рВАХ-НА и pCS-C25A-FLAG, стимулировали носителем или 10 мкМ CS-PEP1 в течение 24 часов и циклогексимидом в течение следующих 6 часов. В указанные моменты времени клетки лизировали и клеточные лизаты (WCL) анализировали на р21 ВАХ, CS и экспрессию актина с использованием вестерн-блоттинга (Фиг. 5D). Уровни экспрессии для р21 ВАХ были количественно определены, стандартизированы для актина и выражены по отношению к уровням, наблюдаемым при Т=0 час. Коэкспрессия ВАХ и CS в присутствии стимуляции CS-PEP1 (синий) и р21 ВАХ с коэкспрессией CS-C25A (красный) показаны как линии тренда (черные кривые). Количественные данные представлены как ±SEM, и их значимость (где р<0,05) определяется с использованием двустороннего критерия t Стьюдента (*р<0,05, **р<0,01 и ***р<0,001).
Наблюдался эффект CS-PEP1 в стабилизации уровней экспрессированного ВАХ при совместной экспрессии ВАХ-НА с CS (Фиг. 5А) или эндогенным белком ВАХ в присутствии индуцированного паклитакселом эндогенного CS (Фиг. 5В). Это было подтверждено наблюдением аналогичных уровней стабильности для ВАХ-НА, коэкспрессируемого с CS-C25A-Flag, и ВАХ-НА, коэкспрессированного с CS-Flag и обработанного CS-PEP1 (Фиг. 5С) в течение шестичасового курса, и где соответствующие периоды полураспада белков ВАХ были почти идентичными (Фиг. 5D).
Пример 5. Стабилизация CS-PEP1 уровня эндогенного белка ВАХ в клетках
CS-PEP1 стабилизирует уровень эндогенного белка ВАХ (в том числе в присутствии экспрессии катепсина S) в клетках 769Р и HEK293 (Фиг. 6). Клетки 769Р и HEK293 трансфицировали 1 мкг пустой экспрессионной плазмиды pcDNA3.1+, pCS-FLAG или PCS-C25A-FLAG в течение 24 часов, а затем обрабатывали 10 мкМ CS-PEP1 еще в течение 24 часов. Клетки собирали, готовили лизаты и анализировали на предмет эндогенной экспрессии ВАХ (анти-ВАХ), катепсина S (с использованием анти-CS антител) и β-актина (анти-β-актин).
В контрольных экспериментах экспрессия CS дестабилизировала эндогенные уровни ВАХ (первый блот, предпоследняя полоса), а доминантно-ингибирующая экспрессия CS-C25A отменила этот эффект (первый блот, полоса 8). При использовании клеток HEK293 эндогенные уровни ВАХ заметно повышались при обработке CS-PEP1 (второй блот, полоса 6). При экспрессии CS уровни ВАХ кажутся повышенными (с учетом того, что уровни β-актина ниже базальных по сравнению с контрольными условиями (см. полосы 3 и 4, второй блот). В HEK293 обработка PVLE не оказала заметного влияния на уровень эндогенного белка ВАХ ни с экспрессией CS, ни с доминантно-ингибирующей экспрессией С25А (третий блот). В совокупности такие результаты свидетельствуют о том, что CS-PEP1 стабилизирует уровень ВАХ как при обработке клеток только ингибиторами, так и при экспрессии CS в клетках 769Р. Аналогичная картина наблюдалась в клетках HEK293.
6. Определение способности CS-PEP1 ингибировть опосредованное катепсином S расщепление полиубиквитинированного производного р120 ВАХ ВАХ (Фиг. 7)
Клетки HEK293, коэкспрессирующие CS-Flag или pCS-C25A-Flag с ВАХ и НА-убиквитином, в течение 6 часов дополнительно обрабатывали в течение 24 часов 10 мкМ CS-PEP1 и очищали лизаты целых клеток, иммунопреципитированные с использованием антител против НА. Иммунные комплексы анализировали на наличие белка ВАХ с помощью вестерн-блоттинга при длительном (верхняя панель) и кратковременном воздействии (нижняя панель). Красной стрелкой выделено полиубиквитинированное производное ВАХ, р120 ВАХ.
Как видно из Фиг. 7, обработка клеток CS-PEP1 также приводит к накоплению полиубиквитинированного производного ВАХ с массой 120 кДа (Пример 6), особенно в присутствии неактивного мутанта CS-C25A-Flag, что подразумевает, что CS может принимать участие в протеолитическом расщеплении убиквитинированного ВАХ и, следовательно, может играть важную роль в протеасомной деградации уровней белка ВАХ.
Пример 7. Определение способности CS-PEP1 вызывать апоптоз и активацию каспазы-3
Клетки HEK293 (Фиг. 8А) или 769Р (Фиг. 8С), соответственно, совместно стимулировали CS-PEP1 (10 мкМ), пероксидом водорода (HP, 5 мкМ) или паклитакселом (Рас, 5 мкг/мл) в течение 24 часов; апоптотические клетки окрашивали с помощью TUNEL и определяли их количество. Растворимые лизаты цельных клеток (WCL), полученные из клеток, обработанных таким же образом, как на панелях А и С, анализировали на экспрессию каспазы-3 (Casp-3) и актина (Фиг. 8С). Уровни экспрессии каспазы-3 были количественно определены и стандартизированы для экспрессии актина по отношению к клеткам, стимулированным одним носителем (Фиг. 8D, график). Количественные данные представлены как ±SEM, и их значимость (где р<0,05) определяется с использованием двустороннего критерия t Стьюдента (*р<0,05, **р<0,01 и ***р<0,001).
Обработка 10 мкМ CS-PEP1 клеток HEK293 или 769Р индуцировала их апоптоз примерно на 6-58% и 1-43%, соответственно (Фиг. 8A). CS-PEP1 может также взаимоусилить индуцирующие апоптоз эффекты обработки 769 клеток перекисью водорода или паклитакселом с 11% до 93% и от 55% до 64%, соответственно (Фиг. 8С). Обнаружение промежуточного соединения каспазы-3 с массой 18 кДа наблюдалось в качестве контроля - индикатора активации апоптоза (Фиг. 8В, D). Таким образом CS-PEP1 вызывает апоптоз и активацию каспазы-3.
Таким образом по результатам проведенных исследований выявлено, что пептид FFSFGGAL обладает рядом ценных терапевтических свойств, поскольку может усиливать ВАХ-опосредованный апоптоз за счет следующих способностей:
1. Подавлять активность катепсина S (так же, как ингибитор протеиназы Pit2 ингибирует растительные папаин-подобные протеиназы).
2. Ингибировать взаимодействие ингибиторного белка Bcl-xl/BAX (благодаря тому, что он является производным от гидрофобного кармана Bcl-xl, который связывает ВН3-домен ВАХ).
3. Подавлять белковые взаимодействия В АХ/В АХ и образование олигомеров (благодаря тому, что они являются производными от гидрофобного кармана Bcl-xl, который связывает ВАХ), тем самым стабилизируя мономерный ВАХ (и который все еще может вызывать апоптоз  Box, Bak and beyond - mitochondrial performance in apoptosis. FEBS J. 2018 Feb; 285(3):416-431. doi: 10.1111/febs.14186. Epub 2017 Sep 4. PMID: 28755482]).
Box, Bak and beyond - mitochondrial performance in apoptosis. FEBS J. 2018 Feb; 285(3):416-431. doi: 10.1111/febs.14186. Epub 2017 Sep 4. PMID: 28755482]).
4. Ингибировать катепсин S-опосредованный протеолиз полиубиквитинированного производного ВАХ (р120 ВАХ).
| название | год | авторы | номер документа |
|---|---|---|---|
| ПЕПТИДНЫЕ СОЕДИНЕНИЯ ДЛЯ ИНДУКЦИИ АПОПТОЗА В ОПУХОЛЕВОЙ КЛЕТКЕ | 2021 |
|
RU2785794C2 |
| СПЕЦИФИЧЕСКИЕ ПЕПТИДНЫЕ ИНГИБИТОРЫ ЦИСТЕИНОВЫХ КАТЕПСИНОВ | 2020 |
|
RU2752531C1 |
| Способ определения количества белков Всl-2 и Вах в сосудистой стенке у пациентов с облитерирующим атеросклерозом артерий нижних конечностей | 2020 |
|
RU2751822C1 |
| ТЕРАПЕВТИЧЕСКИЕ АГЕНТЫ, СОДЕРЖАЩИЕ ПРОАПОПТОЗНЫЕ БЕЛКИ | 2002 |
|
RU2319709C2 |
| Низкомолекулярные ингибиторы фосфорилированные BCL-2-ассоциированного промотора смерти (BAD) | 2018 |
|
RU2799873C2 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ФРАГМЕНТА ПЛАЗМИНОГЕНА ЧЕЛОВЕКА, ОБЛАДАЮЩЕГО АНТИАНГИОГЕННЫМ ДЕЙСТВИЕМ | 2011 |
|
RU2458987C1 |
| Новое химическое соединение, стимулирующее продукцию интерферона-бета человека путем активации сигнального пути STING, и способ его получения | 2023 |
|
RU2811736C1 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО АНТИАНГИОГЕННОГО ПОЛИПЕПТИДА | 2012 |
|
RU2488635C1 |
| СПОСОБ ВЫДЕЛЕНИЯ БЕЛКОВОГО ВЫСОКОМОЛЕКУЛЯРНОГО КОМПЛЕКСА АКТИВАЦИИ КАСПАЗЫ-2 ЧЕЛОВЕКА | 2016 |
|
RU2671510C1 |
| СПОСОБ РАННЕЙ ДИАГНОСТИКИ ПОЧЕЧНО-КЛЕТОЧНОЙ КАРЦИНОМЫ ПО НАЛИЧИЮ АНТИТЕЛ К ЗРИТЕЛЬНОМУ АРРЕСТИНУ | 2018 |
|
RU2707884C1 |

Изобретение относится к области фармацевтической промышленности и может быть использовано в качестве терапевтического средства для лечения заболеваний, связанных с нарушенной экспрессией катепсина S и/или белками семейства BCL-2. Изобретение относится к применению пептидного соединения, содержащего аминокислотную последовательность FFSFGGAL, для подавления активности катепсина S, вызывающего индукцию апоптоза в опухолевой клетке. Изобретение также относится к применению пептидного соединения, содержащего аминокислотную последовательность FFSFGGAL, для приготовления фармацевтической композиции для подавления активности катепсина S, вызывающего индукцию апоптоза в опухолевой клетке. 2 н.п. ф-лы, 8 ил., 7 пр.
1. Применение пептидного соединения, содержащего аминокислотную последовательность FFSFGGAL, для подавления активности катепсина S, вызывающего индукцию апоптоза в опухолевой клетке.
2. Применение пептидного соединения, содержащего аминокислотную последовательность FFSFGGAL, для приготовления фармацевтической композиции для подавления активности катепсина S, вызывающего индукцию апоптоза в опухолевой клетке.
| US 20110318380 A1, 29.12.2011 | |||
| БЕЛКИ, ОТНОСЯЩИЕСЯ К СЕМЕЙСТВУ Всl-2, И ИХ ФРАГМЕНТЫ И ИХ ПРИМЕНЕНИЕ У ПАЦИЕНТОВ СО ЗЛОКАЧЕСТВЕННОЙ ОПУХОЛЬЮ | 2004 |
|
RU2367468C2 |
| US 7521548 B2, 21.04.2009 | |||
| WO 2020241800 A1, 03.12.2020 | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
Авторы
Даты
2023-05-17—Публикация
2022-09-16—Подача