Изобретение относится к способу получения новых азотсодержащих гетероциклических соединений, а именно замещенных О-алкилированных гексагидро-2H-хромено[4,3-d]пиримидин-2,5(1H)-дионов, которые могут быть использованы в качестве прекурсоров для синтеза биологически активных веществ и лекарственных препаратов.
Данные соединения являются новыми, и из уровня техники не известны способы получения таких соединений.
Задачей изобретения является разработка способа получения замещенных О-алкилированных гексагидро-2H-хромено[4,3-d]пиримидин-2,5(1H)-дионов структурной формулы:
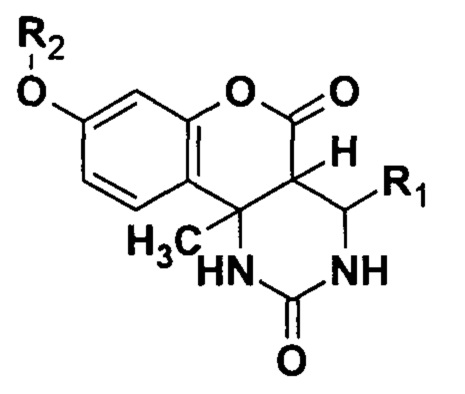
где R1 = С6Н5 или 4-ClC6H4 или 4-МеОС6Н4 или 3-NO2C6H4, R2 = СН3 или СН2С(O)ОСН3 или СН2С6Н5
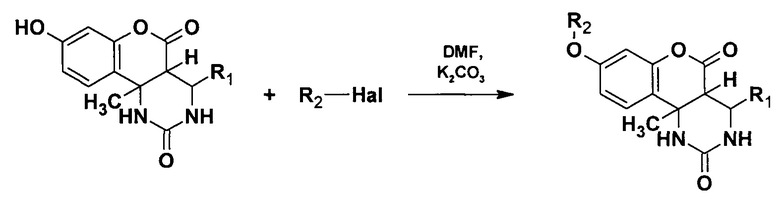
Поставленная задача достигается тем, что в качестве исходных реагентов для синтеза замещенных О-алкилированных гексагидро-2H-хромено[4,3-d]пиримидин-2,5(1H)-дионов используют диастереомерно чистые 8-гидрокси-10b-метил-4-R1-1,2,3,4,4а,10b-гексагидро-2H-хромено[4,3-d]пиримидин-2,5(1H)-дионы, которые взаимодействуют с алкилирующими агентами (CH3I или BrCH2COOCH3 или C6H5CH2Cl) в присутствии карбоната калия и диметилформамида (ДМФА) в качестве растворителя.
Вышеуказанные соединения получают следующей реакцией:
при условиях, описанных ниже.
Исходные диастереомерно чистые 8-гидрокси-10b-метил-4-R1-1,2,3,4,4а,10b-гексагидро-2H-хромено[4,3-d]пиримидин-2,5(1H)-дионы растворяют в 2 мл ДМФА, затем последовательно добавляют карбонат калия (K2CO3) и один из алкилирующих агентов (CH3I или BrCH2COOCH3 или C6H5CH2Cl) и перемешивают реакционную массу при температуре 20…40°С в течение 2-4 часов. В случае использования в качестве алкилирующего агента C6H5CH2Cl реакционную массу дополнительно перемешивают еще в течение 2 часов при температуре 70...80°С до полного завершения реакции. Затем раствор охлаждают и выделяют в холодную воду. Выпавший осадок отфильтровывают и перекристаллизовывают из спирта. Сушат на воздухе при комнатной температуре.
Все приведенные признаки являются существенными, и только заявляемая совокупность признаков позволяет достичь технического результата.
Строение полученных соединений подтверждено методами ИК, ЯМР Н1, ЯМР С13, NOESY, НМВС- спектроскопии и масс-спектрометрией.
Изобретение иллюстрируется следующими примерами.
Пример 1. (4R*,4aS*,10bR*)-8-метокси-10b-метил-4-фенил-1,2,3,4,4а,10b-гексагидро-2H-хромено[4,3-d]пиримидин-2,5(1H)-дион:
Растворяют (4R*,4aS*,10bR*)-8-гидрокси-10b-метил-4-фенил-1,2,3,4,4а,10b-гексагидро-2H-хромено[4,3-d]пиримидин-2,5(1H)-дион (0.5 ммоль) в 2 мл ДМФА, затем последовательно добавляют K2CO3 (2 ммоль) и йодистый метил CH3I (1.5 ммоль) и перемешивают реакционную массу при температуре 20°С в течение 3 часов. Затем раствор охлаждают и выделяют в холодную воду (10 мл). Выпавший осадок отфильтровывают и перекристаллизовывают из спирта. Сушат на воздухе при комнатной температуре. Получают 106 мг (62% от теории) (4R*,4aS*,10bR*)-8-метокси-10b-метил-4-фенил-1,2,3,4,4а,10b-гексагидро-2H-хромено[4,3-d]пиримидин-2,5(1H)-диона - кристаллический осадок белого цвета, Тпл = 271-272°С. ИК спектр, ν/см-1: 3397 (NH), 1777, 1678 (С=O), 1621, 1585 (Ar), 1265, 1138 (С-О). Спектр ЯМР 1Н (400 МГц, δ, м.д., J/Гц): 1.36 (с, 3Н, С(10b)СН3); 3.08 (д, 1Н, С(4а)Н, J=10.8); 3.79 (с, 3Н, С(8)ОСН3); 4.11 (д, 1Н, С(4)Н, J=10.8); 6.78 (д, 1Н, С(7)Н, J=2.2); 6.82 (с, 1Н, N(3)H); 6.91 (дд, 1Н, С(9)Н, J=8.6, 2.2); 7.25 (д, 2Н, С(3',5')Н, J=7.6); 7.29-7.39 (м, 3Н, С(2',4',6')Н); 7.45 (д, 1Н, С(10)Н, J=8.6); 7.66 (с, 1Н, N(1)H). Спектр ЯМР 13С (100 МГц, δ, м.д.): 28.48, 52.76, 52.91, 54.14, 55.58, 102.29, 111.20, 122.07, 126.57, 127.26 (2С), 128.31, 128.36 (2С), 139.07, 148.50, 154.19, 159.99, 165.67. Масс-спектр (ЭУ, 70 эВ), m/z (Iотн, (%)): 338 [М]+ (13), 191 (36), 190 (21), 187 (100), 162 (34), 147 (31), 132 (38), 104 (54), 77 (49). Найдено (%): С, 67.18; Н, 5.34; N, 8.24. C19H18N2O4. Вычислено (%): С, 67.45; Н, 5.36; N, 8.28.
Пример 2. (4R*,4aS*,10bR*)-8-метокси-10b-метил-4-(4-хлорфенил)-1,2,3,4,4а,10b-гексагидро-2H-хромено[4,3-d]пиримидин-2,5(1H)-дион:
Растворяют (4R*,4aS*,10bR*)-8-гидрокси-10b-метил-4-(4-хлорфенил)-1,2,3,4,4а,10b-гексагидро-2H-хромено[4,3-d]пиримидин-2,5(1H)-дион (0.5 ммоль) в 2 мл ДМФА, затем последовательно добавляют K2CO3 (2 ммоль) и йодистый метил CH3I (1.5 ммоль) и перемешивают реакционную массу при температуре 30°С в течение 2 часов. Затем раствор охлаждают и выделяют в холодную воду (10 мл). Выпавший осадок отфильтровывают и перекристаллизовывают из спирта. Сушат на воздухе при комнатной температуре. Получают 101 мг (54% от теории) (4R*,4aS*,10bR*)-8-метокси-10b-метил-4-(4-хлорфенил)-1,2,3,4,4а,10b-гексагидро-2H-хромено[4,3-d]пиримидин-2,5(1H)-диона - кристаллический осадок бежевого цвета, Тпл = 269-270°С. ИК спектр, ν/см-1: 3397 (NH), 1767, 1675 (С=O), 1625, 1585 (Ar), 1268, 1151, 1138 (С-О). Спектр ЯМР 1Н (400 МГц, δ, м.д., J/Гц): 1.37 (с, 3Н, С(10b)СН3); 3.12 (д, 1Н, C(4a)H, J=10.9); 3.79 (с, 3Н, С(8)ОСН3); 4.14 (д, 1Н, С(4)Н, J=10.9); 6.78 (д, 1H, С(7)Н, J=2.1); 6.87 (с, 1Н, N(3)H); 6.91 (дд, 1Н, С(9)Н, J=8.6, 2.4); 7.31 (д, 2Н, С(3',5')Н, J=8.4); 7.41 (д, 2Н, С(2',6')Н, J=8.4); 7.45 (д, 1Н, С(10)Н, J=8.6); 7.66 (с, 1Н, N(1)H). Спектр ЯМР 13С (100 МГц, δ, м.д.): 28.48, 52.43, 52.85, 53.38, 55.56, 102.34, 111.27, 121.93, 126.54, 128.30 (2С), 129.28 (2С), 132.77, 138.1, 148.42, 154.01, 159.98, 165.65. Масс-спектр (ЭУ, 70 эВ), m/z (Iотн, (%)): 374 (6), 372 [М]+ (19), 223 (34), 221 (100), 191 (34), 190 (20), 166 (39), 162 (47), 150 (48), 147 (43), 140 (41), 137 (73), 111 (17), 102 (17), 91 (12), 77 (16). Найдено (%): С, 60.97; Н, 4.63; N, 7.54. C19H17ClN2O4. Вычислено (%): С, 61.21; Н, 4.60; N, 7.51.
Пример 3. (4R*,4aS*,10bR*)-8-метокси-10b-метил-4-(4-метоксифенил)-1,2,3,4,4а,10b-гексагидро-2H-хромено[4,3-d]пиримидин-2,5(1H)-дион:
Растворяют (4R*,4aS*,10bR*)-8-гидрокси-10b-метил-4-(4-метоксифенил)-1,2,3,4,4а,10b-гексагидро-2H-хромено[4,3-d]пиримидин-2,5(1H)-дион (0.5 ммоль) в 2 мл ДМФА, затем последовательно добавляют K2CO3 (2 ммоль) и йодистый метил CH3I (1.5 ммоль) и перемешивают реакционную массу при температуре 40°С в течение 3 часов. Затем раствор охлаждают и выделяют в холодную воду (10 мл). Выпавший осадок отфильтровывают и перекристаллизовывают из спирта. Сушат на воздухе при комнатной температуре. Получают 94 мг (51% от теории) (4R*,4aS*,10bR*)-8-метокси-10b-метил-4-(4-метоксифенил)-1,2,3,4,4а,10b-гексагидро-2H-хромено[4,3-d]пиримидин-2,5(1H)-диона - кристаллический осадок белого цвета, Тпл = 253-255°С. ИК спектр, ν/см-1: 3395 (ОН), 3220 (NH), 1774, 1673 (С=O), 1624, 1588 (Ar), 1268, 1252, 1155 (С-О). Спектр ЯМР 1Н (400 МГц, δ, м.д., J/Гц): 1.37 (с, 3Н, С(10b)СН3); 3.05 (д, 1Н, С(4а)Н, J=10.8); 3.74 (с, 3Н, С(4')ОСН3); 3.79 (с, 3Н, С(8)ОСН3); 4.07 (д, 1Н, С(4)Н, J=10.8); 6.70 (с, 1Н, N(3)H); 6.77 (д, 1Н, С(7)Н, J=2.1); 6.90 (дд, 1Н, С(9)Н, J=8.6, 2.2); 6.89 (д, 2Н, С(3',5')Н, J=8.8); 7.17 (д, 2Н, С(2',6')Н, J=8.8); 7.45 (д, 1Н, С(10)Н, J=8.6); 7.62 (с, 1Н, N(1)H). Спектр ЯМР 13С (100 МГц, δ, м.д.): 28.55, 52.83, 52.88, 53.55, 55.08, 55.58, 102.27, 111.20, 113.72 (2С), 122.17, 126.62, 128.51 (2С), 130.86, 148.50, 154.21, 159.21, 159.98, 165.75. Найдено (%): С, 61.08; Н, 5,49; N, 7.62. C20H20N2O5. Вычислено (%): С, 65.21; Н, 5.47; N, 7.60.
Пример 4. (4R*,4aS*,10bS*)-8-метокси-10b-метил-4-(4-метоксифенил)-1,2,3,4,4а,10b-гексагидро-2H-хромено[4,3-d]пиримидин-2,5(1H)-дион:
Растворяют (4R*,4aS*,10bS*)-8-гидрокси-10b-метил-4-(4-метоксифенил)-1,2,3,4,4а,10b-гексагидро-2H-хромено[4,3-d]пиримидин-2,5(1H)-дион (0.5 ммоль) в 2 мл ДМФА, затем последовательно добавляют K2CO3 (2 ммоль) и йодистый метил CH3I (1.5 ммоль) и перемешивают реакционную массу при температуре 30°С в течение 4 часов. Затем раствор охлаждают и выделяют в холодную воду (10 мл). Выпавший осадок отфильтровывают и перекристаллизовывают из спирта. Сушат на воздухе при комнатной температуре. Получают 67 мг (36% от теории) (4R*,4aS*,10bS*)-8-метокси-10b-метил-4-(4-метоксифенил)-1,2,3,4,4а,10b-гексагидро-2H-хромено[4,3-d]пиримидин-2,5(1H)-диона - кристаллический осадок светло-бежевого цвета, Тпл = 211-213°С. Спектр ЯМР 1Н (400 МГц, δ, м.д., J/Гц): 1.37 (с, 3Н, С(10b)СН3); 3.40 (д, 1Н, С(4а)Н, J=10.8); 3.74 (с, 3Н, С(4')ОСН3); 3.75 (с, 3Н, С(8)ОСН3); 4.69 (д, 1Н, С(4)Н, J=10.8); 6.67 (д, 1Н, С(7)Н, J=2.1); 6.73 (с, 1Н, N(3)H); 6.81 (дд, 1Н, С(9)Н, J=8.6, 2.2); 6.87 (д, 2Н, С(3',5')Н, J=8.8); 7.36 (д, 2Н, С(2',6')Н, J=8.8); 7.46 (с, 1Н, N(1)H); 7.75 (д, 1Н, С(10)Н, J=8.6). Спектр ЯМР 13С (100 МГц, δ, м.д.): 25.59, 48.54, 51.66, 52.38, 54.96, 55.30, 102.14, 110.40, 113.32 (2С), 122.37, 124.80, 129.48 (2С), 133.17, 149.23, 154.60, 158.71, 159.62, 166.02. Масс-спектр (ЭУ, 70 эВ), m/z (Iотн, (%)): 368 (7), 353 (16), 218 (10), 162 (100), 134 (15).
Пример 5. (4R*,4aS*,10bR*)-8-метокси-10b-метил-4-(3-нитрофенил)-1,2,3,4,4а,10b-гексагидро-2H-хромено[4,3-d]пиримидин-2,5(1H)-дион:
Растворяют (4R*,4aS*,10bR*)-8-гидрокси-10b-метил-4-(3-нитрофенил)-1,2,3,4,4а,10b-гексагидро-2H-хромено[4,3-d]пиримидин-2,5(1H)-дион (0.5 ммоль) в 2 мл ДМФА, затем последовательно добавляют K2CO3 (2 ммоль) и йодистый метил CH3I (1.5 ммоль) и перемешивают реакционную массу при температуре 30°С в течение 3 часов. Затем раствор охлаждают и выделяют в холодную воду (10 мл). Выпавший осадок отфильтровывают и перекристаллизовывают из спирта. Сушат на воздухе при комнатной температуре. Получают 148 мг (77% от теории) (4R*,4a*S*,10bR*)-8-метокси-10b-метил-4-(3-нитрофенил)-1,2,3,4,4а,10b-гексагидро-2H-хромено[4,3-d]пиримидин-2,5(1H)-диона - кристаллический осадок белого цвета, Тпл = 208-210°С. ИК спектр, ν/см-1: 3383 (NH), 1768, 1677 (С=O), 1621, 1585 (Ar), 1267, 1156 (С-О). Спектр ЯМР 1Н (400 МГц, δ, м.д., J/Гц): 1.38 (с, 3Н, С(10b)СН3); 3.30 (д, 1Н, С(4а)Н, J=10.8); 3.80 (с, 3Н, С(8)ОСН3); 4.37 (д, 1Н, С(4)Н, J=10.8); 6.81 (д, 1Н, С(7)Н, J=2.5); 6.92 (дд, 1Н, С(9)Н, J=8.6, 2.5); 7.02 (с, 1Н, N(3)H); 7.45 (д, 1Н, С(10)Н, J=8.5); 7.65 (т, 1Н, С(5')Н, J=7.9); 7.73 (уш.с, 1H, N(1)H); 7.80 (д, 1Н, С(6')Н, J=7.7); 8.20 (уш. д, 1Н, С(4')Н, J=8.6); 8.24 (уш. с, 1Н, С(2')Н). Спектр ЯМР 13С (126 МГц, δ, м.д.): 28.46, 51.87, 52.83, 53.15, 55.59, 102.5, 111.34, 121.72, 122.31, 123.26, 126.50, 129.91, 134.49, 141.70, 147.75, 148.49, 154.01, 160.01, 165.73. Масс-спектр (ЭУ, 70 эВ), m/z (Iотн, (%)): 383 [М]+ (41), 366 (53), 339 (17), 323 (31), 232 (100), 191 (45), 177 (44), 162 (32), 147 (32), 104 (26), 77 (39). Найдено (%): С, 59.41; Н, 4.52; N, 11.03. C19H17N3O6. Вычислено (%): С, 59.53; Н, 4.47; N, 10.96.
Пример 6. метил 2-((4R*,4aS*,10bR*)-10b-метил-4-(3-нитрофенил)-2,5-диоксо-1,3,4,4а,5,10b-гексагидро-2H-хромено[4,3-d]пиримидин-8-ил)окси)ацетат:
Растворяют (4R*,4aS*,10bR*)-8-гидрокси-10b-метил-4-(3-нитрофенил)-1,2,3,4,4а,10b-гексагидро-2H-хромено[4,3-d]пиримидин-2,5(1H)-дион (0.5 ммоль) в 2 мл ДМФА, затем последовательно добавляют K2CO3 (2 ммоль) и метиловый эфир бромуксусной кислоты BrCH2COOCH3 (1.5 ммоль) и перемешивают реакционную массу при температуре 20°С в течение 4 часов. Затем раствор охлаждают и выделяют в холодную воду (10 мл). Выпавший осадок отфильтровывают и перекристаллизовывают из спирта. Сушат на воздухе при комнатной температуре. Получают 138 мг (62% от теории) метил 2-((4R*,4aS*,10bR*)-10b-метил-4-(3-нитрофенил)-2,5-диоксо-1,3,4,4а,5,10b-гексагидро-2H-хромено[4,3-d]пиримидин-8-ил)окси)ацетата - кристаллический осадок белого цвета, Тпл = 139-140°С. ИК спектр, ν/см-1: 3374 (NH), 1760, 1679 (С=O), 1623, 1590 (Ar), 1212, 1161, 1144 (С-О). Спектр ЯМР 1Н (400 МГц, δ, м.д, J/Гц): 1.38 (с, 3Н, С(10b)СН3); 3.29 (д, 1Н, С(4а)Н, J=10.8); 3.73 (с, 3Н, С(8)ОСН3); 4.36 (д, 1Н, С(4)Н, J=10.8); 4.86 (с, 2Н, С(8)ОСН2); 6.83 (д, 1Н, С(7)Н, J=2.2); 6.93 (дд, 1Н, С(9)Н, J=8.6, 2.2); 7.03 (с, 1Н, N(3)H); 7.45 (д, 1H, С(10)Н, J=8.6); 7.65 (т, 1Н, С(5')Н, J=7.9); 7.75 (уш с, 1Н, N(1)H); 7.76 (д, 1Н, С(6')Н, J=7.9); 8.20 (уш д, 1Н, С(4')Н, J=7.9); 8.23 (уш. с 1Н, С(2')Н). Спектр ЯМР 13С (126 МГц, δ, м.д.): 28.40, 51.75, 51.89, 52.83, 53.15, 64.90, 103.39, 111.66, 122.30, 122.51, 123.29, 126.57, 129.94, 134.48, 141.68, 147.75, 148.41, 153.98, 158.31, 165.64, 168.94. Масс-спектр (ЭУ, 70 эВ), m/z (Iотн, (%)): 441 [M]+ (18), 426 (20), 424 (50), 397(17), 381(26), 276 (16), 249 (34), 232 (100), 177(23), 151(16), 147(12), 103 (10), 77(10). Найдено (%): С, 56.93; Н, 4.30; N, 9.47. C2,H19N308. Вычислено (%): С, 57.14; Н, 4.34; N, 9.52.
Пример 7. (4R*,4aS*,10bR*)-8-(бензилокси)-10b-метил-4-(3-нитрофенил)-1,2,3,4,4а,10b-гексагидро-2H-хромено[4,3-d]пиримидин-2,5(1H)-дион:
Растворяют (4R*,4aS*,10bR*)-8-гидрокси-10b-метил-4-(3-нитрофенил)-1,2,3,4,4а,10b-гексагидро-2H-хромено[4,3-d]пиримидин-2,5(1H)-дион (0.5 ммоль) в 2 мл ДМФА, затем последовательно добавляют K2CO3 (2 ммоль) и бензилхлорид C6H5CH2Cl (1.5 ммоль) и перемешивают реакционную массу при температуре 40°С в течение 4 часов, а затем еще в течение 2 часов при температуре 75°С до полного завершения реакции. После этого раствор охлаждают и выделяют в холодную воду (10 мл). Выпавший осадок отфильтровывают и перекристаллизовывают из спирта. Сушат на воздухе при комнатной температуре. Получают 97 мг (42% от теории) (4R*,4aS*,10bR*)-8-(бензилокси)-10b-метил-4-(3-нитрофенил)-1,2,3,4,4а,10b-гексагидро-2H-хромено[4,3-d]пиримидин-2,5(1H)-диона - кристаллический осадок белого цвета, Тпл = 145-147°С. ИК спектр, ν/см-1: 3221 (NH), 1770, 1671 (С=O), 1619, 1596 (Ar), 1579 (N02), 1265, 1159 (С-О). Спектр ЯМР 1Н (400 МГц, δ, м.д, J/Гц): 1.38 (с, 3Н, С(10b)СН3); 3.29 (д, 1Н, С(4а)Н, J=10.8); 4.37 (д, 1Н, С(4)Н, J=10.8); 5.14 (с, 2Н, С(8)ОСН2); 6.89 (д, 1Н, С(7)Н, J=2.0); 7.00 (дд, 1Н, С(9)Н, J=8.6, 2.0); 7.01 (с, 1Н, N(3)H); 7.33-7.49 (м, 6Н, С(10, 2'', 3'', 4'', 5'', 6'')Н), 7.65 (т, 1Н, С(5')Н, J=7.90); 7.73 (с, 1Н, 1Н, N(1)H); 7.76 (д, 1Н, С(6')Н, J=7.9); 8.19 (д, 1Н, С(4')Н, J=8.3); 8.23 (с, Н С(2')Н). Спектр ЯМР 13С (126 МГц, δ, м.д.): 28.43, 51.82, 52.83, 53.15, 69.74, 103.33, 111.98, 121.97, 122.30, 123.27, 126.53, 127.86 (2 С), 128.00, 128.47, 129.92, 134.47, 136.59, 141.69, 147.73, 148.45, 153.96, 159.10, 165.70. Масс-спектр (ЭУ, 70 эВ), m/z (Iотн, (%)):.459 [М]+ (2), 442 (6), 415(9), 399 (49), 369(5), 294 (5), 91 (100),. Найдено (%): С, 65.03; Н, 4.64; N,9.14. C25H21N3O6. Вычислено (%): С, 65.35; Н, 4.61; N, 9.15.
Использование предложенного метода синтеза О-алкилированных гексагидро-2H-хромено[4,3-d]пиримидин-2,5(1H)-дионов позволяет получать новые ранее неописанные в литературе замещенные хромено[4,3-d|пиримидин-5-оны.
Техническим результатом изобретения является получение новых химических соединений достаточной степени чистоты, которые могут быть использованы в качестве прекурсоров для синтеза биологически активных веществ и лекарственных препаратов.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения замещенных 8-гидрокси-1,2,3,4,4a,10b-гексагидро-2H-хромено[4,3-d]пиримидин-2,5(1H)-дионов | 2022 |
|
RU2785713C1 |
| Способ получения замещенных (4R*,5S*,6R*)-2-тиогексагидропиримидин-5-карбогидразидов | 2021 |
|
RU2776954C1 |
| Способ получения 4-арилзамещенных 8-гидрокси-5,10а-диметил-1,3,4,10а-тетрагидро-2Н-хромено[2.3-d]пиримидин-2-онов(тионов) | 2023 |
|
RU2821110C1 |
| РЕГУЛЯТОРЫ-ПРОИЗВОДНЫЕ СТЕРОИДОВ, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2797408C2 |
| Макрогетероциклические нуклеозидные производные и их аналоги, получение и применение | 2017 |
|
RU2731385C1 |
| ЗАМЕЩЕННОЕ ГЕТЕРОЦИКЛИЧЕСКОЕ КОНДЕНСИРОВАННОЕ ЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2020 |
|
RU2815814C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИСПИРОИНДОЛИНОНОВ НА ОСНОВЕ 5-ИНДОЛИДЕН-2-ТИОГИДАНТОИНОВ | 2020 |
|
RU2756463C1 |
| ПРОИЗВОДНЫЕ ПИРРОЛОПИРИМИДИНА, ПОЛЕЗНЫЕ В КАЧЕСТВЕ ИНГИБИТОРОВ JAK-КИНАЗЫ | 2012 |
|
RU2618673C2 |
| Производные 2-(хромено[4,3-b]пиридин-5-ил)уксусной кислоты и способ их получения | 2021 |
|
RU2793186C1 |
| ГИДРОКСИПУРИНОВЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2016 |
|
RU2685417C1 |
Настоящее изобретение относится к способу получения замещенных О-алкилированных гексагидро-2H-хромено[4,3-d]пиримидин-2,5(1H)-дионов общей формулы
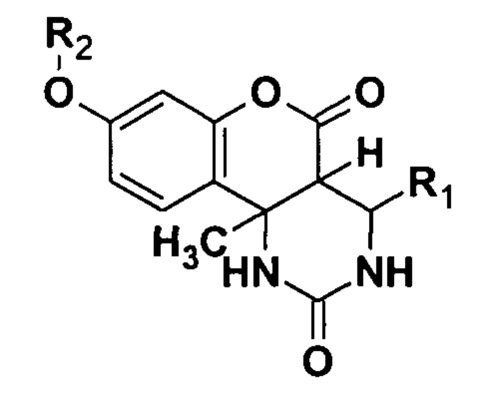
где R1 = С6Н5, или 4-ClC6H4, или 4-МеОС6Н4, или 3-NO2C6H4, R2 = СН3, или СН2С(O)ОСН3, или СН2С6Н5. Предлагаемый способ заключается в том, что в качестве исходных реагентов для синтеза О-алкилированных гексагидро-2H-хромено[4,3-d]пиримидин-2,5(1H)-дионов используют диастереомерно чистые 8-гидрокси-10b-метил-4-R1-1,2,3,4,4а,10b-гексагидро-2H-хромено[4,3-d]пиримидин-2,5(1H)-дионы, которые растворяют в ДМФА, затем последовательно добавляют карбонат калия (K2CO3) и один из алкилирующих агентов (CH3I, или BrCH2COOCH3, или C6H5CH2Cl) и перемешивают реакционную массу при температуре 20…40°С в течение 2-4 часов. При этом при использовании в качестве алкилирующего агента C6H5CH2Cl реакционную массу дополнительно перемешивают еще в течение 2 часов при температуре 70…80°С до полного завершения реакции. Далее полученную реакционную массу охлаждают и выделяют в холодную воду, выпавший осадок отфильтровывают и перекристаллизовывают из спирта, сушат на воздухе при комнатной температуре. Технический результат - получение новых химических соединений достаточной степени чистоты, которые могут быть использованы в качестве прекурсоров для синтеза биологически активных веществ и лекарственных препаратов. 7 пр.
Способ получения замещенных О-алкилированных гексагидро-2H-хромено[4,3-d]пиримидин-2,5(1H)-дионов общей формулы
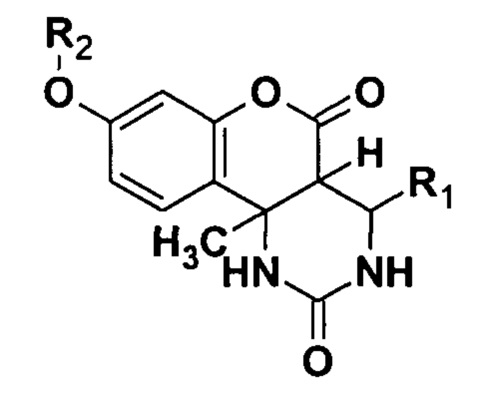
где R1 = С6Н5, или 4-ClC6H4, или 4-МеОС6Н4, или 3-NO2C6H4, R2 = СН3, или СН2С(O)ОСН3, или СН2С6Н5,
заключающийся в том, что в качестве исходных реагентов для синтеза О-алкилированных гексагидро-2H-хромено[4,3-d]пиримидин-2,5(1H)-дионов используют диастереомерно чистые 8-гидрокси-10b-метил-4-R1-1,2,3,4,4а,10b-гексагидро-2H-хромено[4,3-d]пиримидин-2,5(1H)-дионы, которые растворяют в ДМФА, затем последовательно добавляют карбонат калия (K2CO3) и один из алкилирующих агентов (CH3I, или BrCH2COOCH3, или C6H5CH2Cl) и перемешивают реакционную массу при температуре 20…40°С в течение 2-4 часов, при использовании в качестве алкилирующего агента C6H5CH2Cl реакционную массу дополнительно перемешивают еще в течение 2 часов при температуре 70…80°С до полного завершения реакции, далее полученную реакционную массу охлаждают и выделяют в холодную воду, выпавший осадок отфильтровывают и перекристаллизовывают из спирта, сушат на воздухе при комнатной температуре.
| P.K.Ambre et al., Design, synthesis, and evaluation of 4-(substituted)phenyl2-thioxo-3,4-dihydro-1H-chromino[4,3-d]pyrimidin-5-one and 4-(substitutedphenyl-3,4-dihydro-1H-chromino[4,3-d]pyrimidine-2,5-dione analogs as antitubercular agents | |||
| Medicinal Chemistry Research, 2014, 23(5), 2564-2575 | |||
| P.K.Sahu et al., One-pot facile and mild construction |
Авторы
Даты
2023-05-25—Публикация
2022-03-16—Подача