Область изобретения
Настоящее изобретение относится к способам очистки лакто-N-неотетраозы (Gal(β1-4)GlcNAc(β1-3)Gal(β1-4)Glc). Более конкретно, настоящее изобретение относится к простому и экономичному способу отделения лакто-N-неотетраозы от других углеводов, таких как лакто-N-триозы, лактоза и моносахариды, а также больших по размеру олигосахаридов, таких как пара-лакто-N-неогексаоза, которые могут присутствовать в качестве загрязняющих углеводов в ферментационном бульоне, если указанную лакто-N-неотетраозу получают посредством микробной ферментации.
Предшествующий уровень техники
Человеческое грудное молоко считается наилучшим питанием для развития младенца. Оно состоит из жиров, белков, витаминов, минеральных веществ, микроэлементов и сложных олигосахаридов. Помимо лактозы человеческое грудное молоко, а также молоко других млекопитающих, содержит разные структурно различные олигосахариды, которые также известны, как олигосахариды грудного молока (ОГМ) (Usashima Т. et al., (2011) Milk Oligosaccharides, Nova Biomedical Books, New York ISBN 978-1-61122-831-1).
Попытки получить ОГМ химически или посредством биотехнологических подходов привлекли внимание ввиду полезных свойств ОГМ в отношении развития флоры желудочно-кишечного тракта, что, таким образом, поддерживает их применение в продуктах питания (в частности, питания младенцев и маленьких детей, а также в медицинских продуктах питания и продуктах питания взрослых).
Помимо данных пробиотических свойств, к настоящему времени наблюдали много других положительных эффектов ОГМ, что расширяет область их применения (Morrow A.L. & Yu, Y. (2017) Potential public health impact of human milk oligosaccharides. In: Prebiotics and probiotics in human milk. McGuire, M., McGuire, M. & Bode, L. (Eds.) Academic Press, London, pp 207-222).
Ограниченное предложение и сложности получения чистых фракций отдельных олигосахаридов грудного молока приводят к разработке химических путей получения некоторых из данных сложных молекул. Однако, синтез олигосахаридов грудного молока посредством химического синтеза, посредством ферментативного синтеза или посредством ферментации, как оказалось, представляет собой сложную задачу. По меньшей мере получение производственных количеств, а также количеств, достаточных для применений в пищевой промышленности, казалось сложным до сегодняшнего дня.
Из-за сложностей, сопровождающих химический синтез олигосахаридов грудного молока, было разработано несколько ферментативных способов и ферментативных подходов. В частности, ферментативный подход требует очистки желательного олигосахарида от весьма сложного ферментационного бульона, содержащего несколько сотен разных молекул. Отдельно взятая углеводная фракция ферментационного бульона состоит из сложной смеси моно- и олигосахаридов, включая субстраты (например, лактозу и другие сахара, используемые в качестве источника углерода), биосинтетических промежуточных веществ, отдельных моносахаридов, побочных продуктов метаболизма и других полисахаридов, синтезируемых микробом. Кроме того, структуры многих из олигосахаридов, встречающихся в ферментационном бульоне, структурно неизвестны (например, олигосахариды, получаемые посредством синтеза структур гликозилирования клеточной поверхности, подобных встречающимся в природе у хозяина). Таким образом, во многих случаях очистка биотехнологического продукта является гораздо более дорогой, по сравнению с его получением посредством ферментации. В частности, ферментация лакто-N-неотетраозы часто ассоциирована с избыточным синтезом лакто-N-триозы II, биосинтетическим промежуточным веществом в биосинтезе лакто-N-неотетраозы, которое часто экспортируется из клетки в среду. Лакто-N-триозу II можно удалить из ферментационного бульона посредством обработки гликозидазой или хроматографической стадии в способе очистки. За счет β-1,4-связанного остатка галактозы на невосстанавливающем конце лакто-N-неотетраозы, невосстанавливающий конец очень похож на лактозу, что часто приводит к еще одной реакции гликозилирования посредством гликозилтрансфераз, присутствующих в штамме микроорганизма микробной ферментации или посредством гликозилтрансфераз, используемых в биокаталитической реакции. Это приводит к образованию пентаоз, гексаоз, гептаоз и даже больших по размеру олигосахаридов (сверхгликозилирование желательного продукта - лакто-N-неотетраозы). Кроме того, автоклавирование (тепловая обработка) углеводов (например, лактозы) приводит к образованию нежелательных побочных продуктов, таких как продукты альдольной реакции или реакции Майяра, или реакциям перегруппировки (например, превращение лактозы в лактулозу). Наличие таких загрязняющих веществ, в частности в больших количествах, в конечном продукте является нежелательным или неприемлемым.
Способы очистки отдельных олигосахаридов от ферментационного бульона «современного уровня техники» являются технически сложными и часто неэкономичными, в частности, когда указанный олигосахарид предназначен для применений в пище. Для очистки дисахарида лактоза или сахароза от сложных смесей, таких как молочная сыворотка или патока, были разработаны промышленные способы, которые включают множественные стадии кристаллизации. Однако, указанные способы дорабатываются и приводят лишь к низким выходам. Также, данные способы не применимы для предоставления сахарида, подходящего для применения в пищевой промышленности, поскольку молочная сыворотка и патока уже являются пищевым продуктом.
Однако, способы фильтрации, подобно ультрафильтрации, микрофильтрации и нанофильтрации, технически легко осуществить, если все параметры способа известны и оптимизированы. Диафильтрация является еще одним подходящим способом, который включает добавление к раствору свежей воды для удаления мембранопроницаемых компонентов. Ультрафильтрацию и микрофильтрацию обычно используют для отделения гораздо более крупных молекул, подобно белкам или клеткам, от ферментационного бульона или водного раствора. Кроме того, удаление воды, минеральных веществ и очень маленьких молекул посредством нанофильтрации хорошо известно и используется в молочной промышленности для концентрирования и деминерализации молочной сыворотки. В большинстве случаев материалы мембраны для нано- и ультрафильтрации основаны на материалах, подобно пиперазину, полиамиду, полиэфирсульфону, полиэтиленгликолю и керамике. Мембраны могут быть собраны, например, в виде половолоконных модулей, спиральнонавитых модулей и мембран с плоским слоем, и данная сборка может приводить к разным выполнениям разделения. В общем, нанофильтрационные мембраны обладают порогом отсечения по молекулярной массе в интервале 150-300 дальтон. Мембраны с порогом отсечения по молекулярной массе в интервале 400-600 дальтон являются очень редкими, особенно для крупномасштабного промышленного производства. Это делает разделение олигосахаридов еще сложнее, поскольку необходимы другие методики разделения, такие как хроматография, или партиями или в непрерывном режиме.
Для получения олигосахаридов грудного молока посредством микробной ферментации используют рекомбинантные микроорганизмы (рекомбинантные штаммы бактерий или дрожжей). Такое применение приводит к загрязнению ферментационного бульона рекомбинантным материалом, таким как молекулы нуклеиновых кислот и полипептиды, происходящие из данного микроорганизма. Однако, загрязнение продукта для потребления человеком рекомбинантной ДНК или белками на сегодняшний день является неприемлемым как со стороны регулирующих органов, так и потребителей. Таким образом, любые нуклеиновые кислоты и белки, происходящие из рекомбинантного микроорганизма, должны быть удалены из желательных олигосахаридов грудного молока. Пределы обнаружения для рекомбинантных молекул ДНК на сегодняшний день являются очень низкими, что требует схем тщательной очистки. В случае выявления ДНК на основе кПЦР (количественная полимеразная цепная реакция), в образце может быть выявлено даже вплоть до одиночной молекулы ДНК.
Использовали хроматографические способы очистки лакто-N-неотетраозы и близкородственных олигосахаридов грудного молока - лакто-N-тетраозы (Galβ1-3GlcNAcβ1-3-Galβ1-4Glu), в частности эксклюзионную хроматографию (Dumon et al., (2001) In Vivo Fucosylation of lacto-N-neotetraose and lacto-N-neohexaose by Heterologous Expression of Helicobacter pylori α1,3-Fucosyltransferase in Engineered Escherichia coli. Glycoconj. J. 18, 465-474; Priem et al., (2002) A new fermentation process allows large-scale production of human milk oligosaccharides by metabolically engineered bacteria. Glycobiology 12, 235-240;  (2014) Synthesis of the human milk oligosaccharide lacto-N-tetraose in metabolically engineered, plasmid-free E. coli. Chembiochem 15, 1896-1900). Тогда как эксклюзионная хроматография представляет собой удобный лабораторный метод, только хроматография с псевдодвижущимся слоем представляет подходящий способ очистки LNnT в масштабах, сопоставимых с производством продуктов питания. Однако, все другие опубликованные способы страдают недостатком, заключающимся в том, что загрязняющие углеводы, в частности углеводы, связанные со сверхгликозилированием, не могут быть эффективно удалены из желательного продукта.
(2014) Synthesis of the human milk oligosaccharide lacto-N-tetraose in metabolically engineered, plasmid-free E. coli. Chembiochem 15, 1896-1900). Тогда как эксклюзионная хроматография представляет собой удобный лабораторный метод, только хроматография с псевдодвижущимся слоем представляет подходящий способ очистки LNnT в масштабах, сопоставимых с производством продуктов питания. Однако, все другие опубликованные способы страдают недостатком, заключающимся в том, что загрязняющие углеводы, в частности углеводы, связанные со сверхгликозилированием, не могут быть эффективно удалены из желательного продукта.
Таким образом, цель настоящего изобретения заключалась в предложении простого и экономически выгодного способа очистки лакто-N-неотетраозы от продуктов микробной ферментации, где нуклеиновые кислоты и полипептиды, происходящие из рекомбинантного микроорганизма, могут быть отделены от желательных олигосахаридов, а также других указанных углеводов.
Несколько ферментативных подходов было уже разработано для ОГМ более простой структуры, таких как лакто-N-неотетраоза, с использованием сконструированных микробов, таких как штаммы Escherichia coli (например, ЕР 3 141610 А1; WO 2001/004341 A1; Bode, L. et al., (2017) Making human milk oligosaccharides available for research and application - approaches, challenges, and future opportunities. In: Prebiotics and probiotics in human milk. McGuire, M., McGuire, M. & Bode, L. (Eds.) Academic Press, London, pp 251-293).
Однако, также для получения олигосахаридов можно использовать другие подходы микробной ферментации. Помимо бактериальных систем также можно использовать эукариотические производственные штаммы, например, дрожжи и, в частности, Saccharomyces cerevisiae, или любого близкого родственника. В отличие от многих других предположительных производственных организмов, Saccharomyces cerevisiae представляет собой микроорганизм, одобренный для производства пищевых продуктов.
По существу, микроорганизм должен быть генетически сконструирован для поглощения лактозы или для эндогенного биосинтеза лактозы из легко доступного источника углерода (например, глюкозы, галактозы, сахарозы, фруктозы, ксилозы, глицерина и т.д.). Активности, относящиеся к метаболизму лактозы и образованию побочных продуктов, должны быть инактивированы или понижены до степени, которую может достигать продукция лакто-N-неотетраозы. Лакто-N-неотетраозу затем синтезируют посредством ферментативной активности двух гликозилтрансфераз, β-1,3-N-ацетилглюкозаминилтрансферазы и β-1,4-галактозилтрансферазы. Известно несколько гликозилтрансфераз для синтеза лакто-N-неотетраозы, таких как β-1,3-N-ацетилглюкозаминилтрансфераза N. meningitides, кодируемая геном lgtA, и β-1,4-галактозилтрансфераза Helicobacter pylori, кодируемая геном galT. Предпочтительно, экспортер экспрессируется в рекомбинантном микроорганизме для экспорта желательного олигосахарида в ферментационную среду, из которой указанный олигосахарид затем может быть очищен.
Краткое изложение сущности изобретения
Предложен способ очистки лакто-N-неотетраозы, который является простым, экономически эффективным и масштабируемым. Способ очистки лакто-N-неотетраозы может быть осуществлен без применения органического растворителя для кристаллизации указанной лакто-N-неотетраозы. Кроме того, способ очистки лакто-N-неотетраозы можно осуществить без стадии прерываемой хроматографии.
Лакто-N-неотетраоза (Gal(β-4)GlcNAc(β1-3)Gal(β1-4)Glc) представляет олигосахарид грудного молока, чье включение в детскую питательную смесь и лечебный продукт питания является крайне желательным. Высокая стоимость лакто-N-неотетраозы препятствует ее широкому применению, в частности, в детской питательной смеси. В частности, очистка продуктов от продуктов микробной ферментации часто является сложной и дорогой. Также применение органических растворителей и стадий прерываемой хроматографии делает лакто-N-неотетраозу и другие нейтральные олигосахариды чрезмерно дорогими. Также применение этанола неприменимо по некоторым религиозным пищевым стандартам, например, Халяль. Таким образом, изобретение относится к простому экономически эффективному способу очистки лакто-N-неотетраозы от продуктов микробной ферментации с использованием рекомбинантного технологического вспомогательного средства, приводящему к получению продукта лакто-N-неотетраоза, подходящего для потребления человеком, в частности, подходящего для детской питательной смеси и лечебных продуктов питания.
Способ очистки основан на мембранах для очистки/отделения лакто-N-неотетраозы (Gal(β-4)GlcNAc(β1-3)Gal(β1-4)Glc) от загрязняющих углеводов. Разработанные способы представляют экономически эффективную альтернативу хроматографическим способам очистки или способам очистки на основе кристаллизации. Созданное изобретение в частности имеет значимость для очистки лакто-N-нео-тетраозы, полученной посредством микробной ферментации с использованием бактерий или дрожжей в качестве хозяев-продуцентов и биокаталитических способов, в которых используются неочищенные или очищенные ферменты. Способ очистки лакто-N-неотетраозы включает две стадии мембранной фильтрации, где одна мембрана имеет порог отсечения по молекулярной массе от примерно 300 до примерно 500 дальтон, и где другая мембрана имеет порог отсечения по молекулярной массе от примерно 600 до примерно 800 дальтон.
В одном аспекте изобретения любая из двух стадий мембранной фильтрации может быть заменена стадией непрерывной хроматографии, такой как хроматография с псевдодвижущимся слоем (SMB - от англ. simulated moving bed).
Краткое описание графических материалов
На Фиг. 1 изображен результат анализа ВЭЖХ (Высокоэффективная жидкостная хроматография) композиции, содержащей несколько сахаридов, и проиллюстрирован принцип очистки лакто-N-неотетраозы с использованием двух стадий мембранной фильтрации.
На Фиг. 2 изображен результат анализа ВЭЖХ элюата, полученного после обработки ионообменником ферментационного бульона после микробной ферментации для получения лакто-N-неотетраозы.
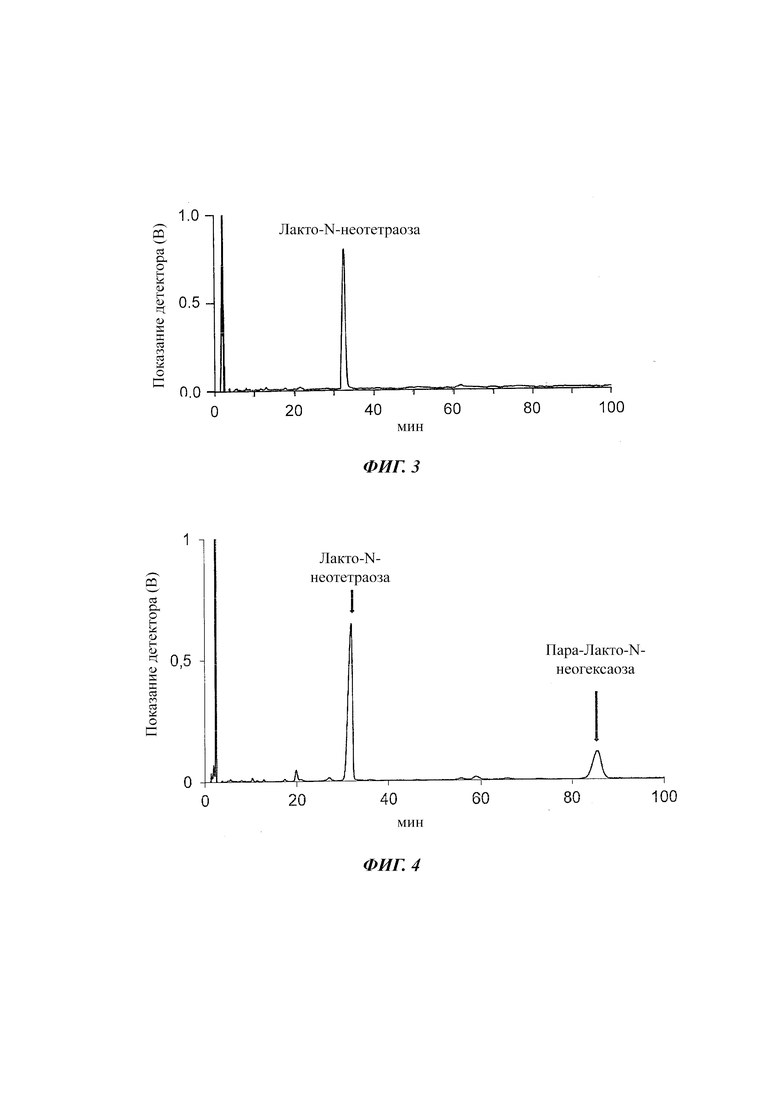
На Фиг. 3 изображен результат анализа ВЭЖХ элюата, полученного после обработки ионообменником ферментационного бульона после микробной ферментации для получения лакто-N-неотетраозы и подвергания двум стадиям мембранной фильтрации.
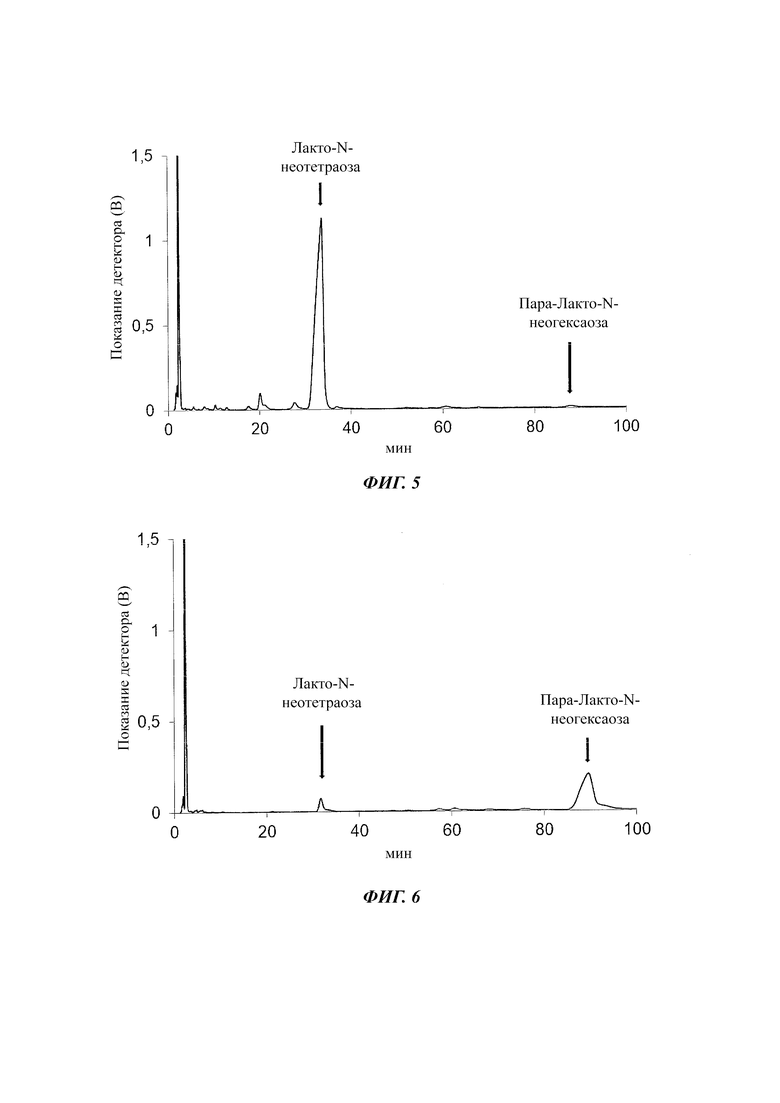
На Фиг. 4 изображен результат анализа ВЭЖХ подачи SMB
На Фиг. 5 изображены результаты анализа ВЭЖХ экстракта SMB.
На Фиг. 6 изображены результаты анализа ВЭЖХ рафината SMB.
Подробное описание
Предложен способ очистки лакто-N-неотетраозы от других углеводов, где данный способ включает стадии подвергания водного раствора, содержащего лакто-N-неотетраозу и другие указанные углеводы, двум стадиям мембранной фильтрации с использованием разных мембран, где одна мембрана имеет порог отсечения по молекулярной массе от примерно 300 до примерно 500 дальтон, и где другая мембрана имеет порог отсечения по молекулярной массе от примерно 600 до примерно 800 дальтон.
Мембрана, имеющая порог отсечения по молекулярной массе от примерно 300 до примерно 500 дальтон, делает возможным удаление основной части углеводов, имеющих молекулярную массу, которая меньше, чем молекулярная масса LNnT. При фильтрации LNnT и углеводы, имеющие молекулярную массу больше, чем молекулярная масса LNnT, остаются в ретентате.
В дополнительном и/или альтернативном воплощении мембрана, имеющая порог отсечения по молекулярной массе от примерно 300 до примерно 500 дальтон, имеет размер пор от 1 до 2 нм.
Подходящие мембраны для удаления основной части углеводов, имеющих молекулярную массу, которая меньше молекулярной массы LNnT, представляют сбой, например, TriSep XN-45 (TriSep Corporation, США), Dairy DK (Suez Water Technologies, formely GE) и Filmtech NF270 (Dow, Midland, MI, США).
Мембрана, имеющая порог отсечения по молекулярной массе от примерно 600 до примерно 800 дальтон, обладает проницаемостью к лакто-N-неотетраозе и углеводам, имеющим молекулярную массу меньше, чем молекулярная масса LNnT. При фильтрации LNnT находится в фильтрате, тогда как углеводы, имеющие молекулярную массу больше, чем молекулярная масса LNnT, остаются в ретентате.
В дополнительном и/или альтернативном воплощении мембрана, имеющая порог отсечения по молекулярной массе от примерно 600 до примерно 800 дальтон, имеет размер пор 2,5-3 нм.
Подходящие мембраны для обладания проницаемостью в отношении LNnT и задерживания в том случае, когда углеводы имеют молекулярную массу больше, чем молекулярная масса LNnT, в ретентате, представляют собой, например, мембрану 0,65 кДа TangenX SIUS TFF (Repligen Corporation), модули Zirkonia 3 нм (Pervatech BV) и S-CUT YSNF-YS600 
Способ не подразумевает применения дорогих стадий прерывающейся хроматографии и также делает ненужными стадии осаждения или кристаллизации с использованием органических растворителей. Таким образом, в дополнительном и/или альтернативном воплощении способ не включает одной или более стадий прерывающейся хроматографии и/или одной или более стадий осаждения и/или кристаллизации LNnT посредством использования органического растворителя.
В дополнительном и/или альтернативном воплощении способа одна из двух стадий мембранной фильтрации может быть заменена непрерывной хроматографией, такой как хроматография с псевдодвижущимся слоем (SMB).
В дополнительном и/или альтернативном воплощении способ очистки лакто-N-неотетраозы от других углеводов характеризуется тем, что способ включает стадии подвергания водного раствора, содержащего лакто-N-неотетраозу, стадии мембранной фильтрации с использованием мембраны, имеющей порог отсечения по молекулярной массе от примерно 300 до примерно 500 дальтон, и подвергания водного раствора непрерывной хроматографии для удаления углеводов, имеющих молекулярную массу больше, чем молекулярная масса LNnT, из водного раствора.
Предпочтительно, стадию мембранной фильтрации проводят перед непрерывной хроматографией, в том отношении, что ретентат стадии мембранной фильтрации подвергают непрерывной хроматографии.
В другом дополнительном и/или альтернативном воплощении способ очистки лакто-N-неотетраозы от других углеводов характеризуется тем, что способ включает стадии подвергания водного раствора, содержащего лакто-N-неотетраозу, стадии мембранной фильтрации с использованием мембраны, имеющей порог отсечения по молекулярной массе от примерно 600 до примерно 800 дальтон, и подвергания водного раствора непрерывной хроматографии для удаления углеводов, имеющих молекулярную массу меньше, чем молекулярная масса LNnT, из водного раствора. Предпочтительно, непрерывную хроматографию проводят перед стадией мембранной фильтрации, в том отношении, что элюат непрерывной хроматографии подвергают стадии мембранной фильтрации.
В дополнительном и/или альтернативном воплощении водный раствор получают в результате ферментации или ферментативного процесса получения лакто-N-неотетраозы.
Способ, описанный в данном документе, подходит для очистки олигосахарида грудного молока - лакто-N-неотетраозы от продуктов микробной ферментации или реакции биокатализа в многотонных количествах, поскольку он является экономически целесообразным и масштабируемым.
В дополнительном и/или альтернативном воплощении водный раствор получают в результате ферментации посредством отделения биомассы от ферментационного бульона. Предпочтительно, отделение биомассы от ферментационного бульона включает по меньшей мере одну стадию ультрафильтрации, предпочтительно две стадии ультрафильтрации, более предпочтительно первую ультрафильтрацию с использованием мембраны, имеющей порог отсечения по молекулярной массе примерно 500 кДа, и вторую ультрафильтрацию с использованием мембраны, имеющей порог отсечения по молекулярной массе примерно 150 кДа.
В дополнительном и/или альтернативном воплощении водный раствор обрабатывают катионообменной смолой, предпочтительно в форме Н+, и анионообменной смолой, предпочтительно в форме Cl-, более предпочтительно перед подверганием водного раствора стадиям мембранной фильтрации.
В дополнительном и/или альтернативном воплощении способ дополнительно включает стадию диализа, предпочтительно стадию электролиза, для удаления ионов.
Продукт можно наиболее удобным образом поставлять в виде стерильного концентрата или в виде продукта, подвергнутого распылительной сушке.
Способ делает возможной очистку лакто-N-неотетраозы, а именно отделение LNnT от других углеводов, где чистота лакто-N-неотетраозы в водном растворе составляет 70% или меньше, 60% или меньше, 50% или меньше, 40% или меньше, 30% или меньше, 20% или меньше; 10% или меньше или 5% или меньше перед очисткой, и/или водный раствор содержит лакто-N-неотетраозу с чистотой 80% или больше, предпочтительно 85% или больше или более предпочтительно 90% или больше после очистки.
В дополнительном и/или альтернативном воплощении очистка включает следующие стадии:
i) отделение биомассы от ферментационного бульона;
ii) подвергание бесклеточного ферментационного бульона обработке ионообменной смолой для удаления заряженного вещества;
iii) подвергание водного раствора, полученного на стадии ii., стадии мембранной фильтрации для удаления углеводов, имеющих молекулярную массу меньше, чем молекулярная масса лакто-N-неотетраозы;
iv) подвергание ретентата, полученного на стадии iii., стадии мембранной фильтрации для удаления углеводов, имеющих молекулярную массу больше, чем молекулярная масса лакто-N-неотетраозы;
v) повышение концентрации лакто-N-неотетраозы, находящейся в фильтрате стадии iv.
Ввиду того, что другие способы, используемые для очистки лакто-N-неотетраозы, являются довольно сложными и, вследствие этого, дорогими, способ, ранее описанный в данном документе, основан главным образом на применении двух стадий мембранной фильтрации. На одной стадии мембранной фильтрации загрязняющие вещества, меньше чем желательный продукт лакто-N-неотетраоза, отфильтровывают.На второй стадии фильтрации молекулы, больше чем молекулы, отфильтровывают от желательного продукта.
В другом воплощении одна из стадий мембранной фильтрации может быть заменена процессом хроматографии с псевдодвижущимся слоем. Хроматография с псевдодвижущимся слоем представляет, в отличие от других хроматографических процессов, непрерывный хроматографический способ, который также можно применять в многотонном масштабе и который, в сравнении с другими прерывающимися хроматографическими процессами, является чрезвычайно экономически выгодным.
В дополнительном и/или альтернативном воплощении способ очистки LNnT включает следующие стадии:
i) отделение биомассы от ферментационного бульона;
ii) подвергание бесклеточного ферментационного бульона обработке ионообменной смолой для удаления заряженного вещества;
iii) подвергание водного раствора, полученного на стадии ii., стадии мембранной фильтрации для удаления углеводов, имеющих молекулярную массу, меньше чем молекулярная масса лакто-N-неотетраозы;
iv) подвергание ретентата, полученного на стадии iii., непрерывной хроматографии для отделения углеводов, имеющих молекулярную массу, больше чем молекулярная масса лакто-N-неотетраозы; большего по размеру материала от лакто-N-неотетраозы;
v.) повышение концентрации лакто-N-неотетраозы, присутствующей в элюате стадии iv.
Согласно другому воплощению изобретения углеводы, имеющие молекулярную массу, которая меньше чем молекулярная масса LNnT (в частности меньшие олигосахариды и моносахариды), можно удалить посредством хроматографии с псевдодвижущимся слоем, и углеводороды, больше чем LNnT, посредством стадии мембранной фильтрации.
В дополнительном и/или альтернативном воплощении способ включает следующие стадии:
i.) отделение биомассы от ферментационного бульона;
ii.) подвергание бесклеточного ферментационного бульона обработке ионообменной смолой для удаления заряженного вещества;
iii.) подвергание водного раствора, полученного на стадии ii., непрерывной хроматографии с удалением углеводов, имеющих молекулярную массу, меньше чем молекулярная масса лакто-N-неотетраозы;
iv.) подвергание элюата стадии iii. стадии мембранной фильтрации с удалением углеводов, имеющих молекулярную массу, больше чем молекулярная масса лакто-N-неотетраозы;
v.) повышение концентрации лакто-N-неотетраозы в фильтрате, полученном на стадии iv.
Согласно другому воплощению изобретения одну или более гликозидаз используют в способе очистки LNnT для гидролиза определенных олигосахаридов на меньшие олигосахариды или моносахариды. Например, побочный продукт лакто-N-триоза II (GlcNAc(β1-3)Gal(β1-4)Glc) может расщепляться на N-ацетилглюкозамин и лактозу (Gal(β1-4)Glc) под действием N-ацетилгексозаминидазы, кодируемой геном bbhl Bifidobacterium bifidum. Лактоза может дополнительно расщепляться на моносахариды - глюкозу и галактозу под действием β-галактозидазы (например, может быть использована β-галактозидаза Escherichia coli, кодируемая геном lacZ, который может быть легко сверхэкспрессирован). Ген bbhl Bifidobacterium bifidum может быть также получен посредством сверхэкспрессии в Е. coli.
В дополнительном и/или альтернативном воплощении способ включает следующие стадии:
i.) отделение биомассы от ферментационного бульона;
ii.) добавление одной или более гликозидаз в ферментационный бульон, где указанные гликозидазы не осуществляют гидролиз LNnT, такие как, например, N-ацетилгексозаминидаза Bbhl В. bifidum;
iii.) подвергание бесклеточного ферментационного бульона обработке ионообменной смолой для удаления заряженного вещества.
iv.) подвергание водного раствора, полученного на стадии iii., стадии мембранной фильтрации для удаления углеводов, имеющих молекулярную массу, меньше чем молекулярная масса лакто-N-неотетраозы;
v.) подвергание ретентата, полученного на стадии iv., стадии мембранной фильтрации для удаления углеводов, имеющих молекулярную массу, больше чем молекулярная масса лакто-N-неотетраозы;
vi.) повышение концентрации лакто-N-неотетраозы, находящейся в фильтрате стадии v.
В дополнительном и/или альтернативном воплощении любая из двух стадий мембранной фильтрации может быть заменена непрерывной хроматографией, как описано ранее в данном документе.
В предпочтительном воплощении рекомбинантный микроорганизм, более предпочтительно генетически сконструированную Е. coli, добавляют в ферментационный бульон в конце процесса ферментации, где указанный рекомбинантный микроорганизм экспрессирует ген bbhl Bifidobacterium bifidum и/или экспрессирует или сверхэкспрессирует β-галактозидазу, предпочтительно β-галактозидазу, кодируемую геном lacZ Е. coli.
В дополнительном и/или альтернативном воплощении способ включает следующие стадии:
i.) добавление рекомбинантного микроорганизма, экспрессирующего ген bbhl Bifidobacterium bifidum и/или ген lacZ E. coli, в ферментационный бульон;
ii.) отделение биомассы от ферментационного бульона;
iii.) подвергание бесклеточного ферментационного бульона обработке ионообменной смолой для удаления заряженного вещества;
iv.) подвергание водного раствора, полученного на стадии ii., стадии мембранной фильтрации для удаления углеводов, имеющих молекулярную массу, меньше чем молекулярная масса лакто-N-неотетраозы;
v.) подвергание ретентата, полученного на стадии iii., стадии мембранной фильтрации для удаления углеводов, имеющих молекулярную массу, больше чем молекулярная масса лакто-N-неотетраозы;
vi.) повышение концентрации лакто-N-неотетраозы, находящейся в фильтрате стадии iv.
В дополнительном и/или альтернативном воплощении любая из двух стадий мембранной фильтрации может быть заменена непрерывной хроматографией, как ранее описано в данном документе.
Некоторые воплощения изобретения включают одну или более дополнительных возможных стадий, таких как стадии диализа (для удаления солей), электродиализ (для удаления заряженных молекул), обработка активированным углем (для обесцвечивания раствора продукта) и/или другие процессы фильтрации (подобно удалению эндотоксинов и/или стерильной фильтрации). Хотя и необязательно, способ может включать обработку водного раствора, содержащего LNnT, органическим растворителем (таким как короткоцепочечные спирты, подобно метанолу) для осаждения загрязняющих олигосахаридов или для элюирования после адсорбции на активированном угле с помощью смесей короткоцепочечных спиртов и воды, и/или для кристаллизации лакто-N-неотетраозы.
Настоящее изобретение будет описано в отношении конкретных воплощений и со ссылкой на графические материалы, но данное изобретение не ограничивается ими, а только формулой изобретения. Кроме того, термины первый, второй и тому подобное в описании и в формуле изобретения используются для проведения различия между похожими элементами и не обязательно для описания последовательности, во времени, в пространстве, по рангу или любым другим образом. Следует понимать, что термины, используемые таким образом, являются взаимозаменяемыми в соответствующих обстоятельствах, и что воплощения изобретения, описанные в данном документе, способны работать в последовательностях, отличных от описанных или проиллюстрированных в данном документе.
Следует понимать, что термин «содержащий», используемый в формуле изобретения, не следует считать ограничивающимся средствами, перечисленными в дальнейшем; он не исключает других элементов или стадий. Таким образом, его следует считать определяющим наличие заявленных признаков, целых чисел, стадий или компонентов, на которые ссылаются, но он не исключает наличие или добавление одного или более других признаков, целых чисел, стадий или компонентов или их групп. Таким образом, объем выражения «устройство, содержащее средства А и В» не следует ограничивать устройствами, состоящими только из компонентов А и В. Оно означает, что в отношении настоящего изобретения, единственными релевантными компонентами устройства являются А и В.
Ссылка на всем протяжении данного описания изобретения на «одно воплощение» или «воплощение» означает, что конкретный признак, структура или характеристика, описанные в связи с данным воплощением, включены в по меньшей мере одно воплощение настоящего изобретения. Таким образом, появления фраз «в одном воплощении» или «в воплощении» в разных местах по всему объему данного описания изобретения не обязательно все относятся к одному и тому же воплощению, но могут. Кроме того, конкретные признаки, структуры или характеристики могут быть объединены любым подходящим образом, как будет очевидно обычному специалисту в данной области из данного раскрытия, в одном или более воплощениях.
Аналогично следует понимать, что в описании иллюстративных воплощений изобретения разные признаки изобретения иногда сгруппированы вместе в одном единственном воплощении, фигуре или его описании в целях упрощения раскрытия и помощи в понимании одного или более разных аспектов изобретения. Данный способ раскрытия, однако, не нужно считать отражающим мысль, что заявленное изобретение требует больше признаков, чем явным образом перечислены в каждом пункте. Скорее, как отражено в следующей формуле изобретения, аспекты изобретения заключаются меньше чем во всех признаках одного вышеизложенного раскрытого воплощения. Таким образом, формула изобретения после подробного описания явным образом включена тем самым в данное подробное описание, причем каждый пункт отдельно стоит в виде отдельного воплощения данного изобретения.
Кроме того, в то время как некоторые воплощения, описанные в данном документе, включают некоторые, но не все признаки, включенные в другие воплощения, подразумевается, что комбинации признаков разных воплощений находятся в объеме изобретения и образуют разные воплощения, как будет понятно специалистам в данной области. Например, в следующей формуле изобретения любое из заявленных воплощений можно использовать в любой комбинации.
Кроме того, некоторые из воплощений описаны в данном документе как способ или комбинация элементов способа, которые могут быть реализованы посредством процессора компьютерной системы или с помощью других средств выполнения функции. Таким образом, процессор с необходимыми инструкциями для осуществления такого способа или элемента способа образует средство осуществления способа или элемента способа. Кроме того, описанный в данном документе элемент воплощения аппарата представляет собой пример средства осуществления функции, выполняемой элементом, с целью осуществления изобретения.
В описании и графических материалах, предоставленных в данном документе, изложены многочисленные конкретные подробности. Однако, понятно, что воплощения изобретения можно осуществлять на практике без данных конкретных подробностей. В других примерах хорошо известные способы, структуры и методики не были показаны подробно для того, чтобы не затруднять понимание данного описания.
Теперь изобретение будет описано с помощью подробного описания нескольких воплощений изобретения. Ясно, что другие воплощения изобретения могут быть скомпонованы в соответствии со знаниями специалистов в данной области, не отклоняясь от истинной сущности или технической идеи изобретения, причем изобретение ограничено только условиями прилагаемой формулы изобретения.
Примеры
Пример 1. Ферментативная продукция лакто-N-неотетраозы
BL21 (DE3) Е. coli использовали в качестве хозяина для разработки штаммов, подходящих для ферментативного синтеза LNnT. В штамме хозяина инактивировали следующие гены: lacZ (кодирующий бета-галактозидазу, araA (кодирующий L-арабинозоизомеразу), wcaJ (возможно кодирующий УДФ (уридиндифосфат)-глюкоза:ундекапренилфосфатглюкозо-1-фосфаттрансферазу), wzxC (предположительно кодирующий экспортер колановой кислоты), fucl (кодирующий L-фукозоизомеразу), fucK (кодирующий и L-фукулозокиназу).
Конструируя штамм, продуцирующий LNnT, дополнительно, удаляли гены nagA и nagB, кодирующие N-ацетилглюкозамин-6-фосфатдеацетилазу и глюкозамин-6-фосфатдеаминазу, соответственно. Для обеспечения продукции LNnT данным штаммом ген lgtA из Neisseria meningitides, кодирующий β-1,3-N-ацетилглюкозаминилтрансферазу, и lex-1, кодирующий β-1,4-галактозилтрансферазу из Aggregatibacter aphrophilus, вводили в геном BL21 посредством транспозиции. LacY из Е. coli, кодирующий лактозопермеазу, также хромосомно интегрировали. Все экзогенные гены конститутивно транскрибируются. Для усиления образования УДФ-галактозы в качестве субстрата-донора в реакции галактозилтрансферазы, гены galE и galU, оба происходящие из K12 Е. coli, сверхэкспрессировали посредством введения данных генов под контролем промотора Т5.
Помимо LNnT производственным штаммом продуцируется трисахарид LNT II и выделяется в ферментационный бульон. Используя ΔlacZ gal+ ara-ΔwzxY-wcaJ ΔfuclK BL21 (DE3) Е. coli, ген lacZ и дерегулированный ген лактозопермеазы (lacY6HIS), оба под контролем конститутивного промотора, вводили в геном для конструирования штамма деградации LNT II. Для деградации побочного продукта LNT-II хромосомно вводили ген с оптимизированными кодонами, кодирующий N-ацетигексозаминидазу, Bbhl из Bifidobacterium bifidum. Для более быстрой деградации моносахарида N-ацетилглюкозамин гены nagA, nagB и nagE, кодирующие N-ацетилглюкозамин-6-фосфатдеацетилазу, глюкозамин-6-фосфатдезаминазу и компонент EIICBA, специфичный к N-ацетилглюкозамину системы PTS, соответственно, происходящие из штамма-хозяина, сверхэкспрессировали посредством введения оперона nagAB под контролем промотора Ptet и nagE, транскрибируемого из промотора Т5. На последней стадии метаболизм галактозы в данном штамме улучшался в результате вставки оперона galETKM из K12 Е. coli.
Производственный штамм культивировали в питательной среде с химически определенным составом, содержащей 7 г/л NH4H2PO4, 7 г/л K2HPO4, 2 г/л KOH, 0,3 г/л лимонной кислоты, 2 г/л MgSO4×7H2O и 0,015 г/л CaCl2×6H2O с добавлением 1 мл/л раствора микроэлементов (54,4 г/л цитрата железа(III)-аммония, 9,8 г/л MnCl2×4H2O, 1,6 г/л CoCl2×6H2O, 1 г/л CuCl2×2H2O, 1,9 г/л H3BO3, 9 г/л ZnSO4×7H2O, 1,1 г/л Na2MoO4×2H2O, 1,5 г/л Na2SeO3, 1,5 г/л NiSO4×6H2O), и содержащей глюкозу в качестве источника углерода и энергии. Лактозу добавляли в качестве субстрата для синтеза LNnT. Ферментацию проводили в виде периодического процесса с подпиткой; контроль рН происходил в результате добавления аммония.
Второй микробный штамм, используемый для внутриклеточной деградации побочных продуктов культивировали в одной и той же среде с глюкозой в качестве источника углерода. В конце процесса получения LNnT оба штамма объединяли в одном ферментационном сосуде. Процесс останавливали, когда больше не выявляли загрязняющих моно- и дисахаридов и LNT II посредством анализа ВЭЖХ.
Пример 2: Получение бесклеточного ферментационного бульона
Клеточную массу (примерно 13% ферментационного бульона) отделяли от среды посредством ультрафильтрации (порог отсечения 0,05 мкм) (CUT membrane technology, Erkrath, Германия) с последующим использованием фильтра с перекрестным током с MWCO (от англ. Molecular-weight cutoff - порог отсечения по молекулярной массе) 150 кДа (Microdyn-Nadir, Wiesbaden, Германия). Бесклеточный ферментационный бульон содержал 53,9% LNnT, 19,4% GlcNAc, 1,5% pLNnH, 3,9% триоз, 4,8% лактозы и 1,5% дисахаридов относительно площади пиков хроматограммы ВЭЖХ.
Пример 3: Обработка ионообменной смолой бесклеточного ферментационного бульона, содержащего лакто-N-неотетраозу
Полученный бесклеточный ферментационный бульон, содержащий 8,9 кг лакто-N-неотетраозы с чистотой 29% (на сухую массу), в объеме 500 л пропускали через сильный катионообменник (Lewatit S2568, полученный от компании Lanxess) в форме Н+ для удаления положительно заряженных загрязняющих веществ (размер объема слоя ионообменника составлял 200 л). Элюирование LNnT с ионообменника продолжалось с помощью деионизированной воды. Затем рН полученного раствора устанавливали на уровне 7 посредством добавления раствора гидроксида натрия. Затем раствор (без задержки) пропускали через колонку с анионообменником (объем слоя ионообменника составлял 200 л). Используемый сильный анионообменник Lewatit S6368 A (Lanxess) находился в форме хлорида (Cl-). Элюирование LNnT продолжали с деионизированной водой. Полученный раствор снова нейтрализовали до рН 7.
Пример 4: Первая мембранная обработка для удаления молекул/углеводов меньшего размера
Раствор, полученный в результате обработки ионообменником, подвергали диафильтрации, используя нанофильтрационную мембрану TriSep XN-45 (TriSep Corporation, США) и 800 л деионизированной воды. Полученный раствор дополнительно концентрировали, используя нанофильтрационную мембрану (RE 8040-ВЕ, CSM-Saehan), где получали раствор лакто-N-неотетраозы с чистотой 36,2% (на сухую массу) и электропроводность 8 мСм/см.
Пример 5: Вторая мембранная обработка для удаления молекул/углеводов большего размера
Перед второй мембранной обработкой получали раствор, содержащий лакто-N-неотетраозу с чистотой 57%, как определено посредством ВЭЖХ. Для фильтрации использовали мембрану 0,65 кДа TangenX SIUS TFF (Repligen Corporation). В данном способе фильтрации удаляли главный побочный продукт ферментации - пара-лакто-N-неогексаозу (Фиг. 3).
Пример 6: Обработка на основе электродиализа
Затем раствор подвергали электродиализу до 0,4 мСм/см, используя электродиализатор PC-Cell 15 (PC-Cell, Heusweiler, Германия), оснащенный мембранным пакетом PC-Cell ED 1000Н. Данный мембранный пакет был оснащен следующими мембранами: катионообменная мембрана СЕМ: PK SK и анионообменная мембрана AEM:PcAcid60 с границей разделения по размеру 60 Да. 0,025 М раствор сульфаминовой кислоты (амидосульфоновая кислота) использовали в качестве электролита в процессе электродиализа. В качестве альтернативы обработки на основе электродиализа можно было использовать способ диафильтрации.
Пример 7: Концентрирование и обработка активированным углем
Некоторое количество воды удаляли из водного раствора, используя фильтр с обратным осмосом и ротационное выпаривание при 45°С с получением 25%-ного (масс./об.) раствора лакто-N-неотетраозы. Затем полученный водный раствор обрабатывали активированным углем (Norit SA2). 125 г активированного угля использовали на 1 л 25%-ного (масс./об.) раствора лакто-N-неотетраозы.
Пример 8: Стерильная фильтрация и удаление эндотоксина
Далее, раствор подвергали стерильной фильтрации посредством пропускания раствора через фильтр 3 кДа (половолоконный модуль ультрафильтрации Pall Microza SEP-2013, Pall Corporation, Dreieich, Германия). Стерильный раствор затем хранили при КТ до распылительной сушки.
Пример 9: Распылительная сушка лакто-N-неотетраозы
Полученную таким образом (пример 8) стерильную лакто-N-неотетраозу затем подвергали распылительной сушке, используя распылительную сушилку NUBILOSA LTC-GMP (NUBILOSA, Konstanz, Германия). Для распылительной сушки лакто-N-неотетраозы раствор пропускали под давлением 3,5 бар (350 кПа) через сопла распылительной сушилки, установленные при 130°С, и поток регулировали для поддержания температуры нагнетания от 67°С до 69°С. Используя данные установки, мог быть получен порошок, высушенный посредством распылительной сушки, с влажностью меньше чем 9%. Содержание влаги определяли посредством титрования по Карлу Фишеру.
Пример 10: Разделение лакто-N-неотетраозы и пара-лакто-N-неогексаозы с использованием хроматографии с псевдодвижущимся слоем в форме Na+
Прозрачный раствор, не содержащий частиц, содержащий лакто-N-неотетраозу (20 г/л), как получено в результате бактериальной ферментации, подвергали электродиализу до электропроводности 0,5 мСм/см, используя электродиализатор PC-Cell перед применением в SMB разделении. Помимо лакто-N-неотетраозы (66,23% от общего содержания углеводов), данный раствор содержал пара-лакто-N-неогексаозу (18,58% от общего содержания углеводов) в качестве главного побочного продукта ферментации. В случае хроматографии SMB с натрием в качестве противоиона раствор лакто-N-неотетраозы концентрировали до 200 г/л (20% масс./об.) под вакуумом при 40°С. В качестве альтернативы, раствор лакто-N-неотетраозы могли концентрировать посредством использования нанофильтрационой мембраны (XN45 from Trisep).
Для хроматографии SMB использовали систему SMB с замкнутым контуром, оснащенную 12 колонками (стеклянные колонки Prosep® следующего размера: 40 мм × 740 мм (Lartek, Eppelheim, Германия), расположенными в 4 зонах. Каждая стеклянная колонка содержала 760 г сильной катионообменной смолы Purolite® PCR833H+. Катионообменную смолу промывали 50 литрами 200 мМ NaCl с замещением ионов Н+ ионами Na+. После уравновешивания систему промывали водой для удаления оставшейся соли.
Система работала при 30°С со следующими установками параметров: скорость потока зоны I имела значение 30,00 мл/мин, скорость потока зоны II имела значение 21,60 мл/мин, скорость потока зоны IV имела значение 20,54 мл/мин. Подачу поддерживали на уровне 1,5 мл/мин, и поток элюента имел значение 4,46 мл/мин с временем переключения 13,35 мин. Дистиллированную воду использовали в качестве элюента.
При данных параметрах лакто-N-неотетраозу и меньшие нейтральные олигосахариды, подобно триозам (гликозилированная или галактозилированная лактоза), фракционировали до экстракта, тогда как пара-N-неогексозу элюировали внутри рафината. Чистота лакто-N-неотетраозы составляла 87,3% вместо 66,23% при подаче SMB, и количество пара-лакто-N-неогексозы уменьшалось до 1,08% (Фиг. 4-6).
Пример 11: ВЭЖХ анализ Лакто-N-неотетраозы
Система ВЭЖХ, которую использовали для анализа LNnT-содержащих растворов, состояла из контроллера системы SCL-10Avp, двух насосов LC-10Avp, печи CTO-10Avp, автоматического дозатора SIL-HTA и рефрактометрического детектора RID-10A. Все модули приобретали у Shimadzu (Киото, Япония). Кроме того, в данной системе использовали предколонку XBridge ВЕН Amide VanGd, 3,5 мкм, 3,9×5 мм (Waters, Eschborn, Германия) и колонку для ВЭЖХ XBridge ВЕН Amide, 3,5 мкм, 4,6×250 мм (Waters, Eschborn, Германия). Растворитель содержал 71% ацетонитрила, 28,9% H2O и 0,1% NH4OH. Скорость потока устанавливали на уровне 1,4 мл/мин. Все измерения ВЭЖХ проводили изократически с растворителем при 35°С, и данные анализировали качественно.
Пример 12: ЖХ-МС/МС анализ лакто-N-неотетраозы
В случае ЖХ-МС (Жидкостная хроматография-масс-спектрометрия) анализа для определения чистоты LNnT относительно сухой массы использовали систему Nexera Х2 LC (Shimadzu, Киото, Япония), которая включала насос LC-30AD, автоматический дозатор SIL-30AC, масс-спектрометр LCMS-8050 (детектор ИЭР-МС (ионизация электрораспылением-масс-спектрометрия)), 3,5 мкм, 50×2,1 мм колонку xBridge ВЕН Amide (Waters, Eschborn, Германия) и предколонку 3,5 мкм xBridge ВЕН Amide (Waters, Eschborn, Германия). Растворитель содержал 60% ацетонитрила, 39,9% ddH2O и 0,1% NH4OH, и скорость потока имела значение 0,3 мл/мин. Все анализы проводили с растворителем изократически при 35°С. Лакто-N-неотетраозу приобретали у OligoTech (Crolles, Франция) и использовали в качестве внутреннего стандарта.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОЧИСТКИ ЛАКТО-N-НЕОТЕТРАОЗЫ | 2020 |
|
RU2793915C1 |
| ВЫСУШЕННЫЕ РАСПЫЛЕНИЕМ ТЕТРАСАХАРИДЫ | 2018 |
|
RU2812853C2 |
| ОЧИСТКА ОЛИГОСАХАРИДОВ ОТ ФЕРМЕНТАЦИОННОГО БУЛЬОНА ПОСРЕДСТВОМ ИСПОЛЬЗОВАНИЯ ФИЛЬТРАЦИИ | 2020 |
|
RU2808729C2 |
| ВЫСУШЕННАЯ РАСПЫЛЕНИЕМ СМЕСЬ ОЛИГОСАХАРИДОВ ГРУДНОГО МОЛОКА | 2018 |
|
RU2803849C2 |
| ВЫСУШЕННАЯ РАСПЫЛЕНИЕМ ЛАКТО-N-ФУКОПЕНТАОЗА | 2018 |
|
RU2812864C2 |
| ВЫСУШЕННАЯ РАСПЫЛЕНИЕМ СИАЛИЛЛАКТОЗА | 2018 |
|
RU2802680C2 |
| ПРОСТОЙ СПОСОБ ОЧИСТКИ СИАЛИЛЛАКТОЗЫ | 2019 |
|
RU2793469C2 |
| СПОСОБ СУШКИ ОЛИГОСАХАРИДОВ ГРУДНОГО МОЛОКА | 2020 |
|
RU2805178C1 |
| ВЫСУШЕННАЯ РАСПЫЛЕНИЕМ 3-ФУКОЗИЛЛАКТОЗА | 2018 |
|
RU2810298C2 |
| СПОСОБ ОЧИСТКИ L-ФУКОЗЫ ОТ ФЕРМЕНТАЦИОННОГО БУЛЬОНА | 2018 |
|
RU2789351C2 |

Изобретение относится к биотехнологии и представляет собой способ очистки лакто-N-неотетраозы от других углеводов, отличающийся тем, что способ включает стадии подвергания водного раствора, содержащего лакто-N-неотетраозу, двум стадиям мембранной фильтрации с использованием разных мембран или подвергания водного раствора, содержащего лакто-N-неотетраозу, стадии мембранной фильтрации и непрерывной хроматографии. Изобретение позволяет получать лакто-N-неотетраозу с высокой степенью очистки. 2 н. и 9 з.п. ф-лы, 6 ил., 12 пр.
1. Способ очистки лакто-N-неотетраозы от других углеводов, где лакто-N-неотетраозу получают посредством микробной ферментации, отличающийся тем, что указанный способ включает стадии:
i) отделения биомассы от ферментационного бульона;
ii) подвергания бесклеточного ферментационного бульона ионообменной обработке для удаления заряженного вещества, при этом водный раствор обрабатывают катионообменной смолой и анионообменной смолой;
iii) подвергания водного раствора, полученного на стадии ii), стадии мембранной фильтрации для удаления углеводов, имеющих молекулярную массу меньше, чем молекулярная масса лакто-N-неотетраозы, где мембрана имеет порог отсечения по молекулярной массе от примерно 300 до примерно 500 дальтон;
iv) подвергания ретентата, полученного на стадии iii), стадии мембранной фильтрации для удаления углеводов, имеющих молекулярную массу больше, чем молекулярная масса лакто-N-неотетраозы, где мембрана имеет порог отсечения по молекулярной массе от примерно 600 до примерно 800 дальтон; и
v) повышения концентрации лакто-N-неотетраозы в фильтрате стадии iv).
2. Способ по п. 1, в котором отделение биомассы от ферментационного бульона включает по меньшей мере одну стадию ультрафильтрации, предпочтительно две стадии ультрафильтрации, более предпочтительно первую ультрафильтрацию с использованием мембраны, имеющей порог отсечения по молекулярной массе примерно 500 кДа, и вторую ультрафильтрацию с использованием мембраны, имеющей порог отсечения по молекулярной массе примерно 150 кДа.
3. Способ по п. 1 или 2, в котором водную среду обрабатывают катионообменной смолой в форме H+ и анионообменной смолой в форме Cl-, предпочтительно перед подверганием водного раствора стадиям мембранной фильтрации.
4. Способ по любому из пп. 1-3, где указанный способ дополнительно включает стадию диализа, предпочтительно электродиализа.
5. Способ очистки лакто-N-неотетраозы от других углеводов, где лакто-N-неотетраозу получают посредством микробной ферментации, отличающийся тем, что указанный способ включает стадии:
i) отделения биомассы от ферментационного бульона;
ii) подвергания бесклеточного ферментационного бульона ионообменной обработке для удаления заряженного вещества, при этом водный раствор обрабатывают катионообменной смолой и анионообменной смолой;
iii) подвергания водного раствора, полученного на стадии ii), стадии мембранной фильтрации для удаления углеводов, имеющих молекулярную массу меньше, чем молекулярная масса лакто-N-неотетраозы, где мембрана имеет порог отсечения по молекулярной массе от примерно 300 до примерно 500 дальтон;
iv) подвергания ретентата, полученного на стадии iii), непрерывной хроматографии для удаления углеводов, имеющих молекулярную массу больше, чем молекулярная масса лакто-N-неотетраозы, и
v) повышения концентрации лакто-N-неотетраозы в элюате стадии iv.
6. Способ по п. 5, в котором отделение биомассы от ферментационного бульона включает по меньшей мере одну стадию ультрафильтрации, предпочтительно две стадии ультрафильтрации, более предпочтительно первую ультрафильтрацию с использованием мембраны, имеющей порог отсечения по молекулярной массе примерно 500 кДа, и вторую ультрафильтрацию с использованием мембраны, имеющей порог отсечения по молекулярной массе примерно 150 кДа.
7. Способ по п. 5 или 6, в котором водный раствор обрабатывают катионообменной смолой в форме H+ и анионообменной смолой в форме Cl-.
8. Способ по любому из пп. 5-7, где указанный способ дополнительно включает стадию диализа, предпочтительно электродиализа.
9. Способ по любому из пп. 1-8, в котором чистота лакто-N-неотетраозы в водном растворе составляет 70% или меньше, 60% или меньше, 50% или меньше, 40% или меньше, 30% или меньше, 20% или меньше; 10% или меньше или 5% или меньше перед очисткой, и/или водный раствор содержит лакто-N-неотетраозу с чистотой 80% или больше, предпочтительно 85% или больше или более предпочтительно 90% или больше после очистки.
10. Способ по любому из пп. 1-9, где указанный способ включает применение по меньшей мере одной гликозидазы для гидролиза одного или более углеводов, отличных от LNnT, в ферментационном бульоне.
11. Способ по любому из пп. 1-10, в котором второй микроорганизм добавляют в ферментационный бульон после ферментативной продукции LNnT, при этом указанный второй микроорганизм экспрессирует бета-галактозидазу, предпочтительно LacZ E. coli, и/или N-ацетилгексозаминидазу, предпочтительно Bbhl B. bifidum.
| WO 2017182965 A1, 26.10.2017 | |||
| WO 2001004341 A1, 18.01.2001 | |||
| EP 3141610 A1, 15.03.2017 | |||
| RU2016128955, 26.02.2018. |
Авторы
Даты
2023-05-30—Публикация
2019-05-06—Подача