Перекрестные ссылки на родственные заявки
Для настоящей заявки испрашивается приоритет в соответствии с 35 USС §119(e) по предварительной заявке США, порядковый номер 62/562,952, поданной 21 сентября 2017, раскрытие которой включено в настоящий документ посредством ссылки во всей своей полноте.
Заявление о правах на изобретение, выполненное в рамках федерально спонсированных исследований и разработок
Не применимо.
Ссылка на прилагаемые «Список последовательностей», таблицу или компьютерную программу, представленные на компакт-диске
Не применимо.
Предпосылки
Злокачественные опухоли используют многочисленные механизмы, позволяющие избежать естественного цитотоксического иммунного ответа организма, так чтобы эти опухоли не уничтожались иммунной системой. Эти механизмы включают дисфункциональную передачу сигналов Т-клеток, супрессорные регуляторные клетки и иммунные контрольные точки, которые обычно задействованы для подавления интенсивности адаптивных иммунных ответов и защищают здоровые ткани от побочных повреждений. Например, опухоли развивают иммунную резистентность, особенно к Т-клеткам, которые специфичны к опухолевым антигенам, путем рекрутирования CCR2+ супрессорных клеток миелоидного происхождения (СКМП) и опухолевых макрофагов в опухоли и окружающей их микросреде.
CCR2+ СКМП выполняют иммуносупрессивные функции. СКМП играют ключевую роль в способности опухоли подавлять иммунные реакции. Другим ключевым компонентом этого подавления является активация иммунных контрольных точек, что, в свою очередь, ограничивает активацию и проникновение Т-клеток в опухоли. Иммунные контрольные точки относятся к ингибиторным путям иммунной системы, которые важны для поддержания аутотолерантности и контроля иммунных реакций в периферических тканях, чтобы минимизировать побочное повреждение тканей.
Белок запрограммированной гибели-1 (PD-1) является одним из многочисленных рецепторов, являющихся иммунной контрольной точкой, которые экспрессируются активированными Т-клетками и опосредуют иммуносупрессию. Лиганды PD-1 включают лиганд запрограммированной гибели-1 (PD-L1) и лиганд запрограммированной гибели-2 (PD-L2), которые экспрессируются на антигенпрезентирующих клетках, а также на многих раковых клетках человека. PD-L1 и PD-L2 могут подавлять активацию Т-клеток и секрецию цитокинов при связывании с PD-1.
Было показано, что ингибиторы взаимодействия PD-1/PD-L1 могут опосредовать сильную противоопухолевую активность и эффективны для лечения некоторых видов рака. Несмотря на эти результаты, остается потребность в эффективном лечении рака, такого как солидные злокачественные опухоли.
Краткое изложение сущности изобретения
Настоящее изобретение относится к комбинированной терапии антагонистом хемокинового рецептора 2 (CCR2) и ингибитором PD-1 и/или PD-L1 при лечении рака.
В некоторых вариантах осуществления антагонист хемокинового рецептора CCR2 имеет формулу I
где каждая переменная описана ниже.
В некоторых вариантах осуществления антагонист хемокинового рецептора CCR2 имеет формулу, выбранную из группы, состоящей из
или их фармацевтически приемлемой соли.
В некоторых вариантах осуществления антагонист CCR2 имеет формулу
или его фармацевтически приемлемой соли.
В некоторых вариантах осуществления антагонист CCR2 имеет формулу
 ,
,
или его фармацевтически приемлемой соли.
В некоторых вариантах осуществления антагонист CCR2 имеет формулу
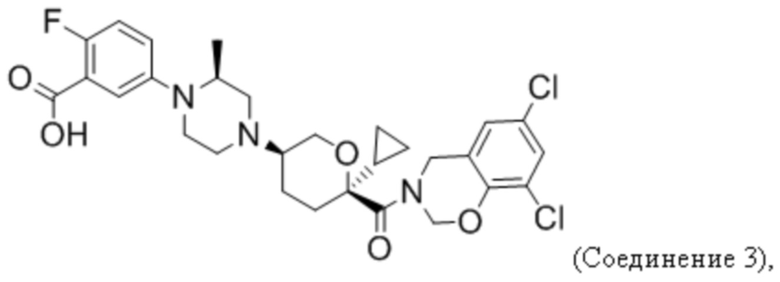
или его фармацевтически приемлемой соли.
В некоторых вариантах осуществления ингибитор PD-1 и/или PD-L1 представляет собой ингибитор PD-1.
В некоторых вариантах осуществления ингибитор PD-1 выбран из группы, состоящей из пембролизумаба, ниволумаба, IBI-308, mDX-400, BGB-108, MEDI-0680, SHR-1210, PF-06801591, PDR-001, GB-226, STI-1110, его биоаналогов, биобеттеров и биоэквивалентов.
В некоторых вариантах осуществления ингибитор PD-1 и/или PD-L1 представляет собой ингибитор PD-L1.
В некоторых вариантах осуществления ингибитор PD-L1 выбран из группы, состоящей из дурвалумаба, атезолизумаба, авелумаба, BMS-936559, ALN-PDL, TSR-042, KD-033, CA-170, STI-1014, KY -1003, их биоаналогов, биобеттеров и биоэквивалентов.
В некоторых вариантах осуществления ингибитор PD-1 и/или PD-L1 представляет собой соединение формулы (II)
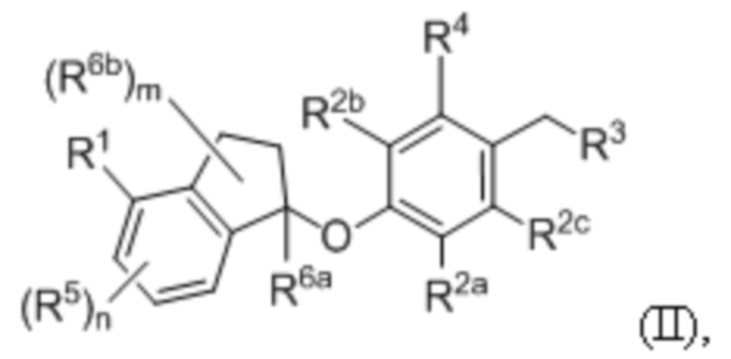
где каждая переменная описана ниже.
В некоторых вариантах осуществления рак представляет собой солидный рак. В некоторых вариантах осуществления рак представляет собой колоректальный рак. В некоторых вариантах осуществления рак является глиобластомой. В некоторых вариантах осуществления рак представляет собой рак поджелудочной железы.
Другие объекты, признаки и преимущества настоящего изобретения будут очевидны для специалиста в данной области техники из следующего подробного описания и фигур.
Краткое описание чертежей
Фиг. 1 показывает иммуногистохимический анализ нормальной и опухолевой ткани человека с использованием анти-hCCR2 мАт. Панели A и B показывают нормальную ткань толстой кишки в увеличении 40X и 200X, соответственно. Панели C, D, E и F показывают типичную ткань рака толстой кишки человека при указанных увеличениях. Специфическое окрашивание CCR2 наблюдалось в 78 злокачественных опухолях (диагностированных на I-III стадиях) у пациентов с раком толстой кишки, но не в нормальных контрольных тканях толстой кишки.
Фиг. 2 иллюстрирует, что CCR2 экспрессируется в субпопуляции инфильтрирующих опухоль лейкоцитов CD11b+ в микроокружении опухоли колоректального рака (CRC) CT27. Использовали гейтирование для живых клеток CD45+. Панель A отображает данные, полученные с использованием маркера CCR2, а панель B отображает данные с использованием изотипического контроля. Обведенная кругом область каждой панели подчеркивает разницу.
Фиг. 3 показывает, что популяция CD11b+/CCR2+ в опухолях CT26 преимущественно включает иммунофенотип Ly6Chi/Ly6Gneg - моноцитарных супрессорных клеток миелоидного происхождения (М-СКМП). Панель А представляет данные, полученные с использованием маркеров CD11b+/CCR2+ и гейтирования CD45+. Панель B отображает данные, полученные для субпопуляции CD11b+/CCR2+ с использованием маркеров Ly6C/Ly6G.
Фиг. 4 показывает прямое гейтирование клеток M-СКМП, выделенных из опухолей CT26, демонстрирующих устойчивую экспрессию CCR2. Панель A: гейтирование живых CD45+ CT26-инфильтрующих клеток в популяции CD11b+. Панель B: гейтирование LyChi/Ly6G- популяции. Панель C: наложение гистограммы окрашивания CCR2 (справа) на окрашивание моноклональными антителами изотипического контроля (слева) в популяции Ly6Chi/Ly6G-.
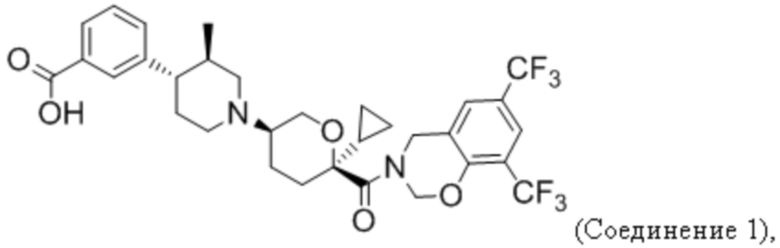
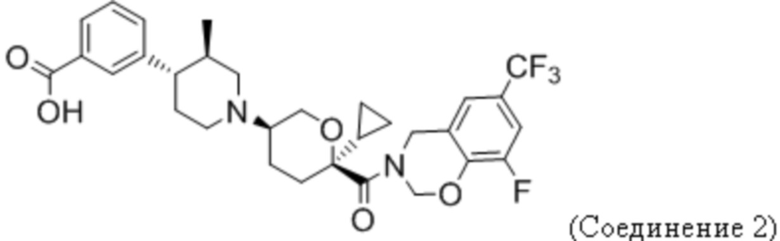
Фиг. 5 иллюстрирует общий дизайн исследования анти-PD-1 + Соединения 1 на модели CT26.
Фиг. 6 показывает, что Соединение 1, применяемое через желудочный зонд в дозе 30 мг/кг в сутки, обеспечивает минимальные уровни в плазме, равные или превышающие уровни, необходимые для полного охвата рецептора. Панель А показывает уровни Соединения 1 в плазме в день 3 введения. На панели B показано Соединение 1 через 23 дня после введения.
Фиг. 7 показывает, что комбинация Соединения 1 и α-PD-1 приводит к меньшим объемам опухоли. На панели A показаны мыши, которым вводили 1% ГПМЦ + изотип. На панели B показаны мыши, которым вводили 1% ГПМЦ + α-PD-1. На панели C показаны мыши, которым вводили 30 мг/кг Соединения 1 + изотип. На панели D показаны мыши, которым вводили 30 мг/кг соединения 1 + α-PD-1. Пунктирная линия показывает наибольший объем опухоли, наблюдаемый в группе Соединение 1 + α-PD-1. «1% ГПМЦ» является контрольным носителем для Соединения 1, «изотип» является идентично дозированным изотипическим контролем для α-PD-1.
Фиг. 8 показывает окрашивание лимфоцитов периферической крови тетрамером молекул I класса МНС и связанных с ними пептидов для иммунодоминантного антигена CT26, демонстрирующее CT26-специфический ответ CD8 Т-клеток у мышей-опухоленосителей.
Фиг. 9 демонстрирует, что для уменьшения размера опухоли, вызванного терапией Соединением 1 + α-PD-1, требуются CD8 T-клетки. Панель A показывает объем опухоли у мышей, получавших носитель + α-PD-1 + α-CD8. Панель В показывает объем опухоли у мышей, получавших 30 мг/кг Соединения 1 + α-PD-1 + изотипический контроль. Панель C показывает объем опухоли у мышей, получавших 30 мг/кг Соединения 1 + α-PD-1 + α-CD8.
Фиг. 10 демонстрирует, что, несмотря на участие цитотоксических Т-клеток в уменьшении размера опухоли, количество CD8 Т-клеток опухоли существенно не изменяется при лечении. Проникающие в опухоль цитотоксические Т-клетки (Thy1+/CD8+) количественно определяли путем взвешивания опухолей перед диссоциацией, что позволяло рассчитывать количество клеток на грамм опухоли.
Фиг. 11 показывает, что Соединение 1 снижает количество M-СКМП в микроокружении CT26 к 24 дню. M-СКМП количественно определяли путем взвешивания опухолей перед диссоциацией, что позволяло рассчитывать количество клеток на грамм опухоли.
Фиг. 12 показывает, что отношение CD8 T-клеток к M-СКМП значительно увеличивается при комбинированном лечении. Соотношение CD8 T-клеток и M-СКМП было вычислено из числа клеток, показанного на фиг. 10 и фиг. 11. Соотношение у контрольных мышей (veh + iso) составило 1:1, что означает одну M-СКМП на каждую CD8 Т-клетку. Комбинированное лечение уменьшало M-СКМП в пользу CD8 T-клеток, давая 100 CD8 T-клеток на каждую M-СКМП. Обработка только лишь Соединением 1 давала 10 CD8 Т-клеток на каждую клетку M-СКМП. Обработка α-PD-1 давала CD8 T-клетку на каждую клетку M-СКМП.
Фиг. 13 показывает, что количество длительно выживающих с CT26 в ответ на α-PD-1 увеличивается при комбинированном лечении CCR2. На 83-й день 6 выживших оставалось в группе α-PD-1 + Соединение 1, в то время как только 2 выживших оставалось в группе α-PD-1 + контрольный раствор. Подгруппы мышей, взятых на 27-й день для анализа клеток, были исключены из этого анализа выживаемости. У одной мыши из группы Iso + Veh и у одной из группы α-PD-1 + 598 опухоль не развивалась, и эти две мыши были исключены из этого анализа. Тест Гехана-Бреслоу-Вилкоксона использовали для определения значения p между красной (средней) и синей (верхней) кривыми.
Фиг. 14 показывает, что выжившие в течение длительного времени обладают специфическим иммунитетом к повторной инокуляции CT26 (панель B), но не к опухоли молочной железы 4T1 (панель A).
Подробное описание изобретения
I. Сокращение и определения
Используемые в настоящей заявке термины в единственном числе включают не только аспекты с одним элементом, но также аспекты с более чем одним элементом. Например, формы единственного числа включают в себя и множественное число, если контекст явно не предписывает иное. Таким образом, например, ссылка на «клетку» включает множество таких клеток, а ссылка на «агент» включает ссылку на один или несколько агентов, известных специалистам в данной области техники, и так далее.
Термины «примерно» и «приблизительно» обычно означают приемлемую степень ошибки для измеряемой величины с учетом характера или точности измерений. Типичные примерные степени ошибки находятся в пределах 20 процентов (%), предпочтительно в пределах 10% и более предпочтительно в пределах 5% от заданного значения или диапазона значений. В альтернативном варианте, особенно в биологических системах, термины «примерно» и «приблизительно» могут означать величины, которые находятся в пределах порядка значения, предпочтительно в пределах 5-кратного и более предпочтительно в пределах 2-кратного значения от приведенной величины. Числовые величины, приведенные в данном документе, являются приблизительными, если не указано иное, что означает, что термин «примерно» или «приблизительно» подразумевается, если он не указан явно.
Термин «алкил» сам по себе или как часть другого заместителя означает, если не указано иное, углеводородный радикал с прямой или разветвленной цепью, имеющий указанное число атомов углерода (то есть С1-8 означает от одного до восьми атомов углерода). Примеры алкильных групп включают метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, изобутил, втор-бутил, н-пентил, н-гексил, н-гептил, н-октил и тому подобное. Термин «алкенил» относится к ненасыщенной алкильной группе, имеющей одну или несколько двойных связей. Аналогичным образом, термин «алкинил» относится к ненасыщенной алкильной группе, имеющей одну или несколько тройных связей. Примеры таких ненасыщенных алкильных групп включают винил, 2-пропенил, кротил, 2-изопентенил, 2-(бутадиенил), 2,4-пентадиенил, 3-(1,4-пентадиенил), этинил, 1- и 3-пропинил, 3-бутинил и высшие гомологи и изомеры. Термин «циклоалкил» относится к углеводородным кольцам, имеющим указанное число атомов кольца (например, C3-6 циклоалкил) и полностью насыщенным или имеющим не более одной двойной связи между вершинами кольца. Термин «циклоалкил» также относится к бициклическим и полициклическим углеводородным кольцам, таким как, например, бицикло [2.2.1] гептан, бицикло[2.2.2] октан и т.д. Термин «гетероциклоалкил» относится к циклоалкильной группе, которая содержит от одного до пяти гетероатомов, выбранных из N, O и S, где атомы азота и серы необязательно окислены, а атом (атомы) азота необязательно кватернизован. Гетероциклоалкил может быть моноциклической, бициклической или полициклической кольцевой системой. Неограничивающие примеры гетероциклоалкильных групп включают пирролидин, имидазолидин, пиразолидин, бутиролактам, валеролактам, имидазолидинон, гидантоин, диоксолан, фталимид, пиперидин, 1,4-диоксан, морфолин, тиоморфолин, тиоморфолин-S-оксид, тиоморфолин-S,S-оксид, пиперазин, пиран, пиридон, 3-пирролин, тиопиран, пирон, тетрагидрофуран, тетрагидротиофен, хинуклидин и тому подобное. Гетероциклоалкильная группа может быть присоединена к остальной части молекулы через углерод или гетероатом кольца. Для таких терминов, как циклоалкилалкил и гетероциклоалкилалкил, подразумевается, что циклоалкильная или гетероциклоалкильная группа присоединена через алкильный или алкиленовый линкер к остальной части молекулы. Например, циклобутилметил - это циклобутильное кольцо, которое присоединено метиленовым линкером к остальной части молекулы.
Термин «алкилен» как таковой или как часть другого заместителя означает двухвалентный радикал, полученный из алкана, например -CH2CH2CH2CH2-. Как правило, алкильная (или алкиленовая) группа будет иметь от 1 до 24 атомов углерода, причем группы, имеющие 10 или менее атомов углерода, являются предпочтительными в настоящем изобретении. «Низший алкил» или «низший алкилен» представляет собой алкильную или алкиленовую группу с более короткой цепью, обычно имеющую четыре или менее атомов углерода. Аналогичным образом, «алкенилен» и «алкинилен» относятся к ненасыщенным формам «алкилена», имеющим двойные или тройные связи, соответственно.
При использовании в настоящем документе волнистая линия «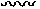 », которая пересекает одинарную, двойную или тройную связь в любой химической структуре, изображенной здесь, представляет собой точечное присоединение одинарной, двойной или тройной связи к остальной части молекулы.
», которая пересекает одинарную, двойную или тройную связь в любой химической структуре, изображенной здесь, представляет собой точечное присоединение одинарной, двойной или тройной связи к остальной части молекулы.
Термин «гетероалкил» как таковой или в сочетании с другим термином означает, если не указано иное, стабильную неразветвленную или разветвленную цепь или циклический углеводородный радикал или их комбинации, состоящие из указанного числа атомов углерода и из одного-трех гетероатомов, выбранных из группы, состоящей из O, N, Si и S, где атомы азота и серы могут быть необязательно окислены, а гетероатом азота может быть необязательно кватернизован. Гетероатом (гетероатомы) O, N и S могут быть расположены в любом внутреннем положении гетероалкильной группы. Гетероатом Si может быть расположен в любом положении гетероалкильной группы, включая положение, в котором алкильная группа присоединена к остальной части молекулы. Примеры включают -CH2-CH2-O-CH3, -CH2-CH2-NH-CH3, -CH2-CH2-N(CH3)-CH3, -CH2-S-CH2-CH3, -CH2-CH2,-S(O)-CH3, -CH2-CH2-S(O)2-CH3, -CH=CH-O-CH3, -Si(CH3)3, -CH2-CH=N-OCH3, и -CH=CH-N(CH3)-CH3. До двух гетероатомов могут быть последовательными, как, например, -CH2-NH-OCH3 и -CH2-O-Si(CH3)3. Аналогичным образом, термины «гетероалкенил» и «гетероалкинил» сами по себе или в сочетании с другим термином означают, если не указано иное, алкенильную группу или алкинильную группу, соответственно, которая содержит указанное число атомов углерода и имеет от одного до трех выбранных гетероатомов из группы, состоящей из O, N, Si и S, и где атомы азота и серы могут быть необязательно окислены, а гетероатом азота может быть необязательно кватернизован. Гетероатом (гетероатомы) O, N и S могут быть расположены в любом внутреннем положении гетероалкильной группы.
Термин «гетероалкилен» сам по себе или как часть другого заместителя означает двухвалентный радикал, насыщенный или ненасыщенный, или полиненасыщенный, полученный из гетероалкила, примером которого являются -CH2-CH2-S-CH2CH2- и -CH2-S-CH2-CH2-NH-CH2-, -O-CH2-CH=CH-, -CH2-CH=C(H)CH2-O-CH2- и -S-CH2-C≡C-. Для гетероалкиленовых групп гетероатомы могут также занимать один или оба конца цепи (например, алкиленокси, алкилендиокси, алкиленамино, алкилендиамино и тому подобное).
Термины «алкокси», «алкиламино» и «алкилтио» (или тиоалкокси) используются в их общепринятом смысле и относятся к тем алкильным группам, которые присоединены к остальной части молекулы через атом кислорода, аминогруппу или атом серы соответственно. Кроме того, для диалкиламиногрупп алкильные части могут быть одинаковыми или разными, и могут также объединяться с образованием 3-7-членного кольца с атомом азота, к которому каждая из них присоединена. Соответственно, группа, представленная как -NRaRb, означает включение пиперидинила, пирролидинила, морфолинила, азетидинила и тому подобного.
Термины «гало» или «галоген» сами по себе или как часть другого заместителя означают, если не указано иное, атом фтора, хлора, брома или йода. Кроме того, такие термины, как «галоалкил», подразумевают включение моногалоалкила и полигалоалкила. Например, термин «С1-4 галоалкил» означает трифторметил, 2,2,2-трифторэтил, 4-хлорбутил, 3-бромпропил и тому подобное.
Термин «арил» означает, если не указано иное, полиненасыщенную, обычно ароматическую, углеводородную группу, которая может представлять собой одно кольцо или несколько колец (до трех колец), которые конденсированы вместе или ковалентно связаны. Термин «гетероарил» относится к арильным группам (или кольцам), которые содержат от одного до пяти гетероатомов, выбранных из N, O и S, где атомы азота и серы необязательно окислены, а атом (атомы) азота необязательно кватернизован. Гетероарильная группа может быть присоединена к остальной части молекулы через гетероатом. Неограничивающие примеры арильных групп включают фенил, нафтил и бифенил, в то время как неограничивающие примеры гетероарильных групп включают пиридил, пиридазинил, пиразинил, пириминдинил, триазинил, хинолинил, хиноксалинил, хиназолинил, циннолинил, фталазинил, бензотриазинил, пуринил, бензимидазолил, бензопиразолил, бензотриазолил, бензизоксазолил, изобензофурил, изоиндолил, индолизинил, бензотриазинил, тиенопиридинил, тиенопиримидинил, пиразолопиримидинил, имидазопиридины, бензотиаксолил, бензофуранил, бензотиенил, индолил, хинолил, изохинолил, изотиазолил, пиразолил, индазолил, птеридинил, имидазолил, триазолил, тетразолил, оксазолил, изоксазолил, тиадиазолил, пирролил, тиазолил, фурил, тиенил и тому подобное. Заместители для каждой из указанных выше арильных и гетероарильных кольцевых систем выбраны из группы приемлемых заместителей, описанных ниже.
Для краткости термин «арил» при использовании в сочетании с другими терминами (например, арилокси, арилтиокси, арилалкил) включает как арильные, так и гетероарильные кольца, как определено выше. Таким образом, термин «арилалкил» подразумевает включение тех радикалов, в которых арильная группа присоединена к алкильной группе, которая присоединена к остальной части молекулы (например, бензил, фенэтил, пиридилметил и тому подобное).
Вышеуказанные термины (например, «алкил», «арил» и «гетероарил») в некоторых вариантах осуществления будут включать как замещенные, так и незамещенные формы указанного радикала. Предпочтительные заместители для каждого типа радикалов приведены ниже. Для краткости, термины «арил» и «гетероарил» будут относиться к замещенным или незамещенным вариантам, представленным ниже, в то время как термин «алкил» и родственные алифатические радикалы означают ссылку на незамещенный вариант, если не указано, что он является замещенным.
Заместители для алкильных радикалов (включая группы, часто называемые алкиленом, алкенилом, алкинилом и циклоалкилом) могут быть различными группами, выбранными из: -галогена, -OR’, -NR’R”, -SR’, -SiR’R”R”’, -OC(O)R’, -C(O)R’, -CO2R’, -CONR’R”, -OC(O)NR’R”, -NR”C(O)R’, -NR’-C(O)NR”R”’, -NR”C(O)2R’, -NH-C(NH2)=NH, -NR’C(NH2)=NH, -NH-C(NH2)=NR’, -S(O)R’, -S(O)2R’, -S(O)2NR’R”, -NR’S(O)2R”, -CN и -NO2 в количестве от нуля до (2m' + 1), где m' - общее число атомов углерода в таком радикале. R’, R” и R”’ каждый независимо относится к водороду, незамещенному С1-8 алкилу, незамещенному гетероалкилу, незамещенному арилу, арилу, замещенному 1-3 галогенами, незамещенной С1-8 алкильной, С1-8 алкокси или С1-8 тиоалкокси группе или незамещенным арил-C1-4 алкильным группам. Когда R' и R" присоединены к одному и тому же атому азота, они могут быть объединены с атомом азота с образованием 3-, 4-, 5-, 6- или 7-членного кольца. Например, -NR’R” означает 1-пирролидинил и 4-морфолинил. Термин «ацил», используемый сам по себе или как часть другой группы, относится к алкильному радикалу, в котором два заместителя на атоме углерода, который находится ближе всего к точке присоединения радикала, заменены заместителем =O (например, -C(O)CH3, -C(O)CH2CH2OR’ и тому подобному).
Аналогичным образом, заместители для арильной и гетероарильной групп могут варьироваться и обычно выбраны из: -галогена, -OR’, -OC(O)R’, -NR’R”, -SR’, -R’, -CN, -NO2, -CO2R’, -CONR’R”, -C(O)R’, -OC(O)NR’R”, -NR”C(O)R’, -NR”C(O)2R’, ,-NR’-C(O)NR”R”’, -NH-C(NH2)=NH, -NR’C(NH2)=NH, -NH-C(NH2)=NR’, -S(O)R’, -S(O)2R’, -S(O)2NR’R”, -NR’S(O)2R”, -N3, перфтор(C1-C4)алкокси и перфтор(C1-C4)алкила, в количестве от нуля до общего числа открытых валентностей в ароматической кольцевой системе; и где R', R" и R"' независимо выбраны из водорода, C1-8 алкила, C3-6 циклоалкила, C2-8 алкенила, C2-8 алкинила, незамещенного арила и гетероарила, (незамещенный арил)-C1-4 алкила и незамещенного арилокси-C1-4-алкила. Другие подходящие заместители включают каждый из вышеуказанных арильных заместителей, связанных с атомом кольца алкиленовым звеном из 1-4 атомов углерода.
Два из заместителей на соседних атомах арильного или гетероарильного кольца могут быть необязательно замещены заместителем формулы -TC(O)-(CH2)q-U-, где T и U независимо представляют собой -NH-, -O-, -CH2- или одинарную связь, а q представляет собой целое число от 0 до 2. В альтернативном варианте два заместителя на соседних атомах арильного или гетероарильного кольца могут быть необязательно заменены заместителем формулы -A-(CH2)r-B-, где A и B независимо представляют собой -CH2-, -O-, -NH-, -S-, -S(O)-, -S(O)2-, -S(O)2NR'- или одинарную связь, а r представляет собой целое число от 1 до 3. Одна из одинарных связей нового кольца, полученного таким образом, может быть необязательно заменена двойной связью. В альтернативном варианте два заместителя на соседних атомах арильного или гетероарильного кольца могут быть необязательно замещены заместителем формулы -(CH2)s-X-(CH2)t-, где s и t независимо представляют собой целые числа от 0 до 3, и X представляет собой -O-, -NR'-, -S-, -S(O)-, -S(O)2- или -S(O)2NR'-. Заместитель R' в -NR’- и -S(O)2NR’- выбран из водорода или незамещенного C1-6 алкила.
Используемый в настоящей заявке термин «гетероатом» включает кислород (О), азот (N), серу (S) и кремний (Si).
Для соединений, представленных в настоящем документе, связь, которая направлена от заместителя (обычно R-группы) к центру ароматического кольца (например, бензола, пиридина и тому подобного), следует понимать, как относящуюся к связи, обеспечивающей соединение в любой из доступных вершин ароматического кольца. В некоторых вариантах осуществления изображение также будет включать соединение в кольце, которое конденсировано с ароматическим кольцом. Например, связь, направленная к центру бензольной части индола, будет указывать на связь с любой доступной вершиной шести- или пятичленных кольцевых частей индола.
Подразумевается, что термин «фармацевтически приемлемые соли» включает соли активных соединений, которые получают с относительно нетоксичными кислотами или основаниями, в зависимости от конкретных заместителей, обнаруженных в соединениях, описанных в настоящей заявке. Когда соединения по настоящему изобретению содержат относительно кислые функциональные группы, соли присоединения основания могут быть получены путем контактирования нейтральной формы таких соединений с достаточным количеством необходимого основания, либо в чистом виде, либо в подходящем инертном растворителе. Примеры солей, полученных из фармацевтически приемлемых неорганических оснований, включают соли алюминия, аммония, кальция, меди, трехвалентного железа, двухвалентного железа, лития, магния, трехвалентного марганца, двухвалентного марганца, калия, натрия, цинка и тому подобного. Соли, полученные из фармацевтически приемлемых органических оснований, включают соли первичных, вторичных и третичных аминов, включая замещенные амины, циклические амины, природные амины и тому подобное, такие как аргинин, бетаин, кофеин, холин, N,N'-дибензилэтилендиамин, диэтиламин, 2-диэтиламиноэтанол, 2-диметиламиноэтанол, этаноламин, этилендиамин, N-этилморфолин, N-этилпиперидин, глюкамин, глюкозамин, гистидин, гидрабамин, изопропиламин, лизин, метилглюкамин, морфолин, пиперазин, пиперадин, полиаминовые смолы, прокаин, пурины, теобромин, триэтиламин, триметиламин, трипропиламин, трометамин и тому подобное. Когда соединения по настоящему изобретению содержат относительно основные функциональные группы, соли присоединения кислоты могут быть получены путем контактирования нейтральной формы таких соединений с достаточным количеством необходимой кислоты, либо в чистом виде, либо в подходящем инертном растворителе. Примеры фармацевтически приемлемых солей добавления кислот включают соли, полученные из неорганических кислот, таких как соляная, бромистоводородная, азотная, угольная, моногидрокарбоновая, фосфорная, моногидрофосфорная, дигидрофосфорная, серная, моногидросерная, йодоводородная или фосфористая кислоты и тому подобное, а также соли, полученные из относительно нетоксичных органических кислот, таких как уксусная, пропионовая, изомасляная, малоновая, бензойная, янтарная, субериновая, фумаровая, миндальная, фталевая, бензолсульфоновая, п-толилсульфоновая, лимонная, винная, метансульфоновая и тому подобное. Также включены соли аминокислот, такие как аргинат и тому подобное, и соли органических кислот, таких как глюкуроновая или галактунориновая кислоты и тому подобное (см., например, Berge, S.M., et al., «Pharmaceutical Salts», Journal of Pharmaceutical Science, 1977, 66, 1-19). Некоторые конкретные соединения по настоящему изобретению содержат как основные, так и кислотные функциональные группы, которые позволяют соединениям превращаться в соли добавления оснований или кислот.
Нейтральные формы соединений могут быть регенерированы путем контактирования соли с основанием или кислотой и выделения исходного соединения обычным способом. Исходная форма соединения отличается от различных солевых форм определенными физическими свойствами, такими как растворимость в полярных растворителях, но в остальном соли эквивалентны исходной форме соединения для целей настоящего изобретения.
В дополнение к солевым формам настоящее изобретение предлагает соединения, которые находятся в форме пролекарства. Пролекарства соединений, описанных в настоящем документе, представляют собой те соединения, которые легко подвергаются химическим изменениям в физиологических условиях с получением соединений по настоящему изобретению. Кроме того, пролекарства могут быть преобразованы в соединения по настоящему изобретению химическими или биохимическими методами в условиях ex vivo. Например, пролекарства могут медленно превращаться в соединения по настоящему изобретению при помещении в резервуар трансдермального пластыря с подходящим ферментом или химическим реагентом.
Некоторые соединения по настоящему изобретению могут существовать в несольватированных формах, а также в сольватированных формах, включая гидратированные формы. В общем, сольватированные формы эквивалентны несольватированным формам и предназначены для включения в объем настоящего изобретения. Некоторые соединения по настоящему изобретению могут существовать в нескольких кристаллических или аморфных формах. В общем, все физические формы эквивалентны для использования, предусмотренного настоящим изобретением, и предназначены для того, чтобы находиться в пределах объема настоящего изобретения.
Некоторые соединения по настоящему изобретению обладают асимметричными атомами углерода (оптическими центрами) или двойными связями; рацематы, диастереомеры, геометрические изомеры, региоизомеры и отдельные изомеры (например, отдельные энантиомеры) предназначены для включения в объем настоящего изобретения. Когда соединения представлены в настоящем документе с идентифицированной стереохимией (обозначенной как R или S, или указанной пунктиром или знаками клиновидной связи), специалистам в данной области техники будет понятно, что эти соединения по существу не содержат других изомеров (например, по меньшей мере, на 80%, 90%, 95%, 98%, 99% и до 100% свободны от другого изомера).
Соединения по настоящему изобретению могут также содержать неприродные пропорции атомных изотопов у одного или нескольких атомов, составляющих такие соединения. Неприродные пропорции изотопа могут быть определены как в диапазоне от количества, встречающегося в природе, до количества, состоящего на 100% из рассматриваемого атома. Например, соединения могут включать радиоактивные изотопы, такие как, например, тритий (3H), йод-125 (125I) или углерод-14 (14C), или нерадиоактивные изотопы, такие как дейтерий (2H) или углерод-13 (13С). Такие изотопные вариации могут обеспечить дополнительную пользу для тех соединений, которые описаны в другом месте в этой заявке. Например, изотопные варианты соединений по изобретению могут найти дополнительное применение, включая применение в качестве диагностических и/или визуализирующих реагентов или в качестве цитотоксических/радиотоксических терапевтических агентов, но не ограничиваясь этим. Кроме того, изотопные варианты соединений по изобретению могут иметь измененные фармакокинетические и фармакодинамические характеристики, которые могут способствовать повышению безопасности, переносимости или эффективности во время лечения. Предполагается, что все изотопные варианты соединений по настоящему изобретению, независимо от того, радиоактивны они или нет, включены в объем настоящего изобретения.
Термин «рак» относится к заболеванию, характеризующемуся неконтролируемым ростом аберрантных клеток. Раковые клетки могут распространяться локально или через кровоток и лимфатическую систему в другие части тела. Примеры различных видов рака описаны в настоящей заявке и включают рак молочной железы, рак предстательной железы, рак яичника, рак шейки матки, рак кожи, рак поджелудочной железы, колоректальный рак, рак почки, рак печени, злокачественные опухоли головного мозга, лимфому, лейкоз, рак легкого, глиобластому и тому подобное, но не ограничиваются этим. Термины «опухоль» и «рак» используются в настоящей заявке взаимозаменяемо, например оба термина охватывают солидные и жидкие, например, диффузные или циркулирующие опухоли. Используемый здесь термин «рак» или «опухоль» включает предраковые, а также злокачественные новообразования и опухоли.
Термин «PD-1» или «рецептор PD-1» относится к белку программируемой гибели-1, к соингибитору Т-клеток, также известному как CD279. Аминокислотная последовательность полноразмерного белка PD-1 человека приведена, например, в GenBank, номер доступа NP_005009.2. PD-1 представляет собой белок из 288 аминокислот с внеклеточным N-концевым доменом, который является IgV-подобным трансмембранным доменом, и внутриклеточным доменом, содержащим иммунорецепторный ингибирующий мотив на основе тирозина (ITIM) и иммунорецепторный переключающий мотив на основе тирозина (ITSM) (Chattopadhyay et al., ImmunolRev, 2009, 229 (1): 356-386). Термин «PD-1» включает рекомбинантный PD-1 или его фрагмент, или его варианты. Рецептор PD-1 имеет два лиганда, PD-лиганд-1 (PD-L1) и PD-лиганд-2 (PD-L2).
Термин «PD-L1» или «лиганд запрограммированной гибели 1» относится к лиганду рецептора PD-1, также известному как CD274 и B7H1. Аминокислотная последовательность полноразмерного белка PD-L1 человека указана, например, в GenBank, номер доступа NP_054862.1. PD-L1 представляет собой белок из 290 аминокислот с внеклеточным IgV-подобным доменом, трансмембранным доменом и высококонсервативным внутриклеточным доменом из приблизительно 30 аминокислот. PD-L1 конститутивно экспрессируется на многих клетках, таких как антигенпрезентирующие клетки (например, дендритные клетки, макрофаги и B-клетки), а также на гемопоэтических и не-гемопоэтических клетках (например, клетках эндотелия сосудов, островков поджелудочной железы и участках иммунной привилегированности). PD-L1 также экспрессируется в самых разных опухолях, вирусно-инфицированных клетках и аутоиммунной ткани.
Путь запрограммированной гибели 1 (PD-1/PD-L1) действует как контрольная точка для ограничения опосредованных Т-клетками иммунных ответов. Оба лиганда PD-1, PD-L1 и PD-L2, могут взаимодействовать с рецептором PD-1 и индуцировать передачу сигналов PD-1 и обратимое ингибирование активации и пролиферации Т-клеток. Когда лиганды PD-1 находятся на поверхности раковых клеток или соседних клеток, эти лиганды связываются с положительными по PD-1-рецептору иммунными эффекторными клетками и используют путь PD-1, чтобы избежать иммунного ответа.
Термин «ингибитор иммунной контрольной точки» или «блокада иммунной контрольной точки» относится к любому агенту, молекуле, соединению, химическому веществу, белку, полипептиду, макромолекуле и т.д., которые блокируют или ингибируют статистически, клинически или биологически значимым образом ингибиторные пути иммунной системы. Такие ингибиторы могут включать низкомолекулярные ингибиторы или могут включать антитела или их антигенсвязывающие фрагменты, которые связывают и блокируют или ингибируют рецепторы иммунной контрольной точки, или антитела, которые связывают и блокируют или ингибируют лиганды рецептора иммунной контрольной точки. Иллюстративные молекулы иммунной контрольной точки, которые могут быть нацелены на блокирование или ингибирование, включают CTLA-4, 4-1BB (CD137), 4-1BBL (CD137L), PDL1, PDL2, PD-1, B7-H3, B7-H4, BTLA, HVEM, TIM3, GAL9, LAG3, TIM3, B7H3, B7H4, VISTA, KIR, 2B4 (принадлежит к семейству молекул CD2 и экспрессируется на всех T-клетках NK, γδ и Т-клетках памяти CD8+(αβ)), CD160 (также называемый BY55) и CGEN-15049, но не ограничиваются ими. Иллюстративные ингибиторы иммунной контрольной точки включают дурвалумаб (антитело против PD-L1; MEDI4736), пембролизумаб (моноклональное антитело против PD-1), ниволумаб (антитело против PD-1), пидилизумаб (CT-011; гуманизированное анти-PD-1 моноклональное антитело), AMP224 (рекомбинантный слитый белок B7-DC-Fc), BMS-936559 (антитело против PD-L1), атезолизумаб (MPLDL3280A; Fc-оптимизированное моноклональное антитело человека против PD-L1), авелумаб (MSB0010718C; человеческое антитело против PD-L1), ипилимумаб (ингибитор контрольной точки анти-CTLA-4), тремелимумаб (блокирующее антитело против CTLA-4) и анти-OX40.
Термины «антагонист CCR2» и «антагонист хемокинового рецептора CCR2» используются взаимозаменяемо и относятся к небольшой молекуле, которая противодействует взаимодействию хемокинового рецептора CCR2 и любого из его лигандов. Такое соединение может ингибировать процессы, обычно запускаемые взаимодействием рецептора с лигандом.
Используемый в настоящей заявке термин «полный ответ» или «CR» относится к исчезновению всех целевых очагов; «частичный ответ» или «PR» относится как минимум к 30% уменьшению суммы самых длинных диаметров (SLD) целевых очагов, принимая за основу базовый уровень SLD; и «стабильное заболевание» или «SD» относится к случаю, где нет ни достаточного сокращения целевых очагов, чтобы это определялось как частичный ответ, ни достаточного увеличения, чтобы это определялось как прогрессирование заболевания, с принятием в качестве эталона наименьшего показателя SLD с начала лечения.
Используемый в настоящей заявке термин «прогрессирующее заболевание» или «PD» относится к увеличению SLD целевых очагов по меньшей мере на 20%, принимая во внимание наименьшее значение SLD, зарегистрированное с момента начала лечения, или наличие одного или нескольких новых очагов.
При использовании в настоящем документе «выживаемость без прогрессирования» (PFS) относится к промежутку времени во время лечения и после лечения, в течение которого заболевание, которое лечат (например, рак), не ухудшается. Выживаемость без прогрессирования может включать количество времени, в течение которого у пациентов отмечался полный или частичный ответ, а также количество времени, в течение которого у пациентов отмечалось стабильное заболевание.
При использовании в настоящем документе «общая частота ответа» (ORR) относится к сумме частоты полного ответа (CR) и частоты частичного ответа (PR).
Используемый в настоящей заявке термин «общая выживаемость» относится к проценту людей в группе, которые могут быть живы через определенный промежуток времени.
Используемый в настоящей заявке термин «млекопитающее» определяется как человек, другие приматы, коровы, овцы, козы, лошади, собаки, кошки, кролики, крысы, мыши и тому подобное. Соединения, агенты и композиции, описанные в настоящем документе, полезны для лечения широкого спектра злокачественных опухолей, включая солидные злокачественные опухоли.
Термин «терапевтически эффективное количество» означает количество рассматриваемого соединения, которое будет вызывать биологический или медицинский ответ клетки, ткани, системы или животного, такого как человек, который необходим для исследователя, ветеринара, врача или другого лица, осуществляющего лечение.
II. Общая информация
Настоящее изобретение обращается к удивительному и неожиданному факту, что комбинированная терапия с использованием антагониста CCR2 и ингибитора PD-1 и/или PD-L1 значительно улучшает лечение рака по сравнению с ингибированием PD-1 и/или PD-L1 по отдельности.
III. Комбинированная терапия с использованием антагониста CCR2 и ингибитора PD-1 и/или PD-L1
В настоящем документе представлены способы, композиции и наборы, в которых используется синергетический эффект антагонистов CCR2 и ингибиторов PD-1 и/или PD-L1 при лечении рака. Комбинированное лечение, которое включает как антагонист CCR2, так и ингибитор PD-1 и/или PD-L1, более эффективно при лечении рака по сравнению с соединением/ антителом по отдельности.
В одном аспекте в настоящем документе предлагаются способы лечения рака у млекопитающего. Способ включает применение у субъекта, нуждающегося в этом, терапевтически эффективного количества антагониста хемокинового рецептора CCR2 и терапевтически эффективного количества ингибитора PD-1 и/или PD-L1.
В некоторых вариантах осуществления способ включает применение у субъекта, нуждающегося в этом, терапевтически эффективного количества антагониста хемокинового рецептора CCR2 и терапевтически эффективного количества ингибитора PD-1.
В некоторых вариантах осуществления способ включает применение у субъекта, нуждающегося в этом, терапевтически эффективного количества антагониста хемокинового рецептора CCR2 и терапевтически эффективного количества ингибитора PD-L1.
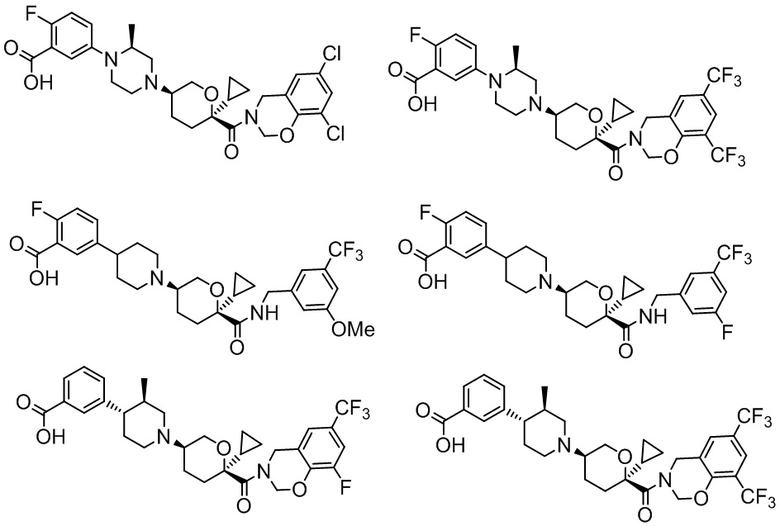
В некоторых вариантах осуществления антагонист хемокинового рецептора CCR2 представляет собой соединение формулы I его подформул ниже. В некоторых вариантах осуществления антагонист хемокинового рецептора CCR2 выбран из группы, состоящей из:
 ,
,
и их фармацевтически приемлемой соли.
В некоторых вариантах осуществления антагонист хемокинового рецептора CCR2 выбран из группы, состоящей из AZ889, AZD2423, INCB-8761, МК-0812, BMS-813160, INCB-003284, PF-04634817, BMS-741672, ценикривирока, CCX -140.
В некоторых вариантах осуществления ингибитор PD-1 выбран из группы, состоящей из пембролизумаба, ниволумаба, IBI-308, mDX-400, BGB-108, MEDI-0680, SHR-1210, PF-06801591, PDR-001 GB-226, STI-1110, их биоаналогов, биобеттеров и биоэквивалентов.
В некоторых вариантах осуществления ингибитор PD-1 выбран из группы, состоящей из пембролизумаба, ниволумаба, IBI-308, mDX-400, BGB-108, MEDI-0680, SHR-1210, PF-06801591, PDR-001 GB-226 и STI-1110.
В некоторых вариантах осуществления ингибитор PD-1 представляет собой RPM1-14.
В некоторых вариантах осуществления ингибитор PD-L1 выбран из группы, состоящей из дурвалумаба, атезолизумаба, авелумаба, BMS-936559, ALN-PDL, TSR-042, KD-033, CA-170, STI-1014, KY -1003, их биоаналогов, биобеттеров и биоэквивалентов.
В некоторых вариантах осуществления ингибитор PD-L1 выбран из группы, состоящей из дурвалумаба, атезолизумаба, авелумаба, BMS-936559, ALN-PDL, TSR-042, KD-033, CA-170, CA-327, STI-1014, KY-1003, их биоаналогов, биобеттеров и биоэквивалентов.
В некоторых вариантах осуществления ингибитор PD-L1 выбран из группы, состоящей из дурвалумаба, атезолизумаба, авелумаба, BMS-936559, ALN-PDL, TSR-042, KD-033, CA-327, STI-1014, KY-1003, их биоаналогов, биобеттеров и биоэквивалентов.
В некоторых вариантах осуществления ингибитор PD-L1 выбран из группы, состоящей из дурвалумаба, атезолизумаба, авелумаба, BMS-936559, ALN-PDL, TSR-042, KD-033, CA-170, STI-1014 и KY-1003.
В некоторых вариантах осуществления ингибитор PD-1 и/или PD-L1 выбран из соединений, раскрытых в US 2015291549, WO16039749, WO15034820 и US2014294898 (BRISTOL MYERS SQUIBB CO), которые тем самым включены посредством ссылки.
В некоторых вариантах осуществления ингибитор PD-1 и/или PD-L1 выбран из соединений, раскрытых в WO14151634, WO15160641, WO16039749, WO16077518, WO16100608, WO16149351, WO2016057624, WO2016100285, US2016194307, US2016222060 и US2014294898 (BRISTOL MYERS SQUIBB CO), которые тем самым включены посредством ссылки.
В некоторых вариантах осуществления низкомолекулярный ингибитор PD-1/PD-L1 выбран из соединений или фармацевтических композиций, раскрытых в WO 2018/005374, поданной ChemoCentryx 26 июня 2017, содержание которой включено в настоящий документ для всех целей.
В некоторых вариантах осуществления антагонист хемокинового рецептора CCR2 и ингибитор PD-1 или ингибитор PD-L1 приготовлены для совместного применения.
В других вариантах осуществления антагонист хемокинового рецептора CCR2 и ингибитор PD-1 или ингибитор PD-L1 приготовлены для последовательного применения.
В некоторых вариантах осуществления опухоль может представлять собой злокачественное или потенциально злокачественное новообразование или массу ткани любого размера, и включает первичные опухоли и вторичные новообразования. Солидная опухоль может представлять собой аномальный рост или массу ткани, которая не содержит кист или областей жидкости.
В некоторых вариантах осуществления применение соединений, агентов и композиций по настоящему изобретению может уменьшать или снижать опухолевую нагрузку, опухолевую массу, размер опухоли и/или количество опухолей у субъекта. В некоторых случаях соединения, агенты и композиции могут предотвращать или минимизировать метастазирование опухоли. В других случаях соединения, агенты и композиции могут вызывать или усиливать некроз опухоли.
В некоторых вариантах осуществления применение соединений, агентов и композиций по настоящему изобретению может привести к частичному ответу или полному ответу (выживаемость без прогрессирования), задерживать прогрессирование заболевания и/или улучшать общую выживаемость. В некоторых случаях соединения, агенты и композиции позволяют увеличить продолжительность общего ответа на лечение, способствовать регрессии опухоли, регрессии рака или стабилизации заболевания и/или обеспечить клиническое преимущество. В других случаях соединения, агенты и композиции позволяют снижать тяжесть по меньшей мере одного симптома заболевания, увеличивать частоту и продолжительность бессимптомных периодов заболевания, или предотвращать нарушение или инвалидность вследствие рака. В некоторых случаях развитие рака или рецидив рака могут быть уменьшены.
Рак обычно включает любое из различных злокачественных новообразований, характеризующихся пролиферацией анапластических клеток, которые имеют тенденцию проникать в окружающие ткани и метастазировать в новые участки тела. Неограничивающие примеры различных типов рака, подходящих для лечения с использованием композиций по настоящему изобретению, включают рак яичника, рак молочной железы, рак легкого (такой как немелкоклеточный рак легкого), рак мочевого пузыря, рак щитовидной железы, рак печени, рак плевры, рак поджелудочной железы, рак шейки матки, рак простаты, рак яичка, рак толстой кишки, рак анального канала, колоректальный рак, рак желчных протоков, карциноидные опухоли желудочно-кишечного тракта, рак пищевода, рак желчного пузыря, рак прямой кишки, рак аппендикса, рак тонкой кишки, рак желудка, рак почки (т.е. почечно-клеточную карциному), злокачественные новообразования центральной нервной системы, рак кожи, хориокарциномы, рак головы и шеи, рак кости, остеогенную саркому, фибросаркому, саркому Капоши, эпидермоидный рак, плоскоклеточный рак, нейробластому, глиому, меланому, лейкоз (например, острый лимфоцитарный лейкоз, хронический лимфолейкоз, острый миелогенный лейкоз, хронический миелогенный лейкоз или волосатоклеточный лейкоз), лимфому (например, неходжкинскую лимфому, лимфому Ходжкина, В-клеточную лимфому или лимфому Беркитта) и множественную миелому.
Дополнительные примеры раковых заболеваний включают фибросаркому, миксосаркому, липосаркому, хондросаркому, остеогенную саркому, хордому, ангиосаркому, эндотелиосаркому, лимфангиосаркому, лимфангиоэндотелиосаркому, синовиому, мезотелиому, опухоль Юинга, лейомиосаркому, рабдомиосаркому, карциному толстой кишки, плоскоклеточную карциному, базальноклеточную карциному, карциному потовых желез, карциному сальных желез, папиллярную карциному, папиллярные аденокарциномы, цистаденокарциному, медуллярную карциному, бронхогенную карциному, почечно-клеточный рак, гепатому, карциному желчных путей, хориокарциному, семиному, эмбриональную карциному, опухоль Вильмса, опухоль яичка, рак легкого, мелкоклеточный рак легкого, рак мочевого пузыря, эпителиальную карциному, глиому, астроцитому, медуллобластому, краниофарингиому, эпендимому, пинеалому, гемангиобластому, акустическую неврому, олигодендроглиому, менингиому, меланому, нейробластому и ретинобластому, но не ограничиваются ими.
В некоторых вариантах осуществления рак представляет собой рак легкого (например, немелкоклеточный рак легкого), меланому, эпителиальный рак (например, рак простаты, рак яичника, рак молочной железы) или гемобластоз (например, лейкоз, лимфому, множественную миелому).
В некоторых вариантах осуществления рак представляет собой солидный рак. В некоторых вариантах осуществления рак представляет собой колоректальный рак. В некоторых вариантах осуществления рак является глиобластомой. В некоторых вариантах осуществления рак представляет собой рак поджелудочной железы.
А. Антагонисты CCR2
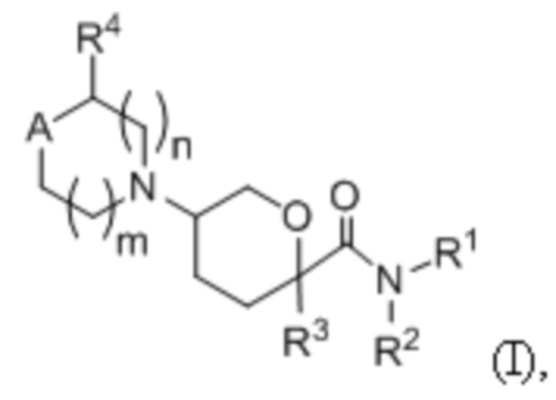
В некоторых вариантах осуществления антагонисты CCR2 представляют собой низкомолекулярный ингибитор CCR2, имеющий формулу (I):
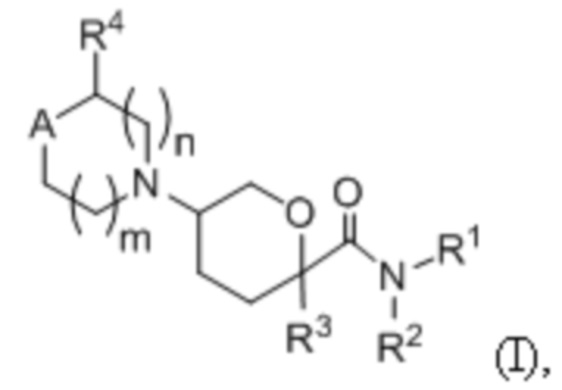
или его фармацевтически приемлемую соль, гидрат, стереоизомер или ротамер; где А представляет собой С(R5)(R6) или N(R5);
каждый индекс m и n независимо представляет собой целое число от 0 до 2, а m + n составляет ≤ 3;
R1 выбран из группы, состоящей из арила, арил-C1-4-алкила, гетероарила и гетероарил-C1-4-алкила, где гетероарильная часть имеет 1-3 гетероатома в качестве членов кольца, выбранных из N, O и S; и где указанные арильные и гетероарильные группы или части необязательно замещены от 1 до 5 заместителями Rx;
R2 выбран из группы, состоящей из Н, C1-8 алкила, С3-8 циклоалкила, С3-8 циклоалкил-С1-4 алкила, арила, арил-С1-4 алкила, гетероарила и гетероарил-С1-4 алкила, где гетероарильная часть имеет 1-3 гетероатома в качестве членов кольца, выбранных из N, O и S; и где указанные арильные и гетероарильные группы или части необязательно замещены от 1 до 4 заместителями Rx;
или, необязательно, R1 и R2 объединены с атомом азота, к которому каждый из них присоединен, с образованием 6-11-членного моноциклического или конденсированного бициклического-гетероциклического или гетероарильного кольца, где -NR1R2 необязательно дополнительно замещен от 1 до 4 Rx заместителями;
R3 выбран из группы, состоящей из Н, С1-8-алкила, С3-8-циклоалкила и С3-8-циклоалкил-С1-4 алкила, каждый из которых необязательно замещен 1-3 заместителями Ry;
R4 выбран из группы, состоящей из Н, С1-8 алкила, необязательно замещенного от 1 до 2 Ry, и -СО2Н;
R5 выбран из группы, состоящей из С1-8 алкила, С1-8 алкокси, С3-8 циклоалкила, С3-8 циклоалкилокси, С3-8 циклоалкил-С1-4 алкила, С1-8 алкиламино, ди-С1-8 алкиламино, арила, арилокси, ариламино, арил-С1-4 алкила, гетероарила, гетероарилокси, гетероариламино и гетероарил-С1-4 алкила, каждый из которых необязательно замещен от 1 до 5 заместителями Rz;
R6 выбран из группы, состоящей из H, F, OH, C1-8 алкила и C1-8 алкокси, где C1-8 алкильная и C1-8 алкокси группа необязательно замещены 1-3 заместителями Rz;
или, необязательно, R5 и R6 соединены с образованием спироциклического 5- или 6-членного циклоалкильного кольца, которое является необязательно ненасыщенным и имеет конденсированную арильную группу, которая необязательно замещена 1-4 заместителями Rz;
каждый Rx независимо выбран из группы, состоящей из галогена, -CN, -Rc, -CO2Ra, -CONRaRb, -C(O)Ra, -OC(O)NRaRb, -NRbC(O)Ra, -NRbC(O)2Rc, -NRa-C(O)NRaRb, -NRaC(O)NRaRb, -NRaRb, -ORa, -O-X1-ORa, -O-X1-NRaRb, -O-X1-CO2Ra, -O-X1-CONRaRb, -X1-ORa, -X1-NRaRb, -X1-CO2Ra, -X1-CONRaRb, -SF5, -S(O)2NRaRb, и 5- или 6-членного арила или гетероарила, где каждый X1 представляет собой C1-4 алкилен; каждый Ra и Rb независимо выбран из водорода, C1-8 алкила и C1-8 галоалкила или, когда они присоединены к одному и тому же атому азота, они могут быть объединены с атомом азота с образованием пяти или шестичленного кольца, имеющего от 0 до 2 дополнительных гетероатомов в качестве членов кольца, выбранных из N, O или S, и необязательно замещены оксо группой; каждый Rc независимо выбран из группы, состоящей из С1-8 алкила, С1-8 галоалкила и С3-6 циклоалкила; и необязательно, когда два заместителя Rx находятся на соседних атомах, объединяются с образованием конденсированного пяти- или шестичленного карбоциклического кольца, и где арильные или гетероарильные группы необязательно замещены 1-3 членами, выбранными из галогена, гидроксила, C1-4 алкила C1-4 алкокси, C1-4 галоалкила и C1-4 галоалкокси;
каждый Ry независимо выбран из группы, состоящей из галогена, -CN, -Rf, -CO2Rd, -CONRdRe, -C(O)Rd, -OC(O)NRdRe, -NReC(O)Rd, -NReC(O)2Rf, -NRdC(O)NRdRe, -NRdC(O)NRdRe, -NRdRe, -ORd, и -S(O)2NRdRe; где каждый Rd и Re независимо выбран из водорода, C1-8 алкила и C1-8 галоалкила, или когда они присоединены к одному и тому же атому азота, они могут быть объединены с атомом азота с образованием пяти- или шестичленного кольца, имеющего от 0 до 2 дополнительных гетероатомов в качестве членов кольца, выбранных из N, O или S; каждый Rf независимо выбран из группы, состоящей из C1-8 алкила, C1-8 галоалкила и C3-6 циклоалкила;
каждый Rz независимо выбран из группы, состоящей из галогена, -CN, -Ri, -CO2Rg, -CONRgRh, -C(O)Rg, -OC(O)NRgRh, -NRhC(O)Rg, -NRhC(O)2Ri, -NRgC(O)NRgRh, -NRgRh, -ORg, -S(O)2NRgRh, -X1-Rj, -X1-NRgRh, -X1-CONRgRh, -X1-NRhC(O)Rg, -NHRj, -NHCH2Rj и тетразола; где каждый Rg и Rh независимо выбраны из водорода, C1-8 алкила, C3-6 циклоалкила и C1-8 галоалкила, или когда они присоединены к одному и тому же атому азота, они могут быть объединены с атомом азота с образованием пяти или шестичленного кольца, имеющего от 0 до 2 дополнительных гетероатомов в качестве членов кольца, выбранных из N, O или S, и необязательно замещены одной или двумя оксо группами; каждый Ri независимо выбран из группы, состоящей из С1-8 алкила, С1-8 галоалкила и С3-6 циклоалкила; и каждый Rj выбран из группы, состоящей из С3-6 циклоалкила, пирролинила, пиперидинила, морфолинила, тетрагидрофуранила и тетрагидропиранила.
Следует понимать, что, когда R1 и R2 объединены с атомом азота, к которому каждый присоединен, с образованием 6-11-членного моноциклического или конденсированного бициклического-гетероциклического кольца, 6-11-членное моноциклическое или конденсированное бициклическое-гетероциклическое кольцо включает моноциклические гетероциклические кольца, конденсированные с арильным или гетероарильным кольцом.
В формуле I заместитель R3 в одном варианте осуществления выбран из группы, состоящей из Н, метила, этила, пропила, изопропила, бутила, изобутила, втор-бутила, циклопропила, циклопропилметила, циклобутила и циклобутилметила.
В описаниях, приведенных в настоящей заявке, специалист в данной области техники поймет, что волнистая линия, пересекающая связь, предназначена для идентификации точки присоединения данного заместителя или группы к остальной части молекулы.
Как отмечено выше, каждый нижний индекс m и n представляет собой целые числа, выбранные из 0, 1 и 2, а m + n составляет ≤ 3. Когда нижний индекс равен 0, специалист в данной области техники поймет, что подразумевается циклическая структура с вершиной кольца A, но соседние вершины кольца с обеих сторон скобок соединены связью. Соответственно, настоящее изобретение включает структуры, в которых кольцо, имеющее A в качестве вершины, должно включать:
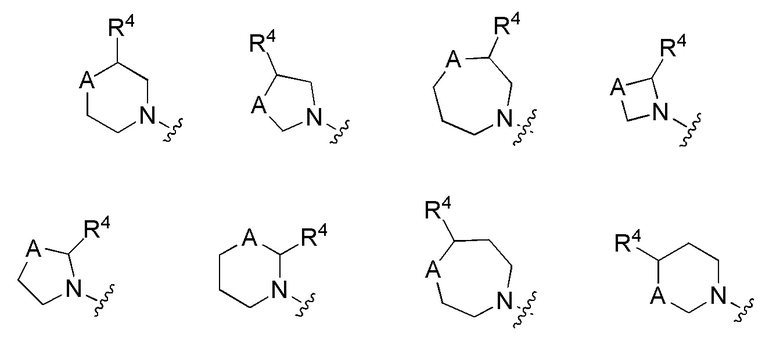
В одной выбранной группе вариантов осуществления m и n оба равны 0. В другой выбранной группе вариантов осуществления m и n оба равны 1. В еще одной группе выбранных вариантов осуществления m равно 1, а n равно 0. В другой группе вариантов осуществления m равно 1, а n равно 2.
В других выбранных вариантах осуществления кольцо, имеющее вершину A, представлено формулой, выбранной из:
В одной подгруппе вариантов осуществления соединения формулы (I) представлены как:
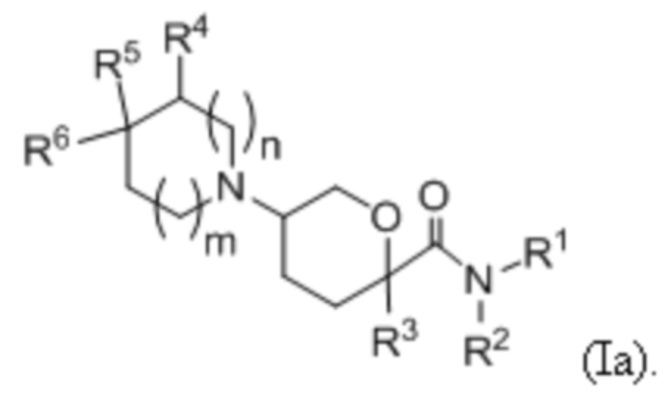
В формуле (Ia) ряд выбранных вариантов осуществления представлен в виде формул Ia1, Ia2, Ia3, Ia4 и Ia5.
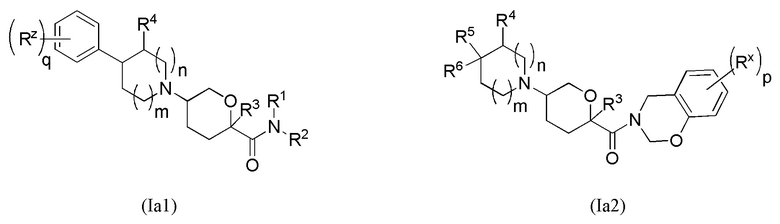
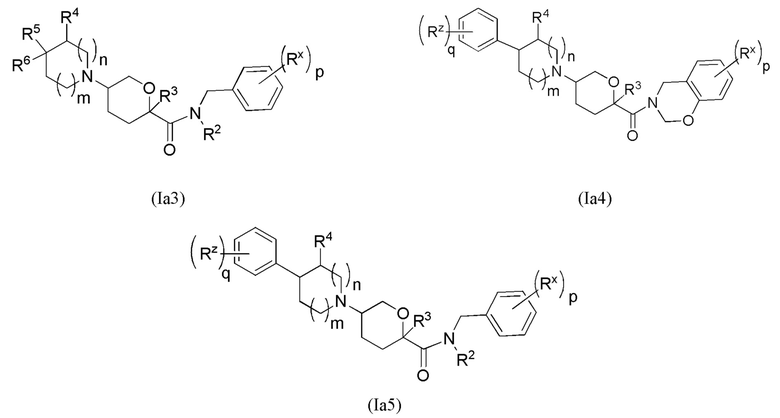
В каждой из формул Ia, Ia1, Ia2, Ia3, Ia4 и Ia5 отмеченные заместители (R1-R6, Rx и Rz) и индексы m и n имеют значения, указанные выше по отношению к формуле I. Индексы p и q имеют следующие значения: для Ia1, Ia4 и Ia5 индекс q представляет собой целое число от 0 до 5; для Ia2 и Ia4 индекс p представляет собой целое число от 0 до 4; и для Ia3 и Ia5 индекс p представляет собой целое число от 0 до 5.
В других выбранных вариантах осуществления соединения, обеспеченные в настоящем документе, представлены формулами, выбранными из:
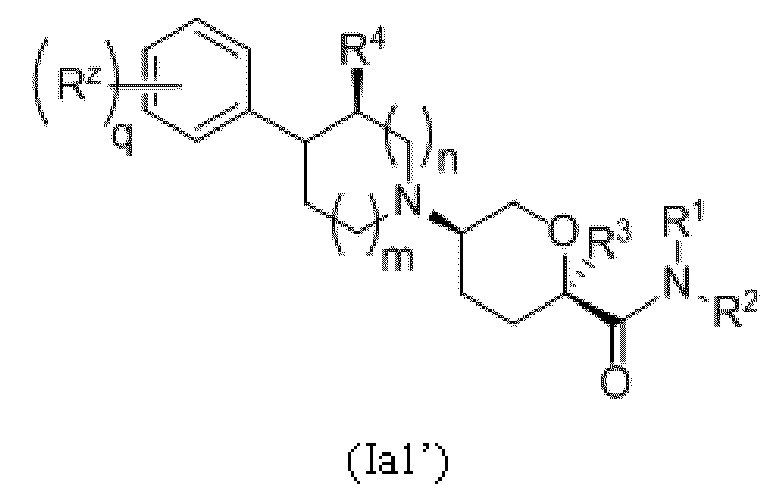
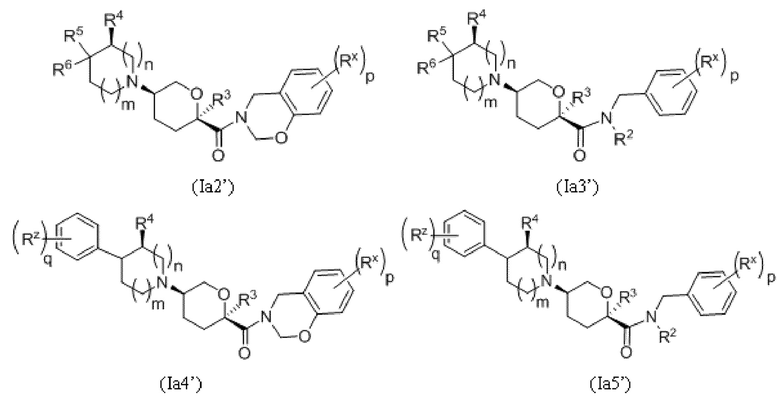
где каждое соединение по существу не содержит других стереоизомеров, и где указанные заместители (R1-R6, Rx и Rz) и индексы m и n имеют значения, указанные выше в отношении формулы I. Индексы p и q имеют следующие значения: для Ia1', Ia4' и Ia5' индекс q представляет собой целое число от 0 до 5; для Ia2’ и Ia4’ индекс p представляет собой целое число от 0 до 4; а для Ia3’ и Ia5’ индекс p представляет собой целое число от 0 до 5.
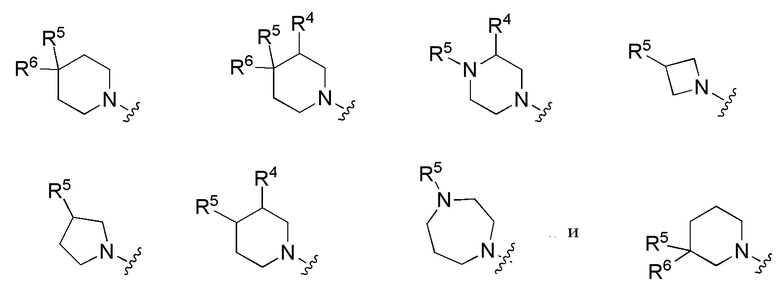
В другой группе вариантов осуществления формулы I A представляет собой C(R5)(R6), где R5 и R6 объединены с образованием кольца. Выбранные варианты осуществления представлены следующим образом:
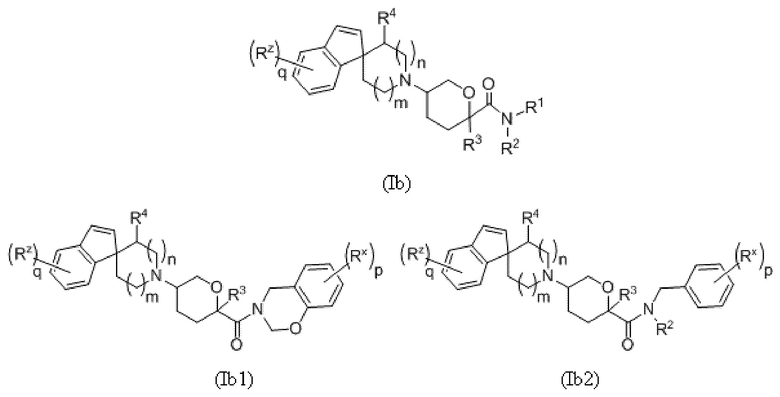
В каждой из формул Ib, Ib1 и Ib2 отмеченные заместители (R1-R6, Rx и Rz) и индексы m и n имеют значения, указанные выше в отношении формулы I. Индексы p и q имеют следующие значения: для Ib, Ib1 и Ib2 индекс q представляет собой целое число от 0 до 5; для Ib1 индекс p представляет собой целое число от 0 до 4; и для Ib2 индекс p представляет собой целое число от 0 до 5.
В другой группе вариантов осуществления формулы I A представляет собой NR5 (см. Формулу Ic). Выбранные варианты осуществления представлены следующим образом:
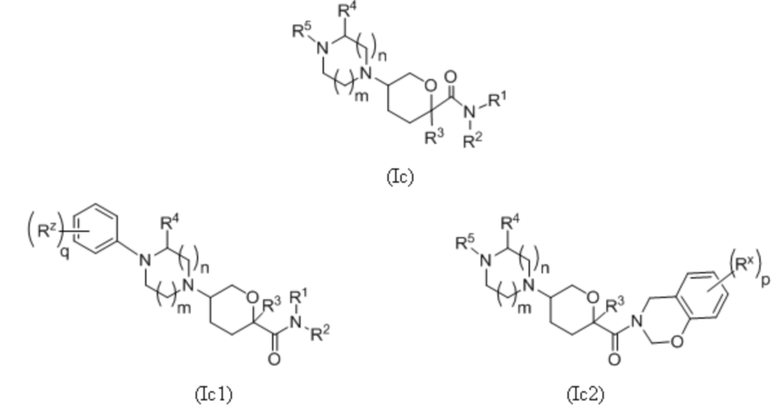
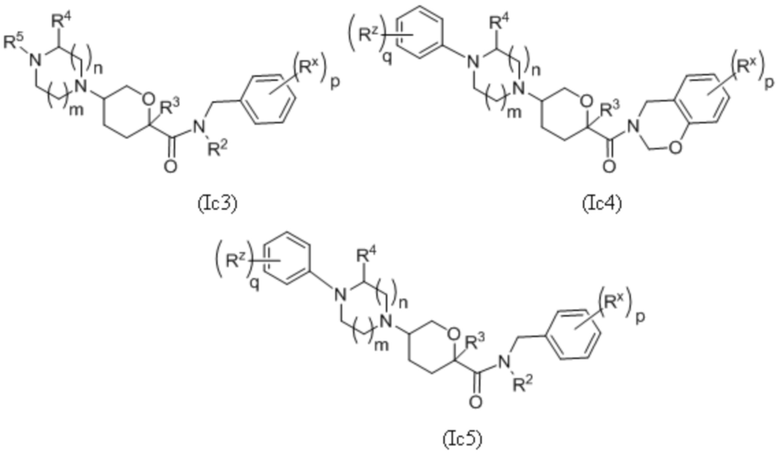
В каждой из формул Ic, Ic1, Ic2, Ic3, Ic4 и Ic5 отмеченные заместители (R1-R6, Rx и Rz) и индексы m и n имеют значения, приведенные выше в отношении формулы I. Индексы p и q имеют следующие значения: для Ic1, Ic4 и Ic5 индекс q представляет собой целое число от 0 до 5; для Ic2 и Ic4 индекс p представляет собой целое число от 0 до 4; и для Ic3 и Ic5 индекс p представляет собой целое число от 0 до 5.
В еще одних выбранных вариантах осуществления соединения, обеспеченные в настоящем документе, представлены формулами, выбранными из:
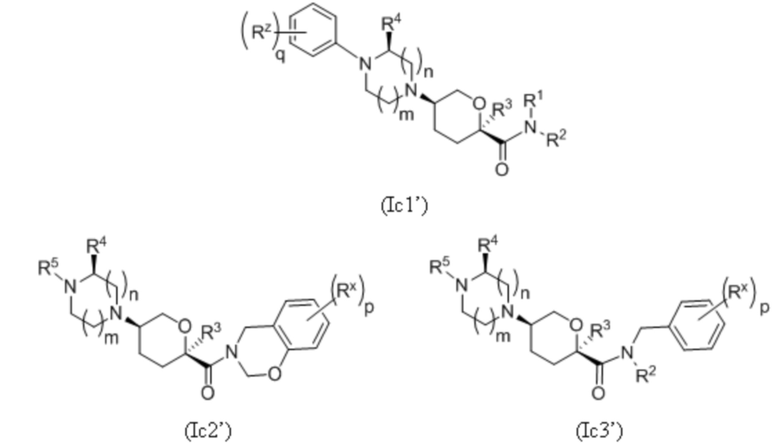
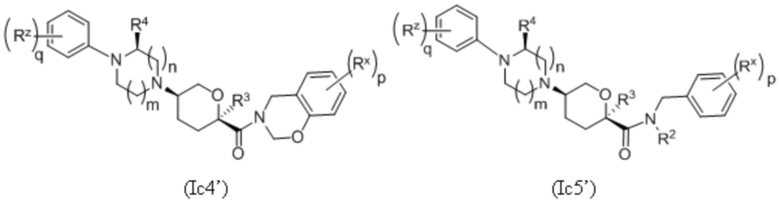
где каждое соединение по существу не содержит других стереоизомеров, и где указанные заместители (R1-R6, Rx и Rz) и индексы m и n имеют значения, указанные выше в отношении формулы I. Индексы p и q имеют следующие значения: для Ic1', Ic4' и Ic5' индекс q представляет собой целое число от 0 до 5; для Ic2’ и Ic4’ индекс p представляет собой целое число от 0 до 4; а для Ic3’ и Ic5’ индекс p представляет собой целое число от 0 до 5.
В других выбранных вариантах осуществления соединения представлены в каждом из I, Ia, Ia1, Ia1’, Ib, Ic, Ic1 и Ic1’, описанных выше, где -N(R1)(R2) выбран из:
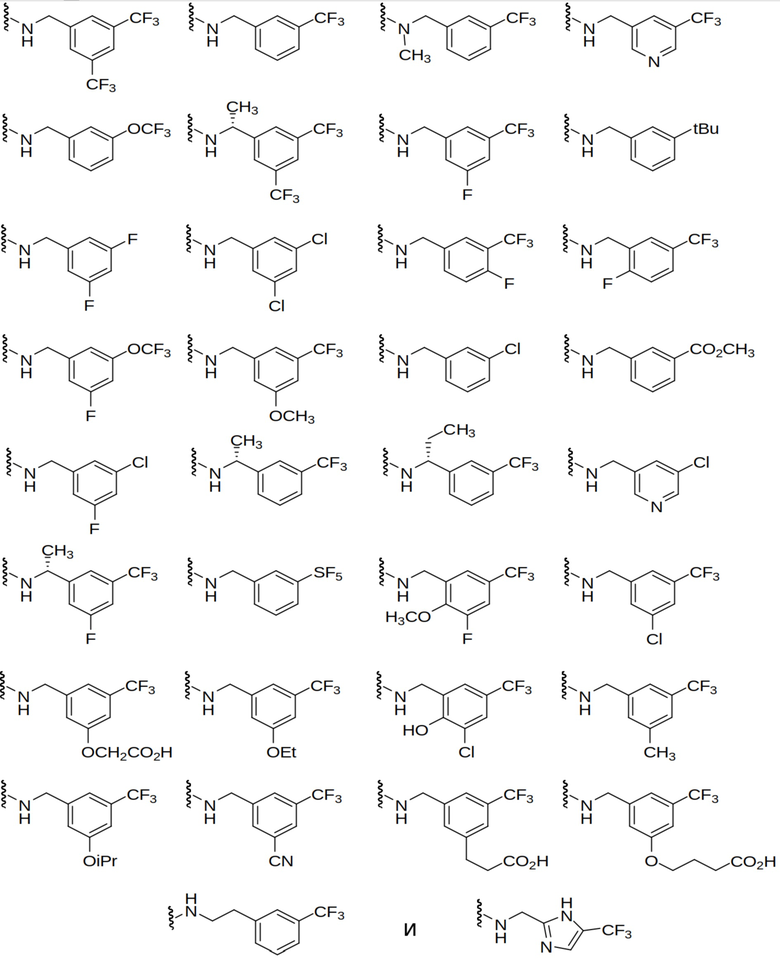
Еще одни выбранные варианты осуществления предоставлены в каждом из I, Ia, Ia1, Ia1’, Ib, Ic, Ic1 и Ic1’, описанных выше, где -N(R1)(R2) выбран из:
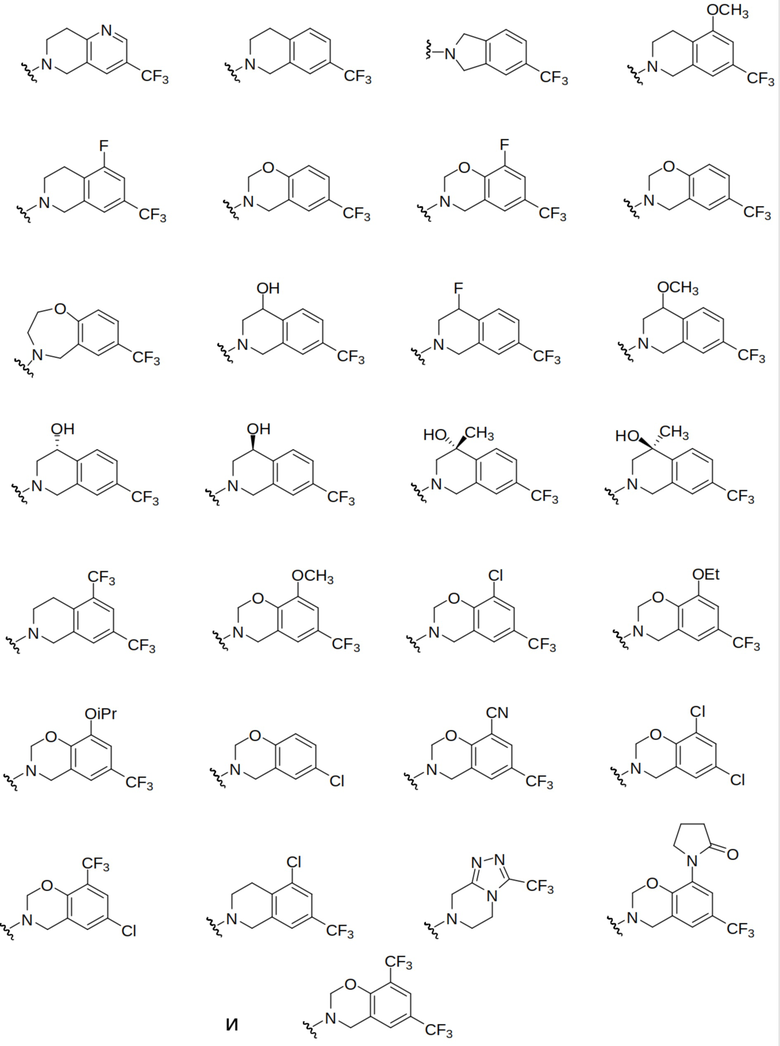
Еще одни выбранные варианты осуществления представлены в каждом из I, Ia, Ia1, Ia1’, Ib, Ic, Ic1 и Ic1’, описанных выше, где -N(R1)(R2) выбран из:
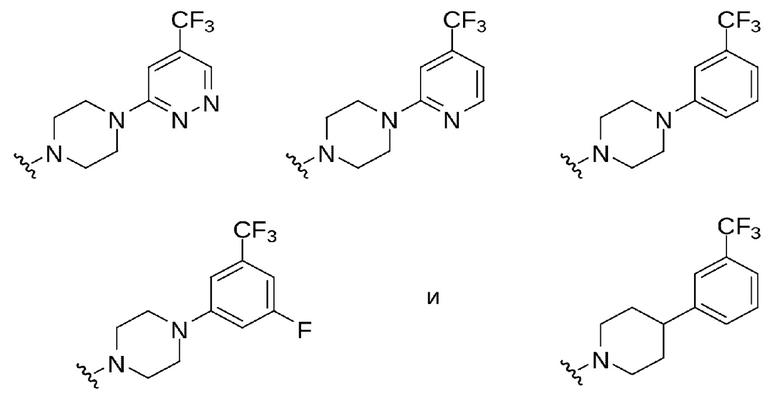
В некоторых вариантах осуществления изобретения представлены соединения формул I, Ia, Ia2, Ia3, Ia2' и Ia3', где A представляет собой C(R5)(R6) или показан в формуле как C(R5)(R6), где R5 выбран из арила, арилокси, ариламино, арил-С1-4 алкила, гетероарила, гетероарилокси, гетероариламино и гетероарил-С1-4 алкила, где арильные или гетероарильные группы или части выбраны из:
В других выбранных вариантах осуществления изобретения предложены соединения формул I, Ia, Ia2, Ia3, Ia2' и Ia3', где A представляет собой C(R5)(R6) или показан в формуле как C(R5)(R6), где R5 выбран из арила, арилокси, ариламино и арил-С1-4 алкила, где арильная группа или часть выбрана из:
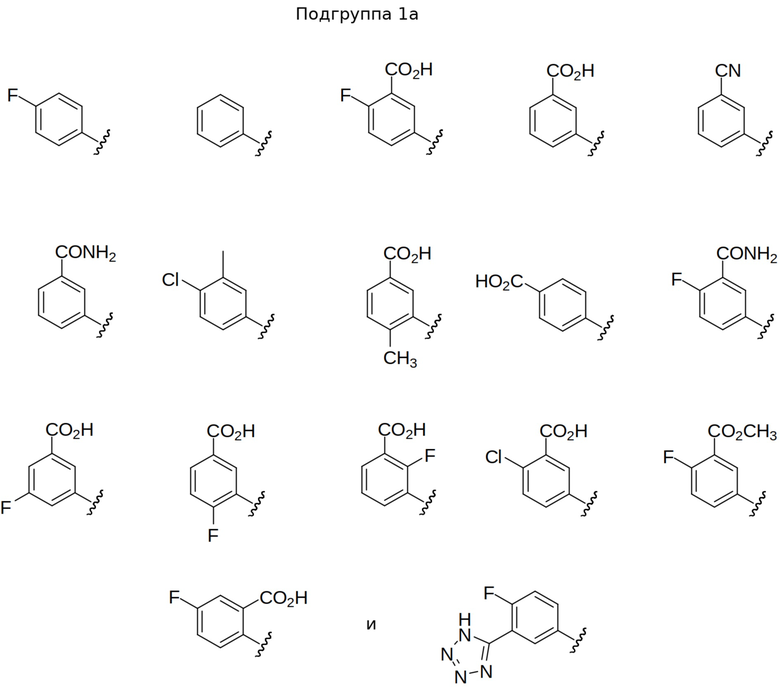
В других выбранных вариантах осуществления изобретения предложены соединения формул I, Ia, Ia2, Ia3, Ia2' и Ia3', где A представляет собой C(R5)(R6) или показан в формуле как C(R5)(R6), где R5 выбран из гетероарила, гетероарилокси, гетероариламино и гетероарил-С1-4 алкила, где гетероарильная группа или часть выбрана из:
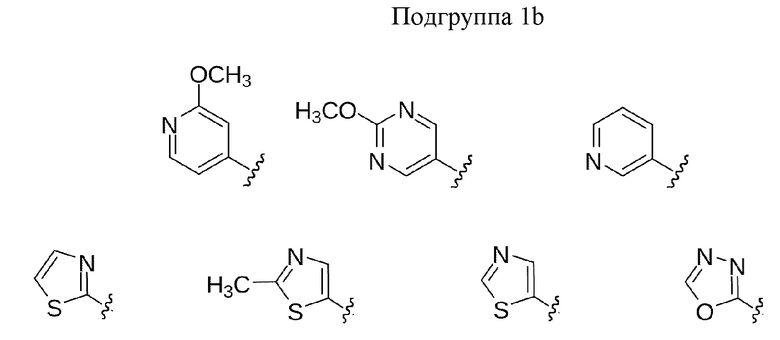
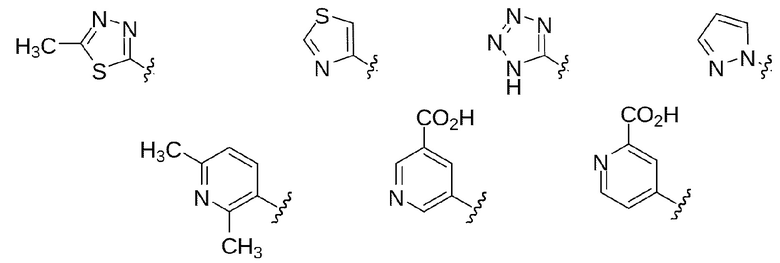
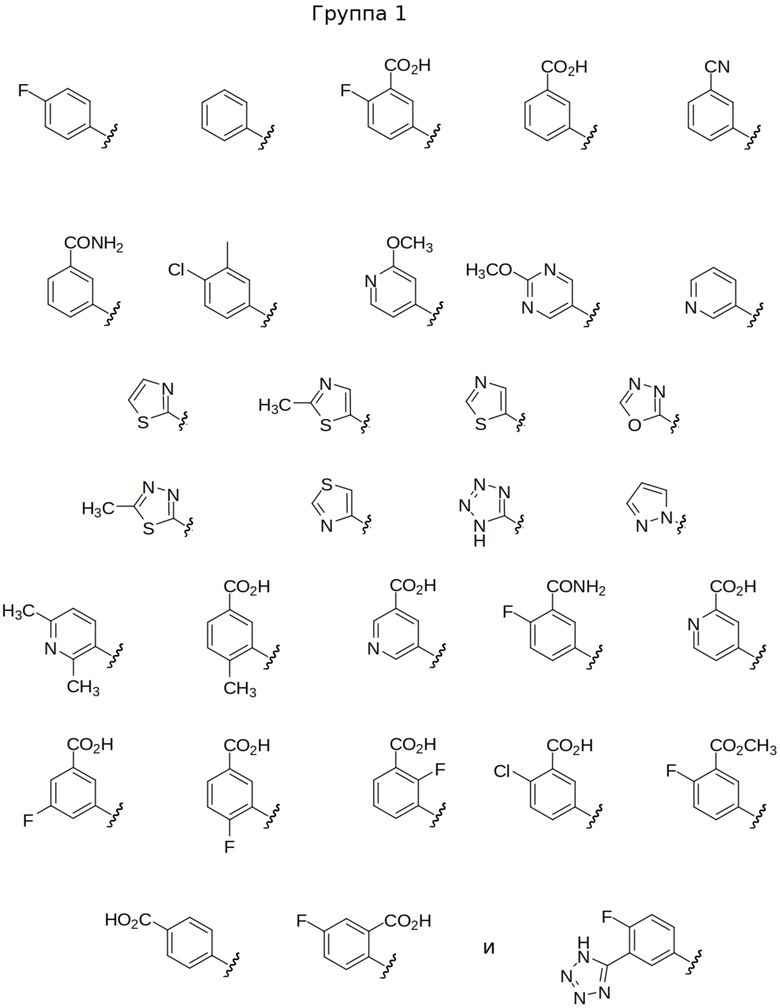
В некоторых вариантах осуществления предлагаются соединения формул I, Ic, Ic2, Ic3, Ic2' и Ic3', где A представляет собой N(R5) или показан в формуле как N(R5), где R5 выбран из арила, арил-С1-4 алкила, гетероарила и гетероарил-С1-4 алкила, где арильные или гетероарильные группы или части выбраны из Группы 1 выше. В некоторых избранных вариантах осуществления представлены соединения формул I, Ic, Ic2, Ic3, Ic2' и Ic3', где A представляет собой N(R5) или обозначен в формуле как N(R5), где R5 выбран из арила и арил-С1-4 алкила, где арильная группа или часть выбрана из Подгруппы 1а выше. В других выбранных вариантах осуществления изобретения представлены соединения формул I, Ic, Ic2, Ic3, Ic2' и Ic3', где A представляет собой N(R5) или показан в формуле как N(R5), где R5 выбран из гетероарила и гетероарил-С1-4 алкила, где гетероарильная группа или часть выбрана из Подгруппы 1b выше.
В некоторых вариантах осуществления антагонист CCR2 имеет формулу, выбранную из группы, состоящей из:

или их фармацевтически приемлемой соли.
В некоторых вариантах осуществления антагонист CCR2 имеет формулу
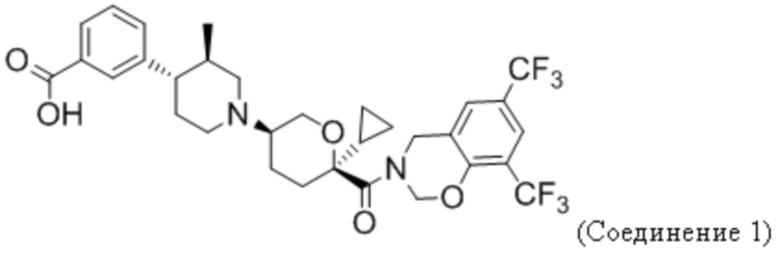
или его фармацевтически приемлемой соли.
В некоторых вариантах осуществления антагонист CCR2 имеет формулу
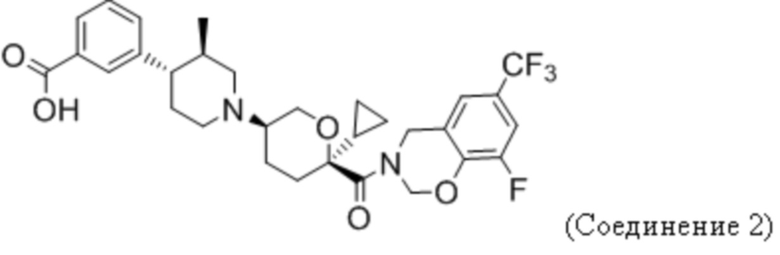
или его фармацевтически приемлемой соли.
В некоторых вариантах осуществления антагонист CCR2 имеет формулу
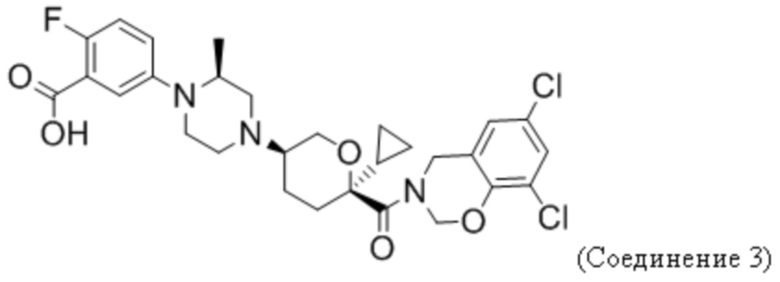
или его фармацевтически приемлемой соли.
В некоторых вариантах осуществления антагонист CCR2 выбран из соединений или фармацевтических композиций, раскрытых в US2016/0340356, происходящих из заявки № 15/158,713, поданной 19 мая 2016 ChemoCentryx, содержание которых включено в настоящий документ для любых целей.
В некоторых вариантах осуществления антагонист хемокинового рецептора CCR2 выбран из группы, состоящей из AZ889, AZD2423, INCB-8761, МК-0812, BMS-813160, INCB-003284, PF-04634817, BMS-741672, ценикривирока, CCX -140.
B. Ингибиторы PD-1 и ингибиторы PD-L1
Способы, композиции и наборы, представленные в настоящем документе, включают ингибиторы иммунной контрольной точки, такие как ингибиторы (агенты) пути PD-1/PD-L1. Ингибиторы PD-1 и/или PD-L1 по настоящему изобретению включают малые молекулы и антитела.
В некоторых вариантах осуществления ингибитор PD-L1 может представлять собой дурвалумаб или атезолизумаб, или авелумаб, или BMS-936559 (MDX-1105), или ALN-PDL, или TSR-042, или KD-033, или CA-170, или CA-327, или STI-1014, или MEDI-0680 или KY-1003.
В некоторых вариантах осуществления ингибитор PD-L1 может представлять собой дурвалумаб или атезолизумаб, или авелумаб, или BMS-936559 (MDX-1105), или ALN-PDL, или TSR-042, или KD-033, или CA-170, или STI-1014, или MEDI-0680 или KY-1003. Дурвалмаб (MEDI4736) представляет собой человеческое моноклональное антитело, направленное против PD-L1. Атрексолизумаб (MPDL3280A) является полностью гуманизированным, сконструированным моноклональным антителом IgG1 против PD-L1. Авелумаб (MSB0010718C) представляет собой полностью гуманизированное, сконструированное моноклональное антитело IgG1 против PD-L1. BMS-936559 (MDX-1105) является полностью человеческим моноклональным антителом IgG4 против PD-L1. ALN-PDL представляет собой ингибирующую РНК (RNAi), нацеленную на PD-L1. TSR-042 относится к сконструированному химерному антителу, которое направлено против пути PD-1/PD-L1. KD-033 относится к бифункциональному слитому белку анти-PD-L1/IL-15, в котором антитело против PD-L1 связано в своем хвосте с цитокином IL-15 посредством суши-домена рецептора IL-15. CA-170 относится к низкомолекулярному антагонисту PD-L1 и VISTA. STI-1014 относится к антителу против PD-L1. KY-1003 представляет собой моноклональное антитело против PD-L1. CA-327 относится к низкомолекулярному антагонисту PD-L1 и TIM3.
В некоторых вариантах осуществления ингибитор PD-1 и/или PD-L1 выбран из группы, состоящей из дурвалумаба, атезолизумаба, пембролизумаба, ниволумаба, АР-106, АР-105, MSB-2311, CBT-501, авелумаба, AK-105, IO-102, IO-103, PDR-001, CX-072, SHR-1316, JTX-4014, GNS-1480, рекомбинантного гуманизированного анти-PD1 мАт (Shanghai Junshi Biosciences), REGN-2810, пелареорепа, SHR-1210, вакцины-ингибитора PD1/PDL1 (THERAVECTYS), BGB-A317, рекомбинантного гуманизированного мАт против PD-1 (Bio-Thera Solutions); Probody™, нацеленного на PD-1 (CytomX); XmAb-20717, FS-118, PSI-001, SN-PDL01, SN-PD07, PD-1-модифицированных противоопухолевых эффекторных лимфоцитов (Sangamo Therapeutics), PRS-332, FPT-155, jienuo мАт (Genor Biopharma), TSR-042, REGN-1979, REGN-2810, ресминостата, FAZ-053, биспецифического антитела PD-1/CTLA-4 (MacroGenics), MGA-012, MGD-013, M-7824, биспецифического антитела на основе PD-1 (Beijing Hanmi Pharmaceutical), AK-112, AK-106, АК-104, АК-103, BI-754091, ENUM-244C8, MCLA-145, MCLA-134, онколитического моноклонального антитела против PD1 (Transgene SA), AGEN-2034, IBI-308, WBP-3155, JNJ-63723283, MEDI-0680, SSI-361, CBT-502, биспецифического антитела против PD-1, моноклональных антител двойного таргетинга против PD-1/LAG-3 (TESARO), моноклональных антител двойного таргетинга против PD-1/TIM-3 (TESARO), PF-06801591, LY-3300054, BCD-100, STI-1110, биоаналога пембролизумаба, биоаналога ниволумаба, PD-L1-TGF-бета-терапии, KY-1003, STI-1014, GLS-010, AM-0001, GX-P2, KD-033, биспецифического антитела PD-L1/BCMA (Immune Pharmaceuticals), биспецифического антитела против PD-1/Ox40 (Immune Pharmaceuticals), BMS-936559, анти-PD-1/VEGF-A DARPins (Molecular Partners), mDX-400, ALN-PDL, PD-1 ингибирующего пептида (Aurigene), миРНК-нагруженной вакцины из дендритных клеток (Alnylam Pharmaceuticals), GB-226, PD-L1-нацеленной иммунотерапии на основе CAR-TNK (TNK Therapeutics/NantKwest), INSIX RA, INDUS-903, AMP-224, биспецифического гуманизированного антитела анти-CTLA-4/анти-PD-1 (Akeso Biopharma), вакцины B7-H1 (Государственная ключевая лаборатория биологии рака/ Четвертый военно-медицинский университет) и GX-D1.
В некоторых вариантах осуществления ингибитором PD-1 может быть пембролизумаб, или ниволумаб, или IBI-308, или mDX-400, или BGB-108, или MEDI-0680, или SHR-1210, или PF-06801591, или PDR-001, или GB-226, или STI-1110. Ниволумаб (также известный как OPDIVO™, MDX-1106, BMS-936558 и ONO-4538) представляет собой человеческое моноклональное антитело IgG4 против PD-1. Пембролизумаб (также известный как KEYTRUDA®, ламбролизумаб и МК-34) является гуманизированным моноклональным антителом изотипа каппа IgG4 против PD-1. IBI-308 относится к моноклональному антителу, направленному на PD-1. mDX-400 относится к мышиному антителу против PD-1. BGB-108 представляет собой гуманизированное моноклональное антитело против PD-1. MEDI-0680 (AMP-514) представляет собой гуманизированное моноклональное антитело IgG4 против PD-1. SHR-1210 относится к моноклональному антителу против PD-1. PF-06801591 представляет собой моноклональное антитело против PD-1. PDR-001 относится к моноклональному антителу против PD-1. GB-226 относится к моноклональному антителу против PD-1. STI-1110 относится к моноклональному антителу против PD-1.
В некоторых вариантах осуществления ингибитор PD-1 представляет собой RPM1-14.
В некоторых вариантах осуществления ингибитор PD-1 представляет собой антитело, выбранное из ниволумаба, пембролизумаба и пидилизумаба.
Антитела против PD-1 и фрагменты антител, описанные в настоящем документе, охватывают белки, имеющие аминокислотные последовательности, которые отличаются от последовательностей описанных антител, но которые сохраняют способность связывать PD-1.
В некоторых вариантах осуществления анти-PD-1-антитела включают биспецифичные антитела и антитело-подобные терапевтические белки, включая DARTs®, DUOBODIES®, BITES®, XmAbs®, TandAbs®, производные Fab и тому подобное, которые связываются с PD-1.
Антитела против PD-L1 и фрагменты антител, описанные в настоящем документе, охватывают белки, имеющие аминокислотные последовательности, которые отличаются от последовательностей описанных антител, но которые сохраняют способность связывать PD-L1. Такие варианты антител и их фрагменты могут содержать одно или несколько из вставок, делеций или замен аминокислот по сравнению с исходной последовательностью, но проявляют биологическую активность, которая по существу эквивалентна или по существу биоэквивалентна активности описанных антител.
В некоторых вариантах осуществления антитела против PD-L1 включают биспецифичные антитела и антитело-подобные терапевтические белки, включая DARTs®, DUOBODIES®, BITES®, XmAbs®, TandAbs®, производные Fab и тому подобные, которые связываются с PD-L1.
Неограничивающие примеры дополнительных ингибиторов пути PD-1/PD-L1 описаны, например, в Chen and Han, Jour Clin Invest, 2015, 125 (9): 3384-3391, патентах США №№ 8168757, 8354509, 855215, 8741295 и 9212224; публикациях патентных заявок США №№ 2014/0341917; 2015/0203580 и 2015/0320859; публикации международной патентной заявки № WO2015/026634.
Биологический продукт, например антитело или его фрагмент, считается биоаналогом, если, например, этот биологический продукт имеет высокое сходство с уже одобренным FDA биологическим продуктом, известным как эталонный (референсный) продукт. Биоаналог не имеет клинически значимых отличий с точки зрения безопасности и эффективности от эталонного продукта. Биоаналог также может иметь такой же механизм действия, способ введения, лекарственную форму и величину дозировки, что и его эталонный продукт.
Два биологических продукта, например антитела или их фрагменты, считаются биоэквивалентными, если, например, они представляют собой фармацевтические эквиваленты или фармацевтические альтернативы, скорость и степень абсорбции которых не показывают значительного различия при введении в одной и той же молярной дозе в аналогичных условиях эксперимента, в однократной или многократной дозировке. Некоторые антитела будут считаться эквивалентами или фармацевтическими альтернативами, если они эквивалентны по степени их абсорбции, но не по скорости их абсорбции, и все же их можно считать биоэквивалентными, поскольку такие различия в скорости абсорбции являются преднамеренными и отражаются в маркировке, не имеют существенного значения для достижения эффективных концентраций лекарств в организме, например при хроническом применении, и считаются с медицинской точки зрения незначительными для конкретного исследуемого лекарственного препарата.
В некоторых вариантах осуществления два биологических продукта (например, два антитела или их фрагменты) являются биоэквивалентными, если нет клинически значимых различий в их безопасности, чистоте или эффективности.
В других вариантах осуществления два биологических продукта (например, два антитела или их фрагмента) являются биоэквивалентными, если пациент может переключаться один или несколько раз между эталонным продуктом и данным биологическим продуктом без ожидаемого увеличения риска побочных эффектов, включая клинически значимое изменение иммуногенности или снижение эффективности по сравнению с продолжением терапии без такого переключения.
В других вариантах осуществления два биологических продукта (например, два антитела или их фрагменты) являются биоэквивалентными, если они оба действуют посредством общего механизма действия для условий использования, в той степени, в которой такие механизмы известны.
Биоэквивалентность может быть продемонстрирована методами in vivo и/или in vitro. Измерения биоэквивалентности включают, например, (а) тест in vivo на людях или других млекопитающих, в котором концентрацию антитела или его метаболитов измеряют в крови, плазме, сыворотке или другой биологической жидкости как функцию времени; (b) тест in vitro, который сопоставляют с данными о биодоступности человека in vivo и который является достаточно прогностическим; (c) тест in vivo на людях или других млекопитающих, в котором соответствующий острый фармакологический эффект антитела (или его мишени) измеряют как функцию времени; и (d) хорошо контролируемое клиническое исследование, которое устанавливает безопасность, эффективность или биодоступность или биоэквивалентность антитела.
Биобеттерные варианты антител, описанных в настоящем документе, могут быть основаны на существующем эталонном антителе, специфичном для целевого антигена, например, PD-1 или PD-L1, которое претерпело изменения, такие, что, например, оно стало проявлять более высокую аффинность связывания к его целевому антигену и/или стало связываться с иным эпитопом, чем эталонное антитело, или получило более желательную терапевтическую эффективность, экспрессию и/или биофизические характеристики.
В некоторых вариантах осуществления ингибитор PD-1 и/или PD-L1 представляет собой низкомолекулярный ингибитор PD-1/PD-L1, имеющий формулу:
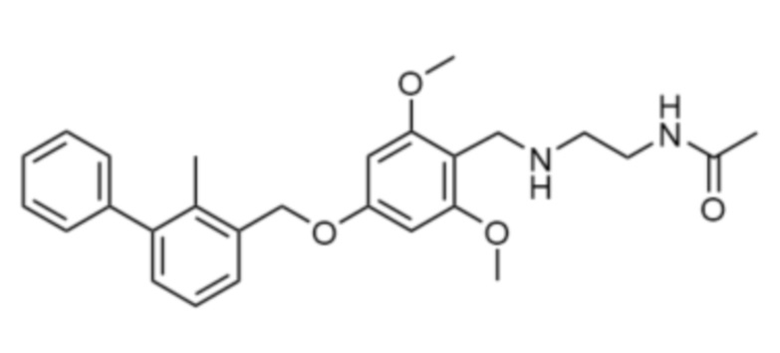 или
или 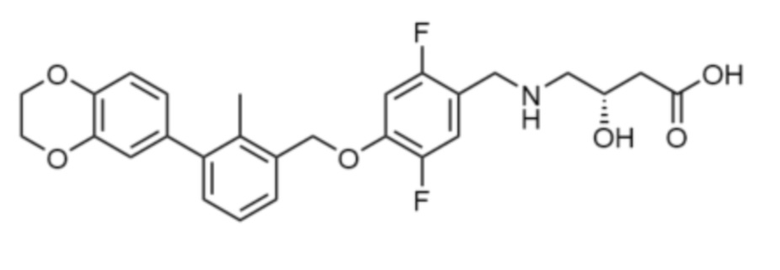 .
.
В некоторых вариантах осуществления ингибитор PD-1 и/или PD-L1 представляет собой низкомолекулярный ингибитор PD-1/PD-L1, имеющий формулу (II)
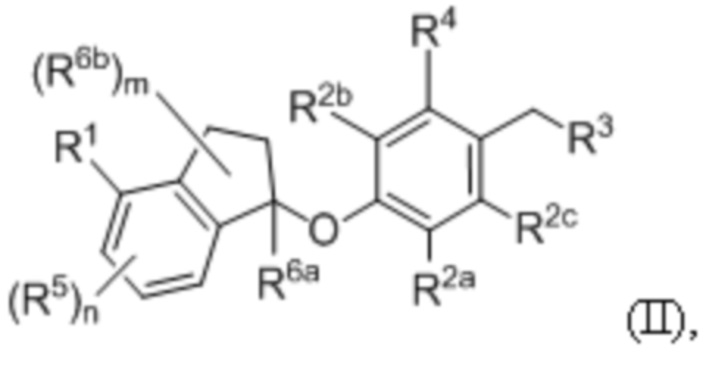
или его фармацевтически приемлемую соль; в которой:
R1 выбран из группы, состоящей из галогена, C5-8 циклоалкила, C6-10 арила и тиенила,
где C6-10 арил и тиенил необязательно замещены 1-5 заместителями Rx;
каждый Rx независимо выбран из группы, состоящей из галогена, -CN, -Rc, -CO2Ra, -CONRaRb, -C(O)Ra, -OC(O)NRaRb, -NRbC(O)Ra, -NRbC(O)2Rc, -NRa-C(O)NRaRb, -NRaRb, -ORa, -O-X1-ORa, -O-X1-CO2Ra, -O-X1-CONRaRb, -X1-ORa, -X1-NRaRb, -X1-CO2Ra, -X1-CONRaRb, -SF5, и -S(O)2NRaRb, где каждый X1 представляет собой C1-4 алкилен;
каждый Ra и Rb независимо выбран из водорода, C1-8 алкила и C1-8 галоалкила или, когда они присоединены к одному и тому же атому азота, они могут быть объединены с атомом азота с образованием пяти или шестичленного кольца, имеющего от 0 до 2 дополнительных гетероатомов в качестве членов кольца, выбранных из N, O или S, где пяти- или шестичленное кольцо необязательно замещено оксо группой; каждый Rc независимо выбран из группы, состоящей из С1-8 алкила, С2-8 алкенила, С2-8 алкинила и С1-8 галоалкила; и, необязательно, когда два заместителя Rx находятся на соседних атомах, они объединяются с образованием конденсированного пяти-, шести- или семичленного карбоциклического или гетероциклического кольца, необязательно замещенного 1-3 заместителями, независимо выбранными из галогена, оксо, C1-8 галоалкила и C1- 8 алкила;
каждый R2a, R2b и R2c независимо выбран из группы, состоящей из H, галогена, -CN, -Rd, -CO2Re, -CONReRf, -C(O)Re, -OC(O)NReRf, -NRfC(O)Re, -NRfC(O)2Rd, -NRe-C(O)NReRf, -NReRf, -ORe, -O-X2-ORe, -O-X2-NReRf, -O-X2-CO2Re, -O-X2-CONReRf, -X2-ORe, -X2-NReRf, -X2-CO2Re, -X2-CONReRf, -SF5, -S(O)2NReRf, C6-10 арила и C5-10 гетероарила, где каждый X2 представляет собой C1-4 алкилен; каждый Re и Rf независимо выбран из водорода, C1-8 алкила и C1-8 галоалкила, или когда они присоединены к одному и тому же атому азота, они могут быть объединены с атомом азота с образованием пяти- или шестичленного кольца, имеющего от 0 до 2 дополнительных гетероатомов в качестве членов кольца, выбранных из N, O и S, и необязательно замещенного оксо группой; каждый Rd независимо выбран из группы, состоящей из С1-8 алкила, С2-8 алкенила и С1-8 галоалкила;
R3 выбран из группы, состоящей из -NRgRh и C4-12 гетероциклила, где C4-12 гетероциклил необязательно замещен 1-6 Ry;
каждый Ry независимо выбран из группы, состоящей из галогена, -CN, -Ri, -CO2Rj, -CONRjRk, -CONHC1-6 алкил-OH, -C(O)Rj, -OC(O)NRjRk, -NRjC(O)Rk, -NRjC(O)2Rk, CONOH, PO3H2, -NRj-C1-6 алкил-C(O)2Rk, -NRjC(O)NRjRk, -NRjRk, -ORj, -S(O)2NRjRk, -O-C1-6алкил-ORj, -O-C1-6 алкил-NRjRk, -O-C1-6 алкил-CO2Rj, -O-C1-6 алкил-CONRjRk, -C1-6 алкил-ORj, - C1-6 алкил-NRjRk, -C1-6 алкил-CO2Rj, -C1-6 алкил-CONRjRk, и SF5,
где C1-6 алкильная часть Ry необязательно дополнительно замещена OH, SO2NH2, CONH2, CONOH, PO3H2, COO-C1-8 алкилом или CO2H, где каждый Rj и Rk независимо выбран из водорода, C1-8 алкила, необязательно замещенного 1-2 заместителями, выбранными из ОН, SO2NH2, CONH2, CONOH, PO3H2, COO-C1-8 алкила или CO2H, и C1-8 галоалкила, необязательно замещенного 1-2- заместителями, выбранными из OH, SO2NH2, CONH2, CONOH, PO3H2, COO-C1-8 алкилом или CO2H или, когда они присоединены к одному и тому же атому азота, Rj и Rk могут быть объединены с атомом азота с образованием пяти- или шестичленного кольца, имеющего от 0 до 2 дополнительных гетероатомов в качестве членов кольца, выбранных из N, O или S, и необязательно замещенного оксо группой; каждый Ri независимо выбран из группы, состоящей из -OH, C1-8 алкила, C2-8 алкенила и C1-8 галоалкила, каждый из которых может быть необязательно замещен OH, SO2NH2, CONH2, CONOH, PO3H2, COO-C1-8 алкилом или CO2H;
Rg выбран из группы, состоящей из Н, С1-8 галоалкила и С1-8 алкила;
Rh выбран из -C1-8 алкила, C1-8 галоалкила, C1-8 алкил-COOH, C1-8 алкил-ОН, C1-8 алкил-CONH2, C1-8 алкил-SO2NH2, C1-8 алкил-PO3H2, C1-8 алкил-CONOH, C1-8 алкил-NRh1Rh2, -C(O)-C1-8 алкила, -C(O)-C1-8 алкил-OH, -C(O)-C1-8 алкил-COOH, C3-10 циклоалкила, -C3-10 циклоалкил-COOH, -C3-10 циклоалкил-OH, C4-8 гетероциклила, -C4-8 гетероциклил-COOH, -C4-8 гетероциклил-OH, -C1-8 алкил-C4-8 гетероциклила, -C1-8 алкил-C3-10 циклоалкила, C5-10 гетероарила, -C1-8 алкил-C5-10 гетероарила, C10 карбоциклила, -C1-8 алкил-C6-10 арила, -C1-8 алкил-(C=O)-C6-10 арила, -C1-8 алкил-NH(C=O)-C1-8 алкенила, -C1-8 алкил-NH(C=O)-C1-8 алкила, -C1-8 алкил-NH(C=O)-C1-8 алкинила, -C1-8 алкил-(C=O)-NH-C1-8 алкил-COOH, и -C1-8 алкил-(C=O)-NH-C1-8 алкил-OH, необязательно замещенного CO2H; или
Rh в сочетании с N, к которому он присоединен, представляет собой моно-, ди- или трипептид, содержащий 1-3 природные аминокислоты и 0-2 неприродные аминокислоты, где
неприродные аминокислоты имеют альфа-углеродный заместитель, выбранный из группы, состоящей из C2-4 гидроксиалкила, C1-3 алкил-гуанидинила и C1-4 алкил-гетероарила,
альфа-углерод каждой природной или неприродной аминокислоты необязательно дополнительно замещен метильной группой, и
концевая часть моно-, ди- или трипептида выбрана из группы, состоящей из C(O)OH, C(O)O-C1-6 алкила и PO3H2, где
Rh1 и Rh2 каждый независимо выбран из группы, состоящей из H, C1-6 алкила и C1-4 гидроксиалкила;
С1-8 алкильные части Rh необязательно дополнительно замещены 1-3 заместителями, независимо выбранными из ОН, СООН, SO2NH2, CONH2, CONOH, СОО-С1-8 алкила, PO3H2 и С5-6 гетероарила, необязательно замещенного 1-2 С1-3 алкильными заместителями,
C10 карбоциклильные, C5-10 гетероарильные и C6-10 арильные части Rh необязательно замещены 1-3 заместителями, независимо выбранными из OH, B(OH)2, COOH, SO2NH2, CONH2, CONOH, PO3H2, COO-C1-8 алкила, C1-4 алкила, C1-4 алкил-OH, C1-4 алкил-SO2NH2, C1-4 алкил CONH2, C1-4 алкил-CONOH, C1-4 алкил-PO3H2, C1-4 алкил-COOH и фенила; и
С4-8 гетероциклильные и С3-10 циклоалкильные части Rh необязательно замещены 1-4 заместителями Rw;
каждый заместитель Rw независимо выбран из С1-4 алкила, С1-4 алкил-ОН, С1-4 алкил-СООН, С1-4 алкил-SO2NH2, С1-4 алкил-CONH2, С1-4 алкил-СОNОН, С1-4 алкил-РО3Н, ОН, СОО-С1-8 алкила, СООН, SO2NH2, CONH2, CONOH, PO3H2 и оксо;
R4 выбран из группы, состоящей из O-C1-8 алкила, O-C1-8 галоалкила, O-C1-8 алкил-Rz, C6-10 арила, C5-10 гетероарила, -O-C1-4 алкил-C6-10 арила и -O-C1-4 алкил-C5-10 гетероарила, где C6-10 арил и C5-10 гетероарил необязательно замещены 1-5 Rz;
каждый Rz независимо выбран из группы, состоящей из галогена, -CN, -Rm, -CO2Rn, -CONRnRp, -C(O)Rn, -OC(O)NRnRp, -NRnC(O)Rp, -NRnC(O)2Rm, -NRn-C(O)NRnRp, -NRnRp, -ORn, -O-X3-ORn, -O-X3-NRnRp, -O-X3-CO2Rn, -O-X3-CONRnRp, -X3-ORn, -X3-NRnRp, -X3-CO2Rn, -X3-CONRnRp, -SF5, -S(O)2RnRp, -S(O)2NRnRp, и 3-7-членного карбоциклического или 4-7-членного гетероциклического кольца, в котором 3-7-членное карбоциклическое или 4-7-членное гетероциклическое кольцо необязательно замещено 1-5 Rt, где каждый Rt независимо выбран из группы, состоящей из C1-8 алкила, C1-8 галоалкила, -CO2Rn, -CONRnRp, -C(O)Rn, -OC(O)NRnRp, -NRnC(O)Rp, -NRnC(O)2Rm, -NRn-C(O)NRnRp, -NRnRp, -ORn, -O-X3-ORn, -O-X3-NRnRp, -O-X3-CO2Rn, -O-X3-CONRnRp, -X3-ORn, -X3-NRnRp,- X3-CO2Rn, -X3-CONRnRp, -SF5, и -S(O)2NRnRp;
где каждый Х3 представляет собой С1-4 алкилен; каждый Rn и Rp независимо выбран из водорода, C1-8 алкила и C1-8 галоалкила или, когда они присоединены к одному и тому же атому азота, они могут быть объединены с атомом азота с образованием пяти- или шестичленного кольца, имеющего от 0 до 2 дополнительных гетероатомов в качестве членов кольца, выбранных из N, О или S, и необязательно замещенного оксо группой; каждый Rm независимо выбран из группы, состоящей из С1-8 алкила, С2-8 алкенила и С1-8 галоалкила; и необязательно, когда два заместителя Rz находятся на соседних атомах, они объединяются с образованием конденсированного пяти- или шестичленного карбоциклического или гетероциклического кольца, необязательно замещенного оксо группой;
n составляет 0, 1, 2 или 3;
каждый R5 независимо выбран из группы, состоящей из галогена, -CN, -Rq, -CO2Rr, -CONRrRs, -C(O)Rr, -OC(O)NRrRs, -NRrC(O)Rs, -NRrC(O)2Rq, -NRr-C(O)NRrRs,-NRrRs, -ORr, -O-X4-ORr, -O-X4-NRrRs, -O-X4-CO2Rr, -O-X4-CONRrRs, -X4-ORr, -X4-NRrRs, -X4-CO2Rr, -X4-CONRrRs, -SF5, -S(O)2NRrRs, где каждый X4 представляет собой C1-4 алкилен; каждый Rr и Rs независимо выбран из водорода, C1-8 алкила и C1-8 галоалкила или, когда они присоединены к одному и тому же атому азота, они могут быть объединены с атомом азота с образованием пяти или шестичленного кольца, имеющего от 0 до 2 дополнительных гетероатомов в качестве членов кольца, выбранных из N, О или S, и необязательно замещенного оксо группой; каждый Rq независимо выбран из группы, состоящей из С1-8 алкила и С1-8 галоалкила;
R6a выбран из группы, состоящей из H, C1-4 алкила и C1-4 галоалкила;
каждый R6b независимо выбран из группы, состоящей из F, C1-4 алкила, O-Ru, C1-4 галоалкила, NRuRv, где каждый Ru и Rv независимо выбран из водорода, С1-8 алкила и С1-8 галоалкила или, когда они присоединены к одному и тому же атому азота, они могут быть объединены с атомом азота с образованием пяти- или шестичленного кольца, имеющего от 0 до 2 дополнительных гетероатомов в качестве членов кольца, выбранных из N, O или S, и необязательно замещенного оксо группой; и
m составляет 0, 1, 2, 3 или 4.
В некоторых вариантах осуществления низкомолекулярный ингибитор PD-1/PD-L1 выбран из соединений или фармацевтических композиций, раскрытых в патенте WO 2018/005374, поданном ChemoCentryx 26 июня 2017, содержание которого включено в настоящий документ для всех цели.
Ингибиторы PD-1 и/или PD-L1 по настоящему изобретению могут быть введены в составы для замедления деградации соединения или антитела, или для минимизации иммуногенности антитела. В данной области техники известны различные методики для достижения этих целей.
IV. Фармацевтические композиции
Фармацевтические композиции, представленные в настоящем документе, такие как те, которые включают соединения для модуляции активности CCR2 и агенты для блокирования пути PD-1/PD-L1, могут содержать фармацевтический носитель или разбавитель.
Используемый в настоящей заявке термин «композиция» предназначен для охвата продукта, включающего указанные ингредиенты в указанных количествах, а также любого продукта, который прямо или опосредованно образуется из комбинации указанных ингредиентов в указанных количествах. Под «фармацевтически приемлемым» подразумевается, что носитель, разбавитель или наполнитель должен быть совместимым с другими ингредиентами состава и не причинять вреда реципиенту.
Биологические продукты, такие как антитела по настоящему изобретению, могут быть приготовлены в виде фармацевтической композиции, содержащей одно антитело или антитела, или их фрагмент и фармацевтически приемлемый носитель. Используемый в настоящей заявке термин «фармацевтически приемлемый носитель» включает любые и все растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты, изотонические агенты и замедляющие абсорбцию агенты, и тому подобные, которые являются физиологически совместимыми. Предпочтительно носитель пригоден для внутривенного, внутримышечного, подкожного, парентерального, спинального или эпидермального введения (например, путем инъекции или инфузии). Фармацевтическая композиция по изобретению может включать одну или несколько фармацевтически приемлемых солей, антиоксидантов, водных и неводных носителей и/или адъювантов, таких как консерванты, смачивающие агенты, эмульгирующие агенты и диспергирующие агенты.
Фармацевтические композиции для применения соединений и агентов по настоящему изобретению могут быть удобно представлены в стандартной лекарственной форме и могут быть получены любым из способов, хорошо известных в области фармации и доставки лекарств. Все способы включают стадию объединения активного ингредиента с носителем, который составляет один или несколько дополнительных ингредиентов. Как правило, фармацевтические композиции готовят путем равномерного и тесного объединения активного ингредиента с жидким носителем или тонкоизмельченным твердым носителем, или с тем и другим, и затем, если необходимо, формования продукта с получением необходимого состава. В фармацевтическую композицию активное соединение по изобретению включают в количестве, достаточном для достижения необходимого эффекта в отношении процесса или состояния заболеваний.
Фармацевтические композиции, содержащие активный ингредиент, могут быть в форме, подходящей для перорального применения, например в виде таблеток, пастилок, леденцов, водных или масляных суспензий, диспергируемых порошков или гранул, эмульсий и самоэмульгируемых веществ, как описано в патенте США № 6451339, твердых или мягких капсул, сиропов, эликсиров, растворов, буккального пластыря, геля для перорального применения, жевательной резинки, жевательных таблеток, шипучего порошка и шипучих таблеток. Композиции, предназначенные для перорального применения, могут быть приготовлены в соответствии с любым известным в данной области техники способом изготовления фармацевтических композиций, и такие композиции могут содержать один или несколько агентов, выбранных из группы, состоящей из подсластителей, ароматизаторов, красителей, антиоксидантов и консервантов для обеспечения фармацевтически элегантных и приятных на вкус препаратов. Таблетки содержат активный ингредиент в смеси с нетоксичными фармацевтически приемлемыми вспомогательными веществами, которые пригодны для изготовления таблеток. Этими вспомогательными веществами могут быть, например, инертные разбавители, такие как целлюлоза, диоксид кремния, оксид алюминия, карбонат кальция, карбонат натрия, глюкоза, маннит, сорбит, лактоза, фосфат кальция или фосфат натрия; гранулирующие и дезинтегрирующие агенты, например кукурузный крахмал или альгиновая кислота; связующие агенты, например ПВП, целлюлоза, ПЭГ, крахмал, желатин или аравийская камедь; и лубриканты, например стеарат магния, стеариновая кислота или тальк. Таблетки могут быть не покрытыми оболочкой или могут быть покрыты кишечнорастворимой или иной оболочкой, посредством известных способов, чтобы задержать распад и всасывание в желудочно-кишечном тракте и тем самым обеспечить устойчивое действие в течение более длительного периода. Например, можно использовать материал, замедляющий высвобождение, такой как глицерилмоностеарат или глицерилдистеарат. Они также могут быть покрыты способами, описанными в патентах США №№ 4256108, 4166452 и №4265874 для получения осмотических терапевтических таблеток для контроля высвобождения.
Композиции для перорального применения также могут быть представлены в виде твердых желатиновых капсул, в которых активный ингредиент смешан с инертным твердым разбавителем, например карбонатом кальция, фосфатом кальция или каолином, или в виде мягких желатиновых капсул, в которых активный ингредиент смешан с водой или масляной средой, например арахисовым маслом, жидким парафином или оливковым маслом. Кроме того, эмульсии могут быть приготовлены с не смешиваемым с водой ингредиентом, таким как масла, и стабилизированы поверхностно-активными веществами, такими как моно-диглицериды, сложные эфиры ПЭГ и тому подобное.
Водные суспензии содержат активные материалы в смеси с вспомогательными веществами, подходящими для изготовления водных суспензий. Такими вспомогательными веществами являются суспендирующие агенты, например карбоксиметилцеллюлоза натрия, метилцеллюлоза, гидроксипропилметилцеллюлоза, альгинат натрия, поливинилпирролидон, камедь трагаканта и аравийская камедь; диспергирующие или увлажняющие агенты могут представлять собой природный фосфатид, например лецитин, или продукты конденсации алкиленоксида с жирными кислотами, например полиоксиэтиленстеарат, или продукты конденсации этиленоксида с алифатическими спиртами с длинной цепью, например гептадекаэтиленоксиоксиэтанол, или продукты конденсации этиленоксида с частичными сложными эфирами, полученными из жирных кислот и гекситола, такие как полиоксиэтиленсорбитан моноолеат, или продукты конденсации этиленоксида с частичными сложными эфирами, полученными из жирных кислот и ангидридов гекситола, например, полиэтиленсорбитан моноолеат. Водные суспензии могут также содержать один или несколько консервантов, например, этил- или н-пропил п-гидроксибензоат, один или несколько красителей, один или несколько ароматизаторов и один или несколько подсластителей, таких как сахароза или сахарин.
Масляные суспензии могут быть приготовлены путем суспендирования активного ингредиента в растительном масле, например арахисовом масле, оливковом масле, кунжутном масле или кокосовом масле, или в минеральном масле, таком как жидкий парафин. Масляные суспензии могут содержать загуститель, например пчелиный воск, твердый парафин или цетиловый спирт. Подсластители, такие как те, которые указаны выше, и ароматизаторы могут быть добавлены для обеспечения приятного на вкус перорального препарата. Эти композиции могут быть консервированы путем добавления антиоксиданта, такого как аскорбиновая кислота.
Диспергируемые порошки и гранулы, подходящие для приготовления водной суспензии путем добавления воды, обеспечивают активный ингредиент в смеси с диспергирующим или смачивающим агентом, суспендирующим агентом и одним или несколькими консервантами. Подходящие диспергирующие или смачивающие агенты и суспендирующие агенты иллюстрируются теми, которые уже упомянуты выше. Также могут присутствовать дополнительные вспомогательные вещества, например подсластители, ароматизаторы и красители.
Фармацевтические композиции по изобретению также могут быть в форме эмульсий масло-в-воде. Масляная фаза может представлять собой растительное масло, например оливковое масло или арахисовое масло, или минеральное масло, например жидкий парафин, или их смеси. Подходящими эмульгирующими агентами могут быть природные камеди, например аравийская камедь или трагакантовая камедь, природные фосфатиды, например из соевых бобов, лецитин, и сложные эфиры или частичные сложные эфиры, полученные из жирных кислот и ангидридов гекситола, например сорбитан моноолеат, и продукты конденсации указанных частичных эфиров с этиленоксидом, например полиоксиэтиленсорбитан моноолеат. Эмульсии также могут содержать подсластители и ароматизаторы.
Сиропы и эликсиры могут быть составлены с подсластителями, например глицерином, пропиленгликолем, сорбитолом или сахарозой. Такие составы могут также содержать смягчающие, консервирующие и вкусоароматические и красящие агенты. Пероральные растворы могут быть приготовлены в комбинации, например, с циклодекстрином, ПЭГ и поверхностно-активными веществами.
Фармацевтические композиции могут быть в форме стерильной водной или масляной суспензии для инъекций. Эта суспензия может быть приготовлена в соответствии с известным уровнем техники с использованием тех подходящих диспергирующих или смачивающих агентов и суспендирующих агентов, которые были упомянуты выше. Стерильный инъекционный препарат также может представлять собой стерильный инъекционный раствор или суспензию в нетоксичном парентерально приемлемом разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле. Среди приемлемых носителей и растворителей, которые можно использовать, находятся вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, стерильные жирные масла обычно используют в качестве растворителя или суспендирующей среды. Для этой цели можно использовать любое асептическое нелетучее масло, включая синтетические моно- или диглицериды. Кроме того, жирные кислоты, такие как олеиновая кислота, находят применение при приготовлении инъекционных препаратов.
Соединения и агенты по настоящему изобретению также можно применять в форме суппозиториев для ректального введения лекарственного средства. Эти композиции могут быть приготовлены путем смешивания лекарственного средства с подходящим нераздражающим наполнителем, который является твердым при обычных температурах, но жидким при ректальной температуре и, как следствие, будет плавиться в прямой кишке с высвобождением лекарственного средства. Такие материалы включают масло какао и полиэтиленгликоли. Кроме того, соединения можно применять путем доставки в глаз посредством растворов или мазей. Кроме того, трансдермальная доставка рассматриваемых соединений может быть осуществлена посредством ионофоретических пластырей и тому подобного. Для местного применения используют кремы, мази, гели, растворы или суспензии и т.д., содержащие соединения по настоящему изобретению. Используемый в настоящей заявке термин «местное применение» также включает использование средств для промывания и полоскания рта.
Соединения по данному изобретению также могут быть связаны с носителем, который представляет собой подходящие полимеры в качестве лекарственных носителей направленного действия. Такие полимеры могут включать поливинилпирролидон, пирановый сополимер, полигидрокси-пропил-метакриламид-фенол, полигидроксиэтил-аспартамид-фенол или полиэтиленоксид-полилизин, замещенный пальмитоильными остатками. Кроме того, соединения по изобретению могут быть связаны с носителем, который представляет собой класс биодеградируемых полимеров, используемых для достижения контролируемого высвобождения лекарственного средства, например полимолочной кислотой, полигликолевой кислотой, сополимерами полимолочной и полигликолевой кислот, полиэпсилонкапролактоном, полигидроксимасляной кислотой, полиортоэфирами, полиацеталями, полидигидропиранами, полицианоакрилатами и сшитыми или амфипатическими блок-сополимерами гидрогелей. Полимеры и полупроницаемые полимерные матрицы могут быть сформованы в формованные изделия, такие как клапаны, стенты, трубки, протезы и тому подобное. В одном варианте осуществления соединение по изобретению связано с полимерной или полупроницаемой полимерной матрицей, которая сформирована в виде стента или стент-графта.
Соединения и агенты по изобретению могут быть приготовлены для депонирования в медицинское устройство, которое может включать любое из множества обычных трансплантатов, стентов, включая стент-графты, катетеры, баллоны, корзины или другое устройство, которое может быть развернуто или постоянно имплантировано в полости тела. В качестве конкретного примера необходимо иметь устройства и способы, которые позволяют доставлять соединения по изобретению в область тела, которую обрабатывают посредством интервенционной техники. Например, соединение и агент могут быть доставлены в опухоль или в микроокружение опухоли.
В некоторых вариантах осуществления соединения и агенты могут быть депонированы в медицинском устройстве, таком как стент, и доставлены к месту лечения для лечения части тела. Стенты используют в качестве средств доставки для терапевтических агентов. Внутрисосудистые стенты обычно перманентно имплантируют в коронарные или периферические сосуды. Конструкции стента включают описываемые в патентах США №№ 4733655, 4800882 и 4886062. Такие конструкции включают как металлические, так и полимерные стенты, а также саморасширяющиеся и баллонно-расширяемые стенты. Стенты могут также использоваться для доставки терапевтических агентов в место контакта с сосудистой сетью, как раскрыто, например, в патенте США № 5102417 и международных патентных заявках №№ WO 91/12779 и WO 90/13332, патентах США №№ 5419760 и 5429634.
Термин «депонированный» означает, что соединение и агент покрыты, адсорбированы, помещены или иным образом включены в устройство способами, известными в данной области техники. Например, соединение и агент могут быть встроены и высвобождены изнутри («матричный тип») или окружены и высвобождены через («резервуарный тип») полимерные материалы, которые покрывают или охватывают медицинское устройство. В последнем примере соединение и агент могут быть захвачены внутри полимерных материалов или связаны с полимерными материалами с использованием одной или нескольких методик получения таких материалов, известных в данной области техники. В других составах соединение и агент могут быть связаны с поверхностью медицинского устройства без необходимости нанесения покрытия посредством разрываемых связей и высвобождения со временем, могут быть удалены с помощью активных механических или химических процессов, или находятся в постоянно иммобилизованной форме, которая представляет ингибирующий агент в месте имплантации.
В одном варианте осуществления соединение и агент могут быть встроены с полимерными композициями во время формирования биосовместимых покрытий для медицинских устройств, таких как стенты. Покрытия, полученные из этих компонентов, обычно являются однородными и полезны для нанесения на ряд устройств, предназначенных для имплантации.
Полимер может быть либо биостабильным, либо биоабсорбируемым полимером в зависимости от необходимой скорости высвобождения или необходимой степени стабильности полимера, но биоабсорбируемый полимер является предпочтительным для этого варианта осуществления, поскольку, в отличие от биостабильного полимера, он не будет присутствовать долго после имплантации, что могло бы вызывать какие-либо неблагоприятные хронические местные реакции. Биоабсорбируемые полимеры, которые можно использовать, включают поли(L-молочную кислоту), поликапролактон, полигликолид (PGA), поли(лактид-со-гликолид) (PLLA/PGA), поли(гидроксибутират), поли(гидроксибутират-со-валерат), полидиоксанон, полиортоэфир, полиангидрид, поли(гликолевую кислоту), поли(D-молочную кислоту), поли(L-молочную кислоту), поли(D,L-молочную кислоту), поли(D,L-лактид) (PLA), поли(L-лактид) (PLLA), поли(гликолевую кислоту-со-триметиленкарбонат) (PGA/PTMC), полиэтиленоксид (PEO), полидиоксанон (PDS), полифосфоэфир, полифосфоэфир уретан, поли(аминокислоты), цианоакрилаты, поли(триметиленкарбонат), поли(иминокарбонат), сополи(эфир-сложные эфиры) (например, PEO/PLA), полиалкиленоксалаты, полифосфазены и биомолекулы, такие как фибрин, фибриноген, целлюлоза, крахмал, коллаген и гиалуроновая кислота, полиэпсилонкапролактон, полигидроксимасляную кислоту, полиортоэфиры, полиацетали, полидигидропираны, полицианоакрилаты, сшитые или амфипатические блок-сополимеры гидрогелей и другие подходящие биоабсорбируемые полимеры, известные в данной области техники, но не ограничиваются ими. Кроме того, можно использовать биостабильные полимеры с относительно низкой хронической тканевой реакцией, такие как полиуретаны, силиконы и сложные полиэфиры, и также можно использовать другие полимеры, если они могут быть растворены и отверждены или полимеризованы на медицинском устройстве, такие как полиолефины, полиизобутилен и этилен- альфаолефиновые сополимеры; акриловые полимеры и сополимеры, винилгалогенидные полимеры и сополимеры, такие как поливинилхлорид; поливинилпирролидон; поливиниловые эфиры, такие как поливинилметиловый эфир; поливинилиденгалогениды, такие как поливинилиденфторид и поливинилиденхлорид; полиакрилонитрил, поливинилкетоны; поливинилароматические соединения, такие как полистирол, поливиниловые эфиры, такие как поливинилацетат; сополимеры виниловых мономеров друг с другом и олефинами, такие как этиленметилметакрилатные сополимеры, акрилонитрилстирольные сополимеры, смолы ABS и этиленвинилацетатные сополимеры; пирановый сополимер; полигидрокси-пропил-метакриламид-фенол; полигидроксиэтил-аспартамид-фенол; полиэтиленоксид-полилизин, замещенный пальмитоильными остатками; полиамиды, такие как нейлон 66 и поликапролактам; алкидные смолы, поликарбонаты; полиоксиметилены; полиимиды; полиэфиры; эпоксидные смолы, полиуретаны; вискоза; триацетатный шелк; целлюлоза, ацетат целлюлозы, бутират целлюлозы; ацетатбутират целлюлозы; целлофан; нитрат целлюлозы; пропионат целлюлозы; эфиры целлюлозы; и карбоксиметилцеллюлоза.
В некоторых вариантах осуществления соединение и агент приготовлены для высвобождения из полимерного покрытия в среду, в которой находится медицинское устройство. Предпочтительно соединение и агент высвобождаются контролируемым образом в течение продолжительного периода времени (например, недель или месяцев) с использованием по меньшей мере одной из нескольких хорошо известных методик, включающих полимерные носители или слои, для контроля элюирования. Некоторые из этих способов были ранее описаны в заявке на патент США № 20040243225.
V. Способы применения комбинированной терапии.
В другом аспекте настоящее изобретение предлагает комбинированную терапию для лечения рака. Комбинированная терапия включает терапевтически эффективное количество антагониста CCR2 и терапевтически эффективное количество ингибитора PD-1 и/или PD-L1. Комбинация терапевтических агентов может действовать синергетически для осуществления лечения или профилактики рака.
В зависимости от состояния заболевания и состояния субъекта, соединения, антитела и составы по настоящему изобретению могут вводиться перорально, парентерально (например, путем внутримышечной, внутрибрюшинной, внутривенной, интрацеребральной, интрастернальной инъекции или инфузии, подкожной инъекции, или имплантации), ингаляционно, интраназально, вагинально, ректально, сублингвально или местно. Кроме того, соединения и антитела могут быть приготовлены, по отдельности или вместе, в подходящих единичных дозированных препаратах, содержащих обычные нетоксичные фармацевтически приемлемые носители, адъюванты и растворители, подходящие для каждого пути введения. Настоящее изобретение также предусматривает возможность введения соединений и антител по настоящему изобретению в виде депо-препаратов.
Понятно, что конкретный уровень дозы и частота приема для любого конкретного пациента могут варьироваться и будут зависеть от множества факторов, включая активность конкретного используемого соединения, метаболическую стабильность и продолжительность действия этого соединения, возраст, массу тела, наследственные характеристики, общее состояние здоровья, пол, диету, способ и время применения, скорость выведения, комбинацию лекарств, тяжесть конкретного состояния и индивидуума, получающего терапию.
При лечении раковых заболеваний, например солидных опухолей, которые требуют модуляции хемокиновых рецепторов, подходящий уровень дозировки антагониста CCR2, как правило, будет составлять примерно от 0,001 до 100 мг на кг массы тела пациента в сутки, который можно вводить в виде однократной или многократной дозы. Предпочтительно уровень дозировки будет составлять примерно от 0,01 до около 25 мг/кг в сутки; более предпочтительно примерно от 0,05 до 10 мг/кг в сутки. Подходящий уровень дозировки может составлять примерно от 0,01 до 25 мг/кг в сутки, примерно от 0,05 до 10 мг/кг в сутки или примерно от 0,1 до 5 мг/кг в сутки. В этом диапазоне дозировка может составлять от 0,005 до 0,05; от 0,05 до 0,5 или от 0,5 до 5,0 мг/кг в сутки. Для перорального введения композиции предпочтительно обеспечиваются в форме таблеток, содержащих от 1,0 до 1000 мг активного ингредиента, в частности 1,0; 5,0; 10,0; 15,0; 20,0; 25,0; 50,0; 75,0; 100,0; 150,0; 200,0; 250,0; 300,0; 400,0; 500,0; 600,0; 750,0; 800,0; 900,0 и 1000,0 мг активного ингредиента для симптоматической корректировки дозировки для пациента, подлежащего лечению. Соединения могут применяться по схеме от 1 до 4 раз в сутки, предпочтительно один или два раза в сутки.
Подходящий уровень дозировки ингибитора PD-1 и/или ингибитора PD-L1 обычно составляет примерно от 0,0001 до 100 мг/кг, обычно примерно от 0,001 до 20 мг/кг и более предпочтительно примерно от 0,01 до 10 мг/кг массы тела субъекта. Предпочтительно доза находится в диапазоне 0,1-10 мг/кг массы тела. Например, дозировки могут составлять 0,1; 0,3; 1; 3; 5 или 10 мг/кг массы тела, и более предпочтительно, 0,3; 1; 3 или 10 мг/кг массы тела. Схема дозирования, как правило, может быть разработана для достижения воздействий, которые приводят к длительной занятости рецепторов (RO) на основе типичных фармакокинетических свойств антитела. Примерный режим лечения антителами включает введение один раз в неделю, один раз каждые две недели, один раз каждые три недели, один раз каждые четыре недели, один раз в месяц, один раз каждые 3 месяца или один раз каждые 3-6 месяцев. Например, схема дозирования может включать введение антитела: (i) каждые две недели в 6-недельных циклах; (ii) каждые четыре недели для шести доз, затем каждые три месяца; (iii) каждые три недели; (iv) 3-10 мг/кг массы тела один раз, затем 1 мг/кг массы тела каждые 2-3 недели. Учитывая, что антитело IgG4 обычно имеет период полураспада 2-3 недели, предпочтительный режим дозировки для антитела против PD-1 или против PD-L1 составляет 0,3-10 мг/кг массы тела, предпочтительно 3-10 мг/кг массы тела, более предпочтительно 3 мг/кг массы тела при внутривенном введении, при этом антитело вводят каждые 14 дней в течение 6-недельных или 12-недельных циклов до полного ответа или подтверждения прогрессирующего заболевания. Примерный режим лечения малыми молекулами подразумевает введение ежедневно, два раза в неделю, три раза в неделю или один раз в неделю. Дозировка и график могут меняться в течение курса лечения.
В некоторых вариантах осуществления два или более антител с различной специфичностью связывания вводят одновременно, и в этом случае дозировка каждого вводимого антитела попадает в указанные диапазоны. Антитело можно вводить несколько раз. Интервалы между однократными дозами могут составлять, например, раз в неделю, каждые 2 недели, каждые 3 недели, ежемесячно, каждые три месяца или раз в год. Интервалы также могут быть нерегулярными, по результатам измерения уровня антител в крови к целевому антигену у пациента. В некоторых способах дозировку регулируют до достижения концентрации антител в плазме примерно 1-1000 мг/мл, а в некоторых способах примерно 25-300 мг/мл.
Описанное в настоящей заявке терапевтическое соединение и агент в комбинированной терапии могут быть введены либо отдельно, либо в фармацевтической композиции, которая содержит терапевтическое соединение и агент и один или несколько фармацевтически приемлемых носителей, наполнителей и разбавителей.
В некоторых вариантах осуществления каждое терапевтическое соединение и агент обеспечиваются в количестве, которое является субтерапевтическим в случае применения по отдельности или без другого соединения. Специалистам в данной области техники будет понятно, что «комбинации» могут включать комбинации в лечении (то есть два или более лекарств можно вводить в виде смеси, или по меньшей мере одновременно, или по меньшей мере вводить субъекту в разное время, но так, чтобы оба присутствовали у субъекта в одно и то же время).
Аналогичным образом, соединения, агенты и композиции по настоящему изобретению можно использовать в сочетании с другими лекарственными средствами, которые используются для лечения, профилактики, подавления или ослабления рака. Такие другие лекарства могут применяться путем и в количестве, обычно используемом для этого, одновременно или последовательно с соединением, агентом или композицией по настоящему изобретению. Когда соединение, агент или композицию по настоящему изобретению используют одновременно с одним или несколькими другими лекарственными средствами, фармацевтическая композиция, содержащая такие другие лекарственные средства в дополнение к соединению, агенту или композиции по настоящему изобретению, является предпочтительной. Соответственно, фармацевтические композиции могут включать те, которые также содержат один или несколько других активных ингредиентов или терапевтических агентов, в дополнение к соединению, агенту или композиции по настоящему изобретению.
Комбинированная терапия включает совместное применение антагониста CCR2 и ингибитора PD-1 и/или PD-L1, последовательное применение антагониста CCR2 и ингибитора PD-1 и/или PD-L1, применение композиции, содержащей антагонист CCR2 и ингибитор PD-1 и/или PD-L1, или одновременное применение отдельных композиций, где одна композиция содержит антагонист CCR2, а другая композиция содержит ингибитор PD-1 и/или PD-L1.
Совместное применение включает применение антагониста CCR2 по настоящему изобретению в течение 0,5; 1, 2, 4, 6, 8, 10, 12, 16, 20 или 24 часов после применения ингибитора PD-1 и/или PD-L1 по настоящему изобретению. Совместное применение также включает применение одновременно, приблизительно одновременно (например, в течение приблизительно 1, 5, 10, 15, 20 или 30 минут друг от друга) или последовательно в любом порядке. Кроме того, каждый из антагониста CCR2 и ингибитора PD-1 и/или PD-L1 может быть введен один раз в сутки, два, три или более раз в сутки, чтобы обеспечить предпочтительный уровень дозировки в сутки.
VI. Наборы
В некоторых аспектах в настоящем документе представлены наборы, содержащие антагонист хемокинового рецептора CCR2 и ингибитор PD-1 и/или PD-L1, раскрытые в данном документе, которые полезны для лечения рака. Набор может содержать фармацевтическую композицию, включающую соединение - антагонист хемокинового рецептора CCR2, например низкомолекулярный ингибитор CCR2, и фармацевтическую композицию, включающую PD-1 и/или PD-L1, например ингибирующее антитело. В некоторых случаях набор включает письменные материалы, например инструкции по применению соединения, антитела или их фармацевтических композиций. Набор может включать буферы, разбавители, фильтры, иглы, шприцы и упаковочные вкладыши с инструкциями по выполнению любых способов, раскрытых в данном документе, но не ограничивается ими.
Подходящий антагонист хемокинового рецептора CCR2 и ингибиторы PD-1 и/или PD-L1 включают соединения, описанные в настоящей заявке.
VII. Примеры
Пример 1. Применение ингибитора CCR2 усиливает терапию анти-PD-1.
Опухоли CT26 сильно инфильтрированы цитотоксическими Т-клетками и другими лейкоцитами, но тем не менее быстро растут у мышей Balb/c после подкожной имплантации. Эти опухоли частично реагируют на лечение моноклональными антителами против PD-1 и против CTLA.
Через шесть дней после подкожной имплантации CT26 в бока самкам мышей Balb/c в возрасте 9 недель (2,5×105/мышь) реципиенты были рандомизированы по размеру опухоли, и было начато лечение. Мыши получали анти-PD-1 (RPM1-14 от BioXcell, Inc., номер по каталогу BE0146) путем интраперитонеальной инъекции на 7, 10, 17 и 21 сутки (200 мкг/мышь) и получали антагонист CCR2, Соединение 1 (30 или 60 мг/кг) или контрольный раствор через желудочный зонд каждые 24 часа, начиная с 7 суток.
Мы обнаружили, что лечебные эффекты анти-PD-1 терапии заметно усиливаются за счет специфической блокады хемокинового рецептора 2 (CCR2) с помощью низкомолекулярного антагониста. Этот комбинированный подход анти-PD-1/CCR2i значительно уменьшает размер опухоли и увеличивает долю выживших в течение длительного времени, причем более 50% мышей (до 73%) демонстрируют полную регрессию ранее установленной опухоли. Эффекты этой комбинированной терапии зависят от присутствия CD8+ T-клеток, так как опухоли не реагируют на терапию у мышей, истощенных по CD8. Противоопухолевый ответ против СТ26 специфичен: выжившие в течение длительного времени устойчивы к повторной инокуляции опухоли СТ26 (даже без дальнейшего применения любого из препаратов), но не устойчивы к опухоли молочной железы 4Т1. Антагонизм CCR2 изменяет микроокружение опухоли, уменьшая количество М-СКМП на грамм опухоли (популяция CCR2hi, фенотипически определяемая как CD11b+/Ly6G-/Ly6Chi). Уменьшение размера опухоли обратно пропорционально отношению CD8 T-клеток к М-СКМП. Данные модели CT26 представлены в следующих параграфах.
На фиг. 1 показан иммуногистохимический анализ нормальной и опухолевой ткани человека с использованием моноклональных антител с человеческому CCR2. Панели A и B показывают нормальную ткань толстой кишки в увеличении 40X и 200X, соответственно. Панели C, D, E и F показывают типичную ткань рака толстой кишки человека при указанных увеличениях. Специфическое окрашивание CCR2 наблюдалось на 78 злокачественных опухолях (диагностированной I-III степени) у пациентов с раком толстой кишки, но не на нормальных контрольных тканях толстой кишки.
CT26 представляет собой аденокарциному толстой кишки, полученную от Balb/c, которая генерирует опухоли при подкожной инъекции мышам Balb/c. Отдельные клетки выделяли из установленных подкожных опухолей CT26 (через 28 дней после инъекции) путем измельчения, кратковременного расщепления ткани коллагеназой-D и пропускания суспензии через сито размером 100 мкм. Клетки окрашивали для проточной цитометрии и гейтировали для живых CD45+ инфильтрирующих опухоль лейкоцитов (фиг. 2). Сравнение между окрашиванием мАт против мышиного CCR2 мАт (фиг. 2A) и сопоставление с изотипическим контролем (фиг. 2B) выявило CCR2-специфическое окрашивание в субпопуляции CD11b+ лейкоцитов.
Гейтирование популяции CCR2+ (фиг. 3B) показывает, что эти клетки экспрессируют высокие уровни Ly6C и не имеют Ly6G; что является отличительными признаками М-СКМП. Такие клетки участвуют в индукции анергии популяций опухолеспецифических цитотоксических Т-клеток.
На фиг. 4 показано прямое гейтирование для клеток M-СКМП, выделенных из опухолей CT26, демонстрирующих устойчивую экспрессию CCR2. Панель A: гейтирование живых CD45+ CT26-инфильтрующих клеток в популяции CD11b+. Панель B: гейтирование популяции LyChi/Ly6G-. Панель C: наложение гистограммы окрашивания CCR2 (справа) на окрашенный мАт изотипический контроль (слева) в Ly6Chi/Ly6G- популяции.
На фиг. 5 показан общий дизайн исследования для анти-PD-1 + Соединения 1 на модели CT26.
На фиг. 6 показано, что Соединение 1, применяемое через желудочный зонд в дозе 30 мг/кг в сутки, обеспечивает минимальные уровни в плазме, равные или превышающие уровни, необходимые для полного охвата рецептора. Панель А показывает уровни Соединения 1 в плазме в день 3 применения. На панели B показано Соединение 1 через 23 дня после применения.
На фиг. 7 показано, что комбинация Соединения 1 и α-PD-1 приводит к снижению объемов опухоли. На панели A показаны результаты для мышей, у которых применяли 1% ГПМЦ + изотип. На панели B показаны результаты для мышей, у которых применяли 1% ГПМЦ + α-PD-1. На панели C показаны результаты для мышей, у которых применяли 30 мг/кг Соединения 1 + изотип. На панели D показаны результаты для мышей, у которых применяли 30 мг/кг Соединения 1 + α-PD-1. Пунктирная линия указывает на наибольший объем опухоли, наблюдаемый в группе Соединения 1 + α-PD-1. «1% ГПМЦ» является контрольным раствором для Соединения 1, «Изотип» представляет собой изотипический контроль в дозе, соответствующей α-PD-1. Как видно на фиг. 7, α-PD-1 по отдельности уменьшает объем опухоли CT26, но комбинация с Соединением 1 усиливает этот эффект.
Окрашивание лимфоцитов периферической крови тетрамером молекул I класса МНС и связанных с ними пептидов для иммунодоминантного антигена CT26 демонстрирует специфичный для CT26 ответ CD8 T-клеток у мышей-опухоленосителей (фиг. 8). AH1, иммунодоминантный пептид для цитотоксического Т-клеточного ответа против CT26, происходит из белка gp70 ретровируса MuLV, эндогенного для CT26. AH1-специфические рецепторы T-клеток в основном отсутствуют в CD8 T-клетках периферической крови интактных мышей, но в изобилии присутствуют в той же популяции мышей, несущих опухоль CT26.
На фиг. 9 показано, что уменьшение размера опухоли, вызванное терапией Соединением 1 + α-PD-1, требует CD8 T-клеток. Панель A: показывает объем опухоли у мышей, получавших Контрольный раствор + α-PD-1 + α-CD8. Панель В: показывает объем опухоли у мышей, получавших 30 мг/кг Соединения 1 + α-PD-1 + изотипический контроль. Панель C: показывает объем опухоли у мышей, получавших 30 мг/кг Соединения 1 + α-PD-1 + α-CD8.
На фиг. 10 показано, что, несмотря на участие цитотоксических Т-клеток в уменьшении размера опухоли, количество CD8 Т-клеток опухоли существенно не изменяется при лечении. Инфильтрирующие опухоль цитотоксические Т-клетки (Thy1+/CD8+) определяли путем взвешивания опухолей перед диссоциацией, что позволяло рассчитывать количество клеток на грамм опухоли.
На фиг. 11 показано, что Соединение 1 снижает количество M-СКМП в микроокружении CT26 к 24 дню. Количество M-СКМП определяли путем взвешивания опухолей перед диссоциацией, что позволяло рассчитывать количество клеток на грамм опухоли. Как видно из фигуры, Соединение 1 по отдельности уменьшает популяцию M-СКМП, но комбинация с α-PD-1 усиливает эффект.
На фиг. 12 показано, что отношение CD8 T-клеток к M-СКМП значительно увеличивается при комбинированном лечении. Соотношение CD8 T-клеток и M-СКМП определяли из числа клеток, показанных на фиг. 10 и фиг. 11. Соотношение у контрольных мышей (veh + iso) составило 1:1, что означает одну M-СКМП на каждую CD8 Т-клетку. Комбинированное лечение уменьшало M-СКМП в пользу CD8 T-клеток, давая 100 CD8 T-клеток на каждую M-СКМП. Лечение Соединением 1 по отдельности давало 10 CD8 Т-клеток на каждую клетку M-СКМП. Лечение α-PD-1 давало CD8 T-клеток на каждую клетку M-СКМП.
На фиг. 13 показано, что количество выживших в течение длительного времени с CT26 в ответ на α-PD-1 увеличивается с помощью комбинированного лечения CCR2. На 83-й день 6 выживших оставались в группе α-PD-1 + Соединение 1, в то время как только 2 выживших оставались в группе α-PD-1 + Veh. Подгруппы мышей, взятых на 27-й день для анализа клеток, были исключены из этого анализа выживаемости. У одной мыши из группы Iso + Veh и у одной из группы α-PD-1 + 598 опухоль вообще не развивалась, и эти две мыши были исключены из этого анализа. Тест Гехана-Бреслоу-Вилкоксона использовали для определения значения p между красной (средней) и синей (верхней) кривыми.
Выживших CT26 мышей, предварительно леченных α-PD-1 с Соединением 1 или без него, не несущих опухолей в течение 2-4 недель, повторно инокулировали CT26 в правый бок и инокулировали 4T1 (впервые) в левый бок. Рост CT26 наблюдался только у мышей, которые ранее не подвергались воздействию CT26 (фиг. 14B). Рост 4T1 отмечен у всех мышей независимо от предыдущего воздействия CT26 (фиг. 14A).
Эти данные согласуются с гипотезой о том, что антагонизм CCR2 усиливает анти-PD-1 терапию, предотвращая накопление М-СКМП в опухоли, таким образом уменьшая их подавляющее действие на цитотоксические Т-клетки.
В дополнение к раку толстой кишки, блокада CCR2 показала эффективность на мышиных моделях глиобластомы и рака поджелудочной железы, а также при раке поджелудочной железы человека.
Хотя вышеизложенное изобретение было описано в некоторых деталях в целях иллюстрации и примера для ясности понимания, специалист в данной области поймет, что определенные изменения и модификации могут быть осуществлены на практике в рамках объема прилагаемой формулы изобретения. Кроме того, каждая ссылка, представленная в данном документе, включена посредством ссылки во всей ее полноте в той же степени, как если бы каждая ссылка была отдельно включена в качестве ссылки. Если существует конфликт между настоящей заявкой и приведенной здесь ссылкой, преимущество имеет настоящая заявка.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМБИНИРОВАННАЯ ТЕРАПИЯ С ИСПОЛЬЗОВАНИЕМ АНТАГОНИСТОВ C-C ХЕМОКИНОВОГО РЕЦЕПТОРА 4 (CCR4) И ОДНОГО ИЛИ БОЛЕЕ ИНГИБИТОРОВ КОНТРОЛЬНЫХ ТОЧЕК | 2019 |
|
RU2810717C2 |
| УМЕНЬШЕНИЕ МАССЫ ОПУХОЛИ ПУТЕМ ВВЕДЕНИЯ CCR1 АНТАГОНИСТОВ В КОМБИНАЦИИ С PD-1 ИНГИБИТОРАМИ ИЛИ PD-L1 ИНГИБИТОРАМИ | 2017 |
|
RU2745195C2 |
| СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ PD-L1 ЗАБОЛЕВАНИЙ | 2020 |
|
RU2838028C2 |
| ГЕТЕРОАРИЛ-БИФЕНИЛ АМИНЫ ДЛЯ ЛЕЧЕНИЯ PD-L1 ЗАБОЛЕВАНИЙ | 2020 |
|
RU2837843C1 |
| СПОСОБЫ ЛЕЧЕНИЯ РАКА С ИСПОЛЬЗОВАНИЕМ АНТАГОНИСТОВ, СВЯЗЫВАЮЩИХ С ОСЬЮ PD-1, И ИНГИБИТОРОВ TIGIT | 2014 |
|
RU2825390C2 |
| КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ РАКА С ПРИМЕНЕНИЕМ АНТАГОНИСТОВ, СВЯЗЫВАЮЩИХСЯ С КОМПОНЕНТОМ СИГНАЛЬНОГО ПУТИ PD-1, И ИНГИБИТОРОВ MEK | 2015 |
|
RU2733735C2 |
| МОДУЛЯТОРЫ CCR2 | 2016 |
|
RU2726206C2 |
| СПОСОБЫ ЛЕЧЕНИЯ РАКА С ИСПОЛЬЗОВАНИЕМ АНТАГОНИСТОВ, СВЯЗЫВАЮЩИХ С ОСЬЮ PD-1, И ИНГИБИТОРОВ TIGIT | 2014 |
|
RU2702108C2 |
| УСТОЙЧИВЫЕ ЛОКАЛЬНЫЕ УРОВНИ ЛЕКАРСТВЕННОГО СРЕДСТВА ДЛЯ АГОНИСТОВ ВРОЖДЕННОГО ИММУНИТЕТА | 2020 |
|
RU2817710C2 |
| КОМБИНАЦИИ ДВОЙНЫХ МОДУЛЯТОРОВ IRS/STAT3 И АНТИТЕЛ К PD-1/PD-L1 ДЛЯ ЛЕЧЕНИЯ РАКА | 2017 |
|
RU2796275C2 |
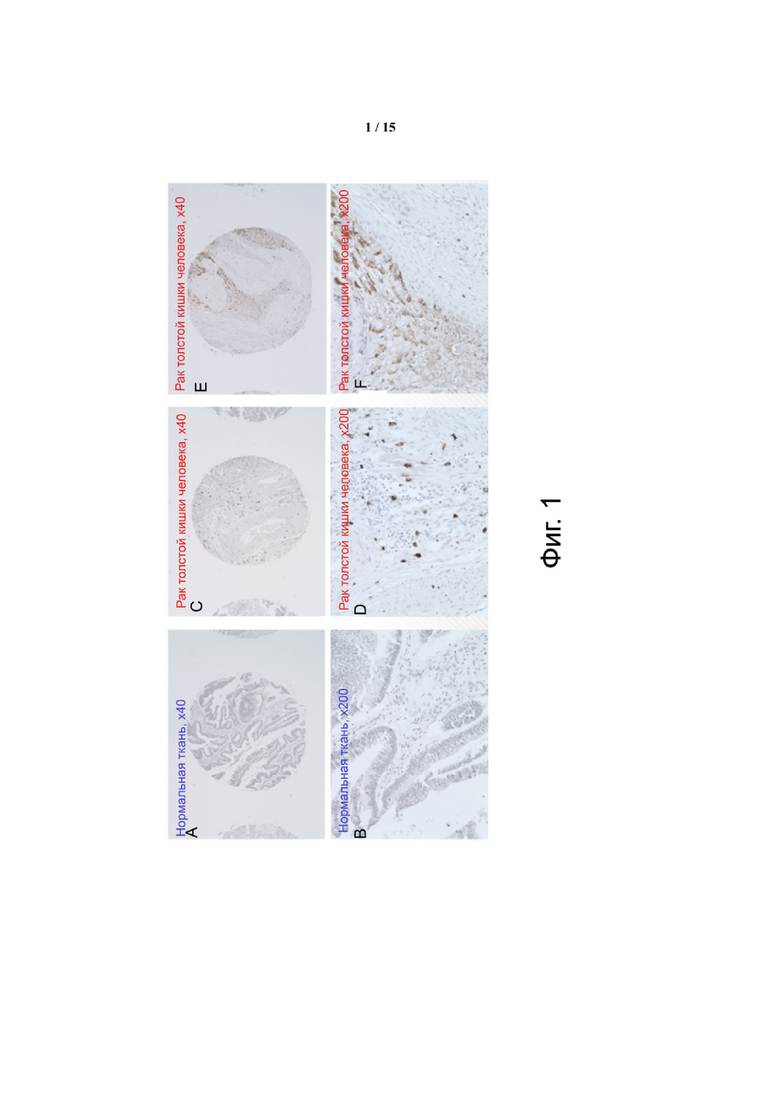
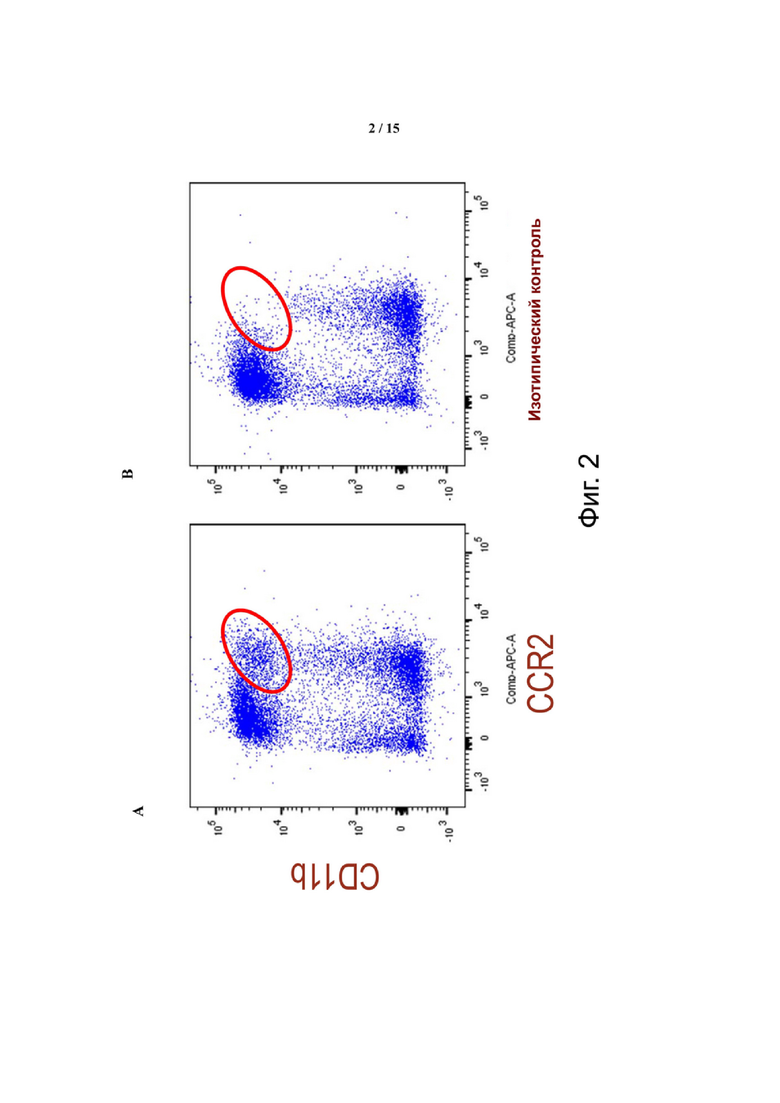
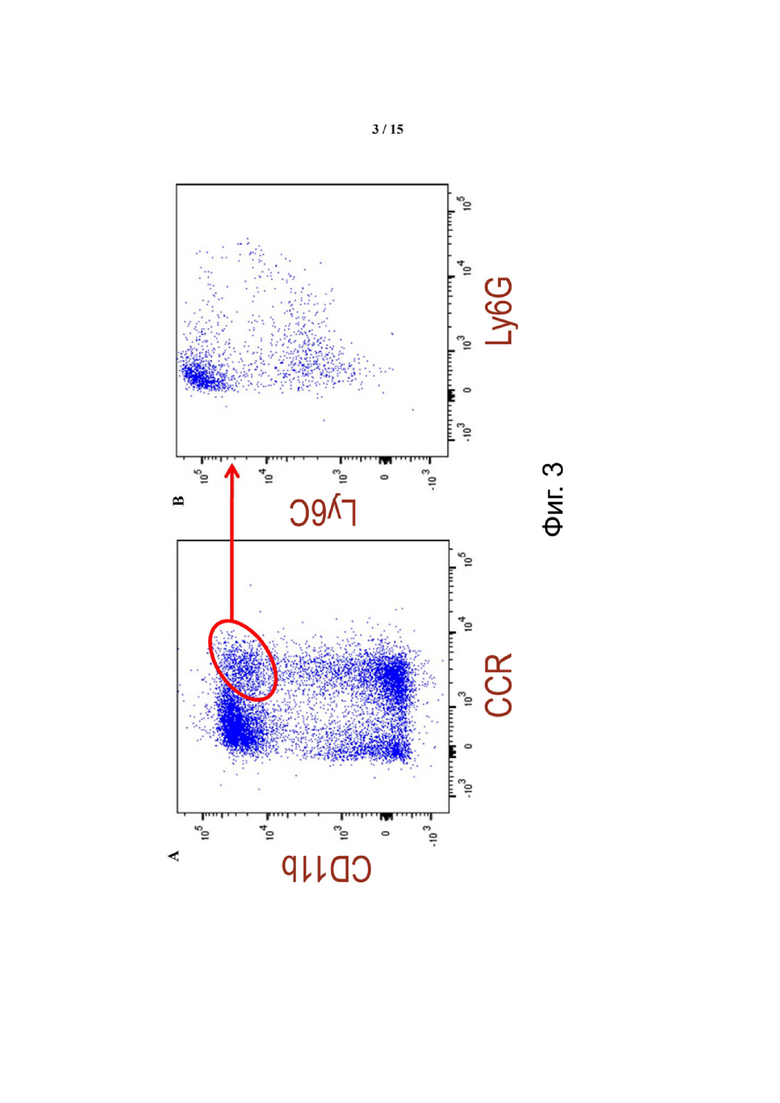
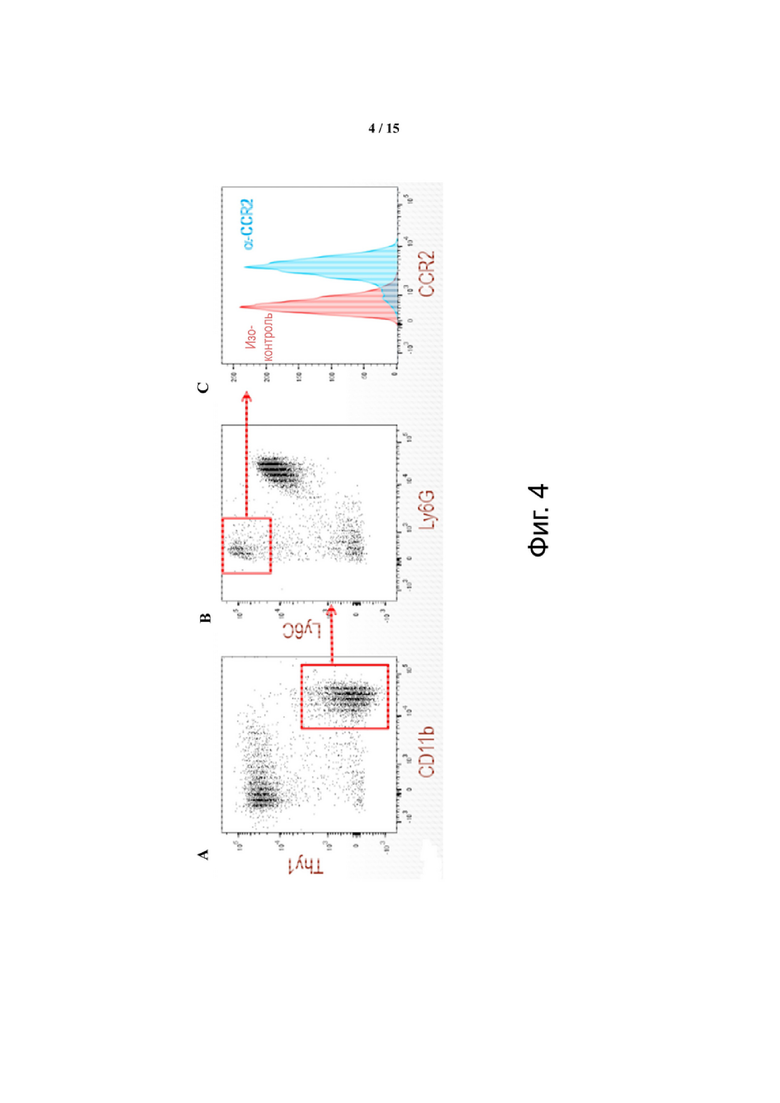

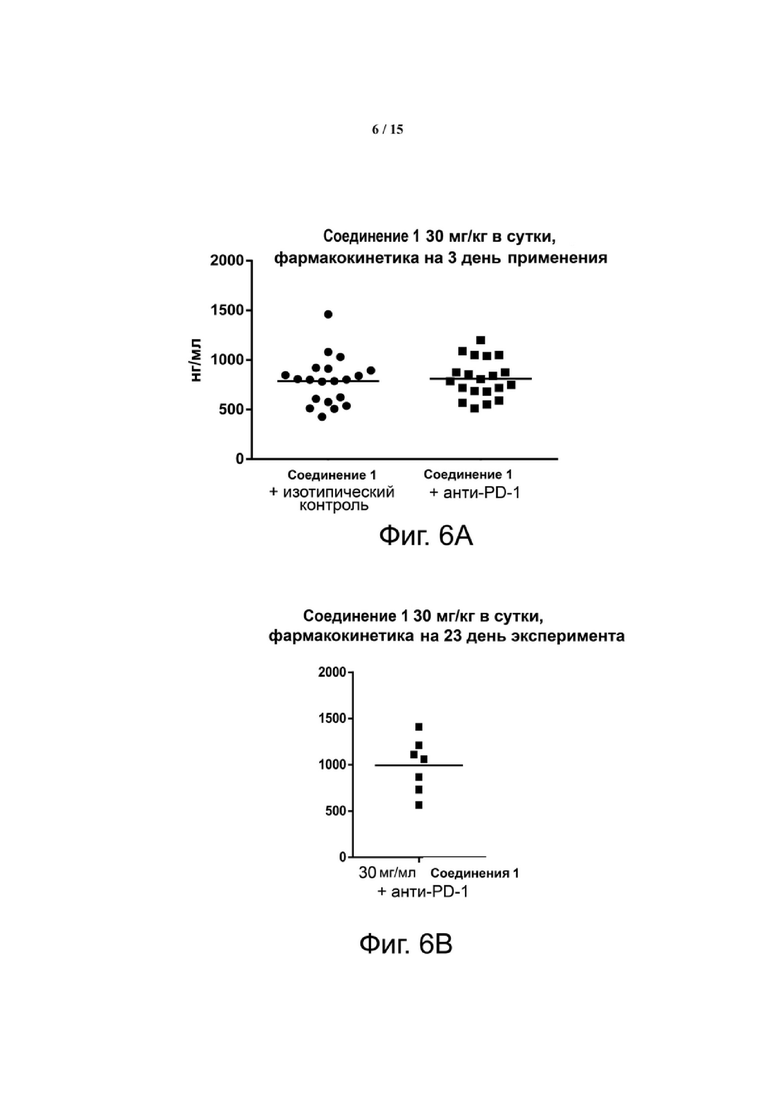
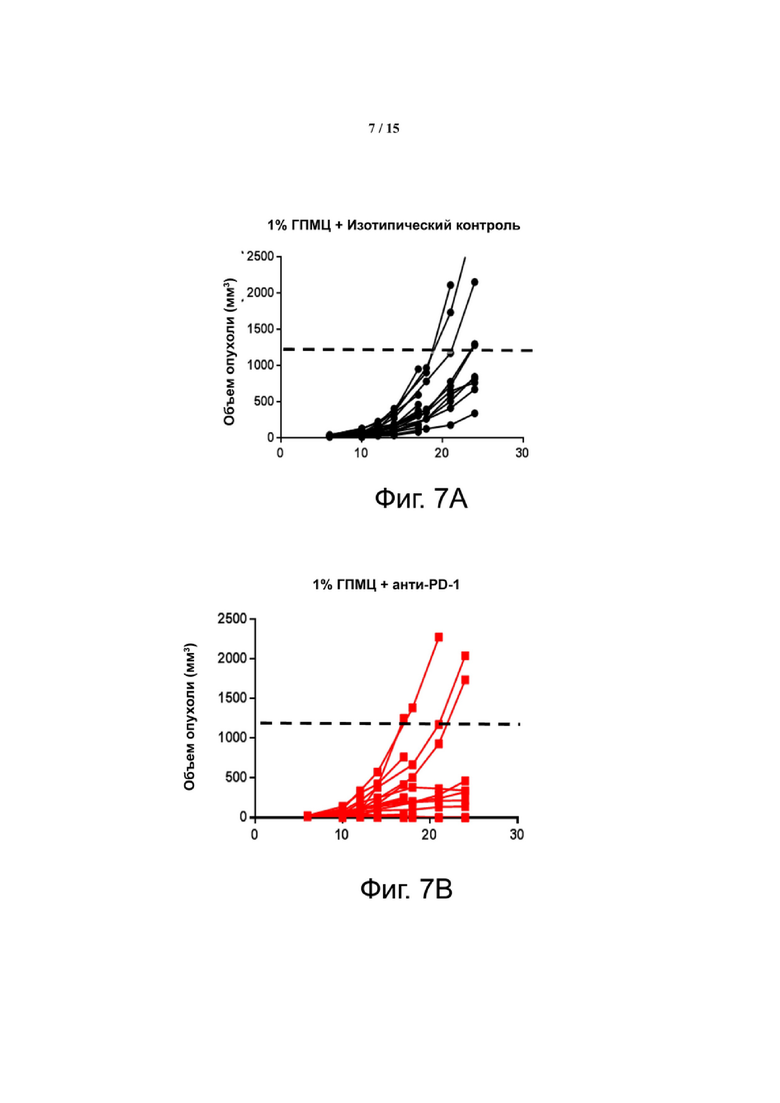
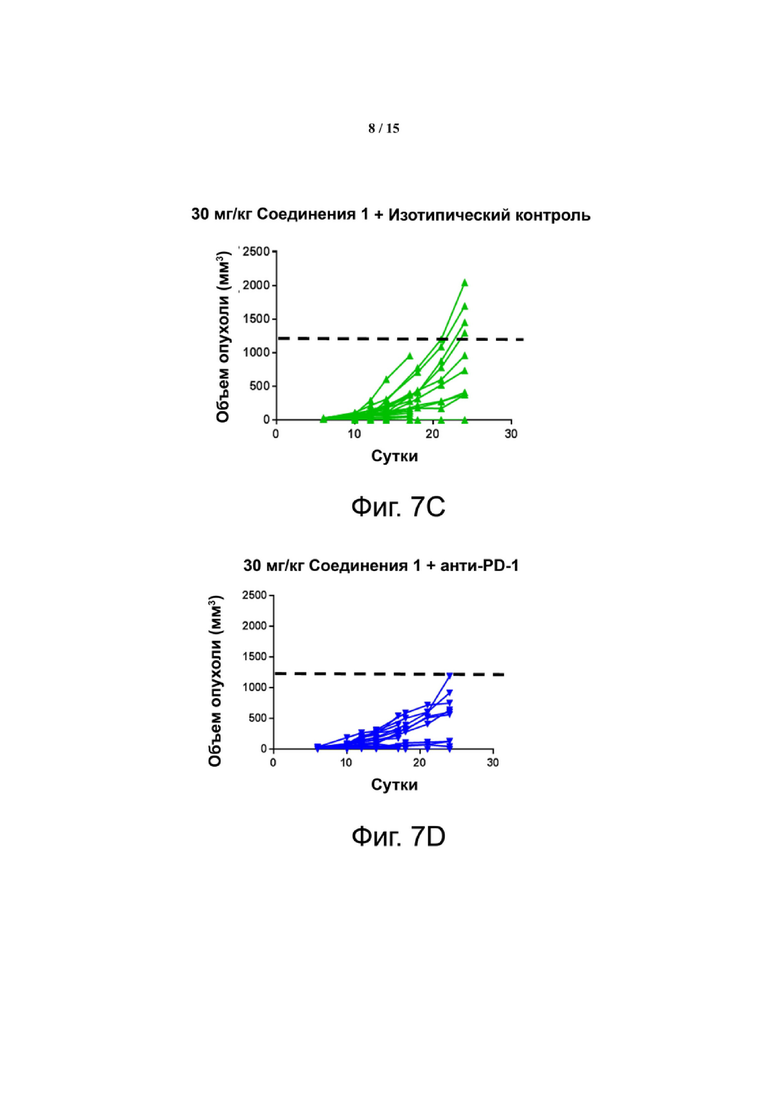
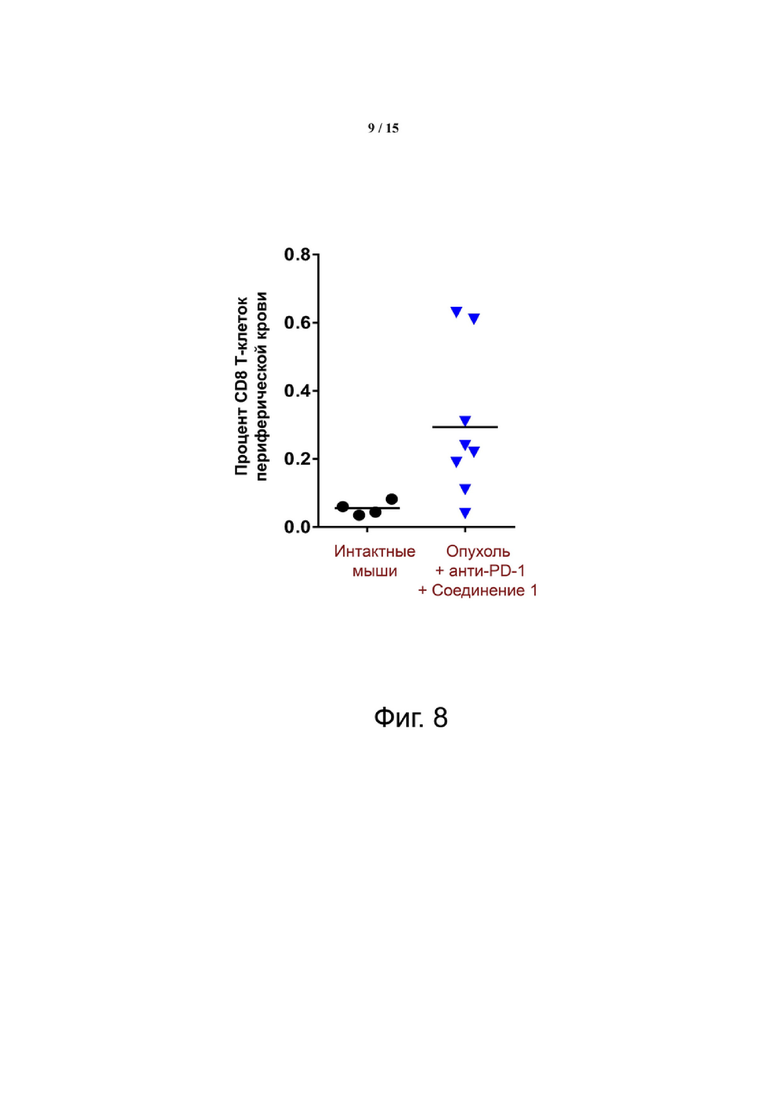
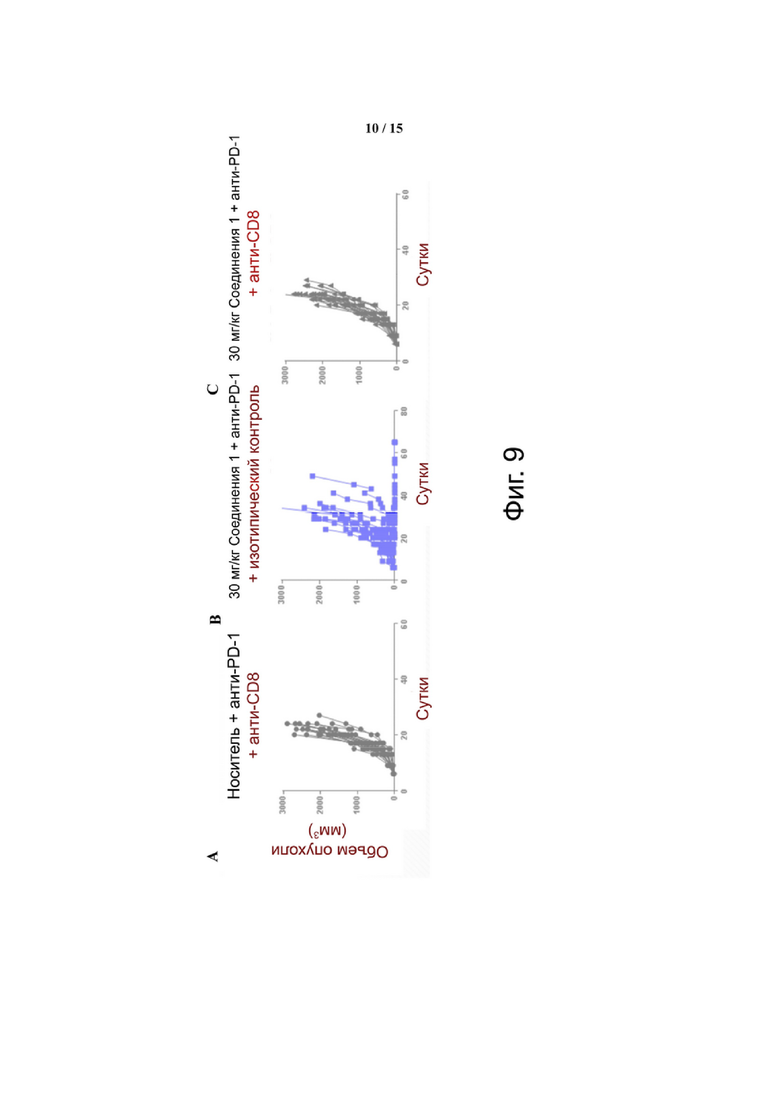
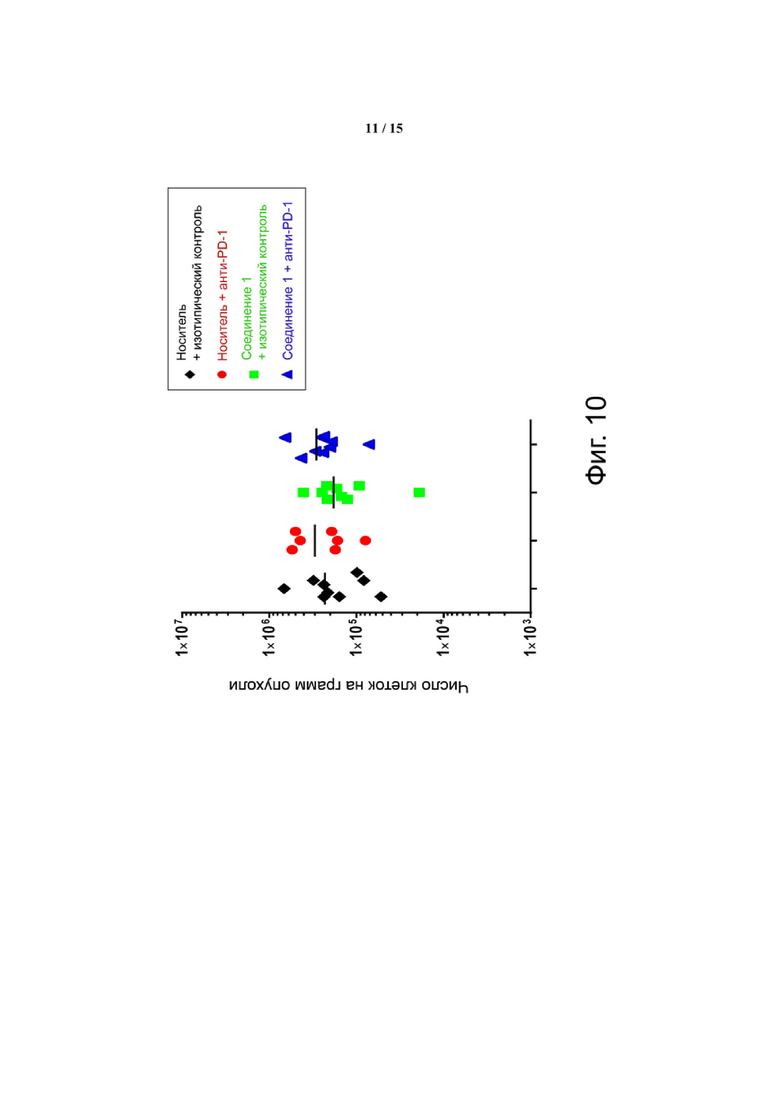
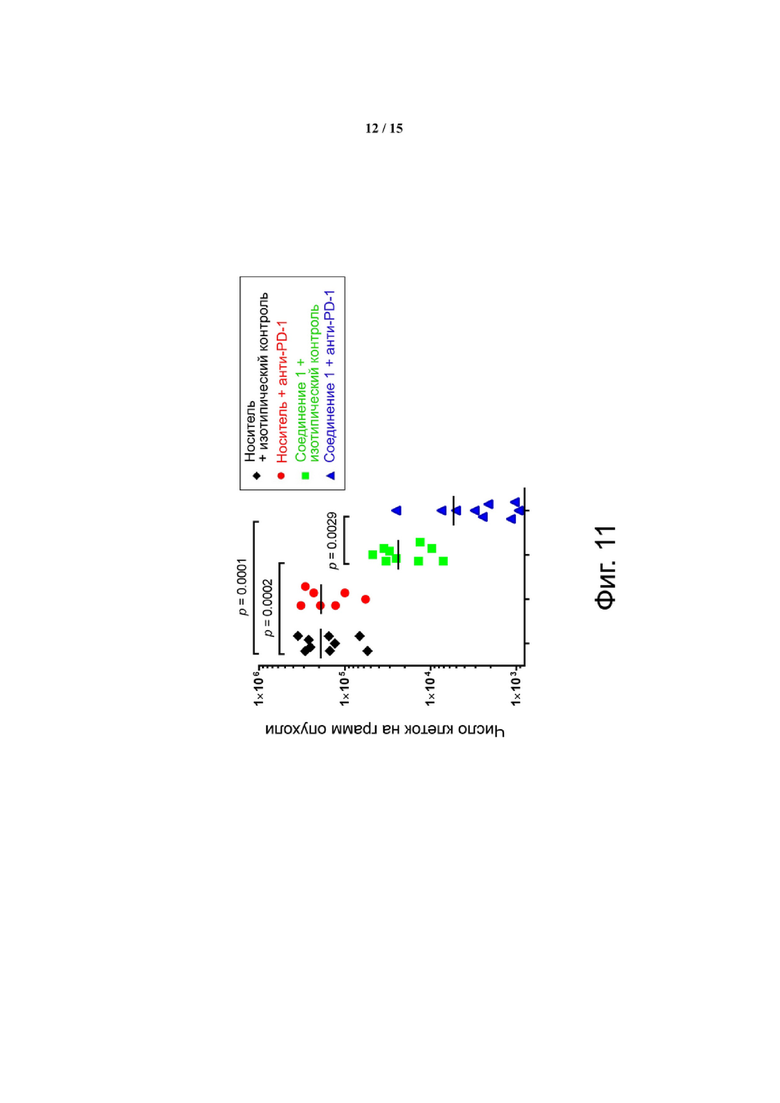
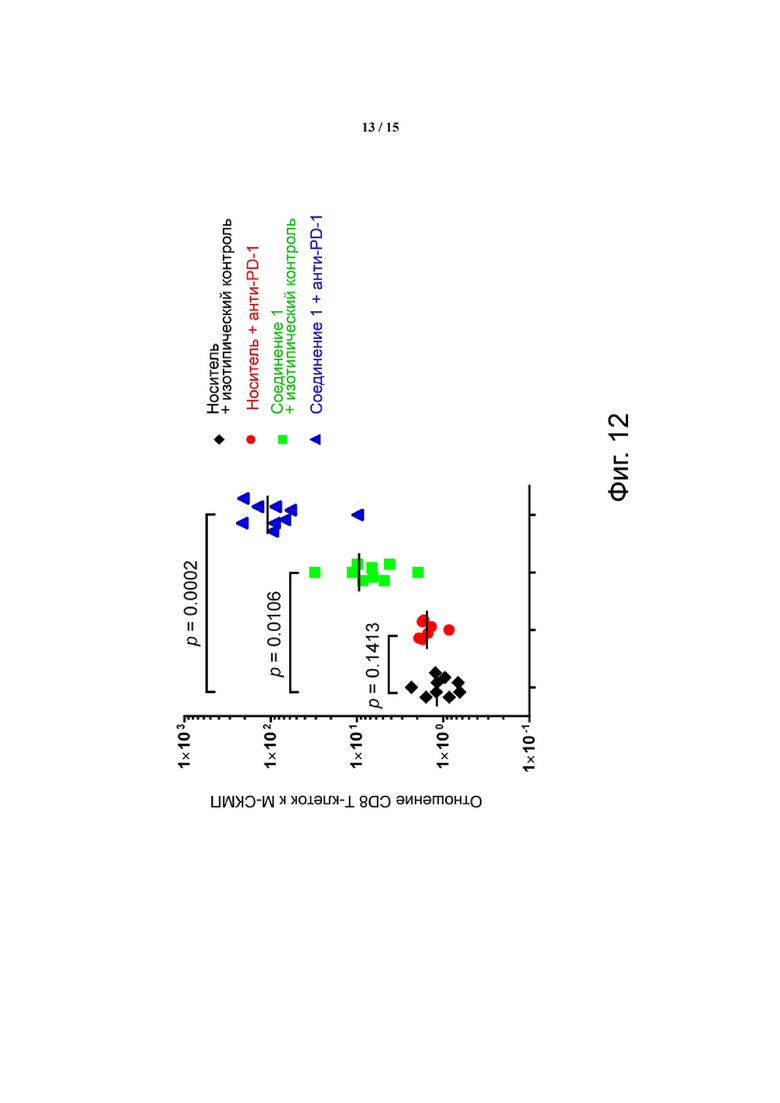
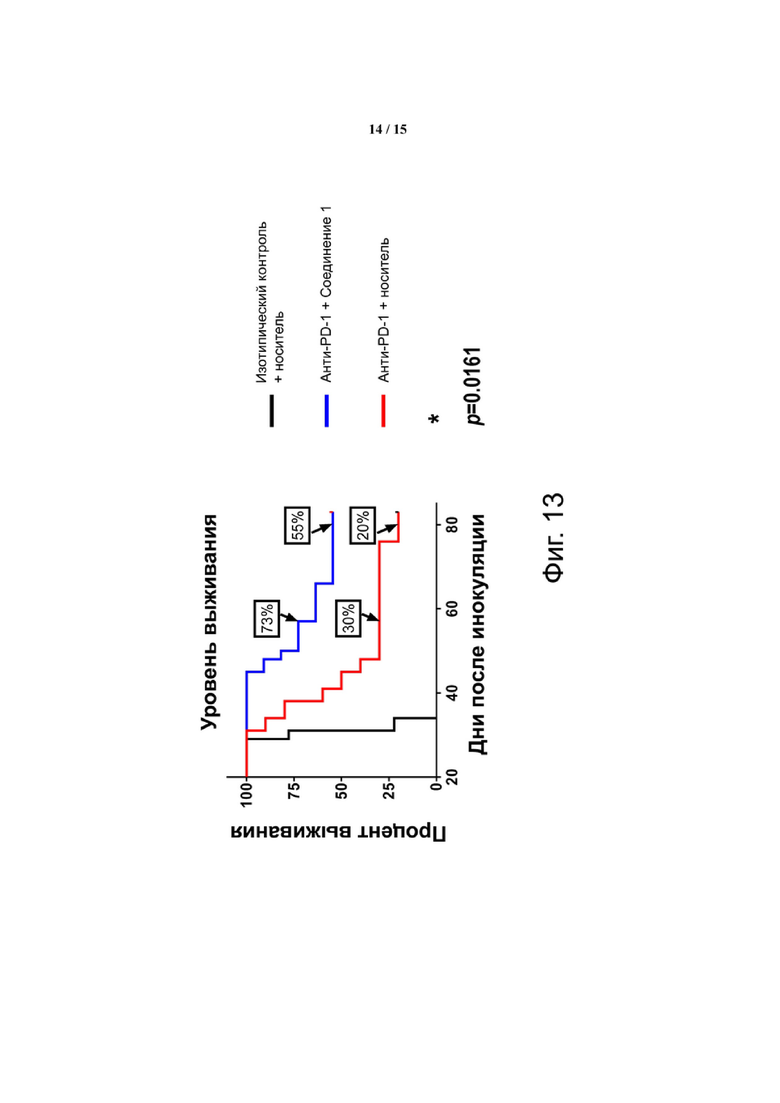
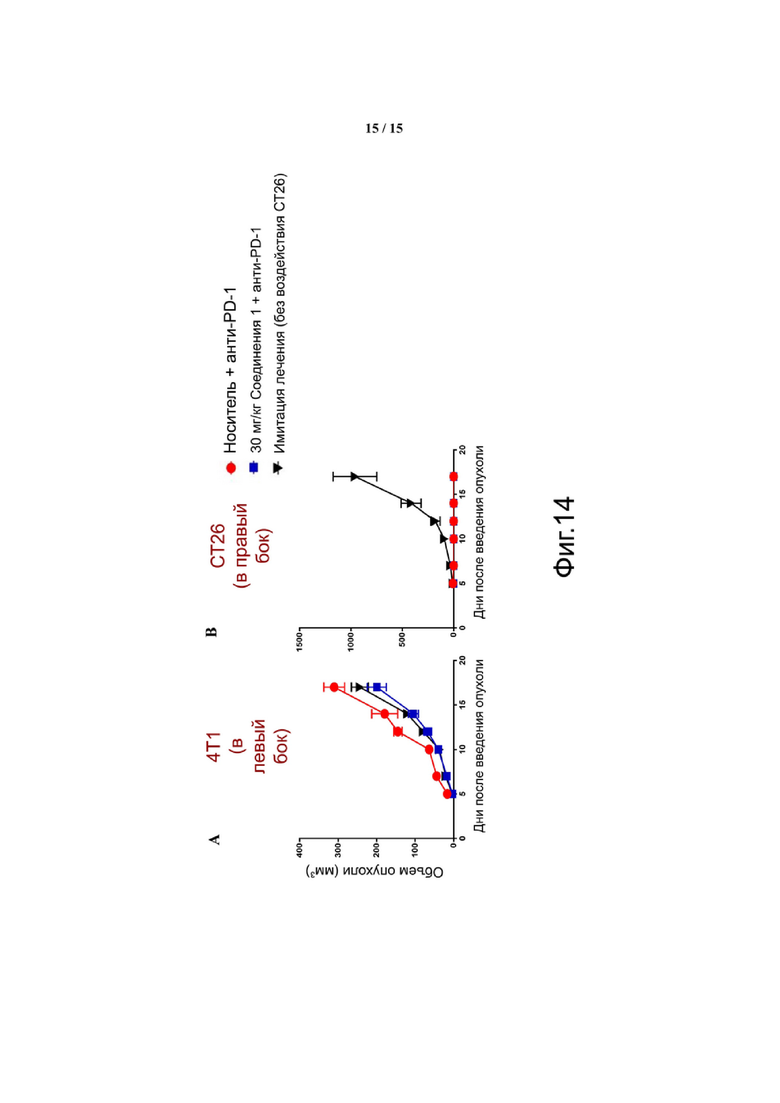
Группа изобретений относится к области медицины, а именно к комбинированной терапии антагонистом хемокинового рецептора 2 (CCR2) и ингибитором PD-1 и/или PD-L1 при лечении колоректального рака. Предложен способ усиления терапевтического эффекта ингибитора PD-1 и/или PD-L1 при лечении колоректального рака у млекопитающего, включающий введение терапевтически эффективного количества антагониста хемокинового рецептора CCR2 и терапевтически эффективного количества ингибитора PD-1 и/или PD-L1 млекопитающему. Предложены также применение терапевтически эффективного количества антагониста хемокинового рецептора CCR2 для усиления терапевтического эффекта ингибитора PD-1 и/или PD-L1 при лечении колоректального рака у субъекта и набор, включающий терапевтически эффективное количество антагониста хемокинового рецептора CCR2, терапевтически эффективное количество ингибитора PD-1 и/или PD-L1 и инструкцию по применению. Обеспечивается значительное уменьшение размера опухоли. 3 н. и 22 з.п. ф-лы, 14 ил., 1 пр.
1. Способ усиления терапевтического эффекта ингибитора PD-1 и/или PD-L1 при лечении колоректального рака у млекопитающего, включающий введение терапевтически эффективного количества антагониста хемокинового рецептора CCR2 и терапевтически эффективного количества ингибитора PD-1 и/или PD-L1 млекопитающему,
где указанный антагонист хемокинового рецептора CCR2 имеет формулу, выбранную из группы, состоящей из:
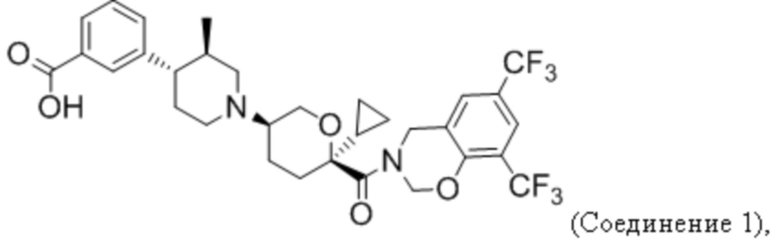
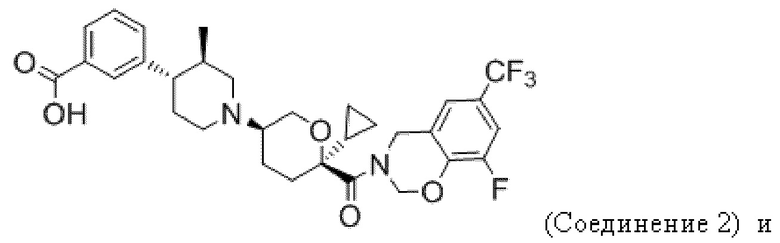
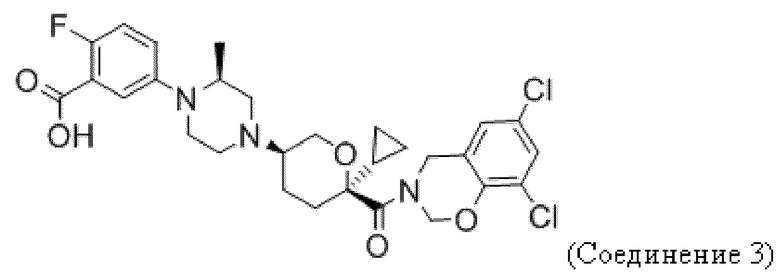
или их фармацевтически приемлемых солей.
2. Способ по п. 1, где указанный антагонист хемокинового рецептора CCR2 имеет формулу
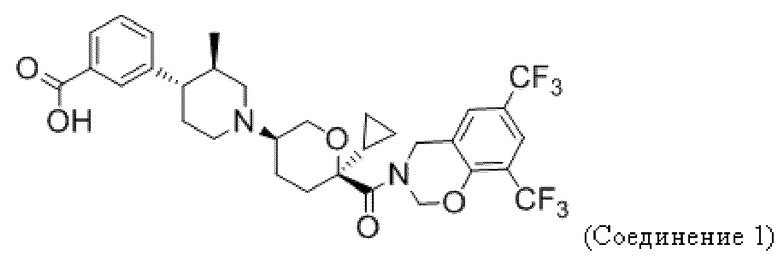
или его фармацевтически приемлемой соли.
3. Способ по п. 1, где указанный антагонист хемокинового рецептора CCR2 имеет формулу
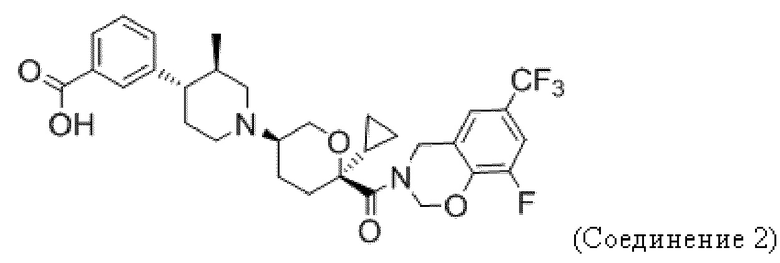
или его фармацевтически приемлемой соли.
4. Способ по п. 1, где указанный антагонист хемокинового рецептора CCR2 имеет формулу
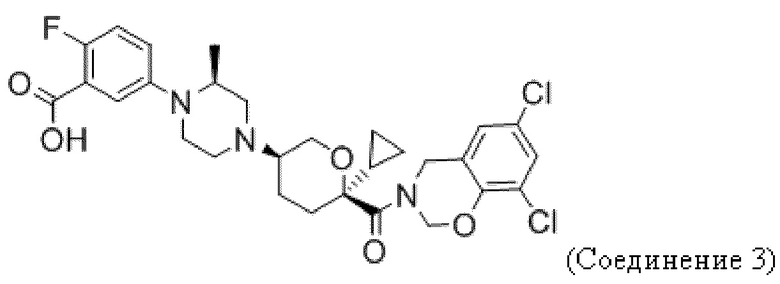
или его фармацевтически приемлемой соли.
5. Способ по любому из пп. 1-4, где указанный ингибитор PD-1 и/или PD-L1 представляет собой ингибитор PD-1.
6. Способ по п. 5, где ингибитор PD-1 выбран из группы, состоящей из пембролизумаба, ниволумаба, IBI-308, mDX-400, BGB-108, MEDI-0680, SHR-1210, PF-06801591, PDR-001, GB-226 и STI-1110.
7. Способ по п. 5, где ингибитор PD-1 выбран из группы, состоящей из ниволумаба, пембролизумаба и пидилизумаба.
8. Способ по любому из пп. 1-4, где указанный ингибитор PD-1 и/или PD-L1 представляет собой ингибитор PD-L1.
9. Способ по п. 8, где ингибитор PD-L1 выбран из группы, состоящей из дурвалумаба, атезолизумаба, авелумаба, BMS-936559, ALN-PDL, TSR-042, KD-033, CA-170, CA-327, STI-1014 и KY-1003.
10. Способ по любому из пп. 1-9, где антагонист хемокинового рецептора CCR2 и ингибитор PD-1 и/или PD-L1 вводят совместно.
11. Способ по п. 10, где антагонист хемокинового рецептора CCR2 и ингибитор PD-1 и/или PD-L1 вводят в комбинированном препарате.
12. Способ по любому из пп. 1-9, где антагонист хемокинового рецептора CCR2 и ингибитор PD-1 и/или PD-L1 вводят последовательно.
13. Способ по п. 12, где антагонист хемокинового рецептора CCR2 вводят до введения ингибитора PD-1 и/или PD-L1.
14. Способ по п. 12, где антагонист хемокинового рецептора CCR2 вводят после введения ингибитора PD-1 и/или PD-L1.
15. Способ по любому из пп. 1-14, где антагонист хемокинового рецептора CCR2 вводят перорально, а ингибитор PD-1 и/или PD-L1 вводят внутривенно.
16. Способ по любому из пп. 1-15, где млекопитающее является человеком.
17. Способ по любому из пп. 1-16, где терапевтический эффект заключается в уменьшении размера опухоли.
18. Применение терапевтически эффективного количества антагониста хемокинового рецептора CCR2 для усиления терапевтического эффекта ингибитора PD-1 и/или PD-L1 при лечении колоректального рака у субъекта,
где указанный антагонист хемокинового рецептора CCR2 имеет формулу, выбранную из группы, состоящей из:
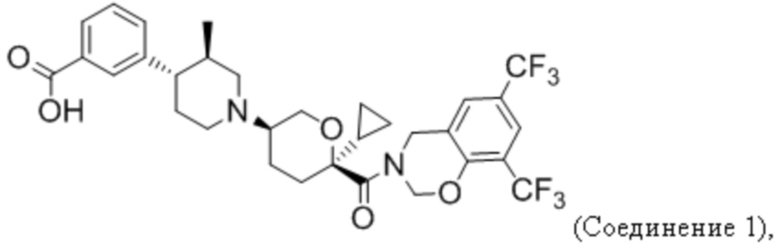
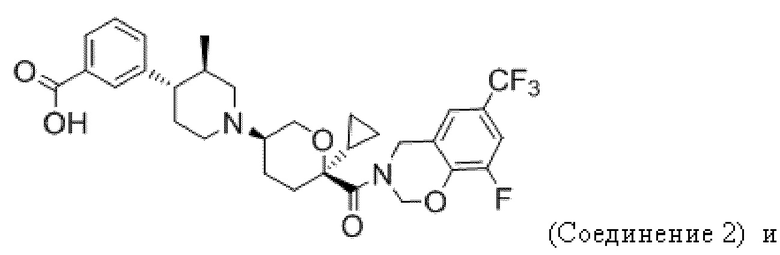
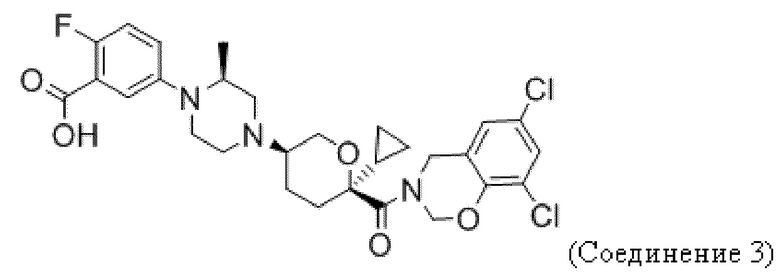
или их фармацевтически приемлемых солей.
19. Применение п. 18, где антагонист хемокинового рецептора CCR2 используется в композиции, содержащей антагонист хемокинового рецептора CCR2, ингибитор PD-1 и/или PD-L1 и фармацевтически приемлемый носитель или эксципиент.
20. Применение по п. 18 или 19, где ингибитор PD-1 и/или PD-L1 выбран из любого ингибитора по пп. 5-9.
21. Применение по любому из пп. 18-20, где терапевтический эффект заключается в уменьшении размера опухоли.
22. Набор для усиления терапевтического эффекта ингибитора PD-1 и/или PD-L1 при лечении субъекта, страдающего колоректальным раком, включающий терапевтически эффективное количество антагониста хемокинового рецептора CCR2 и терапевтически эффективное количество ингибитора PD-1 и/или PD-L1, с инструкцией по эффективному применению,
где указанный антагонист хемокинового рецептора CCR2 имеет формулу, выбранную из группы, состоящей из:
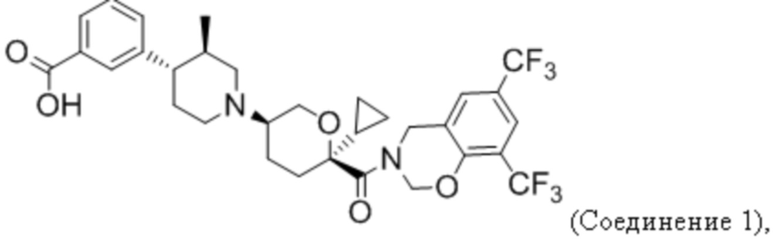

или их фармацевтически приемлемых солей.
23. Набор по п. 22, где ингибитор PD-1 и/или PD-L1 выбран из любого ингибитора по пп. 5-9.
24. Набор по п. 22 или 23, где антагонист хемокинового рецептора CCR2 и ингибитор PD-1 и/или PD-L1 находятся в составе для совместного введения.
25. Набор по п. 22 или 23, где антагонист хемокинового рецептора CCR2 и ингибитор PD-1 и/или PD-L1 находятся в составе для последовательного введения.
| CHRISTINE JANSON ET AL, "Abstract 5655: Inhibition of CCR2 potentiates checkpoint inhibitor immunotherapy in murine model of pancreatic cancer", AACR: CANCER RESEARCH PROCEEDINGS OF THE AMERICAN ASSOCIATION FOR CANCER RESEARCH ANNUAL MEETING, (20170401), vol | |||
| Спускная труба при плотине | 0 |
|
SU77A1 |
| Насос | 1917 |
|
SU13A1 |
| WO 2016187393 | |||
Авторы
Даты
2023-05-29—Публикация
2018-09-24—Подача