Изобретение относится к медицине, а именно к онкологии, и может быть использовано для определения изменения (конверсии) молекулярно-биологического подтипа (МБП) совокупности циркулирующих опухолевых клеток (ЦОК) относительно МБП первичной опухоли у больных раком молочной железы (РМЖ).
Определение молекулярно-биологического подтипа первичной опухоли является важным этапом для оценки прогноза клинического течения заболевания и определения тактики лечения больных раком молочной железы.
Методика определения молекулярно-биологического подтипа первичной опухоли рака молочной железы строго регламентируется клиническими рекомендациями RUSSCO и основывается на интегральной оценке экспрессии маркеров рецепторов эстрогена (ERα,) и прогестерона (PR), маркера пролиферативной активности клеток Ki67 и рецептора эпидермального фактора роста человека (HER2) в совокупности клеток опухоли. С учетом интегральной оценки экспрессии указанных маркеров выделяют 5 основных молекулярно-биологических подтипов рака молочной железы:
- люминальный А положительная экспрессия ERα и/или PR; Ki67 менее 20%, отсутствие гиперэкспрессии гена HER2);
- люминальный В, HER2-негативный (положительная экспрессия ERα и/или PR; Ki67 более 20%, отсутствие гиперэкспрессии гена HER2);
- люминальный В, HER2-позитивный (положительная экспрессия ERα и/или PR, наличие гиперэкспрессии гена HER2);
- HER2-позитивный (отрицательная экспрессия ERα и PR, наличие гиперэкспрессии гена HER2);
- тройной негативный (отрицательная экспрессия ERα, PR, HER2).
Назначение адекватной гормональной терапии, а также конвенциальной химиотерапии и таргетной анти-HER2 терапии при раке молочной железы напрямую зависит от молекулярно-биологического подтипа первичной опухоли. Известно, что экспрессия отдельных маркеров молекулярно-биологического подтипа различается в первичной опухоли, метастатическом узле и циркулирующих опухолевых клетках (ЦОК) (Aktas В. et al. Comparison of the HER2, estrogen and progesterone receptor expression profile of primary tumor, metastases and circulating tumor cells in metastatic breast cancer patients //BMC cancer. - 2016. - T. 16. - №. 1. - C. 1-8.). Адъювантную терапию рекомендуется выбирать с учетом экспрессии молекулярных маркеров опухолевыми клетками метастатического очага. Однако, метастазы не всегда доступны для исследования. ЦОК представляют собой гетерогенную совокупность опухолевых клеток, находящихся в циркуляции, и включают клетки с агрессивными свойствами, часть из которых становятся диссеминированными, «дремлющими» и, в итоге, являются источником отдаленных метастазов.
Таким образом, появилась необходимость ввести определение молекулярно-биологического подтипа совокупности ЦОК, сопоставить его с подтипом первичной опухоли и выявить его изменение (конверсию) относительно МБП первичной опухоли для того, чтобы существенно расширить диагностические, прогностические и терапевтические возможности при раке молочной железы.
На сегодняшний день известны методики, которые позволяют определять экспрессию отдельных маркеров ЦОК и детектировать изменение их экспрессии относительно первичной опухоли, но не конверсию молекулярно-биологического подтипа в целом.
Известен способ определения молекулярно-биологического подтипа первичной опухоли и отдельных маркеров молекулярно-биологического подтипа в ЦОК методом проточной цитометрии. В патенте RU №2757590 описан способ определения экспрессии маркеров Ki67, PR и HER2 в нефиксированной опухолевой ткани, полученной кор-биопсией, методом проточной цитофлуориметрии. К безусловным достоинствам данного способа относится валидация полученных данных методом иммуногистохимии.
В работе Paoletti с соавт.экспрессия рецептора эстрогена в ЦОК определяется с использованием системы CellSearch® (Paoletti С.et al. Circulating tumor cell number and endocrine therapy index in ER positive metastatic breast cancer patients //NPJ breast cancer. - 2021. - T. 7. - №. 1. - C. 1-9.). Аналогичная система используется в работе Beije с соавт. для определения экспрессии HER2 в ЦОК (Beije N. et al. Prognostic impact of HER2 and ER status of circulating tumor cells in metastatic breast cancer patients with a HER2-negative primary tumor //Neoplasia. - 2016. - T. 18. - №. 11. - C. 647-653.).
В работе Kalinsky с соавт. для определения экспрессии рецепторов эстрогена и прогестерона, осуществляется выделение ЦОК микрофлюидным методом с использованием платформы OncoСЕЕ™ и дальнейшим иммуноцитохимическим окрашиванием (Kalinsky K. et al. Correlation of hormone receptor status between circulating tumor cells, primary tumor, and metastasis in breast cancer patients //Clinical and Translational Oncology. - 2015. - Т. 17. - №. 7. - C. 539-546.).
Известен способ определения экспрессии рецептора эстрогена и Ki67 в ЦОК с использованием системы CellSearch® (Paoletti С.et al. Circulating Biomarkers and Resistance to Endocrine Therapy in Metastatic Breast Cancers: Correlative Results from AZD9496 Oral SERD Phase I TrialLiquid Biopsies, Metastatic Breast Cancer, Oral SERD AZD9496 //Clinical Cancer Research. - 2018. - T. 24. - №. 23. - C. 5860-5872.).
Известен способ определения молекулярно-биологического подтипа первичной опухоли методом проточной цитометрии (Wopereis S. et al. Evaluation of ER, PR and HER2 markers by flow cytometry for breast cancer diagnosis and prognosis //Clinica Chimica Acta. - 2021. - T. 523. - C. 504-512.). Недостатком данного способа является несоответствие разработанного подхода для определения сверхэкспрессии маркера HER2 общепринятым клиническим рекомендациям. Авторы интерпретируют промежуточные значения экспрессии HER2 «+» и «++», как наличие сверхэкспрессии маркера HER2, в то время как положительной экспрессией общепринято считать только окрашивание на «+++».
Таким образом, ни один из вышеупомянутых аналогов не подходит для решения поставленной задачи. Общим недостатком рассматриваемых методов является определение отдельных маркеров без заключения о молекулярно-биологическом подтипе совокупности ЦОК. При этом, метод, предложенный Wopereis S. et al., позволяет определить молекулярно-биологический подтип методом проточной цитометрии, но в первичной опухоли, а не совокупности ЦОК.
Новый технический результат - создание способа определения конверсии молекулярно-биологического подтипа совокупности ЦОК у больных раком молочной железы для прогнозирования эффективности применяемой схемы химиотерапии.
Для достижения нового технического результата в способе определения конверсии молекулярно-биологического подтипа (МБП) совокупности циркулирующих опухолевых клеток относительно молекулярно-биологического подтипа первичной опухоли у больных раком молочной железы определяют МБП первичной опухоли согласно регламенту клинических рекомендаций RUSSCO, также определяют МБП совокупности ЦОК, для этого в обогащенной лейкоцитами фракции венозной крови, полученной после осаждения эритроцитов, методом проточной цитометрии определяют экспрессию в ядросодержащих клетках общего лейкоцитарного маркера CD45, EpCam, а также экспрессию маркеров молекулярно-биологического подтипа ER, PR, HER2 и Ki67,соответсвенно, полученные значения сравнивают с таковыми в основном опухолевом узле и при выявлении несоответствия между ними определяют конверсию молекулярно-биологического подтипа в совокупности ЦОК.
Новым является то, что определяют МБП первичной опухоли согласно регламенту клинических рекомендаций RUSSCO,также определяют МБП совокупности ЦОК, для этого в обогащенной лейкоцитами фракции крови, полученной после осаждения эритроцитов венозной крови, методом проточной цитометрии определяют экспрессию в ядросодержащих клетках общего лейкоцитарного маркера CD45, EpCam, а также экспрессию маркеров молекулярно-биологического подтипа ER, PR, HER2 и Ki67, соответсвенно, полученные значения сравнивают с таковыми в основном опухолевом узле и при выявлении несоответствия между ними определяют конверсию молекулярно-биологического подтипа в совокупности ЦОК.
Способ осуществляют следующим образом. После хирургического удаления опухоли проводят иммуногистохимическое исследование образцов опухолевой ткани для определения молекулярно-биологического подтипа основного опухолевого узла. Оценку экспрессии ERα, PR, HER2 и Ki67 в ткани опухоли проводят с использованием автоматического иммуностейнера Leica Bond-Max (Leica, Bannockburn, IL). Окрашивание производят набором Leica Refine в соответствии с автоматизированным протоколом. Демаскировку антигена для PR осуществляляют в Bond Solution #1 (Leica Biosystems, эквивалентно цитратному буферу, рН 6.0), для ERα, HER2 и Ki67 в Bond Solution #2 (Leica Biosystems, эквивалентно ЭДТА буферу, рН 9.0) при 100°С 20 мин. Первичные антитела против ERα (RTU, clone 6F11, mouse, Leica Biosystems, Germany), PR (RTU, clone 16, mouse, Leica Biosystems, Germany), HER2 (1:1000, polyclonal, rabbit, Dako, USA) и Ki67 (1:250, clone SP6, rabbit, Sigma-Aldrich, USA) инкубируют при комнатной температуре 25 мин. Детектирование первичных антител осуществляют с использованием Bond Polymer Refine Detection kit (Leica Biosystems, Germany), и диаминобензидина (DAB) при комнатной температуре в течение 5 мин. Далее образцы докрашивают гематоксилином. Подсчет результатов осуществляют в соответствии с рекомендациями RUSSCO, для ERα и PR более 1% опухолевых клеток с экспрессией, для Ki67 более 20% опухолевых клеток, для HER2 более 10% опухолевых клеток с выраженной и умеренной кольцевой экспрессией или положительным результатом при флуоресцентной гибридизации in situ. Небольшой фрагмент опухолевой ткани (0,5×0,5 см) замораживают при -80°С для дальнейшего анализа методом проточной цитометрии.
Определение экспрессии HER2 в опухолевых клетках методом проточной цитометрии
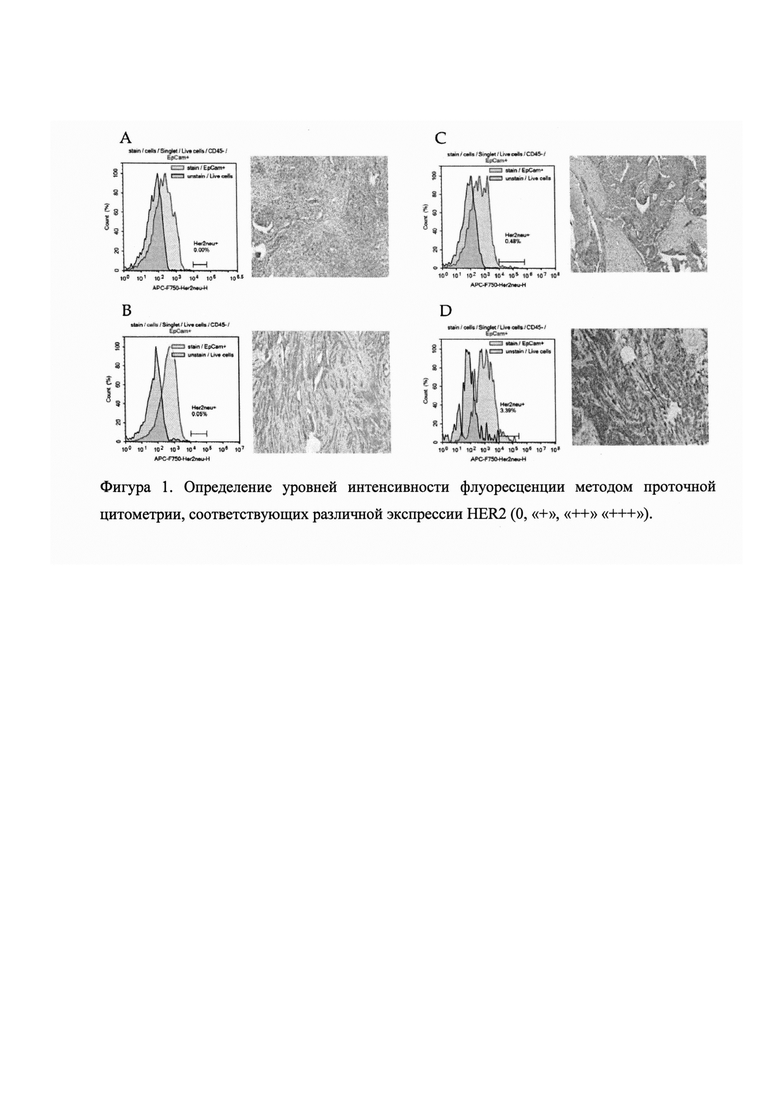
Для определения статуса HER2 необходимо отделить нормальную экспрессию от сверхэкспрессии, что является показанием к таргетной терапии, необходимо установить пороговое значение интенсивности флуоресценции, определяемое методом проточной цитометрии, которое соответствует «+++» при определении экспрессии HER2 в опухоли методом иммуногистохимии или положительной реакцией при флуоресцентной гибридизации in situ.
Для определения уровня интенсивности флуоресценции, соответствующего экспрессии HER2 на «+++», были отобраны образцы первичной опухоли с различной экспрессией HER2 (0, «+», «++» «+++») для анализа методом проточной цитометрии. Образцы были разморожены при комнатной температуре, далее гомогенизированы с использованием MediMachine (BD Biosciences, USA) в 1 мл DMEM, содержащем 5% FBS. Полученная клеточная суспензия была отфильтрована через клеточное сито (Corning Falcon™ Cell Strainer) с размером пор 70 μm и дважды отмыта в фосфатно-солевом буфере (рН=7,4) при 400 × g 10 мин. Далее образцы окрашивали антителами против CD45, EpCam и HER2. Жизнеспособность клеток оценивали с помощью окрашивания 7AAD.
По результатам нашего исследования экспрессия HER2 на «+++» в опухоли соответствовала экспрессии HER2 у более чем 0,5% клеток с уровнем флуоресценции соответствующем 5 декаде логарифмической шкалы проточного цитометра Novocyte 3000 (ACEA Bioscience, США).
Примечание В медицинском учреждении, где будет использоваться предлагаемый способ необходимо один раз определить по изложенной выше методике процент ЦОК и порог уровня флуоресценции HER2, которые соответствуют экспрессии HER2 в опухоли на «+++».
Повторное определение уровня интенсивности флуоресценции HER2 клетками первичной опухоли производится только при изменении технических характеристик прибора или при использовании нового лота антител для проточной цитометрии.
Определение рецепторов ERα, PR, HER2 и Ki67 совокупности ЦОК
Образец ЭДТА-стабилизированной венозной крови в объеме 9 мл забирают утром натощак, первый мл крови в исследование не берется для исключения попадания в образец клеток кожного эпителия. Далее образцы инкубируют в термостате при 37°С в течении 90 мин. После осаждения фракции эритроцитов забирают обогащенную лейкоцитами фракцию, находящуюся на границе раздела фаз между плазмой и эритроцитами. Отобранный клеточный концентрат отмывают в 2 мл Cell Wash buffer (BD Biosciences, USA) и центрифугируют при 800 × g 15 мин. Надосадок удаляют, осадок ресуспендируют в 150 мкл стерильного фосфатно-солевого буфера (рН=7,4). Для дальнейшего исследования образец делят на две части: 50 мкл - неокрашенный контроль, 100 мкл - окрашенная проба. Окрашивание ЦОК для последующей детекции методом проточной цитометрии осуществляют в два этапа, на первом этапе происходит окрашивание поверхностных маркеров (CD45, EpCam, HER2), на втором этапе окрашивание внутриклеточных маркеров (EpCam, ERα, PR, Ki67).
Образцы инкубируют с Fc Receptor Blocking Solution для блокировки неспецифического связывания антител (Sony Biotechnology, USA) при комнатной температуре 10 мин. Далее добавляют по 5 мкл моноклональных антител: BV570-anti-CD45 (clone HI30, mouse IgGl, Sony Biotechnology, USA), BV650-anti-EpCam (clone 9C4, mouse IgG2b, Sony Biotechnology, USA), AF750-anti-HER2 (clone 24D2, mouse IgGl, BioLegend, USA), образцы инкубируют в темноте при комнатной температуре 20 мин. После инкубации проводят лизирование эритроцитов в 250 мкл лизирующего буфера OptiLyse buffer (Beckman Coulter, France) в темноте при комнатной температуре 10 мин, далее образцы отмывают в 2 мл Cell Wash buffer (BD Biosciences, USA) и центрифугируются при 800 × g 6 мин.
Для внутриклеточного окрашивания образцы пермеабилизируются в 250 мкл BD Cytofix/Cytoperm (BD Biosciences, USA) и инкубируют в темноте при 4°С 30 мин, далее отмывают в 1 мл Cell Wash buffer (BD Biosciences, USA) и центрифугируютпри 800 × g 6 мин. Затем, ресуспендируют в 50 мкл BD Perm/Wash buffer (BD Biosciences, USA) и добавляют 5 мкл Fc Receptor Blocking Solution (Human TruStain FcX, Sony Biotechnology, USA) образцы инкубируют в темноте при 4°С 10 мин. Далее добавляют по 5 мкл моноклональных антител: BV650-anti-EpCam (clone 9С4, mouse IgG2b, Sony Biotechnology, USA), AF488-anti-ERα (clone AER314, mouse IgGl, Novus Biologicals, USA), APC-anti-PR (clone PR484, mouse IgGl, Novus Biologicals, USA), BV421-anti-Ki67 (clone 16A8, mouse IgG2a, Sony Biotechnology, USA), образцы инкубируют в темноте при 4°С 20 мин. После инкубации образцы отмывают в 1 мл Cell Wash buffer (BD Biosciences, USA) и центрифугируют при 800 × g 6 мин. Образцы ресуспендируют в 100 мкл стерильного фосфатно-солевого буфера (рН=7,4) и анализируют на проточном цитометре Novocyte 3000 (ACEA Biosciences, USA).
Анализ экспрессии рецепторов ERα и PR проводят следующим образом. В качестве негативного контроля экспрессии рецепторов ERα и PR используют лимфоциты, которые, как известно из литературных данных не экспрессируют ERα и PR. Образцы, в которых более 10% ЦОК имеют интенсивность флуоресценции выше, чем лимфоциты, считают положительными по экспрессии ERα и PR. При оценке экспрессии Ki67 определяют процент ЦОК с интенсивностью флуоресценции выше неокрашенного контроля. Образец ЦОК считали HER2-положительным если ≥0,5% от всей совокупности ЦОК характеризовались интенсивностью экспрессии HER2 на уровне 5 декады логарифмической шкалы.
Учитывая экспрессию ERα, PR, HER2 и Ki67 в ЦОК определяют молекулярно-биологический подтип совокупности ЦОК (фиг 1, Определение уровней интенсивности флуоресценции методом проточной цитометрии, соответствующих различной экспрессии HER2 (0, «+», «++» «+++»).
Способ основан на результатах экспериментально-клинических исследований. Определение молекулярно-биологического подтипа первичной опухоли - важный этап в лечении рака молочной железы. В клинической практике определяют молекулярно-биологический подтип остаточной опухоли при раке молочной железы, а также метастазов (Дергунова Ю.А. и др. Корреляция молекулярно-биологического подтипа первичной опухоли и регионарных метастазов у пациенток с раком молочной железы //Научно-практический рецензируемый журнал Клиническая и экспериментальная морфология. - 2020. - Т. 9. - №.2. - С. 33-39.; Хайленко В.А., Козлов Н.А. Клиническая значимость изменения рецепторного статуса в рецидивных и метастатических опухолях у больных раком молочной железы.). Однако, материал метастаза не всегда доступен. Молекулярно-биологическая классификация рака молочной железы является суррогатной, то есть принадлежность к подтипу основана на анализе экспрессии маркеров ERα, PR, HER2, Ki67. В связи с этим, целесообразно использование общепринятых методов анализа экспрессии маркеров молекулярно-биологического подтипа совокупности ЦОК.
Способ основан на анализе результатов лабораторных и клинических исследований. При анализе 43 случаев рака молочной железы, стадии T1-4N0-3M0, кроме определения молекулярно-биологического подтип основного опухолевого узла согласно регламенту клинических рекомендаций RUSSCO по выше описанной методике был определен молекулярно-биологический подтип (МБП) совокупности ЦОК по выше описанной предлагаемой методике. При сравнении молекулярно-биологического подтипа ЦОК с молекулярно-биологическим подтипом первичной опухоли обнаруживалась конверсия (изменение) МБП, которая выражалась в том, что в 88,4% случаев (38/43) МБП менялся. И в 11,6% (5/43) случаях МБП совокупности ЦОК не менялся по сравнению с МБП первичной опухоли.
На основании полученных данных был сделан вывод о том, что вероятно, изменение (конверсия) молекулярно-биологического подтипа совокупности ЦОК относительно МБП первичной опухоли может является основанием для вынесения рекомендаций по уточнению МБП и, как следствие, изменению схемы химиотерапии на более адекватную, что будет способствовать более эффективной терапии противоопухолевого лечения.
Сущность предлагаемого способа иллюстрируется следующими примерами.
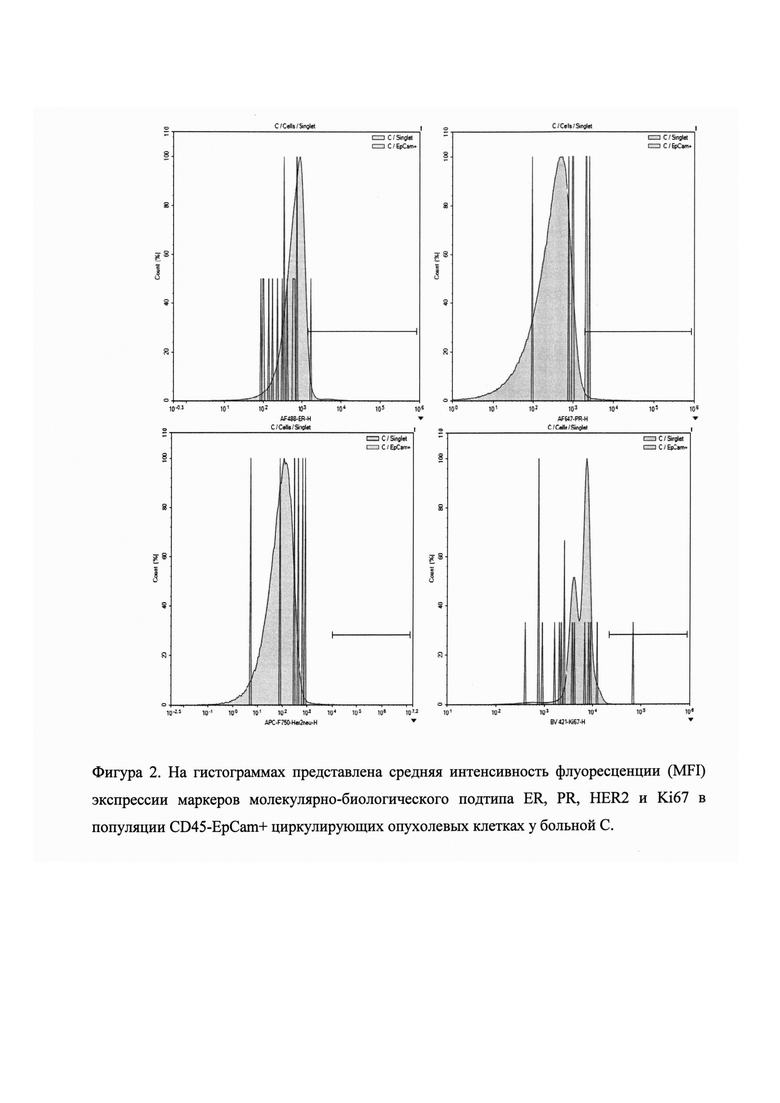
Пример 1. Больная С., 39 лет с диагнозом инвазивная протоковая карцинома неспецифического типа молочной железы. Стадия заболевания IIB. Состояние менструальной функции - сохранена. Степень злокачественности - II. Размер первичного опухолевого узла составляет 2,5 см. С целью выбора терапии был определен МБП первичной опухоли согласно регламенту клинических рекомендаций RUSSCO. Получено: ERα+, PR+, HER2 0, Ki67 - 50%. Молекулярно-биологический подтип первичной опухоли определен как люминальный Б HER2-негативный.
Было поведено определение МБП совокупности ЦОК выделенных из венозной крови и его конверсии относительно МБП первичной опухоли согласно предлагаемому способу. Оказалось, что более 10% циркулирующих опухолевых клеток имели интенсивность флуоресценции выше пороговой по маркерам ER и PR. Отсутствовали опухолевые клетки с экспрессией HER2 выше порогового (≥0,5%) значения интенсивности флуоресценции. Экспрессия Ki67 имела уровень выше порогового уровня интенсивности флуоресценции у 5% опухолевых клеток. Таким образом, молекулярно-биологический подтип совокупности циркулирующих опухолевых клеток быо определен как люминальный Б HER2-негативный. Было подтверждено отсутствует изменение МБП совокупности циркулирующих опухолевых клеток, относительно МБП подтипа первичной опухоли (Фиг. 2 На гистограммах представлена средняя интенсивность флуоресценции (MFI) экспрессии маркеров молекулярно-биологического подтипа ER, PR, HER2 и Ki67 в популяции CD45-EpCam+ циркулирующих опухолевых клетках у больной С.).
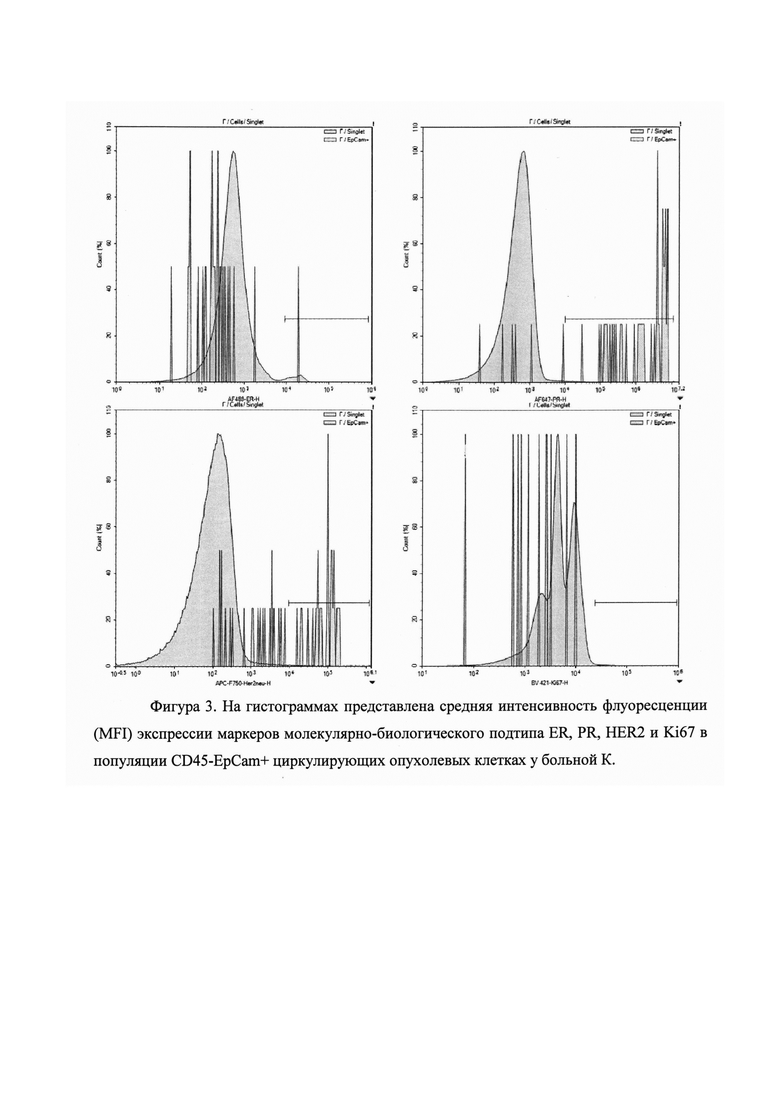
Пример 2. Больная Г., 39 лет с диагнозом инвазивная протоковая карцинома неспецифического типа молочной железы. Стадия заболевания IA. Состояние менструальной функции - сохранена. Степень злокачественности - II. Размер первичного опухолевого узла составляет 2 см. С целью выбора терапии был определен МБП первичной опухоли согласно регламенту клинических рекомендаций RUSSCO. Получено: ERα+, PR+, HER2 0, Ki67 - 24%. Молекулярно-биологический подтип первичной опухоли определен как люминальный Б HER2-негативный.
Было поведено определение МБП совокупности ЦОК, выделенных из венозной крови и его конверсии относительно МБП первичной опухоли согласно предлагаемому способу. Более 10% циркулирующих опухолевых клеток имели интенсивность флуоресценции выше пороговой по маркерам ERα и PR. Экспрессия HER2 была выше порогового значения интенсивности флуоресценции у 46,9% опухолевых клеток. Экспрессия была Ki67 выше порогового уровня интенсивности флуоресценции у 5% опухолевых клеток. Таким образом, молекулярно-биологический подтип совокупности циркулирующих опухолевых клеток определен как люминальный Б HER2-позитивный. Имела место конверсия(изменение)МБП совокупности циркулирующих опухолевых клеток, которая подтверждалась наличием отличия от МБП первичной опухоли (Фигура 3. На гистограммах представлена средняя интенсивность флуоресценции (MFI) экспрессии маркеров молекулярно-биологического подтипа ER, PR, HER2 и Ki67 в популяции CD45-EpCam+ циркулирующих опухолевых клетках у больной К.)
На основании полученных результатов - наличия изменения МБП совокупности ЦОК относительно МБП первичной опухоли возникла необходимость рекомендации по изменению схемы химиотерапии.
Таким образом, предлагаемый способ позволяет определить молекулярно-биологический подтип совокупности ЦОК, сопоставить его с подтипом первичной опухоли для выявления конверсии молекулярно-биологического подтипа, что может существенно расширить диагностические, прогностические и терапевтические возможности при раке молочной железы. Способ имеет ряд преимуществ. Впервые в совокупности ЦОК определяются все маркеры молекулярно-биологического подтипа (ERα, PR, HER2, Ki67) методом проточной цитометрии. Благодаря ориентации на современные клинические рекомендации по определению молекулярно-биологического подтипа первичной опухоли способ может быть легко интегрирован в клиническую практику. Данный способ экономически выгоден, не требует приобретения дополнительного дорогостоящего оборудования и может быть выполнен не только в исследовательских, но и лечебных учреждениях, в том числе онкологических диспансерах.
Источники информации, принятые во внимание при составлении описания:
1. Описание изобретения по заявке RU 2757590 С1.
2. Aktas В. et al. Comparison of the HER2, estrogen and progesterone receptor expression profile of primary tumor, metastases and circulating tumor cells in metastatic breast cancer patients //BMC cancer. - 2016. - T. 16. - №. 1. - C. 1-8.).
3. Beije N. et al. Prognostic impact of HER2 and ER status of circulating tumor cells in metastatic breast cancer patients with a HER2-negative primary tumor //Neoplasia. - 2016. - T. 18. - №. 11. - C. 647-653.
4. Kalinsky K. et al. Correlation of hormone receptor status between circulating tumor cells, primary tumor, and metastasis in breast cancer patients //Clinical and Translational Oncology. - 2015. - Т. 17. - №. 7. - C. 539-546.
5. Paoletti C. et al. Circulating Biomarkers and Resistance to Endocrine Therapy in Metastatic Breast Cancers: Correlative Results from AZD9496 Oral SERD Phase I TrialLiquid Biopsies, Metastatic Breast Cancer, Oral SERD AZD9496 //Clinical Cancer Research. - 2018. - T. 24. - №. 23. - C. 5860-5872.
6. Paoletti C. et al. Circulating tumor cell number and endocrine therapy index in ER positive metastatic breast cancer patients //NPJ breast cancer. - 2021. - T. 7. - №. 1. - C. 1-9.
7. Wopereis S. et al. Evaluation of ER, PR and HER2 markers by flow cytometry for breast cancer diagnosis and prognosis //Clinica Chimica Acta. - 2021. - T. 523. - C. 504-512.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ выявления HER2 положительного молекулярного подтипа рака молочной железы | 2024 |
|
RU2839351C1 |
| Способ прогнозирования риска опухолевой прогрессии у больных раком молочной железы | 2024 |
|
RU2838618C1 |
| СПОСОБЫ И НАБОРЫ ДЛЯ МОЛЕКУЛЯРНОГО СУБТИПИРОВАНИЯ ОПУХОЛЕЙ | 2014 |
|
RU2690241C2 |
| Способ определения прогноза эффективности терапии рака молочной железы | 2021 |
|
RU2757590C1 |
| Способ прогнозирования резистентности к неоадъювантной химиотерапии у больных раком молочной железы | 2022 |
|
RU2802671C1 |
| СПОСОБ ПРОГНОЗИРОВАНИЯ РИСКА ПРОГРЕССИРОВАНИЯ РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ НА ФОНЕ ТАМОКСИФЕНА С УЧЕТОМ ЭКСПРЕССИОННЫХ ОСОБЕННОСТЕЙ ОПУХОЛИ | 2023 |
|
RU2823488C1 |
| Способ прогнозирования гематогенного метастазирования при инвазивной карциноме неспецифического типа молочной железы на основе определения различных популяций циркулирующих опухолевых клеток в крови до лечения | 2018 |
|
RU2678202C1 |
| Способ прогнозирования риска плохого ответа опухоли на неоадъювантную химиотерапию у пациенток с инвазивной карциномой молочной железы | 2018 |
|
RU2682967C1 |
| Способ прогнозирования степени вероятности полной регрессии при проведении неоадъювантной химиотерапии у пациенток с люминальным В молекулярно-генетическим субтипом рака молочной железы | 2016 |
|
RU2632112C1 |
| Способ дооперационного прогнозирования риска рецидива у больных раком эндометрия Т1 стадии | 2021 |
|
RU2762493C1 |
Изобретение относится к онкологии и может быть использовано для определения конверсии молекулярно-биологического подтипа (МБП) совокупности циркулирующих опухолевых клеток (ЦОК) относительно МБП первичной опухоли у больных раком молочной железы. Для этого определяют МБП первичной опухоли согласно регламенту клинических рекомендаций RUSSCO и МБП совокупности ЦОК, для этого в обогащенной лейкоцитами фракции венозной крови после осаждения эритроцитов методом проточной цитометрии определяют экспрессию в ядросодержащих клетках общего лейкоцитарного маркера CD45, EpCam, а также маркеров МБП ER, PR, HER2 и Ki67, полученные значения сравнивают с таковыми в основном опухолевом узле и при выявлении несоответствия между ними определяют конверсию МБП совокупности ЦОК относительно МБП первичной опухоли. Предлагаемый способ определения конверсии МБП совокупности ЦОК у больных раком молочной железы позволяет прогнозировать эффективность применяемой схемы химиотерапии. 3 ил., 2 пр.
Способ определения конверсии молекулярно-биологического подтипа совокупности циркулирующих опухолевых клеток относительно молекулярно-биологического подтипа первичной опухоли у больных раком молочной железы, характеризующийся тем, что определяют молекулярно-биологический подтип первичной опухоли согласно регламенту клинических рекомендаций RUSSCO и молекулярно-биологический подтип совокупности ЦОК, для этого в обогащенной лейкоцитами фракции венозной крови, полученной после осаждения эритроцитов, методом проточной цитометрии определяют экспрессию в ядросодержащих клетках общего лейкоцитарного маркера CD45, EpCam, а также экспрессию маркеров молекулярно-биологического подтипа ER, PR, HER2 и Ki67, соответственно, полученные значения сравнивают с таковыми в основном опухолевом узле и при выявлении несоответствия между ними определяют конверсию молекулярно-биологического подтипа совокупности ЦОК относительно молекулярно-биологического подтипа первичной опухоли.
| STEFANOVIC S | |||
| et al., Molecular Subtype Conversion between Primary and Metastatic Breast Cancer Corresponding to the Dynamics of Apoptotic and Intact Circulating Tumor Cells, Cancers (Basel), 2019, vol | |||
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Спусковой механизм автоматического огнестрельного оружия с отходящим при выстреле вперед стволом | 1929 |
|
SU23161A1 |
| КРУМИНЬ Ю | |||
| С | |||
| и др., Клиническая значимость изменения уровня экспрессии маркеров суррогатных подтипов рака | |||
Авторы
Даты
2023-06-07—Публикация
2022-11-14—Подача