Изобретение относится к медицине и вирусологии, а именно к применению полифенольного комплекса древесины маакии амурской (Maackia amurensis) в качестве средства, обладающего противовирусным действием в отношении герпесвируса человека I типа (HSV-1) и энтеровируса В (ECHO-1).
Ежегодно, по данным ВОЗ, доля инфекционных заболеваний составляет примерно 25% от общего числа болезней со смертельным исходом.
Герпесвирусы человека (род Simplexvirus, сем. Herpesviridae) - большое семейство оболочечных ДНК-содержащих вирусов. Значимость герпесвирусных инфекций по сравнению с другими инфекционными заболеваниями в последние годы возрастает, что объясняется их широким распространением, эпидемиологической ролью и сложностью диагностики, а также увеличением лиц с вторичным иммунодефицитом, при котором герпетические инфекции являются оппортунистическими. Периодическая реактивация на фоне пожизненной персистенции HSV-1 приводит к необходимости постоянного применения антигерпетических препаратов [Викулов Г.Х. Герпесвирусные инфекции человека в новом тысячелетии: классификация, эпидемиология и медико-социальное значение // Эпидемиология и инфекционные болезни. -2014. - Т. 3, С. 35-40].
Энтеровирусы (род Enterovirus, сем. Picornaviridae) - безоболочечные РНК-содержащие вирусы, относящиеся к числу самых распространенных возбудителей инфекционных заболеваний человека [Щелканов М.Ю. и др. Современная классификация пикорнавирусов (Picornavirales, Picornaviridae) // Инфекционные болезни: новости, мнения, обучение. - 2015. - № 3. - С. 56-68]. Актуальность энтеровирусных инфекций, обусловленными энтеровирусами В (в том числе ECHO-1), определяется повсеместным распространением, разнообразием клинических форм и изменчивостью, способствующей появлению новых генетических высокопатогенных вариантов [Голицына Л.Н. и др. Эпидемические варианты неполиомиелитных энтеровирусов в России // Эпидемиология. - 2015. - Т. 5 (40). - С. 136-140]. Устойчивость энтеровирусов В во внешней среде, высокая контагиозность и отсутствие средств вакцинопрофилактики приводит к возникновению вспышечной заболеваемости [Романенкова Н.И. и др. Энтеровирусная инфекция на ряде территорий Российской Федерации в 2017 году // Информационный бюллетень «Заболеваемость, этиологическая структура и вопросы профилактики энтеровирусной (неполио) инфекции». - 2018. - № 5. - С. 23-26].
В терапии вирусных инфекций наиболее востребованным классом химиопрепаратов являются лекарственные соединения на основе модифицированных нуклеозидов, поскольку они проявляют широкий спектр противовирусной активности в отношении ДНК- и РНК-вирусов [Михайлопуло И. А., Мирошников А. И. Современные тенденции в биотехнологии нуклеозидов. // Acta naturae. - 2010. - Т.2 - № 2 (5). - С. 38-61]. Выраженный ингибирующий эффект в отношении ДНК-содержащих вирусов, в том числе герпесвирусов, покс- и аденовирусов, проявляет группа модифицированных нуклеозидов: 5-бром-2'-дезоксиуридин, 1-β-Dарабинозилцитозин, 9-β-D-арабинозиладенин [Wu J.J. et al. Valacyclovir in the treatment of herpes simplex, herpes zoster, and other viral infections // J. Cutan Med. Surg. - 2003. - V. 7. - P. 372-381]. Для терапии герпесвирусной инфекции широко используются ациклические гуанинсодержащие нуклеозиды, например, ациклогуанозин (ацикловир) и фамвир, действие которых направлено на подавление активности основного фермента репликации вируса - ДНК-полимеразы [Ершов Ф.И., Оспельникова Т.П. Современный арсенал антигерпетических лекарственных средств // Инфекции и антимикробная терапия. - 2014 - 3(4) - С. 100-104].
Широким профилем противовирусной активности в отношении многих РНК-содержащих вирусов, включая энтеровирусы, обладает синтетический нуклеозид, родственный с гуанин-рибозидом - рибавирин - 1-β-D-рибофуранозил1,2,4-триазол-3-карбоксамид. Одним из механизмов действия рибавирина считается его встраивание в вирусную РНК, реплицируемую вирусной РНК-зависимой РНК-полимеразой, или ингибирование данного фермента [Parker W.B. Metabolism and antiviral activity of ribavirin // Virus Res. - 2005. - 107(2). - P. 165-171].
В тоже время, использование модифицированных нуклеозидов имеет ряд побочных эффектов. Так, ацикловир может снижать тяжесть течения болезни и частоту появления ее симптомов, однако не обладает способностью излечивать герпесвирусную инфекцию. [World Health Organization. Herpes simplex virus. News bulletin: https://www.who.int/ru/news-room/factsheets/detail/herpes-simplex-virus]. Более того, у пациентов с выраженным иммунодефицитом длительные или повторные курсы терапии ацикловиром могут приводить к появлению резистентных штаммов герпесвирусов, поэтому дальнейшее лечение ацикловиром может быть неэффективным. В свою очередь, относительная токсичность рибавирина, обусловленная длительным депонированием препарата в эритроцитах, где его концентрация может превышать сывороточную примерно в 60 раз, вызывает обратимую и дозозависимую гемолитическую анемию у значительной части больных. В результате, следы рибавирина в организме обнаруживаются даже через 6 месяцев после окончания курса терапии [De Franceschi L. et al. Hemolytic anemia induced by ribavirin therapy in patients with chronic hepatitis C virus infection: role of membrane oxidative damage // Hepatology. - 2000. - Vol. 31. - P. 997-1004]. Упоминается также о тератогенном действии рибавирина. [Ferm V. et al. Teratogenic effects of ribavirin on hamster and rat embryos // Teratology. - 1978 - 17(1) - P. 93-101].
В последние годы в терапии энтеровирусных инфекций также применяют другой химиопрепарат из класса ингибиторов вирусного капсида - плеконарил - 3-[3,5-диметил-4[[3-(3-метил-5-изоксазоил)пропил]окси]фенил]-5-(трифторметил)-1,2,4-оксадиазол, механизм действия которого заключается в связывании с гидрофобным карманом на поверхности капсида энтеровирусов, что предотвращает их адсорбцию на клеточной мембране и высвобождение вирусной РНК [Pevear D.C. et al. Activity of Pleconaril against Enteroviruses // Antimicrob. Agents Chemother. - 1999 - 43 - P. 2109-2115]. Однако его использование связано с высокой частотой проявления тошноты и диареи, возникновения резистентных вирусных штаммов и вмешательства в метаболизм других лекарств путем активации ферментов цитохрома Р450 3А4 [Hayden F.G. et al. Efficacy and safety of oral pleconaril for treatment of colds due to picornaviruses in adults: results of 2 double-blind, randomized, placebo-controlled trials // Clin. Infect. Dis. - 2003. - Vol. 36, No. 12. - P. 1523 - 1532].
Другим классом противовирусных лекарственных соединений, применяемых в комплексной терапии вирусных инфекций, являются интерфероны (лейкоцитарные и рекомбинантные), поскольку патологическое состояние, вызванное герпесвирусами и энтеровирусами, характеризуется подавлением интерфероногенеза [Ершов Ф.И., Оспельникова Т.П. Современный арсенал антигерпетических лекарственных средств // Инфекции и антимикробная терапия. - 2014. - 3(4). - С.100-104; Иммунологические аспекты энтеровирусной инфекции центральной нервной системы: монография / Ю.Г. Лагерева, Я.Б. Бейкин, В.А. Черешнев. - Екатеринбург: Изд-во «УралЭкоЦентр», 2018. - 190 с.]. В настоящее время в качестве противовирусных средств в основном используются препараты рекомбинантных альфа-интерферонов (реаферон, виферон, лайфферон и др.), которые применяют как местно, так и парентерально. К недостаткам интерферонотерапии относят высокую стоимость препаратов, широкий перечень противопоказаний к ее назначению, длительность терапии, наличие побочных эффектов.
Помимо направленного поиска и скрининга синтетических соединений, обладающих противовирусной активностью, представляется перспективным поиск эффективных в противовирусном плане веществ природного происхождения. Особое место среди них занимают растительные полифенолы, оказывающие разнообразное биологическое действие, основанное на их прямой антиоксидантной активности и влиянии на модуляцию внутриклеточной передачи сигналов [Tarbeeva D.V. et al. Biologically active polyphenolic compounds from Lespedeza bicolor. Fitoterapia. 2022. Т. 157. С. 105121]. Показана эффективность растительных полифенолов в отношении вирусов различных таксономических групп [Montenegro-Landívar M.F., et al. Polyphenols and their potential role to fight viral diseases: An overview // Sci Total Environ. - 2021. - Vol. 20 (801). - 149719 (1-14)]. Доказана их способность предотвращать прикрепление вируса к клеточной поверхности, связывать рецепторы на вирусных частицах, препятствуя межклеточному распространению, снижать экспрессию генов, блокировать синтез белка и ингибировать вызванную вирусом активацию факторов транскрипции, подавлять репликацию вируса [Chojnacka K., et al. Antiviral properties of polyphenols from plants // Foods. - 2021. - Vol. 10(10). P. 2277-27835]. Широкий спектр механизмов действия полифенолов, низкая токсичность при достаточно высокой эффективности и отсутствие побочных эффектов на здоровье человека определяет возможности их использования в стратегиях лечения и профилактики вирусных инфекций.
Один из растительных полифенолов - резвератрол - считается перспективным противовирусным соединением в отношении HSV-1. Резвератрол и его оксипроизводное - пицеатаннол ингибируют активность рибонуклеотидредуктазы, тем самым нарушая нормальную экспрессию вирусных белков [Annunziata G., et al. Resveratrol as a Novel Anti-Herpes Simplex Virus Nutraceutical Agent: An Overview // Viruses. - 2018. - Vol. 10. - P. 473 - 483].
Описано применение экстрактов растений артишока и подорожника, в состав которых входит кофейная кислота, для приготовления лекарств, оказывающих, в частности, противовирусное действие в отношении герпесвирусов 1, 2 и 3 типов, аденовируса 3 типа. [Hassan S., et. al. Bioactive natural products with anti-herpes simplex virus properties // J Pharm Pharmacol. - 2015. - Vol. 67 (10). - P. 1325-1336].
Известна противовирусная композиция, содержащая терапевтически эффективное средство из экстрактов растения индийского горного инжира Ficus arnottiana для предупреждения или лечения вирусной инфекции, вызванной HSV-1 [RU 2584245 С2, 20.05.2016].
Средства на основе экстрактов растений горца японского Polygonum cuspidatum Sieb et Zucc., а также ревеня Rheum palmatum L., содержащие полифенольный антиоксидант - резвератрол, эффективно противостоят активности энтеровирусов и могут быть использованы для их профилактики или лечения [TW200817028А, 16.04.2008].
Запатентовано применение экстракта аралии китайской Aralia chinensis L., содержащий аралозиды, для лечения бактериальных и вирусных инфекций, таких как грипп, энтеровирусные и герпесвирусные инфекции [CN108992478В, 14.12.2018].
Однако недостатком этих средств, ингибирующих репликацию вирусов HSV-1 и ECHO-1, является отсутствие данных о токсических свойствах в отношении клеток и живых организмов, а также отсутствуют данные о стандартизации этих препаратов.
Расширение арсенала эффективных и малотоксичных средств, лишенных таких недостатков и проявляющих активность в отношении вирусов различных таксономических групп, в том числе HSV-1 и ECHO-1, является в настоящее время актуальной задачей.
Техническим результатом заявляемого изобретения является применение нового природного ингибитора репликации вирусов HSV-1 и ECHO-1 на основе полифенольного комплекса древесины маакии амурской, являющегося активной субстанцией препарата Максар®, и расширение спектра лекарственных средств против указанных вирусов.
Согласно изобретению, технический результат достигается тем, что заявленный ингибитор репликации выше перечисленных вирусов, является полифенольным комплексом древесины маакии амурской, который проявляет вирусингибирующую дозозависимую активность против вирусов HSV-1 и ECHO-1 в тестах на клеточной культуре Vero.
Маакия амурская (Maackia amurensis Ruper et Max.) - растение семейства бобовых, характеризуется высоким содержанием полифенольных соединений с выраженными антиоксидантными свойствами и низкой токсичностью. При детальном химическом исследовании спиртовых экстрактов ядровой древесины маакии амурской было показано, что основными ее компонентами являются растительные полифенолы, составляющие полифенольный комплекс (ПФК), на основе которого был создан гепатопротективный препарат «Максар®» (регистрационный номер P N003294/01). В состав ПФК ядровой древесины маакии амурской, из которого получают активную субстанцию препарата «Максар®» входят свыше 20 полифенолов, основными из которых являются изофлавоны, птерокарпаны, флаваноны, изофлаваны, изофлаваноны, халконы, лигнаны, мономерные и димерные стильбены. Показано, что Максар® усиливает антиоксидантную защиту организма и снижает уровень перекисного окисления липидов. Этот препарат эффективен при лечении жировой дистрофии печени и снижает общее содержание липидов в крови, обладает антиагрегантными и противоопухолевыми свойствами [Федореев С.А. и др. Препарат максар из дальневосточного растения маакии амурской // Хим.-фарм. журн. - 2004. - Т.38. - № 11. - С. 22-26].
Однако противовирусные свойства полифенолов маакии амурской на сегодняшний день мало изучены. Известно только об антигерпетической активности резвератрола, который обнаружен в составе ПФК [Annunziata G., et al. Resveratrol as a Novel Anti-Herpes Simplex Virus Nutraceutical Agent: An Overview // Viruses. - 2018. - Vol. 10. - P. 473 - 483]. При лечении препаратом Максар® больных с хроническими вирусными гепатитами разной этиологии была показана его терапевтическая эффективность [Путилова Е.А. и др. Клинико-иммунологическая эффективность максара при хронических вирусных гепатитах // Фундаментальные исследования. - 2011. - № 9-3. - С. 484].
Указание на использование активной субстанции препарата Максар® и его компонентов в качестве противовирусного средства в отношении вирусов HSV-1 и ECHO-1 в доступной патентной и другой научно-технической литературе не найдено и обнаружено авторами впервые. Новая функция ПФК активной субстанции препарата Максар® не вытекает с очевидностью из его известных свойств и состава.
Противовирусная активность ПФК древесины маакии амурской в отношении вирусов HSV-1 и ECHO-1 была определена экспериментальным путем (in vitro).
Изобретение иллюстрируется данными экспериментов, представленными на фигурах 1 и 2, и их описанием.
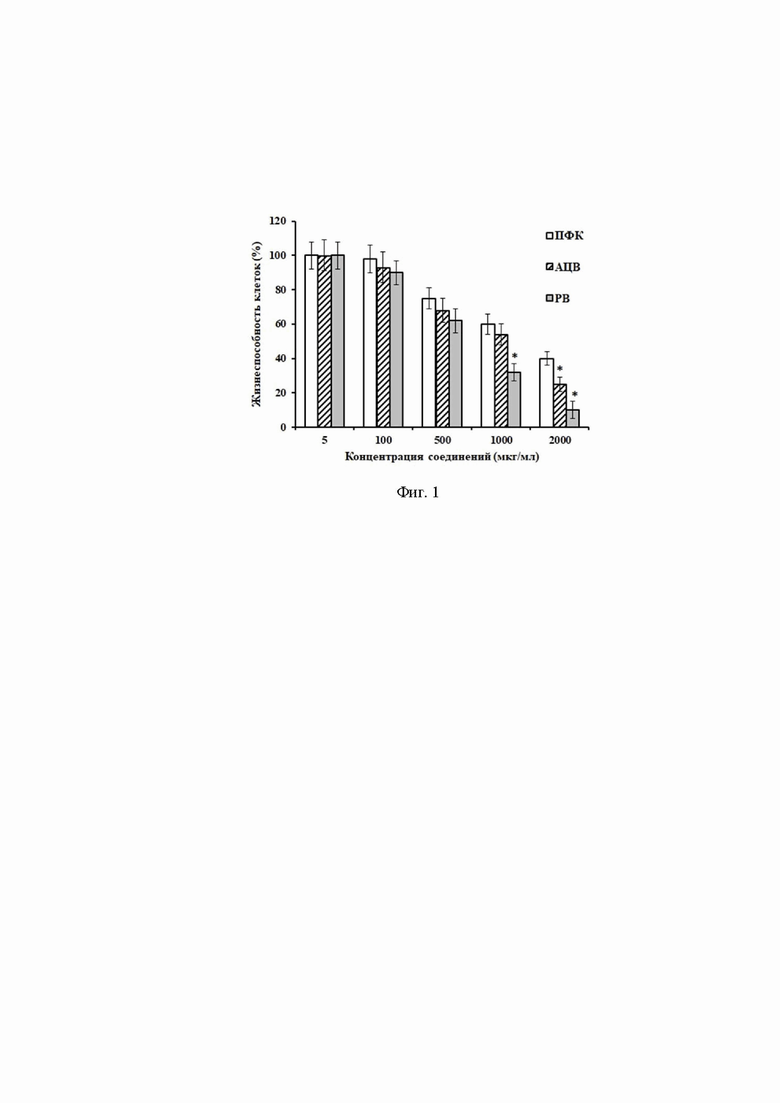
На фиг. 1 представлено влияние исследованных соединений на жизнеспособность клеток Vero; ПФК - полифенольный комплекс древесины маакии амурской, АЦВ - ацикловир, РВ - рибавирин; *- статистически значимые различия между показателями ПФК и референс-препаратами (p≤0,05).
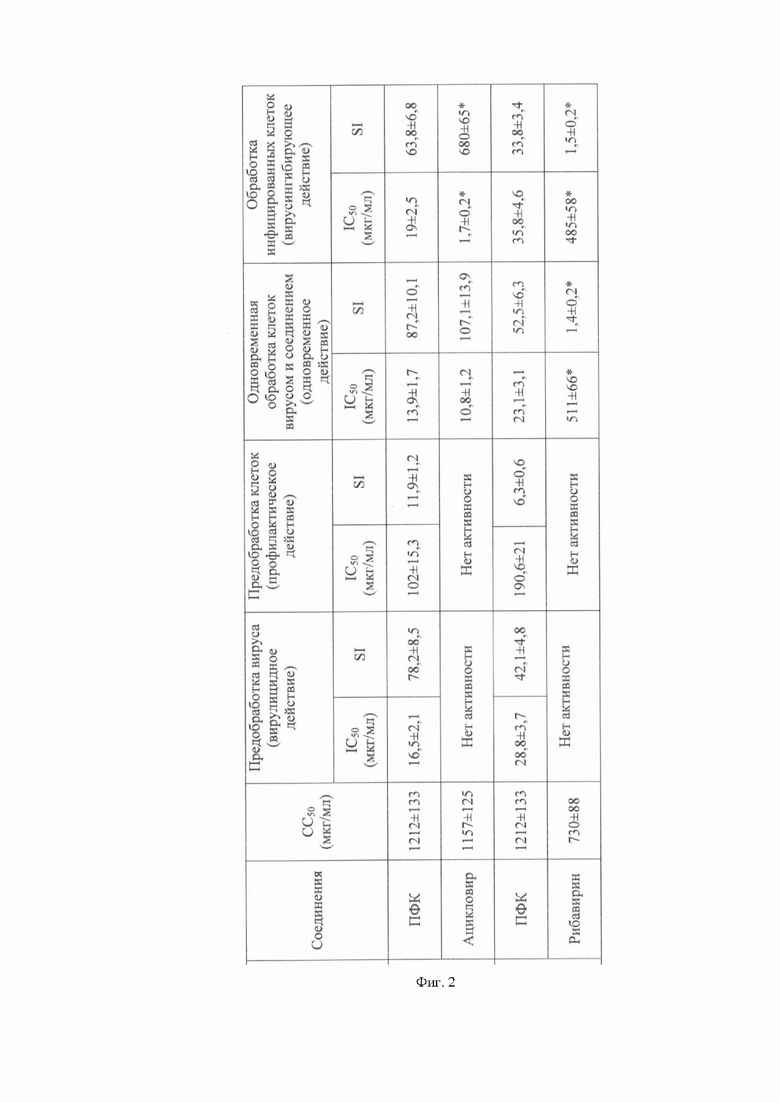
На фиг. 2 представлены результаты изучения противовирусной активности ПФК древесины маакии амурской в отношении HSV-1 и ECHO-1 in vitro.
Примечание: значения представлены как среднее ± стандартное отклонение. CC50 (мкг/мл) - 50% цитотоксическая концентрация; IC50 (мкг/мл) - концентрация, ингибирующая на 50% вирус-индуцированное ЦПД; SI - индекс селективности (CC50/IC50); *- значимость различий между показателями ПФК и соответствующим референсным препаратом (p≤0,05).
Исследуемые соединения
В экспериментах использовали ПФК древесины маакии амурской. Способ получения заявляемого средства заключается в следующем: измельченную ядровую древесину маакии амурской экстрагируют 95% этиловым спиртом при 50-55°С в соотношении сырье : экстрагент 1:5 в батарее перкаляторов, затем спиртовые извлечения упаривают и сушат в вакууме [RU 2104027 C1, 10.02.1998].
Для сравнительной оценки эффективности ПФК в отношении HSV-1 был использован Ацикловир® (Глаксо Смит Кляйн Фармасьютикалз С.А., Польша), официнальный препарат, применяемый в клинике для лечения герпесвирусных инфекций.
Для сравнительной оценки эффективности ПФК в отношении ECHO-1 был использован Рибавирин® (Sigma-Aldrich, USA), препарат выбора, применяемый в клинике для лечения энтеровирусных инфекций.
ПФК и референсные препараты (Ацикловир® и Рибавирин®) растворяли в диметилсульфоксиде (ДМСО, ООО «Биолот», Санкт-Петербург, Россия) и стоковые растворы (10 мг/мл) хранили при -20°C. Рабочие растворы готовили из стоковых растворов путем разведения средой ДМЕМ до конечной концентрации ДМСО 0,5%.
Вирусы
В работе использовали штамм L2 герпесвируса человека I типа (HSV-1), полученный из Государственной коллекции вирусов (ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии им. Н.Ф. Гамалеи», Минздрав России). Штамм IP91 энтеровируса B (ECHO-1) был получен из Федерального научного центра исследований и разработки иммунобиологических препаратов им. М.П. Чумакова РАН (Институт полиомиелита) (Москва, Россия).
Культура клеток
Определение цитотоксичности и противовирусной активности соединений проводили на чувствительной к HSV-1 и ECHO-1 перевиваемой культуре эпителиальных клеток почки африканской зеленой мартышки Vero, полученной из коллекции культур клеток ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России. В качестве среды роста клеток использовали питательную среду ДМЕМ (ООО «Биолот», Санкт-Петербург, Россия) с добавлением 7% эмбриональной телячьей сыворотки (ООО «Биолот», Санкт-Петербург, Россия), 100 Ед/мл гентамицина при 37°С в атмосфере 5% СО2. При культивировании клеток с вирусом в качестве поддерживающей среды использовали питательную среду ДМЕМ с гентамицином, но с добавлением 1% сыворотки. Концентрация клеток в ходе всех экспериментов составляла 1×104 кл/мл.
Определение цитотоксичности исследуемых соединений по отношению к клеткам Vero
Цитотоксичность соединений оценивали по жизнеспособности клеток Vero с использованием МТТ (метилтиазолилтетразолий бромид) теста [Mosmann T. Rapid colorimetric assay for cellular growth and survival: Application to proliferation and cytotoxicity assays // J. Immunol. Methods. - 1983. - Vol. 65. - P. 55]. Монослой клеток (1×104 клеток/лунку), выращенных в 96-луночных планшетах, обрабатывали различными концентрациями (от 5 до 2000 мкг/мл) тестируемых соединений, контролем служили клетки, обработанные ДМСО. Клетки культивировали при 37°C в CO2-инкубаторе в течение 72 ч. После инкубации к монослою клеток добавляли по 20 мкл/лунку 5 мг/мл раствора МТТ (Sigma-Aldrich, USA), оставляли на 2 ч при 37°C. Далее раствор МТТ удаляли и добавляли изопропиловый спирт, подкисленный 0,4 М HCl. Оптическую плотность (ОП) измеряли на планшетном ридере (Labsystems Multiskan RC, Finland) при длине волны 540 нм. Жизнеспособность клеток рассчитывали как (ОПо)/(ОПк)×100%, где ОПо - оптическая плотность клеток, обработанных тестируемыми соединениями, ОПк - оптическая плотность контрольных клеток. Значение 50% цитотоксической концентрации (СС50) определяли с помощью регрессионного анализа как концентрацию соединения, которая уменьшала количество жизнеспособных клеток на 50% по сравнению с контролем клеток.
Определение противовирусной активности исследуемых соединений в отношении вирусов HSV-1 и ECHO-1 с помощью МТТ-теста
Противовирусную активность соединений оценивали по ингибированию цитопатогенного действия (ЦПД) вируса с помощью МТТ-теста. Монослой клеток Vero, выращенный в 96-луночных планшетах (1×104 клеток/лунку), заражали вирусами (HSV-1 и ECHO-1) в инфицирующей дозе 100 ТЦИД50/мл (50% тканевая цитопатическая инфекционная доза). А тестируемые соединения добавляли в концентрациях от 1 до 500 мкг/мл по нескольким схемам, каждая из которых выполнена в трех независимых повторах с использованием триплетов различных концентраций соединений:
Предварительная обработка вируса соединениями (вирулицидное действие)
Вирусную суспензию инкубировали с соединениями (1:1, v/v) в течение 1 ч при 37°C, затем этой смесью инфицировали монослой клеток 1 ч при 37°C. Затем клетки промывали и инкубировали в течение 72 ч при 37°C в атмосфере 5% СО2 до появления ЦПД.
Предварительная обработка клеток соединениями (профилактическое действие)
Монослой клеток обрабатывали соединениями 1 ч при 37°C, затем инфицировали вирусом в течение 1 ч. Клетки промывали от неадсорбированного вируса и инкубировали в течение 72 ч при 37°C в атмосфере 5% СО2 до появления ЦПД.
Одновременная обработка клеток вирусом и соединениями
Монослой клеток инфицировали вирусом и одновременно вносили соединения (1:1, v/v) в течение 1 ч при 37°C. Клетки промывали и инкубировали в течение 72 ч при 37°C в атмосфере 5% СО2 до появления ЦПД.
Обработка инфицированных клеток соединениями (вирусингибирующее действие)
Монослой клеток инкубировали с вирусом 1 ч при 37°C, удаляли неадсорбированный вирус и вносили питательную среду, содержавшую разные концентрации исследуемых соединений, и инкубировали в течение 72 ч при 37°C в атмосфере 5% СО2 до появления ЦПД.
Оценка противовирусной активности осуществлялась с учетом степени подавления (IR) цитопатогенного действия вирусов соединением, а также по 50% ингибирующей концентрации (IC50) и селективному индексу (SI). IR рассчитывали по формуле: IR = (ОПtv - ОПcv) / (ОПcd - ОПcv) × 100%, где ОПtv соответствует оптической плотности инфицированных клеток, обработанных соединением; ОПcv - оптической плотности контрольных инфицированных клеток, ОПcd - оптической плотности контрольных (неинфицированных) клеток. IC50, снижающую на 50% вирус-индуцированное ЦПД, рассчитывали с помощью регрессионного анализа кривых доза-эффект, SI вычисляли как отношение CC50 к IC50 [Руководство по проведению доклинических исследований лекарственных средств, часть первая. - М.: Гриф и К, 2013. 942 с.].
Статистический анализ результатов
Статистическую обработку полученных данных проводили с помощью пакета программы «Statistica-10». Для всех данных были подсчитаны средние арифметические значения и их стандартные отклонения. Для определения значимости межгрупповых различий был использован односторонний анализ дисперсии (ANOVA). Уровень статистической значимости был установлен при p≤0,05.
Статистический анализ результатов исследований проводили методами непараметрической статистики, которые включали оценку различий между показателями в контрольной и опытной групп с использованием критерия Вилкоксона для связанных выборок.
Цитотоксическая активность ПФК древесины маакии амурской
При оценке цитотоксического действия ПФК и референс-препаратов было установлено, что при 72-часовой экспозиции исследуемые препараты оказывают дозозависимое ингибирование интенсивности клеточного дыхания, регистрируемое по снижению суммарной активности митохондриальных дегидрогеназ в МТТ-тесте. С помощью регрессионного анализа были рассчитаны цитотоксические концентрации, снижающие жизнеспособность клеток на 50% по сравнению с контрольными (необработанными) клетками (CC50). Для ПФК значения CC50 составили 1212±133 мкг/мл, для ацикловира - 1157±125 мкг/мл, для рибавирина - 730±88 мкг/мл. Эти данные свидетельствующие о меньшей токсичности ПФК по отношению к клеткам Vero в сравнении с референс-препаратами.
Значимые различия между показателями цитотоксичности ПФК и референс-препаратами АЦВ, РВ (p≤0,05) наблюдались при концентрациях соединений выше 500 мкг/мл. Так, при использовании ПФК в концентрации 1000 мкг/мл выживало около 64±8,0% клеток, в то время как жизнеспособность клеток, обработанных рибавирином и ацикловиром в такой же концентрации, составила 32±5% (p<0,05) и 55,3±5,5% соответственно. При увеличении концентрации исследуемых препаратов до 2000 мкг/мл выживало 44±5,0% (ПФК), 30±4,0% (ацикловир) (p<0,05) и 23,6±5,8% (рибавирин) (p<0,05) клеток (фиг. 1). Поэтому для корректного сравнения противовирусной активности препаратов дальнейшее изучение проводили при концентрациях, обеспечивающих жизнеспособность клеток не менее 70% (менее 500 мкг/мл).
Активность ПФК древесины маакии амурской в отношении вирусов HSV-1 и ECHO-1 in vitro
Результаты оценки противовирусной активности исследуемых соединений представлены в табл. 1. Установлено, что наиболее высокая противовирусная активность исследуемого полифенольного комплекса была зарегистрирована при одновременном воздействии на клетки Vero вируса (как HSV-1, так и ECHO-1, в инфицирующей дозе 100 ТЦИД50/мл) и различных концентраций ПФК (от 5 до 500 мкг/мл). При такой схеме применения, ПФК эффективно предотвращает прикрепление вирусов к клеткам с 50%-ингибирующими концентрациями (IC50) - 13,9±1,7 мкг/мл и 23,1±3,1 мкг/мл в отношении HSV-1 и ECHO-1, и селективными индексами (SI), характеризующими эффективность действия препаратов, равными 87,2±10,1 и 52,5±6,3, соответственно. Необходимо отметить, что эффективность ПФК по отношению к HSV-1 была сравнима с действием референс-препарата ацикловир (p>0,05), при этом активность рибавирина по отношению к ECHO-1 была значимо ниже по сравнению с ПФК (IC50=511±66 мкг/мл; SI=1,4±0,2) (p ≤ 0,05).
Кроме того, ПФК проявлял высокую вирулицидную активность при воздействии непосредственно на HSV-1 (IC50=16,5±2,1мг/мл; SI=78,2±8,5) и умеренную - по отношению к ECHO-1 (IC50=28,8±3; SI=42±4,8), тогда как предварительная обработка вирусов ацикловиром или рибавирином вирулицидного эффекта не оказывала (фиг. 2).
При воздействии полифенольного комплекса на раннюю стадию репликации вирусов (через 1 ч после инфицирования клеток) была выявлена достаточно высокая антигерпетическая (SI>63) и умеренная - анти-энтеровирусная (SI>33) активность ПФК. В этом случае эффективность ацикловира, который, как известно, блокирует репликацию HSV-1, была значительной - SI был > 680; в то же время рибавирин был неэффективен по отношению к ECHO-1 (SI=1,5).
Предварительная обработка клеток Vero ПФК до инфицирования HSV-1 и ECHO-1 (профилактическое действие) была малоэффективной. Ацикловир и рибавирин при таком способе применения также не защищали клетки от вирусов.
Таким образом, с помощью МТТ-анализа была охарактеризована способность полифенольного комплекса древесины маакии амурской целенаправленно воздействовать на разные этапы жизненного цикла ДНК- и РНК-содержащих вирусов (HSV-1 и ECHO-1). Установлено, что механизмы, лежащие в основе противовирусного действия ПФК, связаны с блокированием прикрепления вирусов к клеткам, прямой инактивацией вирусных частиц и ингибированием ранней стадии репликации вирусов.
| название | год | авторы | номер документа |
|---|---|---|---|
| Средство, обладающее противовирусным действием в отношении коронавируса SARS-CoV-2 | 2022 |
|
RU2788762C1 |
| Способ получения полифенольного комплекса из ядровой древесины маакии амурской | 2023 |
|
RU2822249C1 |
| Способ лечения вирусных миелитов у детей | 2024 |
|
RU2837301C1 |
| 2-[6-МЕТИЛ-3-(ТИЕН-2-ИЛ)-5-ФЕНИЛ-5,6-ДИГИДРО-4Н-[1,2,4,5]ТЕТРАЗИН-1-ИЛ]-БЕНЗОТИАЗОЛ С ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ В ОТНОШЕНИИ ВИРУСОВ КОКСАКИ В3 | 2023 |
|
RU2836398C1 |
| 2-[5-(4-Метокси)-3-фенил-5,6-дигидро-4Н-[1,2,4,5]тетразин-1-ил]-бензотиазолы с противовирусной активностью в отношении вирусов Коксаки В3 | 2022 |
|
RU2783659C1 |
| Средство, обладающее противовирусным действием в отношении вируса простого герпеса 1 типа | 2022 |
|
RU2782935C1 |
| Средство, обладающее противовирусным действием в отношении вирусов клещевого энцефалита и герпеса простого I типа | 2018 |
|
RU2697887C1 |
| СПОСОБ КУЛЬТИВИРОВАНИЯ КЛЕТОК ПЛОДОВ СВИНЬИ ДЛЯ ВИРУСОЛОГИИ | 2021 |
|
RU2795135C2 |
| ШТАММ ЭНТЕРОВИРУСА А71 ТИПА СУБГЕНОТИПА С4, ИСПОЛЬЗУЕМЫЙ ДЛЯ ДИАГНОСТИКИ И ИЗУЧЕНИЯ ЭФФЕКТИВНОСТИ ЛЕЧЕБНО-ПРОФИЛАКТИЧЕСКИХ И ВАКЦИННЫХ ПРЕПАРАТОВ | 2014 |
|
RU2565811C1 |
| ГЕПАТОПРОТЕКТИВНОЕ СРЕДСТВО | 2011 |
|
RU2454243C1 |
Изобретение относится к медицине и вирусологии, а именно к применению полифенольного комплекса древесины маакии амурской (ПФК), активной субстации препарата Максар®, в качестве средства, обладающего противовирусным действием в отношении герпесвируса человека I типа и энтеровируса В. Предлагаемое средство обладает низкой цитотоксической активностью по отношению к клеткам Vero и эффективно ингибирует репликацию герпесвируса человека I типа и энтеровируса В при непосредственном воздействии на вирус (вирулицидное действие): 50% ингибирующая концентрация (IC50) составила 16,5±2,1 мкг/мл и селективный индекс (SI), свидетельствующий об эффективности и безопасности соединения, составил 78,2±8,5, заявляемое средство проявляет умеренное вирулицидное действие по отношению к энтеровирусу В (IC50=28,8±3; SI=42±4,8). Средство проявляет вирусингибирующее действие (воздействие на инфицированные вирусами клетки) при лечении герпесвируса человека I типа (IC50=19,0±2,5; SI=63,8±6,8) и энтеровируса В (IC50=35,8±4,6; SI=33,8±3,4). Изобретение расширяет арсенал противовирусных средств в отношении герпесвируса человека I типа и энтеровируса В. 2 ил.
Применение полифенольного комплекса древесины маакии амурской, активной субстанции препарата Максар®, в качестве средства, обладающего противовирусным действием в отношении герпесвируса человека 1 типа и энтеровируса В.
| CN 108992478 B, 14.12.2018 | |||
| ANNUNZIATA G., et al | |||
| Resveratrol as a Novel Anti-Herpes Simplex Virus Nutraceutical Agent: An Overview // Viruses | |||
| Способ получения цианистых соединений | 1924 |
|
SU2018A1 |
| - Vol | |||
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| - P | |||
| Способ смены деревянных мостовых ферм | 1922 |
|
SU473A1 |
| ПРОТИВОВИРУСНАЯ ЭФФЕКТИВНАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2014 |
|
RU2657575C2 |
| KR20190033129 A, 29.03.2019 | |||
| СПОСОБ ПОЛУЧЕНИЯ РАСТИТЕЛЬНЫХ ПОЛИФЕНОЛОВ, ОБЛАДАЮЩИХ ГЕПАТОЗАЩИТНЫМ ДЕЙСТВИЕМ | 1996 |
|
RU2104027C1 |
Авторы
Даты
2023-06-23—Публикация
2022-11-02—Подача