Данная заявка представляет собой международную заявку PCT, в которой заявляется приоритет по предварительной заявке США, серийный номер 62/578124, поданной 27 октября 2017 г., которая полностью включена в данный документ посредством ссылки во всей своей полноте.
Область изобретения
Данное изобретение относится к пептидным иммуногенным конструкциям на основе частей Тау-белка и их составов для профилактики и лечения тауопатий.
Область техники
Тау-белки (или τ-белки, после греческой буквы с таким названием) представляют собой белки, которые стабилизируют микротрубочки (см. на вебсайте: en.wikipedia.org/wiki/Tau_protein). Они многочисленны в нейронах центральной нервной системы и менее распространены в других местах, но также экспрессируются на очень низких уровнях в астроцитах и олигодендроцитах ЦНС. Патологии и деменции нервной системы, такие как болезнь Альцгеймера и болезнь Паркинсона, связаны с Тау-белками, которые стали дефектными и больше не стабилизируют микротрубочки должным образом.
Тау-белки являются продуктом альтернативного сплайсинга из одного гена, который у человека обозначен как MAPT (ассоциированный с микротрубочками Тау-белок) (microtubule-associated protein Tau) и расположен на хромосоме 17. Тау-белки были идентифицированы в 1975 году как термостабильные белки, необходимые для сборки микротрубочек, и затем были охарактеризованы как внутренне неупорядоченные белки.
Тау-белок представляет собой высокорастворимый ассоциированный с микротрубочками белок (MAP). У людей эти белки обнаруживаются в основном в нейронах по сравнению с отличными от нейронов клетками. Одной из основных функций Тау является модуляция стабильности аксонных микротрубочек. Другие MAP нервной системы могут выполнять аналогичные функции, как это было предположено у Тау-нокаутных мышей, у которых не было продемонстрировано отклонений в развитии мозга - возможно, из-за компенсации дефицита Тау другими MAP. Тау не присутствует в дендритах и активен главным образом в дистальных частях аксонов, где он обеспечивает стабилизацию микротрубочек, но также и гибкость при необходимости. Это контрастирует с белками MAP6 (STOP) в проксимальных частях аксонов, которые, по сути, блокируют микротрубочки, и MAP2, которые стабилизируют микротрубочки в дендритах.
Тау-белки взаимодействуют с тубулином для стабилизации микротрубочек и способствуют сборке тубулина в микротрубочки. Тау имеет два способа контроля стабильности микротрубочек: изоформы и фосфорилирование.
В мозге взрослого человека экспрессируются шесть изоформ Тау длиной от 352 до 441 аминокислот; они получены путем альтернативного сплайсинга мРНК транскриптов из MAPT (Fitzpatrick, et al., 2017; UniProtKB - P10636).
Изоформы различаются по количеству доменов связывания. Три изоформы имеют три домена связывания, а три других имеют четыре домена связывания. Домены связывания расположены на С-конце белка и заряжены положительно (что позволяет ему связываться с отрицательно заряженной микротрубочкой). Изоформы с четырьмя доменами связываниями лучше стабилизируют микротрубочки, чем с тремя доменами связываниями. Изоформы отличаются наличием или отсутствием вставок из 29 или 58 аминокислот в N-концевой половине, и включением или отсутствием 31-аминокислотного повтора связывания микротрубочек, кодируемого экзоном 10 MAPT, в С-концевой половине. Включение экзона 10 приводит к получению трех изоформ Тау с четырьмя повторами каждая (4П), а его исключение - к дополнительным трем изоформам с тремя повторами каждая (3П). Четыре повтора (П1 - П4) содержат остатки 244-368 в изоформе Тау из 441 аминокислот.
Тау представляет собой фосфопротеин с 79 потенциальными сайтами фосфорилирования серина (Ser) и треонина (Thr) на самой длинной изоформе Тау. Сообщалось о фосфорилировании в примерно 30 из этих сайтов в нормальных Тау-белках. Фосфорилирование Тау регулируется множеством киназ, включая PKN, серин/треонинкиназу. Когда PKN активируется, она фосфорилирует Тау, что приводит к нарушению организации микротрубочек. Фосфорилирование Тау также регулируется в процессе развития. Например, Тау плода более высоко фосфорилируется в эмбриональной ЦНС, чем Тау взрослого. Степень фосфорилирования у всех шести изоформ уменьшается с возрастом из-за активации фосфатаз. Как и киназы, фосфатазы также играют роль в регуляции фосфорилирования Тау. Например, как PP2A, так и PP2B присутствуют в ткани головного мозга человека и обладают способностью дефосфорилировать Ser396. Связывание этих фосфатаз с Тау влияет на ассоциацию Тау с МТ.
Гиперфосфорилирование Тау-белка (включения Тау, фТау) может привести к самосборке клубков парных спиральных филаментов и прямых филаментов, которые участвуют в патогенезе болезни Альцгеймера, лобно-височной деменции и других тауопатий. Все шесть изоформ Тау присутствуют в обычно гиперфосфорилированном состоянии в парных спиральных филаментах в головном мозге при болезни Альцгеймера. При других нейродегенеративных заболеваниях отмечается отложение агрегатов, обогащенных некоторыми изоформами Тау. При неправильном сворачивании этот хорошо растворимый белок может образовывать крайне нерастворимые агрегаты, которые способствуют развитию ряда нейродегенеративных заболеваний.
Недавние исследования показывают, что Тау может высвобождаться внеклеточно по экзосомному механизму при болезни Альцгеймера. Гендерно-специфическая экспрессия гена Тау в различных участках человеческого мозга недавно была связана с гендерными различиями в проявлениях и риске тауопатий. Некоторые аспекты того, как протекает заболевание, также предполагают, что он имеет некоторые сходства с прионными белками.
Нейродегенеративные заболевания с избыточными филаментными включениями Тау называют тауопатиями. Помимо болезни Альцгеймера, эти заболевания включают деменцию с преобладанием нейрофибриллярных клубков, хроническую травматическую энцефалопатию (CTE - chronic traumatic encephalopathy), заболевание, характеризующееся появлением аргирофильных зерен, прогрессирующий надъядерный паралич, кортикобазальную дегенерацию, глобулярную глиальную тауопатию и болезнь Пика. В отличие от болезни Альцгеймера, у этих других болезней отсутствуют β-амилоидные бляшки. При болезни Альцгеймера, деменции с преобладанием нейрофибриллярных клубков и хронической травматической энцефалопатии все шесть изоформ Тау (3П и 4П) присутствуют в филаментах при заболевании. При заболевании, характеризующимся появлением аргирофильных зерен, прогрессирующем надъядерном параличе, кортикобазальной дегенерации и глобулярной глиальной тауопатии обнаруживаются только 4П изоформы Тау, тогда как при болезни Пика присутствуют только 3П включения Тау. Возникновение тауопатий человека с различной морфологией филаментов привело к идее, что существуют различные молекулярные конформеры агрегированного Тау. Наличие множества молекулярных конформеров может также объяснить, почему филаменты из мозга индивидуумов с болезнью Альцгеймера более эффективны, чем филаменты рекомбинантного белка, собранные in vitro, при индукции Тау-патологии в мозге мыши.
Повторяющиеся легкие черепно-мозговые травмы (ЧМТ) в данное время признаны центральным компонентом черепно-мозговых травм в контактных видах спорта, особенно в американском футболе, и ударной силой военных взрывов. Это может привести к хронической травматической энцефалопатии (ХТЭ), которая характеризуется фибриллярными клубками гиперфосфорилированного Тау. Высокий уровень тау-белка в жидкости, омывающей мозг, связан с недостаточным восстановлением после травмы головы.
Тау-гипотеза утверждает, что чрезмерное или аномальное фосфорилирование Тау приводит к превращению нормального Тау взрослого в PHF-Тау (парный спиральный филамент) (paired helical filament) и NFT (нейрофибриллярные клубки) (neurofibrillary tangles). Тау-белок представляет собой высокорастворимый ассоциированный с микротрубочками белок (MAP). Благодаря своей изоформе и фосфорилированию Тау-белок взаимодействует с тубулином для стабилизации сборки микротрубочек. Тау-белки составляют семейство из шести изоформ с диапазоном от 352 до 441 аминокислот. Самая длинная изоформа в ЦНС содержит четыре повтора (П1, П2, П3 и П4) и две вставки (всего 441 аминокислоты), тогда как самая короткая изоформа содержит три повтора (П1, П3 и П4) и не содержит вставки (всего 352 аминокислоты). Все шесть изоформ Тау часто присутствуют в гиперфосфорилированном состоянии в парных спиральных филаментах при БА.
Мутации, которые изменяют функцию и экспрессию изоформы Тау, приводят к гиперфосфорилированию. Процесс агрегации Тау в отсутствие мутаций неизвестен, но может быть результатом повышенного фосфорилирования, действия протеазы или воздействия полианионов, таких как гликозаминогликаны. Гиперфосфорилированный Тау разбирает микротрубочки и изолирует нормальный Тау, MAP 1 (белок 1, связанный с микротрубочками), MAP 2 и убиквитин в клубки PHF. Эта нерастворимая структура нарушает цитоплазматические функции и препятствует аксональному транспорту, что может привести к гибели клеток.
На сегодняшний день еще существует неудовлетворенная потребность в разработке сайт-направленных пептидных иммуногенов и их составов для экономически эффективного лечения пациентов, страдающих тауопатиями.
Ссылки:
1. "Tau protein," Wikipedia, The Free Encyclopedia, адрес вебсайта: en.wikipedia.org/wiki/Tau_protein (дата обращения 29 сентября 2017 г.).
2. Fitzpatrick, AWP, et al., “Cryo-EM structures of Tau filaments from Alzheimer's disease”, Nature, 547(7662):185-190 (2017).
Краткое описание сущности изобретения
Данное изобретение относится к отдельным пептидным иммуногенным конструкциям, нацеленным на участки Тау-белка для лечения и/или профилактики тауопатий. Данное изобретение также относится к композициям, содержащим пептидные иммуногенные конструкции, способам получения и использования пептидных иммуногенных конструкций и антител, продуцируемых пептидными иммуногенными конструкциями.
Описанные пептидные иммуногенные конструкции содержат около 15 или более аминокислот. Пептидные иммуногенные конструкции содержат В-клеточный эпитоп из частей самой длинной изоформы Тау-белка человека (GenBank: AGF19246.1), имеющей аминокислотную последовательность из SEQ ID NO: 100, показанную в Таблице 8. В-клеточный эпитоп может быть связан с гетерологичным Т-хелперным клеточным (Th) эпитопом, полученным из белков патогенов, посредством необязательного гетерологичного спейсера. Описанные пептидные иммуногенные конструкции стимулируют выработку высокоспецифичных антител, направленных против Тау. Описанные пептидные иммуногенные конструкции могут быть использованы в качестве иммунотерапии для пациентов, страдающих тауопатиями.
Часть на основе В-клеточного эпитопа пептидных иммуногенных конструкций содержит аминокислотные последовательности из полноразмерного Тау-белка (SEQ ID NO: 100). В некоторых вариантах осуществления данного изобретения, B-клеточный эпитоп содержит последовательность, содержащую любую из SEQ ID NO: 1-21 и 101-124, как показано в Таблице 1.
Пептидные иммуногенные конструкции по данному изобретению могут содержать аминокислотную последовательность гетерологичного Th-эпитопа, полученного из патогенного белка (например, SEQ ID NO: 22-50), как показано в Таблице 2. В некоторых вариантах осуществления данного изобретения, гетерологичный Th-эпитоп происходит от природных патогенов, таких как дифтерийный токсин (SEQ ID NO: 26), Plasmodium Falciparum (SEQ ID NO: 27), холерный токсин (SEQ ID NO: 29). В других вариантах осуществления данного изобретения, гетерологичный Th-эпитоп представляет собой идеализированный искусственный Th-эпитоп, полученный из слитого белка вируса кори (MVF 1-5) или поверхностного антигена гепатита B (HBsAg 1-3) в форме одной последовательности или комбинаторных последовательностей (например, SEQ ID NO: 33, 32 и 34).
В некоторых вариантах осуществления данного изобретения, пептидные иммуногенные конструкции содержат В-клеточный эпитоп из Тау, связанный с гетерологичным Т-хелперным клеточным (Th) эпитопом посредством необязательного гетерологичного спейсера. В некоторых вариантах осуществления данного изобретения, пептидные иммуногенные конструкции содержат В-клеточную антигенную детерминанту, имеющую аминокислотную последовательность из Тау (SEQ ID NO: 1-21 и 101-124), связанную с гетерологичным Th-эпитопом, полученным из патогенного белка (например, SEQ ID NO: 22-50) посредством необязательного гетерологичного спейсера. В некоторых вариантах осуществления данного изобретения, необязательный гетерологичный спейсер представляет собой молекулу или химическую структуру, способную связывать две аминокислоты и/или пептида вместе. В некоторых вариантах осуществления данного изобретения, спейсер представляет собой встречающуюся в природе аминокислоту, не встречающуюся в природе аминокислоту или их комбинацию. В конкретных вариантах осуществления данного изобретения, пептидные иммуногенные конструкции имеют аминокислотную последовательность из SEQ ID NO: 51-71 и 125-155, показанные в Таблице 3.
Данное изобретение также относится к композициям, содержащим Тау-пептидную иммуногенную конструкцию. В некоторых вариантах осуществления данного изобретения, описанные композиции содержат более одной Тау-пептидной иммуногенной конструкции для охвата множества B-эпитопов из Тау. В некоторых вариантах осуществления данного изобретения, композиции содержат смесь Тау-пептидных иммуногенных конструкций (например, любую комбинацию из SEQ ID NO: 51-71 и 125-155) с более чем одним гетерологичным Th-эпитопом, полученным из патогенных белков, чтобы охватить широкий генетический фон у пациентов. Композиции, содержащие смесь пептидных иммуногенных конструкций, могут приводить к более высокому проценту положительного клинического ответа при иммунизации для лечения тауопатий по сравнению с композициями, содержащими только одну Th-пептидную иммуногенную конструкцию.
Данное изобретение также направлено на фармацевтические композиции для лечения и/или профилактики тауопатий. В некоторых вариантах осуществления данного изобретения, фармацевтические композиции содержат описанные пептидные иммуногенные конструкции в форме стабилизированного иммуностимулирующего комплекса, образованного посредством электростатических ассоциаций путем смешивания CpG-олигомера с композицией, содержащей пептидный иммуногенный комплекс. Такие стабилизированные иммуностимулирующие комплексы способны дополнительно усиливать иммуногенность пептидных иммуногенных конструкций. В некоторых вариантах осуществления данного изобретения, фармацевтические композиции содержат адъюванты, такие как минеральные соли, включая квасцовый гель (ALHYDROGEL), фосфат алюминия (ADJUPHOS) или эмульсии вода-в-масле, включая MONTANIDE ISA 51 или 720.
Данное изобретение также относится к антителам, направленным против описанных Тау-пептидных иммуногенных конструкций. В частности, пептидные иммуногенные конструкции по данному изобретению способны стимулировать выработку высокоспецифичных антител, которые перекрестно реагируют с аминокислотными последовательностями Тау (SEQ ID NO: 1-21 и 101-124) при введении субъекту. Высокоспецифичные антитела, продуцируемые пептидными иммуногенными конструкциями, перекрестно реагируют с рекомбинантными Тау-содержащими белками. Используемые для усиления иммуногенности описанные антитела связываются с Тау с высокой специфичностью, без особой специфичности, и с любой специфичностью, направленной на гетерологичные Th-эпитопы, что резко контрастирует с обычным белком или другими биологическими носителями, используемыми для такого усиления пептидной антигенности.
Данное изобретение также включает способы лечения и/или профилактики тауопатий с использованием описанных пептидных иммуногенных конструкций и/или антител, направленных против пептидных иммуногенных конструкций. В некоторых вариантах осуществления данного изобретения, способы лечения и/или профилактики тауопатий включают введение хозяину композиции, содержащей описанную пептидную иммуногенную конструкцию. В некоторых вариантах осуществления данного изобретения, композиции, используемые в способах, содержат описанную пептидную иммуногенную конструкцию в форме стабильного иммуностимулирующего комплекса с отрицательно заряженными олигонуклеотидами, такими как CpG-олигомеры, посредством электростатической ассоциации, причем эти комплексы дополнительно дополняются, необязательно, минеральными солями или маслом в качестве адъюванта, для введения пациентам с тауопатиями. Описанные способы также включают схемы применения, лекарственные формы и способы введения пептидных иммуногенных конструкций хозяину, подверженному риску тауопатии или имеющему ее.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг. 1А - результаты ИФА, выраженные в Log10 титров для иммунных сывороток, полученных от множественных иммуногенных конструкций Тау, через 6 недель после начальной инъекции (wpi)(нпи) против нефосфорилированных Тау-пептидов при анализе на антигенных участках Тау.
Фиг. 1В - результаты ИФА, выраженные в Log10 титров для иммунных сывороток, полученных от множественных иммуногенных конструкций Тау, через 6 недель после начальной инъекции (нпи) против фосфорилированных Тау-пептидов при анализе на антигенных участках Тау.
Фиг. 2 - Вестерн-блот анализ клеточных лизатов, содержащих мономеры, димеры, тримеры и олигомеры Тау-белка. Различные дорожки указывают на антитела IgG, образованные в ответ на нефосфорилированныеТау-пептидные иммуногенные конструкции, продемонстрированные над каждой дорожкой (левая сторона). Эти пептидные иммуногенные конструкции соответствуют конструкциям, представленным в Таблице 3. Профили связывания для каждого антитела анализировали и суммировали на гистограмме (с правой стороны). Репрезентативные иммунные сыворотки к иммуногенным конструкциям Тау продемонстрировали реакционную способность связывания с мультивидом Тау (мономеры, димеры, тримеры, олигомеры и полимеры).
Фиг. 3А - Графики, показывающие уровень агрегации полноразмерных Тау (аминокислот Tau441) после воздействия различных антител, направленных против фосфорилированных иммуногенов Тау-пептида в концентрациях от 0 до 5 мкг/мл, продемонстрированы над каждым графиком по сравнению с антителами из преиммунных сывороток. Уровень агрегации Тау измеряли окрашиванием агрегатов Тиофлавином-Т (ThT).
Фиг. 3В - Гистограммы, демонстрирующие уровень агрегации Тау in vitro в присутствии 5 мкг/мл антител, направленных против фосфорилированных Тау-пептидных иммуногенных конструкций и метиленового клея, который, как известно, дезагрегирует Тау in vitro, используемый в качестве положительного контроля.
Фиг. 4 - Графики, демонстрирующие уровень агрегации Тау после воздействия антител, направленных против либо фосфо-, или нефосфо-Тау-пептидных иммуногенов, как указано выше на каждом графике. Уровень агрегации Тау измеряли окрашиванием агрегатов Тиофлавином-Т (ThT). Различная степень ингибирования была обнаружена для антител, направленных против либо фосфо-, или нефосфо-Тау иммуногенов.
Фиг. 5 - Графики, демонстрирующие уровень дезагрегации Тау предварительно сформированных искусственных Тау-фибрилл при воздействии антител, направленных против репрезентативных Тау-пептидных иммуногенов, либо фосфо-, либо нефосфо-, как продемонстрировано под каждым графиком. Уровень агрегации Тау измеряли окрашиванием агрегатов Тиофлавином-Т (ThT). Дезагрегацию в разной степени была обнаруживали с антителами из иммунной сыворотки, полученной от репрезентативных фосфо- или нефосфо-Тау иммуногенов.
Фиг. 6 - Вестерн-блот анализ (в денатурирующих условиях) антифосфо-Тау и анти-нефосфо-Тау IgG, продуцируемых Тау-пептидными иммуногенами по данному изобретению, как показано слева. Дот-блот анализ (в неденатурирующих условиях) антифосфо-Тау и анти-нефосфо-Тау IgG, продуцируемых типичными Тау-пептидными иммуногенами данного изобретения, как продемонстрировано на правой вставке. Антитела, образованные в ответ на фосфо-Тау-пептидные иммуногены продемонстрировали преимущественное связывание с фибриллами и олигомерами Тау.
Фиг. 7 - Иммуногистохимическое окрашивание репрезентативными антителами, генерируемыми как фосфо-, так и нефосфо-Тау-пептидными иммуногенами по данному изобретению. На левой вставке показаны профили связывания в срезах специфичных к болезни Альцгеймера по сравнению с нормальными срезами мозга; тогда как правая вставка демонстрирует, что в нормальных тканях нет перекрестной реактивности.
Фиг. 8А - Окрашивание ткани, демонстрирующее защиту нейронов от фибрилл Тау репрезентативными антителами, генерируемыми как фосфо-, так и нефосфото-Тау-пептидными иммуногенами по данному изобретению.
Фиг. 8В - График количественной оценки защиты нейронов от Тау фибрилл с помощью репрезентативных антител, генерируемых как фосфо-, так и нефосфо-Тау-пептидными иммуногенами по данному изобретению.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Данное изобретение направлено на отдельные пептидные иммуногенные конструкции, нацеленные на участки Тау-белка, для лечения и/или профилактики болезни Альцгеймера и/или тауопатий. Данное изобретение также относится к композициям, содержащим пептидные иммуногенные конструкции, способам получения и использования пептидных иммуногенных конструкций и антител, продуцируемых пептидными иммуногенными конструкциями.
Описанные пептидные иммуногенные конструкции содержат около 15 или более аминокислот. Пептидные иммуногенные конструкции содержат В-клеточный эпитоп из частей самой длинной изоформы Тау-белка человека (GenBank: AGF19246.1), имеющей аминокислотную последовательность из SEQ ID NO: 100, показанную в Таблице 8. В-клеточный эпитоп может быть связан с гетерологичным Т-хелперным клеточным (Th) эпитопом, полученным из белков патогенов, посредством необязательного гетерологичного спейсера. Описанные пептидные иммуногенные конструкции стимулируют выработку высокоспецифичных антител, направленных против Тау. Описанные пептидные иммуногенные конструкции могут быть использованы в качестве иммунотерапии для пациентов, страдающих болезнью Альцгеймера и/или тауопатиями.
Часть на основе В-клеточного эпитопа пептидных иммуногенных конструкций содержит аминокислотные последовательности из полноразмерного Тау-белка (SEQ ID NO: 100). В некоторых вариантах осуществления данного изобретения, B-клеточный эпитоп содержит последовательность, содержащую любую из SEQ ID NO: 1-21 и 101-124, как показано в Таблице 1.
Пептидные иммуногенные конструкции по данному изобретению могут содержать аминокислотную последовательность гетерологичного Th-эпитопа, полученного из патогенного белка (например, SEQ ID NO: 22-50), как показано в Таблице 2. В некоторых вариантах осуществления данного изобретения, гетерологичный Th-эпитоп происходит от природных патогенов, таких как дифтерийный токсин (SEQ ID NO: 26), Plasmodium Falciparum (SEQ ID NO: 27), холерный токсин (SEQ ID NO: 29). В других вариантах осуществления данного изобретения, гетерологичный Th-эпитоп представляет собой идеализированный искусственный Th-эпитоп, полученный из слитого белка вируса кори (MVF 1-5) или поверхностного антигена гепатита B (HBsAg 1-3) в форме одной последовательности или комбинаторных последовательностей (например, SEQ ID NO: 33, 32 и 34).
В некоторых вариантах осуществления данного изобретения, пептидные иммуногенные конструкции содержат В-клеточный эпитоп из Тау, связанный с гетерологичным Т-хелперным клеточным (Th) эпитопом посредством необязательного гетерологичного спейсера. В некоторых вариантах осуществления данного изобретения, пептидные иммуногенные конструкции содержат В-клеточную антигенную детерминанту, имеющую аминокислотную последовательность из Тау (SEQ ID NO: 1-21 и 101-124), связанную с гетерологичным Th-эпитопом, полученным из патогенного белка (например, SEQ ID NO: 22-50) посредством необязательного гетерологичного спейсера. В некоторых вариантах осуществления данного изобретения, необязательный гетерологичный спейсер представляет собой молекулу или химическую структуру, способную связывать две аминокислоты и/или пептида вместе. В некоторых вариантах осуществления данного изобретения, спейсер представляет собой встречающуюся в природе аминокислоту, не встречающуюся в природе аминокислоту или их комбинацию. В конкретных вариантах осуществления данного изобретения, пептидные иммуногенные конструкции имеют аминокислотную последовательность из SEQ ID NO: 51-71 и 125-155 показаны в Таблице 4.
Данное изобретение также относится к композициям, содержащим Тау-пептидную иммуногенную конструкцию. В некоторых вариантах осуществления данного изобретения, описанные композиции содержат более одной Тау-пептидной иммуногенной конструкции для охвата множества B-эпитопов из Тау. В некоторых вариантах осуществления данного изобретения, композиции содержат смесь Тау-пептидных иммуногенных конструкций (например, любую комбинацию из SEQ ID NO: 51-71 и 125-155) с более чем одним гетерологичным Th-эпитопом, полученным из патогенного белка чтобы охватить широкий генетический фон у пациентов. Композиции, содержащие смесь пептидных иммуногенных конструкций, могут приводить к более высокому проценту положительного клинического ответа при иммунизации для лечения болезни Альцгеймера и/или тауопатий по сравнению с композициями, содержащими только одну пептидную иммуногенную конструкцию.
Данное изобретение также относится к фармацевтическим композициям для лечения и/или профилактики болезни Альцгеймера и/или тауопатий. В некоторых вариантах осуществления данного изобретения, фармацевтические композиции содержат описанные пептидные иммуногенные конструкции в форме стабилизированного иммуностимулирующего комплекса, образованного посредством электростатических ассоциаций путем смешивания CpG-олигомера с композицией, содержащей пептидный иммуногенный комплекс. Такие стабилизированные иммуностимулирующие комплексы способны дополнительно усиливать иммуногенность пептидных иммуногенных конструкций. В некоторых вариантах осуществления данного изобретения, фармацевтические композиции содержат адъюванты, такие как минеральные соли, включая квасцовый гель (ALHYDROGEL), фосфат алюминия (ADJUPHOS) или эмульсии вода-в-масле, включая MONTANIDE ISA 51 или 720.
Данное изобретение также относится к антителам, направленным против описанных Тау-пептидных иммуногенных конструкций. В частности, пептидные иммуногенные конструкции по данному изобретению способны стимулировать выработку высокоспецифичных антител, которые перекрестно реагируют с аминокислотными последовательностями Тау (SEQ ID NO: 1-21 и 101-124) при введении субъекту. Высокоспецифичные антитела, продуцируемые пептидными иммуногенными конструкциями, перекрестно реагируют с рекомбинантными Тау-содержащими белками. Используемые для усиления иммуногенности описанные антитела связываются с Тау с высокой специфичностью, без особой специфичности, и с любой специфичностью, направленной на гетерологичные Th-эпитопы, что резко контрастирует с обычным белком или другими биологическими носителями, используемыми для такого усиления пептидной антигенности.
Данное изобретение также включает способы лечения и/или профилактики болезни Альцгеймера и/или тауопатий с использованием описанных пептидных иммуногенных конструкций и/или антител, направленных против пептидных иммуногенных конструкций. В некоторых вариантах осуществления данного изобретения, способы лечения и/или профилактики болезни Альцгеймера и/или тауопатий включают введение хозяину композиции, содержащей описанную пептидную иммуногенную конструкцию. В некоторых вариантах осуществления данного изобретения, композиции, используемые в способах, содержат описанную пептидную иммуногенную конструкцию в форме стабильного иммуностимулирующего комплекса с отрицательно заряженными олигонуклеотидами, такими как CpG-олигомеры, посредством электростатической ассоциации, причем к этим комплексам дополнительно добавляют, необязательно, минеральные соли или масло в качестве адъюванта, для введения пациентам с болезнью Альцгеймера и/или тауопатиями. Описанные способы также включают схемы применения, лекарственные формы и способы введения пептидных иммуногенных конструкций хозяину, подверженному риску или имеющему болезнь Альцгеймера и/или тауопатии.
Заголовки разделов, используемые в данном документе, предназначены только для организационных целей и не должны рассматриваться как ограничивающие предмет описания. Все ссылки или части ссылок, цитируемых в этой заявке, специально включены в данное описание посредством ссылки во всей их полноте для любых целей.
Если не указано иное, все технические и научные термины, используемые в данном документе, имеют то же значение, которое обычно понимает средний специалист в данной области техники, к которой относится это изобретение. Формы единственного включают также формы множественного числа, если контекст явно не предписывает иное. Точно так же слово «или» предназначено для включения «и», если контекст явно не указывает на иное. Следовательно, «содержащий А или В» означает включающий А, или В, или А и В. Кроме того, следует понимать, что все размеры аминокислот и все значения молекулярного веса или молекулярной массы, приведенные для полипептидов, являются приблизительными и представлены для описания. Хотя способы и материалы, подобные или эквивалентные тем, которые описаны в данном документе, могут использоваться при практическом применении или испытании описанного способа, подходящие способы и материалы описаны ниже. Все публикации, заявки на патенты, патенты и другие ссылки, упомянутые в данном документе, включены в качестве ссылки во всей их полноте. В случае конфликта данная спецификация, включая пояснения терминов, будет иметь преимущественную силу. Кроме того, материалы, способы и примеры являются только иллюстративными и не предназначены для ограничения.
Тау-пептидная иммуногенная конструкция
Данное изобретение относится к пептидным иммуногенным конструкциям, содержащим В-клеточный эпитоп с аминокислотной последовательностью из Тау, ковалентно связанной с гетерологичным Т-хелперным клеточным (Th) эпитопом непосредственно или через необязательный гетерологичный спейсер.
Фраза «Тау-пептидная иммуногенная конструкция» или «пептидная иммуногенная конструкция», как используется в данном документе, относится к пептиду, содержащему (а) В-клеточный эпитоп, имеющий около 15 или более аминокислотных остатков из полноразмерной последовательности самой длинной изоформы Тау (SEQ ID NO: 100); (b) гетерологичный Th-эпитоп; и (с) необязательный гетерологичный спейсер.
В некоторых вариантах осуществления данного изобретения, Тау-пептидная иммуногенная конструкция может быть представлена формулами:
(Th)m-(A)n-(фрагмент Тау)-X
или
(фрагмент Тау)-(A)n-(Th)m-X
где
Th представляет собой гетерологичный T-хелперный эпитоп;
А представляет собой гетерологичный спейсер;
(фрагмент Тау) представляет собой В-клеточный эпитоп, имеющий от около 15 до около 40 аминокислотных остатков из SEQ ID NO: 100;
X представляет собой α-COOH или α-CONH2 аминокислоты;
m составляет от 1 до около 4; и
n составляет от 0 до около 10.
Различные компоненты описанной Тау-пептидной иммуногенной конструкции описаны ниже.
а. Фрагменты Тау
Описанные пептидные иммуногенные конструкции содержат около 15 или более аминокислот. Пептидные иммуногенные конструкции содержат В-клеточный эпитоп из частей самой длинной изоформы Тау-белка человека (GenBank: AGF19246.1), имеющей аминокислотную последовательность из SEQ ID NO: 100, показанную в Таблице 8. В-клеточный эпитоп может быть связан с гетерологичным Т-хелперным клеточным (Th) эпитопом, полученным из белков патогенов, посредством необязательного гетерологичного спейсера. Описанные пептидные иммуногенные конструкции стимулируют выработку высокоспецифичных антител, направленных против Тау. Описанные пептидные иммуногенные конструкции могут быть использованы в качестве иммунотерапии для пациентов, страдающих болезнью Альцгеймера и/или тауопатиями.
Часть на основе В-клеточного эпитопа пептидных иммуногенных конструкций содержит аминокислотные последовательности из полноразмерного Тау-белка (SEQ ID NO: 100). В некоторых вариантах осуществления данного изобретения, B-клеточный эпитоп содержит последовательность, содержащую любую из SEQ ID NO: 1-21 и 101-124, как показано в Таблице 1.
В некоторых вариантах осуществления данного изобретения, фрагменты Тау содержат нефосфорилированные аминокислоты (например, SEQ ID NO: 2, 4, 6, 8, 11, 13, 15, 17, 19 и 21), как продемонстрировано в Таблице 1. В других вариантах осуществления данного изобретения, фрагменты Тау содержат фосфорилированные аминокислоты серин и/или треонин (например, SEQ ID NO: 1, 3, 5, 7, 9, 10, 12, 14, 16, 18 и 20), как продемонстрировано в Таблице 1. Фрагменты Тау, а также сайты фосфорилирования, продемонстрированные в пептидах из Таблицы 1, являются иллюстративными, и данное изобретение включает любой другой фрагмент и/или сайт фосфорилирования полноразмерного Тау-белка SEQ ID NO: 100.
b. Гетерологичные Т-хелперные эпитопы (Th-эпитопы)
Данное изобретение относится к пептидным иммуногенным конструкциям, содержащим В-клеточный эпитоп из Тау, ковалентно связанный с гетерологичным Т-хелперным клеточным (Th) эпитопом непосредственно или через необязательный гетерологичный спейсер.
Гетерологичный Th-эпитоп в Тау-пептидной иммуногенной конструкции усиливает иммуногенность фрагментов Тау, что облегчает выработку специфических антител с высоким титром, направленных против оптимизированного В-клеточного эпитопа-мишени (то есть фрагмента Тау), посредством рационального конструирования.
Термин «гетерологичный», используемый в данном документе, относится к аминокислотной последовательности, которая получена из аминокислотной последовательности, которая не является частью или гомологична последовательности Тау дикого типа. Таким образом, гетерологичный Th-эпитоп представляет собой Th-эпитоп, полученный из аминокислотной последовательности, которая не обнаружена в природе в Тау (то есть Th-эпитоп не является аутологичным для Тау). Поскольку Th-эпитоп является гетерологичным по отношению к Тау, природная аминокислотная последовательность Тау не удлиняется ни в N-концевом, ни в C-концевом направлениях, когда гетерологичный Th-эпитоп ковалентно связан с фрагментом Тау.
Гетерологичный Th-эпитоп по данному изобретению может представлять собой любой Th-эпитоп, который не содержит аминокислотною последовательность, обнаруженную естественно в Тау. Th-эпитоп может иметь аминокислотную последовательность, происходящую от любых видов (например, человека, свиньи, крупного рогатого скота, собаки, крысы, мыши, морских свинок и т.д.). Th-эпитоп также может иметь разнородные мотивы связывания с молекулами ГКГС класса II нескольких видов. В некоторых вариантах осуществления данного изобретения, Th-эпитоп содержит множество разнородных мотивов связывания ГКГС класса II, чтобы обеспечить максимальную активацию Т-хелперных клеток, приводящую к инициации и регуляции иммунных ответов. Th-эпитоп предпочтительно является иммуносмолчащим сам по себе, то есть небольшое количество антител, генерируемых Тау-пептидными иммуногенными конструкциями, если таковые вообще имеются, будут направлены к Th-эпитопу, таким образом, обеспечивая очень сфокусированный иммунный ответ, направленный на B-клеточный эпитоп-мишень фрагмента Тау.
Эпитопы по данному изобретению включают, но не ограничиваются ими, аминокислотные последовательности, полученные из чужеродных патогенов, как показано в Таблице 2 (SEQ ID NO: 22-50). Кроме того, Th-эпитопы включают идеализированные искусственные Th-эпитопы и комбинаторные идеализированные искусственные Th-эпитопы (например, SEQ ID NO: 23 и 30-36). Пептиды гетерологичных Th-эпитопов представлены в виде комбинаторной последовательности (например, SEQ ID NO: 31-34), содержат смесь аминокислотных остатков, представленных в определенных положениях в пределах пептидной структуры на основе вариабельных остатков гомологов для этого конкретного пептида. Сборка комбинаторных пептидов может быть синтезирована в одном процессе путем добавления смеси указанных защищенных аминокислот вместо одной конкретной аминокислоты в определенное положение в процессе синтеза. Такие комбинаторные пептиды гетерологичных Th-эпитопов могут обеспечивать широкий охват Th-эпитопов для животных, имеющих разнообразный генетический фон. Типичные комбинаторные последовательности пептидов гетерологичных Th-эпитопов включают SEQ ID NO: 31-34, которые показаны в Таблице 2. Пептиды Th-эпитопов по данному изобретению обеспечивают широкую реактивность и иммуногенность для животных и пациентов из генетически разнообразных популяций.
Тау-пептидные иммуногенные конструкции, содержащие Th-эпитопы, продуцируются одновременно в одном твердофазном пептидном синтезе в тандеме с фрагментом Тау. Th-эпитопы также включают иммунологические аналоги Th-эпитопов. Иммунологические аналоги Th включают иммуномодулирующие аналоги, перекрестно-реактивные аналоги и сегменты любого из этих Th-эпитопов, которые достаточны для усиления или стимуляции иммунного ответа на фрагменты Тау.
Функциональные иммунологические аналоги пептидов Th-эпитопа также эффективны и включены как часть данного изобретения. Функциональные иммунологические аналоги Th могут включать консервативные замены, добавления, делеции и вставки от одного до около пяти аминокислотных остатков в Th-эпитопе, которые по существу не модифицируют Th-стимулирующую функцию Th-эпитопа. Консервативные замены, добавления и вставки могут быть выполнены с природными или неприродными аминокислотами, как описано выше для фрагментов Тау. Таблица 2 идентифицирует другой вариант функционального аналога для пептида Th-эпитопа. В частности, SEQ ID NO: 23 и 30 MvF1 и MvF2 Th являются функциональными аналогами SEQ ID NO: 33 и 35 MvF4 и MvF5 тем, что они отличаются в аминокислотном каркасе делецией (SEQ ID NO: 23 и 30) или включением (SEQ ID NO: 33 и 35) двух аминокислот, каждая на N- и C-концах. Различия между этими двумя сериями аналогичных последовательностей не влияют на функцию Th-эпитопов, содержащихся в пределах этих последовательностях. Следовательно, функциональные иммунологические аналоги Th включают несколько версий Th-эпитопа, полученного из слитого белка вируса кори MvF1-4 Th (SEQ ID NO: 23, 30, 31, 33 и 35) и из поверхностного белка гепатита HBsAg 1-3 Th (SEQ ID NO: 32, 34 и 36).
Th-эпитоп в Тау-пептидной иммуногенной конструкции может быть ковалентно связан на N- или C-терминальном конце Тау-пептида. В некоторых вариантах осуществления данного изобретения, Th-эпитоп ковалентно связан с N-терминальным концом Тау-пептида. В некоторых вариантах осуществления данного изобретения, Th-эпитоп ковалентно связан с C-терминальным концом Тау-пептида. В некоторых вариантах осуществления данного изобретения, более одного Th-эпитопа ковалентно связаны с фрагментом Тау. Когда более чем один Th-эпитоп связан с фрагментом Тау, каждый Th-эпитоп может иметь одинаковую аминокислотную последовательность или разные аминокислотные последовательности. Кроме того, когда более чем один Th-эпитоп связан с фрагментом Тау, Th-эпитопы могут быть расположены в любом порядке. Например, Th-эпитопы могут быть последовательно связаны с N-терминальным концом фрагмента Тау или могут быть последовательно связаны с C-терминальным концом фрагмента Тау, или Th-эпитоп может быть ковалентно связан с N-концевым концом фрагмента Тау, тогда как отдельный Th-эпитоп ковалентно связан с С-терминальным концом фрагмента Тау. В расположении Th-эпитопов нет ограничений по отношению к фрагменту Тау.
В некоторых вариантах осуществления данного изобретения, Th-эпитоп ковалентно связан с фрагментом Тау напрямую. В других вариантах осуществления данного изобретения, Th-эпитоп ковалентно связан с фрагментом Тау через гетерологичный спейсер, более подробно описанный ниже.
с. Гетерологичный спейсер
Описанные Тау-пептидные иммуногенные конструкции необязательно содержат гетерологичный спейсер, который ковалентно связывает В-клеточный эпитоп из Тау с гетерологичным Т-хелперным клеточным (Th) эпитопом.
Как обсуждалось выше, термин «гетерологичный» относится к аминокислотной последовательности, которая получена из аминокислотной последовательности, которая не является частью или гомологична последовательности Тау дикого типа. Таким образом, природная аминокислотная последовательность Тау не расширяется ни в N-концевом, ни в C-концевом направлениях, когда гетерологичный спейсер ковалентно связан с B-клеточным эпитопом из Тау, поскольку спейсер гетерологичен последовательности Тау.
Спейсер представляет собой любую молекулу или химическую структуру, способную связывать две аминокислоты и/или пептиды вместе. Спейсер может варьироваться по длине или полярности в зависимости от применения. Присоединение спейсера может быть через амидную или карбоксильную связь, но возможны и другие функциональные возможности. Спейсер может включать химическое соединение, встречающуюся в природе аминокислоту или не встречающуюся в природе аминокислоту.
Спейсер может обеспечивать структурные особенности для Тау-пептидной иммуногенной конструкции. Структурно спейсер обеспечивает физическое отделение Th-эпитопа от B-клеточного эпитопа фрагмента Тау. Физическое разделение спейсером может нарушить любые искусственные вторичные структуры, созданные путем присоединения Th-эпитопа к B-клеточному эпитопу. Кроме того, физическое разделение эпитопов спейсером может устранить интерференции между Th-клеточными и/или B-клеточными ответами. Кроме того, спейсер может быть предназначен для создания или модификации вторичной структуры пептидной иммуногенной конструкции. Например, спейсер может быть сконструирован так, чтобы действовать как гибкий шарнир для усиления разделения Th-эпитопа и B-клеточного эпитопа. Спейсер гибкого шарнирного участка также может обеспечить более эффективные взаимодействия между представленным пептидным иммуногеном и соответствующими Th-клетками и B-клетками для усиления иммунных ответов на Th-эпитоп и B-клеточный эпитоп. Примеры последовательностей, кодирующих гибкие шарниры, находятся в шарнирном участке тяжелой цепи иммуноглобулина, которые часто богаты пролином. Один особенно полезный гибкий шарнир, который можно использовать в качестве спейсера, обеспечивается последовательностью Pro-Pro-Xaa-Pro-Xaa-Pro (SEQ ID NO: 101), где Xaa представляет собой любую аминокислоту и предпочтительно аспарагиновую кислоту.
Спейсер также может обеспечивать функциональные особенности Тау-пептидной иммуногенной конструкции. Например, спейсер может быть предназначен для изменения общего заряда Тау-пептидной иммуногенной конструкции, которая может влиять на растворимость пептидной иммуногенной конструкции. Кроме того, изменение общего заряда Тау-пептидной иммуногенной конструкции может влиять на способность пептидной иммуногенной конструкции связываться с другими соединениями и реагентами. Как более подробно обсуждается ниже, Тау-пептидная иммуногенная конструкция может быть сформирована в стабильный иммуностимулирующий комплекс с сильно заряженным олигонуклеотидом, таким как CpG-олигомеры, посредством электростатической ассоциации. Общий заряд Тау-пептидной иммуногенной конструкции важен для образования этих стабильных иммуностимулирующих комплексов.
Химические соединения, которые можно использовать в качестве спейсера, включают, но не ограничиваются ими, (2-аминоэтокси) уксусную кислоту (AEA), 5-аминовалериановую кислоту (AVA), 6-аминокапроновую кислоту (Ahx), 8-амино-3,6-диоксаоктановую кислоту (AEEA, мини-PEG1), 12-амино-4,7,10-триоксадодекановую кислоту (мини-PEG2), 15-амино-4,7,10,13-тетраоксапента-декановую кислоту (мини-PEG3 ), триоксатридекан-янтарную кислоту (Ttds), 12-амино-додекановую кислоту, Fmoc-5-амино-3-оксапентановую кислоту (O1Pen) и тому подобное.
Встречающиеся в природе аминокислоты включают аланин, аргинин, аспарагин, аспарагиновую кислоту, цистеин, глутаминовую кислоту, глутамин, глицин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, пролин, серин, треонин, триптофан, тирозин и валин.
Не встречающиеся в природе аминокислоты включают, но не ограничиваются ими, ε-N-лизин, β-аланин, орнитин, норлейцин, норвалин, гидроксипролин, тироксин, γ-амино масляную кислоту, гомосерин, цитруллин, аминобензойную кислоту, 6-аминокапроновую кислоту (Aca; 6-аминогексановая кислота), гидроксипролин, меркаптопропионовую кислоту (MPA), 3-нитро-тирозин, пироглутаминовую кислоту и тому подобное.
Спейсер в Тау-пептидной иммуногенной конструкции может быть ковалентно связан на N- или С-терминальном конце Th-эпитопа и Тау-пептида. В некоторых вариантах осуществления данного изобретения, спейсер ковалентно связан с С-терминальным концом Th-эпитопа и с N-терминальным концом Тау-пептида. В других вариантах осуществления данного изобретения, спейсер ковалентно связан с C-терминальным концом Тау-пептида и с N-терминальным концом Th-эпитопа. В определенных вариантах осуществления данного изобретения, можно использовать более одного спейсера, например, когда в пептидной иммуногенной конструкции присутствует более одного Th-эпитопа. Когда используется более одного спейсера, каждый спейсер может быть таким же, как и другой, или отличаться от него. Кроме того, когда в пептидной иммуногенной конструкции присутствует более одного Th-эпитопа, Th-эпитопы могут быть разделены спейсером, который может быть таким же или отличаться от спейсера, используемого для отделения Th-эпитопа от B-клеточного эпитопа. Нет ограничений в расположении спейсера относительно Th-эпитопа или фрагмента Тау.
В некоторых вариантах осуществления данного изобретения, гетерологичный спейсер представляет собой встречающуюся в природе аминокислоту или не встречающуюся в природе аминокислоту. В других вариантах осуществления данного изобретения, спейсер содержит более одной встречающейся в природе или не встречающейся в природе аминокислоты. В конкретных вариантах осуществления данного изобретения, спейсер представляет собой Lys-, Gly-, Lys-Lys-Lys-, (α, ε-N)Lys или ε-N-Lys-Lys-Lys-Lys (SEQ ID NO: 102).
d. Конкретные варианты осуществления Тау-пептидной иммуногенной конструкции
Тау-пептидная иммуногенная конструкция может быть представлена формулами:
(Th)m-(A)n-(фрагмент Тау)-X
или
(фрагмент Тау)-(A)n-(Th)m-X
где
Th представляет собой гетерологичный T-хелперный эпитоп;
А представляет собой гетерологичный спейсер;
(фрагмент Тау) представляет собой В-клеточный эпитоп, имеющий от около 15 до около 40 аминокислотных остатков из полноразмерного Тау-белка SEQ ID NO: 100;
X представляет собой α-COOH или α-CONH2 аминокислоты;
m составляет от 1 до около 4; и
n составляет от 0 до около 10.
В некоторых вариантах осуществления данного изобретения, гетерологичный Th-эпитоп в Тау-пептидной иммуногенной конструкции содержит аминокислотную последовательность, выбранную из любой из SEQ ID NO: 51-71 и 125-155, и их комбинации, показанные в Таблице 3. В конкретных вариантах осуществления данного изобретения, Th-эпитоп содержит аминокислотную последовательность, выбранную из любой из SEQ ID NO: 30-36. В некоторых вариантах осуществления данного изобретения, Тау-пептидная иммуногенная конструкция содержит более одного Th-эпитопа.
В некоторых вариантах осуществления данного изобретения, необязательный гетерологичный спейсер выбран из любого из Lys-, Gly-, Lys-Lys-Lys-, (α, ε-N)Lys, ε-N-Lys-Lys-Lys-Lys (SEQ ID NO: 102) и их комбинации. В конкретных вариантах осуществления данного изобретения, гетерологичный спейсер представляет собой ε-N-Lys-Lys-Lys-Lys (SEQ ID NO: 102).
В некоторых вариантах осуществления данного изобретения, фрагмент Тау содержит от около 15 до около 40 аминокислотных остатков из полноразмерного Тау-белка SEQ ID NO: 100. В конкретных вариантах осуществления данного изобретения, фрагмент Тау содержит аминокислотную последовательность, представленную как SEQ ID NO: 1-21 и 101-124, как показано в Таблице 1.
В некоторых вариантах осуществления данного изобретения, Тау-пептидная иммуногенная конструкция содержит аминокислотную последовательность, выбранную из любой из SEQ ID NO: 51-71 и 125-155, как показано в Таблице 3.
а. Варианты, гомологи и функциональные аналоги
Варианты и аналоги вышеуказанных иммуногенных пептидов, которые индуцируют и/или перекрестно реагируют с антителами к предпочтительным эпитопам Тау-белка, также могут быть использованы. Аналоги, включая аллельные, видовые и индуцированные варианты, обычно отличаются от встречающихся в природе пептидов в одном, двух или нескольких положениях, часто в силу консервативных замен. Аналоги обычно демонстрируют по меньшей мере 80 или 90% идентичности последовательности с природными пептидами. Некоторые аналоги также включают неприродные аминокислоты или модификации N- или C-концевых аминокислот в одном, двух или нескольких положениях.
Варианты, которые являются функциональными аналогами, могут иметь консервативную замену в положении аминокислоты; изменение общего заряда; ковалентную связь к другому фрагменту; или добавления, вставки или делеции аминокислот; и/или любую их комбинацию.
Консервативные замены - это когда один аминокислотный остаток заменен другим аминокислотным остатком с аналогичными химическими свойствами. Например, неполярные (гидрофобные) аминокислоты включают аланин, лейцин, изолейцин, валин, пролин, фенилаланин, триптофан и метионин; полярные нейтральные аминокислоты включают глицин, серин, треонин, цистеин, тирозин, аспарагин и глутамин; положительно заряженные (основные) аминокислоты включают аргинин, лизин и гистидин; и отрицательно заряженные (кислотные) аминокислоты включают аспарагиновую кислоту и глутаминовую кислоту.
В конкретном варианте осуществления данного изобретения, функциональный аналог имеет по меньшей мере 50% идентичности с исходной аминокислотной последовательностью. В другом варианте осуществления данного изобретения, функциональный аналог имеет по меньшей мере 80% идентичности с исходной аминокислотной последовательностью. В еще одном варианте осуществления данного изобретения, функциональный аналог имеет по меньшей мере 85% идентичности с исходной аминокислотной последовательностью. В еще одном варианте осуществления данного изобретения, функциональный аналог имеет по меньшей мере 90% идентичности с исходной аминокислотной последовательностью.
Варианты также включают вариации фосфорилированных остатков. Например, варианты могут включать различные остатки в пределах пептидов, которые фосфорилированы. Вариант иммуногенных Тау-пептидов также может включать псевдофосфорилированные пептиды. Псевдофосфорилированные пептиды получают заменой одного или более фосфорилированных остатков серина, треонина и тирозина Тау-пептидов на кислотные аминокислотные остатки, такие как глутаминовая кислота и аспарагиновая кислота.
Композиции
Данное изобретение также относится к композициям, содержащим описанную иммуногенную Тау-конструкцию.
а. Пептидные композиции
Композиции, содержащие описанную Тау-пептидную иммуногенную конструкцию, могут находится в жидкой или твердой форме. Жидкие композиции могут содержать воду, буферы, растворители, соли и/или любой другой приемлемый реагент, который не изменяет структурные или функциональные свойства Тау-пептидной иммуногенной конструкции. Пептидные композиции могут содержать одну или более описанных Тау-пептидных иммуногенных конструкций.
b. Фармацевтические композиции
Данное изобретение также относится к фармацевтическим композициям, содержащим описанную Тау-пептидную иммуногенную конструкцию.
Фармацевтические композиции могут содержать носители и/или другие добавки в фармацевтически приемлемой системе доставки. Соответственно, фармацевтические композиции могут содержать фармацевтически эффективное количество Тау-пептидной иммуногенной конструкции вместе с фармацевтически приемлемым носителем, адъювантом и/или другими наполнителями, такими как разбавители, добавки, стабилизирующие агенты, консерванты, солюбилизирующие агенты, буферы и тому подобное.
Фармацевтические композиции могут содержать один или более адъювантов, которые действуют(действует) для ускорения, пролонгации или усиления иммунного ответа на Тау-пептидную иммуногенную конструкцию без какого-либо специфического антигенного действия. Адъюванты, используемые в фармацевтической композиции, могут включать масла, соли алюминия, виросомы, фосфат алюминия (например, ADJU-PHOS®), гидроксид алюминия (например, ALHYDROGEL®), липосин, сапонин, сквален, L121, Emulsigen®, монофосфорил липид A (MPL), QS21, ISA 35, ISA 206, ISA50V, ISA51, ISA 720, а также другие адъюванты и эмульгаторы.
В некоторых вариантах осуществления данного изобретения, фармацевтическая композиция содержит MONTANIDE™ ISA 51 (масляная адъювантная композиция, состоящая из растительного масла и маннида олеата для получения эмульсий вода-в-масле), Tween® 80 (также известный как: Полисорбат 80 или Полиоксиэтилен (20) сорбитан моноолеат), CpG-олигонуклеотид и/или любую их комбинацию. В других вариантах осуществления данного изобретения, фармацевтическая композиция представляет собой эмульсию вода-в-масле-в-воде (то есть в/м/в) с Emulsigen или Emulsigen D в качестве адъюванта.
Фармацевтические композиции могут быть составлены в виде составов с немедленным высвобождением или в виде составов с замедленным высвобождением. Кроме того, фармацевтические композиции могут быть составлены для индукции системного или локализованного иммунитета слизистой оболочки путем захвата иммуногена и совместного введения с микрочастицами. Такие системы доставки легко определяются средним специалистом в данной области техники.
Фармацевтические композиции могут быть приготовлены в виде впрыскиваемых лекарственных средств, либо в виде жидких растворов, либо суспензий. Жидкие носители, содержащие Тау-пептидную иммуногенную конструкцию, также можно приготовить перед инъекцией. Фармацевтическую композицию можно вводить любым подходящим способом применения, например, п/к, в/в, п/о, в/м, интраназально, орально, подкожно и т. д., и в любом подходящем устройстве доставки. В определенных вариантах осуществления данного варианта, фармацевтическая композиция составлена для внутривенного, подкожного, внутридермального или внутримышечного введения. Фармацевтические композиции, подходящие для других способов введения, также могут быть приготовлены, включая пероральное и интраназальное применение.
Фармацевтические композиции могут быть составлены в виде составов с немедленным высвобождением или в виде составов с замедленным высвобождением. Кроме того, фармацевтические композиции могут быть составлены для индукции системного или локализованного иммунитета слизистой оболочки путем захвата иммуногена и совместного введения с микрочастицами. Такие системы доставки легко определяются средним специалистом в данной области техники.
Фармацевтические композиции также могут быть составлены в подходящей единичной дозированной форме. В некоторых вариантах осуществления данного изобретения, фармацевтическая композиция содержит от около 0,5 мкг до около 1 мг Тау-пептидной иммуногенной конструкции на кг массы тела. Эффективные дозы фармацевтических композиций варьируются в зависимости от многих различных факторов, включая способы введения, целевой участок, физиологическое состояние пациента, является ли пациент человеком или животным, вводятся другие лекарственные средства и является ли лечение профилактическим или терапевтическим. Обычно пациент представляет собой человека, но также можно лечить отличных от человека млекопитающих, включая трансгенных млекопитающих. При доставке в нескольких дозах фармацевтические композиции могут быть удобно разделены на подходящее количество на единичную дозированную форму. Вводимая доза будет зависеть от возраста, веса и общего состояния здоровья субъекта, что хорошо известно в области терапии.
В некоторых вариантах осуществления данного изобретения, фармацевтическая композиция содержит более чем одну Тау-пептидную иммуногенную конструкцию. Фармацевтическая композиция, содержащая смесь более чем одной Тау-пептидной иммуногенной конструкции, для обеспечения синергетического усиления иммуноэффективности конструкций. Фармацевтические композиции, содержащие более одной Тау-пептидной иммуногенной конструкции, могут быть более эффективными в большей генетической популяции благодаря широкому охвату ГКГС класса II, таким образом, обеспечивают улучшенный иммунный ответ на Тау-пептидные иммуногенные конструкции.
В некоторых вариантах осуществления данного изобретения, фармацевтическая композиция содержит Тау-пептидную иммуногенную конструкцию, выбранную из SEQ ID NO: 51-71 и 125-155, а также их гомологи, аналоги и/или комбинации. В конкретных вариантах осуществления данного изобретения, фармацевтические композиции содержит Тау-пептидную иммуногенную конструкцию, выбранную из SEQ ID NO: 51-71 и 125-155, и любой их комбинации.
Фармацевтические композиции, содержащие Тау-пептидную иммуногенную конструкцию, можно использовать для индукции иммунного ответа и продуцирования антител у хозяина после введения.
с. Иммуностимулирующие комплексы
Данное изобретение также относится к фармацевтическим композициям, содержащим Тау-пептидную иммуногенную конструкцию в форме иммуностимулирующего комплекса с CpG-олигонуклеотидом. Такие иммуностимулирующие комплексы специфически приспособлены для действия в качестве адъюванта и стабилизатора пептидного иммуногена. Иммуностимулирующие комплексы находятся в форме частиц, которые могут эффективно представлять Тау-пептидный иммуноген клеткам иммунной системы, вызывая иммунный ответ. Иммуностимулирующие комплексы могут быть составлены в виде суспензии для парентерального введения. Иммуностимулирующие комплексы также могут быть составлены в форме в/м эмульсий, в виде суспензии в сочетании с минеральной солью или с желирующим полимером in situ для эффективной доставки Тау-пептидного иммуногена к клеткам иммунной системы хозяина после парентерального введения.
Стабилизированный иммуностимулирующий комплекс может быть образован путем комплексирования Тау-пептидной иммуногенной конструкции с анионной молекулой, олигонуклеотидом, полинуклеотидом или их комбинациями посредством электростатической ассоциации. Стабилизированный иммуностимулирующий комплекс может быть включен в фармацевтическую композицию в качестве системы доставки иммуногена.
В некоторых вариантах осуществления данного изобретения, Тау-пептидная иммуногенная конструкция сконструирована так, чтобы содержать катионную часть, которая положительно заряжена при рН в диапазоне от 5,0 до 8,0. Общий заряд катионной части Тау-пептидной иммуногенной конструкции или смеси конструкций рассчитывают, назначая заряд +1 для каждого лизина (K), аргинина (R) или гистидина (H), заряд -1 для каждой аспарагиновой кислоты (D) или глутаминовой кислоты (E) и заряд 0 для другой аминокислоты в пределах последовательности. Заряды суммируются в пределах катионной части Тау-пептидной иммуногенной конструкции и выражаются как общий средний заряд. Подходящий пептидный иммуноген содержит катионную часть с общим средним положительным зарядом +1. Предпочтительно пептидный иммуноген имеет общий положительный заряд в диапазоне, который больше чем +2. В некоторых вариантах осуществления данного изобретения, катионная часть Тау-пептидной иммуногенной конструкции представляет собой гетерологичный спейсер. В некоторых вариантах осуществления данного изобретения, катионная часть Тау-пептидной иммуногенной конструкции имеет заряд +4, когда спейсерная последовательность представляет собой (α, ε-N)Lys, ε-N-Lys-Lys-Lys-Lys (SEQ ID NO: 102).
«Анионная молекула», как описано в данном документе, относится к любой молекуле, которая заряжена отрицательно при рН в диапазоне 5,0-8,0. В определенных вариантах осуществления данного изобретения, анионная молекула представляет собой олигомер или полимер. Общий отрицательный заряд на олигомере или полимере рассчитывается путем назначения заряда -1 для каждой фосфодиэфирной или фосфоротиоатной группы в олигомере. Подходящим анионным олигонуклеотидом является одноцепочечная молекула ДНК с 8-64 нуклеотидными основаниями с числом повторов мотива CpG в диапазоне от 1 до 10. Предпочтительно CpG иммуностимулирующие молекулы одноцепочечной ДНК содержат 18-48 нуклеотидных оснований с числом повторов мотива CpG в диапазоне от 3 до 8.
Более предпочтительно анионный олигонуклеотид представлен формулой: 5'X1CGX2 3', где C и G являются неметилированными; и X1 выбран из группы, состоящей из A (аденин), G (гуанин) и T (тимин); и Х2 представляет собой С (цитозин) или Т (тимин). Или анионный олигонуклеотид представлен формулой: 5'(X3)2CG(X4)2 3', где C и G являются неметилированными; и X3 выбран из группы, состоящей из A, T или G; и Х4 представляет собой С или Т.
Полученный иммуностимулирующий комплекс находится в форме частиц с размером, обычно находящимся в диапазоне 1-50 мкм, и является функцией многих факторов, включая стехиометрию относительного заряда и молекулярную массу взаимодействующих частиц. Иммуностимулирующий комплекс в виде частиц обладает тем преимуществом, что обеспечивает адъювантый эффект и активацию специфических иммунных ответов in vivo. Кроме того, стабилизированный иммуностимулирующий комплекс подходит для приготовления фармацевтических композиций различными способами, включая эмульсии вода-в-масле, суспензии минеральных солей и полимерные гели.
Антитела
Данное изобретение также относится к антителам, образованные в ответ на Тау-пептидную иммуногенную конструкцию.
Описанные Тау-пептидные иммуногенные конструкции, содержащие фрагмент Тау, гетерологичный Th-эпитоп и необязательный гетерологичный спейсер, способны вызывать иммунный ответ и выработку антител при введении хозяину. Дизайн Тау-пептидных иммуногенных конструкций может нарушать толерантность к самому Тау и вызывать выработку сайт-специфических антител, которые распознают конформационные, а не линейные эпитопы.
Антитела, продуцируемые Тау-пептидными иммуногенными конструкциями, распознают и связываются с Тау в форме мономеров, димеров, тримеров и олигомеров.
Антитела, образованные в ответ на Тау-пептидные иммуногенные конструкции(антиагрегационная активность) и могут диссоциировать предварительно образованные агрегаты Тау (дезагрегационная активность).
Полученные в результате иммунные ответы от животных, иммунизированных Тау-пептидными иммуногенными конструкциями по данному изобретению, продемонстрировали способность конструкций продуцировать мощные сайт-направленные антитела, которые реагируют с Тау в форме мономеров, димеров, тримеров и олигомеров.
Способы
Данное изобретение также направлено на способы получения и использования Тау-пептидных иммуногенных конструкций, композиций и фармацевтических композиций.
а. Способы изготовления Тау-пептидной иммуногенной конструкции
Тау-пептидные иммуногенные конструкции данного описания могут быть получены способами химического синтеза, хорошо известными специалисту в данной области техники (см., например, Fields et al., Chapter 3 in Synthetic Peptides: A User’s Guide, ed. Grant, W. H. Freeman & Co., Нью Йорк, Нью Йорк, 1992, p. 77). Тау-пептидные иммуногенные конструкции могут быть синтезированы с использованием автоматизированных методов твердофазного синтеза Merrifield с α-NH2, защищенным t-Boc или F-moc химией, с использованием аминокислот с боковой цепью, например, на модели синтезатора пептидов Applied Biosystems 430А или 431. Приготовление Тау-пептидных иммуногенных конструкций, содержащих пептиды комбинаторной библиотеки для Th-эпитопов, может быть достигнуто путем предоставления смеси альтернативных аминокислот для связывания в данном вариабельном положении.
После полной сборки желаемой Тау-пептидной иммуногенной конструкции, смолу можно обработать в соответствии со стандартными процедурами для отщепления пептида от смолы, и функциональные группы на боковых цепях аминокислот могут быть разблокированы. Свободный пептид может быть очищен с помощью ВЭЖХ и охарактеризован биохимически, например, аминокислотным анализом или секвенированием. Способы очистки и определения характеристик пептидов хорошо известны среднему специалисту в данной области техники.
Качество пептидов, продуцируемых этим химическим процессом, можно контролировать и определять, и в результате можно гарантировать воспроизводимость Тау-пептидных иммуногенных конструкций, иммуногенность и выход. Подробное описание получения Тау-пептидной иммуногенной конструкции посредством твердофазного пептидного синтеза приведено в Примере 1.
Было обнаружено, что диапазон структурной изменчивости, который допускает сохранение предполагаемой иммунологической активности, является гораздо более приемлемым, чем диапазон структурной изменчивости, допускаемый для сохранения специфической активности лекарственного средства с помощью низкомолекулярного лекарственного средства или желаемых активностей и нежелательных токсичностей, обнаруженных в больших молекулах, которые производятся совместно с полученными биологическим путем лекарственными средствами. Таким образом, аналоги пептидов, либо намеренно сконструированные, либо неизбежно получаемые в результате ошибок синтетического процесса в виде смеси побочных продуктов делеции последовательности , которые имеют хроматографические и иммунологические свойства, аналогичные предполагаемому пептиду, часто так же эффективны, как очищенный препарат желаемого пептида. Разработанные аналоги и непреднамеренные аналоговые смеси эффективны до тех пор, пока разрабатывается четкая процедура контроля качества для контроля как производственного процесса, так и процесса оценки продукта, чтобы гарантировать воспроизводимость и эффективность конечного продукта, использующего эти пептиды.
Тау-пептидные иммуногенные конструкции также могут быть получены с использованием технологии рекомбинантных ДНК, включая молекулы нуклеиновой кислоты, векторы и/или клетки-хозяева. Как таковые, молекулы нуклеиновой кислоты, кодирующие Тау-пептидную иммуногенную конструкцию и их иммунологически функциональные аналоги, также включены в данное изобретение как часть данного изобретения. Подобным образом векторы, включая векторы экспрессии, содержащие молекулы нуклеиновой кислоты, а также клетки-хозяева, содержащие векторы, также включены в данное изобретение как часть данного изобретения.
Различные иллюстративные варианты осуществления данного изобретения также охватывают способы получения Тау-пептидной иммуногенной конструкции и ее иммунологически функциональных аналогов. Например, способы могут включать стадию инкубации клетки-хозяина, содержащей вектор экспрессии, содержащий молекулу нуклеиновой кислоты, кодирующую Тау-пептидную иммуногенную конструкцию и/или ее иммунологически функциональный аналог, в таких условиях, когда экспрессируется пептид и/или аналог. Более длинные синтетические пептидные иммуногены могут быть синтезированы хорошо известными методами рекомбинантных ДНК. Такие методы представлены в известных стандартных руководствах с подробными протоколами. Для конструирования гена, кодирующего пептид по данному изобретению, аминокислотную последовательность подвергают обратной трансляции для получения последовательности нуклеиновой кислоты, кодирующей аминокислотную последовательность, предпочтительно с кодонами, которые являются оптимальными для организма, в котором должен экспрессироваться ген. Затем синтетический ген получают обычно путем синтеза олигонуклеотидов, которые кодируют пептид и любые регуляторные элементы, если это необходимо. Синтетический ген вставляется в подходящий клонирующий вектор и трансфицируется в клетку-хозяина. Затем пептид экспрессируется в подходящих условиях, подходящих для выбранной системы экспрессии и хозяина. Пептид очищается и характеризуется стандартными способами.
b. Способы изготовления иммуностимулирующих комплексов
Различные иллюстративные варианты осуществления данного изобретения также охватывают способы получения иммуностимулирующих комплексов, включающих Тау-пептидные иммуногенные конструкции и молекулу CpG-олигодезоксинуклеотида (ODN) (oligodeoxynucleotide). Стабилизированные иммуностимулирующие комплексы (ISC) (stabilized immunostimulatory complexes) получают из катионной части Тау-пептидной иммуногенной конструкции и полианионной молекулы CpG ODN. Самособирающаяся система приводится в действие электростатической нейтрализацией заряда. Стехиометрия отношения молярного заряда катионной части Тау-пептидной иммуногенной конструкции к анионному олигомеру определяет степень ассоциации. Нековалентная электростатическая ассоциация Тау-пептидной иммуногенной конструкции и CpG ODN является полностью воспроизводимым процессом. Агрегаты иммуностимулирующего пептид/CpG ODN комплекса, которые облегчают презентирование «профессиональными» антигенпрезентирующими клеткам (АПК) иммунной системы, таким образом, дополнительно усиливают иммуногенность комплексов. Эти комплексы легко характеризуются для контроля качества при производстве. ISC пептид/CpG хорошо переносятся in vivo. Эта новая система частиц, содержащая CpG ODN и Тау-пептидные иммуногенные конструкции, полученные из фрагмента Тау, была разработана для использования обобщенной В-клеточной митогенности, связанной с использованием CpG ODN, и в то же время для стимулирования сбалансированных ответов типа Th-1/Th-2.
CpG ODN в описанных фармацевтических композициях на 100% связан с иммуногеном в процессе, опосредованном электростатической нейтрализацией противоположного заряда, что приводит к образованию частиц микронного размера. Форма частиц позволяет значительно снизить дозировку CpG по сравнению с обычным использованием адъювантов CpG, снизить вероятность неблагоприятных врожденных иммунных ответов и облегчить альтернативные пути процессинга иммуногена, включая антиген-презентирующие клетки (АПК). Следовательно, такие составы являются концептуально новыми и предлагают потенциальные преимущества, способствуя стимуляции иммунных ответов альтернативными механизмами.
с. Способы изготовления фармацевтических композиций
Различные иллюстративные варианты осуществления данного изобретения также охватывают фармацевтические композиции, содержащие Тау-пептидные иммуногенные конструкции. В некоторых вариантах осуществления данного изобретения, в фармацевтических композициях используются эмульсии вода-в-масле и суспензии с минеральными солями.
Для того, чтобы фармацевтическая композиция использовалась большой популяцией, а профилактика агрегации Тау также являлась частью цели введения, безопасность становится еще одним важным фактором для рассмотрения. Несмотря на использование эмульсий вода-в-масле у людей для многих составов в клинических испытаниях, квасцы остаются основным адъювантом для использования в составах благодаря своей безопасности. Поэтому квасцы или их минеральные соли алюминия фосфата (ADJUPHOS) часто используется в качестве адъювантов при подготовке к клиническому применению.
Другие адъюванты и иммуностимулирующие агенты включают 3-Де-O-ацилированный монофосфориллипид A (MPL) или 3-DMP, полимерные или мономерные аминокислоты, такие как полиглутаминовая кислота или полилизин. Такие адъюванты могут быть использованы с или без других специфических иммуностимулирующих агентов, таких как мурамилпептиды (например, N-ацетилмурамил-L-треонил-D-изоглутамин (thr-MDP), N-ацетилнормурамил-L-аланил-D-изоглутамин (nor-MDP), N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2- (1'-2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)-этиламин (MTP-PE), N- ацетилглюксаминил-N-ацетилмурамил-L-Al-D-изоглу-L-Ала-дипальмитокси пропиламид (DTP-DPP) Theramide™) или другие компоненты бактериальной клеточной стенки. Эмульсии масло-в-воде включают MF59 (см. WO 90/14837, Van Nest et al., которая полностью включена в данное описание посредством ссылки во всей своей полноте), содержащую 5% сквалена, 0,5% Твин 80 и 0,5% Span 85 (необязательно содержащий различные количества MTP-PE), составленные в субмикронные частицы с использованием микрофлюидизатора; SAF, содержащий 10% сквалена, 0,4% Твин 80, 5% плюроник-блокированного полимера L121 и thr-MDP, либо микрофлюидизированный в субмикронную эмульсию, либо вортексированный с образованием эмульсии с более крупным размером частиц; и адъювантную систему Ribi™ (RAS) (Ribi ImmunoChem, Хамильтон, Монтана), содержащую 2% сквалена, 0,2% Твин 80 и один или более компонентов бактериальной клеточной стенки, выбранных из группы, состоящей из монофосфориллипида A (MPL), трегалозы димиколата (TDM) и скелет клеточной стенки (CWS), предпочтительно MPL+CWS (Detox™). Другие адъюванты включают полный адъювант Фрейнда (CFA) (Complete Freund's Adjuvant), неполный адъювант Фрейнда (IFA) (Incomplete Freund's Adjuvant) и цитокины, такие как интерлейкины (ИЛ-1, ИЛ-2 и ИЛ-12), гранулоцитарно-макрофагальный колониестимулирующий фактор (GM-CSF) (granulocyte-macrophage colony stimulating factor), и фактор некроза опухоли (ФНО).
Выбор адъюванта зависит от стабильности иммуногенного состава, содержащего адъювант, пути введения, схемы применения, эффективности адъюванта для вакцинируемых видов, а у людей фармацевтически приемлемый адъювант представляет собой тот, который был одобрен или разрешен для введения человеку соответствующими регулирующими органами. Например, квасцы, MPL или неполный адъювант Фрейнда (Chang et al., Advanced Drug Delivery Reviews 32: 173-186 (1998), который включен в данное описание в качестве ссылки во всей своей полноте) отдельно или необязательно все их комбинации подходят для введения человеку.
Композиции могут содержать фармацевтически приемлемые, нетоксичные носители или разбавители, которые определяются как носители, обычно используемые для составления фармацевтических композиций для введения животным или людям. Разбавитель выбирается таким образом, чтобы не влиять на биологическую активность комбинации. Примерами таких разбавителей являются дистиллированная вода, физиологический натрий-фосфатный буфер, растворы Рингера, раствор декстрозы и раствор Хэнка. Кроме того, фармацевтическая композиция или состав может также содержать другие носители, адъюванты или нетоксичные, нетерапевтические, неиммуногенные стабилизаторы и тому подобное.
Фармацевтические композиции также могут включать крупные медленно метаболизируемые макромолекулы, такие как белки, полисахариды, такие как хитозан, полимолочные кислоты, полигликолевые кислоты и сополимеры (например, функционализированная латексом сефароза, агароза, целлюлоза и тому подобное), полимерные аминокислоты, аминокислотные сополимеры, и липидные агрегаты (например, масляные капли или липосомы). Кроме того, эти носители могут функционировать в качестве иммуностимулирующих агентов (то есть, адъювантов).
Фармацевтические композиции по данному изобретению могут дополнительно включать подходящий носитель для доставки. Подходящие носители для доставки включают, но не ограничиваются ими, вирусы, бактерии, биоразлагаемые микросферы, микрочастицы, наночастицы, липосомы, минипеллеты коллагена и кохлеаты.
d. Способы с использованием фармацевтических композиций
Данное изобретение также включает способы применения фармацевтических композиций, содержащих Тау-пептидные иммуногенные конструкции.
В некоторых вариантах осуществления данного изобретения, фармацевтические композиции, содержащие Тау-пептидные иммуногенные конструкции, можно использовать для:
(а) ингибирования агрегации Тау у хозяина;
(b) индуцирования дезагрегации предварительно сформированных агрегатов Тау у хозяина;
(с) уменьшения нейродегенерации, вызванной экзогенными агрегатами Тау у хозяина;
(d) уменьшения нейродегенерации в клетках со сверхэкспрессией Тау;
(е) снижения уровня Тау в сыворотке у хозяина;
(f) снижения уровня олигомерного Тау в мозге хозяина;
(g) уменьшения невропатологии и восстановление двигательной активности у хозяина; и тому подобное.
Вышеуказанные способы включают введение фармацевтической композиции, содержащей фармакологически эффективное количество Тау-пептидной иммуногенной конструкции, хозяину, нуждающемуся в этом.
Используемый в данном документе термин «тауопатия» охватывает любое нейродегенеративное заболевание, которое включает патологическую агрегацию микротрубочек Тау-белка в пределах головного мозга. Соответственно, помимо как семейной, так и спорадической болезни Альцгеймера, другие тауопатии, которые можно лечить с использованием способов по данному изобретению, включают, без ограничения, лобно-височную деменцию, паркинсонизм, связанный с хромосомой 17 (FTDP-17), прогрессирующий надъядерный паралич, кортикобазальную дегенерацию, болезнь Пика, прогрессирующий подкорковый глиоз, деменцию с преобладанием нейрофибриллярных клубков, диффузные нейрофибриллярные клубки с кальцификацией, аргирофильную зернистую деменцию, комплекс бокового амиотрофического склероза паркинсонизма-деменции, деменцию боксеров, синдром Дауна, болезнь Герстмана-Штраусслена-Шляйнкера, болезнь Халлервордена-Шпатца, миозит с включенными тельцами, болезнь Крейтцфельда-Якоба, множественную системную атропию, болезнь Ниманна-Пика типа C, церебральную амилоидную ангиопатию белка прионов, подострый склерозирующий панэнцефалит, миотоническую дистрофию, негуанамскую болезнь двигательных нейронов с нейрофибриллярными клубками, постэнцефалитический паркинсонизм и хроническую травматическую энцефалопатию.
Другой аспект данного изобретения относится к способу стимулирования клиренса агрегатов Тау из мозга субъекта. Этот способ включает введение субъекту любого одного или более иммуногенных Тау-пептидов, имеющих аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-21 и 101-124, или одного или более антител, распознающих иммуногенный эпитоп Тау, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-21 и 101-124 и 51-71 и 125-155 в условиях, эффективных для ускорения клиренса агрегатов Тау из мозга субъекта.
Клиренс агрегатов Тау включает клиренс нейрофибриллярных клубков и/или патологических предшественников Тау к нейрофибриллярным клубкам. Нейрофибриллярные клубки часто связаны с нейродегенеративными заболеваниями, включая, например, спорадическую и семейную болезнь Альцгеймера, боковой амиотрофический склероз, аргирофильную зернистую деменцию, деменцию боксеров, хроническую травматическую энцефалопатию, диффузные нейрофибриллярные клубки с кальцификацией, синдром Дауна, болезнь Герстманна-Штраусслера-Шейнкера, болезнь Халлервордена-Шпатца, наследственную лобно-височную деменцию, паркинсонизм, связанный с хромосомой 17 (FTDP-17), миозит с включенными тельцами, болезнь Крейтсфельда-Якоба, множественную системную атрофию, болезнь Нимана-Пика типа C, болезнь Пика, церебральную амилоидную ангиопатию белка прионов, спорадическую кортикобазальную дегенерацию, прогрессирующий надъядерный паралич, подострый склерозирующий панэнцефалит, миотоническую дистрофию, болезнь двигательных нейронов с нейрофибриллярными клубками, деменцию с преобладанием нейрофибриллярных клубков и прогрессирующий подкорковый глиоз.
Другой аспект данного изобретения относится к способу замедления развития поведенческого фенотипа, связанного с Тау-патологией, у субъекта. Этот способ включает введение субъекту любого одного или более иммуногенных Тау-пептидов, содержащих аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-21 и 101-124 и 51-71 и 125-155, или одно или более антител, распознающих иммуногенный эпитоп Тау, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-21 и 101-124 и 51-71 и 125-155, в условиях, эффективных для замедления поведенческого фенотипа, связанного с Тау-патологией, у субъекта.
Как используется в данном документе, поведенческий фенотип, связанный с Тау-патологией, включает, без ограничения, когнитивные нарушения, раннее изменение личности и растормаживание, апатию, абулию, мутизм, апраксию, персеверацию, стереотипные движения/поведение, гиперорализм, дезорганизацию, неспособность планировать или организовывать последовательно задачи, эгоизм/черствость, антисоциальные черты, отсутствие эмпатии, запинание, неграмотную речь с частыми парафазическими ошибками, но относительно сохраненным пониманием, нарушение понимания и дефицит в поиске слов, медленно прогрессирующую нестабильность походки, ретропульсацию, застывание, частые падения, не отвечающую на леводопу осевую ригидность, надъядерный паралич взгляда, квадратные осцилляции, медленные вертикальные саккады, псевдобульбарный паралич, апраксию конечности, дистонию, кортикальную сенсорную потерю и тремор.
В соответствии со способами по данному изобретению в одном варианте осуществления данного изобретения иммуногенный Тау-пептид или комбинацию иммуногенных Тау-пептидов вводят нуждающемуся субъекту. Подходящие иммуногенные Тау-пептидные фрагменты Тау-белка содержат один или более антигенных эпитопов, которые имитируют патологическую форму Тау-белка. Иллюстративные иммуногенные эпитопы Тау фосфорилированы по одной или более аминокислотам, которые фосфорилированы в патологической форме Тау, но не фосфорилированы в нормальной или непатологической форме Тау.
В некоторых вариантах осуществления данного изобретения, введение иммуногенного Тау-пептида индуцирует активный иммунный ответ у субъекта на иммуногенный Тау-пептид и на патологическую форму Тау, тем самым облегчая клиренс связанных агрегатов Тау, замедляя прогрессирование поведения, связанного с Тау-патологией, и лечение основной тауопатии. В соответствии с этим аспектом данного изобретения иммунный ответ включает развитие эффективного гуморального (опосредованного антителами) и/или клеточного (опосредованного антиген-специфическими Т-клетками или их продуктами секреции) ответа, направленного против иммуногенного Тау-пептида.
Наличие гуморального иммунологического ответа можно определить и контролировать путем тестирования биологического образца (например, крови, плазмы, сыворотки, мочи, слюны, ЦСЖ или лимфатической жидкости) от субъекта на наличие антител, направленных на иммуногенный Тау-пептид. Способы обнаружения антител в биологическом образце хорошо известны в данной области техники, например, ИФА, дот-блоттинг, ДСН-ПААГ гели или ELISPOT. Присутствие клеточно-опосредованного иммунологического ответа может быть определено с помощью анализов пролиферации (CD4+ T-клеток) или CTL (цитотоксических T-лимфоцитов) (cytotoxic T lymphocyte), которые хорошо известны в данной области техники.
Выделенные иммуногенные Тау-пептиды по данному изобретению включают любую одну из аминокислотных последовательностей из SEQ ID NO: 1-21 и 101-124 и 51-71 и 125-155 показаны в Таблицах 1 и 3 ниже. Аминокислотные остатки каждой последовательности, которые фосфорилированы, показаны жирным шрифтом и подчеркиванием. Названия пептидов в Таблице 1 соответствуют аминокислотному положению этих пептидов в пределах самой длинной изоформы Тау-белка человека, имеющей аминокислотную последовательность SEQ ID NO: 100, как показано в Таблице 8.
Конкретные варианты осуществления данного изобретения
(1) Тау-пептидная иммуногенная конструкция может быть представлена формулами:
(Th)m-(A)n-(фрагмент Тау)-X
или
(фрагмент Тау)-(A)n-(Th)m-X
где
Th представляет собой гетерологичный T-хелперный эпитоп;
А представляет собой гетерологичный спейсер;
(фрагмент Тау) представляет собой В-клеточный эпитоп, имеющий от около 15 до около 40 аминокислотных остатков из полноразмерного Тау-белка SEQ ID NO: 100;
X представляет собой α-COOH или α-CONH2 аминокислоты;
m составляет от 1 до около 4; и
n составляет от 0 до около 10.
(2) Тау-пептидная иммуногенная конструкция в соответствии с (1), в которой фрагмент Тау выбран из группы, состоящей из SEQ ID NO: 1-21 и 101-124.
(3) Тау-пептидная иммуногенная конструкция в соответствии с любым из (1) или (2), в которой Th-эпитоп выбран из группы, состоящей из SEQ ID NO: 22-50.
(4) Тау-пептидная иммуногенная конструкция в соответствии с (1), в которой пептидная иммуногенная конструкция выбрана из группы, состоящей из SEQ ID NO: 51-71 и 125-155.
(5) Тау-пептидная иммуногенная конструкция, содержащая:
В-клеточный эпитоп, содержащий от около 15 до около 40 аминокислотных остатков из полноразмерной последовательности Тау-белка из SEQ ID NO: 100;
Т-хелперный эпитоп, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 22-50; и
необязательный гетерологичный спейсер, выбранный из группы, состоящей из аминокислоты, Lys-, Gly-, Lys-Lys-Lys-, (α, ε-N)Lys, и ε-N-Lys-Lys-Lys-Lys (SEQ ID NO: 102),
при этом В-клеточный эпитоп ковалентно связан с Т-хелперным эпитопом напрямую или через необязательный гетерологичный спейсер.
(6) Тау-пептидная иммуногенная конструкция по (5), при этом В-клеточный эпитоп выбран из группы, состоящей из SEQ ID NO: 1-21 и 101-124.
(7) Тау-пептидная иммуногенная конструкция по (5), в которой Т-хелперный эпитоп выбран из группы, состоящей из SEQ ID NO: 22-50.
(8) Тау-пептидная иммуногенная конструкция по (5), в которой опциональный гетерологичный спейсер представляет собой (α, ε-N)Lys или ε-N-Lys-Lys-Lys-Lys (SEQ ID NO: 102).
(9) Тау-пептидная иммуногенная конструкция по (5), в которой Т-хелперный эпитоп ковалентно связан с N-концом В-клеточного эпитопа.
(10) Тау-пептидная иммуногенная конструкция по (5), в которой Т-хелперный эпитоп ковалентно связан с N-концом В-клеточного эпитопа через опциональный гетерологичный спейсер.
(11) Композиция, содержащая пептидную иммуногенную конструкцию в соответствии с любым из (1) - (4).
(12) Фармацевтическая композиция, содержащая:
а. пептидную иммуногенную конструкцию в соответствии с любым из (1) - (4); и
b. и фармацевтически приемлемый носитель для доставки и/или адъювант.
(13) Фармацевтическая композиция по (12), в которой
а. Тау-пептидная иммуногенная конструкция выбрана из группы, состоящей из SEQ ID NO: 51-71 и 125-155; и
b. Тау-пептидная иммуногенная конструкция смешивается с CpG-олигодезоксинуклеотидом (ODN) для образования стабилизированного иммуностимулирующего комплекса.
(14) Выделенное антитело или его эпитоп-связывающий фрагмент, которые специфически связываются с В-клеточным эпитопом Тау-пептидной иммуногенной конструкции в соответствии с любым из (1) - (10).
(15) Выделенное антитело или его эпитоп-связывающий фрагмент в соответствии с (14), связанные с Тау-пептидной иммуногенной конструкцией.
(16) Выделенное антитело или его эпитоп-связывающий фрагмент, который специфически связывается с В-клеточным эпитопом Тау-пептидной иммуногенной конструкции в соответствии с любым из (1) - (10).
(17) Композиция, содержащая выделенное антитело или его эпитоп-связывающий фрагмент в соответствии с любым из (14) - (16).
Пример 1
АНТИТЕЛА, ОБРАЗОВАННЫЕ В ОТВЕТ НА НЕФОСФОРИЛИРОВАННЫЕ ТАУ-ПЕПТИДНЫЕ ИММУНОГЕННЫЕ КОНСТРУКЦИИ, И ПРОФИЛИ СВЯЗЫВАНИЯ
а. Синтез фрагментов Тау и иммунизации
Способы синтеза сконструированных фрагментов Тау, которые были включены в процесс разработки нефосфорилированных и фосфорилированных Тау-пептидных иммуногенных конструкций, описаны в Подробном описании. Как правило, пептиды синтезировали в небольших масштабах для серологических анализов, в лабораторных экспериментальных масштабах для полевых или клинических исследований, а также в больших масштабах (килограмм) для промышленного/коммерческого производства фармацевтических композиций. Большой репертуар Тау-связанных антигенных пептидов B-клеточных эпитопов, имеющих последовательности с длинами от приблизительно 10 до приблизительно 40 аминокислот, был разработан для обширного серологического скрининга и отбора в качестве кандидата B-клеточного эпитопа для включения в дизайн Тау-пептидных иммуногенных конструкций для иммуногенности и функционального тестирования для использования в составе Тау вакцины.
Полноразмерный Тау (Таблица 8), использованный в качестве рекомбинантного белка в этих серологических исследованиях, был приобретен у компании rPeptide (Тау-441, T-1001-2). Сегменты Тау-пептида, используемые для картирования эпитопа в различных серологических анализах, указаны в Таблице 1 (SEQ ID NO: 1-21 и 101-124). Выбранные сегменты Тау-пептида были превращены в Тау-пептидные иммуногенные конструкции путем синтетического связывания Тау-пептидов с тщательно сконструированным T-хелперным клеточным (Th) эпитопом , полученным из патогенных белков, включая слитый белок вируса кори (MVF), белок поверхностного антигена гепатита B (HBsAg), гриппа, Clostridum tetani и вирус Эпштейна-Барра (EBV). Сконструированные Th-эпитопы показаны в Таблице 2 (SEQ ID NO: 22-50).
Составы с использованием эмульсий вода-в-масле и в суспензии с минеральными солями готовили, как описано в Подробном описании. При разработке подходящей фармацевтической композиции, которая будет использоваться большой популяцией с целью предотвращения заболевания, важно учитывать безопасность композиции. Несмотря на использование эмульсий вода-в-масле у людей для многих фармацевтических композиций в клинических испытаниях, квасцы остаются основным адъювантом для применения в фармацевтической композиции благодаря их безопасности. Квасцы или их минеральные соли, такие как ADJUPHOS (фосфат алюминия), часто используются в качестве адъювантов при подготовке к клиническому применению. Нефосфорилированные Тау-пептидные иммуногенные конструкции получали (i) в эмульсии вода-в-масле с Seppic MONTANIDE™ ISA 51 в качестве одобренного масла для использования для человека, или (ii) в смеси с минеральными солями ADJUPHOS (фосфат алюминия) или ALHYDROGEL (квасцы) в различных количествах пептидных конструкций, как указано. Композиции обычно готовили путем растворения Тау-пептидных иммуногенных конструкций в воде в концентрации около 400 мкг/мл и смешивали с MONTANIDE™ ISA 51 в эмульсии вода-в-масле (1:1 по объему) или с минеральными солями (1:1 по объему). Композиции выдерживали при комнатной температуре в течение около 30 минут и перемешивали прибором для перемешивания в течение около 10-15 секунд до иммунизации. Некоторых животных иммунизировали более чем одной дозой определенной композиции, которую вводили в моменты времени 0 (прайм) и через 3 недели после начальной иммунизации (нпи) (бустер) и, необязательно, при 6 нпи для повторного стимулирования внутримышечным путем. Затем этих иммунизированных животных тестировали с выбранным пептидом(ами) В-клеточного эпитопа для оценки иммуногенности различных Тау-пептидных иммуногенных конструкций, присутствующих в составе, а также их перекрестной реактивности с соответствующими пептидами или белками-мишенями. Эти Тау-пептидные иммуногенные конструкции с сильной иммуногенностью при первоначальном скрининге у морских свинок затем дополнительно тестировали как в эмульсии вода-в-масле, так и в минеральных солях и в составах на основе квасцов у приматов для схем применения в течение определенного периода, как предписано протоколами иммунизации.
Нефосфорилированные Тау-пептидные иммуногенные конструкции (SEQ ID NO: 52, 54, 56, 58, 61, 63, 65, 67, 69 и 71), растворенные в растворителе (ISA 51 VG, CpG3 50 мкг/мл, 0,2% Твин®-80), инъецировали морским свинкам согласно указанной схеме с иммунными сыворотками, собранными для обширных серологических анализов.
b. Анализы методом ИФА и результаты
Сыворотку от иммунизированных животных собирали в различные моменты времени после начальной иммунизации, и профили связывания первоначально анализировали с помощью ИФА для определения иммуногенности соответствующей конструкции против ее собственного В-клеточного эпитопа-мишени. Оценку серологической перекрестной реактивности среди Тау-пептидов из других функциональных участков была тщательно выполнили с помощью ИФА с планшетами, покрытыми различными пептидами, выбранными из тех, которые показаны в Таблицах 9a-9e.
Протоколы ИФА были разработаны для оценки образцов иммунной сыворотки и описаны в следующих Примерах. Вкратце, лунки 96-луночных планшетов покрывали по отдельности в течение 1 часа при 37 °С 100 мкл Тау-пептидными фрагментами-мишенями A145-P160, P172-P189, P182-P200, S195-P213, R209-L224, V228-L243, K257-K274, R379-L408, V275-K311 и V393-L425 пептидов (SEQ ID NO: 2, 4, 6, 8, 11, 13, 15, 17, 19 и 21, соответственно) в концентрации 2 мкг/мл (если не указано иное), в 10 мМ буфере NaHCO3, рН 9,5 (если не указано иное). Лунки с пептидным покрытием инкубировали с 250 мкл 3% по весу желатина в PBS при 37 °С в течение 1 часа для блокирования сайтов неспецифического связывания белка, после чего три раза промывали PBS, содержащим 0,05% по объему Твин® 20, а затем сушили. Анализируемые сыворотки разбавляли 1:20 (если не указано иное) с PBS, содержащим 20% по объему нормальной козьей сыворотки, 1% по весу желатина и 0,05% по объему Твин® 20. Сто микролитров (100 мкл) разбавленных образцов (например, сыворотки, плазмы) добавляли в каждую лунку и оставляли реагировать в течение 60 минут при 37 °С. Затем лунки шесть раз промывали 0,05% по объему Твин® 20 в PBS с целью удаления несвязанных антител. Конъюгированное с пероксидазой хрена (HRP) специфическое к виду (например, мыши, морской свинки или человека) козье анти-IgG использовали в качестве меченого индикатора для связывания с комплексом антитело/пептидный антиген, образованным в положительных лунках. Сто микролитров (100 мкл) меченого пероксидазой козьего анти-IgG в предварительно титрованном оптимальном разведении и в 1% по объему нормальной козьей сыворотке с 0,05% по объему Твин® 20 в PBS добавляли в каждую лунку и инкубировали при 37 °С еще 30 минут. Лунки промывали шесть раз 0,05% по объему Твин® 20 в PBS для удаления несвязанного антитела и в них проводили реакцию со 100 мкл смеси субстратов, содержащей 0,04% по весу 3', 3', 5', 5'-тетраметилбензидина (TMB) и 0,12% по объему перекиси водорода в натрий-цитратном буфере в течение еще 15 минут. Эту субстратную смесь использовали для обнаружения метки пероксидазы путем формирования окрашенного продукта. Реакции останавливали добавлением 100 мкл 1,0 М H2SO4 и определяли оптическую плотность при 450 нм (А450). Для определения титров антител иммунизированных животных, которые получали различные пептидные иммуногены, полученные из Тау, были протестированы 10-кратными серийными разведениями сывороток от 1:100 до 1:10000, и титр тестируемой сыворотки, выраженный как Log10, был рассчитан путем линейного регрессионного анализа A450 с отсечкой A450, установленной на 0,5. Результаты ИФА, показанные в Таблицах 9a-9e, были дополнительно проанализированы путем построения графиков на гистограммах, как показано на Фиг. 1A.
В целом, было обнаружено, что высокая иммуногенность ассоциирована с каждой из выбранных Тау-пептидных конструкций при тестировании против ее собственного B-клеточного эпитопа (Таблицы 9a-9e и Фиг. 1A). Высокая перекрестная реактивность была обнаружена с антителами, образованными в ответ на пептидные иммуногенные конструкции из SEQ ID NO: 52, 54, 56, 58 и 61 (см. Фиг. 1A).
Интересно, что SEQ ID NO: 65, которая содержит B-клеточный эпитоп K257-K274 (SEQ ID NO: 15), оказалась высокоиммуногенной последовательностью среди сконструированных Тау-пептидных конструкций, однако антитела, образованные в ответ на эту конструкцию, были наиболее специфичными без значительной перекрестной реактивности с любым другим В-клеточным эпитопом (см. Фиг. 1А). Напротив, Тау-пептидная иммуногенная конструкция из SEQ ID NO: 67, которая содержит B-клеточный эпитоп R379-L408 (SEQ ID NO: 17), была наиболее иммуногенной, имела высокую реактивность с собственным B-эпитопом, но также имела приемлемую перекрестную реактивность с другими тау B-клеточными эпитопами (см. Фиг. 1A).
Пример 2
АНТИТЕЛА, ОБРАЗОВАННЫЕ В ОТВЕТ НА ФОСФОРИЛИРОВАННЫЕ ТАУ-ПЕПТИДНЫЕ ИММУНОГЕННЫЕ КОНСТРУКЦИИ, И ПРОФИЛИ СВЯЗЫВАНИЯ
Антитела, образованные против фосфорилированных Тау-пептидных иммуногенных конструкций, оценивали по их способности связываться с их фосфорилированными В-клеточными эпитопами с помощью ИФА через 6 недель после начальной иммунизации (нпи).
а. Иммунизации
Фосфорилированные Тау-пептидные иммуногены (SEQ ID NO: 51, 53, 55, 57, 59, 60, 62, 64, 66, 68 и 70) были составлены и введены морским свинкам при тех же условиях, которые обсуждались в Примере 1 для нефосфорилированных Тау-пептидных иммуногенов. Составы, содержащие фосфорилированные Тау-пептидные иммуногены, вводили через 0, 3 и 6 нпи.
b. Анализы методом ИФА и результаты
Вкратце, лунки 96-луночных планшетов покрывали по отдельности в течение 1 часа при 37 °С 100 мкл Тау-пептидных фрагментов-мишеней A145-P160, P172-P189, P182-P200, S195-P213, R209-L224, V228-L243, K257-K274, R379-L408, V275-K311 и V393-L425 пептидов (SEQ ID NO: 1, 3, 5, 7, 9, 10, 12, 14, 16, 18 и 20, соответственно) в концентрации 2 мкг/мл (если не указано иное), в 10 мМ буфере NaHCO3, рН 9,5 (если не указано иное). Лунки с пептидным покрытием инкубировали с 250 мкл 3% по весу желатина в PBS при 37 °С в течение 1 часа для блокирования сайтов неспецифического связывания белка, после чего три раза промывали PBS, содержащим 0,05% по объему Твин® 20, а затем сушили. Анализируемые сыворотки разбавляли 1:20 (если не указано иное) с PBS, содержащим 20% по объему нормальной козьей сыворотки, 1% по весу желатина и 0,05% по объему Твин® 20. Сто микролитров (100 мкл) разбавленных образцов (например, сыворотки, плазмы) добавляли в каждую лунку и оставляли реагировать в течение 60 минут при 37 °С. Затем лунки шесть раз промывали 0,05% по объему Твин® 20 в PBS с целью удаления несвязанных антител. Конъюгированное с пероксидазой хрена (HRP) специфическое к виду (например, мыши, морской свинки или человека) козье анти-IgG использовали в качестве меченого индикатора для связывания с комплексом антитело/пептидный антиген, образованным в положительных лунках. Сто микролитров (100 мкл) меченого пероксидазой козьего анти-IgG в предварительно титрованном оптимальном разведении и в 1% по объему нормальной козьей сыворотке с 0,05% по объему Твин® 20 в PBS добавляли в каждую лунку и инкубировали при 37°С еще 30 минут. Лунки промывали шесть раз 0,05% по объему Твин® 20 в PBS для удаления несвязанного антитела и в них проводили реакцию со 100 мкл смеси субстратов, содержащей 0,04% по весу 3', 3', 5', 5'-тетраметилбензидина (TMB) и 0,12% по объему перекиси водорода в натрий-цитратном буфере в течение еще 15 минут. Эту субстратную смесь использовали для обнаружения метки пероксидазы путем формирования окрашенного продукта. Реакции останавливали добавлением 100 мкл 1,0 М H2SO4 и определяли оптическую плотность при 450 нм (А450). Для определения титров антител иммунизированных животных, которые получали различные пептидные иммуногены, полученные из Тау, были протестированы 10-кратными серийными разведениями сывороток от 1:100 до 1:10000, и титр тестируемой сыворотки, выраженный как Log10, был рассчитан путем линейного регрессионного анализа A450 с отсечкой A450, установленной на 0,5. Сыворотку от иммунизированных животных собирали в различные моменты времени после инъекции и профили связывания анализировали с помощью ИФА. Планшеты для ИФА покрывали различными фрагментами Тау, и результаты показаны в Таблицах 10a-10d.
Результаты ИФА, показанные в Таблицах 10a-10d, были дополнительно проанализированы путем построения графиков на гистограммах, как показано на Фиг. 1В. Подобные иммуногенные и серологические профили, включая перекрестную реактивность среди B-клеточных эпитопов, были обнаружены при использовании фосфорилированных Тау-пептидных конструкций в качестве иммуногенов.
Пример 3
АНТИТЕЛА, ОБРАЗОВАННЫЕВ ОТВЕТ НА ФОСФОРИЛИРОВАННЫЕ ТАУ-ПЕПТИДНЫЕ ИММУНОГЕННЫЕ КОНСТРУКЦИИ, И ПРОФИЛИ СВЯЗЫВАНИЯ ПРОТИВ ИХ НЕФОСФОРИЛИРОВАННЫХ ПЕПТИДНЫХ АНАЛОГОВ
Антитела, образованные против фосфорилированных Тау-пептидов, оценивали по их способности связываться с их соответствующим нефосфорилированным пептидом-аналогом с помощью ИФА через 6 недель после инъекции (нпи), как более подробно описано ниже.
а. Иммунизации
Фосфорилированные Тау-пептидные иммуногены (SEQ ID NO: 51, 53, 55, 57, 59, 60, 62, 64, 66, 68 и 70) были составлены и введены морским свинкам при тех же условиях, которые обсуждались в Примере 1 для нефосфорилированных Тау-пептидных иммуногенов.
b. Анализы методом ИФА и результаты
Вкратце, лунки 96-луночных планшетов покрывали по отдельности в течение 1 часа при 37 °С 100 мкл Тау-пептидными фрагментами-мишенями A145-P160, P172-P189, P182-P200, S195-P213, R209-L224, V228-L243, K257-K274, R379-L408, V275-K311 и V393-L425 пептидов (SEQ ID NO: 2, 4, 6, 8, 11, 13, 15, 17, 19 и 21, соответственно) в концентрации 2 мкг/мл (если не указано иное), в 10 мМ буфере NaHCO3, рН 9,5 (если не указано иное). Лунки с пептидным покрытием инкубировали с 250 мкл 3% по весу желатина в PBS при 37 °С в течение 1 часа для блокирования сайтов неспецифического связывания белка, после чего три раза промывали PBS, содержащим 0,05% по объему Твин® 20, а затем сушили. Анализируемые сыворотки разбавляли 1:20 (если не указано иное) с PBS, содержащим 20% по объему нормальной козьей сыворотки, 1% по весу желатина и 0,05% по объему Твин® 20. Сто микролитров (100 мкл) разбавленных образцов (например, сыворотки, плазмы) добавляли в каждую лунку и оставляли реагировать в течение 60 минут при 37 °С. Затем лунки шесть раз промывали 0,05% по объему Твин® 20 в PBS с целью удаления несвязанных антител. Конъюгированное с пероксидазой хрена (HRP) специфическое к виду (например, мыши, морской свинки или человека) козье анти-IgG использовали в качестве меченого индикатора для связывания с комплексом антитело/пептидный антиген, образованным в положительных лунках. Сто микролитров (100 мкл) меченого пероксидазой козьего анти-IgG в предварительно титрованном оптимальном разведении и в 1% по объему нормальной козьей сыворотке с 0,05% по объему Твин® 20 в PBS добавляли в каждую лунку и инкубировали при 37 °С еще дополнительных 30 минут. Лунки промывали шесть раз 0,05% по объему Твин® 20 в PBS для удаления несвязанного антитела и в них проводили реакцию со 100 мкл смеси субстратов, содержащей 0,04% по весу 3', 3', 5', 5'-тетраметилбензидина (TMB) и 0,12% по объему перекиси водорода в натрий-цитратном буфере в течение еще 15 минут. Эту субстратную смесь использовали для обнаружения метки пероксидазы путем формирования окрашенного продукта. Реакции останавливали добавлением 100 мкл 1,0 М H2SO4 и определяли оптическую плотность при 450 нм (А450). Для определения титров антител иммунизированных животных, которые получали различные пептидные иммуногены, полученные из Тау, были протестированы 10-кратными серийными разведениями сывороток от 1:100 до 1:10000, и титр тестируемой сыворотки, выраженный как Log10, был рассчитан путем линейного регрессионного анализа A450 с отсечкой A450, установленной на 0,5. Сыворотку от иммунизированных животных собирали в различные моменты времени после инъекции и профили связывания анализировали с помощью ИФА.
Планшеты для ИФА покрывали различными нефосфорилированными фрагментами Тау, и результаты показаны в Таблицах 11a-11e. Подобные серологические профили связывания были получены для всех антител, сформированных против фосфорилированных Тау-пептидных конструкций, когда иммунные сыворотки тестировали на соответствующих нефосфорилированных Тау-пептидах В-клеточного эпитопа. Из обширных исследований иммуногенности и серологических исследований, проведенных в Примерах 1, 2 и 3, ясно, что антитела, образованные в ответ на Тау-пептидные иммуногенные конструкции, проявляют сходные свойства. Большинство из этих свойств можно отнести к аминокислотным последовательностям. Оценка конформации с использованием исследований перекрестной реактивности показывает, что имелись лишь незначительные различия, вызванные фосфорилированием пептидов, что позволяет предположить, что у этих иммунных сывороток будут аналогичные функциональные свойства, вызываемые их соответствующими фосфорилированными против нефосфорилированных пептидных иммуногенных конструкций.
Пример 4
СВЯЗЫВАЮЩИЙ ПРОФИЛЬ АНТИТЕЛ, НАПРАВЛЕННЫХ ПРОТИВ НЕФОСФОРИЛИРОВАННЫХ ТАУ-ПЕПТИДНЫХ ИММУНОГЕНОВ
а. Специфичность антител против нефосфорилированного Тау, очищенных из антисыворотки морской свинки, иммунизированной различными Тау-пептидными иммуногенными конструкциями разных размеров
Морские свинки были иммунизированы нефосфорилированными Тау-пептидными иммуногенными конструкциями, как описано в Примере 1. Вестерн-блоттинг использовали для скрининга антител против нефосфорилированного Тау (анти-не-ф-Тау антител), очищенных из антисыворотки морской свинки, иммунизированной различными Тау-пептидными иммуногенными конструкциями, на специфичность связывания с молекулярным комплексом Тау разных размеров. Различные формы (мономеры, димеры, тримеры, олигомеры и полимеры) Тау (20 мкМ) разделяли на 12% трис-глициновом ДСН-ПААГ и переносили на нитроцеллюлозную (NC) (nitrocellulose) мембрану перед обработкой фотоиндуцированной сшивкой (PICUP). Мембрану инкубировали с анти-не-фТау антителами, очищенными из антисыворотки морских свинок в концентрации 1 мкг/мл, а затем инкубировали с конъюгированным с HRP ослиного антитела против иммуноглобулина морской свинки (706-035-148, Jackson). Блот визуализировали с помощью хемилюминесцентного реагента Western Lightning ECL Pro (PerkinElmer).
b. Результаты
Вестерн-блот анализ лизатов, содержащих мономеры, димеры, тримеры и олигомеры Тау, показаны на Фиг. 2 (левая панель). Мономерный Тау проявлялся в области около 60 кДа, а димер, тример, а также олигомеры проявлялись при их соответствующих молекулярных массах. Коммерческие моноклональные антитела мАт Тау 5 и мАт Тау 46 были способны обнаруживать мономерную и, в незначительной степени, димерную форму Тау (Фиг. 2, дорожки 1 и 2). мАт Тау5 использовали в качестве общего маркера Тау, а Тау46 в качестве маркера для Тау 404-441.
Антитела IgG, образованные в ответ на нефосфорилированные пептидные иммуногенные конструкции (SEQ ID NO: 52, 54, 56, 58, 61, 63, 65, 67, 69 и 71), обнаруживали мономеры, димеры, тримеры и олигомеры Тау с различной эффективностью (Фиг. 2, дорожки 4-13). Профили связывания для каждого антитела анализировали и количественно суммировали на гистограмме (Фиг. 2, правая панель). В целом, антитела, полученные из Тау-пептидных иммуногенных конструкций из С-концевого участка, были способны индуцировать образование антител с более высокими профилями предпочтительного связывания по сравнению с таковыми из N-концевого участка (данные не показаны).
Пример 5
АНТИТЕЛА, НАПРАВЛЕННЫЕ ПРОТИВ НЕФОСФОРИЛИРОВАННОГО ТАУ-ПЕПТИДНОГО ИММУНОГЕНА, ИНГИБИРУЮТ АГРЕГАЦИЮ ТАУ
а. Иммунизация и воздействие Тау
Животные были иммунизированы либо нефосфорилированными Тау иммуногенными конструкциями (SEQ ID NO: 52, 54, 56, 58, 61, 63, 65, 67, 69 и 71), как описано в Примере 1, или фосфорилированными Тау иммуногенными конструкциями (SEQ ID NO: 51, 53, 55, 57, 60, 62, 64, 66, 68 и 70) как описано в Примере 2.
Антитела, сформированные в результате иммунизации, затем подвергали воздействию образцов, содержащих коммерческий полноразмерный рекомбинантный белок Тау441, в условиях, которые способствуют агрегации Тау. β-листовые фибриллы Тау441 были сформированы с использованием 60 мкг Тау, агрегированных в 100 мкл 1xPBS с 10 ед./мл гепарина при 37°C в течение 7 дней, а затем перенесены на фильтры с порогом отсечения 300 кДа (Pall) при 4°C для выделения β-листовых фибрилл. Эти агрегации были подтверждены флуоресценцией Тиофлавин-T (ThT, Sigma).
Тау агрегировали в 200 мкл буфера PBS с гепарином в концентрации 5 мкМ в течение 3 дней с антителами IgG или без них, полученными из Тау-пептидных иммуногенных конструкций. После центрифугирования (13000 × g, 4 °C, 30 минут) агрегаты Тау собирали и подтверждали с помощью анализов ThT.
b. Результаты
Фиг. 3А содержит графики, показывающие уровень агрегации полноразмерного Тау (Тау441) в присутствии антител, направленных против фосфорилированных Тау пептидных иммуногенных конструкций, показанный над каждым графиком. Пунктирная линия, показанная на Фиг. 3А, представляет контрольный образец, который оценивал агрегацию Тау с использованием преиммунного IgG. Результаты показывают, что все антитела, направленные против фосфорилированных Тау-пептидных иммуногенов, ингибировали агрегацию Тау по сравнению с контрольным образцом преиммунной сыворотки. Антитела были способны ингибировать агрегацию Тау с различной скоростью.
На Фиг. 3В количественно представлен уровень агрегации полноразмерного Тау (Тау441) путем окрашивания ThT агрегатов в присутствии антител, направленных против нефосфорилированных Тау-пептидных иммуногенных конструкций, показанных под гистограммой. Результаты показывают, что антитела, направленные против нефосфорилированных Тау-пептидных иммуногенов, ингибируют агрегацию Тау по сравнению с контрольным образцом преиммунной сыворотки. Антитела были способны ингибировать агрегацию Тау с различной скоростью.
Результаты свидетельствуют о том, что при полимеризации Тау наблюдается более высокая анти-агрегационной способность при использовании Тау-пептидных иммуногенных конструкций, имеющих В-клеточные эпитопы ближе к С-концевому участку Тау.
Пример 6
АНТИТЕЛА, НАПРАВЛЕННЫЕ ПРОТИВ ТАУ-ПЕПТИДНЫХ ИММУНОГЕНОВ ИНИГИБИРУЮТ ТАУ АГРЕГАЦИЮ
а. Иммунизация и воздействие Тау
Животные были иммунизированы нефосфорилированными Тау иммуногенными конструкциями, как описано в Примере 1. Животные были иммунизированы фосфорилированными Тау иммуногенными конструкциями, как описано в Примере 2.
Антитела, образованные в результате иммунизации, затем подвергали воздействию клеточных лизатов из (а) нейрональных клеток, обработанных окадаиковой кислотой (ОКА) (клетки SH-SY5Y), как гиперфосфорилированные Тау, или (b) нейрональных клеток, не содержащих ОКА, как нефосфорилированные Тау. OKA добавляли в среду до конечной концентрации 100 нМ в течение трех часов в присутствии антисывороток через 6 и 9 нпи, чтобы определить дозозависимые эффекты антисывороток при ингибировании на агрегацию Тау.
b. Результаты
Фиг. 4 содержит графики, показывающие уровень агрегации Тау различных лизатов после воздействия антител, направленных против Тау-пептидных иммуногенов, показанных над каждым графиком. Уровень агрегации Тау измеряли путем окрашивания ThT агрегатов. Опять же, антитела как из фосфорилированных, так и нефосфорилированных Тау-пептидных иммуногенных конструкций были способны ингибировать агрегацию Тау, что согласуется с серологическим анализом, описанным в предыдущих Примерах.
Результаты свидетельствуют о том, что при полимеризации Тау наблюдается высокая анти-агрегационная способность с эпитопами Тау, полученными из центрального и С-концевого участка Тау.
Пример 7
ДЕЗАГРЕГАЦИЯ ПРЕДСТАВЛЕННЫХ ТАУ АГРЕГАТОВ ПОСЛЕ ВОЗДЕЙСТВИЯ АНТИТЕЛ, НАПРАВЛЕННЫХ ПРОТИВ ТАУ-ПЕПТИДНЫХ ИММУНОГЕНОВ
а. Иммунизация и воздействие предварительно сформированных агрегатов Тау
Животные были иммунизированы нефосфорилированными Тау иммуногенными конструкциями, как описано в Примере 1. Животные были иммунизированы фосфорилированными Тау иммуногенными конструкциями, как описано в Примере 2.
Антитела, образованные в результате иммунизации, затем подвергали воздействию предварительно сформированных Тау-фибрилл. Предварительно образованные агрегаты Тау затем инкубировали с или без антител против ф-Тау или антител против не-ф-Тау, очищенных из антисыворотки морских свинок, в течение 2 и 4 дней. После инкубации агрегаты собирали после центрифугирования при 13000 × g при 4°С в течение 30 минут и затем количественно определяли с помощью анализа ThT.
b. Результаты
Фиг. 5 содержит графики, показывающие уровень дезагрегации Тау после воздействия антител, направленных против Тау-пептидных иммуногенов (репрезентативные пептидные конструкции из SEQ ID NO: 66 и 67), как показано выше на Фиг. 5 (правая панель). Уровень агрегации Тау измеряли окрашиванием ThT и вестерн-блоттингом.
Данные как вестерн-блоттинга, так и анализа ThT показывают, что анти-не-ф/ф-Тау 379-408 IgG, индуцируемые из SEQ ID NO: 67 и 66, соответственно, обладают способностью нарушать агрегацию рекомбинантных Тау-фибрилл.
Пример 8
ДОТ-БЛОТ АНАЛИЗ ДЛЯ СПЕЦИФИЧЕСКОГО СВЯЗЫВАНИЯ НЕДЕНАТУРИРОВАННЫХ ФОРМ ТАУ ФИБРИЛЛ, ОЛИГОМЕРОВ И МОНОМЕРОВ ТАУ С ПОМОЩЬЮ РЕПРЕЗЕНТАТИВНЫХ АНТИТЕЛ, ОБРАЗОВАННЫХ КАК ФОСФОРИЛИРОВАННЫМИ ТАУ, ТАК И НЕФОСФОРИЛИРОВАННЫМИ ТАУ-ПЕПТИДНЫМИ ИММУНОГЕННЫМИ КОНСТРУКЦИЯМИ.
а. Иммунизация, вестерн-блот и дот-блот анализ профилей связывания анти-Тау антител
Животные были иммунизированы нефосфорилированными Тау иммуногенными конструкциями, как описано в Примере 1. Животные были иммунизированы фосфорилированными Тау иммуногенными конструкциями, как описано в Примере 2.
Различные виды Тау-белка (то есть α-спиральные мономеры, β-листовые мономеры, β-листовые олигомеры и β-листовые фибриллы) получали, как описано в Примере 5. Вестерн-блот и дот-блот анализы с различными видами Тау-белка проводили с использованием анти-ф-Тау антител или анти-не-ф-Тау антител, очищенных из антисыворотки морской свинки, иммунизированных различными Тау-пептидными иммуногенными конструкциями, в качестве первичных антител. Различные формы β-листовых фибрилл, олигомеров, мономеров, α-спиральных мономеров и других контрольных реагентов были нанесены на блот для точного специфического контроля. Подробные процедуры приготовления этих реагентов для серологического тестирования и оценки описаны дополнительно в Примере 11.
b. Результаты
Фиг. 6 (левая панель) содержит вестерн-блот анализ (в денатурирующих условиях) анти-ф-Тау IgG, продуцируемого Тау-пептидными иммуногенами (SEQ ID NO: 59, 66 и 70) и анти-не-ф-Тау IgG, продуцируемого Тау-пептидным иммуногеном (SEQ ID NO: 67). Результаты вестерн-блоттинга показывают, что анти-ф-Тау IgG, направленные против C-концевого конца Тау, специфически распознают агрегат Тау с высокой молекулярной массой, но не мономер Тау.
Фиг. 6 (правая панель) содержит дот-блот анализ (в неденатурирующих условиях) анти-ф-Тау и анти-не-ф-Тау IgG, продуцируемых Тау-пептидными иммуногенами из SEQ ID NO: 66 и 67, соответственно. Результаты показывают, что оба анти-не-ф-/ф-Тау379-408 IgG обладают специфическим связыванием с различными формами Тау, но не с другими амилоидогенными белками (то есть Aβ1-42 и альфа-синуклеином). Кроме того, по сравнению с моноклональным антителом мАт Тау 5 и другими IgG против не-С-концевого участка Тау, анти-ф-/анти-не-ф-Тау379-408 IgG, полученные по данному изобретению (SEQ ID NO: 66 и 67, соответственно) имеют более высокое сродство к фибриллам и олигомерам, чем к мономерам. Кроме того, анти-ф-Тау379-408 IgG не связывается с β-листовыми мономерами.
Пример 9
ПРОФИЛИ СВЯЗЫВАНИЯ ТКАНЕЙ АНИТЕЛ, НАПРАВЛЕННЫХ ПРОТИВ ТАУ-ПЕПТИДНЫХ ИММУНОГЕНОВ
а. Иммунизация и окрашивание тканей
Животные были иммунизированы нефосфорилированными Тау иммуногенными конструкциями, как описано в Примере 1. Животные были иммунизированы фосфорилированными Тау иммуногенными конструкциями, как описано в Примере 2.
Антитела, образованные в результате иммунизации, были затем использованы для окрашивания тканей здорового (нормального) мозга и мозга при болезни Альцгеймера (БА). Панель тканей человека (Pantomics) депарафинизировали ксилолом, регидратировали в этаноле и затем обрабатывали 0,25% раствором трипсина с 0,5% CaCl2 в PBS в течение 30 минут и инкубировали в 1% перекиси водорода в метаноле для блокирования активности эндогенной пероксидазы, а затем инкубировали с 10% Block Ace (Sigma) в PBS перед применением или анти-Тау 349-408 (SEQ ID NO: 66 или 67) или преиммунных сывороток к тканям. Срезы были разработаны с использованием 3-3'-диаминобензидина (DAB) (diaminobenzidine) и были окрашены гематоксилином перед микроскопическим исследованием.
b. Результаты
Фиг. 7 демонстрирует окрашивание изображений из этого эксперимента. Антитела, направленные против нефосфорилированных Тау 379-408 (SEQ ID NO: 67) и фосфорилированных Тау 379-408 (SEQ ID NO: 66), не имели перекрестной реактивности со срезами из нормальной ткани, но перекрестно реагировали на ткани мозга при болезни Альцгеймера. Антитело, направленное против фосфорилированного пептида (SEQ ID NO: 66), показало более сильное связывание в участке гиппокампа мозга при БА.
Пример 10
АНТИТЕЛА, ОБРАЗОВАННЫЕ В ОТВЕТ НА ТАУ-ПЕПТИДНЫЕ ИММУНОГЕННЫЕ КОНСТРУКЦИИ, И ИХ СОСТАВЫ: НЕЙРОПРОТЕКТИВНОЕ ВЛИЯНИЕ НА СНИЖЕНИЕ НЕЙРОДЕГЕНЕРАЦИИ, СПРОВОЦИРОВАННОЙ ЭКЗОГЕННЫМИ ТАУ-ФИБРИЛЛАМИ
С целью оценки нейропротективного действия анти-Тау антител, очищенных из антисыворотки морской свинки, иммунизированной различными Тау-пептидными иммуногенными конструкциями, была применена модель нейродегенерации in vitro с экзогенными, предварительно сформированными агрегатами Тау на NGF-обработанных, нейрон-дифференцированных клетках PC12.
Клетки РС12 обрабатывали NGF (100 нг/мл) в течение 6 дней для индукции дифференцировки нейронов. Морфологию нейронально-дифференцированных клеток подтверждали и анализировали с помощью высокопроизводительной системы визуализации cell3 iMager duos (Screen). Флуоресцеиновый краситель использовали для маркировки гибели клеток, и клетки подсчитывали с использованием программного обеспечения для подсчета клеток. Антитела, образованные в ответ на Тау-пептидные иммуногенные конструкции, были способны проникать в клетки и связываться с агрегатами Тау (данные не показаны). Нейротрофические эффекты NGF отражались на разрастании нейритов, и количество нейронально-дифференцированных клеток определялось количественно. Уровни разрастания нейритов и количество нейронально-дифференцированных клеток были показаны в процентах (среднее ± SEM) после нормализации. Длина нейритов клеток РС12 с обработкой NGF и без нее была принята за 100% и 0%, соответственно. Количество нейрон-дифференцированных клеток РС12 через 6 дней обработки NGF было нормализовано до 100%.
Нейродегенерацию наблюдали, добавляя экзогенные, предварительно сформированные агрегаты Тау, обработанные гепарином, в течение одной недели при 37°C на нейронально-дифференцированных клетках PC12. В присутствии предварительно сформированных агрегатов Тау длина нейрита укорачивалась, а количество клеток в нейронально-дифференцированных клетках РС12 уменьшалось. Эта нейродегенерация, вызванная Тау-фибриллами, была пропорциональна количеству экзогенных агрегатов Тау, добавленных в зависимости от концентрации. Коммерчески доступные анти-Тау антитела (например, мАт Тау 5 и мАт Тау46), но не антитела, очищенные из наивных морских свинок, ослабляли нейродегенерацию, вызванную Тау-фибриллами. Эта модель была принята в качестве платформы для скрининга, чтобы определить, какие анти-Тау антитела, очищенные из антисыворотки морской свинки, иммунизированной различными Тау-пептидными иммуногенными конструкциями, обладали нейропротекторными эффектами в восстановлении выживания нейронов в зависимости от концентрации (Фиг. 8A и B).
В результате анти-Тау антитела, очищенные из антисыворотки морской свинки, иммунизированной более чем половиной различных Тау-пептидных иммуногенных конструкций, восстанавливали рост нейритов. Тау-фибриллу обеспечивали в концентрации 5 мкг/мл, ранее оптимизированной для того, чтобы вызывать поражение (Фиг. 8А). Анти-Тау антитела, очищенные из антисыворотки морской свинки, иммунизированной фосфорилированными или нефосфорилированными Тау-пептидными конструкциями, защищали нейрон-дифференцированные клетки PC12 от гибели нейронов, вызванной Тау-фибриллой. На Фиг. 8B показаны данные анти-не-ф-Тау-антител, полученных в результате иммунизации из SEQ ID NO: 65, 67 и 69.
Результаты на Фиг. 8А и 8В показывают, что анти-Тау антитела (например, SEQ ID NO: 65, 67 и 69) способны защищать нейроны от нейротоксичности Тау-фибрилл. Антинейродегенеративные эффекты анти-Тау антител, образованных в ответ на Тау-пептидные иммуногенные конструкции (SEQ ID NO: 65, 67 и 69), наблюдали и количественно определяли посредством расчета с помощью программного обеспечения Cell3 Imager duos (Miteklab) для количества выживших клеток в культуре.
Что касается нейропротекции анти-Тау антителами посредством оценки функционального анализа in vitro, было показано, что нуклеация Тау in vitro может заметно уменьшить патологию и улучшить когнитивные функции in vivo, как сообщают Yanamandra, K, et al. (Neuron 80:402-414, 2013). Мономер Тау считается нативно неструктурированным и может не иметь большой функциональной роли в агрегации Тау и связанной с этим цитотоксичности клеток. Недавние результаты показывают, что начало патологической агрегации может начинаться с превращения мономера Тау из инертной формы в способную к нуклеации форму (Mirbaha, H., et al., ELife 2018; 7: e36584; doi: 10.7554/eLife.36584). Основываясь на этих результатах, мы проверили анти-Тау антитела, образованные в ответ на Тау-пептидные иммуногенные конструкции, на их способность снижать активность нуклеации. В частности, анти-Тау антитела, направленные против Тау-пептидных иммуногенных конструкций, инкубировали с гомогенатами головного мозга пациентов с болезнью Альцгеймера (БА) и обнаружили, что эти антитела обладают способностью снижать такую активность при нуклеации (данные не показаны). Наш обширный дизайн иммуногена на основе Тау, анализ иммуногенности и серологический способствовали разработке нейропротекторного вмешательства в качестве вакцин на молекулярном и серологическом уровнях для лечения тяжелых тауопатий.
Пример 11
ДОПОЛНИТЕЛЬНЫЕ СЕРОЛОГИЧЕСКИЕ АНАЛИЗЫ И РЕАГЕНТЫ
Серологические анализы и реагенты для оценки функциональной иммуногенности синтетических пептидных конструкций и их составов подробно описаны ниже.
а. Анализ точный специфичности и картирование эпитопа на фрагменты Тау с помощью тестов ИФА на основе пептида с кластером B-клеточных эпитопов
Анализ точный специфичности анти-Тау антител у иммунизированных хозяев определяли путем картирования эпитопов. Вкратце, лунки 96-луночных планшетов покрывали отдельными пептидами фрагмента Тау (SEQ ID NO: 115 и 156-171) из Тау 275-311 участка (SEQ ID NO: 19) для картирования, 0,5 мкг на 0,1 мл на лунку, а затем 100 мкл образцов сыворотки (разведение 1:100 в PBS) инкубировали в лунках планшета в двух экземплярах, следуя этапам метода ИФА антител, описанного выше. В-клеточный эпитоп Тау-пептидной иммуногенной конструкции и связанный с ним анализ точной специфичности иммунных сывороток анти-Тау антител у иммунизированных хозяев также тестировали с соответствующими Тау-пептидами (например, SEQ ID NO: 1-21, 101-124, как показано в Таблице 1, SEQ ID NO: 72-99, как показано в Таблицах 4-7, и SEQ ID NO: 100, как показано в Таблице 8) без последовательностей спейсера и Th, для дополнительной реактивности и подтверждения специфичности.
b. Оценка иммуногенности
Образцы преиммунной и иммунной сыворотки от животных собирали в соответствии с протоколами экспериментальной иммунизации и нагревали при 56 °С в течение 30 минут для инактивации факторов комплемента сыворотки. После введения Тау-пептидных иммуногенных конструкций образцы крови получали в соответствии с протоколами и оценивали их иммуногенность в отношении специфического сайта(ов)-мишени. Серийно разведенные сыворотки были протестированы, и положительные титры были выражены как Log10 кратности разведения. Иммуногенность конкретной Тау-пептидной иммуногенной конструкции оценивали по ее способности вызывать В-клеточный ответ с высоким титром, направленный против желаемой специфичности к эпитопу в пределах антигена-мишени, сохраняя при этом низкую или незначительную реактивность антител к «Т-хелперным клеточным эпитопам», используемым для обеспечения усиления желаемых B-клеточных ответов.
с. Получение агрегатов Тау (димеры, тримеры, олигомеры и фибриллы) с рекомбинантным Тау-белком
Для приготовления агрегированного Тау, очищенный рекомбинантный Тау-белок (0,1 мкг/мкл) в 100 мкл буфера агрегации PBS/KCl (2,5 мМ MgCl2, 50 мМ HEPES и 150 мМ KCl в 1 х PBS, pH 7,4) инкубировали при 37°C в пробирках Эппендорфа объемом 1,5 мл в течение 7 дней в термомиксере (Eppendorf) без встряхивания. Агрегированный Тау немедленно замораживали при -80 °С для последующего использования.
d. Очистка анти-Тау антител
Анти-Тау антитела очищали от сывороток, собранных через 3-15 недель после начальной иммунизации (нпи) морских свинок, иммунизированных Тау-пептидными иммуногенными конструкциями, содержащими пептиды различных последовательностей (SEQ ID NO: 51-71 и 125-155) с использованием аффинной колонки (Thermo Scientific, Рокфорд). Вкратце, после уравновешивания буфера (0,1 М фосфата и 0,15 М хлорида натрия, рН 7,2) в колонку Nab Protein G Spin добавляли 400 мкл сыворотки с последующим перемешиванием в течение 10 минут и центрифугированием при 5800 x g в течение 1 минуты. Колонку трижды промывали буфером для связывания (400 мкл). Впоследствии, в спин колонку добавляли элюирующий буфер (400 мкл, 0,1 М глицин, рН 2,0), чтобы элюировать антитела после центрифугирования при 5800 × g в течение 1 минуты. Элюированные антитела смешивали с нейтрализующим буфером (400 мкл, 0,1 М Трис, рН 8,0) и измеряли концентрации этих очищенных антител, используя Nan-Drop при ОП280, с БСА (бычий сывороточный альбумин) в качестве стандарта.
e. Специфичность анти-Тау антител, очищенных из антисыворотки морской свинки, иммунизированной различными Тау-пептидными иммуногенными конструкциями разных размеров
Вестерн-блоттинг использовали для скрининга анти-Тау антител, очищенных из антисыворотки морской свинки, иммунизированной различными конструкциями Тау-пептидных иммуногенов, на специфичность связывания с молекулярным комплексом Тау различных размеров. Различные формы Тау (20 мкМ) разделяли на 12% Трис-глициновом ДСН-ПААГ и переносили на нитроцеллюлозную (НЦ) мембрану перед обработкой фотоиндуцированной сшивкой (PICUP). Мембрану инкубировали с анти-Тау антителами, очищенными из антисыворотки морских свинок в концентрации 1 мкг/мл, а затем инкубировали с конъюгированным с HRP ослиного антитела против иммуноглобулина морской свинки (706-035-148, Jackson). Блот визуализировали с помощью хемилюминесцентного реагента Western Lightning ECL Pro (PerkinElmer). Посредством блоттинга определили, что мономерный Тау имеет размер около 60 кДа, в то время как димер, тример или олигомеры имели соответствующие молекулярные массы в несколько раз больше, чем мономерный Тау. Коммерческое антитело, которое способно обнаруживать различные олигомерные виды, такие как димеры, тримеры и более крупные олигомеры, например, мАт Тау 5 или мАт Тау 46, использовали в качестве положительного контроля.
f. Дот-блот анализ с различными видами амилоидогенных белков
Получение α-спиральных мономеров, β-листовых мономеров, β-листовых олигомеров и β-листовых фибрилл Aβ1-42, Тау и α-Syn описывается следующим образом.
1. Aβ1-42 α-спиральные мономеры: 20 мкг β-листовых мономеров Aβ1-42 (50 мкл) добавляли в 1xPBS, содержащий 20% трифторуксусной кислоты и 20% гексафторизопропанола (10 мкл), и инкубировали при 4°C в течение 24 часов с образованием α-спиральных мономеров.
2. Aβ1-42 β-листовые мономеры: 60 мкг Aβ1-42 в 120 мкл 1xPBS, содержащего 5% TFA, агрегированного при 37°C в течение 24 часов, переносили на фильтр с порогом отсечения 10 кДа (Millipore) для извлечения β-листовых мономеров.
3. Aβ1-42 β-листовые олигомеры: 60 мкг Aβ1-42 в 120 мкл 1xPBS, агрегированных при 37°C в течение 3 дней, обрабатывали ультразвуком на льду и переносили на фильтры с порогом отсечения 10 и 30 кДа (Millipore) для выделения β-листовых олигомерных фибрилл менее 35 кДа.
4. Aβ1-42 β-листовые фибриллы: 60 мкг Aβ1-42 в 120 мкл 1xPBS, агрегированных при 37°C в течение 3 дней, обрабатывали ультразвуком на льду и переносили на фильтры с порогом отсечения 30 кДа (Millipore) для выделения β-листовых фибрилл.
5. α-Syn α-спиральные мономеры: 40 мкг свежеприготовленного α-Syn растворяли в 100 мкл холодного 1xPBS при 4°C и сразу же переносили на фильтр с порогом отсечения 10 кДа (Millipore) для выделения α-спирального мономера.
6. α-Syn β-листовые мономеры: 40 мкг α-Syn, инкубированного в 100 мкл буфера PBS/KCl при 37°C в течение 24 часов, переносили на фильтр с порогом отсечения 10 кДа (Millpore) для выделения β-листовых мономеров.
7. α-Syn β-листовые олигомеры: 40 мкг α-Syn, агрегированного в 100 мкл буфера PBS/KCl при 37°C в течение 8 дней, обрабатывали ультразвуком на льду и затем переносили на фильтры с порогом отсечения 30 и 100 кДа для выделения β-листовых олигомеров.
8. α-Syn β-листовые фибриллы: 40 мкг α-Syn, агрегированного в 100 мкл буфера PBS/KCl при 37°C в течение 8 дней, обрабатывали ультразвуком на льду и затем переносили на фильтры с порогом отсечения 30 и 100 кДа для выделения β-листовых фибрилл.
9. Тау441 α-спиральные мономеры: 60 мкг Тау, приготовленного в 100 мкл 1xPBS при 4 °C, переносили на фильтр с порогом отсечения 100 кДа для выделения α-спиральных мономеров.
10. Тау441 β-листовые мономеры: 60 мкг Тау, агрегированных в 100 мкл 1xPBS с 10 ед./мл гепарина при 25°C в течение 48 часов, переносили на фильтр с порогом отсечения 100 кДа при 4°C для выделения β-листовых мономеров.
11. Тау441 β-листовые олигомеры: 60 мкг Тау, агрегированных в 100 мкл 1xPBS с 10 ед./мл гепарина при 37°C в течение 48 часов, переносили на фильтр с порогом отсечения 100 и 300 кДа (Pall) при 4°C для выделения β-листовых олигомеров.
12. Тау441 β-листовые фибриллы: 60 мкг Тау, агрегированных в 100 мкл 1xPBS с 10 ед./мл гепарина при 37°C в течение 6 часов, переносили на фильтр с порогом отсечения 300 кДа (Pall) при 4°C для выделения β-листовых фибрилл.
Эти мономеры и олигомеры были подтверждены флуоресценцией Тиофлавин-T (ThT, Sigma) или ПААГ (электрофорез в полиакриламидном геле). Концентрации амилоидогенных белков измеряли с помощью Nano-Drop с коммерческим амилоидогенным исходным раствором Aβ1-42 в качестве стандарта. Эти мономеры и олигомеры наносили по отдельности на PVDF-мембраны в количестве 3 мкг для Aβ1-42, 4 мкг для α-Syn и 7 мкг для Тау. Мембраны инкубировали с анти-Тау антителами, очищенными из антисыворотки морских свинок (разведение 1:1000) в качестве первичного антитела, с последующей гибридизацией со вторичным антителом, конъюгированным с HRP, против иммуноглобулина морской свинки (1:5000; Vector Laboratories). Мембраны обрабатывали субстратами Luminata Western HRP (Bio-Rad, г. Геркулес, штат Калифорния, США), а сигналы регистрировали с помощью системы цифровых изображений ChemiDoc-It 810 (UVP Inc., г. Апланд, штат Калифорния, США).
Пример 12
ЖИВОТНЫЕ, ИСПОЛЬЗУЕМЫЕ В ИССЛЕДОВАНИЯХ ИММУНОГЕННОСТИ И ЭФФЕКТИВНОСТИ
a. Морские свинки:
Исследования иммуногенности были проведены на зрелых, наивных, взрослых самцах и самках морских свинок Дункана-Хартли (300-350 г/вес тела). В экспериментах использовалось не менее 3 морских свинок на группу. Протоколы с участием морских свинок Дункана-Хартли (возраст 8-12 недель; Covance Research Laboratories, г. Денвер, штат Пенсильвания, США) были выполнены в соответствии с утвержденными заявками IACUC в контрактных вивариях, а также в United Biomedical, Inc. (UBI), в качестве спонсора.
Пример 13
ИДЕНТИФИКАЦИЯ СФОКУСИРОВАННОГО АНТИТЕЛЬНОГО ОТВЕТА, ВЫЗВАННОГО ТАУ-ПЕПТИДОЙ ИММУНОГЕННОЙ КОНСТРУКЦИЕЙ, К B-КЛЕТОЧНОМУ ЭПИТОПУ-МИШЕНИ: РЕПРЕЗЕНТАТИВНОЕ ИССЛЕДОВАНИЕ
В репрезентативном исследовании точного картирования эпитопов (Таблица 16) для определения сайта(ов) связывания антитела со специфическими остатками, образованного в ответ на Тау-пептидную иммуногенную конструкцию, направленного на его участок 275-311 Тау (SEQ ID NO: 19), перекрывающиеся пептиды с увеличивающейся длиной из этого участка (SEQ ID NO: 115 и 156-171) были синтезированы и по отдельности нанесены на лунки 96-луночного планшета для микротитрования в качестве твердофазных иммуноабсорбентов. Пептиды (0,5 мкг на 0,1 мл на лунку) наносили на планшеты, а затем 100 мкл образцов сыворотки (разведение 1:100 в PBS) инкубировали в лунках планшетов в двух экземплярах, следуя этапам метода ИФА антител, описанного выше.
Объединенную через 6 нпи антисывороткуморской свинки, направленная против Тау-пептидной иммуногенной конструкции SEQ ID NO: 68, добавляли в разведении 1:100 в буфере для разбавителя образца в лунки планшета, покрытые перекрывающимися Тау-пептидами из этого участка при 2,0 мкг/мл, и затем инкубировали в течение одного часа при 37 °С. После промывки лунок планшета промывочным буфером добавляют белок A/G, конъюгированный с пероксидазой хрена, и инкубируют в течение 30 мин. После повторного промывания PBS субстрат добавляют в лунки для измерения оптической плотности при 450 нм с помощью планшет-ридера ИФА, образцы которого анализируют в двух экземплярах. Связывание антисыворотки с соответствующим длинным Тау-пептидом B-эпитопной иммуногенной конструкции представляет максимальное связывание.
Как показано в Таблице 16, объединенные через 6 нпи иммунные сыворотки морских свинок продемонстрировали профиль высокой точности связывания, при котором два Тау-пептида с SEQ ID NO: 164 и 115, имеющие только две аминокислоты, отличающиеся по длине, но более длинный пептид SEQ ID NO: 115 был способен представить сильный эпитоп Тау из этого участка гиперфосфорилирования и агрегации. Однако объединенные иммунные сыворотки не были способны распознавать пептид SEQ ID NO: 164 из-за делеции двух N-концевых аминокислот (I297 и K298), что указывает на то, что эти две аминокислоты имеют решающее значение для представления этом участке в качестве иммунодоминантного эпитопа.
Этот участок был предметом дальнейшей тщательной разработки Тау-пептидных конструкций для исследований иммуногенности, как показано в Таблицах 12, 13a, 13b и 15, включая пептидные иммуногенные конструкции, включающие транс-конформацию пролина в положении 301 для оценки иммуногенности. В целом, высокая иммуногенность была обнаружена с помощью тщательно разработанных Тау-пептидных иммуногенных конструкций SEQ ID NO: 126-132, 135, 136, 140 и 141 за исключением SEQ ID NO: 128 в этом участке гиперфосфорилирования и агрегации.
Дополнительные Тау-пептидные иммуногенные конструкции использовали для участка «нечеткой оболочки» Тау, которая расположена в N-концевом участке, которая часто удаляется из изомеров Тау. Тау-пептидные иммуногенные конструкции из этого участка (SEQ ID NO: 137-139), как показано в Таблице 3, также были сконструированы и оценены на предмет их соответствующей иммуногенности.
В Таблице 14 показано, что Тау-пептидные иммуногенные конструкции из участка нечеткой оболочки были высокоиммуногенными. Эти результаты позволяют предположить, что Тау-пептидные иммуногенные конструкции из N-концевого участка нечеткой оболочки могут быть полезны для включения в композицию для выявления антител для предотвращения агрегации Тау в дополнение к потенциальному снижению инициации нуклеации мономерного Тау, ведущего к агрегации Тау.
Таблица 1
Аминокислотные последовательности фрагментов Тау и фосфо-Тау (фТау) (pTau)
(pT149/pT153)
(pT175/pT181/pS185)
(pS184/pY197)
(pS198/pS208/pS210)
(pS199/pS202/pT205)
(pT212/pS214/pT217)
(pT231/pS235/pS238)
(pS262)
(pS396/pS404)
*P301->S
(pS293/pS301)
(pS396/pS404/pS422)
1 Фосфорилированные остатки выделены жирным шрифтом и подчеркнуты
Таблица 2
Аминокислотные последовательности Th-эпитопов, полученных из патогенных белков, включая идеализированные искусственные Th-эпитопы для использования в разработке Тау-пептидных иммуногенных конструкций
T RT TR T
RRRIKII RII I L IR
VRVV VV V I V
F FF FF F V F
F
T RT TR
FFLL L ITTI

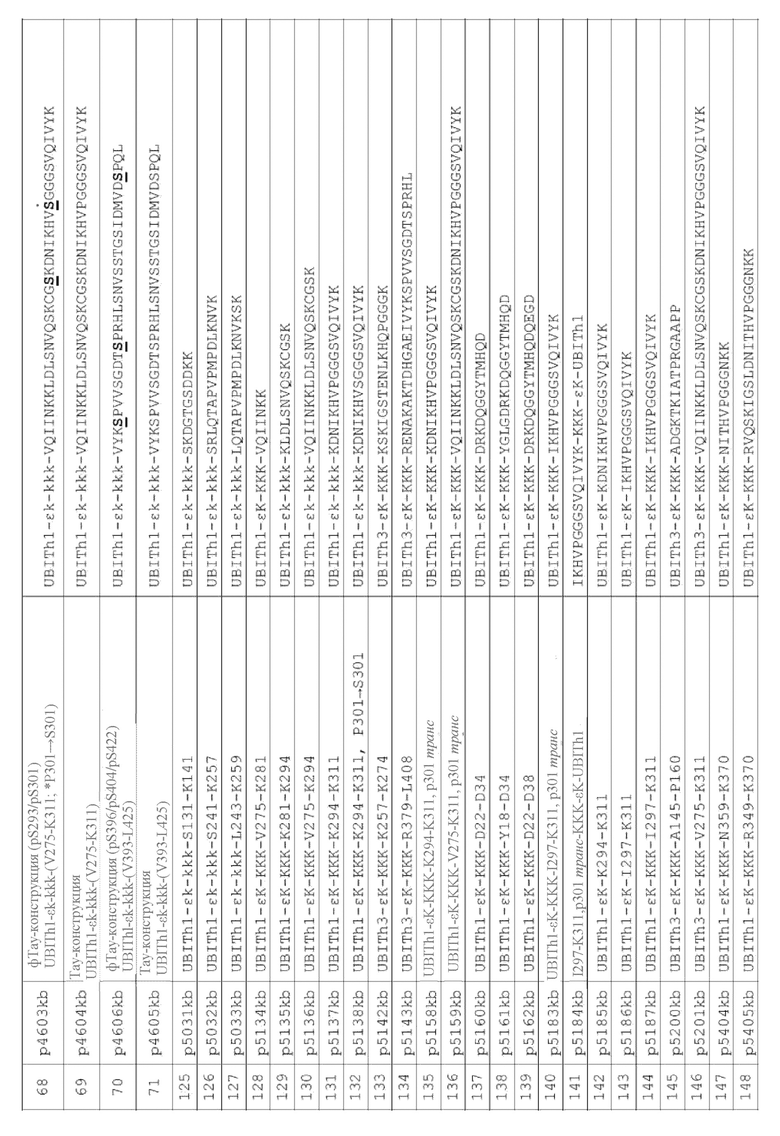
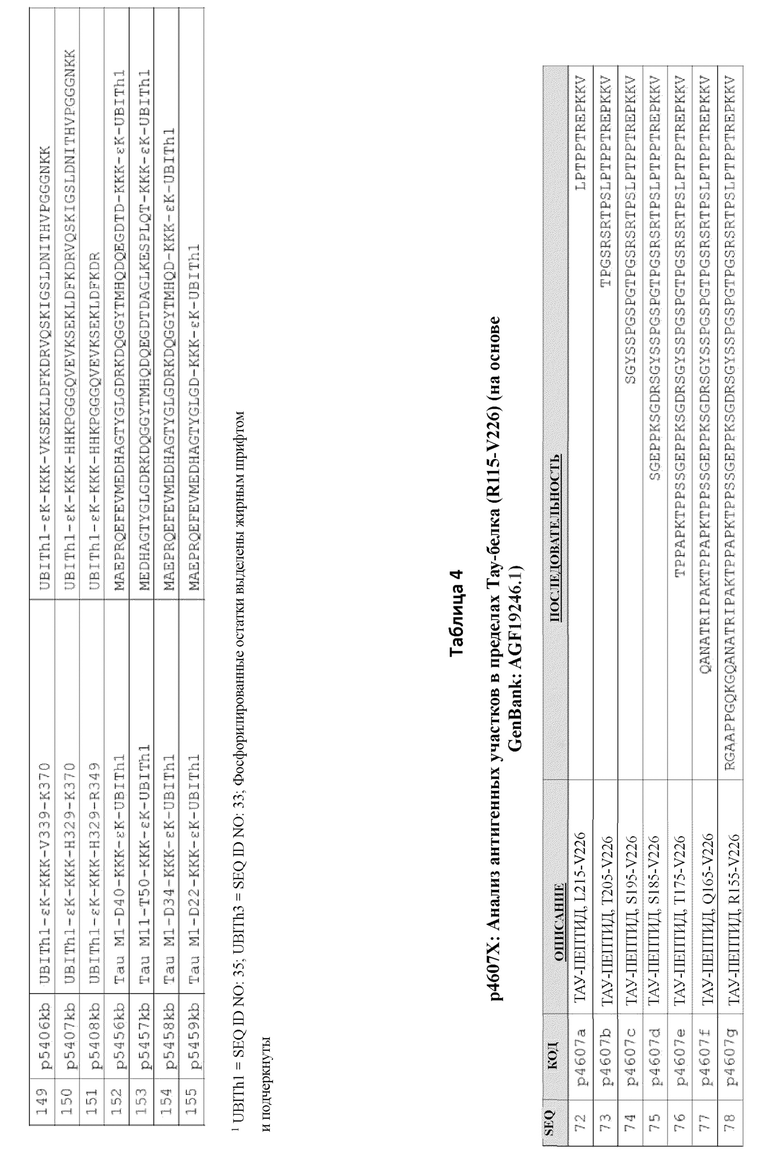
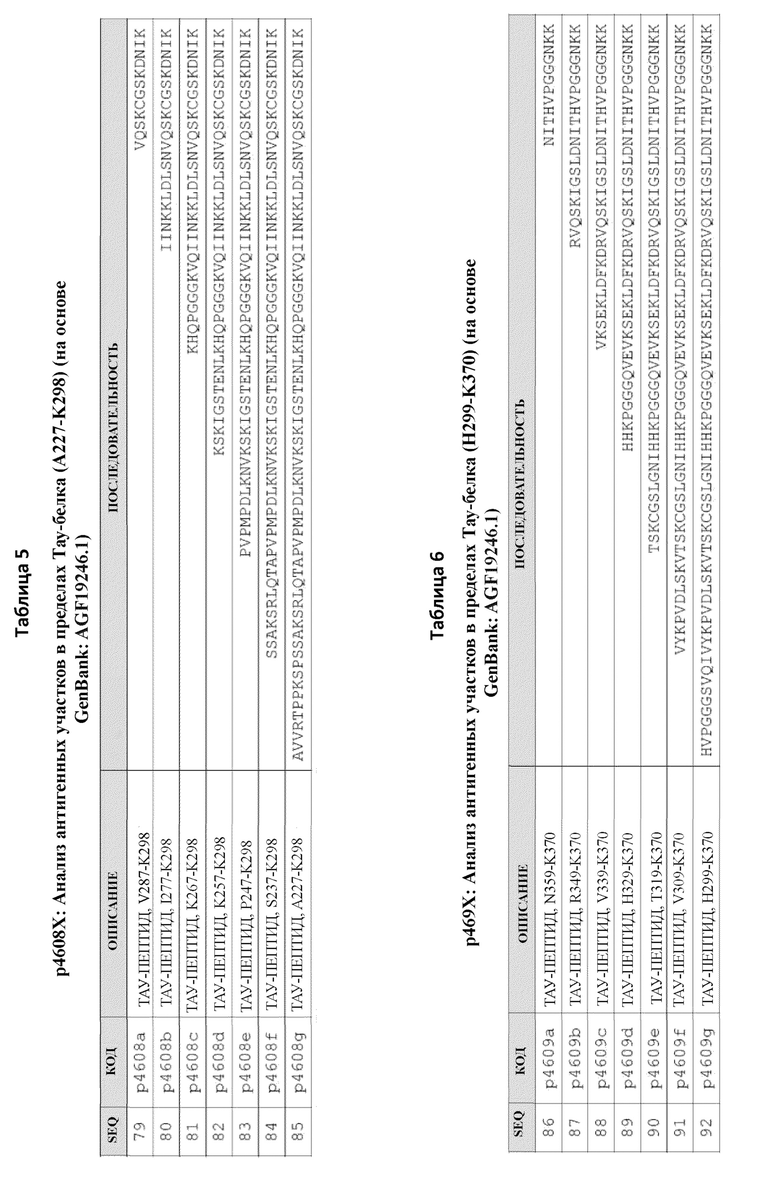
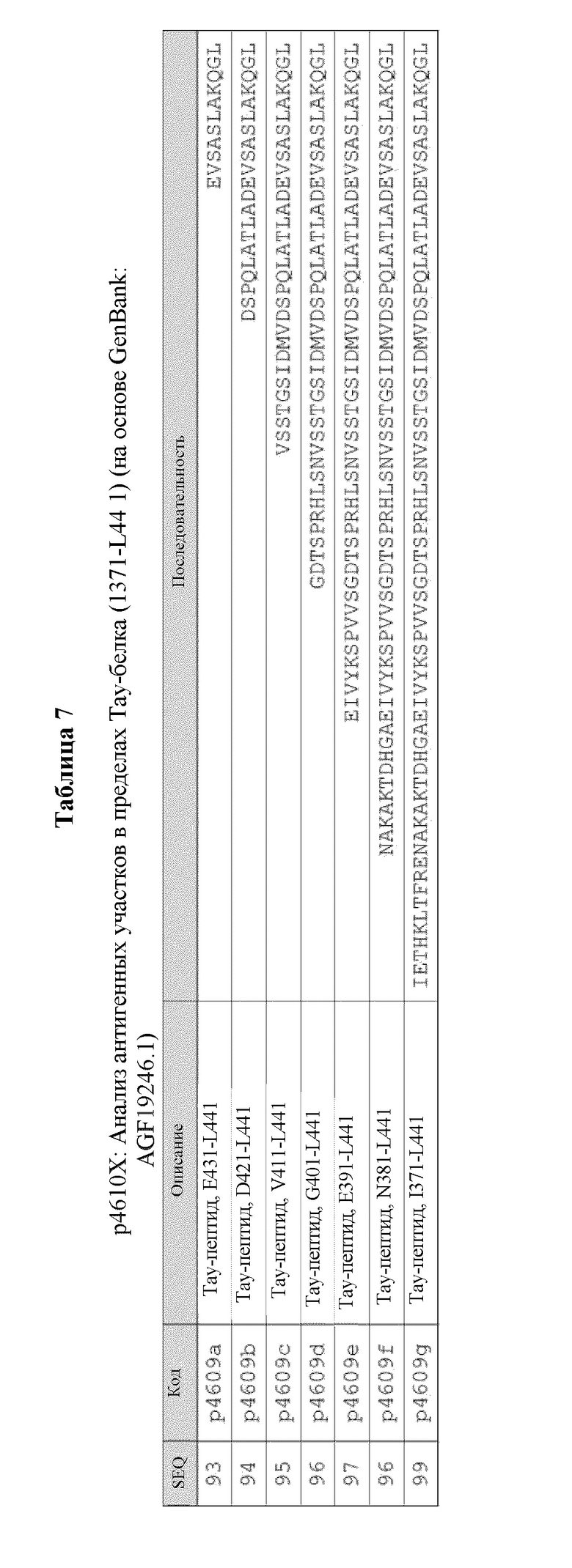
Таблица 8
Последовательность Тау-белка, полноразмерная (441 ак) изоформа с 4R и 2N (GenBank: AGF19246.1)
TAEDVTAPLVDEGAPGKQAAAQPHTEIPEGTTAEEAGIGDTPSLEDEAAGHVTQARMVSKSKDGTGSDDK 140
KAKGADGKTKIATPRGAAPPGQKGQANATRIPAKTPPAPKTPPSSGEPPKSGDRSGYSSPGSPGTPGSRS 210
RTPSLPTPPTREPKKVAVVRTPPKSPSSAKSRLQTAPVPMPDLKNVKSKIGSTENLKHQPGGGKVQIINK 280
KLDLSNVQSKCGSKDNIKHVPGGGSVQIVYKPVDLSKVTSKCGSLGNIHHKPGGGQVEVKSEKLDFKDRV 350
QSKIGSLDNITHVPGGGNKKIETHKLTFRENAKAKTDHGAEIVYKSPVVSGDTSPRHLSNVSSTGSIDMV 420
DSPQLATLADEVSASLAKQGL
Таблица 9a
Анализ иммуногенности Тау-пептидных конструкций
(Данные соответствуют Фиг. 1А)
Адъювант: ISA 51VG; CpG3 50 мкг/мл; 0,2% твин 80
Доза иммуногена: Прайм: 400 мкг/1,0 мл/доза/ в/м (четыре места введения, 0,25 мл/место); Буст: 100 мкг/0,25 мл/доза/ в/м
Схема вакцинации: 0, 3 и 6 нпи
Log10 титра ИФА
(SEQ ID NO: 2)
Log10 титра ИФА
(SEQ ID NO: 4)
Таблица 9b
Анализ иммуногенности Тау-пептидных конструкций
(Данные соответствуют Фиг. 1А)
Адъювант: ISA 51VG; CpG3 50 мкг/мл; 0,2% Твин 80
Доза иммуногена: Прайм: 400 мкг/1,0 мл/доза/ в/м (четыре места введения, 0,25 мл/место); Буст: 100 мкг/0,25 мл/доза/ в/м
Схема вакцинации: 0, 3 и 6 нпи
Log10 титра ИФА
(SEQ ID NO: 6)
Log10 титра ИФА
(SEQ ID NO: 8)
Таблица 9c
Анализ иммуногенности Тау-пептидных конструкций
(Данные соответствуют Фиг. 1А)
Адъювант: ISA 51VG; CpG3 50 мкг/мл; 0,2% Твин 80
Доза иммуногена: Прайм: 400 мкг/1,0 мл/доза/ в/м (четыре места введения, 0,25 мл/место); Буст: 100 мкг/0,25 мл/доза/ в/м
Схема вакцинации: 0, 3 и 6 нпи
Log10 титра ИФА
(SEQ ID NO: 11)
Log10 титра ИФА
(SEQ ID NO: 13)
Таблица 9d
Анализ иммуногенности Тау-пептидных конструкций
(Данные соответствуют Фиг. 1А)
Адъювант: ISA 51VG; CpG3 50 мкг/мл; 0,2% Твин 80
Доза иммуногена: Прайм: 400 мкг/1,0 мл/доза/ в/м (четыре места введения, 0,25 мл/место); Буст: 100 мкг/0,25 мл/доза/ в/м
Схема вакцинации: 0, 3 и 6 нпи
Log10 титра ИФА
(SEQ ID NO: 15)
Log10 титра ИФА
(SEQ ID NO: 17)
Таблица 9e
Анализ иммуногенности Тау-пептидных конструкций
(Данные соответствуют Фиг. 1А)
Адъювант: ISA 51VG; CpG3 50 мкг/мл; 0,2% Твин 80
Доза иммуногена: Прайм: 400 мкг/1,0 мл/доза/ в/м (четыре места введения, 0,25 мл/место); Буст: 100 мкг/0,25 мл/доза/ в/м
Схема вакцинации: 0, 3 и 6 нпи
Log10 титра ИФА
(SEQ ID NO: 19)
Log10 титра ИФА
(SEQ ID NO: 21)
Таблица 10а
Анализ иммуногенности фосфорилированных Тау-пептидных конструкций
(Данные соответствуют Фиг. 1В)
Адъювант: ISA 51VG; CpG3 50 мкг/мл; 0,2% Твин 80
Доза иммуногена: Прайм: 400 мкг/1,0 мл/доза/ в/м (четыре места введения, 0,25 мл/место); Буст: 100 мкг/0,25 мл/доза/ в/м
Схема вакцинации: 0, 3 и 6 нпи
Log10 титра ИФА
(SEQ ID NO: 1)
Log10 титра ИФА
(SEQ ID NO: 3)
Log10 титра ИФА
(SEQ ID NO: 5)
Таблица 10b
Анализ иммуногенности фосфорилированных Тау-пептидных конструкций
(Данные соответствуют Фиг. 1В)
Адъювант: ISA 51VG; CpG3 50 мкг/мл; 0,2% Твин 80
Доза иммуногена: Прайм: 400 мкг/1,0 мл/доза/ в/м (четыре места введения, 0,25 мл/место); Буст: 100 мкг/0,25 мл/доза/ в/м
Схема вакцинации: 0, 3 и 6 нпи
Log10 титра ИФА
(SEQ ID NO: 9)
Log10 титра ИФА
(SEQ ID NO: 7)
Log10 титра ИФА
(SEQ ID NO: 10)
Таблица 10c
Анализ иммуногенности фосфорилированных Тау-пептидных конструкций
(Данные соответствуют Фиг. 1В)
Адъювант: ISA 51VG; CpG3 50 мкг/мл; 0,2% Твин 80
Доза иммуногена: Прайм: 400 мкг/1,0 мл/доза/ в/м (четыре места введения, 0,25 мл/место); Буст: 100 мкг/0,25 мл/доза/ в/м
Схема вакцинации: 0, 3 и 6 нпи
Log10 титра ИФА
(SEQ ID NO: 12)
Log10 титра ИФА
(SEQ ID NO: 14)
Log10 титра ИФА
(SEQ ID NO: 16)
Таблица 10d
Анализ иммуногенности фосфорилированных Тау-пептидных конструкций
(Данные соответствуют Фиг. 1В)
Адъювант: ISA 51VG; CpG3 50 мкг/мл; 0,2% Твин 80
Доза иммуногена: Прайм: 400 мкг/1,0 мл/доза/ в/м (четыре места введения, 0,25 мл/место); Буст: 100 мкг/0,25 мл/доза/ в/м
Схема вакцинации: 0, 3 и 6 нпи
(SEQ ID NO: 18)
(SEQ ID NO: 20)
Таблица 11a
Анализ иммуногенности фосфорилированных Тау-пептидных конструкций
Адъювант: ISA 51VG; CpG3 50 мкг/мл; 0,2% Твин 80
Доза иммуногена: Прайм: 400 мкг/1,0 мл/доза/ в/м (четыре места введения, 0,25 мл/место); Буст: 100 мкг/0,25 мл/доза/ в/м
Схема вакцинации: 0, 3, 6 нпи
Log10 титра ИФА
(SEQ ID NO: 2)
Log10 титра ИФА
(SEQ ID NO: 4)
Таблица 11b
Анализ иммуногенности фосфорилированных Тау-пептидных конструкций
Адъювант: ISA 51VG; CpG3 50 мкг/мл; 0,2% Твин 80
Доза иммуногена: Прайм: 400 мкг/1,0 мл/доза/ в/м (четыре места введения, 0,25 мл/место); Буст: 100 мкг/0,25 мл/доза/ в/м
Схема вакцинации: 0, 3, 6 нпи
Log10 титра ИФА
(SEQ ID NO: 6)
Log10 титра ИФА
(SEQ ID NO: 8)
Таблица 11c
Анализ иммуногенности фосфорилированных Тау-пептидных конструкций
Адъювант: ISA 51VG; CpG3 50 мкг/мл; 0,2% Твин 80
Доза иммуногена: Прайм: 400 мкг/1,0 мл/доза/ в/м (четыре места введения, 0,25 мл/место); Буст: 100 мкг/0,25 мл/доза/ в/м
Схема вакцинации: 0, 3, 6 нпи
Log10 титра ИФА
(SEQ ID NO: 11)
Log10 титра ИФА
(SEQ ID NO: 13)
Таблица 11d
Анализ иммуногенности фосфорилированных Тау-пептидных конструкций
Адъювант: ISA 51VG; CpG3 50 мкг/мл; 0,2% Твин 80
Доза иммуногена: Прайм: 400 мкг/1,0 мл/доза/ в/м (четыре места введения, 0,25 мл/место); Буст: 100 мкг/0,25 мл/доза/ в/м
Схема вакцинации: 0, 3, 6 нпи
Log10 титра ИФА
(SEQ ID NO: 15)
Log10 титра ИФА
(SEQ ID NO: 17)
Таблица 11e
Анализ иммуногенности фосфорилированных Тау-пептидных конструкций
Адъювант: ISA 51VG; CpG3 50 мкг/мл; 0,2% Твин 80
Доза иммуногена: Прайм: 400 мкг/1,0 мл/доза/ в/м (четыре места введения, 0,25 мл/место); Буст: 100 мкг/0,25 мл/доза/ в/м
Схема вакцинации: 0, 3, 6 нпи
Log10 титра ИФА
(SEQ ID NO: 19)
Log10 титра ИФА
(SEQ ID NO: 21)
Таблица 12
Анализ иммуногенности Тау-пептидных конструкций, содержащих В-эпитоп, из сайта гиперфосфорилирования и агрегации Тау
Адъювант: ISA 51VG; CpG3: 50 мкм/мл; 0,2% Твин 80
Доза иммуногена: Прайм: 400 мкг/1,0 мл/доза/ в/м четыре места введения, 0,25 мл/место; Буст: 100 мкг/0,25 мл/доза/ в/м
Схема вакцинации: 0, 3 и 6 нпи
SEQ ID NO: 101
SEQ ID NO: 102
SEQ ID NO: 103
UBITh1-εk-kkk-Тау 131-141
SEQ ID NO: 125
UBITh1-εk-kkk-Тау 241-257
SEQ ID NO: 126
UBITh1-εk-kkk-Тау 243-259
SEQ ID NO: 127
Таблица 13a
Анализ иммуногенности Тау-пептидных конструкций, полученных из B эпитопа из участка Тау 275-311
Адъювант: ISA 51VG; CpG3: 50 мкм/мл; 0,2% Твин 80
Доза иммуногена: Прайм: 400 мкг/1,0 мл/доза/ в/м четыре места введения, 0,25 мл/место; Буст: 100 мкг/0,25 мл/доза/ в/м
Схема вакцинации: 0, 3 и 6 нпи
SEQ ID NO: 104
SEQ ID NO: 105
SEQ ID NO: 106
UBITh1-εk-kkk-Тау 275-281
SEQ ID NO: 128
UBITh1-εk-kkk-Тау 281-294
SEQ ID NO: 129
UBITh1-εk-kkk-Тау 275-294
SEQ ID NO: 130
UBITh1-εk-kkk-Тау 294-311
SEQ ID NO: 131
UBITh1-εk-kkk-Тау 294-311, P301 -> S301
SEQ ID NO: 132
Таблица 13b
SEQ ID NO: 107
Log10 титра ИФА
SEQ ID NO: 108
UBITh1-εk-kkk-Тау 275-281
SEQ ID NO: 128
UBITh1-εk-kkk-Тау 281-294
SEQ ID NO: 129
UBITh1-εk-kkk-Тау 275-294
SEQ ID NO: 130
UBITh1-εk-kkk-Тау 294-311
SEQ ID NO: 131
UBITh1-εk-kkk-Тау 294-311, P301 -> S301
SEQ ID NO: 132
Таблица 14
Анализ иммуногенности Тау-пептидных конструкций из N-концевого «нечеткого покрытия» Тау
Адъювант: ISA 51VG; CpG3: 50 мкм/мл; 0,2% Твин 80
Доза иммуногена: Прайм: 400 мкг/1,0 мл/доза/ в/м четыре места введения, 0,25 мл/место; Буст: 100 мкг/0,25 мл/доза/ в/м
Схема вакцинации: 0, 3 и 6 нпи
SEQ ID NO: 112
SEQ ID NO: 113
SEQ ID NO: 114
UBITh1-εK-KKK-Тау D22-D34
SEQ ID NO: 137
UBITh1-εK-KKK-Тау Y18-D34
SEQ ID NO: 138
UBITh1-εK-KKK-Тау D22-D38
SEQ ID NO: 139
Таблица 15
Анали иммуногенности Тау-пептидных конструкций, содержащих Р301 транс, из положения, склонного к агрегации Тау
Адъювант: ISA 51VG; CpG3: 50 мкм/мл; 0,2% Твин 80
Доза иммуногена: Прайм: 400 мкг/1,0 мл/доза/ в/м четыре места введения, 0,25 мл/место; Буст: 100 мкг/0,25 мл/доза/ в/м
Схема вакцинации: 0, 3 и 6 нпи
SEQ ID NO: 110
SEQ ID NO: 111
SEQ ID NO: 107
SEQ ID NO: 19
UBITh1-εK-KKK-К294-К311, р301 транс
SEQ ID NO: 135
UBITh1-εK-KKK-V275-К311, р301 транс
SEQ ID NO: 136
UBITh1-εK-KKK-I297-К311, р301 транс
SEQ ID NO: 140
KKK-εK-UBITh1
SEQ ID NO: 141
Таблица 16
Локализация иммуногенного участка в пределах Тау 275-311 посредством точного картирования эпитопов
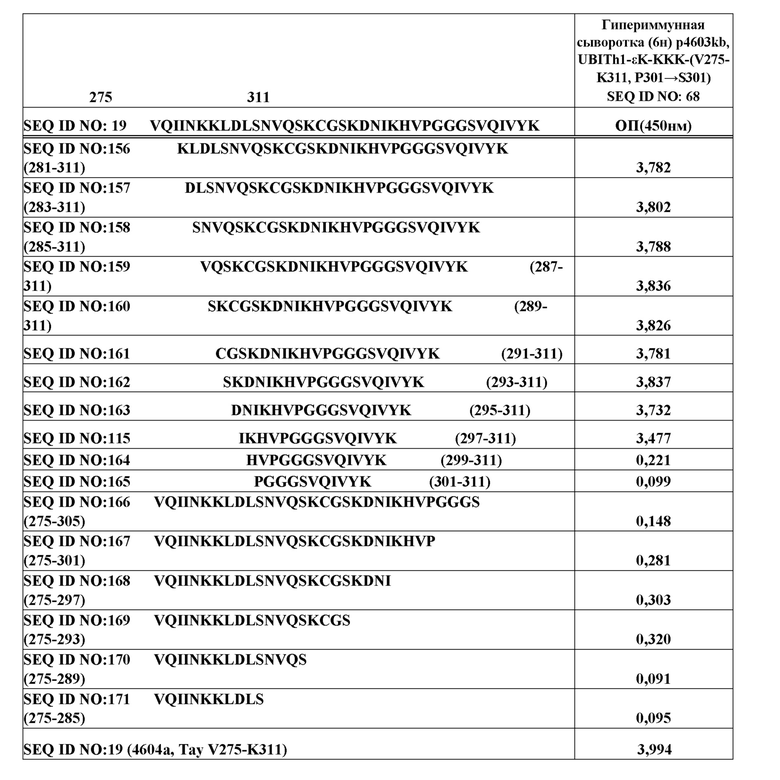
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> United Neuroscience
UNS IP Holdings, LLC
Wang, Chang-Yi
<120> ТАУ-ПЕПТИДНЫЕ ИММУНОГЕННЫЕ КОНСТРУКЦИИ
<130> 1008578.102WO2 (UNS1002-TW)
<140> TBD
<141> 26.10.2018
<150> US 62/578 124
<151> 27.10.2017
<160> 171
<170> PatentIn версия 3.5
<210> 1
<211> 16
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(16)
<223> фТау-пептид - aк145-160
(pT149/pT153)
<220>
<221> MOD_RES
<222> (5)..(5)
<223> ФОСФОРИЛИРОВАНИЕ
<220>
<221> MOD_RES
<222> (9)..(9)
<223> ФОСФОРИЛИРОВАНИЕ
<400> 1
Ala Asp Gly Lys Thr Lys Ile Ala Thr Pro Arg Gly Ala Ala Pro Pro
1 5 10 15
<210> 2
<211> 16
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(16)
<223> Тау-пептид - aк145-160
<400> 2
Ala Asp Gly Lys Thr Lys Ile Ala Thr Pro Arg Gly Ala Ala Pro Pro
1 5 10 15
<210> 3
<211> 18
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(18)
<223> фТау-пептид - aк172-189
(pT175/pT181/pS185)
<220>
<221> MOD_RES
<222> (4)..(4)
<223> ФОСФОРИЛИРОВАНИЕ
<220>
<221> MOD_RES
<222> (10)..(10)
<223> ФОСФОРИЛИРОВАНИЕ
<220>
<221> MOD_RES
<222> (14)..(14)
<223> ФОСФОРИЛИРОВАНИЕ
<400> 3
Pro Ala Lys Thr Pro Pro Ala Pro Lys Thr Pro Pro Ser Ser Gly Glu
1 5 10 15
Pro Pro
<210> 4
<211> 18
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(18)
<223> Тау-пептид - aк172-189
<400> 4
Pro Ala Lys Thr Pro Pro Ala Pro Lys Thr Pro Pro Ser Ser Gly Glu
1 5 10 15
Pro Pro
<210> 5
<211> 19
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> фТау-пептид - aк182-200
(pS184/pY197)
<220>
<221> MOD_RES
<222> (3)..(3)
<223> ФОСФОРИЛИРОВАНИЕ
<220>
<221> MOD_RES
<222> (16)..(16)
<223> ФОСФОРИЛИРОВАНИЕ
<400> 5
Pro Pro Ser Ser Gly Glu Pro Pro Lys Ser Gly Asp Arg Ser Gly Tyr
1 5 10 15
Ser Ser Pro
<210> 6
<211> 19
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Тау-пептид - aк182-200
<400> 6
Pro Pro Ser Ser Gly Glu Pro Pro Lys Ser Gly Asp Arg Ser Gly Tyr
1 5 10 15
Ser Ser Pro
<210> 7
<211> 19
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> фТау-пептид - aк195-213
(pS198/pS208/pS210)
<220>
<221> MOD_RES
<222> (4)..(4)
<223> ФОСФОРИЛИРОВАНИЕ
<220>
<221> MOD_RES
<222> (14)..(14)
<223> ФОСФОРИЛИРОВАНИЕ
<220>
<221> MOD_RES
<222> (16)..(16)
<223> ФОСФОРИЛИРОВАНИЕ
<400> 7
Ser Gly Tyr Ser Ser Pro Gly Ser Pro Gly Thr Pro Gly Ser Arg Ser
1 5 10 15
Arg Thr Pro
<210> 8
<211> 19
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Тау-пептид - aк195-213
<400> 8
Ser Gly Tyr Ser Ser Pro Gly Ser Pro Gly Thr Pro Gly Ser Arg Ser
1 5 10 15
Arg Thr Pro
<210> 9
<211> 19
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> фТау-пептид - aк195-213
(pS199/pS202/pT205)
<220>
<221> MOD_RES
<222> (5)..(5)
<223> ФОСФОРИЛИРОВАНИЕ
<220>
<221> MOD_RES
<222> (8)..(8)
<223> ФОСФОРИЛИРОВАНИЕ
<220>
<221> MOD_RES
<222> (11)..(11)
<223> ФОСФОРИЛИРОВАНИЕ
<400> 9
Ser Gly Tyr Ser Ser Pro Gly Ser Pro Gly Thr Pro Gly Ser Arg Ser
1 5 10 15
Arg Thr Pro
<210> 10
<211> 16
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(16)
<223> фТау-пептид - aк209-224
(pT212/pS214/pT217)
<220>
<221> MOD_RES
<222> (4)..(4)
<223> ФОСФОРИЛИРОВАНИЕ
<220>
<221> MOD_RES
<222> (6)..(6)
<223> ФОСФОРИЛИРОВАНИЕ
<220>
<221> MOD_RES
<222> (9)..(9)
<223> ФОСФОРИЛИРОВАНИЕ
<400> 10
Arg Ser Arg Thr Pro Ser Leu Pro Thr Pro Pro Thr Arg Glu Pro Lys
1 5 10 15
<210> 11
<211> 16
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(16)
<223> тау-пептид - aк209-224
<400> 11
Arg Ser Arg Thr Pro Ser Leu Pro Thr Pro Pro Thr Arg Glu Pro Lys
1 5 10 15
<210> 12
<211> 16
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(16)
<223> фТау-пептид - aк228-243
(pT231/pS235/pS238)
<220>
<221> MOD_RES
<222> (4)..(4)
<223> ФОСФОРИЛИРОВАНИЕ
<220>
<221> MOD_RES
<222> (8)..(8)
<223> ФОСФОРИЛИРОВАНИЕ
<220>
<221> MOD_RES
<222> (11)..(11)
<223> ФОСФОРИЛИРОВАНИЕ
<400> 12
Val Val Arg Thr Pro Pro Lys Ser Pro Ser Ser Ala Lys Ser Arg Leu
1 5 10 15
<210> 13
<211> 16
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(16)
<223> тау-пептид - aк228-243
<400> 13
Val Val Arg Thr Pro Pro Lys Ser Pro Ser Ser Ala Lys Ser Arg Leu
1 5 10 15
<210> 14
<211> 18
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(18)
<223> фТау-пептид - aк257-274
(pS262)
<220>
<221> MOD_RES
<222> (6)..(6)
<223> ФОСФОРИЛИРОВАНИЕ
<400> 14
Lys Ser Lys Ile Gly Ser Thr Glu Asn Leu Lys His Gln Pro Gly Gly
1 5 10 15
Gly Lys
<210> 15
<211> 18
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(18)
<223> Тау-пептид - aк257-274
<400> 15
Lys Ser Lys Ile Gly Ser Thr Glu Asn Leu Lys His Gln Pro Gly Gly
1 5 10 15
Gly Lys
<210> 16
<211> 30
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(30)
<223> фТау-пептид - aк379-408
(pS396/pS404)
<220>
<221> MOD_RES
<222> (18)..(18)
<223> ФОСФОРИЛИРОВАНИЕ
<220>
<221> MOD_RES
<222> (26)..(26)
<223> ФОСФОРИЛИРОВАНИЕ
<400> 16
Arg Glu Asn Ala Lys Ala Lys Thr Asp His Gly Ala Glu Ile Val Tyr
1 5 10 15
Lys Ser Pro Val Val Ser Gly Asp Thr Ser Pro Arg His Leu
20 25 30
<210> 17
<211> 30
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(30)
<223> Тау-пептид - aк379-408
<400> 17
Arg Glu Asn Ala Lys Ala Lys Thr Asp His Gly Ala Glu Ile Val Tyr
1 5 10 15
Lys Ser Pro Val Val Ser Gly Asp Thr Ser Pro Arg His Leu
20 25 30
<210> 18
<211> 37
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(37)
<223> фТау-пептид - aк275-311
*P301->S
(pS293/pS301)
<220>
<221> MOD_RES
<222> (19)..(19)
<223> ФОСФОРИЛИРОВАНИЕ
<220>
<221> MOD_RES
<222> (27)..(27)
<223> ФОСФОРИЛИРОВАНИЕ
<400> 18
Val Gln Ile Ile Asn Lys Lys Leu Asp Leu Ser Asn Val Gln Ser Lys
1 5 10 15
Cys Gly Ser Lys Asp Asn Ile Lys His Val Ser Gly Gly Gly Ser Val
20 25 30
Gln Ile Val Tyr Lys
35
<210> 19
<211> 37
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(37)
<223> Тау-пептид - aк275-311
<400> 19
Val Gln Ile Ile Asn Lys Lys Leu Asp Leu Ser Asn Val Gln Ser Lys
1 5 10 15
Cys Gly Ser Lys Asp Asn Ile Lys His Val Pro Gly Gly Gly Ser Val
20 25 30
Gln Ile Val Tyr Lys
35
<210> 20
<211> 33
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(33)
<223> фТау-пептид - aк393-425
(pS396/pS404/pS422)
<220>
<221> MOD_RES
<222> (4)..(4)
<223> ФОСФОРИЛИРОВАНИЕ
<220>
<221> MOD_RES
<222> (12)..(12)
<223> ФОСФОРИЛИРОВАНИЕ
<220>
<221> MOD_RES
<222> (30)..(30)
<223> ФОСФОРИЛИРОВАНИЕ
<400> 20
Val Tyr Lys Ser Pro Val Val Ser Gly Asp Thr Ser Pro Arg His Leu
1 5 10 15
Ser Asn Val Ser Ser Thr Gly Ser Ile Asp Met Val Asp Ser Pro Gln
20 25 30
Leu
<210> 21
<211> 33
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(33)
<223> тау-пептид - aк393-425
<400> 21
Val Tyr Lys Ser Pro Val Val Ser Gly Asp Thr Ser Pro Arg His Leu
1 5 10 15
Ser Asn Val Ser Ser Thr Gly Ser Ile Asp Met Val Asp Ser Pro Gln
20 25 30
Leu
<210> 22
<211> 17
<212> Белок
<213> Clostridium tetani
<220>
<221> ПЕПТИД
<222> (1)..(17)
<223> Th Clostridium tetani 1
<400> 22
Lys Lys Gln Tyr Ile Lys Ala Asn Ser Lys Phe Ile Gly Ile Thr Glu
1 5 10 15
Leu
<210> 23
<211> 15
<212> Белок
<213> вирус кори
<220>
<221> ПЕПТИД
<222> (1)..(15)
<223> Th MvF1
<400> 23
Leu Ser Glu Ile Lys Gly Val Ile Val His Arg Leu Glu Gly Val
1 5 10 15
<210> 24
<211> 24
<212> Белок
<213> Bordetella pertussis
<220>
<221> ПЕПТИД
<222> (1)..(24)
<223> Th Bordetella pertussis
<400> 24
Gly Ala Tyr Ala Arg Cys Pro Asn Gly Thr Arg Ala Leu Thr Val Ala
1 5 10 15
Glu Leu Arg Gly Asn Ala Glu Leu
20
<210> 25
<211> 17
<212> Белок
<213> Clostridium tetani
<220>
<221> ПЕПТИД
<222> (1)..(17)
<223> Th Clostridium tetani 2
<400> 25
Trp Val Arg Asp Ile Ile Asp Asp Phe Thr Asn Glu Ser Ser Gln Lys
1 5 10 15
Thr
<210> 26
<211> 23
<212> Белок
<213> diphtheria bacilli
<220>
<221> ПЕПТИД
<222> (1)..(23)
<223> Th Дифтерии
<400> 26
Asp Ser Glu Thr Ala Asp Asn Leu Glu Lys Thr Val Ala Ala Leu Ser
1 5 10 15
Ile Leu Pro Gly His Gly Cys
20
<210> 27
<211> 21
<212> Белок
<213> Plasmodium falciparum
<220>
<221> ПЕПТИД
<222> (1)..(21)
<223> Th Plasmodium falciparum
<400> 27
Asp His Glu Lys Lys His Ala Lys Met Glu Lys Ala Ser Ser Val Phe
1 5 10 15
Asn Val Val Asn Ser
20
<210> 28
<211> 17
<212> Белок
<213> Schistosoma mansoni
<220>
<221> ПЕПТИД
<222> (1)..(17)
<223> Th Schistosoma mansoni
<400> 28
Lys Trp Phe Lys Thr Asn Ala Pro Asn Gly Val Asp Glu Lys His Arg
1 5 10 15
His
<210> 29
<211> 25
<212> Белок
<213> холерный токсин
<220>
<221> ПЕПТИД
<222> (1)..(25)
<223> Th холерного токсина
<400> 29
Ala Leu Asn Ile Trp Asp Arg Phe Asp Val Phe Cys Thr Leu Gly Ala
1 5 10 15
Thr Thr Gly Tyr Leu Lys Gly Asn Ser
20 25
<210> 30
<211> 15
<212> Белок
<213> вирус кори
<220>
<221> ПЕПТИД
<222> (1)..(15)
<223> Th MvF 2
<400> 30
Ile Ser Glu Ile Lys Gly Val Ile Val His Lys Ile Glu Gly Ile
1 5 10 15
<210> 31
<211> 22
<212> Белок
<213> вирус кори
<220>
<221> ПЕПТИД
<222> (1)..(22)
<223> Th KKKMvF 3
<220>
<221> Белок
<222> (7)..(7)
<223> S или T
<220>
<221> Белок
<222> (10)..(10)
<223> K или R
<220>
<221> Белок
<222> (11)..(11)
<223> G или T
<220>
<221> Белок
<222> (15)..(15)
<223> H или T
<220>
<221> Белок
<222> (16)..(16)
<223> K или R
<220>
<221> Белок
<222> (19)..(19)
<223> G или T
<400> 31
Lys Lys Lys Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa
1 5 10 15
Ile Glu Xaa Ile Leu Phe
20
<210> 32
<211> 18
<212> Белок
<213> вирус гепатита B
<220>
<221> ПЕПТИД
<222> (1)..(18)
<223> Th HBsAg 1
<220>
<221> Белок
<222> (1)..(1)
<223> K или R
<220>
<221> Белок
<222> (2)..(2)
<223> K или R
<220>
<221> Белок
<222> (3)..(3)
<223> K или R
<220>
<221> Белок
<222> (4)..(4)
<223> L или I или V или F
<220>
<221> Белок
<222> (5)..(5)
<223> F или K или R
<220>
<221> Белок
<222> (6)..(6)
<223> L или I или V или F
<220>
<221> Белок
<222> (7)..(7)
<223> L или I или V или F
<220>
<221> Белок
<222> (9)..(9)
<223> K или R
<220>
<221> Белок
<222> (10)..(10)
<223> L или I или V или F
<220>
<221> Белок
<222> (11)..(11)
<223> L или I или V или F
<220>
<221> Белок
<222> (13)..(13)
<223> L или I или V или F
<220>
<221> Белок
<222> (15)..(15)
<223> Q или L или I или V или F
<220>
<221> Белок
<222> (17)..(17)
<223> L или I или V или F
<220>
<221> Белок
<222> (18)..(18)
<223> D или R
<400> 32
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Thr Xaa Xaa Xaa Thr Xaa Pro Xaa Ser
1 5 10 15
Xaa Xaa
<210> 33
<211> 19
<212> Белок
<213> вирус кори
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF 4
<220>
<221> Белок
<222> (4)..(4)
<223> S или T
<220>
<221> Белок
<222> (7)..(7)
<223> K или R
<220>
<221> Белок
<222> (8)..(8)
<223> G или T
<220>
<221> Белок
<222> (12)..(12)
<223> H или T
<220>
<221> Белок
<222> (13)..(13)
<223> K или R
<400> 33
Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr
1 5 10 15
Ile Leu Phe
<210> 34
<211> 18
<212> Белок
<213> вирус гепатита B
<220>
<221> ПЕПТИД
<222> (1)..(18)
<223> Th HBsAg 2
<220>
<221> Белок
<222> (4)..(4)
<223> I или F
<220>
<221> Белок
<222> (5)..(5)
<223> I или F
<220>
<221> Белок
<222> (6)..(6)
<223> T или L
<220>
<221> Белок
<222> (7)..(7)
<223> I или L
<220>
<221> Белок
<222> (11)..(11)
<223> I или L
<220>
<221> Белок
<222> (14)..(14)
<223> P или I
<220>
<221> Белок
<222> (15)..(15)
<223> Q или T
<220>
<221> Белок
<222> (16)..(16)
<223> S или T
<220>
<221> Белок
<222> (17)..(17)
<223> L или I
<400> 34
Lys Lys Lys Xaa Xaa Xaa Xaa Thr Arg Ile Xaa Thr Ile Xaa Xaa Xaa
1 5 10 15
Xaa Asp
<210> 35
<211> 19
<212> Белок
<213> вирус кори
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF 5
<400> 35
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe
<210> 36
<211> 18
<212> Белок
<213> вирус гепатита B
<220>
<221> ПЕПТИД
<222> (1)..(18)
<223> Th HBsAg 3
<400> 36
Lys Lys Lys Ile Ile Thr Ile Thr Arg Ile Ile Thr Ile Ile Thr Thr
1 5 10 15
Ile Asp
<210> 37
<211> 11
<212> Белок
<213> вирус гриппа
<220>
<221> ПЕПТИД
<222> (1)..(11)
<223> Th матричного белка вируса гриппа 1 _1
<220>
<221> ПЕПТИД
<222> (1)..(11)
<223> Th матричного белка вируса гриппа 1_1
<400> 37
Phe Val Phe Thr Leu Thr Val Pro Ser Glu Arg
1 5 10
<210> 38
<211> 15
<212> Белок
<213> вирус гриппа
<220>
<221> ПЕПТИД
<222> (1)..(15)
<223> Th матричного белка вируса гриппа 1_2
<400> 38
Ser Gly Pro Leu Lys Ala Glu Ile Ala Gln Arg Leu Glu Asp Val
1 5 10 15
<210> 39
<211> 9
<212> Белок
<213> вирус гриппа
<220>
<221> ПЕПТИД
<222> (1)..(9)
<223> Th неструктурного белка вируса гриппа 1
<400> 39
Asp Arg Leu Arg Arg Asp Gln Lys Ser
1 5
<210> 40
<211> 19
<212> Белок
<213> вирус Эпштейна-Барр
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th EBV BHRF1
<400> 40
Ala Gly Leu Thr Leu Ser Leu Leu Val Ile Cys Ser Tyr Leu Phe Ile
1 5 10 15
Ser Arg Gly
<210> 41
<211> 15
<212> Белок
<213> Clostridium tetani
<220>
<221> ПЕПТИД
<222> (1)..(15)
<223> Th Clostridium tetani TT1
<400> 41
Gln Tyr Ile Lys Ala Asn Ser Lys Phe Ile Gly Ile Thr Glu Leu
1 5 10 15
<210> 42
<211> 20
<212> Белок
<213> вирус Эпштейна-Барр
<220>
<221> ПЕПТИД
<222> (1)..(20)
<223> Th EBV EBNA-1
<400> 42
Pro Gly Pro Leu Arg Glu Ser Ile Val Cys Tyr Phe Met Val Phe Leu
1 5 10 15
Gln Thr His Ile
20
<210> 43
<211> 21
<212> Белок
<213> Clostridium tetani
<220>
<221> ПЕПТИД
<222> (1)..(21)
<223> Th Clostridium tetani TT2
<400> 43
Phe Asn Asn Phe Thr Val Ser Phe Trp Leu Arg Val Pro Lys Val Ser
1 5 10 15
Ala Ser His Leu Glu
20
<210> 44
<211> 16
<212> Белок
<213> Clostridium tetani
<220>
<221> ПЕПТИД
<222> (1)..(16)
<223> Th Clostridium tetani TT3
<400> 44
Lys Phe Ile Ile Lys Arg Tyr Thr Pro Asn Asn Glu Ile Asp Ser Phe
1 5 10 15
<210> 45
<211> 16
<212> Белок
<213> Clostridium tetani
<220>
<221> ПЕПТИД
<222> (1)..(16)
<223> Th Clostridium tetani TT4
<400> 45
Val Ser Ile Asp Lys Phe Arg Ile Phe Cys Lys Ala Leu Asn Pro Lys
1 5 10 15
<210> 46
<211> 18
<212> Белок
<213> вирус Эпштейна-Барр
<220>
<221> ПЕПТИД
<222> (1)..(18)
<223> Th EBV CP
<400> 46
Val Pro Gly Leu Tyr Ser Pro Cys Arg Ala Phe Phe Asn Lys Glu Glu
1 5 10 15
Leu Leu
<210> 47
<211> 14
<212> Белок
<213> цитомегаловирус человека
<220>
<221> ПЕПТИД
<222> (1)..(14)
<223> Th HCMV IE1
<400> 47
Asp Lys Arg Glu Met Trp Met Ala Cys Ile Lys Glu Leu His
1 5 10
<210> 48
<211> 15
<212> Белок
<213> вирус Эпштейна-Барр
<220>
<221> ПЕПТИД
<222> (1)..(15)
<223> Th EBV GP340
<400> 48
Thr Gly His Gly Ala Arg Thr Ser Thr Glu Pro Thr Thr Asp Tyr
1 5 10 15
<210> 49
<211> 13
<212> Белок
<213> вирус Эпштейна-Барр
<220>
<221> ПЕПТИД
<222> (1)..(13)
<223> Th EBV BPLF1
<400> 49
Lys Glu Leu Lys Arg Gln Tyr Glu Lys Lys Leu Arg Gln
1 5 10
<210> 50
<211> 11
<212> Белок
<213> вирус Эпштейна-Барр
<220>
<221> ПЕПТИД
<222> (1)..(11)
<223> Th EBV EBNA-2
<400> 50
Thr Val Phe Tyr Asn Ile Pro Pro Met Pro Leu
1 5 10
<210> 51
<211> 39
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF5 (UBITh1)
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(39)
<223> фТау 145-P160 (pT149/pT153)
<220>
<221> MOD_RES
<222> (28)..(28)
<223> ФОСФОРИЛИРОВАНИЕ
<220>
<221> MOD_RES
<222> (32)..(32)
<223> ФОСФОРИЛИРОВАНИЕ
<400> 51
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Ala Asp Gly Lys Thr Lys Ile Ala Thr
20 25 30
Pro Arg Gly Ala Ala Pro Pro
35
<210> 52
<211> 39
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF5 (UBITh1)
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(39)
<223> Тау 145-160
<400> 52
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Ala Asp Gly Lys Thr Lys Ile Ala Thr
20 25 30
Pro Arg Gly Ala Ala Pro Pro
35
<210> 53
<211> 41
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF5 (UBITh1)
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(41)
<223> фТау 172-189 (pT175/pT181/pS185)
<220>
<221> MOD_RES
<222> (27)..(27)
<223> ФОСФОРИЛИРОВАНИЕ
<220>
<221> MOD_RES
<222> (33)..(33)
<223> ФОСФОРИЛИРОВАНИЕ
<220>
<221> MOD_RES
<222> (37)..(37)
<223> ФОСФОРИЛИРОВАНИЕ
<400> 53
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Pro Ala Lys Thr Pro Pro Ala Pro Lys
20 25 30
Thr Pro Pro Ser Ser Gly Glu Pro Pro
35 40
<210> 54
<211> 41
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF5 (UBITh1)
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(41)
<223> Тау 172-189
<400> 54
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Pro Ala Lys Thr Pro Pro Ala Pro Lys
20 25 30
Thr Pro Pro Ser Ser Gly Glu Pro Pro
35 40
<210> 55
<211> 42
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF5 (UBITh1)
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(42)
<223> фТау 182-200 (pS184/pY197)
<220>
<221> MOD_RES
<222> (26)..(26)
<223> ФОСФОРИЛИРОВАНИЕ
<220>
<221> MOD_RES
<222> (39)..(39)
<223> ФОСФОРИЛИРОВАНИЕ
<400> 55
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Pro Pro Ser Ser Gly Glu Pro Pro Lys
20 25 30
Ser Gly Asp Arg Ser Gly Tyr Ser Ser Pro
35 40
<210> 56
<211> 42
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF5 (UBITh1)
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(42)
<223> Тау 182-200
<400> 56
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Pro Pro Ser Ser Gly Glu Pro Pro Lys
20 25 30
Ser Gly Asp Arg Ser Gly Tyr Ser Ser Pro
35 40
<210> 57
<211> 42
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF5 (UBITh1)
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(42)
<223> фТау 195-213 (pS199/pS202/pT205)
<220>
<221> MOD_RES
<222> (28)..(28)
<223> ФОСФОРИЛИРОВАНИЕ
<220>
<221> MOD_RES
<222> (31)..(31)
<223> ФОСФОРИЛИРОВАНИЕ
<220>
<221> MOD_RES
<222> (34)..(34)
<223> ФОСФОРИЛИРОВАНИЕ
<400> 57
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Ser Gly Tyr Ser Ser Pro Gly Ser Pro
20 25 30
Gly Thr Pro Gly Ser Arg Ser Arg Thr Pro
35 40
<210> 58
<211> 42
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF5 (UBITh1)
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(42)
<223> Тау 195-213
<400> 58
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Ser Gly Tyr Ser Ser Pro Gly Ser Pro
20 25 30
Gly Thr Pro Gly Ser Arg Ser Arg Thr Pro
35 40
<210> 59
<211> 42
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF 5 (UBITh1)
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(42)
<223> фТау 195-213 (pS198/pS208/pS210)
<220>
<221> MOD_RES
<222> (27)..(27)
<223> ФОСФОРИЛИРОВАНИЕ
<220>
<221> MOD_RES
<222> (37)..(37)
<223> ФОСФОРИЛИРОВАНИЕ
<220>
<221> MOD_RES
<222> (39)..(39)
<223> ФОСФОРИЛИРОВАНИЕ
<400> 59
Ile Ser Ile Ser Glu Ile Lys Gly Val Ile Val His Lys Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Ser Gly Tyr Ser Ser Pro Gly Ser Pro
20 25 30
Gly Thr Pro Gly Ser Arg Ser Arg Thr Pro
35 40
<210> 60
<211> 39
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF5 (UBITh1)
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(39)
<223> фТау 209-224 (pT212/pS214/pT217)
<220>
<221> MOD_RES
<222> (27)..(27)
<223> ФОСФОРИЛИРОВАНИЕ
<220>
<221> MOD_RES
<222> (29)..(29)
<223> ФОСФОРИЛИРОВАНИЕ
<220>
<221> MOD_RES
<222> (32)..(32)
<223> ФОСФОРИЛИРОВАНИЕ
<400> 60
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Arg Ser Arg Thr Pro Thr Pro Gly Ser
20 25 30
Arg Ser Arg Thr Pro Ser Leu
35
<210> 61
<211> 39
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF5 (UBITh1)
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(39)
<223> Тау 209-224
<400> 61
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Arg Ser Arg Thr Pro Thr Pro Gly Ser
20 25 30
Arg Ser Arg Thr Pro Ser Leu
35
<210> 62
<211> 39
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF5 (UBITh1)
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(39)
<223> фТау 228-243 (pT231/pS235/pS238)
<220>
<221> MOD_RES
<222> (27)..(27)
<223> ФОСФОРИЛИРОВАНИЕ
<220>
<221> MOD_RES
<222> (31)..(31)
<223> ФОСФОРИЛИРОВАНИЕ
<220>
<221> MOD_RES
<222> (34)..(34)
<223> ФОСФОРИЛИРОВАНИЕ
<400> 62
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Val Val Arg Thr Pro Pro Lys Ser Pro
20 25 30
Ser Ser Ala Lys Ser Arg Leu
35
<210> 63
<211> 39
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF5 (UBITh1)
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(39)
<223> Тау 228-243
<400> 63
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Val Val Arg Thr Pro Pro Lys Ser Pro
20 25 30
Ser Ser Ala Lys Ser Arg Leu
35
<210> 64
<211> 41
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF5 (UBITh1)
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(41)
<223> фТау 257-274 (pS262)
<220>
<221> MOD_RES
<222> (29)..(29)
<223> ФОСФОРИЛИРОВАНИЕ
<400> 64
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Lys Ser Lys Ile Gly Ser Thr Glu Asn
20 25 30
Leu Lys His Gln Pro Gly Gly Gly Lys
35 40
<210> 65
<211> 41
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF5 (UBITh1)
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(41)
<223> Тау 257-274
<400> 65
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Lys Ser Lys Ile Gly Ser Thr Glu Asn
20 25 30
Leu Lys His Gln Pro Gly Gly Gly Lys
35 40
<210> 66
<211> 53
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF5 (UBITh1)
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(53)
<223> фТау 379-408 (pS396/pS404)
<220>
<221> MOD_RES
<222> (41)..(41)
<223> ФОСФОРИЛИРОВАНИЕ
<220>
<221> MOD_RES
<222> (49)..(49)
<223> ФОСФОРИЛИРОВАНИЕ
<400> 66
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Arg Glu Asn Ala Lys Ala Lys Thr Asp
20 25 30
His Gly Ala Glu Ile Val Tyr Lys Ser Pro Val Val Ser Gly Asp Thr
35 40 45
Ser Pro Arg His Leu
50
<210> 67
<211> 53
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF5 (UBITh1)
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(53)
<223> Тау 379-408
<400> 67
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Arg Glu Asn Ala Lys Ala Lys Thr Asp
20 25 30
His Gly Ala Glu Ile Val Tyr Lys Ser Pro Val Val Ser Gly Asp Thr
35 40 45
Ser Pro Arg His Leu
50
<210> 68
<211> 60
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF 5 (UBITh1)
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(60)
<223> фТау 275-311 (*P301->S301; pS293/pS301)
<220>
<221> MOD_RES
<222> (42)..(42)
<223> ФОСФОРИЛИРОВАНИЕ
<220>
<221> MOD_RES
<222> (50)..(50)
<223> ФОСФОРИЛИРОВАНИЕ
<400> 68
Ile Ser Ile Ser Glu Ile Lys Gly Val Ile Val His Lys Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Val Gln Ile Ile Asn Lys Lys Leu Asp
20 25 30
Leu Ser Asn Val Gln Ser Lys Cys Gly Ser Lys Asp Asn Ile Lys His
35 40 45
Val Ser Gly Gly Gly Ser Val Gln Ile Val Tyr Lys
50 55 60
<210> 69
<211> 60
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF5 (UBITh1)
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(60)
<223> Тау 275-311
<400> 69
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Val Gln Ile Ile Asn Lys Lys Leu Asp
20 25 30
Leu Ser Asn Val Gln Ser Lys Cys Gly Ser Lys Asp Asn Ile Lys His
35 40 45
Val Pro Gly Gly Gly Ser Val Gln Ile Val Tyr Lys
50 55 60
<210> 70
<211> 56
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF5 (UBITh1)
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(56)
<223> фТау 393-425 (pS396/pS404/pS422)
<220>
<221> MOD_RES
<222> (27)..(27)
<223> ФОСФОРИЛИРОВАНИЕ
<220>
<221> MOD_RES
<222> (35)..(35)
<223> ФОСФОРИЛИРОВАНИЕ
<220>
<221> MOD_RES
<222> (53)..(53)
<223> ФОСФОРИЛИРОВАНИЕ
<400> 70
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Val Tyr Lys Ser Pro Val Val Ser Gly
20 25 30
Asp Thr Ser Pro Arg His Leu Ser Asn Val Ser Ser Thr Gly Ser Ile
35 40 45
Asp Met Val Asp Ser Pro Gln Leu
50 55
<210> 71
<211> 56
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF5
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(56)
<223> Тау 393-425
<400> 71
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Val Tyr Lys Ser Pro Val Val Ser Gly
20 25 30
Asp Thr Ser Pro Arg His Leu Ser Asn Val Ser Ser Thr Gly Ser Ile
35 40 45
Asp Met Val Asp Ser Pro Gln Leu
50 55
<210> 72
<211> 12
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(12)
<223> Тау-пептид, L215-V226
<400> 72
Leu Pro Thr Pro Pro Thr Arg Glu Pro Lys Lys Val
1 5 10
<210> 73
<211> 22
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(22)
<223> Тау-пептид, T205-V226
<400> 73
Thr Pro Gly Ser Arg Ser Arg Thr Pro Ser Leu Pro Thr Pro Pro Thr
1 5 10 15
Arg Glu Pro Lys Lys Val
20
<210> 74
<211> 32
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(32)
<223> Тау-пептид, S195-V226
<400> 74
Ser Gly Tyr Ser Ser Pro Gly Ser Pro Gly Thr Pro Gly Ser Arg Ser
1 5 10 15
Arg Thr Pro Ser Leu Pro Thr Pro Pro Thr Arg Glu Pro Lys Lys Val
20 25 30
<210> 75
<211> 42
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(42)
<223> Тау-пептид, S185-V226
<400> 75
Ser Gly Glu Pro Pro Lys Ser Gly Asp Arg Ser Gly Tyr Ser Ser Pro
1 5 10 15
Gly Ser Pro Gly Thr Pro Gly Ser Arg Ser Arg Thr Pro Ser Leu Pro
20 25 30
Thr Pro Pro Thr Arg Glu Pro Lys Lys Val
35 40
<210> 76
<211> 52
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(52)
<223> Тау-пептид, T175-V226
<400> 76
Thr Pro Pro Ala Pro Lys Thr Pro Pro Ser Ser Gly Glu Pro Pro Lys
1 5 10 15
Ser Gly Asp Arg Ser Gly Tyr Ser Ser Pro Gly Ser Pro Gly Thr Pro
20 25 30
Gly Ser Arg Ser Arg Thr Pro Ser Leu Pro Thr Pro Pro Thr Arg Glu
35 40 45
Pro Lys Lys Val
50
<210> 77
<211> 62
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(62)
<223> Тау-пептид, Q165-V226
<400> 77
Gln Ala Asn Ala Thr Arg Ile Pro Ala Lys Thr Pro Pro Ala Pro Lys
1 5 10 15
Thr Pro Pro Ser Ser Gly Glu Pro Pro Lys Ser Gly Asp Arg Ser Gly
20 25 30
Tyr Ser Ser Pro Gly Ser Pro Gly Thr Pro Gly Ser Arg Ser Arg Thr
35 40 45
Pro Ser Leu Pro Thr Pro Pro Thr Arg Glu Pro Lys Lys Val
50 55 60
<210> 78
<211> 72
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(72)
<223> Тау-пептид, R155-V226
<400> 78
Arg Gly Ala Ala Pro Pro Gly Gln Lys Gly Gln Ala Asn Ala Thr Arg
1 5 10 15
Ile Pro Ala Lys Thr Pro Pro Ala Pro Lys Thr Pro Pro Ser Ser Gly
20 25 30
Glu Pro Pro Lys Ser Gly Asp Arg Ser Gly Tyr Ser Ser Pro Gly Ser
35 40 45
Pro Gly Thr Pro Gly Ser Arg Ser Arg Thr Pro Ser Leu Pro Thr Pro
50 55 60
Pro Thr Arg Glu Pro Lys Lys Val
65 70
<210> 79
<211> 12
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(12)
<223> Тау-пептид, V287-K298
<400> 79
Val Gln Ser Lys Cys Gly Ser Lys Asp Asn Ile Lys
1 5 10
<210> 80
<211> 22
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(22)
<223> Тау-пептид, I277-K298
<400> 80
Ile Ile Asn Lys Lys Leu Asp Leu Ser Asn Val Gln Ser Lys Cys Gly
1 5 10 15
Ser Lys Asp Asn Ile Lys
20
<210> 81
<211> 32
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(32)
<223> Тау-пептид, K267-K298
<400> 81
Lys His Gln Pro Gly Gly Gly Lys Val Gln Ile Ile Asn Lys Lys Leu
1 5 10 15
Asp Leu Ser Asn Val Gln Ser Lys Cys Gly Ser Lys Asp Asn Ile Lys
20 25 30
<210> 82
<211> 42
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(42)
<223> Тау-пептид, K257-K298
<400> 82
Lys Ser Lys Ile Gly Ser Thr Glu Asn Leu Lys His Gln Pro Gly Gly
1 5 10 15
Gly Lys Val Gln Ile Ile Asn Lys Lys Leu Asp Leu Ser Asn Val Gln
20 25 30
Ser Lys Cys Gly Ser Lys Asp Asn Ile Lys
35 40
<210> 83
<211> 52
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(52)
<223> Тау-пептид, P247-K298
<400> 83
Pro Val Pro Met Pro Asp Leu Lys Asn Val Lys Ser Lys Ile Gly Ser
1 5 10 15
Thr Glu Asn Leu Lys His Gln Pro Gly Gly Gly Lys Val Gln Ile Ile
20 25 30
Asn Lys Lys Leu Asp Leu Ser Asn Val Gln Ser Lys Cys Gly Ser Lys
35 40 45
Asp Asn Ile Lys
50
<210> 84
<211> 62
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(62)
<223> Тау-пептид, S237-K298
<400> 84
Ser Ser Ala Lys Ser Arg Leu Gln Thr Ala Pro Val Pro Met Pro Asp
1 5 10 15
Leu Lys Asn Val Lys Ser Lys Ile Gly Ser Thr Glu Asn Leu Lys His
20 25 30
Gln Pro Gly Gly Gly Lys Val Gln Ile Ile Asn Lys Lys Leu Asp Leu
35 40 45
Ser Asn Val Gln Ser Lys Cys Gly Ser Lys Asp Asn Ile Lys
50 55 60
<210> 85
<211> 72
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(72)
<223> Тау-пептид, A227-K298
<400> 85
Ala Val Val Arg Thr Pro Pro Lys Ser Pro Ser Ser Ala Lys Ser Arg
1 5 10 15
Leu Gln Thr Ala Pro Val Pro Met Pro Asp Leu Lys Asn Val Lys Ser
20 25 30
Lys Ile Gly Ser Thr Glu Asn Leu Lys His Gln Pro Gly Gly Gly Lys
35 40 45
Val Gln Ile Ile Asn Lys Lys Leu Asp Leu Ser Asn Val Gln Ser Lys
50 55 60
Cys Gly Ser Lys Asp Asn Ile Lys
65 70
<210> 86
<211> 12
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(12)
<223> Тау-пептид, N359-K370
<400> 86
Asn Ile Thr His Val Pro Gly Gly Gly Asn Lys Lys
1 5 10
<210> 87
<211> 22
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(22)
<223> Тау-пептид, R349-K370
<400> 87
Arg Val Gln Ser Lys Ile Gly Ser Leu Asp Asn Ile Thr His Val Pro
1 5 10 15
Gly Gly Gly Asn Lys Lys
20
<210> 88
<211> 32
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(32)
<223> Тау-пептид, V339-K370
<400> 88
Val Lys Ser Glu Lys Leu Asp Phe Lys Asp Arg Val Gln Ser Lys Ile
1 5 10 15
Gly Ser Leu Asp Asn Ile Thr His Val Pro Gly Gly Gly Asn Lys Lys
20 25 30
<210> 89
<211> 42
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(42)
<223> Тау-пептид, H329-K370
<400> 89
His His Lys Pro Gly Gly Gly Gln Val Glu Val Lys Ser Glu Lys Leu
1 5 10 15
Asp Phe Lys Asp Arg Val Gln Ser Lys Ile Gly Ser Leu Asp Asn Ile
20 25 30
Thr His Val Pro Gly Gly Gly Asn Lys Lys
35 40
<210> 90
<211> 52
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(52)
<223> Тау-пептид, T319-K370
<400> 90
Thr Ser Lys Cys Gly Ser Leu Gly Asn Ile His His Lys Pro Gly Gly
1 5 10 15
Gly Gln Val Glu Val Lys Ser Glu Lys Leu Asp Phe Lys Asp Arg Val
20 25 30
Gln Ser Lys Ile Gly Ser Leu Asp Asn Ile Thr His Val Pro Gly Gly
35 40 45
Gly Asn Lys Lys
50
<210> 91
<211> 62
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(62)
<223> Тау-пептид, V309-K370
<400> 91
Val Tyr Lys Pro Val Asp Leu Ser Lys Val Thr Ser Lys Cys Gly Ser
1 5 10 15
Leu Gly Asn Ile His His Lys Pro Gly Gly Gly Gln Val Glu Val Lys
20 25 30
Ser Glu Lys Leu Asp Phe Lys Asp Arg Val Gln Ser Lys Ile Gly Ser
35 40 45
Leu Asp Asn Ile Thr His Val Pro Gly Gly Gly Asn Lys Lys
50 55 60
<210> 92
<211> 72
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(72)
<223> Тау-пептид, H299-K370
<400> 92
His Val Pro Gly Gly Gly Ser Val Gln Ile Val Tyr Lys Pro Val Asp
1 5 10 15
Leu Ser Lys Val Thr Ser Lys Cys Gly Ser Leu Gly Asn Ile His His
20 25 30
Lys Pro Gly Gly Gly Gln Val Glu Val Lys Ser Glu Lys Leu Asp Phe
35 40 45
Lys Asp Arg Val Gln Ser Lys Ile Gly Ser Leu Asp Asn Ile Thr His
50 55 60
Val Pro Gly Gly Gly Asn Lys Lys
65 70
<210> 93
<211> 11
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(11)
<223> Тау-пептид, E431-L441
<400> 93
Glu Val Ser Ala Ser Leu Ala Lys Gln Gly Leu
1 5 10
<210> 94
<211> 21
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(21)
<223> Тау-пептид, D421-L441
<400> 94
Asp Ser Pro Gln Leu Ala Thr Leu Ala Asp Glu Val Ser Ala Ser Leu
1 5 10 15
Ala Lys Gln Gly Leu
20
<210> 95
<211> 31
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(31)
<223> Тау-пептид, V411-L441
<400> 95
Val Ser Ser Thr Gly Ser Ile Asp Met Val Asp Ser Pro Gln Leu Ala
1 5 10 15
Thr Leu Ala Asp Glu Val Ser Ala Ser Leu Ala Lys Gln Gly Leu
20 25 30
<210> 96
<211> 41
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(41)
<223> Тау-пептид, G401-L441
<400> 96
Gly Asp Thr Ser Pro Arg His Leu Ser Asn Val Ser Ser Thr Gly Ser
1 5 10 15
Ile Asp Met Val Asp Ser Pro Gln Leu Ala Thr Leu Ala Asp Glu Val
20 25 30
Ser Ala Ser Leu Ala Lys Gln Gly Leu
35 40
<210> 97
<211> 51
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(51)
<223> Тау-пептид, E391-L441
<400> 97
Glu Ile Val Tyr Lys Ser Pro Val Val Ser Gly Asp Thr Ser Pro Arg
1 5 10 15
His Leu Ser Asn Val Ser Ser Thr Gly Ser Ile Asp Met Val Asp Ser
20 25 30
Pro Gln Leu Ala Thr Leu Ala Asp Glu Val Ser Ala Ser Leu Ala Lys
35 40 45
Gln Gly Leu
50
<210> 98
<211> 61
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(61)
<223> Тау-пептид, N381-L441
<400> 98
Asn Ala Lys Ala Lys Thr Asp His Gly Ala Glu Ile Val Tyr Lys Ser
1 5 10 15
Pro Val Val Ser Gly Asp Thr Ser Pro Arg His Leu Ser Asn Val Ser
20 25 30
Ser Thr Gly Ser Ile Asp Met Val Asp Ser Pro Gln Leu Ala Thr Leu
35 40 45
Ala Asp Glu Val Ser Ala Ser Leu Ala Lys Gln Gly Leu
50 55 60
<210> 99
<211> 71
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(71)
<223> Тау-пептид, I371-L441
<400> 99
Ile Glu Thr His Lys Leu Thr Phe Arg Glu Asn Ala Lys Ala Lys Thr
1 5 10 15
Asp His Gly Ala Glu Ile Val Tyr Lys Ser Pro Val Val Ser Gly Asp
20 25 30
Thr Ser Pro Arg His Leu Ser Asn Val Ser Ser Thr Gly Ser Ile Asp
35 40 45
Met Val Asp Ser Pro Gln Leu Ala Thr Leu Ala Asp Glu Val Ser Ala
50 55 60
Ser Leu Ala Lys Gln Gly Leu
65 70
<210> 100
<211> 441
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(441)
<223> изоформа Тау с 4R и 2N (GenBank: AGF19246.1)
<400> 100
Met Ala Glu Pro Arg Gln Glu Phe Glu Val Met Glu Asp His Ala Gly
1 5 10 15
Thr Tyr Gly Leu Gly Asp Arg Lys Asp Gln Gly Gly Tyr Thr Met His
20 25 30
Gln Asp Gln Glu Gly Asp Thr Asp Ala Gly Leu Lys Glu Ser Pro Leu
35 40 45
Gln Thr Pro Thr Glu Asp Gly Ser Glu Glu Pro Gly Ser Glu Thr Ser
50 55 60
Asp Ala Lys Ser Thr Pro Thr Ala Glu Asp Val Thr Ala Pro Leu Val
65 70 75 80
Asp Glu Gly Ala Pro Gly Lys Gln Ala Ala Ala Gln Pro His Thr Glu
85 90 95
Ile Pro Glu Gly Thr Thr Ala Glu Glu Ala Gly Ile Gly Asp Thr Pro
100 105 110
Ser Leu Glu Asp Glu Ala Ala Gly His Val Thr Gln Ala Arg Met Val
115 120 125
Ser Lys Ser Lys Asp Gly Thr Gly Ser Asp Asp Lys Lys Ala Lys Gly
130 135 140
Ala Asp Gly Lys Thr Lys Ile Ala Thr Pro Arg Gly Ala Ala Pro Pro
145 150 155 160
Gly Gln Lys Gly Gln Ala Asn Ala Thr Arg Ile Pro Ala Lys Thr Pro
165 170 175
Pro Ala Pro Lys Thr Pro Pro Ser Ser Gly Glu Pro Pro Lys Ser Gly
180 185 190
Asp Arg Ser Gly Tyr Ser Ser Pro Gly Ser Pro Gly Thr Pro Gly Ser
195 200 205
Arg Ser Arg Thr Pro Ser Leu Pro Thr Pro Pro Thr Arg Glu Pro Lys
210 215 220
Lys Val Ala Val Val Arg Thr Pro Pro Lys Ser Pro Ser Ser Ala Lys
225 230 235 240
Ser Arg Leu Gln Thr Ala Pro Val Pro Met Pro Asp Leu Lys Asn Val
245 250 255
Lys Ser Lys Ile Gly Ser Thr Glu Asn Leu Lys His Gln Pro Gly Gly
260 265 270
Gly Lys Val Gln Ile Ile Asn Lys Lys Leu Asp Leu Ser Asn Val Gln
275 280 285
Ser Lys Cys Gly Ser Lys Asp Asn Ile Lys His Val Pro Gly Gly Gly
290 295 300
Ser Val Gln Ile Val Tyr Lys Pro Val Asp Leu Ser Lys Val Thr Ser
305 310 315 320
Lys Cys Gly Ser Leu Gly Asn Ile His His Lys Pro Gly Gly Gly Gln
325 330 335
Val Glu Val Lys Ser Glu Lys Leu Asp Phe Lys Asp Arg Val Gln Ser
340 345 350
Lys Ile Gly Ser Leu Asp Asn Ile Thr His Val Pro Gly Gly Gly Asn
355 360 365
Lys Lys Ile Glu Thr His Lys Leu Thr Phe Arg Glu Asn Ala Lys Ala
370 375 380
Lys Thr Asp His Gly Ala Glu Ile Val Tyr Lys Ser Pro Val Val Ser
385 390 395 400
Gly Asp Thr Ser Pro Arg His Leu Ser Asn Val Ser Ser Thr Gly Ser
405 410 415
Ile Asp Met Val Asp Ser Pro Gln Leu Ala Thr Leu Ala Asp Glu Val
420 425 430
Ser Ala Ser Leu Ala Lys Gln Gly Leu
435 440
<210> 101
<211> 11
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(11)
<223> Тау-пептид - aк131-141
<400> 101
Ser Lys Asp Gly Thr Gly Ser Asp Asp Lys Lys
1 5 10
<210> 102
<211> 17
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(17)
<223> Тау-пептид - aк241-257
<400> 102
Ser Arg Leu Gln Thr Ala Pro Val Pro Met Pro Asp Leu Lys Asn Val
1 5 10 15
Lys
<210> 103
<211> 17
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(17)
<223> Тау-пептид - aк243-259
<400> 103
Leu Gln Thr Ala Pro Val Pro Met Pro Asp Leu Lys Asn Val Lys Ser
1 5 10 15
Lys
<210> 104
<211> 7
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(7)
<223> Тау-пептид - aк275-281
<400> 104
Val Gln Ile Ile Asn Lys Lys
1 5
<210> 105
<211> 14
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(14)
<223> Тау-пептид - aк281-294
<400> 105
Lys Leu Asp Leu Ser Asn Val Gln Ser Lys Cys Gly Ser Lys
1 5 10
<210> 106
<211> 20
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(20)
<223> Тау-пептид - aк275-294
<400> 106
Val Gln Ile Ile Asn Lys Lys Leu Asp Leu Ser Asn Val Gln Ser Lys
1 5 10 15
Cys Gly Ser Lys
20
<210> 107
<211> 18
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(18)
<223> Тау-пептид - aк294-311
<400> 107
Lys Asp Asn Ile Lys His Val Pro Gly Gly Gly Ser Val Gln Ile Val
1 5 10 15
Tyr Lys
<210> 108
<211> 18
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(18)
<223> Тау-пептид - aк294-311, от P301 до S301
<400> 108
Lys Asp Asn Ile Lys His Val Ser Gly Gly Gly Ser Val Gln Ile Val
1 5 10 15
Tyr Lys
<210> 109
<211> 18
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(18)
<223> Тау-пептид - ак294-311, p301 транс
<400> 109
Lys Asp Asn Ile Lys His Val Pro Gly Gly Gly Ser Val Gln Ile Val
1 5 10 15
Tyr Lys
<210> 110
<211> 37
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(37)
<223> Тау-пептид - ак275-311, p301 транс
<400> 110
Val Gln Ile Ile Asn Lys Lys Leu Asp Leu Ser Asn Val Gln Ser Lys
1 5 10 15
Cys Gly Ser Lys Asp Asn Ile Lys His Val Pro Gly Gly Gly Ser Val
20 25 30
Gln Ile Val Tyr Lys
35
<210> 111
<211> 15
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(15)
<223> Тау-пептид - ак297-311, p301 транс
<400> 111
Ile Lys His Val Pro Gly Gly Gly Ser Val Gln Ile Val Tyr Lys
1 5 10 15
<210> 112
<211> 13
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(13)
<223> Тау-пептид - aк22-34
<400> 112
Asp Arg Lys Asp Gln Gly Gly Tyr Thr Met His Gln Asp
1 5 10
<210> 113
<211> 17
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(17)
<223> Тау-пептид - aк18-34
<400> 113
Tyr Gly Leu Gly Asp Arg Lys Asp Gln Gly Gly Tyr Thr Met His Gln
1 5 10 15
Asp
<210> 114
<211> 17
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(17)
<223> Тау-пептид - aк22-38
<400> 114
Asp Arg Lys Asp Gln Gly Gly Tyr Thr Met His Gln Asp Gln Glu Gly
1 5 10 15
Asp
<210> 115
<211> 15
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(15)
<223> Тау-пептид - aк297-311
<400> 115
Ile Lys His Val Pro Gly Gly Gly Ser Val Gln Ile Val Tyr Lys
1 5 10 15
<210> 116
<211> 12
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(12)
<223> Тау-пептид - aк359-370
<400> 116
Asn Ile Thr His Val Pro Gly Gly Gly Asn Lys Lys
1 5 10
<210> 117
<211> 22
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(22)
<223> Тау-пептид - aк349-370
<400> 117
Arg Val Gln Ser Lys Ile Gly Ser Leu Asp Asn Ile Thr His Val Pro
1 5 10 15
Gly Gly Gly Asn Lys Lys
20
<210> 118
<211> 32
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(32)
<223> Тау-пептид - aк339-370
<400> 118
Val Lys Ser Glu Lys Leu Asp Phe Lys Asp Arg Val Gln Ser Lys Ile
1 5 10 15
Gly Ser Leu Asp Asn Ile Thr His Val Pro Gly Gly Gly Asn Lys Lys
20 25 30
<210> 119
<211> 42
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(42)
<223> Тау-пептид - aк329-370
<400> 119
His His Lys Pro Gly Gly Gly Gln Val Glu Val Lys Ser Glu Lys Leu
1 5 10 15
Asp Phe Lys Asp Arg Val Gln Ser Lys Ile Gly Ser Leu Asp Asn Ile
20 25 30
Thr His Val Pro Gly Gly Gly Asn Lys Lys
35 40
<210> 120
<211> 21
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(21)
<223> Тау-пептид - aк329-349
<400> 120
His His Lys Pro Gly Gly Gly Gln Val Glu Val Lys Ser Glu Lys Leu
1 5 10 15
Asp Phe Lys Asp Arg
20
<210> 121
<211> 40
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(40)
<223> Тау-пептид - aк1-40
<400> 121
Met Ala Glu Pro Arg Gln Glu Phe Glu Val Met Glu Asp His Ala Gly
1 5 10 15
Thr Tyr Gly Leu Gly Asp Arg Lys Asp Gln Gly Gly Tyr Thr Met His
20 25 30
Gln Asp Gln Glu Gly Asp Thr Asp
35 40
<210> 122
<211> 40
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(40)
<223> Тау-пептид - aк11-50
<400> 122
Met Glu Asp His Ala Gly Thr Tyr Gly Leu Gly Asp Arg Lys Asp Gln
1 5 10 15
Gly Gly Tyr Thr Met His Gln Asp Gln Glu Gly Asp Thr Asp Ala Gly
20 25 30
Leu Lys Glu Ser Pro Leu Gln Thr
35 40
<210> 123
<211> 34
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(34)
<223> Тау-пептид - aк1-34
<400> 123
Met Ala Glu Pro Arg Gln Glu Phe Glu Val Met Glu Asp His Ala Gly
1 5 10 15
Thr Tyr Gly Leu Gly Asp Arg Lys Asp Gln Gly Gly Tyr Thr Met His
20 25 30
Gln Asp
<210> 124
<211> 22
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(22)
<223> Тау-пептид - aк1-22
<400> 124
Met Ala Glu Pro Arg Gln Glu Phe Glu Val Met Glu Asp His Ala Gly
1 5 10 15
Thr Tyr Gly Leu Gly Asp
20
<210> 125
<211> 34
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF5 (UBITh1)
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(34)
<223> Тау S131-K141
<400> 125
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Ser Lys Asp Gly Thr Gly Ser Asp Asp
20 25 30
Lys Lys
<210> 126
<211> 40
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF5 (UBITh1)
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(40)
<223> Тау S241-K257
<400> 126
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Ser Arg Leu Gln Thr Ala Pro Val Pro
20 25 30
Met Pro Asp Leu Lys Asn Val Lys
35 40
<210> 127
<211> 40
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF5 (UBITh1)
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(40)
<223> Тау L243-K259
<400> 127
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Leu Gln Thr Ala Pro Val Pro Met Pro
20 25 30
Asp Leu Lys Asn Val Lys Ser Lys
35 40
<210> 128
<211> 30
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF5 (UBITh1)
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(30)
<223> Тау V275-K281
<400> 128
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Val Gln Ile Ile Asn Lys Lys
20 25 30
<210> 129
<211> 37
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF5 (UBITh1)
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(37)
<223> Тау K281-K294
<400> 129
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Lys Leu Asp Leu Ser Asn Val Gln Ser
20 25 30
Lys Cys Gly Ser Lys
35
<210> 130
<211> 43
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF5 (UBITh1)
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(43)
<223> Тау V275-K294
<400> 130
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Val Gln Ile Ile Asn Lys Lys Leu Asp
20 25 30
Leu Ser Asn Val Gln Ser Lys Cys Gly Ser Lys
35 40
<210> 131
<211> 41
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF5 (UBITh1)
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(41)
<223> Тау K294-K311
<400> 131
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Lys Asp Asn Ile Lys His Val Pro Gly
20 25 30
Gly Gly Ser Val Gln Ile Val Tyr Lys
35 40
<210> 132
<211> 41
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF5 (UBITh1)
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(41)
<223> Тау K294-K311, от P301 до S301
<400> 132
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Lys Asp Asn Ile Lys His Val Ser Gly
20 25 30
Gly Gly Ser Val Gln Ile Val Tyr Lys
35 40
<210> 133
<211> 41
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF 4 (UBITh3)
<220>
<221> Белок
<222> (4)..(4)
<223> S или T
<220>
<221> Белок
<222> (7)..(7)
<223> K или R
<220>
<221> Белок
<222> (8)..(8)
<223> G или T
<220>
<221> Белок
<222> (12)..(12)
<223> H или T
<220>
<221> Белок
<222> (13)..(13)
<223> K или R
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(41)
<223> Тау K257-K274
<400> 133
Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Lys Ser Lys Ile Gly Ser Thr Glu Asn
20 25 30
Leu Lys His Gln Pro Gly Gly Gly Lys
35 40
<210> 134
<211> 53
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF 4 (UBITh3)
<220>
<221> Белок
<222> (4)..(4)
<223> S или T
<220>
<221> Белок
<222> (7)..(7)
<223> K или R
<220>
<221> Белок
<222> (8)..(8)
<223> G или T
<220>
<221> Белок
<222> (12)..(12)
<223> H или T
<220>
<221> Белок
<222> (13)..(13)
<223> K или R
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(53)
<223> Тау R379-L408
<400> 134
Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Arg Glu Asn Ala Lys Ala Lys Thr Asp
20 25 30
His Gly Ala Glu Ile Val Tyr Lys Ser Pro Val Val Ser Gly Asp Thr
35 40 45
Ser Pro Arg His Leu
50
<210> 135
<211> 41
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF5 (UBITh1)
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(41)
<223> Тау K294-K311, p301 транс
<400> 135
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Lys Asp Asn Ile Lys His Val Pro Gly
20 25 30
Gly Gly Ser Val Gln Ile Val Tyr Lys
35 40
<210> 136
<211> 60
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF5 (UBITh1)
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(60)
<223> Тау V275-K311, p301 транс
<400> 136
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Val Gln Ile Ile Asn Lys Lys Leu Asp
20 25 30
Leu Ser Asn Val Gln Ser Lys Cys Gly Ser Lys Asp Asn Ile Lys His
35 40 45
Val Pro Gly Gly Gly Ser Val Gln Ile Val Tyr Lys
50 55 60
<210> 137
<211> 36
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF5 (UBITh1)
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(36)
<223> Тау D22-D34
<400> 137
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Asp Arg Lys Asp Gln Gly Gly Tyr Thr
20 25 30
Met His Gln Asp
35
<210> 138
<211> 40
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF5 (UBITh1)
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(40)
<223> Тау Y18-D34
<400> 138
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Tyr Gly Leu Gly Asp Arg Lys Asp Gln
20 25 30
Gly Gly Tyr Thr Met His Gln Asp
35 40
<210> 139
<211> 40
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF5 (UBITh1)
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(40)
<223> Тау D22-D38
<400> 139
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Asp Arg Lys Asp Gln Gly Gly Tyr Thr
20 25 30
Met His Gln Asp Gln Glu Gly Asp
35 40
<210> 140
<211> 38
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF5 (UBITh1)
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(38)
<223> Тау I297-K311, p301 транс
<400> 140
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Ile Lys His Val Pro Gly Gly Gly Ser
20 25 30
Val Gln Ile Val Tyr Lys
35
<210> 141
<211> 38
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(15)
<223> Тау I297-K311
<220>
<221> Белок
<222> (16)..(16)
<223> эпсилон K
<220>
<221> ПЕПТИД
<222> (16)..(19)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (20)..(38)
<223> Th MvF5 (UBITh1)
<400> 141
Ile Lys His Val Pro Gly Gly Gly Ser Val Gln Ile Val Tyr Lys Lys
1 5 10 15
Lys Lys Lys Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg
20 25 30
Ile Glu Thr Ile Leu Phe
35
<210> 142
<211> 38
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF5 (UBITh1)
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (21)..(38)
<223> Тау K294-K311
<400> 142
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Asp Asn Ile Lys His Val Pro Gly Gly Gly Ser
20 25 30
Val Gln Ile Val Tyr Lys
35
<210> 143
<211> 35
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF5 (UBITh1)
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (21)..(35)
<223> Тау I297-K311
<400> 143
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Ile Lys His Val Pro Gly Gly Gly Ser Val Gln Ile
20 25 30
Val Tyr Lys
35
<210> 144
<211> 38
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF5 (UBITh1)
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(38)
<223> Тау I297-K311
<400> 144
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Ile Lys His Val Pro Gly Gly Gly Ser
20 25 30
Val Gln Ile Val Tyr Lys
35
<210> 145
<211> 39
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF 4 (UBITH3)
<220>
<221> Белок
<222> (4)..(4)
<223> S или T
<220>
<221> Белок
<222> (7)..(7)
<223> K или R
<220>
<221> Белок
<222> (8)..(8)
<223> G или T
<220>
<221> Белок
<222> (12)..(12)
<223> H или T
<220>
<221> Белок
<222> (13)..(13)
<223> K или R
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(39)
<223> Тау A145-P160
<400> 145
Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Ala Asp Gly Lys Thr Lys Ile Ala Thr
20 25 30
Pro Arg Gly Ala Ala Pro Pro
35
<210> 146
<211> 60
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF 4 (UBITh3)
<220>
<221> Белок
<222> (4)..(4)
<223> S или T
<220>
<221> Белок
<222> (7)..(7)
<223> K или R
<220>
<221> Белок
<222> (8)..(8)
<223> G или T
<220>
<221> Белок
<222> (12)..(12)
<223> H или T
<220>
<221> Белок
<222> (13)..(13)
<223> K или R
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(60)
<223> Тау V275-K311
<400> 146
Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Val Gln Ile Ile Asn Lys Lys Leu Asp
20 25 30
Leu Ser Asn Val Gln Ser Lys Cys Gly Ser Lys Asp Asn Ile Lys His
35 40 45
Val Pro Gly Gly Gly Ser Val Gln Ile Val Tyr Lys
50 55 60
<210> 147
<211> 35
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF5 (UBITh1)
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(35)
<223> Тау N359-K370
<400> 147
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Asn Ile Thr His Val Pro Gly Gly Gly
20 25 30
Asn Lys Lys
35
<210> 148
<211> 45
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF 5 (UBITh1)
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(45)
<223> Тау R349-K370
<400> 148
Ile Ser Ile Ser Glu Ile Lys Gly Val Ile Val His Lys Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Arg Val Gln Ser Lys Ile Gly Ser Leu
20 25 30
Asp Asn Ile Thr His Val Pro Gly Gly Gly Asn Lys Lys
35 40 45
<210> 149
<211> 55
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF5 (UBITh1)
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(55)
<223> Тау V339-K370
<400> 149
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Val Lys Ser Glu Lys Leu Asp Phe Lys
20 25 30
Asp Arg Val Gln Ser Lys Ile Gly Ser Leu Asp Asn Ile Thr His Val
35 40 45
Pro Gly Gly Gly Asn Lys Lys
50 55
<210> 150
<211> 65
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF5 (UBITh1)
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(65)
<223> Тау H329-K370
<400> 150
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys His His Lys Pro Gly Gly Gly Gln Val
20 25 30
Glu Val Lys Ser Glu Lys Leu Asp Phe Lys Asp Arg Val Gln Ser Lys
35 40 45
Ile Gly Ser Leu Asp Asn Ile Thr His Val Pro Gly Gly Gly Asn Lys
50 55 60
Lys
65
<210> 151
<211> 44
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Th MvF5 (UBITh1)
<220>
<221> Белок
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(44)
<223> Тау H329-R349
<400> 151
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys His His Lys Pro Gly Gly Gly Gln Val
20 25 30
Glu Val Lys Ser Glu Lys Leu Asp Phe Lys Asp Arg
35 40
<210> 152
<211> 63
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(40)
<223> Тау M1-D40
<220>
<221> Белок
<222> (41)..(41)
<223> эпсилон K
<220>
<221> ПЕПТИД
<222> (41)..(44)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (45)..(63)
<223> Th MvF5 (UBITh1)
<400> 152
Met Ala Glu Pro Arg Gln Glu Phe Glu Val Met Glu Asp His Ala Gly
1 5 10 15
Thr Tyr Gly Leu Gly Asp Arg Lys Asp Gln Gly Gly Tyr Thr Met His
20 25 30
Gln Asp Gln Glu Gly Asp Thr Asp Lys Lys Lys Lys Ile Ser Ile Thr
35 40 45
Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr Ile Leu Phe
50 55 60
<210> 153
<211> 63
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(40)
<223> Тау M11-T50
<220>
<221> Белок
<222> (41)..(41)
<223> эпсилон K
<220>
<221> ПЕПТИД
<222> (41)..(44)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (45)..(63)
<223> Th MvF5 (UBITh1)
<400> 153
Met Glu Asp His Ala Gly Thr Tyr Gly Leu Gly Asp Arg Lys Asp Gln
1 5 10 15
Gly Gly Tyr Thr Met His Gln Asp Gln Glu Gly Asp Thr Asp Ala Gly
20 25 30
Leu Lys Glu Ser Pro Leu Gln Thr Lys Lys Lys Lys Ile Ser Ile Thr
35 40 45
Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr Ile Leu Phe
50 55 60
<210> 154
<211> 57
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(34)
<223> Тау M1-D34
<220>
<221> Белок
<222> (35)..(35)
<223> эпсилон K
<220>
<221> ПЕПТИД
<222> (35)..(38)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (39)..(57)
<223> Th MvF5 (UBITh1)
<400> 154
Met Ala Glu Pro Arg Gln Glu Phe Glu Val Met Glu Asp His Ala Gly
1 5 10 15
Thr Tyr Gly Leu Gly Asp Arg Lys Asp Gln Gly Gly Tyr Thr Met His
20 25 30
Gln Asp Lys Lys Lys Lys Ile Ser Ile Thr Glu Ile Lys Gly Val Ile
35 40 45
Val His Arg Ile Glu Thr Ile Leu Phe
50 55
<210> 155
<211> 45
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(22)
<223> Тау M1-D22
<220>
<221> Белок
<222> (23)..(23)
<223> эпсилон K
<220>
<221> ПЕПТИД
<222> (23)..(26)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (27)..(45)
<223> Th MvF5 (UBITh1)
<400> 155
Met Ala Glu Pro Arg Gln Glu Phe Glu Val Met Glu Asp His Ala Gly
1 5 10 15
Thr Tyr Gly Leu Gly Asp Lys Lys Lys Lys Ile Ser Ile Thr Glu Ile
20 25 30
Lys Gly Val Ile Val His Arg Ile Glu Thr Ile Leu Phe
35 40 45
<210> 156
<211> 31
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(31)
<223> Тау-пептид - aк281-311
<400> 156
Lys Leu Asp Leu Ser Asn Val Gln Ser Lys Cys Gly Ser Lys Asp Asn
1 5 10 15
Ile Lys His Val Pro Gly Gly Gly Ser Val Gln Ile Val Tyr Lys
20 25 30
<210> 157
<211> 29
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(29)
<223> Тау-пептид - aк283-311
<400> 157
Asp Leu Ser Asn Val Gln Ser Lys Cys Gly Ser Lys Asp Asn Ile Lys
1 5 10 15
His Val Pro Gly Gly Gly Ser Val Gln Ile Val Tyr Lys
20 25
<210> 158
<211> 27
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(27)
<223> Тау-пептид - aк285-311
<400> 158
Ser Asn Val Gln Ser Lys Cys Gly Ser Lys Asp Asn Ile Lys His Val
1 5 10 15
Pro Gly Gly Gly Ser Val Gln Ile Val Tyr Lys
20 25
<210> 159
<211> 25
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(25)
<223> Тау-пептид - aк287-311
<400> 159
Val Gln Ser Lys Cys Gly Ser Lys Asp Asn Ile Lys His Val Pro Gly
1 5 10 15
Gly Gly Ser Val Gln Ile Val Tyr Lys
20 25
<210> 160
<211> 23
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(23)
<223> Тау-пептид - aк289-311
<400> 160
Ser Lys Cys Gly Ser Lys Asp Asn Ile Lys His Val Pro Gly Gly Gly
1 5 10 15
Ser Val Gln Ile Val Tyr Lys
20
<210> 161
<211> 21
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(21)
<223> Тау-пептид - aк291-311
<400> 161
Cys Gly Ser Lys Asp Asn Ile Lys His Val Pro Gly Gly Gly Ser Val
1 5 10 15
Gln Ile Val Tyr Lys
20
<210> 162
<211> 19
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Тау-пептид - aк293-311
<400> 162
Ser Lys Asp Asn Ile Lys His Val Pro Gly Gly Gly Ser Val Gln Ile
1 5 10 15
Val Tyr Lys
<210> 163
<211> 17
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(17)
<223> Тау-пептид - aк295-311
<400> 163
Asp Asn Ile Lys His Val Pro Gly Gly Gly Ser Val Gln Ile Val Tyr
1 5 10 15
Lys
<210> 164
<211> 13
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(13)
<223> Тау-пептид - aк299-311
<400> 164
His Val Pro Gly Gly Gly Ser Val Gln Ile Val Tyr Lys
1 5 10
<210> 165
<211> 11
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(11)
<223> Тау-пептид - aк301-311
<400> 165
Pro Gly Gly Gly Ser Val Gln Ile Val Tyr Lys
1 5 10
<210> 166
<211> 31
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(31)
<223> Тау-пептид - aк275-305
<400> 166
Val Gln Ile Ile Asn Lys Lys Leu Asp Leu Ser Asn Val Gln Ser Lys
1 5 10 15
Cys Gly Ser Lys Asp Asn Ile Lys His Val Pro Gly Gly Gly Ser
20 25 30
<210> 167
<211> 27
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(27)
<223> Тау-пептид - aк275-301
<400> 167
Val Gln Ile Ile Asn Lys Lys Leu Asp Leu Ser Asn Val Gln Ser Lys
1 5 10 15
Cys Gly Ser Lys Asp Asn Ile Lys His Val Pro
20 25
<210> 168
<211> 23
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(23)
<223> Тау-пептид - aк275-297
<400> 168
Val Gln Ile Ile Asn Lys Lys Leu Asp Leu Ser Asn Val Gln Ser Lys
1 5 10 15
Cys Gly Ser Lys Asp Asn Ile
20
<210> 169
<211> 19
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> Тау-пептид - aк275-293
<400> 169
Val Gln Ile Ile Asn Lys Lys Leu Asp Leu Ser Asn Val Gln Ser Lys
1 5 10 15
Cys Gly Ser
<210> 170
<211> 15
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(15)
<223> Тау-пептид - aк275-289
<400> 170
Val Gln Ile Ile Asn Lys Lys Leu Asp Leu Ser Asn Val Gln Ser
1 5 10 15
<210> 171
<211> 11
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(11)
<223> Тау-пептид - aк275-285
<400> 171
Val Gln Ile Ile Asn Lys Lys Leu Asp Leu Ser
1 5 10
<---
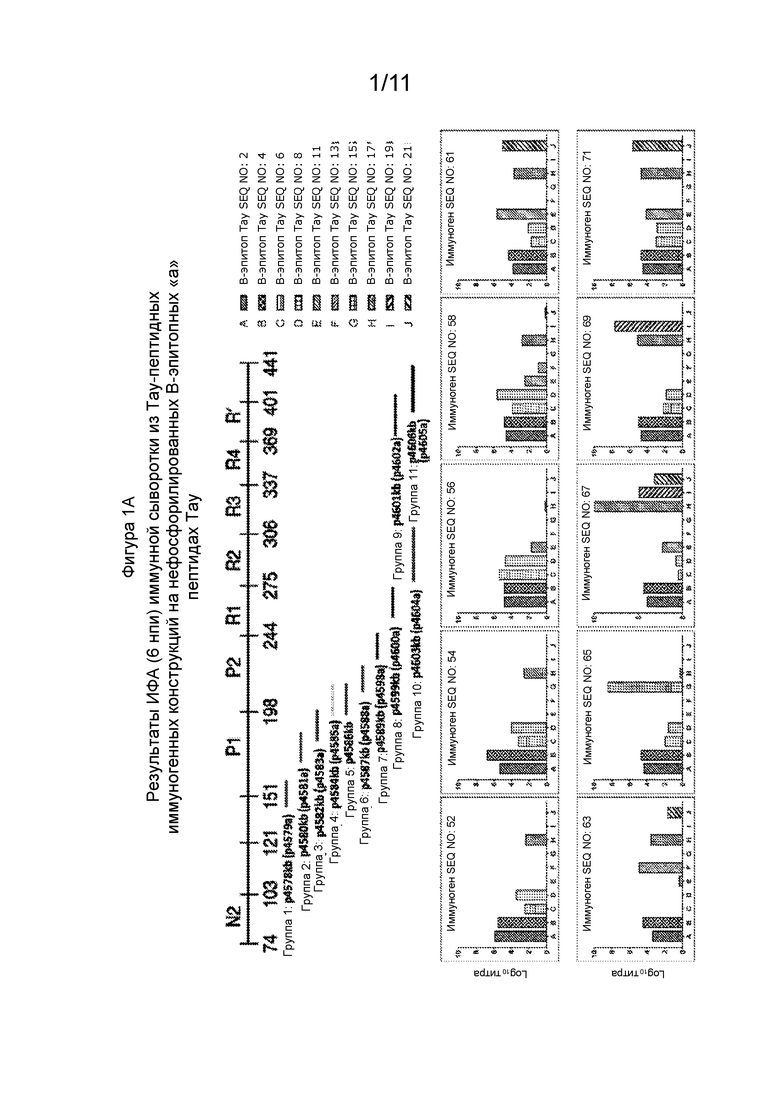

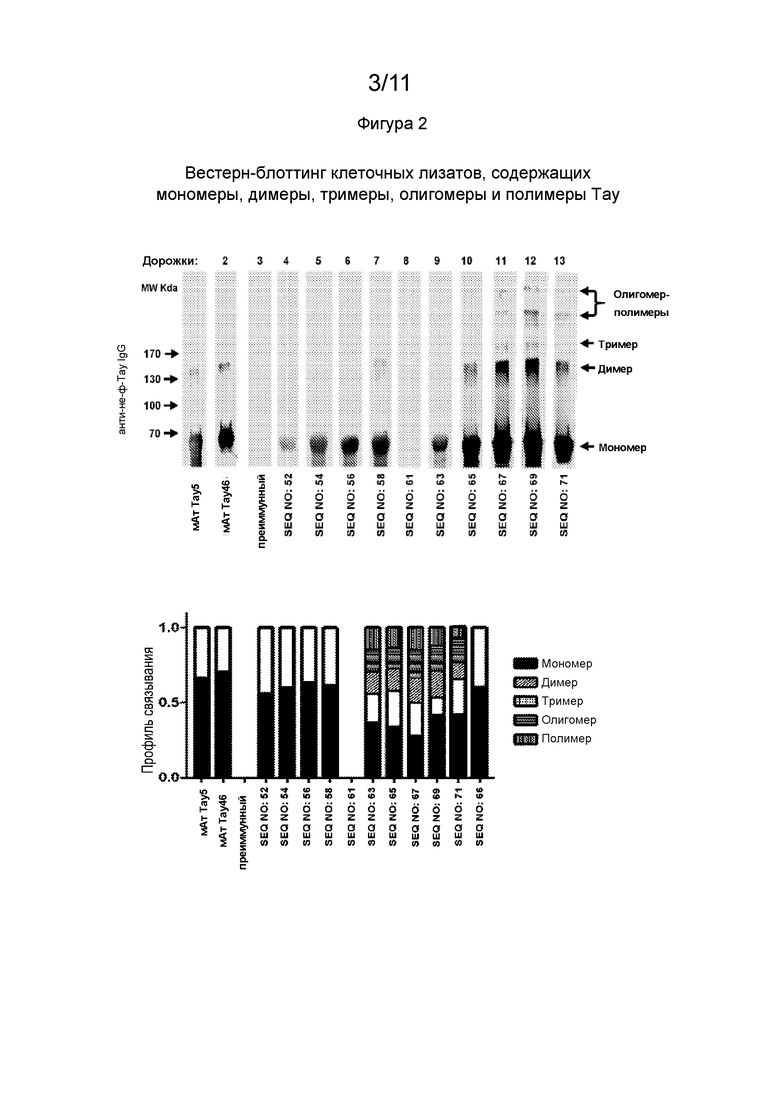

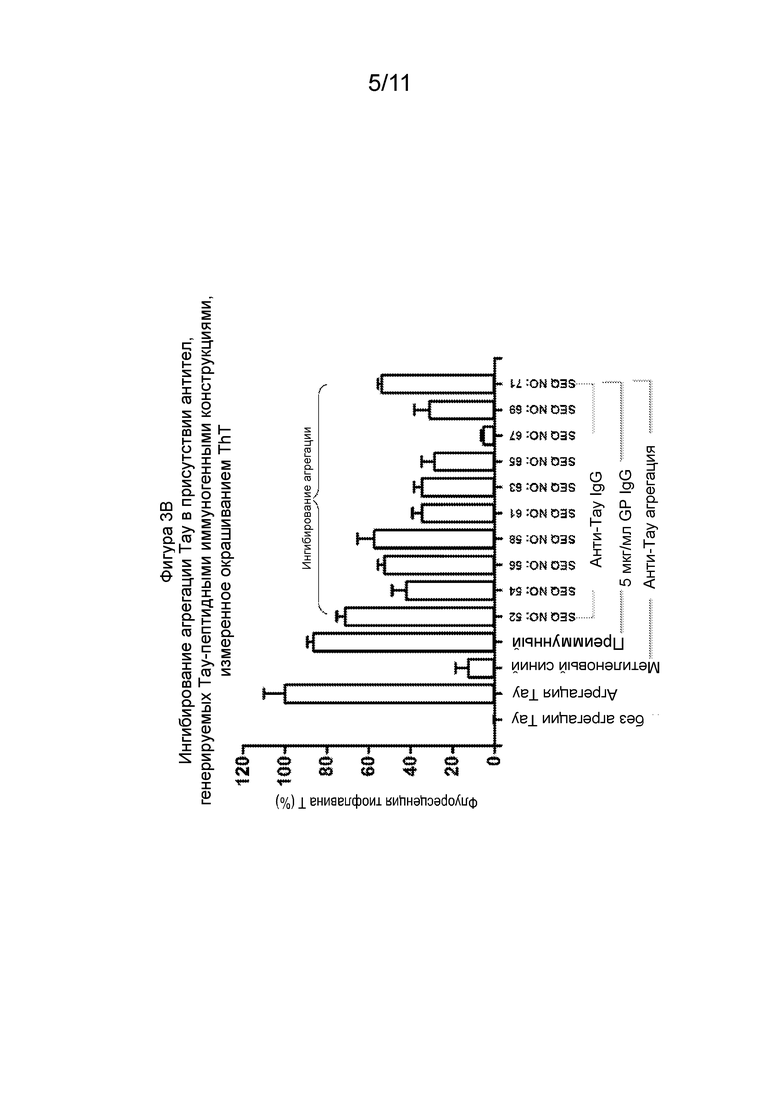
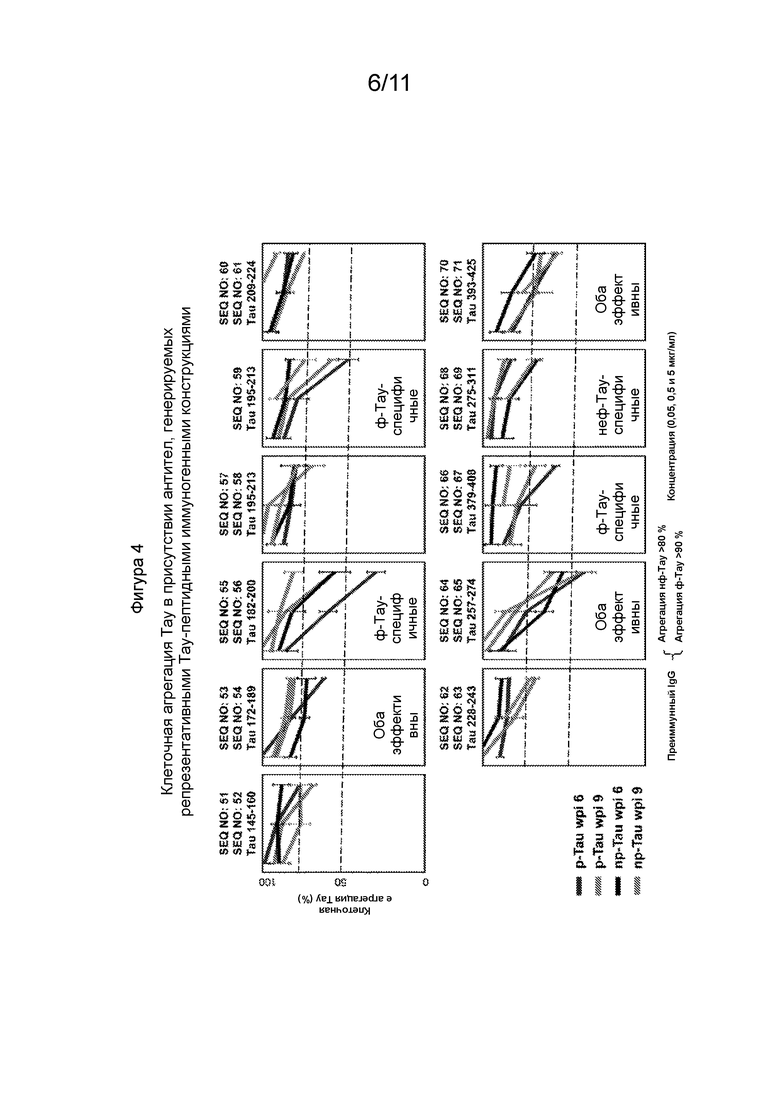
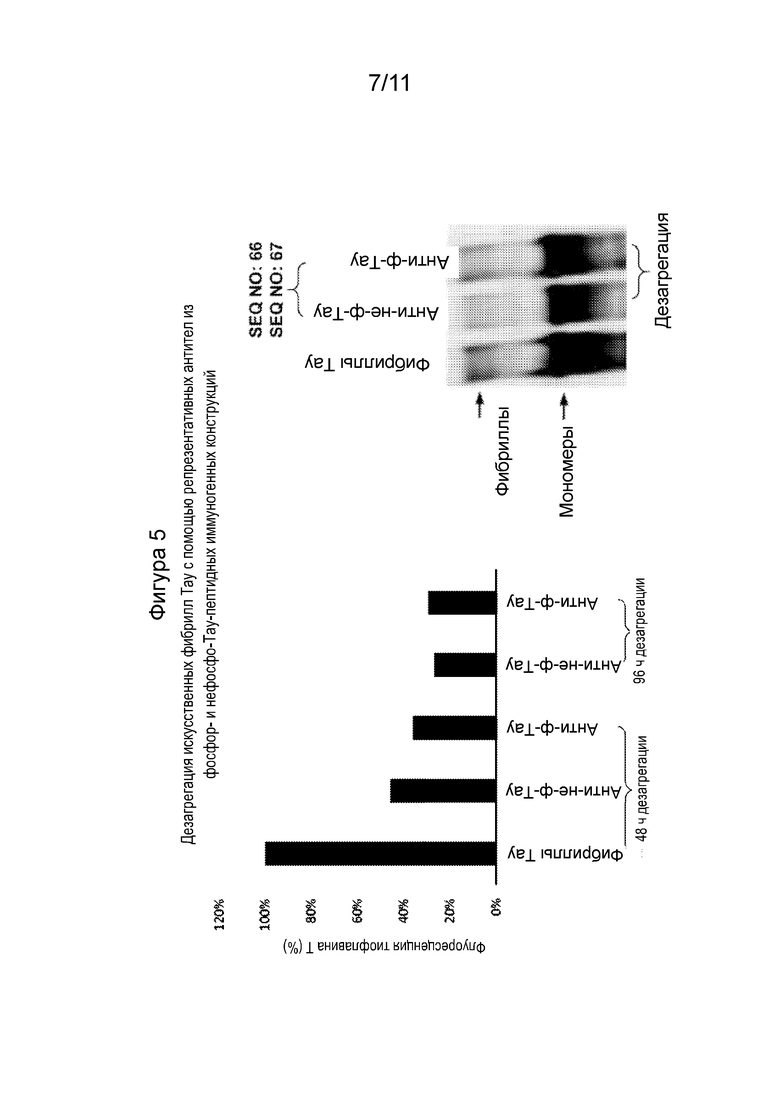
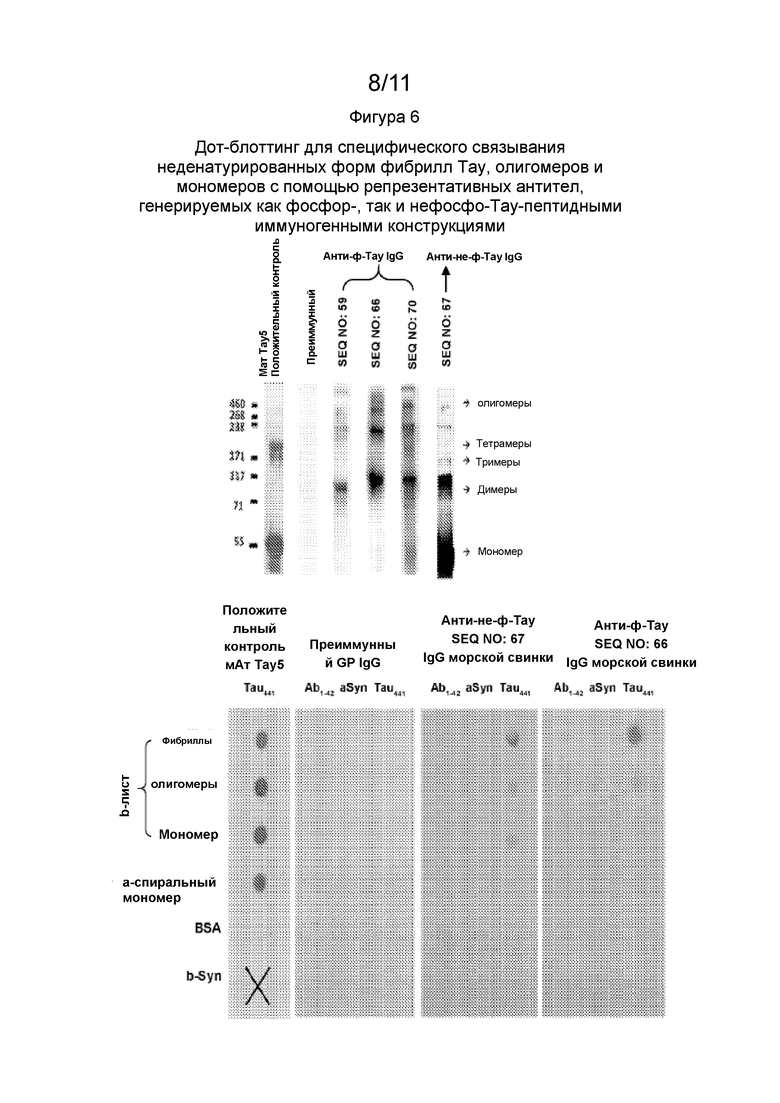


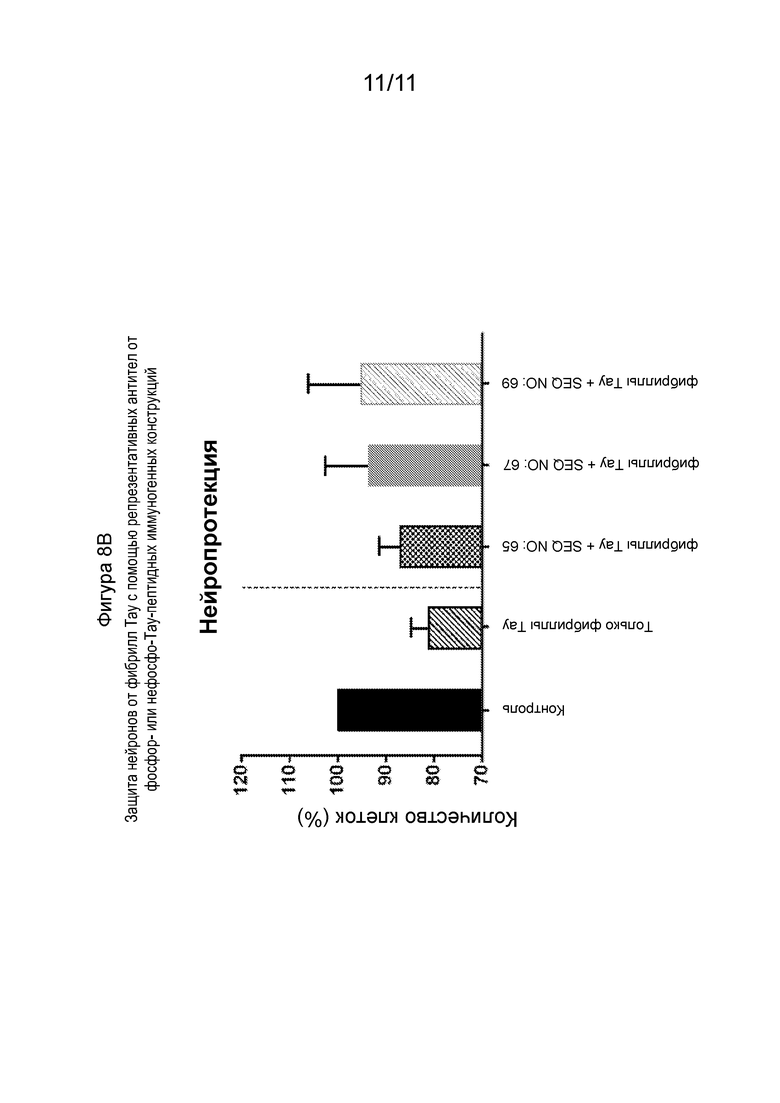
Настоящее изобретение относится к области биотехнологии, в частности к новым терапевтическим агентам для лечения нейродегенеративных заболеваний. Изобретение раскрывает пептидные иммуногенные конструкции, нацеленные на участки Тау-белка. Изобретение может быть использовано для лечения или профилактики таупатии. 5 н. и 7 з.п. ф-лы, 8 ил., 16 табл., 13 пр.
1. Тау-пептидная иммуногенная конструкция, которая может быть представлена формулами:
(Th)m-(A)n-фрагмент Тау-X
или
фрагмент Тау-(A)n-(Th)m-X, где
Th представляет собой гетерологичный T-хелперный эпитоп;
А представляет собой гетерологичный спейсер;
фрагмент Тау представляет собой В-клеточный эпитоп, выбранный из группы, состоящей из SEQ ID NOs: 1-21 и 101-124;
X представляет собой α-COOH или α-CONH2 аминокислоты;
m составляет от 1 до 4; и
n составляет от 1 до 10.
2. Тау-пептидная иммуногенная конструкция по п. 1, где Th-эпитоп выбран из группы, состоящей из SEQ ID NO: 22-50.
3. Тау-пептидная иммуногенная конструкция по п. 1, где пептидная иммуногенная конструкция выбрана из группы, состоящей из SEQ ID NOs: 51-71 и 125-155.
4. Тау-пептидная иммуногенная конструкция, содержащая:
В-клеточный эпитоп, выбранный из группы, состоящей из SEQ ID NOs: 1-21 и 101-124;
Т-хелперный эпитоп, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 22-50; и
необязательный гетерологичный спейсер, выбранный из группы, состоящей из аминокислоты, Lys-, Gly-, Lys-Lys-Lys-, (α, ε-N)Lys, и ε-N-Lys-Lys-Lys-Lys из SEQ ID NO: 102,
где В-клеточный эпитоп ковалентно связан с Т-хелперным эпитопом напрямую или через необязательный гетерологичный спейсер.
5. Тау-пептидная иммуногенная конструкция по п. 4, где Т-хелперный эпитоп выбран из группы, состоящей из SEQ ID NO: 22-50.
6. Тау-пептидная иммуногенная конструкция по п. 4, где необязательный гетерологичный спейсер представляет собой (α, ε-N)Lys или ε-N-Lys-Lys-Lys-Lys из SEQ ID NO: 102.
7. Тау-пептидная иммуногенная конструкция по п. 4, где Т-хелперный эпитоп ковалентно связан с N-концом В-клеточного эпитопа.
8. Тау-пептидная иммуногенная конструкция по п. 4, где Т-хелперный эпитоп ковалентно связан с N-концом В-клеточного эпитопа через необязательный гетерологичный спейсер.
9. Имуногенная композиция, содержащая пептидную иммуногенную конструкцию по любому из пп. 1-3.
10. Фармацевтическая композиция для лечения таупатии, содержащая:
а. пептидную иммуногенную конструкцию по любому из пп. 1-3; и
b. фармацевтически приемлемый носитель для доставки и/или адъювант.
11. Фармацевтическая композиция для профилактики таупатии, содержащая:
а. пептидную иммуногенную конструкцию по любому из пп. 1-3; и
b. фармацевтически приемлемый носитель для доставки и/или адъювант.
12. Фармацевтическая композиция по п. 10 или 11, где
а. Тау-пептидная иммуногенная конструкция выбрана из группы, состоящей из SEQ ID NOs: 51-71 и 125-155; и
b. Тау-пептидная иммуногенная конструкция смешана с CpG-олигодезоксинуклеотидом (ODN) с образованием стабилизированного иммуностимулирующего комплекса.
| KONTSEKOVA E | |||
| et al., First-in-man tau vaccine targeting structural determinants essential for pathological tau-tau interaction reduces tau oligomerisation and neurofibrillary degeneration in an Alzheimer's disease model | |||
| Alzheimers Res Ther | |||
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Приспособление для плетения проволочного каркаса для железобетонных пустотелых камней | 1920 |
|
SU44A1 |
| SIGURDSSON E.M | |||
| Tau Immunotherapy | |||
| Neurodegener Dis | |||
| Токарный резец | 1924 |
|
SU2016A1 |
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2023-06-29—Публикация
2018-10-26—Подача