Данная заявка является международной заявкой PCT, в которой заявляется приоритет по предварительной заявке США, серийный номер 62/597130, поданной 11 декабря 2017 г., которая полностью включена в данный документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
Данное описание относится к пептидным иммуногенным конструкциям, нацеленным на интерлейкин-31 (IL-31), и их составам в качестве фармацевтической композиции для лечения и/или профилактики атопического дерматита.
УРОВЕНЬ ТЕХНИКИ
Атопический дерматит (AД) был определен целевой группой Американского колледжа ветеринарной дерматологии как «генетически предрасположенное воспалительное и сопровождающееся зудом аллергическое заболевание кожи с характерными клиническими признаками» (Olivry 2001). Группа специалистов также признала, что болезнь у представителей семейства собачьих была связана с аллерген-специфическим IgE (Olivry 2001; Marsella & Olivry 2003). Тяжелый зуд, наряду с вторичной алопецией и эритемой, являются наиболее заметными и тревожными симптомами для владельцев домашних животных (патент США № 8790651).
Распространенность атопического дерматита точно неизвестна из-за плохих и противоречивых эпидемиологических данных, но оценивается в 10% от общей популяции представителей семейства собачьих (Marsella & Olivry 2003; Scott 2002; Hillier 2001). Во всем мире около 4,5 миллионов собак страдают этим хроническим и продолжающимся в течение всей жизни патологическим состоянием. По всей видимости, уровень заболеваемости увеличивается. Полагали, что есть предрасположенность в отношении породы и пола, однако в зависимости от географического региона могут быть сильные различия (Hillier 2001; Picco 2008).
Возможные факторы, связанные с аллергическим дерматитом, многочисленны и плохо изучены. Атопический дерматит могут инициировать присутствующие в пище компоненты (Picco, 2008), а также аллергены из окружающей среды, такие как блохи, пылевые клещи, амброзия, растительные экстракты и т.д. Важную роль также играют генетические факторы. И хотя никаких подтверждений предрасположенности в отношении породы нет, полагают, что имеется некоторое влияние наследственности в повышении предрасположенности к атопическому дерматиту (Sousa & Marsella 2001; Schwartzman 1971).
Интерлейкин-31 (IL-31) представляет собой цитокин, клонирование которого было осуществлено в 2004 году. Он в основном продуцируется активированными Т-хелперами (Th)2 (Dillon 2004), но также продуцируется в тучных клетках и макрофагах. IL-31 связывает корецептор, состоящий из рецептора A IL-31 (IL-31RA) и рецептора онкостатина M (OSMR) (Dillon 2004 и Bilsborough 2006). Активация рецептора приводит к фосфорилированию STAT с участием рецептора(ов) JAK. Экспрессия корецептора была показана в макрофагах, кератиноцитах и дорсальных корешковых ганглиях. Недавно было обнаружено, что IL-31 вовлечен в дерматит, кожный зуд, аллергию и гиперчувствительность дыхательных путей.
Стимуляция Т-клеток антителами к CD3 и к CD28 незамедлительно повышает экспрессию мРНК IL-31 (Dillon 2004). Посредством анализа с применением микрочипов показано, что IL-31 индуцирует некоторые гены хемотаксических агентов, таких как CXCL1, CLL17 (тимусный и регулируемый активацией хемокин (TARC)), CCL19 (макрофагальный воспалительный белок (MIP) 3β), CCL22 (моноцитарный хемокин (MDC)), CCL23 (MIP3) и CCL4 (MIPβ) (Dillon 2004).
У трансгенных мышей, которые сверхэкспрессируют IL-31, проявляется кожное воспаление, зуд, тяжелый дерматит и алопеция (Dillon 2004). Подкожная инъекция IL-31 мышам инициирует инфильтрацию под действием воспалительных клеток, нейтрофилов, эозинофилов, лимфоцитов и макрофагов и приводит к эпидермальному утолщению и акантозу кожи. У мышей NC/Nga с атопическим дерматитом (АД) вследствие естественных причин IL-31 сверхэкспрессируетя в местах поражения кожи, и его уровень коррелирует с пруритом (Takaoka 2005; Takaoka 2006). Кроме того, на мышиных моделях показано, что IL-31 индуцирует быстронаступающий прурит (Raap 2008).
В других исследованиях показано, что IL-31 ассоциирован с индуцируемым атопическим дерматитом кожным воспалением и пруритом у людей. У пациентов-людей с АД в значительно большей степени наблюдается экспрессия мРНК IL-31 в местах поражения кожи, чем в непораженных участках кожи, а экспрессия в непораженных участках кожи превышает таковую в нормальной коже здоровых пациентов (Sonkoly 2006). В другом исследовании сообщалось, что CD45RO+ Т-клетки (памяти), положительные в отношении кожного лимфоцитарного антигена (CLA), экспрессируют мРНК и белок IL-31 в коже пациентов с АД (Bilsborough 2006). Также сообщалось, что сверхэкспрессия мРНК IL-31 в коже пациентов или аллергический контактный дерматит коррелируют с экспрессией мРНК IL-4 и IL-13, а не с экспрессией мРНК интерферона (ИФН)-γ (Neis 2006). Помимо этого, показано, что уровни IL-31 в сыворотке крови пациентов-людей с хронической спонтанной крапивницей повышены и еще больше повышены у пациентов с АД (Raap 2010). Кроме того, у людей наблюдали корреляцию степени тяжести АД с уровнями IL-31 в сыворотке крови (Rapp 2008). Также показано, что секреция IL-31 усиливалась в тучных клетках после перекрестного связывания IgE и в ответ на стафилококковый суперантиген у индивидуумов с атопией. Помимо этого, показано, что IL-31 стимулирует выработку некоторых провоспалительных медиаторов, включая IL-6, IL-8, CXCL1, СС17 и многочисленные металлопротеиназы, в миофибробластах толстой кишки человека (Yagi 2007).
Считается, что гиперчувствительность I типа к аллергенам из окружающей среды представляет собой главный механизм АД у представителей семейства собачьих, а уровни Th2-опосредованных цитокинов, таких как IL-4, в местах поражения кожи собак с АД повышены (Nuttall 2002). Кроме того, инфильтрация воспалительными клетками, лимфоцитами и нейтрофилами представляет собой важный механизм, лежащий в основе обострения кожных поражений; сверхэкспрессия генов хемотаксических агентов, таких как CCL17/TARC, CCR4 и CCL28/ассоциированный со слизистой оболочкой эпителиальный хемокин (МЕС), вносит вклад в обострение поражений кожи у собак с АД (Maeda 2005; Maeda 2002; и Maeda 2008).
Последние данные указывают на то, что IL-31 может быть вовлечен в стимуляцию аллергического воспаления и ответную реакцию эпителия дыхательных путей, характерную для аллергической астмы (Chattopadhyay 2007; и Wai 2007).
Эти наблюдения подтверждают гипотезу о том, что IL-31 играет существенную роль как в сопровождающихся зудом, так и в аллергических состояниях. Было бы желательно обеспечить пептидный иммуноген, способный индуцировать выработку антител к IL-31, полезных для лечения зудящего состояния и/или аллергического состояния, такого как атопический дерматит у собак, кошек и/или людей.
Ссылки:
1. BAMMERT, et al., патент США № 8790651 (выдан 29 июля 2014 г.)
2. BILSBOROUGH, et al., J Allergy Clin Immunol., 117(2):418-25 (2006)
3. CHATTOPADHYAY, et al., J Biol Chem, 282:3014-26 (2007)
4. LENG, et al., патент США № 8426163 (выдан 23 апреля 2013 г.)
5. DILLON, et al., Nat Immunol, 5:752-60 (2004)
6. HILLIER, Veterinary Immunology and Immunopathology, 81: 147-151 (2001)
7. MAEDA, et al., Vet. Immunol. Immunopathol., 90, 145-154; (2002)
8. MAEDA, et al., Vet. Immunol. Immunopathol., 103, 83-92; (2003)
9. MAEDA, et al., J. Vet. Med. Sci., 70, 51-55 (2008)
10. MARSELLA & OLIVRY, Clinics in Dermatology, 21: 122-133 (2003)
11. NEIS, et al., J. Allergy Clin. Immunol., 118, 930-937 (2006)
12. NUTTALL, et al., Vet. Immunol. Immunopathol., 87, 379-384 (2002)
13. OLIVRY, et al., Veterinary Immunology and Immunopathology, 81: 143-146 (2001)
14. PICCO, et al., Vet Dermatol., 19: 150-155 (2008)
15. RAAP, et al., J Allergy Clin Immunol., 122(2):421-3 (2008)
16. RAAP, et al., Exp Dermatol., 19(5):464-6 (2010)
17. SCHWARTZMAN, et al., Clin. Exp. Immunol., 9: 549-569 (2971)
18. SCOTT, et al., Canadian Veterinary Journal, 43: 601-603 (2002)
19. SONKOLY, et al., J Allergy Clin Immunol., 117:411-7 (2006)
20. SOUSA, et al., Veterinary Immunology and Immunopathology, 81:153-157 (2001)
21. TAKAOKA, et al., Eur J. Pharmacol., 516, 180-181 (2005)
22. TAKAOKA, et al., Exp. Dermatol., 15, 161-167 (2006)
23. WAI, et al., Immunology, 122, 532-541 (2007)
24. WALKER, et al., патент США № 6361966 (выдан 26 марта 2002 г.)
25. YAGI, et al., International Journal of Molecular Medicine, 19(6): 941-946 (2007)
26. “Atopic Dermatitis”, Wikipedia, The Free Encyclopedia, website address: en.wikipedia.org/wiki/Atopic_dermatitis (accessed December 8, 2017).
27. “Interleukin 31”, Wikipedia, The Free Encyclopedia, адрес веб-сайта: en.wikipedia.org/wiki/Interleukin_31 (по состоянию на 8 декабря 2017 г.).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Данное описание относится к отдельным пептидным иммуногенным конструкциям, нацеленным на части белка интерлейкина-31 (IL-31), для лечения и/или профилактики зудящего состояния и/или аллергического состояния, такого как атопический дерматит. Данное описание также относится к композициям, содержащим пептидные иммуногенные конструкции, способам получения и применения пептидных иммуногенных конструкций и антител, продуцируемых против пептидных иммуногенных конструкций.
Описанные пептидные иммуногенные конструкции содержат около 25 или более аминокислот. Пептидные иммуногенные конструкции содержат В-клеточный эпитоп из частей собачьего белка IL-31 (GenBank: BAH97742.1). Полноразмерная аминокислотная последовательность собачьего и человеческого белка IL-31 показана в таблице 1 как SEQ ID NO: 1 и SEQ ID NO: 2, соответственно. В-клеточный эпитоп может быть связан с гетерологичным Т-хелперным (Th) эпитопом, полученным из патогенных белков, через необязательный гетерологичный спейсер. Описанные пептидные иммуногенные конструкции стимулируют выработку высокоспецифических антител, направленных против IL-31. Описанные пептидные иммуногенные конструкции можно использовать в качестве иммунотерапии для животных, страдающих от зудящего состояния или аллергического состояния, такого как атопический дерматит.
Часть В-клеточного эпитопа пептидных иммуногенных конструкций имеет аминокислотные последовательности из полноразмерного собачьего белка IL-31 (SEQ ID NO: 1) или полноразмерного человеческого белка IL-31 (SEQ ID NO: 2). В некоторых вариантах осуществления B-клеточный эпитоп имеет последовательность, содержащую любую из SEQ ID NO: 1-13 и 93-98, как показано в таблице 1.
Пептидные иммуногенные конструкции согласно данному описанию могут содержать аминокислотную последовательность гетерологичного Th-эпитопа, полученную из патогенного белка (например, SEQ ID NO: 14-42), как показано в таблице 2. В некоторых вариантах осуществления гетерологичный Th-эпитоп получен из природных патогенов, таких как токсин дифтерии (SEQ ID NO: 18), Plasmodium Falciparum (SEQ ID NO: 19), токсин холеры (SEQ ID NO: 21). В других вариантах осуществления гетерологичный Th-эпитоп представляет собой идеализированный искусственный Th-эпитоп, полученный из слитого белка вируса кори (MVF 1-5) или поверхностного антигена гепатита B (HBsAg 1-3) в форме одной последовательности или комбинаторных последовательностей (например, SEQ ID NO: 25, 24 и 26).
В некоторых вариантах осуществления пептидные иммуногенные конструкции содержат В-клеточный эпитоп из IL-31, связанный с гетерологичным Т-хелперным (Th) эпитопом через необязательный гетерологичный спейсер. В некоторых вариантах осуществления пептидные иммуногенные конструкции содержат В-клеточную антигенную детерминанту, имеющую аминокислотную последовательность из IL-31 (например, SEQ ID NO: 1-13 и 93-98), связанную с гетерологичным Th-эпитопом, полученным из патогенного белка (например, SEQ ID NO: 14-42), через необязательный гетерологичный спейсер. В некоторых вариантах осуществления необязательный гетерологичный спейсер представляет собой молекулу или химическую структуру, способную связывать две аминокислоты и/или пептида вместе. В некоторых вариантах осуществления спейсер представляет собой природную аминокислоту, неприродную аминокислоту или их комбинацию. В конкретных вариантах осуществления пептидные иммуногенные конструкции имеют аминокислотную последовательность SEQ ID NO: 43-90 и 99-105, приведенную в таблице 3.
Данное описание также относится к композициям, содержащим пептидную иммуногенную конструкцию IL-31. В некоторых вариантах осуществления описанные композиции содержат более одной пептидной иммуногенной конструкции IL-31. В некоторых вариантах осуществления композиции содержат смесь пептидных иммуногенных конструкций IL-31 (например, любую комбинацию SEQ ID NO: 43-90 и 99-105), чтобы охватить широкий генетический фон у субъектов. Композиции, содержащие смесь пептидных иммуногенных конструкций, могут приводить к более высокой процентной доле пациентов с клиническим ответом при иммунизации для лечения зудящего состояния и/или аллергического состояния, такого как атопический дерматит, по сравнению с композициями, содержащими только одну пептидную иммуногенную конструкцию.
Данное описание также относится к фармацевтическим композициям для лечения и/или профилактики зудящего состояния и/или аллергического состояния, такого как атопический дерматит. В некоторых вариантах осуществления фармацевтические композиции содержат описанные пептидные иммуногенные конструкции в форме стабилизированного иммуностимулирующего комплекса, образованного посредством электростатических ассоциаций путем смешивания CpG-олигомера с композицией, содержащей пептидный иммуногенный комплекс. Такие стабилизированные иммуностимулирующие комплексы способны дополнительно усиливать иммуногенность пептидных иммуногенных конструкций. В некоторых вариантах осуществления фармацевтические композиции содержат адъюванты, такие как минеральные соли, включая гель на основе квасцов (ALHYDROGEL), фосфат алюминия (ADJUPHOS) или водно-масляные эмульсии, включая MONTANIDE ISA 50V2, ISA 51 или ISA 720.
Данное описание также относится к антителам, направленным против описанных пептидных иммуногенных конструкций IL-31. В частности, пептидные иммуногенные конструкции согласно данному описанию способны стимулировать выработку высокоспецифических антител, которые перекрестно реагируют с аминокислотными последовательностями IL-31 (SEQ ID NO: 1-13) при введении субъекту. Высокоспецифические антитела, продуцируемые против пептидных иммуногенных конструкций, перекрестно реагируют с рекомбинантными белками, содержащими IL-31. Используемые для усиления иммуногенности описанные антитела связываются с IL-31 с высокой специфичностью, без особой специфичности, и с любой специфичностью, направленной на гетерологичные Th-эпитопы, что резко контрастирует со стандартным белком или другими биологическими носителями, используемыми для такого усиления пептидной антигенности.
Данное описание также включает способы лечения и/или профилактики зудящего состояния и/или аллергического состояния, такого как атопический дерматит, с использованием описанных пептидных иммуногенных конструкций и/или антител, направленных против пептидных иммуногенных конструкций. В некоторых вариантах осуществления способы лечения и/или профилактики зудящего состояния и/или аллергического состояния, такого как атопический дерматит, включают введение хозяину композиции, содержащей описанную пептидную иммуногенную конструкцию. В некоторых вариантах осуществления композиции, используемые в способах, содержат описанную пептидную иммуногенную конструкцию в форме стабильного иммуностимулирующего комплекса с отрицательно заряженными олигонуклеотидами, такими как CpG-олигомеры, посредством электростатической ассоциации, причем к этим комплексам дополнительно добавляют, необязательно, минеральные соли или масло в качестве адъюванта, для введения субъектам с зудящим состоянием и/или аллергическим состоянием, таким как атопический дерматит. Описанные способы также включают схемы применения, лекарственные формы и способы введения пептидных иммуногенных конструкций хозяину, подверженному риску зудящего состояния и/или аллергического состояния, такого как атопический дерматит, или страдающему от такого патологического состояния.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Фиг. 1A-1B - Аминокислотная последовательность собачьего белка IL-31 (SEQ ID NO: 1) с выделенными структурными и функциональными признаками (Фиг. 1A), и выравнивание последовательностей и локализация антигенных детерминант, используемых в данном описании, относительно полноразмерного собачьего белка IL-31 (Фиг. 1B).
Фиг. 2 - Графики, иллюстрирующие титры поликлональных антител к IL-31 (Log10) с рекомбинантным собачьим белком IL-31 после иммунизации морских свинок различными составами, содержащими пептидные иммуногены IL-31 в адъюванте ISA50V2. Образцы анализировали через 3, 6, 9, 12 и 15 недель после инъекции (нпи).
Фиг. 3A-3D - Карта плазмиды собачьего IL-31 с His-меткой на С-конце для экспрессии в клетках млекопитающих (Expi 293F) (Фиг. 3A) и вестерн-блот, обработанный антителом к His-метки из клеточного лизата и культуральной среды (Фиг. 3B). Экспрессированный His-меченный белок IL-31 окрашивали кумасси синим и очищали на 12% Бис-трис ДСН-ПААГ (Фиг. 3C). Вестерн-блот геля ДСН-ПААГ, показанный на Фиг. 3C, обрабатывали антителом к метки His (Фиг. 3D).
Фиг. 4А-4В - схема, иллюстрирующая функциональный анализ ингибирования индуцированной IL-31 сигнальной трансдукции in vitro с использованием антител к IL-31 (Фиг. 4А). Увеличенный вид стадий анализа приведен на Фиг. 4В.
Фиг. 5А и 5В - Графики, на которых показаны результаты функционального анализа in vitro для измерения уровня фосфорилирования STAT3 в собачьих моноцитах DH82, индуцированного собачьим IL-31, полученным из клеток expi293. На Фиг. 5А показано, что pSTAT3 индуцируется собачьим IL-31 зависимым от дозы образом. На Фиг. 5B показано, что pSTAT3 индуцируется собачьим IL-31 зависимым от времени образом.
Фиг. 6А и 6В - графики, на которых показано ингибирование индуцированной собачьим IL-31 (1 мкг/мл) передачи сигнала pSTAT3 в моноцитах DH82 собаки с помощью антител к IL-31, полученных с использованием пептидных иммуногенных конструкций IL-31 (SEQ ID NO: 43, 47, 51, 55. и 59), через 12 недель после первичной иммунизации (нпи) (Фиг. 6A) и 15 нпи (Фиг. 6B).
Фиг. 7 - График, на котором показано ингибирование индуцированной собачьим IL-31 (1 мкг/мл) передачи сигнала pSTAT3 в моноцитах DH82 собаки с помощью антител к IL-31, полученных с использованием пептидных иммуногенных конструкций IL-31 p4751kb (SEQ ID NO: 43) и p4752 ( SEQ ID NO: 47), через 15 недель после инъекции (нпи). На нижней панели приведена информация об ингибировании (IC50) для индуцированной рекомбинантным собачьим белком IL-31 передачи сигнала pSTAT.
Фиг. 8 - Графики, иллюстрирующие титры поликлональных антител к IL-31 (Log10) с рекомбинантным собачьим белком IL-31 после иммунизации морских свинок составами, содержащими пептидные иммуногены IL-31 (SEQ ID NO: 63, 68, 71, 76, 80, 84) в адъюванте ISA50V2. Образцы анализировали через 3, 6, 9, 12 и 15 недель после первичной иммунизации (нпи).
Фиг. 9А-9В - Графики, на которых показан процент фосфорилирования (Фиг. 9А) и процент ингибирования (Фиг. 9В) индуцированной собачьим IL-31 (1 мкг/мл) передачи сигнала pSTAT3 в моноцитах DH82 собаки при помощи антител к IL-31, полученных с помощью описанных пептидных иммуногенных конструкций IL-31 (SEQ ID NO: 63, 68, 71, 76, 80 и 84), через 6 и 12 недель после первичной иммунизации (нпи).
Фиг.10А-10В - Графики, на которых показан процент фосфорилирования (Фиг 10А) и процент ингибирования (Фиг. 10В) индуцированной собачьим IL-31 (1 мкг/мл) передачи сигнала pSTAT3 в моноцитах DH82 собаки при помощи антител к IL-31, полученных с помощью описанных пептидных иммуногенных конструкций IL-31 (SEQ ID NO: 63, 68, 71 и 64) через 9 и 12 недель после первичной иммунизации (нпи).
Фиг. 11А-11В - Гистограммы, на которых показан процент фосфорилирования (Фиг. 11А) и процент ингибирования (Фиг. 11В) индуцированной собачьим IL-31 (1 мкг/мл) передачи сигнала pSTAT3 в моноцитах DH82 собаки в присутствии антител к IL-31, полученных с помощью пептидных иммуногенных конструкций IL-31 p4854kb (SEQ ID NO: 63) и p4859 (SEQ ID NO: 84) через 6, 9 и 12 недель после первичной иммунизации (нпи).
Фиг. 12 - Кривые, на которых показан процент фосфорилирования индуцированной собачьим IL-31 (1 мкг/мл) передачи сигнала pSTAT3 в моноцитах DH82 собаки с помощью антител к IL-31, полученных с использованием пептидных иммуногенных конструкций IL-31 p4854kb (SEQ ID NO: 63) и p4859 ( SEQ ID NO: 84), через 6, 9, и 12 недель после иммунизации (нпи). На нижней панели приведена информация об ингибировании (IC50) для индуцированной рекомбинантным собачьим белком IL-31 передачи сигнала pSTAT.
Фиг. 13 - Протокол иммунизации собак породы бигль с использованием пептидной иммуногенной конструкции собачьего IL-31 (SEQ ID NO: 84).
Фиг. 14 - Оценка иммуногенности пептидной иммуногенной конструкции человеческого IL-31 (SEQ ID NO: 84) (Log10) к В-клеточному эпитопному пептиду (2-е Ат: конъюгированное с ПХ козье антитело к IgG собаки) у собак породы бигль.
Фиг. 15 - Титры антител в сыворотке собаки (Log10) к белку рсIL-31 с использованием пептидной иммуногенной конструкции IL-31 (SEQ ID NO: 84) (2-е Ат: конъюгированное с ПХ кроличье антитело к IgG собаки) на 21 и 41 сутки после первичной иммунизации (СПИ).
Фиг. 16 - Титры антител в сыворотке собаки (Log10) к белку рсIL-31 с использованием пептидной иммуногенной конструкции IL-31 (SEQ ID NO: 84) (2-е Ат: протеин A/G-ПХ) на 21 и 41 сутки после первичной иммунизации (СПИ).
Фиг. 17А-17В - Графики, на которых показан процент фосфорилирования (Фиг. 17А) и процент ингибирования (Фиг. 17В) индуцированной собачьим IL-31 передачи сигнала pSTAT в моноцитах DH82 собаки с помощью очищенных IgG из иммунной сыворотки собаки (типовые образцы 1-10).
Фиг. 18А-18В - Графики, на которых показан процент фосфорилирования (Фиг. 18А) и процент ингибирования (Фиг. 18В) индуцированной собачьим IL-31 передачи сигнала pSTAT в моноцитах DH82 собаки с помощью Cytopoint (мкАт к IL-31) - IC50: 3,21 мкг/мл.
Фиг. 19А-19С -- Схематический чертеж, на котором показана схема иммунизации и кровопускания у морских свинок, иммунизированных различными пептидными иммуногенными конструкциями IL-31 (SEQ ID NO: 83 и 85), представлен на Фиг. 19А. Графики, на которых показан процент фосфорилирования (Фиг. 19B) и процент ингибирования (Фиг. 19C) индуцированной собачьим IL-31 передачи сигнала pSTAT в моноцитах DH82 собаки при помощи очищенных IgG из иммунной сыворотки морской свинки на 6 и 15 нпи, соответственно.
Фиг. 20А-20В - График, иллюстрирующий иммуногенность различных пептидных иммуногенных конструкций человеческого IL-31 (SEQ ID NO: 87, 99, 100 и 101) у морских свинок (Фиг. 20А) вместе с краткими результатами LogEC50 для каждой конструкции (Фиг. 20B).
Фигура 21 - График, иллюстрирующий ингибирование взаимодействия IL-31 и IL-31Rα реактивными к IL-31 поликлональными антителами из иммунной сыворотки морской свинки против пептидных иммуногенных конструкций IL-31 (SEQ ID NO: 87, 99, 100 и 101) вместе с краткими результатами IC50 для каждой конструкции.
Фиг. 22 - Подавление индуцированного IL-31 фосфорилирования STAT3 на клетках U87MG реактивными к IL-31 поликлональными антителами из иммунной сыворотки морских свинок против пептидных иммуногенных конструкций IL-31 (SEQ ID NO: 87 и 101).
Фиг. 23 - Подавление индуцированной IL-31 экспрессии IL-20 на клетках HaCaT реактивными к IL-31 поликлональными антителами из иммунной сыворотки морских свинок против пептидных иммуногенных конструкций IL-31 (SEQ ID NO: 87 и 101).
Фиг. 24А-24В - График, иллюстрирующий иммуногенность типовой пептидной конструкции человеческого IL-31 (SEQ ID NO: 101) в различных многокомпонентных составах (Фиг. 24А) вместе с краткими результатами LogEC50 для каждого состава (Фиг. 24В).
Фиг. 25A-25B - График, демонстрирующий ингибирование взаимодействия IL-31 и IL-31α реактивными к IL-31 поликлональными антителами из иммунной сыворотки морской свинки против пептидной иммуногенной конструкции человеческого IL-31 (SEQ ID NO: 101) в различных составах (Фиг. 25А) вместе с краткими результатами IC50 для каждого состава (Фиг. 25В).
Фиг. 26 - Подавление индуцированной IL-31 экспрессии IL-20 на клетках HaCaT реактивными к IL-31 поликлональными антителами из иммунной сыворотки морских свинок к пептидной иммуногенной конструкции IL-31 (SEQ ID NO: 101) в различных составах.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Данное описание относится к отдельным пептидным иммуногенным конструкциям, нацеленным на части белка интерлейкина-31 (IL-31), для лечения и/или профилактики зудящего состояния и/или аллергического состояния, такого как атопический дерматит. Данное описание также относится к композициям, содержащим пептидные иммуногенные конструкции, способам получения и применения пептидных иммуногенных конструкций и антител, продуцируемых против пептидных иммуногенных конструкций.
Описанные пептидные иммуногенные конструкции содержат около 25 или более аминокислот. Пептидные иммуногенные конструкции содержат В-клеточный эпитоп из частей собачьего белка IL-31 (GenBank: BAH97742.1). Полноразмерная аминокислотная последовательность собачьего и человеческого белка IL-31 показана в таблице 1 как SEQ ID NO: 1 и SEQ ID NO: 2, соответственно. В-клеточный эпитоп может быть связан с гетерологичным Т-хелперным (Th) эпитопом, полученным из патогенных белков, через необязательный гетерологичный спейсер. Описанные пептидные иммуногенные конструкции стимулируют выработку высокоспецифических антител, направленных против IL-31. Описанные пептидные иммуногенные конструкции можно использовать в качестве иммунотерапии для животных, страдающих от зудящего состояния или аллергического состояния, такого как атопический дерматит.
Часть В-клеточного эпитопа пептидных иммуногенных конструкций имеет аминокислотные последовательности из полноразмерного собачьего белка IL-31 (SEQ ID NO: 1) или полноразмерного человеческого белка IL-31 (SEQ ID NO: 2). В некоторых вариантах осуществления B-клеточный эпитоп имеет последовательность, содержащую любую из SEQ ID NO: 1-13 и 93-98, как показано в таблице 1.
Пептидные иммуногенные конструкции согласно данному описанию могут содержать аминокислотную последовательность гетерологичного Th-эпитопа, полученную из патогенного белка (например, SEQ ID NO: 14-42), как показано в таблице 2. В некоторых вариантах осуществления гетерологичный Th-эпитоп получен из природных патогенов, таких как токсин дифтерии (SEQ ID NO: 18), Plasmodium Falciparum (SEQ ID NO: 19), токсин холеры (SEQ ID NO: 21). В других вариантах осуществления гетерологичный Th-эпитоп представляет собой идеализированный искусственный Th-эпитоп, полученный из слитого белка вируса кори (MVF 1-5) или поверхностного антигена гепатита B (HBsAg 1-3) в форме одной последовательности или комбинаторных последовательностей (например, SEQ ID NO: 25, 24 и 26).
В некоторых вариантах осуществления пептидные иммуногенные конструкции содержат В-клеточный эпитоп из IL-31, связанный с гетерологичным Т-хелперным (Th) эпитопом через необязательный гетерологичный спейсер. В некоторых вариантах осуществления пептидные иммуногенные конструкции содержат В-клеточную антигенную детерминанту, имеющую аминокислотную последовательность из IL-31 (например, SEQ ID NO: 1-13 и 93-98), связанную с гетерологичным Th-эпитопом, полученным из патогенного белка (например, SEQ ID NO: 14-42), через необязательный гетерологичный спейсер. В некоторых вариантах осуществления необязательный гетерологичный спейсер представляет собой молекулу или химическую структуру, способную связывать две аминокислоты и/или пептида вместе. В некоторых вариантах осуществления спейсер представляет собой природную аминокислоту, неприродную аминокислоту или их комбинацию. В конкретных вариантах осуществления пептидные иммуногенные конструкции имеют аминокислотную последовательность SEQ ID NO: 43-90 и 99-105, приведенную в таблице 3.
Данное описание также относится к композициям, содержащим пептидную иммуногенную конструкцию IL-31. В некоторых вариантах осуществления описанные композиции содержат более одной пептидной иммуногенной конструкции IL-31. В некоторых вариантах осуществления композиции содержат смесь пептидных иммуногенных конструкций IL-31 (например, любую комбинацию SEQ ID NO: 43-90 и 99-105), чтобы охватить широкий генетический фон у субъектов. Композиции, содержащие смесь пептидных иммуногенных конструкций, могут приводить к более высокой процентной доле пациентов с клиническим ответом при иммунизации для лечения зудящего состояния и/или аллергического состояния, такого как атопический дерматит, по сравнению с композициями, содержащими только одну пептидную иммуногенную конструкцию.
Данное описание также относится к фармацевтическим композициям для лечения и/или профилактики зудящего состояния и/или аллергического состояния, такого как атопический дерматит. В некоторых вариантах осуществления фармацевтические композиции содержат описанные пептидные иммуногенные конструкции в форме стабилизированного иммуностимулирующего комплекса, образованного посредством электростатических ассоциаций путем смешивания CpG-олигомера с композицией, содержащей пептидный иммуногенный комплекс. Такие стабилизированные иммуностимулирующие комплексы способны дополнительно усиливать иммуногенность пептидных иммуногенных конструкций. В некоторых вариантах осуществления фармацевтические композиции содержат адъюванты, такие как минеральные соли, включая гель на основе квасцов (ALHYDROGEL), фосфат алюминия (ADJUPHOS) или водно-масляные эмульсии, включая MONTANIDE ISA 50V2, ISA 51 или ISA 720.
Данное описание также относится к антителам, направленным против описанных пептидных иммуногенных конструкций IL-31. В частности, пептидные иммуногенные конструкции согласно данному описанию способны стимулировать образование высокоспецифических антител, которые перекрестно реагируют с аминокислотными последовательностями IL-31 (SEQ ID NO: 1-13 и 93-98) при введении субъекту. Высокоспецифические антитела, продуцируемые против пептидных иммуногенных конструкций, перекрестно реагируют с рекомбинантными белками, содержащими IL-31. Используемые для усиления иммуногенности описанные антитела связываются с IL-31 с высокой специфичностью, без особой специфичности, и с любой специфичностью, направленной на гетерологичные Th-эпитопы, что резко контрастирует со стандартным белком или другими биологическими носителями, используемыми для такого усиления пептидной антигенности.
Данное описание также включает способы лечения и/или профилактики зудящего состояния и/или аллергического состояния, такого как атопический дерматит, с использованием описанных пептидных иммуногенных конструкций и/или антител, направленных против пептидных иммуногенных конструкций. В некоторых вариантах осуществления способы лечения и/или профилактики зудящего состояния и/или аллергического состояния, такого как атопический дерматит, включают введение хозяину композиции, содержащей описанную пептидную иммуногенную конструкцию. В некоторых вариантах осуществления композиции, используемые в способах, содержат описанную пептидную иммуногенную конструкцию в форме стабильного иммуностимулирующего комплекса с отрицательно заряженными олигонуклеотидами, такими как CpG-олигомеры, посредством электростатической ассоциации, причем к этим комплексам дополнительно добавляют, необязательно, минеральные соли или масло в качестве адъюванта, для введения субъектам с зудящим состоянием и/или аллергическим состоянием, таким как атопический дерматит. Описанные способы также включают схемы применения, лекарственные формы и способы введения пептидных иммуногенных конструкций хозяину, подверженному риску зудящего состояния и/или аллергического состояния, такого как атопический дерматит, или страдающему от такого патологического состояния..
Заголовки разделов, используемые в данном документе, предназначены только для целей структурирования и не должны рассматриваться как ограничивающие заявленный предмет. Все ссылки или части ссылок, приведенные в данной заявке, специально включены в данный документ посредством ссылки во всей их полноте для любых целей.
Если не указано иное, все технические и научные термины, используемые в данном документе, имеют то же значение, которое обычно понимает средний специалист в данной области техники, к которой относится это изобретение. Формы единственного числа включают ссылки на формы множественного числа, если в контексте явно не указано иное. Подобным образом, слово «или» предназначено для охвата «и», если в контексте явно не указано иное. Следовательно, «содержащий А или В» означает включающий А, или В, или А и В. Кроме того, следует понимать, что все размеры аминокислот и все значения молекулярного веса или молекулярной массы, приведенные для полипептидов, являются приблизительными и представлены для описания. Хотя способы и материалы, подобные или эквивалентные тем, которые описаны в данном документе, могут использоваться на практике или при тестировании описанного способа, подходящие способы и материалы описаны ниже. Все публикации, заявки на патенты, патенты и другие ссылки, упоминаемые в данном документе, включены посредством ссылки во всей своей полноте. В случае конфликта приоритет будет иметь данное описание, включая объяснения терминов. Кроме того, материалы, способы и примеры являются иллюстративными и не носят ограничительного характера.
Пептидная иммуногенная конструкция IL-31
Данное описание относится к пептидным иммуногенным конструкциям, содержащим В-клеточный эпитоп с аминокислотной последовательностью из IL-31, ковалентно связанной с гетерологичным Т-хелперным (Th) эпитопом непосредственно или через необязательный гетерологичный спейсер.
В контексте данного документа фраза «пептидная иммуногенная конструкция IL-31» или «пептидная иммуногенная конструкция» относится к пептиду, содержащему (а) В-клеточный эпитоп, имеющий около 15 или более аминокислотных остатков из полноразмерной последовательности собачьего IL-31 (SEQ ID NO: 1) или человеческого IL-31 (SEQ ID NO: 2); (b) гетерологичный Th-эпитоп; и (с) необязательный гетерологичный спейсер.
В некоторых вариантах осуществления пептидная иммуногенная конструкция IL-31 может быть представлена формулами:
(Th)m-(A)n-(фрагмент IL-31)-X
или
(Фрагмент IL-31)-(A)n-(Th)m-X
где
Th представляет собой гетерологичный T-хелперный эпитоп;
А представляет собой гетерологичный спейсер;
(фрагмент IL-31) представляет собой В-клеточный эпитоп, имеющий от около 15 до около 75 аминокислотных остатков из SEQ ID NO: 1 или SEQ ID NO: 2;
X представляет собой α-COOH или α-CONH2 аминокислоты;
m равно от 1 до около 4; и
n равно от 0 до около 10.
Различные компоненты описанного пептидной иммуногенной конструкции IL-31 описаны ниже.
а. Фрагменты IL-31
Описанные пептидные иммуногенные конструкции содержат около 25 или более аминокислот в общем и около 15 аминокислот из белка IL-31. Пептидные иммуногенные конструкции содержат B-клеточный эпитоп из собачьего белка IL-31 (GenBank: BAH97742.1), имеющий аминокислотную последовательность SEQ ID NO: 1, приведенную в таблице 1, или человеческий белок IL-31 (GenBank: AAS86448.1) имеющий аминокислотную последовательность SEQ ID NO: 2, приведенную в таблице 1. В-клеточный эпитоп может быть связан с гетерологичным Т-хелперным (Th) эпитопом, полученным из патогенных белков, через необязательный гетерологичный спейсер. Описанные пептидные иммуногенные конструкции стимулируют выработку высокоспецифических антител, направленных против IL-31. Описанные пептидные иммуногенные конструкции могут быть использованы в качестве иммунотерапии для субъектов, страдающих от зудящего состояния и/или аллергического состояния, такого как атопический дерматит.
В некоторых вариантах осуществления B-клеточный эпитоп имеет последовательность, содержащую любую из SEQ ID NO: 1-13 и 93-98, как показано в таблице 1. Фрагменты IL-31, приведенные в таблице 1, являются иллюстративными, и данное описание включает любой другой фрагмент полноразмерного собачьего белка IL-31 или человеческого белка IL-31 с SEQ ID NO: 1 и 2, соответственно.
b. Гетерологичные Т-хелперные эпитопы (Th-эпитопы)
Данное описание относится к пептидным иммуногенным конструкциям, содержащим В-клеточный эпитоп из IL-31, ковалентно связанного с гетерологичным Т-хелперным (Th) эпитопом непосредственно или через необязательный гетерологичный спейсер.
Гетерологичный Th-эпитоп в пептидной иммуногенной конструкции IL-31 усиливает иммуногенность фрагментов IL-31, что облегчает выработку высоких титров специфических антител, направленных против оптимизированного целевого В-клеточного эпитопа (то есть фрагмента IL-31), посредством рационального дизайна.
Используемый в данном документе термин «гетерологичный» относится к аминокислотной последовательности, которая получена из аминокислотной последовательности, которая не является частью или гомологична последовательности IL-31 дикого типа. Таким образом, гетерологичный Th-эпитоп представляет собой Th-эпитоп, полученный из аминокислотной последовательности, которая не обнаружена в природе в IL-31 (т.е. Th-эпитоп не является аутологичным по отношению к IL-31). Поскольку Th-эпитоп является гетерологичным по отношению к IL-31, природная аминокислотная последовательность IL-31 не удлиняется ни в N-концевом, ни в C-концевом направлениях, когда гетерологичный Th-эпитоп ковалентно связан с фрагментом IL-31.
Гетерологичный Th-эпитоп согласно данному описанию может представлять собой любой Th-эпитоп, который не имеет аминокислотной последовательности, которая не обнаружена в природе в IL-31. Th-эпитоп может иметь аминокислотную последовательность, полученную от любого вида (например, человека, свиньи, крупного рогатого скота, собаки, крысы, мыши, морских свинок и т. д.). Th-эпитоп также может иметь разнородные мотивы связывания с молекулами ГКГС класса II нескольких видов. В некоторых вариантах осуществления Th-эпитоп содержит множество разнородных мотивов связывания ГКГС класса II для обеспечения максимальной активации Т-хелперов, которая приводит к инициации и регуляции иммунных ответов. Th-эпитоп предпочтительно является иммуномолчащим сам по себе, то есть небольшое количество антител, генерируемых пептидными иммуногенными конструкциями IL-31, если таковые вообще имеются, будет направлено к Th-эпитопу, таким образом обеспечивая очень сфокусированный иммунный ответ, направленный на целевой B-клеточный эпитоп фрагмента IL-31.
Эпитопы согласно данному описанию включают, но не ограничиваются ими, аминокислотные последовательности, полученные из чужеродных патогенов, как показано в таблице 2 (SEQ ID NO: 14-42). Кроме того, Th-эпитопы включают идеализированные искусственные Th-эпитопы и комбинаторные идеализированные искусственные Th-эпитопы (например, SEQ ID NO: 15 и 22-28). Гетерологичные Th-эпитопные пептиды, представленные в виде комбинаторной последовательности (например, SEQ ID NO: 23-26), содержат смесь аминокислотных остатков, представленных в определенных положениях в пределах пептидного остова на основе вариабельных остатков гомологов для этого конкретного пептида. Сборка комбинаторных пептидов может быть синтезирована в одном процессе путем добавления смеси указанных защищенных аминокислот вместо одной конкретной аминокислоты в определенное положение в процессе синтеза. Такие комбинаторные пептиды гетерологичных Th-эпитопов могут обеспечивать широкий охват Th-эпитопов для животных, имеющих разнообразный генетический фон. Типовые комбинаторные последовательности гетерологичных Th-эпитопных пептидов включают SEQ ID NO: 23-26, которые приведены в таблице 2. Th-эпитопные пептиды согласно данному изобретению обеспечивают широкую реактивность и иммуногенность для животных и пациентов из генетически разнообразных популяций.
Пептидные иммуногенные конструкции IL-31, содержащие Th-эпитопы, продуцируются одновременно в одном твердофазном пептидном синтезе в тандеме с фрагментом IL-31. Th-эпитопы также включают иммунологические аналоги Th-эпитопов. Иммунологические аналоги Th включают иммуномодулирующие аналоги, перекрестно-реактивные аналоги и сегменты любого из этих Th-эпитопов, которые достаточны для усиления или стимуляции иммунного ответа на фрагменты IL-31.
Функциональные иммунологические аналоги Th-эпитопных пептидов также эффективны и включены как часть данного изобретения. Функциональные иммунологические аналоги Th могут включать консервативные замены, добавления, делеции и вставки от одного до около пяти аминокислотных остатков в Th-эпитопе, которые по существу не модифицируют Th-стимулирующую функцию Th-эпитопа. Консервативные замены, добавления и вставки могут быть выполнены с природными или неприродными аминокислотами, как описано выше для фрагментов IL-31. Таблица 2 идентифицирует другой вариант функционального аналога для Th-эпитопного пептида. В частности, SEQ ID NO: 15 и 22 для MvF1 и MvF2 Th являются функциональными аналогами SEQ ID NO: 25 и 27 для MvF4 и MvF5 в том смысле, что они отличаются в аминокислотном остове делецией (SEQ ID NO: 15 и 22 ) или включением (SEQ ID NO: 25 и 27) двух аминокислот, каждая на N- и C-концах. Различия между этими двумя сериями аналогичных последовательностей не влияют на функцию Th-эпитопов, содержащихся в пределах этих последовательностях. Следовательно, функциональные иммунологические аналоги Th включают несколько версий Th-эпитопа, полученного из слитого белка вируса кори MvF1-4 Th (SEQ ID NO: 15, 22, 23, 25, и 27) и из поверхностного белка гепатита HBsAg 1-3 Th (SEQ ID NO: 24, 26, и 28).
Th-эпитоп в пептидной иммуногенной конструкции IL-31 может быть ковалентно связан в N- или C-концевой области пептида IL-31. В некоторых вариантах осуществления Th-эпитоп ковалентно связан с N-концевой областью пептида IL-31. В других вариантах осуществления Th-эпитоп ковалентно связан с С-концевой областью пептида IL-31. В некоторых вариантах осуществления более одного Th-эпитопа ковалентно связаны с фрагментом IL-31. Когда более чем один Th-эпитоп связан с фрагментом IL-31, каждый Th-эпитоп может иметь одинаковую аминокислотную последовательность или разные аминокислотные последовательности. Кроме того, когда более чем один Th-эпитоп связан с фрагментом IL-31, Th-эпитопы могут быть расположены в любом порядке. Например, Th-эпитопы могут быть последовательно связаны с N-концевой областью фрагмента IL-31 или могут быть последовательно связаны с C-концевой областью фрагмента IL-31, или Th-эпитоп может быть ковалентно связан с N -концевой областью фрагмента IL-31, в то время как отдельный Th-эпитоп ковалентно связан с C-концевой областью фрагмента IL-31. В расположении Th-эпитопов отсутствуют ограничения по отношению к фрагменту IL-31.
В некоторых вариантах осуществления Th-эпитоп непосредственно ковалентно связан с фрагментом IL-31. В других вариантах осуществления Th-эпитоп ковалентно связан с фрагментом IL-31 через гетерологичный спейсер, более подробно описанный ниже.
с. Гетерологичный спейсер
Описанные пептидные иммуногенные конструкции IL-31 необязательно содержат гетерологичный спейсер, который ковалентно связывает В-клеточный эпитоп из IL-31 с гетерологичным Т-хелперным (Th) эпитопом.
Как обсуждалось выше, термин «гетерологичный» относится к аминокислотной последовательности, которая получена из аминокислотной последовательности, которая не является частью или гомологична последовательности IL-31 дикого типа. Таким образом, природная аминокислотная последовательность IL-31 не удлиняется ни в N-концевом, ни в C-концевом направлениях, когда гетерологичный спейсер ковалентно связан с B-клеточным эпитопом из IL-31, поскольку спейсер является гетерологичным по отношению к последовательности IL-31.
Спейсер представляет собой любую молекулу или химическую структуру, способную связывать две аминокислоты и/или пептида вместе. Спейсер может варьироваться по длине или полярности в зависимости от применения. Спейсер может быть присоединен через амидную или карбоксильную связь, но возможно и через другие функциональные группы. Спейсер может включать химическое соединение, природную аминокислоту или неприродную аминокислоту.
Спейсер может обеспечивать структурные особенности пептидной иммуногенной конструкции IL-31. В структурном отношении спейсер обеспечивает физическое разделение Th-эпитопа и B-клеточного эпитопа фрагмента IL-31. Физическое разделение спейсером может нарушить любые искусственные вторичные структуры, созданные путем присоединения Th-эпитопа к B-клеточному эпитопу. Кроме того, физическое разделение эпитопов при помощи спейсера может устранить интерференции между Th-клеточными и/или B-клеточными ответами. Кроме того, спейсер может быть предназначен для создания или модификации вторичной структуры пептидной иммуногенной конструкции. Например, спейсер может быть сконструирован так, чтобы действовать как гибкий шарнирный участок для усиления разделения Th-эпитопа и B-клеточного эпитопа. Спейсер гибкого шарнирного участка также может обеспечить более эффективные взаимодействия между представленным пептидным иммуногеном и соответствующими Th-клетками и B-клетками для усиления иммунных ответов на Th-эпитоп и B-клеточный эпитоп. Примеры последовательностей, кодирующих гибкие шарнирные участки, находятся в шарнирном участке тяжелой цепи иммуноглобулина, которые часто богаты пролином. Один особенно полезный гибкий шарнирный участок, который можно использовать в качестве спейсера, обеспечивается последовательностью Pro-Pro-Xaa-Pro-Xaa-Pro (SEQ ID NO: 92), где Xaa представляет собой любую аминокислоту, и предпочтительно аспарагиновую кислоту.
Спейсер также может обеспечивать функциональные особенности пептидной иммуногенной конструкции IL-31. Например, спейсер может быть предназначен для изменения общего заряда пептидной иммуногенной конструкции IL-31, который может влиять на растворимость пептидной иммуногенной конструкции. Кроме того, изменение общего заряда пептидной иммуногенной конструкции IL-31 может влиять на способность пептидной иммуногенной конструкции связываться с другими соединениями и реактивами. Как более подробно обсуждается ниже, пептидная иммуногенная конструкция IL-31 может образовывать стабильный иммуностимулирующий комплекс с высоко заряженным олигонуклеотидом, таким как CpG-олигомеры, посредством электростатической ассоциации. Общий заряд пептидной иммуногенной конструкции IL-31 важен для образования этих стабильных иммуностимулирующих комплексов.
Химические соединения, которые можно использовать в качестве спейсера, включают, но не ограничиваются ими, (2-аминоэтокси) уксусную кислоту (AEA), 5-аминовалериановую кислоту (AVA), 6-аминокапроновую кислоту (Ahx), 8-амино-3,6-диоксаоктановую кислоту (AEEA, мини-ПЭГ1), 12-амино-4,7,10-триоксадодекановую кислоту (мини-ПЭГ2), 15-амино-4,7,10,13-тетраоксапента-декановую кислоту (мини-ПЭГ3 ), триоксатридекан-янтарную кислоту (Ttds), 12-амино-додекановую кислоту, Fmoc-5-амино-3-оксапентановую кислоту (O1Pen) и тому подобное.
Природные аминокислоты включают аланин, аргинин, аспарагин, аспарагиновую кислоту, цистеин, глутаминовую кислоту, глутамин, глицин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, пролин, серин, треонин, триптофан, тирозин и валин.
Неприродные аминокислоты включают, но не ограничиваются ими, ε-N-лизин, ß-аланин, орнитин, норлейцин, норвалин, гидроксипролин, тироксин, γ-амино масляную кислоту, гомосерин, цитруллин, аминобензойную кислоту, 6-аминокапроновую кислоту (Aca; 6-аминогексановую кислоту), гидроксипролин, меркаптопропионовую кислоту (MPA), 3-нитро-тирозин, пироглутаминовую кислоту и тому подобное.
Спейсер в пептидной иммуногенной конструкции IL-31 может быть ковалентно связан в N- или С-концевой области Th-эпитопа и пептида IL-31. В некоторых вариантах осуществления спейсер ковалентно связан с C-концевой областью Th-эпитопа и с N-концевой областью пептида IL-31. В других вариантах осуществления спейсер ковалентно связан с C-концевой областью пептида IL-31 и с N-концевой областью Th-эпитопа. В определенных вариантах осуществления можно использовать более одного спейсера, например, когда в пептидной иммуногенной конструкции присутствует более одного Th-эпитопа. Когда используется более одного спейсера, каждый спейсер может быть таким же, как и другой, или отличаться от него. Кроме того, когда в пептидной иммуногенной конструкции присутствует более одного Th-эпитопа, Th-эпитопы могут быть разделены спейсером, который может быть таким же или отличаться от спейсера, используемого для разделения Th-эпитопа и B-клеточного эпитопа. В расположении спейсера отсутствуют ограничения относительно Th-эпитопа или фрагмента IL-31.
В некоторых вариантах осуществления гетерологичный спейсер представляет собой природную аминокислоту или неприродную аминокислоту. В других вариантах осуществления спейсер содержит более одной природной или неприродной аминокислоты. В конкретных вариантах осуществления спейсер представляет собой Lys-, Gly-, Lys-Lys-Lys-, (α, ε-N)Lys, или ε-N-Lys-Lys-Lys-Lys (SEQ ID NO: 91).
d. Конкретные варианты осуществления пептидной иммуногенной конструкции IL-31
В некоторых вариантах осуществления пептидная иммуногенная конструкция IL-31 может быть представлена формулами:
(Th)m-(A)n-(фрагмент IL-31)-X
или
(фрагмент IL-31)-(A)n-(Th)m-X
где
Th представляет собой гетерологичный T-хелперный эпитоп;
А представляет собой гетерологичный спейсер;
(фрагмент IL-31) представляет собой В-клеточный эпитоп, имеющий от около 15 до около 75 аминокислотных остатков из SEQ ID NO: 1 или SEQ ID NO: 2;
X представляет собой α-COOH или α-CONH2 аминокислоты;
m равно от 1 до около 4; и
n равно от 0 до около 10.
В конкретных вариантах осуществления гетерологичный Th-эпитоп в пептидной иммуногенной конструкции IL-31 имеет аминокислотную последовательность, выбранную из любой из SEQ ID NO: 14-42 и их комбинаций, приведенных в таблице 2. В конкретных вариантах осуществления Th-эпитоп имеет аминокислотную последовательность, выбранную из любой из SEQ ID NO: 22-28. В определенных вариантах осуществления пептидная иммуногенная конструкция IL-31 содержит более одного Th-эпитопа.
В определенных вариантах осуществления необязательный гетерологичный спейсер выбран из любого из Lys-, Gly-, Lys-Lys-Lys-, (α, ε-N)Lys, ε-N-Lys-Lys-Lys-Lys (SEQ ID NO: 91), и их комбинаций. В конкретных вариантах осуществления гетерологичный спейсер представляет собой ε-N-Lys-Lys-Lys-Lys (SEQ ID NO: 91).
В определенных вариантах осуществления фрагмент IL-31 имеет от около 15 до около 65 аминокислотных остатков из SEQ ID NO: 1 или SEQ ID NO: 2. В конкретных вариантах осуществления фрагмент IL-31 имеет аминокислотную последовательность, представленную SEQ ID NO: 1-13 и 93-98, как показано в таблице 1.
В некоторых вариантах осуществления пептидная иммуногенная конструкция IL-31 имеет аминокислотную последовательность, выбранную из любой из SEQ ID NO: 43-90 и 99-105, как показано в таблице 3.
e. Варианты, гомологи и функциональные аналоги
Также могут быть использованы варианты и аналоги вышеуказанных иммуногенных пептидов, которые индуцируют и/или перекрестно реагируют с антителами к предпочтительным эпитопам белка IL-31. Аналоги, включая аллельные, видовые и индуцированные варианты, обычно отличаются от природных пептидов в одном, двух или более положениях, часто в силу консервативных замен. Аналоги обычно демонстрируют по меньшей мере 80 или 90% идентичности последовательности с природными пептидами. Некоторые аналоги также включают неприродные аминокислоты или модификации N- или C-концевых аминокислот в одном, двух или более положениях.
Варианты, которые являются функциональными аналогами, могут иметь консервативную замену в положении аминокислоты; изменение общего заряда; ковалентную связь к другому фрагменту; или добавления, вставки или делеции аминокислот; и/или любую их комбинацию.
Консервативные замены - это когда один аминокислотный остаток заменен другим аминокислотным остатком с аналогичными химическими свойствами. Например, неполярные (гидрофобные) аминокислоты включают аланин, лейцин, изолейцин, валин, пролин, фенилаланин, триптофан и метионин; полярные нейтральные аминокислоты включают глицин, серин, треонин, цистеин, тирозин, аспарагин и глутамин; положительно заряженные (основные) аминокислоты включают аргинин, лизин и гистидин; и отрицательно заряженные (кислые) аминокислоты включают аспарагиновую кислоту и глутаминовую кислоту.
В конкретном варианте осуществления функциональный аналог имеет по меньшей мере 50% идентичности с исходной аминокислотной последовательностью. В другом варианте осуществления функциональный аналог имеет по меньшей мере 80% идентичности с исходной аминокислотной последовательностью. В еще одном варианте осуществления функциональный аналог имеет по меньшей мере 85% идентичности с исходной аминокислотной последовательностью. В еще одном варианте осуществления функциональный аналог имеет по меньшей мере 90% идентичности с исходной аминокислотной последовательностью.
Варианты также содержат вариации фосфорилированных остатков. Например, варианты могут содержать различные остатки в пределах пептидов, которые фосфорилированы. Вариантные иммуногенные пептиды IL-31 также могут включать псевдофосфорилированные пептиды. Псевдофосфорилированные пептиды получают путем замены одного или более фосфорилированных остатков серина, треонина и тирозина в пептидах IL-31 на кислые аминокислотные остатки, такие как глутаминовая кислота и аспарагиновая кислота.
Композиции
Данное описание также обеспечивает композиции, содержащие описанную иммуногенную конструкцию IL-31.
а. Пептидные композиции
Композиции, содержащие описанную пептидную иммуногенную конструкцию IL-31, могут находиться в жидкой или твердой форме. Жидкие композиции могут содержать воду, буферы, растворители, соли и/или любой другой приемлемый реактив, который не изменяет структурные или функциональные свойства пептидной иммуногенной конструкции IL-31. Пептидные композиции могут содержать один или более описанных пептидных иммуногенных конструкций IL-31.
b. Фармацевтические композиции
Данное описание также относится к фармацевтическим композициям, содержащим описанную пептидную иммуногенную конструкцию IL-31.
Фармацевтические композиции могут содержать носители и/или другие добавки в фармацевтически приемлемой системе доставки. Соответственно, фармацевтические композиции могут содержать фармацевтически эффективное количество пептидной иммуногенной конструкции IL-31 вместе с фармацевтически приемлемым носителем, адъювантом и/или другими вспомогательными веществами, такими как разбавители, добавки, стабилизирующие агенты, консерванты, солюбилизирующие агенты, буферы и тому подобное.
Фармацевтические композиции могут содержать один или более адъювантов, которые действуют для ускорения, пролонгации или усиления иммунного ответа на пептидную иммуногенную конструкцию IL-31 без какого-либо специфического антигенного действия. Адъюванты, используемые в фармацевтической композиции, могут включать масла, масляные эмульсии, соли алюминия, соли кальция, иммуностимулирующие комплексы, бактериальные и вирусные производные, виросомы, углеводы, цитокины, полимерные микрочастицы. В некоторых вариантах осуществления адъювант может быть выбран из квасцов (калий алюминий фосфат), фосфата алюминия (например, ADJU-PHOS®), гидроксида алюминия (например, ALHYDROGEL®), фосфата кальция, неполного адъюванта Фрейнда (IFA), полного адъюванта Фрейнда, MF59, адъюванта 65, Lipovant, ISCOM, липосина, сапонина, сквалена, L121, EMULSIGEN®, монофосфориллипида A (MPL), Quil A, QS21, MONTANIDE® ISA 35, ISA 50V, ISA 50V2, ISA 51, ISA 206, ISA 720, липосом, фосфолипидов, пептидогликанов, липополисахаридов (ЛПС), ASO1, ASO2, ASO3, AsO4, AF03, липофильных фосфолипидов (липида А), гамма-инулина, альгаммулина, глюкана, декстранов, глюкоманнанов, галактоманнанрв, леванов, ксиланов, бромида диметилдиоктадециламмония (DDA), а также другие адъювантов и эмульгаторов.
В некоторых вариантах осуществления фармацевтическая композиция содержит MONTANIDE™ ISA 51 (масляная адъювантная композиция, состоящая из растительного масла и маннида олеата для получения водно-масляных эмульсий), TWEEN® 80 (также известный как: Полисорбат 80 или Полиоксиэтилен (20) сорбитан моноолеат), CpG-олигонуклеотид и/или любую их комбинацию. В других вариантах осуществления фармацевтическая композиция представляет собой эмульсию вода-в-масле-в-воде (то есть в/м/в) с EMULSIGEN или EMULSIGEN D в качестве адъюванта.
Фармацевтические композиции могут также содержать фармацевтически приемлемые добавки или вспомогательные вещества. Например, фармацевтические композиции могут содержать антиоксиданты, связывающие вещества, буферы, объемообразующие агенты, носители, хелатирующие агенты, красители, разбавители, дезинтегранты, эмульгаторы, наполнители, гелеобразующие агенты, рН-буферные агенты, консерванты, солюбилизирующие агенты, стабилизаторы и тому подобное.
Фармацевтические композиции могут быть составлены в виде составов с немедленным высвобождением или в виде составов с замедленным высвобождением. Кроме того, фармацевтические композиции могут быть составлены для индукции системного или локализованного иммунитета слизистой оболочки путем захвата иммуногена и совместного введения с микрочастицами. Такие системы доставки легко определяются средним специалистом в данной области техники.
Фармацевтические композиции могут быть приготовлены в виде впрыскиваемых лекарственных средств, или в виде жидких растворов, или суспензий. Жидкие носители, содержащие пептидную иммуногенную конструкцию IL-31, также можно приготовить перед инъекцией. Фармацевтическую композицию можно вводить любым подходящим способом применения, например, п/к, в/в, п/о, в/м, интраназально, перорально, подкожно и т. д., и в любом подходящем устройстве доставки. В некоторых вариантах осуществления фармацевтическая композиция составлена для внутривенного, подкожного, интрадермального или внутримышечного введения. Также могут быть приготовлены фармацевтические композиции, подходящие для других способов введения, включая пероральное и интраназальное применение.
Фармацевтические композиции также могут быть составлены в подходящей единичной дозированной форме. В некоторых вариантах осуществления фармацевтическая композиция содержит от около 0,5 мкг до около 1 мг пептидной иммуногенной конструкции IL-31 на кг массы тела. Эффективные дозы фармацевтических композиций варьируются в зависимости от многих различных факторов, включая способы введения, целевой участок, физиологическое состояние пациента, является ли пациент человеком или животным, вводятся другие лекарственные средства и является ли лечение профилактическим или терапевтическим. Как правило, пациент представляет собой человека, но также можно лечить отличных от человека млекопитающих, включая трансгенных млекопитающих. При доставке в нескольких дозах фармацевтические композиции могут быть удобно разделены на подходящее количество на единичную дозированную форму. Вводимая доза будет зависеть от возраста, массы и общего состояния здоровья субъекта, что хорошо известно в области терапии.
В некоторых вариантах осуществления фармацевтическая композиция содержит более одной пептидной иммуногенной конструкции IL-31. Фармацевтическая композиция, содержащая смесь более чем одну пептидную иммуногенную конструкцию IL-31, для обеспечения синергетического усиления иммуноэффективности конструкций. Фармацевтические композиции, содержащие более одной пептидной иммуногенной конструкции IL-31, могут быть более эффективными в большей генетической популяции благодаря широкому охвату ГКГС класса II, таким образом обеспечивая улучшенный иммунный ответ на пептидные иммуногенные конструкции IL-31.
В некоторых вариантах осуществления фармацевтическая композиция содержит пептидную иммуногенную конструкцию IL-31, выбранный из SEQ ID NO: 43-90 и 99-105 (таблица 3), а также его гомологи, аналоги и/или комбинации. В конкретных вариантах осуществления фармацевтические композиции содержат пептидную иммуногенную конструкцию IL-31, выбранный из SEQ ID NO: 43-90 и 99-105 (таблица 3), и любой их комбинации.
Фармацевтические композиции, содержащие пептидную иммуногенную конструкцию IL-31, можно использовать для индукции иммунного ответа и продуцирования антител у хозяина после введения.
с. Иммуностимулирующие комплексы
Данное описание также относится к фармацевтическим композициям, содержащим пептидную иммуногенную конструкцию IL-31 в форме иммуностимулирующего комплекса с CpG-олигонуклеотидом, таким как CpG1 (SEQ ID NO: 108), CpG2 (SEQ ID NO: 109), или CpG3 (SEQ ID NO: 110). Такие иммуностимулирующие комплексы специально приспособлены для действия в качестве адъюванта и стабилизатора пептидного иммуногена. Иммуностимулирующие комплексы находятся в форме частиц, которые могут эффективно представлять пептидный иммуноген IL-31 клеткам иммунной системы, вызывая иммунный ответ. Иммуностимулирующие комплексы могут быть составлены в виде суспензии для парентерального введения. Иммуностимулирующие комплексы также могут быть составлены в форме в/м эмульсий, в виде суспензии в комбинации с минеральной солью или с желирующим полимером in situ для эффективной доставки пептидного иммуногена IL-31 к клеткам иммунной системы хозяина после парентерального введения.
Стабилизированный иммуностимулирующий комплекс может быть образован путем комплексирования пептидной иммуногенной конструкции IL-31 с анионной молекулой, олигонуклеотидом, полинуклеотидом или их комбинациями посредством электростатической ассоциации. Стабилизированный иммуностимулирующий комплекс может быть включен в фармацевтическую композицию в качестве системы доставки иммуногена.
В некоторых вариантах осуществления пептидная иммуногенная конструкция IL-31 сконструирована с возможностью содержания катионной части, которая положительно заряжена при рН в диапазоне от 5,0 до 8,0. Общий заряд катионной части пептидной иммуногенной конструкции IL-31 или смеси конструкций рассчитывают, назначая заряд +1 для каждого лизина (K), аргинина (R) или гистидина (H), заряд -1 для каждой аспарагиновой кислоты (D) или глутаминовой кислоты (E) и заряд 0 для другой аминокислоты в пределах последовательности. Заряды суммируются в пределах катионной части пептидной иммуногенной конструкции IL-31 и выражаются как общий средний заряд. Подходящий пептидный иммуноген содержит катионную часть с общим средним положительным зарядом +1. Предпочтительно пептидный иммуноген имеет общий положительный заряд в диапазоне, который больше чем +2. В некоторых вариантах осуществления катионная часть пептидной иммуногенной конструкции IL-31 представляет собой гетерологичный спейсер. В некоторых вариантах осуществления катионная часть пептидной иммуногенной конструкции IL-31 имеет заряд +4, когда последовательность спейсера представляет собой (α, ε-N)Lys, ε-N-Lys-Lys-Lys-Lys (SEQ ID NO: 91).
«Анионная молекула», как описано в данном документе, относится к любой молекуле, которая заряжена отрицательно при рН в диапазоне 5,0-8,0. В определенных вариантах осуществления анионная молекула представляет собой олигомер или полимер. Общий отрицательный заряд на олигомере или полимере рассчитывается путем назначения заряда -1 для каждой фосфодиэфирной или фосфоротиоатной группы в олигомере. Подходящим анионным олигонуклеотидом является одноцепочечная молекула ДНК с 8-64 нуклеотидными основаниями с числом повторов CpG-мотива в диапазоне от 1 до 10. Предпочтительно CpG иммуностимулирующие молекулы одноцепочечной ДНК содержат 18-48 нуклеотидных оснований с числом повторов CpG-мотива в диапазоне от 3 до 8.
Более предпочтительно анионный олигонуклеотид представлен формулой: 5' X1CGX2 3', где C и G являются неметилированными; и X1 выбран из группы, состоящей из A (аденина), G (гуанина) и T (тимина); и Х2 представляет собой С (цитозин) или Т (тимин). Или анионный олигонуклеотид представлен формулой: 5' (X3)2CG(X4)2 3', где C и G являются неметилированными; и X3 выбран из группы, состоящей из A, T или G; и Х4 представляет собой С или Т.
Полученный иммуностимулирующий комплекс находится в форме частиц с размером, обычно находящимся в диапазоне 1-50 мкм и являющимся функцией многих факторов, включая стехиометрию относительного заряда и молекулярную массу взаимодействующих частиц. Иммуностимулирующий комплекс в виде частиц обладает тем преимуществом, что обеспечивает адъювантый эффект и активацию специфических иммунных ответов in vivo. Кроме того, стабилизированный иммуностимулирующий комплекс подходит для приготовления фармацевтических композиций различными способами, включая водно-масляные эмульсии, суспензии минеральных солей и полимерные гели.
Антитела
Данное описание обеспечивает антитела, образованные в ответ на пептидную иммуногенную конструкцию IL-31.
Описанные пептидные иммуногенные конструкции IL-31, содержащие фрагмент IL-31, гетерологичный Th-эпитоп и необязательный гетерологичный спейсер, способны вызывать иммунный ответ и выработку антител при введении хозяину. Дизайн пептидных иммуногенных конструкций IL-31 может нарушать толерантность к самому IL-31 и вызывать выработку сайт-специфических антител, которые распознают конформационные, а не линейные эпитопы.
Антитела, продуцируемые в ответ на пептидные иммуногенные конструкции IL-31, распознают и связываются с IL-31 в форме мономеров, димеров, тримеров и олигомеров.
Полученные иммунные ответы от животных, иммунизированных пептидными иммуногенными конструкциями IL-31 согласно данному изобретению, продемонстрировали способность конструкций продуцировать сильные сайт-направленные антитела, которые способны реагировать с IL-31.
Способы
Данное описание также направлено на способы получения и применения пептидных иммуногенных конструкций IL-31, композиций и фармацевтических композиций.
а. Способы получения пептидной иммуногенной конструкции IL-31
Пептидные иммуногенные конструкции IL-31 согласно данному описанию могут быть получены способами химического синтеза, хорошо известными специалисту в данной области техники (см., например, Fields et al., Chapter 3 in Synthetic Peptides: A User's Guide, ed. Grant, W. H. Freeman & Co., New York, NY, 1992, p. 77). Пептидные иммуногенные конструкции IL-31 могут быть синтезированы с использованием автоматизированных методов твердофазного синтеза Merrifield с α-NH2, защищенным t-Boc- или F-moc-группами, с использованием аминокислот с боковой цепью, например, на модели синтезатора пептидов Applied Biosystems 430А или 431. Приготовление пептидных иммуногенных конструкций IL-31, содержащих пептиды комбинаторной библиотеки для Th-эпитопов, может быть достигнуто путем обеспечения смеси альтернативных аминокислот для связывания в данном вариабельном положении.
После полной сборки желаемой пептидной иммуногенной конструкции IL-31, смолу можно обработать в соответствии со стандартными процедурами для отщепления пептида от смолы, и функциональные группы на боковых цепях аминокислот могут быть разблокированы. Свободный пептид может быть очищен с помощью ВЭЖХ и охарактеризован биохимически, например, при помощи аминокислотного анализа или секвенирования. Способы очистки и определения характеристик пептидов хорошо известны специалисту в данной области техники.
Качество пептидов, получаемых при помощи этого химического процесса, можно контролировать и определять, и в результате можно гарантировать воспроизводимость пептидных иммуногенных конструкций IL-31, иммуногенность и выход. Подробное описание получения пептидной иммуногенной конструкции IL-31 посредством твердофазного пептидного синтеза приведено в Примере 1.
Было обнаружено, что диапазон структурной изменчивости, который допускает сохранение предполагаемой иммунологической активности, является гораздо более приемлемым, чем диапазон структурной изменчивости, допускаемый для сохранения специфической активности лекарственного средства с помощью низкомолекулярного лекарственного средства или желаемых активностей и нежелательных токсичностей, обнаруженных в больших молекулах, которые производятся совместно с полученными биологическим лекарственными средствами. Таким образом, аналоги пептидов, или намеренно сконструированные, или неизбежно получаемые в результате ошибок синтетического процесса в виде смеси побочных продуктов делеции последовательности, которые имеют хроматографические и иммунологические свойства, аналогичные предполагаемому пептиду, часто так же эффективны, как очищенный препарат желаемого пептида. Разработанные аналоги и непреднамеренные аналоговые смеси эффективны до тех пор, пока разрабатывается четкая процедура контроля качества для контроля как производственного процесса, так и процесса оценки продукта, чтобы гарантировать воспроизводимость и эффективность конечного продукта, в котором используются эти пептиды.
Пептидные иммуногенные конструкции IL-31 также могут быть получены с использованием технологии рекомбинантных ДНК, включая молекулы нуклеиновой кислоты, векторы и/или клетки-хозяева. Таким образом, молекулы нуклеиновой кислоты, кодирующие пептидную иммуногенную конструкцию IL-31 и его иммунологически функциональные аналоги, также включены в данное описание как часть данного изобретения. Подобным образом векторы, включая векторы экспрессии, содержащие молекулы нуклеиновой кислоты, а также клетки-хозяева, содержащие векторы, также включены в данное описание как часть данного изобретения.
Различные иллюстративные варианты осуществления также охватывают способы получения пептидной иммуногенной конструкции IL-31 и его иммунологически функциональных аналогов. Например, способы могут включать стадию инкубации клетки-хозяина, содержащей вектор экспрессии, содержащий молекулу нуклеиновой кислоты, кодирующую пептидную иммуногенную конструкцию IL-31 и/или его иммунологически функциональный аналог, в таких условиях, когда экспрессируется пептид и/или аналог. Более длинные синтетические пептидные иммуногены могут быть синтезированы хорошо известными методами рекомбинантных ДНК. Такие методы представлены в известных стандартных руководствах с подробными протоколами. Для конструирования гена, кодирующего пептид согласно изобретению, аминокислотную последовательность подвергают обратной трансляции для получения последовательности нуклеиновой кислоты, кодирующей аминокислотную последовательность, предпочтительно с кодонами, которые являются оптимальными для организма, в котором должен экспрессироваться ген. Затем синтетический ген получают, как правило, путем синтеза олигонуклеотидов, которые кодируют пептид и любые регуляторные элементы, если это необходимо. Синтетический ген вставляют в подходящий клонирующий вектор и трансфицируют в клетку-хозяина. Затем пептид экспрессируется в подходящих условиях, подходящих для выбранной системы экспрессии и хозяина. Пептид очищают и характеризуют при помощи стандартных способов.
В некоторых вариантах осуществления пептидная иммуногенная конструкция IL-31 может экспрессироваться в определенных штаммах E.coli, которые обеспечивают возможность липидирования с образованием липопротеина IL-31, как описано в патенте США № 8426163, который включен в данный документ посредством ссылки во всей своей полноте. В некоторых вариантах осуществления используемые штаммы E.coli устойчивы к токсическим эффектам, вызванным сверхэкспрессией экзогенных белков, в частности, мембранных белков. Такие штаммы E.coli могут быть идентифицированы/получены при помощи способов, описанных в патенте США № 6361966, который включен в данный документ посредством ссылки во всей своей полноте. Примеры штаммов E.coli, которые способны продуцировать липопротеин в липидированной форме, включают, но не ограничиваются ими, C43(DE3) (ECCC B96070445), C41(DE3) (ECCC B96070444), C0214(DE3), DK8(DE3)S (NCIMB 40885), и C2014(DE3) (NCIMB 40884). Липидированная форма IL-31 может быть экспрессирована в одном из штаммов E.coli, отмеченных выше, с помощью обычной рекомбинантной технологии. Вкратце, фрагмент ДНК, кодирующий IL-31, получают из его нативного источника, например, с помощью ПЦР-амплификации, и необязательно модифицируют для оптимизации использования кодонов в E.coli. Затем фрагмент ДНК встраивают в вектор экспрессии E.coli для получения экспрессионной плазмиды. Предпочтительно экспрессия липопротеина BK-31 управляется сильным промотором, например, T7, T5, T3 или SP6, который может индуцироваться, например, IPTG. Затем экспрессионную плазмиду вводят в выбранный штамм E.coli, и положительные трансформанты культивируют в подходящих условиях для экспрессии белка. Экспрессированный таким образом липопротеин может быть выделен из клеток E.coli, и его статус липидирования может быть подтвержден при помощи способов, известных в данной области техники, например, иммуноблоттинга с антителом к липопротеина или масс-спектрометрии.
b. Способы получения иммуностимулирующих комплексов
Различные иллюстративные варианты осуществления также охватывают способы получения иммуностимулирующих комплексов, содержащих пептидные иммуногенные конструкции IL-31 и молекулу CpG-олигодезоксинуклеотида (ODN). Стабилизированные иммуностимулирующие комплексы (ISC) получают из катионной части пептидной иммуногенной конструкции IL-31 и полианионной молекулы CpG-ODN. Самособирающаяся система приводится в действие электростатической нейтрализацией заряда. Стехиометрия отношения молярного заряда катионной части пептидной иммуногенной конструкции IL-31 к анионному олигомеру определяет степень ассоциации. Нековалентная электростатическая ассоциация пептидной иммуногенной конструкции IL-31 и CpG-ODN является полностью воспроизводимым процессом. Агрегаты иммуностимулирующего комплекса пептид/CpG-ODN, которые облегчают презентирование «профессиональными» антигенпрезентирующими клетками (АПК) иммунной системы, таким образом, дополнительно усиливают иммуногенность комплексов. Эти комплексы легко характеризуются для контроля качества при производстве. ISC пептид/CpG хорошо переносятся in vivo. Эта новая система частиц, содержащая CpG ODN и пептидные иммуногенные конструкции, полученные из фрагмента IL-31, была разработана для использования преимуществ общей митогенности в отношении В-клеток, связанной с использованием CpG-ODN, и в то же время для стимуляции сбалансированных ответов типа Th-1/Th-2.
CpG-ODN в описанных фармацевтических композициях на 100% связывается с иммуногеном в процессе, опосредованном электростатической нейтрализацией противоположного заряда, что приводит к образованию частиц микронного размера. Форма частиц позволяет значительно снизить дозировку CpG по сравнению с обычным использованием адъювантов CpG, вероятность неблагоприятных врожденных иммунных ответов и облегчить альтернативные пути процессинга иммуногена, включая антигенпрезентирующие клетки (АПК). Следовательно, такие составы являются концептуально новыми и предлагают потенциальные преимущества, способствуя стимуляции иммунных ответов альтернативными механизмами.
с. Способы получения фармацевтических композиций
Различные иллюстративные варианты осуществления также охватывают фармацевтические композиции, содержащие пептидные иммуногенные конструкции IL-31. В некоторых вариантах осуществления в фармацевтических композициях используются водно-масляные эмульсии и суспензии с минеральными солями.
Чтобы большая популяция могла использовать фармацевтическую композицию, а частью цели введения было предотвращение агрегации IL-31, еще одним важным фактором для рассмотрения становится безопасность. Несмотря на использование водно-масляных эмульсий у людей для многих составов в клинических испытаниях, квасцы остаются основным адъювантом для использования в составах благодаря своей безопасности. Поэтому квасцы или их минеральные соли алюминия фосфата (ADJUPHOS) часто используется в качестве адъювантов при подготовке к клиническому применению.
Другие адъюванты и иммуностимулирующие агенты включают 3-Де-O-ацилированный монофосфориллипид A (MPL) или 3-DMP, полимерные или мономерные аминокислоты, такие как полиглутаминовая кислота или полилизин. Такие адъюванты могут быть использованы с или без других специфических иммуностимулирующих агентов, таких как мурамилпептиды (например, N-ацетилмурамил-L-треонил-D-изоглутамин (thr-MDP), N-ацетилнормурамил-L-аланил-D-изоглутамин (nor-MDP), N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2- (1'-2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)-этиламин (MTP-PE), N- ацетилглюксаминил-N-ацетилмурамил-L-Al-D-изоглу-L-аланин-дипальмитокси пропиламид (DTP-DPP) Theramide™) или другие компоненты бактериальной клеточной стенки. Водно-масляные эмульсии включают MF59 (см. WO 90/14837, Van Nest et al., которая полностью включена в данный документ посредством ссылки во всей своей полноте), содержащую 5% сквалена, 0,5% TWEEN 80 и 0,5% Span 85 (необязательно содержащий различные количества MTP-PE), составленные в субмикронные частицы с использованием микрофлюидизатора; SAF, содержащий 10% сквалена, 0,4% TWEEN 80, 5% плюроник-блокированного полимера L121 и thr-MDP, или микрофлюидизированный в субмикронную эмульсию, или перемешанный на вортексе с образованием эмульсии с более крупным размером частиц; и адъювантную систему Ribi™ (RAS) (Ribi ImmunoChem, Хамильтон, Монтана), содержащую 2% сквалена, 0,2% TWEEN 80 и один или более компонентов бактериальной клеточной стенки, выбранных из группы, состоящей из монофосфориллипида-A (MPL), трегалозы димиколата (TDM) и скелет клеточной стенки (CWS), предпочтительно MPL+CWS (Detox™). Другие адъюванты включают полный адъювант Фрейнда (CFA), неполный адъювант Фрейнда (IFA) и цитокины, такие как интерлейкины (IL-1, IL-2 и IL-12), макрофагальный колониестимулирующий фактор (М-КСФ), и фактор некроза опухоли (ФНО).
Выбор адъюванта зависит от стабильности иммуногенного состава, содержащего адъювант, пути введения, схемы применения, эффективности адъюванта для вакцинируемых видов, а у людей фармацевтически приемлемый адъювант представляет собой тот, который был одобрен или разрешен для введения человеку соответствующими регулирующими органами. Например, квасцы, MPL или неполный адъювант Фрейнда (Chang et al., Advanced Drug Delivery Reviews 32: 173-186 (1998), который включен в данный документ посредством ссылки во всей своей полноте) отдельно или необязательно все их комбинации подходят для введения человеку.
Композиции могут содержать фармацевтически приемлемые, нетоксичные носители или разбавители, которые определяются как носители, обычно используемые для составления фармацевтических композиций для введения животным или людям. Разбавитель выбирается таким образом, чтобы не влиять на биологическую активность комбинации. Примерами таких разбавителей являются дистиллированная вода, физиологический раствор с фосфатным буфером, растворы Рингера, раствор декстрозы и раствор Хэнка. Кроме того, фармацевтическая композиция или состав может также содержать другие носители, адъюванты или нетоксичные, нетерапевтические, неиммуногенные стабилизаторы и тому подобное.
Фармацевтические композиции также могут включать крупные медленно метаболизируемые макромолекулы, такие как белки, полисахариды, такие как хитозан, полимолочные кислоты, полигликолевые кислоты и сополимеры (например, функционализированная латексом сефароза, агароза, целлюлоза и тому подобное), полимерные аминокислоты, аминокислотные сополимеры, и липидные агрегаты (например, масляные капли или липосомы). Кроме того, эти носители могут функционировать в качестве иммуностимулирующих агентов (то есть, адъювантов).
Фармацевтические композиции согласно данному изобретению могут дополнительно содержать подходящий носитель для доставки. Подходящие носители для доставки включают, но не ограничиваются ими, вирусы, бактерии, биоразлагаемые микросферы, микрочастицы, наночастицы, липосомы, минипеллеты коллагена и кохлеаты.
d. Способы с использованием фармацевтических композиций
Данное описание также включает способы применения фармацевтических композиций, содержащих пептидные иммуногенные конструкции IL-31.
В некоторых вариантах осуществления фармацевтические композиции, содержащие пептидные иммуногенные конструкции IL-31, можно использовать для лечения и/или профилактики зудящего состояния и/или аллергического состояния, такого как атопический дерматит.
Конкретные варианты осуществления изобретения
(1) Пептидная иммуногенная конструкция IL-31 может быть представлен формулами:
(Th)m-(A)n-(фрагмент IL-31)-X
или
(Фрагмент IL-31)-(A)n-(Th)m-X
где
Th представляет собой гетерологичный T-хелперный эпитоп;
А представляет собой гетерологичный спейсер;
(фрагмент IL-31) представляет собой В-клеточный эпитоп, имеющий от около 15 до около 75 аминокислотных остатков из SEQ ID NO: 1 или SEQ ID NO: 2;
X представляет собой α-COOH или α-CONH2 аминокислоты;
m равно от 1 до около 4; и
n равно от 0 до около 10.
(2) Пептидная иммуногенная конструкция IL-31 в соответствии с (1), отличающаяся тем, что фрагмент IL-31 выбран из группы, состоящей из SEQ ID NO: 1-13 и 93-98.
(3) Пептидная иммуногенная конструкция IL-31 в соответствии с любым из (1) или (2), отличающаяся тем, что Th-эпитоп выбран из группы, состоящей из SEQ ID NO: 14-42.
(4) Пептидная иммуногенная конструкция IL-31 в соответствии с (1), отличающаяся тем, что пептидная иммуногенная конструкция выбрана из группы, состоящей из SEQ ID NO: 43-90 и 99-105.
(5) Пептидная иммуногенная конструкция IL-31, содержащий:
В-клеточный эпитоп, содержащий от около 15 до около 75 аминокислотных остатков из последовательности полноразмерного белка IL-31 из SEQ ID NO: 1 или SEQ ID NO: 2;
Т-хелперный эпитоп, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 14-42; и
необязательный гетерологичный спейсер, выбранный из группы, состоящей из аминокислоты, Lys-, Gly-, Lys-Lys-Lys-, (α, ε-N)Lys, и ε-N-Lys-Lys-Lys-Lys (SEQ ID NO: 91),
при этом В-клеточный эпитоп ковалентно связан с Т-хелперным эпитопом напрямую или через необязательный гетерологичный спейсер.
(6) Пептидная иммуногенная конструкция IL-31 согласно (5), отличающаяся тем, что В-клеточный эпитоп выбран из группы, состоящей из SEQ ID NO: 1-13 и 93-98.
(7) Пептидная иммуногенная конструкция IL-31 согласно (5), отличающаяся тем, что Т-хелперный эпитоп выбран из группы, состоящей из SEQ ID NO: 14-42.
(8) Пептидная иммуногенная конструкция IL-31 согласно (5), отличающаяся тем, что необязательный гетерологичный спейсер представляет собой (α, ε-N)Lys или ε-N-Lys-Lys-Lys-Lys (SEQ ID NO: 91).
(9) Пептидная иммуногенная конструкция IL-31 согласно (5), отличающаяся тем, что Т-хелперный эпитоп ковалентно связан с N-концом В-клеточного эпитопа.
(10) Пептидная иммуногенная конструкция IL-31 согласно (5), отличающаяся тем, что Т-хелперный эпитоп ковалентно связан с N-концом В-клеточного эпитопа через необязательный гетерологичный спейсер.
(11) Композиция, содержащая пептидную иммуногенную конструкцию в соответствии с любым из (1)-(4).
(12) Фармацевтическая композиция, содержащая:
а. пептидную иммуногенную конструкцию в соответствии с любым из (1)-(4); и
b. фармацевтически приемлемый носитель для доставки и/или адъювант.
(13) Фармацевтическая композиция согласно (12), отличающаяся тем, что
а. пептидная иммуногенная конструкция IL-31 выбрана из группы, состоящей из SEQ ID NO: 43-90 и 99-105; и
b. пептидная иммуногенная конструкция IL-31 смешивается с CpG-олигодезоксинуклеотидом (ODN) для образования стабилизированного иммуностимулирующего комплекса.
(14) Выделенное антитело или его эпитопсвязывающий фрагмент, которые специфически связываются с В-клеточным эпитопом пептидной иммуногенной конструкции IL-31 в соответствии с любым из (1)-(10).
(15) Выделенное антитело или его эпитопсвязывающий фрагмент в соответствии с (14) связаны с пептидной иммуногенной конструкцией IL-31.
(16) Выделенное антитело или его эпитопсвязывающий фрагмент, которые специфически связывается с В-клеточным эпитопом пептидной иммуногенной конструкции IL-31 в соответствии с любым из (1)-(10).
(17) Композиция, содержащая выделенное антитело или его эпитопсвязывающий фрагмент в соответствии с любым из (14)-(16).
ПРИМЕР 1
СИНТЕЗ ПЕПТИДОВ, СВЯЗАННЫХ С IL-31, И ПОЛУЧЕНИЕ ИХ СОСТАВОВ
а. Фрагменты IL-31
Описаны способы синтеза сконструированных фрагментов IL-31, которые были включены в процесс разработки пептидных иммуногенных конструкций IL-31. Пептиды были синтезированы в небольших количествах, которые достаточны для серологических анализов и лабораторных поисковых и экспериментальных исследований, которые применимы для анализа фармацевтических композиций. Большой репертуар связанных с IL-31 антигенных пептидов, имеющих последовательности длиной от приблизительно 15 до приблизительно 75 аминокислот (таблица 1), был разработан для скрининга и выбора наиболее оптимальных пептидных конструкций для применения в эффективной пептидной иммуногенной конструкции IL-31.
Использовали аминокислотные последовательности из полноразмерных белков собачьего IL-31 (SEQ ID NO: 1) (Фиг. 1A) и человеческого IL-31 (SEQ ID NO: 2). В таблице 1 указаны фрагменты IL-31, используемые для картирования эпитопов в различных серологических анализах, (SEQ ID NO: 3-13 и 93-98), а на Фиг. 1В показано относительное выравнивание последовательностей фрагментов IL-31 с полноразмерной последовательностью. Из выбранных фрагментов IL-31 (SEQ ID NO: 3-13 и 93-98) делали пептидные иммуногенные конструкции IL-31 путем синтетического связывания с тщательно сконструированным Т-хелперным (Th) эпитопом, полученным из белков патогенов, включая UBITh®1 и UBITh®2, указанные в таблице 2 (SEQ ID NO: 26 и 25, соответственно). Th-эпитопы использовали или в одной последовательности (UBITh®1), или в комбинаторной библиотеке (UBITh®3) для усиления иммуногенности соответствующих им пептидных иммуногенных конструкций IL-31.
В таблице 3 указаны типовые пептидные иммуногенные конструкции IL-31 (SEQ ID NO: 43-90 и 99-105). Пептидные иммуногенные конструкции IL-31, которые были синтезированы и оценены, показаны в таблице 3 с идентифицированным пептидным кодом.
b. Типичный синтез пептидов
Пептиды, используемые для исследований иммуногенности или связанных с ними серологических тестов для обнаружения и/или измерения антител к IL-31, обычно синтезируют в небольшом масштабе с использованием химии F-moc с помощью пептидных синтезаторов Applied BioSystems Models 430A, 431 и/или 433. Каждый пептид получают при помощи отдельного синтеза на твердофазной подложке с F-moc-защитой на N-конце и защитными группами трифункциональных аминокислот боковой цепи. Полученные пептиды отщепляются от твердой подложки, а защитные группы боковых цепей удаляют при помощи 90% трифторуксусной кислотой (TFA). Препараты на основе синтетических пептидов оценивают с помощью время-пролетной масс-спектрометрии с лазерной десорбцией/ионизацией с использованием матрицы (MALDI-TOF) для гарантирования правильного содержания аминокислот. Каждый синтетический пептид также оценивают с помощью обращенно-фазовой ВЭЖХ (ОФ-ВЭЖХ), чтобы подтвердить профиль синтеза и концентрацию препарата. Несмотря на строгий контроль процесса синтеза (включая поэтапный контроль эффективности сочетания), пептидные аналоги также образуются из-за нежелательных явлений во время циклов элонгации, включая вставку аминокислот, делецию, замену и преждевременную терминацию. Таким образом, синтезированные препараты обычно включают множество пептидных аналогов наряду с целевым пептидом. Несмотря на включение таких непреднамеренных пептидных аналогов, полученные синтезированные пептидные препараты, тем не менее, пригодны для применения в иммунологических целях, включая иммунодиагностику (в качестве антигенов для захвата антител) и фармацевтических композициях (в качестве пептидных иммуногенов). Как правило, такие пептидные аналоги, или специально сконструированные, или полученные путем синтеза в виде смеси побочных продуктов, часто столь же эффективны, как и очищенный препарат желаемого пептида, при условии, что разработана четкая процедура контроля качества для контроля как процесса производства, так и процесса оценки продукта, чтобы гарантировать воспроизводимость и эффективность конечного продукта, в котором используются эти пептиды. Крупномасштабный синтез пептидов в количествах от нескольких сотен грамм до килограммов проводят на специализированном автоматизированном синтезаторе пептидов UBI2003 или подобном в масштабе от 15 ммоль до 150 ммоль. Для активных ингредиентов, которые будут использоваться в конечной фармацевтической композиции для клинических исследований, пептидные конструкции IL-31 очищают при помощи препаративной ОФ-ВЭЖХ в условиях низкого градиента элюирования и характеризуют при помощи масс-спектрометрии MALDI-TOF, аминокислотного анализа и ОФ-ВЭЖХ в отношении чистоты и идентичности.
ПРИМЕР 2
ИММУНИЗАЦИЯ МОРСКИХ СВИНОК ПЕПТИДНЫМИ ИММУНОГЕННЫМИ КОНСТРУКЦИЯМИ IL-31 ДЛЯ ОЦЕНКИ ИММУНОГЕННОСТИ
а. Животные
Морские свинки (300-350 г в весе) были использованы для иммунизации для оценки иммуногенности типовых сконструированных пептидных иммуногенных конструкций собачьего IL-31 (SEQ ID NO: 43, 47, 51, 55 и 59). Пятнадцать (15) морских свинок разделяли на группы по 3 животных в каждой группе и проводили первичную иммунизацию 400 мкг пептида с последующими 4 бустерными инъекциями по 100 мкг через 3, 6, 9 и 12 недель после первичной иммунизации (нпи), как показано в таблице 4. Образцы крови собирали на 0, 3, 6, 9, 12 и 15 нпи для измерения титра антител к IL-31 и для оценки других функциональных свойств антител, присутствующих в соответствующих иммунных сыворотках.
b. Состав
В общем, составы, используемые для иммунизации, содержали следующее:
1. 400 мкг пептидной иммуногенной конструкции IL-31
2. CpG при соотношении пептид: CpG 0,7: 1
3. 0.2% TWEEN 80
с. Титрование сывороточных антител к IL-31 методом ИФА
Титрование сывороточных антител к IL-31, образованных в ответ на пептидные иммуногенные конструкции IL-31, оценивали в соответствии со следующим протоколом:
Лунки 96-луночных планшетов покрывали 100 мкл рекомбинантного белка собачьего IL-31 (рсIL-31) (50 нг/лунку) или B-эпитопного пептида IL-31 (SEQ ID NO: 3-13 и 93-98) в количестве 0,2 мкг/0,1 мл/лунку в течение 1 часа при 37°С и 1 мкг/мл в 50 мМ карбонизированном бикарбонатном буфере, рН 9,6.
Лунки, покрытые рсIL-31, инкубировали с 200 мкл 1% BSA в PBS при 37°С в течение 1 часа для блокирования неспецифического связывания белка, затем три раза промывали PBS, содержащим 0,05% TWEEN 20, и затем сушили. Сто микролитров (100 мкл) серийных разведенных образцов сывороток от иммунизированных морских свинок добавляли в каждую лунку и проводили реакцию в течение 1 часа при 37°С. Затем лунки промывали PBS, содержащим 0,05% TWEEN 20, пять раз и сушили. 100 мкл меченного пероксидазой козьего антитела к IgG морской свинки с оптимальным разведением, приготовленным в PBS, содержащем 1% BSA и 0,05% TWEEN 20, добавляли в каждую лунку и инкубировали при 37°С в течение 1 часа. После инкубации лунки промывали PBS, содержащим 0,05% TWEEN 20, шесть раз и приводили в контакт с 100 мкл субстрата TMB в течение еще 15 минут. Реакции останавливали 2 н. H2SO4 и определяли поглощение при 450 нм.
Для определения титра антител у морских свинок, которые получали состав вакцины на основе пептида IL-31, проводили 10-кратное серийное разведение сывороток от 1: 100 или более для первичного скрининга типовых целевых B-эпитопных пептидов IL-31 с титром, выраженным в виде Log10. Для дальнейшего анализа сывороток, перекрестно реагирующих с рекомбинантным собачьим IL-31, 2-кратное серийное разведение сывороток от 1: 100 до 1: 54248800 выполняли на ИФА, и титр выражали в виде Log EC50.
d. Результаты
Результаты оценки иммуногенности с соответствующими титрами в отношении целевого B-эпитопного пептида IL-31 (SEQ ID NO: 43, 47, 51, 55 и 59) показаны в таблице 5.Титры антител (Log10 EC50) к рекомбинантному собачьему IL-31 для каждого из пептидных иммуногенных конструкций IL-31 показаны в таблице 6 и на Фиг. 2.
С помощью этих тщательно сконструированных пептидных иммуногенных конструкций собачьего IL-31 была выявлена высокая иммуногенность, причем в ответ на однократное введение на 3 нпи были образованы высокие титры антител к области IL-31 AA90-AA144 (SEQ ID NO: 8), охватываемой пептидами SEQ ID NO: 3-7. Для антител, образованных в ответ на тщательно сконструированные пептидные иммуногенные конструкции IL-31 (SEQ ID NO: 43, 47, 51, 55 и 59), была выявлена высокая перекрестная реактивность к собачьему рIL-31.
Пример 3
Получение, очистка и характеристика собачьего IL-31 для применения в биологических исследованиях
а. Экспрессирующий конструкцию
Последовательность собачьего IL-31 была идентифицирована с использованием ресурсов с геномной информацией NCBI (веб-сайт: ncbi.nlm.nih.gov). Была создана экспрессирующая конструкция с полноразмерным геном собачьего IL-31, содержащим С-концевую метку 6-His для обнаружения и очистки (см. Фиг.3А и 3В). Плазмиду с подтвержденной последовательностью использовали для трансфекции в клетки Expi293, а экспрессированный IL-31 должен секретироваться в культуральную среду. Среду собирали после 72 часов трансфекции, а с использованием никель-кобальтовой смолы проводили очистку рекомбинантных белков. После того как среда, содержащая секретированную форму IL-31, связывалась со смолой, колонку промывали промывочным буфером, содержащим 50 мМ трис-буфера, рН 8,0, 500 мМ NaCl и 20 мМ имидазола, три раза в 10-кратном объеме колонки. Затем рекомбинантный IL-31 элюировали при помощи элюирующего буфера, содержащего 50 мМ трис-буфера, pH 8,0, 500 мМ NaCl и 250 мМ имидазола, в 5-кратном объеме колонки. Элюированную фракцию анализировали при помощи ДСН-ПААГ-электрофореза и вестерн-блота, обработанного антителом к His.
b. Результаты
Экспрессированный His-меченный белок IL-31 окрашивали кумасси синим и очищали на 12% Бис-трис ДСН-ПААГ (Фиг. 3C). Вестерн-блоттинг геля ДСН-ПААГ показан на Фиг. 3C, который обрабатывали антителом к метки His (Фиг. 3D). Этот 21,1 кДа белок, секретируемый в среде, был идентифицирован и очищен для использования в следующих анализах и в качестве эталонного белка для оценки иммуногенности и перекрестной реактивности.
Пример 4
Опосредованная IL-31 передача сигнала pSTAT3 в клеточном анализе
а. Анализ
Функциональный анализ ингибирования индуцированной IL-31 сигнальной трансдукции in vitro с использованием антител к IL-31, образованных в ответ на пептидные иммуногенные конструкции IL-31, приведен на Фиг. 4А и 4В и Фиг. 5А и 5В.
b. Опосредованная IL-31 передача сигнала pSTAT3
Клетки DH-82 высевали в 96-луночные плоскодонные планшеты для культивирования клеток с плотностью 1 × 105 клеток на лунку в питательной среде MEM, содержащей 15% инактивированной нагреванием фетальной бычьей сыворотки, 2 ммоль/л GlutaMax, 1 ммоль/л натрия пирувата, 50 мг/л гентамицина и собачий интерферон-γ в концентрации 20 нг/мл в течение 16 часов при 37°C в увлажненном воздухе с добавлением 5% CO2. Клетки культивировали в бессывороточной среде в течение двух часов до обработки IL-31 для увеличения экспрессии рецептора IL-31. После предварительной обработки рекомбинантный собачий IL-31 добавляли в различных дозах (от 0,0001 до 10 нг/мл) в течение 5 минут (Фиг. 5А) или в концентрации 1 мкг/мл в течение 0, 3, 5, 10 и 15 минут (Фиг.5В). После инокуляции клетки лизировали с использованием 20% конечного объема смеси для лизиса клеток Cell Lysis Mix (5Х) и встряхивали при 300 об/мин при 37 °С в течение 10 минут. Для оценки pSTAT3 использовали 50 мкл клеточных лизатов. В лунки для тестирования добавляли 50 мкл меченного пероксидазой антитела к pSTAT3 (y705) или меченного пероксидазой антитела к STAT3 и оставляли реагировать в течение 1 часа при 37°С. Затем лунки промывали PBS, содержащим 0,05% TWEEN 20, пять раз и приводили в контакт со 100 мкл субстрата TMB в течение еще 15 минут. Реакции останавливали 2 н. H2SO4 и определяли поглощение при 450 нм.
с. Результаты
На Фиг. 5А и 5В показаны графики передачи сигнала pSTAT3 в моноцитах DH-82 собаки, индуцированного собачьим IL-31, продуцируемым клетками expi293. На Фиг. 5А показано, что фосфорилирование pSTAT3 индуцируется собачьим IL-31 зависимым от дозы образом с оптимальной концентрацией 1 мкг/мл, которая была выбрана для оценки уровня фосфорилирования для оценки анализа. На Фиг. 5В показано, что pSTAT3 индуцируется собачьим IL-31 зависимым от времени образом с 5 минутами в качестве момента времени, выбранного для анализов ингибирования, описанных в следующих примерах, для оценки ингибирующей активности антител к IL-31.
Пример 5
ИНГИБИРОВАНИЕ ОПОСРЕДОВАННОЙ IL-31 ПЕРЕДАЧИ СИГНАЛА PSTAT3 В КЛЕТОЧНОМ АНАЛИЗЕ
а. Опосредованная IL-31 передача сигнала pSTAT3
Клетки DH-82 высевали в 96-луночные плоскодонные планшеты для культивирования клеток с плотностью 1 × 105 клеток на лунку в питательной среде MEM, содержащей 15% инактивированной нагреванием фетальной бычьей сыворотки, 2 ммоль/л GlutaMax, 1 ммоль/л натрия пирувата, 50 мг/л гентамицина и собачий интерферон-γ в концентрации 20 нг/мл в течение 16 часов при 37°C в увлажненном воздухе с добавлением 5% CO2. Клетки культивировали в бессывороточной среде в течение двух часов до обработки IL-31 для увеличения экспрессии рецептора IL-31. Во время выращивания клеток на бессывороточной среде 100 мкл серийно разведенных образцов антител, очищенных смолой с протеином А из иммунной сыворотки морских свинок и собачьим IL-31 в концентрации 1 мкг/мл, хорошо перемешивали и совместно инкубировали в течение 1 часа при 37°С. После предварительной обработки в течение 5 минут добавляли 50 мкл рекомбинантного собачьего IL-31 и смеси очищенных образцов сывороток. После инокуляции клетки лизировали с использованием 20% конечного объема смеси для лизиса клеток Cell Lysis Mix (5Х) и встряхивали при 300 об/мин при 37°С в течение 10 минут. Для оценки pSTAT3 использовали 50 мкл клеточных лизатов. В лунки для тестирования добавляли 50 мкл меченного пероксидазой антитела к pSTAT3 (y705) или меченного пероксидазой антитела к STAT3 и оставляли реагировать в течение 1 часа при 37 °С. Затем лунки промывали PBS, содержащим 0,05% TWEEN 20, пять раз и приводили в контакт со 100 мкл субстрата TMB в течение еще 15 минут. Реакции останавливали 2 н. H2SO4 и определяли поглощение при 450 нм.
b. Результаты
На Фиг. 6А и 6В показаны графики, на которых показано ингибирование индуцированной собачьим IL-31 передачи сигнала pSTAT3 в моноцитах DH82 собаки с помощью антител к IL-31, полученных с использованием описанных пептидных иммуногенных конструкций IL-31 (SEQ ID NO: 43, 47, 51, 55. и 59), через 12 недель после первичной иммунизации (нпи) (Фиг. 6A) и 15 нпи (Фиг. 6B).
На Фиг. 7 показан график, на котором приведены дополнительные подробности, касающиеся ингибирования индуцированной собачьим IL-31 передачи сигнала pSTAT3 в моноцитах DH82 собаки с помощью антител к IL-31, полученных с использованием пептидных иммуногенных конструкций IL-31 p4751kb (SEQ ID NO: 43) и p4752 ( SEQ ID NO: 47), через 15 недель после первичной иммунизации (нпи).На Фиг. 7 также приведена информация об ингибировании (IC50) для индуцированной рекомбинантным собачьим белком IL-31 передачи сигнала pSTAT.
Пример 6
ДАЛЬНЕЙШЕЕ УЛУЧШЕНИЕ ПЕПТИДНЫХ ИММУНОГЕННЫХ КОНСТРУКЦИЙ СОБАЧЬЕГО IL-31 ДЛЯ ОЦЕНКИ ИММУНОГЕННОСТИ У МОРСКИХ СВИНОК
а. Животные
Всего для иммунизации использовали 18 морских свинок (300-350 г по весу). 18 морских свинок разделяли на 6 групп по 3 животных в каждой группе и проводили первичную иммунизацию 400 мкг пептида (SEQ ID NO: 63, 68, 71, 76, 80 и 84) с последующими 4 бустерными инъекциями на 3, 6, 9 и 12 неделях после первичной иммунизации (нпи), как показано в таблице 7. Образцы крови собирали на 0, 3, 6, 9, 12 и 15 нпи для титров антител к IL-31 с помощью соответствующих им пептидных иммуногенных конструкций IL-31.
b. Состав
В общем, составы, используемые для иммунизации, содержали следующее:
1. 400 мкг пептидной иммуногенной конструкции IL-31
2. CpG при соотношении пептид: CpG 0,7: 1
3. 0.2% TWEEN 80
с. Титрование сывороточных антител к IL-31 методом ИФА
Титрование сывороточных антител к IL-31, образованных в ответ на пептидные иммуногенные конструкции IL-31, оценивали в соответствии со следующим протоколом:
Лунки 96-луночных планшетов покрывали 100 мкл рекомбинантного белка собачьего IL-31 (50 нг/лунку) или соответствующего B-эпитопного пептида IL-31 (0,2 мкг/100 мкл/лунку) в течение 1 часа при 37°С в концентрации 1 мкг/мл в 50 мМ карбонизированного бикарбонатного буфера, рН 9,6.
Лунки, покрытые рсIL-31 или соответствующим В-эпитопным пептидом IL-31 (SEQ ID NO: 9 или 12), инкубировали с 200 мкл 1% BSA в PBS при 37°С в течение 1 часа для блокирования неспецифического связывания белка, затем три раза промывали PBS, содержащим 0,05% TWEEN 20, и затем сушили. Сто микролитров (100 мкл) серийных разведенных образцов сывороток от иммунизированных морских свинок добавляли в каждую лунку и проводили реакцию в течение 1 часа при 37°С. Затем лунки промывали PBS, содержащим 0,05% TWEEN 20, пять раз и сушили. 100 мкл меченного пероксидазой козьего антитела к IgG морской свинки с оптимальным разведением, приготовленным в PBS, содержащем 1% BSA и 0,05% TWEEN 20, добавляли в каждую лунку и инкубировали при 37°С в течение 1 часа. После инкубации лунки промывали PBS, содержащим 0,05% TWEEN 20, шесть раз и приводили в контакт с 100 мкл субстрата TMB в течение еще 15 минут. Реакции останавливали 2 н. H2SO4 и определяли поглощение при 450 нм.
Для определения титров антител у морских свинок, которые получали состав вакцины на основе пептида IL-31, проводили 10-кратное серийное разведение сывороток от 1: 100 или более для первичного скрининга типовых целевых B-эпитопных пептидов IL-31 с титрами, выраженными в виде Log10. Для дальнейшего анализа сывороток, перекрестно реагирующих с рекомбинантным собачьим IL-31, 2-кратное серийное разведение сывороток от 1: 100 до 1: 54248800 выполняли на ИФА, и титры выражали в виде Log10 EC50.
d. Результаты
Результаты исследования по оценке иммуногенности приведены в таблице 8.
Титры антител (Log EC50) к рекомбинантному IL-31 для каждого из пептидных иммуногенных конструкций IL-31 (SEQ ID NO: 63, 68, 71, 76, 80 и 84) показаны в таблице 9 и на Фиг. 8.
Высокая иммуногенность была обнаружена с помощью этих тщательно сконструированных собачьих пептидных иммуногенных конструкций IL-31, для которых на 3 нпи в ответ даже на однократное введение образовывались высокие титры антител. Для антител, образованных в ответ на тщательно сконструированные пептидные иммуногенные конструкции IL-31 (SEQ ID NO: 63, 68, 71, 76, 80 и 84), была выявлена высокая перекрестная реактивность к собачьему рIL-31.
Пример 7
ИНГИБИРОВАНИЕ ОПОСРЕДОВАННОЙ IL-31 ПЕРЕДАЧИ СИГНАЛА PSTAT3 С ПОМОЩЬЮ АНТИТЕЛ ПРОТИВ IL-31 ИЗ ИММУННОЙ СЫВОРОТКИ МОРСКИХ СВИНОК В КЛЕТОЧНОМ АНАЛИЗЕ
а. Опосредованная IL-31 передача сигнала pSTAT3
Клетки DH-82 высевали в 96-луночные плоскодонные планшеты для культивирования клеток с плотностью 1 × 105 клеток на лунку в питательной среде MEM, содержащей 15% инактивированной нагреванием фетальной бычьей сыворотки, 2 ммоль/л GlutaMax, 1 ммоль/л натрия пирувата, 50 мг/л гентамицина и собачий интерферон-γ в концентрации 20 нг/мл в течение 16 часов при 37°C в увлажненном воздухе с добавлением 5% CO2. В течение двух часов до обработки IL-31 для увеличения экспрессии рецептора IL-31 их культивировали в бессывороточной среде. Тем временем 100 мкл серийно разведенных образцов сывороток, очищенных смолой с протеином A от 6 и 12 нпи иммунизированных морских свинок и собачьего IL-31 в концентрации 1 мкг/мл, хорошо перемешивали для совместной инкубации в течение 1 часа при 37°C. После предварительной обработки в течение 5 минут добавляли 50 мкл рекомбинантного собачьего IL-31 и смеси очищенных образцов сывороток. После инокуляции клетки лизировали с использованием 20% конечного объема смеси для лизиса клеток Cell Lysis Mix (5Х) и встряхивали при 300 об/мин при 37°С в течение 10 минут. Для оценки pSTAT3 использовали 50 мкл клеточных лизатов. В лунки для тестирования добавляли 50 мкл меченного пероксидазой антитела к pSTAT3 (y705) или меченного пероксидазой антитела к STAT3 и оставляли реагировать в течение 1 часа при 37°С. Затем лунки промывали PBS, содержащим 0,05% TWEEN 20, пять раз и приводили в контакт со 100 мкл субстрата TMB в течение еще 15 минут. Реакции останавливали 2 н. H2SO4 и определяли поглощение при 450 нм.
b. Результаты
На Фиг. 9А и 9В показаны графики, на которых показан % фосфорилирования (Фиг. 9А) и ингибирования фосфорилирования STAT3 (Фиг. 9В) с помощью индуцированной собачьим IL-31 передачи сигнала pSTAT3 в моноцитах DH82 собаки в присутствии антител к IL-31, полученных из иммунной сыворотки морских свинок, полученных с помощью описанных пептидных иммуногенных конструкций IL-31 (SEQ ID NO: 63, 68, 71, 76, 80 и 84), через 6 и 12 недель после первичной иммунизации (нпи) (Фиг. 9A).
На Фиг. 10А и 10В показаны графики, на которых показан % фосфорилирования (Фиг. 10А) и ингибирования фосфорилирования STAT3 (Фиг. 10В) индуцированной собачьим IL-31 передачи сигнала pSTAT3 в моноцитах DH82 собаки при помощи антител к IL-31, полученных из иммунной сыворотки морских свинок, полученных с помощью описанных пептидных иммуногенных конструкций IL-31 (SEQ ID NO: 63, 68, 71, 84), через 9 и 12 недель после первичной иммунизации (нпи).
В целом, для реактивных антител к IL-31, образованных в ответ на эти тщательно сконструированные пептидные иммуногенные конструкции IL-31, было обнаружено зависимое от дозы значительное ингибирование индуцированной IL-31 передачи сигнала pSTAT3 в моноцитах DH82 собаки
Пример 8
ИНГИБИРОВАНИЕ ОПОСРЕДОВАННОЙ IL-31 ПЕРЕДАЧИ СИГНАЛА PSTAT3 В КЛЕТОЧНОМ АНАЛИЗЕ
а. Опосредованная IL-31 передача сигнала pSTAT3
Клетки DH-82 высевали в 96-луночные плоскодонные планшеты для культивирования клеток с плотностью 1 × 105 клеток на лунку в питательной среде MEM, содержащей 15% инактивированной нагреванием фетальной бычьей сыворотки, 2 ммоль/л GlutaMax, 1 ммоль/л натрия пирувата, 50 мг/л гентамицина и собачий интерферон-γ в концентрации 20 нг/мл в течение 16 часов при 37°C в увлажненном воздухе с добавлением 5% CO2. В течение двух часов до обработки IL-31 для увеличения экспрессии рецептора IL-31 их культивировали в бессывороточной среде. Тем временем 100 мкл серийно разведенных образцов сывороток, очищенных смолой с протеином A от 6, 9 и 12 нпи иммунизированных морских свинок и собачьего IL-31 в концентрации 1 мкг/мл, хорошо перемешивали для совместной инкубации в течение 1 часа при 37°C. После предварительной обработки в течение 5 минут добавляли 50 мкл рекомбинантного собачьего IL-31 и смеси очищенных образцов сывороток. После инокуляции клетки лизировали 20% конечным объемом смеси для лизиса клеток Cell Lysis Mix (5Х) и встряхивали при 300 об/мин при 37°С в течение 10 минут. Для оценки pSTAT3 использовали пятьдесят микролитров (50 мкл) клеточных лизатов. В лунки для тестирования добавляли пятьдесят микролитров (50 мкл) меченного пероксидазой антитела к pSTAT3 (y705) или меченного пероксидазой антитела к STAT3 и оставляли реагировать в течение 1 часа при 37℃. Затем лунки промывали PBS, содержащим 0,05% TWEEN 20, пять раз и приводили в контакт со 100 мкл субстрата TMB в течение еще 15 минут. Реакции останавливали 2 н. H2SO4 и определяли поглощение при 450 нм.
b. Результаты
На Фиг. 11А и 11В приведены гистограммы, на которых показан процент фосфорилирования (Фиг. 11А) и процент ингибирования (Фиг. 11В) индуцированной собачьим IL-31 передачи сигнала pSTAT3 в моноцитах DH82 собаки в присутствии антител к IL-31, полученных из иммунной сыворотки морских свинок, полученных с помощью пептидных иммуногенных конструкций IL-31 p4854kb (SEQ ID NO: 63) и p4859 (SEQ ID NO: 84) через 6, 9 и 12 недель после первичной иммунизации (нпи).
На Фиг. 12 показаны графики с аппроксимирующими кривыми, на которых показаны процент фосфорилирования индуцированной собачьим IL-31 передачи сигнала pSTAT3 в моноцитах DH82 собаки при помощи антител к IL-31, полученными из иммунных сывороток морских свинок, полученных с помощью пептидных иммуногенных конструкций IL-31 p4854kb (SEQ ID NO: 63) и p4859 (SEQ ID NO: 84), через 6, 9 и 12 недель после первичной иммунизации (нпи). На нижней панели приведена информация о соответствующем ингибировании (IC50) для индуцированной рекомбинантным собачьим белком IL-31 передачи сигнала pSTAT.
В целом, для реактивных антител к IL-31, образованных в ответ на эти тщательно сконструированные пептидные иммуногенные конструкции IL-31, было обнаружено зависимое от дозы значительное ингибирование индуцированной IL-31 передачи сигнала pSTAT3 в моноцитах DH82 собаки
Пример 9
ПОЛУЧЕНИЕ ЛИПИДИРОВАННЫХ БЕЛКОВ В E. COLI
Пептидные иммуногенные конструкции IL-31 могут экспрессироваться в определенных штаммах E.coli, в которых возможно липидирование, для получения липопротеина, и использоваться в качестве иммуногена для лечения атопического дерматита.
Этот процесс описан в патенте США № 8426163, который полностью включен в данный документ посредством ссылки.
ПРИМЕР 10
ИММУНИЗАЦИЯ СОБАК ВЫБРАННОЙ ПЕПТИДНОЙ ИММУНОГЕННОЙ КОНСТРУКЦИЕЙ IL-31 (SEQ ID NO: 84) ДЛЯ ФУНКЦИОНАЛЬНОЙ ОЦЕНКИ ИММУНОГЕННОСТИ В ДОКАЗАТЕЛЬСТВЕ КОНЦЕПЦИИ
а. Животные
Всего для иммунизации было использовано 15 собак породы бигль. Собак делили на 2 группы, одну группу из 8 собак тестировали составом в виде водно-масляной эмульсии, а другую группу из 7 собак тестировали квасцами в комбинации с сапониновым составом. За первичной иммунизацией 100 мкг пептидной иммуногенной конструкции IL-31 с SEQ ID NO: 84 следовал еще один буст тем же составом в той же дозе через 21 сутки после первичной иммунизации (СПИ). Образцы крови собирали на 0, 21 и 41 СПИ для измерения титров антител к IL-31 и для оценки других функциональных свойств антител, присутствующих в соответствующих иммунных сыворотках. Протокол иммунизации приведен на Фиг. 13.
b. Титрование сывороточных антител к IL-31 к B-эпитопному пептиду IL-31 или рекомбинантному собачьему белку IL-31 методом ИФА
Титрование сывороточных антител к IL-31, образованных в ответ на пептидную иммуногенную конструкцию IL-31 (SEQ ID NO: 84), оценивали в соответствии со следующим протоколом:
Лунки 96-луночных планшетов покрывали 100 мкл рекомбинантного собачьего белка IL-31 (50 нг/лунку) или B-эпитопного пептида IL-31 (SEQ ID NO: 84) при 0,2 мкг/0,1 мл/лунку в течение 1 часа при 37℃ в концентрации 1 мкг/мл в 50 мМ карбонизированном бикарбонатном буфере, рН 9,6. Лунки, покрытые антигеном, инкубировали с 200 мкл 1% BSA в PBS при 37°С в течение 1 часа для блокирования неспецифического связывания белка, затем три раза промывали PBS, содержащим 0,05% TWEEN 20, и затем сушили. Сто микролитров (100 мкл) серийных разведенных образцов сывороток от иммунизированных собак добавляли в каждую лунку и проводили реакцию в течение 1 часа при 37°С. Затем лунки промывали PBS, содержащим 0,05% TWEEN 20, пять раз и сушили. Сто микролитров (100 мкл) меченного пероксидазой антител кролика к IgG собаки или меченного пероксидазой рекомбинантного протеина A/G (Pierce™) с оптимальным разведением, приготовленным в PBS, содержащем 1% BSA и 0,05% TWEEN 20, добавляли в каждую лунку и инкубировали при 37℃ в течение 1 часа. После инкубации лунки промывали PBS, содержащим 0,05% TWEEN 20, шесть раз и приводили в контакт с 100 мкл субстрата TMB в течение еще 15 минут. Реакции останавливали 2 н. H2SO4 и определяли поглощение при 450 нм. Для определения титров антител у собак породы бигль, которые получали состав вакцины на основе пептида IL-31, 2-кратное серийное разведение сывороток от 1: 100 до 1: 54248800 выполняли на ИФА, и титры выражали в виде Log10.
с. Ингибирование опосредованной IL-31 передачи сигнала pSTAT3 в клеточном анализе
Клетки DH-82 высевали в 96-луночные плоскодонные планшеты для культивирования клеток с плотностью 1 × 105 клеток на лунку в питательной среде MEM, содержащей 15% инактивированной нагреванием фетальной бычьей сыворотки, 2 ммоль/л GlutaMax, 1 ммоль/л натрия пирувата, 50 мкг/л гентамицина и собачий интерферон-γ в концентрации 20 нг/мл в течение 16 часов при 37°C в увлажненном воздухе с добавлением 5% CO2. В течение двух часов до обработки IL-31 для увеличения экспрессии рецептора IL-31 их культивировали в бессывороточной среде. Во время выращивания клеток на бессывороточной среде 100 мкл серийно разведенных образцов сывороток, очищенных смолой с протеином А из иммунизированных собак породы бигль и собачьим IL-31 в концентрации 1 мкг/мл, хорошо перемешивали для совместной инкубации в течение 1 часа при 37°С. После предварительной обработки в течение 5 минут добавляли 50 мкл рекомбинантного собачьего IL-31 и смеси очищенных образцов сывороток. После инокуляции фосфорилирование STAT3 определяли с помощью коммерческого набора (InstantOne™ ELISA Kit, Thermo). Клетки лизировали с использованием 20% конечного объема смеси для лизиса клеток Cell Lysis Mix (5X) и встряхивали при 300 об/мин при 37°С в течение 10 минут. Для оценки pSTAT3 использовали 50 мкл клеточных лизатов, а в лунки для тестирования добавляли полученных 50 мкл меченного пероксидазой антитела к pSTAT3 (y705) или меченного пероксидазой антитела к STAT3 и оставляли реагировать в течение 1 часа при 37°С. Затем лунки промывали PBS, содержащим 0,05% TWEEN 20, пять раз и приводили в контакт со 100 мкл субстрата TMB в течение еще 15 минут. Реакции останавливали 2 н. H2SO4 и определяли поглощение при 450 нм.
d. Результаты
Результаты оценки иммуногенности при помощи различных составов с соответствующими титрами в отношении целевого В-эпитопного пептида IL-31 (SEQ ID NO: 84) приведены на Фиг. 14. Титры антител (Log10 EC50) к рекомбинантному собачьему IL-31 на 21 СПИ и 41 СПИ для каждой из собак показаны на Фиг. 15 и 16, где конъюгированное с ПХ антитело кролика к IgG собаки (Фиг. 15) или протеин A/G HRP (Фиг. 16) использовали в качестве второго меченого вещества.
Высокая иммуногенность была обнаружена с типовым пептидной иммуногенной конструкцией собачьего IL-31 с SEQ ID NO: 84, причем в ответ на однократное введение на 21 СПИ были образованы высокие титры антител к В-эпитопному пептиду IL-31B (Фиг. 14) и с высокой перекрестной реактивностью по отношению к собачьему рIL-31 (Фиг. 15 и 16).
В этом исследовании состава ясно, что квасцы в присутствии адъюванта сапонина обеспечивали лучшее усиление иммунитета, чем состав в виде водно-масляной эмульсии. Оба меченых вещества демонстрировали одинаковые профили связывания и сопоставимые титры. Другим важным открытием этого исследования иммуногенности на собаках является то, что запатентованный UBITh®-T-хелперный пептид был способен помочь последовательности ауто-IL-31 разрушить/или преодолеть иммунную толерантность, присущую большинству аутобелков.
В целом, было обнаружено зависимое от дозы значительное ингибирование индуцированной IL-31 передачи сигнала pSTAT3 в моноцитах DH82 собаки (от 500, 250, 100, 75, 50, 12,5 до 6,25 мкг) для собачьих реактивных антител к собачьего IL-31, образованных в ответ на эти тщательно сконструированные пептидные иммуногенные конструкции IL-31, для обоих составов с квасцами/сапонином, обеспечивающими около 40-60% ингибирование индуцированного IL-31 фосфорилирования pSTAT3, при этом состав в виде эмульсии обеспечивал около 35-50% ингибирование по сравнению с моноклональным антителом к IL-31 (Cytopoint), которое обеспечивало аналогичное 50-75% ингибирование. Как показано на Фиг.18А и 18В, моноклональное антитело к собачьему IL-31 «Cytopoint» обладает способностью ингибировать передачу сигнала с IC50=3,21 мкг/мл.
В связанном исследовании иммуногенности морских свинок антитела из иммунной сыворотки на 6 нпи после 2 иммунизаций имеют гораздо более низкий % ингибирования в такой передаче сигнала pSTAT3, где антитела из иммунной сыворотки на 15 нпи обеспечивают более высокий зависимый от дозы общий % ингибирования передачи сигнала (см. Фиг. 19A-19C). Эти данные предполагают, что иммунизация собак более чем 2 инъекциями обеспечивает еще лучшее ингибирование передачи сигнала. Таким образом, такая пептидная иммуногенная конструкция собачьего IL-31 продемонстрировала свой потенциал и способность индуцировать у собак эффективные поликлональные антитела для уменьшения/подавления/ингибирования стимулирующего эффекта IL-31, который может вызывать атопический дерматит у собак.
ПРИМЕР 11
ДАЛЬНЕЙШЕЕ УЛУЧШЕНИЕ В КОНСТРУИРОВАНИИ ПЕПТИДНЫХ ИММУНОГЕННЫХ КОНСТРУКЦИЙ ЧЕЛОВЕЧЕСКОГО IL-31 ДЛЯ ФУНКЦИОНАЛЬНОЙ ОЦЕНКИ ИММУНОГЕННОСТИ У МОРСКИХ СВИНОК
а. Конструирование связанных с IL-31 пептидных иммуногенных конструкций в качестве продолжения аналогов собачьего IL-31
IL-31 представляет собой цитокин со структурой четырехспирального пучка, принадлежащий к семейству цитокинов IL-6. IL-31 преимущественно продуцируется активированными CD4+ TH2-клетками и кожно-хоминговыми CD45RO+ Т-клетками (памяти), положительными по кожному лимфоцитосвязанному антигену. IL-4 индуцирует экспрессию генов и высвобождение белка IL-31 из TH2-клеток человека, а IL-33 дополнительно усиливает индуцированное IL-4 высвобождение IL-31.
Рецептор IL-31 (IL-31R) состоит из гетеродимера α-цепи рецептора IL-31 (IL-31Rα) и β-субъединицы рецептора онкостатина М (OSMR-β). Гетеродимерный IL-31R экспрессируется в макрофагах, дендритных клетках, базофилах, кожных нейронах и эпителиальных клетках, включая кератиноциты. IL-31Rα наиболее широко экспрессируется в дорсальных корешковых ганглиях, где расположены тела кожных сенсорных нейронов. Недавние исследования демонстрируют, что IL-31 может напрямую связываться с сенсорными нервами через IL-31R и служить ключевой нейроиммунной связью между Th2-клетками и сенсорными нейронами для генерации воспалительного зуда, опосредованного Т-клетками. OSMR-β не только является субъединицей IL-31R, но также взаимодействует с gp130 с образованием OSM, связывающего рецепторный комплекс типа II. OSMR-β широко экспрессируется в сосудистой системе, сердце, легких, жировой ткани, коже, мочевом пузыре, ткани молочной железы, надпочечниках и предстательной железе.
IL-31 связывается преимущественно с IL-31Rα, но не с β OSMR в комплексе IL-31R. Однако при связывании β OSMR превращает IL-31R в высокоаффинный рецептор и увеличивает связывание IL-31. Взаимодействие IL-31 и комплекса рецепторов IL-31Rα/OSMR-β индуцирует активацию путей Jak/сигнального трансдуктора и активатора транскрипции (STAT), сигнальной трансдукции фосфоинозитид-3-киназы (PI3K)/AKT и митоген-активируемой протеинкиназы (MAPK).
Данные рентгеноструктурного анализа для IL-31 или комплекса IL-31/IL-31Rα пока отсутствуют. Однако сайт-направленный мутагенез предполагает взаимодействие сайта II человеческого IL-31 с IL-31Rα и сайта III с OSMR-β. В частности, E22 в спирали A и E83/H87 в спирали C образуют сайт II, а K111 в N-конце спирали D является важной частью сайта III. Ab initio моделирование человеческого IL-31, генерируемого I-TASSER, показало классическую укладку в виде четырехспирального пучка из семейства цитокинов IL-31 с топологией «вверх-вверх-вниз-вниз». Три ключевых остатка, E22, E83 и H87, для взаимодействия IL-31R2 α пространственно сгруппированы, демонстрируя спрогнозированный сайт II.
В-клеточные эпитопы человеческого IL-31 пептидных иммуногенных конструкций IL-31 были дополнительно разработаны для нацеливания области связывания IL-31Rα на молекулу IL-31. Для поддержания конформации боковых цепей E83 и H87, подвергаемых воздействию растворителя, спираль C была затруднена соседними спиралями тремя различными способами: (1) спираль C-петля-спираль D (SEQ ID NO: 13), (2) спираль B-петля-спираль C (SEQ ID NO: 95) и (3) спираль B-C-D (SEQ ID NO: 93). В-клеточные эпитопные пептиды содержат от 31 до 64 аминокислотных остатков, полученных из L75-S122, S62-I92 или A64-L127. Чтобы боковые цепи E83 и H87 были обращены в одном направлении, эпитоп спирали С в пределах p5095kb (SEQ ID NO: 101) был затруднен спиралью B посредством взаимодействия спираль-спираль и введения искусственной дисульфидной связи. Также была протестирована пептидная конструкция p5094kb (SEQ ID NO: 100) с простой спиралью C в качестве B-эпитопа (SEQ ID NO: 94).
b. Тест методом ИФА на основе IL-31 для анализа специфичности антител
Рекомбинантный человеческий белок IL-31 (Sino Biological Inx.) или отдельные B-эпитопные пептиды человеческого IL-31 (SEQ ID NO: 13, 94, 95 и 93) иммобилизовали на микропланшетах для титрования при 50 нг/лунку для рекомбинантного человеческого белка IL-31 или для соответствующего В-эпитопного пептида IL-31 при 200 нг/лунку в буфере для иммобилизации (1,5 г/л a2CO3, 2,9 г/л NaHCO3, pH 9,6) и инкубировали при 4°C в течение ночи. Планшеты промывали 3 раза 200 мкл/лунку промывочного буфера (PBS с 0,05% TWEEN-20). Покрытые лунки блокировали 200 мкл /лунку аналитического разбавителя (0,5% BSA, 0,05% TWEEN-20, 0,01% ProClin 300 в PBS) при комнатной температуре в течение 1 часа. Планшеты промывали 3 раза с использованием 200 мкл/лунку промывочного буфера. В покрытые лунки добавляли 100 мкл антисыворотки (серийно 4-кратно разведенной от 1: 100 до 1: 4,19 × 108, всего 12 разведений) или разбавители антител (серийно 4-кратно разведенные от 100 мг/мл до 0,0238 нг/мл, всего 12 разведений). Инкубацию проводили при комнатной температуре в течение 1 часа. Содержимое все лунок аспирировали, а лунки промывали 5 раз 200 мкл/лунку промывочного буфера. Планшеты инкубировали с разведением 1: 10000 конъюгированных с ПХ козьих антител к IgG морской свинки (H+L) (Jackson ImmunoResearch Laboratories) в течение 1 часа (100 мкл/лунку). Затем все лунки промывали 5 раз 200 мкл/лунку промывочного буфера. Наконец, лунки обрабатывали 100 мкл/лунку субстрата NeA-Blue TMB (Clinical Science Products), и реакцию останавливали добавлением 100 мкл/лунку 1 М H2SO4. Поглощение измеряли при ОП450 на микропланшетном ридере для ИФА (Molecular Devices). Специфический титр антисыворотки, выраженный как Log10 титров или Log10 (EC50), определяли как разведение образца в log, которое дает 50% максимум поглощения для четырехпараметрической кривой, с использованием нелинейного регрессионного анализа в программном обеспечении Prism (GraphPad). Реакционную способность очищенного поликлонального антитела IgG выражали как половину эффективной концентрации (ЕС50) к четырехпараметрической кривой с использованием нелинейного регрессионного анализа при помощи программного обеспечения Prism.
с. Оценка функциональных свойств антител, образованных в ответ на пептидные иммуногенные конструкции IL-31 и их составы у животных
Иммунную сыворотку или очищенные поликлональные антитела к IL-31 в иммунизированных вакцинах дополнительно тестировали на их способность (1) блокировать взаимодействие между IL-31 и его рецептором IL-31Rα, (2) подавлять индуцированное IL-31 фосфорилирование STAT3. в клетках глиомы U87MG и (3) ингибировать экспрессию IL-20 в клеточной линии HaCaT, трансфицированной IL-31Rα.
1. Клетки
Клеточную линию U87MG поддерживали в EMEM с добавлением 10% телячьей сыворотки и 1% пенициллина/стрептомицина в инкубаторе с увлажнением при 37°C с 5% CO2.
Сверхэкспрессирующие IL-31Rα трансфектанты HaCaT поддерживали в среде DMEM (с высоким содержанием глюкозы, Gibco) с добавлением 10% FBS, 1% пенициллина/стрептомицина, 1 мМ пирувата натрия и 200 мкг/мл гигромицина B (Gibco) в инкубаторе с увлажнением при 37°C с 5% CO2.
2. Связывание IL-31 с α-цепью IL-31R
Очищенные поликлональные антитела IgG из объединенных иммунных сывороток морских свинок, предварительно иммунизированных различными пептидными иммуногенными конструкциями IL-31, исследовали на их относительную способность ингибировать связывание IL-31 с IL-31Rα с помощью ИФА. Лунки 96-луночных планшетов по отдельности покрывали 50 нг моноклонального антитела к His (GenScript) в буфере для иммобилизации (15 мМ Na2CO3, 35 мМ NaHCO3, pH 9,6) и инкубировали при 4 °С в течение ночи. Покрытые лунки блокировали 200 мкл/лунку аналитических разбавителей (1% BSA, 0,05% TWEEN-20 и 0,01% ProClin 300 в PBS) при комнатной температуре в течение 1 часа. Планшеты промывали 3 раза 200 мкл/лунку промывочного буфера (PBS с 0,05% TWEEN-20 и 0,01% ProClin 300). 100 нг рекомбинантного His-меченного человеческого белка IL-31Rα (R&D Systems) иммобилизовали на поверхности с антителом к His при комнатной температуре в течение 1 часа. После промывки 100 мкл смеси человеческого IL-31 (GenScript) в концентрации 10 нг/мл и очищенных поликлональных антител IgG морских свинок при различных концентрациях предварительно инкубировали в течение 1 часа при комнатной температуре и затем добавляли в покрытые лунки. Инкубацию проводили при комнатной температуре в течение 1 часа. Содержимое все лунок аспирировали, а лунки промывали 3 раз 200 мкл/лунку промывочного буфера. Захваченный IL-31 детектировали с помощью 100 мкл/лунку меченного биотином кроличьего антитела к IL-31 в концентрации 0,25 мкг/мл (PeproTech Inc.) при комнатной температуре в течение 1 часа. Затем связанные антитела, меченные биотином, детектировали с использованием полиПХ-стрептавидина (разведение 1: 10000, Thermo Fisher Scientific) в течение 1 часа (100 мкл/лунку). Содержимое все лунок аспирировали, а лунки промывали 3 раз 200 мкл/лунку промывочного буфера. Наконец, лунки обрабатывали 100 мкл/лунку субстрата OptEIA TMB (BD Biosciences), и реакцию останавливали добавлением 100 мкл/лунку 1 М H2SO4. Колориметрическое поглощение измеряли при помощи микропланшетного ридера для ИФА VersaMax ELISA (Molecular Devices), а кривую реактивности получали с использованием четырехпараметрической логистической регрессии для расчета полумаксимальной ингибирующей концентрации (IC50) в программном обеспечении Prism 6 (программное обеспечение GraphPad).
3. Анализ индуцированного IL-31 фосфорилирования STAT3
Чтобы исследовать, может ли очищенный IgG ингибировать индуцированное IL-31 фосфорилирование STAT3 в клетках U87MG, клетки высевали в 12-луночный планшет (2 × 105/лунку) и культивировали в среде с пониженным содержанием сыворотки (1% телячья сыворотки в EMEM) в течение 16 часов. Затем клетки одновременно инкубировали с IL-31 в конечной концентрации 10 нг/мл в присутствии поликлональных антител морских свинок при общем объеме 500 мкл среды с пониженным содержанием сыворотки при 37°C, 5% CO2 в течение 30 минут. Моноклональное антитело к IL-31, MT313 (Mabtech AB), также включали в качестве контроля в исследовании. Уровень фосфорилированного STAT3 измеряли с помощью набора ELISA PathScan p-Stat3 (Cell Signaling). Вкратце, клеточный лизат получали путем суспендирования клеток в 30 мкл буфера для лизиса клеток (Cell Signaling), с добавлением 1% смеси ингибиторов фосфатаз 3 (Sigma-Aldrich), с удалением клеточного дебриса при помощи центрифугирования при 12000 g при 4°C в течение 10 минут. Для измерения содержания фосфорилированного STAT3 в соответствии с инструкцией использовали десять микрограммов (10 мкг) прозрачного клеточного лизата. Колориметрическое поглощение измеряли при помощи микропланшетного ридера для ИФА VersaMax ELISA (Molecular Devices).
4. Индуцированная IL-31 экспрессия IL-20
HaCaT представляет собой линию спонтанно трансформированных анеуплоидных бессмертных кератиноцитов из кожи взрослого человека. Для облегчения изучения индуцированной IL-31 экспрессии IL-20 был получен стабильный клон HaCaT, который сверхэкспрессировал человеческий IL-31Rα. Зависимая от IL-31 экспрессия IL-20 может модулироваться антителами к IL-31, образованными в ответ на пептидные иммуногенные конструкции IL-31 согласно данному описанию. Анализ проводили путем инкубации 4×105 клеток, человеческого рекомбинантного IL-31 в конечной концентрации 10 нг/мл и очищенных поликлональных антител IgG морских свинок в различных концентрациях в общем объеме 1000 мкл культуральной среды на лунку при 37°С, 5% CO2 в течение 1 часа. Моноклональное антитело к IL-31, MT313 (Mabtech AB), также включали в качестве контроля в исследовании. РНК экстрагировали с помощью набора PureLink RNA Mini Kit (Thermo Fisher Scientific Inc.) в соответствии с инструкцией производителя, а остаточную геномную ДНК удаляли с помощью смеси ферментов SuperScript™ III/RNaseOUT Enzyme Mix (Thermo Fisher Scientific Inc.). С помощью набора SuperScript III First-Strand Synthesis SuperMix kit (Thermo Fisher Scientific Inc.) в общей сложности 1 мкг РНК обратно транскрибировали в кДНК, и полученную кДНК анализировали с помощью количественной ПЦР в реальном времени с использованием Applied Biosystems 7500 Real-Time PCR Systems (Thermo Fisher Scientific Inc.). Реакции ПЦР в реальном времени проводили с использованием набора Power SYBRGreen PCR Master Mix (Thermo Fisher Scientific Inc.). Пару праймеров QuantiTect для IL-20 (Hs_IL20_1_SG) приобретали у Qiagen, а пару праймеров для HPRT (прямой: 5'-TGACACTGGCAAAACAATGCA-3' (SEQ ID NO: 106); обратный: 5'-GGTCCTTTTCACCAGCAAGCT-3' SE (ID NO: 107)) синтезировали. Все измерения выполняли в двух повторностях. Относительную количественную оценку рассчитывали с использованием метода расчета значений порогового цикла и нормировали к HPRT. Относительный уровень экспрессии IL-20 в каждой группе, получавшей антитело, был нормирован по сравнению с уровнем в группе, не получавшей лечение.
d. Результаты
Разработка, скрининг, идентификация, оценка функциональных свойств и оптимизация многокомпонентных составов вакцин, содержащих типовые иммуногенные конструкции человеческого IL-31.
1. Селекция пептидных последовательностей В-клеточных эпитопных пептидов человеческого IL-31
Спираль C IL-31 была выбрана для конструирования B-клеточного эпитопного пептида, поскольку было обнаружено, что два ключевых остатка, E83 и H87, в этой области взаимодействуют с IL-31Rα. Пептидные конструкции на основе спирали С, связанные с Т-хелперным пептидом UBITh1 (SEQ ID NO: 27) и коротким линкером εK, были составлены с ISA 51 и CpG для праймирующей иммунизации морских свинок при 400 мкг/1 мл и бустов (3, 6 и 9 нпи) при 100 мкг/0,25 мл. Для проверки иммуногенности у морских свинок применяли анализ методом ИФА с иммунными сыворотками морских свинок, разведенными в 4-кратном серийном разведении от 1: 100 до 1: 4,19 × 108. Планшеты для ИФА покрывали рекомбинантным человеческим белком IL-31 из расчета 50 нг на лунку. Титр тестируемой сыворотки, выраженный как LogEC50, рассчитывали с помощью четырехпараметрического нелинейного регрессионного анализа А450 нм. Результаты ИФА показали, что четыре пептидные иммуногенные конструкции не только индуцировали высокую иммуногенность и титры в отношении соответствующего В-эпитопного пептида IL-31 (таблица 10 (SEQ ID NO: 87); таблица 11 (SEQ ID NO: 100 и 101; и таблица 13, группа 3 (SEQ ID NO: 99), но также индуцировали перекрестную реактивность от умеренной до высокой в отношении человеческого белка IL-31 (Фиг. 20А и 20В).
2. Оценка иммуногенности пептидных иммуногенных конструкций человеческого IL-31 в отношении их антител для ингибирования взаимодействия IL-31 и IL-31Rα
Было проведено исследование, чтобы определить, могут ли антитела из пептидных иммуногенных конструкций IL-31, образуемые у морских свинок, нейтрализовать IL-31, чтобы блокировать взаимодействие между IL-31 и IL-31Rα. В частности, очищенные IgG морских свинок из иммунной сыворотки морских свинок, иммунизированных 4 соответствующими потенциальными пептидными иммуногенными конструкциями IL-31 (SEQ ID NO: 87, 99, 100 и 101), использовали в анализе методом ИФА, из которых рекомбинантный человеческий белок IL-31Rα был иммобилизован на твердой фазе, покрытой антителом к His. Как показано на Фиг. 21, типовые антитела, очищенные от иммунной сыворотки морских свинок, иммунизированных соответствующими пептидными иммуногенными конструкциями IL-31, конкурентно ингибировали взаимодействие IL-31 и IL-31Rα дозозависимым образом (от 10E-3 до 10E2 мкг/мл).
3. Подавление индуцированного IL-31 фосфорилирования STAT3 антителами к IL-31
Сигнальный путь IL-31 участвует первоначально в образовании комплекса IL-31Rα/OSMRβ на клеточной мембране с последующим фосфорилированием нижележащего белка STAT3 в цитоплазме. Линию клеток U87MG использовали для оценки способности этих очищенных антител к IL-31, полученных из иммунных сывороток морских свинок, иммунизированных пептидными иммуногенными конструкциями IL-31, подавлять индуцированное IL-31 фосфорилирование STAT3.
Сначала культивируемые клетки обрабатывали IL-31 (10 нг/мл) и очищенными IgG в разных концентрациях одновременно. Моноклональное антитело к IL-31, MT313, включали в качестве положительного контроля. Как видно на Фиг. 22, IgG к IL-31, образованные в ответ на типовые иммуногены (SEQ ID NO: 87 и 101), могут, наряду с MT313, снижать фосфорилирование STAT3 дозозависимым образом.
4. Подавление индуцированной IL-31 экспрессии IL-20
IL-20 структурно связан с IL-10 и аутокринным фактором для кератиноцитов, который регулирует их участие в воспалении. IL-31 может индуцировать экспрессию IL-20 в линии кератиноцитов HaCaT. Чтобы исследовать, могут ли антитела к IL-31, образованные у морских свинок в ответ на пептидные иммуногенные конструкции IL-31, подавлять зависимую от IL-31 экспрессию IL-20 в трансфектантах HaCaT, сверхэкспрессирующих IL-31Rα, все группы клеточных культур обрабатывали IL-31 в концентрации 10 нг/мл в течение 30 мин для индукции транскрипции гена IL-20. Типовые препараты очищенных IgG из иммунной сыворотки морских свинок, образованные в ответ на потенциальные пептидные иммуногенные конструкции IL-31 (SEQ ID NO: 87 и 101), добавляли в тестируемые группы в различных концентрациях, а в качестве положительного контроля также включали MT313. В качестве отрицательного контроля устанавливали культуру клеток в присутствии только IL-31 без добавления антител. Как показано на Фиг. 23, зависимое от концентрации антитела подавление экспрессии IL-20 наблюдали в группах с обработкой очищенными антителами IgG, образованными в ответ на типовые пептидные конструкты-кандидаты с SEQ ID NO: 87 и 101.
Вышеупомянутые функциональные исследования ex-vivo предполагают, что пептидный иммуноген IL-31, состоящий из спирали C, затрудненной спиралью B посредством взаимодействия спираль-спираль и введением искусственной дисульфидной связи, продемонстрировал блокирование взаимодействия IL-31-IL-31Rα и подавление индуцированного IL-31 сигнального каскада.
5. Оценка функциональной иммуногенности типовой пептидной конструкции человеческого IL-31 (SEQ ID NO: 101) в различных многокомпонентных составах
Всего для иммунизации использовали 27 морских свинок (300-350 г по весу). 27 морских свинок разделяли на 9 групп по 3 животных в каждой группе и проводили первичную иммунизацию 400 мкг пептида с последующими 2 бустерными инъекциями через 3 и через 6 недель после первичной иммунизации (нпи), как показано в таблице 15. Образцы крови собирали на 0, 3, 6, 9, 12 и 15 нпи для титров антител к IL-31 с помощью соответствующих им В-эпитопных пептидов IL-31 (SEQ ID NO: 95). Эти девять групп, как показано в таблице 15, представляли собой плацебо (с PBS), CPG1, CpG3, ISA51VG, ADJUPHOS, ISA51VG+CpG1, ADJUPHOS+CpG1, ISA51VG+CPG3 и ADJUPHOS+CpG 3. Титрование сывороточных антител к IL-31 проводили методом ИФА с использованием В-эпитопного пептида IL-31 (SEQ ID NO: 95), как описано выше, где титры выражали в Log10, как показано в таблице 15 (для 0, 3, 6, 9, 12 и 15 нпи). Данные иммуногенности показаны на верхней панели Фиг. 24 для 0, 3, 6 и 9 нпи. Подробные средние титры для каждой из групп составов были показаны в Log10 на нижней панели Фиг. 24.
Результаты этого исследования иммуногенности указывают на высокую эффективность составов, в которых используются ISA51 и CpG в виде водно-масляной эмульсии, демонстрирующих более высокие результаты, чем те, в которых используется ADJUPHOS в качестве адъюванта. Следовательно, иммуногенность сконструированных пептидных иммуногенных конструкций IL-31 может быть дополнительно повышена путем применения оптимальных составов.
Очищенные поликлональные антитела из этих иммунных сывороток морских свинок против пептидной иммуногенной конструкции IL-31 на 9 нпи (SEQ ID NO: 101) в различных составах дополнительно тестировали в анализе связывающего взаимодействия IL-31 и IL-31Rα, как показано на Фиг. 25. Как показано на Фиг. 25 для каждого из составов были рассчитаны подробные значения IC50 (мкг/мл). И в этом случае наиболее эффективными ингибиторами этих антител являются те, которые составлены в ISA51/CpG 1 или ISA51/CpG со значениями IC50, равными 0,2036 и 0,1965 мкг/мл, соответственно.
Кроме того, очищенные поликлональные антитела из этих иммунных сывороток морских свинок против пептидной иммуногенной конструкции IL-31 на 9 нпи (SEQ ID NO: 101) в различных составах тестировали в режиме ex-vivo на способность этих антител к IL-31 подавлять индуцированную IL-31 экспрессию IL-20 и индуцированное IL-31 фосфорилирование STAT3.
Как показано на Фиг. 25 и 26, зависимое от концентрации антитела подавление наблюдали в группах с обработкой очищенными антителами, образованными в ответ на пептидную иммуногенную конструкцию (SEQ ID NO: 101) в типовых составах (группы 1-9). И в этом случае составы в ISA51+CPG1 или CpG3 в виде водно-масляных эмульсий вызывали наибольшее подавление экспрессии IL-20, как показано на Фиг. 25 (от 0,3 или 0,4 раза от контроля при 1 мкг/мл до нуля при тестировании при 10 и 100 мкг/мл) и аналогично для фосфорилирования STAT3 (Фиг. 26).
ПРИМЕР 12
ДОПОЛНИТЕЛЬНАЯ ОЦЕНКА ПЕРЕКРЕСТНЫХ РЕАКТИВНОСТЕЙ ИММУНОГЕННОСТИ СРЕДИ РАЗЛИЧНЫХ ВИДОВ ДЛЯ ПЕПТИДНЫХ ИММУНОГЕННЫХ КОНСТРУКЦИЙ СОБАЧЬЕГО, МЫШИНОГО ИЛИ ЧЕЛОВЕЧЕСКОГО IL-31
а. Тест методом ИФА на основе IL-31 для анализа специфичности антител
Отдельный В-эпитопный пептид собачьего, мышиного и человеческого IL-31 (SEQ ID NO: 12, 93, 96, 97 или 98) иммобилизовали на микропланшетах для титрования при 200 нг/лунку для соответствующего В-эпитопного пептида IL-31 в буфере для иммобилизации (1,5 г/л Na2CO3, 2,9 г/л NaHCO3, pH 9,6) и инкубировали при 4°C в течение ночи. Планшеты промывали 3 раза 200 мкл/лунку промывочного буфера (PBS с 0,05% TWEEN-20). Покрытые лунки блокировали 200 мкл/лунку аналитического разбавителя (0,5% BSA, 0,05% TWEEN-20, 0,01% ProClin 300 в PBS) при комнатной температуре в течение 1 часа. Планшеты промывали 3 раза по 200 мкл/лунку промывочного буфера. 100 мкл антисыворотки (серийно 10-кратно разведенной) в разбавителях антител добавляли в покрытые лунки. Инкубацию проводили при комнатной температуре в течение 1 часа. Содержимое все лунок аспирировали, а лунки промывали 5 раз 200 мкл/лунку промывочного буфера. Планшеты инкубировали с разведением 1: 10000 конъюгированных с ПХ козьих антител к IgG морской свинки (H+L) (Jackson ImmunoResearch Laboratories) в течение 1 часа (100 мкл/лунку). Затем все лунки промывали 5 раз 200 мкл/лунку промывочного буфера. Наконец, лунки обрабатывали 100 мкл/лунку субстрата NeA-Blue TMB (Clinical Science Products), и реакцию останавливали добавлением 100 мкл/лунку 1 М H2SO4. Поглощение измеряли при ОП450 на микропланшетном ридере для ИФА (Molecular Devices). Был определен специфический титр антисыворотки, выраженный в виде Log10 титров.
b. Результаты
Результаты исследования по оценке иммуногенности приведены в таблицах 13 и 14.
Значительная перекрестная реактивность с B-эпитопными пептидами IL-31 (SEQ ID NO: 12 и 93) была обнаружена среди иммунных сывороток морских свинок против соответствующих пептидных аналогов как от собачьих видов (SEQ ID NO: 83 и 85), так и от человека (SEQ ID № 99), как показано в таблице 13. Однако ограниченная перекрестная реактивность для их связывания с соответствующими В-эпитопными пептидами IL-31 (SEQ ID NO: 96 для собак к 97 и 98 для мышей) была обнаружена для иммунной сыворотки морских свинок, направленной против пептидных иммуногенных конструкций мышиного IL-31 (SEQ ID NO: 104 и 105) с соответствующими аналогами пептидной иммуногенной конструкции от видов семейства собачьих (102 и 103). Не было обнаружено перекрестной реактивности иммунных сывороток морских свинок, направленных против пептидных иммуногенных конструкций собачьего IL-31 (SEQ ID NO: 102 и 103), с их соответствующими аналогами В-эпитопных пептидов мышиного IL-31 (SEQ ID NO: 97 и 98), как показано в таблице 14. Следовательно, собачья модель может быть использована в доказательстве концепции для применения человеком.
ПРИМЕР 13
ОЦЕНКА ИММУНОГЕННОСТИ У МОРСКИХ СВИНЕЙ РЕКОМБИНАНТНОГО СОБАЧЬЕГО БЕЛКА IL-31 И ЛИПОПРОТЕИНА, СОДЕРЖАЩЕГО UBITH1, В РАЗЛИЧНЫХ СОСТАВАХ С ИЛИ БЕЗ АДЪЮВАНТА
Как рекомбинантный полноразмерный собачий белок IL-31 (ПР собачий IL-31), так и рекомбинантный полноразмерный собачий белок IL-31 (липопротеин ПР собачьего IL-31), содержащий последовательность UBITh®1, расположенную в N-концевой области белка IL-31 для усиления иммуногенности, были получены в двух типах составов, один без адъюванта и один с ADJUPHOS для сравнения их относительной иммуногенности, причем составы без адъюванта были протестированы в двух, высоких и низких, дозировках 50 мкг/0,5 мл/доза/внутримышечно и 25 мкг/0,5 мл/доза/внутримышечно, тогда как состав с ADJUPHOS в качестве составов с адъювантом тестировали только в высокой дозировке 50 мкг/0,5 мл/доза/внутримышечно с протоколом, приведенным в таблице 12.
а. Тест методом ИФА на основе IL-31 для анализа специфичности антител
Рекомбинантный полноразмерный (ПР) собачий белок IL-31 иммобилизовали на микропланшетах для титрования при 50 нг/лунка в буфере для иммобилизации (1,5 г/л Na2CO3, 2,9 г/л NaHCO3, pH 9,6) и инкубировали при 4°C в течение ночи. Планшеты промывали 3 раза 200 мкл/лунку промывочного буфера (PBS с 0,05% TWEEN-20). Покрытые лунки блокировали 200 мкл/лунку аналитического разбавителя (0,5% BSA, 0,05% TWEEN-20, 0,01% ProClin 300 в PBS) при комнатной температуре в течение 1 часа. Планшеты промывали 3 раза по 200 мкл/лунку промывочного буфера. 100 мкл антисыворотки (серийно 10-кратно разведенной) в разбавителях антител добавляли в покрытые лунки. Инкубацию проводили при комнатной температуре в течение 1 часа. Содержимое все лунок аспирировали, а лунки промывали 5 раз 200 мкл/лунку промывочного буфера. Планшеты инкубировали с разведением 1: 10000 конъюгированных с ПХ козьих антител к IgG морской свинки (H+L) (Jackson ImmunoResearch Laboratories) в течение 1 часа (100 мкл/лунку). Затем все лунки промывали 5 раз 200 мкл/лунку промывочного буфера. Наконец, лунки обрабатывали 100 мкл/лунку субстрата NeA-Blue TMB (Clinical Science Products), и реакцию останавливали добавлением 100 мкл/лунку 1 М H2SO4. Поглощение измеряли при ОП450 на микропланшетном ридере для ИФА (Molecular Devices). Был определен специфический титр антисыворотки, выраженный в виде Log10 титров.
b. Результаты
Результаты исследования по оценке иммуногенности вышеуказанных двух рекомбинантных белков приведены в таблице 12.
Как липопротеин собачьего IL-31 (группы 1-3), так и обычный собачий белок IL-31 (группы 4-6) оказались иммуногенными даже в отсутствие адъюванта (группы 1, 2, 4 и 5), в тех случаях, когда такие белки были усилены в отношении их иммуногенности с помощью UBITh®1, связанного в N-концевой области. В целом, была обнаружено, что иммуногенность липопротеина IL-31 (группы 1-3) была выше, чем у обычного нелипопротеинового IL-31 (группы 4-6), при параллельном сравнении тех же составов, где было обнаружено, что эти группы липопротеинов обладают высокой иммуногенностью только при единственной иммунизации. Группы иммунизации обычными белками (группы с 4 по 6) наверстывали соответствующую им иммуногенность при дальнейшей бустер-иммунизации и достигали эквивалентной иммуногенности после двух бустерных инъекций, как показали иммунная сыворотка из крови, полученной посредством кровопусканий на 8 нпи.
Таблица 1
Аминокислотные последовательности IL-31 и их фрагменты, используемые в серологических анализах
положения
(Uniprot C7G0W1-1; GenBank: BAH97742.1)
(GenBank: AAS86448.1)
(p4751)
(p4752)
(p4753)
(p4754)
(p4755)
(p4854) / (p4855)
(p4856)
(p4857)
(p4858)
(p4859)
(p4847)
(p5114)
(p5094)
(p5095)
(p5202) / (p5216)
(p5217)
(p5218)
* Аминокислоты, замененные серином или цистеином, подчеркнуты
Таблица 2
Выбранные универсальные Т-хелперные эпитопы для использования в конструировании пептидных иммуногенных конструктов, полученных из IL-31
NO:
T RT TR T
RRRIKII RII I L IR
VRVV VV V I V
F FF FF F V F
F
T RT TR
FFLL L ITTI
Таблица 3
Аминокислотные последовательности пептидных иммуногенных конструктов IL-31
* Аминокислоты, замененные серином или цистеином, подчеркнуты; UBITh1=SEQ ID NO: 27; UBITh3=SEQ ID NO: 25
Таблица 4
Протокол оценки иммуногенности у морских свинок в отношении пептидных иммуногенных конструктов собачьего IL-31
иммуногена
UBITh3-εK-KKK-
собачий IL-31 97-144
Бусты: 100 мкг/0,25 мл/доза/внутримышечно
пептид: CpG
400 мкг/мл
UBITh3-εK-KKK-
собачий IL-31 97-133
Бусты: 100 мкг/0,25 мл/доза/внутримышечно
пептид: CpG
400 мкг/мл
UBITh3-εK-KKK-
собачий IL-31 97-122
Бусты: 100 мкг/0,25 мл/доза/внутримышечно
пептид: CpG
400 мкг/мл
UBITh3-εK-KKK-
собачий IL-31 97-114
Бусты: 100 мкг/0,25 мл/доза/внутримышечно
пептид: CpG
400 мкг/мл
UBITh3-εK-KKK-
собачий IL-31 90-110
Бусты: 100 мкг/0,25 мл/доза/внутримышечно
пептид: CpG
400 мкг/мл
Иммунизации проводят на 0, 3, 6, 9 и 12 неделях
Сыворотку собирают на 0, 3, 6, 9, 12 и 15 неделях
Таблица 5
Оценка иммуногенности у морских свинок иммуногенных в отношении пептидных иммуногенных конструктов собачьего IL-31
(SEQ ID NO: 3) Log10 титра ИФА
UBITh3-εK-KKK-
собачий IL-31 97-144
UBITh3-εK-KKK-
собачий IL-31 97-133
UBITh3-εK-KKK-
собачий IL-31 97-122
UBITh3-εK-KKK-
собачий IL-31 97-114
UBITh3-εK-KKK-
собачий IL-31 90-110
Таблица 6
Титр антител (Log10 EC50) к рекомбинантному собачьему белку IL-31
Таблица 7
Протокол оценки иммуногенности у морских свинок в отношении пептидных иммуногенных конструктов собачьего IL-31
иммуногена
UBITh3-εK-KKK-
Собачий IL-31 90-144
Бусты: 100 мкг/0,25 мл/доза/внутримышечно
пептид: CpG
400 мкг/мл
UBITh3-εK-
Собачий IL-31 90-144
Бусты: 100 мкг/0,25 мл/доза/внутримышечно
пептид: CpG
400 мкг/мл
UBITh3-εK-KKK-
Собачий IL-31 86-144
Бусты: 100 мкг/0,25 мл/доза/внутримышечно
пептид: CpG
400 мкг/мл
UBITh3-εK-
Собачий IL-31 97-149
Бусты: 100 мкг/0,25 мл/доза/внутримышечно
пептид: CpG
400 мкг/мл
UBITh3-εK-
Собачий IL-31 90-149
Бусты: 100 мкг/0,25 мл/доза/внутримышечно
пептид: CpG
400 мкг/мл
UBITh3-εK-
Собачий IL-31 86-149
Бусты: 100 мкг/0,25 мл/доза/внутримышечно
пептид: CpG
400 мкг/мл
Иммунизации проводят на 0, 3, 6, 9 и 12 неделях
Сыворотку собирают на 0, 3, 6, 9, 12 и 15 неделях
Таблица 8
Оценка иммуногенности у морских свинок иммуногенных в отношении пептидных иммуногенных конструктов собачьего IL-31
(SEQ ID NO: 9) Log10 титра ИФА
UBITh3-εK-KKK-
собачий IL-31 97-144
UBITh3-εK-KKK-
собачий IL-31 97-133
UBITh3-εK-KKK-
собачий IL-31 97-122
UBITh3-εK-KKK-
собачий IL-31 97-114
UBITh3-εK-KKK-
собачий IL-31 90-110
UBITh3-εK-KKK-
собачий IL-31 90-110
Таблица 9
Оценка иммуногенности у морских свинок иммуногенных в отношении пептидных иммуногенных конструктов собачьего IL-31
на их перекрестную реактивность с рекомбинантным собачьим белком IL-31
Таблица 10
Оценка иммуногенности у морских свинок иммуногенных в отношении пептидных иммуногенных конструктов человеческого IL-31
(SEQ ID NO: 13) Log10 титра ИФА
UBITh1-εK-KKK-человеческий IL-31 98-145
Таблица 11
Оценка иммуногенности у морских свинок иммуногенных в отношении пептидных иммуногенных конструктов человеческого IL-31
(SEQ ID NO: 94) Log10 титра ИФА
(SEQ ID NO: 95) Log10 титра ИФА
UBITh1-εK-KKK-человеческий IL-31 105-113
UBITh1-εK-KKK-человеческий IL-31 85-115
Таблица 12
Оценка иммуногенности у морских свинок в отношении полноразмерного рекомбинантного
человеческого белка IL-31 и его липопротеинового аналога
50 мкг/0,5 мл/доза/внутримышечно
25 мкг/0,5 мл/доза/внутримышечно
25 мкг/0,5 мл/доза/внутримышечно
+ Adju-Phos
50 мкг/0,5 мл/доза/внутримышечно
25 мкг/0,5 мл/доза/внутримышечно
25 мкг/0,5 мл/доза/внутримышечно
+ Adju-Phos
Иммунизации проводят на 0, 3 и 6 неделях
Сыворотку собирают на 0, 3, 6, 8, 10, 12 и 14 неделях
Таблица 13
Оценка иммуногенности у морских свинок иммуногенных в отношении пептидных иммуногенных конструктов собачьего и человеческого IL-31 и их соответствующих перекрестных реактивностей
(SEQ ID NO: 12) Log10 титра ИФА
CpG3
Tween 80
CpG3
Tween 80
Таблица 14
Оценка иммуногенности у морских свинок иммуногенных в отношении пептидных иммуногенных конструктов собачьего и мышиного IL-31 и их соответствующих перекрестных реактивностей
№
NO:
(SEQ ID NO: 96) Log10 титра ИФА
UBITh1-εK-KKK-собачий IL-31 84-114
UBITh3-εK-KKK-собачий IL-31 84-114
UBITh3-εK-KKK-мышиный IL-31 86-117
UBITh3-εK-KKK-мышиный IL-31 87-116
Таблица 15
Оценка иммуногенности типового пептидного иммуногенного конструкта человеческого IL-31 (SEQ ID NO: 101) у морских свинок в многокомпонентных составах
(SEQ ID NO: 95) Log10 титра ИФА
UBITh1-εK-KKK-
человеческий IL-31 85-115
SEO ID NO: 101
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> UBI IP Holdings
UBI US Holdings, LLC
Wang, Chang Yi
<120> ПЕПТИДНЫЕ ИММУНОГЕНЫ ИЛ-31 И ИХ СОСТАВЫ ДЛЯ
ЛЕЧЕНИЯ И/ИЛИ ПРОФИЛАКТИКИ АТОПИЧЕСКОГО ДЕРМАТИТА
<130> 2037-WO
<140> TBD
<141> 11.12.2018
<150> US 62/597 130
<151> 11.12.2017
<160> 110
<170> PatentIn версия 3.5
<210> 1
<211> 159
<212> Белок
<213> Canis lupus
<220>
<221> ПЕПТИД
<222> (1)..(159)
<223> 1-159 собачьего ИЛ-31 (Uniprot C7G0W1-1; GenBank: BAH97742.1)
<400> 1
Met Leu Ser His Thr Gly Pro Ser Arg Phe Ala Leu Phe Leu Leu Cys
1 5 10 15
Ser Met Glu Thr Leu Leu Ser Ser His Met Ala Pro Thr His Gln Leu
20 25 30
Pro Pro Ser Asp Val Arg Lys Ile Ile Leu Glu Leu Gln Pro Leu Ser
35 40 45
Arg Gly Leu Leu Glu Asp Tyr Gln Lys Lys Glu Thr Gly Val Pro Glu
50 55 60
Ser Asn Arg Thr Leu Leu Leu Cys Leu Thr Ser Asp Ser Gln Pro Pro
65 70 75 80
Arg Leu Asn Ser Ser Ala Ile Leu Pro Tyr Phe Arg Ala Ile Arg Pro
85 90 95
Leu Ser Asp Lys Asn Ile Ile Asp Lys Ile Ile Glu Gln Leu Asp Lys
100 105 110
Leu Lys Phe Gln His Glu Pro Glu Thr Glu Ile Ser Val Pro Ala Asp
115 120 125
Thr Phe Glu Cys Lys Ser Phe Ile Leu Thr Ile Leu Gln Gln Phe Ser
130 135 140
Ala Cys Leu Glu Ser Val Phe Lys Ser Leu Asn Ser Gly Pro Gln
145 150 155
<210> 2
<211> 164
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(164)
<223> 1-164 человеческого ИЛ-31 (GenBank: AAS86448.1)
<400> 2
Met Ala Ser His Ser Gly Pro Ser Thr Ser Val Leu Phe Leu Phe Cys
1 5 10 15
Cys Leu Gly Gly Trp Leu Ala Ser His Thr Leu Pro Val Arg Leu Leu
20 25 30
Arg Pro Ser Asp Asp Val Gln Lys Ile Val Glu Glu Leu Gln Ser Leu
35 40 45
Ser Lys Met Leu Leu Lys Asp Val Glu Glu Glu Lys Gly Val Leu Val
50 55 60
Ser Gln Asn Tyr Thr Leu Pro Cys Leu Ser Pro Asp Ala Gln Pro Pro
65 70 75 80
Asn Asn Ile His Ser Pro Ala Ile Arg Ala Tyr Leu Lys Thr Ile Arg
85 90 95
Gln Leu Asp Asn Lys Ser Val Ile Asp Glu Ile Ile Glu His Leu Asp
100 105 110
Lys Leu Ile Phe Gln Asp Ala Pro Glu Thr Asn Ile Ser Val Pro Thr
115 120 125
Asp Thr His Glu Cys Lys Arg Phe Ile Leu Thr Ile Ser Gln Gln Phe
130 135 140
Ser Glu Cys Met Asp Leu Ala Leu Lys Ser Leu Thr Ser Gly Ala Gln
145 150 155 160
Gln Ala Thr Thr
<210> 3
<211> 48
<212> Белок
<213> Canis lupus
<220>
<221> ПЕПТИД
<222> (1)..(48)
<223> 97-144 собачьего ИЛ-31
<400> 3
Leu Ser Asp Lys Asn Ile Ile Asp Lys Ile Ile Glu Gln Leu Asp Lys
1 5 10 15
Leu Lys Phe Gln His Glu Pro Glu Thr Glu Ile Ser Val Pro Ala Asp
20 25 30
Thr Phe Glu Cys Lys Ser Phe Ile Leu Thr Ile Leu Gln Gln Phe Ser
35 40 45
<210> 4
<211> 37
<212> Белок
<213> Canis lupus
<220>
<221> ПЕПТИД
<222> (1)..(37)
<223> 97-133 собачьего ИЛ-31
<400> 4
Leu Ser Asp Lys Asn Ile Ile Asp Lys Ile Ile Glu Gln Leu Asp Lys
1 5 10 15
Leu Lys Phe Gln His Glu Pro Glu Thr Glu Ile Ser Val Pro Ala Asp
20 25 30
Thr Phe Glu Cys Lys
35
<210> 5
<211> 26
<212> Белок
<213> Canis lupus
<220>
<221> ПЕПТИД
<222> (1)..(26)
<223> 97-122 собачьего ИЛ-31
<400> 5
Leu Ser Asp Lys Asn Ile Ile Asp Lys Ile Ile Glu Gln Leu Asp Lys
1 5 10 15
Leu Lys Phe Gln His Glu Pro Glu Thr Glu
20 25
<210> 6
<211> 18
<212> Белок
<213> Canis lupus
<220>
<221> ПЕПТИД
<222> (1)..(18)
<223> 97-114 собачьего ИЛ-31
<400> 6
Leu Ser Asp Lys Asn Ile Ile Asp Lys Ile Ile Glu Gln Leu Asp Lys
1 5 10 15
Leu Lys
<210> 7
<211> 21
<212> Белок
<213> Canis lupus
<220>
<221> ПЕПТИД
<222> (1)..(21)
<223> 90-110 собачьего ИЛ-31
<400> 7
Tyr Phe Arg Ala Ile Arg Pro Leu Ser Asp Lys Asn Ile Ile Asp Lys
1 5 10 15
Ile Ile Glu Gln Leu
20
<210> 8
<211> 55
<212> Белок
<213> Canis lupus
<220>
<221> ПЕПТИД
<222> (1)..(55)
<223> 90-144 собачьего ИЛ-31
<400> 8
Tyr Phe Arg Ala Ile Arg Pro Leu Ser Asp Lys Asn Ile Ile Asp Lys
1 5 10 15
Ile Ile Glu Gln Leu Asp Lys Leu Lys Phe Gln His Glu Pro Glu Thr
20 25 30
Glu Ile Ser Val Pro Ala Asp Thr Phe Glu Cys Lys Ser Phe Ile Leu
35 40 45
Thr Ile Leu Gln Gln Phe Ser
50 55
<210> 9
<211> 59
<212> Белок
<213> Canis lupus
<220>
<221> ПЕПТИД
<222> (1)..(59)
<223> 86-144 собачьего ИЛ-31
<400> 9
Ala Ile Leu Pro Tyr Phe Arg Ala Ile Arg Pro Leu Ser Asp Lys Asn
1 5 10 15
Ile Ile Asp Lys Ile Ile Glu Gln Leu Asp Lys Leu Lys Phe Gln His
20 25 30
Glu Pro Glu Thr Glu Ile Ser Val Pro Ala Asp Thr Phe Glu Cys Lys
35 40 45
Ser Phe Ile Leu Thr Ile Leu Gln Gln Phe Ser
50 55
<210> 10
<211> 53
<212> Белок
<213> Canis lupus
<220>
<221> ПЕПТИД
<222> (1)..(53)
<223> 97–149 собачьего ИЛ-31, C146-S146
<400> 10
Leu Ser Asp Lys Asn Ile Ile Asp Lys Ile Ile Glu Gln Leu Asp Lys
1 5 10 15
Leu Lys Phe Gln His Glu Pro Glu Thr Glu Ile Ser Val Pro Ala Asp
20 25 30
Thr Phe Glu Cys Lys Ser Phe Ile Leu Thr Ile Leu Gln Gln Phe Ser
35 40 45
Ala Ser Leu Glu Ser
50
<210> 11
<211> 60
<212> Белок
<213> Canis lupus
<220>
<221> ПЕПТИД
<222> (1)..(60)
<223> 90–149 собачьего ИЛ-31, C146-S146
<400> 11
Tyr Phe Arg Ala Ile Arg Pro Leu Ser Asp Lys Asn Ile Ile Asp Lys
1 5 10 15
Ile Ile Glu Gln Leu Asp Lys Leu Lys Phe Gln His Glu Pro Glu Thr
20 25 30
Glu Ile Ser Val Pro Ala Asp Thr Phe Glu Cys Lys Ser Phe Ile Leu
35 40 45
Thr Ile Leu Gln Gln Phe Ser Ala Ser Leu Glu Ser
50 55 60
<210> 12
<211> 64
<212> Белок
<213> Canis lupus
<220>
<221> ПЕПТИД
<222> (1)..(64)
<223> 86–149 собачьего ИЛ-31, C146-S146
<400> 12
Ala Ile Leu Pro Tyr Phe Arg Ala Ile Arg Pro Leu Ser Asp Lys Asn
1 5 10 15
Ile Ile Asp Lys Ile Ile Glu Gln Leu Asp Lys Leu Lys Phe Gln His
20 25 30
Glu Pro Glu Thr Glu Ile Ser Val Pro Ala Asp Thr Phe Glu Cys Lys
35 40 45
Ser Phe Ile Leu Thr Ile Leu Gln Gln Phe Ser Ala Ser Leu Glu Ser
50 55 60
<210> 13
<211> 48
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(48)
<223> 98-145 человеческого ИЛ-31
<400> 13
Leu Asp Asn Lys Ser Val Ile Asp Glu Ile Ile Glu His Leu Asp Lys
1 5 10 15
Leu Ile Phe Gln Asp Ala Pro Glu Thr Asn Ile Ser Val Pro Thr Asp
20 25 30
Thr His Glu Cys Lys Arg Phe Ile Leu Thr Ile Ser Gln Gln Phe Ser
35 40 45
<210> 14
<211> 17
<212> Белок
<213> Clostridium tetani
<220>
<221> ПЕПТИД
<222> (1)..(17)
<223> Clostridium tetani 1 Th
<400> 14
Lys Lys Gln Tyr Ile Lys Ala Asn Ser Lys Phe Ile Gly Ile Thr Glu
1 5 10 15
Leu
<210> 15
<211> 15
<212> Белок
<213> вирус кори
<220>
<221> ПЕПТИД
<222> (1)..(15)
<223> MvF1 Th
<400> 15
Leu Ser Glu Ile Lys Gly Val Ile Val His Arg Leu Glu Gly Val
1 5 10 15
<210> 16
<211> 24
<212> Белок
<213> Bordetella pertussis
<220>
<221> ПЕПТИД
<222> (1)..(24)
<223> Bordetella pertussis Th
<400> 16
Gly Ala Tyr Ala Arg Cys Pro Asn Gly Thr Arg Ala Leu Thr Val Ala
1 5 10 15
Glu Leu Arg Gly Asn Ala Glu Leu
20
<210> 17
<211> 17
<212> Белок
<213> Clostridium tetani
<220>
<221> ПЕПТИД
<222> (1)..(17)
<223> Clostridium tetani 2 Th
<400> 17
Trp Val Arg Asp Ile Ile Asp Asp Phe Thr Asn Glu Ser Ser Gln Lys
1 5 10 15
Thr
<210> 18
<211> 23
<212> Белок
<213> diphtheria bacilli
<220>
<221> ПЕПТИД
<222> (1)..(23)
<223> Diphtheria Th
<400> 18
Asp Ser Glu Thr Ala Asp Asn Leu Glu Lys Thr Val Ala Ala Leu Ser
1 5 10 15
Ile Leu Pro Gly His Gly Cys
20
<210> 19
<211> 21
<212> Белок
<213> Plasmodium falciparum
<220>
<221> ПЕПТИД
<222> (1)..(21)
<223> Plasmodium falciparum Th
<400> 19
Asp His Glu Lys Lys His Ala Lys Met Glu Lys Ala Ser Ser Val Phe
1 5 10 15
Asn Val Val Asn Ser
20
<210> 20
<211> 17
<212> Белок
<213> Schistosoma mansoni
<220>
<221> ПЕПТИД
<222> (1)..(17)
<223> Schistosoma mansoni Th
<400> 20
Lys Trp Phe Lys Thr Asn Ala Pro Asn Gly Val Asp Glu Lys His Arg
1 5 10 15
His
<210> 21
<211> 25
<212> Белок
<213> холерный токсин
<220>
<221> ПЕПТИД
<222> (1)..(25)
<223> холерный токсин Th
<400> 21
Ala Leu Asn Ile Trp Asp Arg Phe Asp Val Phe Cys Thr Leu Gly Ala
1 5 10 15
Thr Thr Gly Tyr Leu Lys Gly Asn Ser
20 25
<210> 22
<211> 15
<212> Белок
<213> вирус кори
<220>
<221> ПЕПТИД
<222> (1)..(15)
<223> MvF 2 Th
<400> 22
Ile Ser Glu Ile Lys Gly Val Ile Val His Lys Ile Glu Gly Ile
1 5 10 15
<210> 23
<211> 22
<212> Белок
<213> вирус кори
<220>
<221> ПЕПТИД
<222> (1)..(22)
<223> KKKMvF 3 Th
<220>
<221> SITE
<222> (7)..(7)
<223> S или T
<220>
<221> SITE
<222> (10)..(10)
<223> K или R
<220>
<221> SITE
<222> (11)..(11)
<223> G или T
<220>
<221> SITE
<222> (15)..(15)
<223> H или T
<220>
<221> SITE
<222> (16)..(16)
<223> K или R
<220>
<221> SITE
<222> (19)..(19)
<223> G или T
<400> 23
Lys Lys Lys Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa
1 5 10 15
Ile Glu Xaa Ile Leu Phe
20
<210> 24
<211> 18
<212> Белок
<213> вирус гепатита B
<220>
<221> ПЕПТИД
<222> (1)..(18)
<223> HBsAg 1 Th
<220>
<221> SITE
<222> (1)..(1)
<223> K или R
<220>
<221> SITE
<222> (2)..(2)
<223> K или R
<220>
<221> SITE
<222> (3)..(3)
<223> K или R
<220>
<221> SITE
<222> (4)..(4)
<223> L или I или V или F
<220>
<221> SITE
<222> (5)..(5)
<223> F или K или R
<220>
<221> SITE
<222> (6)..(6)
<223> L или I или V или F
<220>
<221> SITE
<222> (7)..(7)
<223> L или I или V или F
<220>
<221> SITE
<222> (9)..(9)
<223> K или R
<220>
<221> SITE
<222> (10)..(10)
<223> L или I или V или F
<220>
<221> SITE
<222> (11)..(11)
<223> L или I или V или F
<220>
<221> SITE
<222> (13)..(13)
<223> L или I или V или F
<220>
<221> SITE
<222> (15)..(15)
<223> Q или L или I или V или F
<220>
<221> SITE
<222> (17)..(17)
<223> L или I или V или F
<220>
<221> SITE
<222> (18)..(18)
<223> D или R
<400> 24
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Thr Xaa Xaa Xaa Thr Xaa Pro Xaa Ser
1 5 10 15
Xaa Xaa
<210> 25
<211> 19
<212> Белок
<213> вирус кори
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 4 Th
<220>
<221> SITE
<222> (4)..(4)
<223> S или T
<220>
<221> SITE
<222> (7)..(7)
<223> K или R
<220>
<221> SITE
<222> (8)..(8)
<223> G или T
<220>
<221> SITE
<222> (12)..(12)
<223> H или T
<220>
<221> SITE
<222> (13)..(13)
<223> K или R
<400> 25
Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr
1 5 10 15
Ile Leu Phe
<210> 26
<211> 18
<212> Белок
<213> вирус гепатита B
<220>
<221> ПЕПТИД
<222> (1)..(18)
<223> HBsAg 2 Th
<220>
<221> SITE
<222> (4)..(4)
<223> I или F
<220>
<221> SITE
<222> (5)..(5)
<223> I или F
<220>
<221> SITE
<222> (6)..(6)
<223> T или L
<220>
<221> SITE
<222> (7)..(7)
<223> I или L
<220>
<221> SITE
<222> (11)..(11)
<223> I или L
<220>
<221> SITE
<222> (14)..(14)
<223> P или I
<220>
<221> SITE
<222> (15)..(15)
<223> Q или T
<220>
<221> SITE
<222> (16)..(16)
<223> S или T
<220>
<221> SITE
<222> (17)..(17)
<223> L или I
<400> 26
Lys Lys Lys Xaa Xaa Xaa Xaa Thr Arg Ile Xaa Thr Ile Xaa Xaa Xaa
1 5 10 15
Xaa Asp
<210> 27
<211> 19
<212> Белок
<213> вирус кори
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 5 Th
<400> 27
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe
<210> 28
<211> 18
<212> Белок
<213> вирус гепатита B
<220>
<221> ПЕПТИД
<222> (1)..(18)
<223> HBsAg 3 Th
<400> 28
Lys Lys Lys Ile Ile Thr Ile Thr Arg Ile Ile Thr Ile Ile Thr Thr
1 5 10 15
Ile Asp
<210> 29
<211> 11
<212> Белок
<213> вирус гриппа
<220>
<221> ПЕПТИД
<222> (1)..(11)
<223> матричный белок гриппа 1 _1 Th
<220>
<221> ПЕПТИД
<222> (1)..(11)
<223> матричный белок гриппа 1_1 Th
<400> 29
Phe Val Phe Thr Leu Thr Val Pro Ser Glu Arg
1 5 10
<210> 30
<211> 15
<212> Белок
<213> вирус гриппа
<220>
<221> ПЕПТИД
<222> (1)..(15)
<223> матричный белок гриппа 1_2 Th
<400> 30
Ser Gly Pro Leu Lys Ala Glu Ile Ala Gln Arg Leu Glu Asp Val
1 5 10 15
<210> 31
<211> 9
<212> Белок
<213> вирус гриппа
<220>
<221> ПЕПТИД
<222> (1)..(9)
<223> неструктурный белок гриппа 1 Th
<400> 31
Asp Arg Leu Arg Arg Asp Gln Lys Ser
1 5
<210> 32
<211> 19
<212> Белок
<213> вирус Эпштейна-Барр
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> EBV BHRF1 Th
<400> 32
Ala Gly Leu Thr Leu Ser Leu Leu Val Ile Cys Ser Tyr Leu Phe Ile
1 5 10 15
Ser Arg Gly
<210> 33
<211> 15
<212> Белок
<213> Clostridium tetani
<220>
<221> ПЕПТИД
<222> (1)..(15)
<223> Clostridium tetani TT1 Th
<400> 33
Gln Tyr Ile Lys Ala Asn Ser Lys Phe Ile Gly Ile Thr Glu Leu
1 5 10 15
<210> 34
<211> 20
<212> Белок
<213> вирус Эпштейна-Барр
<220>
<221> ПЕПТИД
<222> (1)..(20)
<223> EBV EBNA-1 Th
<400> 34
Pro Gly Pro Leu Arg Glu Ser Ile Val Cys Tyr Phe Met Val Phe Leu
1 5 10 15
Gln Thr His Ile
20
<210> 35
<211> 21
<212> Белок
<213> Clostridium tetani
<220>
<221> ПЕПТИД
<222> (1)..(21)
<223> Clostridium tetani TT2 Th
<400> 35
Phe Asn Asn Phe Thr Val Ser Phe Trp Leu Arg Val Pro Lys Val Ser
1 5 10 15
Ala Ser His Leu Glu
20
<210> 36
<211> 16
<212> Белок
<213> Clostridium tetani
<220>
<221> ПЕПТИД
<222> (1)..(16)
<223> Clostridium tetani TT3 Th
<400> 36
Lys Phe Ile Ile Lys Arg Tyr Thr Pro Asn Asn Glu Ile Asp Ser Phe
1 5 10 15
<210> 37
<211> 16
<212> Белок
<213> Clostridium tetani
<220>
<221> ПЕПТИД
<222> (1)..(16)
<223> Clostridium tetani TT4 Th
<400> 37
Val Ser Ile Asp Lys Phe Arg Ile Phe Cys Lys Ala Leu Asn Pro Lys
1 5 10 15
<210> 38
<211> 18
<212> Белок
<213> вирус Эпштейна-Барр
<220>
<221> ПЕПТИД
<222> (1)..(18)
<223> EBV CP Th
<400> 38
Val Pro Gly Leu Tyr Ser Pro Cys Arg Ala Phe Phe Asn Lys Glu Glu
1 5 10 15
Leu Leu
<210> 39
<211> 14
<212> Белок
<213> цитомегаловирус человека
<220>
<221> ПЕПТИД
<222> (1)..(14)
<223> HCMV IE1 Th
<400> 39
Asp Lys Arg Glu Met Trp Met Ala Cys Ile Lys Glu Leu His
1 5 10
<210> 40
<211> 15
<212> Белок
<213> вирус Эпштейна-Барр
<220>
<221> ПЕПТИД
<222> (1)..(15)
<223> EBV GP340 Th
<400> 40
Thr Gly His Gly Ala Arg Thr Ser Thr Glu Pro Thr Thr Asp Tyr
1 5 10 15
<210> 41
<211> 13
<212> Белок
<213> вирус Эпштейна-Барр
<220>
<221> ПЕПТИД
<222> (1)..(13)
<223> EBV BPLF1 Th
<400> 41
Lys Glu Leu Lys Arg Gln Tyr Glu Lys Lys Leu Arg Gln
1 5 10
<210> 42
<211> 11
<212> Белок
<213> вирус Эпштейна-Барр
<220>
<221> ПЕПТИД
<222> (1)..(11)
<223> EBV EBNA-2 Th
<400> 42
Thr Val Phe Tyr Asn Ile Pro Pro Met Pro Leu
1 5 10
<210> 43
<211> 71
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 4 Th (UBITH3)
<220>
<221> SITE
<222> (4)..(4)
<223> S или T
<220>
<221> SITE
<222> (7)..(7)
<223> K или R
<220>
<221> SITE
<222> (8)..(8)
<223> G или T
<220>
<221> SITE
<222> (12)..(12)
<223> H или T
<220>
<221> SITE
<222> (13)..(13)
<223> K или R
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(71)
<223> 97-144 собачьего ИЛ-31
<400> 43
Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Leu Ser Asp Lys Asn Ile Ile Asp Lys
20 25 30
Ile Ile Glu Gln Leu Asp Lys Leu Lys Phe Gln His Glu Pro Glu Thr
35 40 45
Glu Ile Ser Val Pro Ala Asp Thr Phe Glu Cys Lys Ser Phe Ile Leu
50 55 60
Thr Ile Leu Gln Gln Phe Ser
65 70
<210> 44
<211> 68
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 4 Th (UBITh3)
<220>
<221> SITE
<222> (4)..(4)
<223> S или T
<220>
<221> SITE
<222> (7)..(7)
<223> K или R
<220>
<221> SITE
<222> (8)..(8)
<223> G или T
<220>
<221> SITE
<222> (12)..(12)
<223> H или T
<220>
<221> SITE
<222> (13)..(13)
<223> K или R
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K как спейсер
<220>
<221> ПЕПТИД
<222> (21)..(68)
<223> 97-144 собачьего ИЛ-31
<400> 44
Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Leu Ser Asp Lys Asn Ile Ile Asp Lys Ile Ile Glu
20 25 30
Gln Leu Asp Lys Leu Lys Phe Gln His Glu Pro Glu Thr Glu Ile Ser
35 40 45
Val Pro Ala Asp Thr Phe Glu Cys Lys Ser Phe Ile Leu Thr Ile Leu
50 55 60
Gln Gln Phe Ser
65
<210> 45
<211> 71
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF5 Th (UBITh1)
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(71)
<223> 97-144 собачьего ИЛ-31
<400> 45
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Leu Ser Asp Lys Asn Ile Ile Asp Lys
20 25 30
Ile Ile Glu Gln Leu Asp Lys Leu Lys Phe Gln His Glu Pro Glu Thr
35 40 45
Glu Ile Ser Val Pro Ala Asp Thr Phe Glu Cys Lys Ser Phe Ile Leu
50 55 60
Thr Ile Leu Gln Gln Phe Ser
65 70
<210> 46
<211> 68
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 5 Th (UBITh1)
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K как спейсер
<220>
<221> ПЕПТИД
<222> (21)..(68)
<223> 97-144 собачьего ИЛ-31
<400> 46
Ile Ser Ile Ser Glu Ile Lys Gly Val Ile Val His Lys Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Leu Ser Asp Lys Asn Ile Ile Asp Lys Ile Ile Glu
20 25 30
Gln Leu Asp Lys Leu Lys Phe Gln His Glu Pro Glu Thr Glu Ile Ser
35 40 45
Val Pro Ala Asp Thr Phe Glu Cys Lys Ser Phe Ile Leu Thr Ile Leu
50 55 60
Gln Gln Phe Ser
65
<210> 47
<211> 60
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 4 Th (UBITH3)
<220>
<221> SITE
<222> (4)..(4)
<223> S или T
<220>
<221> SITE
<222> (7)..(7)
<223> K или R
<220>
<221> SITE
<222> (8)..(8)
<223> G или T
<220>
<221> SITE
<222> (12)..(12)
<223> H или T
<220>
<221> SITE
<222> (13)..(13)
<223> K или R
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(60)
<223> 97-133 собачьего ИЛ-31
<400> 47
Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Leu Ser Asp Lys Asn Ile Ile Asp Lys
20 25 30
Ile Ile Glu Gln Leu Asp Lys Leu Lys Phe Gln His Glu Pro Glu Thr
35 40 45
Glu Ile Ser Val Pro Ala Asp Thr Phe Glu Cys Lys
50 55 60
<210> 48
<211> 57
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 4 Th (UBITh3)
<220>
<221> SITE
<222> (4)..(4)
<223> S или T
<220>
<221> SITE
<222> (7)..(7)
<223> K или R
<220>
<221> SITE
<222> (8)..(8)
<223> G или T
<220>
<221> SITE
<222> (12)..(12)
<223> H или T
<220>
<221> SITE
<222> (13)..(13)
<223> K или R
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K как спейсер
<220>
<221> ПЕПТИД
<222> (21)..(57)
<223> 97-133 собачьего ИЛ-31
<400> 48
Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Leu Ser Asp Lys Asn Ile Ile Asp Lys Ile Ile Glu
20 25 30
Gln Leu Asp Lys Leu Lys Phe Gln His Glu Pro Glu Thr Glu Ile Ser
35 40 45
Val Pro Ala Asp Thr Phe Glu Cys Lys
50 55
<210> 49
<211> 60
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF5 Th (UBITh1)
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(60)
<223> 97-133 собачьего ИЛ-31
<400> 49
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Leu Ser Asp Lys Asn Ile Ile Asp Lys
20 25 30
Ile Ile Glu Gln Leu Asp Lys Leu Lys Phe Gln His Glu Pro Glu Thr
35 40 45
Glu Ile Ser Val Pro Ala Asp Thr Phe Glu Cys Lys
50 55 60
<210> 50
<211> 57
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 5 Th (UBITh1)
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K как спейсер
<220>
<221> ПЕПТИД
<222> (21)..(57)
<223> 97-133 собачьего ИЛ-31
<400> 50
Ile Ser Ile Ser Glu Ile Lys Gly Val Ile Val His Lys Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Leu Ser Asp Lys Asn Ile Ile Asp Lys Ile Ile Glu
20 25 30
Gln Leu Asp Lys Leu Lys Phe Gln His Glu Pro Glu Thr Glu Ile Ser
35 40 45
Val Pro Ala Asp Thr Phe Glu Cys Lys
50 55
<210> 51
<211> 49
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 4 Th (UBITH3)
<220>
<221> SITE
<222> (4)..(4)
<223> S или T
<220>
<221> SITE
<222> (7)..(7)
<223> K или R
<220>
<221> SITE
<222> (8)..(8)
<223> G или T
<220>
<221> SITE
<222> (12)..(12)
<223> H или T
<220>
<221> SITE
<222> (13)..(13)
<223> K или R
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(49)
<223> 97-122 собачьего ИЛ-31
<400> 51
Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Leu Ser Asp Lys Asn Ile Ile Asp Lys
20 25 30
Ile Ile Glu Gln Leu Asp Lys Leu Lys Phe Gln His Glu Pro Glu Thr
35 40 45
Glu
<210> 52
<211> 46
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 4 Th (UBITh3)
<220>
<221> SITE
<222> (4)..(4)
<223> S или T
<220>
<221> SITE
<222> (7)..(7)
<223> K или R
<220>
<221> SITE
<222> (8)..(8)
<223> G или T
<220>
<221> SITE
<222> (12)..(12)
<223> H или T
<220>
<221> SITE
<222> (13)..(13)
<223> K или R
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K как спейсер
<220>
<221> ПЕПТИД
<222> (21)..(46)
<223> 97-122 собачьего ИЛ-31
<400> 52
Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Leu Ser Asp Lys Asn Ile Ile Asp Lys Ile Ile Glu
20 25 30
Gln Leu Asp Lys Leu Lys Phe Gln His Glu Pro Glu Thr Glu
35 40 45
<210> 53
<211> 49
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF5 Th (UBITh1)
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(49)
<223> 97-122 собачьего ИЛ-31
<400> 53
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Leu Ser Asp Lys Asn Ile Ile Asp Lys
20 25 30
Ile Ile Glu Gln Leu Asp Lys Leu Lys Phe Gln His Glu Pro Glu Thr
35 40 45
Glu
<210> 54
<211> 46
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 5 Th (UBITh1)
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K как спейсер
<220>
<221> ПЕПТИД
<222> (21)..(46)
<223> 97-122 собачьего ИЛ-31
<400> 54
Ile Ser Ile Ser Glu Ile Lys Gly Val Ile Val His Lys Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Leu Ser Asp Lys Asn Ile Ile Asp Lys Ile Ile Glu
20 25 30
Gln Leu Asp Lys Leu Lys Phe Gln His Glu Pro Glu Thr Glu
35 40 45
<210> 55
<211> 41
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 4 Th (UBITH3)
<220>
<221> SITE
<222> (4)..(4)
<223> S или T
<220>
<221> SITE
<222> (7)..(7)
<223> K или R
<220>
<221> SITE
<222> (8)..(8)
<223> G или T
<220>
<221> SITE
<222> (12)..(12)
<223> H или T
<220>
<221> SITE
<222> (13)..(13)
<223> K или R
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(41)
<223> 97-114 собачьего ИЛ-31
<400> 55
Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Leu Ser Asp Lys Asn Ile Ile Asp Lys
20 25 30
Ile Ile Glu Gln Leu Asp Lys Leu Lys
35 40
<210> 56
<211> 38
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 4 Th (UBITh3)
<220>
<221> SITE
<222> (4)..(4)
<223> S или T
<220>
<221> SITE
<222> (7)..(7)
<223> K или R
<220>
<221> SITE
<222> (8)..(8)
<223> G или T
<220>
<221> SITE
<222> (12)..(12)
<223> H или T
<220>
<221> SITE
<222> (13)..(13)
<223> K или R
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K как спейсер
<220>
<221> ПЕПТИД
<222> (21)..(38)
<223> 97-114 собачьего ИЛ-31
<400> 56
Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Leu Ser Asp Lys Asn Ile Ile Asp Lys Ile Ile Glu
20 25 30
Gln Leu Asp Lys Leu Lys
35
<210> 57
<211> 41
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF5 Th (UBITh1)
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(41)
<223> 97-114 собачьего ИЛ-31
<400> 57
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Leu Ser Asp Lys Asn Ile Ile Asp Lys
20 25 30
Ile Ile Glu Gln Leu Asp Lys Leu Lys
35 40
<210> 58
<211> 38
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 5 Th (UBITh1)
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K как спейсер
<220>
<221> ПЕПТИД
<222> (21)..(38)
<223> 97-114 собачьего ИЛ-31
<400> 58
Ile Ser Ile Ser Glu Ile Lys Gly Val Ile Val His Lys Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Leu Ser Asp Lys Asn Ile Ile Asp Lys Ile Ile Glu
20 25 30
Gln Leu Asp Lys Leu Lys
35
<210> 59
<211> 44
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 4 Th (UBITH3)
<220>
<221> SITE
<222> (4)..(4)
<223> S или T
<220>
<221> SITE
<222> (7)..(7)
<223> K или R
<220>
<221> SITE
<222> (8)..(8)
<223> G или T
<220>
<221> SITE
<222> (12)..(12)
<223> H или T
<220>
<221> SITE
<222> (13)..(13)
<223> K или R
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(44)
<223> 90-110 собачьего ИЛ-31
<400> 59
Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Tyr Phe Arg Ala Ile Arg Pro Leu Ser
20 25 30
Asp Lys Asn Ile Ile Asp Lys Ile Ile Glu Gln Leu
35 40
<210> 60
<211> 41
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 4 Th (UBITh3)
<220>
<221> SITE
<222> (4)..(4)
<223> S или T
<220>
<221> SITE
<222> (7)..(7)
<223> K или R
<220>
<221> SITE
<222> (8)..(8)
<223> G или T
<220>
<221> SITE
<222> (12)..(12)
<223> H или T
<220>
<221> SITE
<222> (13)..(13)
<223> K или R
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K как спейсер
<220>
<221> ПЕПТИД
<222> (21)..(41)
<223> 90-110 собачьего ИЛ-31
<400> 60
Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Tyr Phe Arg Ala Ile Arg Pro Leu Ser Asp Lys Asn
20 25 30
Ile Ile Asp Lys Ile Ile Glu Gln Leu
35 40
<210> 61
<211> 44
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF5 Th (UBITh1)
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(44)
<223> 90-110 собачьего ИЛ-31
<400> 61
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Tyr Phe Arg Ala Ile Arg Pro Leu Ser
20 25 30
Asp Lys Asn Ile Ile Asp Lys Ile Ile Glu Gln Leu
35 40
<210> 62
<211> 41
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 5 Th (UBITh1)
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K как спейсер
<220>
<221> ПЕПТИД
<222> (21)..(41)
<223> 90-110 собачьего ИЛ-31
<400> 62
Ile Ser Ile Ser Glu Ile Lys Gly Val Ile Val His Lys Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Tyr Phe Arg Ala Ile Arg Pro Leu Ser Asp Lys Asn
20 25 30
Ile Ile Asp Lys Ile Ile Glu Gln Leu
35 40
<210> 63
<211> 78
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 4 Th (UBITH3)
<220>
<221> SITE
<222> (4)..(4)
<223> S или T
<220>
<221> SITE
<222> (7)..(7)
<223> K или R
<220>
<221> SITE
<222> (8)..(8)
<223> G или T
<220>
<221> SITE
<222> (12)..(12)
<223> H или T
<220>
<221> SITE
<222> (13)..(13)
<223> K или R
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(78)
<223> 90-144 собачьего ИЛ-31
<400> 63
Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Tyr Phe Arg Ala Ile Arg Pro Leu Ser
20 25 30
Asp Lys Asn Ile Ile Asp Lys Ile Ile Glu Gln Leu Asp Lys Leu Lys
35 40 45
Phe Gln His Glu Pro Glu Thr Glu Ile Ser Val Pro Ala Asp Thr Phe
50 55 60
Glu Cys Lys Ser Phe Ile Leu Thr Ile Leu Gln Gln Phe Ser
65 70 75
<210> 64
<211> 75
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 4 Th (UBITh3)
<220>
<221> SITE
<222> (4)..(4)
<223> S или T
<220>
<221> SITE
<222> (7)..(7)
<223> K или R
<220>
<221> SITE
<222> (8)..(8)
<223> G или T
<220>
<221> SITE
<222> (12)..(12)
<223> H или T
<220>
<221> SITE
<222> (13)..(13)
<223> K или R
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K как спейсер
<220>
<221> ПЕПТИД
<222> (21)..(75)
<223> 90-144 собачьего ИЛ-31
<400> 64
Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Tyr Phe Arg Ala Ile Arg Pro Leu Ser Asp Lys Asn
20 25 30
Ile Ile Asp Lys Ile Ile Glu Gln Leu Asp Lys Leu Lys Phe Gln His
35 40 45
Glu Pro Glu Thr Glu Ile Ser Val Pro Ala Asp Thr Phe Glu Cys Lys
50 55 60
Ser Phe Ile Leu Thr Ile Leu Gln Gln Phe Ser
65 70 75
<210> 65
<211> 78
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF5 Th (UBITh1)
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(78)
<223> 90-144 собачьего ИЛ-31
<400> 65
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Tyr Phe Arg Ala Ile Arg Pro Leu Ser
20 25 30
Asp Lys Asn Ile Ile Asp Lys Ile Ile Glu Gln Leu Asp Lys Leu Lys
35 40 45
Phe Gln His Glu Pro Glu Thr Glu Ile Ser Val Pro Ala Asp Thr Phe
50 55 60
Glu Cys Lys Ser Phe Ile Leu Thr Ile Leu Gln Gln Phe Ser
65 70 75
<210> 66
<211> 75
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 5 Th (UBITh1)
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K как спейсер
<220>
<221> ПЕПТИД
<222> (21)..(75)
<223> 90-144 собачьего ИЛ-31
<400> 66
Ile Ser Ile Ser Glu Ile Lys Gly Val Ile Val His Lys Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Tyr Phe Arg Ala Ile Arg Pro Leu Ser Asp Lys Asn
20 25 30
Ile Ile Asp Lys Ile Ile Glu Gln Leu Asp Lys Leu Lys Phe Gln His
35 40 45
Glu Pro Glu Thr Glu Ile Ser Val Pro Ala Asp Thr Phe Glu Cys Lys
50 55 60
Ser Phe Ile Leu Thr Ile Leu Gln Gln Phe Ser
65 70 75
<210> 67
<211> 78
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 4 Th (UBITH3)
<220>
<221> SITE
<222> (4)..(4)
<223> S или T
<220>
<221> SITE
<222> (7)..(7)
<223> K или R
<220>
<221> SITE
<222> (8)..(8)
<223> G или T
<220>
<221> SITE
<222> (12)..(12)
<223> H или T
<220>
<221> SITE
<222> (13)..(13)
<223> K или R
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(78)
<223> 90-144 собачьего ИЛ-31
<400> 67
Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Tyr Phe Arg Ala Ile Arg Pro Leu Ser
20 25 30
Asp Lys Asn Ile Ile Asp Lys Ile Ile Glu Gln Leu Asp Lys Leu Lys
35 40 45
Phe Gln His Glu Pro Glu Thr Glu Ile Ser Val Pro Ala Asp Thr Phe
50 55 60
Glu Cys Lys Ser Phe Ile Leu Thr Ile Leu Gln Gln Phe Ser
65 70 75
<210> 68
<211> 75
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 4 Th (UBITh3)
<220>
<221> SITE
<222> (4)..(4)
<223> S или T
<220>
<221> SITE
<222> (7)..(7)
<223> K или R
<220>
<221> SITE
<222> (8)..(8)
<223> G или T
<220>
<221> SITE
<222> (12)..(12)
<223> H или T
<220>
<221> SITE
<222> (13)..(13)
<223> K или R
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K как спейсер
<220>
<221> ПЕПТИД
<222> (21)..(75)
<223> 90-144 собачьего ИЛ-31
<400> 68
Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Tyr Phe Arg Ala Ile Arg Pro Leu Ser Asp Lys Asn
20 25 30
Ile Ile Asp Lys Ile Ile Glu Gln Leu Asp Lys Leu Lys Phe Gln His
35 40 45
Glu Pro Glu Thr Glu Ile Ser Val Pro Ala Asp Thr Phe Glu Cys Lys
50 55 60
Ser Phe Ile Leu Thr Ile Leu Gln Gln Phe Ser
65 70 75
<210> 69
<211> 78
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF5 Th (UBITh1)
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(78)
<223> 90-144 собачьего ИЛ-31
<400> 69
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Tyr Phe Arg Ala Ile Arg Pro Leu Ser
20 25 30
Asp Lys Asn Ile Ile Asp Lys Ile Ile Glu Gln Leu Asp Lys Leu Lys
35 40 45
Phe Gln His Glu Pro Glu Thr Glu Ile Ser Val Pro Ala Asp Thr Phe
50 55 60
Glu Cys Lys Ser Phe Ile Leu Thr Ile Leu Gln Gln Phe Ser
65 70 75
<210> 70
<211> 75
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 5 Th (UBITh1)
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K как спейсер
<220>
<221> ПЕПТИД
<222> (21)..(75)
<223> 90-144 собачьего ИЛ-31
<400> 70
Ile Ser Ile Ser Glu Ile Lys Gly Val Ile Val His Lys Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Tyr Phe Arg Ala Ile Arg Pro Leu Ser Asp Lys Asn
20 25 30
Ile Ile Asp Lys Ile Ile Glu Gln Leu Asp Lys Leu Lys Phe Gln His
35 40 45
Glu Pro Glu Thr Glu Ile Ser Val Pro Ala Asp Thr Phe Glu Cys Lys
50 55 60
Ser Phe Ile Leu Thr Ile Leu Gln Gln Phe Ser
65 70 75
<210> 71
<211> 82
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 4 Th (UBITH3)
<220>
<221> SITE
<222> (4)..(4)
<223> S или T
<220>
<221> SITE
<222> (7)..(7)
<223> K или R
<220>
<221> SITE
<222> (8)..(8)
<223> G или T
<220>
<221> SITE
<222> (12)..(12)
<223> H или T
<220>
<221> SITE
<222> (13)..(13)
<223> K или R
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(82)
<223> 86-144 собачьего ИЛ-31
<400> 71
Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Ala Ile Leu Pro Tyr Phe Arg Ala Ile
20 25 30
Arg Pro Leu Ser Asp Lys Asn Ile Ile Asp Lys Ile Ile Glu Gln Leu
35 40 45
Asp Lys Leu Lys Phe Gln His Glu Pro Glu Thr Glu Ile Ser Val Pro
50 55 60
Ala Asp Thr Phe Glu Cys Lys Ser Phe Ile Leu Thr Ile Leu Gln Gln
65 70 75 80
Phe Ser
<210> 72
<211> 79
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 4 Th (UBITh3)
<220>
<221> SITE
<222> (4)..(4)
<223> S или T
<220>
<221> SITE
<222> (7)..(7)
<223> K или R
<220>
<221> SITE
<222> (8)..(8)
<223> G или T
<220>
<221> SITE
<222> (12)..(12)
<223> H или T
<220>
<221> SITE
<222> (13)..(13)
<223> K или R
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K как спейсер
<220>
<221> ПЕПТИД
<222> (21)..(79)
<223> 86-144 собачьего ИЛ-31
<400> 72
Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Ala Ile Leu Pro Tyr Phe Arg Ala Ile Arg Pro Leu
20 25 30
Ser Asp Lys Asn Ile Ile Asp Lys Ile Ile Glu Gln Leu Asp Lys Leu
35 40 45
Lys Phe Gln His Glu Pro Glu Thr Glu Ile Ser Val Pro Ala Asp Thr
50 55 60
Phe Glu Cys Lys Ser Phe Ile Leu Thr Ile Leu Gln Gln Phe Ser
65 70 75
<210> 73
<211> 82
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF5 Th (UBITh1)
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(82)
<223> 86-144 собачьего ИЛ-31
<400> 73
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Ala Ile Leu Pro Tyr Phe Arg Ala Ile
20 25 30
Arg Pro Leu Ser Asp Lys Asn Ile Ile Asp Lys Ile Ile Glu Gln Leu
35 40 45
Asp Lys Leu Lys Phe Gln His Glu Pro Glu Thr Glu Ile Ser Val Pro
50 55 60
Ala Asp Thr Phe Glu Cys Lys Ser Phe Ile Leu Thr Ile Leu Gln Gln
65 70 75 80
Phe Ser
<210> 74
<211> 79
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 5 Th (UBITh1)
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K как спейсер
<220>
<221> ПЕПТИД
<222> (21)..(79)
<223> 86-144 собачьего ИЛ-31
<400> 74
Ile Ser Ile Ser Glu Ile Lys Gly Val Ile Val His Lys Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Ala Ile Leu Pro Tyr Phe Arg Ala Ile Arg Pro Leu
20 25 30
Ser Asp Lys Asn Ile Ile Asp Lys Ile Ile Glu Gln Leu Asp Lys Leu
35 40 45
Lys Phe Gln His Glu Pro Glu Thr Glu Ile Ser Val Pro Ala Asp Thr
50 55 60
Phe Glu Cys Lys Ser Phe Ile Leu Thr Ile Leu Gln Gln Phe Ser
65 70 75
<210> 75
<211> 76
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 4 Th (UBITH3)
<220>
<221> SITE
<222> (4)..(4)
<223> S или T
<220>
<221> SITE
<222> (7)..(7)
<223> K или R
<220>
<221> SITE
<222> (8)..(8)
<223> G или T
<220>
<221> SITE
<222> (12)..(12)
<223> H или T
<220>
<221> SITE
<222> (13)..(13)
<223> K или R
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(76)
<223> 97–149 собачьего ИЛ-31, C146-S146
<400> 75
Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Leu Ser Asp Lys Asn Ile Ile Asp Lys
20 25 30
Ile Ile Glu Gln Leu Asp Lys Leu Lys Phe Gln His Glu Pro Glu Thr
35 40 45
Glu Ile Ser Val Pro Ala Asp Thr Phe Glu Cys Lys Ser Phe Ile Leu
50 55 60
Thr Ile Leu Gln Gln Phe Ser Ala Ser Leu Glu Ser
65 70 75
<210> 76
<211> 73
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 4 Th (UBITh3)
<220>
<221> SITE
<222> (4)..(4)
<223> S или T
<220>
<221> SITE
<222> (7)..(7)
<223> K или R
<220>
<221> SITE
<222> (8)..(8)
<223> G или T
<220>
<221> SITE
<222> (12)..(12)
<223> H или T
<220>
<221> SITE
<222> (13)..(13)
<223> K или R
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K как спейсер
<220>
<221> ПЕПТИД
<222> (21)..(73)
<223> 97–149 собачьего ИЛ-31, C146-S146
<400> 76
Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Leu Ser Asp Lys Asn Ile Ile Asp Lys Ile Ile Glu
20 25 30
Gln Leu Asp Lys Leu Lys Phe Gln His Glu Pro Glu Thr Glu Ile Ser
35 40 45
Val Pro Ala Asp Thr Phe Glu Cys Lys Ser Phe Ile Leu Thr Ile Leu
50 55 60
Gln Gln Phe Ser Ala Ser Leu Glu Ser
65 70
<210> 77
<211> 76
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF5 Th (UBITh1)
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(76)
<223> 97–149 собачьего ИЛ-31, C146-S146
<400> 77
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Leu Ser Asp Lys Asn Ile Ile Asp Lys
20 25 30
Ile Ile Glu Gln Leu Asp Lys Leu Lys Phe Gln His Glu Pro Glu Thr
35 40 45
Glu Ile Ser Val Pro Ala Asp Thr Phe Glu Cys Lys Ser Phe Ile Leu
50 55 60
Thr Ile Leu Gln Gln Phe Ser Ala Ser Leu Glu Ser
65 70 75
<210> 78
<211> 73
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 5 Th (UBITh1)
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K как спейсер
<220>
<221> ПЕПТИД
<222> (21)..(73)
<223> 97–149 собачьего ИЛ-31, C146-S146
<400> 78
Ile Ser Ile Ser Glu Ile Lys Gly Val Ile Val His Lys Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Leu Ser Asp Lys Asn Ile Ile Asp Lys Ile Ile Glu
20 25 30
Gln Leu Asp Lys Leu Lys Phe Gln His Glu Pro Glu Thr Glu Ile Ser
35 40 45
Val Pro Ala Asp Thr Phe Glu Cys Lys Ser Phe Ile Leu Thr Ile Leu
50 55 60
Gln Gln Phe Ser Ala Ser Leu Glu Ser
65 70
<210> 79
<211> 83
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 4 Th (UBITH3)
<220>
<221> SITE
<222> (4)..(4)
<223> S или T
<220>
<221> SITE
<222> (7)..(7)
<223> K или R
<220>
<221> SITE
<222> (8)..(8)
<223> G или T
<220>
<221> SITE
<222> (12)..(12)
<223> H или T
<220>
<221> SITE
<222> (13)..(13)
<223> K или R
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(83)
<223> 90–149 собачьего ИЛ-31, C146-S146
<400> 79
Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Tyr Phe Arg Ala Ile Arg Pro Leu Ser
20 25 30
Asp Lys Asn Ile Ile Asp Lys Ile Ile Glu Gln Leu Asp Lys Leu Lys
35 40 45
Phe Gln His Glu Pro Glu Thr Glu Ile Ser Val Pro Ala Asp Thr Phe
50 55 60
Glu Cys Lys Ser Phe Ile Leu Thr Ile Leu Gln Gln Phe Ser Ala Ser
65 70 75 80
Leu Glu Ser
<210> 80
<211> 80
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 4 Th (UBITh3)
<220>
<221> SITE
<222> (4)..(4)
<223> S или T
<220>
<221> SITE
<222> (7)..(7)
<223> K или R
<220>
<221> SITE
<222> (8)..(8)
<223> G или T
<220>
<221> SITE
<222> (12)..(12)
<223> H или T
<220>
<221> SITE
<222> (13)..(13)
<223> K или R
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K как спейсер
<220>
<221> ПЕПТИД
<222> (21)..(80)
<223> 90–149 собачьего ИЛ-31, C146-S146
<400> 80
Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Tyr Phe Arg Ala Ile Arg Pro Leu Ser Asp Lys Asn
20 25 30
Ile Ile Asp Lys Ile Ile Glu Gln Leu Asp Lys Leu Lys Phe Gln His
35 40 45
Glu Pro Glu Thr Glu Ile Ser Val Pro Ala Asp Thr Phe Glu Cys Lys
50 55 60
Ser Phe Ile Leu Thr Ile Leu Gln Gln Phe Ser Ala Ser Leu Glu Ser
65 70 75 80
<210> 81
<211> 83
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF5 Th (UBITh1)
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(83)
<223> 90–149 собачьего ИЛ-31, C146-S146
<400> 81
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Tyr Phe Arg Ala Ile Arg Pro Leu Ser
20 25 30
Asp Lys Asn Ile Ile Asp Lys Ile Ile Glu Gln Leu Asp Lys Leu Lys
35 40 45
Phe Gln His Glu Pro Glu Thr Glu Ile Ser Val Pro Ala Asp Thr Phe
50 55 60
Glu Cys Lys Ser Phe Ile Leu Thr Ile Leu Gln Gln Phe Ser Ala Ser
65 70 75 80
Leu Glu Ser
<210> 82
<211> 80
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 5 Th (UBITh1)
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K как спейсер
<220>
<221> ПЕПТИД
<222> (21)..(80)
<223> 90–149 собачьего ИЛ-31, C146-S146
<400> 82
Ile Ser Ile Ser Glu Ile Lys Gly Val Ile Val His Lys Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Tyr Phe Arg Ala Ile Arg Pro Leu Ser Asp Lys Asn
20 25 30
Ile Ile Asp Lys Ile Ile Glu Gln Leu Asp Lys Leu Lys Phe Gln His
35 40 45
Glu Pro Glu Thr Glu Ile Ser Val Pro Ala Asp Thr Phe Glu Cys Lys
50 55 60
Ser Phe Ile Leu Thr Ile Leu Gln Gln Phe Ser Ala Ser Leu Glu Ser
65 70 75 80
<210> 83
<211> 87
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 4 Th (UBITH3)
<220>
<221> SITE
<222> (4)..(4)
<223> S или T
<220>
<221> SITE
<222> (7)..(7)
<223> K или R
<220>
<221> SITE
<222> (8)..(8)
<223> G или T
<220>
<221> SITE
<222> (12)..(12)
<223> H или T
<220>
<221> SITE
<222> (13)..(13)
<223> K или R
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(87)
<223> 86–149 собачьего ИЛ-31, C146-S146
<400> 83
Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Ala Ile Leu Pro Tyr Phe Arg Ala Ile
20 25 30
Arg Pro Leu Ser Asp Lys Asn Ile Ile Asp Lys Ile Ile Glu Gln Leu
35 40 45
Asp Lys Leu Lys Phe Gln His Glu Pro Glu Thr Glu Ile Ser Val Pro
50 55 60
Ala Asp Thr Phe Glu Cys Lys Ser Phe Ile Leu Thr Ile Leu Gln Gln
65 70 75 80
Phe Ser Ala Ser Leu Glu Ser
85
<210> 84
<211> 84
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 4 Th (UBITh3)
<220>
<221> SITE
<222> (4)..(4)
<223> S или T
<220>
<221> SITE
<222> (7)..(7)
<223> K или R
<220>
<221> SITE
<222> (8)..(8)
<223> G или T
<220>
<221> SITE
<222> (12)..(12)
<223> H или T
<220>
<221> SITE
<222> (13)..(13)
<223> K или R
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K как спейсер
<220>
<221> ПЕПТИД
<222> (21)..(84)
<223> 86–149 собачьего ИЛ-31, C146-S146
<400> 84
Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Ala Ile Leu Pro Tyr Phe Arg Ala Ile Arg Pro Leu
20 25 30
Ser Asp Lys Asn Ile Ile Asp Lys Ile Ile Glu Gln Leu Asp Lys Leu
35 40 45
Lys Phe Gln His Glu Pro Glu Thr Glu Ile Ser Val Pro Ala Asp Thr
50 55 60
Phe Glu Cys Lys Ser Phe Ile Leu Thr Ile Leu Gln Gln Phe Ser Ala
65 70 75 80
Ser Leu Glu Ser
<210> 85
<211> 87
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF5 Th (UBITh1)
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(87)
<223> 86–149 собачьего ИЛ-31, C146-S146
<400> 85
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Ala Ile Leu Pro Tyr Phe Arg Ala Ile
20 25 30
Arg Pro Leu Ser Asp Lys Asn Ile Ile Asp Lys Ile Ile Glu Gln Leu
35 40 45
Asp Lys Leu Lys Phe Gln His Glu Pro Glu Thr Glu Ile Ser Val Pro
50 55 60
Ala Asp Thr Phe Glu Cys Lys Ser Phe Ile Leu Thr Ile Leu Gln Gln
65 70 75 80
Phe Ser Ala Ser Leu Glu Ser
85
<210> 86
<211> 84
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 5 Th (UBITh1)
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K как спейсер
<220>
<221> ПЕПТИД
<222> (21)..(84)
<223> 86–149 собачьего ИЛ-31, C146-S146
<400> 86
Ile Ser Ile Ser Glu Ile Lys Gly Val Ile Val His Lys Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Ala Ile Leu Pro Tyr Phe Arg Ala Ile Arg Pro Leu
20 25 30
Ser Asp Lys Asn Ile Ile Asp Lys Ile Ile Glu Gln Leu Asp Lys Leu
35 40 45
Lys Phe Gln His Glu Pro Glu Thr Glu Ile Ser Val Pro Ala Asp Thr
50 55 60
Phe Glu Cys Lys Ser Phe Ile Leu Thr Ile Leu Gln Gln Phe Ser Ala
65 70 75 80
Ser Leu Glu Ser
<210> 87
<211> 71
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF5 Th (UBITh1)
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(71)
<223> 98-145 человеческого ИЛ-31
<400> 87
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Leu Asp Asn Lys Ser Val Ile Asp Glu
20 25 30
Ile Ile Glu His Leu Asp Lys Leu Ile Phe Gln Asp Ala Pro Glu Thr
35 40 45
Asn Ile Ser Val Pro Thr Asp Thr His Glu Cys Lys Arg Phe Ile Leu
50 55 60
Thr Ile Ser Gln Gln Phe Ser
65 70
<210> 88
<211> 68
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 5 Th (UBITh1)
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K как спейсер
<220>
<221> ПЕПТИД
<222> (21)..(68)
<223> 98-145 человеческого ИЛ-31
<400> 88
Ile Ser Ile Ser Glu Ile Lys Gly Val Ile Val His Lys Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Leu Asp Asn Lys Ser Val Ile Asp Glu Ile Ile Glu
20 25 30
His Leu Asp Lys Leu Ile Phe Gln Asp Ala Pro Glu Thr Asn Ile Ser
35 40 45
Val Pro Thr Asp Thr His Glu Cys Lys Arg Phe Ile Leu Thr Ile Ser
50 55 60
Gln Gln Phe Ser
65
<210> 89
<211> 71
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 4 Th (UBITH3)
<220>
<221> SITE
<222> (4)..(4)
<223> S или T
<220>
<221> SITE
<222> (7)..(7)
<223> K или R
<220>
<221> SITE
<222> (8)..(8)
<223> G или T
<220>
<221> SITE
<222> (12)..(12)
<223> H или T
<220>
<221> SITE
<222> (13)..(13)
<223> K или R
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(71)
<223> 98-145 человеческого ИЛ-31
<400> 89
Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Leu Asp Asn Lys Ser Val Ile Asp Glu
20 25 30
Ile Ile Glu His Leu Asp Lys Leu Ile Phe Gln Asp Ala Pro Glu Thr
35 40 45
Asn Ile Ser Val Pro Thr Asp Thr His Glu Cys Lys Arg Phe Ile Leu
50 55 60
Thr Ile Ser Gln Gln Phe Ser
65 70
<210> 90
<211> 68
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 4 Th (UBITh3)
<220>
<221> SITE
<222> (4)..(4)
<223> S или T
<220>
<221> SITE
<222> (7)..(7)
<223> K или R
<220>
<221> SITE
<222> (8)..(8)
<223> G или T
<220>
<221> SITE
<222> (12)..(12)
<223> H или T
<220>
<221> SITE
<222> (13)..(13)
<223> K или R
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K как спейсер
<220>
<221> ПЕПТИД
<222> (21)..(68)
<223> 98-145 человеческого ИЛ-31
<400> 90
Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Leu Asp Asn Lys Ser Val Ile Asp Glu Ile Ile Glu
20 25 30
His Leu Asp Lys Leu Ile Phe Gln Asp Ala Pro Glu Thr Asn Ile Ser
35 40 45
Val Pro Thr Asp Thr His Glu Cys Lys Arg Phe Ile Leu Thr Ile Ser
50 55 60
Gln Gln Phe Ser
65
<210> 91
<211> 4
<212> Белок
<213> cинтетический пептид
<220>
<221> SITE
<222> (1)..(1)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (1)..(4)
<223> эпсилон-K-KKK как спейсер
<400> 91
Lys Lys Lys Lys
1
<210> 92
<211> 6
<212> Белок
<213> cинтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(6)
<223> Гибкий шарнирный спейсер
<400> 92
Pro Pro Xaa Pro Xaa Pro
1 5
<210> 93
<211> 64
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(64)
<223> 87-150 человеческого ИЛ-31, C147-S147
<400> 93
Ala Ile Arg Ala Tyr Leu Lys Thr Ile Arg Gln Leu Asp Asn Lys Ser
1 5 10 15
Val Ile Asp Glu Ile Ile Glu His Leu Asp Lys Leu Ile Phe Gln Asp
20 25 30
Ala Pro Glu Thr Asn Ile Ser Val Pro Thr Asp Thr His Glu Cys Lys
35 40 45
Arg Phe Ile Leu Thr Ile Ser Gln Gln Phe Ser Glu Ser Met Asp Leu
50 55 60
<210> 94
<211> 9
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(9)
<223> 105-113 человеческого ИЛ-31
<400> 94
Asp Glu Ile Ile Glu His Leu Asp Lys
1 5
<210> 95
<211> 31
<212> Белок
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(31)
<223> 85-115 человеческого ИЛ-31, S85-C85, I115-C115
<400> 95
Cys Pro Ala Ile Arg Ala Tyr Leu Lys Thr Ile Arg Gln Leu Asp Asn
1 5 10 15
Lys Ser Val Ile Asp Glu Ile Ile Glu His Leu Asp Lys Leu Cys
20 25 30
<210> 96
<211> 31
<212> Белок
<213> Canis lupus
<220>
<221> ПЕПТИД
<222> (1)..(31)
<223> 84-114 собачьего ИЛ-31, S84-C84, K114-C114
<400> 96
Cys Ser Ala Ile Leu Pro Tyr Phe Arg Ala Ile Arg Pro Leu Ser Asp
1 5 10 15
Lys Asn Ile Ile Asp Lys Ile Ile Glu Gln Leu Asp Lys Leu Cys
20 25 30
<210> 97
<211> 32
<212> Белок
<213> Mus musculus
<220>
<221> 1PEPTIDE
<222> (1)..(32)
<223> 86-117 ИЛ-31 мыши, S86-C86
<400> 97
Cys Val Ile Ile Ala His Leu Glu Lys Val Lys Val Leu Ser Glu Asn
1 5 10 15
Thr Val Asp Thr Ser Trp Val Ile Arg Trp Leu Thr Asn Ile Ser Cys
20 25 30
<210> 98
<211> 30
<212> Белок
<213> Mus musculus
<220>
<221> ПЕПТИД
<222> (1)..(30)
<223> 87-116 ИЛ-31 мыши, V87-C87, S116- C116
<400> 98
Cys Ile Ile Ala His Leu Glu Lys Val Lys Val Leu Ser Glu Asn Thr
1 5 10 15
Val Asp Thr Ser Trp Val Ile Arg Trp Leu Thr Asn Ile Cys
20 25 30
<210> 99
<211> 87
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF5 Th (UBITh1)
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(87)
<223> 87-150 человеческого ИЛ-31, C147-S147
<400> 99
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Ala Ile Arg Ala Tyr Leu Lys Thr Ile
20 25 30
Arg Gln Leu Asp Asn Lys Ser Val Ile Asp Glu Ile Ile Glu His Leu
35 40 45
Asp Lys Leu Ile Phe Gln Asp Ala Pro Glu Thr Asn Ile Ser Val Pro
50 55 60
Thr Asp Thr His Glu Cys Lys Arg Phe Ile Leu Thr Ile Ser Gln Gln
65 70 75 80
Phe Ser Glu Ser Met Asp Leu
85
<210> 100
<211> 32
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF5 Th (UBITh1)
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(32)
<223> 105-113 человеческого ИЛ-31
<400> 100
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Asp Glu Ile Ile Glu His Leu Asp Lys
20 25 30
<210> 101
<211> 54
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF5 Th (UBITh1)
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(54)
<223> 85-115 человеческого ИЛ-31, S85-C85, I115-C115
<400> 101
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Cys Pro Ala Ile Arg Ala Tyr Leu Lys
20 25 30
Thr Ile Arg Gln Leu Asp Asn Lys Ser Val Ile Asp Glu Ile Ile Glu
35 40 45
His Leu Asp Lys Leu Cys
50
<210> 102
<211> 54
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF5 Th (UBITh1)
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(54)
<223> 84-114 собачьего ИЛ-31, S84-C84, K114-C114
<400> 102
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Cys Ser Ala Ile Leu Pro Tyr Phe Arg
20 25 30
Ala Ile Arg Pro Leu Ser Asp Lys Asn Ile Ile Asp Lys Ile Ile Glu
35 40 45
Gln Leu Asp Lys Leu Cys
50
<210> 103
<211> 54
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 4 Th (UBITH3)
<220>
<221> SITE
<222> (4)..(4)
<223> S или T
<220>
<221> SITE
<222> (7)..(7)
<223> K или R
<220>
<221> SITE
<222> (8)..(8)
<223> G или T
<220>
<221> SITE
<222> (12)..(12)
<223> H или T
<220>
<221> SITE
<222> (13)..(13)
<223> K или R
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(54)
<223> 84-114 собачьего ИЛ-31, S84-C84, K114-C114
<400> 103
Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Cys Ser Ala Ile Leu Pro Tyr Phe Arg
20 25 30
Ala Ile Arg Pro Leu Ser Asp Lys Asn Ile Ile Asp Lys Ile Ile Glu
35 40 45
Gln Leu Asp Lys Leu Cys
50
<210> 104
<211> 55
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 4 Th (UBITH3)
<220>
<221> SITE
<222> (4)..(4)
<223> S или T
<220>
<221> SITE
<222> (7)..(7)
<223> K или R
<220>
<221> SITE
<222> (8)..(8)
<223> G или T
<220>
<221> SITE
<222> (12)..(12)
<223> H или T
<220>
<221> SITE
<222> (13)..(13)
<223> K или R
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(55)
<223> 86-117 ИЛ-31 мыши, S86-C86
<400> 104
Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Cys Val Ile Ile Ala His Leu Glu Lys
20 25 30
Val Lys Val Leu Ser Glu Asn Thr Val Asp Thr Ser Trp Val Ile Arg
35 40 45
Trp Leu Thr Asn Ile Ser Cys
50 55
<210> 105
<211> 53
<212> Белок
<213> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 4 Th (UBITH3)
<220>
<221> SITE
<222> (4)..(4)
<223> S или T
<220>
<221> SITE
<222> (7)..(7)
<223> K или R
<220>
<221> SITE
<222> (8)..(8)
<223> G или T
<220>
<221> SITE
<222> (12)..(12)
<223> H или T
<220>
<221> SITE
<222> (13)..(13)
<223> K или R
<220>
<221> SITE
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK как спейсер
<220>
<221> ПЕПТИД
<222> (24)..(53)
<223> 87-116 ИЛ-31 мыши, V87-C87, S116- C116
<400> 105
Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Cys Ile Ile Ala His Leu Glu Lys Val
20 25 30
Lys Val Leu Ser Glu Asn Thr Val Asp Thr Ser Trp Val Ile Arg Trp
35 40 45
Leu Thr Asn Ile Cys
50
<210> 106
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> прямой праймер HPRT
<400> 106
tgacactggc aaaacaatgc a 21
<210> 107
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> обратный праймер HPRT
<400> 107
ggtccttttc accagcaagc t 21
<210> 108
<211> 32
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ODN олигонуклеотида CpG1
<400> 108
tcgtcgtttt gtcgttttgt cgttttgtcg tt 32
<210> 109
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ODN олигонуклеотида CpG2
<220>
<221> прочий_признак
<222> (1)..(1)
<223> фосфоротиоатная группа
<400> 109
tcgtcgtttt gtcgttttgt cgtt 24
<210> 110
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ODN олигонуклеотида CpG3
<400> 110
tcgtcgtttt gtcgttttgt cgtt 24
<---
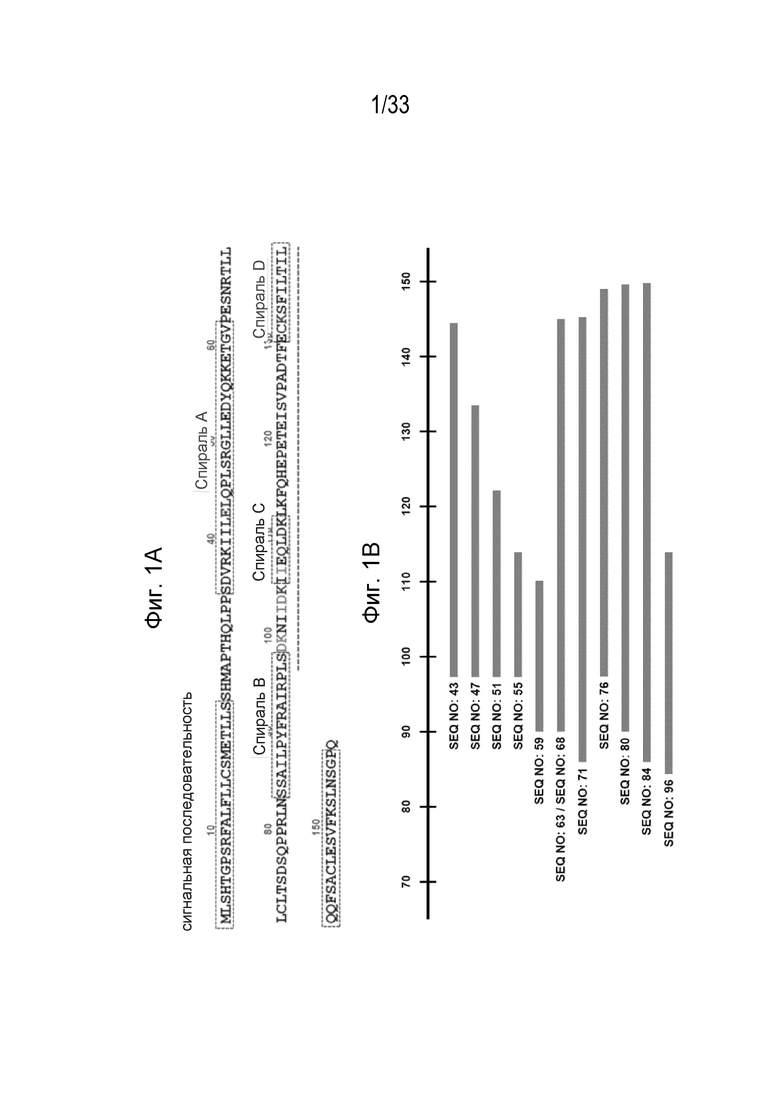
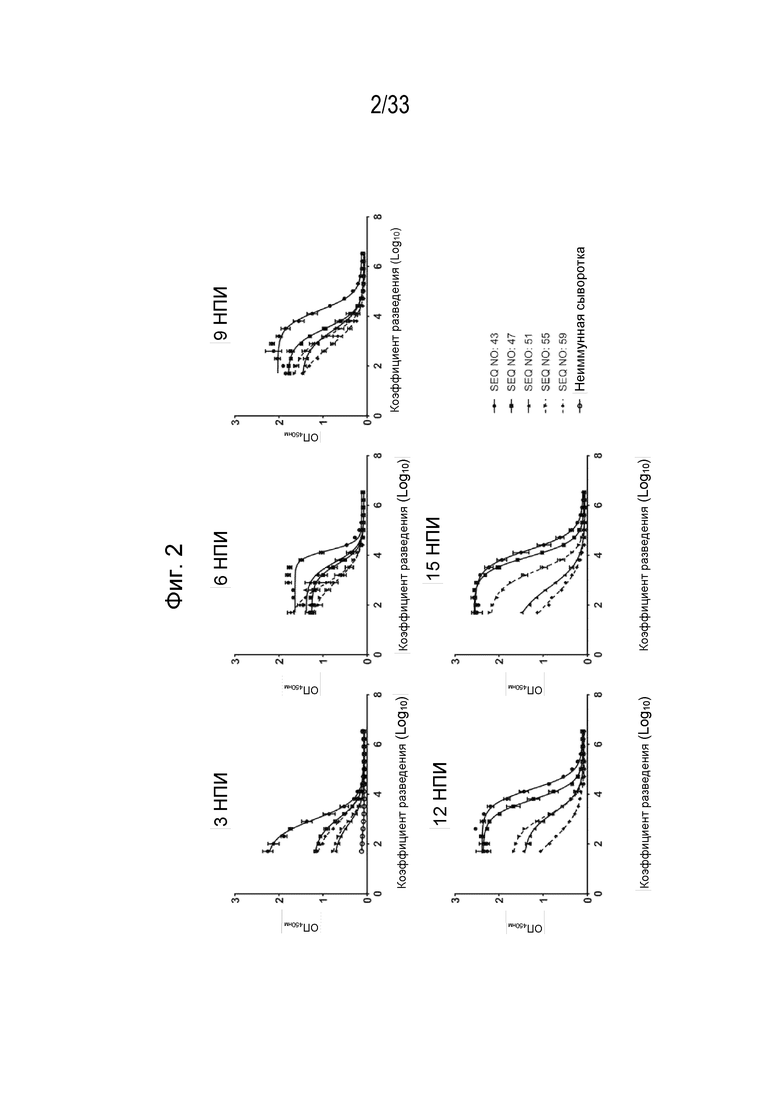
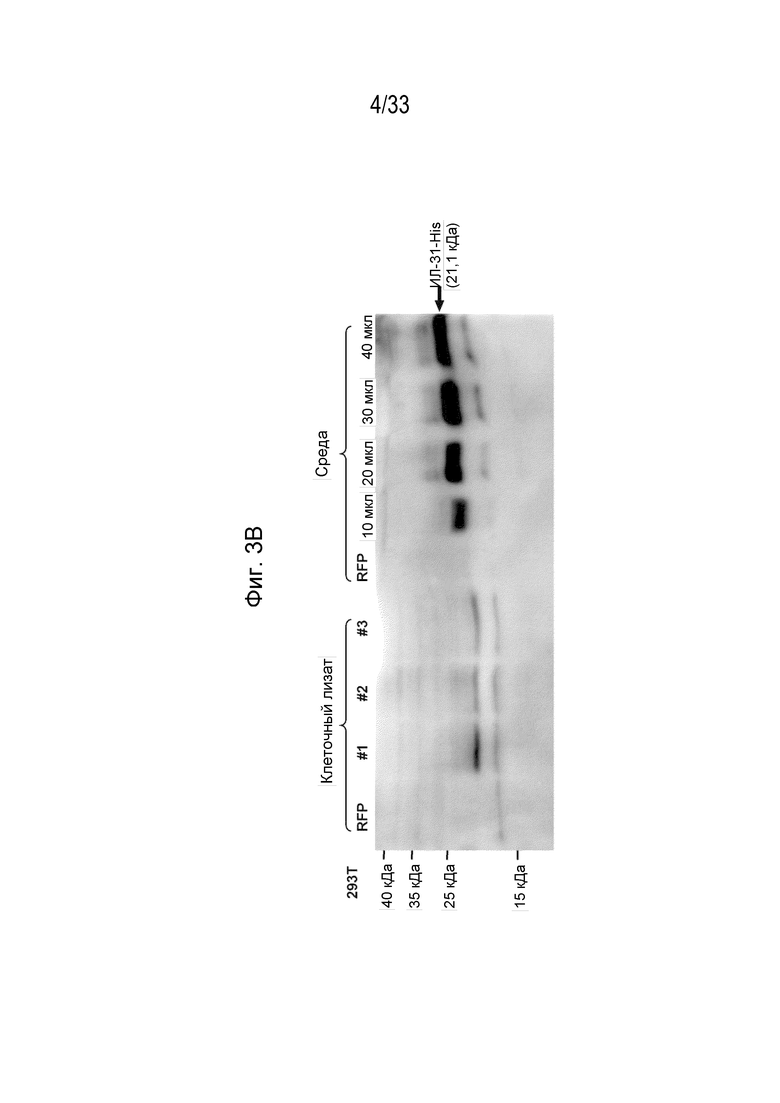
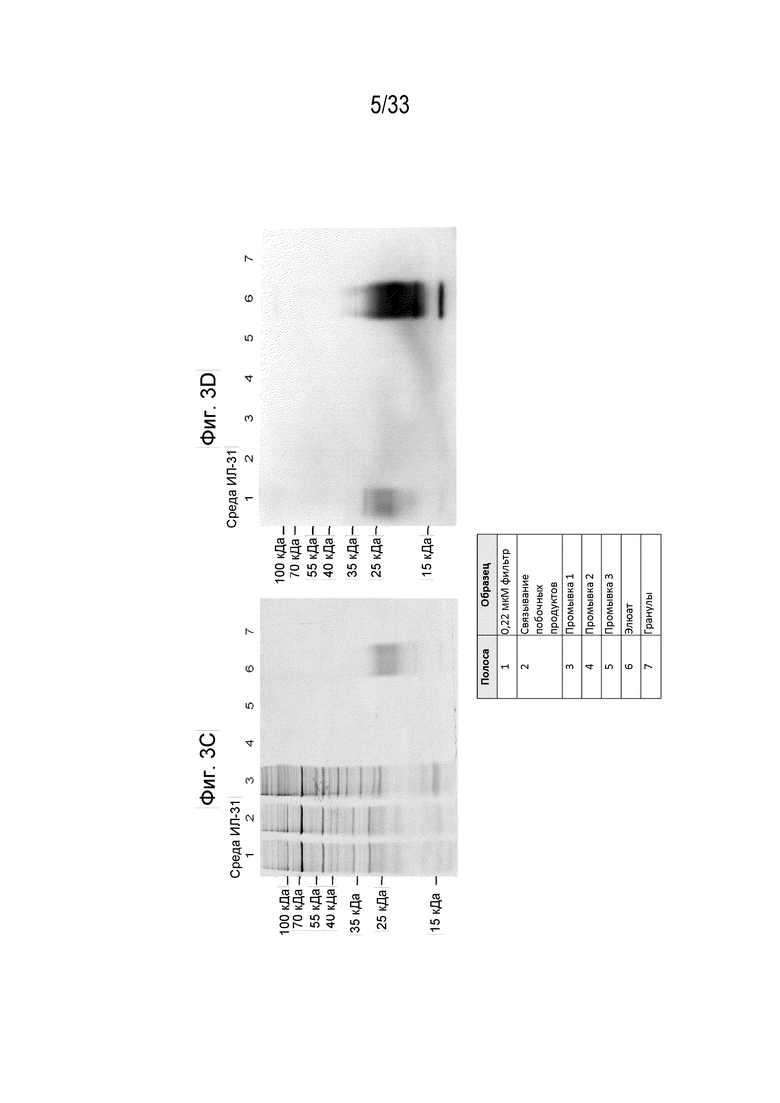

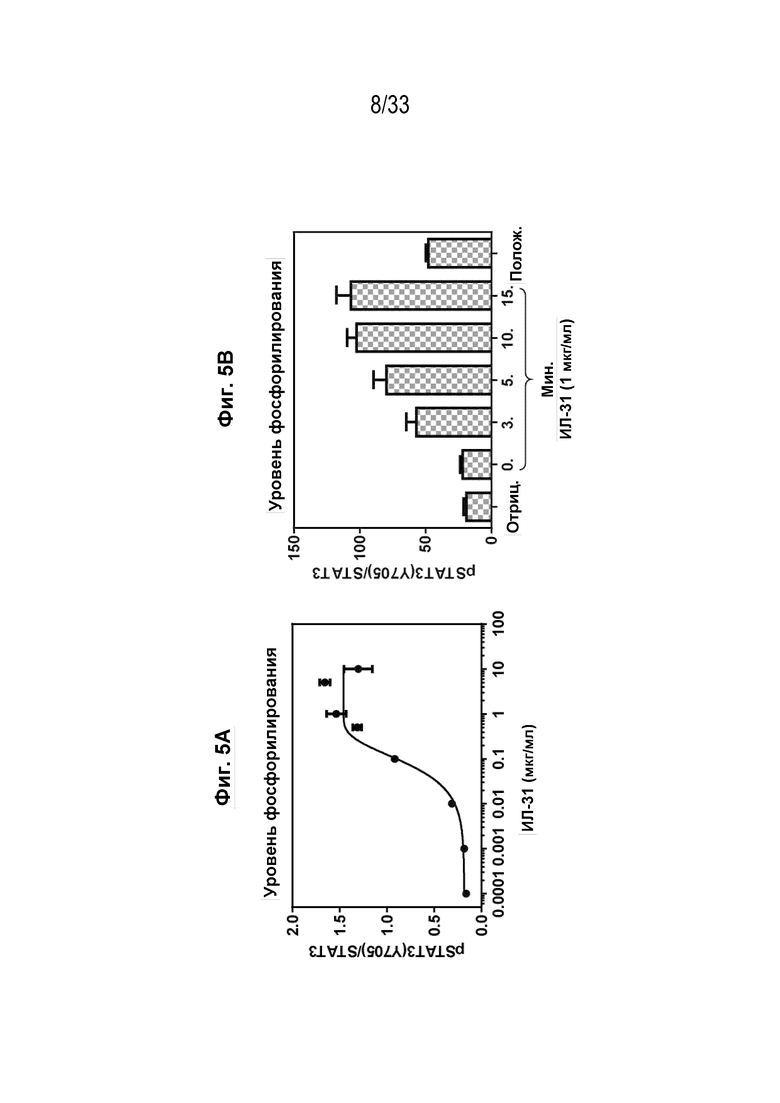
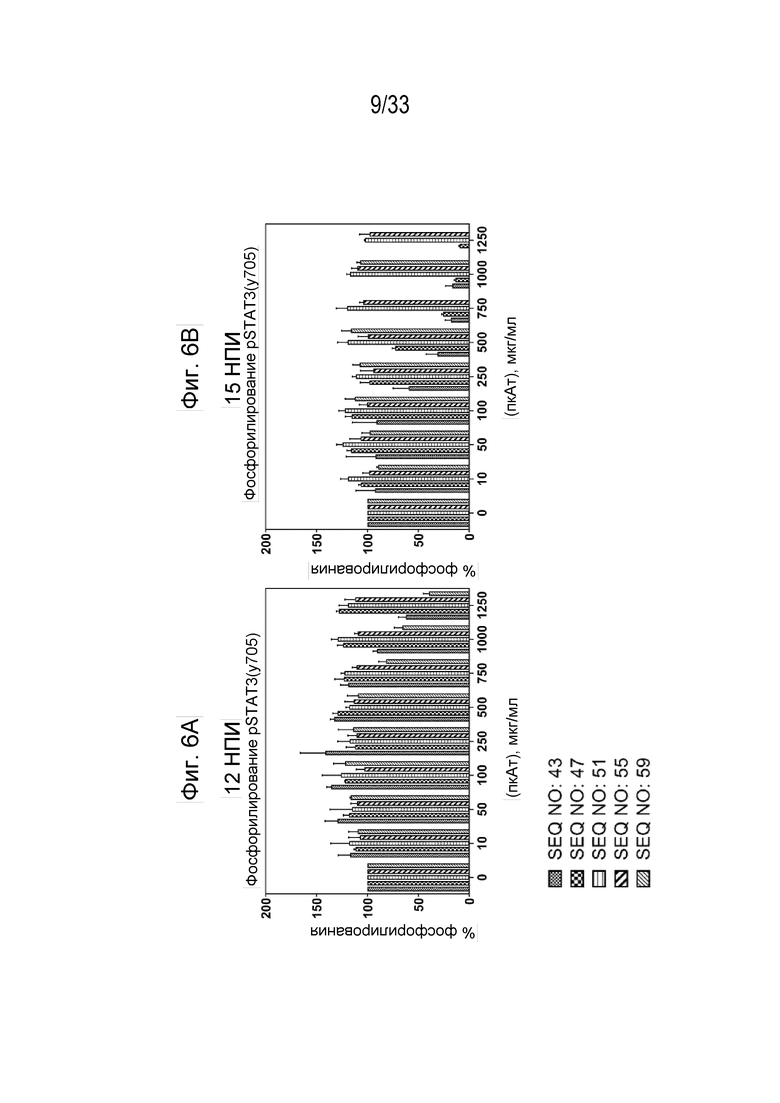
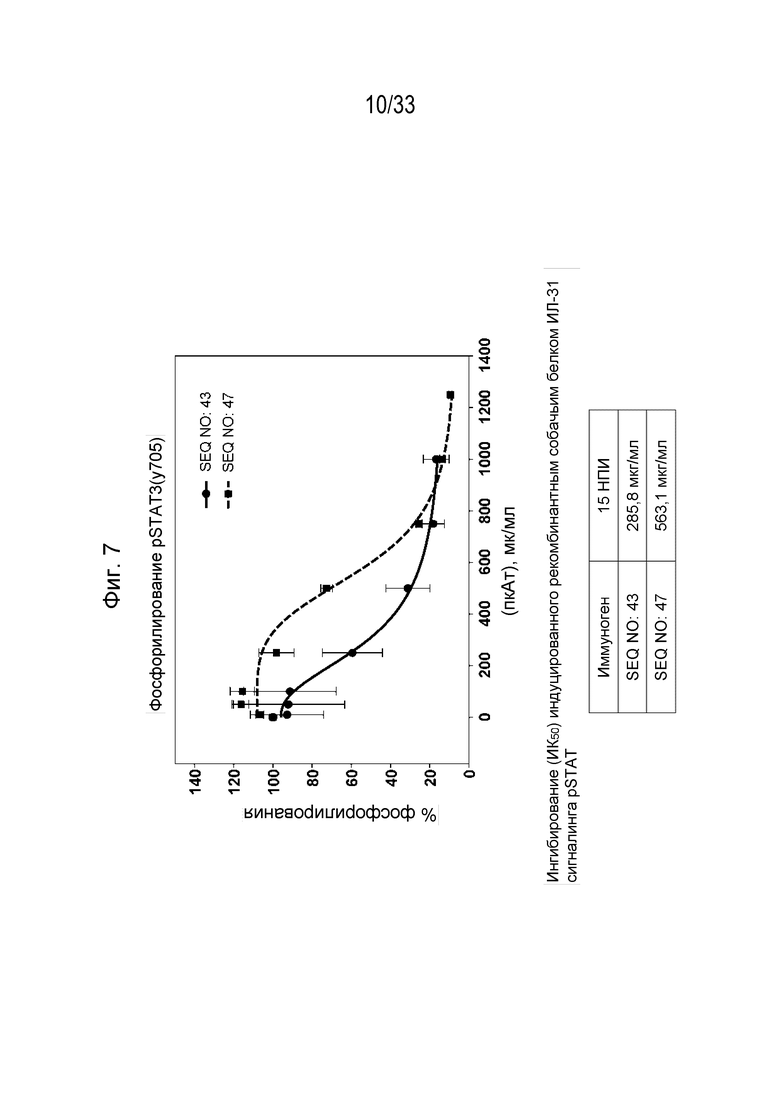
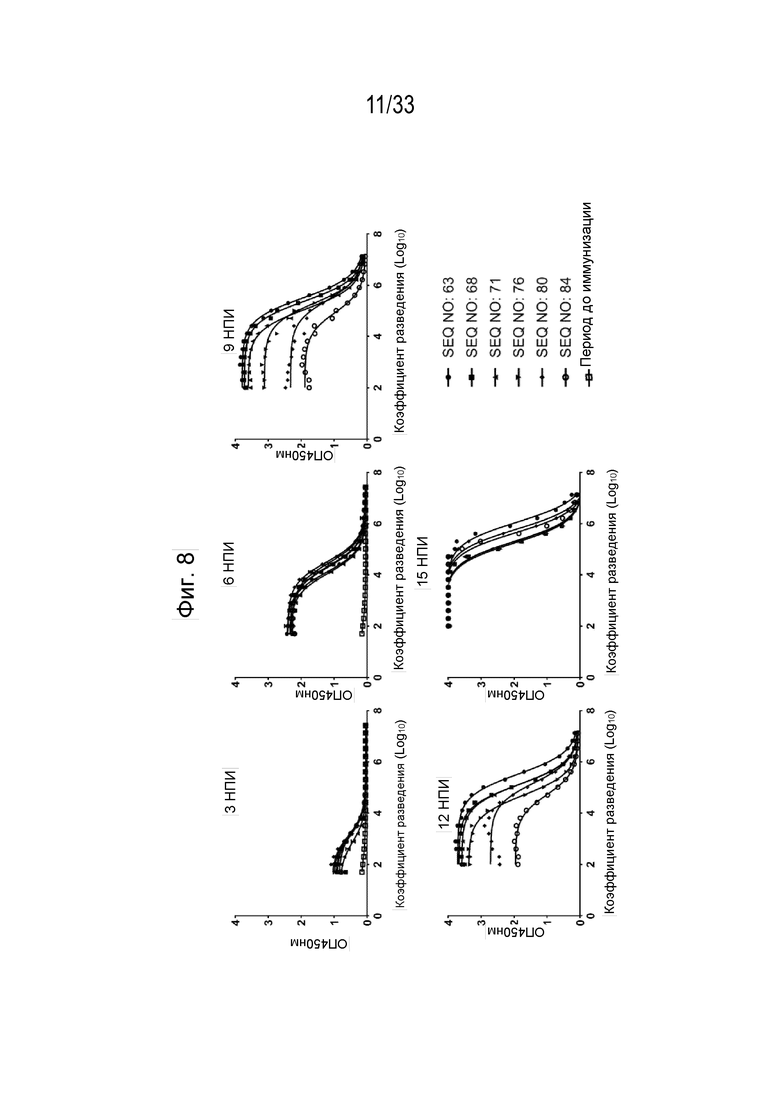
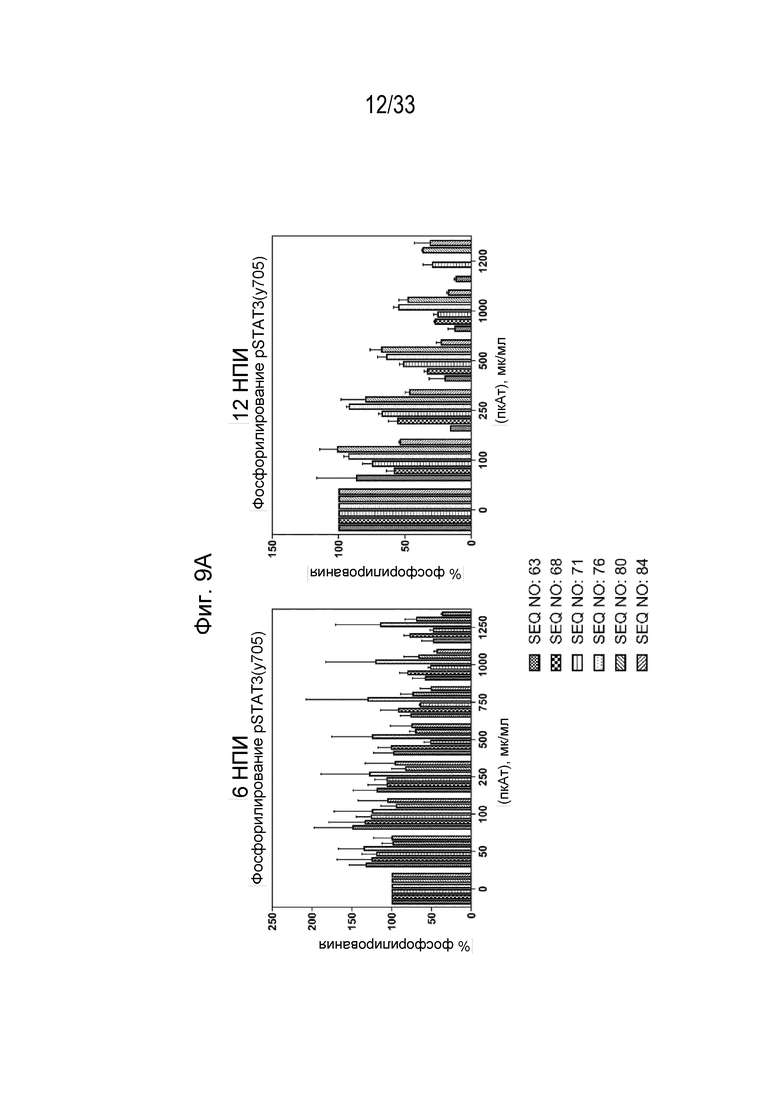
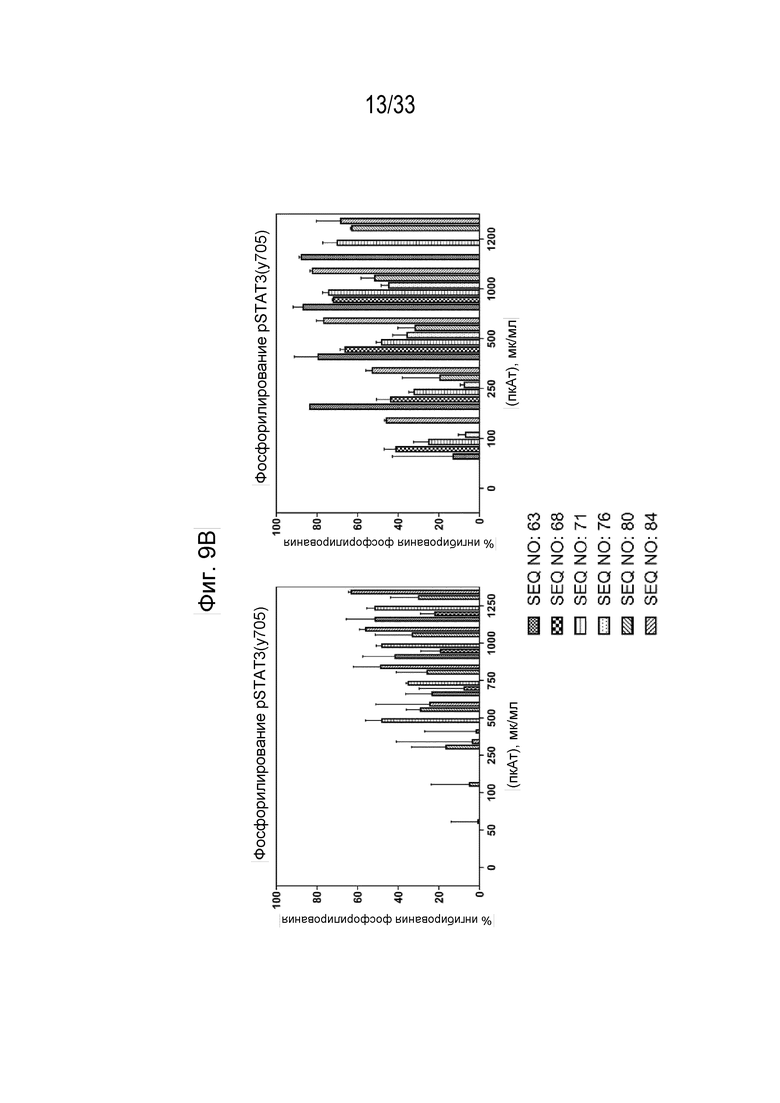
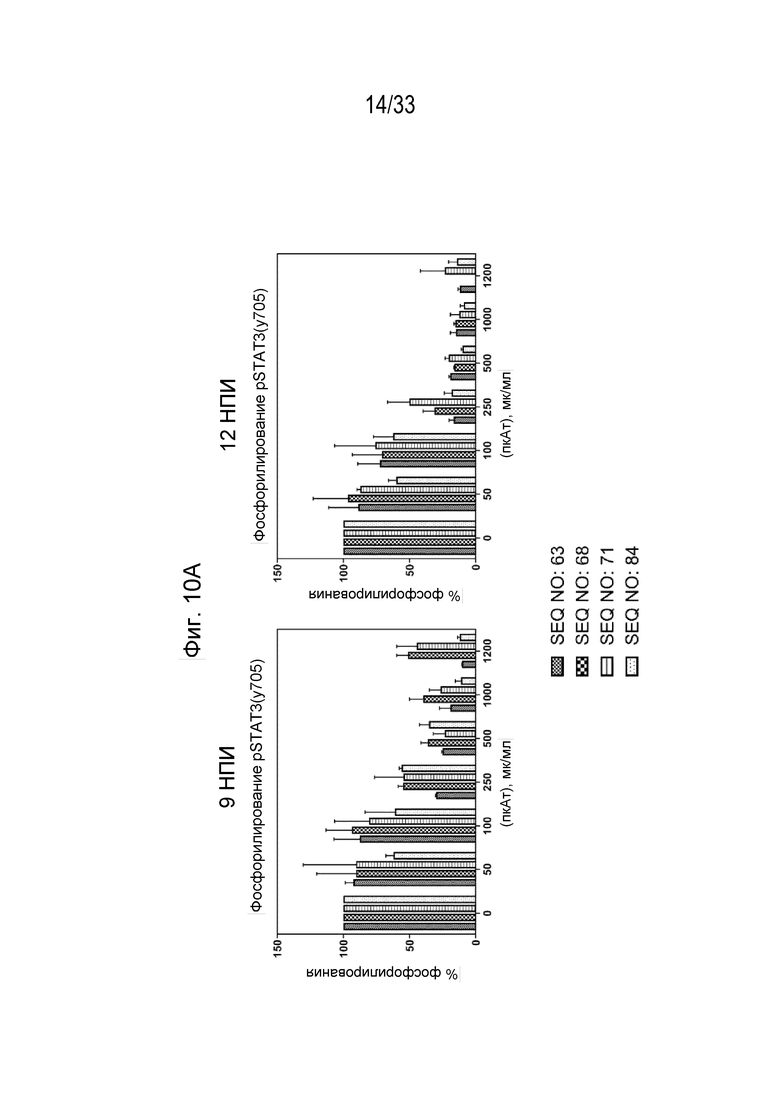
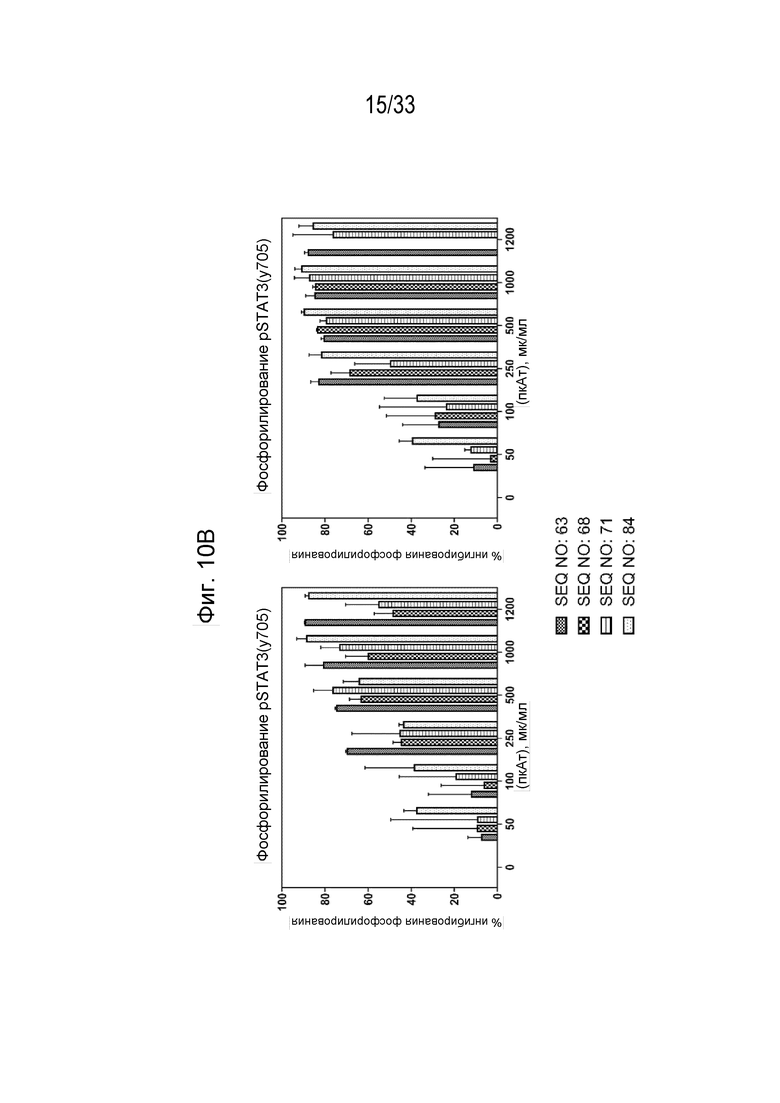
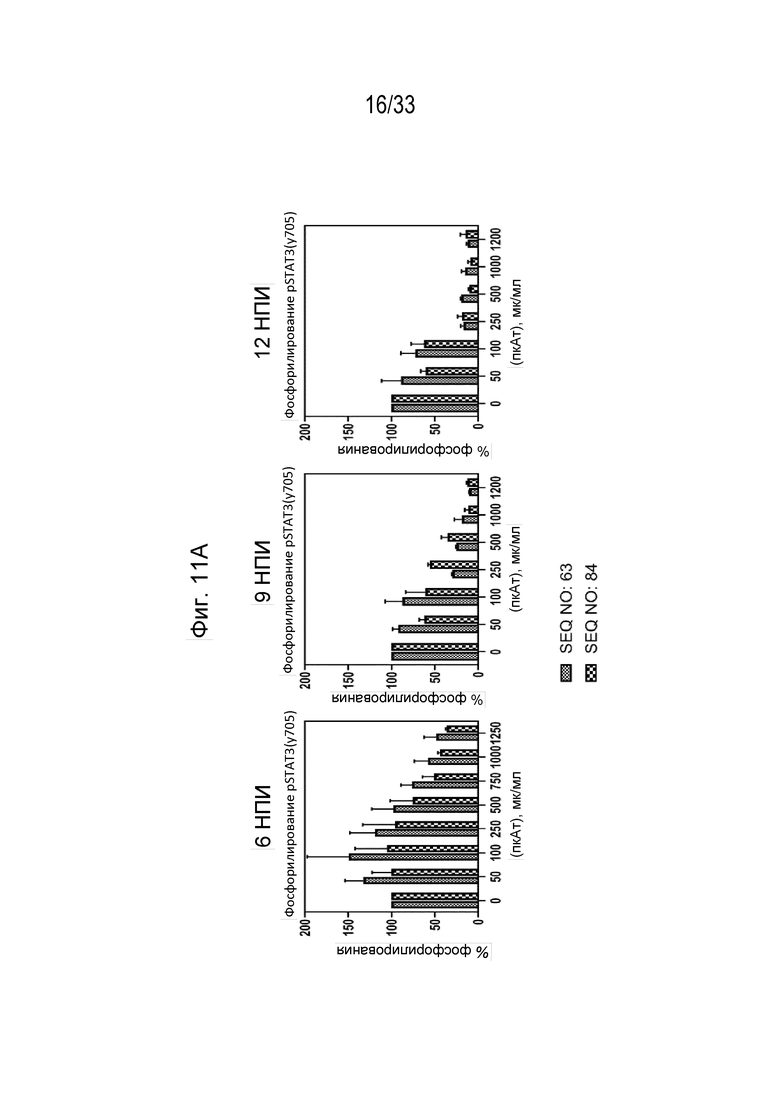
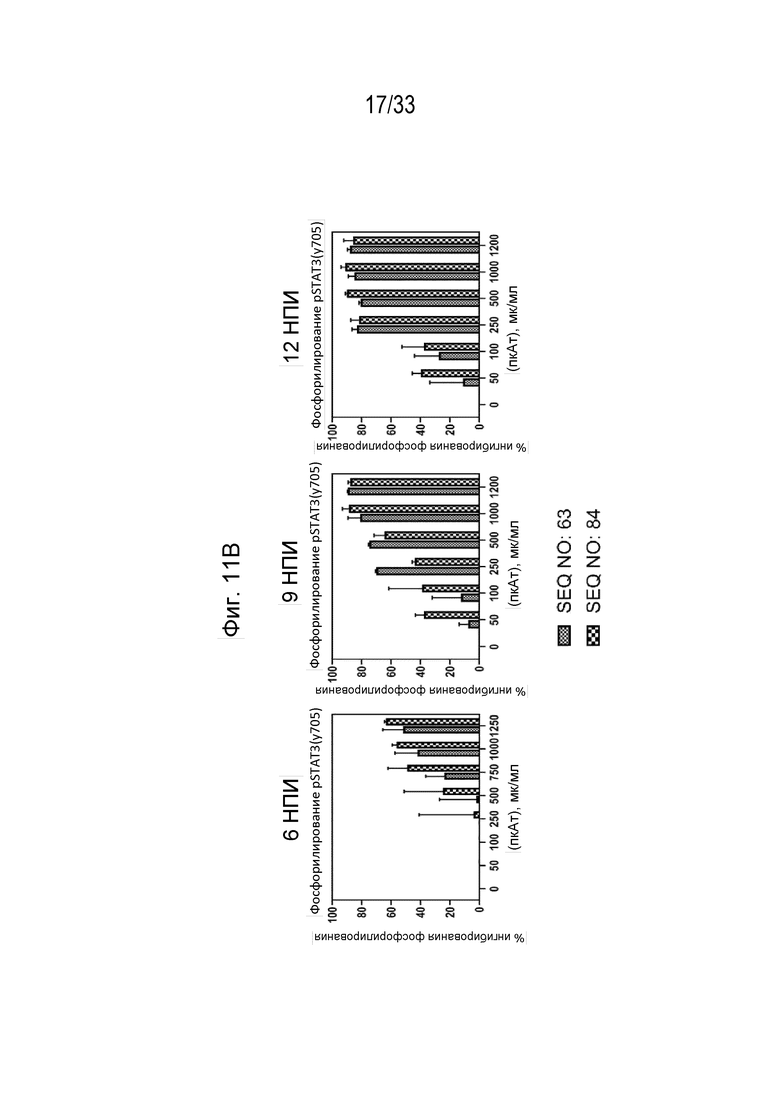
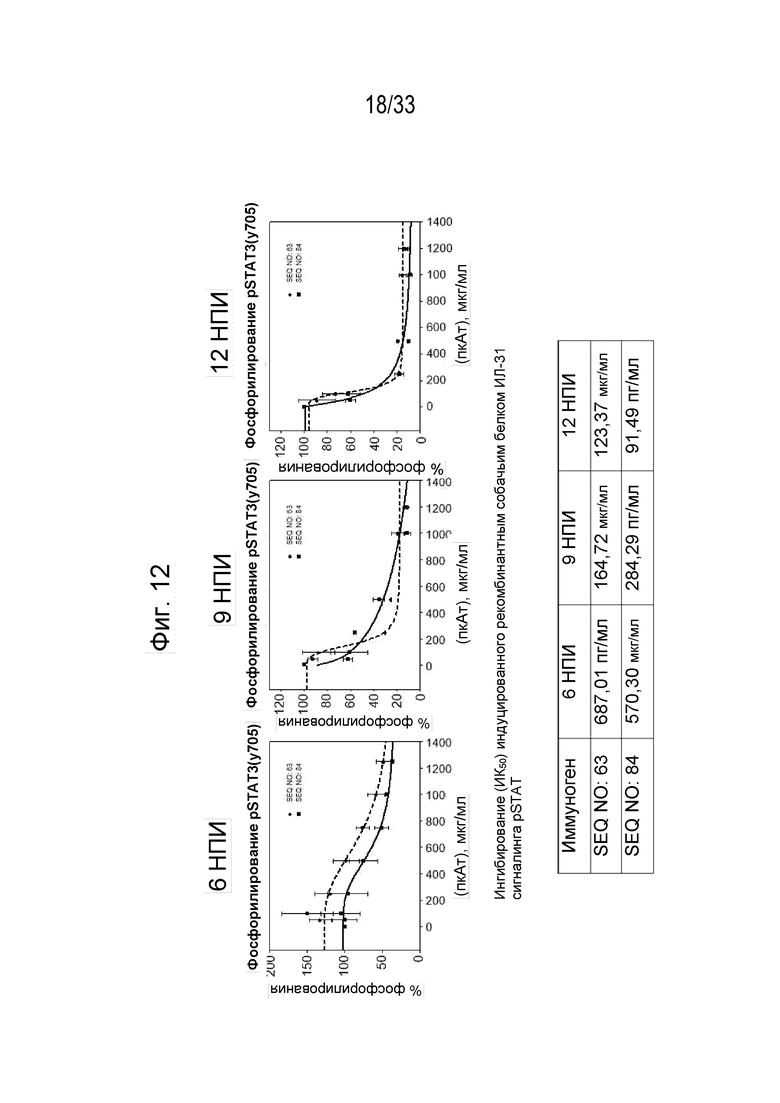
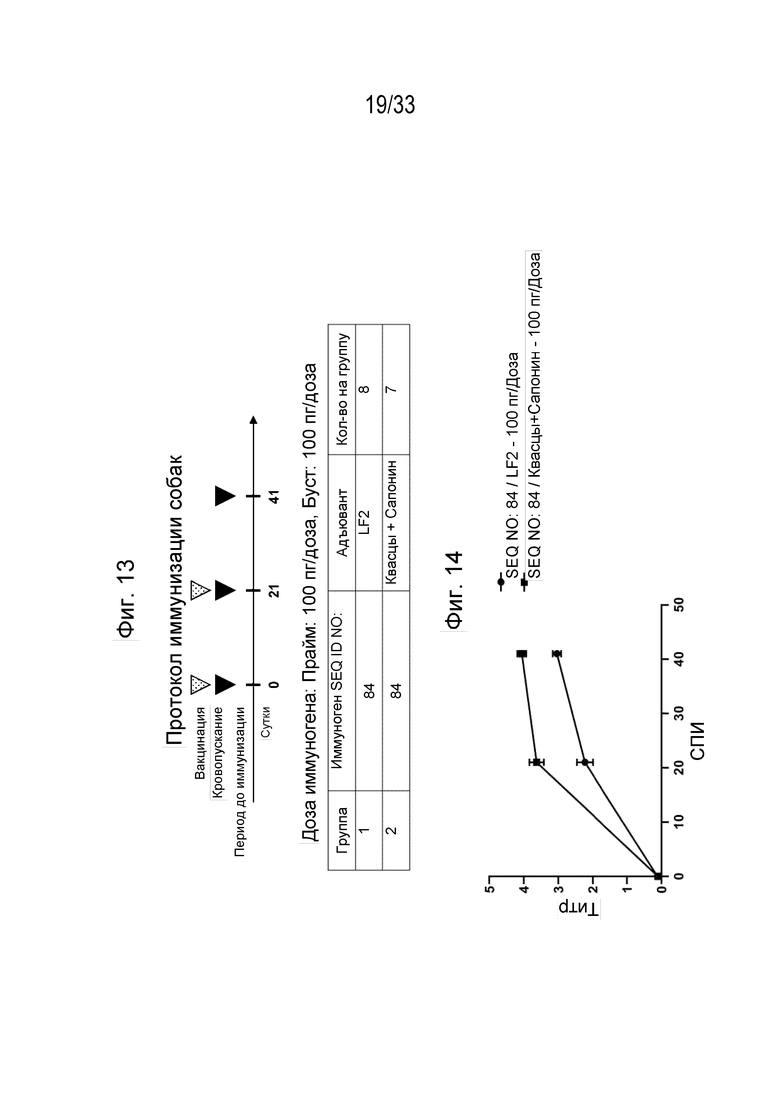
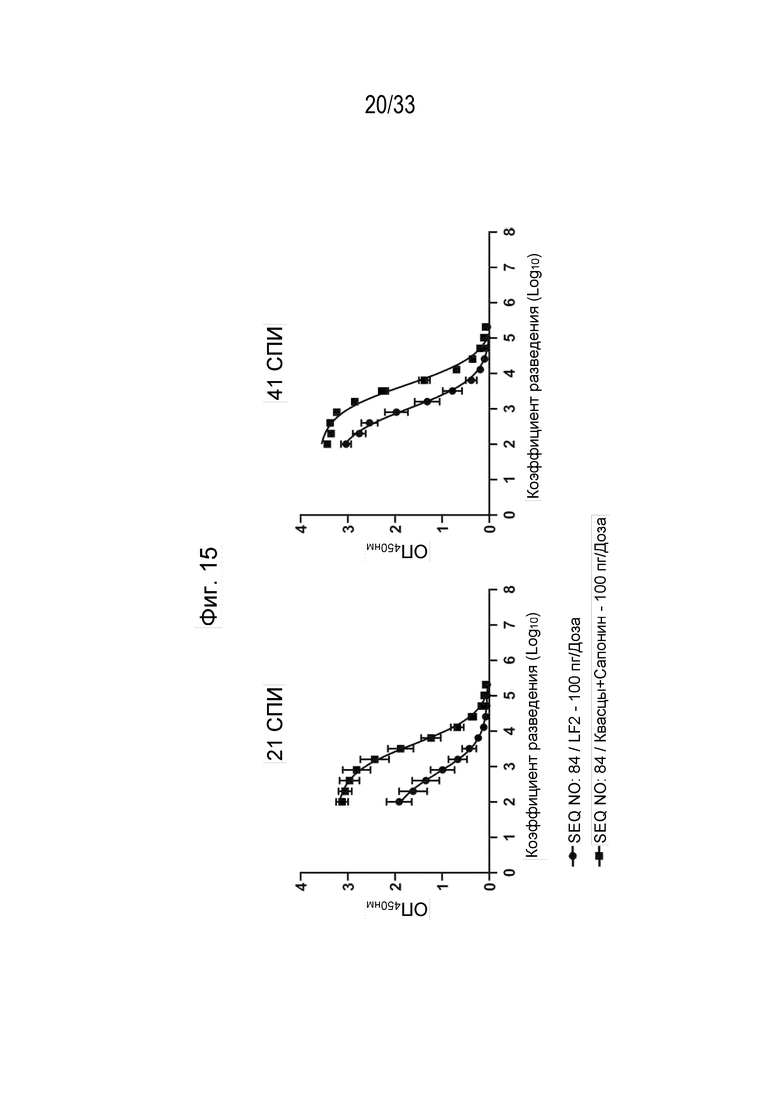
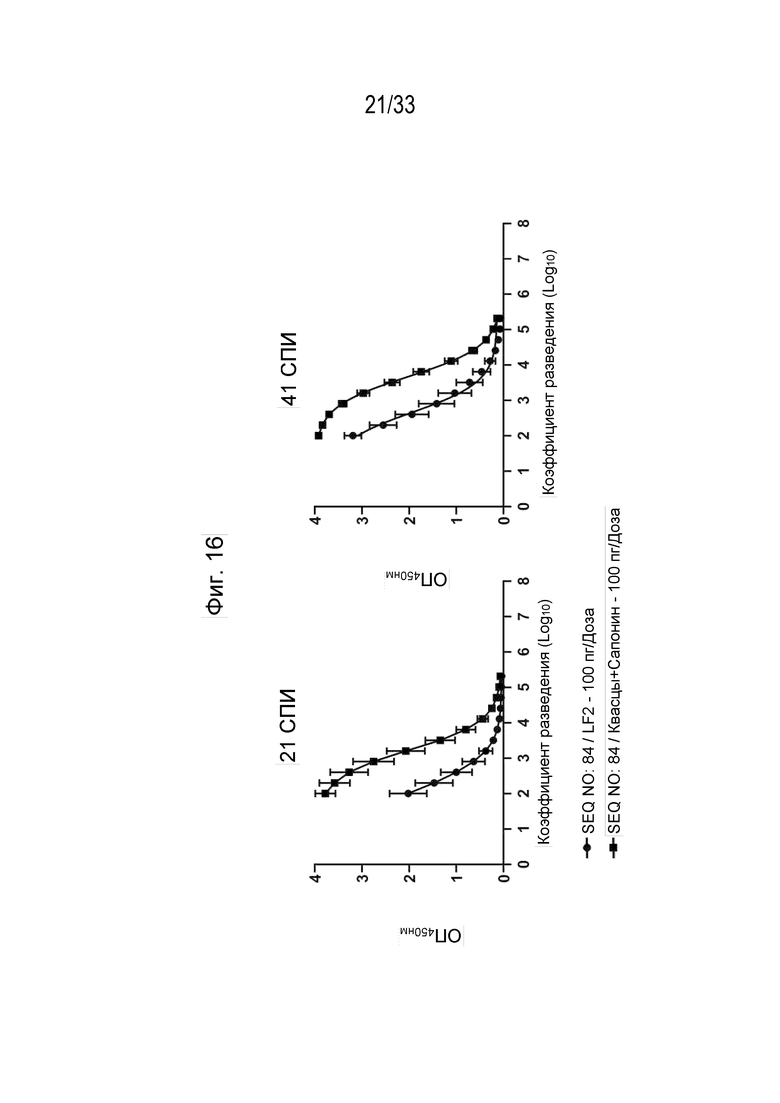
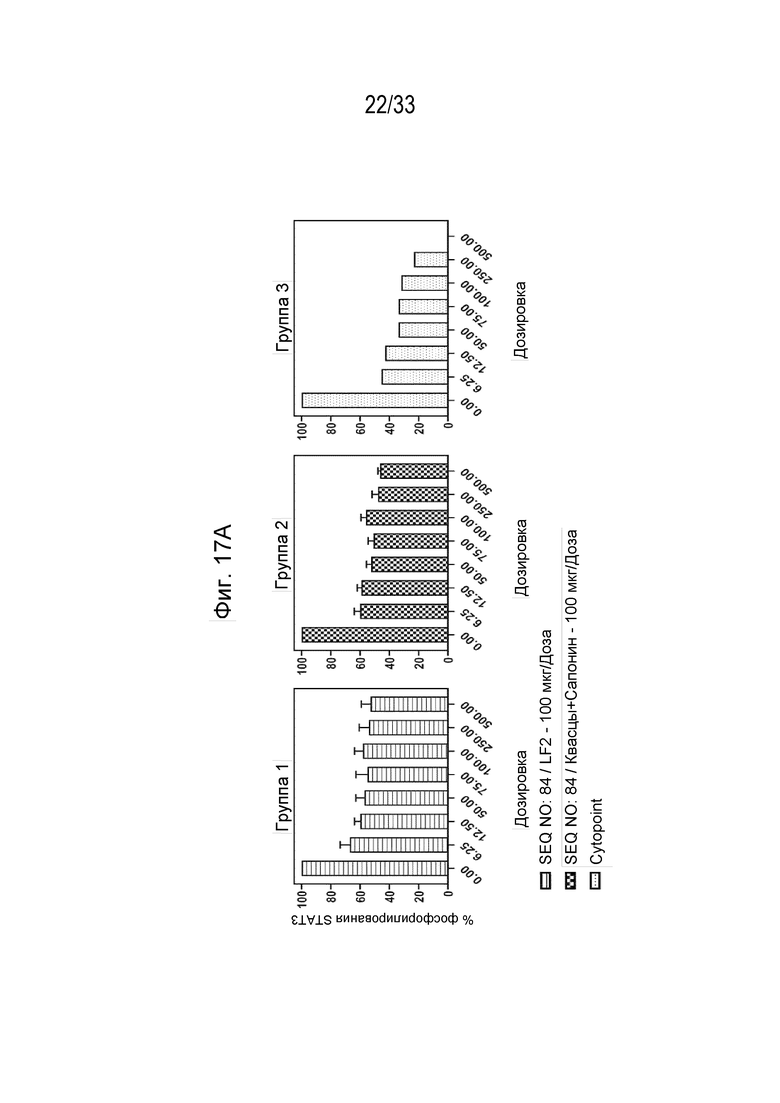
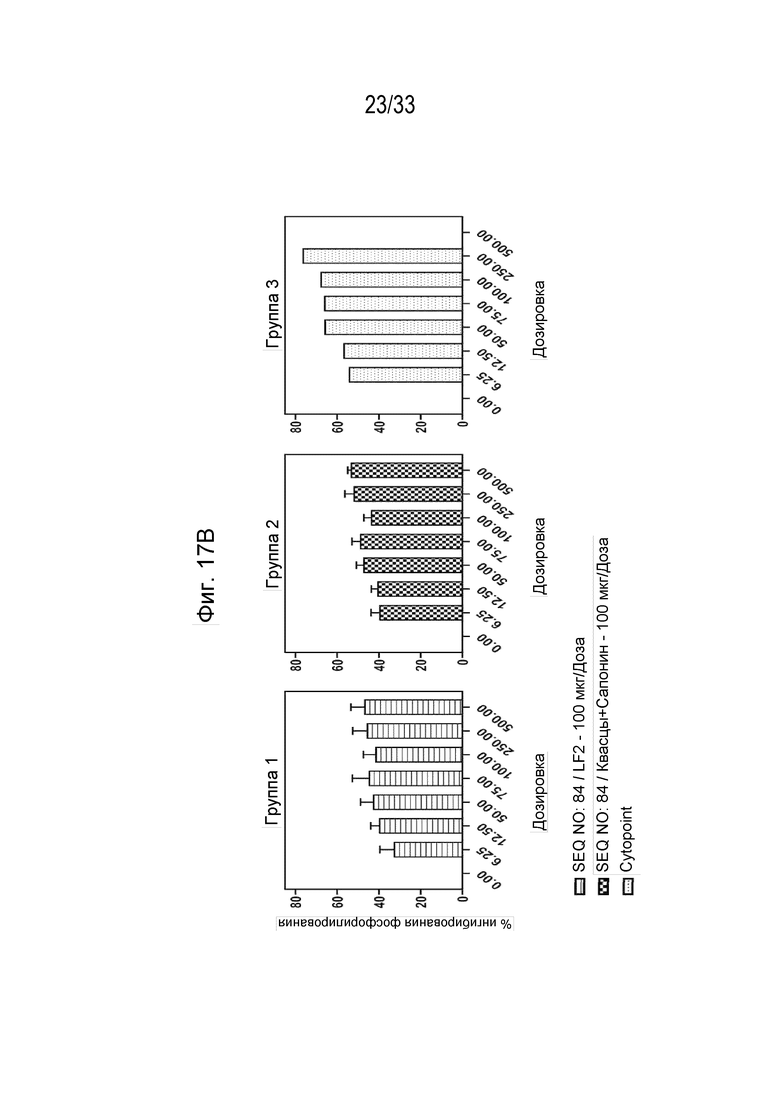
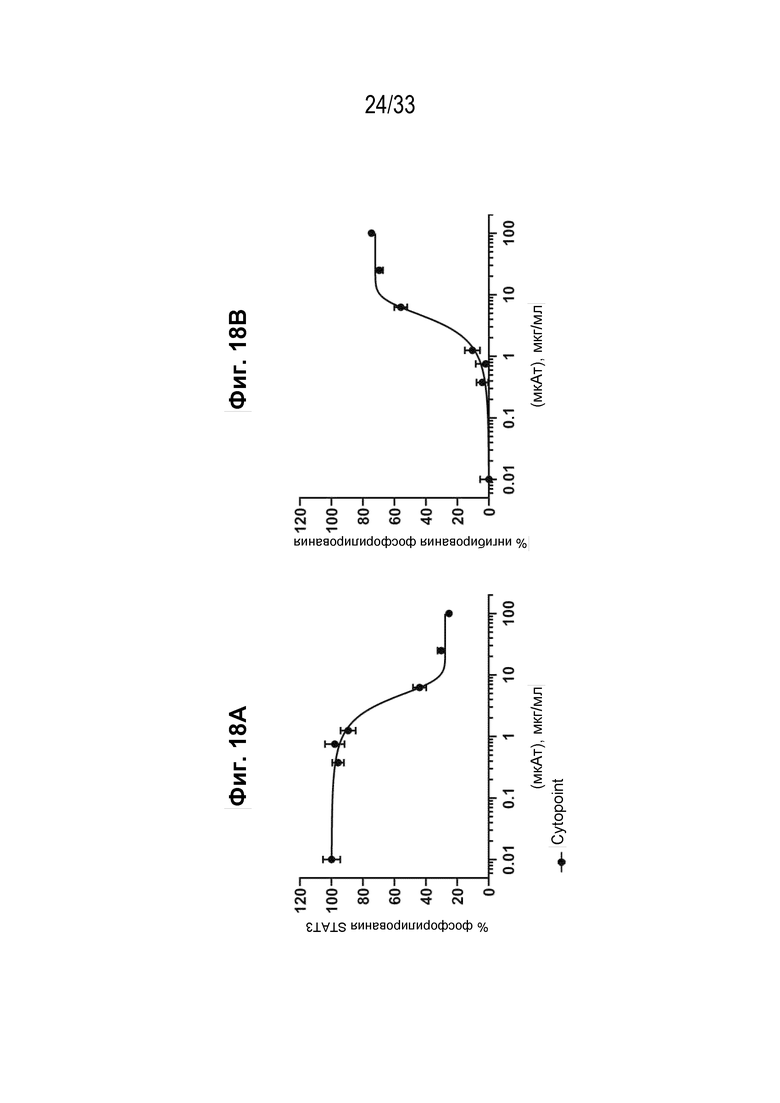

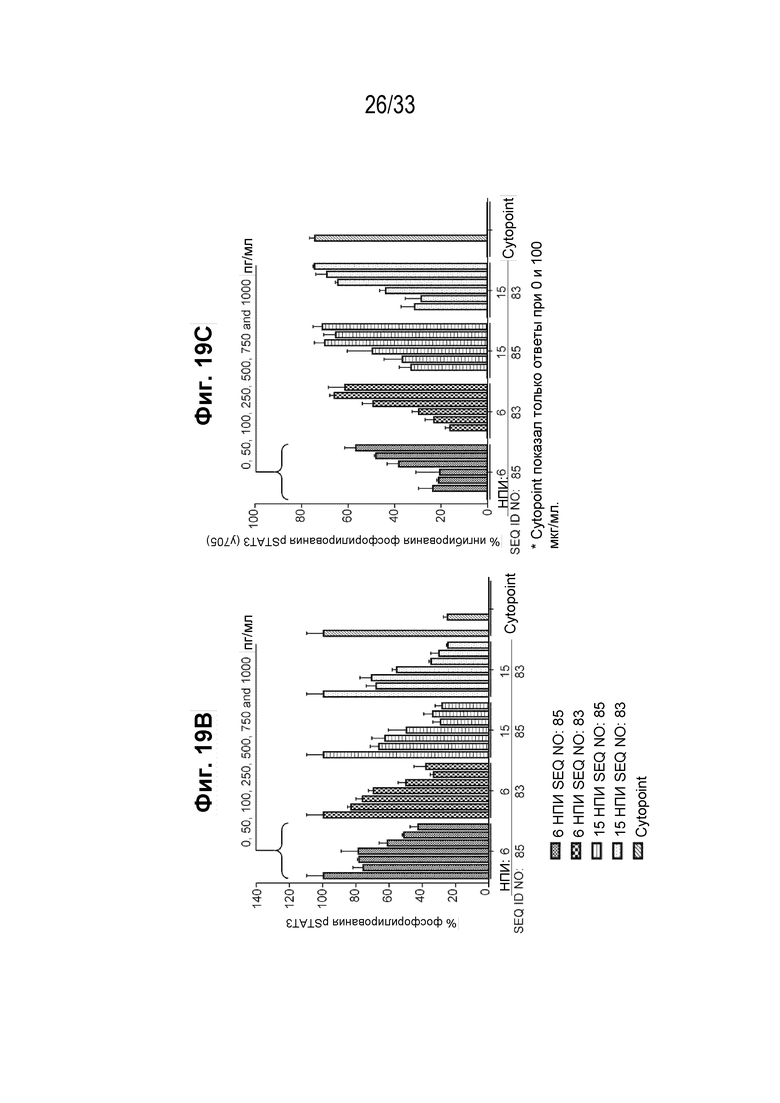
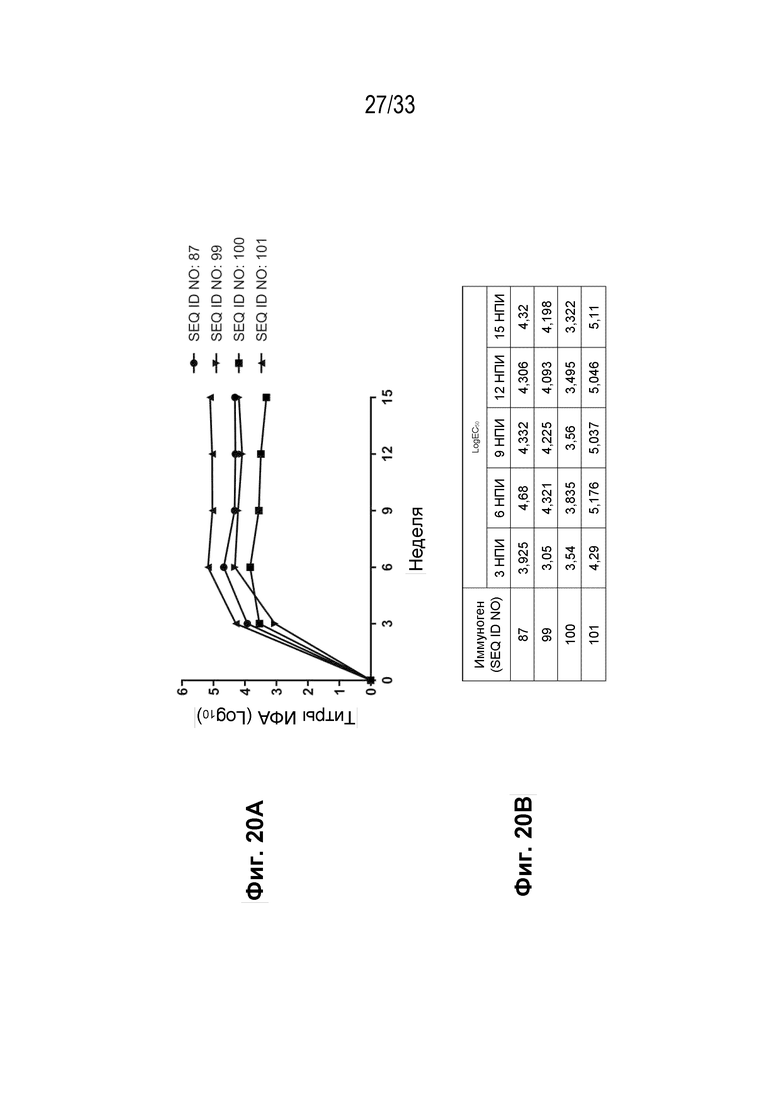
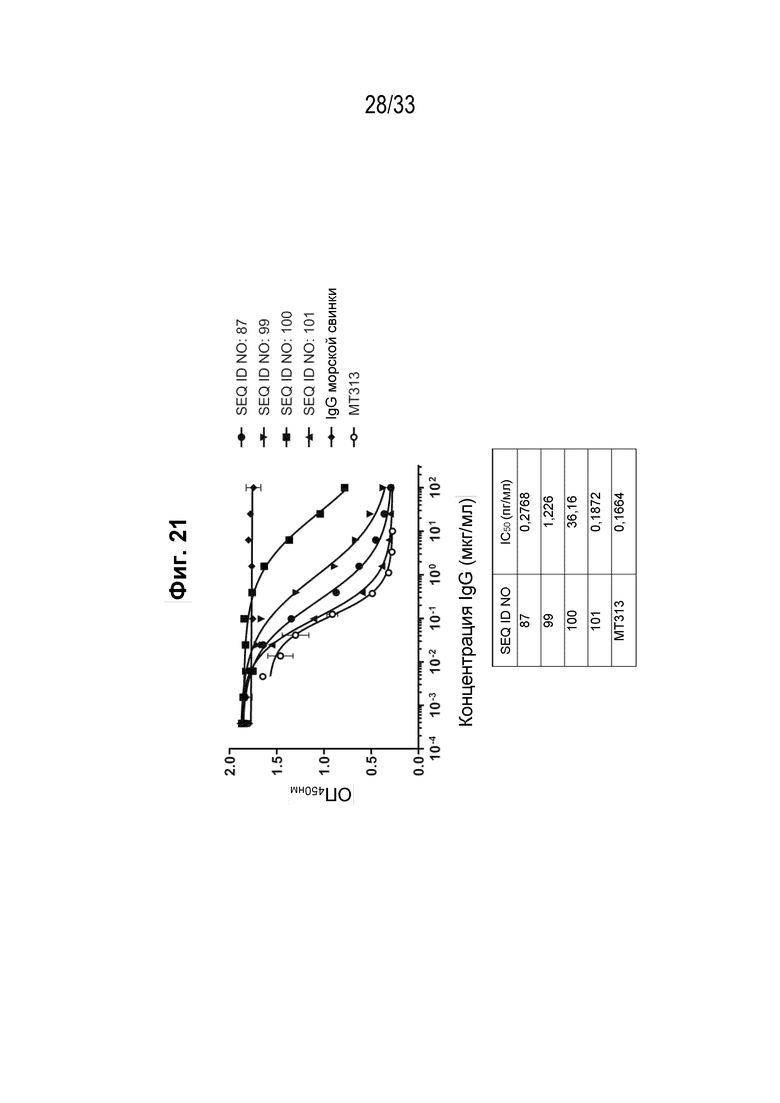
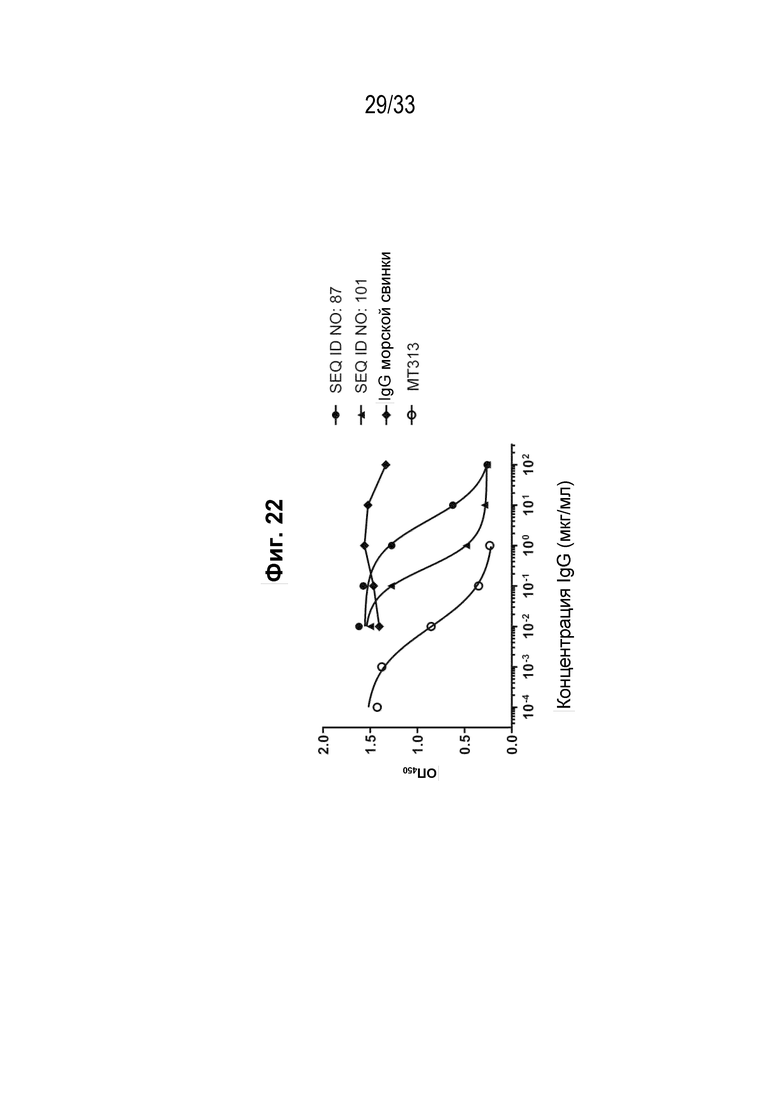
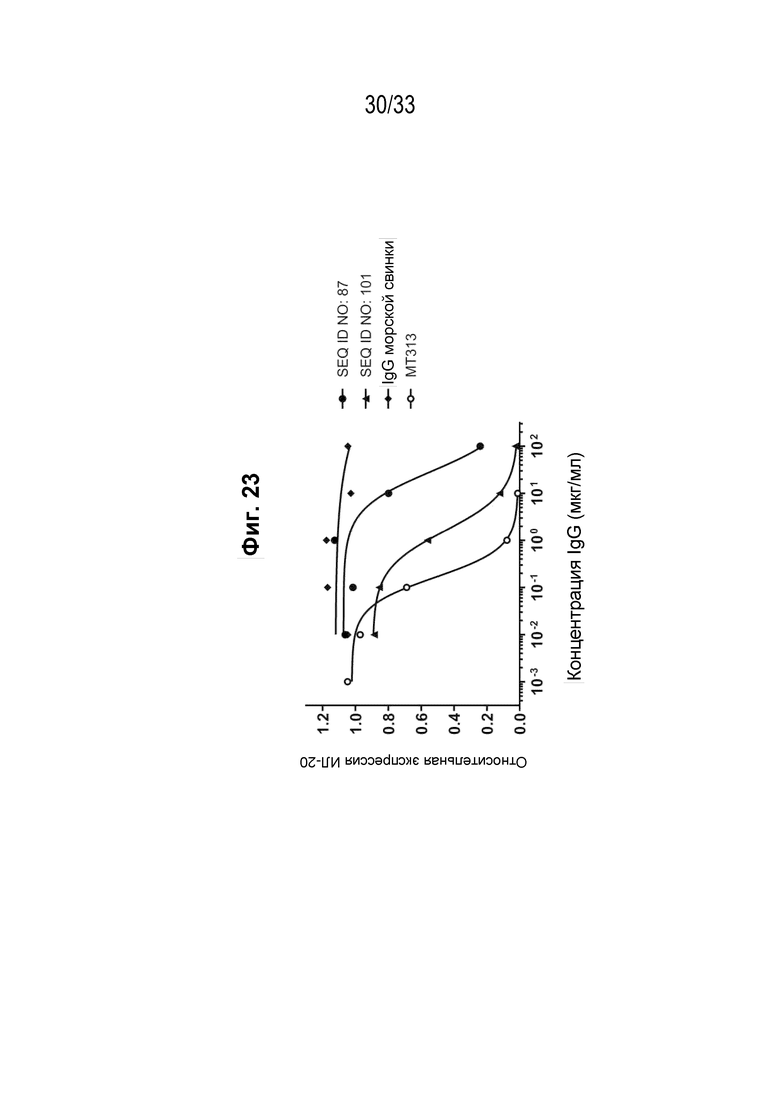
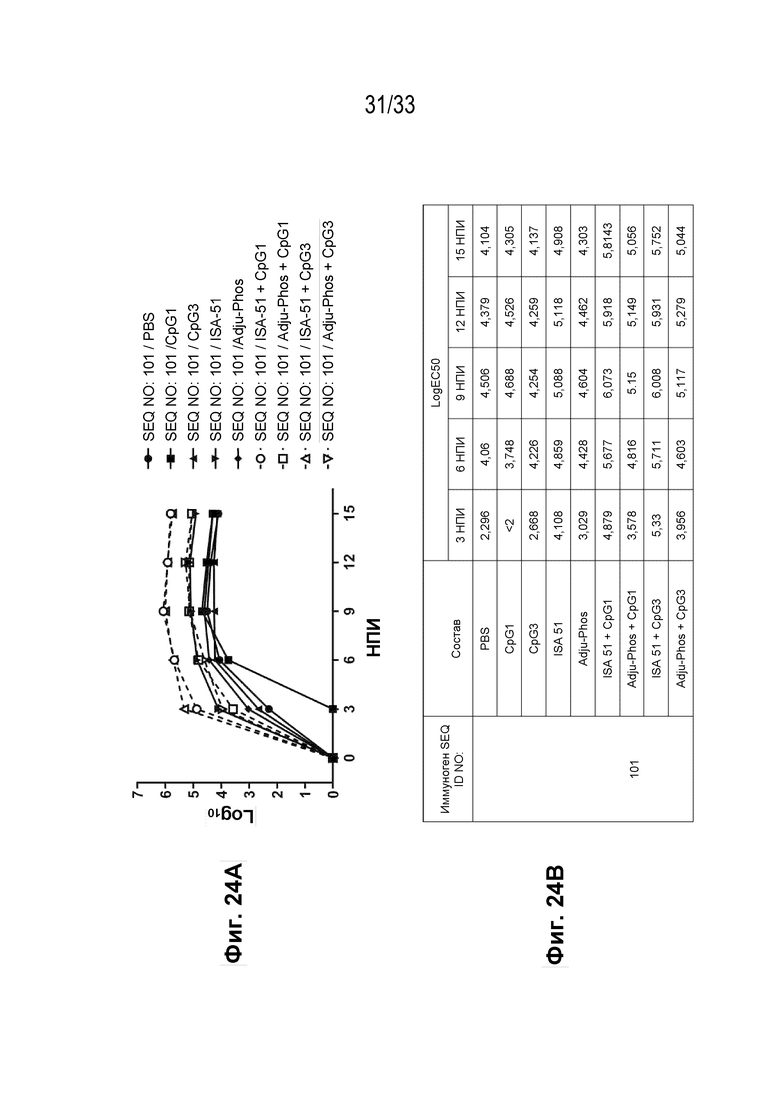
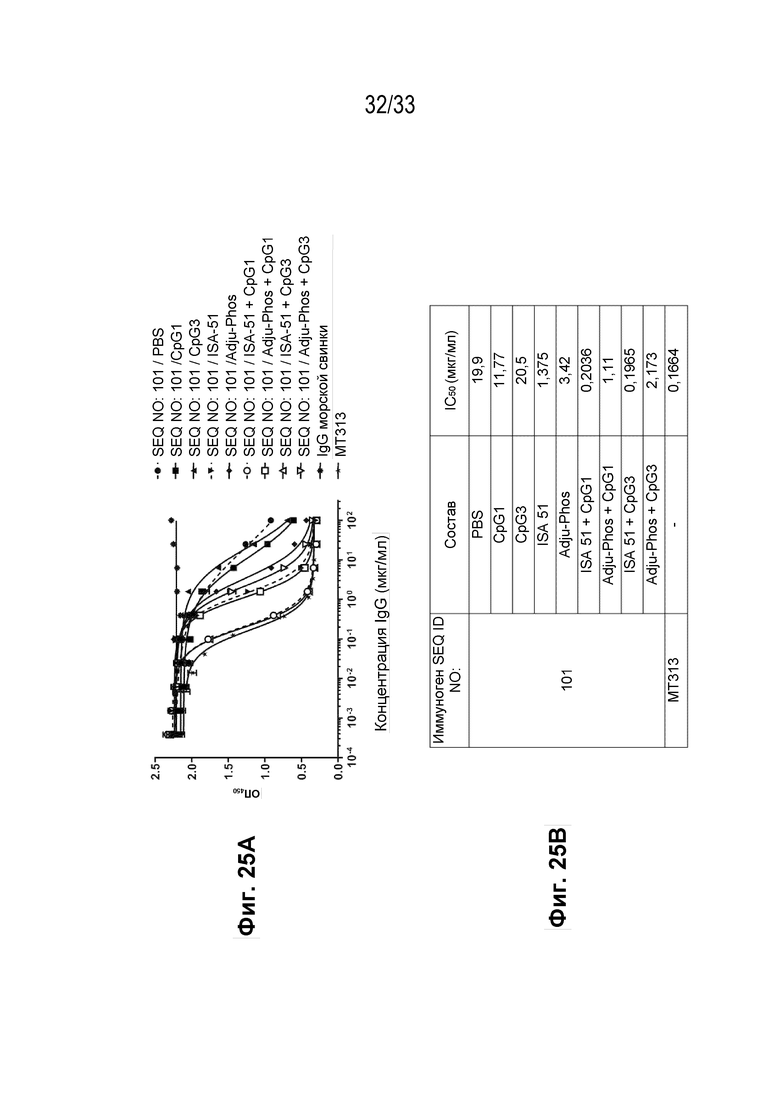
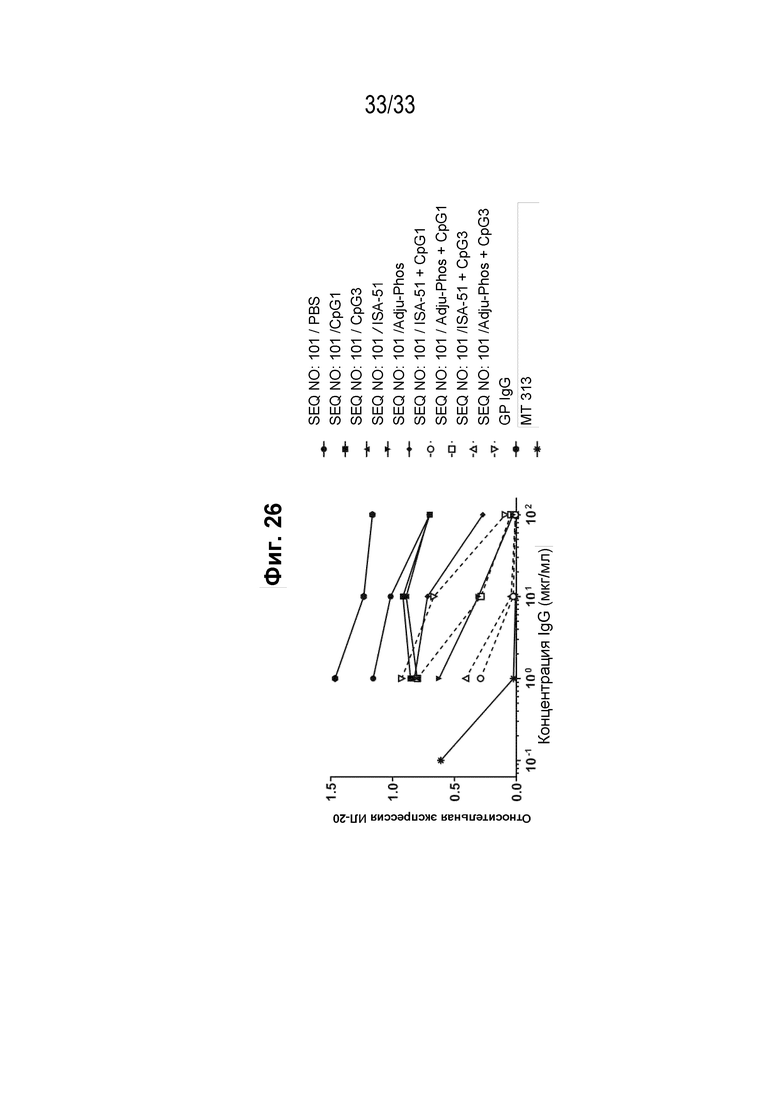
Настоящее изобретение относится к области биотехнологии, в частности к новым иммуногенным пептидным конструкциям, и может быть использовано в медицине. Изобретение раскрывает пептидную конструкцию, нацеленную на части белка интерлейкина-31 (IL-31), а также фармацевтические составы, включающие ее в качестве активного ингредиента. Изобретение может быть использовано в медицинской практике при профилактике или лечении зуда и различных сопровождающихся зудом аллергических состояний, в том числе при лечении атопического дерматита. 2 н. и 1 з.п. ф-лы, 26 ил., 15 табл., 13 пр.
1. Пептидная иммуногенная конструкция интерлейкина-31 (IL-31) для лечения или профилактики атопического дерматита, выбранная из группы, состоящей из SEQ ID NO: 43-90 и 99-105.
2. Фармацевтическая композиция для лечения или профилактики атопического дерматита, содержащая:
a) эффективное количество пептидной иммуногенной конструкции IL-31 по п. 1; и
b) фармацевтически приемлемый носитель для доставки и/или адъювант.
3. Фармацевтическая композиция по п. 2, где указанная пептидная иммуногенная конструкция IL-31 смешана с CpG-олигодезоксинуклеотидом (ODN) для образования стабилизированного иммуностимулирующего комплекса.
| US 6713301 B1, 30.03.2004 | |||
| WO 2017186813 A1, 02.11.2017 | |||
| US 20140286958 A1, 25.09.2014 | |||
| МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА ПРОТИВ IL-31 И СПОСОБЫ ПРИМЕНЕНИЯ | 2006 |
|
RU2444528C2 |
Авторы
Даты
2023-07-05—Публикация
2018-12-11—Подача