Данная заявка представляет собой международную заявку согласно РСТ, в которой испрашивается приоритет по предварительной заявке США с серийным номером 62/786 192, поданной 28 декабря 2018 г., которая в полном объеме включена в данный документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Настоящее описание относится к пептидным иммуногенным конструкциям, нацеленным на интерлейкин 6 (IL-6), и их составам для иммунотерапии заболеваний, на которые влияет нарушение регуляции IL-6.
УРОВЕНЬ ТЕХНИКИ
IL-6 представляет собой небольшой (~25 кДа) секретируемый гликопротеин, состоящий из 184 аминокислот (таблица 1) и характеризующийся структурой в виде четырехспирального пучка. Он вырабатывается несколькими типами клеток, включая лейкоциты (Т- и В-лимфоциты, моноциты, макрофаги), фибробласты, остеобласты, кератиноциты, эндотелиальные клетки, мезангиальные клетки, адипоциты, скелетные миоциты, кардиомиоциты, клетки головного мозга (астроглиоцит, микроглиоцит, нейроны) и некоторые опухолевые клетки, в ответ на различные стимулы, такие как липополисахариды и другие бактериальные продукты, вирусы, цитокины (ФНО-α, IL-1, трансформирующий фактор роста-β (TGF-β)), аденозинтрифосфат, паратгормон, витамин D3, гомоцистеин и ангиотензин II (Sebba, 2008).
Циркулирующий IL-6 присутствует в крови здоровых людей в низкой концентрации (≤1 пг/мл), которая значительно повышается при воспалительных реакциях, достигая значений в диапазоне нг/мл при сепсисе. IL-6 существенно способствует иммунной защите организма против инфекций и повреждений тканей, стимулируя иммунный ответ острой фазы и гемопоэз. Кроме того, он также регулирует метаболические, регенеративные и нервные процессы в физиологических условиях. После высвобождения IL-6 оказывает плейотропное биологическое воздействие путем активации уникальной системы сигнализации рецептора IL-6 (IL-6 R), включая молекулы IL-6R и нисходящие сигнальные молекулы.
IL-6R состоит из двух цепей: (1) IL-6-связывающей цепи или IL-6Rα, которая существует в двух формах, а именно (a) трансмембранной IL-6Rα с массой 80 кДа (mIL-6Rα) и (b) растворимой IL-6Rα (sIL-6Rα) с массой 50-55 кДа, и (2) передающей сигнал цепи с массой 130 кДа, называемой IL-6Rβ (или gp130).
Мембранная IL-6Rα (или mIL-6Rα) экспрессируется на поверхности ограниченного числа типов клеток, а именно гепатоцитов, мегакариоцитов и лейкоцитов, включая моноциты, макрофаги, нейтрофилы, а также Т- и В-лимфоциты. Растворимая IL-6Rα (или sIL-6Rα) присутствует в человеческой плазме (25-75 нг/мл) и тканевых жидкостях и может быть получена путем протеолитического расщепления (шеддинга) mIL-6Rα металлопротеазами (дизинтегрином и металлопротеиназами (т.е. ADAM)) или реже - с помощью альтернативного сплайсинга путем исключения трансмембранного домена. Мембранная IL-6Rβ повсеместно экспрессируется на всех клетках человека (Sebba, 2008).
При связывании с IL-6Rα (mIL-6Rα или sIL-6Rα) IL-6 индуцирует гомодимеризацию цепей IL-6Rα/IL-6Rβ, что приводит к образованию гексамера (содержащего два белка IL-6, два белка IL-6Rα и два белка IL-6Rβ), что в свою очередь вызывает нисходящий сигнальный каскад (Rose-John, et al., 2017).
Клеточная активация посредством связывания IL-6 с mIL-6Rα называется «классической сигнализацией». Все остальные клетки, которые не экспрессируют mIL-6Rα, получают сигналы IL-6 путем «транс-сигнализации»: где IL-6 связывается с циркулирующей sIL-6Rα, и этот комплекс образует сигнальный комплекс с IL-6Rβ на клеточной поверхности. Транс-сигнализация может происходить в широком спектре клеток человека, тем самым способствуя объяснению плейотропной активности IL-6. В настоящее время известно, что гомеостатическая и регенеративная активность IL-6 опосредована классической сигнализацией, тогда как провоспалительный эффект вызван в основном активацией транс-сигнального пути. Все больше данных указывает на то, что транс-сигнализация IL-6 особенно участвует в развитии заболеваний. Растворимая форма sIL-6Rβ (или sgp130) также была обнаружена в кровотоке в относительно высоких концентрациях, что в основном было вызвано альтернативным сплайсингом. Поскольку sIL-6Rβ может связываться с комплексом IL-6/sIL-6Rα, она действует в качестве природного и специфического ингибитора опосредованной IL-6 транс-сигнализации, тогда как на классическую сигнализацию sIL-6Rβ не оказывает никакого влияния.
В то время как IL-6Rα является уникальным рецептором связывания для IL-6, передающая сигнал цепь IL-6Rβ (или gp130) является общей для членов семейства IL-6, содержащего фактор ингибирования лейкоза, онкостатин М, цилиарный нейротрофический фактор, IL-11, кардиотропин-1, нейропоэтин-1, IL-27 и IL-35.
После связывания IL-6 гомодимеризация рецептора способствует взаимодействию цепи IL-6Rβ (или gp130) с тирозинкиназой JAK (Янус-киназа), что приводит к их взаимной трансактивации. В свою очередь активация JAK инициирует три основных внутриклеточных сигнальных пути посредством фосфорилирования двух ключевых белков: 1) тирозин фосфатазы-2 (SHP-2) с доменом гомологии Srс и 2) переносчика сигнала и активатора транскрипции (STAT1-STAT3). После фосфорилирования SHP-2 может взаимодействовать с Grb2 (белком 2, связанным с рецептором фактора роста), что приводит к активации каскада Ras/ERK/MAPK (белок саркомы крыс/внеклеточная сигнальная киназа/митоген-активируемая протеинкиназа); и/или активировать путь PI3K/Akt (фосфоинозитол-3-киназа/протеинкиназа B). И наоборот, фосфорилирование белков STAT индуцирует образование гетеродимеров (STAT1/STAT3) или гомодимеров (STAT1/STAT1 и/или STAT3/STAT3), которые впоследствии транслоцируются в ядро. Во всех случаях активация этих внутриклеточных путей приводит к индукции транскрипции нескольких генов-мишеней, отвечающих за плейотропную биологическую активность IL-6 (Lazzerini, et al., 2016).
IL-6 обладает широким спектром биологических активностей, играющих решающую роль в активации острого воспалительного ответа, а также в переходе от врожденного иммунитета к приобретенному. IL-6 выполняет несколько дополнительных функций во множестве других процессов, включая метаболизм, когнитивную функцию и эмбриональное развитие.
Был изучен эффект IL-6 на активацию острого воспалительного ответа. При возникновении инфекций или поражений тканей различного происхождения быстро возникает системный ответ острой фазы, чтобы нейтрализовать патогены и предотвратить их дальнейшее распространение, минимизировать повреждение тканей и способствовать заживлению ран. Этот ответ острой фазы, заключающийся в повышении температуры и выработке гепатоцитами белков острой фазы, преимущественно управляется IL-6.
Если точнее, IL-6 повышает температуру тела, воздействуя на нейроны преоптической зоны гипоталамуса, участвующей в терморегуляции, и стимулирует синтез в печени белков острой фазы, таких как С-реактивный белок (СРБ), фибриноген, компонент комплемента С3, сывороточный амилоид A, гепсидин, гаптоглобин, α1-кислый гликопротеин, α1-антитрипсин, α1-антихимотрипсин и церулоплазмин, тогда как выработка альбумина, трансферрина, фибронектина, транстиретина и ретинол-связывающего белка («отрицательные» белки острой фазы) ингибируется.
Кроме того, IL-6 способствует дифференцировке моноцитов в макрофаги, стимулирует созревание миелоидных клеток-предшественников и мегакариоцитов, вызывая нейтрофилию и тромбоцитоз, индуцирует ангиогенез посредством выработки фактора роста эндотелия сосудов, повышает транспорт лимфоцитов и нейтрофилов путем повышения экспрессии молекул адгезии на эндотелиальных клетках (в частности, молекулы внутриклеточной адгезии 1 (ICAM-1) и молекулы адгезии сосудистых клеток 1 (VCAM-1)), повышает выработку антител В-лимфоцитами и стимулирует пролиферацию хелперных T-лимфоцитов (TH), способствуя их дифференцировке в клетки TH2 или TH17. Во всех случаях эти изменения посредством разных, но синергических механизмов способствуют реализации комплексного ответа в виде иммунной защиты организма.
Помимо ключевой роли в иммуновоспалительном ответе, IL-6 также играет важную роль в физиологических условиях, модулируя ряд мультисистемных функций, таких как эмбриогенез, метаболизм глюкозы и липидов, ремоделирование кости, регенерация печени, гомеостаз нервной ткани, когнитивная функция, сон, память, боль и эмоциональное поведение.
Знание этих дополнительных иммуновоспалительных эффектов может помочь объяснить патогенез некоторых системных проявлений, наблюдаемых при ревматоидном артрите (РА) и других хронических воспалительных заболеваниях, характеризующихся постоянно повышенными уровнями IL-6.
У пациентов с РА влияние этого цитокина на метаболизм и гомеостаз кости представляет особый патофизиологический и клинический интерес.
Жировая ткань в значительной степени способствует выработке IL-6 в физиологических условиях, составляя ~35% уровня циркулирующего IL-6. При длительных физических нагрузках сокращающаяся скелетная мышца становится основным источником IL-6, повышая его уровни в плазме в 100 раз. IL-6 стимулирует липолиз (и ингибирует липогенез) в адипоцитах и повышает поглощение холестерина и триглицеридов периферическими тканями посредством повышения экспрессии рецепторов липопротеинов очень низкой плотности, способствуя снижению массы тела и снижению уровня липидов в сыворотке. Кроме того, IL-6 повышает чувствительность гепатоцитов и мышечных клеток к инсулину, повышая утилизацию глюкозы и толерантность к ней. Хотя такой эффект свидетельствует о том, что этот цитокин может быть частью физиологического механизма, лежащего в основе вызванного физической нагрузкой повышения активности инсулина, которая увеличивает выносливость. Однако хроническое повышение уровня IL-6 частично вследствие, например, длительной чрезмерной нагрузки может привести к инсулинорезистентности в клетках печени и жировых клетках.
Что касается воздействия на костную ткань, IL-6 влияет на резорбцию и формирование костной ткани, необходимые для развития, роста и поддержания скелета, путем регуляции дифференцировки и активности остеобластов, остеокластов и хондроцитов. Роль IL-6 в повышении экспрессии лиганда рецептора-активатора ядерного фактора каппа-В (RANKL) на поверхности стромальных/остеобластных клеток, что в свою очередь стимулирует дифференцировку остеокластов и резорбцию костной ткани, может способствовать ремоделированию кости с потенциальным положительным эффектом для гомеостаза кости в физиологических условиях. При РА его повышенная и длительная активация индуцирует аномальный остеокластогенез, приводящий к остеопорозу и разрушению кости.
Обновленный обзор IL-6, рецептора IL-6, передачи сигнала IL-6, плейотропного биологического воздействия IL-6, воздействия на иммуновоспалительный ответ, дополнительных иммуновоспалительных эффектов, а также роли IL-6 в различных патологических состояниях, включая ревматоидный артрит, развитие аутоиммунных процессов, повреждения суставов, внесуставные проявления, включен в настоящий документ посредством ссылки (Lazzerini, P., et al., 2016), где можно найти подтверждающую документацию для утверждений, сделанных в разделе «Уровень техники» выше.
Поскольку IL-6 представляет собой плейотропный цитокин, который участвует в физиологии практически всех систем органов и играет основную роль в ответе на повреждение или инфекцию, аберрантная экспрессия IL-6 наблюдается при различных заболеваниях человека, особенно при воспалительных и аутоиммунных нарушениях, болезнях коронарных артерий и неврологических заболеваниях, гестационных нарушениях и новообразованиях.
Существует интерес к разработке антител для ингибирования связывания IL-6 с комплексом IL6R (т.е. IL-6Rα и IL-6Rβ/или gp130) в качестве терапии против многих таких заболеваний. Первым таким разработанным антителом является тоцилизумаб, а вторым - сарилумаб. Оба эти антитела нацелены на IL-6R, и они были одобрены для лечения ревматоидного артрита, болезни Кастлемана и системного ювенильного идиопатического артрита. Силтуксимаб, моноклональное антитело, которое нацелено на IL-6, в настоящее время является единственным одобренным FDA США средством лечения идиопатической многоочаговой болезни Кастлемана (MCD). Сирукумаб, другое высокоаффинное моноклональное антитело к IL-6, разработанное для блокирования пути IL-6 у взрослых с ревматоидным артритом средней и тяжелой степени тяжести, не был рекомендован Консультативным комитетом по лечению артрита FDA для одобрения из-за повышенной смертности среди пациентов, которые принимали данный препарат. Многие другие моноклональные антитела к IL-6 или IL-6R (обсуждается у Rose-John, et al., 2017) активно изучаются в этом отношении. Хотя многие моноклональные антитела к IL-6 или рецептору IL-6 могут оказаться эффективными при иммунотерапии определенных заболеваний, они являются дорогостоящими и требуют частого и постоянного введения для обеспечения достаточной супрессии IL-6 в сыворотке и поддержания клинической эффективности вследствие их введения.
Также было описано несколько способов вакцинации для борьбы с иммунными заболеваниями, связанными с IL-6. В одном подходе в качестве иммуногена используется вариант IL-6 человека с семью аминокислотными заменами, Sant1 (De Benedetti, et al., 2001; патент США № 6,706,261). Однако со времени своего первоначального раскрытия почти два десятилетия назад эта работа не привела к каким-либо клиническим разработкам. Другая группа (Desallais, L., et al., 2014) сообщила об использовании пяти случайным образом выбранных пептидов IL-6, покрывающих более 40% белка IL-6 длиной 184 остатка, которые были присоединены посредством сложной процедуры химического связывания к большому белку-носителю KLH для повышения иммуногенности соответствующих пептидов. Полученная таким способом вакцина давала антитела, которые в основном были направлены на нежелательный белок-носитель KLH, и лишь небольшая их часть - на целевой IL-6. Кроме того, в состав этой вакцины должны были входить полный адъювант Фрейнда (ПАФ) и неполный адъювант Фрейнда (НАФ), которые являются не самым оптимальным решением для клинического и промышленного применения.
Как было описано выше, существует ряд ограничений и проблем с существующими дизайнами вакцин IL-6 (например, сложная процедура химического связывания для получения иммуногена; использование KLH в качестве белка-носителя, когда большинство вызванных антител направлены на белок-носитель; использование клинически неодобренного полного адъюванта Фрейнда для повышения иммуногенности при вакцинации; слабая иммуногенность против целевого IL-6 у вакцинированных животных, несмотря на использование наиболее агрессивного протокола иммунизации; неясный механизм действия и т.д.). Таким образом, очевидно, что существует неудовлетворенная потребность в разработке эффективной иммунотерапевтической вакцины, способной вызывать высокоспецифичные иммунные ответы против IL-6, которую можно будет легко вводить пациентам, производить в соответствии со строгими стандартами надлежащей производственной практики (GMP) и которая будет рентабельной для применения во всем мире для лечения пациентов, страдающих от заболеваний, на которые влияет нарушение регуляции IL-6.
Главная цель настоящего раскрытия заключается в создании/разработке пептидных иммуногенных конструкций IL-6 и их вакцинных составов, в которых В-эпитоп разработанных пептидных иммуногенных конструкций точно имитирует сайты связывания IL-6R на IL-6; причем такие пептидные иммуногенные конструкции и их составы способны вызывать сильные иммунные ответы у вакцинированных хозяев с целью нарушения иммунной толерантности к собственному белку IL-6 и выработки эффективных антител, нацеленных на сайт связывания IL-6R, для лечения заболеваний, на которые влияет нарушение регуляции IL-6.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее описание направлено на отдельные пептидные иммуногенные конструкции, нацеленные на интерлейкин 6 (IL-6), и их составы для иммунотерапии заболеваний, на которые влияет нарушение регуляции IL-6.
Такие отдельные пептидные иммуногенные конструкции IL-6 имеют длину 30 или более аминокислот и содержат функциональные В-клеточные эпитопы, полученные из связывающих рецептор IL-6 областей E42-C83 (SEQ ID NO: 16) или N144-I166 (SEQ ID NO: 19) или их фрагментов, которые связаны посредством остатков спейсера с гетерологичными эпитопами Т-хелперных клеток (Th-эпитопами), полученными из патогенных белков. Эти пептидные конструкции IL-6, содержащие разработанные В-клеточные и Th-клеточные эпитопы, действуют вместе, чтобы стимулировать выработку высокоспецифичных антител, направленных против связывающих IL-6R областей, обеспечивая терапевтические иммунные ответы у субъектов, предрасположенных к заболеваниям, на которые влияет нарушение регуляции IL-6, или страдающих от таких заболеваний.
В некоторых вариантах осуществления описанные пептидные иммуногенные конструкции IL-6 содержат гибридный пептид, имеющий В-клеточный антигенный сайт (SEQ ID NO: 5-20; 72-74, показаны в таблице 1), полученный из связывающей IL-6R области или ее фрагментов, который связан с гетерологичным Th-эпитопом, полученным из патогенных белков (SEQ ID NO: 78-106 и 216-226, показаны в таблице 2), которые действуют вместе, чтобы стимулировать выработку высокоспецифичных антител, которые являются перекрестно-реактивными с рекомбинантным IL-6 человека (SEQ ID NO: 1) или IL-6 других видов, таких как макак (SEQ ID NO: 2), мышь (SEQ ID NO: 3) и крыса (SEQ ID NO: 4).
ЛИТЕРАТУРА
1. CHANG, J.C.C., et al., "Adjuvant activity of incomplete Freund's adjuvant," Advanced Drug Delivery Reviews, 32(3):173-186 (1998)
2. CILIBERTO, G., et al., “Compositions and methods comprising immunogenic muteins of interleukin-6”, US Patent No. 6,706,261 (2004)
3. DE BENEDETTI, F., et al., “In Vivo Neutralization of Human IL-6 (hIL-6) Achieved by Immunization of hIL-6-Transgenic Mice with a hIL-6 Receptor Antagonist”, J. Immunol. 166:4334-4340 (2001)
4. DESALLAIS, L., et al., “Method for treating chronic colitis and systemic sclerosis for eliciting protective immune reaction against human IL-6”, US Patent No. 9,669,077 (2017)
5. DESALLAIS, L., et al., “Immunization against an IL-6 peptide induces anti-IL-6 antibodies and modulates the Delayed-Type-Hypersensitivity reaction in cynomolgus monkeys”, Scientific Reports. 6:19549; doi:10.1038/srep19549 (2016)
6. DESALLAIS, L., et al., “Targeting IL-6 by both passive and active immunization strategies prevents bleomycin-induced skin fibrosis”, Arthritis Research and Therapy. 16:R157 (2014)
7. FIELDS, G.B., et al., Chapter 3 in Synthetic Peptides: A User’s Guide, ed. Grant, W.H. Freeman & Co., New York, NY, p.77 (1992)
8. LAZZERINI, P., et al., “Spotlight on sirukumab for the treatment of rheumatoid arthritis: the evidence to date”, Drug Design, Development and Therapy, 10:3083-3098; website: doi.org/10.2147/DDDT.S99898) (2016)
9. MIHARA, M., et al., “IL-6/IL-6 receptor system and its role in physiological and pathological conditions”, Clinical Science, 122(4):143-159 (2012)
10. ROSE-JOHN, S., et al., “The role of IL-6 in host defense against infections: immunobiology and clinical implications”, Nature Reviews Rheumatology, 13:399-409 (2017)
11. SEBBA, A., “Tocilizumab: The first interleukin-6-receptor inhibitor”, American Journal of Health-System Pharmacy, 65(15):1413-1418 (2008)
12. TRAGGIAI, E., et al., “An efficient method to make human monoclonal antibodies from memory B cells: potent neutralization of SARS coronavirus”, Nature Medicine, 10(8):871-875 (2004).
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На Фиг. 1 показано выравнивание последовательностей IL-6 человека (SEQ ID NO: 227), макака (SEQ ID NO: 228), мыши (SEQ ID NO: 229) и крысы (SEQ ID NO: 230). Внутримолекулярные петлевые структуры, которые возникают в аминокислотных положениях 44-50 и 73-83, обозначены заштрихованными цистеинами и скобками.
На Фиг. 2 представлена блок-схема, показывающая процесс разработки, который приводит к коммерческой реализации (переводу в промышленное производство) фармацевтической композиции, направленной против выбранной мишени, в соответствии с конкретным вариантом осуществления, описанным в настоящем документе. Настоящее описание включает в себя дизайн пептидного иммуногена IL-6, дизайн пептидной композиции IL-6, дизайн фармацевтического состава IL-6, дизайн функционального исследования антигенности IL-6 in vitro, дизайн исследования иммуногенности и эффективности IL-6 in vivo, а также дизайн клинического протокола лечения IL-6. Подробные оценка и анализ каждого этапа привели к серии экспериментов, которые в конечном итоге приведут к коммерческой реализации безопасной и эффективной фармацевтической композиции IL-6.
На Фиг. 3A-3D представлены графики, которые демонстрируют кинетику ответа антител в течение 12-недельного периода у морских свинок, иммунизированных различными пептидными иммуногенными конструкциями IL-6. В частности, ответ антител на пептидные иммуногенные конструкции из SEQ ID NO: 107, 112-114 и 116-118 показан на Фиг. 3A; из SEQ ID NO: 124-130 показан на Фиг. 3B; из SEQ ID NO: 131-137 показан на Фиг. 3C и из SEQ ID NO: 138-145 показан на Фиг. 3D. Планшеты для ИФА покрывали рекомбинантным человеческим IL-6. Сыворотку разводили от 1:100 до 1:4,19×108 путем 4-кратных серийных разведений. Титр исследуемой сыворотки, выраженный как Log10(EC50), рассчитывали путем нелинейной регрессии с подбором четырехпараметрической логистической кривой.
На Фиг. 4A-4B показана перекрестная реактивность различных очищенных поликлональных антител к IL-6, направленных против различных пептидных иммуногенных конструкций IL-6. В частности, результаты для SEQ ID NO: 107, 116, 118, 124-128 показаны на Фиг. 4A, а для SEQ ID NO: 129-133 показаны на Фиг. 4B. Планшеты ИФА покрывали рекомбинантными белками IL-6 человека, обезьяны, мыши или крысы. Поликлональные антитела IgG к IL-6, очищенные из сывороток морских свинок с помощью хроматографии на основе белка A, разводили от 10 мкг/мл до 0,00238 нг/мл путем 4-кратных серийных разведений. Значение EC50 рассчитывали путем нелинейной регрессии с подбором четырехпараметрической логистической кривой.
На Фиг. 5A проиллюстрирована нейтрализующая активность различных очищенных поликлональных антител к IL-6, вызванных различными пептидными иммуногенными конструкциями IL-6 (SEQ ID NO: 107, 116, 118, 124, 132, 133, 124 и 137, а также IgG морских свинок), по отношению к взаимодействию IL-6 и IL-6R в анализе на основе ИФА. Планшеты для ИФА покрывали рекомбинантным человеческим белком IL-6R. Человеческий IL-6 в концентрации 10 нг/мл и различные поликлональные антитела IgG к IL-6 в концентрациях, снижающихся от 100 до 0,412 мкг/мл путем 3-кратных серийных разведений, предварительно смешивали и затем добавляли в покрытые IL-6R лунки. Захваченный IL-6 обнаруживали с помощью меченного биотином кроличьего антитела к IL-6 с последующим применением стрептавидина поли-HRP. Значение IC50 рассчитывали путем нелинейной регрессии с подбором четырехпараметрической логистической кривой.
На Фиг. 5B проиллюстрирована нейтрализующая активность различных очищенных поликлональных антител к IL-6, вызванных различными пептидными иммуногенными конструкциями IL-6 (SEQ ID NO: 128, 129, 134 и 135, а также IgG морских свинок), по отношению к взаимодействию IL-6/IL-6R и gp130 в анализе на основе ИФА. Планшеты для ИФА покрывали рекомбинантным слитым белком gp130-Fc. Заранее сформированный комплекс IL-6/IL-6R в заранее определенном соотношении и различные поликлональные антитела IgG к IL-6 в концентрациях, снижающихся от 100 до 0,412 мкг/мл путем 3-кратных серийных разведений, предварительно смешивали и затем добавляли в покрытые gp130-Fc лунки. Захваченный комплекс IL-6/IL-6R обнаруживали с помощью меченного биотином кроличьего антитела к IL-6 с последующим применением стрептавидина поли-HRP. Значение IC50 рассчитывали путем нелинейной регрессии с подбором четырехпараметрической логистической кривой.
На Фиг. 6 проиллюстрирована нейтрализующая активность различных очищенных поликлональных антител к IL-6, вызванных различными пептидными иммуногенными конструкциями IL-6 (SEQ ID NO: 116, 124, 127, 128, 129, 134, 135 и 137, а также IgG морских свинок), по отношению к зависимому от IL-6 фосфорилированию STAT3 в анализе на основе ИФА. Клетки RMPI 8226 инкубировали с человеческим IL-6 в концентрации 10 нг/мл и различными поликлональными антителами IgG к IL-6 в концентрации 100 мкг/мл при 37°C, 5% CO2 в течение 30 минут, а затем лизировали для определения уровня фосфорилированного STAT3 в анализе на основе ИФА.
На Фиг. 7A-7B проиллюстрирована нейтрализующая активность различных очищенных поликлональных антител к IL-6, вызванных различными пептидными иммуногенными конструкциями IL-6, по отношению к зависимой от IL-6 пролиферации клеток. Нейтрализующая активность SEQ ID NO: 116, 118, 124-129, 131, 132 и 133 показана на Фиг. 7A, а нейтрализующая активность SEQ ID NO: 134-145 показана на Фиг. 7B. Клетки TF-1 инкубировали с человеческим IL-6 в концентрации 10 нг/мл и различными поликлональными антителами IgG к IL-6 в указанных концентрациях при 37°C, 5% CO2 в течение 72 часов. Жизнеспособность клеток отслеживали путем измерения количества АТФ в метаболически активных клетках.
На Фиг. 8A-8B проиллюстрирована нейтрализующая активность различных очищенных поликлональных антител к IL-6, вызванных различными пептидными иммуногенными конструкциями IL-6, по отношению к индуцированной IL-6 секреции MCP-1. Нейтрализующая активность SEQ ID NO: 116, 118, 124-134 и 136 показана на Фиг. 8A, а нейтрализующая активность SEQ ID NO: 138-145 показана на Фиг. 8B. Клетки U937 инкубировали с человеческим IL-6 в концентрации 10 нг/мл и различными поликлональными антителами IgG к IL-6 в указанных концентрациях при 37°C, 5% CO2 в течение 24 часов. Супернатанты культур собирали для определения уровня MCP-1.
На Фиг. 9 проиллюстрирован дизайн эксперимента для оценки эффективности пептидных конструкций IL-6 крысы в профилактической модели коллаген-индуцированного артрита (КИА) у крыс. Самок крыс Lewis (n=7 на группу) внутримышечно иммунизировали пептидными иммуногенными конструкциями SEQ ID NO: 148 или 157 в дозе 45 мкг в дни -31, -10 и 4. Чтобы вызвать артрит, животным внутрикожно вводили эмульсию бычьего коллагена II типа/НАФ в дни 0 и 7.
На Фиг. 10 проиллюстрирована кинетика ответа антител в течение 28-дневного периода у крыс, иммунизированных различными пептидными иммуногенными конструкциями IL-6 (SEQ ID NO: 148 и 157). Планшеты для ИФА покрывали рекомбинантным крысиным IL-6. Сыворотку разводили от 1:100 до 1:4,19×108 путем 4-кратных серийных разведений. Титр исследуемой сыворотки, выраженный как Log10(EC50), рассчитывали путем нелинейной регрессии с подбором четырехпараметрической логистической кривой.
На Фиг. 11 проиллюстрировано снижение оценки артрита у крыс, которым вводили коллаген и которых ранее иммунизировали различными пептидными иммуногенными конструкциями IL-6 (SEQ ID NO: 148 и 157).
На Фиг. 12 проиллюстрировано уменьшение отека задней лапы у крыс, которым вводили коллаген и которых ранее иммунизировали различными пептидными иммуногенными конструкциями IL-6 (SEQ ID NO: 148 и 157).
На Фиг. 13 проиллюстрировано уменьшение нейтрофилии крови у крыс, которым вводили коллаген и которых ранее иммунизировали различными пептидными иммуногенными конструкциями IL-6 (SEQ ID NO: 148 и 157).
На Фиг. 14 проиллюстрирован дизайн эксперимента для оценки эффективности пептидных иммуногенных конструкций IL-6 крысы в терапевтической модели коллаген-индуцированного артрита (КИА) у крыс. Самок крыс Lewis (n=6 или 7 на группу) внутримышечно иммунизировали SEQ ID NO: 148 в дозе 45 мкг в дни -7, 7, 14, 21 и 28. Чтобы вызвать артрит, животным внутрикожно вводили эмульсию бычьего коллагена II типа/НАФ в дни 0 и 7.
На Фиг. 15 проиллюстрирована кинетика ответа антител в течение 43-дневного периода у крыс, иммунизированных SEQ ID NO: 148, составленной с применением либо ISA 51, либо ISA 51/CpG. Планшеты для ИФА покрывали рекомбинантным крысиным IL-6. Сыворотку разводили от 1:100 до 1:4,19×108 путем 4-кратных серийных разведений. Титр исследуемой сыворотки, выраженный как Log10(EC50), рассчитывали путем нелинейной регрессии с подбором четырехпараметрической логистической кривой.
На Фиг. 16 проиллюстрировано снижение оценки артрита и уменьшение отека задней лапы у крыс, которым вводили коллаген и которых ранее иммунизировали SEQ ID NO: 148, составленной с применением либо ISA 51, либо ISA 51/CpG.
На Фиг. 17 проиллюстрировано снижение уровня С-реактивного белка (СРБ) в печени у крыс, которым вводили коллаген и которых ранее иммунизировали SEQ ID NO: 148, составленной с применением либо ISA 51, либо ISA 51/CpG.
На Фиг. 18 проиллюстрировано уменьшение повреждения голеностопного сустава у крыс, которым вводили коллаген и которых ранее иммунизировали SEQ ID NO: 148, составленной с применением либо ISA 51, либо ISA 51/CpG.
На Фиг. 19 проиллюстрировано снижение выработки тканями воспалительных цитокинов (ФНО-α, IL-17 и MCP-1) у крыс, которым вводили коллаген и которых ранее иммунизировали SEQ ID NO: 148, составленной с применением либо ISA 51, либо ISA 51/CpG.
На Фиг. 20 проиллюстрирована кинетика ответа антител в течение 43-дневного периода у крыс, иммунизированных различными дозами SEQ ID NO: 148, составленной с применением либо ISA 51/CpG, либо ADJU-PHOS/CpG. Исследование проводили в соответствии с аналогичным дизайном эксперимента, указанным на Фиг. 17. Планшеты для ИФА покрывали рекомбинантным крысиным IL-6. Сыворотку разводили от 1:100 до 1:4,19×108 путем 4-кратных серийных разведений. Титр исследуемой сыворотки, выраженный как Log10, рассчитывали путем включения порогового значения 0,45 в четырехпараметрическую логистическую кривую для каждого образца сыворотки с нелинейной регрессией.
На Фиг. 21 проиллюстрировано уменьшение потери массы тела у крыс, которым вводили коллаген и которых иммунизировали возрастающими дозами SEQ ID NO: 148, составленной с применением либо ISA 51/CpG, либо ADJU-PHOS/CpG.
На Фиг. 22 проиллюстрировано уменьшение отека задней лапы у крыс, которым вводили коллаген и которых иммунизировали возрастающими дозами SEQ ID NO: 148, составленной с применением либо ISA 51/CpG, либо ADJU-PHOS/CpG.
На Фиг. 23 проиллюстрировано макроскопическое наблюдение задней лапы в день 24 у крыс, которым вводили коллаген и которых иммунизировали возрастающими дозами SEQ ID NO: 148, составленной с применением либо ISA 51/CpG, либо ADJU-PHOS/CpG.
На Фиг. 24 проиллюстрировано снижение оценки артрита у крыс, которым вводили коллаген и которых иммунизировали возрастающими дозами SEQ ID NO: 148, составленной с применением либо ISA 51/CpG, либо ADJU-PHOS/CpG.
На Фиг. 25 проиллюстрировано уменьшение нейтрофилии крови у крыс, которым вводили коллаген и которых иммунизировали возрастающими дозами SEQ ID NO: 148, составленной с применением либо ISA 51/CpG, либо ADJU-PHOS/CpG.
На Фиг. 26 проиллюстрировано уменьшение высвобождения тромбоцитов у крыс, которым вводили коллаген и которых иммунизировали возрастающими дозами SEQ ID NO: 148, составленной с применением либо ISA 51/CpG, либо ADJU-PHOS/CpG.
На Фиг. 27 проиллюстрировано снижение повышенного уровня АСТ в крови у крыс, которым вводили коллаген и которых иммунизировали возрастающими дозами SEQ ID NO: 148, составленной с применением либо ISA 51/CpG, либо ADJU-PHOS/CpG.
На Фиг. 28 проиллюстрирована кинетика ответа антител в течение 12-недельного периода у морских свинок, иммунизированных различными пептидными иммуногенными конструкциями IL-6 (SEQ ID NO: 102, 114, 115, 117 и 118), составленными с применением указанных адъювантов. Планшеты для ИФА покрывали рекомбинантным человеческим IL-6. Сыворотку разводили от 1:100 до 1:4,19×108 путем 4-кратных серийных разведений. Титр исследуемой сыворотки, выраженный как Log10(EC50), рассчитывали путем нелинейной регрессии с подбором четырехпараметрической логистической кривой.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее описание направлено на отдельные пептидные иммуногенные конструкции, нацеленные на интерлейкин 6 (IL-6), и их составы для иммунотерапии заболеваний, на которые влияет нарушение регуляции IL-6.
Описанные пептидные иммуногенные конструкции IL-6 имеют 30 или более аминокислот и содержат функциональные В-клеточные эпитопы, полученные из связывающих рецептор IL-6 (IL-6R) областей E42-C83 (SEQ ID NO: 16) или N144-I166 (SEQ ID NO: 19) или их фрагментов (SEQ ID NO: 5-19), которые связаны посредством необязательного гетерологичного спейсера с гетерологичными эпитопами Т-хелперных клеток (Th-эпитопами), полученными из патогенных белков (SEQ ID NO: 78-106 и 216-226). Эти пептидные конструкции IL-6, содержащие разработанные В-клеточные и Th-клеточные эпитопы, действуют вместе, чтобы стимулировать выработку высокоспецифичных антител, направленных против связывающей IL-6R области, обеспечивая профилактические и/или терапевтические иммунные ответы у пациентов, страдающих от заболеваний, на которые влияет нарушение регуляции IL-6, или предрасположенных к таким заболеваниям. Описанные пептидные иммуногенные конструкции IL-6 могут содержать гибридный пептид, имеющий В-клеточный антигенный сайт (SEQ ID NO: 5-20; 72-75), полученный из связывающей IL-6R области или ее фрагмента, который связан с гетерологичным Th-эпитопом, полученным из патогенного белка (например, SEQ ID NO: 78-106 и 216-226 в таблице 2), которые действуют вместе, чтобы стимулировать выработку высокоспецифичных антител, которые являются перекрестно-реактивными с рекомбинантным IL-6 человека (SEQ ID NO: 1) или IL-6 других видов, таких как макак (SEQ ID NO: 2), мышь (SEQ ID NO: 3) и крыса (SEQ ID NO: 4).
В некоторых вариантах осуществления пептидные иммуногенные конструкции IL-6 (например, SEQ ID NO: 107-186 из таблицы 3) содержат гибридные пептиды, имеющие В-клеточный антигенный сайт, например, C73-C83 (SEQ ID NO: 5), связанный с гетерологичными Th-эпитопами, полученными из различных патогенных белков (SEQ ID NO: 78-106 и 216-226), которые способны вызывать антитела, которые являются перекрестно-реактивными с рекомбинантным человеческим IL-6 (SEQ ID NO: 1) и обладают перекрестной реактивностью по отношению к IL-6 других видов (SEQ ID NO: 2, 3, 4). Из всех гетерологичных Th-эпитопов, применяемых для усиления В-клеточного антигенного сайта, Th-эпитопы, полученные из природных патогенов EBV BPLF1 (SEQ ID NO: 105), EBV CP (SEQ ID NO: 102), Clostridium Tetani1,2,4 (SEQ ID NO: 78, 99-101), холерного токсина (SEQ ID NO: 85), Schistosoma mansoni (SEQ ID NO: 84), а также идеализированные искусственные Th-эпитопы, полученные из слитого белка вируса кори (MVF 1-5) и поверхностного антигена гепатита B (HBsAg 1-3), в форме одной последовательности или комбинаторных последовательностей (например, SEQ ID NO: 79, 86-92), находят особое применение для такого усиления В-клеточной антигенности посредством скринингового исследования на иммуногенность.
Настоящее изобретение также направлено на пептидные композиции, содержащие смесь пептидных иммуногенных конструкций IL-6 с гетерологичными Th-эпитопами, полученными из разных патогенов. Композиции, содержащие смесь пептидных иммуногенных конструкций IL-6, могут использоваться для обеспечения широкого охвата генетического фона у пациентов, приводя к более высокому проценту частоты ответа после иммунизации с целью предотвращения и/или лечения заболеваний, на которые влияет нарушение регуляции IL-6. Синергическое усиление иммунного ответа можно наблюдать при использовании пептидных композиций, содержащих более одной пептидной иммуногенной конструкции IL-6.
Ответ антител, полученный благодаря таким пептидным иммуногеннным конструкциям, в основном (>90%) сфокусирован на желаемой перекрестной реактивности против пептидов связывающей IL-6R области (SEQ ID NO: 5-19), при этом незначительный процент, если таковой имеется, направлен на гетерологичные Th-эпитопы, применяемые для усиления иммуногенности. В этом заключается резкое отличие от стандартных способов, в которых используется обычный белок-носитель, такой как KLH, анатоксин или другие биологические носители, используемые для такого усиления пептидной антигенности.
Настоящее изобретение также направлено на фармацевтические композиции, включая составы для предотвращения и/или лечения заболеваний, на которые влияет нарушение регуляции IL-6. В некоторых вариантах осуществления фармацевтические композиции содержат стабилизированный иммуностимулирующий комплекс, который образован путем смешивания олигомера CpG с пептидной композицией, содержащей смесь пептидных иммуногенных конструкций IL-6, посредством электростатической ассоциации, для дополнительного усиления пептидной иммуногенности IL-6 в сторону желаемой перекрестной реактивности с полноразмерным IL-6 человека (SEQ ID NO: 1) или IL-6 других видов, таких как макак (SEQ ID NO: 2), мышь (SEQ ID NO: 3) и крыса (SEQ ID NO: 4).
В других вариантах осуществления фармацевтические композиции, содержащие пептидную композицию смеси пептидных иммуногенных конструкций IL-6 в контакте с минеральными солями, включая гель на основе квасцов (ALHYDROGEL) или фосфат алюминия (ADJU-PHOS), для образования суспензии или с MONTANIDE ISA 51 или 720 в качестве адъюванта для образования эмульсий вода-в-масле, использовали для введения пациентам с целью предотвращения и/или лечения заболеваний, на которые влияет нарушение регуляции IL-6.
Более того, в настоящем изобретении также предложен способ недорогого производства и контроля качества пептидных иммуногенных конструкций IL-6 и их составов для использования в целях профилактики и/или лечения животных и пациентов с заболеваниями, на которые влияет нарушение регуляции IL-6.
Настоящее изобретение также направлено на антитела, направленные против описанных пептидных иммуногенных конструкций IL-6. В частности, пептидные иммуногенные конструкции IL-6 по настоящему изобретению способны стимулировать выработку высокоспецифичных антител, которые являются перекрестно-реактивными с сайтами связывания IL-6R на молекуле IL-6. Описанные антитела связываются с высокой специфичностью с сайтами связывания IL-6R, при этом незначительный процент, если таковой имеется, направлен на гетерологичные Th-эпитопы, применяемые для усиления иммуногенности, в чем заключается резкое отличие от антител, полученных с помощью обычных белков или других биологических носителей, используемых для такого усиления пептидной иммуногенности. Таким образом, описанные пептидные иммуногенные конструкции IL-6 способны нарушать иммунную толерантность к собственному белку IL-6 с высокой частотой ответа по сравнению с другими пептидными или белковыми иммуногенами.
В конкретных вариантах осуществления антитела направлены против и специфически связываются с сайтами связывания IL-6R на молекуле IL-6 человека (SEQ ID NO: 1). Высокоспецифичные антитела, вызванные пептидными иммуногенными конструкциями IL-6, могут ингибировать связывание IL-6 и IL-6R, а также последующие события, такие как индуцированное IL-6 фосфорилирование STAT3, зависимая от IL-6 пролиферация клеток, индуцированная IL-6 выработка MCP и другие связанные с IL-6 патологические состояния; что обеспечивает эффективное лечение пациентов, страдающих от заболеваний, на которые влияет нарушение регуляции IL-6.
В дополнительном аспекте в настоящем изобретении предложены человеческие антитела (поликлональные и моноклональные) к IL-6, вызванные у пациентов, получающих композиции, содержащие описанные пептидные иммуногенные конструкции IL-6. Эффективный способ создания человеческих моноклональных антител из В-клеток, выделенных из крови пациента-человека, описан в Traggiai, et al. (2004), полное описание которой включено в настоящий документ посредством ссылки.
Исходя из своих уникальных характеристик и свойств, описанные антитела, вызванные пептидными иммуногенными конструкциями IL-6, способны обеспечивать иммунотерапевтический подход к лечению пациентов, страдающих от заболеваний, на которые влияет нарушение регуляции IL-6.
Настоящее изобретение также направлено на способы создания описанных пептидных иммуногенных конструкций IL-6, композиций и антител. Описанные способы обеспечивают недорогое производство и контроль качества пептидных иммуногенных конструкций IL-6 и композиций, содержащих эти конструкции, что может быть использовано в способах лечения пациентов, страдающих от заболеваний, на которые влияет нарушение регуляции IL-6.
Настоящее изобретение также включает в себя способы предотвращения и/или лечения заболеваний, на которые влияет нарушение регуляции IL-6, у субъекта, используя описанные пептидные иммуногенные конструкции IL-6 и/или антитела, направленные против пептидных иммуногенных конструкций IL-6. Описанные способы включают в себя этап введения субъекту композиции, содержащей описанную пептидную иммуногенную конструкцию IL-6. В некоторых вариантах осуществления используемая в способах композиция содержит описанную пептидную иммуногенную конструкцию IL-6 в форме стабилизированного иммуностимулирующего комплекса с отрицательно заряженными олигонуклеотидами, такими как олигомер CpG, посредством электростатической ассоциации, что может быть дополнено адъювантом, для введения субъекту, предрасположенному к заболеванию, на которое влияет нарушение регуляции IL-6, или страдающему от такого заболевания.
Описанные способы также включают в себя схемы введения, лекарственные формы и пути введения пептидных иммуногенных конструкций в целях предотвращения и/или лечения заболеваний, на которые влияет нарушение регуляции IL-6.
Общие сведения
Заголовки разделов, используемые в настоящем описании, предназначены только для организационных целей и не должны толковаться как ограничивающие описанный предмет. Все ссылки или части ссылок, процитированные в этой заявке, прямо включены в настоящий документ посредством ссылки в полном объеме для любых целей.
Если не указано иное, все употребляемые в настоящем документе технические и научные термины имеют то же значение, которое, как правило, подразумевается обычным специалистом в данной области техники, к которой относится настоящее изобретение. Формы единственного числа включают ссылки на формы множественного числа, если в контексте явно не указано иное. Подобным образом, слово «или» предназначено для охватывания «и», если в контексте явно не указано иное. Следовательно, фраза «содержащий A или B» означает включение A, или B, или A и B. Кроме того, следует понимать, что все размеры аминокислот, а также все значения молекулярной массы или молекулярных масс, приведенные для полипептидов, являются приблизительными и представлены для описания. Хотя способы и материалы, подобные или эквивалентные описанным в настоящем документе, можно применять на практике или при тестировании описанного способа, пригодные способы и материалы описаны ниже. Все публикации, заявки на патенты, патенты и другие ссылки, упомянутые в настоящем документе, полностью включены в настоящий документ посредством ссылки. В случае конфликта приоритет будет иметь настоящее описание, включая объяснения терминов. Кроме того, описанные в настоящем документе материалы, способы и примеры являются исключительно иллюстративными и не подразумевают ограничения.
Пептидная иммуногенная конструкция IL-6
В настоящем описании предложены пептидные иммуногенные конструкции, содержащие В-клеточный эпитоп с аминокислотной последовательностью из связывающей рецептор IL-6 (IL-6R) области E42-C83 (SEQ ID NO: 16) или N144-I166 (SEQ ID NO: 19) или ее фрагментов (например, SEQ ID NO: 5-19). В-клеточный эпитоп ковалентно связан с гетерологичным эпитопом Т-хелперных клеток (Th-эпитопом), полученным из патогенного белка, непосредственно или с помощью необязательного гетерологичного спейсера. Эти конструкции, содержащие разработанные В-клеточные и Th-клеточные эпитопы, действуют вместе, чтобы стимулировать выработку высокоспецифичных антител, направленных против связывающей IL-6R области на IL-6, обеспечивая терапевтические иммунные ответы у пациентов, предрасположенных к заболеваниям, на которые влияет нарушение регуляции IL-6, или страдающих от таких заболеваний.
Фраза «пептидная иммуногенная конструкция IL-6» или «пептидная иммуногенная конструкция», как используется в настоящем документе, относится к пептиду длиной более чем 30 аминокислот, содержащему (а) В-клеточный эпитоп, имеющий около более чем 10 смежных аминокислотных остатков из связывающей IL-6R области, представленной пептидом E42-C83 (SEQ ID NO: 16) или N144-I166 (SEQ ID NO: 19), или ее фрагментов (например, SEQ ID NO: 5-19), полноразмерного человеческого IL-6 (SEQ ID NO: 1); (b) гетерологичный Th-эпитоп и (с) необязательный гетерологичный спейсер.
В определенных вариантах осуществления пептидная иммуногенная конструкция IL-6 может быть представлена формулами:
(Th)m-(A)n-(связывающая IL-6R область IL-6 или ее фрагмент)-X
или
(связывающая IL-6R область IL-6 или ее фрагмент)-(A)n-(Th)m-X
или
(Th)m-(A)n-(связывающая IL-6R область IL-6 или ее фрагмент)-(A)n-(Th)m-X
где
Th представляет собой гетерологичный Т-хелперный эпитоп;
А представляет собой гетерологичный спейсер;
(связывающая IL-6R область IL-6 или ее фрагмент) представляет собой В-клеточный эпитопный пептид, имеющий от 7 до 42 аминокислотных остатков из связывающей IL-6R области IL-6 (SEQ ID NO: 1);
X представляет собой α-COOH или α-CONH2 аминокислоты;
m равно от 1 до около 4; и
n равно от 0 до около 10.
Пептидные иммуногенные конструкции IL-6 по настоящему изобретению были разработаны и выбраны, исходя из ряда оснований, включая:
i. В-клеточный эпитопный пептид IL-6 сам по себе не является иммуногенным во избежание активации аутологичных Т-клеток;
ii. В-клеточный эпитопный пептид IL-6 можно сделать иммуногенным, используя белок-носитель или мощный Т-хелперный эпитоп(-ы);
iii. когда В-клеточный эпитопный пептид IL-6 был сделан иммуногенным и введен хозяину, пептидная иммуногенная конструкция выполняет следующее:
a. вызывает появление антител с высоким титром, преимущественно направленных против пептидной последовательности IL-6 (В-клеточный эпитоп), а не против белка-носителя или Т-хелперных эпитопов;
b. нарушает иммунную толерантность у иммунизированного хозяина и генерирует высокоспецифичные антитела, обладающие перекрестной реактивностью с IL-6 (SEQ ID NO: 1);
c. генерирует высокоспецифичные антитела, способные ингибировать связывание IL-6 и IL-6R, а также последующие события, такие как индуцированное IL-6 фосфорилирование STAT3, зависимая от IL-6 пролиферация клеток, индуцированная IL-6 выработка MCP; и
d. генерирует высокоспецифичные антитела, способные вызывать снижение других связанных с IL-6 патологических состояний in vivo.
Описанные пептидные иммуногенные конструкции IL-6 и их составы могут эффективно функционировать в качестве фармацевтической композиции для предотвращения и/или лечения субъектов, предрасположенных к заболеваниям, на которые влияет нарушение регуляции IL-6, или страдающих от таких заболеваний.
Различные компоненты описанной пептидной иммуногенной конструкции IL-6 более подробно описаны ниже.
a. В-клеточный эпитопный пептид из связывающей IL-6R области
Настоящее описание направлено на новую пептидную композицию для выработки антител с высоким титром, обладающих специфичностью в отношении человеческого рекомбинантного белка IL-6 и перекрестной реактивностью по отношению к белкам IL-6 макака, мыши и крысы. Сайт-специфичность пептидной композиции минимизирует выработку антител, которые направлены на нерелевантные сайты других областей на IL-6 или нерелевантные сайты на белках-носителях, тем самым обеспечивая высокий коэффициент безопасности.
Термин «IL-6», как используется в настоящем документе, относится к полноразмерному белку IL-6 человека (UniProtKB P05231; номер доступа Genbank NP_000591.1) и других видов с перекрестной реактивностью, включая макака (UniProtKB A0A1D5QM02-1; номер доступа Genbank NP_001274245.1), мышь (UniProtKB P08505; номер доступа Genbank NP_112445.1) и крысу (UniProtKB P20607; номер доступа Genbank NP_036721.1). Выравнивание полноразмерных аминокислотных последовательностей IL-6 человека (SEQ ID NO: 227), макака (SEQ ID NO: 228), мыши (SEQ ID NO: 229) и крысы (SEQ ID NO: 230) показано на Фиг. 1.
Более конкретно, термин «IL-6», как используется в настоящем документе, относится к аминокислотной последовательности полноразмерного зрелого белка IL-6 с расщепленным N-концевым сигнальным пептидом (содержащим около 24-28 аминокислот в зависимости от вида). Аминокислотные последовательности полноразмерного зрелого белка IL-6 человека (SEQ ID NO: 1), макака (SEQ ID NO: 2), мыши (SEQ ID NO: 3) и крысы (SEQ ID NO: 4) показаны в таблице 1. В настоящей заявке нумерация аминокислотных положений в пределах белка IL-6 основана на полноразмерных зрелых последовательностях IL-6, в котором N-концевая сигнальная последовательность расщеплена, представленных в SEQ ID NO: 1-4, как показано в таблице 1.
IL-6R состоит из двух цепей: (1) IL-6-связывающей цепи или IL-6Rα, которая существует в двух формах, а именно (a) трансмембранной IL-6Rα с массой 80 кДа (mIL-6Rα) (UniProtKB: P08887; номер доступа GenBank NP_000556.1) и (b) растворимой IL-6Rα (sIL-6Rα) с массой 50-55 кДа (UniProtKB: P08887 или P08887-2), и (2) передающей сигнал цепи с массой 130 кДа, называемой IL-6Rβ или gp130 (UniProtKB: P40189; номер доступа GenBank NP_002175.2).
Мембранная IL-6Rα (или mIL-6Rα) экспрессируется на поверхности ограниченного числа типов клеток, а именно гепатоцитов, мегакариоцитов и лейкоцитов, включая моноциты, макрофаги, нейтрофилы, а также Т- и В-лимфоциты. Растворимая IL-6Rα (или sIL-6Rα) присутствует в человеческой плазме (25-75 нг/мл) и тканевых жидкостях и может быть получена путем протеолитического расщепления (шеддинга) mIL-6Rα металлопротеазами (дизинтегрином и металлопротеиназами (т. е. ADAM)) или реже - с помощью альтернативного сплайсинга путем исключения трансмембранного домена.
Мембранная IL-6Rβ или gp130 повсеместно экспрессируется на всех клетках человека (Sabba, 2008).
При классической сигнализации IL-6 связывается с мембраносвязанным рецептором IL-6 (mIL-6Rα), а комплекс IL-6-mIL-6Rα связывается с субъединицей IL-6Rβ (gp130), индуцируя димеризацию gp130 и внутриклеточную сигнализацию. Альтернативно, IL-6 может связываться с растворимой IL-6Rα (sIL-6Rα), которая генерируется путем расщепления mIL-6Rα белком 17, содержащим домен дезинтегрина и металлопротеиназы (ADAM17). Комплекс IL-6-sIL-6Rα затем связывается с мембраносвязанной субъединицей IL-6Rβ (gp130), даже на тех клетках, которые не экспрессируют IL-6R, и индуцирует транс-сигнализацию. Таким образом, при связывании с mIL-6Rα (или sIL-6Rα) IL-6 индуцирует образование гексамера (содержащего два белка IL-6, два белка IL-6Rα и два белка IL-6Rβ (gp130)), что в свою очередь вызывает нисходящий сигнальный каскад (Rose-John, et al., 2017).
Клеточная активация посредством связывания IL-6 с mIL-6Rα называется «классической сигнализацией». Все остальные клетки, которые не экспрессируют mIL-6Rα, получают сигналы IL-6 путем «транс-сигнализации»: IL-6 связывается с циркулирующей sIL-6Rα, и этот комплекс образует сигнальный комплекс с IL-6Rβ или gp130 на клеточной поверхности. Транс-сигнализация может происходить в широком спектре клеток человека, тем самым способствуя плейотропной активности IL-6. В настоящее время известно, что гомеостатическая и регенеративная активность IL-6 опосредована классической сигнализацией, тогда как провоспалительный эффект вызван в основном активацией транс-сигнального пути. Все больше данных указывает на то, что транс-сигнализация IL-6 особенно участвует в развитии заболеваний. Растворимая форма IL-6Rβ (sIL-6Rβ) или gp130 (sgp130) также была обнаружена в кровотоке в относительно высоких концентрациях, что в основном было вызвано альтернативным сплайсингом. Поскольку sgp130 может связываться с комплексом IL-6/sIL-6Rα, она действует в качестве природного и специфического ингибитора опосредованной IL-6 транс-сигнализации, тогда как на классическую сигнализацию sgp130 не оказывает никакого влияния.
В то время как IL-6Rα является уникальным рецептором связывания для IL-6, передающая сигнал цепь IL-6Rβ (или gp130) является общей для членов семейства IL-6, содержащего фактор ингибирования лейкоза, онкостатин М, цилиарный нейротрофический фактор, IL-11, кардиотропин-1, нейропоэтин-1, IL-27 и IL-35.
Часть В-клеточного эпитопа IL-6 пептидных иммуногенных конструкций IL-6 нацелена на связывающие IL-6R области молекулы IL-6. В-клеточные эпитопные пептиды содержат от около 7 до около 42 аминокислотных остатков, полученных из E42-C83 (SEQ ID NO: 16) или N144-I166 (SEQ ID NO: 19) полноразмерного зрелого белка IL-6 (SEQ ID NO: 1-4). В-клеточные эпитопы IL-6 были отобраны после обширного серологического скрининга с использованием фрагментов белка IL-6, некоторые из которых содержали существующую в природе внутримолекулярную петлю в пределах белка, как показано с помощью заштрихованных цистеиновых остатков на Фиг. 1.
В определенных вариантах осуществления В-клеточный эпитопный пептид, прошедший скрининг и отбор на основании обоснований дизайна, содержит аминокислотную последовательность из внутренней внутримолекулярной петли IL-6, образованной эндогенными цистеинами (например, C73-C83 (SEQ ID NO: 5) или C44-C50 (SEQ ID NO: 15)) в соответствии с нумерацией последовательности полноразмерного зрелого белка IL-6 (SEQ ID NO: 1), или из С-конца молекулы IL-6, включая аминокислотную последовательность из N144-I166 (SEQ ID NO: 19). В некоторых вариантах осуществления В-клеточный эпитоп имеет аминокислотную последовательность SEQ ID NO: 5-19, как показано в таблице 1.
В-клеточный эпитопный пептид IL-6 по настоящему изобретению также включает в себя иммунологически функциональные аналоги или гомологи пептидов IL-6 (SEQ ID NO: 5-19). Функциональные иммунологические аналоги или гомологи В-клеточного эпитопного пептида IL-6 включают в себя варианты, которые сохраняют по существу такую же иммуногенность, что и исходный пептид. Иммунологически функциональные аналоги могут иметь консервативную замену в аминокислотном положении; изменение в общем заряде; ковалентное присоединение к другому фрагменту; или аминокислотные добавления, вставки или делеции; и/или любую их комбинацию (например, пептиды IL-6 SEQ ID NO: 72-76).
b. Гетерологичные эпитопы Т-хелперных клеток (Th-эпитопы)
В настоящем изобретении предложены пептидные иммуногенные конструкции, содержащие В-клеточный эпитоп IL-6, ковалентно связанный с гетерологичным эпитопом Т-хелперных клеток (Th-эпитопом) непосредственно или с помощью необязательного гетерологичного спейсера.
Гетерологичный Th-эпитоп в пептидной иммуногенной конструкции IL-6 усиливает иммуногенность фрагмента IL-6, что способствует выработке специфичных антител с высоким титром, направленных против оптимизированного целевого В-клеточного эпитопного пептида (т.е. фрагмента IL-6), прошедшего скрининг и отбор на основании обоснований дизайна.
Термин «гетерологичный», как используется в настоящем документе, относится к аминокислотной последовательности, которая получена из аминокислотной последовательности, которая не является частью или не гомологична последовательности IL-6 дикого типа. Таким образом, гетерологичный Th-эпитоп представляет собой Th-эпитоп, полученный из аминокислотной последовательности, которая не встречается в природе в IL-6 (т.е. Th-эпитоп не является аутологичным по отношению к IL-6). Поскольку Th-эпитоп является гетерологичным по отношению к IL-6, природная аминокислотная последовательность IL-6 не удлиняется ни в N-концевом, ни в C-концевом направлениях, когда гетерологичный Th-эпитоп ковалентно связан с фрагментом IL-6.
Гетерологичный Th-эпитоп по настоящему изобретению может представлять собой любой Th-эпитоп, который не имеет аминокислотной последовательности, которая встречается в природе в IL-6. Th-эпитоп может также иметь мотивы неизбирательного связывания с молекулами ГКГС класса II множества видов. В некоторых вариантах осуществления Th-эпитоп содержит множественные неизбирательные мотивы связывания ГКГС класса II для обеспечения максимальной активации Т-хелперов, которая приводит к инициации и регуляции иммунных ответов. Предпочтительно, Th-эпитоп сам по себе является иммуномолчащим, т.е. небольшое количество антител, генерируемых пептидными иммуногенными конструкциями IL-6, если они вообще есть, будут направлены на Th-эпитоп, что позволяет получить очень сфокусированный иммунный ответ, направленный на целевой В-клеточный эпитопный пептид IL-6.
Эпитопы по настоящему изобретению включают в себя, помимо прочего, аминокислотные последовательности, полученные из чужеродных патогенов, как проиллюстрировано в таблице 2 (SEQ ID NO: 78-106 и 216-226). Более того, Th-эпитопы включают в себя идеализированные искусственные Th-эпитопы и комбинаторные идеализированные искусственные Th-эпитопы (например, SEQ ID NO: 79, 86, 91, 92 и 79, 86-92). Гетерологичные Th-эпитопные пептиды, представленные в виде комбинаторной последовательности (например, SEQ ID NO: 87-90) содержат смесь аминокислотных остатков, представленных в определенных положениях в пределах пептидного остова на основе вариабельных остатков гомологов для этого конкретного пептида. Комбинация комбинаторных пептидов может быть синтезирована в одном процессе путем добавления смеси обозначенных защищенных аминокислот вместо одной конкретной аминокислоты в определенное положение во время процесса синтеза. Такие комбинаторные сборки гетерологичных Th-эпитопных пептидов могут обеспечивать широкий охват Th-эпитопов для животных, имеющих разнообразный генетический фон. Репрезентативные комбинаторные последовательности гетерологичных Th-эпитопных пептидов включают в себя SEQ ID NO: 87-90, которые приведены в таблице 2. Th-эпитопные пептиды по настоящему изобретению обеспечивают широкую реактивность и иммуногенность для животных и пациентов из генетически разнообразных популяций.
c. Гетерологичный спейсер
Описанные пептидные иммуногенные конструкции IL-6 необязательно содержат гетерологичный спейсер, который ковалентно связывает В-клеточный эпитопный пептид IL-6 с гетерологичным эпитопом Т-хелперных клеток (Th-эпитопом).
Как обсуждалось выше, термин «гетерологичный» относится к аминокислотной последовательности, которая получена из аминокислотной последовательности, которая не является частью или не гомологична природной последовательности IL-6. Таким образом, природная аминокислотная последовательность IL-6 не удлиняется ни в N-концевом, ни в C-концевом направлениях, когда гетерологичный спейсер ковалентно связан с В-клеточным эпитопным пептидом IL-6, поскольку спейсер является гетерологичным последовательности IL-6.
Спейсер представляет собой любую молекулу или химическую структуру, способную связывать вместе две аминокислоты и/или пептида. Спейсер может варьироваться по длине или полярности в зависимости от применения. Спейсер может присоединяться посредством амидной или карбоксильной связи, однако другие функциональные группы также возможны. Спейсер может включать в себя химическое соединение, встречающуюся в природе аминокислоту или не встречающуюся в природе аминокислоту.
Спейсер может придавать пептидной иммуногенной конструкции IL-6 структурные особенности. В структурном отношении спейсер обеспечивает физическое разделение Th-эпитопа и В-клеточного эпитопа фрагмента IL-6. Физическое разделение с помощью спейсера может нарушать любые искусственные вторичные структуры, созданные путем соединения Th-эпитопа и В-клеточного эпитопа. Кроме того, физическое разделение эпитопов с помощью спейсера может устранить интерференцию между Th-клеточными и/или В-клеточными ответами. Более того, спейсер может быть предназначен для создания или модификации вторичной структуры пептидной иммуногенной конструкции. Например, спейсер может быть предназначен для того, чтобы действовать в качестве гибкого шарнира для улучшения разделения Th-эпитопа и В-клеточного эпитопа. Гибкий шарнирный спейсер также может обеспечить более эффективное взаимодействие между представленным пептидным иммуногеном и соответствующими Th-клетками и В-клетками для усиления иммунных ответов на Th-эпитопы и В-клеточные эпитопы. Примеры последовательностей, кодирующих гибкие шарниры, можно найти в шарнирной области тяжелой цепи иммуноглобулина, которая часто является богатой пролином. Один особенно пригодный гибкий шарнир, который можно использовать в качестве спейсера, представлен последовательностью Pro-Pro-Xaa-Pro-Xaa-Pro (SEQ ID NO: 76), где Xaa представляет собой любую аминокислоту, а предпочтительно аспарагиновую кислоту.
Спейсер может также придавать пептидной иммуногенной конструкции IL-6 функциональные свойства. Например, спейсер может быть разработан с возможностью изменения общего заряда пептидной иммуногенной конструкции IL-6, что может повлиять на растворимость пептидной иммуногенной конструкции. Кроме того, изменение общего заряда пептидной иммуногенной конструкции IL-6 может повлиять на способность пептидной иммуногенной конструкции связываться с другими соединениями и реагентами. Как более подробно обсуждается ниже, пептидная иммуногенная конструкция IL-6 может быть сформирована в стабилизированный иммуностимулирующий комплекс с высокозаряженным олигонуклеотидом, таким как олигомеры CpG, посредством электростатической ассоциации. Общий заряд пептидной иммуногенной конструкции IL-6 является важным для образования таких стабилизированных иммуностимулирующих комплексов.
Химические соединения, которые можно использовать в качестве спейсера, включают в себя, помимо прочего, (2-аминоэтокси)уксусную кислоту (AEA), 5-аминовалериановую кислоту (AVA), 6-аминокапроновую кислоту (Ahx), 8-амино-3,6-диоксаоктановую кислоту (AEEA, мини-PEG1), 12-амино-4,7,10-триоксадодекановую кислоту (мини-PEG2), 15-амино-4,7,10,13-тетраоксапентадекановую кислоту (мини-PEG3), триоксатридеканянтарную кислоту (Ttds), 12-аминододекановую кислоту, Fmoc-5-амино-3-оксапентановую кислоту (O1Pen) и т.п.
Природные аминокислоты включают в себя аланин, аргинин, аспарагин, аспарагиновую кислоту, цистеин, глутаминовую кислоту, глутамин, глицин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, пролин, серин, треонин, триптофан, тирозин и валин.
Не встречающиеся в природе аминокислоты включают в себя, помимо прочего, ε-N-лизин, β-аланин, орнитин, норлейцин, норвалин, гидроксипролин, тироксин, γ-амино масляную кислоту, гомосерин, цитруллин, аминобензойную кислоту, 6-аминокапроновую кислоту (Aca; 6-аминогексановую кислоту), гидроксипролин, меркаптопропионовую кислоту (MPA), 3-нитро-тирозин, пироглутаминовую кислоту и тому подобное.
Спейсер в пептидной иммуногенной конструкции IL-6 может быть ковалентно связан либо на N-, либо на C-конце Th-эпитопа и B-клеточного эпитопного пептида IL-6. В некоторых вариантах осуществления спейсер ковалентно связан с С-концом Th-эпитопа и N-концом B-клеточного эпитопного пептида IL-6. В других вариантах осуществления спейсер ковалентно связан с С-концом B-клеточного эпитопного пептида IL-6 и N-концом Th-эпитопа. В определенных вариантах осуществления может быть использован более чем один спейсер, например, когда более чем один Th-эпитоп присутствует в пептидной иммуногенной конструкции IL-6. Когда используется более чем один спейсер, каждый спейсер может быть таким же или отличаться. Кроме того, когда в пептидной иммуногенной конструкции IL-6 присутствует более чем один Th-эпитоп, Th-эпитопы могут быть разделены с помощью спейсера, который может быть таким же, как и спейсер, используемый для разделения Th-эпитопа и В-клеточного эпитопного пептида IL-6, или отличаться от него. В расположении спейсеров отсутствуют ограничения по отношению к Th-эпитопу или В-клеточному эпитопному пептиду IL-6.
В определенных вариантах осуществления гетерологичный спейсер представляет собой встречающуюся в природе аминокислоту или не встречающуюся в природе аминокислоту. В других вариантах осуществления спейсер содержит более чем одну встречающуюся в природе аминокислоту или не встречающуюся в природе аминокислоту. В конкретных вариантах осуществления спейсер представляет собой Lys-, Gly-, Lys-Lys-Lys-, (α, ε-N)Lys, ε-N-Lys-Lys-Lys-Lys (SEQ ID NO: 77) или Lys-Lys-Lys- ε-N-Lys (SEQ ID NO: 231).
d. Конкретные варианты осуществления пептидных иммуногенных конструкций IL-6
В определенных вариантах осуществления пептидные иммуногенные конструкции IL-6 могут быть представлены следующими формулами:
Пептидная иммуногенная конструкция IL-6, имеющая длину около более чем 30 аминокислот, представленная формулами:
(Th)m-(A)n-(связывающая IL-6R область IL-6 или ее фрагмент)-X
или
(связывающая IL-6R область IL-6 или ее фрагмент)-(A)n-(Th)m-X
или
(Th)m-(A)n-(связывающая IL-6R область IL-6 или ее фрагмент)-(A)n-(Th)m-X,
где
Th представляет собой гетерологичный Т-хелперный эпитоп;
А представляет собой гетерологичный спейсер;
(связывающая IL-6R область IL-6 или ее фрагмент) представляет собой В-клеточный эпитопный пептид, имеющий от около 7 до около 42 аминокислотных остатков из связывающей IL-6R области IL-6 (SEQ ID NO: 1);
X представляет собой α-COOH или α-CONH2 аминокислоты;
m равно от 1 до около 4; и
n равно от 0 до около 10.
В некоторых вариантах осуществления (связывающая IL-6R область IL-6 или ее фрагмент) представляет собой В-клеточный эпитопный пептид, имеющий любую одну аминокислотную последовательность, выбранную из SEQ ID NO: 5-19. В определенных вариантах осуществления В-клеточный эпитоп имеет аминокислотную последовательность из E42-C83 (SEQ ID NO: 16) или N144-I166 (SEQ ID NO: 19) из IL-6 (SEQ ID NO: 1-4) или ее фрагменты. В конкретных вариантах осуществления (связывающая IL-6R область IL-6 или ее фрагмент) представляет собой В-клеточный эпитоп, содержащий по меньшей мере одну существующую в природе внутримолекулярную петлю из C73-C83 (SEQ ID NO: 5) и/или C44-C50 (SEQ ID NO: 15), как показано на Фиг. 1.
В определенных вариантах осуществления гетерологичный Th-эпитоп в пептидной иммуногенной конструкций IL-6 имеет любую одну аминокислотную последовательность, выбранную из SEQ ID NO: 78-106, 216-226 или их комбинаций, как показано в таблице 2. В некоторых вариантах осуществления пептидная иммуногенная конструкция IL-6 содержит более чем один Th-эпитоп.
В определенных вариантах осуществления необязательный гетерологичный спейсер выбран из Lys-, Gly-, Lys-Lys-Lys-, (α, ε-N)Lys, Pro-Pro-Xaa-Pro-Xaa-Pro (SEQ ID NO: 76), ε-N-Lys-Lys-Lys-Lys (SEQ ID NO: 77), Lys-Lys-Lys- ε-N-Lys (SEQ ID NO: 231) и любой их комбинации, где Xaa представляет собой любую аминокислоту, а предпочтительно аспарагиновую кислоту. В конкретных вариантах осуществления гетерологичный спейсер представляет собой ε-N-Lys-Lys-Lys-Lys (SEQ ID NO: 77) или Lys-Lys-Lys- ε-N-Lys (SEQ ID NO: 231).
В определенных вариантах осуществления В-клеточный эпитопный пептид IL-6 имеет от около 7 до около 42 аминокислотных остатков полноразмерного зрелого белка IL-6 из SEQ ID NO: 1. В конкретных вариантах осуществления В-клеточный эпитопный пептид IL-6 содержит аминокислотную последовательность из внутримолекулярной петли IL-6, содержащейся в пределах (E42-C83, SEQ ID NO: 16). В конкретных вариантах осуществления В-клеточный эпитопный пептид IL-6 содержит внутреннюю петлю IL-6 из аминокислот C73-C83 (SEQ ID NO: 5) или IL-6 C44-C50 (SEQ ID NO: 15) (например, SEQ ID NO: 5-8, 10, 12, 15-17), как показано в таблице 1.
В определенных вариантах осуществления пептидная иммуногенная конструкция IL-6 имеет любую одну аминокислотную последовательность, выбранную из SEQ ID NO: 107-215, как показано в таблице 3. В конкретных вариантах осуществления пептидная иммуногенная конструкция IL-6 имеет любую одну аминокислотную последовательность, выбранную из SEQ ID NO: 107-160.
Пептидные иммуногенные конструкции IL-6, содержащие Th-эпитопы, могут быть получены одновременно в одном твердофазном пептидном синтезе в тандеме с фрагментом IL-6. Th-эпитопы также включают в себя иммунологические аналоги Th-эпитопов. Иммунологические Th-аналоги включают в себя иммуностимулирующие аналоги, перекрестно-реактивные аналоги и сегменты любого из этих Th-эпитопов, которые достаточны для усиления или стимуляции иммунного ответа на В-клеточный эпитопный пептид IL-6.
Th-эпитоп в пептидной иммуногеной конструкции IL-6 может быть ковалентно связан либо на N-, либо на C-конце B-клеточного эпитопного пептида IL-6. В некоторых вариантах осуществления Th-эпитоп ковалентно связан с N-концом В-клеточного эпитопного пептида IL-6. В других вариантах осуществления Th-эпитоп ковалентно связан с С-концом В-клеточного эпитопного пептида IL-6. В определенных вариантах осуществления более чем один Th-эпитоп ковалентно связан с В-клеточным эпитопным пептидом IL-6. Когда более чем один Th-эпитоп связан с В-клеточным эпитопным пептидом IL-6, каждый Th-эпитоп может иметь одинаковую аминокислотную последовательность или разные аминокислотные последовательности. Кроме того, когда более чем один Th-эпитоп связан с В-клеточным эпитопным пептидом IL-6, Th-эпитопы могут быть расположены в любом порядке. Например, Th-эпитопы могут быть последовательно связаны с N-концом В-клеточного эпитопного пептида IL-6 или могут быть последовательно связаны с C-концом В-клеточного эпитопного пептида IL-6, или Th-эпитоп может быть ковалентно связан с N-концом В-клеточного эпитопного пептида IL-6, в то время как отдельный Th-эпитоп ковалентно связан с C-концом В-клеточного эпитопного пептида IL-6. В расположении Th-эпитопов отсутствуют ограничения по отношению к В-клеточному эпитопному пептиду IL-6.
В некоторых вариантах осуществления Th-эпитоп ковалентно связан с В-клеточным эпитопным пептидом IL-6 непосредственно. В других вариантах осуществления Th-эпитоп ковалентно связан с фрагментом IL-6 посредством гетерологичного спейсера.
e. Варианты, гомологи и функциональные аналоги
Варианты и аналоги указанных выше иммуногенных пептидных конструкций, которые индуцируют и/или перекрестно реагирую с антителами к предпочтительным В-клеточным эпитопным пептидам IL-6, также могут использоваться. Аналоги, включая аллельные, видовые и индуцированные варианты, как правило, отличаются от встречающихся в природе пептидов в одном, двух или нескольких положениях, часто за счет консервативных замен. Аналоги, как правило, демонстрируют по меньшей мере 80 или 90% идентичности последовательности с природными пептидами. Некоторые аналоги также включают в себя неприродные аминокислоты или модификации N- или C-концевых аминокислот в одном, двух или нескольких положениях.
Варианты, которые являются функциональными аналогами, могут иметь консервативную замену в аминокислотном положении; изменение в общем заряде; ковалентное присоединение к другому фрагменту; или аминокислотные добавления, вставки или делеции; и/или любую их комбинацию.
Консервативные замены - это такие замены, когда один аминокислотный остаток заменяется другим аминокислотным остатком с аналогичными химическими свойствами. Например, неполярные (гидрофобные) аминокислоты включают в себя аланин, лейцин, изолейцин, валин, пролин, фенилаланин, триптофан и метионин; полярные нейтральные аминокислоты включают в себя глицин, серин, треонин, цистеин, тирозин, аспарагин и глутамин; положительно заряженные (основные) аминокислоты включают в себя аргинин, лизин и гистидин; а отрицательно заряженные (кислые) аминокислоты включают в себя аспарагиновую кислоту и глутаминовую кислоту.
В конкретном варианте осуществления функциональный аналог имеет по меньшей мере 50% идентичности с исходной аминокислотной последовательностью. В другом варианте осуществления функциональный аналог имеет по меньшей мере 80% идентичности с исходной аминокислотной последовательностью. В еще одном варианте осуществления функциональный аналог имеет по меньшей мере 85% идентичности с исходной аминокислотной последовательностью. В еще одном варианте осуществления функциональный аналог имеет по меньшей мере 90% идентичности с исходной аминокислотной последовательностью.
Варианты также включают в себя вариации фосфорилированных остатков. Например, варианты могут включать в себя различные остатки в пределах пептидов, которые являются фосфорилированными. Варианты иммуногенных пептидов IL-6 могут также включать в себя псевдофосфорилированные пептиды. Псевдофосфорилированные пептиды получают путем замены одного или более из фосфорилированного серинового, треонинового и тирозинового остатков пептидов IL-6 кислыми аминокислотными остатками, такими как глутаминовая кислота и аспарагиновая кислота.
Функциональные иммунологические аналоги Th-эпитопных пептидов также эффективны и включены как часть настоящего изобретения. Функциональные иммунологические Th-аналоги могут включать в себя консервативные замены, добавления, делеции и вставки от одного до около пяти аминокислотных остатков в Th-эпитопе, которые существенно не изменяют Th-стимулирующую функцию Th-эпитопа. Консервативные замены, добавления и вставки могут быть выполнены с природными или неприродными аминокислотами, как описано выше для В-клеточного эпитопного пептида IL-6. Таблица 2 идентифицирует другой вариант функционального аналога Th-эпитопного пептида. В частности, SEQ ID NO: 79 и 86 MvF1 и MvF2 Th являются функциональными аналогами SEQ ID NO: 89 и 91 MvF4 и MvF5 в том смысле, что они различаются в аминокислотной рамке по делеции (SEQ ID NO: 79 и 86) или включению (SEQ ID NO: 89 и 91) двух аминокислот, каждая на N- и C-концах. Различия между этими двумя сериями аналогичных последовательностей не влияют на функцию Th-эпитопов, содержащихся в этих последовательностях. Следовательно, функциональные иммунологические Th-аналоги включают в себя несколько версий Th-эпитопа, полученного из слитого белка вируса кори MvF1-4 Ths (SEQ ID NO: 79, 86, 87 и 89) и из поверхностного белка гепатита HBsAg 1-3 Ths (SEQ ID NO: 88, 90 и 92).
Композиции
В настоящем изобретении также предложены композиции, содержащие описанные иммуногенные пептидные конструкции IL-6.
a. Пептидные композиции
Композиции, содержащие описанные пептидные иммуногенные конструкции IL-6, могут быть в жидкой или твердой/лиофилизированной формах. Жидкие композиции могут включать в себя воду, буферы, растворители, соли и/или любой другой приемлемый реагент, который не изменяет структурные или функциональные свойства пептидных иммуногенных конструкций IL-6. Пептидные композиции могут содержать одну или более из описанных пептидных иммуногенных конструкций IL-6.
b. Фармацевтические композиции
Настоящее изобретение также направлено на фармацевтические композиции, содержащие описанные пептидные иммуногенные конструкции IL-6.
Фармацевтические композиции могут содержать носители и/или другие добавки в фармацевтически приемлемой системе доставки. Соответственно, фармацевтические композиции могут содержать фармацевтически эффективное количество пептидной иммуногенной конструкции IL-6 вместе с фармацевтически приемлемым носителем, адъювантом и/или другими вспомогательными веществами, такими как разбавители, добавки, стабилизирующие агенты, консерванты, солюбилизирующие агенты, буферы и т.п.
Фармацевтические композиции могут содержать один или более адъювантов, которые действуют для ускорения, продления или усиления иммунного ответа на пептидные иммуногенные конструкции IL-6, не оказывая какого-либо конкретного антигенного эффекта сами по себе. Адъюванты, используемые в фармацевтической композиции, могут включать в себя масла, масляные эмульсии, соли алюминия, соли кальция, иммуностимулирующие комплексы, бактериальные и вирусные производные, виросомы, углеводы, цитокины, полимерные микрочастицы. В определенных вариантах осуществления адъювант может быть выбран из квасцов (алюминия-калия фосфата), фосфата алюминия (например, ADJU-PHOS®), гидроксида алюминия (например, ALHYDROGEL®), фосфата кальция, неполного адъюванта Фрейнда (НАФ), полного адъюванта Фрейнда, MF59, адъюванта 65, Lipovant, ISCOM, липосина, сапонина, сквалена, L121, EmulsIL-6n®, монофосфориллипида A (MPL), Quil A, QS21, MONTANIDE® ISA 35, ISA 50V, ISA 50V2, ISA 51, ISA 206, ISA 720, липосом, фосфолипидов, пептидогликана, липополисахаридов (ЛПС), ASO1, ASO2, ASO3, ASO4, AF03, липофильного фосфолипида (липида А), гамма-инулина, альгаммулина, глюканов, декстранов, глюкоманнанов, галактоманнанов, леванов, ксиланов, диметилдиоктадециламмония бромида (DDA), а также других адъювантов и эмульгаторов.
В некоторых вариантах осуществления фармацевтическая композиция содержит MONTANIDE™ ISA 51 (масляная адъювантная композиция, состоящая из растительного масла и маннида олеата для получения эмульсий вода-в-масле), TWEEN® 80 (также известный как: Полисорбат 80 или Полиоксиэтилен (20) сорбитан моноолеат), CpG-олигонуклеотид и/или любую их комбинацию. В других вариантах осуществления фармацевтическая композиция представляет собой эмульсию вода-в-масле-в-воде (т.е. В/М/В) с EmulsIL-6n или EmulsIL-6n D в качестве адъюванта.
Фармацевтические композиции могут также включать в себя фармацевтически приемлемые добавки или вспомогательные вещества. Например, фармацевтические композиции могут содержать антиоксиданты, связующие вещества, буферы, объемообразующие агенты, носители, хелатирующие агенты, красители, разбавители, разрыхлители, эмульгаторы, наполнители, желирующие агенты, буферные агенты для поддержания pH, консерванты, солюбилизирующие агенты, стабилизаторы и т.п.
Фармацевтические композиции могут быть приготовлены в виде составов с немедленным высвобождением или замедленным высвобождением. Дополнительно фармацевтические композиции могут быть приготовлены для индуцирования системного, или местного мукозного, иммунитета путем захвата иммуногена и совместного введения с микрочастицами. Такие системы доставки легко определяются специалистом в данной области техники.
Фармацевтические композиции могут быть приготовлены в виде впрыскиваемых лекарственных средств, или в виде жидких растворов, или суспензий. Жидкие носители, содержащие пептидную иммуногенную конструкцию IL-6, также можно приготовить перед инъекцией. Фармацевтическую композицию можно вводить любым пригодным для этого способом, например, в/к, в/в, в/б, в/м, интраназально, перорально, подкожно и т.д., и в любом пригодном устройстве доставки. В определенных вариантах осуществления фармацевтическую композицию составляют для внутривенного, подкожного, внутрикожного или внутримышечного введения. Также могут быть приготовлены фармацевтические композиции, пригодные для других способов введения, включая пероральное и интраназальное применение.
Фармацевтические композиции также могут быть составлены в пригодной единичной дозированной форме. В некоторых вариантах осуществления фармацевтическая композиция содержит от около 0,1 мкг до около 1 мг пептидной иммуногенной конструкции IL-6 на кг массы тела. Эффективные дозы фармацевтических композиций варьируются в зависимости от многих различных факторов, включая способы введения, место назначения, физиологическое состояние пациента, является ли пациент человеком или животным, вводятся ли другие лекарственные препараты, и является ли лечение профилактическим или терапевтическим. Как правило, пациент является человеком, однако также можно лечить отличных от человека млекопитающих, включая трансгенных млекопитающих. При доставке несколькими дозами фармацевтические композиции могут быть удобно разделены на соответствующее количество на единичную дозированную форму. Вводимая доза будет зависеть от возраста, массы и общего состояния здоровья субъекта, как хорошо известно в терапевтической области.
В некоторых вариантах осуществления фармацевтическая композиция содержит более одной пептидной иммуногенной конструкции IL-6. Фармацевтическая композиция, содержащая смесь более одной пептидной иммуногенной конструкции IL-6, обеспечивает синергическое усиление иммуноэффективности этих конструкций. Фармацевтические композиции, содержащие более одной пептидной иммуногенной конструкции IL-6, могут быть более эффективными в большей генетической популяции вследствие широкого охвата ГКГС класса II, тем самым обеспечивая улучшенный иммунный ответ на пептидные иммуногенные конструкции IL-6.
В некоторых вариантах осуществления фармацевтическая композиция содержит пептидную иммуногенную конструкцию IL-6, выбранную из SEQ ID NO: 107-215 (таблица 3), а также их гомологи, аналоги и/или комбинации.
В определенных вариантах осуществления пептидные иммуногенные конструкции IL-6 (SEQ ID NO: 170-172) с гетерологичными Th-эпитопами, полученными из MVF и HBsAg в комбинаторной форме (SEQ ID NO: 87-90), смешивали в эквимолярном соотношении для применения в составах с целью обеспечения максимального охвата популяции хозяев, имеющих разнообразный генетический фон. Синергическое усиление в иммуногенных конструкциях IL-6 73-83 (SEQ ID NO: 170, 172) наблюдали в пептидных композициях по настоящему изобретению.
Кроме того, ответ антител, вызванный пептидной иммуногенной конструкцией IL-6 (например, UBITh®1 с SEQ ID NO: 91), в основном (>90%) сфокусирован на желаемой перекрестной реактивности против В-клеточного эпитопного пептида IL-6 (SEQ ID NO: 5), при этом незначительный процент, если таковой имеется, направлен на гетерологичные Th-эпитопы, применяемые для усиления иммуногенности (пример 6, таблица 8). В этом заключается резкое отличие от обычного белка, такого как KLH, или других биологических белков-носителей, используемых для такого усиления иммуногенности пептида IL-6.
В других вариантах осуществления фармацевтические композиции, содержащие пептидную композицию, например, из смеси пептидных иммуногенных конструкций IL-6 в контакте с минеральными солями, включая гель на основе квасцов (ALHYDROGEL) или фосфат алюминия (ADJUPHOS) в качестве адъюванта, для образования суспензии, использовали для введения хозяевам.
Фармацевтические композиции, содержащие пептидную иммуногенную конструкцию IL-6, можно использовать, чтобы вызвать иммунный ответ и выработать антитела у хозяина после введения.
c. Иммуностимулирующие комплексы
Настоящее изобретение также направлено на фармацевтические композиции, содержащие пептидную иммуногенную конструкцию IL-6 в форме иммуностимулирующего комплекса с олигонуклеотидом CpG. Такие иммуностимулирующие комплексы специально приспособлены для действия в качестве адъюванта и стабилизатора пептидного иммуногена. Иммуностимулирующие комплексы находятся в форме частиц, которые могут эффективно презентировать пептидный иммуноген IL-6 клеткам иммунной системы, вызывая иммунный ответ. Иммуностимулирующие комплексы могут быть приготовлены в виде суспензии для парентерального введения. Иммуностимулирующие комплексы также могут быть приготовлены в форме эмульсий вода-в-масле (В/М), в виде суспензии в комбинации с минеральной солью или с желирующим полимером in situ для эффективной доставки пептидной иммуногенной конструкции IL-6 к клеткам иммунной системы хозяина после парентерального введения.
Стабилизированный иммуностимулирующий комплекс может быть сформирован путем образования комплекса пептидной иммуногенной конструкции IL-6 с анионной молекулой, олигонуклеотидом, полинуклеотидом или их комбинациями посредством электростатической ассоциации. Стабилизированный иммуностимулирующий комплекс может быть включен в фармацевтическую композицию в качестве системы доставки иммуногена.
В определенных вариантах осуществления пептидная иммуногенная конструкция IL-6 сконструирована с возможностью содержания катионной части, которая положительно заряжена при рН в диапазоне от 5,0 до 8,0. Суммарный заряд катионной части пептидной иммуногенной конструкции IL-6 или смеси конструкций рассчитывают, назначая заряд +1 для каждого лизина (K), аргинина (R) или гистидина (H), заряд -1 для каждой аспарагиновой кислоты (D) или глутаминовой кислоты (E) и заряд 0 для другой аминокислоты в пределах последовательности. Заряды суммируются в пределах катионной части пептидной иммуногенной конструкции IL-6 и выражаются как суммарный средний заряд. Пригодный пептидный иммуноген имеет катионную часть с суммарным средним положительным зарядом +1. Предпочтительно пептидный иммуноген имеет суммарный положительный заряд в диапазоне, превышающем +2. В некоторых вариантах осуществления катионная часть пептидной иммуногенной конструкции IL-6 представляет собой гетерологичный спейсер. В определенных вариантах осуществления катионная часть пептидной иммуногенной конструкции IL-6 имеет заряд +4, когда последовательность спейсера представляет собой (α, ε-N)Lys, ε-N-Lys-Lys-Lys-Lys (SEQ ID NO: 77).
«Анионная молекула», как описано в настоящем документе, относится к любой молекуле, которая имеет отрицательный заряд при pH в диапазоне 5,0-8,0. В определенных вариантах осуществления анионная молекула представляет собой олигомер или полимер. Суммарный отрицательный заряд олигомера или полимера рассчитывается путем присвоения заряда -1 для каждой фосфодиэфирной или фосфоротиоатной группы в олигомере. Пригодным анионным олигонуклеотидом является одноцепочечная молекула ДНК с 8-64 нуклеотидными основаниями с числом повторов CpG-мотива в диапазоне от 1 до 10. Предпочтительно иммуностимулирующие одноцепочечные молекулы CpG ДНК содержат 18-48 нуклеотидных оснований с числом повторов CpG-мотива в диапазоне от 3 до 8.
Более предпочтительно анионный олигонуклеотид представлен формулой: 5' X1CGX2 3', где C и G являются неметилированными; а X1 выбран из группы, состоящей из A (аденина), G (гуанина) и T (тимина); и Х2 представляет собой С (цитозин) или Т (тимин). Или анионный олигонуклеотид представлен формулой: 5' (X3)2CG(X4)2 3’, где C и G являются неметилированными; а X3 выбран из группы, состоящей из A, T или G; а X4 представляет собой C или T. В конкретных вариантах осуществления олигонуклеотид CpG имеет последовательность CpG1: 5' TCg TCg TTT TgT CgT TTT gTC gTT TTg TCg TT 3' (полностью фосфоротиоатная) (SEQ ID NO: 232), CpG2: 5' фосфат TCg TCg TTT TgT CgT TTT gTC gTT 3' (полностью фосфоротиоатная) (SEQ ID NO: 233) или CpG3 5' TCg TCg TTT TgT CgT TTT gTC gTT 3' (полностью фосфоротиоатная) (SEQ ID NO: 234).
Полученный иммуностимулирующий комплекс имеет форму частиц с размером обычно в диапазоне от 1 до 50 микрон и является функцией многих факторов, включая стехиометрию относительного заряда и молекулярную массу взаимодействующих частиц. Иммуностимулирующий комплекс в виде частиц имеет то преимущество, что обеспечивает адъювантацию и активацию специфических иммунных ответов in vivo. Кроме того, стабилизированный иммуностимулирующий комплекс является пригодным для приготовления фармацевтических композиций различными способами, включая эмульсии вода-в-масле, суспензии минеральных солей и полимерные гели.
Настоящее изобретение также направлено на фармацевтические композиции, включая составы, для предотвращения и/или лечения заболеваний, на которые влияет нарушение регуляции IL-6. В некоторых вариантах осуществления фармацевтические композиции, содержащие стабилизированный иммуностимулирующий комплекс, который был образован путем смешивания олигомера CpG с пептидной композицией, содержащей смесь пептидных иммуногенных конструкций IL-6 (например, SEQ ID NO: 107-215), посредством электростатической ассоциации, чтобы дополнительно усилить иммуногенность пептидных иммуногенных конструкций IL-6 и вызвать антитела, которые являются перекрестно реактивными с белками IL-6 из SEQ ID NO: 1-4, направленными на связывающие IL-6R области (пример 6).
В еще других вариантах осуществления фармацевтические композиции содержат смесь пептидных иммуногенных конструкций IL-6 (например, любую комбинацию SEQ ID NO: 107-215) в форме стабилизированного иммуностимулирующего комплекса с олигомерами CpG, которые необязательно смешаны с минеральными солями, включая гель на основе квасцов (ALHYDROGEL) или фосфат алюминия (ADJUPHOS) в качестве адъюванта с высоким коэффициентом безопасности, для образования суспензии для введения хозяевам.
Антитела
В настоящем изобретении также предложены антитела, вызванные описанными пептидными иммуногенными конструкциями IL-6.
В настоящем изобретении предложены пептидные иммуногенные конструкции IL-6 и их составы, которые являются рентабельными при производстве, оптимальными по своему дизайну и способны вызывать антитела с высоким титром, нацеленные на связывающую IL-6R область молекулы IL-6, способной нарушать иммунную толерантность к собственному белку IL-6 с высокой частотой ответа у иммунизированных хозяев. Антитела, вызванные пептидными иммуногенными конструкциями IL-6, обладают высокой аффинностью в отношении связывающей IL-6R области.
В некоторых вариантах осуществления пептидные иммуногенные конструкции IL-6 для выработки антител содержат гибрид пептида IL-6, содержащий В-клеточный эпитоп, содержащий от около 7 до около 42 аминокислот, охватывающих связывающие IL-6Rα и IL-6Rβ области, с необязательной возможностью содержать внутримолекулярную петлевую структуру, полученную из C73-C83 (SSEQ ID NO: 5) или C44-C50 (SEQ ID NO: 15) пептида IL-6 в пределах IL-6 (см. Таблицу 1, Фиг. 1 и SEQ ID NO: 1 и 227), который связан с гетерологичным Th-эпитопом, полученным из патогенных белков, таких как слитый белок вируса кори (MVF) и другие (SEQ ID NO: 78-106 и 216-226), посредством необязательного спейсера. В-клеточный эпитоп и Th-эпитоп пептидных иммуногенных конструкций IL-6 действуют вместе для стимуляции выработки высокоспецифичных антител, являющихся перекрестно-реактивными со связывающей IL-6R областью белка IL-6 (SEQ ID NO: 1).
Традиционные способы иммуностимулирования пептида, например, посредством химического связывания с белком-носителем, например, гемоцианином лимфы улитки (KLH), или другими белками-носителями, такими как дифтерийный анатоксин (DT) и столбнячный анатоксин (TT), как правило, приводят к получению большого количества антител, направленных против белка-носителя. Таким образом, основной недостаток таких композиций пептид-белок-носитель заключается в том, что большая часть (>90%) антител, генерируемых иммуногеном, представляет собой нефункциональные антитела, направленные против белка-носителя KLH, DT или TT, что может привести к супрессии эпитопов.
В отличие от традиционных способов иммуностимулирования пептида, антитела, генерируемые описанными пептидными иммуногенными конструкциями IL-6 (например, SEQ ID NO: 142), связываются с высокой специфичностью с В-клеточным эпитопным пептидом IL-6 (например, SEQ ID NO: 5-19), при этом небольшое количество антител, если таковые имеются, направлено против гетерологичного Th-эпитопа (например, SEQ ID NO: 91 из таблицы 8) или необязательного гетерологичного спейсера. В частности, поликлональные антитела, вызванные у иммунизированных животных, связываются с высокой специфичностью с центральной связывающей IL-6R областью (SEQ ID NO: 107), что приводит к ингибированию взаимодействия IL-6 и IL-6R посредством цис-сигнализации, как показано на Фиг. 5A.
Способы
Настоящее изобретение также направлено на способы создания и применения пептидных иммуногенных конструкций IL-6, композиций и фармацевтических композиций.
a. Способы производства пептидной иммуногенной конструкции IL-6
Пептидные иммуногенные конструкции IL-6 по настоящему изобретению могут быть получены с помощью способов химического синтеза, хорошо известных обычному специалисту в данной области техники (см., например, Fields et al., Chapter 3 in Synthetic Peptides: A User’s Guide, ed. Grant, W. H. Freeman & Co., New York, NY, 1992, p. 77). Пептидные иммуногенные конструкции IL-6 могут быть синтезированы с применением методики автоматизированного твердофазного синтеза Меррифилда с α-NH2, защищенным с помощью химических соединений t-Boc или F-moc, используя аминокислоты с защищенной боковой цепью, например, на пептидном синтезаторе компании Applied Biosystems модели 430A или 431. Получение пептидных иммуногенных конструкций IL-6, содержащих пептиды из комбинаторных библиотек для Th-эпитопов, может осуществляться путем обеспечения смеси альтернативных аминокислот для связывания в заданном вариабельном положении.
После полной сборки желаемой пептидной иммуногенной конструкции IL-6 смолу можно обработать в соответствии со стандартными процедурами, чтобы отщепить пептид от смолы и разблокировать функциональные группы на боковых цепях аминокислот. Свободный пептид можно очистить с помощью ВЭЖХ и охарактеризовать биохимически, например, с помощью аминокислотного анализа или секвенирования. Способы очистки и характеристики пептидов хорошо известны обычному специалисту в данной области техники.
Качество пептидов, полученных в результате этого химического процесса, можно контролировать и определять, в результате чего можно гарантировать воспроизводимость пептидных иммуногенных конструкций IL-6, иммуногенность и выход. Подробное описание производства пептидной иммуногенной конструкции IL-6 путем твердофазного пептидного синтеза приведено в примере 1.
Было обнаружено, что диапазон структурных вариаций, позволяющий сохранять предполагаемую иммунологическую активность, является намного более аккомодационным, чем диапазон структурных вариаций, позволяющий сохранять специфическую активность лекарственного вещества низкомолекулярным лекарственным средством или желаемую активность и нежелательную токсичность, обнаруженные в больших молекулах, которые совместно вырабатываются с лекарственными средствами, полученными биологическим методом.
Таким образом, пептидные аналоги, разработанные намеренно или неизбежно полученные в результате ошибок в процессе синтеза в виде смеси побочных продуктов последовательностей делеции, обладающих хроматографическими и иммунологическими свойствами, аналогичными предполагаемому пептиду, часто являются такими же эффективными, что и очищенный препарат желаемого пептида. Разработанные аналоги и смеси непреднамеренных аналогов являются эффективными, если разработана процедура КЯ для различения с целью мониторинга как производственного процесса, так и процесса оценки продукта, чтобы гарантировать воспроизводимость и эффективность конечного продукта, в котором используются эти пептиды.
Пептидные иммуногенные конструкции IL-6 также могут быть получены с использованием технологии рекомбинантной ДНК, включая молекулы нуклеиновых кислот, векторы и/или клетки-хозяева. Соответственно, молекулы нуклеиновых кислот, кодирующие пептидную иммуногенную конструкцию IL-6 и ее иммунологически функциональные аналоги, также охватываются настоящим изобретением как часть настоящего изобретения. Аналогично, векторы, включая векторы экспрессии, содержащие молекулы нуклеиновых кислот, а также клетки-хозяева, содержащие векторы, также охватываются настоящим изобретением как часть настоящего изобретения.
Различные иллюстративные варианты осуществления также охватывают способы получения пептидной иммуногенной конструкции IL-6 и ее иммунологически функциональных аналогов. Например, способы могут включать в себя этап инкубации клетки-хозяина, содержащей вектор экспрессии, содержащий молекулу нуклеиновой кислоты, кодирующую пептидную иммуногенную конструкцию IL-6 и/или ее иммунологически функциональные аналоги, в таких условиях, когда экспрессируется пептид и/или аналог. Более длинные синтетические пептидные иммуногены могут быть синтезированы с помощью хорошо известных методик рекомбинантной ДНК. Такие методики представлены в хорошо известных стандартных справочных руководствах с подробным описанием протоколов. Чтобы сконструировать ген, кодирующий пептид по этому изобретению, аминокислотная последовательность обратно транслируется для получения последовательности нуклеиновой кислоты, кодирующей аминокислотную последовательность, предпочтительно с применением кодонов, оптимальных для организма, в котором будет экспрессироваться ген. Затем получают синтетический ген, как правило, путем синтеза олигонуклеотидов, которые кодируют пептид, и любых регуляторных элементов, если это необходимо. Синтетический ген вставляют в подходящий вектор клонирования и трансфицируют в клетку-хозяина. Пептид затем экспрессируется в подходящих условиях, пригодных для выбранной системы экспрессии и хозяина. Пептид очищают и характеризуют с помощью стандартных способов.
b. Способы производства иммуностимулирующих комплексов
Различные иллюстративные варианты осуществления также охватывают способы получения иммуностимулирующих комплексов, содержащих пептидные иммуногенные конструкции IL-6 и молекулу олигодезоксинуклеотида CpG (ODN). Стабилизированные иммуностимулирующие комплексы (ISC) получены из катионной части пептидной иммуногенной конструкции IL-6 и полианионной молекулы ODN CpG. Самособираемая система управляется электростатической нейтрализацией заряда. Стехиометрия молярного соотношения зарядов катионной части пептидной иммуногенной конструкции IL-6 и анионного олигомера определяет степень ассоциации. Нековалентная электростатическая ассоциация пептидной иммуногенной конструкции IL-6 и ODN CpG является полностью воспроизводимым процессом. Агрегаты иммуностимулирующего комплекса пептид/ODN CpG, которые способствуют презентации «профессиональным» антигенпрезентирующим клеткам (APC) иммунной системы, тем самым дополнительно повышая иммуногенность этих комплексов. Эти комплексы легко охарактеризовать для контроля качества в ходе производства. ISC пептид/CpG хорошо переносятся in vivo. Эта новая система в форме частиц, содержащая ODN CpG и пептидные иммуногенные конструкции IL-6, была разработана для использования преимуществ общей В-клеточной митогенности, связанной с использованием ODN CpG, и в то же время для обеспечения сбалансированных ответов типа Th-1/Th-2.
ODN CpG в описанных фармацевтических композициях на 100% связывается с иммуногеном в ходе процесса, опосредованного электростатической нейтрализацией противоположного заряда, что приводит к образованию частиц микронного размера. Форма в виде частиц позволяет значительно снизить дозу CpG по сравнению с обычным использованием адъювантов CpG, уменьшить потенциал для нежелательных врожденных иммунных ответов, а также она обеспечивает альтернативные пути иммуногенной обработки, включая антигенпрезентирующие клетки (APC). Следовательно, такие составы являются концептуально новыми и предлагают потенциальные преимущества, способствуя стимуляции иммунных ответов с помощью альтернативных механизмов.
c. Способы производства фармацевтических композиций
Различные иллюстративные варианты осуществления также охватывают фармацевтические композиции, содержащие пептидные иммуногенные конструкции IL-6. В определенных вариантах осуществления в фармацевтических композициях применяют эмульсии вода-в-масле, а также суспензии с минеральными солями.
Чтобы обеспечить использование фармацевтической композиции большой популяцией, безопасность становится еще одним важным фактором, который следует учитывать. Несмотря на то, что эмульсии вода-в-масле используются во многих клинических исследованиях, квасцы остаются основным адъювантом, применяемым в составах, благодаря своей безопасности. Квасцы или их минеральная соль фосфат алюминия (ADJUPHOS), таким образом, часто используются в качестве адъювантов в препаратах для клинического применения.
Другие адъюванты и иммуностимулирующие агенты включают в себя 3-де-O-ацилированный монофосфориллипид A (MPL) или 3-DMP, полимерные или мономерные аминокислоты, такие как полиглутаминовая кислота или полилизин. Такие адъюванты могут быть использованы с другими специфичными иммуностимулирующими агентами, такими как мурамилпептиды (например, N-ацетилмурамил-L-треонил-D-изоглутамин (thr-MDP), N-ацетилнормурамил-L-аланил-D-изоглутамин (nor-MDP), N-ацетилмурамил-L-аланил-D-изоглутаминил-L-аланин-2-(1′-2′ дипальмитоил-сн-глицеро-3-гидроксифосфорилокси)-этиламин (MTP-PE), N-ацетилглюкозаминил-N-ацетилмурамил-L-Al-D-изоглу-L-Ala-дипальмитоксипропиламид (DTP-DPP) THERAMIDE™) или другие компоненты клеточной стенки бактерии, либо без таких иммуностимулирующих агентов. Эмульсии масло-в-воде включают в себя MF59 (см. WO 90/14837, Van Nest et al., которая полностью включена в настоящий документ посредством ссылки), содержащую 5% сквален, 0,5% TWEEN 80 и 0,5% Span 85 (необязательно содержащий различные количества MTP-PE), составленную в виде субмикронных частиц с использованием микрофлюидизатора; SAF, содержащую 10% сквален, 0,4% TWEEN 80, 5% блокированный плюроником полимер L121 и thr-MDP, либо микрофлюидизированную в субмикронную эмульсию, либо перемешанную на вортексе для получения эмульсии с более крупным размером частиц; и адъювантную систему RIBI™ (RAS) (Ribi ImmunoChem, Hamilton, Mont.), содержащую 2% сквален, 0,2% TWEEN 80 и один или более компонентов клеточной стенки бактерии, выбранных из группы, состоящей из монофосфориллипида A (MPL), димиколата трегалозы (TDM) и скелета клеточной стенки (CWS), предпочтительно MPL+CWS (Detox™). Другие адъюванты включают в себя полный адъювант Фрейнда (ПАФ), неполный адъювант Фрейнда (НАФ) и цитокины, такие как интерлейкины (IL-1, IL-2 и IL-12), макрофагальный колониестимулирующий фактор (M-CSF) и фактор некроза опухоли (ФНО-α).
Выбор адъюванта зависит от стабильности иммуногенного состава, содержащего адъювант, пути введения, схемы дозирования, эффективности адъюванта для вида, подвергаемого иммунизации, а для человека фармацевтически приемлемый адъювант представляет собой адъювант, который одобрен или может быть одобрен для введения человеку соответствующими контролирующими органами. Например, для введения человеку пригодны квасцы, MPL или неполный адъювант Фрейнда (Chang, et al., 1998, которая полностью включена в настоящий документ посредством ссылки) отдельно или необязательно в любой их комбинации.
Композиции могут включать в себя фармацевтически приемлемые нетоксичные носители или разбавители, которые определены как носители, как правило, используемые для приготовления фармацевтических композиций для введения животным или человеку. Разбавитель подбирается так, чтобы не влиять на биологическую активность комбинации. Примерами таких разбавителей является дистиллированная вода, физиологический фосфатно-солевой буфер, раствор Рингера, раствор декстрозы и раствор Хэнка. Кроме того, фармацевтическая композиция или состав может также включать в себя другие носители, адъюванты или нетоксичные, нетерапевтические, неиммуногенные стабилизаторы и тому подобное.
Фармацевтические композиции могут также включать в себя большие, медленно метаболизируемые макромолекулы, такие как белки, полисахариды, такие как хитозан, полимолочные кислоты, полигликолевые кислоты и сополимеры (например, функционализированная латексом сефароза, агароза, целлюлоза и т. п.), полимерные аминокислоты, аминокислотные сополимеры и липидные агрегаты (например, масляные капли или липосомы). Кроме того, эти носители могут выполнять функцию иммуностимулирующих агентов (т. е. адъювантов).
Фармацевтические композиции по настоящему изобретению могут дополнительно включать в себя подходящий носитель для доставки. Подходящие носители для доставки включают в себя, помимо прочего, вирусы, бактерии, биоразлагаемые микросферы, микрочастицы, наночастицы, липосомы, коллагеновые мини-гранулы и кохелаты.
d. Способы применения фармацевтических композиций
Настоящее изобретение также включает в себя способы применения фармацевтических композиций, содержащих пептидные иммуногенные конструкции IL-6.
В определенных вариантах осуществления фармацевтические композиции, содержащие пептидные иммуногенные конструкции IL-6, могут использоваться для лечения заболеваний, на которые влияет нарушение регуляции IL-6.
В некоторых вариантах осуществления способы включают в себя введение фармацевтической композиции, содержащей фармакологически эффективное количество пептидной иммуногенной конструкции IL-6, нуждающемуся в этом хозяину. В определенных вариантах осуществления способы включают в себя введение фармацевтической композиции, содержащей фармакологически эффективное количество пептидной иммуногенной конструкции IL-6, теплокровному животному (например, людям, яванским макакам, мышам), чтобы вызвать высокоспецифичные антитела, являющиеся перекрестно-реактивными с человеческим белком IL-6 (SEQ ID NO: 1) или белками IL-6 других видов (SEQ ID NO: 2-4).
В определенных вариантах осуществления фармацевтические композиции, содержащие пептидные иммуногенные конструкции IL-6, можно использовать для лечения заболеваний, на которые влияет нарушение регуляции IL-6, как показано в анализах in vitro и на моделях заболеваний in vivo.
e. Функциональные анализы in vitro и подтверждающие концепцию исследования in vivo
Антитела, вызванные у иммунизированных хозяев пептидными иммуногенными конструкциями IL-6, можно использовать в функциональных анализах in vitro. Такие функциональные анализы включают в себя, помимо прочего:
(1) связывание in vitro с белком IL-6 (SEQ ID NO: 1) в качестве рекомбинантного белка;
(2) ингибирование in vitro цис-связывания IL-6 с IL-6 Rα;
(3) ингибирование in vitro транс-связывания IL-6/IL-6Rα с IL-6Rβ (пример 3);
(4) ингибирование in vitro индуцированной IL-6 пролиферации TF-1 (примеры 3 и 7);
(5) ингибирование in vitro индуцированного IL-6 фосфорилирования STAT3 (примеры 3 и 7);
(6) ингибирование in vitro индуцированной IL-6 выработки MCP-1 человеческими клетками U937 (примеры 3 и 7);
(7) ингибирование in vivo модели коллаген-индуцированного артрита (КИА) у крыс;
(8) ингибирование/ослабление in vivo высвобождения нейтрофилов из костного мозга в кровоток у крыс;
(9) ингибирование in vivo симптомов артрита в соответствии с оценками артрита у крыс, измеренными с помощью:
(i) вызванных воспалением секреторных белков печени;
(ii) повреждения голеностопного сустава;
(iii) выработки ФНО-α, IL-17 и MCP в тканях;
(iv) обратимой потери массы тела;
(v) отека задней лапы;
(vi) уменьшения нейтрофилии;
(vii) уменьшения высвобождения тромбоцитов.
Конкретные варианты осуществления данного изобретения
(1) Пептидная иммуногенная конструкция IL-6, имеющая около 30 или более аминокислот, представленная формулами:
(Th)m-(A)n-(связывающая IL-6R область IL-6 или ее фрагмент)-X
или
(связывающая IL-6R область IL-6 или ее фрагмент)-(A)n-(Th)m-X
или
(Th)m-(A)n-(связывающая IL-6R область IL-6 или ее фрагмент)-(A)n-(Th)m-X?
где
Th представляет собой гетерологичный Т-хелперный эпитоп;
А представляет собой гетерологичный спейсер;
(связывающая IL-6R область IL-6 или ее фрагмент) представляет собой В-клеточный эпитопный пептид, имеющий от около 7 до около 42 аминокислотных остатков из связывающей IL-6R области IL-6 (SEQ ID NO: 1);
X представляет собой α-COOH или α-CONH2 аминокислоты;
m равно от 1 до около 4; и
n равно от 0 до около 10.
(2) Пептидная иммуногенная конструкция IL-6 по п. (1), в которой связывающая IL-6R область или ее фрагмент выбраны из группы, состоящей из SEQ ID NO: 5-19.
(3) Пептидная иммуногенная конструкция IL-6 по любому из пп. (1) или (2), в которой Th-эпитоп выбран из группы, состоящей из SEQ ID NO: 78-106 и 216-226.
(4) Пептидная иммуногенная конструкция IL-6 по п. (1), в которой пептидная иммуногенная конструкция выбрана из группы, состоящей из SEQ ID NO: 107-215.
(5) Пептидная иммуногенная конструкция IL-6, содержащая:
a. В-клеточный эпитоп, содержащий от около 7 до около 42 аминокислотных остатков из последовательности IL-6 SEQ ID NO: 1-4;
b. Т-хелперный эпитоп, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 78-106, 216-226 и любой их комбинации; и
c. необязательный гетерологичный спейсер, выбранный из группы, состоящей из аминокислоты, Lys-, Gly-, Lys-Lys-Lys-, (α, ε-N)Lys, ε-N-Lys-Lys-Lys-Lys (SEQ ID NO: 77), Lys-Lys-Lys- ε-N-Lys (SEQ ID NO: 231) и Pro-Pro-Xaa-Pro-Xaa-Pro (SEQ ID NO: 76) и любой их комбинации,
причем В-клеточный эпитоп ковалентно связан с Т-хелперным эпитопом непосредственно или с помощью необязательного гетерологичного спейсера.
(6) Пептидная иммуногенная конструкция IL-6 по п. (5), в которой В-клеточный эпитоп выбран из группы, состоящей из SEQ ID NO: 5-19.
(7) Пептидная иммуногенная конструкция IL-6 по п. (5), в которой Т-хелперный эпитоп выбран из группы, состоящей из SEQ ID NO: 78-106.
(8) Пептидная иммуногенная конструкция IL-6 по п. (5), в которой необязательный гетерологичный спейсер представляет собой (α, ε-N)Lys, ε-N-Lys-Lys-Lys-Lys (SEQ ID NO: 77), Lys-Lys-Lys-ε-N-Lys (SEQ ID NO: 231) или Pro-Pro-Xaa-Pro-Xaa-Pro (SEQ ID NO: 76), где Xaa представляет собой любую аминокислоту, а предпочтительно аспарагиновую кислоту.
(9) Пептидная иммуногенная конструкция IL-6 по п. (5), в которой Т-хелперный эпитоп ковалентно связан с амино-концом B-клеточного эпитопа.
(10) Пептидная иммуногенная конструкция IL-6 по п. (5), в которой Т-хелперный эпитоп ковалентно связан с амино-концом B-клеточного эпитопа с помощью необязательного гетерологичного спейсера.
(11) Композиция, содержащая пептидную иммуногенную конструкцию IL-6 по п. (1).
(12) Фармацевтическая композиция, содержащая:
a. пептидную иммуногенную конструкцию по п. (1) и
b. фармацевтически приемлемый носитель для доставки и/или адъювант.
(13) Фармацевтическая композиция по п. (12), в которой:
a. связывающая IL-6R область или ее фрагмент выбраны из группы, состоящей из SEQ ID NO: 5-19;
b. Th-эпитоп выбран из группы, состоящей из SEQ ID NO: 78-106 и 216-226; и
c. гетерологичный спейсер выбран из группы, состоящей из аминокислоты, Lys-, Gly-, Lys-Lys-Lys-, (α, ε-N)Lys, ε-N-Lys-Lys-Lys-Lys (SEQ ID NO: 77), Lys-Lys-Lys- ε-N-Lys (SEQ ID NO: 231) и Pro-Pro-Xaa-Pro-Xaa-Pro (SEQ ID NO: 76), и любой их комбинации; и
причем пептидная иммуногенная конструкция IL-6 смешана с олигодезоксинуклеотидом CpG (ODN) с образованием стабильного иммуностимулирующего комплекса.
(14) Фармацевтическая композиция по п. (12), в которой:
a. пептидная иммуногенная конструкция IL-6 выбрана из группы, состоящей из SEQ ID NO: 107-215; и
причем пептидная иммуногенная конструкция IL-6 смешана с олигодезоксинуклеотидом CpG (ODN) с образованием стабильного иммуностимулирующего комплекса.
(15) Способ получения антител к IL-6 у животного, включающий в себя введение животному фармацевтической композиции по п. (12).
(16) Выделенное антитело или его эпитопсвязывающий фрагмент, которые специфически связываются со связывающей IL-6R областью IL-6 или ее фрагментом в пептидной иммуногенной конструкции IL-6 по п. (1).
(17) Выделенное антитело или его эпитопсвязывающий фрагмент по п. (16), связанные с пептидной иммуногенной конструкцией IL-6.
Выделенное антитело или его эпитопсвязывающий фрагмент, которые специфически связываются с В-клеточным эпитопным пептидом из пептидной иммуногенной конструкции IL-6 по любому из пп. (1)-(10).
(18) Композиция, содержащая выделенное антитело или его эпитопсвязывающий фрагмент по п. (16).
(19) Способ предотвращения и/или лечения заболевания, на которое влияет нарушение регуляции IL-6, у животного, включающий в себя введение указанному животному фармацевтической композиции по п. (12).
ПРИМЕР 1
СИНТЕЗ РОДСТВЕННЫХ IL-6 ПЕПТИДОВ И ПОЛУЧЕНИЕ ИХ СОСТАВОВ
a. Синтез родственных IL-6 пептидов
Описаны способы синтеза родственных IL-6 пептидов, которые были включены в разработку пептидных иммуногенных конструкций IL-6. Пептиды были синтезированы в небольших количествах, пригодных для серологических анализов, лабораторных пилотных и экспериментальных исследований, а также в больших количествах (в килограммах), пригодных для промышленного/коммерческого производства фармацевтических композиций. Большой репертуар родственных IL-6 антигенных пептидов, имеющих последовательности длиной от около 7 до около 70 аминокислот, был разработан для картирования эпитопов, а также для скрининга и отбора наиболее оптимальных пептидных иммуногенных конструкций для применения в эффективных, нацеленных на IL-6 терапевтических композициях.
Иллюстративные полноразмерные IL-6 человека, мыши, крысы и макака (SEQ ID NO: 1-4), пептидные фрагменты IL-6 и 10-мерный пептид, используемые для картирования эпитопов в различных серологических анализах, приведены в таблице 1 (SEQ ID NO: 5-75).
Выбранные В-клеточные эпитопные пептиды IL-6 были превращены в пептидные иммуногенные конструкции IL-6 путем синтетического связывания с тщательно разработанным эпитопным пептидом Т-хелперных клеток (Th), который был получен из патогенных белков, включая слитый белок вируса кори (MVF), поверхностный антиген гепатита B (HBsAg), пептид вируса гриппа, столбнячную палочку и вирус Эпштейна-Барр (EBV), представленные в таблице 2 (SEQ ID NO: 78-106 и 216-226). Th-эпитопные пептиды использовались в виде либо одной последовательности (SEQ ID NO: 78-86 и 91-106), либо комбинаторной библиотеки (SEQ ID NO: 87-90) для повышения иммуногенности соответствующих пептидных иммуногенных конструкций IL-6.
Иллюстративные пептидные иммуногенные конструкции IL-6, выбранные из сотен пептидных конструкций, приведены в таблице 3 (SEQ ID NO: 107-215).
Все пептиды, используемые в исследованиях иммуногенности или связанных с ними серологических тестах для обнаружения и/или измерения антител к IL-6, были синтезированы в небольшом масштабе, используя химическое соединение F-moc, с помощью пептидных синтезаторов Applied BioSystems, модели 430A, 431 и/или 433. Каждый пептид получали путем независимого синтеза на твердой подложке с защитой F-moc на N-конце и защитными группами боковой цепи трифункциональных аминокислот. Готовые пептиды отщепляли от твердой подложки и удаляли защитные группы боковой цепи с помощью 90% трифторуксусной кислоты (ТФУ). Синтетические пептидные препараты оценивали с помощью времяпролетной масс-спектрометрии с матрично-активированной лазерной ионизацией и десорбцией (МАЛДИ-ВП МС), чтобы обеспечить правильное содержание аминокислот. Каждый синтетический пептид также оценивали с помощью обращенно-фазовой ВЭЖХ (ОФ-ВЭЖХ), чтобы подтвердить профиль синтеза и концентрацию препарата. Несмотря на строгий контроль процесса синтеза (включая поэтапный мониторинг эффективности связывания), также были получены пептидные аналоги вследствие непреднамеренных событий в ходе циклов удлинения, включая вставку, делецию, замену аминокислоты и преждевременную терминацию. Таким образом, синтезированные препараты, как правило, включали в себя множественные пептидные аналоги вместе с целевым пептидом.
Несмотря на включение таких непреднамеренных пептидных аналогов, полученные синтезированные пептидные препараты были тем не менее пригодны для использования в иммунологических целях, включая иммунодиагностику (в качестве захватывающих антитела антигенов) и фармацевтические композиции (в качестве пептидных иммуногенов). Как правило, такие пептидные аналоги, разработанные намеренно или полученные в результате процесса синтеза в виде смеси побочных продуктов, часто являются такими же эффективными, что и очищенный препарат желаемого пептида, если разработана процедура КЯ для различения с целью мониторинга как производственного процесса, так и процесса оценки продукта, чтобы гарантировать воспроизводимость и эффективность конечного продукта, в котором используются эти пептиды. Крупномасштабный пептидный синтез в количествах нескольких сотен килограммов проводили на настраиваемом автоматическом пептидном синтезаторе UBI2003 или аналогичном приборе в масштабе от 15 ммоль до 150 ммоль.
Для активных ингредиентов, используемых в конечной фармацевтической композиции для проведения клинических исследований, родственные IL-6 пептидные иммуногенные конструкции очищали с помощью препаративной ОФ-ВЭЖХ в условиях пологого градиента для элюирования и характеризовали с помощью масс-спектрометрии ВП-МАЛДИ, аминокислотного анализа и ОФ-ВЭЖХ в отношении чистоты и идентичности.
b. Получение композиций, содержащих пептидные иммуногенные конструкции IL-6
Были получены составы, в которых используются эмульсии вода-в-масле и суспензия с минеральными солями. Чтобы обеспечить использование разработанной фармацевтической композиции большой популяцией, безопасность становится еще одним важным фактором, который следует учитывать. Несмотря на тот факт, что эмульсии вода-в-масле используются для людей в виде фармацевтических композиций во многих клинических исследованиях, квасцы остаются основным адъювантом, применяемым в фармацевтических композициях, благодаря своей безопасности. Квасцы или их минеральная соль ADJUPHOS (фосфат алюминия), таким образом, часто используются в качестве адъювантов в препаратах для клинического применения.
Вкратце, составы, указанные в каждой исследуемой группе, описанной ниже, обычно содержали все типы разработанных пептидных иммуногенных конструкций IL-6. Свыше 200 разработанных пептидных иммуногенных конструкций IL-6 были тщательно оценены у морских свинок на предмет их относительной иммуногенности с соответствующим пептидом IL-6, репрезентативным для В-клеточных эпитопных пептидов иммуногена. Картирование эпитопов и серологическую перекрестную реактивность анализировали среди различных гомологичных пептидов с помощью анализов ИФА, используя планшеты, покрытые пептидами, выбранными из списка SEQ ID NO: 1-75.
Пептидные иммуногенные конструкции IL-6 в различных количествах получали в эмульсии вода-в-масле с MONTANIDE™ ISA 51 компании Seppic в качестве масла, одобренного для использования человеком, или смешивали с минеральными солями ADJUPHOS (фосфат алюминия) или ALHYDROGEL (квасцы), как указано. Композиции, как правило, получали путем растворения пептидных иммуногенных конструкций IL-6 в воде в концентрации от около 20 до 800 мкг/мл и составляли с MONTANIDE™ ISA 51 в виде эмульсий вода-в-масле (1:1 по объему) или с минеральными солями ADJUPHOS или ALHYDROGEL (квасцы) (1:1 по объему). Композиции держали при комнатной температуре в течение около 30 минут и смешивали на вортексе в течение около 10-15 секунд перед иммунизацией. Животных иммунизировали 2-3 дозами конкретной композиции, которые вводили в 0 момент времени (первичная иммунизация) и через 3 недели после начальной иммунизации (wpi) (буст-иммунизация), необязательно в момент времени 5 или 6 wpi выполняли вторую буст-иммунизацию, внутримышечным путем. Сыворотку иммунизированных животных затем тестировали с выбранными В-эпитопными пептидами, чтобы оценить иммуногенность различных пептидных иммуногенных конструкций IL-6, присутствующих в составе, а также тестировали на предмет перекрестной реактивности соответствующей сыворотки с белками IL-6. Те пептидные иммуногенные конструкции IL-6, у которых наблюдалась высокая иммуногенность при первоначальном скрининге морских свинок, были дополнительно протестированы в анализах in vitro на предмет функциональных свойств соответствующей сыворотки. Выбранные кандидатные пептидные иммуногенные конструкции IL-6 затем были получены в виде эмульсии вода-в-масле, минеральных солей и составов на основе квасцов для схем применения в течение заданного периода времени, как указано в протоколах иммунизации.
Только наиболее перспективные пептидные иммуногенные конструкции IL-6 прошли дополнительную тщательную оценку перед включением в конечные составы для изучения иммуногенности, продолжительности, токсичности и эффективности в доклинических исследованиях в соответствии с НЛП в рамках подготовки к подаче заявки на проведение клинических испытаний нового лекарственного препарата с последующими клиническими испытаниями с участием пациентов, на которых влияет нарушение регуляции IL-6.
Следующие ниже примеры служат для иллюстрации настоящего изобретения и не предназначены для ограничения объема изобретения.
ПРИМЕР 2
СЕРОЛОГИЧЕСКИЕ АНАЛИЗЫ И РЕАГЕНТЫ
Серологические анализы и реагенты для оценки функциональной иммуногенности пептидных иммуногенных конструкций IL-6 и их составов подробно описаны ниже.
a. ИФА на основе IL-6 или пептидных фрагментов IL-6 для анализа специфичности антител
Анализы ИФА для оценки образцов иммунной сыворотки, описанные в следующих примерах, были разработаны и описаны ниже. Лунки 96-луночных планшетов покрывали по отдельности в течение 1 часа при температуре 37°C с помощью 100 мкл IL-6 или пептидных фрагментов IL-6 (SEQ ID NO: 1-20, 72-75) в концентрации 2 мкг/мл (если не указано иное) в 10 мМ буфера NaHCO3, pH 9,5 (если не указано иное).
Покрытые IL-6 или пептидным фрагментом IL-6 лунки инкубировали с 250 мкл 3% по массе желатина в ФСБ при 37°C в течение 1 часа, чтобы блокировать неспецифические сайты связывания белков, а затем трижды промывали ФСБ, содержащим 0,05% по объему TWEEN® 20, и сушили. Анализируемую сыворотку разбавляли 1:20 (если не указано иное) ФСБ, содержащим 20% по объему нормальной козьей сыворотки, 1% по весу желатина и 0,05% по объему TWEEN® 20. Сто микролитров (100 мкл) разбавленных образцов (например, сыворотки, плазмы) добавляли в каждую из лунок и оставляли реагировать в течение 60 минут при 37°C. Затем лунки промывали шесть раз 0,05% по объему TWEEN® 20 в ФСБ, чтобы удалить несвязанные антитела. Специфическое козье поликлональное анти-IgG антитело, конъюгированное с пероксидазой хрена (HRP) (например, морской свинки или крысы), или белок A/G применяли в качестве меченого индикатора для связывания с комплексом антитело/пептидный антиген, образованным в положительных лунках. Сто микролитров реагента для обнаружения, меченного HRP, в предварительно заданном оптимальном разведении и в 1% по объему нормальной козьей сыворотке с 0,05% по объему TWEEN® 20 в ФСБ добавляли в каждую лунку и инкубировали при 37°C в течение еще 30 минут. Лунки промывали шесть раз с помощью 0,05% по объему TWEEN® 20 в ФСБ для удаления несвязанного антитела и вводили в реакцию со 100 мкл смеси субстратов, содержащей 0,04% по массе 3’, 3’, 5’, 5’-тетраметилбензидин (TMB) и 0,12% по объему перекись водорода в буфере цитрата натрия, в течение дополнительных 15 минут. Эту смесь субстратов применяли для обнаружения пероксидазной метки путем образования окрашенного продукта. Реакции останавливали добавлением 100 мкл 1,0 M H2SO4 и определяли оптическую плотность при 450 нм (A450). Для определения титров антител у иммунизированных животных, которые получали различные пептидные составы, тестировали 10-кратные серийные разведения сывороток от 1:100 до 1:10000 или 4-кратные серийные разведения сывороток от 1:100 до 1:4,19×108, и титр тестируемой сыворотки, выраженный как Log10, рассчитывали с помощью линейного регрессионного анализа A450 с пороговым значением A450, установленным на 0,5.
b. Оценка реактивности антител к Th-пептиду с помощью тестов ИФА на основе Th-пептидов
Лунки 96-луночных планшетов для ИФА покрывали по отдельности в течение 1 часа при температуре 37°C 100 мкл Th-пептида в концентрации 2 мкг/мл (если не указано иное) в 10 мМ буфера NaHCO3, pH 9,5 (если не указано иное) аналогичным способом ИФА и выполняли, как описано выше. Для определения титров антител у иммунизированных животных, которые получали различные пептидные составы IL-6, тестировали 10-кратные серийные разведения сывороток от 1:100 до 1:10000, и титр тестируемой сыворотки, выраженный как Log10, рассчитывали с помощью линейного регрессионного анализа A450 с пороговым значением A450, установленным на 0,5.
c. Анализы высокой специфичности целевого В-клеточного эпитопного пептида IL-6, определенные с помощью картирования эпитопов посредством тестов ИФА на основе 10-мерных пептидов В-клеточного эпитопного кластера
Анализы высокой специфичности антител к IL-6, полученных от хозяев, иммунизированных пептидными иммуногенными конструкциями IL-6, были определены с помощью картирования эпитопов, используя тесты ИФА на основе 10-мерных пептидов В-клеточного эпитопного кластера. Вкратце, лунки 96-луночных планшетов покрывали отдельными 10-мерными пептидами IL-6 (SEQ ID NO: 21-71) в количестве 0,5 мкг на 0,1 мл на лунку, а затем 100 мкл образцов сывороток (разведение 1:100 в ФСБ) инкубировали в 10-мерных лунках планшета в двух повторностях в соответствии с этапами метода ИФА антител, описанного выше. Связанные с целевым В-клеточным эпитопом анализы высокой специфичности антител к IL-6, полученных от иммунизированных хозяев, были протестированы с помощью соответствующего пептида IL-6 или нерелевантного контрольного пептида для подтверждения специфичности.
d. Оценка иммуногенности
Преиммунные и иммунные образцы сыворотки от животных или субъектов-людей собирали в соответствии с экспериментальными протоколами и нагревали при 56°C в течение 30 минут для инактивации факторов комплемента сыворотки. После введения составов образцы крови получали в соответствии с протоколами и оценивали их иммуногенность против конкретных целевых сайтов с помощью соответствующих тестов ИФА на основе В-клеточных эпитопных пептидов IL-6. Тестировали серийно разведенные сыворотки, и положительные титры выражали как Log10 обратного разведения. Иммуногенность конкретного состава оценивали по его способности вызывать ответ антител с высоким титром, направленный против желаемой эпитопной специфичности в пределах целевого антигена, и высокой перекрестной реактивности с белками IL-6 при сохранении низкой или незначительной реактивности антител по отношению к «эпитопам Т-хелперных клеток», используемых для обеспечения усиления желаемых ответов В-клеток.
e. Иммуноанализ для оценки уровня С-реактивного белка (СРБ) в сыворотке крыс
Уровни С-реактивного белка (СРБ) у крыс измеряли с помощью сэндвич-ИФА, используя поликлональное кроличье антитело к СРБ крысы (Sino Biological) в качестве захватывающего антитела, а меченное биотином кроличье антитело к СРБ крысы (Assaypro LLC) в качестве антитела для обнаружения. Вкратце, поликлональное кроличье антитело к СРБ крысы иммобилизовали на 96-луночных планшетах в концентрации 50 нг/лунку в покрывающем буфере (15 мМ Na2CO3, 35 мМ NaHCO3, pH 9,6) и инкубировали при 4°C в течение ночи. Покрытые лунки блокировали с помощью 200 мкл/лунку растворов для разведения (1% BSA, 0,05% TWEEN-20 и 0,01% ProClin 300 в ФСБ) при комнатной температуре в течение 1 часа. Планшеты промывали 3 раза с помощью 200 мкл/лунку промывочного буфера (ФСБ с 0,05% TWEEN-20 и 0,01% ProClin 300). Рекомбинантный СРБ крысы (Sino Biological) использовали для получения стандартной кривой (диапазон от 450 до 1,84 нг/мл путем 2,5-кратного серийного разведения) в растворе для разведений. 100 мкл разведенных сывороток (1:30000) и стандарты добавляли в покрытые лунки. Инкубацию проводили при комнатной температуре в течение 2 часов. Все лунки аспирировали и промывали 5 раз с помощью 200 мкл/лунку промывочного буфера. Захваченный СРБ инкубировали со 100 мкл раствора антител для обнаружения (100 нг/мл меченного биотином кроличьего антитела к СРБ крысы в растворе для разведения) при комнатной температуре в течение 1 часа. Затем связанные меченые биотином антитела обнаруживали с применением стрептавидина поли-HRP (разведение 1:10000, Thermo Fisher Scientific) в течение 1 часа (100 мкл/лунку). Все лунки аспирировали и промывали 6 раз с помощью 200 мкл/лунку промывочного буфера. Наконец, лунки проявляли с помощью 100 мкл/лунку субстрата TMB NeA-Blue (Clinical Science Products) и реакцию останавливали добавлением 100 мкл/лунку 1M H2SO4. Колориметрическое поглощение измеряли на микропланшетном ридере VersaMax ELISA (Molecular Devices) и стандартную кривую генерировали с помощью программного обеспечения SoftMax Pro (Molecular Devices) для создания подгонки четырехпараметрической логистической кривой и применяли для расчета концентраций СРБ во всех тестируемых образцах. t-критерий Стьюдента применяли для сравнения данных с помощью программного обеспечения Prism (GraphPad Software).
ПРИМЕР 3
ОЦЕНКА ФУНКЦИОНАЛЬНЫХ СВОЙСТВ АНТИТЕЛ, ВЫЗВАННЫХ ПЕПТИДНЫМИ ИММУНОГЕННЫМИ КОНСТРУКЦИЯМИ IL-6 И ИХ СОСТАВАМИ, У ЖИВОТНЫХ
Иммунные сыворотки или очищенные антитела к IL-6 у иммунизированных животных подвергали дополнительным тестам в отношении их способности (1) блокировать взаимодействие между IL-6 и его рецептором IL-6R (IL-6α и IL-6Rβ/gp130), (2) подавлять индуцированное IL-6 фосфорилирование STAT3 в клетках RPMI 8226, (3) подавлять зависимую от IL-6 пролиферацию клеток TF-1, а также (4) ингибировать выработку моноцитарного хемоаттрактантного белка-1 (MCP-1) в клеточной линии U937.
a. Клетки
(1) Клеточную линию RPMI 8226 приобрели в Американской коллекции типовых культур (г. Манассас, штат Вирджиния) и поддерживали в среде RPMI1640, дополненной 10% фетальной бычьей сывороткой (ФБС), 4,5 г/л L-глутамина, пируватом натрия и 1% пенициллином-стрептомицином, в увлажненном инкубаторе при 37°C с 5% CO2.
(2) Клеточную линию TF-1 поддерживали в среде RPMI 1640, дополненной 2 мM глутамина, 1% пируватом натрия (NaP), 2 нг/мл человеческого гранулоцитарно-макрофагального колониестимулирующего фактора (человеческого GM-CSF), 10% ФБС и 1% пенициллином-стрептомицином, в увлажненном инкубаторе при 37°C с 5% CO2.
(3) Клеточную линию U937 поддерживали в среде RPMI 1640, дополненной 2 мM глутамина, 1% NaP, 10% ФБС и 1% пенициллином-стрептомицином, в увлажненном инкубаторе при 37°C с 5% CO2.
b. Связывание IL-6 с цепью IL-6Rα (цис-связывание)
Очищенные поликлональные антитела IgG из объединенных иммунных сывороток морских свинок, ранее иммунизированных различными пептидными иммуногенными конструкциями IL-6, изучали на предмет их относительной способности ингибировать связывание IL-6 с IL-6Rα с помощью ИФА. Лунки 96-луночных планшетов покрывали по отдельности 50 мкл рекомбинантной His-меченной IL-6Rα человека (GenScript) в концентрации 4 мкг/мл в покрывающем буфере (15 мM Na2CO3, 35 мM NaHCO3, pH 9,6) и инкубировали при 4°C в течение ночи. Покрытые лунки блокировали с помощью 200 мкл/лунку растворов для разведения (1% BSA, 0,05% TWEEN-20 и 0,01% ProClin 300 в ФСБ) при комнатной температуре в течение 1 часа. Планшеты промывали 3 раза с помощью 200 мкл/лунку промывочного буфера (ФСБ с 0,05% TWEEN-20 и 0,01% ProClin 300). 100 мкл смеси человеческого IL-6 (GenScript) в концентрации 10 нг/мл и очищенных поликлональных антител IgG морских свинок в разных концентрациях предварительно инкубировали в течение 1 часа при комнатной температуре, а затем добавляли в покрытые лунки. Инкубацию проводили при комнатной температуре в течение 1 часа. Все лунки аспирировали и промывали 3 раза с помощью 200 мкл/лунку промывочного буфера. Захваченный IL-6 обнаруживали с помощью 100 мкл/лунку меченного биотином кроличьего антитела к IL-6 (разведение 1:1 000, R&D Systems) при комнатной температуре в течение 1 часа. Затем связанные меченые биотином антитела обнаруживали с применением стрептавидина поли-HRP (разведение 1:40000, Thermo Fisher Scientific) в течение 1 часа (100 мкл/лунку). Все лунки аспирировали и промывали 3 раза с помощью 200 мкл/лунку промывочного буфера. Наконец, лунки проявляли с помощью 100 мкл/лунку субстрата TMB OptEIA (BD Biosciences) и реакцию останавливали добавлением 100 мкл/лунку 1M H2SO4. Колориметрическое поглощение измеряли на микропланшетном ридере VersaMax ELISA (Molecular Devices) и кривую реактивности генерировали с использованием подбора четырехпараметрической логистической кривой для расчета концентрации полумаксимального ингибирования (IC50) в программном обеспечении Prism 6 (GraphPad Software).
c. Связывание комплекса IL-6/цепь IL-6Rα с цепью IL-6Rβ/gp130 (транс-связывание)
Лунки 96-луночных планшетов покрывали по отдельности 50 мкл рекомбинантного химерного белка gp130-Fc человека (R&D systems) в концентрации 300 нг/мл в покрывающем буфере (15 мM Na2CO3, 35 мM NaHCO3, pH 9,6) и инкубировали при 4°C в течение ночи. Покрытые лунки блокировали с помощью 200 мкл/лунку растворов для разведения (1% BSA, 0,05% TWEEN-20 и 0,01% ProClin 300 в ФСБ) при комнатной температуре в течение 1 часа. Планшеты промывали 3 раза с помощью 200 мкл/лунку промывочного буфера (ФСБ с 0,05% TWEEN-20 и 0,01% ProClin 300). Перед проведением анализа комплексы sIL-6Rα/IL-6 были сформированы в молярном соотношении IL-6 к sIL-6Rα 1:20 путем инкубирования His-меченной IL-6Rα человека (4 мкг/мл, GenScript) и IL-6 (100 нг/мл, GenScript) при комнатной температуре в течение 1 часа. Десять мкл предварительно сформированного раствора комплекса инкубировали с очищенными поликлональными антителами IgG морских свинок в разных концентрациях общим объемом 100 мкл при комнатной температуре в течение 1 часа, а затем эту смесь добавляли в покрытые gp130-Fc лунки. Инкубацию проводили при комнатной температуре в течение 1 часа. Все лунки аспирировали и промывали 3 раза с помощью 200 мкл/лунку промывочного буфера. Захваченный IL-6 обнаруживали с помощью 100 мкл/лунку меченного биотином кроличьего антитела к IL-6 (разведение 1:1 000, R&D Systems) при комнатной температуре в течение 1 часа. Затем связанные, меченые биотином антитела обнаруживали с применением стрептавидина поли-HRP (разведение 1:40000, Thermo Fisher Scientific) в течение 1 часа (100 мкл/лунку). Все лунки аспирировали и промывали 3 раза с помощью 200 мкл/лунку промывочного буфера. Наконец, лунки проявляли с помощью 100 мкл/лунку субстрата TMB OptEIA (BD Biosciences) и реакцию останавливали добавлением 100 мкл/лунку 1M H2SO4. Колориметрическое поглощение измеряли на микропланшетном ридере VersaMax ELISA (Molecular Devices) и кривую реактивности генерировали с использованием подбора четырехпараметрической логистической кривой для расчета концентрации полумаксимального ингибирования (IC50) в программном обеспечении Prism 6 (GraphPad Software).
d. Анализ зависимой от IL-6 пролиферации клеток TF-1
Клетки эритролейкоза человека TF-1 способны пролиферировать в ответ на IL-6 человека. Анализ проводили путем одновременной инкубации 5×103 клеток с рекомбинантным IL-6 человека в конечной концентрации 10 нг/мл в присутствии очищенных поликлональных антител IgG морских свинок в разных концентрациях в общем объеме 100 мкл среды RPMI 1640, дополненной 2,5% ФБС на лунку, при 37°C, 5% CO2 в течение 72 часов. Тоцилизумаб, антитело к рецептору IL-6, также был включен в качестве контроля исследования. Рост и жизнеспособность клеток определяли путем добавления 40 мкл реагента CellTiterGlo (Promega) на лунку и последующей инкубации реакционной смеси при комнатной температуре в течение 10 минут. Полученную люминесценцию измеряли с помощью многорежимного микропланшетного ридера SpectraMax i3x (Molecular Devices) и кривую реактивности генерировали с использованием подбора четырехпараметрической логистической кривой для расчета концентрации полумаксимального ингибирования (IC50) в программном обеспечении Prism 6 (GraphPad Software).
e. Анализ индуцированного IL-6 фосфорилирования STAT3
Клеточная линия миеломы человека RPMI 8226 без фосфорилирования конститутивно активного STAT3 требует воздействия IL-6 для активации STAT3. Чтобы исследовать, может ли очищенный IgG ингибировать индуцированное IL-6 фосфорилирование STAT3 в клетках RPMI 8226, 8×105 клеток одновременно инкубировали с IL-6 в конечной концентрации 10 нг/мл в присутствии поликлональных антител морских свинок в концентрации 100 мкг/мл в общем объеме 500 мкл культуральной среды RMPI 8226 при 37°C, 5% CO2 в течение 30 минут. Тоцилизумаб, антитело к рецептору IL-6, был включен в качестве контроля исследования. Уровень фосфорилированного STAT3 измеряли с помощью набора для ИФА PathScan p-Stat3 (Cell Signaling). Вкратце, клеточный лизат получали путем суспендирования клеток в 30 мкл буфера для лизиса клеток (Cell Signaling), дополненного 1% коктейлем 3 с ингибитором фосфатазы (Sigma-Aldrich), при этом клеточный дебрис удаляли центрифугированием со скоростью 12000 x g при 4°C в течение 10 минут. Десять мкг очищенного клеточного лизата использовали для измерения содержания фосфорилированного STAT3 в соответствии с инструкциями поставщика. Колориметрическое поглощение измеряли на микропланшетном ридере VersaMax ELISA (Molecular Devices).
f. Индуцированная IL-6 выработка MCP-1
U937 представляет собой клеточную линию промоноцитов, которую можно индуцировать для дифференцировки в зрелые макрофаги с помощью нескольких агентов. IL-6 может способствовать выработке MCP-1 в клетках моноцитов. Антитела к IL-6, вызванные иммуногенами пептидных конструкций IL-6, могут модулировать зависимую от IL-6 секрецию MCP-1 в клеточной линии U937. Анализ проводили путем инкубации 8×103 клеток, рекомбинантного IL-6 человека в конечной концентрации 10 нг/мл и очищенных поликлональных антител IgG морских свинок в разных концентрациях в общем объеме 100 мкл культуральной среды U937 на лунку при 37°C, 5% CO2 в течение 24 часов. Тоцилизумаб, как антитело к рецептору IL-6, также был включен в качестве контроля исследования. Очищенный супернатант получали путем центрифугирования культуральной среды со скоростью 300xg в течение 10 минут и хранили при -30°C. 100 мкл разбавленного супернатанта (разведение 1:100) применяли к набору ИФА для количественного определения MCP-1 человека (Thermo Fisher) в соответствии с инструкциями поставщика. Колориметрическое поглощение измеряли на микропланшетном ридере VersaMax ELISA (Molecular Devices), стандартную кривую генерировали с помощью программного обеспечения SoftMax Pro (Molecular Devices) для создания подгонки четырехпараметрической логистической кривой и применяли для расчета концентраций MCP-1 во всех тестируемых образцах. Кривую реактивности генерировали с использованием подбора четырехпараметрической логистической кривой для расчета концентрации полумаксимального ингибирования (IC50) в программном обеспечении Prism 6 (GraphPad Software).
ПРИМЕР 4
ЖИВОТНЫЕ, ИСПОЛЬЗУЕМЫЕ В ИССЛЕДОВАНИЯХ БЕЗОПАСНОСТИ, ИММУНОГЕННОСТИ, ТОКСИЧНОСТИ И ЭФФЕКТИВНОСТИ
Морские свинки:
Исследования иммуногенности проводили на зрелых, не подвергавшихся воздействию взрослых самцах и самках морских свинок Данкин-Хартли (300-350 г/МТ). В экспериментах использовали по меньшей мере 3 морские свинки на группу. Протоколы, включающие морских свинок Данкин-Хартли (в возрасте 8-12 недель; Covance Research Laboratories, Денвер, штат Пенсильвания, США), выполняли в соответствии с одобренными IACUC применениями в контрактном отделении для животных при финансовой поддержке UBI.
Крысы:
Крысы Lewis были использованы, чтобы вызвать коллаген-индуцированный артрит (КИА). Самки крыс Lewis в возрасте 8-12 недель были приобретены у компании Biolasco и подобраны по массе приблизительно 180 г. Животных содержали в отделении для животных лаборатории Asia Laboratory компании UBI и акклиматизировали в течение 1 недели при постоянной температуре (22°C), влажности (72%) и цикле 12 часов света/12 часов темноты. Крысы имели свободный доступ к пище и воде. Все протоколы следовали принципам по уходу за лабораторными животными. Инъекцию коллагена вводили в основание хвоста в день 0 и 7 внутрикожным путем. Сбор крови выполняли, как указано в протоколе. Клиническое наблюдение осуществляли 3 раза в неделю, используя систему подсчета баллов для оценки степени тяжести артрита в моделях грызунов с КИА вплоть до дня 35. Титры антител определяли в отношении IL-6 (крысы) с помощью ИФА. Были оценены релевантные воспалительные биомаркеры, такие как СРБ, и гематологические анализы в отношении количества лейкоцитов.
ПРИМЕР 5
СОСТАВЫ ДЛЯ ОЦЕНКИ ИММУНОГЕННОСТИ ПЕПТИДНЫХ КОНСТРУКЦИЙ IL-6 У МОРСКИХ СВИНОК
Фармацевтические композиции и составы, используемые в каждом эксперименте, более подробно описаны, как показано ниже. Вкратце, составы, указанные в каждой из исследуемых групп, как правило, содержали все типы разработанных пептидных иммуногенных конструкций IL-6 с сегментом В-клеточного эпитопного пептида IL-6, связанного посредством различных спейсеров (например, εLys (εK) или лизин-лизин-лизин (KKK) для повышения растворимости пептидной конструкции), и неизбирательных эпитопов Т-хелперных клеток, включая два набора искусственных Т-хелперных эпитопов, полученных из слитого белка вируса кори и поверхностного антигена гепатита B. В-клеточные эпитопные пептиды IL-6 связаны на N- или C-конце разработанных пептидных конструкций. Сотни разработанных пептидных иммуногенных конструкций IL-6 были первоначально оценены у морских свинок на предмет их относительной иммуногенности с соответствующими В-клеточными эпитопными пептидами IL-6. Пептидные иммуногенные конструкции IL-6 получали либо в различных количествах в эмульсии вода-в-масле с MONTANIDE ISA 51 компании Seppic в качестве масла, одобренного для использования в человеческих вакцинах, либо с минеральными солями (ADJUPHOS) или ALHYDROGEL (квасцы) в виде суспензии, как указано. Составы, как правило, получали путем растворения пептидных конструкций IL-6 в воде в концентрации от около 20 до 800 мкг/мл и составляли либо с MONTANIDE ISA 51 в виде эмульсий вода-в-масле (1:1 по объему), либо с минеральными солями (ADJUPHOS) или ALHYDROGEL (квасцы) (1:1 по объему). Составы держали при комнатной температуре в течение около 30 минут и смешивали на вортексе в течение около 10-15 секунд перед иммунизацией.
Некоторых животных иммунизировали 2-3 дозами конкретного состава, которые вводили в 0 момент времени (первичная иммунизация) и через 3 недели после начальной иммунизации (wpi) (буст-иммунизация), необязательно в момент времени 5 или 6 wpi выполняли вторую буст-иммунизацию, внутримышечным путем. Этих иммунизированных животных затем оценивали на предмет иммуногенности соответствующих пептидных иммуногенных конструкций IL-6, используемых в соответствующих составах, на предмет их перекрестной реактивности с рекомбинантным IL-6. Те пептидные иммуногенные конструкции IL-6, у которых наблюдалась высокая иммуногенность при первоначальном скрининге у морских свинок, были дополнительно протестированы в эмульсии вода-в-масле, минеральных солях и составах на основе квасцов у макак для схем применения в течение заданного периода времени, как указано в протоколах иммунизации.
Только наиболее перспективные кандидатные пептидные иммуногенные конструкции IL-6 прошли дополнительную тщательную оценку в отношении их способности нарушать иммунную толерантность у мышей или крыс, используя соответствующие мышиные или крысиные пептидные иммуногенные конструкции IL-6. Пептидные иммуногенные конструкции IL-6 с самой высокой иммуногенностью у крыс, которые вызывали титры антител к IL-6 против эндогенного IL-6; в частности, в отношении способности подавлять воспалительные факторы крови и облегчать клинические симптомы ревматоидного артрита в моделях крыс Lewis с индуцированным КИА или у яванских макак в отношении способности подавлять нейтрофилию крови, вызванную подкожным введением экзогенного IL-6. Оптимизированные пептидные иммуногенные конструкции IL-6 были включены в конечные составы для исследований иммуногенности, продолжительности, токсичности и подтверждения эффективности в соответствии с НЛП в рамках подготовки к подаче заявки на проведение клинических испытаний нового лекарственного препарата и клиническим испытаниям с участием пациентов с аутоиммунным ревматоидным артритом.
ПРИМЕР 6
ОБОСНОВАНИЕ ДИЗАЙНА, СКРИНИНГ, ИДЕНТИФИКАЦИЯ, ОЦЕНКА ФУНКЦИОНАЛЬНЫХ СВОЙСТВ И ОПТИМИЗАЦИЯ МНОГОКОМПОНЕНТНЫХ СОСТАВОВ, СОДЕРЖАЩИХ ПЕПТИДНЫЕ ИММУНОГЕННЫЕ КОНСТРУКЦИИ IL-6, ДЛЯ ЛЕЧЕНИЯ АУТОИММУННОГО РЕВМАТОИДНОГО АРТРИТА
Цитокин IL-6 был выбран в качестве молекулы-мишени для разработки и в качестве содержимого настоящего изобретения. На Фиг. 1 показано выравнивание последовательностей IL-6 человека (SEQ ID NO: 227), макака (SEQ ID NO: 228), мыши (SEQ ID NO: 229) и крысы (SEQ ID NO: 230). Общий обзор изобретательского этапа и этапа разработки приведен на Фиг. 2 в виде блок-схемы, описывающей процесс разработки, который приводит к коммерческой реализации (переводу в промышленное производство) состава IL-6. Подробная оценка и анализ каждого из этапов вместе с приятными и неприятными сюрпризами привели ко множеству экспериментов в прошлом, что в конечном итоге приведет к коммерческой реализации безопасного и эффективного состава IL-6.
a. История разработок
Каждая пептидная иммуногенная конструкция или иммунотерапевтический продукт требуют при разработке своего собственного центра внимания и подхода, основанных на конкретном механизме заболевания и белках-мишенях, требуемых для вмешательства. Молекула-мишень IL-6, чей дизайн моделируют, представляет собой цитокин. Процесс перехода от исследований к коммерческой реализации, как правило, занимает одно или более десятилетий. Идентификация В-клеточных эпитопных пептидов IL-6, коррелирующих с функциональными сайтами для вмешательства, является ключевой в дизайне иммуногенных конструкций. Последующие пилотные исследования иммуногенности на морских свинках, включающие в себя различную Т-хелперную поддержку (белки-носители или подходящие Т-хелперные пептиды) в различных составах, проводятся с целью оценки функциональных свойств вызванных антител. После обширной серологической валидации кандидатные В-клеточные эпитопные пептидные иммуногенные конструкции IL-6 затем дополнительно тестируются в целевом виде или отличных от человека приматах, чтобы дополнительно подтвердить иммуногенность и направление дизайна пептидной иммуногенной конструкции IL-6. Выбранные пептидные иммуногенные конструкции IL-6 затем получают в различных смесях, чтобы оценить незначительные отличия функциональных свойств, связанных с соответствующими взаимодействиями между пептидными конструкциями при использовании в комбинации. После дополнительной оценки определяют конечные пептидные конструкции, пептидные композиции и их составы вместе с соответствующими физическими параметрами составов, что приводит к финальному процессу разработки продукта.
b. Дизайн и валидация пептидных иммуногенных конструкций IL-6 для фармацевтических композиций, потенциально способных лечить пациентов, страдающих от заболеваний, на которые влияет нарушение регуляции IL-6, включая аутоиммунный ревматоидный артрит.
Чтобы получить наиболее эффективные пептидные конструкции для включения в фармацевтические композиции, был дополнительно разработан репертуар В-клеточных эпитопных пептидов IL-6 человека (SEQ ID NO: 5-19) и неизбирательных Т-хелперных эпитопов, полученных из различных патогенов, или искусственных Т-хелперных эпитопов (SEQ ID NO: 78-106 и 216-226), который был превращен в пептидные иммуногенные конструкции IL-6 (SEQ ID NO: 107-215) для исследований иммуногенности первоначально на морских свинках.
i) Выбор последовательностей В-клеточного эпитопного пептида IL-6 из области, содержащей две внутримолекулярные петли, для разработки
Область, расположенную посередине и содержащую две внутримолекулярные петли, выбирают среди многих других протестированных областей для дальнейшей разработки В-клеточного эпитопного пептида. Оказалось, что эта область расположена вблизи α- и β- или gp130 цепей IL-6R. При связывании IL-6 с IL-6R IL-6R внутриклеточно передает сигналы активации, что приводит впоследствии к значимым клеточным событиям. Две петли представляют собой C73-C83 (SEQ ID NO: 5) и C44-C50 (SEQ ID NO: 15), как показано в пределах SEQ ID NO: 1 из таблицы 1 или SEQ ID NO: 227 на Фиг. 1, между двумя петлями расположены от 3 до 4 альфа-спиральных пучка.
Первоначально эквивалентные петлевые структуры мыши и крысы (например, SEQ ID NO: 20 и 74) для C73-C83 IL-6 (SEQ ID NO: 5) были выбраны в качестве В-эпитопа для разработки пептидной иммуногенной конструкции IL-6, связанной с Т-хелперным пептидом UBITh®3 (SEQ ID NO: 89) и линкером (SEQ ID NO: 77). Две пептидные иммуногенные конструкции IL-6 были составлены с ISA 51 и CpG для первичной иммунизации морских свинок в дозе 400 мкг/1 мл и буст-иммунизаций (3, 6 и 9 wpi) в дозе 100 мкг/0,25 мл. Для исследования иммуногенности у морских свинок использовали анализ ИФА с иммунными сыворотками морских свинок, разведенными путем 10-кратных серийных разведений от 1:100 до 1:10000. Планшеты для ИФА покрывали человеческим пептидом IL-6 (SEQ ID NO: 5), мышиным или крысиным пептидом (SEQ ID NO: 20 и 74) в количестве 0,5 мкг пептида на лунку. Титр исследуемой сыворотки, выраженный как Log10, рассчитывали с помощью линейного регрессионного анализа A450 нм с порогом A450, установленным на 0,5. Результаты ИФА показали, что две пептидные иммуногенные конструкции из 73-83 IL-6 человека (SEQ ID NO: 107) и 72-82 IL-6 мыши (SEQ ID NO: 146) не только индуцировали высокие титры иммуногенности против собственного В-эпитопного пептида C73-C83 IL-6 человека (SEQ ID NO: 5) и В-эпитопного пептида мыши (SEQ ID NO: 20), было также обнаружено, что две антисыворотки обладали умеренной перекрестной реактивностью против собственных гомологичных В-эпитопных пептидов из человеческого и мышиного IL-6, как показано в таблице 4. Исследование показало, что два разработанных пептидных иммуногена способны индуцировать специфичные антитела с перекрестной реактивностью против человеческого пептида C73-C83 IL-6 и его мышиного аналога. Кроме того, пептидные иммуногенные конструкции IL-6 124, 125,126, 132 (циклическая) и 133 (нециклическая) с последовательностями, удлиненными за пределы 73-83 IL-6 к N-концевой части петли, были также протестированы на предмет иммуногенности, а также их перекрестной реактивности с человеческим белком IL-6, как показано в таблице 5A, что указывает как на высокую иммуногенность, так и на умеренную перекрестную реактивность.
Затем другую петлевую структуру из C44-C50 IL-6 подвергали разработке. Разные размеры В-клеточных эпитопных пептидов, покрывающих петлю C44-C50, были выбраны для конструирования пептидных иммуногенов IL-6. Т-хелперный эпитопный пептид UBITh®1 (SEQ ID NO: 91) и короткий линкер εK или более длинный линкер KKK-εK (SEQ ID NO: 77) использовали для создания новых иммуногенных конструкций IL-6 человека. Т-хелперный эпитопный пептид UBITh®1 вместе с линкерной последовательностью размещали на N- или C-конце либо на обоих концах конструкции по отношению к целевому В-клеточному эпитопному пептиду. Семь иммуногенных конструкций IL-6 человека (SEQ ID NO: 128, 129, 131 и 134-137) от В-эпитопов трех разных размеров 44-50 IL-6 (SEQ ID NO: 15), 42-57 IL-6 (SEQ ID NO: 12), 42-72 IL-6 (SEQ ID NO: 10) были разработаны и использованы в исследовании иммуногенности. Каждый пептидный иммуноген составляли с ISA51 и CpG для иммунизации морских свинок в дозе 400 мкг/мл в качестве первичной иммунизации и 100 мкг/мл в качестве бустерной дозы через 3, 6, 9 wpi, по 3 морские свинки на группу. ИФА проводили для оценки иммуногенности разработанных пептидных иммуногенов IL-6. В-эпитопные пептиды IL-6 и человеческий белок IL-6 (SEQ ID NO: 1) использовали, чтобы покрыть лунки планшетов, которые служили нацеливающими пептидами. Иммунную сыворотку морской свинки разводили от 1:100 до 1:100000 путем 10-кратного серийного разведения. Титр исследуемой сыворотки, выраженный как Log10, рассчитывали с помощью линейного регрессионного анализа A450 нм с порогом A450, установленным на 0,5. Все восемь пептидных иммуногенов индуцировали сильные титры иммуногенности против В-эпитопных пептидов, нанесенных в лунки планшета. Результаты ИФА показали, что эти семь пептидных иммуногенных конструкций не только индуцировали высокие титры иммуногенности против соответствующего В-эпитопного пептида IL-6, но эти антисыворотки также обладали умеренной перекрестной реактивностью против человеческого белка IL-6 (SEQ ID NO: 1), как показано в таблице 5B.
Более того, разработке подвергали два других В-клеточных эпитопных пептида с последовательностями, взятыми между двумя петлями SEQ ID NO: 13 и SEQ ID NO: 9 (т. е. 61-75 IL-6 и 52-72 IL-6). Т-хелперный эпитопный пептид UBITh®1 (SEQ ID NO: 91) и короткий линкер εK или более длинный линкер KKK-εK (SEQ ID NO: 77) использовали для создания новых иммуногенных конструкций IL-6 человека (SEQ ID NO: 127, 138-145). Т-хелперный эпитопный пептид UBITh®1 вместе с линкерной последовательностью размещали на N- или C-конце конструкции по отношению к целевому В-клеточному эпитопному пептиду. Девять иммуногенных конструкций IL-6 человека (SEQ ID NO: 127, 138-145) от В-эпитопов трех разных размеров 52-72 IL-6 (SEQ ID NO: 9), 61-75 IL-6 (SEQ ID NO: 13), 61-72 IL-6 (SEQ ID NO: 14) были разработаны и использованы в исследовании иммуногенности. Каждый пептидный иммуноген составляли с ISA51 и CpG для иммунизации морских свинок в дозе 400 мкг/мл в качестве первичной иммунизации и 100 мкг/мл в качестве бустерной дозы через 3, 6, 9 wpi, по 3 морские свинки на группу. ИФА проводили для оценки иммуногенности разработанных пептидных иммуногенов IL-6. В-эпитопные пептиды IL-6 и человеческий белок IL-6 (SEQ ID NO: 1) использовали, чтобы покрыть лунки планшетов, которые служили нацеливающими пептидами. Иммунную сыворотку морской свинки разводили от 1:100 до 1:100000 путем 10-кратного серийного разведения. Титр исследуемой сыворотки, выраженный как Log10, рассчитывали с помощью линейного регрессионного анализа A450 нм с порогом A450, установленным на 0,5. Все девять пептидных иммуногенов индуцировали сильные титры иммуногенности против В-эпитопных пептидов, нанесенных в лунки планшета. Результаты ИФА показали, что эти восемь пептидных иммуногенных конструкций не только индуцировали высокие титры иммуногенности против соответствующего В-эпитопного пептида IL-6, но эти антисыворотки также обладали умеренной перекрестной реактивностью против человеческого белка IL-6 (SEQ ID NO: 1), как показано в таблице 5C.
В дополнение к пептидным конструкциям, содержащим эндогенные внутренние петли, как описано выше, дизайн В-клеточного эпитопного пептида IL-6 был также направлен на эпитоп, связанный с моноклональным антителом олокизумабом на IL-6 человека. Известно, что олокизумаб ингибирует связывание IL-6/sIL-6R с gp130. Два пептида с разным размером последовательностей, покрывающие часть олокизумаба, связанного с конформационным эпитопом, были разработаны для создания пептидных иммуногенных конструкций IL-6. Т-хелперный эпитопный пептид UBITh®1 (SEQ ID NO: 91) и более длинный линкер εK-KKK (SEQ ID NO: 77) были выбраны для создания новых иммуногенных конструкций IL-6 человека. Т-хелперный эпитоп UBITh®1 и линкерную последовательность размещали на N-конце или C-конце либо на обоих концах В-эпитопного пептида. Пять иммуногенных конструкций IL-6 человека (SEQ ID NO: 112-117) от В-эпитопов двух разных размеров (SEQ ID NO: 18 и 19) были разработаны и использованы в исследовании иммуногенности. Еще одна конструкция 73-83 IL-6 (SEQ ID NO: 118) с UBITh®1 на обоих концах N и C (группа 6) служила в качестве контроля для иммуногенности и сравнения иммунной специфичности. Каждый пептидный иммуноген составляли с ISA51 и CpG для иммунизации морских свинок в дозе 400 мкг/мл в качестве первичной иммунизации и 100 мкг/мл в качестве бустерной дозы через 3, 6, 9 wpi, по 3 морские свинки на группу. ИФА проводили для оценки иммуногенности этих разработанных пептидных иммуногенов. Три В-эпитопных пептида C73-C83 IL-6 (SEQ ID NO: 5), 150-162 IL-6 (SEQ ID NO: 18) и 144-166 IL-6 (SEQ ID NO: 19) использовали, чтобы покрыть лунки планшетов, которые служили нацеливающими пептидами. Иммунную сыворотку морской свинки разводили от 1:100 до 1:100000 путем 10-кратного серийного разведения. Титр исследуемой сыворотки, выраженный как Log10, рассчитывали с помощью линейного регрессионного анализа A450 нм с порогом A450, установленным на 0,5. Все шесть пептидных иммуногенов индуцировали сильные титры иммуногенности против собственных В-эпитопных пептидов, нанесенных в лунки планшета. Данные ИФА показали, что среди пяти иммуногенных конструкций (SEQ ID NO: 112-117) наблюдалась перекрестная реактивность, поскольку они имеют одинаковые структуры «спираль-поворот-спираль» из последовательности aa 144-166, как показано в таблице 5D. Перекрестная реактивность иммунных сывороток из этих конструкций с человеческим белком IL-6 была показана в таблице 5E, что указывает на потенциальное вмешательство этого сайта в связывание IL-6, которое будет протестировано в других индуцированных IL-6 функциональных анализах.
ii) Ранжирование гетерологичных Т-хелперных эпитопов, полученных из патогенов, и их включение в дизайн пептидных иммуногенных конструкций IL-6 для повышения иммуногенности выбранного В-эпитопного пептида IL-6.
В таблице 2 приведены 29 гетерологичных Th-эпитопов (SEQ ID NO: 78-106 и 216-226), которые были протестированы на предмет их относительной активности у нескольких видов: мышей, крыс, морских свинок, бабуинов, макак и т. д. для повышения иммуногенности В-клеточного эпитопа.
Репрезентативное исследование пептидных иммуногенных конструкций IL-6, содержащих В-клеточный эпитопный пептид C73-C83 IL-6 (SEQ ID NO: 5), связанный посредством спейсера εK с отдельными неизбирательными Т-хелперными эпитопами, было проведено для изучения иммуногенности у морских свинок с целью оценки относительной эффективности соответствующих гетерологичных Т-хелперных эпитопов, как показано в таблице 6. Результаты, полученные через 6 недель после начальной иммунизации (6 wpi), использовали для ранжирования различных пептидных иммуногенных конструкций IL-6. Несмотря на то что все выбранные Th-эпитопы обладали способностью повышать иммуногенность В-эпитопного пептида IL-6, наиболее активной оказалась конструкция SEQ ID NO: 119.
Тщательная калибровка иммуногенности для каждой пептидной иммуногенной конструкции IL-6 у разных видов, включая приматов, будет обеспечивать окончательный отбор Th-пептида и успех в разработке окончательного состава.
iii) Оценка иммуногенности пептидных иммуногенных конструкций IL-6 в отношении их реактивности антител с рекомбинантным IL-6.
На Фиг. 3 дополнительно проиллюстрирована кинетика антисывороток в течение 12-недельного периода у морских свинок, иммунизированных 25 различными пептидными иммуногенными конструкциями IL-6 (SEQ ID NO: 107, 112-114, 116-118 и 124-145). Антисыворотки морских свинок от 0, 3, 6, 8/9 и 12 wpi разводили от 1:100 до 1:4,19×108 путем 4-кратного серийного разведения. Планшеты для ИФА покрывали человеческим IL-6 (GenScript) в количестве 50 нг на лунку. Титр исследуемой сыворотки, выраженный как Log (EC50), рассчитывали с использованием подбора четырехпараметрической логистической кривой для получения полумаксимальной эффективной концентрации (EC50) в виде Log. Все 25 иммуногенных конструкций были способны вызывать определенную степень перекрестной реактивности с нативным IL-6 человека, свидетельствуя о том, что вызванные ими антитела к IL-6 могут потенциально нейтрализовать активность IL-6.
Изучение того, будут ли разработанные пептидные иммуногены IL-6 человека вызывать антитела с перекрестной реактивностью от разных видов животных, может предоставить полезную информацию для дальнейшего исследования на животных. Сыворотки от 8 или 9 wpi, индуцированные 29 различными иммуногенными конструкциями (SEQ ID NO: 107, 112-114, 116-118 и 124-145), были выбраны для очистки IgG с помощью аффинной хроматографии с белком А. На Фиг. 4 показаны очищенные поликлональные IgG морских свинок, индуцированные SEQ ID NO: 107, 116, 118 и 124-133, которые перекрестно реагируют с рекомбинантными белками IL-6 человека, обезьяны и крысы (все были приобретены у компании GenScript). Среди них пептиды из (SEQ ID NO: 107, 118 и 124-126) содержат петлю 73-83 IL-6 с разной пептидной конструкцией, пептиды из (SEQ ID NO: 128, 129 и 131) содержат петлю 44-50 IL-6, а SEQ ID NO: 132 содержит обе петли.
iv) Идентификация эндогенных/аутологичных Th-эпитопов для исключения из дизайна В-эпитопного пептида IL-6.
Идентификация потенциальных эндогенных/аутологичных Th-эпитопов, присутствующих в белке-мишени, принесет пользу для дизайна композиции для иммунотерапевтического вмешательства, так как присутствие структурной особенности эпитопа(-ов) Т-хелперных клеток в пептидной иммуногенной конструкции может потенциально вызвать нежелательное воспаление при бустерной иммунизации вследствие активации аутологичных Т-клеток, как было ранее в случае с AN1792 для вакцины от болезни Альцгеймера. Как показано в таблице 7, несмотря на составление в виде активной эмульсии вода-в-масле, свободные В-клеточные эпитопные пептиды IL-6: 62-83 IL-6 (SEQ ID NO: 6), 58-83 IL-6 (SEQ ID NO: 7); 52-83 IL-6 (SEQ ID NO: 8), 52-72 IL-6 (SEQ ID NO: 9) и 42-72 IL-6 (SEQ ID NO: 10) давали чистый фон при тестировании иммуногенности, что указывает на их квалификацию в качестве кандидатов для В-клеточных эпитопных пептидов IL-6, используемых для создания пептидных иммуногенных конструкций IL-6 для применения в составе IL-6.
v) Сфокусированный ответ антител, вызванный пептидными иммуногенными конструкциями IL-6, нацелен только на В-клеточный эпитоп IL-6
Хорошо известно, что все белки-носители (например, гемоцианин лимфы улитки (KLH) или другие белки-носители, такие как дифтерийный анатоксин (DT) и столбнячный анатоксин (TT)), используемые для стимуляции иммунного ответа, направленного против целевого В-клеточного эпитопного пептида, посредством химической конъюгации такого В-клеточного эпитопного пептида с соответствующим белком-носителем, будут вызывать более 90% антител, направленных против стимулирующего белка-носителя, и менее 10% антител, направленных против целевого В-клеточного эпитопа, у иммунизированных хозяев. Следовательно, оценка специфичности пептидных иммуногенных конструкций IL-6 по настоящему изобретению представляет интерес. Для оценки иммуногенности была получена серия из восьми пептидных иммуногенных конструкций IL-6 (SEQ ID NO: 138-145 из таблицы 3) с В-клеточными эпитопами разной длины, которые связаны посредством спейсерной последовательности с гетерологичным Т-клеточным эпитопом UBITh®1 (SEQ ID NO: 91). UBITh®1 (Т-хелперный пептид, используемый для иммуностимулирования В-эпитопа) наносили на планшеты и использовали иммунные сыворотки морских свинок для тестирования на предмет перекрестной реактивности с пептидом UBITh®1, используемым для иммуностимулирования. В отличие от высокой иммуногенности этих конструкций по отношению к соответствующим целевым В-клеточным эпитопным пептидам IL-6, как проиллюстрировано с помощью высоких титров антител, генерируемых против В-эпитопа(-ов) IL-6, было обнаружено, что большинство, если не все, иммунные сыворотки были нереактивными по отношению к пептиду UBITh®1, как показано в таблице 8.
Таким образом, простой дизайн иммуногена, включающий в себя целевой В-клеточный эпитопный пептид IL-6, связанный с тщательно отобранным Т-хелперным эпитопом, позволяет генерировать сфокусированный и четкий иммунный ответ, направленный исключительно на соответствующий В-клеточный эпитопный пептид IL-6. С точки зрения дизайна фармацевтической композиции чем более специфичный иммунный ответ он генерирует, тем выше профиль безопасности он обеспечивает для композиции. Пептидные иммуногенные конструкции IL-6 по настоящему изобретению, таким образом, являются высокоспецифичными и в то же время высокоактивными по отношению к своей мишени.
vi) Оценка иммуногенности пептидных иммуногенных конструкций IL-6 в отношении способности их антител ингибировать взаимодействие IL-6 и IL-6R
IL-6 передает сигналы через гетеротримерный комплекс IL-6R/gp130, чье взаимодействие вызывает активацию нисходящих сигнальных путей. Ни IL-6, ни IL-6R сами по себе не могут активировать нисходящие сигнальные пути. Было проведено дальнейшее исследование, чтобы изучить, могут ли кандидатные пептидные иммуногенные конструкции IL-6 вызывать антитела у морских свинок и могут ли эти вызванные антитела нейтрализовать IL-6, чтобы блокировать взаимодействие между IL-6 и рецептором IL-6 (IL-6R) (Rose-John, et al., 2017).
Очищенные IgG морских свинок из иммунных сывороток морских свинок, иммунизированных 25 соответствующими кандидатными пептидными иммуногенными конструкциями IL-6 (SEQ ID NO: 107, 116, 118, 124-145), использовали в анализе ИФА для оценки их (а) относительной иммуногенности методом ИФА, используя соответствующий В-клеточный эпитопный пептид IL-6 в качестве твердофазного антигенного покрытия, как описано в ПРИМЕРЕ 3; (b) относительной способности перекрестно реагировать с белками IL-6 человека, обезьяны и грызунов; и в случае наличия как (a), так и (b), оценки того, могут ли эти очищенные антитела нейтрализовать белок IL-6 и тем самым ингибировать взаимодействия между IL-6 и IL-6Ra (т. е. цис-сигнализацию) или IL-6/IL-6Ra и IL-6Rb/или gp130 (т. е. транс-сигнализацию).
Как показано на Фиг. 3, все очищенные антитела морских свинок, иммунизированных тщательно разработанными соответствующими кандидатными пептидными иммуногенными конструкциями IL-6, продемонстрировали значительные титры антител с течением времени, совпадающие со схемой иммунизации. Более того, все очищенные антитела из иммунных сывороток, полученных в результате иммунизации этими пептидными иммуногенными конструкциями IL-6, продемонстрировали высокую реактивность с белком IL-6 человека, а также умеренную перекрестную реактивность с белками IL-6 обезьяны (макака) и грызунов, как показано на Фиг. 4A и 4B.
Более того, как показано на Фиг. 5A, иллюстративные антитела, очищенные из иммунных сывороток морских свинок, иммунизированных соответствующими кандидатными пептидными иммуногенными конструкциями IL-6 (например, с SEQ ID NO: 107, 116, 118, 124, 132-134 и 137), конкурентно ингибировали дозозависимым образом взаимодействие IL-6 и IL-6Ra посредством цис-сигнализации.
Как показано на Фиг. 5B, иллюстративные антитела, очищенные из иммунных сывороток морских свинок, иммунизированных соответствующими кандидатными пептидными иммуногенными конструкциями IL-6 (например, с SEQ ID NO: 128, 129, 134 и 135), конкурентно ингибировали дозозависимым образом взаимодействие комплекса IL-6-IL-6Ra с IL-6Rb/gp130 посредством транс-сигнализации.
Напротив, антитела, очищенные из иммунных сывороток, полученных из пептидной иммуногенной конструкции (SEQ ID NO: 130), содержащей последовательность В-клеточного эпитопного пептида (SEQ ID NO: 11) предшествующего уровня техники, не могли подавлять ни цис-, ни транс-путь.
vii) Картирование эпитопов для анализа высокой специфичности с использованием иммунных сывороток (9 wpi), вызванных различными пептидными иммуногенными конструкциями IL-6
Дизайн композиции IL-6, содержащей пептидную иммуногенную конструкцию IL-6, был сфокусирован на области, содержащей две внутримолекулярные петли C44-C50 (SEQ ID NO: 15) и C73-C83 (SEQ ID NO: 5) вблизи от сайта связывания IL-6R. Такой структурный дизайн направлен на сохранение по меньшей мере одной нативной внутримолекулярной петли в качестве иммуногенной мишени.
Восемь иллюстративных В-клеточных эпитопных пептида IL-6: 62-83 (SEQ ID NO: 124), 58-83 (SEQ ID NO: 125), 52-83 (SEQ ID NO: 126), 52-72 (SEQ ID NO: 127), 42-72 (SEQ ID NO: 128 с Th, расположенным на N-конце В-клеточного эпитопа), 42-72 (SEQ ID NO: 129 с Th, расположенным на С-конце В-клеточного эпитопа), 50-67 (SEQ ID NO: 130) и 73-83 (SEQ ID NO: 107).
IL-6 62-83 (SEQ ID NO: 6), 58-83 (SEQ ID NO: 7), 52-83 (SEQ ID NO: 8), 52-72 (SEQ ID NO: 9), 42-72 (SEQ ID NO: 10), 50-67 (SEQ ID NO: 11) и 73-83 (SEQ ID NO: 5) использовали для разработки В-клеточных эпитопных пептидов, которые были связаны с UBITh®1 (SEQ ID NO: 91) на N- или C-конце В-клеточных эпитопных пептидов для образования прототипных пептидных иммуногенов. Линкер εK или спейсер εK-KKK (SEQ ID NO: 77) использовали между В-клеточным эпитопом и Th-эпитопом для образования пептидных иммуногенных конструкций, приведенных в таблице 3 (SEQ ID NO: 124-130,107). Все В-клеточные эпитопные пептиды в пределах аминокислот (aa) 42-83, 42-72 и 73-83 были разработаны с ограниченной петлевой структурой C44-C50 или C73-C83 путем циклизации.
Тесты ИФА с использованием отдельных В-клеточных эпитопных пептидов IL-6 C73-C83 (SEQ ID NO: 5) и E42-G72 (SEQ ID NO: 10) для покрытия планшетов оценивали реактивность антител гипериммунных сывороток, полученных от морских свинок, иммунизированных пептидными иммуногенными конструкциями IL-6 (SEQ ID NO: 124-130, 107). Результаты показали, что конструкции SEQ ID NO: 124, 125, 126 и 107, содержащие петлевую структуру C73-C83, вызывали антитела с высоким титром против В-клеточного эпитопного пептида IL-6 C73-C83 (SEQ ID NO: 5), тогда как антисыворотки морских свинок, вызванные пептидными иммуногенными конструкциями IL-6 SEQ ID NO: 127-130, содержащими петлевую структуру C44-C50, обладали реактивностью антител с В-клеточным эпитопным пептидом E42-C72 (SEQ ID NO: 10), в то же время обладая слабой или отсутствующей перекрестной реактивностью с петлей C73-C83 (SEQ ID NO: 5), что указывает на высокую специфичность иммуногенности, т. е. разработанные иммуногенные конструкции способны вызывать специфичные антитела для вступления в реакцию с соответствующими В-клеточными эпитопными доменами IL-6 (таблица 9).
В исследовании тонкого картирования эпитопов (таблица 9) с целью локализовать сайт(-ы) связывания антител со специфичными остатками в пределах целевой области, синтезировали 51 перекрывающийся 10-мерный пептид (SEQ ID NO: 21-71), охватывающие область IL-6 с аминокислоты 32 по аминокислоту 91. Эти 10-мерные пептиды по отдельности наносили на лунки 96-луночного микротитровального планшета в качестве твердофазных иммуноабсорбентов. Объединенные антисыворотки морских свинок добавляли в разведении 1:100 в буфере для разведения образцов в лунки планшета, покрытые 10-мерным пептидом в концентрации 2,0 мкг/мл, с последующей инкубацией в течение одного часа при 37°C. После промывания лунок планшета промывочным буфером добавляли белок A/G, конъюгированный с пероксидазой хрена, и инкубировали в течение 30 минут. После еще одного промывания с помощью ФСБ в лунки добавляли субстрат для измерения поглощения при 450 нм с помощью планшетного ридера ИФА, когда образцы были проанализированы в двух повторностях. Связывание пептидного иммуногена IL-6 вызвало иммунные сыворотки на лунки, покрытые соответствующим В-клеточным эпитопным пептидом IL-6, что представляет максимальный сигнал связывания антитела.
Результаты тонкого картирования эпитопов показали, что объединенные сыворотки морских свинок из пептидных иммуногенных конструкций IL-6 SEQ ID NO: 124, 125, 126 и 107, содержащих петлевую структуру C73-C83, вызывали антитела с высоким титром в основном против кластера 10-мерных пептидов из аминокислот от 69-78 (SEQ ID NO: 58) до 76-85 (SEQ ID NO: 65) с высокой перекрестной реактивностью с пептидами с аминокислотами 35-44 (SEQ ID NO: 24) и некоторой случайной умеренной активностью в сторону небольшого удлинения за пределы N-конца петли.
Удивительно, но объединенные сыворотки морских свинок из пептидных иммуногенных конструкций IL-6 SEQ ID NO: 127-129, содержащих петлевую структуру C44-C50, вызывали антитела с высоким титром в основном против кластера 10-мерных пептидов из аминокислот от 61-70 (SEQ ID NO: 50) до 67-76 (SEQ ID NO: 56) за пределами петли C44-C50, при этом пептидная конструкция IL-6 129 обладала более широкой разбросанной реактивностью антител, удлиненной к N-концевой части В-клеточного эпитопного пептида 41-50 (SEQ ID NO: 30), 45-54 (SEQ ID NO: 34), 57-66 (SEQ ID NO: 46), 58-67 (SEQ ID NO: 47). Интересно отметить, что иммунные сыворотки, сгенерированные пептидными иммуногенными конструкциями IL-6 128 и 129, продемонстрировали предпочтительное транс-ингибирование в исследования ингибирования конкурентного IL-6/IL-6Rα цис- и (комплекс IL-6/IL-6Rα)/IL-6Rβ транс-конкурентного связывания с помощью соответствующих анализов ИФА.
Таким образом, разработанные синтетические пептидные иммуногенные конструкции IL-6, представленные петлевыми структурами C44-C50 и C73-C83 в пределах IL-6, связанного с эпитопным пептидом UBITh®1, которые вызывали устойчивый иммунный ответ, генерирующий поликлональные антитела, нацеленные на отдельные кластеры 10-мерных пептидов, находящиеся в непосредственной близости от связывающей IL-6R области, что обеспечивает ингибирование связывания опосредованного IL-6/IL-6Rα ЦИС- или опосредованного (комплексом IL-6/IL-6Rα)/IL-6Rβ (или Gp130) ТРАНС-конкурентного связывания (см. Фиг. 5A и 5B), должны иметь важное медицинское значение.
ПРИМЕР 7
ОЦЕНКА ФУНКЦИОНАЛЬНЫХ СВОЙСТВ АНТИТЕЛ, ВЫЗВАННЫХ ПЕПТИДНЫМИ ИММУНОГЕННЫМИ КОНСТРУКЦИЯМИ IL-6 И ИХ СОСТАВАМИ, EX VIVO
После демонстрации высокой иммуногенности и перекрестной реактивности антител, очищенных из иммунных сывороток морских свинок, иммунизированных тщательно отобранными соответствующими кандидатными иммуногенными конструкциями IL-6, были разработаны следующие исследования, чтобы оценить, могут ли репрезентативные очищенные IgG из этих иммунных сывороток (а) подавлять индуцированное IL-6 фосфорилирование STAT3; (b) ингибировать клеточную пролиферацию в клеточной линии TF-1; и (c) подавлять индуцированную IL-6 выработку MCP-1 в клетках U937, и все это в условиях ex vivo.
Подавление индуцированного IL-6 фосфорилирования STAT3 антителами к IL-6
Сигнальный путь IL-6 участвует в образовании комплекса IL-6/IL-6Ra/IL6Rb (или Gp130) сначала на клеточной мембране с последующим фосфорилированием нижележащего белка STAT3 в цитоплазме. Клеточную линию RPMI 8226 использовали для оценки способности таких очищенных антител к IL-6, полученных из иммунных сывороток морских свинок, иммунизированных тщательно отобранными кандидатными пептидными иммуногенными конструкциями IL-6, подавлять индуцированное IL-6 фосфорилирование STAT3, поскольку эта клеточная линия 8226 не экспрессирует конститутивно фосфорилированный STAT3.
Сначала культивируемые клетки одновременно обрабатывали с помощью IL-6 (10 нг/мл) и очищенных IgG в разных концентрациях. Моноклональное антитело к IL-6R, как видно на Фиг. 6, IgG к IL-6, вызванные репрезентативными иммуногенами (SEQ ID NO: 128, 129, 134, 135 и 137), были способны уменьшать фосфорилирование STAT3 при концентрации IgG 100 мкг/мл. IgG из иммунных сывороток, вызванные пептидной конструкцией (SEQ ID NO: 130), содержащей В-эпитопную последовательность предшествующего уровня техники (SEQ ID NO: 11), не могли ингибировать фосфорилирование STAT3.
Подавление зависимой от IL-6 клеточной пролиферации в клетках TF-1
Клетки эритролейкоза человека TF-1 способны пролиферировать в ответ на IL-6 человека. Чтобы изучить, способны ли очищенные IgG из иммунных сывороток морских свинок, иммунизированных тщательно отобранными кандидатными пептидными конструкциями IL-6 (SEQ ID NO: 116, 118, 124-129, 131-145), подавлять зависимую от IL-6 клеточную пролиферацию в клеточной линии TF-1, все клеточные культуры TF-1 одновременно обрабатывали с помощью IL-6 (10 нг/мл) и очищенных IgG морских свинок. Клетки TF-1 без обработки IL-6, а также клетки TF-1 только с IL-6, но без антител, были определены в качестве контролей. Как показано на Фиг. 7A и 7B, клетки TF-1 были в большей степени пролиферативными в присутствии только IL-6, чем все остальные группы, и эти клетки пролиферировали не менее чем в два раза больше по сравнению с клетками без IL-6. Рост клеток TF-1 в присутствии антител IgG к IL-6, вызванных репрезентативными кандидатными пептидными иммуногенными конструкциями IL-6 (SEQ ID NO: 116, 118, 124-245, 127-129, 131-145), мог быть подавлен в определенной степени (Фиг. 7A и 7B). IgG из иммунных сывороток, вызванные пептидной конструкцией (SEQ ID NO: 130), содержащей В-эпитопную последовательность предшествующего уровня техники (SEQ ID NO: 11), не могли ингибировать индуцированную IL-6 пролиферацию клеток.
Подавление индуцированной IL-6 выработки MCP-1
MCP-1 играет центральную роль как при острых, так и хронических воспалительных процессах. MCP-1 представляет собой хемотаксический фактор, который привлекает моноциты и базофилы в патогенезе заболеваний. IL-6 может индуцировать экспрессию MCP-1 в клеточной линии промоноцитов U937. Чтобы изучить, способны ли антитела к IL-6, вызванные у морских свинок пептидными иммуногенными конструкциями IL-6, подавлять зависимую от IL-6 секрецию MCP-1 в клеточной линии U937, все группы клеточных культур обрабатывали с помощью цитокина IL-6 в концентрации 10 нг/мл для индуцирования выработки MCP-1. Репрезентативные препараты очищенных IgG из иммунных сывороток морских свинок, вызванных кандидатными пептидными иммуногенными конструкциями IL-6 (SEQ ID NO: 116, 118, 124-134, 136, 138-145), добавляли в исследуемые группы в разных концентрациях, а также в качестве положительного контроля был включен тоцилизумаб. Клеточную культуру U937 в присутствии только IL-6 без добавления антитела определили в качестве отрицательного контроля. Зависимое от концентрации антител подавление выработки MCP-1 наблюдали в группах лечения с очищенными антителами IgG, вызванными репрезентативными кандидатными пептидными конструкциями дозозависимым образом, как показано на Фиг. 8A и 8B, в различной степени, за исключением IgG из иммунных сывороток, вызванных пептидной конструкцией (SEQ ID NO: 130), содержащей В-эпитопную последовательность предшествующего уровня техники (SEQ ID NO: 11) (см. Фиг. 8A).
Приведенные выше функциональные исследования ex-vivo указывают на то, что эти репрезентативные пептидные иммуногенные конструкции IL-6 продемонстрировали подавление вызванных IL-6 воспалительных процессов и патогенеза, что свидетельствует об их потенциале для лечения заболеваний, на которые влияет нарушение регуляции IL-6, включая аутоиммунный ревматоидный артрит.
ПРИМЕР 8
ОЦЕНКА КАНДИДАТНЫХ ПЕПТИДНЫХ ИММУНОГЕННЫХ КОНСТРУКЦИЙ IL-6 КРЫСЫ В ПРОФИЛАКТИЧЕСКОЙ МОДЕЛИ КОЛЛАГЕН-ИНДУЦИРОВАННОГО АРТРИТА (КИА) У КРЫС LEWIS
Влияние пептидных иммуногенных конструкций IL-6 на ревматоидный артрит в модели коллаген-индуцированного артрита (КИА) крыс оценивали в профилактическом исследовании, как описано ниже.
Человеческий IL-6 имеет около 40% идентичности с аминокислотной последовательностью крысиного IL-6. Исходя из последовательности белка IL-6 крысы, пептидные иммуногенные конструкции крысы (SEQ ID NO: 148 и 157) были разработаны как гомологи В-клеточных эпитопных пептидов IL-6 человека из 73-83 IL-6 и 144-166 IL-6 с UBITh®3 в качестве Т-хелперного эпитопа (SEQ ID NO: 89), усиливающего В-клеточный эпитопный пептид, и εK-KKK в качестве линкера (SEQ ID NO: 77), связанного на N- или C-конце В-эпитопного пептида IL-6, соответственно.
Крыс Lewis использовали в этом исследовании в соответствии с протоколом, кратко показанным на Фиг. 9. Крыс общим количеством 21 особь распределили по 3 группам, причем в группе плацебо вводили только адъювант. Крысам в экспериментальных группах вводили пептидные иммуногенные конструкции IL-6, составленные с ISA 51 и CpG, в дозе 45 мкг/0,5 мл в качестве первичной и бустерной иммунизации. Всего было введено три дозы в дни -31, -10 и 4. Всем крысам в основание хвоста вводили эмульсию бычьего коллагена II типа/НАФ (100 мкг в 100 мл на крысу) внутрикожным путем за 4 дня до третьего введения (день 0), а бустерную дозу вводили через 3 дня после третьего введения (день 7). У крыс брали кровь в дни -31, -10, 0, 7, 14, 21, 26, 28 и 35. Анализ ИФА использовали для измерения титров иммуногенности против рекомбинантного белка IL-6 крысы.
Результаты ИФА показали, что никакого обнаруживаемого титра антител не наблюдалось в каждой группе перед иммунизацией в день -31. После трех иммунизаций ни одна из получавших плацебо крыс не продемонстрировала обнаруживаемые титры антител против рекомбинантного IL-6 крысы. Пептидный иммуноген (SEQ ID NO: 148), нацеленный на В-клеточный эпитоп 73-83 IL-6, был способен вызвать более высокие титры антител к IL-6, чем иммуноген в другой группе (SEQ ID NO: 157), составляющие около 3,0 Log(EC50) в течение периода КИА (Фиг. 10).
Эффект иммунотерапии IL-6, оцененный в профилактической модели КИА у крыс
Крыс, иммунизированных пептидной конструкцией IL-6 крысы (с SEQ ID NO 148 или 157) с последующим индуцированием КИА, тщательно изучали на предмет клинических признаков и симптомов артрита. Индуцированный КИА быстро развивался у крыс с инъекциями коллагена (бычий коллаген II типа, Chondrex Inc.). Клинические признаки воспаления острого артрита, включая эритему и отек суставов, оцененные по шкале от 0 до 4 для каждой лапы (общая оценка в диапазоне от 0 до 16), были обнаружены в задних лапах приблизительно через 2 недели после введения коллагена. Максимальная оценка тяжести артрита и наиболее сильный отек лапы были обнаружены приблизительно через 3 недели после индуцирования КИА в каждой группе (Фиг. 11 и 12). Эффективность лечения разными иммуногенными конструкциями IL-6 оценивали с помощью шкалы оценки тяжести артрита. Группа, иммунизированная (SEQ ID NO: 148), продемонстрировала более низкую оценку тяжести артрита и меньший отек лапы, чем другая тестируемая иммуногенная конструкция (SEQ ID NO: 157), и статистически значимое отличие по сравнению с группой плацебо в ходе этого иммунотерапевтического исследования in vivo (Фиг. 11 и 12, а также таблицы 10 и 11).
Чтобы наблюдать, способен ли иммуноген IL-6 снижать высвобождение нейтрофилов из костного мозга в кровоток во время исследования индуцированного КИА у крыс, результаты показали, что количество нейтрофилов, высвобожденных из костного мозга, постепенно увеличивалось, начиная с дня 0, и достигло своего пика в день 14. Иммуногены IL-6 крысы (SEQ ID NO: 148) эффективно снижали высвобождение нейтрофилов из костного мозга в кровоток (Фиг. 13 и таблица 12). Это указывает на то, что обе разработанные иммуногенные конструкции IL-6 играют важную роль в снижении воспалительных процессов.
Результаты этого исследования показали, что В-клеточный эпитопный пептид IL-6 крысы 72-82 IL-6 является хорошим кандидатом для пептидной иммуногенной конструкции IL-6 человека, содержащей 73-83 IL-6 в качестве В-клеточного эпитопного пептида, для лечения заболеваний, на которые влияет нарушение регуляции IL-6, в качестве профилактики, когда вызванные поликлональные антитела к молекуле IL-6 будут нейтрализовать циркулирующий в крови цитокин IL-6 с целью блокировать/подавлять передачу его сигналов, тем самым снижая клинические воспалительные патологические процессы.
Крысам с КИА трижды вводили внутримышечным путем пептидные иммуногенные конструкции IL-6 крысы или только адъювант. Животные продемонстрировали хорошую общую переносимость кандидатных составов IL-6 крысы в дозе 45 мкг/0,5 мл. Кандидатный пептидный иммуноген IL-6 крысы SEQ ID NO: 148 продемонстрировал более высокую эффективность с точки зрения ответа антител и снижения тяжести артрита, чем пептидный иммуноген SEQ ID NO: 157.
ПРИМЕР 9
ЭФФЕКТ ПЕПТИДНЫХ ИММУНОГЕННЫХ КОНСТРУКЦИЙ IL-6 И ИХ СОСТАВОВ ПРИ ЛЕЧЕНИИ РЕВМАТОИДНОГО АРТРИТА, КАК ПОКАЗАНО НА ТЕРАПЕВТИЧЕСКОЙ МОДЕЛИ КИА У КРЫС LEWIS
Исследование для подтверждения концепции (PoC) с применением пептидных иммуногенных конструкций IL-6 на модели коллаген-индуцированного артрита (КИА) у крыс Lewis
Чтобы подтвердить эффективность иммуногенной конструкции IL-6 (SEQ ID NO: 148), провели исследование POC на модели КИА у крыс Lewis, в котором два разных состава адъювантов оценивали в рамках этого исследования эффективности, как показано на Фиг. 14. По семь животных распределили в каждую из двух групп лечения, а шесть животных распределили в группу плацебо. Животным из двух групп лечения вводили пептидную иммуногенную конструкцию (SEQ ID NO: 148), составленную либо только с ISA 51, либо с ISA51/CpG, в дозе 45 мкг/0,5 мл для прайм- и буст-режимов в дни -7, 7, 14, 21 и 28. Группе плацебо вводили только адъювант-носитель без пептидной иммуногенной конструкции в те же временные точки, что и в группах лечения. Всем группам вводили эмульсию бычьего коллагена II типа/НАФ (100 мкг в 100 мл на крысу) в основание хвоста внутрикожным путем в дни 0 и 7 для индуцирования артрита. Исследование было прекращено на 35 день.
Титр иммуногенности против рекомбинантного белка IL-6 крысы из сыворотки иммунизированных крыс оценивали с помощью ИФА. Результаты показали, что обе группы лечения с одной и той же пептидной иммуногенной конструкцией IL-6, составленной с разными адъювантами, демонстрировали высокие титры антител против IL-6 крысы с устойчивым увеличением после иммунизации. Титр достигал своего пика в обеих группах лечения в день 21 на уровне 3 Log (EC50) и сохранял плато до завершения исследования в день 35 (Фиг. 15). Такой результат дополнительно подтверждает, что эта пептидная иммуногенная конструкция (SEQ ID NO: 148) является довольно иммуногенной и способна нарушить иммунную толерантность, чтобы вызвать специфичные поликлональные антитела против IL-6 крысы, причем оба состава адъювантов эффективно усиливали выработку антител.
Клиническую оценку индуцированного артрита КИА у крыс Lewis выполняли для группы лечения и группы плацебо до и после иммунизации иммуногенными конструкциями IL-6, а также индуцирования КИА. Степень тяжести артрита оценивали по шкале от 0 до 4 для каждой лапы (общая оценка в диапазоне от 0 до 16), исходя их клинических признаков тяжести артрита в ходе исследования. Результаты показали, что индуцированный КИА быстро развивался у крыс после введения коллагена. В группе плацебо с адъювантом была достигнута максимальная оценка артрита 9 в день 14. Напротив, в обеих группах лечения наблюдалась намного более легкая степень тяжести артрита, обе оценки составляли менее 6 в один и тот же момент времени на 14 день со статистической значимостью (p <0,01). С того момента снижение оценки артрита наблюдалось во всех группах, мониторинг в которых осуществлялся каждые 2-3 дня, начиная с дня 14 по 35, всего до завершения исследования было выполнено 9 оценок. Результаты каждой оценки показали, что в двух группах лечения оценки степени тяжести артрита были намного ниже, чем в группе плацебо, со статистической значимостью (в основном с p <0,01 или P <0,001) в дни с 14 по 35. К концу исследования на 35 день в группе плацебо оценка составляла около 6, тогда как в обеих группах лечения оценки составляли около 3, как показано на Фиг. 16. Были также оценены клинические признаки КИА в задней лапе, результаты показали увеличение объема задней лапы у всех крыс с артритом, начиная с 14 дня, вследствие воспаления суставов. Однако наблюдали аналогичный результат, что в двух группах лечения объемы задних лап были значительно меньше, чем в группе плацебо, в дни 14, 21, 28 и 35, соответственно, со статистической значимостью (в основном от p < 0,01 до P < 0,001). К концу исследования на 35 день объемы задних лап в этих двух группах лечения приближались к нормальным, тогда как в группе плацебо объемы были больше, как показано на Фиг. 16. Все эти данные указывают на то, что два адъюванта продемонстрировали схожую клиническую эффективность в настоящем исследовании, однако комбинация ISA51+CpG является несколько лучше, чем ISA51.
Уровни IL-6 в сыворотке положительно коррелировали со степенью и тяжестью поражения суставов; в то же время некоторые другие нисходящие воспалительные биомаркеры в сыворотке, такие как С-реактивный белок (СРБ), также являются индикатором при оценке тяжести воспаления. Для определения уровней СРБ в сыворотке использовали анализы ИФА. У крыс из группы плацебо (лечение КИА с помощью адъюванта-носителя) уровни СРБ в сыворотке были значительно повышены (p < 0,05) при сравнении с двумя группами лечения (Фиг. 17). Средние значения СРБ в сыворотке крыс, получавших лечение КИА иммуногеном (SEQ ID NO: 148), приближались к нормальным значениям и были значительно ниже, чем эти значения в группе плацебо, в день 21.
Было проведено гистопатологическое исследование для оценки влияния пептидного иммуногена IL-6 на гистологические повреждения голеностопных суставов. Крыс с КИА (по 7 на группу лечения, 6 в группе плацебо) умерщвляли на 35 день и удаляли ткани голеностопных суставов для фиксации, декальцификации и покрытия парафином срезов ткани. Срезы ткани получали и окрашивали с помощью ГЭ. Гистопатологическое исследование показано на Фиг. 18, где нормальная контрольная группа имела здоровые суставы и нормальные ткани. Напротив, группа плацебо продемонстрировала типичные признаки артрита, характеризующиеся заметным синовиальным и околосуставным воспалением, синовиальной гиперплазией и эрозией кости. Патологическое исследование суставов крыс с КИА, иммунизированных с помощью (SEQ ID NO: 148), выявило намного более слабое воспаление с более слабой инфильтрацией клеток, более легкую степень синовиальной гиперплазии и эрозии кости, что указывает на то, что повреждение голеностопных суставов было облегчено пептидной иммуногенной конструкцией (SEQ ID NO: 148). На Фиг. 18 также представлено сравнение патологических оценок в трех разных группах, при этом модифицированная шкала оценки Mankin была адаптирована для оценки суставного хряща в баллах от 0 до 6 для структуры хряща, 0-3 для морфологии клеток, 0-4 для окрашивания сафранином-О и 0-4 для синовиального воспаления и гиперплазии (Clin Immunol. 124:244-257). В группах лечения пептидной иммуногенной конструкцией (SEQ ID NO: 148) патологическая оценка значительно снизилась до 6 по сравнению с оценкой 11 в группе плацебо.
Предполагается, что воспалительные цитокины играют важную роль в патогенезе РА. Метод иммуногистохимического окрашивания применяли для оценки воспаленных тканей голеностопа. Вкратце, зафиксированные в формалине и залитые парафином срезы тканей депарафинизировали в ксилене, погружали в уменьшающиеся концентрации этанола и повторно гидратировали в воде. Все срезы обрабатывали для усиленной микроволнами демаскировки антигена. Нанесенные на предметные стекла срезы, погруженные в цитратный раствор для демаскировки антигена (Scytek), нагревали до кипения в микроволновой печи при максимальной мощности и охлаждали до комнатной температуры в течение 30 минут. Эндогенную пероксидазную активность блокировали с помощью 3% перекиси водорода/ФСБ в течение 10 минут. Срезы предварительно инкубировали с протеиновым блоком Ultravision (ThermoFisher) при комнатной температуре в течение 1 часа. Затем срезы инкубировали с первичным кроличьим антителом к IL-17 крысы (Abbiotec, разведение 1:100 в ФСБТ), к ФНО-α крысы (Abcam, разведение 1:100 в ФСБТ) или к MCP-1 крысы (Abcam, разведение 1:200 в ФСБТ) при 4°C в течение ночи, промывали с помощью TBST (Scytek) и проявляли с помощью набора Polink-2 Plus HRP Rabbit with DAB (GBI Labs). Срезы контрастировали гематоксилином (Leica Biosystems), обезвоживали и помещали в среду для заливки Surgipath Micromount (Leica Biosystems). На Фиг. 19 показано значительное увеличение ФНО-α, IL-17 и MCP-1 в тканях в группе плацебо. Однако выработка этих цитокинов была в значительной степени подавлена у крыс с КИА, получавших лечение иммуногеном IL-6.
Это исследование показало, что иммунизация пептидными иммуногенными конструкциями IL-6 значительно сокращает частоту возникновения воспалительного артрита и защищает кости и хрящи от разрушения. Эти данные надежно подтверждают клиническое применение иммунизации пептидными иммуногенами IL-6 in vivo для лечения или предотвращения ревматоидного артрита и других аутоиммунных заболеваний.
Оценка влияния введения доз и адъювантов на иммунный ответ, вызванный пептидными иммуногенными конструкциями IL-6, на моделях КИА
Исследование POC на крысах с КИА продемонстрировало, что разработанные пептидные иммуногенные конструкции с высокой иммуногенностью и терапевтической эффективностью, направленными на IL-6-индуцированный патогенез, предполагают потенциальное иммунотерапевтическое применение при ревматоидном артрите и других аутоиммунных заболеваниях. Последующие исследования будут сосредоточены на оптимизации пептидных иммуногенных конструкций и выборе адъювантов, а также на определении дозы у крыс Lewis с КИА.
MONTANIDE ISA 51 и ADJU-PHOS как разные адъюванты, составленные с одним и тем же пептидным иммуногеном (SEQ ID NO: 148) плюс CpG, соответственно, оценивали в исследовании иммунизации крыс с КИА. Пять крыс, определенных в каждую из 5 групп, получали один из двух составов адъюванта, в общей сложности 10 групп для этих двух разных адъювантов. Всем животным в группах лечения внутримышечно вводили разные дозы 5, 15, 45, 150 мкг в 0,5 мл в прайм- и буст-режиме в день -7, 7, 14, 21 и 28 с клиническим наблюдением до дня 35. Две разные группы плацебо с адъювантом без пептидного иммуногена получали инъекции только с адъювантами-носителями в составе. В последующих исследованиях оценивали титры против IL-6, массу тела, отек задней лапы, оценку тяжести артрита, количество нейтрофилов, тромбоцитов в крови, а также функцию печени.
Титр против IL-6 измеряли с помощью ИФА относительно рекомбинантного белка IL-6 крысы, нанесенного в лунки планшета. Полученные результаты продемонстрировали, что ни в одной из двух групп плацебо, которым вводили два разных адъюванта-носителя, не было обнаружено определяемых титров антител к IL-6, в то время как все группы лечения, иммунизированные иммуногенной конструкцией IL-6 (SEQ ID NO: 148) с обоими адъювантными составами, генерировали антитела против крысиного IL-6 в ИФА. В целом результат продемонстрировал, что наблюдалась зависимость от дозы, особенно для групп с составом ISA 51 (Фиг. 20). Состав ISA 51 вызывал более высокий иммунный ответ, чем состав ADJUPHOS, у иммунизированных крыс, при этом иммуногенность имела значения Log10 более 3 для всех доз, соответственно.
Массу тела отслеживали каждые семь дней в ходе исследования, которое продолжалось 35 дней. На Фиг. 21 изображена картина изменения массы тела иммунизированных крыс по сравнению с нормальными крысами, потеря массы тела у экспериментальных крыс с КИА началась на 14 день, достигнув самого нижнего значения на 21 день, а затем в каждой группе началось постепенное увеличение массы тела. В конце исследования (день 35) у всех крыс с КИА все еще наблюдалась потеря массы тела на около 10% по сравнению с нормальными крысами. Данные также указывают на дозозависимый характер изменения массы тела: наименьшая потеря массы тела наблюдалась в группе с более высокой дозой. Группы с дозой 150 мкг набрали больше массы, чем группы с другими дозами вне зависимости от используемого адъюванта. Для сравнения, группа с дозой 150 мкг с ADJUPHOS набрала больше массы, чем любая другая группа в дни 28 и 35, свыше 200 г (таблица 13).
Клиническую тяжесть вызванного КИА воспаления и повреждения у крыс также оценивали путем количественного определения изменений объема лап. Макроскопическое наблюдение показало, что иммуногенная конструкция IL-6 (SEQ ID NO: 148), составленная с ISA 51 либо с ADJUPHOS, способна защитить от развития КИА в крысиной модели. Острые клинические признаки отека и покраснения лап были зарегистрированы у крыс в ходе исследования после введения коллагена. Все иммунизированные крысы продемонстрировали увеличение отека лап в период с дня 7 по 21, а затем они постепенно выздоравливали с уменьшением воспаления, как показано на Фиг. 22 и в таблице 14. Группа плацебо при макроскопическом наблюдении продемонстрировала значительные изменения отека и покраснения при сравнении с нормальной группой в день 24 (Фиг. 23). Пептидная иммуногенная конструкция (SEQ ID NO: 148) уменьшала покраснение и отек лапы дозозависимым образом. Максимальное уменьшение воспаления было обнаружено в группе с дозой 150 мкг в день 24 путем количественного анализа. ADJU-PHOS демонстрировал несколько лучшие результаты, чем MONTANIDE ISA 51.
Клиническую тяжесть артрита оценивали по шкале (0-4) для каждой лапы в соответствии с воспалительными изменениями признаков эритемы и отека (оценочные критерии). Животных осматривали каждые два или три дня и измеряли как среднее ± СО для оценки степени тяжести артрита (Фиг. 24 и таблица 15). Первоначальные признаки развития артрита, вызванного введением коллагена, стали заметны на 14 день. Оценки артрита в группах с КИА быстро повышались, достигнув максимального значения 5-9 приблизительно на 20 день, а затем воспалительные проявления постепенно становились слабее с 21 по 35 день в обеих группах лечения и группе плацебо. Однако во всех группах лечения иммуногенной конструкцией (SEQ ID NO: 148) было достигнуто более значительное ослабление артрита с точки зрения оценки клинических признаков, чем в группе плацебо, в ходе исследования. Также наблюдался дозозависимый характер лечения пептидным иммуногеном: группы с более высокими дозами получили более низкую оценку артрита во всех группах лечения с адъювантом ISA51 либо с ADJUPHOS. Две группы плацебо с двумя разными адъювантами-носителями продемонстрировали более тяжелые клинические признаки артрита, получив более высокие оценки клинических признаков, чем все группы лечения. Было определено, что наилучший уровень дозы составляет 45 и 150 мкг, который значительно уменьшил признаки и симптомы артрита по сравнению с дозами 5 и 15 мкг, для составов как с ISA 51, так и с ADJUPHOS. В дни 33 и 35 группы с дозой состава ADJUPHOS 150 мкг продемонстрировали более значительное снижение оценок артрита, составляющее 61% и 63%, чем группы с ISA 51, в которых снижение составило 31% и 45%, соответственно.
Количество нейтрофилов быстро увеличивалось в дни с 0 по 7 после первой инъекции коллагена, а затем постепенно возрастало после второй инъекции до дня 14. Повышенное количество нейтрофилов быстро снижалось после иммунизации дозозависимым образом (Фиг. 25 и таблица 16). Во всех группах лечения иммуногеном было обнаружено более сильное снижение количества нейтрофилов, чем в группах плацебо, в каждый момент времени. В группах лечения иммуногеном IL-6 две более высокие дозы значительно уменьшали нейтрофилию, однако дозы состава с ADJUPHOS 45 и 150 мкг значительно снижали количество нейтрофилов (p <0,001) до 1,55±0,23×103 на мкл и 1,36±0,25×103 на мкл, соответственно, что является лучшим результатом, чем у состава с ISA 51 при таких же уровнях доз.
Коллаген-индуцированный артрит также связан со значительным увеличением количества тромбоцитов. Тестируемые крысы с КИА демонстрируют стабильное увеличение среднего количества тромбоцитов после первой инъекции коллагена во всех группах, а затем его постепенное снижение (Фиг. 26 и таблица 17). Также наблюдался дозозависимый характер, что указывает на меньшее количество тромбоцитов при более высоких дозах. В частности, композиция IL-6, составленная с ADJUPHOS, в дозах 45 и 150 мкг значительно снизила уровень тромбоцитов практически до нормального значения, тогда как в группах плацебо количество тромбоцитов в крови было выше в каждой временной точке.
Поражение печени количественно определяли путем измерения уровня аспартатаминотрансферазы (АСТ) в сыворотке (Фиг. 27 и таблица 18), используя обычный тест АСТ человека на биохимическом анализаторе Hitachi 7080 (Hitachi). Введение крысам состава пептидной иммуногенной конструкции IL-6 и коллагена привело к умеренному повышению уровней АСТ в сыворотке в дни с 0 по 7 по сравнению с нормальной группой крыс. Концентрации АСТ были стабильными до дня 21, а затем медленно снижались до завершения исследования. Зависимость от дозы также наблюдалась для уровней АСТ. Крысы, получавшие дозу 150 мкг, демонстрировали значительно более низкий уровень АСТ для обоих составов. При дозе 45 мкг значительно более низкий уровень АСТ наблюдался только для состава с ADJUPHOS, но не с ISA 51.
Таким образом, пептидная иммуногенная конструкция Il-6 (SEQ ID NO: 148), составленная с адъювантами, способна вызывать антитела к IL-6 для нейтрализации чрезмерного IL-6, что приводит к уменьшению тяжести артрита и подавлению факторов воспаления, таких как количество нейтрофилов и тромбоцитов в крови, а также обеспечивает защиту функции печени. Аналогичный дозозависимый характер ответа на композицию наблюдался в каждой группе лечения пептидными иммуногенными конструкциями IL-6. Результаты показали, что животные, получавшие дозу 150 мкг, продемонстрировали самый высокий иммунный ответ, на втором месте оказались животные, получавшие дозу 45 мкг. Более того, обе системы адъювантной доставки ISA 51 и ADJUPHOS продемонстрировали способность ослабления симптомов артрита при использовании в комбинации с пептидными иммуногенными конструкциями IL-6. Однако адъювант ADJU-PHOS продемонстрировал несколько лучшие результаты, чем MONTANIDE ISA 51 с точки зрения всех связанных с артритом патологических параметров. Самая высокая доза ADJUPHOS 150 мкг на 0,5 мл, таким образом, считается оптимальной для иммунизации крыс и будет использована в качестве ориентира при изучении иммуногенности у других видов.
ПРИМЕР 10
ЛЕЧЕНИЕ ХРОНИЧЕСКИХ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ С ПОМОЩЬЮ ИММУНИЗАЦИИ ПЕПТИДНЫМИ ИММУНОГЕННЫМИ КОНСТРУКЦИЯМИ IL-6 И ИХ СОСТАВАМИ
IL-6 участвует в широком спектре биологических событий, таких как иммунные ответы, гемопоэз и острофазовые реакции. Однако избыточная выработка IL-6 участвует в патогенезе различных заболеваний, включая несколько хронических воспалительных заболеваний и рак. Применение ингибиторов по отношению к сигнальному пути IL-6 должно обеспечить важную информацию для лучшего понимания молекулярных механизмов заболеваний, на которые влияет нарушение регуляции IL-6, что будет способствовать развитию нового терапевтического вмешательства для этих заболеваний. Клинические применения пептидных иммуногенных конструкций IL-6 и их составов по настоящему изобретению в качестве фармацевтических композиций для предотвращения и/или лечения заболеваний описаны в ПРИМЕРАХ 11-15. Статья с обзором потенциальных клинических применений ингибиторов IL-6 по отношению к сигнальному пути IL-6 при заболеваниях представлена в настоящем документе в качестве ссылки (Mihara, et al., 2012).
Анемия при хронических воспалительных заболеваниях (ACD)
Анемия часто наблюдается у пациентов с хроническими воспалительными заболеваниями, такими как РА, воспалительное заболевание кишечника и рак, и называется ACD (англ. «anemia of chronic disease» - анемия хронического заболевания). ACD характеризуется пониженным содержанием железа в крови при наличии достаточных запасов железа. Считается, что воспалительные цитокины играют важную роль в ACD.
Анемия, наблюдаемая при коллаген-индуцированном артрите у обезьян, характеризуется пониженным уровнем железа в сыворотке и насыщением трансферрина, а также повышенным уровнем ферритина в сыворотке. Степень тяжести анемии коррелирует с уровнями IL-6 в сыворотке. Гепсидин является главным регулятором гомеостаза железа у людей и других млекопитающих. Он ингибирует всасывание железа в тонком кишечнике и высвобождение рециркулирующего железа из макрофагов, эффективно снижая доставку железа в зреющие эритроциты в костном мозге. Мыши, генетически созданные для сверхвыработки гепсидина, умирают от острого дефицита железа вскоре после рождения.
IL-6 индуцирует выработку гепсидина в клетках печени. Введение TCZ, моноклонального антитела, направленного против рецептора IL-6, обезьянам с коллаген-индуцированным артритом быстро уменьшало анемию и индуцировало быстрое, но временное снижение уровня гепсидина в сыворотке. Экспрессию мРНК гепсидина сильнее индуцировала сыворотка обезьян с артритом, чем сыворотка здоровых животных, и она ингибировалась введением TCZ. Эти наборы данных указывают на то, что TCZ уменьшает анемию у обезьян с артритом путем ингибирования индуцированной IL-6 выработки гепсидина.
Вместо дорогостоящего лечения антителами, введение пептидных иммуногенных конструкций IL-6 и их составов по настоящему изобретению пациентам с целью вызвать антитела с сайтом связывания IL-6R для вмешательства в связывание IL-6 и IL-6 R приведет к лечению заболевания.
ПРИМЕР 11
ЛЕЧЕНИЕ РАКА С ПОМОЩЬЮ ИММУНИЗАЦИИ ПЕПТИДНЫМИ ИММУНОГЕННЫМИ КОНСТРУКЦИЯМИ IL-6 И ИХ СОСТАВАМИ
Хроническое воспаление при канцерогенезе человека
Хроническое воспаление играет важную роль в канцерогенезе человека. Существует множество сообщений, описывающих повышенные уровни IL-6 в сыворотке у пациентов с раком, которые связаны со степенью тяжести и исходом заболевания. IL-6 участвует в модуляции роста и дифференцировки многих раковых заболеваний. Также было обнаружено, что повышение уровня IL-6 связано с неблагоприятным прогнозом при почечно-клеточной карциноме, раке яичника, лимфоме, меланоме и раке предстательной железы. Активируя ERK1/2, IL-6 стимулирует пролиферацию опухолевых клеток. IL-6 является важным регулятором выживания клеток, обеспечивая опухолевым клеткам механизм избежания гибели, вызванной стрессом и цитотоксическими препаратами. Кроме того, было показано, что физиологическая роль IL-6 способствует не только пролиферации опухоли, но также и метастазированию и развитию симптомов кахексии.
Множественная миелома (ММ)
ММ представляет собой злокачественное новообразование плазматических клеток и является наиболее распространенной злокачественной лимфомой у взрослых. Она характеризуется локализацией опухолевых клеток в костном мозге, где эти клетки диссеменируются и вызывают заболевания костей. Взаимодействие между клетками ММ и стромальными клетками в микросреде костного мозга стимулирует выработку цитокинов, факторов роста и молекул адгезии. Вместе они играют важную роль в пролиферации и локализации клеток ММ в костном мозге. Клетки ММ вызывают остеолиз, который приводит к боли в костях и гиперкальциемии. IL-6 является основным фактором роста для клеток ММ. Приблизительно у половины всех пациентов с ММ наблюдалось, что пролиферация культивируемых клеток ММ опосредована аутокринной петлей, и на сегодняшний день хорошо известно, что IL-6, вырабатываемый в микросреде костного мозга, является основным цитокином, участвующим в росте и выживании клеток ММ. Более того, хорошо известно, что IL-6 является основным фактором для выживания клеток ММ, поскольку он предотвращает апоптоз клеток ММ, вызванный различными стимулами, такими как дексаметазон, Fas и сывороточная депривация. Комплекс IL-6-sIL-6R является более эффективным, чем IL-6 сам по себе, при повышении экспрессии Bcl-xL и Mcl-l в нативных клетках ММ, которые не экспрессируют IL-6R на клеточной поверхности. Таким образом, важно иметь композиции, содержащие пептидные иммуногенные конструкции IL-6, которые могут вызывать антитела, направленные на сайты, которые будут препятствовать транс-сигнализации, т.е. препятствовать на уровне комплекса IL-6/IL-6Rα с IL-6Rβ, т.е. gp130. Композиция IL-6 по настоящему изобретению, таким образом, может применяться для лечения ММ.
Рак предстательной железы
Экспрессия IL-6 и IL-6R, а также роль IL-6 как фактора роста при раке предстательной железы хорошо задокументированы. IL-6 отвечает за устойчивость к апоптозу и повышенные уровни антиапоптотического члена семейства Bcl-2 в клеточной линии LNCaP рака предстательной железы на поздней стадии. Поскольку рост клеток рака предстательной железы зависит от присутствия андрогенов, почти все пациенты с раком предстательной железы на поздней стадии сначала отвечают на андрогенную депривацию и антиандрогенную терапию. Поскольку IL-6 стимулирует синтез андрогенов и экспрессию АР (андрогенных рецепторов) на клетках рака предстательной железы, возможно, что IL-6 снижает терапевтический эффект антиандрогенной терапии рака предстательной железы. С другой стороны в АР-отрицательных клетках рака предстательной железы IL-6 известен как ингибитор апоптоза. Композиции IL-6 по настоящему изобретению позволят генерировать антитела к IL-6 у иммунизированных пациентов для нейтрализации негативного влияния, оказываемого IL-6 у этих пациентов с раком.
Связанные с раком анорексия и кахексия
Связанные с раком анорексия и кахексия являются серьезными осложнениями, ассоциированными со злокачественными заболеваниями. Кахексия характеризуется анемией, нарушением функции печени, усталостью и рвотой. Наблюдается повышенный уровень IL-6 в сыворотке у пациентов с раком поджелудочной железы и его связь с кахексией. Как было описано выше, IL-6 связан с метаболизмом железа. Кроме того, IL-6 также играет регуляторную роль по отношению к чрезмерному метаболизму глюкозы и потере мышечной массы. Также известно, что IL-6 необходим для кахексии при раковом заболевании в сингенной модели у мышей, в которой лечение с помощью антител к IL-6 предотвращало индуцирование кахексии при раковом заболевании. Кроме того, у сингенных мышей введение клеток карциномы легкого Lewis, трансфицированных кДНК IL-6, приводило к неизмененной чистой скорости роста опухоли, но вызывало потерю массы тела и сокращало время выживания. Сообщалось, что антитело к IL-6 человека (ALD518) уменьшает усталость и снижает потерю безжировой массы тела (-0,19 кг у пациентов, принимающих ALD518, по сравнению с -1,50 кг у пациентов, принимающих плацебо) у пациентов с прогрессирующим немелкоклеточным раком легкого. У этих пациентов ALD518 повышало уровень гемоглобина, гематокрита, средний уровень корпускулярного гемоглобина и альбумина, а также повышало уровни гемоглобина до ≥ 12 г/дл у 58% пациентов с исходными уровнями гемоглобина ≤ 11 г/дл. Таким образом, антитела к IL-6, в виде либо моноклональных антител, либо антител, вызванных путем иммунизации пациентов композициями, содержащими пептидные иммуногенные конструкции IL-6, могут быть неэритропоэтическим стимулирующим агентом для связанной с раком анемии.
Пациенты с длительным язвенным колитом имеют намного больший риск развития рака толстой кишки, что свидетельствует о роли иммунной системы в качестве опухолевого промотора в толстой кишке. Исследование показало, что IL-6, который вырабатывается в клетках врожденного иммунитета в собственной пластинке слизистой оболочки в ответ на повреждение кишечника, увеличивает пролиферацию инициирующих опухоль клеток и защищает нормальные и предзлокачественные эпителиальные клетки кишечника от апоптоза при остром воспалении толстой кишки и идуцировании CAC (англ. «colitis-associated cancer» - рак, связанный с колитом). Более того, в вызванных азоксиметаном опухолях толстой кишки в моделях язвенного колита появление опухолей сопровождалось появлением подмножества макрофагов F4/80+CD11bhighGr1low (M2), которое является источником способствующих опухоли факторов, включая IL-6. Эти результаты свидетельствуют о том, что блокада IL-6 может представлять подход к лечению рака, связанного с колитом.
Вместо дорогостоящего лечения антителами, с целью вмешательства во взаимодействие IL-6 с рецептором IL-6 и снижения уровня IL-6 в сыворотке, приводящего к лечению и облегчению рака, включая множественную миелому (ММ), андроген-зависимый или андроген-независимый рак предстательной железы, немелкоклеточный рак легкого, связанную с раком анорексию и кахексию, связанную с раком анемию и связанный с колитом рак, иммунизация пептидными иммуногенными конструкциями IL-6 и их составами будет пригодна для лечения таких тяжелых заболеваний.
ПРИМЕР 12
ЛЕЧЕНИЕ РЕВМАТОИДНОГО АРТРИТА С ПОМОЩЬЮ ИММУНИЗАЦИИ ПЕПТИДНОЙ ИММУНОГЕННОЙ КОНСТРУКЦИЕЙ IL-6 И ЕЕ СОСТАВАМИ
Ревматоидный артрит (РА)
Ревматоидный артрит (РА) представляет собой хроническое прогрессирующее аутоиммунное воспалительное заболевание неясной этиологии, которое в частности поражает суставы рук и ног. Синовиальная ткань пораженных суставов инфильтрируется воспалительными клетками, такими как макрофаги и лимфоциты, что приводит к гиперплазии с неоваскуляризацией, что в свою очередь вызывает отек, скованность и боль в суставах. Этот процесс в конечном итоге приводит к разрушению хрящей и резорбции кости в суставах, причем некоторые пациенты страдают от стойкой нетрудоспособности. Биологическая активность IL-6 и повышение уровня IL-6 в сыворотке и синовиальных жидкостях пациентов с РА указывает на то, что IL-6 является одним из главных цитокинов, вовлеченных в развитие РА. Семь клинических испытаний фазы III моноклонального антитела TCZ (тоцилизумаба) к IL-6R, проведенных в Японии и других странах мира, показали его эффективность в качестве монотерапии или комбинированной терапии с БМАРП (болезнь-модифицирующие антиревматические препараты) для лечения взрослых пациентов с РА умеренной и тяжелой степени тяжести. Более того, исследования SAMURAI (Исследование активной контролируемой монотерапии, применяемой для лечения ревматоидного артрита, в виде ингибитора IL-6) и LITHE (Исследование безопасности тоцилизумаба и его способности предотвращать структурное повреждение суставов) доказали, что радиологическое повреждение суставов в значительной степени ингибировалось при лечении TCZ. Как результат, TCZ был одобрен для лечения РА во многих странах.
Системный ювенильный идиопатический артрит (сЮИА)
Системный ювенильный идиопатический артрит (сЮИА) является подтипом хронического детского артрита, который приводит к разрушению суставов и функциональной инвалидности, сопровождающихся системным воспалением. Такое длительное воспаление также вызывает повышение температуры, анемию и нарушение роста. Острое осложнение сЮИА, известное как синдром активации макрофагов, связано с серьезной заболеваемостью. Сообщалось, что уровень IL-6 заметно повышен в крови и синовиальной жидкости пациентов, и было продемонстрировано, что уровень IL-6 коррелирует с активностью заболевания. TCZ продемонстрировал явную эффективность в рандомизированном двойном слепом плацебо-контролируемом исследовании фазы III с отменой препарата, в котором участвовали 56 пациентов с сЮИА, невосприимчивых к традиционным режимам лечения. В 2008 г. его одобрили в качестве первого биологического лекарственного препарата для лечения сЮИА.
Вместо дорогостоящего лечения антителами, как показано выше, для вмешательства на уровне взаимодействия IL-6 и рецептора IL-6 с целью снижения уровня IL-6 в сыворотке и облегчения сЮИА иммунизация пептидными иммуногенными конструкциями IL-6 и их составами по настоящему изобретению будет пригодна для лечения сЮИА.
ПРИМЕР 13
ЛЕЧЕНИЕ БОЛЕЗНИ КАСТЛЕМАНА С ПОМОЩЬЮ ИММУНИЗАЦИИ ПЕПТИДНЫМИ ИММУНОГЕННЫМИ КОНСТРУКЦИЯМИ IL-6 И ИХ СОСТАВАМИ
Болезнь Кастлемана представляет собой лимфопролиферативное заболевание с доброкачественными гиперпластическими лимфатическими узлами, характеризующимися фолликулярной гиперплазией и капиллярной пролиферацией, сопровождающимися эндотелиальной гиперплазией. Высокие уровни IL-6 вырабатываются в гиперпластических лимфатических узлах, и IL-6 является ключевым элементом, отвечающим за различные клинические симптомы. Два открытых клинических испытания показали, что антитело TCZ к IL-6R, вводимое в дозе 8 мг/кг массы тела каждые 2 недели, оказывало заметный эффект на клинические симптомы, результаты лабораторных исследований, а также на гистологически определенное облегчение симптомов. Более того, лечение TCZ вызвало быстрое снижение уровня гепсидина-25 в сыворотке у пациентов с болезнью Кастлемана. Долгосрочное снижение, сопровождающееся прогрессирующей нормализацией связанных с железом показателей и улучшением симптомов, наблюдалось после начала лечения TCZ, что указывает на то, что IL-6 играет важную роль в индуцировании гепсидина при болезни Кастлемана. TCZ одобрили в качестве орфанного препарата для лечения болезни Кастлемана в Японии в 2005 г.
Вместо дорогостоящего лечения антителами, для вмешательства на уровне взаимодействия IL-6 и рецептора IL-6, вызывающего снижение уровня IL-6 в сыворотке и облегчение болезни Кастлемана, иммунизация пептидными иммуногенными конструкциями IL-6 и их составами будет пригодна для лечения болезни Кастлемана.
ПРИМЕР 14
ЛЕЧЕНИЕ ДЕПРЕССИИ С ПОМОЩЬЮ ИММУНИЗАЦИИ ПЕПТИДНЫМИ ИММУНОГЕННЫМИ КОНСТРУКЦИЯМИ IL-6 И ИХ СОСТАВАМИ
Связь между иммунной системой и головным мозгом может предложить новое понимание и сведения о механизме действия при лечении депрессии. Цитокин-опосредованное сообщение между иммунной системой и головным мозгом участвует в патогенезе депрессии. Большая депрессия является распространенной (каждый четвертый случай) после лечения интерфероном, мощным индуктором цитокинов, у пациентов, пораженных вирусом гепатита С. Экспериментальная иммуноактивация у здоровых добровольцев приводит к появлению симптомов депрессии и снижению когнитивных функций. Мета-анализ исследований методом поперечных срезов подтвердил наличие повышенных уровней циркулирующих воспалительных цитокинов у пациентов с депрессией. Лонгитюдные исследования продемонстрировали, что повышенные уровни цитокинов в сыворотке предшествуют симптомам депрессии, то есть потенциально вызывают их. Более того, считается, что активация воспалительной системы лежит в основе резистентности к антидепрессантам, подчеркивая вовлечение воспаления в ответную реакцию на лечение. Исходя из этих данных, было бы наиболее полезно воздействовать на воспалительные цитокины, в частности пептидные иммуногенные конструкции IL-6, использующие IL-6, и их составы по настоящему изобретению, чтобы обеспечить терапевтический эффект для пациентов с депрессией и болью, в частности для тех, кто страдает от хронических воспалительных состояний.
Таблица 1
Аминокислотные последовательности IL-6 и его фрагментов, используемые в серологических анализах
в пределах IL-6
*Цистеины, которые замещают аминокислоты на N-конце и/или C-конце фрагментов IL-6, подчеркнуты.
Таблица 2
Аминокислотные последовательности Th-эпитопов, полученных из патогенных белков, включая идеализированные искусственные Th-эпитопы, для применения в дизайне пептидных иммуногенных конструкций IL-6
NO:
T RT TR T
RRRIKII RII I L IR
VRVV VV V I V
F FF FF F V F
F
T RT TR
FFLL L ITTI
217
KKKISITEIRTVIVTRIETILF
219
220
221
222
RRRIKIITRIITIPLSIR
KKKVRVVTKVVTVPISVD
KKKFFFFTKFFTFPVSFD
KKKLFLLTKLLTLPFSLD
224
ISITEIRTVIVTRIETILF
226
KKKFFLLTRILTIITTID
Таблица 3
Аминокислотные последовательности пептидных иммуногенных конструкций IL-6
NO:
Таблица 3 (продолжение)
NO:
T RT TR T
RRRIKII RII I L IR
VRVV VV V I V
F FF FF F V F
F
FFLL L ITTI
Таблица 3 (продолжение)
NO:
T RT TR T
RRRIKII RII I L IR
VRVV VV V I V
F FF FF F V F
F
FFLL L ITTI
* Полипептид, циклизированный образованием межцистеиновой дисульфидной связи, обозначен жирным курсивом. Цистеины, которые замещают аминокислоты на N-конце и/или C-конце фрагментов IL-6, подчеркнуты.
UBITh®1: SEQ ID NO: 91
UBITh®2: SEQ ID NO: 92
UBITh®3: SEQ ID NO: 89
Таблица 4
Оценка иммуногенности составов вакцин, содержащих пептидные иммуногенные конструкции IL-6, нацеленные на сайты связывания IL-6R, у морских свинок
Титр Log10 ИФА
Титр Log10 ИФА
Таблицы 5A - 5E
Оценка иммуногенности составов вакцин, содержащих пептидные иммуногенные конструкции IL-6, нацеленные на сайты связывания IL-6/IL-6Rα/IL-6Rβ (или gp130)
(Таблица 5А)
Титр Log10 ИФА
без циклизации
(Таблица 5B)
Титр Log10 ИФА
Титр Log10 ИФА
(Таблица 5C)
Титр Log10 ИФА
Титр Log10 ИФА
IL-661-75
IL-661-72
(Таблица 5D)
Титр Log10 ИФА
Титр Log10 ИФА
IL-6150-162
IL-6150-162-KKK-εK-UBITh®1
IL-6144-166-KKK-εK-UBITh®1
(Таблица 5E)
Таблица 6
Усиление иммуногенности В-эпитопного пептида IL-6 (C73-C83) с ранжированием гетерологичных Тh-эпитопных пептидов из патогенных белков
IL-6 человека
Титр Log10 ИФА
IL-6 человека
Титр Log10 ИФА
IL-6 (C73-C83)
IL-6 (C73-C83)
IL-6 (C73-C83)
IL-6 (C73-C83)
IL-6 (C73-C83)
Таблица 7
Отсутствие эндогенных Th-эпитопов IL-6 в пределах выбранных последовательностей В-эпитопа сайта связывания IL6R
(SEQ ID NO: 8)
Титр Log10 ИФА
(SEQ ID NO: 10) Титр Log10 ИФА
IL-6 человека
Титр Log10 ИФА
Таблица 8
Оценка иммуногенности у морских свинок против части Th-эпитопа пептидных иммуногенных конструкций IL-6
Титр Log10 ИФА
Таблица 9
Картирование связывающих IL6R В-эпитопов с помощью иммунных сывороток из пептидных иммуногенных конструкций IL-6
пептидных иммуногенных конструкций IL-6
SEQ ID NO
IL658-83
IL652-83
IL652-72
IL642-72
IL642-72
IL650-67
IL673-83
Таблица 10
Оценка артрита у крыс с КИА, иммунизированных вакцинами, содержащими пептидные конструкции сайта связывания IL-6R
(IL-6 72-82 крысы)
(IL-6 144-166 крысы)
*, p<0,05 **, p<0,01 ***, p<0,001 ****, p<0,0001.
Таблица 11
Отек задней лапы у крыс с КИА, иммунизированных вакцинами, содержащими пептидные конструкции сайта связывания IL-6R
*, p<0,05 **, p<0,01 ***, p<0,001.
Таблица 12
Уровни нейтрофилов у крыс с КИА, иммунизированных вакцинами, содержащими пептидные конструкции сайта связывания IL-6R
*, p<0,05 **, p<0,01.
Таблица 13
Масса тела крыс с КИА, иммунизированных составами вакцин, содержащими пептидную конструкцию (SEQ ID NO: 148), полученную из сайта связывания IL-6R, при различных уровнях дозы
(+9,3%)
(+8,2%)
(+10,6%)
(+8,6%)
*, p<0,05 **, p<0,01.
Таблица 14
Отек задней лапы у крыс с КИА, иммунизированных составами вакцин, содержащими пептидную конструкцию (SEQ ID NO: 148) сайта связывания IL-6R, при различных уровнях дозы
(-5,4%)
(-8,4%)
(-7,4%)
(-11,9%)
(-10%)
(-10,4%)
(-10%)
(-16,8%)
(-13,1%)
*, p<0,05 **, p<0,01 ***, p<0,001.
Таблицы 15A - 15B
Оценка артрита у крыс с КИА, иммунизированных составами вакцин, содержащими пептидную конструкцию (SEQ ID NO: 148) сайта связывания IL-6R, при различных уровнях дозы
(Таблица 15A) Состав с ISA 51/CpG
(-18%)
(-22%)
(-25%)
(-24%)
(-28%)
(-24%)
(-28%)
(-19%)
(-23%)
(-30%)
(-38%)
(-26%)
(-38%)
(-25%)
(-32%)
(-29%)
(-26%)
(-24%)
(-35%)
(-45%)
*, p<0,05 **, p<0,01 ***, p<0,001.
(Таблица 15B) Состав с ADJU-PHOS/CpG
(-18%)
(-21%)
(-24%)
(-22%)
(-21%)
(-23%)
(-23%)
(-13%)
(-16%)
(-33%)
(-26%)
(-26%)
(-34%)
(-28%)
(-29%)
(-29%)
(-22%)
(-36%)
(-61%)
(-63%)
*, p<0,05 **, p<0,01 ***, p<0,001.
Таблицы 16A - 16B
Уровень нейтрофилов у крыс с КИА, иммунизированных составами вакцин, содержащими пептидную конструкцию (SEQ ID NO: 148) сайта связывания IL-6R, при различных уровнях дозы
(Таблица 16A) Состав с ISA 51/CpG
(-38%)
(-32%)
(-12%)
(-15%)
(-17%)
(-47%)
(-34%)
(-14%)
(-26%)
(-27%)
*, p<0,05 **, p<0,01.
(Таблица 16B) Состав с ADJU-PHOS/CpG
(-40%)
(-18%)
(-15%)
(-15%)
(-33%)
(-65%)
(-36%)
(-40%)
(-38%)
(-41%)
*, p<0,05 **, p<0,01 ***, p <0,001 ****, p<0,0001.
Таблицы 17A - 17B
Высвобождение тромбоцитов у крыс с КИА, иммунизированных составами вакцин, содержащими пептидную конструкцию (SEQ ID NO: 148) сайта связывания IL-6R, при различных уровнях дозы
(Таблица 17A) Состав с ISA 51/CpG
(-11%)
(-16%)
(-15%)
(-17%)
(-12%)
(-19%)
(-21%)
(-19%)
*, p<0,05 **, p<0,01.
(Таблица 17B) Состав с ADJU-PHOS/CpG
(-7%)
(-12%)
(-21%)
(-16%)
(-14%)
(-18%)
(-22%)
(-16%)
*, p<0,05 **, p<0,01 ***, p<0,001.
Таблицы 18A - 18B
АСТ у крыс с КИА, иммунизированных составами вакцин, содержащими пептидную конструкцию IL-6 (SEQ ID NO: 148), при различных уровнях дозы
(Таблица 18A) Состав с ISA 51/CpG
(-23%)
(-18%)
(-11%)
(-7%)
(-24%)
(-29%)
(-17%)
(-29%)
*, p<0,05 **, p<0,01.
(Таблица 18B) Состав с ADJU-PHOS/CpG
(-14%)
(-11%)
(-16%)
(-22%)
(-18%)
(-22%)
(-24%)
*, p<0,05 **, p<0,01.
Таблица 19
Перекрестная реактивность IgG из иммунных сывороток, нацеленных на пептидные иммуногенные конструкции сайта связывания IL-6R человека с белками IL-6 макак и грызунов
Таблицы 20A - 20B
Нейтрализующая активность IgG, вызванных пептидными иммуногенными конструкциями IL-6, по отношению к цис/транс-связыванию
(Таблица 20A) IC50 для ингибирующего эффекта на цис-связывание
(Таблица 20B) IC50 для ингибирующего эффекта на транс-связывание
Таблица 21
Нейтрализующая активность IgG, вызванных пептидными иммуногенными конструкциями IL-6, по отношению к индуцированной IL-6 пролиферации TF-1
Таблица 22
Перекрестная реактивность с IL-6 человека, обезьяны и грызунов IgG, вызванных пептидными иммуногенными конструкциями IL-6
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> UBI IP Holdings
UBI US Holdings, LLC
Wang, Chang Yi
Lin, Feng
Chen, Jiun Bo
Ding, Shuang
<120> ПЕПТИДНЫЕ ИММУНОГЕНЫ, НАЦЕЛЕННЫЕ НА ИНТЕРЛЕЙКИН 6 (IL-6), И
ИХ СОСТАВЫ ДЛЯ ИММУНОТЕРАПИИ ЗАБОЛЕВАНИЙ, НА КОТОРЫЕ ВЛИЯЕТ
НАРУШЕНИЕ РЕГУЛЯЦИИ IL-6
<130> 1004263.221WO2 (2040-WO)
<140> TBD
<141> 28.12.2019
<150> US 62/786 192
<151> 28.12.2018
<160> 236
<170> PatentIn версия 3.5
<210> 1
<211> 184
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(184)
<223> IL-6 1-184 человека
<400> 1
Pro Val Pro Pro Gly Glu Asp Ser Lys Asp Val Ala Ala Pro His Arg
1 5 10 15
Gln Pro Leu Thr Ser Ser Glu Arg Ile Asp Lys Gln Ile Arg Tyr Ile
20 25 30
Leu Asp Gly Ile Ser Ala Leu Arg Lys Glu Thr Cys Asn Lys Ser Asn
35 40 45
Met Cys Glu Ser Ser Lys Glu Ala Leu Ala Glu Asn Asn Leu Asn Leu
50 55 60
Pro Lys Met Ala Glu Lys Asp Gly Cys Phe Gln Ser Gly Phe Asn Glu
65 70 75 80
Glu Thr Cys Leu Val Lys Ile Ile Thr Gly Leu Leu Glu Phe Glu Val
85 90 95
Tyr Leu Glu Tyr Leu Gln Asn Arg Phe Glu Ser Ser Glu Glu Gln Ala
100 105 110
Arg Ala Val Gln Met Ser Thr Lys Val Leu Ile Gln Phe Leu Gln Lys
115 120 125
Lys Ala Lys Asn Leu Asp Ala Ile Thr Thr Pro Asp Pro Thr Thr Asn
130 135 140
Ala Ser Leu Leu Thr Lys Leu Gln Ala Gln Asn Gln Trp Leu Gln Asp
145 150 155 160
Met Thr Thr His Leu Ile Leu Arg Ser Phe Lys Glu Phe Leu Gln Ser
165 170 175
Ser Leu Arg Ala Leu Arg Gln Met
180
<210> 2
<211> 184
<212> БЕЛОК
<213> Macaca fascicularis
<220>
<221> ПЕПТИД
<222> (1)..(184)
<223> IL-6 1-184 макака
<400> 2
Pro Val Leu Pro Gly Glu Asp Ser Lys Asp Val Ala Ala Pro His Ser
1 5 10 15
Gln Pro Leu Thr Ser Ser Glu Arg Ile Asp Lys His Ile Arg Tyr Ile
20 25 30
Leu Asp Gly Ile Ser Ala Leu Arg Lys Glu Thr Cys Asn Arg Ser Asn
35 40 45
Met Cys Glu Ser Ser Lys Glu Ala Leu Ala Glu Asn Asn Leu Asn Leu
50 55 60
Pro Lys Met Ala Glu Lys Asp Gly Cys Phe Gln Ser Gly Phe Asn Glu
65 70 75 80
Asp Thr Cys Leu Val Lys Ile Ile Thr Gly Leu Leu Glu Phe Glu Val
85 90 95
Tyr Leu Glu Tyr Leu Gln Asn Arg Phe Glu Ser Ser Glu Glu Gln Ala
100 105 110
Arg Ala Val Gln Met Ser Thr Lys Val Leu Ile Gln Phe Leu Gln Lys
115 120 125
Lys Ala Lys Asn Leu Asp Ala Ile Thr Thr Pro Glu Pro Thr Thr Asn
130 135 140
Ala Ser Leu Leu Thr Lys Leu Gln Ala Gln Asn Gln Trp Leu Gln Asp
145 150 155 160
Met Thr Thr His Leu Ile Leu Arg Ser Phe Lys Glu Phe Leu Gln Ser
165 170 175
Ser Leu Arg Ala Leu Arg Gln Met
180
<210> 3
<211> 184
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕПТИД
<222> (1)..(184)
<223> IL-6 1-184 мыши
<400> 3
Ser Gln Val Arg Arg Gly Asp Phe Thr Glu Asp Thr Thr Pro Asn Arg
1 5 10 15
Pro Val Tyr Thr Thr Ser Gln Val Gly Gly Leu Ile Thr His Val Leu
20 25 30
Trp Glu Ile Val Glu Met Arg Lys Glu Leu Cys Asn Gly Asn Ser Asp
35 40 45
Cys Met Asn Asn Asp Asp Ala Leu Ala Glu Asn Asn Leu Lys Leu Pro
50 55 60
Glu Ile Gln Arg Asn Asp Gly Cys Tyr Gln Thr Gly Tyr Asn Gln Glu
65 70 75 80
Ile Cys Leu Leu Lys Ile Ser Ser Gly Leu Leu Glu Tyr His Ser Tyr
85 90 95
Leu Glu Tyr Met Lys Asn Asn Leu Lys Asp Asn Lys Lys Asp Lys Ala
100 105 110
Arg Val Leu Gln Arg Asp Thr Glu Thr Leu Ile His Ile Phe Asn Gln
115 120 125
Glu Val Lys Asp Leu His Lys Ile Val Leu Pro Thr Pro Ile Ser Asn
130 135 140
Ala Leu Leu Thr Asp Lys Leu Glu Ser Gln Lys Glu Trp Leu Arg Thr
145 150 155 160
Lys Thr Ile Gln Phe Ile Leu Lys Ser Leu Glu Glu Phe Leu Lys Val
165 170 175
Thr Leu Arg Ser Thr Arg Gln Thr
180
<210> 4
<211> 184
<212> БЕЛОК
<213> Rattus norvegicus
<220>
<221> ПЕПТИД
<222> (1)..(184)
<223> IL-6 1-184 крысы
<400> 4
Ser Gln Val Arg Arg Gly Asp Phe Thr Glu Asp Thr Thr His Asn Arg
1 5 10 15
Pro Val Tyr Thr Thr Ser Gln Val Gly Gly Leu Ile Thr Tyr Val Leu
20 25 30
Arg Glu Ile Leu Glu Met Arg Lys Glu Leu Cys Asn Gly Asn Ser Asp
35 40 45
Cys Met Asn Ser Asp Asp Ala Leu Ser Glu Asn Asn Leu Lys Leu Pro
50 55 60
Glu Ile Gln Arg Asn Asp Gly Cys Phe Gln Thr Gly Tyr Asn Gln Glu
65 70 75 80
Ile Cys Leu Leu Lys Ile Cys Ser Gly Leu Leu Glu Phe Arg Phe Tyr
85 90 95
Leu Glu Phe Val Lys Asn Asn Leu Gln Asp Asn Lys Lys Asp Lys Ala
100 105 110
Arg Val Ile Gln Ser Asn Thr Glu Thr Leu Val His Ile Phe Lys Gln
115 120 125
Glu Ile Lys Asp Ser Tyr Lys Ile Val Leu Pro Thr Pro Thr Ser Asn
130 135 140
Ala Leu Leu Met Glu Lys Leu Glu Ser Gln Lys Glu Trp Leu Arg Thr
145 150 155 160
Lys Thr Ile Gln Leu Ile Leu Lys Ala Leu Glu Glu Phe Leu Lys Val
165 170 175
Thr Met Arg Ser Thr Arg Gln Thr
180
<210> 5
<211> 11
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(11)
<223> IL-6 73-83
<400> 5
Cys Phe Gln Ser Gly Phe Asn Glu Glu Thr Cys
1 5 10
<210> 6
<211> 22
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(22)
<223> IL-6 62-83
<400> 6
Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly Cys Phe Gln Ser Gly
1 5 10 15
Phe Asn Glu Glu Thr Cys
20
<210> 7
<211> 26
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(26)
<223> IL-6 58-83
<400> 7
Ala Glu Asn Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly Cys
1 5 10 15
Phe Gln Ser Gly Phe Asn Glu Glu Thr Cys
20 25
<210> 8
<211> 32
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(32)
<223> IL-6 52-83
<400> 8
Ser Ser Lys Glu Ala Leu Ala Glu Asn Asn Leu Asn Leu Pro Lys Met
1 5 10 15
Ala Glu Lys Asp Gly Cys Phe Gln Ser Gly Phe Asn Glu Glu Thr Cys
20 25 30
<210> 9
<211> 21
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(21)
<223> IL-6 52-72
<400> 9
Ser Ser Lys Glu Ala Leu Ala Glu Asn Asn Leu Asn Leu Pro Lys Met
1 5 10 15
Ala Glu Lys Asp Gly
20
<210> 10
<211> 31
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(31)
<223> IL-6 42-72
<400> 10
Glu Thr Cys Asn Lys Ser Asn Met Cys Glu Ser Ser Lys Glu Ala Leu
1 5 10 15
Ala Glu Asn Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly
20 25 30
<210> 11
<211> 18
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(18)
<223> IL-6 50-67, C67 замещает M67
<400> 11
Cys Glu Ser Ser Lys Glu Ala Leu Ala Glu Asn Asn Leu Asn Leu Pro
1 5 10 15
Lys Cys
<210> 12
<211> 16
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(16)
<223> IL-6 42-57
<400> 12
Glu Thr Cys Asn Lys Ser Asn Met Cys Glu Ser Ser Lys Glu Ala Leu
1 5 10 15
<210> 13
<211> 15
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(15)
<223> IL-6 61-75, S73 замещает C73
<400> 13
Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly Ser Phe Gln
1 5 10 15
<210> 14
<211> 12
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(12)
<223> IL-6 61-72
<400> 14
Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly
1 5 10
<210> 15
<211> 7
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(7)
<223> IL-6 44-50
<400> 15
Cys Asn Lys Ser Asn Met Cys
1 5
<210> 16
<211> 42
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(42)
<223> IL-6 44-83
<400> 16
Glu Thr Cys Asn Lys Ser Asn Met Cys Glu Ser Ser Lys Glu Ala Leu
1 5 10 15
Ala Glu Asn Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly Cys
20 25 30
Phe Gln Ser Gly Phe Asn Glu Glu Thr Cys
35 40
<210> 17
<211> 40
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(40)
<223> IL-6 44-83
<400> 17
Cys Asn Lys Ser Asn Met Cys Glu Ser Ser Lys Glu Ala Leu Ala Glu
1 5 10 15
Asn Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly Cys Phe Gln
20 25 30
Ser Gly Phe Asn Glu Glu Thr Cys
35 40
<210> 18
<211> 13
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(13)
<223> IL-6 150-162, C150 замещает K150, C162 замещает T162
<400> 18
Cys Leu Gln Ala Gln Asn Gln Trp Leu Gln Asp Met Cys
1 5 10
<210> 19
<211> 23
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(23)
<223> IL-6 144-166, C144 замещает N144, C166 замещает I166
<400> 19
Cys Ala Ser Leu Leu Thr Lys Leu Gln Ala Gln Asn Gln Trp Leu Gln
1 5 10 15
Asp Met Thr Thr His Leu Cys
20
<210> 20
<211> 11
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕПТИД
<222> (1)..(11)
<223> IL-6 72-82 мыши
<400> 20
Cys Tyr Gln Thr Gly Tyr Asn Gln Glu Ile Cys
1 5 10
<210> 21
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 32-41
<400> 21
Ile Leu Asp Gly Ile Ser Ala Leu Arg Lys
1 5 10
<210> 22
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 33-42
<400> 22
Leu Asp Gly Ile Ser Ala Leu Arg Lys Glu
1 5 10
<210> 23
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 34-43
<400> 23
Asp Gly Ile Ser Ala Leu Arg Lys Glu Thr
1 5 10
<210> 24
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 35-44
<400> 24
Gly Ile Ser Ala Leu Arg Lys Glu Thr Cys
1 5 10
<210> 25
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 36-45
<400> 25
Ile Ser Ala Leu Arg Lys Glu Thr Cys Asn
1 5 10
<210> 26
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 37-46
<400> 26
Ser Ala Leu Arg Lys Glu Thr Cys Asn Lys
1 5 10
<210> 27
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 38-47
<400> 27
Ala Leu Arg Lys Glu Thr Cys Asn Lys Ser
1 5 10
<210> 28
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 39-48
<400> 28
Leu Arg Lys Glu Thr Cys Asn Lys Ser Asn
1 5 10
<210> 29
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 40-49
<400> 29
Arg Lys Glu Thr Cys Asn Lys Ser Asn Met
1 5 10
<210> 30
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 41-50
<400> 30
Lys Glu Thr Cys Asn Lys Ser Asn Met Cys
1 5 10
<210> 31
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 42-51
<400> 31
Glu Thr Cys Asn Lys Ser Asn Met Cys Glu
1 5 10
<210> 32
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 43-52
<400> 32
Thr Cys Asn Lys Ser Asn Met Cys Glu Ser
1 5 10
<210> 33
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 44-53
<400> 33
Cys Asn Lys Ser Asn Met Cys Glu Ser Ser
1 5 10
<210> 34
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 45-54
<400> 34
Asn Lys Ser Asn Met Cys Glu Ser Ser Lys
1 5 10
<210> 35
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 46-55
<400> 35
Lys Ser Asn Met Cys Glu Ser Ser Lys Glu
1 5 10
<210> 36
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 47-56
<400> 36
Ser Asn Met Cys Glu Ser Ser Lys Glu Ala
1 5 10
<210> 37
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 48-57
<400> 37
Asn Met Cys Glu Ser Ser Lys Glu Ala Leu
1 5 10
<210> 38
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 49-58
<400> 38
Met Cys Glu Ser Ser Lys Glu Ala Leu Ala
1 5 10
<210> 39
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 50-59
<400> 39
Cys Glu Ser Ser Lys Glu Ala Leu Ala Glu
1 5 10
<210> 40
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 51-60
<400> 40
Glu Ser Ser Lys Glu Ala Leu Ala Glu Asn
1 5 10
<210> 41
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL6- 52-61
<400> 41
Ser Ser Lys Glu Ala Leu Ala Glu Asn Asn
1 5 10
<210> 42
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 53-62
<400> 42
Ser Lys Glu Ala Leu Ala Glu Asn Asn Leu
1 5 10
<210> 43
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 54-63
<400> 43
Lys Glu Ala Leu Ala Glu Asn Asn Leu Asn
1 5 10
<210> 44
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 55-64
<400> 44
Glu Ala Leu Ala Glu Asn Asn Leu Asn Leu
1 5 10
<210> 45
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 56-65
<400> 45
Ala Leu Ala Glu Asn Asn Leu Asn Leu Pro
1 5 10
<210> 46
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 57-66
<400> 46
Leu Ala Glu Asn Asn Leu Asn Leu Pro Lys
1 5 10
<210> 47
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 58-67
<400> 47
Ala Glu Asn Asn Leu Asn Leu Pro Lys Met
1 5 10
<210> 48
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 59-68
<400> 48
Glu Asn Asn Leu Asn Leu Pro Lys Met Ala
1 5 10
<210> 49
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 60-69
<400> 49
Asn Asn Leu Asn Leu Pro Lys Met Ala Glu
1 5 10
<210> 50
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 61-70
<400> 50
Asn Leu Asn Leu Pro Lys Met Ala Glu Lys
1 5 10
<210> 51
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 62-71
<400> 51
Leu Asn Leu Pro Lys Met Ala Glu Lys Asp
1 5 10
<210> 52
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 63-72
<400> 52
Asn Leu Pro Lys Met Ala Glu Lys Asp Gly
1 5 10
<210> 53
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 64-73
<400> 53
Leu Pro Lys Met Ala Glu Lys Asp Gly Cys
1 5 10
<210> 54
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 65-74
<400> 54
Pro Lys Met Ala Glu Lys Asp Gly Cys Phe
1 5 10
<210> 55
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 66-75
<400> 55
Lys Met Ala Glu Lys Asp Gly Cys Phe Gln
1 5 10
<210> 56
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 67-76
<400> 56
Met Ala Glu Lys Asp Gly Cys Phe Gln Ser
1 5 10
<210> 57
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 68-77
<400> 57
Ala Glu Lys Asp Gly Cys Phe Gln Ser Gly
1 5 10
<210> 58
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 69-78
<400> 58
Glu Lys Asp Gly Cys Phe Gln Ser Gly Phe
1 5 10
<210> 59
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 70-79
<400> 59
Lys Asp Gly Cys Phe Gln Ser Gly Phe Asn
1 5 10
<210> 60
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 71-80
<400> 60
Asp Gly Cys Phe Gln Ser Gly Phe Asn Glu
1 5 10
<210> 61
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 72-81
<400> 61
Gly Cys Phe Gln Ser Gly Phe Asn Glu Glu
1 5 10
<210> 62
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 73-82
<400> 62
Cys Phe Gln Ser Gly Phe Asn Glu Glu Thr
1 5 10
<210> 63
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 74-83
<400> 63
Phe Gln Ser Gly Phe Asn Glu Glu Thr Cys
1 5 10
<210> 64
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 75-84
<400> 64
Gln Ser Gly Phe Asn Glu Glu Thr Cys Leu
1 5 10
<210> 65
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 76-85
<400> 65
Ser Gly Phe Asn Glu Glu Thr Cys Leu Val
1 5 10
<210> 66
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 77-86
<400> 66
Gly Phe Asn Glu Glu Thr Cys Leu Val Lys
1 5 10
<210> 67
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 78-87
<400> 67
Phe Asn Glu Glu Thr Cys Leu Val Lys Ile
1 5 10
<210> 68
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 79-88
<400> 68
Asn Glu Glu Thr Cys Leu Val Lys Ile Ile
1 5 10
<210> 69
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 80-89
<400> 69
Glu Glu Thr Cys Leu Val Lys Ile Ile Thr
1 5 10
<210> 70
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 81-90
<400> 70
Glu Thr Cys Leu Val Lys Ile Ile Thr Gly
1 5 10
<210> 71
<211> 10
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(10)
<223> IL-6 82-91
<400> 71
Thr Cys Leu Val Lys Ile Ile Thr Gly Leu
1 5 10
<210> 72
<211> 14
<212> БЕЛОК
<213> Rattus norvegicus
<220>
<221> ПЕПТИД
<222> (1)..(14)
<223> IL-6 150-162 крысы, C150 замещает K150, C162 замещает T162
<400> 72
Cys Leu Glu Ser Gln Lys Glu Trp Leu Arg Thr Lys Thr Cys
1 5 10
<210> 73
<211> 23
<212> БЕЛОК
<213> Rattus norvegicus
<220>
<221> ПЕПТИД
<222> (1)..(23)
<223> IL-6 144-166 крысы
<220>
<221> ПЕПТИД
<222> (1)..(23)
<223> IL-6 144-166 крысы, C144 замещает N144, C166 замещает I162
<400> 73
Asn Ala Leu Leu Met Glu Lys Leu Glu Ser Gln Lys Glu Trp Leu Arg
1 5 10 15
Thr Lys Thr Ile Gln Leu Ile
20
<210> 74
<211> 11
<212> БЕЛОК
<213> Rattus norvegicus
<220>
<221> ПЕПТИД
<222> (1)..(11)
<223> IL-6 72-82 крысы
<400> 74
Cys Phe Gln Thr Gly Tyr Asn Gln Glu Ile Cys
1 5 10
<210> 75
<211> 11
<212> БЕЛОК
<213> Macaca fascicularis
<220>
<221> ПЕПТИД
<222> (1)..(11)
<223> IL-6 73-83 макака
<400> 75
Cys Phe Gln Ser Gly Phe Asn Glu Asp Thr Cys
1 5 10
<210> 76
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(6)
<223> Spacer1
<220>
<221> САЙТ
<222> (3)..(3)
<223> Любая аминокислота, предпочтительно аспарагиновая кислота
<220>
<221> САЙТ
<222> (5)..(5)
<223> Любая аминокислота, предпочтительно аспарагиновая кислота
<400> 76
Pro Pro Xaa Pro Xaa Pro
1 5
<210> 77
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(4)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (1)..(1)
<223> эпсилон-K
<400> 77
Lys Lys Lys Lys
1
<210> 78
<211> 17
<212> БЕЛОК
<213> Clostridium tetani
<220>
<221> ПЕПТИД
<222> (1)..(17)
<223> Clostridium tetani 1 Th
<400> 78
Lys Lys Gln Tyr Ile Lys Ala Asn Ser Lys Phe Ile Gly Ile Thr Glu
1 5 10 15
Leu
<210> 79
<211> 15
<212> БЕЛОК
<213> вирус кори
<220>
<221> ПЕПТИД
<222> (1)..(15)
<223> MvF1 Th
<400> 79
Leu Ser Glu Ile Lys Gly Val Ile Val His Arg Leu Glu Gly Val
1 5 10 15
<210> 80
<211> 24
<212> БЕЛОК
<213> Bordetella pertussis
<220>
<221> ПЕПТИД
<222> (1)..(24)
<223> Bordetella pertussis Th
<400> 80
Gly Ala Tyr Ala Arg Cys Pro Asn Gly Thr Arg Ala Leu Thr Val Ala
1 5 10 15
Glu Leu Arg Gly Asn Ala Glu Leu
20
<210> 81
<211> 17
<212> БЕЛОК
<213> Clostridium tetani
<220>
<221> ПЕПТИД
<222> (1)..(17)
<223> Clostridium tetani 2 Th
<400> 81
Trp Val Arg Asp Ile Ile Asp Asp Phe Thr Asn Glu Ser Ser Gln Lys
1 5 10 15
Thr
<210> 82
<211> 23
<212> БЕЛОК
<213> diphtheria bacilli
<220>
<221> ПЕПТИД
<222> (1)..(23)
<223> Diphtheria Th
<400> 82
Asp Ser Glu Thr Ala Asp Asn Leu Glu Lys Thr Val Ala Ala Leu Ser
1 5 10 15
Ile Leu Pro Gly His Gly Cys
20
<210> 83
<211> 21
<212> БЕЛОК
<213> Plasmodium falciparum
<220>
<221> ПЕПТИД
<222> (1)..(21)
<223> Plasmodium falciparum Th
<400> 83
Asp His Glu Lys Lys His Ala Lys Met Glu Lys Ala Ser Ser Val Phe
1 5 10 15
Asn Val Val Asn Ser
20
<210> 84
<211> 17
<212> БЕЛОК
<213> Schistosoma mansoni
<220>
<221> ПЕПТИД
<222> (1)..(17)
<223> Schistosoma mansoni Th
<400> 84
Lys Trp Phe Lys Thr Asn Ala Pro Asn Gly Val Asp Glu Lys His Arg
1 5 10 15
His
<210> 85
<211> 25
<212> БЕЛОК
<213> холерный токсин
<220>
<221> ПЕПТИД
<222> (1)..(25)
<223> холерный токсин Th
<400> 85
Ala Leu Asn Ile Trp Asp Arg Phe Asp Val Phe Cys Thr Leu Gly Ala
1 5 10 15
Thr Thr Gly Tyr Leu Lys Gly Asn Ser
20 25
<210> 86
<211> 15
<212> БЕЛОК
<213> вирус кори
<220>
<221> ПЕПТИД
<222> (1)..(15)
<223> MvF 2 Th
<400> 86
Ile Ser Glu Ile Lys Gly Val Ile Val His Lys Ile Glu Gly Ile
1 5 10 15
<210> 87
<211> 22
<212> БЕЛОК
<213> вирус кори
<220>
<221> ПЕПТИД
<222> (1)..(22)
<223> KKKMvF 3 Th
<220>
<221> САЙТ
<222> (7)..(7)
<223> S или T
<220>
<221> САЙТ
<222> (10)..(10)
<223> K или R
<220>
<221> САЙТ
<222> (11)..(11)
<223> G или T
<220>
<221> САЙТ
<222> (15)..(15)
<223> H или T
<220>
<221> САЙТ
<222> (16)..(16)
<223> K или R
<220>
<221> САЙТ
<222> (19)..(19)
<223> G или T
<400> 87
Lys Lys Lys Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa
1 5 10 15
Ile Glu Xaa Ile Leu Phe
20
<210> 88
<211> 18
<212> БЕЛОК
<213> вирус гепатита B
<220>
<221> ПЕПТИД
<222> (1)..(18)
<223> HBsAg 1 Th
<220>
<221> САЙТ
<222> (1)..(1)
<223> K или R
<220>
<221> САЙТ
<222> (2)..(2)
<223> K или R
<220>
<221> САЙТ
<222> (3)..(3)
<223> K или R
<220>
<221> САЙТ
<222> (4)..(4)
<223> L или I или V или F
<220>
<221> САЙТ
<222> (5)..(5)
<223> F или K или R
<220>
<221> САЙТ
<222> (6)..(6)
<223> L или I или V или F
<220>
<221> САЙТ
<222> (7)..(7)
<223> L или I или V или F
<220>
<221> САЙТ
<222> (9)..(9)
<223> K или R
<220>
<221> САЙТ
<222> (10)..(10)
<223> L или I или V или F
<220>
<221> САЙТ
<222> (11)..(11)
<223> L или I или V или F
<220>
<221> САЙТ
<222> (13)..(13)
<223> L или I или V или F
<220>
<221> САЙТ
<222> (15)..(15)
<223> Q или L или I или V или F
<220>
<221> САЙТ
<222> (17)..(17)
<223> L или I или V или F
<220>
<221> САЙТ
<222> (18)..(18)
<223> D или R
<400> 88
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Thr Xaa Xaa Xaa Thr Xaa Pro Xaa Ser
1 5 10 15
Xaa Xaa
<210> 89
<211> 19
<212> БЕЛОК
<213> вирус кори
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 4 Th (UBITh3)
<220>
<221> САЙТ
<222> (4)..(4)
<223> S или T
<220>
<221> САЙТ
<222> (7)..(7)
<223> K или R
<220>
<221> САЙТ
<222> (8)..(8)
<223> G или T
<220>
<221> САЙТ
<222> (12)..(12)
<223> H или T
<220>
<221> САЙТ
<222> (13)..(13)
<223> K или R
<400> 89
Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr
1 5 10 15
Ile Leu Phe
<210> 90
<211> 18
<212> БЕЛОК
<213> вирус гепатита B
<220>
<221> ПЕПТИД
<222> (1)..(18)
<223> HBsAg 2 Th
<220>
<221> САЙТ
<222> (4)..(4)
<223> I или F
<220>
<221> САЙТ
<222> (5)..(5)
<223> I или F
<220>
<221> САЙТ
<222> (6)..(6)
<223> T или L
<220>
<221> САЙТ
<222> (7)..(7)
<223> I или L
<220>
<221> САЙТ
<222> (11)..(11)
<223> I или L
<220>
<221> САЙТ
<222> (14)..(14)
<223> P или I
<220>
<221> САЙТ
<222> (15)..(15)
<223> Q или T
<220>
<221> САЙТ
<222> (16)..(16)
<223> S или T
<220>
<221> САЙТ
<222> (17)..(17)
<223> L или I
<400> 90
Lys Lys Lys Xaa Xaa Xaa Xaa Thr Arg Ile Xaa Thr Ile Xaa Xaa Xaa
1 5 10 15
Xaa Asp
<210> 91
<211> 19
<212> БЕЛОК
<213> вирус кори
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 5 Th (UBITh1)
<400> 91
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe
<210> 92
<211> 18
<212> БЕЛОК
<213> вирус гепатита B
<220>
<221> ПЕПТИД
<222> (1)..(18)
<223> HBsAg 3 Th (UBITh2)
<400> 92
Lys Lys Lys Ile Ile Thr Ile Thr Arg Ile Ile Thr Ile Ile Thr Thr
1 5 10 15
Ile Asp
<210> 93
<211> 11
<212> БЕЛОК
<213> вирус гриппа
<220>
<221> ПЕПТИД
<222> (1)..(11)
<223> Грипп MP1_1 Th
<400> 93
Phe Val Phe Thr Leu Thr Val Pro Ser Glu Arg
1 5 10
<210> 94
<211> 15
<212> БЕЛОК
<213> вирус гриппа
<220>
<221> ПЕПТИД
<222> (1)..(15)
<223> Грипп MP1_2 Th
<400> 94
Ser Gly Pro Leu Lys Ala Glu Ile Ala Gln Arg Leu Glu Asp Val
1 5 10 15
<210> 95
<211> 9
<212> БЕЛОК
<213> вирус гриппа
<220>
<221> ПЕПТИД
<222> (1)..(9)
<223> Грипп NSP1 Th
<400> 95
Asp Arg Leu Arg Arg Asp Gln Lys Ser
1 5
<210> 96
<211> 19
<212> БЕЛОК
<213> вирус Эпштейна-Барр
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> EBV BHRF1 Th
<400> 96
Ala Gly Leu Thr Leu Ser Leu Leu Val Ile Cys Ser Tyr Leu Phe Ile
1 5 10 15
Ser Arg Gly
<210> 97
<211> 15
<212> БЕЛОК
<213> Clostridium tetani
<220>
<221> ПЕПТИД
<222> (1)..(15)
<223> Clostridium tetani TT1 Th
<400> 97
Gln Tyr Ile Lys Ala Asn Ser Lys Phe Ile Gly Ile Thr Glu Leu
1 5 10 15
<210> 98
<211> 20
<212> БЕЛОК
<213> вирус Эпштейна-Барр
<220>
<221> ПЕПТИД
<222> (1)..(20)
<223> EBV EBNA-1 Th
<400> 98
Pro Gly Pro Leu Arg Glu Ser Ile Val Cys Tyr Phe Met Val Phe Leu
1 5 10 15
Gln Thr His Ile
20
<210> 99
<211> 21
<212> БЕЛОК
<213> Clostridium tetani
<220>
<221> ПЕПТИД
<222> (1)..(21)
<223> Clostridium tetani TT2 Th
<400> 99
Phe Asn Asn Phe Thr Val Ser Phe Trp Leu Arg Val Pro Lys Val Ser
1 5 10 15
Ala Ser His Leu Glu
20
<210> 100
<211> 16
<212> БЕЛОК
<213> Clostridium tetani
<220>
<221> ПЕПТИД
<222> (1)..(16)
<223> Clostridium tetani TT3 Th
<400> 100
Lys Phe Ile Ile Lys Arg Tyr Thr Pro Asn Asn Glu Ile Asp Ser Phe
1 5 10 15
<210> 101
<211> 16
<212> БЕЛОК
<213> Clostridium tetani
<220>
<221> ПЕПТИД
<222> (1)..(16)
<223> Clostridium tetani TT4 Th
<400> 101
Val Ser Ile Asp Lys Phe Arg Ile Phe Cys Lys Ala Leu Asn Pro Lys
1 5 10 15
<210> 102
<211> 18
<212> БЕЛОК
<213> вирус Эпштейна-Барр
<220>
<221> ПЕПТИД
<222> (1)..(18)
<223> EBV CP Th
<400> 102
Val Pro Gly Leu Tyr Ser Pro Cys Arg Ala Phe Phe Asn Lys Glu Glu
1 5 10 15
Leu Leu
<210> 103
<211> 14
<212> БЕЛОК
<213> цитомегаловирус человека
<220>
<221> ПЕПТИД
<222> (1)..(14)
<223> HCMV IE1 Th
<400> 103
Asp Lys Arg Glu Met Trp Met Ala Cys Ile Lys Glu Leu His
1 5 10
<210> 104
<211> 15
<212> БЕЛОК
<213> вирус Эпштейна-Барр
<220>
<221> ПЕПТИД
<222> (1)..(15)
<223> EBV GP340 Th
<400> 104
Thr Gly His Gly Ala Arg Thr Ser Thr Glu Pro Thr Thr Asp Tyr
1 5 10 15
<210> 105
<211> 13
<212> БЕЛОК
<213> вирус Эпштейна-Барр
<220>
<221> ПЕПТИД
<222> (1)..(13)
<223> EBV BPLF1 Th
<400> 105
Lys Glu Leu Lys Arg Gln Tyr Glu Lys Lys Leu Arg Gln
1 5 10
<210> 106
<211> 11
<212> БЕЛОК
<213> вирус Эпштейна-Барр
<220>
<221> ПЕПТИД
<222> (1)..(11)
<223> EBV EBNA-2 Th
<400> 106
Thr Val Phe Tyr Asn Ile Pro Pro Met Pro Leu
1 5 10
<210> 107
<211> 34
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 4 Th (UBITh3)
<220>
<221> САЙТ
<222> (4)..(4)
<223> S или T
<220>
<221> САЙТ
<222> (7)..(7)
<223> K или R
<220>
<221> САЙТ
<222> (8)..(8)
<223> G или T
<220>
<221> САЙТ
<222> (12)..(12)
<223> H или T
<220>
<221> САЙТ
<222> (13)..(13)
<223> K или R
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (24)..(34)
<223> IL-6 73-83 циклизированный
<400> 107
Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Cys Phe Gln Ser Gly Phe Asn Glu Glu
20 25 30
Thr Cys
<210> 108
<211> 34
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(11)
<223> IL-6 73-83 циклизированный
<220>
<221> ПЕПТИД
<222> (12)..(15)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (15)..(15)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (16)..(34)
<223> MvF4 Th (UBITh3)
<220>
<221> САЙТ
<222> (19)..(19)
<223> S или T
<220>
<221> САЙТ
<222> (22)..(22)
<223> K или R
<220>
<221> САЙТ
<222> (23)..(23)
<223> G или T
<220>
<221> САЙТ
<222> (27)..(27)
<223> H или T
<220>
<221> САЙТ
<222> (28)..(28)
<223> K или R
<400> 108
Cys Phe Gln Ser Gly Phe Asn Glu Glu Thr Cys Lys Lys Lys Lys Ile
1 5 10 15
Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr Ile
20 25 30
Leu Phe
<210> 109
<211> 54
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF4 Th (UBITh3)
<220>
<221> САЙТ
<222> (4)..(4)
<223> S или T
<220>
<221> САЙТ
<222> (7)..(7)
<223> K или R
<220>
<221> САЙТ
<222> (8)..(8)
<223> G или T
<220>
<221> САЙТ
<222> (12)..(12)
<223> H или T
<220>
<221> САЙТ
<222> (13)..(13)
<223> K или R
<220>
<221> САЙТ
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> ПЕПТИД
<222> (24)..(54)
<223> IL-6 154-184
<400> 109
Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Gln Asn Gln Trp Leu Gln Asp Met Thr
20 25 30
Thr His Leu Ile Leu Arg Ser Phe Lys Glu Phe Leu Gln Ser Ser Leu
35 40 45
Arg Ala Leu Arg Gln Met
50
<210> 110
<211> 58
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(31)
<223> (IL-6 154-184) x 6 в качестве разветвленного пептида
<220>
<221> САЙТ
<222> (32)..(33)
<223> (эпсилон K-K) x 4 в качестве линкера
<220>
<221> САЙТ
<222> (34)..(35)
<223> (эпсилон K-K) x 2 в качестве линкера
<220>
<221> ПЕПТИД
<222> (36)..(39)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> ПЕПТИД
<222> (40)..(58)
<223> MvF4 Th (UBITh3)
<220>
<221> САЙТ
<222> (43)..(43)
<223> S или T
<220>
<221> САЙТ
<222> (46)..(46)
<223> K или R
<220>
<221> САЙТ
<222> (47)..(47)
<223> G или T
<220>
<221> САЙТ
<222> (51)..(51)
<223> H или T
<220>
<221> САЙТ
<222> (52)..(52)
<223> K или R
<400> 110
Gln Asn Gln Trp Leu Gln Asp Met Thr Thr His Leu Ile Leu Arg Ser
1 5 10 15
Phe Lys Glu Phe Leu Gln Ser Ser Leu Arg Ala Leu Arg Gln Met Lys
20 25 30
Lys Lys Lys Lys Lys Lys Lys Ile Ser Ile Xaa Glu Ile Xaa Xaa Val
35 40 45
Ile Val Xaa Xaa Ile Glu Thr Ile Leu Phe
50 55
<210> 111
<211> 60
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(33)
<223> (KK- IL-6 154-184) x 6 в качестве разветвленного пептида
<220>
<221> САЙТ
<222> (34)..(35)
<223> (эпсилон K-K) x 4 в качестве линкера
<220>
<221> САЙТ
<222> (36)..(37)
<223> (эпсилон K-K) x 2 в качестве линкера
<220>
<221> ПЕПТИД
<222> (38)..(41)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> ПЕПТИД
<222> (42)..(60)
<223> MvF4 Th (UBITh3)
<220>
<221> САЙТ
<222> (45)..(45)
<223> S или T
<220>
<221> САЙТ
<222> (48)..(48)
<223> K или R
<220>
<221> САЙТ
<222> (49)..(49)
<223> G или T
<220>
<221> САЙТ
<222> (53)..(53)
<223> H или T
<220>
<221> САЙТ
<222> (54)..(54)
<223> K или R
<400> 111
Lys Lys Gln Asn Gln Trp Leu Gln Asp Met Thr Thr His Leu Ile Leu
1 5 10 15
Arg Ser Phe Lys Glu Phe Leu Gln Ser Ser Leu Arg Ala Leu Arg Gln
20 25 30
Met Lys Lys Lys Lys Lys Lys Lys Lys Ile Ser Ile Xaa Glu Ile Xaa
35 40 45
Xaa Val Ile Val Xaa Xaa Ile Glu Thr Ile Leu Phe
50 55 60
<210> 112
<211> 36
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF5 Th (UBITh1)
<220>
<221> САЙТ
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> ПЕПТИД
<222> (24)..(36)
<223> IL-6 150-162 циклизированный
<400> 112
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Cys Leu Gln Ala Gln Asn Gln Trp Leu
20 25 30
Gln Asp Met Cys
35
<210> 113
<211> 36
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(13)
<223> IL-6 150-162 циклизированный
<220>
<221> ПЕПТИД
<222> (14)..(17)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (17)..(17)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (18)..(36)
<223> MvF5 Th (UBITh1)
<400> 113
Cys Leu Gln Ala Gln Asn Gln Trp Leu Gln Asp Met Cys Lys Lys Lys
1 5 10 15
Lys Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu
20 25 30
Thr Ile Leu Phe
35
<210> 114
<211> 59
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF5 Th (UBITh1)
<220>
<221> САЙТ
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> ПЕПТИД
<222> (24)..(36)
<223> IL-6 150-162 циклизированный
<220>
<221> ПЕПТИД
<222> (37)..(40)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (40)..(40)
<223> эпсилон K
<220>
<221> ПЕПТИД
<222> (41)..(59)
<223> MvF5 Th (UBITh1)
<400> 114
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Cys Leu Gln Ala Gln Asn Gln Trp Leu
20 25 30
Gln Asp Met Cys Lys Lys Lys Lys Ile Ser Ile Thr Glu Ile Lys Gly
35 40 45
Val Ile Val His Arg Ile Glu Thr Ile Leu Phe
50 55
<210> 115
<211> 46
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF5 Th (UBITh1)
<220>
<221> САЙТ
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> ПЕПТИД
<222> (24)..(46)
<223> IL-6 144-166 циклизированный
<400> 115
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Cys Ala Ser Leu Leu Thr Lys Leu Gln
20 25 30
Ala Gln Asn Gln Trp Leu Gln Asp Met Thr Thr His Leu Cys
35 40 45
<210> 116
<211> 46
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(23)
<223> IL-6 144-166 циклизированный
<220>
<221> ПЕПТИД
<222> (24)..(27)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (27)..(27)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (28)..(46)
<223> MvF5 Th (UBITh1)
<400> 116
Cys Ala Ser Leu Leu Thr Lys Leu Gln Ala Gln Asn Gln Trp Leu Gln
1 5 10 15
Asp Met Thr Thr His Leu Cys Lys Lys Lys Lys Ile Ser Ile Thr Glu
20 25 30
Ile Lys Gly Val Ile Val His Arg Ile Glu Thr Ile Leu Phe
35 40 45
<210> 117
<211> 69
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF5 Th (UBITh1)
<220>
<221> САЙТ
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> ПЕПТИД
<222> (24)..(46)
<223> IL-6 144-166 циклизированный
<220>
<221> ПЕПТИД
<222> (47)..(50)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (50)..(50)
<223> эпсилон K
<220>
<221> ПЕПТИД
<222> (51)..(69)
<223> MvF5 Th (UBITh1)
<400> 117
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Cys Ala Ser Leu Leu Thr Lys Leu Gln
20 25 30
Ala Gln Asn Gln Trp Leu Gln Asp Met Thr Thr His Leu Cys Lys Lys
35 40 45
Lys Lys Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile
50 55 60
Glu Thr Ile Leu Phe
65
<210> 118
<211> 57
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF5 Th (UBITh1)
<220>
<221> САЙТ
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> ПЕПТИД
<222> (24)..(34)
<223> IL-6 73-83 циклизированный
<220>
<221> ПЕПТИД
<222> (35)..(38)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (38)..(38)
<223> эпсилон K
<220>
<221> ПЕПТИД
<222> (39)..(57)
<223> MvF5 Th (UBITh1)
<400> 118
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Cys Phe Gln Ser Gly Phe Asn Glu Glu
20 25 30
Thr Cys Lys Lys Lys Lys Ile Ser Ile Thr Glu Ile Lys Gly Val Ile
35 40 45
Val His Arg Ile Glu Thr Ile Leu Phe
50 55
<210> 119
<211> 34
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF5 Th (UBITh1)
<220>
<221> САЙТ
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> ПЕПТИД
<222> (24)..(34)
<223> IL-6 73-83 циклизированный
<400> 119
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Cys Phe Gln Ser Gly Phe Asn Glu Glu
20 25 30
Thr Cys
<210> 120
<211> 33
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(18)
<223> HBsAg3 Th (UBITh2)
<220>
<221> САЙТ
<222> (19)..(19)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (19)..(22)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> ПЕПТИД
<222> (23)..(33)
<223> IL-6 73-83 циклизированный
<400> 120
Lys Lys Lys Ile Ile Thr Ile Thr Arg Ile Ile Thr Ile Ile Thr Thr
1 5 10 15
Ile Asp Lys Lys Lys Lys Cys Phe Gln Ser Gly Phe Asn Glu Glu Thr
20 25 30
Cys
<210> 121
<211> 45
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(23)
<223> IL-6 144-166 циклизированный
<220>
<221> ПЕПТИД
<222> (24)..(27)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (27)..(27)
<223> эпсилон K
<220>
<221> ПЕПТИД
<222> (28)..(45)
<223> HBsAg3 Th (UBITh2)
<400> 121
Cys Ala Ser Leu Leu Thr Lys Leu Gln Ala Gln Asn Gln Trp Leu Gln
1 5 10 15
Asp Met Thr Thr His Leu Cys Lys Lys Lys Lys Lys Lys Lys Ile Ile
20 25 30
Thr Ile Thr Arg Ile Ile Thr Ile Ile Thr Thr Ile Asp
35 40 45
<210> 122
<211> 31
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF5 Th (UBITh1)
<220>
<221> САЙТ
<222> (20)..(20)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (21)..(31)
<223> IL-6 73-83 циклизированный
<400> 122
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Cys Phe Gln Ser Gly Phe Asn Glu Glu Thr Cys
20 25 30
<210> 123
<211> 30
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(18)
<223> HBsAg3 Th (UBITh2)
<220>
<221> САЙТ
<222> (19)..(19)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (20)..(30)
<223> IL-6 73-83 циклизированный
<400> 123
Lys Lys Lys Ile Ile Thr Ile Thr Arg Ile Ile Thr Ile Ile Thr Thr
1 5 10 15
Ile Asp Lys Cys Phe Gln Ser Gly Phe Asn Glu Glu Thr Cys
20 25 30
<210> 124
<211> 42
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF5 Th (UBITh1)
<220>
<221> САЙТ
<222> (20)..(20)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (21)..(42)
<223> IL-6 62-83 циклизированный
<400> 124
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly Cys
20 25 30
Phe Gln Ser Gly Phe Asn Glu Glu Thr Cys
35 40
<210> 125
<211> 46
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF5 Th (UBITh1)
<220>
<221> САЙТ
<222> (20)..(20)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (21)..(46)
<223> IL-6 58-83 циклизированный
<400> 125
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Ala Glu Asn Asn Leu Asn Leu Pro Lys Met Ala Glu
20 25 30
Lys Asp Gly Cys Phe Gln Ser Gly Phe Asn Glu Glu Thr Cys
35 40 45
<210> 126
<211> 52
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF5 Th (UBITh1)
<220>
<221> САЙТ
<222> (20)..(20)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (21)..(52)
<223> IL-6 52-83 циклизированный
<400> 126
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Ser Ser Lys Glu Ala Leu Ala Glu Asn Asn Leu Asn
20 25 30
Leu Pro Lys Met Ala Glu Lys Asp Gly Cys Phe Gln Ser Gly Phe Asn
35 40 45
Glu Glu Thr Cys
50
<210> 127
<211> 41
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF5 Th (UBITh1)
<220>
<221> САЙТ
<222> (20)..(20)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (21)..(41)
<223> IL-6 52-72
<400> 127
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Ser Ser Lys Glu Ala Leu Ala Glu Asn Asn Leu Asn
20 25 30
Leu Pro Lys Met Ala Glu Lys Asp Gly
35 40
<210> 128
<211> 51
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF5 Th (UBITh1)
<220>
<221> САЙТ
<222> (20)..(20)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (21)..(51)
<223> IL-6 42-72 циклизированный
<400> 128
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Glu Thr Cys Asn Lys Ser Asn Met Cys Glu Ser Ser
20 25 30
Lys Glu Ala Leu Ala Glu Asn Asn Leu Asn Leu Pro Lys Met Ala Glu
35 40 45
Lys Asp Gly
50
<210> 129
<211> 51
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(31)
<223> IL-6 42-72 циклизированный
<220>
<221> САЙТ
<222> (32)..(32)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (33)..(51)
<223> MvF5 Th (UBITh1)
<400> 129
Glu Thr Cys Asn Lys Ser Asn Met Cys Glu Ser Ser Lys Glu Ala Leu
1 5 10 15
Ala Glu Asn Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly Lys
20 25 30
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
35 40 45
Ile Leu Phe
50
<210> 130
<211> 38
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF5 Th (UBITh1)
<220>
<221> САЙТ
<222> (20)..(20)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (21)..(38)
<223> IL-6 50-67 циклизированный
<400> 130
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Cys Glu Ser Ser Lys Glu Ala Leu Ala Glu Asn Asn
20 25 30
Leu Asn Leu Pro Lys Cys
35
<210> 131
<211> 27
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF5 Th (UBITh1)
<220>
<221> САЙТ
<222> (20)..(20)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (21)..(27)
<223> IL-6 44-50 циклизированный
<400> 131
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Cys Asn Lys Ser Asn Met Cys
20 25
<210> 132
<211> 60
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF5 Th (UBITh1)
<220>
<221> САЙТ
<222> (20)..(20)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (21)..(60)
<223> IL-6 44-83 циклизированный
<400> 132
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Cys Asn Lys Ser Asn Met Cys Glu Ser Ser Lys Glu
20 25 30
Ala Leu Ala Glu Asn Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp
35 40 45
Gly Cys Phe Gln Ser Gly Phe Asn Glu Glu Thr Cys
50 55 60
<210> 133
<211> 60
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF5 Th (UBITh1)
<220>
<221> САЙТ
<222> (20)..(20)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (21)..(60)
<223> IL-6 44-83
<400> 133
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Cys Asn Lys Ser Asn Met Cys Glu Ser Ser Lys Glu
20 25 30
Ala Leu Ala Glu Asn Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp
35 40 45
Gly Cys Phe Gln Ser Gly Phe Asn Glu Glu Thr Cys
50 55 60
<210> 134
<211> 39
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF5 Th (UBITh1)
<220>
<221> САЙТ
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> ПЕПТИД
<222> (24)..(39)
<223> IL-6 42-57 циклизированный
<400> 134
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Glu Thr Cys Asn Lys Ser Asn Met Cys
20 25 30
Glu Ser Ser Lys Glu Ala Leu
35
<210> 135
<211> 39
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(16)
<223> IL-6 42-57 циклизированный
<220>
<221> ПЕПТИД
<222> (17)..(20)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (21)..(39)
<223> MvF5 Th (UBITh1)
<400> 135
Glu Thr Cys Asn Lys Ser Asn Met Cys Glu Ser Ser Lys Glu Ala Leu
1 5 10 15
Lys Lys Lys Lys Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His
20 25 30
Arg Ile Glu Thr Ile Leu Phe
35
<210> 136
<211> 36
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF5 Th (UBITh1)
<220>
<221> САЙТ
<222> (20)..(20)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (21)..(36)
<223> IL-6 42-57 циклизированный
<400> 136
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Glu Thr Cys Asn Lys Ser Asn Met Cys Glu Ser Ser
20 25 30
Lys Glu Ala Leu
35
<210> 137
<211> 36
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(16)
<223> IL-6 42-57 циклизированный
<220>
<221> САЙТ
<222> (17)..(17)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (18)..(36)
<223> MvF5 Th (UBITh1)
<400> 137
Glu Thr Cys Asn Lys Ser Asn Met Cys Glu Ser Ser Lys Glu Ala Leu
1 5 10 15
Lys Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu
20 25 30
Thr Ile Leu Phe
35
<210> 138
<211> 38
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF5 Th (UBITh1)
<220>
<221> САЙТ
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> ПЕПТИД
<222> (24)..(38)
<223> IL-6 61-75
<400> 138
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Asn Leu Asn Leu Pro Lys Met Ala Glu
20 25 30
Lys Asp Gly Ser Phe Gln
35
<210> 139
<211> 38
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(15)
<223> IL-6 61-75
<220>
<221> ПЕПТИД
<222> (16)..(19)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (19)..(19)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(38)
<223> MvF5 Th (UBITh1)
<400> 139
Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly Ser Phe Gln Lys
1 5 10 15
Lys Lys Lys Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg
20 25 30
Ile Glu Thr Ile Leu Phe
35
<210> 140
<211> 35
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF5 Th (UBITh1)
<220>
<221> САЙТ
<222> (20)..(20)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (21)..(35)
<223> IL-6 61-75
<400> 140
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly
20 25 30
Ser Phe Gln
35
<210> 141
<211> 35
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(15)
<223> IL-6 61-75
<220>
<221> САЙТ
<222> (16)..(16)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (17)..(35)
<223> MvF5 Th (UBITh1)
<400> 141
Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly Ser Phe Gln Lys
1 5 10 15
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
20 25 30
Ile Leu Phe
35
<210> 142
<211> 35
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF5 Th (UBITh1)
<220>
<221> САЙТ
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> ПЕПТИД
<222> (24)..(35)
<223> IL-6 61-72
<400> 142
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Asn Leu Asn Leu Pro Lys Met Ala Glu
20 25 30
Lys Asp Gly
35
<210> 143
<211> 35
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(12)
<223> IL-6 61-72
<220>
<221> ПЕПТИД
<222> (13)..(16)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (16)..(16)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (17)..(35)
<223> MvF5 Th (UBITh1)
<400> 143
Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly Lys Lys Lys Lys
1 5 10 15
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
20 25 30
Ile Leu Phe
35
<210> 144
<211> 32
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF5 Th (UBITh1)
<220>
<221> САЙТ
<222> (20)..(20)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (21)..(32)
<223> IL-6 61-72
<400> 144
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly
20 25 30
<210> 145
<211> 32
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(12)
<223> IL-6 61-72
<220>
<221> САЙТ
<222> (13)..(13)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (14)..(32)
<223> MvF5 Th (UBITh1)
<400> 145
Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly Lys Ile Ser Ile
1 5 10 15
Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr Ile Leu Phe
20 25 30
<210> 146
<211> 34
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 4 Th (UBITh3)
<220>
<221> САЙТ
<222> (4)..(4)
<223> S или T
<220>
<221> САЙТ
<222> (7)..(7)
<223> K или R
<220>
<221> САЙТ
<222> (8)..(8)
<223> G или T
<220>
<221> САЙТ
<222> (12)..(12)
<223> H или T
<220>
<221> САЙТ
<222> (13)..(13)
<223> K или R
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (24)..(34)
<223> мышиный аналог IL-6 72-82 циклизированный
<400> 146
Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Cys Tyr Gln Thr Gly Tyr Asn Gln Glu
20 25 30
Ile Cys
<210> 147
<211> 54
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF4 Th (UBITh3)
<220>
<221> САЙТ
<222> (4)..(4)
<223> S или T
<220>
<221> САЙТ
<222> (7)..(7)
<223> K или R
<220>
<221> САЙТ
<222> (8)..(8)
<223> G или T
<220>
<221> САЙТ
<222> (12)..(12)
<223> H или T
<220>
<221> САЙТ
<222> (13)..(13)
<223> K или R
<220>
<221> САЙТ
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> ПЕПТИД
<222> (24)..(54)
<223> мышиный аналог IL-6 154-184
<400> 147
Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Gln Lys Glu Trp Leu Arg Thr Lys Thr
20 25 30
Ile Gln Phe Ile Leu Lys Ser Leu Glu Glu Phe Leu Lys Val Thr Leu
35 40 45
Arg Ser Thr Arg Gln Thr
50
<210> 148
<211> 34
<212> БЕЛОК
<213> Rattus norvegicus
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 4 Th (UBITh3)
<220>
<221> САЙТ
<222> (4)..(4)
<223> S или T
<220>
<221> САЙТ
<222> (7)..(7)
<223> K или R
<220>
<221> САЙТ
<222> (8)..(8)
<223> G или T
<220>
<221> САЙТ
<222> (12)..(12)
<223> H или T
<220>
<221> САЙТ
<222> (13)..(13)
<223> K или R
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (24)..(34)
<223> крысиный аналог IL-6 72-82 циклизированный
<400> 148
Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Cys Phe Gln Thr Gly Tyr Asn Gln Glu
20 25 30
Ile Cys
<210> 149
<211> 57
<212> БЕЛОК
<213> Rattus norvegicus
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 4 Th (UBITh3)
<220>
<221> САЙТ
<222> (4)..(4)
<223> S или T
<220>
<221> САЙТ
<222> (7)..(7)
<223> K или R
<220>
<221> САЙТ
<222> (8)..(8)
<223> G или T
<220>
<221> САЙТ
<222> (12)..(12)
<223> H или T
<220>
<221> САЙТ
<222> (13)..(13)
<223> K или R
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (24)..(34)
<223> крысиный аналог IL-6 72-82 циклизированный
<220>
<221> ПЕПТИД
<222> (35)..(38)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (38)..(38)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (39)..(57)
<223> MvF 4 Th (UBITh3)
<220>
<221> САЙТ
<222> (42)..(42)
<223> S или T
<220>
<221> САЙТ
<222> (45)..(45)
<223> K или R
<220>
<221> САЙТ
<222> (46)..(46)
<223> G или T
<220>
<221> САЙТ
<222> (50)..(50)
<223> H или T
<220>
<221> САЙТ
<222> (51)..(51)
<223> K или R
<400> 149
Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Cys Phe Gln Thr Gly Tyr Asn Gln Glu
20 25 30
Ile Cys Lys Lys Lys Lys Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile
35 40 45
Val Xaa Xaa Ile Glu Thr Ile Leu Phe
50 55
<210> 150
<211> 34
<212> БЕЛОК
<213> Rattus norvegicus
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF5 Th (UBITh1)
<220>
<221> САЙТ
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> ПЕПТИД
<222> (24)..(34)
<223> крысиный аналог IL-6 72-82 циклизированный
<400> 150
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Cys Phe Gln Thr Gly Tyr Asn Gln Glu
20 25 30
Ile Cys
<210> 151
<211> 57
<212> БЕЛОК
<213> Rattus norvegicus
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF5 Th (UBITh1)
<220>
<221> САЙТ
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> ПЕПТИД
<222> (24)..(34)
<223> крысиный аналог IL-6 72-82 циклизированный
<220>
<221> ПЕПТИД
<222> (35)..(38)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (38)..(38)
<223> эпсилон K
<220>
<221> ПЕПТИД
<222> (39)..(57)
<223> MvF5 Th (UBITh1)
<400> 151
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Cys Phe Gln Thr Gly Tyr Asn Gln Glu
20 25 30
Ile Cys Lys Lys Lys Lys Ile Ser Ile Thr Glu Ile Lys Gly Val Ile
35 40 45
Val His Arg Ile Glu Thr Ile Leu Phe
50 55
<210> 152
<211> 36
<212> БЕЛОК
<213> Rattus norvegicus
<220>
<221> ПЕПТИД
<222> (1)..(13)
<223> крысиный аналог IL-6 150-162 циклизированный
<220>
<221> ПЕПТИД
<222> (14)..(17)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (17)..(17)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (18)..(36)
<223> MvF5 Th (UBITh1)
<400> 152
Cys Leu Glu Ser Gln Lys Glu Trp Leu Arg Thr Lys Cys Lys Lys Lys
1 5 10 15
Lys Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu
20 25 30
Thr Ile Leu Phe
35
<210> 153
<211> 59
<212> БЕЛОК
<213> Rattus norvegicus
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF5 Th (UBITh1)
<220>
<221> САЙТ
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> ПЕПТИД
<222> (24)..(36)
<223> крысиный аналог IL-6 150-162 циклизированный
<220>
<221> ПЕПТИД
<222> (37)..(40)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (40)..(40)
<223> эпсилон K
<220>
<221> ПЕПТИД
<222> (41)..(59)
<223> MvF5 Th (UBITh1)
<400> 153
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Cys Leu Glu Ser Gln Lys Glu Trp Leu
20 25 30
Arg Thr Lys Cys Lys Lys Lys Lys Ile Ser Ile Thr Glu Ile Lys Gly
35 40 45
Val Ile Val His Arg Ile Glu Thr Ile Leu Phe
50 55
<210> 154
<211> 46
<212> БЕЛОК
<213> Rattus norvegicus
<220>
<221> ПЕПТИД
<222> (1)..(23)
<223> крысиный аналог IL-6 144-166 циклизированный
<220>
<221> ПЕПТИД
<222> (24)..(27)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (27)..(27)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (28)..(46)
<223> MvF5 Th (UBITh1)
<400> 154
Cys Ala Leu Leu Met Glu Lys Leu Glu Ser Gln Lys Glu Trp Leu Arg
1 5 10 15
Thr Lys Thr Ile Gln Leu Cys Lys Lys Lys Lys Ile Ser Ile Thr Glu
20 25 30
Ile Lys Gly Val Ile Val His Arg Ile Glu Thr Ile Leu Phe
35 40 45
<210> 155
<211> 36
<212> БЕЛОК
<213> Rattus norvegicus
<220>
<221> ПЕПТИД
<222> (1)..(13)
<223> крысиный аналог IL-6 150-162 циклизированный
<220>
<221> ПЕПТИД
<222> (14)..(17)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (17)..(17)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (18)..(36)
<223> MvF4 Th (UBITh3)
<220>
<221> САЙТ
<222> (21)..(21)
<223> S или T
<220>
<221> САЙТ
<222> (24)..(24)
<223> K или R
<220>
<221> САЙТ
<222> (25)..(25)
<223> G или T
<220>
<221> САЙТ
<222> (29)..(29)
<223> H или T
<220>
<221> САЙТ
<222> (30)..(30)
<223> K или R
<400> 155
Cys Leu Glu Ser Gln Lys Glu Trp Leu Arg Thr Lys Cys Lys Lys Lys
1 5 10 15
Lys Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu
20 25 30
Thr Ile Leu Phe
35
<210> 156
<211> 59
<212> БЕЛОК
<213> Rattus norvegicus
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 4 Th (UBITh3)
<220>
<221> САЙТ
<222> (4)..(4)
<223> S или T
<220>
<221> САЙТ
<222> (7)..(7)
<223> K или R
<220>
<221> САЙТ
<222> (8)..(8)
<223> G или T
<220>
<221> САЙТ
<222> (12)..(12)
<223> H или T
<220>
<221> САЙТ
<222> (13)..(13)
<223> K или R
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (24)..(36)
<223> крысиный аналог IL-6 150-162 циклизированный
<220>
<221> ПЕПТИД
<222> (37)..(40)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (40)..(40)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (41)..(59)
<223> MvF 4 Th (UBITh3)
<220>
<221> САЙТ
<222> (44)..(44)
<223> S или T
<220>
<221> САЙТ
<222> (47)..(47)
<223> K или R
<220>
<221> САЙТ
<222> (48)..(48)
<223> G или T
<220>
<221> САЙТ
<222> (52)..(52)
<223> H или T
<220>
<221> САЙТ
<222> (53)..(53)
<223> K или R
<400> 156
Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Cys Leu Glu Ser Gln Lys Glu Trp Leu
20 25 30
Arg Thr Lys Cys Lys Lys Lys Lys Ile Ser Ile Xaa Glu Ile Xaa Xaa
35 40 45
Val Ile Val Xaa Xaa Ile Glu Thr Ile Leu Phe
50 55
<210> 157
<211> 46
<212> БЕЛОК
<213> Rattus norvegicus
<220>
<221> ПЕПТИД
<222> (1)..(23)
<223> крысиный аналог IL-6 144-166 циклизированный
<220>
<221> ПЕПТИД
<222> (24)..(27)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (27)..(27)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (28)..(46)
<223> MvF4 Th (UBITh3)
<220>
<221> САЙТ
<222> (31)..(31)
<223> S или T
<220>
<221> САЙТ
<222> (34)..(34)
<223> K или R
<220>
<221> САЙТ
<222> (34)..(35)
<223> G или T
<220>
<221> САЙТ
<222> (39)..(39)
<223> H или T
<220>
<221> САЙТ
<222> (40)..(40)
<223> K или R
<400> 157
Cys Ala Leu Leu Met Glu Lys Leu Glu Ser Gln Lys Glu Trp Leu Arg
1 5 10 15
Thr Lys Thr Ile Gln Leu Cys Lys Lys Lys Lys Ile Ser Ile Xaa Glu
20 25 30
Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr Ile Leu Phe
35 40 45
<210> 158
<211> 34
<212> БЕЛОК
<213> Macaca fascicularis
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF 4 Th (UBITh3)
<220>
<221> САЙТ
<222> (4)..(4)
<223> S или T
<220>
<221> САЙТ
<222> (7)..(7)
<223> K или R
<220>
<221> САЙТ
<222> (8)..(8)
<223> G или T
<220>
<221> САЙТ
<222> (12)..(12)
<223> H или T
<220>
<221> САЙТ
<222> (13)..(13)
<223> K или R
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (24)..(34)
<223> макаковый аналог IL-6 73-83 циклизированный
<400> 158
Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Cys Phe Gln Ser Gly Phe Asn Glu Asp
20 25 30
Thr Cys
<210> 159
<211> 34
<212> БЕЛОК
<213> Macaca fascicularis
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> MvF5 Th (UBITh1)
<220>
<221> САЙТ
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> ПЕПТИД
<222> (24)..(34)
<223> макаковый аналог IL-6 73-83 циклизированный
<400> 159
Ile Ser Ile Thr Glu Ile Lys Gly Val Ile Val His Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe Lys Lys Lys Lys Cys Phe Gln Ser Gly Phe Asn Glu Asp
20 25 30
Thr Cys
<210> 160
<211> 33
<212> БЕЛОК
<213> Macaca fascicularis
<220>
<221> ПЕПТИД
<222> (1)..(18)
<223> HBsAg3 Th (UBITh2)
<220>
<221> САЙТ
<222> (19)..(19)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (19)..(22)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> ПЕПТИД
<222> (23)..(33)
<223> макаковый аналог IL-6 73-83 циклизированный
<400> 160
Lys Lys Lys Ile Ile Thr Ile Thr Arg Ile Ile Thr Ile Ile Thr Thr
1 5 10 15
Ile Asp Lys Lys Lys Lys Cys Phe Gln Ser Gly Phe Asn Glu Asp Thr
20 25 30
Cys
<210> 161
<211> 32
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(17)
<223> Clostridium tetani1 Th
<220>
<221> ПЕПТИД
<222> (18)..(21)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (21)..(21)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (22)..(32)
<223> IL-6 73-83
<400> 161
Lys Lys Gln Tyr Ile Lys Ala Asn Ser Lys Phe Ile Gly Ile Thr Glu
1 5 10 15
Leu Lys Lys Lys Lys Cys Phe Gln Ser Gly Phe Asn Glu Glu Thr Cys
20 25 30
<210> 162
<211> 30
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(15)
<223> MvF1 Th
<220>
<221> ПЕПТИД
<222> (16)..(19)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (19)..(19)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(30)
<223> IL-6 73-83
<400> 162
Leu Ser Glu Ile Lys Gly Val Ile Val His Arg Leu Glu Gly Val Lys
1 5 10 15
Lys Lys Lys Cys Phe Gln Ser Gly Phe Asn Glu Glu Thr Cys
20 25 30
<210> 163
<211> 39
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(24)
<223> Bordetella pertussis Th
<220>
<221> ПЕПТИД
<222> (25)..(28)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (28)..(28)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (29)..(39)
<223> IL-6 73-83
<400> 163
Gly Ala Tyr Ala Arg Cys Pro Asn Gly Thr Arg Ala Leu Thr Val Ala
1 5 10 15
Glu Leu Arg Gly Asn Ala Glu Leu Lys Lys Lys Lys Cys Phe Gln Ser
20 25 30
Gly Phe Asn Glu Glu Thr Cys
35
<210> 164
<211> 32
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(17)
<223> Clostridium tetani2 Th
<220>
<221> ПЕПТИД
<222> (18)..(21)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (21)..(21)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (22)..(32)
<223> IL-6 73-83
<400> 164
Trp Val Arg Asp Ile Ile Asp Asp Phe Thr Asn Glu Ser Ser Gln Lys
1 5 10 15
Thr Lys Lys Lys Lys Cys Phe Gln Ser Gly Phe Asn Glu Glu Thr Cys
20 25 30
<210> 165
<211> 38
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(23)
<223> Diphtheria Th
<220>
<221> ПЕПТИД
<222> (24)..(27)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (27)..(27)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (28)..(38)
<223> IL-6 73-83
<400> 165
Asp Ser Glu Thr Ala Asp Asn Leu Glu Lys Thr Val Ala Ala Leu Ser
1 5 10 15
Ile Leu Pro Gly His Gly Cys Lys Lys Lys Lys Cys Phe Gln Ser Gly
20 25 30
Phe Asn Glu Glu Thr Cys
35
<210> 166
<211> 36
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(21)
<223> Plasmodium falciparum Th
<220>
<221> ПЕПТИД
<222> (22)..(25)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (25)..(25)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (26)..(36)
<223> IL-6 73-83
<400> 166
Asp His Glu Lys Lys His Ala Lys Met Glu Lys Ala Ser Ser Val Phe
1 5 10 15
Asn Val Val Asn Ser Lys Lys Lys Lys Cys Phe Gln Ser Gly Phe Asn
20 25 30
Glu Glu Thr Cys
35
<210> 167
<211> 32
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(17)
<223> Schistosoma mansoni Th
<220>
<221> ПЕПТИД
<222> (18)..(21)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (21)..(21)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (22)..(32)
<223> IL-6 73-83
<400> 167
Lys Trp Phe Lys Thr Asn Ala Pro Asn Gly Val Asp Glu Lys His Arg
1 5 10 15
His Lys Lys Lys Lys Cys Phe Gln Ser Gly Phe Asn Glu Glu Thr Cys
20 25 30
<210> 168
<211> 40
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(25)
<223> холерный токсин Th
<220>
<221> ПЕПТИД
<222> (26)..(29)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (29)..(29)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (30)..(40)
<223> IL-6 73-83
<400> 168
Ala Leu Asn Ile Trp Asp Arg Phe Asp Val Phe Cys Thr Leu Gly Ala
1 5 10 15
Thr Thr Gly Tyr Leu Lys Gly Asn Ser Lys Lys Lys Lys Cys Phe Gln
20 25 30
Ser Gly Phe Asn Glu Glu Thr Cys
35 40
<210> 169
<211> 30
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(15)
<223> MvF2 Th
<220>
<221> ПЕПТИД
<222> (16)..(19)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (19)..(19)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(30)
<223> IL-6 73-83
<400> 169
Ile Ser Glu Ile Lys Gly Val Ile Val His Lys Ile Glu Gly Ile Lys
1 5 10 15
Lys Lys Lys Cys Phe Gln Ser Gly Phe Asn Glu Glu Thr Cys
20 25 30
<210> 170
<211> 37
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(22)
<223> KKKMvF3 Th
<220>
<221> САЙТ
<222> (7)..(7)
<223> S или T
<220>
<221> САЙТ
<222> (10)..(10)
<223> K или R
<220>
<221> САЙТ
<222> (11)..(11)
<223> G или T
<220>
<221> САЙТ
<222> (15)..(15)
<223> H или T
<220>
<221> САЙТ
<222> (16)..(16)
<223> K или R
<220>
<221> САЙТ
<222> (19)..(19)
<223> G или T
<220>
<221> ПЕПТИД
<222> (23)..(26)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (26)..(26)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (27)..(37)
<223> IL-6 73-83
<400> 170
Lys Lys Lys Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa
1 5 10 15
Ile Glu Xaa Ile Leu Phe Lys Lys Lys Lys Cys Phe Gln Ser Gly Phe
20 25 30
Asn Glu Glu Thr Cys
35
<210> 171
<211> 33
<212> БЕЛОК
<213> вирус гепатита B
<220>
<221> ПЕПТИД
<222> (1)..(18)
<223> HBsAg 1 Th
<220>
<221> САЙТ
<222> (1)..(1)
<223> K или R
<220>
<221> САЙТ
<222> (2)..(2)
<223> K или R
<220>
<221> САЙТ
<222> (3)..(3)
<223> K или R
<220>
<221> САЙТ
<222> (4)..(4)
<223> L или I или V или F
<220>
<221> САЙТ
<222> (5)..(5)
<223> F или K или R
<220>
<221> САЙТ
<222> (6)..(6)
<223> L или I или V или F
<220>
<221> САЙТ
<222> (7)..(7)
<223> L или I или V или F
<220>
<221> САЙТ
<222> (9)..(9)
<223> K или R
<220>
<221> САЙТ
<222> (10)..(10)
<223> L или I или V или F
<220>
<221> САЙТ
<222> (11)..(11)
<223> L или I или V или F
<220>
<221> САЙТ
<222> (13)..(13)
<223> L или I или V или F
<220>
<221> САЙТ
<222> (15)..(15)
<223> Q или L или I или V или F
<220>
<221> САЙТ
<222> (17)..(17)
<223> L или I или V или F
<220>
<221> САЙТ
<222> (18)..(18)
<223> D или R
<220>
<221> ПЕПТИД
<222> (19)..(22)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (22)..(22)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (23)..(33)
<223> IL-6 73-83
<400> 171
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Thr Xaa Xaa Xaa Thr Xaa Pro Xaa Ser
1 5 10 15
Xaa Xaa Lys Lys Lys Lys Cys Phe Gln Ser Gly Phe Asn Glu Glu Thr
20 25 30
Cys
<210> 172
<211> 33
<212> БЕЛОК
<213> вирус гепатита B
<220>
<221> ПЕПТИД
<222> (1)..(18)
<223> HBsAg 2 Th
<220>
<221> САЙТ
<222> (4)..(4)
<223> I или F
<220>
<221> САЙТ
<222> (5)..(5)
<223> I или F
<220>
<221> САЙТ
<222> (6)..(6)
<223> T или L
<220>
<221> САЙТ
<222> (7)..(7)
<223> I или L
<220>
<221> САЙТ
<222> (11)..(11)
<223> I или L
<220>
<221> САЙТ
<222> (14)..(14)
<223> P или I
<220>
<221> САЙТ
<222> (15)..(15)
<223> Q или T
<220>
<221> САЙТ
<222> (16)..(16)
<223> S или T
<220>
<221> САЙТ
<222> (17)..(17)
<223> L или I
<220>
<221> ПЕПТИД
<222> (19)..(22)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (22)..(22)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (23)..(33)
<223> IL-6 73-83
<400> 172
Lys Lys Lys Xaa Xaa Xaa Xaa Thr Arg Ile Xaa Thr Ile Xaa Xaa Xaa
1 5 10 15
Xaa Asp Lys Lys Lys Lys Cys Phe Gln Ser Gly Phe Asn Glu Glu Thr
20 25 30
Cys
<210> 173
<211> 26
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(11)
<223> Грипп MP1_1 Th
<220>
<221> ПЕПТИД
<222> (12)..(15)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (15)..(15)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (16)..(26)
<223> IL-6 73-83
<400> 173
Phe Val Phe Thr Leu Thr Val Pro Ser Glu Arg Lys Lys Lys Lys Cys
1 5 10 15
Phe Gln Ser Gly Phe Asn Glu Glu Thr Cys
20 25
<210> 174
<211> 30
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(15)
<223> Грипп MP1_2 Th
<220>
<221> ПЕПТИД
<222> (16)..(19)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (19)..(19)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (30)..(30)
<223> IL-6 73-83
<400> 174
Ser Gly Pro Leu Lys Ala Glu Ile Ala Gln Arg Leu Glu Asp Val Lys
1 5 10 15
Lys Lys Lys Cys Phe Gln Ser Gly Phe Asn Glu Glu Thr Cys
20 25 30
<210> 175
<211> 24
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(9)
<223> Грипп NSP1 Th
<220>
<221> ПЕПТИД
<222> (10)..(13)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (13)..(13)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (14)..(24)
<223> IL-6 73-83
<400> 175
Asp Arg Leu Arg Arg Asp Gln Lys Ser Lys Lys Lys Lys Cys Phe Gln
1 5 10 15
Ser Gly Phe Asn Glu Glu Thr Cys
20
<210> 176
<211> 34
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(19)
<223> EBV BHRF1 Th
<220>
<221> ПЕПТИД
<222> (20)..(23)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (23)..(23)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (24)..(34)
<223> IL-6 73-83
<400> 176
Ala Gly Leu Thr Leu Ser Leu Leu Val Ile Cys Ser Tyr Leu Phe Ile
1 5 10 15
Ser Arg Gly Lys Lys Lys Lys Cys Phe Gln Ser Gly Phe Asn Glu Glu
20 25 30
Thr Cys
<210> 177
<211> 30
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(15)
<223> Clostridium tetani TT1 Th
<220>
<221> ПЕПТИД
<222> (16)..(19)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (19)..(19)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(30)
<223> IL-6 73-83
<400> 177
Gln Tyr Ile Lys Ala Asn Ser Lys Phe Ile Gly Ile Thr Glu Leu Lys
1 5 10 15
Lys Lys Lys Cys Phe Gln Ser Gly Phe Asn Glu Glu Thr Cys
20 25 30
<210> 178
<211> 35
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(20)
<223> EBV EBNA-1 Th
<220>
<221> ПЕПТИД
<222> (21)..(24)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (24)..(24)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (25)..(35)
<223> IL-6 73-83
<400> 178
Pro Gly Pro Leu Arg Glu Ser Ile Val Cys Tyr Phe Met Val Phe Leu
1 5 10 15
Gln Thr His Ile Lys Lys Lys Lys Cys Phe Gln Ser Gly Phe Asn Glu
20 25 30
Glu Thr Cys
35
<210> 179
<211> 36
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(21)
<223> Clostridium tetani TT2 Th
<220>
<221> ПЕПТИД
<222> (22)..(25)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (25)..(25)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (26)..(36)
<223> IL-6 73-83
<400> 179
Phe Asn Asn Phe Thr Val Ser Phe Trp Leu Arg Val Pro Lys Val Ser
1 5 10 15
Ala Ser His Leu Glu Lys Lys Lys Lys Cys Phe Gln Ser Gly Phe Asn
20 25 30
Glu Glu Thr Cys
35
<210> 180
<211> 31
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(16)
<223> Clostridium tetani TT3 Th
<220>
<221> ПЕПТИД
<222> (17)..(20)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (21)..(31)
<223> IL-6 73-83
<400> 180
Lys Phe Ile Ile Lys Arg Tyr Thr Pro Asn Asn Glu Ile Asp Ser Phe
1 5 10 15
Lys Lys Lys Lys Cys Phe Gln Ser Gly Phe Asn Glu Glu Thr Cys
20 25 30
<210> 181
<211> 31
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(16)
<223> Clostridium tetani TT4 Th
<220>
<221> ПЕПТИД
<222> (17)..(20)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (20)..(20)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (21)..(31)
<223> IL-6 73-83
<400> 181
Val Ser Ile Asp Lys Phe Arg Ile Phe Cys Lys Ala Leu Asn Pro Lys
1 5 10 15
Lys Lys Lys Lys Cys Phe Gln Ser Gly Phe Asn Glu Glu Thr Cys
20 25 30
<210> 182
<211> 33
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(18)
<223> EBV CP Th
<220>
<221> ПЕПТИД
<222> (19)..(22)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (22)..(22)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (23)..(33)
<223> IL-6 73-83
<400> 182
Val Pro Gly Leu Tyr Ser Pro Cys Arg Ala Phe Phe Asn Lys Glu Glu
1 5 10 15
Leu Leu Lys Lys Lys Lys Cys Phe Gln Ser Gly Phe Asn Glu Glu Thr
20 25 30
Cys
<210> 183
<211> 29
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(14)
<223> HCMV IE1 Th
<220>
<221> ПЕПТИД
<222> (15)..(18)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (18)..(18)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (19)..(29)
<223> IL-6 73-83
<400> 183
Asp Lys Arg Glu Met Trp Met Ala Cys Ile Lys Glu Leu His Lys Lys
1 5 10 15
Lys Lys Cys Phe Gln Ser Gly Phe Asn Glu Glu Thr Cys
20 25
<210> 184
<211> 30
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(15)
<223> EBV GP340 Th
<220>
<221> ПЕПТИД
<222> (16)..(19)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (19)..(19)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (20)..(30)
<223> IL-6 73-83
<400> 184
Thr Gly His Gly Ala Arg Thr Ser Thr Glu Pro Thr Thr Asp Tyr Lys
1 5 10 15
Lys Lys Lys Cys Phe Gln Ser Gly Phe Asn Glu Glu Thr Cys
20 25 30
<210> 185
<211> 28
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(13)
<223> EBV BPLF1 Th
<220>
<221> ПЕПТИД
<222> (14)..(17)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (17)..(17)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (18)..(28)
<223> IL-6 73-83
<400> 185
Lys Glu Leu Lys Arg Gln Tyr Glu Lys Lys Leu Arg Gln Lys Lys Lys
1 5 10 15
Lys Cys Phe Gln Ser Gly Phe Asn Glu Glu Thr Cys
20 25
<210> 186
<211> 26
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(11)
<223> EBV EBNA-2 Th
<220>
<221> ПЕПТИД
<222> (12)..(15)
<223> эпсилон K-KKK в качестве спейсера
<220>
<221> САЙТ
<222> (15)..(15)
<223> эпсилон-K
<220>
<221> ПЕПТИД
<222> (16)..(26)
<223> IL-6 73-83
<400> 186
Thr Val Phe Tyr Asn Ile Pro Pro Met Pro Leu Lys Lys Lys Lys Cys
1 5 10 15
Phe Gln Ser Gly Phe Asn Glu Glu Thr Cys
20 25
<210> 187
<211> 49
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(31)
<223> IL-6 42-72, циклизированный
<220>
<221> САЙТ
<222> (32)..(32)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (33)..(49)
<223> Clostridium tetani 1 Th
<400> 187
Glu Thr Cys Asn Lys Ser Asn Met Cys Glu Ser Ser Lys Glu Ala Leu
1 5 10 15
Ala Glu Asn Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly Lys
20 25 30
Lys Lys Gln Tyr Ile Lys Ala Asn Ser Lys Phe Ile Gly Ile Thr Glu
35 40 45
Leu
<210> 188
<211> 47
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(31)
<223> IL-6 42-72, циклизированный
<220>
<221> САЙТ
<222> (32)..(32)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (33)..(47)
<223> MvF1 Th
<400> 188
Glu Thr Cys Asn Lys Ser Asn Met Cys Glu Ser Ser Lys Glu Ala Leu
1 5 10 15
Ala Glu Asn Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly Lys
20 25 30
Leu Ser Glu Ile Lys Gly Val Ile Val His Arg Leu Glu Gly Val
35 40 45
<210> 189
<211> 56
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(31)
<223> IL-6 42-72, циклизированный
<220>
<221> САЙТ
<222> (32)..(32)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (33)..(56)
<223> Bordetella pertussis Th
<400> 189
Glu Thr Cys Asn Lys Ser Asn Met Cys Glu Ser Ser Lys Glu Ala Leu
1 5 10 15
Ala Glu Asn Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly Lys
20 25 30
Gly Ala Tyr Ala Arg Cys Pro Asn Gly Thr Arg Ala Leu Thr Val Ala
35 40 45
Glu Leu Arg Gly Asn Ala Glu Leu
50 55
<210> 190
<211> 49
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(31)
<223> IL-6 42-72, циклизированный
<220>
<221> САЙТ
<222> (32)..(32)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (33)..(49)
<223> Clostridium tetani 2 Th
<400> 190
Glu Thr Cys Asn Lys Ser Asn Met Cys Glu Ser Ser Lys Glu Ala Leu
1 5 10 15
Ala Glu Asn Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly Lys
20 25 30
Trp Val Arg Asp Ile Ile Asp Asp Phe Thr Asn Glu Ser Ser Gln Lys
35 40 45
Thr
<210> 191
<211> 55
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(31)
<223> IL-6 42-72, циклизированный
<220>
<221> САЙТ
<222> (32)..(32)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (33)..(55)
<223> Diphtheria Th
<400> 191
Glu Thr Cys Asn Lys Ser Asn Met Cys Glu Ser Ser Lys Glu Ala Leu
1 5 10 15
Ala Glu Asn Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly Lys
20 25 30
Asp Ser Glu Thr Ala Asp Asn Leu Glu Lys Thr Val Ala Ala Leu Ser
35 40 45
Ile Leu Pro Gly His Gly Cys
50 55
<210> 192
<211> 53
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(31)
<223> IL-6 42-72, циклизированный
<220>
<221> САЙТ
<222> (32)..(32)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (33)..(53)
<223> Plasmodium falciparum Th
<400> 192
Glu Thr Cys Asn Lys Ser Asn Met Cys Glu Ser Ser Lys Glu Ala Leu
1 5 10 15
Ala Glu Asn Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly Lys
20 25 30
Asp His Glu Lys Lys His Ala Lys Met Glu Lys Ala Ser Ser Val Phe
35 40 45
Asn Val Val Asn Ser
50
<210> 193
<211> 49
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(31)
<223> IL-6 42-72, циклизированный
<220>
<221> САЙТ
<222> (32)..(32)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (33)..(49)
<223> Schistosoma mansoni Th
<400> 193
Glu Thr Cys Asn Lys Ser Asn Met Cys Glu Ser Ser Lys Glu Ala Leu
1 5 10 15
Ala Glu Asn Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly Lys
20 25 30
Lys Trp Phe Lys Thr Asn Ala Pro Asn Gly Val Asp Glu Lys His Arg
35 40 45
His
<210> 194
<211> 25
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(25)
<223> холерный токсин Th
<400> 194
Ala Leu Asn Ile Trp Asp Arg Phe Asp Val Phe Cys Thr Leu Gly Ala
1 5 10 15
Thr Thr Gly Tyr Leu Lys Gly Asn Ser
20 25
<210> 195
<211> 47
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(31)
<223> IL-6 42-72, циклизированный
<220>
<221> САЙТ
<222> (32)..(32)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (33)..(47)
<223> MvF 2 Th
<400> 195
Glu Thr Cys Asn Lys Ser Asn Met Cys Glu Ser Ser Lys Glu Ala Leu
1 5 10 15
Ala Glu Asn Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly Lys
20 25 30
Ile Ser Glu Ile Lys Gly Val Ile Val His Lys Ile Glu Gly Ile
35 40 45
<210> 196
<211> 54
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(31)
<223> IL-6 42-72, циклизированный
<220>
<221> САЙТ
<222> (32)..(32)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (33)..(54)
<223> KKKMvF 3 Th
<220>
<221> САЙТ
<222> (39)..(39)
<223> S или T
<220>
<221> САЙТ
<222> (42)..(42)
<223> K или R
<220>
<221> САЙТ
<222> (43)..(43)
<223> G или T
<220>
<221> САЙТ
<222> (47)..(47)
<223> H или T
<220>
<221> САЙТ
<222> (48)..(48)
<223> K или R
<220>
<221> САЙТ
<222> (51)..(51)
<223> G или T
<400> 196
Glu Thr Cys Asn Lys Ser Asn Met Cys Glu Ser Ser Lys Glu Ala Leu
1 5 10 15
Ala Glu Asn Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly Lys
20 25 30
Lys Lys Lys Ile Ser Ile Xaa Glu Ile Xaa Xaa Val Ile Val Xaa Xaa
35 40 45
Ile Glu Xaa Ile Leu Phe
50
<210> 197
<211> 50
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(31)
<223> IL-6 42-72, циклизированный
<220>
<221> САЙТ
<222> (32)..(32)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (33)..(50)
<223> HBsAg 1 Th
<220>
<221> САЙТ
<222> (33)..(33)
<223> K или R
<220>
<221> САЙТ
<222> (34)..(34)
<223> K или R
<220>
<221> САЙТ
<222> (35)..(35)
<223> K или R
<220>
<221> САЙТ
<222> (36)..(36)
<223> L или I или V или F
<220>
<221> САЙТ
<222> (37)..(37)
<223> F или K или R
<220>
<221> САЙТ
<222> (38)..(38)
<223> L или I или V или F
<220>
<221> САЙТ
<222> (39)..(39)
<223> L или I или V или F
<220>
<221> САЙТ
<222> (41)..(41)
<223> K или R
<220>
<221> САЙТ
<222> (42)..(42)
<223> L или I или V или F
<220>
<221> САЙТ
<222> (43)..(43)
<223> L или I или V или F
<220>
<221> САЙТ
<222> (45)..(45)
<223> L или I или V или F
<220>
<221> САЙТ
<222> (47)..(47)
<223> Q или L или I или V или F
<220>
<221> САЙТ
<222> (49)..(49)
<223> L или I или V или F
<220>
<221> САЙТ
<222> (50)..(50)
<223> D или R
<400> 197
Glu Thr Cys Asn Lys Ser Asn Met Cys Glu Ser Ser Lys Glu Ala Leu
1 5 10 15
Ala Glu Asn Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly Lys
20 25 30
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Thr Xaa Xaa Xaa Thr Xaa Pro Xaa Ser
35 40 45
Xaa Xaa
50
<210> 198
<211> 50
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(31)
<223> IL-6 42-72, циклизированный
<220>
<221> САЙТ
<222> (32)..(32)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (33)..(50)
<223> HBsAg 2 Th
<220>
<221> САЙТ
<222> (36)..(36)
<223> I или F
<220>
<221> САЙТ
<222> (37)..(37)
<223> I или F
<220>
<221> САЙТ
<222> (38)..(38)
<223> T или L
<220>
<221> САЙТ
<222> (39)..(39)
<223> I или L
<220>
<221> САЙТ
<222> (43)..(43)
<223> I или L
<220>
<221> САЙТ
<222> (46)..(46)
<223> P или I
<220>
<221> САЙТ
<222> (47)..(47)
<223> Q или T
<220>
<221> САЙТ
<222> (48)..(48)
<223> S или T
<220>
<221> САЙТ
<222> (49)..(49)
<223> L или I
<400> 198
Glu Thr Cys Asn Lys Ser Asn Met Cys Glu Ser Ser Lys Glu Ala Leu
1 5 10 15
Ala Glu Asn Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly Lys
20 25 30
Lys Lys Lys Xaa Xaa Xaa Xaa Thr Arg Ile Xaa Thr Ile Xaa Xaa Xaa
35 40 45
Xaa Asp
50
<210> 199
<211> 50
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(18)
<223> HBsAg 3 Th (UBITh2)
<220>
<221> ПЕПТИД
<222> (1)..(31)
<223> IL-6 42-72, циклизированный
<220>
<221> САЙТ
<222> (32)..(32)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (33)..(50)
<223> HBsAg 3 Th (UBITh2)
<400> 199
Glu Thr Cys Asn Lys Ser Asn Met Cys Glu Ser Ser Lys Glu Ala Leu
1 5 10 15
Ala Glu Asn Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly Lys
20 25 30
Lys Lys Lys Ile Ile Thr Ile Thr Arg Ile Ile Thr Ile Ile Thr Thr
35 40 45
Ile Asp
50
<210> 200
<211> 43
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(11)
<223> Грипп MP1_1 Th
<220>
<221> ПЕПТИД
<222> (1)..(11)
<223> Грипп MP1_1 Th
<220>
<221> ПЕПТИД
<222> (1)..(31)
<223> IL-6 42-72, циклизированный
<220>
<221> САЙТ
<222> (32)..(32)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (33)..(43)
<223> Грипп MP1_1 Th
<400> 200
Glu Thr Cys Asn Lys Ser Asn Met Cys Glu Ser Ser Lys Glu Ala Leu
1 5 10 15
Ala Glu Asn Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly Lys
20 25 30
Phe Val Phe Thr Leu Thr Val Pro Ser Glu Arg
35 40
<210> 201
<211> 47
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(31)
<223> IL-6 42-72, циклизированный
<220>
<221> САЙТ
<222> (32)..(32)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (33)..(47)
<223> Грипп MP1_2 Th
<400> 201
Glu Thr Cys Asn Lys Ser Asn Met Cys Glu Ser Ser Lys Glu Ala Leu
1 5 10 15
Ala Glu Asn Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly Lys
20 25 30
Ser Gly Pro Leu Lys Ala Glu Ile Ala Gln Arg Leu Glu Asp Val
35 40 45
<210> 202
<211> 41
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(31)
<223> IL-6 42-72, циклизированный
<220>
<221> САЙТ
<222> (32)..(32)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (33)..(41)
<223> Грипп NSP1 Th
<400> 202
Glu Thr Cys Asn Lys Ser Asn Met Cys Glu Ser Ser Lys Glu Ala Leu
1 5 10 15
Ala Glu Asn Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly Lys
20 25 30
Asp Arg Leu Arg Arg Asp Gln Lys Ser
35 40
<210> 203
<211> 51
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(31)
<223> IL-6 42-72, циклизированный
<220>
<221> САЙТ
<222> (32)..(32)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (33)..(51)
<223> EBV BHRF1 Th
<400> 203
Glu Thr Cys Asn Lys Ser Asn Met Cys Glu Ser Ser Lys Glu Ala Leu
1 5 10 15
Ala Glu Asn Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly Lys
20 25 30
Ala Gly Leu Thr Leu Ser Leu Leu Val Ile Cys Ser Tyr Leu Phe Ile
35 40 45
Ser Arg Gly
50
<210> 204
<211> 47
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(31)
<223> IL-6 42-72, циклизированный
<220>
<221> САЙТ
<222> (32)..(32)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (33)..(47)
<223> Clostridium tetani TT1 Th
<400> 204
Glu Thr Cys Asn Lys Ser Asn Met Cys Glu Ser Ser Lys Glu Ala Leu
1 5 10 15
Ala Glu Asn Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly Lys
20 25 30
Gln Tyr Ile Lys Ala Asn Ser Lys Phe Ile Gly Ile Thr Glu Leu
35 40 45
<210> 205
<211> 52
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(31)
<223> IL-6 42-72, циклизированный
<220>
<221> САЙТ
<222> (32)..(32)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (33)..(52)
<223> EBV EBNA-1 Th
<400> 205
Glu Thr Cys Asn Lys Ser Asn Met Cys Glu Ser Ser Lys Glu Ala Leu
1 5 10 15
Ala Glu Asn Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly Lys
20 25 30
Pro Gly Pro Leu Arg Glu Ser Ile Val Cys Tyr Phe Met Val Phe Leu
35 40 45
Gln Thr His Ile
50
<210> 206
<211> 53
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(31)
<223> IL-6 42-72, циклизированный
<220>
<221> САЙТ
<222> (32)..(32)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (33)..(53)
<223> Clostridium tetani TT2 Th
<400> 206
Glu Thr Cys Asn Lys Ser Asn Met Cys Glu Ser Ser Lys Glu Ala Leu
1 5 10 15
Ala Glu Asn Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly Lys
20 25 30
Phe Asn Asn Phe Thr Val Ser Phe Trp Leu Arg Val Pro Lys Val Ser
35 40 45
Ala Ser His Leu Glu
50
<210> 207
<211> 48
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(31)
<223> IL-6 42-72, циклизированный
<220>
<221> САЙТ
<222> (32)..(32)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (33)..(48)
<223> Clostridium tetani TT3 Th
<400> 207
Glu Thr Cys Asn Lys Ser Asn Met Cys Glu Ser Ser Lys Glu Ala Leu
1 5 10 15
Ala Glu Asn Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly Lys
20 25 30
Lys Phe Ile Ile Lys Arg Tyr Thr Pro Asn Asn Glu Ile Asp Ser Phe
35 40 45
<210> 208
<211> 48
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(31)
<223> IL-6 42-72, циклизированный
<220>
<221> САЙТ
<222> (32)..(32)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (33)..(48)
<223> Clostridium tetani TT4 Th
<400> 208
Glu Thr Cys Asn Lys Ser Asn Met Cys Glu Ser Ser Lys Glu Ala Leu
1 5 10 15
Ala Glu Asn Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly Lys
20 25 30
Val Ser Ile Asp Lys Phe Arg Ile Phe Cys Lys Ala Leu Asn Pro Lys
35 40 45
<210> 209
<211> 50
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(31)
<223> IL-6 42-72, циклизированный
<220>
<221> САЙТ
<222> (32)..(32)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (33)..(50)
<223> EBV CP Th
<400> 209
Glu Thr Cys Asn Lys Ser Asn Met Cys Glu Ser Ser Lys Glu Ala Leu
1 5 10 15
Ala Glu Asn Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly Lys
20 25 30
Val Pro Gly Leu Tyr Ser Pro Cys Arg Ala Phe Phe Asn Lys Glu Glu
35 40 45
Leu Leu
50
<210> 210
<211> 46
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(31)
<223> IL-6 42-72, циклизированный
<220>
<221> САЙТ
<222> (32)..(32)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (33)..(46)
<223> HCMV IE1 Th
<400> 210
Glu Thr Cys Asn Lys Ser Asn Met Cys Glu Ser Ser Lys Glu Ala Leu
1 5 10 15
Ala Glu Asn Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly Lys
20 25 30
Asp Lys Arg Glu Met Trp Met Ala Cys Ile Lys Glu Leu His
35 40 45
<210> 211
<211> 47
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(31)
<223> IL-6 42-72, циклизированный
<220>
<221> САЙТ
<222> (32)..(32)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (33)..(47)
<223> EBV GP340 Th
<400> 211
Glu Thr Cys Asn Lys Ser Asn Met Cys Glu Ser Ser Lys Glu Ala Leu
1 5 10 15
Ala Glu Asn Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly Lys
20 25 30
Thr Gly His Gly Ala Arg Thr Ser Thr Glu Pro Thr Thr Asp Tyr
35 40 45
<210> 212
<211> 45
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(31)
<223> IL-6 42-72, циклизированный
<220>
<221> САЙТ
<222> (32)..(32)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (33)..(45)
<223> EBV BPLF1 Th
<400> 212
Glu Thr Cys Asn Lys Ser Asn Met Cys Glu Ser Ser Lys Glu Ala Leu
1 5 10 15
Ala Glu Asn Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly Lys
20 25 30
Lys Glu Leu Lys Arg Gln Tyr Glu Lys Lys Leu Arg Gln
35 40 45
<210> 213
<211> 43
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(31)
<223> IL-6 42-72, циклизированный
<220>
<221> САЙТ
<222> (32)..(32)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (33)..(43)
<223> EBV EBNA-2 Th
<400> 213
Glu Thr Cys Asn Lys Ser Asn Met Cys Glu Ser Ser Lys Glu Ala Leu
1 5 10 15
Ala Glu Asn Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly Lys
20 25 30
Thr Val Phe Tyr Asn Ile Pro Pro Met Pro Leu
35 40
<210> 214
<211> 47
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(31)
<223> IL-6 42-72, циклизированный
<220>
<221> САЙТ
<222> (32)..(32)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (33)..(47)
<223> HBsAg4 Th (UBITh4)
<400> 214
Glu Thr Cys Asn Lys Ser Asn Met Cys Glu Ser Ser Lys Glu Ala Leu
1 5 10 15
Ala Glu Asn Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly Lys
20 25 30
Phe Phe Leu Leu Thr Arg Ile Leu Thr Ile Pro Gln Ser Leu Asp
35 40 45
<210> 215
<211> 48
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Синтетический пептид
<220>
<221> ПЕПТИД
<222> (1)..(31)
<223> IL-6 42-72, циклизированный
<220>
<221> САЙТ
<222> (32)..(32)
<223> эпсилон-K в качестве спейсера
<220>
<221> ПЕПТИД
<222> (33)..(48)
<223> Yersinia Invasin (Inv) Th
<400> 215
Glu Thr Cys Asn Lys Ser Asn Met Cys Glu Ser Ser Lys Glu Ala Leu
1 5 10 15
Ala Glu Asn Asn Leu Asn Leu Pro Lys Met Ala Glu Lys Asp Gly Lys
20 25 30
Thr Ala Lys Ser Lys Lys Phe Pro Ser Tyr Thr Ala Thr Tyr Gln Phe
35 40 45
<210> 216
<211> 22
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> KKKMvF3 Th (отдельный)
<400> 216
Lys Lys Lys Ile Ser Ile Ser Glu Ile Lys Gly Val Ile Val His Lys
1 5 10 15
Ile Glu Gly Ile Leu Phe
20
<210> 217
<211> 22
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> KKKMvF3 Th (отдельный)
<400> 217
Lys Lys Lys Ile Ser Ile Thr Glu Ile Arg Thr Val Ile Val Thr Arg
1 5 10 15
Ile Glu Thr Ile Leu Phe
20
<210> 218
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> HBsAg1 Th (отдельный)
<400> 218
Lys Lys Lys Leu Phe Leu Leu Thr Lys Leu Leu Thr Leu Pro Gln Ser
1 5 10 15
Leu Asp
<210> 219
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> HBsAg1 Th (отдельный)
<400> 219
Arg Arg Arg Ile Lys Ile Ile Thr Arg Ile Ile Thr Ile Pro Leu Ser
1 5 10 15
Ile Arg
<210> 220
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> HBsAg1 Th (отдельный)
<400> 220
Lys Lys Lys Val Arg Val Val Thr Lys Val Val Thr Val Pro Ile Ser
1 5 10 15
Val Asp
<210> 221
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> HBsAg1 Th (отдельный)
<400> 221
Lys Lys Lys Phe Phe Phe Phe Thr Lys Phe Phe Thr Phe Pro Val Ser
1 5 10 15
Phe Asp
<210> 222
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> HBsAg1 Th (отдельный)
<400> 222
Lys Lys Lys Leu Phe Leu Leu Thr Lys Leu Leu Thr Leu Pro Phe Ser
1 5 10 15
Leu Asp
<210> 223
<211> 19
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> MvF4 Th (отдельный)
<400> 223
Ile Ser Ile Ser Glu Ile Lys Gly Val Ile Val His Lys Ile Glu Thr
1 5 10 15
Ile Leu Phe
<210> 224
<211> 19
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> MvF4 Th (отдельный)
<400> 224
Ile Ser Ile Thr Glu Ile Arg Thr Val Ile Val Thr Arg Ile Glu Thr
1 5 10 15
Ile Leu Phe
<210> 225
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> HBsAg2 Th (отдельный)
<400> 225
Lys Lys Lys Ile Ile Thr Ile Thr Arg Ile Ile Thr Ile Pro Gln Ser
1 5 10 15
Leu Asp
<210> 226
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> HBsAg2 Th (отдельный)
<400> 226
Lys Lys Lys Phe Phe Leu Leu Thr Arg Ile Leu Thr Ile Ile Thr Thr
1 5 10 15
Ile Asp
<210> 227
<211> 212
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(212)
<223> Белок IL-6
<400> 227
Met Asn Ser Phe Ser Thr Ser Ala Phe Gly Pro Val Ala Phe Ser Leu
1 5 10 15
Gly Leu Leu Leu Val Leu Pro Ala Ala Phe Pro Ala Pro Val Pro Pro
20 25 30
Gly Glu Asp Ser Lys Asp Val Ala Ala Pro His Arg Gln Pro Leu Thr
35 40 45
Ser Ser Glu Arg Ile Asp Lys Gln Ile Arg Tyr Ile Leu Asp Gly Ile
50 55 60
Ser Ala Leu Arg Lys Glu Thr Cys Asn Lys Ser Asn Met Cys Glu Ser
65 70 75 80
Ser Lys Glu Ala Leu Ala Glu Asn Asn Leu Asn Leu Pro Lys Met Ala
85 90 95
Glu Lys Asp Gly Cys Phe Gln Ser Gly Phe Asn Glu Glu Thr Cys Leu
100 105 110
Val Lys Ile Ile Thr Gly Leu Leu Glu Phe Glu Val Tyr Leu Glu Tyr
115 120 125
Leu Gln Asn Arg Phe Glu Ser Ser Glu Glu Gln Ala Arg Ala Val Gln
130 135 140
Met Ser Thr Lys Val Leu Ile Gln Phe Leu Gln Lys Lys Ala Lys Asn
145 150 155 160
Leu Asp Ala Ile Thr Thr Pro Asp Pro Thr Thr Asn Ala Ser Leu Leu
165 170 175
Thr Lys Leu Gln Ala Gln Asn Gln Trp Leu Gln Asp Met Thr Thr His
180 185 190
Leu Ile Leu Arg Ser Phe Lys Glu Phe Leu Gln Ser Ser Leu Arg Ala
195 200 205
Leu Arg Gln Met
210
<210> 228
<211> 212
<212> БЕЛОК
<213> Macaca fascicularis
<220>
<221> ПЕПТИД
<222> (1)..(212)
<223> Белок IL-6
<400> 228
Met Asn Ser Phe Ser Thr Ser Ala Phe Gly Pro Val Ala Phe Ser Leu
1 5 10 15
Gly Leu Leu Leu Val Leu Pro Ala Ala Phe Pro Ala Pro Val Leu Pro
20 25 30
Gly Glu Asp Ser Lys Asn Val Ala Ala Pro His Ser Gln Pro Leu Thr
35 40 45
Ser Ser Glu Arg Ile Asp Lys His Ile Arg Tyr Ile Leu Asp Gly Ile
50 55 60
Ser Ala Leu Arg Lys Glu Thr Cys Asn Arg Ser Asn Met Cys Glu Ser
65 70 75 80
Ser Lys Glu Ala Leu Ala Glu Asn Asn Leu Asn Leu Pro Lys Met Ala
85 90 95
Glu Lys Asp Gly Cys Phe Gln Ser Gly Phe Asn Glu Asp Thr Cys Leu
100 105 110
Val Lys Ile Ile Thr Gly Leu Leu Glu Phe Glu Val Tyr Leu Glu Tyr
115 120 125
Leu Gln Asn Arg Phe Glu Ser Ser Glu Glu Gln Ala Arg Ala Val Gln
130 135 140
Met Ser Thr Lys Val Leu Ile Gln Phe Leu Gln Lys Lys Ala Lys Asn
145 150 155 160
Leu Asp Ala Ile Thr Thr Pro Glu Pro Thr Thr Asn Ala Ser Leu Leu
165 170 175
Thr Lys Leu Gln Ala Gln Asn Gln Trp Leu Gln Asp Met Thr Thr His
180 185 190
Leu Ile Leu Arg Ser Phe Lys Glu Phe Leu Gln Ser Asn Leu Arg Ala
195 200 205
Leu Arg Gln Met
210
<210> 229
<211> 211
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕПТИД
<222> (1)..(211)
<223> Белок IL-6
<400> 229
Met Lys Phe Leu Ser Ala Arg Asp Phe His Pro Val Ala Phe Leu Gly
1 5 10 15
Leu Met Leu Val Thr Thr Thr Ala Phe Pro Thr Ser Gln Val Arg Arg
20 25 30
Gly Asp Phe Thr Glu Asp Thr Thr Pro Asn Arg Pro Val Tyr Thr Thr
35 40 45
Ser Gln Val Gly Gly Leu Ile Thr His Val Leu Trp Glu Ile Val Glu
50 55 60
Met Arg Lys Glu Leu Cys Asn Gly Asn Ser Asp Cys Met Asn Asn Asp
65 70 75 80
Asp Ala Leu Ala Glu Asn Asn Leu Lys Leu Pro Glu Ile Gln Arg Asn
85 90 95
Asp Gly Cys Tyr Gln Thr Gly Tyr Asn Gln Glu Ile Cys Leu Leu Lys
100 105 110
Ile Ser Ser Gly Leu Leu Glu Tyr His Ser Tyr Leu Glu Tyr Met Lys
115 120 125
Asn Asn Leu Lys Asp Asn Lys Lys Asp Lys Ala Arg Val Leu Gln Arg
130 135 140
Asp Thr Glu Thr Leu Ile His Ile Phe Asn Gln Glu Val Lys Asp Leu
145 150 155 160
His Lys Ile Val Leu Pro Thr Pro Ile Ser Asn Ala Leu Leu Thr Asp
165 170 175
Lys Leu Glu Ser Gln Lys Glu Trp Leu Arg Thr Lys Thr Ile Gln Phe
180 185 190
Ile Leu Lys Ser Leu Glu Glu Phe Leu Lys Val Thr Leu Arg Ser Thr
195 200 205
Arg Gln Thr
210
<210> 230
<211> 211
<212> БЕЛОК
<213> Rattus norvegicus
<220>
<221> ПЕПТИД
<222> (1)..(211)
<223> Белок IL-6
<400> 230
Met Lys Phe Leu Ser Ala Arg Asp Phe Gln Pro Val Ala Phe Leu Gly
1 5 10 15
Leu Met Leu Leu Thr Ala Thr Ala Phe Pro Thr Ser Gln Val Arg Arg
20 25 30
Gly Asp Phe Thr Glu Asp Thr Thr His Asn Arg Pro Val Tyr Thr Thr
35 40 45
Ser Gln Val Gly Gly Leu Ile Thr Tyr Val Leu Arg Glu Ile Leu Glu
50 55 60
Met Arg Lys Glu Leu Cys Asn Gly Asn Ser Asp Cys Met Asn Ser Asp
65 70 75 80
Asp Ala Leu Ser Glu Asn Asn Leu Lys Leu Pro Glu Ile Gln Arg Asn
85 90 95
Asp Gly Cys Phe Gln Thr Gly Tyr Asn Gln Glu Ile Cys Leu Leu Lys
100 105 110
Ile Cys Ser Gly Leu Leu Glu Phe Arg Phe Tyr Leu Glu Phe Val Lys
115 120 125
Asn Asn Leu Gln Asp Asn Lys Lys Asp Lys Ala Arg Val Ile Gln Ser
130 135 140
Asn Thr Glu Thr Leu Val His Ile Phe Lys Gln Glu Ile Lys Asp Ser
145 150 155 160
Tyr Lys Ile Val Leu Pro Thr Pro Thr Ser Asn Ala Leu Leu Met Glu
165 170 175
Lys Leu Glu Ser Gln Lys Glu Trp Leu Arg Thr Lys Thr Ile Gln Leu
180 185 190
Ile Leu Lys Ala Leu Glu Glu Phe Leu Lys Val Thr Met Arg Ser Thr
195 200 205
Arg Gln Thr
210
<210> 231
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> спейсер KKK-эпсилон-K
<220>
<221> ПЕПТИД
<222> (1)..(4)
<223> KKK-эпсилон-K в качестве спейсера
<220>
<221> САЙТ
<222> (4)..(4)
<223> эпсилон-K
<400> 231
Lys Lys Lys Lys
1
<210> 232
<211> 32
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотид ODN CpG1
<400> 232
tcgtcgtttt gtcgttttgt cgttttgtcg tt 32
<210> 233
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотид ODN CpG2
<220>
<221> misc_feature
<222> (1)..(1)
<223> фосфоротиоатная группа
<400> 233
tcgtcgtttt gtcgttttgt cgtt 24
<210> 234
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Олигонуклеотид ODN CpG3
<400> 234
tcgtcgtttt gtcgttttgt cgtt 24
<210> 235
<211> 60
<212> БЕЛОК
<213> Homo sapiens
<220>
<221> ПЕПТИД
<222> (1)..(60)
<223> IL-6 (32-91)
<400> 235
Ile Leu Asp Gly Ile Ser Ala Leu Arg Lys Glu Thr Cys Asn Lys Ser
1 5 10 15
Asn Met Cys Glu Ser Ser Lys Glu Ala Leu Ala Glu Asn Asn Leu Asn
20 25 30
Leu Pro Lys Met Ala Glu Lys Asp Gly Cys Phe Gln Ser Gly Phe Asn
35 40 45
Glu Glu Thr Cys Leu Val Lys Ile Ile Thr Gly Leu
50 55 60
<210> 236
<211> 31
<212> БЕЛОК
<213> Mus musculus
<220>
<221> ПЕПТИД
<222> (1)..(31)
<223> IL-6 (154-184)
<400> 236
Gln Lys Glu Trp Leu Arg Thr Lys Thr Ile Gln Phe Ile Leu Lys Ser
1 5 10 15
Leu Glu Glu Phe Leu Lys Val Thr Leu Arg Ser Thr Arg Gln Thr
20 25 30
<---


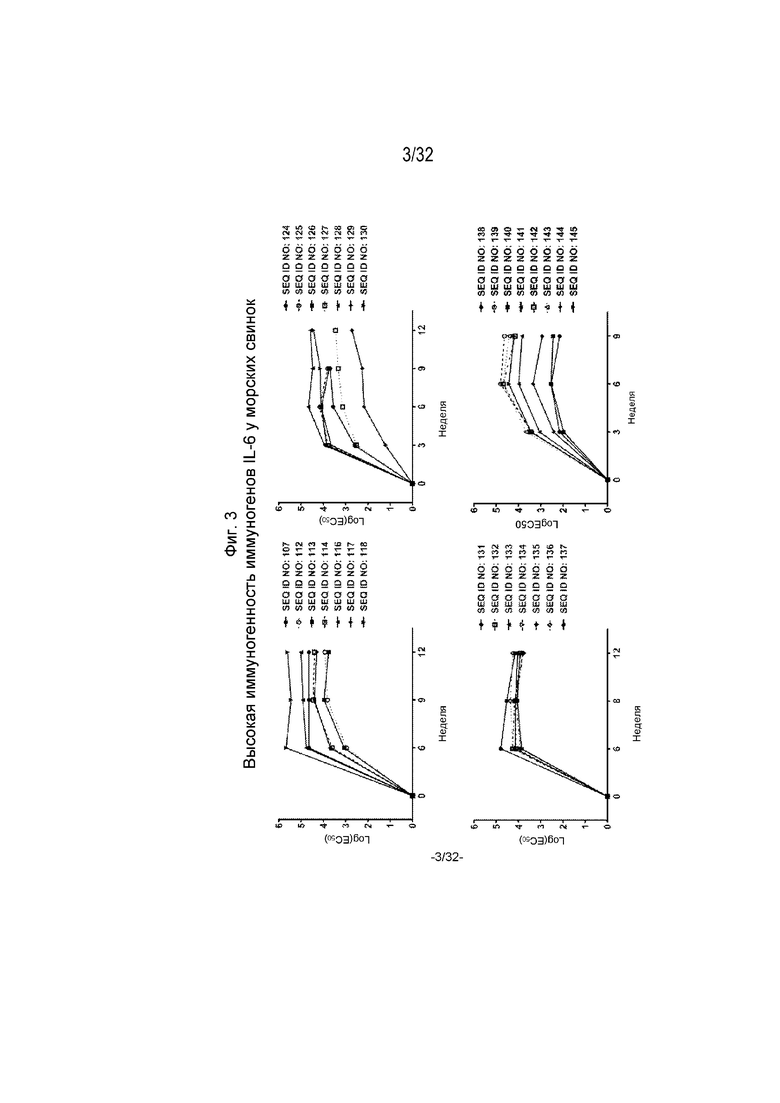

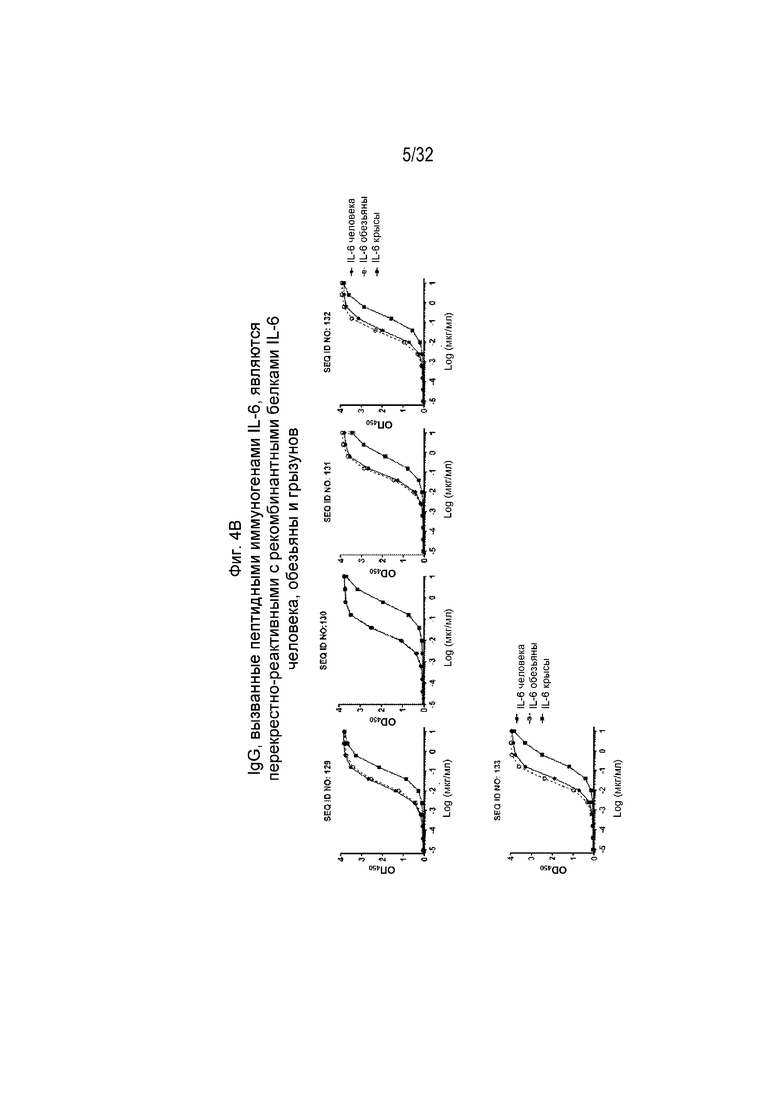

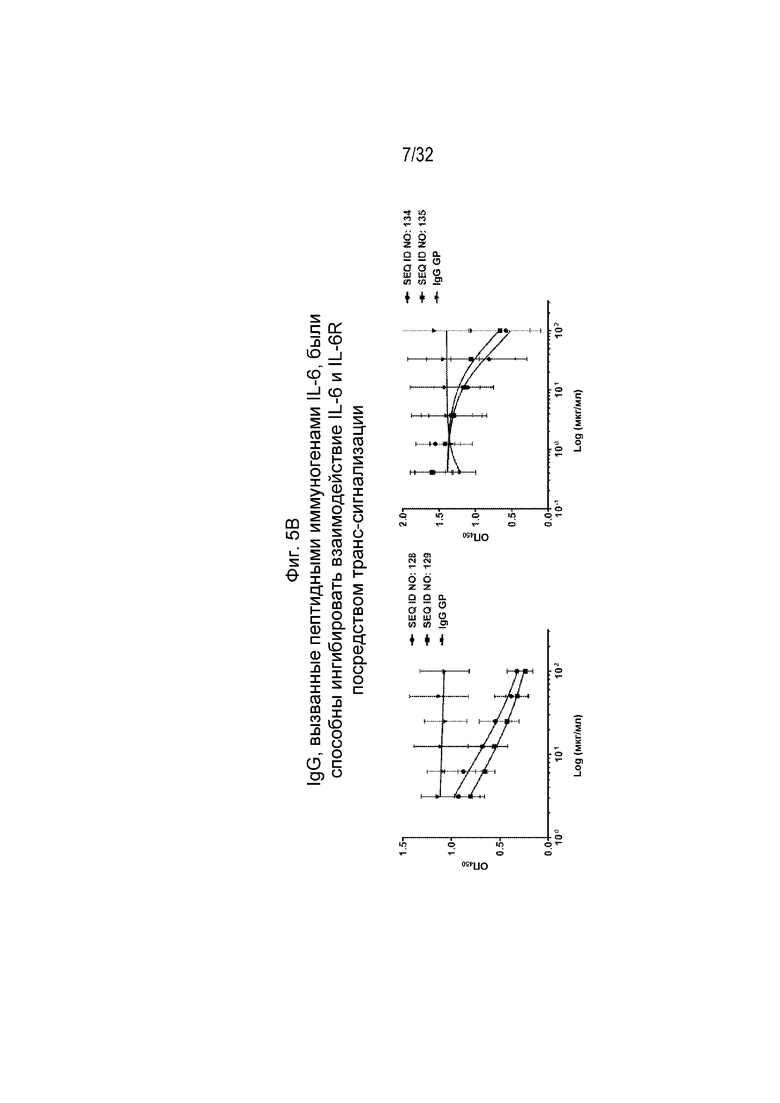
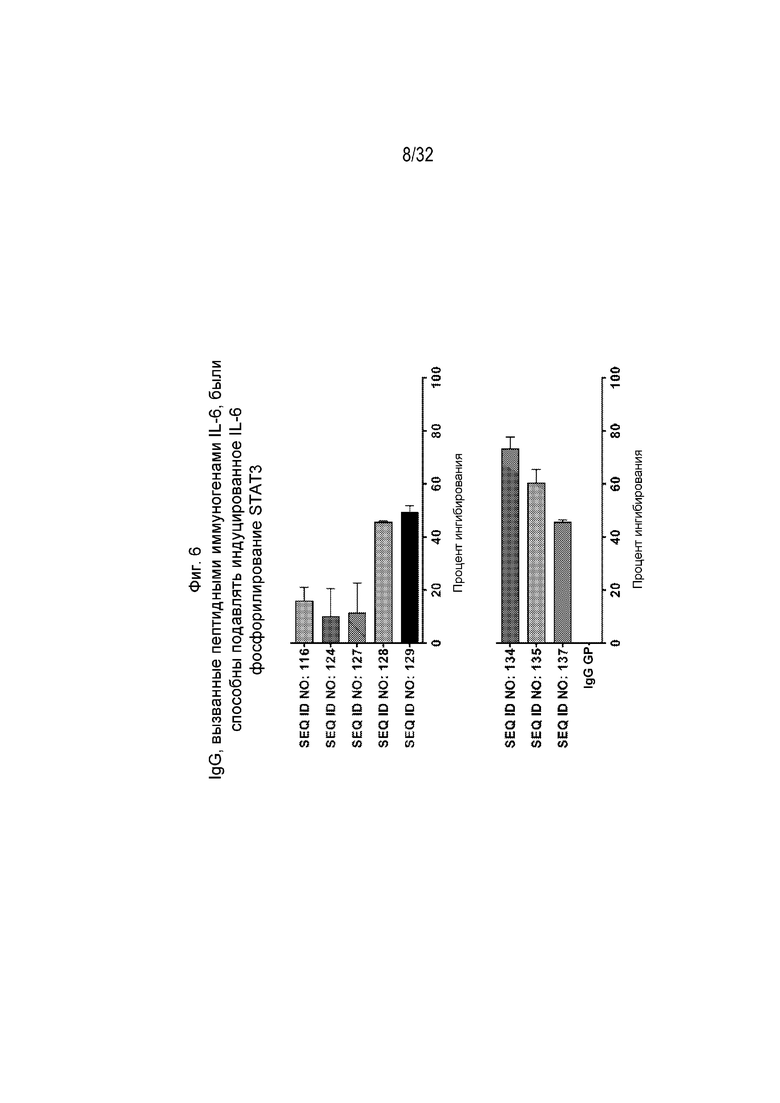
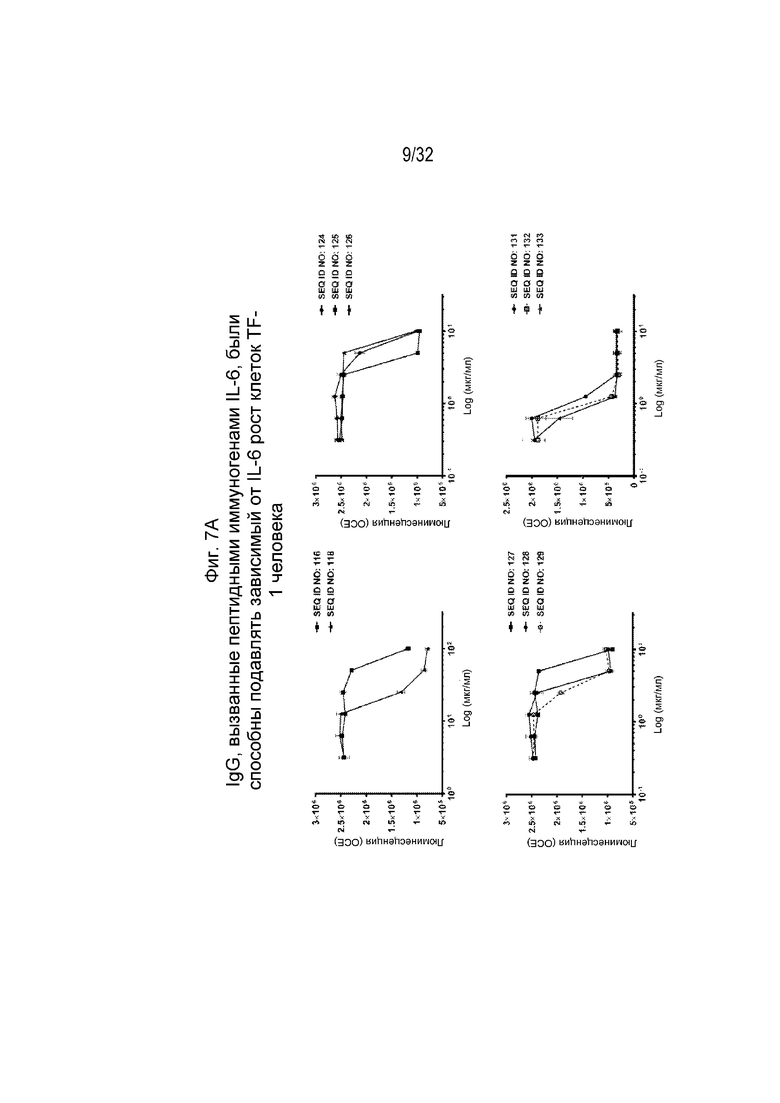
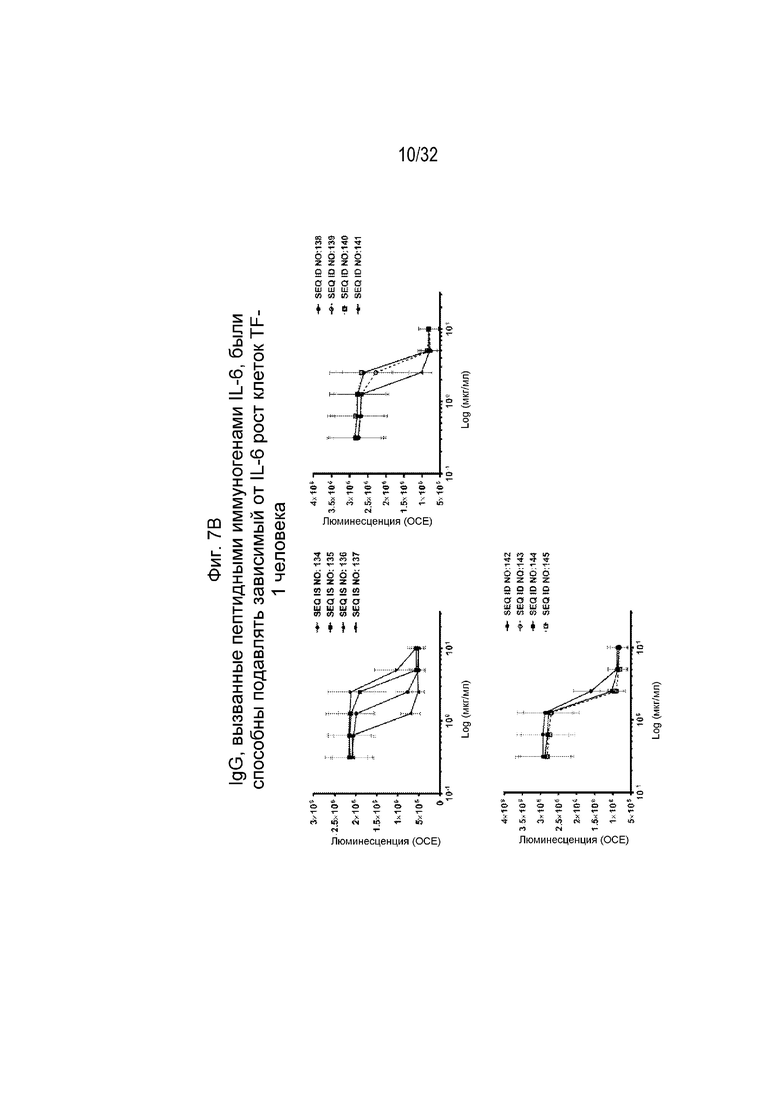
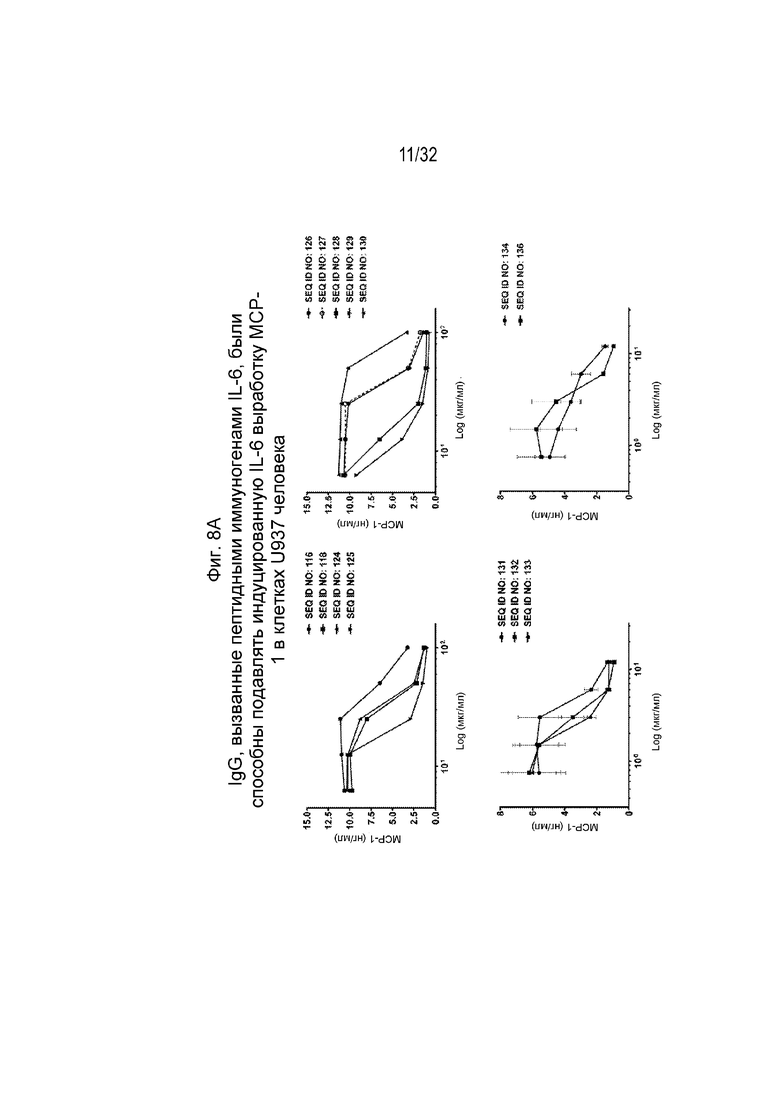
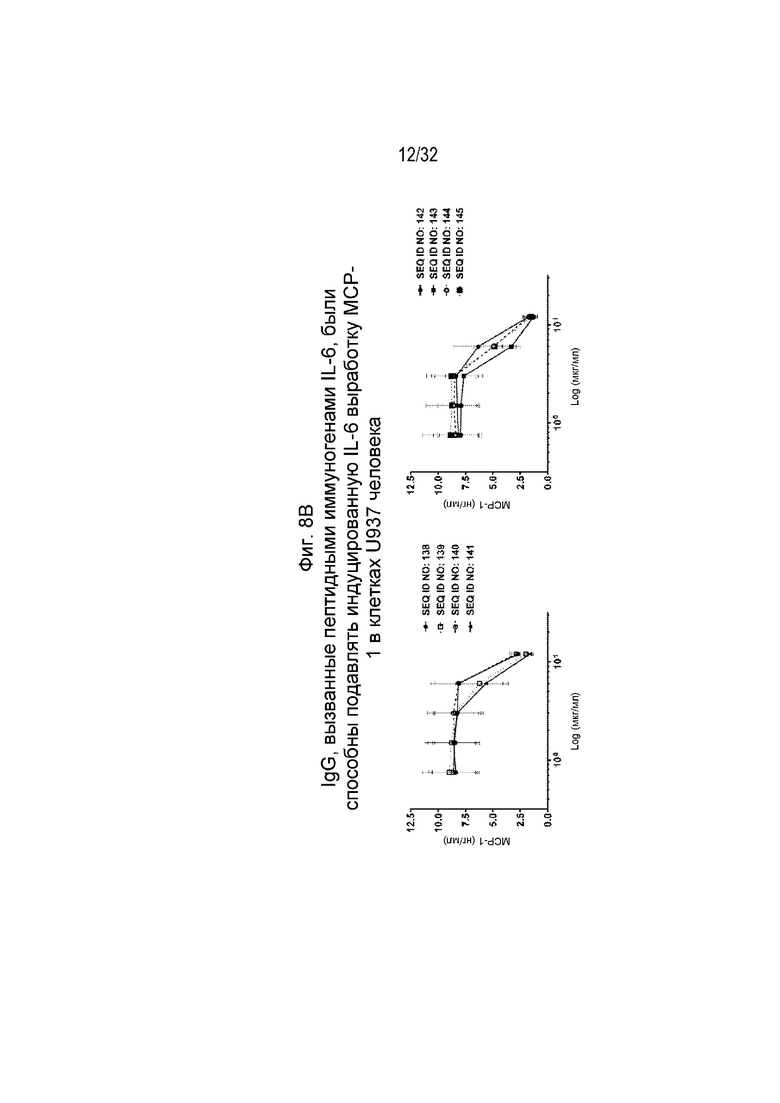

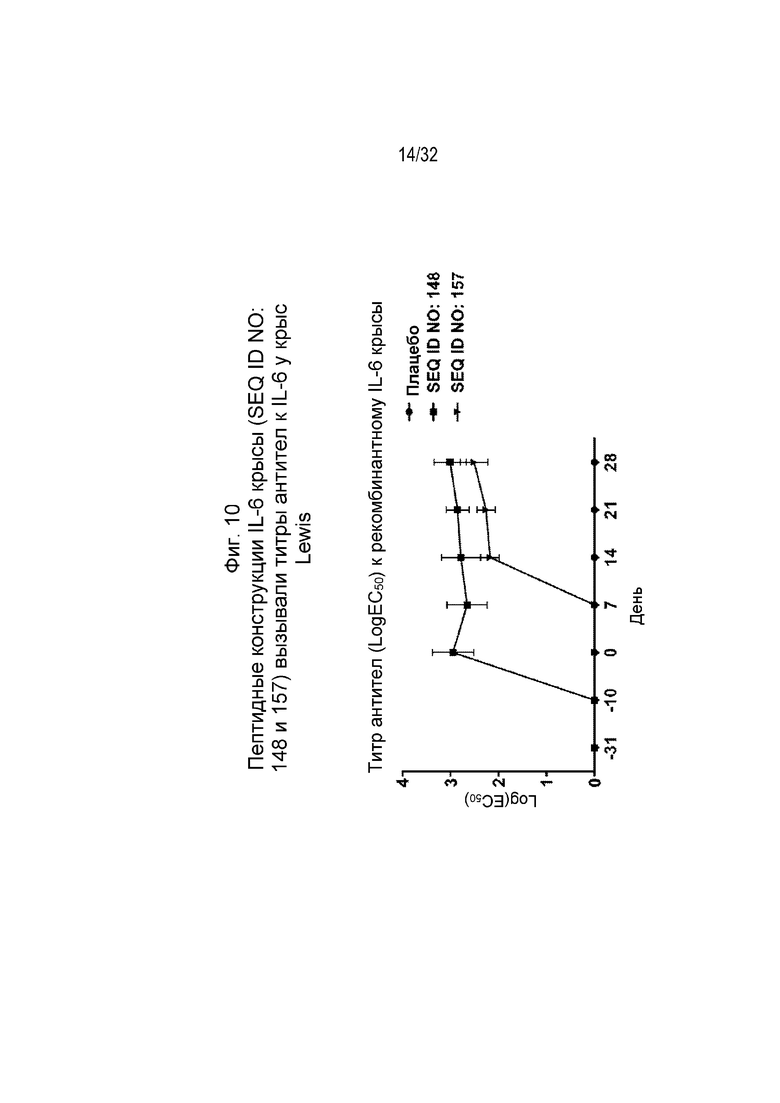
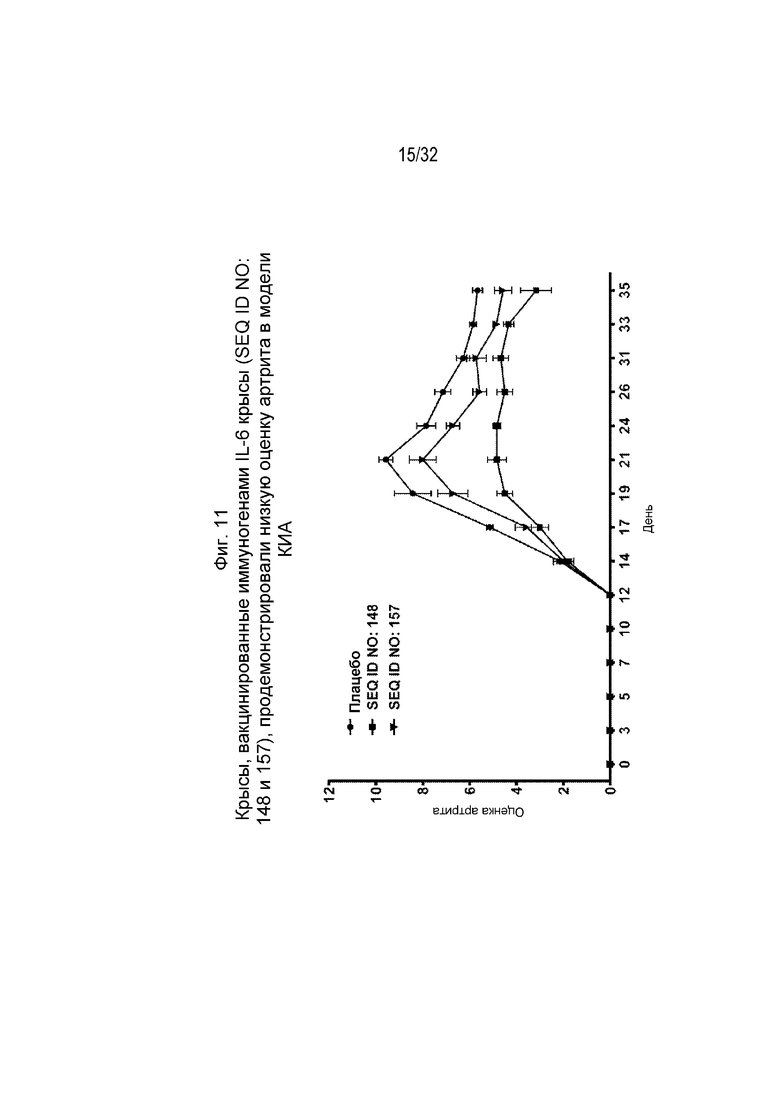
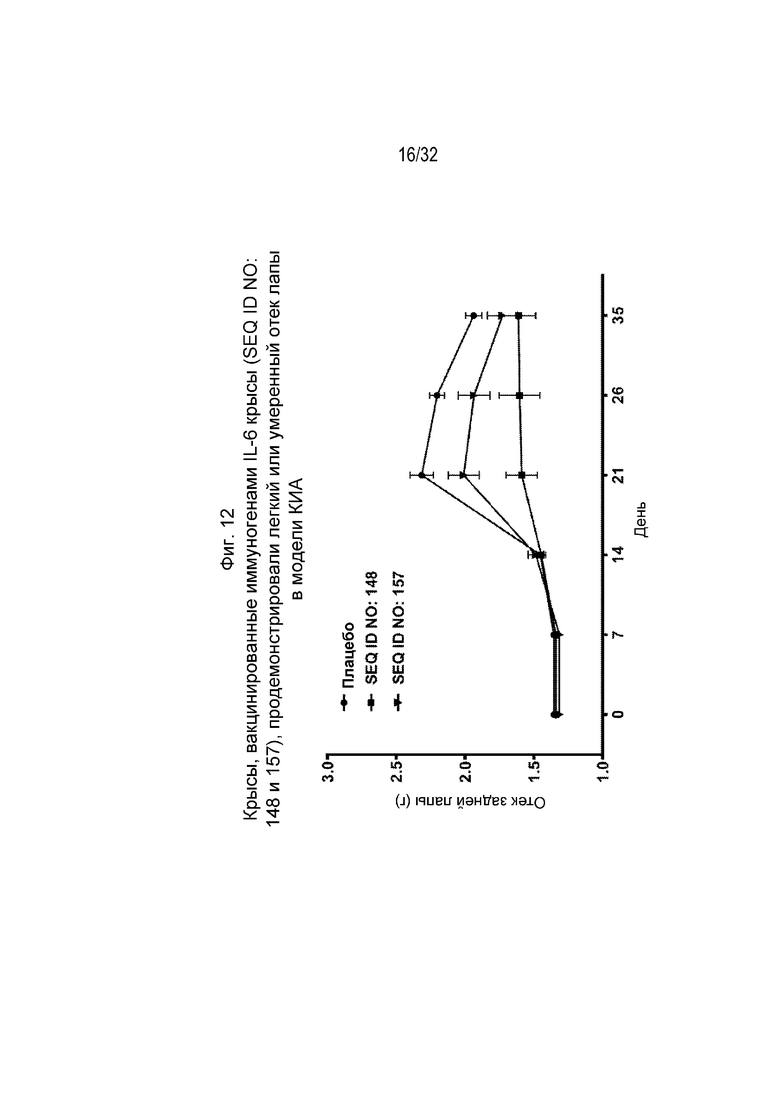
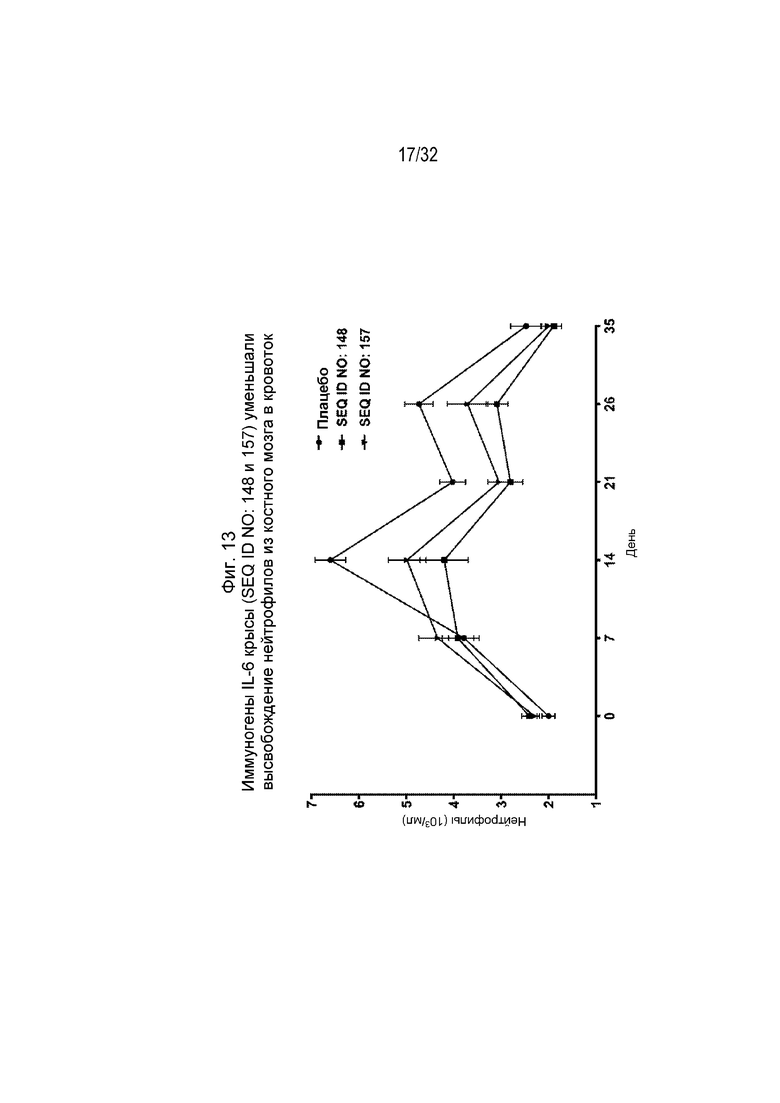

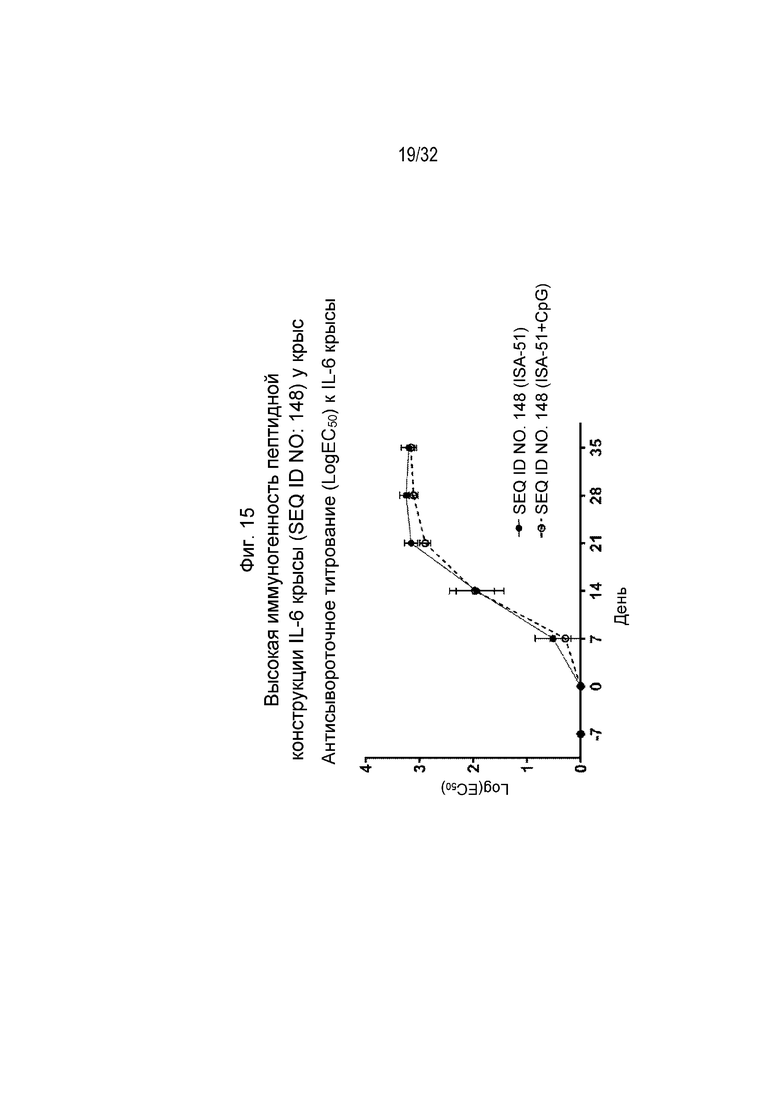
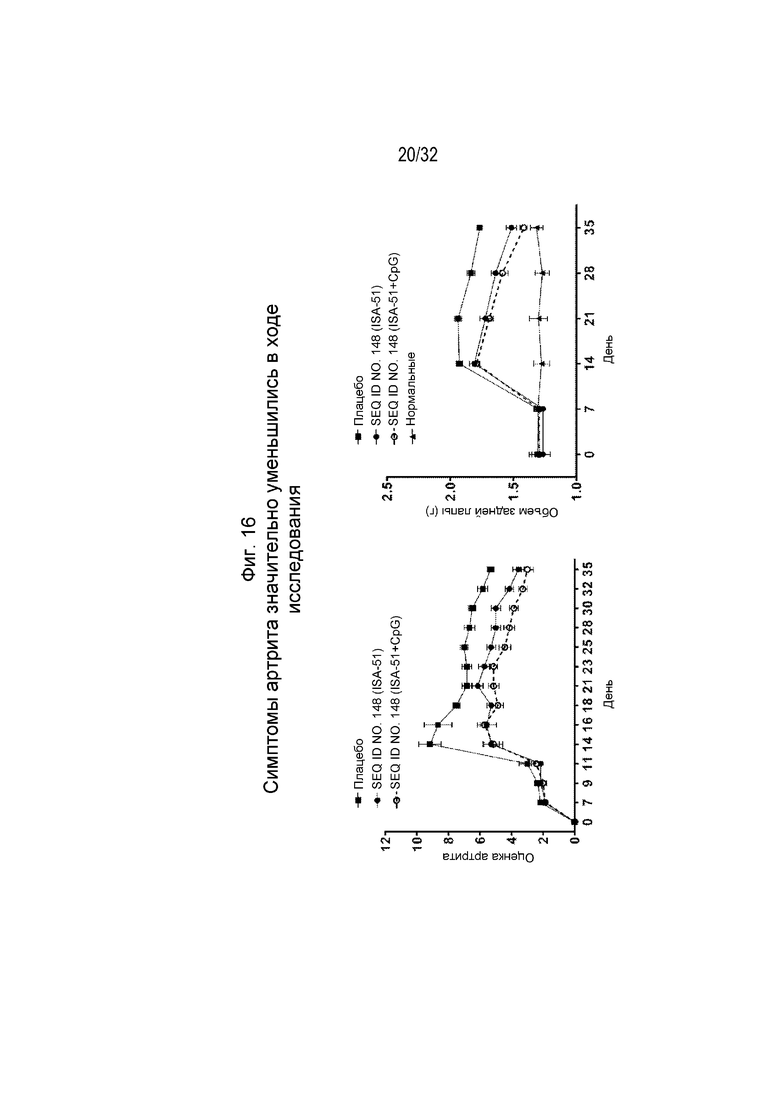



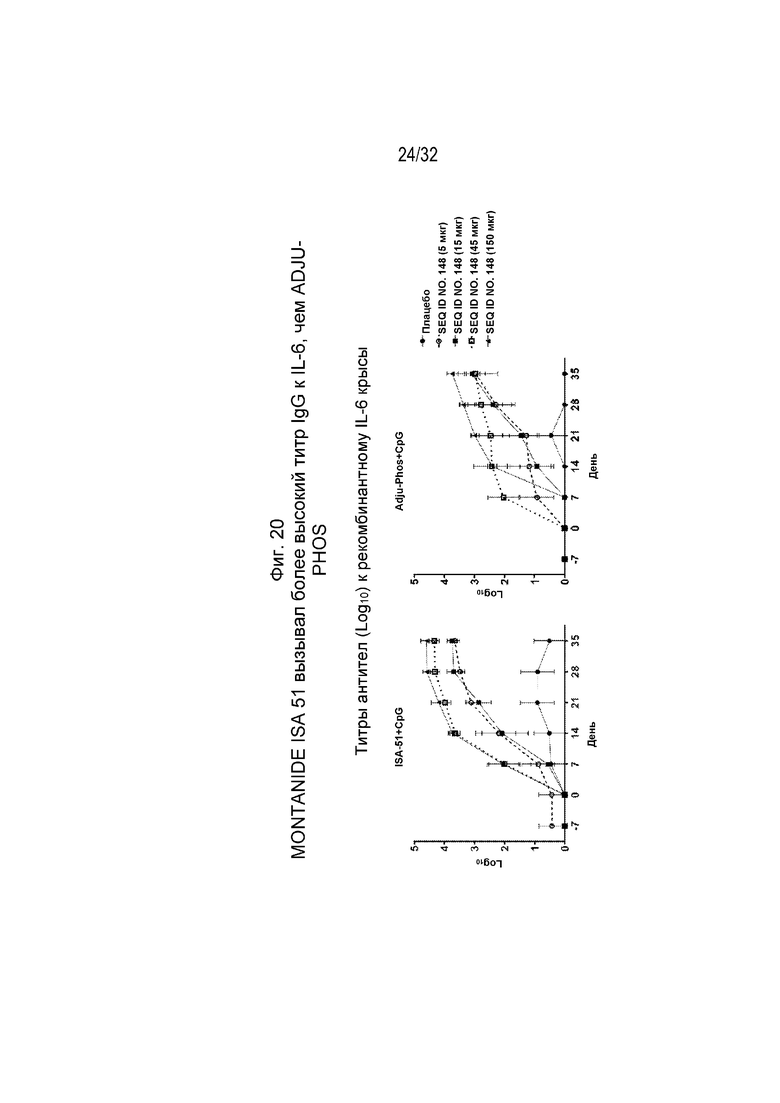



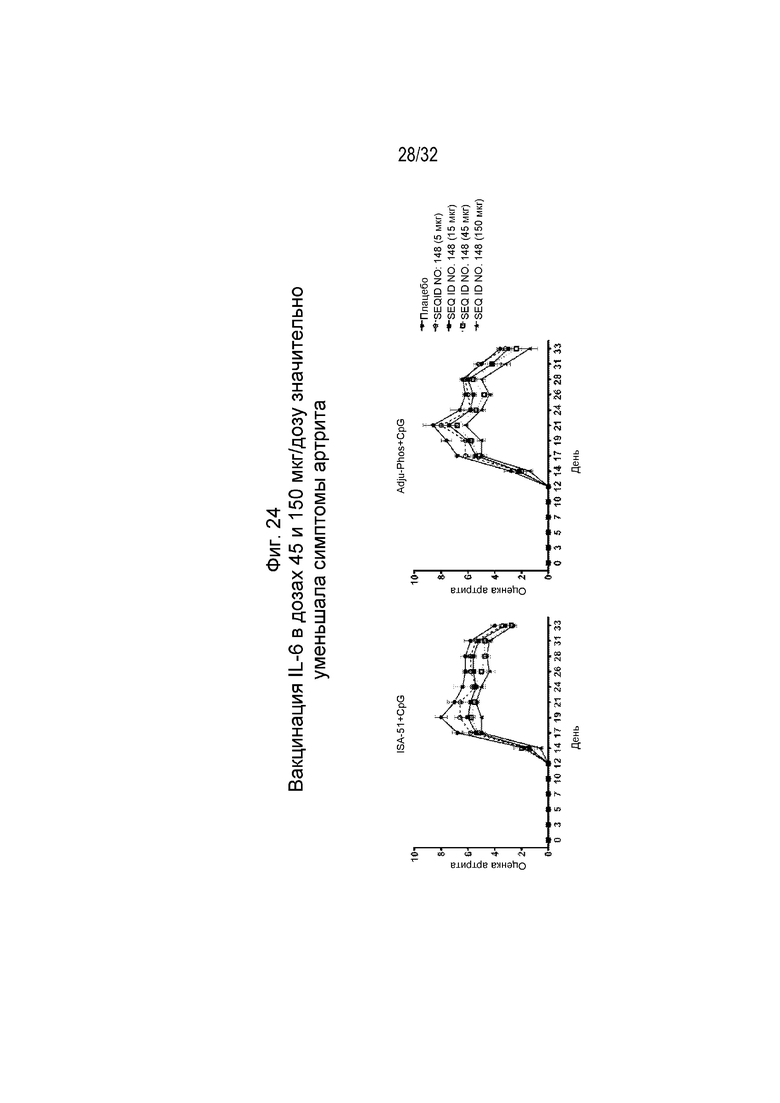

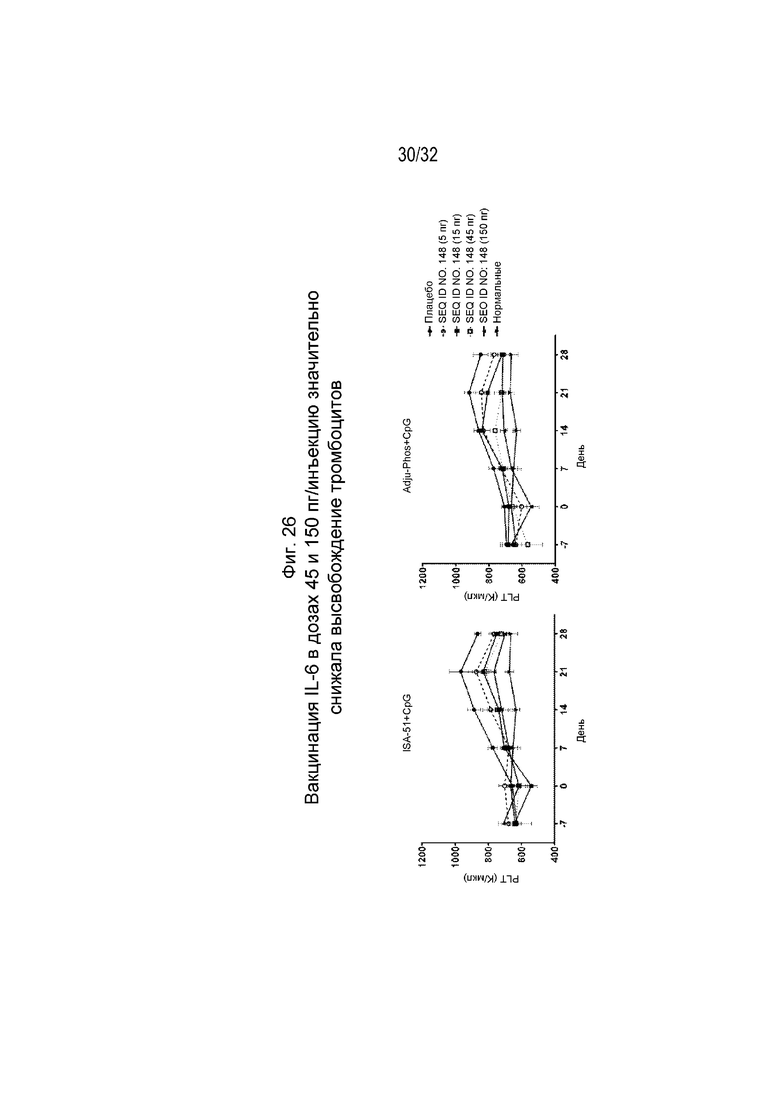
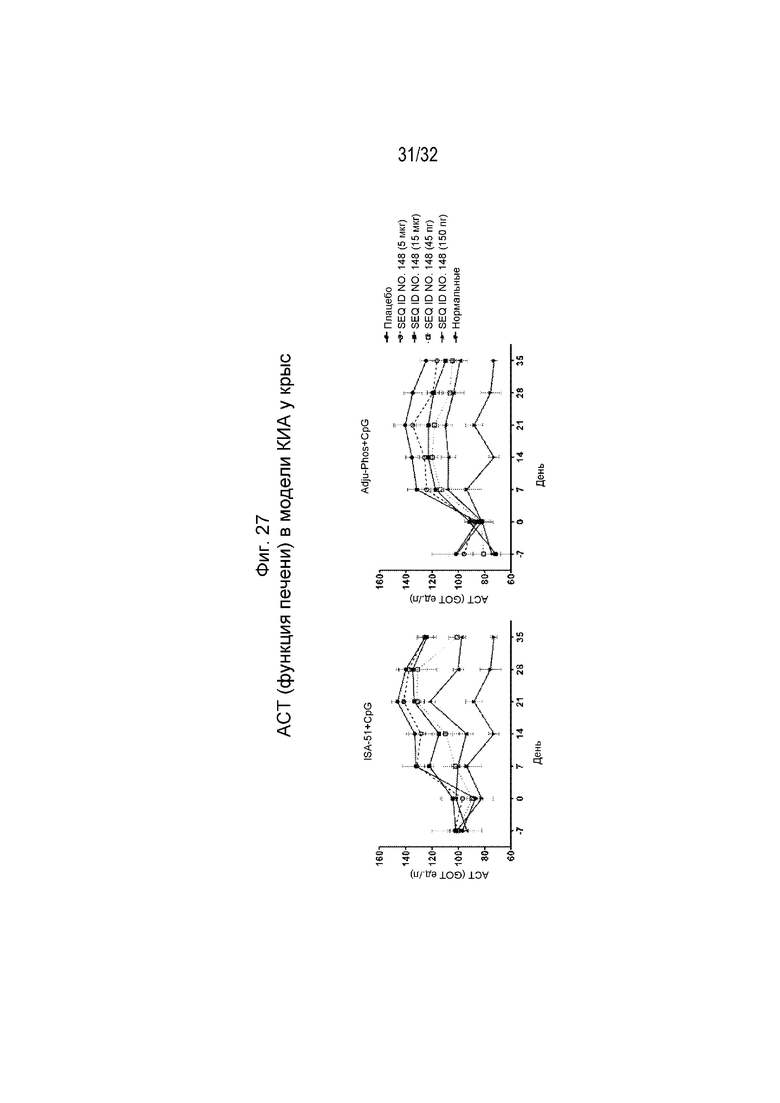
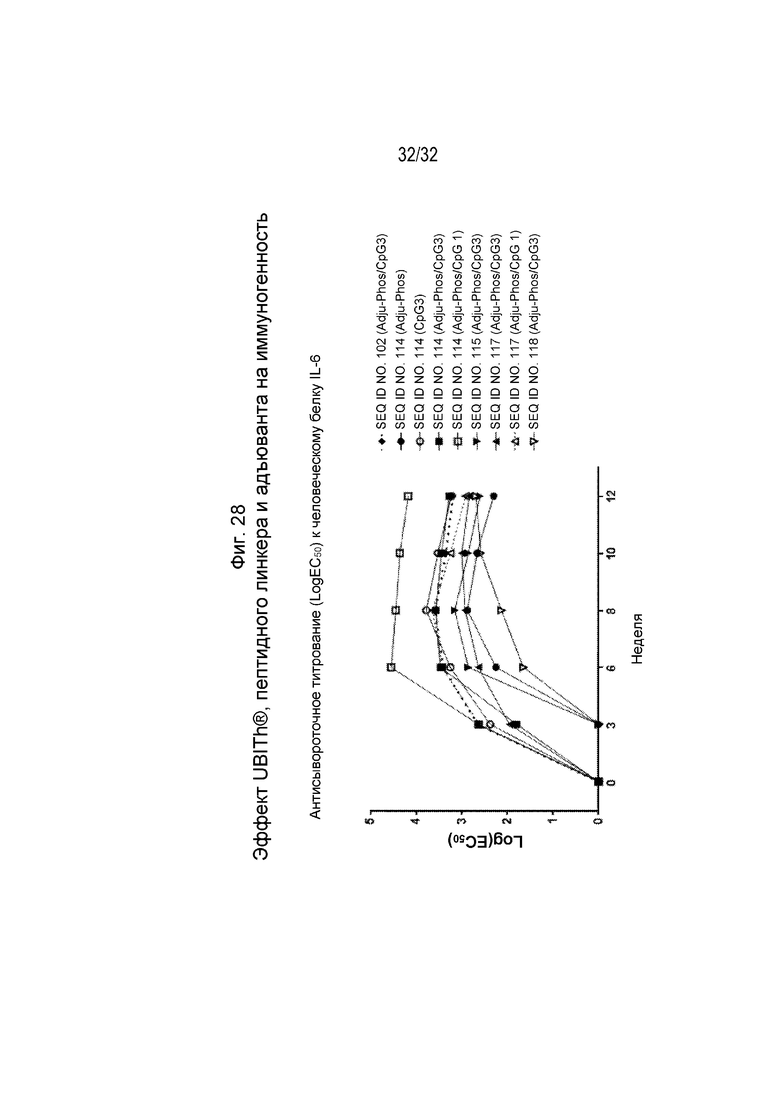
Настоящее изобретение относится к пептидным иммуногенным конструкциям, нацеленным на интерлейкин 6 (IL-6), к фармацевтическим композициям для профилактики и лечения заболеваний, на которые влияет нарушение регуляции IL-6, содержащим указанные иммуногенные конструкции, к способам получения антител к IL-6, а также к способам профилактики и лечения заболеваний, на которые влияет нарушение регуляции IL-6. Описанные пептидные иммуногенные конструкции IL-6 содержат В-клеточный эпитоп IL-6, связанный с гетерологичным эпитопом Т-хелперных клеток (Th-эпитопом) непосредственно или с помощью необязательного гетерологичного спейсера. Пептидные иммуногенные конструкции IL-6 стимулируют выработку высокоспецифичных антител, направленных на сайт связывания рецептора IL-6 (IL-6R). 8 н. и 2 з.п. ф-лы, 28 ил., 22 табл., 14 пр.
1. Пептидная иммуногенная конструкция IL-6 для профилактики заболевания, на которое влияет нарушение регуляции IL-6, выбранная из группы, состоящей из SEQ ID NO: 107-215.
2. Фармацевтическая композиция для профилактики заболевания, на которое влияет нарушение регуляции IL-6, содержащая:
а. эффективное количество пептидной иммуногенной конструкции IL-6 по п.1; и
b. фармацевтически приемлемый носитель для доставки и/или адъювант.
3. Фармацевтическая композиция по п.2, в которой пептидная иммуногенная конструкция IL-6 смешана с олигодезоксинуклеотидом CpG (ODN) с образованием стабильного иммуностимулирующего комплекса.
4. Способ получения антител к IL-6 у животного, включающий введение животному фармацевтической композиции по п.2.
5. Способ профилактики заболевания, на которое влияет нарушение регуляции IL-6, у животного, включающий введение указанному животному фармацевтической композиции по п.2.
6. Пептидная иммуногенная конструкция IL-6 для лечения заболевания, на которое влияет нарушение регуляции IL-6, выбранная из группы, состоящей из SEQ ID NO: 107-215.
7. Фармацевтическая композиция для лечения заболевания, на которое влияет нарушение регуляции IL-6, содержащая:
a. эффективное количество пептидной иммуногенной конструкции IL-6 по п.6; и
b. фармацевтически приемлемый носитель для доставки и/или адъювант.
8. Фармацевтическая композиция по п.7, в которой пептидная иммуногенная конструкция IL-6 смешана с олигодезоксинуклеотидом CpG (ODN) с образованием стабильного иммуностимулирующего комплекса.
9. Способ получения антител к IL-6 у животного, включающий введение животному фармацевтической композиции по п.7.
10. Способ лечения заболевания, на которое влияет нарушение регуляции IL-6, у животного, включающий введение животному фармацевтической композиции по п.7.
| WO2018232369 A1, 20.12.2018 | |||
| MX2009012812 A, 24.02.2010 | |||
| DESALLAIS L | |||
| et al | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Sci Rep, 2016, Vol | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Магнитное устройство для кидки челнока на ткацком станке | 1929 |
|
SU19549A1 |
| СПОСОБЫ ЛЕЧЕНИЯ ИНТЕРЛЕЙКИН-6-ЗАВИСИМЫХ ЗАБОЛЕВАНИЙ | 2004 |
|
RU2509574C2 |
Авторы
Даты
2022-09-20—Публикация
2019-12-28—Подача