Область техники, к которой относится изобретение
Настоящее изобретение относится к радиофармацевтическим средствам, направленным на рецептор гастрин-высвобождающего пептида (GRPR), и к их применению. В частности, настоящее изобретение относится к фармацевтической композиции, содержащей антагонист GRPR с радиоактивной меткой и поверхностно-активное вещество. Настоящее изобретение также относится к антагонисту GRPR с радиоактивной меткой для использования в лечении или профилактики рака.
Предшествующий уровень техники
Рецептор гастрин-высвобождающего пептида (GRPR), также известный как рецептор бомбезина подтипа 2, представляет собой сопряженный с G-белком рецептор, экспрессируемый в различных органах, в том числе в желудочно-кишечном тракте и поджелудочной железе (Guo M, et al. Curr Opin Endocrinol Diabetes Obes. 2015; 22:3–8,2; Gonzalez N, et al. Curr Opin Enocrinol Diabetes Obes. 2008; 15:58–64). При связывании подходящего лиганда GRPR активируется, вызывая множественные физиологические процессы, такие как регуляция экзокринной и эндокринной секреции (Guo M, et al. Curr Opin Endocrinol Diabetes Obes. 2015; 22:3–8,2; Gonzalez N, et al. Curr Opin Enocrinol Diabetes Obes. 2008; 15:58–64). В последние десятилетия экспрессия GRPR была зарегистрирована при различных типах рака, включая рак простаты и рак молочной железы (Gugger M and Reubi JC. Gastrin-releasing peptide receptors in non-neoplastic and neoplastic human breast. Am J Pathol. 1999; 155:2067–2076; Markwalder R and Reubi JC. Cancer Res. 1999; 59:1152–1159). Таким образом, GRPR стал интересной мишенью для рецепторно-опосредованной визуализации и лечения опухолей, таких как пептидная рецепторная сцинтиграфия и пептидная рецепторная радионуклидная терапия (Gonzalez N, et al. Curr Opin Enocrinol Diabetes Obes. 2008; 15:58–64). После успешного применения пептидных аналогов соматостатина с радиоактивной меткой в нейроэндокринных опухолях для ядерной визуализации и терапии (Brabander T, et al. Front Horm Res. 2015; 44:73–87; Kwekkeboom DJ and Krenning EP. Hematol Oncol Clin North Am. 2016; 30:179–191), множество радиолигандов GRPR с радиоактивной меткой было синтезировано и изучено в доклинических, а также в клинических исследованиях, в основном у пациентов с раком простаты. Примеры таких пептидных аналогов включают AMBA, серию Demobesin, и MP2653 (Yu Z, et al. Curr Pharm Des. 2013; 19:3329–3341; Lantry LE, et al. J Nucl Med. 2006; 47:1144–1152.; Schroeder RP et al. Eur J Nucl Med Mol Imaging. 2010; 37:1386–1396.; Nock B, et al. Eur J Nucl Med Mol Imaging. 2003; 30:247–258; Mather SJ, et al. Mol Imaging Biol. 2014; 16:888–895). Недавние исследования показали превосходство антагонистов GRPR над агонистами GRPR (Mansi R, et al. Eur J Nucl Med Mol Imaging. 2011; 38:97–107; Cescato R, et al. J Nucl Med. 2008; 49:318–326). По сравнению с агонистами рецептора антагонисты часто показывают более высокое связывание и благоприятную фармакокинетику (Ginj M, et al. Proc Natl Acad Sci USA. 2006; 103:16436–16441). Кроме того, клинические исследования с агонистами GRPR с радиоактивной меткой показали нежелательные побочные эффекты у пациентов, вызванные активацией GRPR после связывания пептида с рецептором ((Bodei L, et al. [abstract]. Eur J Nucl Med Mol Imaging. 2007; 34:S221).
Недавно было обнаружено, что некоторые антагонисты GRPR, такие как NeoВОМВ1, могут быть помечены различными радионуклидами, и могут быть потенциально использованы для визуализации и для лечения раков, экспрессирующих GRPR, например, рака простаты и рака молочной железы, но не ограничиваясь ими. Тем не менее, до настоящего времени сообщалось только об исследованиях по биораспределению, и не разработано никаких эффективных протоколов лечения или фармацевтических композиций.
Таким образом, в этом контексте, необходимо обеспечить фармацевтическую композицию, включающую антагонист GRPR, которую можно применять у пациентов. Кроме того, также необходимо обеспечить эффективный протокол лечения больных раком с применением антагониста GRPR.
Изложение сущности изобретения
В первом аспекте настоящее изобретение относится к фармацевтической композиции, содержащей:
- антагонист GRPR с радиоактивной меткой, имеющий следующую формулу:
MС-S-P
где:
М является радиоактивным металлом, а C является хелатором, связывающим M;
S является необязательным спейсером, ковалентно связанным между C и N-концом P;
P является пептидным антагонистом рецептора GRP общей формулы:
Xaa1-Xaa2—Xaa3—Xaa4 —Xaa5—Xaa6—Xaa7—Z;
Xаа1 отсутствует или выбран из группы, состоящей из аминокислотных остатков Asn, Thr, Phe, 3-(2-тиенил)аланина (Thi), 4-хлорфенилаланина (Cра), α-нафтилаланина (α-Nal), β-нафтилаланина (β-Nal), 1,2,3,4-тетрагидроноргарман-3-карбоновой кислоты (Tpi), Tyr, 3-йод-тирозина (о-I-Tyr), Trp и пентафторфенилаланина (5-F-Phe) (все в виде L- или D-изомеров);
Xaa2 представляет собой Gln, Asn или His;
Xаа3 представляет собой Trp или 1,2,3,4-тетрагидроноргарман-3-карбоновую кислоту (Tpi);
Xаа4 представляет собой Ala, Ser или Val;
Xaa5 представляет собой Val, Ser или Thr;
Xаа6 представляет собой Gly, саркозин (Sar), D-Ala, или β-Ala;
Xaa7 представляет собой His или (3-метил)гистидин (3-Me)His;
Z выбран из -NHOH, -NHNH2, -NH-алкила, -N(алкил)2, и -О-алкила,
или Z представляет собой
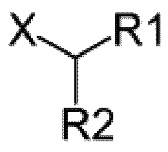
где X представляет собой NH (амид) или O (сложный эфир), а R1 и R2 являются одинаковыми или различными, и выбраны из протона, необязательно замещенного алкила, необязательно замещенного алкилового эфира, арила, арилового эфира или алкил-, галоген-, гидроксил- или гидроксиалкил-замещенной арильной или гетероарильной группы; и
- поверхностно-активное вещество, содержащее соединение, имеющее (i) цепь полиэтиленгликоля и (ii) сложный эфир жирной кислоты.
Во втором аспекте настоящее изобретение относится к композиции, содержащей антагонист GRPR с радиоактивной меткой, для применения в лечении или профилактики рака у субъекта, где:
- антагонист GRPR с радиоактивной меткой имеет следующую формулу:
MС-S-P
где:
М является радиоактивным металлом, а C является хелатором, связывающим M;
S является необязательным спейсером, ковалентно связанным между C и N-концом P;
P является пептидным антагонистом рецептора GRP общей формулы:
Xaa1-Xaa2—Xaa3—Xaa4 —Xaa5—Xaa6—Xaa7—Z;
Xаа1 отсутствует или выбран из группы, состоящей из аминокислотных остатков Asn, Thr, Phe, 3-(2-тиенил)аланина (Thi), 4-хлорфенилаланина (Cра), α-нафтилаланина (α-Nal), β-нафтилаланина (β-Nal), 1,2,3,4-тетрагидроноргарман-3-карбоновой кислоты (Tpi), Tyr, 3-йод-тирозина (о-I-Tyr), Trp и пентафторфенилаланина (5-F-Phe) (все в виде L- или D-изомеров);
Xaa2 представляет собой Gln, Asn или His;
Xаа3 представляет собой Trp или 1,2,3,4-тетрагидроноргарман-3-карбоновую кислоту (Tpi);
Xаа4 представляет собой Ala, Ser или Val;
Xaa5 представляет собой Val, Ser или Thr;
Xаа6 представляет собой Gly, саркозин (Sar), D-Ala, или β-Ala;
Xaa7 представляет собой His или (3-метил)гистидин (3-Me)His;
Z выбран из -NHOH, -NHNH2, -NH-алкила, -N(алкил)2, и -О-алкила,
или Z представляет собой
 ,
,
где X представляет собой NH (амид) или O (сложный эфир), а R1 и R2 являются одинаковыми или различными, и выбраны из протона, необязательно замещенного алкила, необязательно замещенного алкилового эфира, арила, арилового эфира или алкил-, галоген-, гидроксил- или гидроксиалкил-замещенной арильной или гетероарильной группы; и
- антагонист GRPR с радиоактивной меткой применяют у указанного субъекта в терапевтически эффективном количестве, составляющем от 2000 до 10000 МБк.
Краткое описание чертежей/фигур
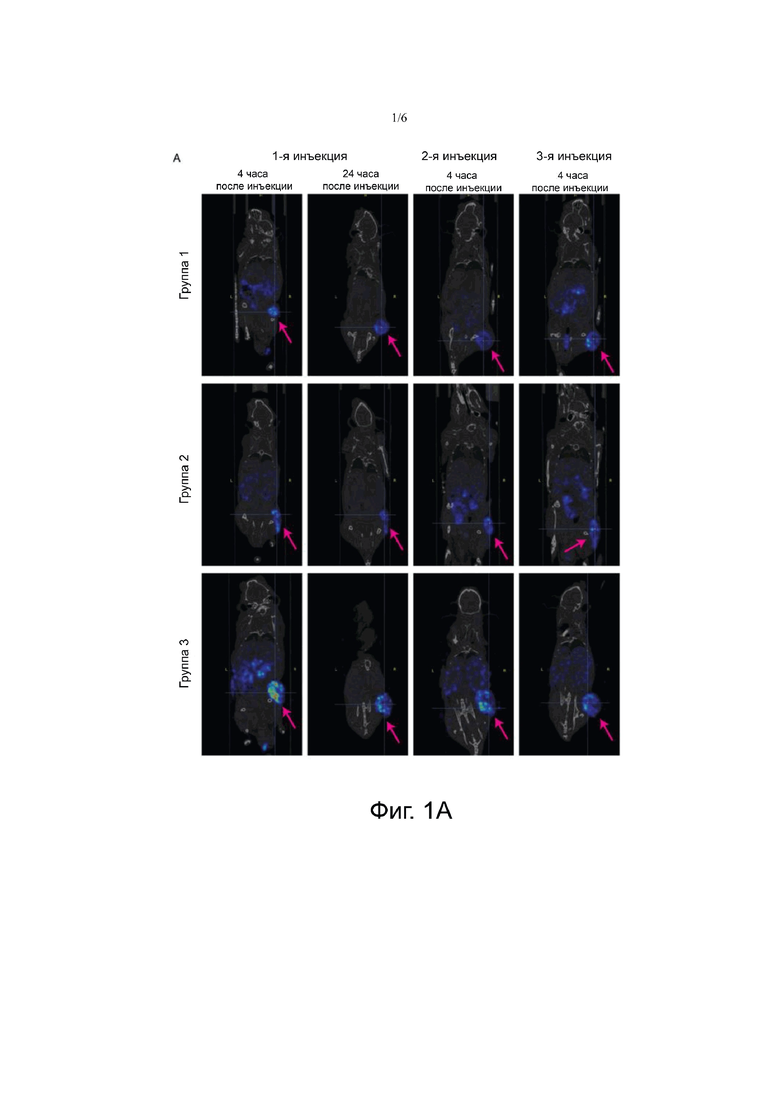
Фигура 1А. На Фигуре 1А представлены изображения ОФЭКТ/КТ спустя 4 часа и 24 часа после 1-й инъекции, и спустя 4 часа после 2-й и 3-й инъекции. Стрелками указана опухоль. Животным вводили 30 МБк/300 пмоль (группа 1), 40 МБк/400 пмоль (группа 2) или 60 МБк/ 600 пмоль 177LU-NeoBОМВ1.
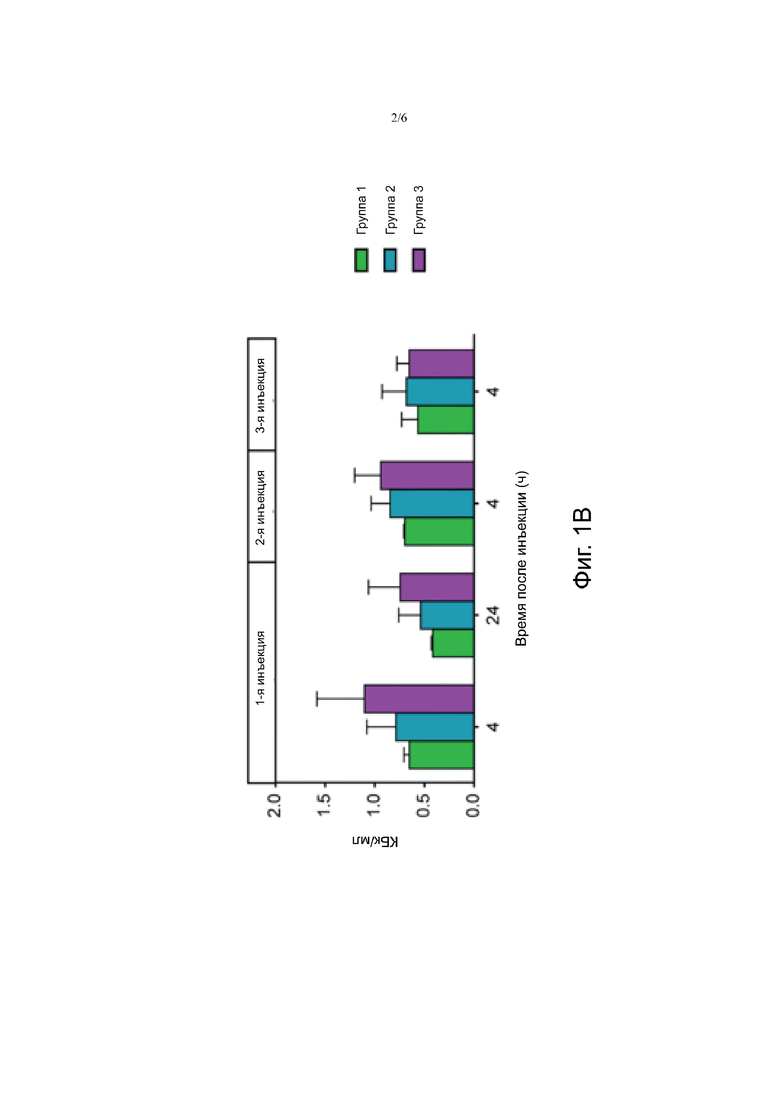
Фигура 1В. На Фигуре 1B показана количественное поглощение опухолью (n=2 на группу) после инъекций, описанных на Фигуре 1А.
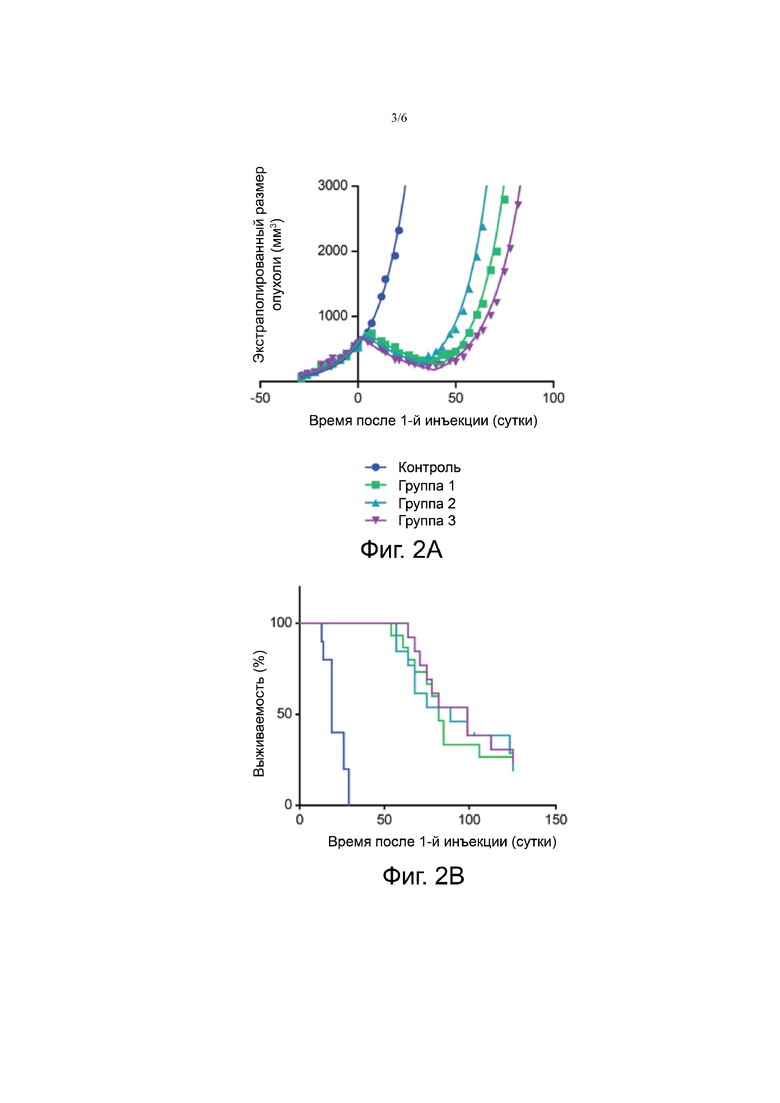
Фигура 2А, 2В. На Фигуре 2А показаны экстраполированные значения размера опухоли не получавших лечение животных, и животных, получавших 3×30 МБк/300 пмоль (группа 1), 3×40 МБк/400 пмоль (группа 2) и 3×60 МБк/600 пмоль 177LU-NеоBOMВ1 (группа 3). На Фигуре 2B показано выживание не получавших лечения животных и животных, получавших 3×30 МБк/300 пмоль (группа 1), 3×40 МБк/400 пмоль (группа 2) и 3×60 МБк/600 пмоль 177LU-NeoBОМВ1 (группа 3).
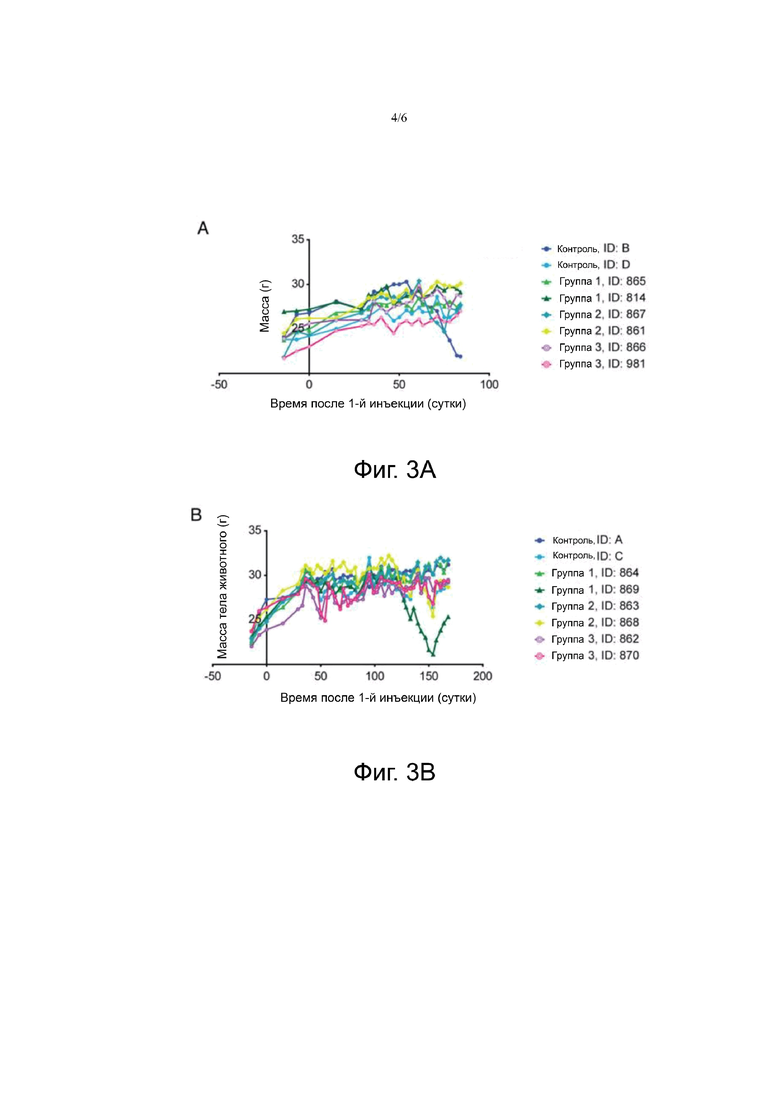
Фигура 3А, 3В. На фигуре 3А показана масса тела животных до лечения, и до 12 недель после лечения. На фигуре 3B показана масса тела животных до лечения, и до 24 недель после лечения.
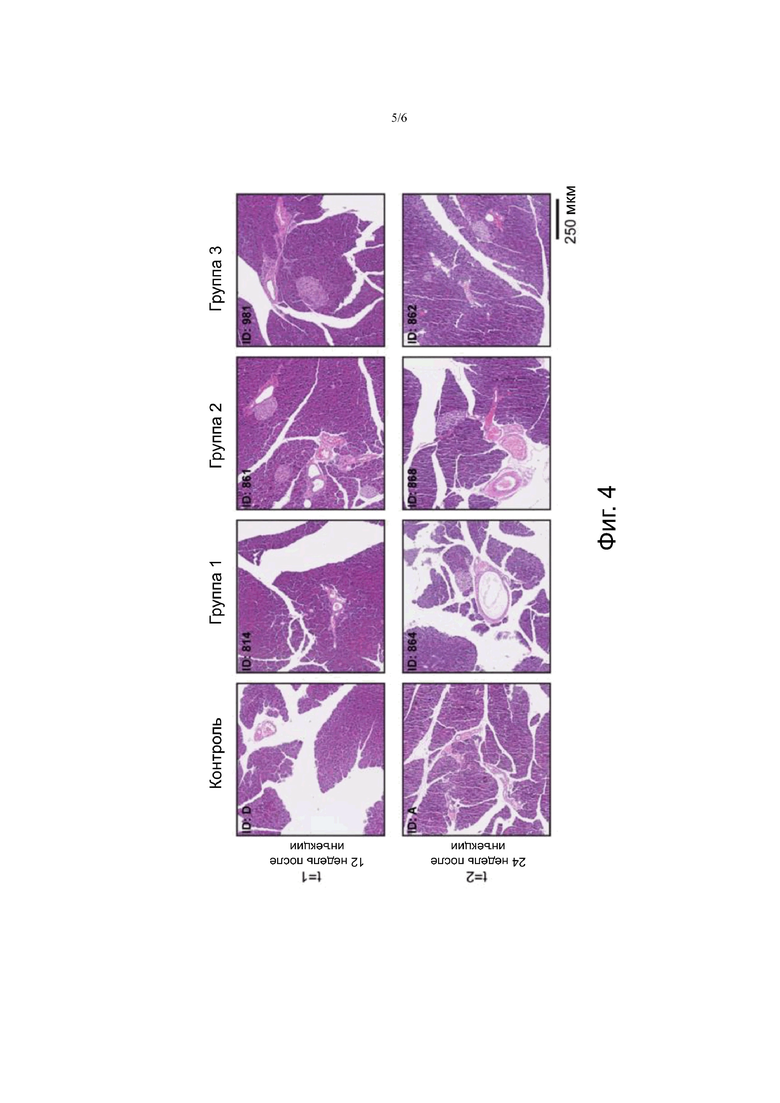
Фигура 4. На фигуре 4 показаны образцы ткани поджелудочной железы после окрашивание гематоксилином и эозином, от не получавших лечения животных и животных, получавших лечение (3×30 МБк/300 пмоль (группа 1), 3×40 МБк/400 пмоль (группа 2) и 3×60 МБк/600 пмоль 177LU-NеоBOMВ1 (группа 3)).
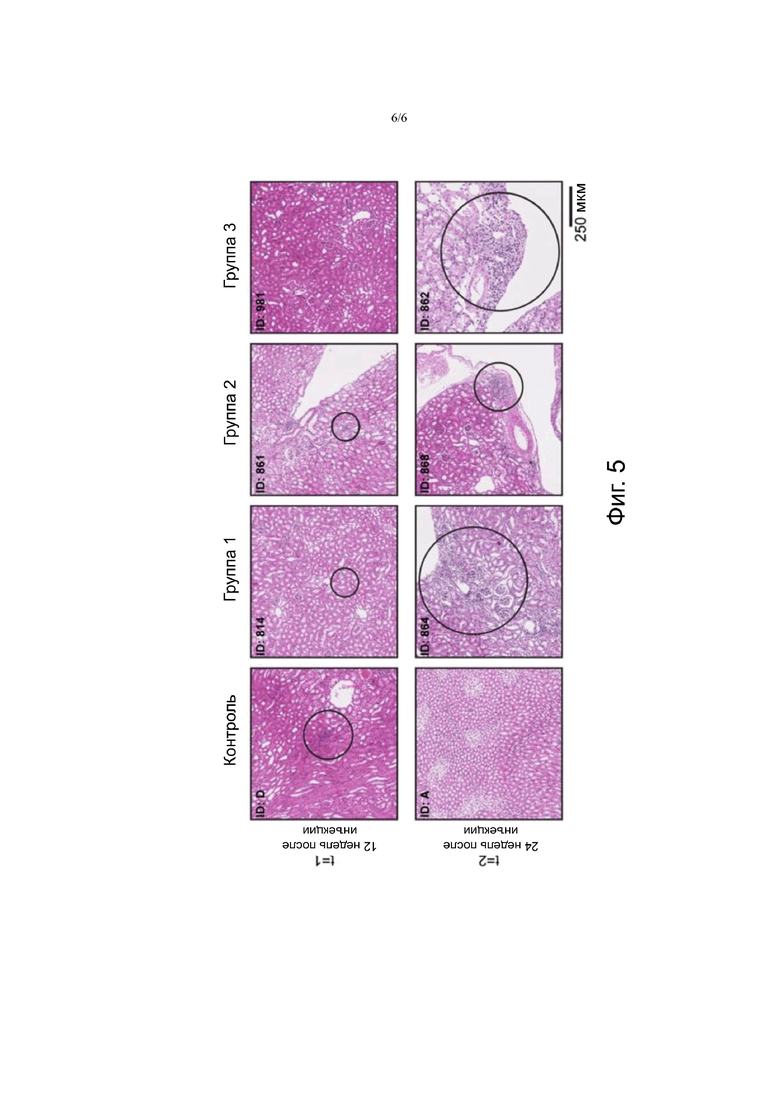
Фигура 5. На Фигуре 5 показаны образцы ткани почек после окрашивания гематоксилином и эозином, от не получавших лечения животных и животных, получавших лечение (3×30 МБк/300 пмоль (группа 1), 3×40 МБк/400 пмоль (группа 2) и 3×60 МБк/600 пмоль 177LU-NеоBOMВ1 (группа 3)). Область, выделенная кругом, указывает на поражения с лимфоцитарной инфильтрацией (ID: D, 814, 861, 868 и 862) или с атрофией и фиброзом (ID: 864).
Подробное описание изобретения
Определения
Выражение «лечение» включает улучшение или прекращение заболевания, расстройства или их симптома.
Выражение «предотвращение» включает предупреждение начала заболевания, расстройства или их симптома.
В соответствии с международной системой единиц, «МБк» - это обозначение единицы радиоактивности «Мегабеккерель».
Используемое в настоящей заявке сокращение «ПЭТ» означает позитронно-эмиссионную томографию.
Используемое в настоящей заявке сокращение «ОФЭКТ» означает однофотонную эмиссионную компьютерную томографию.
Используемый в настоящей заявке термины «эффективное количество» или «терапевтически эффективное количество» соединения относятся к количеству соединения, которое будет вызывать биологическую или медицинскую реакцию субъекта, например, улучшать симптомы, облегчать состояния, замедлять или задерживать прогрессирование заболевания, или предотвращать болезнь.
Используемый в настоящей заявке термины «замещенная» или «необязательно замещенная» относится к группе, которая необязательно замещена одним или несколькими заместителями, выбранными из: галогена, -OR’, -NR’R”, -SR’, -SiR’R”R’”, -OC(O)R’, -C(O)R’, -CO2R’, -C(O)NR’R”, -OC(O)NR’R”, -NR”C(O)R’, -NR’-C(O)NR”R’”, -NR”C(O)OR’, -NR-C(NR’R”R’”)=NR””, -NR-C(NR’R”)=NR’” -S(O)R’, -S(O)2R’, -S(O)2NR’R”, -NRSO2R’, -CN, -NO2, -R’, -N3, -CH(Ph)2, фтор(C1-C4)алкоксо, и фтор(C1-C4)алкила в количестве от нуля до общего количества открытых валентностей на ароматической кольцевой системе; и где R’, R”, R’” и R”” могут быть независимо выбраны из водорода, алкила, гетероалкила, циклоалкила, гетероциклоалкила, арила и гетероарила. Когда соединение по изобретению включает более одной группы R, например, каждая из групп R независимо выбрана, где они являются R’, R”, R’” и R”” группами, когда присутствует более одной из этих групп.
Используемый в настоящей заявке термин «алкил», как таковой или как часть другого заместителя, относится к линейной или разветвленной алкильной функциональной группе, имеющей от 1 до 12 атомов углерода. Подходящие алкильные группы включают метил, этил, n-пропил, i-пропил, n-бутил, i-бутил, s-бутил и t-бутил, пентил и его изомеры (например, n-пентил, изо-пентил), и гексил и его изомеры (например, n-гексил, изо-гексил).
Используемый в настоящей заявке термин «гетероарил» относится к полиненасыщенной ароматической кольцевой системе, имеющей одно кольцо или множественные ароматические кольца, конденсированные вместе или ковалентно связанные, содержащие от 5 до 10 атомов, где по меньшей мере одно кольцо является ароматическим, и по меньшей мере один атом кольца является гетероатомом, выбранным из N, O и S. Гетероатомы азота и серы могут необязательно быть окисленными, а гетероатомы азота могут необязательно кватернизованными. Такие кольца могут быть конденсированы с арильным, циклоалкильным или гетероциклильным кольцом. Неограничивающие примеры такого гетероарила включают фуранил, тиофенил, пирролил, пиразолил, имидазолил, оксазолил, изоксазолил, тиазолил, изотиазолил, триазолил, оксадиазолил, тиадиазолил, тетразолил, оксатриазолил, тиатриазолил, пиридинил, пиримидил, пиразинил, пиридазинил, оксазинил, диоксинил, тиазинил, триазинил, индолил, изоиндолил, бензофуранил, изобензофуранил, бензотиофенил, изобензотиофенил, индазолил, бензимидазолил, бензоксазолил, пуринил, бензотиадиазолил, хинолинил, изохинолинил, циннолинил, хиназолинил и хиноксалинил.
Используемый в настоящей заявке термины «арил» относятся к полиненасыщенной ароматической гидрокарбильной группе, имеющей единичное кольцо или множественные ароматические кольца, конденсированные вместе, содержащие от 6 до 10 кольцевых атомов, где по меньшей мере одно кольцо является ароматическим. Ароматическое кольцо может необязательно включать от одного до двух дополнительных колец (циклоалкил, гетероциклил или гетероарил, как определено в настоящей заявке), конденсированных с ним. Подходящие арильные группы включают фенил, нафтил и фенильное кольцо, конденсированное с гетероциклилом, таким как бензопиранил, бензодиоксолил, бензодиоксианил, и тому подобное.
Используемый в настоящей заявке термин «галоген» относится к фторо- (-F), хлоро- (-Cl), бромо- (-Br), или йодо- (-I) группе.
Используемый в настоящей заявке термин «необязательно замещенная алифатическая цепь» относится к необязательно замещенной алифатической цепи, имеющей от 4 до 36 атомов углерода, предпочтительно от 12 до 24 атомов углерода.
Антагонист GRPR с радиоактивной меткой
Как используется в настоящей заявке документе, антагонист GRPR имеет следующую формулу:
MС-S-P
где:
М является радиоактивным металлом, а C является хелатором, связывающим M;
S является необязательным спейсером, ковалентно связанным между C и N-концом P;
P является пептидным антагонистом рецептора GRP общей формулы:
Xaa1-Xaa2—Xaa3—Xaa4 —Xaa5—Xaa6—Xaa7—Z;
Xаа1 отсутствует или выбран из группы, состоящей из аминокислотных остатков Asn, Thr, Phe, 3-(2-тиенил)аланина (Thi), 4-хлорфенилаланина (Cра), α-нафтилаланина (α-Nal), β-нафтилаланина (β-Nal), 1,2,3,4-тетрагидроноргарман-3-карбоновой кислоты (Tpi), Tyr, 3-йод-тирозина (о-I-Tyr), Trp и пентафторфенилаланина (5-F-Phe) (все в виде L- или D-изомеров);
Xaa2 представляет собой Gln, Asn или His;
Xаа3 представляет собой Trp или 1,2,3,4-тетрагидроноргарман-3-карбоновую кислоту (Tpi);
Xаа4 представляет собой Ala, Ser или Val;
Xaa5 представляет собой Val, Ser или Thr;
Xаа6 представляет собой Gly, саркозин (Sar), D-Ala, или β-Ala;
Xaa7 представляет собой His или (3-метил)гистидин (3-Me)His;
Z выбран из -NHOH, -NHNH2, -NH-алкила, -N(алкил)2, и -О-алкила;
или Z представляет собой

где X представляет собой NH (амид) или O (сложный эфир), а R1 и R2 являются одинаковыми или различными, и выбраны из протона, необязательно замещенного алкила, необязательно замещенного алкилового эфира, арила, арилового эфира или
алкил-, галоген-, гидроксил- или гидроксиалкил-замещенной арильной или гетероарильной группы.
Согласно одному варианту осуществления, Z выбран из одной из следующих формул, где X представляет собой NH или O:
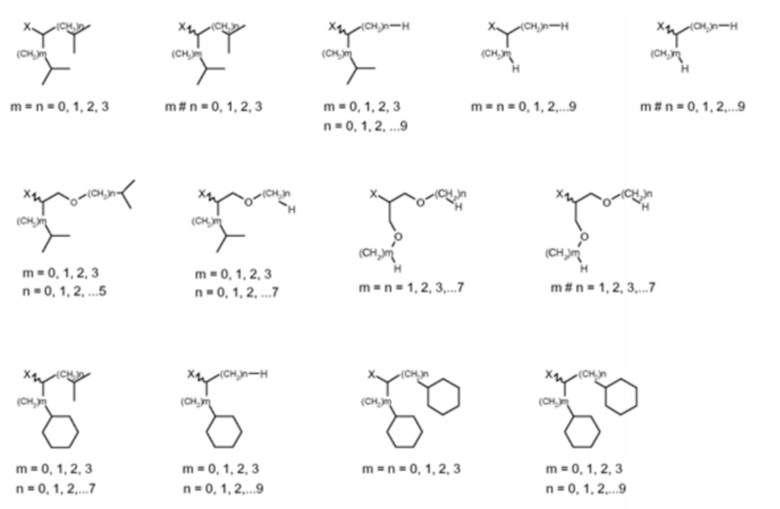
Согласно одному варианту осуществления, хелатор C выбран из группы, состоящей из:
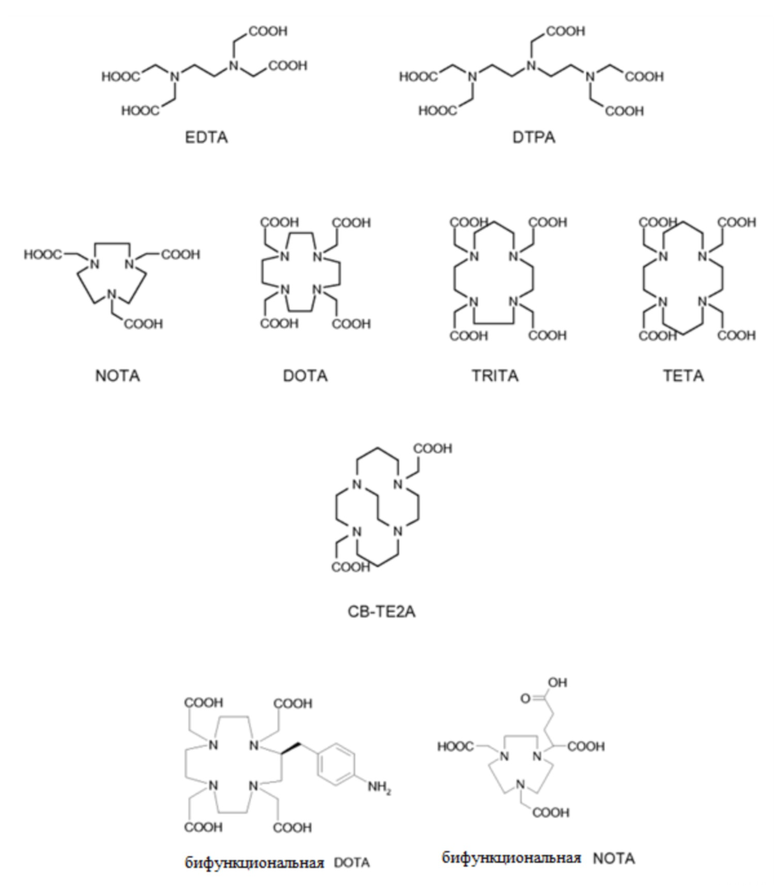
В конкретных вариантах осуществления C выбран из группы, состоящей из:
Согласно одному варианту осуществления, S выбран из группы, состоящей из:
а) арилсодержащих остатков формул:
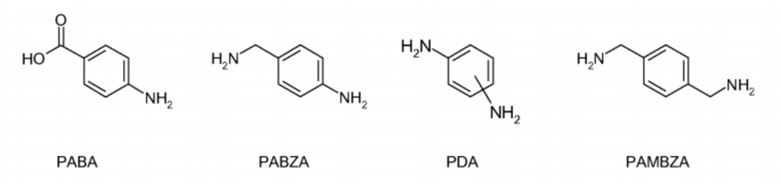 ,
,
где РАВА является P-аминобензойной кислотой, PABZA является п-аминобензиламином, PDA представляет собой фенилендиамин, а PAMBZA представляет собой (аминометил)бензиламин;
b) дикарбоновых кислот, ω-аминокарбоновых кислот, ω-диаминокарбоновых кислот или диаминов формул:
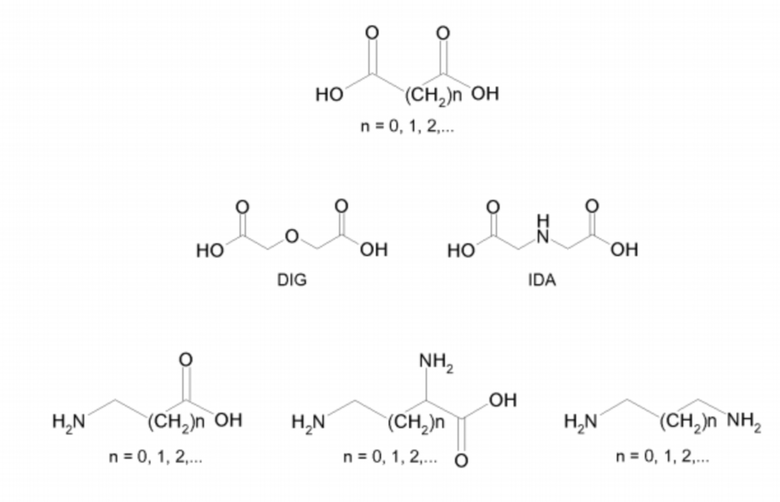 ,
,
где DIG является дигликолевой кислотой, а IDA является иминодиуксусной кислотой;
с) спейсеров на основе ПЭГ с различной длиной цепи, в частности ПЭГ-спейсеров, выбранных из:
d) α- и β-аминокислот, одиночных или в гомологичных цепях различной длины, или гетерологичных цепях различной длины, в частности:

GRP (1-18), GRP (14-18), GRP (13-18), BBN(1-5) или [Tyr4] BB (1-5); или
е) комбинаций a, b, c и d.
Согласно одному варианту осуществления, антагонист GRPR выбран из группы, состоящей из соединений следующих формул:
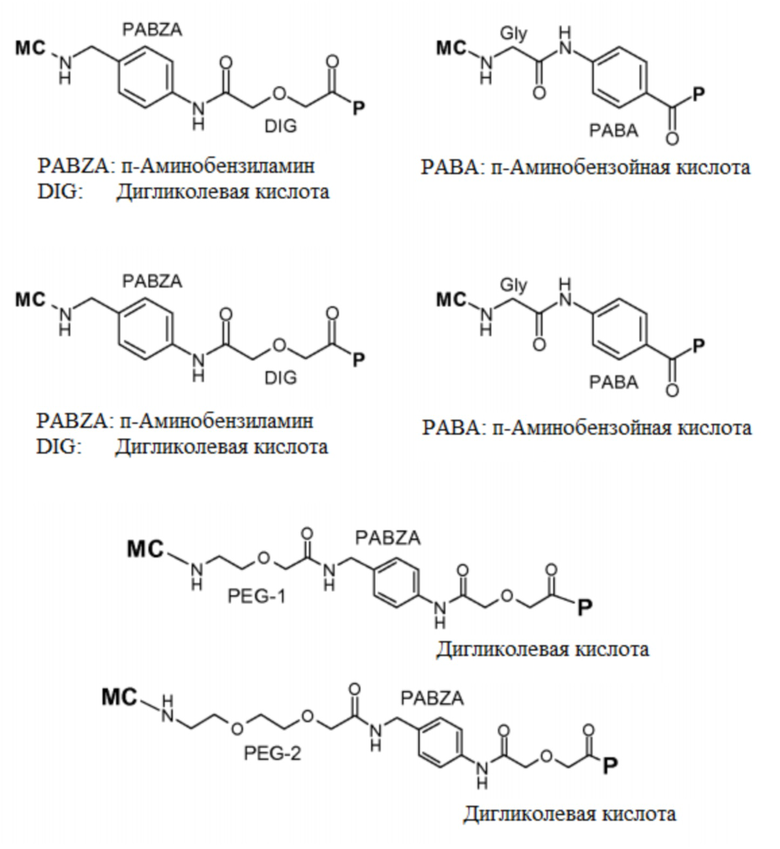
где MC и P являются такими, как определено выше.
Согласно одному варианту осуществления, P представляет собой DPhe-Gln-Trp-Ala-Val-Gly-His-NH-CH(CH2-CH(CH3)2)2.
Согласно одному варианту осуществления, антагонист GRPR с радиоактивной меткой представляет собой NeoBOMB1 с радиоактивной меткой формулы (I):
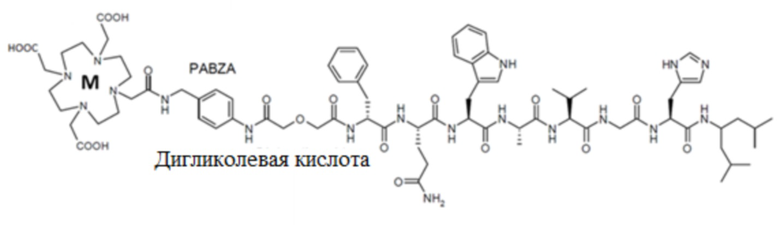 (I)
(I)
(M-DОТА-(п-аминобензиламин-дигликолевая кислота)- [D-Phe6, His-NH-CH[(CH2-CH(CH3)2]212, дез-Leu13, дез-Met14]BBN(6-14));
где M представляет собой радиоактивный металл, предпочтительно M выбран из 177Lu, 68Ga и 111In.
Согласно одному варианту осуществления, антагонист GRPR с радиоактивной меткой представляет собой NeoBOMB2 с радиоактивной меткой формулы (II):
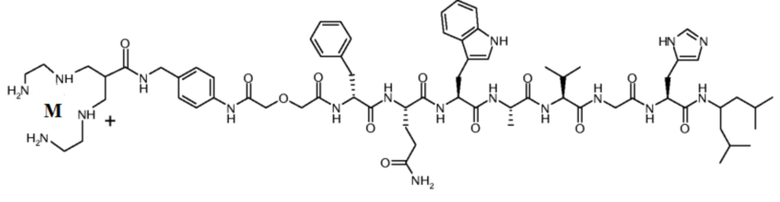 (II)
(II)
(M-N4 (п-аминобензиламин-дигликолевая кислота)-[D-Phe6, His-NH-CH[(CH2-CH(CH3)2]212, дез-Leu13, дез-Met14]BBN(6-14));
где M представляет собой радиоактивный металл.
В одном варианте осуществления M представляет собой радиоактивный металл, который может быть выбран из 111In, 133mIn, 99mTc, 94mTc, 67Ga, 66Ga, 68Ga, 52Fe, 169Er, 72As, 97Ru, 203Pb, 212Pb, 62Cu, 64Cu, 67Cu, 186Re, 188Re, 86Y, 90Y, 51Cr, 52mMn, 157Gd, 177Lu, 161Tb, 69Yb, 175Yb, 105Rh, 166Dy, 166Ho, 153Sm, 149Pm, 151Pm, 172Tm, 121Sn, 117mSn, 213Bi, 212Bi, 142Pr, 143Pr, 198Au, 199Au, 89Zr, 225Ac и 47Sc. Предпочтительно M выбран из 177Lu, 68Ga и 111In.
Согласно одному варианту осуществления М представляет собой 177Lu. В этом случае антагонист GRPR с радиоактивной меткой может быть использован для радионуклидной терапии. Согласно другому варианту осуществления М представляет собой 68Ga. В этом случае антагонист GRPR с радиоактивной меткой может быть использован для ПЭТ. Согласно другому варианту осуществления М представляет собой 111In. В этом случае антагонист GRPR с радиоактивной меткой может быть использован для ОФЭКТ.
Фармацевтическая композиция
Антагонист GRPR имеет тенденцию прилипать к стеклянным и пластиковым поверхностям из-за неспецифического связывания (NSB), которая является проблемой для составления фармацевтической композиции. Для обеспечения устойчивой композиции было протестировано несколько поверхностно-активных веществ. Авторы изобретения неожиданно обнаружили, что среди всех испытанных поверхностно-активных веществ поверхностно-активные вещества, содержащие соединение, имеющее (i) полиэтиленгликольную цепь и (ii) жирнокислотный сложный эфир, давали наилучшие результаты.
В первом аспекте настоящее изобретение относится к фармацевтической композиции, включающей антагонист GRPR с радиоактивной меткой, описанный в настоящей заявке, и поверхностно-активное вещество, содержащее соединение, имеющее (i) полиэтиленгликольную цепь и (ii) жирнокислотный сложный эфир. В одном варианте осуществления поверхностно-активное вещество также содержит свободный этиленгликоль.
В одном варианте осуществления поверхностно-активное вещество включает соединение формулы (III)
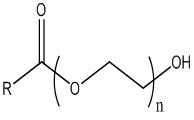 (III),
(III),
где n составляет от 3 до 1000, предпочтительно от 5 до 500, и более предпочтительно от 10 до 50, и
R представляет собой жирнокислотную цепь, предпочтительно необязательно замещенную алифатическую цепь.
В одном варианте осуществления поверхностно-активное вещество включает полиэтиленгликоль 15-гидроксистеарат и свободный этиленгликоль.
Антагонист GRPR с радиоактивной меткой может присутствовать в концентрации, обеспечивающей объемную радиоактивность не менее 100 МБк/мл, предпочтительно по меньшей мере 250 МБк/мл. Антагонист GRPR с радиоактивной меткой может присутствовать в концентрации, обеспечивающей объемную радиоактивность, составляющую от 100 МБк/мл до 1000 МБк/мл, предпочтительно от 250 МБк/мл до 500 МБк/мл.
Поверхностно-активное вещество может присутствовать в концентрации по меньшей мере 5 мкг/мл, предпочтительно по меньшей мере 25 мкг/мл, и более предпочтительно по меньшей мере 50 мкг/мл. Поверхностно-активное вещество может присутствовать в концентрации от 5 мкг/мл до 5000 мкг/мл, предпочтительно от 25 мкг/мл до 2000 мкг/мл, и более предпочтительно от 50 мкг/мл до 1000 мкг/мл.
В одном варианте осуществления композиция содержит по меньшей мере одно другое фармацевтически приемлемое вспомогательное вещество. Фармацевтически приемлемое вспомогательное вещество может быть любым из обычно используемых, и ограничено только физико-химическими соображениями, такими как растворимость и отсутствие реактивности с активным соединением (соединениями).
В частности, одно или несколько вспомогательных веществ могут быть выбраны из стабилизаторов против радиолитической деградации, буферов, секвестрационных агентов и их смесей.
Используемый в настоящей заявке «стабилизатор против радиолитической деградации» относится к стабилизирующему агенту, который защищает органические молекулы против радиолитической деградации, например, когда гамма-лучи, испускаемые радионуклидом, расщепляют связь между атомами органических молекул, и образуются радикалы, эти радикалы затем захватываются стабилизатором, который позволяет избежать любых других химических реакций этих радикалов, которые могут привести к появлению нежелательных, потенциально неэффективных или даже токсичных молекул. Следовательно, эти стабилизаторы также называют «акцепторами свободных радикалов» или кратко «акцепторами радикалов». Другими альтернативными обозначениями для этих стабилизаторов являются термины «усилители радиационной устойчивости», «радиолитические стабилизаторы» или просто «гасители».
Используемый в настоящей заявке термин «секвестрирующий агент» относится к хелатирующему агенту, подходящему для комплексообразования свободных ионов радионуклидных металлов в препарате (которые не образуют комплексов с пептидом, несущим радиоактивную метку).
Буферы включают ацетатный буфер, цитратный буфер и фосфатный буфер.
Согласно одному варианту осуществления фармацевтическая композиция представляет собой водный раствор, например, в инъекционной композиции. Согласно конкретному варианту осуществления фармацевтическая композиция представляет собой раствор для инфузии.
Требования к эффективным фармацевтическим носителям для инъекционных композиций хорошо известны специалистам в данной области техники (см., например, «Pharmaceutics and Pharmacy Practice», J.B. Lippincott Company, Philadelphia, PA, Banker and Chalmers, eds., pages 238-250 (1982), и «SHP Handbook on Injectable Drugs», Trissel, 15th ed., pages 622-630 (2009)).
Изобретение также относится к способу получения фармацевтической композиции, содержащей комбинацию антагониста GRPR с радиоактивной меткой и поверхностно-активного вещества.
Изобретение также относится к фармацевтической композиции, как описано выше, для использования при лечении или профилактики рака.
Используемый в настоящей заявке термин «рак» относятся к клеткам, обладающим способностью к автономному росту, то есть аномальным статусом или состоянием, характеризующимся быстро пролиферирующим ростом клеток. Гиперпролиферативные и неопластические болезненные состояния могут быть классифицированы как патологические, т.е. характеризующиеся или составляющие болезненное состояние, или могут быть классифицированы как непатологические, то есть как отклоняющиеся от нормального состояния, но не связанные с патологическим состоянием. Термин предназначен для включения всех типов ракового роста или онкогенных процессов, метастатических тканей или злокачественно трансформированных клеток, тканей или органов, независимо от гистопатологического типа или стадии инвазивности.
В конкретных вариантах осуществления рак выбран из рака предстательной железы, рака молочной железы, мелкоклеточного рака легкого, рака толстой кишки, гастроинтестинальных стромальных опухолей, гастриномы, почечно-клеточных карцином, гастроэнтеропанкреатических нейроэндокринных опухолей, плоскоклеточного рака пищевода, нейробластом, плоскоклеточных карцином головы и шеи, а также опухолей яичников, эндометрия и поджелудочной железы, отображающих связанную с неоплазией сосудистую сеть, т.е. GRPR. В одном варианте осуществления рак представляет собой рак простаты или рак молочной железы.
Изобретение также относится к фармацевтической композиции, как описано выше, для использования в визуализации in vivo, в частности, для обнаружения положительных по GRPR опухолей у субъекта, нуждающегося в этом, предпочтительно посредством визуализации с помощью ПЭТ и ОФЭКТ.
Изобретение также относится к способу лечения или профилактики рака у субъекта, нуждающегося в этом, включающему применение у указанного субъекта терапевтически эффективного количества фармацевтической композиции, как описано выше.
Изобретение также относится к способу визуализации in vivo, включающему применение у субъекта эффективного количества фармацевтической композиции, как описано выше, и детекцию сигнала, полученного от распада радиоизотопа, присутствующего в указанном соединении.
GRPR-антагонист с радиоактивной меткой для применения в лечении рака
Во втором аспекте изобретение также относится к композиции, содержащей антагонист GRPR с радиоактивной меткой для использования при лечении или профилактике рака у субъекта, нуждающегося в этом, где антагонист GRPR с радиоактивной меткой применяют у указанного субъекта в терапевтически эффективном количестве, составляющемся от 2000 до 10000 МБк.
В конкретных вариантах осуществления терапевтически эффективное количество композиции применяют у указанного субъекта от 2 до 8 раз на курс лечения. Например, пациент может получать лечение антагонистом GRPR с радиоактивной меткой, в частности 177Lu-NeoBOMB1, внутривенно в 2-8 циклах от 2000 до 10000 мБк на каждый цикл.
В некоторых аспектах субъект представляет собой млекопитающее, например, грызунов, собачьих, кошачьи или приматов, но не ограничиваясь ими. В некоторых аспектах субъект является человеком.
Авторы изобретения обнаружили, что 177Lu-NеоBOMВ1 является эффективным, как показано на животных моделях рака. По сравнению с не получавшими лечения животными, в группах лечения отмечалось значительно более длительное время задержки роста опухоли и значительно более длительное время среднего выживания. В неограничивающих примерах, описанных в настоящей заявке, животные получали 3×30 МБк/300 пмоль, 3×40 МБк/400 пмоль или 3×60 МБк/600 пмоль 177Lu-NеоBOMВ1. Никаких существенных различий в задержке роста опухоли и средней выживаемости не было обнаружено между группами лечения. Эта находка была неожиданной, поскольку предварительные дозиметрические расчеты с использованием линейно-квадратичной модели прогнозировали разницу в вероятности контроля опухоли между группами лечения (вероятность контроля опухоли: 0%, 75% и 100%, для животных, получаемых 3×30 МБк/300 пмоль, 3×40 МБк/400 пмоль и 3×60 МБк/600 пмоль, соответственно). Не желая углубляться в теорию, предполагается, что доза, необходимая для лечения пациента, будет намного ниже, чем ожидалось от предшествующих дозиметрических расчетов, что приведет к более низкой токсичности NеоBOMВ1 с радиоактивной меткой.
Предпочтительно антагонист GRPR с радиоактивной меткой несет 177Lu.
В конкретных вариантах осуществления вышеуказанных способов рак выбран из рака предстательной железы, рака молочной железы, мелкоклеточного рака легкого, рака толстой кишки, гастроинтестинальных стромальных опухолей, гастриномы, почечно-клеточных карцином, гастроэнтеропанкреатических нейроэндокринных опухолей, плоскоклеточного рака пищевода, нейробластом, плоскоклеточных карцином головы и шеи, а также опухолей яичников, эндометрия и поджелудочной железы, отображающих связанную с неоплазией сосудистую сеть, которые являются положительными по GRPR. В одном варианте осуществления рак представляет собой рак простаты или рак молочной железы.
Согласно одному варианту осуществления композиция для использования представляет собой фармацевтическую композицию, как описано в предыдущем разделе.
Изобретение также относится к способу лечения или профилактики рака, включающему введение субъекту, страдающему раком, эффективного количества композиции, содержащей антагонист GRPR с радиоактивной меткой, применяемый у указанного субъекта в терапевтически эффективном количестве, составляющем от 2000 до 10000 МБк.
В настоящей заявке представлен способ лечения или профилактики рака, включающий введение субъекту, страдающему раком, эффективного количества композиции, содержащей антагонист GRPR с радиоактивной меткой, как описано в настоящей заявке. В некоторых аспектах рак представляет собой рак простаты или рак молочной железы.
В некоторых аспектах применение композиции, содержащей антагонист GRPR с радиоактивной меткой, у субъекта, страдающего раком, может ингибировать, задерживать и/или уменьшать рост опухоли у субъекта. В некоторых аспектах рост опухоли задерживается по меньшей мере на 50%, 60%, 70% или 80% по сравнению с не получавшим лечения контрольным субъектом. В некоторых аспектах рост опухоли задерживается по меньшей мере на 80% по сравнению с не получавшим лечения контрольным субъектом. В некоторых аспектах рост опухоли задерживается по меньшей мере на 50%, на 60%, 70% или 80% по сравнению с прогнозируемым ростом опухоли без лечения. В некоторых аспектах рост опухоли задерживается по меньшей мере на 80% по сравнению с прогнозируемым ростом опухоли без лечения. Рядовому специалисту в данной области техники понятно, что прогнозы темпов роста опухоли могут быть сделаны на основе эпидемиологических данных, отчетов в медицинской литературе и других знаниях в данной области техники, типа опухоли и измерения размера опухоли, и т.д.
В некоторых аспектах применение композиции, содержащей антагонист GRPR с радиоактивной меткой, у субъекта, страдающего раком, может увеличить продолжительность выживания субъекта. В некоторых аспектах увеличение выживания отмечается по сравнению с не получавшим лечения контрольным субъектом. В некоторых аспектах увеличение выживания отмечается по сравнению с прогнозируемой продолжительностью выживания субъекта без лечения. В некоторых аспектах продолжительность выживания увеличивается по меньшей мере в 3 раза, в 4 раза, или в 5 раз по сравнению с не получавшим лечения контрольным субъектом. В некоторых аспектах продолжительность выживания увеличивается по меньшей мере в 4 раза по сравнению с не получавшим лечения контрольным субъектом. В некоторых аспектах продолжительность выживания увеличивается по меньшей мере в 3 раза, в 4 раза, или в 5 раз по сравнению с прогнозируемой продолжительностью выживания у субъекта без лечения. В некоторых аспектах продолжительность выживания увеличивается по меньшей мере в 4 раза по сравнению с прогнозируемой продолжительностью выживания субъекта без лечения. В некоторых аспектах продолжительность выживания увеличивается по меньшей мере на одну неделю, две недели, один месяц, два месяца, три месяца, шесть месяцев, один год, два года или три года по сравнению с не получавшим лечения контрольным субъектом. В некоторых аспектах продолжительность выживания увеличивается по меньшей мере на один месяц, два месяца или три месяца по сравнению с не получавшим лечения контрольным субъектом. В некоторых аспектах продолжительность выживания увеличивается по меньшей мере на одну неделю, две недели, один месяц, два месяца, три месяца, шесть месяцев, один год, два года или три года по сравнению с прогнозируемой продолжительностью выживания субъекта без лечения. В некоторых аспектах продолжительность выживания увеличивается по меньшей мере на один месяц, два месяца или три месяца по сравнению с прогнозируемой продолжительностью выживания субъекта без лечения.
В некоторых аспектах количество применяемого антагониста GRPR с радиоактивной меткой меньше, чем количество, прогнозируемое как обеспечивающее у субъекта 100% вероятность контроля опухоли.
В некоторых аспектах количество антагониста GRPR с радиоактивной меткой меньше, чем прогнозируемое количество, обеспечивающее у субъекта вероятность контроля опухоли по меньшей мере 75%. В некоторых аспектах количество антагониста GRPR с радиоактивной меткой меньше, чем прогнозируемое количество, обеспечивающее у субъекта вероятность контроля опухоли 50%. В некоторых аспектах количество антагониста GRPR с радиоактивной меткой меньше, чем прогнозируемое количество, обеспечивающее у субъекта вероятность контроля опухоли 25%. В некоторых аспектах количество антагониста GRPR с радиоактивной меткой меньше, чем прогнозируемое количество, обеспечивающее у субъекта вероятность контроля опухоли 10%. В некоторых аспектах количество антагониста GRPR с радиоактивной меткой составляет не более 25%, 30%, 40%, 50%, 60%, 70% или 75% от прогнозируемого количества, обеспечивающего у субъекта вероятность контроля опухоли 100%. В некоторых аспектах количество антагониста GRPR с радиоактивной меткой составляет не более 50%, 60%, 70%, 75%, 80% или 85% от прогнозируемого количества, обеспечивающего у субъекта по меньшей мере 75% вероятность контроля опухоли. В некоторых аспектах количество антагониста GRPR с радиоактивной меткой составляет не более 60%, 65%, 70%, 75%, 80%, 85% или 90% от прогнозируемого количества, обеспечивающего у субъекта по меньшей мере 50% вероятность контроля опухоли. В некоторых аспектах применяемое количество антагониста GRPR с радиоактивной меткой является прогнозируемым количеством, обеспечивающим у субъекта вероятность контроля опухоли менее 25%, 20%, 15% 10%, или 5%. В некоторых аспектах применяемое количество антагониста GRPR с радиоактивной меткой является прогнозируемым количеством, обеспечивающим у субъекта вероятность контроля опухоли 0%.
Примеры
Пример 1: Скрининг композиции для уменьшения адгезии NeoBОМВ1 с использованием 68Gа-NeoВОМВ1
Во время разработки набора композиции мы поняли, что пептид имеет особую тенденцию прилипать к стеклянным и пластиковым поверхностям.
Это явление называется неспецифическим связыванием (NSB). Пептиды часто демонстрируют более выраженные проблемы NSB, чем малые молекулы, особенно не заряженные пептиды могут сильно адсорбироваться на пластиках. Причины могут быть разными: физические/химические свойства, взаимодействия Ван-дер-Ваальса, ионные взаимодействия.
Органический растворитель может повышать растворимость и предотвращать адсорбцию. Этанол, например, можно использовать в радиофармацевтических инъекциях для повышения растворимости высоко липофильных индикаторов или уменьшения адсорбции на флаконах, мембранных фильтрах и инъекционных шприцах. Мы отвергли этанол, потому что он несовместим с лиофилизацией.
Человеческий сывороточный альбумин (HSA) также используется в ряде белковых составов в качестве стабилизатора для предотвращения адсорбции на поверхности, но это вспомогательное вещество непригодно из-за его термической нестабильности. Другим возможным подходом было использование поверхностно-активных веществ (например, полисорбата 20, полисорбата 80, плюроника F-68, сорбитан-триолеата).
Мы сосредоточили наше внимание на изучении неионных поверхностно-активных веществ, поскольку ионные поверхностно-активные вещества могут препятствовать введению метки 68Ga.
Неионные поверхностно-активные вещества, такие как Коллифор HS 15, Коллифор K188, Твин 20, Твин 80, поливинилпирролидон K10, коммерчески доступны в качестве солюбилизирующих вспомогательных веществ в пероральных и инъекционных композициях. В таблице ниже приведены первоначальные испытания, которые были выполнены с различными поверхностно-активными агентами.
Материалы и методы:
Маркировка NeoBomb1 была основана на ранее опубликованном подходе с набором Castaldi et al. (Castaldi E, Muzio V, D’Angeli L, Fugazza L. 68GaDOTATATE lyophilized ready to use kit for PET imaging in pancreatic cancer murine model, J Nucl Med 2014; 55(suppl 1):1926).
Был проведен скрининг различных поверхностно-активных веществ и определен % адгезии полученного водного раствора путем калибровочного измерения дозы общей радиоактивности, остающейся во флаконе после полного извлечения радиомеченого раствора. Разница, выраженная в процентах между полной радиоактивностью, измеренной до и после извлечения образца, напрямую коррелирует с адгезией пептида на системе упаковки. Результаты суммированы в Таблице 1.
Таблица 1 – Поверхностно-активные агенты - влияние на адгезию
Наилучшие результаты с точки зрения пептидной адгезии были получены с помощью Коллифор HS 15 и Твин 20. Эти два вспомогательных вещества были дополнительно исследованы, чтобы определить итоговое количество в наборе. Полученные результаты были хорошими с точки зрения радиохимической чистоты и пептидной адгезии.
Таблица 2 - Сравнение Твин 20 и Коллифор HS 15
(%)
Мы сосредоточились на Коллифоре HS 15, потому что полисорбаты (Tвин 20) могут подвергаться аутоокислению, расщеплению на субъединицах этиленоксида и гидролизу жирнокислотных эфирных связей, вызванному присутствием кислорода, ионов металлов, пероксидов или повышенной температурой.
Пример 2: Доклинические исследования терапевтической эффективности 177Lu-NeoBОМВ1
В настоящей заявке раскрыты приведенные в качестве образца неограничивающие примеры доклинических испытаний терапевтической эффективности 177Lu-NeoВОМВ1, включающие лечение животных с ксенотрансплантатами на основе хорошо известной GRPR-экспрессирующей клеточной линией рака предстательной железы PC-3 с 3 различными дозами 177Lu-NeoВОМВ1. Кроме того, в небольшой группе животных, не являющихся носителями опухолей, изучали влияние лечения 177Lu-NeoВОМВ1 на почки и поджелудочную железу посредством гистопатологического анализа после лечения.
Материалы и методы
Введение радиоактивной метки
NeoВОМВ1 (Advanced Accelerator Applications) (WO2014052471) разбавляли в ультра-чистой воде, и контролировали концентрацию и химическую чистоту с помощью собственного разработанного метода титрования (Breeman WA, de Zanger RM, Chan HS, de Blois E. Alternative method to determine specific activity of 177Lu by HPLC. Curr Radiopharm. 2015; 8:119–122). Добавляли радиоактивное вещество (100 МБк/нмоль 177Lu) во флакон, содержащий все необходимые вспомогательные вещества, например, буфер, антиоксиданты и пептид, включая поверхностно-активный агент (Коллифор HS 15), чтобы предотвратить прилипание пептида. Высокоэффективную жидкостную хроматографию проводили в градиенте метанола и 0,1% трифторуксусной кислоты для определения радиохимической чистоты. Включение радиоактивного металла, измеренное путем мгновенной тонкослойной хроматографии на силикагеле, как описано ранее (de Blois E, Chan HS, Konijnenberg M, de Zanger R, Breeman WA. Effectiveness of quenchers to reduce radiolysis of (111)In- or (177)Lu-labelled methionine-containing regulatory peptides. Maintaining radiochemical purity as measured by HPLC. Curr Top Med Chem. 2012; 12:2677-2685), составило >67% и >90% при ОФЭКТ/КТ, а также в исследованиях эффективности и токсичности, соответственно.
Модель на животных, эффективность и токсичность
Все исследования на животных были проведены в соответствии с требованиями Комитета по вопросам гуманного обращения с животными Медицинского центра Erasmus и в соответствии с принятыми руководящими принципами.
Самцам мышей Вalb c nu/nu подкожно инокулировали в правое плечо по 200 мкл 4×106 клеток PC-3 (American Type Culture Collection) в среде для инокуляции (в 1/3 Matrigel высокой концентрации (Corning) + 2/3 сбалансированного солевого раствора Хэнкса (Thermofisher Scientific)). Спустя четыре недели после инокуляции опухолевых клеток при достижении среднего размера опухоли 543±177 мм3, животных разделяли на четыре группы: контрольная группа (n = 10) и группа лечения 1-3 (n = 15 на группу). Для определения эффективности 177Lu-NeoВОМВ1 животные получили либо 3 инъекции растворителя (контрольная группа), либо 3×30 МБк/300 пмоль 177Lu-NeoВОМВ1 (группа 1), 3×40 МБк/ 400 пмоль 177Lu-NeoВОМВ1 (группа 2) или 3×60 МБк/600 пмоль 177Lu-NeoВОМВ1 (группа 3) под анестезией изофлюраном/O2. Инъекции осуществляли внутривенным способом и с интервалом в 1 неделю.
Чтобы определить влияние лечения на ткани поджелудочной железы и почек, у не являющихся опухоленосителями мышей-самцов Вalb c nu/nu проводили такое же лечение, как и у животных, включенных в исследование эффективности. В 2 разных момента времени после последней терапевтической инъекции (12 недель и 24 недели) животных умерщвляли и собирали ткани поджелудочной железы и почек для патологического анализа.
В обоих исследованиях массу тела животных и/или размер опухоли измеряли два раза в неделю. Когда размер опухоли был ≥2000 мм3, или уменьшение массы тела животных составляло ≥20% в течение 48 часов, животных исключали из исследования. В исследовании эффективности животных контролировали до достижения максимально допустимого возраста 230 дней.
ОФЭКТ/КТ
Для количественной оценки поглощения опухолью ОФЭКТ/КТ-визуализацию выполняли в дополнительной группе животных с ксенотрансплантатами РС-3 (n = 2 на группу). Когда размер опухоли составлял 477±57 мм3, животным вводили те же количества пептидов, что и животным, включенным в исследования эффективности и токсичности. Спустя 4 часа и 24 часа после 1-й терапевтической инъекции, и спустя 4 часа после 2-й и 3-й терапевтической инъекции проводили сканирование всего тела посредством ОФЭКТ/КТ на гибридном сканере ОФЭКТ/КТ (VECTor5, MILabs, Утрехт, Нидерланды). ОФЭКТ анализ проводили за 30 минут с 40 положениями подложки, используя точечный коллиматор 2,0 мм, с отчетным пространственным разрешением 0,85 мм (Ivashchenko O, van der Have F, Goorden MC, Ramakers RM, Beekman FJ. Ultra-high-sensitivity submillimeter mouse SPECT. J Nucl Med. 2015; 56:470-475). ОФЭКТ изображения были реконструированы с использованием окон фотопиков 113 и 208 кэВ, с окном фона с обеих сторон фотопика с шириной 20% от соответствующего фотопика, и соответствующим методом реконструкции SR-OSEM (Vaissier PE, Beekman FJ, Goorden MC. Similarity-regulation of OS-EM for accelerated SPECT reconstruction. Phys Med Biol. 2016; 61:4300-4315), размер вокселя 0,8 мм3, и регистрировали данные КТ. Применяли последующую реконструкцию 3-мерного гауссовского фильтра (1 мм FWHM). КТ выполняли со следующими настройками: 0,24 мА, 50 кВ, полное угловое сканирование, 1 положение. КТ реконструировали на 100 мкм3.
Патологический анализ
Ткань поджелудочной железы и почек, собранную для патологического анализа, фиксировали формалином и заливали парафином. Окрашивание гематоксилином и эозином проводили на срезах тканей толщиной 4 мкм с использованием протокола Ventana Symphony™ H&E (Ventana), чтобы определить различия в структуре тканей между 4 группами лечения. В общей сложности оценивали 4 среза тканей, отделенных друг от друга на 50 мкМ, для каждого органа. Срезы, окрашенные гематоксилином и эозином, были оценены опытными патологами.
Дозиметрия
Реалистичную мышиную модель RADAR (Keenan MA, Stabin MG, Segars WP, Fernald MJ. RADAR realistic animal model series for dose assessment. J Nucl Med. 2010; 51:471-476) с массой тела 25 г, и данные из ранее опубликованных исследований по биораспределению и фармакокинетике (Dalm SU, Bakker IL, de Blois E, et al. 68Ga/177Lu-NeoBOMB1, a Novel Radiolabeled GRPR Antagonist for Theranostic Use in Oncology. J Nucl Med. 2017; 58:293-299) использовали для расчета дозы для опухоли, поджелудочной железы и почек, когда животным вводили 3×30 МБк/300 пмоль, 4×40 МБк/400 пмоль или 3×60 МБк/600 пмоль 177Lu-NeoBОМВ1. Данные по биораспределению из нашей ранее опубликованной статьи (Dalm SU, Bakker IL, de Blois E, et al. 68Ga/177Lu-NeoBOMB1, a Novel Radiolabeled GRPR Antagonist for Theranostic Use in Oncology. J Nucl Med. 2017; 58:293-299) были подогнаны для экспоненциальных кривых для определения кривой времени-активности в опухоли и органах. Интегрированные по времени активности для 177Lu были получены путем интеграции этих экспоненциальных кривых, сложенных с кривой распада 177Lu (T1/2 = 6,647 дней). Поглощенные дозы на введенную активность были получены путем умножения на S-значения для органов по Keenan et al. (Keenan MA, Stabin MG, Segars WP, Fernald MJ. RADAR realistic animal model series for dose assessment. J Nucl Med. 2010; 51:471-476) или с использованием S-значений сферических узлов (Stabin MG, Konijnenberg MW. Re-evaluation of absorbed fractions for photons and electrons in spheres of various sizes. J Nucl Med. 2000; 41:149-160) для опухоли 340 мг.
Дозиметрию опухоли использовали для прогнозирования терапевтического результата, используя вероятность контроля опухоли (ТСР) на основе линейной квадратичной (LQ) модели (Konijnenberg MW, Breeman WA, de Blois E, et al. Therapeutic application of CCK2R-targeting PP-F11: influence of particle range, activity and peptide amount. EJNMMI Res. 2014; 4:47).
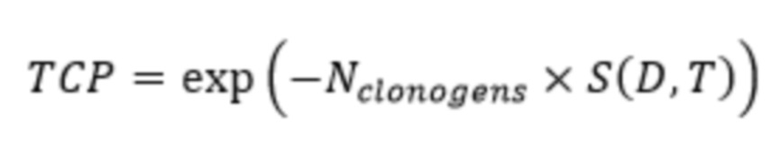
С Nclonogens количество клоногенных (стволовых) клеток в опухоли и S(D,T) выживших фракций клеток является функцией поглощенной дозы D и времени T. Модель LQ указывает на выживание как функцию поглощенной дозы для роста опухоли с удвоенным временем Td:
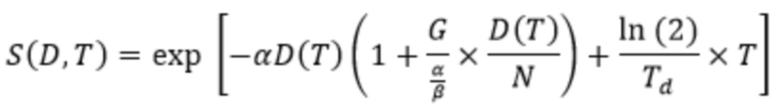 ,
,
где α является чувствительностью опухоли к излучению, α/β является соотношением между прямой (α) и косвенной (β) чувствительностью к излучению, а G является временным фактором, выражающим развитие косвенного повреждения при доставке дозы в зависимости от периода полуисчезновения эффективного вещества и периода полувосстановления после сублетального повреждения. Время удвоения опухоли определяли путем подгонки экспоненциальной функции роста к объему опухоли по времени в контрольной группе. Параметры чувствительности к излучению для опухолей PC-3 были получены из данных выживаемости LDR и HDR брахитерапии и α/β = 4,1 (2,5 - 5,7) Гр (Carlson DJ, Stewart RD, Li XA, Jennings K, Wang JZ, Guerrero M. Comparison of in vitro and in vivo alpha/beta ratios for prostate cancer. Phys Med Biol. 2004; 49:4477-4491). Период полувосстановления после сублетального повреждения для PC-3 опухолей составил 6,6 (5,3 - 8,0) часов (Carlson DJ, Stewart RD, Li XA, Jennings K, Wang JZ, Guerrero M. Comparison of in vitro and in vivo alpha/beta ratios for prostate cancer. Phys Med Biol. 2004; 49:4477-4491), но значение было консервативно закреплено на более низком уровне 1 час (Joiner M, Kogel Avd. Basic clinical radiobiology. 4th ed. London: Hodder Arnold; 2009). Модель TCP была использована для выбора применяемой активности, которая приводит только к задержке роста (TCP = 0%), частичному ответу (TCP >75%) и полному ответу (TCP = 100%). Плотность клоногенных клеток в ксенотрансплантатах PC-3 составила 106 клеток/см3.
Анализ объема опухоли
Время удвоения опухоли определяли путем подгонки функции экспоненциального роста к объему опухоли по времени в контрольной группе. В группах лечения интервал с экспоненциальным снижением объема опухоли был подогнан к началу повторного роста после времени самой низкой точки. Кривые роста были экстраполированы за пределы точек цензурирования для мышей со слишком большими опухолями (>2000 мм3), чтобы определить среднюю статистику роста. Время задержки роста опухоли определяли индивидуально, сравнивая время, необходимое для достижения максимального размера опухоли 2000 мм3, со средним временем, найденным в контрольной группе.
Статистика
Для статистических анализов использовали программное обеспечение PRISM (версия 5.01, программное обеспечение GraphPad). Значения p>0,05 считались статистически значимыми. Разница в ростах объема опухоли и времени задержки для 4 групп была установлена с односторонним тестом ANOVA с несколькими сравнительными тестами Бонферрони. Подгонку кривых проводили в соответствии с методом наименьших квадратов с критерием Пирсона R2, чтобы количественно определить их пригодность.
Результаты
ОФЭКТ/КТ
В большинстве моментов времени среднее поглощение радиоактивности, количественно определяемое на ОФЭКТ/КТ, было самым высоким в группе 3, а затем в группе 2 и группе 1. Однако различия между группами не были достоверными. Фигура 1А показывает сканирование одного животного каждой группы, полученное через 4 часа и через 24 часа после 1-й инъекции, и через 4 часа после 2-й и 3-й инъекции. Количественное поглощение опухолью изображено на Фигуре 1В.
Эффективность лечения 177Lu-NeoВОМВ1
Терапия 177Lu-NeoВОМВ1 оказалась эффективной. У животных в контрольной группе опухоли достигли размера 2000 мм3 в пределах 20,3 ± 5,9 дней, в то время как этот размер был достигнут за 97±59 дней, 103±66 дней и 95±26 дней для группы 1, группы 2 и группы 3, соответственно (Фигура 2А). Кроме того, два животных из группы 1 и одно животное из группы 2 не показывали никаких опухолей как результат полного ответа. Тем не менее, не было значительных различий во времени задержки роста опухоли в группах лечения, тогда как разница с контрольной группой была очень значительной (P <0,0001).
В соответствии с вышесказанным, животные в группах лечения имели значительно лучшее выживание при сравнении с контрольной группой (P<0,001) (Фиг.2В). Среднее выживание составляло 19 дней, 82 дня, 89 дней и 99 дней для контрольной группы, группы 1, группы 2 и группы 3, соответственно.
Пять животных (n = 3 из группы 2 и n = 2 из группы 3) были исключены из исследования из-за следующих причин: 1 животное погибло после 1-й инъекции, 1 животное имело очень маленькую опухоль в начале терапии, которая исчезла в течение нескольких дней, 1 животное имела потерю массы тела более 10% в течение 48 часов, и у 1 животного накапливалась жидкость в брюшной полости. Не отмечено признаков того, что любое из упомянутых событий было связано с лечением.
Токсичность для почек и поджелудочной железы
Животные, включенные в исследование токсичности, не показали критического снижения массы тела в течение всего периода наблюдения (Фиг.3). Масса тела животных увеличилась в первые недели и оставалась относительно устойчивой с течением времени. Одно животное в контрольной группе (ID: B) и одно животное из группы 1 (ID: 869) показали снижение массы тела, но оно составило менее чем 10% в течение 48 часов.
Гистопатологические анализы поджелудочной железы не показали повреждения тканей или других нарушений (Фиг.4). Что касается почек (Фиг.5), небольшие области с лимфоцитарной инфильтрацией наблюдались в почках через 12 недель и через 24 недели после последней терапевтической инъекции. Она была отмечена в почках животных в контрольной группе и в опытных группах, указывая на то, что это явление не было связано с лечением. Спустя двадцать четыре недели после лечения атрофия и фиброз наблюдались в почках только одного животного, которое получило самую низкую терапевтическую дозу (ID: 864), и эти явления вряд ли связаны с лечением. В почках обоих животных от группы 3, которые были умерщвлены через 24 недели после начала лечения, наблюдался легкий хронический воспалительный ответ.
Дозиметрия
Была проведена оценка дозы радиоактивности для опухоли, поджелудочной железы и почек после лечения 3×30 МБк/300 пмоль, 3×40 МБк/400 пмоль или 3×60 МБк/600 пмоль 177Lu-NeoВОМВ1 (см. Таблицу 3 ниже). Для этого предполагалось, что поглощение опухолью и органами было сходным после каждой инъекции.
Таблица 3. Расчетные дозы для опухоли, поджелудочной железы и почки, когда животных лечили 3×30 МБк/300 пмоль, 3×40 МБк/400 пмоль или 3×60 МБк/600 пмоль 177Lu-NeoВОМВ1*.
| название | год | авторы | номер документа |
|---|---|---|---|
| МЕЧЕННЫЙ РАДИОАКТИВНЫМ ИЗОТОПОМ АНТАГОНИСТ GRPR ДЛЯ ПРИМЕНЕНИЯ В КАЧЕСТВЕ ЛЕЧЕБНО-ДИАГНОСТИЧЕСКОГО СРЕДСТВА | 2020 |
|
RU2839888C1 |
| АНТАГОНИСТЫ GRPR ДЛЯ ОБНАРУЖЕНИЯ, ДИАГНОСТИКИ И ЛЕЧЕНИЯ GRPR-ПОЗИТИВНОГО ОНКОЛОГИЧЕСКОГО ЗАБОЛЕВАНИЯ | 2013 |
|
RU2693465C2 |
| СТАБИЛЬНАЯ КОНЦЕНТРИРОВАННАЯ РАДИОФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2020 |
|
RU2839656C1 |
| АНТАГОНИСТЫ GRPR ДЛЯ ОБНАРУЖЕНИЯ, ДИАГНОСТИКИ И ЛЕЧЕНИЯ GRPR-ПОЗИТИВНОГО ОНКОЛОГИЧЕСКОГО ЗАБОЛЕВАНИЯ | 2013 |
|
RU2821944C2 |
| КОНЪЮГАТЫ АНТАГОНИСТА ПЕПТИДА АНАЛОГА БОМБЕЗИНА | 2009 |
|
RU2523531C2 |
| ТЕРАПЕВТИЧЕСКИЕ СРЕДСТВА И ИХ ПРИМЕНЕНИЕ | 2012 |
|
RU2606773C2 |
| НОВЫЕ ПСА-СВЯЗЫВАЮЩИЕ АГЕНТЫ И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2787105C2 |
| СПОСОБЫ ЛЕЧЕНИЯ РАКА | 2019 |
|
RU2825637C2 |
| ПОЛИПЕПТИДЫ АНТИТЕЛ И ИХ ПРИМЕНЕНИЯ | 2014 |
|
RU2687163C1 |
| КОМПЛЕКС, СОДЕРЖАЩИЙ НАЦЕЛИВАЮЩЕЕСЯ НА PSMA СОЕДИНЕНИЕ, СВЯЗАННОЕ С РАДИОНУКЛИДОМ СВИНЦА ИЛИ ТОРИЯ | 2018 |
|
RU2795398C2 |
Настоящее изобретение относится к радиофармацевтическим средствам, а именно к направленной на рецептор гастрин-высвобождающего пептида (GRPR) фармацевтической композиции, содержащей антагонист GRPR с радиоактивной меткой и поверхностно-активное вещество, содержащее полиэтиленгликоль-15-гидроксистеарат. При этом антагонист имеет следующую формулу: MС-S-P, где М является радиоактивным металлом, а C является хелатором, связывающим M; S является необязательным спейсером, ковалентно связанным между C и N-концом P; P является пептидным антагонистом рецептора GRP общей формулы: Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-Xaa7-Z, где Xаа1 представляет собой D-изомер Phe; Xaa2 представляет собой Gln; Xаа3 представляет собой Trp; Xаа4 представляет собой Ala; Xaa5 представляет собой Val; Xаа6 представляет собой Gly; Xaa7 представляет собой His; Z представляет собой -NH-алкил или Z представляет собой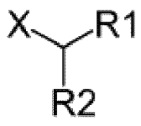 , где X представляет собой NH, а R1 и R2 являются одинаковыми или различными и выбраны из протона или необязательно замещенного алкила. Настоящее изобретение также относится к применению указанной фармацевтической композиции, способу лечения или профилактики рака и способу визуализации опухоли. Изобретение позволяет обеспечить получение устойчивой фармацевтической композиции, предотвращая адгезию пептида. 5 н. и 8 з.п. ф-лы, 8 ил., 3 табл., 2 пр.
, где X представляет собой NH, а R1 и R2 являются одинаковыми или различными и выбраны из протона или необязательно замещенного алкила. Настоящее изобретение также относится к применению указанной фармацевтической композиции, способу лечения или профилактики рака и способу визуализации опухоли. Изобретение позволяет обеспечить получение устойчивой фармацевтической композиции, предотвращая адгезию пептида. 5 н. и 8 з.п. ф-лы, 8 ил., 3 табл., 2 пр.
1. Направленная на рецептор гастрин-высвобождающего пептида (GRPR) фармацевтическая композиция, содержащая
антагонист GRPR с радиоактивной меткой, имеющий следующую формулу:
MС-S-P,
где М является радиоактивным металлом, а C является хелатором, связывающим M;
S является необязательным спейсером, ковалентно связанным между C и N-концом P;
P является пептидным антагонистом рецептора GRP общей формулы:
Xaa1-Xaa2-Xaa3-Xaa4-Xaa5-Xaa6-Xaa7-Z;
Xаа1 представляет собой D-изомер Phe;
Xaa2 представляет собой Gln;
Xаа3 представляет собой Trp;
Xаа4 представляет собой Ala;
Xaa5 представляет собой Val;
Xаа6 представляет собой Gly;
Xaa7 представляет собой His;
Z представляет собой -NH-алкил или Z представляет собой
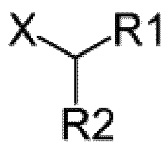 ,
,
где X представляет собой NH, а R1 и R2 являются одинаковыми или различными и выбраны из протона или необязательно замещенного алкила; и
поверхностно-активное вещество, содержащее полиэтиленгликоль-15-гидроксистеарат.
2. Фармацевтическая композиция по п.1, где S представляет собой остаток п-аминобензиламиндигликолевой кислоты.
3. Фармацевтическая композиция по п.1 или 2, где P представляет собой DPhe-Gln-Trp-Ala-Val-Gly-His-NH-CH(CH2-CH(CH3)2)2.
4. Фармацевтическая композиция по любому из предыдущих пунктов, где антагонист GRPR представляет собой NeoВОМВ1 формулы (I):
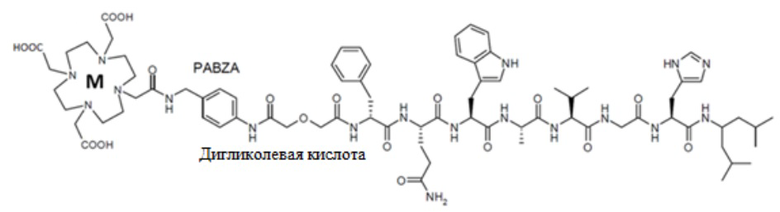
где M представляет собой радиоактивный металл, предпочтительно M выбран из 177Lu, 68Ga.
5. Фармацевтическая композиция по любому из предыдущих пунктов, где антагонист GRPR с радиоактивной меткой присутствует в концентрации, обеспечивающей объемную радиоактивность по меньшей мере 100 МБк/мл, предпочтительно от 250 до 500 МБк/мл.
6. Фармацевтическая композиция по любому из предыдущих пунктов, где поверхностно-активное вещество присутствует в концентрации по меньшей мере 5 мкг/мл, предпочтительно по меньшей мере 25 мкг/мл, более предпочтительно от 50 до 1000 мкг/мл.
7. Фармацевтическая композиция по любому из предыдущих пунктов, где антагонист GRPR с радиоактивной меткой несет 177Lu, 68Ga или 111In.
8. Фармацевтическая композиция по любому из предыдущих пунктов, представляющая собой водный раствор.
9. Фармацевтическая композиция по любому из предыдущих пунктов, представляющая собой раствор для инфузии.
10. Применение фармацевтической композиции по любому из пп.1-9 для лечения или профилактики рака.
11. Применение фармацевтической композиции по любому из пп.1-9 для визуализации in vivo, предпочтительно визуализации посредством ПЭТ или ОФЭКТ.
12. Способ лечения или профилактики рака у субъекта, нуждающегося в этом, включающий введение указанному субъекту терапевтически эффективного количества композиции по любому из пп.1-9.
13. Способ визуализации опухолей in vivo у субъекта, нуждающегося в этом, в частности для обнаружения положительных по GRPR опухолей, включающий введение указанному субъекту эффективного количества композиции по любому из пп.1-9 и детекцию сигнала, полученного при распаде радиоизотопа, присутствующего в указанном соединении, обеспечивая тем самым определение положительных по GRPR опухолей.
| WO 2014052471 A1, 03.04.2014 | |||
| CHI EVA Y., Excipients Used in Biotechnology Products, Pharmaceutical Excipients: Properties, Functionality, and Applications in Research and Industry, First Edition, Edited by Otilia M.Y | |||
| Koo, 2016, p | |||
| Заслонка для русской печи | 1919 |
|
SU145A1 |
| STRICKLEY R.G., Solubilizing Excipients in Oral and Injectable Formulations, Pharmaceutical Research, | |||
Авторы
Даты
2023-06-30—Публикация
2019-10-11—Подача