ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
В настоящей заявке заявлен приоритет, согласно Кодексу законов США, раздел 35, § 119(e), по предварительной заявке на патент США с серийным № 62/734649, поданной 21 сентября 2018 года, полное описание которой включено в настоящий документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
В настоящем описании раскрыты конъюгаты для доставки лекарственных соединений для таргетной терапии. В настоящем описании раскрыты способы лечения рака, экспрессирующего PSMA, комбинацией соединений формул I-Lu или Ia-Lu и I-Ac или Ia-Ac, где 177Lu или 225Ac связаны в комплекс с соединениями I и Ia. В настоящем описании также раскрыты способы лечения рака, экспрессирующего PSMA, комбинацией соединений формул I-Lu или Ia-Lu и I-Ac или Ia-Ac.
УРОВЕНЬ ТЕХНИКИ
Простатоспецифический мембранный антиген (PSMA) представляет собой связанный с мембраной клеточной поверхности гликопротеин II типа с молекулярной массой ~110 кДа, содержащий внутриклеточный сегмент (аминокислоты 1-18) и трансмембранный домен (аминокислоты 19-43), а также крупный внеклеточный домен (аминокислоты 44-750). В то время как функции внутриклеточного сегмента и трансмембранных доменов в настоящее время считаются незначительными, внеклеточный домен участвует в нескольких реальных процессах. PSMA играет роль в центральной нервной системе, где он метаболизирует N-ацетиласпартилглутамат (NAAG) в глутаминовую и N-ацетиласпарагиновую кислоту. Соответственно, иногда его упоминают также как N-ацетилированную альфа-связанную кислотную дипептидазу (NAALADase). PSMA также называют фолатгидролазой I (FOLH I) или глутаматкарбоксипептидазой (GCP II) благодаря его роли в проксимальном тонком кишечнике, где он отщепляет γ-связанный глутамат от поли-γ-глутамированного фолата и α-связанный глутамат от пептидов и низкомолекулярных соединений.
PSMA получил свое название, главным образом, вследствие более высокого уровня его экспрессии на клетках рака предстательной железы; однако его конкретное действие на клетки рака предстательной железы остается невыясненным. Экспрессия PSMA у людей существенно ограничена, происходит только в ткани слюнных желез, почечной ткани и в небольшом количестве клеток в тонком и толстом кишечнике. PSMA сверхэкспрессируется в злокачественных тканях предстательной железы, по сравнению с другими органами человеческого организма, такими как почки, проксимальный тонкий кишечник и слюнные железы. Повышенная экспрессия PSMA связана с высокозлокачественным, метастатическим и кастрационно-резистентным заболеванием. Экспрессия в опухоли при раке предстательной железы обычно в 100-1000 раз выше. В отличие от многих других мембраносвязанных белков, PSMA подвергается быстрой интернализации в клетку подобно рецепторам, связанным с клеточной поверхностью, таким как рецепторы витаминов. PSMA интернализируется через ямки, окаймленные клатрином, и затем может либо возвращаться на клеточную поверхность, либо двигаться к лизосомам. Сделано предположение, что димерная и мономерная форма PSMA являются взаимопревращаемыми, несмотря на дискуссии о прямых доказательствах такого взаимного превращения. Даже если так, ферментативной активностью обладает только димер PSMA, а мономер не обладает.
PSMA также экспрессируется на новообразованных сосудах других опухолей, таких как рак щитовидной железы, светлоклеточная карцинома почек, переходноклеточная карцинома мочевого пузыря, аденокарцинома толстой кишки, нейроэндокринная карцинома, мультиформная глиобластома, злокачественная меланома, карцинома протоков поджелудочной железы, немелкоклеточная карцинома легких и саркома мягких тканей, карцинома молочной железы. Указанные раковые заболевания представляют собой широкий ряд различных опухолей с различными гистологическими подтипами, скоростью роста и продолжительностью клеточного цикла. В некоторых случаях раковые опухоли внедряются в нормальные ткани, имеющие различную стойкость к облучению. Кроме того, гипоксические области более крупных депозитарных изменений также могут обусловливать радиорезистентность. Эти и другие факторы, как известно, обусловливают разный объективный ответ на традиционную наружную дистанционную лучевую терапию.
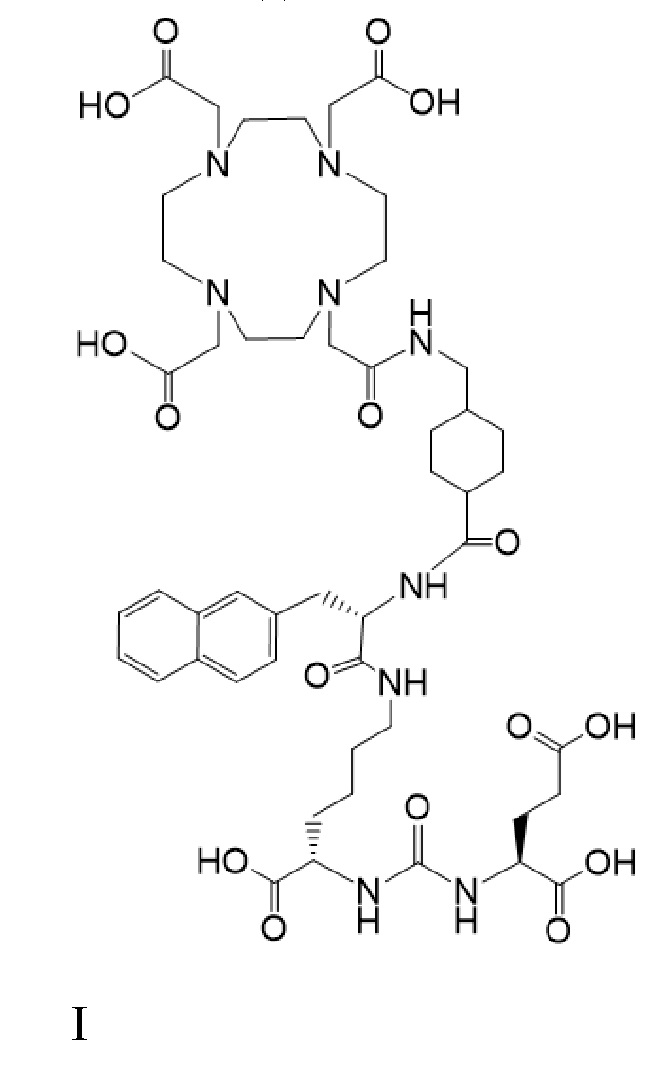
Несмотря на то, что активность PSMA на клеточной поверхности клеток предстательной железы остается на стадии исследования, авторы согласно настоящему раскрытию полагают, что PSMA представляет собой заслуживающую внимания мишень для селективной и/или специфической доставки биологически активных агентов или комбинаций биологически активных агентов, содержащих лекарственные соединения, в указанные клетки предстательной железы. Одним из таких лекарственных соединений является соединение формулы I
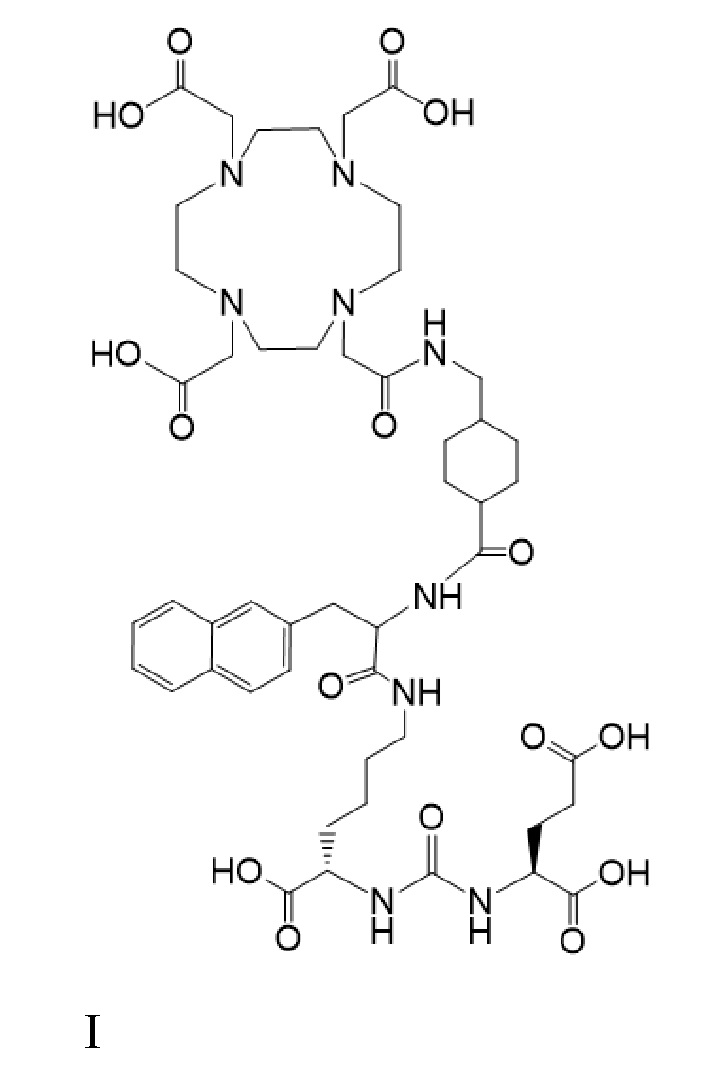
причем 177Lu связан в комплекс с указанным соединением с образованием I-Lu, или 225Ac связан в комплекс с указанным соединением с образованием I-Ac, которые пригодны для лечения рака, как описано в WO2015/055318. Соединения I-Lu и I-Ac могут быть получены способами, описанными в публикации WO2015/055318, содержание которой включено в настоящий документ в отношении получения соединений I-Lu и I-Ac, описанного в примере 3 и в примере 5.
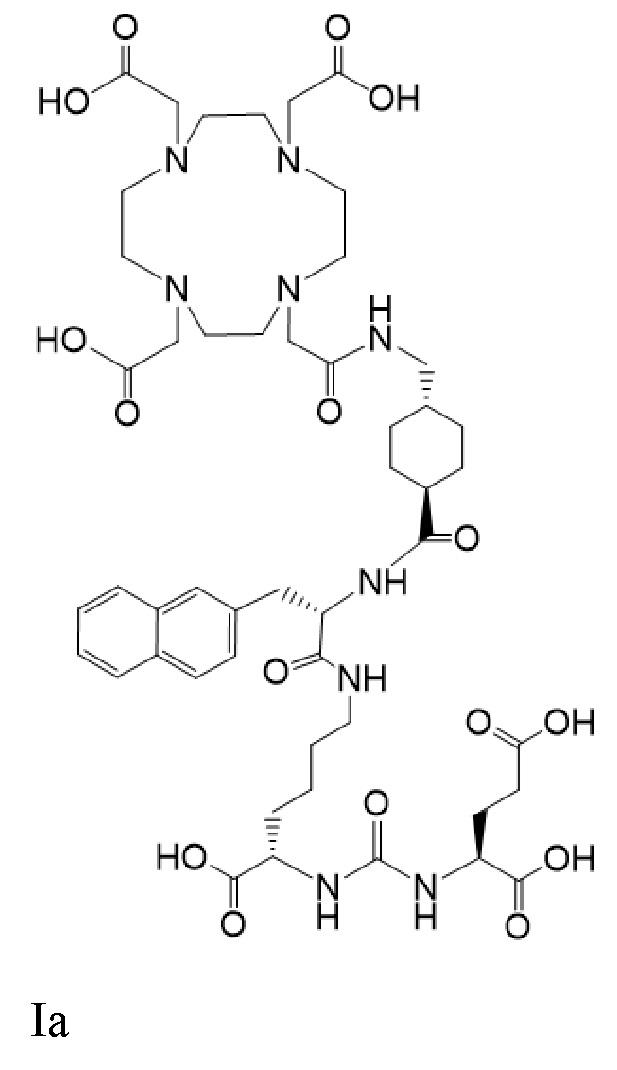
Другим таким лекарственным соединением является соединение Ia
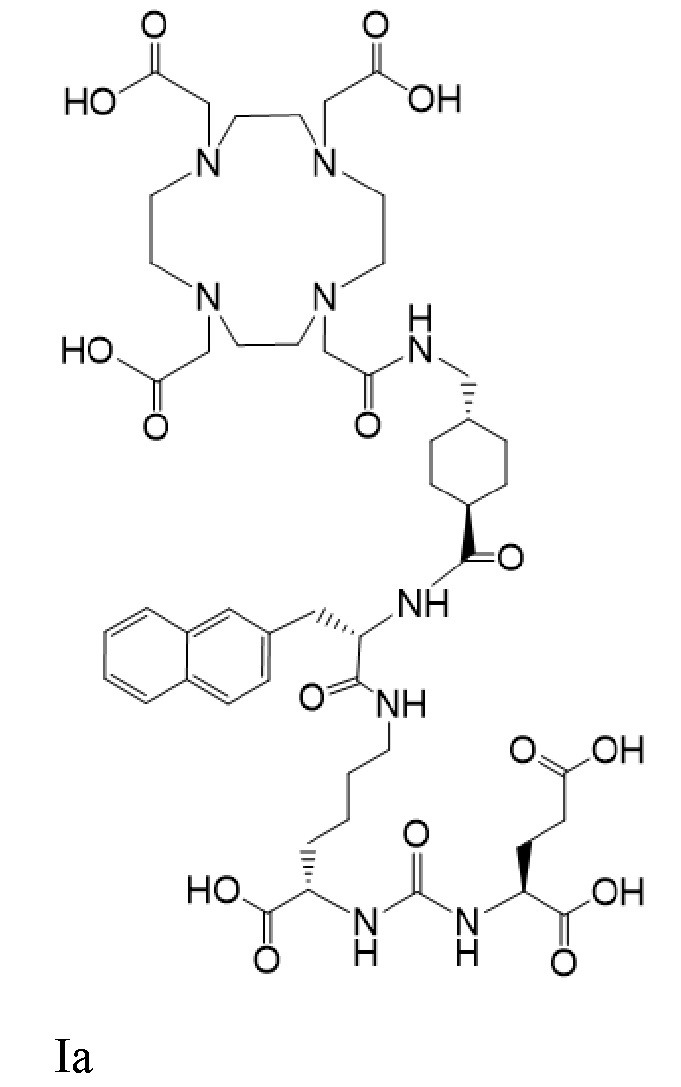
(также известное как (3S,10S,14S)-3-[(нафталин-2-ил)метил]-1,4,12-триоксо-1-[(1R,4S)-4-[[2-[4,7,10-трис(карбоксиметил)-1,4,7,10-тетраазоциклододекан-1-ил]ацетамидо]метил]циклогексил]-2,5,11,13-тетраазагексадекан-10,14,16-трикарбоновая кислота), причем 177Lu связан в комплекс с соединением Ia с образованием Ia-Lu, или 225Ac связан в комплекс с указанным соединением с образованием Ia-Ac, которые пригодны для лечения рака, как описано в WO2015/055318. Соединения Ia-Lu и Ia-Ac могут быть получены способами, описанными в публикации WO2015/055318, содержание которой включено в настоящий документ в отношении получения соединений Ia-Lu и Ia-Ac, описанного в примере 3 и в примере 5.
Соединение I или Ia может быть описано как низкомолекулярное соединение, которое специфически связывается с PSMA (простатоспецифическим мембранным антигеном), который экспрессируется на поверхности клеток рака предстательной железы. Соединение I или Ia может быть описано как состоящее из фармакофорного лиганда, глутамат-мочевина-лизин; хелатообразующего соединения, DOTA (способного связывать в комплекс 177Lu и 225Ac); и линкера, связывающего лиганд и хелатообразующее соединение. Не ограничиваясь теорией, полагают, что фармакофорный лиганд на основе мочевины обеспечивает возможность связывания и интернализации указанного агента в PSMA в очаге заболевания. Кроме того, полагают, что связывание I-Lu, I-Ac, Ia-Lu или Ia-Ac может приводить к интернализации посредством эндоцитоза, что может обеспечивать длительное удерживание лиганда и связанного с ним радиоактивного карго внутри раковой клетки.
В известных клинических способах терапии с применением радиолигандов (RLT) используют 131I при раке щитовидной железы, а также элементы, испускающие альфа-излучение, такие как 223радий или 89стронций, для лечения метастазов в кости.
177Lu имеет период полураспада 6,7 суток. Он испускает комбинацию энергии 0,5 МэВ, состоящей из отрицательно заряженных бета-частиц (электронов), которые хаотично проходят через ткани на примерно 20-80 клеток или 0,5-2 мм и вызывают, главным образом, повреждение оснований и одноцепочечные разрывы. При высокой дозе указанные повреждения могут вступать во взаимодействия и обусловливать переход сублетального поражения (SLD) или потенциально летального поражения (PLD) в непоправимое летальное поражение. 177Lu также испускает излучение 113 кВ и 208 кВ, которое можно использовать для визуализации.
225Ac имеет период полураспада 9,9 суток и, напротив, испускает альфа-частицы с энергией 8,38 МВ. Лишь 0,5% энергии испускается в форме фотонов с 142 кВ. Таким образом, большинство радиационных частиц имеют положительный заряд, и их количество примерно в 8000 раз больше, чем β-частиц. Кроме того, энергия от указанных частиц поглощается на относительно коротком расстоянии (2-3 клетки). В результате возникает плотное и тяжелое повреждение ткани в форме разрывов двойной спирали с множеством поврежденных сайтов, которое представляет сбой непоправимое летальное повреждение. Это так называемая ионизация с высокой линейной передачей энергии (LET) или плотноионизирующее излучение, которое обеспечивает доставку в 3-7 раз более высокой поглощенной дозы, чем β.
Тип клеточного повреждения, вызванный любым изотопом (177Lu или 225Ac), предположительно является другим вследствие различий характеристик каждой из активных групп. 177Lu предположительно обеспечивает более продолжительную радиационную длину и, следовательно, может быть эффективным для доставки радиации в соседние клетки. Преобладание одноцепочечных разрывов, особенно в присутствии кислорода, обеспечивает возможность восстановления сублетального повреждения (SLD) и/или потенциально летального повреждения (PLD), создавая оптимальные условия для нормального восстановления ткани. Напротив, 225Ac обеспечивает доставку чрезвычайно мощного излучения с высокой линейной передачей энергии излучения (LET), и возможность восстановления нормальной ткани ограничена гораздо больше. Радиологическая биологическая эффективность альфа-излучения по меньшей мере в 5 раз выше, чем для бета-излучения, при введении доз следует учитывать относительную биологическую эффективность (RBE). В случае 225Ac терапии тип вызываемого повреждения ДНК не требует наличия кислорода, следовательно, она также может быть более эффективной в гипоксических зонах опухоли. Возможным недостатком 225Ac терапии является то, что короткая длина пробега может приводить к депонированию большого количества поражающего излучения лишь в пределах короткого расстояния из 2-4 клеток.
Другим таким соединением является конъюгат 4 для визуализации PSMA
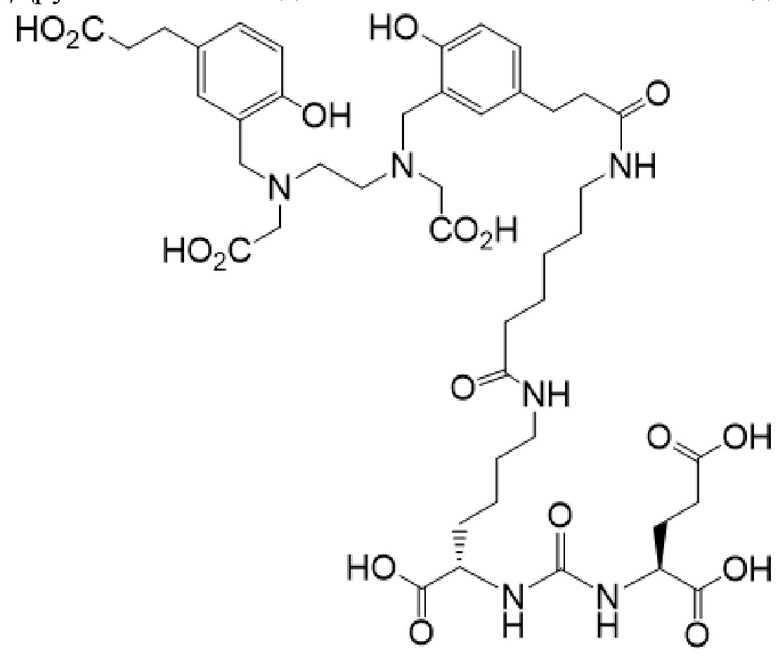
(также известный как 4,6,12,19-тетраазадокозан-1,3,7-трикарбоновая кислота, 22-[3-[[[2-[[[5-(2-карбоксиэтил)-2-гидроксифенил]метил](карбоксиметил)амино]этил](карбоксиметил)амино]метил]-4-гидроксифенил]-5,13,20-триоксо-(3S,7S)), где 68Ga (или подобный радиоактивный изотоп металла) связан в комплекс с указанным конъюгатом, который пригоден для визуализации рака, как описано в публикации Eder M, Schafer M, Bauder-Wust U, Hull WE, Wangler C, Mier W, et al. 68Ga-complex lipophilicity and the targeting property of a urea-based PSMA inhibitor for PET imaging. Bioconjug Chem. 2012; 23: 688-97. Конъюгат 4 для визуализации PSMA может быть получен в соответствии со способами, описанными в публикации (Eder, 2012), и публикация (Eder, 2012) включена в настоящий документ посредством ссылки в отношении получения конъюгата 4 для визуализации PSMA, описанного в примерах.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
В некоторых вариантах реализации согласно настоящему раскрытиюсогласно настоящему раскрытию предложен способ лечения рака у пациента, нуждающегося в таком лечении, включающий введение пациенту терапевтически эффективного количества соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac.
В некоторых вариантах реализации согласно настоящему раскрытию предложено применение соединения I-Lu или Ia-Lu в комбинации с соединением I-Ac или Ia-Ac для лечения рака у пациента. В некоторых аспектах применение включает введение пациенту терапевтически эффективного количества соединения I-Lu или Ia-Lu и терапевтически эффективного количества соединения I-Ac или Ia-Ac.
В некоторых вариантах реализации согласно настоящему раскрытию предложено применение комбинации соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac для получения лекарственного средства, пригодного для лечения рака у пациента. В некоторых аспектах предложенное лекарственное средство содержит терапевтически эффективную комбинацию соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac.
В некоторых вариантах реализации согласно настоящему раскрытию предложено применение соединения I-Lu или Ia-Lu для получения лекарственного средства, пригодного для лечения рака у пациента, в комбинации с соединением I-Ac или Ia-Ac. В некоторых аспектах предложенное лекарственное средство содержит терапевтически эффективное количество соединения I-Lu или I-Lu.
В некоторых вариантах реализации согласно настоящему раскрытию предложено применение соединения I-Ac или Ia-Ac для получения лекарственного средства, пригодного для лечения рака у пациента, в комбинации с соединением I-Lu или Ia-Lu. В некоторых аспектах предложенное лекарственное средство содержит терапевтически эффективное количество соединения I-Ac или I-Ac.
В некоторых вариантах реализации согласно настоящему раскрытию предложено применение соединения I-Lu или Ia-Lu для получения первого лекарственного средства, пригодного для лечения рака у пациента, в комбинации со вторым лекарственным средством, содержащим соединение I-Ac или Ia-Ac. В некоторых аспектах первое лекарственное средство содержит терапевтически эффективное количество соединения I-Lu или I-Lu, и второе лекарственное средство содержит терапевтически эффективное количество соединения I-Ac или I-Ac.
В некоторых аспектах указанных вариантов реализации рак представляет собой рак, экспрессирующий PSMA. В некоторых аспектах указанных вариантов реализации предложенное соединение имеет чистоту по меньшей мере примерно 98 процентов. В некоторых вариантах реализации рак выбран из группы, состоящей из глиомы, карциномы, саркомы, лимфомы, меланомы, мезотелиомы, карциномы носоглотки, лейкоза, аденокарциномы и миеломы.
В некоторых аспектах указанных вариантов реализации рак выбран из группы, состоящей из рака легких, рака кости, рака поджелудочной железы, рака кожи, рака головы, рака шеи, кожной меланомы, внутриглазной меланомы, рака матки, рака яичника, эндометриального рака, ректального рака, рака желудка, рака толстой кишки, карциномы молочной железы, трижды негативного рака молочной железы, метастатического рака молочной железы, карциномы фаллопиевых труб, карциномы эндометрия, карциномы шейки матки, карциномы влагалища, карциномы вульвы, болезни Ходжкина, рака пищевода, рака тонкого кишечника, рака эндокринной системы, рака щитовидной железы, рака паращитовидной железы, немелкоклеточной карциномы легких, рака надпочечников, саркомы мягких тканей, рака уретры, рака пениса, рака предстательной железы, метастатического кастрационно-резистентного рака предстательной железы (mCRPC), рака щитовидной железы, переходно-клеточной карциномы мочевого пузыря, аденокарциномы толстой кишки, нейроэндокринной карциномы, мультиформной глиобластомы, злокачественной меланомы, карциномы протоков поджелудочной железы, хронического лейкоза, острого лейкоза, лимфоцитарной лимфомы, плевральной мезотелиомы, рака мочевого пузыря, лимфомы Беркитта, рака уретры, рака почки, почечно-клеточной карциномы, карциномы почечной лоханки, неоплазм центральной нервной системы (ЦНС), первичной лимфомы ЦНС, опухолей оси позвоночника, глиомы, глиомы ствола головного мозга, аденомы гипофиза и аденокарциномы желудочно-пищеводного соединения. В некоторых аспектах указанных вариантов реализации рак представляет собой первичный или вторичный рак головного мозга. В некоторых аспектах указанных вариантов реализации рак представляет собой рак предстательной железы. В некоторых аспектах указанных вариантов реализации рак представляет собой метастатический рак предстательной железы.
В некоторых аспектах указанных вариантов реализации комбинацию соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac вводят в парентеральной лекарственной форме. В некоторых аспектах указанных вариантов реализации парентеральная лекарственная форма выбрана из группы, состоящей из внутрикожной, подкожной, внутримышечной, интраперитонеальной, внутривенной и интратекальной. В некоторых аспектах указанных вариантов реализации терапевтически эффективное количество I-Lu или Ia-Lu составляет от примерно 2 ГБк до примерно 13 ГБк. В некоторых аспектах указанных вариантов реализации терапевтически эффективное количество I-Lu или Ia-Lu составляет от примерно 4 ГБк до примерно 11 ГБк. В некоторых аспектах указанных вариантов реализации терапевтически эффективное количество I-Lu или Ia-Lu составляет от примерно 5 ГБк до примерно 10 ГБк. В некоторых аспектах указанных вариантов реализации терапевтически эффективное количество I-Lu или Ia-Lu составляет от примерно 6 ГБк до примерно 9 ГБк. В некоторых аспектах указанных вариантов реализации терапевтически эффективное количество I-Lu или Ia-Lu составляет от примерно 6,5 ГБк до примерно 8,5 ГБк. В некоторых аспектах указанных вариантов реализации терапевтически эффективное количество I-Lu или Ia-Lu составляет от примерно 7 ГБк до примерно 8 ГБк. В некоторых аспектах указанных вариантов реализации терапевтически эффективное количество I-Lu или Ia-Lu составляет примерно 7,4 ГБк. В некоторых аспектах указанных вариантов реализации суммарная доза I-Lu или Ia-Lu составляет от примерно 15 ГБк до примерно 200 ГБк. В некоторых аспектах указанных вариантов реализации суммарная доза I-Lu или Ia-Lu составляет от примерно 25 ГБк до примерно 185 ГБк. В некоторых аспектах указанных вариантов реализации суммарная доза I-Lu или Ia-Lu составляет от примерно 35 ГБк до примерно 150 ГБк. В некоторых аспектах указанных вариантов реализации суммарная доза I-Lu или Ia-Lu составляет от примерно 40 ГБк до примерно 100 ГБк. В некоторых аспектах указанных вариантов реализации суммарная доза I-Lu или Ia-Lu составляет примерно 44 ГБк. В некоторых аспектах указанных вариантов реализации максимальная продолжительность лечения субъекта составляет от примерно 19 до 23 месяцев.
В некоторых аспектах указанных вариантов реализации терапевтически эффективное количество I-Ac или Ia-Ac составляет от примерно 1 МБк до примерно 20 МБк. В некоторых аспектах указанных вариантов реализации терапевтически эффективное количество I-Ac или Ia-Ac составляет от примерно 4 МБк до примерно 14 МБк. В некоторых аспектах указанных вариантов реализации терапевтически эффективное количество I-Ac или Ia-Ac составляет от примерно 5 МБк до примерно 10 МБк. В некоторых аспектах указанных вариантов реализации терапевтически эффективное количество I-Ac или Ia-Ac составляет от примерно 6 МБк до примерно 8 МБк. В некоторых аспектах указанных вариантов реализации терапевтически эффективное количество I-Ac или Ia-Ac составляет от примерно 1 МБк до примерно 4 МБк. В некоторых аспектах указанных вариантов реализации терапевтически эффективное количество I-Ac или Ia-Ac составляет от примерно 2 МБк до примерно 3 МБк. В некоторых аспектах указанных вариантов реализации терапевтически эффективное количество I-Ac или Ia-Ac составляет примерно 2,5 МБк.
В других аспектах способы и области применения, описанные в настоящем документе, дополнительно включают визуализацию экспрессии PSMA раковой опухолью. В некоторых аспектах указанных вариантов реализации стадию визуализации осуществляют до стадии введения. В некоторых аспектах указанных вариантов реализации стадию визуализации осуществляют после стадии введения. В некоторых аспектах указанных вариантов реализации визуализацию осуществляют посредством формирования изображения, причем формирование изображение выбрано из группы, состоящей из визуализации однофотонной эмиссионной компьютерной томографией (ОФЭКТ), визуализации протонно-эмиссионной томографией (ПЭТ), иммуногистохимии (ИГХ) и флуоресцентной гибридизации in situ (FISH). В некоторых аспектах указанных вариантов реализации визуализацию осуществляют посредством формирования изображения ОФЭКТ.
В некоторых аспектах указанных вариантов реализации стадия визуализации включает введение пациенту конъюгата формулы 2, визуализирующего лиганд PSMA
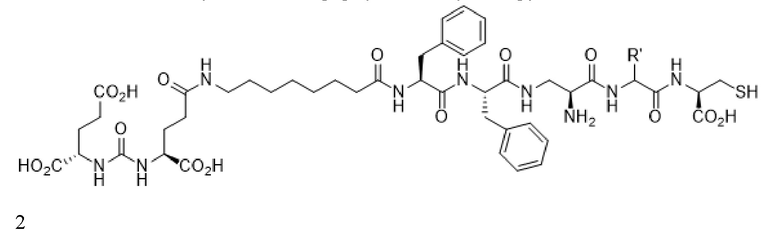
или его фармацевтически приемлемой соли, где R' представляет собой водород, или R' выбран из группы, состоящей из алкила, аминоалкила, карбоксиалкила, гидроксиалкила, гетероалкила, арила, арилалкила и гетероарилалкила, каждый из которых необязательно замещен, и при этом радионуклид связан с указанным конъюгатом.
В некоторых аспектах указанных вариантов реализации стадия визуализации включает введение конъюгата формулы 3, визуализирующего лиганд PSMA
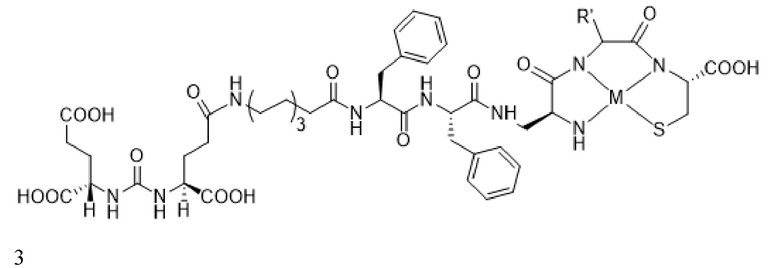
или его фармацевтически приемлемой соли, где R' представляет собой водород, или R' выбран из группы, состоящей из алкила, аминоалкила, карбоксиалкила, гидроксиалкила, гетероалкила, арила, арилалкила и гетероарилалкила, каждый из которых необязательно замещен, и при этом M представляет собой катион радионуклида. В некоторых аспектах указанных вариантов реализации M в конъюгате или его фармацевтически приемлемой соли выбран из группы, состоящей из изотопа галлия, изотопа индия, изотопа меди, изотопа технеция и изотопа рения. В некоторых аспектах указанных вариантов реализации M в конъюгате или его фармацевтически приемлемой соли представляет собой изотоп технеция.
В некоторых аспектах указанных вариантов реализации конъюгат, визуализирующий лиганд PSMA, имеет формулу 2a
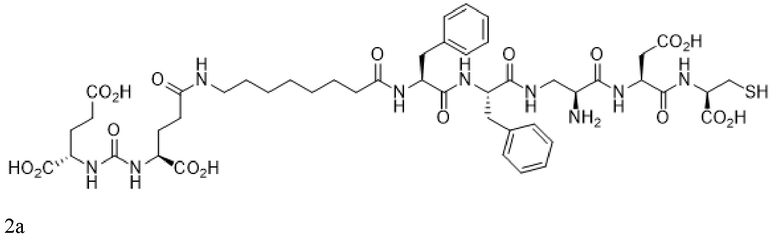
или его фармацевтически приемлемая соль, причем радионуклид связан с указанным конъюгатом. В некоторых аспектах указанных вариантов реализации конъюгат, визуализирующий лиганд PSMA, имеет формулу 3a
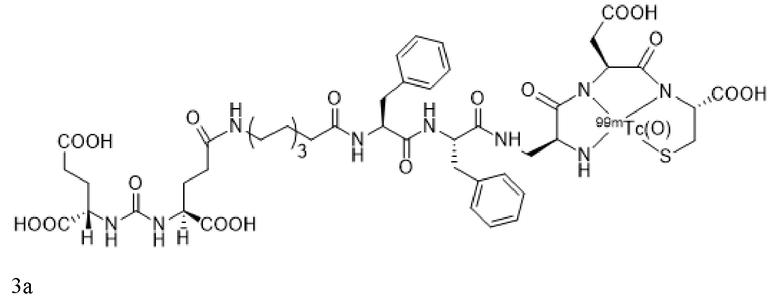
или его фармацевтически приемлемая соль.
В некоторых аспектах указанных вариантов реализации стадия визуализации включает введение пациенту конъюгата формулы 4, визуализирующего лиганд PSMA
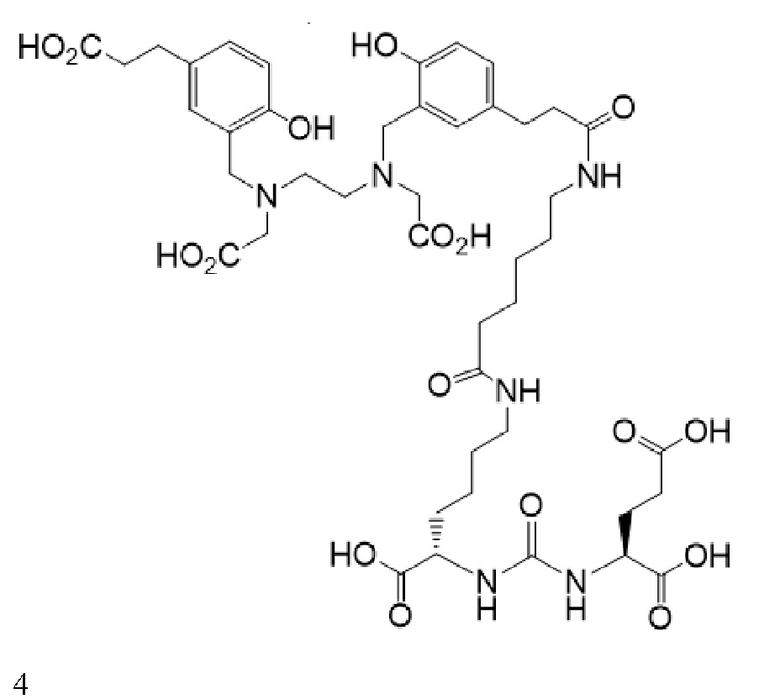
или его фармацевтически приемлемая соль, причем радионуклид связан с указанным конъюгатом. В некоторых аспектах указанных вариантов реализации радионуклид представляет собой 68Ga.
В некоторых аспектах указанных вариантов реализации стадия визуализации включает обнаружение соединения формулы I-Lu или Ia-Lu, введенного с целью лечения.
В других аспектах способы и области применения, описанные в настоящем документе, дополнительно включают определение с помощью визуализации статуса PSMA у пациента. В некоторых аспектах указанных вариантов реализации стадию такого определения осуществляют до стадии введения. В некоторых аспектах указанных вариантов реализации стадию такого определения осуществляют после стадии введения. В некоторых аспектах указанных вариантов реализации визуализация представляет собой формирование изображения ОФЭКТ. В некоторых аспектах указанных вариантов реализации статус PSMA у пациента коррелирует с улучшением клинических показателей у пациента. В некоторых аспектах указанных вариантов реализации улучшение клинических показателей выбрано из группы, состоящей из замедления роста опухоли, стабилизации заболевания, частичного ответа и полного ответа. В некоторых аспектах указанных вариантов реализации улучшение клинических показателей представляет собой стабилизацию заболевания. В некоторых аспектах указанных вариантов реализации PSMA-позитивные поражения указывают на функционально активный PSMA.
В некоторых аспектах указанных вариантов реализации стадия такого определения включает введение пациенту конъюгата формулы 2, визуализирующего лиганд PSMA
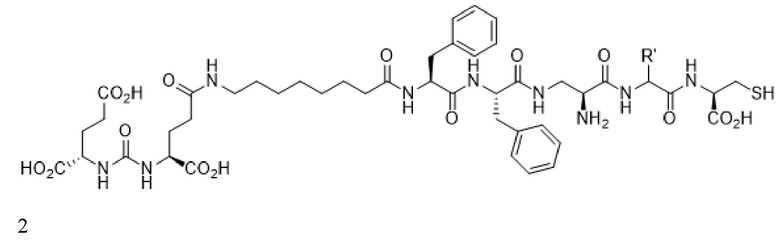
или его фармацевтически приемлемой соли, где R' представляет собой водород, или R' выбран из группы, состоящей из алкила, аминоалкила, карбоксиалкила, гидроксиалкила, гетероалкила, арила, арилалкила и гетероарилалкила, каждый из которых необязательно замещен, и при этом конъюгат связан с радионуклидом.
В некоторых аспектах указанных вариантов реализации стадия указанного определения включает введение конъюгата формулы 3, визуализирующего лиганд PSMA
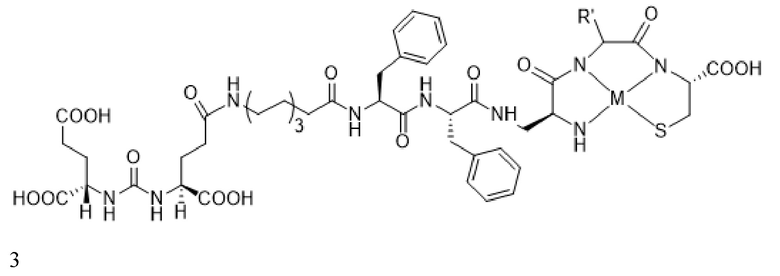
или его фармацевтически приемлемой соли, где R' представляет собой водород, или R' выбран из группы, состоящей из алкила, аминоалкила, карбоксиалкила, гидроксиалкила, гетероалкила, арила, арилалкила и гетероарилалкила, каждый из которых необязательно замещен, и при этом M представляет собой катион радионуклида.
В некоторых аспектах указанных вариантов реализации M в конъюгате или его фармацевтически приемлемой соли выбран из группы, состоящей из изотопа галлия, изотопа индия, изотопа меди, изотопа технеция и изотопа рения. В некоторых аспектах указанных вариантов реализации M в конъюгате или его фармацевтически приемлемой соли представляет собой изотоп технеция. В некоторых аспектах указанных вариантов реализации конъюгат, визуализирующий лиганд PSMA, имеет формулу 2a
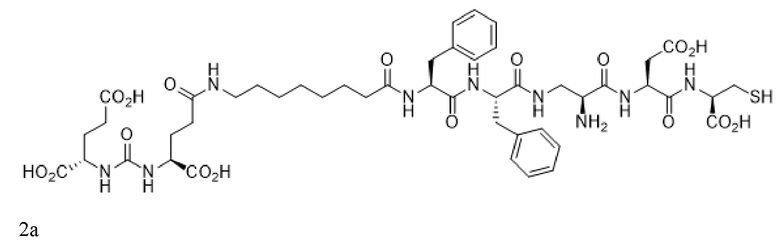
или его фармацевтически приемлемая соль, причем радионуклид связан с указанным конъюгатом.
В некоторых аспектах указанных вариантов реализации конъюгат, визуализирующий лиганд PSMA, имеет формулу 3a
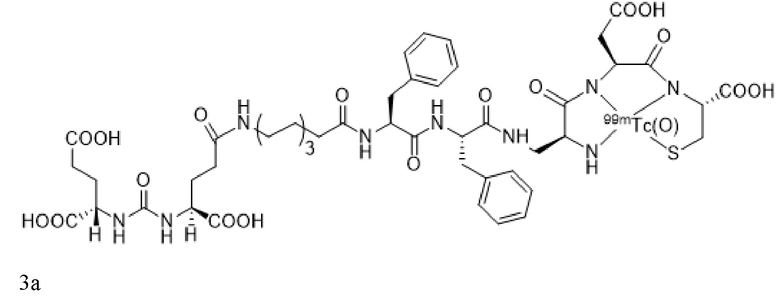
или его фармацевтически приемлемая соль.
В некоторых аспектах указанных вариантов реализации стадия такого определения включает введение пациенту конъюгата формулы 4, визуализирующего лиганд PSMA

или его фармацевтически приемлемая соль, причем радионуклид связан с указанным конъюгатом. В некоторых аспектах указанных вариантов реализации радионуклид представляет собой 68Ga.
В некоторых аспектах указанных вариантов реализации стадия указанного определения включает обнаружение соединения формулы I-Lu или Ia-Lu, введенного с целью лечения.
В других вариантах реализации согласно настоящему раскрытию предложен способ лечения рака у пациента, нуждающегося в таком лечении, включающий введение пациенту терапевтически эффективного количества комбинации соединений I-Lu и I-Ac
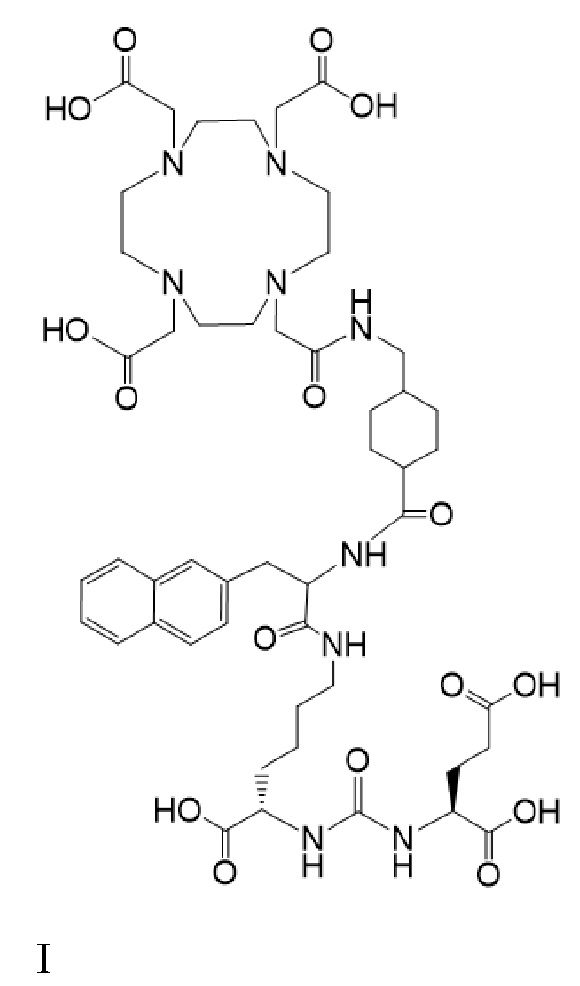
причем 177Lu связан в комплекс с указанным соединением с образованием I-Lu, и 225Ac связан в комплекс с указанным соединением с образованием I-Ac, при этом комбинация соединений I-Lu и I-Ac приводит к стабилизации заболевания.
В других вариантах реализации согласно настоящему раскрытию предложен способ лечения рака у пациента, нуждающегося в таком лечении, включающий введение пациенту терапевтически эффективного количества комбинации соединений Ia-Lu и Ia-Ac
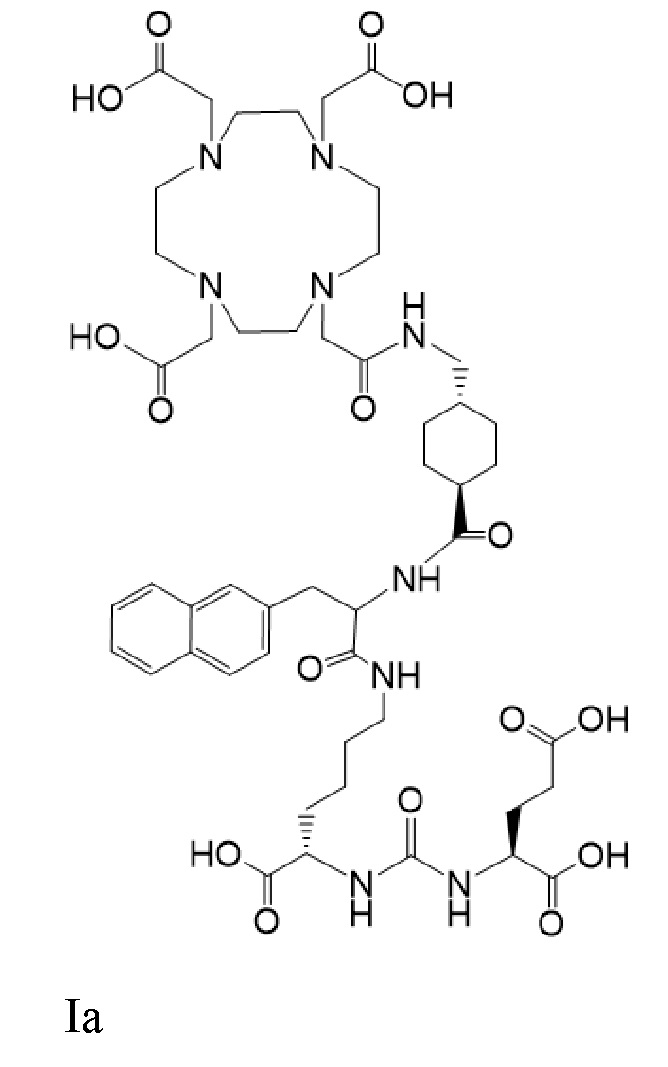
причем 177Lu связан в комплекс с указанным соединением с образованием Ia-Lu, и 225Ac связан в комплекс с указанным соединением I с образованием Ia-Ac, при этом комбинация соединений Ia-Lu и Ia-Ac приводит к стабилизации заболевания.
В других вариантах реализации согласно настоящему раскрытию предложено применение соединений I-Lu и I-Ac
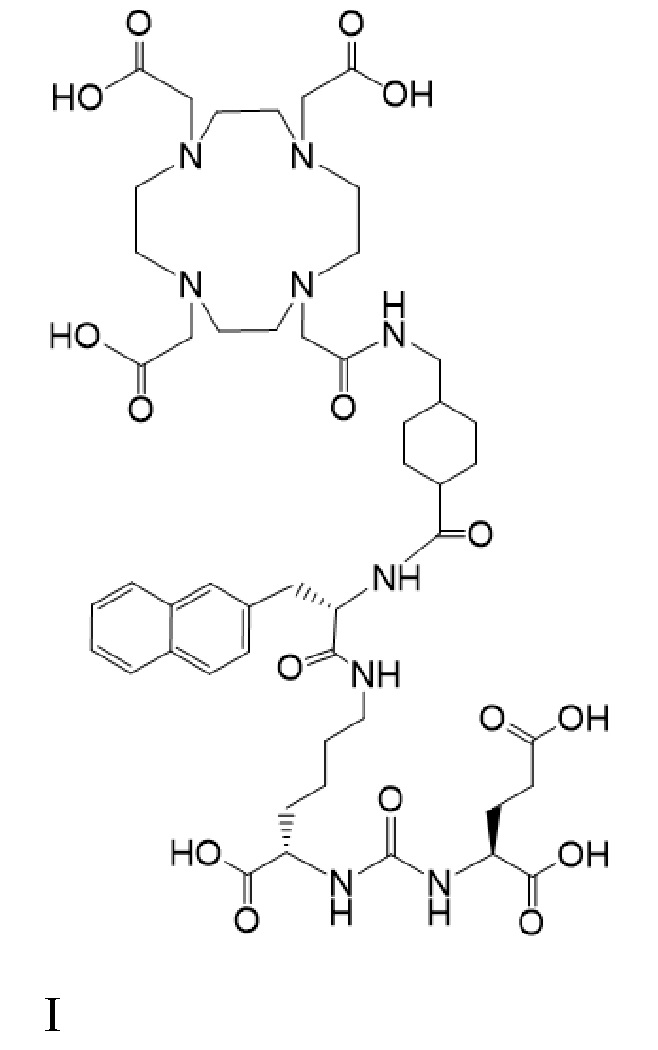
причем 177Lu связан в комплекс с указанным соединением с образованием I-Lu, и 225Ac связан в комплекс с указанным соединением I с образованием Ia-Ac, при этом введение комбинации соединений I-Lu и I-Ac приводит к стабилизации заболевания. В некоторых аспектах указанных вариантов реализации применение включает введение пациенту терапевтически эффективной комбинации соединений I-Lu и I-Ac
В других вариантах реализации согласно настоящему раскрытию предложено применение соединений Ia-Lu и Ia-Ac
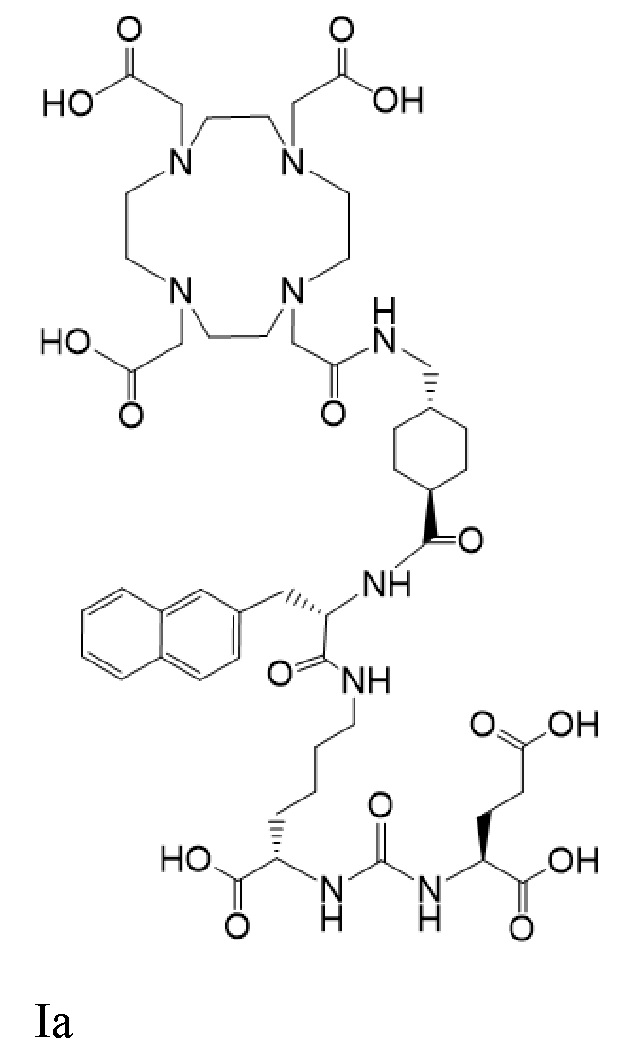
причем 177Lu связан в комплекс с указанным соединением с образованием Ia-Lu, и 225Ac связан в комплекс с указанным соединением Ia с образованием Ia-Ac, при этом введение комбинации соединений Ia-Lu и Ia-Ac приводит к стабилизации заболевания. В некоторых аспектах указанных вариантов реализации применение включает введение пациенту терапевтически эффективной комбинации соединений Ia-Lu и Ia-Ac.
В других вариантах реализации согласно настоящему раскрытию предложено применение соединений I-Lu и I-Ac
причем 177Lu связан в комплекс с соединением I с образованием I-Lu, и 225Ac связан в комплекс с соединением I с образованием I-Ac, для получения лекарственного средства, пригодного для лечения рака у пациента. В некоторых аспектах предложенное лекарственное средство содержит терапевтически эффективную комбинацию соединений I-Lu и I-Ac.
В других вариантах реализации согласно настоящему раскрытию предложено применение соединений I-Lu и I-Ac
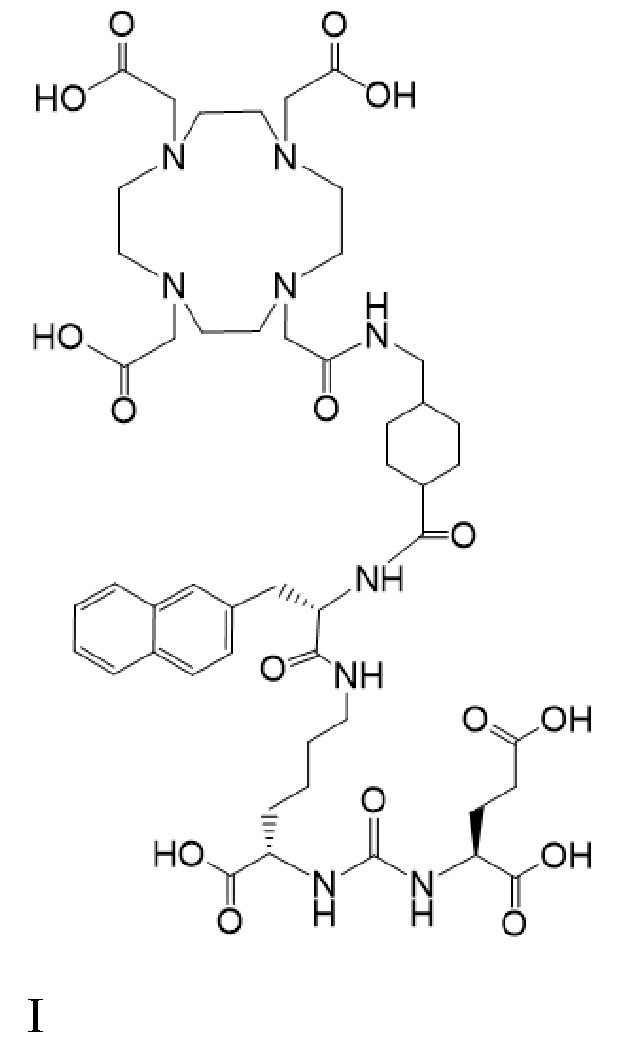
причем 177Lu связан в комплекс с соединением I с образованием I-Lu, и 225Ac связан в комплекс с соединением I с образованием I-Ac, для получения лекарственного средства, пригодного для лечения рака у пациента, при этом введение комбинации соединений I-Lu и I-Ac приводит к стабилизации заболевания. В некоторых аспектах предложенное лекарственное средство содержит терапевтически эффективную комбинацию соединений I-Lu и I-Ac.
В других вариантах реализации согласно настоящему раскрытию предложено применение соединений Ia-Lu и Ia-Ac
причем 177Lu связан в комплекс с соединением Ia с образованием Ia-Lu, и 225Ac связан в комплекс с соединением Ia с образованием Ia-Ac, для получения лекарственного средства, пригодного для лечения рака у пациента. В некоторых аспектах предложенное лекарственное средство содержит терапевтически эффективную комбинацию соединений Ia-Lu и Ia-Ac.
В других вариантах реализации согласно настоящему раскрытию предложено применение соединений Ia-Lu и Ia-Ac
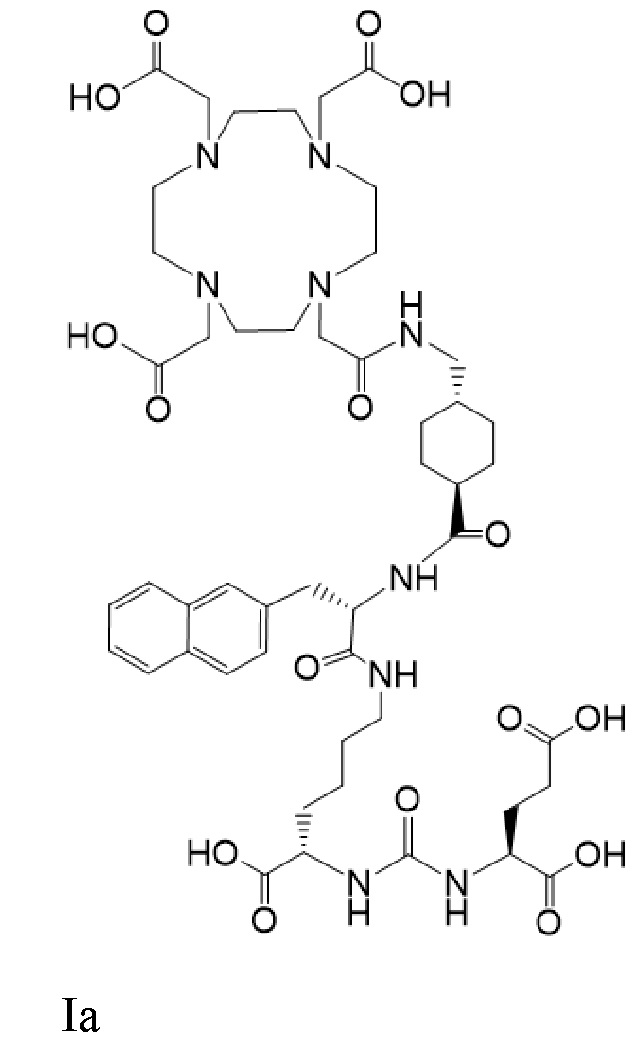
причем 177Lu связан в комплекс с соединением Ia с образованием Ia-Lu, и 225Ac связан в комплекс с соединением Ia с образованием Ia-Ac, для получения лекарственного средства, пригодного для лечения рака у пациента, при этом введение комбинации соединений Ia-Lu и Ia-Ac приводит к стабилизации заболевания. В некоторых аспектах предложенное лекарственное средство содержит терапевтически эффективную комбинацию соединений Ia-Lu и Ia-Ac.
В некоторых аспектах указанных вариантов реализации пациент ранее проходил по меньшей мере одно лечение. В некоторых аспектах указанных вариантов реализации по меньшей мере одно предшествующее лечение выбрано из группы, состоящей из системного лечения андрогенной оси, химиотерапевтического агента, операции, лучевой терапии, иммунотерапии, фотодинамической терапии, терапии с применением стволовых клеток и гипертермии. В некоторых аспектах указанных вариантов реализации по меньшей мере одно предшествующее лечение представляет собой системное лечение. В некоторых аспектах указанных вариантов реализации системное лечение выбрано из группы, состоящей из палифосфамида, 5-фторурацила, капецитабина, пеметрекседа, цисплатина, карбоплатина, гемцитабина, паклитаксела, винорелбина, эрибулина, доцетаксела, циклофосфамида, доксорубицина, регорафиниба и их комбинаций. В некоторых аспектах указанных вариантов реализации рак представляет собой рак, экспрессирующий PSMA. В некоторых аспектах указанных вариантов реализации предложенное соединение имеет чистоту по меньшей мере примерно 98 процентов.
В некоторых аспектах указанных вариантов реализации I-Lu или Ia-Lu вводят до I-Ac или Ia-Ac. В некоторых аспектах указанных вариантов реализации I-Lu или Ia-Lu вводят до I-Ac или Ia-Ac в тот же день. В некоторых аспектах указанных вариантов реализации I-Lu или Ia-Lu вводят одновременно с I-Ac или Ia-Ac. В некоторых аспектах указанных вариантов реализации I-Ac или Ia-Ac вводят до I-Lu или Ia-Lu. В некоторых аспектах указанных вариантов реализации I-Ac или Ia-Ac вводят до I-Lu или Ia-Lu в тот же день.
Некоторые варианты реализации дополнительно описаны следующими нумерованными пунктами:
1. Способ лечения рака у животного-хозяина, включающий стадию введения животному-хозяину терапевтически эффективного количества первого соединения, имеющего формулу I
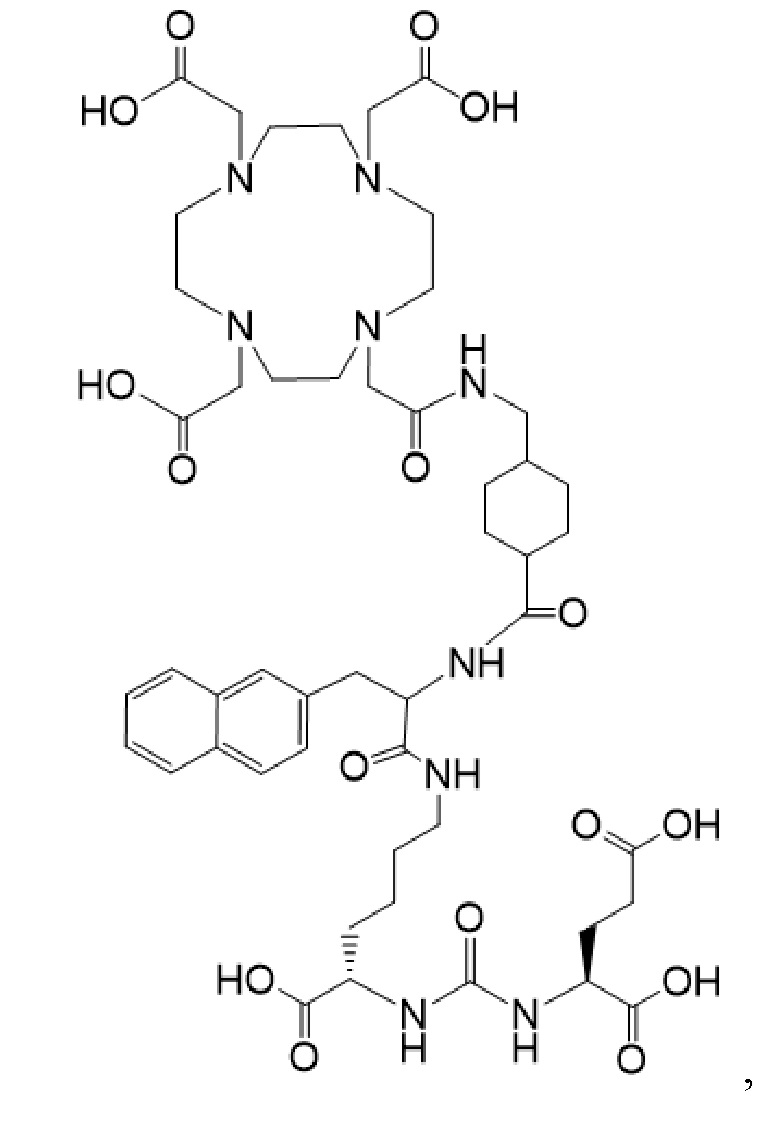
причем указанное соединение связано в комплекс с 177Lu (I-Lu);
в комбинации с терапевтически эффективным количеством второго соединения, имеющего формулу I
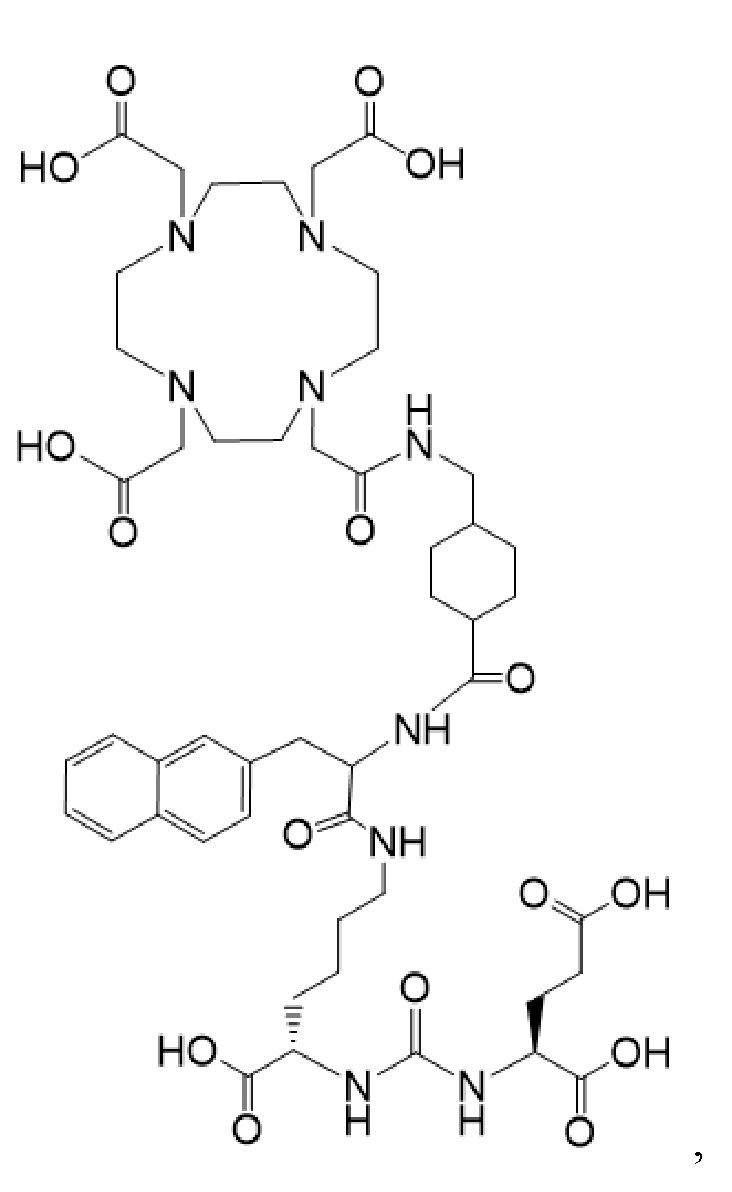
причем указанное соединение связано в комплекс с 225Ac (I-Ac).
2. Способ по п. 1, отличающийся тем, что первое соединение имеет формулу Ia
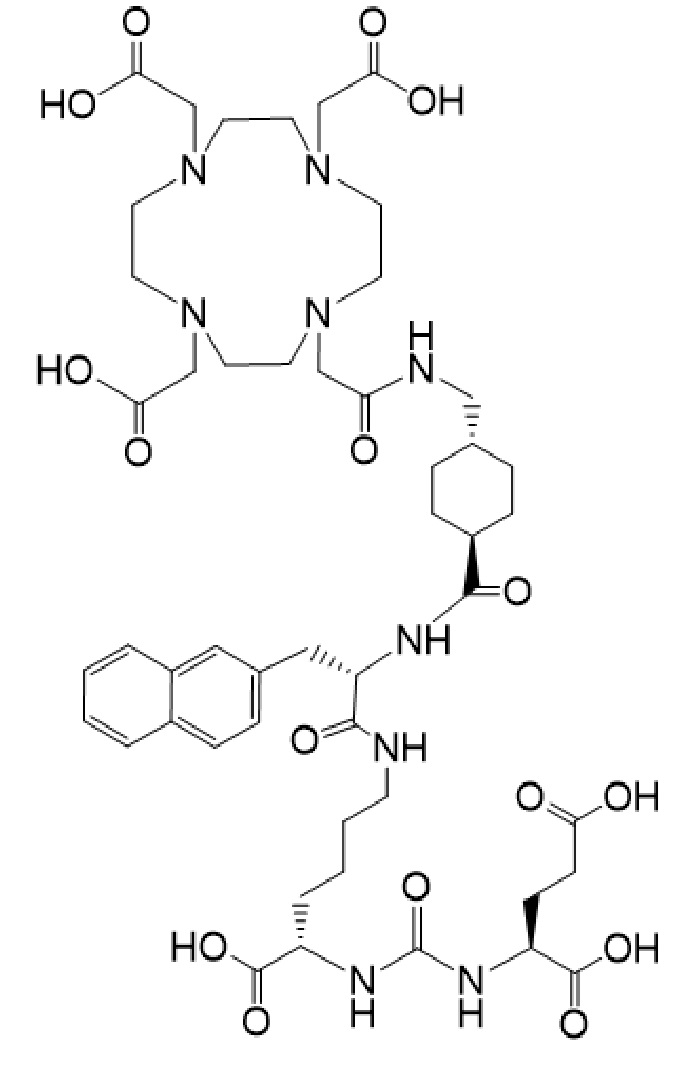
причем указанное соединение связано в комплекс с 177Lu.
3. Способ по п. 1 или 2, отличающийся тем, что второе соединение имеет формулу Ia
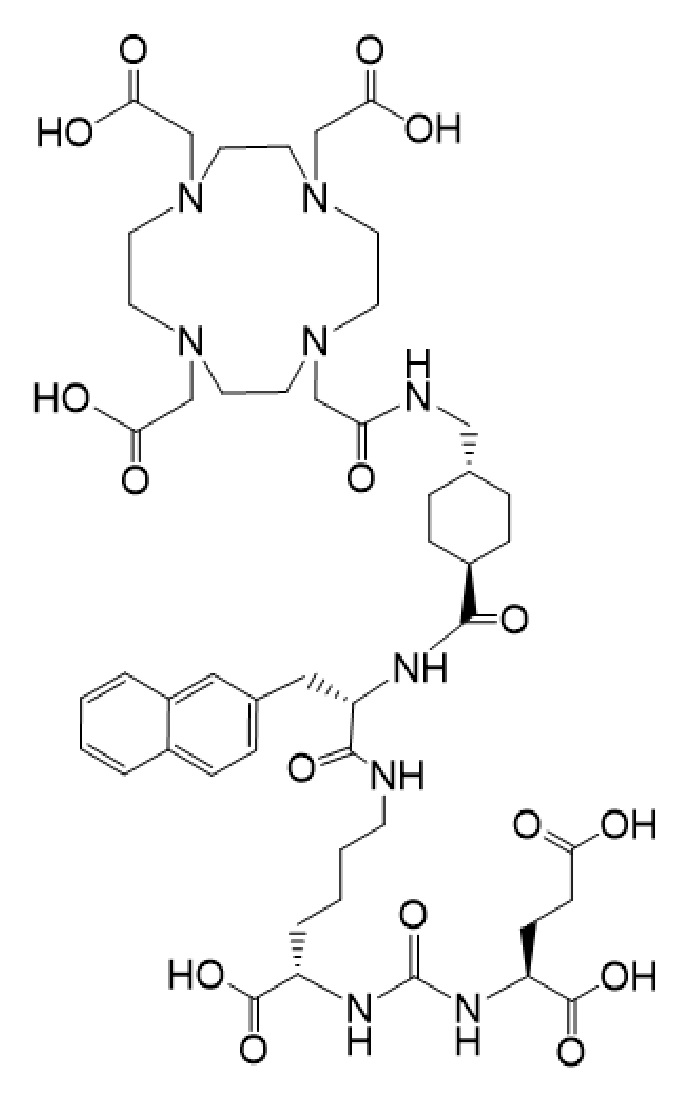
причем указанное соединение связано в комплекс с 225Ac.
4. Способ по пп. 1-3, отличающийся тем, что рак связан с экспрессией простатоспецифического мембранного антигена (PSMA).
5. Способ по любому из предшествующих пунктов, отличающийся тем, что рак выбран из группы, состоящей из рака предстательной железы, метастатического кастрационно-резистентного рака предстательной железы (mCRPC), рака щитовидной железы, почечно-клеточной карциномы, переходно-клеточной карциномы мочевого пузыря, аденокарциномы толстой кишки, нейроэндокринной карциномы, мультиформной глиобластомы, злокачественной меланомы, карциномы протоков поджелудочной железы, немелкоклеточной карциномы легких, саркомы мягких тканей и карциномы молочной железы.
6. Способ по любому из предшествующих пунктов, отличающийся тем, что рак представляет собой рак предстательной железы.
7. Способ по любому из предшествующих пунктов, отличающийся тем, что рак представляет собой метастатический кастрационно-резистентный рак предстательной железы (mCRPC).
8. Способ по любому из предшествующих пунктов, отличающийся тем, что терапевтически эффективное количество I-Lu или Ia-Lu составляет от примерно 2 ГБк до примерно 20 ГБк.
9. Способ по любому из предшествующих пунктов, отличающийся тем, что терапевтически эффективное количество I-Lu или Ia-Lu составляет от примерно 6 ГБк до примерно 8 ГБк.
10. Способ по любому из предшествующих пунктов, отличающийся тем, что терапевтически эффективное количество I-Lu или Ia-Lu составляет примерно 7,4 ГБк.
11. Способ по любому из предшествующих пунктов, отличающийся тем, что терапевтически эффективное количество I-Ac или Ia-Ac составляет от примерно 1 МБк до примерно 10 МБк; или от примерно 5 МБк до примерно 10 МБк; или от примерно 5 МБк до примерно 7 МБк.
12. Способ по любому из предшествующих пунктов, отличающийся тем, что терапевтически эффективное количество I-Ac или Ia-Ac составляет примерно 5 МБк.
13. Способ по любому из предшествующих пунктов, отличающийся тем, что соединение формулы I-Lu или Ia-Lu вводят одновременно с соединением формулы I-Ac или Ia-Ac.
14. Способ по любому из пп. 1-12, отличающийся тем, что соединение формулы I-Lu или Ia-Lu вводят примерно за 1 час до соединения формулы I-Ac или Ia-Ac; или примерно за 12 часов до соединения формулы I-Ac или Ia-Ac; или примерно за 24 часа до соединения формулы I-Ac или Ia-Ac; или примерно за 48 часов до соединения формулы I-Ac или Ia-Ac; или примерно за 72 часа до соединения формулы I-Ac или Ia-Ac.
15. Способ по любому из пп. 1-12, отличающийся тем, что соединение формулы I-Ac или Ia-Ac вводят примерно за 1 час до соединения формулы I-Lu или Ia-Lu; или примерно за 12 часов до соединения формулы I-Lu или Ia-Lu; или примерно за 24 часа до соединения формулы I-Lu или Ia-Lu; или примерно за 48 часов до соединения формулы I-Lu или Ia-Lu; или примерно за 72 часа до соединения формулы I-Lu или Ia-Lu.
16. Способ по п. 13, дополнительно включающий введение терапевтически эффективного количества соединения формулы I-Lu или Ia-Lu в режиме один раз в неделю на протяжении от примерно 1 до примерно 7 циклов после введения I-Lu или Ia-Lu и I-Ac или Ia-Ac.
17. Способ по п. 14, дополнительно включающий введение терапевтически эффективного количества соединения формулы I-Lu или Ia-Lu в режиме один раз в неделю на протяжении от примерно 1 до примерно 7 циклов после введения обоих соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac.
18. Способ по п. 15, дополнительно включающий введение терапевтически эффективного количества соединения формулы I-Lu или Ia-Lu в режиме один раз в неделю на протяжении от примерно 1 до примерно 7 циклов после введения обоих соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac.
19. Соединение формулы I-Lu
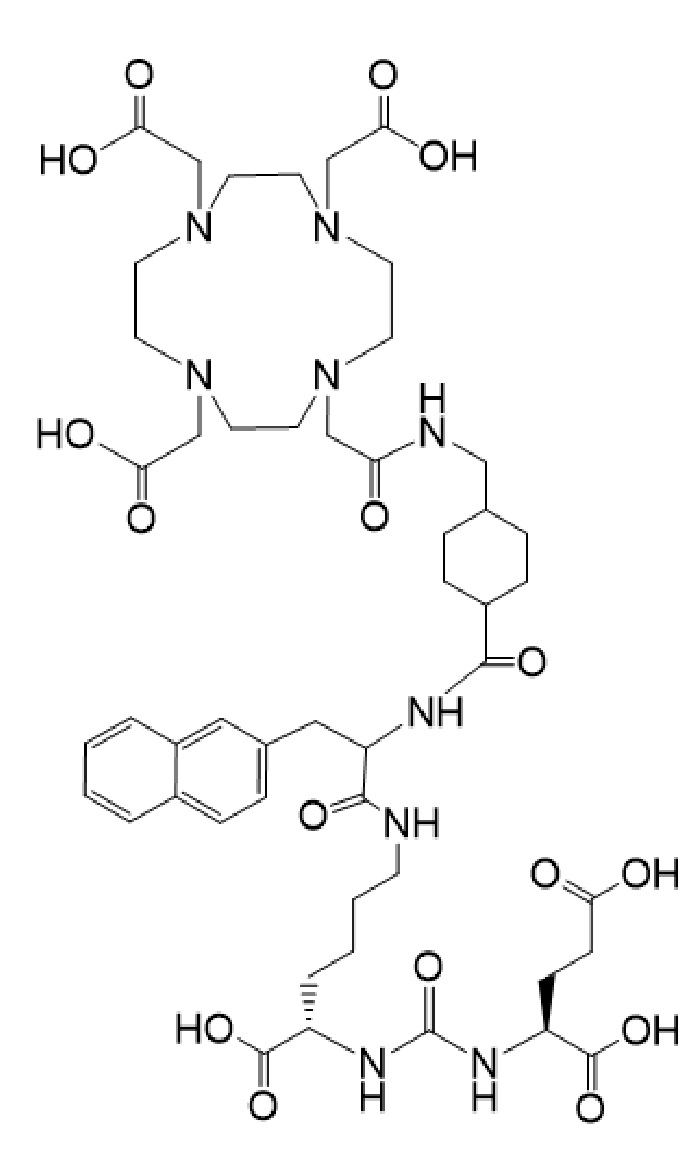
причем указанное соединение связано в комплекс с 177Lu, для применения для лечения рака у пациента в комбинации с терапевтически эффективным количеством соединения формулы I-Ac

причем указанное соединение связано в комплекс с 225Ac.
20. Соединение по п. 19, отличающееся тем, что указанное соединение имеет формулу Ia-Lu
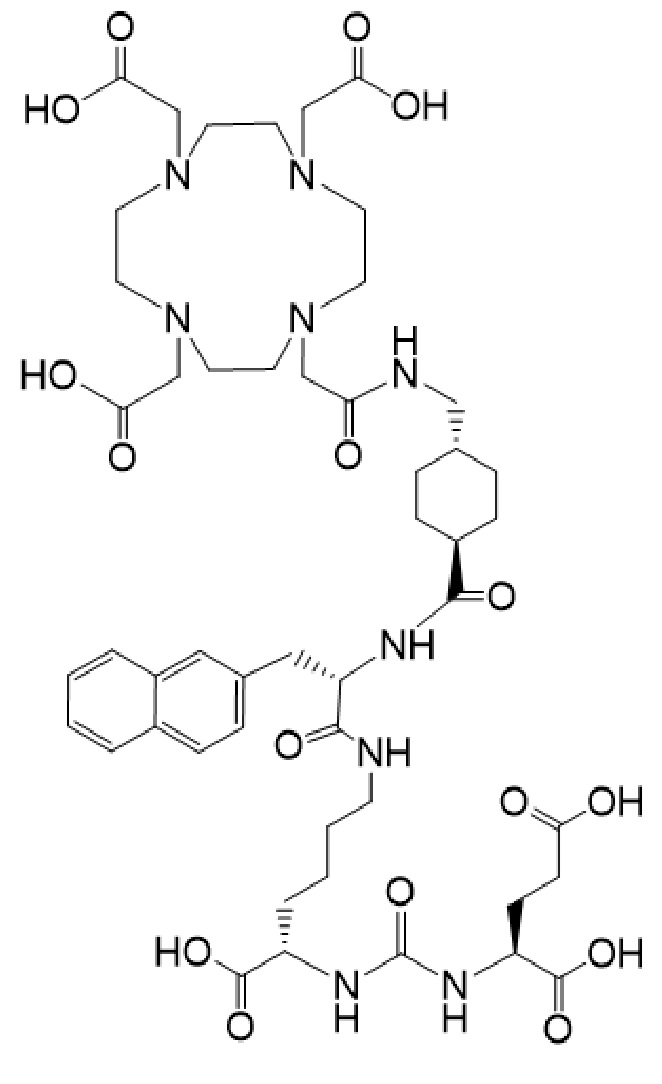
причем указанное соединение связано в комплекс с 177Lu.
21. Соединение по п. 19, отличающееся тем, что соединение I-Ac имеет формулу Ia-Ac
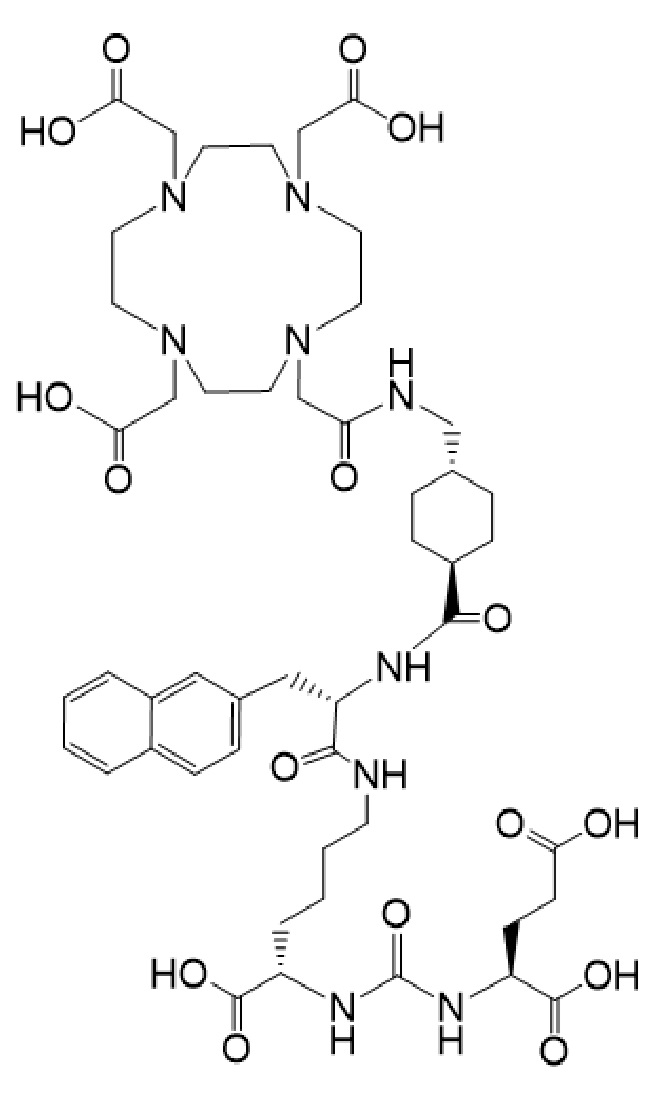
причем указанное соединение связано в комплекс с 225Ac.
22. Соединение по любому из пп. 19-21, отличающееся тем, что рак связан с экспрессией простатоспецифического мембранного антигена (PSMA).
23. Соединение по любому из пп. 19-22, отличающееся тем, что рак выбран из группы, состоящей из рака предстательной железы, метастатического кастрационно-резистентного рака предстательной железы (mCRPC), рака щитовидной железы, почечно-клеточной карциномы, переходно-клеточной карциномы мочевого пузыря, аденокарциномы толстой кишки, нейроэндокринной карциномы, мультиформной глиобластомы, злокачественной меланомы, карциномы протоков поджелудочной железы, немелкоклеточной карциномы легких, саркомы мягких тканей и карциномы молочной железы.
24. Соединение по любому из пп. 19-23, отличающееся тем, что рак представляет собой рак предстательной железы.
25. Соединение по любому из пп. 19-24, отличающееся тем, что рак представляет собой метастатический кастрационно-резистентный рак предстательной железы (mCRPC).
26. Соединение по любому из пп. 19-25, отличающееся тем, что терапевтически эффективное количество I-Lu или Ia-Lu составляет от примерно 2 ГБк до примерно 20 ГБк.
27. Соединение по любому из пп. 19-26, отличающееся тем, что терапевтически эффективное количество I-Lu или Ia-Lu составляет от примерно 6 ГБк до примерно 8 ГБк.
28. Соединение по любому из пп. 19-27, отличающееся тем, что терапевтически эффективное количество I-Lu или Ia-Lu составляет примерно 7,4 ГБк.
29. Соединение по любому из пп. 19-28, отличающееся тем, что терапевтически эффективное количество I-Ac или Ia-Ac составляет от примерно 1 МБк до примерно 10 МБк; или от примерно 5 МБк до примерно 10 МБк; или от примерно 5 МБк до примерно 7 МБк.
30. Соединение по любому из пп. 19-29, отличающееся тем, что терапевтически эффективное количество I-Ac или Ia-Ac составляет примерно 5 МБк.
31. Соединение по любому из пп. 19-30, отличающееся тем, что соединение формулы I-Lu или Ia-Lu вводят одновременно с соединением формулы I-Ac или Ia-Ac.
32. Соединение по любому из пп. 19-30, отличающееся тем, что соединение формулы I-Lu или Ia-Lu вводят примерно за 1 час до соединения формулы I-Ac или Ia-Ac; или примерно за 12 часов до соединения формулы I-Ac или Ia-Ac; или примерно за 24 часа до соединения формулы I-Ac или Ia-Ac; или примерно за 48 часов до соединения формулы I-Ac или Ia-Ac; или примерно за 72 часа до соединения формулы I-Ac или Ia-Ac.
33. Соединение по любому из пп. 19-30, отличающееся тем, что соединение формулы I-Ac или Ia-Ac вводят примерно за 1 час до соединения формулы I-Lu или Ia-Lu; или примерно за 12 часов до соединения формулы I-Lu или Ia-Lu; или примерно за 24 часа до соединения формулы I-Lu или Ia-Lu; или примерно за 48 часов до соединения формулы I-Lu или Ia-Lu; или примерно за 72 часа до соединения формулы I-Lu или Ia-Lu.
34. Соединение по п. 31, дополнительно включающее введение терапевтически эффективного количества соединения формулы I-Lu или Ia-Lu в режиме один раз в неделю на протяжении от примерно 1 до примерно 7 циклов после введения I-Lu или Ia-Lu и I-Ac или Ia-Ac.
35. Соединение по п. 32, дополнительно включающее введение терапевтически эффективного количества соединения формулы I-Lu или Ia-Lu в режиме один раз в неделю на протяжении от примерно 1 до примерно 7 циклов после введения обоих соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac.
36. Соединение по п. 33, дополнительно включающее введение терапевтически эффективного количества соединения формулы I-Lu или Ia-Lu в режиме один раз в неделю на протяжении от примерно 1 до примерно 7 циклов после введения обоих соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac.
37. Применение соединения формулы I-Lu,
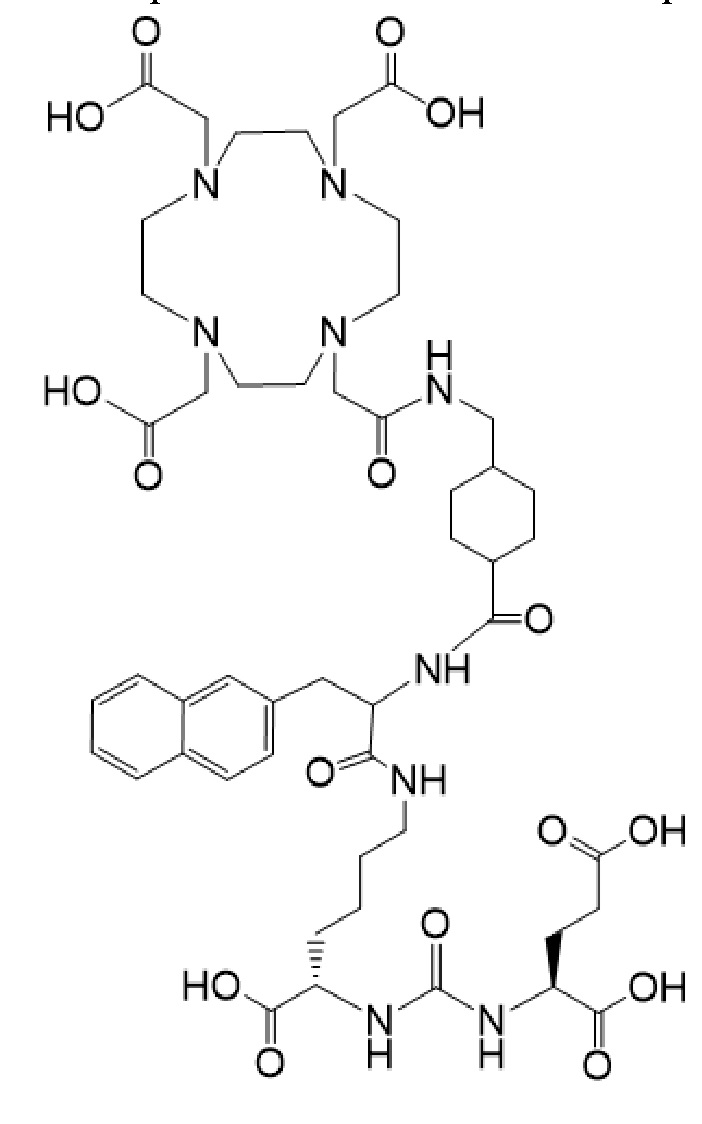
причем указанное соединение связано в комплекс с 177Lu, для получения лекарственного средства, содержащего терапевтически эффективное количество соединения формулы I-Lu, для лечения рака у пациента в комбинации с терапевтически эффективным количеством соединения формулы I-Ac
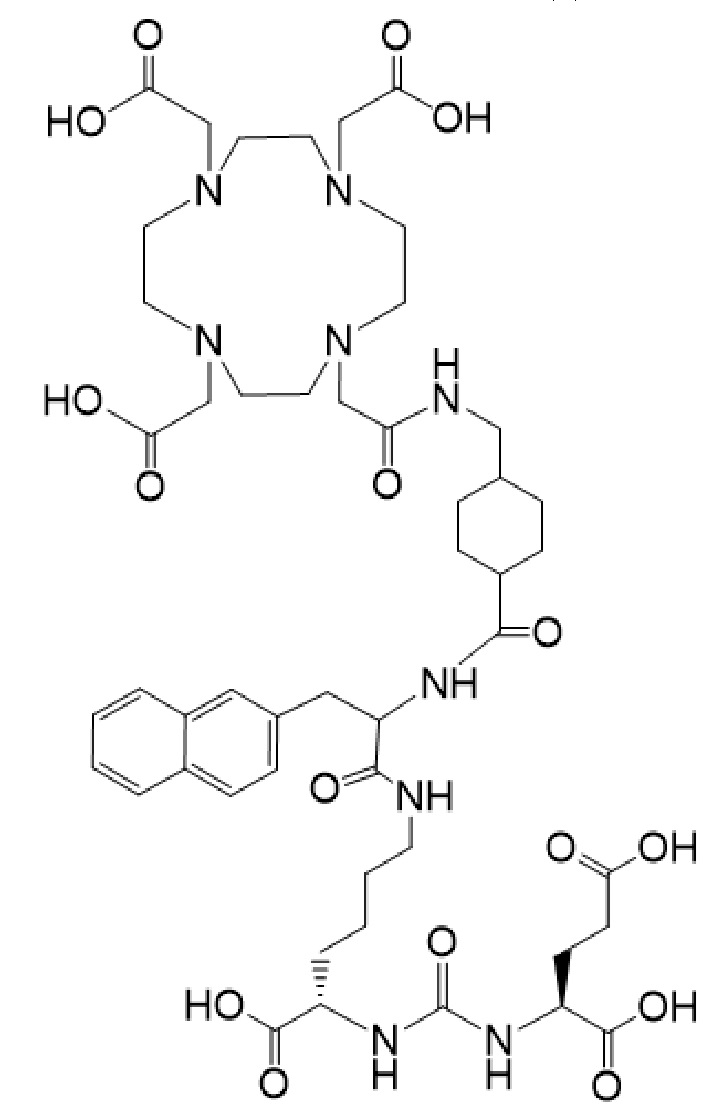
причем указанное соединение связано в комплекс с 225Ac.
38. Применение по п. 37, отличающееся тем, что соединение формулы I-Lu имеет формулу Ia-Lu
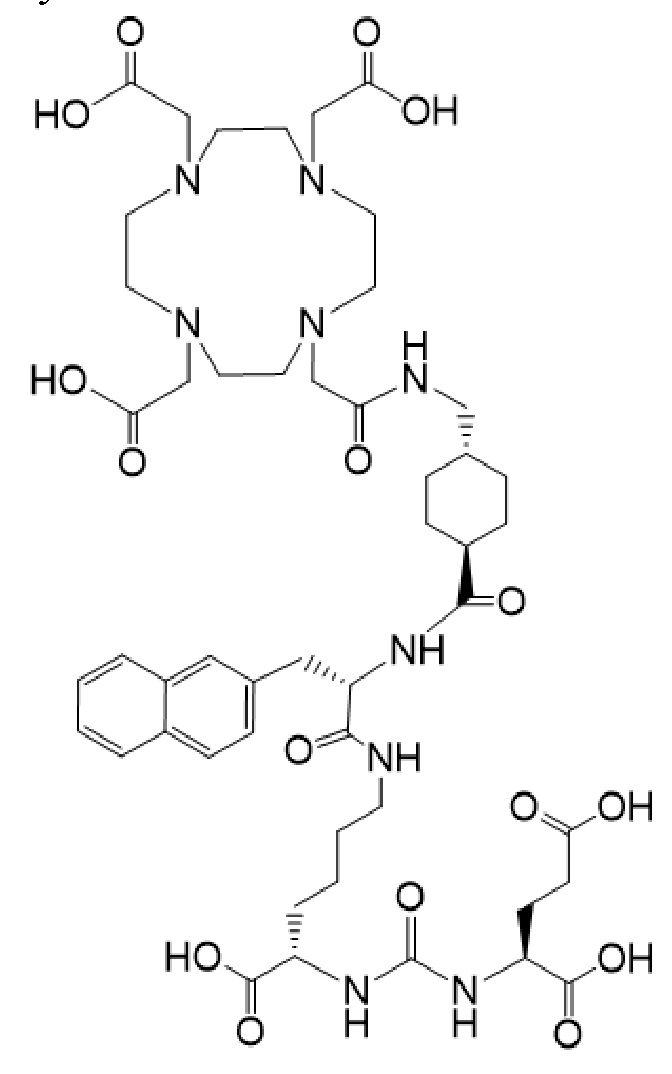
причем указанное соединение связано в комплекс с 177Lu.
39. Применение по п. 37, отличающееся тем, что соединение формулы I-Ac имеет формулу Ia-Ac
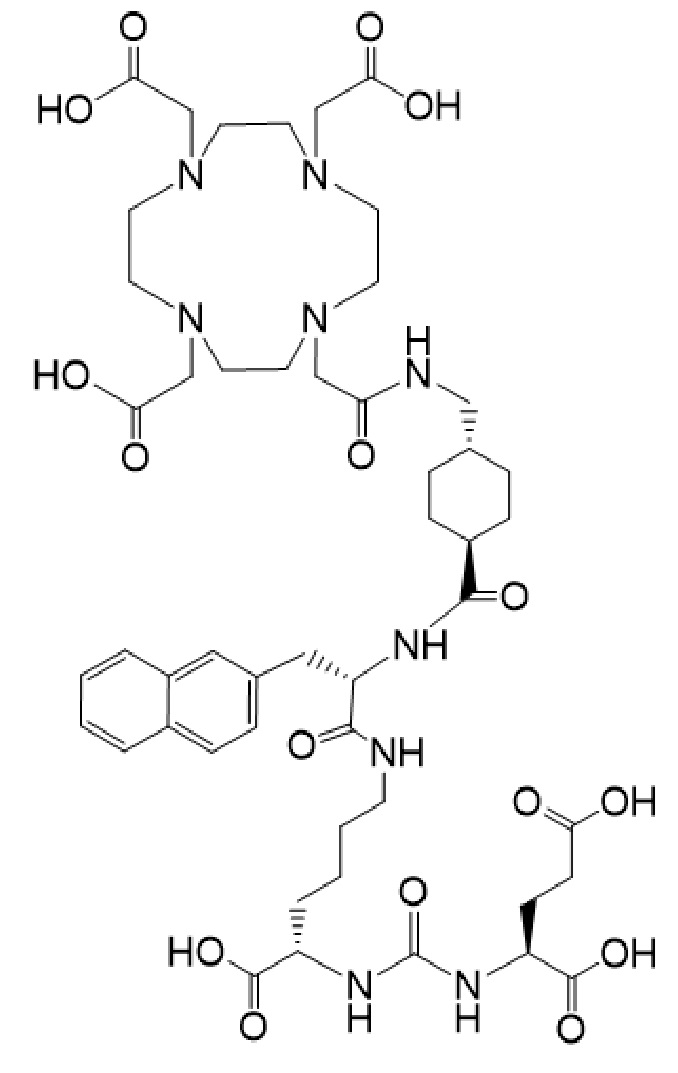
причем указанное соединение связано в комплекс с 225Ac.
40. Применение по любому из пп. 37-39, отличающееся тем, что рак связан с экспрессией простатоспецифического мембранного антигена (PSMA).
41. Применение по любому из пп. 37-40, отличающееся тем, что рак выбран из группы, состоящей из рака предстательной железы, метастатического кастрационно-резистентного рака предстательной железы (mCRPC), рака щитовидной железы, почечно-клеточной карциномы, переходно-клеточной карциномы мочевого пузыря, аденокарциномы толстой кишки, нейроэндокринной карциномы, мультиформной глиобластомы, злокачественной меланомы, карциномы протоков поджелудочной железы, немелкоклеточной карциномы легких, саркомы мягких тканей и карциномы молочной железы.
42. Применение по любому из пп. 37-41, отличающееся тем, что рак представляет собой рак предстательной железы.
43. Применение по любому из пп. 37-42, отличающееся тем, что рак представляет собой метастатический кастрационно-резистентный рак предстательной железы (mCRPC).
44. Применение по любому из пп. 37-43, отличающееся тем, что терапевтически эффективное количество I-Lu или Ia-Lu составляет от примерно 2 ГБк до примерно 20 ГБк.
45. Применение по любому из пп. 37-44, отличающееся тем, что терапевтически эффективное количество I-Lu или Ia-Lu составляет от примерно 6 ГБк до примерно 8 ГБк.
46. Применение по любому из пп. 37-45, отличающееся тем, что терапевтически эффективное количество I-Lu или Ia-Lu составляет примерно 7,4 ГБк.
47. Применение по любому из пп. 37-46, отличающееся тем, что терапевтически эффективное количество I-Ac или Ia-Ac составляет от примерно 1 МБк до примерно 10 МБк; или от примерно 5 МБк до примерно 10 МБк; или от примерно 5 МБк до примерно 7 МБк.
48. Применение по любому из пп. 37-47, отличающееся тем, что терапевтически эффективное количество I-Ac или Ia-Ac составляет примерно 5 МБк.
49. Применение по любому из пп. 37-48, отличающееся тем, что соединение формулы I-Lu или Ia-Lu вводят одновременно с соединением формулы I-Ac или Ia-Ac.
50. Применение по любому из пп. 37-49, отличающееся тем, что соединение формулы I-Lu или Ia-Lu вводят примерно за 1 час до соединения формулы I-Ac или Ia-Ac; или примерно за 12 часов до соединения формулы I-Ac или Ia-Ac; или примерно за 24 часа до соединения формулы I-Ac или Ia-Ac; или примерно за 48 часов до соединения формулы I-Ac или Ia-Ac; или примерно за 72 часа до соединения формулы I-Ac или Ia-Ac.
51. Применение по любому из пп. 37-50, отличающееся тем, что соединение формулы I-Ac или Ia-Ac вводят примерно за 1 час до соединения формулы I-Lu или Ia-Lu; или примерно за 12 часов до соединения формулы I-Lu или Ia-Lu; или примерно за 24 часа до соединения формулы I-Lu или Ia-Lu; или примерно за 48 часов до соединения формулы I-Lu или Ia-Lu; или примерно за 72 часа до соединения формулы I-Lu или Ia-Lu.
52. Применение по п. 49, дополнительно включающее введение терапевтически эффективного количества соединения формулы I-Lu или Ia-Lu в режиме один раз в неделю на протяжении от примерно 1 до примерно 7 циклов после введения I-Lu или Ia-Lu и I-Ac или Ia-Ac.
53. Применение по п. 50, дополнительно включающее введение терапевтически эффективного количества соединения формулы I-Lu или Ia-Lu в режиме один раз в неделю на протяжении от примерно 1 до примерно 7 циклов после введения обоих соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac.
54. Применение по п. 51, дополнительно включающее введение терапевтически эффективного количества соединения формулы I-Lu или Ia-Lu в режиме один раз в неделю на протяжении от примерно 1 до примерно 7 циклов после введения обоих соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac.
55. Композиция, содержащая соединение формулы I-Lu,
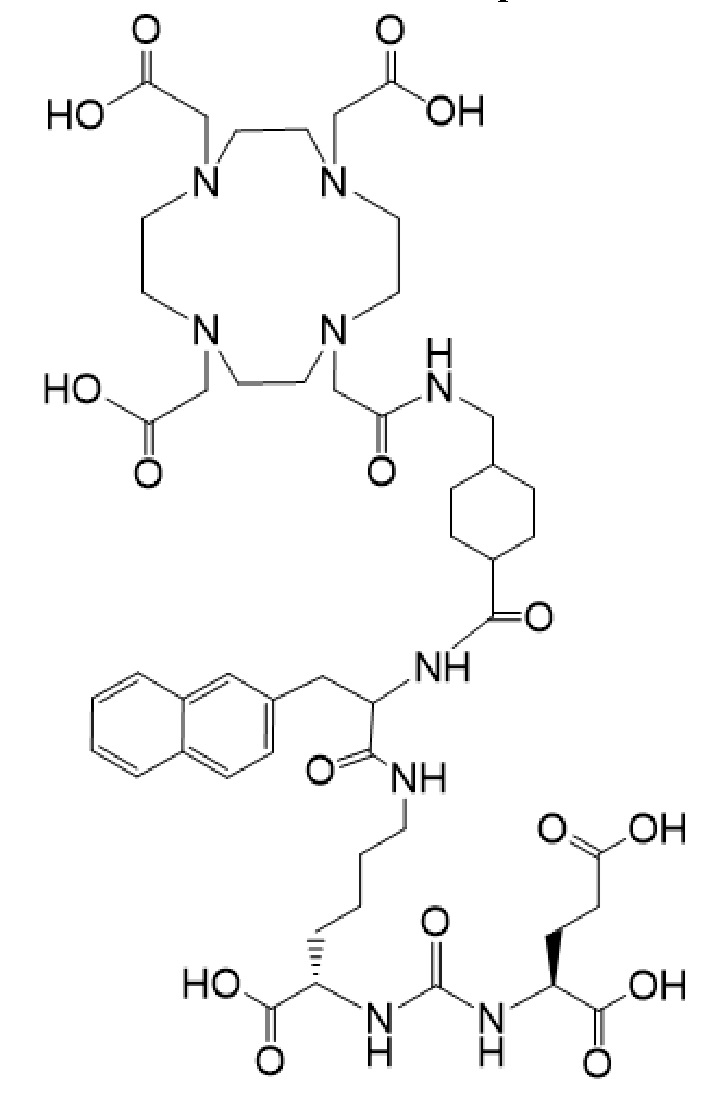
причем указанное соединение связано в комплекс с 177Lu, в терапевтически эффективном количестве, для применения для лечения рака у пациента в комбинации с терапевтически эффективным количеством соединения формулы I-Ac
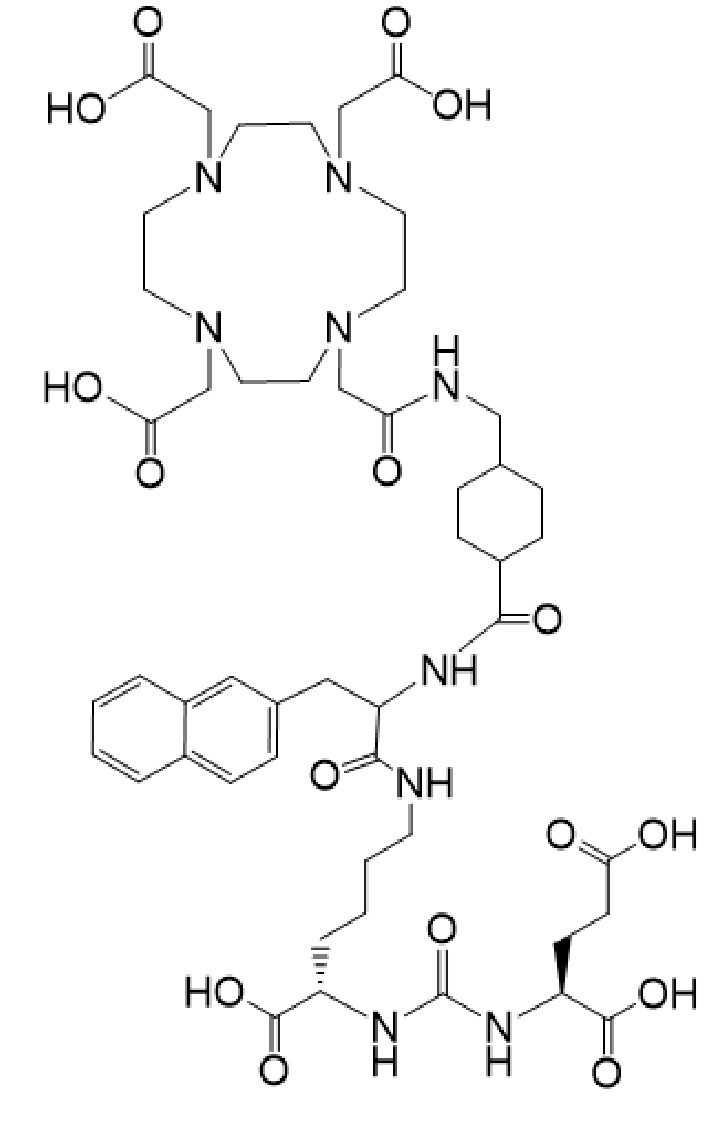
причем указанное соединение связано в комплекс с 225Ac.
56. Композиция по п. 55, отличающаяся тем, что соединение формулы I-Lu имеет формулу Ia-Lu
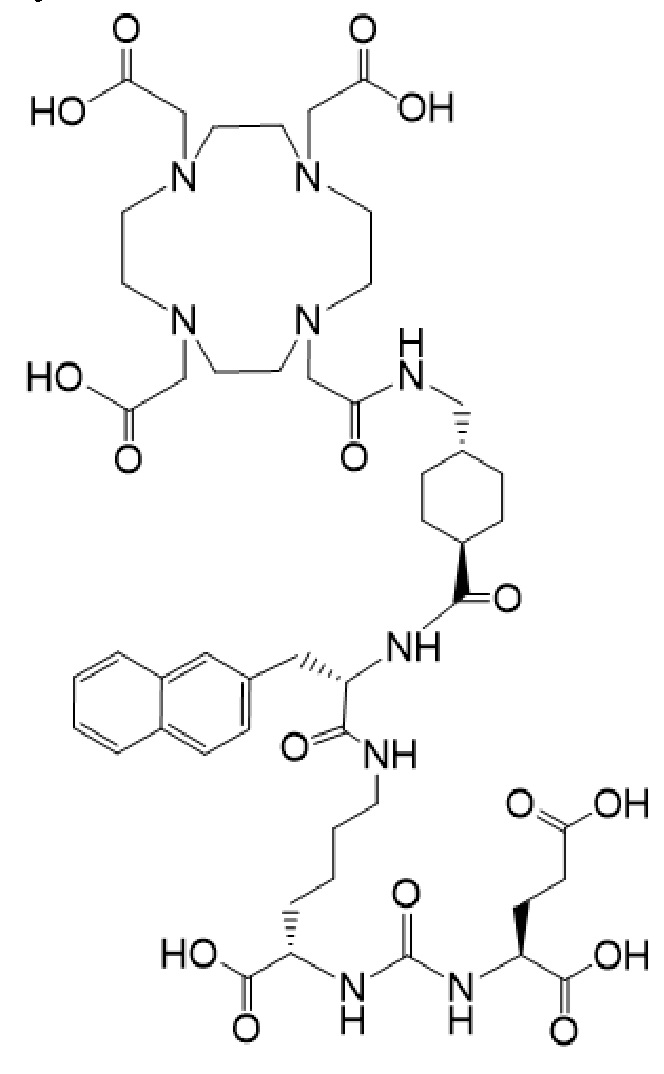
причем указанное соединение связано в комплекс с 177Lu.
57. Композиция по п. 55, отличающаяся тем, что соединение формулы I-Ac имеет формулу Ia-Ac
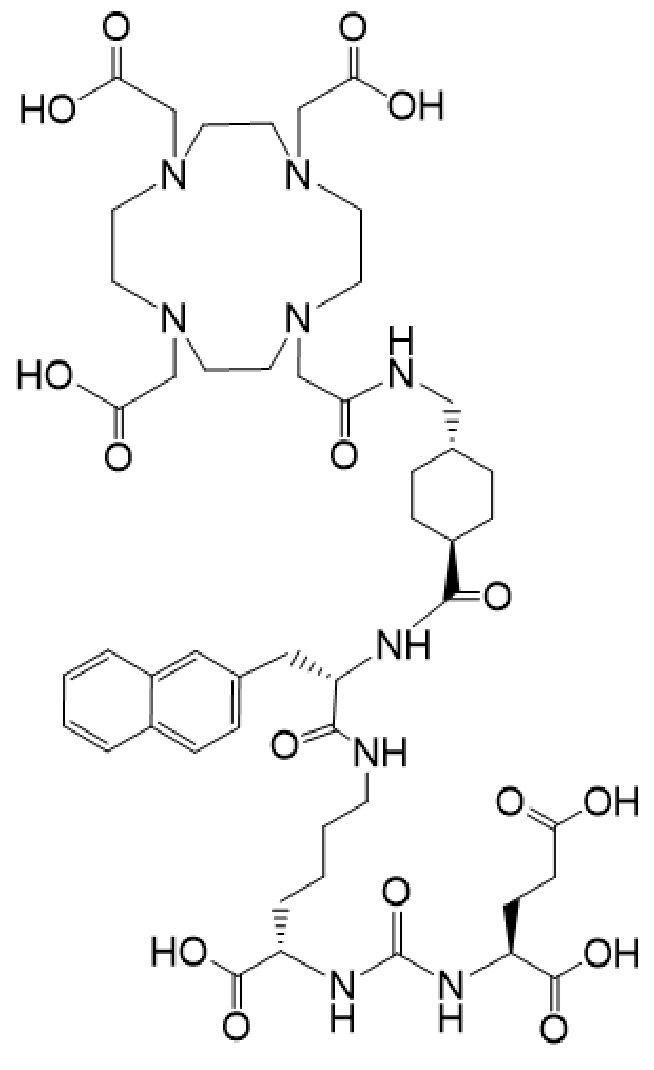
причем указанное соединение связано в комплекс с 225Ac.
58. Композиция по любому из пп. 55-57, отличающаяся тем, что рак связан с экспрессией простатоспецифического мембранного антигена (PSMA).
59. Композиция по любому из пп. 55-58, отличающаяся тем, что рак выбран из группы, состоящей из рака предстательной железы, метастатического кастрационно-резистентного рака предстательной железы (mCRPC), рака щитовидной железы, почечно-клеточной карциномы, переходно-клеточной карциномы мочевого пузыря, аденокарциномы толстой кишки, нейроэндокринной карциномы, мультиформной глиобластомы, злокачественной меланомы, карциномы протоков поджелудочной железы, немелкоклеточной карциномы легких, саркомы мягких тканей и карциномы молочной железы.
60. Композиция по любому из пп. 55-59, отличающаяся тем, что рак представляет собой рак предстательной железы.
61. Композиция по любому из пп. 55-60, отличающаяся тем, что рак представляет собой метастатический кастрационно-резистентный рак предстательной железы (mCRPC).
62. Композиция по любому из пп. 58-61, отличающаяся тем, что терапевтически эффективное количество I-Lu или Ia-Lu составляет от примерно 2 ГБк до примерно 20 ГБк.
63. Композиция по любому из пп. 58-62, отличающаяся тем, что терапевтически эффективное количество I-Lu или Ia-Lu составляет от примерно 6 ГБк до примерно 8 ГБк.
64. Композиция по любому из пп. 58-63, отличающаяся тем, что терапевтически эффективное количество I-Lu или Ia-Lu составляет примерно 7,4 ГБк.
65. Композиция по любому из пп. 58-64, отличающаяся тем, что терапевтически эффективное количество I-Ac или Ia-Ac составляет от примерно 1 МБк до примерно 10 МБк; или от примерно 5 МБк до примерно 10 МБк; или от примерно 5 МБк до примерно 7 МБк.
66. Композиция по любому из пп. 58-65, отличающаяся тем, что терапевтически эффективное количество I-Ac или Ia-Ac составляет примерно 5 МБк.
67. Композиция по любому из пп. 58-66, отличающаяся тем, что соединение формулы I-Lu или Ia-Lu вводят одновременно с соединением формулы I-Ac или Ia-Ac.
68. Композиция по любому из пп. 58-67, отличающаяся тем, что соединение формулы I-Lu или Ia-Lu вводят примерно за 1 час до соединения формулы I-Ac или Ia-Ac; или примерно за 12 часов до соединения формулы I-Ac или Ia-Ac; или примерно за 24 часа до соединения формулы I-Ac или Ia-Ac; или примерно за 48 часов до соединения формулы I-Ac или Ia-Ac; или примерно за 72 часа до соединения формулы I-Ac или Ia-Ac.
69. Композиция по любому из пп. 58-68, отличающаяся тем, что соединение формулы I-Ac или Ia-Ac вводят примерно за 1 час до соединения формулы I-Lu или Ia-Lu; или примерно за 12 часов до соединения формулы I-Lu или Ia-Lu; или примерно за 24 часа до соединения формулы I-Lu или Ia-Lu; или примерно за 48 часов до соединения формулы I-Lu или Ia-Lu; или примерно за 72 часа до соединения формулы I-Lu или Ia-Lu.
70. Композиция по п. 67, дополнительно включающая введение терапевтически эффективного количества соединения формулы I-Lu или Ia-Lu в режиме один раз в неделю на протяжении от примерно 1 до примерно 7 циклов после введения I-Lu или Ia-Lu и I-Ac или Ia-Ac.
71. Композиция по п. 68, дополнительно включающая введение терапевтически эффективного количества соединения формулы I-Lu или Ia-Lu в режиме один раз в неделю на протяжении от примерно 1 до примерно 7 циклов после введения обоих соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac.
72. Композиция по п. 69, дополнительно включающая введение терапевтически эффективного количества соединения формулы I-Lu или Ia-Lu в режиме один раз в неделю на протяжении от примерно 1 до примерно 7 циклов после введения обоих соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac.
73. Лекарственное средство, содержащее соединение формулы I-Lu,
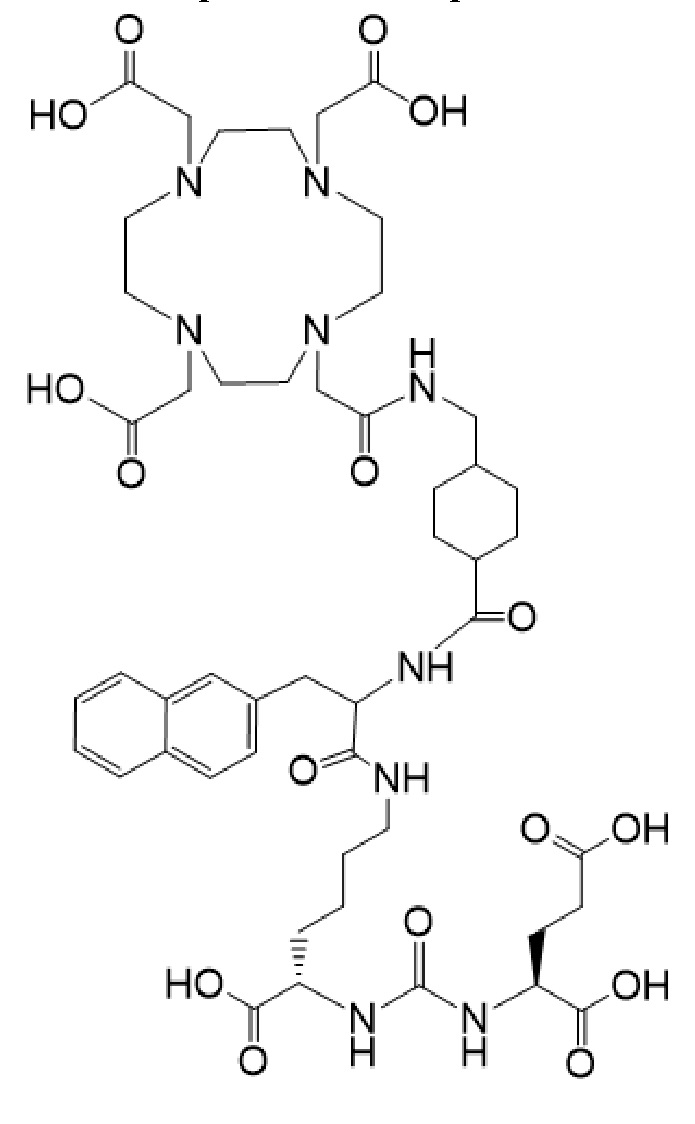
причем указанное соединение связано в комплекс с 177Lu, в терапевтически эффективном количестве в комбинации с терапевтически эффективным количеством соединения формулы I-Ac
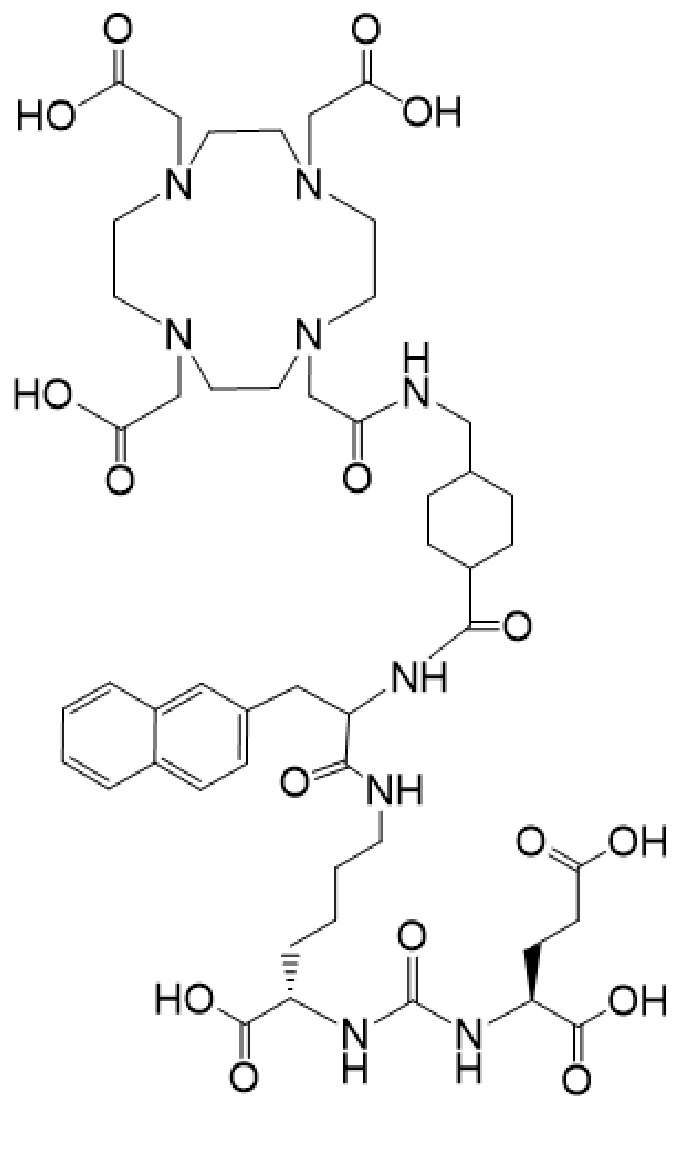
причем указанное соединение связано в комплекс с 225Ac.
74. Лекарственное средство по п. 73, отличающееся тем, что соединение формулы I-Lu имеет формулу Ia-Lu
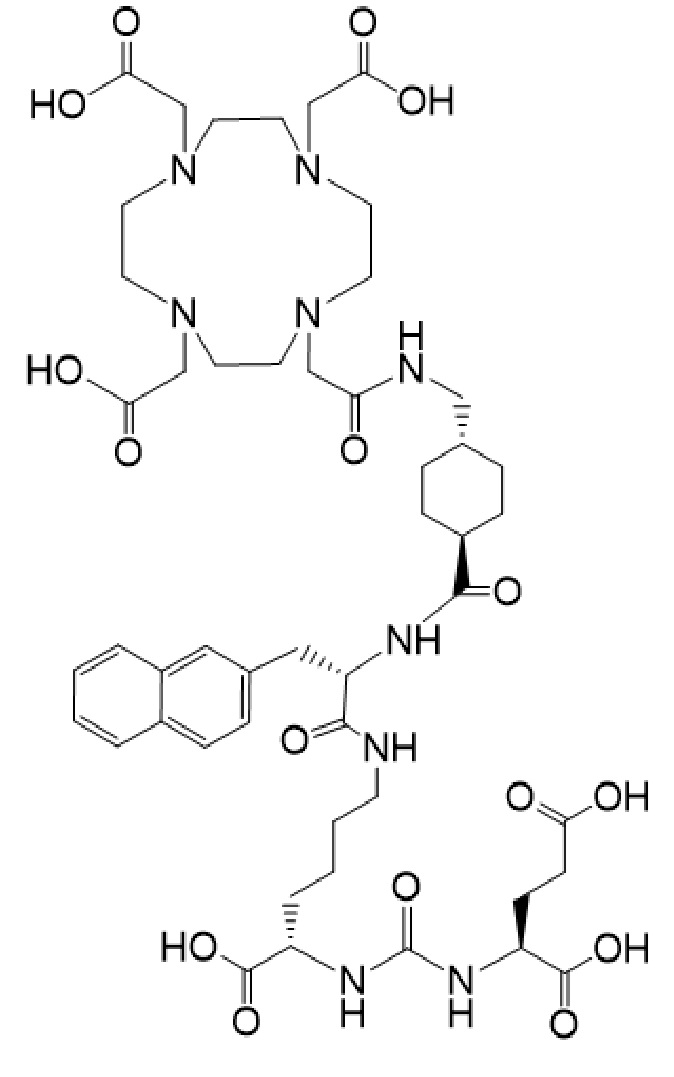
причем указанное соединение связано в комплекс с 177Lu.
75. Лекарственное средство по п. 73, отличающееся тем, что соединение формулы I-Ac имеет формулу Ia-Ac
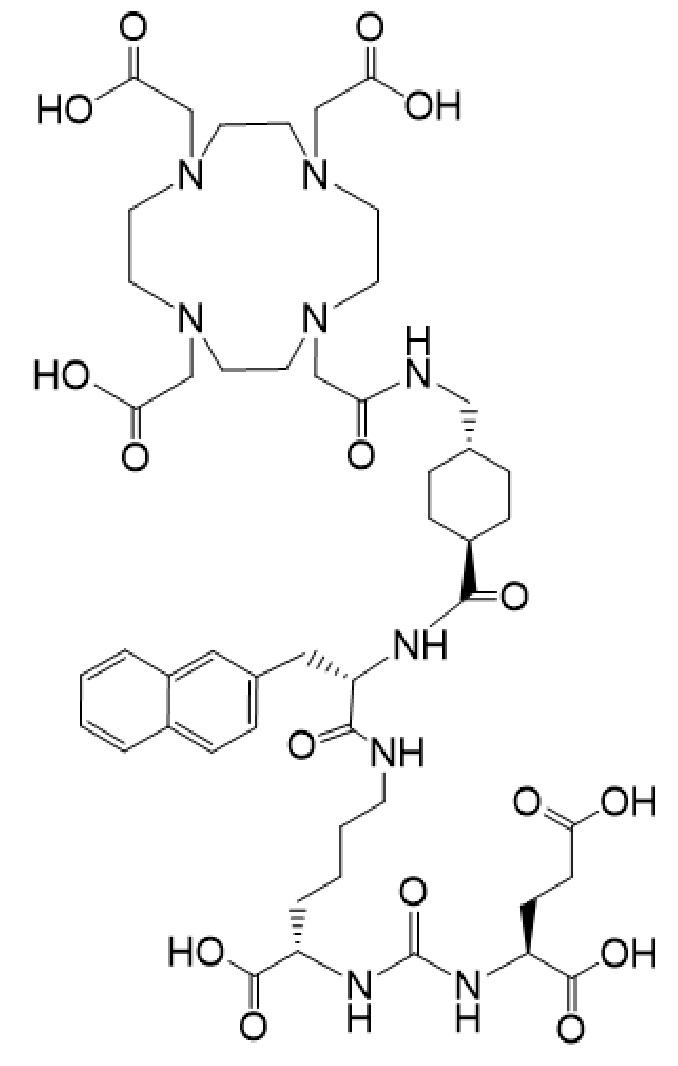
причем указанное соединение связано в комплекс с 225Ac.
76. Лекарственное средство по любому из пп. 73-75, отличающееся тем, что указанное лекарственное средство обеспечивает синергетический эффект в отношении рака, связанного с экспрессией простатоспецифического мембранного антигена (PSMA).
77. Лекарственное средство по любому из пп. 73-76, отличающееся тем, что рак выбран из группы, состоящей из рака предстательной железы, метастатического кастрационно-резистентного рака предстательной железы (mCRPC), рака щитовидной железы, почечно-клеточной карциномы, переходно-клеточной карциномы мочевого пузыря, аденокарциномы толстой кишки, нейроэндокринной карциномы, мультиформной глиобластомы, злокачественной меланомы, карциномы протоков поджелудочной железы, немелкоклеточной карциномы легких, саркомы мягких тканей и карциномы молочной железы.
78. Лекарственное средство по любому из пп. 73-77, отличающееся тем, что рак представляет собой рак предстательной железы.
79. Лекарственное средство по любому из пп. 73-78, отличающееся тем, что рак представляет собой метастатический кастрационно-резистентный рак предстательной железы (mCRPC).
80. Лекарственное средство по любому из пп. 73-79, отличающееся тем, что терапевтически эффективное количество I-Lu или Ia-Lu составляет от примерно 2 ГБк до примерно 20 ГБк.
81. Лекарственное средство по любому из пп. 73-80, отличающееся тем, что терапевтически эффективное количество I-Lu или Ia-Lu составляет от примерно 6 ГБк до примерно 8 ГБк.
82. Лекарственное средство по любому из пп. 73-81, отличающееся тем, что терапевтически эффективное количество I-Lu или Ia-Lu составляет примерно 7,4 ГБк.
83. Лекарственное средство по любому из пп. 73-82, отличающееся тем, что терапевтически эффективное количество I-Ac или Ia-Ac составляет от примерно 1 МБк до примерно 10 МБк; или от примерно 5 МБк до примерно 10 МБк; или от примерно 5 МБк до примерно 7 МБк.
84. Лекарственное средство по любому из пп. 73-83, отличающееся тем, что терапевтически эффективное количество I-Ac или Ia-Ac составляет примерно 5 МБк.
85. Лекарственное средство по любому из пп. 73-84, отличающееся тем, что соединение формулы I-Lu или Ia-Lu вводят одновременно с соединением формулы I-Ac или Ia-Ac.
86. Лекарственное средство по любому из пп. 73-85, отличающееся тем, что соединение формулы I-Lu или Ia-Lu вводят примерно за 1 час до соединения формулы I-Ac или Ia-Ac; или примерно за 12 часов до соединения формулы I-Ac или Ia-Ac; или примерно за 24 часа до соединения формулы I-Ac или Ia-Ac; или примерно за 48 часов до соединения формулы I-Ac или Ia-Ac; или примерно за 72 часа до соединения формулы I-Ac или Ia-Ac.
87. Лекарственное средство по любому из пп. 73-86, отличающееся тем, что соединение формулы I-Ac или Ia-Ac вводят примерно за 1 час до соединения формулы I-Lu или Ia-Lu; или примерно за 12 часов до соединения формулы I-Lu или Ia-Lu; или примерно за 24 часа до соединения формулы I-Lu или Ia-Lu; или примерно за 48 часов до соединения формулы I-Lu или Ia-Lu; или примерно за 72 часа до соединения формулы I-Lu или Ia-Lu.
88. Лекарственное средство по п. 87, дополнительно включающее введение терапевтически эффективного количества соединения формулы I-Lu или Ia-Lu в режиме один раз в неделю на протяжении от примерно 1 до примерно 7 циклов после введения I-Lu или Ia-Lu и I-Ac или Ia-Ac.
89. Лекарственное средство по п. 88, дополнительно включающее введение терапевтически эффективного количества соединения формулы I-Lu или Ia-Lu в режиме один раз в неделю на протяжении от примерно 1 до примерно 7 циклов после введения обоих соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac.
90. Лекарственное средство по п. 89, дополнительно включающее введение терапевтически эффективного количества соединения формулы I-Lu или Ia-Lu в режиме один раз в неделю на протяжении от примерно 1 до примерно 7 циклов после введения обоих соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac.
91. Синергетическая композиция, содержащая соединение формулы I-Lu,
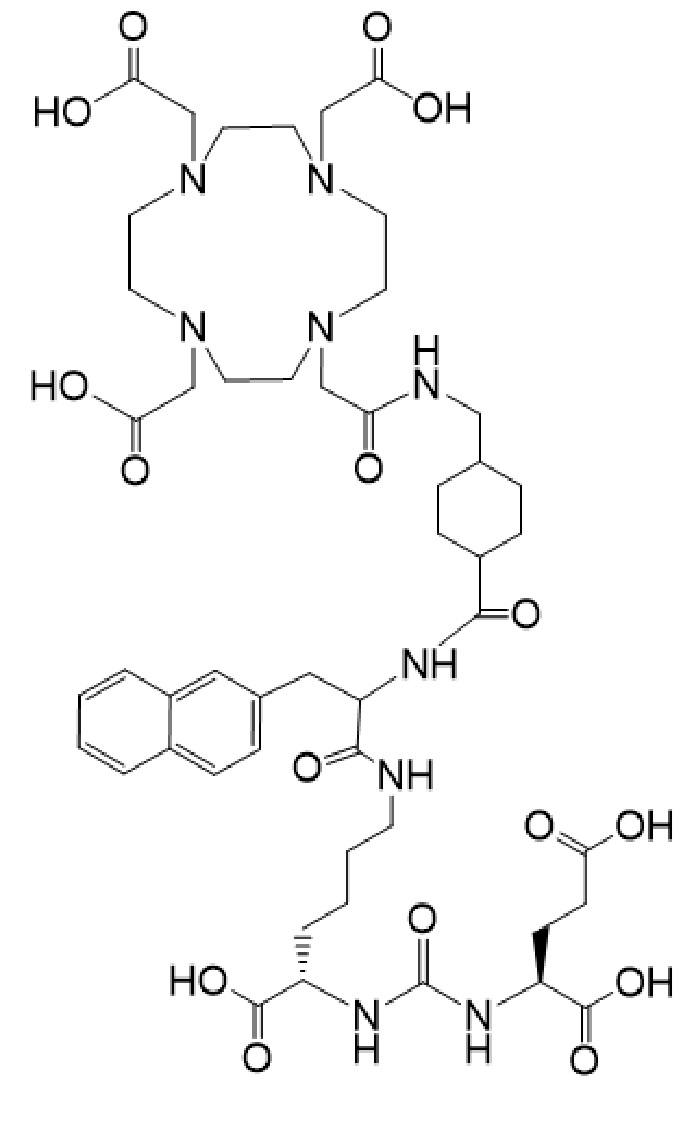
причем указанное соединение связано в комплекс с 177Lu, в терапевтически эффективном количестве, для применения для лечения рака у пациента в комбинации с терапевтически эффективным количеством соединения формулы I-Ac
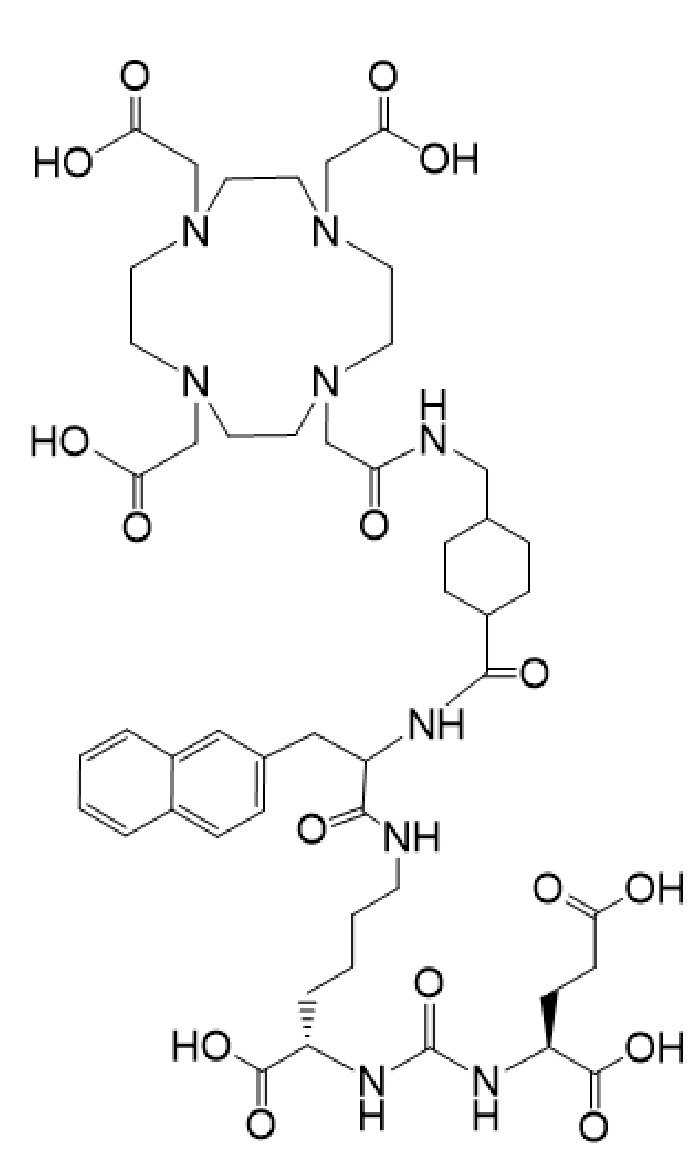
причем указанное соединение связано в комплекс с 225Ac.
92. Синергетическая композиция по п. 91, отличающаяся тем, что соединение формулы I-Lu имеет формулу Ia-Lu
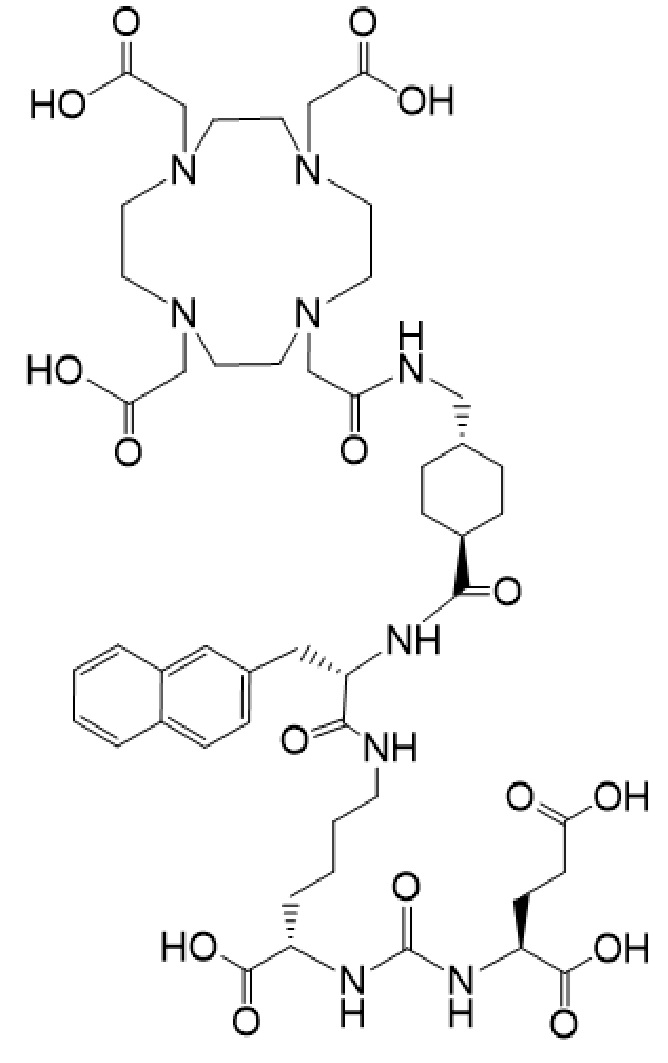
причем указанное соединение связано в комплекс с 177Lu.
93. Синергетическая композиция по п. 91, отличающаяся тем, что соединение формулы I-Ac имеет формулу Ia-Ac
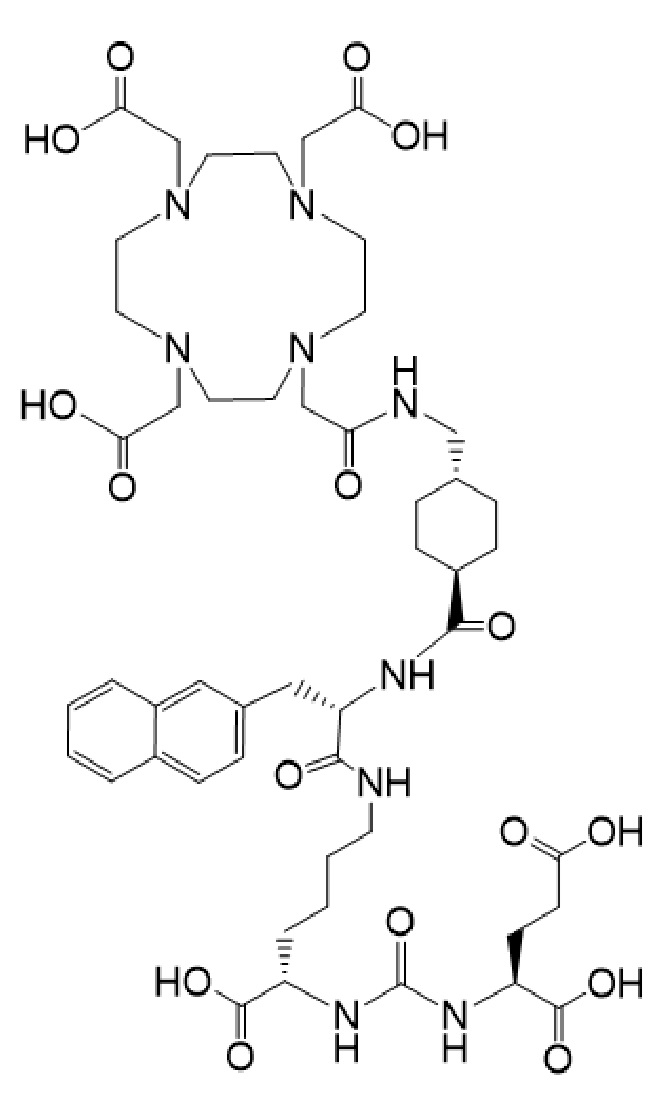
причем указанное соединение связано в комплекс с 225Ac.
94. Синергетическая композиция по любому из пп. 91-93, отличающаяся тем, что рак связан с экспрессией простатоспецифического мембранного антигена (PSMA).
95. Синергетическая композиция по любому из пп. 91-94, отличающаяся тем, что рак выбран из группы, состоящей из рака предстательной железы, метастатического кастрационно-резистентного рака предстательной железы (mCRPC), рака щитовидной железы, почечно-клеточной карциномы, переходно-клеточной карциномы мочевого пузыря, аденокарциномы толстой кишки, нейроэндокринной карциномы, мультиформной глиобластомы, злокачественной меланомы, карциномы протоков поджелудочной железы, немелкоклеточной карциномы легких, саркомы мягких тканей и карциномы молочной железы.
96. Синергетическая композиция по любому из пп. 91-95, отличающаяся тем, что рак представляет собой рак предстательной железы.
97. Синергетическая композиция по любому из пп. 91-96, отличающаяся тем, что рак представляет собой метастатический кастрационно-резистентный рак предстательной железы (mCRPC).
98. Синергетическая композиция по любому из пп. 91-97, отличающаяся тем, что терапевтически эффективное количество I-Lu или Ia-Lu составляет от примерно 2 ГБк до примерно 20 ГБк.
99. Синергетическая композиция по любому из пп. 91-98, отличающаяся тем, что терапевтически эффективное количество I-Lu или Ia-Lu составляет от примерно 6 ГБк до примерно 8 ГБк.
100. Синергетическая композиция по любому из пп. 91-99, отличающаяся тем, что терапевтически эффективное количество I-Lu или Ia-Lu составляет примерно 7,4 ГБк.
101. Синергетическая композиция по любому из пп. 91-100, отличающаяся тем, что терапевтически эффективное количество I-Ac или Ia-Ac составляет от примерно 1 МБк до примерно 10 МБк; или от примерно 5 МБк до примерно 10 МБк; или от примерно 5 МБк до примерно 7 МБк.
102. Синергетическая композиция по любому из пп. 91-101, отличающаяся тем, что терапевтически эффективное количество I-Ac или Ia-Ac составляет примерно 5 МБк.
103. Синергетическая композиция по любому из пп. 91-102, отличающаяся тем, что соединение формулы I-Lu или Ia-Lu вводят одновременно с соединением формулы I-Ac или Ia-Ac.
104. Синергетическая композиция по любому из пп. 91-103, отличающаяся тем, что соединение формулы I-Lu или Ia-Lu вводят примерно за 1 час до соединения формулы I-Ac или Ia-Ac; или примерно за 12 часов до соединения формулы I-Ac или Ia-Ac; или примерно за 24 часа до соединения формулы I-Ac или Ia-Ac; или примерно за 48 часов до соединения формулы I-Ac или Ia-Ac; или примерно за 72 часа до соединения формулы I-Ac или Ia-Ac.
105. Синергетическая композиция по любому из пп. 91-104, отличающаяся тем, что соединение формулы I-Ac или Ia-Ac вводят примерно за 1 час до соединения формулы I-Lu или Ia-Lu; или примерно за 12 часов до соединения формулы I-Lu или Ia-Lu; или примерно за 24 часа до соединения формулы I-Lu или Ia-Lu; или примерно за 48 часов до соединения формулы I-Lu или Ia-Lu; или примерно за 72 часа до соединения формулы I-Lu или Ia-Lu.
106. Синергетическая композиция по п. 103, дополнительно включающая введение терапевтически эффективного количества соединения формулы I-Lu или Ia-Lu в режиме один раз в неделю на протяжении от примерно 1 до примерно 7 циклов после введения I-Lu или Ia-Lu и I-Ac или Ia-Ac.
107. Синергетическая композиция по п. 104, дополнительно включающая введение терапевтически эффективного количества соединения формулы I-Lu или Ia-Lu в режиме один раз в неделю на протяжении от примерно 1 до примерно 7 циклов после введения обоих соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac.
108. Синергетическая композиция по п. 105, дополнительно включающая введение терапевтически эффективного количества соединения формулы I-Lu или Ia-Lu в режиме один раз в неделю на протяжении от примерно 1 до примерно 7 циклов после введения обоих соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac.
ОПРЕДЕЛЕНИЯ
В данном контексте «функционально активный PSMA» означает гликопротеин, связанный мембраной клеточной поверхности, который связывается с лигандом PSMA. Следует понимать, что лиганды PSMA хорошо известны специалистам в данной области техники, как описано, например, в публикации патента США № US 2010/0324008 A1, содержание которой включено в настоящий документ посредством ссылки.
В данном контексте «клинический эффект» означает ответ пациента на лечение комбинацией соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac, причем указанный ответ включает общую выживаемость пациента, способность принимать четыре или более циклов терапии (например, четыре недели терапии) с соединениями I-Lu или Ia-Lu и I-Ac или Ia-Ac, замедление роста опухоли, стабилизацию заболевания, частичный ответ и/или полный ответ, среди прочих клинических эффектов, определенных Управлением по контролю за продуктами и лекарственными средствами в Соединенных Штатах Америки.
В данном контексте «замедление роста опухоли» означает уменьшение размера опухоли, полное исчезновение опухоли или рост опухоли у пациента менее чем на 30% в течение курса терапии с использованием комбинации соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac.
В данном контексте «стабилизация заболевания» означает отсутствие существенного прогрессирования заболевания у пациента в течение курса терапии с применением комбинации соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac.
В данном контексте «частичный ответ» означает уменьшение размера опухоли на 30% или более у пациента, проходящего лечение комбинацией соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac.
В данном контексте «полный ответ» означает исчезновение обнаруживаемого заболевания у пациента, проходящего лечение комбинацией соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac.
В данном контексте «предшествующее лечение» означает, что пациент ранее проходил лечение по меньшей мере одним способом, известным в данной области техники. Следует понимать, что предшествующее лечение может представлять собой любое лечение, известное специалистам в данной области техники, включая, но не ограничиваясь ими, химиотерапевтический агент, операцию, лучевую терапию, иммунотерапию, фотодинамическую терапию, терапию с применением стволовых клеток, гипертермию и т.п. Предшествующие средства лечения могут включать системные средства лечения, включая, но не ограничиваясь ими, лечение с применением абиратерона, ортеронела, галетерона, севитеронела, апалутамида, энзалутамида, палифосфамида, 5-фторурацила, капецитабина, пеметрекседа, цисплатина, карбоплатина, гемцитабина, паклитаксела, винорелбина, эрибулина, доцетаксела, циклофосфамида, доксорубицина, регорафиниба и их комбинаций.
В данном контексте термин «алкил» включает цепь атомов углерода, которая является необязательно разветвленной. Кроме того, следует понимать, что в некоторых вариантах реализации алкил преимущественно имеет ограниченную длину, включая C1-C24, C1-C12, C1-C8, C1-C6 и C1-C4. Например, такие алкильные группы со специально ограниченной длиной, включая C1-C8, C1-C6 и C1-C4, могут быть упомянуты как низший алкил. В данном контексте предполагается, что более короткие алкильные, алкенильные и/или алкинильные группы могут меньше усиливать липофильность соединения и, соответственно, оно будет иметь другие фармакокинетические свойства. Следует понимать, что в некоторых вариантах реализации упоминание алкила в каждом случае относится к алкилу, определение которого приведено в данном документе, и необязательно к низшему алкилу. Примеры алкильных групп включают, но не ограничиваются ими, метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, пентил, 2-пентил, 3-пентил, неопентил, гексил, гептил, октил и т.п. В данном контексте «карбоксиалкильная» группа включает комбинацию «алкильной группы», описанной в настоящем документе, с «карбокси» группой. В данном контексте «гидроксиалкильная» группа включает комбинацию «алкильной группы», описанной в настоящем документе, с «гидрокси» группой. В данном контексте «аминоалкильная» группа включает комбинацию «алкильной группы», описанной в настоящем документе, с «амино» группой.
В данном контексте термин «гетероалкил» включает цепь атомов, которая содержит атомы углерода и по меньшей мере один гетероатом и является необязательно разветвленной. Иллюстративные гетероатомы включают азот, кислород и серу. В некоторых вариантах иллюстративные гетероатомы также включают фосфор и селен.
В данном контексте термин «арил» включает моноциклические и полициклические ароматические карбоциклические группы, содержащие от 6 до 14 кольцевых атомов углерода, каждая из которых может быть необязательно замещенной. Иллюстративные ароматические карбоциклические группы, описанные в настоящем документе, включают, но не ограничиваются ими, фенил, нафтил и т.п. В данном контексте термин «гетероарил» включает ароматические гетероциклические группы, содержащие от 5 до 10 кольцевых атомов, каждая из которых может быть необязательно замещенной. Иллюстративные ароматические гетероциклические группы включают, но не ограничиваются ими, пиридинил, пиримидинил, пиразинил, триазинил, тетразинил, хинолинил, хиназолинил, хиноксалинил, тиенил, пиразолил, имидазолил, оксазолил, тиазолил, изоксазолил, изотиазолил, оксадиазолил, тиадиазолил, триазолил, бензимидазолил, бензоксазолил, бензтиазолил, бензизоксазолил, бензизотиазолил и т.п. В данном контексте термин «гетероарилалкил» включает комбинацию «алкильной» группы, описанной в настоящем документе, с «гетероарильной» группой, описанной в настоящем документе. В данном контексте термин «арилалкил» включает комбинацию «алкильной» группы, описанной в настоящем документе, с «арильной» группой, описанной в настоящем документе, например с бензильной группой.
Термин «необязательно замещенный» в данном контексте включает замену атомов водорода другими функциональными группами у того радикала, который является необязательно замещенным. Такие другие функциональные группы иллюстративно включают, но не ограничиваются ими, амино, гидроксил, галоген, тиол, алкил, галогеналкил, гетероалкил, арил, арилалкил, арилгетероалкил, гетероарил, гетероарилалкил, гетероарилгетероалкил, нитро, сульфоновые кислоты и их производные, карбоновые кислоты и их производные и т.п. Например, любой из амино, гидроксила, тиола, алкила, галогеналкила, гетероалкила, арила, арилалкила, арилгетероалкила, гетероарила, гетероарилалкила, гетероарилгетероалкила и/или сульфоновой кислоты является необязательно замещенным.
В данном контексте термин «введение» включает все способы введения пациенту комбинации соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac и/или конъюгата, визуализирующего лиганд PSMA, описанного в настоящем документе, включая, но не ограничиваясь ими, пероральный (po), внутривенный (iv), внутримышечный (im), подкожный (sc), трансдермальный, ингаляции, буккальный, офтальмологический, сублингвальный, вагинальный, ректальный и т.п. Комбинацию соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac и/или конъюгата, визуализирующего лиганд PSMA, описанного в настоящем документе, можно вводить в единичных лекарственных формах и/или составах, содержащих обычные нетоксичные фармацевтически приемлемые носители, адъюванты и среды.
В данном контексте «беккерель» означает единицу радиоактивности в системе СИ в значении, обычно понимаемом специалистами в данной области техники. Один беккерель определяют как активность такого количества радиоактивного материала, в котором за одну секунду происходит распад одного ядра. Таким образом, беккерель является эквивалентом обратной секунды, с-1. Беккерель известен специалистам в данной области техники как последующий вариант кюри (Ки), более старой единицы радиоактивности, не входящей в СИ, основанной на активности 1 грамм радия-226. Кюри определяют как 3,7. 1010 с−1 или 37 ГБк.
В данном контексте «кюри» или «Ки» означает единицу радиоактивности, названную в честь французского физика и химика Марии Кюри, в значении, обычно понимаемом специалистами в данной области техники. Приставки милли и микро взяты из метрической системы и означают 0,001 и 0,000001, соответственно. Таким образом, милликюри (мКи) равен 0,001 кюри. Микрокюри (мкКи) равен 0,000001 кюри.
ПОДРОБНОЕ ОПИСАНИЕ
Варианты реализации нумерованных пунктов, представленных выше в сущности изобретения, или любые их комбинации предусмотрены для комбинирования с любым из вариантов реализации, описанных в разделе «Подробное описание» настоящей заявки на патент.
В некоторых вариантах реализации факторы стратификации для плана предложенного способа включают, но не ограничиваются ими, сывороточную лактатдегидрогеназу (LDH) (</= 260 МЕ/л, а не >260 МЕ/л), наличие метастазов в печени, оценку ECOG (0-1, а не 2), включение NAAD в оптимальную поддерживающую/оптимальную стандартную терапию и т.п. В некоторых вариантах реализации первичной конечной точкой может быть общая выживаемость. В некоторых вариантах реализации вторичные конечные точки включают, но не ограничиваются ими, выживаемость без радиографических признаков прогрессирования заболевания (rPFS), ответ по «Критериям оценки объективного ответа при солидных опухолях» (RECIST), время до первого симптомного явления со стороны костной системы (SSE) и т.п. В некоторых вариантах реализации дополнительные вторичные конечные точки включают, но не ограничиваются ими, безопасность и переносимость, связанное со здоровьем качество жизни (HRQoL; EQ-5D-5L, FACT-P и Краткий опросник оценки боли - сокращенная форма [BPI-SF]), финансовые показатели лечения, выживаемость без прогрессирования (прогрессирование по радиологическим, клиническим или PSA данным), биохимический ответ, такой как содержание PSA, уровень щелочной фосфатазы и/или уровень лактатдегидрогеназы. В некоторых вариантах реализации конечная точка для способов лечения, описанных в настоящем документе, может означать пациента, достигшего >/=50% снижение относительно исходного значения, подтвержденное при повторном измерении PSA через >/=4 недели. В некоторых вариантах реализации конечная точка для способов лечения, описанных в настоящем документе, может означать пациента, достигшего >/=40% снижение относительно исходного значения, подтвержденное при повторном измерении PSA через >/=4 недели. В некоторых вариантах реализации конечная точка для способов лечения, описанных в настоящем документе, может означать пациента, достигшего >/=30% снижение относительно исходного значения, подтвержденное при повторном измерении PSA через >/=4 недели.
В одном варианте реализации способы, описанные в настоящем документе, можно использовать как для клинического лечения людей, так и для ветеринарного применения. Таким образом, «пациенту» можно вводить комбинацию соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac и/или конъюгаты, визуализирующие лиганд PSMA, описанные в настоящем документе, и он может представлять собой человека или, в случае ветеринарного применения, может представлять собой лабораторное, сельскохозяйственное, домашнее или дикое животное. В одном аспектом пациентом может быть человек, лабораторное животное, такое как грызун (например, мыши, крысы, хомяки и т.д.), кролик, обезьяна, шимпанзе, домашние животные, такие как собаки, кошки и кролики, сельскохозяйственные животные, такие как коровы, лошади, свиньи, овцы, козы, и дикие животные в неволе, такие как медведи, панды, львы, тигры, леопарды, слоны, зебры, жирафы, гориллы, дельфины и киты.
В некоторых вариантах реализации пациенты с PSMA-позитивными сканами могут быть рандомизированы в соотношении 2:1 для приема комбинации соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac с оптимальной поддерживающей/оптимальной стандартной терапией или для приема только оптимальной поддерживающей/оптимальной стандартной терапии. В некоторых вариантах реализации оптимальная поддерживающая/оптимальная стандартная терапия может быть установлена лечащим врачом/исследователем. В некоторых вариантах реализации оптимальная поддерживающая/оптимальная стандартная терапия может быть установлена лечащим врачом/исследователем, но исключает экспериментальные агенты, цитотоксическую химиотерапию, другие системные радиоизотопы и лучевую терапию половины тела. В некоторых вариантах реализации допустимы новые препараты для андрогенной оси [NAAD], такие как абиратерон или энзалутамид.
В некоторых вариантах реализации пациентов наблюдают в течение всего 6-10-месячного периода лечения на предмет выживания, прогрессирования заболевания и неблагоприятных явлений. В некоторых вариантах реализации продолжительный период последующего наблюдения может включать сбор обновленных данных о выживании и лечении, оценку неблагоприятных явлений, а также получение образцов крови для гематологических и химических анализов.
В некоторых вариантах реализации возраст пациента составляет 18 лет или более. В некоторых вариантах реализации пациентом является мужчина. В некоторых вариантах реализации у пациента ранее диагностирован рак предстательной железы. В некоторых вариантах реализации в пациента ранее диагностирован метастатический кастрационно-резистентный рак предстательной железы (mCRPC). В некоторых вариантах реализации пациент удовлетворяет одному или более критериям, выбранным из группы, состоящей из оценки общего состояния онкологического больного Восточной объединенной онкологической группы (ECOG) от 0 до 2; ожидаемой продолжительности жизни по меньшей мере 6 месяцев; гистологического, патологического и/или цитологического подтверждения рака предстательной железы; позитивного скана ПЭТ/КТ 68Ga-PSMA-11; предшествующей орхиэктомии и/или продолжающейся антиандрогенной терапии и кастрационного уровня тестостерона сыворотки (<50 нг/дл или <1,7 нмоль/л); предшествующего приема по меньшей мере одного NAAD, такого как энзалутамид и/или абиратерон; предшествующего лечения с применением по меньшей мере 1 или 2 предыдущих таксановых схем, причем таксановая схема включает минимальное воздействие 2 циклов таксана, или предшествующего лечения с применением только одной таксановой схемы и a. пациент не желает принимать вторую таксановую схему или b. врач пациента считает, что он не может принимать вторую таксановую схему, например, вследствие немощности по оценке гериатрического статуса или состояния здоровья, или вследствие непереносимости; прогрессирующего mCRPC, такого как документально подтвержденный прогрессирующий mCRPC на основании по меньшей мере одного критерия, такого как a. прогрессирование PSA в сыворотке, установленное как 2 последовательных прироста PSA относительно предыдущего референсного значения, измеренного по меньшей мере на 1 неделю раньше, причем минимальное начальное значение составляет 2,0 нг/мл, b. прогрессирование мягких тканей, установленное как увеличение ≥20% суммы диаметра (SOD) (короткой оси для узловых поражений и длинной оси для неузловых поражений) всех очагов-мишеней на основании наименьшего SOD с момента начала лечения или появление одного или более новых поражений, и c. прогрессирование костного заболевания, такого как пригодное для оценки заболевание, или новое костное поражение(ия), на основании скана костей (критерии 2+2 PCWG3); по меньшей мере одного метастатического поражения, присутствующего на исходном КТ, МРТ или при визуализации скана кости, полученного за ≤28 дней до начала терапии с применением комбинации соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac; восстановление до ≤ 2 степени по всем клинически существенным видам токсичности, связанным с предшествующими терапиями, такими как предшествующая химиотерапия, облучение, иммунотерапия и т.п.; адекватной функции органов, такой как a. костномозговой резерв, включая количество белых кровяных клеток (WBC) ≥2,5×10^9/л (2,5×10^9/л эквивалентно 2,5×103/мкл и 2,5 x тыс./мкл и 2,5×103/мм3 и 2500/мкл) или абсолютное количество нейтрофилов (ANC) ≥1,5×109/л (1,5×109/л эквивалентно 1,5×103/мкл и 1,5 x тыс./мкл и 1,5×103/мм3 и 1500/мкл), тромбоцитов ≥ 100×10^9/л (100×10^9/л эквивалентно 100×10^3/мкл и 100 x тыс./мкл и 100×10^3/мм3 и 100000/мкл), и/или гемоглобина ≥ 9 г/дл (9 г/дл эквивалентно 90 г/л и 5,59 ммоль/л); b. функция печени, например, общий билирубин ≤1,5 x установленной верхней границы нормы (ULN) (для пациентов с выявленным синдромом Жильбера допустимно значение ≤ 3 x ULN), аланинаминотрансферазы (ALT) или аспартатаминотрансферазы (AST) ≤3,0 x ULN или ≤5,0 x ULN для пациентов с метастазами в печени, и c. функция почек, например, креатинин сыворотки ≤1,5 x ULN или клиренс креатинина ≥50 мл/мин.; альбумина >3,0 г/дл (3,0 г/дл эквивалентно 30 г/л); и устоявшейся схемы приема бисфосфоната или деносумаба на протяжении ≥30 дней до данного лечения.
В некоторых вариантах реализации пациент может не получать данное лечение, если пациент ранее проходил одну или более терапий с применением стронция-89, самария-153, рения-186, рения-188, радия-223 или облучения половины тела в течение примерно 6 месяцев до данного лечения; проходил ранее PSMA-таргетную радиолигандную терапию; ранее проходил системную противораковую терапию (например, химиотерапию, иммунотерапию или биологическую терапию [включая моноклональные антитела]) на протяжении примерно 28 дней до данного лечения; ранее принимал экспериментальные агенты на протяжении примерно 28 дней до данного лечения; имеет известную гиперчувствительность к компонентам данной терапии или их аналогам; в случае любой другой сопутствующей цитотоксической химиотерапии, иммунотерапии, радиолигандной терапии или экспериментальной терапии; переливании в течение примерно 30 дней до данного лечения; имеют метастазы ЦНС в анамнезе, против которых применяли терапию (операцию, радиотерапию, гамма-нож), и являются неврологически стабильными, бессимптомными и не применяют кротикостероиды с целью поддержания неврологической стойкости; в случае феномена «суперскана», наблюдаемого на исходном скане кости; симптоматическом сдавливании спинного мозга или клинических или радиологических фактах, свидетельствующих о приближающемся сдавливании спинного мозга; при сопутствующих тяжелых (по решению врача) медицинских состояниях, включая, но не ограничиваясь ими, застойную сердечную недостаточность III или IV класса по классификации Нью-Йоркской кардиологической ассоциации, анамнез врожденного синдрома удлиненного QT, неконтролируемую инфекцию, активный гепатит B или C или другие существенные сопутствующие заболевания, которые, по мнению исследователя, оказывают влияние на лечение или взаимодействие; или в случае диагноза других злокачественных заболеваний, которые предположительно изменяют ожидаемую продолжительность жизни или могут влиять на оценку заболевания.
В различных вариантах реализации раковые образования, описанные в настоящем документе, могут представлять собой популяцию раковых клеток, которая является опухолеродной, включая доброкачественные опухоли и злокачественные опухоли, или рак может быть неопухолеродным. Рак может возникать спонтанно или вследствие таких процессов, как мутации, происходящие в генеративной линии пациента или соматические мутации, или рак может быть вызван химическими веществами, вирусами или радиацией. Раковые заболевания, применимые к настоящему изобретению, описанному в данном документе, включают, но не ограничиваются ими, глиому, карциному, саркому, лимфому, меланому, мезотелиому, карциному носоглотки, лейкоз, аденокарциному и миелому.
В некоторых аспектах раковые заболевания могут представлять собой рак легких, рак кости, рак поджелудочной железы, рак кожи, рак головы, рак шеи, кожную меланому, внутриглазную меланому, рак матки, рак яичника, эндометриальный рак, ректальный рак, рак желудка, рак толстой кишки, рак молочной железы, трижды негативный рак молочной железы, метастатический рак молочной железы, карциному фаллопиевых труб, карциному эндометрия, карциному шейки матки, карциному влагалища, карциному вульвы, болезнь Ходжкина, рак пищевода, рак тонкого кишечника, рак эндокринной системы, рак щитовидной железы, рак паращитовидной железы, немелкоклеточный рак легких, рак надпочечников, саркому мягких тканей, рак уретры, рак пениса, рак предстательной железы, хронический лейкоз, острый лейкоз, лимфоцитарную лимфому, плевральную мезотелиому, рак мочевого пузыря, лимфому Беркитта, рак уретры, рак почки, почечно-клеточную карциному, карциному почечной лоханки, неоплазмы центральной нервной системы (ЦНС), первичную лимфому ЦНС, опухоли оси позвоночника, глиому, глиому ствола головного мозга, аденому гипофиза и аденокарциному желудочно-пищеводного соединения.
Соединение Ia имеет формулу
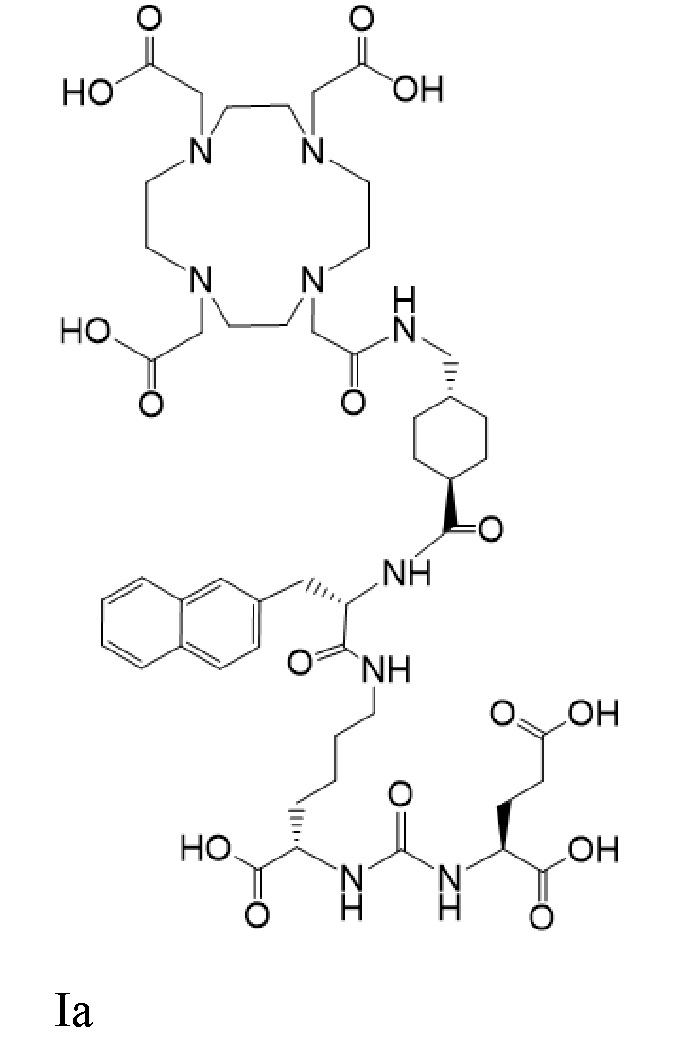
причем 177Lu связан в комплекс с указанным соединением с образованием Ia-Lu, и 225Ac связан в комплекс с указанным соединением с образованием Ia-Ac.
В других вариантах реализации можно использовать любые из множества конъюгатов, визуализирующих лиганд PSMA, конъюгатов, обнаруживаемых с помощью ПЭТ визуализации, ОФЭКТ визуализации и т.п. Точный способ визуализации не ограничен визуализирующими агентами, описанными в настоящем документе. В совокупности, конъюгаты, визуализирующие лиганд PSMA, подходящие для визуализации, описанной в настоящем документе, включая те, которые описаны формулами, и агенты, подходящие для ПЭТ визуализации, ОФЭКТ визуализации и т.д., упомянуты в настоящем документе как «конъюгаты, визуализирующие лиганд PSMA».
В одном варианте реализации соединения I-Lu или Ia-Lu и I-Ac или Ia-Ac и/или конъюгаты, визуализирующие лиганд PSMA, описанные в настоящем документе, связываются с экспрессированным PSMA на раковых клетках. В одном иллюстративном аспекте соединения I-Lu или Ia-Lu и I-Ac или Ia-Ac и/или конъюгаты, визуализирующие лиганд PSMA, могут дифференцированно связывать PSMA на раковых клетках, по сравнению с нормальными клетками вследствие предпочтительной экспрессии (или сверхэкспрессии) PSMA на раковых клетках.
В некоторых вариантах реализации комбинацию соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac и конъюгатов, визуализирующих лиганд PSMA, описанных в настоящем документе, можно вводить в виде лекарственной формы в сочетании с одним или более фармацевтически приемлемыми носителями. В некоторых аспектах указанных вариантов реализации комбинацию соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac объединяют в одну лекарственную форму. В некоторых аспектах указанных вариантов реализации комбинацию соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac вводят в виде агентов, составленных в отдельные лекарственные формы. Носители могут представлять собой вспомогательные вещества. Выбор носителя в значительной степени зависит от таких факторов, как конкретный способ введения, влияние носителя на растворимость и стабильность, а также тип лекарственной формы. Фармацевтические композиции, подходящие для доставки комбинации соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac и конъюгатов, визуализирующих лиганд PSMA, описанных в настоящем документе, а также способы их получения без труда понятны специалистам в данной области техники. Такие композиции и способы их получения представлены, например, в публикации Remington: The Science & Practice of Pharmacy, 21е издание (Lippincott Williams & Wilkins, 2005), содержание которой включено в настоящий документ посредством ссылки.
В одном иллюстративном аспекте фармацевтически приемлемый носитель включает любой и все растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты, изотонические средства и агенты замедления абсорбции, и т.п., а также их комбинации, которые являются физиологически совместимыми. В некоторых вариантах реализации носитель пригоден для парентерального введения. Фармацевтически приемлемые носители включают стерильные водные растворы или дисперсии, а также стерильные порошки для получения стерильных растворов или дисперсий для инъекций непосредственно перед применением. В состав композиций согласно настоящему изобретению также могут быть введены дополнительные активные соединения.
В различных вариантах реализации жидкие лекарственные формы могут включать суспензии и растворы. Такие лекарственные формы могут содержать носитель, например, воду, этанол, полиэтиленгликоль, пропиленгликоль, метилцеллюлозу или подходящее масло, и один или более эмульгирующих агентов и/или суспендирующих агентов. Жидкие лекарственные формы также могут быть получены разбавлением твердого вещества.
В одном варианте реализации водная суспензия может содержать активные материалы в смеси с подходящими вспомогательными веществами. Такие вспомогательные вещества представляют собой суспендирующие агенты, например, карбоксиметилцеллюлозу натрия, метилцеллюлозу, гидропропилметилцеллюлозу, альгинат натрия, поливинилпирролидон, трагакантовую камедь и гуммиарабик; диспергирующие или увлажняющие агенты, которые могут представлять собой природные фосфатиды, например, лецитин; продукт конденсации алкиленоксида с жирной кислотой, например, полиоксиэтиленстеарат; или продукт конденсации этиленоксида с длинноцепочечным алифатическим спиртом, например, гептадекаэтиленоксицетанол; продукт конденсации этиленоксида с неполным сложным эфиром, полученным из жирных кислот и гексита, такой как полиоксиэтиленсорбитмоноолеат; или продукт конденсации этиленоксида с неполным сложным эфиром, полученным из жирных кислот и ангидридов гексита, например, полиоксиэтиленсорбитмоноолеат. Водные суспензии могут также содержать один или более консервантов, например, аскорбиновую кислоту, этил-, н-пропил- или п-гидроксибензоат; или один или более окрашивающих агентов.
В одном иллюстративном варианте реализации диспергируемые порошки и гранулы, подходящие для получения водной суспензии посредством добавления воды, обеспечивают активный ингредиент в смеси с диспергирующим или смачивающим агентом, суспендирующим агентом и одним или более консервантами. Также могут присутствовать дополнительные вспомогательные вещества, например, окрашивающие агенты.
Подходящие эмульгирующие агенты могут представлять собой природные камеди, например, гуммиарабик или трагакантовую камедь; природные фосфатиды, например, соевый лецитин; и сложные эфиры, включая неполные сложные эфиры, полученные из жирных кислот и ангидридов гексита, например, сорбитмоноолеат, и продукты конденсации указанных неполных сложных эфиров с этиленоксидом, например, полиоксиэтиленсорбитмоноолеат.
В других вариантах реализации в композицию могут быть включены изотонические агенты, например, сахара, полиспирты, такие как маннит, сорбит, или хлорид натрия. Пролонгированная абсорбция инъецируемых композиций может быть обеспечена посредством включения в композицию агента, замедляющего абсорбцию, например, моностеаратных солей и желатина.
Иллюстративные формы для перорального введения включают таблетки, капсулы, эликсиры, сиропы и т.п.
В зависимости от типа рака, описанного в настоящем документе, способ введения и/или локальное или системное введение комбинации соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac и/или конъюгатов, визуализирующих лиганд PSMA, в настоящем документе предусмотрен широкий диапазон допустимых доз, включая дозы, входящие в диапазон от примерно 1 МБк до примерно 4 МБк соединения I-Ac или Ia-Ac. В некоторых вариантах реализации в настоящем документе предусмотрены допустимые дозы для I-Lu или Ia-Lu, выраженные в единицах ГБк, включая дозы, входящие в диапазон от примерно 2 ГБк до примерно 13 ГБк. Дозы могут быть однократными или дробными, и их можно вводить в соответствии с различными протоколами, включая q.d., b.i.d., t.i.d. или даже через день, два раза в неделю (b.i.w.), один раз в неделю, один раз в месяц, один раз в квартал и т.п. В каждом из указанных случаев следует понимать, что терапевтически эффективные количества, описанные в настоящем документе, соответствуют отдельному моменту введения или альтернативно общей суточной, недельной, месячной или квартальной дозе, в соответствии с протоколом введения доз. В некоторых вариантах реализации комбинацию соединений формулы I-Lu или Ia-Lu и I-Ac или Ia-Ac можно вводить по независимым схемам однократно, или один раз в неделю, или один раз в две недели, или один раз в три недели, или один раз в четыре недели, или один раз в пять недель, или один раз в шесть недель, или один раз в семь недель, или один раз в восемь недель и т.п.
В одном аспекте комбинацию соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac, или конъюгат, визуализирующий лиганд PSMA, описанный в настоящем документе, можно вводить непосредственно в кровоток, в мышцу или во внутренний орган. Подходящие способы такого парентерального введения включают внутривенную, внутриартериальную, интраперитонеальную, эпидуральную, интрацеребровентрикулярную, интрауретральную, интрастернальную, внутричерепную, внутриопухолевую, внутримышечную и подкожную доставку. Подходящие средства для парентерального введения включают игловые (включая микроигловые) шприцы, безигловые шприцы и инфузионные технологии.
В одном иллюстративном аспекте парентеральные лекарственные формы обычно представляют собой водные растворы, которые могут содержать носители или вспомогательные вещества, такие как соли, углеводы и буферные агенты (предпочтительно при рН от 3 до 9), но для некоторых применений они могут быть более подходящим образом составлены в композицию стерильного неводного раствора или в высушенной форме для использования вместе с подходящим носителем, таким как стерильная апирогенная вода. В других вариантах реализации любые жидкие лекарственные формы, описанные в настоящем документе, могут быть адаптированы для парентерального введения I-Lu или Ia-Lu и I-Ac или Ia-Ac, или конъюгатов, визуализирующих лиганд PSMA, описанных в настоящем документе. Получение парентеральных лекарственных форм в стерильных условиях, например, посредством лиофилизации в стерильных условиях, можно без труда осуществить стандартными фармацевтическими технологиями, известными специалистам в данной области техники. В одном варианте реализации растворимость комбинации соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac, или конъюгата, визуализирующего лиганд PSMA, используемого для получения парентеральной лекарственной формы, может быть повышена посредством использования соответствующих технологий составления лекарственных форм, таких как введение агентов, улучшающих растворимость.
В различных вариантах реализации лекарственные формы для парентерального введения могут быть составлены для мгновенного и/или модифицированного высвобождения. В одном иллюстративном аспекте комбинацию активных агентов согласно настоящему изобретению (т.е. соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac, или конъюгатов, визуализирующих лиганд PSMA) можно вводить в лекарственной форме с временным высвобождением, например, в композиции, которая содержит полимер с медленным высвобождением. Активные соединения I-Lu или Ia-Lu и I-Ac или Ia-Ac, или конъюгаты, визуализирующие лиганд PSMA, могут быть получены с носителями, которые защищают соединения I-Lu или Ia-Lu и I-Ac или Ia-Ac, или конъюгат, визуализирующий лиганд PSMA, от быстрого высвобождения, например, в лекарственной форме с контролируемым высвобождение, включая имплантаты и микроинкапсулированные системы доставки. Могут быть использованы биоразлагаемые, биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевая кислота, коллаген, полиортоэфиры, полимолочная кислота и сополимеры полимолочной и полигликолевой кислот (PGLA). Способы получения таких лекарственных форм, в целом, известны специалистам в данной области техники. В другом варианте реализации комбинацию соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac, или конъюгатов, визуализирующих лиганд PSMA, описанных в настоящем документе, или композиции, содержащие соединения I-Lu или Ia-Lu и I-Ac или Ia-Ac, или конъюгаты, визуализирующие лиганд PSMA, можно вводить непрерывно, сообразно обстоятельствам.
В одном варианте реализации предложен набор. При необходимости введения комбинации активных соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac, и конъюгатов, визуализирующих лиганд PSMA, можно объединять две или более фармацевтических композиций в форме набора, подходящего для последовательного введения или совместного введения композиций. Такой набор содержит две или более отдельных фармацевтических композиций, по меньшей мере один из которых содержит комбинацию соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac, или конъюгат, визуализирующий лиганд PSMA, описанный в настоящем документе, и средства для раздельного хранения композиций, такие как контейнер, градуированная бутылка или градуированный пакет из фольги. В другом варианте реализации предложены композиции, содержащие одно или более из комбинации соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac, или конъюгатов, визуализирующих лиганд PSMA, описанных в настоящем документе, в контейнерах с этикетками, на которых представлены инструкции по применению комбинации соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac, или конъюгатов, визуализирующих лиганд PSMA, для выбора и/или лечения пациента.
В одном варианте реализации стерильные растворы для инъекций могут быть получены введением требуемого количества активного агента в соответствующий растворитель с одним или с комбинацией ингредиентов, описанных выше, по необходимости, с последующей стерилизацией фильтрованием. Обычно дисперсии получают введением активной комбинации соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac, или конъюгата, визуализирующего лиганд PSMA, в стерильный носитель, который содержит дисперсионную среду и любые дополнительные ингредиенты из тех, которые описаны выше. В случае стерильных порошков для получения стерильных растворов для инъекций, предпочтительные способы получения представляют собой вакуумную сушку и сушку вымораживанием, в результате которых из предварительно стерильно отфильтрованного раствора получают порошок активного компонента и любого дополнительного требуемого ингредиента, или указанные ингредиенты могут быть стерильно отфильтрованы вместе.
Композиция может быть составлена в виде раствора, микроэмульсии, липосомы или другой упорядоченной структуры, пригодной для высокой концентрации лекарства. Носителем может быть растворитель или дисперсионная среда, содержащая, например, воду, этанол, многоатомный спирт (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль, и т.д.) и их подходящие смеси. В одном варианте реализации необходимую текучесть можно поддерживать, например, с помощью покрытий, таких как лецитин, посредством сохранения требуемого размера частиц в случае дисперсий, а также с помощью поверхностно-активных веществ.
Можно использовать любую эффективную схему введения комбинации соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac. Например, комбинацию соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac можно вводить в виде разовых доз, или указанные дозы можно делить и вводить по схеме введения доз несколько раз в сутки. Кроме того, в качестве альтернативы ежедневному лечению можно использовать скользящую схему, например, от одного до пяти дней в неделю, и для способов, описанных в настоящем документе, такая чередующаяся или разнесенная по дням схема считается эквивалентной ежедневному лечению, и является предусмотренной. В одном иллюстративном варианте реализации пациента лечат несколькими инъекциями комбинации соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac для лечения рака. В одном варианте реализации пациенту несколько раз (предпочтительно от примерно 2 до примерно 50 раз) вводят инъекцию комбинации соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac, например, с интервалами по 12-72 часа или с интервалами по 48-72 часа. Дополнительные инъекции комбинации соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac можно вводить пациенту через несколько дней или месяцев после первоначальной инъекции(ий), и дополнительные инъекции могут предотвращать рецидив рака. В другом иллюстративном варианте реализации пациента лечат однократными инъекциями соединения I-Lu или Ia-Lu и соединения I-Ac или Ia-Ac в один и тот же день, в любом порядке введения инъекций, затем вводят несколько инъекций I-Lu или Ia-Lu для лечения рака. В некоторых вариантах реализации пациенту несколько раз (предпочтительно от примерно 2 до примерно 50 раз) вводят инъекции соединения I-Lu или Ia-Lu после приема первоначальной инъекции каждого из соединения I-Lu или Ia-Lu и соединения I-Ac или Ia-Ac в тот же день, в любом порядке, или в одно время, например, с интервалами в 12-72 часа, или с интервалами в 48-72 часа, или один раз в неделю, или один раз каждые две недели.
Можно использовать любой подходящий курс терапии с применением комбинации соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac. В одном иллюстративном варианте реализации комбинацию соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac вводят в виде однократной суточной дозы, которую вводят пять дней в неделю в 1, 2 и 3 неделю каждого 4-недельного цикла, причем в 4 неделю дозу не вводят. В альтернативном варианте реализации комбинацию соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac вводят в виде однократной суточной дозы, которую вводят три дня в неделю в 1 и 3 неделю каждого 4-недельного цикла, причем во 2 и в 4 неделю дозу не вводят. В альтернативном варианте реализации комбинацию соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac вводят два раза в неделю в 1 и 2 неделю, т.е. на 1, 4, 8, 11 день 3-недельного цикла. В альтернативном варианте реализации комбинацию соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac вводят один раз в неделю в 1 и 2 неделю, т.е. на 1 и 8 день 3-недельного цикла. В альтернативном варианте реализации комбинацию соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac вводят в один день, в любом порядке, или в одно и то же время, с последующим циклическим введением соединения I-Lu или Ia-Lu один раз в неделю на протяжении от примерно 2 до примерно 6 циклов. В альтернативном варианте реализации комбинацию соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac вводят в один день, в любом порядке, или в одно и то же время, с последующим циклическим введением соединения I-Lu или Ia-Lu один раз в неделю на протяжении от примерно 2 до примерно 6 циклов, с последующим введением комбинации соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac в один день, в любом порядке, или в одно и то же время, с последующим циклическим введением соединения I-Lu или Ia-Lu один раз в неделю на протяжении от примерно 2 до примерно 6 циклов.
В альтернативном варианте реализации комбинацию соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac вводят в течение примерно 2-72 часов относительно друг друга, в любом порядке, с последующим циклическим введением соединения I-Lu или Ia-Lu один раз в неделю на протяжении от примерно 2 до примерно 6 циклов. В альтернативном варианте реализации комбинацию соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac вводят в течение примерно 2-72 часов относительно друг друга, в любом порядке, с последующим циклическим введением соединения I-Lu или Ia-Lu один раз в неделю на протяжении от примерно 2 до примерно 6 циклов, с последующим введением комбинации соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac в один день, в любом порядке, или в одно и то же время, с последующим циклическим введением соединения I-Lu или Ia-Lu один раз в неделю на протяжении от примерно 2 до примерно 6 циклов.
Уровень доз соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac может быть измерен в ГБк и МБк, соответственно. В некоторых вариантах реализации терапевтически эффективное количество I-Lu или Ia-Lu составляет от примерно 2 ГБк до примерно 20 ГБк. В некоторых вариантах реализации терапевтически эффективное количество I-Lu или Ia-Lu составляет от примерно 2 ГБк до примерно 13 ГБк. В некоторых вариантах реализации терапевтически эффективное количество I-Lu или Ia-Lu составляет от примерно 4 ГБк до примерно 11 ГБк. В некоторых вариантах реализации терапевтически эффективное количество I-Lu или Ia-Lu составляет от примерно 5 ГБк до примерно 10 ГБк. В некоторых вариантах реализации терапевтически эффективное количество I-Lu или Ia-Lu составляет от примерно 6 ГБк до примерно 9 ГБк. В некоторых вариантах реализации терапевтически эффективное количество I-Lu или Ia-Lu составляет от примерно 6 ГБк до примерно 8 ГБк. В некоторых вариантах реализации терапевтически эффективное количество I-Lu или Ia-Lu составляет от примерно 6,5 ГБк до примерно 8,5 ГБк. В некоторых вариантах реализации терапевтически эффективное количество I-Lu или Ia-Lu составляет от примерно 7 ГБк до примерно 8 ГБк. В некоторых вариантах реализации терапевтически эффективное количество I-Lu или Ia-Lu составляет примерно 7,4 ГБк. В некоторых вариантах реализации суммарная доза I-Lu или Ia-Lu составляет от примерно 15 ГБк до примерно 200 ГБк. В некоторых вариантах реализации суммарная доза I-Lu или Ia-Lu составляет от примерно 25 ГБк до примерно 185 ГБк. В некоторых вариантах реализации суммарная доза I-Lu или Ia-Lu составляет от примерно 35 ГБк до примерно 150 ГБк. В некоторых вариантах реализации суммарная доза I-Lu или Ia-Lu составляет от примерно 40 ГБк до примерно 100 ГБк. В некоторых вариантах реализации суммарная доза I-Lu или Ia-Lu составляет примерно 44 ГБк. В некоторых вариантах реализации максимальная продолжительность лечения субъекта составляет от примерно 19 до 23 месяцев.
В некоторых вариантах реализации терапевтически эффективное количество I-Lu или Ia-Lu составляет от 2 ГБк до 20 ГБк. В некоторых вариантах реализации терапевтически эффективное количество I-Lu или Ia-Lu составляет от 2 ГБк до 13 ГБк. В некоторых вариантах реализации терапевтически эффективное количество I-Lu или Ia-Lu составляет от 4 ГБк до 11 ГБк. В некоторых вариантах реализации терапевтически эффективное количество I-Lu или Ia-Lu составляет от 5 ГБк до 10 ГБк. В некоторых вариантах реализации терапевтически эффективное количество I-Lu или Ia-Lu составляет от 6 ГБк до 9 ГБк. В некоторых вариантах реализации терапевтически эффективное количество I-Lu или Ia-Lu составляет от 6 ГБк до 8 ГБк. В некоторых вариантах реализации терапевтически эффективное количество I-Lu или Ia-Lu составляет от 6,5 ГБк до 8,5 ГБк. В некоторых вариантах реализации терапевтически эффективное количество I-Lu или Ia-Lu составляет от 7 ГБк до 8 ГБк. В некоторых вариантах реализации терапевтически эффективное количество I-Lu или Ia-Lu составляет 7,4 ГБк. В некоторых вариантах реализации суммарная доза I-Lu или Ia-Lu составляет от 15 ГБк до 200 ГБк. В некоторых вариантах реализации суммарная доза I-Lu или Ia-Lu составляет от 25 ГБк до 185 ГБк. В некоторых вариантах реализации суммарная доза I-Lu или Ia-Lu составляет от 35 ГБк до 150 ГБк. В некоторых вариантах реализации суммарная доза I-Lu или Ia-Lu составляет от 40 ГБк до 100 ГБк. В некоторых вариантах реализации суммарная доза I-Lu или Ia-Lu составляет 44 ГБк. В некоторых вариантах реализации максимальная продолжительность лечения субъекта составляет от 19 до 23 месяцев.
В некоторых вариантах реализации терапевтически эффективное количество I-Ac или Ia-Ac составляет от примерно 1 МБк до примерно 20 МБк. В некоторых вариантах реализации терапевтически эффективное количество I-Ac или Ia-Ac составляет от примерно 1 МБк до примерно 10 МБк. В некоторых вариантах реализации терапевтически эффективное количество I-Ac или Ia-Ac составляет от примерно 4 МБк до примерно 14 МБк. В некоторых вариантах реализации терапевтически эффективное количество I-Ac или Ia-Ac составляет от примерно 5 МБк до примерно 10 МБк. В некоторых вариантах реализации терапевтически эффективное количество I-Ac или Ia-Ac составляет от примерно 6 МБк до примерно 8 МБк. В некоторых вариантах реализации терапевтически эффективное количество I-Ac или Ia-Ac составляет от примерно 5 МБк до примерно 7 МБк. В некоторых вариантах реализации терапевтически эффективное количество I-Ac или Ia-Ac составляет от примерно 1 МБк до примерно 4 МБк. В некоторых вариантах реализации терапевтически эффективное количество I-Ac или Ia-Ac составляет от примерно 2 МБк до примерно 3 МБк. В некоторых вариантах реализации терапевтически эффективное количество I-Ac или Ia-Ac составляет примерно 5 МБк. В некоторых вариантах реализации терапевтически эффективное количество I-Ac или Ia-Ac составляет примерно 2,5 МБк.
В некоторых вариантах реализации терапевтически эффективное количество I-Ac или Ia-Ac составляет от 1 МБк до 20 МБк. В некоторых вариантах реализации терапевтически эффективное количество I-Ac или Ia-Ac составляет от 1 МБк до 10 МБк. В некоторых вариантах реализации терапевтически эффективное количество I-Ac или Ia-Ac составляет от 4 МБк до 14 МБк. В некоторых вариантах реализации терапевтически эффективное количество I-Ac или Ia-Ac составляет от 5 МБк до 10 МБк. В некоторых вариантах реализации терапевтически эффективное количество I-Ac или Ia-Ac составляет от 6 МБк до 8 МБк. В некоторых вариантах реализации терапевтически эффективное количество I-Ac или Ia-Ac составляет от 5 МБк до 7 МБк. В некоторых вариантах реализации терапевтически эффективное количество I-Ac или Ia-Ac составляет от 1 МБк до 4 МБк. В некоторых вариантах реализации терапевтически эффективное количество I-Ac или Ia-Ac составляет от 2 МБк до 3 МБк. В некоторых вариантах реализации терапевтически эффективное количество I-Ac или Ia-Ac составляет 5 МБк. В некоторых вариантах реализации терапевтически эффективное количество I-Ac или Ia-Ac составляет 2,5 МБк.
Конъюгаты, визуализирующие лиганд PSMA, и соединения I-Lu, I-Ac, Ia-Lu и Ia-Ac, описанные в настоящем документе, могут содержать один или более хиральных центров, или иным образом могут быть способны существовать в форме нескольких стереоизомеров. Соответственно, следует понимать, что настоящее изобретение включает чистые стереоизомеры, а также смеси стереоизомеров, такие как энантиомеры, диастереомеры и энантиомерно или диастереомерно обогащенные смеси. Конъюгаты, визуализирующие лиганд PSMA, и соединения I-Lu, I-Ac, Ia-Lu и Ia-Ac, описанные в настоящем документе, могут быть способны существовать в форме геометрических изомеров. Соответственно, следует понимать, что настоящее изобретение включает чистые геометрические изомеры или смеси геометрических изомеров.
Предусмотрено, что конъюгаты, визуализирующие лиганд PSMA, и соединения I-Lu, I-Ac и Ia-Lu, Ia-Ac, описанные в настоящем документе, могут существовать в несольватированных формах, а также в сольватированных формах, включая гидратированные формы. В целом, сольватированные формы эквивалентны несольватированным формам и входят в объем согласно настоящему раскрытию. Конъюгаты, визуализирующие лиганд PSMA, и соединения I-Lu, I-Ac, Ia-Lu и Ia-Ac, описанные в настоящем документе, могут существовать в различных кристаллических или аморфных формах. Как правило, все физические формы эквивалентны для применения, предполагаемого настоящим изобретением, и подразумеваются входящими в объем согласно настоящему раскрытию.
В другом варианте реализации композиции и/или лекарственные формы для введения комбинации соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac получают из соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac с чистотой по меньшей мере примерно 90%, или примерно 95%, или примерно 96%, или примерно 97%, или примерно 98%, или примерно 99%, или примерно 99,5%. В другом варианте реализации композиции и/или лекарственные формы для введения комбинации соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac получают из соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac с чистотой по меньшей мере 90%, или по меньшей мере 95%, или по меньшей мере 96%, или по меньшей мере 97%, или по меньшей мере 98%, или по меньшей мере 99%, или по меньшей мере 99,5%.
В другом варианте реализации композиции и/или лекарственные формы для введения конъюгата, визуализирующего лиганд PSMA, получают из конъюгата, визуализирующего лиганд PSMA, с чистотой по меньшей мере примерно 90%, или примерно 95%, или примерно 96%, или примерно 97%, или примерно 98%, или примерно 99%, или примерно 99,5%. В другом варианте реализации композиции и/или лекарственные формы для введения конъюгата, визуализирующего лиганд PSMA, получают из конъюгата, визуализирующего лиганд PSMA, с чистотой по меньшей мере 90%, или по меньшей мере 95%, или по меньшей мере 97%, или по меньшей мере 98%, или по меньшей мере 99%, или по меньшей мере 99,5%.
В другом варианте реализации композиции и/или лекарственные формы для введения конъюгата, визуализирующего лиганд PSMA, с радиоактивной меткой получают из конъюгата, визуализирующего лиганд PSMA, с радиохимической чистотой по меньшей мере примерно 90%, или примерно 95%, или примерно 96%, или примерно 97%, или примерно 98%, или примерно 99%, или примерно 99,5%. В другом варианте реализации композиции и/или лекарственные формы для введения конъюгата, визуализирующего лиганд PSMA, получают из конъюгата, визуализирующего лиганд PSMA, с чистотой по меньшей мере 90%, или по меньшей мере 95%, или по меньшей мере 96%, или по меньшей мере 97%, или по меньшей мере 98%, или по меньшей мере 99%, или по меньшей мере 99,5%.
Чистоту соединений I-Lu, I-Ac, Ia-Lu и Ia-Ac или конъюгатов, визуализирующих лиганд PSMA, описанных в настоящем документе, можно измерять любой стандартной технологией, включая различные хроматографические или спектроскопические технологии, такие как жидкостная хроматография высокого давления или высокоэффективная жидкостная хроматография (ВЭЖХ), спектроскопия ядерного магнитного резонанса, ТСХ, спектроскопия УФ поглощения, флуоресцентная спектроскопия и т.п.
В другом варианте реализации соединения I-Lu, I-Ac, Ia-Lu и Ia-Ac или конъюгат, визуализирующий лиганд PSMA, описанный в настоящем документе, представлен в стерильном контейнере или упаковке.
В одном аспекте клинический эффект лечения пациента комбинацией соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac может быть охарактеризован как общая выживаемость (OS). В данном контексте термин «общая выживаемость (OS)» означает время со дня рандомизации до дня гибели по любой причине.
В одном аспекте клинический эффект лечения пациента комбинацией соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac может быть охарактеризован с использованием критериев оценки ответа солидных опухолей на терапию (RECIST). Иллюстративно, указанные критерии адаптированы из исходной публикации WHO Handbook (3), с учетом измерения наибольшего диаметра для всех целевых очагов: полный ответ (CR) - исчезновения всех целевых очагов; частичный ответ (PR) - по меньшей мере 30% уменьшение суммы наибольших диаметров целевых очагов с использованием в качестве точки отсчета исходной суммы наибольших диаметров; стабилизация заболевания (SD) - отсутствие существенного сокращения для отнесения к классу частичного ответа, но и отсутствие существенного увеличения для отнесения к классу прогрессирования заболевания, с использованием в качестве точки отсчета наименьшей суммы наибольших диаметров с момента начала лечения; прогрессирование заболевания (PD) - по меньшей мере 20% увеличение суммы наибольших диаметров целевых очагов, с использованием в качестве точки отсчета суммы наименьшей суммы наибольших диаметров, зарегистрированной с момента начала лечения, или появление одного или более новых очагов. В другом аспекте общая частота ответа болезни (ORR) представляет собой клинический эффект, и ее рассчитывают как процент пациентов, достигших наилучшего ответа CR или PR. Общая частота контроля заболевания (DCR) может быть другим клиническим эффектом, и ее рассчитывают как процентов, достигших наилучшего ответа CR, PR или SD. В некоторых вариантах реализации ответ может представлять собой частоту контроля заболевания (DCR), измеренную по критериям RECIST версии 1.1.
В другом аспекте клинический эффект лечения пациента комбинацией соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac может быть охарактеризован как радиографическое выживание без прогрессирования (rPFS). В данном контексте «радиографическое выживание без прогрессирования (rPFS)» означает время со дня рандомизации до дня радиографического прогрессирования заболевания, как описано в руководстве Рабочей группы по раку предстательной железы 3 (PCWG3) или до гибели по любой причине. См., например, Scher HI, Morris MJ, Stadler WM, Higano C, Basch E, Fizazi K, et al. Trial Design and Objectives for Castration-Resistant Prostate Cancer: Updated Recommendations from the Prostate Cancer Clinical Trials Work Group 3. J Clin Oncol 2016;34(12):1402-18. В другом аспекте клинический эффект лечения пациента соединением I-Lu или Ia-Lu и I-Ac или Ia-Ac может быть охарактеризован как время до первого симптоматического явления со стороны костной системы (SSE). Следует понимать, что симптоматическое явление со стороны костной системы означает клинически значимый патологический перелом, операция или облучение кости, или компрессия спинного мозга. В данном контексте «время до первого симптоматического явления со стороны костной системы» означает время со дня рандомизации до дня первого нового симптоматического патологического перелома кости, компрессии спинного мозга, связанного с опухолью ортопедического хирургического вмешательства или необходимости в лучевой терапии для облегчения боли в кости, в зависимости от того, что случится первым.
В одном иллюстративном примере общая выживаемость представляет собой время до гибели данного пациента, определенное как количество дней с первого дня приема пациентом предписанного лечения (C1D1) до дня смерти пациента. Могут быть включены все случаи смерти, независимо от того, возник ли данный случай в период приема пациентом экспериментального препарата или после прекращения пациентом приема экспериментального препарата. Если пациент не погиб, то данные могут быть отредактированы по дню последнего экспериментального визита или по последнему дню контакта, или по тому дню, когда было последний раз известно о том, что пациент жив, в зависимости от того, что случится последним.
Альтернативно, клинический эффект лечения пациента с применением комбинации соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac может быть охарактеризован как подавление роста опухоли, которое может быть идентифицировано у пациента, например, с помощью визуализации рака при последующем наблюдении пациента после лечения с применением I-Lu или Ia-Lu и I-Ac или Ia-Ac. Например, подавление роста опухоли может быть охарактеризовано посредством измерения размера опухоли у пациента после введения I-Lu или Ia-Lu и I-Ac или Ia-Ac в соответствии с любой из технологий визуализации, описанных в настоящем документе, причем о подавлении роста опухоли свидетельствует стабилизация размера опухоли или уменьшение размера опухоли. Следует понимать, что идентификация подавления роста опухоли может быть осуществлена с использованием различных технологий, и не ограничена способами визуализации, описанными в настоящем документе (например, визуализация КТ, МРТ, ПЭТ, визуализация ОФЭКТ или рентгенография органов грудной клетки).
В одном варианте реализации предложен способ определения того, показана ли комбинация соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac для лечения пациента, страдающего от рака, и предложенный способ включает стадию определения статуса PSMA у пациента, страдающего от рака, причем комбинация соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac показана для лечения пациента, если статус PSMA у данного пациента является позитивным.
В одном варианте реализации предложен способ оценки того, показана ли комбинация соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac для лечения пациента, страдающего от одного из видов рака, описанных в настоящем документе. Предложенный способ включает стадии визуального определения статуса PSMA у данного пациента, причем статус PSMA основан на визуализации опухолей, которые являются PSMA-позитивными у данного пациента, и при этом комбинация соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac показана для лечения пациента, если статус PSMA у данного пациента является позитивным.
В описанных выше вариантах реализации, если пациент входит в группу с положительным статусом PSMA, то показан клинический эффект лечения с применением комбинации соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac. В одном варианте реализации клинический эффект для пациента может представлять собой общую выживаемость пациента, способность принимать четыре или более циклов терапии с комбинацией соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac, подавление роста опухоли, стабилизацию заболевания, частичный ответ пациента на терапию, полный ответ пациента на терапию, контроль заболевания (т.е. наилучший достигнутый результат представляет собой полный ответ, частичный ответ или стабилизацию заболевания) и/или общий ответ заболевания (т.е. наилучший достигнутый результат представляет собой полный ответ или частичный ответ). В одном иллюстративном примере клинический эффект для пациента, проходящего лечение плевральной мезотелиомы или аденокарциномы (например, аденокарциномы желудочно-пищеводного соединения), представляет собой стабилизацию заболевания.
В другом варианте реализации способы, описанные в настоящем документе, включают следующие примеры. Представленные примеры дополнительно иллюстрируют другие признаки различных вариантов реализации согласно настоящему раскрытию. Однако следует понимать, что приведенные примеры являются иллюстративными, и их не следует толковать как ограничение других вариантов реализации согласно настоящему раскрытию. Кроме того, предусмотрено, что другие варианты примеров включены в различные варианты реализации согласно настоящему раскрытию. Кроме того, следует понимать, что все диапазоны, описанные в настоящем документе, такие как диапазоны, описанные в связи с различными вариантами реализации, являются иллюстративными и не предназначены в качестве ограничения. Специалистам в данной области техники понятно, что все диапазоны, описанные нижней и верхней границами, например, от примерно 1 до примерно 20, включают все возможные значения, содержащиеся между нижней и верхней границами, и включают все возможные диапазоны значений, которые могут быть получены из набора возможных значений, содержащихся между нижней и верхней границами.
ПРИМЕРЫ
Пример 1:
Пациентам с PSMA-позитивными сканами вводили однократную дозу соединения Ia-Ac на 1 день 1 цикла клинической схемы с применением 7,4 ГБк соединения Ia-Lu, которое вводили 6 раз в неделю на протяжении не более 5 циклов. Субъектов осматривали один раз в неделю для оценки неблагоприятных явлений (возникновения, продолжительности, степени и связи с лечением) только на протяжении 1 цикла. DLT определяли по нежелательным явлениям только в 1 цикле.
Повторную оценку субъектов проводили по окончании каждых 2 циклов. Во время каждой повторной оценки пациентов оценивали по ПЭТ PSMA и по фтор-ПЭТ/КТ скану кости. Оценка костного заболевания соответствовала критериям PCWG23. Оценку PSA проводили в соответствии с установленной практикой по меньшей мере 2 раза в неделю.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ЛЕЧЕНИЯ РАКА | 2019 |
|
RU2811406C2 |
| ПСМА-ТАРГЕТНОЕ СОЕДИНЕНИЕ И ЕГО КОМПЛЕКС С РАДИОНУКЛИДАМИ ДЛЯ ТЕРАНОСТИКИ ОПУХОЛЕЙ, ЭКСПРЕССИРУЮЩИХ ПСМА | 2022 |
|
RU2803734C1 |
| КОМПЛЕКС, СОДЕРЖАЩИЙ НАЦЕЛИВАЮЩЕЕСЯ НА PSMA СОЕДИНЕНИЕ, СВЯЗАННОЕ С РАДИОНУКЛИДОМ СВИНЦА ИЛИ ТОРИЯ | 2018 |
|
RU2795398C2 |
| СПОСОБ ПРЕДОТВРАЩЕНИЯ ЛУЧЕВОГО ПОВРЕЖДЕНИЯ ЖЕЛЕЗ У ЧЕЛОВЕКА | 2020 |
|
RU2821523C1 |
| НОВЫЕ СВЯЗЫВАЮЩИЕ ОПУХОЛЕВЫЙ АНТИГЕН АГЕНТЫ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2831681C2 |
| СПОСОБ ПОЛУЧЕНИЯ КОМПЛЕКСА ПСМА-ТАРГЕТНОГО СОЕДИНЕНИЯ НА ОСНОВЕ МОЧЕВИНЫ Lu-PS-161 И КОМПЛЕКС | 2023 |
|
RU2808636C1 |
| СОЕДИНЕНИЕ, ЦЕЛЕНАПРАВЛЕННО ВОЗДЕЙСТВУЮЩЕЕ НА ПРОСТАТСПЕЦИФИЧЕСКИЙ МЕМБРАННЫЙ АНТИГЕН, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2022 |
|
RU2832300C2 |
| Лиофилизат на основе лигандов к простат-специфическому мембранному антигену (ПСМА) для приготовления радиофармацевтической композиции в форме раствора для инъекций для лечения рака предстательной железы, радиофармацевтическая композиция на ее основе для лечения рака предстательной железы и способ приготовления радиофармацевтической композиции | 2023 |
|
RU2817970C1 |
| ПАРААМИНОГИППУРОВАЯ КИСЛОТА (ПАГ) КАК ВЕЩЕСТВО ДЛЯ ЗАЩИТЫ ПОЧЕК | 2020 |
|
RU2804349C2 |
| МЕЧЕННЫЙ РАДИОАКТИВНЫМ ИЗОТОПОМ АНТАГОНИСТ GRPR ДЛЯ ПРИМЕНЕНИЯ В КАЧЕСТВЕ ЛЕЧЕБНО-ДИАГНОСТИЧЕСКОГО СРЕДСТВА | 2020 |
|
RU2839888C1 |
Настоящее изобретение относится к способу лечения рака, связанного с экспрессией простатоспецифического мембранного антигена (PSMA). Предложенный способ включает стадию введения животному-хозяину терапевтически эффективного количества первого соединения, имеющего формулу I, причем указанное соединение связано в комплекс с 177Lu (I-Lu), в комбинации с терапевтически эффективным количеством второго соединения, имеющего формулу I, причем указанное соединение связано в комплекс с 225Ac (I-Ac). Также предложено применение соединения формулы I-Lu для получения лекарственного средства в комбинации с соединением формулы I-Ac. В результате лечения рака, экспрессирующего PSMA, с применением комбинации соединений формул I-Lu и I-Ас происходит стабилизация заболевания. 2 н. и 32 з.п. ф-лы, 1 пр.
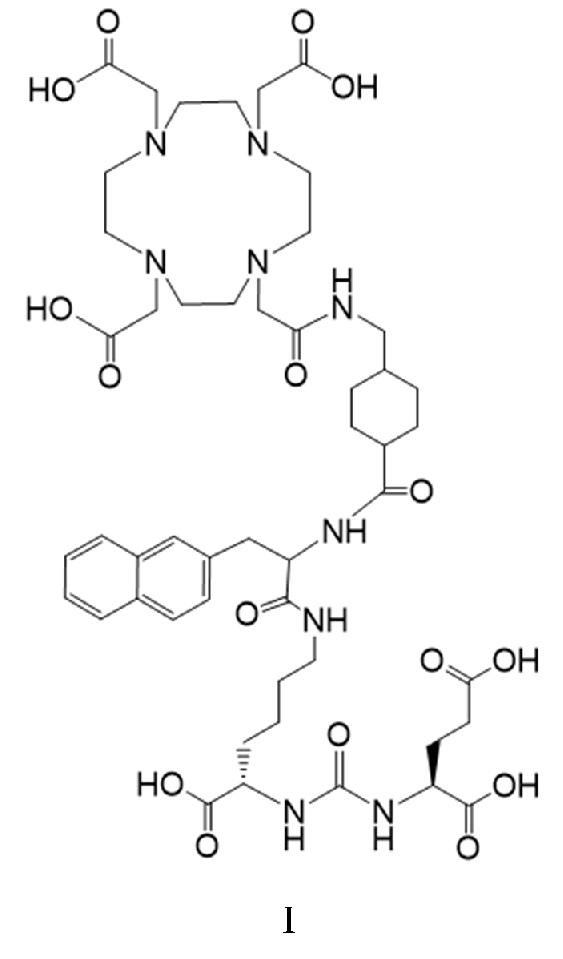
1. Способ лечения рака, связанного с экспрессией простатоспецифического мембранного антигена (PSMA), у животного-хозяина, включающий стадию введения животному-хозяину терапевтически эффективного количества первого соединения, имеющего формулу I
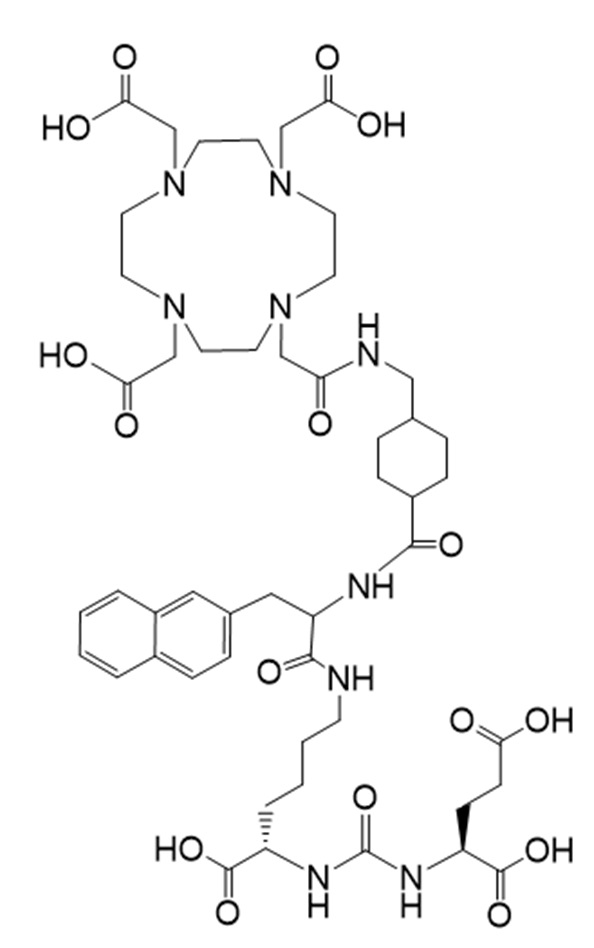 ,
,
причем указанное соединение связано в комплекс с 177Lu (I-Lu);
в комбинации с терапевтически эффективным количеством второго соединения, имеющего формулу I
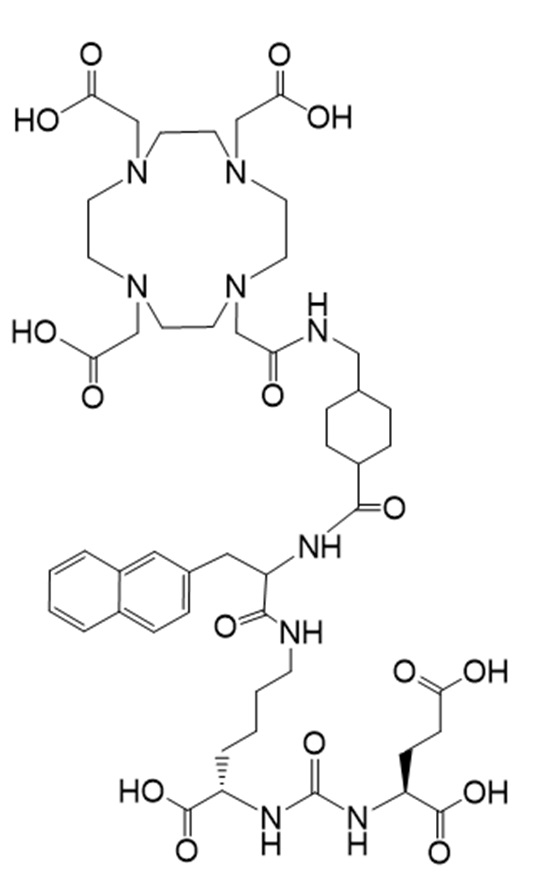 ,
,
причем указанное соединение связано в комплекс с 225Ac (I-Ac).
2. Способ по п. 1, отличающийся тем, что первое соединение имеет формулу Ia
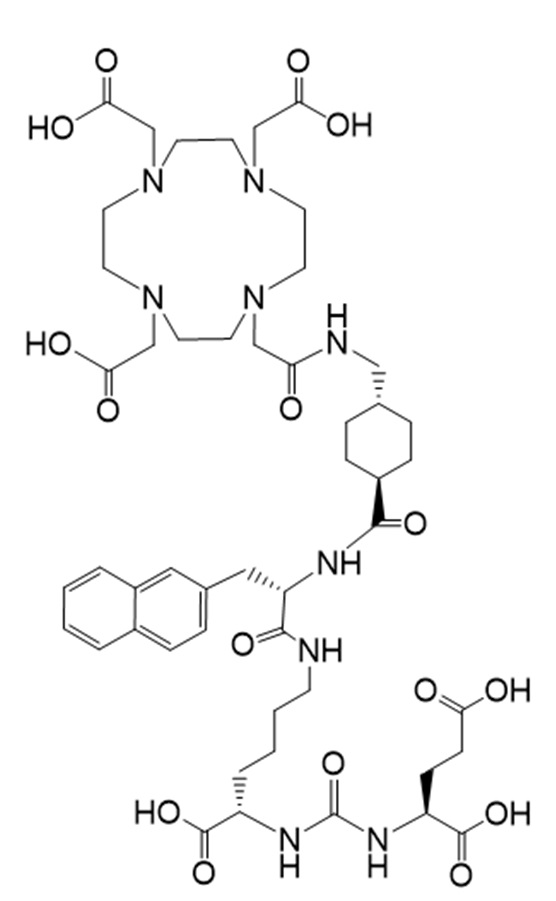
причем указанное соединение связано в комплекс с 177Lu (Ia-Lu).
3. Способ по п. 2, отличающийся тем, что второе соединение имеет формулу Ia
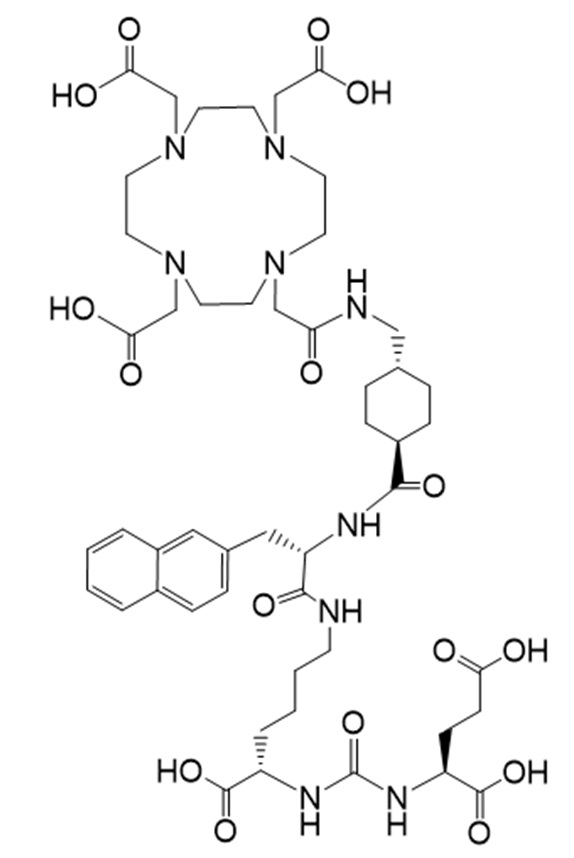
причем указанное соединение связано в комплекс с 225Ac (Ia-Ac).
4. Способ по любому одному из пп. 1-3, отличающийся тем, что рак выбран из группы, состоящей из рака предстательной железы, метастатического кастрационно-резистентного рака предстательной железы (mCRPC), рака щитовидной железы, почечно-клеточной карциномы, переходно-клеточной карциномы мочевого пузыря, аденокарциномы толстой кишки, нейроэндокринной карциномы, мультиформной глиобластомы, злокачественной меланомы, карциномы протоков поджелудочной железы, немелкоклеточной карциномы легких, саркомы мягких тканей и карциномы молочной железы.
5. Способ по п. 4, отличающийся тем, что рак представляет собой рак предстательной железы.
6. Способ по п. 4, отличающийся тем, что рак представляет собой метастатический кастрационно-резистентный рак предстательной железы (mCRPC).
7. Способ по любому из пп. 1-3, отличающийся тем, что терапевтически эффективное количество I-Lu или Ia-Lu составляет от примерно 2 ГБк до примерно 20 ГБк.
8. Способ по любому из пп. 1-3, отличающийся тем, что терапевтически эффективное количество I-Lu или Ia-Lu составляет от примерно 6 ГБк до примерно 8 ГБк.
9. Способ по любому из пп. 1-3, отличающийся тем, что терапевтически эффективное количество I-Lu или Ia-Lu составляет примерно 7,4 ГБк.
10. Способ по любому из пп. 1-3, отличающийся тем, что терапевтически эффективное количество I-Ac или Ia-Ac составляет от примерно 1 МБк до примерно 10 МБк; или от примерно 5 МБк до примерно 10 МБк; или от примерно 5 МБк до примерно 7 МБк.
11. Способ по любому из пп. 1-3, отличающийся тем, что терапевтически эффективное количество I-Ac или Ia-Ac составляет примерно 5 МБк.
12. Способ по любому из пп. 1-3, отличающийся тем, что соединение формулы I-Lu или Ia-Lu вводят одновременно с соединением формулы I-Ac или Ia-Ac.
13. Способ по любому из пп. 1-3, отличающийся тем, что соединение формулы I-Lu или Ia-Lu вводят примерно за 1 час до соединения формулы I-Ac или Ia-Ac; или примерно за 12 часов до соединения формулы I-Ac или Ia-Ac; или примерно за 24 часа до соединения формулы I-Ac или Ia-Ac; или примерно за 48 часов до соединения формулы I-Ac или Ia-Ac; или примерно за 72 часа до соединения формулы I-Ac или Ia-Ac.
14. Способ по любому из пп. 1-3, отличающийся тем, что соединение формулы I-Ac или Ia-Ac вводят примерно за 1 час до соединения формулы I-Lu или Ia-Lu; или примерно за 12 часов до соединения формулы I-Lu или Ia-Lu; или примерно за 24 часа до соединения формулы I-Lu или Ia-Lu; или примерно за 48 часов до соединения формулы I-Lu или Ia-Lu; или примерно за 72 часа до соединения формулы I-Lu или Ia-Lu.
15. Способ по п. 12, дополнительно включающий введение терапевтически эффективного количества соединения формулы I-Lu или Ia-Lu в режиме один раз в неделю на протяжении от примерно 1 до примерно 7 циклов после введения I-Lu или Ia-Lu и I-Ac или Ia-Ac.
16. Способ по п. 13, дополнительно включающий введение терапевтически эффективного количества соединения формулы I-Lu или Ia-Lu в режиме один раз в неделю на протяжении от примерно 1 до примерно 7 циклов после введения обоих соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac.
17. Способ по п. 14, дополнительно включающий введение терапевтически эффективного количества соединения формулы I-Lu или Ia-Lu в режиме один раз в неделю на протяжении от примерно 1 до примерно 7 циклов после введения обоих соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac.
18. Применение соединения формулы I-Lu,
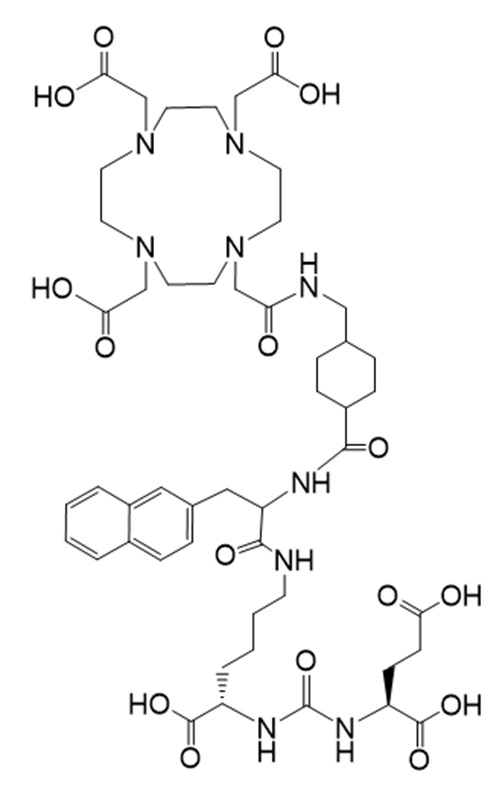
причем указанное соединение связано в комплекс с 177Lu, для получения лекарственного средства, содержащего терапевтически эффективное количество соединения формулы I-Lu, для лечения рака, связанного с экспрессией простатоспецифического мембранного антигена (PSMA), у пациента в комбинации с терапевтически эффективным количеством соединения формулы I-Ac
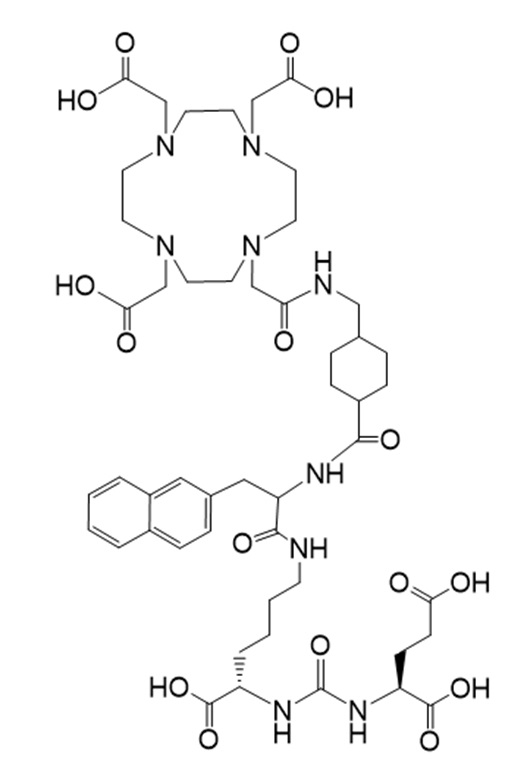
причем указанное соединение связано в комплекс с 225Ac.
19. Применение по п. 18, отличающееся тем, что соединение формулы I-Lu имеет формулу Ia-Lu
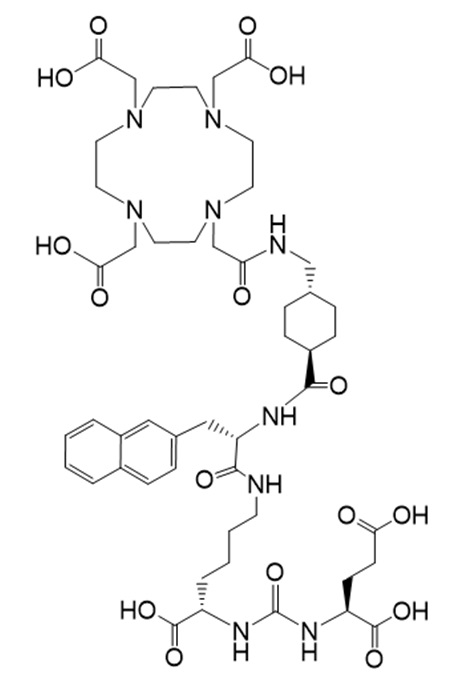
причем указанное соединение связано в комплекс с 177Lu.
20. Применение по п. 18 или 19, отличающееся тем, что соединение формулы I-Ac имеет формулу Ia-Ac
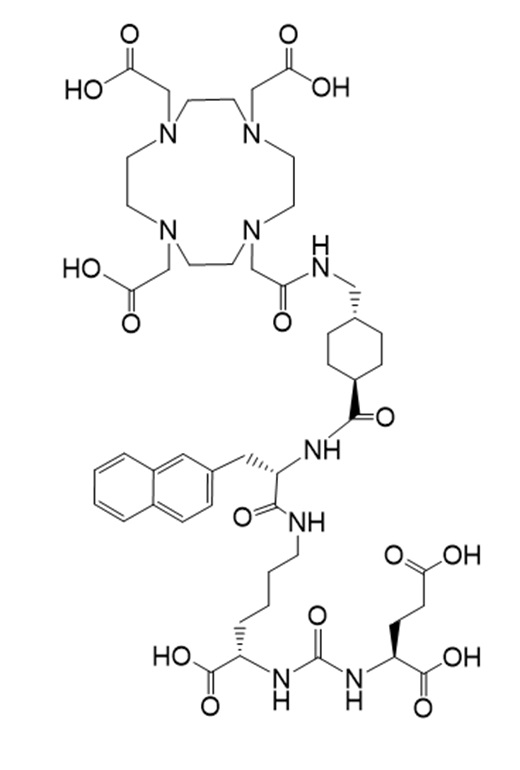
причем указанное соединение связано в комплекс с 225Ac.
21. Применение по любому одному из пп. 18-20, отличающееся тем, что рак выбран из группы, состоящей из рака предстательной железы, метастатического кастрационно-резистентного рака предстательной железы (mCRPC), рака щитовидной железы, почечно-клеточной карциномы, переходно-клеточной карциномы мочевого пузыря, аденокарциномы толстой кишки, нейроэндокринной карциномы, мультиформной глиобластомы, злокачественной меланомы, карциномы протоков поджелудочной железы, немелкоклеточной карциномы легких, саркомы мягких тканей и карциномы молочной железы.
22. Применение по любому одному из пп. 18-20, отличающееся тем, что рак представляет собой рак предстательной железы.
23. Применение по любому одному из пп. 18-20, отличающееся тем, что рак представляет собой метастатический кастрационно-резистентный рак предстательной железы (mCRPC).
24. Применение по любому одному из пп. 18-20, отличающееся тем, что терапевтически эффективное количество I-Lu или Ia-Lu составляет от примерно 2 ГБк до примерно 20 ГБк.
25. Применение по любому одному из пп. 18-20, отличающееся тем, что терапевтически эффективное количество I-Lu или Ia-Lu составляет от примерно 6 ГБк до примерно 8 ГБк.
26. Применение по любому одному из пп. 18-20, отличающееся тем, что терапевтически эффективное количество I-Lu или Ia-Lu составляет примерно 7,4 ГБк.
27. Применение по любому одному из пп. 18-20, отличающееся тем, что терапевтически эффективное количество I-Ac или Ia-Ac составляет от примерно 1 МБк до примерно 10 МБк; или от примерно 5 МБк до примерно 10 МБк; или от примерно 5 МБк до примерно 7 МБк.
28. Применение по любому одному из пп. 18-20, отличающееся тем, что терапевтически эффективное количество I-Ac или Ia-Ac составляет примерно 5 МБк.
29. Применение по любому одному из пп. 18-20, отличающееся тем, что соединение формулы I-Lu или Ia-Lu вводят одновременно с соединением формулы I-Ac или Ia-Ac.
30. Применение по любому одному из пп. 18-20, отличающееся тем, что соединение формулы I-Lu или Ia-Lu вводят примерно за 1 час до соединения формулы I-Ac или Ia-Ac; или примерно за 12 часов до соединения формулы I-Ac или Ia-Ac; или примерно за 24 часа до соединения формулы I-Ac или Ia-Ac; или примерно за 48 часов до соединения формулы I-Ac или Ia-Ac; или примерно за 72 часа до соединения формулы I-Ac или Ia-Ac.
31. Применение по любому одному из пп. 18-20, отличающееся тем, что соединение формулы I-Ac или Ia-Ac вводят примерно за 1 час до соединения формулы I-Lu или Ia-Lu; или примерно за 12 часов до соединения формулы I-Lu или Ia-Lu; или примерно за 24 часа до соединения формулы I-Lu или Ia-Lu; или примерно за 48 часов до соединения формулы I-Lu или Ia-Lu; или примерно за 72 часа до соединения формулы I-Lu или Ia-Lu.
32. Применение по п. 29, дополнительно включающее введение терапевтически эффективного количества соединения формулы I-Lu или Ia-Lu в режиме один раз в неделю на протяжении от примерно 1 до примерно 7 циклов после введения I-Lu или Ia-Lu и I-Ac или Ia-Ac.
33. Применение по п. 30, дополнительно включающее введение терапевтически эффективного количества соединения формулы I-Lu или Ia-Lu в режиме один раз в неделю на протяжении от примерно 1 до примерно 7 циклов после введения обоих соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac.
34. Применение по п. 31, дополнительно включающее введение терапевтически эффективного количества соединения формулы I-Lu или Ia-Lu в режиме один раз в неделю на протяжении от примерно 1 до примерно 7 циклов после введения обоих соединений I-Lu или Ia-Lu и I-Ac или Ia-Ac.
| US 20160228587 A1, 11.08.2016 | |||
| WO 2018108287 A1, 21.06.2018 | |||
| KRATOCHWIL C | |||
| et al | |||
| Кулисный парораспределительный механизм | 1920 |
|
SU177A1 |
| Способ получения на волокне оливково-зеленой окраски путем образования никелевого лака азокрасителя | 1920 |
|
SU57A1 |
| Топка с несколькими решетками для твердого топлива | 1918 |
|
SU8A1 |
| 1170-1176 | |||
| SATHEKGE M | |||
| et al | |||
| Синхронизирующее устройство для аппарата, служащего для передачи изображений на расстояние | 1920 |
|
SU225A1 |
Авторы
Даты
2024-08-28—Публикация
2019-09-20—Подача