РОДСТВЕННЫЕ ЗАЯВКИ
[0001] В настоящей заявке испрашиваются приоритет и преимущества согласно предварительным заявкам на патент США: No. 62/263377, зарегистрированной 4 декабря 2015 года, и No. 62/422454, зарегистрированной 15 ноября 2016 года, содержание которых полностью включено в настоящий документ посредством ссылки.
ВКЛЮЧЕНИЕ СПИСКА ПОСЛЕДОВАТЕЛЬНОСТЕЙ ПОСРЕДСТВОМ ССЫЛКИ
[0002] Содержание текстового файла под именем ʺDFCI-126-001WO-Sequence Listing.txtʺ, который был подготовлен 2 декабря 2016 года и имеет размер 30,9 кбайт, включено в настоящее описание полностью, посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0003] Настоящее изобретение в основном относится к композиции и способам индукции противоопухолевого иммунного ответа у субъекта.
УЧАСТИЕ ПРАВИТЕЛЬСТВЕННЫХ ОРГАНОВ
[0004] Настоящее изобретение было выполнено при правительственной поддержке, в соответствии с грантом R01CA173750, полученным от Национального Института Здоровья (National Institutes of Health). В этой связи, правительство имеет определенные права на данное изобретение.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
[0005] Последние достижения в области иммунотерапии рака продемонстрировали способность иммунной системы излечивать даже развитые формы рака. И эти терапевтические подходы быстро меняют само понятие лечения рака. В отличие от лечения с использованием моноклональных антител, где требуется повторное введение антител для предупреждения рецидива развития опухоли, указанные вакцины могут индуцировать эндогенную иммунологическую память и, таким образом, имеют потенциал создания длительной защиты.
[0006] Выбор антигенов для проведения терапии с использованием вакцин требует широкого понимания биологической роли тех или иных возможных антигенов в опухолевом росте, а также знания уровней их экспрессии опухолевыми клетками, в сравнении с нормальными тканями. MICA и тесно связанный с ним белок MICB (сокращенно, в целом, MIC) представляют собой антигены, которые отсутствуют в нормальных клетках или экспрессируются в них на очень низком уровне, но которые активируются в большом числе различных видов рака, как вторичный процесс после геномного повреждения. MIC является важным лигандом для рецептора NKG2D на цитотоксических лимфоцитах, а именно NK-клетках, CD8 T-клетках и гамма-дельта T- клетках. Экспрессия MIC направляет уничтожение таких клеток иммунной системой. Однако было обнаружено, что многие опухоли уходят от этого важного механизма контроля путем шеддинга MIC с поверхности клеток, процесса, в котором альфа3-домен MIC теряет свою складчатую структуру под действием дисульфид-изомеразы ERp5, придавая чувствительность к расщеплению матричными металлопротеазами, такими как ADAM 10 и ADAM 17. Шеддинг MIC приводит к ингибированию NKG2D рецептора на NK-клетках и CD8 T-клетках. Тогда как протеолитическое расщепление делает из иммуностимулирующего белка иммуносупрессорное вещество.
[0007] Таким образом, имеется потребность в соединениях, способных ингибировать шеддинг MICA.
КРАТКОЕ ОПИСАНИЕ
СУЩНОСТИ ИЗОБРЕЕНИЯ
[0008] Настоящее изобретение, в различных своих аспектах, относится к вакцинным композициям, включающим в качестве иммуногенного компонента эффективное количество пептида, содержащего альфа3-домен MIC. Эффективное количество в данном случае обозначает то количество, которое позволяет эффективно проявить иммунный ответ против альфа3-домена MIC.
[0009] Альфа3-домен MIC представляет собой альфа3-домен MICA или MICB. При этом, необязательно альфа3-домен MIC является негликозилированным. Предпочтительно, указанный пептид включает аминокислотную последовательность SEQ ID NO: 3 или SEQ ID NO: 4. Вакцинная композиция, в различных аспектах настоящего изобретения, включает множество пептидов. В некоторых аспектах, указанный пептид конъюгирован с белком-носителем.
[00010] В другом своем аспекте, настоящее изобретение относится к белку слияния, включающему мономерный субъединичный белок ферритин, который присоединен к белку альфа3-домена MIC. Указанный мономерный субъединичный белок ферритин включает домен, который придает белку слияния способность к самосборке с образованием наночастиц. В предпочтительном варианте осуществления настоящего изобретения, указанная мономерная субъединица представляет собой белок ферритин из Helicobacter pylori. Указанный белок слияния необязательно может быть конъюгирован с олигонуклеотидом CpG.
[00011] В еще одном аспекте, настоящее изобретение относится к наночастице, включающей белок слияния по настоящему изобретению. Указанная наночастица включает множество пептидов альфа3-домена MIC.
[00012] В еще одном аспекте, настоящее изобретение относится к вакцинной композиции, включающей наночастицу по настоящему изобретению. Указанная вакцинная композиция может также включать ГМ-КСФ (GM-CSF).
[00013] В еще одном аспекте, настоящее изобретение относится к способу лечения рака у субъекта путем введения указанному субъекту вакцинной композиции по настоящему изобретению. Такая композиция может необязательно содержать ГМ-КСФ (GM-CSF). Для указанного субъекта доказано наличие шеддинга MIC, по результатам анализа сыворотки крови. Указанную вакцинную композиции вводят в качестве составной части схемы лечения. Схема лечения включает, например, лучевую терапию, прицельную терапию, иммунотерапию или химиотерапию. Указанному субъекту также необязательно может/могут быть также введена/введены одна или несколько вакцин, специфичных для антигена, отличного от альфа3-домена MIC.
[00014] В другом аспекте, настоящее изобретение относится к способу лечения рака путем введения субъекту вакцины, включающей клетки, которые экспрессируют альфа3-домена MIC. В другом аспекте, настоящее изобретение относится к способу лечения рака, где иммунный ответ против MIC индуцируется за счет использования репликативного или нерепликативного вируса.
[00015] Если особо не оговорено иное, все используемые здесь технические или научные термины имеют общепринятое значение, известное специалистам в той области, к которой относится настоящее изобретение. Хотя в практике осуществления настоящего изобретения могут использоваться способы и материалы, эквивалентные тем, что приведены здесь, ниже описаны репрезентативные способы и материалы, подходящие для осуществления настоящего изобретения. Все приводимые здесь публикации, патентные заявки, патенты и другие материалы включены в настоящее описания полностью, посредством ссылок. В случае расхождения, следует рассматривать в качестве первоочередного варианта, настоящее описание, включающее соответствующие определения. Следует также подчеркнуть, что материалы, способы и примеры, описанные здесь, даны здесь лишь для целей пояснения и их не следует рассматривать как ограничивающие в чем-то настоящее изобретение.
[00016] Другие особенности и преимущества настоящего изобретения станут очевидны из приведенного ниже подробного описания и формулы изобретения.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[00017] На фиг. 1A приведена схема, которая демонстрирует взаимодействие между гомодимером NKG2D и MICA. Альфа3-домен MICA идентифицирован в приведенной ниже ссылке: Nat Immunol. 2001 May; 2(5):443-51: Complex structure of the activating immunoreceptor NKG2D and its MHC class I-like ligand MICA.
[00018] На фиг. 1В приведена схема, которая демонстрирует один механизм, посредством которого опухоли уходят из-под иммунологического надзора путем шеддинга MIC с поверхности опухолевых клеток.
[00019] На фиг. 1С приведена схема, которая изображает частицу ферритина.
[00020] На фиг. 1D схематически показана карта, которая демонстрирует клеточный и гуморальный иммунные ответы против человеческого и мышиного ферритина.
[00021] На фиг. 2А схематически показана генная конструкция белка слияния ферритина и альфа3-MICA.
[00022] На фиг. 2В схематически показана (слева) хроматограмма, полученная при проведении гель-фильтрационной хроматографии альфа3 MICA-ферритина с использованием колонки XK16/60 Superdex200 (скорость течения: 2 мл/мин; буфер для хроматографии: 50 мМ Tris, 150 мМ NaCl, pH 7,5). На фиг. 2B также приведены (справа) результаты хроматографирования в ДСН-геле (SDS-гель) в восстановительных условиях, где показаны данные по образцам, которые были отобраны в период 22-27 минуты на белковом пике.
[00023] На фиг. 2С схематически показана дегликозилированная генная конструкция белка слияния ферритина и альфа3-MICA.
[00024] На фиг. 2D схематически показана (слева) хроматограмма, полученная при проведении гель-фильтрационной хроматографии альфа3 MICA-ферритина с использованием колонки Superdex200 (скорость течения: 1 мл/мин; буфер для хроматографии: 50 мМ Tris, 150 мМ NaCl, pH 7,5). На фиг. 2D также приведены (справа) результаты хроматографирования в ДСН-геле (SDS-гель) в восстановительных условиях, где показаны данные по образцам, которые были отобраны в период 16-20 минуты на белковом пике.
[00025] На фиг. 3 приведена схема, которая демонстрирует использование вакцины с нанопалочками из оксида кремния (Mesoporous silica rods (MSR)) для подкожной инъекции и достигнутую при этом индукцию мощных иммунных ответов. См. Kim, J & Aileen, W.L. et al. Nature Biotech, 2015.
[00026] На фиг. 4А и 4В приведена серия графиков, которые показывают эффективность вакцины с α3-доменом MIC на модели метастаз легкого. Данные, представленные на фиг. 4A, были получены следующим образом. Мышей B6 иммунизировали с использованием 200 мкг α3-белка MIC, 1 мкг ГМ-КСФ (GM-CSF) и 100 мкг CpG-ODN, вводимого либо в виде болюса, без скаффолда (болюс), либо внутри скаффолда нанопалочек из оксида кремния (MSR) (MSR вакцина). Мышам делали одну бустерную инъекцию на 28 день. Через три недели мышам делали провокацию путем в/в инъекции 5×105 опухолевых клеток B16-MIC. На 14 день после инъекции опухолевых клеток подсчитывали количество метастаз в легких. Данные, приведенные на фиг. 4B, получали следующим образом. Уровень подвергнутого шеддингу MIC определяли по методу ИФТФА (ELISA) в дни 0, 5 и 13 после инъекции опухолевых клеток. До начала экспериментов было показано, что антитела, специфичные к α3 домену MIC, не взаимодействуют с материалом ИФТФА (ELISA), используемым для детекции подвергнутого шеддингу MIC.
[00027] На фиг. 5А и 5В приведена серия графиков и диаграмм, которые показывают, что вакцинация с использованием белка слияния MICA-ферритин индуцирует высокий титр специфических антител против MICA. На фиг. 5A приведен график, иллюстрирующий результат анализа специфических к MICAα3 антител по методу активируемой флуоресценцией сортировки (FACS) в сыворотке иммунизированных мышей для полноразмерного MICA, экспрессированного на поверхности клеток меланомы мышей B16F10. В клетки меланомы B16F10 вводили трансфекцией кДНК для MICA человека (аллель 009) и затем метили изотипное контрольное антитело (отрицательный контроль) или насыщенную концентрацию мышиного мАт, специфичного MICA (6D4, положительный контроль). Эту систему далее использовали для анализа сыворотки крови мышей, вакцинированных с использованием белка слияния MICA α3-ферритин или контрольным антигеном (OVA). Использовали ПЭ-меченое вторичное противомышиное IgG антитело для детекции антител, связанных с клеточной поверхностью. Уровень флуоресценции оценивали по методу активируемой сортировки FACS. Наблюдалось выраженное окрашивание даже при анализе 1 мкл сыворотки мышей в период 14-42 часов после вакцинации. На фиг. 5B приведена гистограмма, иллюстрирующая среднее значение интенсивности флуоресценции (MFI), где показаны величины +/- СКО для 3 повторных анализов связывания специфичных к MICAα3 антител в сыворотке крови иммунизированных мышей для полноразмерного MICA, экспрессированного на поверхности клеток меланомы мышей B16F10.
[00028] На фиг. 6 приведена серия графиков, иллюстрирующих результаты анализа сыворотки крови мышей, иммунизированных с использованием белка слияния MICA-ферритин, с последующим анализом по методу ИФТФА (ELISA) для определения разных подклассов IgG, индуцированных при вакцинации.
[00029] На фиг. 7 приведен график, иллюстрирующий тот факт, что сывороточные антитела в группе животных, иммунизированных с использованием белка слияния MICA-ферритин, препятствуют шеддингу MICA с поверхности опухолевых клеток.
[00030] На фиг. 8А и 8В приведена серия графиков, которые иллюстрируют терапевтическую активность вакцины на основе белка слияния MICA-ферритин. Мышей C57BL/6 иммунизировали с использованием белка слияния MICA α3-ферритин или овальбумин и затем на 28 день проводили бустерную инъекцию. Далее мышам вводили путем внутривенной инъекции 5×105 опухолевых клеток B16-MICA, что приводило к образованию метастаз в легких. Количество метастаз в легких подсчитывали на 14 день (фиг. 8A) и определяли в сыворотке крови уровень MICA, подвергнутого шеддингу (фиг. 8B). Вакцина, содержащая α3-домен MICA, существенно снижала число метастаз в легких, тогда как в контрольной вакцине этот уровень оставался прежним. Кроме того, подвергнутый шеддингу MICA переставал выявляться в сыворотке мышей, которым вводили вакцину с белком слияния MICA α3-ферритин, тогда как в обеих контрольных группах уровень подвергнутого шеддингу MICA оставался очень высоким. На фиг. 8A показано, что иммунизация с использованием белка слияния MICA альфа3-ферритина препятствует образованию метастаз в сравнении с необработанными контролями или в сравнении с животными, которым инъецировали белок OVA. На фиг. 8B приведен график, на котором показаны результаты, получены при анализе по методу ИФТФА (ELISA), где видно, что в сыворотке вакцинированных мышей не обнаруживается sMICA (подвергнутый шеддингу MICA).
[00031] На фиг. 9А-9С приведена серия графиков, которые показывают титр антител, индуцированных вакцинацией с использованием белка слияния MICA-ферритин (фиг. 9A), а также влияние дозы вакцины на количество легочных узлов (фиг. 9B) и уровень sMICA (фиг. 9C).
[00032] На фиг. 10А и 10В приведена серия графиков, которые иллюстрируют эффект использования вакцины с дегликозилированным вариантом MICAα3 (не связанный с наночастицей ферритина) на связывание специфических антител против MICAα3 в сыворотке иммунизированных мышей против полноразмерного MICA, экспрессированного на поверхности клеток меланомы мышей B16F10, по результатам анализа методом проточной цитометрии (фиг. 10A), а также графики, демонстрирующие результаты анализа по методу ИФТФА (ELISA), который использовался для определения разных подклассов IgG, индуцированных вакцинацией (фиг. 10B).
[00033] На фиг. 11А и 11В приведена серия графиков, которые иллюстрируют значимое терапевтическое преимущество при тестировании in vivo одной MICAα3 вакцины (не слитой с ферритином). На фиг. 11A приведен график, который иллюстрирует число метастаз в легких после вакцинации с использованием вакцины, содержащей только MICAα. На фиг. 11В приведен график, который иллюстрирует уровень sMICA в сыворотке крови мышей в день 0, день 5 и день 13 после вакцинации с использованием вакцины, содержащей только MICAα.
[00034] На фиг. 12А и 12В показано, что вакцина, содержащая белок слияния MICA-ферритин, задерживает рост опухоли на модели мышей B16F10 с подкожной инъекцией опухолевых клеток. На фиг. 12A, приведены данные по 7-недельным самкам мышей C57BL/6 (n=8), которых иммунизировали с использованием вакцины, содержащей белок слияния MICA-ферритин, с последующим бустингом на 12 день. Далее, на 25 день после первой вакцинации, мышам вводили подкожной инъекцией 0,5×106 клеток B16F10, экспрессирующих MICA, и раз в два дня определяли объем опухоли. Рост опухоли в группе животных, которым вводили для иммунизации белок слияния MICA-ферритин, был существенно снижен (пустой квадрат), в сравнении с мышами контрольной группы того же возраста, не подвергнутыми соответствующей обработке (затемненный круг). На фиг. 12B проиллюстрирован тот факт, что уровни sMICA перестают выявляться в сыворотке мышей, иммунизированных с использованием вакцины, содержащей белок слияния MICA-ферритин (пустой треугольник), тогда как через две недели после провокации введением опухолевых клеток в сыворотке неиммунизированных мышей из контрольной группы обнаруживались высокие уровни sMICA (затемненный треугольник).
[00035] На фиг. 13А и 13В показано, что снижение числа CD8 T клеток ускоряет рост опухоли на модели меланомы у мышей B16F10, полученной путем подкожной инъекции вакцины, содержащей MICA-ферритин. На фиг. 13A показан результат иммунизации 7-недельных самок мышей C57BL/6 с использованием вакцины, содержащей MICA-ферритин (n=16) или контрольной OVA вакцины (n=8), с последующим бустингом на 14 день. Не 21 день после первой вакцинации мышам вводили путем подкожной инъекции 0,5×106 B16F10 клеток, экспрессирующих MICA. За 2 дня до введения опухолевых клеток мышам вводили внутривенной инъекций 200 мкг анти-CD8 антитела (n=8) или изотипного контрольного антитела (n=8) и затем два раза в неделю по 100 мкг в расчете на мышь, вплоть до окончания исследования. Один раз в два дня проводили измерение объема опухоли. После достижения размера опухоли ≥250 мм2 мышей подвергали эвтаназии. Опухоли достигали максимального размера на 12 день у контрольных мышей, которых иммунизировали с использованием вакцины с OVA белком и которых лечили CD8 антителом (пустой треугольник) и к 14 дню у необработанных, не леченных ранее мышей в контрольной группе, где уровень CD8 не снижался (затемненный круг). Снижение уровня CD8 ускоряло рост опухоли в группе мышей, иммунизированных MICA вакциной (затемненный треугольник), в сравнении с группой животных, которых иммунизировали MICA вакциной и которым вводили изотипное антитело (пустой квадрат). На фиг. 13B проиллюстрирован анализ выживания в эксперименте со снижением уровня CD8, где толстой жирной линией показан вариант контрольной группы животных сходного возраста, не леченных ранее, не обработанных, без снижения уровня CD8, тогда как вариант анализа животных, которым вводили OVA белок, обозначен прерывистой тонкой линией, вариант анализа животных, которых иммунизировали вакциной, содержащей MICA-ферритин, со снижением уровня CD8, обозначен толстой прерывистой линией, и вариант иммунизации мышей вакциной MICA-ферритин, с ведением изотипного антитела обозначен тонкой жирной линией.
[00036] На фиг. 14А и 14В показано, что NK клетки вносят положительный вклад в терапевтический эффект вакцины MICA-ферритин на модели меланомы у мышей B16F10, полученной при вакцинации путем подкожной инъекции. На фиг. 14A проиллюстрированы результаты иммунизации 7-недельных самок мышей C57BL/6 с использованием вакцины MICA-ферритин (n=16), с последующим бустингом на 14 день. На 21 день после первой вакцинации, мышам вводили путем подкожной инъекции 0,5×106 клеток B16F10, экспрессирующих MICA. За 2 дня до введения опухолевых клеток, мышам вводили внутривенно 200 мкг анти-NK1.1 антитела (n=8) или изотипного контрольного антитела (n=8), и далее два раза в неделю в дозе по 100 мкг на мышь, вплоть до окончания исследования. Один раз в два дня проводили измерение объема опухоли. После достижения размера опухоли ≥250 мм2 мышей подвергали эвтаназии. Опухоли достигали максимального размера на 14 день у необработанных, не леченных ранее мышей в контрольной группе животных (затемненный круг). Снижение числа NK клеток ускоряло рост опухоли в группе животных, которых иммунизировали с использованием вакцины MICA (пустой треугольник), в сравнении группой животных, которых иммунизировали с использованием вакцины MICA и которым вводили изотипное антитело (заполненный квадрат). На фиг. 14B проиллюстрирован анализ выживания в эксперименте со снижением числа NK клеток, где вариант анализа животных сходного возраста, не леченных ранее, необработанных, без снижения числа NK клеток в контрольной группе обозначен толстой жирной линией; вариант анализа животных после иммунизации вакциной, содержащей MICA-ферритин, со снижением числа NK клеток обозначен прерывистой линией и вариант иммунизации мышей вакциной, содержащей MICA-ферритин, с инъекцией изотипного антитела, обозначен тонкой жирной линией.
[00037] На фиг. 15А и 15В показано, что сывороточные поликлональные антитела, выработанные в ответ на введение вакцины MICA-ферритин, препятствуют образованию метастаз в легких у мышей, которым вводили опухолевые клетки B16F10-MICA. На фиг. 15A проиллюстрирован эксперимент, в котором 8-недельным самкам мышей Ighmtm1Cgn/J (n=12) вводили путем внутривенной инъекции 0,5×106 клеток меланомы B16F10, экспрессирующих MICA. Мышей распределяли случайным образом по 3 когортам, каждая из которых включала по 4 мыши. В дни 1, 2, 4 и 6 после введения опухолевых клеток, мышам инъецировали (внутрибрюшинно), вплоть до конечной точки исследования, по 100 мкл сыворотки от нелеченных мышей C57BL/6, которые были иммунизированы белком OVA или белком слияния MICA-ферритин. Проводили эвтаназию мышей через 14 дней после введения опухолевых клеток; отбирали легкие, фиксировали их в 10% забуференном нейтральном формалине и подсчитывали число метастаз в легких. В группе мышей, которым инъецировали вакцину, содержащую белок слияния MICA-ферритин (пустой квадрат), наблюдалось значительно сниженное число метастаз в легких, в сравнении с мышами, которым инъецировали сыворотки от необработанных животных сходного возраста из контрольной группы (затемненный круг), а также в сравнении с животными в группе, которых иммунизировали белком OVA. На фиг. 15B показано, что уровень sMICA был ниже у мышей, которым вводили сыворотки от животных из группы, где проводили иммунизацию вакциной с белком слияния MICA-ферритин (пустой квадрат), в сравнении с мышами, которым вводили сыворотки от необработанных животных или от животных в группе, где проводилась иммунизация белком OVA.
[00038] На фиг. 16А и 16В показано, что вакцина, содержащая MICA-ферритин, также контролирует рост опухоли после подкожного введения клеток B16F10-MICB005. На фиг. 16A проиллюстрирован эксперимент, в котором 7-недельных самок мышей C57BL/6 (n=4) иммунизировали с использованием вакцины MICA-ферритин, с последующим бустингом на 14 день. На 21 день после первой вакцинации, мышам вводили путем подкожной инъекции 0,5×106 клеток B16F10, экспрессирующих MICB, и раз в два дня проводили измерение объема опухоли. Было показано, что рост опухоли B16F10-MICB в группе мышей, которых иммунизировали белком слияния MICA-ферритин, был значимо снижен (пустой квадрат), в сравнении с животными из контрольной группы, которых иммунизировали белком OVA (затемненный круг). На фиг. 16B показано, что уровни sMICB практически не определяются в сыворотках мышей, которых иммунизировали вакциной, содержащей MICA-ферритин (пустой квадрат), тогда как в сыворотках мышей из контрольной группы, которых иммунизировали белком OVA, наблюдались высокие уровни sMICB через две недели после введения опухолевых клеток (затемненный круг).
[00039] На фиг. 17 приведена серия графиков, иллюстрирующих окрашивание клеток в клеточной линии B16, которые экспрессируют MICA, при использовании сывороток от мышек, которых иммунизировали вакциной, содержащей MICA-ферритин, при наличии в композиции нанопалочек из оксида кремния (MSR) (пунктирная линия), или в варианте прямого конъюгирования CpG с белком слияния MICA-ферритин (без MSR (тонкая жирная линия)). Эти данные иллюстрируют тот факт, что вакцинация с использованием CpG, который напрямую конъюгирован с пептидом MICA-феррин, индуцирует более сильный иммунный ответ на альфа3 домен MIC, чем вакцина, включающая MSR скаффолд. В случае вакцины, включающей MSR, используют 5 мг MSR+200 мкг белка+100 мкг CpG+1 мкг ГМ-КСФ (GM-CSF), иммунизацию проводят в день 0; бустинг на 14 день; сыворотку отбирают на 28 день. Для достижения прямого конъюгирования, берут 200 мкг белка для конъюгирования с ~5 мкг CpG (первичная иммунизация); для бустинга используют 100 мкг белка, конъюгированного с ~5 мкг CpG+адъювант addaVax (100 мкл)+ГМ-КСФ (GM-CSF) (1 мкг); иммунизацию проводят в день 0; бустинг на 21 день; сыворотку отбирают на 28 день.
[00040] На фиг. 18A показана электронная микрофотография очищенных наночастиц MICAα3-ферритина.
[00041] На фиг. 18B показан результат электрофореза в ДСН-ПААГ (SDS-PAGE) белковой вакцины, с последующей очисткой методами аффинной хроматографии и гель-фильтрации.
[00042] На фиг. 19 приведен график, демонстрирующий тот факт, что поликлональные антитела, индуцированные вакциной, содержащее α3-домен MICA, ингибируют шеддинг MICA опухолевыми клетками человека. Шеддинг MICA клетками клеточной линии меланомы человека A375 оценивали с использованием иммуноферментной хроматографии (ИФТФА (ELISA)). Добавление небольших количеств сыворотки (1-10 μl) от мышей, вакцинированных с использованием MICAα3-ферритина, выраженно ингибирует шеддинг, тогда как добавление сыворотки от контрольных мышей оказывает лишь небольшой эффект.
[00043] На фиг. 20A-2C приведена серия графиков, демонстрирующих тот факт, что вакцина, содержащая MICA-ферритин, индуцирует вторичные ответы T-клеток на неоантигены. Авторы исследовали, индуцирует ли вакцина, содержащая α3-домен MICB, вторичные ответы на опухолевые неоантигены. Т-клетки из лимфатических узлов метили флуоресцентной меткой CFSE (сукцинимилиловый эфир карбоксифлуоресцеина) и культивировали в течение трех дней с четырьмя разными пептидными неоантигенами, которые ранее идентифицированы для опухолей B16F10 как CD4 T-клеточные эпитопы. CD4 T-клеточные ответы были идентифицированы для трех из четырех пептидов, по результатам внутриклеточного окрашивания с использованием IFNγ в пролиферирующих клетках (CFSElow). Авторы предположили, что антитела против MICA запускают опосредованное участием Fc рецептора поглощение апоптозных опухолевых фрагментов дендритными клетками и, в этой связи, способствуют проявлению T-клеточных ответов на неоантигены. На фиг. 20A-20B проиллюстрирован эксперимент по иммунизации мышей B6 с использованием вакцины MICBα3-ферритин или OVA (n=5/группу) и с инъекцией опухолевых клеток B16F10-MICB. Т-клетки выделяли из дренированных лимфатических узлов через 10 дней после имплантации опухоли и метили с использованием флуоресцентного красителя CFSE. T-клетки культивировали в течение 3 дней с клетками селезенки CD11c+ в присутствии четырех разных CD4 пептидных неоантигенов (10мкг/мл), которые ранее были идентифицированы для опухолей B16F10. Проводили внутриклеточное окрашивание с использованием IFNγ и оценивали пролиферирующие T-клетки (слабое окрашивание CFSE), положительные по внутриклеточному окрашиванию на IFNγ. Сравнивали T-клеточные ответы на пептидные неоантигены для мышей, иммунизированных контрольным антигеном OVA (фиг. 20A) или α3-доменом MICB (фиг. 20B). Обе популяции Т-клеток инкубировали in vitro с неоантигеном M30. На фиг. 2C показаны в общем виде Т-клеточные ответы на три неоантигена (M30, M44 и M48), для которых были выявлены усиленные Т-клеточные ответы у мышей, которых иммунизировали с использованием MICB.
[00044] На фиг. 21A-21B приведены графики, иллюстрирующие иммунизацию с использованием наночастиц MICA-ферритин, конъюгированных с CpG, которая индуцирует высокий титр антител. На фиг. 21A показан вариант, в котором MICA/B-ферритин из макаки был конъюгирован с CpG ODN 1826 с использованием методов клик-химии (белково-олигонуклеотидный набор для конъюгирования, Solulink). В общих чертах, процедура состояла в том, что S-HyNic (сукцинимидил-6-гидразино-никотинамид) линкер конъюгировали с белком через первичные аминные группы на лизине и S-4B (сукцинимидил-4-формилбензамид) линкер добавляли к CpG олигонуклеотиду. Модифицированный белок и олигонуклеотид инкубировали в условиях каталитической реакции конъюгации. После завершения реакции, избыток неконъюгированного CpG удаляли с использованием метода гель-фильтрационной хроматографии. Полученная белково-олигонуклеотидная сопряженная связь (стабильная, бис-арилгидразоновая связь) выявляется в УФ при длине волны 350 нм (см. график). На фиг. 21B показано, что конъюгат CpG-белок использовали для иммунизации мышей C57BL/6. На 14 день в сыворотке мышей анализировали специфические антитела, выработанные против MICA/B, путем мечения B16-MICA клеток. Связанный с CpG белок индуцировал более высокий титр антител (тонкая жирная линия), чем вакцина с белком слияния MICA-ферритин, изготовленная с использованием скаффолда (пунктирная линия; толстая жирная линия показывает фоновые уровни окрашивания).
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
[00045] Настоящее изобретение относится к вакцине, используемой при раке. Более конкретно, настоящее изобретение относится к вакцине, включающей альфа3-домен MIC, которая может вызывать иммунный ответ против альфа3-домена MIC. Важен тот факт, что вакцина вызывает выработку антител против альфа3-домена MIC, но не против α1-α2 доменов MIC, так что не будет препятствовать процессу связывания α1-α2 доменов с NKG2D рецептором на NK клетках.
[00046] Настоящая вакцина была разработана с целью индуцировать выработку поликлональных антител, которые связываются с ближайшим к мембране Ig доменом MICA и ингибируют протеолитический шеддинг этого белка опухолевыми клетками. Альфа3-домен MICA экспрессировался на поверхности наночастиц. Конкретно, кодирующую последовательность альфа3-домена MICA объединяли с последовательностью ферритина (из Н. pylori), поскольку ферритин способен спонтанно формировать наночастицы. Вакцину изготавливали либо путем включения скаффолда для иммунизации (наночастицы с оксидом кремния) с использованием CpG в качестве адъюванта и ГМ-КСФ (GM-CSF) для рекрутинга дендритных клеток к сайту инъекции или путем прямого конъюгирования CpG с белком слияния альфа3-домена MICA-ферритин и ГМ-КСФ (GM-CSF. Было показано, что инъекции этих вакцин индуцировали выработку высоких титра антител против альфа3-домена MICA. Неожиданно, было обнаружено, что белок слияния альфа3-домен MICA-ферритин, который включал непосредственно встроенный путем конъюгации CpG, индуцировал более высокий титр антител.
[00047] Эти антитела, индуцированные композицией вакцины по настоящему изобретению, связываются с множеством MICA и окрашивают опухолевые клетки, положительные по MICA. Важно отметить тот факт, что эти поликлональные антитела ингибировали шеддинг MICA опухолевыми клетками. Эффективность вакцины in vivo исследовали с использованием модели меланомы мышей с метастазами. Клетки меланомы B16F10 генетически модифицировали для достижения экспрессии MICA и инъецировали внутривенно мышам после проведения им двух вакцинаций. Указанная вакцина создавала высокий уровень защиты, тогда как у контрольных мышей наблюдалось большое число метастаз в легких (~150-200).
[00048] Вакцина по настоящему изобретению принципиально отличается от стандартных вакцин против рака, нацеленных на индукцию иммунного ответа, который удаляет все раковые клетки, экспрессирующие определенный антиген. Тогда как целью настоящего изобретения является предотвратить уход опухолевых клеток от важного пути иммунного надзора. Эта вакцина будет безопасной, как показано в испытаниях, включавших пациентов с антителами против MICA, и ввиду того факта, что экспрессия MIC метит клетки, которые должны быть удалены цитотоксическими лимфоцитами. Преимущества такого подхода следующие: низкая стоимость вакцины, длительная защита против уклонения опухолевых клеток от механизма иммунного надзора, индукция поликлональных антител, которые ингибируют шеддинг и быстро убирают подвергнутый шеддингу MIC путем образования иммунных комплексов и индукции Т-клеточного ответа против других опухолевых антигенов за счет усиленного поглощения подвергнутых апоптозу фрагментов опухолевых клеток дендритными клетками.
[00049] Настоящее изобретение также относится к процессу самосборки наночастиц на основе ферритина, которые проявляют свойства иммуногенных частей альфа3-домена MICA на своей поверхности. Необязательно, указанные наночастицы также включают CpG олигонуклеотид. Например, CpG олигонуклеотид может быть ковалентно присоединен к белку слияния альфа3-домена MICA-ферритин. Такие наночастицы используют для вакцинации пациентов. Соответственно, настоящее изобретение также относится к белкам слияния для целей получения таких наночастиц и к молекулам нуклеиновой кислоты, кодирующим такие белки. Кроме того, настоящее изобретение также относится к способам получения наночастиц по настоящему изобретению и к способам использования таких наночастиц для вакцинации пациентов.
[00050] Настоящее изобретение также относится к вакцинным композициям, включающим пептид альфа3 домена MIC, присоединенный к CpG олигонуклеотиду.
[00051] ВАКЦИНЫ ПРОТИВ БЕЛКА АЛЬФА3 ДОМЕНА MIC
[00052] Настоящее изобретение также относится к вакцинной композиции, подходящей для введения человеку, которая включает, в качестве иммуногенного компонента, по меньшей мере один пептид альфа3 домена MIC. Указанный пептид альфа3-домена MIC включает полноразмерный альфа3 домен MICA или MICB или полностью состоит из него, где указанный домен соответствует участку от 181 до 274 аминокислоты в SEQ ID NO: 1 или SEQ ID NO: 2. Необязательно указанный пептид включает одну или несколько фланкирующих его аминокислот. В данном контексте, термин ʺфланкирующие аминокислотыʺ относится к аминокислотам, локализованным рядом с последовательностью альфа3-домена MIC в полноразмерной стандартной последовательности [SEQ ID NO: 1 для MICA или SEQ ID NO: 2 для MICB]. В некоторых вариантах осуществления настоящего изобретения, указанный пептид включает 2, 4, 6, 8 или 10 фланкирующих его аминокислот на своем N- или C-концевом участке или на них обоих. В некоторых вариантах осуществления настоящего изобретения, указанный вакцинный пептид не гликозилирован.

[00053] В предпочтительном варианте осуществления настоящего изобретения, указанная вакцина включает пептид с аминокислотной последовательностью: RTVPPMVNVTRSEASEGNITVTCRASGFYPWNITLSWRQDGVSLSHDTQQWGDVLPDG NGTYQTWVATRIS QGEEQRFTCYMEHSGNHSTHPVPSGKVLVLQSHWQTFH (SEQ ID NO: 3) или RTVPPMVQVTRSEASEGQITVTCRASGFYPWNINLSWRQD GVSLSHDTQQWGDVLPDGNGTYQTWVATRISQGEEQRFTCYMEHSGQHSTHPVPSGK VLVLQSHWQTFH (SEQ ID NO:4).
[00054] В другом варианте осуществления настоящего изобретения, указанная вакцинная композиция включает нуклеиновую кислоту, кодирующую альфа3-домен MIC. Указанная нуклеиновая кислота может присутствовать в виде вектора экспрессии, например, плазмидного или вирусного вектора, или указанная нуклеиновая кислота может быть встроена в состав наночастиц. В одном варианте осуществления настоящего изобретения, указанная нуклеиновая кислота вводится пациенту путем инъекции. В одном варианте осуществления настоящего изобретения, указанную нуклеиновую кислоту инъецируют в виде очищенной ДНК или в форме наночастиц. В одном варианте осуществления настоящего изобретения, инъецируют модифицированные иммунные клетки, которые были модифицированы для достижения способности клеток экспрессировать указанную нуклеиновую кислоту. В одном варианте осуществления настоящего изобретения, указанные иммунные клетки модифицируют путем трансфекции или инфекции in vitro вектором, включающим указанную нуклеиновую кислоту.
[00055] Пептиды, которые образуют вакцинные композиции по настоящему изобретению или которые включаются в состав таких вакцинных композиций, предпочтительно очищают от контаминантов, созданных химическими предшественниками, если указанные пептиды были получены химическим синтезом, или по существу освобождают их от клеточного материала, происходящего из клеточного или тканевого источника, из которого они были выделены. В конкретном варианте осуществления настоящего изобретения, указанные пептиды на 60%, предпочтительно на 65%, 70%, 75%, 80%, 85%, 90%, 95% или на 99% свободны от контаминирующих химических предшественников, таких как белки, липиды или нуклеиновые кислоты. В предпочтительном варианте осуществления настоящего изобретения, указанные пептиды по существу не содержат контаминирующий вирус. Предпочтительно, каждая композиция, применяемая для введения пациенту, по меньшей мере, на 95%, по меньшей мере, на 97% или по меньшей мере, на 99% свободна от контаминирующего вируса.
[00056] В одном варианте осуществления настоящего изобретения, указанный альфа3 домен MIC в вакцинной композиции по настоящему изобретению включает один или несколько пептидов или полностью состоит из одного или нескольких пептидов, которые, по меньшей мере, на 90%, по меньшей мере, на 95%, по меньшей мере, на 98%, или по меньшей мере, на 99% идентичны пептиду, включающему участок от 181 до 274 аминокислоты в последовательности SEQ ID NO: 1 или SEQ ID NO: 2. В данном контексте, термин ʺаналогичныйʺ относится к уровню близости аминокислотной последовательности, которая определяется по числу консервативных или неконсервативных аминокислотных замещений в данной конкретной последовательности относительно стандартной последовательности. Консервативные и неконсервативные аминокислотные замещения известны в данной области. См, например, W. R. Taylor, The Classification of Amino Acid Conservation, J. Theor. Biol. 1986 119:205-218, и D. Bordo and P. Argos, Suggestions for "Safe" Residue Substitutions in Site-Directed Mutagensis, 1991 J. Mol. Biol. 217:721-729. В основном, понятие консервативное аминокислотное замещение относится к замещению одной аминокислоты другой аминокислотой, обладающей по существу близкими химическими свойствами, в частности, в том, что касается боковых цепей аминокислот. Неконсервативное аминокислотное замещение относится к замещению одной аминокислоты другой аминокислотой, имеющей по существу другие химические свойства. Общепринятое в данной области мнение таково, что консервативные замещения не должны оказывать эффект на общую структуру или биологическую функцию полипептида, тогда как неконсервативные замещения рассматриваются как воздействия, в большей степени способные затронуть структуру и функцию полипептида.
[00057] Неограничивающие примеры консервативного аминокислотного замещения включает замещение аминокислот внутри следующих групп аминокислот: алифатические, ароматические, полярные, неполярные, с кислотными свойствами, с основными свойствами, фосфорилируемые гидрофобные, гидрофильные, малые неполярные, малые полярные, крупные неполярные и крупные полярные аминокислоты. Неограничивающие примеры неконсервативного аминокислотного замещения включает замещение аминокислот указанными выше группами.
[00058] В одном варианте осуществления настоящего изобретения, консервативное аминокислотное замещение представляет собой такое замещение, при котором матрица замен для пары остатков имеет положительное значение. Примеры аминокислотных матриц замен известны в данной области и включают, например, BLOSUM50 матрицу или PAM250 матрицу (см. W. A. Pearson, Rapid and Sensitive Sequence Comparison with FASTP and FASTA, Meth. Enzymology, 1990 183:63-98, ed. R. Doolittle, Academic Press, San Diego). Другие примеры весовых матриц и их сравнительную оценку см. в работе M. S. Johnson and J. P. Overington, 1993, A Structural Basis for Sequence Comparisons: An Evaluation of Scoring Methodologies, J. Mol. Biol. 233:716-738.
[00059] В предпочтительном варианте осуществления настоящего изобретения, консервативное аминокислотное замещение представляет собой замещение одной аминокислоты другой аминокислотой внутри одной и той же группы, где указанные группы выбраны из нейтральных и полярных аминокислот (Ser, Thr, Pro, Ala, Gly, Asn, Gln), отрицательно заряженных и полярных аминокислот (Asp, Glu), положительно заряженных и полярных аминокислот (His, Arg, Lys), неполярных аминокислот, не содержащих кольцевой структуры (Met, Ile, Leu, Val), неполярных аминокислот, содержащих кольцевую структуру (Phe, Tyr, Trp) и цистеина.
[00060] В различных вариантах осуществления настоящего изобретения, проводят конъюгирование указанного пептида с CpG олигонуклеотидной последовательностью.
[00061] В других вариантах осуществления настоящего изобретения, проводят конъюгирование указанного пептида с белком-носителем. Термин ʺбелок-носительʺ в контексте настоящего описания обозначает как малые пептиды, так и крупные полипептиды (>10 кДа). Белок-носитель может представлять собой любой пептид или белок. Он может включать один или несколько Т-хелперных эпитопов. Указанный белок-носитель может представлять собой столбнячный анатоксин (TT), С фрагмент столбнячного анатоксина, нетоксичные мутантны столбнячного анатоксина [следует отметить, что в контексте настоящего изобретения все такие варианты TT рассматриваются как белок-носитель одного и того же типа], полипептиды, включающие Т-клеточные эпитопы столбнячного анатоксина, такие как N19 (WO2006/067632), дифтерийный анатоксин (DT), CRM197, другие нетоксичные мутанты дифтерийного токсина, такие как CRM176, CRM 197, CRM228, CRM 45 (Uchida et al J. Biol. Chem. 218; 3838-3844, 1973); CRM 9, CRM 45, CRM102, CRM 103 и CRM107, формы, содержащие другие мутации, описанные в работе Nicholls and Youle, Genetically Engineered Toxins, Ed: Frankel, Maecel Dekker Inc, 1992; а также формы, включающие делецию или мутацию Glu-148 на Asp, Gln или Ser и/или Ala 158 на Gly, и другие мутации, описанные в патентах США NoNo. 4709017 или 4950740; в том числе мутацию по меньшей мере одного или нескольких остатков из числа Lys 516, Lys 526, Phe 530 и/или Lys 534 и другие мутации, описанные в патентах США NoNo. 5917017 или 6455673; или их фрагмент, описанный в патенте США. No. 5843711] (следует отметить, что в контексте настоящего изобретения все такие варианты DT рассматриваются как белок-носитель одного и того же типа), пневмококковый пневмолизин (Kuo et al (1995), Infect Immun 63; 2706-13), OMPC (белок внешней мембраны менингококка, который обычно экстрагируют из N. Meningitides, серогруппа B-EP0372501), синтетические пептиды (EP0378881, EP0427347), белки теплового шока (WO 93/17712, WO 94/03208), коклюшные белки (WO 98/58668, EP0471177), цитокины, лимфокины, факторы роста или гормоны (WO 91/01146), искусственные белки, включающие множественные эпитопы CD4+ Т-клеток человека для антигенов, полученных из разных патогенов (Falugi et al. (2001) Eur J Immunol 31; 3816-3824), такие как белок N19 (Baraldoi et al. (2004) Infect Immun 72; 4884-7), поверхностный белок пневмококков PspA (WO 02/091998), белки, участвующие в поглощении железа (WO 01/72337), токсин A или B из C. difficile (WO 00/61761), белок D из H. influenzae D (EP594610 и WO 00/56360), пневмококковый белок PhtA (WO 98/18930, также обозначаемый как Sp36), пневмококковый белок PhtD (описанный в WO 00/37105, также обозначаемый как Sp036D), пневмококковый белок PhtB (описанный в WO 00/37105, также обозначаемый как Sp036B) или PhtE (описанный в WO00/30299 и также обозначаемый как BVH-3).
[00062] В одном варианте осуществления настоящего изобретения, указанный белок-носитель может быть выбран из группы, состоящей из: столбнячного анатоксина (TT), фрагмента C столбнячного анатоксина, дифтерийного анатоксина (DT), CRM197, пневмолизина (Ply), белка D, PhtD, PhtDE и N19. В одном варианте осуществления настоящего изобретения, указанный белок-носитель представляет собой CRM197.
[00063] ВАКЦИНЫ, ВКЛЮЧАЮЩИЕ БЕЛКИ СЛИЯНИЯ ГА-ФЕРРИТИН
[00064] Авторы настоящего изобретения обнаружили, что слияние пептида альфа3-домен MIC с белком ферритином (белок слияния альфа3 MIC-ферритин) позволяет получить вакцину, которая вызывает мощный иммунный ответ организма на рак. Такие белки слияния альфа3-домен MIC-ферритин подвергаются далее самосборке с образованием наночастиц, которые проявляют свойства иммуногенных частей пептида альфа3-домена MIC на своей поверхности. Указанные наночастицы используются для вакцинации пациентов против альфа3-домена MIC. Таким образом, настоящее изобретение в одном варианте своего осуществления относится к белку слияния альфа3-ферритина MIC, включающему описанную здесь мономерную субъединицу ферритина, которая присоединена к пептиду альфа3-домен MIC, также описанному здесь. Указанный белок слияния альфа3-домен MIC-ферритин способен к самосборке с образованием наночастиц. В разных описанных здесь аспектах, указанный белок слияния также включает CpG олигонуклеотид. Указанная олигонуклеотидная последовательность CpG может быть ковалентно присоединена к белку слияния альфа3-домен MIC-ферритин.
[00065] Ферритин представляет собой глобулярный белок, встречающийся у всех животных, бактерий и растений, действие которого направлено, прежде всего, на контроль скорости образования и локализации многоядерного Fe(III)2O3 посредством транспорта гидратированных ионов железа и протонов как по направлению минерализованного ядра, так и от него. Глобулярная форма ферритина создана из мономерных субъединичных белков (известных также как мономерные субъединицы ферритина), которые представляют собой полипептиды с молекулярной массой примерно 17-20 кДа. Каждая мономерная субъединица ферритина имеет топологию спирального пучка, который включает четыре антипараллельных спиральных мотива, с пятой укороченной спиралью (С-концевая спираль), расположенной строго перпендикулярно к длинной оси 4-спирального пучка. Согласно конвенции, спирали помечены как `A, B, C и D и E` от N-конца, соответственно. N-концевая последовательность располагается рядом c тригиром капсида и доходит далее до поверхности, где E спирали упаковываются вместе вдоль оси структуры четырехмерной симметрией с C-концом, доходящим до ядра частицы. Последовательность в этой упаковке создает две поры на поверхности капсида. Предполагается, что одна или обе эти поры будут отражать точку, через которую гидратированный ион железа диффундирует в капсид и из него. После образования, эти мономерные субъединичные белки ферритина подвергаются самосборке с образованием глобулярного белка ферритина. Таким образом, глобулярная форма ферритина включает субъединичные белки ферритина, состоящие из 24 мономерных единиц, а также характеризуется капсидоподобной структурой с симметрией 432-мерности.
[00066] Согласно настоящему изобретению, мономерная субъединица ферритина по настоящему изобретению представляет собой один полноразмерный полипептид белка ферритина или любую его часть, которая способна направлять самосборку мономерных субъединиц ферритина с образованием глобулярной формы белка. Аминокислотные последовательности из мономерных субъединиц ферритина для любого известного белка ферритина могут использоваться для получения белков слияния по настоящему изобретению, при условии, что такая мономерная субъединица ферритина способна к самосборке с образованием наночастицы, проявляющей на своей поверхности свойства альфа3-домена MIC. В одном варианте осуществления настоящего изобретения, указанная мономерная субъединица получена из белка ферритина, выбранного из группы, состоящей бактериального белка ферритина, растительного белка ферритина, белка ферритина из водорослей, белка ферритина из насекомых, белка ферритина из грибов и белка ферритина от млекопитающего. В одном варианте осуществления настоящего изобретения, указанный белок ферритин получен из Helicobacter pylori.
[00067] Белки слияния альфа3-домен MIC-ферритин по настоящему изобретению необязательно включают полноразмерную последовательность мономерной субъединицы полипептида белка ферритина. Могут использоваться части или участки мономерной субъединицы белка ферритина, при условии, что указанная часть включает аминокислотную последовательность, которая направляет самосборку мономерных субъединиц ферритина с образованием глобулярной формы белка. Один из таких участков, взятый в качестве примера, расположен между аминокислотами 5 и 167 в белке ферритин из Helicobacter pylori. Более подробно такие участки описаны в работе Zhang, Y. Self-Assembly in the Ferritin Nano-Cage Protein Super Family. 2011, Int. J. Mol. Sci., 12, 5406-5421, которая включена в настоящее описание полностью посредством ссылки.
[00068] Настоящее изобретение в одном варианте своего осуществления относится к белку слияния альфа3 MIC-ферритин, включающему альфа3-домен MIC по настоящему изобретению, присоединенный по меньшей мере к последовательности из 25 аминокислот, по меньшей мере к последовательности из 50 аминокислот, по меньшей мере к последовательности из 75 аминокислот, по меньшей мере к последовательности из 100 аминокислот или по меньшей мере к последовательности из 150 аминокислот из мономерной субъединицы ферритина, где белок слияния альфа3-MIC-ферритин способен к самосборке с образованием наночастиц. В одном варианте, настоящее изобретение относится к белку слияния альфа3 MIC-ферритин, включающему белок альфа3-домена MIC по настоящему изобретению, присоединенный по меньшей мере к последовательности из 25 аминокислот, по меньшей мере к последовательности из 50 аминокислот, по меньшей мере к последовательности из 75 аминокислот, по меньшей мере к последовательности из 100 аминокислот или по меньшей мере к последовательности из 150 аминокислот из участка белка ферритина, соответствующего аминокислотным последовательностям мономерной субъединицы ферритина из Helicobacter pylori, который направляет самосборку мономерных субъединиц с образованием глобулярной формы белка ферритина, где указанный белок слияния альфа3 MIC-ферритин способен к самосборке с образованием наночастиц.
[00069] В данной области известно, что в аминокислотную последовательность белка могут быть введены некоторые вариации, которые не затронут активность белка. Такие вариации включают вставки аминокислотных остатков, делеции аминокислотных остатков и замещения аминокислотных остатков. Соответственно, в одном варианте осуществления настоящего изобретения, последовательность мономерной субъединицы ферритина в достаточной мере отличается от последовательности природного ферритина, который присутствует у млекопитающего, так что, когда вариант мономерной субъединицы ферритина вводят млекопитающему, это не приводит к образованию антител, которые взаимодействуют с природным белком ферритина млекопитающих. Согласно настоящему изобретению, такая мономерная субъединица обозначается как иммуногенетически нейтральная. В одном варианте осуществления, настоящее изобретение относится к белку слияния альфа3-MIC-ферритин, включающему белок альфа3-домена MIC по настоящему изобретению, присоединенный к аминокислотной последовательности, которая по меньшей мера на 80%, по меньшей мера на 85%, по меньшей мера на 90%, по меньшей мера на 95% и по меньшей мера на 97% идентична аминокислотной последовательности мономерной субъединицы ферритина, отвечающей за прямую самосборку мономерных субъединиц ферритина с образованием глобулярной формы белка, где белок слияния альфа3-MIC-ферритин способен к самосборке с образованием наночастиц. В одном варианте осуществления настоящего изобретения, белок слияния ГА-ферритин включает полипептидную последовательность, идентичную по последовательности мономерной субъединице ферритина. В одном варианте осуществления, настоящее изобретение относится к белку слияния альфа3 MIC-ферритин, включающему белок альфа3- домена MIC по настоящему изобретению, присоединенный к аминокислотной последовательности, которая по меньшей на 80%, по меньшей на 85%, по меньшей на 90%, по меньшей на 95% и по меньшей на 97% идентична аминокислотной последовательности мономерной субъединицы ферритина из Helicobacter pylori, где белок слияния альфа3 MIC-ферритин способен к самосборке с образованием наночастиц.
[00070] В некоторых вариантах осуществления настоящего изобретения, может быть полезно встраивать мутации в аминокислотные последовательности белков по настоящему изобретению. Так, например, можно получить хороший эффект, если изменить сайты, такие как сайты узнавания ферментов или сайты гликозилирования в мономерной субъединице ферритина, домены тримеризации или линкерные последовательности, с тем чтобы придать белку слияния нужные свойства (например, растворимость, период полувыведения, маскировка частей белка с целью уклонения от иммунного надзора). В этой связи, следует отметить, что известно об отсутствии в мономерной субъединице ферритина природного гликизилирования. Однако его можно подвергнуть гликозилированию, если он будет экспрессироваться как секретируемый белок в клетках млекопитающего или в клетках дрожжей. Таким образом, в одном варианте осуществления настоящего изобретения, потенциальные N-связанные сайты гликозилирования в аминокислотных последовательностях из мономерной субъединицы ферритина мутированы, так что мутированные последовательности субъединицы ферритина уже не будут гликозилироваться на мутированном сайте.
[00071] Белки по настоящему изобретению кодируются молекулами нуклеиновой кислоты по настоящему изобретению. Кроме того, они экспрессируются конструкциями нуклеиновой кислоты по настоящему изобретению. В контексте настоящего описания, термин «конструкция нуклеиновой кислоты» обозначает рекомбинантный вектор экспрессии, т.е., вектор, присоединенный к молекуле нуклеиновой кислоты, кодирующей белок, так что указанная молекула нуклеиновой кислоты может влиять на экспрессию белка, в случае введения такой конструкции нуклеиновой кислоты, например, субъекту или в орган, ткань или клетку. Указанный вектор также способствует транспорту молекулы нуклеиновой кислоты в клетку, находящуюся в соответствующей среде, такой как, без ограничения, организм, ткань или культура клеток. Конструкция нуклеиновой кислоты продуцируется при введении человеку. Указанная конструкция нуклеиновой кислоты может представлять собой ДНК, РНК или их варианты. Указанный вектор может представлять собой ДНК-содержащую плазмиду, вирусный вектор или другой вектор. В одном варианте осуществления настоящего изобретения, вектор может представлять собой цитомегаловирус (CMV), ретровирус, аденовирус, аденоассоциированный вирус, вирус герпеса, вирус осповакцины, полиовирус, вирус Синдбис или любой другой вектор на основе ДНК-вируса или РНК-вируса. В одном варианте осуществления настоящего изобретения, указанный вектор может представлять собой псевдотипированный лентивирусный или ретровирусный вектор. В одном варианте осуществления настоящего изобретения, указанный вектор может представлять собой ДНК-содержащую плазмиду. В одном варианте осуществления настоящего изобретения, указанный вектор может представлять собой ДНК-содержащую плазмиду, включающую вирусные компоненты и плазмидные компоненты, позволяющие осуществлять процессы доставки и экспрессии молекулы нуклеиновой кислоты. Способы создания конструкций нуклеиновой кислоты по настоящему изобретению известны в данной области. См, например, Molecular Cloning: a Laboratory Manual, 3.sup.rd edition, Sambrook et al. 2001, Cold Spring Harbor Laboratory Press, и Current Protocols in Molecular Biology, Ausubel et al. eds., John Wiley & Sons, 1994. В одном варианте осуществления настоящего изобретения, указанный вектор может представлять собой ДНК-содержащую плазмиду, такую как CMV/R плазмида или CMV/R 8 KB (также обозначаемую здесь как CMV/R 8 кбайт). В настоящем описании приведены примеры CMV/R и CMV/R 8 кбайт. Плазмида CMV/R также описана в патенте США No. 7094598 B2, выданном 22 августа 2006 года.
[00072] Согласно настоящему изобретению, указанная молекула нуклеиновой кислоты включает последовательность нуклеиновой кислоты, которая кодирует иммуногенный пептид альфа3-домена MIC, мономерную субъединицу ферритина и/или белок слияния альфа3 MIC-ферритин по настоящему изобретению. Молекула нуклеиновой кислоты может быть получена по рекомбинатному методу, путем синтеза или при использовании сочетания рекомбинантных процедур и методов синтеза. Молекула нуклеиновой кислоты по настоящему изобретению может включать последовательность нуклеиновой кислоты дикого типа или последовательность нуклеиновой кислоты с модифицированными кодонами, например, за счет включения кодонов, которые лучше распознаются системой трансляции человека. В одном варианте осуществления настоящего изобретения, молекула нуклеиновой кислоты может быть подвергнута генноинженерным манипуляциям для целей встраивания или устранения кодонов, кодирующих другие аминокислоты, например, как в случае введения кодонов, которые кодируют N-связанный сайт гликозилирования. Способы получения молекул нуклеиновой кислоты по настоящему изобретению известны в данной области, особенно если уже известна последовательность нуклеиновой кислоты. Следует отметить, что конструкция нуклеиновой кислоты может содержать одну молекулу нуклеиновой кислоты или несколько молекул нуклеиновой кислоты. Следует также понимать, что молекула нуклеиновой кислоты может кодировать один белок, но может кодировать и более, чем один белок.
[00073] В одном варианте осуществления настоящего изобретения, указанная мономерная субъединица ферритина выделена из белка ферритина из Helicobacter pylori.
[00074] Настоящее изобретение также относится к молекулам нуклеиновой кислоты, которые представляют собой варианты последовательности нуклеиновой кислоты, кодирующей белок по настоящему изобретению. Такие варианты включают инсерции нуклетидов, делеции нуклеотидов и замещения нуклеотидов, при условии, что все такие изменения не будут влиять на способность белка слияния по настоящему изобретению к самосброке с образованием частиц, или не будут в значительной мере затрагивать способность альфа3-доменной части MIC в белках слияния вызывать иммунный ответ на белок альфа3-домена MIC.
[00075] Настоящее изобретение также относится к системам экспрессии для целей получения белков слияния по настоящему изобретению. В одном варианте осуществления настоящего изобретения, молекулы нуклеиновой кислоты по настоящему изобретению необязательно присоединены к промотору. В контексте настоящего описания, выражение «необязательно присоединены» означает, что белки, кодируемые такими присоединенными молекулами нуклеиновой кислоты, могут экспрессироваться, когда активируется присоединенный промотор. Промоторы, используемые в практике осуществления настоящего изобретения, известны специалистам в данной области. В одном варианте осуществления, настоящее изобретение относится к рекомбинантной клетке, включающей молекулу нуклеиновой кислоты по настоящему изобретению. В одном варианте осуществления, настоящее изобретение относится к рекомбинантному вирусу, включающему молекулу нуклеиновой кислоты по настоящему изобретению.
[00076] Как было указано выше, для целей получения белков слияния с ферритином по настоящему изобретению, может применяться рекомбинатная процедура, с использованием любой подходящей для этой цели рекомбинантной технологии из числа известных в данной области. Так, например, может проводиться молекулярное клонирование белка слияния, такого как белок ферритин с подходящим белком, таким как белок альфа3-домена-MIC, посредством экспрессии в клетках E. Coli, вместе с подходящим мономерным субъединичным белком, таким как мономерная субъединица ферритина из Helicobacter pylori. Указанная конструкция может быть далее трансформирована в клетки, экспрессирующие белок, которые должны вырасти до соответствующего размера, для индукции образования белка слияния.
[00077] Как было описано ранее, поскольку белки слияния альфа3-MIC-ферритин по настоящему изобретению включают мономерную субъединицу, они обладают способностью к самосборке. Согласно настоящему изобретению, получаемая в результате такой самосборки молекула обозначается здесь как наночастица на основе ферритина, экспрессирующая альфа3 MIC. Для простоты представления материала, наночастица на основе ферритина, экспрессирующая альфа3 MIC, будет просто обозначаться как наночастица (np). Наночастицы по настоящему изобретению обладают теми же структурными особенностями, что и белки ферритина, описанные ранее. Так, в частности, они содержат 24 субъединицы и обладают симметрией 432 порядка. В случае наночастиц по настоящему изобретению, указанные субъединицы представляют собой белки слияния, включающие мономерную субъединицу ферритина, присоединенную к белку альфа3-домена-MIC. Такие наночастицы проявляют на своей поверхности, по меньшей мере часть, свойств белка альфа3-домена-MIC. Таким образом, в одном варианте осуществления, настоящее изобретение относится к наночастице, включающей белок слияния альфа3 MIC-ферритин, где указанный белок слияния включает мономерную субъединицу ферритина, присоединенную к белку альфа3-домена MIC. В одном варианте осуществления настоящего изобретения, указанная наночастица представляет собой октаэдр.
[00078] Поскольку белки слияния альфа3 MIC-ферритин и наночастицы по настоящему изобретению могут вызывать иммунный ответ на белок альфа3-домена MIC, они могут использоваться в качестве вакцин при лечении рака. Согласно настоящему изобретению, указанная вакцина может представлять собой иммуногенный пептид альфа3-домена MIC, белок слияния альфа3 MIC-ферритин или наночастицу по настоящему изобретению. Вакцины по настоящему изобретению могут также содержать другие компоненты, такие как адъюванты, буферы и др. Хотя может использоваться любой адъювант, тем не менее, предпочтительные варианты осуществления настоящего изобретения могут включать следующие компоненты в качестве адъюванта: химические адъюванты, такие как фосфат алюминия, хлорид бензалкония, убенимекс и QS21; адъюванты генетической природы, такие как ген IL-2 или его фрагменты, гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ (GM-CSF)) или его фрагменты, ген IL-18 или его фрагменты, ген лиганда 21 (CCL21) хемокина (C--C мотив) или его фрагменты, ген IL-6 или его фрагменты, агонисты CpG, LPS, TLR и другие гены иммуностимулирующего действия; белковые адъюванты, такие как IL-2 или его фрагменты, гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ (GM-CSF)) или его фрагменты, IL-18 или его фрагменты, лиганд 21 (CCL21) хемокина (C--C мотив) или его фрагменты, IL-6 или его фрагменты, агонисты CpG, LPS, TLR и другие иммуностимулирующие цитокины или их фрагменты; липидные адъюванты, такие как катионные липосомы, N3 (катионный липид), монофосфориллипид A (MPL1); другие адъюванты, включающие холерный токсин, энтеротоксин, лиганд Fms-подобной тирозинкиназы-3 (Flt-3L), бупивакаин, маркаин и левамизол.
[00079] МЕЗОПОРИСТЫЙ ОКСИД КРЕМНИЯ
[00080] Вакцинная композиция по настоящему изобретению может также включать скаффолд для иммунизации. В одном варианте осуществления настоящего изобретения, указанный скаффолд для иммунизации представляет собой наночастицы мезопористого оксида кремния (МОК (MSR)). МОК (MSR) может быть любого вида и любой формы, представляя собой, частности, палочки, сферы, прутики, кубики или многогранники. Вид или форма МКО (MSR) обычно определяется конкретными условиями реакции и есть их результат. Так, например, наночастицы мезопористого оксида кремния могут быть синтезированы по любому известному в данной области способу, такому как способ, основанный на реакции тетраэтилортосиликата с матрицей, изготовленной из мицеллярных палочек. В результате этой реакции, образуется набор сфер или палочек наноразмера, которые содержат поры, сгруппированные в определенном порядке. Затем матрица может быть удалена путем промывки растворителем, с определенным, откорректированным до нужного значения pH. Согласно другой используемой для этой цели методике, указанная мезопористая частица может быть синтезирована с использованием простой золь-гелевой технологии или по методу распылительной сушки. Тетраэтилортосиликат также может использоваться вместе с дополнительным полимерным мономером (в качестве матрицы). Другие подходы включают те методы, которые были описаны в публикациях по патентам США 20150072009, 20120264599 and 20120256336, которые включены в настоящее описание посредством ссылки.
[00081] Гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ (GM-CSF))
[00082] Гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ (GM-CSF)) представляет собой белок, секретируемый макрофагами, T-клетками, тучными клетками, эндотелиальными клетками и фибробластами. В конкретном варианте, ГМ-КСФ (GM-CSF) представляет собой цитокин, который функционирует как ростовой фактор для лейкоцитов крови. ГМ-КСФ (GM-CSF) стимулирует стволовые клетки в направлении продукции гранулоцитов и моноцитов. Моноциты выходят из кровотока, мигрируют в ткань и далее созревают с образованием макрофагов.
[00083] Описанные здесь скаффолд-устройства включают и высвобождают полипептиды ГМ-КСФ (GM-CSF) для аттрактирования ДК организма-хозяина к устройству. Приемлемые для целей настоящего изобретения полипептиды ГМ-КСФ (GM-CSF) могут быть выделены из эндогенных источников или синтезированы in vivo или in vitro. Эндогенные полипептиды ГМ-КСФ (GM-CSF) выделяют из ткани здорового человека. Синтетические полипептиды ГМ-КСФ (GM-CSF) получают путем синтеза in vivo после трансфекции или трансформации матричной ДНК в организм хозяина или отдельную клетку организма-хозяина, например, в клетку млекопитающего или в клетки из культуры клеточной линии человека. Альтернативно, синтетические полипептиды ГМ-КСФ (GM-CSF) получают путем синтеза in vitro при проведении полимеразно-цепьевой реакции (ПЦР) или с использованием других методов, известных в данной области (см., например, Sambrook, J., Fritsch, E. F., and Maniatis, T., Molecular Cloning: A Laboratory Manual. Cold Spring Harbor Laboratory Press, NY, Vol. 1, 2, 3 (1989), где указанная работа включена в настоящее описание посредством ссылки).
[00084] ГМ-КСФ (GM-CSF) подвергают модификации для целей повышения стабильности белка in vivo. Альтернативно, полипептиды ГМ-КСФ (GM-CSF) подвергают генноинженерным манипуляциям, с тем чтобы сделать их более или, наоборот, менее иммуногенными. Эндогенные зрелые полипептиды ГМ-КСФ (GM-CSF) человека характеризуются наличием повторного гликозилирования, по аминокислотным остаткам 23 (лейцин), 27 (аспарагин) и 39 (глютаминовая кислота) (см. патент США No. 5073627). Полипептиды ГМ-КСФ (GM-CSF) по настоящему изобретению модифицированы по одному или нескольким аминокислотным остаткам, применительно к их уровню гликозилирования.
[00085] Полипептиды ГМ-КСФ (GM-CSF) представляют собой рекомбинантные молекулы. Альтернативно, полипептиды ГМ-КСФ (GM-CSF) представляют собой гуманизированные производные полипептидов ГМ-КСФ (GM-CSF) млекопитающего. Примеры тех видов млекопитающих, от которых могут быть получены полипептиды ГМ-КСФ (GM-CSF), включают, без ограничения, мышь, крысу, хомяка, морскую свинку, хорька, кошку, собаку, мартышку или другого примата. В предпочтительном варианте осуществления настоящего изобретения, указанный ГМ-КСФ (GM-CSF) представляет собой рекомбинантный белок человека (PeproTech, номер по каталогу 300-03). Альтернативно, указанный ГМ-КСФ (GM-CSF) представляет собой рекомбинантный мышиный белок (белок мыши) (PeproTech, номер по каталогу 315-03). И, наконец, указанный ГМ-КСФ (GM-CSF) представляет собой гуманизированное производное рекомбинатного белка мыши.
[00086] Рекомбинантный ГМ-КСФ (GM-CSF) человека (PeproTech, номер по каталогу 300-03) кодируется полипептидной последовательностью, показанной ниже:
[00087] MAPARSPSPS TQPWEHVNAI QEARRLLNLS RDTAAEMNET VEVISEMFDL QEPTCLQTRL ELYKQGLRGS LTKLKGPLTM MASHYKQHCP PTPETSCATQ IITFESFKEN LKDFLLVIPF DCWEPVQE (SEQ ID NO: 26)
[00088] Мышиный рекомбинантный ГМ-КСФ (GM-CSF) (PeproTech, номер по каталогу 315-03) кодируется полипептидной последовательностью, показанной ниже:
[00089] MAPTRSPITV TRPWKHVEAI KEALNLLDDM PVTLNEEVEV VSNEFSFKKL TCVQTRLKIF EQGLRGNFTK LKGALNMTAS YYQTYCPPTP ETDCETQVTT YADFIDSLKT FLTDIPFECK KPVQK (SEQ ID NO: 27)
[00090] Эндогенный ГМ-КСФ (GM-CSF) человека кодируется указанной ниже последовательностью мРНК (NCBI Accession No. NM 000758 и SEQ ID NO: 28): acacagagag aaaggctaaa gttctctgga ggatgtggct gcagagcctg ctgctcttgg 61 gcactgtggc ctgcagcatc tctgcacccg cccgctcgcc cagccccagc acgcagccct 121 gggagcatgt gaatgccatc caggaggccc ggcgtctcct gaacctgagt agagacactg 181 ctgctgagat gaatgaaaca gtagaagtca tctcagaaat gtttgacctc caggagccga 241 cctgcctaca gacccgcctg gagctgtaca agcagggcct gcggggcagc ctcaccaagc 301 tcaagggccc cttgaccatg atggccagcc actacaagca gcactgccct ccaaccccgg 361 aaacttcctg tgcaacccag attatcacct ttgaaagttt caaagagaac ctgaaggact 421 ttctgcttgt catccccttt gactgctggg agccagtcca ggagtgagac cggccagatg 481 aggctggcca agccggggag ctgctctctc atgaaacaag agctagaaac tcaggatggt 541 catcttggag ggaccaaggg gtgggccaca gccatggtgg gagtggcctg gacctgccct 601 gggccacact gaccctgata caggcatggc agaagaatgg gaatatttta tactgacaga 661 aatcagtaat atttatatat ttatattttt aaaatattta tttatttatt tatttaagtt 721 catattccat atttattcaa gatgttttac cgtaataatt attattaaaa atatgcttct 781 a (SEQ ID NO: 28)
[00091] Эндогенный ГМ-КСФ (GM-CSF) человека кодируется указанной ниже аминокислотной последовательностью (NCBI Accession No. NP000749.2 и SEQ ID NO: 29):
[00092] WLQSLLLLGTVACSISAPARSPSPSTQPWEHVNAIQEARRLLNLSRDT AAEMNETVEVISEMFDLQEPTCLQTRLELYKQGLRGSLTKLKGPLTMM ASHYKQHCPPTPETSCATQIITFESFKENLKDFLLVIPFDCWEPVQE (SEQ ID NO: 29)
[00093] Цитозин-гуанозин (CpG) в олигонуклеотидных последовательностях (CpG-ODN)
[00094] CpG представляют собой участки дезоксирибонуклеиновой кислоты (ДНК), где цистеиновый нуклеотид присутствует рядом с гуаниновым нуклеотидом в линейной последовательности оснований по ее длине (где "p" обозначает фосфатную связь между ними и отличает их от варианта цитозин-гуанинового комплементарного спаривания оснований). CpG выполняют жизненно важную роль в процессах метилирования ДНК, которое представляет собой один из нескольких эндогенных механизмов, которая клетка использует для того, чтобы достичь состояния молчания генной экспрессии. Метилирование CpG сайтов внутри промоторных элементов может привести к молчанию генов. Известно, что в случае рака гены-супрессоры опухоли часто пребывают в состоянии молчания, тогда как онкогены или гены, индуцирующие опухоль, экспрессируются. Сайты CpG на промоторных участках генов-супрессоров опухоли (которые препятствуют образованию рака), как было показано, метилированы, тогда как CpG сайты на промоторных участках онкогенов недометилированы или, как в случае некоторых видов рака, полностью не метилированы. Рецептор TLR-9 связывается с неметилированными сайтами CpG в ДНК.
[00095] Описанные здесь вакцинные композиции включают CpG олигонуклеотиды. Указанные CpG олигонуклеотиды могут быть выделены из эндогенных источников или синтезированы in vivo или in vitro. Репрезентативные примеры источников эндогенных CpG олигонуклеотидов включают, без ограничения, микроорганизмы, бактерии, грибы, простейшие, вирусы, плесневые формы или паразитов. Альтернативно, эндогенные CpG олигонуклеотиды могут быть выделены из доброкачественной или злокачественной неопластической опухоли млекопитающего. Синтетические CpG олигонуклеотиды получают путем синтеза in vivo после трансфекции или трансформации матричной ДНК в организм хозяина. Синтетические CpG олигонуклеотиды получают путем синтеза in vitro с использованием полимеразно-цепьевой реакции (ПЦР) или других известных в данной области методов синтеза (Sambrook, J., Fritsch, E. F., and Maniatis, T., Molecular Cloning: A Laboratory Manual. Cold Spring Harbor Laboratory Press, NY, Vol. 1, 2, 3 (1989), где указанная работа включена в настоящее описании посредством ссылки).
[00096] CpG олигонуклеотиды презентируются для захвата дендритными клетками. Используются, например, оголенные CpG олигонуклеотиды. Термин "оголенный" в контексте настоящего описания относится к выделенному из эндогенного источника или синтезированному полинуклеотиду (или олигонуклеотиду), который не содержит каких-либо дополнительных заместителей. В другом варианте осуществления настоящего изобретения, CpG олигонуклеотиды связывают с одним или несколькими соединениями для целей повышения эффективности клеточного захвата. Альтернативно или в дополнение к сказанному, CpG олигонуклеотиды связывают с одним или несколькими соединениями для целей повышения стабильности указанного олигонуклеотида внутри скаффолда и/или в дендритной клетке. CpG олигонуклеотиды необязательно подвергают конденсации перед захватом клеткой. Например, CpG олигонуклеотиды конденсируют с использованием полиэтиленимина (ПЭИ), катионного полимера, который повышает эффективность клеточного захвата в дендритные клетки.
[00097] CpG олигонуклеотиды подразделяют на множество различных классов. Например, репрезентативные CpG-ODN, применяемые в композициях, способах и устрой1ствах по настоящему изобретению, могут представлять собой стимулирующие, нейтральные или супрессорные соединения. Термин "стимулирующий", в контексте настоящего описания обозначает такой класс последовательностей CpG-ODN, которые способны активировать TLR9. Термин "нейтральный" используется здесь для описания последовательностей CpG-ODN, которые не способны активировать TLR9. Термин "супрессорный" используется здесь для описания последовательностей CpG-ODN, которые не способны ингибировать LR9. Термин "активировать TLR9" используется здесь для описания процесса, в ходе которого TLR9 запускает внутриклеточный сигнал.
[00098] Стимулирующие CpG-ODN могут быть далее подразделены еще на три типа: A, B и C, которые различаются по своей иммуностимулирующей активности. Стимулирующие CpG-ODN типа A характеризуются наличием расположенного в центре молекулы фосфодиэфирного CpG-содержащего палиндромного мотива и фосфоротиоат-3'-поли-G нити. После активации TLR9, эти CpG ODN индуцируют продукцию высоких количеств IFN-альфа плазмацитоидными дендритными клетками (пДК (pDC)). Данные CpG-ODN типа А в слабой степени стимулируют TLR9-зависимую NF-.каппа в сигнальную функцию.
[00099] Стимулирующие CpG-ODN типа В содержат полноразмерный фосфоротиоатный скелет, в котором имеется/имеются один или несколько CpG динуклеотидов. После активации TLR9, такие CpG-ODN вызывают мощную активацию B клеток. В отличие от CpG-ODN типа А, CpG-ODN типа В лишь незначительно стимулируют секрецию IFN-.альфа.
[000100] Стимулирующие CpG-ODN типа С включают особенности, свойственные как олигонуклеотидам типа А, так и олигонуклеотидам типа B. CpG-ODN типа С содержат полноразмерный фосфоротиоатный скелет и CpG-содержащий палиндромный мотив. Аналогично CpG-ODN типа А, CpG-ODN типа С индуцируют мощную продукцию IFN-.альфа. дендритными клетками (пДК (pDC)). Аналогично CpG-ODN типа В, CpG-ODN типа С индуцируют мощную стимуляцию B клеток.
[000101] Репрезентативные примеры стимулирующих CpG-ODN включают, без ограничения, ODN 1585, ODN 1668, ODN 1826, ODN 2006, ODN 2006-G5, ODN 2216, ODN 2336, ODN 2395, ODN M362 (все олигонуклеотиды от компании InvivoGen). Настоящее изобретение включает также любой гуманизированный вариант всех указанных выше CpG-ODN. В одном предпочтительном варианте осуществления настоящего изобретения, композиции, способы и устройства по настоящему изобретению включают ODN 1826 (последовательность, в которой на участке от 5' до 3' находится tccatgacgttcctgacgtt, где CpG выделены жирным шрифтом, SEQ ID NO: 30).
[000102] Нейтральные, или контрольные CpG-ODN, которые не стимулируют TLR9, также включаются в область настоящего изобретения. Указанные ODN включают такую же последовательность, что и их стимулирующие варианты, но в ней содержатся GpC динуклеотиды вместо CpG динуклеотидов.
[000103] Репрезентативные примеры нейтральных, или контрольных CpG-ODN по настоящему изобретению включают, без ограничения, контрольный ODN 1585, контрольный ODN 1668, контрольный ODN 1826, контрольный ODN 2006, контрольный ODN 2216, контрольный ODN 2336, контрольный ODN 2395, контрольный ODN M362 (все указанные олигонуклеотиды от компании InvivoGen). Настоящее изобретение включает также любой гуманизированный вариант всех указанных выше CpG-ODN.
[000104] СПОСОБЫ ЛЕЧЕНИЯ И ВВЕДЕНИЯ
[000105] Вакцинные композиции по настоящему изобретению используют с целью профилактики рака и при лечении рака. Соответственно, настоящее изобретение относится к способам профилактики рака у субъекта, имеющего риск развития рака, и к способам лечения рака субъекта, у которого имеется такая потребность. В одном варианте осуществления настоящего изобретения, указанный рак выбран из группы, состоящей из рака предстательной железы, множественной миеломы, мультиформной глиобластомы и меланомы. В одном варианте осуществления настоящего изобретения, указанный рак представляет собой меланому.
[000106] В одном варианте осуществления настоящего изобретения, указанную вакцинную композицию по настоящему изобретению вводят субъекту, который имеет рак, ассоциированный со сверхэкспрессией MICA. Указанная сверхэкспрессия MICA может быть определена с использованием любого известного в данной области способа, позволяющего оценить уровень белка или соответствующей нуклеиновой кислоты. Такие способы включают, без ограничения, вестерн-блоттинг, нозерн-блоттинг, саузерн-блоттинг, ИФТФА (ELISA), иммуноосаждение, иммунофлуоресценцию, проточную цитометрию, иммуноцитохимию, технологию гибридизации нуклеиновых кислот, методы, основанные на обратной транскрипции нуклеиновых кислот, и методы амплификации нуклеиновых кислот. В одном варианте осуществления настоящего изобретения, указанный рак выбран из группы, состоящей из меланомы, карциномы легкого, молочной железы, почки, яичника, предстательной железы, поджелудочной железы, желудка и толстой кишки, лимфомы или лейкоза. В одном варианте осуществления настоящего изобретения, указанный рак представляет собой меланому. В одном варианте осуществления настоящего изобретения, указанный рак представляет собой злокачественное ноовобразование плазматических клеток, например, множественную миелому (MM) или предраковое состояние плазматических клеток. В одном варианте осуществления настоящего изобретения, указанный субъект был диагностирован как имеющий рак или как предрасположенный к развитию рака.
[000107] Вакцинные композиции по настоящему изобретению могут вводиться по отдельности или в качестве составной части курса лечения или комбинированной терапии, как описано ниже. Вакцинные композиции по настоящему изобретению могут также вводиться однократно или в режиме множественных введений, например, с использованием стратегии прайм-буст/примирования-бустинга. В контексте настоящего описания, термин ʺпрайм-бустʺ относится к способу, включающему последовательное использованием двух разных иммуногенов. Обычно указанные два разных иммуногена вводятся в последовательном режиме с соблюдением периода между введениями от 10 до 30 дней или от 10 до 60 дней. В одном варианте осуществления настоящего изобретения, указанный период времени составляет от 2 до 4 недель. Так, например, в одном варианте осуществления настоящего изобретения, указанную композицию по настоящему изобретению вводят в момент времени ноль и затем вторую вакцинную композицию по настоящему изобретению (включающую другой иммуноген) вводят по истечению периода времени, составляющего, например, от 10 до 30 дней, от 10 до 60 дней или от 2 до 4 недель.
[000108] Первая и вторая вакцинные композиции могут представлять собой одну и ту же композицию, хотя это необязательно. Таким образом, например, в одном варианте осуществления настоящего изобретения, указанная стадия введения вакцины включает введение первой вакцинной композиции и затем, через некоторое время, введение второй вакцинной композиции.
[000109] В одном варианте осуществления настоящего изобретения, указанные одна или множество разных вакцинных композиций по настоящему изобретению вводят субъекту через множество разных сайтов, как это описано в патенте США 8110196. Предпочтительно, через каждый такой сайт осуществляется дренаж на лимфатический узел или группу лимфатических узлов. В одном варианте осуществления настоящего изобретения, указанную вакцинную композицию по настоящему изобретению вводят на множество сайтов, через которых идет дренаж к двум или большему числу узлов, выбранных из группы, состоящей из лимфатических узлов головы и шеи, подмышечных лимфатических узлов, трахеобронхиальных лимфатических узлов, париетальных лимфатических узлов, желудочных лимфатических узлов, повздошно-ободочных лимфатических узлов и паховых и подпаховых лимфатических узлов. В другом варианте осуществления настоящего изобретения, указанные сайты выбирают из группы, состоящей из правой руки, левой руки, правого бедра, левого бедра, правого плеча, левого плеча, правой стороны груди, левой стороны груди, живота, правой ягодицы и левой ягодицы. В одном варианте осуществления настоящего изобретения, указанный сайт представляет собой неинкапсулированный кластер лимфоидной ткани или через этот сайт идет дренаж на такой неинкапсулированный кластер лимфоидной ткани, где указанный кластер выбран из группы, состоящей из миндалин, аденоидов, аппендикса и пейеровых бляшек. В одном варианте осуществления настоящего изобретения, указанную вакцинную композицию по настоящему изобретению вводят на сайт, через который идет дренаж в селезенку.
[000110] В одном варианте осуществления настоящего изобретения, каждую указанную вакцинную композицию вводят посредством способа, независимо выбранного из группы, состоящей из интрадермального введения, подкожного введения, трансдермального введения, внутримышечного введения, перорального введения, ректального введения, вагинального введения, введения путем ингаляции или с использованием их определенного сочетания. В одном варианте осуществления настоящего изобретения, по меньшей мере, одну композицию инъецируют непосредственно в анатомически выделенный лимфатический узел, кластер лимфатических узлов или неинкапсулированный кластер лимфоидной ткани.
[000111] Любой подходящий способ введения включается в область настоящего изобретения, такой как, например, интрадермальный, подкожный, внутривенный, внутримышечный или введение через слизистую оболочку. Способы введения через слизистую оболочку включают, без ограничения, пероральное введение, ректальное введение, вагинальное введение и назальное введение. В предпочтительном варианте осуществления настоящего изобретения, по меньшей мере, одну композицию вводят трансдермально, интрадермально, подкожно, перорально, ректально, вагинально или путем ингаляции. Любой способ введения, разрешенный Управлением по контролю за продуктами питания и лекарственными средствами США (FDA) может использоваться для введения вакцинных композиций по настоящему изобретению. Репрезентативные примеры способов введения описаны в Руководстве Управления по контролю за продуктами питания и лекарственными средствами США (FDA), включающем данные по стандартам и нормам, редакция 004 (FDA's CDER Data Standards Manual, version number 004) (указанный документ доступен на сайте fda.give/cder/dsm/DRG/drg00301.htm).
[000112] Предпочтительно, указанный способ выбирают для целевой доставки композиции к конкретному сайту, например, путем инъекции непосредственно в лимфатический узел или кластер лимфатических узлов, путем перорального введения, с тем чтобы целенаправленно доставить в лимфатические узлы желудка, путем анального введения, с тем чтобы целенаправленно доставить в лимфатические узлы прямой кишки, путем ингаляции или аэрозольного распыления, с тем чтобы целенаправленно доставить в лимфатические узлы легких или осуществить целенаправленную доставку путем любого другого способа введения.
[000113] Там, где способы по настоящему изобретению включают введение вакцинной композиции на множественные сайты, каждую такую композицию предпочтительно вводят по существу в одно и то же время, в период от одного до восьми часов или в ходе одного визита к врачу. В одном варианте осуществления изобретения, каждую такую композицию вводят в течение периода времени от одного до двух часов, в течение периода времени от одного до трех часов, в течение периода времени от одного до четырех часов или в течение периода времени от одного до пяти часов.
[000114] В тех случаях, когда вакцинная композиция представлена в виде скаффолда, указанный способ вакцинации субъекта включает имплантирование указанной скаффолд-композиции субъекту, предпочтительно, путем подкожного имплантирования. В некоторых вариантах осуществления настоящего изобретения, указанный способ вакцинации субъекта может включать имплантирование или инъекцию вакцинной композиции в форме скаффолда в две или большее число анатомических зон субъекта.
[000115] В одном варианте осуществления настоящего изобретения, указанные способы по настоящему изобретению также включают введение указанному субъекту антиген-презентирующих клеток, которые были сенсибилизированы по меньшей мере, одним пептидом MIC. В предпочтительном варианте осуществления настоящего изобретения, указанные антиген-презентирующие клетки представляют собой дендритные клетки.
[000116] В одном варианте осуществления настоящего изобретения, указанный способ также включает введение субъекту одного или нескольких адъювантов. В одном варианте осуществления настоящего изобретения, указанные один или несколько адъювантов выбраны из группы, состоящей из масляного адъюванта, CpG-ДНК адъюванта, полиинозиновой:полицитидиловой кислоты (обычно обозначается в сокращенном виде как поли(I:C)), минеральной соли адъюванта, минеральной соли геля адъюванта, адъюванта в форме частиц, адъюванта в форме микрочастиц, слизистого адъюванта и цитокина. Такие адъюванты могут быть либо включены в состав композиций по настоящему изобретению, либо они могут быть введены отдельно от указанных композиций, например, до их введения, одновременно с ними или после введения композиций субъекту. Указанные один или несколько адъювантов могут быть присоединены посредством ковалентной связи к пептиду или белку слияния по настоящему изобретению. Например, CpG-ДНК адъювант присоединяют посредством ковалентной связи к пептиду или белку слияния по настоящему изобретению.
[000117] Описанные здесь способы применимы к большому числу видов, например, таких, как человек, приматы, отличные от человека (например, мартышки), лошади, крупный рогатый скот, свиньи, овцы, олень, лоси, козы, собаки, кошки, куницы, кролики, морские свинки, хомяки, крысы и мыши.
[000118] В контексте настоящего описания термин "лечить" или "лечение" относится к частичному или полному облегчению, подавлению, ослаблению, облегчению заболевания или состояния, от которых страдает тот или иной субъект. В некоторых случаях, лечение может привести к длительному отсутствию заболевания или состояния, от которых страдает субъект.
[000119] В основном, описанные здесь способы включают выбор субъекта, имеющего риск развития рассматриваемого заболевания или состояния. В некоторых случаях, указанное состояние или заболевание субъекта может быть проведено при использовании фармацевтической композиции, описанной здесь. Так, например, в некоторых случаях, указанные способы включают выбор субъекта, больного раком, например, такого субъекта, лечение которого может быть проведено путем целевой доставки одного или двух MICA.
[000120] В некоторых случаях, указанные способы лечения могут включать однократное введение, множественное введение и повторное введение, в зависимости от имеющихся потребностей, в профилактике или лечении заболевания или состояния, от которых страдает субъект. В некоторых случаях, указанные способы лечения могут включать оценку степени развития заболевания у субъекта, перед проведением лечения, в ходе лечения и/или после лечения. В некоторых случаях, указанное лечение может продолжаться до снижения степени развития заболевания у субъекта.
[000121] Термины "вводить", "введение" или иные их грамматические формы, используемые в настоящем описании, относятся к имплантированию, абсорбированию, проглатыванию, инъекции или ингаляции рассматриваемого инновационного пептида, независимо от его формы. В некоторых случаях, один или несколько пептидов, описанных здесь, могут вводиться субъекту в местном режиме (например, назально) и/или перорально. Так, например, описанные здесь способы включают введение эффективного количества соединения или композиции на основе такого соединения с целью достижения желательного или указанного эффекта. Конкретные дозировки и стратегии лечения, применяемые для конкретного пациента, будут определяться множеством факторов, включающих активность соответствующего используемого соединения, возраст пациента, вес тела пациента, общее состояние его здоровья, пол, пищевые привычки, время введения, скорость экскреции, наличие другого лекарственного соединения, применяемого для лечения, тяжесть и особенности проявления заболевания, состояния или симптомов, предрасположенность пациента к заболеванию, а также заключение лечащего врача.
[000122] После введения, может быть проведен осмотр пациента, с целью выявления, оценки или определения степени развития заболевания. В некоторых случаях, лечение может продолжаться до достижения изменения (например, снижения) степени развития заболевания у субъекта.
[000123] При улучшении состояния пациента (например, при изменении (например, снижении) степени развития заболевания у субъекта), в схему лечения пациента вносят изменение путем перевода на введение поддерживающей дозы соединения, композиции или сочетания по настоящему изобретению, при необходимости. Затем, дозировка или частота введения, или оба этих показателя, могут быть снижены, в зависимости от симптомов, до уровня, при котором будет поддерживаться достигнутое состояние улучшения. Однако, при возникновении любого рецидива симптомов заболевания, может потребоваться длительная интермиттирующая терапия таких пациентов.
[000124] В некоторых случаях, согласно настоящему изобретению, могут применяться способы детекции у пациента иммунных клеток, например, B-клеток и/или В-клеток памяти. Такие способы могут использоваться, например, для целей мониторинга у пациента уровня иммунных клеток, например, B-клеток и/или В-клеток памяти, в частности, после соответствующих событий. Репрезентативные примеры таких событий включают, без ограничения, выявление заболеваний, инфекцию; введение терапевтической композиции по настоящему изобретению, введение терапевтического агента или проведение определенной схемы лечения, введение вакцины, индукцию иммунного ответа. Такие способы могут использоваться в варианте клинического применения и/или с исследовательской целью.
[000125] Эффективные количества и дозировки
[000126] В одном варианте осуществления настоящего изобретения, эффективное количество вакцинной композиции по настоящему изобретению представляет собой количество, достаточное для ослабления тяжести проявления рака у субъекта, имеющего рак, или количество, достаточное для снижения или ослабления тяжести одного или нескольких симптомов рака, или количество, достаточное для предупреждения прогрессирования рака, или количество, достаточное для предупреждения дальнейшего образования метастаз рака, или количество, достаточное для того, чтобы вызвать клиническую регрессию рака, или количество, достаточное для того, чтобы усилить или улучшить терапевтический/ие эффект/ы другой терапии или другого терапевтического агента, вводимого одновременно с вакцинной композицией по настоящему изобретению, до или после ее введения.
[000127] Симптомы рака хорошо известны специалистам в данной области и включают, без ограничения, родинки с необычными свойствами, изменения во внешнем виде родинки, включая асимметрию, изменение границ, цвета и/или диаметра, новые пигментные пятна на коже, аномальные родинки или бородавки, затемненную зону под ногтями, уплотнения в груди, изменения в области сосков, кисты молочной железы, боль в области груди, смертельное заболевание?, потерю веса, слабость, переутомление, затруднения при приеме пищи, потерю аппетита, хронический кашель, усиление одышки, кашель с кровью, кровь в моче, кровь в каловых массах, тошноту, рвоту, метастазы в печени, метастазы в легком, метастазы в костях, чувство переполненности кишечника, вспучивание, жидкость в перитонеальной полости, вагинальное кровотечение, засорение желудка, вздутие живота, прободение толстой кишки, острый перитонит (инфекция, лихорадка, боль), боль, рвоту с кровью, сильное потоотделение, лихорадку, высокое давление крови, анемию, диарею, желтуху, головокружение, озноб, мышечные спазмы, метастазы в толстой кишке, метастазы в легком, метастазы в мочевом пузыре, метастазы в печени, метастазы в костях, метастазы в почке и метастазы в поджелудочной железе, затруднения при глотании и др.
[000128] В одном варианте осуществления настоящего изобретения, эффективное количество вакцинной композиции по настоящему изобретению представляет собой количество, достаточное для индукции иммунного ответа посредством выработки антитела, секретируемого В-клетками или цитотоксическими Т-клетками, против одного или нескольких пептидов из вакцинной композиции по настоящему изобретению. В одном варианте осуществления настоящего изобретения, эффективное количество вакцинной композиции по настоящему изобретению представляет собой количество, достаточное для индукции иммунного ответа посредством выработки антитела, секретируемого В-клетками или цитотоксическими Т-клетками, против раковой клетки. Способность вакцинных композиций по настоящему изобретению вызывать иммунный ответ может быть определена при использовании стандартного метода, известного специалистам в данной области. В одном варианте осуществления настоящего изобретения, эффективное количество каждой композиции представляет собой количество, достаточное для индукции ответа цитотоксических Т-клеток у субъекта, который может быть оценен, например, в рамках объединенного теста на Т-клетки и лимфоциты.
[000129] В одном варианте осуществления настоящего изобретения, эффективное количество вакцинной композиции, вводимое субъекту или в определенный сайт субъекта, представляет собой такое количество, которое будет доставлять от 1 до 1000 микрограмм одного или нескольких пептидов по настоящему изобретению. В одном варианте осуществления настоящего изобретения, указанное количество пептидов составляет от 1 до 100 микрограмм, от 1 до 200 микрограмм, от 1 до 300 микрограмм, от 1 до 400 микрограмм, от 1 до 500 микрограмм, от 1 до 600 микрограмм, от 1 до 700 микрограмм, от 1 до 800 микрограмм или от 1 до 900 микрограмм. В другом варианте осуществления настоящего изобретения, указанное количество пептидов составляет от 1 до 10 микрограмм, от 1 до 20 микрограмм, от 1 до 30 микрограмм, от 1 до 40 микрограмм, от 1 до 50 микрограмм, от 1 до 60 микрограмм, от 1 до 70 микрограмм, от 1 до 80 микрограмм или 1 до 90 микрограмм. В одном варианте осуществления настоящего изобретения, указанное общее количество пептидов, вводимое субъекту, не должно превышать 5 миллиграмм. В одном варианте осуществления настоящего изобретения, указанное общее количество пептидов, вводимое субъекту, не должно превышать 2 миллиграмм.
[000130] КОМБИНИРОВАННАЯ ТЕРАПИЯ
[000131] Настоящее изобретение также относится к способам лечения или профилактики рака, которые включают введение субъекту вакцинной композиции по настоящему изобретению, при наличии такой потребности, вместе с одним или несколькими дополнительными терапевтическими агентами или в сочетании с другими схемами лечения. В одном варианте осуществления настоящего изобретения, указанную вакцинную композицию по настоящему изобретению вводят в качестве составной части схемы лечения, которая включает хирургическое вмешательство, химиотерапевтическое средство или лучевую терапию, а также иммунотерапию или любое сочетание указанных выше видов лечения.
[000132] В одном варианте осуществления настоящего изобретения, указанная терапевтическая стратегия включает или дополнительно включает одно или несколько иммунотерапевтических средств. В одном варианте осуществления настоящего изобретения, указанные одно или несколько иммунотерапевтических средств выбраны из группы, состоящей из анти-CTLA-4 антитела или пептида, анти-PD-1 антитела или пептида, анти-PDL-1 антитела или пептида, анти-OX40 (также известного как CD134, TNFRSF4, ACT35 и/или TXGP1L) антитела или пептида, анти-GITR (также известного как TNFRSF18, AITR и/или CD357) антитела или пептида, анти-LAG-3 антитела или пептида и/или анти-TIM-3 антитела или пептида.
[000133] В одном варианте осуществления настоящего изобретения, указанные одно или несколько иммунотерапевтических средств выбраны из анти-MICA антитела, описанного в WO 2013/049517 или WO 2008/036981. В одном варианте осуществления настоящего изобретения, указанные одно или несколько иммунотерапевтических средств выбраны из CM33322 Ab4, CM33322 Ab28 и CM33322 Ab29, которые описаны в предварительной заявках на патент США NoNo. 61/792034 и 61/913198 и в заявке на патент США No. 14/025573.
[000134] В одном варианте осуществления настоящего изобретения, указанная терапевтическая стратегия включает или дополнительно включает один или несколько цитокинов. В одном варианте осуществления настоящего изобретения, указанные вакцинные композиции по настоящему изобретению включают один или несколько цитокинов. В одном варианте осуществления настоящего изобретения, по меньшей мере, один цитокин представляет собой интерлейкин или интерферон. В одном варианте осуществления настоящего изобретения, по меньшей мере, один цитокин представляет собой интерлейкин, выбранный из группы, состоящей из IL-1.альфа., IL-1.бета., IL-2, IL-3, IL-4, IL-5, IL-6, IL-7, IL-8, IL-9, IL-11, IL-12, IL-13, IL-15 и IL-18. В другом варианте осуществления настоящего изобретения, по меньшей мере, один цитокин представляет собой интерферон, выбранный из группы, состоящей из IFN.альфа., IFN.бета. и IFN.гамма.
[000135] В одном варианте осуществления настоящего изобретения, указанную вакцинную композицию по настоящему изобретению вводят как часть терапевтической стратегии, которая включает введение субъекту по меньшей мере химиотерапевтического агента, выбранного из группы, состоящей из ингибиторов гистондеацетилазы (ʺHDACʺ), протеасомных ингибиторов, алкилирующих агентов и ингибиторов топоизомеразы.
[000136] В одном варианте осуществления настоящего изобретения, указанный химиотерапевтический агент представляет собой ингибитор HDAC, выбранный из группы, состоящей из гидроксамовой кислоты, воринстата (золинза) (Vorinostat (Zolinza)), субероиланилида гидроксамовой кислоты (SAHA) (Merck), трихостатина А (Trichostatin A) (TSA), LAQ824 (Novartis), панобиностата (Panobinostat) (LBH589) (Novartis), белиностата (Belinostat) (PXD101) (CuraGen), ITF2357 италфармако SpA (Italfarmaco SpA) (Cinisello), циклического тетрапептида, депсипептида (Depsipeptide) (ромидепсин (romidepsin), FK228) (Gloucester Pharmaceuticals), бензамида, энтиностата (Entinostat) (SNDX-275/MS-275) (Syndax Pharmaceuticals), MGCD0103 (Celgene), короткоцепочечных алифатических кислот, вальпроевой кислоты, фенилбутирата, AN-9, пиванекса (Titan Pharmaceutical), CHR-3996 (Chroma Therapeutics) и CHR-2845 (Chroma Therapeutics).
[000137] В одном варианте осуществления настоящего изобретения, указанный химиотерапевтический агент представляет собой протеасомный ингибитор, выбранный из группы, состоящей из бортезомиба (Bortezomib), (Millennium Pharmaceuticals), NPI-0052 (Nereus Pharmaceuticals), карфилзомиба (Carfilzomib) (PR-171) (Onyx Pharmaceuticals), CEP 18770 и MLN9708.
[000138] В одном варианте осуществления настоящего изобретения, указанный химиотерапевтический агент представляет собой алкилирующий агент, такой как мефалан.
[000139] В одном варианте осуществления настоящего изобретения, указанный химиотерапевтический агент представляет собой ингибитор топоизомеразы, такой как адриамицин (Adriamycin) (доксорубицин (doxorubicin)).
[000140] В одном варианте осуществления настоящего изобретения, указанная схема лечения включает или дополнительно включает один или несколько видов химиотерапии, лучевой терапии, введение цитокинов, хемокинов и других биологических сигнальных молекул, специфических противоопухолевых вакцин, вакцин на основе раковых клеток (например, ГМ-КСФ-трансдуцированные раковые клетки), опухолеспецифические моноклональные антитела, вакцины, способствующие уклонению от действия аутологичных и аллогенных стволовых клетока (например, для того, чтобы усилить реакцию «трансплантат против опухоли»), другие терапевтические антитела, терапии, основанные на применении молекул целенаправленного воздействия, анти-ангиогенную терапию, инфекционные агенты с терапевтической составляющей (такие как бактерии, локализованные в опухолях) и генную терапию.
[000141] НАБОРЫ
[000142] Настоящее изобретение относится к фармацевтической упаковке или фармацевтическому набору для осуществления способов по настоящему изобретению или соответствующих схем лечения. В одном варианте осуществления настоящего изобретения, указанный набор включает вакцинную композицию по настоящему изобретению в лиофилизированном виде. В одном варианте осуществления настоящего изобретения, указанный набор включает вакцинную композицию по настоящему изобретению в виде скаффолд-белка.
[000143] В одном варианте осуществления настоящего изобретения, указанный набор включает в одном или нескольких дополнительных контейнерах цитокин или адъювант.
[000144] Композиция в каждом из контейнеров может быть представлена в виде фармацевтически приемлемого раствора, например, в сочетании со стерильным солевым раствором, раствором декстрозы или забуференным раствором, или в сочетании с другой фармацевтически приемлемой стерильной жидкостью. Альтернативно, указанная композиция может быть лиофилизирована или обезвожена; в этом случае, указанный набор необязательно также включает в отдельном контейнере фармацевтически приемлемый раствор (например, солевой раствор, раствор декстрозы и др.), предпочтительно стерильный, для восстановления композиции с получением раствора, подходящего для целей инъекции.
[000145] В другом варианте осуществления настоящего изобретения, указанный набор также включает одно или несколько устройств, подходящих для многократного применения при введении, или одноразовые устройства для введения (например, шприцы, иглы, дозаторы-ручки), предпочтительные упакованные в стерильном виде, и/или упакованные вместе с медицинской спиртовой салфеткой. В набор могут быть также включены инструкции для медицинского работника по введению композиций пациенту. Указанный набор может также включать другие материалы, например, металлическую или пластиковую фольгу, такую как в случае блистерной упаковки.
[000146] В некоторых вариантах осуществления, настоящее изобретение относится к способам использования одной или нескольких вакцинных композиций (обозначенных в приведенных ниже примерах символом 'X'), описанных здесь, в приведенных способах.
[000147] Вещество X, используемое в качестве лекарственного средства при лечении одного или нескольких заболеваний или состояний, из числа описанных здесь, (например, рака, обозначенного в приведенных ниже примерах как 'Y'). Использование вещества X при получении лекарственного средства для лечения для лечения Y; и вещества X, используемого при лечении Y.
[000148] В нескольких случаях, описанные здесь терапевтические композиции могут быть изготовлены для продажи в США, импорта в США и/или для экспорта в США.
[000149] Если особо не указано иное, все используемые в описании технические и научные термины имеют значения, известные специалистам в той области, к которой относится настоящее изобретение. В настоящем описании указаны способы и материалы, применимые для осуществления настоящего изобретения; в данной области известны другие, подходящие для целей настоящего изобретения способы и материалы, и они также могут использоваться. Материалы, способы и примеры даны здесь только для пояснения, но не с целью какого-либо ограничения. Все публикации, патентные заявки, патенты, последовательности, информация по базам данных и другие ссылки, указанные здесь, полностью приведены в настоящем описании посредством ссылок. В случае расхождения, в том числе применительно к определениям, следует применять значения, указанные в настоящем описании, в том числе определения.
ПРИМЕРЫ
[000150] ПРИМЕР 1: ОБЩИЕ МЕТОДЫ
[000151] Конструирование вектора
[000152] Поливалентные вакцины индуцируют существенно более высокий титр антител в ответ на их применение, чем моновалентные белки. В данном случае использовался поливалентный дисплей, в котором альфа3-домен MICA слит с ферритином из Helicobacter pylori (H. pylori). Недавно было показано, что наночастицы на основе ферритина индуцируют высокий титр антител на вакцины гриппа и EBV. Ферритин присутствует в подавляющем большинстве организмов в качестве белка-депо железа. Ферритин обладает к самосборке частиц с образованием в результате этого процесса сферической частицы с симметрией октаэдра, состоящей из 24 субъединиц. На фиг. 1C и 1D схематически показана частица ферритина, а также приведена карта, демонстрирующая клеточный и гуморальный иммунные ответы против ферритина человека и мыши. Белок слияния альф3 MICA-ферритин (обозначаемый сокращенно как MICA-ферритин) был получен путем слияния гена, кодирующего α3-домен MICA, с ферритином из H. pylori с использованием Gly-Ser-Gly линкера (фиг. 2A). Была введена точечная мутация (Asn19Gln) в ферритин из H. pylori для удаления потенциального сайта N-гликозилирования. Для определения иммунного ответа в варианте образования антител против одного MICAα3 (без ферритина), был получен дегликозилированный вариант гена MICAα3 путем мутации 7 из 8 потенциальных сайтов N-гликозилирования на Asp или Gln. Была также встроена C-концевая метка ГА для очистки белка по направлению считывания гена. Гены синтезировали с использованием платформы для синтеза генов GeneArt® (Gene Synthesis platform) и при оптимизации кодонов для экспрессии клеток насекомых. Далее, синтезированные гены клонировали в векторе экспрессии бакуловируса pAcDB3 (см. фиг. 2C).
[000153] Тесты, которые демонстрируют создание вакцины на основе альфа3-домена MIC и получение вакцины на основе дегликозилированного альфа3-домена MICA показаны на фиг. 2B и 2D, соответственно.
[000154] Биосинтез белка и очистка белка
[000155] Белки слияния на основе MICAα3 и MICA-ферритин экспреесировали в клетках насекомых Sf9 (Spodoptera frugiperda) путем инфицирования этих клеток рекомбинантным бакуловирусом с множественностью заражения 10. Клетки растили в бессывороточной среде для экспрессии Sf900 (Life Technologies), и через 3 дня после заражения, собирали супернатанты из культуральной среды. Далее, супернатанты концентрировали и проводили замену на Трис буфер (буфер, содержащий 50 мМ Трис, 150 мМ NaCl, pH 7,5). Белки очищали путем ГА-аффинной хроматографии, а образованные агрегаты удаляли при проведении гель-фильтрационной хроматографии с использованием колонки Superose 6 (GE Healthcare). Проводили замену буфера на ФБР для очищенных белков с использованием обессоливающих колонок PD-10 (GE) и далее концентрировали до концентрации 1 мг/мл с использованием центрифужных фильтров Amicon Ultra (4 мл). Чистоту и размер полученных белков подтверждали при проведении электрофореза в ДСН-ПААГ (SDS-PAGE).
[000156] Получение MPS вакцины и проведение иммунизации
[000157] Приведенная здесь скаффолд-вакцина была недавно описана (Kim et al Nat. Biotechnol. 2015, 33, 64-72). Мезопористые нанопалочки из оксида кремния (MSR), инъецированные иглой, начинают спонтанно собираться in vivo с образованием макропористой структуры, напоминающей стог сена, которая обеспечивает 3D клеточную микросреду для дендритных клеток. Указанный биоразлагаемый скаффолд выполняет функцию рекрутинга и обучения дендритных клеток, которые затем мигрируют к лимфатическим узлам, где индуцируют иммунный ответ. К 5 мг MSR добавляли 1 мкг ГМ-КСФ (GM-CSF) (для рекрутинга дендритных клеток), 100 мкг CpG олигонуклеотида (для индукции процесса активации дендритных клеток) и 200 мкг белка слияния MICA-ферритин или контрольного белка (овальбумин) и оставляли на 12 часов при комнатной температуре. Затем частицы подвергали лиофильной сушке, ресуспендировали в ФБР и инъецировали подкожно в боковую область живота мышей of C57BL/6. На 14 или 21 день после первой иммунизации указанным мышам проводили бустерную иммунизацию. Неиммунизированных (нелеченных) мышей сходного возраста и мышей, иммунизированных овальбумином, использовали в качестве контрольных групп в экспериментах по иммунизации с использованием MICA-ферритина. В качестве дополнительного контроля в экспериментах с MICAα3, использовали группу мышей, которых иммунизировали всеми компонентами вакцины, но без MSR скаффолда (болюсом).
[000158] Эксперимент с метастазами в легких у мышей, иммунизированных с использованием MICAα3 и MICA-ферритина
[000159] Мышей C57Bl/6J иммунизировали с использованием вакцины MICAα3 или MICAα-ферритин. Через три недели после бустинга, проводили контрольное заражение мышей путем внутривенной (в/в) инъекции 0,5×106 клеток меланомы B16F10, экспрессирующих MICA. Сыворотки отбирали до введения опухолевых клеток и после заражения с недельными интервалами для анализа уровней подвергнутого шеддингу MICA. Через 14 после введения опухолевых клеток, мышей подвергали эвтаназии; легкие собирали и фиксировали в 10% забуференном нейтральном формалине и подсчитывали число метастаз в легких.
[000160] Использование методов проточной цитометрии и ИФТФА (ELISA) для определения титра антител против MICA у иммунизированных мышей
[000161] Титры MICA-специфичных антител определяли путем иммуноферменного анализа по методу ИФТФА (ELISA) с использованием полноразмерного внеклеточного домена MICA. Вносили полноразмерный белок MICA (по 0,2 мкг) в лунки 96-луночного планшета для ИФТФА (ELISA) и выдерживали в течение ночи при температуре 4°C. Затем планеты блокировали добавлением ФБР/2% БСА в течение часа при комнатной температуре. После этого, планшеты промывали и инкубировали с серийными разведениями сыворотки, собранными с недельными интервалами от животных из каждой экспериментальной группы. Использовали козий противомышиный HRP в качестве антитела детекции. Использовали проточную цитометрию для анализа связывания сывороточных антител с полноразмерным белком, экспрессированным на поверхности опухолевых клеток. В общих чертах, процедура состояла в том, что 1×105 опухолевых клеток инкубировали с 1 мкл сыворотки в течение 2 часов при температуре 4°C. Далее, указанные 1×105 клеток окрашивали с использованием 1 мкл сыворотки от неиммунизированных (нелеченных) мышей, а также от мышей, иммунизированных всеми компонентами вакцины, за исключением MSR скаффолда (болюс), или вакциной MICA-ферритин (вакцинированные) в 100 мкл ФБР в течение 2 часов. Коммерчески доступное моноклональное антитело 6D4, которое связывается с альфа1-альфа2 доменами MICA, использовали в качестве положительного контроля (10 мкг). ПЭ-конъюгированный противомышиный IgG использовали в качестве вторичного антитела.
[000162] ПРИМЕР 2: СКАФФОЛД-ВАКЦИНА ДЛЯ ИНДУКЦИИ ИММУННОГО ОТВЕТА НА БЕЛОК
[000163] Проводили экспрессию α3 домена MIC в виде рекомбинантного белка в системе Baculovirus; белок проявлялся в поливалентной форме на ферритине H. pylori, белке-депо железа, с 24 идентичными субъединцами. Использованная стратегия вакцинации включала применение мезопористых нанопалочек из оксида кремния (MSR), описанных ранее в работе Kim et al. Nat. Biotechnol. 2015, 33, 64-72, где указанная работа включена в настоящее описание полностью посредством ссылки (см. фиг. 3). MSR, которые были инъецированы подкожно с помощью иглы, спонтанно самоорганизовывались in vivo в макропористые структуры, которые обеспечивали нужную 3D-клеточную микросреду для иммунных клеток организма-хозяина. Эта система осуществляет мобилизацию большого числа иммунных клеток, подвергает их контакту с соответствующими антигенами и обеспечивает нужные молекулярные ключи для индукции мощного иммунного ответа. Белок α3-домена MIC захватывается MSR, вместе с ГМ-КСФ (GM-CSF) (для целей рекрутинга дендритных клеток) и CpG олигонуклеотидом (адъювантом, который активирует дендритные клетки). Такая стратегия вакцинации позволяет достичь индукции высокого титра антител, специфичных для α3-домена MIC. Эти антитела окрашивают опухолевые клетки, которые экспрессируют MIC, и ингибируют шеддинг MIC опухолевыми клетками.
[000164] Для оценки противоопухолевой активности этой вакцины, авторы использовали клетки меланомы B16, трансфицированные MIC человека. Когда такие опухолевые клетки инъецировали внутривенно неиммунизированным мышам, они создавали у мышей множество метастаз в легких (~200 метастаз/мышь). А вакцина на основе MSR-скаффолда обеспечивала мощную защиту от развития таких метастаз. Когда компоненты вакцины инъецировали в виде болюса, не содержащего MSR-скаффолд, наблюдалась лишь частичная защита, при этом биологический эффект был намного слабее. Этот результат показывает, что локальный рекрутинг иммунных клеток в направлении MSR-скаффолда существенно повышает активность этой вакцины (см. фиг. 4).
[000165] ПРИМЕР 3: ВАКЦИНАЦИЯ С ИСПОЛЬЗОВАНИЕМ БЕЛКА СЛИЯНИЯ MICA-ФЕРРИТИН ИНДУЦИРУЕТ ВЫСОКИЙ ТИТР MICA-СПЕЦИФИЧНЫХ АНТИТЕЛ
[000166] Связыванием антител, специфичных против MICAα3, в сыворотке мышей с полноразмерным MICA, экспрессированным на поверхности клеток меланомы мышей B16F10 исследовали с использованием метода проточной цитомерии. В общих чертах, процедура состояла в том, что проводили окрашивание 1×105 клеток с использованием для этой цели 1 мкл сыворотки от неиммунизированных мышей (нелеченных), мышей иммунизировали контрольной вакциной (белок OVA) или вакциной на основе MICA-ферритин, в следующие дни: 14, 28 и 42 (вакцинирование) в 100 мкл ФБР в течение 2 часов. В качестве положительного контроля, использовали коммерчески доступное моноклональное антитело 6D4 (10 мкг), которое связывается с α1-α2 доменами MICA. ПЭ-конъюгированный противомышиный IgG использовали в качестве вторичного антитела. Специфичные против MICAα3 антитела в сыворотках вакцинированных мышей (гистограммы - зеленый цвет (d14), синий цвет (d28), крассный цвет (d42) продемонстрировали значимое связывание с MICA, экспрессированным на поверхности опухолевых клеток (фиг. 5A и 5B). Результаты эти исследований показывают, что вакцинация с использованием белка слияния MICA-ферритин индуцирует высокие титры MICA-специфичных антител.
[000167] ПРИМЕР 4: ВАКЦИНАЦИЯ С ИСПОЛЬЗОВАНИЕМ БЕЛКА СЛИЯНИЯ MICA-ФЕРРИТИН ПРИВОДИТ К ПРОДУКЦИИ ВЫСОКИХ УРОВНЕЙ ПОЛИКЛОНАЛЬНЫХ АНТИТЕЛ, СПЕЦИФИЧНЫХ ДЛЯ IGG1, IGG2a И IGG3 MICAA3
[000168] Использовали сыворотки от мышей, иммунизированных MICA-ферритином, в методе ИФТФА (ELISA) для определения разных подклассов IgG, индуцированных при вакцинации. А сыворотки от мышей, иммунизированных OVA-белком (болюсом), или от неиммунизированных мышей (нелеченных) использовали в качестве контрольных групп. Полноразмерный MICA был использован в качестве связываемого антигена в методе «антигенной ловушки», и для внесения в каждую лунку микротитрационного планшета использовали разведения 1/1000. Для целей детектирования были взяты HRP-конъюгированные иммуноглобулины IgG1, IgG2a, IgG2b или IgG3. Было показано, что иммунизация с использованием MICA-ферритина (путем вакцинации) индуцирует высокие уровни всех подклассов, исследованных IgG (см. фиг. 6).
[000169] ПРИМЕР 5: ПОЛИКЛОНАЛЬНЫЕ АНТИТЕЛА, ВЫРАБОТАННЫЕ В ОТВЕТ НА ВВЕДЕНИЕ ВАКЦИНЫ НА ОСНОВЕ MICA-ФЕРРИТИН, ПРЕПЯТСТВУЮТ ШЕДДИНГУ MICA С ПОВЕРХНОСТИ МЕСТАСТАЗНЫХ КЛЕТОК В ЛИНИИ МЕЛАНОМЫ ЧЕЛОВЕКА
[000170] Индукция MICA антител у пациентов с меланомой, которых лечили аутологичной противоопухолевой вакциной (GVAX) в сочетании Ipilimumab, коррелировала со снижением уровней растворимого сывороточного MICA (sMICA). Внеклеточная часть MICA/B содержит два класса I-подобных доменов (α1 и α2) из ГКГ (главный комплекс гистосовместимости) и прилежащий к мембране иммуноглобулиновый домен (α3). Было показано, что дисульфид-изомераза ERp5 расщепляет структурную дисульфидную связи в α3 домене MICA, и получаемое при этом развертывание данного домена дает возможность осуществления протеолитического расщепления под действием ADAM 10, ADAM 17 и MMP-14. Целью такого теста является установление того факта, препятствуют ли поликлональные антитела, вырабатываемые в ответ на введение вакцины на основе MICA-ферритин, шеддингу MICA клетками меланомы человека в клеточной линии опухолевых клеток A375.
[000171] Для проведения указанных исследований, 4×105 клеток из клеточной линии злокачественной меланомы A375 вносили в лунки 96-луночного планшета в 200 мкл среды. Далее, клетки инкубировали без сыворотки или с сывороткой от нелеченных мышей, или с сывороткой от мышей, иммунизированных OVA-белком, или сывороткой от мышей, вакцинированных с использованием MICA-ферритин (фиг. 7, прямоугольники с перевернутым треугольником) в течение 24 час. sMICA в супернатанте анализировали с использованием набора для определения MICA по методу ИФТФА (ELISA), который включает антитела против α1-α2 доменов MICA для связывания по типу «генной ловушки» и последующей детекции. Выявлялись сниженные уровни sMICA в супернатанте клеток, инкубируемых с сывороткой от мышей, вакцинированных с использованием вакцины на основе MICA-ферритин (фиг. 7, прямоугольники с перевернутым треугольником), в сравнении с клетками, которые инкубировали без сыворотки, или с сывороткой от нелеченных мышей (фиг. 7, прямоугольник с кругами и квадратами), или с сывороткой от мышей, иммунизированных OVA-белком (фиг. 7, прямоугольники с треугольником), и этот результат указывает на то, специфичные против MICAα3 антитела могут ингибировать шеддинг MICA с поверхности опухолевых клеток.
[000172] ПРИМЕР 6: ТЕРАПЕВТИЧЕСКАЯ АКТИВНОСТЬ ВАКЦИНЫ НА ОСНОВЕ MICA-ФЕРРИТИН
[000173] Терапевтическую активность вакцины на основе MICA-ферритин оценивали с использованием высоко агрессивной модели опухолевых клеток меланомы B16F10. Клетки опухоли меланомы B16F10 генетически модифицировали для достижения экспрессии MICA человека. MICA связывали с мышиным рецептором NKG2D, получив таким образом подходящую модельную систему. Мышей C57BL/6 иммунизировали вакциной на основе MICA-ферритин, или вакциной на основе OVA-белка (контрольный антиген), оставив также группу неиммунизированных мышей (соответствующего возраста и пола), и затем проводили контрольное заражение всех мышей путем в/в инъекции опухолевых клеток B16F10-MICA. Сыворотки отбирали до введения опухолевых клеток и затем на 7 день и на 13 день. Через 14 дней после введения опухолевых клеток, мышей подвергали эвтаназии и подсчитывали число метастаз в легких (см. фиг. 8A).
[000174] Для проведения указанных исследований, 8-недельных самок мышей C57BL/6 иммунизировали с использованием вакцины на основе альфа3 MICA-ферритин или ova-белком, с последующим бустингом на 28 день. Через три недели, проводили контрольное заражение мышей путем в/в инъекции 5×105 клеток меланомы B16F10, экспрессирующих MICA. Через 14 дней после введения опухолевых клеток, мышей подвергали эвтаназии и подсчитывали число метастаз в легких. Уровень подвергнутого шеддингу MICA (sMICA) в сыворотках оценивали с использованием иммуноферментного анализа (ИФТФА (ELISA)). Результаты этих экспериментов показали, что мыши, вакцинированные с использованием вакцины на основе MICA-ферритин, практически не имели опухолей. Тогда как неиммунизированные мыши аналогичного возраста (нелеченные) и мыши, вакцинированные контрольным антигеном - овальбумином, имели большое число метастаз в легких (в среднем ~150 метастаз в легком/мышь) (фиг. 8A). Важен также тот факт, что sMICA не выявлялся в сыворотках мышей, иммунизированных вакциной на основе MICA-ферритин (треугольник), тогда как обнаруживались высокие уровни sMICA, в течение двух недель после заражения опухолевыми клетками, в сыворотках мышей, иммунизированных овальбумином (квадрат), и у неиммунизированных мышей в контрольной группе (круг) (фиг. 8B).
[000175] ПРИМЕР 7: ОПРЕДЕЛЕНИЕ ЭФФЕКТИВНОЙ ДОЗЫ ВАКЦИНЫ НА ОСНОВЕ MICA-ФЕРРИТИН И ОЦЕНКА КИНЕТИКИ ИММУННОГО ОТВЕТА, ОСУЩЕСТВЛЯЕМОГО ПУТЕМ ВЫРАБОТКИ ПОЛИКЛОНАЛЬНЫХ АНТИТЕЛ In Vivo
[000176] В этих исследованиях, мышам проводили две инъекции вакцины до заражения опухолевыми клетками. При этом через две недели после первой иммунизации достигались практически максимальные уровни антител. Для того чтобы определить оптимальные параметры вакцинации, такие как дозировка, и оценить кинетику образования поликлональных антител при разных дозах, мышей C57Bl/6J иммунизировали разными дозами белка MICA-ферритин (50-200 мкг), абсорбируемых на MSR. На 17 день мышам проводили бустерную иммунизацию. Сыворотки отбирали с недельными интервалами через ретроорбитальное кровопускание, для целей определения титра антител против MICA в рамках иммуноферментного анализа (ИФТФА (ELISA)). На 25 день после первой иммунизации, проводили контрольное заражение мышей путем в/в инъекции клеток меланомы B16F10, экспрессирующих MICA. Сыворотки отбирали до введения опухолевых клеток и далее, с недельными интервалами, для определения уровней подвергнутого шеддингу MICA. На 14 день после введения опухолевых клеток, мышей подвергали эвтаназии; легкие отбирали, фиксировали в 10% забуференном нейтральном формалине и подсчитывали число образовавшихся в легких метастаз.
[000177] Для проведения этих исследований, 8-недельных самок мышей C57BL/6 иммунизировали с использованием вакцины на основе альфа3 MICA-ферритин, взятой в разных дозах (50 мкг, 100 мкг или 200 мкг) и затем, на 17 день проводили бустерную иммунизацию. Титр антител в конечной точке определяли путем оценки связывания серийных разведений исследуемых сывороток с полноразмерным белком MICA путем иммуноферментного анализа (ИФТФА (ELISA)). Мыши, иммунизированные с использованием MICA-ферритин, демонстрировали высокие уровни титра антител к 14 дню (конечное значение титров при анализе методом ИФТФА (ELISA) составляет 105) при всех исследованных дозах, и титр повышался примерно в 1000 раз после проведения бустерной иммунизации на 17 день. Нелеченные, необработанные мыши аналогичного возраста использовались в качестве контрольной группы (см. фиг. 9A).
[000178] На 25 день после первой иммунизации, проводили заражение мышей путем в/в инъекции 0,5×106 клеток меланомы B16F10, экспрессирующих MICA. Сыворотки отбирали до введения опухолевых клеток и далее, с недельными интервалами, для определения уровней подвергнутого шеддингу MICA. На 14 день после введения опухолевых клеток, мышей подвергали эвтаназии; легкие отбирали, фиксировали в 10% забуференном нейтральном формалине и подсчитывали число образовавшихся в легких метастаз. Мыши, иммунизированные дозами 100 мкг и 200 мкг, практически не имели опухолей, в сравнении с мышами, иммунизированными вакциной в дозе 50 мкг (~2-12 метастаз в легком). sMICA не выявлялся в сыворотках мышей, иммунизированных разными дозами вакцины на основе MICA-ферритин (50 мкг - квадрат, 100 мкг - треугольник с вершиной вверх, 200 мкг - треугольник с вершиной вниз), тогда как обнаруживались высокие уровни sMICA, в течение двух недель после введения опухолевых клеток, в сыворотках неиммунизированных мышей из контрольной группы (пустой круг) (см. фиг. 9B и 9C).
[000179] ПРИМЕР 8: ОДНА ВАКЦИНА НА ОСНОВЕ MICAα3 ИНДУЦИРУЕТ ВЫСОКИЙ ТИТР СПЕЦИФИЧЕСКИ АНТИТЕЛ ПРОТИВ MICA
[000180] Для оценки эффекта одной вакцины на основе MICAα3 (без ферритина) в индукции иммунного ответа путем выработки специфических поликлональных антител против MICA, получали дегликозилированный вариант гена MICAα3 путем мутации 7 из 8 потенциальных сайтов N- гликозилирования на Asp или Gln. После получения белка и его очистки, как описано в разделе «Методы», изготавливали вакцину MICAα3 при внесении в 5мг MSR 1 мкг ГМ-КСФ (GM-CSF), 100 мкг CpG-ODN и 150 мкг дегикозилированного белка MICAα3 (сокращенно, вакцина MICAα3). Далее, частицы подвергали лиофильной сушке, ресуспендировали в холодном ФБР (150 мкл) и инъецировали подкожно в боковую область живота самок мышей C57Bl/6J. После этого, мышей иммунизировали с использованием всех компонентов вакцины, но без MSR скаффолда (болюсом), а необработанных мышей аналогичного возраста использовали в качестве контрольной группы. Сыворотки от мышей собирали с недельными интервалами путем ретроорбитального кровопускания. На 28 день после первой иммунизации, указанным мышам делали бустерную инъекцию.
[000181] Для проведения указанных исследований 1×105 клеток меланомы B16F10, экспрессирующих MICA009, окрашивали с использованием 1 мкл сыворотки от неиммунизированных мышей (нелеченных), от мышей, иммунизированных MICAα3 без добавления MSR (болюсом), или вакциной на основе MICAα3 (вакцинированные мыши) в 100 мкл ФБР в течение 2 часов. Коммерчески доступное моноклональное антитело 6D4, которое связывается с доменами α1-α2 MICA, использовали в качестве положительного контроля (10 мкг). ПЭ-конъюгированный противомышиный IgG использовали в качестве вторичного антитела. Специфичные антитела против MICAα3 в сыворотке вакцинированных мышей и мышей из группы, иммунизированных болюсом, демонстрировали, после бустинга, значимое связывание с MICA, экспрессированным на поверхности опухолевых клеток, на уровне, близком к соответствующему значению в группе положительного контроля (см. фиг. 10A).
[000182] Сыворотки от мышей, иммунизированных вакциной на основе MICAα3, анализировали по методу ИФТФА (ELISA) для определения разных подклассов IgG, индуцированных при вакцинации. Сыворотки от неиммунизированных мышей использовали с целью оценки соответствующих показателей для контрольной группы. Полноразмерный вариант MICA использовали в качестве «антигенной ловушки» и в каждую лунку микротитрационного планшета вносили серийное разведение 1/1000. Для детекции использовали HRP-конъюгированный противомышиные IgG1, IgG2a, IgG2b или IgG3. Было показано, что иммунизация с использованием вакцины на онове MICAα3 и вакцины на основе болюса индуцирует образование антител всех исследованных подклассов IgG, при этом уровни IgG1 были выше, чем при использовании вакцины на основе MICA-ферритин (см. фиг. 10B).
[000183] ПРИМЕР 8: ВАКЦИНА НА ОСНОВЕ MICAA3, ОДНА (НЕ СЛИТАЯ С ФЕРРИТИНОМ) ДЕМОНСТРИРУЕТ ЗНАЧИМЫЙ ТЕРАПЕВТИЧЕСКИЙ ЭФФЕКТ In Vivo
[000184] Для проведения указанных исследований, самок 8-недельных мышей C57Bl/6J иммунизировали вакциной на основе MICAα3 или болюсом, который содержал все компоненты данной вакцины, но не включал MSR скаффолд. Необработанных самок мышей C57Bl/6J аналогичного возраста оценивали в качестве животных контрольной группы. Через три недели после бустерной инъекции, проводили заражение мышей путем в/в инъекции 0,5×106 клеток меланомы B16F10, экспрессирующих MICAs. Мышей подвергали эвтаназии через 14 дней после введения опухолевых клеток; отбирали легкие, фиксировали их в 10% забуференном нейтральном формалине и подсчитывали количество метастаз в легких. Мыши, вакцинированные с использованием MICAα3, практически не содержали опухоли, в сравнении с необработанными животными аналогичного возраста из контрольной группы. Число метастаз в легких было значительно ниже в группе животных, иммунизированных болюсом (~100-125), чем в группе неиммунизированных животных (~200-250) (см. фиг. 11A).
[000185] Уровни sMICA не выявлялись в сыворотках мышей, иммунизированных вакциной на основе MICAα3 (треугольник), тогда как у необработанных животных в контрольной группе, в течение двух недель после введения опухолевых клеток, обнаруживались повышенные уровни sMICA (круг). У животных в группе иммунизации болюсом наблюдались относительно низкие уровни sMICA в сыворотках (квадрат), в сравнении с животными из контрольной группы. (см. фиг. 11B). Увеличенное число метастаз в легких и повышенные уровни sMICA у мышей, иммунизированных болюсом MICAα3, в сравнении с вакцинированной группой, скорее всего, объясняются наблюдаемым снижением титра специфических антител против MICA на 62 день после первой вакцинации, в сравнении с вариантом вакцинированной группы (данные не показаны).
[000186] ПРИМЕР 9: ОПРЕДЕЛЕНИЕ ПОПУЛЯЦИЙ ЦИТОТОКСИЧЕСКИХ ЛИМФОЦИТОВ, КОТОРЫЕ НЕОБХОДИМЫ ДЛЯ ДОСТИЖЕНИЯ ЭФФЕКТИВНОСТИ ВАКЦИНЫ
[000187] При снижении моноклональными антителами уровня CD8 T-клеток или NK-клеток, было показано, что как CD8 T-клетки, так и NK-клетки вносят определенный вклад в терапевтическую эффективность вакцины (фиг. 13A-13B и 14A-14B).
[000188] ПРИМЕР 10: ИММУНОФЕРМЕНТНЫЙ АНАЛИЗ (ELISA), ПРИМЕНЯЕМЫЙ ДЛЯ КОЛИЧЕСТВЕННОЙ ОЦЕНКИ УРОВНЯ АНТИТЕЛ ПРОТИВ MIC
[000189] Использовали иммуноферментный анализ (ELISA) для определения количества антител против MIC, индуцированных вакциной (Figure 6).
[000190] ПРИМЕР 11: ПЛАНИРУЕМЫЕ БУДУЩИЕ ИССЛЕДОВАНИЯ
Ниже приведен перечень запланированных на будущее исследований, подготовленный с целью дальнейшей оценки характеристик этой вакцины.
1. Оптимизация вакцинных композиций на основе результатов определения оптимального количества антигена и сравнения двух адъювантов, CpG олигонуклеотида и поли (I:C).
2. Исследование эффективности вакцины с использованием множества моделей опухолей, в частности, модели на основе клеток меланомы B16-MIC (модели для исследования подкожного введения и для оценки уровня метастаз) и ортотопической модели TRAMP-MIC для исследования рака предстательной железы. Эти исследования включают определение эффективности вакцины путем оценки степени ингибирования роста опухоли и снижения количества подвергнутого шеддингу MIC в сыворотке.
3. Исследование, будет ли достаточна достигнутая при переносе сывороток от иммунизированных мышей к неиммунизированным реципиентам индукция MIC-специфических антител для защиты, осуществляемой данной вакциной.
4. Определение, будет ли вакцина обеспечивать защиту против вторичного заражения опухолевыми клетками, у которых отсутствует экспрессия MIC в результате индукции CD8 T-клеточного ответа против других антигенов. Мыши, которые выживут на модели метастаз B16-MIC, будут далее подвергнуты заражению путем в/в введения высокой дозы опухолевых клеток B16, которые экспрессируют или не экспрессируют MIC.
Проведение дополнительных исследований биомаркеров, которые отражают механистическую активность индуцированных антител. В эти исследования будут включены следующие подходы.
1. Проведение иммуноферментного анализа (ELISA) для определения сывороточного уровня, подвергнутого шеддингу MIC; этот вид исследования доступен и будет систематически проводиться с использованием образцов сыворотки от пациентов с развитой формой рака.
2. Исследование функциональной активности индуцированных антител против α3-домена MIC. Определение, в том числе, какие из клеточных линий опухоли человека оптимальны для тестов, которые позволяют оценить опосредованное антителами ингибирование шеддинга MIC (доступна панель клеточных линий).
3. Использование метода проточной цитометрии для анализа иммунных клеток в периферической крови и в образцах опухолевых биоптатов. Особенно важно оценить уровни NKG2D на поверхности клеток, при воздействии CD8 T-клеток и NK-клеток; для такого исследования доступны соответствующие антитела и указанная панель также будет оптимизирована.
[000191] ПРИМЕР 12: ЭКСПРЕССИЯ В КЛЕТКАХ BACULOVIRUS АЛЬФА3 MICA002, СЛИТОГО С ФЕРРИТИНОМ (H. PYLORI)
Цель исследования: экспрессия в клетках насекомых наночастиц альфа3MICA (002), слитого с ферритином
Общая схема исследования:
Сигнальный пептид, 6-his метка, линкер, N-концевой пептид из ГА, альфа3-домен domain (*002:01), GSG линкер, феритин из H. pylori, стоп-кодон
1 MVPCTLLLLL AAALAPTQTR AHHHHHHSKS YPYDVPDYAR сигнальный пептид, 6HIS, линке, ГА
41 TVPPMVNVTR SEASEGNITV TCRASGFYPW NITLSWRQDG альфа3 MICA
81 VSLSHDTQQW GDVLPDGNGT YQTWVATRIS QGEEQRFTCY
121 MEHSGNHSTH PVPSGKVLVL QSHWQTFHGS GDIIKLLNEQ линкер, ферритин
161 VNKEMQSSNL YMSMSSWCYT HSLDGAGLFL FDHAAEEYEH
201 AKKLIIFLNE NNVPVQLTSI SAPEHKFEGL TQIFQKAYEH
241 EQHISESINN IVDHAIKSKD HATFNFLQWY VAEQHEEEVL
281 FKDILDKIEL IGNENHGLYL ADQYVKGIAK SRKS* (SEQ ID NO: 5)
Стратегия: клонирование в векторе pacDB3 между сайтами SmaI и BamHI
Стратегия: клонирование в векторе pacDB3
Трансляция DNAMAN18(1-945)
Универсальный код
Общее количество аминокислот: 314, М.в.=35668
Макс. ОРС (ORF): 1-942, 314 аминокислот, М.в.=35668

SEQ DNAMAN: 945 пн;
Композиция 254 A; 252 C; 241 G; 198 T; 0 Другие
Процентный состав: 26,9% A; 26,7% C; 25,5% G; 21,0% T; 0,0% Другие
Молекулярный вес (кДа): оцДНК: 291,81; дцДНК: 582,6
Происхождение

Стадия 1. Амплификация матрицы для ПЦР 1 (сигнальный пептид, 6 his, линкер, ГА, альфа3 MICA) из конструкции C1347, полученной с использованием следующих праймеров
Прямой праймер# ferritin_baculo_SmaIfor
5' AAAAAACCCGGGATGGTCCCCTGTACCCTGCTGCTGCTGC 3' (SEQ ID NO: 9)
Внутренний обратный праймер: # ferritin baculo_IRev
5' GTTCGTTCAGCAGCTTAATGATATCGCCTGATCCATGAAATGTCTGCCAG 3'(SEQ ID NO: 10)
Стадия 2. Амплификация матрицы для ПЦР 2 (ферритин) из конструкции C1347, полученной с использованием следующих праймеров
Внутренний прямой праймер: #ферритин baculo_IF
5' CTGGCAGACATTTCATGGATCAGGCGATATCATTAAGCTGCTGAACGAAC 3'
(SEQ ID NO: 11)
Обратный праймер: #ферритин baculo_BamHIRev
5' AAAAAAGGATCCTCATGATTTCCTTGACTTTGCGATGCCCTTG 3' (SEQ ID NO: 12)
Стадия 3: ПЦР слияния с использованием следующих праймеров
#ферритин_baculo_SmaIfor и
#ферритин_ baculo_BamHIRev
Рестрикционный анализ DNAMAN18
Метилирование: dam-No dcm-No
Screened with 117 enzymes, 18 sites found
ApaI 1 GGGCC/C
63
BclI 2 T/GATCA
573 611
BglII 1 A/GATCT
695
BsiI 2 C/TCGTG
718 823
Bsp1407I 1 T/GTACA
509
BspHI 1 T/CATGA
940
BspMI 1 ACCTGCNNNN/ (SEQ ID NO: 13)
361
Eam1105I 1 GACNNN/NNGTC (SEQ ID NO: 14)
240
Eco56I 1 G/CCGGC
556
EcoNI 1 CCTNN/NNNAGG (SEQ ID NO: 15)
841
EcoRV 1 GAT/ATC
456
NaeI 1 GCC/GGC
558
NheI 1 G/CTAGC
157
PstI 2 CTGCA/G
422 803
PvuII 1 CAG/CTG
648
Список, указывающий порядок следования сайтов
Нерасщепляющие ферменты
Ферритин из H. Pylori
MLSKDIIKLLNEQVNKEMQSSNLYMSMSSWCYTHSLDGAGLFLFDHAAEEYEH AKKLIIF
LNENNVPVQLTSISAPEHKFEGLTQIFQKAYEHEQHISESINNIVDHAIKSKDHATF NFL
QWYVAEQHEEEVLFKDILDKIELIGNENHGLYLADQYVKGIAKSRKS 181 (SEQ ID NO: 16)
Положение N19 заменено на Q (для удаления сайта N-связанного гликозилирования), старт с положения 5 (подчеркнуто)
ферритин [Helicobacter pylori]
Стандартная последовательность от NCBI: WP_000949190.1
Графическая программа FASTA
Направление к:
Локус WP_000949190 167 аминокислота линейный BCT
16-мая-2013 г.
Определение: ферритин [Helicobacter pylori]
Доступ WP_000949190
Версия WP_000949190.1 GI:446871934
Ключевые слова RefSeq
Источник Helicobacter pylori
Организм Helicobacter pylori
Бактерии; Proteobacteria; Epsilonproteobacteria; Campylobacterales; Helicobacteraceae; Helicobacter.
Комментарий от REFSEQ: Эта запись относится к единичной, неповторяющейся последовательности, которая может быть определена на многих различных геномах от RefSeq, взятых из одного или разных видов.
Полнота представления: последовательность полной длины.
Особенность Расположение/Спецификаторы
источник 1..167
/организм= "Helicobacter pylori"
/db_xref="таксон:210"
Белок 1..167
/продукт= "ферритин"
/рассчитанный_мол_вес=19183
Участок 3..158
/участок_наименование= "Негемный_ферритин"
/примечание="ферритины с негемным железом; cd01055"
/db_xref="CDD:153113"
Участок 7..144
/участок_наименование ="ферритин"
/примечание="ферритин-подобный домен; pfam00210"
/db_xref="CDD:249681"
Сайт порядок (17,49..50,53,94,126,129..130)
/сайт_тип= "другой"
/примечание="центр ферроксидазы дижелеза [ион-связывающий]"
/db_xref="CDD:153113"
Происхождение
1 mlskdiikll neqvnkemns snlymsmssw cythsldgag lflfdhaaee yehakkliif
61 lnennvpvql tsisapehkf egltqifqka yeheqhises innivdhaik skdhatfnfl
121 qwyvaeqhee evlfkdildk ielignenhg lyladqyvkg iaksrks (SEQ ID NO: 17)
ПРИМЕР 11: ЭКСПРЕССИЯ ДЕГЛИКОЗИЛИРОВАННОГО БЕЛКА MICA 002 В КЛЕТКАХ НАСЕКОМЫХ
Цель: Экспрессия в системе Baculovirus дегликозилированного альфа3 MICA (*002:01)
Общая схема исследования:
Сигнальный пептид, N-концевой пептид НГА, альфа3-домен MICA (*002:01), стоп-кодон
1 MVPCTLLLLL AAALAPTQTR ASKSYPYDVP DYARTVPPMV QVTRSEASEG QITVTCRASG сигнальный пептид, ГА
61 FYPWNINLSW RQDGVSLSHD TQQWGDVLPD GNGTYQTWVA TRISQGEEQR FTCYMEHSGQ альфа3 MICA
121 HSTHPVPSGK VLVLQSHWQT FH* стоп (SEQ ID NO: 25)
Стратегия: клонирование в сайте расщепления pAcDB3 рестриктазами BglII-EcoRI
SEQ DNAMAN1: 432 нп;
Композиция 96 A; 125 C; 122 G; 89 T; 0 другие
Процентный состав: 22,2% A; 28,9% C; 28,2% G; 20,6% T; 0,0% другие
Молекулярный вес (кДа): оцДНК: 133,37 дцДНК: 266,4
Происхождение
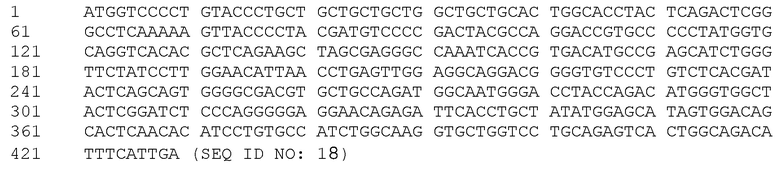
Трансляция DNAMAN1(1-432)
Универсальный код
Общее число аминокислот: 143, М.в.=15928
Макс. ОРС (ORF): 1-429, 143 аминокислот, М.в.=15928
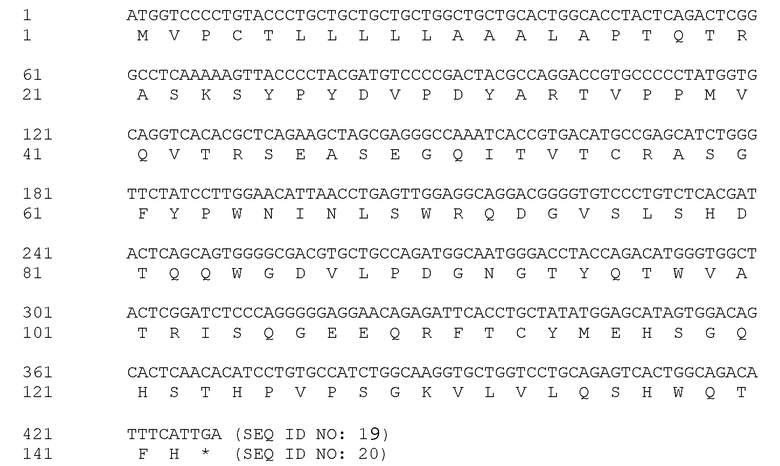
Рестрикционный анализ DNAMAN1
Метилирование: dam-No dcm-No
Скринирование выполнено с использованием 117 ферментов, обнаружено 5 сайтов
BspMI 2 ACCTGCNNNN/ (SEQ ID NO: 21)
343 111
Eam1105I 1 GACNNN/NNGTC (SEQ ID NO: 22)
222
NheI 1 G/CTAGC
139
PstI 1 CTGCA/G
404
Список, указывающий порядок следования сайтов

Нерасщепляющие ферменты
4099: MICA002_baculo_BglIIfor
5' AAAAAAAGATCTATGGTCCCCTGTACCCTGCTGCTGCTGC 3' (SEQ ID NO: 23)
4100: MICA002_baculo_EcoRIRev
5'AAAAAAGAATTCTCAATGAAATGTCTGCCAGTGACTCTGC 3' (SEQ ID NO: 24)
ДРУГИЕ ВАРИАНТЫ ОСУЩЕСТВЛЕНИЯ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Настоящее изобретение представлено выше в сочетании с его подробным описанием, однако приведенное выше описание следует рассматривать как поясняющее настоящее изобретение, но никоим образом не ограничивающее область и объем настоящего изобретения, которое определяется областью и объемом формулы изобретения. Другие аспекты, преимущества и возможные модификации также охватываются объемом приведенной ниже формулы изобретения.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Dana-Farber Cancer Institute, Inc.
<120> ВАКЦИНАЦИЯ С ИСПОЛЬЗОВАНИЕМ АЛЬФА 3 ДОМЕНА MICA/B ДЛЯ ЛЕЧЕНИЯ РАКА
<130> DFCI-126/001WO
<150> US 62/263,377
<151> 2015-12-04
<150> US 62/422,454
<151> 2016-11-15
<160> 30
<170> PatentIn version 3.5
<210> 1
<211> 360
<212> PRT
<213> Homo sapiens
<400> 1
His Ser Leu Arg Tyr Asn Leu Thr Val Leu Ser Trp Asp Gly Ser Val
1 5 10 15
Gln Ser Gly Phe Leu Ala Glu Val His Leu Asp Gly Gln Pro Phe Leu
20 25 30
Arg Tyr Asp Arg Gln Lys Cys Arg Ala Lys Pro Gln Gly Gln Trp Ala
35 40 45
Glu Asp Val Leu Gly Asn Lys Thr Trp Asp Arg Glu Thr Arg Asp Leu
50 55 60
Thr Gly Asn Gly Lys Asp Leu Arg Met Thr Leu Ala His Ile Lys Asp
65 70 75 80
Gln Lys Glu Gly Leu His Ser Leu Gln Glu Ile Arg Val Cys Glu Ile
85 90 95
His Glu Asp Asn Ser Thr Arg Ser Ser Gln His Phe Tyr Tyr Asp Gly
100 105 110
Glu Leu Phe Leu Ser Gln Asn Val Glu Thr Glu Glu Trp Thr Val Pro
115 120 125
Gln Ser Ser Arg Ala Gln Thr Leu Ala Met Asn Val Arg Asn Phe Leu
130 135 140
Lys Glu Asp Ala Met Lys Thr Lys Thr His Tyr His Ala Met His Ala
145 150 155 160
Asp Cys Leu Gln Glu Leu Arg Arg Tyr Leu Glu Ser Ser Val Val Leu
165 170 175
Arg Arg Thr Val Pro Pro Met Val Asn Val Thr Arg Ser Glu Ala Ser
180 185 190
Glu Gly Asn Ile Thr Val Thr Cys Arg Ala Ser Ser Phe Tyr Pro Arg
195 200 205
Asn Ile Thr Leu Thr Trp Arg Gln Asp Gly Val Ser Leu Ser His Asp
210 215 220
Thr Gln Gln Trp Gly Asp Val Leu Pro Asp Gly Asn Gly Thr Tyr Gln
225 230 235 240
Thr Trp Val Ala Thr Arg Ile Cys Gln Gly Glu Glu Gln Arg Phe Thr
245 250 255
Cys Tyr Met Glu His Ser Gly Asn His Ser Thr His Pro Val Pro Ser
260 265 270
Gly Lys Val Leu Val Leu Gln Ser His Trp Gln Thr Phe His Val Ser
275 280 285
Ala Val Ala Ala Ala Ala Ala Ala Ile Phe Val Ile Ile Ile Phe Tyr
290 295 300
Val Arg Cys Cys Lys Lys Lys Thr Ser Ala Ala Glu Gly Pro Glu Leu
305 310 315 320
Val Ser Leu Gln Val Leu Asp Gln His Pro Val Gly Thr Ser Asp His
325 330 335
Arg Asp Ala Thr Gln Leu Gly Phe Gln Pro Leu Met Ser Ala Leu Gly
340 345 350
Ser Thr Gly Ser Thr Glu Gly Ala
355 360
<210> 2
<211> 358
<212> PRT
<213> Homo sapiens
<400> 2
Pro His Ser Leu Arg Tyr Asn Leu Met Val Leu Ser Gln Asp Gly Ser
1 5 10 15
Val Gln Ser Gly Phe Leu Ala Glu Gly His Leu Asp Gly Gln Pro Phe
20 25 30
Leu Arg Tyr Asp Arg Gln Lys Arg Arg Ala Lys Pro Gln Gly Gln Trp
35 40 45
Ala Glu Asp Val Leu Gly Ala Lys Thr Trp Asp Thr Glu Thr Glu Asp
50 55 60
Leu Thr Glu Asn Gly Gln Asp Leu Arg Arg Thr Leu Thr His Ile Lys
65 70 75 80
Asp Gln Lys Gly Gly Leu His Ser Leu Gln Glu Ile Arg Val Cys Glu
85 90 95
Ile His Glu Asp Ser Ser Thr Arg Gly Ser Arg His Phe Tyr Tyr Asp
100 105 110
Gly Glu Leu Phe Leu Ser Gln Asn Leu Glu Thr Gln Glu Ser Thr Val
115 120 125
Pro Gln Ser Ser Arg Ala Gln Thr Leu Ala Met Asn Val Thr Asn Phe
130 135 140
Trp Lys Glu Asp Ala Met Lys Thr Lys Thr His Tyr Arg Ala Met Gln
145 150 155 160
Ala Asp Cys Leu Gln Lys Leu Gln Arg Tyr Leu Lys Ser Gly Val Ala
165 170 175
Ile Arg Arg Thr Val Pro Pro Met Val Asn Val Thr Cys Ser Glu Val
180 185 190
Ser Glu Gly Asn Ile Thr Val Thr Cys Arg Ala Ser Ser Phe Tyr Pro
195 200 205
Arg Asn Ile Thr Leu Thr Trp Arg Gln Asp Gly Val Ser Leu Ser His
210 215 220
Asn Thr Gln Gln Trp Gly Asp Val Leu Pro Asp Gly Gly Thr Tyr Gln
225 230 235 240
Thr Trp Val Ala Thr Arg Ile Arg Gln Gly Glu Glu Gln Arg Phe Thr
245 250 255
Cys Tyr Met Glu His Ser Gly Asn His Gly Thr His Pro Val Pro Ser
260 265 270
Gly Lys Ala Leu Val Leu Gln Ser Gln Arg Thr Asp Phe Pro Tyr Val
275 280 285
Ser Ala Ala Met Pro Cys Phe Val Ile Ile Ile Ile Leu Cys Val Pro
290 295 300
Cys Cys Lys Lys Lys Thr Ser Ala Ala Glu Gly Pro Glu Leu Val Ser
305 310 315 320
Leu Gln Val Leu Asp Gln His Pro Val Gly Thr Gly Asp His Arg Asp
325 330 335
Ala Ala Gln Leu Gly Phe Gln Pro Leu Met Ser Ala Thr Gly Ser Thr
340 345 350
Gly Ser Thr Glu Gly Ala
355
<210> 3
<211> 109
<212> PRT
<213> Искусственная последовательность
<220>
<223> Искусственный полипептид
<400> 3
Arg Thr Val Pro Pro Met Val Asn Val Thr Arg Ser Glu Ala Ser Glu
1 5 10 15
Gly Asn Ile Thr Val Thr Cys Arg Ala Ser Gly Phe Tyr Pro Trp Asn
20 25 30
Ile Thr Leu Ser Trp Arg Gln Asp Gly Val Ser Leu Ser His Asp Thr
35 40 45
Gln Gln Trp Gly Asp Val Leu Pro Asp Gly Asn Gly Thr Tyr Gln Thr
50 55 60
Trp Val Ala Thr Arg Ile Ser Gln Gly Glu Glu Gln Arg Phe Thr Cys
65 70 75 80
Tyr Met Glu His Ser Gly Asn His Ser Thr His Pro Val Pro Ser Gly
85 90 95
Lys Val Leu Val Leu Gln Ser His Trp Gln Thr Phe His
100 105
<210> 4
<211> 109
<212> PRT
<213> Искусственная последовательность
<220>
<223> Искусственный полипептид
<400> 4
Arg Thr Val Pro Pro Met Val Gln Val Thr Arg Ser Glu Ala Ser Glu
1 5 10 15
Gly Gln Ile Thr Val Thr Cys Arg Ala Ser Gly Phe Tyr Pro Trp Asn
20 25 30
Ile Asn Leu Ser Trp Arg Gln Asp Gly Val Ser Leu Ser His Asp Thr
35 40 45
Gln Gln Trp Gly Asp Val Leu Pro Asp Gly Asn Gly Thr Tyr Gln Thr
50 55 60
Trp Val Ala Thr Arg Ile Ser Gln Gly Glu Glu Gln Arg Phe Thr Cys
65 70 75 80
Tyr Met Glu His Ser Gly Gln His Ser Thr His Pro Val Pro Ser Gly
85 90 95
Lys Val Leu Val Leu Gln Ser His Trp Gln Thr Phe His
100 105
<210> 5
<211> 314
<212> PRT
<213> Искусственная последовательность
<220>
<223> Искусственный полипептид
<400> 5
Met Val Pro Cys Thr Leu Leu Leu Leu Leu Ala Ala Ala Leu Ala Pro
1 5 10 15
Thr Gln Thr Arg Ala His His His His His His Ser Lys Ser Tyr Pro
20 25 30
Tyr Asp Val Pro Asp Tyr Ala Arg Thr Val Pro Pro Met Val Asn Val
35 40 45
Thr Arg Ser Glu Ala Ser Glu Gly Asn Ile Thr Val Thr Cys Arg Ala
50 55 60
Ser Gly Phe Tyr Pro Trp Asn Ile Thr Leu Ser Trp Arg Gln Asp Gly
65 70 75 80
Val Ser Leu Ser His Asp Thr Gln Gln Trp Gly Asp Val Leu Pro Asp
85 90 95
Gly Asn Gly Thr Tyr Gln Thr Trp Val Ala Thr Arg Ile Ser Gln Gly
100 105 110
Glu Glu Gln Arg Phe Thr Cys Tyr Met Glu His Ser Gly Asn His Ser
115 120 125
Thr His Pro Val Pro Ser Gly Lys Val Leu Val Leu Gln Ser His Trp
130 135 140
Gln Thr Phe His Gly Ser Gly Asp Ile Ile Lys Leu Leu Asn Glu Gln
145 150 155 160
Val Asn Lys Glu Met Gln Ser Ser Asn Leu Tyr Met Ser Met Ser Ser
165 170 175
Trp Cys Tyr Thr His Ser Leu Asp Gly Ala Gly Leu Phe Leu Phe Asp
180 185 190
His Ala Ala Glu Glu Tyr Glu His Ala Lys Lys Leu Ile Ile Phe Leu
195 200 205
Asn Glu Asn Asn Val Pro Val Gln Leu Thr Ser Ile Ser Ala Pro Glu
210 215 220
His Lys Phe Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala Tyr Glu His
225 230 235 240
Glu Gln His Ile Ser Glu Ser Ile Asn Asn Ile Val Asp His Ala Ile
245 250 255
Lys Ser Lys Asp His Ala Thr Phe Asn Phe Leu Gln Trp Tyr Val Ala
260 265 270
Glu Gln His Glu Glu Glu Val Leu Phe Lys Asp Ile Leu Asp Lys Ile
275 280 285
Glu Leu Ile Gly Asn Glu Asn His Gly Leu Tyr Leu Ala Asp Gln Tyr
290 295 300
Val Lys Gly Ile Ala Lys Ser Arg Lys Ser
305 310
<210> 6
<211> 945
<212> DNA
<213> Искусственная последовательность
<220>
<223> Искусственный полинуклеотид
<400> 6
atggtcccct gtaccctgct gctgctgctg gctgctgcac tggcacctac tcagactcgg 60
gcccaccatc atcaccatca ctcaaaaagt tacccctacg atgtccccga ctacgccagg 120
accgtgcccc ctatggtgaa cgtcacacgc tcagaagcta gcgagggcaa tatcaccgtg 180
acatgccgag catctgggtt ctatccttgg aacattacac tgagttggag gcaggacggg 240
gtgtccctgt ctcacgatac tcagcagtgg ggcgacgtgc tgccagatgg caatgggacc 300
taccagacat gggtggctac tcggatctcc cagggggagg aacagagatt cacctgctat 360
atggagcata gtggaaacca ctcaacacat cctgtgccat ctggcaaggt gctggtcctg 420
cagagtcact ggcagacatt tcatggatca ggcgatatca ttaagctgct gaacgaacag 480
gtgaacaagg agatgcagtc tagtaacctg tacatgagca tgtcaagctg gtgttataca 540
cactccctgg acggagccgg cctgttcctg tttgatcacg ccgctgagga atacgaacat 600
gctaagaaac tgatcatttt cctgaatgag aacaatgtgc cagtccagct gactagcatt 660
tccgcacccg aacacaagtt cgagggcctg acccagatct ttcagaaagc ctacgaacac 720
gagcagcata tctctgaaag tatcaacaac atcgtggacc acgcaatcaa gagcaaagat 780
catgccacct tcaactttct gcagtggtac gtggccgagc agcacgagga agaggtcctg 840
tttaaggaca ttctggataa aatcgaactg attggcaatg agaatcacgg gctgtacctg 900
gcagatcagt atgtcaaggg catcgcaaag tcaaggaaat catga 945
<210> 7
<211> 314
<212> PRT
<213> Искусственная последовательность
<220>
<223> Искусственный полипептид
<400> 7
Met Val Pro Cys Thr Leu Leu Leu Leu Leu Ala Ala Ala Leu Ala Pro
1 5 10 15
Thr Gln Thr Arg Ala His His His His His His Ser Lys Ser Tyr Pro
20 25 30
Tyr Asp Val Pro Asp Tyr Ala Arg Thr Val Pro Pro Met Val Asn Val
35 40 45
Thr Arg Ser Glu Ala Ser Glu Gly Asn Ile Thr Val Thr Cys Arg Ala
50 55 60
Ser Gly Phe Tyr Pro Trp Asn Ile Thr Leu Ser Trp Arg Gln Asp Gly
65 70 75 80
Val Ser Leu Ser His Asp Thr Gln Gln Trp Gly Asp Val Leu Pro Asp
85 90 95
Gly Asn Gly Thr Tyr Gln Thr Trp Val Ala Thr Arg Ile Ser Gln Gly
100 105 110
Glu Glu Gln Arg Phe Thr Cys Tyr Met Glu His Ser Gly Asn His Ser
115 120 125
Thr His Pro Val Pro Ser Gly Lys Val Leu Val Leu Gln Ser His Trp
130 135 140
Gln Thr Phe His Gly Ser Gly Asp Ile Ile Lys Leu Leu Asn Glu Gln
145 150 155 160
Val Asn Lys Glu Met Gln Ser Ser Asn Leu Tyr Met Ser Met Ser Ser
165 170 175
Trp Cys Tyr Thr His Ser Leu Asp Gly Ala Gly Leu Phe Leu Phe Asp
180 185 190
His Ala Ala Glu Glu Tyr Glu His Ala Lys Lys Leu Ile Ile Phe Leu
195 200 205
Asn Glu Asn Asn Val Pro Val Gln Leu Thr Ser Ile Ser Ala Pro Glu
210 215 220
His Lys Phe Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala Tyr Glu His
225 230 235 240
Glu Gln His Ile Ser Glu Ser Ile Asn Asn Ile Val Asp His Ala Ile
245 250 255
Lys Ser Lys Asp His Ala Thr Phe Asn Phe Leu Gln Trp Tyr Val Ala
260 265 270
Glu Gln His Glu Glu Glu Val Leu Phe Lys Asp Ile Leu Asp Lys Ile
275 280 285
Glu Leu Ile Gly Asn Glu Asn His Gly Leu Tyr Leu Ala Asp Gln Tyr
290 295 300
Val Lys Gly Ile Ala Lys Ser Arg Lys Ser
305 310
<210> 8
<211> 945
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственный полинуклеотид
<400> 8
atggtcccct gtaccctgct gctgctgctg gctgctgcac tggcacctac tcagactcgg 60
gcccaccatc atcaccatca ctcaaaaagt tacccctacg atgtccccga ctacgccagg 120
accgtgcccc ctatggtgaa cgtcacacgc tcagaagcta gcgagggcaa tatcaccgtg 180
acatgccgag catctgggtt ctatccttgg aacattacac tgagttggag gcaggacggg 240
gtgtccctgt ctcacgatac tcagcagtgg ggcgacgtgc tgccagatgg caatgggacc 300
taccagacat gggtggctac tcggatctcc cagggggagg aacagagatt cacctgctat 360
atggagcata gtggaaacca ctcaacacat cctgtgccat ctggcaaggt gctggtcctg 420
cagagtcact ggcagacatt tcatggatca ggcgatatca ttaagctgct gaacgaacag 480
gtgaacaagg agatgcagtc tagtaacctg tacatgagca tgtcaagctg gtgttataca 540
cactccctgg acggagccgg cctgttcctg tttgatcacg ccgctgagga atacgaacat 600
gctaagaaac tgatcatttt cctgaatgag aacaatgtgc cagtccagct gactagcatt 660
tccgcacccg aacacaagtt cgagggcctg acccagatct ttcagaaagc ctacgaacac 720
gagcagcata tctctgaaag tatcaacaac atcgtggacc acgcaatcaa gagcaaagat 780
catgccacct tcaactttct gcagtggtac gtggccgagc agcacgagga agaggtcctg 840
tttaaggaca ttctggataa aatcgaactg attggcaatg agaatcacgg gctgtacctg 900
gcagatcagt atgtcaaggg catcgcaaag tcaaggaaat catga 945
<210> 9
<211> 40
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственный полинуклеотид
<400> 9
aaaaaacccg ggatggtccc ctgtaccctg ctgctgctgc 40
<210> 10
<211> 50
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственный полинуклеотид
<400> 10
gttcgttcag cagcttaatg atatcgcctg atccatgaaa tgtctgccag 50
<210> 11
<211> 50
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственный полинуклеотид
<400> 11
ctggcagaca tttcatggat caggcgatat cattaagctg ctgaacgaac 50
<210> 12
<211> 43
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственный полинуклеотид
<400> 12
aaaaaaggat cctcatgatt tccttgactt tgcgatgccc ttg 43
<210> 13
<211> 10
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственный полинуклеотид
<220>
<221> другие свойства
<222> (7)..(10)
<223> n is a, c, g, or t
<400> 13
acctgcnnnn 10
<210> 14
<211> 11
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственный полинуклеотид
<220>
<221> другие свойства
<222> (4)..(8)
<223> n is a, c, g, or t
<400> 14
gacnnnnngt c 11
<210> 15
<211> 11
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственный полинуклеотид
<220>
<221> другие свойства
<222> (4)..(8)
<223> n is a, c, g, or t
<400> 15
cctnnnnnag g 11
<210> 16
<211> 167
<212> PRT
<213> Helicobacter pylori
<400> 16
Met Leu Ser Lys Asp Ile Ile Lys Leu Leu Asn Glu Gln Val Asn Lys
1 5 10 15
Glu Met Gln Ser Ser Asn Leu Tyr Met Ser Met Ser Ser Trp Cys Tyr
20 25 30
Thr His Ser Leu Asp Gly Ala Gly Leu Phe Leu Phe Asp His Ala Ala
35 40 45
Glu Glu Tyr Glu His Ala Lys Lys Leu Ile Ile Phe Leu Asn Glu Asn
50 55 60
Asn Val Pro Val Gln Leu Thr Ser Ile Ser Ala Pro Glu His Lys Phe
65 70 75 80
Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala Tyr Glu His Glu Gln His
85 90 95
Ile Ser Glu Ser Ile Asn Asn Ile Val Asp His Ala Ile Lys Ser Lys
100 105 110
Asp His Ala Thr Phe Asn Phe Leu Gln Trp Tyr Val Ala Glu Gln His
115 120 125
Glu Glu Glu Val Leu Phe Lys Asp Ile Leu Asp Lys Ile Glu Leu Ile
130 135 140
Gly Asn Glu Asn His Gly Leu Tyr Leu Ala Asp Gln Tyr Val Lys Gly
145 150 155 160
Ile Ala Lys Ser Arg Lys Ser
165
<210> 17
<211> 167
<212> PRT
<213> Helicobacter pylori
<400> 17
Met Leu Ser Lys Asp Ile Ile Lys Leu Leu Asn Glu Gln Val Asn Lys
1 5 10 15
Glu Met Asn Ser Ser Asn Leu Tyr Met Ser Met Ser Ser Trp Cys Tyr
20 25 30
Thr His Ser Leu Asp Gly Ala Gly Leu Phe Leu Phe Asp His Ala Ala
35 40 45
Glu Glu Tyr Glu His Ala Lys Lys Leu Ile Ile Phe Leu Asn Glu Asn
50 55 60
Asn Val Pro Val Gln Leu Thr Ser Ile Ser Ala Pro Glu His Lys Phe
65 70 75 80
Glu Gly Leu Thr Gln Ile Phe Gln Lys Ala Tyr Glu His Glu Gln His
85 90 95
Ile Ser Glu Ser Ile Asn Asn Ile Val Asp His Ala Ile Lys Ser Lys
100 105 110
Asp His Ala Thr Phe Asn Phe Leu Gln Trp Tyr Val Ala Glu Gln His
115 120 125
Glu Glu Glu Val Leu Phe Lys Asp Ile Leu Asp Lys Ile Glu Leu Ile
130 135 140
Gly Asn Glu Asn His Gly Leu Tyr Leu Ala Asp Gln Tyr Val Lys Gly
145 150 155 160
Ile Ala Lys Ser Arg Lys Ser
165
<210> 18
<211> 429
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственный полинуклеотид
<400> 18
atggtcccct gtaccctgct gctgctgctg gctgctgcac tggcacctac tcagactcgg 60
gcctcaaaaa gttaccccta cgatgtcccc gactacgcca ggaccgtgcc ccctatggtg 120
caggtcacac gctcagaagc tagcgagggc caaatcaccg tgacatgccg agcatctggg 180
ttctatcctt ggaacattaa cctgagttgg aggcaggacg gggtgtccct gtctcacgat 240
actcagcagt ggggcgacgt gctgccagat ggcaatggga cctaccagac atgggtggct 300
actcggatct cccaggggga ggaacagaga ttcacctgct atatggagca tagtggacag 360
cactcaacac atcctgtgcc atctggcaag gtgctggtcc tgcagagtca ctggcagaca 420
tttcattga 429
<210> 19
<211> 429
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственный полинуклеотид
<400> 19
atggtcccct gtaccctgct gctgctgctg gctgctgcac tggcacctac tcagactcgg 60
gcctcaaaaa gttaccccta cgatgtcccc gactacgcca ggaccgtgcc ccctatggtg 120
caggtcacac gctcagaagc tagcgagggc caaatcaccg tgacatgccg agcatctggg 180
ttctatcctt ggaacattaa cctgagttgg aggcaggacg gggtgtccct gtctcacgat 240
actcagcagt ggggcgacgt gctgccagat ggcaatggga cctaccagac atgggtggct 300
actcggatct cccaggggga ggaacagaga ttcacctgct atatggagca tagtggacag 360
cactcaacac atcctgtgcc atctggcaag gtgctggtcc tgcagagtca ctggcagaca 420
tttcattga 429
<210> 20
<211> 142
<212> PRT
<213> Искусственная последовательность
<220>
<223> Искусственный полипептид
<400> 20
Met Val Pro Cys Thr Leu Leu Leu Leu Leu Ala Ala Ala Leu Ala Pro
1 5 10 15
Thr Gln Thr Arg Ala Ser Lys Ser Tyr Pro Tyr Asp Val Pro Asp Tyr
20 25 30
Ala Arg Thr Val Pro Pro Met Val Gln Val Thr Arg Ser Glu Ala Ser
35 40 45
Glu Gly Gln Ile Thr Val Thr Cys Arg Ala Ser Gly Phe Tyr Pro Trp
50 55 60
Asn Ile Asn Leu Ser Trp Arg Gln Asp Gly Val Ser Leu Ser His Asp
65 70 75 80
Thr Gln Gln Trp Gly Asp Val Leu Pro Asp Gly Asn Gly Thr Tyr Gln
85 90 95
Thr Trp Val Ala Thr Arg Ile Ser Gln Gly Glu Glu Gln Arg Phe Thr
100 105 110
Cys Tyr Met Glu His Ser Gly Gln His Ser Thr His Pro Val Pro Ser
115 120 125
Gly Lys Val Leu Val Leu Gln Ser His Trp Gln Thr Phe His
130 135 140
<210> 21
<211> 10
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственный полинуклеотид
<220>
<221> другие_свойства
<222> (7)..(10)
<223> n is a, c, g, or t
<400> 21
acctgcnnnn 10
<210> 22
<211> 11
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственный полинуклеотид
<220>
<221> другие_свойства
<222> (4)..(8)
<223> n is a, c, g, or t
<400> 22
gacnnnnngt c 11
<210> 23
<211> 40
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственный полинуклеотид
<400> 23
aaaaaaagat ctatggtccc ctgtaccctg ctgctgctgc 40
<210> 24
<211> 40
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственный полинуклеотид
<400> 24
aaaaaagaat tctcaatgaa atgtctgcca gtgactctgc 40
<210> 25
<211> 142
<212> PRT
<213> Искусственная последовательность
<220>
<223> Искусственный полипептид
<400> 25
Met Val Pro Cys Thr Leu Leu Leu Leu Leu Ala Ala Ala Leu Ala Pro
1 5 10 15
Thr Gln Thr Arg Ala Ser Lys Ser Tyr Pro Tyr Asp Val Pro Asp Tyr
20 25 30
Ala Arg Thr Val Pro Pro Met Val Gln Val Thr Arg Ser Glu Ala Ser
35 40 45
Glu Gly Gln Ile Thr Val Thr Cys Arg Ala Ser Gly Phe Tyr Pro Trp
50 55 60
Asn Ile Asn Leu Ser Trp Arg Gln Asp Gly Val Ser Leu Ser His Asp
65 70 75 80
Thr Gln Gln Trp Gly Asp Val Leu Pro Asp Gly Asn Gly Thr Tyr Gln
85 90 95
Thr Trp Val Ala Thr Arg Ile Ser Gln Gly Glu Glu Gln Arg Phe Thr
100 105 110
Cys Tyr Met Glu His Ser Gly Gln His Ser Thr His Pro Val Pro Ser
115 120 125
Gly Lys Val Leu Val Leu Gln Ser His Trp Gln Thr Phe His
130 135 140
<210> 26
<211> 128
<212> PRT
<213> Искусственная последовательность
<220>
<223> Искусственный полипептид
<400> 26
Met Ala Pro Ala Arg Ser Pro Ser Pro Ser Thr Gln Pro Trp Glu His
1 5 10 15
Val Asn Ala Ile Gln Glu Ala Arg Arg Leu Leu Asn Leu Ser Arg Asp
20 25 30
Thr Ala Ala Glu Met Asn Glu Thr Val Glu Val Ile Ser Glu Met Phe
35 40 45
Asp Leu Gln Glu Pro Thr Cys Leu Gln Thr Arg Leu Glu Leu Tyr Lys
50 55 60
Gln Gly Leu Arg Gly Ser Leu Thr Lys Leu Lys Gly Pro Leu Thr Met
65 70 75 80
Met Ala Ser His Tyr Lys Gln His Cys Pro Pro Thr Pro Glu Thr Ser
85 90 95
Cys Ala Thr Gln Ile Ile Thr Phe Glu Ser Phe Lys Glu Asn Leu Lys
100 105 110
Asp Phe Leu Leu Val Ile Pro Phe Asp Cys Trp Glu Pro Val Gln Glu
115 120 125
<210> 27
<211> 125
<212> PRT
<213> Искусственная последовательность
<220>
<223> Искусственный полипептид
<400> 27
Met Ala Pro Thr Arg Ser Pro Ile Thr Val Thr Arg Pro Trp Lys His
1 5 10 15
Val Glu Ala Ile Lys Glu Ala Leu Asn Leu Leu Asp Asp Met Pro Val
20 25 30
Thr Leu Asn Glu Glu Val Glu Val Val Ser Asn Glu Phe Ser Phe Lys
35 40 45
Lys Leu Thr Cys Val Gln Thr Arg Leu Lys Ile Phe Glu Gln Gly Leu
50 55 60
Arg Gly Asn Phe Thr Lys Leu Lys Gly Ala Leu Asn Met Thr Ala Ser
65 70 75 80
Tyr Tyr Gln Thr Tyr Cys Pro Pro Thr Pro Glu Thr Asp Cys Glu Thr
85 90 95
Gln Val Thr Thr Tyr Ala Asp Phe Ile Asp Ser Leu Lys Thr Phe Leu
100 105 110
Thr Asp Ile Pro Phe Glu Cys Lys Lys Pro Val Gln Lys
115 120 125
<210> 28
<211> 781
<212> ДНК
<213> Homo sapiens
<400> 28
acacagagag aaaggctaaa gttctctgga ggatgtggct gcagagcctg ctgctcttgg 60
gcactgtggc ctgcagcatc tctgcacccg cccgctcgcc cagccccagc acgcagccct 120
gggagcatgt gaatgccatc caggaggccc ggcgtctcct gaacctgagt agagacactg 180
ctgctgagat gaatgaaaca gtagaagtca tctcagaaat gtttgacctc caggagccga 240
cctgcctaca gacccgcctg gagctgtaca agcagggcct gcggggcagc ctcaccaagc 300
tcaagggccc cttgaccatg atggccagcc actacaagca gcactgccct ccaaccccgg 360
aaacttcctg tgcaacccag attatcacct ttgaaagttt caaagagaac ctgaaggact 420
ttctgcttgt catccccttt gactgctggg agccagtcca ggagtgagac cggccagatg 480
aggctggcca agccggggag ctgctctctc atgaaacaag agctagaaac tcaggatggt 540
catcttggag ggaccaaggg gtgggccaca gccatggtgg gagtggcctg gacctgccct 600
gggccacact gaccctgata caggcatggc agaagaatgg gaatatttta tactgacaga 660
aatcagtaat atttatatat ttatattttt aaaatattta tttatttatt tatttaagtt 720
catattccat atttattcaa gatgttttac cgtaataatt attattaaaa atatgcttct 780
a 781
<210> 29
<211> 144
<212> PRT
<213> Homo sapiens
<400> 29
Met Trp Leu Gln Ser Leu Leu Leu Leu Gly Thr Val Ala Cys Ser Ile
1 5 10 15
Ser Ala Pro Ala Arg Ser Pro Ser Pro Ser Thr Gln Pro Trp Glu His
20 25 30
Val Asn Ala Ile Gln Glu Ala Arg Arg Leu Leu Asn Leu Ser Arg Asp
35 40 45
Thr Ala Ala Glu Met Asn Glu Thr Val Glu Val Ile Ser Glu Met Phe
50 55 60
Asp Leu Gln Glu Pro Thr Cys Leu Gln Thr Arg Leu Glu Leu Tyr Lys
65 70 75 80
Gln Gly Leu Arg Gly Ser Leu Thr Lys Leu Lys Gly Pro Leu Thr Met
85 90 95
Met Ala Ser His Tyr Lys Gln His Cys Pro Pro Thr Pro Glu Thr Ser
100 105 110
Cys Ala Thr Gln Ile Ile Thr Phe Glu Ser Phe Lys Glu Asn Leu Lys
115 120 125
Asp Phe Leu Leu Val Ile Pro Phe Asp Cys Trp Glu Pro Val Gln Glu
130 135 140
<210> 30
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Искусственный полинуклеотид
<400> 30
tccatgacgt tcctgacgtt 20
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИГЕННЫЕ ПОЛИПЕПТИДЫ НА ОСНОВЕ ПОСЛЕДОВАТЕЛЬНОСТИ РЕСПИРАТОРНО-СИНЦИТИАЛЬНОГО ВИРУСА | 2019 |
|
RU2807992C2 |
| АНТИГЕННЫЕ ПОЛИПЕПТИДЫ НА ОСНОВЕ ПОСЛЕДОВАТЕЛЬНОСТИ OspA | 2019 |
|
RU2816208C2 |
| БИОЛОГИЧЕСКИЕ МАТЕРИАЛЫ ДЛЯ МОДУЛЯЦИИ ИММУННЫХ ОТВЕТОВ | 2017 |
|
RU2770060C2 |
| КОМПОЗИЦИЯ ДЛЯ ИММУНОСТИМУЛЯЦИИ И ЕЕ ПРИМЕНЕНИЕ | 2020 |
|
RU2815763C1 |
| МОДИФИЦИРОВАННЫЕ НЕПРИРОДНЫЕ ЛИГАНДЫ NKG2D, КОТОРЫЕ ИЗБИРАТЕЛЬНО ДОСТАВЛЯЮТ ПРИСОЕДИНЕННЫЕ ГЕТЕРОЛОГИЧНЫЕ МОЛЕКУЛЫ К НЕПРИРОДНЫМ РЕЦЕПТОРАМ NKG2D НА CAR-КЛЕТКАХ | 2020 |
|
RU2823728C2 |
| БЕЛОК И ВАКЦИНА ПРОТИВ ИНФЕКЦИИ SARS-CoV-2 | 2020 |
|
RU2815060C1 |
| УСОВЕРШЕНСТВОВАННАЯ КОРОНАВИРУСНАЯ ВАКЦИНА | 2022 |
|
RU2816182C2 |
| СУБЪЕДИНИЧНАЯ ВАКЦИНА ДЛЯ ЛЕЧЕНИЯ ИЛИ ПРЕДОТВРАЩЕНИЯ ИНФЕКЦИИ ДЫХАТЕЛЬНЫХ ПУТЕЙ | 2020 |
|
RU2811991C2 |
| ВАКЦИНЫ НА ОСНОВЕ ИНФОРМАЦИОННОЙ РНК ПРОТИВ ШИРОКОГО СПЕКТРА ВАРИАНТОВ КОРОНАВИРУСА | 2022 |
|
RU2826172C2 |
| ТЕРАПЕВТИЧЕСКАЯ ПРОТИВОРАКОВАЯ НЕОЭПИТОПНАЯ ВАКЦИНА | 2017 |
|
RU2782422C2 |
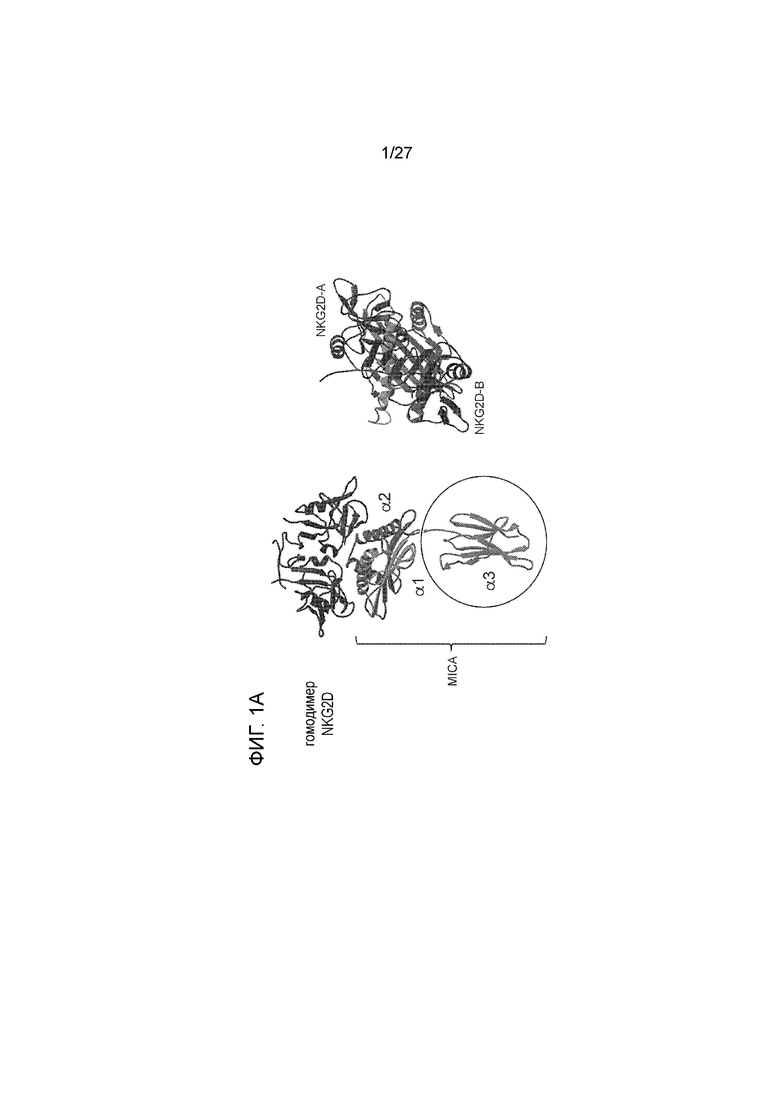
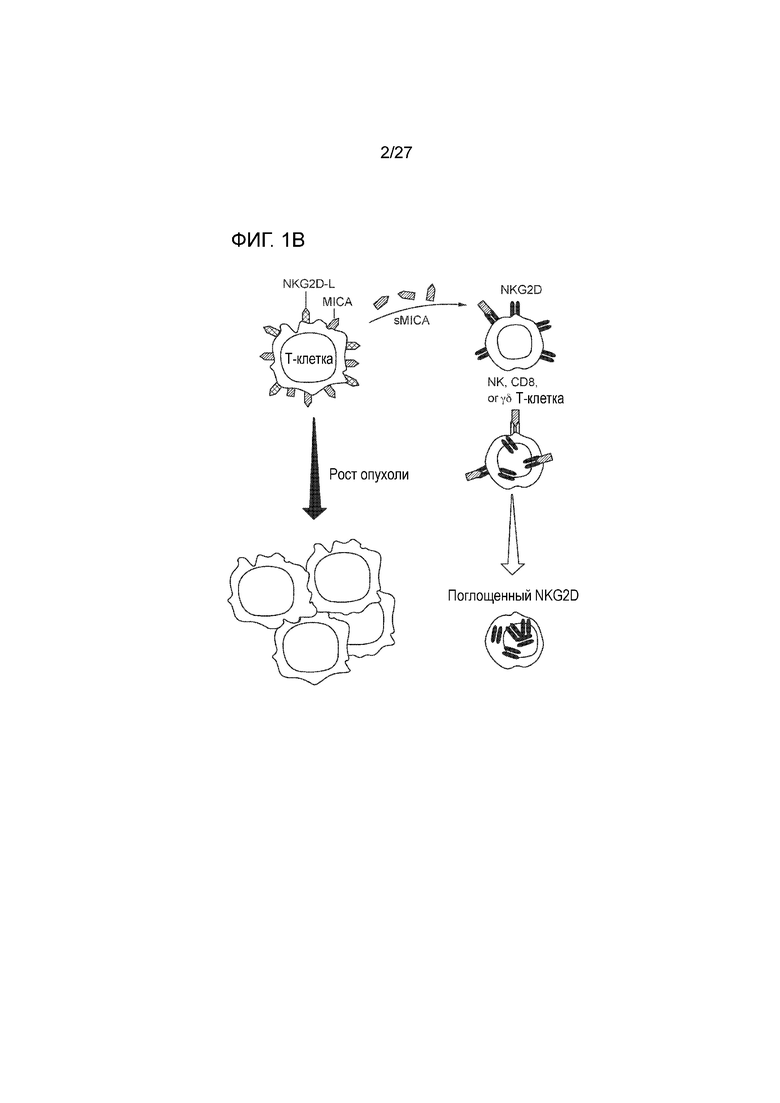
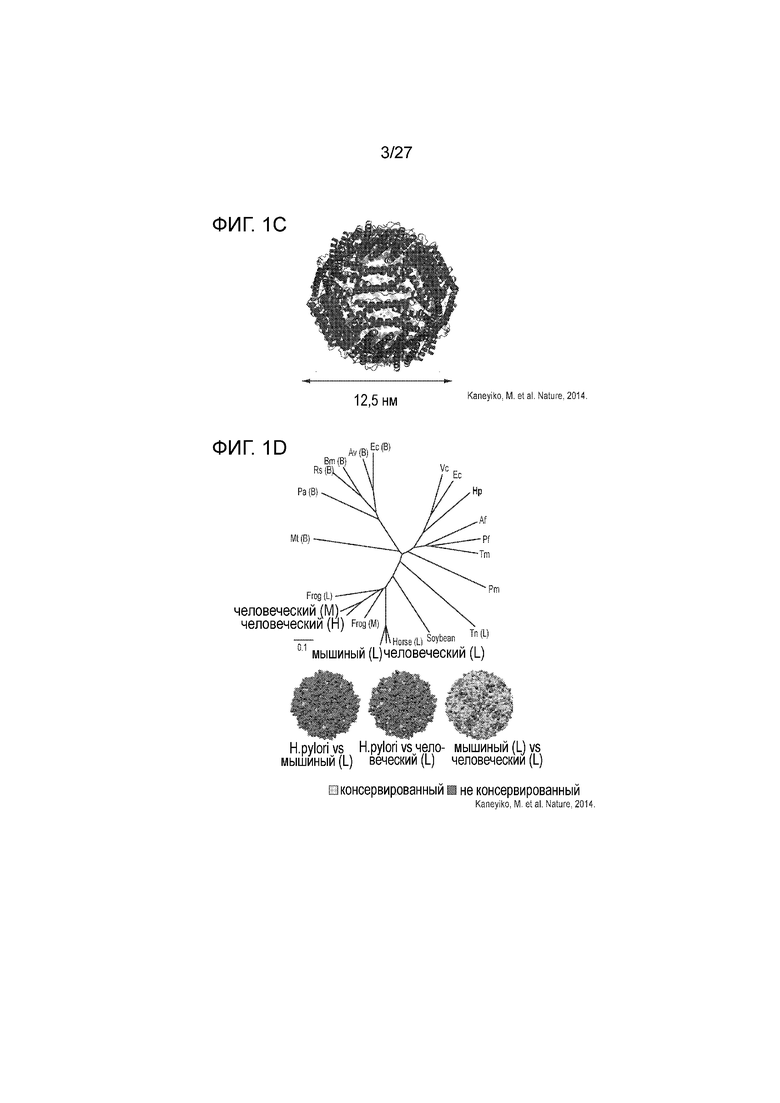
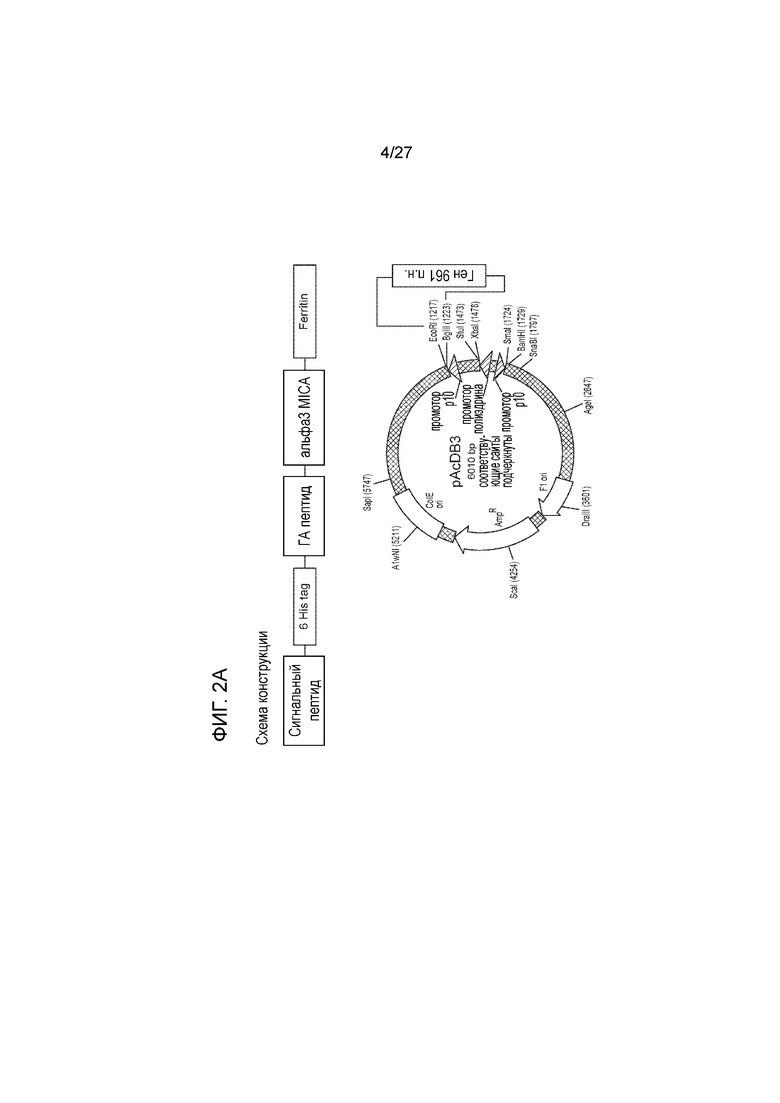
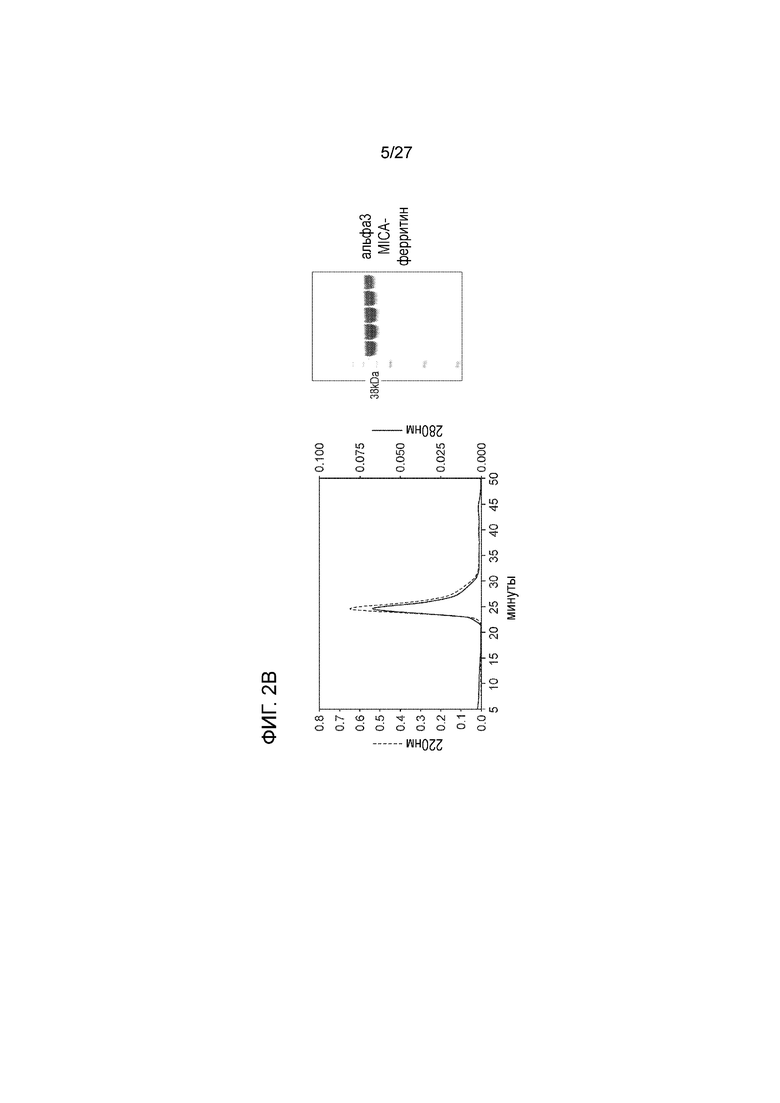
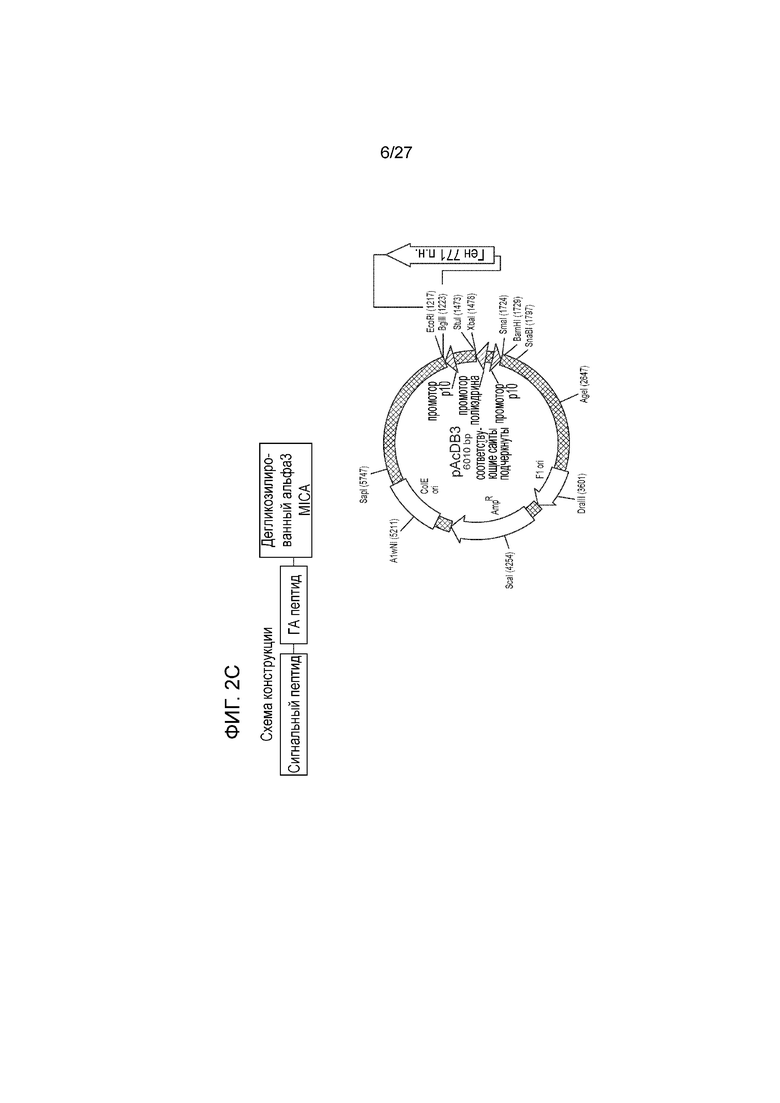
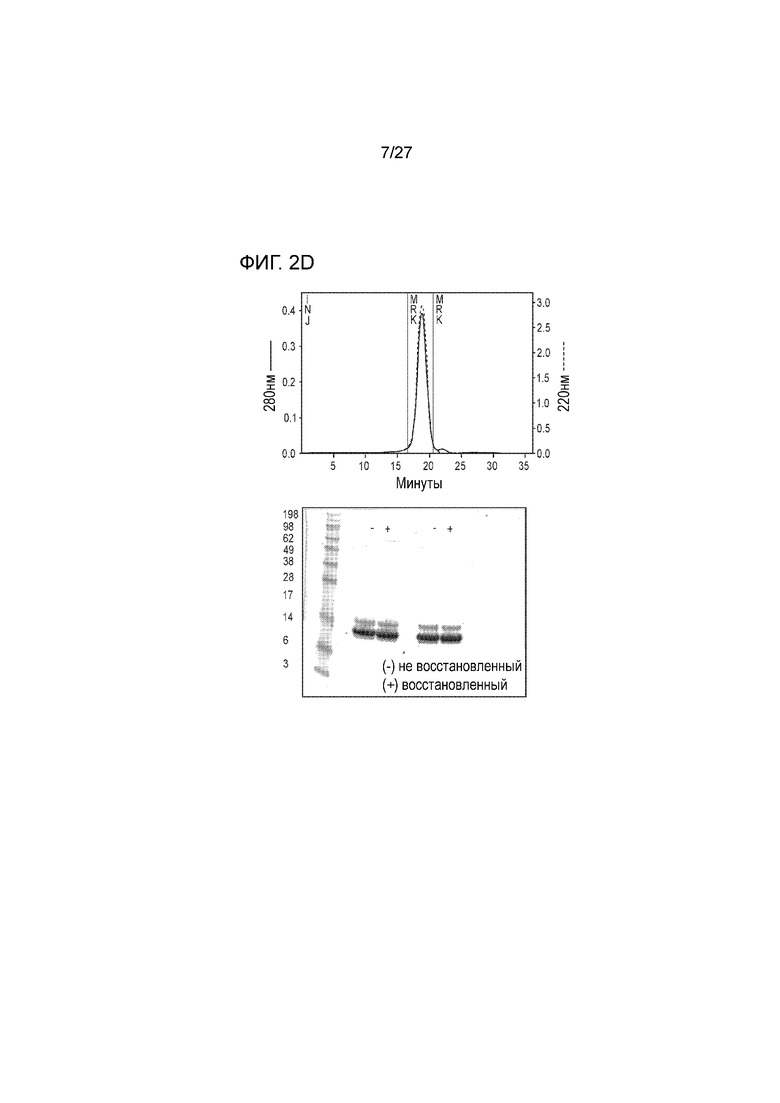

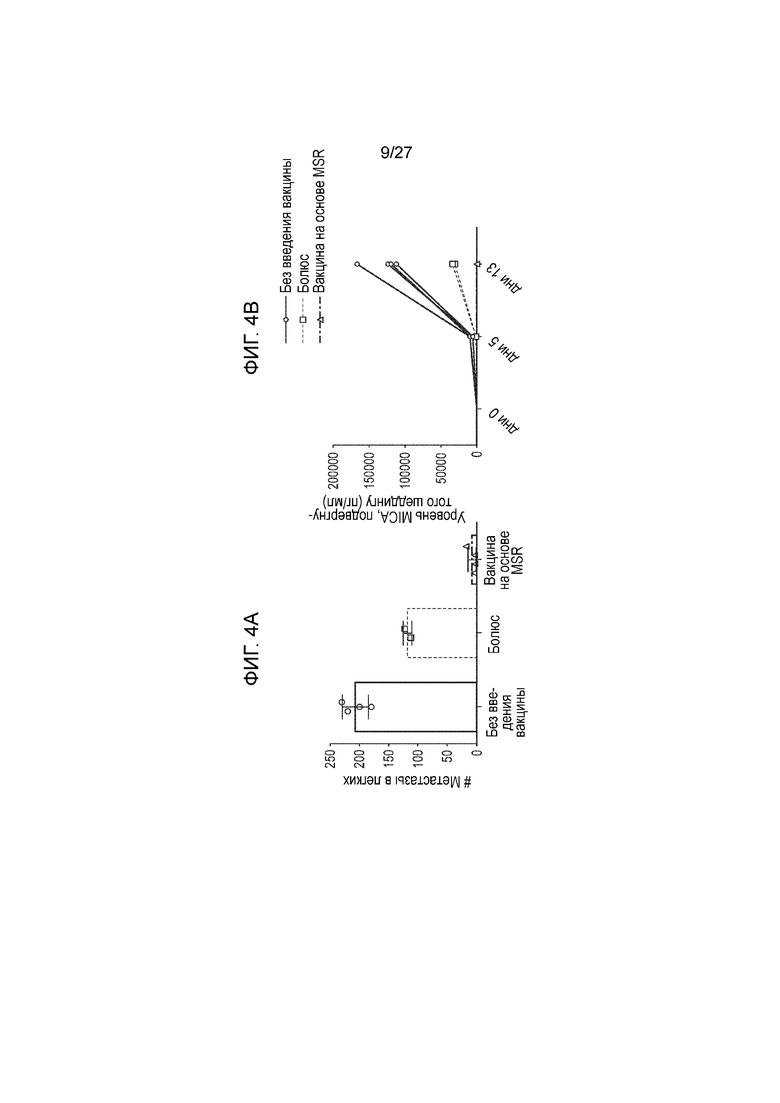
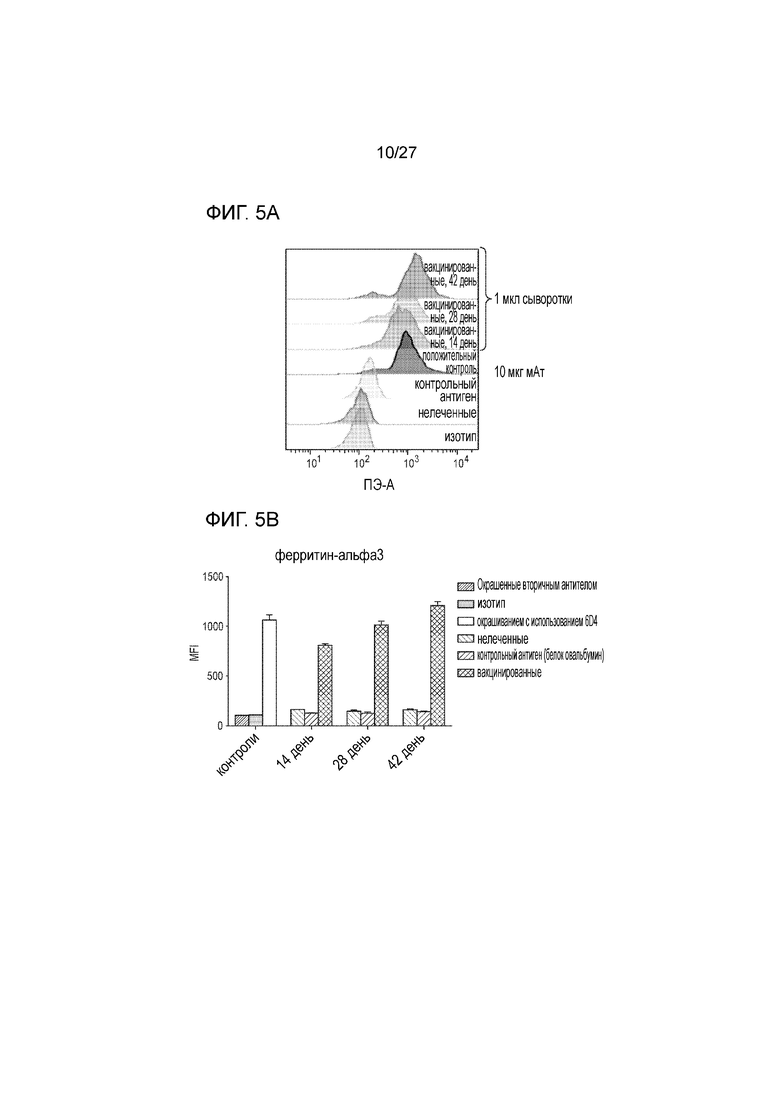

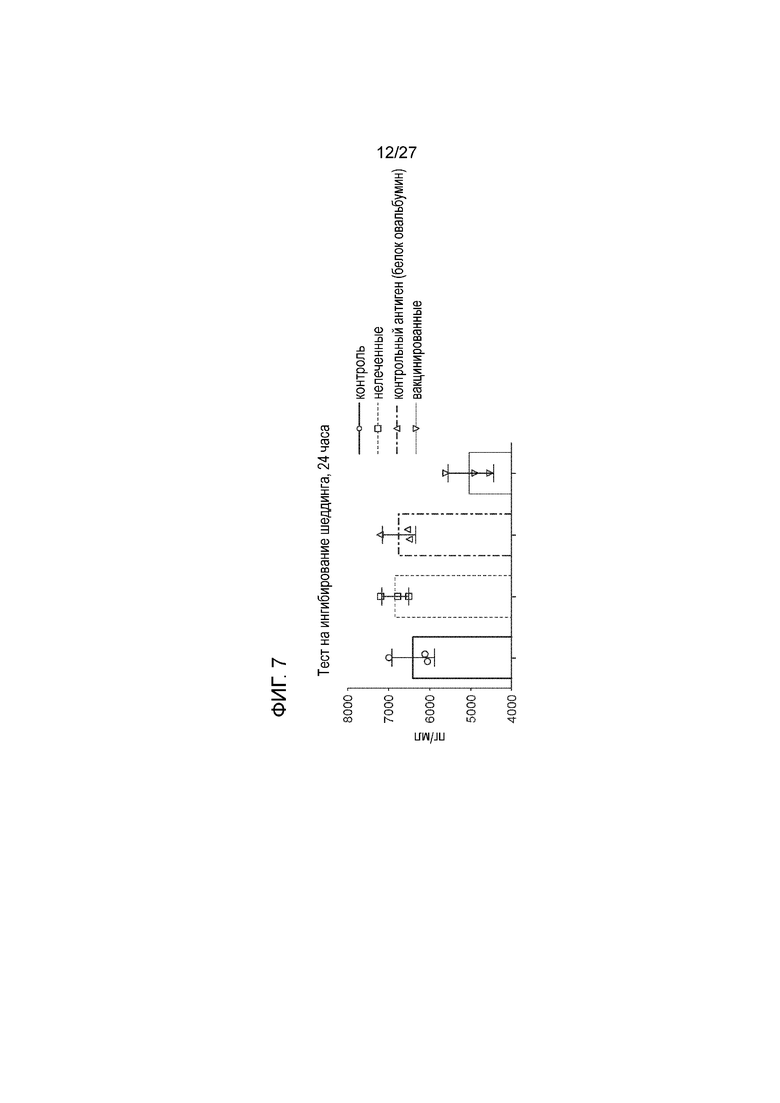
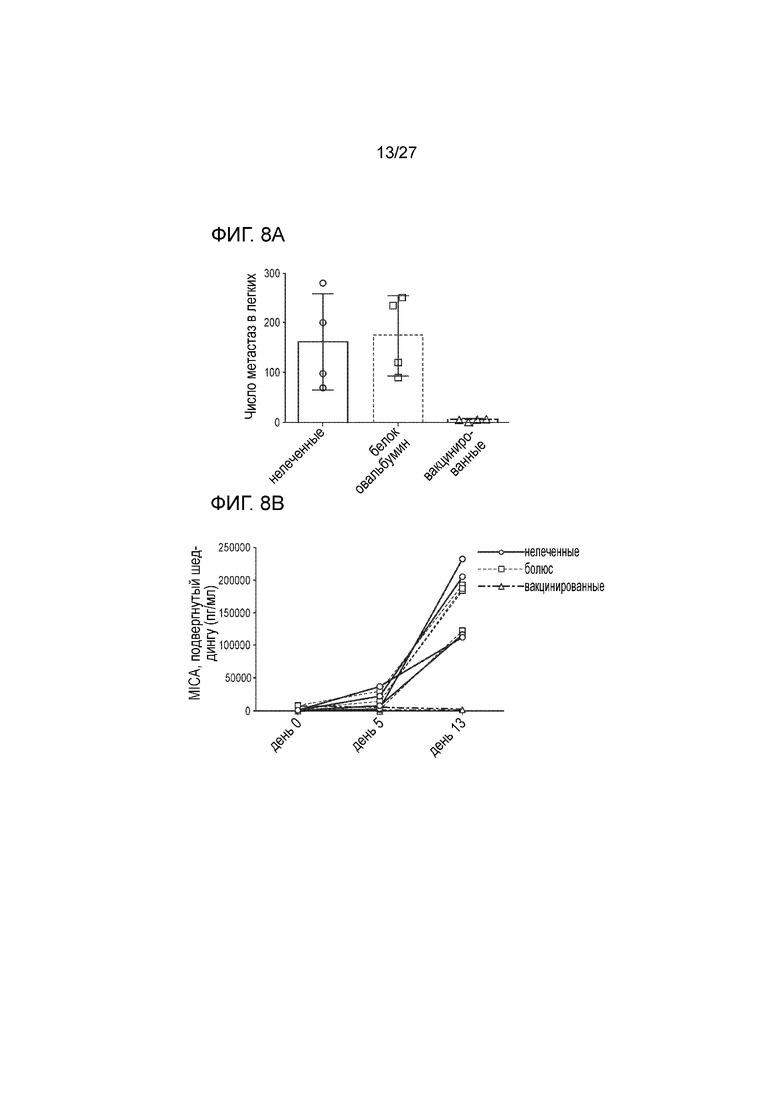
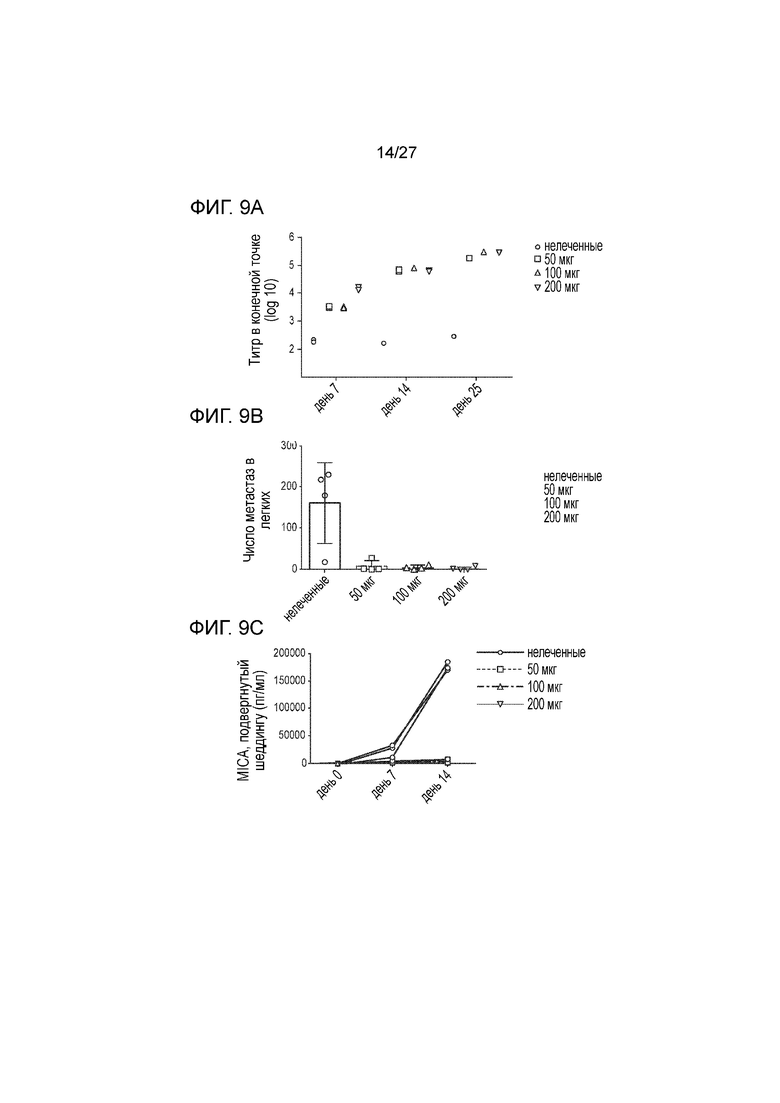


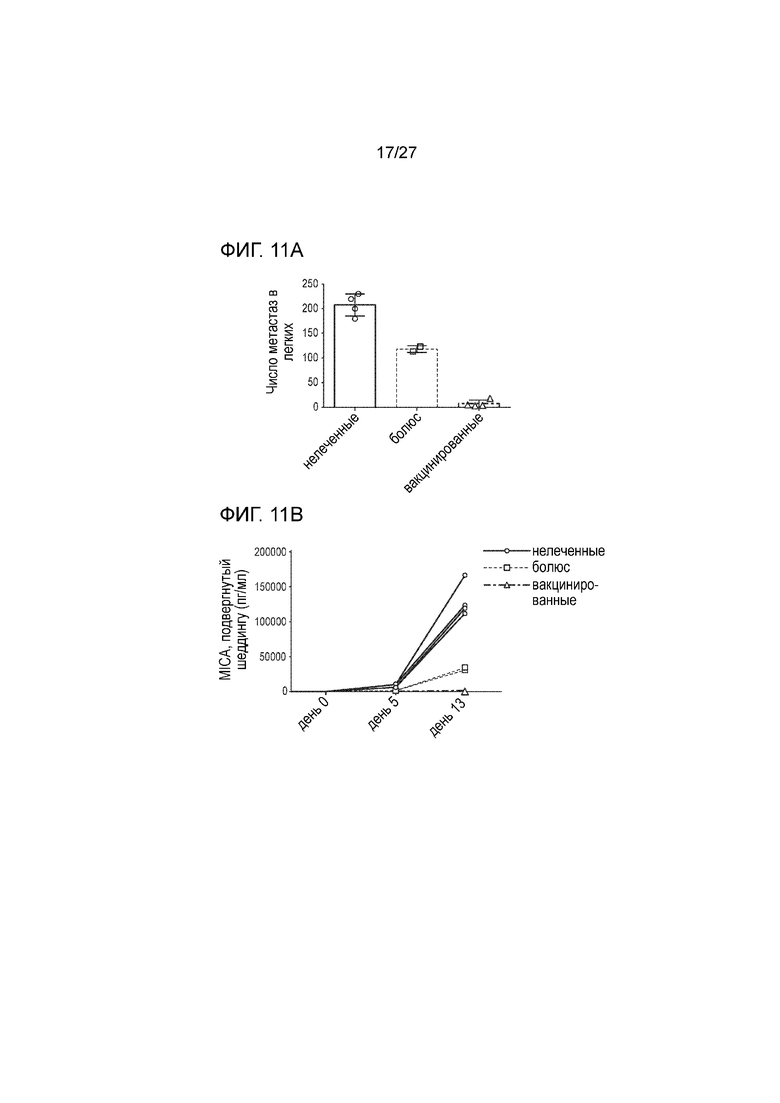
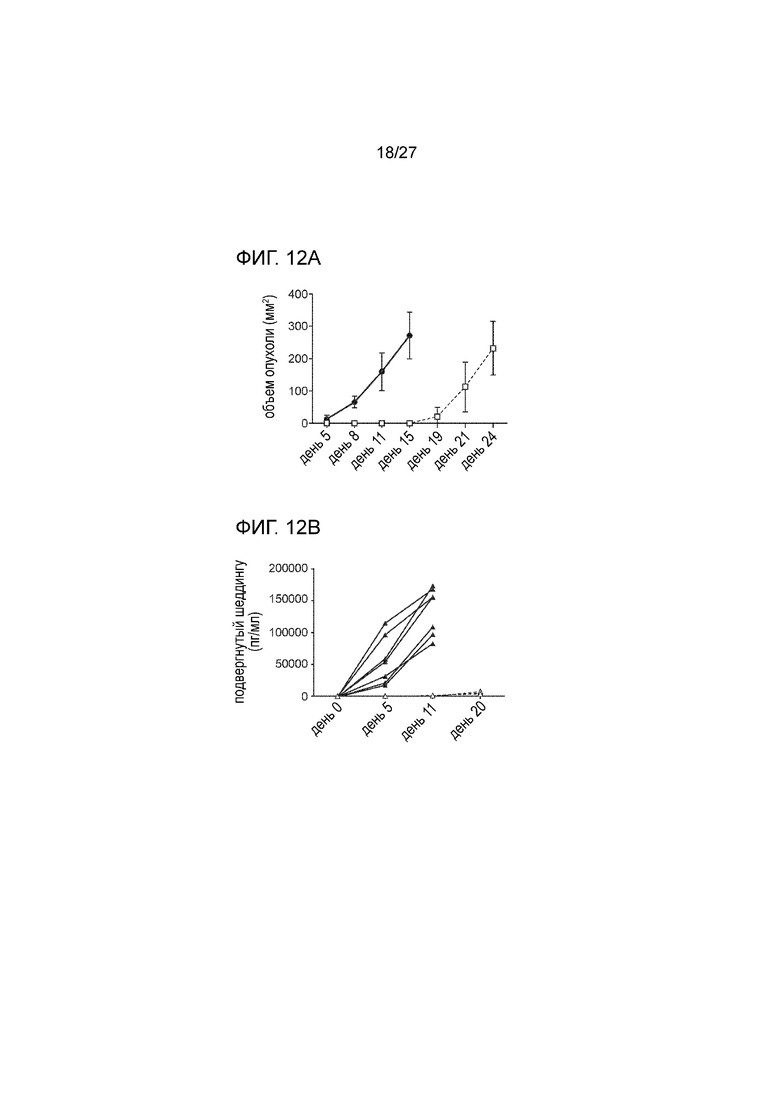
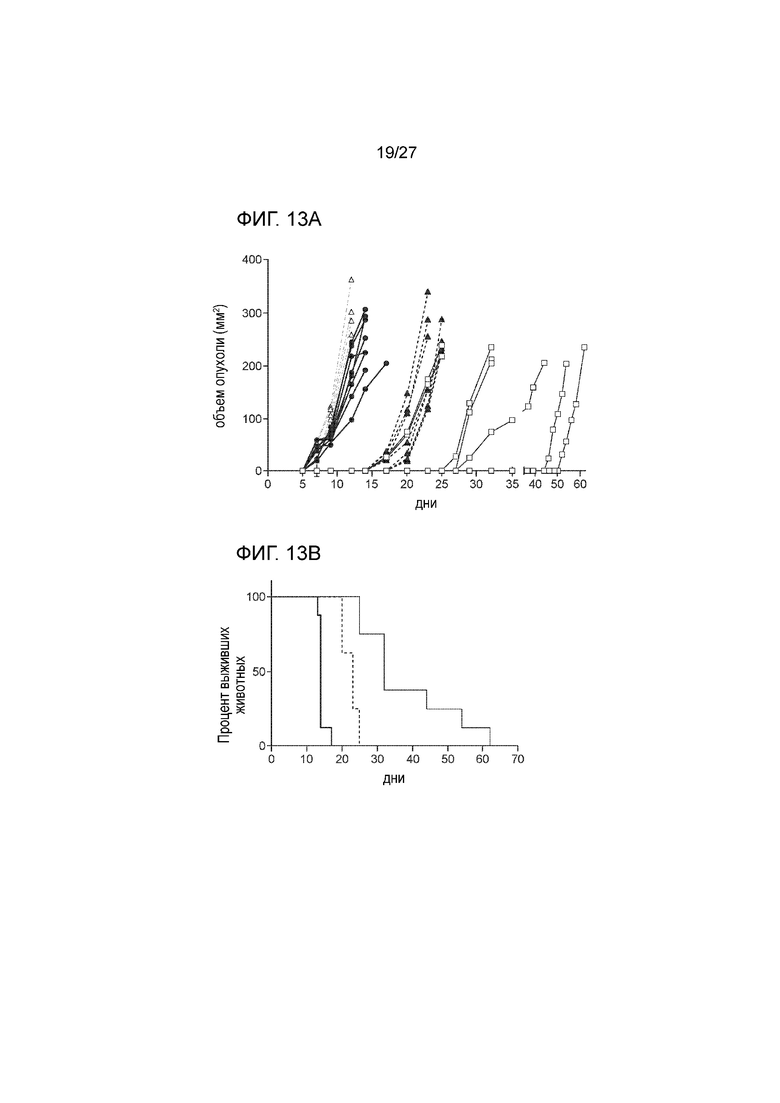
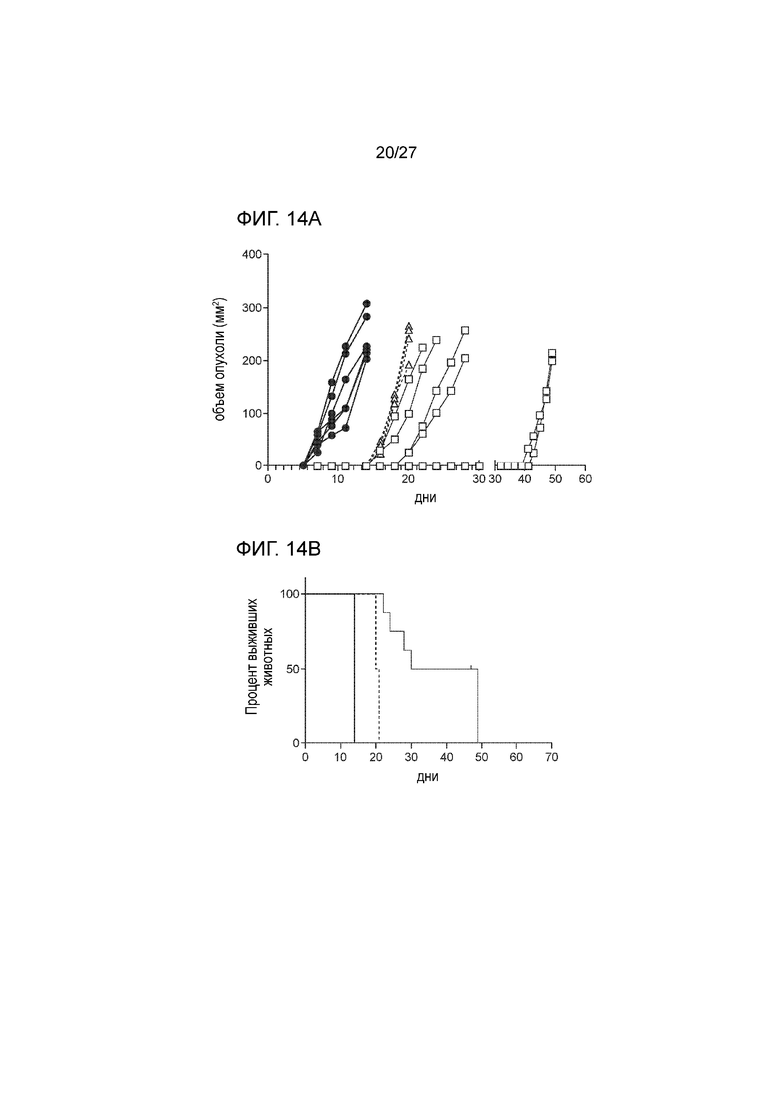
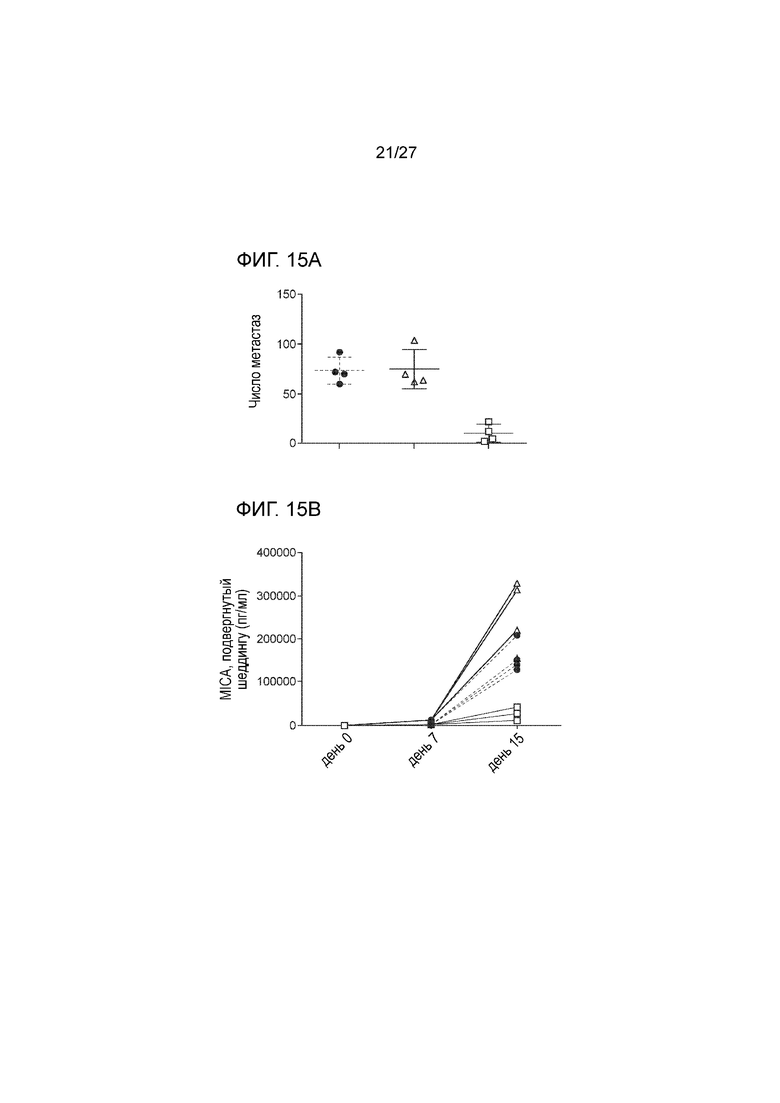
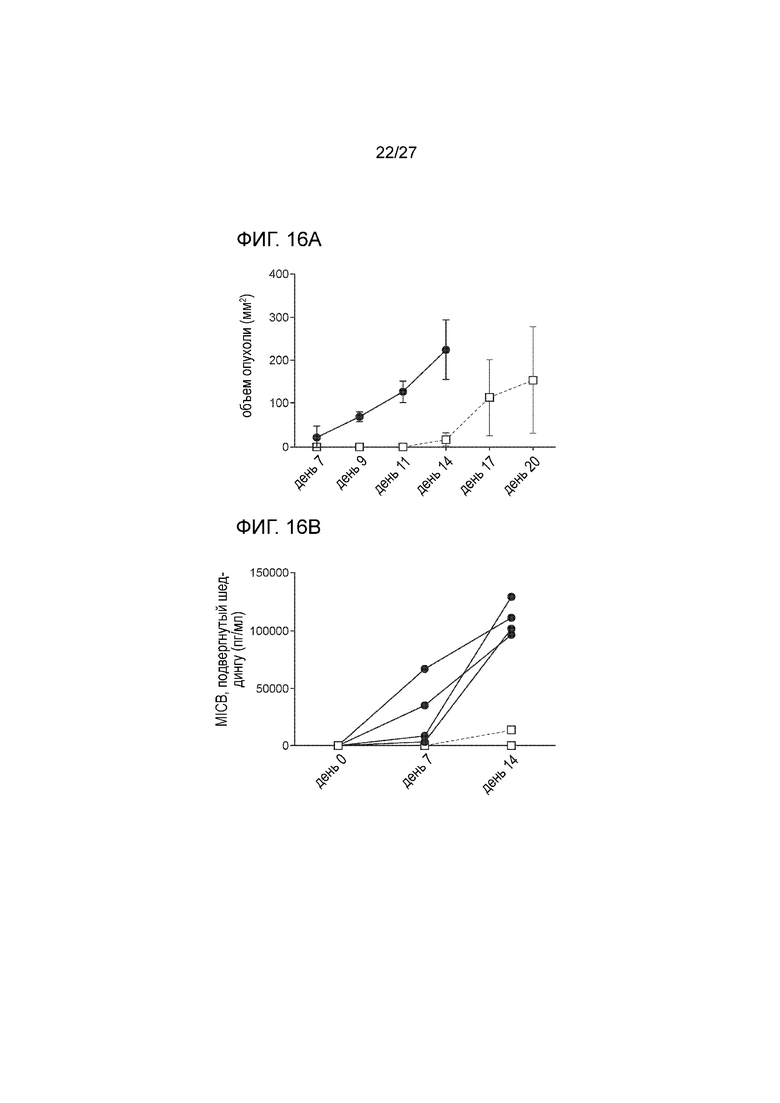
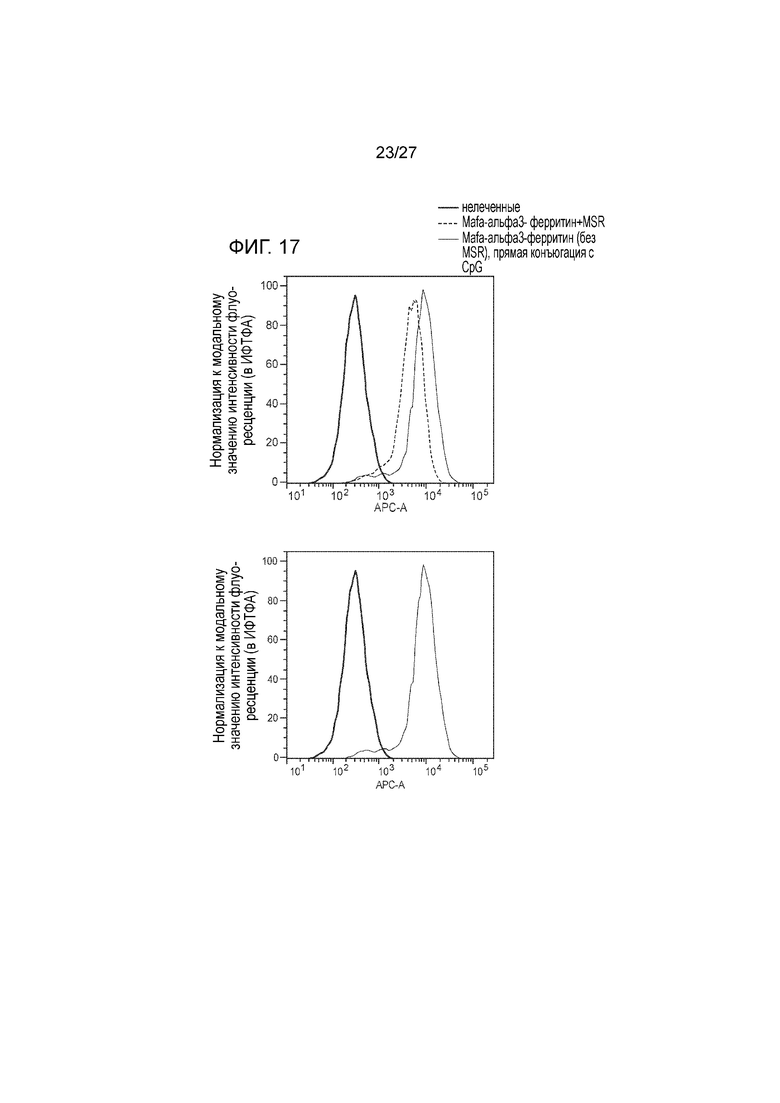

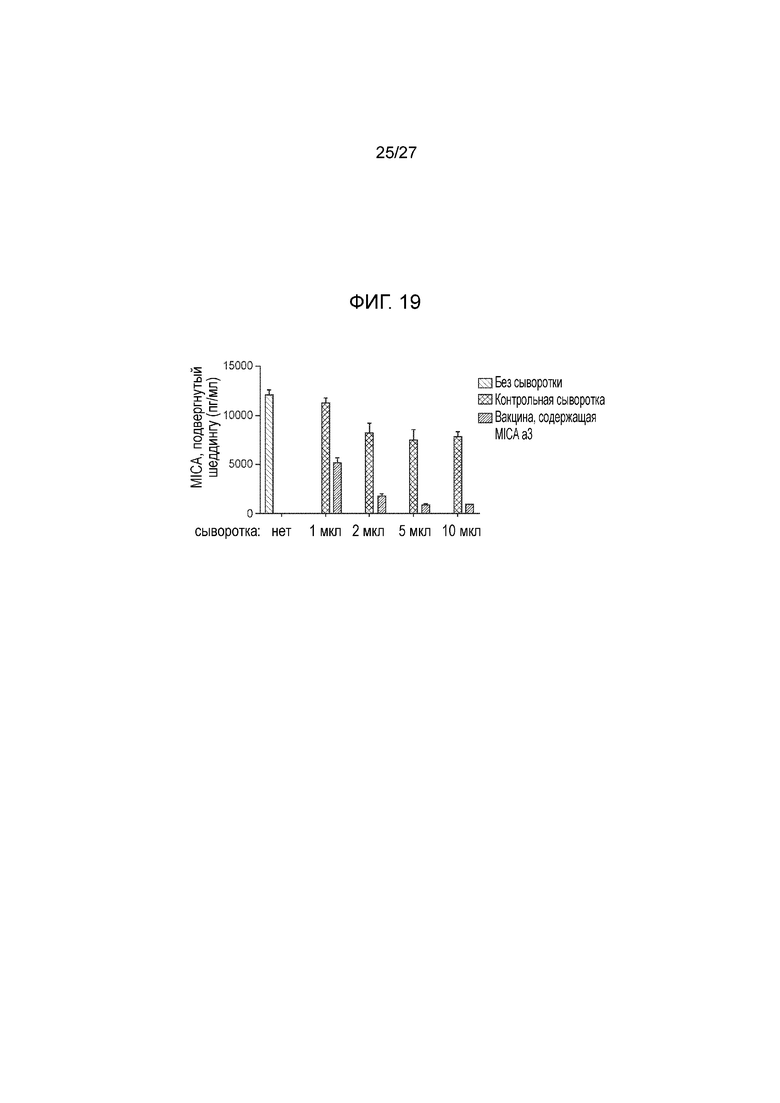
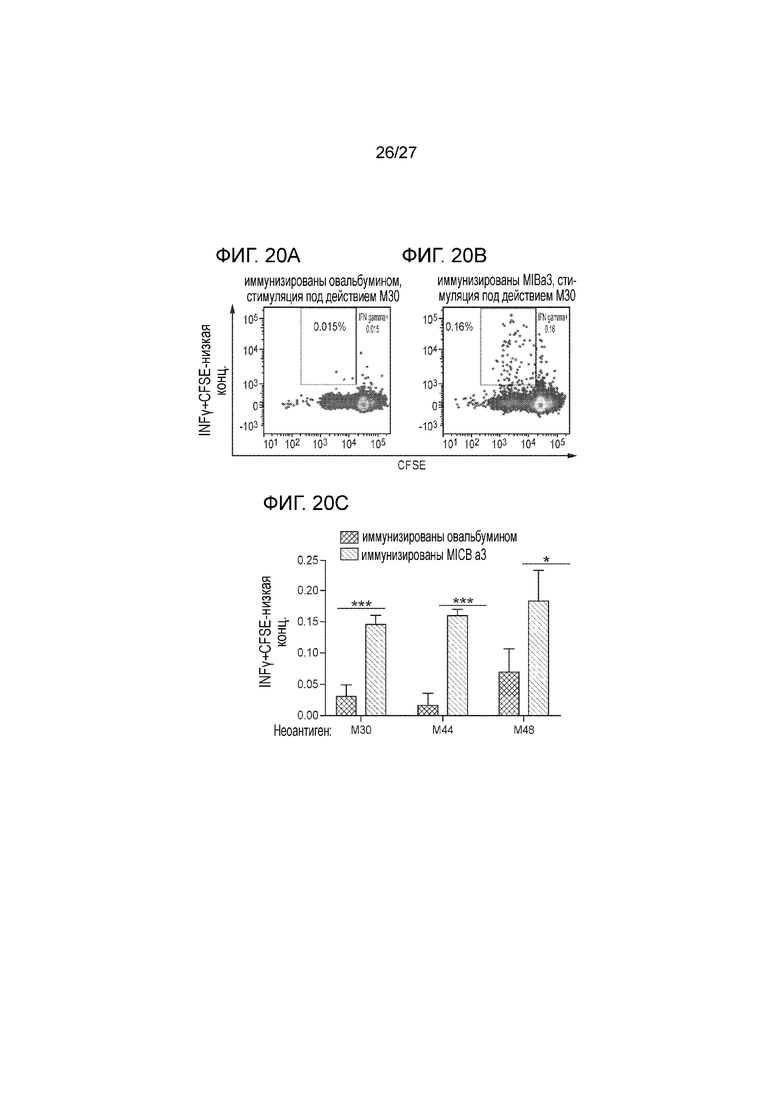
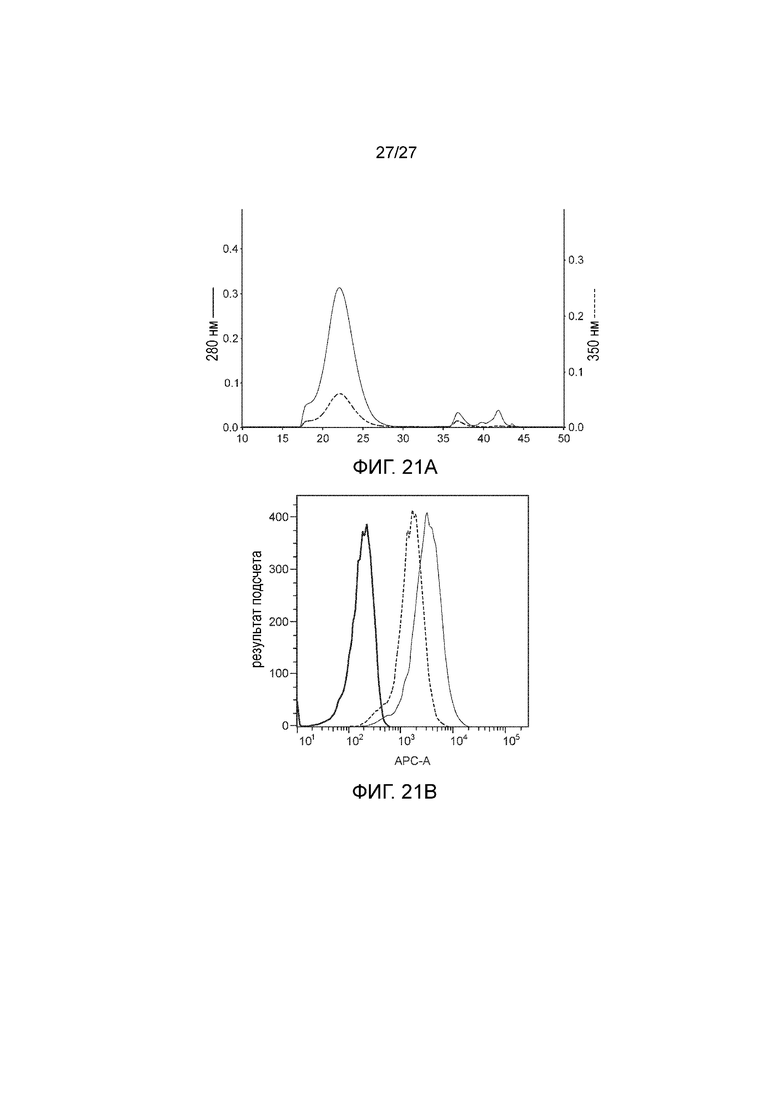
Настоящее изобретение относится к области биотехнологии, конкретно к индукции иммунного ответа против полипептида альфа3-домена из цепи главного комплекса гистосовместимости класса I (MIC), и может быть использовано в медицине для лечения рака, клетки которого экспрессируют указанный полипептид. Предложен белок слияния, включающий мономерную субъединицу белка ферритина, определяющую способность указанного белка слияния к самосборке с образованием наночастиц, которая присоединена к белку альфа3-домена из цепи MIC. Изобретение обеспечивает индукцию высоких титров антител против альфа3-домена MIC. 4 н. и 8 з.п. ф-лы, 11 пр., 21 ил.
1. Белок слияния для вызова иммунного ответа против альфа3-домена MIC, включающий мономерную субъединицу белка ферритин, присоединенную к белку альфа3-домена из цепи главного комплекса гистосовместимости класса I (MIC), где указанная мономерная субъединица белка ферритин включает домен, который определяет способность указанного белка слияния к самосборке с образованием наночастиц, и где белок альфа3-домена MIC содержит полипептид с аминокислотной последовательностью SEQ ID NO: 3 или SEQ ID NO: 4 или с последовательностью, которая имеет по меньшей мере 90% идентичность к указанным последовательностям.
2. Белок слияния по п. 1, отличающийся тем, что указанная мономерная субъединица представляет собой мономерную субъединицу белка ферритин из Helicobacter pylori.
3. Белок слияния по п. 1 или 2, где слитый белок дополнительно конъюгирован с (CpG) олигонуклеотидной последовательностью.
4. Наночастица для вызова иммунного ответа против альфа3-домена MIC, включающая белок слияния по любому из пп. 1-3.
5. Вакцинная композиция для вызова иммунного ответа против альфа3-домена MIC, включающая наночастицу по п.4 и фармацевтически приемлемый носитель, и дополнительно включающая адъювант.
6. Вакцинная композиция по п. 5, где адъювант включает ГМ-КСФ (GM-CSF) или CpG.
7. Способ лечения экспрессирующего MIC рака у субъекта, отличающийся тем, что указанный способ включает введение субъекту вакцинной композиции по любому из пп. 5-6.
8. Способ по п. 7, включающий также введение ГМ-КСФ (GM-CSF).
9. Способ по п. 7 или 8, отличающийся тем, что указанную вакцинную композицию вводят в качестве составной части схемы лечения.
10. Способ по п. 9, отличающийся тем, что указанная схема лечения представляет собой лучевую терапию, прицельную терапию, иммунотерапию или химиотерапию.
11. Способ по любому из пп. 7-10, отличающийся тем, что указанный субъект, по результатам анализа, является положительным по наличию шеддинга MIC в сыворотке.
12. Способ по любому из пп. 7-11, включающий также введение указанному субъекту одной или несколько вакцин, специфичных для антигена, отличного от антигена альфа3-домена MIC.
| WO2015139020 А2, 17.09.2015; WO 03094849 А2, 20.11.2003; RU 2489169 C2, 10.08.2013; ORLANDO M., Modification of proteins and low molecular weight substances with hydroxyethyl starch (HES), Inauguraldissertation, Giesen, 2003, p.166; CHEN X | |||
| et al., Fusion protein linkers: property, design and functionality, Advanced drug delivery reviews, 2013, |
Авторы
Даты
2021-05-04—Публикация
2016-12-05—Подача