ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет в соответствии с §199(e) раздела 35 Свода законов США согласно предварительной заявке США № 62/567417, поданной 3 октября 2017 года, и предварительной заявке США № 62/511194, поданной 25 мая 2017 года, каждая из которых полностью включена в настоящий документ посредством ссылки.
ЗАЯВЛЕНИЕ О ПЕРЕЧНЕ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Перечень последовательностей, связанный с этой заявкой, предоставлен в текстовом формате вместо бумажной копии и тем самым включен в описание посредством ссылки. Текстовый файл, содержащий перечень последовательностей, назван BLBD_087_02WO_ST25.txt. Текстовый файл имеет размер 152 Кбайт, был создан 25 мая 2018 года и подается в электронном виде с помощью EFS-Web одновременно с подачей описания.
УРОВЕНЬ ТЕХНИКИ
Область техники
Настоящее изобретение относится к улучшенным композициям для редактирования генома. Более конкретно, настоящее изобретение относится к вариантам нуклеаз, композициям и способам их применения для редактирования человеческого протоонкогена B (CBLB) лимфомы B-клеточной линии дифференцировки Каситас (Casitas) (Cbl).
Описание предшествующего уровня техники
Мировое бремя рака удвоилось в период между 1975 и 2000 годами. Рак является второй по значимости причиной заболеваемости и смертности во всем мире, при этом в 2012 году было примерно 14,1 миллиона новых случаев рака и 8,2 миллиона смертей от рака. Наиболее распространенными видами рака являются рак молочной железы, рак легких и бронхов, рак предстательной железы, рак толстой и прямой кишки, рак мочевого пузыря, меланома кожи, неходжкинская лимфома, рак щитовидной железы, рак почек и почечной лоханки, рак эндометрия, лейкоз и рак поджелудочной железы. Прогнозируется, что число новых случаев рака увеличится до 22 миллионов в течение следующих двух десятилетий.
Иммунная система играет ключевую роль в обнаружении и борьбе с раком у человека. Большинство трансформированных клеток быстро обнаруживаются иммунными стражами и разрушаются за счет активации антигенспецифических Т-клеток с помощью клонально экспрессируемых T-клеточных рецепторов (ТКР).
Соответственно, рак можно считать иммунологическим нарушением, неспособностью иммунной системы вызвать необходимый противоопухолевый ответ для длительного подавления и устранения заболевания. Для более эффективной борьбы с раком определенные иммунотерапевтические вмешательства, разработанные в последние несколько десятилетий, были специально направлены на усиление T-клеточного иммунитета. Эти способы лечения привели только к спорадическим случаям ремиссии заболевания и в целом не имели существенного успеха.
Совсем недавно стратегии адоптивной клеточной терапии, которые основаны на выделении, модификации, размножении и повторной инфузии T-клеток, были изучены и испытаны на ранних этапах клинических исследований. T-клетки часто были наиболее предпочтительными эффекторными клетками для иммунотерапии рака благодаря свойственному им селективному распознаванию и мощным эффекторным механизмам. Эти способы лечения показали различную успешность, но небольшое количество пациентов имело длительную ремиссию, что подчеркивает пока еще не реализованный потенциал видов иммунотерапии на основе T-клеток.
Успешное распознавание цитолитическими T-клетками антигенов, ассоциированных с опухолевыми клетками, инициирует нацеленный лизис опухоли и лежит в основе любого эффективного подхода к иммунотерапии рака. Инфильтрирующие опухоль T-клетки (ИОЛ) экспрессируют ТКР, специфично направленные на антигены, ассоциированные с опухолью; однако значительное количество ИОЛ ограничено только несколькими видами рака человека. Модифицированные T-клеточные рецепторы (ТКР) и химерные антигенные рецепторы (CAR) потенциально увеличивают применимость иммунотерапии на основе T-клеток при многих видах рака и других иммунных нарушениях.
Помимо этого современные модифицированные T-клетки по-прежнему регулируются сложной иммуносупрессорной микросредой опухоли, которая состоит из раковых клеток, воспалительных клеток, стромальных клеток и цитокинов. Среди этих компонентов раковые клетки, воспалительные клетки и супрессорные цитокины отрицательно влияют на фенотип и функцию T-клеток. В совокупности микросреда опухоли запускает окончательную дифференцировку T-клеток в истощенные T-клетки.
Истощение T-клеток это состояние дисфункции T-клеток в долговременной среде, которое характеризуется повышенной экспрессией ингибирующих рецепторов или повышенной передачей сигналов с их участием; сниженной выработкой эффекторных цитокинов; и уменьшенной способностью выживать и устранять рак. Истощенные T-клетки также проявляют иерархическую потерю функции: уменьшенная выработка ИЛ-2 и способность к уничтожению в условиях ex vivo теряются на ранней стадии истощения, выработка ФНО-α теряется на промежуточной стадии, и выработка ИФН-γ и GzmB теряется на поздней стадии истощения. Большинство T-клеток в микросреде опухоли дифференцируются в истощенные T-клетки, теряют способность устранять рак и в конечном итоге устраняются.
До настоящего времени отсутствовали наглядные клинические примеры видов адоптивной клеточной терапии с повышенной стойкостью и устойчивостью к иммуносупрессорной микросреде опухоли.
КРАТКОЕ ОПИСАНИЕ
Настоящее изобретение в целом относится, помимо прочего, к композициям, содержащим варианты хоуминг-эндонуклеаз и megaTAL, которые расщепляют сайт-мишень в человеческом протоонкогене B (CBLB) лимфомы B-клеточной линии дифференцировки Каситас(Cbl), и способам их применения.
Согласно различным вариантам реализации в настоящем изобретении, помимо прочего, предусмотрен полипептид, содержащий вариант хоуминг-эндонуклеазы (HE), который расщепляет сайт-мишень в человеческом гене CBLB.
Согласно конкретным вариантам реализации настоящего изобретения вариант HE представляет собой вариант хоуминг-эндонуклеазы LAGLIDADG (LHE).
Согласно некоторым вариантам реализации настоящего изобретения полипептид содержит биологически активный фрагмент варианта HE.
Согласно определенным вариантам реализации настоящего изобретения биологически активный фрагмент не содержит 1, 2, 3, 4, 5, 6, 7 или 8 N-концевых аминокислот по сравнению с соответствующей HE дикого типа.
Согласно некоторым вариантам реализации настоящего изобретения биологически активный фрагмент не содержит 4 N-концевые аминокислоты по сравнению с соответствующей HE дикого типа.
Согласно другим вариантам реализации настоящего изобретения биологически активный фрагмент не содержит 8 N-концевых аминокислот по сравнению с соответствующей HE дикого типа.
Согласно конкретным вариантам реализации настоящего изобретения биологически активный фрагмент не содержит 1, 2, 3, 4, 5 или 6 C-концевых аминокислот по сравнению с соответствующей HE дикого типа.
Согласно конкретным вариантам реализации настоящего изобретения биологически активный фрагмент не содержит C-концевую аминокислоту по сравнению с соответствующей HE дикого типа.
Согласно дополнительным вариантам реализации настоящего изобретения биологически активный фрагмент не содержит 2 C-концевые аминокислоты по сравнению с соответствующей HE дикого типа.
Согласно конкретным вариантам реализации настоящего изобретения вариант HE представляет собой вариант LHE, выбранный из группы, состоящей из: I-CreI и I-SceI.
Согласно определенным вариантам реализации настоящего изобретения вариант HE представляет собой вариант LHE, выбранный из группы, состоящей из: I-AabMI, I-AaeMI, I-AniI, I-ApaMI, I-CapIII, I-CapIV, I-CkaMI, I-CpaMI, I-CpaMII, I-CpaMIII, I-CpaMIV, I-CpaMV, I-CpaV, I-CraMI, I-EjeMI, I-GpeMI, I-GpiI, I-GzeMI, I-GzeMII, I-GzeMIII, I-HjeMI, I-LtrII, I-LtrI, I-LtrWI, I-MpeMI, I-MveMI, I-NcrII, I-Ncrl, I-NcrMI, I-OheMI, I-OnuI, I-OsoMI, I-OsoMII, I-OsoMIII, I-OsoMIV, I-PanMI, I-PanMII, I-PanMIII, I-PnoMI, I-ScuMI, I-SmaMI, I-SscMI и I-Vdi141I.
Согласно некоторым вариантам реализации настоящего изобретения вариант HE представляет собой вариант LHE, выбранный из группы, состоящей из: I-CpaMI, I-HjeMI, I-OnuI, I-PanMI и SmaMI.
Согласно дополнительным вариантам реализации настоящего изобретения вариант HE представляет собой вариант LHE I-OnuI.
Согласно конкретным вариантам реализации настоящего изобретения вариант HE содержит одну или более замен аминокислот в поверхности распознавания ДНК в положениях аминокислот, выбранных из группы, состоящей из: 24, 26, 28, 30, 32, 34, 35, 36, 37, 38, 40, 42, 44, 46, 48, 68, 70, 72, 75, 76, 78, 80, 82, 180, 182, 184, 186, 188, 189, 190, 191, 192, 193, 195, 197, 199, 201, 203, 223, 225, 227, 229, 231, 232, 234, 236, 238 и 240 аминокислотной последовательности LHE I-OnuI, представленной в SEQ ID NO: 1-5, или его биологически активный фрагмент.
Согласно некоторым вариантам реализации настоящего изобретения вариант HE содержит по меньшей мере 5, по меньшей мере 15, предпочтительно по меньшей мере 25, более предпочтительно по меньшей мере 35 или даже более предпочтительно по меньшей мере 40 или более замен аминокислот в поверхности распознавания ДНК в положениях аминокислот, выбранных из группы, состоящей из: 24, 26, 28, 30, 32, 34, 35, 36, 37, 38, 40, 42, 44, 46, 48, 68, 70, 72, 75, 76, 78, 80, 82, 180, 182, 184, 186, 188, 189, 190, 191, 192, 193, 195, 197, 199, 201, 203, 223, 225, 227, 229, 231, 232, 234, 236, 238 и 240 аминокислотной последовательности LHE I-OnuI, представленной в SEQ ID NO: 1-5, или его биологически активный фрагмент.
Согласно конкретным вариантам реализации настоящего изобретения вариант HE содержит одну или более замен аминокислот в положениях аминокислот, выбранных из группы, состоящей из: 19, 24, 26, 28, 30, 32, 34, 35, 36, 37, 38, 40, 42, 44, 46, 48, 59, 68, 70, 72, 75, 76 77, 78, 80, 82, 168, 180, 182, 184, 186, 188, 189, 190, 191, 192, 193, 195, 197, 199, 201, 203, 223, 225, 227, 229, 231, 232, 234, 236, 238 и 240 аминокислотной последовательности LHE I-OnuI, представленной в SEQ ID NO: 1-5, или его биологически активный фрагмент.
Согласно определенным вариантам реализации настоящего изобретения вариант HE содержит по меньшей мере 5, по меньшей мере 15, предпочтительно по меньшей мере 25, более предпочтительно по меньшей мере 35 или даже более предпочтительно по меньшей мере 40 или более замен аминокислот в положениях аминокислот, выбранных из группы, состоящей из: 19, 24, 26, 28, 30, 32, 34, 35, 36, 37, 38, 40, 42, 44, 46, 48, 59, 68, 70, 72, 75, 76 77, 78, 80, 82, 168, 180, 182, 184, 186, 188, 189, 190, 191, 192, 193, 195, 197, 199, 201, 203, 223, 225, 227, 229, 231, 232, 234, 236, 238 и 240 аминокислотной последовательности LHE I-OnuI, представленной в SEQ ID NO: 1-5, или его биологически активный фрагмент.
Согласно конкретным вариантам реализации настоящего изобретения вариант HE содержит по меньшей мере 5, по меньшей мере 15, предпочтительно по меньшей мере 25, более предпочтительно по меньшей мере 35 или даже более предпочтительно по меньшей мере 40 или более замен аминокислот по меньшей мере в одном положении, выбранном из группы положений, состоящей из положений: 24, 26, 28, 30, 32, 34, 35, 36, 37, 38, 40, 42, 44, 46, 48, 68, 70, 72, 78, 80, 92, 116, 138, 143, 159, 168, 178, 180, 182, 184, 186, 188, 189, 190, 191, 192, 193, 195, 197, 199, 201, 203, 207, 223, 225, 227, 232, 236 и 238 любой из SEQ ID NO: 1-5, или его биологически активный фрагмент.
Согласно некоторым вариантам реализации настоящего изобретения вариант HE содержит по меньшей мере 5, по меньшей мере 15, предпочтительно по меньшей мере 25, более предпочтительно по меньшей мере 35 или даже более предпочтительно по меньшей мере 40 или более из следующих замен аминокислот: S24C, L26R, L26G, R28D, R28Y, R30H, N32A, N32S, K34D, K34V, S35L, S36R, V37A, V37S, S40R, E42R, G44A, G44S, Q46E, T48V, T48S, V68T, V68K, A70Y, S72A, S78R, K80Q, D92G, V116L, L138M, T143N, S159P, F168L, E178D, C180S, F182V, F182M, N184E, I186K, I186M, S188R, S188N, K189R, S190N, K191P, K191N, L192V, G193K, G193I, Q195G, Q195R, Q197R, V199R, S201G, T203S, K207R, Y223R, K225V, K227N, F232H, D236E и V238I любой из SEQ ID NO: 1-5, или его биологически активный фрагмент.
Согласно дополнительным вариантам реализации настоящего изобретения вариант HE содержит по меньшей мере 5, по меньшей мере 15, предпочтительно по меньшей мере 25, более предпочтительно по меньшей мере 35 или даже более предпочтительно по меньшей мере 40 или более из следующих замен аминокислот: S24C, L26R, R28D, N32A, K34D, S35L, S36R, V37A, S40R, E42R, G44A, Q46E, T48V, V68T, A70Y, S72A, S78R, K80Q, L138M, T143N, F168L, E178D, C180S, F182V, N184E, I186K, S188R, K189R, K191P, L192V, G193K, Q195G, Q197R, V199R, K207R, Y223R, K225V, K227N, F232H, D236E и V238I любой из SEQ ID NO: 1-5, или его биологически активный фрагмент.
Согласно конкретным вариантам реализации настоящего изобретения вариант HE содержит по меньшей мере 5, по меньшей мере 15, предпочтительно по меньшей мере 25, более предпочтительно по меньшей мере 35 или даже более предпочтительно по меньшей мере 40 или более из следующих замен аминокислот: S24C, L26R, R28D, N32A, K34D, S35L, S36R, V37A, S40R, E42R, G44A, Q46E, T48V, V68T, A70Y, S72A, S78R, K80Q, L138M, T143N, S159P, F168L, E178D, C180S, F182M, N184E, I186M, S188N, S190N, K191N, L192V, G193I, Q195R, Q197R, V199R, T203S, K207R, Y223R, K225V, K227N, F232H, D236E и V238I любой из SEQ ID NO: 1-5, или его биологически активный фрагмент.
Согласно некоторым вариантам реализации настоящего изобретения вариант HE содержит по меньшей мере 5, по меньшей мере 15, предпочтительно по меньшей мере 25, более предпочтительно по меньшей мере 35 или даже более предпочтительно по меньшей мере 40 или более из следующих замен аминокислот: S24C, L26R, R28D, N32A, K34D, S35L, S36R, V37A, S40R, E42R, G44S, Q46E, T48S, V68T, A70Y, S72A, S78R, K80Q, D92G, V116L, L138M, T143N, S159P, F168L, E178D, C180S, F182M, N184E, I186M, S188N, S190N, K191N, L192V, G193I, Q195R, Q197R, V199R, T203S, K207R, Y223R, K225V, K227N, F232H, D236E и V238I любой из SEQ ID NO: 1-5, или его биологически активный фрагмент.
Согласно некоторым вариантам реализации настоящего изобретения вариант HE содержит по меньшей мере 5, по меньшей мере 15, предпочтительно по меньшей мере 25, более предпочтительно по меньшей мере 35 или даже более предпочтительно по меньшей мере 40 или более из следующих замен аминокислот: S24C, L26R, R28D, R30H, N32A, K34V, S35L, S36R, V37S, S40R, E42R, G44S, Q46E, T48V, V68T, V68K, A70Y, S72A, S78R, K80Q, L138M, T143N, S159P, F168L, E178D, C180S, F182M, N184E, I186M, S188N, S190N, K191N, L192V, G193I, Q195R, Q197R, V199R, T203S, K207R, Y223R, K225V, K227N, F232H, D236E и V238I любой из SEQ ID NO: 1-5, или его биологически активный фрагмент.
Согласно конкретным вариантам реализации настоящего изобретения вариант HE содержит по меньшей мере 5, по меньшей мере 15, предпочтительно по меньшей мере 25, более предпочтительно по меньшей мере 35 или даже более предпочтительно по меньшей мере 40 или более из следующих замен аминокислот: S24C, L26G, R28Y, R30H, N32S, K34V, S35L, S36R, V37S, S40R, E42R, G44S, Q46E, T48S, V68T, A70Y, S72A, S78R, K80Q, V116L, L138M, T143N, S159P, F168L, E178D, C180S, F182M, N184E, I186M, S188N, S190N, K191N, L192V, G193I, Q195R, Q197R, V199R, T203S, K207R, Y223R, K225V, K227N, F232H, D236E и V238I любой из SEQ ID NO: 1-5, или его биологически активный фрагмент.
Согласно некоторым вариантам реализации настоящего изобретения вариант HE содержит по меньшей мере 5, по меньшей мере 15, предпочтительно по меньшей мере 25, более предпочтительно по меньшей мере 35 или даже более предпочтительно по меньшей мере 40 или более из следующих замен аминокислот: S24C, L26R, R28D, R30H, N32A, K34V, S35L, S36R, V37S, S40R, E42R, G44S, Q46E, T48V, V68T, A70Y, S72A, S78R, K80Q, V116L, L138M, T143N, S159P, F168L, E178D, C180S, F182V, N184E, I186K, S188R, K189R, K191P, L192V, G193K, Q195G, Q197R, V199R, S201G, K207R, Y223R, K225V, K227N, F232H, D236E и V238I любой из SEQ ID NO: 1-5, или его биологически активный фрагмент.
Согласно дополнительным вариантам реализации настоящего изобретения вариант HE содержит по меньшей мере 5, по меньшей мере 15, предпочтительно по меньшей мере 25, более предпочтительно по меньшей мере 35 или даже более предпочтительно по меньшей мере 40 или более из следующих замен аминокислот: S24C, L26R, R28D, N32A, K34D, S35L, S36R, V37A, S40R, E42R, G44A, Q46E, T48V, V68T, A70Y, S72A, S78R, K80Q, D92G, L138M, T143N, S159P, F168L, E178D, C180S, F182M, N184E, I186M, S188N, S190N, K191N, L192V, G193I, Q195R, Q197R, V199R, T203S, K207R, Y223R, K225V, K227N, F232H, D236E и V238I любой из SEQ ID NO: 1-5, или его биологически активный фрагмент.
Согласно конкретным вариантам реализации настоящего изобретения вариант HE содержит аминокислотную последовательность, которая по меньшей мере на 80%, предпочтительно по меньшей мере на 85%, более предпочтительно по меньшей мере на 90% или еще более предпочтительно по меньшей мере на 95% идентична аминокислотной последовательности, представленной в любой из SEQ ID NO: 6-12, или его биологически активный фрагмент.
Согласно некоторым вариантам реализации настоящего изобретения вариант HE содержит аминокислотную последовательность, представленную в SEQ ID NO: 6, или его биологически активный фрагмент.
Согласно дополнительным вариантам реализации настоящего изобретения вариант HE содержит аминокислотную последовательность, представленную в SEQ ID NO: 7, или его биологически активный фрагмент.
Согласно конкретным вариантам реализации настоящего изобретения вариант HE содержит аминокислотную последовательность, представленную в SEQ ID NO: 8, или его биологически активный фрагмент.
Согласно конкретным вариантам реализации настоящего изобретения вариант HE содержит аминокислотную последовательность, представленную в SEQ ID NO: 9, или его биологически активный фрагмент.
Согласно дополнительным вариантам реализации настоящего изобретения вариант HE содержит аминокислотную последовательность, представленную в SEQ ID NO: 10, или его биологически активный фрагмент.
Согласно некоторым вариантам реализации настоящего изобретения вариант HE содержит аминокислотную последовательность, представленную в SEQ ID NO: 11, или его биологически активный фрагмент.
Согласно некоторым вариантам реализации настоящего изобретения вариант HE содержит аминокислотную последовательность, представленную в SEQ ID NO: 12, или его биологически активный фрагмент.
Согласно некоторым вариантам реализации настоящего изобретения полипептид связывает полинуклеотидную последовательность, представленную в SEQ ID NO: 20.
Согласно конкретным вариантам реализации настоящего изобретения полипептид дополнительно содержит ДНК-связывающий домен.
Согласно дополнительным вариантам реализации настоящего изобретения ДНК-связывающий домен выбран из группы, состоящей из: ДНК-связывающего домена TALE и ДНК-связывающего домена с цинковыми пальцами.
Согласно определенным вариантам реализации настоящего изобретения ДНК-связывающий домен TALE содержит от приблизительно 9,5 повторяющегося звена TALE до приблизительно 15,5 повторяющегося звена TALE.
Согласно другим вариантам реализации настоящего изобретения ДНК-связывающий домен TALE связывает полинуклеотидную последовательность в гене CBLB.
Согласно конкретным вариантам реализации настоящего изобретения ДНК-связывающий домен TALE связывает полинуклеотидную последовательность, представленную в SEQ ID NO: 21.
Согласно конкретным вариантам реализации настоящего изобретения полипептид связывает и расщепляет полинуклеотидную последовательность, представленную в SEQ ID NO: 22.
Согласно конкретным вариантам реализации настоящего изобретения ДНК-связывающий домен с цинковыми пальцами содержит 2, 3, 4, 5, 6, 7 или 8 мотивов цинковых пальцев.
Согласно дополнительным вариантам реализации настоящего изобретения полипептид дополнительно содержит пептидный линкер и модифицирующий концы фермент или его биологически активный фрагмент.
Согласно определенным вариантам реализации настоящего изобретения полипептид дополнительно содержит вирусный саморасщепляющийся пептид 2А и модифицирующий концы фермент или его биологически активный фрагмент.
Согласно другим вариантам реализации настоящего изобретения модифицирующий концы фермент или его биологически активный фрагмент имеет 5'-3'-экзонуклеазную, 5'-3'-щелочную экзонуклеазную, 3'-5'-экзонуклеазную, 5'-флэп (flap)-эндонуклеазную, геликазную, TdT или независимую от матрицы ДНК-полимеразную активность.
Согласно некоторым вариантам реализации настоящего изобретения модифицирующий концы фермент содержит Trex2 или его биологически активный фрагмент.
Согласно другим вариантам реализации настоящего изобретения полипептид содержит аминокислотную последовательность, представленную в любой из SEQ ID NO: 13-19, или его биологически активный фрагмент.
Согласно дополнительным вариантам реализации настоящего изобретения полипептид содержит аминокислотную последовательность, представленную в SEQ ID NO: 13, или его биологически активный фрагмент.
Согласно конкретным вариантам реализации настоящего изобретения полипептид содержит аминокислотную последовательность, представленную в SEQ ID NO: 14, или его биологически активный фрагмент.
Согласно некоторым вариантам реализации настоящего изобретения полипептид содержит аминокислотную последовательность, представленную в SEQ ID NO: 15, или его биологически активный фрагмент.
Согласно некоторым вариантам реализации настоящего изобретения полипептид содержит аминокислотную последовательность, представленную в SEQ ID NO: 16, или его биологически активный фрагмент.
Согласно некоторым вариантам реализации настоящего изобретения полипептид содержит аминокислотную последовательность, представленную в SEQ ID NO: 17, или его биологически активный фрагмент.
Согласно конкретным вариантам реализации настоящего изобретения полипептид содержит аминокислотную последовательность, представленную в SEQ ID NO: 18, или его биологически активный фрагмент.
Согласно другим вариантам реализации настоящего изобретения полипептид содержит аминокислотную последовательность, представленную в SEQ ID NO: 19, или его биологически активный фрагмент.
Согласно конкретным вариантам реализации настоящего изобретения полипептид расщепляет человеческий ген CBLB в полинуклеотидной последовательности, представленной в SEQ ID NO: 20 или 22.
Согласно различным вариантам реализации настоящего изобретения, помимо прочего, предложен полинуклеотид, кодирующий полипептид, предусмотренный в настоящем документе.
Согласно некоторым вариантам реализации настоящего изобретения, помимо прочего, предложена иРНК, кодирующая полипептид, предусмотренный в настоящем документе.
Согласно конкретным вариантам реализации настоящего изобретения, помимо прочего, предложена кДНК, кодирующая полипептид, предусмотренный в настоящем документе.
Согласно различным вариантам реализации настоящего изобретения, помимо прочего, предложен вектор, содержащий полинуклеотид, кодирующий полипептид, предусмотренный в настоящем документе.
Согласно различным вариантам реализации настоящего изобретения, помимо прочего, предложена клетка, содержащая полипептид, предусмотренный в настоящем документе.
Согласно дополнительным вариантам реализации настоящего изобретения, помимо прочего, предложена клетка, содержащая полинуклеотид, кодирующий полипептид, предусмотренный в настоящем документе.
Согласно другим вариантам реализации настоящего изобретения, помимо прочего, предложена клетка, содержащая вектор, предусмотренный в настоящем документе.
Согласно некоторым вариантам реализации настоящего изобретения, помимо прочего, предложена клетка, содержащая одну или более модификаций генома, введенных с помощью полипептида, предусмотренного в настоящем документе.
Согласно конкретным вариантам реализации настоящего изобретения клетка содержит полинуклеотид, кодирующий один или более из усилителя иммунопотенции, подавителя иммуносупрессорного сигнала или модифицированного антигенного рецептора.
Согласно другим вариантам реализации настоящего изобретения полинуклеотид дополнительно содержит промотор РНК-полимеразы II, функционально соединенный с полинуклеотидом, кодирующим усилитель иммунопотенции, подавитель иммуносупрессорного сигнала или модифицированный антигенный рецептор.
Согласно некоторым вариантам реализации настоящего изобретения промотор РНК-полимеразы II выбран из группы, состоящей из короткого промотора EF1α, длинного промотора EF1α, промотора человеческого локуса ROSA26, промотора убиквитина C (UBC), промотора фосфоглицераткиназы-1 (PGK), энхансера цитомегаловируса/промотора β-актина курицы (CAG), промотора β-актина и промотора с энхансером вируса миелопролиферативной саркомы, с удаленным участком отрицательного контроля и с сайтом связывания праймера, замененным на последовательность из dl587rev (MND).
Согласно дополнительным вариантам реализации настоящего изобретения полинуклеотид дополнительно кодирует один или более саморасщепляющихся вирусных пептидов, функционально соединенных, помещенных между ними и/или фланкирующих усилитель иммунопотенции, подавитель иммуносупрессорного сигнала или модифицированный антигенный рецептор.
Согласно конкретным вариантам реализации настоящего изобретения саморасщепляющийся вирусный пептид представляет собой пептид 2А.
Согласно определенным вариантам реализации настоящего изобретения полинуклеотид дополнительно содержит гетерологичный сигнал полиаденилирования.
Согласно конкретным вариантам реализации настоящего изобретения подавитель иммуносупрессорного сигнала обладает ферментативной функцией, которая противодействует иммуносупрессорному фактору.
Согласно дополнительным вариантам реализации настоящего изобретения подавитель иммуносупрессорного сигнала обладает кинурениназной активностью.
Согласно конкретным вариантам реализации настоящего изобретения подавитель иммуносупрессорного сигнала содержит: экзодомен, который связывает иммуносупрессорный фактор, причем необязательно экзодомен представляет собой антитело или его антигенсвязывающий фрагмент; экзодомен, который связывает иммуносупрессорный фактор, и трансмембранный домен; или экзодомен, который связывает иммуносупрессорный фактор, трансмембранный домен и модифицированный эндодомен, который не способен передавать иммуносупрессорные сигналы к клетке.
Согласно другим вариантам реализации настоящего изобретения усилитель иммунопотенции выбран из группы, состоящей из: биспецифической молекулы, активирующей T-клетки (BiTE), иммунопотенциирующего фактора и переключающего (flip) рецептора.
Согласно некоторым вариантам реализации настоящего изобретения иммунопотенциирующий фактор выбран из группы, состоящей из цитокина, хемокина, цитотоксина, рецептора цитокина и их вариантов.
Согласно некоторым вариантам реализации настоящего изобретения переключающий рецептор содержит экзодомен и трансмембранный домен TGFβRII; и эндодомен из TLR4, CD28, CD134, CD137, CD278 и/или CD3ζ, гибридизованный в пределах рамки считывания с C-концевой частью трансмембранного домена TGFβRII.
Согласно конкретным вариантам реализации настоящего изобретения переключающий рецептор содержит экзодомен TGFβRII; трансмембранный домен, выделенный из полипептида TLR4, CD3, CD4, CD8α, CD28, CD134 или CD137; и эндодомен из TLR4, CD28, CD134, CD137, CD278 и/или CD3ζ, гибридизованный в пределах рамки считывания с C-концевой частью экзодомена TGFβRII.
Согласно определенным вариантам реализации настоящего изобретения переключающий рецептор содержит экзодомен TGFβRII; и трансмембранный домен и эндодомен, выделенные из полипептида TLR4, CD3, CD4, CD8α, CD28, CD134 или CD137, гибридизованные в пределах рамки считывания с C-концевой частью экзодомена TGFβRII.
Согласно конкретным вариантам реализации настоящего изобретения модифицированный антигенный рецептор выбран из группы, состоящей из: модифицированного ТКР, CAR, Daric или зетакина.
Согласно дополнительным вариантам реализации настоящего изобретения модифицированный рецептор не интегрирован в ген CBLB.
Согласно другим вариантам реализации настоящего изобретения полинуклеотид, кодирующий один или более из усилителя иммунопотенции, подавителя иммуносупрессорного сигнала или модифицированного антигенного рецептора, интегрирован в ген CBLB.
Согласно другим вариантам реализации настоящего изобретения донорная матрица для восстановления, содержащая полинуклеотид, кодирующий один или более из усилителя иммунопотенции, подавителя иммуносупрессорного сигнала или модифицированного антигенного рецептора, интегрирована в ген CBLB в сайте разрыва двухцепочечной ДНК, введенном с помощью полипептида, предусмотренного в настоящем документе.
Согласно конкретным вариантам реализации настоящего изобретения клетка представляет собой гемопоэтическую клетку.
Согласно некоторым вариантам реализации настоящего изобретения клетка представляет собой T-клетку.
Согласно конкретным вариантам реализации настоящего изобретения клетка представляет собой CD3+, CD4+ и/или CD8+ клетку.
Согласно дополнительным вариантам реализации настоящего изобретения клетка представляет собой иммунную эффекторную клетку.
Согласно конкретным вариантам реализации настоящего изобретения клетка представляет собой цитотоксический Т-лимфоцит (ЦТЛ), инфильтрирующий опухоль лимфоцит (ИОЛ) или хелперную T-клетку.
Согласно некоторым вариантам реализации настоящего изобретения клетка представляет собой клетку природного киллера (NK) или клетку природного T-киллера (NKT).
Согласно предпочтительному варианту реализации настоящего изобретения клетка представляет собой T-клетку, которая была генетически модифицирована для экспрессии модифицированного антигенного рецептора.
Согласно предпочтительному варианту реализации настоящего изобретения клетка представляет собой T-клетку, которая была генетически модифицирована для экспрессии химерного антигенного рецептора (CAR) или модифицированного T-клеточного рецептора (ТКР).
Согласно дополнительным вариантам реализации настоящего изобретения источник клетки представляет собой мононуклеарные клетки периферической крови (МКПК), костный мозг, ткань лимфатических узлов, пуповинную кровь, ткань тимуса, ткань из очага инфекции, асциты, плевральный выпот, ткань селезенки или опухоли.
Согласно некоторым вариантам реализации настоящего изобретения клетка содержит один или более модифицированных аллелей CBLB.
Согласно другим вариантам реализации настоящего изобретения один или более модифицированных аллелей CBLB являются нефункциональными или имеют по существу сниженную функцию и/или активность CBLB.
Согласно конкретным вариантам реализации настоящего изобретения клетка содержит нуклеиновую кислоту, кодирующую усилитель иммунопотенции или подавитель иммуносупрессорного сигнала, введенную в один или более модифицированных аллелей CBLB, и клетка дополнительно содержит модифицированный антигенный рецептор, который не введен в один или более модифицированных аллелей CBLB.
Согласно некоторым вариантам реализации настоящего изобретения, помимо прочего, предложено множество клеток, содержащее одну или более клеток, предусмотренных в настоящем документе.
Согласно различным вариантам реализации настоящего изобретения, помимо прочего, предложена композиция, содержащая одну или более клеток, предусмотренных в настоящем документе.
Согласно некоторым вариантам реализации настоящего изобретения, помимо прочего, предложена композиция, содержащая одну или более клеток, предусмотренных в настоящем документе, и физиологически приемлемый носитель.
Согласно конкретным вариантам реализации настоящего изобретения, помимо прочего, предложен способ редактирования человеческого гена CBLB в клетке, включающий: введение в клетку полинуклеотида, кодирующего полипептид, предусмотренный в настоящем документе, причем экспрессия полипептида создает двухцепочечный разрыв в сайте-мишени в человеческом гене CBLB.
Согласно некоторым вариантам реализации настоящего изобретения, помимо прочего, предложен способ редактирования человеческого гена CBLB в клетке, включающий: введение в клетку полинуклеотида, кодирующего полипептид, предусмотренный в настоящем документе, причем экспрессия полипептида создает двухцепочечный разрыв в сайте-мишени в человеческом гене CBLB, при этом разрыв восстанавливается с помощью негомологичного соединения концов (NHEJ).
Согласно определенным вариантам реализации настоящего изобретения, помимо прочего, предложен способ редактирования человеческого гена CBLB в клетке, включающий: введение в клетку полинуклеотида, кодирующего полипептид, предусмотренный в настоящем документе, и донорной матрицы для восстановления, причем экспрессия полипептида создает двухцепочечный разрыв в сайте-мишени в человеческом гене CBLB, и донорная матрица для восстановления встраивается в человеческий ген CBLB с помощью направляемого гомологией восстановления (HDR) в сайте двухцепочечного разрыва (ДЦР).
Согласно конкретным вариантам реализации настоящего изобретения клетка представляет собой гемопоэтическую клетку.
Согласно определенным вариантам реализации настоящего изобретения клетка представляет собой T-клетку.
Согласно определенным вариантам реализации настоящего изобретения клетка представляет собой CD3+, CD4+ и/или CD8+ клетку.
Согласно некоторым вариантам реализации настоящего изобретения клетка представляет собой иммунную эффекторную клетку.
Согласно дополнительным вариантам реализации настоящего изобретения клетка представляет собой цитотоксический Т-лимфоцит (ЦТЛ), инфильтрирующий опухоль лимфоцит (ТИЛ) или хелперную T-клетку.
Согласно дополнительным вариантам реализации настоящего изобретения клетка представляет собой клетку природного киллера (NK) или клетку природного T-киллера (NKT).
Согласно конкретным вариантам реализации настоящего изобретения источник клетки представляет собой мононуклеарные клетки периферической крови, костный мозг, ткань лимфатических узлов, пуповинную кровь, ткань тимуса, ткань из очага инфекции, асциты, плевральный выпот, ткань селезенки или опухоли.
Согласно конкретным вариантам реализации настоящего изобретения полинуклеотид, кодирующий полипептид, представляет собой иРНК.
Согласно определенным вариантам реализации настоящего изобретения полинуклеотид, кодирующий 5'-3'-экзонуклеазу, вводят в клетку.
Согласно другим вариантам реализации настоящего изобретения полинуклеотид, кодирующий Trex2 или его биологически активный фрагмент, вводят в клетку.
Согласно некоторым вариантам реализации настоящего изобретения донорная матрица для восстановления кодирует ген CBLB или его часть, содержащую одну или более мутаций по сравнению с геном CBLB дикого типа.
Согласно конкретным вариантам реализации настоящего изобретения донорная матрица для восстановления кодирует один или более из усилителя иммунопотенции, подавителя иммуносупрессорного сигнала или модифицированного антигенного рецептора.
Согласно некоторым вариантам реализации настоящего изобретения донорная матрица для восстановления дополнительно содержит промотор РНК-полимеразы II, функционально соединенный с усилителем иммунопотенции, подавителем иммуносупрессорного сигнала или модифицированным антигенным рецептором.
Согласно другим вариантам реализации настоящего изобретения промотор РНК-полимеразы II выбран из группы, состоящей из короткого промотора EF1α, длинного промотора EF1α, промотора человеческого локуса ROSA26, промотора убиквитина C (UBC), промотора фосфоглицераткиназы-1 (PGK), энхансера цитомегаловируса/промотора β-актина курицы (CAG), промотора β-актина и промотора с энхансером вируса миелопролиферативной саркомы, с удаленным участком отрицательного контроля и с сайтом связывания праймера, замещенным на последовательность из dl587rev (MND).
Согласно конкретным вариантам реализации настоящего изобретения донорная матрица для восстановления дополнительно кодирует один или более саморасщепляющихся вирусных пептидов, функционально соединенных, расположенных между ними и/или фланкирующих усилитель иммунопотенции, подавитель иммуносупрессорного сигнала или модифицированный антигенный рецептор.
Согласно дополнительным вариантам реализации настоящего изобретения саморасщепляющийся вирусный пептид представляет собой пептид 2А.
Согласно определенным вариантам реализации настоящего изобретения донорная матрица для восстановления дополнительно содержит гетерологичный сигнал полиаденилирования.
Согласно другим вариантам реализации настоящего изобретения подавитель иммуносупрессорного сигнала обладает ферментативной функцией, которая противодействует иммуносупрессорному фактору.
Согласно конкретным вариантам реализации настоящего изобретения подавитель иммуносупрессорного сигнала обладает кинурениназной активностью.
Согласно некоторым вариантам реализации настоящего изобретения подавитель иммуносупрессорного сигнала содержит: экзодомен, который связывает иммуносупрессорный фактор, причем необязательно экзодомен представляет собой антитело или его антигенсвязывающий фрагмент; экзодомен, который связывает иммуносупрессорный фактор, и трансмембранный домен; или экзодомен, который связывает иммуносупрессорный фактор, трансмембранный домен и модифицированный эндодомен, который не способен передавать иммуносупрессорные сигналы к клетке.
Согласно некоторым вариантам реализации настоящего изобретения экзодомен и/или трансмембранный домен подавителя иммуносупрессорного сигнала представляет собой экзодомен и/или трансмембранный домен TGFβRII.
Согласно некоторым вариантам реализации настоящего изобретения усилитель иммунопотенции выбран из группы, состоящей из: биспецифической молекулы, активирующей T-клетки (BiTE), иммунопотенциирующего фактора и переключающего рецептора.
Согласно конкретным вариантам реализации настоящего изобретения иммунопотенциирующий фактор выбран из группы, состоящей из цитокина, хемокина, цитотоксина, рецептора цитокина и их вариантов.
Согласно дополнительным вариантам реализации настоящего изобретения переключающий рецептор содержит экзодомен и трансмембранный домен TGFβRII; и эндодомен из TLR4, CD28, CD134, CD137, CD278 и/или CD3ζ, гибридизованный в пределах рамки считывания с C-концевой частью трансмембранного домена TGFβRII.
Согласно конкретным вариантам реализации настоящего изобретения переключающий рецептор содержит экзодомен TGFβRII; трансмембранный домен, выделенный из полипептида TLR4, CD3, CD4, CD8α, CD28, CD134 или CD137; и эндодомен из TLR4, CD28, CD134, CD137, CD278 и/или CD3ζ, гибридизованный в пределах рамки считывания с C-концевой частью экзодомена TGFβRII.
Согласно другим вариантам реализации настоящего изобретения переключающий рецептор содержит экзодомен TGFβRII; и трансмембранный домен и эндодомен, выделенные из полипептида TLR4, CD3, CD4, CD8α, CD28, CD134 или CD137, гибридизованные в пределах рамки считывания с C-концевой частью экзодомена TGFβRII.
Согласно некоторым вариантам реализации настоящего изобретения модифицированный антигенный рецептор выбран из группы, состоящей из: модифицированного ТКР, CAR, Daric или зетакина.
Согласно некоторым вариантам реализации настоящего изобретения донорная матрица для восстановления содержит 5'-плечо гомологии, гомологичное последовательности человеческого гена CBLB, расположенной в 5'-направлении от ДЦР, и 3'-плечо гомологии, гомологичное последовательности человеческого гена CBLB, расположенной в 3'-направлении от ДЦР.
Согласно другим вариантам реализации настоящего изобретения длины 5'- и 3'-плеч гомологии независимо выбраны из диапазона от приблизительно 100 п.о. до приблизительно 2500 п.о.
Согласно конкретным вариантам реализации настоящего изобретения длины 5'- и 3'-плеч гомологии независимо выбраны из диапазона от приблизительно 600 п.о. до приблизительно 1500 п.о.
Согласно конкретным вариантам реализации настоящего изобретения 5'-плечо гомологии составляет приблизительно 1500 п.о., и 3'-плечо гомологии составляет приблизительно 1000 п.о.
Согласно некоторым вариантам реализации настоящего изобретения 5'-плечо гомологии составляет приблизительно 600 п.о., и 3'-плечо гомологии составляет приблизительно 600 п.о.
Согласно определенным вариантам реализации настоящего изобретения для введения донорной матрицы для восстановления в клетку применяют вирусный вектор.
Согласно дополнительным вариантам реализации настоящего изобретения вирусный вектор представляет собой рекомбинантный вектор на основе аденоассоциированного вируса (rAAV) или ретровирус.
Согласно конкретным вариантам реализации настоящего изобретения rAAV имеет один или более ITR из AAV2.
Согласно дополнительным вариантам реализации настоящего изобретения rAAV имеет серотип, выбранный из группы, состоящей из: AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9 и AAV10.
Согласно другим вариантам реализации настоящего изобретения rAAV имеет серотип AAV2 или AAV6.
Согласно определенным вариантам реализации настоящего изобретения ретровирус представляет собой лентивирус.
Согласно некоторым вариантам реализации настоящего изобретения лентивирус представляет собой дефицитный по интегразе лентивирус (IDLV).
Согласно различным вариантам реализации настоящего изобретения, помимо прочего, предложен способ лечения, предотвращения или уменьшения по меньшей мере одного симптома рака, инфекционного заболевания, аутоиммунного заболевания, воспалительного заболевания и иммунодефицита или состояния, ассоциированного с ними, включающий введение субъекту эффективного количества композиции, предусмотренной в настоящем документе.
Согласно определенным вариантам реализации настоящего изобретения, помимо прочего, предложен способ лечения солидного рака, включающий введение субъекту эффективного количества композиции, предусмотренной в настоящем документе.
Согласно конкретным вариантам реализации настоящего изобретения солидный рак включает рак печени, рак поджелудочной железы, рак легких, рак молочной железы, рак яичников, рак предстательной железы, рак яичка, рак мочевого пузыря, рак мозга, саркому, рак головы и шеи, рак костей, рак щитовидной железы, рак почек или рак кожи.
Согласно некоторым вариантам реализации настоящего изобретения, помимо прочего, предложен способ лечения гематологического злокачественного новообразования, включающий введение субъекту эффективного количества композиции, предусмотренной в настоящем документе.
Согласно некоторым вариантам реализации настоящего изобретения гематологическое злокачественное новообразование представляет собой лейкоз, лимфому или множественную миелому.
КРАТКОЕ ОПИСАНИЕ НЕСКОЛЬКИХ ВИДОВ ЧЕРТЕЖЕЙ
На Фигуре 1 показан ген CBLB и сайт-мишень HE в экзоне 6 (SEQ ID NO: 20 и 76), который кодирует домен SH2.
На Фигуре 2 показано перепрограммирование CBLB HE за счет модификации NTD и CTD против химерных «полусайтов» с помощью трех раундов сортировки с последующей гибридизацией перепрограммированных доменов и скринингом против полного сайта-мишени CBLB для выделения полностью перепрограммированной HE.
На Фигуре 3 показана активность вариантов CBLB HE в репортерном хромосомном анализе.
На Фигуре 4 показано титрование аффинности варианта HE CBLB.E3 на поверхности дрожжей.
На Фигуре 5 показано выравнивание вариантов CBLB HE (SEQ ID NO: 77-83) с белком I-OnuI дикого типа (SEQ ID NO: 1), неидентичные положения выделены.
На Фигуре 6 показан сайт связывания (SEQ ID NO: 22 и 84) для RVD TAL, гибридизованных с вариантом HE CBLB.E3, для получения CBLB.E3 megaTAL.
На Фигуре 7 показаны сопоставимые значения частоты редактирования гена CBLB в CAR T-клетках при применении CBLB megaTAL.
На Фигуре 8 показано уменьшение внутриклеточной экспрессии белка CBLB в T-клетках, обработанных CBLB megaTAL.
На Фигуре 9 показано, что CBL-редактированные T-клетки вырабатывают больше ИФН-γ и ФНО-α при стимуляции антителом к CD3 или CAR-специфичным антигеном.
На Фигуре 10 показан TIDE-анализ T-клеток, редактированных с помощью совместной доставки иРНК, кодирующих различные CBLB megaTAL и TREX2. Частота редактирования в локусе-мишени составила 61-93%.
На Фигуре 11 показана схема стратегии HDR для вставки кассеты экспрессии MND-GFP в сайт-мишень CBLB с применением CBLB megaTAL и AAV-донора.
На Фигуре 12 показано стабильное увеличение экспрессии GFP в T-клетках, редактированных с применением стратегии HDR, изображенной на Фигуре 11, по сравнению с T-клетками с имитированным редактированием.
На Фигуре 13 представлены результаты исследования на мышах в условиях in vivo. Мышам с опухолями A549 вводили T-клетки, обработанные наполнителем (верхняя левая панель), T-клетки, редактированные с применением CBLB megaTAL (верхняя правая панель), направленные против РЭФР CAR-T-клетки (нижняя левая панель) и направленные против РЭФР CAR-T-клетки, редактированные с применением CBLB megaTAL (нижняя правая панель). Средний объем опухоли измеряли в течение некоторого времени.
КРАТКОЕ ОПИСАНИЕ ИДЕНТИФИКАТОРОВ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID NO: 1 представляет собой аминокислотную последовательность хоуминг-эндонуклеазы I-OnuI LAGLIDADG дикого типа (LHE).
SEQ ID NO: 2 представляет собой аминокислотную последовательность LHE I-OnuI дикого типа.
SEQ ID NO: 3 представляет собой аминокислотную последовательность биологически активного фрагмента LHE I-OnuI дикого типа.
SEQ ID NO: 4 представляет собой аминокислотную последовательность биологически активного фрагмента LHE I-OnuI дикого типа.
SEQ ID NO: 5 представляет собой аминокислотную последовательность биологически активного фрагмента LHE I-OnuI дикого типа.
SEQ ID NO: 6-12 представляют собой аминокислотные последовательности вариантов LHE I-OnuI, перепрограммированных для связывания и расщепления сайта-мишени в человеческом гене CBLB.
SEQ ID NO: 13-19 представляют собой аминокислотные последовательности вариантов LHE I-OnuI, перепрограммированных для связывания и расщепления сайта-мишени в человеческом гене CBLB.
SEQ ID NO: 20 представляет собой сайт-мишень варианта LHE I-OnuI в экзоне 6 человеческого гена CBLB.
SEQ ID NO: 21 представляет собой сайт-мишень ДНК-связывающего домена TALE в экзоне 6 человеческого гена CBLB.
SEQ ID NO: 22 представляет собой сайт-мишень megaTAL в экзоне 6 человеческого гена CBLB.
SEQ ID NO: 23, 25, 27 и 29 представляют собой сайты-мишени N-концевого домена варианта LHE I-OnuI в экзоне 6 человеческого гена CBLB.
SEQ ID NO: 24, 26 и 28 представляют собой сайты-мишени C-концевого домена варианта LHE I-OnuI в экзоне 6 человеческого гена CBLB.
SEQ ID NO: 30 представляет собой полинуклеотидную последовательность плазмиды для поверхностного дисплея CBLB.E3.
SEQ ID NO: 31-36 представляют собой последовательности иРНК, кодирующие CBLB megaTAL.
SEQ ID NO: 37 представляет собой последовательность иРНК, кодирующую мышиный Trex2.
SEQ ID NO: 38 представляет собой аминокислотную последовательность, кодирующую мышиный Trex2.
SEQ ID NO: 39-49 представляют собой аминокислотные последовательности различных линкеров.
SEQ ID NO: 50-74 представляют собой аминокислотные последовательности сайтов расщепления протеазой и сайтов саморасщепления полипептида. В приведенных выше последовательностях X, если присутствует, относится к любой аминокислоте или к ее отсутствию.
ПОДРОБНОЕ ОПИСАНИЕ
A. Обзор
Настоящее изобретение в целом относится, помимо прочего, к улучшенным композициям для редактирования генома и способам их применения. Безотносительно к какой-либо конкретной теории, композиции для редактирования генома, предусмотренные в различных вариантах реализации, можно применять для предотвращения или лечения рака, инфекционного заболевания, аутоиммунного заболевания, воспалительного заболевания и иммунодефицита или состояния, ассоциированного с ними, или для уменьшения по меньшей мере одного их симптома. Одним ограничением или проблемой, которые вызывают беспокойство в отношении существующей адоптивной клеточной терапии, является гипореактивность иммунных эффекторных клеток вследствие истощения, опосредуемого микросредой опухоли. Истощенные T-клетки имеют уникальную молекулярную характеристику, которая заметно отличается от наивных, эффекторных T-клеток или T-клеток памяти. Истощенные T-клетки представляют собой T-клетки с уменьшенной экспрессией цитокинов и эффекторной функцией.
Протоонкоген B лимфомы B-клеточной линии дифференцировки Каситас (Cbl) является членом семейства RING-пальцев или убиквитинлигаз U3 и экспрессируется в широком спектре тканей и типов клеток, включая клетки гемопоэтической линии. CBLB облегчает убиквитинирование субстратных белков-мишеней за счет привлечения убиквитинконъюгирующих ферментов E2 к своему домену RING-пальца. Убиквитинирование субстратных белков CBLB может способствовать разрушению белка или препятствовать межбелковым взаимодействиям. CBLB связывается с субстратными белками за счет своего SH2-содержащего тирозинкиназного связывающего домена, своих богатых пролином последовательностей, которые взаимодействуют с белками, содержащими домен SH3, или своего ассоциированного с убиквитином домена, который взаимодействует с мечеными убиквитином белками.
CBLB также участвует в отрицательной регуляции активности и стойкости эффекторных T-клеток. T-клетки мышей с выключенным геном CBLB являются гиперпролиферативными, вырабатывают повышенные уровни ИЛ-2 и ИФН-γ в ответ на стимуляцию антигеном, устойчивы к TGFβ-опосредуемой супрессии и имеют более низкий порог активации, это указывает на то, что CBLB играет роль в отрицательной регуляции активации T-клеток. Безотносительно к какой-либо конкретной теории, предусмотрено, что разрушение гена CBLB в T-клетках с применением модифицированных нуклеаз приведет к более эффективным и стойким видам адоптивной клеточной иммунотерапии.
Согласно конкретным вариантам реализации настоящего изобретения иммунные эффекторные клетки с редактированным геномом, предусмотренные в настоящем документе, делают более устойчивыми к истощению за счет устранения, уменьшения или подавления экспрессии CBLB, активности CBLB и/или передачи сигналов с участием CBLB.
Композиции и способы редактирования генома, предусмотренные в различных вариантах реализации, содержат варианты нуклеаз, разработанные для связывания и расщепления сайта-мишени в протоонкогене B (CBLB) лимфомы B-клеточной линии дифференцировки Каситас (Cbl). Варианты нуклеаз, предусмотренные в конкретных вариантах реализации, можно применять для введения двухцепочечного разрыва в целевой полинуклеотидной последовательности, который может быть восстановлен с помощью негомологичного соединения концов (NHEJ) в отсутствие полинуклеотидной матрицы, например, донорной матрицы для восстановления, или с помощью направляемого гомологией восстановления (HDR), т.е. гомологичной рекомбинации, в присутствии донорной матрицы для восстановления. Варианты нуклеаз, предусмотренные в определенных вариантах реализации, также могут быть разработаны как никазы, которые создают одноцепочечные разрывы ДНК, которые могут быть восстановлены с применением клеточного аппарата эксцизионного восстановления оснований (BER) или гомологичной рекомбинации в присутствии донорной матрицы для восстановления. NHEJ представляет собой подверженный ошибкам процесс, который часто приводит к образованию небольших вставок и делеций, которые нарушают функцию гена. Гомологичная рекомбинация требует гомологичной ДНК в качестве матрицы для восстановления и может быть использована для создания неограниченного разнообразия модификаций, определяемых введением в сайт-мишень донорной ДНК, содержащей желательную последовательность, фланкированную по обеим сторонам последовательностями, которые гомологичны областям, фланкирующим сайт-мишень.
Согласно одному предпочтительному варианту реализации композиции для редактирования генома, предусмотренные в настоящем документе, содержат вариант хоуминг-эндонуклеазы или megaTAL, который нацелен на человеческий ген CBLB.
Согласно одному предпочтительному варианту реализации композиции для редактирования генома, предусмотренные в настоящем документе, содержат вариант хоуминг-эндонуклеазы или megaTAL и модифицирующий концы фермент, например, Trex2.
Согласно различным вариантам реализации предусмотрены клетки с редактированным геномом. Клетки с редактированным геномом содержат редактированный ген CBLB, причем стратегия редактирования разработана для уменьшения или устранения экспрессии CBLB. Согласно конкретным вариантам реализации настоящего изобретения CAR-T-клетки, T-клетки с модифицированными ТКР или DARIC-T-клетки содержат редактированный ген CBLB.
Согласно различным вариантам реализации разрыв ДНК создают в сайте-мишени гена CBLB в T-клетке, например, иммунной эффекторной клетке, и NHEJ концов расщепленной геномной последовательности может приводить к получению клетки с низкой или отсутствующей экспрессией CBLB, и предпочтительно T-клетки, у которой отсутствует или по существу отсутствует функциональная экспрессия CBLB и/или передача сигналов с участием CBLB, например, отсутствует способность увеличивать истощение T-клеток. Безотносительно к какой-либо конкретной теории, T-клетки, у которых отсутствует функциональная экспрессия CBLB, более устойчивы к иммуносупрессии и истощению T-клеток и, следовательно, являются более стойкими и терапевтически эффективными.
Согласно различным другим вариантам реализации настоящего изобретения предложена донорная матрица для восстановления расщепленной геномной последовательности CBLB. Ген CBLB восстанавливают с применением последовательности матрицы путем гомологичной рекомбинации в сайте разрыва ДНК. Согласно конкретным вариантам реализации настоящего изобретения матрица для восстановления содержит полинуклеотидную последовательность, которая разрушает и предпочтительно по существу уменьшает или устраняет функциональную экспрессию CBLB.
Согласно конкретным вариантам реализации настоящего изобретения ген CBLB восстанавливают с применением полинуклеотида, кодирующего усилитель иммунопотенции, подавитель иммуносупрессорного сигнала или модифицированный антигенный рецептор.
Согласно конкретным вариантам реализации настоящего изобретения ген CBLB восстанавливают с применением полинуклеотида, кодирующего усилитель иммунопотенции, подавитель иммуносупрессорного сигнала или модифицированный антигенный рецептор и введенного в ген CBLB так, чтобы начать использовать эндогенный промотор CBLB для транскрипционного контроля экспрессии усилителя иммунопотенции, подавителя иммуносупрессорного сигнала или модифицированного антигенного рецептора.
Согласно предпочтительным вариантам реализации настоящего изобретения композиции и способы редактирования генома, предусмотренные в настоящем документе, применяют для редактирования человеческого гена CBLB.
Соответственно, способы и композиции, предусмотренные в настоящем документе, представляют собой существенное улучшение по сравнению с существующими видами адаптивной клеточной терапии.
Методики синтеза рекомбинантных (т.е. модифицированных) ДНК, пептидов и олигонуклеотидов, иммуноанализов, культивирования тканей, трансформации (например, электропорации, липофекции), ферментативных реакций, очистки и связанные с ними методики и процедуры обычно можно выполнять, как описано в различных общих и более конкретных литературных источниках в области микробиологии, молекулярной биологии, биохимии, молекулярной генетики, клеточной биологии, вирусологии и иммунологии, которые цитируются и обсуждаются в тексте настоящего описания. См., например, Sambrook et al., Molecular Cloning: A Laboratory Manual, 3rd ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y.; Current Protocols in Molecular Biology (John Wiley and Sons, обновлено в июле 2008); Short Protocols in Molecular Biology: A Compendium of Methods from Current Protocols in Molecular Biology, Greene Pub. Associates and Wiley-Interscience; Glover, DNA Cloning: A Practical Approach, vol. I & II (IRL Press, Oxford Univ. Press USA, 1985); Current Protocols in Immunology (под ред. John E. Coligan, Ada M. Kruisbeek, David H. Margulies, Ethan M. Shevach, Warren Strober 2001 John Wiley & Sons, NY, NY); Real-Time PCR: Current Technology and Applications, под ред. Julie Logan, Kirstin Edwards and Nick Saunders, 2009, Caister Academic Press, Norfolk, UK; Anand, Techniques for the Analysis of Complex Genomes, (Academic Press, New York, 1992); Guthrie and Fink, Guide to Yeast Genetics and Molecular Biology (Academic Press, New York, 1991); Oligonucleotide Synthesis (N. Gait, Ed., 1984); Nucleic Acid The Hybridization (под ред.B. Hames & S. Higgins, 1985); Transcription and Translation (под ред. B. Hames & S. Higgins, 1984); Animal Cell Culture (под ред. R. Freshney, 1986); Perbal, A Practical Guide to Molecular Cloning (1984); Next-Generation Genome Sequencing (Janitz, 2008 Wiley-VCH); PCR Protocols (Methods in Molecular Biology) (под ред. Park, 3rd ed., 2010 Humana Press); Immobilized Cells And Enzymes (IRL Press, 1986); учебник Methods In Enzymology (Academic Press, Inc., N.Y.); Gene Transfer Vectors For Mammalian Cells (под ред. J. H. Miller and M. P. Calos, 1987, Cold Spring Harbor Laboratory); Harlow and Lane, Antibodies, (Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1998); Immunochemical Methods In Cell And Molecular Biology (под ред. Mayer and Walker, Academic Press, London, 1987); Handbook Of Experimental Immunology, Volumes I-IV (под ред. D. M. Weir and CC Blackwell, 1986); Roitt, Essential Immunology, 6th ed., (Blackwell Scientific Publications, Oxford, 1988); Current Protocols in Immunology (под ред. Q. E. Coligan, A. M. Kruisbeek, D. H. Margulies, E. M. Shevach and W. Strober, 1991); Annual Review of Immunology; а также монографии в журналах, таких как Advances in Immunology.
B. ОПРЕДЕЛЕНИЯ
Перед более подробным описанием настоящего изобретения, чтобы облегчить его понимание, будут даны определения некоторых терминов, которые будут использоваться в настоящем документе.
Если не указано иное, все технические и научные термины используются в настоящем документе в значении, соответствующем обычному пониманию специалиста в области техники, к которой относится настоящее изобретение. Несмотря на то, что любые способы и материалы, сходные или эквивалентные тем, которые описаны в настоящем документе, можно применять при практической реализации или испытании конкретных вариантов реализации, в настоящем документе описаны предпочтительные варианты реализации композиций, способов и материалов. Для целей настоящего изобретения ниже определены нижеследующие термины. Дополнительные определения представлены в тексте настоящего изобретения.
Артикли (соотв. «а», «an» или «the» в исходном тексте на английском языке), используются в настоящем документе для обозначения одного или более чем одного (т. е., по меньшей мере одного или одного или более) грамматического объекта изделия. Например, «элемент» означает один элемент или один или более элементов.
Использование альтернативы (например, «или») следует понимать как означающее либо одну, либо обе, либо любую комбинацию альтернатив.
Термин «и/или» следует понимать как означающий либо одну, либо обе альтернативы.
В настоящем документе термин «около» или «приблизительно» относится к количеству, уровню, значению, числу, частоте, проценту, измерению, размеру, величине, массе или длине, которые варьируются не менее чем на 15%, 10%, 9%, 8%, 7%, 6%, 5%, 4%, 3%, 2% или 1% от контрольного количества, уровня, значения, числа, частоты, процента, размера, измерения, величины, массы или длины. Согласно одному варианту реализации термин «около» или «приблизительно» относится к диапазону количества, уровня, значения, числа, частоты, процента, размера, измерения, величины, массы или длины ± 15%, ± 10%, ± 9%, ± 8%, ± 7%, ± 6%, ± 5%, ± 4%, ± 3%, ± 2% или ± 1% относительно эталонной величины, уровня, значения, числа, частоты, процента, размера, измерения, величины, массы или длины.
Согласно одному варианту реализации диапазон, например, от 1 до 5, от приблизительно 1 до 5 или от приблизительно 1 до приблизительно 5, относится к каждому числовому значению, охватываемому диапазоном. Например, в одном неограничивающем и только иллюстративном варианте реализации диапазон «от 1 до 5» эквивалентен выражению 1, 2, 3, 4, 5; или 1,0, 1,5, 2,0, 2,5, 3,0, 3,5, 4,0, 4,5 или 5,0; или 1,0, 1,1, 1,2, 1,3, 1,4, 1,5, 1,6, 1,7, 1,8, 1,9, 2,0, 2,1, 2,2, 2,3, 2,4, 2,5, 2,6, 2,7, 2,8, 2,9, 3,0, 3,1, 3,2, 3,3, 3,4, 3,5, 3,6, 3,7, 3,8, 3,9, 4,0, 4,1, 4,2, 4,3, 4,4, 4,5, 4,6, 4,7, 4,8, 4,9 или 5,0.
В настоящем документе термин «по существу» относится к количеству, уровню, значению, числу, частоте, проценту, измерению, размеру, величине, массе или длине, которые составляют 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более по сравнению с эталонной величиной, уровнем, значением, числом, частотой, процентом, измерением, размером, величиной, массой или длиной. Согласно одному варианту реализации «по существу то же» относится к количеству, уровню, значению, числу, частоте, проценту, измерению, размеру, величине, массе или длине, которые производят эффект, например, физиологический эффект, который приблизительно такой же, как и для эталонной величины, уровня, значения, числа, частоты, процента, измерения, размера, величины, массы или длины.
По всему тексту описания, если контекст не требует иного, слова «содержат», «содержит» и «содержащий» будут пониматься как подразумевающие включение указанного этапа или элемента или группы этапов или элементов, но не исключение какого-либо другого этапа или элемента или группы этапов или элементов. Под «состоящий из» подразумевают включение всего того, что следует за выражением «состоящий из» и ограничение этим. Таким образом, выражение «состоящий из» означает, что перечисленные элементы являются требуемыми или обязательными и что не могут присутствовать какие-либо другие элементы. Термин «состоящий по существу из» означает включение любых элементов, перечисленных после выражения, и ограничивается другими элементами, которые не препятствуют или не способствуют активности или действию, указанному в описании для перечисленных элементов. Таким образом, выражение «состоящий по существу из» указывает на то, что перечисленные элементы являются требуемыми или обязательными, но не присутствуют другие элементы, которые существенным образом влияют на активность или действие перечисленных элементов.
Ссылка по всему описанию на «один вариант реализации», «вариант реализации», «конкретный вариант реализации», «связанный вариант реализации», «определенный вариант реализации», «дополнительный вариант реализации» или «другой вариант реализации» или их комбинации означает, что конкретный признак, структура или характеристика, описанные в связи с вариантом реализации, включены в по меньшей мере один вариант реализации. Таким образом, появления вышеупомянутых выражений в различных местах по всему описанию необязательно все относятся к одному и тому же варианту реализации. Кроме того, конкретные признаки, структуры или характеристики могут быть комбинированы любым подходящим способом в одном или более вариантах реализации. Также следует понимать, что положительное перечисление признака в одном варианте реализации служит основой для исключения признака в конкретном варианте реализации.
Термин «ex vivo» обычно относится к видам активности, которые происходят вне организма, таким как эксперименты или измерения, выполненные в живых тканях или на них в искусственной среде вне организма, предпочтительно с минимальным изменением природных условий. Согласно конкретным вариантам реализации настоящего изобретения процедуры «ex vivo» включают живые клетки или ткани, взятые из организма и культивируемые или модулируемые в лабораторном аппарате, обычно в стерильных условиях и обычно в течение нескольких часов или до приблизительно 24 часов, но включая до 48 или 72 часов, в зависимости от обстоятельств. Согласно определенным вариантам реализации настоящего изобретения такие ткани или клетки могу быть собраны и заморожены, а затем оттаяны для обработки ex vivo. Эксперименты или процедуры культивирования тканей с применением живых клеток или ткани, длящиеся более чем несколько дней, обычно рассматриваются как «in vitro», несмотря на то, что в определенных вариантах реализации настоящего изобретения этот термин может использоваться взаимозаменяемо с ex vivo.
Термин «in vivo» обычно относится к видам активности, которые происходят внутри организма. Согласно одному варианту реализации клеточные геномы конструируют, редактируют или модифицируют в условиях in vivo.
Термин «усиливать» или «способствовать», «увеличивать», «продлевать» или «потенцировать» обычно относится к способности варианта нуклеазы, композиции для редактирования генома или клетки с редактированным геномом, предусмотренных в настоящем документе, вырабатывать, вызывать или обуславливать больший ответ (т.е. физиологический ответ) по сравнению с ответом, вызванным либо наполнителем, либо контролем. Измеримый ответ может включать увеличение каталитической активности, аффинности связывания, специфичности сайта связывания, селективности сайта связывания, стойкости, цитолитической активности и/или увеличение количества провоспалительных цитокинов, помимо прочих, очевидных на основании представлений в данной области техники и данного описания. «Увеличенное» или «повышенное» количество обычно представляет собой «статистически значимое» количество и может включать увеличение в 1,1, 1,2, 1,5, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 30 или более раз (например, 500, 1000 раз) (включая все целые числа и десятичные знаки между и выше 1, например, 1,5, 1,6, 1,7, 1,8 и т.д.) ответа, вызванного наполнителем или контролем.
Под «уменьшать» или «понижать», или «сокращать», или «снижать», или «ослаблять», или «устранять», или «ингибировать», или «подавлять» обычно понимают способность варианта нуклеазы, композиции для редактирования генома или клетки с редактированным геномом, предусмотренных в настоящем документе, вырабатывать, вызывать или обуславливать меньший ответ (т.е. физиологический ответ) по сравнению с ответом, вызванным наполнителем или контролем. Измеримый ответ может включать уменьшение нецелевой аффинности связывания, нецелевой специфичности расщепления, истощение T-клеток и тому подобное. «Уменьшенное» или «сниженное» количество, как правило, представляет собой «статистически значимое» количество и может включать снижение в 1,1, 1,2, 1,5, 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 30 или более раз (например, 500, 1000 раз) (включая все целые числа и десятичные знаки между и выше 1, например, 1,5, 1,6, 1,7, 1,8 и т.д.) ответа (эталонного ответа), вызванного наполнителем или контролем.
«Поддерживать» или «сохранять», или «поддержание», или «без изменений», или «без существенных изменений», или «без существенного уменьшения» обычно относится к способности варианта нуклеазы, композиции для редактирования генома или клетки с редактированным геномом, предусмотренных в настоящем документе, вырабатывать, вызывать или обуславливать по существу сходный или сравнимый физиологический ответ (т.е. последующие эффекты) по сравнению с ответом, вызванным либо наполнителем, либо контролем. Сравнимый ответ это ответ, который существенно не отличается или измеримо не отличается от эталонного ответа.
В настоящем документе термины «аффинность специфичного связывания» или «специфично связывает», или «специфично связанный», или «специфичное связывание», или «специфично нацеливает» описывают связывание одной молекулы с другой, например, связывание ДНК-связывающего домена полипептида с ДНК, с большей аффинностью связывания, чем неспецифичное связывание. Связывающий домен «специфично связывается» с сайтом-мишенью, если он связывается или ассоциируется с сайтом-мишенью с аффинностью или Ka (т.е. равновесной константой ассоциации конкретного связывающего взаимодействия с единицами 1/M), например, большей или равной приблизительно 105 М-1. Согласно определенным вариантам реализации настоящего изобретения связывающий домен связывается с сайтом-мишенью с Ка большей или равной приблизительно 106 М-1, 107 М-1, 108 М-1, 109 М-1, 1010 М-1, 1011 М-1, 1012 М-1 или 1013 М-1. «Высокая аффинность» связывающих доменов относится к связывающим доменам с Ka по меньшей мере 107 М-1, по меньшей мере 108 М-1, по меньшей мере 109 М-1, по меньшей мере 1010 М-1, по меньшей мере 1011 М-1, по меньшей мере 1012 М-1, по меньшей мере 1013 М-1 или более.
Согласно другому варианту аффинность может быть определена в конкретных вариантах реализации настоящего изобретения как равновесная константа диссоциации (Kd) конкретного связывающего взаимодействия с единицами М (например, от 10-5 М до 10-13 М или менее). Величины аффинности вариантов нуклеаз, содержащих один или более ДНК-связывающих доменов для сайтов-мишеней ДНК, предусмотренных в конкретных вариантах реализации настоящего изобретения, могут быть легко определены с применением обычных методик, например, дисплея на поверхности дрожжевых клеток или анализа связывания или анализа вытеснения с применением меченых лигандов.
Согласно одному варианту реализации аффинность специфичного связывания приблизительно в 2 раза больше, чем неспецифичного связывания, приблизительно в 5 раз больше, чем неспецифичного связывания, приблизительно в 10 раз больше, чем неспецифичного связывания, приблизительно в 20 раз больше, чем неспецифичного связывания, приблизительно в 50 раз больше, чем неспецифичного связывания, приблизительно в 100 раз больше, чем неспецифичного связывания или приблизительно в 1000 раз больше, чем неспецифичного связывания или более.
Термины «селективно связывает» или «селективно связанный», или «селективно связывающий», или «селективно нацеливает» описывают преимущественное связывание одной молекулы с молекулой-мишенью (целевое связывание) в присутствии множества нецелевых молекул. Согласно конкретным вариантам реализации настоящего изобретения HE или megaTAL селективно связывает целевой сайт связывания ДНК приблизительно в 5, 10, 15, 20, 25, 50, 100 или 1000 раз чаще, чем HE или megaTAL связывает нецелевой сайт связывания ДНК.
«Целевой» относится к последовательности сайта-мишени.
«Нецелевой» относится к последовательности, сходной, но не идентичной последовательности сайта-мишени.
«Сайт-мишень» или «последовательность-мишень» представляет собой последовательность хромосомной или внехромосомной нуклеиновой кислоты, которая определяет часть нуклеиновой кислоты, с которой будет связываться и/или которую будет расщеплять связывающая молекула, при условии наличия достаточных условий для связывания и/или расщепления. При ссылке на полинуклеотидную последовательность или SEQ ID NO, которая ссылается только на одну цепь сайта-мишени или последовательности-мишени, следует понимать, что сайт-мишень или последовательность-мишень, связанные и/или расщепленные вариантом нуклеазы, являются двухцепочечными и содержат эталонную последовательность и комплементарную ей последовательность. Согласно предпочтительному варианту реализации настоящего изобретения сайт-мишень представляет собой последовательность в человеческом гене CBLB.
«Рекомбинация» относится к процессу обмена генетической информацией между двумя полинуклеотидами, включая, но не ограничиваясь этим, захват донора за счет негомологичного соединения концов (NHEJ) и гомологичной рекомбинации. Для целей настоящего изобретения термин «гомологичная рекомбинация (HR)» относится к специализированной форме такого обмена, который имеет место, например, во время восстановления двухцепочечных разрывов в клетках за счет механизмов направляемого гомологией восстановления (HDR). Этот процесс требует гомологии нуклеотидных последовательностей и в качестве матрицы для восстановления «целевой» молекулы (т.е. той, которая подверглась двухцепочечному разрыву) применяется «донорная» молекула, он известен под различными названиями «некроссоверная конверсия генов» или «конверсия короткого участка генов», поскольку он ведет к передаче генетической информации от донора к мишени. Безотносительно к какой-либо конкретной теории, такой перенос может включать коррекцию несоответствий гетеродуплексной ДНК, которая образуется между поврежденной мишенью и донором, и/или «зависимую от синтеза ренатурацию цепей», при которой донор применяется для повторного синтеза генетической информации, которая станет частью мишени, и/или связанных процессов. Такой специализированный HR часто приводит к изменению последовательности молекулы-мишени так, что часть или вся последовательность донорного полинуклеотида встраивается в полинуклеотид-мишень.
«NHEJ» или «негомологичное соединение концов» относится к устранению двухцепочечного разрыва в отсутствие донорной матрицы для восстановления или гомологичной последовательности. NHEJ может привести к вставкам и делециям в сайте разрыва. NHEJ опосредуется несколькими субпутями, каждый из которых имеет определенные мутационные последствия. Классический путь NHEJ (cNHEJ) нуждается в комплексе KU/DNA-PKcs/Lig4/XRCC4, вновь лигирует концы наряду с минимальным процессингом и часто приводит к точному восстановлению разрыва. Альтернативные пути NHEJ (altNHEJ) также активны в устранении разрывов дцДНК, но эти пути являются значительно более мутагенными и часто приводят к неточному восстановлению разрыва, характеризуемому вставками и делециями. Безотносительно к какой-либо конкретной теории, предусмотрено, что модификация разрывов дцДНК ферментами, модифицирующими концы, такими как, например, экзонуклеазы, например, Trex2, может увеличить вероятность неточного восстановления.
«Расщепление» относится к разрушению ковалентного остова молекулы ДНК. Расщепление может быть инициировано различными способами, включая, но не ограничиваясь указанными, ферментативный или химический гидролиз фосфодиэфирной связи. Возможно как одноцепочечное расщепление, так и двухцепочечное расщепление. Двухцепочечное расщепление может происходить в результате двух отдельных событий одноцепочечного расщепления. Расщепление ДНК может привести к образованию либо тупых концов, либо ступенчатых концов. Согласно определенным вариантам реализации настоящего изобретения полипептиды и варианты нуклеаз, например, варианты хоуминг-эндонуклеаз, megaTAL и т.д., предусмотренные в настоящем документе, применяют для нацеленного расщепления двухцепочечной ДНК. Сайты распознавания для расщепления эндонуклеазой могут находиться на любой цепи ДНК.
«Экзогенная» молекула представляет собой молекулу, которая обычно не присутствует в клетке, но которую вводят в клетку с помощью одного или более генетических, биохимических или других способов. Примерные экзогенные молекулы включают, но не ограничиваются указанными, небольшие органические молекулы, белок, нуклеиновую кислоту, углевод, липид, гликопротеин, липопротеин, полисахарид, любое модифицированное производное вышеуказанных молекул или любой комплекс, содержащий одну или более из вышеуказанных молекул. Способы введения экзогенных молекул в клетки известны специалистам в данной области техники и включают, но не ограничиваются указанными, опосредуемый липидами перенос (т.е. липосомы, включая нейтральные и катионные липиды), электропорацию, прямую инъекцию, слияние клеток бомбардировку частицами, наночастицы биополимера, совместное осаждение с фосфатом кальция, опосредуемый DEAE-декстраном перенос и опосредуемый вирусным вектором перенос.
«Эндогенная» молекула представляет собой молекулу, которая обычно присутствует в конкретной клетке на определенной стадии развития в определенных условиях окружающей среды. Дополнительные эндогенные молекулы могут включать белки.
«Ген» относится к области ДНК, кодирующей продукт гена, а также ко всем областям ДНК, которые регулируют выработку продукта гена, независимо от того, расположены ли такие регуляторные последовательности рядом с кодирующими и/или транскрибируемыми последовательностями или нет. Ген включает, но не ограничивается указанными, промоторные последовательности, энхансеры, сайленсеры, инсуляторы, граничные элементы, терминаторы, последовательности полиаденилирования, посттранскрипционные элементы ответа, трансляционные регуляторные последовательности, такие как сайты связывания рибосомы и сайты внутренней посадки рибосомы, точки начала репликации, сайты прикрепления матрицы и области контроля локусов.
«Экспрессия гена» относится к преобразованию информации, содержащейся в гене, в продукт гена. Продукт гена может представлять собой непосредственный продукт транскрипции гена (например, иРНК, тРНК, рРНК, антисмысловую РНК, рибозим, структурную РНК или любой другой тип РНК) или белок, полученный в результате трансляции иРНК. Продукты генов также включают РНК, которые модифицированы в результате таких процессов как кэпирование, полиаденилирование, метилирование и редактирование, и белки, модифицированные, например, метилированием, ацетилированием, фосфорилированием, убиквитинированием, ADP-рибозилированием, миристилированием и гликозилированием.
В настоящем документе термин «генетически сконструированный» или «генетически модифицированный» относится к хромосомному или внехромосомному добавлению дополнительного генетического материала в форме ДНК или РНК к общему генетическому материалу в клетке. Генетические модификации могут быть нацелены или не нацелены на конкретный сайт в геноме клетки. Согласно одному варианту реализации генетическая модификация является сайт-специфичной. Согласно одному варианту реализации генетическая модификация не является сайт-специфичной.
В настоящем документе термин «редактирование генома» относится к замене, делеции и/или введению генетического материала в сайт-мишень в геноме клетки, что восстанавливает, корректирует, нарушает и/или модифицирует экспрессию гена или продукта гена. Редактирование генома, предусмотренное в конкретных вариантах реализации, включает введение одного или более вариантов нуклеаз в клетку для создания повреждений ДНК в сайте-мишени или проксимально относительного него в геноме клетки, необязательно в присутствии донорной матрицы для восстановления.
В настоящем документе термин «генная терапия» относится к введению дополнительного генетического материала в общий генетический материал в клетке, что восстанавливает, корректирует или модифицирует экспрессию гена или продукта гена, или с целью экспрессии терапевтического полипептида. Согласно конкретным вариантам реализации настоящего изобретения генной терапией считается введение генетического материала в геном клетки с помощью редактирования генома, что восстанавливает, корректирует, нарушает или модифицирует экспрессию гена или продукта гена, или с целью экспрессии терапевтического полипептида.
«Иммунное нарушение» относится к заболеванию, которое вызывает ответ иммунной системы. Согласно конкретным вариантам реализации настоящего изобретения термин «иммунное нарушение» относится к раку, болезни «трансплантат против хозяина», аутоиммунному заболеванию или иммунодефициту. Согласно одному варианту реализации иммунные нарушения охватывают инфекционное заболевание.
В настоящем документе термин «рак» обычно относится к классу заболеваний или состояний, при которых патологические клетки делятся без контроля и могут проникать в близлежащие ткани.
В настоящем документе термин «злокачественный» относится к раку, при котором группа опухолевых клеток проявляет одно или более из неконтролируемого размножения (т.е. деления сверх нормальных пределов), инвазии (т.е. вторжения на соседние ткани и их разрушения) и метастазирования (т.е. распространения в другие участки тела за счет лимфы или крови).
В настоящем документе термин «метастазирование» относится к распространению рака из одной части тела в другую. Опухоль, образованная распространившимися клетками, называется «метастатическая опухоль» или «метастаз». Метастатическая опухоль содержит клетки, сходные с клетками исходной (первичной) опухоли.
В настоящем документе термин «доброкачественный» или «незлокачественный» относится к опухолям, которые могут увеличиваться в размерах, но не распространяются в другие части тела. Доброкачественные опухоли являются самоограниченными и обычно не способны к инвазии и метастазированию.
«Раковая клетка» или «опухолевая клетка» относится к отдельной клетке ракового образования или ткани. Опухоль обычно относится к отеку или повреждению, образованному в результате патологического размножения клеток, которые могут быть доброкачественными, предзлокачественными или злокачественными. Большинство видов рака образуют опухоли, но некоторые, например, лейкоз, не обязательно образуют опухоли. Для тех видов рака, которые образуют опухоли, термины рак (раковая клетка) и опухоль (опухолевая клетка) используются взаимозаменяемо. Количество опухоли у индивидуума представляет собой «опухолевую нагрузку», которую можно измерить как количество, объем или массу опухоли.
Термин «болезнь трансплантат против хозяина» или «РТПХ» относится к осложнениям, которые могут возникнуть после трансплантации клетки, ткани или плотного органа. РТПХ может возникнуть после трансплантации стволовых клеток или костного мозга, когда трансплантированные донорские клетки атакуют тело реципиента трансплантата. Острая РТПХ у человека происходит в течение приблизительно 60 дней после трансплантации и приводит к повреждению кожи, печени и кишечника под действием цитолитических лимфоцитов. Хроническая РТПХ возникает позже и представляет собой системное аутоиммунное заболевание, которое поражает главным образом кожу, что приводит к поликлональной активации В-клеток и гипервыработке Ig и аутоантител. «Болезнь трансплантат против хозяина» для трансплантата плотного органа (SOT-GVHD) встречается в двух формах. Более распространенным типом является тот, который опосредован антителами, причем антитела от донора с группой крови О атакуют красные кровяные клетки реципиента у реципиентов с группой крови А, В или АВ, что приводит к кратковременным гемолитическим анемиям легкой степени тяжести. Вторая форма SOT-GVHD представляет собой клеточный тип, ассоциированный с высокой смертностью, при котором T-клетки, происходящие от донора, вызывают иммунологическую атаку против иммунологически отличной ткани хозяина, чаще всего в коже, печени, желудочно-кишечном тракте и костном мозге, что приводит к осложнениям в этих органах.
Термин «трансплантат против лейкоза» или «GVL» относится к иммунному ответу иммунных клеток, присутствующих в трансплантированной ткани донора, такой как костный мозг или периферическая кровь, на клетки лейкоза человека.
«Аутоиммунное заболевание» относится к заболеванию, при котором организм вырабатывает иммуногенный (т.е. ответ иммунной системы) ответ на некоторую составляющую своей собственной ткани. Другими словами, иммунная система теряет способность распознавать какую-то ткань или систему в теле как «свою» и нацеливается и атакует ее как чужеродную. Иллюстративные примеры аутоиммунных заболеваний включают, но не ограничиваются ими: артрит, воспалительное заболевание кишечника, тиреоидит Хашимото, болезнь Грейвса, волчанку, рассеянный склероз, ревматоидный артрит, гемолитическую анемию, антииммунный тиреоидит, системную красную волчанку, целиакию, болезнь Крона, колит, диабет, склеродермию, псориаз и тому подобное.
«Иммунодефицит» означает состояние пациента, иммунная система которого была ослаблена в результате заболевания или введения химических соединений. Это состояние делает систему дефицитной по количеству и типу клеток крови, необходимых для защиты от инородного вещества. Иммунодефицитные состояния или заболевания известны в данной области техники и включают, например, СПИД (синдром приобретенного иммунодефицита), SCID (тяжелый комбинированный иммунодефицит), селективный дефицит IgA, вариабельный неклассифицируемый иммунодефицит, Х-сцепленную агаммаглобулинемию, хроническую гранулематозную болезнь, гипер-IgM-синдром, синдром Вискотта-Олдрича (WAS) и диабет.
«Инфекционное заболевание» относится к заболеванию, которое может передаваться от человека к человеку или от организма к организму и вызывается микробным или вирусным агентом (например, простуда). Инфекционные заболевания известны в данной области техники и включают, например, гепатит, заболевания, передаваемые половым путем (например, хламидиоз, гонорею), туберкулез, ВИЧ/СПИД, дифтерию, гепатит B, гепатит C, холеру и грипп.
В настоящем документе термины «индивидуум» и «субъект» часто используются взаимозаменяемо и относятся к любому животному, у которого проявляется симптом иммунного нарушения, которое можно лечить с применением вариантов нуклеаз, композиций для редактирования генома, векторов для генной терапии, векторов для редактирования генома, клеток с редактированным геномом и способов, предусмотренных в другом месте настоящего документа. Подходящие субъекты (например, пациенты) включают лабораторных животных (таких как мышь, крыса, кролик или морская свинка), сельскохозяйственных животных и домашних животных или животных-компаньонов (таких как кошка или собака). Включены приматы, не относящиеся к человеку, и предпочтительно человек. Типичные субъекты включают пациентов-людей, у которых было диагностировано иммунное нарушение или подвергающиеся риску его развития.
В настоящем документе термин «пациент» относится к субъекту, у которого диагностировано иммунное нарушение, которое можно лечить с применением вариантов нуклеаз, композиций для редактирования генома, векторов для генной терапии, векторов для редактирования генома, клеток с редактированным геномом и способов, предусмотренных в других местах настоящего документа.
В настоящем документе термин «лечение» или «лечащий» включает любой благоприятный или желательный эффект на симптомы или патологию заболевания или патологическое состояние и может включать даже минимальное снижение одного или более измеримых маркеров заболевания или состояния, которое лечат, например, рака, РТПХ, инфекционного заболевания, аутоиммунного заболевания, воспалительного заболевания и иммунодефицита. Лечение может включать задержку прогрессирования заболевания или состояния. «Лечение» не обязательно означает полное устранение или излечение заболевания или состояния или связанных с ним симптомов.
В настоящем документе термины «предотвращать» и подобные слова, такие как «предотвращение», «предотвращенный», «предотвращающий» и т.д., указывают на подход к предотвращению, ингибированию или снижению вероятности возникновения или рецидива заболевания или состояния, например, рака, РТПХ, инфекционного заболевания, аутоиммунного заболевания, воспалительного заболевания и иммунодефицита. Это также относится к задержке начала или рецидива заболевания или состояния или задержке появления или рецидива симптомов заболевания или состояния. В настоящем документе термин «предотвращение» и подобные слова также включают снижение интенсивности, эффекта, симптомов и/или бремени заболевания или состояния до начала или рецидива заболевания или состояния.
В настоящем документе выражение «уменьшение по меньшей мере одного симптома» относится к уменьшению одного или более симптомов заболевания или состояния, которое лечат у субъекта, например, рака, РТПХ, инфекционного заболевания, аутоиммунного заболевания, воспалительного заболевания и иммунодефицита. Согласно конкретным вариантам реализации настоящего изобретения заболевание или состояние, которое лечат, представляет собой рак, при котором один или более уменьшенных симптомов включают, но не ограничиваются указанными, слабость, усталость, одышку, легкие кровоподтеки и кровотечение, частые инфекции, увеличенные лимфатические узлы, вздутый или болезненный живот (из-за увеличенных органов брюшной полости), боль в костях или суставах, переломы, незапланированную потерю массы, плохой аппетит, ночной пот, стойкую легкую лихорадку и уменьшение мочеиспускания (из-за нарушения функции почек).
В настоящем документе термин «количество» относится к «количеству, эффективному» или «эффективному количеству» варианта нуклеазы, композиции для редактирования генома или клетки с редактированным геномом, достаточному для достижения благоприятного или желательного профилактического или терапевтического результата, включая клинические результаты.
«Профилактически эффективное количество» относится к количеству варианта нуклеазы, композиции для редактирования генома или клетки с редактированным геномом, достаточному для достижения желательного профилактического результата. Как правило, но не обязательно, поскольку профилактическая доза используется у субъектов до начала заболевания или на его более ранней стадии, профилактически эффективное количество меньше терапевтически эффективного количества.
«Терапевтически эффективное количество» варианта нуклеазы, композиции для редактирования генома или клетки с редактированным геномом может варьироваться в соответствии с такими факторами как патологическое состояние, возраст, пол и масса индивидуума и способность вызывать желательный ответ у индивидуума. Терапевтически эффективное количество также представляет собой количество, при котором терапевтически благоприятные эффекты превосходят любые токсические или вредные эффекты. Термин «терапевтически эффективное количество» включает количество, которое эффективно для «лечения» субъекта (например, пациента). Если указано терапевтическое количество, точное количество композиций, предусмотренных в конкретных вариантах реализации, которое должно быть введено, может быть определено врачом с учетом описания и с учетом индивидуальных различий в возрасте, массе, размере опухоли, степени инфекции или метастазов и состоянии пациента (субъекта).
C. ВАРИАНТЫ НУКЛЕАЗ
Варианты нуклеаз, предусмотренные в конкретных вариантах реализации в настоящем документе, являются подходящими для редактирования генома сайта-мишени в гене CBLB и содержат один или более ДНК-связывающих доменов и один или более доменов расщепления ДНК (например, один или более эндонуклеазных и/или экзонуклеазных доменов) и необязательно один или более линкеров, предусмотренных в настоящем документе. Термины «перепрограммированная нуклеаза», «модифицированная нуклеаза» или «вариант нуклеазы» используются взаимозаменяемо и относятся к нуклеазе, содержащей один или более ДНК-связывающих доменов и один или более доменов расщепления ДНК, причем нуклеаза была разработана и/или модифицирована из исходной или природной нуклеазы для связывания и расщепления двухцепочечной последовательности-мишени ДНК в гене CBLB.
Согласно конкретным вариантам реализации настоящего изобретения вариант нуклеазы связывает и расщепляет последовательность-мишень в экзоне 6 гена CBLB, предпочтительно в SEQ ID NO: 20 в экзоне 6 гена CBLB и более предпочтительно в последовательности «ATTC» в SEQ ID NO: 20 в экзоне 6 гена CBLB.
Вариант нуклеазы может быть разработан и/или модифицирован из природной нуклеазы или из предыдущего варианта нуклеазы. Варианты нуклеаз, предусмотренные в конкретных вариантах реализации, могут дополнительно содержать один или более дополнительных функциональных доменов, например, модифицирующий концы ферментативный домен из модифицирующего концы фермента, который проявляет 5'-3'-экзонуклеазную, 5'-3'-щелочную экзонуклеазную, 3'-5'-экзонуклеазную (например, Trex2), 5'-флэп-эндонуклеазную, геликазную активность, зависимую от матрицы или независимую от матрицы ДНК-полимеразную активность.
Иллюстративные примеры вариантов нуклеаз, которые связывают и расщепляют последовательность-мишень в гене CBLB, включают, но не ограничиваются указанными, варианты хоуминг-эндонуклеаз (мегануклеазу) и megaTAL.
1. ВАРИАНТЫ ХОУМИНГ-ЭНДОНУКЛЕАЗ (МЕГАНУКЛЕАЗА)
Согласно различным вариантам реализации хоуминг-эндонуклеазу или мегануклеазу перепрограммируют для введения двухцепочечного разрыва (ДЦР) в сайт-мишень в гене CBLB. Согласно конкретным вариантам реализации настоящего изобретения вариант хоуминг-эндонуклеазы вводит двухцепочечный разрыв в экзоне 6 гена CBLB, предпочтительно в SEQ ID NO: 20 в экзоне 6 гена CBLB и более предпочтительно в последовательность «ATTC» в SEQ ID NO: 20 в экзоне 6 гена CBLB.
«Хоуминг-эндонуклеаза» и «мегануклеаза» используются взаимозаменяемо и относятся к природным хоуминг-эндонуклеазам, которые распознают сайты расщепления из 12-45 пар оснований и обычно сгруппированы в пять семейств на основе последовательности и структурных мотивов: LAGLIDADG, GIY-YIG, HNH, блок His-Cys и PD-(D/E)XK.
«Эталонная хоуминг-эндонуклеаза» или «эталонная мегануклеаза» относится к хоуминг-эндонуклеазе дикого типа или хоуминг-эндонуклеазе, встречающейся в природе. Согласно одному варианту реализации «эталонная хоуминг-эндонуклеаза» относится к хоуминг-эндонуклеазе дикого типа, которая была модифицирована для увеличения исходной активности.
«Модифицированная хоуминг-эндонуклеаза», «перепрограммированная хоуминг-эндонуклеаза», «вариант хоуминг-эндонуклеазы», «модифицированная мегануклеаза», «перепрограммированная мегануклеаза» или «вариант мегануклеазы» относится к хоуминг-эндонуклеазе, содержащей один или более ДНК-связывающих доменов и один или более доменов расщепления ДНК, причем хоуминг-эндонуклеаза была разработана и/или модифицирована из исходной или природной хоуминг-эндонуклеазы для связывания и расщепления последовательности-мишени ДНК в гене CBLB. Вариант хоуминг-эндонуклеазы может быть разработан и/или модифицирован из природной хоуминг-эндонуклеазы или из другого варианта хоуминг-эндонуклеазы. Варианты хоуминг-эндонуклеаз, предусмотренные в конкретных вариантах реализации, могут дополнительно содержать один или более дополнительных функциональных доменов, например, модифицирующий концы ферментативный домен из модифицирующего концы фермента, который проявляет 5'-3'-экзонуклеазную, 5'-3'-щелочную экзонуклеазную, 3'-5'-экзонуклеазную (например, Trex2), 5'-флэп-эндонуклеазную, геликазную активность, зависимую от матрицы или независимую от матрицы ДНК-полимеразную активность.
Варианты хоуминг-эндонуклеаз (HE) не существуют в природе и могут быть получены с помощью технологии рекомбинантной ДНК или случайного мутагенеза. Варианты HE могут быть получены путем внесения одного или более изменений аминокислот, например, путем мутирования, замены, добавления или удаления одной или более аминокислот в природной HE или варианте HE. Согласно конкретным вариантам реализации настоящего изобретения вариант HE содержит одно или более изменений аминокислот в поверхности распознавания ДНК.
Варианты HE, предусмотренные в конкретных вариантах реализации, могут дополнительно содержать один или более линкеров и/или дополнительных функциональных доменов, например, модифицирующий концы ферментативный домен из модифицирующего концы фермента, который проявляет 5'-3'-экзонуклеазную, 5'-3'-щелочную экзонуклеазную, 3'-5'-экзонуклеазную (например, Trex2), 5'-флэп-эндонуклеазную, геликазную активность, зависимую от матрицы или независимую от матрицы ДНК-полимеразную активность. Согласно конкретным вариантам реализации настоящего изобретения варианты HE вводят в T-клетку с применением модифицирующего концы фермента, который проявляет 5'-3'-экзонуклеазную, 5'-3'-щелочную экзонуклеазную, 3'-5'-экзонуклеазную (например, Trex2), 5'-флэп-эндонуклеазную, геликазную активность, зависимую от матрицы или независимую от матрицы ДНК-полимеразную активность. Вариант HE и 3'-модифицирующий фермент могут быть введены по отдельности, например, в разных векторах или отдельных иРНК, или вместе, например, в виде гибридного белка, или в полицистронной конструкции, разделенной вирусным саморасщепляющимся пептидом или элементом IRES.
«Поверхность распознавания ДНК» относится к аминокислотным остаткам HE, которые взаимодействуют с основаниями-мишенями нуклеиновых кислот, а также к соседним с ними остаткам. Для каждой HE поверхность распознавания ДНК содержит обширную сеть контактов боковая цепь-боковая цепь и боковая цепь-ДНК, большинство из которых являются единственно необходимыми для распознавания конкретной последовательности-мишени нуклеиновой кислоты. Таким образом, аминокислотная последовательность поверхности распознавания ДНК, соответствующая конкретной последовательности нуклеиновой кислоты, значительно варьируется и представляет собой характерный признак любой природной HE или варианта HE. В качестве неограничивающего примера, вариант HE, предусмотренный в конкретных вариантах реализации, может быть получен путем конструирования библиотек вариантов HE, в которых варьируется один или более остатков аминокислот, локализованных в поверхности распознавания ДНК природной HE (или полученного ранее варианта HE). Библиотеки могут быть подвергнуты скринингу в отношении активности расщепления мишени против каждого предсказанного сайта-мишени CBLB с применением анализов расщепления (см., например, Jarjour et al., 2009. Nuc. Acids Res. 37(20): 6871-6880).
Хоуминг-эндонуклеазы LAGLIDADG (LHE) являются наиболее хорошо изученным семейством хоуминг-эндонуклеаз, кодируются главным образом у архей и в ДНК органелл зеленых водорослей и грибов, а также проявляют самую высокую общую специфичность распознавания ДНК. LHE содержат один или два каталитических мотива LAGLIDADG на цепь белка и функционируют как гомодимеры или одноцепочечные мономеры, соответственно. Структурные исследования белков LAGLIDADG выявили высококонсервативную коровую структуру (Stoddard 2005), характеризующуюся складкой αββαββα, при этом мотив LAGLIDADG принадлежит первой спирали этой складки. Высокоэффективное и специфичное расщепление LHE представляет собой белковый каркас для получения новых высокоспецифичных эндонуклеаз. Однако модификация LHE для связывания и расщепления неприродного или неканонического сайта-мишени требует отбора подходящего каркаса LHE, исследования локуса-мишени, отбора предполагаемых сайтов-мишеней и значительного изменения LHE для изменения ее точек контакта с ДНК и специфичности расщепления, в вплоть до двух третьих положений пар оснований в сайте-мишени.
Согласно одному варианту реализации LHE, из которых могут быть разработаны перепрограммированные LHE или варианты LHE, включают, но не ограничиваются указанными, I-CreI и I-SceI.
Иллюстративные примеры LHE, из которых могут быть разработаны перепрограммированные LHE или варианты LHE, включают, но не ограничиваются указанными, I-AabMI, I-AaeMI, I-AniI, I-ApaMI, I-CapIII, I-CapIV, I-CkaMI, I-CpaMI, I-CpaMII, I-CpaMIII, I-CpaMIV, I-CpaMV, I-CpaV, I-CraMI, I-EjeMI, I-GpeMI, I-GpiI, I-GzeMI, I-GzeMII, I-GzeMIII, I-HjeMI, I-LtrII, I-LtrI, I-LtrWI, I-MpeMI, I-MveMI, I-NcrII, I-Ncrl, I-NcrMI, I-OheMI, I-OnuI, I-OsoMI, I-OsoMII, I-OsoMIII, I-OsoMIV, I-PanMI, I-PanMII, I-PanMIII, I-PnoMI, I-ScuMI, I-SmaMI, I-SscMI и I-Vdi141I.
Согласно одному варианту реализации перепрограммированная LHE или вариант LHE выбран из группы, состоящей из: варианта I-CpaMI, варианта I-HjeMI, варианта I-OnuI, варианта I-PanMI и варианта I-SmaMI.
Согласно одному варианту реализации перепрограммированная LHE или вариант LHE представляет собой вариант I-OnuI. См., например, SEQ ID NO: 6-12.
Согласно одному варианту реализации перепрограммированные LHE I-OnuI или варианты I-OnuI, нацеленные на ген CBLB, были получены из природной I-OnuI или ее биологически активного фрагмента (SEQ ID NO: 1-5). Согласно предпочтительному варианту реализации настоящего изобретения перепрограммированные LHE I-OnuI или варианты I-OnuI, нацеленные на человеческий ген CBLB, были получены из существующего варианта I-OnuI. Согласно одному варианту реализации перепрограммированные LHE I-OnuI получены против сайта-мишени человеческого гена CBLB, представленного в SEQ ID NO: 20.
Согласно конкретному варианту реализации перепрограммированная LHE I-OnuI или вариант I-OnuI, который связывает и расщепляет человеческий ген CBLB, содержит одну или более замен аминокислот в поверхности распознавания ДНК. Согласно конкретным вариантам реализации настоящего изобретения LHE I-OnuI, которая связывает и расщепляет человеческий ген CBLB, по меньшей мере на 70%, по меньшей мере на 71%, по меньшей мере на 72%, по меньшей мере на 73%, по меньшей мере на 74%, по меньшей мере на 75%, по меньшей мере на 76%, по меньшей мере на 77%, по меньшей мере на 78%, по меньшей мере на 79%, по меньшей мере на 80%, по меньшей мере на 81%, по меньшей мере на 82%, по меньшей мере на 83%, по меньшей мере на 84%, по меньшей мере на 85%, по меньшей мере на 86%, по меньшей мере на 87%, по меньшей мере на 88%, по меньшей мере на 89%, по меньшей мере на 90%, по меньшей мере на 91%, по меньшей мере на 92%, по меньшей мере на 93%, по меньшей мере на 94%, по меньшей мере на 95%, по меньшей мере на 96%, по меньшей мере на 97%, по меньшей мере на 98% или по меньшей мере на 99% идентична последовательности поверхности распознавания ДНК I-OnuI (Taekuchi et al. 2011. Proc Natl Acad Sci U. S. A. 2011 Aug 9; 108(32): 13077-13082) или варианта LHE I-OnuI, представленного в любой из SEQ ID NO: 6-12, ее биологически активные фрагменты и/или ее дополнительные варианты.
Согласно одному варианту реализации LHE I-OnuI, которая связывает и расщепляет человеческий ген CBLB, по меньшей мере на 70%, более предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 85%, более предпочтительно по меньшей мере на 90%, более предпочтительно по меньшей мере на 95% более предпочтительно по меньшей мере на 97%, более предпочтительно по меньшей мере на 99% идентична последовательности поверхности распознавания ДНК I-OnuI (Taekuchi et al. 2011. Proc Natl Acad Sci U. S. A. 2011 Aug 9; 108(32): 13077-13082) или варианта LHE I-OnuI, представленного в любой из SEQ ID NO: 6-12, ее биологически активные фрагменты и/или ее дополнительные варианты.
Согласно конкретному варианту реализации вариант LHE I-OnuI, который связывает и расщепляет человеческий ген CBLB, содержит одну или более замен аминокислот или модификаций в поверхности распознавания ДНК I-OnuI, представленной в любой из SEQ ID NO: 1-12, его биологически активные фрагменты и/или его дополнительные варианты.
Согласно конкретному варианту реализации вариант LHE I-OnuI, который связывает и расщепляет человеческий ген CBLB, содержит одну или более замен аминокислот или модификаций в поверхности распознавания ДНК, в частности, в субдоменах, расположенных в положениях 24-50, 68-82, 180-203 и 223-240 I-OnuI (SEQ ID NO: 1-5) или варианта I-OnuI, представленного в любой из SEQ ID NO: 6-12, его биологически активные фрагменты и/или его дополнительные варианты.
Согласно конкретным вариантам реализации настоящего изобретения вариант HE содержит одну или более замен аминокислот в поверхности распознавания ДНК в положениях аминокислот, выбранных из группы, состоящей из: 24, 26, 28, 30, 32, 34, 35, 36, 37, 38, 40, 42, 44, 46, 48, 68, 70, 72, 75, 76, 78, 80, 82, 180, 182, 184, 186, 188, 189, 190, 191, 192, 193, 195, 197, 199, 201, 203, 223, 225, 227, 229, 231, 232, 234, 236, 238 и 240 I-OnuI (SEQ ID NO: 1-5) или варианта I-OnuI, представленного в любой из SEQ ID NO: 6-12, его биологически активные фрагменты и/или его дополнительные варианты.
Согласно конкретным вариантам реализации настоящего изобретения вариант HE содержит одну или более замен аминокислот в положениях аминокислот, выбранных из группы, состоящей из: 19, 24, 26, 28, 30, 32, 34, 35, 36, 37, 38, 40, 42, 44, 46, 48, 59, 68, 70, 72, 75, 76 77, 78, 80, 82, 168, 180, 182, 184, 186, 188, 189, 190, 191, 192, 193, 195, 197, 199, 201, 203, 223, 225, 227, 229, 231, 232, 234, 236, 238 и 240 I-OnuI (SEQ ID NO: 1-5) или варианта I-OnuI, представленного в любой из SEQ ID NO: 6-12, его биологически активные фрагменты и/или его дополнительные варианты.
Согласно конкретному варианту реализации настоящего изобретения вариант LHE I-OnuI, который связывает и расщепляет человеческий ген CBLB, содержит 5, 10, 15, 20, 25, 30, 35 или 40 или более замен аминокислот или модификаций в поверхности распознавания ДНК, в частности, в субдоменах, расположенных в положениях 24-50, 68-82, 180-203 и 223-240 I-OnuI (SEQ ID NO: 1-5) или варианта I-OnuI, представленного в любой из SEQ ID NO: 6-12, его биологически активные фрагменты и/или его дополнительные варианты.
Согласно конкретному варианту реализации настоящего изобретения вариант LHE I-OnuI, который связывает и расщепляет человеческий ген CBLB, содержит 5, 10, 15, 20, 25, 30, 35 или 40 или более замен аминокислот или модификаций в положениях аминокислот, выбранных из группы, состоящей из: 24, 26, 28, 30, 32, 34, 35, 36, 37, 38, 40, 42, 44, 46, 48, 68, 70, 72, 75, 76, 78, 80, 82, 180, 182, 184, 186, 188, 189, 190, 191, 192, 193, 195, 197, 199, 201, 203, 223, 225, 227, 229, 231, 232, 234, 236, 238 и 240 I-OnuI (SEQ ID NO: 1-5) или варианта I-OnuI, представленного в любой из SEQ ID NO: 6-12, его биологически активные фрагменты и/или его дополнительные варианты.
Согласно конкретному варианту реализации настоящего изобретения вариант LHE I-OnuI, который связывает и расщепляет человеческий ген CBLB, содержит 5, 10, 15, 20, 25, 30, 35 или 40 или более замен аминокислот или модификаций в положениях аминокислот, выбранных из группы, состоящей из: 19, 24, 26, 28, 30, 32, 34, 35, 36, 37, 38, 40, 42, 44, 46, 48, 59, 68, 70, 72, 75, 76 77, 78, 80, 82, 168, 180, 182, 184, 186, 188, 189, 190, 191, 192, 193, 195, 197, 199, 201, 203, 223, 225, 227, 229, 231, 232, 234, 236, 238 и 240 I-OnuI (SEQ ID NO: 1-5) или варианта I-OnuI, представленного в любой из SEQ ID NO: 6-12, его биологически активные фрагменты и/или его дополнительные варианты.
Согласно одному варианту реализации вариант LHE I-OnuI, который связывает и расщепляет человеческий ген CBLB, содержит одну или более замен аминокислот или модификаций в дополнительных положениях, расположенных где-либо в пределах полной последовательности I-OnuI. Остатки, которые могут быть заменены и/или модифицированы, включают, но не ограничиваются указанными, аминокислоты, которые контактируют с нуклеиновой кислотой-мишенью или которые взаимодействуют с остовом нуклеиновой кислоты или с нуклеотидными основаниями, непосредственно или за счет молекулы воды. В одном неограничивающем примере вариант LHE I-OnuI, предусмотренный в настоящем документе, который связывает и расщепляет человеческий ген CBLB, содержит одну или более замен и/или модификаций, предпочтительно по меньшей мере 5, предпочтительно по меньшей мере 10, предпочтительно по меньшей мере 15, предпочтительно по меньшей мере 20, более предпочтительно по меньшей мере 25, более предпочтительно по меньшей мере 30, еще более предпочтительно по меньшей мере 35 или еще более предпочтительно по меньшей мере 40 или более замен аминокислот в по меньшей мере одном положении, выбранном из группы положений, состоящей из положений: 24, 26, 28, 30, 32, 34, 35, 36, 37, 38, 40, 42, 44, 46, 48, 68, 70, 72, 78, 80, 92, 116, 138, 143, 159, 168, 178, 180, 182, 184, 186, 188, 189, 190, 191, 192, 193, 195, 197, 199, 201, 203, 207, 223, 225, 227, 232, 236 и 238 I-OnuI (SEQ ID NO: 1-5) или варианта I-OnuI, представленного в любой из SEQ ID NO: 6-12, его биологически активные фрагменты и/или его дополнительные варианты.
Согласно определенным вариантам реализации настоящего изобретения вариант HE расщепляет сайт-мишень экзона 6 CBLB и содержит по меньшей мере 5, по меньшей мере 15, предпочтительно по меньшей мере 25, более предпочтительно по меньшей мере 35 или даже более предпочтительно по меньшей мере 40 или более из следующих замен аминокислот: S24C, L26R, L26G, R28D, R28Y, R30H, N32A, N32S, K34D, K34V, S35L, S36R, V37A, V37S, S40R, E42R, G44A, G44S, Q46E, T48V, T48S, V68T, V68K, A70Y, S72A, S78R, K80Q, D92G, V116L, L138M, T143N, S159P, F168L, E178D, C180S, F182V, F182M, N184E, I186K, I186M, S188R, S188N, K189R, S190N, K191P, K191N, L192V, G193K, G193I, Q195G, Q195R, Q197R, V199R, S201G, T203S, K207R, Y223R, K225V, K227N, F232H, D236E и V238I I-OnuI (SEQ ID NO: 1-5) или варианта I-OnuI, представленного в любой из SEQ ID NO: 6-12, его биологически активные фрагменты и/или его дополнительные варианты.
Согласно некоторым вариантам реализации настоящего изобретения вариант HE расщепляет сайт-мишень CBLB и содержит по меньшей мере 5, по меньшей мере 15, предпочтительно по меньшей мере 25, более предпочтительно по меньшей мере 35 или даже более предпочтительно по меньшей мере 40 или более из следующих замен аминокислот: S24C, L26R, R28D, N32A, K34D, S35L, S36R, V37A, S40R, E42R, G44A, Q46E, T48V, V68T, A70Y, S72A, S78R, K80Q, L138M, T143N, F168L, E178D, C180S, F182V, N184E, I186K, S188R, K189R, K191P, L192V, G193K, Q195G, Q197R, V199R, K207R, Y223R, K225V, K227N, F232H, D236E и V238I I-OnuI (SEQ ID NO: 1-5) или варианта I-OnuI, представленного в любой из SEQ ID NO: 6-12, его биологически активные фрагменты и/или его дополнительные варианты.
Согласно конкретным вариантам реализации настоящего изобретения вариант HE расщепляет сайт-мишень CBLB и содержит по меньшей мере 5, по меньшей мере 15, предпочтительно по меньшей мере 25, более предпочтительно по меньшей мере 35 или даже более предпочтительно по меньшей мере 40 или более из следующих замен аминокислот: S24C, L26R, R28D, N32A, K34D, S35L, S36R, V37A, S40R, E42R, G44A, Q46E, T48V, V68T, A70Y, S72A, S78R, K80Q, L138M, T143N, S159P, F168L, E178D, C180S, F182M, N184E, I186M, S188N, S190N, K191N, L192V, G193I, Q195R, Q197R, V199R, T203S, K207R, Y223R, K225V, K227N, F232H, D236E и V238I из I-OnuI (SEQ ID NO: 1-5) или варианта I-OnuI, представленного в любой из SEQ ID NO: 6-12, его биологически активные фрагменты и/или его дополнительные варианты.
Согласно конкретным вариантам реализации настоящего изобретения вариант HE расщепляет сайт-мишень CBLB и содержит по меньшей мере 5, по меньшей мере 15, предпочтительно по меньшей мере 25, более предпочтительно по меньшей мере 35 или даже более предпочтительно по меньшей мере 40 или более из следующих замен аминокислот: S24C, L26R, R28D, N32A, K34D, S35L, S36R, V37A, S40R, E42R, G44S, Q46E, T48S, V68T, A70Y, S72A, S78R, K80Q, D92G, V116L, L138M, T143N, S159P, F168L, E178D, C180S, F182M, N184E, I186M, S188N, S190N, K191N, L192V, G193I, Q195R, Q197R, V199R, T203S, K207R, Y223R, K225V, K227N, F232H, D236E и V238I I-OnuI (SEQ ID NO: 1-5) или варианта I-OnuI, представленного в любой из SEQ ID NO: 6-12, его биологически активные фрагменты и/или его дополнительные варианты.
Согласно конкретным вариантам реализации настоящего изобретения вариант HE расщепляет сайт-мишень CBLB и содержит по меньшей мере 5, по меньшей мере 15, предпочтительно по меньшей мере 25, более предпочтительно по меньшей мере 35 или даже более предпочтительно по меньшей мере 40 или более из следующих замен аминокислот: S24C, L26R, R28D, R30H, N32A, K34V, S35L, S36R, V37S, S40R, E42R, G44S, Q46E, T48V, V68T, V68K, A70Y, S72A, S78R, K80Q, L138M, T143N, S159P, F168L, E178D, C180S, F182M, N184E, I186M, S188N, S190N, K191N, L192V, G193I, Q195R, Q197R, V199R, T203S, K207R, Y223R, K225V, K227N, F232H, D236E и V238I I-OnuI (SEQ ID NO: 1-5) или варианта I-OnuI, представленного в любой из SEQ ID NO: 6-12, его биологически активные фрагменты и/или его дополнительные варианты.
Согласно конкретным вариантам реализации настоящего изобретения вариант HE расщепляет сайт-мишень CBLB и содержит по меньшей мере 5, по меньшей мере 15, предпочтительно по меньшей мере 25, более предпочтительно по меньшей мере 35 или даже более предпочтительно по меньшей мере 40 или более из следующих замен аминокислот: S24C, L26G, R28Y, R30H, N32S, K34V, S35L, S36R, V37S, S40R, E42R, G44S, Q46E, T48S, V68T, A70Y, S72A, S78R, K80Q, V116L, L138M, T143N, S159P, F168L, E178D, C180S, F182M, N184E, I186M, S188N, S190N, K191N, L192V, G193I, Q195R, Q197R, V199R, T203S, K207R, Y223R, K225V, K227N, F232H, D236E и V238I I-OnuI (SEQ ID NO: 1-5) или варианта I-OnuI, представленного в любой из SEQ ID NO: 6-12, его биологически активные фрагменты и/или его дополнительные варианты.
Согласно конкретным вариантам реализации настоящего изобретения вариант HE расщепляет сайт-мишень CBLB и содержит по меньшей мере 5, по меньшей мере 15, предпочтительно по меньшей мере 25, более предпочтительно по меньшей мере 35 или даже более предпочтительно по меньшей мере 40 или более из следующих замен аминокислот: S24C, L26R, R28D, R30H, N32A, K34V, S35L, S36R, V37S, S40R, E42R, G44S, Q46E, T48V, V68T, A70Y, S72A, S78R, K80Q, V116L, L138M, T143N, S159P, F168L, E178D, C180S, F182V, N184E, I186K, S188R, K189R, K191P, L192V, G193K, Q195G, Q197R, V199R, S201G, K207R, Y223R, K225V, K227N, F232H, D236E и V238I I-OnuI (SEQ ID NO: 1-5) или варианта I-OnuI, представленного в любой из SEQ ID NO: 6-12, его биологически активные фрагменты и/или его дополнительные варианты.
Согласно конкретным вариантам реализации настоящего изобретения вариант HE расщепляет сайт-мишень CBLB и содержит по меньшей мере 5, по меньшей мере 15, предпочтительно по меньшей мере 25, более предпочтительно по меньшей мере 35 или даже более предпочтительно по меньшей мере 40 или более из следующих замен аминокислот: S24C, L26R, R28D, N32A, K34D, S35L, S36R, V37A, S40R, E42R, G44A, Q46E, T48V, V68T, A70Y, S72A, S78R, K80Q, D92G, L138M, T143N, S159P, F168L, E178D, C180S, F182M, N184E, I186M, S188N, S190N, K191N, L192V, G193I, Q195R, Q197R, V199R, T203S, K207R, Y223R, K225V, K227N, F232H, D236E и V238I I-OnuI (SEQ ID NO: 1-5) или варианта I-OnuI, представленного в любой из SEQ ID NO: 6-12, его биологически активные фрагменты и/или его дополнительные варианты.
Согласно конкретным вариантам реализации настоящего изобретения вариант LHE I-OnuI, который связывает и расщепляет человеческий ген CBLB, содержит аминокислотную последовательность, которая по меньшей мере на 80%, предпочтительно по меньшей мере на 85%, более предпочтительно по меньшей мере на 90% или даже более предпочтительно по меньшей мере на 95% идентична аминокислотной последовательности, представленной в любой из SEQ ID NO: 6-12, или его биологически активный фрагмент.
Согласно конкретным вариантам реализации настоящего изобретения вариант LHE I-OnuI содержит аминокислотную последовательность, представленную в любой из SEQ ID NO: 6-12, или его биологически активный фрагмент.
Согласно конкретным вариантам реализации настоящего изобретения вариант LHE I-OnuI содержит аминокислотную последовательность, представленную в SEQ ID NO: 6, или его биологически активный фрагмент.
Согласно конкретным вариантам реализации настоящего изобретения вариант LHE I-OnuI содержит аминокислотную последовательность, представленную в SEQ ID NO: 7, или его биологически активный фрагмент.
Согласно конкретным вариантам реализации настоящего изобретения вариант LHE I-OnuI содержит аминокислотную последовательность, представленную в SEQ ID NO: 8, или его биологически активный фрагмент.
Согласно конкретным вариантам реализации настоящего изобретения вариант LHE I-OnuI содержит аминокислотную последовательность, представленную в SEQ ID NO: 9, или его биологически активный фрагмент.
Согласно конкретным вариантам реализации настоящего изобретения вариант LHE I-OnuI содержит аминокислотную последовательность, представленную в SEQ ID NO: 10, или его биологически активный фрагмент.
Согласно конкретным вариантам реализации настоящего изобретения вариант LHE I-OnuI содержит аминокислотную последовательность, представленную в SEQ ID NO: 11, или его биологически активный фрагмент.
Согласно конкретным вариантам реализации настоящего изобретения вариант LHE I-OnuI содержит аминокислотную последовательность, представленную в SEQ ID NO: 12, или его биологически активный фрагмент.
2. MegaTAL
Согласно различным вариантам реализации megaTAL, содержащую вариант хоуминг-эндонуклеазы, перепрограммируют для введения двухцепочечного разрыва (ДЦР) в сайт-мишень в гене CBLB. Согласно конкретным вариантам реализации настоящего изобретения megaTAL вводит ДЦР в экзоне 6 гена CBLB, предпочтительно в SEQ ID NO: 20 в экзоне 6 гена CBLB и более предпочтительно в последовательности «ATTC» в SEQ ID NO: 20 в экзоне 6 гена CBLB.
«MegaTAL» относится к полипептиду, содержащему ДНК-связывающий домен TALE и вариант хоуминг-эндонуклеазы, который связывает и расщепляет последовательность-мишень ДНК в гене CBLB, и необязательно содержит один или более линкеров и/или дополнительных функциональных доменов, например, модифицирующий концы ферментативный домен из модифицирующего концы фермента, который проявляет 5'-3'-экзонуклеазную, 5'-3'-щелочную экзонуклеазную, 3'-5'-экзонуклеазную (например, Trex2), 5'-флэп-эндонуклеазную, геликазную активность, независимую от матрицы ДНК-полимеразную активность.
Согласно конкретным вариантам реализации настоящего изобретения megaTAL может быть введена в клетку вместе с модифицирующим концы ферментом, который проявляет 5'-3'-экзонуклеазную, 5'-3'-щелочную экзонуклеазную, 3'-5'-экзонуклеазную (например, Trex2), 5'-флэп-эндонуклеазную, геликазную активность, зависимую от матрицы или независимую от матрицы ДНК-полимеразную активность. MegaTAL и 3'-модифицирующий фермент могут быть введены по отдельности, например, в разных векторах или отдельных иРНК, или вместе, например, в виде гибридного белка, или в полицистронной конструкции, разделенной вирусным саморасщепляющимся пептидом или элементом IRES.
«ДНК-связывающий домен TALE» представляет собой ДНК-связывающую часть эффекторов, подобных активаторам транскрипции (TALE или TAL-эффекторы), которые имитируют активаторы транскрипции растений для манипулирования транскриптомом растения (см., например, Kay et al., 2007. Science 318:648-651). ДНК-связывающие домены TALE, предусмотренные в конкретных вариантах реализации, модифицированы de novo или из природных TALE, например, AvrBs3 из Xanthomonas campestris pv. vesicatoria, Xanthomonas gardneri, Xanthomonas translucens, Xanthomonas axonopodis, Xanthomonas perforans, Xanthomonas alfalfa, Xanthomonas citri, Xanthomonas euvesicatoria и Xanthomonas oryzae, а также brg11 и hpx17 из Ralstonia solanacearum. Иллюстративные примеры белков TALE для получения и разработки ДНК-связывающих доменов раскрыты в патенте США № 9017967 и цитированных в нем ссылках, все из которых полностью включены в настоящий документ посредством ссылки.
Согласно конкретным вариантам реализации настоящего изобретения megaTAL содержит ДНК-связывающий домен TALE, содержащий одно или более повторяющихся звеньев, которые участвуют в связывании ДНК-связывающего домена TALE с соответствующей ему последовательностью ДНК-мишени. Одно «повторяющееся звено» (также называемое «повтор»), как правило, имеет 33-35 аминокислот в длину. Каждое повторяющееся звено ДНК-связывающего домена TALE включает 1 или 2 ДНК-связывающих остатка, составляющих пару вариабельных аминокислотных остатков (RVD), обычно в положениях 12 и/или 13 повтора. Природный (канонический) код для распознавания ДНК этих ДНК-связывающих доменов TALE был определен и установлено, что последовательность HD в положениях 12 и 13 приводит к связыванию с цитозином (C), NG связывается с T, NI связывается с A, NN связывается с G или A и NG связывается с T. Согласно определенным вариантам реализации настоящего изобретения предусмотрены неканонические (нетипичные) RVD.
Иллюстративные примеры неканонических RVD, подходящих для применения в конкретных megaTAL, предусмотренных в конкретных вариантах реализации, включают, но не ограничиваются указанными, HH, KH, NH, NK, NQ, RH, RN, SS, NN, SN, KN для распознавания гуанина (G); NI, KI, RI, HI, SI для распознавания аденина (A); NG, HG, KG, RG для распознавания тимина (T); RD, SD, HD, ND, KD, YG для распознавания цитозина (C); NV, HN для распознавания A или G; и H*, HA, KA, N*, NA, NC, NS, RA, S* для распознавания A или T, или G, или C, где (*) означает, что аминокислота в положении 13 отсутствует. Дополнительные иллюстративные примеры RVD, подходящих для применения в конкретных megaTAL, предусмотренных в конкретных вариантах реализации, дополнительно включают те, которые раскрыты в патенте США № 8614092, который полностью включен в настоящий документ посредством ссылки.
Согласно конкретным вариантам реализации настоящего изобретения megaTAL, предусмотренная в настоящем документе, содержит ДНК-связывающий домен TALE, содержащий от 3 до 30 повторяющихся звеньев. Согласно некоторым вариантам реализации настоящего изобретения megaTAL содержит 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 повторяющихся звеньев ДНК-связывающего домена TALE. Согласно предпочтительному варианту реализации настоящего изобретения megaTAL, предусмотренная в настоящем документе, содержит ДНК-связывающий домен TALE, содержащий 5-15 повторяющихся звеньев, более предпочтительно 7-15 повторяющихся звеньев, более предпочтительно 9-15 повторяющихся звеньев и более предпочтительно 9, 10, 11, 12, 13, 14 или 15 повторяющихся звеньев.
Согласно конкретным вариантам реализации настоящего изобретения megaTAL, предусмотренная в настоящем документе, содержит ДНК-связывающий домен TALE, содержащий от 3 до 30 повторяющихся звеньев, и дополнительное одиночное укороченное повторяющееся звено TALE, содержащее 20 аминокислот, расположенных на C-конце группы повторяющихся звеньев TALE, т.е. дополнительное C-концевое повторяющееся полузвено ДНК-связывающего домена TALE (аминокислоты от -20 до -1 C-кэпа, раскрытые ниже в другом месте настоящего документа). Таким образом, согласно конкретным вариантам реализации настоящего изобретения megaTAL, предусмотренная в настоящем документе, содержит ДНК-связывающий домен TALE, содержащий от 3,5 до 30,5 повторяющегося звена. Согласно некоторым вариантам реализации настоящего изобретения megaTAL содержит 3,5, 4,5, 5,5, 6,5, 7,5, 8,5, 9,5, 10,5, 11,5, 12,5, 13,5, 14,5, 15,5, 16,5, 17,5, 18,5, 19,5, 20,5, 21,5, 22,5, 23,5, 24,5, 25,5, 26,5, 27,5, 28,5, 29,5 или 30,5 повторяющегося звена ДНК-связывающего домена TALE. Согласно предпочтительному варианту реализации настоящего изобретения megaTAL, предусмотренная в настоящем документе, содержит ДНК-связывающий домен TALE, содержащий 5,5-15,5 повторяющегося звена, более предпочтительно 7,5-15,5 повторяющегося звена, более предпочтительно 9,5-15,5 повторяющегося звена и более предпочтительно 9,5, 10,5, 11,5, 12,5, 13,5, 14,5 или 15,5 повторяющегося звена.
Согласно конкретным вариантам реализации настоящего изобретения megaTAL имеет архитектуру TAL-эффектора, содержащую полипептид «N-концевого домена (NTD)», один или более повторяющихся доменов/звеньев TALE, полипептид «C-концевого домена (CTD)» и вариант хоуминг-эндонуклеазы. Согласно некоторым вариантам реализации настоящего изобретения NTD, повторы TALE и/или домены CTD принадлежат к одному и тому же виду. Согласно другим вариантам реализации настоящего изобретения один или более из NTD, повторов TALE и/или доменов CTD принадлежат к разным видам.
В настоящем документе термин «полипептид N-концевого домена (NTD)» относится к последовательности, которая фланкирует N-концевой участок или фрагмент природного ДНК-связывающего домена TALE. Последовательность NTD, если она присутствует, может иметь любую длину, при условии, что повторяющиеся звенья ДНК-связывающего домена TALE сохраняют способность связывать ДНК. Согласно конкретным вариантам реализации настоящего изобретения полипептид NTD содержит от по меньшей мере 120 до по меньшей мере 140 или более аминокислот, которые являются N-концевыми по отношению к ДНК-связывающему домену TALE (0 представляет собой аминокислоту 1 наиболее N-концевого повторяющегося звена). Согласно конкретным вариантам реализации настоящего изобретения полипептид NTD содержит по меньшей мере приблизительно 120, 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139 или по меньшей мере 140 аминокислот, которые являются N-концевыми по отношению к ДНК-связывающему домену TALE. Согласно одному варианту реализации megaTAL, предусмотренная в настоящем документе, содержит полипептид NTD, содержащий по меньшей мере аминокислоты от приблизительно +1 до +122 и по меньшей мере от приблизительно от +1 до +137 белка TALE Xanthomonas (0 представляет собой аминокислоту 1 наиболее N-концевого повторяющегося звена). Согласно конкретным вариантам реализации настоящего изобретения полипептид NTD содержит по меньшей мере приблизительно 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136 или 137 аминокислот, которые являются N-концевыми по отношению к ДНК-связывающему домену TALE белка TALE Xanthomonas. Согласно одному варианту реализации megaTAL, предусмотренная в настоящем документе, содержит полипептид NTD, содержащий по меньшей мере аминокислоты от +1 до +121 белка TALE Ralstonia (0 представляет собой аминокислоту 1 наиболее N-концевого повторяющегося звена). Согласно конкретным вариантам реализации настоящего изобретения полипептид NTD содержит по меньшей мере приблизительно 121, 122, 123, 124, 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136 или 137 аминокислот, которые являются N-концевыми по отношению к ДНК-связывающему домену белка TALE Ralstonia.
В настоящем документе термин полипептид «C-концевого домена (CTD)» относится к последовательности, которая фланкирует C-концевую часть или фрагмент природного ДНК-связывающего домена TALE. Последовательность CTD, если она присутствует, может иметь любую длину, при условии, что повторяющиеся звенья ДНК-связывающего домена TALE сохраняют способность связывать ДНК. Согласно конкретным вариантам реализации настоящего изобретения полипептид CTD содержит от по меньшей мере 20 до по меньшей мере 85 или более аминокислот, которые являются C-концевыми по отношению к последнему полному повтору ДНК-связывающего домена TALE (первые 20 аминокислот представляют собой повторяющееся полузвено, которое является C-концевым по отношению к последнему C-концевому полному повторяющемуся звену). Согласно конкретным вариантам реализации настоящего изобретения полипептид CTD содержит по меньшей мере приблизительно 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 443, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75 , 76, 77, 78, 79, 80, 81, 82, 83, 84 или по меньшей мере 85 аминокислот, которые являются C-концевыми по отношению к последнему полному повтору ДНК-связывающего домена TALE. Согласно одному варианту реализации megaTAL, предусмотренная в настоящем документе, содержит полипептид CTD, содержащий по меньшей мере приблизительно аминокислоты от -20 до -1 белка TALE Xanthomonas (-20 представляет собой аминокислоту 1 повторяющегося полузвена, которое является C-концевым по отношению к последнему C-концевому полному повторяющемуся звену). Согласно конкретным вариантам реализации настоящего изобретения полипептид CTD содержит по меньшей мере приблизительно 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 аминокислоту, которые являются C-концевыми по отношению к последнему полному повтору ДНК-связывающего домена TALE из белка TALE Xanthomonas. Согласно одному варианту реализации megaTAL, предусмотренная в настоящем документе, содержит полипептид CTD, содержащий по меньшей мере приблизительно аминокислоты от -20 до -1 белка TALE Ralstonia (-20 представляет собой аминокислоту 1 повторяющегося полузвена, которое является C-концевым по отношению к последнему C-концевому полному повторяющемуся звену). Согласно конкретным вариантам реализации настоящего изобретения полипептид CTD содержит по меньшей мере приблизительно 20, 19, 18, 17, 16, 15, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 аминокислоту, которые являются C-концевыми по отношению к последнему полному повтору ДНК-связывающего домена TALE из белка TALE Ralstonia.
Согласно конкретным вариантам реализации настоящего изобретения megaTAL, предусмотренная в настоящем документе, содержит гибридный полипептид, содержащий ДНК-связывающий домен TALE, модифицированный для связывания последовательности-мишени, хоуминг-эндонуклеазу, перепрограммированную для связывания и расщепления последовательности-мишени, и необязательно полипептид NTD и/или CTD, необязательно соединенные друг с другом с помощью одного или более линкерных полипептидов, предусмотренных в другом месте настоящего документа. Безотносительно к какой-либо конкретной теории, предусмотрено, что megaTAL, содержащая ДНК-связывающий домен TALE и необязательно полипептид NTD и/или CTD, гибридизована с линкерным полипептидом, который в свою очередь гибридизован с вариантом хоуминг-эндонуклеазы. Таким образом, ДНК-связывающий домен TALE связывает последовательность-мишень ДНК, которая находится в пределах приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 нуклеотидов от последовательности-мишени, связываемой ДНК-связывающим доменом варианта хоуминг-эндонуклеазы. Таким образом, предусмотренные в настоящем документе megaTAL увеличивают специфичность и эффективность редактирования генома.
Согласно одному варианту реализации megaTAL содержит вариант хоуминг-эндонуклеазы и ДНК-связывающий домен TALE, который связывает нуклеотидную последовательность, которая находится в пределах приблизительно 4, 5 или 6 нуклеотидов, предпочтительно 5 или 6 нуклеотидов в 5'-направлении относительно сайта связывания перепрограммированной хоуминг-эндонуклеазы.
Согласно одному варианту реализации megaTAL содержит вариант хоуминг-эндонуклеазы и ДНК-связывающий домен TALE, который связывает нуклеотидную последовательность, представленную в SEQ ID NO: 21, которая находится на расстоянии 5 нуклеотидов в 5'-направлении (т.е., между сайтом связывания TALE и связывающим сайтом HE имеются 4 нуклеотида) относительно нуклеотидной последовательности, связываемой и расщепляемой вариантом хоуминг-эндонуклеазы (SEQ ID NO: 20). Согласно предпочтительным вариантам реализации настоящего изобретения последовательность-мишень megaTAL представляет собой SEQ ID NO: 22.
Согласно конкретным вариантам реализации настоящего изобретения megaTAL, предусмотренная в настоящем документе, содержит одно или более ДНК-связывающих повторяющихся звеньев TALE и вариант LHE, разработанный или перепрограммированный из LHE, выбранной из группы, состоящей из: II-AabMI, I-AaeMI, I-AniI, I-ApaMI, I-CapIII, I-CapIV, I-CkaMI, I-CpaMI, I-CpaMII, I-CpaMIII, I-CpaMIV, I-CpaMV, I-CpaV, I-CraMI, I-EjeMI, I-GpeMI, I-GpiI, I-GzeMI, I-GzeMII, I-GzeMIII, I-HjeMI, I-LtrII, I-LtrI, I-LtrWI, I-MpeMI, I-MveMI, I-NcrII, I-Ncrl, I-NcrMI, I-OheMI, I-OnuI, I-OsoMI, I-OsoMII, I-OsoMIII, I-OsoMIV, I-PanMI, I-PanMII, I-PanMIII, I-PnoMI, I-ScuMI, I-SmaMI, I-SscMI, I-Vdi141I и их вариантов или предпочтительно I-CpaMI, I-HjeMI, I-OnuI, I-PanMI, SmaMI и их вариантов, или более предпочтительно I-OnuI и ее вариантов.
Согласно конкретным вариантам реализации настоящего изобретения megaTAL, предусмотренная в настоящем документе, содержит NTD, одно или более ДНК-связывающих повторяющихся звеньев TALE, CTD и вариант LHE, выбранный из группы, состоящей из: I-AabMI, I-AaeMI, I-AniI, I-ApaMI, I-CapIII, I-CapIV, I-CkaMI, I-CpaMI, I-CpaMII, I-CpaMIII, I-CpaMIV, I-CpaMV, I-CpaV, I-CraMI, I-EjeMI, I-GpeMI, I-GpiI, I-GzeMI, I-GzeMII, I-GzeMIII, I-HjeMI, I-LtrII, I-LtrI, I-LtrWI, I-MpeMI, I-MveMI, I-NcrII, I-Ncrl, I-NcrMI, I-OheMI, I-OnuI, I-OsoMI, I-OsoMII, I-OsoMIII, I-OsoMIV, I-PanMI, I-PanMII, I-PanMIII, I-PnoMI, I-ScuMI, I-SmaMI, I-SscMI, I-Vdi141I и их вариантов или предпочтительно I-CpaMI, I-HjeMI, I-OnuI, I-PanMI, SmaMI и их вариантов, или более предпочтительно I-OnuI и ее вариантов.
Согласно конкретным вариантам реализации настоящего изобретения megaTAL, предусмотренная в настоящем документе, содержит NTD, от приблизительно 9,5 до приблизительно 15,5 ДНК-связывающего повторяющегося звена TALE и вариант LHE, выбранный из группы, состоящей из I-AabMI, I-AaeMI, I-AniI, I-ApaMI, I-CapIII, I-CapIV, I-CkaMI, I-CpaMI, I-CpaMII, I-CpaMIII, I-CpaMIV, I-CpaMV, I-CpaV, I-CraMI, I-EjeMI, I-GpeMI, I-GpiI, I-GzeMI, I-GzeMII, I-GzeMIII, I-HjeMI, I-LtrII, I-LtrI, I-LtrWI, I-MpeMI, I-MveMI, I-NcrII, I-Ncrl, I-NcrMI, I-OheMI, I-OnuI, I-OsoMI, I-OsoMII, I-OsoMIII, I-OsoMIV, I-PanMI, I-PanMII, I-PanMIII, I-PnoMI, I-ScuMI, I-SmaMI, I-SscMI, I-Vdi141I и их вариантов или предпочтительно I-CpaMI, I-HjeMI, I-OnuI, I-PanMI, SmaMI и их вариантов, или более предпочтительно I-OnuI и ее вариантов.
Согласно конкретным вариантам реализации настоящего изобретения megaTAL, предусмотренная в настоящем документе, содержит NTD, содержащий от приблизительно 122 аминокислот до 137 аминокислот, приблизительно 9,5, приблизительно 10,5, приблизительно 11,5, приблизительно 12,5, приблизительно 13,5, приблизительно 14,5 или приблизительно 15,5 связывающего повторяющегося звена, CTD, содержащий от приблизительно 20 до приблизительно 85 аминокислот, и вариант LHE I-OnuI. Согласно конкретным вариантам реализации настоящего изобретения любой один, два или все из NTD, ДНК-связывающего домена и CTD могут быть разработаны из одного и того же вида или из разных видов в любой подходящей комбинации.
Согласно конкретным вариантам реализации настоящего изобретения megaTAL, предусмотренная в настоящем документе, содержит аминокислотную последовательность, представленную в любой из SEQ ID NO: 13-19.
Согласно конкретным вариантам реализации настоящего изобретения гибридный белок megaTAL-Trex2, предусмотренный в настоящем документе, содержит аминокислотную последовательность, представленную в любой из SEQ ID NO: 13-19 и 38.
Согласно некоторым вариантам реализации настоящего изобретения megaTAL содержит ДНК-связывающий домен TALE, и вариант LHE I-OnuI связывает и расщепляет нуклеотидную последовательность, представленную в SEQ ID NO: 22.
3. МОДИФИЦИРУЮЩИЕ КОНЦЫ ФЕРМЕНТЫ
Композиции и способы редактирования генома, предусмотренные в конкретных вариантах реализации, включают редактирование клеточных геномов с применением варианта нуклеазы и одной или более копий модифицирующего концы фермента. Согласно конкретным вариантам реализации настоящего изобретения один полинуклеотид кодирует вариант хоуминг-эндонуклеазы и модифицирующий концы фермент, отделенные линкером, последовательностью саморасщепляющегося пептида, например, последовательностью 2A, или последовательностью IRES. Согласно конкретным вариантам реализации настоящего изобретения композиции для редактирования генома содержат полинуклеотид, кодирующий вариант нуклеазы, и отдельный полинуклеотид, кодирующий модифицирующий концы фермент. Согласно конкретным вариантам реализации настоящего изобретения композиции для редактирования генома содержат полинуклеотид, кодирующий вариант хоуминг-эндонуклеазы и модифицирующий концы фермент в одном гибридном полипептиде. Согласно одному варианту реализации гибридный полипептид содержит megaTAL и одну или более копий модифицирующего концы фермента, каждая из которых отделена саморасщепляющимся пептидом.
Термин «модифицирующий концы фермент» относится к ферменту, который модифицирует открытые концы полинуклеотидной цепи. Полинуклеотид может представлять собой двухцепочечную ДНК (дцДНК), одноцепочечную ДНК (оцДНК), РНК, двухцепочечные гибриды ДНК и РНК и синтетическую ДНК (например, содержащую основания, отличные от A, C, G и T). Модифицирующий концы фермент может модифицировать открытые концы полинуклеотидной цепи путем добавления одного или более нуклеотидов, удаления одного или более нуклеотидов, удаления или модификации фосфатной группы и/или удаления или модификации гидроксильной группы. Модифицирующий концы фермент может модифицировать концы в сайтах разреза эндонуклеазой или на концах, полученных с помощью других химических или механических способов, таких как сдвиг (например, при прохождении через мелкокалиберную иглу, нагревании, обработке ультразвуком, перемешивании с микрогранулами и распылении), ионизирующее излучение, ультрафиолетовое излучение, кислородные радикалы, химический гидролиз и химиотерапевтические агенты.
Согласно конкретным вариантам реализации настоящего изобретения композиции и способы редактирования генома, предусмотренные в конкретных вариантах реализации, включают редактирование клеточных геномов с применением варианта хоуминг-эндонуклеазы или megaTAL и модифицирующего концы ДНК фермента.
Термин «модифицирующий концы ДНК фермент» относится к ферменту, который модифицирует открытые концы ДНК. Модифицирующий концы ДНК фермент может модифицировать тупые концы или ступенчатые концы (концы с 5' или 3'-выступами). Модифицирующий концы ДНК фермент может модифицировать одноцепочечную или двухцепочечную ДНК. Модифицирующий концы ДНК фермент может модифицировать концы в местах разреза эндонуклеазой или на концах, полученных с помощью других химических или механических способов, таких как сдвиг (например, при прохождении через мелкокалиберную иглу, нагревании, обработке ультразвуком, перемешивании с микрогранулами и распылении), ионизирующее излучение, ультрафиолетовое излучение, кислородные радикалы, химический гидролиз и химиотерапевтические агенты. Модифицирующий концы ДНК фермент может модифицировать открытые концы ДНК, добавляя один или более нуклеотидов, удаляя один или более нуклеотидов, удаляя или модифицируя фосфатную группу и/или удаляя или модифицируя гидроксильную группу.
Иллюстративные примеры модифицирующих концы ДНК ферментов, подходящих для применения в конкретных вариантах реализации, предусмотренных в настоящем документе, включают, но не ограничиваются ими: 5'-3'-экзонуклеазы, 5'-3'-щелочные экзонуклеазы, 3'-5'-экзонуклеазы, 5'-флэп-эндонуклеазы, геликазы, фосфатазы, гидролазы и независимые от матрицы ДНК-полимеразы.
Дополнительные иллюстративные примеры модифицирующих концы ДНК ферментов, подходящих для применения в конкретных вариантах реализации, предусмотренных в настоящем документе, включают, но не ограничиваются указанными, Trex2, Trex1, Trex1 без трансмембранного домена, Apollo, Artemis, DNA2, Exo1, ExoT, ExoIII, Fen1, Fan1, MreII, Rad2, Rad9, TdT (концевую дезоксинуклеотидилтрансферазу), PNKP, RecE, RecJ, RecQ, лямбда-экзонуклеазу, Sox, ДНК-полимеразу вируса осповакцины, экзонуклеазу I, экзонуклеазу III, экзонуклеазу VII, NDK1, NDK5, NDK7, NDK8, WRN, T7-экзонуклеазу гена 6, белок интеграции вируса миелобластоза птиц (IN), Bloom, антарктическую фосфатазу, щелочную фосфатазу, полинуклеотидкиназу (PNK), ApeI, нуклеазу из золотистой фасоли, Hex1, TTRAP (TDP2), Sgs1, Sae2, CUP, Pol мю, Pol лямбда, MUS81, EME1, EME2, SLX1, SLX4 и UL-12.
Согласно конкретным вариантам реализации настоящего изобретения композиции для редактирования генома и способы редактирования клеточных геномов, предусмотренные в настоящем документе, содержат полипептиды, содержащие вариант хоуминг-эндонуклеазы или megaTAL и экзонуклеазу. Термин «экзонуклеаза» относится к ферментам, которые расщепляют фосфодиэфирные связи на конце полинуклеотидной цепи за счет реакции гидролиза, которая разрушает фосфодиэфирные связи на 3'- или 5'-конце.
Иллюстративные примеры экзонуклеаз, подходящих для применения в конкретных вариантах реализации, предусмотренных в настоящем документе, включают, но не ограничиваются ими: hExoI, ExoI дрожжей, ExoI E.coli, hTREX2, TREX2 мыши, TREX2 крысы, hTREX1, TREX1 мыши и TREX1 крысы.
Согласно конкретным вариантам реализации настоящего изобретения модифицирующий концы ДНК фермент представляет собой 3'- или 5'-экзонуклеазу, предпочтительно Trex1 или Trex2, более предпочтительно Trex2 и еще более предпочтительно человеческую или мышиную Trex2.
D. САЙТЫ-МИШЕНИ
Варианты нуклеаз, предусмотренные в конкретных вариантах реализации, могут быть разработаны для связывания с любой подходящей последовательностью-мишенью и могут иметь новую специфичность связывания по сравнению с природной нуклеазой. Согласно конкретным вариантам реализации настоящего изобретения сайт-мишень представляет собой регуляторную область гена, включая, но не ограничиваясь указанными, промоторы, энхансеры, репрессорные элементы и тому подобное. Согласно конкретным вариантам реализации настоящего изобретения сайт-мишень представляет собой кодирующую область гена или сайт сплайсинга. Согласно определенным вариантам реализации настоящего изобретения варианты нуклеаз разработаны для подавления или уменьшения экспрессии гена. Согласно конкретным вариантам реализации настоящего изобретения вариант нуклеазы и донорная матрица для восстановления могут быть разработаны для восстановления или удаления желательной последовательности-мишени.
Согласно различным вариантам реализации варианты нуклеазы связываются и расщепляют последовательность-мишень в человеческом протоонкогене B (CBLB) лимфомы B-клеточной линии дифференцировки Каситас (Cbl). CBL также называется CBL2; нарушение, сходное с синдромом Нунан с ювенильным миеломоноцитарным лейкозом или без него (NSLL); C-CBL; белок RING-пальца 55 (RNF55); хрупкий сайт, тип фолиевой кислоты, редкий, fra (11)(q23.3) (FRA11B); E3 убиквитинпротеинлигаза CBL; Cas-Br-M (мышиная) экотропная ретровирусная трансформирующая последовательность; протоонкоген Cbl, убиквитинпротеинлигаза Е3; убиквитинтрансфераза E3 RING-типа CBL; протоонкоген B-клеточной линии дифференцировки Каситас; онкоген CBL2; протоонкоген c-Cbl; и белок сигнальной трансдукции CBL.
Этот ген является протоонкогеном, который кодирует убиквитинлигазу E3 с RING пальцем. Кодируемый белок является одним из ферментов, необходимых для нацеливания на субстраты для разрушения протеасомой. Этот белок опосредует перенос убиквитина от убиквитинконъюгирующих ферментов (E2) к специфическим субстратам. Этот белок также содержит N-концевой фосфотирозинсвязывающий домен, который позволяет ему взаимодействовать с многочисленными фосфорилированными по тирозину субстратами и нацеливать на них для разрушения протеасомой. CBLB функционирует как отрицательный регулятор многих путей передачи сигналов, включая активацию и стойкость T-клеток.
Согласно конкретным вариантам реализации настоящего изобретения вариант хоуминг-эндонуклеазы или megaTAL вводит двухцепочечный разрыв (ДЦР) в сайт-мишень в гене CBLB. Согласно конкретным вариантам реализации настоящего изобретения вариант хоуминг-эндонуклеазы или megaTAL вводит ДЦР в экзон 6 гена CBLB, предпочтительно в SEQ ID NO: 20 в экзоне 6 гена CBLB и более предпочтительно в последовательность «ATTC» в SEQ ID NO: 20 в экзоне 6 гена CBLB.
Согласно предпочтительному варианту реализации настоящего изобретения вариант хоуминг-эндонуклеазы или megaTAL расщепляет двухцепочечную ДНК и вводит ДЦР в полинуклеотидную последовательность, представленную в SEQ ID NO: 20 или 22.
Согласно предпочтительному варианту реализации настоящего изобретения ген CBLB представляет собой человеческий ген CBLB.
E. ДОНОРНЫЕ МАТРИЦЫ ДЛЯ ВОССТАНОВЛЕНИЯ
Варианты нуклеаз можно применять для введения ДЦР в последовательность-мишень; ДЦР может быть восстановлен с помощью механизмов направляемого гомологией восстановления (HDR) в присутствии одной или более донорных матриц для восстановления.
Согласно различным вариантам реализации донорная матрица для восстановления содержит один или более полинуклеотидов, кодирующих усилитель иммунопотенции, подавитель иммуносупрессорного сигнала или модифицированный антигенный рецептор.
Согласно различным вариантам реализации предусмотрено, что обеспечение в клетке модифицированной нуклеазы в присутствии множества донорных матриц для восстановления, независимо кодирующих усилители иммунопотенции и/или подавители иммуносупрессорного сигнала, нацеленные на различные пути иммуносупрессии, приводит к получению T-клеток с редактированным геномом с повышенной терапевтической эффективностью и стойкостью. Например, в конкретных вариантах реализации настоящего изобретения предпочтительными могут быть усилители иммунопотенции или комбинации, нацеленные на иммуносупрессорные сигналы, путей PD-1, LAG-3, CTLA-4, TIM3, IL-10R, TIGIT и TGFβRII.
Согласно конкретным вариантам реализации настоящего изобретения донорную матрицу для восстановления применяют для вставки последовательности в геном. Согласно конкретным предпочтительным вариантам реализации настоящего изобретения донорную матрицу для восстановления применяют для восстановления или модификации последовательности в геноме.
Согласно различным вариантам реализации донорную матрицу для восстановления вводят в гемопоэтическую клетку, например, T-клетку, путем трансдукции клетки аденоассоциированным вирусом (AAV), ретровирусом, например, лентивирусом, IDLV и т.д., вирусом простого герпеса, аденовирусом или вектором на основе вируса осповакцины, содержащим донорную матрицу для восстановления.
Согласно конкретным вариантам реализации донорная матрица для восстановления содержит одно или более плеч гомологии, которые фланкируют сайт ДЦР.
В настоящем документе термин «плечи гомологии» относится к последовательности нуклеиновой кислоты в донорной матрице для восстановления, которая идентична или почти идентична последовательности ДНК, фланкирующей разрыв ДНК, введенный нуклеазой в сайт-мишень. Согласно одному варианту реализации донорная матрица для восстановления содержит 5'-плечо гомологии, которое содержит последовательность нуклеиновой кислоты, которая идентична или почти идентична последовательности ДНК, расположенной в 5'-направлении относительно сайта разрыва ДНК. Согласно одному варианту реализации донорная матрица для восстановления содержит 3'-плечо гомологии, которое содержит последовательность нуклеиновой кислоты, которая идентична или почти идентична последовательности ДНК, расположенной в 3'-направлении относительно сайта разрыва ДНК. Согласно предпочтительному варианту реализации донорная матрица для восстановления содержит 5'-плечо гомологии и 3'-плечо гомологии. Донорная матрица для восстановления может быть гомологична геномной последовательности, примыкающей непосредственно к сайту ДЦР, или гомологична геномной последовательности в пределах любого количества пар оснований от сайта ДЦР. Согласно конкретным вариантам реализации настоящего изобретения пара плеч гомологии содержит плечо гомологии, содержащее полинуклеотидную последовательность, которая содержит сайт-мишень для двухцепочечного разрыва с мутацией в сайте-мишени, чтобы свести к минимуму повторное расщепление сайта-мишени. Согласно одному варианту реализации донорная матрица для восстановления содержит последовательность нуклеиновой кислоты, которая гомологична геномной последовательности, или плечо гомологии из приблизительно 5 п.о., приблизительно 10 п.о., приблизительно 25 п.о., приблизительно 50 п.о., приблизительно 100 п.о., приблизительно 250 п.о., приблизительно 500 п.о., приблизительно 1000 п.о., приблизительно 2500 п.о., приблизительно 5000 п.о., приблизительно 10000 п.о. или более, включая любую промежуточную длину гомологичной последовательности.
Иллюстративные примеры подходящих длин плеч гомологии, предусмотренных в конкретных вариантах реализации, могут быть выбраны независимо и включают, но не ограничиваются ими: 5 п.о., приблизительно 10 п.о., приблизительно 25 п.о., приблизительно 50 п.о., приблизительно 100 п.о., приблизительно 200 п.о., приблизительно 300 п.о., приблизительно 400 п.о., приблизительно 500 п.о., приблизительно 600 п.о., приблизительно 700 п.о., приблизительно 800 п.о., приблизительно 900 п.о., приблизительно 1000 п.о., приблизительно 1100 п.о., приблизительно 1200 п.о., приблизительно 1300 п.о., приблизительно 1400 п.о., приблизительно 1500 п.о. приблизительно 1600 п.о., приблизительно 1700 п.о., приблизительно 1800 п.о., приблизительно 1900 п.о., приблизительно 2000 п.о., приблизительно 2100 п.о., приблизительно 2200 п.о., приблизительно 2300 п.о., приблизительно 2400 п.о., приблизительно 2500 п.о., приблизительно 2600 п.о., приблизительно 2700 п.о., приблизительно 2800 п.о., приблизительно 2900 п.о. или приблизительно 3000 п.о. или более длинные плечи гомологии, включая все промежуточные длины плеч гомологии.
Дополнительные иллюстративные примеры подходящих длин плеч гомологии включают, но не ограничиваются ими: от приблизительно 100 п.о. до приблизительно 3000 п.о., от приблизительно 200 п.о. до приблизительно 3000 п.о., от приблизительно 300 п.о. до приблизительно 3000 п.о., от приблизительно 400 п.о. до приблизительно 3000 п.о., от приблизительно 500 п.о. до приблизительно 3000 п.о., от приблизительно 500 п.о. до приблизительно 2500 п.о., от приблизительно 500 п.о. до приблизительно 2000 п.о., от приблизительно 750 п.о. до приблизительно 2000 п.о., от приблизительно 750 п.о. до приблизительно 1500 п.о. или от приблизительно 1000 п.о. до приблизительно 1500 п.о., включая все промежуточные длины плеч гомологии.
Согласно конкретному варианту реализации длины 5'- и 3'-плеч гомологии независимо выбраны из диапазона от приблизительно 500 п.о. до приблизительно 1500 п.о. Согласно одному варианту реализации 5'-плечо гомологии составляет приблизительно 1500 п.о., и 3'-плечо гомологии составляет приблизительно 1000 п.о. Согласно одному варианту реализации 5'-плечо гомологии составляет от приблизительно 200 п.о. до приблизительно 600 п.о., и 3'-плечо гомологии составляет от приблизительно 200 п.о. до приблизительно 600 п.о. Согласно одному варианту реализации 5'-плечо гомологии составляет приблизительно 200 п.о., и 3'-плечо гомологии составляет приблизительно 200 п.о. Согласно одному варианту реализации 5-плечо гомологии составляет приблизительно 300 п.о., и 3-плечо гомологии составляет приблизительно 300 п.о. Согласно одному варианту реализации 5'-плечо гомологии составляет приблизительно 400 п.о., и 3'-плечо гомологии составляет приблизительно 400 п.о. Согласно одному варианту реализации 5'-плечо гомологии составляет приблизительно 500 п.о., и 3'-плечо гомологии составляет приблизительно 500 п.о. Согласно одному варианту реализации 5-плечо гомологии составляет приблизительно 600 п.о., и 3-плечо гомологии составляет приблизительно 600 п.о.
Донорные матрицы для восстановления могут содержать одну или более кассет экспрессии в конкретных вариантах реализации настоящего изобретения. Согласно определенным вариантам реализации настоящего изобретения донорные матрицы для восстановления могут содержать одно или более плеч гомологии и один или более полинуклеотидов, включая, но не ограничиваясь указанными, промоторы и/или энхансеры, нетранслируемые области (НТО), последовательности Козак, сигналы полиаденилирования, дополнительные сайты распознавания ферментами рестрикции, сайты множественного клонирования, сайты внутренней посадки рибосомы (IRES), сайты распознавания рекомбиназами (например, сайты LoxP, FRT и Att), кодоны терминации, сигналы терминации транскрипции, полинуклеотиды, кодирующие саморасщепляющиеся полипептиды и эпитопные метки.
Согласно различным вариантам реализации донорная матрица для восстановления содержит 5'-плечо гомологии, промотор РНК-полимеразы II, один или более полинуклеотидов, кодирующих усилитель иммунопотенции, подавитель иммуносупрессорного сигнала или модифицированный антигенный рецептор, и 3'-плечо гомологии.
Согласно различным вариантам реализации сайт-мишень модифицируют с применением донорной матрицы для восстановления, содержащей 5'-плечо гомологии, один или более полинуклеотидов, кодирующих саморасщепляющийся вирусный пептид, например, T2A, усилитель иммунопотенции, подавитель иммуносупрессорного сигнала или модифицированный антигенный рецептор, необязательно полиА-сигнал или саморасщепляющийся пептид и 3'-плечо гомологии, причем экспрессия одного или более полинуклеотидов регулируется эндогенным промотором CBLB.
1. УСИЛИТЕЛИ ИММУНОПОТЕНЦИИ
Согласно конкретным вариантам реализации настоящего изобретения иммунные эффекторные клетки с редактированным геномом, предусмотренные в настоящем документе, делают более эффективными и/или устойчивыми к иммуносупрессорным факторам путем введения ДЦР в ген CBLB в присутствии донорной матрицы для восстановления, содержащей полинуклеотид, кодирующий усилитель иммунопотенции. В настоящем документе термин «усилитель иммунопотенции» относится к неприродным молекулам, которые стимулируют и/или потенцируют активацию и/или функцию T-клеток, иммунопотенциирующим факторам и неприродным полипептидам, которые преобразуют иммуносупрессорные сигналы из микросреды опухоли в иммуностимулирующий сигнал в T-клетке или других иммунных клетках.
Согласно конкретным вариантам реализации настоящего изобретения усилитель иммунопотенции выбран из группы, состоящей из: биспецифической молекулы, активирующей T-клетки (BiTE); иммунопотенциирующего фактора, включая, но не ограничиваясь указанными, цитокины, хемокины, цитотоксины и/или рецепторы цитокинов; и переключающий рецептор.
Согласно некоторым вариантам реализации настоящего изобретения усилитель иммунопотенции, иммунопотенциирующий фактор или переключающий рецептор представляют собой гибридные полипептиды, содержащие домен дестабилизации белка.
a. Биспецифические молекулы, активирующие T-клетки (BiTE)
Согласно конкретным вариантам реализации настоящего изобретения иммунные эффекторные клетки с редактированным геномом, предусмотренные в настоящем документе, делают более эффективными путем введения ДЦР в ген CBLB в присутствии донорной матрицы для восстановления, содержащей полинуклеотид, кодирующий биспецифические молекулы, активирующие T-клетки (BiTE). Молекулы BiTE представляют собой двусоставные молекулы, содержащие первый связывающий домен, который связывает антиген-мишень, линкер или спейсер, как предусмотрено в другом месте настоящего документа, и второй связывающий домен, который связывает стимулирующую или костимулирующую молекулу на иммунной эффекторной клетке. Первый и второй связывающие домены могут быть независимо выбраны из лигандов, рецепторов, антител или их антигенсвязывающих фрагментов, лектинов и углеводов.
Согласно конкретным вариантам реализации настоящего изобретения первый и второй связывающие домены являются антигенсвязывающими доменами.
Согласно конкретным вариантам реализации настоящего изобретения первый и второй связывающие домены представляют собой антитела или их антигенсвязывающие фрагменты. Согласно одному варианту реализации первый и второй связывающие домены представляют собой одноцепочечные вариабельные фрагменты (scFv).
Иллюстративные примеры антигенов-мишеней, которые могут быть распознаны и связаны первым связывающим доменом, в конкретных вариантах реализации настоящего изобретения включают, но не ограничиваются ими: альфа-рецептор фолата, 5T4, интегрин αvβ6, BCMA, B7-H3, B7-H6, CAIX, CD16, CD19, CD20, CD22, CD30, CD33, CD44, CD44v6, CD44v7/8, CD70, CD79a, CD79b, CD123, CD138, CD171, CEA, CSPG4, EGFR, семейство EGFR, включая ErbB2 (HER2), EGFRvIII, EGP2, EGP40, EPCAM, EphA2, EpCAM, FAP, фетальный AchR, GD2, GD3, глайпикан-3 (GPC3), HLA-A1+MAGE1, HLA-A2+MAGE1, HLA-A3+MAGE1, HLA-A1+NY-ESO-1, HLA-A2+NY-ESO-1, HLA-A3+NY-ESO-1, IL-11Rα, IL-13Rα2, лямбда, Льюис-Y, каппа, мезотелин, Muc1, Muc16, NCAM, лиганды NKG2D, NY-ESO-1, PRAME, PSCA, PSMA, ROR1, SSX, сурвивин, TAG72, TEM, VEGFR2 и WT-1.
Другие иллюстративные варианты реализации антигенов-мишеней включают комплексы ГКГС-пептид, причем необязательно пептид получен из: альфа-рецептора фолата, 5T4, интегрина αvβ6, BCMA, B7-H3, B7-H6, CAIX, CD16, CD19, CD20, CD22, CD30, CD33, CD44, CD44v6, CD44v7/8, CD70, CD79a, CD79b, CD123, CD138, CD171, CEA, CSPG4, EGFR, семейства EGFR, включая ErbB2 (HER2), EGFRvIII, EGP2, EGP40, EPCAM, EphA2, EpCAM, FAP, фетального AchR, GD2, GD3, глайпикана-3 (GPC3), MAGE1, NY-ESO-1, IL-11Rα, IL-13Rα2, лямбда, Льюис-Y, каппа, мезотелина, Muc1, Muc16, NCAM, лигандов NKG2D, PRAME, PSCA, PSMA, ROR1, SSX, сурвивина, TAG72, TEM, VEGFR2 и WT-1.
Иллюстративные примеры стимулирующих или костимулирующих молекул на иммунных эффекторных клетках, распознаваемых и связываемых вторым связывающим доменом, в конкретных вариантах реализации настоящего изобретения включают, но не ограничиваются ими: CD3γ, CD3δ, CD3ε, CD3ζ, CD28, CD134, CD137 и CD278.
Согласно конкретным вариантам реализации настоящего изобретения ДЦР вводят в ген CBLB с помощью модифицированной нуклеазы, и донорную матрицу для восстановления, содержащую полинуклеотид, кодирующий BiTE, вводят в клетку и встраивают в ген CBLB с помощью гомологичной рекомбинации.
b. Иммунопотенциирующие факторы
Согласно конкретным вариантам реализации настоящего изобретения иммунные эффекторные клетки с редактированным геномом, предусмотренные в настоящем документе, делают более эффективными путем повышения количества иммунопотенциирующих факторов либо в клетках с редактированным геномом, либо в клетках в микросреде опухоли. Иммунопотенциирующие факторы относятся к конкретным цитокинам, хемокинам, цитотоксинам и рецепторам цитокинов, которые потенциируют иммунный ответ в иммунных эффекторных клетках. Согласно одному варианту реализации T-клетки модифицируют путем введения ДЦР в гене CBLB в присутствии донорной матрицы для восстановления, содержащей полинуклеотид, кодирующий цитокин, хемокин, цитотоксин или рецептор цитокина.
Согласно конкретным вариантам реализации настоящего изобретения донорная матрица для восстановления содержит полинуклеотид, кодирующий цитокин, выбранный из группы, состоящей из: ИЛ-2, инсулина, ИФН-γ, ИЛ-7, ИЛ-21, ИЛ-10, ИЛ-12, ИЛ-15 и ФНО-α.
Согласно конкретным вариантам реализации настоящего изобретения донорная матрица для восстановления содержит полинуклеотид, кодирующий хемокин, выбранный из группы, состоящей из: MIP-1α, MIP-1β, MCP-1, MCP-3 и RANTE.
Согласно конкретным вариантам реализации настоящего изобретения донорная матрица для восстановления содержит полинуклеотид, кодирующий цитотоксин, выбранный из группы, состоящей из перфорина, гранзима A и гранзима B.
Согласно конкретным вариантам реализации настоящего изобретения донорная матрица для восстановления содержит полинуклеотид, кодирующий рецептор цитокина, выбранный из группы, состоящей из рецептора ИЛ-2, рецептора ИЛ-7, рецептора ИЛ-12, рецептора ИЛ-15 и рецептора ИЛ-21.
c. Переключающие рецепторы
Согласно конкретным вариантам реализации настоящего изобретения иммунные эффекторные клетки с редактированным геномом, предусмотренные в настоящем документе, делают более устойчивыми к истощению путем «переключения» или «обращения» иммуносупрессорного сигнала от иммуносупрессорных факторов, вызванных микросредой опухоли, в положительный иммуностимулирующий сигнал. Согласно одному варианту реализации T-клетки модифицируют путем введения ДЦР в ген CBLB в присутствии донорной матрицы для восстановления, содержащей полинуклеотид, кодирующий переключающий рецептор. В настоящем документе термин «переключающий рецептор» относится к неприродному полипептиду, который превращает иммуносупрессорные сигналы из микросреды опухоли в иммуностимулирующий сигнал в T-клетке. Согласно предпочтительным вариантам реализации настоящего изобретения переключающий рецептор относится к полипептиду, который содержит экзодомен, который связывает иммуносупрессорный фактор, трансмембранный домен и эндодомен, который передает иммуностимулирующий сигнал к T-клетке.
Согласно одному варианту реализации донорная матрица для восстановления кодирует переключающий рецептор, содержащий экзодомен или внеклеточный связывающий домен, который связывает иммуносупрессорный цитокин, трансмембранный домен и эндодомен иммунопотенциирующего рецептора цитокинов.
Согласно конкретным вариантам реализации настоящего изобретения переключающий рецептор содержит экзодомен, который связывает иммуносупрессорный цитокин, представляющий собой внеклеточный связывающий цитокины домен рецептора ИЛ-4, рецептора ИЛ-6, рецептора ИЛ-8, рецептора ИЛ-10, рецептора ИЛ-13, рецептора TGFβ типа 1 или рецептора TGFβ типа 2; трансмембранный домен, выделенный из CD4, CD8α, CD27, CD28, CD134, CD137, CD3, рецептора TGFβ типа 1, рецептора TGFβ типа 2, рецептора ИЛ-2, рецептора ИЛ-7, рецептора ИЛ-12, рецептора ИЛ-15 или рецептора ИЛ-21; и эндодомен, выделенный из рецептора ИЛ-2, рецептора ИЛ-7, рецептора ИЛ-12, рецептора ИЛ-15 или рецептора ИЛ-21.
Согласно конкретным вариантам реализации настоящего изобретения переключающий рецептор содержит экзодомен, который связывает иммуносупрессорный цитокин, представляющий собой антитело или его антигенсвязывающий фрагмент, который связывает ИЛ-4, ИЛ-6, ИЛ-8, ИЛ-10, ИЛ-13, рецептор TGFβ типа 1 или рецептор TGFβ типа 2; трансмембранный домен, выделенный из CD4, CD8α, CD27, CD28, CD134, CD137, CD3, рецептора TGFβ типа 1 или рецептора TGFβ типа 2, рецептора ИЛ-2, рецептора ИЛ-7, рецептора ИЛ-12, рецептора ИЛ-15 или рецептора ИЛ-21; и эндодомен, выделенный из рецептора ИЛ-2, рецептора ИЛ-7, рецептора ИЛ-12, рецептора ИЛ-15 или рецептора ИЛ-21.
Согласно одному варианту реализации донорная матрица для восстановления содержит переключающий рецептор, содержащий экзодомен, который связывает иммуносупрессорный фактор, трансмембранный домен и один или более внутриклеточных костимулирующих сигнальных доменов и/или первичных сигнальных доменов.
Иллюстративные примеры экзодоменов, подходящих для применения в конкретных вариантах реализации переключающих рецепторов, предусмотренных в конкретных вариантах реализации, включают, но не ограничиваются ими: внеклеточный лигандсвязывающий домен рецептора, который содержит ITIM и/или ITSM.
Дополнительные иллюстративные примеры экзодоменов, подходящих для применения в конкретных вариантах реализации переключающих рецепторов, предусмотренных в конкретных вариантах реализации, включают, но не ограничиваются указанными, внеклеточный лигандсвязывающий домен из: PD-1, LAG-3, TIM-3, CTLA-4, BTLA, CEACAM1, TIGIT, TGFβRI, TGFβRII, IL4R, IL6R, CXCR1, CXCR2, IL10R, IL13Rα2, TRAILR1, RCAS1R и FAS.
Согласно одному варианту реализации экзодомен содержит внеклеточный лигандсвязывающий домен рецептора, выбранного из группы, состоящей из: PD-1, LAG-3, TIM-3, CTLA-4, IL10R, TIGIT, TGFβRI и TGFβRII.
Согласно одному варианту реализации донорная матрица для восстановления содержит переключающий рецептор, содержащий экзодомен, который связывает иммуносупрессорный цитокин, трансмембранный домен и один или более внутриклеточных костимулирующих сигнальных доменов и/или первичных сигнальных доменов.
Иллюстративные примеры трансмембранных доменов, подходящих для применения в конкретных вариантах реализации переключающих рецепторов, предусмотренных в конкретных вариантах реализации, включают, но не ограничиваются указанными, трансмембранные домены следующих белков: PD-1, LAG-3, TIM-3, CTLA-4, IL10R, TIGIT, TGFβRI и TGFβRII, альфа или бета-цепей T-клеточного рецептора, CDδ, CD3ε, CDγ, CD3ζ, CD4, CD5, CD8α, CD9, CD16, CD22, CD27, CD28, CD33, CD37, CD45, CD64, CD80, CD86, CD134, CD137 или CD154.
Согласно различным вариантам реализации переключающий рецептор содержит эндодомен, который вызывает иммуностимулирующий сигнал. В настоящем документе термин «эндодомен» относится к иммуностимулирующему мотиву или домену, включая, но не ограничиваясь указанными, иммунорецепторный тирозиновый активирующий мотив (ITAM), костимулирующий сигнальный домен, первичный сигнальный домен или другой внутриклеточный домен, который ассоциирован с вызовом иммуностимулирующих сигналов в T-клетках.
Иллюстративные примеры эндодоменов, подходящих для применения в конкретных вариантах реализации переключающих рецепторов, предусмотренных в конкретных вариантах реализации, включают, но не ограничиваются указанными, домены, содержащие мотив ITAM.
Дополнительные иллюстративные примеры эндодоменов, подходящих для применения в конкретных вариантах реализации переключающих рецепторов, предусмотренных в конкретных вариантах реализации, включают, но не ограничиваются указанными, костимулирующие сигнальные домены, выделенные из: TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, CARD11, CD2, CD7, CD27, CD28, CD30, CD40, CD54 (ICAM), CD83, CD134 (OX40), CD137 (4-1BB), CD278 (ICOS), DAP10, LAT, NKD2C, SLP76, TRIM или ZAP70.
Дополнительные иллюстративные примеры эндодоменов, подходящих для применения в конкретных вариантах реализации переключающих рецепторов, предусмотренных в конкретных вариантах реализации, включают, но не ограничиваются указанными, эндодомен, выделенный из рецептора ИЛ-2, рецептора ИЛ-7, рецептора ИЛ-12, рецептора ИЛ-15 или рецептора ИЛ-21.
Дополнительные иллюстративные примеры эндодоменов, подходящих для применения в конкретных вариантах реализации переключающих рецепторов, предусмотренных в конкретных вариантах реализации, включают, но не ограничиваются указанными, первичные сигнальные домены, выделенные из: FcRγ, FcRβ, CD3γ, CD3δ, CD3ε, CD3ζ, CD22, CD79a, CD79b и CD66d.
Согласно конкретным вариантам реализации настоящего изобретения переключающий рецептор содержит экзодомен, который содержит внеклеточный домен из PD-1, LAG-3, TIM-3, CTLA-4, IL10R, TIGIT, TGFβRI или TGFβRII: эндодомен, выделенный из рецептора ИЛ-2, рецептора ИЛ-7, рецептора ИЛ-12, рецептора ИЛ-15 или рецептора ИЛ-21.
Согласно конкретным вариантам реализации настоящего изобретения переключающий рецептор содержит экзодомен, который содержит внеклеточный домен из PD-1, LAG-3, TIM-3, CTLA-4, IL10R, TIGIT, TGFβRI или TGFβRII; трансмембранный домен из полипептида CD3, CD4, CD8α, CD28, CD134, CD137, PD-1, LAG-3, TIM-3, CTLA-4, IL10R, TGFβRI и TGFβRII; и эндодомен из CD28, CD134, CD137, CD278, и/или CD3ζ.
Согласно конкретным вариантам реализации настоящего изобретения переключающий рецептор содержит экзодомен, который содержит внеклеточный домен из PD-1, LAG-3, TIM-3, CTLA-4, IL10R, TIGIT или TGFβRII; трансмембранный домен из полипептида CD3, CD4, CD8α, CD28, CD134 или CD137; и эндодомен из CD28, CD134, CD137, CD278 и/или CD3ζ.
2. ПОДАВИТЕЛИ ИММУНОСУПРЕССОРНЫХ СИГНАЛОВ
Одним ограничением или проблемой, которые вызывают беспокойство в отношении существующей адоптивной клеточной терапии, является гипореактивность иммунных эффекторных клеток вследствие истощения, опосредуемого микросредой опухоли. Истощенные T-клетки имеют уникальную молекулярную характеристику, которая заметно отличается от наивных, эффекторных T-клеток или T-клеток памяти. Их определяют как T-клетки с уменьшенной экспрессией цитокинов и эффекторной функцией.
Согласно конкретным вариантам реализации настоящего изобретения иммунные эффекторные клетки с редактированным геномом, предусмотренные в настоящем документе, делают более устойчивыми к истощению за счет уменьшения или подавления передачи сигналов иммуносупрессорными факторами. Согласно одному варианту реализации T-клетки модифицируют путем введения ДЦР в ген CBLB в присутствии донорной матрицы для восстановления, содержащей полинуклеотид, кодирующий подавитель иммуносупрессорного сигнала.
В настоящем документе термин «подавитель иммуносупрессорного сигнала» относится к неприродному полипептиду, который уменьшает передачу иммуносупрессорных сигналов из микросреды опухоли к T-клетке. Согласно одному варианту реализации подавитель иммуносупрессорного сигнала представляет собой антитело или его антигенсвязывающий фрагмент, который связывает иммуносупрессорный фактор. Согласно предпочтительным вариантам реализации настоящего изобретения подавитель иммуносупрессорного сигнала относится к полипептиду, который оказывает супрессорный, подавляющий или доминирующий отрицательный эффект на конкретный иммуносупрессорный фактор или путь передачи сигналов, поскольку подавитель содержит экзодомен, который связывает иммуносупрессорный фактор, и необязательно трансмембранный домен, а также необязательно модифицированный эндодомен (например, внутриклеточный сигнальный домен).
Согласно конкретным вариантам реализации настоящего изобретения экзодомен представляет собой внеклеточный связывающий домен, который распознает и связывает иммуносупрессорный фактор.
Согласно конкретным вариантам реализации настоящего изобретения модифицированный эндодомен мутируют для уменьшения или ингибирования иммуносупрессорных сигналов. Подходящие стратегии мутирования включают, но не ограничиваются указанными, замену, добавление или удаление аминокислот. Подходящие мутации также включают, но не ограничиваются указанными, укорочение эндодомена для удаления сигнальных доменов, мутирование эндодоменов для удаления остатков, важных для активности сигнального мотива, и мутирование эндодоменов для блокирования циклирования рецептора. Согласно конкретным вариантам реализации настоящего изобретения эндодомен, если он присутствует, не передает иммуносупрессорные сигналы или имеет по существу сниженную передачу сигналов.
Таким образом, согласно некоторым вариантам реализации настоящего изобретения подавитель иммуносупрессорного сигнала действует как поглотитель для одного или более иммуносупрессорных факторов из микросреды опухоли и ингибирует соответствующие пути иммуносупрессорной передачи сигналов в T-клетке.
Один иммуносупрессорный сигнал опосредуется катаболизмом триптофана. Катаболизм триптофана индоламин-2,3-диоксигеназой (IDO) в раковых клетках приводит к выработке кинуренинов, которые, как было показано, оказывают иммуносупрессорный эффект на T-клетки в микросреде опухоли. См., например, Platten et al. (2012) Cancer Res. 72(21):5435-40.
Согласно одному варианту реализации донорная матрица для восстановления содержит фермент с кинурениназной активностью.
Иллюстративные примеры ферментов, обладающих кинурениназной активностью, подходящих для применения в конкретных вариантах реализации настоящего изобретения, включают, но не ограничиваются этим, L-кинуренингидролазу.
Согласно одному варианту реализации донорная матрица для восстановления содержит один или более полинуклеотидов, которые кодируют подавитель иммуносупрессорного сигнала, который уменьшает или блокирует иммуносупрессорную передачу сигналов, опосредованную иммуносупрессорным фактором.
Иллюстративные примеры иммуносупрессорных факторов, на которые нацелены подавители иммуносупрессорного сигнала, предусмотренные в конкретных вариантах реализации, включают, но не ограничиваются ими: лиганд белка запрограммированный гибели клеток 1 (PD-L1), лиганд белка запрограммированный гибели клеток 2 (PD-L2), трансформирующий фактор роста β (TGFβ), макрофагальный колониестимулирующий фактор 1 (M-CSF1), родственный фактору некроза опухолей лиганд, индуцирующий апоптоз (TRAIL), лиганд рецепторсвязывающего ракового антигена, экспрессированного на клетках SiSo (RCAS1), лиганд Fas (FasL), CD47, интерлейкин-4 (ИЛ-4), интерлейкин-6 (ИЛ-6), интерлейкин-8 (ИЛ-8), интерлейкин-10 (ИЛ-10) и интерлейкин-13 (ИЛ-13).
Согласно различным вариантам реализации настоящего изобретения подавитель иммуносупрессорного сигнала содержит антитело или его антигенсвязывающий фрагмент, который связывает иммуносупрессорный фактор.
Согласно различным вариантам реализации настоящего изобретения подавитель иммуносупрессорного сигнала содержит экзодомен, который связывает иммуносупрессорный фактор.
Согласно конкретным вариантам реализации настоящего изобретения подавитель иммуносупрессорного сигнала содержит экзодомен, который связывает иммуносупрессорный фактор, и трансмембранный домен.
Согласно другому варианту реализации настоящего изобретения подавитель иммуносупрессорного сигнала содержит экзодомен, который связывает иммуносупрессорный фактор, трансмембранный домен и модифицированный эндодомен, который не передает иммуносупрессорные сигналы или обладает существенно сниженной способностью передавать иммуносупрессорные сигналы.
В настоящем документе термин «экзодомен» относится к антигенсвязывающему домену. Согласно одному варианту реализации экзодомен представляет собой внеклеточный лигандсвязывающий домен иммуносупрессорного рецептора, который передает иммуносупрессорные сигналы из микросреды опухоли к T-клетке. Согласно конкретным вариантам реализации настоящего изобретения экзодомен относится к внеклеточному лигандсвязывающему домену рецептора, который содержит иммунорецепторный ингибирующий тирозиновый мотив (ITIM) и/или иммунорецепторный переключающий тирозиновый мотив (ITSM).
Иллюстративные примеры экзодоменов, подходящих для применения в конкретных вариантах реализации подавителей иммуносупрессорного сигнала, включают, но не ограничиваются указанными, антитела или их антигенсвязывающие фрагменты или внеклеточные лигандсвязывающие домены, выделенные из следующих полипептидов: белка запрограммированный гибели клеток 1 (PD-1), белка гена активации лимфоцитов 3 (LAG-3), домена иммуноглобулина T-клеток и домена 3 муцина (TIM3), антигена цитотоксических Т-лимфоцитов 4 (CTLA-4), B- и T-лимфоцитарного аттенюатора (BTLA), иммуноглобулина T-клеток и домена иммунорецепторного ингибирующего тирозинового мотива (TIGIT), рецептора трансформирующего фактора роста 1 (TGFβRI), рецептора трансформирующего фактора роста 2 (TGFβRII), рецептора макрофагального колониестимулирующего фактора 1 (CSF1R), рецептора интерлейкина-4 (IL4R), рецептора интерлейкина-6 (IL6R), рецептора хемокина 1 (мотив C-X-C) (CXCR1), рецептора хемокина 2 (мотив C-X-C) (CXCR2), альфа-субъединицы рецептора интерлейкина-10 (IL10R), альфа-субъединицы рецептора 2 интерлейкина-13 (IL13R2), родственного фактору некроза опухолей лиганда, индуцирующего апоптоз (TRAILR1), рецепторсвязывающего ракового антигена, экспрессирующегося на клетках SiSo (RCAS1R), и поверхностного Fas-рецептора гибели клеток (FAS).
Согласно одному варианту реализации экзодомен содержит внеклеточный лигандсвязывающий домен рецептора, выбранного из группы, состоящей из: PD-1, LAG-3, TIM3, CTLA-4, IL10R, TIGIT, CSF1R, TGFβRII и TGFβRII.
Ряд трансмембранных доменов можно применять в конкретных вариантах реализации настоящего изобретения. Иллюстративные примеры трансмембранных доменов, подходящих для применения в конкретных вариантах реализации подавителей иммуносупрессорных сигналов, предусмотренных в конкретных вариантах реализации, включают, но не ограничиваются указанными, трансмембранные домены следующих белков: альфа- или бета-цепей T-клеточного рецептора, CDδ, CD3ε, CDγ, CD3ζ, CD4, CD5, CD8α, CD9, CD 16, CD22, CD27, CD28, CD33, CD37, CD45, CD64, CD80, CD86, CD 134, CD137, CD152, CD154 и PD-1.
3. МОДИФИЦИРОВАННЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ
Согласно конкретным вариантам реализации настоящего изобретения иммунные эффекторные клетки с редактированным геномом, предусмотренные в настоящем документе, содержат модифицированный антигенный рецептор. Согласно одному варианту реализации T-клетки, содержащие полинуклеотид, кодирующий модифицированный антигенный рецептор, редактируют путем введения ДЦР в гене CBLB. Согласно одному варианту реализации T-клетки модифицируют путем введения ДЦР в гене CBLB в присутствии донорной матрицы для восстановления, содержащей полинуклеотид, кодирующий модифицированный антигенный рецептор.
Согласно конкретным вариантам реализации настоящего изобретения модифицированный антигенный рецептор представляет собой модифицированный T-клеточный рецептор (ТКР), химерный антигенный рецептор (CAR), рецептор Daric или его компоненты или химерный рецептор цитокина.
a. Модифицированные ТКР
Согласно конкретным вариантам реализации настоящего изобретения иммунные эффекторные клетки с редактированным геномом, предусмотренные в настоящем документе, содержат полинуклеотид, кодирующий модифицированный ТКР. Согласно одному варианту реализации T-клетки, содержащие полинуклеотид, кодирующий модифицированный ТКР, редактируют путем введения ДЦР в гене CBLB. Согласно одному варианту реализации T-клетки модифицируют путем введения ДЦР в гене CBLB в присутствии донорной матрицы для восстановления, кодирующей модифицированный ТКР. Согласно конкретному варианту реализации модифицированный ТКР вставляют в ДЦР в одном аллеле CBLB. Согласно другому варианту реализации настоящего изобретения альфа-цепь модифицированного ТКР вставляют в ДЦР в одном аллеле CBLB, и бета-цепь модифицированного ТКР вставляют в ДЦР в другом аллеле CBLB.
Согласно одному варианту реализации модифицированные T-клетки, предусмотренные в настоящем документе, содержат полинуклеотид, кодирующий модифицированный ТКР, который не вставлен в ген CBLB, и/или один или более из подавителя иммуносупрессорного сигнала, переключающего рецептора, альфа- и/или бета-цепей модифицированного T-клеточного рецептора (ТКР), химерного антигенного рецептора (CAR), рецептора Daric или его компонентов или химерного рецептора цитокина вставлены в ДЦР в одном или более аллелях CBLB.
Природные T-клеточные рецепторы содержат две субъединицы: субъединицу альфа-цепи и бета-цепи, каждая из которых является уникальным белком, вырабатываемым в результате рекомбинационного события в геноме каждой T-клетки. Библиотеки ТКР могут быть подвергнуты скринингу для определения их селективности в отношении конкретных антигенов-мишеней. Таким способом природные ТКР, которые обладают высокой авидностью и реактивностью в отношении антигенов-мишеней, могут быть отобраны, клонированы и впоследствии введены в популяцию T-клеток, применяемых для адоптивной иммунотерапии.
Согласно одному варианту реализации T-клетки модифицируют путем введения донорной матрицы для восстановления, содержащей полинуклеотид, кодирующий субъединицу ТКР, в ДЦР в одном или более аллелях CBLB, причем субъединица ТКР обладает способностью образовывать ТКР, которые придают специфичность T-клеткам в отношении опухолевых клеток, экспрессирующих антиген-мишень. Согласно конкретным вариантам реализации настоящего изобретения субъединицы содержат одну или более замен, делеций, вставок или модификаций аминокислот по сравнению с природной субъединицей, при условии, что субъединицы сохраняют способность образовывать ТКР и придают трансфицированным T-клеткам способность возвращаться к клеткам-мишеням и участвовать в иммунологически целесообразной передаче сигналов с участием цитокинов. Модифицированные ТКР предпочтительно также связывают с высокой авидностью клетки-мишени, экспонирующие соответствующий ассоциированный с опухолью пептид, и необязательно опосредуют эффективное уничтожение клеток-мишеней, презентирующих соответствующий пептид в условиях in vivo.
Нуклеиновые кислоты, кодирующие модифицированные ТКР, предпочтительно выделяют из их природного окружения в (природной) хромосоме T-клетки, и они могут быть встроены в подходящие векторы, описанные в другом месте настоящего документа. Как нуклеиновые кислоты, так и векторы, которые их содержат, могут быть перенесены в клетку, предпочтительно T-клетку согласно конкретным вариантам реализации настоящего изобретения. Модифицированные T-клетки затем способны экспрессировать одну или более цепей ТКР, кодируемых трансдуцированной нуклеиновой кислотой или нуклеиновыми кислотами. Согласно предпочтительным вариантам реализации настоящего изобретения модифицированный ТКР представляет собой экзогенный ТКР, поскольку его вводят в T-клетки, которые обычно не экспрессируют конкретный ТКР. Существенным аспектом модифицированных ТКР является то, что они имеют высокую авидность в отношении опухолевого антигена, презентированного главным комплексом гистосовместимости (ГКГС) или подобным иммунологическим компонентом. В отличие от модифицированных ТКР CAR модифицированы для того чтобы связывать антигены-мишени способом, не зависящим от ГКГС.
ТКР может быть экспрессирован с дополнительными полипептидами, присоединенными к амино-концевой или карбокси-концевой части альфа-цепи или бета-цепи ТКР, при условии, что присоединенный дополнительный полипептид не нарушает способность альфа-цепи или бета-цепи образовывать функциональный T-клеточный рецептор и ГКГС-зависимое распознавание антигена.
Антигены, которые распознаются модифицированными ТКР, предусмотренными в конкретных вариантах реализации, включают, но не ограничиваются указанными, антигены рака, включая антигены как на разных видах гематологического рака, так и солидный опухолях. Иллюстративные антигены включают, но не ограничиваются указанными, альфа-рецептор фолата, 5T4, интегрин αvβ6, BCMA, B7-H3, B7-H6, CAIX, CD19, CD20, CD22, CD30, CD33, CD44, CD44v6, CD44v7/8, CD70, CD79a, CD79b, CD123, CD138, CD171, CEA, CSPG4, EGFR, семейство EGFR, включая ErbB2 (HER2), EGFRvIII, EGP2, EGP40, EPCAM, EphA2, EpCAM, FAP, фетальный AchR, GD2, GD3, глайпикан-3 (GPC3), HLA-A1+MAGE1, HLA-A2+MAGE1, HLA-A3+MAGE1, HLA-A1+NY-ESO-1, HLA-A2+NY-ESO-1, HLA-A3+NY-ESO-1, IL-11Rα, IL-13Rα2, лямбда, Льюис-Y, каппа, мезотелин, Muc1, Muc16, NCAM, лиганды NKG2D, NY-ESO-1, PRAME, PSCA, PSMA, ROR1, SSX, сурвивин, TAG72, TEM, VEGFR2 и WT-1.
Согласно одному варианту реализации донорная матрица для восстановления содержит полинуклеотид, кодирующий промотор РНК-полимеразы II или первый саморасщепляющийся вирусный пептид, и полинуклеотид, кодирующий альфа-цепь и/или бета-цепь модифицированного ТКР, интегрированные в один модифицированный и/или нефункциональный ген CBLB.
Согласно одному варианту реализации донорная матрица для восстановления содержит полинуклеотид, кодирующий промотор РНК-полимеразы II или первый саморасщепляющийся вирусный пептид, и полинуклеотид, кодирующий альфа-цепь и бета-цепь модифицированного ТКР, интегрированные в один модифицированный и/или нефункциональный ген CBLB.
Согласно конкретному варианту реализации донорная матрица для восстановления содержит, в направлении от 5'-конца к 3'-концу, полинуклеотид, кодирующий первый саморасщепляющийся вирусный пептид, полинуклеотид, кодирующий альфа-цепь модифицированного ТКР, полинуклеотид, кодирующий второй саморасщепляющийся вирусный пептид, и полинуклеотид, кодирующий бета-цепь модифицированного ТКР, интегрированные в один модифицированный и/или нефункциональный ген CBLB. В таком случае другой ген CBLB может быть функциональным или может иметь уменьшенную функцию или мог стать нефункциональным в результате ДЦР и восстановления с помощью NHEJ. Согласно одному варианту реализации другой ген CBLB был модифицирован с помощью модифицированной нуклеазы, предусмотренной в настоящем документе, и может иметь уменьшенную функцию или мог стать нефункциональным.
Согласно определенному варианту реализации оба гена CBLB модифицированы и имеют уменьшенную функцию или являются нефункциональными: первый модифицированный ген CBLB содержит нуклеиновую кислоту, содержащую полинуклеотид, кодирующий первый саморасщепляющийся вирусный пептид, и полинуклеотид, кодирующий альфа-цепь модифицированного ТКР, и второй модифицированный ген CBLB содержат полинуклеотид, кодирующий второй саморасщепляющийся вирусный пептид, и полинуклеотид, кодирующий бета-цепь модифицированного ТКР.
b. Химерные антигенные рецепторы (CAR)
Согласно конкретным вариантам реализации настоящего изобретения модифицированные иммунные эффекторные клетки, предусмотренные в настоящем документе, содержат один или более химерных антигенных рецепторов (CAR). Согласно одному варианту реализации T-клетки, содержащие полинуклеотид, кодирующий один или более CAR, редактируют путем введения ДЦР в гене CBLB. Согласно одному варианту реализации T-клетки модифицируют путем введения ДЦР в одном или более генах CBLB в присутствии донорной матрицы для восстановления, кодирующей CAR. Согласно конкретному варианту реализации CAR вставляют в ДЦР в одном гене CBLB.
Согласно одному варианту реализации модифицированные T-клетки, предусмотренные в настоящем документе, содержат CAR, который не вставлен в ген CBLB, и один или более из подавителя иммуносупрессорного сигнала, переключающего рецептора, альфа- и/или бета-цепей модифицированного T-клеточного рецептора (ТКР), химерного антигенного рецептора (CAR), рецептора Daric или его компонентов или химерного рецептора цитокина вставлены в ДЦР в одном или более генах CBLB.
Согласно различным вариантам реализации T-клетки с редактированным геномом экспрессируют CAR, которые перенаправляют цитотоксичность на опухолевые клетки. CAR представляют собой молекулы, которые сочетают специфичность антител к антигену-мишени (например, опухолевому антигену) и внутриклеточный домен, активирующий T-клеточные рецепторы, с получением химерного белка, который проявляет специфичную противоопухолевую клеточную иммунную активность. В настоящем документе термин «химерный» описывает комбинацию частей разных белков или ДНК различного происхождения.
Согласно различным вариантам реализации CAR содержит внеклеточный домен, который связывается со специфичным антигеном-мишенью (также называемый связывающим доменом или антигенспецифичным связывающим доменом), трансмембранный домен и домен внутриклеточной сигнализации. Основной характеристикой CAR является их способность перенаправлять специфичность иммунных эффекторных клеток, что запускает пролиферацию, выработку цитокинов, фагоцитоз или выработку молекул, которые могут опосредовать гибель экспрессирующей антиген-мишень клетки путем, не зависящим от главного комплекса гистосовместимости (ГКГС), используя способности к специфичному нацеливанию на клетки моноклональных антител, растворимых лигандов или специфичных для клеток корецепторов.
Согласно конкретным вариантам реализации настоящего изобретения CAR содержат внеклеточный связывающий домен, который специфично связывается с полипептидом-мишенью, например, антигеном-мишенью, экспрессируемым на опухолевой клетке. В настоящем документе термины «связывающий домен», «внеклеточный домен», «внеклеточный связывающий домен», «антигенсвязывающий домен», «антигенспецифичный связывающий домен» и «внеклеточный антигенсвязывающий домен» используются взаимозаменяемо и представляют химерный рецептор, например, CAR или Daric, обладающий способностью специфично связываться с антигеном-мишенью, представляющим интерес. Связывающий домен может содержать любой белок, полипептид, олигопептид или пептид, который обладает способностью специфично распознавать и связываться с биологической молекулой (например, рецептором клеточной поверхности или опухолевым белком, липидом, полисахаридом или другой целевой молекулой клеточной поверхности, или их компонентом). Связывающий домен включает любого природного, синтетического, полусинтетического или рекомбинантно полученного партнера по связыванию для биологической молекулы, представляющей интерес.
Согласно конкретным вариантам реализации настоящего изобретения внеклеточный связывающий домен содержит антитело или его антигенсвязывающий фрагмент.
«Антитело» относится к связывающему агенту, который представляет собой полипептид, содержащий по меньшей мере вариабельную область легкой цепи или тяжелой цепи иммуноглобулина, которая специфично распознает и связывает эпитоп антигена-мишени, такого как пептид, липид, полисахарид или нуклеиновая кислота, содержащая антигенную детерминанту, такую как те, которые распознаются иммунной клеткой. Антитела включают антигенсвязывающие фрагменты, например, Ig верблюда (антитело верблюдовых или его фрагмент VHH), Ig NAR, фрагменты Fab, фрагменты Fab', фрагменты F(ab)'2, фрагменты F(ab)'3, Fv, одноцепочечное антитело Fv («scFv»), бис-scFv, (scFv)2, минитело, диатело, тритело, тетратело, стабилизированный дисульфидом белок Fv («dsFv») и однодоменное антитело (sdAb, нанотело) или другие фрагменты антител. Термин также включает генетически модифицированные формы, такие как химерные антитела (например, гуманизированные мышиные антитела), гетероконъюгатные антитела (такие как биспецифические антитела) и их антигенсвязывающие фрагменты. См. также Pierce Catalog and Handbook, 1994-1995 (Pierce Chemical Co., Rockford, IL); Kuby, J., Immunology, 3rd ed., W. H. Freeman & Co., New York, 1997.
Согласно одному предпочтительному варианту реализации настоящего изобретения связывающий домен представляет собой scFv.
Согласно другому предпочтительному варианту реализации настоящего изобретения связывающий домен представляет собой антитело верблюдовых.
Согласно конкретным вариантам реализации настоящего изобретения CAR содержит внеклеточный домен, который связывает антиген, выбранный из группы, состоящей из: альфа-рецептора фолата, 5T4, интегрина αvβ6, BCMA, B7-H3, B7-H6, CAIX, CD16, CD19, CD20, CD22, CD30, CD33, CD44, CD44v6, CD44v7/8, CD70, CD79a, CD79b, CD123, CD138, CD171, CEA, CSPG4, EGFR, семейства EGFR, включая ErbB2 (HER2), EGFRvIII, EGP2, EGP40, EPCAM, EphA2, EpCAM, FAP, фетального AchR, GD2, GD3, глайпикана-3 (GPC3), HLA-A1+MAGE1, HLA-A2+MAGE1, HLA-A3+MAGE1, HLA-A1+NY-ESO-1, HLA-A2+NY-ESO-1, HLA-A3+NY-ESO-1, IL-11Rα, IL-13Rα2, лямбда, Льюис-Y, каппа, мезотелина, Muc1, Muc16, NCAM, лигандов NKG2D, NY-ESO-1, PRAME, PSCA, PSMA, ROR1, SSX, сурвивина, TAG72, TEM, VEGFR2 и WT-1.
Согласно конкретным вариантам реализации настоящего изобретения CAR содержат внеклеточный связывающий домен, например, антитело или его антигенсвязывающий фрагмент, который связывает антиген, причем антиген представляет собой комплекс ГКГС-пептид, такой как комплекс ГКГС класса I-пептид или комплекс ГКГС класса II-пептид.
Согласно определенным вариантам реализации настоящего изобретения CAR содержат линкерные остатки между различными доменами. «Соединяющая вариабельную область последовательность» представляет собой аминокислотную последовательность, которая соединяет вариабельную область тяжелой цепи с вариабельной областью легкой цепи и обеспечивает функцию спейсера, совместимую с взаимодействием двух связывающих субдоменов так, что полученный полипептид сохраняет характерную аффинность связывания в отношении той же молекулы-мишени, как и антитело, которое содержит аналогичные вариабельные области легкой и тяжелой цепей. Согласно конкретным вариантам реализации настоящего изобретения CAR содержат один, два, три, четыре или пять или более линкеров. Согласно конкретным вариантам реализации настоящего изобретения длина линкера составляет от приблизительно 1 до приблизительно 25 аминокислот, от приблизительно 5 до приблизительно 20 аминокислот или от приблизительно 10 до приблизительно 20 аминокислот или любое промежуточное количество аминокислот в длину. Согласно некоторым вариантам реализации настоящего изобретения линкер содержит 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 или более аминокислот в длину.
Согласно конкретным вариантам реализации настоящего изобретения после связывающего домена CAR расположен один или более «спейсерных доменов», которые относятся к области, которая перемещает антигенсвязывающий домен от поверхности эффекторных клеток, чтобы обеспечить надлежащий контакт клетка/клетка, связывание антигена и активацию (Patel et al., Gene Therapy, 1999; 6: 412-419). Спейсерный домен может происходить из природного, синтетического, полусинтетического или рекомбинантного источника. Согласно определенным вариантам реализации настоящего изобретения спейсерный домен представляет собой часть иммуноглобулина, включая, но не ограничиваясь указанными, одну или более константных областей тяжелой цепи, например, CH2 и CH3. Спейсерный домен может содержать аминокислотную последовательность природной шарнирной области иммуноглобулина или измененную шарнирную область иммуноглобулина.
Согласно одному варианту реализации спейсерный домен содержит CH2 и CH3 из IgG1, IgG4 или IgD.
Согласно одному варианту реализации связывающий домен CAR соединен с одним или более «шарнирными доменами», которые участвуют в перемещении антигенсвязывающего домена в сторону от поверхности эффекторных клеток, чтобы обеспечить надлежащий контакт клетка/клетка, связывание антигена и активацию. CAR обычно содержит один или более шарнирных доменов между связывающим доменом и трансмембранным доменом (TM). Шарнирный домен может происходить из природного, синтетического, полусинтетического или рекомбинантного источника. Шарнирный домен может содержать аминокислотную последовательность природной шарнирной области иммуноглобулина или измененную шарнирную область иммуноглобулина.
Иллюстративные шарнирные домены, подходящие для применения в CAR, описанных в настоящем документе, включают шарнирную область, происходящую из внеклеточных областей мембранных белков типа 1, таких как CD8α и CD4, которые могут быть шарнирными областями дикого типа из этих молекул или могут быть изменены. В другом варианте шарнирный домен содержит шарнирную область CD8α.
Согласно одному варианту реализации шарнирная область представляет собой шарнирную область PD-1 или шарнирную область CD152.
«Трансмембранный домен» представляет собой часть CAR, которая соединяет внеклеточную связывающую часть и внутриклеточный сигнальный домен и закрепляет CAR в плазматической мембране иммунной эффекторной клетки. Домен TM может происходить из природного, синтетического, полусинтетического или рекомбинантного источника.
Иллюстративные домены TM могут происходить из, т.е. содержать по меньшей мере трансмембранную (ые) область (и), альфа- или бета-цепей T-клеточного рецептора, CD3δ, CD3ε, CD3γ, CD3ζ, CD4, CD5, CD8α, CD9, CD 16, CD22, CD27, CD28, CD33, CD37, CD45, CD64, CD80, CD86, CD 134, CD137, CD152, CD154, AMN и PD-1.
Согласно одному варианту реализации CAR содержит домен TM, происходящий из CD8α. Согласно другому варианту реализации настоящего изобретения CAR, предусмотренный в настоящем документе, содержит домен TM, происходящий из CD8α, и короткий олиго- или полипептидный линкер, предпочтительно из 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислот в длину, который соединяет домен TM и внутриклеточный сигнальный домен CAR. Глицин-сериновый линкер обеспечивает особенно подходящий линкер.
Согласно конкретным вариантам реализации настоящего изобретения CAR содержит внутриклеточный сигнальный домен. «Внутриклеточный сигнальный домен» относится к части CAR, которая участвует в передаче информации об эффективном связывании CAR с антигеном-мишенью внутрь иммунной эффекторной клетки, чтобы вызвать эффекторную функцию клеток, например, активацию, выработку цитокинов, пролиферацию и цитотоксическую активность, включая высвобождение цитотоксических факторов в CAR-связанную клетку-мишень, или другие клеточные ответы, вызванные связыванием антигена с внеклеточным доменом CAR.
Термин «эффекторная функция» относится к специализированной функции клетки. Эффекторная функция T-клетки, например, может представлять собой цитолитическую активность или вспомогательную активность или активность, включающую секрецию цитокина. Таким образом, термин «внутриклеточный сигнальный домен» относится к части белка, которая передает эффекторный функциональный сигнал и которая побуждает клетку выполнять специализированную функцию. Несмотря на то, что обычно может применяться полный внутриклеточный сигнальный домен, во многих случаях нет необходимости применять полный домен. В той степени, в которой применяется укороченный участок внутриклеточного сигнального домена, такой укороченный участок может применяться вместо полного домена, при условии, что он передает эффекторный функциональный сигнал. Термин «внутриклеточный сигнальный домен» подразумевает включение любой укороченной части внутриклеточного сигнального домена, достаточной для передачи эффекторного функционального сигнала.
Известно, что для полной активации T-клетки недостаточно сигналов, создаваемых только за счет ТКР, и что также необходим вторичный или костимулирующий сигнал. Таким образом, можно сказать, что активация T-клеток опосредуется двумя различными классами внутриклеточных сигнальных доменов: первичными сигнальными доменами, которые инициируют антигензависимую первичную активацию за счет ТКР (например, комплекс ТКР/CD3), и костимулирующими сигнальными доменами, которые действуют антиген-независимым способом, чтобы обеспечить вторичный или костимулирующий сигнал. Согласно предпочтительным вариантам реализации настоящего изобретения CAR содержит внутриклеточный сигнальный домен, который содержит один или более «костимулирующих сигнальных доменов» и «первичный сигнальный домен».
Первичные сигнальные домены регулируют первичную активацию комплекса ТКР либо стимулирующим образом, либо ингибирующим образом. Первичные сигнальные домены, которые действуют стимулирующим образом, могут содержать сигнальные мотивы, известные как иммунорецепторные активирующие тирозиновые мотивы или ITAM.
Иллюстративные примеры ITAM-содержащих первичных сигнальных доменов, подходящих для применения в CAR, предусмотренных в конкретных вариантах реализации, включают те, которые происходят из FcRγ, FcRβ, CD3γ, CD3δ, CD3ε, CD3ζ, CD22, CD79a, CD79b и CD66d. Согласно конкретным предпочтительным вариантам реализации настоящего изобретения CAR содержит первичный сигнальный домен CD3ζ и один или более костимулирующих сигнальных доменов. Внутриклеточные первичные сигнальные и костимулирующие сигнальные домены могут быть соединены в любом порядке в тандеме с карбоксильным концом трансмембранного домена.
Согласно конкретным вариантам реализации настоящего изобретения CAR содержит один или более костимулирующих сигнальных доменов для повышения эффективности и размножения T-клеток, экспрессирующих CAR-рецепторы. В настоящем документе термин «костимулирующий сигнальный домен» или «костимулирующий домен» относится к внутриклеточному сигнальному домену костимулирующей молекулы.
Иллюстративные примеры таких костимулирующих молекул, подходящих для применения в CAR, предусмотренных в конкретных вариантах реализации, включают TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, CARD11, CD2, CD7, CD27, CD28, CD30, CD40, CD54 (ICAM), CD83, CD134 (OX40), CD137 (4-1BB), CD278 (ICOS), DAP10, LAT, NKD2C, SLP76, TRIM и ZAP70. Согласно одному варианту реализации CAR содержит один или более костимулирующих сигнальных доменов, выбранных из группы, состоящей из CD28, CD137 и CD134, и первичный сигнальный домен CD3ζ.
Согласно различным вариантам реализации CAR содержит: внеклеточный домен, который связывает антиген, выбранный из группы, состоящей из: BCMA, CD19, CSPG4, PSCA, ROR1 и TAG72; трансмембранный домен, выделенный из полипептида, выбранного из группы, состоящей из: CD4, CD8α, CD154 и PD-1; один или более внутриклеточных костимулирующих сигнальных доменов, выделенных из полипептида, выбранного из группы, состоящей из: CD28, CD134 и CD137; и сигнальный домен, выделенный из полипептида, выбранного из группы, состоящей из: FcRγ, FcRβ, CD3γ, CD3δ, CD3ε, CD3ζ, CD22, CD79a, CD79b и CD66d.
c. Рецепторы Daric
Согласно конкретным вариантам реализации настоящего изобретения модифицированные иммунные эффекторные клетки содержат один или более рецепторов Daric. В настоящем документе термин «рецептор Daric» относится к многоцепочечному модифицированному антигенному рецептору. Согласно одному варианту реализации T-клетки, содержащие полинуклеотид, кодирующий один или более компонентов рецептора Daric, редактируют с помощью введения ДЦР в гене CBLB. Согласно одному варианту реализации T-клетки модифицируют с помощью введения ДЦР в одном или более аллелях CBLB в присутствии донорной матрицы для восстановления, кодирующей один или более компонентов Daric. Согласно конкретному варианту реализации Daric или один или более его компонентов вставлен в ДЦР в одном аллеле CBLB.
Согласно одному варианту реализации настоящего изобретения модифицированные T-клетки содержат Daric, который не вставлен в ген CBLB, и один или более из подавителя иммуносупрессорного сигнала, переключающего рецептора, альфа- и/или бета-цепей модифицированного T-клеточного рецептора (ТКР), химерного антигенного рецептора (CAR) или рецептора Daric или его компонентов вставлены в ДЦР в одном или более аллелях CBLB.
Иллюстративные примеры типов архитектуры и компонентов Daric раскрыты в PCT публикации № WO 2015/017214 и публикации патента США № 20150266973, каждая из которых полностью включена в настоящий документ посредством ссылки.
Согласно одному варианту реализации настоящего изобретения донорная матрица для восстановления содержит следующие компоненты Daric: сигнальный полипептид, содержащий первый домен мультимеризации, первый трансмембранный домен и один или более внутриклеточных костимулирующих сигнальных доменов и/или первичных сигнальных доменов; и связывающий полипептид, содержащий связывающий домен, второй домен мультимеризации и необязательно второй трансмембранный домен. Функциональный Daric содержит мостиковый фактор, который способствует образованию комплекса рецептора Daric на клеточной поверхности, при этом мостиковый фактор ассоциирован с доменами мультимеризации сигнального полипептида и связывающего полипептида и расположен между ними.
Согласно конкретным вариантам реализации настоящего изобретения первый и второй домены мультимеризации ассоциированы с мостиковым фактором, выбранным из группы, состоящей из: рапамицина или его рапалога, кумермицина или его производного, гиббереллина или его производного, абсцизовой кислоты (ABA) или ее производного, метотрексата или его производного, циклоспорина A или его производного, FKCsA или его производного, триметоприм (Tmp)-синтетического лиганда для FKBP (SLF) или его производного и любой их комбинации.
Иллюстративные примеры аналогов рапамицина (рапалогов) включают те, которые раскрыты в патенте США № 6649595, структуры этих рапалогов полностью включены в настоящий документ посредством ссылки. Согласно определенным вариантам реализации настоящего изобретения мостиковый фактор представляет собой рапалог с по существу сниженным иммуносупрессорным эффектом по сравнению с рапамицином. «По существу сниженный иммуносупрессорный эффект» относится к рапалогу, иммуносупрессорный эффект которого по меньшей мере менее чем в 0,1-0,005 раз меньше того, который наблюдается или ожидается для эквимолярного количества рапамицина, измеренного либо клинически, либо в соответствующей имитации иммуносупрессорной активности у человека условиях in vitro (например, ингибирование пролиферации T-клеток) или in vivo. Согласно одному варианту реализации «по существу сниженный иммуносупрессорный эффект» относится к рапалогу, имеющему значение ЭК50 в таком анализе in vitro, которое по меньшей мере в 10-250 раз превышает значение ЭК50, наблюдаемое для рапамицина в аналогичном анализе.
Другие иллюстративные примеры рапалогов включают, но не ограничиваются указанными, эверолимус, новолимус, пимекролимус, ридафоролимус, такролимус, темсиролимус, умиролимус и зотаролимус.
Согласно некоторым вариантам реализации настоящего изобретения домены мультимеризации будут ассоциироваться с мостиковым фактором, представляющим собой рапамицин или его рапалог. Например, первый и второй домены мультимеризации представляют собой пару, выбранную из FKBP и FRB. Домены FRB представляют собой полипептидные области (белковые «домены»), которые способны образовывать трехчленный комплекс с белком FKBP и рапамицином или его рапалогом. Домены FRB присутствуют в ряде природных белков, включая белки mTOR (также называемые в литературе FRAP, RAPT1 или RAFT) человека и других видов; дрожжевые белки, включая Tor1 и Tor2; и гомолог FRAP Candida. Информация, касающаяся нуклеотидных последовательностей, клонирования и других аспектов этих белков уже известна в данной области техники. Например, номер доступа для последовательности человеческого белка mTOR представляет собой номер доступа в GenBank № L34075.1 (Brown et al., Nature 369:756, 1994).
Домены FRB, подходящие для применения в конкретных вариантах реализации настоящего изобретения, предусмотренных в настоящем документе, обычно содержат по меньшей мере от приблизительно 85 до приблизительно 100 остатков аминокислот. Согласно определенным вариантам реализации настоящего изобретения аминокислотная последовательность FRB для применения в гибридных белках согласно настоящему изобретению будет содержать последовательность из 93 аминокислот от Ile-2021 до Lys-2113 и мутацию T2098L на основе аминокислотной последовательности под номером доступа в GenBank L34075.1. Домен FRB для применения в Daric, предусмотренных в конкретных вариантах реализации, будет способен связываться с комплексом белка FKBP, связанного с рапамицином или его рапалогом. Согласно определенным вариантам реализации настоящего изобретения пептидная последовательность домена FRB содержит (а) природную пептидную последовательность, охватывающую по меньшей мере указанную область из 93 аминокислот человеческого mTOR или соответствующие области гомологичных белков; (b) вариант природного FRB, в котором до приблизительно десяти аминокислот или от приблизительно 1 до приблизительно 5 аминокислот, или от приблизительно 1 до приблизительно 3 аминокислот, или, в некоторых вариантах реализации, только одна аминокислота природного пептида были удалены, вставлены или заменены; или (c) пептид, кодируемый молекулой нуклеиновой кислоты, способной селективно гибридизоваться с молекулой ДНК, кодирующей природный домен FRB, или последовательностью ДНК, которая может быть способна, не учитывая вырожденность генетического кода, селективно гибридизоваться с молекулой ДНК, кодирующей природный домен FRB.
FKBP (FK506-связывающие белки) представляют собой цитозольные рецепторы макролидов, такие как FK506, FK520 и рапамицин, и являются высококонсервативными для всех видовых линий. FKBP представляют собой белки или белковые домены, которые способны связываться с рапамицином или его рапалогом и дополнительно образовывать трехчленный комплекс с FRB-содержащим белком или гибридным белком. Домен FKBP также может называться «домен связывания рапамицина». Информация, касающаяся нуклеотидных последовательностей, клонирования и других аспектов различных типов FKBP, известна в данной области техники (см., например, Staendart et al., Nature 346:671, 1990 (человеческий FKBP12); Kay, Biochem. J. 314:361, 1996). Гомологичные белки FKBP у других видов млекопитающих, у дрожжей и у других организмов также известны в данной области техники и могут применяться в гибридных белках, раскрытых в настоящем документе. Домен FKBP, предусмотренный в конкретных вариантах реализации, будет способен связываться с рапамицином или его рапалогом и участвовать в трехчленном комплексе с FRB-содержащим белком (что может быть определено любыми способами, прямыми или косвенными, для обнаружения такого связывания).
Иллюстративные примеры доменов FKBP, подходящих для применения в Daric, предусмотренном в конкретных вариантах реализации, включают, но не ограничиваются ими: природную последовательность пептида FKBP, предпочтительно выделенную из человеческого белка FKBP12 (номер доступа в GenBank AAA58476.1), или выделенную из нее пептидную последовательность, из другого человеческого FKBP, из FKBP мыши или другого млекопитающего, или из FKBP какого-либо другого животного, дрожжей или грибов; вариант природной последовательности FKBP, в которой до приблизительно десяти аминокислот или от приблизительно 1 до приблизительно 5 аминокислот, или от приблизительно 1 до приблизительно 3 аминокислот, или, в некоторых вариантах реализации, только одна аминокислота природного пептида были удалены, вставлены или заменены; или пептидную последовательность, кодируемую молекулой нуклеиновой кислоты, способной селективно гибридизоваться с молекулой ДНК, кодирующей природный FKBP, или последовательностью ДНК, которая может быть способна, не учитывая вырожденность генетического кода, селективно гибридизоваться с молекулой ДНК, кодирующей природный FKBP.
Другие иллюстративные примеры пар доменов мультимеризации, подходящих для применения в Daric, предусмотренном в конкретных вариантах реализации, включают, но не ограничиваются указанными, FKBP и FRB, FKBP и кальцинейрин, FKBP и циклофилин, FKBP и бактериальный DHFR, кальцинейрин и циклофилин, PYL1 и ABI1 или GIB1 и GAI, или их варианты.
В других вариантах реализации противомостиковый фактор блокирует ассоциацию сигнального полипептида и связывающего полипептида с мостиковым фактором. Например, циклоспорин или FK506 могут применяться в качестве противомостиковых факторов для титрования рапамицина и, следовательно, для остановки передачи сигналов, поскольку связан только один домен мультимеризации. Согласно определенным вариантам реализации настоящего изобретения противомостиковый фактор (например, циклоспорин, FK506) представляет собой иммуносупрессорный агент. Например, иммуносупрессорный противомостиковый фактор можно применять для блокирования или сведения к минимуму функции компонентов Daric, предусмотренных в конкретных вариантах реализации, и в то же время ингибировать или блокировать нежелательный или патологический воспалительный ответ в клинических условиях.
Согласно одному варианту реализации первый домен мультимеризации содержит FRB T2098L, второй домен мультимеризации содержит FKBP12 и мостиковый фактор представляет собой рапалог AP21967.
Согласно другому варианту реализации настоящего изобретения первый домен мультимеризации содержит FRB, второй домен мультимеризации содержит FKBP12 и мостиковый фактор представляет собой рапамицин, темсиролимус или эверолимус.
Согласно конкретным вариантам реализации настоящего изобретения сигнальный полипептид содержит первый трансмембранный домен, и связывающий полипептид содержит второй трансмембранный домен или GPI-якорь. Иллюстративные примеры первого и второго трансмембранных доменов выделены из полипептида, независимо выбранного из группы, состоящей из: CD3δ, CD3ε, CD3γ, CD3ζ, CD4, CD5, CD8α, CD9, CD 16, CD22, CD27, CD28, CD33, CD37, CD45, CD64, CD80, CD86, CD 134, CD137, CD152, CD154, AMN и PD-1.
Согласно одному варианту реализации сигнальный полипептид содержит один или более внутриклеточных костимулирующих сигнальных доменов и/или первичных сигнальных доменов.
Иллюстративные примеры первичных сигнальных доменов, подходящих для применения в сигнальных компонентах Daric, предусмотренных в конкретных вариантах реализации, включают те, которые происходят из FcRγ, FcRβ, CD3γ, CD3δ, CD3ε, CD3ζ, CD22, CD79a, CD79b и CD66d. Согласно конкретным предпочтительным вариантам реализации сигнальный компонент Daric содержит первичный сигнальный домен CD3ζ и один или более костимулирующих сигнальных доменов. Внутриклеточные первичные сигнальные и костимулирующие сигнальные домены могут быть связаны в любом порядке в тандеме с карбоксильным концом трансмембранного домена.
Иллюстративные примеры таких костимулирующих молекул, подходящих для применения в сигнальных компонентах Daric, предусмотренных в конкретных вариантах реализации, включают TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, CARD11, CD2, CD7, CD27, CD28, CD30, CD40, CD54 (ICAM), CD83, CD134 (OX40), CD137 (4-1BB), CD278 (ICOS), DAP10, LAT, NKD2C, SLP76, TRIM и ZAP70. Согласно одному варианту реализации сигнальный компонент Daric содержит один или более костимулирующих сигнальных доменов, выбранных из группы, состоящей из CD28, CD137 и CD134, и первичный сигнальный домен CD3ζ.
Согласно конкретным вариантам реализации настоящего изобретения связывающий компонент Daric содержит связывающий домен. Согласно одному варианту реализации связывающий домен представляет собой антитело или его антигенсвязывающий фрагмент.
Антитело или его антигенсвязывающий фрагмент содержит по меньшей мере вариабельную область легкой цепи или тяжелой цепи иммуноглобулина, которая специфично распознает и связывает эпитоп антигена-мишени, такого как пептид, липид, полисахарид или нуклеиновая кислота, содержащая антигенную детерминанту, такую как те, которые распознаются иммунной клеткой. Антитела включают антигенсвязывающие фрагменты, например, Ig верблюда (антитело верблюдовых или его фрагмент VHH), Ig NAR, фрагменты Fab, фрагменты Fab', фрагменты F(ab)'2, фрагменты F(ab)'3, Fv, одноцепочечное антитело Fv («scFv»), бис-scFv, (scFv)2, минитело, диатело, тритело, тетратело, стабилизированный дисульфидом белок Fv («dsFv») и однодоменное антитело (sdAb, нанотело) или другие фрагменты антител. Термин также включает генетически модифицированные формы, такие как химерные антитела (например, гуманизированные мышиные антитела), гетероконъюгатные антитела (такие как биспецифические антитела) и их антигенсвязывающие фрагменты. См. также Pierce Catalog and Handbook, 1994-1995 (Pierce Chemical Co., Rockford, IL); Kuby, J., Immunology, 3rd ed., W. H. Freeman & Co., New York, 1997.
Согласно одному предпочтительному варианту реализации настоящего изобретения связывающий домен представляет собой scFv.
Согласно другому предпочтительному варианту реализации связывающий домен представляет собой антитело верблюдовых.
Согласно конкретным вариантам реализации настоящего изобретения связывающий компонент Daric содержит внеклеточный домен, который связывает антиген, выбранный из группы, состоящей из: альфа-рецептора фолата, 5T4, интегрина αvβ6, BCMA, B7-H3, B7-H6, CAIX, CD16, CD19, CD20, CD22, CD30, CD33, CD44, CD44v6, CD44v7/8, CD70, CD79a, CD79b, CD123, CD138, CD171, CEA, CSPG4, EGFR, семейства EGFR, включая ErbB2 (HER2), EGFRvIII, EGP2, EGP40, EPCAM, EphA2, EpCAM, FAP, фетального AchR, GD2, GD3, глайпикана-3 (GPC3), HLA-A1+MAGE1, HLA-A2+MAGE1, HLA-A3+MAGE1, HLA-A1+NY-ESO-1, HLA-A2+NY-ESO-1, HLA-A3+NY-ESO-1, IL-11Rα, IL-13Rα2, лямбда, Льюис-Y, каппа, мезотелина, Muc1, Muc16, NCAM, лигандов NKG2D, NY-ESO-1, PRAME, PSCA, PSMA, ROR1, SSX, сурвивина, TAG72, TEM, VEGFR2 и WT-1.
Согласно одному варианту реализации связывающий компонент Daric содержит внеклеточный домен, например, антитело или его антигенсвязывающий фрагмент, который связывает комплекс ГКГС-пептид, такой как комплекс ГКГС класса I-пептид или комплекс ГКГС класса II-пептид.
Согласно конкретным вариантам реализации настоящего изобретения компоненты Daric, предусмотренные в настоящем документе, содержат линкер или спейсер, который соединяет два белка, полипептида, пептида, домена, области или мотива. Согласно определенным вариантам реализации настоящего изобретения линкер содержит от приблизительно двух до приблизительно 35 аминокислот или от приблизительно четырех до приблизительно 20 аминокислот, или от приблизительно восьми до приблизительно 15 аминокислот, или от приблизительно 15 до приблизительно 25 аминокислот. Согласно другим вариантам реализации настоящего изобретения спейсер может иметь конкретную структуру, такую как домен антитела CH2CH3, шарнирный домен или тому подобное. Согласно одному варианту реализации спейсер содержит домены CH2 и CH3 из IgG1, IgG4 или IgD.
Согласно конкретным вариантам реализации настоящего изобретения компоненты Daric, предусмотренные в настоящем документе, содержат один или более «шарнирных доменов», которые участвуют в расположении доменов, чтобы обеспечить надлежащий контакт клетка/клетка, связывание антигена и активацию. Daric может содержать один или более шарнирных доменов между доменом связывания и доменом мультимеризации и/или трансмембранным доменом (TM) или между доменом мультимеризации и трансмембранным доменом. Шарнирный домен может происходить из природного, синтетического, полусинтетического или рекомбинантного источника. Шарнирный домен может содержать аминокислотную последовательность природной шарнирной области иммуноглобулина или другую шарнирную область иммуноглобулина. Согласно конкретному варианту реализации шарнир представляет собой шарнир CD8α или шарнир CD4.
Согласно одному варианту реализации настоящего изобретения Daric содержит сигнальный полипептид, содержащий первый домен мультимеризации FRB T2098L, трансмембранный домен CD8, костимулирующий домен 4-1BB и первичный сигнальный домен CD3ζ; связывающий полипептид, содержащий scFv, который связывает CD19, второй домен мультимеризации FKBP12 и трансмембранный домен CD4; и мостиковый фактор, представляющий собой рапалог AP21967.
Согласно одному варианту реализации настоящего изобретения Daric содержит сигнальный полипептид, содержащий первый домен мультимеризации FRB, трансмембранный домен CD8, костимулирующий домен 4-1BB и первичный сигнальный домен CD3ζ; связывающий полипептид, содержащий scFv, который связывает CD19, второй домен мультимеризации FKBP12 и трансмембранный домен CD4; и мостиковый фактор, представляющий собой рапамицин, темсиролимус или эверолимус.
d. Зетакины
Согласно конкретным вариантам реализации настоящего изобретения модифицированные иммунные эффекторные клетки, предусмотренные в настоящем документе, содержат один или более химерных рецепторов цитокинов. Согласно одному варианту реализации настоящего изобретения T-клетки, содержащие полинуклеотид, кодирующий зетакин, редактируют с помощью введения ДЦР в ген CBLB. Согласно одному варианту реализации настоящего изобретения T-клетки модифицируют с помощью введения ДЦР в одном или более аллелях CBLB в присутствии донорной матрицы для восстановления, кодирующей CAR. Согласно конкретному варианту реализации настоящего изобретения химерный рецептор цитокина встраивают в ДЦР в одном аллеле CBLB.
Согласно одному варианту реализации настоящего изобретения модифицированные T-клетки, предусмотренные в настоящем документе, содержат химерный рецептор цитокина, который не вставлен в ген CBLB, и один или более из подавителя иммуносупрессорного сигнала, переключающего рецептора, альфа- и/или бета-цепей модифицированного T-клеточного рецептора (ТКР), химерного антигенного рецептора (CAR), рецептора Daric или его компонентов или химерного рецептора цитокина вставлены в ДЦР в одном или более аллелях CBLB.
Согласно различным вариантам реализации настоящего изобретения T-клетки с редактированным геномом экспрессируют химерный рецептор цитокина, который перенаправляет цитотоксичность на опухолевые клетки. Зетакины представляют собой химерные трансмембранные иммунорецепторы, которые содержат внеклеточный домен, содержащий растворимый лиганд рецептора, соединенный со вспомогательной областью, способной присоединять внеклеточный домен к клеточной поверхности, трансмембранную область и внутриклеточный сигнальный домен. Зетакины, при экспрессии на поверхности Т-лимфоцитов, направляют активность T-клеток на те клетки, которые экспрессируют рецептор, в отношении которого специфичен растворимый лиганд рецептора. Химерные иммунорецепторы, зетакины, перенаправляют антигенную специфичность T-клеток, что можно применять для лечения различных видов рака, в частности, за счет аутокринных/паракринных цитокиновых систем, используемых злокачественными новообразованиями человека.
Согласно конкретным вариантам реализации настоящего изобретения химерный рецептор цитокина содержит иммуносупрессорный цитокин или его вариант, связывающий рецептор цитокина, линкер, трансмембранный домен и внутриклеточный сигнальный домен.
Согласно конкретным вариантам реализации настоящего изобретения цитокин или его вариант, связывающий рецептор цитокина, выбран из группы, состоящей из: интерлейкина-4 (ИЛ-4), интерлейкина-6 (ИЛ-6), интерлейкина-8 (ИЛ-8), интерлейкина-10 (ИЛ-10) и интерлейкина-13 (ИЛ-13).
Согласно некоторым вариантам реализации настоящего изобретения линкер содержит домен CH2CH3, шарнирный домен или тому подобное. Согласно одному варианту реализации линкер содержит домены CH2 и CH3 из IgG1, IgG4 или IgD. Согласно одному варианту реализации линкер содержит шарнирный домен CD8α или CD4.
Согласно конкретным вариантам реализации настоящего изобретения трансмембранный домен выбран из группы, состоящей из: альфа- или бета-цепей T-клеточного рецептора, CD3δ, CD3ε, CD3γ, CD3ζ, CD4, CD5, CD8α, CD9, CD16, CD22, CD27, CD28, CD33, CD37, CD45, CD64, CD80, CD86, CD134, CD137, CD152, CD154, AMN и PD-1.
Согласно конкретным вариантам реализации настоящего изобретения внутриклеточный сигнальный домен выбран из группы, состоящей из: ITAM-содержащего первичного сигнального домена и/или костимулирующего домена.
Согласно конкретным вариантам реализации настоящего изобретения внутриклеточный сигнальный домен выбран из группы, состоящей из: FcRγ, FcRβ, CD3γ, CD3δ, CD3ε, CD3ζ, CD22, CD79a, CD79b и CD66d.
Согласно конкретным вариантам реализации настоящего изобретения внутриклеточный сигнальный домен выбран из группы, состоящей из: TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, CARD11, CD2, CD7, CD27, CD28, CD30, CD40, CD54 (ICAM), CD83, CD134 (OX40), CD137 (4-1BB), CD278 (ICOS), DAP10, LAT, NKD2C, SLP76, TRIM и ZAP70.
Согласно одному варианту реализации химерный рецептор цитокина содержит один или более костимулирующих сигнальных доменов, выбранных из группы, состоящей из CD28, CD137 и CD134, и первичный сигнальный домен CD3ζ.
F. ПОЛИПЕПТИДЫ
В настоящем документе предусмотрены различные полипептиды, включая, но не ограничиваясь указанными, варианты хоуминг-эндонуклеаз, megaTAL и гибридные полипептиды. Согласно предпочтительным вариантам реализации настоящего изобретения полипептид содержит аминокислотную последовательность, представленную в SEQ ID NO: 1-19 и 38. «Полипептид», «полипептидный фрагмент», «пептид» и «белок» используются взаимозаменяемо, если не указано иное, и в соответствии с общепринятым значением, т.е. как последовательность аминокислот. Согласно одному варианту реализации «полипептид» включает гибридные полипептиды и другие варианты. Полипептиды могут быть получены с применением любой из множества хорошо известных рекомбинантных и/или синтетических методик. Полипептиды не ограничены конкретной длиной, например, они могут содержать полноразмерную белковую последовательность, фрагмент полноразмерного белка или гибридный белок и могут содержать посттрансляционные модификации полипептида, например, гликозилирования, ацетилирования, фосфорилирования и тому подобное, а также другие модификации, известные в данной области техники, как природные, так и неприродные.
В настоящем документе «выделенный белок», «выделенный пептид» или «выделенный полипептид» и тому подобное относятся к синтезу, выделению и/или очистке в условиях in vitro молекулы пептида или полипептида от клеточной среды и от ассоциации с другими компонентами клетки, т.е. она существенно не ассоциирована с веществами в условиях in vivo.
Иллюстративные примеры полипептидов, предусмотренных в конкретных вариантах реализации, включают, но не ограничиваются указанными, варианты хоуминг-эндонуклеаз, megaTAL, BiTE, цитокины, хемокины, цитотоксины и рецепторы цитокинов, переключающие рецепторы, подавители иммуносупрессорного сигнала, CAR, DARIC, ТКР и зетакины.
Полипептиды включают «варианты полипептидов». Варианты полипептидов могут отличаться от природных полипептидов одной или более заменами, делециями, добавлениями и/или вставками аминокислот. Такие варианты могут быть природными или могут быть получены синтетическим путем, например, путем модификации одной или более аминокислот вышеуказанных полипептидных последовательностей. Например, согласно конкретным вариантам реализации настоящего изобретения, желательным может быть улучшение биологических свойств хоуминг-эндонуклеазы, megaTAL или т.п., которая связывает и расщепляет сайт-мишень в человеческом гене CBLB, путем введения одной или более замен, делеций, добавлений и/или вставок в полипептид. Согласно конкретным вариантам реализации настоящего изобретения полипептиды включают полипептиды, аминокислотная последовательность которых по меньшей мере приблизительно на 65%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%,85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентична любой из эталонных последовательностей, предусмотренных в настоящем документе, как правило, если вариант сохраняет по меньшей мере один вид биологической активности эталонной последовательности.
Варианты полипептидов включают биологически активные «полипептидные фрагменты». Иллюстративные примеры биологически активных полипептидных фрагментов включают ДНК-связывающие домены, нуклеазные домены и тому подобное. В настоящем документе термин «биологически активный фрагмент» или «минимальный биологически активный фрагмент» относится к полипептидному фрагменту, который сохраняет по меньшей мере 100%, по меньшей мере 90%, по меньшей мере 80%, по меньшей мере 70%, по меньшей мере 60%, по меньшей мере 50%, по меньшей мере 40%, по меньшей мере 30%, по меньшей мере 20%, по меньшей мере 10% или по меньшей мере 5% активности природного полипептида. Согласно предпочтительным вариантам реализации настоящего изобретения биологическая активность представляет собой аффинность связывания и/или активность расщепления в отношении последовательности-мишени. Согласно определенным вариантам реализации настоящего изобретения полипептидный фрагмент может содержать аминокислотную цепь, содержащую по меньшей мере от 5 до приблизительно 1700 аминокислот в длину. Следует понимать, что согласно определенным вариантам реализации настоящего изобретения фрагменты содержат по меньшей мере 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 110, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700 или более аминокислот в длину. Согласно конкретным вариантам реализации настоящего изобретения полипептид содержит биологически активный фрагмент варианта хоуминг-эндонуклеазы. Согласно конкретным вариантам реализации настоящего изобретения полипептиды, представленные в настоящем документе, могут содержать одну или более аминокислот, обозначенных как «X». «X», если присутствует в аминокислотной последовательности SEQ ID NO, относится к любой аминокислоте. Один или более остатков «X» могут присутствовать на N- и C-конце аминокислотной последовательности, представленной в конкретных SEQ ID NO, предусмотренных в настоящем документе. Если аминокислоты «Х» не присутствуют, то оставшаяся часть аминокислотной последовательности, представленная в SEQ ID NO, может считаться биологически активным фрагментом.
Согласно конкретным вариантам реализации настоящего изобретения полипептид содержит биологически активный фрагмент варианта хоуминг-эндонуклеазы, например, SEQ ID NO: 3-12, или megaTAL (SEQ ID NO: 13-19). Биологически активный фрагмент может содержать N-концевое укорочение и/или C-концевое укорочение. Согласно конкретному варианту реализации биологически активный фрагмент не содержит или содержит делецию 1, 2, 3, 4, 5, 6, 7 или 8 N-концевых аминокислот варианта хоуминг-эндонуклеазы по сравнению с соответствующей последовательностью хоуминг-эндонуклеазы дикого типа, более предпочтительно делецию 4 N-концевых аминокислот варианта хоуминг-эндонуклеазы по сравнению с соответствующей последовательностью хоуминг-эндонуклеазы дикого типа. Согласно конкретному варианту реализации биологически активный фрагмент не содержит или содержит делецию 1, 2, 3, 4 или 5 C-концевых аминокислот варианта хоуминг-эндонуклеазы по сравнению с соответствующей последовательностью хоуминг-эндонуклеазы дикого типа, более предпочтительно делецию 2 C-концевых аминокислот варианта хоуминг-эндонуклеазы по сравнению с соответствующей последовательностью хоуминг-эндонуклеазы дикого типа. В конкретном предпочтительном варианте реализации биологически активный фрагмент не содержит или содержит делецию 4 N-концевых аминокислот и 2 C-концевых аминокислот варианта хоуминг-эндонуклеазы по сравнению с соответствующей последовательностью хоуминг-эндонуклеазы дикого типа.
Согласно конкретному варианту реализации вариант I-OnuI содержит делецию 1, 2, 3, 4, 5, 6, 7 или 8 следующих N-концевых аминокислот: M, A, Y, M, S, R, R, E; и/или делецию следующих 1, 2, 3, 4 или 5 C-концевых аминокислот: R, G, S, F, V.
Согласно конкретному варианту реализации вариант I-OnuI содержит делецию или замену 1, 2, 3, 4, 5, 6, 7 или 8 следующих N-концевых аминокислот: M, A, Y, M, S, R, R, E; и/или делецию или замену следующих 1, 2, 3, 4 или 5 C-концевых аминокислот: R, G, S, F, V.
Как отмечено выше, полипептиды могут быть изменены различными путями, включая замены, делеции, укорочения и вставки аминокислот. Способы таких манипуляций в целом известны в данной области техники. Например, варианты аминокислотной последовательности эталонного полипептида могут быть получены с помощью мутаций в ДНК. Способы мутагенеза и изменения нуклеотидных последовательностей хорошо известны в данной области техники. См., например, Kunkel (1985, Proc. Natl. Acad. Sci. USA. 82: 488-492), Kunkel et al., (1987, Methods in Enzymol, 154: 367-382), патент США № 4873192, Watson, J. D. et al., (Molecular Biology of the Gene, 4th ed., Benjamin/Cummings, Menlo Park, Calif., 1987) и ссылки, цитированные в них. Руководство по подходящим заменам аминокислот, которые не влияют на биологическую активность белка, представляющего интерес, можно найти в модели Dayhoff et al., (1978) Atlas of Protein Sequence and Structure (Natl. Biomed. Res. Found., Washington, D.C.).
Согласно определенным вариантам реализации настоящего изобретения вариант будет содержать одну или более консервативных замен. «Консервативная замена» представляет собой замену аминокислоты другой аминокислотой, которая обладает сходными свойствами так, что специалист в области химии пептидов может ожидать, что вторичная структура и гидропатическая характеристика полипептида по существу не изменятся. Модификации могут быть внесены в структуру полинуклеотидов и полипептидов, предусмотренных в конкретных вариантах реализации, причем полипептиды включают полипептиды, имеющие по меньшей мере приблизительно <…> и при этом получить функциональную молекулу, которая кодирует вариант или производное полипептида с желательными характеристиками. Если желательно изменить аминокислотную последовательность полипептида для создания эквивалентного, или даже улучшенного, варианта полипептида, специалист в данной области техники может изменить, например, один или более кодонов кодирующей последовательности ДНК, например, в соответствии с таблицей 1.
ТАБЛИЦА 1 - Кодоны аминокислот
Рекомендации по определению того, какие остатки аминокислот могут быть заменены, вставлены или удалены без потери биологической активности, можно найти с помощью компьютерных программ, хорошо известных в данной области техники, таких как программное обеспечение DNASTAR, GCG, DNA Strider, Geneious, Mac Vector или Vector NTI. Предпочтительно изменения аминокислот в вариантах белка, раскрытых в настоящем документе, представляют собой консервативные замены аминокислот, т.е. замены одинаково заряженных или незаряженных аминокислот. Консервативное изменение аминокислоты включает замену одной из семейства аминокислот, боковые цепи которых являются родственными. Природные аминокислоты обычно подразделяют на четыре семейства: кислые (аспартат, глутамат), основные (лизин, аргинин, гистидин), неполярные (аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан) и незаряженные полярные (глицин, аспарагин, глутамин, цистеин, серин, треонин, тирозин) аминокислоты. Фенилаланин, триптофан и тирозин иногда классифицируют в совокупности как ароматические аминокислоты. Подходящие консервативные замены аминокислот в пептиде или белке известны специалистам в данной области техники и обычно могут быть сделаны без изменения биологической активности полученной молекулы. Специалисты в данной области техники понимают, что в целом отдельные замены аминокислот в несущественных областях полипептида по существу не изменяют биологическую активность (см., например, Watson et al. Molecular Biology of the Gene, 4th ed., 1987, The Benjamin/Cummings Pub. Co., p.224).
Согласно одному варианту реализации, если желательна экспрессия двух или более полипептидов, полинуклеотидные последовательности, кодирующие их, могут быть разделены последовательностью IRES, как описано в другом месте настоящего документа.
Полипептиды, предусмотренные в конкретных вариантах реализации, включают гибридные полипептиды. Согласно конкретным вариантам реализации настоящего изобретения предложены гибридные полипептиды и полинуклеотиды, кодирующие гибридные полипептиды. Гибридные полипептиды и гибридные белки относятся к полипептиду, имеющему по меньшей мере два, три, четыре, пять, шесть, семь, восемь, девять или десять полипептидных сегментов.
Согласно другому варианту реализации два или более полипептидов могут быть экспрессированы в виде гибридного белка, который содержит одну или более последовательностей саморасщепляющихся полипептидов, как раскрыто в другом месте настоящего документа.
Согласно одному варианту реализации гибридный белок, предусмотренный в настоящем документе, содержит один или более ДНК-связывающих доменов и одну или более нуклеаз, а также один или более линкерных и/или саморасщепляющихся полипептидов.
Согласно одному варианту реализации гибридный белок, предусмотренный в настоящем документе, содержит вариант нуклеазы; линкер или саморасщепляющийся пептид; и модифицирующий концы фермент, включая, но не ограничиваясь этим, 5'-3'-экзонуклеазу, 5'-3'-щелочную экзонуклеазу и 3'-5'-экзонуклеазу (например, Trex2).
Гибридные полипептиды могут содержать один или более полипептидных доменов или сегментов, включая, но не ограничиваясь указанными, сигнальные пептиды, проникающие в клетки пептидные домены (CPP), ДНК-связывающие домены, нуклеазные домены и т.д., эпитопные метки (например, связывающий мальтозу белок («MBP»), глутатион-S-трансферазу (GST), HIS6, MYC, FLAG, V5, VSV-G и HA), полипептидные линкеры и сигналы расщепления полипептидов. Гибридные полипептиды, как правило, соединены C-концом к N-концу, хотя они также могут быть соединены C-концом к C-концу, N-концом к N-концу или N-концом к C-концу. Согласно конкретным вариантам реализации настоящего изобретения полипептиды гибридного белка могут быть расположены в любом порядке. Гибридные полипептиды или гибридные белки также могут включать консервативно модифицированные варианты, полиморфные варианты, аллели, мутанты, субпоследовательности и межвидовые гомологи, при условии, что сохраняется желательная активность гибридного полипептида. Гибридные полипептиды могут быть получены с помощью способов химического синтеза или за счет образования химической связи между двумя фрагментами или обычно могут быть получены с применением других стандартных методик. Лигированные последовательности ДНК, содержащие гибридный полипептид, функционально соединены с подходящими элементами контроля транскрипции или трансляции, как описано в другом месте настоящего документа.
Гибридные полипептиды необязательно могут содержать линкер, который можно применять для соединения одного или более полипептидов или доменов внутри полипептида. Пептидную линкерную последовательность можно применять для отделения любых двух или более полипептидных компонентов на расстояние, достаточное для того, чтобы каждый полипептид складывался в свои соответствующие вторичные и третичные структуры так, чтобы позволить полипептидным доменам выполнять свои целевые функции. Такая пептидная линкерная последовательность встроена в гибридный полипептид с применением стандартных методик в данной области техники. Подходящие пептидные линкерные последовательности могут быть выбраны на основании следующих факторов: (1) их способности принимать гибкую удлиненную конформацию; (2) их неспособности принимать вторичную структуру, которая могла бы взаимодействовать с функциональными эпитопами на первом и втором полипептидах; и (3) отсутствие гидрофобных или заряженных остатков, которые могут реагировать с полипептидными функциональными эпитопами. Предпочтительные пептидные линкерные последовательности содержат остатки Gly, Asn и Ser. Другие почти нейтральные аминокислоты, такие как Thr и Ala, также можно применять в линкерной последовательности. Аминокислотные последовательности, которые можно эффективно применять в качестве линкеров, включают последовательности, раскрытые в Maratea et al., Gene 40:39-46, 1985; Murphy et al., Proc. Natl. Acad. Sci. USA 83:8258-8262, 1986; патенте США № 4935233 и патенте США № 4751180. Линкерные последовательности не требуются, если конкретный сегмент гибридного полипептида содержит несущественные N-концевые аминокислотные области, которые можно применять для разделения функциональных доменов и предотвращения стерического вмешательства. Предпочтительные линкеры, как правило, представляют собой гибкие аминокислотные подпоследовательности, которые синтезируются как часть рекомбинантного гибридного белка. Линкерные полипептиды могут содержать от 1 до 200 аминокислот в длину, от 1 до 100 аминокислот в длину или от 1 до 50 аминокислот в длину, включая все промежуточные целочисленные значения.
Примерные линкеры включают, но не ограничиваются указанными, следующие аминокислотные последовательности: полимеры глицина (G)n; полимеры глицин-серин (G1-5S1-5)n, где n представляет собой целое число, выбранное из по меньшей мере одного, двух, трех, четырех или пяти; полимеры глицин-аланин; полимеры аланин-серин; GGG (SEQ ID NO: 39); DGGGS (SEQ ID NO: 40); TGEKP (SEQ ID NO: 41) (см., например, Liu et al., PNAS 5525-5530 (1997)); GGRR (SEQ ID NO: 42) (Pomerantz et al. 1995, выше); (GGGGS)n, где n = 1, 2, 3, 4 или 5 (SEQ ID NO: 43) (Kim et al., PNAS 93, 1156-1160 (1996.); EGKSSGSGSESKVD (SEQ ID NO: 44) (Chaudhary et al., 1990, Proc. Natl. Acad. Sci. U.S.A. 87:1066-1070); KESGSVSSEQLAQFRSLD (SEQ ID NO: 45) (Bird et al., 1988, Science 242:423-426), GGRRGGGS (SEQ ID NO: 46); LRQRDGERP (SEQ ID NO: 47); LRQKDGGGSERP (SEQ ID NO: 48); LRQKD(GGGS)2ERP (SEQ ID NO: 49). Согласно другому варианту гибкие линкеры могут быть рационально разработаны с применением компьютерной программы, способной моделировать ДНК-связывающие сайты и пептиды как таковые (Desjarlais & Berg, PNAS 90:2256-2260 (1993), PNAS 91:11099-11103 (1994)) или с помощью способов фагового дисплея.
Гибридные полипептиды могут дополнительно содержать сигнал расщепления полипептида между каждым из полипептидных доменов, описанных в настоящем документе, или между эндогенной открытой рамкой считывания и полипептидом, кодируемым донорной матрицей для восстановления. Помимо этого сайт расщепления полипептида может быть введен в любую последовательность линкерного пептида. Примерные сигналы расщепления полипептидов включают распознаваемые сайты расщепления полипептидов, такие как сайты расщепления протеазами, сайты расщепления нуклеазами (например, сайты распознавания редкими рестрикционными ферментами, сайты распознавания рибозимами с саморасщеплением) и саморасщепляющиеся вирусные олигопептиды (см. eFelipe and Ryan, 2004. Traffic, 5(8); 616-26).
Подходящие сайты расщепления протеазами и саморасщепляющиеся пептиды известны специалисту в данной области техники (см., например, Ryan et al., 1997. J. Gener. Virol. 78, 699-722; Scymczak et al. (2004) Nature Biotech. 5, 589-594). Примерные сайты расщепления протеазами включают, но не ограничиваются указанными, сайты расщепления протеазами NIa потивируса (например, протеазой вируса гравировки табака), протеазами HC потивируса, протеазами P1 (P35) потивируса, протеазами NIa беовируса, протеазами, кодируемыми РНК-2 беовируса, протеазами L афтовируса, протеазами 2A энтеровируса, протеазами 2A риновируса, протеазами 3C пикорнавируса, протеазами 24K комовируса, протеазами 24K неповируса, 3C-подобной протеазой RTSV (сферического вируса риса тунгро), 3C-подобной протеазой PYVF (вируса желтой пятнистости пастернака), гепарином, тромбином, фактором Xa и энтерокиназой. Благодаря высокой строгости расщепления сайты расщепления протеазой TEV (вируса гравировки табака) являются предпочтительными в одном варианте реализации, например, EXXYXQ(G/S) (SEQ ID NO: 50), например, ENLYFQG (SEQ ID NO: 51) и ENLYFQS (SEQ ID NO: 52), где X представляет собой любую аминокислоту (расщепление под действием TEV происходит между Q и G или Q и S).
Согласно определенным вариантам реализации настоящего изобретения сайт саморасщепляющегося полипептида содержит 2A или 2A-подобный сайт, последовательность или домен (Donnelly et al., 2001. J. Gen. Virol. 82:1027-1041). Согласно конкретному варианту реализации вирусный пептид 2А представляет собой пептид 2А афтовируса, пептид 2А потивируса или пептид 2А кардиовируса.
Согласно одному варианту реализации вирусный пептид 2А выбран из группы, состоящей из: пептида вируса ящура (FMDV) (F2A), пептида вируса ринита лошадей А (ERAV) (E2A), пептида вируса Thosea asigna (TaV) (T2A), пептида свиного тешовируса 1 (PTV-1) (P2A), пептида тейловируса 2A и пептида 2A вируса энцефаломиокардита.
Иллюстративные примеры сайтов 2А представлены в таблице 2.
ТАБЛИЦА 2: Примерные сайты 2А включают следующие последовательности:
G. ПОЛИНУКЛЕОТИДЫ
Согласно конкретным вариантам реализации настоящего изобретения предложены полинуклеотиды, кодирующие один или более вариантов хоуминг-эндонуклеаз, megaTAL, модифицирующих концы ферментов и гибридных полипептидов или один или более биологически активных фрагментов или вариантов, предусмотренных в настоящем документе. В настоящем документе термины «полинуклеотид» или «нуклеиновая кислота» относятся к дезоксирибонуклеиновой кислоте (ДНК), рибонуклеиновой кислоте (РНК) и гибридам ДНК/РНК. Полинуклеотиды могут быть одноцепочечными или двухцепочечными, а также рекомбинантными, синтетическими или выделенными. Полинуклеотиды включают, но не ограничиваются указанными: предшественника информационной РНК (пре-иРНК), информационную РНК (иРНК), РНК, короткую интерферирующую РНК (киРНК), короткую шпилечную РНК (кшРНК), микроРНК (миРНК), рибозимы, геномную РНК (гРНК), плюс нить РНК (РНК (+)), минус нить РНК (РНК (-)), tracr-РНК, cr-РНК, одиночную направляющую РНК (онРНК), синтетическую РНК, синтетическую иРНК, геномную ДНК (гДНК), ПЦР-амплифицированную ДНК комплементарную ДНК (кДНК), синтетическую ДНК или рекомбинантную ДНК. Согласно конкретным вариантам реализации настоящего изобретения полинуклеотиды представляют собой полинуклеотидные фрагменты, которые кодируют один или более биологически активных полипептидных фрагментов или вариантов. Полинуклеотиды относятся к полимерной форме нуклеотидов, содержащей по меньшей мере 5, по меньшей мере 10, по меньшей мере 15, по меньшей мере 20, по меньшей мере 25, по меньшей мере 30, по меньшей мере 40, по меньшей мере 50, по меньшей мере 100, по меньшей мере 200, по меньшей мере 300, по меньшей мере 400, по меньшей мере 500, по меньшей мере 1000, по меньшей мере 5000, по меньшей мере 10000 или по меньшей мере 15000 или более нуклеотидов в длину, либо рибонуклеотидов, либо дезоксирибонуклеотидов, или к модифицированной форме любого типа нуклеотидов, включая все промежуточные значения длины. Следует понимать, что «промежуточные значения длины» в данном контексте означает любую длину в пределах указанных значений, например, 6, 7, 8, 9 и т.д., 101, 102, 103 и т.д.; 151, 152, 153 и т.д.; 201, 202, 203 и т.д. Согласно конкретным вариантам реализации настоящего изобретения полинуклеотиды или варианты имеют по меньшей мере или приблизительно 50%, 55%, 60%, 65%, 70%, 71%, 72%, 73%, 74%, 75%, 76%, 77%, 78%, 79%, 80%, 81%, 82%, 83%, 84%,85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности с эталонной последовательностью.
Согласно конкретным вариантам реализации настоящего изобретения полинуклеотиды могут быть оптимизированы по кодонам. В настоящем документе термин «оптимизированный по кодонам» относится к замене кодонов в полинуклеотиде, кодирующем полипептид, для увеличения экспрессии, стабильности и/или активности полипептида. Факторы, которые влияют на оптимизацию кодонов, включают, но не ограничиваются одним или более из: (i) изменения предпочтения кодонов между двумя или более организмами или генами или искусственно составленными таблицами предпочтения кодонов, (ii) изменения степени предпочтения кодонов в организме, гене или наборе генов, (iii) систематического изменения кодонов, включая контекст, (iv) изменения кодонов в соответствии с их декодирующими тРНК, (v) изменения кодонов в соответствии с процентом (%) GC, либо в целом, либо в одном положении триплета, (vi) изменения степени сходства с эталонной последовательностью, например, природной последовательностью, (vii) изменения точки отсечения частоты кодона, (viii) структурных свойств иРНК, транскрибируемых с последовательности ДНК, (ix) имеющейся информации о функции последовательностей ДНК, на которых должен основываться дизайн набора для замены кодона, (x) систематического изменения наборов кодонов для каждой аминокислоты и/или (xi) изолированного удаления ложных сайтов инициации трансляции.
В настоящем документе термин «нуклеотид» относится к гетероциклическому азотистому основанию, соединенному N-гликозидной связью с фосфорилированным сахаром. Следует понимать, что нуклеотиды включают природные основания и широкий спектр общеизвестных в данной области техники модифицированных оснований. Такие основания обычно расположены в положении 1' сахарного фрагмента нуклеотида. Нуклеотиды обычно содержат основание, сахар и фосфатную группу. В рибонуклеиновой кислоте (РНК) сахар представляет собой рибозу, и в дезоксирибонуклеиновой кислоте (ДНК) сахар представляет собой дезоксирибозу, т.е. сахар, в котором отсутствует гидроксильная группа, присутствующая в рибозе. Примерные природные азотистые основания включают пурины, аденозин (A) и гуанидин (G), и пиримидины, цитидин (C) и тимидин (T) (или в случае РНК, урацил (U)). Атом С-1 дезоксирибозы связан с N-1 пиримидина или N-9 пурина. Нуклеотиды обычно представляют собой моно-, ди- или трифосфаты. Нуклеотиды могут быть немодифицированными или модифицированными по сахарному, фосфатному и/или основному фрагменту (также взаимозаменяемо называемые аналоги нуклеотидов, производные нуклеотидов, модифицированные нуклеотиды, неприродные нуклеотиды и нестандартные нуклеотиды; см., например, WO 92/07065 и WO 93/15187). Примеры модифицированных оснований нуклеиновых кислот обобщены Limbach et al., (1994, Nucleic Acids Res. 22, 2183-2196).
Нуклеотид также может рассматриваться как фосфатный эфир нуклеозида, причем этерификация происходит на гидроксильной группе, присоединенной к С-5 сахара. В настоящем документе термин «нуклеозид» относится к гетероциклическому азотистому основанию, соединенному за счет N-гликозидной связи с сахаром. В данной области техники известно, что нуклеозиды включают природные основания, а также включают хорошо известные модифицированные основания. Такие основания обычно располагаются в положении 1' сахарного фрагмента нуклеозида. Нуклеозиды обычно содержат основание и сахарную группу. Нуклеозиды могут быть немодифицированными или модифицированными по сахару и/или основному остатку (также взаимозаменяемо называются аналоги нуклеозидов, производные нуклеозидов, модифицированные нуклеозиды, неприродные нуклеозиды или нестандартные нуклеозиды). Как уже отмечено выше, примеры модифицированных оснований нуклеиновых кислот обобщены Limbach et al., (1994, Nucleic Acids Res. 22, 2183-2196).
Иллюстративные примеры полинуклеотидов включают, но не ограничиваются указанными, полинуклеотиды, кодирующие SEQ ID NO: 1-19 и 38, и полинуклеотидные последовательности, представленные в SEQ ID NO: 20-37.
В различных иллюстративных вариантах реализации полинуклеотиды, предусмотренные в настоящем документе, включают, но не ограничиваются указанными, полинуклеотиды, кодирующие варианты хоуминг-эндонуклеаз, megaTAL, модифицирующие концы ферменты, гибридные полипептиды, и векторы экспрессии, вирусные векторы и переносящие плазмиды, содержащие полинуклеотиды, предусмотренные в настоящем документе.
В настоящем документе термины «вариант полинуклеотида» и «вариант» и тому подобное относятся к полинуклеотидам, проявляющим существенную идентичность последовательности с эталонной полинуклеотидной последовательностью, или полинуклеотидами, которые гибридизуются с эталонной последовательностью в строгих условиях, которые определены ниже. Эти термины также охватывают полинуклеотиды, которые отличаются от эталонного полинуклеотида добавлением, делецией, заменой или модификацией по меньшей мере одного нуклеотида. Соответственно, термины «вариант полинуклеотида» и «вариант» включают полинуклеотиды, в которых один или более нуклеотидов были добавлены или удалены, или модифицированы, или заменены различными нуклеотидами. В связи с этим в данной области техники хорошо известно, что определенные изменения, включая мутации, добавления, делеции и замены, могут быть сделаны в отношении эталонного полинуклеотида, при условии, что измененный полинуклеотид сохраняет биологическую функцию или активность эталонного полинуклеотида.
Варианты полинуклеотидов включают фрагменты полинуклеотидов, которые кодируют биологически активные фрагменты или варианты полипептидов. В настоящем документе термин «фрагмент полинуклеотида» относится к фрагменту полинуклеотида, содержащему по меньшей мере 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 110, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700 или более нуклеотидов в длину, кодирующему вариант полипептида, который сохраняет по меньшей мере 100%, по меньшей мере 90%, по меньшей мере 80%, по меньшей мере 70%, по меньшей мере 60%, по меньшей мере 50%, по меньшей мере 40%, по меньшей мере 30%, по меньшей мере 20%, по меньшей мере 10% или по меньшей мере 5% активности природного полипептида. Фрагменты полинуклеотидов относятся к полинуклеотиду, который кодирует полипептид, который имеет амино-концевую делецию, карбокси-концевую делецию и/или внутреннюю делецию или замену одной или более аминокислот природного или рекомбинантно полученного полипептида.
Согласно одному варианту реализации полинуклеотид содержит нуклеотидную последовательность, которая гибридизуется с последовательностью нуклеиновой кислоты-мишени в строгих условиях. Гибридизация в «строгих условиях» описывает протоколы гибридизации, в которых нуклеотидные последовательности, идентичные друг другу по меньшей мере на 60%, остаются гибридизованными. Обычно строгие условия выбраны так, чтобы они были приблизительно на 5°C ниже, чем температура плавления (Tm) для конкретной последовательности при определенной ионной силе и pH. Tm представляет собой температуру (при определенной ионной силе, pH и концентрации нуклеиновой кислоты), при которой 50% зондов, комплементарных последовательности-мишени, гибридизуются с последовательностью-мишенью в равновесном состоянии. Поскольку последовательности-мишени обычно присутствуют в избытке, при Tm 50% зондов занято в равновесном состоянии.
В настоящем документе выражения «идентичность последовательности» или, например, содержащие «последовательность, идентичную на 50%» относятся к степени, в которой последовательности идентичны на основании сопоставления нуклеотид-нуклеотид или на основании сопоставления аминокислота-аминокислота в окне сравнения. Таким образом, «процент идентичности последовательности» может быть рассчитан путем сравнения двух оптимально выравненных последовательностей в окне сравнения, определения количества положений, в которых идентичное основание нуклеиновой кислоты (например, A, T, C, G, I) или идентичный остаток аминокислоты (например, Ala, Pro, Ser, Thr, Gly, Val, Leu, Ile, Phe, Tyr, Trp, Lys, Arg, His, Asp, Glu, Asn, Gln, Cys и Met) встречается в обеих последовательностях, чтобы получить количество совпадающих положений, деления количества совпадающих положений на общее количество положений в окне сравнения (т.е. размер окна) и умножения результата на 100, чтобы получить процент идентичности последовательности. Предусмотрены нуклеотиды и полипептиды, имеющие по меньшей мере приблизительно 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или 100% идентичность последовательности с любой из эталонных последовательностей, описанных в настоящем документе, как правило, если вариант полипептида поддерживает по меньшей мере один вид биологической активности эталонного полипептида.
Термины, используемые для описания взаимосвязей последовательностей между двумя или более полинуклеотидами или полипептидами, включают «эталонная последовательность», «окно сравнения», «идентичность последовательности», «процент идентичности последовательности» и «существенная идентичность». «Эталонная последовательность» содержит по меньшей мере 12, но часто от 15 до 18 и часто по меньшей мере 25 мономерных звеньев в длину, включая нуклеотиды и остатки аминокислот. Поскольку каждый из двух полинуклеотидов может содержать (1) последовательность (т.е. только часть полной полинуклеотидной последовательности), которая является сходной между двумя полинуклеотидами, и (2) последовательность, которая отличается в двух полинуклеотидах, сравнения последовательностей между двумя (или более) полинуклеотидами обычно выполняют путем сравнения последовательностей двух полинуклеотидов в «окне сравнения» для выявления и сравнения локальных областей сходства последовательностей. «Окно сравнения» относится к концептуальному сегменту из по меньшей мере 6 смежных положений, обычно от приблизительно 50 до приблизительно 100, более обычно от приблизительно 100 до приблизительно 150, в котором последовательность сравнивают с эталонной последовательностью, состоящей из того же количества смежных положений, после оптимального выравнивания двух последовательностей. Окно сравнения может содержать добавления или делеции (т.е. пропуски) приблизительно 20% или менее по сравнению с эталонной последовательностью (которая не содержит добавления или делеции) для оптимального выравнивания двух последовательностей. Оптимальное выравнивание последовательностей для выравнивания окна сравнения может быть выполнено с помощью компьютеризированных реализаций алгоритмов (GAP, BESTFIT, FASTA и TFASTA, например, в программном обеспечении DNASTAR, GCG, DNA Strider, Geneious, Mac Vector или Vector NTI) или путем проверки, с последующим отбором наилучшего выравнивания (т.е. приводящего к наибольшему проценту гомологии в окне сравнения), полученному с помощью любого из различных способов. Также можно сослаться на семейство программ BLAST, например, раскрытое Altschul et al., 1997, Nucl. Acids Res. 25:3389. Подробное обсуждение анализа последовательности можно найти в разделе 19.3 Ausubel et al., Current Protocols in Molecular Biology, John Wiley & Sons Inc., 1994-1998, гл. 15.
В настоящем документе «выделенный полинуклеотид» относится к полинуклеотиду, который был очищен от последовательностей, фланкирующих его в природном состоянии, например, к фрагменту ДНК, который был извлечен из последовательностей, которые обычно соседствуют с фрагментом. Согласно конкретным вариантам реализации настоящего изобретения «выделенный полинуклеотид» относится к комплементарной ДНК (кДНК), рекомбинантному полинуклеотиду, синтетическому полинуклеотиду или другому полинуклеотиду, который не существует в природе и который был создан человеком.
Согласно различным вариантам реализации полинуклеотид содержит иРНК, кодирующую полипептид, предусмотренный в настоящем документе, включая, но не ограничиваясь указанными, вариант хоуминг-эндонуклеазы, megaTAL и модифицирующий концы фермент. Согласно некоторым вариантам реализации настоящего изобретения иРНК содержит кэп, один или более нуклеотидов и полиА-хвост.
В настоящем документе термины «5'-кэп» или «5'-кэп структура» или «5'-кэп фрагмент» относятся к химической модификации, которая была встроена в 5'-конец иРНК. 5'-кэп участвует в ядерном экспорте, стабильности иРНК и трансляции.
Согласно конкретным вариантам реализации настоящего изобретения иРНК, предусмотренная в настоящем документе, содержит 5'-кэп, содержащий 5'-ppp-5'-трифосфатную связь между концевым гуанозиновым остатком кэпа и 5'-концевым транскрибированным смысловым нуклеотидом молекулы иРНК. Этот 5'-гуанилатный кэп затем может быть метилирован с образованием остатка N7-метилгуанилата.
Иллюстративные примеры 5'-кэпа, подходящего для применения в конкретных вариантах реализации полинуклеотидов иРНК, предусмотренных в настоящем документе, включают, но не ограничиваются ими: неметилированные аналоги 5'-кэпа, например, G(5')ppp(5')G, G(5')ppp(5')C, G(5')ppp(5')A; метилированные аналоги 5'-кэпа, например, m7G(5')ppp(5')G, m7G(5')ppp(5')C и m7G(5')ppp(5')A; диметилированные аналоги 5'-кэпа, например, m2,7G(5')ppp(5')G, m2,7G(5')ppp(5')C и m2,7G(5')ppp(5')A; триметилированные аналоги 5'-кэпа, например, m2,2,7G(5')ppp(5')G, m2,2,7G(5')ppp(5')C и m2,2,7G(5')ppp(5')A; диметилированные симметричные аналоги 5'-кэпа, например, m7G(5')pppm7(5')G, m7G(5')pppm7(5')C и m7G(5')pppm7(5')A; и аналоги 5-кэпа с правильной ориентацией, например, аналог кэп-структуры с правильной ориентацией (ARCA), обозначенный 3'O-Me-m7G(5')ppp(5')G, 2'O-Me-m7G(5')ppp(5')G, 2'O-Me-m7G(5')ppp(5')C, 2'O-Me-m7G(5')ppp(5')A, m72'd(5')ppp(5')G, m72'd(5')ppp(5')C, m72'd(5')ppp(5')A, 3'O-Me-m7G(5')ppp(5')C, 3'O-Me-m7G(5')ppp(5')A, m73'd(5')ppp(5')G, m73'd(5')ppp(5')C, m73'd(5')ppp(5')A и их тетрафосфатные производные (см., например, Jemielity et al., RNA, 9: 1108-1122 (2003)).
Согласно конкретным вариантам реализации настоящего изобретения иРНК содержат 5'-кэп, который представляет собой 7-метилгуанилат («m7G»), соединенный за счет трифосфатного мостика с 5'-концом первого транскрибированного нуклеотида, что приводит к получению m7G(5')ppp(5')N, где N представляет собой любой нуклеозид.
Согласно некоторым вариантам реализации настоящего изобретения иРНК содержат 5'-кэп, где кэп представляет собой структуру Cap0 (структуры Cap0 не содержат 2'-O-метильный остаток рибозы, присоединенный к основаниям 1 и 2), структуру Cap1 (структуры Cap1 имеют 2'-О-метильный остаток у основания 2) или структуру Cap2 (структуры Cap2 имеют 2'-O-метильный остаток, присоединенный к обоим основаниям 2 и 3).
Согласно одному варианту реализации иРНК содержит m7G(5')ppp(5')G кэп.
Согласно одному варианту реализации иРНК содержит ARCA-кэп.
Согласно конкретным вариантам реализации настоящего изобретения иРНК, предусмотренная в настоящем документе, содержит один или более модифицированных нуклеозидов.
Согласно одному варианту реализации иРНК содержит один или более модифицированных нуклеозидов, выбранных из группы, состоящей из: псевдоуридина, пиридин-4-он-рибонуклеозида, 5-азауридина, 2-тио-5-азауридина, 2-тиоуридина, 4-тиопсевдоуридина, 2-тиопсевдоуридина, 5-гидроксиуридина, 3-метилуридина, 5-карбоксиметилуридина, 1-карбоксиметилпсевдоуридина, 5-пропинилуридина, 1-пропинилпсевдоуридина, 5-тауринометилуридина, 1-тауринометилпсевдоуридина, 5-тауринометил-2-тиоуридина, 1-тауринометил-4-тиоуридина, 5-метилуридина, 1-метилпсевдоуридина, 4-тио-1-метилпсевдоуридина, 2-тио-1-метилпсевдоуридина, 1-метил-1-деазапсевдоуридина, 2-тио-1-метил-1-деазапсевдоуридина, дигидроуридина, дигидропсевдуридина, 2-тиодигидроуридина, 2-тиодигидропсевдуридина, 2-метоксиуридина, 2-метокси-4-тиоуридина, 4-метоксипсевдоуридина, 4-метокси-2-тиопсевдоуридина, 5-азацитидина, псевдоизоцитидина, 3-метилцитидина, N4-ацетилцитидина, 5-формилцитидина, N4-метилцитидина, 5-гидроксиметилцитидина, 1-метилпсевдоизоцитидина, пирролоцитидина, пирролопсевдоизоцитидина, 2-тиоцитидина, 2-тио-5-метилцитидина, 4-тиопсевдоизоцитидина, 4-тио-1-метилпсевдоизоцитидина, 4-тио-1-метил-1-деазапсевдоизоцитидина, 1-метил-1-деазапсевдоизоцитидина, зебуларина, 5-азазебуларина, 5-метилзебуларина, 5-аза-2-тиозебуларина, 2-тиозебуларина, 2-метоксицитидина, 2-метокси-5-метилцитидина, 4-метоксипсевдоизоцитидина, 4-метокси-1-метилпсевдоизоцитидина, 2-аминопурина, 2,6-диаминопурина, 7-деазааденина, 7-деаза-8-азааденина, 7-деаза-2-аминопурина, 7-деаза-8-аза-2-аминопурина, 7-деаза-2,6-диаминопурина, 7-деаза-8-аза-2,6-диаминопурина, 1-метиладенозина, N6-метиладенозина, N6-изопентениладенозина, N6-(цис-гидроксиизопентенил)аденозина, 2-метилтио-N6-(цис-гидроксиизопентенил)аденозина, N6-глицинилкарбамоиладенозина, N6-треонилкарбамоиладенозина, 2-метилтио-N6-треонилкарбамоиладенозина, N6,N6-диметиладенозина, 7-метиладенина, 2-метилтиоаденина, 2-метоксиаденина, инозина, 1-метилинозина, вайозина, вайбутозина, 7-деазагуанозина, 7-деаза-8-азагуанозина, 6-тиогуанозина, 6-тио-7-деазагуанозина, 6-тио-7-деаза-8-азагуанозина, 7-метилгуанозина, 6-тио-7-метилгуанозина, 7-метилинозина, 6-метоксигуанозина, 1-метилгуанозина, N2-метилгуанозина, N2,N2-диметилгуанозина, 8-оксогуанозина, 7-метил-8-оксогуанозина, 1-метил-6-тиогуанозина, N2-метил-6-тиогуанозина и N2,N2-диметил-6-тиогуанозина.
Согласно одному варианту реализации иРНК содержит один или более модифицированных нуклеозидов, выбранных из группы, состоящей из: псевдоуридина, пиридин-4-он-рибонуклеозида, 5-азауридина, 2-тио-5-азауридина, 2-тиоуридина, 4-тиопсевдоуридина, 2-тиопсевдоуридина, 5-гидроксиуридина, 3-метилуридина, 5-карбоксиметилуридина, 1-карбоксиметилпсевдоуридина, 5-пропинилуридина, 1-пропинилпсевдоуридина, 5-тауринометилуридина, 1-тауринометилпсевдоуридина, 5-тауринометил-2-тиоуридина, 1-тауринометил-4-тиоуридина, 5-метилуридина, 1-метилпсевдоуридина, 4-тио-1-метилпсевдоуридина, 2-тио-1-метилпсевдоуридина, 1-метил-1-деазапсевдоуридина, 2-тио-1-метил-1-деазапсевдоуридина, дигидроуридина, дигидропсевдоуридина, 2-тиодигидроуридина, 2-тиодигидропсевдоуридина, 2-метоксиуридина, 2-метокси-4-тиоуридина, 4-метоксипсевдоуридина и 4-метокси-2-тиопсевдоуридина.
Согласно одному варианту реализации иРНК содержит один или более модифицированных нуклеозидов, выбранных из группы, состоящей из 5-азацитидина, псевдоизоцитидина, 3-метилцитидина, N4-ацетилцитидина, 5-формилцитидина, N4-метилцитидина, 5-гидроксиметилцитидина, 1-метилпсевдоизоцитидина, пирролоцитидина, пирролопсевдоизоцитидина, 2-тиоцитидина, 2-тио-5-метилцитидина, 4-тиопсевдоизоцитидина, 4-тио-1-метилпсевдоизоцитидина, 4-тио-1-метил-1-деазапсевдоизоцитидина, 1-метил-1-деазапсевдоизоцитидина, зебуларина, 5-азазебуларина, 5-метилзебуларина, 5-аза-2-тиозебуларина, 2-тиозебуларина, 2-метоксицитидина, 2-метокси-5-метилцитидина, 4-метоксипсевдоизоцитидина и 4-метокси-1-метилпсевдоизоцитидина.
Согласно одному варианту реализации иРНК содержит один или более модифицированных нуклеозидов, выбранных из группы, состоящей из 2-аминопурина, 2,6-диаминопурина, 7-деазааденина, 7-деаза-8-азааденина, 7-деаза-2-аминопурина, 7-деаза-8-аза-2-аминопурина, 7-деаза-2,6-диаминопурина, 7-деаза-8-аза-2,6-диаминопурина, 1-метиладенозина, N6-метиладенозина, N6-изопентениладенозина, N6-(цис-гидроксиизопентенил)аденозина, 2-метилтио-N6-(цис-гидроксиизопентенил)аденозина, N6-глицинилкарбамоиладенозина, N6-треонилкарбамоиладенозина, 2-метилтио-N6-треонилкарбамоиладенозина, N6,N6-диметиладенозина, 7-метиладенина, 2-метилтиоаденина и 2-метоксиаденина.
Согласно одному варианту реализации иРНК содержит один или более модифицированных нуклеозидов, выбранных из группы, состоящей из: инозина, 1-метилинозина, вайозина, вайбутозина, 7-деазагуанозина, 7-деаза-8-азагуанозина, 6-тиогуанозина, 6-тио-7-деазагуанозина, 6-тио-7-деаза-8-азагуанозина, 7-метилгуанозина, 6-тио-7-метилгуанозина, 7-метилинозина, 6-метоксигуанозина, 1-метилгуанозина, N2-метилгуанозина, N2,N2-диметилгуанозина, 8-оксогуанозина, 7-метил-8-оксо-гуанозина, 1-метил-6-тиогуанозина, N2-метил-6-тиогуанозина и N2,N2-диметил-6-тиогуанозина.
Согласно одному варианту реализации иРНК содержит один или более псевдоуридинов, один или более 5-метилцитозинов и/или один или более 5-метилцитидинов.
Согласно одному варианту реализации иРНК содержит один или более псевдоуридинов.
Согласно одному варианту реализации иРНК содержит один или более 5-метилцитидинов.
Согласно одному варианту реализации иРНК содержит один или более 5-метилцитозинов.
Согласно конкретным вариантам реализации настоящего изобретения иРНК, предусмотренная в настоящем документе, содержит полиА-хвост, чтобы облегчить защиту иРНК от разрушения экзонуклеазами, стабилизировать иРНК и облегчить трансляцию. Согласно определенным вариантам реализации настоящего изобретения иРНК содержит 3'-полиА-хвостовую структуру.
Согласно конкретным вариантам реализации настоящего изобретения длина полиА-хвоста составляет по меньшей мере приблизительно 10, 25, 50, 75, 100, 150, 200, 250, 300, 350, 400, 450 или по меньшей мере приблизительно 500 или более адениновых нуклеотидов или любое промежуточное количество адениновых нуклеотидов. Согласно конкретным вариантам реализации настоящего изобретения длина полиА-хвоста составляет по меньшей мере приблизительно 125, 126, 127, 128, 129, 130, 131, 132, 133, 134, 135, 136, 137, 138, 139, 140, 141, 142, 143, 144, 145, 146, 147, 148, 149, 150, 151, 152, 153, 154, 155, 156, 157, 158, 159, 160, 161, 162, 163, 164, 165, 166, 167, 168, 169, 170, 171, 172, 173, 174, 175, 176, 177, 178, 179, 180, 181, 182, 183, 184, 185, 186, 187, 188, 189, 190, 191, 192, 193, 194, 195, 196, 197, 198, 199, 200, 201, 202, 202, 203, 205, 206, 207, 208, 209, 210, 211, 212, 213, 214, 215, 216, 217, 218, 219, 220, 221, 222, 223, 224, 225, 226, 227, 228, 229, 230, 231, 232, 233, 234, 235, 236, 237, 238, 239, 240, 241, 242, 243, 244, 245, 246, 247, 248, 249, 250, 251, 252, 253, 254, 255, 256, 257, 258, 259, 260, 261, 262, 263, 264, 265, 266, 267, 268, 269, 270, 271, 272, 273, 274 или 275 или более адениновых нуклеотидов.
Согласно конкретным вариантам реализации настоящего изобретения длина полиА-хвоста составляет от приблизительно 10 до приблизительно 500 адениновых нуклеотидов, от приблизительно 50 до приблизительно 500 адениновых нуклеотидов, от приблизительно 100 до приблизительно 500 адениновых нуклеотидов, от приблизительно 150 до приблизительно 500 адениновых нуклеотидов, от приблизительно 200 до приблизительно 500 адениновых нуклеотидов, от приблизительно 250 до приблизительно 500 адениновых нуклеотидов, от приблизительно 300 до приблизительно 500 адениновых нуклеотидов, от приблизительно 50 до приблизительно 450 адениновых нуклеотидов, от приблизительно 50 до приблизительно 400 адениновых нуклеотидов, от приблизительно 50 до приблизительно 350 адениновых нуклеотидов, от приблизительно 100 до приблизительно 500 адениновых нуклеотидов, от приблизительно 100 до приблизительно 450 адениновых нуклеотидов, от приблизительно 100 до приблизительно 400 адениновых нуклеотидов, от приблизительно 100 до приблизительно 350 адениновых нуклеотидов, от приблизительно 100 до приблизительно 300 адениновых нуклеотидов, от приблизительно 150 до приблизительно 500 адениновых нуклеотидов, от приблизительно 150 до приблизительно 450 адениновых нуклеотидов, от приблизительно 150 до приблизительно 400 адениновых нуклеотидов, от приблизительно 150 до приблизительно 350 адениновых нуклеотидов, от приблизительно 150 до приблизительно 300 адениновых нуклеотидов, от приблизительно 150 до приблизительно 250 адениновых нуклеотидов, от приблизительно 150 до приблизительно 200 адениновых нуклеотидов, от приблизительно 200 до приблизительно 500 адениновых нуклеотидов, от приблизительно 200 до приблизительно 450 адениновых нуклеотидов, от приблизительно 200 до приблизительно 400 адениновых нуклеотидов, от приблизительно 200 до приблизительно 350 адениновых нуклеотидов, от приблизительно 200 до приблизительно 300 адениновых нуклеотидов, от приблизительно 250 до приблизительно 500 адениновых нуклеотидов, от приблизительно 250 до приблизительно 450 адениновых нуклеотидов, от приблизительно 250 до приблизительно 400 адениновых нуклеотидов, от приблизительно 250 до приблизительно 350 адениновых нуклеотидов или от приблизительно 250 до приблизительно 300 адениновых нуклеотидов или любой промежуточный диапазон адениновых нуклеотидов.
Термины, которые описывают ориентацию полинуклеотидов, включают: 5' (обычно конец полинуклеотида, имеющий свободную фосфатную группу) и 3' (обычно конец полинуклеотида, имеющий свободную гидроксильную (OH) группу). Полинуклеотидные последовательности могут быть аннотированы в ориентации от 5' к 3' или от 3' к 5'. Для ДНК и иРНК 5'-3' цепь обозначена как «смысловая», «плюс» или «кодирующая» цепь, поскольку ее последовательность идентична последовательности предшественника информационной РНК (пре-иРНК) [за исключением урацила (U) в РНК вместо тимина (T) в ДНК]. Для ДНК и иРНК комплементарная 3'-5' цепь, которая представляет собой цепь, транскрибируемую РНК-полимеразой, обозначена как «матрица», «антисмысловая», «минус» или «некодирующая» цепь. В настоящем документе термин «обратная ориентация» относится к последовательности от 5' к 3', записанной в ориентации от 3' к 5', или последовательности от 3' к 5', записанной в ориентации от 5' к 3'.
Термины «комплементарный» и «комплементарность» относятся к полинуклеотидам (т.е. последовательности нуклеотидов), связанным правилами спаривания оснований. Например, комплементарной цепью последовательности ДНК 5' A G T C A T G 3' является 3' T C A G T A C 5'. Последняя последовательность часто пишется как обратная комплементарная последовательность с 5'-концом слева и 3'-концом справа, 5' C A T G A C T 3'. Последовательность, которая совпадает со своей обратной комплементарной последовательностью, называется палиндромной последовательностью. Комплементарность может быть «частичной», при которой только некоторые из оснований нуклеиновых кислот сопоставляются в соответствии с правилами спаривания оснований. Или между нуклеиновыми кислотами может быть «полная» или «общая» комплементарность.
В настоящем документе термин «кассета нуклеиновой кислоты» или «кассета экспрессии» относится к генетическим последовательностям внутри вектора, которые могут экспрессировать РНК, а затем и полипептид. Согласно одному варианту реализации кассета нуклеиновой кислоты содержит представляющий (ие) интерес ген (ы), например, представляющий (ие) интерес полинуклеотид (ы). Согласно другому варианту реализации настоящего изобретения кассета нуклеиновой кислоты содержит одну или более последовательностей контроля экспрессии, например, промотор, энхансер, полиА последовательность и представляющий (ие) интерес ген (ы), например, полинуклеотид (ы), представляющий (ие) интерес. Векторы могут содержать 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 или более кассет нуклеиновой кислоты. Кассета нуклеиновой кислоты позиционно и последовательно ориентирована внутри вектора так, что нуклеиновая кислота в кассете может транскрибироваться в РНК и, при необходимости, транслироваться в белок или полипептид, подвергаться соответствующим посттрансляционным модификациям, необходимым для активности в трансформированной клетке, и может быть перемещена в соответствующий компартмент для биологической активности путем нацеливания на соответствующие внутриклеточные компартменты или секрецию во внеклеточные компартменты. Предпочтительно, согласно некоторым вариантам реализации, кассета имеет 3'- и 5'-концы, адаптированные для быстрой вставки в вектор и/или геном, например, она имеет сайты рестрикционной эндонуклеазы на каждом конце. Согласно предпочтительному варианту реализации настоящего изобретения кассета нуклеиновой кислоты содержит последовательность терапевтического гена, применяемого для лечения, предотвращения или улучшения генетического нарушения. Кассета может быть удалена и вставлена в плазмиду или вирусный вектор как единый блок.
Полинуклеотиды включают представляющий (ие) интерес полинуклеотид (ы). В настоящем документе термин «представляющий интерес полинуклеотид» относится к полинуклеотиду, кодирующему полипептид или гибридный полипептид, или к полинуклеотиду, который служит в качестве матрицы для транскрипции ингибиторного полинуклеотида, как предусмотрено в настоящем документе.
Кроме того, обычные специалисты в данной области техники поймут, что в результате вырожденности генетического кода существует много нуклеотидных последовательностей, которые могут кодировать полипептид или его фрагмент, как предусмотрено в настоящем документе. Некоторые из этих полинуклеотидов обладают минимальной гомологией с нуклеотидной последовательностью любого нативного гена. Тем не менее, полинуклеотиды, которые отличаются из-за различий в использовании кодонов, специально предусмотрены в конкретных вариантах реализации, например, полинуклеотиды, которые оптимизированы по набору кодонов человека и/или приматов. Согласно одному варианту реализации предложены полинуклеотиды, содержащие конкретные аллельные последовательности. Аллели представляют собой эндогенные полинуклеотидные последовательности, которые изменяются в результате одной или более мутаций, таких как делеции, добавления и/или замены нуклеотидов.
Согласно определенному варианту реализации настоящего изобретения представляющий интерес полинуклеотид содержит донорную матрицу для восстановления.
Согласно определенному варианту реализации настоящего изобретения представляющий интерес полинуклеотид содержит ингибирующий полинуклеотид, включая, но не ограничиваясь указанными, киРНК, миРНК, кшРНК, рибозим или другую ингибирующую РНК.
Согласно одному варианту реализации донорная матрица для восстановления, содержащая ингибирующую РНК, содержит одну или более регуляторных последовательностей, таких как, например, сильный конститутивный промотор pol III, например, промотор U6 мяРНК человека или мыши, промотор H1 РНК человека и мыши или промотор тРНК-val человека или сильный конститутивный промотор pol II, как описано в другом месте настоящего документа.
Полинуклеотиды, предусмотренные в конкретных вариантах реализации, независимо от длины самой кодирующей последовательности, можно комбинировать с другими последовательностями ДНК, такими как промоторы и/или энхансеры, нетранслируемые области (НТО), последовательности Козак, сигналы полиаденилирования, дополнительные сайты рестрикционных ферментов, сайты множественного клонирования, сайты внутренней посадки рибосомы (IRES), сайты распознавания рекомбиназой (например, сайты LoxP, FRT и Att), терминирующие кодоны, сигналы терминации транскрипции, посттранскрипционные элементы ответа и полинуклеотиды, кодирующие саморасщепляющиеся полипептиды, эпитопные метки, как раскрыто в другом месте настоящего документа или как известно в данной области техники, так, что их общая длина может значительно варьироваться. Поэтому согласно конкретным вариантам реализации настоящего изобретения предусмотрено применение полинуклеотидного фрагмента практически любой длины, причем общая длина предпочтительно ограничена простотой получения и применения в предполагаемом протоколе рекомбинантной ДНК.
Полинуклеотиды могут быть получены, обработаны, экспрессированы и/или доставлены с применением любой из множества хорошо известных методик, известных и доступных в данной области техники. Для того чтобы экспрессировать желательный полипептид, нуклеотидная последовательность, кодирующая полипептид, может быть вставлена в соответствующий вектор. Желательный полипептид также может быть экспрессирован путем доставки кодирующей полипептид иРНК в клетку.
Иллюстративные примеры векторов включают, но не ограничиваются указанными, плазмиду, автономно реплицирующиеся последовательности и транспонируемые элементы, например, Sleeping Beauty, PiggyBac.
Дополнительные иллюстративные примеры векторов включают, но не ограничиваются указанными, плазмиды, фагмиды, космиды, искусственные хромосомы, такие как дрожжевая искусственная хромосома (YAC), бактериальная искусственная хромосома (BAC) или искусственная хромосома, происходящая из P1 (PAC), бактериофаги, такие как лямбда-фаг или фаг М13, и вирусы животных.
Иллюстративные примеры вирусов, подходящих в качестве векторов, включают, но не ограничиваются указанными, ретровирус (включая лентивирус), аденовирус, аденоассоциированный вирус, герпесвирус (например, вирус простого герпеса), поксвирус, бакуловирус, вирус папилломы и паповавирус (например, SV40).
Иллюстративные примеры векторов экспрессии включают, но не ограничиваются указанными, векторы pClneo (Promega) для экспрессии в клетках млекопитающих; pLenti4/V5-DEST™, pLenti6/V5-DEST™ и pLenti6.2/V5-GW/lacZ (Invitrogen) для опосредуемого лентивирусами переноса и экспрессии генов в клетках млекопитающих. Согласно конкретным вариантам реализации настоящего изобретения кодирующие последовательности полипептидов, раскрытые в настоящем документе, могут быть лигированы в такие векторы экспрессии для экспрессии полипептидов в клетках млекопитающих.
Согласно конкретным вариантам реализации настоящего изобретения вектор представляет собой эписомальный вектор или вектор, который поддерживается внехромосомно. В настоящем документе термин «эписомальный» относится к вектору, который способен реплицироваться без интеграции в хромосомную ДНК хозяина и без постепенной потери из делящейся клетки-хозяина, это также означает, что указанный вектор реплицируется внехромосомно или эписомально.
«Последовательности контроля экспрессии», «контрольные элементы» или «регуляторные последовательности», присутствующие в векторе экспрессии, представляют собой нетранслируемые области вектора - точку начала репликации, селективные кассеты, промоторы, энхансеры, сигналы инициации трансляции (последовательность Шайна-Дальгарно или последовательность Козак), интроны, посттранскрипционные регуляторные элементы, последовательность полиаденилирования, 5'- и 3'-нетранслируемые области, которые взаимодействуют с клеточными белками хозяев для осуществления транскрипции и трансляции. Такие элементы могут различаться по своей силе и специфичности. В зависимости от используемой векторной системы и хозяина можно применять любое количество подходящих элементов транскрипции и трансляции, включая широко распространенные промоторы и индуцируемые промоторы.
Согласно конкретным вариантам реализации настоящего изобретения полинуклеотид содержит вектор, включая, но не ограничиваясь указанными, векторы экспрессии и вирусные векторы. Вектор может содержать одну или более экзогенных, эндогенных или гетерологичных контрольных последовательностей, таких как промоторы и/или энхансеры. «Эндогенная контрольная последовательность» представляет собой последовательность, которая естественным образом связана с данным геном в геноме. «Экзогенная контрольная последовательность» представляет собой последовательность, которую помещают рядом с геном посредством генетических манипуляций (т.е. молекулярно-биологических методик) так, что транскрипция этого гена направляется соединенным энхансером/промотором. «Гетерологичная контрольная последовательность» представляет собой экзогенную последовательность, которая происходит из другого вида, чем клетки, подвергаемые генетической манипуляции. «Синтетическая» контрольная последовательность может содержать элементы еще одной эндогенной и/или экзогенной последовательности и/или последовательностей, определенных в условиях in vitro или in silico, которые обеспечивают оптимальную промоторную и/или энхансерную активность для конкретной терапии.
В настоящем документе термин «промотор» относится к распознаваемому сайту полинуклеотида (ДНК или РНК), с которым связывается РНК-полимераза. РНК-полимераза инициирует и транскрибирует полинуклеотиды, функционально соединенные с промотором. Согласно конкретным вариантам реализации настоящего изобретения промоторы, действующие в клетках млекопитающих, содержат AT-богатую область, расположенную приблизительно на расстоянии 25-30 оснований в 5'-направлении от сайта инициации транскрипции, и/или другую последовательность, находящуюся на расстоянии 70-80 оснований в 5'-направлении от точки начала транскрипции, область CNCAAT, где N может представлять собой любой нуклеотид.
Термин «энхансер» относится к сегменту ДНК, который содержит последовательности, способные обеспечивать усиленную транскрипцию и, в некоторых случаях, которые могут функционировать независимо от их ориентации относительно другой контрольной последовательности. Энхансер может функционировать совместно или аддитивно с промоторами и/или другими энхансерными элементами. Термин «промотор/энхансер» относится к сегменту ДНК, который содержит последовательности, способные обеспечивать функции как промотора, так и энхансера.
Термин «функционально соединенный» относится к смежному положению, в котором описанные компоненты находятся во взаимосвязи, позволяющей им функционировать предполагаемым способом. Согласно одному варианту реализации термин относится к функциональной связи между последовательностью контроля экспрессии нуклеиновой кислоты (такой как промотор и/или энхансер) и второй полинуклеотидной последовательностью, например, представляющим интерес полинуклеотидом, причем последовательность контроля экспрессии направляет транскрипцию нуклеиновой кислоты, соответствующей второй последовательности.
В настоящем документе термин «последовательность контроля конститутивной экспрессии» относится к промотору, энхансеру или промотору/энхансеру, который постоянно или непрерывно обеспечивает транскрипцию функционально соединенной последовательности. Последовательность контроля конститутивной экспрессии может представлять собой «широко распространенный» промотор, энхансер или промотор/энхансер, который обеспечивает экспрессию в широком разнообразии типов клеток и тканей, или «специфичный для клеток», «специфичный для типа клеток», «специфичный для клеточной линии» или «тканеспецифичный» промотор, энхансер или промотор/энхансер, который обеспечивает экспрессию в ограниченном разнообразии типов клеток и тканей, соответственно.
Иллюстративные широко распространенные последовательности контроля экспрессии, подходящие для применения в конкретных вариантах реализации, включают, но не ограничиваются указанными, немедленный ранний промотор цитомегаловируса (CMV), промотор вируса обезьян 40 (SV40) (например, ранний или поздний), промотор LTR вируса лейкоза мышей Молони (MoMLV), LTR вируса саркомы Рауса (RSV), промотор вируса простого герпеса (HSV) (тимидинкиназа), промоторы H5, P7.5 и P11 из вируса осповакцины, короткий промотор фактора удлинения 1-альфа (EF1a-short), длинный промотор фактора удлинения 1-альфа (EF1a-long), промотор раннего ростового ответа 1 (EGR1), ферритина H (FerH), ферритина L (FerL), глицеральдегид 3-фосфатдегидрогеназы (GAPDH), эукариотического фактора инициации трансляции 4A1 (EIF4A1), белка теплового шока 5 массой 70 кДа (HSPA5), члена 1-бета семейства белков теплового шока массой 90 кДа (HSP90B1), белка теплового шока массой 70 кДа (HSP70), β-кинезина (β-KIN), человеческого локуса ROSA26 (Irions et al., Nature Biotechnology 25, 1477 - 1482 (2007)), промотор убиквитина С (UBC), промотор фосфоглицераткиназы-1 (PGK), энхансер цитомегаловируса/промотор β-актина курицы (CAG), промотор β-актина и промотор с энхансером вируса миелопролиферативной саркомы, с удаленным участком отрицательного контроля и с сайтом связывания праймера, замещенным на последовательность из dl587rev (MND) (Challita et al., J Virol. 69(2):748-55 (1995)).
Согласно конкретному варианту реализации желательным может быть применение последовательности контроля экспрессии, специфичной для клетки, типа клеток, клеточной линии или ткани, чтобы достичь специфичной для типа клеток, специфичной для линии или специфичной для ткани экспрессии желательной полинуклеотидной последовательности (например, для экспрессии конкретной нуклеиновой кислоты, кодирующей полипептид, только в подгруппе типов клеток, клеточных линий или тканей или на определенных стадиях развития).
В настоящем документе «условная экспрессия» может относиться к любому типу условной экспрессии, включая, но не ограничиваясь этим, индуцируемую экспрессию; репрессируемую экспрессию; экспрессию в клетках или тканях, имеющих конкретное физиологическое, биологическое или патологическое состояние и т.д. Это определение не предназначено для исключения экспрессии, специфичной для типа клеток или ткани. Определенные варианты реализации обеспечивают условную экспрессию представляющего интерес полинуклеотида, например, экспрессию контролируют путем воздействия на клетку, ткань, организм и т.д. обработки или условия, которое вызывает экспрессию полинуклеотида или которое вызывает увеличение или уменьшение экспрессии полинуклеотида, кодируемого представляющим интерес полинуклеотидом.
Иллюстративные примеры индуцируемых промоторов/систем включают, но не ограничиваются указанными, стероид-индуцируемые промоторы, такие как промоторы для генов, кодирующих рецепторы глюкокортикоидов или эстрогенов (индуцируемые обработкой соответствующим гормоном), металлотиониновый промотор (индуцируемый обработкой различными тяжелыми металлами), промотор MX-1 (индуцируемый интерфероном), мифепристон-регулируемая система GeneSwitch (Sirin et al., 2003, Gene, 323:67), индуцируемый куматом переключатель гена (WO 2002/088346), тетрациклин-зависимые регуляторные системы и т.д.
Условная экспрессия также может быть достигнута с применением сайт-специфичной ДНК-рекомбиназы. В соответствии с определенными вариантами реализации полинуклеотиды содержат по меньшей мере один (обычно два) сайт для рекомбинации, опосредуемой сайт-специфичной рекомбиназой. В настоящем документе термины «рекомбиназа» или «сайт-специфичная рекомбиназа» включают вырезающие или встраивающие белки, ферменты, кофакторы или ассоциированные белки, которые участвуют в реакциях рекомбинации с участием одного или более сайтов рекомбинации (например, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти или более), которые могут представлять собой белки дикого типа (см. Landy, Current Opinion in Biotechnology 3:699-707 (1993)) или их мутантов, производные (например, гибридные белки, содержащие последовательности рекомбинационных белков или их фрагменты), фрагменты и варианты. Иллюстративные примеры рекомбиназ, подходящих для применения в конкретных вариантах реализации, включают, но не ограничиваются ими: Cre, Int, IHF, Xis, Flp, Fis, Hin, Gin, ϕC31, Cin, резолвазу Tn3, TndX, XerC, XerD, TnpX, Hjc, Gin, SpCCE1 и ParA.
Полинуклеотиды могут содержать один или более сайтов рекомбинации для любой из множества сайт-специфичных рекомбиназ. Следует понимать, что сайт-мишень для сайт-специфичной рекомбиназы является дополнением к любому (ым) сайту (ам), необходимому (ым) для интеграции вектора, например, ретровирусного вектора или лентивирусного вектора. В настоящем документе термины «последовательность рекомбинации», «сайт рекомбинации» или «сайт для сайт-специфичной рекомбинации» относятся к конкретной последовательности нуклеиновой кислоты, которую распознает и связывает рекомбиназа.
Например, один сайт рекомбинации для Cre-рекомбиназы представляет собой loxP, который представляет собой последовательность из 34 пар оснований, содержащую два инвертированных повтора из 13 пар оснований (служащих сайтами связывания рекомбиназы), фланкирующих коровую последовательность из 8 пар оснований (Sauer, B., Current Opinion in Biotechnology 5:521-527 (1994)). Другие примерные сайты loxP включают, но не ограничиваются ими: lox511 (Hoess et al., 1996; Bethke and Sauer, 1997), lox5171 (Lee and Saito, 1998), lox2272 (Lee and Saito, 1998), m2 (Langer et al., 2002), lox71 (Albert et al., 1995) и lox66 (Albert et al., 1995).
Подходящие сайты распознавания для рекомбиназы FLP включают, но не ограничиваются ими: FRT (McLeod, et al., 1996), F1, F2, F3 (Schlake and Bode, 1994), F4, F5 (Schlake and Bode, 1994), FRT(LE) (Senecoff et al., 1988), FRT(RE) (Senecoff et al., 1988).
Другие примеры распознаваемых последовательностей представляют собой последовательности attB, attP, attL и attR, которые распознаются ферментом-рекомбиназой λ-интегразой, например, phi-c31. SSR ϕC31 обеспечивает рекомбинацию только между гетеротипическими сайтами attB (34 п.о. в длину) и attP (39 п.о. в длину) (Groth et al., 2000). attB и attP, названные по сайтам прикрепления для фаговой интегразы на бактериальном и фаговом геномах, соответственно, оба содержат неполные инвертированные повторы, которые, вероятно, связываются гомодимерами ϕC31 (Groth et al., 2000). Сайты продуктов, attL и attR, эффективно инертны к последующей рекомбинации, опосредуемой ϕC31 (Belteki et al., 2003), делая реакцию необратимой. Было обнаружено, что для катализа вставок attB-несущая ДНК вставляется в геномный сайт attP легче, чем сайт attP вставляется в геномный сайт attB (Thyagarajan et al., 2001; Belteki et al., 2003). Таким образом, типичные стратегии позволяют поместить с помощью гомологичной рекомбинации attP-несущий «закрепляющий сайт» в определенный локус, который затем является партнером для attB-несущей вносимой последовательности для вставки.
Согласно одному варианту реализации полинуклеотид, предусмотренный в настоящем документе, содержит донорный полинуклеотид-матрицу для восстановления, фланкированный парой сайтов распознавания рекомбиназой. Согласно конкретным вариантам реализации настоящего изобретения полинуклеотид-матрица для восстановления фланкирован сайтами LoxP, сайтами FRT или сайтами att.
Согласно конкретным вариантам реализации настоящего изобретения полинуклеотиды, предусмотренные в настоящем документе, включают один или более представляющих интерес полинуклеотидов, которые кодируют один или более полипептидов. Согласно конкретным вариантам реализации настоящего изобретения для достижения эффективной трансляции каждого из множества полипептидов полинуклеотидные последовательности могут быть отделены одной или более последовательностями IRES или полинуклеотидными последовательностями, кодирующими саморасщепляющиеся полипептиды.
В настоящем документе термин «сайт внутренней посадки рибосомы» или «IRES» относится к элементу, который способствует непосредственной внутренней посадке рибосомы в инициирующий кодон, такой как ATG, цистрона (кодирующей белок области), что ведет к кэп-независимой трансляции гена. См., например, Jackson et al., 1990. Trends Biochem Sci 15(12):477-83) и Jackson and Kaminski. 1995. RNA 1(10):985-1000. Примеры IRES, обычно применяемых специалистами в данной области техники, включают те, которые описаны в патенте США № 6692736. Дополнительные примеры «IRES», известные в данной области техники, включают, но не ограничиваются указанными, IRES, который может быть получен из пикорнавируса (Jackson et al., 1990), и IRES, который может быть получен из вирусных или клеточных источников иРНК, таких как, например, белок, связывающий тяжелую цепь иммуноглобулина (BiP), фактор роста эндотелия сосудов (VEGF) (Huez et al. 1998. Mol. Cell. Biol. 18(11):6178-6190), фактор роста фибробластов 2 (FGF-2) и инсулиноподобный фактор роста (IGFII), фактор инициации трансляции eIF4G и транскрипционные факторы дрожжей TFIID и HAP4, вирус энцефаломиокардита (EMCV), который коммерчески доступен от Novagen (Duke et al., 1992. J. Virol 66(3):1602-9) и VEGF IRES (Huez et al., 1998. Mol Cell Biol 18(11):6178-90). IRES также были обнаружены в вирусных геномах видов Picornaviridae, Dicistroviridae и Flaviviridae, а также в ВГС, вирусе лейкоза мышей Френда (FrMLV) и вирусе лейкоза мышей Молони (MoMLV).
Согласно одному варианту реализации IRES, применяемый в полинуклеотидах, предусмотренных в настоящем документе, представляет собой IRES EMCV.
Согласно конкретным вариантам реализации настоящего изобретения полинуклеотиды включают полинуклеотиды, которые имеют консенсусную последовательность Козак и которые кодируют желательный полипептид. В настоящем документе термин «последовательность Козак» относится к короткой нуклеотидной последовательности, которая значительно облегчает начальное связывание иРНК с малой субъединицей рибосомы и увеличивает трансляцию. Консенсусная последовательность Козак представляет собой (GCC)RCCATGG (SEQ ID NO:75), где R представляет собой пурин (A или G) (Kozak, 1986. Cell. 44(2):283-92, и Kozak, 1987. Nucleic Acids Res. 15(20):8125-48).
Элементы, направляющие эффективную терминацию и полиаденилирование транскриптов гетерологичных нуклеиновых кислот, увеличивают экспрессию гетерологичных генов. Сигналы терминации транскрипции обычно обнаруживаются в 3'-направлении от сигнала полиаденилирования. Согласно конкретным вариантам реализации настоящего изобретения векторы содержат последовательность полиаденилирования, расположенную в 3'-направлении от полинуклеотида, кодирующего полипептид, который должен быть экспрессирован. В настоящем документе термин «сайт полиА» или «последовательность полиА» обозначает последовательность ДНК, которая направляет как терминацию, так и полиаденилирование растущего РНК-транскрипта РНК-полимеразой II. Последовательности полиаденилирования могут способствовать стабильности иРНК путем добавления полиА-хвоста к 3'-концу кодирующей последовательности и таким образом способствовать повышению эффективности трансляции. Расщепление и полиаденилирование направляются последовательностью полиА в РНК. Коровая последовательность полиА для пре-иРНК млекопитающих имеет два элемента распознавания, фланкирующих сайт расщепления-полиаденилирования. Как правило, почти инвариантный гексамер AAUAAA находится на расстоянии 20-50 нуклеотидов в 5'-направлении от более вариабельного элемента, богатого остатками U или GU. Расщепление растущего транскрипта происходит между этими двумя элементами и связано с добавлением до 250 аденозинов к 5' продукта расщепления. Согласно конкретным вариантам реализации настоящего изобретения коровая последовательность полиА представляет собой оптимальную последовательность полиА (например, AATAAA, ATTAAA, AGTAAA). Согласно конкретным вариантам реализации настоящего изобретения последовательность полиА представляет собой последовательность полиА SV40, последовательность полиА бычьего гормона роста (BGHpA), последовательность полиА β-глобина кролика (rβgpA), их варианты или другую подходящую гетерологичную или эндогенную последовательность полиА, известную в данной области техники.
Согласно некоторым вариантам реализации настоящего изобретения полинуклеотид или клетка, несущая полинуклеотид, использует ген «самоубийства», включая индуцируемый ген «самоубийства», чтобы снизить риск прямой токсичности и/или неконтролируемой пролиферации. Согласно конкретным вариантам реализации настоящего изобретения ген «самоубийства» не является иммуногенным для хозяина, несущего полинуклеотид или клетку. Определенный пример гена «самоубийства», который можно применять, представляет собой каспазу-9 или каспазу-8 или цитозиндезаминазу. Каспазу-9 можно активировать с помощью специфичного химического индуктора димеризации (CID).
Согласно определенным вариантам реализации настоящего изобретения полинуклеотиды содержат генные сегменты, которые вызывают восприимчивость генетически модифицированных клеток, предусмотренных в настоящем документе, к отрицательному отбору в условиях in vivo. «Отрицательный отбор» относится к клетке после воздействия, которая может быть удалена в результате изменения состояния индивидуума in vivo. Отрицательный селективный фенотип может быть результатом вставки гена, который придает чувствительность к вводимому агенту, например, соединению. Гены для отрицательной селекции известны в данной области техники и включают, но не ограничиваются ими: ген тимидинкиназы вируса простого герпеса типа I (HSV-I TK), который придает чувствительность к ганцикловиру; ген клеточной гипоксантинфосфорибозилтрансферазы (HPRT), ген клеточной аденинфосфорибозилтрансферазы (APRT) и ген бактериальной цитозиндезаминазы.
Согласно некоторым вариантам реализации настоящего изобретения генетически модифицированные клетки содержат полинуклеотид, дополнительно содержащий положительный маркер, который обеспечивает отбор клеток с отрицательным селективным фенотипом в условиях in vitro. Положительный селективный маркер может представлять собой ген, который при введении в клетку-хозяина экспрессирует доминантный фенотип, позволяющий осуществлять положительный отбор клеток, несущих ген. Гены этого типа известны в данной области техники и включают, но не ограничиваются указанными, ген гигромицин В-фосфотрансферазы (hph), который придает устойчивость к гигромицину В, ген аминогликозидфосфотрансферазы (neo или aph) из Tn5, который кодирует устойчивость к антибиотику G418, ген дигидрофолатредуктазы (DHFR), ген аденозиндезаминазы (ADA) и ген множественной лекарственной устойчивости (MDR).
Согласно одному варианту реализации положительный селективный маркер и отрицательный селективный элемент соединены так, что потеря отрицательного селективного элемента обязательно также сопровождается потерей положительного селективного маркера. Согласно конкретному варианту реализации положительные и отрицательные селективные маркеры гибридизованы так, что потеря одного обязательно ведет к потере другого. Примером гибридного полинуклеотида, который в качестве продукта экспрессии дает полипептид, который придает желательные признаки как положительного, так и отрицательного отбора, описанные выше, является гибридный ген гигромицинфосфотрансферазы-тимидинкиназы (HyTK). Экспрессия этого гена приводит к получению полипептида, который придает устойчивость к гигромицину В для положительного отбора в условиях in vitro и чувствительность к ганцикловиру для отрицательного отбора в условиях in vivo. См. также публикации PCT US91/08442 и PCT/US94/05601 за авторством S. D. Lupton, в которых описано применение бифункциональных селективных гибридных генов, полученных в результате гибридизации доминантных положительных селективных маркеров с отрицательными селективными маркерами.
Предпочтительные положительные селективные маркеры происходят из генов, выбранных из группы, состоящей из hph, nco и gpt, и предпочтительные отрицательные селективные маркеры происходят из генов, выбранных из группы, состоящей из цитозиндезаминазы, HSV-I TK, VZV TK, HPRT, APRT и gpt. Примерные бифункциональные селективные гибридные гены, предусмотренные в конкретных вариантах реализации, включают, но не ограничиваются указанными, гены, в которых положительный селективный маркер происходит из hph или neo, и отрицательный селективный маркер происходит из гена цитозиндезаминазы или TK, или селективного маркера.
Согласно конкретным вариантам реализации настоящего изобретения полинуклеотиды, кодирующие один или более вариантов нуклеаз, megaTAL, модифицирующих концы ферментов или гибридных полипептидов, могут быть введены в гемопоэтические клетки, например, T-клетки, с помощью как невирусных, так и вирусных способов. Согласно конкретным вариантам реализации настоящего изобретения доставка одного или более полинуклеотидов, кодирующих нуклеазы и/или донорные матрицы для восстановления, может быть обеспечена с помощью одного и того же способа или разными способами и/или с помощью одного и того же вектора или разных векторов.
В настоящем документе термин «вектор» используется для обозначения молекулы нуклеиновой кислоты, способной переносить или транспортировать другую молекулу нуклеиновой кислоты. Переносимая нуклеиновая кислота обычно соединена, например, вставлена в векторную молекулу нуклеиновой кислоты. Вектор может содержать последовательности, которые управляют автономной репликацией в клетке, или может содержать последовательности, достаточные для того чтобы обеспечить интеграцию в ДНК клетки-хозяина. Согласно конкретным вариантам реализации настоящего изобретения невирусные векторы применяют для доставки одного или более полинуклеотидов, предусмотренных в настоящем документе, к T-клетке.
Иллюстративные примеры невирусных векторов включают, но не ограничиваются указанными, плазмиды (например, ДНК-плазмиды или РНК-плазмиды), транспозоны, космиды и бактериальные искусственные хромосомы.
Иллюстративные способы невирусной доставки полинуклеотидов, предусмотренных в конкретных вариантах реализации, включают, но не ограничиваются ими: электропорацию, сонопорацию, липофекцию, микроинъекцию, биолистику, виросомы, липосомы, иммунолипосомы, наночастицы, конъюгаты поликатионов или липидов с нуклеиновыми кислотами, оголенную ДНК, искусственные вирионы, опосредуемый DEAE-декстраном перенос, введение с помощью генной пушки и тепловой шок.
Иллюстративные примеры систем доставки полинуклеотидов, подходящих для применения в конкретных вариантах реализации, предусмотренные в конкретных вариантах реализации, включают, но не ограничиваются указанными, те, которые предоставляются Amaxa Biosystems, Maxcyte, Inc., BTX Molecular Delivery Systems и Copernicus Therapeutics Inc. Реагенты для липофекции продаются коммерчески (например, Transfectam™ и Lipofectin™). Катионные и нейтральные липиды, которые подходят для эффективной липофекции полинуклеотидов, опосредуемой распознаванием рецепторами, описаны в литературе. См., например, Liu et al. (2003) Gene Therapy. 10:180-187; и Balazs et al. (2011) Journal of Drug Delivery. 2011:1-12. Согласно конкретным вариантам реализации настоящего изобретения также предусмотрена доставка, нацеливаемая антителами, доставка с помощью бактериальных систем, доставка на основе искусственных наноклеток.
Вирусные векторы, содержащие полинуклеотиды, предусмотренные в конкретных вариантах реализации, могут быть доставлены в условиях in vivo путем введения отдельному пациенту, как правило, путем системного введения (например, путем внутривенной, внутрибрюшинной, внутримышечной, подкожной или внутричерепной инфузии) или местного применения, как описано ниже. Согласно другому варианту векторы могут быть доставлены в клетки в условиях ex vivo, такие как клетки, эксплантированные от отдельного пациента (например, мобилизованная периферическая кровь, лимфоциты, аспираты костного мозга, биопсия ткани и т.д.), или универсальные донорские гемопоэтические стволовые клетки с последующей повторной имплантацией клеток пациенту.
Согласно одному варианту реализации вирусные векторы, содержащие варианты нуклеаз и/или донорные матрицы для восстановления, вводят непосредственно в организм для трансдукции клеток в условиях in vivo. Согласно другому варианту может быть введена оголенная ДНК. Введение осуществляют любым путем, обычно применяемым для введения молекулы для окончательного контакта с кровью или клетками ткани, включая, но не ограничиваясь указанными, инъекцию, инфузию, местное применение и электропорацию. Подходящие способы введения таких нуклеиновых кислот доступны и хорошо известны специалистам в данной области техники, и, несмотря на то, что для введения конкретной композиции можно применять более одного пути, конкретный путь часто может обеспечить более срочную и более эффективную реакцию, чем другой путь.
Иллюстративные примеры вирусных векторных систем, подходящих для применения в конкретных вариантах реализации, предусмотренные в настоящем документе, включают, но не ограничиваются указанными, векторы на основе аденоассоциированного вируса (AAV), ретровируса, вируса простого герпеса, аденовируса и вируса осповакцины.
Согласно различным вариантам реализации один или более полинуклеотидов, кодирующих вариант нуклеазы и/или донорную матрицу для восстановления, вводят в гемопоэтическую клетку, например, T-клетку, путем трансдукции клетки рекомбинантным аденоассоциированным вирусом (rAAV), содержащим один или более полинуклеотидов.
AAV представляет собой небольшой (~26 нм) дефицитный по репликации, главным образом эписомальный и лишенный оболочки вирус. AAV может инфицировать как делящиеся, так и неделящиеся клетки и может встраивать свой геном в геном клетки-хозяина. Рекомбинантные AAV (rAAV), как правило, состоят по меньшей мере из трансгена и его регуляторных последовательностей, а также 5' и 3'-инвертированных концевых повторов AAV (ITR). Последовательности ITR имеют приблизительно 145 п.о. в длину. Согласно конкретным вариантам реализации настоящего изобретения rAAV содержит ITR и капсидные последовательности, выделенные из AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9 или AAV10.
Согласно некоторым вариантам реализации настоящего изобретения применяется химерный rAAV, последовательности ITR которого выделены из одного серотипа AAV и последовательности капсида выделены из другого серотипа AAV. Например, rAAV с последовательностями ITR, происходящими из AAV2, и капсидными последовательностями, происходящими из AAV6, называется AAV2/AAV6. Согласно конкретным вариантам реализации настоящего изобретения вектор rAAV может содержать ITR из AAV2 и капсидные белки из любого из AAV1, AAV2, AAV3, AAV4, AAV5, AAV6, AAV7, AAV8, AAV9 или AAV10. Согласно предпочтительному варианту реализации настоящего изобретения rAAV содержит последовательности ITR, происходящие из AAV2, и капсидные последовательности, происходящие из AAV6. Согласно предпочтительному варианту реализации настоящего изобретения rAAV содержит последовательности ITR, происходящие из AAV2, и капсидные последовательности, происходящие из AAV2.
Согласно некоторым вариантам реализации настоящего изобретения способы модификации и селекции могут быть применены к капсидам AAV, чтобы повысить вероятность трансдукции ими клеток, представляющих интерес.
Конструирование векторов rAAV, их получение и очистка раскрыты, например, в патентах США №№ 9169494; 9169492; 9012224; 8889641; 8809058; и 8784799, каждый из которых полностью включен в настоящий документ посредством ссылки.
Согласно различным вариантам реализации настоящего изобретения один или более полинуклеотидов, кодирующих вариант нуклеазы и/или донорную матрицу для восстановления, вводят в гемопоэтическую клетку путем трансдукции клетки ретровирусом, например, лентивирусом, содержащим один или более полинуклеотидов.
В настоящем документе термин «ретровирус» относится к РНК-вирусу, который осуществляет обратную транскрипцию своей геномной РНК в линейную двухцепочечную копию ДНК и впоследствии ковалентно включает свою геномную ДНК в геном хозяина. Иллюстративные ретровирусы, подходящие для применения в конкретных вариантах реализации, включают, но не ограничиваются ими: вирус лейкоза мышей Молони (M-MuLV), вирус саркомы мышей Молони (MoMSV), вирус саркомы мышей Харви (HaMuSV), вирус опухоли молочной железы мышей (MuMTV), вирус лейкоза гиббонов (GaLV), вирус лейкоза кошек (FLV), спумавирус, вирус лейкоза мышей Френда, вирус мышиных стволовых клеток (MSCV) и вирус саркомы Рауса (RSV)), а также лентивирус.
В настоящем документе термин «лентивирус» относится к группе (или роду) сложных ретровирусов. Иллюстративные лентивирусы включают, но не ограничиваются ими: ВИЧ (вирус иммунодефицита человека; включая ВИЧ типа 1 и ВИЧ типа 2); вирус висна-маэди (VMV); вирус артрита-энцефалита коз и овец (CAEV); вирус инфекционной анемии лошадей (EIAV); вирус иммунодефицита кошек (FIV); вирус иммунодефицита крупного рогатого скота (BIV); и вирус иммунодефицита обезьян (SIV). Согласно одному варианту реализации предпочтительными являются остовы векторов на основе ВИЧ (т.е. элементы цис-действующей последовательности ВИЧ).
Согласно различным вариантам реализации настоящего изобретения лентивирусный вектор, предусмотренный в настоящем документе, содержит один или более LTR и один или более, или все, из следующих вспомогательных элементов: cPPT/FLAP, сигнал упаковки Psi (Ψ), элемент экспорта, последовательности полиА, и может необязательно содержать WPRE или HPRE, элемент инсулятора, селективный маркер и ген «самоубийства» клетки, как обсуждается в другом месте настоящего документа.
Согласно конкретным вариантам реализации настоящего изобретения лентивирусные векторы, предусмотренные в настоящем документе, могут представлять собой интегрирующийся или неинтегрирующийся или дефектный по интеграции лентивирус. В настоящем документе термин «дефектный по интеграции лентивирус» или «IDLV» относится к лентивирусу, имеющему интегразу, которая не способна интегрировать вирусный геном в геном клеток-хозяев. Некомпетентные по интеграции вирусные векторы были описаны в заявке на патент WO 2006/010834, которая полностью включена в настоящий документ посредством ссылки.
Иллюстративные мутации в гене pol ВИЧ-1, подходящие для снижения активности интегразы, включают, но не ограничиваются ими: H12N, H12C, H16C, H16V, S81 R, D41A, K42A, H51A, Q53C, D55V, D64E, D64V, E69A, K71A, E85A, E87A, D116N, D1161, D116A, N120G, N1201, N120E, E152G, E152A, D35E, K156E, K156A, E157A, K159E, K159A, K160A, R166A, D167A, E170A, H171A, K173A, K186Q, K186T, K188T, E198A, R199c, R199T, R199A, D202A, K211A, Q214L, Q216L, Q221 L, W235F, W235E, K236S, K236A, K246A, G247W, D253A, R262A, R263A и K264H.
Согласно одному варианту реализации ген pol ВИЧ-1, дефицитного по интегразе, содержит мутацию D64V, D116I, D116A, E152G или E152A; мутации D64V, D116I и E152G; или мутации D64V, D116A и E152A.
Согласно одному варианту реализации ген pol ВИЧ-1, дефицитного по интегразе, содержит мутацию D64V.
Термин «длинный концевой повтор (LTR)» относится к доменам из пар оснований, расположенным на концах ретровирусных ДНК, которые, в окружении их природной последовательности, являются прямыми повторами и содержат области U3, R и U5.
В настоящем документе термин «элемент FLAP» или «cPPT/FLAP» относится к нуклеиновой кислоте, последовательность которой включает центральный полипуриновый участок и центральные последовательности терминации (cPPT и CTS) ретровируса, например, ВИЧ-1 или ВИЧ-2. Подходящие элементы FLAP описаны в патенте США № 6682907 и в Zennou, et al., 2000, Cell, 101:173. Согласно другому варианту реализации настоящего изобретения лентивирусный вектор содержит элемент FLAP с одной или более мутациями в элементах cPPT и/или CTS. В еще одном варианте реализации лентивирусный вектор содержит либо элемент cPPT, либо CTS. В еще одном варианте реализации лентивирусный вектор не содержит элемент cPPT или CTS.
В настоящем документе термин «сигнал упаковки» или «последовательность упаковки» относится к последовательностям psi [Ψ], расположенным внутри ретровирусного генома, которые необходимы для вставки вирусной РНК в вирусный капсид или частицу, см., например, Clever et al., 1995. J. of Virology, Vol. 69, No. 4; pp. 2101-2109.
Термин «элемент экспорта» относится к цис-действующему посттранскрипционному регуляторному элементу, который регулирует транспорт РНК-транскрипта из ядра в цитоплазму клетки. Примеры элементов экспорта РНК включают, но не ограничиваются указанными, элемент ответа rev (RRE) вируса иммунодефицита человека (ВИЧ) (см., например, Cullen et al., 1991. J. Virol. 65: 1053; и Cullen et al., 1991. Cell 58: 423) и посттранскрипционный регуляторный элемент вируса гепатита B (HPRE).
Согласно конкретным вариантам реализации настоящего изобретения экспрессию гетерологичных последовательностей в вирусных векторах повышают путем встраивания в векторы посттранскрипционных регуляторных элементов, эффективных сайтов полиаденилирования и необязательно сигналов терминации транскрипции. Разнообразные посттранскрипционные регуляторные элементы могут повышать экспрессию гетерологичной нуклеиновой кислоты в белок, например, посттранскрипционный регуляторный элемент вируса гепатита сурка (WPRE; Zufferey et al., 1999, J. Virol., 73:2886); посттранскрипционный регуляторный элемент, присутствующий в вирусе гепатита B (HPRE) (Huang et al., Mol. Cell. Biol., 5:3864); и тому подобные (Liu et al., 1995, Genes Dev., 9:1766).
Лентивирусные векторы предпочтительно содержат ряд улучшений в отношении безопасности в результате модификации LTR. «Самоинактивирующиеся» (SIN) векторы относятся к дефектным по репликации векторам, например, в которых правая (3') область энхансера-промотора LTR, известная как область U3, была модифицирована (например, путем удаления или замены), чтобы предотвратить вирусную транскрипцию после первого раунда вирусной репликации. Дополнительное повышение безопасности обеспечивается с помощью замены U3-области 5'-LTR гетерологичным промотором, чтобы запускать транскрипцию вирусного генома во время выработки вирусных частиц. Примеры гетерологичных промоторов, которые можно применять, включают, например, промотор вируса обезьян 40 (SV40) (например, ранний или поздний), промотор цитомегаловируса (CMV) (например, немедленный ранний), промотор вируса лейкоза мышей Молони (MoMLV), промотор вируса саркомы Рауса (RSV) и промотор вируса простого герпеса (HSV) (тимидинкиназы).
В настоящем документе термины «псевдотип» или «псевдотипирование» относятся к вирусу, белки вирусной оболочки которого были заменены белками другого вируса, обладающими предпочтительными характеристиками. Например, ВИЧ может быть псевдотипирован с использованием G-белков оболочки вируса везикулярного стоматита (VSV-G), что позволяет ВИЧ инфицировать более широкий круг клеток, поскольку белки оболочки ВИЧ (кодируемые геном env) обычно нацеливают вирус на CD4+-презентирующие клетки.
Согласно определенным вариантам реализации настоящего изобретения лентивирусные векторы получают в соответствии с известными способами. См., например, Kutner et al., BMC Biotechnol. 2009;9:10. doi: 10.1186/1472-6750-9-10; Kutner et al. Nat. Protoc. 2009;4(4):495-505. doi: 10.1038/nprot.2009.22.
В соответствии с определенными конкретными вариантами реализации, предусмотренными в настоящем документе, большинство или все последовательности остова вирусного вектора происходят из лентивируса, например, ВИЧ-1. Однако следует понимать, что можно применять или комбинировать множество различных источников ретровирусных и/или лентивирусных последовательностей, и многочисленные замены и изменения в некоторых из лентивирусных последовательностей могут быть адаптированы без нарушения способности переносящего вектора выполнять функции, описанные в настоящем документе. Более того, в данной области техники известны различные лентивирусные векторы, см. Naldini et al., (1996a, 1996b и 1998); Zufferey et al., (1997); Dull et al., 1998, патенты США №№ 6013516; и 5994136, многие из которых могут быть адаптированы для получения вирусного вектора или переносящей плазмиды, предусмотренных в настоящем документе.
Согласно различным вариантам реализации один или более полинуклеотидов, кодирующих вариант нуклеазы и/или донорную матрицу для восстановления, вводят в гемопоэтическую клетку путем трансдукции клетки аденовирусом, содержащим один или более полинуклеотидов.
Векторы на основе аденовирусов способны к очень высокой эффективности трансдукции во многих типах клеток и не требуют деления клеток. При применении таких векторов был получен высокий титр и высокие уровни экспрессии. Этот вектор может быть получен в больших количествах в относительно простой системе. Большинство аденовирусных векторов модифицированы так, что трансген заменяет гены E1a, E1b и/или E3 аденовируса; впоследствии вектор, дефектный по репликации, размножают в клетках человека 293, которые обеспечивают функцию удаленного гена в транс-конфигурации. Аденовирусные векторы могут трансдуцировать различные типы тканей в условиях in vivo, включая неделящиеся, дифференцированные клетки, такие как клетки печени, почек и мышц. Обычные аденовирусные векторы имеют большую переносящую способность.
При получении и размножении современных аденовирусных векторов, которые дефицитны по репликации, можно применять уникальную линию клеток-помощников, обозначенную 293, которая была трансформирована из клеток эмбриональной почки человека с применением фрагментов ДНК Ad5 и конститутивно экспрессирует белки E1 (Graham et al., 1977). Поскольку область E3 удалена из аденовирусного генома (Jones & Shenk, 1978), современные аденовирусные векторы, с помощью клеток 293, несут чужеродную ДНК либо в E1, либо в D3, либо в обеих областях (Graham & Prevec, 1991). Аденовирусные векторы были использованы для экспрессии генов эукариот (Levrero et al., 1991; Gomez-Foix et al., 1992) и разработки вакцин (Grunhaus & Horwitz, 1992; Graham & Prevec, 1992). Исследования по введению рекомбинантного аденовируса в различные ткани включают инстилляцию трахеи (Rosenfeld et al., 1991; Rosenfeld et al., 1992), инъекцию в мышцы (Ragot et al., 1993), периферические внутривенные инъекции (Herz & Gerard, 1993) и стереотаксическую инокуляцию в мозг (Le Gal La Salle et al., 1993). Пример применения аденовирусного вектора в клинических исследованиях включал полинуклеотидную терапию для противоопухолевой иммунизации с применением внутримышечной инъекции (Sterman et al., Hum. Gene Ther. 7:1083-9 (1998)).
Согласно различным вариантам реализации один или более полинуклеотидов, кодирующих вариант нуклеазы и/или донорную матрицу для восстановления, вводят в гемопоэтическую клетку путем трансдукции клетки вирусом простого герпеса, например, ВПГ-1, ВПГ-2, содержащим один или более полинуклеотидов.
Зрелый вирион ВПГ состоит из покрытого оболочкой икосаэдрического капсида с вирусным геномом, состоящим из линейной двухцепочечной молекулы ДНК, которая содержит 152 т.п.о. Согласно одному варианту реализации вирусный вектор на основе ВПГ является дефицитным по одному или более существенным или несущественным генам ВПГ. Согласно одному варианту реализации вирусный вектор на основе ВПГ является дефицитным по репликации. Большинство векторов ВПГ, дефицитных по репликации, содержат делецию для удаления одного или более промежуточных-ранних, ранних или поздних генов ВПГ, чтобы предотвратить репликацию. Например, вектор ВПГ может быть дефицитным по немедленному раннему гену, выбранному из группы, состоящей из: ICP4, ICP22, ICP27, ICP47 и их комбинации. Преимущества вектора ВПГ заключаются в его способности переходить в латентную стадию, которая может привести к длительной экспрессии ДНК, и в его большом вирусном ДНК-геноме, который может вмещать вставки экзогенной ДНК до 25 т.п.о. Векторы на основе ВПГ описаны, например, в патентах США №№ 5837532, 5846782 и 5804413, а также в международных заявках на патент WO 91/02788, WO 96/04394, WO 98/15637 и WO 99/06583, каждый из которых полностью включен в настоящий документ посредством ссылки.
H. КЛЕТКИ С РЕДАКТИРОВАННЫМ ГЕНОМОМ
Клетки с редактированным геномом, изготовленные с помощью способов, предусмотренных в конкретных вариантах реализации, содержат одно или более редактирований генов в гене CBLB и обеспечивают улучшенные клеточные терапевтические средства для предотвращения, лечения или уменьшения по меньшей мере одного симптома рака, РТПХ, инфекционного заболевания, аутоиммунного заболевания, иммунодефицита или состояния, ассоциированного с ними. Безотносительно к какой-либо конкретной теории, полагают, что композиции и способы, предусмотренные в настоящем документе, повышают эффективность видов адоптивной клеточной терапии, в частности, делая терапевтические клетки более стойкими и более устойчивыми к иммуносупрессорным сигналам и истощению.
Клетки с редактированным геномом, предусмотренные в конкретных вариантах реализации, могут быть аутологичными/аутогенными («собственными») или неаутологичными («не собственными», например, аллогенными, сингенными или ксеногенными). В настоящем документе «аутологичный» относится к клеткам от одного и того же субъекта. В настоящем документе «аллогенный» относится к клеткам одного и того же вида, которые генетически отличаются от сравниваемой клетки. В настоящем документе «сингенный» относится к клеткам другого субъекта, которые генетически идентичны сравниваемой клетке. В настоящем документе «ксеногенный» относится к клеткам из другого вида, чем сравниваемая клетка. Согласно предпочтительным вариантам реализации настоящего изобретения клетки получают от субъекта-млекопитающего. В более предпочтительном варианте реализации клетки получают от субъекта-примата, необязательно примата, отличного от человека. В наиболее предпочтительном варианте реализации клетки получают от субъекта-человека.
«Выделенная клетка» относится к неприродной клетке, например, клетке, которая не существует в природе, модифицированной клетке, сконструированной клетке и т.д., которая была получена из ткани или органа в условиях in vivo и по существу не содержит внеклеточный матрикс.
В настоящем документе термин «популяция клеток» относится к множеству клеток, которое может состоять из любого количества и/или комбинации гомогенных или гетерогенных типов клеток, как описано в другом месте настоящего документа. Например, для трансдукции T-клеток популяция клеток может быть выделена или получена из периферической крови. Популяция клеток может содержать приблизительно 10%, приблизительно 20%, приблизительно 30%, приблизительно 40%, приблизительно 50%, приблизительно 60%, приблизительно 70%, приблизительно 80%, приблизительно 90% или приблизительно 100% целевого типа клеток, подлежащего редактированию. Согласно определенным вариантам реализации настоящего изобретения T-клетки могут быть выделены или очищены из популяции гетерогенных клеток с применением способов, известных в данной области техники.
Иллюстративные примеры типов клеток, геном которых можно редактировать с применением композиций и способов, предусмотренных в настоящем документе, включают, но не ограничиваются указанными, клеточные линии, первичные клетки, стволовые клетки, клетки-предшественники и дифференцированные клетки, а также их смеси.
Согласно предпочтительному варианту реализации настоящего изобретения композиции и способы редактирования генома применяют для редактирования гемопоэтических клеток, более предпочтительно иммунных клеток и еще более предпочтительно T-клеток.
Термины «T-клетка» или «Т-лимфоцит» общепризнанны в данной области техники и предназначены для включения тимоцитов, иммунных эффекторных клеток, регуляторных T-клеток, наивных Т-лимфоцитов, незрелых Т-лимфоцитов, зрелых Т-лимфоцитов, покоящихся Т-лимфоцитов или активированных Т-лимфоцитов. T-клетка может представлять собой хелперную T-клетку (Th), например, хелперную T-клетку типа 1 (Th1) или хелперную T-клетку типа 2 (Th2). T-клетка может представлять собой хелперную T-клетку (HTL; CD4+ T-клетку) CD4+ T-клетку, цитотоксическую T-клетку (CTL; CD8+ T-клетку), инфильтрирующую опухоль цитотоксическую T-клетку (ИОЛ; CD8+ T-клетку), CD4+CD8+ T клетку, CD4-CD8- T-клетку или любую другую подгруппу T-клеток. Согласно одному варианту реализации T-клетка представляет собой иммунную эффекторную клетку. Согласно одному варианту реализации T-клетка представляет собой NKT-клетку. Другие иллюстративные популяции T-клеток, подходящие для применения в конкретных вариантах реализации, включают наивные T-клетки и T-клетки памяти.
Согласно различным вариантам реализации клетки с редактированным геномом включают иммунные эффекторные клетки, содержащие ген CBLB, редактированный с помощью композиций и способов, предусмотренных в настоящем документе. «Иммунная эффекторная клетка» представляет собой любую клетку иммунной системы, которая имеет одну или более эффекторных функций (например, цитотоксическую активность, направленную на уничтожение клеток, секрецию цитокинов, индукцию АЗКЦ и/или КЗЦ). Иллюстративные иммунные эффекторные клетки, предусмотренные в конкретных вариантах реализации, представляют собой T-лимфоциты, в частности цитотоксические T-клетки (CTL; CD8+ T-клетки), ИОЛ и хелперные T-клетки (HTL; CD4+ T-клетки). Согласно одному варианту реализации иммунные эффекторные клетки включают T-клетки. Согласно одному варианту реализации иммунные эффекторные клетки включают природные клетки-киллеры (NK). Согласно одному варианту реализации иммунные эффекторные клетки включают природные T-киллеры (NKT).
«Эффективные T-клетки» и «молодые T-клетки» используются взаимозаменяемо в конкретных вариантах реализации настоящего изобретения и относятся к фенотипам T-клеток, при которых T-клетки способны к пролиферации и сопутствующему уменьшению дифференцировки. Согласно конкретным вариантам реализации настоящего изобретения молодая T-клетка имеет фенотип «наивной T-клетки». Согласно конкретным вариантам реализации настоящего изобретения молодые T-клетки содержат один или более, или все, из следующих биологических маркеров: CD62L, CCR7, CD28, CD27, CD122, CD127, CD197 и CD38. Согласно одному варианту реализации молодые T-клетки содержат один или более или все из следующих биологических маркеров: CD62L, CD127, CD197 и CD38. Согласно одному варианту реализации молодые T-клетки не экспрессируют CD57, CD244, CD160, PD-1, CTLA4, PD-1 и LAG3.
T-клетки могут быть получены из ряда источников, включая, но не ограничиваясь указанными, мононуклеарные клетки периферической крови, костный мозг, ткань лимфатических узлов, пуповинную кровь, ткань тимуса, ткань из очага инфекции, асциты, плевральный выпот, ткань селезенки и опухоли.
Согласно конкретным вариантам реализации настоящего изобретения популяция клеток, содержащая иммунные эффекторные клетки или T-клетки, содержит редактированный ген CBLB, причем редактирование представляет собой ДЦР, восстановленный с помощью NHEJ. Согласно конкретным вариантам реализации настоящего изобретения иммунная эффекторная клетка или T-клетка содержит редактированный ген CBLB, причем редактирование представляет собой ДЦР, восстановленный с помощью NHEJ. Согласно конкретным вариантам реализации настоящего изобретения редактирование представляет собой вставку или делецию (INDEL) приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25 или более нуклеотидов в кодирующей последовательности гена CBLB, предпочтительно в экзоне 6 гена CBLB, более предпочтительно в SEQ ID NO: 20 (или SEQ ID NO: 22) в экзоне 6 гена CBLB.
Согласно конкретным вариантам реализации настоящего изобретения популяция клеток, содержащая иммунные эффекторные клетки или T-клетки, содержит редактированный ген CBLB, содержащий донорную матрицу для восстановления, встроенную в ДЦР, восстановленный с помощью HDR.
Согласно конкретным вариантам реализации настоящего изобретения популяция клеток, содержащая иммунные эффекторные клетки или T-клетки, содержит редактированный ген CBLB, содержащий донорную матрицу для восстановления, содержащую ген CBLB или его часть и предназначенную для введения одной или более мутаций в геномную последовательность CBLB для модификации экспрессии, активности или передачи сигналов CBLB, и предпочтительно для уменьшения или устранения экспрессии, активности и/или передачи сигналов CBLB.
Согласно различным вариантам реализации клетка с редактированным геномом содержит редактирование в гене CBLB и дополнительно содержит полинуклеотид, кодирующий переключающий рецептор, биспецифическую молекулу, активирующую T-клетки (BiTE); цитокин (например, ИЛ-2, инсулин, ИФН-γ, ИЛ-7, ИЛ-21, ИЛ-10, ИЛ-12, ИЛ-15 и ФНО-α), хемокин (например, MIP-1α, MIP-1β, MCP-1, MCP-3 и RANTES), цитотоксин (например, перфорин, гранзим A и гранзим B), рецептор цитокина (например, рецептор ИЛ-2, рецептор ИЛ-7, рецептор ИЛ-12, рецептор ИЛ-15 и рецептор ИЛ-21) или модифицированный антигенный рецептор (например, модифицированный T-клеточный рецептор (ТКР), химерный антигенный рецептор (CAR), рецептор Daric или его компоненты, или химерный рецептор цитокина). Согласно одному варианту реализации донорную матрицу для восстановления, содержащую полинуклеотид и вариант нуклеазы, вводят в клетку, и полинуклеотид встраивают в геном клетки в сайт ДЦР в гене CBLB путем восстановления с помощью HDR. Полинуклеотид также может быть введен в клетку в сайт, отличный от гена CBLB, например, путем трансдукции клетки вектором, содержащим полинуклеотид.
I. КОМПОЗИЦИИ И СОСТАВЫ
Композиции, предусмотренные в конкретных вариантах реализации, могут содержать один или более полипептидов, полинуклеотидов, векторов, содержащих их, а также композиции для редактирования генома и композиции клеток с редактированным геномом, предусмотренные в настоящем документе. Композиции и способы редактирования генома, предусмотренные в конкретных вариантах реализации, можно применять для редактирования сайта-мишени в человеческом гене CBLB в клетке или популяции клеток. Согласно предпочтительным вариантам реализации настоящего изобретения композицию для редактирования генома применяют для редактирования гена CBLB в гемопоэтической клетке, например, T-клетке или иммунной эффекторной клетке.
Согласно различным вариантам реализации настоящего изобретения композиции, предусмотренные в настоящем документе, содержат вариант нуклеазы и необязательно модифицирующий концы фермент, например, 3'-5' экзонуклеазу (Trex2). Вариант нуклеазы может быть в форме иРНК, которую вводят в клетку с помощью способов доставки полинуклеотидов, описанных выше, например, электропорации, липидных наночастиц и т.д. Согласно одному варианту реализации композицию, содержащую иРНК, кодирующую вариант хоуминг-эндонуклеазы или megaTAL и необязательно 3'-5' экзонуклеазу, вводят в клетку с помощью способов доставки полинуклеотидов, описанных выше. Композицию можно применять для получения клетки с редактированным геномом или популяции клеток с редактированным геномом с помощью склонного к ошибкам NHEJ.
Согласно различным вариантам реализации композиции, предусмотренные в настоящем документе, содержат донорную матрицу для восстановления. Композиция может быть доставлена в клетку, которая экспрессирует или будет экспрессировать вариант нуклеазы и необязательно модифицирующий концы фермент. Согласно одному варианту реализации композиция может быть доставлена в клетку, которая экспрессирует или будет экспрессировать вариант хоуминг-эндонуклеазы или megaTAL и необязательно 3'-5' экзонуклеазу. Экспрессию редактирующих гены ферментов в присутствии донорной матрицы для восстановления можно применять для получения клетки с редактированным геномом или популяции клеток с редактированным геномом с помощью HDR.
Согласно конкретным вариантам реализации настоящего изобретения композиции, предусмотренные в настоящем документе, содержат популяцию клеток, вариант нуклеазы и необязательно донорную матрицу для восстановления. Согласно конкретным вариантам реализации настоящего изобретения композиции, предусмотренные в настоящем документе, содержат популяцию клеток, вариант нуклеазы, модифицирующий концы фермент и необязательно донорную матрицу для восстановления. Вариант нуклеазы и/или модифицирующий концы фермент могут быть в форме иРНК, которую вводят в клетку с помощью способов доставки полинуклеотидов, описанных выше.
Согласно конкретным вариантам реализации настоящего изобретения композиции, предусмотренные в настоящем документе, содержат популяцию клеток, вариант хоуминг-эндонуклеазы или megaTAL и необязательно донорную матрицу для восстановления. Согласно конкретным вариантам реализации настоящего изобретения композиции, предусмотренные в настоящем документе, содержат популяцию клеток, вариант хоуминг-эндонуклеазы или megaTAL, 3'-5'-экзонуклеазу и необязательно донорную матрицу для восстановления. Вариант хоуминг-эндонуклеазы, megaTAL и/или 3'-5'-экзонуклеаза могут быть в форме иРНК, которую вводят в клетку с помощью способов доставки полинуклеотидов, описанных выше, например, электропорации.
Согласно конкретным вариантам реализации настоящего изобретения популяция клеток содержит генетически модифицированные иммунные эффекторные клетки.
Композиции включают, но не ограничиваются указанными, фармацевтические композиции. «Фармацевтическая композиция» относится к композиции, изготовленной в фармацевтически приемлемых или физиологически приемлемых растворах для введения в клетку или животному, либо по отдельности, либо в комбинации с одним или более другими способами терапии. Также следует понимать, что, при необходимости, композиции также могут быть введены в комбинации с другими агентами, такими как, например, цитокины, факторы роста, гормоны, небольшие молекулы, химиотерапевтические средства, пролекарства, лекарственные препараты, антитела или различные другие фармацевтически активные агенты. Практически отсутствуют ограничения для других компонентов, которые также могут быть включены в композиции, при условии, что дополнительные агенты не оказывают нежелательное влияние на композицию.
В настоящем документе выражение «фармацевтически приемлемый» применяется для обозначения тех соединений, материалов, композиций и/или лекарственных форм, которые, на основании обоснованного врачебного заключения, подходят для применения в контакте с тканями людей и животных без чрезмерной токсичности, раздражения, аллергической реакции или других проблем или осложнений, соразмерно с разумным соотношением польза/риск.
Термин «фармацевтически приемлемый носитель» относится к разбавителю, адъюванту, вспомогательному веществу или наполнителю, с которым вводят терапевтические клетки. Иллюстративными примерами фармацевтических носителей могут быть стерильные жидкости, такие как среды для культивирования клеток, вода и масла, включая масла нефтяного, животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и тому подобное. Солевые растворы и водные растворы декстрозы и глицерина также можно применять в качестве жидких носителей, в частности, для инъекционных растворов. Подходящие фармацевтические вспомогательные вещества в конкретных вариантах реализации настоящего изобретения включают крахмал, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, мел, силикагель, стеарат натрия, моностеарат глицерина, тальк, хлорид натрия, сухое обезжиренное молоко, глицерин, пропилен, гликоль, воду, этанол и тому подобное. За исключением случаев, когда какие-либо обычные среды или агент несовместимы с активным ингредиентом, предусмотрено их применение в терапевтических композициях. В композиции также могут быть включены дополнительные активные ингредиенты.
Согласно одному варианту реализации композиция, содержащая фармацевтически приемлемый носитель, является подходящей для введения субъекту. Согласно конкретным вариантам реализации настоящего изобретения композиция, содержащая носитель, является подходящей для парентерального введения, например, внутрисосудистого (внутривенного или внутриартериального), внутрибрюшинного или внутримышечного введения. Согласно конкретным вариантам реализации настоящего изобретения композиция, содержащая фармацевтически приемлемый носитель, является подходящей для внутрижелудочкового, внутриспинального или внутритекального введения. Фармацевтически приемлемые носители включают стерильные водные растворы, среды для культивирования клеток или дисперсии. Применение таких сред и агентов для фармацевтически активных веществ хорошо известно в данной области техники. За исключением случаев, когда какие-либо обычные среды или агент несовместимы с трансдуцированными клетками, предусмотрено их применение в фармацевтических композициях.
Согласно конкретным вариантам реализации настоящего изобретения композиции, предусмотренные в настоящем документе, содержат генетически модифицированные T-клетки и фармацевтически приемлемый носитель. Композиция, содержащая композицию на основе клеток, предусмотренная в настоящем документе, может быть введена по отдельности с помощью способов энтерального или парентерального введения или в комбинации с другими подходящими соединениями для достижения желательных целей лечения.
Фармацевтически приемлемый носитель должен иметь достаточно высокую чистоту и достаточно низкую токсичность, чтобы быть подходящим для введения субъекту-человеку, которого лечат. Он также должен поддерживать или повышать стабильность композиции. Фармацевтически приемлемый носитель может быть жидким или твердым, и его выбирают, с учетом планируемого способа введения, чтобы обеспечить желательный нерасфасованный продукт, консистенцию и т.д. в комбинации с другими компонентами композиции. Например, фармацевтически приемлемый носитель может представлять собой, но не ограничивается указанными, связующий агент (например, предварительно желатинизированный кукурузный крахмал, поливинилпирролидон или гидроксипропилметилцеллюлозу и т.д.), наполнитель (например, лактозу и другие сахара, микрокристаллическую целлюлозу, пектин, желатин, сульфат кальция, этилцеллюлозу, полиакрилаты, гидрофосфат кальция и т.д.), смазывающее вещество (например, стеарат магния, тальк, диоксид кремния, коллоидный диоксид кремния, стеариновую кислоту, стеараты металлов, гидрогенизированные растительные масла, кукурузный крахмал, полиэтиленгликоли, бензоат натрия, ацетат натрия и т.д.), разрыхлитель (например, крахмал, крахмал гликолят натрия и т.д.) или смачивающий агент (например, лаурилсульфат натрия и т.д.). Другие подходящие фармацевтически приемлемые носители для композиций, предусмотренных в настоящем документе, включают, но не ограничиваются указанными, воду, солевые растворы, спирты, полиэтиленгликоли, желатины, амилозы, стеараты магния, тальки, кремниевые кислоты, вязкие парафины, гидроксиметилцеллюлозы, поливинилпирролидоны и тому подобное.
Такие растворы-носители также могут содержать буферы, разбавители и другие подходящие добавки. В настоящем документе термин «буфер» относится к раствору или жидкости, химический состав которых нейтрализует кислоты или основания без значительного изменения pH. Примеры буферов, предусмотренных в настоящем документе, включают, но не ограничиваются указанными, забуференный фосфатом физиологический раствор Дульбекко (PBS), раствор Рингера, 5% раствор декстрозы в воде (D5W), нормальный/физиологический солевой раствор (0,9% NaCl).
Фармацевтически приемлемые носители могут присутствовать в количествах, достаточных для поддержания рН композиции приблизительно 7. Согласно другому варианту композиция имеет рН в диапазоне от приблизительно 6,8 до приблизительно 7,4, например, 6,8, 6,9, 7,0, 7,1, 7,2, 7,3 и 7,4. В еще одном варианте реализации композиция имеет рН приблизительно 7,4.
Композиции, предусмотренные в настоящем документе, могут содержать нетоксичную фармацевтически приемлемую среду. Композиции могут представлять собой суспензию. В настоящем документе термин «суспензия» относится к неадгезивным условиям, при которых клетки не прикреплены к твердой подложке. Например, клетки, поддерживаемые в виде суспензии, можно перемешивать или взбалтывать, и они не прикреплены к подложке, такой как культуральная чашка.
Согласно конкретным вариантам реализации настоящего изобретения композиции, предусмотренные в настоящем документе, изготовлены в виде суспензии, в которой T-клетки с редактированным геномом диспергированы в приемлемой жидкой среде или растворе, например, в солевом растворе или бессывороточной среде, в пакете для внутривенной (в/в) инфузии или тому подобном. Приемлемые разбавители включают, но не ограничиваются указанными, воду, PlasmaLyte, раствор Рингера, изотонический раствор хлорида натрия (солевой раствор), бессывороточную среду для культивирования клеток и среду, подходящую для криогенного хранения, например, среду Cryostor®.
Согласно определенным вариантам реализации настоящего изобретения фармацевтически приемлемый носитель по существу не содержит природные белки человеческого или животного происхождения и пригоден для хранения композиции, содержащей популяцию T-клеток с редактированным геномом. Терапевтическая композиция предназначена для введения пациенту-человеку и, следовательно, по существу не содержит компоненты клеточной культуры, такие как бычий сывороточный альбумин, лошадиная сыворотка и фетальная бычья сыворотка.
Согласно некоторым вариантам реализации настоящего изобретения композиции изготовлены в фармацевтически приемлемой среде для культивирования клеток. Такие композиции подходят для введения субъектам-людям. Согласно конкретным вариантам реализации настоящего изобретения фармацевтически приемлемая среда для культивирования клеток представляет собой бессывороточную среду.
Бессывороточная среда имеет несколько преимуществ по сравнению со средой, содержащей сыворотку, включая упрощенный и более точный состав, сниженную степень загрязнений, устранение потенциального источника инфекционных агентов и более низкую стоимость. Согласно различным вариантам реализации бессывороточная среда не содержит вещества животного происхождения и необязательно может не содержать белки. Необязательно среда может содержать биофармацевтически приемлемые рекомбинантные белки. Среда «без веществ животного происхождения» относится к среде, в которой компоненты происходят из источников, отличных от животных. Рекомбинантные белки заменяют нативные животные белки в среде без веществ животного происхождения, и питательные вещества получены из синтетических, растительных или микробных источников. «Безбелковая» среда, напротив, определяется как по существу не содержащая белок.
Иллюстративные примеры бессывороточных сред, применяемых в конкретных композициях, включают, но не ограничиваются указанными, QBSF-60 (Quality Biological, Inc.), StemPro-34 (Life Technologies) и X-VIVO 10.
Согласно предпочтительному варианту реализации настоящего изобретения композиции, содержащие T-клетки с редактированным геномом, изготовлены в PlasmaLyte.
Согласно различным вариантам реализации композиции, содержащие T-клетки с редактированным геномом, изготовлены в криоконсервационной среде. Например, криоконсервационная среда с криоконсервационными агентами может применяться для поддержания высокой жизнеспособности клеток после оттаивания. Иллюстративные примеры криоконсервационных сред, применяемых в конкретных композициях, включают, но не ограничиваются указанными, CryoStor CS10, CryoStor CS5 и CryoStor CS2.
Согласно одному варианту реализации композиции изготовлены в растворе, содержащем PlasmaLyte A и CryoStor CS10 в соотношении 50:50.
Согласно конкретным вариантам реализации настоящего изобретения композиция по существу не загрязнена микоплазмами, эндотоксинами и микробами. Под «по существу не содержит» в отношении эндотоксина подразумевается, что содержание эндотоксина на дозу клеток меньше, чем разрешено Управлением по контролю качества пищевых продуктов и лекарственных средств США (FDA) для биопрепарата, т.е. общее количество эндотоксина составляет 5 ЕЭ/кг массы тела в сутки, что для обычного индивидуума массой 70 кг составляет 350 ЕЭ на общую дозу клеток. Согласно конкретным вариантам реализации настоящего изобретения композиции, содержащие гемопоэтические стволовые клетки или клетки-предшественники, трансдуцированные ретровирусным вектором, предусмотренным в настоящем документе, содержат от приблизительно 0,5 ЕЭ/мл до приблизительно 5,0 ЕЭ/мл или приблизительно 0,5 ЕЭ/мл, 1,0 ЕЭ/мл, 1,5 ЕЭ/мл, 2,0 ЕЭ/мл, 2,5 ЕЭ/мл, 3,0 ЕЭ/мл, 3,5 ЕЭ/мл, 4,0 ЕЭ/мл, 4,5 ЕЭ/мл или 5,0 ЕЭ/мл.
Согласно определенным вариантам реализации настоящего изобретения предусмотрены композиции и составы, подходящие для доставки полинуклеотидов, включая, но не ограничиваясь указанными, одну или более иРНК, кодирующих одну или более перепрограммированных нуклеаз и необязательно модифицирующие концы ферменты.
Примерные составы для доставки ex vivo также могут включать применение различных трансфекционных агентов, известных в данной области техники, таких как фосфат кальция, электропорация, тепловой шок и различные липосомные составы (т.е. опосредуемая липидами трансфекция). Липосомы, как описано более подробно ниже, представляют собой липидные бислои, захватывающие фракцию водной жидкости. ДНК самопроизвольно ассоциируется с внешней поверхностью катионных липосом (благодаря своему заряду), и эти липосомы будут взаимодействовать с клеточной мембраной.
Согласно конкретным вариантам реализации настоящего изобретения состав фармацевтически приемлемых растворов-носителей хорошо известен специалистам в данной области техники, также как и разработка подходящих схем дозирования и лечения для применения конкретных композиций, описанных в настоящем документе, в различных схемах лечения, включая, например, энтеральное и парентеральное, например, внутрисосудистое, внутривенное, внутриартериальное, внутрикостное, внутрижелудочковое, внутримозговое, внутричерепное, внутриспинальное, внутритекальное и внутримедуллярное введение и состав. Квалифицированный специалист в данной области техники поймет, что конкретные варианты реализации, предусмотренные в настоящем документе, могут включать другие составы, такие как те, которые хорошо известны в области фармацевтики и описаны, например, в Remington: The Science and Practice of Pharmacy, том I и том II. 22 изд. под ред. Loyd V. Allen Jr. Philadelphia, PA: Pharmaceutical Press; 2012, полностью включенном в настоящий документ посредством ссылки.
J. ВИДЫ ТЕРАПИИ НА ОСНОВЕ КЛЕТОК С РЕДАКТИРОВАННЫМ ГЕНОМОМ
Клетки, содержащие редактированный ген CBLB, которые изготовлены с помощью композиций и способов, предусмотренных в настоящем документе, обеспечивают улучшенные лекарственные продукты для применения в предотвращении, лечении или уменьшении по меньшей мере одного симптома рака, РТПХ, инфекционного заболевания, аутоиммунного заболевания, воспалительного заболевания или иммунодефицита. В настоящем документе термин «лекарственный продукт» относится к генетически модифицированным клеткам, полученным с применением композиций и способов, предусмотренных в настоящем документе. Согласно конкретным вариантам реализации настоящего изобретения лекарственный продукт содержит генетически редактированные иммунные эффекторные клетки или T-клетки. Согласно предпочтительным вариантам реализации настоящего изобретения лекарственный продукт содержит генетически редактированные иммунные эффекторные клетки или T-клетки, которые экспрессируют модифицированный ТКР или CAR или другой модифицированный антигенный рецептор. Кроме того, T-клетки с редактированным геномом, предусмотренные в конкретных вариантах реализации, обеспечивают более безопасные и более эффективные виды адоптивной клеточной терапии, поскольку они устойчивы к истощению T-клеток и проявляют повышенную стойкость и устойчивость в микросреде опухоли, что может привести к длительной терапии.
Согласно конкретным вариантам реализации настоящего изобретения эффективное количество иммунных эффекторных клеток или T-клеток с редактированным геномом, содержащих редактированный ген CBLB, вводят субъекту для предотвращения, лечения или уменьшения по меньшей мере одного симптома рака, РТПХ, инфекционного заболевания, аутоиммунного заболевания, воспалительного заболевания или иммунодефицита.
Согласно конкретным вариантам реализации настоящего изобретения CBLB-редактированные клетки по существу не экспрессируют или не экспрессируют CBLB и, следовательно, не имеют или по существу не имеют экспрессии и/или активности функционального CBLB, например, не способны увеличивать истощение T-клеток и ингибировать экспрессию провоспалительных цитокинов. Согласно конкретным вариантам реализации настоящего изобретения иммунные эффекторные клетки с редактированным геномом, которые не содержат CBLB, являются более устойчивыми к иммуносупрессорным сигналам из микросреды опухоли и проявляют повышенную стойкость и устойчивость к истощению T-клеток.
Согласно конкретным вариантам реализации настоящего изобретения способ предотвращения, лечения или уменьшения по меньшей мере одного симптома рака включает введение субъекту эффективного количества иммунных эффекторных клеток или T-клеток с редактированным геномом, содержащих редактированный ген CBLB и модифицированный ТКР, CAR или Daric, или другой терапевтический трансген для перенаправления клеток к опухоли или раку. Генетически модифицированные клетки представляют собой более долговечный и стойкий лекарственный продукт, поскольку клетки более устойчивы к иммуносупрессорным сигналам из микросреды опухоли благодаря редактированию гена CBLB для уменьшения или устранения экспрессии CBLB.
Согласно конкретным вариантам реализации настоящего изобретения клетки с редактированным геномом, предусмотренные в настоящем документе, применяют для лечения солидных опухолей или разных видов рака.
Согласно конкретным вариантам реализации настоящего изобретения клетки с редактированным геномом, предусмотренные в настоящем документе, применяют для лечения солидных опухолей или разных видов рака, включая, но не ограничиваясь ими: рак надпочечников, адренокортикальную карциному, рак анального канала, рак червеобразного отростка, астроцитому, атипичную тератоидную/рабдоидную опухоль, базальноклеточную карциному, рак желчных протоков, рак мочевого пузыря, рак костей, рак головного мозга/ЦНС, рак молочной железы, бронхиальные опухоли, опухоли сердца, рак шейки матки, холангиокарциному, хондросаркому, хордому, рак толстой кишки, колоректальный рак, краниофарингиому, карциному из эпителия протоков in situ (DCIS) рак эндометрия, эпендимому, рак пищевода, эстезионейробластому, саркому Юинга, опухоль из экстракраниальных половых клеток, опухоль из внегонадных половых клеток, рак глаза, рак маточной трубы, фиброзную гистиосаркому, фибросаркому, рак желчного пузыря, рак желудка, карциноидные опухоли желудочно-кишечного тракта, стромальные опухоли желудочно-кишечного тракта, опухоли из половых клеток, глиому, глиобластому, рак головы и шеи, гемангиобластому, гепатоцеллюлярный рак, гипофарингиальный рак, внутриглазную меланому, саркому Капоши, рак почек, рак гортани, лейомиосаркому, рак губы, липосаркому, рак печени, рак легких, немелкоклеточный рак легких, карциноидную опухоль легких, злокачественную мезотелиому, медуллярную карциному, медуллобластому, менангиому, меланому, карциному из клеток Меркеля, карциному срединного тракта, рак рта, миксосаркому, миелодиспластический синдром, миелопролиферативные новообразования, рак полости носа и околоносовых пазух, рак носоглотки, нейробластому, олигодендроглиому, рак ротовой полости, рак полости рта, рак ротоглотки, остеосаркому, рак яичников, рак поджелудочной железы, опухоли из островковых клеток поджелудочной железы, папиллярную карциному, параганглиому, рак паращитовидной железы, рак полового члена, рак глотки, феохромоцитому, пинеалому, опухоль гипофиза, плевропульмонарную бластому, первичный рак брюшины, рак предстательной железы, рак прямой кишки, ретинобластому, карциному почек, рак почечной лоханки и мочеточника, рабдомиосаркому, рак слюнных желез, карциному сальных желез, рак кожи, саркому мягких тканей, плоскоклеточную карциному, мелкоклеточный рак легких, рак тонкого кишечника, рак желудка, карциному потовых желез, синовиому, рак яичка, рак горла, рак тимуса, рак щитовидной железы, рак уретры, рак матки, саркому матки, рак влагалища, рак сосудов, рак вульвы и опухоль Вильмса.
Согласно конкретным вариантам реализации настоящего изобретения клетки с редактированным геномом, предусмотренные в настоящем документе, применяют для лечения солидных опухолей или разных видов рака, включая, но не ограничиваясь указанными, рак печени, рак поджелудочной железы, рак легких, рак молочной железы, рак мочевого пузыря, рак мозга, рак костей, рак щитовидной железы, рак почек или рак кожи.
Согласно конкретным вариантам реализации настоящего изобретения клетки с редактированным геномом, предусмотренные в настоящем документе, применяют в лечении различных видов рака, включая, но не ограничиваясь указанными, рак поджелудочной железы, рак мочевого пузыря и рак легких.
Согласно конкретным вариантам реализации настоящего изобретения клетки с редактированным геномом, предусмотренные в настоящем документе, применяют для лечения гемобластозов или разных видов гематологического рака.
Согласно конкретным вариантам реализации настоящего изобретения клетки с редактированным геномом, предусмотренные в настоящем документе, применяют для лечения В-клеточных злокачественных новообразований, включая, но не ограничиваясь указанными, лейкозы, лимфомы и множественную миелому.
Согласно конкретным вариантам реализации настоящего изобретения клетки с редактированным геномом, предусмотренные в настоящем документе, применяют для лечения гемобластозов, включая, но не ограничиваясь указанными, лейкозы, лимфомы и множественные миеломы: острый лимфолейкоз (ALL), острый миелолейкоз (AML), миелобластный, промиелоцитарный, миеломоноцитарный, моноцитарный, эритролейкоз, лейкоз ворсистых клеток (HCL), хронический лимфолейкоз (CLL) и хронический миелолейкоз (CML), хронический миеломоноцитарный лейкоз (CMML) и истинную полицитемию, лимфому Ходжкина, узловую лимфому Ходжкина с лимфоидным преобладанием, лимфому Беркитта, мелкоклеточную лимфоцитарную лимфому (SLL), диффузную крупноклеточную B-клеточную лимфому, фолликулярную лимфому, иммунобластную крупноклеточную лимфому, B-лимфобластную лимфому из клеток-предшественников, лимфому из клеток мантийной зоны, лимфому из клеток краевой зоны, грибовидный микоз, анапластическую крупноклеточную лимфому, синдром Сезари, Т-лимфобластную лимфому из клеток-предшественников, множественную миелому, наблюдаемую множественную миелому, тлеющую множественную миелому, лейкоз плазматических клеток, несекреторную миелому, миелому IgD, остеосклеротическую миелому, солитарную плазмоцитому кости и экстрамедуллярную плазмоцитому.
Предпочтительные клетки для применения в способах редактирования генома, предусмотренных в настоящем документе, включают аутологичные/аутогенные («собственные») клетки, предпочтительно гемопоэтические клетки, более предпочтительно T-клетки и более предпочтительно иммунные эффекторные клетки. Согласно одному варианту реализации клетки представляют собой Treg-клетки.
Согласно конкретным вариантам реализации настоящего изобретения предложены способы, включающие введение пациенту, нуждающемуся в этом, терапевтически эффективного количества клеток с редактированным геномом, предусмотренных в настоящем документе, или композиции, содержащей их, по отдельности или в комбинации с одним или более терапевтическими агентами. Согласно определенным вариантам реализации настоящего изобретения клетки применяют в лечении пациентов, подверженных риску развития рака, РТПХ, инфекционного заболевания, аутоиммунного заболевания, воспалительного заболевания или иммунодефицита. Таким образом, конкретные варианты реализации включают лечение, предотвращение или уменьшение по меньшей мере одного симптома рака, инфекционного заболевания, аутоиммунного заболевания, воспалительного заболевания или иммунодефицита, включающее введение субъекту, нуждающемуся в этом, терапевтически эффективного количества клеток с редактированным геномом, предусмотренных в настоящем документе.
Согласно одному варианту реализации способ лечения рака, РТПХ, инфекционного заболевания, аутоиммунного заболевания, воспалительного заболевания или иммунодефицита у субъекта, нуждающегося в этом, включает введение эффективного количества, например, терапевтически эффективного количества композиции, содержащей клетки с редактированным геномом, предусмотренные в настоящем документе. Количество и частота введения будут определяться такими факторами как состояние пациента, а также тип и степень тяжести заболевания пациента, несмотря на то, что соответствующие дозировки могут быть определены в клинических исследованиях.
В одном иллюстративном варианте реализации эффективное количество клеток с редактированным геномом, обеспеченных субъекту, составляет по меньшей мере 2×106 клеток/кг, по меньшей мере 3×106 клеток/кг, по меньшей мере 4×106 клеток/кг, по меньшей мере 5×106 клеток/кг, по меньшей мере 6×106 клеток/кг, по меньшей мере 7×106 клеток/кг, по меньшей мере 8×106 клеток/кг, по меньшей мере 9×106 клеток/кг или по меньшей мере 10×106 клеток/кг или более клеток/кг, включая все промежуточные дозы клеток.
В другом иллюстративном варианте реализации эффективное количество клеток с редактированным геномом, обеспеченных субъекту, составляет приблизительно 2×106 клеток/кг, приблизительно 3×106 клеток/кг, приблизительно 4×106 клеток/кг, приблизительно 5×106 клеток/кг, приблизительно 6×106 клеток/кг, приблизительно 7×106 клеток/кг, приблизительно 8×106 клеток/кг, приблизительно 9×106 клеток/кг или приблизительно 10×106 клеток/кг или более клеток/кг, включая все промежуточные дозы клеток.
В другом иллюстративном варианте реализации эффективное количество клеток с редактированным геномом, обеспеченных субъекту, составляет от приблизительно 2×106 клеток/кг до приблизительно 10×106 клеток/кг, от приблизительно 3×106 клеток/кг до приблизительно 10×106 клеток/кг, от приблизительно 4×106 клеток/кг до приблизительно 10×106 клеток/кг, от приблизительно 5×106 клеток/кг до приблизительно 10×106 клеток/кг, от 2×106 клеток/кг до приблизительно 6×106 клеток/кг, от 2×106 клеток/кг до приблизительно 7×106 клеток/кг, от 2×106 клеток/кг до приблизительно 8×106 клеток/кг, от 3×106 клеток/кг до приблизительно 6×106 клеток/кг, от 3×106 клеток/кг до приблизительно 7×106 клеток/кг, от 3×106 клеток/кг до приблизительно 8×106 клеток/кг, от 4×106 клеток/кг до приблизительно 6×106 клеток/кг, от 4×106 клеток/кг до приблизительно 7×106 клеток/кг, от 4×106 клеток/кг до приблизительно 8×106 клеток/кг, от 5×106 клеток/кг до приблизительно 6×106 клеток/кг, от 5×106 клеток/кг до приблизительно 7×106 клеток/кг, от 5×106 клеток/кг до приблизительно 8×106 клеток/кг или от 6×106 клеток/кг до приблизительно 8×106 клеток/кг, включая все промежуточные дозы клеток.
Обычный специалист в данной области техники поймет, что для осуществления желаемой терапии может потребоваться несколько введений композиций, предусмотренных в конкретных вариантах реализации. Например, композицию можно вводить 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 или более раз в течение 1 недели, 2 недель, 3 недель, 1 месяца, 2 месяцев, 3 месяцев, 4 месяцев, 5 месяцев, 6 месяцев, 1 года, 2 лет, 5 лет, 10 лет или более.
Согласно определенным вариантам реализации настоящего изобретения желательным может быть введение активированных T-клеток субъекту с последующим повторным взятием крови (или проведением афереза), активацией T-клеток из этой крови и повторным введением пациенту этих активированных и размноженных T-клеток. Этот способ можно осуществлять несколько раз каждые несколько недель. Согласно определенным вариантам реализации настоящего изобретения T-клетки могут быть активированы из образцов крови объемом от 10 до 400 см3. Согласно определенным вариантам реализации настоящего изобретения T-клетки активируют из образцов крови объемом 20 см3, 30 см3, 40 см3, 50 см3, 60 см3, 70 см3, 80 см3, 90 см3, 100 см3, 150 см3, 250 см3, 300 см3, 350 см3 или 400 см3 или более. Безотносительно к какой-либо теории, этот протокол многократного взятия крови/многократной повторной инфузии можно применять для отбора определенных популяций T-клеток.
Введение композиций, предусмотренных в конкретных вариантах реализации, можно осуществлять любым удобным способом, включая аэрозольную ингаляцию, инъекцию, прием внутрь, переливание, имплантацию или трансплантацию. Согласно предпочтительному варианту реализации настоящего изобретения композиции вводят парентерально. В настоящем документе выражения «парентеральное введение» и «введенный парентерально» относятся к способам введения, отличным от энтерального и местного введения, обычно путем инъекции, и включают, но не ограничиваются указанными, внутрисосудистую, внутривенную, внутримышечную, внутриартериальную, внутритекальную, внутрикапсулярную, внутриорбитальную, внутриопухолевую, внутрисердечную, внутрикожную, внутрибрюшинную, транстрахеальную, подкожную, подкутикулярную, внутрисуставную, субкапсулярную, субарахноидальную, внутриспинальную и внутристернальную инъекцию и инфузию. Согласно одному варианту реализации композиции, предусмотренные в настоящем документе, вводят субъекту путем прямой инъекции в опухоль, лимфатический узел или очаг инфекции.
Согласно одному варианту реализации способ лечения субъекта, у которого диагностирован рак, включает извлечение иммунных эффекторных клеток у субъекта, редактирование генома указанных иммунных эффекторных клеток, получение популяции иммунных эффекторных клеток с редактированным геномом и введение популяции иммунных эффекторных клеток с редактированным геномом этому же субъекту. Согласно предпочтительному варианту реализации настоящего изобретения иммунные эффекторные клетки содержат T-клетки.
Способы введения клеточных композиций, предусмотренных в конкретных вариантах реализации, включают любой способ, который эффективен для повторного введения иммунных эффекторных клеток с редактированным геномом ex vivo или повторного введения предшественников иммунных эффекторных клеток с редактированным геномом, которые при введении субъекту дифференцируются в зрелые иммунные эффекторные клетки. Один способ включает редактирование генома T-клеток периферической крови ex vivo и возвращение трансдуцированных клеток субъекту.
Все публикации, заявки на патенты и выданные патенты, цитированные в этом описании, включены в настоящий документ посредством ссылки, как если бы каждая отдельная публикация, заявка на патент или выданный патент были специально и индивидуально указаны для включения посредством ссылки.
Несмотря на то, что представленные выше варианты реализации были достаточно подробно описаны с помощью иллюстрации и примера для ясности понимания, обычный специалист в данной области техники легко поймет с учетом идей, предусмотренных в настоящем документе, что определенные изменения и модификации могут быть сделаны в них, не отступая от сущности или объема прилагаемой формулы изобретения. Следующие примеры приведены только для иллюстрации и не являются ограничивающими. Специалисты в данной области техники легко установят различные некритические параметры, которые могут быть изменены или модифицированы для получения по существу аналогичных результатов.
ПРИМЕРЫ
ПРИМЕР 1
ПЕРЕПРОГРАММИРОВАНИЕ I-ONUI ДЛЯ РАЗРУШЕНИЯ ЧЕЛОВЕЧЕСКОГО ПРОТООНКОГЕНА B (CBLB) ЛИМФОМЫ B-КЛЕТОЧНОЙ ЛИНИИ ДИФФЕРЕНЦИРОВКИ КАСИТАС (CBL)
I-OnuI перепрограммировали для нацеливания на экзон 6 гена CBLB (Фигура 1) путем конструирования модульных библиотек, содержащих вариабельные аминокислотные остатки в поверхности распознавания ДНК. Для конструирования вариантов вырожденные кодоны встраивали в ДНК-связывающие домены I-OnuI с применением олигонуклеотидов. Олигонуклеотиды, кодирующие вырожденные кодоны, использовали в качестве матриц для ПЦР, чтобы получить библиотеки вариантов с помощью рекомбинации разрыва в штамме дрожжей S. cerevisiae. Каждая библиотека вариантов охватывала как N-концевой, так и C-концевой домен распознавания ДНК I-OnuI и содержала ~107-108 уникальных трансформантов. Полученные библиотеки для поверхностного дисплея подвергали скринингу с помощью проточной цитометрии для определения активности расщепления против сайтов-мишеней, содержащих «полусайты» соответствующих доменов (SEQ ID NO: 23-29), как показано на Фигуре 2.
Дрожжи, экспонирующие HE I-OnuI с перепрограммированным N- и C-концевым доменом, очищали и экстрагировали плазмидную ДНК. Реакции ПЦР выполняли для амплификации перепрограммированных доменов, которые впоследствии гибридизовали и трансформировали в S. cerevisiae для создания библиотеки комбинаций перепрограммированных доменов. Полностью перепрограммированные варианты I-OnuI, которые распознают полный сайт-мишень (SEQ ID NO: 20), присутствующий в экзоне 6 гена CBLB, выявляли из этой библиотеки и очищали.
ПРИМЕР 2
ПЕРЕПРОГРАММИРОВАННЫЕ ХОУМИНГ-ЭНДОНУКЛЕАЗЫ I-ONUI, КОТОРЫЕ НАЦЕЛЕНЫ НА ЭКЗОН 6 ГЕНА CBLB
Активность перепрограммированных HE I-OnuI, которые нацелены на экзон 6 гена CBLB, измеряли с применением включенной в хромосому флуоресцентной репортерной системы (Certo et. al., 2011). Полностью перепрограммированные HE I-OnuI, которые связывают и расщепляют последовательность-мишень CBLB (SEQ ID NO: 20), клонировали в плазмиды для экспрессии у млекопитающих и затем индивидуально трансфецировали в клеточную линию фибробластов HEK 293T, которая содержала последовательность-мишень CBLB, расположенную в 5'-направлении относительно гена, кодирующего флуоресцентный белок iRFP, который находился вне рамки считывания. Расщепление внедренного сайта-мишени под действием HE и накопление вставок/делеций после восстановления ДНК за счет негомологичного соединения концов (NHEJ) приводит к получению приблизительно одного из трех восстановленных локусов, в котором флуоресцентный репортерный ген вновь помещен в рамку считывания. Поэтому процентное содержание клеток HEK 293T с флуоресценцией iRFP используют для регистрации активности эндонуклеазы на хромосомно внедренной последовательности-мишени. Полностью перепрограммированные HE I-OnuI, которые связывают и расщепляют последовательность-мишень CBLB, проявили высокую частоту экспрессии iRFP в окружении клеточной хромосомы, это указывает на то, что варианты HE обладали желательным свойством высокой эффективности редактирования в окружении клеточной хромосомы. Фигура 3
Аффинность варианта HE CBLB.E3 в отношении сайта-мишени для экзона 6 была в субнаномолярном диапазоне. Фигура 4. На Фигуре 5 показаны относительные выравнивания типичных вариантов I-OnuI, а также информация о положении остатков, составляющих поверхность распознавания ДНК.
ПРИМЕР 3
ХАРАКТЕРИСТИКА MEGATAL, КОТОРЫЕ НАЦЕЛЕНЫ НА ЭКЗОН 6 CBLB
Варианты HE CBLB.E3, CBLB.A8, CBLB.B5, CBLB.D2 и CBLB.F6 получали в формате megaTAL (SEQ ID NO: 13-19) путем добавления массива из 11,5 звена TAL, соответствующего сайту-мишени из 12 пар оснований для массива TAL (SEQ ID NO: 21), к N-концу домена мегануклеазы (как описано в Boissel et al., 2013). Фигура 6. Последовательность сайта-мишени megaTAL приведена в SEQ ID NO: 22.
Эффективность редактирования megaTAL оценивали путем предварительной стимуляции первичных человеческих T-клеток антителами к CD3 и к CD28 в средах, дополненных цитокинами, в течение 48-72 часов, и затем электропорации клеток транскрибированной in vitro (IVT), кэпированной и полиаденилированной иРНК, кодирующей megaTAL. Помимо этого IVT-иРНК, кодирующую 3'-5'-экзонуклеазу Trex2, добавляли для усиления обработки разрыва с помощью негомологичного соединения концов (NHEJ) (см. Certo et al., 2012).
В одной серии экспериментов клетки культивировали в течение 7 дней после электропорации (10-дневная общая культура), эффективность редактирования измеряли с помощью выделения геномной ДНК на 5, 7 и 10 дни культивирования и секвенирования по сайту-мишени CBLB, чтобы измерить частоту вставок/делеций. Фигура 7. Уровни белка CBLB измеряли с помощью внутриклеточного FACS-анализа CD3+ T-клеток. Фигура 8.
T-клетки или CAR T-клетки, редактированные с помощью CBLB megaTAL, проявили повышенные уровни выработки цитокинов при стимуляции агонистическими антителами к CD3 или CAR-специфическим антигеном, соответственно, по сравнению с нередактированными T-клетками и CAR T-клетками, которые не содержали активную megaTAL (электропорация неактивной megaTAL) или вообще не содержали megaTAL (без электропорации). Фигура 9.
В другой серии экспериментов клетки культивировали в течение 7-10 дней в средах, дополненных цитокинами. На 7 день после электропорации выделяли геномную ДНК с последующей ПЦР-амплификацией сайта-мишени экзона 6 CBLB. Частоту вставок/делеций измеряли с помощью отслеживания вставок/делеций методом DEcomposition (TIDE, см. Brinkman et al., 2014). На Фигуре 10 показан репрезентативный анализ TIDE.
ПРИМЕР 4
ИЛЛЮСТРАТИВНОЕ НАПРАВЛЯЕМОЕ ГОМОЛОГИЕЙ ВОССТАНОВЛЕНИЕ С ПРИМЕНЕНИЕМ MEGATAL CBLB
Разрабатывали и конструировали плазмиду на основе аденоассоциированного вируса (AAV), содержащую трансгенные кассеты, содержащие промотор с энхансером вируса миелопролиферативной саркомы, с удаленным участком отрицательного контроля и с сайтом связывания праймера, замещенным на последовательность из dl587rev (MND), функционально соединенный с трансгеном, кодирующим флуоресцентный белок (GFP), посттранскрипционный регуляторный элемент вируса гепатита сурка (WPRE) и сигнал позднего полиаденилирования SV40 (Фигура 11, AAV-донор). Целостность AAV-плазмиды подтверждали с помощью расщепления XmaI и секвенирования. Трансгенную кассету помещали между двумя гомологичными областями по 0,3 т.п.о., фланкирующими сайт расщепления CBLB megaTAL (SEQ ID NO: 20, 22). Ни одна гомологичная область не содержала полный сайт-мишень megaTAL.
Рекомбинантный AAV (rAAV) получали путем временной котрансфекции клеток HEK 293T одной или более плазмидами, обеспечивающими необходимые репликационные, капсидные и вспомогательные аденовирусные элементы. Рекомбинантный AAV очищали от котрансфецированной клеточной культуры HEK 293T с применением ультрацентрифугирования в градиенте на основе йодиксанола.
megaTAL-индуцированную гомологичную рекомбинацию оценивали в первичных человеческих T-клетках, активированных CD3 и CD28 и культивированных в полной среде, дополненной ИЛ-2. Через 3 дня T-клетки промывали и подвергали электропорации транскрибированной в условиях in vitro иРНК, кодирующей megaTAL CBLB.A8 (SEQ ID NO: 32), и затем трансдуцировали очищенным рекомбинантным AAV, кодирующим донорную ДНК-матрицу для восстановления, содержащую описанную выше трансгенную кассету MND-GFP. Проточную цитометрию использовали в нескольких временных точках для измерения частоты T-клеток, экспрессирующих флуоресцентный белок, и для дифференциации временной экспрессии флуоресцентного белка из неинтегрированного нацеливающего rAAV-вектора.
Длительную экспрессию трансгена наблюдали в 21-24% T-клеток, которые были обработаны как megaTAL, так и нацеливающим rAAV-вектором. Напротив, необработанные контрольные образцы не экспрессировали детектируемые уровни флуоресцентного белка. Результаты подтверждали в экспериментах, выполненных на T-клетках, выделенных от независимых доноров.
ПРИМЕР 5
НАПРАВЛЕННЫЕ ПРОТИВ РЭФР CAR-T-КЛЕТКИ С РЕДАКТИРОВАННЫМ CBL-B ПРОЯВЛЯЮТ ПОВЫШЕННУЮ ПРОТИВООПУХОЛЕВУЮ ЭФФЕКТИВНОСТЬ В МОДЕЛИ ОПУХОЛИ IN VIVO
Направленные против РЭФР CAR-T-клетки применяли для проверки эффекта редактирования гена CBLB на фармакологию CAR-T-клеток в модели опухоли A549 у мышей в условиях in vivo.
Человеческие мононуклеарные клетки периферической крови (МКПК) (1×106 клеток/мл) активировали растворимыми антителами к CD3 и к CD28 на 0 день. После 24-часовой инкубации 1×106 клеток трансдуцировали лентивирусом, несущим CAR против РЭФР. Через семьдесят два часа после стимуляции антителами трансдуцированные МКПК или нетрансдуцированные контрольные МКПК подвергали электропорации (Lonza Nucleofector) транскрибированной в условиях in vitro иРНК, кодирующей CBLB megaTAL.E3 (SEQ ID NO: 31), или без нее. Электропорированные клетки культивировали в среде, содержащей ИЛ-2, в течение 10 дней. После культивирования 71% T-клеток были CBLB-отрицательными, согласно результатам оценки с помощью анализа вставок/делеций методом секвенирования следующего поколения (NGS).
Мышам вводили подкожно линию клеток эпителиальной карциномы (A549), и рост опухоли контролировали, используя измерения штангенциркулем. Мышам вводили путем инфузии эквивалентные дозы CAR+ T-клеток (3×107 CAR+ T-клеток), когда средний объем опухоли достигал 120 мм3. Обработанные наполнителем T-клетки и нетрансдуцированные контрольные T-клетки оказывали минимальное влияние на рост опухоли. Животные, обработанные направленными против РЭФР CAR-T-клетками без редактирования CBLB, были способны к задержке роста опухоли по сравнению с контрольными группами; две из семи мышей проявили полный контроль опухоли. Напротив, все семь мышей, получавших направленные против РЭФР CAR-T-клетки с редактированным CBLB, полностью устраняли опухоли A549 и не имели опухолей в течение всего периода исследования (35 дней после введения CAR-T-клеток).
В целом термины, используемые в нижеследующей формуле изобретения, не должны толковаться как ограничивающие формулу изобретения конкретными вариантами реализации, раскрытыми в описании и формуле изобретения, но должны толковаться как включающие все возможные варианты реализации вместе с полным объемом эквивалентов, к которым относится формула изобретения. Соответственно, формула изобретения не ограничивается настоящим раскрытием.
--->
Перечень последовательностей
<110> БЛУБЁРД БИО, ИНК.
ДЖАРДЖУР, Джордан
ХЕЙВЕНС, Кайл
КРОСТАГ, Энн-Рэйчел
<120> ВАРИАНТЫ, КОМПОЗИЦИИ И СПОСОБЫ ПРИМЕНЕНИЯ ЭНДОНУКЛЕАЗЫ CBLB
<130> BLBD-087/02WO 315698-2662
<150> US 62/567,417
<151> 2017-10-30
<150> US 62/511,194
<151> 2017-05-25
<160> 84
<170> PatentIn version 3.5
<210> 1
<211> 303
<212> PRT
<213> Ophiostoma novo-ulmi
<400> 1
Met Ala Tyr Met Ser Arg Arg Glu Ser Ile Asn Pro Trp Ile Leu Thr
1 5 10 15
Gly Phe Ala Asp Ala Glu Gly Ser Phe Leu Leu Arg Ile Arg Asn Asn
20 25 30
Asn Lys Ser Ser Val Gly Tyr Ser Thr Glu Leu Gly Phe Gln Ile Thr
35 40 45
Leu His Asn Lys Asp Lys Ser Ile Leu Glu Asn Ile Gln Ser Thr Trp
50 55 60
Lys Val Gly Val Ile Ala Asn Ser Gly Asp Asn Ala Val Ser Leu Lys
65 70 75 80
Val Thr Arg Phe Glu Asp Leu Lys Val Ile Ile Asp His Phe Glu Lys
85 90 95
Tyr Pro Leu Ile Thr Gln Lys Leu Gly Asp Tyr Met Leu Phe Lys Gln
100 105 110
Ala Phe Cys Val Met Glu Asn Lys Glu His Leu Lys Ile Asn Gly Ile
115 120 125
Lys Glu Leu Val Arg Ile Lys Ala Lys Leu Asn Trp Gly Leu Thr Asp
130 135 140
Glu Leu Lys Lys Ala Phe Pro Glu Ile Ile Ser Lys Glu Arg Ser Leu
145 150 155 160
Ile Asn Lys Asn Ile Pro Asn Phe Lys Trp Leu Ala Gly Phe Thr Ser
165 170 175
Gly Glu Gly Cys Phe Phe Val Asn Leu Ile Lys Ser Lys Ser Lys Leu
180 185 190
Gly Val Gln Val Gln Leu Val Phe Ser Ile Thr Gln His Ile Lys Asp
195 200 205
Lys Asn Leu Met Asn Ser Leu Ile Thr Tyr Leu Gly Cys Gly Tyr Ile
210 215 220
Lys Glu Lys Asn Lys Ser Glu Phe Ser Trp Leu Asp Phe Val Val Thr
225 230 235 240
Lys Phe Ser Asp Ile Asn Asp Lys Ile Ile Pro Val Phe Gln Glu Asn
245 250 255
Thr Leu Ile Gly Val Lys Leu Glu Asp Phe Glu Asp Trp Cys Lys Val
260 265 270
Ala Lys Leu Ile Glu Glu Lys Lys His Leu Thr Glu Ser Gly Leu Asp
275 280 285
Glu Ile Lys Lys Ile Lys Leu Asn Met Asn Lys Gly Arg Val Phe
290 295 300
<210> 2
<211> 303
<212> PRT
<213> Ophiostoma novo-ulmi
<400> 2
Met Ala Tyr Met Ser Arg Arg Glu Ser Ile Asn Pro Trp Ile Leu Thr
1 5 10 15
Gly Phe Ala Asp Ala Glu Gly Ser Phe Leu Leu Arg Ile Arg Asn Asn
20 25 30
Asn Lys Ser Ser Val Gly Tyr Ser Thr Glu Leu Gly Phe Gln Ile Thr
35 40 45
Leu His Asn Lys Asp Lys Ser Ile Leu Glu Asn Ile Gln Ser Thr Trp
50 55 60
Lys Val Gly Val Ile Ala Asn Ser Gly Asp Asn Ala Val Ser Leu Lys
65 70 75 80
Val Thr Arg Phe Glu Asp Leu Lys Val Ile Ile Asp His Phe Glu Lys
85 90 95
Tyr Pro Leu Ile Thr Gln Lys Leu Gly Asp Tyr Lys Leu Phe Lys Gln
100 105 110
Ala Phe Ser Val Met Glu Asn Lys Glu His Leu Lys Glu Asn Gly Ile
115 120 125
Lys Glu Leu Val Arg Ile Lys Ala Lys Leu Asn Trp Gly Leu Thr Asp
130 135 140
Glu Leu Lys Lys Ala Phe Pro Glu Asn Ile Ser Lys Glu Arg Ser Leu
145 150 155 160
Ile Asn Lys Asn Ile Pro Asn Phe Lys Trp Leu Ala Gly Phe Thr Ser
165 170 175
Gly Glu Gly Cys Phe Phe Val Asn Leu Ile Lys Ser Lys Ser Lys Leu
180 185 190
Gly Val Gln Val Gln Leu Val Phe Ser Ile Thr Gln His Ile Lys Asp
195 200 205
Lys Asn Leu Met Asn Ser Leu Ile Thr Tyr Leu Gly Cys Gly Tyr Ile
210 215 220
Lys Glu Lys Asn Lys Ser Glu Phe Ser Trp Leu Asp Phe Val Val Thr
225 230 235 240
Lys Phe Ser Asp Ile Asn Asp Lys Ile Ile Pro Val Phe Gln Glu Asn
245 250 255
Thr Leu Ile Gly Val Lys Leu Glu Asp Phe Glu Asp Trp Cys Lys Val
260 265 270
Ala Lys Leu Ile Glu Glu Lys Lys His Leu Thr Glu Ser Gly Leu Asp
275 280 285
Glu Ile Lys Lys Ile Lys Leu Asn Met Asn Lys Gly Arg Val Phe
290 295 300
<210> 3
<211> 303
<212> PRT
<213> Ophiostoma novo-ulmi
<220>
<221> MOD_RES
<222> (1)..(3)
<223> Любая аминокислота или отсутствует
<400> 3
Xaa Xaa Xaa Met Ser Arg Arg Glu Ser Ile Asn Pro Trp Ile Leu Thr
1 5 10 15
Gly Phe Ala Asp Ala Glu Gly Ser Phe Leu Leu Arg Ile Arg Asn Asn
20 25 30
Asn Lys Ser Ser Val Gly Tyr Ser Thr Glu Leu Gly Phe Gln Ile Thr
35 40 45
Leu His Asn Lys Asp Lys Ser Ile Leu Glu Asn Ile Gln Ser Thr Trp
50 55 60
Lys Val Gly Val Ile Ala Asn Ser Gly Asp Asn Ala Val Ser Leu Lys
65 70 75 80
Val Thr Arg Phe Glu Asp Leu Lys Val Ile Ile Asp His Phe Glu Lys
85 90 95
Tyr Pro Leu Ile Thr Gln Lys Leu Gly Asp Tyr Lys Leu Phe Lys Gln
100 105 110
Ala Phe Ser Val Met Glu Asn Lys Glu His Leu Lys Glu Asn Gly Ile
115 120 125
Lys Glu Leu Val Arg Ile Lys Ala Lys Leu Asn Trp Gly Leu Thr Asp
130 135 140
Glu Leu Lys Lys Ala Phe Pro Glu Asn Ile Ser Lys Glu Arg Ser Leu
145 150 155 160
Ile Asn Lys Asn Ile Pro Asn Phe Lys Trp Leu Ala Gly Phe Thr Ser
165 170 175
Gly Glu Gly Cys Phe Phe Val Asn Leu Ile Lys Ser Lys Ser Lys Leu
180 185 190
Gly Val Gln Val Gln Leu Val Phe Ser Ile Thr Gln His Ile Lys Asp
195 200 205
Lys Asn Leu Met Asn Ser Leu Ile Thr Tyr Leu Gly Cys Gly Tyr Ile
210 215 220
Lys Glu Lys Asn Lys Ser Glu Phe Ser Trp Leu Asp Phe Val Val Thr
225 230 235 240
Lys Phe Ser Asp Ile Asn Asp Lys Ile Ile Pro Val Phe Gln Glu Asn
245 250 255
Thr Leu Ile Gly Val Lys Leu Glu Asp Phe Glu Asp Trp Cys Lys Val
260 265 270
Ala Lys Leu Ile Glu Glu Lys Lys His Leu Thr Glu Ser Gly Leu Asp
275 280 285
Glu Ile Lys Lys Ile Lys Leu Asn Met Asn Lys Gly Arg Val Phe
290 295 300
<210> 4
<211> 303
<212> PRT
<213> Ophiostoma novo-ulmi
<220>
<221> MOD_RES
<222> (1)..(4)
<223> Любая аминокислота или отсутствует
<220>
<221> MOD_RES
<222> (302)..(303)
<223> Любая аминокислота или отсутствует
<400> 4
Xaa Xaa Xaa Xaa Ser Arg Arg Glu Ser Ile Asn Pro Trp Ile Leu Thr
1 5 10 15
Gly Phe Ala Asp Ala Glu Gly Ser Phe Leu Leu Arg Ile Arg Asn Asn
20 25 30
Asn Lys Ser Ser Val Gly Tyr Ser Thr Glu Leu Gly Phe Gln Ile Thr
35 40 45
Leu His Asn Lys Asp Lys Ser Ile Leu Glu Asn Ile Gln Ser Thr Trp
50 55 60
Lys Val Gly Val Ile Ala Asn Ser Gly Asp Asn Ala Val Ser Leu Lys
65 70 75 80
Val Thr Arg Phe Glu Asp Leu Lys Val Ile Ile Asp His Phe Glu Lys
85 90 95
Tyr Pro Leu Ile Thr Gln Lys Leu Gly Asp Tyr Lys Leu Phe Lys Gln
100 105 110
Ala Phe Ser Val Met Glu Asn Lys Glu His Leu Lys Glu Asn Gly Ile
115 120 125
Lys Glu Leu Val Arg Ile Lys Ala Lys Leu Asn Trp Gly Leu Thr Asp
130 135 140
Glu Leu Lys Lys Ala Phe Pro Glu Asn Ile Ser Lys Glu Arg Ser Leu
145 150 155 160
Ile Asn Lys Asn Ile Pro Asn Phe Lys Trp Leu Ala Gly Phe Thr Ser
165 170 175
Gly Glu Gly Cys Phe Phe Val Asn Leu Ile Lys Ser Lys Ser Lys Leu
180 185 190
Gly Val Gln Val Gln Leu Val Phe Ser Ile Thr Gln His Ile Lys Asp
195 200 205
Lys Asn Leu Met Asn Ser Leu Ile Thr Tyr Leu Gly Cys Gly Tyr Ile
210 215 220
Lys Glu Lys Asn Lys Ser Glu Phe Ser Trp Leu Asp Phe Val Val Thr
225 230 235 240
Lys Phe Ser Asp Ile Asn Asp Lys Ile Ile Pro Val Phe Gln Glu Asn
245 250 255
Thr Leu Ile Gly Val Lys Leu Glu Asp Phe Glu Asp Trp Cys Lys Val
260 265 270
Ala Lys Leu Ile Glu Glu Lys Lys His Leu Thr Glu Ser Gly Leu Asp
275 280 285
Glu Ile Lys Lys Ile Lys Leu Asn Met Asn Lys Gly Arg Xaa Xaa
290 295 300
<210> 5
<211> 303
<212> PRT
<213> Ophiostoma novo-ulmi
<220>
<221> MOD_RES
<222> (1)..(8)
<223> Любая аминокислота или отсутствует
<220>
<221> MOD_RES
<222> (302)..(303)
<223> Любая аминокислота или отсутствует
<400> 5
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Ser Ile Asn Pro Trp Ile Leu Thr
1 5 10 15
Gly Phe Ala Asp Ala Glu Gly Ser Phe Leu Leu Arg Ile Arg Asn Asn
20 25 30
Asn Lys Ser Ser Val Gly Tyr Ser Thr Glu Leu Gly Phe Gln Ile Thr
35 40 45
Leu His Asn Lys Asp Lys Ser Ile Leu Glu Asn Ile Gln Ser Thr Trp
50 55 60
Lys Val Gly Val Ile Ala Asn Ser Gly Asp Asn Ala Val Ser Leu Lys
65 70 75 80
Val Thr Arg Phe Glu Asp Leu Lys Val Ile Ile Asp His Phe Glu Lys
85 90 95
Tyr Pro Leu Ile Thr Gln Lys Leu Gly Asp Tyr Lys Leu Phe Lys Gln
100 105 110
Ala Phe Ser Val Met Glu Asn Lys Glu His Leu Lys Glu Asn Gly Ile
115 120 125
Lys Glu Leu Val Arg Ile Lys Ala Lys Leu Asn Trp Gly Leu Thr Asp
130 135 140
Glu Leu Lys Lys Ala Phe Pro Glu Asn Ile Ser Lys Glu Arg Ser Leu
145 150 155 160
Ile Asn Lys Asn Ile Pro Asn Phe Lys Trp Leu Ala Gly Phe Thr Ser
165 170 175
Gly Glu Gly Cys Phe Phe Val Asn Leu Ile Lys Ser Lys Ser Lys Leu
180 185 190
Gly Val Gln Val Gln Leu Val Phe Ser Ile Thr Gln His Ile Lys Asp
195 200 205
Lys Asn Leu Met Asn Ser Leu Ile Thr Tyr Leu Gly Cys Gly Tyr Ile
210 215 220
Lys Glu Lys Asn Lys Ser Glu Phe Ser Trp Leu Asp Phe Val Val Thr
225 230 235 240
Lys Phe Ser Asp Ile Asn Asp Lys Ile Ile Pro Val Phe Gln Glu Asn
245 250 255
Thr Leu Ile Gly Val Lys Leu Glu Asp Phe Glu Asp Trp Cys Lys Val
260 265 270
Ala Lys Leu Ile Glu Glu Lys Lys His Leu Thr Glu Ser Gly Leu Asp
275 280 285
Glu Ile Lys Lys Ile Lys Leu Asn Met Asn Lys Gly Arg Xaa Xaa
290 295 300
<210> 6
<211> 306
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтезированный вариант I-OnuI CBLB.E3
<220>
<221> MOD_RES
<222> (1)..(8)
<223> Любая аминокислота или отсутствует
<220>
<221> MOD_RES
<222> (302)..(306)
<223> Любая аминокислота или отсутствует
<400> 6
Xaa Xaa Xaa Xaa Ser Arg Arg Glu Ser Ile Asn Pro Trp Ile Leu Thr
1 5 10 15
Gly Phe Ala Asp Ala Glu Gly Cys Phe Arg Leu Asp Ile Arg Asn Ala
20 25 30
Asn Asp Leu Arg Ala Gly Tyr Arg Thr Arg Leu Ala Phe Glu Ile Val
35 40 45
Leu His Asn Lys Asp Lys Ser Ile Leu Glu Asn Ile Gln Ser Thr Trp
50 55 60
Lys Val Gly Thr Ile Tyr Asn Ala Gly Asp Asn Ala Val Arg Leu Gln
65 70 75 80
Val Thr Arg Phe Glu Asp Leu Lys Val Ile Ile Asp His Phe Glu Lys
85 90 95
Tyr Pro Leu Ile Thr Gln Lys Leu Gly Asp Tyr Lys Leu Phe Lys Gln
100 105 110
Ala Phe Ser Val Met Glu Asn Lys Glu His Leu Lys Glu Asn Gly Ile
115 120 125
Lys Glu Leu Val Arg Ile Lys Ala Lys Met Asn Trp Gly Leu Asn Asp
130 135 140
Glu Leu Lys Lys Ala Phe Pro Glu Asn Ile Ser Lys Glu Arg Ser Leu
145 150 155 160
Ile Asn Lys Asn Ile Pro Asn Leu Lys Trp Leu Ala Gly Phe Thr Ser
165 170 175
Gly Asp Gly Ser Phe Val Val Glu Leu Lys Lys Arg Arg Ser Pro Val
180 185 190
Lys Val Gly Val Arg Leu Arg Phe Ser Ile Thr Gln His Ile Arg Asp
195 200 205
Lys Asn Leu Met Asn Ser Leu Ile Thr Tyr Leu Gly Cys Gly Arg Ile
210 215 220
Val Glu Asn Asn Lys Ser Glu His Ser Trp Leu Glu Phe Ile Val Thr
225 230 235 240
Lys Phe Ser Asp Ile Asn Asp Lys Ile Ile Pro Val Phe Gln Glu Asn
245 250 255
Thr Leu Ile Gly Val Lys Leu Glu Asp Phe Glu Asp Trp Cys Lys Val
260 265 270
Ala Lys Leu Ile Glu Glu Lys Lys His Leu Thr Glu Ser Gly Leu Asp
275 280 285
Glu Ile Lys Lys Ile Lys Leu Asn Met Asn Lys Gly Arg Xaa Xaa Xaa
290 295 300
Xaa Xaa
305
<210> 7
<211> 306
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтезированный вариант I-OnuI CBLB.F6
<220>
<221> MOD_RES
<222> (1)..(8)
<223> Любая аминокислота или отсутствует
<220>
<221> MOD_RES
<222> (302)..(306)
<223> Любая аминокислота или отсутствует
<400> 7
Xaa Xaa Xaa Xaa Ser Arg Arg Glu Ser Ile Asn Pro Trp Ile Leu Thr
1 5 10 15
Gly Phe Ala Asp Ala Glu Gly Cys Phe Arg Leu Asp Ile Arg Asn Ala
20 25 30
Asn Asp Leu Arg Ala Gly Tyr Arg Thr Arg Leu Ala Phe Glu Ile Val
35 40 45
Leu His Asn Lys Asp Lys Ser Ile Leu Glu Asn Ile Gln Ser Thr Trp
50 55 60
Lys Val Gly Thr Ile Tyr Asn Ala Gly Asp Asn Ala Val Arg Leu Gln
65 70 75 80
Val Thr Arg Phe Glu Asp Leu Lys Val Ile Ile Asp His Phe Glu Lys
85 90 95
Tyr Pro Leu Ile Thr Gln Lys Leu Gly Asp Tyr Lys Leu Phe Lys Gln
100 105 110
Ala Phe Ser Val Met Glu Asn Lys Glu His Leu Lys Glu Asn Gly Ile
115 120 125
Lys Glu Leu Val Arg Ile Lys Ala Lys Met Asn Trp Gly Leu Asn Asp
130 135 140
Glu Leu Lys Lys Ala Phe Pro Glu Asn Ile Ser Lys Glu Arg Pro Leu
145 150 155 160
Ile Asn Lys Asn Ile Pro Asn Leu Lys Trp Leu Ala Gly Phe Thr Ser
165 170 175
Gly Asp Gly Ser Phe Met Val Glu Leu Met Lys Asn Lys Asn Asn Val
180 185 190
Ile Val Arg Val Arg Leu Arg Phe Ser Ile Ser Gln His Ile Arg Asp
195 200 205
Lys Asn Leu Met Asn Ser Leu Ile Thr Tyr Leu Gly Cys Gly Arg Ile
210 215 220
Val Glu Asn Asn Lys Ser Glu His Ser Trp Leu Glu Phe Ile Val Thr
225 230 235 240
Lys Phe Ser Asp Ile Asn Asp Lys Ile Ile Pro Val Phe Gln Glu Asn
245 250 255
Thr Leu Ile Gly Val Lys Leu Glu Asp Phe Glu Asp Trp Cys Lys Val
260 265 270
Ala Lys Leu Ile Glu Glu Lys Lys His Leu Thr Glu Ser Gly Leu Asp
275 280 285
Glu Ile Lys Lys Ile Lys Leu Asn Met Asn Lys Gly Arg Xaa Xaa Xaa
290 295 300
Xaa Xaa
305
<210> 8
<211> 306
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтезированный вариант I-OnuI CBLB.E6
<220>
<221> MOD_RES
<222> (1)..(8)
<223> Любая аминокислота или отсутствует
<220>
<221> MOD_RES
<222> (302)..(306)
<223> Любая аминокислота или отсутствует
<400> 8
Xaa Xaa Xaa Xaa Ser Arg Arg Glu Ser Ile Asn Pro Trp Ile Leu Thr
1 5 10 15
Gly Phe Ala Asp Ala Glu Gly Cys Phe Arg Leu Asp Ile Arg Asn Ala
20 25 30
Asn Asp Leu Arg Ala Gly Tyr Arg Thr Arg Leu Ser Phe Glu Ile Ser
35 40 45
Leu His Asn Lys Asp Lys Ser Ile Leu Glu Asn Ile Gln Ser Thr Trp
50 55 60
Lys Val Gly Thr Ile Tyr Asn Ala Gly Asp Asn Ala Val Arg Leu Gln
65 70 75 80
Val Thr Arg Phe Glu Asp Leu Lys Val Ile Ile Asp His Phe Glu Lys
85 90 95
Tyr Pro Leu Ile Thr Gln Lys Leu Gly Asp Tyr Lys Leu Phe Lys Gln
100 105 110
Ala Phe Ser Val Met Glu Asn Lys Glu His Leu Lys Glu Asn Gly Ile
115 120 125
Lys Glu Leu Val Arg Ile Lys Ala Lys Met Asn Trp Gly Leu Asn Asp
130 135 140
Glu Leu Lys Lys Ala Phe Pro Glu Asn Ile Ser Lys Glu Arg Pro Leu
145 150 155 160
Ile Asn Lys Asn Ile Pro Asn Leu Lys Trp Leu Ala Gly Phe Thr Ser
165 170 175
Gly Asp Gly Ser Phe Met Val Glu Leu Met Lys Asn Lys Asn Asn Val
180 185 190
Ile Val Arg Val Arg Leu Arg Phe Ser Ile Ser Gln His Ile Arg Asp
195 200 205
Lys Asn Leu Met Asn Ser Leu Ile Thr Tyr Leu Gly Cys Gly Arg Ile
210 215 220
Val Glu Asn Asn Lys Ser Glu His Ser Trp Leu Glu Phe Ile Val Thr
225 230 235 240
Lys Phe Ser Asp Ile Asn Asp Lys Ile Ile Pro Val Phe Gln Glu Asn
245 250 255
Thr Leu Ile Gly Val Lys Leu Glu Asp Phe Glu Asp Trp Cys Lys Val
260 265 270
Ala Lys Leu Ile Glu Glu Lys Lys His Leu Thr Glu Ser Gly Leu Asp
275 280 285
Glu Ile Lys Lys Ile Lys Leu Asn Met Asn Lys Gly Arg Xaa Xaa Xaa
290 295 300
Xaa Xaa
305
<210> 9
<211> 306
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтезированный вариант I-OnuI CBLB.D2
<220>
<221> MOD_RES
<222> (1)..(8)
<223> Любая аминокислота или отсутствует
<220>
<221> MOD_RES
<222> (302)..(306)
<223> Любая аминокислота или отсутствует
<400> 9
Xaa Xaa Xaa Xaa Ser Arg Arg Glu Ser Ile Asn Pro Trp Ile Leu Thr
1 5 10 15
Gly Phe Ala Asp Ala Glu Gly Cys Phe Arg Leu Asp Ile His Asn Ala
20 25 30
Asn Val Leu Arg Ser Gly Tyr Arg Thr Arg Leu Ser Phe Glu Ile Val
35 40 45
Leu His Asn Lys Asp Lys Ser Ile Leu Glu Asn Ile Gln Ser Thr Trp
50 55 60
Lys Val Gly Lys Ile Tyr Asn Ala Gly Asp Asn Ala Val Arg Leu Gln
65 70 75 80
Val Thr Arg Phe Glu Asp Leu Lys Val Ile Ile Asp His Phe Glu Lys
85 90 95
Tyr Pro Leu Ile Thr Gln Lys Leu Gly Asp Tyr Lys Leu Phe Lys Gln
100 105 110
Ala Phe Ser Val Met Glu Asn Lys Glu His Leu Lys Glu Asn Gly Ile
115 120 125
Lys Glu Leu Val Arg Ile Lys Ala Lys Met Asn Trp Gly Leu Asn Asp
130 135 140
Glu Leu Lys Lys Ala Phe Pro Glu Asn Ile Ser Lys Glu Arg Pro Leu
145 150 155 160
Ile Asn Lys Asn Ile Pro Asn Leu Lys Trp Leu Ala Gly Phe Thr Ser
165 170 175
Gly Asp Gly Ser Phe Met Val Glu Leu Met Lys Asn Lys Asn Asn Val
180 185 190
Ile Val Arg Val Arg Leu Arg Phe Ser Ile Ser Gln His Ile Arg Asp
195 200 205
Lys Asn Leu Met Asn Ser Leu Ile Thr Tyr Leu Gly Cys Gly Arg Ile
210 215 220
Val Glu Asn Asn Lys Ser Glu His Ser Trp Leu Glu Phe Ile Val Thr
225 230 235 240
Lys Phe Ser Asp Ile Asn Asp Lys Ile Ile Pro Val Phe Gln Glu Asn
245 250 255
Thr Leu Ile Gly Val Lys Leu Glu Asp Phe Glu Asp Trp Cys Lys Val
260 265 270
Ala Lys Leu Ile Glu Glu Lys Lys His Leu Thr Glu Ser Gly Leu Asp
275 280 285
Glu Ile Lys Lys Ile Lys Leu Asn Met Asn Lys Gly Arg Xaa Xaa Xaa
290 295 300
Xaa Xaa
305
<210> 10
<211> 306
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтезированный вариант I-OnuI CBLB.C2
<220>
<221> MOD_RES
<222> (1)..(8)
<223> Любая аминокислота или отсутствует
<220>
<221> MOD_RES
<222> (302)..(306)
<223> Любая аминокислота или отсутствует
<400> 10
Xaa Xaa Xaa Xaa Ser Arg Arg Glu Ser Ile Asn Pro Trp Ile Leu Thr
1 5 10 15
Gly Phe Ala Asp Ala Glu Gly Cys Phe Gly Leu Tyr Ile His Asn Ser
20 25 30
Asn Val Leu Arg Ser Gly Tyr Arg Thr Arg Leu Ser Phe Glu Ile Ser
35 40 45
Leu His Asn Lys Asp Lys Ser Ile Leu Glu Asn Ile Gln Ser Thr Trp
50 55 60
Lys Val Gly Thr Ile Tyr Asn Ala Gly Asp Asn Ala Val Arg Leu Gln
65 70 75 80
Val Thr Arg Phe Glu Asp Leu Lys Val Ile Ile Asp His Phe Glu Lys
85 90 95
Tyr Pro Leu Ile Thr Gln Lys Leu Gly Asp Tyr Lys Leu Phe Lys Gln
100 105 110
Ala Phe Ser Leu Met Glu Asn Lys Glu His Leu Lys Glu Asn Gly Ile
115 120 125
Lys Glu Leu Val Arg Ile Lys Ala Lys Met Asn Trp Gly Leu Asn Asp
130 135 140
Glu Leu Lys Lys Ala Phe Pro Glu Asn Ile Ser Lys Glu Arg Pro Leu
145 150 155 160
Ile Asn Lys Asn Ile Pro Asn Leu Lys Trp Leu Ala Gly Phe Thr Ser
165 170 175
Gly Asp Gly Ser Phe Met Val Glu Leu Met Lys Asn Lys Asn Asn Val
180 185 190
Ile Val Arg Val Arg Leu Arg Phe Ser Ile Ser Gln His Ile Arg Asp
195 200 205
Lys Asn Leu Met Asn Ser Leu Ile Thr Tyr Leu Gly Cys Gly Arg Ile
210 215 220
Val Glu Asn Asn Lys Ser Glu His Ser Trp Leu Glu Phe Ile Val Thr
225 230 235 240
Lys Phe Ser Asp Ile Asn Asp Lys Ile Ile Pro Val Phe Gln Glu Asn
245 250 255
Thr Leu Ile Gly Val Lys Leu Glu Asp Phe Glu Asp Trp Cys Lys Val
260 265 270
Ala Lys Leu Ile Glu Glu Lys Lys His Leu Thr Glu Ser Gly Leu Asp
275 280 285
Glu Ile Lys Lys Ile Lys Leu Asn Met Asn Lys Gly Arg Xaa Xaa Xaa
290 295 300
Xaa Xaa
305
<210> 11
<211> 306
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтезированный вариант I-OnuI CBLB.B5
<220>
<221> MOD_RES
<222> (1)..(8)
<223> Любая аминокислота или отсутствует
<220>
<221> MOD_RES
<222> (302)..(306)
<223> Любая аминокислота или отсутствует
<400> 11
Xaa Xaa Xaa Xaa Ser Arg Arg Glu Ser Ile Asn Pro Trp Ile Leu Thr
1 5 10 15
Gly Phe Ala Asp Ala Glu Gly Cys Phe Arg Leu Asp Ile His Asn Ala
20 25 30
Asn Val Leu Arg Ser Gly Tyr Arg Thr Arg Leu Ser Phe Glu Ile Val
35 40 45
Leu His Asn Lys Asp Lys Ser Ile Leu Glu Asn Ile Gln Ser Thr Trp
50 55 60
Lys Val Gly Thr Ile Tyr Asn Ala Gly Asp Asn Ala Val Arg Leu Gln
65 70 75 80
Val Thr Arg Phe Glu Asp Leu Lys Val Ile Ile Asp His Phe Glu Lys
85 90 95
Tyr Pro Leu Ile Thr Gln Lys Leu Gly Asp Tyr Lys Leu Phe Lys Gln
100 105 110
Ala Phe Ser Leu Met Glu Asn Lys Glu His Leu Lys Glu Asn Gly Ile
115 120 125
Lys Glu Leu Val Arg Ile Lys Ala Lys Met Asn Trp Gly Leu Asn Asp
130 135 140
Glu Leu Lys Lys Ala Phe Pro Glu Asn Ile Ser Lys Glu Arg Pro Leu
145 150 155 160
Ile Asn Lys Asn Ile Pro Asn Leu Lys Trp Leu Ala Gly Phe Thr Ser
165 170 175
Gly Asp Gly Ser Phe Val Val Glu Leu Lys Lys Arg Arg Ser Pro Val
180 185 190
Lys Val Gly Val Arg Leu Arg Phe Gly Ile Thr Gln His Ile Arg Asp
195 200 205
Lys Asn Leu Met Asn Ser Leu Ile Thr Tyr Leu Gly Cys Gly Arg Ile
210 215 220
Val Glu Asn Asn Lys Ser Glu His Ser Trp Leu Glu Phe Ile Val Thr
225 230 235 240
Lys Phe Ser Asp Ile Asn Asp Lys Ile Ile Pro Val Phe Gln Glu Asn
245 250 255
Thr Leu Ile Gly Val Lys Leu Glu Asp Phe Glu Asp Trp Cys Lys Val
260 265 270
Ala Lys Leu Ile Glu Glu Lys Lys His Leu Thr Glu Ser Gly Leu Asp
275 280 285
Glu Ile Lys Lys Ile Lys Leu Asn Met Asn Lys Gly Arg Xaa Xaa Xaa
290 295 300
Xaa Xaa
305
<210> 12
<211> 306
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтезированный вариант I-OnuI CBLB.A8
<220>
<221> MOD_RES
<222> (1)..(8)
<223> Любая аминокислота или отсутствует
<220>
<221> MOD_RES
<222> (302)..(306)
<223> Любая аминокислота или отсутствует
<400> 12
Xaa Xaa Xaa Xaa Ser Arg Arg Glu Ser Ile Asn Pro Trp Ile Leu Thr
1 5 10 15
Gly Phe Ala Asp Ala Glu Gly Cys Phe Arg Leu Asp Ile Arg Asn Ala
20 25 30
Asn Asp Leu Arg Ala Gly Tyr Arg Thr Arg Leu Ala Phe Glu Ile Val
35 40 45
Leu His Asn Lys Asp Lys Ser Ile Leu Glu Asn Ile Gln Ser Thr Trp
50 55 60
Lys Val Gly Thr Ile Tyr Asn Ala Gly Asp Asn Ala Val Arg Leu Gln
65 70 75 80
Val Thr Arg Phe Glu Asp Leu Lys Val Ile Ile Gly His Phe Glu Lys
85 90 95
Tyr Pro Leu Ile Thr Gln Lys Leu Gly Asp Tyr Lys Leu Phe Lys Gln
100 105 110
Ala Phe Ser Val Met Glu Asn Lys Glu His Leu Lys Glu Asn Gly Ile
115 120 125
Lys Glu Leu Val Arg Ile Lys Ala Lys Met Asn Trp Gly Leu Asn Asp
130 135 140
Glu Leu Lys Lys Ala Phe Pro Glu Asn Ile Ser Lys Glu Arg Pro Leu
145 150 155 160
Ile Asn Lys Asn Ile Pro Asn Leu Lys Trp Leu Ala Gly Phe Thr Ser
165 170 175
Gly Asp Gly Ser Phe Met Val Glu Leu Met Lys Asn Lys Asn Asn Val
180 185 190
Ile Val Arg Val Arg Leu Arg Phe Ser Ile Ser Gln His Ile Arg Asp
195 200 205
Lys Asn Leu Met Asn Ser Leu Ile Thr Tyr Leu Gly Cys Gly Arg Ile
210 215 220
Val Glu Asn Asn Lys Ser Glu His Ser Trp Leu Glu Phe Ile Val Thr
225 230 235 240
Lys Phe Ser Asp Ile Asn Asp Lys Ile Ile Pro Val Phe Gln Glu Asn
245 250 255
Thr Leu Ile Gly Val Lys Leu Glu Asp Phe Glu Asp Trp Cys Lys Val
260 265 270
Ala Lys Leu Ile Glu Glu Lys Lys His Leu Thr Glu Ser Gly Leu Asp
275 280 285
Glu Ile Lys Lys Ile Lys Leu Asn Met Asn Lys Gly Arg Xaa Xaa Xaa
290 295 300
Xaa Xaa
305
<210> 13
<211> 914
<212> PRT
<213> Искусственная последовательность
<220>
<223> Получено в лаборатории - синтезированная конструкция megaTAL CBLB.E3
<400> 13
Met Gly Ser Ala Pro Pro Lys Lys Lys Arg Lys Val Val Asp Leu Arg
1 5 10 15
Thr Leu Gly Tyr Ser Gln Gln Gln Gln Glu Lys Ile Lys Pro Lys Val
20 25 30
Arg Ser Thr Val Ala Gln His His Glu Ala Leu Val Gly His Gly Phe
35 40 45
Thr His Ala His Ile Val Ala Leu Ser Gln His Pro Ala Ala Leu Gly
50 55 60
Thr Val Ala Val Thr Tyr Gln His Ile Ile Thr Ala Leu Pro Glu Ala
65 70 75 80
Thr His Glu Asp Ile Val Gly Val Gly Lys Gln Trp Ser Gly Ala Arg
85 90 95
Ala Leu Glu Ala Leu Leu Thr Asp Ala Gly Glu Leu Arg Gly Pro Pro
100 105 110
Leu Gln Leu Asp Thr Gly Gln Leu Val Lys Ile Ala Lys Arg Gly Gly
115 120 125
Val Thr Ala Met Glu Ala Val His Ala Ser Arg Asn Ala Leu Thr Gly
130 135 140
Ala Pro Leu Asn Leu Thr Pro Asp Gln Val Val Ala Ile Ala Ser Asn
145 150 155 160
Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
165 170 175
Leu Cys Gln Asp His Gly Leu Thr Pro Asp Gln Val Val Ala Ile Ala
180 185 190
Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
195 200 205
Pro Val Leu Cys Gln Asp His Gly Leu Thr Pro Asp Gln Val Val Ala
210 215 220
Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
225 230 235 240
Leu Leu Pro Val Leu Cys Gln Asp His Gly Leu Thr Pro Asp Gln Val
245 250 255
Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val
260 265 270
Gln Arg Leu Leu Pro Val Leu Cys Gln Asp His Gly Leu Thr Pro Asp
275 280 285
Gln Val Val Ala Ile Ala Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu
290 295 300
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Asp His Gly Leu Thr
305 310 315 320
Pro Asp Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala
325 330 335
Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Asp His Gly
340 345 350
Leu Thr Pro Asp Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys
355 360 365
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Asp
370 375 380
His Gly Leu Thr Pro Asp Gln Val Val Ala Ile Ala Ser Asn Ile Gly
385 390 395 400
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
405 410 415
Gln Asp His Gly Leu Thr Pro Asp Gln Val Val Ala Ile Ala Ser Asn
420 425 430
Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
435 440 445
Leu Cys Gln Asp His Gly Leu Thr Pro Asp Gln Val Val Ala Ile Ala
450 455 460
Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
465 470 475 480
Pro Val Leu Cys Gln Asp His Gly Leu Thr Pro Asp Gln Val Val Ala
485 490 495
Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
500 505 510
Leu Leu Pro Val Leu Cys Gln Asp His Gly Leu Thr Pro Asp Gln Val
515 520 525
Val Ala Ile Ala Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu Ser Ile
530 535 540
Val Ala Gln Leu Ser Arg Pro Asp Pro Ala Leu Ala Ala Leu Thr Asn
545 550 555 560
Asp His Leu Val Ala Leu Ala Cys Leu Gly Gly Arg Pro Ala Met Asp
565 570 575
Ala Val Lys Lys Gly Leu Pro His Ala Pro Glu Leu Ile Arg Arg Val
580 585 590
Asn Arg Arg Ile Gly Glu Arg Thr Ser His Arg Val Ala Ile Ser Arg
595 600 605
Val Gly Gly Ser Ser Arg Arg Glu Ser Ile Asn Pro Trp Ile Leu Thr
610 615 620
Gly Phe Ala Asp Ala Glu Gly Cys Phe Arg Leu Asp Ile Arg Asn Ala
625 630 635 640
Asn Asp Leu Arg Ala Gly Tyr Arg Thr Arg Leu Ala Phe Glu Ile Val
645 650 655
Leu His Asn Lys Asp Lys Ser Ile Leu Glu Asn Ile Gln Ser Thr Trp
660 665 670
Lys Val Gly Thr Ile Tyr Asn Ala Gly Asp Asn Ala Val Arg Leu Gln
675 680 685
Val Thr Arg Phe Glu Asp Leu Lys Val Ile Ile Asp His Phe Glu Lys
690 695 700
Tyr Pro Leu Ile Thr Gln Lys Leu Gly Asp Tyr Lys Leu Phe Lys Gln
705 710 715 720
Ala Phe Ser Val Met Glu Asn Lys Glu His Leu Lys Glu Asn Gly Ile
725 730 735
Lys Glu Leu Val Arg Ile Lys Ala Lys Met Asn Trp Gly Leu Asn Asp
740 745 750
Glu Leu Lys Lys Ala Phe Pro Glu Asn Ile Ser Lys Glu Arg Ser Leu
755 760 765
Ile Asn Lys Asn Ile Pro Asn Leu Lys Trp Leu Ala Gly Phe Thr Ser
770 775 780
Gly Asp Gly Ser Phe Val Val Glu Leu Lys Lys Arg Arg Ser Pro Val
785 790 795 800
Lys Val Gly Val Arg Leu Arg Phe Ser Ile Thr Gln His Ile Arg Asp
805 810 815
Lys Asn Leu Met Asn Ser Leu Ile Thr Tyr Leu Gly Cys Gly Arg Ile
820 825 830
Val Glu Asn Asn Lys Ser Glu His Ser Trp Leu Glu Phe Ile Val Thr
835 840 845
Lys Phe Ser Asp Ile Asn Asp Lys Ile Ile Pro Val Phe Gln Glu Asn
850 855 860
Thr Leu Ile Gly Val Lys Leu Glu Asp Phe Glu Asp Trp Cys Lys Val
865 870 875 880
Ala Lys Leu Ile Glu Glu Lys Lys His Leu Thr Glu Ser Gly Leu Asp
885 890 895
Glu Ile Lys Lys Ile Lys Leu Asn Met Asn Lys Gly Arg Val Phe Ser
900 905 910
Gly Arg
<210> 14
<211> 914
<212> PRT
<213> Искусственная последовательность
<220>
<223> Получено в лаборатории - синтезированная конструкция megaTAL CBLB.F6
<400> 14
Met Gly Ser Ala Pro Pro Lys Lys Lys Arg Lys Val Val Asp Leu Arg
1 5 10 15
Thr Leu Gly Tyr Ser Gln Gln Gln Gln Glu Lys Ile Lys Pro Lys Val
20 25 30
Arg Ser Thr Val Ala Gln His His Glu Ala Leu Val Gly His Gly Phe
35 40 45
Thr His Ala His Ile Val Ala Leu Ser Gln His Pro Ala Ala Leu Gly
50 55 60
Thr Val Ala Val Thr Tyr Gln His Ile Ile Thr Ala Leu Pro Glu Ala
65 70 75 80
Thr His Glu Asp Ile Val Gly Val Gly Lys Gln Trp Ser Gly Ala Arg
85 90 95
Ala Leu Glu Ala Leu Leu Thr Asp Ala Gly Glu Leu Arg Gly Pro Pro
100 105 110
Leu Gln Leu Asp Thr Gly Gln Leu Val Lys Ile Ala Lys Arg Gly Gly
115 120 125
Val Thr Ala Met Glu Ala Val His Ala Ser Arg Asn Ala Leu Thr Gly
130 135 140
Ala Pro Leu Asn Leu Thr Pro Asp Gln Val Val Ala Ile Ala Ser Asn
145 150 155 160
Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
165 170 175
Leu Cys Gln Asp His Gly Leu Thr Pro Asp Gln Val Val Ala Ile Ala
180 185 190
Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
195 200 205
Pro Val Leu Cys Gln Asp His Gly Leu Thr Pro Asp Gln Val Val Ala
210 215 220
Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
225 230 235 240
Leu Leu Pro Val Leu Cys Gln Asp His Gly Leu Thr Pro Asp Gln Val
245 250 255
Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val
260 265 270
Gln Arg Leu Leu Pro Val Leu Cys Gln Asp His Gly Leu Thr Pro Asp
275 280 285
Gln Val Val Ala Ile Ala Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu
290 295 300
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Asp His Gly Leu Thr
305 310 315 320
Pro Asp Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala
325 330 335
Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Asp His Gly
340 345 350
Leu Thr Pro Asp Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys
355 360 365
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Asp
370 375 380
His Gly Leu Thr Pro Asp Gln Val Val Ala Ile Ala Ser Asn Ile Gly
385 390 395 400
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
405 410 415
Gln Asp His Gly Leu Thr Pro Asp Gln Val Val Ala Ile Ala Ser Asn
420 425 430
Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
435 440 445
Leu Cys Gln Asp His Gly Leu Thr Pro Asp Gln Val Val Ala Ile Ala
450 455 460
Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
465 470 475 480
Pro Val Leu Cys Gln Asp His Gly Leu Thr Pro Asp Gln Val Val Ala
485 490 495
Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
500 505 510
Leu Leu Pro Val Leu Cys Gln Asp His Gly Leu Thr Pro Asp Gln Val
515 520 525
Val Ala Ile Ala Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu Ser Ile
530 535 540
Val Ala Gln Leu Ser Arg Pro Asp Pro Ala Leu Ala Ala Leu Thr Asn
545 550 555 560
Asp His Leu Val Ala Leu Ala Cys Leu Gly Gly Arg Pro Ala Met Asp
565 570 575
Ala Val Lys Lys Gly Leu Pro His Ala Pro Glu Leu Ile Arg Arg Val
580 585 590
Asn Arg Arg Ile Gly Glu Arg Thr Ser His Arg Val Ala Ile Ser Arg
595 600 605
Val Gly Gly Ser Ser Arg Arg Glu Ser Ile Asn Pro Trp Ile Leu Thr
610 615 620
Gly Phe Ala Asp Ala Glu Gly Cys Phe Arg Leu Asp Ile Arg Asn Ala
625 630 635 640
Asn Asp Leu Arg Ala Gly Tyr Arg Thr Arg Leu Ala Phe Glu Ile Val
645 650 655
Leu His Asn Lys Asp Lys Ser Ile Leu Glu Asn Ile Gln Ser Thr Trp
660 665 670
Lys Val Gly Thr Ile Tyr Asn Ala Gly Asp Asn Ala Val Arg Leu Gln
675 680 685
Val Thr Arg Phe Glu Asp Leu Lys Val Ile Ile Asp His Phe Glu Lys
690 695 700
Tyr Pro Leu Ile Thr Gln Lys Leu Gly Asp Tyr Lys Leu Phe Lys Gln
705 710 715 720
Ala Phe Ser Val Met Glu Asn Lys Glu His Leu Lys Glu Asn Gly Ile
725 730 735
Lys Glu Leu Val Arg Ile Lys Ala Lys Met Asn Trp Gly Leu Asn Asp
740 745 750
Glu Leu Lys Lys Ala Phe Pro Glu Asn Ile Ser Lys Glu Arg Pro Leu
755 760 765
Ile Asn Lys Asn Ile Pro Asn Leu Lys Trp Leu Ala Gly Phe Thr Ser
770 775 780
Gly Asp Gly Ser Phe Met Val Glu Leu Met Lys Asn Lys Asn Asn Val
785 790 795 800
Ile Val Arg Val Arg Leu Arg Phe Ser Ile Ser Gln His Ile Arg Asp
805 810 815
Lys Asn Leu Met Asn Ser Leu Ile Thr Tyr Leu Gly Cys Gly Arg Ile
820 825 830
Val Glu Asn Asn Lys Ser Glu His Ser Trp Leu Glu Phe Ile Val Thr
835 840 845
Lys Phe Ser Asp Ile Asn Asp Lys Ile Ile Pro Val Phe Gln Glu Asn
850 855 860
Thr Leu Ile Gly Val Lys Leu Glu Asp Phe Glu Asp Trp Cys Lys Val
865 870 875 880
Ala Lys Leu Ile Glu Glu Lys Lys His Leu Thr Glu Ser Gly Leu Asp
885 890 895
Glu Ile Lys Lys Ile Lys Leu Asn Met Asn Lys Gly Arg Val Phe Ser
900 905 910
Gly Arg
<210> 15
<211> 914
<212> PRT
<213> Искусственная последовательность
<220>
<223> Получено в лаборатории - синтезированная конструкция megaTAL CBLB.E6
<400> 15
Met Gly Ser Ala Pro Pro Lys Lys Lys Arg Lys Val Val Asp Leu Arg
1 5 10 15
Thr Leu Gly Tyr Ser Gln Gln Gln Gln Glu Lys Ile Lys Pro Lys Val
20 25 30
Arg Ser Thr Val Ala Gln His His Glu Ala Leu Val Gly His Gly Phe
35 40 45
Thr His Ala His Ile Val Ala Leu Ser Gln His Pro Ala Ala Leu Gly
50 55 60
Thr Val Ala Val Thr Tyr Gln His Ile Ile Thr Ala Leu Pro Glu Ala
65 70 75 80
Thr His Glu Asp Ile Val Gly Val Gly Lys Gln Trp Ser Gly Ala Arg
85 90 95
Ala Leu Glu Ala Leu Leu Thr Asp Ala Gly Glu Leu Arg Gly Pro Pro
100 105 110
Leu Gln Leu Asp Thr Gly Gln Leu Val Lys Ile Ala Lys Arg Gly Gly
115 120 125
Val Thr Ala Met Glu Ala Val His Ala Ser Arg Asn Ala Leu Thr Gly
130 135 140
Ala Pro Leu Asn Leu Thr Pro Asp Gln Val Val Ala Ile Ala Ser Asn
145 150 155 160
Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
165 170 175
Leu Cys Gln Asp His Gly Leu Thr Pro Asp Gln Val Val Ala Ile Ala
180 185 190
Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
195 200 205
Pro Val Leu Cys Gln Asp His Gly Leu Thr Pro Asp Gln Val Val Ala
210 215 220
Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
225 230 235 240
Leu Leu Pro Val Leu Cys Gln Asp His Gly Leu Thr Pro Asp Gln Val
245 250 255
Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val
260 265 270
Gln Arg Leu Leu Pro Val Leu Cys Gln Asp His Gly Leu Thr Pro Asp
275 280 285
Gln Val Val Ala Ile Ala Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu
290 295 300
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Asp His Gly Leu Thr
305 310 315 320
Pro Asp Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala
325 330 335
Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Asp His Gly
340 345 350
Leu Thr Pro Asp Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys
355 360 365
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Asp
370 375 380
His Gly Leu Thr Pro Asp Gln Val Val Ala Ile Ala Ser Asn Ile Gly
385 390 395 400
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
405 410 415
Gln Asp His Gly Leu Thr Pro Asp Gln Val Val Ala Ile Ala Ser Asn
420 425 430
Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
435 440 445
Leu Cys Gln Asp His Gly Leu Thr Pro Asp Gln Val Val Ala Ile Ala
450 455 460
Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
465 470 475 480
Pro Val Leu Cys Gln Asp His Gly Leu Thr Pro Asp Gln Val Val Ala
485 490 495
Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
500 505 510
Leu Leu Pro Val Leu Cys Gln Asp His Gly Leu Thr Pro Asp Gln Val
515 520 525
Val Ala Ile Ala Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu Ser Ile
530 535 540
Val Ala Gln Leu Ser Arg Pro Asp Pro Ala Leu Ala Ala Leu Thr Asn
545 550 555 560
Asp His Leu Val Ala Leu Ala Cys Leu Gly Gly Arg Pro Ala Met Asp
565 570 575
Ala Val Lys Lys Gly Leu Pro His Ala Pro Glu Leu Ile Arg Arg Val
580 585 590
Asn Arg Arg Ile Gly Glu Arg Thr Ser His Arg Val Ala Ile Ser Arg
595 600 605
Val Gly Gly Ser Ser Arg Arg Glu Ser Ile Asn Pro Trp Ile Leu Thr
610 615 620
Gly Phe Ala Asp Ala Glu Gly Cys Phe Arg Leu Asp Ile Arg Asn Ala
625 630 635 640
Asn Asp Leu Arg Ala Gly Tyr Arg Thr Arg Leu Ser Phe Glu Ile Ser
645 650 655
Leu His Asn Lys Asp Lys Ser Ile Leu Glu Asn Ile Gln Ser Thr Trp
660 665 670
Lys Val Gly Thr Ile Tyr Asn Ala Gly Asp Asn Ala Val Arg Leu Gln
675 680 685
Val Thr Arg Phe Glu Asp Leu Lys Val Ile Ile Asp His Phe Glu Lys
690 695 700
Tyr Pro Leu Ile Thr Gln Lys Leu Gly Asp Tyr Lys Leu Phe Lys Gln
705 710 715 720
Ala Phe Ser Val Met Glu Asn Lys Glu His Leu Lys Glu Asn Gly Ile
725 730 735
Lys Glu Leu Val Arg Ile Lys Ala Lys Met Asn Trp Gly Leu Asn Asp
740 745 750
Glu Leu Lys Lys Ala Phe Pro Glu Asn Ile Ser Lys Glu Arg Pro Leu
755 760 765
Ile Asn Lys Asn Ile Pro Asn Leu Lys Trp Leu Ala Gly Phe Thr Ser
770 775 780
Gly Asp Gly Ser Phe Met Val Glu Leu Met Lys Asn Lys Asn Asn Val
785 790 795 800
Ile Val Arg Val Arg Leu Arg Phe Ser Ile Ser Gln His Ile Arg Asp
805 810 815
Lys Asn Leu Met Asn Ser Leu Ile Thr Tyr Leu Gly Cys Gly Arg Ile
820 825 830
Val Glu Asn Asn Lys Ser Glu His Ser Trp Leu Glu Phe Ile Val Thr
835 840 845
Lys Phe Ser Asp Ile Asn Asp Lys Ile Ile Pro Val Phe Gln Glu Asn
850 855 860
Thr Leu Ile Gly Val Lys Leu Glu Asp Phe Glu Asp Trp Cys Lys Val
865 870 875 880
Ala Lys Leu Ile Glu Glu Lys Lys His Leu Thr Glu Ser Gly Leu Asp
885 890 895
Glu Ile Lys Lys Ile Lys Leu Asn Met Asn Lys Gly Arg Val Phe Ser
900 905 910
Gly Arg
<210> 16
<211> 914
<212> PRT
<213> Искусственная последовательность
<220>
<223> Получено в лаборатории - синтезированная конструкция megaTAL CBLB.D2
<400> 16
Met Gly Ser Ala Pro Pro Lys Lys Lys Arg Lys Val Val Asp Leu Arg
1 5 10 15
Thr Leu Gly Tyr Ser Gln Gln Gln Gln Glu Lys Ile Lys Pro Lys Val
20 25 30
Arg Ser Thr Val Ala Gln His His Glu Ala Leu Val Gly His Gly Phe
35 40 45
Thr His Ala His Ile Val Ala Leu Ser Gln His Pro Ala Ala Leu Gly
50 55 60
Thr Val Ala Val Thr Tyr Gln His Ile Ile Thr Ala Leu Pro Glu Ala
65 70 75 80
Thr His Glu Asp Ile Val Gly Val Gly Lys Gln Trp Ser Gly Ala Arg
85 90 95
Ala Leu Glu Ala Leu Leu Thr Asp Ala Gly Glu Leu Arg Gly Pro Pro
100 105 110
Leu Gln Leu Asp Thr Gly Gln Leu Val Lys Ile Ala Lys Arg Gly Gly
115 120 125
Val Thr Ala Met Glu Ala Val His Ala Ser Arg Asn Ala Leu Thr Gly
130 135 140
Ala Pro Leu Asn Leu Thr Pro Asp Gln Val Val Ala Ile Ala Ser Asn
145 150 155 160
Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
165 170 175
Leu Cys Gln Asp His Gly Leu Thr Pro Asp Gln Val Val Ala Ile Ala
180 185 190
Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
195 200 205
Pro Val Leu Cys Gln Asp His Gly Leu Thr Pro Asp Gln Val Val Ala
210 215 220
Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
225 230 235 240
Leu Leu Pro Val Leu Cys Gln Asp His Gly Leu Thr Pro Asp Gln Val
245 250 255
Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val
260 265 270
Gln Arg Leu Leu Pro Val Leu Cys Gln Asp His Gly Leu Thr Pro Asp
275 280 285
Gln Val Val Ala Ile Ala Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu
290 295 300
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Asp His Gly Leu Thr
305 310 315 320
Pro Asp Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala
325 330 335
Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Asp His Gly
340 345 350
Leu Thr Pro Asp Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys
355 360 365
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Asp
370 375 380
His Gly Leu Thr Pro Asp Gln Val Val Ala Ile Ala Ser Asn Ile Gly
385 390 395 400
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
405 410 415
Gln Asp His Gly Leu Thr Pro Asp Gln Val Val Ala Ile Ala Ser Asn
420 425 430
Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
435 440 445
Leu Cys Gln Asp His Gly Leu Thr Pro Asp Gln Val Val Ala Ile Ala
450 455 460
Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
465 470 475 480
Pro Val Leu Cys Gln Asp His Gly Leu Thr Pro Asp Gln Val Val Ala
485 490 495
Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
500 505 510
Leu Leu Pro Val Leu Cys Gln Asp His Gly Leu Thr Pro Asp Gln Val
515 520 525
Val Ala Ile Ala Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu Ser Ile
530 535 540
Val Ala Gln Leu Ser Arg Pro Asp Pro Ala Leu Ala Ala Leu Thr Asn
545 550 555 560
Asp His Leu Val Ala Leu Ala Cys Leu Gly Gly Arg Pro Ala Met Asp
565 570 575
Ala Val Lys Lys Gly Leu Pro His Ala Pro Glu Leu Ile Arg Arg Val
580 585 590
Asn Arg Arg Ile Gly Glu Arg Thr Ser His Arg Val Ala Ile Ser Arg
595 600 605
Val Gly Gly Ser Ser Arg Arg Glu Ser Ile Asn Pro Trp Ile Leu Thr
610 615 620
Gly Phe Ala Asp Ala Glu Gly Cys Phe Arg Leu Asp Ile His Asn Ala
625 630 635 640
Asn Val Leu Arg Ser Gly Tyr Arg Thr Arg Leu Ser Phe Glu Ile Val
645 650 655
Leu His Asn Lys Asp Lys Ser Ile Leu Glu Asn Ile Gln Ser Thr Trp
660 665 670
Lys Val Gly Lys Ile Tyr Asn Ala Gly Asp Asn Ala Val Arg Leu Gln
675 680 685
Val Thr Arg Phe Glu Asp Leu Lys Val Ile Ile Asp His Phe Glu Lys
690 695 700
Tyr Pro Leu Ile Thr Gln Lys Leu Gly Asp Tyr Lys Leu Phe Lys Gln
705 710 715 720
Ala Phe Ser Val Met Glu Asn Lys Glu His Leu Lys Glu Asn Gly Ile
725 730 735
Lys Glu Leu Val Arg Ile Lys Ala Lys Met Asn Trp Gly Leu Asn Asp
740 745 750
Glu Leu Lys Lys Ala Phe Pro Glu Asn Ile Ser Lys Glu Arg Pro Leu
755 760 765
Ile Asn Lys Asn Ile Pro Asn Leu Lys Trp Leu Ala Gly Phe Thr Ser
770 775 780
Gly Asp Gly Ser Phe Met Val Glu Leu Met Lys Asn Lys Asn Asn Val
785 790 795 800
Ile Val Arg Val Arg Leu Arg Phe Ser Ile Ser Gln His Ile Arg Asp
805 810 815
Lys Asn Leu Met Asn Ser Leu Ile Thr Tyr Leu Gly Cys Gly Arg Ile
820 825 830
Val Glu Asn Asn Lys Ser Glu His Ser Trp Leu Glu Phe Ile Val Thr
835 840 845
Lys Phe Ser Asp Ile Asn Asp Lys Ile Ile Pro Val Phe Gln Glu Asn
850 855 860
Thr Leu Ile Gly Val Lys Leu Glu Asp Phe Glu Asp Trp Cys Lys Val
865 870 875 880
Ala Lys Leu Ile Glu Glu Lys Lys His Leu Thr Glu Ser Gly Leu Asp
885 890 895
Glu Ile Lys Lys Ile Lys Leu Asn Met Asn Lys Gly Arg Val Phe Ser
900 905 910
Gly Arg
<210> 17
<211> 914
<212> PRT
<213> Искусственная последовательность
<220>
<223> Получено в лаборатории - синтезированная конструкция megaTAL CBLB.C2
<400> 17
Met Gly Ser Ala Pro Pro Lys Lys Lys Arg Lys Val Val Asp Leu Arg
1 5 10 15
Thr Leu Gly Tyr Ser Gln Gln Gln Gln Glu Lys Ile Lys Pro Lys Val
20 25 30
Arg Ser Thr Val Ala Gln His His Glu Ala Leu Val Gly His Gly Phe
35 40 45
Thr His Ala His Ile Val Ala Leu Ser Gln His Pro Ala Ala Leu Gly
50 55 60
Thr Val Ala Val Thr Tyr Gln His Ile Ile Thr Ala Leu Pro Glu Ala
65 70 75 80
Thr His Glu Asp Ile Val Gly Val Gly Lys Gln Trp Ser Gly Ala Arg
85 90 95
Ala Leu Glu Ala Leu Leu Thr Asp Ala Gly Glu Leu Arg Gly Pro Pro
100 105 110
Leu Gln Leu Asp Thr Gly Gln Leu Val Lys Ile Ala Lys Arg Gly Gly
115 120 125
Val Thr Ala Met Glu Ala Val His Ala Ser Arg Asn Ala Leu Thr Gly
130 135 140
Ala Pro Leu Asn Leu Thr Pro Asp Gln Val Val Ala Ile Ala Ser Asn
145 150 155 160
Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
165 170 175
Leu Cys Gln Asp His Gly Leu Thr Pro Asp Gln Val Val Ala Ile Ala
180 185 190
Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
195 200 205
Pro Val Leu Cys Gln Asp His Gly Leu Thr Pro Asp Gln Val Val Ala
210 215 220
Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
225 230 235 240
Leu Leu Pro Val Leu Cys Gln Asp His Gly Leu Thr Pro Asp Gln Val
245 250 255
Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val
260 265 270
Gln Arg Leu Leu Pro Val Leu Cys Gln Asp His Gly Leu Thr Pro Asp
275 280 285
Gln Val Val Ala Ile Ala Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu
290 295 300
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Asp His Gly Leu Thr
305 310 315 320
Pro Asp Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala
325 330 335
Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Asp His Gly
340 345 350
Leu Thr Pro Asp Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys
355 360 365
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Asp
370 375 380
His Gly Leu Thr Pro Asp Gln Val Val Ala Ile Ala Ser Asn Ile Gly
385 390 395 400
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
405 410 415
Gln Asp His Gly Leu Thr Pro Asp Gln Val Val Ala Ile Ala Ser Asn
420 425 430
Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
435 440 445
Leu Cys Gln Asp His Gly Leu Thr Pro Asp Gln Val Val Ala Ile Ala
450 455 460
Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
465 470 475 480
Pro Val Leu Cys Gln Asp His Gly Leu Thr Pro Asp Gln Val Val Ala
485 490 495
Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
500 505 510
Leu Leu Pro Val Leu Cys Gln Asp His Gly Leu Thr Pro Asp Gln Val
515 520 525
Val Ala Ile Ala Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu Ser Ile
530 535 540
Val Ala Gln Leu Ser Arg Pro Asp Pro Ala Leu Ala Ala Leu Thr Asn
545 550 555 560
Asp His Leu Val Ala Leu Ala Cys Leu Gly Gly Arg Pro Ala Met Asp
565 570 575
Ala Val Lys Lys Gly Leu Pro His Ala Pro Glu Leu Ile Arg Arg Val
580 585 590
Asn Arg Arg Ile Gly Glu Arg Thr Ser His Arg Val Ala Ile Ser Arg
595 600 605
Val Gly Gly Ser Ser Arg Arg Glu Ser Ile Asn Pro Trp Ile Leu Thr
610 615 620
Gly Phe Ala Asp Ala Glu Gly Cys Phe Gly Leu Tyr Ile His Asn Ser
625 630 635 640
Asn Val Leu Arg Ser Gly Tyr Arg Thr Arg Leu Ser Phe Glu Ile Ser
645 650 655
Leu His Asn Lys Asp Lys Ser Ile Leu Glu Asn Ile Gln Ser Thr Trp
660 665 670
Lys Val Gly Thr Ile Tyr Asn Ala Gly Asp Asn Ala Val Arg Leu Gln
675 680 685
Val Thr Arg Phe Glu Asp Leu Lys Val Ile Ile Asp His Phe Glu Lys
690 695 700
Tyr Pro Leu Ile Thr Gln Lys Leu Gly Asp Tyr Lys Leu Phe Lys Gln
705 710 715 720
Ala Phe Ser Leu Met Glu Asn Lys Glu His Leu Lys Glu Asn Gly Ile
725 730 735
Lys Glu Leu Val Arg Ile Lys Ala Lys Met Asn Trp Gly Leu Asn Asp
740 745 750
Glu Leu Lys Lys Ala Phe Pro Glu Asn Ile Ser Lys Glu Arg Pro Leu
755 760 765
Ile Asn Lys Asn Ile Pro Asn Leu Lys Trp Leu Ala Gly Phe Thr Ser
770 775 780
Gly Asp Gly Ser Phe Met Val Glu Leu Met Lys Asn Lys Asn Asn Val
785 790 795 800
Ile Val Arg Val Arg Leu Arg Phe Ser Ile Ser Gln His Ile Arg Asp
805 810 815
Lys Asn Leu Met Asn Ser Leu Ile Thr Tyr Leu Gly Cys Gly Arg Ile
820 825 830
Val Glu Asn Asn Lys Ser Glu His Ser Trp Leu Glu Phe Ile Val Thr
835 840 845
Lys Phe Ser Asp Ile Asn Asp Lys Ile Ile Pro Val Phe Gln Glu Asn
850 855 860
Thr Leu Ile Gly Val Lys Leu Glu Asp Phe Glu Asp Trp Cys Lys Val
865 870 875 880
Ala Lys Leu Ile Glu Glu Lys Lys His Leu Thr Glu Ser Gly Leu Asp
885 890 895
Glu Ile Lys Lys Ile Lys Leu Asn Met Asn Lys Gly Arg Val Phe Ser
900 905 910
Gly Arg
<210> 18
<211> 914
<212> PRT
<213> Искусственная последовательность
<220>
<223> Получено в лаборатории - синтезированная конструкция megaTAL CBLB.B5
<400> 18
Met Gly Ser Ala Pro Pro Lys Lys Lys Arg Lys Val Val Asp Leu Arg
1 5 10 15
Thr Leu Gly Tyr Ser Gln Gln Gln Gln Glu Lys Ile Lys Pro Lys Val
20 25 30
Arg Ser Thr Val Ala Gln His His Glu Ala Leu Val Gly His Gly Phe
35 40 45
Thr His Ala His Ile Val Ala Leu Ser Gln His Pro Ala Ala Leu Gly
50 55 60
Thr Val Ala Val Thr Tyr Gln His Ile Ile Thr Ala Leu Pro Glu Ala
65 70 75 80
Thr His Glu Asp Ile Val Gly Val Gly Lys Gln Trp Ser Gly Ala Arg
85 90 95
Ala Leu Glu Ala Leu Leu Thr Asp Ala Gly Glu Leu Arg Gly Pro Pro
100 105 110
Leu Gln Leu Asp Thr Gly Gln Leu Val Lys Ile Ala Lys Arg Gly Gly
115 120 125
Val Thr Ala Met Glu Ala Val His Ala Ser Arg Asn Ala Leu Thr Gly
130 135 140
Ala Pro Leu Asn Leu Thr Pro Asp Gln Val Val Ala Ile Ala Ser Asn
145 150 155 160
Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
165 170 175
Leu Cys Gln Asp His Gly Leu Thr Pro Asp Gln Val Val Ala Ile Ala
180 185 190
Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
195 200 205
Pro Val Leu Cys Gln Asp His Gly Leu Thr Pro Asp Gln Val Val Ala
210 215 220
Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
225 230 235 240
Leu Leu Pro Val Leu Cys Gln Asp His Gly Leu Thr Pro Asp Gln Val
245 250 255
Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val
260 265 270
Gln Arg Leu Leu Pro Val Leu Cys Gln Asp His Gly Leu Thr Pro Asp
275 280 285
Gln Val Val Ala Ile Ala Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu
290 295 300
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Asp His Gly Leu Thr
305 310 315 320
Pro Asp Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala
325 330 335
Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Asp His Gly
340 345 350
Leu Thr Pro Asp Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys
355 360 365
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Asp
370 375 380
His Gly Leu Thr Pro Asp Gln Val Val Ala Ile Ala Ser Asn Ile Gly
385 390 395 400
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
405 410 415
Gln Asp His Gly Leu Thr Pro Asp Gln Val Val Ala Ile Ala Ser Asn
420 425 430
Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
435 440 445
Leu Cys Gln Asp His Gly Leu Thr Pro Asp Gln Val Val Ala Ile Ala
450 455 460
Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
465 470 475 480
Pro Val Leu Cys Gln Asp His Gly Leu Thr Pro Asp Gln Val Val Ala
485 490 495
Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
500 505 510
Leu Leu Pro Val Leu Cys Gln Asp His Gly Leu Thr Pro Asp Gln Val
515 520 525
Val Ala Ile Ala Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu Ser Ile
530 535 540
Val Ala Gln Leu Ser Arg Pro Asp Pro Ala Leu Ala Ala Leu Thr Asn
545 550 555 560
Asp His Leu Val Ala Leu Ala Cys Leu Gly Gly Arg Pro Ala Met Asp
565 570 575
Ala Val Lys Lys Gly Leu Pro His Ala Pro Glu Leu Ile Arg Arg Val
580 585 590
Asn Arg Arg Ile Gly Glu Arg Thr Ser His Arg Val Ala Ile Ser Arg
595 600 605
Val Gly Gly Ser Ser Arg Arg Glu Ser Ile Asn Pro Trp Ile Leu Thr
610 615 620
Gly Phe Ala Asp Ala Glu Gly Cys Phe Arg Leu Asp Ile His Asn Ala
625 630 635 640
Asn Val Leu Arg Ser Gly Tyr Arg Thr Arg Leu Ser Phe Glu Ile Val
645 650 655
Leu His Asn Lys Asp Lys Ser Ile Leu Glu Asn Ile Gln Ser Thr Trp
660 665 670
Lys Val Gly Thr Ile Tyr Asn Ala Gly Asp Asn Ala Val Arg Leu Gln
675 680 685
Val Thr Arg Phe Glu Asp Leu Lys Val Ile Ile Asp His Phe Glu Lys
690 695 700
Tyr Pro Leu Ile Thr Gln Lys Leu Gly Asp Tyr Lys Leu Phe Lys Gln
705 710 715 720
Ala Phe Ser Leu Met Glu Asn Lys Glu His Leu Lys Glu Asn Gly Ile
725 730 735
Lys Glu Leu Val Arg Ile Lys Ala Lys Met Asn Trp Gly Leu Asn Asp
740 745 750
Glu Leu Lys Lys Ala Phe Pro Glu Asn Ile Ser Lys Glu Arg Pro Leu
755 760 765
Ile Asn Lys Asn Ile Pro Asn Leu Lys Trp Leu Ala Gly Phe Thr Ser
770 775 780
Gly Asp Gly Ser Phe Val Val Glu Leu Lys Lys Arg Arg Ser Pro Val
785 790 795 800
Lys Val Gly Val Arg Leu Arg Phe Gly Ile Thr Gln His Ile Arg Asp
805 810 815
Lys Asn Leu Met Asn Ser Leu Ile Thr Tyr Leu Gly Cys Gly Arg Ile
820 825 830
Val Glu Asn Asn Lys Ser Glu His Ser Trp Leu Glu Phe Ile Val Thr
835 840 845
Lys Phe Ser Asp Ile Asn Asp Lys Ile Ile Pro Val Phe Gln Glu Asn
850 855 860
Thr Leu Ile Gly Val Lys Leu Glu Asp Phe Glu Asp Trp Cys Lys Val
865 870 875 880
Ala Lys Leu Ile Glu Glu Lys Lys His Leu Thr Glu Ser Gly Leu Asp
885 890 895
Glu Ile Lys Lys Ile Lys Leu Asn Met Asn Lys Gly Arg Val Phe Ser
900 905 910
Gly Arg
<210> 19
<211> 914
<212> PRT
<213> Искусственная последовательность
<220>
<223> Получено в лаборатории - синтезированная конструкция megaTAL CBLB.A8
<400> 19
Met Gly Ser Ala Pro Pro Lys Lys Lys Arg Lys Val Val Asp Leu Arg
1 5 10 15
Thr Leu Gly Tyr Ser Gln Gln Gln Gln Glu Lys Ile Lys Pro Lys Val
20 25 30
Arg Ser Thr Val Ala Gln His His Glu Ala Leu Val Gly His Gly Phe
35 40 45
Thr His Ala His Ile Val Ala Leu Ser Gln His Pro Ala Ala Leu Gly
50 55 60
Thr Val Ala Val Thr Tyr Gln His Ile Ile Thr Ala Leu Pro Glu Ala
65 70 75 80
Thr His Glu Asp Ile Val Gly Val Gly Lys Gln Trp Ser Gly Ala Arg
85 90 95
Ala Leu Glu Ala Leu Leu Thr Asp Ala Gly Glu Leu Arg Gly Pro Pro
100 105 110
Leu Gln Leu Asp Thr Gly Gln Leu Val Lys Ile Ala Lys Arg Gly Gly
115 120 125
Val Thr Ala Met Glu Ala Val His Ala Ser Arg Asn Ala Leu Thr Gly
130 135 140
Ala Pro Leu Asn Leu Thr Pro Asp Gln Val Val Ala Ile Ala Ser Asn
145 150 155 160
Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
165 170 175
Leu Cys Gln Asp His Gly Leu Thr Pro Asp Gln Val Val Ala Ile Ala
180 185 190
Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
195 200 205
Pro Val Leu Cys Gln Asp His Gly Leu Thr Pro Asp Gln Val Val Ala
210 215 220
Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
225 230 235 240
Leu Leu Pro Val Leu Cys Gln Asp His Gly Leu Thr Pro Asp Gln Val
245 250 255
Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val
260 265 270
Gln Arg Leu Leu Pro Val Leu Cys Gln Asp His Gly Leu Thr Pro Asp
275 280 285
Gln Val Val Ala Ile Ala Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu
290 295 300
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Asp His Gly Leu Thr
305 310 315 320
Pro Asp Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala
325 330 335
Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Asp His Gly
340 345 350
Leu Thr Pro Asp Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys
355 360 365
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Asp
370 375 380
His Gly Leu Thr Pro Asp Gln Val Val Ala Ile Ala Ser Asn Ile Gly
385 390 395 400
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
405 410 415
Gln Asp His Gly Leu Thr Pro Asp Gln Val Val Ala Ile Ala Ser Asn
420 425 430
Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
435 440 445
Leu Cys Gln Asp His Gly Leu Thr Pro Asp Gln Val Val Ala Ile Ala
450 455 460
Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
465 470 475 480
Pro Val Leu Cys Gln Asp His Gly Leu Thr Pro Asp Gln Val Val Ala
485 490 495
Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
500 505 510
Leu Leu Pro Val Leu Cys Gln Asp His Gly Leu Thr Pro Asp Gln Val
515 520 525
Val Ala Ile Ala Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu Ser Ile
530 535 540
Val Ala Gln Leu Ser Arg Pro Asp Pro Ala Leu Ala Ala Leu Thr Asn
545 550 555 560
Asp His Leu Val Ala Leu Ala Cys Leu Gly Gly Arg Pro Ala Met Asp
565 570 575
Ala Val Lys Lys Gly Leu Pro His Ala Pro Glu Leu Ile Arg Arg Val
580 585 590
Asn Arg Arg Ile Gly Glu Arg Thr Ser His Arg Val Ala Ile Ser Arg
595 600 605
Val Gly Gly Ser Ser Arg Arg Glu Ser Ile Asn Pro Trp Ile Leu Thr
610 615 620
Gly Phe Ala Asp Ala Glu Gly Cys Phe Arg Leu Asp Ile Arg Asn Ala
625 630 635 640
Asn Asp Leu Arg Ala Gly Tyr Arg Thr Arg Leu Ala Phe Glu Ile Val
645 650 655
Leu His Asn Lys Asp Lys Ser Ile Leu Glu Asn Ile Gln Ser Thr Trp
660 665 670
Lys Val Gly Thr Ile Tyr Asn Ala Gly Asp Asn Ala Val Arg Leu Gln
675 680 685
Val Thr Arg Phe Glu Asp Leu Lys Val Ile Ile Gly His Phe Glu Lys
690 695 700
Tyr Pro Leu Ile Thr Gln Lys Leu Gly Asp Tyr Lys Leu Phe Lys Gln
705 710 715 720
Ala Phe Ser Val Met Glu Asn Lys Glu His Leu Lys Glu Asn Gly Ile
725 730 735
Lys Glu Leu Val Arg Ile Lys Ala Lys Met Asn Trp Gly Leu Asn Asp
740 745 750
Glu Leu Lys Lys Ala Phe Pro Glu Asn Ile Ser Lys Glu Arg Pro Leu
755 760 765
Ile Asn Lys Asn Ile Pro Asn Leu Lys Trp Leu Ala Gly Phe Thr Ser
770 775 780
Gly Asp Gly Ser Phe Met Val Glu Leu Met Lys Asn Lys Asn Asn Val
785 790 795 800
Ile Val Arg Val Arg Leu Arg Phe Ser Ile Ser Gln His Ile Arg Asp
805 810 815
Lys Asn Leu Met Asn Ser Leu Ile Thr Tyr Leu Gly Cys Gly Arg Ile
820 825 830
Val Glu Asn Asn Lys Ser Glu His Ser Trp Leu Glu Phe Ile Val Thr
835 840 845
Lys Phe Ser Asp Ile Asn Asp Lys Ile Ile Pro Val Phe Gln Glu Asn
850 855 860
Thr Leu Ile Gly Val Lys Leu Glu Asp Phe Glu Asp Trp Cys Lys Val
865 870 875 880
Ala Lys Leu Ile Glu Glu Lys Lys His Leu Thr Glu Ser Gly Leu Asp
885 890 895
Glu Ile Lys Lys Ile Lys Leu Asn Met Asn Lys Gly Arg Val Phe Ser
900 905 910
Gly Arg
<210> 20
<211> 22
<212> ДНК
<213> Homo sapiens
<400> 20
ctgtaagata ttcccatccc ca 22
<210> 21
<211> 13
<212> ДНК
<213> Homo sapiens
<400> 21
ttgttatgag gta 13
<210> 22
<211> 39
<212> ДНК
<213> Homo sapiens
<400> 22
ttgttatgag gtatggtctg taagatattc ccatcccca 39
<210> 23
<211> 22
<212> ДНК
<213> Homo sapiens
<400> 23
ctgtaagata ttcaaccttt ta 22
<210> 24
<211> 22
<212> ДНК
<213> Homo sapiens
<400> 24
tttccactta ttcccatccc ca 22
<210> 25
<211> 22
<212> ДНК
<213> Homo sapiens
<400> 25
ctgtaagata ttctacgtct gc 22
<210> 26
<211> 22
<212> ДНК
<213> Homo sapiens
<400> 26
cttccaggaa ttcccatccc ca 22
<210> 27
<211> 22
<212> ДНК
<213> Homo sapiens
<400> 27
ctgtaagata ttccacaggc tc 22
<210> 28
<211> 22
<212> PRT
<213> Homo sapiens
<400> 28
Thr Gly Thr Cys Cys Ala Ala Thr Ala Ala Thr Thr Cys Cys Cys Ala
1 5 10 15
Thr Cys Cys Cys Cys Ala
20
<210> 29
<211> 22
<212> ДНК
<213> Homo sapiens
<400> 29
ctgtaagata ttcaccgatt tt 22
<210> 30
<211> 7244
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Получено в лаборатории - плазмида для поверхностного дисплея синтезированного варианта I-OnuI CBLB.E3
<400> 30
gacgaaaggg cctcgtgata cgcctatttt tataggttaa tgtcatgata ataatggttt 60
cttaggacgg atcgcttgcc tgtaacttac acgcgcctcg tatcttttaa tgatggaata 120
atttgggaat ttactctgtg tttatttatt tttatgtttt gtatttggat tttagaaagt 180
aaataaagaa ggtagaagag ttacggaatg aagaaaaaaa aataaacaaa ggtttaaaaa 240
atttcaacaa aaagcgtact ttacatatat atttattaga caagaaaagc agattaaata 300
gatatacatt cgattaacga taagtaaaat gtaaaatcac aggattttcg tgtgtggtct 360
tctacacaga caagatgaaa caattcggca ttaatacctg agagcaggaa gagcaagata 420
aaaggtagta tttgttggcg atccccctag agtcttttac atcttcggaa aacaaaaact 480
attttttctt taatttcttt ttttactttc tatttttaat ttatatattt atattaaaaa 540
atttaaatta taattatttt tatagcacgt gatgaaaagg acccaggtgg cacttttcgg 600
ggaaatgtgc gcggaacccc tatttgttta tttttctaaa tacattcaaa tatgtatccg 660
ctcatgagac aataaccctg ataaatgctt caataatatt gaaaaaggaa gagtatgagt 720
attcaacatt tccgtgtcgc ccttattccc ttttttgcgg cattttgcct tcctgttttt 780
gctcacccag aaacgctggt gaaagtaaaa gatgctgaag atcagttggg tgcacgagtg 840
ggttacatcg aactggatct caacagcggt aagatccttg agagttttcg ccccgaagaa 900
cgttttccaa tgatgagcac ttttaaagtt ctgctatgtg gcgcggtatt atcccgtatt 960
gacgccgggc aagagcaact cggtcgccgc atacactatt ctcagaatga cttggttgag 1020
tactcaccag tcacagaaaa gcatcttacg gatggcatga cagtaagaga attatgcagt 1080
gctgccataa ccatgagtga taacactgcg gccaacttac ttctgacaac gatcggagga 1140
ccgaaggagc taaccgcttt ttttcacaac atgggggatc atgtaactcg ccttgatcgt 1200
tgggaaccgg agctgaatga agccatacca aacgacgagc gtgacaccac gatgcctgta 1260
gcaatggcaa caacgttgcg caaactatta actggcgaac tacttactct agcttcccgg 1320
caacaattaa tagactggat ggaggcggat aaagttgcag gaccacttct gcgctcggcc 1380
cttccggctg gctggtttat tgctgataaa tctggagccg gtgagcgtgg gtctcgcggt 1440
atcattgcag cactggggcc agatggtaag ccctcccgta tcgtagttat ctacacgacg 1500
ggcagtcagg caactatgga tgaacgaaat agacagatcg ctgagatagg tgcctcactg 1560
attaagcatt ggtaactgtc agaccaagtt tactcatata tactttagat tgatttaaaa 1620
cttcattttt aatttaaaag gatctaggtg aagatccttt ttgataatct catgaccaaa 1680
atcccttaac gtgagttttc gttccactga gcgtcagacc ccgtagaaaa gatcaaagga 1740
tcttcttgag atcctttttt tctgcgcgta atctgctgct tgcaaacaaa aaaaccaccg 1800
ctaccagcgg tggtttgttt gccggatcaa gagctaccaa ctctttttcc gaaggtaact 1860
ggcttcagca gagcgcagat accaaatact gtccttctag tgtagccgta gttaggccac 1920
cacttcaaga actctgtagc accgcctaca tacctcgctc tgctaatcct gttaccagtg 1980
gctgctgcca gtggcgataa gtcgtgtctt accgggttgg actcaagacg atagttaccg 2040
gataaggcgc agcggtcggg ctgaacgggg ggttcgtgca cacagcccag cttggagcga 2100
acgacctaca ccgaactgag atacctacag cgtgagcatt gagaaagcgc cacgcttccc 2160
gaagggagaa aggcggacag gtatccggta agcggcaggg tcggaacagg agagcgcacg 2220
agggagcttc caggggggaa cgcctggtat ctttatagtc ctgtcgggtt tcgccacctc 2280
tgacttgagc gtcgattttt gtgatgctcg tcaggggggc cgagcctatg gaaaaacgcc 2340
agcaacgcgg cctttttacg gttcctggcc ttttgctggc cttttgctca catgttcttt 2400
cctgcgttat cccctgattc tgtggataac cgtattaccg cctttgagtg agctgatacc 2460
gctcgccgca gccgaacgac cgagcgcagc gagtcagtga gcgaggaagc ggaagagcgc 2520
ccaatacgca aaccgcctct ccccgcgcgt tggccgattc attaatgcag ctggcacgac 2580
aggtttcccg actggaaagc gggcagtgag cgcaacgcaa ttaatgtgag ttacctcact 2640
cattaggcac cccaggcttt acactttatg cttccggctc ctatgttgtg tggaattgtg 2700
agcggataac aatttcacac aggaaacagc tatgaccatg attacgccaa gctcggaatt 2760
aaccctcact aaagggaaca aaagctgggt acccgacagg ttatcagcaa caacacagtc 2820
atatccattc tcaattagct ctaccacagt gtgtgaacca atgtatccag caccacctgt 2880
aaccaaaaca attttagaag tactttcact ttgtaactga gctgtcattt atattgaatt 2940
ttcaaaaatt cttacttttt ttttggatgg acgcaaagaa gtttaataat catattacat 3000
ggcattacca ccatatacat atccatatac atatccatat ctaatcttac ttatatgttg 3060
tggaaatgta aagagcccca ttatcttagc ctaaaaaaac cttctctttg gaactttcag 3120
taatacgctt aactgctcat tgctatattg aagtacggat tagaagccgc cgagcgggtg 3180
acagccctcc gaaggaagac tctcctccgt gcgtcctcgt cttcaccggt cgcgttcctg 3240
aaacgcagat gtgcctcgcg ccgcactgct ccgaacaata aagattctac aatactagct 3300
tttatggtta tgaagaggaa aaattggcag taacctggcc ccacaaacct tcaaatgaac 3360
gaatcaaatt aacaaccata ggatgataat gcgattagtt ttttagcctt atttctgggg 3420
taattaatca gcgaagcgat gatttttgat ctattaacag atatataaat gcaaaaactg 3480
cataaccact ttaactaata ctttcaacat tttcggtttg tattacttct tattcaaatg 3540
taataaaaga tcgaatccta cttcatacat tttcaattaa gatgcagtta cttcgctgtt 3600
tttcaatatt ttctgttatt gcttcagttt tagcacagga actgacaact atatgcgagc 3660
aaatcccctc accaacttta gaatcgacgc cgtactcttt gtcaacgact actattttgg 3720
ccaacgggaa ggcaatgcaa ggagtttttg aatattacaa atcagtaacg tttgtcagta 3780
attgcggttc tcacccctca acaactagca aaggcagccc cataaacaca cagtatgttt 3840
ttaaggacaa tagctcgacg attgaaggta gatacccata cgacgttcca gactacgctc 3900
tgcaggctag tggtggagga ggctctggtg gaggcggtag cggaggcgga gggtcggcta 3960
gctccatcaa cccatggatt ctgactggtt tcgctgatgc cgaaggatgc ttccgactag 4020
acatccgcaa cgcaaacgat ttaagagccg gatacagaac tagactggcc ttcgaaatcg 4080
tactgcacaa caaggacaaa tcgattctgg agaatatcca gtcgacttgg aaggtcggca 4140
caatctacaa cgcgggcgac aacgcagtca gactgcaagt cacacgtttc gaagatttga 4200
aagtgattat cgaccacttc gagaaatatc cgctgataac acagaaattg ggcgattaca 4260
agttgtttaa acaggcattc agcgtcatgg agaacaaaga acatcttaag gagaatggga 4320
ttaaggagct cgtacgaatc aaagctaaga tgaattgggg tctcaatgac gaattgaaaa 4380
aagcatttcc agagaacatt agcaaagagc gctcccttat caataagaac attccgaatc 4440
tcaaatggct ggctggattc acatctggtg acggctcgtt cgtggtggaa ctaaagaaga 4500
gaagaagccc cgtcaaggta ggagtgcggc tgcgattcag catcacccag cacatcagag 4560
acaagaacct gatgaattca ttgataacat acctaggctg tggtcgtatc gttgagaata 4620
acaaatctga gcacagttgg ctcgaattca ttgtaacaaa attcagcgat atcaacgaca 4680
agatcattcc ggtattccag gaaaatactc tgattggcgt caaactcgag gactttgaag 4740
attggtgcaa ggttgccaaa ttgatcgaag agaagaaaca cctgaccgaa tccggtttgg 4800
atgagattaa gaaaatcaag ctgaacatga acaaaggtcg tgtcttctct agaggcggtt 4860
ccagaagcgg atctggtact ggcgaacaga aactcataag cgaagaagac cttagcggga 4920
ctggagagca aaagttgatt tctgaggagg atttgtcggg aaccggggag cagaagttaa 4980
tcagtgaaga ggatctcagt ggaacgggcg aacaaaagtt gatctcggag gaagacttat 5040
aatgaagatc tgataacaac agtgtagatg taacaaaatc gactttgttc ccactgtact 5100
tttagctcgt acaaaataca atatactttt catttctccg taaacaacat gttttcccat 5160
gtaatatcct tttctatttt tcgttccgtt accaacttta cacatacttt atatagctat 5220
tcacttctat acactaaaaa actaagacaa ttttaatttt gctgcctgcc atatttcaat 5280
ttgttataaa ttcctataat ttatcctatt agtagctaaa aaaagatgaa tgtgaatcga 5340
atcctaagag aattgagctc caattcgccc tatagtgagt cgtattacaa ttcactggcc 5400
gtcgttttac aacgtcgtga ctgggaaaac cctggcgtta cccaacttaa tcgccttgca 5460
gcacatcccc ctttcgccag ctggcgtaat agcgaagagg cccgcaccga tcgcctttcc 5520
caacagttgc gcagcctgaa tggcgaatgg acgcgccctg tagcggcgca ttaagcgcgg 5580
cgggtgtggt ggttacgcgc agcgtgaccg ctacacttgc cagcgcccta gcgcccgctc 5640
ctttcgcttt cttcccttcc tttctcgcca cgttcgccgg ctttccccgt caagctctaa 5700
atcgggggct ccctttaggg ttccgattta gtgctttacg gcacctcgac cccaaaaaac 5760
ttgattaggg tgatggttca cgtagtgggc catcgccctg atagacggtt tttcgccctt 5820
tgacgttgga gtccacgttc tttaatagtg gactcttgtt ccaaactgga acaacactca 5880
accctatctc ggtctattct tttgatttat aagggatttt gccgatttcg gcctattggt 5940
taaaaaatga gctgatttaa caaaaattta acgcgaattt taacaaaata ttaacgttta 6000
caatttcctg atgcggtatt ttctccttac gcatctgtgc ggtatttcac accgcaggca 6060
agtgcacaaa caatacttaa ataaatacta ctcagtaata acctatttct tagcattttt 6120
gacgaaattt gctattttgt tagagtcttt tacaccattt gtctccacac ctccgcttac 6180
atcaacacca ataacgccat ttaatctaag cgcatcacca acattttctg gcgtcagtcc 6240
accagctaac ataaaatgta agctttcggg gctctcttgc cttccaaccc agtcagaaat 6300
cgagttccaa tccaaaagtt cacctgtccc acctgcttct gaatcaaaca agggaataaa 6360
cgaatgaggt ttctgtgaag ctgcactgag tagtatgttg cagtcttttg gaaatacgag 6420
tcttttaata actggcaaac cgaggaactc ttggtattct tgccacgact catctccatg 6480
cagttggacg acatcaatgc cgtaatcatt gaccagagcc aaaacatcct ccttaggttg 6540
attacgaaac acgccaacca agtatttcgg agtgcctgaa ctatttttat atgcttttac 6600
aagacttgaa attttccttg caataaccgg gtcaattgtt ctctttctat tgggcacaca 6660
tataataccc agcaagtcag catcggaatc aagagcacat tctgcggcct ctgtgctctg 6720
caagccgcaa actttcacca atggaccaga actacctgtg aaattaataa cagacatact 6780
ccaagctgcc tttgtgtgct taatcacgta tactcacgtg ctcaatagtc accaatgccc 6840
tccctcttgg ccctctcctt ttcttttttc gaccgaatta attcttaatc ggcaaaaaaa 6900
gaaaagctcc ggatcaagat tgtacgtaag gtgacaagct atttttcaat aaagaatatc 6960
ttccactact gccatctggc gtcataactg caaagtacac atatattacg atgctgtcta 7020
ttaaatgctt cctatattat atatatagta atgtcgttta tggtgcactc tcagtacaat 7080
ctgctctgat gccgcatagt taagccagcc ccgacacccg ccaacacccg ctgacgcgcc 7140
ctgacgggct tgtctgctcc cggcatccgc ttacagacaa gctgtgaccg tctccgggag 7200
ctgcatgtgt cagaggtttt caccgtcatc accgaaacgc gcga 7244
<210> 31
<211> 2748
<212> РНК
<213> Искусственная последовательность
<220>
<223> Получено в лаборатории - иРНК синтезированной megaTAL CBLB.E3
<400> 31
augggauccg cgccaccuaa gaagaaacgc aaagucgugg aucuacgcac gcucggcuac 60
agucagcagc agcaagagaa gaucaaaccg aaggugcguu cgacaguggc gcagcaccac 120
gaggcacugg ugggccaugg guuuacacac gcgcacaucg uugcgcucag ccaacacccg 180
gcagcguuag ggaccgucgc ugucacguau cagcacauaa ucacggcguu gccagaggcg 240
acacacgaag acaucguugg cgucggcaaa cagugguccg gcgcacgcgc ccuggaggcc 300
uugcucacgg augcggggga guugagaggu ccgccguuac aguuggacac aggccaacuu 360
gugaagauug caaaacgugg cggcgugacc gcaauggagg cagugcaugc aucgcgcaau 420
gcacugacgg gugccccccu gaacuuaaca cccgaucaag ugguagcgau agcgucaaac 480
ggcgggggua aacaggcuuu ggagacggua cagcgguuau ugccgguacu cugccaggac 540
cacggauuga caccggacca agugguggcg auugcgucca acaacggagg caagcaggca 600
cuagagacug uccaacggcu ucuucccguu cuuugucagg aucaugggcu aaccccugau 660
cagguagucg cuauagcuuc aaauggaggg ggcaagcaag cacuggagac uguucaacga 720
cuccugccag ugcucugcca agaccacgga cuuacaccag aucaaguggu ugcuauugcc 780
uccaauggug gcgggaaaca agcguuggaa acugugcaga gacuguuacc ugucuugugu 840
caagaccacg gccucacgcc agaucaggug guagccauag cgucgaacau uggugguaag 900
caagcccuug aaacggucca gcgucuucug ccgguguugu gccaggacca cggacuaacg 960
ccggaucagg ucguagccau ugcuucaaau gggggcggca aacaggcgcu agagacaguc 1020
cagcgccucu ugccuguguu augccaggau cacggcuuaa ccccagacca aguuguggcu 1080
auugcaucua acaauggugg caaacaagcc uuggagacag ugcaacgauu acugccuguc 1140
uuaugucagg aucauggccu gacgcccgau cagguagugg caaucgcauc uaacauugga 1200
gguaagcaag cacuggagac uguccagaga uuguuacccg uacuauguca agaucauggu 1260
uugacgccug aucagguugu ugcgauagcc agcaauaacg gagggaaaca ggcucuugaa 1320
accguacagc gacuucuccc agucuugugc caagaucacg ggcuuacucc ugaucaaguc 1380
guagcuaucg ccagcaauaa cgguggaaaa caggcccugg aaaccguaca acgucuccuc 1440
ccaguacuuu gucaagacca cggguugacu ccggaucaag ucgucgcgau cgcgagcaau 1500
ggugggggga agcaggcgcu ggaaacuguu cagagacugc ugccuguacu uugucaggac 1560
cauggucuga caccugacca aguuguggcg auagccagua auaucggggg aaaacaggca 1620
cuagagagca uuguggccca gcugagccgg ccugauccgg cguuggccgc guugaccaac 1680
gaccaccucg ucgccuuggc cugccucggc ggacguccug ccauggaugc agugaaaaag 1740
ggauugccgc acgcgccgga auugaucaga agagucaauc gccguauugg cgaacgcacg 1800
ucccaucgcg uugcgauauc uagaguggga ggaagcucgc gcagagaguc caucaaccca 1860
uggauucuga cugguuucgc ugaugccgaa ggaugcuucc gacuagacau ccgcaacgca 1920
aacgauuuaa gagccggaua cagaacuaga cuggccuucg aaaucguacu gcacaacaag 1980
gacaaaucga uucuggagaa uauccagucg acuuggaagg ucggcacaau cuacaacgcg 2040
ggcgacaacg cagucagacu gcaagucaca cguuucgaag auuugaaagu gauuaucgac 2100
cacuucgaga aauauccgcu gauaacacag aaauugggcg auuacaaguu guuuaaacag 2160
gcauucagcg ucauggagaa caaagaacau cuuaaggaga augggauuaa ggagcucgua 2220
cgaaucaaag cuaagaugaa uuggggucuc aaugacgaau ugaaaaaagc auuuccagag 2280
aacauuagca aagagcgcuc ccuuaucaau aagaacauuc cgaaucucaa auggcuggcu 2340
ggauucacau cuggugacgg cucguucgug guggaacuaa agaagagaag aagccccguc 2400
aagguaggag ugcggcugcg auucagcauc acccagcaca ucagagacaa gaaccugaug 2460
aauucauuga uaacauaccu aggcuguggu cguaucguug agaauaacaa aucugagcac 2520
aguuggcucg aauucauugu aacaaaauuc agcgauauca acgacaagau cauuccggua 2580
uuccaggaaa auacucugau uggcgucaaa cucgaggacu uugaagauug gugcaagguu 2640
gccaaauuga ucgaagagaa gaaacaccug accgaauccg guuuggauga gauuaagaaa 2700
aucaagcuga acaugaacaa aggucguguc uucagcggcc gcugauaa 2748
<210> 32
<211> 2748
<212> РНК
<213> Искусственная последовательность
<220>
<223> Получено в лаборатории - иРНК синтезированной megaTAL CBLB.A8
<400> 32
augggauccg cgccaccuaa gaagaaacgc aaagucgugg aucuacgcac gcucggcuac 60
agucagcagc agcaagagaa gaucaaaccg aaggugcguu cgacaguggc gcagcaccac 120
gaggcacugg ugggccaugg guuuacacac gcgcacaucg uugcgcucag ccaacacccg 180
gcagcguuag ggaccgucgc ugucacguau cagcacauaa ucacggcguu gccagaggcg 240
acacacgaag acaucguugg cgucggcaaa cagugguccg gcgcacgcgc ccuggaggcc 300
uugcucacgg augcggggga guugagaggu ccgccguuac aguuggacac aggccaacuu 360
gugaagauug caaaacgugg cggcgugacc gcaauggagg cagugcaugc aucgcgcaau 420
gcacugacgg gugccccccu gaacuuaaca cccgaucaag ugguagcgau agcgucaaac 480
ggcgggggua aacaggcuuu ggagacggua cagcgguuau ugccgguacu cugccaggac 540
cacggauuga caccggacca agugguggcg auugcgucca acaacggagg caagcaggca 600
cuagagacug uccaacggcu ucuucccguu cuuugucagg aucaugggcu aaccccugau 660
cagguagucg cuauagcuuc aaauggaggg ggcaagcaag cacuggagac uguucaacga 720
cuccugccag ugcucugcca agaccacgga cuuacaccag aucaaguggu ugcuauugcc 780
uccaauggug gcgggaaaca agcguuggaa acugugcaga gacuguuacc ugucuugugu 840
caagaccacg gccucacgcc agaucaggug guagccauag cgucgaacau uggugguaag 900
caagcccuug aaacggucca gcgucuucug ccgguguugu gccaggacca cggacuaacg 960
ccggaucagg ucguagccau ugcuucaaau gggggcggca aacaggcgcu agagacaguc 1020
cagcgccucu ugccuguguu augccaggau cacggcuuaa ccccagacca aguuguggcu 1080
auugcaucua acaauggugg caaacaagcc uuggagacag ugcaacgauu acugccuguc 1140
uuaugucagg aucauggccu gacgcccgau cagguagugg caaucgcauc uaacauugga 1200
gguaagcaag cacuggagac uguccagaga uuguuacccg uacuauguca agaucauggu 1260
uugacgccug aucagguugu ugcgauagcc agcaauaacg gagggaaaca ggcucuugaa 1320
accguacagc gacuucuccc agucuugugc caagaucacg ggcuuacucc ugaucaaguc 1380
guagcuaucg ccagcaauaa cgguggaaaa caggcccugg aaaccguaca acgucuccuc 1440
ccaguacuuu gucaagacca cggguugacu ccggaucaag ucgucgcgau cgcgagcaau 1500
ggugggggga agcaggcgcu ggaaacuguu cagagacugc ugccuguacu uugucaggac 1560
cauggucuga caccugacca aguuguggcg auagccagua auaucggggg aaaacaggca 1620
cuagagagca uuguggccca gcugagccgg ccugauccgg cguuggccgc guugaccaac 1680
gaccaccucg ucgccuuggc cugccucggc ggacguccug ccauggaugc agugaaaaag 1740
ggauugccgc acgcgccgga auugaucaga agagucaauc gccguauugg cgaacgcacg 1800
ucccaucgcg uugcgauauc uagaguggga ggaagcucgc gcagagaguc caucaaccca 1860
uggauucuga cugguuucgc ugaugccgaa ggaugcuucc gacuagacau ccgcaacgca 1920
aacgauuuaa gagccggaua cagaacuaga cuggccuucg aaaucguacu gcacaacaag 1980
gacaaaucga uucuggagaa uauccagucg acuuggaagg ucggcacaau cuacaacgcg 2040
ggcgacaacg cagucagacu gcaagucaca cguuucgaag auuugaaagu gauuaucggc 2100
cacuucgaga aauauccgcu gauaacacag aaauugggcg auuacaaguu guuuaaacag 2160
gcauucagcg ucauggagaa caaagaacau cuuaaggaga augggauuaa ggagcucgua 2220
cgaaucaaag cuaagaugaa uuggggucuc aaugacgaau ugaaaaaagc auuuccagag 2280
aacauuagca aagagcgccc ccuuaucaau aagaacaucc caaaucucaa auggcuggcu 2340
ggauucacau cuggugacgg cucguucaug guggaacuaa ugaagaauaa gaauaacguu 2400
auuguacgug ugcgucugag auucucaauc ucccagcaca ucagagacaa gaaccugaug 2460
aauucauuga uaacauaccu aggcuguggu cguaucguug agaauaacaa aucugagcac 2520
aguuggcucg aauucauugu aacaaaauuc agcgauauca acgacaagau cauuccggua 2580
uuccaggaaa auacucugau uggcgucaaa cucgaggacu uugaagauug gugcaagguu 2640
gccaaauuga ucgaagagaa gaaacaccug accgaauccg guuuggauga gauuaagaaa 2700
aucaagcuga acaugaacaa aggucguguc uucagcggcc gcugauaa 2748
<210> 33
<211> 2748
<212> РНК
<213> Искусственная последовательность
<220>
<223> Получено в лаборатории - иРНК оптимизированной по кодонам megaTAL CBLB.E3
<400> 33
augggauccg cccccccgaa aaagaagcgg aaaguggucg accuuagaac ccugggauac 60
ucccagcagc agcaggaaaa gauuaagccg aagguccggu caacaguggc ccagcaccac 120
gaggcacuug ugggacacgg auuuacccau gcccauaucg ucgcccuuuc ccagcauccg 180
gcggcucugg gaaccgucgc cgugaccuac cagcauauaa ucacugcgcu gccugaagcu 240
acccacgagg auauuguggg agugggaaag caguggagcg gagcgagagc gcuggaagcc 300
cuccugaccg acgcaggaga gcuccgggga ccuccacucc aacucgacac uggacagcuu 360
gugaagauug ccaagagagg cggcgucacc gcuauggagg cggugcacgc uucccggaac 420
gcucugaccg gagccccucu gaaucugacu ccagaccaag ucguggcaau cgcauccaac 480
ggcgggggca agcaagcucu ggaaacagug caacgccucc ugcccgugcu gugccaggac 540
cacggacuca cccccgauca aguaguggcc aucgcuucca acaacggugg aaaacaggcu 600
cucgaaacag uccagcggcu guugccaguc cugugccaag accacggguu gacgccugac 660
caaguggugg ccauagcguc gaauggugga ggcaagcaag ccuuggaaac cguucagagg 720
uugcucccag ugcuuugcca ggaucacgga cugacaccug accagguggu cgcaauugcc 780
uccaacggag gggggaagca ggcccucgaa acggugcaac ggcugcugcc ugugcucugu 840
caggaccacg gcuugacccc cgaccaagug guggccaucg cgagcaauau ugguggaaag 900
caggccuugg agacugugca gagacuucug ccggugcucu gccaagauca uggccuuacc 960
ccagaucaag uggucgcgau cgcuucgaac ggaggcggca aacaggcccu ggagacugug 1020
caaagacugc ugccgguguu gugucaggau cauggauuga cucccgauca ggugguggcg 1080
aucgccucaa auaacggagg aaaacaagcc cucgagacug uucagcggcu acugcccguc 1140
cugugucagg accauggcuu gacacccgac cagguagucg ccaucgcguc caacaucggc 1200
ggcaagcagg cacucgaaac cgugcagaga cugcucccgg ugcugugcca ggaccacggu 1260
cugacuccgg aucaggucgu ugcuaucgcc ucgaacaacg ggggaaagca agcgcuugag 1320
acuguccaac gccuucugcc cgucuugugu caagaucacg ggcuuacucc ggaccagguc 1380
guggcuauug ccagcaacaa cggcgggaag caagcccugg aaacugugca gcgccuguug 1440
ccggucuugu gccaagacca cgggcucacc ccggaucaag ucgucgcuau cgcaucgaac 1500
gguggaggua aacaagcacu ggaaaccguc cagaggcugc uuccgguccu cugucaagac 1560
cauggccuca cuccugauca aguggucgcc auagccagca auaucggugg gaaacaggca 1620
cuggagagca ucgucgccca gcuuucccgg ccagauccgg cccuggccgc uuugacgaac 1680
gaccaucugg uggcccuggc uugccugggg ggaaggccag cgauggacgc cgugaagaag 1740
ggacugcccc augccccuga gcugauucgg cgagugaaca ggcggaucgg cgaacggacc 1800
ucccaccgcg uggcgaucuc cagagucggg ggaucgucca gacgcgaguc caucaaccca 1860
uggauccuca ccggauucgc cgaugcagaa ggguguuucc ggcuggauau cagaaacgcg 1920
aacgaucucc gugcugggua ccggaccaga cuggccuucg agaucgugcu gcacaacaag 1980
gacaagagca uucucgaaaa cauccagucg accuggaaag ugggaacuau cuacaacgcg 2040
ggagauaacg cggugcgccu gcaagucacc agguucgagg aucucaaggu gaucaucgau 2100
cacuucgaga aguacccucu gaucacccaa aagcugggug auuacaagcu guucaagcag 2160
gcguucuccg ucauggagaa caaggaacac cucaaggaaa acggcauuaa agagcucgug 2220
agaaucaagg ccaagaugaa cuggggccug aacgacgaac ucaagaaagc cuuccccgag 2280
aacaucucca aggagcgguc ccugaucaac aagaacaucc ccaaccugaa guggcucgcg 2340
ggcuucacca gcggagaugg cucguucgug gucgaacuga agaagaggcg guccccagug 2400
aaggugggag ugcgacugcg guucuccauu acucagcaca uccgcgacaa gaaccugaug 2460
aacucgcuga ucaccuaccu uggaugcggc agaaucgugg agaauaacaa guccgagcac 2520
uccuggcugg aguucaucgu gaccaaguuu ucggauauua augacaagau uauuccggug 2580
uuccaggaaa acacccugau uggugucaaa cuggaggacu uugaggacug gugcaaggug 2640
gccaagcuua ucgaagagaa gaagcaccug accgaguccg ggcuggacga gaucaagaag 2700
aucaagcuga acaugaacaa gggucgcgug uucuccgguc gcugauag 2748
<210> 34
<211> 2748
<212> РНК
<213> Искусственная последовательность
<220>
<223> Получено в лаборатории - иРНК синтезированной megaTAL CBLB.D2
<400> 34
augggauccg cgccaccuaa gaagaaacgc aaagucgugg aucuacgcac gcucggcuac 60
agucagcagc agcaagagaa gaucaaaccg aaggugcguu cgacaguggc gcagcaccac 120
gaggcacugg ugggccaugg guuuacacac gcgcacaucg uugcgcucag ccaacacccg 180
gcagcguuag ggaccgucgc ugucacguau cagcacauaa ucacggcguu gccagaggcg 240
acacacgaag acaucguugg cgucggcaaa cagugguccg gcgcacgcgc ccuggaggcc 300
uugcucacgg augcggggga guugagaggu ccgccguuac aguuggacac aggccaacuu 360
gugaagauug caaaacgugg cggcgugacc gcaauggagg cagugcaugc aucgcgcaau 420
gcacugacgg gugccccccu gaacuuaaca cccgaucaag ugguagcgau agcgucaaac 480
ggcgggggua aacaggcuuu ggagacggua cagcgguuau ugccgguacu cugccaggac 540
cacggauuga caccggacca agugguggcg auugcgucca acaacggagg caagcaggca 600
cuagagacug uccaacggcu ucuucccguu cuuugucagg aucaugggcu aaccccugau 660
cagguagucg cuauagcuuc aaauggaggg ggcaagcaag cacuggagac uguucaacga 720
cuccugccag ugcucugcca agaccacgga cuuacaccag aucaaguggu ugcuauugcc 780
uccaauggug gcgggaaaca agcguuggaa acugugcaga gacuguuacc ugucuugugu 840
caagaccacg gccucacgcc agaucaggug guagccauag cgucgaacau uggugguaag 900
caagcccuug aaacggucca gcgucuucug ccgguguugu gccaggacca cggacuaacg 960
ccggaucagg ucguagccau ugcuucaaau gggggcggca aacaggcgcu agagacaguc 1020
cagcgccucu ugccuguguu augccaggau cacggcuuaa ccccagacca aguuguggcu 1080
auugcaucua acaauggugg caaacaagcc uuggagacag ugcaacgauu acugccuguc 1140
uuaugucagg aucauggccu gacgcccgau cagguagugg caaucgcauc uaacauugga 1200
gguaagcaag cacuggagac uguccagaga uuguuacccg uacuauguca agaucauggu 1260
uugacgccug aucagguugu ugcgauagcc agcaauaacg gagggaaaca ggcucuugaa 1320
accguacagc gacuucuccc agucuugugc caagaucacg ggcuuacucc ugaucaaguc 1380
guagcuaucg ccagcaauaa cgguggaaaa caggcccugg aaaccguaca acgucuccuc 1440
ccaguacuuu gucaagacca cggguugacu ccggaucaag ucgucgcgau cgcgagcaau 1500
ggugggggga agcaggcgcu ggaaacuguu cagagacugc ugccuguacu uugucaggac 1560
cauggucuga caccugacca aguuguggcg auagccagua auaucggggg aaaacaggca 1620
cuagagagca uuguggccca gcugagccgg ccugauccgg cguuggccgc guugaccaac 1680
gaccaccucg ucgccuuggc cugccucggc ggacguccug ccauggaugc agugaaaaag 1740
ggauugccgc acgcgccgga auugaucaga agagucaauc gccguauugg cgaacgcacg 1800
ucccaucgcg uugcgauauc uagaguggga ggaagcucgc gcagagaguc caucaaccca 1860
uggauucuga cugguuucgc ugaugccgaa ggaugcuucc gacuagacau ccacaacgca 1920
aacguauuga ggucugguua cagaacuaga cuguccuucg aaaucguacu gcacaacaag 1980
gacaaaucga uucuggagaa uauccagucg acuuggaagg ucggcaaaau cuacaacgcg 2040
ggcgacaacg cagucagacu gcaagucaca cguuucgaag auuugaaagu gauuaucgac 2100
cacuucgaga aauauccgcu gauaacacag aaauugggcg auuacaaguu guuuaaacag 2160
gcauucagcg ucauggagaa caaagaacau cuuaaggaga augggauuaa ggagcucgua 2220
cgaaucaaag cuaagaugaa uuggggucuc aaugacgaau ugaaaaaagc auuuccagag 2280
aacauuagca aagagcgccc ccuuaucaau aagaacauuc cgaaucucaa auggcuggcu 2340
ggauucacau cuggugacgg cucguucaug guggaacuaa ugaagaauaa gaauaacguu 2400
auuguacgug ugcgucugag auucucaauc ucccagcaca ucagagacaa gaaccugaug 2460
aauucauuga uaacauaccu aggcuguggu cguaucguug agaauaacaa aucugagcac 2520
aguuggcucg aauucauugu aacaaaauuc agcgauauca acgacaagau cauuccggua 2580
uuccaggaaa auacucugau uggcgucaaa cucgaggacu uugaagauug gugcaagguu 2640
gccaaauuga ucgaagagaa gaaacaccug accgaauccg guuuggauga gauuaagaaa 2700
aucaagcuga acaugaacaa aggucguguc uucagcggcc gcugauaa 2748
<210> 35
<211> 2748
<212> РНК
<213> Искусственная последовательность
<220>
<223> Получено в лаборатории - иРНК синтезированной megaTAL CBLB.B5
<400> 35
augggauccg cgccaccuaa gaagaaacgc aaagucgugg aucuacgcac gcucggcuac 60
agucagcagc agcaagagaa gaucaaaccg aaggugcguu cgacaguggc gcagcaccac 120
gaggcacugg ugggccaugg guuuacacac gcgcacaucg uugcgcucag ccaacacccg 180
gcagcguuag ggaccgucgc ugucacguau cagcacauaa ucacggcguu gccagaggcg 240
acacacgaag acaucguugg cgucggcaaa cagugguccg gcgcacgcgc ccuggaggcc 300
uugcucacgg augcggggga guugagaggu ccgccguuac aguuggacac aggccaacuu 360
gugaagauug caaaacgugg cggcgugacc gcaauggagg cagugcaugc aucgcgcaau 420
gcacugacgg gugccccccu gaacuuaaca cccgaucaag ugguagcgau agcgucaaac 480
ggcgggggua aacaggcuuu ggagacggua cagcgguuau ugccgguacu cugccaggac 540
cacggauuga caccggacca agugguggcg auugcgucca acaacggagg caagcaggca 600
cuagagacug uccaacggcu ucuucccguu cuuugucagg aucaugggcu aaccccugau 660
cagguagucg cuauagcuuc aaauggaggg ggcaagcaag cacuggagac uguucaacga 720
cuccugccag ugcucugcca agaccacgga cuuacaccag aucaaguggu ugcuauugcc 780
uccaauggug gcgggaaaca agcguuggaa acugugcaga gacuguuacc ugucuugugu 840
caagaccacg gccucacgcc agaucaggug guagccauag cgucgaacau uggugguaag 900
caagcccuug aaacggucca gcgucuucug ccgguguugu gccaggacca cggacuaacg 960
ccggaucagg ucguagccau ugcuucaaau gggggcggca aacaggcgcu agagacaguc 1020
cagcgccucu ugccuguguu augccaggau cacggcuuaa ccccagacca aguuguggcu 1080
auugcaucua acaauggugg caaacaagcc uuggagacag ugcaacgauu acugccuguc 1140
uuaugucagg aucauggccu gacgcccgau cagguagugg caaucgcauc uaacauugga 1200
gguaagcaag cacuggagac uguccagaga uuguuacccg uacuauguca agaucauggu 1260
uugacgccug aucagguugu ugcgauagcc agcaauaacg gagggaaaca ggcucuugaa 1320
accguacagc gacuucuccc agucuugugc caagaucacg ggcuuacucc ugaucaaguc 1380
guagcuaucg ccagcaauaa cgguggaaaa caggcccugg aaaccguaca acgucuccuc 1440
ccaguacuuu gucaagacca cggguugacu ccggaucaag ucgucgcgau cgcgagcaau 1500
ggugggggga agcaggcgcu ggaaacuguu cagagacugc ugccuguacu uugucaggac 1560
cauggucuga caccugacca aguuguggcg auagccagua auaucggggg aaaacaggca 1620
cuagagagca uuguggccca gcugagccgg ccugauccgg cguuggccgc guugaccaac 1680
gaccaccucg ucgccuuggc cugccucggc ggacguccug ccauggaugc agugaaaaag 1740
ggauugccgc acgcgccgga auugaucaga agagucaauc gccguauugg cgaacgcacg 1800
ucccaucgcg uugcgauauc uagaguggga ggaagcucgc gcagagaguc caucaaccca 1860
uggauucuga cugguuucgc ugaugccgaa ggaugcuucc gacuagacau ccacaacgca 1920
aacguauuga ggucugguua cagaacuaga cuguccuucg aaaucguacu gcacaacaag 1980
gacaaaucga uucuggagaa uauccagucg acuuggaagg ucggcacaau cuacaacgcg 2040
ggcgacaacg cagucagacu gcaagucaca cguuucgaag auuugaaagu gauuaucgac 2100
cacuucgaga aauauccgcu gauaacacag aaauugggcg auuacaaguu guuuaaacag 2160
gcauucagcc ucauggagaa caaagaacau cuuaaggaga augggauuaa ggagcucgua 2220
cgaaucaaag cuaagaugaa uuggggucuc aaugacgaau ugaaaaaagc auuuccagag 2280
aacauuagca aagagcgccc ccuuaucaau aagaacauuc cgaaucucaa auggcuggcu 2340
ggauucacau cuggugacgg cucguucgug guggaacuaa agaagagaag aagccccguc 2400
aagguaggag ugcggcugcg auucggcauc acccagcaca ucagagacaa gaaccugaug 2460
aauucauuga uaacauaccu aggcuguggu cguaucguug agaauaacaa aucugagcac 2520
aguuggcucg aauucauugu aacaaaauuc agcgauauca acgacaagau cauuccggua 2580
uuccaggaaa auacucugau uggcgucaaa cucgaggacu uugaagauug gugcaagguu 2640
gccaaauuga ucgaagagaa gaaacaccug accgaauccg guuuggauga gauuaagaaa 2700
aucaagcuga acaugaacaa aggucguguc uucagcggcc gcugauaa 2748
<210> 36
<211> 2748
<212> РНК
<213> Искусственная последовательность
<220>
<223> Получено в лаборатории - иРНК синтезированной megaTAL CBLB.F6
<400> 36
augggauccg cgccaccuaa gaagaaacgc aaagucgugg aucuacgcac gcucggcuac 60
agucagcagc agcaagagaa gaucaaaccg aaggugcguu cgacaguggc gcagcaccac 120
gaggcacugg ugggccaugg guuuacacac gcgcacaucg uugcgcucag ccaacacccg 180
gcagcguuag ggaccgucgc ugucacguau cagcacauaa ucacggcguu gccagaggcg 240
acacacgaag acaucguugg cgucggcaaa cagugguccg gcgcacgcgc ccuggaggcc 300
uugcucacgg augcggggga guugagaggu ccgccguuac aguuggacac aggccaacuu 360
gugaagauug caaaacgugg cggcgugacc gcaauggagg cagugcaugc aucgcgcaau 420
gcacugacgg gugccccccu gaacuuaaca cccgaucaag ugguagcgau agcgucaaac 480
ggcgggggua aacaggcuuu ggagacggua cagcgguuau ugccgguacu cugccaggac 540
cacggauuga caccggacca agugguggcg auugcgucca acaacggagg caagcaggca 600
cuagagacug uccaacggcu ucuucccguu cuuugucagg aucaugggcu aaccccugau 660
cagguagucg cuauagcuuc aaauggaggg ggcaagcaag cacuggagac uguucaacga 720
cuccugccag ugcucugcca agaccacgga cuuacaccag aucaaguggu ugcuauugcc 780
uccaauggug gcgggaaaca agcguuggaa acugugcaga gacuguuacc ugucuugugu 840
caagaccacg gccucacgcc agaucaggug guagccauag cgucgaacau uggugguaag 900
caagcccuug aaacggucca gcgucuucug ccgguguugu gccaggacca cggacuaacg 960
ccggaucagg ucguagccau ugcuucaaau gggggcggca aacaggcgcu agagacaguc 1020
cagcgccucu ugccuguguu augccaggau cacggcuuaa ccccagacca aguuguggcu 1080
auugcaucua acaauggugg caaacaagcc uuggagacag ugcaacgauu acugccuguc 1140
uuaugucagg aucauggccu gacgcccgau cagguagugg caaucgcauc uaacauugga 1200
gguaagcaag cacuggagac uguccagaga uuguuacccg uacuauguca agaucauggu 1260
uugacgccug aucagguugu ugcgauagcc agcaauaacg gagggaaaca ggcucuugaa 1320
accguacagc gacuucuccc agucuugugc caagaucacg ggcuuacucc ugaucaaguc 1380
guagcuaucg ccagcaauaa cgguggaaaa caggcccugg aaaccguaca acgucuccuc 1440
ccaguacuuu gucaagacca cggguugacu ccggaucaag ucgucgcgau cgcgagcaau 1500
ggugggggga agcaggcgcu ggaaacuguu cagagacugc ugccuguacu uugucaggac 1560
cauggucuga caccugacca aguuguggcg auagccagua auaucggggg aaaacaggca 1620
cuagagagca uuguggccca gcugagccgg ccugauccgg cguuggccgc guugaccaac 1680
gaccaccucg ucgccuuggc cugccucggc ggacguccug ccauggaugc agugaaaaag 1740
ggauugccgc acgcgccgga auugaucaga agagucaauc gccguauugg cgaacgcacg 1800
ucccaucgcg uugcgauauc uagaguggga ggaagcucgc gcagagaguc caucaaccca 1860
uggauucuga cugguuucgc ugaugccgaa ggaugcuucc gacuagacau ccgcaacgca 1920
aacgauuuaa gagccggaua cagaacuaga cuggccuucg aaaucguacu gcacaacaag 1980
gacaaaucga uucuggagaa uauccagucg acuuggaagg ucggcacaau cuacaacgcg 2040
ggcgacaacg cagucagacu gcaagucaca cguuucgaag auuugaaagu gauuaucgac 2100
cacuucgaga aauauccgcu gauaacacag aaauugggcg auuacaaguu guuuaaacag 2160
gcauucagcg ucauggagaa caaagaacau cuuaaggaga augggauuaa ggagcucgua 2220
cgaaucaaag cuaagaugaa uuggggucuc aaugacgaau ugaaaaaagc auuuccagag 2280
aacauuagca aagagcgccc ccuuaucaau aagaacauuc cgaaucucaa auggcuggcu 2340
ggauucacau cuggugacgg cucguucaug guggaacuaa ugaagaauaa gaauaacguu 2400
auuguacgug ugcgucugag auucucaauc ucccagcaca ucagagacaa gaaccugaug 2460
aauucauuga uaacauaccu aggcuguggu cguaucguug agaauaacaa aucugagcac 2520
aguuggcucg aauucauugu aacaaaauuc agcgauauca acgacaagau cauuccggua 2580
uuccaggaaa auacucugau uggcgucaaa cucgaggacu uugaagauug gugcaagguu 2640
gccaaauuga ucgaagagaa gaaacaccug accgaauccg guuuggauga gauuaagaaa 2700
aucaagcuga acaugaacaa aggucguguc uucagcggcc gcugauaa 2748
<210> 37
<211> 711
<212> РНК
<213> Mus musculus
<400> 37
augucugagc caccucgggc ugagaccuuu guauuccugg accuagaagc cacugggcuc 60
ccaaacaugg acccugagau ugcagagaua ucccuuuuug cuguucaccg cucuucccug 120
gagaacccag aacgggauga uucugguucc uuggugcugc cccguguucu ggacaagcuc 180
acacugugca ugugcccgga gcgccccuuu acugccaagg ccagugagau uacugguuug 240
agcagcgaaa gccugaugca cugcgggaag gcugguuuca auggcgcugu gguaaggaca 300
cugcagggcu uccuaagccg ccaggagggc cccaucugcc uuguggccca caauggcuuc 360
gauuaugacu ucccacugcu gugcacggag cuacaacguc ugggugccca ucugccccaa 420
gacacugucu gccuggacac acugccugca uugcggggcc uggaccgugc ucacagccac 480
ggcaccaggg cucaaggccg caaaagcuac agccuggcca gucucuucca ccgcuacuuc 540
caggcugaac ccagugcugc ccauucagca gaaggugaug ugcacacccu gcuucugauc 600
uuccugcauc gugcuccuga gcugcucgcc ugggcagaug agcaggcccg cagcugggcu 660
cauauugagc ccauguacgu gccaccugau gguccaagcc ucgaagccug a 711
<210> 38
<211> 236
<212> PRT
<213> Mus musculus
<400> 38
Met Ser Glu Pro Pro Arg Ala Glu Thr Phe Val Phe Leu Asp Leu Glu
1 5 10 15
Ala Thr Gly Leu Pro Asn Met Asp Pro Glu Ile Ala Glu Ile Ser Leu
20 25 30
Phe Ala Val His Arg Ser Ser Leu Glu Asn Pro Glu Arg Asp Asp Ser
35 40 45
Gly Ser Leu Val Leu Pro Arg Val Leu Asp Lys Leu Thr Leu Cys Met
50 55 60
Cys Pro Glu Arg Pro Phe Thr Ala Lys Ala Ser Glu Ile Thr Gly Leu
65 70 75 80
Ser Ser Glu Ser Leu Met His Cys Gly Lys Ala Gly Phe Asn Gly Ala
85 90 95
Val Val Arg Thr Leu Gln Gly Phe Leu Ser Arg Gln Glu Gly Pro Ile
100 105 110
Cys Leu Val Ala His Asn Gly Phe Asp Tyr Asp Phe Pro Leu Leu Cys
115 120 125
Thr Glu Leu Gln Arg Leu Gly Ala His Leu Pro Gln Asp Thr Val Cys
130 135 140
Leu Asp Thr Leu Pro Ala Leu Arg Gly Leu Asp Arg Ala His Ser His
145 150 155 160
Gly Thr Arg Ala Gln Gly Arg Lys Ser Tyr Ser Leu Ala Ser Leu Phe
165 170 175
His Arg Tyr Phe Gln Ala Glu Pro Ser Ala Ala His Ser Ala Glu Gly
180 185 190
Asp Val His Thr Leu Leu Leu Ile Phe Leu His Arg Ala Pro Glu Leu
195 200 205
Leu Ala Trp Ala Asp Glu Gln Ala Arg Ser Trp Ala His Ile Glu Pro
210 215 220
Met Tyr Val Pro Pro Asp Gly Pro Ser Leu Glu Ala
225 230 235
<210> 39
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> Примерная линкерная последовательность
<400> 39
Gly Gly Gly
1
<210> 40
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Примерная линкерная последовательность
<400> 40
Asp Gly Gly Gly Ser
1 5
<210> 41
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Примерная линкерная последовательность
<400> 41
Thr Gly Glu Lys Pro
1 5
<210> 42
<211> 4
<212> PRT
<213> Искусственная последовательность
<220>
<223> Примерная линкерная последовательность
<400> 42
Gly Gly Arg Arg
1
<210> 43
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Примерная линкерная последовательность
<400> 43
Gly Gly Gly Gly Ser
1 5
<210> 44
<211> 14
<212> PRT
<213> Искусственная последовательность
<220>
<223> Примерная линкерная последовательность
<400> 44
Glu Gly Lys Ser Ser Gly Ser Gly Ser Glu Ser Lys Val Asp
1 5 10
<210> 45
<211> 18
<212> PRT
<213> Искусственная последовательность
<220>
<223> Примерная линкерная последовательность
<400> 45
Lys Glu Ser Gly Ser Val Ser Ser Glu Gln Leu Ala Gln Phe Arg Ser
1 5 10 15
Leu Asp
<210> 46
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> Примерная линкерная последовательность
<400> 46
Gly Gly Arg Arg Gly Gly Gly Ser
1 5
<210> 47
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> Примерная линкерная последовательность
<400> 47
Leu Arg Gln Arg Asp Gly Glu Arg Pro
1 5
<210> 48
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Примерная линкерная последовательность
<400> 48
Leu Arg Gln Lys Asp Gly Gly Gly Ser Glu Arg Pro
1 5 10
<210> 49
<211> 16
<212> PRT
<213> Искусственная последовательность
<220>
<223> Примерная линкерная последовательность
<400> 49
Leu Arg Gln Lys Asp Gly Gly Gly Ser Gly Gly Gly Ser Glu Arg Pro
1 5 10 15
<210> 50
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность, расщепляемая протеазой TEV
<220>
<221> misc_feature
<222> (2)..(3)
<223> Xaa представляет собой любую аминокислоту
<220>
<221> misc_feature
<222> (5)..(5)
<223> Xaa представляет собой любую аминокислоту
<220>
<221> MISC_FEATURE
<222> (7)..(7)
<223> Xaa = Gly или Ser
<400> 50
Glu Xaa Xaa Tyr Xaa Gln Xaa
1 5
<210> 51
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность, расщепляемая протеазой TEV
<400> 51
Glu Asn Leu Tyr Phe Gln Gly
1 5
<210> 52
<211> 7
<212> PRT
<213> Искусственная последовательность
<220>
<223> Последовательность, расщепляемая протеазой TEV
<400> 52
Glu Asn Leu Tyr Phe Gln Ser
1 5
<210> 53
<211> 22
<212> PRT
<213> Искусственная последовательность
<220>
<223> Саморасщепляющийся полипептид, содержащий сайт 2A
<400> 53
Gly Ser Gly Ala Thr Asn Phe Ser Leu Leu Lys Gln Ala Gly Asp Val
1 5 10 15
Glu Glu Asn Pro Gly Pro
20
<210> 54
<211> 19
<212> PRT
<213> Искусственная последовательность
<220>
<223> Саморасщепляющийся полипептид, содержащий сайт 2A
<400> 54
Ala Thr Asn Phe Ser Leu Leu Lys Gln Ala Gly Asp Val Glu Glu Asn
1 5 10 15
Pro Gly Pro
<210> 55
<211> 14
<212> PRT
<213> Искусственная последовательность
<220>
<223> Саморасщепляющийся полипептид, содержащий сайт 2A
<400> 55
Leu Leu Lys Gln Ala Gly Asp Val Glu Glu Asn Pro Gly Pro
1 5 10
<210> 56
<211> 21
<212> PRT
<213> Искусственная последовательность
<220>
<223> Саморасщепляющийся полипептид, содержащий сайт 2A
<400> 56
Gly Ser Gly Glu Gly Arg Gly Ser Leu Leu Thr Cys Gly Asp Val Glu
1 5 10 15
Glu Asn Pro Gly Pro
20
<210> 57
<211> 18
<212> PRT
<213> Искусственная последовательность
<220>
<223> Саморасщепляющийся полипептид, содержащий сайт 2A
<400> 57
Glu Gly Arg Gly Ser Leu Leu Thr Cys Gly Asp Val Glu Glu Asn Pro
1 5 10 15
Gly Pro
<210> 58
<211> 13
<212> PRT
<213> Искусственная последовательность
<220>
<223> Саморасщепляющийся полипептид, содержащий сайт 2A
<400> 58
Leu Leu Thr Cys Gly Asp Val Glu Glu Asn Pro Gly Pro
1 5 10
<210> 59
<211> 23
<212> PRT
<213> Искусственная последовательность
<220>
<223> Саморасщепляющийся полипептид, содержащий сайт 2A
<400> 59
Gly Ser Gly Gln Cys Thr Asn Tyr Ala Leu Leu Lys Leu Ala Gly Asp
1 5 10 15
Val Glu Ser Asn Pro Gly Pro
20
<210> 60
<211> 20
<212> PRT
<213> Искусственная последовательность
<220>
<223> Саморасщепляющийся полипептид, содержащий сайт 2A
<400> 60
Gln Cys Thr Asn Tyr Ala Leu Leu Lys Leu Ala Gly Asp Val Glu Ser
1 5 10 15
Asn Pro Gly Pro
20
<210> 61
<211> 14
<212> PRT
<213> Искусственная последовательность
<220>
<223> Саморасщепляющийся полипептид, содержащий сайт 2A
<400> 61
Leu Leu Lys Leu Ala Gly Asp Val Glu Ser Asn Pro Gly Pro
1 5 10
<210> 62
<211> 25
<212> PRT
<213> Искусственная последовательность
<220>
<223> Саморасщепляющийся полипептид, содержащий сайт 2A
<400> 62
Gly Ser Gly Val Lys Gln Thr Leu Asn Phe Asp Leu Leu Lys Leu Ala
1 5 10 15
Gly Asp Val Glu Ser Asn Pro Gly Pro
20 25
<210> 63
<211> 22
<212> PRT
<213> Искусственная последовательность
<220>
<223> Саморасщепляющийся полипептид, содержащий сайт 2A
<400> 63
Val Lys Gln Thr Leu Asn Phe Asp Leu Leu Lys Leu Ala Gly Asp Val
1 5 10 15
Glu Ser Asn Pro Gly Pro
20
<210> 64
<211> 14
<212> PRT
<213> Искусственная последовательность
<220>
<223> Саморасщепляющийся полипептид, содержащий сайт 2A
<400> 64
Leu Leu Lys Leu Ala Gly Asp Val Glu Ser Asn Pro Gly Pro
1 5 10
<210> 65
<211> 19
<212> PRT
<213> Искусственная последовательность
<220>
<223> Саморасщепляющийся полипептид, содержащий сайт 2A
<400> 65
Leu Leu Asn Phe Asp Leu Leu Lys Leu Ala Gly Asp Val Glu Ser Asn
1 5 10 15
Pro Gly Pro
<210> 66
<211> 19
<212> PRT
<213> Искусственная последовательность
<220>
<223> Саморасщепляющийся полипептид, содержащий сайт 2A
<400> 66
Thr Leu Asn Phe Asp Leu Leu Lys Leu Ala Gly Asp Val Glu Ser Asn
1 5 10 15
Pro Gly Pro
<210> 67
<211> 14
<212> PRT
<213> Искусственная последовательность
<220>
<223> Саморасщепляющийся полипептид, содержащий сайт 2A
<400> 67
Leu Leu Lys Leu Ala Gly Asp Val Glu Ser Asn Pro Gly Pro
1 5 10
<210> 68
<211> 17
<212> PRT
<213> Искусственная последовательность
<220>
<223> Саморасщепляющийся полипептид, содержащий сайт 2A
<400> 68
Asn Phe Asp Leu Leu Lys Leu Ala Gly Asp Val Glu Ser Asn Pro Gly
1 5 10 15
Pro
<210> 69
<211> 20
<212> PRT
<213> Искусственная последовательность
<220>
<223> Саморасщепляющийся полипептид, содержащий сайт 2A
<400> 69
Gln Leu Leu Asn Phe Asp Leu Leu Lys Leu Ala Gly Asp Val Glu Ser
1 5 10 15
Asn Pro Gly Pro
20
<210> 70
<211> 24
<212> PRT
<213> Искусственная последовательность
<220>
<223> Саморасщепляющийся полипептид, содержащий сайт 2A
<400> 70
Ala Pro Val Lys Gln Thr Leu Asn Phe Asp Leu Leu Lys Leu Ala Gly
1 5 10 15
Asp Val Glu Ser Asn Pro Gly Pro
20
<210> 71
<211> 40
<212> PRT
<213> Искусственная последовательность
<220>
<223> Саморасщепляющийся полипептид, содержащий сайт 2A
<400> 71
Val Thr Glu Leu Leu Tyr Arg Met Lys Arg Ala Glu Thr Tyr Cys Pro
1 5 10 15
Arg Pro Leu Leu Ala Ile His Pro Thr Glu Ala Arg His Lys Gln Lys
20 25 30
Ile Val Ala Pro Val Lys Gln Thr
35 40
<210> 72
<211> 18
<212> PRT
<213> Искусственная последовательность
<220>
<223> Саморасщепляющийся полипептид, содержащий сайт 2A
<400> 72
Leu Asn Phe Asp Leu Leu Lys Leu Ala Gly Asp Val Glu Ser Asn Pro
1 5 10 15
Gly Pro
<210> 73
<211> 40
<212> PRT
<213> Искусственная последовательность
<220>
<223> Саморасщепляющийся полипептид, содержащий сайт 2A
<400> 73
Leu Leu Ala Ile His Pro Thr Glu Ala Arg His Lys Gln Lys Ile Val
1 5 10 15
Ala Pro Val Lys Gln Thr Leu Asn Phe Asp Leu Leu Lys Leu Ala Gly
20 25 30
Asp Val Glu Ser Asn Pro Gly Pro
35 40
<210> 74
<211> 33
<212> PRT
<213> Искусственная последовательность
<220>
<223> Саморасщепляющийся полипептид, содержащий сайт 2A
<400> 74
Glu Ala Arg His Lys Gln Lys Ile Val Ala Pro Val Lys Gln Thr Leu
1 5 10 15
Asn Phe Asp Leu Leu Lys Leu Ala Gly Asp Val Glu Ser Asn Pro Gly
20 25 30
Pro
<210> 75
<211> 10
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Консенсусная последовательность Козак
<400> 75
gccrccatgg 10
<210> 76
<211> 22
<212> ДНК
<213> Homo sapiens
<400> 76
tggggatggg aatatcttac ag 22
<210> 77
<211> 293
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтезированный вариант I-OnuI CBLB.E3
<400> 77
Ser Ile Asn Pro Trp Ile Leu Thr Gly Phe Ala Asp Ala Glu Gly Cys
1 5 10 15
Phe Arg Leu Asp Ile Arg Asn Ala Asn Asp Leu Arg Ala Gly Tyr Arg
20 25 30
Thr Arg Leu Ala Phe Glu Ile Val Leu His Asn Lys Asp Lys Ser Ile
35 40 45
Leu Glu Asn Ile Gln Ser Thr Trp Lys Val Gly Thr Ile Tyr Asn Ala
50 55 60
Gly Asp Asn Ala Val Arg Leu Gln Val Thr Arg Phe Glu Asp Leu Lys
65 70 75 80
Val Ile Ile Asp His Phe Glu Lys Tyr Pro Leu Ile Thr Gln Lys Leu
85 90 95
Gly Asp Tyr Lys Leu Phe Lys Gln Ala Phe Ser Val Met Glu Asn Lys
100 105 110
Glu His Leu Lys Glu Asn Gly Ile Lys Glu Leu Val Arg Ile Lys Ala
115 120 125
Lys Met Asn Trp Gly Leu Asn Asp Glu Leu Lys Lys Ala Phe Pro Glu
130 135 140
Asn Ile Ser Lys Glu Arg Ser Leu Ile Asn Lys Asn Ile Pro Asn Leu
145 150 155 160
Lys Trp Leu Ala Gly Phe Thr Ser Gly Asp Gly Ser Phe Val Val Glu
165 170 175
Leu Lys Lys Arg Arg Ser Pro Val Lys Val Gly Val Arg Leu Arg Phe
180 185 190
Ser Ile Thr Gln His Ile Arg Asp Lys Asn Leu Met Asn Ser Leu Ile
195 200 205
Thr Tyr Leu Gly Cys Gly Arg Ile Val Glu Asn Asn Lys Ser Glu His
210 215 220
Ser Trp Leu Glu Phe Ile Val Thr Lys Phe Ser Asp Ile Asn Asp Lys
225 230 235 240
Ile Ile Pro Val Phe Gln Glu Asn Thr Leu Ile Gly Val Lys Leu Glu
245 250 255
Asp Phe Glu Asp Trp Cys Lys Val Ala Lys Leu Ile Glu Glu Lys Lys
260 265 270
His Leu Thr Glu Ser Gly Leu Asp Glu Ile Lys Lys Ile Lys Leu Asn
275 280 285
Met Asn Lys Gly Arg
290
<210> 78
<211> 293
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтезированный вариант I-OnuI CBLB.F6
<400> 78
Ser Ile Asn Pro Trp Ile Leu Thr Gly Phe Ala Asp Ala Glu Gly Cys
1 5 10 15
Phe Arg Leu Asp Ile Arg Asn Ala Asn Asp Leu Arg Ala Gly Tyr Arg
20 25 30
Thr Arg Leu Ala Phe Glu Ile Val Leu His Asn Lys Asp Lys Ser Ile
35 40 45
Leu Glu Asn Ile Gln Ser Thr Trp Lys Val Gly Thr Ile Tyr Asn Ala
50 55 60
Gly Asp Asn Ala Val Arg Leu Gln Val Thr Arg Phe Glu Asp Leu Lys
65 70 75 80
Val Ile Ile Asp His Phe Glu Lys Tyr Pro Leu Ile Thr Gln Lys Leu
85 90 95
Gly Asp Tyr Lys Leu Phe Lys Gln Ala Phe Ser Val Met Glu Asn Lys
100 105 110
Glu His Leu Lys Glu Asn Gly Ile Lys Glu Leu Val Arg Ile Lys Ala
115 120 125
Lys Met Asn Trp Gly Leu Asn Asp Glu Leu Lys Lys Ala Phe Pro Glu
130 135 140
Asn Ile Ser Lys Glu Arg Pro Leu Ile Asn Lys Asn Ile Pro Asn Leu
145 150 155 160
Lys Trp Leu Ala Gly Phe Thr Ser Gly Asp Gly Ser Phe Met Val Glu
165 170 175
Leu Met Lys Asn Lys Asn Asn Val Ile Val Arg Val Arg Leu Arg Phe
180 185 190
Ser Ile Ser Gln His Ile Arg Asp Lys Asn Leu Met Asn Ser Leu Ile
195 200 205
Thr Tyr Leu Gly Cys Gly Arg Ile Val Glu Asn Asn Lys Ser Glu His
210 215 220
Ser Trp Leu Glu Phe Ile Val Thr Lys Phe Ser Asp Ile Asn Asp Lys
225 230 235 240
Ile Ile Pro Val Phe Gln Glu Asn Thr Leu Ile Gly Val Lys Leu Glu
245 250 255
Asp Phe Glu Asp Trp Cys Lys Val Ala Lys Leu Ile Glu Glu Lys Lys
260 265 270
His Leu Thr Glu Ser Gly Leu Asp Glu Ile Lys Lys Ile Lys Leu Asn
275 280 285
Met Asn Lys Gly Arg
290
<210> 79
<211> 293
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтезированный вариант I-OnuI CBLB.E6
<400> 79
Ser Ile Asn Pro Trp Ile Leu Thr Gly Phe Ala Asp Ala Glu Gly Cys
1 5 10 15
Phe Arg Leu Asp Ile Arg Asn Ala Asn Asp Leu Arg Ala Gly Tyr Arg
20 25 30
Thr Arg Leu Ser Phe Glu Ile Ser Leu His Asn Lys Asp Lys Ser Ile
35 40 45
Leu Glu Asn Ile Gln Ser Thr Trp Lys Val Gly Thr Ile Tyr Asn Ala
50 55 60
Gly Asp Asn Ala Val Arg Leu Gln Val Thr Arg Phe Glu Asp Leu Lys
65 70 75 80
Val Ile Ile Asp His Phe Glu Lys Tyr Pro Leu Ile Thr Gln Lys Leu
85 90 95
Gly Asp Tyr Lys Leu Phe Lys Gln Ala Phe Ser Val Met Glu Asn Lys
100 105 110
Glu His Leu Lys Glu Asn Gly Ile Lys Glu Leu Val Arg Ile Lys Ala
115 120 125
Lys Met Asn Trp Gly Leu Asn Asp Glu Leu Lys Lys Ala Phe Pro Glu
130 135 140
Asn Ile Ser Lys Glu Arg Pro Leu Ile Asn Lys Asn Ile Pro Asn Leu
145 150 155 160
Lys Trp Leu Ala Gly Phe Thr Ser Gly Asp Gly Ser Phe Met Val Glu
165 170 175
Leu Met Lys Asn Lys Asn Asn Val Ile Val Arg Val Arg Leu Arg Phe
180 185 190
Ser Ile Ser Gln His Ile Arg Asp Lys Asn Leu Met Asn Ser Leu Ile
195 200 205
Thr Tyr Leu Gly Cys Gly Arg Ile Val Glu Asn Asn Lys Ser Glu His
210 215 220
Ser Trp Leu Glu Phe Ile Val Thr Lys Phe Ser Asp Ile Asn Asp Lys
225 230 235 240
Ile Ile Pro Val Phe Gln Glu Asn Thr Leu Ile Gly Val Lys Leu Glu
245 250 255
Asp Phe Glu Asp Trp Cys Lys Val Ala Lys Leu Ile Glu Glu Lys Lys
260 265 270
His Leu Thr Glu Ser Gly Leu Asp Glu Ile Lys Lys Ile Lys Leu Asn
275 280 285
Met Asn Lys Gly Arg
290
<210> 80
<211> 293
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтезированный вариант I-OnuI CBLB.D2
<400> 80
Ser Ile Asn Pro Trp Ile Leu Thr Gly Phe Ala Asp Ala Glu Gly Cys
1 5 10 15
Phe Arg Leu Asp Ile His Asn Ala Asn Val Leu Arg Ser Gly Tyr Arg
20 25 30
Thr Arg Leu Ser Phe Glu Ile Val Leu His Asn Lys Asp Lys Ser Ile
35 40 45
Leu Glu Asn Ile Gln Ser Thr Trp Lys Val Gly Lys Ile Tyr Asn Ala
50 55 60
Gly Asp Asn Ala Val Arg Leu Gln Val Thr Arg Phe Glu Asp Leu Lys
65 70 75 80
Val Ile Ile Asp His Phe Glu Lys Tyr Pro Leu Ile Thr Gln Lys Leu
85 90 95
Gly Asp Tyr Lys Leu Phe Lys Gln Ala Phe Ser Val Met Glu Asn Lys
100 105 110
Glu His Leu Lys Glu Asn Gly Ile Lys Glu Leu Val Arg Ile Lys Ala
115 120 125
Lys Met Asn Trp Gly Leu Asn Asp Glu Leu Lys Lys Ala Phe Pro Glu
130 135 140
Asn Ile Ser Lys Glu Arg Pro Leu Ile Asn Lys Asn Ile Pro Asn Leu
145 150 155 160
Lys Trp Leu Ala Gly Phe Thr Ser Gly Asp Gly Ser Phe Met Val Glu
165 170 175
Leu Met Lys Asn Lys Asn Asn Val Ile Val Arg Val Arg Leu Arg Phe
180 185 190
Ser Ile Ser Gln His Ile Arg Asp Lys Asn Leu Met Asn Ser Leu Ile
195 200 205
Thr Tyr Leu Gly Cys Gly Arg Ile Val Glu Asn Asn Lys Ser Glu His
210 215 220
Ser Trp Leu Glu Phe Ile Val Thr Lys Phe Ser Asp Ile Asn Asp Lys
225 230 235 240
Ile Ile Pro Val Phe Gln Glu Asn Thr Leu Ile Gly Val Lys Leu Glu
245 250 255
Asp Phe Glu Asp Trp Cys Lys Val Ala Lys Leu Ile Glu Glu Lys Lys
260 265 270
His Leu Thr Glu Ser Gly Leu Asp Glu Ile Lys Lys Ile Lys Leu Asn
275 280 285
Met Asn Lys Gly Arg
290
<210> 81
<211> 293
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтезированный вариант I-OnuI CBLB.C2
<400> 81
Ser Ile Asn Pro Trp Ile Leu Thr Gly Phe Ala Asp Ala Glu Gly Cys
1 5 10 15
Phe Gly Leu Tyr Ile His Asn Ser Asn Val Leu Arg Ser Gly Tyr Arg
20 25 30
Thr Arg Leu Ser Phe Glu Ile Ser Leu His Asn Lys Asp Lys Ser Ile
35 40 45
Leu Glu Asn Ile Gln Ser Thr Trp Lys Val Gly Thr Ile Tyr Asn Ala
50 55 60
Gly Asp Asn Ala Val Arg Leu Gln Val Thr Arg Phe Glu Asp Leu Lys
65 70 75 80
Val Ile Ile Asp His Phe Glu Lys Tyr Pro Leu Ile Thr Gln Lys Leu
85 90 95
Gly Asp Tyr Lys Leu Phe Lys Gln Ala Phe Ser Leu Met Glu Asn Lys
100 105 110
Glu His Leu Lys Glu Asn Gly Ile Lys Glu Leu Val Arg Ile Lys Ala
115 120 125
Lys Met Asn Trp Gly Leu Asn Asp Glu Leu Lys Lys Ala Phe Pro Glu
130 135 140
Asn Ile Ser Lys Glu Arg Pro Leu Ile Asn Lys Asn Ile Pro Asn Leu
145 150 155 160
Lys Trp Leu Ala Gly Phe Thr Ser Gly Asp Gly Ser Phe Met Val Glu
165 170 175
Leu Met Lys Asn Lys Asn Asn Val Ile Val Arg Val Arg Leu Arg Phe
180 185 190
Ser Ile Ser Gln His Ile Arg Asp Lys Asn Leu Met Asn Ser Leu Ile
195 200 205
Thr Tyr Leu Gly Cys Gly Arg Ile Val Glu Asn Asn Lys Ser Glu His
210 215 220
Ser Trp Leu Glu Phe Ile Val Thr Lys Phe Ser Asp Ile Asn Asp Lys
225 230 235 240
Ile Ile Pro Val Phe Gln Glu Asn Thr Leu Ile Gly Val Lys Leu Glu
245 250 255
Asp Phe Glu Asp Trp Cys Lys Val Ala Lys Leu Ile Glu Glu Lys Lys
260 265 270
His Leu Thr Glu Ser Gly Leu Asp Glu Ile Lys Lys Ile Lys Leu Asn
275 280 285
Met Asn Lys Gly Arg
290
<210> 82
<211> 293
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтезированный вариант I-OnuI CBLB.B5
<400> 82
Ser Ile Asn Pro Trp Ile Leu Thr Gly Phe Ala Asp Ala Glu Gly Cys
1 5 10 15
Phe Arg Leu Asp Ile His Asn Ala Asn Val Leu Arg Ser Gly Tyr Arg
20 25 30
Thr Arg Leu Ser Phe Glu Ile Val Leu His Asn Lys Asp Lys Ser Ile
35 40 45
Leu Glu Asn Ile Gln Ser Thr Trp Lys Val Gly Thr Ile Tyr Asn Ala
50 55 60
Gly Asp Asn Ala Val Arg Leu Gln Val Thr Arg Phe Glu Asp Leu Lys
65 70 75 80
Val Ile Ile Asp His Phe Glu Lys Tyr Pro Leu Ile Thr Gln Lys Leu
85 90 95
Gly Asp Tyr Lys Leu Phe Lys Gln Ala Phe Ser Leu Met Glu Asn Lys
100 105 110
Glu His Leu Lys Glu Asn Gly Ile Lys Glu Leu Val Arg Ile Lys Ala
115 120 125
Lys Met Asn Trp Gly Leu Asn Asp Glu Leu Lys Lys Ala Phe Pro Glu
130 135 140
Asn Ile Ser Lys Glu Arg Pro Leu Ile Asn Lys Asn Ile Pro Asn Leu
145 150 155 160
Lys Trp Leu Ala Gly Phe Thr Ser Gly Asp Gly Ser Phe Val Val Glu
165 170 175
Leu Lys Lys Arg Arg Ser Pro Val Lys Val Gly Val Arg Leu Arg Phe
180 185 190
Gly Ile Thr Gln His Ile Arg Asp Lys Asn Leu Met Asn Ser Leu Ile
195 200 205
Thr Tyr Leu Gly Cys Gly Arg Ile Val Glu Asn Asn Lys Ser Glu His
210 215 220
Ser Trp Leu Glu Phe Ile Val Thr Lys Phe Ser Asp Ile Asn Asp Lys
225 230 235 240
Ile Ile Pro Val Phe Gln Glu Asn Thr Leu Ile Gly Val Lys Leu Glu
245 250 255
Asp Phe Glu Asp Trp Cys Lys Val Ala Lys Leu Ile Glu Glu Lys Lys
260 265 270
His Leu Thr Glu Ser Gly Leu Asp Glu Ile Lys Lys Ile Lys Leu Asn
275 280 285
Met Asn Lys Gly Arg
290
<210> 83
<211> 293
<212> PRT
<213> Искусственная последовательность
<220>
<223> Синтезированный вариант I-OnuI CBLB.A8
<400> 83
Ser Ile Asn Pro Trp Ile Leu Thr Gly Phe Ala Asp Ala Glu Gly Cys
1 5 10 15
Phe Arg Leu Asp Ile Arg Asn Ala Asn Asp Leu Arg Ala Gly Tyr Arg
20 25 30
Thr Arg Leu Ala Phe Glu Ile Val Leu His Asn Lys Asp Lys Ser Ile
35 40 45
Leu Glu Asn Ile Gln Ser Thr Trp Lys Val Gly Thr Ile Tyr Asn Ala
50 55 60
Gly Asp Asn Ala Val Arg Leu Gln Val Thr Arg Phe Glu Asp Leu Lys
65 70 75 80
Val Ile Ile Gly His Phe Glu Lys Tyr Pro Leu Ile Thr Gln Lys Leu
85 90 95
Gly Asp Tyr Lys Leu Phe Lys Gln Ala Phe Ser Val Met Glu Asn Lys
100 105 110
Glu His Leu Lys Glu Asn Gly Ile Lys Glu Leu Val Arg Ile Lys Ala
115 120 125
Lys Met Asn Trp Gly Leu Asn Asp Glu Leu Lys Lys Ala Phe Pro Glu
130 135 140
Asn Ile Ser Lys Glu Arg Pro Leu Ile Asn Lys Asn Ile Pro Asn Leu
145 150 155 160
Lys Trp Leu Ala Gly Phe Thr Ser Gly Asp Gly Ser Phe Met Val Glu
165 170 175
Leu Met Lys Asn Lys Asn Asn Val Ile Val Arg Val Arg Leu Arg Phe
180 185 190
Ser Ile Ser Gln His Ile Arg Asp Lys Asn Leu Met Asn Ser Leu Ile
195 200 205
Thr Tyr Leu Gly Cys Gly Arg Ile Val Glu Asn Asn Lys Ser Glu His
210 215 220
Ser Trp Leu Glu Phe Ile Val Thr Lys Phe Ser Asp Ile Asn Asp Lys
225 230 235 240
Ile Ile Pro Val Phe Gln Glu Asn Thr Leu Ile Gly Val Lys Leu Glu
245 250 255
Asp Phe Glu Asp Trp Cys Lys Val Ala Lys Leu Ile Glu Glu Lys Lys
260 265 270
His Leu Thr Glu Ser Gly Leu Asp Glu Ile Lys Lys Ile Lys Leu Asn
275 280 285
Met Asn Lys Gly Arg
290
<210> 84
<211> 39
<212> ДНК
<213> Homo sapiens
<400> 84
tggggatggg aatatcttac agaccatacc tcataacaa 39
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ВАРИАНТЫ, КОМПОЗИЦИИ И МЕТОДЫ ПРИМЕНЕНИЯ ХОМИНГ-ЭНДОНУКЛЕАЗЫ PD-1 | 2017 |
|
RU2781083C2 |
| СПОСОБЫ ПОЛУЧЕНИЯ ПРОМЫШЛЕННЫХ ПРОДУКТОВ ИЗ РАСТИТЕЛЬНЫХ ЛИПИДОВ | 2015 |
|
RU2743384C2 |
| УЛУЧШЕНИЕ ИММУНОГЕННОСТИ ПЕПТИДА L2 ВПЧ | 2017 |
|
RU2743016C2 |
| СПЕЦИФИЧНЫЕ К MUC16 ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ И ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2795198C2 |
| ПОЛИПЕПТИДЫ, ЯВЛЯЮЩИЕСЯ РАСТВОРИМЫМИ РЕЦЕПТОРАМИ 3 ФАКТОРА РОСТА ФИБРОБЛАСТОВ (SFGFR3), И ПУТИ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2751483C2 |
| НОВЫЕ ЭУКАРИОТИЧЕСКИЕ КЛЕТКИ И СПОСОБЫ ИХ ПОЛУЧЕНИЯ ДЛЯ РЕКОМБИНАНТНОЙ ЭКСПРЕССИИ ПРЕДСТАВЛЯЮЩЕГО ИНТЕРЕС ПРОДУКТА | 2014 |
|
RU2720525C2 |
| СЛИТЫЙ БЕЛОК ИЗ БЕЛКА DCTN1 С БЕЛКОМ RET | 2018 |
|
RU2813996C2 |
| CD3-СВЯЗЫВАЮЩИЙ ДОМЕН | 2015 |
|
RU2742691C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ, НАЦЕЛЕННЫЕ НА АНТИГЕН СОЗРЕВАНИЯ В-КЛЕТОК, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2829097C2 |
| ВАКЦИНА ПРОТИВ АФРИКАНСКОЙ ЧУМЫ СВИНЕЙ | 2020 |
|
RU2819672C2 |
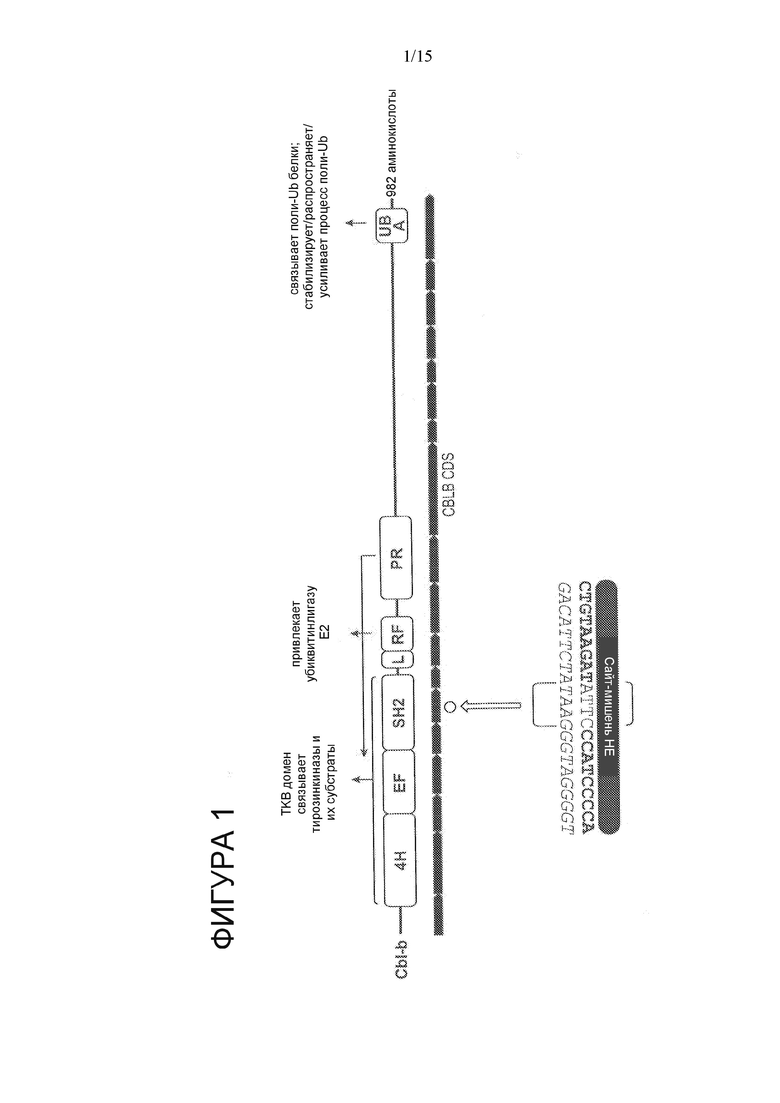

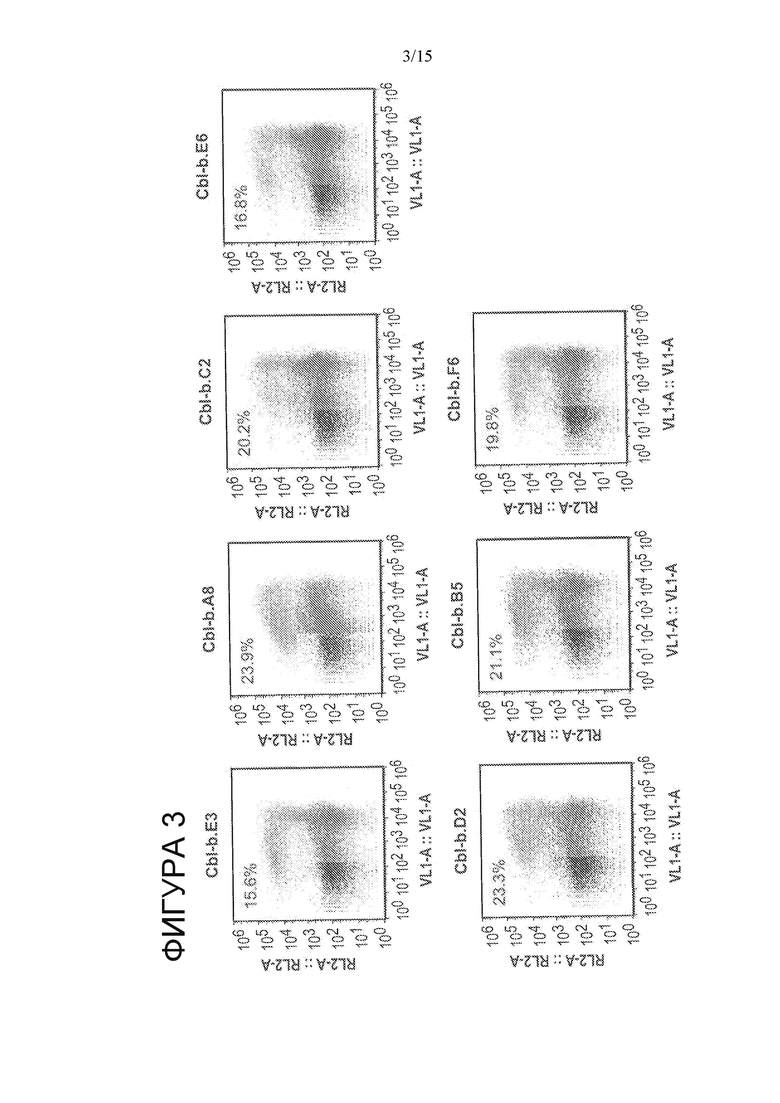
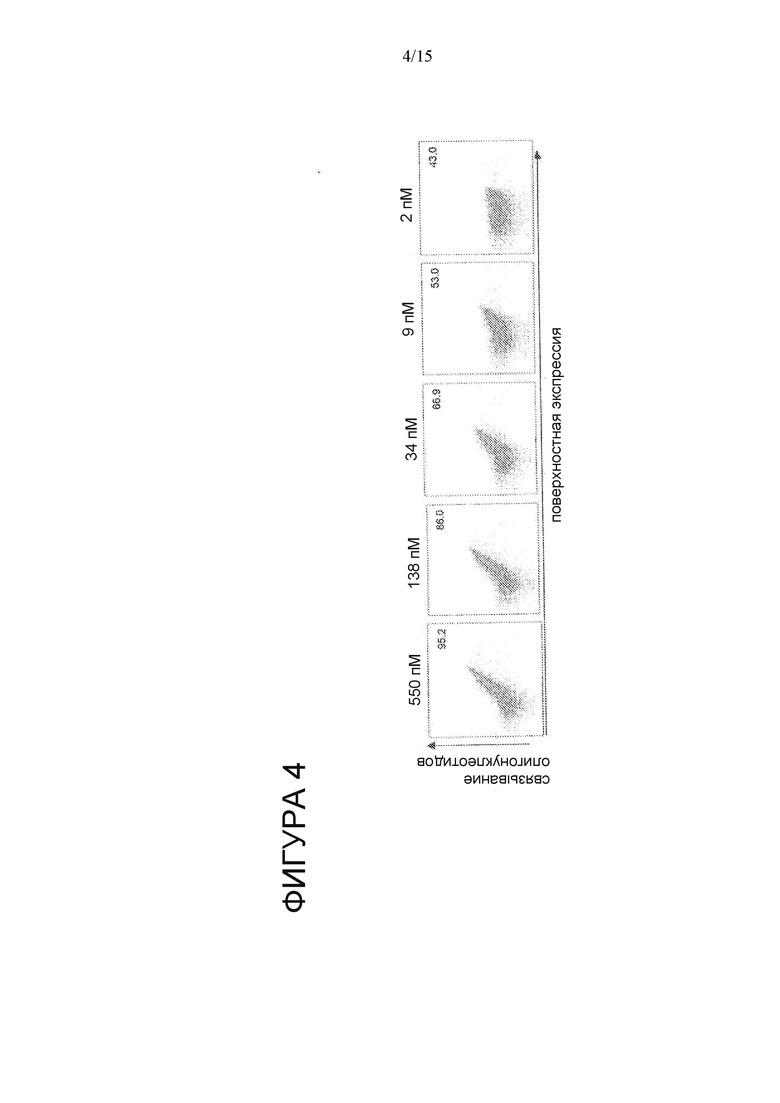
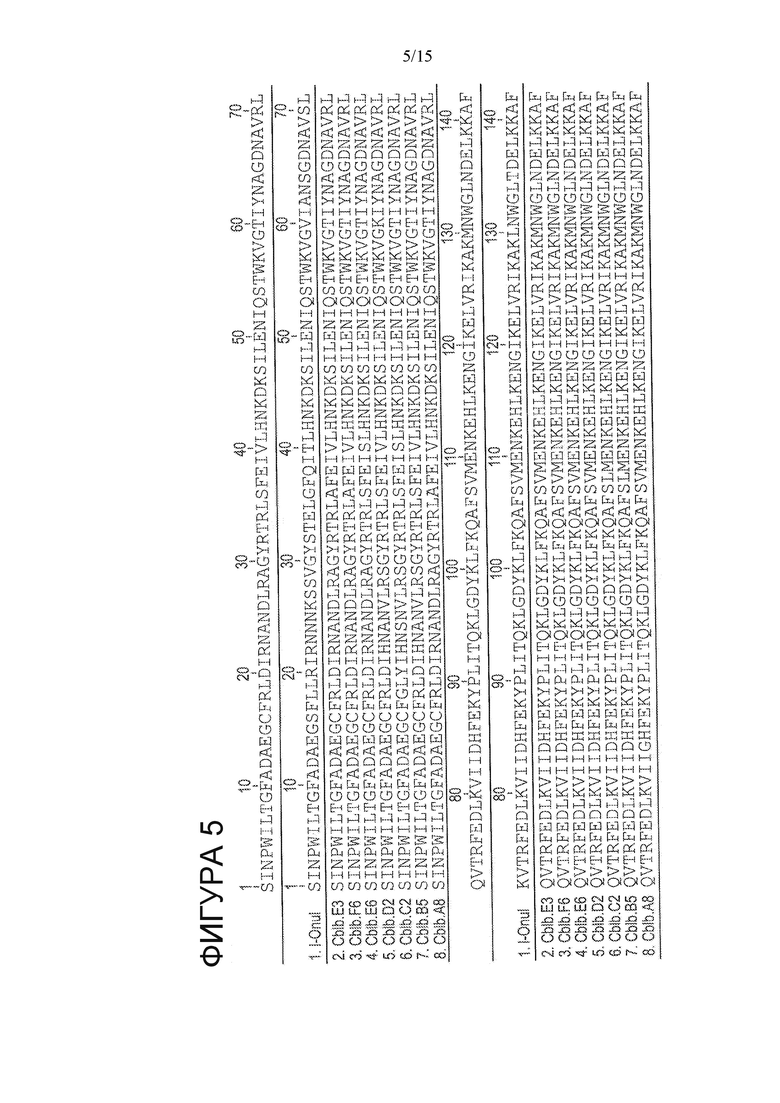
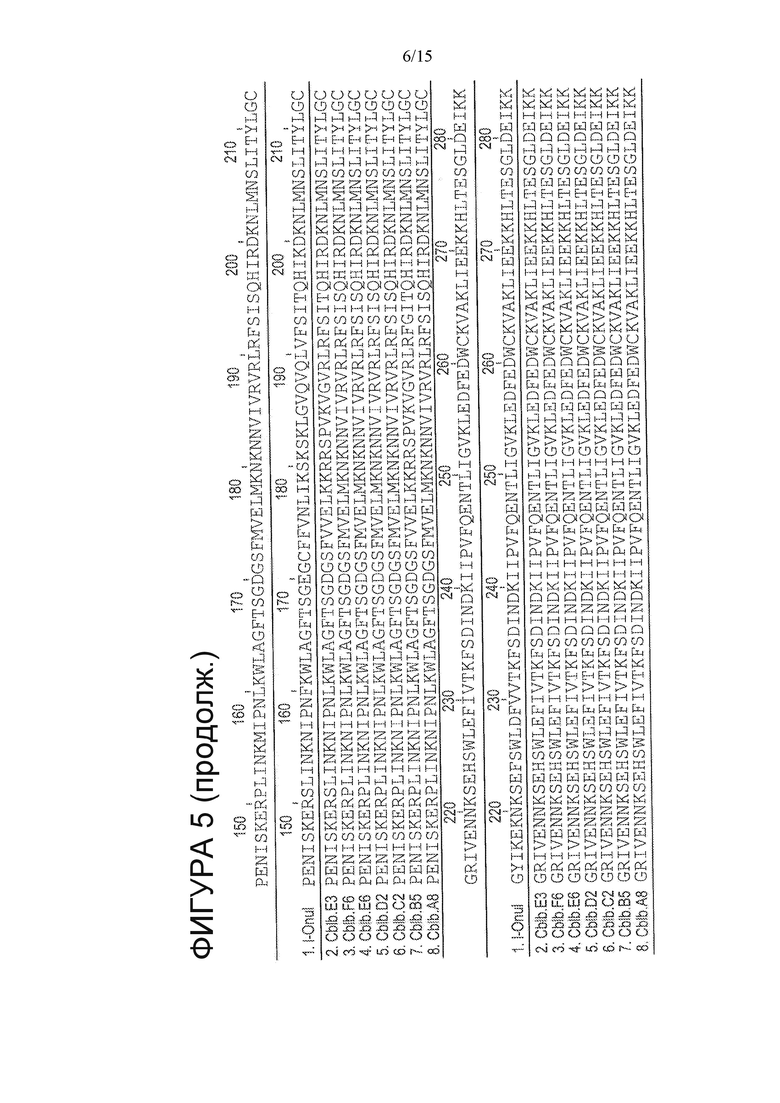
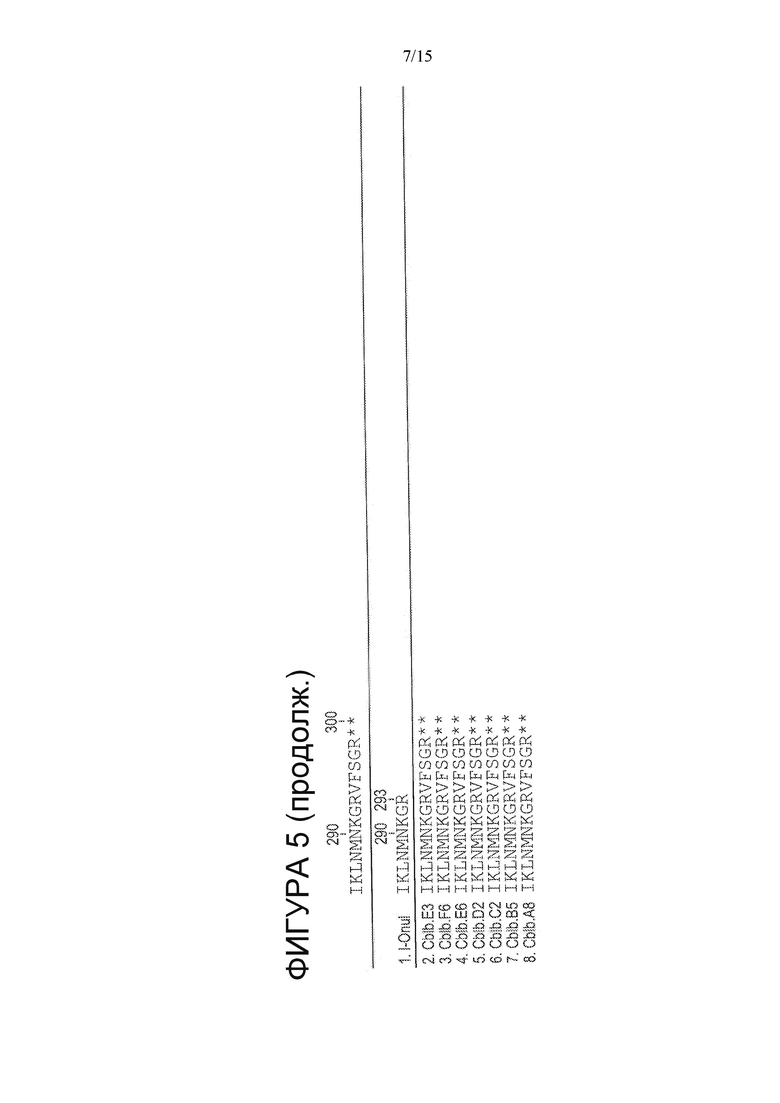
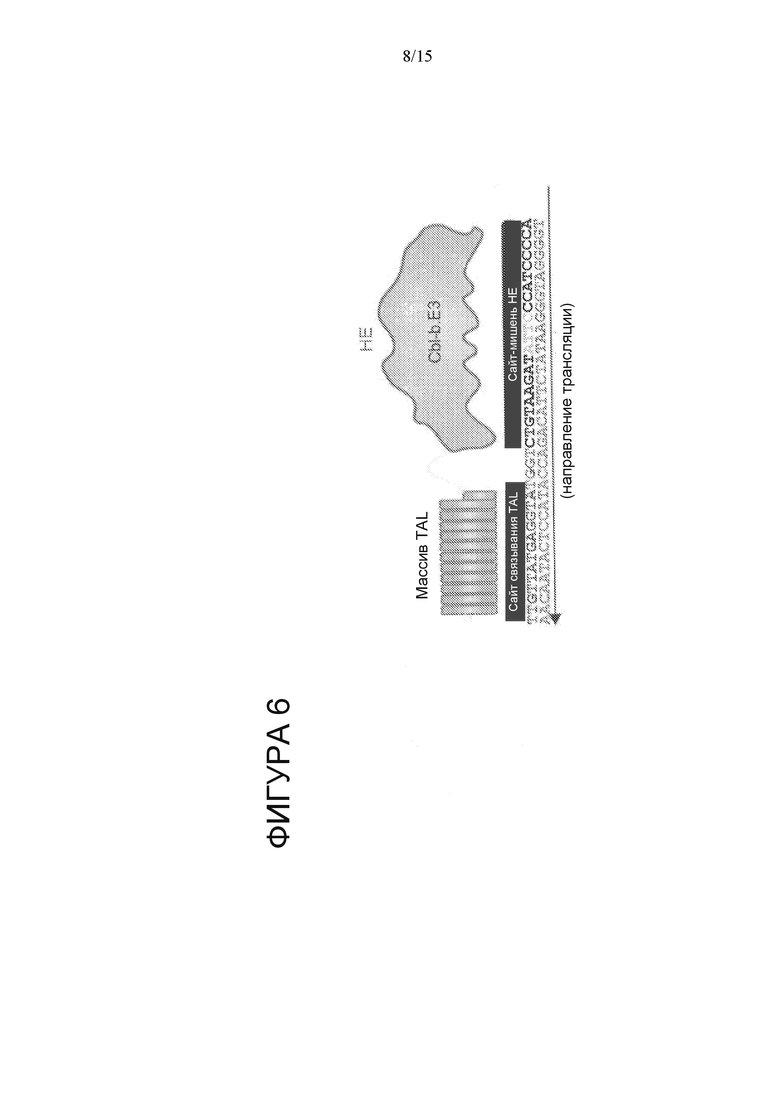
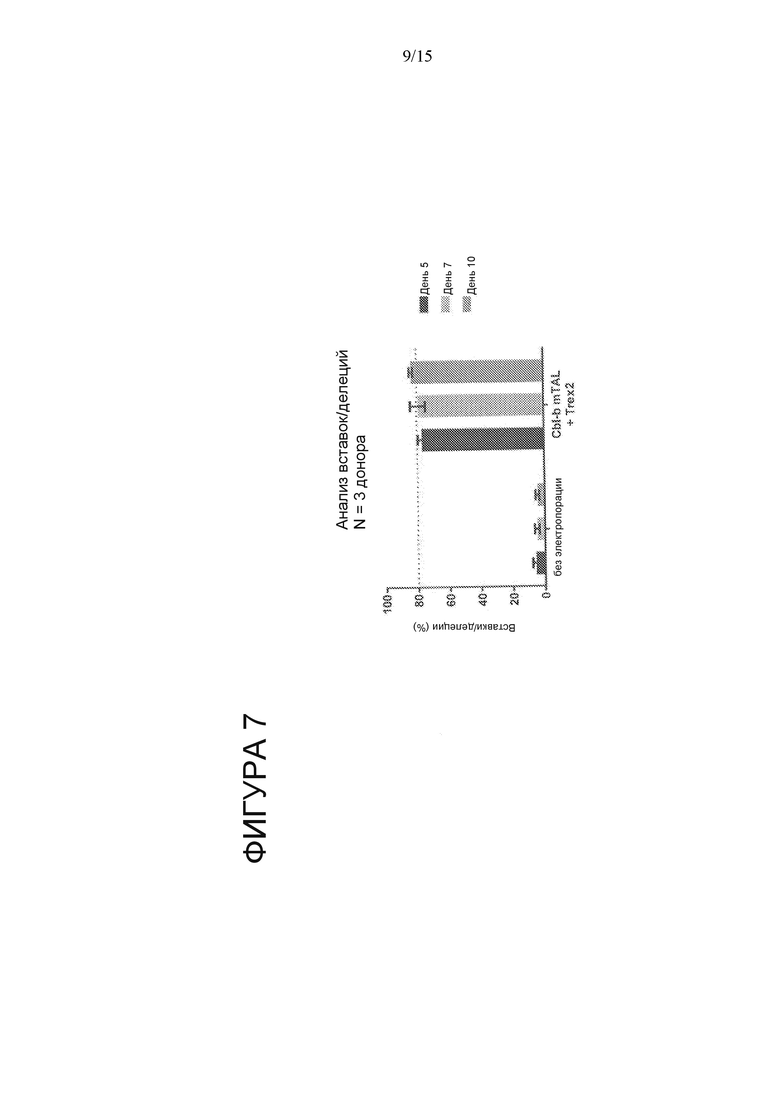
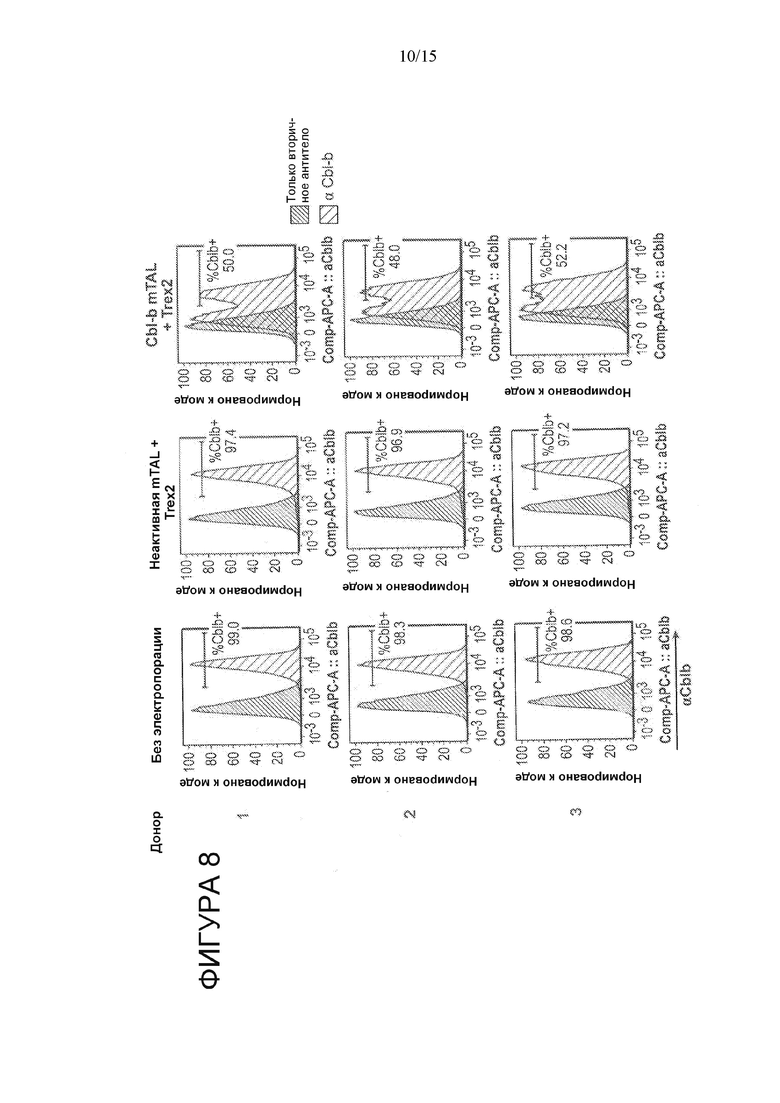

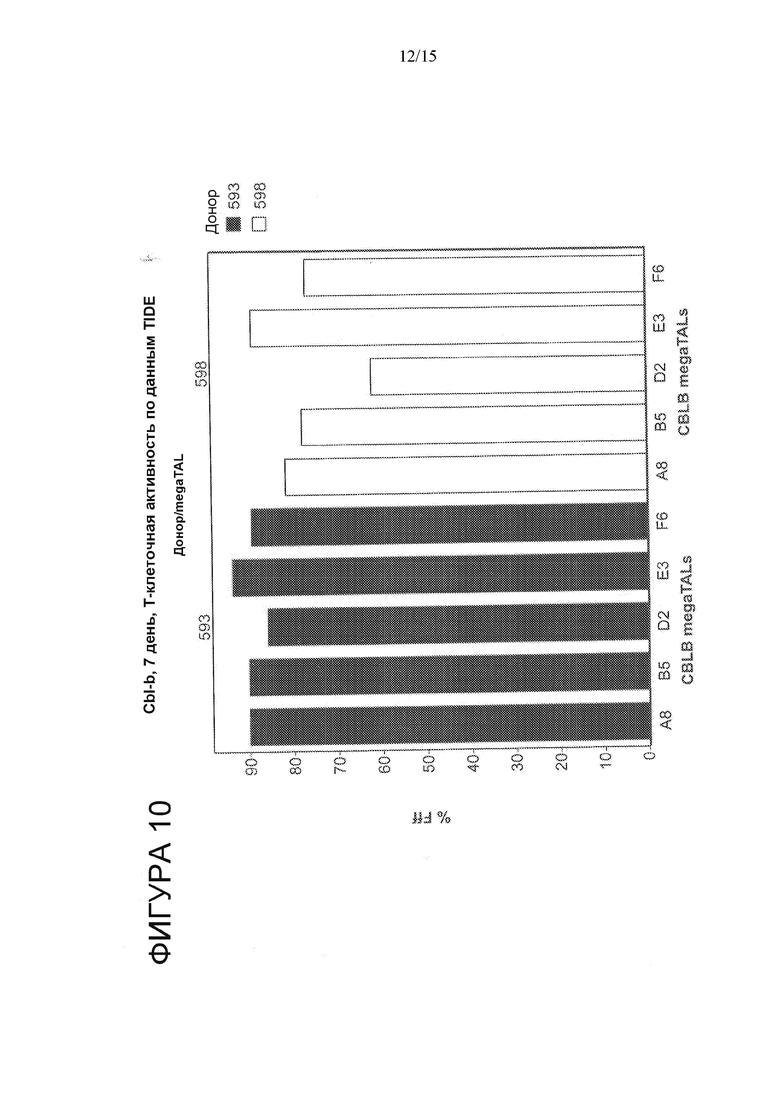
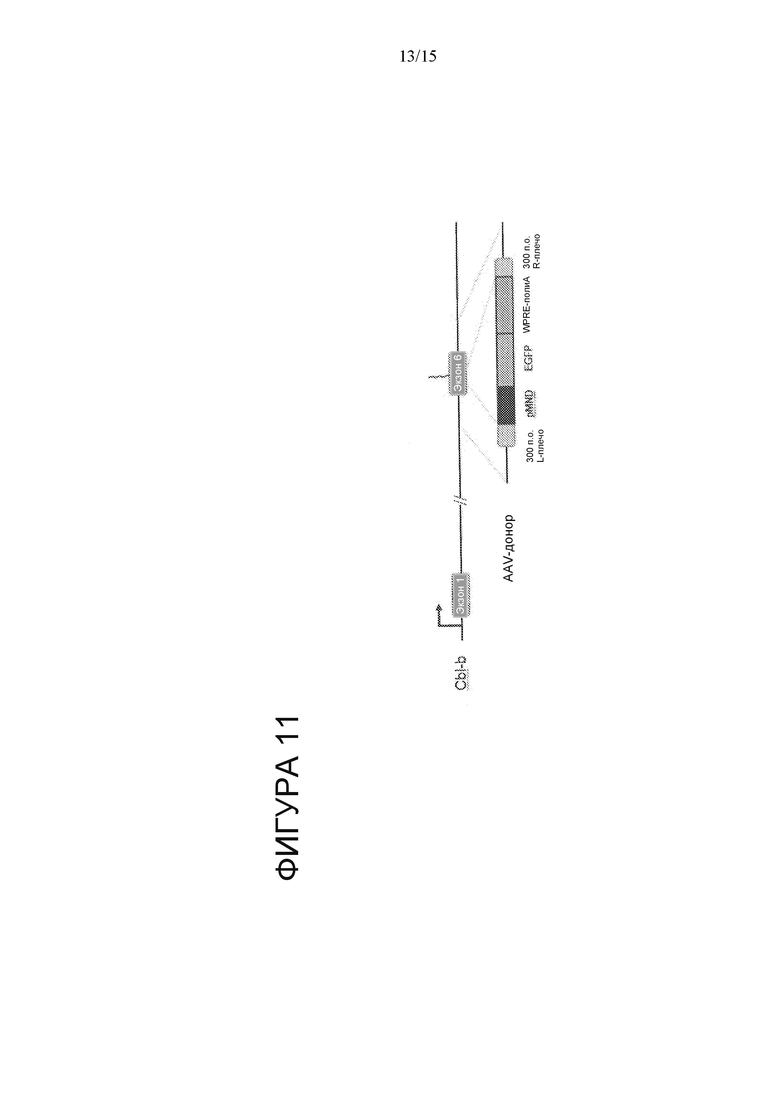
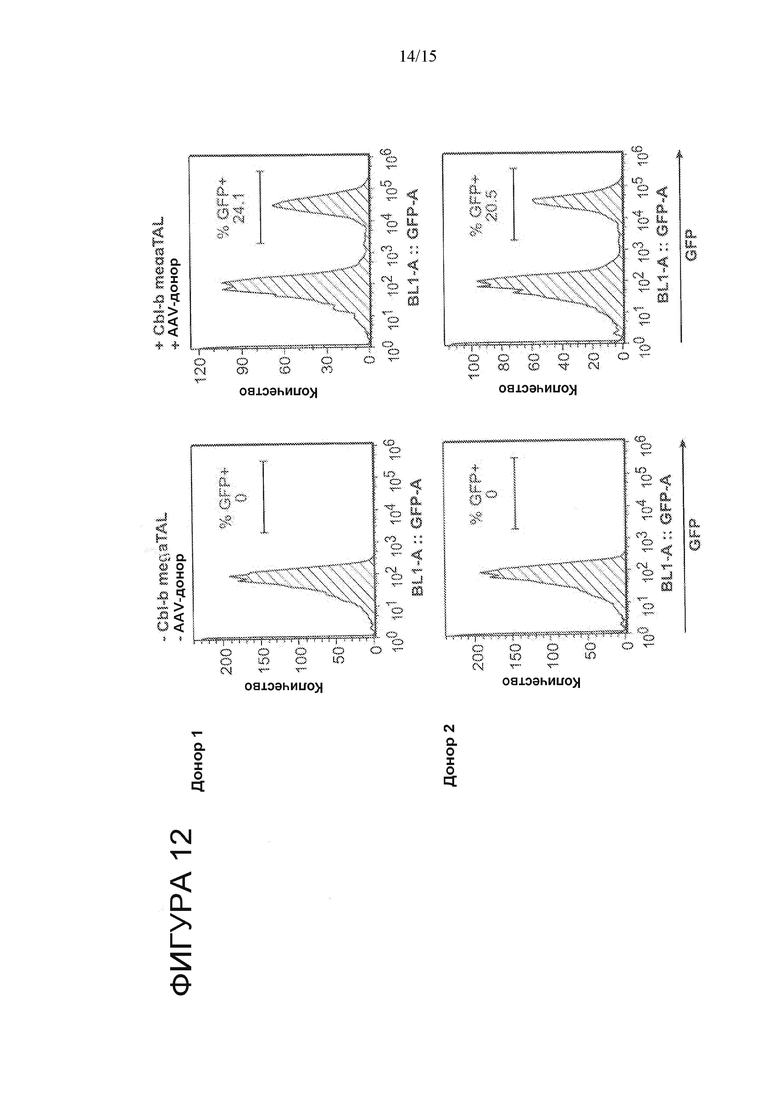
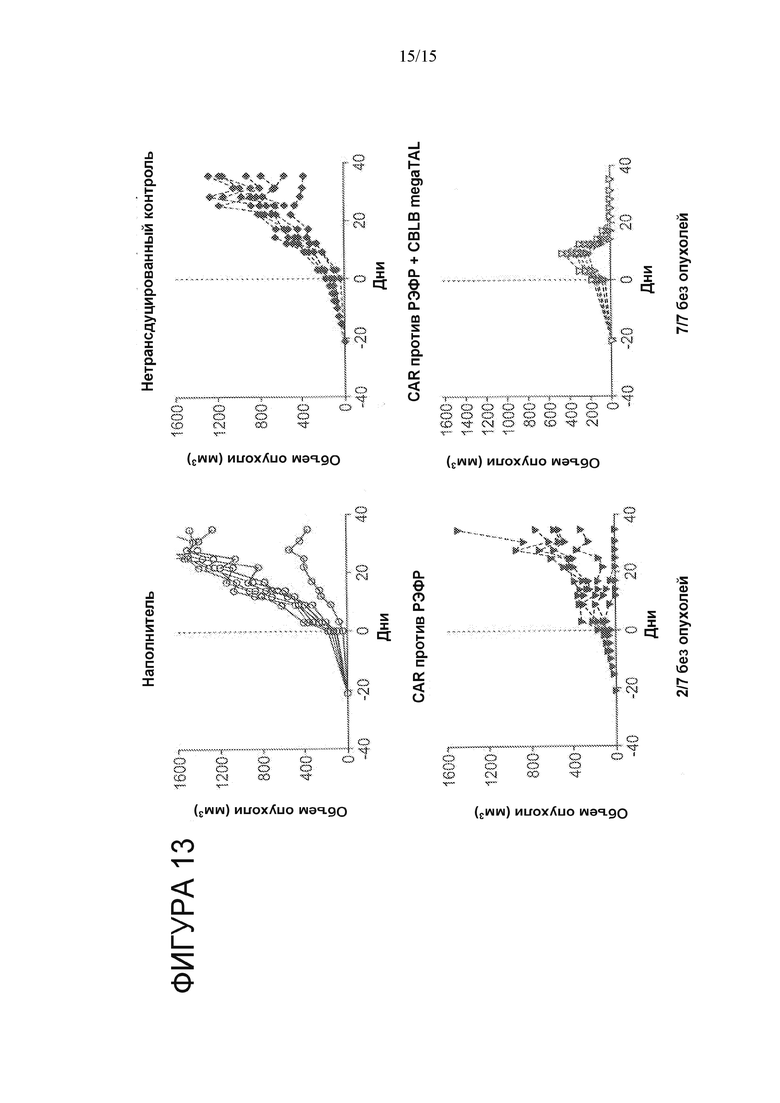
Изобретение относится к области биотехнологии, в частности к полипептиду для генетического редактирования генома клетки, содержащему вариант хоуминг-эндонуклеазы (НЕ) I-OnuI, а также к полинуклеотиду, иРНК и кДНК, его кодирующим. Также раскрыты вектор и клетка, содержащие вышеуказанный полипептид или полинуклеотид. Изобретение также относится к композиции, содержащей вышеуказанную клетку, а также к способу редактирования человеческого гена CBLB в клетке, предусматривающему использование вышеуказанного полипептида. Изобретение эффективно для лечения рака, в том числе гематологической злокачественной опухоли. 12 н. и 9 з.п. ф-лы, 13 ил., 2 табл., 5 пр.
1. Полипептид для генетического редактирования генома клетки, содержащий вариант хоуминг-эндонуклеазы (НЕ) I-Onul, содержащий аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 6, и который расщепляет сайт-мишень в человеческом протоонкогене В (CBLB) лимфомы В-клеточной линии дифференцировки Каситас (Cb1), при этом сайт-мишень представляет собой SEQ ID NO: 20.
2. Полипептид для генетического редактирования генома клетки, содержащий вариант хоуминг-эндонуклеазы (НЕ) I-Onul, содержащий аминокислотную последовательность, которая по меньшей мере на 90% идентична SEQ ID NO: 6, и который расщепляет сайт-мишень в человеческом протоонкогене В (CBLB) лимфомы В-клеточной линии дифференцировки Каситас (Cb1), при этом сайт-мишень представляет собой SEQ ID NO: 20, и при этом полипептид дополнительно содержит ДНК-связывающий домен TALE, содержащий от приблизительно 9,5 повторяющегося звена TALE до приблизительно 15,5 повторяющегося звена TALE, который связывает полинуклеотидную последовательность в гене CBLB.
3. Полипептид по п. 1 или 2, где вариант I-Onul НЕ содержит:
(а) аминокислотную последовательность, которая по меньшей мере на 95% идентична SEQ ID NO: 6;
(б) аминокислотную последовательность, которая по меньшей мере на 99% идентична SEQ ID NO: 6; или
(в) аминокислотную последовательность, представленную в SEQ ID NO: 6.
4. Полипептид по п. 1 или 2, где указанный вариант НЕ содержит следующие замены аминокислот:
(a) S24C, L26R, R28D, N32A, K34D, S35L, S36R, V37A, S40R, E42R, G44A, Q46E, T48V, V68T, A70Y, S72A, S78R, K80Q, L138M, T143N, F168L, E178D, C180S, F182V, N184E, I186K, S188R, K189R, K191P, L192V, G193K, Q195G, Q197R, V199R, K207R, Y223R, K225V, K227N, F232H, D236E и V238I из SEQ ID NO: 4;
(б) S24C, L26R, R28D, N32A, K34D, S35L, S36R, V37A, S40R, E42R, G44A, Q46E, T48V, V68T, A70Y, S72A, S78R, K80Q, L138M, T143N, S159P, F168L, E178D, C180S, F182M, N184E, I186M, S188N, S190N, K191N, L192V, G193I, Q195R, Q197R, V199R, T203S, K207R, Y223R, K225V, K227N, F232H, D236E, и V238I из SEQ ID NO: 4;
(в) S24C, L26R, R28D, N32A, K34D, S35L, S36R, V37A, S40R, E42R, G44S, Q46E, T48S, V68T, A70Y, S72A, S78R, K80Q, D92G, V116L, L138M, T143N, S159P, F168L, E178D, C180S, F182M, N184E, I186M, S188N, S190N, K191N, L192V, G193I, Q195R, Q197R, V199R, T203S, K207R, Y223R, K225V, K227N, F232H, D236E, и V238I из SEQ ID NO: 4;
(г) S24C, L26R, R28D, R30H, N32A, K34V, S35L, S36R, V37S, S40R, E42R, G44S, Q46E, T48V, V68T, V68K, A70Y, S72A, S78R, K80Q, L138M, T143N, S159P, F168L, E178D, C180S, F182M, N184E, I186M, S188N, S190N, K191N, L192V, G193I, Q195R, Q197R, V199R, T203S, K207R, Y223R, K225V, K227N, F232H, D236E, и V238I из SEQ ID NO: 4;
(д) S24C, L26G, R28Y, R30H, N32S, K34V, S35L, S36R, V37S, S40R, E42R, G44S, Q46E, T48S, V68T, A70Y, S72A, S78R, K80Q, V116L, L138M, T143N, S159P, F168L, E178D, C180S, F182M, N184E, I186M, S188N, S190N, K191N, L192V, G193I, Q195R, Q197R, V199R, T203S, K207R, Y223R, K225V, K227N, F232H, D236E, и V238I из SEQ ID NO: 4;
(е) S24C, L26R, R28D, R30H, N32A, K34V, S35L, S36R, V37S, S40R, E42R, G44S, Q46E, T48V, V68T, A70Y, S72A, S78R, K80Q, V116L, L138M, T143N, S159P, F168L, E178D, C180S, F182V, N184E, I186K, S188R, K189R, К191Р, L192V, G193K, Q195G, Q197R, V199R, S201G, K207R, Y223R, K225V, K227N, F232H, D236E, и V238I из SEQ ID NO: 4; или
(ж) S24C, L26R, R28D, N32A, K34D, S35L, S36R, V37A, S40R, E42R, G44A, Q46E, T48V, V68T, A70Y, S72A, S78R, K80Q, D92G, L138M, T143N, S159P, F168L, E178D, C180S, F182M, N184E, I186M, S188N, S190N, K191N, L192V, G193I, Q195R, Q197R, V199R, T203S, K207R, Y223R, K225V, K227N, F232H, D236E, и V238I из SEQ ID NO: 4.
5. Полипептид по п. 1 или 2, где указанный вариант НЕ содержит аминокислотную последовательность, представленную в любой из SEQ ID NO: 6-12.
6. Полипептид по любому из пп. 2-5, где указанный ДНК-связывающий домен TALE связывается с полинуклеотидной последовательностью, представленной в SEQ ID NO: 21.
7. Полипептид по любому из пп. 2-6, где указанный полипептид связывает и расщепляет полинуклеотидную последовательность, представленную в SEQ ID NO: 22.
8. Полипептид по любому из пп. 2-7, где указанный полипептид содержит аминокислотную последовательность, на 95% идентичную аминокислотной последовательности, представленной в любой из SEQ ID NO: 13-19.
9. Полинуклеотид, кодирующий полипептид по любому из пп. 1-8.
10. иРНК, кодирующая полипептид по любому из пп. 1-8.
11. кДНК, кодирующая полипептид по любому из пп. 1-8.
12. Вектор экспрессии, содержащий полинуклеотид, кодирующий полипептид по любому из пп. 1-8.
13. Клетка для применения в адоптивной клеточной терапии, при этом клетка содержит полипептид по любому из пп. 1-8, полинуклеотид, содержащий нуклеотидную последовательность, кодирующий полипептид по любому из пп. 1-8, или вектор экспрессии, содержащий полинуклеотид, кодирующий полипептид по любому из пп. 1-8; и
при этом клетка содержит полинуклеотид, содержащий нуклеотидную последовательность, кодирующий модифицированный антигенный рецептор.
14. Клетка по п. 13, отличающаяся тем, что модифицированный антигенный рецептор содержит химерный антигенный рецептор (CAR).
15. Клетка по п. 14, отличающаяся тем, что указанная клетка представляет собой гемопоэтическую клетку; Т-клетку; CD3+, CD4+ и/или CD8+ клетку; иммунную эффекторную клетку; цитотоксический Т-лимфоцит (ЦТЛ), инфильтрирующий опухоль лимфоцит (ТИЛ), или хелперную Т-клетку; или клетку природного киллера (NK) или клетку природного Т-киллера (NKT).
16. Композиция для адоптивной клеточной терапии, при этом композиция содержит эффективное количество клетки по любому из пп. 13-15.
17. Композиция для адоптивной клеточной терапии, при этом композиция содержит эффективное количество клетки по любому из пп. 13-15 и физиологически приемлемый носитель.
18. Способ редактирования человеческого гена CBLB в клетке, включающий: введение в указанную клетку полинуклеотида, содержащего нуклеотидную последовательность, кодирующего полипептид по любому из пп. 1-8, причем экспрессия указанного полипептида создает двухцепочечный разрыв в сайте-мишени в человеческом гене CBLB; и где клетка содержит полинуклеотид, содержащий нуклеотидную последовательность, кодирующий модифицированный антигенный рецептор.
19. Способ лечения рака, включающий введение субъекту эффективного количества композиции по п. 17.
20. Способ лечения гематологической злокачественной опухоли, включающий введение субъекту эффективного количества композиции по п. 17.
21. Способ по п. 20, отличающийся тем, что указанная гематологическая злокачественная опухоль представляет собой лейкоз, лимфому или множественную миелому.
| WO2017001572 A1, 05.01.2017 | |||
| WO2014191525 A1, 04.12.2014 | |||
| WO2014191527, 04.12.2014 | |||
| WO2011156430 A2, 15.12.2011 | |||
| FANG-YI LO et al., An E3 ubiquitin ligase c-Cbl: a new therapeutic target of lung cancer in cell and animal models, Cancer, 2011, Vol | |||
| Аппарат для испытания прессованных хлебопекарных дрожжей | 1921 |
|
SU117A1 |
| Приспособление для удаления незахваченных навойником политурок на гильзовых машинах | 1925 |
|
SU5344A1 |
| ЖДАНОВ Д.Д.и др., Эндонуклеаза EndoG индуцирует альтернативный сплайсинг | |||
Авторы
Даты
2022-08-31—Публикация
2018-05-25—Подача