Область техники, к которой относится изобретение
Настоящее изобретение относится к химерным антигенным рецепторам (CAR), которые представляют собой рекомбинантные химерные белки, обладающие способностью перенаправлять специфичность и реактивность иммунных клеток на выбранные мембранные антигены, более конкретно, в которых внеклеточный лигандсвязывающий домен представляет собой scFV, полученный из моноклонального антитела к CD123, что обусловливает специфический иммунитет против CD123-позитивных клеток. Установлено, что на опухолевых клетках при лейкозе, прежде всего при остром миелоидном лейкозе (AML), часто имеет место сверхэкспрессия альфа-цепи рецептора интерлейкина-3 (CD123) по сравнению со здоровыми гематопоэтическими стволовыми клетками. Сконструированные иммунные клетки, наделенные CAR, предлагаемые в изобретении, отличаются более высокой эффективностью при лечении лимфом и лейкозов.
Предпосылки создания изобретения
Адаптивная иммунотерапия, в которой применяют перенос аутологичных антигенспецифических Т-клеток, созданных ex vivo, представляет собой перспективную стратегию для лечения вирусных инфекций и рака. Т-клетки, применяемые для адаптивной иммунотерапии, можно создавать либо путем размножения антигенспецифических Т-клеток, либо посредством перенаправления Т-клеток с помощью методов генетической инженерии (Park, Rosenberg и др., 2011). Перенос Т-клеток, специфических в отношении вирусных антигенов, является хорошо зарекомендовавшей себя процедурой, которую применяют для лечения ассоциированных с трансплантацией вирусных инфекций и редких связанных с вирусами злокачественных заболеваний. Продемонстрировано также, что выделение и перенос специфических в отношении опухоли Т-клеток приводит к успеху при лечении меланомы.
В Т-клетках были успешно созданы новые специфичности посредством генетического переноса трансгенных Т-клеточных рецепторов или химерных антигенных рецепторов (CAR) (Jena, Dotti и др., 2010). CAR представляют собой синтетические рецепторы, состоящие из «нацеливающего» фрагмента, ассоциированного с одним или несколькими сигнальными доменами в одной слитой молекуле. В целом, связывающий фрагмент CAR состоит из антигенсвязывающего домена одноцепочечного антитела (scFv), который содержит фрагменты моноклонального антитела, представляющие собой вариабельные домены легкой и тяжелой цепи, соединенные гибким линкером. Успешно применяли также связывающие фрагменты на основе доменов рецептора или лиганда. Сигнальные домены для первого поколения CAR получали из цитоплазматической области дзета-цепей CD3 или гамма-цепей Fc- рецептора. Было продемонстрировано, что первое поколение CAR позволяло успешно перенаправлять Т-клеточную цитотоксичность, однако для них не удалось обеспечить пролонгированное размножение и противоопухолевую активность in vivo. Для повышения выживаемости и усиления пролиферации модифицированных с помощью CAR Т-клеток осуществляли добавление сигнальных доменов из костимулирующих молекул, включая CD28, ОХ-40 (CD134) и 4-1BB (CD137), по отдельности (второе поколение) или в комбинации (третье поколение). CAR позволяли успешно перенаправлять Т-клетки на антигены, экспрессируемые на поверхности опухолевых клеток при различных злокачественных заболеваниях, включая лимфомы и солидные опухоли (Jena, Dotti и др., 2010)
Следует отметить, что индукционные терапии острого миелоидного лейкоза (AML) в основном не изменялись в течение практически 50 лет, и AML остается заболеванием с плохим прогнозом. Острый миелоидный лейкоз (AML) представляет собой заболевание, характеризующееся быстрой пролиферацией незрелых миелоидных клеток в костном мозге, что приводит к нарушению гематопоэза. Хотя стандартная индукционная химиотерапия может приводить к полным ремиссиям, у многих пациентов, в конце концов, наступает рецидив и смерть в результате заболевания, что требует разработки новых терапевтических средств для лечения AML.
Современные успехи, достигнутые в отношении иммунофенотипировая клеток AML, позволили установить несколько ассоциированных с AML антигенов клеточной поверхности, которые могут являться мишенями при разработке терапий в будущем. Альфа-цепь рецептора интерлейкина-3 (IL-3Rα; CD123 - регистрационный номер NCBI: NP_001254642) идентифицирована в качестве потенциальной иммунотерапевтической мишени, поскольку для нее характерна сверхэкспрессия на опухолевых клетках AML по сравнению со здоровыми гематопоэтическими стволовыми клетками. Кроме того, завершена фаза I испытаний двух CD123-специфических терапевтических средств, в которых продемонстрированы хорошие профили безопасности обоих лекарственных средств (ClinicalTrials.gov ID: NCT00401739 и NCT00397579). К сожалению, указанные имеющие в качестве мишени CD123 лекарственные средства обладали ограниченной эффективностью, что свидетельствует о потребности в альтернативных и более эффективных и специфических нацеленных на CD123 терапевтических средствах с выраженной противолейкозной активностью.
Вероятно, более эффективной альтернативной терапией для лечения лейкоза может являться применение Т-клеток, экспрессирующих химерные антигенные рецепторы (CAR), которые перенаправляют Т-клеточную специфичность на антигены, ассоциированные с поверхностью опухолевых клеток (ТАА) независимым от ГКГС образом. Разработано несколько групп CAR, мишенью которых являются различные антигены, для лечения В-клеточных злокачественных заболеваний. Однако несущие сконструированный CAR Т-клетки, предназначенные для лечения AML, остаются редкими.
В частности, все еще существует необходимость в улучшении конструкции CAR, которые лучше совместимы с пролиферацией Т-клеток, для того, чтобы обеспечивать выраженное клиническое преимущество клеток, экспрессирующих указанные CAR.
Кроме того, существует потребность в усовершенствовании CD123-CAR, которые обладают способностью к пролиферации и избирательному нацеливанию на экспрессирующие CD123 клетки.
Кроме того, применение указанной экспрессирующей CAR иммунной Т-клетки, мишенью которой является CD123, в комбинации с цитотоксическими химиотерапевтическими агентами, которые обычно применяют в качестве противораковых терапий, остается проблематичным.
Ряд цитотоксических агентов, таких как антиметаболиты, алкилирующие агенты, антрациклины, ингибиторы ДНК-метилтрансферазы, соединения платины и веретенные яды (токсины, блокирующие митотическое веретено), разработаны для уничтожения раковых клеток, прежде всего экспрессирующих CD123 раковых клеток.
Эти химиотерапевтические агенты могут оказаться вредными при разработке сильных противоопухолевых иммунокомпетентных клеток из-за их неспецифической токсичности. Основанные на применении малых молекул терапии, мишенью которых являются пути клеточной пролиферации, тоже могут мешать созданию противоопухолевого иммунитета.
Таким образом, существует также необходимость в разработке Т-клеток, мишенью которых является CD123, которые являлись бы специфическими и совместимыми с применением лекарственных средств, прежде всего противораковых химиотерапии, в том числе влияющих на клеточную пролиферацию.
Таким образом, с целью применения «имеющихся в наличии» аллогенных терапевтических клеток в сочетании с химиотерапией при создании изобретения был разработан способ конструирования аллогенных Т-клеток, менее аллогенных и устойчивых к химиотерапевтическим средствам. Связанная с этой стратегий терапевтическая польза состоит в повышенной эффективности в результате синергетического действия между химиотерапией и иммунотерапией. Кроме того, устойчивость к лекарственным средствам может также являться благоприятной из-за способности к избирательному размножению сконструированной Т-клетки, что позволяет избегать проблем, связанных с неэффективным генным переносом в указанные клетки
Краткое изложение сущности изобретения
При создании изобретения были разработаны CD123-специфические CAR, обладающие различной структурой и содержащие различные scFV, полученные из различных специфических в отношении CD123 антител. Указанные CD123-специфические CAR взаимозаменяемо обозначают как CD123-специфический CAR или анти-CD123 CAR, или 123 CAR, или «CAR, предлагаемый в изобретении».
В частности, при создании изобретения разработан CD123-специфический CAR, содержащий scFV, полученный из Klon43, с различными архитектурами, и идентифицированы высоко специфические и обладающие очень высокой избирательностью конструкции CAR, которые связываются с экспрессирующими CD123 клетками и избирательно разрушают экспрессирующие CD123 раковые клетки.
После неспецифической активации in vitro (например, с использованием покрытых CD3/CD28 гранул и рекомбинантного IL2), Т-клетки из доноров трансформировали полинуклеотидами, экспрессирующими указанные CAR, используя вирусную трансдукцию. В некоторых случаях Т-клетки подвергали дополнительному конструированию для создания неаллореактивных Т-клеток, более конкретно путем разрушения компонента TCR (αβ-цепи Т-клеточных рецепторов) для предупреждения реакции «трансплантат-против-хозяина».
Т-клетки конструировали также для создания Т-клеток, устойчивых к противораковым лекарственным средствам, для их применения в комбинации с указанными классическими противораковыми лекарственными средствами.
Полученные сконструированные Т-клетки обладали разной степенью реактивностью in vitro в отношении CD123-позитивных клеток, что свидетельствует о том, что CAR, предлагаемые в настоящем изобретении, принимали участие в антигензависимой активации, а также пролиферации Т-клеток, что делает возможным их применение для иммунотерапии.
Полученные сконструированные Т-клетки обладали реактивностью in vivo в отношении CD123-позитивных клеток и значительно снижали количество раковых клеток in vivo.
Сконструированные Т-клетки, предлагаемые в изобретении, которые созданы для проявления реактивности in vivo в отношении CD123-позитивных клеток, хорошо переносятся при их применении в сочетании с противораковыми лекарственными средствами. В конкретном варианте осуществления сконструированные Т-клетки, предлагаемые в изобретении, сохраняют эффективность даже после несколько введений, что делает их ценными для иммунотерапии в качестве первой обработки (индукции), в качестве консолидированного лечения, в качестве лечения в комбинации с классической противораковой химиотерапией.
В настоящей заявке подробно описаны полипептидные и полинуклеотидные последовательности, которые кодируют CAR, предлагаемые в настоящем изобретении.
Сконструированные иммунные клетки, предлагаемые в настоящем изобретении, наиболее пригодны для таких терапевтических применений, как лечение В-клеточной лимфомы или лейкоза.
Краткое описание чертежей
На чертежах показано:
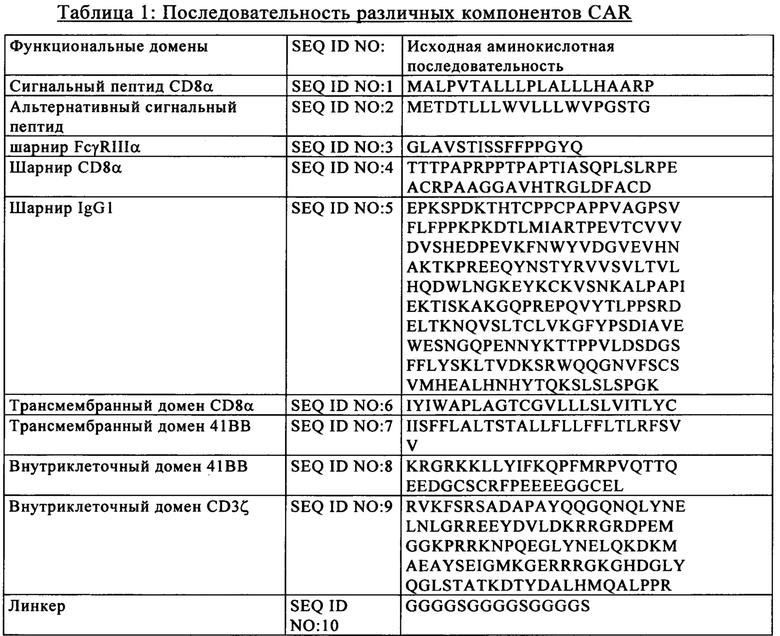
на фиг. 1 - схематическое изображение сконструированной иммунной клетки, предлагаемой в изобретении. Сконструированная иммунная клетка, представленная на этом чертеже, представляет собой Т-клетку, трансдуцированную ретровирусом, кодирующим полипептид CAR. Указанную Т-клетку конструировали также с целью обеспечения улучшенного и более безопасного приживления трансплантата пациенту, что необязательно подпадает под объем настоящего изобретения. Ген X может представлять собой, например, ген, экспрессирующий компонент TCR (TCRaльфa или TCRбета), ген Y может представлять собой ген, с которым связана чувствительность Т-клетки к иммуносупрессорным лекарственным средствам типа средств, мишенью которых является CD52 (таких как Campath (Кэмпас) или HPRT (таких как 6-тиогуанин);
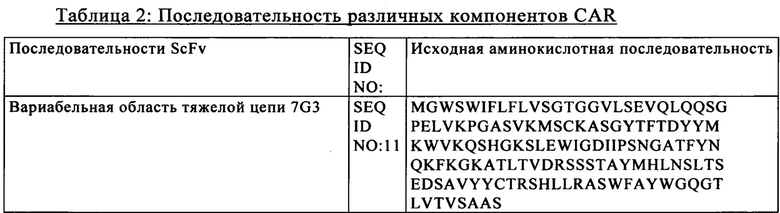
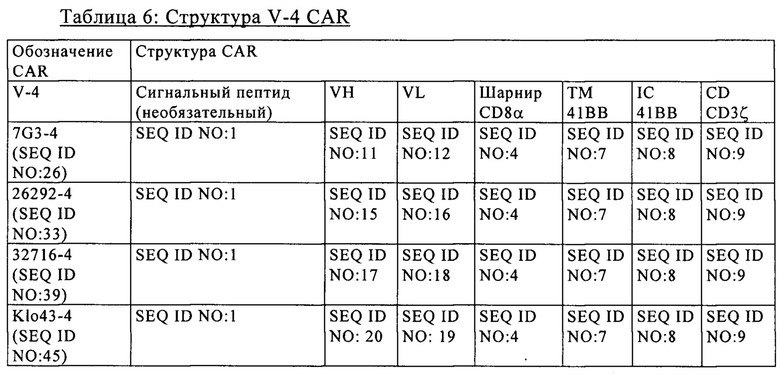
на фиг. 2 - схематическое изображение различной архитектуры CAR (V1-V6), предлагаемого в изобретении (123 CAR);
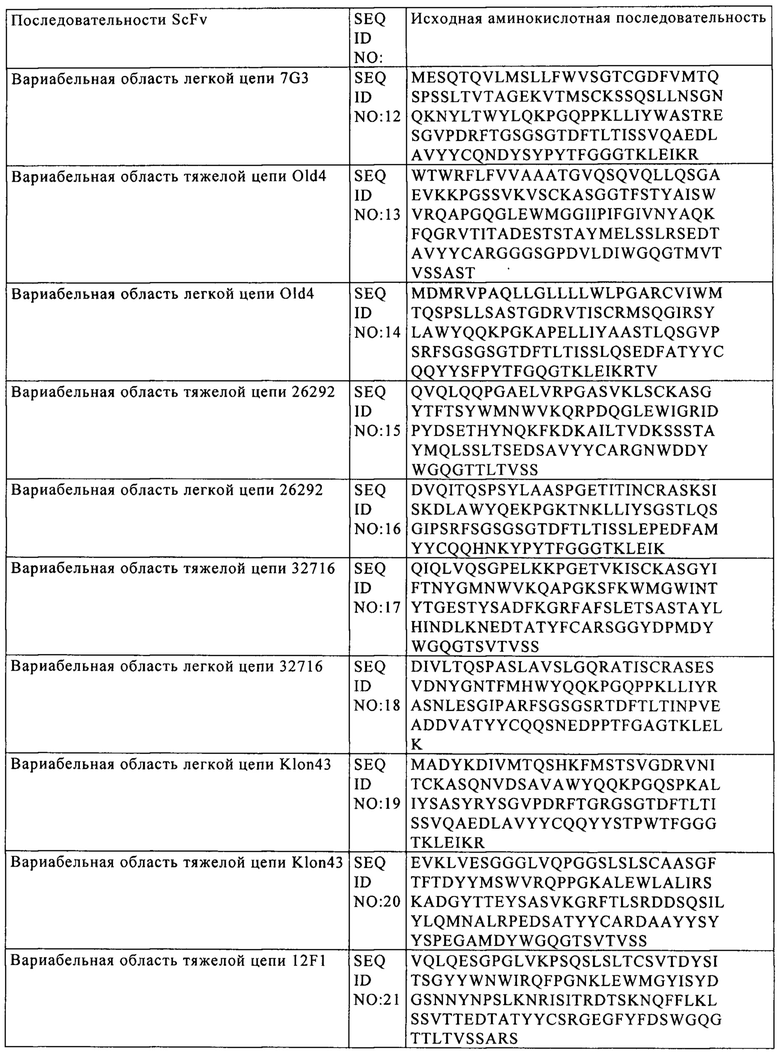
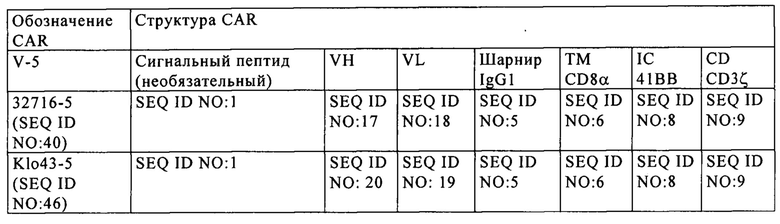
на фиг. 3 - различные структуры CAR, предлагаемого в изобретении, каждый из которых различается применяемой шарнирной областью;
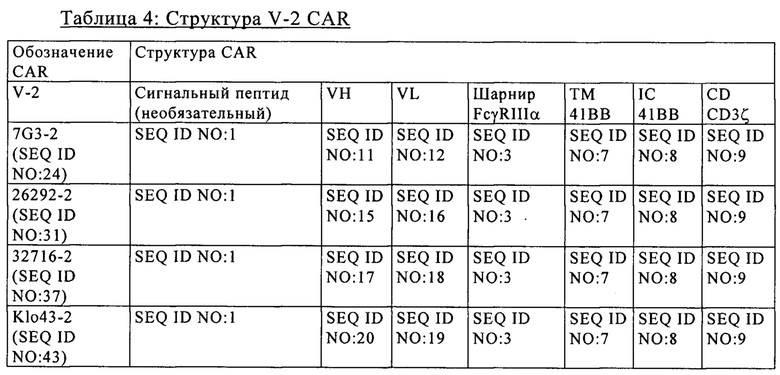
на фиг. 4 - данные о дегранулирующей активности в процентах (%) дегрануляции 6 различных scFv с одной конкретной архитектурой (v3: шарнир CD8 /трансмембранный домен CD8), полученные при совместном культивировании CAR+-T-клеток в течение 6 ч с экспрессирующими CD123 клетками (RPMI8226) или с клетками, которые не экспрессируют CD123 (K562). Белые прямоугольники соответствуют сигналам, свидетельствующим о дегрануляции, которые обнаружены в Т-клетках, которые культивировали индивидуально, черные прямоугольники соответствуют сигналам, которые обнаружены, когда Т-клетки совместно культивировали с клетками RPMI8226, а серые прямоугольники соответствуют сигналам, свидетельствующим о дегрануляции, которые обнаружены, когда Т-клетки совместно культивировали с клетками K562;
на фиг. 5 - данные о дегранулирующей активности (CD8/CD107a+-клетки), выраженные в виде средней интенсивности флуоресценции (MFI), CAR Т-клеток после совместного культивирования в течение 6 ч с CD123neg-клетками (K562) или клетками, экспрессирующими высокие или низкие уровни CD123 (RPMI8226 и KG1a соответственно);
на фиг. 6 - проценты (%) дегрануляции, обусловленной различными анти-CD123 CAR Т-клетками, при совместном культивировании в течение 6 ч с клетками, экспрессирующими различные уровни CD123 (KG1a или RPMI8226), или с клетками, которые не экспрессируют CD123 (K562);
на фиг. 7 - данные о количестве IFN гамма (IFNγ), высвободившегося различными экспрессирующими анти-CD123 CAR Т-клетками при совместном культивировании в течение 24 ч с клетками, экспрессирующими различные уровни CD123 (KG1a или RPMI8226), или с клетками, которые не экспрессируют CD123 (K562);
на фиг. 8 - данные об удельной цитолитической активности различных экспрессирующих анти-CD123 CAR+-Т-клеток. Анализы осуществляли через 48 ч после трансфекции мРНК CAR. Т-клетки совместно культивировали с клетками K562 + KG1a или K562 + RPMI8226. Определяли жизнеспособность клеток для каждой клеточной линии в конце периода совместного культивирования и рассчитывали процент удельного клеточного лизиса;
на фиг. 9 - общая конструкция, применяемая для трансдукции Т-клеток и проценты (%) Т-клеток, экспрессирующих CAR или BFP (синий флуоресцентный белок), в день 8 или 10 после трансдукции, в образцах из двух различных доноров при анализе с помощью проточной цитометрии. CAR соответствовали конструкции CAR Klon43-v3 CAR и 32716-V3 CAR;
на фиг. 10 - данные о дегранулирующей активности Т-клеток, экспрессирующих Klon43-v3 CAR и 32716-V3 CAR, в отношении различных клеточных линий (клетки Дауди и K562, которые не экспрессируют CD123, KG1a, MOLM13 и RPMI8226, которые экспрессируют повышенные уровни CD123 (KG1a<MOLM13<RPMI8226). На верхней панели представлены % CD107a+-клеток (в популяции CD8+-клеток) для трех независимых доноров, а на нижней панели представлены данные об интенсивности окрашивания CD107a для репрезентативного донора. NTD обозначает нетрансдуцированные клетки;
на фиг. 11 - данные о количестве IFN гамма, высвободившегося после совместного культивирования в течение 24 ч Т-клеток, экспрессирующих Klon43-v3 CAR и 32716-V3 CAR, с различными клеточными линиями;
на фиг. 12 - данные об удельной цитолитической активности Т-клеток, экспрессирующих Klon43-v3 CAR и 32716-V3 CAR. Рассчитывали процент удельного клеточного лизиса. Результаты представляют собой данные, полученные по меньшей мере для двух независимых доноров;
на фиг. 13 - данные о дегранулирующей активности (в процентах (%) дегрануляции) Т-клеток, экспрессирующих Klon43-v3 CAR и 32716-V3 CAR;
на фиг. 14 - данные о дегранулирующей активности (в MFI) Т-клеток, экспрессирующих Klon43-v3 CAR и 32716-V3 CAR;
на фиг. 15 - данные об активности in vivo Т-клеток, экспрессирующих Klon43-v3 CAR, в организме мышей с иммунодефицитом NOG. Мышам инъецировали клетки MOLM13, содержащие люциферазу, либо за 2, либо за 7 дней до инъекции нетрансдуцированных человеческих Т-клеток и взятые в различных дозах анти-CD123 CAR+-Т-клетки. Результаты выражены в виде биолюминесцентного сигнала, обнаруженного в различные моменты времени после инъекции Т-клеток (среднее значение для 4 мышей в каждой группе за исключением группы G12, в которой 1 из 4 мышей умерла между днями 21 и 28).


-


Подробное описание изобретения
Если специально не указано иное, то все технические и научные понятия, использованные в настоящем описании, имеют значение, которое является общепринятым для специалистов в области генной терапии, биохимии, генетики и молекулярной биологии.
Для осуществления на практике или тестирования настоящего изобретения можно применять все методы и материалы, сходные или эквивалентные тем, которые указаны в настоящем описании, при этом в настоящей заявке описаны приемлемые методы и материалы. Все публикации, заявки на патент, патенты и другие ссылки, упомянутые в настоящем описании, полностью включены в настоящее описание в качестве ссылки. В случае разночтения следует руководствоваться настоящим описанием, включая определения. Кроме того, материалы, методы и примеры представлены только для иллюстрации и не направлены на ограничение объема изобретения, если не указано иное.
При осуществлении на практике настоящего изобретения следует применять, если не указано иное, общепринятые методы клеточной биологии, культивирования клеток, молекулярной биологии, трансгенной биологии, микробиологии, рекомбинантной ДНК и иммунологии, известные специалисту в данной области. Такие методы подробно описаны в литературе, см., например, Current Protocols in Molecular Biology (Frederick M. AUSUBEL, изд-во Wiley and son Inc, Library of Congress, USA, 2000); Molecular Cloning: A Laboratory Manual, 3-е изд. (Sambrook и др., изд-во Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York, 2001); Oligonucleotide Synthesis, под ред. M.J. Gait, 1984; Mullis и др., US №4683195; Nucleic Acid Hybridization (под ред. В.D. Harries и S.J. Higgins, 1984); Transcription And Translation (под ред. В.D. Hames и S.J. Higgins, 1984); Culture Of Animal Cells (R.I. Freshney, изд-во Alan R. Liss, Inc., 1987); Immobilized Cells And Enzymes (изд-во IRL Press, 1986); B. Perbal, A Practical Guide To Molecular Cloning, 1984; серия: Methods In ENZYMOLOGY (под. ред. J. Abelson и M. Simon, изд-во Academic Press, Inc., New York), прежде всего том 154 и том 155 (под ред. Wu и др.) и том 185, «Gene Expression Technology)) (под ред. D. Goeddel); Gene Transfer Vectors For Mammalian Cells (под ред. J.H. Miller и M.P. Calos, 1987, изд-во Cold Spring Harbor Laboratory); Immunochemical Methods In Cell And Molecular Biology (под ред. Mayer и Walker, изд-во Academic Press, London, 1987); Handbook Of Experimental Immunology, тома I-IV (под ред. D.M. Weir и С.С. Blackwell, 1986); и Manipulating the Mouse Embryo, (изд-во Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y., 1986).
В настоящем изобретении предложен CD123-специфический химерный антигенный рецептор («123 CAR» или «CAR»), который имеет одну из полипептидных структур, выбранных из V1-V6, которые проиллюстрированы на фиг. 2, указанная структура содержит внеклеточный лигандсвязывающий домен, который содержит VH и VL из моноклонального антитела к CD123, шарнир, трансмембранный домен, цитоплазматический домен, включающий сигнальный домен CD3дзета и костимуляторный домен из 4-1ВВ, где последовательность указанного 123 CAR идентична по меньшей мере на 80% любой из SEQ ID NO: 42, SEQ ID NO: 44, SEQ ID NO: 46, SEQ ID NO: 29 или SEQ ID NO: 48.
В настоящем изобретении предложен CD123-специфический химерный антигенный рецептор (123 CAR), который имеет одну из полипептидных структур, выбранных из V1, V3 и V5, которые проиллюстрированы на фиг. 2, указанная структура содержит внеклеточный лигандсвязывающий домен, который содержит VH и VL из моноклонального антитела к CD123, шарнир, трансмембранный домен, цитоплазматический домен, включающий сигнальный домен СD3дзета и костимуляторный домен из 4-1ВВ, где последовательность указанного 123 CAR идентична по меньшей мере на 80% любой из SEQ ID NO: 42, SEQ ID NO: 44 или SEQ ID NO: 46.
В настоящем изобретении предложен CD123-специфический химерный антигенный рецептор (123 CAR), который имеет одну из полипептидных структур, выбранных из V1, V3 и V5, которые проиллюстрированы на фиг. 2, указанная структура содержит внеклеточный лигандсвязывающий домен, который содержит VH и VL из моноклонального антитела к CD123, шарнир, трансмембранный домен, цитоплазматический домен, включающий сигнальный домен СD3дзета и костимуляторный домен из 4-1ВВ, где последовательность указанного 123 CAR идентична по меньшей мере на 80% любой из SEQ ID NO: 75, SEQ ID NO: 76, SEQ ID NO: 77.
В настоящем изобретении предложен специфический химерный антигенный рецептор (123 CAR), который имеет полипептидную структуру V3, которая проиллюстрирована на фиг. 2 и описана выше, где последовательность указанного 123 CAR идентична по меньшей мере на 80% SEQ ID NO: 42.
В настоящем изобретении предложен специфический химерный антигенный рецептор (123 CAR), который имеет полипептидную структуру V3, которая проиллюстрирована на фиг. 2 и описана выше, где последовательность указанного 123 CAR идентична по меньшей мере на 80% SEQ ID NO: 44.
В настоящем изобретении предложен специфический химерный антигенный рецептор (123 CAR), который имеет полипептидную структуру V3, которая проиллюстрирована на фиг. 2 и описана выше, где последовательность указанного 123 CAR идентична по меньшей мере на 80% SEQ ID NO: 46.
В настоящем изобретении предложен специфический химерный антигенный рецептор (123 CAR), который имеет полипептидную структуру V3, которая проиллюстрирована на фиг. 2 и описана выше, где последовательность указанного 123 CAR идентична по меньшей мере на 80% SEQ ID NO: 75.
В настоящем изобретении предложен специфический химерный антигенный рецептор (123 CAR), который имеет полипептидную структуру V3, которая проиллюстрирована на фиг. 2 и описана выше, где последовательность указанного 123 CAR идентична по меньшей мере на 80% SEQ ID NO: 76.
В настоящем изобретении предложен специфический химерный антигенный рецептор (123 CAR), который имеет полипептидную структуру V3, которая проиллюстрирована на фиг. 2 и описана выше, где последовательность указанного 123 CAR идентична по меньшей мере на 80% SEQ ID NO: 77.
В настоящем изобретении предложен CD123-специфический химерный антигенный рецептор (CAR), который имеет полипептидную структуру V3, которая проиллюстрирована на фиг. 2 и описана выше, где указанная структура содержит внеклеточный лигандсвязывающий домен, который содержит VH и VL из моноклонального антитела к CD123, содержащие следующие последовательности CDR:
GFTFTDYY (SEQ ID NO: 67),
RSKADGYTT (SEQ ID NO: 68),
ARDAAYYSYYSPEGAMDY (SEQ ID NO: 69) и
QNVDSA (SEQ ID NO: 70),
SAS (SEQ ID NO: 71),
QQYYSTPWT (SEQ ID NO: 72),
- и где указная структура содержит:
шарнир, трансмембранный домен и цитоплазматический домен, включающий сигнальный домен CD3дзета и костимуляторный домен из 4-1ВВ.
В настоящем изобретении предложен CD123-специфический химерный антигенный рецептор (123 CAR), описанный выше, в котором внеклеточный лигандсвязывающий домен, содержащий VH и VL, является гуманизированным.
В настоящем изобретении предложен CD123-специфический химерный антигенный рецептор (123 CAR), описанный выше, в котором указанный внеклеточный лигандсвязывающий домен является гуманизированным.
В настоящем изобретении предложен CD123-специфический химерный антигенный рецептор (123 CAR), описанный выше, где указанный CD123-специфический химерный антигенный рецептор является гуманизированным.
В настоящем изобретении предложен CD123-специфический химерный антигенный рецептор (123 CAR), описанный выше, в котором внеклеточный лигандсвязывающий домен, содержащий VH и VL из моноклонального антитела к CD123, содержит следующую последовательность
 и
и
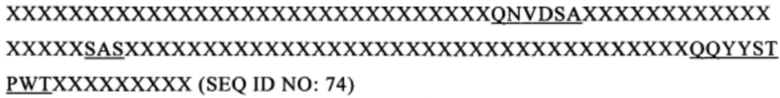 , в которой X обозначает аминокислоту,
, в которой X обозначает аминокислоту,
аминокислота может представлять собой любую из аминокислот, например, аланин, аспарагин, аспарагиновую кислоту, цистеин, глутамин, глутаминовую кислоту, глицин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, пролин, серии, треонин, триптофан, тирозин, валин.
В настоящем изобретении предложен CD123-специфический химерный антигенный рецептор (CAR), описанный выше, в котором указанный внеклеточный лигандсвязывающий домен, содержащий VH и VL из моноклонального антитела к CD123 соответственно, содержит по меньшей мере одну из следующих последовательностей:
(вариант VH1: SEQ ID NO: 60):

(вариант VH2: SEQ ID NO: 61):
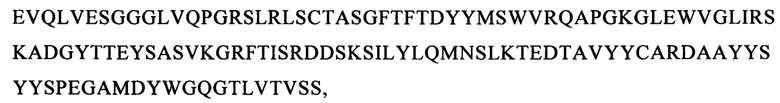
(вариант VH3: SEQ ID NO: 62):
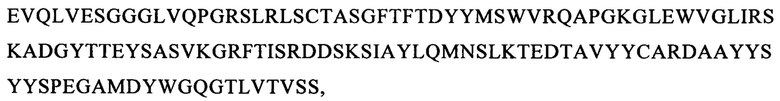
(вариант VH4: SEQ ID NO: 63):
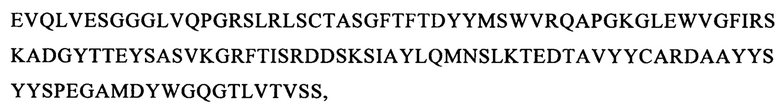
(вариант VH5: SEQ ID NO: 64):
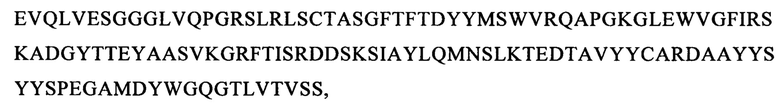
(вариант VH6: SEQ ID NO: 65):
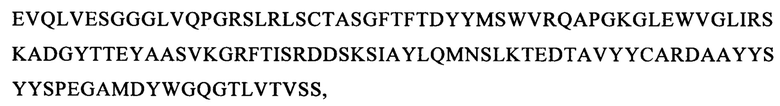
(вариант VH7: SEQ ID NO: 66):
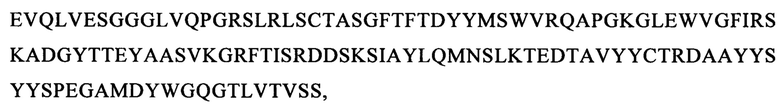
(вариант VL1: SEQ ID NO: 54):

(вариант VL2: SEQ ID NO: 55):

(вариант VL3: SEQ ID NO: 56):

(вариант VL4: SEQ ID NO: 57):

(вариант VL5: SEQ ID NO: 58):

 и
и
(вариант VL6: SEQ ID NO: 59):

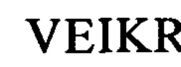 или их комбинацию.
или их комбинацию.
В настоящем изобретении предложен CD123-специфический химерный антигенный рецептор (CAR), описанный выше, в котором указанный внеклеточный лигандсвязывающий домен, содержащий VH и VL из моноклонального антитела к CD123 соответственно, содержит по меньшей мере одну из следующих последовательностей: 
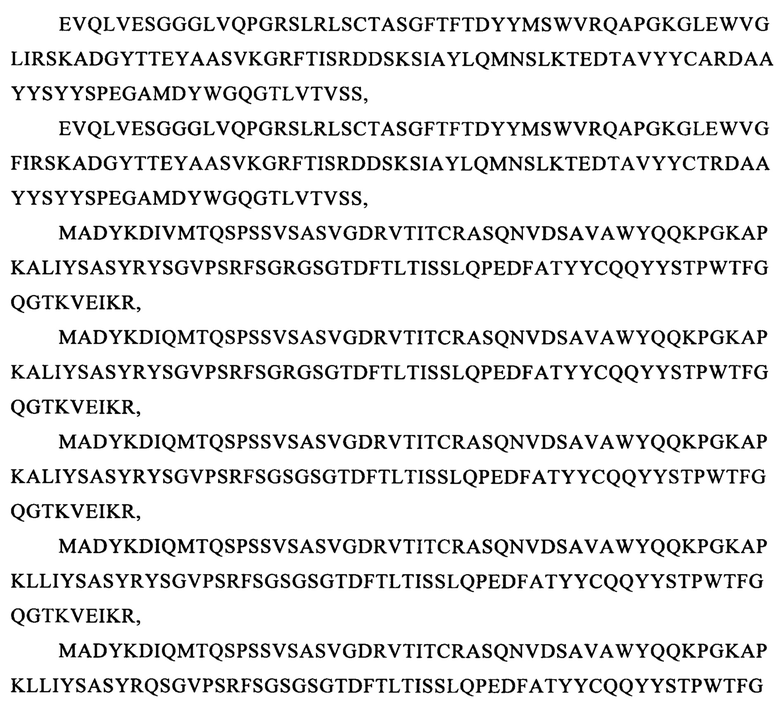
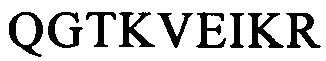 и
и

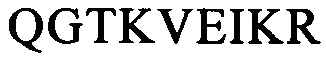 или их комбинацию.
или их комбинацию.
Предпочтительно в настоящем изобретении предложен CD123-специфический химерный антигенный рецептор (CAR), описанный выше, в котором указанный внеклеточный лигандсвязывающий домен, содержащий VH и VL из моноклонального антитела к CD123 соответственно, содержит по меньшей мере одну из следующих последовательностей: 

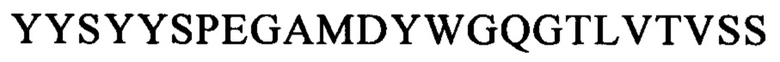 и по меньшей мере одну из следующих последовательностей:
и по меньшей мере одну из следующих последовательностей:


В настоящем изобретении предложен CD123-специфический CAR, описанный выше, в котором указанная структура V3 содержит шарнир СD8альфа и трансмембранный домен СD8альфа.
В настоящем изобретении предложен CD123-специфический CAR, описанный выше, в котором указанная структура V3 содержит шарнир СD8альфа, цитоплазматический домен 4-1ВВ и трансмембранный домен СD8альфа.
В настоящем изобретении предложен CD123-специфический CAR, описанный выше, в котором указанная структура V3 содержит шарнир СD8альфа и трансмембранный домен 4-1ВВ.
В настоящем изобретении предложен CD123-специфический CAR, описанный выше, в котором указанные VH и VL идентичны по меньшей мере на 80% полипептидной последовательности, выбранной из SEQ ID NO: 19 и SEQ ID NO: 20.
В настоящем изобретении предложен CD123-специфический CAR, описанный выше, в котором указанные VH и VL идентичны по меньшей мере на 80% полипептиду, имеющему SEQ ID NO: 19 и/или SEQ ID NO: 20.
В настоящем изобретении предложен CD123-специфический CAR, описанный выше, дополнительно содержащий другой внеклеточный лигандсвязывающий домен, который не является специфическим для CD123.
В настоящем изобретении предложен CD123-специфический CAR, описанный выше, дополнительно содержащий сигнальный пептид, предпочтительно имеющий SEQ ID NO: 1 или SEQ ID NO: 2.
В настоящем изобретении предложен CD123-специфический CAR, описанный выше, в котором линкер, имеющий SEQ ID NO: 10, встроен между VH и VL.
В настоящем изобретении предложен полинуклеотид, который кодирует CD123-специфический химерный антигенный рецептор, соответствующий любому из описанных выше CD123-специфических CAR, указанный полинуклеотид дополнительно содержит сигнальный пептид, предпочтительно имеющий SEQ ID NO: 1 или SEQ ID NO: 2.
В настоящем изобретении предложен экспрессионный вектор, содержащий описанный выше полинуклеотид.
В настоящем изобретении предложена сконструированная иммунная клетка, экспрессирующая на поверхности клеточной мембраны CD123-специфический химерный антигенный рецептор, описанный выше, предпочтительно сконструированная иммунная клетка может экспрессировать на поверхности клеточной мембраны CD123-специфический химерный антигенный рецептор, описанный выше.
В настоящем изобретении предложена сконструированная иммунная клетка, описанная выше, полученная из Т-лимфоцитов, необязательно устойчивая к противораковому лекарственному средству и несущая делецию в гене, который кодирует TCR альфа или TCR бета.
В настоящем изобретении предложена сконструированная иммунная клетка, описанная выше, в которой экспрессия TCR подавлена.
В настоящем изобретении предложена сконструированная иммунная клетка, описанная выше, где экспрессия по меньшей мере одного белка ГКГС, предпочтительно β2m или HLA, подавлена в указанной сконструированной иммунной клетке. β2m обозначает бета-2-микроглобулин, a HLA обозначает человеческий лейкоцитарный антиген. Белок ГКГС представляет собой белок ГКГС класса I или класса II.
В настоящем изобретении предложена сконструированная иммунная клетка, описанная выше, где сконструированная иммунная клетка подвергнута мутации для придания устойчивости по меньшей мере к одному иммуносупрессорному лекарственному средству, химиотерапевтическому лекарственному средству или противораковому лекарственному средству.
В настоящем изобретении предложена сконструированная иммунная клетка, описанная выше, предназначенная для применения в терапии.
В настоящем изобретении предложена сконструированная иммунная клетка, описанная выше, которая предназначена для применения в терапии, где пациент представляет собой человека.
В настоящем изобретении предложена сконструированная иммунная клетка, описанная выше, которая предназначена для применения в терапии, где состояние представляет собой предзлокачественное или злокачественное связанное с раком состояние, отличающееся наличием экспрессирующих CD123 клеток.
В настоящем изобретении предложена сконструированная иммунная клетка, описанная выше, которая предназначена для применения в терапии, где состояние представляет собой состояние, отличающееся избыточным количеством экспрессирующих CD123 клеток.
В настоящем изобретении предложена сконструированная иммунная клетка, описанная выше, которая предназначена для применения в терапии, где состояние представляет собой состояние, связанное с гематологическим раком.
В настоящем изобретении предложена сконструированная иммунная клетка, описанная выше, которая предназначена для применения в терапии, где состояние, связанное с гематологическим раком, представляет собой лейкоз или злокачественные лимфопролиферативные нарушения.
В настоящем изобретении предложена сконструированная иммунная клетка, описанная выше, которая предназначена для применения в терапии, где указанный лейкоз выбран из группы, состоящей из острого миелогенного лейкоза, хронического миелогенного лейкоза, мелодиспластического синдрома, острого лимфоидного лейкоза, хронического лимфоидного лейкоза и миелодиспластического синдрома.
В настоящем изобретении предложена сконструированная иммунная клетка, описанная выше, которая предназначена для применения в терапии, где указанный лейкоз представляет собой острый миелогенный лейкоз (AML).
В настоящем изобретении предложена сконструированная иммунная клетка, описанная выше, которая предназначена для применения в терапии, где указанный гематологический рак представляет собой злокачественное лимфопролиферативное нарушение.
В настоящем изобретении предложена сконструированная иммунная клетка, описанная выше, которая предназначена для применения в терапии, где указанное лимфопролиферативное нарушение представляет собой лимфому.
В настоящем изобретении предложена сконструированная иммунная клетка, описанная выше, которая предназначена для применения в терапии, где указанная лимфома выбрана из группы, состоящей из множественной миеломы, неходжкинской лимфомы, лимфомы Беркитта и фолликулярной лимфомы (мелкоклеточной и крупноклеточной).
В настоящем изобретении предложен способ разрушения клетки гематологического рака, заключающийся в том, что приводят в контакт указанную клетку гематологического рака со сконструированной клеткой по одному из п.п. 13-17 формулы изобретения, в количестве, эффективном для разрушения указанной раковой клетки.
В настоящем изобретении предложен способ создания иммунной клетки, заключающийся в том, что:
(а) получают иммунную клетку,
(б) осуществляют экспрессию на поверхности указанной клетки по меньшей мере одного CD123-специфического химерного антигенного рецептора по одному из п.п. 1-10 формулы изобретения.
В настоящем изобретении предложен способ создания описанной выше иммунной клетки, заключающийся в том, что:
(а) получают иммунную клетку,
(б) интродуцируют в указанную клетку по меньшей мере один полинуклеотид, который кодирует указанный CD123-специфический химерный антигенный рецептор,
(в) осуществляют экспрессию указанного полинуклеотида в указанной клетке.
В настоящем изобретении предложен способ создания описанной выше иммунной клетки, заключающийся в том, что:
(а) получают иммунную клетку,
(б) интродуцируют в указанную клетку по меньшей мере один полинуклеотид, который кодирует указанный CD123-специфический химерный антигенный рецептор,
(в) интродуцируют по меньшей мере один другой химерный антигенный рецептор, который не является специфическим для CD123.
В настоящем изобретении предложен также способ лечения индивидуума, который нуждается в этом, заключающийся в том, что:
(а) получают иммунную клетку, экспрессирующую на поверхности CD123- специфический химерный антигенный рецептор по одному из п.п. 1-10 формулы изобретения,
(б) вводят указанные иммунные клетки указанному пациенту.
В настоящем изобретении предложен способ лечения указанного выше индивидуума, нуждающегося в этом, заключающийся в том, что указанную иммунную клетку получают из донора.
В настоящем изобретении предложен способ лечения указанного выше индивидуума, нуждающегося в этом, заключающийся в том, что указанную иммунную клетку получают из организма самого пациента.
CD123-специфические химерные антигенные рецепторы
Настоящее изобретение относится к новым конструкциям анти-CD123 химерного антигенного рецептора (CAR), которые содержат внеклеточный лигандсвязывающий домен, трансмембранный домен и домен трансдукции сигнала.
Понятие «внеклеточный лигандсвязывающий домен» в контексте настоящего описания обозначает олиго- или полипептид, обладающий способностью связываться с лигандом. Предпочтительно домен должен обладать способностью взаимодействовать с молекулой клеточной поверхности. Например, можно выбирать внеклеточный лигандсвязывающий домен, позволяющий распознавать лиганд, который функционирует в качестве маркера клеточной поверхности на клетках-мишенях, ассоциированных с конкретным болезненным состоянием. В предпочтительном варианте осуществления изобретения указанный внеклеточный лигандсвязывающий домен содержит одноцепочечный фрагмент антитела (scFv), содержащий вариабельный фрагмент легкой (VL) и тяжелой (VH) цепи специфического в отношении антигена-мишени моноклонального антитела к CD123, соединенные гибким линкером. Указанные VL и VH предпочтительно выбирают из антител, обозначенных в научной литературе как 7G3, Old4, 26292, 32716, Klon43 и 12F1, которые описаны в таблице 1-8, более предпочтительно Old4, Klon43 и 12F1 и еще более предпочтительно Klon43. Они предпочтительно сцеплены друг с другом гибким линкером, который содержит последовательность SEQ ID NO: 10. Другими словами, указанные CAR предпочтительно содержат внеклеточный лигандсвязывающий домен, который содержит полипептидную последовательность, идентичную по меньшей мере на 90%, 95%, 97% или 99% аминокислотной последовательности, которая выбрана из группы, состоящей из SEQ ID NO: 11-SEQ ID NO: 22 (см. таблицу 2).
Более предпочтительно указанные CAR предпочтительно содержат внеклеточный лигандсвязывающий домен, который содержит полипептидную последовательность, идентичную по меньшей мере на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% аминокислотной последовательности, которая выбрана из группы, состоящей из SEQ ID NO: 13, 14, 19, 20, 21, 22, и еще более предпочтительно указанные CAR предпочтительно содержат внеклеточный лигандсвязывающий домен, который содержит полипептидную последовательность, идентичную по меньшей мере на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% аминокислотным последовательностям, имеющим SEQ ID NO: 19 и/или 20.
Еще более предпочтительно указанные CAR содержат внеклеточный лигандсвязывающий домен, который содержит полипептидную последовательность, идентичную по меньшей мере на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% аминокислотной последовательности, выбранной из группы, состоящей из SEQ ID NO: 1 + SEQ ID NO: 13, SEQ ID NO: 1 + SEQ ID NO: 14, SEQ ID NO: 1 + SEQ ID NO: 19, SEQ ID NO: 1 + SEQ ID NO: 20, SEQ ID NO: 1 + SEQ ID NO: 21 и SEQ ID NO: 1 + SEQ ID NO: 22, и еще более предпочтительно указанные CAR предпочтительно содержат внеклеточный лигандсвязывающий домен, который содержит полипептидную последовательность, идентичную по меньшей мере на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% аминокислотным последовательностям, имеющим SEQ ID NO: 1 + SEQ ID NO: 19 и SEQ ID NO: 1 + SEQ ID NO: 20.
В контексте настоящего описания понятие «рекомбинантное антитело» означает антитело или фрагмент антитела, созданное/созданный с помощью технологии рекомбинантной ДНК, такое, например, как антитело или фрагмент антитела, экспрессируемое/экспрессируемый бактериофагом, системой экспрессии дрожжей или системой экспрессии клеток млекопитающих. Подразумевается также, что понятие относится к антителу или фрагменту антитела, созданному с помощью синтеза молекулы ДНК, которая кодирует антитело или фрагмент антитела, и эта молекула ДНК экспрессирует белок антитела или фрагмента антитела или аминокислотную последовательность, специфическую для антитела или фрагмента антитела, при этом ДНК или аминокислотную последовательность получали с использованием технологии получения рекомбинантной или синтетической ДНК, которая доступна и хорошо известна в данной области.
В контексте настоящего описания подразумевается, что понятие «консервативные модификации последовательности» или «гуманизация» относится к модификациям аминокислот, которые существенно не влияют или не изменяют характеристики связывания CAR и/или которые не оказывают существенного влияния на активность CAR, содержащего модифицированную аминокислотную последовательность, и снижают или аннулируют ответ в виде человеческого антимышиного антитела (HAMA). Указанные консервативные модификации включают аминокислотные замены, добавления и делеции в указанном фрагменте антитела в указанном CAR и/или в любых других частях указанной молекулы CAR. Модификации можно интродуцировать в антитело, во фрагмент антитела или в любую из других частей молекулы CAR, предлагаемой в изобретении, с помощью стандартных технологий, известных в данной области, таких как сайтнаправленный мутагенез, опосредуемый ПЦР мутагенез, или путем применения оптимизированных последовательностей зародышевых линий.
Консервативные аминокислотные замены представляют собой замены, при которых аминокислотный остаток заменяют на аминокислотный остаток, который имеет сходную боковую цепь. Семейства аминокислотных остатков, имеющих сходные боковые цепи, известны в данной области. Эти семейства включают аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислотными боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серии, треонин, тирозин, цистеин, триптофан), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фениланин, метионин), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Таким образом, один или несколько аминокислотных остатков в CAR, предлагаемом в изобретении, можно заменять на другие аминокислотные остатки из того же семейства боковых цепей и измененный CAR можно тестировать в отношении способности связывать CD123, используя функциональные анализы, представленные в настоящем описании.
Домен трансдукции сигнала или внутриклеточный сигнальный домен CAR, предлагаемого в настоящем изобретении, ответствен за внутриклеточную передачу сигнала после связывания внеклеточного лигандсвязывающего домена с мишенью, приводя к активации иммунной клетки и иммунному ответу. Другими словами, домен трансдукции сигнала ответствен за активацию по меньшей мере одной из обычных эффекторных функций иммунной клетки, в которой экспрессируется CAR. Например, эффекторная функция Т-клетки может представлять собой цитолитическую активность или хелперную активность, включая секрецию цитокинов. Таким образом, понятие «домен трансдукции сигнала» относится к участку белка, который трансдуцирует сигнал эффекторной сигнальной функции и побуждает клетку осуществлять специализированную функцию.
Предпочтительными примерами домена трансдукции сигнала, которые можно применять в CAR, могут являться цитоплазматические последовательности Т-клеточного рецептора и корецепторов, совместное действие которых состоит в инициации трансдукции сигнала после контакта с рецептором антигена, а также любое производное или любой вариант указанных последовательностей и любой синтетической последовательности, которая имеет такую же функциональную способность. Домен трансдукции сигнала содержит два различных класса цитоплазматических сигнальных последовательностей, те, которые инициируют антигензависимую первичную активацию, и те, которые действуют независимым от антигена образом, обеспечивая вторичный или костимуляторный сигнал. Первичная цитоплазматическая сигнальная последовательность может содержать сигнальные мотивы, известные как мотивы активации иммунных рецепторов на основе тирозина, ITAM. ITAM представляют собой хорошо известные сигнальные мотивы, присутствующие во внутрицитоплазматическом «хвосте» различных рецепторов, которые служат в качестве сайтов связывания для класса syk/zap70 тирозинкиназ. Примерами ITAM, применяемых согласно изобретению, могут служить (но, не ограничиваясь только ими) ITAM, происходящие из ТСRдзета, FcR-гамма, FcR-бета, FcRэпсилон, СD3гамма, CD3дельта, СD3эпсилон, CD5, CD22, CD79a, CD79b и CD66d. В предпочтительном варианте осуществления изобретения домен трансдукции сигнала CAR может содержать происходящий из СD3дзета сигнальный домен, который имеет аминокислотную последовательность, идентичную по меньшей мере на 70%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 90%, 95%, 97%-99% или 100% аминокислотной последовательности, выбранной из группы, включающей SEQ ID NO: 9.
В конкретном варианте осуществления изобретения домен трансдукции сигнала CAR, предлагаемого в настоящем изобретении, содержит костимуляторную сигнальную молекулу. Костимуляторная молекула представляет собой молекулу клеточной поверхности, отличную от антигенного рецептора или его лигандов, которая требуется для эффективного иммунного ответа. Понятие «костимуляторный лиганд» относится к молекуле на антигенпрезентирующей клетке, которая специфически связывается с когнатной костимуляторной молекулой на Т-клетке, создавая тем самым сигнал, который, в дополнение к первичному сигналу, создаваемому, например, при связывании комплекса TCR/CD3 с молекулой ГКГС, загруженной пептидом, опосредует Т-клеточный ответ, включая (но, не ограничиваясь только ими) активацию пролиферации, дифференцировку и т.п. Костимуляторный лиганд может включать (но, не ограничиваясь только ими) CD7, В7-1 (CD80), В7-2 (CD86), PD-L1, PD-L2, 4-1BBL, OX40L, индуцибельный костимуляторный лиганд (ICOS-L), молекулу межклеточной адгезии (ICAM, CD30L, CD40, CD70, CD83, HLA-G, MICA, М1СВ, HVEM, рецептор лимфотоксина бета, 3/TR6, ILT3, ILT4, агонист или антитело, который/которое связывается с лигандом Толл-рецептора, и лиганд, который специфически связывается с В7-Н3. Под понятие «костимуляторный лиганд» подпадает, среди прочего, антитело, которое специфически связывается с костимуляторной молекулой, присутствующей на Т-клетке, такой как (но, не ограничиваясь только ими) CD27, CD28, 4-1ВВ, ОХ40, CD30, CD40, PD-1, ICOS, антиген-1, ассоциированный с функцией лимфоцитов (LFA-1), CD2, CD7, LTGHT, NKG2C, В7-Н3, лиганд, специфически связывающийся с CD83. Понятие «костимуляторная молекула» относится к когнатному связывающему партнеру, присутствующему на Т-клетке, который специфически связывается с костимуляторным лигандом, опосредуя тем самым костимуляторный ответ клетки, такой как (но, не ограничиваясь только им) пролиферация. Костимуляторные молекулы включают (но, не ограничиваясь только ими) молекулу ГКГС класса I, BTLA и лиганд Толл-рецептора. Примерами костимуляторных молекул являются CD27, CD28, CD8, 4-1ВВ (CD137), ОХ40, CD30, CD40, PD-1, ICOS, антиген-1, ассоциированный с функцией лимфоцитов (LFA-1), CD2, CD7, LIGHT, NKG2C, В7-Н3 и лиганд, специфически связывающийся с CD83, и т.п.
В предпочтительном варианте осуществления изобретения домен трансдукции сигнала CAR, предлагаемого в настоящем изобретении, содержит часть костимуляторной сигнальной молекулы, выбранной из группы, состоящей из фрагмента 4-1ВВ (GenBank: ААА53133.) и CD28 (NP_006130.1). В частности, домен трансдукции сигнала CAR, предлагаемого в настоящем изобретении, содержит аминокислотную последовательность, идентичную по меньшей мере на 70%, предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 90%, 95%, 97% или 99% аминокислотной последовательности, выбранной из группы, включающей SEQ ID NO: 8.
CAR, предлагаемый в настоящем изобретении, экспрессируется на поверхности клеточной мембраны. Таким образом, CAR содержит также трансмембранный домен. Отличительными особенностями соответствующих трансмембранных доменов являются способность экспрессироваться на поверхности клетки, согласно настоящему изобретению предпочтительно на поверхности иммунной клетки, прежде всего лимфоцитов или естественных клеток-киллеров (NK), и взаимодействовать друг с другом, направляя клеточный ответ иммунной клетки на заранее определенную клетку-мишень. Трансмембранный домен можно получать как из встречающегося в естественных условиях, так и синтетического источника. Трансмембранный домен можно получать из любого связанного с мембраной или трансмембранного белка. Примерами трансмембранных полипептидов могут служить (но, не ограничиваясь только ими) субъединица Т-клеточного рецептора, такая как α-, β-, γ- или δ-субъединица, полипептид, образующий комплекс с CD3, р55 (α-цепь), р75 (β-цепь) или γ-цепь рецептора IL2, цепь субъединицы Fc-рецепторов, в частности, Fcγ-рецептора III, или CD-белки. Альтернативно этому, трансмембранный домен может быть синтетическим, и он может содержать преимущественно гидрофобные остатки, такие как лейцин и валин. В предпочтительном варианте осуществления изобретения указанный трансмембранный домен получают из альфа-цепи человеческого CD8 (например, NP_001139345.1). Трансмембранный домен может содержать также шарнирную область между указанным внеклеточным лигандсвязывающим доменом и указанным трансмембранным доменом. В контексте настоящего описания понятие «шарнирная область», как правило, обозначает любой олиго- или полипептид, функция которого заключается в сцеплении трансмембранного домена с внеклеточным лигандсвязывающим доменом. В частности, шарнирную область используют для обеспечения большей гибкости и доступности внеклеточного лигандсвязывающего домена. Шарнирная область может содержать вплоть до 300 аминокислот, предпочтительно от 10 до 100 аминокислот, и наиболее предпочтительно от 25 до 50 аминокислот. Шарнирную область можно получать из полных встречающихся в естественных условиях молекул, или их частей, таких как полная внеклеточная область CD8, CD4 или CD28, или ее часть, или полная константная область антитела или ее часть. Альтернативно этому, шарнирная область может представлять собой синтетическую последовательность, которая соответствует встречающейся в естественных условиях шарнирной последовательности, или может представлять собой полностью синтетическую шарнирную последовательность. В предпочтительном варианте осуществления изобретения указанная шарнирная область представляет собой часть альфа-цепи человеческого CD8, FcγRIIIα-рецептора или IgG1 соответственно, которые обозначены в настоящем описании как SEQ ID NO: 3, SEQ ID NO: 4 и SEQ ID NO: 5, или шарнирные полипептиды, последовательности которых идентичны предпочтительно по меньшей мере на 80%, более предпочтительно по меньшей мере на 90%, 95%, 97% или 99% последовательностям указанных полипептидов.
CAR, предлагаемый в изобретении, как правило, дополнительно содержит трансмембранный домен (ТМ), более конкретно выбранный из CD8α и 4-1ВВ, который идентичен полипептидам, имеющим SEQ ID NO: 6 или 7.
CAR, предлагаемый в изобретении, как правило, дополнительно содержит трансмембранный домен (ТМ) из CD8α и 4-1ВВ, и еще более предпочтительно идентичный полипептидам, имеющим SEQ ID NO: 6 или 7.
В предпочтительном варианте осуществления изобретения CAR, предлагаемый в изобретении, дополнительно содержит ТМ-домен из CD8α, имеющий SEQ ID NO: 6, или идентичный по меньшей мере на 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% последовательности SEQ ID NO: 6.
В раковых клетках часто имеет место понижающая регуляция или мутация антигенов-мишеней, что приводит к появлению так называемых вариантов «потерянных антигенов» (антигенов, ускользающих от иммунологического надзора). Таким образом, для того, чтобы противостоять ускользанию опухоли от иммунологического надзора и придавать иммунной клетке большую специфичность в отношении мишени, CD123-специфический CAR, предлагаемый в изобретении, может содержать другие внеклеточные лигандсвязывающие домены, предназначенные для одновременного связывания с другими элементами на мишени и усиления тем самым активации и функции иммунной клетки. В одном из вариантов осуществления изобретения внеклеточные лигандсвязывающие домены можно размещать тандемно на одном и том же трансмембранном полипептиде и их необязательно можно отделять друг от друга с помощью линкера. В другом варианте осуществления изобретения указанные другие внеклеточные лигандсвязывающие домены можно размещать на различных трансмембранных полипептидах, из которых состоит CAR. Другой вариант осуществления настоящего изобретения относится к популяции CAR, каждый из которых содержит различные внеклеточные лигандсвязывающие домены. В частности, настоящее изобретение относится к способу создания иммунных клеток, заключающемуся в том, что получают иммунную клетку и экспрессируют на поверхности указанной клетки популяцию CAR, каждый из которых содержит различные внеклеточные лигандсвязывающие домены. Другой конкретный вариант осуществления настоящего изобретения относится к способу создания иммунной клетки, заключающемуся в том, что получают иммунную клетку и интродуцируют в указанную клетку полинуклеотиды, кодирующие полипептиды, из которых состоит популяция CAR, каждый из которых содержит различные внеклеточные лигандсвязывающие домены. Под популяцией CAR подразумевают по меньшей мере два, три, четыре, пять, шесть или большее количество CAR, каждый из которых содержит различные внеклеточные лигандсвязывающие домены. Согласно настоящему изобретению различные внеклеточные лигандсвязывающие домены, предлагаемые в настоящем изобретении, предпочтительно могут связываться одновременно с различными элементами на мишени, усиливая тем самым активацию и функцию иммунной клетки. Настоящее изобретение относится также к выделенной иммунной клетке, которая содержит популяцию CAR, каждый из которых содержит различные внеклеточные лигандсвязывающие домены.
В предпочтительном варианте осуществления изобретения CAR, предлагаемый в изобретении, содержит полипептид, имеющий SEQ ID NO: 19, и/или полипептид, имеющий SEQ ID NO: 20, более предпочтительно CAR, предлагаемый в изобретении, содержит полипептид, идентичный по меньшей мере на 80%, предпочтительно идентичный на 80%-99% SEQ ID NO: 19, и/или полипептид, идентичный на 80%-99% SEQ ID NO: 20. Еще более предпочтительно CAR, предлагаемый в изобретении, содержит полипептид, идентичный на 85-99% полипептиду, имеющему SEQ ID NO: 19 и/или SEQ ID NO: 20.
В более предпочтительном варианте осуществления изобретения CAR, предлагаемый в изобретении, содержит полипептид, имеющий следующие последовательности:
 и
и

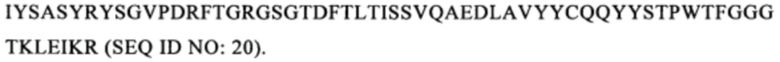
В одном из предпочтительных вариантов осуществления изобретения CAR, предлагаемый в изобретении, содержит по меньшей мере полипептид, имеющий следующую последовательность:

В одном из предпочтительных вариантов осуществления изобретения CAR, предлагаемый в изобретении, содержит полипептид, имеющий следующую последовательность:

В одном из предпочтительных вариантов осуществления изобретения CAR, предлагаемый в изобретении, содержит полипептид, имеющий следующую последовательность:

В одном из предпочтительных вариантов осуществления изобретения CAR, предлагаемый в изобретении, содержит полипептид, имеющий следующую последовательность:

В одном из предпочтительных вариантов осуществления изобретения CAR, предлагаемый в изобретении, содержит полипептид, имеющий следующую последовательность:

В одном из предпочтительных вариантов осуществления изобретения CAR, предлагаемый в изобретении, содержит полипептид, имеющий следующую последовательность:

В одном из предпочтительных вариантов осуществления изобретения CAR, предлагаемый в изобретении, содержит полипептид, имеющий следующую последовательность:

В одном из предпочтительных вариантов осуществления изобретения CAR, предлагаемый в изобретении, содержит полипептид, имеющий следующую последовательность:

В одном из предпочтительных вариантов осуществления изобретения CAR, предлагаемый в изобретении, содержит полипептид, имеющий следующую последовательность:

В одном из предпочтительных вариантов осуществления изобретения CAR, предлагаемый в изобретении, содержит полипептид, имеющий следующую последовательность:

В одном из предпочтительных вариантов осуществления изобретения CAR, предлагаемый в изобретении, содержит полипептид, имеющий следующую последовательность:

В одном из предпочтительных вариантов осуществления изобретения CAR, предлагаемый в изобретении, содержит полипептид, имеющий следующую последовательность:

В одном из предпочтительных вариантов осуществления изобретения CAR, предлагаемый в изобретении, содержит полипептид, имеющий следующую последовательность:

В одном из предпочтительных вариантов осуществления изобретения CAR, предлагаемый в изобретении, содержит по меньшей мере один полипептид, выбранный из следующих последовательностей: 
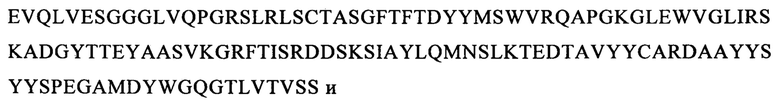
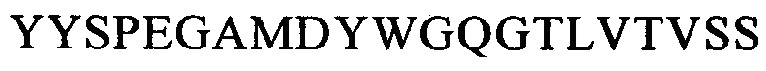 и
и
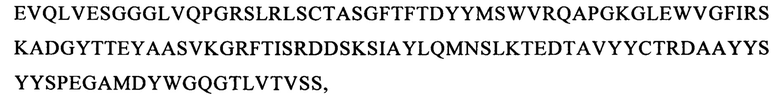
и по меньшей мере одну последовательность, выбранную из следующих последовательностей

 и
и

В одном из предпочтительных вариантов осуществления изобретения CAR, предлагаемый в изобретении, содержит один полипептид, выбранный из следующих последовательностей: SEQ ID NO: 54, SEQ ID NO: 55, SEQ ID NO: 56, SEQ ID NO: 57, SEQ ID NO: 58, SEQ ID NO: 59, SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63, SEQ ID NO: 64, SEQ ID NO: 65 и SEQ ID NO: 66.
В более предпочтительном варианте осуществления изобретения CAR, предлагаемый в изобретении, содержит один полипептид, выбранный из следующих последовательностей: SEQ ID NO: 54, SEQ ID NO: 55, SEQ ID NO: 56, SEQ ID NO: 57, SEQ ID NO: 58, SEQ ID NO: 59, и пептид выбранный из следующих последовательностей: SEQ ID NO: 60, SEQ ID NO: 61, SEQ ID NO: 62, SEQ ID NO: 63, SEQ ID NO: 64, SEQ ID NO: 65 и SEQ ID NO: 66.
В одном из вариантов осуществления изобретения CAR, предлагаемый в изобретении, содержит полипептид, выбранный из перечня, состоящего из SEQ ID NO: 42, SEQ ID NO: 44 и SEQ ID NO: 46, предпочтительно CAR идентичен на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% полипептиду, имеющему SEQ ID NO: 42, CAR идентичен на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% полипептиду, имеющему SEQ ID NO: 44, и CAR идентичен на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% полипептиду, имеющему SEQ ID NO: 46.
В более предпочтительном варианте осуществления изобретения CAR, предлагаемый в изобретении, содержит полипептид, идентичный на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% SEQ ID NO: 1 + SEQ ID NO: 42.
В другом предпочтительном варианте осуществления изобретения CAR, предлагаемый в изобретении, содержит полипептид, имеющий SEQ ID NO: 10 + SEQ ID NO: 42, еще более предпочтительно CAR идентичен на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% SEQ ID NO: 10 + SEQ ID NO: 42, в частности CAR идентичен на 85%-99% SEQ ID NO: 10 + SEQ ID NO: 42.
В более предпочтительном варианте осуществления изобретения CAR, предлагаемый в изобретении, содержит полипептид, идентичный на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% SEQ ID NO: 1 + SEQ ID NO: 44.
В еще более предпочтительном варианте осуществления изобретения CAR, предлагаемый в изобретении, содержит полипептид, имеющий SEQ ID NO: 10 + SEQ ID NO: 44, еще более предпочтительно CAR идентичен на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% SEQ ID NO: 10 + SEQ ID NO: 44, в частности CAR идентичен на 85%-99% SEQ ID NO: 10 + SEQ ID NO: 44.
В более предпочтительном варианте осуществления изобретения CAR, предлагаемый в изобретении, содержит полипептид, идентичный на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% SEQ ID NO: 1 + SEQ ID NO: 46.
В еще более предпочтительном варианте осуществления изобретения CAR, предлагаемый в изобретении, содержит полипептид, имеющий SEQ ID NO: 10 + SEQ ID NO: 46, еще более предпочтительно CAR идентичен на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% SEQ ID NO: 10 + SEQ ID NO: 46, в частности CAR идентичен на 85%-99% SEQ ID NO: 10 + SEQ ID NO: 46.
В другом предпочтительном варианте осуществления изобретения CAR, предлагаемый в изобретении, состоит из полипептида, имеющего SEQ ID NO: 1 + SEQ ID NO: 10 + SEQ ID NO: 42, еще более предпочтительно CAR состоит из полипептида, идентичного на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% SEQ ID NO: SEQ ID NO: 1 + SEQ ID NO: 10 + SEQ ID NO: 42.
В другом предпочтительном варианте осуществления изобретения CAR, предлагаемый в изобретении, состоит из полипептида, имеющего SEQ ID NO: 1 + SEQ ID NO: 10 + SEQ ID NO: 44, еще более предпочтительно CAR состоит из полипептида, идентичного на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% SEQ ID NO: SEQ ID NO: 1 + SEQ ID NO: 10 + SEQ ID NO: 44.
В другом предпочтительном варианте осуществления изобретения CAR, предлагаемый в изобретении, состоит из полипептида, имеющего SEQ ID NO: 1 + SEQ ID NO: 10 + SEQ ID NO: 46, еще более предпочтительно CAR состоит из полипептида, идентичного на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% SEQ ID NO: SEQ ID NO: 1 + SEQ ID NO: 10 + SEQ ID NO: 46.
Согласно изобретению иммунные клетки, экспрессирующие анти-CD123, предлагаемый в изобретении, запускают противораковый иммунный ответ. В предпочтительном варианте осуществления изобретения иммунные клетки, экспрессирующие CAR, предлагаемый в изобретении, наделенные анти-CD123 CAR, предлагаемым в изобретении, запускают иммунный ответ, который не включает ответ в виде человеческого антимышиного антитела (HAMA).
Согласно изобретению сконструированную иммунную клетку можно вводить в эффективном количестве пациенту, который нуждается в этом, по меньшей мере один, два или большее количество раз, индивидуально или в сочетании с другой обработкой.
В настоящем изобретении описан CD123-специфический химерный антигенный химерный рецептор (CAR), который имеет одну из полипептидных структур, выбранных из V1-V6, которые проиллюстрированы на фиг. 2, указанная структура содержит внеклеточный лигандсвязывающий домен, содержащий VH и VL из моноклонального антитела к CD123, шарнир, трансмембранный домен и цитоплазматический домен, включающий сигнальный домен CD3дзета и костимуляторный домен из 4-1ВВ.
Полинуклеотиды, векторы:
Настоящее изобретение относится также к полинуклеотидам, векторам, кодирующим описанный выше CAR, предлагаемый в изобретении.
Полинуклеотид может содержаться в кассете экспрессии или экспрессионном векторе (например, в плазмиде, предназначенной для интродукции в бактериальную клетку-хозяина, или вирусном векторе, таком как бакуловирусный вектор, предназначенный для трансфекции клетки насекомого- хозяина, или плазмидном или вирусном векторе, таком как лентивирус, предназначенном для трансфекции клетки млекопитающего-хозяина).
В конкретном варианте осуществления изобретения можно включать различные нуклеотидные последовательности в один полинуклеотид или вектор, который содержит нуклеотидную последовательность, кодирующую рибосомальную skip-последовательность, такую как последовательность, кодирующую пептид 2А. Пептиды 2А, которые были идентифицированы в подгруппе афтовирусов группы пикорнавирусов, приводят к рибосомальному «перескоку» (skip) от одного кодона к следующему без образования пептидной связи между двумя аминокислотами, кодируемыми кодонами (см. Donnelly и Elliott, 2001; Atkins, Wills и др., 2007; Doronina, Wu и др., 2008). Под «кодоном» понимают три нуклеотида на мРНК (или на смысловой цепи молекулы ДНК), которые транслируются рибосомой в один аминокислотный остаток. Таким образом, можно синтезировать два полипептида из одной непрерывной рамки считывания в мРНК, если полипептиды разделены последовательностью олигопептида 2А, присутствующей в рамке считывания. Такие рибосомальные skip-механизмы хорошо известны в данной области и известно их применение в нескольких векторах для экспрессии нескольких белков, кодируемых одной матричной РНК.
Для направления трансмембранного полипептида в секреторный путь клетки-хозяина, в последовательность полинуклеотида или в последовательность вектора помещают секреторную сигнальную последовательность (известную также как лидерная последовательность, пре- про-последовательность или пре-последовательность). Секреторную сигнальную последовательность функционально связывают с трансмембранной нуклеотидной последовательностью, т.е. две последовательности соединяют в правильной рамке считывания и размещают так, чтобы направлять новый синтезированный полипептид в секреторный путь клетки-хозяина. Секреторные сигнальные последовательности, как правило, размещают в 5'-направлении относительно нуклеотидной последовательности, кодирующей представляющий интерес полипептид, хотя некоторые секреторные сигнальные последовательности можно размещать и в другом месте представляющей интерес нуклеотидной последовательности (см., например, Welch и др., US №5037743; Holland и др., US №5143830). В предпочтительном варианте осуществления изобретения сигнальный пептид содержит аминокислотные последовательности SEQ ID NO: 1 и 2 или идентичные по меньшей мере на 90%, 95%, 97% или 99% SEQ ID NO: 1 и/или 2.
Специалистам в данной области должно быть очевидно, что с учетом вырожденности генетического кода могут иметь место значительные вариации последовательности указанных полинуклеотидных молекул. Предпочтительно нуклеотидные последовательности, предлагаемые в настоящем изобретении, имеют оптимизированные кодоны для экспрессии в клетках млекопитающих, предпочтительно для экспрессии в человеческих клетках. Оптимизация кодонов относится к замене в представляющей интерес последовательности кодонов, встречающихся относительно редко в генах с высоким уровнем экспрессии, на кодоны, которые, как правило, часто встречаются в генах с высоким уровнем экспрессии в указанных видах, такие кодоны кодируют те же аминокислоты, что и подлежащие замене кодоны. Клетки
Клетка, предлагаемая в настоящем изобретении, представляет собой клетку, происходящую из гематопоэтической клетки, функционально участвующую в инициации и/или реализации врожденного или адаптивного иммунного ответа. Клетка, предлагаемая в настоящем изобретении, предпочтительно представляет собой Т-клетку, полученную из донора. Указанную Т-клетку, предлагаемую в настоящем изобретении, можно получать из стволовой клетки. Стволовые клетки могут представлять собой зрелые стволовые клетки, эмбриональные стволовые клетки, более предпочтительно нечеловеческие стволовые клетки, стволовые клетки из пуповинной крови, клетки-предшественники, стволовые клетки костного мозга, тотипотентные стволовые клетки или гематопоэтические стволовые клетки. В предпочтительном варианте осуществления изобретения клетки представляют собой человеческие клетки, прежде всего человеческие стволовые клетки.
Репрезентативными человеческими клетками являются CD34+-клетки. Указанная выделенная клетка может представлять собой также дендритную клетку, дендритную киллерную клетку, тучную клетку, NK-клетку, В-клетку или Т-клетку, выбранную из группы, состоящей из воспалительных Т-лимфоцитов, цитотоксических Т-лимфоцитов, регуляторных Т-лимфоцитов или хелперных Т-лимфоцитов. В другом варианте осуществления изобретения указанная клетка может иметь происхождение из группы, состоящей из CD4+-Т-лимфоцитов и CD8+-Т-лимфоцитов. Перед осуществлением размножения и генетической модификации клеток, предлагаемых в изобретении, из организма индивидуума можно получать источник клеток с помощью различных методов, не ограничивающих объем изобретения. Клетки можно получать из многочисленных источников, включая (но, не ограничиваясь только ими) мононуклеарные клетки периферической крови, костный мозг, ткань лимфатических узлов, пуповинную кровь, ткань тимуса, ткань из инфицированной области, асциты, плевральный выпот, ткань селезенки и опухоли. В некоторых вариантах осуществления настоящего изобретения можно применять любое количество Т-клеточных линий, доступных и известных специалистам в данной области. В другом варианте осуществления изобретения указанную клетку предпочтительно получают из организма здорового донора. В другом варианте осуществления изобретения указанная клетка представляет собой часть смешанной популяции клеток, обладающих различными фенотипическими характеристиками.
Предпочтительно для выделения и получения стволовых клеток не требуется разрушение по меньшей мере одного человеческого эмбриона. Иммунные клетки могут иметь происхождение из организма пациента, если предполагается осуществление аутологичных обработок, или из организма доноров, если требуется получение аллогенных клеток, которые можно применять для аллогенных обработок.
Более предпочтительно иммунная клетка, предлагаемая в изобретении, экспрессирует анти-CD123 CAR, который соответствует SEQ ID NO: 42, SEQ ID NO: 44 или SEQ ID NO: 46, еще более предпочтительно иммунная клетка, предлагаемая в изобретении, экспрессирует гуманизированный анти-CD123 CAR, который соответствует гуманизированной SEQ ID NO: 42, SEQ ID NO: 44 или SEQ ID NO: 46.
Методы конструирования иммунных клеток, наделенных CAR:
В настоящем изобретении предложен способ получения иммунных клеток для иммунотерапии, заключающийся в том, что интродуцируют ex vivo в указанные иммунные клетки полинуклеотиды или векторы, кодирующие CD123 CAR, ранее описанные в WO 2014/130635, WO 2013/176916, WO 2013/176915, которые включены в настоящее описание в качестве ссылки.
В предпочтительном варианте осуществления изобретения указанные полинуклеотиды включают в лентивирусные векторы, принимая во внимание, что они стабильно экспрессируются в клетках.
В других вариантах осуществления изобретения указанный способ дополнительно включает стадию, на которой генетически модифицируют указанную клетку, делая ее более пригодной для аллогенной трансплантации.
Модификация Т-клетки путем инактивации по меньшей мере одного гена, кодирующего компонент Т-клеточного рецептора (TCR)
Согласно первому объекту изобретения иммунную клетку можно делать менее аллогенной, например, путем инактивации по меньшей мере одного гена, экспрессирующего один или несколько компонентов Т-клеточного рецептора (TCR), согласно методу, описанному в WO 2013/176915, что можно объединять с инактивацией гена, кодирующего или регулирующего экспрессию белка HLA или β2m. Таким образом, существенно снижают риск возникновения реакции «трансплантат-против-хозяина» и отторжение трансплантата.
Таким образом, когда иммунные клетки представляют собой Т-клетки, то в настоящем изобретении предложены также способы создания менее аллогенных Т-клеток.
Методы получения менее аллогенных Т-клеток могут включать стадию инактивации по меньшей мере одного гена, кодирующего компонент Т-клеточного рецептора (TCR), в частности, генов TCRaльфa, TCRбета.
Описанные в WO 2013/176915 методы получения экспрессирующей CAR иммунной клетки, пригодной для аллогенной трансплантации, путем инактивации одного или нескольких компонентов Т-клеточного рецептора (TCR), все включены в настоящее описание в качестве ссылки.
Настоящее изобретение относится к экспрессирующей анти-CD123 CAR иммунной клетке, в которой инактивируют по меньшей мере один ген, экспрессирующий один или несколько компонентов Т-клеточного рецептора (TCR). Таким образом, в изобретении предложена экспрессирующая анти-CD123 CAR Т-клетка, в которой CAR имеет происхождение из Klon43, в частности идентичен по меньшей мере на 80% SEQ ID NO: 44, и в которой инактивируют по меньшей мере один ген, экспрессирующий один или несколько компонентов Т-клеточного рецептора (TCR).
Согласно изобретению экспрессирующие анти-CD123 CAR иммунные клетки с инактивированным одним или несколькими компонентами Т-клеточного рецептора (TCR) предназначены для применения в качестве лекарственного средства.
Под инактивированным геном TCR подразумевается, что представляющий интерес ген не экспрессируется в форме функционального белка. В конкретных вариантах осуществления изобретения способ генетической модификации основан на экспрессии в предназначенной для конструирования клетке редко расщепляющей эндонуклеазы, которая катализирует расщепление в требуемом гене, инактивируя тем самым указанный требуемый ген. Разрывы нуклеотидной цепи, вызываемые редко расщепляемой эндонуклеазой, как правило, репарируются с помощью различных механизмов гомологичной рекомбинации или соединения негомологичных концов (NHEJ). Однако NHEJ представляет собой несовершенный процесс репарации, который часто приводит к изменениям последовательности ДНК в сайте расщепления. Механизмы включают повторное соединение остатков двух концов ДНК посредством прямого повторного лигирования (Critchlow и Jackson, 1998) или посредством так называемого опосредуемого микрогомологией соединения концов (Betts, Brenchley и др., 2003; Ma, Kim и др., 2003). Репарация посредством соединения негомологичных концов (NHEJ) часто приводит к небольшим инсерциям или делециям и ее можно применять для создания специфических «выключений» генов. Указанная модификация может представлять собой замену, делецию или добавление по меньшей мере одного нуклеотида. Клетки, в которых произошел случай индуцированного расщеплением мутагенеза, т.е. случай мутагенеза, являющегося результатом NHEJ, можно идентифицировать и/или отбирать с помощью метода, хорошо известного в данной области. В конкретном варианте осуществления изобретения стадия инактивации по меньшей мере одного гена, кодирующего компонент Т-клеточного рецептора (TCR) в клетках каждого индивидуального образца, включает интродукцию в клетку редко расщепляющей эндонуклеазы, которая обладает способностью разрушать по меньшей мере один ген, кодирующий компонент Т-клеточного рецептора (TCR). В более конкретном варианте осуществления изобретения указанные клетки каждого индивидуального образца трансформируют нуклеиновой кислотой, кодирующей редко расщепляющую эндонуклеазу, которая обладает способностью разрушать по меньшей мере один ген, кодирующий компонент Т-клеточного рецептора (TCR), и указанную редко расщепляющую эндонуклеазу экспрессируют в указанных клетках.
Указанная редко расщепляющая эндонуклеаза может представлять собой мегануклеазу, нуклеазу с цинковыми пальцами, нуклеазу CRISPR/Cas9, нуклеазу Argonaute, TALE-нуклеазу или нуклеазу MBBBD (связывающие домены, обладающие сходными модульными свойствами связывания нуклеиновых кислот по типу «основание-с-основанием») (Modular Base-per-Base Binding domain (MBBBD)). В предпочтительном варианте осуществления изобретения указанная редко расщепляющая нуклеаза представляет собой TALE-нуклеазу. Под TALE-нуклеазой понимают слитый белок, который состоит из связывающего ДНК домена, происходящего, из подобного активатору транскрипции эффектора (TALE), и одного нуклеазного каталитического домена для расщепления последовательности нуклеиновой кислоты-мишени. (Boch, Scholze и др., 2009; Moscou и Bogdanove, 2009; Christian, Cermak и др., 2010; Cermak, Doyle и др., 2011; Geissler, Scholze и др., 2011; Huang, Xiao и др., 2011; Li, Huang и др., 2011; Mahfouz, Li и др., 2011; Miller, Tan и др., 2011; Morbitzer, Romer и др., 2011; Mussolino, Morbitzer и др., 2011; Sander, Cade и др., 2011; Tesson, Usal и др., 2011; Weber, Gruetzner и др., 2011; Zhang, Cong и др., 2011; Deng, Yan и др., 2012; Li, Piatek и др., 2012; Mahfouz, Li и др., 2012; Мак, Bradley и др., 2012). При создании настоящего изобретения были получены новые TALE-нуклеазы для точного нацеливания на соответствующие гены, пригодные для стратегий адаптивной иммунотерапии.
Предпочтительные TALE-нуклеазы, которые распознают и расщепляют последовательность-мишень, описаны в РСТ/ЕР2014/075317. В частности, можно также интродуцировать дополнительный каталитический домен в клетку с указанной редко расщепляющей эндонуклеазой для усиления мутагенеза с целью повышения способности к инактивации генов-мишеней. Более конкретно, указанный дополнительный каталитический домен представляет собой фермент, процессирующий конец ДНК. Примерами ферментов, процессирующих конец ДНК, являются (но, не ограничиваясь только ими) 5-3'-экзонуклеазы, 3-5'-экзонуклеазы, щелочные 5-3'-экзонуклеазы, 5'-флэп-эндонуклеазы, геликазы, фосфатаза, гидролазы и независимые от матриц ДНК-полимеразы. Примером указанного каталитического домена является (но, не ограничиваясь только ими) белковый домен или каталитически активное производное белкового домена, выбранного из группы, состоящей из hExoI (EXO1_HUMAN), Exol дрожжей (EXO1_YEAST), Exol E.coli, человеческой TREX2 (3'-репарационная экзонуклеаза), мышиной TREX1, человеческой TREX1, бычьей TREX1, крысиной TREX1, TdT (концевая дезоксинуклеотидил-трансфераза), человеческой ДНК2, ДНК2 дрожжей (DNA2_YEAST). В предпочтительном варианте осуществления изобретения указанный дополнительный каталитический домен обладает 3'-5'-экзонуклеазной активностью и в более предпочтительном варианте осуществления изобретения указанный дополнительный каталитический домен представляет собой каталитический домен TREX, более предпочтительно каталитический домен TREX2 (WO 2012/058458). В другом предпочтительном варианте осуществления изобретения указанный каталитический домен описывается одноцепочечным полипептидом TREX2. Указанный дополнительный каталитический домен можно сливать с содержащим нуклеазу слитым белком или химерным белком, предлагаемым в изобретении, необязательно с помощью пептидного линкера.
Известно, что эндонуклеолитические разрывы стимулируют скорость гомологичной рекомбинации. Таким образом, в другом варианте осуществления изобретения стадия генетической модификации способа дополнительно включает стадию интродукции в клетки экзогенной нуклеиновой кислоты, которая содержит по меньшей мере последовательность, гомологичную части нуклеотидной последовательности-мишени, в результате чего происходит гомологичная рекомбинация между последовательностью нуклеиновой кислоты-мишени и экзогенной нуклеиновой кислотой. В конкретных вариантах осуществления изобретения указанная экзогенная нуклеиновая кислота содержит первый и второй участки, которые гомологичны 5'- и 3'-областям последовательности нуклеиновой кислоты-мишени соответственно. В этих вариантах осуществления изобретения указанная экзогенная нуклеиновая кислота содержит третий участок, расположенный между первым и вторым участками, который не обладает никакой гомологией с 5'- и 3'-областями последовательности нуклеиновой кислоты-мишени. После расщепления последовательности нуклеиновой кислоты-мишени стимулируется случай гомологичной рекомбинации между последовательностью нуклеиновой кислоты-мишени и экзогенной нуклеиновой кислотой. Предпочтительно в указанном донорском матриксе применяют гомологичные последовательности, состоящие по меньшей мере из 50, предпочтительно более чем из 100 и более предпочтительно более чем из 200 пар оснований. В более конкретном варианте осуществления изобретения гомологичная последовательность может состоять из 200-6000, более предпочтительно 1000-2000 пар оснований. Фактически разделенные гомологи нуклеиновых кислот локализованы в областях, фланкирующих в направлении протии хода транскрипции и по ходу транскрипции сайт разрыва и подлежащую интродукции последовательность нуклеиновой кислоты следует располагать между двумя плечами. Иммунные «контрольные точки» (чекпойнты) В настоящем изобретении предложены аллогенные Т-клетки, экспрессирующие анти-CD123 CAR, в частности анти-CD123 CAR, имеющий SEQ ID NO: 44 или SEQ ID NO: 1 + SEQ ID NO: 44, в которых по меньшей мере один ген, который экспрессирует один или несколько компонентов Т-клеточного рецептора (TCR), инактивируют и/или один ген, выбранный из генов CTLA4, РРР2СА, РРР2СВ, PTPN6, PTPN22, PDCD1, LAG3, HAVCR2, BTLA, CD160, TIGIT, CD96, CRTAM, LAIR1, SIGLEC7, SIGLEC9, CD244, TNFRSF10B, TNFRSF10A, CASP8, С ASP 10, CASP3, CASP6, CASP7, FADD, FAS, TGFBRII, TGFBRI, SMAD2, SMAD3, SMAD4, SMAD10, SKI, SKIL, TGIF1, IL10RA, IL10RB, HMOX2, IL6R, IL6ST, CSK, PAG1, SIT1, FOXP3, PRDM1 (orblimp1), BATF, GUCY1A2, GUCY1A3, GUCY1B2, GUCY1B3, инактивируют, что описано в WO 2014/184741.
Устойчивые к лекарственным средствам Т-клетки
Согласно другому объекту изобретения экспрессирующую анти-CD123 CAR Т-клетку, предлагаемую в изобретении, можно подвергать дополнительной генетической инженерии для повышения ее устойчивости к иммуносупрессорным лекарственным средствам или химиотерапевтическим обработкам, которые применяют в качества стандартной медицинской помощи в случае CD123-позитивных злокачественных клеток.
Для уничтожения раковых клеток разработан ряд цитотоксических агентов, таких как антиметаболиты, алкилирующие агенты, антрациклины, ингибиторы ДНК-метилтрансферазы, соединения платины и веретенные яды. Однако применение этих агентов в сочетании с новыми терапиями, такими как иммунотерапии, является проблематичным. Например, химиотерапевтические агенты могут оказаться вредными при разработке сильных противоопухолевых иммунокомпетентных клеток из-за неспецифических профилей токсичности этих агентов. Основанные на применении малых молекул терапии, мишенью которых являются пути клеточной пролиферации, могут также мешать созданию противоопухолевого иммунитета. Если химиотерапевтические режимы, которые обладают кратковременной эффективностью, удается объединять с новыми терапиями на основе иммунокомпетентных клеток, то можно достигать значительного усиления антинеопластической терапии (см. обзор Dasgupta, McCarty м др., 2011).
Для усиления противораковой терапии и избирательного приживления аллогенных Т-клеток указанным аллогенным Т-клеткам придают устойчивость к лекарственным средствам для их защиты от токсических побочных действий химиотерапевтического агента. Устойчивость Т-клеток к лекарственным средствам также приводит к увеличению их количества in vivo или ex vivo, поскольку Т-клетки, которые экспрессируют ген, обусловливающий устойчивость к лекарственному средству, должны выживать и размножаться в отличие от чувствительных к лекарственному средству клеток.
Методы создания Т-клеток, устойчивых к химиотерапевтическим агентам, описаны в РСТ/ЕР2014/075317, документ полностью включен в настоящем описание в качестве ссылки.
В частности, настоящее изобретение относится к способу создания аллогенных клеток, пригодных для иммунотерапии, в которых по меньшей мере один ген, кодирующий компонент Т-клеточного рецептора (TCR), инактивируют, и один ген модифицируют с целью придания устойчивости к лекарственному средству, заключающемуся в том, что:
- получают экспрессирующую анти-CD123 CAR Т-клетку; в частности, Т-клетку, которая экспрессирует анти-CD123 CAR, имеющий SEQ ID NO: 42, SEQ ID NO: 44, SEQ ID NO: 46, предпочтительно гуманизированный 123 CAR, имеющий SEQ ID NO: 42, SEQ ID NO: 44, SEQ ID NO: 46;
- модифицируют указанную экспрессирующую анти-CD123 CAR Т-клетку путем инактивации по меньшей мере одного гена, кодирующего компонент Т-клеточного рецептора (TCR);
- модифицируют указанную экспрессирующую анти-CD123 CAR Т-клетку для придания устойчивости к лекарственному средству указанной экспрессирующей анти-CD123 CAR Т-клетке;
- размножают указанную сконструированную экспрессирующую анти-CD123 CAR Т-клетку в присутствии указанного лекарственного средства.
Альтернативно этому, настоящее изобретение относится к способу, заключающемуся в том, что:
- получают экспрессирующую анти-CD123 CAR Т-клетку; в частности, Т-клетку, которая экспрессирует анти-CD123 CAR, имеющий SEQ ID NO: 42, SEQ ID NO: 44, SEQ ID NO: 46, предпочтительно гуманизированный 123 CAR, имеющий SEQ ID NO: 42, SEQ ID NO: 44, SEQ ID NO: 46;
- модифицируют указанную экспрессирующую анти-CD123 CAR Т-клетку для придания устойчивости к лекарственному средству указанной экспрессирующей анти-CD123 CAR Т-клетке;
- модифицируют указанную экспрессирующую анти-CD123 CAR Т-клетку путем инактивации по меньшей мере одного гена, кодирующего компонент T-клеточного рецептора (TCR);
- размножают указанную сконструированную экспрессирующую анти-CD123 CAR Т-клетку в присутствии указанного лекарственного средства.
В частности, настоящее изобретение относится также к способу создания аллогенных клеток, пригодных для иммунотерапии, в которых по меньшей мере один ген, кодирующий компонент T-клеточного рецептора (TCR), инактивируют, и один ген модифицируют с целью придания устойчивости к лекарственному средству, заключающемуся в том, что:
- получают экспрессирующую анти-CD123 CAR Т-клетку; в частности, Т-клетку, которая экспрессирует анти-CD123 CAR, имеющий SEQ ID NO: 75, SEQ ID NO: 76, SEQ ID NO: 77, предпочтительно гуманизированный 123 CAR, имеющий SEQ ID NO: 75, SEQ ID NO: 76, SEQ ID NO: 77, более предпочтительно гуманизированный 123 CAR, имеющий SEQ ID NO: 75;
- модифицируют указанную экспрессирующую анти-CD123 CAR Т-клетку путем инактивации по меньшей мере одного гена, кодирующего компонент Т-клеточного рецептора (TCR);
- модифицируют указанную экспрессирующую анти-CD123 CAR Т-клетку для придания устойчивости к лекарственному средству указанной экспрессирующей анти-CD123 CAR Т-клетке;
- размножают указанную сконструированную экспрессирующую анти-CD123 CAR Т-клетку в присутствии указанного лекарственного средства.
Альтернативно этому, настоящее изобретение относится к способу, заключающемуся в том, что:
- получают экспрессирующую анти-CD123 CAR Т-клетку; в частности, Т-клетку, которая экспрессирует анти-CD123 CAR, имеющий SEQ ID NO: 75, SEQ ID NO: 76, SEQ ID NO: 77, предпочтительно гуманизированный 123 CAR, имеющий SEQ ID NO: 75, SEQ ID NO: 76, SEQ ID NO: 77, более предпочтительно гуманизированный 123 CAR, имеющий SEQ ID NO: 75;
- модифицируют указанную экспрессирующую анти-CD123 CAR Т-клетку для придания устойчивости к лекарственному средству указанной экспрессирующей анти-CD123 CAR Т-клетке;
- модифицируют указанную экспрессирующую анти-CD123 CAR Т-клетку путем инактивации по меньшей мере одного гена, кодирующего компонент Т-клеточного рецептора (TCR);
- размножают указанную сконструированную экспрессирующую анти-CD123 CAR Т-клетку в присутствии указанного лекарственного средства.
Экспрессия генов, обусловливающих устойчивость к лекарственным средствам в экспрессирующих анти-CD123 CAR иммунных клетках
В конкретном варианте осуществления изобретения указанную устойчивость к лекарственным средствам можно придавать Т-клетке путем экспрессии по меньшей мере одного гена, обусловливающего устойчивость к лекарственному средству. Указанный ген, обусловливающий устойчивость к лекарственному средству, представляет собой нуклеотидную последовательность, которая кодирует «устойчивость» к агенту, такому как химиотерапевтический агент (например, метотрексат). Другими словами, экспрессия гена, обусловливающего устойчивость к лекарственному средству, в клетке обеспечивает пролиферацию клетки в присутствии агента в большей степени, чем пролиферация соответствующей клетки, в которой отсутствует ген, обусловливающий устойчивость к лекарственному средству. Экспрессия гена, обусловливающего устойчивость к лекарственному средству, в клетке обеспечивает пролиферацию клеток в присутствии агента и не влияет на их эффективность. Ген, обусловливающий устойчивость к лекарственному средству, может кодировать устойчивость к антиметаболиту, метотрексату, винбластину, цисплатину, алкилирующим агентам, антрациклинам, цитотоксическим антибиотикам, анти-иммунофилинам, их аналогам или производным и т.п.
В одном из вариантов осуществления изобретения ген, обусловливающий устойчивость к лекарственному средству, предлагаемый в изобретении, может придавать устойчивость к лекарственному средству (или агенту), в частности, в к противораковому лекарственному средству, выбранному из арацитина, цитозин-арабинозида, амсакрина, даунорубицина, идарубицина, новантрона, митоксантрона, вепезида, этопозида (VP16), триоксида мышьяка, транс-ретиноевой кислоты, комбинации триоксида мышьяка и транс-ретиноевой кислоты, мехлорэтамина, прокарбазина, хлорамбуцила, цитарабина, антрациклинов, 6-тиогуанина, гидроксимочевины, преднизона и их комбинации.
Идентифицировано несколько генов, обусловливающих устойчивость к лекарственному средству, которые потенциально можно применять для придания устойчивости к лекарственному средству требуемым клеткам (Takebe, Zhao и др., 2001; Sugimoto, Tsukahara и др., 2003; Zielske, Reese и др., 2003; Nivens, Felder и др., 2004; Bardenheuer, Lehmberg и др., 2005; Kushman, Kabler и др., 2007).
Одним примером гена, обусловливающего устойчивость к лекарственному средству, может являться также мутантная или модифицированная форма дигидрофолат-редуктазы (DHFR). DHFR представляет собой фермент, участвующий в регулировании количества тетрагидрофолата в клетке, и является важным для синтеза ДНК. Аналоги фолата, такие как метотрексат (МТХ), ингибируют DHFR и поэтому применяются в качестве антинеопластических агентов в клинических условиях. Описаны различные мутантные формы DHFR, которые обладают повышенной устойчивостью к ингибированию антифолатными агентами, которые применяют в терапии. В конкретном варианте осуществления изобретения ген, обусловливающий устойчивость к лекарственному средству, предлагаемый в настоящем изобретении, может представлять собой нуклеотидную последовательность, кодирующую мутантную форму человеческой DHFR дикого типа (GenBank: ААН71996.1), которая содержит по меньшей мере одну мутацию, обусловливающую устойчивость к лечению антифолатным средством, таким как метотрексат. В конкретном варианте осуществления изобретения мутантная форма DHFR содержит по меньшей мере одну измененную в результате мутации аминокислоту в положении G15, L22, F31 или F34, предпочтительно в положениях L22 или F31 (Schweitzer, Dicker и др., 1990); международная заявка на патент WO 94/24277; патент США US №6642043). В конкретном варианте осуществления изобретения указанная мутантная форма DHFR содержит две измененные в результате мутации аминокислоты в положении L22 и F31. Соответствие аминокислотным положениям, указанным в настоящем описании, часто выражают в виде положений аминокислот в полипептиде DHFR дикого типа, зарегистрированного в GenBank: ААН71996.1. В конкретном варианте осуществления изобретения остаток серина в положении 15 предпочтительно заменяют на остаток триптофана. В другом конкретном варианте осуществления изобретения остаток лейцина в положении 22 предпочтительно заменяют на аминокислоту, которая может нарушать связывание мутантной DHFR с антифолатными агентами, предпочтительно на незаряженные аминокислотные остатки, такие как фенилаланин или тирозин. В другом конкретном варианте осуществления изобретения остаток фенилаланина в положениях 31 или 34 предпочтительно заменяют на остаток низкомолекулярной гидрофильной аминокислоты, такой как аланин, серии или глицин.
В контексте настоящего описания понятие «антифолатный агент» или «аналоги фолатов» относится к молекуле, которая должна оказывать некоторое воздействие на муть метаболизма фолатов. Примеры антифолатных агентов включают, например, метотрексат (МТХ); аминоптерин; триметрексат (Neutrexin™); эдатрексат; N10-пропаргил-5,8-дидеазафолиевую кислоту (СВ3717); ZD 1694 (тумодекс), 5,8-дидеазафолиевую кислоту (IAHQ); 5,10-дидеазатетрагидрофолиевую кислоту (DDATHF); 5-деазафолиевую кислоту; РТ523 (N-альфа-(4-амино-4-дезоксиптероил)-N-дельта-гемифталоил-L-орнитин); 10-этил-10-дезаминоптерин (DDATHF, ломатрексол); пиритрексим; 10-EDAM; ZD1694; GW1843; пеметрексат и PDX (10-пропаргил-10-дезаминоптерин).
Другим примером гена, обусловливающего устойчивость к лекарственному средству, может являться также мутантная или модифицированная форма инозин-5'-монофосфатдегидрогеназы II (IMPDH2), фермента, ограничивающего скорость синтеза de novo гуанозиновых нуклеотидов. Мутантная или модифицированная форма IMPDH2 представляет собой ген, обусловливающий устойчивость к ингибитору IMPDH. Ингибиторы IMPDH могут представлять собой микофеноловую кислоту (MPA) или ее пролекарство микофенолата мофетил (MMF). Мутант IMPDH2 может содержать по меньшей мере одну, предпочтительно две мутации в сайте связывания MAP человеческой IMPDH2 дикого типа (NP 000875.2), которые приводят к значительному повышению устойчивости к ингибитору IMPDH. Мутации предпочтительно затрагивают положения Т333 и/или S351 (Yam, Jensen и др., 2006; Sangiolo, Lesnikova и др., 2007; Jonnalagadda, Brown и др., 2013). В конкретном варианте осуществления изобретения остаток треонина в положении 333 заменяют на остаток изолейцина и остаток серина в положении 351 заменяют на остаток тирозина. Соответствие аминокислотным положениям, указанным в настоящем описании, часто выражают в виде положений аминокислот в человеческом полипептиде IMPDH2 дикого типа, зарегистрированного под номером NP_000875.2.
Другим геном, обусловливающим устойчивость к лекарственному средству, является мутантная форма кальциневрин. Кальциневрин (РР2В) представляет собой повсеместно экспрессируемую серин/треониновую протеинфосфатазу, которая участвует во многих биологических процессах и которая играет центральную роль в активации Т-клеток. Кальциневрин представляет собой гетеродимер, состоящий из каталитической субъединицы (CnA; три изоформы) и регуляторной субъединицы (CnB; две изоформы). После контакта с Т-клеточным рецептором кальциневрин дефосфоририлирует фактор транскрипции NFAT, что приводит к его транслокации в ядро, где он активирует имеющий решающее значение ген, такой как IL2. FK506 в комплексе с FKBP12 или циклоспорин А (CsA) в комплексе с СуРА блокируют доступ NFAT к активному сайту кальциневрина, препятствуя его дефосфорилированию и ингибируя тем самым активацию Т-клеток (Brewin, Мапсао и др., 2009). Ген, обусловливающий устойчивость к лекарственному средству, предлагаемый в настоящем изобретении, может представлять собой нуклеотидную последовательность, которая кодирует мутантную форму кальциневрина, устойчивую к ингибитору кальциневрина, такому как FK506 и/или CsA. В конкретном варианте осуществления изобретения указанная мутантная форма может содержать по меньшей мере одну мутантную аминокислоту в гетеродимере кальциневрина дикого типа в положениях: V314, Y341, М347, Т351, W352, L354, K360, предпочтительно двойные мутации в положениях Т351 и L354 или V314 и Y341. В конкретном варианте осуществления изобретения остаток валина в положении 341 можно заменять на остаток лизина или аргинина, остаток тирозина в положении 341 можно заменять на остаток фенилаланина; метионин в положении 347 можно заменять на остаток глутаминовой кислоты, аргинина или триптофана; треонин в положении 351 можно заменять на остаток глутаминовой кислоты; остаток триптофана в положении 352 можно заменять на остаток цистеин, глутаминовой кислоты или аланина, серии в положении 353 можно заменять на остаток гистидина или аспарагина, лейцин в положении 354 можно заменять на остаток аланина; лизин в положении 360 можно заменять на остаток аланина или фенилаланина в последовательности, соответствующей последовательности, зарегистрированной в GenBank: АСХ34092.1. Соответствие аминокислотным положениям, указанным в настоящем описании, часто выражают в виде положений аминокислот в человеческом полипептиде гетеродимера кальциневрина дикого типа, зарегистрированного в GenBank: АСХ34092.1.
В другом конкретном варианте осуществления изобретения указанная мутантная форма может содержать по меньшей мере одну мутантную аминокислоту в гетеродимере кальциневрина дикого типа в положениях: V120, N123, L124 или K125, предпочтительно двойные мутации в положениях L124 и K125. В конкретном варианте осуществления изобретения валин в положении 120 можно заменять на остаток серина, аспарагиновой кислоты, фенилаланина или лейцина; аспарагин в положении 123 можно заменять на триптофан, лизин, фенилаланин, аргинин, гистидин или серии; лейцин в положении 124 можно заменять на остаток треонина; лизин в положении 125 можно заменять на аланин, глутаминовую кислоту, триптофан, или два остатка, такие как лейцин- аргинин или изолейцин-глутаминовая кислота, можно добавлять после лизина в положении 125 в аминокислотную последовательность, соответствующую последовательности, зарегистрированной в GenBank: АСХ34095.1. Соответствие аминокислотным положениям, указанным в настоящем описании, часто выражают в виде положений аминокислот в человеческом полипептиде гетеродимера кальциневрина дикого типа, зарегистрированного в GenBank: АСХ34095.1.
Другим геном, обусловливающим устойчивость к лекарственному средству, является ген O(6)-метилгуанинметилтрансферазы (MGMT), кодирующий человеческую алкилгуанинтрансферазу (hAGT). AGT представляет собой репарирующий ДНК белок, который придает устойчивость к цитотоксическим действиям алкилирующих агентов, таких как нитрозомочевины и темозоломид (TMZ). 6-бензилгуанин (6-BG) является ингибитором AGT, который потенцирует токсичность нитрозомочевины и его вводят совместно с TMZ для усиления цитотоксических действий этого агента. Несколько мутантных форм MGMT, которые кодируют варианты AGT, обладают высокой устойчивостью к инактивации с помощью 6-BG, но сохраняют их способность к репарации повреждения ДНК (Maze, Kurpad и др., 1999). В конкретном варианте осуществления изобретения мутантная форма AGT может содержать мутантную аминокислоту в положении Р140 AGT дикого типа в аминокислотной последовательности SEQ ID NO: 18 (UniProtKB: Р16455). В предпочтительном варианте осуществления изобретения указанный пролин в положении 140 заменяют на остаток лизина.
Другим геном, обусловливающим устойчивость к лекарственному средству, может являться ген обусловливающего устойчивость ко многим лекарственным средствам белка 1 (MDR1). Этот ген кодирует мембранный гликопротеин, известный как P-гликопротеин (P-GP), который участвует в транспорте побочных продуктов метаболизма через клеточную мембрану. Белок P-GP обладает широким спектром специфичности в отношении нескольких структурно неродственных химиотерапевтических агентов.
Установлено, что сверхэкспрессия обусловливающего устойчивость ко многим лекарственным средствам белка 1, приводит к устойчивости к таким лекарственным средства как митоксантрон (Charles S. Morrow, Christina Peklak- Scott, Bimjhana Bishwokarma, Timothy E. Kute, Pamela K. Smitherman и Alan J. Townsend. Multidrug Resistance Protein 1 (MRP1, ABCC1) Mediates Resistance to Mitoxantrone via Glutathione-Dependent Drug Efflux Mol Pharmacol, 69, апрель 2006 г., cc. 1499-1505).
Таким образом, устойчивость к лекарственному средству можно придавать клеткам в результате экспрессии нуклеотидной последовательности, которая кодирует MDR-1 (NP 000918).
Еще один путь получения клеток, устойчивых к лекарственному средству, состоит в получении клеток со специфической(ими) мутацией(ями), такими как мутации Arg486 и Glu571 в гене человеческой топоизомеразы II, для придания устойчивости к амсакрину (S. Patel, В.A. Keller и L.М. Fisher. Molecular Pharmacology, т.57, 2000, сс.784-791).
Еще один путь получения клеток, устойчивых к лекарственному средству, состоит в получении клеток, сверхэкспрессирующих микроРНК-21, для придания устойчивости к даунорубицину (Involvement of miR-21 in resistance to daunorubicin by regulating PTEN expression in the leukaemia K562 cell line Bai, Haitao и др., FEBS Letters, т.585, вып.2, сс.402-408).
В предпочтительном варианте осуществления изобретения клетки, которые несут указанную обусловливающую устойчивость к лекарственному средству мРНК или белок, содержат также ингибирующую мРНК или ген, обусловливающий ее экспрессию, что позволяет избирательно разрушать указанные устойчивые к лекарственному средству клетки в присутствии указанного лекарственного средства или после введения указанного лекарственного средства.
Ген, обусловливающий устойчивость к лекарственному средству, может придавать также устойчивость к цитотоксическим антибиотикам, и может представлять собой ген ble или ген mcrA. Эктопическая экспрессия гена ble или гена mcrA в иммунной клетке обеспечивает избирательное преимущество при воздействии химиотерапевтического средства, т.е. блеомицина или митомицина С соответственно.
Наиболее широко распространенным практическим подходом к генной терапии является добавление гена для создания Т-клетки посредством эффективной доставки гена с помощью векторов, предпочтительно вирусного вектора. Таким образом, в конкретном варианте осуществления изобретения указанный ген, обусловливающий устойчивость к лекарственному средству, можно экспрессировать в клетке в результате интродукции в клетку трансгена, предпочтительно кодируемого по меньшей мере одним вектором.
В одном из вариантов осуществления изобретения клетки, которые несут ген, обусловливающий устойчивость к лекарственному средству, или модифицированный ген, обусловливающий устойчивость к лекарственному средству, содержат также индуцибельный ген суицида, индукция которого провоцирует клеточную гибель, что обеспечивает их избирательное разрушение.
Случайная инсерция генов в геном может приводить к несоответствующей экспрессии встроенного гена или гена, расположенного вблизи сайта инсерции. Специфическая генная терапия с использованием гомологичной рекомбинации экзогенной нуклеиновой кислоты, содержащей эндогенные последовательности, для направления генов к специфическим сайтам в геноме может позволять конструировать безопасные Т-клетки. Как описано выше, стадия генетической модификации в способе может включать стадию интродукции в клетки экзогенной нуклеиновой кислоты, которая содержит по меньшей мере одну последовательность, кодирующую ген, обусловливающий устойчивость к лекарственному средству, и часть эндогенного гена, в результате чего имеет место гомологичная рекомбинация между эндогенным геном и экзогенной нуклеиновой кислотой. В конкретном варианте осуществления изобретения указанный эндогенный ген может представлять собой ген дикого типа «обусловливающий устойчивость к лекарственному средству», в результате после гомологичной рекомбинации ген дикого типа заменяется мутантной формой гена, которая обусловливает устойчивость к лекарственному средству.
Известно, что эндонуклеолитические разрывы стимулируют скорость гомологичной рекомбинации. Таким образом, в конкретном варианте осуществления изобретения способ, предлагаемый в изобретении, дополнительно включает стадию экспрессии в клетке редко расщепляющей эндонуклеазы, которая может расщеплять последовательность-мишень в эндогенном гене. Указанный эндогенный ген может кодировать, например, DHFR, IMPDH2, кальциневрин или AGT. Указанная редко расщепляющая эндонуклеаза может представлять собой TALE-нуклеазу, нуклеазу с цинковыми пальцами, нуклеазу CRISPR/Cas9, MBBBD-нуклеазу или мегануклеазу.
Инактивация генов, повышающих чувствительность к лекарственным средствам в иммунных клетках, экспрессирующих анти-CD123 CAR
В другом варианте осуществления изобретения указанная устойчивость к лекарственному средству можно придавать клетке, предлагаемой в изобретении (экспрессирующей анти-CD123 CAR иммунной клетке) путем инактивации гена, повышающего чувствительность к лекарственному средству.
При создании изобретения предпринимали попытку инактивировать потенциально повышающий чувствительность к лекарственному средству ген для создания предназначенной для иммунотерапии Т-клетки, в частности, для создания экспрессирующей анти-CD123 CAR иммунной клетки, которую можно применять в комбинации с терапевтическим агентом (противораковым лекарственным средством).
Под инактивацией ген подразумевается, что представляющий интерес ген не экспрессируется в форме функционально белка. В конкретном варианте осуществления изобретения метод генетической модификации, применяемый при конструировании клеток, основывается на экспрессии одной редко расщепляющей эндонуклеазы, которая специфически катализирует расщепление в одном гене-мишени, инактивируя тем самым указанный ген-мишень. В конкретном варианте осуществления изобретения стадия инактивации по меньшей мере одного повышающего чувствительность к лекарственному средству гена включает интродукцию в клетку редко расщепляющей эндонуклеазы, которая может разрушать по меньшей мере один повышающий чувствительность к лекарственному средству ген. В более конкретном варианте осуществления изобретения указанные клетки трансформируют нуклеиновой кислотой, которая кодирует редко расщепляющую эндонуклеазу, которая может разрушать повышающий чувствительность к лекарственному средству ген, и экспрессируют указанную редко расщепляющую эндонуклеазу в указанной клетке. Указанная редко расщепляющая эндонуклеаза может представлять собой мегануклеазу, нуклеазу с цинковыми пальцами, нуклеазу CRISPR/Cas9, MBBBD- нуклеазу или TALE-нуклеазу. В предпочтительном варианте осуществления изобретения указанная редко расщепляющая эндонуклеаза представляет собой TALE-нуклеазу.
В предпочтительном варианте осуществления изобретения повышающий чувствительность к лекарственному средству ген, который можно инактивировать для придания устойчивости к лекарственному средству Т-клетке, представляет собой ген человеческой дезоксицитидинкиназы (dCK). Этот фермент требуется для фосфорилирования дезоксирибонуклеозидов дезоксицитидина (dC), дезоксигуанозина (dG) и дезоксиаденозина (dA). Пуриновые нуклеотидные аналоги (PNA) метаболизируются dCK с образованием моно-, ди- и трифосфата PNA. Указанные трифосфатные формы, и прежде всего клофарабина трифосфат, конкурируют с АТФ при синтезе ДНК, действуют в качестве проапоптозного агента и являются потеницильными ингибиторами рибонуклеотидредуктазы (RNR), которая участвует в производстве тринуклеотидов.
Предпочтительно инактивация dCK в Т-клетках опосредуется TALE-нуклеазой. Для достижения указанной цели разработано несколько пар TALE-нуклеаз для dCK, собраны на полинуклеотидном уровне и подтверждены секвенированием. Примеры пар TALE-нуклеаз, которые можно применять согласно изобретению, описаны в РСТ/ЕР2014/075317.
Инактивация dCK в Т-клетках обусловаливает устойчивость в аналогам пуриновых нуклеозидов (PNA), таким как клофарабин и флударабин.
В другом предпочтительном варианте осуществления изобретения инактивацию dCK в Т-клетках объединяют с инактивацией генов TRAC, получая указанные Т-клетки с двойным «выключением» (KO), которые обладают устойчивостью к лекарственному средству, такому как клофарабин, и являются менее аллогенными. Указанные двойные свойства являются наиболее ценными для терапевтичесих целей, позволяя применять «имеющиеся в наличии» алллогенные клетки для иммунотерапии в сочетании с химиотерапией для лечения срадающих раком пациентов. Указанную двойную инактивацию посредством KO dCK/TRAC можно осуществлять одновременно или последовательно. Один из примеров пары TALE-нуклеаза dCK/TRAC, которая обеспечивает успех согласно изобретению, описан в РСТ/ЕР2014/075317, при этом, в частности, последовательности-мишени находятся в 2 локусах (dCK и TRAC).
Другим примером фермента, который можно инактивировать, является ген человеческой гипоксантин-гуанин-фосфорибозилтрансферазы (HPRT) (Genbank: М26434.1). В частности, HPRT можно инактивировать в сконструированных Т-клетках для придания устойчивости к цитостатическому метаболиту 6-тиогуанину (6TG), который под действием HPRT превращается в цитотоксический тиогуаниновый нуклеотид и который в настоящем время применяют для лечения страдающих раком, прежде всего лейкозами, пациентов (Hacke, Treger и др., 2013). Аналоги гуанинов метаболизируются трансферазой HPRT, которая катализирует добавление фосфорибозильного фрагмента и позволяет получать гуаниновые аналоги TGMP, включая 6-меркаптопурин (6МР) и 6-тиогуанин (6TG), которые можно применять в качестве очищающих лимфу лекарственных средств, предназначенных для лечения ALL. Они метаболизируются HPRT (гипоксантин-фосфорибозилтрансфераза, которая катализирует добавление фосфорибозильного фрагмента и позволяет получать TGMP). Их последующее фосфорилирование приводит к образованию их трифосфорилированных форм, которые в конце концов интнгрируются в ДНК. После включения в ДНК тио-ГТФ нарушает правильность репликации ДНК посредством их тиолатной группировки и создают точки случайной мутации, которые являются очень опасными для целостности клеток.
В другом варианте осуществления изобретения инактивация CD3, который в норме экспрессируется на поверхности Т-клетки, может обусловливать устойчивость к антителам к CD3, таким как теплизумаб.
В контексте настоящего описания понятия «терапевтический агент», «химиотерапевтический агент» или «лекарственное средство», или «противораковое лекарственное средство» относятся к медикаментозному препарату, предпочтительно соединению или его производному, которое может оказывать воздействие на раковую клетку, тем самым снижая пролиферативный статус клетки и/или уничтожая клетку. Примерами химиотерапевтических лекарственных средств или «противораковых лекарственных средств» являются (но, не ограничиваясь только ими) алкилирующие агенты (например, бусульфан, карбоплатин, хлорамбуцил, цисплатин, циклофосфамид, ифосфамид, мелфалан, мехлорэтамин, оксалиплатин, урамустин, темозоломид, фотемустин), антагонисты метаболизма (например, антиметаболит пуриновых нуклеозидов, такой как клофарабин, флударабин или 2'-дезоксиаденозин, метотрексат (МТХ), 5-фторурацил или его производные, азатиоприн, капецитабин, цитарабин, флоксуридин, фторурацил, гемцитабин, метотрексат, пеметрексед), противоопухолевые антибиотики (например, митомицин, адриамицин, блеомицин, даунорубицин, доксорубицин, эпирубицин, гидроксимочевина, ударубицин, митомицин С, митоксантрон), противоопухолевые агенты растительного происхождения (например, винкристин, виндезин, таксол, винбластин, винорелбин, доцетаксел, паклитаксел), ингибитор топоизомеразы (иринотекан, топотекан, этопозид).
В предпочтительном варианте осуществления изобретения понятия «терапевтический агент», «химиотерапевтическое лекарственное средство» в контексте настоящего описания относятся к соединению или его производному, которое можно применять для лечения гематопоэтической раковой клетки и более конкретно AML, снижая тем самым пролиферативный статус раковой клетки и/или уничтожая раковую клетку. Примеры химиотерапевтических агентов включают (но, не ограничиваясь только ими) арацитин, цитозин-арабинозид, амсакрин, даунорубицин, идарубицин, новантрон, митоксантрон, вепезид, этопозид (VP16), триоксид мышьяка, транс-ретиноевую кислоту, мехлорэтамин, прокарбазин, хлорамбуцил и их комбинации.
В других вариантах осуществления настоящего изобретения клетки, предлагаемые в изобретении, вводят пациенту в сочетании с лекарственным средством (или агентом), выбранным из арацитина, цитозин-арабинозида, амсакрина, даунорубицина, идарубицина, новантрона, митоксантрона, вепезида, этопозида (VP16), триоксида мышьяка, транс-ретиноевой кислоты, цитарабина, антрациклинов, 6-тиогуанина, гидроксимочевины, преднизона и их комбинации.
Указанные агенты могут включать также (но, не ограничиваясь только ими) противораковые агенты TRIMETHOTRIXATE™ (ТМТХ), TEMOZOLOMIDE™, RALTRITREXED™, S-(4-нитробензил)-6-тиоинозин (NBMPR), 6-бензилгуанидин (6-BG), бис-хлорнитрозомочевину (BCNU) и CAMPTOTHECIN™ или терапевтическое производное любого из указанных средств.
В более предпочтительном варианте осуществления изобретения Т-клетку, экспрессирующую анти-CD123 CAR, имеющий SEQ ID NO: 44, вводят пациенту в комбинации по меньшей мере с одним терапевтическим агентом, выбранным из арацитина, цитозин-арабинозида, амсакрина, даунорубицина, идарубицина, новантрона, митоксантрона, вепезида, этопозида (VP16), триоксида мышьяка, транс-ретиноевой кислоты и их комбинации.
В контексте настоящего описания понятие «клетка, устойчивая или толерантная» к агенту относится к клетке, которую генетически модифицировали так, чтобы клетка размножалась в присутствии агента в количестве, которое ингибирует или предупреждает пролиферацию клетки без модификации.
Устойчивые ко многим лекарственным средствам экспрессирующие анти-CD123 CAR иммунные клетки
Согласно другому конкретному варианту осуществления изобретения при создании изобретения предусматривалась разработка стратегии иммунотерапии на основе «имеющихся в наличии» аллогенных Т-клеток, в частности, аллогенной экспрессирующей анти-CD123 CAR Т-клетки, устойчивой ко многим лекарственным средствам, для селекции сконструированных Т-клеток, когда пациента лечат различными лекарственными средствами. Терапевтическую эффективность можно значительно повышать путем создания методами генетической инженерии устойчивых ко многим лекарственным средствам аллогенных Т-клеток. Указанная стратегия может быть особенно эффективной при лечении опухолей, которые дают ответ на комбинации лекарственных средств, обладающих синергетическими действиями. Более того, сконструированные Т-клетки с устойчивостью ко многим лекарственным средствам можно размножать и отбирать с использованием минимальной дозы лекарственных средств.
Так, способ, предлагаемый в настоящем изобретении, может включать модификацию Т-клетку для придания устойчивости ко многим лекарственным средствам указанной Т-клетке. Указанную устойчивость ко многим лекарственным средствам можно получать либо путем экспрессии более одного гена, обусловливающего устойчивость к лекарственному средству, либо путем инактивации более одного гена, повышающего чувствительность к лекарственному средству. В другом конкретном варианте осуществления изобретения устойчивость ко многим лекарственным средствам можно придавать указанной Т-клетке путем экспрессии по меньше мере одного гена, обусловливающего устойчивость к лекарственному средству, и инактивации по меньшей мере одного гена, повышающего чувствительность к лекарственному средству. В частности, устойчивость ко многим лекарственным средствам можно придавать указанной Т-клетке путем экспрессии по меньшей мере одного гена, обусловливающего устойчивость к лекарственному средству, такого как мутантная форма DHFR, мутантная форма IMPDH2, мутантная форма кальциневрина, мутантная форма MGMT, ген ble и ген mcrA, и инактивации по меньшей мере одного гена, повышающего чувствительность к лекарственному средству, такого как ген HPRT. В предпочтительном варианте осуществления изобретения устойчивость ко многим лекарственным средствам можно придавать путем инактивации гена HPRT и экспрессии мутантной формы DHFR; или путем инактивации гена HPRT и экспрессии мутантной формы IMPDH2; или путем инактивации гена HPRT и экспрессии мутантной формы кальциневрина; путем инактивации гена HPRT и экспрессии мутантной формы MGMT; путем инактивации гена HPRT и экспрессии гена ble; путем инактивации гена HPRT и экспрессии гена mcrA.
Одним из вариантов осуществления настоящего изобретения является аллогенная экспрессирующая анти-CD123 CAR Т-клетка, которая экспрессирует ген, обусловливающий устойчивость более чем к одному лекарственному средству, или в которой инактивирован ген, повышающий чувствительность более чем к одному лекарственному средству.
Гены суицида в экспрессирующих анти-CD123 CAR иммунных клетках В некоторых случаях, в связи с тем, что сконструированные Т-клетки могут размножаться и сохраняться в течение нескольких лет после введения, может оказаться желательным включать безопасный механизм для избирательной делеции введенных Т-клеток. Так, согласно некоторым вариантам осуществления изобретения способ, предлагаемый в изобретении, может включать трансформацию указанных Т-клеток рекомбинантным геном суицида. Указанный рекомбинантный ген суицида применяют для снижения риска непосредственной токсичности и/или неконтролируемой пролиферации указанных Т-клеток после введения индивидууму (Quintarelli С, Vera F., Blood, 2007; Теу S.K, Dotti G., Rooney CM, Boil blood marrow transplant, 2007). Гены суицида позволяют осуществлять избирательную делецию трансформированных клеток in vivo. В частности, ген суицида обладает способностью превращать нетоксичное пролекарство в цитотоксическое лекарственное средство или экспрессировать токсичный продукт экспрессии гена. Другими словами, «ген суицида» представляет собой нуклеиновую кислоту, кодирующую продукт, где продукт вызывает гибель клеток сам или в присутствии других соединений.
Репрезентативным примером указанного гена суицида является ген, который кодирует тимидинкиназу вируса герпеса простого. Другими примерами являются тимидинкиназа вируса ветряной оспы и бактериальный ген цитозиндеаминазы, которая может превращать 5-фторцитозин в высокотоксичное соединение 5-фторурацил. Гены суицида также включают, например (но, не ограничиваясь только ими) ген каспазы-9 или каспазы-8 или цитозиндеаминазы. Каспазу-9 можно активировать с помощью специфического химического индуктора димеризации (CID). Гены суицида могут также представлять собой гены полипептидов, которые экспрессируются на поверхности клетке и могут придавать клетке чувствительность к терапевтическим моноклональным антителам. В контексте настоящего описания «пролекарство» обозначает любое соединение, которое можно применять в способах, предлагаемых в настоящем изобретении, которое может превращаться в токсичный продукт. В способе, предлагаемом в настоящем изобретении, пролекарство превращается в токсичный продукт с помощью генного продукта гена суицида. Репрезентативным примером такого пролекарства является ганцикловир, который превращается in vivo в токсичное соединение с помощью тимидинкиназы HSV. После этого производное ганцикловира проявляет токсичность в отношении опухолевых клеток. Другие репрезентативные примеры пролекарств включают ацикловир, FIAU [1-(2-дезокси-2-фтор-β-D-арабинофуранозил)-5-йодурпцил], 6-метоксиарабинозид для VZV-TK и 5- фторцитозин для цитозиндеаминазы.
В одной из предпочтительных систем гена суицида применяется рекомбинантный антигенный полипептид, который содержит антигенный мотив, распознаваемый МАт к CD20 ритуксимабом, прежде всего QBen10, такой как так называемый полипептид RQR8, описанный в WO 2013/153391. Ритуксимаб, запатентованное лекарственное средство, представляющее собой антитело, затем можно применять при необходимости для клеточного истощения.
Одним из вариантов осуществления настоящего изобретения является аллогенная экспрессирующая анти-CD123 CAR Т-клетка, которая экспрессирует ген, обусловливающий устойчивость более чем к одному лекарственному средству, или в которой инактивирован ген, повышающий чувствительность более чем к одному лекарственному средству, в которой присутствует ген суицида, позволяющий разрушать указанные клетки
Устойчивые к клофарабину экспрессирующие анти-CD123 CAR иммунные клетки
Изобретение относится к производству для терапевтического применения Т-клеток, который являются устойчивыми к лекарственному средству, такому как клофарабин. Их можно получать путем инактивации гена dCK, что описано ранее. Согласно предпочтительному варианту осуществления изобретения Т-клеткам придают устойчивость к химиотерапии и делают их менее аллогенными путем объединения инактивации генов dCK и TCR, что описано ранее.
Таким образом, в настоящем изобретении предложена экспрессирующая анти-CD123 CAR клетка, в частности, экспрессирующая анти-CD123 CAR Т-клетка, в которой CAR получают из Klon43 (содержащего SEQ ID NO: 42 или SEQ ID NO: 44, необязательно гуманизированную), и в которой ген dCK инактивирован.
Устойчивые к лекарственному средству CD123+/luc+-клетки Дауди для тестирования цитотоксичности устойчивых к лекарственному средству аллогенных CAR-T-клеток
Настоящее изобретения относится также к способу получения клеток- мишеней, которые экспрессируют как рецептор клеточной поверхности, специфический в отношении CAR-T-клеток, так и ген устойчивости. Указанные клетки-мишени являются особенно ценными для тестирования цитотоксичности CAR-T-клеток. Эти клетки уже являются устойчивыми к применяемой в клинических условиях дозе клофарабина и обладают люциферазной активностью. Указанная комбинация признаков позволяет отслеживать их на мышиной модели in vivo или при необходимости разрушать их.
Более конкретно, их можно применять для оценки цитотоксических свойств устойчивых к лекарственному средству Т-клеток у мышей в присутствии клофарабина или других PNA. Устойчивые к клофарабину клетки Дауди имитируют физиологическое состояние страдающих острым лимфобластным лейкозом (ALL) пациентов с рецидивом после индукционной терапии, которые имеют устойчивые к лекарственному средству В-клеточные злокачественные состояния. Таким образом, указанные клетки представляют большой интерес для оценки достоверности и цитотоксичности устойчивых к лекарственному средству CAR-T-клеток. Предпочтительно эти клетки-мишени представляют собой CD123+-люцифераза+-клетки Дауди.
Выделенная клетка
Настоящее изобретение относится к выделенной Т-клетке, экспрессирующей CAR, который связывается с CD123. Таким образом, в изобретении предложена экспрессирующая анти-CD123 CAR клетка. В конкретном варианте осуществления изобретения указанная экспрессирующая анти-CD123 CAR клетка, является устойчивой по меньшей мере к одному лекарственному средству и/или содержит по меньшей мере один разрушенный ген, кодирующий компонент Т-клеточного рецептора.
Предпочтительным вариантом осуществления настоящего изобретения является выделенная Т-клетка, экспрессирующая CAR, который связывается с CD123. В изобретении предложена экспрессирующая анти-CD123 CAR Т-клетка. В конкретном варианте осуществления изобретения указанная экспрессирующая анти-CD123 CAR Т-клетка, является устойчивой по меньшей мере к одному лекарственному средству и/или содержит по меньшей мере один разрушенный ген, кодирующий компонент Т-клеточного рецептора.
В конкретном варианте осуществления изобретения указанная анти-CD123 CAR Т-клетка экспрессирует по меньшей мере один ген, обусловливающий устойчивость к лекарственному средству, предпочтительно ген ble или ген mcrA, или ген, кодирующий мутант DHFR, мутант IMPDH2, мутант AGT или мутант кальциневрина.
В другом конкретном варианте осуществления изобретения указанная экспрессирующая анти-CD123 CAR Т-клетка содержит по меньшей мере один разрушенный ген, повышающий чувствительность к лекарственному средству, такой как ген dCK или ген HPRT. В более конкретном варианте осуществления изобретения указанная выделенная анти-CD123 CAR Т-клетка содержит разрушенный ген HPRT и экспрессирует мутант DHFR; указанная выделенная анти-CD123 CAR Т-клетка содержит разрушенный ген HPRT и экспрессирует мутант IMPDH2; указанная выделенная анти-CD123 CAR Т-клетка содержит разрушенный ген HPRT и экспрессирует мутант кальциневрина; указанная выделенная анти-CD123 CAR Т-клетка содержит разрушенный ген HPRT и экспрессирует мутант AGT.
Аллогенная устойчивая к лекарственному средству анти-CD123 CAR Т-клетка, предназначенная для применения в иммунотерапии
В частности, настоящее изобретение относится к аллогенной Т-клетке, в частности аллогенной экспрессирующей анти-CD123 CAR Т-клетке, и предпочтительно аллогенной экспрессирующей анти-CD123 CAR Т-клетке, которая содержит пептид, идентичный на 80%-100% Scfv из Klon43, указанная аллогенная экспрессирующая анти-CD123 CAR Т-клетка, которая содержит пептид, идентичный на 80%-100% Scfv из Klon43, более предпочтительно обладает устойчивостью к лекарственному средству и является особенно пригодной для иммунотерапии.
В предпочтительном варианте осуществления изобретения указанная аллогенная экспрессирующая анти-CD123 CAR Т-клетка содержит пептид, идентичный на 80%-100% SEQ ID NO: 44 и обладает устойчивостью к лекарственному средству и является особенно пригодной для иммунотерапии.
Устойчивость к лекарственному средству можно придавать путем инактивации генов, повышающих чувствительность к лекарственным средствам, или путем экспрессии генов, обусловливающих устойчивость к лекарственным средствам. Некоторыми примерами лекарственных средств, которые можно применять согласно изобретению, являются аналоги пуриновых нуклеозидов (PNA), такие как клофарабин или флударабин, или другие лекарственные средства, такие как 6-меркаптопурин (6МР) и 6-тиогуанин (6TG).
Одним из объектов настоящего изобретения являются способы такого создания иммунных клеток, которое делает их устойчивыми к аналогам пуриновых нуклеозидов (PNA), таким как клофарабин или флударабин, в результате чего их можно применять для противораковой иммунотерапии пациентов, которые предварительно лечили указанными общепринятыми химиотерапевтическими средствами.
Устойчивость к лекарственным средствам можно придавать Т-клеткам путем инактивации одного или нескольких гена(ов), ответственного(ых) за чувствительность клеток к лекарственному средству (повышающий(ие) чувствительность к лекарственному средству ген(ы)), такие как гены dcK и/или HPRT.
Согласно другому объекту изобретения устойчивость к лекарственным средствам можно придавать Т-клетке путем экспрессии гена, обусловливающего устойчивость к лекарственному средству. Установлено, что аллельные варианты некоторых генов, таких как ген дигидрофолат-редуктазы (DHFR), инозин-монофосфат-дегидрогеназы 2 (IMPDH2), кальциневрина или метилгуанинтрансферазы (MGMT), придают устойчивость к лекарственному средству клетке, предлагаемой в изобретении.
Например, CD52 и глюкортикоидные рецепторы (GR), которые являются мишенями лекарственных средств при лечении Campath (алемтузумаб) или ритуксимабом и глюкокортикоидами, можно инактивировать, придавая клеткам устойчивость к указанным обработкам и давая конкурентное преимущество по сравнению с собственными Т-клетками пациента, не наделенными CD123-специфическими CAR. Можно также подавлять или снижать экспрессию гена CD3, придавая устойчивость к теплизумабу, который представляет собой другое иммуносупрессорное средство. Согласно изобретению можно также подавлять или снижать экспрессию HPRT, придавая устойчивость к 6-тиогуанину, цитостатическому агенту, обычно применяемому для химиотерапии, прежде всего для лечения острого лимфобластного лейкоза.
Согласно другому объекту изобретения на иммунные клетки можно дополнительно оказывать воздействие, делая их более активными или ограничивая их истощение, путем инактивации генов, кодирующих белки, которые действуют в качестве «иммунных контрольных точек», выступая в качестве регуляторов активации Т-клеток, таких как гены, выбранные из CTLA4, РРР2СА, РРР2СВ, PTPN6, PTPN22, PDCD1, LAG3, HAVCR2, BTLA, CD160, TIGIT, CD96, CRTAM, LAIR1, SIGLEC7, SIGLEC9, CD244, TNFRSF10B, TNFRSF10A, CASP8, CASP10, CASP3, CASP6, CASP7, FADD, FAS, TGFBRII, TGFBRI, SMAD2, SMAD3, SMAD4, SMAD10, SKI, SKIL, TGIF1, IL10RA, IL10RB, HMOX2, IL6R, IL6ST, CSK, PAG1, SIT1, FOXP3, PRDM1 (orblimp1), BATF, GUCY1A2, GUCY1A3, GUCY1B2, GUCY1B3, предпочтительно указанный ген представляет собой PDCD1 или CTLA-4. Примеры генов, экспрессию которых можно снижать или подавлять, представлены в таблице 9.
В одном из вариантов осуществления изобретения указанный ген представляет собой ген, который действует в качестве регулятора активации Т-клеток, кодирующий белок бета-2-микроглобулина.
Согласно другому объекту изобретения анти-CD123 CAR-иммунные клетки, предлагаемые в изобретении, можно подвергать дополнительным манипуляциям, придавая им устойчивость к лекарственному средству, в частности к лекарственному средству, которое применяют при химиотерапии против рака, в частности, рака, опосредуемого экспрессирующими CD123 клетками, такого как AML. Для достижения этого можно интродуцировать ген, придающий устойчивость к указанному лекарственному средству. Указанный ген можно «включать» и «выключать», используя описанный ранее ген, индуцирующий ингибирование/экспрессию системы (Garcia E.L., Mills А.А. Getting around lethality with inducible Cre-mediated excision. Semin Cell Dev Biol 13, 2002, cc. 151-158; Lewandoski M., Conditional control of gene expression in the mouse. Nat Rev Genet 2, 2001, cc. 743-755; Scharfenberger L., Hennerici Т., Kirly G. и др., Transgenic mouse technology in skin biology: Generation of complete or tissue-specific knockout mice. J Invest Dermatol 134:el6, 2014; Schwenk F., Kuhn R., Angrand P.O. и др., Temporally and spatially regulated somatic mutagenesis in mice. Nucleic Acids Res 26, 1998, cc. 1427-1432).
Таким образом, объектом настоящего изобретения является экспрессирующая анти-CD123 CAR, устойчивая к лекарственному средству иммунная клетка, в которой (I) по меньшей мере один ген, экспрессирующий один или несколько компонентов Т-клеточного рецептора (TCR), инактивирован, (II) по меньшей мере один ген, обусловливающий устойчивость к лекарственному средству, встроен или ген, обусловливающий чувствительность к указанному лекарственному средств удален или изменен в результате мутации для него инактивации, (III) необязательно другой ген, выбранный из генов, указанных в таблице 9, инактивирован.
В настоящем изобретении предложены выделенные анти-CD123 CAR-иммунные клетки или клеточные линии, которые можно получать способом, предлагаемым в изобретении, более конкретно выделенные клетки, содержащие любые белки, полипептиды, аллельные варианты, измененные или удаленные гены или векторы, представленные в настоящем описании.
Иммунные клетки, предлагаемые в настоящем изобретении, или клеточные линии могут содержать дополнительно экзогенные рекомбинантные полинуклеотиды, в частности CAR, или гены суицида, и они могут содержать измененные гены или из них могут быть удалены гены, которые кодируют белки «контрольных точек» или их лиганды, которые влияют на их эффективность в качестве терапевтического продукта, в идеальном варианте «имеющегося в наличии» продукта. Другим объектом настоящего изобретения является способ лечения или предупреждения рака у пациента, заключающийся в том, что вводят по меньшей мере одну сконструированную иммунную клетку, которую можно получать с помощью описанных выше способов.
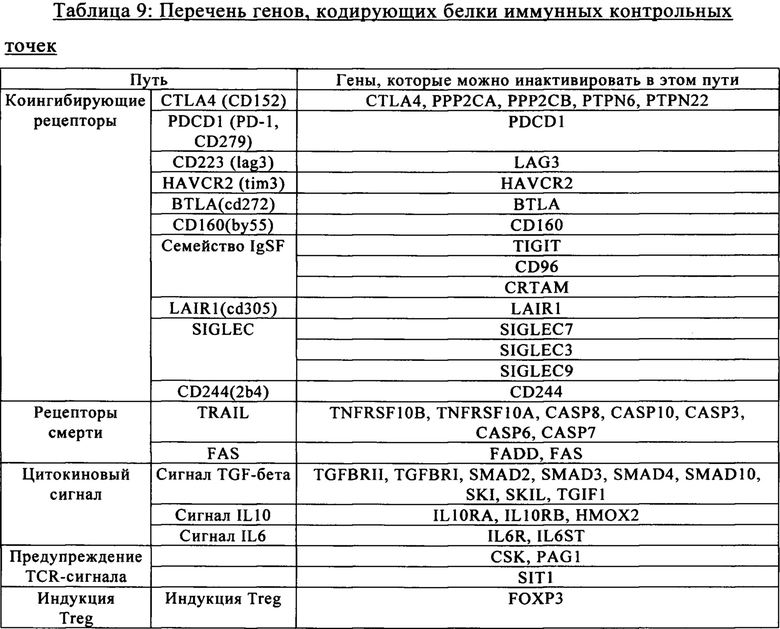

В предпочтительном варианте осуществления изобретения указанный способ дополнительного конструирования иммунных клеток включает интродукцию в указанные Т-клетки полинуклеотидов, прежде всего мРНК, кодирующих специфическую редко расщепляющую эндонуклеазу, обладающую способностью осуществлять избирательную инактивацию указанных выше генов путем расщепления ДНК. В более предпочтительном варианте осуществления изобретения указанные редко расщепляющие эндонуклеазы представляют собой TALE-нуклеазы или эндонуклеазу Cas9. К настоящему времени доказано, что TAL-нуклеазы обладают более высокой специфичностью и эффективностью расщепления по сравнению с другими типами редко расщепляющих эндонуклеаз, поэтому их выбирают в качестве эндонуклеаз для получения сконструированных иммунных клеток при крупномасштабном производстве с постоянным циклом.
Методы доставки
Различные описанные выше методы включают экспрессию в клетке представляющего интерес белка, такого как белок гена, обусловливающего устойчивость к лекарственному средству, редко расщепляющая эндонуклеаза, химерный антигенный рецептор (CAR), прежде всего анти-CD123 CAR и более конкретно CAR, который содержит SEQ ID NO: 1 + SEQ ID NO: 44, и гена суицида.
Например (но, не ограничиваясь только этим), указанный представляющий интерес белок можно экспрессировать в клетке путем его интродукции в виде трансгена, предпочтительно кодируемого по меньшей мере одним плазмидным вектором. Полипептиды можно экспрессировать в клетке в результате интродукции в клетку полинуклеотидов, кодирующих указанные полипептиды. Альтернативно этому, указанные полипептиды можно получать вне клетки и затем интродуцировать в нее.
Методы интродукции полинуклеотидных конструкций в клетки известны в данной области и их примерами являются (но, не ограничиваясь только ими) методы стабильной трансформации, в которых полинуклеотидную конструкцию интегрируют в геном клетки, методы кратковременной трансформации, в которых полинуклеотидную конструкцию не интегрируют в геном клетки, и методы, основанные на использовании вирусов.
Указанные полинуклеотиды можно интродуцировать в клетку, например, с использованием рекомбинантных вирусных векторов (например, ретровирусов, аденовирусов), липосом и т.п. Например, методы кратковременной трансформации включают микроинъекцию, электропорацию или бомбардировку частицами. Указанные полинуклеотиды можно включать в векторы, более конкретно, в плазмиды или вирусы, с целью экспрессии в клетках. Указанный плазмидный вектор может содержать также селектируемый маркер, обеспечивающий идентификацию и/или отбор клеток, в которые встроен указанный вектор.
В один вектор можно включать различные трансгены. Указанный вектор может содержать нуклеотидную последовательность, кодирующую рибосомальную skip-последовательность, такую как последовательность, кодирующую пептид 2А. Пептиды 2А, которые были идентифицированы в подгруппе афтовирусов группы пикорнавирусов, приводят к рибосомальному «перескоку» (skip) от одного кодона к следующему без образования пептидной связи между двумя аминокислотами, кодируемыми кодонами (см. Donnelly и др., J. of General Virology 82, 2001, cc. 1013-1025; Donnelly и др., J. of Gen. Virology 78, 1997, cc. 13-21; Doronina и др., Mol. And. Cell. Biology 28(13), 2008, cc. 4227-4239; Atkins и др., RNA 13, 2007, cc. 803-810).
Под «кодоном» понимают три нуклеотида на мРНК (или на смысловой цепи молекулы ДНК), которые транслируются рибосомой в один аминокислотный остаток. Таким образом, можно синтезировать два полипептида из одной непрерывной рамки считывания в мРНК, если полипептиды разделены последовательностью олигопептида 2А, присутствующей в рамке считывания. Такие рибосомальные skip-механизмы хорошо известны в данной области и известно их применение в нескольких векторах для экспрессии нескольких белков, кодируемых одной матричной РНК.
В более предпочтительном варианте осуществления изобретения полинуклеотиды, которые кодируют полипептиды, предлагаемые в настоящем изобретении, могут представлять собой мРНК, которые интродуцируют непосредственно в клетки, например, путем электропорации. При создании изобретения были определены оптимальные условия для электропорации мРНК в Т-клетку. При создании изобретения применяли технологию cytoPulse, которая позволяет с помощью пульсирующих электрических полей кратковременно повышать проницаемость (пермеабилизовать) живые клетки для доставки материала в клетки. Технология, основанная на применении системы создания волновых форм для электропорации PulseAgile® (фирма ВТХ Havard Apparatus, 84 October Hill Road, Holliston, MA 01746, США), гарантирует точный контроль продолжительности, интенсивности импульса, а также интервала между импульсами (US №6010613 и Международная заявка РСТ WO 2004/083379). Все указанные параметры можно модифицировать для достижения наилучших условий для высокоэффективной трансфекции с минимальной смертностью. В целом, первые электрические импульсы высокой интенсивностью приводят к образованию пор, а последующие электрические импульсы более низкой интенсивности позволяют полинуклеотиду проникать в клетку.
Различные методы, описанные выше, предполагают интродукцию CAR в клетку. Например (но, не ограничиваясь только этим), указанный CAR можно интродуцировать в виде трансгенов, кодируемых одним плазмидным вектором. Указанный плазмидный вектор может содержать также селектируемый маркер, обеспечивающий идентификацию и/или отбор клеток, в которые встроен указанный вектор.
Полипептиды можно синтезировать in situ в клетке в результате интродукции в клетку полинуклеотидов, кодирующих указанные полипептиды. Альтернативно этому, указанные полипептиды можно получать вне клетки и затем интродуцировать в нее. Методы интродукции полинуклеотидных конструкций в клетки известны в данной области и их примерами являются (но, не ограничиваясь только ими) методы стабильной трансформации, в которых полинуклеотидную конструкцию интегрируют в геном клетки, методы кратковременной трансформации, в которых полинуклеотидную конструкцию не интегрируют в геном клетки, и методы, основанные на использовании вирусов. Указанные полинуклеотиды можно интродуцировать в клетку, например, с использованием рекомбинантных вирусных векторов (например, ретровирусов, аденовирусов), липосом и т.п. Например, методы кратковременной трансформации включают микроинъекцию, электропорацию или бомбардировку частицами. Указанные полинуклеотиды можно включать в векторы, более конкретно, в плазмиды или вирусы, с целью экспрессии в клетках.
Сконструированные иммунные клетки
Настоящее изобретение относится также к выделенным клеткам или клеточным линиям, которые можно получать указанным способом создания клеток. В частности, указанная выделенная клетка содержит по меньшей мере один описанный выше CAR. В другом варианте осуществления изобретения указанная выделенная клетка содержит популяцию CAR, каждый из которых содержит различные внеклеточные лигандсвязывающие домены. В частности, указанная выделенная клетка содержит экзогенную полинуклеотидную последовательность, кодирующую CAR. Активация и пролиферация генетически модифицированных иммунных клеток, предлагаемых в настоящем изобретении, происходит независимо от механизмов связывания с антигеном.
Под объем настоящего изобретения подпадает также выделенная иммунная клетка, предпочтительно Т-клетка, полученная с помощью одного из описанных ранее методов. Указанная иммунная клетка представляет собой клетку, происходящую из гематопоэтической клетки, функционально участвующую в инициации и/или реализации врожденного или адаптивного иммунного ответа. Указанную иммунную клетку, предлагаемую в настоящем изобретении, можно получать из стволовой клетки. Стволовые клетки могут представлять собой зрелые стволовые клетки, нечеловеческие эмбриональные стволовые клетки, более предпочтительно нечеловеческие стволовые клетки, стволовые клетки из пуповинной крови, клетки-предшественники, стволовые клетки костного мозга, индуцированные плюрипотентные стволовые клетки, тотипотентные стволовые клетки или гематопоэтические стволовые клетки. Репрезентативными человеческими клетками являются CD34+-клетки. Указанная выделенная клетка может представлять собой также дендритную клетку, дендритную киллерную клетку, тучную клетку, NK-клетку, В-клетку или Т-клетку, выбранную из группы, состоящей из воспалительных Т-лимфоцитов, цитотоксических Т-лимфоцитов, регуляторных Т-лимфоцитов или хелперных Т-лимфоцитов. В другом варианте осуществления изобретения указанная клетка может иметь происхождение из группы, состоящей из CD4+-Т-лимфоцитов и CD8+-T- лимфоцитов. Перед осуществлением размножения и генетической модификации клеток, предлагаемых в изобретении, из организма индивидуума можно получать источник клеток с помощью различных методов, не ограничивающих объем изобретения. Клетки можно получать из многочисленных источников, включая (но, не ограничиваясь только ими) мононуклеарные клетки периферической крови, костный мозг, ткань лимфатических узлов, пуповинную кровь, ткань тимуса, ткань из инфицированной области, асциты, плевральный выпот, ткань селезенки и опухоли. В некоторых вариантах осуществления настоящего изобретения можно применять любое количество T-клеточных линий, доступных и известных специалистам в данной области. В другом варианте осуществления изобретения указанную клетку можно получать из организма здорового донора, пациента, у которого диагностирован рак, или пациента, у которого диагностирована инфекция. В другом варианте осуществления изобретения указанная клетка представляет собой часть смешанной популяции клеток, обладающих различными фенотипическими характеристиками. Под объем настоящего изобретения подпадает также клеточная линия, полученная из Т-клетки, трансформированной согласно ранее описанному методу. Под объем настоящего изобретения подпадают модифицированные клетки, полученные с помощью ранее описанного метода, которые являются устойчивыми или чувствительными к иммуносупрессорной обработке.
Предпочтительными вариантами осуществления настоящего изобретения являются Т-клетки или популяция Т-клеток, наделенных CD123 CAR, описанные выше, которые не экспрессируют функциональный TCR и которые обладают реактивностью в отношении CD123-позитивных клеток, предназначенные для их аллогенной трансплантации пациентам.
Более предпочтительным вариантом осуществления настоящего изобретения являются сконструированные иммунные клетки, предлагаемые в изобретении, включающие Т-клетки или популяцию Т-клеток, наделенных CD123 CAR, описанные выше, и которые обладают реактивностью в отношении CD123-позитивных клеток, которые не экспрессируют функциональный TCR и обладают устойчивостью к отобранному лекарственному средству, предназначенные для аллогенной трансплантации пациентам, которых лечат указанным отобранным лекарственным средством.
Еще более предпочтительным вариантом осуществления настоящего изобретения являются Т-клетки или популяция Т-клеток, наделенных анти-CD123 CAR, который содержит полипептид, имеющий SEQ ID NO: 1 + SEQ ID NO: 44, еще более предпочтительно анти-CD123 CAR, который идентичен на 80%, 81%, 82%, 83%, 84%, 85%, 86%, 87%, 88%, 89%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% SEQ ID NO: 1+ SEQ ID NO: 44, в частности, анти-CD123-CAR, который идентичен на 85%-99% SEQ ID NO: 1 + SEQ ID NO: 44.
Активация и размножение Т-клеток
Как до, так и после осуществления генетической модификации Т-клеток, даже в том случае, если активация и пролиферация генетически модифицированных иммунных клеток, предлагаемых в настоящем изобретении, не зависит от механизмов связывания с антигеном, иммунные клетки, прежде всего Т-клетки, предлагаемые в настоящем изобретении, можно подвергать дополнительной активации и размножать с помощью методов, описанных, например, в US №№6352694; 6534055; 6905680; 6692964; 5858358; 6887466; 6905681; 7144575; 7067318; 7172869; 7232566; 7175843; 5883223; 6905874; 6797514; 6867041 и публикации заявки на патент США №2006/0121005. Т-клетки можно размножать in vitro или in vivo.
Как правило, Т-клетки, предлагаемые в изобретении, размножают путем приведения в контакт с агентом, который стимулирует комплекс CD3 TCR, и костимуляторной молекулой на поверхности Т-клеток с целью создания сигнала активации для Т-клетки. Например, для создания сигнала активации для Т-клетки можно применять химические соединения, такие как ионофор кальция А23187, форбол-12-миристат-13-ацетат (ФМА), или митогенные лектины, такие как фитогемагглютинин (ФГА).
Например (но, не ограничиваясь только этим), популяции Т-клеток можно стимулировать in vitro путем приведения в контакт с антителом к CD3 или его антигенсвязывающим фрагментом, или антителом к CD2, иммобилизованным на поверхности, или путем приведения в контакт с активатором протеинкиназы С (например, бриостатином) в сочетании с ионофором кальция. Для костимуляции вспомогательной молекулы на поверхности Т-клеток используют лиганд, который связывается с вспомогательной молекулой. Например, популяцию Т-клеток можно приводить в контакт с антителом к CD3 и антителом к CD28 в условиях, обеспечивающих стимуляцию пролиферации Т-клеток. Условия, пригодные для культивирования Т-клеток, включают соответствующие среды (например, минимальную поддерживающую среду или среду RPMI 1640, или X-vivo 5, (фирма Lonza)), которые могут содержать факторы, необходимые для обеспечения пролиферации и жизнеспособности, включая сыворотку (например, фетальную бычью сыворотку или человеческую сыворотку), интерлейкин-2 (IL-2), инсулин, IFN-g, 1L-4, 1L-7, GM-CSF, -10, -2, 1L-15, TGFp и TNF, или любые другие добавки для роста клеток, известные специалисту в данной области. Другие добавки для роста клеток включают (но, не ограничиваясь только ими) сурфактант, плазманат и восстановители, такие как N-ацетилцистеин и 2-меркаптоэтанол. Среды могут представлять собой RPMI 1640, A1M-V, DMEM, MEM, а-МЕМ, F-12, Х-Vivo 1 и Х-Vivo 20, Optimizer, содержащие в качестве добавок аминокислоты, пируват натрия и витамины, они могут быть бессывороточными или могут содержать в качестве добавок в определенном количестве сыворотку (или плазму) или определенный набор гормонов, и/или цитокин(ы) в количестве, достаточном для роста и размножения Т-клеток. Антибиотики, например, пенициллин и стрептомицин, включают только в экспериментальные культуры, но не в культуры клеток, которые предназначены для введения путем инфузии индивидууму. Клетки-мишени поддерживают в условиях, необходимых для поддержания роста, например, при соответствующей температуре (например, при 37°C) и атмосфере (например, в воздухе плюс 5% СО2). Клетки, которые подвергали стимуляции в течение различных промежутков времени, могут обладать различными характеристиками.
В другом конкретном варианте осуществления изобретения указанные клетки можно размножать путем совместного культивирования с тканью или клетками. Указанные клетки можно размножать также in vivo, например, в крови индивидуума после введения указанной клетки индивидууму.
Терапевтические применения
В другом варианте осуществления изобретения выделенные клетки, полученные различными методами, или клеточную линию, полученную из указанной выделенной клетки, согласно описанному ранее методу, можно применять в качестве лекарственного средства.
В другом варианте осуществления изобретения указанное лекарственное средство можно применять для лечения рака, прежде всего для лечения В-клеточных лимфом и лейкозов у пациента, нуждающегося в этом.
В другом варианте осуществления изобретения указанную выделенную клетку, предлагаемую в изобретении, или клеточную линию, полученную из указанной выделенной клетки, можно применять для изготовления лекарственного средства, предназначенного для лечения рака у пациента, нуждающегося в этом.
В конкретном варианте осуществления изобретения предложена экспрессирующая анти-CD123 CAR Т-клетка в качестве лекарственного средства, предназначенного для лечения AML, подтипа AML, связанного с AML осложнения или связанного с AML состояния. В предпочтительном варианте осуществления изобретения в качестве лекарственного средства предложена экспрессирующая анти-CD123 CAR Т-клетка, в которой указанный анти-CD123 CAR содержит SEQ ID NO: 44.
Согласно другому варианту осуществления изобретения указанное лекарственное средство можно применять для лечения опосредуемого экспрессирующей CD123 клеткой патологического состояния или состояния, отличающегося прямой или косвенной активностью экспрессирующей CD123 клетки. Другими словами, изобретение относится к экспрессирующей анти-CD123 CAR Т-клетке, содержащей 80%-100% SEQ ID NO: 44, предназначенной для применения для лечения состояния, связанного с вредоносной активностью экспрессирующих CD123 клеток, в частности, для лечения состояния, выбранного из AML, подтипа AML, связанного с AML осложнения или связанного с AML состояния.
Другой объект настоящего изобретения относится к способам лечения пациентов, нуждающихся в этом, где указанный способ заключается в том, что осуществляют по меньшей мере одну из следующих стадий, на которых:
(а) получают иммунную клетку, которую можно создавать с помощью одного из ранее описанных способов;
(б) вводят указанные трансформированные иммунные клетки указанному пациенту.
В одном из вариантов осуществления изобретения указанные Т-клетки можно подвергать интенсивному Т-клеточному размножению in vivo и их можно сохранять в течение продолжительного периода времени.
Указанное лечение может быть облегчающим, терапевтическим или профилактическим. Оно может представлять собой либо составную часть аутологичного иммунотерапевтического лечения, либо составную часть аллогенного иммунотерапевтического лечения. Понятие «аутологичный» означает, что клетки, клеточная линия или популяция клеток, применяемые для лечения пациентов, получают из организма указанного пациента или из организма совместимого по человеческому лейкоцитарному антигену (HLA) донора. Понятие «аллогенный» означает, что клетки или популяция клеток, применяемые для лечения пациентов, не получают из организма указанного пациента, но получают из организма донора.
В предыдущих разделах описаны клетки, которые можно применять в описанных выше способах. Указанное лечение можно применять для лечения пациентов, у которых диагностировано предзлокачественное или злокачественное связанное с раком состояние, отличающееся наличием экспрессирующих CD123 клеток, прежде всего избыточным количеством экспрессирующих CD123 клеток. Такие состояния имеют место при гематологических видах рака, таких как лейкоз или злокачественные лимфопролиферативные нарушения. Лимфопролиферативное нарушение может представлять собой лимфому, в частности, множественную миелому, неходжскинскую лимфому, лимфому Беркитта и фолликулярную лимфому (мелкоклеточную и крупноклеточную).
Типы рака, которые можно лечить, включают несолидные опухоли (такие как гематологические опухоли, включая (но, не ограничиваясь только ими) пре-В ALL (при педиатрических показаниях), ALL взрослых, лимфому из клеток мантии, диффузную крупноклеточную В-клеточную лимфому и т.п. Типы рака, которые можно лечить с помощью CAR, предлагаемых в изобретении, включают (но, не ограничиваясь только ими) некоторые типы лейкозов или лимфоидных злокачественных заболеваний. Они включают также опухоли/типы рака взрослых и детские опухоли/типы рака.
Одним из вариантов осуществления настоящего изобретения является композиция, предназначенная для применения для лечения заболевания, опосредуемого экспрессирующими CD123 клетками, в частности, опосредуемого экспрессирующими CD123 клетками гематологического рака, указанная композиция содержит указанную экспрессирующую анти-CD123 CAR Т-клетку, предлагаемую в изобретении, предпочтительно указанный анти-CD123 CAR имеет SEQ ID NO: 44 или SEQ ID NO: 1 + SEQ ID NO: 44.
Любые другие опосредуемые CD123 или включающие CD123 злокачественные лимфопролиферативные нарушения, указанные в настоящем описании, можно облегчать с помощью экспрессирующих анти-CD123 CAR клеток, предлагаемых в настоящем изобретении.
В предпочтительном варианте осуществления изобретения рак, который можно лечить с помощью экспрессирующих анти-CD123 CAR клеток, предлагаемых в настоящем изобретении, представляет собой лейкоз, заболевание, ассоциированное с лейкозом или с его осложнением.
Лейкозы, которые можно лечить с помощью экспрессирующих анти-CD123 CAR клеток, предлагаемых в настоящем изобретении, могут представлять собой острый миелогенный лейкоз (AML), хронический миелогенный лейкоз, мелодиспластический синдром, острый лимфоидный лейкоз, хронический лимфоидный лейкоз и миелодиспластический синдром.
AML или подтипы AML, которые можно лечить с помощью экспрессирующих анти-CD123 CAR клеток, предлагаемых в настоящем изобретении, могут представлять собой, в частности, острый миелобластный лейкоз, минимально-дифференцированный острый миелобластный лейкоз, острый миелобластный лейкоз без созревания (клеток), острый миелобластный лейкоз с созреванием гранулоцитов, промиелоцитарный или острый промиелоцитарный лейкоз (APL), острый миеломоноцитарный лейкоз, миеломоноцитарный лейкоз в сочетании с эозинофилией костного мозга, острый монобластный лейкоз (М5а) или острый моноцитарный лейкоз (M5b), острый эритроидный лейкоз, включая эритролейкоз (М6а) и очень редкий чистый эритроидный лейкоз (M6b), острый мегакариобластный лейкоз, острый базофильный лейкоз, острый панмиелоз с миелофиброзом, в которых участвуют CD123-позитивные клетки.
Подтипы AML включают также волосатоклеточный лейкоз, лейкоз, позитивный по филадельфийской хромосоме.
AML можно классифицировать как AML со специфическим генетическими аномалиями. Классификация основывается на возможности прогнозировать на основе кариотипа ответ на индукционную терапию, риск рецидива, продолжительность жизни.
Таким образом, AML, который можно лечить с помощью экспрессирующих анти-CD123 CAR клеток, предлагаемых в настоящем изобретении, может представлять собой AML с транслокацией между хромосомами 8 и 21, AML с транслокацией или инверсией в хромосоме 16, AML с транслокацией между хромосомами 9 и 11, APL (М3) с транслокацией между хромосомами 15 и 17, AML с транслокацией между хромосомами 6 и 9, AML с транслокацией или инверсией в хромосоме 3, AML (мегакариобластный) с транслокацией между хромосомами 1 и 22.
Настоящее изобретение является наиболее ценным для лечения AML, ассоциированного с указанными конкретными цитогенетическими маркерами.
В настоящем изобретении предложена также экспрессирующая анти-CD123 CAR Т-клетка для лечения пациентов со специфическими цитогенетическими субпопуляциями AML, например, пациентов с t(15; 17)(q22; q21), идентифицированных с помощью полностью транс-ретиноевой кислоты (ATRA) 16-19, и для лечения пациентов с t(8; 21)(q22; q22) или inv(16)(p13q22)/t(16; 16)(p13; q22), идентифицированных с помощью повторяющихся высоких доз цитарабина.
Предпочтительно в настоящем изобретении предложена экспрессирующая анти-CD123 CAR Т-клетка для лечения пациентов с аберрациям, такими как -5/del(5q), -7, аномалиями 3q или комплексным кариотипом, у которых обнаружены плохие уровни полной ремиссии и выживаемости.
Группа пациентов
Предпочтительным вариантом осуществления изобретения является лечение лейкоза, в частности, у страдающих AML пациентов, возрастом старше 60 лет, пациентов возрастом моложе 20 лет.
Более предпочтительным вариантом осуществления настоящего изобретения является педиатрическое лечение, в частности педиатрическое лечение AML или ассоциированных с AML заболеваний или осложнений.
Еще более предпочтительным вариантом осуществления изобретения является применение для лечения страдающих AML пациентов с низким, плохим или неблагоприятным статусом, основой для определения которого является прогнозируемая выживаемость, составляющая менее 5 лет. В этой группе пациенты, страдающие AML со следующими цитогенетическими характеристиками: -5; 5q; -7; 7q-; 11q23; nоn t(9; 11); inv(3); t(3; 3); t(6; 9); t(9; 22), имеют статус, ассоциированный с риском неблагоприятного исхода (Byrd J.С. и др., Blood, 100 (13), 15 декабря 2002 г.; и для них прежде всего пригодно лечение, предлагаемое в настоящем изобретении, или лечение на основе объекта настоящего изобретения.
В одном из вариантов осуществления изобретения экспрессирующую анти-CD123 CAR Т-клетку, предлагаемую в настоящем изобретении, можно применять в качестве индукционной терапии, в качестве терапии после ремиссии AML или в качестве консолидирующей терапии для пациентов с AML. Предпочтительно клетки, экспрессирующие по меньшей мере один анти-CD123 CAR, имеющий SEQ ID NO: 1 + SEQ ID NO: 44, применяют в качестве терапии после ремиссии AML или консолидирующей терапии для пациентов с AML.
В одном из вариантов осуществления изобретения экспрессирующую анти-CD123 CAR Т-клетку, предлагаемую в настоящем изобретении, можно применять в случае рецидива AML или в случае рефрактерного или устойчивого AML. Предпочтительно клетки, содержащие по меньшей мере один анти-CD123 CAR, предлагаемый в изобретении, который имеет SEQ ID NO: 1 + SEQ ID NO: 44, применяют для пациентов с рецидивом AML или рефрактерным или устойчивым AML, более предпочтительно в сочетании по меньшей мере с одним другим противораковым лекарственным средством.
В другом предпочтительном варианте осуществления изобретения по меньшей мере одну клетку, экспрессирующую анти-CD123 CAR, имеющий SEQ ID NO: 1 + SEQ ID NO: 44, применяют для предупреждения развития раковых клеток, что имеет место, в частности, после противоракового лечения, в процессе деплеции (очистки) костного мозга или перед трансплантацией костного мозга, после разрушения костного мозга.
Связанные с AML осложнения
Одним из предпочтительных вариантов осуществления изобретения является лекарственное средство, которое улучшает состояние здоровья пациента, в частности, пациента с осложнениями, связанными с AML. Более предпочтительно указанная сконструированная экспрессирующая анти-CD123 CAR Т-клетка, предлагаемая в изобретении, экспрессирует по меньшей мере один анти-CD123 CAR, содержащий SEQ ID NO: 1 + SEQ ID NO: 44, и ее применяют в качестве лекарственного средства для лечения осложнения, связанного с AML.
Осложнение или заболевание, связанное с AML, может включать предшествующую миелодисплазии фазу, вторичный лейкоз, в частности, вторичный AML, высокое содержание лейкоцитов и отсутствие палочек Ауэра. Среди прочего, в качестве осложнения или заболевания, связанного с AML, рассматриваются лейкостаз и затрагивающий центральную нервную систему (ЦНС) гиперлейкоцитоз, остаточные явления болезни также рассматриваются в качестве осложнения или заболевания, связанного с AML.
Ассоциированные с AML заболевания
Одним из вариантов осуществления настоящего изобретения является также экспрессирующая анти-CD123 CAR Т-клетка, предназначенная для лечения патологического состояния, связанного с AML. Предпочтительно в настоящем изобретении предложна клетка, экспрессирующая по меньшей мере один анти-CD123 CAR, имеющий SEQ ID NO: 1 + SEQ ID NO: 44, для лечения патологического состояния, связанного с AML. В настоящем изобретении предложена терапия связанных с AML миелоидных неоплазм, острого миелоидного лейкоза и миелодиспластического синдрома, лечение рецидивирующего или рефракторного острого миелоидного лейкоза, лечение рецидивирующего или рефракторного острого промиелоцитарного лейкоза у взрослых, лечение острого промиелоидного лейкоза, лечения острого миелоидного лейкоза у взрослых возрастом старше 60 лет.
Другим объектом настоящего изобретения является композиция, предназначенная для лечения ассоциированных с AML заболеваний, в частности, гематологических злокачественных связанных с AML заболеваний.
Гематологические злокачественные связанные с AML состояния включают миелодиспластический синдром (MDS, ранее известный как «предлейкоз»), который представляет собой широкий спектр гематологических состояний, объединенных неэффективным производством (или дисплазией) миелоидных клеток крови и риск трансформации в AML.
Другим вариантом осуществления изобретения является лекарственное средство, предлагаемое в изобретении, которое улучшает состояние здоровья пациента, страдающего множественной миеломой.
Другие патологические состояния или генетические синдромы, ассоциированные с риском AML, можно улучшать посредством соответствующего применения настоящего изобретения, указанные генетические синдромы включают синдром Дауна, трисомию, анемию Фанкони, синдром Блума, атаксию-телеангиэктазию, анемию Даймонда-Блекфена, синдром Швахмана-Даймонда, синдром Ли-Фраумени, нейтрофиброматоз типа 1, серьезную врожденную нейтропению (которую называют также синдромом Костмана).
Другие опосредуемые CD123 патологические состояния
Другим объектом настоящего изобретения является композиция, предназначенная для лечения опосредуемых CD123+-клеткой заболеваний. Указанные опосредуемые CD123+-клеткой заболевания включают воспалительные, аутоиммунные заболевания.
В частности, настоящее изобретение можно применять для лечения опосредуемых CD123+-клеткой заболеваний, таких как воспаление слизистой оболочки желудочно-кишечного тракта и более конкретно воспалительных заболеваний кишечника, назальной аллергии, воспаления кожи, такого как ювенильный дерматомиозит, гематодермия.
Настоящее изобретение можно применять в качестве лекарственного средства для лечения опосредуемых CD123+-клеткой заболеваний, таких как аутоиммунные заболевания, в частности, болезнь Кикучи.
Предпочтительно в настоящем изобретении предложено лечение рекуррентной инфекции, включая инфекцию, связанную с вирусами, такими как вирус Эпштейна-Барра, вирус герпеса простого, в частности онкогенные вирусы, HHV-8, HHV-6, HTLV или ВИЧ, паразитарной инфекции, вызываемой Plasmodium falciparum, Plasmodium vivax, Plasmodium ovale или Plasmodium malariae.
В частности, в настоящем изобретении предложено лечение вызываемого вирусом Эпштейна-Барра лимфаденита, вызываемого вирусом герпеса простого лимфаденита.
Другим объектом настоящего изобретения является композиция, предназначенная для лечения связанного с системной красной волчанкой лимфаденита, туберкулеза, муковисцидоза, гепатита, билиарной атрезии, в частности, индуцированной вирусом гепатита, или билиарной атрезии у детей, аутоиммунного гепатита; первичного билиарного цирроза.
Композицию, содержащую сконструированные Т-клетки, предлагаемые в изобретении, можно применять в качестве медикаментозного средства и в способе его применения.
В настоящем изобретении предложена также композиция, предназначенная для применения, или способ лечения заболевания. Согласно одному из объектов изобретения заболевание представляет собой гематологический рак, в частности, рак из стволовых клеток, включая (но, не ограничиваясь только ими) лейкоз (такой как острый миелогенный лейкоз (AML), хронический миелогенный лейкоз, острый лимфоидный лейкоз, хронический лимфоидный лейкоз и миелодиспластический синдром) и злокачественные лимфопролиферативные состояния, включая лимфому (такую как множественная миелома, неходжскинская лимфома, лимфома Беркитта и мелкоклеточная и крупноклеточная фолликулярная лимфома), или связанные с ними осложнения.
В настоящем изобретении предложена также композиция, предназначенная для применения, или способ ингибирования пролиферации или снижения численности популяции экспрессирующих CD123 клеток или их активности у пациента. Приведенный в качестве примера способ заключается в том, что приводят в контакт популяцию клеток, содержащую экспрессирующую CD123 клетку, с экспрессирующей CD123 CAR Т-клеткой, предлагаемой в изобретении, которая связывается с экспрессирующей CD123 клеткой.
Более конкретным объектом настоящего изобретения является предназначенная для применения композиция или способ ингибирования пролиферации или снижения численности популяции раковых клеток, которые экспрессируют CD123, у пациента, где способы заключаются в том, что приводят в контакт популяцию клеток, содержащую экспрессирующую CD123 клетку, с экспрессирующей CD123 CAR Т-клеткой, предлагаемой в изобретении, которая связывается с экспрессирующей CD123 клеткой, связывание экспрессирующей CD123 CAR Т-клетки, предлагаемой в изобретении, с экспрессирующей CD123 клеткой приводит к разрушению экспрессирующих CD123 раковых клеток.
Согласно некоторым объектам изобретения экспрессирующая CD123 CAR Т-клетка, предлагаемая в изобретении, снижает уровень, число, количество или процент клеток и/или раковых клеток по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 65%, по меньшей мере на 75%, по меньшей мере на 85%, по меньшей мере на 95% или по меньшей мере на 99% (до неподдающегося обнаружению уровня) у индивидуума или на животной модели миелоидного лейкоза или другого вида рака, ассоциированного с экспрессирующими CD123 клетками, относительно отрицательного контроля.
В настоящем изобретении предложены также предназначенная для применения композиция или способ предупреждения, лечения и/или контроля нарушения или состояния, ассоциированного с экспрессирующими CD123 клетками (например, ассоциированного с гематологическим раком), где способы заключаются в том, что вводят индивидууму, который нуждается в этом, экспрессирующую CD123 CAR Т-клетку, предлагаемую в изобретении, которая связывается с экспрессирующей CD123 клеткой. В одном из объектов изобретения индивидуум представляет собой человека. Примерами нарушений, ассоциированных с экспрессирующими CD123 клетками, являются (но, не ограничиваясь только ими) аутоиммунные нарушения (такие как волчанка), воспалительные нарушения (такие как аллергии, IBD и астма) и разные виды рака (например, виды гематологического рака, в частности, AML или связанные с AML осложнения).
Настоящее изобретение относится также к предназначенной для применения композиции или способу предупреждения, лечения и/или контроля заболевания, ассоциированного с экспрессирующими CD123 клетками, где способ заключается в том, что вводят индивидууму, который нуждается в этом, экспрессирующую CD123 CAR Т-клетку, предлагаемую в изобретении, которая связывается с экспрессирующей CD123 клеткой. В одном из объектов изобретения индивидуум представляет собой человека. Примерами заболеваний, ассоциированных с экспрессирующими CD123 клетками, являются (но, не ограничиваясь только ими) острый миелоидный лейкоз (AML), миелодисплазия, В-клеточный острый лимфоидный лейкоз, Т-клеточный острый лимфоидный лейкоз, волосатоклеточный лейкоз, неоплазм из бластных плазмоцитоидных дендритных клеток, хронический миелоидный лейкоз, лимфома Ходжкина.
Настоящее изобретение относится также к предназначенной для применения композиции или способу лечения или предупреждения рецидива рака, ассоциированного с экспрессирующими CD123 клетками, где способ заключается в том, что вводят индивидууму, который нуждается в этом, экспрессирующую CD123 CAR Т-клетку, предлагаемую в изобретении, которая связывается с экспрессирующей CD123 клеткой. Согласно другому объекту изобретения способы заключаются в том, что вводят индивидууму, который нуждается в этом, в эффективном количестве экспрессирующую CD123 CAR Т-клетку, предлагаемую в изобретении, которая связывается с экспрессирующей CD123 клеткой, в сочетании с применяемой в эффективном количестве другой терапией.
В одном из объектов изобретения CD123 рассматривается в качестве маркера «раковой стволовой клетки» при AML. Таким образом, экспрессирующая CD123 CAR Т-клетка, предлагаемая в изобретении, может предупреждать рецидив AML или даже лечить AML, который главным образом является CD123-негативным, но имеет популяцию «стволовых» CD123+-клеток (экспрессирующих CD123 клеток).
Одним из объектов изобретения являются композиции и способы, предназначенные для лечения индивидуумов, которых подвергают лечению по поводу заболевания или нарушения, ассоциированного с повышенными уровнями экспрессии CD19, и которые имеют заболевание или нарушение, ассоциированное с повышенными уровнями CD123.
Согласно одному из объектов изобретения В-клеточный острый лимфоидный лейкоз (ALL) является примером заболевания, для лечения которого требуются серийные обработки с использованием CAR-T-клеток. Например, лечение с помощью анти-CD19 CAR Т-клеток может иногда приводить к CD19-негативному рецидиву, который можно лечить с помощью анти-CD123 CAR Т-клеток, предлагаемых в изобретении. Альтернативно этому, настоящее изобретение включает двойное целенаправленное воздействие на В-ALL с помощью CAR-T-клеток, которые содержат анти-CD19 CAR и анти-CD123 CAR.
Лечение с помощью сконструированных иммунных клеток, предлагаемых в изобретении, можно осуществлять в сочетании с применением одного или нескольких типов противораковой терапии, выбранных из группы, включающей терапию на основе антител, химиотерапию, цитокиновую терапию, терапию с использованием дендритных клеток, генную терапию, гормональную терапию, свето-лазерную терапию и лучевую терапию.
Предпочтительно лечение сконструированные иммунными клетками, предлагаемыми в изобретении, можно осуществлять в комбинации (например, до, одновременно или после) с одним или несколькими противораковыми терапевтическими средствами, выбранным из арацитина, цитозин-арабинозида, амсакрина, даунорубицина, идарубицина, новантрона, митоксантрона, вепезида, этопозида (VP16), триоксида мышьяка, транс-ретиноевой кислоты, комбинации триоксида мышьяка, транс-ретиноевой кислоты, мехлорэтамина, прокарбазина, хлорамбуцила и их комбинации.
Согласно предпочтительному варианту осуществления изобретения указанное лечение можно применять для пациентов, подвергающихся иммуносупрессорной терапии. Фактически настоящее изобретение предпочтительно относится к клеткам или популяциям клеток, которым придана устойчивость по меньшей мере к одному иммуноспрессорному агенту в результате инактивации гена, который кодирует рецептор для указанного иммуносупрессорного агента. В этом аспекте иммуноспрессорное лечение должно способствовать отбору и размножению Т-клеток, предлагаемых в изобретении, в организме пациента.
Введение клеток или популяции клеток, предлагаемых в настоящем изобретении, можно осуществлять любым пригодным методом, включая ингаляцию аэрозоля, инъекцию, прием внутрь, трансфузию, имплантацию или трансплантацию. Композиции, представленные в настоящем описании, можно вводить пациенту подкожно, внутрикожно, внутрь опухоли, интранодально, интрамедуллярно, внутримышечно, путем внутривенной или внутрилимфатической инъекции, или внутрибрюшинно. В одном из вариантов осуществления изобретения клеточные композиции, предлагаемые в настоящем изобретении, предпочтительно вводят путем внутривенной инъекции.
Введение клеток или популяции клеток может заключаться во введении 104-109 клеток/кг веса тела, предпочтительно от 105 до 106 клеток/кг веса тела, включая все целочисленные количества клеток в указанных диапазонах. Клетки или популяцию клеток можно вводить в виде одной или нескольких доз. В другом варианте осуществления изобретения указанное эффективное количество клеток вводят в виде однократной дозы. В другом варианте осуществления изобретения указанное эффективное количество клеток вводят в виде более чем одной дозы в течение некоторого периода времени. График введения находится в компетенции лечащего врача и зависит от клинического состояния пациента. Клетки или популяцию клеток можно получать из любого источника, такого как банк крови или донор. Поскольку индивидуальные потребности варьируются, определение оптимальных диапазонов эффективных количеств рассматриваемого типа клеток для конкретного заболевания или состояний, находится в компетенции специалиста в данной области. Эффективное количество представляет собой количество, которое обеспечивает терапевтическое или профилактическое полезное действие. Вводимая доза должна зависеть от возраста, состояния здоровья и веса реципиента, вида одновременно применяемого лечения, если это имеет место, частоты обработки и природы требуемого действия.
В другом варианте осуществления изобретения клетки или композицию, содержащую эти клетки, вводят в указанном эффективном количестве парентерально. Указанное введение может представлять собой внутривенное введение. Указанное введение можно осуществлять непосредственно путем инъекции в опухоль.
В некоторых вариантах осуществления настоящего изобретения клетки вводят пациенту в сочетании с осуществлением (например, до, одновременно или после) любого количества соответствующих форм лечения, включая (но, не ограничиваясь только ими) лечение с помощью средств противовирусной терапии, таких как цидофовир и интерлейкин-2, цитарабин (известный также под названием ARA-C), или лечение натализумабом пациентов с MS (рассеянный склероз), или лечение эфализумабом пациентов с псориазом, или другие виды лечения пациентов с PML (прогрессирующая многоочаговая лейкоэнцефалопатия). В других вариантах осуществления изобретения Т-клетки, предлагаемые в изобретении, можно применять в сочетании с химиотерапией, лучевой терапией, иммунодепрессантами, такими как циклоспорин, азатиоприн, метотрексат, микофенолат и FK506, антителами или другими иммунодеструктивными агентами, такими как CAMPATH, антитела к CD3, или с другими видами терапии на основе антител, цитоксином, флударибином, циклоспорином, FK506, рапамицином, микофеноловой кислотой, стероидами, FR901228, цитокинами и облучением. Эти лекарственные средства ингибируют или кальций-зависимую фосфатазу, кальцинеурин (циклоспорин и FK506), или ингибируют киназу p70S6, которая важна для индуцируемой фактором роста передачи сигнала (рапамицин) (Henderson, Naya и др., 1991; Liu, Albers и др., 1992; Bierer, Hollander и др., 1993). В другом варианте осуществления изобретения клеточные композиции, предлагаемые в настоящем изобретении, вводят пациенту в сочетании с (например, до, одновременно или после) трансплантацией костного мозга, Т-клеточной абляционной терапией с использованием либо химиотерапевтических средств, таких как флударабин, либо внешней лучевой терапии (XRT), циклофосфамида, либо антител, таких как OKT3 или САМРАТН. В другом варианте осуществления изобретения клеточные композиции, предлагаемые в настоящем изобретении, вводят после осуществления В-клеточной абляционной терапии с использованием агентов, которые взаимодействуют с CD20, таких, например, как ритуксан. Например, в одном из вариантов осуществления изобретения индивидуумов можно подвергать стандартной обработке химиотерапевтическими средствами в высокой дозе с последующей трансплантацией стволовых клеток периферической крови. В некоторых вариантах осуществления изобретения после трансплантации индивидуумам вводят путем инфузии размноженные иммунные клетки, предлагаемые в настоящем изобретении. В еще одном варианте осуществления изобретения размноженные клетки вводят до или после хирургического вмешательства.
В некоторых вариантах осуществления настоящего изобретения экспрессирующие анти-CD123 CAR клетки вводят пациенту в сочетании с (например, до, одновременно или после) лекарственным средством, выбранным из арацитина, цитозин-арабинозида, амсакрина, даунорубицина, идарубицина, новантрона, митоксантрона, вепезида, этопозида (VP 16), триоксида мышьяка, транс-ретиноевой кислоты, мехлорэтамина, прокарбазина, хлорамбуцила и их комбинации. В указанных вариантах осуществления изобретения экспрессирующие анти-CD123 CAR клетки могут обладать устойчивостью к конкретному лекарственному средству или комбинации лекарственных средств, которое/которые вводят в сочетании с экспрессирующими анти-CD123 CAR клетками.
В других вариантах осуществления настоящего изобретения экспрессирующие анти-CD123 CAR клетки вводят пациенту в сочетании с лекарственным средством, выбранным из цитарабина, антрациклинов, 6-тиогуанина, гидроксимочевины, преднизона и их комбинации.
Другие определения
- Если специально не указано иное, то множественное число и единственное число и понятие «по меньшей мере один» используются взаимозаменяемо и означают «один» или «более чем один».
- Аминокислотные остатки в полипептидной последовательности обозначают в настоящем описании с помощью однобуквенного кода, согласно которому, например, Q обозначает Gin или остаток глутамина, R обозначает Arg или остаток аргинина и D обозначает Asp или остаток аспарагиновой кислоты.
- Аминокислотная замена обозначает замену одного аминокислотного остатка на другой, например, замена остатка аргинина на остаток глутамина в пептидной последовательности представляет собой аминокислотную замену.
- Нуклеотиды обозначают следующим образом: однобуквенный код используют для обозначения основания нуклеозида: а обозначает аденин, t обозначает тимин, с обозначает цитозин и g обозначает гуанин. Для вырожденных нуклеотидов r обозначает g или а (пуриновые нуклеотиды), к обозначает g или t, s обозначает g или с, w обозначает а или t, m обозначает а или с, y обозначает t или с (пиримидиновые нуклеотиды), d обозначает g, а или t, v обозначает g, а или с, b обозначает g, t или с, h обозначает a, t или сип обозначает g, a, t или с.
- В контексте настоящего описания понятия «нуклеиновая кислота» или «полинуклеотиды» относятся к нуклеотидам и/или полинуклеотидам, таким как дезоксирибонуклеиновая кислота (ДНК) или рибонуклеиновая кислота (РНК), олигонуклеотидам, фрагментам, созданным с помощью полимеразной цепной реакции (ПЦР), и фрагментам, созданным путем лигирования, расщепления, обработки эндонуклеазами и обработки экзонуклеазами. Молекулы нуклеиновой кислоты могут состоять из мономеров, которые являются встречающимися в естественных условиях нуклеотидами (такими как ДНК или РНК) или аналогами встречающихся в естественных условиях нуклеотидов (например, энантиомерными формами встречающихся в естественных условиях нуклеотидов), или представляют собой их комбинацию. Модифицированные нуклеотиды могут иметь изменения в сахарных фрагментах и/или во фрагментах, содержащих пиримидиновые или пуриновые основания. Модификации Сахаров включают, например, замену одной или нескольких гидроксильных групп на галогены, алкильные группы, амины и азидогруппы, или сахара могут быть функционализированы до простых или сложных эфиров. Кроме того, весь сахарный фрагмент может быть заменен стерически и электронно сходными структурами, такими как аза-сахара и карбоциклические аналоги сахаров. Примерами модификаций во фрагменте, представляющем собой основание, могут служить алкилированные пурины и пиримидины, ацилированные пурины или пиримидины или другие хорошо известные гетероциклические заместители. Мономеры нуклеиновой кислоты могут быть сшиты фосфодиэфирными связями или аналогами таких связей. Нуклеиновые кислоты могут быть одноцепочечными или двухцепочечными.
- Под химерным антигенным рецептором (CAR) подразумевают молекулы, в которых объединен связывающий домен, направленный против компонента, присутствующего на клетке-мишени, например, присущую антителу специфичность в отношении требуемого антигена (например, опухолевого антигена), с активирующим Т-клеточный рецептор внутриклеточным доменом, в результате чего образуется химерный белок, обладающий специфической клеточной иммунной активностью в отношении мишени. Как правило, CAR состоит из внеклеточного одноцепочечного антитела (scFvFc), слитого с внутриклеточным сигнальным доменом дзета-цепи комплекса Т-клеточный антиген-рецептор (scFvFc:ζ), и при экспрессии в Т-клетках он обладает способностью перенаправлять распознавание антигена благодаря специфичности моноклонального антитела. Одним из примеров CAR, применяемого в настоящем изобретении, является CAR, направленный против антигена CD123, и он может, например, содержать (но, не ограничиваясь только ими) аминокислотные последовательности: SEQ ID NO: 23-48.
- Понятие «эндонуклеаза» относится к ферменту дикого типа или его варианту, обладающему способностью катализировать гидролиз (расщепление) связей между нуклеиновыми кислотами в молекуле ДНК или РНК, предпочтительно в молекуле ДНК. Эндонуклеазы не расщепляют молекулу ДНК или РНК независимо от ее последовательности, но они распознают и расщепляют молекулу ДНК или РНК в специфических полинуклеотидных последовательностях, в дальнейшем обозначенных как «последовательности-мишени» или «сайты-мишени». Эндонуклеазы можно классифицировать как редко расщепляющие эндонуклеазы, для которых, как правило, полинуклеотидный сайт распознавания имеет длину более 12 пар оснований (bp), более предпочтительно 14-55 пар оснований. Редко расщепляющие эндонуклеазы значительно повышают гомологичную рекомбинацию (HR), индуцируя двухцепочечные разрывы ДНК (DSB) в определенном локусе (Perrin, Buckle и др., 1993; Rouet, Smih и др., 1994; Choulika, Perrin и др., 1995; Pingoud и Silva, 2007). Редко расщепляющие эндонуклеазы могут представлять собой, например, хоминг-эндонуклеазу (Paques и Duchateau, 2007), химерную нуклеазу с цинковыми пальцами (ZFN), образованную слиянием сконструированных доменов «цинковых пальцев» с каталитическим доменом рестриктазы, такой как FokI (Porteus и Carroll, 2005), эндонуклеазу Cas9 из системы CRISPR (Gasiunas, Barrangou и др., 2012; Jinek, Chylinski и др., 2012; Cong, Ran и др., 2013; Mali, Yang и др., 2013) или химическую эндонуклеазу (Eisenschmidt, Lanio и др., 2005; Arimondo, Thomas и др., 2006). В химических эндонуклеазах химический или пептидный расщепляющий компонент конъюгируют либо с полимером нуклеиновой кислоты, либо с другой ДНК, распознающей специфическую последовательность-мишень, тем самым обеспечивая направление расщепляющей активности на специфическую последовательность. Химические эндонуклеазы включают также синтетические нуклеазы типа конъюгатов ортофенантролина, ДНК-расщепляющей молекулы и триплекс-образующих олигонуклеотидов (TFO), которые, как известно, связываются со специфическими последовательностями ДНК (Kalish и Glazer, 2005). Такие химические эндонуклеазы подпадают под понятие «эндонуклеазы» в контексте настоящего изобретения.
- Под «TALE-нуклеазой» (TALEN) понимают слитый белок, который состоит из связывающего нуклеиновую кислоту домена, как правило, происходящего из подобного активатору транскрипции эффектора (TALE), и одного нуклеазного каталитического домена для расщепления последовательности нуклеиновой кислоты-мишени. Каталитический домен предпочтительно представляет собой нуклеазный домен и более предпочтительно домен, обладающий эндонуклеазной активностью, например, типа I-TevI, ColE7, NucA и Fok-I. В конкретном варианте осуществления изобретения домен TALE может быть слит с мегануклеазой, например, типа I-CreI и I-OnuI, или ее функциональным вариантом. В более предпочтительном варианте осуществления изобретения указанная нуклеаза представляет собой мономерную TALE-нуклеазу. Мономерная TALE-нуклеаза представляет собой TALE-нуклеазу, которая не требует димеризации для специфического распознавания и расщепления, например, в виде слияний сконструированных повторов TAL с каталитическим доменом I-TevI, описанным в WO 2012/138927. Подобные активатору транскрипции эффекторы (TALE) представляют собой белки из видов бактерий рода Xanthomonas, содержащие несколько повторяющихся последовательностей, где каждый повтор содержит di-остатки (двойные остатки) в положениях 12 и 13 (RVD), обладающие специфичностью в отношении каждого нуклеотидного основания последовательности нуклеиновой кислоты-мишени. Связывающие домены, обладающие сходными модульными свойствами связывания нуклеиновых кислот по типу основание-с основанием («base-per-base») (MBBBD) могут быть получены также из новых модульных белков, недавно обнаруженных заявителями в различных видах бактерий. Преимущество новых модульных белков заключается в том, что они характеризуются большей вариабельностью последовательности, чем TAL-повторы. Предпочтительно RVD, ассоциированные с распознаванием различных нуклеотидов, представляют собой HD для распознавания С, NG для распознавания Т, NI для распознавания А, NN для распознавания G или A, NS для распознавания А, С, G или Т, HG для распознавания Т, IG для распознавания Т, NK для распознавания G, НА для распознавания С, ND для распознавания С, HI для распознавания С, HN для распознавания G, NA для распознавания G, SN для распознавания G или А и YG для распознавания Т, TL для распознавания А, VT для распознавания А или G и SW для распознавания А. В другом варианте осуществления изобретения имеющие решающее значение аминокислоты 12 и 13 можно изменять путем мутации на другие аминокислотные остатки для модуляции их специфичности в отношении нуклеотидов А, Т, С и G и, прежде всего, для повышения их специфичности. Ранее уже была описана TALE-нуклеаза, и ее применяют для стимуляции генного нацеливания и генных модификаций (Boch, Scholze и др., 2009; Moscou и Bogdanove, 2009; Christian, Cermak и др., 2010; Li, Huang и др., 2011). Сконструированные TAL-нуклеазы поступают в продажу под товарным знаком TALEN™ (фирма Cellectis, 8 rue de la Croix Jarry, 75013, Париж, Франция).
Редко расщепляющая эндонуклеаза, предлагаемая в настоящем изобретении, может представлять собой также эндонуклеазу Cas9. В последние годы был разработан новый инструмент для генетической инженерии на основе РНК-направляемой нуклеазы Cas9 (Gasiunas, Barrangou и др., 2012; Jinek, Chylinski и др., 2012; Cong, Ran и др., 2013; Mali, Yang и др., 2013) из адаптивной иммунной системы CRISPR (короткие палиндромные повторы, регулярно расположенные группами (Clustered Regularly Interspaced Short palindromic Repeats)) типа II прокариот (см. обзор Sorek, Lawrence и др., 2013). CRISPR-ассоциированная (Cas) система впервые была обнаружена в бактериях, и ее функция состоит в защите от чужой вирусной или плазмидной ДНК. При осуществлении опосредуемой CRISPR генетической инженерии сначала проводят отбор последовательности-мишени, часто фланкированной короткой последовательностью мотива, который обозначают как примыкающий к протоспейсеру мотив (РАМ). После отбора последовательности-мишени конструируют специфическую crРНК (CRISPR-РНК), комплементарную указанной последовательности-мишени. Для систем CRISPR типа II требуется трансактивирующая crРНК (tracrРНК), спаренная с crRNA и связанная с внесенным белком Cas9. Cas9 функционирует в качестве молекулярного якоря, облегчающего спаривание оснований tracРНК с сРНК (Deltcheva, Chylinski и др., 2011). В этом тройном комплексе двойная структура tracrРНКrcrРНК функционирует в качестве направляющей РНК, которая направляет эндонуклеазу Cas9 к когнатной последовательности-мишени. Распознавание мишени комплексом Cas9-tracrРНК:crРНК инициируется путем сканирования последовательности-мишени для обнаружения гомологии между последовательностью-мишенью и crРНК. Помимо комплементарности последовательности-мишени и crРНК, нацеливание ДНК требует присутствия короткого мотива, примыкающего к протоспейсеру (примыкающий к протоспейсеру мотив - РАМ). После спаривания двойной РНК и последовательности-мишени Cas9 интродуцирует «тупой» двухцепочечный разрыв на расстоянии 3 пар оснований в обратном направлении относительно мотива РАМ (Garneau, Dupuis и др., 2010).
Редко расщепляющая эндонуклеаза может представлять собой хоминг-эндонуклеазу, также известную под названием мегануклеаза. Такие хоминг-эндонуклеазы хорошо известны в данной области (Stoddard, 2005). Хоминг-эндонуклеазы распознают последовательность ДНК-мишени и создают одноцепочечный или двухцепочечный разрыв. Хоминг-эндонуклеазы обладают высокой специфичностью, распознавая сайты ДНК-мишени длиной от 12 до 45 пар оснований (bp), как правило, длиной от 14 до 40 пар оснований. Хоминг-эндонуклеаза, предлагаемая в изобретении, может соответствовать, например, эндонуклеазе LAGLIDADG, эндонуклеазе HNH или эндонуклеазе GIY-YIG. Предпочтительно хоминг-эндонуклеаза, предлагаемая в настоящем изобретении, может представлять собой вариант I-CreI.
- Под «вектором для доставки» или «векторами для доставки» понимают любой доставляющий вектор, который можно применять согласно настоящему изобретению для приведения в контакт с клеткой (т.е. для «контактирования») или доставки внутрь клетки или в субклеточные компартменты (т.е. для «интродукции») агентов/химических веществ и молекул (белков или нуклеиновых кислот), требующихся для осуществления настоящего изобретения. К ним относятся (но, не ограничиваясь только ими) липосомальные векторы для доставки, вирусные векторы для доставки, векторы для доставки лекарственного средства, химические носители, полимерные носители, липоплексы, полиплексы, дендримеры, микропузырьки (ультразвуковые контрастные агенты), наночастицы, эмульсии или другие пригодные векторы для переноса. Такие векторы для доставки позволяют доставлять молекулы, химические вещества, макромолекулы (гены, белки) или другие векторы, такие как плазмиды, пептиды, разработанные фирмой Diatos. В этих случаях векторы для доставки представляют собой молекулы-носители. Под «вектором для доставки» или «векторами для доставки» понимают также методы доставки, предназначенные для осуществления трансфекции.
- Понятия «вектор» или «векторы» относятся к молекуле нуклеиновой кислоты, обладающей способностью транспортировать другую нуклеиновую кислоту, с которой она сцеплена. К «векторам», применяемым согласно настоящему изобретению, относятся (но, не ограничиваясь только ими) вирусный вектор, плазмида, РНКовый вектор или молекула линейной или кольцевой ДНК или РНК, которые могут состоять из хромосомальных, нехромосомальных, полусинтетических или синтетических нуклеиновых кислот. Предпочтительными векторами являются векторы, которые способны автономно реплицировать (эписомальный вектор) и/или экспрессировать нуклеиновые кислоты, с которыми они сцеплены (экспрессионные векторы). Специалистам в данной области известно большое количество пригодных векторов, которые поступают в продажу.
К вирусным векторам относятся ретровирус, аденовирус, парвовирус (например, аденоассоциированный вирусы), коронавирус, РНК-вирусы с негативной цепью, такие как ортомиксовирус (например, вирус гриппа), рабдовирус (например, вирус бешенства и вирус везикулярного стоматита), парамиксовирус (например, вирус кори и вирус Сендай), РНК-вирусы с позитивной цепью, такие как пикорнавирус и альфавирус, и вирусы с двухцепочечной ДНК, включая аденовирус, вирус герпеса (например, вирус герпеса простого типов 1 и 2, вирус Эпштейна-Барра, цитомегаловирус) и вирус оспы (например, вирус коровьей оспы, вирус оспы птиц и вирус оспы канарейки). Другие вирусы включают, например, вирус Норвалк, тогавирус, флавивирус, реовирусы, паповирус, гепаднавирус и вирус гепатита. Примерами ретровирусов являются: вирус птичьего лейкоза-саркомы, вирусы млекопитающих С-типа, В-типа, вирусы D-типа, группа HTLV-BLV, лентивирус, спумавирус (Coffin J.М., Retroviridae: The viruses and their replication, в: Fundamental Virology, 3-е изд., под ред. В.N. Fields и др., изд-во Lippincott-Raven Publishers, Philadelphia, 1996).
- Под «лентивирусным вектором» подразумевают лентивирусные векторы на основе ВИЧ, которые являются очень перспективными с точки зрения доставки гена благодаря их относительно большой способности к упаковке, пониженной иммуногенности и их способности стабильно трансдуцировать с высокой эффективностью большой спектр различных типов клеток.
Лентивирусные векторы, как правило, создают посредством кратковременной трансфекции клеток-продуцентов тремя (упаковывающая плазмида, оболочечная плазмида и плазмида переноса) или большим количеством плазмид. Подобно ВИЧ, лентивирусные векторы проникают в клетку-мишень посредством взаимодействия гликопротеинов вирусной поверхности с рецепторами на клеточной поверхности. После проникновения вирусная РНК подвергается обратной транскрипции, опосредуемой комплексом вирусной обратной транскриптазы. Продуктом обратной транскрипции является двухцепочечная линейная вирусная ДНК, которая служит субстратом для вирусной интеграции в ДНК инфицированных клеток. Понятие «интегрирующие лентивирусные векторы (или LV)» обозначает, например (но, не ограничиваясь только ими), такие векторы, которые способны интегрироваться в геном клетки-мишени. В противоположность этому, понятие «неинтегрирующие лентивирусные векторы (или NILV)» обозначает эффективные векторы для доставки генов, которые не интегрируются в геном клетки-мишени под действием вирусной интегразы.
- Векторы для доставки и векторы можно объединять или комбинировать с любыми методами клеточной пермеабилизации, такими как сонопорация или электропорация, или вариантами этих методов.
- Под клеткой или клетками подразумевают любые эукариотические живые клетки, первичные клетки и клеточные линии, выведенные из указанных организмов для получения культур in vitro.
- Под «первичной клеткой» или «первичными клетками» подразумевают клетки, взятые непосредственно из живой ткани (т.е. материал, полученный путем биопсии) и подготовленные для выращивания in vitro, в популяции которых имело место лишь небольшое количество удвоений, и следовательно они являются более репрезентативными с точки зрения основных функциональных компонентов и характеристик тканей, из которых они происходят, по сравнению с непрерывно поддерживаемыми или искусственно иммортализованными онкогенными клеточными линиями.
Примерами таких клеточных линий могут являться (но, не ограничиваясь только ими) клеточные линии, выбранные из группы, состоящей из клеток линии СНО-K1; клеток линии НЕK293; клеток линии Сасо2; клеток линии U2-OS; клеток линии NIH 3Т3; клеток линии NSO; клеток линии SP2; клеток линии CHO-S; клеток линии DG44; клеток линии К-562, клеток линии U-937; клеток линии MRC5; клеток линии IMR90; клеток линии Jurkat; клеток линии HepG2; клеток линии HeLa; клеток линии НТ-1080; клеток линии НСТ-116; клеток линии Hu-h7; клеток линии Huvec; клеток линии Molt 4.
Все эти клеточные линии можно модифицировать с помощью способа, предлагаемого в настоящем изобретении, создавая модели клеточных линий для получения, экспрессии, количественной оценки, обнаружения, изучения представляющего интерес гена или белка; эти модели можно применять также для скрининга представляющих интерес биологически активных молекул для исследовательских и промышленных целей в различных областях, например, таких как (но, не ограничиваясь только ими) химия, биотопливо, терапевтические средства и агрономия.
- Под «мутацией» подразумевают замену, делецию или инсерцию одного/одной, двух, трех, четырех, пяти, шести, семи, восьми, девяти, десяти, одиннадцати, двенадцати, тринадцати, четырнадцати, пятнадцати, двадцати, двадцати пяти, тридцати, сорока, пятидесяти или большего количества нуклеотидов/аминокислот в полинуклеотидной (кДНК, ген) или полипептидной последовательности. Мутация может влиять на кодирующую последовательность гена или его регуляторную последовательность. Она может влиять также на структуру геномной последовательности или структуру/стабильность кодируемой мРНК.
- Под «вариантом(ами)» подразумевают вариант повтора, вариант, ДНК-связывающий вариант, вариант TALE-нуклеазы, вариант полипептида, полученный в результате мутации или замены по меньшей мере одного остатка в аминокислотной последовательности родительской молекулы.
- Под «функциональным вариантом» подразумевают обладающий каталитической активностью мутант белка или домена белка; такой мутант может обладать такой же активностью, что и родительский белок или домен белка, или дополнительными свойствами, или более высокой или более низкой активностью.
- Понятие «идентичность» относится к идентичности последовательностей двух молекул нуклеиновых кислот или полипептидов. Идентичность можно оценивать путем сравнения положений в каждой из последовательностей, которые можно выравнивать для целей сравнения. Если положение в сравниваемой последовательности занято тем же самым основанием, то молекулы являются идентичными в этом положении. Степень сходства или идентичности между двумя нуклеотидными или аминокислотными последовательностями является функцией количества идентичных или совпадающих нуклеотидов в положениях нуклеотидных последовательностей. Для расчета идентичности двух последовательностей можно использовать различные алгоритмы и/или программы сравнительного анализа первичной структуры последовательностей, включая FASTA или BLAST, которые доступны в виде компонента пакета программ анализа последовательностей GCG (Университет Висконсина, Мэдисон, шт. Висконсин), и их можно применять, например, с использованием задаваемых по умолчанию параметров. Например, можно рассматривать полипептиды, обладающие идентичностью, составляющей по меньшей мере 70%, 85%, 90%, 95%, 98% или 99%, с конкретными полипептидами, представленными в настоящем описании, и предпочтительно обладающие практически такими же функциями, а также полинуклеотиды, кодирующие такие полипептиды.
- Понятие «сходство» характеризует степень родства между аминокислотными последовательностями двух или большего количества полипептидов. BLASTP можно применять также для идентификации аминокислотной последовательности, идентичной по меньшей мере на 70%, 75%, 80%, 85%, 87,5%, 90%, 92,5%, 95%, 97,5%, 98%, 99% аминокислотной референс-последовательности, с использованием матриц сходства, таких как BLOSUM45, BLOSUM62 или BLOSUM80. Если специально не указано иное, то указанные в описании баллы сходства получены с использованием BLOSUM62. При использовании BLASTP процент сходства основан на рассчитанном программой BLASTP балле положительных оценок, а процент идентичности последовательностей основан на рассчитанном BLASTP балле идентичности. Рассчитанные с помощью BLASTP «идентичности» представляют собой количество и пропорцию идентичных остатков относительно общего количества остатков в парах последовательностей с высокими баллами; а рассчитанные с помощью BLASTP «положительные оценки» представляют собой количество и пропорцию остатков, для которых полученные при сравнительном анализе первичной структуры последовательностей баллы, являются положительными, и которые сходны друг с другом. В настоящей заявке предложены и подпадают под объем изобретения аминокислотные последовательности, имеющие указанные степени идентичности или сходства, или любую промежуточную степень идентичности или сходства с представленными в настоящем описании аминокислотными последовательностями. Полинуклеотидные последовательности сходных полипептидов выводят с использованием генетического кода и их можно получать с помощью общепринятых методов. Например, функциональный вариант рТальфа может иметь последовательность, сходную на 70%, 75%, 80%, 85%, 87.5%, 90%, 92.5%, 95%, 97.5%, 98%, 99% аминокислотной последовательности SEQ ID NO: 107. Полинуклеотид, кодирующий такой функциональный вариант, можно получать путем обратной трансляции его аминокислотной последовательности с использованием генетического кода.
- Понятия «домен трансдукции сигнала» или «костимуляторный лиганд» относятся к молекуле на антигенпрезентирующей клетке, которая специфически связывается с когнатной костимуляторной молекулой на Т-клетке, обеспечивая тем самым сигнал, который в дополнение к первичному сигналу, обеспечиваемому, например, связыванием комплекса TCR/CD3 с молекулой ГКГС, загруженной пептидом, опосредует Т-клеточный ответ, включая (но, не ограничиваясь только ими) активацию пролиферации, дифференцировку и т.п. Костимуляторным лигандом могут служить (но, не ограничиваясь только ими) CD7, В7-1 (CD80), В7-2 (CD86), PD-L1, PD-L2, 4-1BBL, OX40L, индуцибельный костимуляторный лиганд (ICOS-L), молекула межклеточной адгезии (ICAM, CD30L, CD40, CD70, CD83, HLA-G, MICA, М1СВ, HVEM, рецептор лимфотоксина бета, 3/TR6, ILT3, ILT4, агонист или антитело, который/которое связывается с лигандом Толл-рецептора, и лиганд, который специфически связывается с В7-Н3. Костимуляторный лиганд включает также, среди прочего, антитело, которое специфически связывается с костимуляторной молекулой, присутствующей на Т-клетке, такой как (но, не ограничиваясь только ими) CD27, CD28, 4-1ВВ, ОХ40, CD30, CD40, PD-1, ICOS, ассоциированный с функцией лимфоцитов антиген-1 (LFA-1), CD2, CD7, LTGHT, NKG2C, В7-Н3, лиганд, который специфически связывается с CD83.
Понятие «костимуляторная молекула» относится к когнатному связывающему партнеру на Т-клетке, который специфически связывается с костимуляторным лигандом, опосредуя тем самым костимуляторный ответ клетки, такой как (но, не ограничиваясь только им) пролиферация. Костимуляторные молекулы включают (но, не ограничиваясь только ими) молекулу ГКГС класса I, BTLA и лиганд Толл-рецептора.
В контексте настоящего описания понятие «костимуляторный сигнал» относится к сигналу, который в сочетании с первичным сигналом, таким как сигнал, обусловленный сцеплением TCR/CD3, приводит к пролиферации Т-клеток и/или повышающей или понижающей регуляции имеющих решающее значение молекул.
- В контексте настоящего описания понятие «внеклеточный лигандсвязывающий домен» обозначает олиго- или полипептид, который обладает способностью связываться с лигандом. Предпочтительно домен должен обладать способностью взаимодействовать с молекулой клеточной поверхности. Например, можно выбирать внеклеточный лигандсвязывающий домен для распознавания лиганда, который функционирует в качестве маркера клеточной поверхности на клетках-мишенях, ассоциированных с конкретным болезненным состоянием. Так, примерами маркеров клеточной поверхности, которые могут функционировать в качестве лигандов, являются маркеры, ассоциированные с вирусными, бактериальными и паразитарными инфекциями, аутоиммунным заболеванием и раковыми клетками.
В контексте настоящего описания понятие «индивидуум» или «пациент» включает всех представителей царства животных, в том числе приматов кроме человека и человека.
Понятие «наличие рецидива» относится к ситуации, когда у индивидуума или млекопитающего, у которого наблюдалась ремиссия рака после терапии, вновь появляются раковые клетки.
Понятие «рефракторая или устойчивая» относится к ситуации, когда у индивидуума или млекопитающего даже после интенсивного лечения в организме присутствуют оставшиеся раковые клетки.
Понятие «устойчивость к лекарственному средству» относится к состоянию, когда заболевание не реагирует на лечение лекарственным средством или лекарственными средствами. Устойчивость к лекарственному средству может быть либо врожденная (или первичная устойчивость), это означает, что заболевание никогда не обладало чувствительностью к лекарственному средству или лекарственным средствам, либо может быть приобретенной, это означает, что заболевание перестало реагировать на лекарственное средство или лекарственные средства, к которому(ым) оно ранее обладало чувствительностью (вторичная устойчивость). В некоторых вариантах осуществления изобретения устойчивость к лекарственному средству является врожденной. В некоторых вариантах осуществления изобретения устойчивость к лекарственному средству является приобретенной.
Понятие «гематологическое злокачественное заболевание» или «гематологический рак» относится к раку крови - костного мозга и/или лимфатической ткани организма. Примеры гематологических злокачественных заболеваний включают, например, миелодисплазию, лейкоз, лимфомы, такие, например, как кожные лимфомы, неходжскинсую лимфому, болезнь Ходжкина (который называют также лимфомой Ходжкина) и миелому, такую как острый лимфоцитарный лейкоз (ALL), острый миелоидный лейкоз (AML), острый промиелоцитарный лейкоз (APL), хронический лимфоцитарный лейкоз (CLL), хронический миелоидный лейкоз (CML), хронический нейтрофильный лейкоз (CNL), острый недифференцированный лейкоз (AUL), анапластическую крупноклеточную лимфому (ALCL), пролимфоцитарный лейкоз (PML), ювенильный миеломиноцитарный лейкоз (JMML), Т-клеточный ALL взрослых, AML с трехлинейной миелодисплазией (AML/TMDS), смешанную линию лейкоза (миелоидная/лимфоидная) (MLL), миелодиспластические синдромы (MDS), миелопролиферативные нарушения (MPD) и множественную миелому (ММ).
Понятие «лейкоз» относится к злокачественным неоплазмам кроветворных тканей, включая (но, не ограничиваясь только ими) хронический лимфоцитарный лейкоз или хронический лимфоидный лейкоз, хронический миелоцитарный лейкоз или хронический миелогенный лейкоз, острый лимфобластный лейкоз, острый миелоидный лейкоз или острый миелогенный лейкоз (AML) и острый миелобластный лейкоз.
В представленном выше описании изобретения изложены подход и способ его осуществления и применения, так что любой специалист в данной области способен осуществлять и применять его, эта возможность относится, прежде всего, к сущности изобретения, изложенной в прилагаемой формуле изобретения, которая представляет собой составную часть исходного описания.
Если в настоящем описании указаны численные пределы или численный диапазон, то они включают их границы. Кроме того, считается, что включены все значения и поддиапазоны, находящиеся в указанных пределах или указанном численном диапазоне, как если бы они были специально указаны.
Приведенное выше описание представлено для того, чтобы дать возможность специалисту в данной области осуществлять и применять изобретение, и оно изложено в контексте конкретного применения и требуемых для этого условий. Специалистам в данной области должны быть очевидны различные модификации предпочтительных вариантов осуществления изобретения, и общие принципы, указанные в нем могут быть применены для других вариантов осуществления изобретения и применений без отклонения от сущности и объема изобретения. Таким образом, не следует считать, что настоящее изобретение ограничено представленными вариантами осуществления изобретения, напротив, оно соответствует наиболее широкому объему, согласующемуся с принципами и отличительными признаками, указанными в настоящем описании.
Имея общее описание настоящего изобретения, можно достичь более полного понимания после ознакомления с некоторыми конкретными примерами, которые представлены в настоящем описании только для целей иллюстрации и не направлены на ограничение объема, если специально не указано иное.
Общие методы
Культуры первичных Т-клеток
Т-клетки очищают из образцов лейкоцитарных пленок, полученных на фирме EFS (Etablissement Francais du Sang, Париж, Франция), используя среду с градиентом плотности фиколла. Выделяют слой РВМС и Т-клетки очищают, используя поступающий в продажу набор для обогащения Т-клеток. Очищенные Т-клетки активируют в среде X-Vivo™-15 (фирма Lonza), дополненной человеческим IL-2 в концентрации 20 нг/мл, человеческой сывороткой в концентрации 5%, и используя гранулы Dynabeads® с активатором человеческих Т-клеток CD3/CD28 при соотношении гранулы: клетки 1:1 (фирма Life Technologies).
Трансфекция мРНК CAR
Трансфекции осуществляют в день 4 или день 11 после очистки и активации Т-клеток. 5 миллионов клеток трансфектируют 15 мкг мРНК, кодирующих различные конструкции CAR. мРНК CAR получают, применяя трансфекции с использованием мРНК-полимеразы Т7, с использованием технологии Cytopulse, путем применения двух импульсов по 0,1 мс при 3000 В/см с последующими 4 импульсами по 0,2 мс при 325 В/см в кюветах с расстоянием между электродами 0,4 см в конечном объеме 200 мкл буфера Т для цитопорации («Cytoporation buffer Т») (устройство ВТХ Harvard). Клетки немедленно разводят в среде X-Vivo™-15 (фирма Lonza) и инкубируют при 37°С в атмосфере с 5% СО2. IL-2 добавляют через 2 ч после электропорации в концентрации 20 нг/мл.
Анализ дегрануляции (мобилизация CD107a)
Т-клетки инкубируют в 96-луночных планшетах (40000 клеток/лунку) вместе с равным количеством клеток, экспрессирующих различные уровни белка CD123. Совместные культуры поддерживают в конечном объеме 100 мкл среды X-Vivo™-15 (фирма Lonza) в течение 6 ч при 37°С в атмосфере с 5% СО2. Окрашивание CD107a осуществляют в процессе стимуляции клеток, добавляя флуоресцентное антитело к CD107a в начале совместного культивирования, вместе с антителом к CD49d в концентрации 1 мкг/мл, антителом к CD28 в концентрации 1 мкг/мл, и 1-кратным раствором монензина. После периода инкубации, составляющего 6 ч, клетки окрашивают фиксирующим витальным красителем и конъюгированным с флуорохромом антителом к CD8 и анализируют с помощью проточной цитометрии. Дегранулирующую активность определяют в виде % CD8+/CD107a+-клеток и на основе определения средней интенсивности сигнала флуоресценции (MFI) для окрашивания CD107a в популяции CD8+-клеток. Анализы дегрануляции осуществляют через 24 ч после трансфекции мРНК.
Анализ высвобождения IFN гамма
Т-клетки инкубируют в 96-луночных планшетах (40000 клеток/лунку) вместе с клеточными линиями, экспрессирующими различные уровни белка CD123. Совместные культуры поддерживают в конечном объеме 100 мкл среды X-Vivo™-15 (фирма Lonza) в течение 24 ч при 37°С в атмосфере с 5% CO2. После указанного периода инкубации планшеты центрифугируют при 1500 об/мин в течение 5 мин и супернатанты переносят в новый планшет. Обнаружение IFN гамма в супернатантах клеточных культур осуществляют с помощью ELISA-анализа. Анализы высвобождения IFN гамма осуществляют в начале совместного культивирования клеток через 24 ч после трансфекции мРНК.
Анализ цитотоксичности
Т-клетки инкубируют в 96-луночных планшетах (100000 клеток/лунку) вместе с 10000 клеток-мишеней (экспрессирующих CD123) и 10000 контрольных (CD123neg) клеток в одной и той же лунке. Клетки-мишени и контрольные клетки метят флуоресцентными внутриклеточными красителями (CFSE или Cell Trace Violet) перед их совместным культивированием с CAR+-Т-клетками. Совместные культуры инкубируют в течение 4 ч при 37°С в атмосфере с 5% СО2. После указанного периода инкубации клетки метят фиксирующим витальным красителем и анализируют с помощью проточной цитометрии. Определяют жизнеспособность каждой клеточной популяции (клетки-мишени или контрольные CD123neg-клетки) и рассчитывают % удельного клеточного лизиса. Анализы цитотоксичности осуществляют через 48 ч после трансфекции мРНК.
Трансдукция Т-клеток
Трансдукцию Т-клеток рекомбинантными лентивирусными векторами, экспрссирующими CAR, осуществляют через 3 дня после очистки/активации Т-клеток. Обнаружение CAR на поверхности Т-клеток осуществляют, используя рекомбинантный белок, который состоит из белка внеклеточного домена человеческого белка CD123, слитого с Fc-фрагментом мышиного IgG1. Связывание указанного белка с молекулой CAR определяют с помощью конъюгированного с флуорохромом вторичного антитела, мишенью которого является белок мышиного Fc-фрагмента, и анализируют с помощью проточной цитомерии.
Мышиная модель для оценки противоопухолевого действия
Мышам с иммунодефицитом линии NOG инъецируют внутривенно (iv) клетки, экспрессирующие CD123_MOLM13-люциферазу, в качестве мышиной модели ксенотрансплантата AML. Необязательно мышей подвергают противоопухолевой обработке. Затем мышам инъецируют iv (например, через 2 или 7 дней после инъекции линии опухолевых клеток) CAR+-Т-клетки в тестируемых различных дозах или Т-клетки, не трансдуированные несущим CAR лентивирусным вектором. Биолюминесцентые сигналы определяют в день инъекции Т-клеток (D0), в D7, 14, 21, 28 и 40 после инъекции Т-клеток, для отслеживания развития опухолей у различных животных. Примеры
Пример 1: Пролиферация клеток с инактивированным TCRaльфa, экспрессирующих CD123-CAR
Конструировали и получали гетеродимерную TALE-нуклеазу, нацеленную на две последовательности длиной 17 пар оснований (которые обозначали как полумишени), разделенные состоящим из 15 пар оснований спейсером в гене константной области альфа-цепи Т-клеточного рецептора (TRAC). Каждая из полумишеней распознавалась повторами половин TALE-нуклеаз, представленными в таблице 11.

Каждую конструкцию TALE-нуклеазы субклонировали с использованием расщепления рестриктазами в экспрессионном векторе млекопитающих под контролем промотора Т7. мРНК, кодирующую TALE-нуклеазу, которая расщепляла геномную последовательность TRAC, синтезировали с использованием плазмиды, несущей кодирующую последовательность, расположенную в прямом направлении относительно промотора Т7.
Очищенные Т-клетки, предварительно активированные в течение 72 ч покрытыми антителом к CD3/CD28 гранулами, трансфектировали каждой из 2 мРНК, кодирующих обе половины TRAC_T01 TALE-нуклеаз. Через 48 ч после трансфекции различные группы Т-клеток из одного и того же донора соответственно трансдуцировали лентивирусным вектором, кодирующим один из ранее описанных CD123 CAR (SEQ ID NO: 23-48). Через 2 для после трансдукции CD3NEG-клетки очищали с использованием покрытых антителом к CD3 магнитных гранул и через 5 дней после трансдукции клетки реактивировали растворимым антителом к CD28 (5 мкг/мл).
Мониторинг клеточной пролиферации осуществляли в течение периода времени вплоть до 30 дней после реактивации, подсчитывая количество клеток 2 раза в неделю. Обнаружено увеличение пролиферации клеток с инактивированным TCR альфа, экспрессирующих CD123 CAR, прежде всего в том случае, когда их реактивировали антителом к CD28, по сравнению с нетрансдуцированными клетками.
Для изучения вопроса о том, находятся ли человеческие Т-клетки, экспрессирующие CD123 CAR, в активированном состоянии, анализировали экспрессию маркера активации CD25 с помощью FACS через 7 дней после трансдукции. Очищенные клетки, трансдуцированные лентивирусным вектором, кодирующим CD123 CAR, экспрессировали значительно в большем количестве CD25 на своей поверхности, чем нетрансдуцированные клетки. Повышенный уровень экспрессии CD25 обнаружен как в условиях после реактивации антителом к CD28, так и в условиях без реактивации.
Пример 2:
Конструирование CD123 CAR с использованием фрагментов различных антител к CD123
Культуры первичных Т-клеток
Т-клетки очищали из образцов лейкоцитарных пленок, полученных на фирме EFS (Etablissement Francais du Sang, Париж, Франция), используя среду с градиентом плотности фиколла(среда Ficoll Paque PLUS/фирма GE Healthcare Life Sciences). Выделяли слой PBMC и Т-клетки очищали, используя поступающий в продажу набор для обогащения Т-клеток (фирма Stem Cell Technologies). Очищенные Т-клетки активировали в среде X-Vivo™-15 (фирма Lonza), дополненной человеческим IL-2 в концентрации 20 нг/мл (фирма Miltenyi Biotech), человеческой сывороткой в концентрации 5% (фирма Sera Laboratories) и гранулами Dynabeads® с активатором человеческих Т-клеток CD3/CD28 при соотношении гранулы: клетки 1:1 (фирма Life Technologies). После активации клетки выращивали и поддерживали в среде X-Vivo™-15 (фирма Lonza), дополненной человеческим IL-2 в концентрации 20 нг/мл (фирма Miltenyi Biotech) и человеческой сывороткой в концентрации 5% (фирма Sera Laboratories).
Трансфекция мРНК CAR
Трансфекции осуществляли в день 4 или день 11 после очистки и активации Т-клеток. 5 миллионов клеток трансфектировали 15 мкг мРНК, кодирующих различные конструкции CAR. мРНК CAR получали, применяя набор mMESSAGE mMACHINE Т7 (фирма Life Technologies) и очищали, используя вращающиеся колонки RNeasy Mini (фирма Qiagen). Трансфекции осуществляли, используя технологию Cytopulse, применяя два импульса по 0,1 мс при 3000 В/см с последующими 4 импульсами по 0,2 мс при 325 В/см в кюветах с расстоянием между электродами 0,4 см в конечном объеме 200 мкл буфера Т для цитопорации («Cytoporation buffer Т») (устройство ВТХ Harvard). Клетки немедленно разводили в среде X-Vivo™-15 (фирма Lonza) и инкубировали при 37°С в атмосфере с 5% СО2. IL-2 (фирма Miltenyi Biotec) добавляли через 2 ч после электропорации в концентрации 20 нг/мл.
Анализ дегрануляции (мобилизация CD107a)
Т-клетки инкубировали в 96-луночных планшетах (40000 клеток/лунку) вместе с равным количеством клеток, экспрессирующих различные уровни белка CD123. Совместные культуры поддерживали в конечном объеме 100 мкл среды X-Vivo™-15 (фирма Lonza) в течение 6 ч при 37°С в атмосфере с 5% СО2. Окрашивание CD107a осуществляли в процессе стимуляции клеток, добавляя флуоресцентное антитело к CD107a (конъюгированное с АРС, фирма Miltenyi Biotec) в начале совместного культивирования, вместе с антителом к CD49d (фирма BD Pharmingen) в концентрации 1 мкг/мл, антителом к CD28 (фирма Miltenyi Biotec) в концентрации 1 мкг/мл, и 1 -кратным раствором монензина (фирма eBioscience). После периода инкубации, составляющего 6 ч, клетки окрашивали фиксирующим витальным красителем (eFluor 780, фирма eBioscience) и конъюгированным с флуорохромом антителом к CD8 (конъюгированное с РЕ, фирма Miltenyi Biotec) и анализировали с помощью проточной цитометрии. Дегранулирующую активность определяли в виде % CD8+/CD107a+-клеток и на основе определения средней интенсивности сигнала флуоресцении (MFI) для окрашивания CD107a в популяции CD8+-клеток. Анализы дегрануляции осуществляли через 24 ч после трансфекции мРНК. Анализ высвобождения IFN гамма
Т-клетки инкубировали в 96-луночных планшетах (40000 клеток/лунку) вместе с клеточными линиями, экспрессирующими различные уровни белка CD123. Совместные культуры поддерживали в конечном объеме 100 мкл среды X-Vivo™-15 (фирма Lonza) в течение 24 ч при 37°С в атмосфере с 5% СО2. После указанного периода инкубации планшеты центрифугировали при 1500 об/мин в течение 5 мин и супернатанты переносили в новый планшет. Обнаружение IFN гамма в супернатантах клеточных культур осуществляли с помощью ELISA-анализа (набор Human IFN-gamma Quantikine ELISA, фирма R&D Systems). Анализы высвобождения IFN гамма осуществляли в начале совместного культивирования клеток через 24 ч после трансфекции мРНК.
Анализ цитотоксичности
Т-клетки инкубировали в 96-луночных планшетах (100000 клеток/лунку) вместе с 10000 клеток-мишеней (экспрессирующих CD123) и 10000 контрольных (CD123neg) клеток в одной и той же лунке. Клетки-мишени и контрольные клетки метили флуоресцентными внутриклеточными красителями (CFSE или Cell Trace Violet, фирма Life Technologies) перед их совместным культивированием с CAR+-Т-клетками. Совместные культуры инкубировали в течение 4 ч при 37°С в атмосфере с 5% СО2. После указанного периода инкубации клетки метили фиксирующим витальным красителем (eFluor 780, фирма eBioscience) и анализировали с помощью проточной цитометрии. Определяли жизнеспособность каждой клеточной популяции (клетки-мишени или контрольные CD123neg-клетки) и рассчитывали % удельного клеточного лизиса. Анализы цитотоксичности осуществляли через 48 ч после трансфекции мРНК.
Результаты
Применяли 6 различных scFv из 7G3, 32716, Klon43, 12F1, 26292 и 01d4 для создания химерных антигенных рецепторов (CAR) и для их скрининга в отношении дегранулирующей активности в CD123+-клетках.
Конструировали конструкции с различной архитектурой (фиг. 2 и фиг. 3) и определяли их активность после кратковременной экспрессии в человеческих Т-клетках (фиг. 5, фиг. 6, фиг. 7 и фиг. 8).
Т-клетки очищали из образцов лимфоцитарных пленок и активировали с помощью покрытых CD3/CD28 гранул. Через 4 дня после активации клетки трансфектировали мРНК, кодирующими различные молекулы CAR (применяя электропорацию с использованием технологии PulseAgile) и оценивали дегранулирующую активность через 24 ч после трансфекции.
На фиг. 4 и фиг. 5 проиллюстрированы результаты изучения дегранулирующей активности 6 различных scFv с одной конкретной архитектурой (v3: шарнир CD8/трансмембранный домен CD8), когда CAR+-T-клетки совместно культивировали в течение 6 ч с экспрессирующими CD123 клетками (RPMI8226), или с клетками, которые не экспрессируют CD123 (K562). Белые прямоугольники соответствуют сигналам дегрануляции, которые обнаружены в Т-клетках, которые культивировали индивидуально, черные прямоугольники соответствуют сигналам, которые обнаружены, когда Т-клетки совместно культивировали с клетками RPMI8226, а серые прямоугольники соответствуют сигналам, которые обнаружены, когда Т-клетки совместно культивировали с клетками K562.
На фиг. 4 представлены данные о дегранулирующей активности в процентах (%) дегрануляции 6 различных scFv с одной конкретной архитектурой (v3: шарнир CD8/трансмембранный домен CD8), полученные при совместном культивировании CAR+-T-клеток в течение 6 ч с экспрессирующими CD123 клетками (RPMI8226) или с клетками, которые не экспрессируют CD123 (K562).
На фиг. 5 представлены данные о дегранулирующей активности (CD8/CD107a+-клетки), выраженные в виде средней интенсивности флуоресценции (MFI) CAR Т-клеток после совместного культивирования в течение 6 ч с CD123neg-клетками (K562) или клетками, экспрессирующими высокие или низкие уровни CD123 (RPMI8226 и KG1a соответственно). Результаты представляют собой средние значения по трем независимым экспериментам.
Неожиданно было установлено, что хотя 7G3 представляет собой антитело к CD123, обладающее сильной аффинностью и авидностью и эффективностью in vivo (Jin и др., Cell Stem Cell 5, 2009, сс.31-42), Т-клетки, экспрессирующие CD123 CAR, полученный из 7G3, не обладали активностью в указанных экспериментальных условиях.
Клетки, экспрессирующие 26292-, 32716-Klon43-CAR, обладали сильной активностью по сравнению с контролем-имитатором), при этом наиболее активными оказались клетки, экспрессирующие Klon43-CAR.
Важно отметить, что в то время как клетки, экспрессирующие 26292-CAR, и клетки, экспрессирующие 32716-CAR, обладали слабой активностью в отношении клеток, которые не экспрессируют CD123 (K562) (серые прямоугольники), активность Klon43 в отношении клеток, которые не экспрессируют CD123, оказалась сопоставимой с активностью контрольных Т-клеток.
Из сконструированных молекул CAR, проиллюстрированных на фиг. 2, восемь отбирали для дополнительной оценки активности (фиг. 6, фиг. 7 и фиг. 8).
Конструирование CD123 CAR с использованием анти-CD123 scFv-фрагментов антител, полученных из Klon43, 12F1, 32716 и 26292, и функциональный анализ
Для указанной цели выделяли Т-клетки из образцов лейкоцитарных пленок и активировали, применяя CD3/CD28-гранулы. Клетки кратковременно трансфектировали мРНК, которые кодируют различные кандидаты, в D11 после активации. Активность CAR оценивали, измеряя их дегранулирующую способность, высвобождение IFN-гамма и цитотоксическую активность при совместном культивировании с клетками, экспрессирующими или не экспрессирующими CD123.
На фиг. 6 представлены данные о дегранулирующей активности (CD8/CD107a+-клетки) CAR Т-клеток после совместного культивирования с клетками CD123neg (K562) или клетками, экспрессирующими высокие или низкие уровни CD123 (RPMI8226 и KG1a соответственно). Совместное культивирование начинали через 24 ч после электропорации мРНК CAR. Результаты представляют собой средние значения по трем независимым экспериментам.
На фиг. 7 представлены данные о количестве IFN гамма, высвободившегося из Т-клеток при совместном культивировании в течение 24 ч с клетками, экспрессирующими различные уровни CD123 (KG1a или RPMI8226), или с клетками, которые не экспрессируют CD123 (K562). Представлены также данные о высвобождении IFN гамма из Т-клеток, которые культивировали индивидуально в таких же условиях, в которых осуществляли совместное культивирование. Эксперименты осуществляли с использованием образцов из организмов трех независимых доноров и в настоящем описании представлены результаты, полученные для репрезентативного донора.
На фиг. 8 представлены данные об удельной цитолитической активности экспрессирующих CAR Т-клеток. Анализы осуществляли через 48 ч после трансфекции мРНК CAR. Т-клетки совместно культивировали с клетками K562+KG1a или K562+RPMI8226 в течение 4 ч. Определяли жизнеспособность клеток для каждой клеточной линии в конце периода совместного культивирования и рассчитывали процент удельного клеточного лизиса.
Все конструкции оказались активными, при этом по сравнению с контролем среди других CAR наиболее высокая активность обнаружена для Klon43 V3 CAR и 32716V3 CAR.
Трансдукция Т-клеток
Трансдукцию Т-клеток рекомбинантными лентивирусными векторами, экспрессирующими CAR, осуществляли через 3 дня после очистки/активации Т-клеток. Лентивирусные векторы получали на фирме Vectalys SA (Тулуза, Франция) путем трансфекции геномными и хелперными плазмидами клеток линии HEK-293. Трансдукции осуществляли, используя множественность заражения, составляющую 5, применяя 106 клеток на трансдукцию. Обнаружение CAR на поверхности Т-клеток осуществляли, используя рекомбинантный белок, который состоит из внеклеточного домена человеческого белка CD123, слитого с Fc-фрагментом мышиного IgG1 (который получали на фирме LakePharma). Связывание указанного белка с молекулой CAR определяли с помощью конъюгированного с РЕ вторичного антитела (фирма Jackson Immunoresearch), мишенью которого является белок мышиного Fc-фрагмента, и анализ осуществляли методом проточной цитометрии.
Затем отбирали два перспективных CAR, а именно CAR Klon43 V3 и CAR 32716V3, и клонировали в лентивирусном векторе, в котором CAR экспрессировали в виде слияния с BFP через пептид 2А и под контролем промотора EF1a. Схематическое изображение лентивирусного вектора представлено на верхней панели на фиг. 9. Т-клетки выделяли из образцов лейкоцитарных пленок, активировали с помощью CD3/CD28-гранул и трансдуцировали через 3 дня после активации с помощью лентивирусных векторов с MOI, составляющей 5.
Обнаружение CAR осуществляли, используя рекомбинантный белок, в котором внеклеточный домен человеческого белка CD123 был слит с Fc-фрагментом мышиного IgG1. Связывание CAR на клеточной поверхности с CD123-участком слитого белка определяли с помощью конъюгированного с РЕ анти-Fc антитела, и анализ осуществляли методом проточной цитометрии. На фиг. 9 представлены данные о % экспрессирующих CAR+- или ВРР+-T-клеток (по данным FACS-анализа) в день 8 или 10 после трансдукции образцов, полученных из двух различных доноров.
Оценки активности осуществляли между D10 и 12 после трансдукции: На фиг. 10 представлены данные о дегранулирующей активности в отношении различных линий трансдуцированных клеток. Клетки Дауди и K562 не экспрессируют CD123, а клетки KG1a, MOLM13 и RPMI8226 экспрессируют различные уровни CD123 (KG1a<MOLM13<RPMI8226). На верхней панели представлены % CD107a+-клеток (в популяции CD8+-клеток) для трех независимых доноров, а на нижней панели представлены данные об интенсивности окрашивания CD107a для репрезентативного донора. NTD обозначает нетрансдуцированные клетки.
И в этих анализах продемонстрировано, что активность (дегрануляция на фиг. 10 или лизис CD123+-клеток на фиг. 11) клеток, экспрессирующих анти-CD123 CAR, полученный из Klon43 V3, эквивалента активности 32716V3 (фиг. 10 и фиг. 11).
Наиболее неожиданным является тот факт, что клетки, экспрессирующие полученный из 32716V3 CAR, обладали более сильной фоновой активностью (активность в отношении клеток, которые не экспрессируют CD123, т.е. клетки DAUDI и K562), чем клетки, экспрессирующие полученный из Klon43 V3 CAR (фиг. 10 и фиг. 11).
Экспрессирующие Klon43 V3 CAR клетки обладали более высокой удельной активностью и небольшой, но существенно более высокой активностью, по сравнению с клетками, экспрессирующими полученный из 32716V3 CAR (фиг. 10, фиг. 11 и фиг. 12), в частности, в отношении клеток RPMI8226, которые экспрессируют более высокий уровень CD123 (см. фиг. 13 и фиг. 14).
На фиг. 11 представлены данные о количестве IFN гамма, высвободившегося после совместного культивирования в течение 24 ч Т-клеток, экспрессирующих CAR, с различными клеточными линиями.
На фиг. 12 представлены данные об удельной цитолитической активности экспрессирующих CAR Т-клеток. Т-клетки совместно культивировали с клетками Дауди+KG1a, Дауди+MOLM13 или Дayди+RPMI8226 в течение 4 ч. Жизнеспособность клеток каждой клеточной линии определяли в конце периода совместного культивирования и рассчитывали процент удельного клеточного лизиса. Результаты представляют собой данные, полученные по меньшей мере для двух независимых доноров.
Результаты свидетельствуют о том, что для Т-клеток, стабильно экспрессирующих CAR, Klon43-v3, характерна несколько более высокая активность по сравнению с клетками, экспрессирующими 32716-v3, во всех тестах по оценке активности. Кроме того, обнаружена фоновая активность в анализах по оценке дегрануляции и высвобождению IFN гамма, когда Т-клетки, экспрессирующие 32716-v3 CAR, культивировали индивидуально или в присутствии клеток, которые не экспрессируют CD123. Это не обнаружено для Т-клеток, экспрессирующих Klon43-v3 CAR. По этим причинам Klon43-v3 CAR отбирали для проведения экспериментов по оценке противоопухолевой активности in vivo на мышиной модели.
На фиг. 13 и 14 представлены данные о зависящей от дозы дегранулирующей активности каждого из применяемых CAR. 96-луночные планшеты сенсибилизировали взятым в различных дозах белком CD123-Fc (тем же, который применяли для обнаружения CAR+-T-клеток, см. примечание к фиг. 5) и клетки культивировали в течение 6 ч в этом планшете в присутствии флуоресцентного антитела к CD107a. Результаты представлены в виде дегранулирующей активности (% CD107a+-клеток (фиг. 13) и интенсивности сигнала CD107a (фиг. 14) в популяции CD8+-клеток соответственно).
Пример 3: Мышиная модель для оценки противоопухолевой активности
Самкам мышей с иммунодефицитом линии NOG инъецировали внутривенно (iv) клетки MOLM13, содержащие люциферазу, для создания мышиной модели с использованием ксенотрансплантата AML. Мышей линии NOG (NOD.Cg-PrkdcscidII2rgtm1Sug/JicTac) возрастом 6-8 недель получали от фирмы Taconic (Ри, Дания). Для создания клеточной линии MOLM13-Luc клетки MOLM13 (DSMZ АСС 554) трансдуцировали лентивирусом, кодирующим GFP (зеленый флуоресцентный белок) и люциферазу светляка (amsbio LVP438-PBS). GFP-позитивные клетки отбирали с помощью неомицина (каталожный номер 10131-027, фирма Gibco, Life Technologies, Сент-Обен, Франция). В качестве информации, клеточная линия MOLM13 была создана из периферической крови 20-летнего мужчины с острым миелоидным лейкозом AML FAB М5а на стадии рецидива в 1995 г. После миелодиспластических синдромов (MDS, рефрактерная анемия с избытком бластных клеток, RAEB).
Затем мышам инъецировали iv (либо через 2, либо через 7 дней после инъекции линии опухолевых клеток) в различных дозах CAR+-Т-клетки (Klon43-v3 CAR) или Т-клетки, не трансдуцированные экспрессирующим CAR лентивирусным вектором. Биолюминесцентные сигналы определяли в день инъекции Т-клеток (D0) или в D7, 14, 21, 28 и 40 после инъекции Т-клеток для мониторинга развития опухолей у различных животных.
Содержание животных и экспериментальные процедуры осуществляли на фирме Oncodesign (Дижон, Франция; http://www.oncodesign.com/) в соответствии с французскими и европейскими правилами и руководством NRC по содержанию и уходу и использованию лабораторных животных.
Результаты
На фиг. 15 представлены данные об активности in vivo Т-клеток, экспрессирующих Klon43-v3 CAR.
Мышам с иммунодефицитом линии NOG инъецировали клетки MOLM13, содержащие люциферазу, либо за 2, либо за 7 дней до инъекции нетрансдуцированных человеческих Т-клеток или взятых в различных дозах анти-CD123 CAR+-Т-клеток. Результаты выражены в виде биолюминесцентного сигнала, обнаруженного в различные моменты времени после инъекции Т-клеток (среднее значение для 4 мышей в каждой группе за исключением группы G12, в которой 1 из 4 мышей умерла между днями 21 и 28).
Результаты свидетельствуют о том, что объект настоящего изобретения можно применять против раковых CD123+-клеток для лечения человеческих раковых лейкозных СБ123+-клеток.
7G3-1 (SEQ ID NO: 1 + SEQ ID NO:23)

7G3-2 (SEP ID NO: 1 + SEQ ID NO: 24)

7G3-3 (SEQ ID NO: 1 + SEQ ID NO: 25)

7G3-4 (SEQ ID NO: 1 + SEQ ID NO: 26)

7G3-5 (SEQ ID NO: 1 + SEQ ID NO: 27)


7G3-6 (SEQ ID NO: 1 + SEQ ID NO: 28)

Old4-3 (SEQ ID NO: 1 + SEQ ID NO: 29)

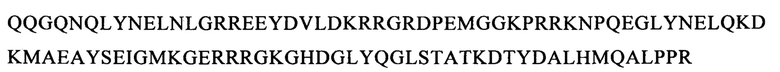
26292-1 (SEQ ID NO: 1 + SEQ ID NO: 30)

26292-2 (SEQ ID NO: 1 + SEQ ID NO: 31)

26292-3 (SEQ ID NO: 1 + SEQ ID NO: 32)

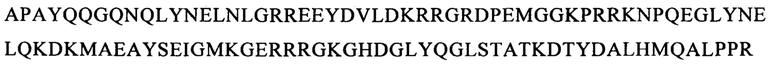
26292-4 (SEQ ID NO: 1 + SEQ ID NO: 33)

26292-5 (SEQ ID NO: 1 + SEQ ID NO: 34)

26292-6 (SEQ ID NO: 1 + SEQ ID NO: 35)


32716-1 (SEQ ID NO: 1 + SEQ ID NO: 36)

32716-2 (SEQ ID NO: 1 + SEQ ID NO: 37)

32716-3 (SEQ ID NO: 1 + SEQ ID NO: 38)

32716-4 (SEQ ID NO: 1 + SEQ ID NO: 39)

32716-5 (SEQ ID NO: 1 + SEQ ID NO: 40)


32716-6 (SEQ ID NO: 1 + SEQ ID NO: 41)

Klo43-1 (SEQ ID NO: 1 + SEQ ID NO: 42)

Klo43-2 (SEQ ID NO: 1 + SEQ ID NO: 43)

Klo43-3 (SEQ ID NO: 1 + SEQ ID NO: 44)

Klo43-4 (SEQ ID NO: 1 + SEQ ID NO: 45)

Klo43-5 (SEQ ID NO: 1 + SEQ ID NO: 46)

Klo43-6 (SEQ ID NO: 1 + SEQ ID NO: 47)

12F1-3 (SEQ ID NO: 1 + SEQ ID NO:48)

Ссылки
Arimondo P.В., С.J. Thomas и др., "Exploring the cellular activity of camptothecin-triple-helix-forming oligonucleotide conjugates", Mol Cell Biol 26(1), 2006, cc. 324-333.
Atkins J.F., N.M. Wills и др., "A case for "StopGo": reprogramming translation to augment codon meaning of GGN by promoting unconventional termination (Stop) after addition of glycine and then allowing continued translation (Go)", Rna 13(6), 2007, cc. 803-810.
Bardenheuer W., K. Lehmberg и др., "Resistance to cytarabine and gemcitabine and in vitro selection of transduced cells after retroviral expression of cytidine deaminase in human hematopoietic progenitor cells", Leukemia 19(12), 2005, cc. 2281-2288.
Betts M.R., J.M. Brenchley и др., "Sensitive and viable identification of antigen-specific CD8+ T cells by a flow cytometric assay for degranulation", J Immunol Methods 281(1-2). 2003, cc. 65-78.
Bierer В.E., G. Hollander и др., "Cyclosporin A and FK506: molecular mechanisms of immunosuppression and probes for transplantation biology", Curr Opin Immunol 5(5), 1993, cc. 763-773.
Boch J., H. Scholze и др., "Breaking the code of DNA binding specificity of TAL-type III effectors", Science 326(5959), 2009, cc. 1509-1512.
Brewin J., С. Mancao и др., "Generation of EBV-specific cytotoxic T cells that are resistant to calcineutin inhibitors for the treatment of posttransplantation lymphoproliferative disease", Blood 114(23). 2009, cc. 4792-4803.
Choulika A., A. Perrin и др., "Induction of homologous recombination in mammalian chromosomes by using the I-SceI system of Saccharomyces cerevisiae", Mol Cell Biol 15(4), 1995, cc. 1968-1973.
Christian M., T. Cermak и др., "Targeting DNA double-strand breaks with TAL effector nucleases", Genetics 186(2), 2010, cc. 757-761.
Cong L., F.A. Ran и др., "Multiplex genome engineering using CRISPR/Cas systems", Science 339(6121), 2013, cc. 819-823.
Critchlow S.E. и S.P. Jackson, "DNA end-joining: from yeast to man", Trends Biochem Sci 23(10), 1998, cc. 394-398.
Dasgupta A., D. McCarty и др., "Engineered drug-resistant immunocompetent cells enhance tumor cell killing during a chemotherapy challenge", Biochem Biophys Res Commun 391(1). 2011, cc. 170-175.
Deltcheva E., K. Chylinski и др., "CRISPR RNA maturation by trans-encoded small RNA and host factor RNase III", Nature 471(7340). 2011, cc. 602-607.
Deng D., C. Yan и др., "Structural basis for sequence-specific recognition of DNA by TAL effectors", Science 335(6069), 2012, cc. 720-723.
Donnelly M. и G. Elliott, "Nuclear localization and shuttling of herpes simplex virus tegument protein VP13/14", J Virol 75(6), 2001, cc. 2566-2574.
Doronina V.A., C. Wu и др., "Site-specific release of nascent chains from ribosomes at a sense codon", Mol Cell Biol 28(13), 2008, cc. 4227-4239.
Eisenschmidt K., T. Lanio и др., "Developing a programmed restriction endonuclease for highly specific DNA cleavage", Nucleic Acids Res 33(22), 2005, cc. 7039-7047.
Garneau J.E., M.E. Dupuis и др., "The CRISPR/Cas bacterial immune system cleaves bacteriophage and plasmid DNA", Nature 468(7320), 2010, cc. 67-71.
Gasiunas G., R. Barrangou и др., "Cas9-crRNA ribonucleoprotein complex mediates specific DNA cleavage for adaptive immunity in bacteria", Proc Natl Acad Sci USA 109(39), 2012, cc. E2579-2586.
Geissler R., H. Scholze и др., "Transcriptional activators of human genes with programmable DNA-specificity", PLoS One 6(5), 2011, c. e19509.
Hacke K., J.A. Treger и др., "Genetic modification of mouse bone marrow by lentiviral vector-mediated delivery of hypoxanthine-Guanine phosphoribosyltransferase short hairpin RNA confers chemoprotection against 6-thioguanine cytotoxicity", Transplant Proc 45(5), 2013, cc. 2040-2044.
Henderson D.J., I. Naya и др., "Comparison of the effects of FK-506, cyclosporin A and rapamycin on IL-2 production", Immunology 73(3), 1991, cc. 316-321.
Huang P., A. Xiao и др., "Heritable gene targeting in zebrafish using customized TALENs". Nat Biotechnol 29(8). 2011, cc. 699-700.
Jena В., G. Dotti и др., "Redirecting T-cell specificity by introducing a tumor-specific chimeric antigen receptor", Blood 116(7), 2010, cc. 1035-1044.
Jinek M., K. Chylinski и др., "A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity", Science 337(6096), 2012, cc. 816-821.
Jonnalagadda M., С.E. Brown и др., "Engineering human T cells for resistance to methotrexate and mycophenolate mofetil as an in vivo cell selection strategy", PLoS One 8(6), 2013, cc. e65519.
Kalish J.M. и P.M. Glazer, "Targeted genome modification via triple helix formation", Ann N Y Acad Sci 1058, 2005, cc. 151-161.
Kushman M.E., S.L. Kabler и др., "Expression of human glutathione S-transferase P1 confers resistance to benzo[a]pyrene or benzo[a]pyrene-7,8-dihydrodiol mutagenesis, macromolecular alkylation and formation of stable N2-Gua-BPDE adducts in stably transfected V79MZ cells co-expressing hCYP1A1", Carcinogenesis 28(1), 2007, cc. 207-214.
Li L., M. J. Piatek и др., "Rapid and highly efficient construction of TALE-based transcriptional regulators and nucleases for genome modification", Plant Mol Biol 78(4-5), 2012, cc. 407-416.
Li Т., S. Huang и др., "TAL nucleases (TALNs): hybrid proteins composed of TAL effectors and Fokl DNA-cleavage domain", Nucleic Acids Res 39(1), 2011, cc. 359-372.
Li Т., S. Huang, и др. "Modularly assembled designer TAL effector nucleases for targeted gene knockout and gene replacement in eukaryotes", Nucleic Acids Res 39(14), 2011, cc. 6315-5325.
Liu J., M.W. Albers и др., "Inhibition of T cell signaling by immunophilin-ligand complexes correlates with loss of calcineurin phosphatase activity", Biochemistry 31(16). 1992, cc. 3896-38901.
Ma J.L., E.M. Kim и др., "Yeast Mrel 1 and Radl proteins define a Ku-independent mechanism to repair double-strand breaks lacking overlapping end sequences", Mol Cell Biol 23(23), 2003, cc. 8820-8828.
Mahfouz M.M., L. Li и др., "Targeted transcriptional repression using a chimeric TALE-SRDX repressor protein", Plant Mol Biol 78(3), 2012, cc. 311-321.
Mahfouz M.M., L. Li и др., "De novo-engineered transcription activator-like effector (TALE) hybrid nuclease with novel DNA binding specificity creates double-strand breaks", Proc Natl Acad Sci USA 108(6), 2011, cc. 2623-2628.
Mak A.N., P. Bradley и др., "The crystal structure of TAL effector PthXol bound to its DNA target", Science 335(6069), 2012, cc. 716-719.
Mali P., L. Yang и др., "RNA-guided human genome engineering via Cas9", Science 339(6121), 2013, cc. 823-826.
Miller J.C, S. Tan и др., "A TALE nuclease architecture for efficient genome editing", Nat Biotechnol 29(2), 2011, cc. 143-148.
Morbitzer R., P. Romer и др., "Regulation of selected genome loci using de novo-engineered transcription activator-like effector (TALE)-type transcription factors", Proc Natl Acad Sci USA 107(50), 2011, cc. 21617-2122.
Moscou M.J. и A.J. Bogdanove, "A simple cipher governs DNA recognition by TAL effectors", Science 326(5959), 2009, c. 1501.
Mussolino C., R. Morbitzer и др., "A novel TALE nuclease scaffold enables high genome editing activity in combination with low toxicity", Nucleic Acids Res 39(21), 2011, cc. 9283-9293.
Nivens M.С, T. Felder и др., "Engineered resistance to camptothecin and antifolates by retroviral coexpression of tyrosyl DNA phosphodiesterase-I and thymidylate synthase", Cancer Chemother Pharmacol 53(2), 2004, cc. 107-115.
Paques F. и P. Duchateau, "Meganucleases and DNA double-strand break-induced recombination: perspectives for gene therapy", Curr Gene Ther 7(1), 2007, cc. 49-66.
Park T.S., S.A. Rosenberg т др., "Treating cancer with genetically engineered T cells", Trends Biotechnol 29(11), 2011, cc. 550-557.
Peipp M., D. Saul и др., "Efficient eukaryotic expression of fluorescent scFv fusion proteins directed against CD antigens for FACS applications", J Immunol Methods 285(2), 2004, cc. 265-280.
Perrin A., M. Buckle и др., "Asymmetrical recognition and activity of the I-SceI endonuclease on its site and on intron-exon junctions", Embo J 12(7), 1993, cc. 2939-2947.
Pingoud А. и G.H. Silva, "Precision genome surgery", Nat Biotechnol 25(7), 2007), cc. 743-744.
Porteus M.H. и D. Carroll, "Gene targeting using zinc finger nucleases", Nat Biotechnol 23(8), 2005, cc. 967-973.
Rouet P., F. Smih и др, "Introduction of double-strand breaks into the genome of mouse cells by expression of a rare-cutting endonuclease", Mol Cell Biol 14(12), 1994, cc. 8096-8106.
Sander J.D., L. Cade и др., "Targeted gene disruption in somatic zebrafish cells using engineered TALENs", Nat Biotechnol 29(8), 2011, cc. 697-698.
Sangiolo D., M. Lesnikova и др., "Lentiviral vector conferring resistance to mycophenolate mofetil and sensitivity to ganciclovir for in vivo T-cell selection", Gene Ther 14(21), 2007, cc. 1549-1554.
Schweitzer В.I., A.P. Dicker и др., "Dihydrofolate reductase as a therapeutic target", Faseb J 4(8), 1990, cc. 2441-2452.
Sorek R., С.M. Lawrence и др., "CRISPR-mediated Adaptive Immune Systems in Bacteria and Archaea", Annu Rev Biochem., 2013.
Stoddard B.L., "Homing endonuclease structure and function", Q Rev Biophys 38(1), 2005, cc. 49-95.
Sugimoto Y., S. Tsukahara и др., "Drug-selected co-expression of P-glycoprotein and gp91 in vivo from an MDR1-bicistronic retrovirus vector Ha-MDR-IRES-gp91", J Gene Med 5(5), 2003, cc. 366-376.
Takebe N., S.C. Zhao и др., "Generation of dual resistance to 4- hydroperoxycyclophosphamide and methotrexate by retroviral transfer of the human aldehyde dehydrogenase class 1 gene and a mutated dihydrofolate reductase gene", Mol Ther 3(1), 2001, cc. 88-96.
Tesson L., C. Usal и др., "Knockout rats generated by embryo microinjection of TALENs", Nat Biotechnol 29(8). 2011, cc. 695-696.
Weber E., R. Gruetzner и др., "Assembly of designer TAL effectors by Golden Gate cloning", PLoS One 6(5), 2011, c. e19722.
Yam P., M. Jensen и др., "Ex vivo selection and expansion of cells based on expression of a mutated inosine monophosphate dehydrogenase 2 after HIV vector transduction: effects on lymphocytes, monocytes, and CD34+ stem cells", Mol Ther 14(2), 2006, cc. 236-244.
Zhang F., L. Cong и др., "Efficient construction of sequence-specific TAL effectors for modulating mammalian transcription", Nat Biotechnol 29(2), 2011, cc. 149-53.
Zielske S.P., J.S. Reese и др., "In vivo selection of MGMT(P140K) lentivirus-transduced human NOD/SCID repopulating cells without pretransplant irradiation conditioning", J Clin Invest 112(10), 2003, cc. 1561-1570.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Cеллектис
<120> CD123-специфические химерные антигенные рецепторы
для иммунотерапии рака
<130> P81401654PCT00
<150> PA201470137
<151> 2014-03-19
<160> 77
<210> 1
<211> 20
<212> PRT
<213> искусственная последовательность
<220>
<223> сигнальный пептид
<400> 1
Met Glu Thr Asp Thr Leu Leu Leu Trp Val Leu Leu Leu Trp Val Pro
1 5 10 15
Gly Ser Thr Gly
20
<210> 2
<211> 21
<212> PRT
<213> искусственная последовательность
<220>
<223> сигнальный пептид
<400> 2
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro
20
<210> 3
<211> 16
<212> PRT
<213> Homo sapiens
<220>
<223> шарнир FcgRIIIa
<400> 3
Gly Leu Ala Val Ser Thr Ile Ser Ser Phe Phe Pro Pro Gly Tyr Gln
1 5 10 15
<210> 4
<211> 45
<212> PRT
<213> Homo sapiens
<220>
<223> Предшественник фрагмента альфа-цепи гликопротеина T-клеточной поверхности CD8, изофорама 1 (остатки 138-206)
<400> 4
Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala
1 5 10 15
Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly
20 25 30
Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp
35 40 45
<210> 5
<211> 231
<212> PRT
<213> Homo sapiens
<220>
<223> шарнир IgG1
<400> 5
Glu Pro Lys Ser Pro Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala
1 5 10 15
Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys
20 25 30
Asp Thr Leu Met Ile Ala Arg Thr Pro Glu Val Thr Cys Val Val Val
35 40 45
Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp
50 55 60
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr
65 70 75 80
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
85 90 95
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu
100 105 110
Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
115 120 125
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys
130 135 140
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
145 150 155 160
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
165 170 175
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
180 185 190
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
195 200 205
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
210 215 220
Leu Ser Leu Ser Pro Gly Lys
225 230
<210> 6
<211> 24
<212> PRT
<213> Homo sapiens
<220>
<223> трансмембранный домен CD8альфа
<400> 6
Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu
1 5 10 15
Ser Leu Val Ile Thr Leu Tyr Cys
20
<210> 7
<211> 27
<212> PRT
<213> Homo sapiens
<220>
<223> трансмембранный домен 4-1BB
<400> 7
Ile Ile Ser Phe Phe Leu Ala Leu Thr Ser Thr Ala Leu Leu Phe Leu
1 5 10 15
Leu Phe Phe Leu Thr Leu Arg Phe Ser Val Val
20 25
<210> 8
<211> 42
<212> PRT
<213> Homo sapiens
<220>
<223> фрагмент 4-1BB (остатки 214-255)
<400> 8
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
1 5 10 15
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
20 25 30
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu
35 40
<210> 9
<211> 112
<212> PRT
<213> Homo sapiens
<220>
<223> фрагмент дзнта-цепи гликопротеина T-клеточной поверхности CD3
<400> 9
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly
1 5 10 15
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
20 25 30
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
35 40 45
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
50 55 60
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
65 70 75 80
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
85 90 95
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
100 105 110
<210> 10
<211> 15
<212> PRT
<213> искусственная последовательность
<220>
<223> линкер
<400> 10
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 11
<211> 141
<212> PRT
<213> искусственная последовательность
<220>
<223> вариабельная область тяжелой цепи 7G3
<400> 11
Met Gly Trp Ser Trp Ile Phe Leu Phe Leu Val Ser Gly Thr Gly Gly
1 5 10 15
Val Leu Ser Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys
20 25 30
Pro Gly Ala Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe
35 40 45
Thr Asp Tyr Tyr Met Lys Trp Val Lys Gln Ser His Gly Lys Ser Leu
50 55 60
Glu Trp Ile Gly Asp Ile Ile Pro Ser Asn Gly Ala Thr Phe Tyr Asn
65 70 75 80
Gln Lys Phe Lys Gly Lys Ala Thr Leu Thr Val Asp Arg Ser Ser Ser
85 90 95
Thr Ala Tyr Met His Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val
100 105 110
Tyr Tyr Cys Thr Arg Ser His Leu Leu Arg Ala Ser Trp Phe Ala Tyr
115 120 125
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ala Ala Ser
130 135 140
<210> 12
<211> 134
<212> PRT
<213> искусственная последовательность
<220>
<223> вариабельная область легкой цепи 7G3
<400> 12
Met Glu Ser Gln Thr Gln Val Leu Met Ser Leu Leu Phe Trp Val Ser
1 5 10 15
Gly Thr Cys Gly Asp Phe Val Met Thr Gln Ser Pro Ser Ser Leu Thr
20 25 30
Val Thr Ala Gly Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser
35 40 45
Leu Leu Asn Ser Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Leu Gln
50 55 60
Lys Pro Gly Gln Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg
65 70 75 80
Glu Ser Gly Val Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp
85 90 95
Phe Thr Leu Thr Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr
100 105 110
Tyr Cys Gln Asn Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gly Gly Thr
115 120 125
Lys Leu Glu Ile Lys Arg
130
<210> 13
<211> 140
<212> PRT
<213> искусственная последовательность
<220>
<223> вариабельная область тяжелой цепи Old4
<400> 13
Trp Thr Trp Arg Phe Leu Phe Val Val Ala Ala Ala Thr Gly Val Gln
1 5 10 15
Ser Gln Val Gln Leu Leu Gln Ser Gly Ala Glu Val Lys Lys Pro Gly
20 25 30
Ser Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Thr
35 40 45
Tyr Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp
50 55 60
Met Gly Gly Ile Ile Pro Ile Phe Gly Ile Val Asn Tyr Ala Gln Lys
65 70 75 80
Phe Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala
85 90 95
Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr
100 105 110
Cys Ala Arg Gly Gly Gly Ser Gly Pro Asp Val Leu Asp Ile Trp Gly
115 120 125
Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr
130 135 140
<210> 14
<211> 132
<212> PRT
<213> искусственная последовательность
<220>
<223> вариабельная область легкой цепи Old4
<400> 14
Met Asp Met Arg Val Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp
1 5 10 15
Leu Pro Gly Ala Arg Cys Val Ile Trp Met Thr Gln Ser Pro Ser Leu
20 25 30
Leu Ser Ala Ser Thr Gly Asp Arg Val Thr Ile Ser Cys Arg Met Ser
35 40 45
Gln Gly Ile Arg Ser Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys
50 55 60
Ala Pro Glu Leu Leu Ile Tyr Ala Ala Ser Thr Leu Gln Ser Gly Val
65 70 75 80
Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
85 90 95
Ile Ser Ser Leu Gln Ser Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln
100 105 110
Tyr Tyr Ser Phe Pro Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile
115 120 125
Lys Arg Thr Val
130
<210> 15
<211> 115
<212> PRT
<213> искусственная последовательность
<220>
<223> вариабельная область тяжелой цепи 26292
<400> 15
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Lys Gln Arg Pro Asp Gln Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Ile Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Leu Thr
100 105 110
Val Ser Ser
115
<210> 16
<211> 107
<212> PRT
<213> искусственная последовательность
<220>
<223> вариабельная область легкой цепи 26292
<400> 16
Asp Val Gln Ile Thr Gln Ser Pro Ser Tyr Leu Ala Ala Ser Pro Gly
1 5 10 15
Glu Thr Ile Thr Ile Asn Cys Arg Ala Ser Lys Ser Ile Ser Lys Asp
20 25 30
Leu Ala Trp Tyr Gln Glu Lys Pro Gly Lys Thr Asn Lys Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Ile Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Glu Pro
65 70 75 80
Glu Asp Phe Ala Met Tyr Tyr Cys Gln Gln His Asn Lys Tyr Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105
<210> 17
<211> 118
<212> PRT
<213> искусственная последовательность
<220>
<223> вариабельная область тяжелой цепи 32716
<400> 17
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Asn Tyr
20 25 30
Gly Met Asn Trp Val Lys Gln Ala Pro Gly Lys Ser Phe Lys Trp Met
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Ser Thr Tyr Ser Ala Asp Phe
50 55 60
Lys Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu His Ile Asn Asp Leu Lys Asn Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Arg Ser Gly Gly Tyr Asp Pro Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser
115
<210> 18
<211> 111
<212> PRT
<213> искусственная последовательность
<220>
<223> вариабельная область легкой цепи 32716
<400> 18
Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu Ser Val Asp Asn Tyr
20 25 30
Gly Asn Thr Phe Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu Ser Gly Ile Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe Thr Leu Thr Ile Asn
65 70 75 80
Pro Val Glu Ala Asp Asp Val Ala Thr Tyr Tyr Cys Gln Gln Ser Asn
85 90 95
Glu Asp Pro Pro Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys
100 105 110
<210> 19
<211> 113
<212> PRT
<213> искусственная последовательность
<220>
<223> вариабельная область легкой цепи Klon43
<400> 19
Met Ala Asp Tyr Lys Asp Ile Val Met Thr Gln Ser His Lys Phe Met
1 5 10 15
Ser Thr Ser Val Gly Asp Arg Val Asn Ile Thr Cys Lys Ala Ser Gln
20 25 30
Asn Val Asp Ser Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser
35 40 45
Pro Lys Ala Leu Ile Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro
50 55 60
Asp Arg Phe Thr Gly Arg Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
65 70 75 80
Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Gln Tyr
85 90 95
Tyr Ser Thr Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg
<210> 20
<211> 127
<212> PRT
<213> искусственная последовательность
<220>
<223> вариабельная область тяжелой цепи Klon43
<400> 20
Glu Val Lys Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Ser Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Ser Trp Val Arg Gln Pro Pro Gly Lys Ala Leu Glu Trp Leu
35 40 45
Ala Leu Ile Arg Ser Lys Ala Asp Gly Tyr Thr Thr Glu Tyr Ser Ala
50 55 60
Ser Val Lys Gly Arg Phe Thr Leu Ser Arg Asp Asp Ser Gln Ser Ile
65 70 75 80
Leu Tyr Leu Gln Met Asn Ala Leu Arg Pro Glu Asp Ser Ala Thr Tyr
85 90 95
Tyr Cys Ala Arg Asp Ala Ala Tyr Tyr Ser Tyr Tyr Ser Pro Glu Gly
100 105 110
Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser
115 120 125
<210> 21
<211> 119
<212> PRT
<213> искусственная последовательность
<220>
<223> вариабельная область тяжелой цепи 12F1
<400> 21
Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln Ser
1 5 10 15
Leu Ser Leu Thr Cys Ser Val Thr Asp Tyr Ser Ile Thr Ser Gly Tyr
20 25 30
Tyr Trp Asn Trp Ile Arg Gln Phe Pro Gly Asn Lys Leu Glu Trp Met
35 40 45
Gly Tyr Ile Ser Tyr Asp Gly Ser Asn Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Asn Arg Ile Ser Ile Thr Arg Asp Thr Ser Lys Asn Gln Phe Phe Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Thr Glu Asp Thr Ala Thr Tyr Tyr Cys Ser
85 90 95
Arg Gly Glu Gly Phe Tyr Phe Asp Ser Trp Gly Gln Gly Thr Thr Leu
100 105 110
Thr Val Ser Ser Ala Arg Ser
115
<210> 22
<211> 113
<212> PRT
<213> искусственная последовательность
<220>
<223> вариабельная область легкой цепи 12F1
<400> 22
Asp Ile Met Met Ser Gln Ser Pro Ser Ser Leu Ala Val Ser Val Gly
1 5 10 15
Glu Lys Phe Thr Met Thr Cys Lys Ser Ser Gln Ser Leu Phe Phe Gly
20 25 30
Ser Thr Gln Lys Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln
35 40 45
Ser Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
50 55 60
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Ala
65 70 75 80
Ile Ser Ser Val Met Pro Glu Asp Leu Ala Val Tyr Tyr Cys Gln Gln
85 90 95
Tyr Tyr Asn Tyr Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
100 105 110
Lys
<210> 23
<211> 484
<212> PRT
<213> искусственная последовательность
<220>
<223> полипептидная последовательность CAR 7GR-1
<400> 23
Met Gly Trp Ser Trp Ile Phe Leu Phe Leu Val Ser Gly Thr Gly Gly
1 5 10 15
Val Leu Ser Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys
20 25 30
Pro Gly Ala Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe
35 40 45
Thr Asp Tyr Tyr Met Lys Trp Val Lys Gln Ser His Gly Lys Ser Leu
50 55 60
Glu Trp Ile Gly Asp Ile Ile Pro Ser Asn Gly Ala Thr Phe Tyr Asn
65 70 75 80
Gln Lys Phe Lys Gly Lys Ala Thr Leu Thr Val Asp Arg Ser Ser Ser
85 90 95
Thr Ala Tyr Met His Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val
100 105 110
Tyr Tyr Cys Thr Arg Ser His Leu Leu Arg Ala Ser Trp Phe Ala Tyr
115 120 125
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ala Ala Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Met Glu Ser Gln
145 150 155 160
Thr Gln Val Leu Met Ser Leu Leu Phe Trp Val Ser Gly Thr Cys Gly
165 170 175
Asp Phe Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
180 185 190
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
195 200 205
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Leu Gln Lys Pro Gly Gln
210 215 220
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
225 230 235 240
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
245 250 255
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
260 265 270
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
275 280 285
Lys Arg Gly Leu Ala Val Ser Thr Ile Ser Ser Phe Phe Pro Pro Gly
290 295 300
Tyr Gln Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu
305 310 315 320
Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys
325 330 335
Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr
340 345 350
Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly
355 360 365
Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala
370 375 380
Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg
385 390 395 400
Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu
405 410 415
Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn
420 425 430
Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met
435 440 445
Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly
450 455 460
Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala
465 470 475 480
Leu Pro Pro Arg
<210> 24
<211> 487
<212> PRT
<213> искусственная последовательность
<220>
<223> полипептидная последовательность CAR 7GR-2
<400> 24
Met Gly Trp Ser Trp Ile Phe Leu Phe Leu Val Ser Gly Thr Gly Gly
1 5 10 15
Val Leu Ser Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys
20 25 30
Pro Gly Ala Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe
35 40 45
Thr Asp Tyr Tyr Met Lys Trp Val Lys Gln Ser His Gly Lys Ser Leu
50 55 60
Glu Trp Ile Gly Asp Ile Ile Pro Ser Asn Gly Ala Thr Phe Tyr Asn
65 70 75 80
Gln Lys Phe Lys Gly Lys Ala Thr Leu Thr Val Asp Arg Ser Ser Ser
85 90 95
Thr Ala Tyr Met His Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val
100 105 110
Tyr Tyr Cys Thr Arg Ser His Leu Leu Arg Ala Ser Trp Phe Ala Tyr
115 120 125
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ala Ala Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Met Glu Ser Gln
145 150 155 160
Thr Gln Val Leu Met Ser Leu Leu Phe Trp Val Ser Gly Thr Cys Gly
165 170 175
Asp Phe Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
180 185 190
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
195 200 205
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Leu Gln Lys Pro Gly Gln
210 215 220
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
225 230 235 240
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
245 250 255
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
260 265 270
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
275 280 285
Lys Arg Gly Leu Ala Val Ser Thr Ile Ser Ser Phe Phe Pro Pro Gly
290 295 300
Tyr Gln Ile Ile Ser Phe Phe Leu Ala Leu Thr Ser Thr Ala Leu Leu
305 310 315 320
Phe Leu Leu Phe Phe Leu Thr Leu Arg Phe Ser Val Val Lys Arg Gly
325 330 335
Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val
340 345 350
Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu
355 360 365
Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp
370 375 380
Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn
385 390 395 400
Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg
405 410 415
Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly
420 425 430
Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu
435 440 445
Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu
450 455 460
Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His
465 470 475 480
Met Gln Ala Leu Pro Pro Arg
485
<210> 25
<211> 513
<212> PRT
<213> искусственная последовательность
<220>
<223> полипептидная последовательность CAR 7GR-3
<400> 25
Met Gly Trp Ser Trp Ile Phe Leu Phe Leu Val Ser Gly Thr Gly Gly
1 5 10 15
Val Leu Ser Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys
20 25 30
Pro Gly Ala Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe
35 40 45
Thr Asp Tyr Tyr Met Lys Trp Val Lys Gln Ser His Gly Lys Ser Leu
50 55 60
Glu Trp Ile Gly Asp Ile Ile Pro Ser Asn Gly Ala Thr Phe Tyr Asn
65 70 75 80
Gln Lys Phe Lys Gly Lys Ala Thr Leu Thr Val Asp Arg Ser Ser Ser
85 90 95
Thr Ala Tyr Met His Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val
100 105 110
Tyr Tyr Cys Thr Arg Ser His Leu Leu Arg Ala Ser Trp Phe Ala Tyr
115 120 125
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ala Ala Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Met Glu Ser Gln
145 150 155 160
Thr Gln Val Leu Met Ser Leu Leu Phe Trp Val Ser Gly Thr Cys Gly
165 170 175
Asp Phe Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
180 185 190
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
195 200 205
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Leu Gln Lys Pro Gly Gln
210 215 220
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
225 230 235 240
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
245 250 255
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
260 265 270
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
275 280 285
Lys Arg Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr
290 295 300
Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala
305 310 315 320
Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile
325 330 335
Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser
340 345 350
Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr
355 360 365
Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu
370 375 380
Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu
385 390 395 400
Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln
405 410 415
Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu
420 425 430
Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly
435 440 445
Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln
450 455 460
Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu
465 470 475 480
Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr
485 490 495
Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro
500 505 510
Arg
<210> 26
<211> 516
<212> PRT
<213> искусственная последовательность
<220>
<223> полипептидная последовательность CAR 7GR-4
<400> 26
Met Gly Trp Ser Trp Ile Phe Leu Phe Leu Val Ser Gly Thr Gly Gly
1 5 10 15
Val Leu Ser Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys
20 25 30
Pro Gly Ala Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe
35 40 45
Thr Asp Tyr Tyr Met Lys Trp Val Lys Gln Ser His Gly Lys Ser Leu
50 55 60
Glu Trp Ile Gly Asp Ile Ile Pro Ser Asn Gly Ala Thr Phe Tyr Asn
65 70 75 80
Gln Lys Phe Lys Gly Lys Ala Thr Leu Thr Val Asp Arg Ser Ser Ser
85 90 95
Thr Ala Tyr Met His Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val
100 105 110
Tyr Tyr Cys Thr Arg Ser His Leu Leu Arg Ala Ser Trp Phe Ala Tyr
115 120 125
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ala Ala Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Met Glu Ser Gln
145 150 155 160
Thr Gln Val Leu Met Ser Leu Leu Phe Trp Val Ser Gly Thr Cys Gly
165 170 175
Asp Phe Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
180 185 190
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
195 200 205
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Leu Gln Lys Pro Gly Gln
210 215 220
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
225 230 235 240
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
245 250 255
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
260 265 270
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
275 280 285
Lys Arg Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr
290 295 300
Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala
305 310 315 320
Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile
325 330 335
Ile Ser Phe Phe Leu Ala Leu Thr Ser Thr Ala Leu Leu Phe Leu Leu
340 345 350
Phe Phe Leu Thr Leu Arg Phe Ser Val Val Lys Arg Gly Arg Lys Lys
355 360 365
Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr
370 375 380
Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly
385 390 395 400
Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala
405 410 415
Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg
420 425 430
Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu
435 440 445
Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn
450 455 460
Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met
465 470 475 480
Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly
485 490 495
Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala
500 505 510
Leu Pro Pro Arg
515
<210> 27
<211> 699
<212> PRT
<213> искусственная последовательность
<220>
<223> полипептидная последовательность CAR 7GR-5
<400> 27
Met Gly Trp Ser Trp Ile Phe Leu Phe Leu Val Ser Gly Thr Gly Gly
1 5 10 15
Val Leu Ser Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys
20 25 30
Pro Gly Ala Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe
35 40 45
Thr Asp Tyr Tyr Met Lys Trp Val Lys Gln Ser His Gly Lys Ser Leu
50 55 60
Glu Trp Ile Gly Asp Ile Ile Pro Ser Asn Gly Ala Thr Phe Tyr Asn
65 70 75 80
Gln Lys Phe Lys Gly Lys Ala Thr Leu Thr Val Asp Arg Ser Ser Ser
85 90 95
Thr Ala Tyr Met His Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val
100 105 110
Tyr Tyr Cys Thr Arg Ser His Leu Leu Arg Ala Ser Trp Phe Ala Tyr
115 120 125
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ala Ala Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Met Glu Ser Gln
145 150 155 160
Thr Gln Val Leu Met Ser Leu Leu Phe Trp Val Ser Gly Thr Cys Gly
165 170 175
Asp Phe Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
180 185 190
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
195 200 205
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Leu Gln Lys Pro Gly Gln
210 215 220
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
225 230 235 240
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
245 250 255
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
260 265 270
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
275 280 285
Lys Arg Glu Pro Lys Ser Pro Asp Lys Thr His Thr Cys Pro Pro Cys
290 295 300
Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
305 310 315 320
Pro Lys Asp Thr Leu Met Ile Ala Arg Thr Pro Glu Val Thr Cys Val
325 330 335
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
340 345 350
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
355 360 365
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
370 375 380
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
385 390 395 400
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
405 410 415
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu
420 425 430
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
435 440 445
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
450 455 460
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
465 470 475 480
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
485 490 495
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
500 505 510
Lys Ser Leu Ser Leu Ser Pro Gly Lys Ile Tyr Ile Trp Ala Pro Leu
515 520 525
Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr
530 535 540
Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe
545 550 555 560
Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg
565 570 575
Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser
580 585 590
Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr
595 600 605
Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys
610 615 620
Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn
625 630 635 640
Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu
645 650 655
Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly
660 665 670
His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr
675 680 685
Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
690 695
<210> 28
<211> 702
<212> PRT
<213> искусственная последовательность
<220>
<223> полипептидная последовательность CAR 7GR-6
<400> 28
Met Gly Trp Ser Trp Ile Phe Leu Phe Leu Val Ser Gly Thr Gly Gly
1 5 10 15
Val Leu Ser Glu Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys
20 25 30
Pro Gly Ala Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe
35 40 45
Thr Asp Tyr Tyr Met Lys Trp Val Lys Gln Ser His Gly Lys Ser Leu
50 55 60
Glu Trp Ile Gly Asp Ile Ile Pro Ser Asn Gly Ala Thr Phe Tyr Asn
65 70 75 80
Gln Lys Phe Lys Gly Lys Ala Thr Leu Thr Val Asp Arg Ser Ser Ser
85 90 95
Thr Ala Tyr Met His Leu Asn Ser Leu Thr Ser Glu Asp Ser Ala Val
100 105 110
Tyr Tyr Cys Thr Arg Ser His Leu Leu Arg Ala Ser Trp Phe Ala Tyr
115 120 125
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ala Ala Ser Gly Gly Gly
130 135 140
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Met Glu Ser Gln
145 150 155 160
Thr Gln Val Leu Met Ser Leu Leu Phe Trp Val Ser Gly Thr Cys Gly
165 170 175
Asp Phe Val Met Thr Gln Ser Pro Ser Ser Leu Thr Val Thr Ala Gly
180 185 190
Glu Lys Val Thr Met Ser Cys Lys Ser Ser Gln Ser Leu Leu Asn Ser
195 200 205
Gly Asn Gln Lys Asn Tyr Leu Thr Trp Tyr Leu Gln Lys Pro Gly Gln
210 215 220
Pro Pro Lys Leu Leu Ile Tyr Trp Ala Ser Thr Arg Glu Ser Gly Val
225 230 235 240
Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr
245 250 255
Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Asn
260 265 270
Asp Tyr Ser Tyr Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
275 280 285
Lys Arg Glu Pro Lys Ser Pro Asp Lys Thr His Thr Cys Pro Pro Cys
290 295 300
Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys
305 310 315 320
Pro Lys Asp Thr Leu Met Ile Ala Arg Thr Pro Glu Val Thr Cys Val
325 330 335
Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr
340 345 350
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
355 360 365
Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
370 375 380
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
385 390 395 400
Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
405 410 415
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu
420 425 430
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
435 440 445
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
450 455 460
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
465 470 475 480
Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val
485 490 495
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
500 505 510
Lys Ser Leu Ser Leu Ser Pro Gly Lys Ile Ile Ser Phe Phe Leu Ala
515 520 525
Leu Thr Ser Thr Ala Leu Leu Phe Leu Leu Phe Phe Leu Thr Leu Arg
530 535 540
Phe Ser Val Val Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys
545 550 555 560
Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys
565 570 575
Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val
580 585 590
Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn
595 600 605
Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val
610 615 620
Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg
625 630 635 640
Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys
645 650 655
Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg
660 665 670
Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys
675 680 685
Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
690 695 700
<210> 29
<211> 510
<212> PRT
<213> искусственная последовательность
<220>
<223> полипептидная последовательность CAR Old4-3
<400> 29
Trp Thr Trp Arg Phe Leu Phe Val Val Ala Ala Ala Thr Gly Val Gln
1 5 10 15
Ser Gln Val Gln Leu Leu Gln Ser Gly Ala Glu Val Lys Lys Pro Gly
20 25 30
Ser Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Thr
35 40 45
Tyr Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp
50 55 60
Met Gly Gly Ile Ile Pro Ile Phe Gly Ile Val Asn Tyr Ala Gln Lys
65 70 75 80
Phe Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala
85 90 95
Tyr Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr
100 105 110
Cys Ala Arg Gly Gly Gly Ser Gly Pro Asp Val Leu Asp Ile Trp Gly
115 120 125
Gln Gly Thr Met Val Thr Val Ser Ser Ala Ser Thr Gly Gly Gly Gly
130 135 140
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Met Asp Met Arg Val
145 150 155 160
Pro Ala Gln Leu Leu Gly Leu Leu Leu Leu Trp Leu Pro Gly Ala Arg
165 170 175
Cys Val Ile Trp Met Thr Gln Ser Pro Ser Leu Leu Ser Ala Ser Thr
180 185 190
Gly Asp Arg Val Thr Ile Ser Cys Arg Met Ser Gln Gly Ile Arg Ser
195 200 205
Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Glu Leu Leu
210 215 220
Ile Tyr Ala Ala Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser
225 230 235 240
Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln
245 250 255
Ser Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr Tyr Ser Phe Pro
260 265 270
Tyr Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys Arg Thr Val Thr
275 280 285
Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser
290 295 300
Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly
305 310 315 320
Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp
325 330 335
Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile
340 345 350
Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys
355 360 365
Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys
370 375 380
Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val
385 390 395 400
Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn
405 410 415
Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val
420 425 430
Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg
435 440 445
Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys
450 455 460
Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg
465 470 475 480
Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys
485 490 495
Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
500 505 510
<210> 30
<211> 431
<212> PRT
<213> искусственная последовательность
<220>
<223> полипептидная последовательность CAR 26292-1
<400> 30
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Lys Gln Arg Pro Asp Gln Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Ile Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Leu Thr
100 105 110
Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Asp Val Gln Ile Thr Gln Ser Pro Ser Tyr Leu Ala Ala Ser
130 135 140
Pro Gly Glu Thr Ile Thr Ile Asn Cys Arg Ala Ser Lys Ser Ile Ser
145 150 155 160
Lys Asp Leu Ala Trp Tyr Gln Glu Lys Pro Gly Lys Thr Asn Lys Leu
165 170 175
Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Ile Pro Ser Arg Phe
180 185 190
Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu
195 200 205
Glu Pro Glu Asp Phe Ala Met Tyr Tyr Cys Gln Gln His Asn Lys Tyr
210 215 220
Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Gly Leu Ala
225 230 235 240
Val Ser Thr Ile Ser Ser Phe Phe Pro Pro Gly Tyr Gln Ile Tyr Ile
245 250 255
Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val
260 265 270
Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe
275 280 285
Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly
290 295 300
Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg
305 310 315 320
Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln
325 330 335
Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp
340 345 350
Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro
355 360 365
Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp
370 375 380
Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg
385 390 395 400
Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr
405 410 415
Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
420 425 430
<210> 31
<211> 434
<212> PRT
<213> искусственная последовательность
<220>
<223> полипептидная последовательность CAR 26292-2
<400> 31
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Lys Gln Arg Pro Asp Gln Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Ile Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Leu Thr
100 105 110
Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Asp Val Gln Ile Thr Gln Ser Pro Ser Tyr Leu Ala Ala Ser
130 135 140
Pro Gly Glu Thr Ile Thr Ile Asn Cys Arg Ala Ser Lys Ser Ile Ser
145 150 155 160
Lys Asp Leu Ala Trp Tyr Gln Glu Lys Pro Gly Lys Thr Asn Lys Leu
165 170 175
Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Ile Pro Ser Arg Phe
180 185 190
Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu
195 200 205
Glu Pro Glu Asp Phe Ala Met Tyr Tyr Cys Gln Gln His Asn Lys Tyr
210 215 220
Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Gly Leu Ala
225 230 235 240
Val Ser Thr Ile Ser Ser Phe Phe Pro Pro Gly Tyr Gln Ile Ile Ser
245 250 255
Phe Phe Leu Ala Leu Thr Ser Thr Ala Leu Leu Phe Leu Leu Phe Phe
260 265 270
Leu Thr Leu Arg Phe Ser Val Val Lys Arg Gly Arg Lys Lys Leu Leu
275 280 285
Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu
290 295 300
Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys
305 310 315 320
Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln
325 330 335
Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu
340 345 350
Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly
355 360 365
Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu
370 375 380
Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly
385 390 395 400
Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser
405 410 415
Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro
420 425 430
Pro Arg
<210> 32
<211> 460
<212> PRT
<213> искусственная последовательность
<220>
<223> полипептидная последовательность CAR 26292-3
<400> 32
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Lys Gln Arg Pro Asp Gln Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Ile Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Leu Thr
100 105 110
Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Asp Val Gln Ile Thr Gln Ser Pro Ser Tyr Leu Ala Ala Ser
130 135 140
Pro Gly Glu Thr Ile Thr Ile Asn Cys Arg Ala Ser Lys Ser Ile Ser
145 150 155 160
Lys Asp Leu Ala Trp Tyr Gln Glu Lys Pro Gly Lys Thr Asn Lys Leu
165 170 175
Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Ile Pro Ser Arg Phe
180 185 190
Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu
195 200 205
Glu Pro Glu Asp Phe Ala Met Tyr Tyr Cys Gln Gln His Asn Lys Tyr
210 215 220
Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Thr Thr Thr
225 230 235 240
Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro
245 250 255
Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val
260 265 270
His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro
275 280 285
Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu
290 295 300
Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro
305 310 315 320
Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys
325 330 335
Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe
340 345 350
Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu
355 360 365
Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp
370 375 380
Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys
385 390 395 400
Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala
405 410 415
Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys
420 425 430
Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr
435 440 445
Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
450 455 460
<210> 33
<211> 463
<212> PRT
<213> искусственная последовательность
<220>
<223> полипептидная последовательность CAR 26292-4
<400> 33
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Lys Gln Arg Pro Asp Gln Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Ile Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Leu Thr
100 105 110
Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Asp Val Gln Ile Thr Gln Ser Pro Ser Tyr Leu Ala Ala Ser
130 135 140
Pro Gly Glu Thr Ile Thr Ile Asn Cys Arg Ala Ser Lys Ser Ile Ser
145 150 155 160
Lys Asp Leu Ala Trp Tyr Gln Glu Lys Pro Gly Lys Thr Asn Lys Leu
165 170 175
Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Ile Pro Ser Arg Phe
180 185 190
Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu
195 200 205
Glu Pro Glu Asp Phe Ala Met Tyr Tyr Cys Gln Gln His Asn Lys Tyr
210 215 220
Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Thr Thr Thr
225 230 235 240
Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro
245 250 255
Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val
260 265 270
His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Ile Ser Phe Phe Leu
275 280 285
Ala Leu Thr Ser Thr Ala Leu Leu Phe Leu Leu Phe Phe Leu Thr Leu
290 295 300
Arg Phe Ser Val Val Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe
305 310 315 320
Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly
325 330 335
Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg
340 345 350
Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln
355 360 365
Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp
370 375 380
Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro
385 390 395 400
Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp
405 410 415
Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg
420 425 430
Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr
435 440 445
Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
450 455 460
<210> 34
<211> 646
<212> PRT
<213> искусственная последовательность
<220>
<223> полипептидная последовательность CAR 26292-5
<400> 34
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Lys Gln Arg Pro Asp Gln Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Ile Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Leu Thr
100 105 110
Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Asp Val Gln Ile Thr Gln Ser Pro Ser Tyr Leu Ala Ala Ser
130 135 140
Pro Gly Glu Thr Ile Thr Ile Asn Cys Arg Ala Ser Lys Ser Ile Ser
145 150 155 160
Lys Asp Leu Ala Trp Tyr Gln Glu Lys Pro Gly Lys Thr Asn Lys Leu
165 170 175
Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Ile Pro Ser Arg Phe
180 185 190
Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu
195 200 205
Glu Pro Glu Asp Phe Ala Met Tyr Tyr Cys Gln Gln His Asn Lys Tyr
210 215 220
Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Glu Pro Lys
225 230 235 240
Ser Pro Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Pro Val
245 250 255
Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
260 265 270
Met Ile Ala Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
275 280 285
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
290 295 300
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr
305 310 315 320
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
325 330 335
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro
340 345 350
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
355 360 365
Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val
370 375 380
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
385 390 395 400
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
405 410 415
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr
420 425 430
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
435 440 445
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
450 455 460
Ser Pro Gly Lys Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
465 470 475 480
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
485 490 495
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
500 505 510
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
515 520 525
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
530 535 540
Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
545 550 555 560
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
565 570 575
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
580 585 590
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
595 600 605
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
610 615 620
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
625 630 635 640
Gln Ala Leu Pro Pro Arg
645
<210> 35
<211> 649
<212> PRT
<213> искусственная последовательность
<220>
<223> полипептидная последовательность CAR 26292-6
<400> 35
Gln Val Gln Leu Gln Gln Pro Gly Ala Glu Leu Val Arg Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Trp Met Asn Trp Val Lys Gln Arg Pro Asp Gln Gly Leu Glu Trp Ile
35 40 45
Gly Arg Ile Asp Pro Tyr Asp Ser Glu Thr His Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Lys Ala Ile Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Asn Trp Asp Asp Tyr Trp Gly Gln Gly Thr Thr Leu Thr
100 105 110
Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
115 120 125
Gly Ser Asp Val Gln Ile Thr Gln Ser Pro Ser Tyr Leu Ala Ala Ser
130 135 140
Pro Gly Glu Thr Ile Thr Ile Asn Cys Arg Ala Ser Lys Ser Ile Ser
145 150 155 160
Lys Asp Leu Ala Trp Tyr Gln Glu Lys Pro Gly Lys Thr Asn Lys Leu
165 170 175
Leu Ile Tyr Ser Gly Ser Thr Leu Gln Ser Gly Ile Pro Ser Arg Phe
180 185 190
Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu
195 200 205
Glu Pro Glu Asp Phe Ala Met Tyr Tyr Cys Gln Gln His Asn Lys Tyr
210 215 220
Pro Tyr Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Glu Pro Lys
225 230 235 240
Ser Pro Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Pro Val
245 250 255
Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
260 265 270
Met Ile Ala Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
275 280 285
His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu
290 295 300
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr
305 310 315 320
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
325 330 335
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro
340 345 350
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
355 360 365
Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val
370 375 380
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
385 390 395 400
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
405 410 415
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr
420 425 430
Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val
435 440 445
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
450 455 460
Ser Pro Gly Lys Ile Ile Ser Phe Phe Leu Ala Leu Thr Ser Thr Ala
465 470 475 480
Leu Leu Phe Leu Leu Phe Phe Leu Thr Leu Arg Phe Ser Val Val Lys
485 490 495
Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg
500 505 510
Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro
515 520 525
Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser
530 535 540
Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu
545 550 555 560
Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg
565 570 575
Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln
580 585 590
Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr
595 600 605
Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp
610 615 620
Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala
625 630 635 640
Leu His Met Gln Ala Leu Pro Pro Arg
645
<210> 36
<211> 438
<212> PRT
<213> искусственная последовательность
<220>
<223> полипептидная последовательность CAR 32716-1
<400> 36
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Asn Tyr
20 25 30
Gly Met Asn Trp Val Lys Gln Ala Pro Gly Lys Ser Phe Lys Trp Met
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Ser Thr Tyr Ser Ala Asp Phe
50 55 60
Lys Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu His Ile Asn Asp Leu Lys Asn Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Arg Ser Gly Gly Tyr Asp Pro Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Gly Gly Gly Gly Ser Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu
130 135 140
Ala Val Ser Leu Gly Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu
145 150 155 160
Ser Val Asp Asn Tyr Gly Asn Thr Phe Met His Trp Tyr Gln Gln Lys
165 170 175
Pro Gly Gln Pro Pro Lys Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu
180 185 190
Ser Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe
195 200 205
Thr Leu Thr Ile Asn Pro Val Glu Ala Asp Asp Val Ala Thr Tyr Tyr
210 215 220
Cys Gln Gln Ser Asn Glu Asp Pro Pro Thr Phe Gly Ala Gly Thr Lys
225 230 235 240
Leu Glu Leu Lys Gly Leu Ala Val Ser Thr Ile Ser Ser Phe Phe Pro
245 250 255
Pro Gly Tyr Gln Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
260 265 270
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
275 280 285
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
290 295 300
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
305 310 315 320
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
325 330 335
Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
340 345 350
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
355 360 365
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
370 375 380
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
385 390 395 400
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
405 410 415
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
420 425 430
Gln Ala Leu Pro Pro Arg
435
<210> 37
<211> 441
<212> PRT
<213> искусственная последовательность
<220>
<223> полипептидная последовательность CAR 32716-2
<400> 37
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Asn Tyr
20 25 30
Gly Met Asn Trp Val Lys Gln Ala Pro Gly Lys Ser Phe Lys Trp Met
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Ser Thr Tyr Ser Ala Asp Phe
50 55 60
Lys Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu His Ile Asn Asp Leu Lys Asn Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Arg Ser Gly Gly Tyr Asp Pro Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Gly Gly Gly Gly Ser Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu
130 135 140
Ala Val Ser Leu Gly Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu
145 150 155 160
Ser Val Asp Asn Tyr Gly Asn Thr Phe Met His Trp Tyr Gln Gln Lys
165 170 175
Pro Gly Gln Pro Pro Lys Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu
180 185 190
Ser Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe
195 200 205
Thr Leu Thr Ile Asn Pro Val Glu Ala Asp Asp Val Ala Thr Tyr Tyr
210 215 220
Cys Gln Gln Ser Asn Glu Asp Pro Pro Thr Phe Gly Ala Gly Thr Lys
225 230 235 240
Leu Glu Leu Lys Gly Leu Ala Val Ser Thr Ile Ser Ser Phe Phe Pro
245 250 255
Pro Gly Tyr Gln Ile Ile Ser Phe Phe Leu Ala Leu Thr Ser Thr Ala
260 265 270
Leu Leu Phe Leu Leu Phe Phe Leu Thr Leu Arg Phe Ser Val Val Lys
275 280 285
Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg
290 295 300
Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro
305 310 315 320
Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser
325 330 335
Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu
340 345 350
Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg
355 360 365
Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln
370 375 380
Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr
385 390 395 400
Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp
405 410 415
Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala
420 425 430
Leu His Met Gln Ala Leu Pro Pro Arg
435 440
<210> 38
<211> 467
<212> PRT
<213> искусственная последовательность
<220>
<223> полипептидная последовательность CAR 32716-3
<400> 38
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Asn Tyr
20 25 30
Gly Met Asn Trp Val Lys Gln Ala Pro Gly Lys Ser Phe Lys Trp Met
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Ser Thr Tyr Ser Ala Asp Phe
50 55 60
Lys Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu His Ile Asn Asp Leu Lys Asn Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Arg Ser Gly Gly Tyr Asp Pro Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Gly Gly Gly Gly Ser Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu
130 135 140
Ala Val Ser Leu Gly Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu
145 150 155 160
Ser Val Asp Asn Tyr Gly Asn Thr Phe Met His Trp Tyr Gln Gln Lys
165 170 175
Pro Gly Gln Pro Pro Lys Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu
180 185 190
Ser Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe
195 200 205
Thr Leu Thr Ile Asn Pro Val Glu Ala Asp Asp Val Ala Thr Tyr Tyr
210 215 220
Cys Gln Gln Ser Asn Glu Asp Pro Pro Thr Phe Gly Ala Gly Thr Lys
225 230 235 240
Leu Glu Leu Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala
245 250 255
Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg
260 265 270
Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys
275 280 285
Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu
290 295 300
Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu
305 310 315 320
Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln
325 330 335
Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly
340 345 350
Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr
355 360 365
Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg
370 375 380
Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met
385 390 395 400
Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu
405 410 415
Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys
420 425 430
Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu
435 440 445
Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu
450 455 460
Pro Pro Arg
465
<210> 39
<211> 470
<212> PRT
<213> искусственная последовательность
<220>
<223> полипептидная последовательность CAR 32716-4
<400> 39
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Asn Tyr
20 25 30
Gly Met Asn Trp Val Lys Gln Ala Pro Gly Lys Ser Phe Lys Trp Met
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Ser Thr Tyr Ser Ala Asp Phe
50 55 60
Lys Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu His Ile Asn Asp Leu Lys Asn Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Arg Ser Gly Gly Tyr Asp Pro Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Gly Gly Gly Gly Ser Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu
130 135 140
Ala Val Ser Leu Gly Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu
145 150 155 160
Ser Val Asp Asn Tyr Gly Asn Thr Phe Met His Trp Tyr Gln Gln Lys
165 170 175
Pro Gly Gln Pro Pro Lys Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu
180 185 190
Ser Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe
195 200 205
Thr Leu Thr Ile Asn Pro Val Glu Ala Asp Asp Val Ala Thr Tyr Tyr
210 215 220
Cys Gln Gln Ser Asn Glu Asp Pro Pro Thr Phe Gly Ala Gly Thr Lys
225 230 235 240
Leu Glu Leu Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala
245 250 255
Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg
260 265 270
Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys
275 280 285
Asp Ile Ile Ser Phe Phe Leu Ala Leu Thr Ser Thr Ala Leu Leu Phe
290 295 300
Leu Leu Phe Phe Leu Thr Leu Arg Phe Ser Val Val Lys Arg Gly Arg
305 310 315 320
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
325 330 335
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
340 345 350
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
355 360 365
Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
370 375 380
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
385 390 395 400
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
405 410 415
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
420 425 430
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
435 440 445
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
450 455 460
Gln Ala Leu Pro Pro Arg
465 470
<210> 40
<211> 653
<212> PRT
<213> искусственная последовательность
<220>
<223> полипептидная последовательность CAR 32716-5
<400> 40
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Asn Tyr
20 25 30
Gly Met Asn Trp Val Lys Gln Ala Pro Gly Lys Ser Phe Lys Trp Met
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Ser Thr Tyr Ser Ala Asp Phe
50 55 60
Lys Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu His Ile Asn Asp Leu Lys Asn Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Arg Ser Gly Gly Tyr Asp Pro Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Gly Gly Gly Gly Ser Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu
130 135 140
Ala Val Ser Leu Gly Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu
145 150 155 160
Ser Val Asp Asn Tyr Gly Asn Thr Phe Met His Trp Tyr Gln Gln Lys
165 170 175
Pro Gly Gln Pro Pro Lys Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu
180 185 190
Ser Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe
195 200 205
Thr Leu Thr Ile Asn Pro Val Glu Ala Asp Asp Val Ala Thr Tyr Tyr
210 215 220
Cys Gln Gln Ser Asn Glu Asp Pro Pro Thr Phe Gly Ala Gly Thr Lys
225 230 235 240
Leu Glu Leu Lys Glu Pro Lys Ser Pro Asp Lys Thr His Thr Cys Pro
245 250 255
Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro
260 265 270
Pro Lys Pro Lys Asp Thr Leu Met Ile Ala Arg Thr Pro Glu Val Thr
275 280 285
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn
290 295 300
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
305 310 315 320
Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
325 330 335
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
340 345 350
Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys
355 360 365
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp
370 375 380
Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
385 390 395 400
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
405 410 415
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
420 425 430
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
435 440 445
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
450 455 460
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Ile Tyr Ile Trp Ala
465 470 475 480
Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr
485 490 495
Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln
500 505 510
Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser
515 520 525
Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys
530 535 540
Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln
545 550 555 560
Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu
565 570 575
Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg
580 585 590
Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met
595 600 605
Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly
610 615 620
Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp
625 630 635 640
Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
645 650
<210> 41
<211> 656
<212> PRT
<213> искусственная последовательность
<220>
<223> полипептидная последовательность CAR 32716-6
<400> 41
Gln Ile Gln Leu Val Gln Ser Gly Pro Glu Leu Lys Lys Pro Gly Glu
1 5 10 15
Thr Val Lys Ile Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Asn Tyr
20 25 30
Gly Met Asn Trp Val Lys Gln Ala Pro Gly Lys Ser Phe Lys Trp Met
35 40 45
Gly Trp Ile Asn Thr Tyr Thr Gly Glu Ser Thr Tyr Ser Ala Asp Phe
50 55 60
Lys Gly Arg Phe Ala Phe Ser Leu Glu Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Leu His Ile Asn Asp Leu Lys Asn Glu Asp Thr Ala Thr Tyr Phe Cys
85 90 95
Ala Arg Ser Gly Gly Tyr Asp Pro Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Gly Gly Gly Gly Ser Asp Ile Val Leu Thr Gln Ser Pro Ala Ser Leu
130 135 140
Ala Val Ser Leu Gly Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Glu
145 150 155 160
Ser Val Asp Asn Tyr Gly Asn Thr Phe Met His Trp Tyr Gln Gln Lys
165 170 175
Pro Gly Gln Pro Pro Lys Leu Leu Ile Tyr Arg Ala Ser Asn Leu Glu
180 185 190
Ser Gly Ile Pro Ala Arg Phe Ser Gly Ser Gly Ser Arg Thr Asp Phe
195 200 205
Thr Leu Thr Ile Asn Pro Val Glu Ala Asp Asp Val Ala Thr Tyr Tyr
210 215 220
Cys Gln Gln Ser Asn Glu Asp Pro Pro Thr Phe Gly Ala Gly Thr Lys
225 230 235 240
Leu Glu Leu Lys Glu Pro Lys Ser Pro Asp Lys Thr His Thr Cys Pro
245 250 255
Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro
260 265 270
Pro Lys Pro Lys Asp Thr Leu Met Ile Ala Arg Thr Pro Glu Val Thr
275 280 285
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn
290 295 300
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
305 310 315 320
Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
325 330 335
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
340 345 350
Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys
355 360 365
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp
370 375 380
Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
385 390 395 400
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
405 410 415
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
420 425 430
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
435 440 445
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
450 455 460
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Ile Ile Ser Phe Phe
465 470 475 480
Leu Ala Leu Thr Ser Thr Ala Leu Leu Phe Leu Leu Phe Phe Leu Thr
485 490 495
Leu Arg Phe Ser Val Val Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile
500 505 510
Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp
515 520 525
Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu
530 535 540
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly
545 550 555 560
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
565 570 575
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
580 585 590
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
595 600 605
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
610 615 620
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
625 630 635 640
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
645 650 655
<210> 42
<211> 449
<212> PRT
<213> искусственная последовательность
<220>
<223> полипептидная последовательность CAR Klo43-1
<400> 42
Glu Val Lys Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Ser Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Ser Trp Val Arg Gln Pro Pro Gly Lys Ala Leu Glu Trp Leu
35 40 45
Ala Leu Ile Arg Ser Lys Ala Asp Gly Tyr Thr Thr Glu Tyr Ser Ala
50 55 60
Ser Val Lys Gly Arg Phe Thr Leu Ser Arg Asp Asp Ser Gln Ser Ile
65 70 75 80
Leu Tyr Leu Gln Met Asn Ala Leu Arg Pro Glu Asp Ser Ala Thr Tyr
85 90 95
Tyr Cys Ala Arg Asp Ala Ala Tyr Tyr Ser Tyr Tyr Ser Pro Glu Gly
100 105 110
Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Met Ala
130 135 140
Asp Tyr Lys Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser Thr
145 150 155 160
Ser Val Gly Asp Arg Val Asn Ile Thr Cys Lys Ala Ser Gln Asn Val
165 170 175
Asp Ser Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys
180 185 190
Ala Leu Ile Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro Asp Arg
195 200 205
Phe Thr Gly Arg Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser
210 215 220
Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Ser
225 230 235 240
Thr Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Gly
245 250 255
Leu Ala Val Ser Thr Ile Ser Ser Phe Phe Pro Pro Gly Tyr Gln Ile
260 265 270
Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser
275 280 285
Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr
290 295 300
Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu
305 310 315 320
Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu
325 330 335
Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln
340 345 350
Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu
355 360 365
Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly
370 375 380
Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln
385 390 395 400
Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu
405 410 415
Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr
420 425 430
Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro
435 440 445
Arg
<210> 43
<211> 452
<212> PRT
<213> искусственная последовательность
<220>
<223> полипептидная последовательность CAR Klo43-2
<400> 43
Glu Val Lys Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Ser Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Ser Trp Val Arg Gln Pro Pro Gly Lys Ala Leu Glu Trp Leu
35 40 45
Ala Leu Ile Arg Ser Lys Ala Asp Gly Tyr Thr Thr Glu Tyr Ser Ala
50 55 60
Ser Val Lys Gly Arg Phe Thr Leu Ser Arg Asp Asp Ser Gln Ser Ile
65 70 75 80
Leu Tyr Leu Gln Met Asn Ala Leu Arg Pro Glu Asp Ser Ala Thr Tyr
85 90 95
Tyr Cys Ala Arg Asp Ala Ala Tyr Tyr Ser Tyr Tyr Ser Pro Glu Gly
100 105 110
Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Met Ala
130 135 140
Asp Tyr Lys Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser Thr
145 150 155 160
Ser Val Gly Asp Arg Val Asn Ile Thr Cys Lys Ala Ser Gln Asn Val
165 170 175
Asp Ser Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys
180 185 190
Ala Leu Ile Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro Asp Arg
195 200 205
Phe Thr Gly Arg Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser
210 215 220
Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Ser
225 230 235 240
Thr Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Gly
245 250 255
Leu Ala Val Ser Thr Ile Ser Ser Phe Phe Pro Pro Gly Tyr Gln Ile
260 265 270
Ile Ser Phe Phe Leu Ala Leu Thr Ser Thr Ala Leu Leu Phe Leu Leu
275 280 285
Phe Phe Leu Thr Leu Arg Phe Ser Val Val Lys Arg Gly Arg Lys Lys
290 295 300
Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr
305 310 315 320
Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly
325 330 335
Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala
340 345 350
Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg
355 360 365
Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu
370 375 380
Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn
385 390 395 400
Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met
405 410 415
Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly
420 425 430
Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala
435 440 445
Leu Pro Pro Arg
450
<210> 44
<211> 478
<212> PRT
<213> искусственная последовательность
<220>
<223> полипептидная последовательность CAR Klo43-3
<400> 44
Glu Val Lys Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Ser Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Ser Trp Val Arg Gln Pro Pro Gly Lys Ala Leu Glu Trp Leu
35 40 45
Ala Leu Ile Arg Ser Lys Ala Asp Gly Tyr Thr Thr Glu Tyr Ser Ala
50 55 60
Ser Val Lys Gly Arg Phe Thr Leu Ser Arg Asp Asp Ser Gln Ser Ile
65 70 75 80
Leu Tyr Leu Gln Met Asn Ala Leu Arg Pro Glu Asp Ser Ala Thr Tyr
85 90 95
Tyr Cys Ala Arg Asp Ala Ala Tyr Tyr Ser Tyr Tyr Ser Pro Glu Gly
100 105 110
Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Met Ala
130 135 140
Asp Tyr Lys Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser Thr
145 150 155 160
Ser Val Gly Asp Arg Val Asn Ile Thr Cys Lys Ala Ser Gln Asn Val
165 170 175
Asp Ser Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys
180 185 190
Ala Leu Ile Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro Asp Arg
195 200 205
Phe Thr Gly Arg Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser
210 215 220
Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Ser
225 230 235 240
Thr Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Thr
245 250 255
Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser
260 265 270
Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly
275 280 285
Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp
290 295 300
Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile
305 310 315 320
Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys
325 330 335
Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys
340 345 350
Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val
355 360 365
Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn
370 375 380
Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val
385 390 395 400
Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg
405 410 415
Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys
420 425 430
Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg
435 440 445
Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys
450 455 460
Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
465 470 475
<210> 45
<211> 481
<212> PRT
<213> искусственная последовательность
<220>
<223> полипептидная последовательность CAR Klo43-4
<400> 45
Glu Val Lys Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Ser Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Ser Trp Val Arg Gln Pro Pro Gly Lys Ala Leu Glu Trp Leu
35 40 45
Ala Leu Ile Arg Ser Lys Ala Asp Gly Tyr Thr Thr Glu Tyr Ser Ala
50 55 60
Ser Val Lys Gly Arg Phe Thr Leu Ser Arg Asp Asp Ser Gln Ser Ile
65 70 75 80
Leu Tyr Leu Gln Met Asn Ala Leu Arg Pro Glu Asp Ser Ala Thr Tyr
85 90 95
Tyr Cys Ala Arg Asp Ala Ala Tyr Tyr Ser Tyr Tyr Ser Pro Glu Gly
100 105 110
Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Met Ala
130 135 140
Asp Tyr Lys Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser Thr
145 150 155 160
Ser Val Gly Asp Arg Val Asn Ile Thr Cys Lys Ala Ser Gln Asn Val
165 170 175
Asp Ser Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys
180 185 190
Ala Leu Ile Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro Asp Arg
195 200 205
Phe Thr Gly Arg Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser
210 215 220
Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Ser
225 230 235 240
Thr Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Thr
245 250 255
Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser
260 265 270
Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly
275 280 285
Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Ile Ser Phe
290 295 300
Phe Leu Ala Leu Thr Ser Thr Ala Leu Leu Phe Leu Leu Phe Phe Leu
305 310 315 320
Thr Leu Arg Phe Ser Val Val Lys Arg Gly Arg Lys Lys Leu Leu Tyr
325 330 335
Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu
340 345 350
Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu
355 360 365
Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln
370 375 380
Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu
385 390 395 400
Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly
405 410 415
Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln
420 425 430
Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu
435 440 445
Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr
450 455 460
Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro
465 470 475 480
Arg
<210> 46
<211> 664
<212> PRT
<213> искусственная последовательность
<220>
<223> полипептидная последовательность CAR Klo43-5
<400> 46
Glu Val Lys Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Ser Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Ser Trp Val Arg Gln Pro Pro Gly Lys Ala Leu Glu Trp Leu
35 40 45
Ala Leu Ile Arg Ser Lys Ala Asp Gly Tyr Thr Thr Glu Tyr Ser Ala
50 55 60
Ser Val Lys Gly Arg Phe Thr Leu Ser Arg Asp Asp Ser Gln Ser Ile
65 70 75 80
Leu Tyr Leu Gln Met Asn Ala Leu Arg Pro Glu Asp Ser Ala Thr Tyr
85 90 95
Tyr Cys Ala Arg Asp Ala Ala Tyr Tyr Ser Tyr Tyr Ser Pro Glu Gly
100 105 110
Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Met Ala
130 135 140
Asp Tyr Lys Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser Thr
145 150 155 160
Ser Val Gly Asp Arg Val Asn Ile Thr Cys Lys Ala Ser Gln Asn Val
165 170 175
Asp Ser Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys
180 185 190
Ala Leu Ile Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro Asp Arg
195 200 205
Phe Thr Gly Arg Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser
210 215 220
Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Ser
225 230 235 240
Thr Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Glu
245 250 255
Pro Lys Ser Pro Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
260 265 270
Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
275 280 285
Thr Leu Met Ile Ala Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
290 295 300
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
305 310 315 320
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn
325 330 335
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
340 345 350
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
355 360 365
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
370 375 380
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn
385 390 395 400
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
405 410 415
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
420 425 430
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
435 440 445
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
450 455 460
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
465 470 475 480
Ser Leu Ser Pro Gly Lys Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr
485 490 495
Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg
500 505 510
Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro
515 520 525
Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu
530 535 540
Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala
545 550 555 560
Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu
565 570 575
Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly
580 585 590
Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu
595 600 605
Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser
610 615 620
Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly
625 630 635 640
Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu
645 650 655
His Met Gln Ala Leu Pro Pro Arg
660
<210> 47
<211> 667
<212> PRT
<213> искусственная последовательность
<220>
<223> полипептидная последовательность CAR Klo43-6
<400> 47
Glu Val Lys Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Ser Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Ser Trp Val Arg Gln Pro Pro Gly Lys Ala Leu Glu Trp Leu
35 40 45
Ala Leu Ile Arg Ser Lys Ala Asp Gly Tyr Thr Thr Glu Tyr Ser Ala
50 55 60
Ser Val Lys Gly Arg Phe Thr Leu Ser Arg Asp Asp Ser Gln Ser Ile
65 70 75 80
Leu Tyr Leu Gln Met Asn Ala Leu Arg Pro Glu Asp Ser Ala Thr Tyr
85 90 95
Tyr Cys Ala Arg Asp Ala Ala Tyr Tyr Ser Tyr Tyr Ser Pro Glu Gly
100 105 110
Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Met Ala
130 135 140
Asp Tyr Lys Asp Ile Val Met Thr Gln Ser His Lys Phe Met Ser Thr
145 150 155 160
Ser Val Gly Asp Arg Val Asn Ile Thr Cys Lys Ala Ser Gln Asn Val
165 170 175
Asp Ser Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Lys
180 185 190
Ala Leu Ile Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro Asp Arg
195 200 205
Phe Thr Gly Arg Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser
210 215 220
Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys Gln Gln Tyr Tyr Ser
225 230 235 240
Thr Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Glu
245 250 255
Pro Lys Ser Pro Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro
260 265 270
Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
275 280 285
Thr Leu Met Ile Ala Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
290 295 300
Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly
305 310 315 320
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn
325 330 335
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
340 345 350
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro
355 360 365
Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
370 375 380
Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn
385 390 395 400
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
405 410 415
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
420 425 430
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys
435 440 445
Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys
450 455 460
Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
465 470 475 480
Ser Leu Ser Pro Gly Lys Ile Ile Ser Phe Phe Leu Ala Leu Thr Ser
485 490 495
Thr Ala Leu Leu Phe Leu Leu Phe Phe Leu Thr Leu Arg Phe Ser Val
500 505 510
Val Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe
515 520 525
Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg
530 535 540
Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser
545 550 555 560
Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr
565 570 575
Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys
580 585 590
Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn
595 600 605
Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu
610 615 620
Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly
625 630 635 640
His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr
645 650 655
Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
660 665
<210> 48
<211> 470
<212> PRT
<213> искусственная последовательность
<220>
<223> полипептидная последовательность CAR 12F1-3
<400> 48
Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln Ser
1 5 10 15
Leu Ser Leu Thr Cys Ser Val Thr Asp Tyr Ser Ile Thr Ser Gly Tyr
20 25 30
Tyr Trp Asn Trp Ile Arg Gln Phe Pro Gly Asn Lys Leu Glu Trp Met
35 40 45
Gly Tyr Ile Ser Tyr Asp Gly Ser Asn Asn Tyr Asn Pro Ser Leu Lys
50 55 60
Asn Arg Ile Ser Ile Thr Arg Asp Thr Ser Lys Asn Gln Phe Phe Leu
65 70 75 80
Lys Leu Ser Ser Val Thr Thr Glu Asp Thr Ala Thr Tyr Tyr Cys Ser
85 90 95
Arg Gly Glu Gly Phe Tyr Phe Asp Ser Trp Gly Gln Gly Thr Thr Leu
100 105 110
Thr Val Ser Ser Ala Arg Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Asp Ile Met Met Ser Gln Ser Pro Ser Ser
130 135 140
Leu Ala Val Ser Val Gly Glu Lys Phe Thr Met Thr Cys Lys Ser Ser
145 150 155 160
Gln Ser Leu Phe Phe Gly Ser Thr Gln Lys Asn Tyr Leu Ala Trp Tyr
165 170 175
Gln Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile Tyr Trp Ala Ser
180 185 190
Thr Arg Glu Ser Gly Val Pro Asp Arg Phe Thr Gly Ser Gly Ser Gly
195 200 205
Thr Asp Phe Thr Leu Ala Ile Ser Ser Val Met Pro Glu Asp Leu Ala
210 215 220
Val Tyr Tyr Cys Gln Gln Tyr Tyr Asn Tyr Pro Trp Thr Phe Gly Gly
225 230 235 240
Gly Thr Lys Leu Glu Ile Lys Thr Thr Thr Pro Ala Pro Arg Pro Pro
245 250 255
Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu
260 265 270
Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp
275 280 285
Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
290 295 300
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
305 310 315 320
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
325 330 335
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
340 345 350
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
355 360 365
Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
370 375 380
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
385 390 395 400
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
405 410 415
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
420 425 430
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
435 440 445
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
450 455 460
Gln Ala Leu Pro Pro Arg
465 470
<210> 49
<211> 49
<212> PRT
<213> Искусственная последовательность
<220>
<223> Мишень TALEN TRAC_T01
<400> 49
Thr Thr Gly Thr Cys Cys Cys Ala Cys Ala Gly Ala Thr Ala Thr Cys
1 5 10 15
Cys Ala Gly Ala Ala Cys Cys Cys Thr Gly Ala Cys Cys Cys Thr Gly
20 25 30
Cys Cys Gly Thr Gly Thr Ala Cys Cys Ala Gly Cys Thr Gly Ala Gly
35 40 45
Ala
<210> 50
<211> 530
<212> PRT
<213> Искусственная последовательность
<220>
<223> TAL-связывающий домен TRAC_T01-L
<400> 50
Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Lys
1 5 10 15
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
20 25 30
His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Asn Gly
35 40 45
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
50 55 60
Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn
65 70 75 80
Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
85 90 95
Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala
100 105 110
Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
115 120 125
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala
130 135 140
Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
145 150 155 160
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val
165 170 175
Val Ala Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val
180 185 190
Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu
195 200 205
Gln Val Val Ala Ile Ala Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu
210 215 220
Thr Val Gln Ala Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
225 230 235 240
Pro Glu Gln Val Val Ala Ile Ala Ser His Asp Gly Gly Lys Gln Ala
245 250 255
Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly
260 265 270
Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Asn Ile Gly Gly Lys
275 280 285
Gln Ala Leu Glu Thr Val Gln Ala Leu Leu Pro Val Leu Cys Gln Ala
290 295 300
His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Asn Gly
305 310 315 320
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
325 330 335
Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Asn
340 345 350
Ile Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Ala Leu Leu Pro Val
355 360 365
Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala
370 375 380
Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
385 390 395 400
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala
405 410 415
Ile Ala Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Ala
420 425 430
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val
435 440 445
Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu Thr Val
450 455 460
Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu
465 470 475 480
Gln Val Val Ala Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu
485 490 495
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
500 505 510
Pro Gln Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Arg Pro Ala
515 520 525
Leu Glu
530
<210> 51
<211> 530
<212> PRT
<213> Искусственная последовательность
<220>
<223> TAL-связывающий домен TRAC_T01-R
<400> 51
Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser His Asp Gly Gly Lys
1 5 10 15
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
20 25 30
His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Gly Gly
35 40 45
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
50 55 60
Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser His
65 70 75 80
Asp Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val
85 90 95
Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala
100 105 110
Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Ala Leu Leu
115 120 125
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln Gln Val Val Ala
130 135 140
Ile Ala Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg
145 150 155 160
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val
165 170 175
Val Ala Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val
180 185 190
Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln
195 200 205
Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Lys Gln Ala Leu Glu
210 215 220
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
225 230 235 240
Pro Gln Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys Gln Ala
245 250 255
Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly
260 265 270
Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys
275 280 285
Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala
290 295 300
His Gly Leu Thr Pro Gln Gln Val Val Ala Ile Ala Ser Asn Gly Gly
305 310 315 320
Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu Pro Val Leu Cys
325 330 335
Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala Ser Asn
340 345 350
Ile Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Ala Leu Leu Pro Val
355 360 365
Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala Ile Ala
370 375 380
Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Arg Leu Leu
385 390 395 400
Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val Val Ala
405 410 415
Ile Ala Ser Asn Ile Gly Gly Lys Gln Ala Leu Glu Thr Val Gln Ala
420 425 430
Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Glu Gln Val
435 440 445
Val Ala Ile Ala Ser His Asp Gly Gly Lys Gln Ala Leu Glu Thr Val
450 455 460
Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr Pro Gln
465 470 475 480
Gln Val Val Ala Ile Ala Ser Asn Asn Gly Gly Lys Gln Ala Leu Glu
485 490 495
Thr Val Gln Arg Leu Leu Pro Val Leu Cys Gln Ala His Gly Leu Thr
500 505 510
Pro Gln Gln Val Val Ala Ile Ala Ser Asn Gly Gly Gly Arg Pro Ala
515 520 525
Leu Glu
530
<210> 52
<211> 2814
<212> PRT
<213> Искусственная последовательность
<220>
<223> полинуклеотид, кодирующий TRAC_T01-L TALEN
<400> 52
Ala Thr Gly Gly Gly Cys Gly Ala Thr Cys Cys Thr Ala Ala Ala Ala
1 5 10 15
Ala Gly Ala Ala Ala Cys Gly Thr Ala Ala Gly Gly Thr Cys Ala Thr
20 25 30
Cys Gly Ala Thr Thr Ala Cys Cys Cys Ala Thr Ala Cys Gly Ala Thr
35 40 45
Gly Thr Thr Cys Cys Ala Gly Ala Thr Thr Ala Cys Gly Cys Thr Ala
50 55 60
Thr Cys Gly Ala Thr Ala Thr Cys Gly Cys Cys Gly Ala Thr Cys Thr
65 70 75 80
Ala Cys Gly Cys Ala Cys Gly Cys Thr Cys Gly Gly Cys Thr Ala Cys
85 90 95
Ala Gly Cys Cys Ala Gly Cys Ala Gly Cys Ala Ala Cys Ala Gly Gly
100 105 110
Ala Gly Ala Ala Gly Ala Thr Cys Ala Ala Ala Cys Cys Gly Ala Ala
115 120 125
Gly Gly Thr Thr Cys Gly Thr Thr Cys Gly Ala Cys Ala Gly Thr Gly
130 135 140
Gly Cys Gly Cys Ala Gly Cys Ala Cys Cys Ala Cys Gly Ala Gly Gly
145 150 155 160
Cys Ala Cys Thr Gly Gly Thr Cys Gly Gly Cys Cys Ala Cys Gly Gly
165 170 175
Gly Thr Thr Thr Ala Cys Ala Cys Ala Cys Gly Cys Gly Cys Ala Cys
180 185 190
Ala Thr Cys Gly Thr Thr Gly Cys Gly Thr Thr Ala Ala Gly Cys Cys
195 200 205
Ala Ala Cys Ala Cys Cys Cys Gly Gly Cys Ala Gly Cys Gly Thr Thr
210 215 220
Ala Gly Gly Gly Ala Cys Cys Gly Thr Cys Gly Cys Thr Gly Thr Cys
225 230 235 240
Ala Ala Gly Thr Ala Thr Cys Ala Gly Gly Ala Cys Ala Thr Gly Ala
245 250 255
Thr Cys Gly Cys Ala Gly Cys Gly Thr Thr Gly Cys Cys Ala Gly Ala
260 265 270
Gly Gly Cys Gly Ala Cys Ala Cys Ala Cys Gly Ala Ala Gly Cys Gly
275 280 285
Ala Thr Cys Gly Thr Thr Gly Gly Cys Gly Thr Cys Gly Gly Cys Ala
290 295 300
Ala Ala Cys Ala Gly Thr Gly Gly Thr Cys Cys Gly Gly Cys Gly Cys
305 310 315 320
Ala Cys Gly Cys Gly Cys Thr Cys Thr Gly Gly Ala Gly Gly Cys Cys
325 330 335
Thr Thr Gly Cys Thr Cys Ala Cys Gly Gly Thr Gly Gly Cys Gly Gly
340 345 350
Gly Ala Gly Ala Gly Thr Thr Gly Ala Gly Ala Gly Gly Thr Cys Cys
355 360 365
Ala Cys Cys Gly Thr Thr Ala Cys Ala Gly Thr Thr Gly Gly Ala Cys
370 375 380
Ala Cys Ala Gly Gly Cys Cys Ala Ala Cys Thr Thr Cys Thr Cys Ala
385 390 395 400
Ala Gly Ala Thr Thr Gly Cys Ala Ala Ala Ala Cys Gly Thr Gly Gly
405 410 415
Cys Gly Gly Cys Gly Thr Gly Ala Cys Cys Gly Cys Ala Gly Thr Gly
420 425 430
Gly Ala Gly Gly Cys Ala Gly Thr Gly Cys Ala Thr Gly Cys Ala Thr
435 440 445
Gly Gly Cys Gly Cys Ala Ala Thr Gly Cys Ala Cys Thr Gly Ala Cys
450 455 460
Gly Gly Gly Thr Gly Cys Cys Cys Cys Gly Cys Thr Cys Ala Ala Cys
465 470 475 480
Thr Thr Gly Ala Cys Cys Cys Cys Cys Cys Ala Gly Cys Ala Gly Gly
485 490 495
Thr Gly Gly Thr Gly Gly Cys Cys Ala Thr Cys Gly Cys Cys Ala Gly
500 505 510
Cys Ala Ala Thr Gly Gly Cys Gly Gly Thr Gly Gly Cys Ala Ala Gly
515 520 525
Cys Ala Gly Gly Cys Gly Cys Thr Gly Gly Ala Gly Ala Cys Gly Gly
530 535 540
Thr Cys Cys Ala Gly Cys Gly Gly Cys Thr Gly Thr Thr Gly Cys Cys
545 550 555 560
Gly Gly Thr Gly Cys Thr Gly Thr Gly Cys Cys Ala Gly Gly Cys Cys
565 570 575
Cys Ala Cys Gly Gly Cys Thr Thr Gly Ala Cys Cys Cys Cys Cys Cys
580 585 590
Ala Gly Cys Ala Gly Gly Thr Gly Gly Thr Gly Gly Cys Cys Ala Thr
595 600 605
Cys Gly Cys Cys Ala Gly Cys Ala Ala Thr Ala Ala Thr Gly Gly Thr
610 615 620
Gly Gly Cys Ala Ala Gly Cys Ala Gly Gly Cys Gly Cys Thr Gly Gly
625 630 635 640
Ala Gly Ala Cys Gly Gly Thr Cys Cys Ala Gly Cys Gly Gly Cys Thr
645 650 655
Gly Thr Thr Gly Cys Cys Gly Gly Thr Gly Cys Thr Gly Thr Gly Cys
660 665 670
Cys Ala Gly Gly Cys Cys Cys Ala Cys Gly Gly Cys Thr Thr Gly Ala
675 680 685
Cys Cys Cys Cys Cys Cys Ala Gly Cys Ala Gly Gly Thr Gly Gly Thr
690 695 700
Gly Gly Cys Cys Ala Thr Cys Gly Cys Cys Ala Gly Cys Ala Ala Thr
705 710 715 720
Gly Gly Cys Gly Gly Thr Gly Gly Cys Ala Ala Gly Cys Ala Gly Gly
725 730 735
Cys Gly Cys Thr Gly Gly Ala Gly Ala Cys Gly Gly Thr Cys Cys Ala
740 745 750
Gly Cys Gly Gly Cys Thr Gly Thr Thr Gly Cys Cys Gly Gly Thr Gly
755 760 765
Cys Thr Gly Thr Gly Cys Cys Ala Gly Gly Cys Cys Cys Ala Cys Gly
770 775 780
Gly Cys Thr Thr Gly Ala Cys Cys Cys Cys Gly Gly Ala Gly Cys Ala
785 790 795 800
Gly Gly Thr Gly Gly Thr Gly Gly Cys Cys Ala Thr Cys Gly Cys Cys
805 810 815
Ala Gly Cys Cys Ala Cys Gly Ala Thr Gly Gly Cys Gly Gly Cys Ala
820 825 830
Ala Gly Cys Ala Gly Gly Cys Gly Cys Thr Gly Gly Ala Gly Ala Cys
835 840 845
Gly Gly Thr Cys Cys Ala Gly Cys Gly Gly Cys Thr Gly Thr Thr Gly
850 855 860
Cys Cys Gly Gly Thr Gly Cys Thr Gly Thr Gly Cys Cys Ala Gly Gly
865 870 875 880
Cys Cys Cys Ala Cys Gly Gly Cys Thr Thr Gly Ala Cys Cys Cys Cys
885 890 895
Gly Gly Ala Gly Cys Ala Gly Gly Thr Gly Gly Thr Gly Gly Cys Cys
900 905 910
Ala Thr Cys Gly Cys Cys Ala Gly Cys Cys Ala Cys Gly Ala Thr Gly
915 920 925
Gly Cys Gly Gly Cys Ala Ala Gly Cys Ala Gly Gly Cys Gly Cys Thr
930 935 940
Gly Gly Ala Gly Ala Cys Gly Gly Thr Cys Cys Ala Gly Cys Gly Gly
945 950 955 960
Cys Thr Gly Thr Thr Gly Cys Cys Gly Gly Thr Gly Cys Thr Gly Thr
965 970 975
Gly Cys Cys Ala Gly Gly Cys Cys Cys Ala Cys Gly Gly Cys Thr Thr
980 985 990
Gly Ala Cys Cys Cys Cys Gly Gly Ala Gly Cys Ala Gly Gly Thr Gly
995 1000 1005
Gly Thr Gly Gly Cys Cys Ala Thr Cys Gly Cys Cys Ala Gly Cys Cys
1010 1015 1020
Ala Cys Gly Ala Thr Gly Gly Cys Gly Gly Cys Ala Ala Gly Cys Ala
1025 1030 1035 1040
Gly Gly Cys Gly Cys Thr Gly Gly Ala Gly Ala Cys Gly Gly Thr Cys
1045 1050 1055
Cys Ala Gly Cys Gly Gly Cys Thr Gly Thr Thr Gly Cys Cys Gly Gly
1060 1065 1070
Thr Gly Cys Thr Gly Thr Gly Cys Cys Ala Gly Gly Cys Cys Cys Ala
1075 1080 1085
Cys Gly Gly Cys Thr Thr Gly Ala Cys Cys Cys Cys Gly Gly Ala Gly
1090 1095 1100
Cys Ala Gly Gly Thr Gly Gly Thr Gly Gly Cys Cys Ala Thr Cys Gly
1105 1110 1115 1120
Cys Cys Ala Gly Cys Ala Ala Thr Ala Thr Thr Gly Gly Thr Gly Gly
1125 1130 1135
Cys Ala Ala Gly Cys Ala Gly Gly Cys Gly Cys Thr Gly Gly Ala Gly
1140 1145 1150
Ala Cys Gly Gly Thr Gly Cys Ala Gly Gly Cys Gly Cys Thr Gly Thr
1155 1160 1165
Thr Gly Cys Cys Gly Gly Thr Gly Cys Thr Gly Thr Gly Cys Cys Ala
1170 1175 1180
Gly Gly Cys Cys Cys Ala Cys Gly Gly Cys Thr Thr Gly Ala Cys Cys
1185 1190 1195 1200
Cys Cys Gly Gly Ala Gly Cys Ala Gly Gly Thr Gly Gly Thr Gly Gly
1205 1210 1215
Cys Cys Ala Thr Cys Gly Cys Cys Ala Gly Cys Cys Ala Cys Gly Ala
1220 1225 1230
Thr Gly Gly Cys Gly Gly Cys Ala Ala Gly Cys Ala Gly Gly Cys Gly
1235 1240 1245
Cys Thr Gly Gly Ala Gly Ala Cys Gly Gly Thr Cys Cys Ala Gly Cys
1250 1255 1260
Gly Gly Cys Thr Gly Thr Thr Gly Cys Cys Gly Gly Thr Gly Cys Thr
1265 1270 1275 1280
Gly Thr Gly Cys Cys Ala Gly Gly Cys Cys Cys Ala Cys Gly Gly Cys
1285 1290 1295
Thr Thr Gly Ala Cys Cys Cys Cys Gly Gly Ala Gly Cys Ala Gly Gly
1300 1305 1310
Thr Gly Gly Thr Gly Gly Cys Cys Ala Thr Cys Gly Cys Cys Ala Gly
1315 1320 1325
Cys Ala Ala Thr Ala Thr Thr Gly Gly Thr Gly Gly Cys Ala Ala Gly
1330 1335 1340
Cys Ala Gly Gly Cys Gly Cys Thr Gly Gly Ala Gly Ala Cys Gly Gly
1345 1350 1355 1360
Thr Gly Cys Ala Gly Gly Cys Gly Cys Thr Gly Thr Thr Gly Cys Cys
1365 1370 1375
Gly Gly Thr Gly Cys Thr Gly Thr Gly Cys Cys Ala Gly Gly Cys Cys
1380 1385 1390
Cys Ala Cys Gly Gly Cys Thr Thr Gly Ala Cys Cys Cys Cys Cys Cys
1395 1400 1405
Ala Gly Cys Ala Gly Gly Thr Gly Gly Thr Gly Gly Cys Cys Ala Thr
1410 1415 1420
Cys Gly Cys Cys Ala Gly Cys Ala Ala Thr Ala Ala Thr Gly Gly Thr
1425 1430 1435 1440
Gly Gly Cys Ala Ala Gly Cys Ala Gly Gly Cys Gly Cys Thr Gly Gly
1445 1450 1455
Ala Gly Ala Cys Gly Gly Thr Cys Cys Ala Gly Cys Gly Gly Cys Thr
1460 1465 1470
Gly Thr Thr Gly Cys Cys Gly Gly Thr Gly Cys Thr Gly Thr Gly Cys
1475 1480 1485
Cys Ala Gly Gly Cys Cys Cys Ala Cys Gly Gly Cys Thr Thr Gly Ala
1490 1495 1500
Cys Cys Cys Cys Gly Gly Ala Gly Cys Ala Gly Gly Thr Gly Gly Thr
1505 1510 1515 1520
Gly Gly Cys Cys Ala Thr Cys Gly Cys Cys Ala Gly Cys Ala Ala Thr
1525 1530 1535
Ala Thr Thr Gly Gly Thr Gly Gly Cys Ala Ala Gly Cys Ala Gly Gly
1540 1545 1550
Cys Gly Cys Thr Gly Gly Ala Gly Ala Cys Gly Gly Thr Gly Cys Ala
1555 1560 1565
Gly Gly Cys Gly Cys Thr Gly Thr Thr Gly Cys Cys Gly Gly Thr Gly
1570 1575 1580
Cys Thr Gly Thr Gly Cys Cys Ala Gly Gly Cys Cys Cys Ala Cys Gly
1585 1590 1595 1600
Gly Cys Thr Thr Gly Ala Cys Cys Cys Cys Cys Cys Ala Gly Cys Ala
1605 1610 1615
Gly Gly Thr Gly Gly Thr Gly Gly Cys Cys Ala Thr Cys Gly Cys Cys
1620 1625 1630
Ala Gly Cys Ala Ala Thr Gly Gly Cys Gly Gly Thr Gly Gly Cys Ala
1635 1640 1645
Ala Gly Cys Ala Gly Gly Cys Gly Cys Thr Gly Gly Ala Gly Ala Cys
1650 1655 1660
Gly Gly Thr Cys Cys Ala Gly Cys Gly Gly Cys Thr Gly Thr Thr Gly
1665 1670 1675 1680
Cys Cys Gly Gly Thr Gly Cys Thr Gly Thr Gly Cys Cys Ala Gly Gly
1685 1690 1695
Cys Cys Cys Ala Cys Gly Gly Cys Thr Thr Gly Ala Cys Cys Cys Cys
1700 1705 1710
Gly Gly Ala Gly Cys Ala Gly Gly Thr Gly Gly Thr Gly Gly Cys Cys
1715 1720 1725
Ala Thr Cys Gly Cys Cys Ala Gly Cys Ala Ala Thr Ala Thr Thr Gly
1730 1735 1740
Gly Thr Gly Gly Cys Ala Ala Gly Cys Ala Gly Gly Cys Gly Cys Thr
1745 1750 1755 1760
Gly Gly Ala Gly Ala Cys Gly Gly Thr Gly Cys Ala Gly Gly Cys Gly
1765 1770 1775
Cys Thr Gly Thr Thr Gly Cys Cys Gly Gly Thr Gly Cys Thr Gly Thr
1780 1785 1790
Gly Cys Cys Ala Gly Gly Cys Cys Cys Ala Cys Gly Gly Cys Thr Thr
1795 1800 1805
Gly Ala Cys Cys Cys Cys Cys Cys Ala Gly Cys Ala Gly Gly Thr Gly
1810 1815 1820
Gly Thr Gly Gly Cys Cys Ala Thr Cys Gly Cys Cys Ala Gly Cys Ala
1825 1830 1835 1840
Ala Thr Gly Gly Cys Gly Gly Thr Gly Gly Cys Ala Ala Gly Cys Ala
1845 1850 1855
Gly Gly Cys Gly Cys Thr Gly Gly Ala Gly Ala Cys Gly Gly Thr Cys
1860 1865 1870
Cys Ala Gly Cys Gly Gly Cys Thr Gly Thr Thr Gly Cys Cys Gly Gly
1875 1880 1885
Thr Gly Cys Thr Gly Thr Gly Cys Cys Ala Gly Gly Cys Cys Cys Ala
1890 1895 1900
Cys Gly Gly Cys Thr Thr Gly Ala Cys Cys Cys Cys Gly Gly Ala Gly
1905 1910 1915 1920
Cys Ala Gly Gly Thr Gly Gly Thr Gly Gly Cys Cys Ala Thr Cys Gly
1925 1930 1935
Cys Cys Ala Gly Cys Cys Ala Cys Gly Ala Thr Gly Gly Cys Gly Gly
1940 1945 1950
Cys Ala Ala Gly Cys Ala Gly Gly Cys Gly Cys Thr Gly Gly Ala Gly
1955 1960 1965
Ala Cys Gly Gly Thr Cys Cys Ala Gly Cys Gly Gly Cys Thr Gly Thr
1970 1975 1980
Thr Gly Cys Cys Gly Gly Thr Gly Cys Thr Gly Thr Gly Cys Cys Ala
1985 1990 1995 2000
Gly Gly Cys Cys Cys Ala Cys Gly Gly Cys Thr Thr Gly Ala Cys Cys
2005 2010 2015
Cys Cys Thr Cys Ala Gly Cys Ala Gly Gly Thr Gly Gly Thr Gly Gly
2020 2025 2030
Cys Cys Ala Thr Cys Gly Cys Cys Ala Gly Cys Ala Ala Thr Gly Gly
2035 2040 2045
Cys Gly Gly Cys Gly Gly Cys Ala Gly Gly Cys Cys Gly Gly Cys Gly
2050 2055 2060
Cys Thr Gly Gly Ala Gly Ala Gly Cys Ala Thr Thr Gly Thr Thr Gly
2065 2070 2075 2080
Cys Cys Cys Ala Gly Thr Thr Ala Thr Cys Thr Cys Gly Cys Cys Cys
2085 2090 2095
Thr Gly Ala Thr Cys Cys Gly Gly Cys Gly Thr Thr Gly Gly Cys Cys
2100 2105 2110
Gly Cys Gly Thr Thr Gly Ala Cys Cys Ala Ala Cys Gly Ala Cys Cys
2115 2120 2125
Ala Cys Cys Thr Cys Gly Thr Cys Gly Cys Cys Thr Thr Gly Gly Cys
2130 2135 2140
Cys Thr Gly Cys Cys Thr Cys Gly Gly Cys Gly Gly Gly Cys Gly Thr
2145 2150 2155 2160
Cys Cys Thr Gly Cys Gly Cys Thr Gly Gly Ala Thr Gly Cys Ala Gly
2165 2170 2175
Thr Gly Ala Ala Ala Ala Ala Gly Gly Gly Ala Thr Thr Gly Gly Gly
2180 2185 2190
Gly Gly Ala Thr Cys Cys Thr Ala Thr Cys Ala Gly Cys Cys Gly Thr
2195 2200 2205
Thr Cys Cys Cys Ala Gly Cys Thr Gly Gly Thr Gly Ala Ala Gly Thr
2210 2215 2220
Cys Cys Gly Ala Gly Cys Thr Gly Gly Ala Gly Gly Ala Gly Ala Ala
2225 2230 2235 2240
Gly Ala Ala Ala Thr Cys Cys Gly Ala Gly Thr Thr Gly Ala Gly Gly
2245 2250 2255
Cys Ala Cys Ala Ala Gly Cys Thr Gly Ala Ala Gly Thr Ala Cys Gly
2260 2265 2270
Thr Gly Cys Cys Cys Cys Ala Cys Gly Ala Gly Thr Ala Cys Ala Thr
2275 2280 2285
Cys Gly Ala Gly Cys Thr Gly Ala Thr Cys Gly Ala Gly Ala Thr Cys
2290 2295 2300
Gly Cys Cys Cys Gly Gly Ala Ala Cys Ala Gly Cys Ala Cys Cys Cys
2305 2310 2315 2320
Ala Gly Gly Ala Cys Cys Gly Thr Ala Thr Cys Cys Thr Gly Gly Ala
2325 2330 2335
Gly Ala Thr Gly Ala Ala Gly Gly Thr Gly Ala Thr Gly Gly Ala Gly
2340 2345 2350
Thr Thr Cys Thr Thr Cys Ala Thr Gly Ala Ala Gly Gly Thr Gly Thr
2355 2360 2365
Ala Cys Gly Gly Cys Thr Ala Cys Ala Gly Gly Gly Gly Cys Ala Ala
2370 2375 2380
Gly Cys Ala Cys Cys Thr Gly Gly Gly Cys Gly Gly Cys Thr Cys Cys
2385 2390 2395 2400
Ala Gly Gly Ala Ala Gly Cys Cys Cys Gly Ala Cys Gly Gly Cys Gly
2405 2410 2415
Cys Cys Ala Thr Cys Thr Ala Cys Ala Cys Cys Gly Thr Gly Gly Gly
2420 2425 2430
Cys Thr Cys Cys Cys Cys Cys Ala Thr Cys Gly Ala Cys Thr Ala Cys
2435 2440 2445
Gly Gly Cys Gly Thr Gly Ala Thr Cys Gly Thr Gly Gly Ala Cys Ala
2450 2455 2460
Cys Cys Ala Ala Gly Gly Cys Cys Thr Ala Cys Thr Cys Cys Gly Gly
2465 2470 2475 2480
Cys Gly Gly Cys Thr Ala Cys Ala Ala Cys Cys Thr Gly Cys Cys Cys
2485 2490 2495
Ala Thr Cys Gly Gly Cys Cys Ala Gly Gly Cys Cys Gly Ala Cys Gly
2500 2505 2510
Ala Ala Ala Thr Gly Cys Ala Gly Ala Gly Gly Thr Ala Cys Gly Thr
2515 2520 2525
Gly Gly Ala Gly Gly Ala Gly Ala Ala Cys Cys Ala Gly Ala Cys Cys
2530 2535 2540
Ala Gly Gly Ala Ala Cys Ala Ala Gly Cys Ala Cys Ala Thr Cys Ala
2545 2550 2555 2560
Ala Cys Cys Cys Cys Ala Ala Cys Gly Ala Gly Thr Gly Gly Thr Gly
2565 2570 2575
Gly Ala Ala Gly Gly Thr Gly Thr Ala Cys Cys Cys Cys Thr Cys Cys
2580 2585 2590
Ala Gly Cys Gly Thr Gly Ala Cys Cys Gly Ala Gly Thr Thr Cys Ala
2595 2600 2605
Ala Gly Thr Thr Cys Cys Thr Gly Thr Thr Cys Gly Thr Gly Thr Cys
2610 2615 2620
Cys Gly Gly Cys Cys Ala Cys Thr Thr Cys Ala Ala Gly Gly Gly Cys
2625 2630 2635 2640
Ala Ala Cys Thr Ala Cys Ala Ala Gly Gly Cys Cys Cys Ala Gly Cys
2645 2650 2655
Thr Gly Ala Cys Cys Ala Gly Gly Cys Thr Gly Ala Ala Cys Cys Ala
2660 2665 2670
Cys Ala Thr Cys Ala Cys Cys Ala Ala Cys Thr Gly Cys Ala Ala Cys
2675 2680 2685
Gly Gly Cys Gly Cys Cys Gly Thr Gly Cys Thr Gly Thr Cys Cys Gly
2690 2695 2700
Thr Gly Gly Ala Gly Gly Ala Gly Cys Thr Cys Cys Thr Gly Ala Thr
2705 2710 2715 2720
Cys Gly Gly Cys Gly Gly Cys Gly Ala Gly Ala Thr Gly Ala Thr Cys
2725 2730 2735
Ala Ala Gly Gly Cys Cys Gly Gly Cys Ala Cys Cys Cys Thr Gly Ala
2740 2745 2750
Cys Cys Cys Thr Gly Gly Ala Gly Gly Ala Gly Gly Thr Gly Ala Gly
2755 2760 2765
Gly Ala Gly Gly Ala Ala Gly Thr Thr Cys Ala Ala Cys Ala Ala Cys
2770 2775 2780
Gly Gly Cys Gly Ala Gly Ala Thr Cys Ala Ala Cys Thr Thr Cys Gly
2785 2790 2795 2800
Cys Gly Gly Cys Cys Gly Ala Cys Thr Gly Ala Thr Ala Ala
2805 2810
<210> 53
<211> 2832
<212> PRT
<213> Искусственная последовательность
<220>
<223> полинуклеотид, кодирующий TRAC_T01-R TALEN
<400> 53
Ala Thr Gly Gly Gly Cys Gly Ala Thr Cys Cys Thr Ala Ala Ala Ala
1 5 10 15
Ala Gly Ala Ala Ala Cys Gly Thr Ala Ala Gly Gly Thr Cys Ala Thr
20 25 30
Cys Gly Ala Thr Ala Ala Gly Gly Ala Gly Ala Cys Cys Gly Cys Cys
35 40 45
Gly Cys Thr Gly Cys Cys Ala Ala Gly Thr Thr Cys Gly Ala Gly Ala
50 55 60
Gly Ala Cys Ala Gly Cys Ala Cys Ala Thr Gly Gly Ala Cys Ala Gly
65 70 75 80
Cys Ala Thr Cys Gly Ala Thr Ala Thr Cys Gly Cys Cys Gly Ala Thr
85 90 95
Cys Thr Ala Cys Gly Cys Ala Cys Gly Cys Thr Cys Gly Gly Cys Thr
100 105 110
Ala Cys Ala Gly Cys Cys Ala Gly Cys Ala Gly Cys Ala Ala Cys Ala
115 120 125
Gly Gly Ala Gly Ala Ala Gly Ala Thr Cys Ala Ala Ala Cys Cys Gly
130 135 140
Ala Ala Gly Gly Thr Thr Cys Gly Thr Thr Cys Gly Ala Cys Ala Gly
145 150 155 160
Thr Gly Gly Cys Gly Cys Ala Gly Cys Ala Cys Cys Ala Cys Gly Ala
165 170 175
Gly Gly Cys Ala Cys Thr Gly Gly Thr Cys Gly Gly Cys Cys Ala Cys
180 185 190
Gly Gly Gly Thr Thr Thr Ala Cys Ala Cys Ala Cys Gly Cys Gly Cys
195 200 205
Ala Cys Ala Thr Cys Gly Thr Thr Gly Cys Gly Thr Thr Ala Ala Gly
210 215 220
Cys Cys Ala Ala Cys Ala Cys Cys Cys Gly Gly Cys Ala Gly Cys Gly
225 230 235 240
Thr Thr Ala Gly Gly Gly Ala Cys Cys Gly Thr Cys Gly Cys Thr Gly
245 250 255
Thr Cys Ala Ala Gly Thr Ala Thr Cys Ala Gly Gly Ala Cys Ala Thr
260 265 270
Gly Ala Thr Cys Gly Cys Ala Gly Cys Gly Thr Thr Gly Cys Cys Ala
275 280 285
Gly Ala Gly Gly Cys Gly Ala Cys Ala Cys Ala Cys Gly Ala Ala Gly
290 295 300
Cys Gly Ala Thr Cys Gly Thr Thr Gly Gly Cys Gly Thr Cys Gly Gly
305 310 315 320
Cys Ala Ala Ala Cys Ala Gly Thr Gly Gly Thr Cys Cys Gly Gly Cys
325 330 335
Gly Cys Ala Cys Gly Cys Gly Cys Thr Cys Thr Gly Gly Ala Gly Gly
340 345 350
Cys Cys Thr Thr Gly Cys Thr Cys Ala Cys Gly Gly Thr Gly Gly Cys
355 360 365
Gly Gly Gly Ala Gly Ala Gly Thr Thr Gly Ala Gly Ala Gly Gly Thr
370 375 380
Cys Cys Ala Cys Cys Gly Thr Thr Ala Cys Ala Gly Thr Thr Gly Gly
385 390 395 400
Ala Cys Ala Cys Ala Gly Gly Cys Cys Ala Ala Cys Thr Thr Cys Thr
405 410 415
Cys Ala Ala Gly Ala Thr Thr Gly Cys Ala Ala Ala Ala Cys Gly Thr
420 425 430
Gly Gly Cys Gly Gly Cys Gly Thr Gly Ala Cys Cys Gly Cys Ala Gly
435 440 445
Thr Gly Gly Ala Gly Gly Cys Ala Gly Thr Gly Cys Ala Thr Gly Cys
450 455 460
Ala Thr Gly Gly Cys Gly Cys Ala Ala Thr Gly Cys Ala Cys Thr Gly
465 470 475 480
Ala Cys Gly Gly Gly Thr Gly Cys Cys Cys Cys Gly Cys Thr Cys Ala
485 490 495
Ala Cys Thr Thr Gly Ala Cys Cys Cys Cys Gly Gly Ala Gly Cys Ala
500 505 510
Gly Gly Thr Gly Gly Thr Gly Gly Cys Cys Ala Thr Cys Gly Cys Cys
515 520 525
Ala Gly Cys Cys Ala Cys Gly Ala Thr Gly Gly Cys Gly Gly Cys Ala
530 535 540
Ala Gly Cys Ala Gly Gly Cys Gly Cys Thr Gly Gly Ala Gly Ala Cys
545 550 555 560
Gly Gly Thr Cys Cys Ala Gly Cys Gly Gly Cys Thr Gly Thr Thr Gly
565 570 575
Cys Cys Gly Gly Thr Gly Cys Thr Gly Thr Gly Cys Cys Ala Gly Gly
580 585 590
Cys Cys Cys Ala Cys Gly Gly Cys Thr Thr Gly Ala Cys Cys Cys Cys
595 600 605
Cys Cys Ala Gly Cys Ala Gly Gly Thr Gly Gly Thr Gly Gly Cys Cys
610 615 620
Ala Thr Cys Gly Cys Cys Ala Gly Cys Ala Ala Thr Gly Gly Cys Gly
625 630 635 640
Gly Thr Gly Gly Cys Ala Ala Gly Cys Ala Gly Gly Cys Gly Cys Thr
645 650 655
Gly Gly Ala Gly Ala Cys Gly Gly Thr Cys Cys Ala Gly Cys Gly Gly
660 665 670
Cys Thr Gly Thr Thr Gly Cys Cys Gly Gly Thr Gly Cys Thr Gly Thr
675 680 685
Gly Cys Cys Ala Gly Gly Cys Cys Cys Ala Cys Gly Gly Cys Thr Thr
690 695 700
Gly Ala Cys Cys Cys Cys Gly Gly Ala Gly Cys Ala Gly Gly Thr Gly
705 710 715 720
Gly Thr Gly Gly Cys Cys Ala Thr Cys Gly Cys Cys Ala Gly Cys Cys
725 730 735
Ala Cys Gly Ala Thr Gly Gly Cys Gly Gly Cys Ala Ala Gly Cys Ala
740 745 750
Gly Gly Cys Gly Cys Thr Gly Gly Ala Gly Ala Cys Gly Gly Thr Cys
755 760 765
Cys Ala Gly Cys Gly Gly Cys Thr Gly Thr Thr Gly Cys Cys Gly Gly
770 775 780
Thr Gly Cys Thr Gly Thr Gly Cys Cys Ala Gly Gly Cys Cys Cys Ala
785 790 795 800
Cys Gly Gly Cys Thr Thr Gly Ala Cys Cys Cys Cys Gly Gly Ala Gly
805 810 815
Cys Ala Gly Gly Thr Gly Gly Thr Gly Gly Cys Cys Ala Thr Cys Gly
820 825 830
Cys Cys Ala Gly Cys Ala Ala Thr Ala Thr Thr Gly Gly Thr Gly Gly
835 840 845
Cys Ala Ala Gly Cys Ala Gly Gly Cys Gly Cys Thr Gly Gly Ala Gly
850 855 860
Ala Cys Gly Gly Thr Gly Cys Ala Gly Gly Cys Gly Cys Thr Gly Thr
865 870 875 880
Thr Gly Cys Cys Gly Gly Thr Gly Cys Thr Gly Thr Gly Cys Cys Ala
885 890 895
Gly Gly Cys Cys Cys Ala Cys Gly Gly Cys Thr Thr Gly Ala Cys Cys
900 905 910
Cys Cys Cys Cys Ala Gly Cys Ala Gly Gly Thr Gly Gly Thr Gly Gly
915 920 925
Cys Cys Ala Thr Cys Gly Cys Cys Ala Gly Cys Ala Ala Thr Ala Ala
930 935 940
Thr Gly Gly Thr Gly Gly Cys Ala Ala Gly Cys Ala Gly Gly Cys Gly
945 950 955 960
Cys Thr Gly Gly Ala Gly Ala Cys Gly Gly Thr Cys Cys Ala Gly Cys
965 970 975
Gly Gly Cys Thr Gly Thr Thr Gly Cys Cys Gly Gly Thr Gly Cys Thr
980 985 990
Gly Thr Gly Cys Cys Ala Gly Gly Cys Cys Cys Ala Cys Gly Gly Cys
995 1000 1005
Thr Thr Gly Ala Cys Cys Cys Cys Gly Gly Ala Gly Cys Ala Gly Gly
1010 1015 1020
Thr Gly Gly Thr Gly Gly Cys Cys Ala Thr Cys Gly Cys Cys Ala Gly
1025 1030 1035 1040
Cys Cys Ala Cys Gly Ala Thr Gly Gly Cys Gly Gly Cys Ala Ala Gly
1045 1050 1055
Cys Ala Gly Gly Cys Gly Cys Thr Gly Gly Ala Gly Ala Cys Gly Gly
1060 1065 1070
Thr Cys Cys Ala Gly Cys Gly Gly Cys Thr Gly Thr Thr Gly Cys Cys
1075 1080 1085
Gly Gly Thr Gly Cys Thr Gly Thr Gly Cys Cys Ala Gly Gly Cys Cys
1090 1095 1100
Cys Ala Cys Gly Gly Cys Thr Thr Gly Ala Cys Cys Cys Cys Cys Cys
1105 1110 1115 1120
Ala Gly Cys Ala Gly Gly Thr Gly Gly Thr Gly Gly Cys Cys Ala Thr
1125 1130 1135
Cys Gly Cys Cys Ala Gly Cys Ala Ala Thr Gly Gly Cys Gly Gly Thr
1140 1145 1150
Gly Gly Cys Ala Ala Gly Cys Ala Gly Gly Cys Gly Cys Thr Gly Gly
1155 1160 1165
Ala Gly Ala Cys Gly Gly Thr Cys Cys Ala Gly Cys Gly Gly Cys Thr
1170 1175 1180
Gly Thr Thr Gly Cys Cys Gly Gly Thr Gly Cys Thr Gly Thr Gly Cys
1185 1190 1195 1200
Cys Ala Gly Gly Cys Cys Cys Ala Cys Gly Gly Cys Thr Thr Gly Ala
1205 1210 1215
Cys Cys Cys Cys Cys Cys Ala Gly Cys Ala Gly Gly Thr Gly Gly Thr
1220 1225 1230
Gly Gly Cys Cys Ala Thr Cys Gly Cys Cys Ala Gly Cys Ala Ala Thr
1235 1240 1245
Ala Ala Thr Gly Gly Thr Gly Gly Cys Ala Ala Gly Cys Ala Gly Gly
1250 1255 1260
Cys Gly Cys Thr Gly Gly Ala Gly Ala Cys Gly Gly Thr Cys Cys Ala
1265 1270 1275 1280
Gly Cys Gly Gly Cys Thr Gly Thr Thr Gly Cys Cys Gly Gly Thr Gly
1285 1290 1295
Cys Thr Gly Thr Gly Cys Cys Ala Gly Gly Cys Cys Cys Ala Cys Gly
1300 1305 1310
Gly Cys Thr Thr Gly Ala Cys Cys Cys Cys Cys Cys Ala Gly Cys Ala
1315 1320 1325
Gly Gly Thr Gly Gly Thr Gly Gly Cys Cys Ala Thr Cys Gly Cys Cys
1330 1335 1340
Ala Gly Cys Ala Ala Thr Ala Ala Thr Gly Gly Thr Gly Gly Cys Ala
1345 1350 1355 1360
Ala Gly Cys Ala Gly Gly Cys Gly Cys Thr Gly Gly Ala Gly Ala Cys
1365 1370 1375
Gly Gly Thr Cys Cys Ala Gly Cys Gly Gly Cys Thr Gly Thr Thr Gly
1380 1385 1390
Cys Cys Gly Gly Thr Gly Cys Thr Gly Thr Gly Cys Cys Ala Gly Gly
1395 1400 1405
Cys Cys Cys Ala Cys Gly Gly Cys Thr Thr Gly Ala Cys Cys Cys Cys
1410 1415 1420
Cys Cys Ala Gly Cys Ala Gly Gly Thr Gly Gly Thr Gly Gly Cys Cys
1425 1430 1435 1440
Ala Thr Cys Gly Cys Cys Ala Gly Cys Ala Ala Thr Gly Gly Cys Gly
1445 1450 1455
Gly Thr Gly Gly Cys Ala Ala Gly Cys Ala Gly Gly Cys Gly Cys Thr
1460 1465 1470
Gly Gly Ala Gly Ala Cys Gly Gly Thr Cys Cys Ala Gly Cys Gly Gly
1475 1480 1485
Cys Thr Gly Thr Thr Gly Cys Cys Gly Gly Thr Gly Cys Thr Gly Thr
1490 1495 1500
Gly Cys Cys Ala Gly Gly Cys Cys Cys Ala Cys Gly Gly Cys Thr Thr
1505 1510 1515 1520
Gly Ala Cys Cys Cys Cys Gly Gly Ala Gly Cys Ala Gly Gly Thr Gly
1525 1530 1535
Gly Thr Gly Gly Cys Cys Ala Thr Cys Gly Cys Cys Ala Gly Cys Ala
1540 1545 1550
Ala Thr Ala Thr Thr Gly Gly Thr Gly Gly Cys Ala Ala Gly Cys Ala
1555 1560 1565
Gly Gly Cys Gly Cys Thr Gly Gly Ala Gly Ala Cys Gly Gly Thr Gly
1570 1575 1580
Cys Ala Gly Gly Cys Gly Cys Thr Gly Thr Thr Gly Cys Cys Gly Gly
1585 1590 1595 1600
Thr Gly Cys Thr Gly Thr Gly Cys Cys Ala Gly Gly Cys Cys Cys Ala
1605 1610 1615
Cys Gly Gly Cys Thr Thr Gly Ala Cys Cys Cys Cys Gly Gly Ala Gly
1620 1625 1630
Cys Ala Gly Gly Thr Gly Gly Thr Gly Gly Cys Cys Ala Thr Cys Gly
1635 1640 1645
Cys Cys Ala Gly Cys Cys Ala Cys Gly Ala Thr Gly Gly Cys Gly Gly
1650 1655 1660
Cys Ala Ala Gly Cys Ala Gly Gly Cys Gly Cys Thr Gly Gly Ala Gly
1665 1670 1675 1680
Ala Cys Gly Gly Thr Cys Cys Ala Gly Cys Gly Gly Cys Thr Gly Thr
1685 1690 1695
Thr Gly Cys Cys Gly Gly Thr Gly Cys Thr Gly Thr Gly Cys Cys Ala
1700 1705 1710
Gly Gly Cys Cys Cys Ala Cys Gly Gly Cys Thr Thr Gly Ala Cys Cys
1715 1720 1725
Cys Cys Gly Gly Ala Gly Cys Ala Gly Gly Thr Gly Gly Thr Gly Gly
1730 1735 1740
Cys Cys Ala Thr Cys Gly Cys Cys Ala Gly Cys Ala Ala Thr Ala Thr
1745 1750 1755 1760
Thr Gly Gly Thr Gly Gly Cys Ala Ala Gly Cys Ala Gly Gly Cys Gly
1765 1770 1775
Cys Thr Gly Gly Ala Gly Ala Cys Gly Gly Thr Gly Cys Ala Gly Gly
1780 1785 1790
Cys Gly Cys Thr Gly Thr Thr Gly Cys Cys Gly Gly Thr Gly Cys Thr
1795 1800 1805
Gly Thr Gly Cys Cys Ala Gly Gly Cys Cys Cys Ala Cys Gly Gly Cys
1810 1815 1820
Thr Thr Gly Ala Cys Cys Cys Cys Gly Gly Ala Gly Cys Ala Gly Gly
1825 1830 1835 1840
Thr Gly Gly Thr Gly Gly Cys Cys Ala Thr Cys Gly Cys Cys Ala Gly
1845 1850 1855
Cys Cys Ala Cys Gly Ala Thr Gly Gly Cys Gly Gly Cys Ala Ala Gly
1860 1865 1870
Cys Ala Gly Gly Cys Gly Cys Thr Gly Gly Ala Gly Ala Cys Gly Gly
1875 1880 1885
Thr Cys Cys Ala Gly Cys Gly Gly Cys Thr Gly Thr Thr Gly Cys Cys
1890 1895 1900
Gly Gly Thr Gly Cys Thr Gly Thr Gly Cys Cys Ala Gly Gly Cys Cys
1905 1910 1915 1920
Cys Ala Cys Gly Gly Cys Thr Thr Gly Ala Cys Cys Cys Cys Cys Cys
1925 1930 1935
Ala Gly Cys Ala Gly Gly Thr Gly Gly Thr Gly Gly Cys Cys Ala Thr
1940 1945 1950
Cys Gly Cys Cys Ala Gly Cys Ala Ala Thr Ala Ala Thr Gly Gly Thr
1955 1960 1965
Gly Gly Cys Ala Ala Gly Cys Ala Gly Gly Cys Gly Cys Thr Gly Gly
1970 1975 1980
Ala Gly Ala Cys Gly Gly Thr Cys Cys Ala Gly Cys Gly Gly Cys Thr
1985 1990 1995 2000
Gly Thr Thr Gly Cys Cys Gly Gly Thr Gly Cys Thr Gly Thr Gly Cys
2005 2010 2015
Cys Ala Gly Gly Cys Cys Cys Ala Cys Gly Gly Cys Thr Thr Gly Ala
2020 2025 2030
Cys Cys Cys Cys Thr Cys Ala Gly Cys Ala Gly Gly Thr Gly Gly Thr
2035 2040 2045
Gly Gly Cys Cys Ala Thr Cys Gly Cys Cys Ala Gly Cys Ala Ala Thr
2050 2055 2060
Gly Gly Cys Gly Gly Cys Gly Gly Cys Ala Gly Gly Cys Cys Gly Gly
2065 2070 2075 2080
Cys Gly Cys Thr Gly Gly Ala Gly Ala Gly Cys Ala Thr Thr Gly Thr
2085 2090 2095
Thr Gly Cys Cys Cys Ala Gly Thr Thr Ala Thr Cys Thr Cys Gly Cys
2100 2105 2110
Cys Cys Thr Gly Ala Thr Cys Cys Gly Gly Cys Gly Thr Thr Gly Gly
2115 2120 2125
Cys Cys Gly Cys Gly Thr Thr Gly Ala Cys Cys Ala Ala Cys Gly Ala
2130 2135 2140
Cys Cys Ala Cys Cys Thr Cys Gly Thr Cys Gly Cys Cys Thr Thr Gly
2145 2150 2155 2160
Gly Cys Cys Thr Gly Cys Cys Thr Cys Gly Gly Cys Gly Gly Gly Cys
2165 2170 2175
Gly Thr Cys Cys Thr Gly Cys Gly Cys Thr Gly Gly Ala Thr Gly Cys
2180 2185 2190
Ala Gly Thr Gly Ala Ala Ala Ala Ala Gly Gly Gly Ala Thr Thr Gly
2195 2200 2205
Gly Gly Gly Gly Ala Thr Cys Cys Thr Ala Thr Cys Ala Gly Cys Cys
2210 2215 2220
Gly Thr Thr Cys Cys Cys Ala Gly Cys Thr Gly Gly Thr Gly Ala Ala
2225 2230 2235 2240
Gly Thr Cys Cys Gly Ala Gly Cys Thr Gly Gly Ala Gly Gly Ala Gly
2245 2250 2255
Ala Ala Gly Ala Ala Ala Thr Cys Cys Gly Ala Gly Thr Thr Gly Ala
2260 2265 2270
Gly Gly Cys Ala Cys Ala Ala Gly Cys Thr Gly Ala Ala Gly Thr Ala
2275 2280 2285
Cys Gly Thr Gly Cys Cys Cys Cys Ala Cys Gly Ala Gly Thr Ala Cys
2290 2295 2300
Ala Thr Cys Gly Ala Gly Cys Thr Gly Ala Thr Cys Gly Ala Gly Ala
2305 2310 2315 2320
Thr Cys Gly Cys Cys Cys Gly Gly Ala Ala Cys Ala Gly Cys Ala Cys
2325 2330 2335
Cys Cys Ala Gly Gly Ala Cys Cys Gly Thr Ala Thr Cys Cys Thr Gly
2340 2345 2350
Gly Ala Gly Ala Thr Gly Ala Ala Gly Gly Thr Gly Ala Thr Gly Gly
2355 2360 2365
Ala Gly Thr Thr Cys Thr Thr Cys Ala Thr Gly Ala Ala Gly Gly Thr
2370 2375 2380
Gly Thr Ala Cys Gly Gly Cys Thr Ala Cys Ala Gly Gly Gly Gly Cys
2385 2390 2395 2400
Ala Ala Gly Cys Ala Cys Cys Thr Gly Gly Gly Cys Gly Gly Cys Thr
2405 2410 2415
Cys Cys Ala Gly Gly Ala Ala Gly Cys Cys Cys Gly Ala Cys Gly Gly
2420 2425 2430
Cys Gly Cys Cys Ala Thr Cys Thr Ala Cys Ala Cys Cys Gly Thr Gly
2435 2440 2445
Gly Gly Cys Thr Cys Cys Cys Cys Cys Ala Thr Cys Gly Ala Cys Thr
2450 2455 2460
Ala Cys Gly Gly Cys Gly Thr Gly Ala Thr Cys Gly Thr Gly Gly Ala
2465 2470 2475 2480
Cys Ala Cys Cys Ala Ala Gly Gly Cys Cys Thr Ala Cys Thr Cys Cys
2485 2490 2495
Gly Gly Cys Gly Gly Cys Thr Ala Cys Ala Ala Cys Cys Thr Gly Cys
2500 2505 2510
Cys Cys Ala Thr Cys Gly Gly Cys Cys Ala Gly Gly Cys Cys Gly Ala
2515 2520 2525
Cys Gly Ala Ala Ala Thr Gly Cys Ala Gly Ala Gly Gly Thr Ala Cys
2530 2535 2540
Gly Thr Gly Gly Ala Gly Gly Ala Gly Ala Ala Cys Cys Ala Gly Ala
2545 2550 2555 2560
Cys Cys Ala Gly Gly Ala Ala Cys Ala Ala Gly Cys Ala Cys Ala Thr
2565 2570 2575
Cys Ala Ala Cys Cys Cys Cys Ala Ala Cys Gly Ala Gly Thr Gly Gly
2580 2585 2590
Thr Gly Gly Ala Ala Gly Gly Thr Gly Thr Ala Cys Cys Cys Cys Thr
2595 2600 2605
Cys Cys Ala Gly Cys Gly Thr Gly Ala Cys Cys Gly Ala Gly Thr Thr
2610 2615 2620
Cys Ala Ala Gly Thr Thr Cys Cys Thr Gly Thr Thr Cys Gly Thr Gly
2625 2630 2635 2640
Thr Cys Cys Gly Gly Cys Cys Ala Cys Thr Thr Cys Ala Ala Gly Gly
2645 2650 2655
Gly Cys Ala Ala Cys Thr Ala Cys Ala Ala Gly Gly Cys Cys Cys Ala
2660 2665 2670
Gly Cys Thr Gly Ala Cys Cys Ala Gly Gly Cys Thr Gly Ala Ala Cys
2675 2680 2685
Cys Ala Cys Ala Thr Cys Ala Cys Cys Ala Ala Cys Thr Gly Cys Ala
2690 2695 2700
Ala Cys Gly Gly Cys Gly Cys Cys Gly Thr Gly Cys Thr Gly Thr Cys
2705 2710 2715 2720
Cys Gly Thr Gly Gly Ala Gly Gly Ala Gly Cys Thr Cys Cys Thr Gly
2725 2730 2735
Ala Thr Cys Gly Gly Cys Gly Gly Cys Gly Ala Gly Ala Thr Gly Ala
2740 2745 2750
Thr Cys Ala Ala Gly Gly Cys Cys Gly Gly Cys Ala Cys Cys Cys Thr
2755 2760 2765
Gly Ala Cys Cys Cys Thr Gly Gly Ala Gly Gly Ala Gly Gly Thr Gly
2770 2775 2780
Ala Gly Gly Ala Gly Gly Ala Ala Gly Thr Thr Cys Ala Ala Cys Ala
2785 2790 2795 2800
Ala Cys Gly Gly Cys Gly Ala Gly Ala Thr Cys Ala Ala Cys Thr Thr
2805 2810 2815
Cys Gly Cys Gly Gly Cys Cys Gly Ala Cys Thr Gly Ala Thr Ala Ala
2820 2825 2830
<210> 54
<211> 113
<212> PRT
<213> Искусственная последовательность
<220>
<223> Гуманизированный scFv Klon43, вариант VL1
<400> 54
Met Ala Asp Tyr Lys Asp Ile Val Met Thr Gln Ser Pro Ser Ser Val
1 5 10 15
Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln
20 25 30
Asn Val Asp Ser Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala
35 40 45
Pro Lys Ala Leu Ile Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro
50 55 60
Ser Arg Phe Ser Gly Arg Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
65 70 75 80
Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr
85 90 95
Tyr Ser Thr Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg
<210> 55
<211> 113
<212> PRT
<213> Искусственная последовательность
<220>
<223> Гуманизированный scFv Klon43, вариант VL2
<400> 55
Met Ala Asp Tyr Lys Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val
1 5 10 15
Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln
20 25 30
Asn Val Asp Ser Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala
35 40 45
Pro Lys Ala Leu Ile Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro
50 55 60
Ser Arg Phe Ser Gly Arg Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
65 70 75 80
Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr
85 90 95
Tyr Ser Thr Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg
<210> 56
<211> 113
<212> PRT
<213> Искусственная последовательность
<220>
<223> Гуманизированный scFv Klon43, вариант VL3
<400> 56
Met Ala Asp Tyr Lys Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val
1 5 10 15
Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln
20 25 30
Asn Val Asp Ser Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala
35 40 45
Pro Lys Ala Leu Ile Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro
50 55 60
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
65 70 75 80
Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr
85 90 95
Tyr Ser Thr Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg
<210> 57
<211> 113
<212> PRT
<213> Искусственная последовательность
<220>
<223> Гуманизированный scFv Klon43, вариант VL4
<400> 57
Met Ala Asp Tyr Lys Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val
1 5 10 15
Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln
20 25 30
Asn Val Asp Ser Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala
35 40 45
Pro Lys Leu Leu Ile Tyr Ser Ala Ser Tyr Arg Tyr Ser Gly Val Pro
50 55 60
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
65 70 75 80
Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr
85 90 95
Tyr Ser Thr Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg
<210> 58
<211> 113
<212> PRT
<213> Искусственная последовательность
<220>
<223> Гуманизированный scFv Klon43, вариант VL5
<400> 58
Met Ala Asp Tyr Lys Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val
1 5 10 15
Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln
20 25 30
Asn Val Asp Ser Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala
35 40 45
Pro Lys Leu Leu Ile Tyr Ser Ala Ser Tyr Arg Gln Ser Gly Val Pro
50 55 60
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
65 70 75 80
Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr
85 90 95
Tyr Ser Thr Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg
<210> 59
<211> 113
<212> PRT
<213> Искусственная последовательность
<220>
<223> Гуманизированный scFv Klon43, вариант VL6
<400> 59
Met Ala Asp Tyr Lys Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Val
1 5 10 15
Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln
20 25 30
Asn Val Asp Ser Ala Val Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala
35 40 45
Pro Lys Leu Leu Ile Tyr Ser Ala Ser Tyr Gly Gln Ser Gly Val Pro
50 55 60
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
65 70 75 80
Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Tyr
85 90 95
Tyr Ser Thr Pro Trp Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys
100 105 110
Arg
<210> 60
<211> 127
<212> PRT
<213> Искусственная последовательность
<220>
<223> Гуманизированный scFv Klon43, вариант VH1
<400> 60
Glu Val Lys Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Leu Ile Arg Ser Lys Ala Asp Gly Tyr Thr Thr Glu Tyr Ser Ala
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Ala Arg Asp Ala Ala Tyr Tyr Ser Tyr Tyr Ser Pro Glu Gly
100 105 110
Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 61
<211> 127
<212> PRT
<213> Искусственная последовательность
<220>
<223> Гуманизированный scFv Klon43, вариант VH2
<400> 61
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Leu Ile Arg Ser Lys Ala Asp Gly Tyr Thr Thr Glu Tyr Ser Ala
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile
65 70 75 80
Leu Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Ala Arg Asp Ala Ala Tyr Tyr Ser Tyr Tyr Ser Pro Glu Gly
100 105 110
Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 62
<211> 127
<212> PRT
<213> Искусственная последовательность
<220>
<223> Гуманизированный scFv Klon43, вариант VH3
<400> 62
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Leu Ile Arg Ser Lys Ala Asp Gly Tyr Thr Thr Glu Tyr Ser Ala
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile
65 70 75 80
Ala Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Ala Arg Asp Ala Ala Tyr Tyr Ser Tyr Tyr Ser Pro Glu Gly
100 105 110
Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 63
<211> 127
<212> PRT
<213> Искусственная последовательность
<220>
<223> Гуманизированный scFv Klon43, вариант VH4
<400> 63
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Phe Ile Arg Ser Lys Ala Asp Gly Tyr Thr Thr Glu Tyr Ser Ala
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile
65 70 75 80
Ala Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Ala Arg Asp Ala Ala Tyr Tyr Ser Tyr Tyr Ser Pro Glu Gly
100 105 110
Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 64
<211> 127
<212> PRT
<213> Искусственная последовательность
<220>
<223> Гуманизированный scFv Klon43, вариант VH5
<400> 64
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Phe Ile Arg Ser Lys Ala Asp Gly Tyr Thr Thr Glu Tyr Ala Ala
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile
65 70 75 80
Ala Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Ala Arg Asp Ala Ala Tyr Tyr Ser Tyr Tyr Ser Pro Glu Gly
100 105 110
Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 65
<211> 127
<212> PRT
<213> Искусственная последовательность
<220>
<223> Гуманизированный scFv Klon43, вариант VH6
<400> 65
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Leu Ile Arg Ser Lys Ala Asp Gly Tyr Thr Thr Glu Tyr Ala Ala
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile
65 70 75 80
Ala Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Ala Arg Asp Ala Ala Tyr Tyr Ser Tyr Tyr Ser Pro Glu Gly
100 105 110
Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 66
<211> 127
<212> PRT
<213> Искусственная последовательность
<220>
<223> Гуманизированный scFv Klon43, вариант VH7
<400> 66
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Thr Ala Ser Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Gly Phe Ile Arg Ser Lys Ala Asp Gly Tyr Thr Thr Glu Tyr Ala Ala
50 55 60
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asp Ser Lys Ser Ile
65 70 75 80
Ala Tyr Leu Gln Met Asn Ser Leu Lys Thr Glu Asp Thr Ala Val Tyr
85 90 95
Tyr Cys Thr Arg Asp Ala Ala Tyr Tyr Ser Tyr Tyr Ser Pro Glu Gly
100 105 110
Ala Met Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120 125
<210> 67
<211> 8
<212> PRT
<213> Искусственная последовательность
<220>
<223> CDR1
<400> 67
Gly Phe Thr Phe Thr Asp Tyr Tyr
1 5
<210> 68
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> CDR2
<400> 68
Arg Ser Lys Ala Asp Gly Tyr Thr Thr
1 5
<210> 69
<211> 18
<212> PRT
<213> Искусственная последовательность
<220>
<223> CDR3
<400> 69
Ala Arg Asp Ala Ala Tyr Tyr Ser Tyr Tyr Ser Pro Glu Gly Ala Met
1 5 10 15
Asp Tyr
<210> 70
<211> 6
<212> PRT
<213> Искусственная последовательность
<220>
<223> CDR4
<400> 70
Gln Asn Val Asp Ser Ala
1 5
<210> 71
<211> 3
<212> PRT
<213> Искусственная последовательность
<220>
<223> CDR5
<400> 71
Ser Ala Ser
1
<210> 72
<211> 9
<212> PRT
<213> Искусственная последовательность
<220>
<223> CDR6
<400> 72
Gln Gln Tyr Tyr Ser Thr Pro Trp Thr
1 5
<210> 73
<211> 117
<212> PRT
<213> Искусственная последовательность
<220>
<223> hVH Klo43-3, стандартный
<400> 73
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
1 5 10 15
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Gly Phe Thr Phe Thr Asp Tyr
20 25 30
Tyr Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
35 40 45
Xaa Xaa Ile Arg Ser Lys Ala Asp Gly Tyr Thr Thr Xaa Xaa Xaa Xaa
50 55 60
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
65 70 75 80
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Ala Arg Asp Ala Ala Tyr Tyr Ser
85 90 95
Tyr Tyr Ser Pro Glu Gly Ala Met Asp Tyr Xaa Xaa Xaa Xaa Xaa Xaa
100 105 110
Xaa Xaa Xaa Xaa Xaa
115
<210> 74
<211> 111
<212> PRT
<213> Искусственная последовательность
<220>
<223> hVL Klo43-3, стандартный
<400> 74
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
1 5 10 15
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Gln
20 25 30
Asn Val Asp Ser Ala Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
35 40 45
Xaa Xaa Xaa Xaa Xaa Xaa Ser Ala Ser Xaa Xaa Xaa Xaa Xaa Xaa Xaa
50 55 60
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
65 70 75 80
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Gln Gln Tyr
85 90 95
Tyr Ser Thr Pro Trp Thr Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
100 105 110
<210> 75
<211> 470
<212> PRT
<213> Искусственная последовательность
<220>
<223> Klo43-1+SP
<400> 75
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Lys Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Ser Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Thr Asp Tyr Tyr Met Ser Trp Val Arg Gln Pro Pro Gly Lys
50 55 60
Ala Leu Glu Trp Leu Ala Leu Ile Arg Ser Lys Ala Asp Gly Tyr Thr
65 70 75 80
Thr Glu Tyr Ser Ala Ser Val Lys Gly Arg Phe Thr Leu Ser Arg Asp
85 90 95
Asp Ser Gln Ser Ile Leu Tyr Leu Gln Met Asn Ala Leu Arg Pro Glu
100 105 110
Asp Ser Ala Thr Tyr Tyr Cys Ala Arg Asp Ala Ala Tyr Tyr Ser Tyr
115 120 125
Tyr Ser Pro Glu Gly Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser Val
130 135 140
Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
145 150 155 160
Gly Gly Ser Met Ala Asp Tyr Lys Asp Ile Val Met Thr Gln Ser His
165 170 175
Lys Phe Met Ser Thr Ser Val Gly Asp Arg Val Asn Ile Thr Cys Lys
180 185 190
Ala Ser Gln Asn Val Asp Ser Ala Val Ala Trp Tyr Gln Gln Lys Pro
195 200 205
Gly Gln Ser Pro Lys Ala Leu Ile Tyr Ser Ala Ser Tyr Arg Tyr Ser
210 215 220
Gly Val Pro Asp Arg Phe Thr Gly Arg Gly Ser Gly Thr Asp Phe Thr
225 230 235 240
Leu Thr Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys
245 250 255
Gln Gln Tyr Tyr Ser Thr Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu
260 265 270
Glu Ile Lys Arg Gly Leu Ala Val Ser Thr Ile Ser Ser Phe Phe Pro
275 280 285
Pro Gly Tyr Gln Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly
290 295 300
Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg
305 310 315 320
Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln
325 330 335
Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu
340 345 350
Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala
355 360 365
Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu
370 375 380
Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp
385 390 395 400
Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu
405 410 415
Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile
420 425 430
Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr
435 440 445
Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met
450 455 460
Gln Ala Leu Pro Pro Arg
465 470
<210> 76
<211> 499
<212> PRT
<213> Искусственная последовательность
<220>
<223> Klo43-3+SP
<400> 76
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Lys Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Ser Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Thr Asp Tyr Tyr Met Ser Trp Val Arg Gln Pro Pro Gly Lys
50 55 60
Ala Leu Glu Trp Leu Ala Leu Ile Arg Ser Lys Ala Asp Gly Tyr Thr
65 70 75 80
Thr Glu Tyr Ser Ala Ser Val Lys Gly Arg Phe Thr Leu Ser Arg Asp
85 90 95
Asp Ser Gln Ser Ile Leu Tyr Leu Gln Met Asn Ala Leu Arg Pro Glu
100 105 110
Asp Ser Ala Thr Tyr Tyr Cys Ala Arg Asp Ala Ala Tyr Tyr Ser Tyr
115 120 125
Tyr Ser Pro Glu Gly Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser Val
130 135 140
Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
145 150 155 160
Gly Gly Ser Met Ala Asp Tyr Lys Asp Ile Val Met Thr Gln Ser His
165 170 175
Lys Phe Met Ser Thr Ser Val Gly Asp Arg Val Asn Ile Thr Cys Lys
180 185 190
Ala Ser Gln Asn Val Asp Ser Ala Val Ala Trp Tyr Gln Gln Lys Pro
195 200 205
Gly Gln Ser Pro Lys Ala Leu Ile Tyr Ser Ala Ser Tyr Arg Tyr Ser
210 215 220
Gly Val Pro Asp Arg Phe Thr Gly Arg Gly Ser Gly Thr Asp Phe Thr
225 230 235 240
Leu Thr Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys
245 250 255
Gln Gln Tyr Tyr Ser Thr Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu
260 265 270
Glu Ile Lys Arg Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala
275 280 285
Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg
290 295 300
Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys
305 310 315 320
Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu
325 330 335
Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu
340 345 350
Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln
355 360 365
Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly
370 375 380
Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr
385 390 395 400
Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg
405 410 415
Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met
420 425 430
Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu
435 440 445
Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys
450 455 460
Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu
465 470 475 480
Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu
485 490 495
Pro Pro Arg
<210> 77
<211> 685
<212> PRT
<213> Искусственная последовательность
<220>
<223> Klo43-5+SP
<400> 77
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Glu Val Lys Leu Val Glu Ser Gly Gly Gly Leu
20 25 30
Val Gln Pro Gly Gly Ser Leu Ser Leu Ser Cys Ala Ala Ser Gly Phe
35 40 45
Thr Phe Thr Asp Tyr Tyr Met Ser Trp Val Arg Gln Pro Pro Gly Lys
50 55 60
Ala Leu Glu Trp Leu Ala Leu Ile Arg Ser Lys Ala Asp Gly Tyr Thr
65 70 75 80
Thr Glu Tyr Ser Ala Ser Val Lys Gly Arg Phe Thr Leu Ser Arg Asp
85 90 95
Asp Ser Gln Ser Ile Leu Tyr Leu Gln Met Asn Ala Leu Arg Pro Glu
100 105 110
Asp Ser Ala Thr Tyr Tyr Cys Ala Arg Asp Ala Ala Tyr Tyr Ser Tyr
115 120 125
Tyr Ser Pro Glu Gly Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser Val
130 135 140
Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
145 150 155 160
Gly Gly Ser Met Ala Asp Tyr Lys Asp Ile Val Met Thr Gln Ser His
165 170 175
Lys Phe Met Ser Thr Ser Val Gly Asp Arg Val Asn Ile Thr Cys Lys
180 185 190
Ala Ser Gln Asn Val Asp Ser Ala Val Ala Trp Tyr Gln Gln Lys Pro
195 200 205
Gly Gln Ser Pro Lys Ala Leu Ile Tyr Ser Ala Ser Tyr Arg Tyr Ser
210 215 220
Gly Val Pro Asp Arg Phe Thr Gly Arg Gly Ser Gly Thr Asp Phe Thr
225 230 235 240
Leu Thr Ile Ser Ser Val Gln Ala Glu Asp Leu Ala Val Tyr Tyr Cys
245 250 255
Gln Gln Tyr Tyr Ser Thr Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu
260 265 270
Glu Ile Lys Arg Glu Pro Lys Ser Pro Asp Lys Thr His Thr Cys Pro
275 280 285
Pro Cys Pro Ala Pro Pro Val Ala Gly Pro Ser Val Phe Leu Phe Pro
290 295 300
Pro Lys Pro Lys Asp Thr Leu Met Ile Ala Arg Thr Pro Glu Val Thr
305 310 315 320
Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn
325 330 335
Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg
340 345 350
Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val
355 360 365
Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser
370 375 380
Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys
385 390 395 400
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp
405 410 415
Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
420 425 430
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu
435 440 445
Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe
450 455 460
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
465 470 475 480
Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr
485 490 495
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Ile Tyr Ile Trp Ala
500 505 510
Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr
515 520 525
Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln
530 535 540
Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser
545 550 555 560
Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys
565 570 575
Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln
580 585 590
Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu
595 600 605
Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg
610 615 620
Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met
625 630 635 640
Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly
645 650 655
Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp
660 665 670
Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
675 680 685
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР (CAR) ПРОТИВ CD123 ДЛЯ ИСПОЛЬЗОВАНИЯ В ЛЕЧЕНИИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ | 2015 |
|
RU2724999C2 |
| CD20 ТЕРАПИЯ, CD22 ТЕРАПИЯ И КОМБИНИРОВАННАЯ ТЕРАПИЯ КЛЕТКАМИ, ЭКСПРЕССИРУЮЩИМИ ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР (CAR) K CD19 | 2016 |
|
RU2752918C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ ДЛЯ ЛЕЧЕНИЯ РАКА | 2017 |
|
RU2826270C2 |
| РЕКРУТИРУЮЩИЕ Т-КЛЕТКИ ПОЛИПЕПТИДЫ, СПОСОБНЫЕ СВЯЗЫВАТЬ CD123 И TCR АЛЬФА/БЕТА | 2017 |
|
RU2775063C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ИЗБИРАТЕЛЬНОЙ ЭКСПРЕССИИ БЕЛКА | 2017 |
|
RU2795467C2 |
| ИММУННЫЕ КЛЕТКИ, ЭКСПРЕССИРУЮЩИЕ ОБРАТНЫЙ УНИВЕРСАЛЬНЫЙ ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР, ДЛЯ НАЦЕЛИВАНИЯ НА РАЗЛИЧНЫЕ МНОГОЧИСЛЕННЫЕ АНТИГЕНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ РАКА, ИНФЕКЦИЙ И АУТОИММУННЫХ ЗАБОЛЕВАНИЙ | 2019 |
|
RU2824391C2 |
| Химерные антигенные рецепторы, нацеливающиеся на CD70 | 2019 |
|
RU2801824C2 |
| БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА К Vβ17/CD123 | 2020 |
|
RU2831786C2 |
| ВИДЫ КОМБИНИРОВАННОЙ ТЕРАПИИ С ИСПОЛЬЗОВАНИЕМ ХИМЕРНЫХ АНТИГЕННЫХ РЕЦЕПТОРОВ И ИНГИБИТОРОВ PD-1 | 2017 |
|
RU2809160C2 |
| АНТИ-CLL1-СПЕЦИФИЧЕСКИЕ ОДНОЦЕПОЧЕЧНЫЕ ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ (scCAR) ДЛЯ ИММУНОТЕРАПИИ РАКА | 2016 |
|
RU2731543C2 |
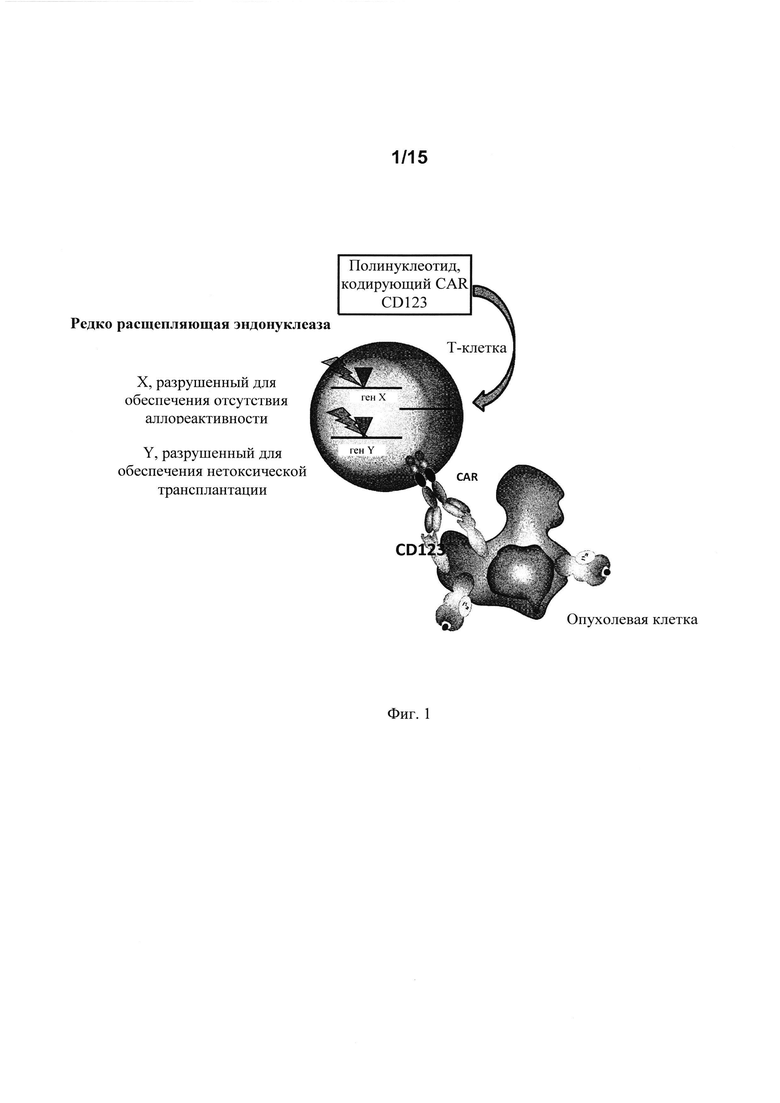
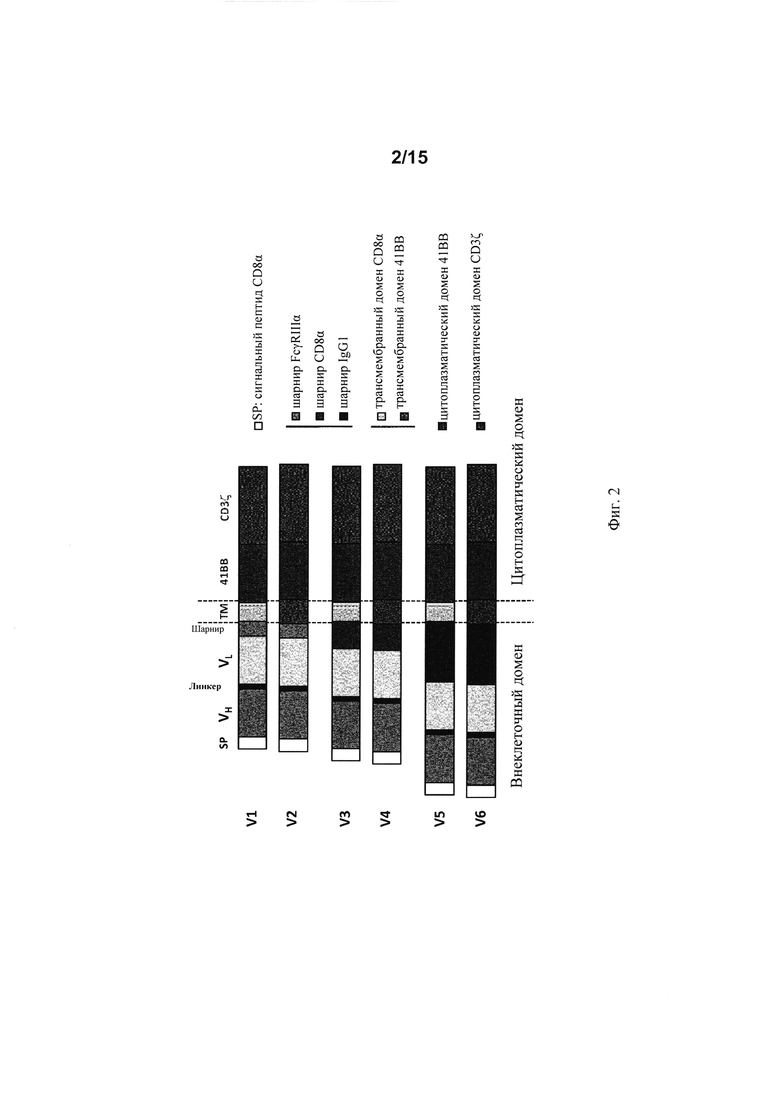

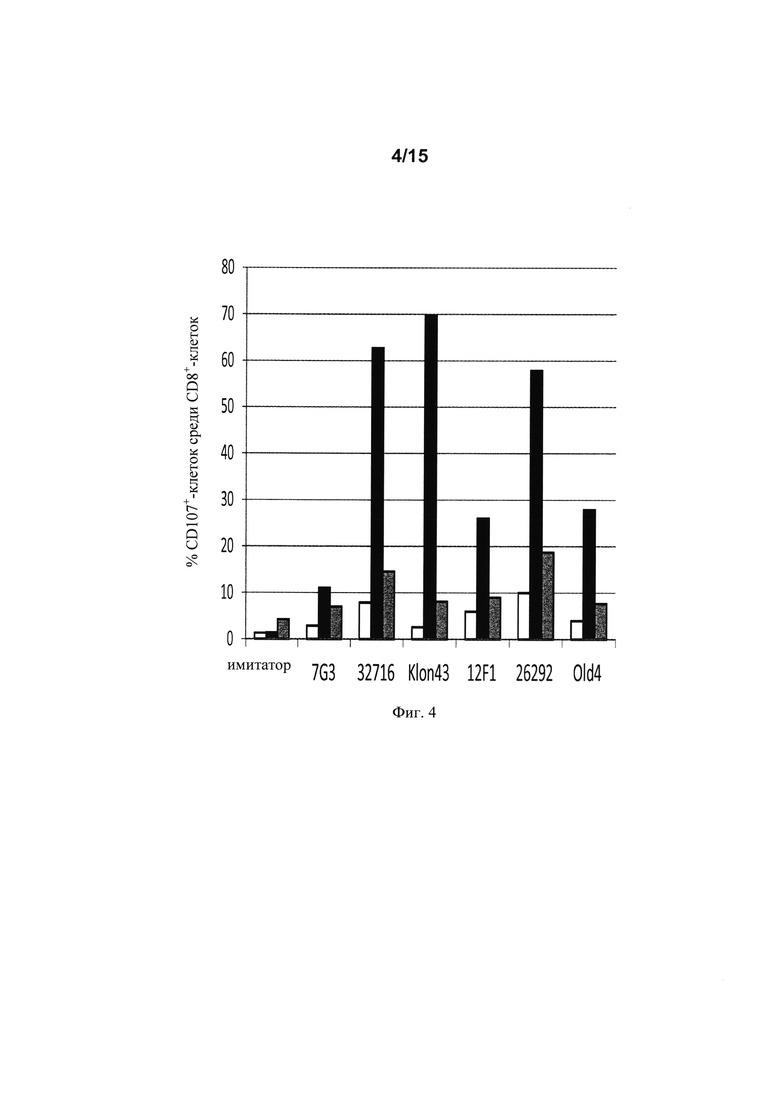
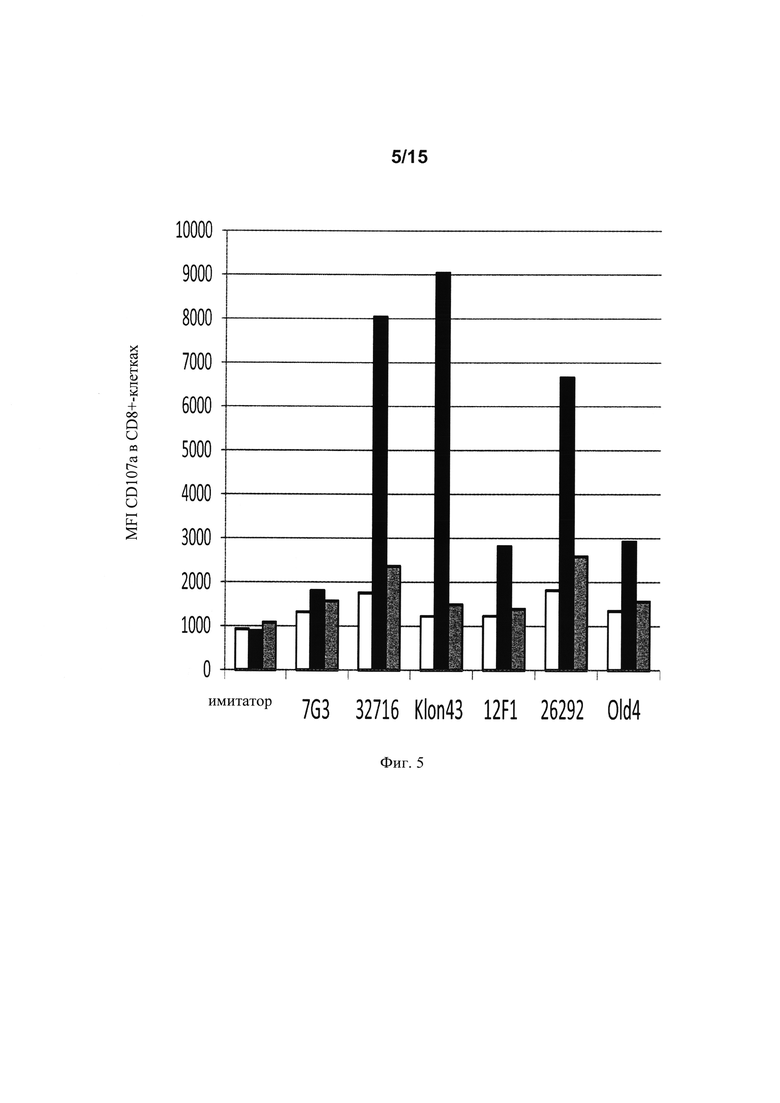
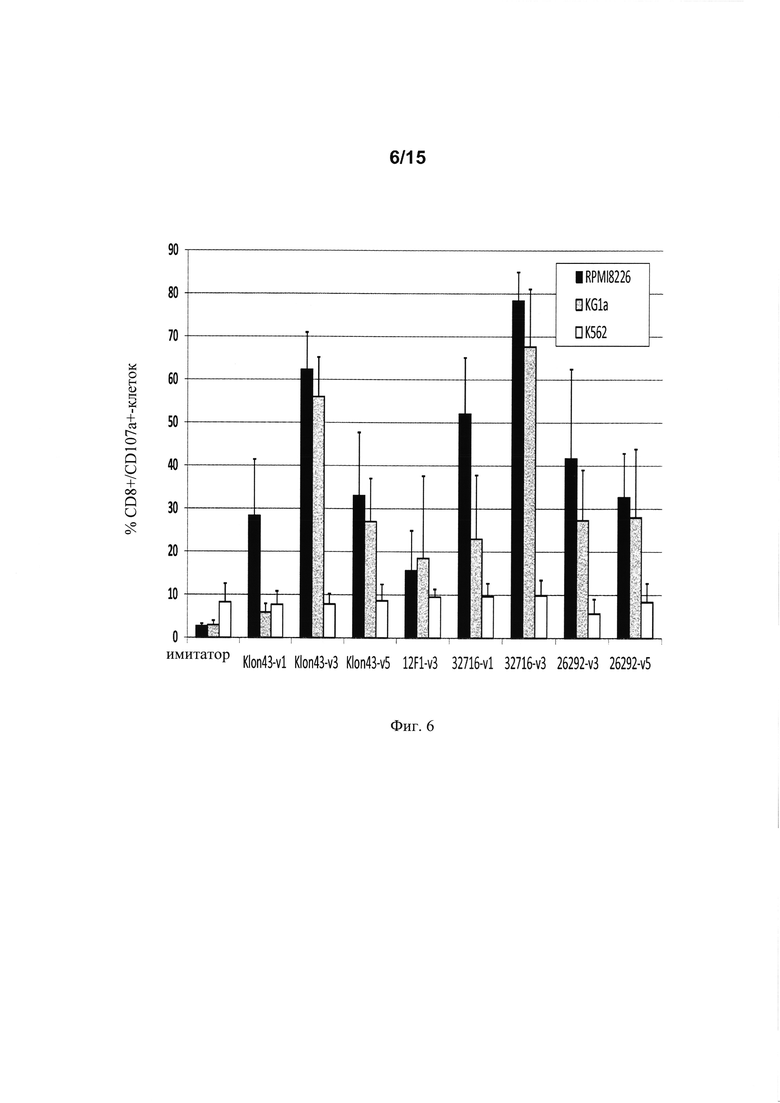

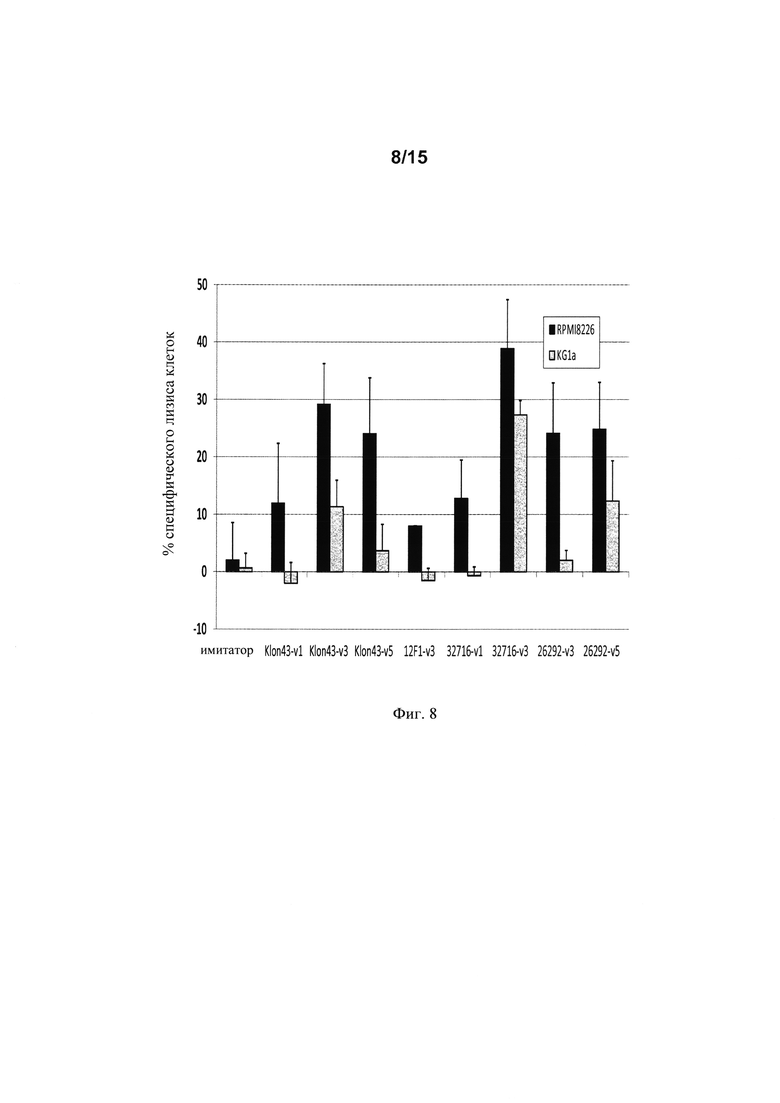
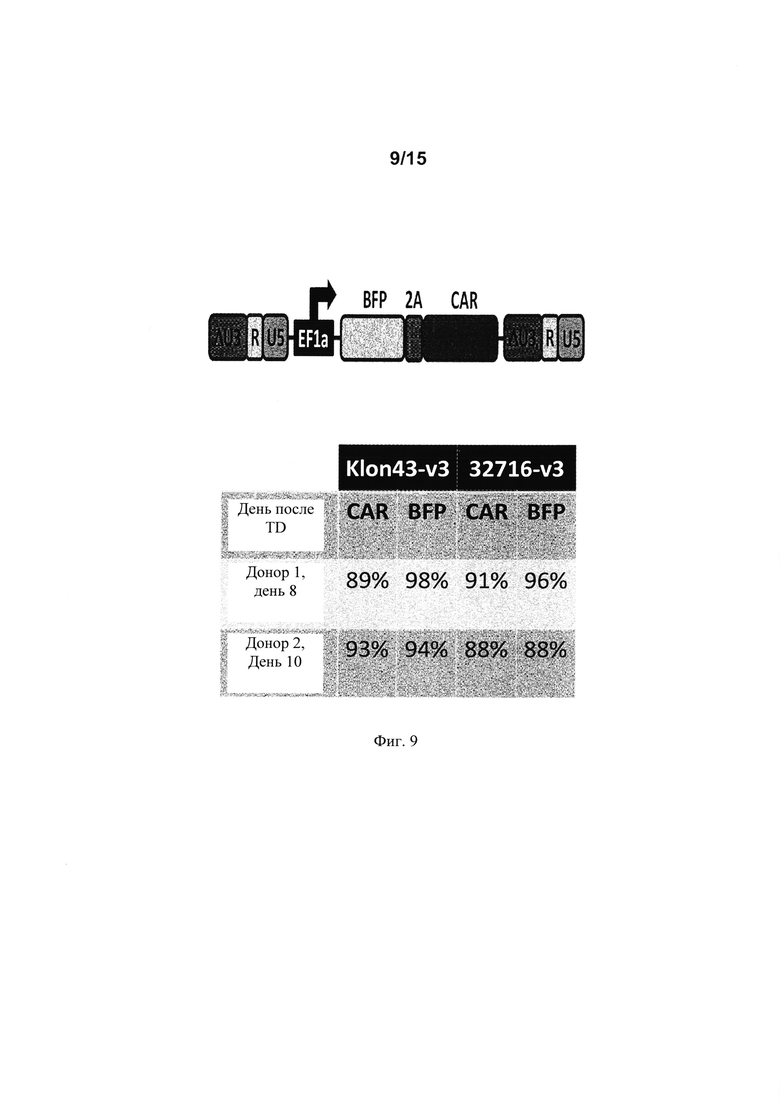
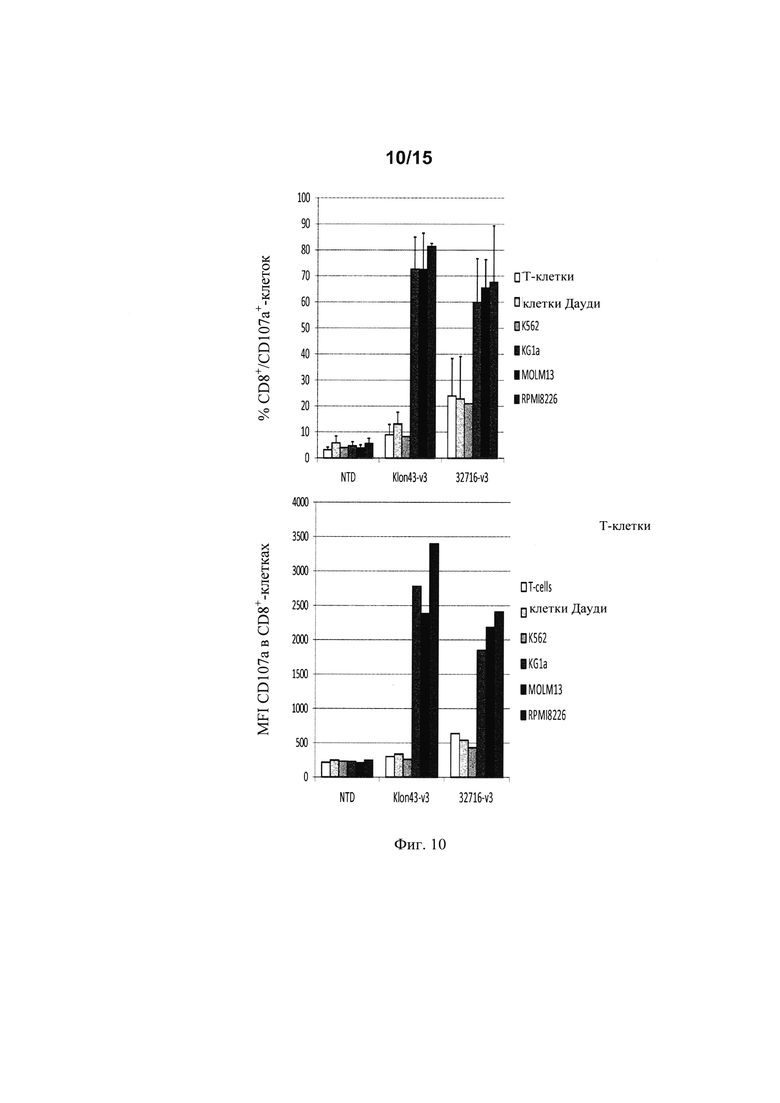
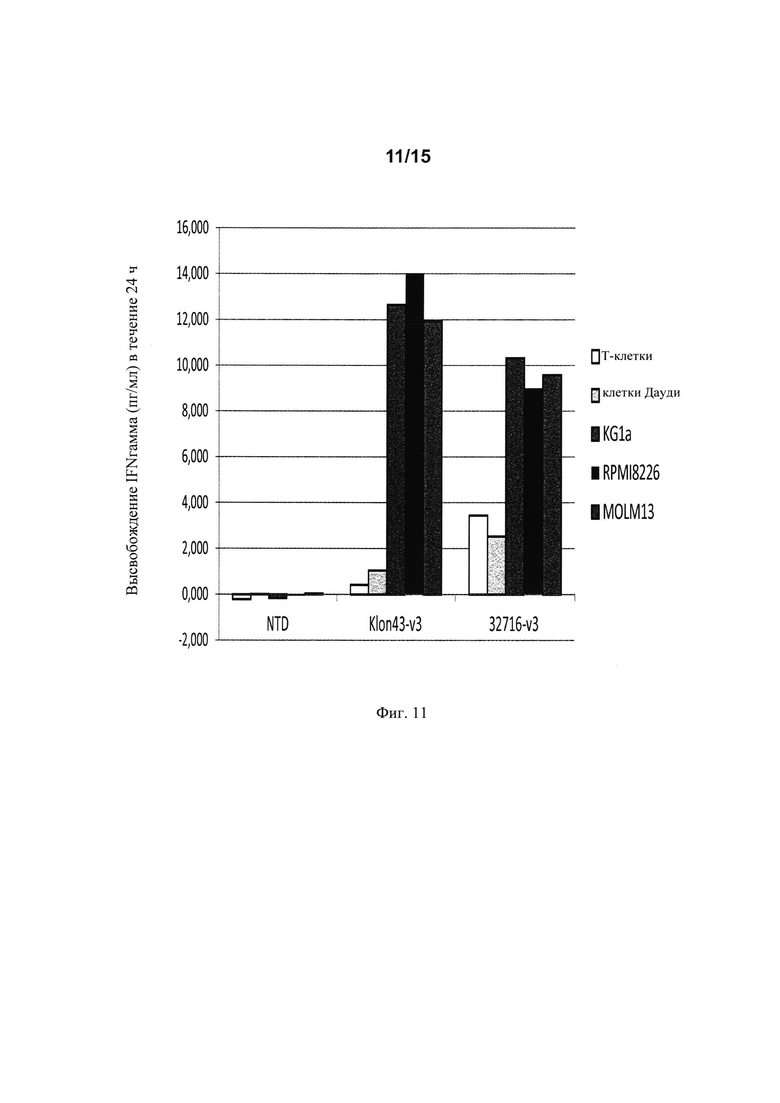
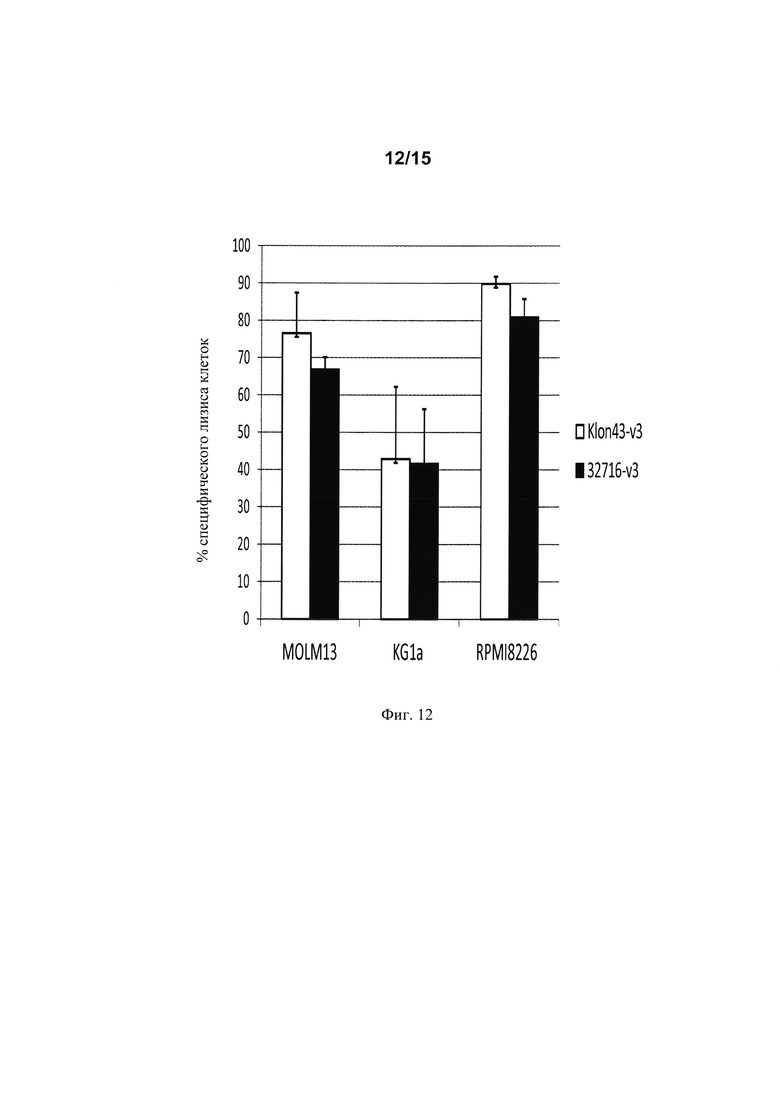
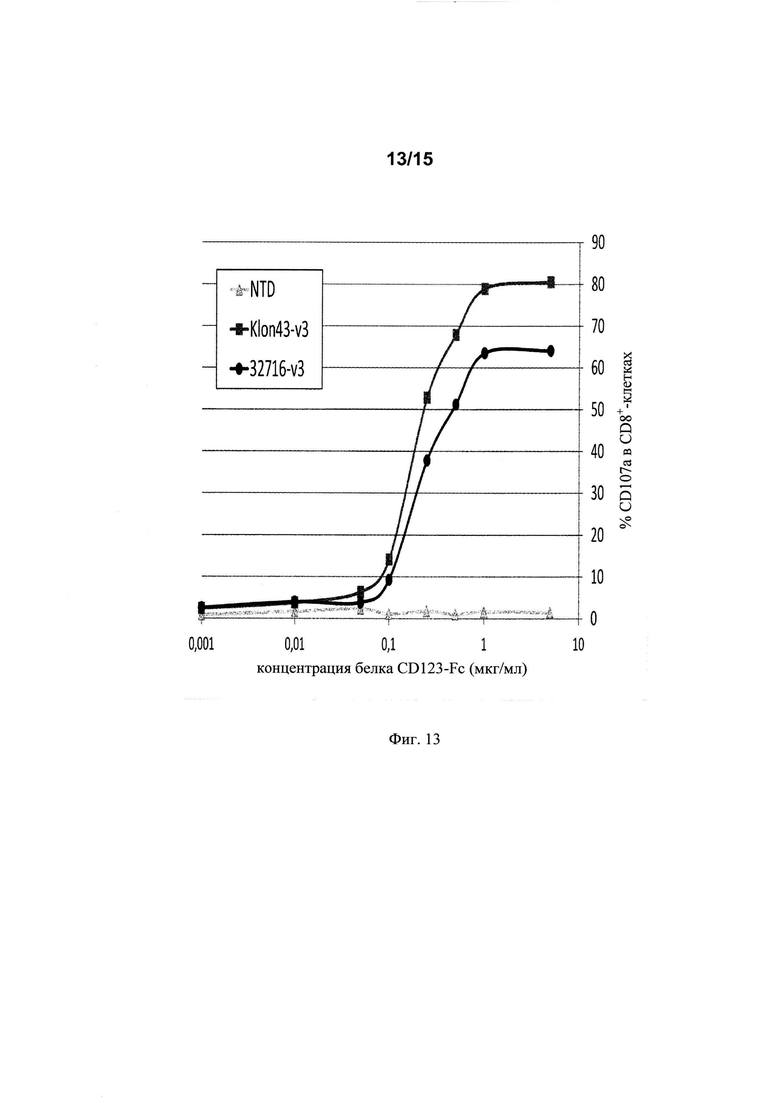
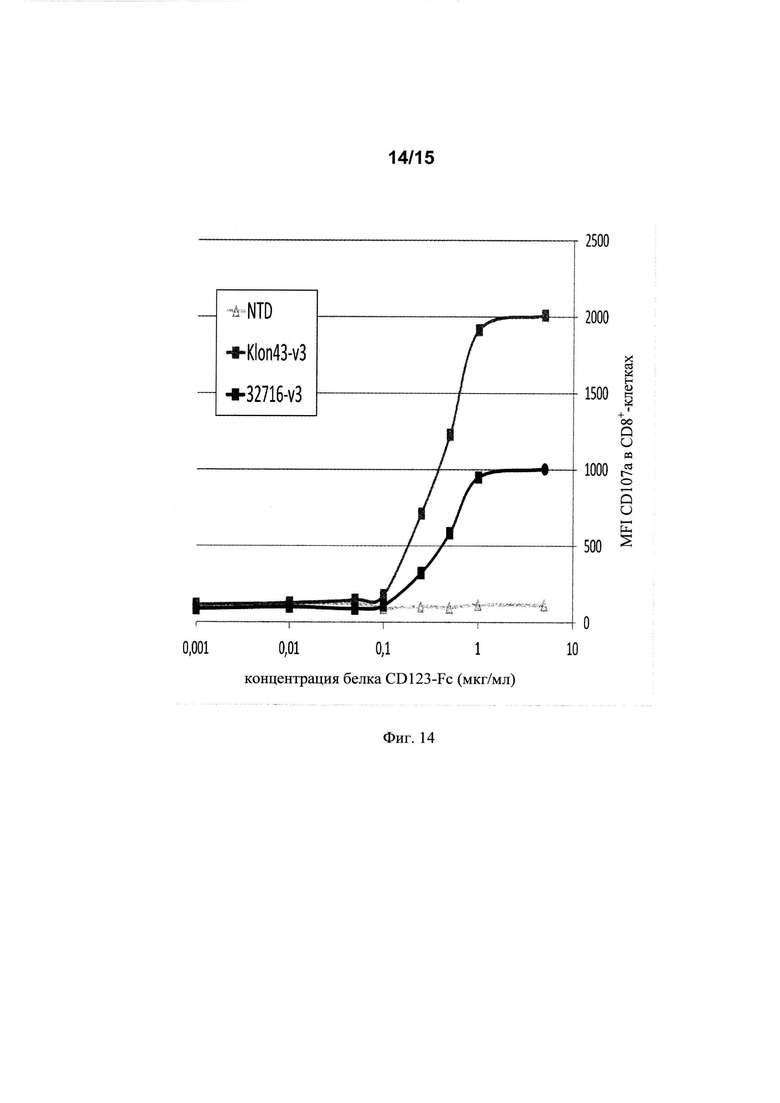
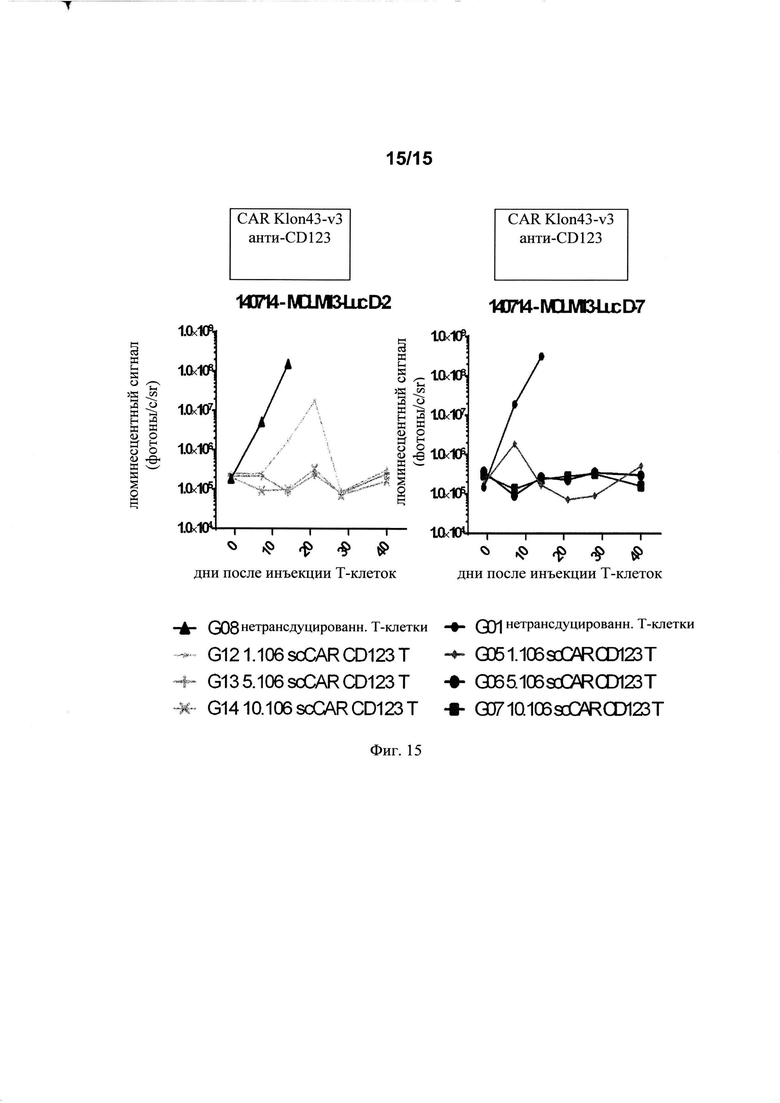
Настоящее изобретение относится к иммунологии. Предложен CD123-специфический химерный антигенный рецептор (CAR), а также кодирующий его полинуклеотид, экспрессионный вектор, экспрессирующая CAR цитотоксическая Т-клетка и способ ее создания. Описано применение цитотоксической Т-клетки в терапии, способ разрушения клетки гематологического рака и способ лечения. Данное изобретение может найти дальнейшее применение в терапии CD123-ассоциированных заболеваний, в том числе для лечения лимфом и лейкозов. 8 н. и 23 з.п. ф-лы, 15 ил., 11 табл., 3 пр.
1. CD123-специфический химерный антигенный рецептор (123 CAR), который имеет полипептидную структуру, включающую внеклеточный лигандсвязывающий домен, содержащий вариабельную область тяжелой цепи (VH) и вариабельную область легкой цепи (VL) из моноклонального антитела к CD123, шарнир FcγRIIIα, CD8α или IgG1, CD8α трансмембранный домен, цитоплазматический домен, включающий сигнальный домен CD3дзета и костимуляторный домен из 4-1ВВ, где последовательность указанного CAR по меньшей мере на 80% идентична SEQ ID NO: 42, SEQ ID NO: 44 либо SEQ ID NO: 46 соответственно; и где указанная VH включает CDR последовательности SEQ ID NO: 67, 68 и 69, и указанная VL включает CDR последовательности SEQ ID NO: 70, 71 и 72.
2. CD123-специфический CAR по п. 1, где последовательность указанного 123 CAR идентична по меньшей мере на 80% SEQ ID NO: 44.
3. CD123-специфический CAR по п. 1 или 2, в котором указанный внеклеточный лигандсвязывающий домен, содержащий VH и VL, является гуманизированным.
4. CD123-специфический CAR по п. 1 или 2, в котором указанные VH и VL содержат следующие последовательности
XXXXXXXXXXXXXXXXXXXXXXXXXXXXXXGFTFTDYYXXXXXXXXXXXXXXXXXIRSKADGYTTXXXXXXXXXXXXXXXXXXXXXXXXXXXXARDAAYYSYYSPEGAMDYXXXXXXXXXXX (SEQ ID NO: 73) и
XXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXQNVDSAXXXXXXXXXXXXXXXXXSASXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXXQQYYSTPWTXXXXXXXXX (SEQ ID NO: 74) соответственно, где X обозначает аминокислоту.
5. CD123-специфический CAR по п. 1 или 2, в котором указанная VH содержит полипептидную последовательность, выбранную из следующих последовательностей:
(вариант VH1: SEQ ID NO: 60):
EVKLVESGGGLVQPGRSLRLSCTASGFTFTDYYMSWVRQAPGKGLEWVGLIRSKADGYTTEYSASVKGRFTISRDDSKSILYLQMNSLKTEDTAVYYCARDAAYYSYYSPEGAMDYWGQGTLVTVSS,
(вариант VH2: SEQ ID NO: 61):
EVQLVESGGGLVQPGRSLRLSCTASGFTFTDYYMSWVRQAPGKGLEWVGLIRSKADGYTTEYSASVKGRFTISRDDSKSILYLQMNSLKTEDTAVYYCARDAAYYSYYSPEGAMDYWGQGTLVTVSS,
(вариант VH3: SEQ ID NO: 62):
EVQLVESGGGLVQPGRSLRLSCTASGFTFTDYYMSWVRQAPGKGLEWVGLIRSKADGYTTEYSASVKGRFTISRDDSKSIAYLQMNSLKTEDTAVYYCARDAAYYSYYSPEGAMDYWGQGTLVTVSS,
(вариант VH4: SEQ ID NO: 63):
EVQLVESGGGLVQPGRSLRLSCTASGFTFTDYYMSWVRQAPGKGLEWVGFIRSKADGYTTEYSASVKGRFTISRDDSKSIAYLQMNSLKTEDTAVYYCARDAAYYSYYSPEGAMDYWGQGTLVTVSS,
(вариант VH5: SEQ ID NO: 64):
EVQLVESGGGLVQPGRSLRLSCTASGFTFTDYYMSWVRQAPGKGLEWVGFIRSKADGYTTEYAASVKGRFTISRDDSKSIAYLQMNSLKTEDTAVYYCARDAAYYSYYSPEGAMDYWGQGTLVTVSS, и
(вариант VH6: SEQ ID NO: 65):
EVQLVESGGGLVQPGRSLRLSCTASGFTFTDYYMSWVRQAPGKGLEWVGLIRSKADGYTTEYAASVKGRFTISRDDSKSIAYLQMNSLKTEDTAVYYCARDAAYYSYYSPEGAMDYWGQGTLVTVSS,
и указанная VL содержит полипептидную последовательность, выбранную из следующих последовательностей:
(вариант VL1: SEQ ID NO: 54):
MADYKDIVMTQSPSSVSASVGDRVTITCRASQNVDSAVAWYQQKPGKAPKALIYSASYRYSGVPSRFSGRGSGTDFTLTISSLQPEDFATYYCQQYYSTPWTFGQGTKVEIKR,
(вариант VL2: SEQ ID NO: 55):
MADYKDIQMTQSPSSVSASVGDRVTITCRASQNVDSAVAWYQQKPGKAPKALIYSASYRYSGVPSRFSGRGSGTDFTLTISSLQPEDFATYYCQQYYSTPWTFGQGTKVEIKR,
(вариант VL3: SEQ ID NO: 56):
MADYKDIQMTQSPSSVSASVGDRVTITCRASQNVDSAVAWYQQKPGKAPKALIYSASYRYSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYYSTPWTFGQGTKVEIKR,
(вариант VL4: SEQ ID NO: 57):
MADYKDIQMTQSPSSVSASVGDRVTITCRASQNVDSAVAWYQQKPGKAPKLLIYSASYRYSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYYSTPWTFGQGTKVEIKR,
(вариант VL5: SEQ ID NO: 58):
MADYKDIQMTQSPSSVSASVGDRVTITCRASQNVDSAVAWYQQKPGKAPKLLIYSASYRQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYYSTPWTFGQGTKVEIKR и
(вариант VL6: SEQ ID NO: 59):
MADYKDIQMTQSPSSVSASVGDRVTITCRASQNVDSAVAWYQQKPGKAPKLLIYSASYGQSGVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQYYSTPWTFGQGTKVEIKR.
6. CD123-специфический CAR по п. 1 или 2, в котором указанные VH и VL идентичны по меньшей мере на 80% SEQ ID NO: 20 и 19 соответственно.
7. CD123-специфический CAR по п. 1 или 2, дополнительно содержащий другой внеклеточный лигандсвязывающий домен, не специфический в отношении CD123.
8. CD123-специфический CAR по п. 1 или 2, дополнительно содержащий сигнальный пептид, предпочтительно имеющий SEQ ID NO: 1 или SEQ ID NO: 2.
9. Полинуклеотид, кодирующий CD123-специфический CAR по одному из пп. 1-8.
10. Экспрессионный вектор, содержащий полинуклеотид по п. 9.
11. Сконструированная цитотоксическая Т-клетка, экспрессирующая на мембране клеточной поверхности CD123-специфический химерный антигенный рецептор по одному из пп. 1-8.
12. Сконструированная цитотоксическая Т-клетка по п. 11, где в указанной сконструированной цитотоксической Т-клетке экспрессия TCR подавлена.
13. Сконструированная цитотоксическая Т-клетка по п. 11 или 12, где в указанной цитотоксической Т-клетке экспрессия по меньшей мере одного белка ГКГС, предпочтительно β2m или HLA, подавлена.
14. Сконструированная цитотоксическая Т-клетка по п. 11 или 12, где указанная цитотоксическая Т-клетка изменена в результате мутации для придания устойчивости по меньшей мере к одному иммуносупрессорному лекарственному средству, химиотерапевтическому лекарственному средству или противораковому лекарственному средству.
15. Применение сконструированной цитотоксической Т-клетки по одному из пп. 11-14 в терапии предзлокачественного или злокачественного, связанного с раком состояния, характеризующегося наличием экспрессирующих CD123 клеток.
16. Применение по п. 15, где пациент представляет собой человека.
17. Применение сконструированной цитотоксической Т-клетки для терапии по п. 15, где состояние представляет собой состояние, отличающееся избыточным количеством экспрессирующих CD123 клеток.
18. Применение по п. 15, где злокачественное раковое состояние представляет собой связанное с гематологическим раком состояние.
19. Применение по п. 18, где связанное с гематологическим раком состояние представляет собой лейкоз или злокачественные лимфопролиферативные нарушения.
20. Применение по п. 19, где указанный лейкоз выбран из группы, состоящей из острого миелогенного лейкоза, хронического миелогенного лейкоза, мелодиспластического синдрома, острого лимфоидного лейкоза, хронического лимфоидного лейкоза и миелодиспластического синдрома.
21. Применение по п. 19 или 20, где указанный лейкоз представляет собой острый миелогенный лейкоз (AML).
22. Применение по п. 21, где указанный гематологический рак представляет собой злокачественное лимфопролиферативное нарушение.
23. Применение по п. 22, где указанное злокачественное лимфопролиферативное нарушение представляет собой лимфому.
24. Применение по п. 23, где указанная лимфома выбрана из группы, состоящей из множественной миеломы, неходжскинской лимфомы, лимфомы Беркитта и фолликулярной лимфомы (мелкоклеточной и крупноклеточной).
25. Способ разрушения клетки гематологического рака, которая экспрессирует CD123, где способ включает контактирование указанной клетки гематологического рака с цитотоксической сконструированной Т-клеткой по одному из пп. 11-14 в количестве, эффективном для разрушения указанной раковой клетки.
26. Способ создания цитотоксической Т-клетки, включающий:
(а) получение цитотоксической Т-клетки,
(б) осуществление экспрессии на поверхности указанной цитотоксической Т-клетки по меньшей мере одного CD123-специфического CAR по одному из пп. 1-8.
27. Способ по п. 26, включающий:
(а) получение цитотоксической Т-клетки,
(б) интродукцию в указанную цитотоксическую Т-клетку по меньшей мере одного полинуклеотида, кодирующего указанный CD123-специфический CAR,
(в) осуществление экспрессии указанного полинуклеотида в указанной цитотоксической Т-клетке.
28. Способ по п. 26, включающий:
(а) получение цитотоксической Т-клетки,
(б) интродукцию в указанную цитотоксическую Т-клетку по меньшей мере одного полинуклеотида, кодирующего указанный CD123-специфический CAR,
(в) интродукцию в указанную цитотоксическую Т-клетку по меньшей мере одного другого химерного антигенного рецептора, который не является специфическим в отношении CD123.
29. Способ лечения индивидуума, у которого диагностировано предзлокачественное или злокачественное, связанное с раком состояние, характеризующееся наличием экспрессирующих CD123 клеток, включающий:
(а) получение цитотоксической Т-клетки, которая экспрессирует на поверхности CD123-специфический CAR по одному из пп. 1-8,
(б) введение указанных цитотоксических Т-клеток указанному пациенту.
30. Способ по п. 29, в котором указанную Т-клетку получают от донора.
31. Способ по п. 29, в котором указанную Т-клетку получают из организма самого пациента.
| MARDIROS A | |||
| et al | |||
| Устройство для разметки подлежащих сортированию и резанию лесных материалов | 1922 |
|
SU123A1 |
| СПОСОБ ПОЛУЧЕНИЯ СТАБИЛЬНОГО РАСТВОРА КАЛЬЦИЯ ГЛЮКОНАТА ДЛЯ ИНЪЕКЦИЙ | 2007 |
|
RU2332994C1 |
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| PIZZITOLA I | |||
| et al | |||
| Способ сопряжения брусьев в срубах | 1921 |
|
SU33A1 |
Авторы
Даты
2020-07-21—Публикация
2015-03-19—Подача