ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к новому соединению, содержащему оксадиазол, которое пригодно в качестве противоэпилептического лекарственного средства для предотвращения или лечения эпилепсии, способу его получения, содержащей его фармацевтической композиции, и его применению в качестве лекарственного средства.
УРОВЕНЬ ТЕХНИКИ
Эпилепсия представляет собой заболевание, при котором эпилептические припадки повторяются и продолжаются без особых причин, и также вызывают повреждение головного мозга и физические/психические расстройства, когда они становятся хроническими. В результате эпилепсия является смертельным заболеванием, которое ложится тяжелым социальным и экономическим бременем, а также ухудшает качество жизни. Эпилепсия варьируется в зависимости от ее причины или области головного мозга, где происходят изменения, и проявляет различные симптомы от простых повторяющихся движений тела, которые на первый взгляд кажутся бессмысленными, до генерализованных судорог и потери сознания. В большинстве случаев невозможно предсказать проявление симптомов, потому что симптомы появляются внезапно. Известно, что механизм возникновения эпилепсии вызван аномалией и возбуждением коры головного мозга, и сообщалось, что заболевание, вызывающее поражения в головном мозге, также может вызывать судороги. Однако идиопатическая эпилепсия, истинная причина которой точно не известна, составляет от 60 до 70%, и врожденные заболевания, инфекции, опухоли, инсульт, дегенеративные заболевания, повреждение головы и подобные известны как другие причины. Распространенность пациентов с эпилепсией составляет 0,5% населения (1 на каждые 200 человек), и по оценкам Всемирной организации здравоохранения (ВОЗ) во всем мире насчитывается более 50 миллионов пациентов с эпилепсией.
В принципе, предпочтительно проводят лечение эпилепсии, применяя лекарственное средство, и хирургическое лечение можно применять в случае рефрактерной эпилепсии, не имеющей ответа на лекарственное средство. Терапевтический агент от эпилепсии представляет собой лекарственное средство, которое непосредственно действует на мозг, и лекарство подбирается по-разному в зависимости от типа припадков. Чаще всего применяют около 10 лекарственных средств, таких как карбамазепин, фенитоин, вальпроевая кислота, фенобарбитал, топирамат, леветирацетам и подобные, и с 1990 года были разработаны различные новые лекарственные средства. Однако, хотя были выбраны соответствующие лекарственные средства и соответствующие дозы, соотношение рефрактерных пациентов, симптомы которых продолжаются несколько раз в неделю, достигает от 30 до 40% от общего числа пациентов с эпилепсией, и поскольку леветирацетам UCB, который в настоящее время применяют в качестве золотого стандарта, достигает только 40-58% степени лечения рефрактерных пациентов, требуется значительное улучшение с точки зрения эффективности.
В этом отношении в европейском патенте № 0162036 B1 описано соединение (S)-α-этил-2-оксо-1-пирролидинацетамид, которое хорошо известно под общим названием леветирацетам. Кроме того, в международной публикации № WO 2003/006467 описано сульфаматное производное, применяемое для лечения эпилепсии, и типичное соединение хорошо известно под общим названием топирамат. Европейский патент № 0021121 B1 описывает 1,2,4-триазиновое производное, пригодное для лечения эпилепсии, и типичное соединение хорошо известно под общим названием ламотриджин. Большинство существующих терапевтических агентов против эпилепсии были разработаны на основе эффективности в модели эпилепсии на животных, а не на открытии нового лекарственного средства, основанном на мишенях лекарственных средств.
[Документы предшествующего уровня техники]
[Патентные документы]
(Патентный документ 1) европейский патент No. 0162036 B1
(Патентный документ 2) международная публикация No. WO 2003/006467
(Патентный документ 3) европейский патент No. 0021121 B1
ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
ТЕХНИЧЕСКАЯ ПРОБЛЕМА
Цель настоящего изобретения заключается в предоставлении нового соединения, представленного химической формулой 1, или его оптического изомера, стереоизомера или фармацевтически приемлемой соли.
Другая цель настоящего изобретения заключается в предоставлении способа получения нового соединения, представленного химической формулой 1, или его оптического изомера, стереоизомера или фармацевтически приемлемой соли.
Еще другая цель настоящего изобретения заключается в предоставлении фармацевтической композиции для предотвращения или лечения эпилепсии, содержащей соединение выше, его оптический изомер, стереоизомер, или фармацевтически приемлемую соль, и способа ее получения.
Еще другая цель настоящего изобретения заключается в предоставлении способа лечения эпилепсии у субъекта применением соединения выше или его оптического изомера, стереоизомера или фармацевтически приемлемой соли.
РЕШЕНИЕ ПРОБЛЕМЫ
Для достижения указанной выше цели, настоящее изобретение предоставляет соединение, представленное следующей химической формулой 1, или его оптический изомер, стереоизомер или фармацевтически приемлемую соль:
[Химическая формула 1]
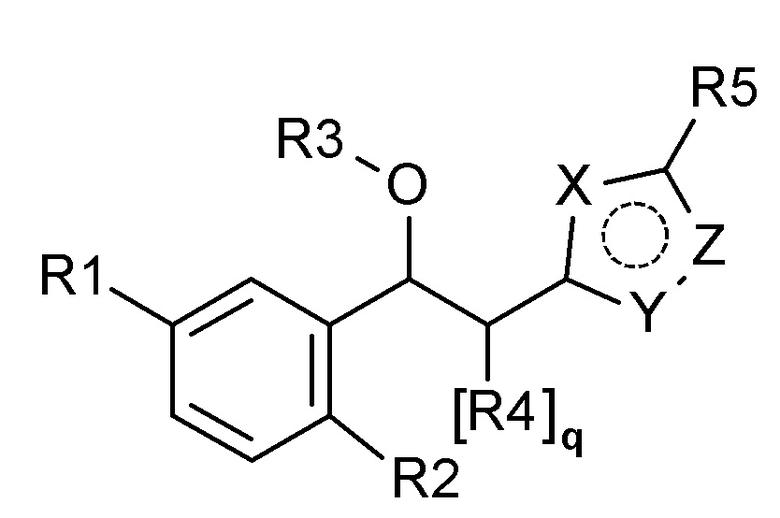
где
R1 выбран из группы, состоящей из следующих формул:
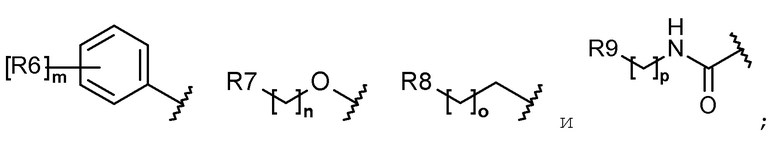
R2 представляет собой водород, галоген, гидрокси, алкил, галогеналкил, гидроксиалкил, алкоксиалкил, карбамоилокси, алкокси, алкилтио, галогеналкокси или гидроксиалкокси;
R3 представляет собой водород, алкил, циклоалкил, галогеналкил, гидроксиалкил, алкоксиалкил, карбамоил, алкилкарбамоил, диалкилкарбамоил, карбонил или алкилкарбонил;
R4 представляет собой водород, галоген, гидрокси, алкил, галогеналкил, гидроксиалкил, алкоксиалкил, карбамоил, алкилкарбамоил или диалкилкарбамоил;
R5 представляет собой водород, галоген, гидрокси, алкил, галогеналкил, гидроксиалкил, алкоксиалкил, карбамоил, алкилкарбамоил или диалкилкарбамоил;
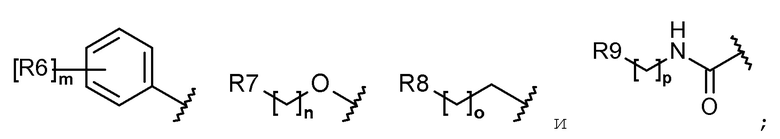
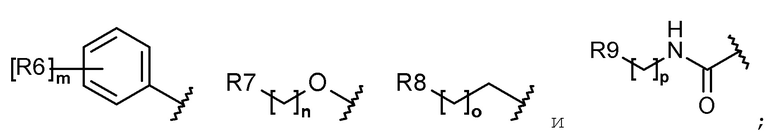
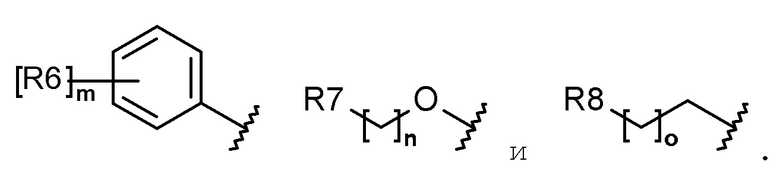
каждый R6, R7, R8 и R9 независимо представляет собой водород, галоген, алкил, галогеналкил, гидроксиалкил, алкоксиалкил, карбамоилоксиалкил, алкил-C(O)O-алкил, алкокси, алкилтио, галогеналкокси, гидроксиалкокси, алкоксиалкокси, карбамоилоксиалкокси, алкил-C(O)O-алкокси, амино, диалкиламино, карбониламино, алкилкарбониламино, галогеналкилкарбониламино или гетероциклоалкил, содержащий 1-3 атома азота (N);
каждый X, Y и Z независимо выбран из группы, состоящей из азота (N) и кислорода (O), где, по меньшей мере, один из X, Y и Z представляет собой кислород (O);
m представляет собой целое число 0-3;
каждый n, o и p независимо представляет собой целое число 0-5; и
q представляет собой целое число 0-2.
Соединение формулы 1 согласно настоящему изобретению может образовывать фармацевтически приемлемую соль. Фармацевтически приемлемые соли включают соли присоединения кислот или и их стереохимические изомерные формы. Соль может включать любую соль, которая сохраняет активность исходного соединения у субъекта, которому ее вводят, и не вызывает каких-либо нежелательных эффектов, но не ограничивается этим. Соли включают неорганические соли и органические соли, и могут быть солями присоединения кислот, например, уксусной кислоты, азотной кислоты, аспарагиновой кислоты, сульфоновой кислоты, серной кислоты, малеиновой кислоты, глутаминовой кислоты, муравьиной кислоты, янтарной кислоты, фосфорной кислоты, фталевой кислоты, дубильной кислоты, винной кислоты, бромистоводородной кислоты, пропионовой кислоты, бензолсульфоновой кислоты, бензойной кислоты, стеариновой кислоты, этансульфоновой кислоты, молочной кислоты, бикарбоновой кислоты, бисерной кислоты, дивинной кислоты кислота, щавелевой кислоты, бутиловой кислоты, эдетата кальция, камзиловой кислоты, угольной кислоты, хлорбензойной кислоты, лимонной кислоты, этилендиаминтетрауксусной кислоты, толуолсульфоновой кислоты, эдицилиновой кислоты, эцилиновой кислоты, фумаровой кислоты, глюцептиновой кислоты, памовой кислоты, глюконовой кислоты, гликолларсаниловой кислоты, метилнитрата, полигалактуроновой кислоты, гексиллизорциноновой кислоты, малоновой кислоты, гидрабаминовой кислоты, хлористоводородной кислоты, йодистоводородной кислоты, гидроксинафтолевой кислоты, изетионовой кислоты, лактобионовой кислоты, миндальной кислоты, эстолиновой кислоты, слизевой кислоты, нафтеновой кислоты, муконовой кислоты, п-нитрометансульфоновой кислоты, гексаминовой кислоты, пантотеновой кислоты, моногидрофосфорной кислоты, дигидрофосфорной кислоты, салициловой кислоты, сульфаминовой кислоты, сульфаниловой кислоты, метансульфоновой кислоты или теокловой кислоты. Кроме того, примеры основных солей включают соли щелочных и щелочноземельных металлов, такие как соли аммония, соли лития, соли натрия, соли калия, соли магния и соли кальция, соли, содержащие органические основания, такие как соли бензатина, N-метил-D-глюкамина и гидрабамина, и соли, содержащие аминокислоты, такие как аргинин и лизин. Кроме того, солевую форму можно превращать в свободную форму обработкой подходящим основанием или кислотой. Как применяют в настоящем изобретении, термин «дополнительная соль» может включать сольваты, получаемые из любого соединения, представленного химической формулы 1, и его солей. Примеры данных сольватов представляют собой гидраты или алкоголяты. Соединение химической формулы 1 согласно настоящему изобретению можно превратить в ее соль общепринятым способом.
Между тем, поскольку соединения настоящего изобретения могут содержать асимметричный углеродный центр и асимметричную ось или асимметричную плоскость, они могут существовать как по существу чистые энантиомеры, такие как R и S энантиомеры, а также все оптические и стереоизомерные формы, включая рацемическую смесь, и все их изомеры и смеси входят в объем настоящего изобретения. Относительно чистого энантиомера, энантиомерный избыток данного энантиомера и его фармацевтически приемлемой соли, представленных химической формулой 1, содержащих оксадиазол, может предпочтительно составлять 60% ee или более, более предпочтительно 95% ee или более, и самое предпочтительное 98% ee или более.
Термин “ee” относится к энантиомерному избытку. Например, один энантиомер в конкретном соединении присутствует в виде смеси энантиомеров в соединении в большем количестве, чем другие энантиомеры. Энантиомерно обогащенные формы могут включать энантиомерные соединения конкретного соединения, в котором концентрация одного энантиомера в энантиомерной смеси конкретного соединения составляет, по меньшей мере, 50%, более обычно, по меньшей мере, 60%, 70%, 80% или 90%, или более (например, >95%, >97%, >98%, >99%, >99,5%) относительно других энантиомеров соединения.
В настоящем изобретении, если не указано иначе, соединение, представленное химической формулой 1, применяют как обозначение, включающие все из соединений, представленных химической формулой 1, их оптического изомера, стереоизомера и фармацевтически приемлемой соли.
При определении соединения химической формулы 1 в настоящем описании применяют следующие концепции в отношении заместителей.
Как применяют в настоящем изобретении, термин “галоген” или отдельно или в комбинации с другими терминами (например, галогеналкил), относится к радикалу фтора(F), хлора (Cl), брома (Br) или йода (I).
Как применяют в настоящем изобретении, термин “алкил”, или отдельно или в комбинации с другими терминами (например, галогеналкил), относится к радикалу насыщенной или ненасыщенной алифатической углеводородной группы, содержащей 1-10, предпочтительно 1-5 атомов углерода линейной или разветвленной цепи, и могут содержать одинарную связь, двойную связь или тройную связь. Например, алкил может включать метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил, трет-бутил, н-пентил, изопентил, неопентил, трет-пентил, 1-метилбутил, 2-метилбутил, 1-этилпропил, и 1,2-диметилпропил, но не ограничиваются ими.
Как применяют в настоящем изобретении, термин “циклоалкил” представляет собой частично или полностью насыщенный одинарный или конденсированный циклический углеводород, который может представлять собой C3-C12-циклоалкил, и C3-C6-циклоалкил является предпочтительным, включая, но не ограничиваясь, например, циклопропил, циклобутил, циклопентил, циклогексил, циклогеканил и подобные.
Как применяют в настоящем изобретении, термин “алкокси” относится к алкилокси, содержащему 1-10, предпочтительно 1-5 атомов углерода, если не указано иначе.
Как применяют в настоящем изобретении, термин “гетероциклоалкил” относится к частично или полностью насыщенному углеводороду, содержащему 1-3 атома азота (N) в качестве кольцевых атомов, и 3-8-членный или 5-8-членный гетероцикл является предпочтительным. Например, включены азиридинил, азетидинил, пирролидинил, пиперидинил, имидазолинил, пиперазинил и подобные, но не ограничиваются ими.
Алкил, циклоалкил, алкокси и гетероцикл и подобные можно необязательно замещать, например, одним или более заместителями, выбранными из следующих групп: гидрокси, галоген, алкил, алкокси, галогеналкил и галогеналкокси.
Как применяют в настоящем изобретении, термин “эпилепсия” относится к группе заболеваний, при которых приступы эпилепсии возникают неоднократно и становятся хроническими, даже если нет причинного фактора, способного вызвать приступы эпилепсии. Эпилепсию можно разделить на приступы с очаговым началом, приступы с генерализованным началом и приступы с неизвестным началом. Кроме того, эпилепсия может быть специфически очаговым приступом с вторичным генерализованным приступом или без него.
Атомы водорода химической формулы 1 настоящего изобретения можно выбрать из водорода, дейтерия и трития.
Согласно другому варианту осуществления, в химической формуле 1,
R1 выбран из группы, состоящей из следующих формул:
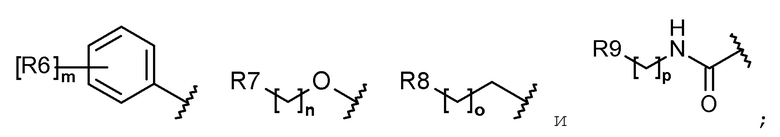
R2 представляет собой водород, галоген, гидрокси, C1-C5 алкил, галоген-C1-C5 алкил, гидрокси-C1-C5 алкил, C1-C5 алкокси-C1-C5 алкил, карбамоилокси, C1-C5 алкокси, C1-C5 алкилтио, галоген-C1-C5 алкокси, или гидрокси-C1-C5 алкокси;
R3 представляет собой водород, C1-C5 алкил, C3-C6 циклоалкил, галоген-C1-C5 алкил, гидрокси-C1-C5 алкил, C1-C5 алкокси-C1-C5 алкил, карбамоил, C1-C5 алкилкарбамоил, ди(C1-C5 алкил)карбамоил, карбонил, или C1-C5 алкилкарбонил;
R4 представляет собой водород, галоген, гидрокси, C1-C5 алкил, галоген-C1-C5 алкил, гидрокси-C1-C5 алкил, C1-C5 алкокси-C1-C5 алкил, карбамоил, C1-C5 алкилкарбамоил или ди(C1-C5 алкил)карбамоил;
R5 представляет собой водород, галоген, гидрокси, C1-C5 алкил, галоген-C1-C5 алкил, гидрокси-C1-C5 алкил, C1-C5 алкокси-C1-C5 алкил, карбамоил, C1-C5 алкилкарбамоил или ди(C1-C5 алкил)-карбамоил;
каждый R6, R7, R8 и R9 независимо представляет собой водород, галоген, C1-C5 алкил, галоген-C1-C5 алкил, гидрокси-C1-C5 алкил, C1-C5 алкокси-C1-C5 алкил, карбамоилокси-C1-C5 алкил, C1-C5 алкил-C(O)O-C1-C5 алкил, C1-C5 алкокси, C1-C5 алкилтио, галоген-C1-C5 алкокси, гидрокси-C1-C5 алкокси, C1-C5 алкокси-C1-C5 алкокси, карбамоилокси-C1-C5-алкокси, C1-C5 алкил-C(O)O-C1-C5 алкокси, амино, ди(C1-C5 алкил)амино, карбониламино, C1-C5 алкилкарбониламино, галоген-C1-C5 алкилкарбониламино или a 3-8-членный гетероциклоалкил, содержащий 1-3 атома азота (N);
каждый X, Y, Z независимо выбран из группы, состоящей из азота (N) и кислорода (O), где, по меньшей мере, один из X, Y или Z представляет собой кислород (O);
m представляет собой целое число 0-3;
каждый n, o и p независимо представляет собой целое число 0-5; и
q представляет собой целое число 0-2.
Согласно еще другому варианту осуществления, в химической формуле 1,
R1 выбран из группы, состоящей из следующих формул:
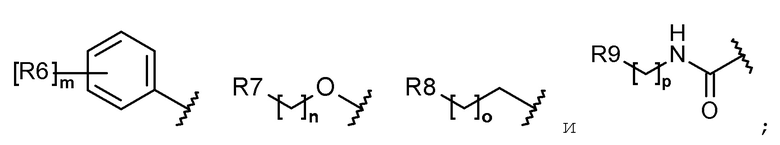
R2 представляет собой водород, галоген, алкил, галогеналкил, гидроксиалкил, алкоксиалкил, алкокси, алкилтио, галогеналкокси или гидроксиалкокси;
R3 представляет собой водород, алкил, циклоалкил, галогеналкил, алкоксиалкил, карбамоил, алкилкарбамоил, диалкилкарбамоил, карбонил, или алкилкарбонил;
R4 представляет собой водород, галоген, алкил, галогеналкил, алкоксиалкил, карбамоил, алкилкарбамоил или диалкилкарбамоил;
R5 представляет собой водород, галоген, алкил, галогеналкил, алкоксиалкил, карбамоил, алкилкарбамоил или диалкилкарбамоил;
Каждый R6, R7, R8 и R9 независимо представляет собой водород, галоген, алкил, галогеналкил, алкоксиалкил, карбамоилоксиалкил, алкил-C(O)O-алкил, алкокси, алкилтио, галогеналкокси, алкоксиалкокси, карбамоилокси-алкокси, алкил-C(O)O-алкокси, амино, диалкиламино, карбониламино, алкилкарбониламино, галогеналкилкарбониламино или гетероциклоалкил, содержащий 1 или 2 атома азота (N);
каждый X, Y и Z независимо выбран из группы, состоящей из азота (N) и кислорода (O), где один из X, Y или Z представляет собой кислород (O), и другие два представляют собой азот (N);
m представляет собой целое число 0-3;
каждый n, o и p независимо представляет собой целое число 0-4; и
q представляет собой целое число 0-2.
Согласно еще другому варианту осуществления, в химической формуле 1,
R1 выбран из группы, состоящей из следующих формул:
R2 представляет собой водород, галоген, C1-C5 алкил, галоген-C1-C5 алкил, гидрокси-C1-C5 алкил, C1-C5 алкокси-C1-C5 алкил, C1-C5 алкокси, C1-C5 алкилтио, галоген-C1-C5 алкокси или гидрокси-C1-C5 алкокси;
R3 представляет собой водород, C1-C5 алкил, C3-C6 циклоалкил, галоген-C1-C5 алкил, C1-C5 алкокси-C1-C5 алкил, карбамоил, C1-C5 алкилкарбамоил, ди(C1-C5 алкил)карбамоил, карбонил или C1-C5 алкилкарбонил;
R4 представляет собой водород, галоген, C1-C5 алкил, галоген-C1-C5 алкил, C1-C5 алкокси-C1-C5 алкил, карбамоил, C1-C5 алкилкарбамоил или ди(C1-C5 алкил)карбамоил;
R5 представляет собой водород, галоген, C1-C5 алкил, галоген-C1-C5 алкил, C1-C5 алкокси-C1-C5 алкил, карбамоил, C1-C5 алкилкарбамоил или ди(C1-C5 алкил)карбамоил;
каждый R6, R7, R8 и R9 независимо представляет собой водород, галоген, C1-C5 алкил, галоген-C1-C5 алкил, C1-C5 алкокси-C1-C5 алкил, карбамоилокси-C1-C5 алкил, C1-C5 алкил-C(O)O-C1-C5 алкил, C1-C5 алкокси, C1-C5 алкилтио, галоген-C1-C5 алкокси, C1-C5 алкокси-C1-C5 алкокси, карбамоилокси-C1-C5 алкокси, C1-C5 алкил-C(O)O-C1-C5 алкокси, амино, ди(C1-C5 алкил)амино, карбониламино, C1-C5 алкилкарбониламино, галоген-C1-C5 алкилкарбониламино, или 5-8-членный гетероциклоалкил, содержащий один или два атома азота (N);
каждый X, Y, Z независимо выбран из группы, состоящей из азота (N) и кислорода (O), где один из X, Y или Z представляет собой кислород (O), и два других представляют собой азот (N);
m представляет собой целое число 0-3;
каждый n, o и p независимо представляет собой целое число 0-4; и
q представляет собой целое число 0-2.
Согласно еще другому варианту осуществления, в химической формуле 1,
R1 выбран из группы, состоящей из следующих формул:

R2 представляет собой водород, галоген, алкил, галогеналкил, алкоксиалкил, алкокси или алкилтио;
R3 представляет собой водород, алкил, циклоалкил, галогеналкил, карбамоил, алкилкарбамоил, диалкилкарбамоил или карбонил;
R4 представляет собой водород, галоген, алкил, галогеналкил или алкоксиалкил;
R5 представляет собой водород, галоген, алкил, галогеналкил или алкоксиалкил;
каждый R6, R7, R8 и R9 независимо представляет собой водород, галоген, алкил, галогеналкил, алкоксиалкил, алкокси, алкилтио, галогеналкокси, амино, диалкиламино, алкилкарбониламино, галогеналкилкарбониламино или гетероциклоалкил, содержащий один или два атома азота (N);
Каждый X, Y, Z независимо выбран из группы, состоящей из азота (N) и кислорода (O), где один из X, Y или Z представляет собой кислород (O), и другие два представляют собой азот (N);
m представляет собой целое число 1-3;
каждый n, o и p независимо представляет собой целое число 0-4; и
q представляет собой целое число 0-2.
Согласно еще другому варианту осуществления настоящего изобретения, в химической формуле 1,
R1 выбран из группы, состоящей из следующих формул;
R2 представляет собой водород, галоген, C1-C5 алкил, галоген-C1-C5 алкил, C1-C5 алкокси-C1-C5 алкил, C1-C5 алкокси, или C1-C5 алкилтио;
R3 представляет собой водород, C1-C5 алкил, C3-C6 циклоалкил, галоген-C1-C5 алкил, карбамоил, C1-C5 алкилкарбамоил, ди(C1-C5 алкил)карбамоил или карбонил;
R4 представляет собой водород, галоген, C1-C5 алкил, галоген-C1-C5 алкил или C1-C5 алкокси-C1-C5 алкил;
R5 представляет собой водород, галоген, C1-C5 алкил, галоген-C1-C5 алкил или C1-C5 алкокси-C1-C5 алкил;
каждый R6, R7, R8 и R9 независимо представляет собой водород, галоген, C1-C5 алкил, галоген-C1-C5 алкил, C1-C5 алкокси-C1-C5 алкил, C1-C5 алкокси, C1-C5 алкилтио, галоген-C1-C5 алкокси, амино, ди(C1-C5 алкил)амино, C1-C5 алкилкарбониламино, галоген-C1-C5 алкилкарбониламино или 5-8-членный гетероциклоалкил, содержащий один или два атома азота (N);
каждый X, Y и Z независимо выбран из группы, состоящей из азота (N) и кислорода (O), где один из X, Y или Z представляет собой кислород (O), и два других представляют собой азот (N);
m представляет собой целое число 1-3;
каждый n, o и p независимо представляет собой целое число 0-4; и
q представляет собой целое число 0-2.
Согласно еще другому варианту осуществления, в химической формуле 1, R1 выбран из группы, состоящей из следующих формул:
Согласно еще другому варианту осуществления, в химической формуле 1, R1 представлен следующей формулой:
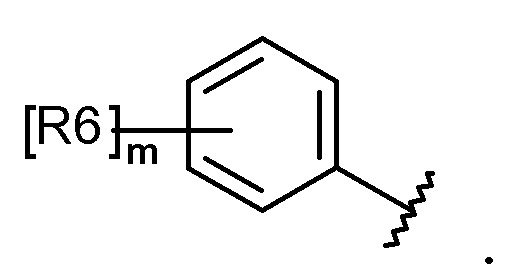
Согласно еще другому варианту осуществления настоящего изобретения в химической формуле 1 каждый R6, R7, R8 и R9 независимо представляет собой водород, галоген, алкил, галогеналкил, алкокси, галогеналкокси, диалкиламино или гетероциклоалкил, содержащий 1-3 атома азота (N).
Согласно еще другому варианту осуществления настоящего изобретения в химической формуле 1 каждый R6, R7, R8 и R9 независимо представляет собой водород, галоген, C1-C5 алкил, галоген-C1-C5 алкил, C1-C5 алкокси, галоген-C1-C5 алкокси, ди(C1-C5 алкил)амино или 3-8-членный гетероциклоалкил, содержащий 1-3 атома азота (N).
Согласно еще другому варианту осуществления настоящего изобретения в химической формуле 1 каждый R6, R7 и R8 независимо представляет собой галоген, алкил, галогеналкил, алкокси или галогеналкокси.
Согласно еще другому варианту осуществления настоящего изобретения в химической формуле 1 каждый R6, R7 и R8 независимо представляет собой галоген, C1-C5 алкил, галоген-C1-C5 алкил, C1-C5 алкокси или галоген-C1-C5 алкокси.
Согласно еще другому варианту осуществления настоящего изобретения в химической формуле 1 R6 представляет собой галоген, галогеналкил, алкокси или галогеналкокси.
Согласно еще другому варианту осуществления настоящего изобретения, в химической формуле 1, R6 представляет собой галоген, галоген-C1-C5 алкил, C1-C5 алкокси или галоген-C1-C5 алкокси.
Согласно еще другому варианту осуществления настоящего изобретения в химической формуле 1
R2 представляет собой водород, галоген, алкил или алкокси;
R3 представляет собой водород, алкил или карбамоил;
R4 представляет собой водород, галоген или алкил; и
R5 представляет собой водород или алкил.
Согласно еще другому варианту осуществления настоящего изобретения, в химической формуле 1,
R2 представляет собой водород, галоген, C1-C5 алкил или C1-C5 алкокси;
R3 представляет собой водород, C1-C5 алкил или карбамоил;
R4 представляет собой водород, галоген или C1-C5 алкил; и
R5 представляет собой водород или C1-C5 алкил.
Согласно еще другому варианту осуществления настоящего изобретения в химической формуле 1, X представляет собой кислород (O), и каждый из Y и Z представляет собой азот (N).
Согласно еще другому варианту осуществления настоящего изобретения, в химической формуле 1,
m представляет собой целое число 1 или 2;
каждый n, o и p независимо представляет собой целое число 1-4; и
q представляет собой целое число 0 или 1.
Типичные примеры соединения химической формулы 1 согласно настоящему изобретению могут включать соединения, показанные в таблице 1, но не ограничиваются ими.
[Таблица 1]
Термины и сокращения, применяемые в настоящем описании, имеют оригинальные значения, если не указано иначе.
Настоящее изобретение также относится к способу получения соединения химической формулы 1. В настоящем изобретении далее, способ получения соединения химической формулы 1 будет описан на основе примерной схемы реакций для лучшего понимания настоящего изобретения. Однако следует понимать, что специалист в данной области техники может получить соединение химической формулы 1 различными способами, применяя известные соединения, исходя из структуры химической формулы 1, или соединения, которые можно легко получить из них, и следует понимать, что все способы могут быть включены в объем настоящего изобретения. То есть соединение химической формулы 1 можно получить произвольным комбинированием нескольких способов синтеза, описанных в настоящем описании или описанных на предшествующем уровне техники, и, таким образом, следующее описание, относящееся к способу соединения химической формулы 1, является просто иллюстративным, и при необходимости порядок единичных операций можно выборочно изменять, и объем способа получения настоящего изобретения этим не ограничивается.
В настоящем изобретении далее, M относится к молярной концентрации, и N относится к нормальной концентрации. Описание терминов и сокращений, применяемых в реакционных схемах, примерах получения и примерах настоящего описания является следующим:
LDA: диизопропиламид лития
TBDMS: трет-бутилдиметилсилил
PPh3: трифенилфосфин
[Реакционная схема 1]
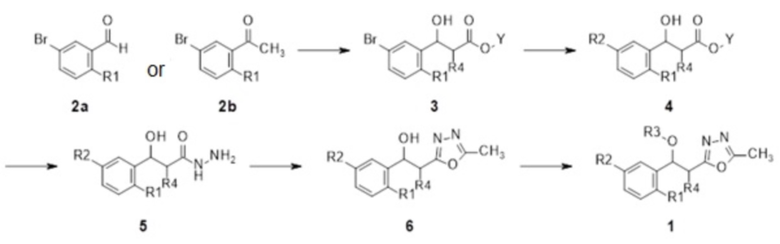
Общий способ получения заключается в получении промежуточного соединения 4, в которое R2 вводят из исходного соединения 2a или 2b реакцией сочетания Сузуки с промежуточным соединением 3, в которое вводят сложный эфир. Оксадиазол можно ввести в промежуточное соединение 6 реакцией циклизации, применяя гидразидное промежуточное соединение 5, из соединения, и конечное соединение 1 можно получить реакцией нуклеофильного замещения по гидрокси-группе на конечной стадии.
[Реакционная схема 2]
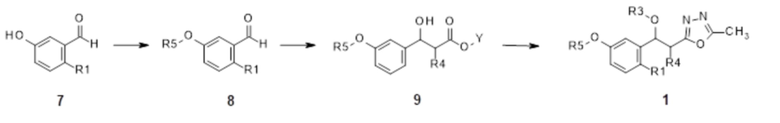
В качестве другого способа получения, соединение 8, замещенное эфирной группой, получают из исходного материала 7 реакцией Мицунобу, и промежуточное соединение 9, в которое введен сложный эфир, получают из полученного соединения таким же способом, как получение промежуточного соединения 4 по реакционной схеме 1. Затем конечное соединение 1 можно получить тем же способом, как на реакционной схеме 1.
[Реакционная схема 3]
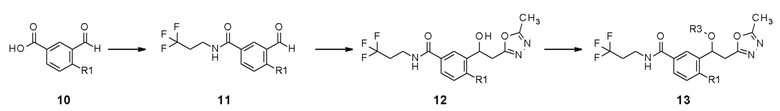
В качестве другого способа получения, промежуточное соединение 11, содержащее введенную в него амидную группу, можно получить из исходного соединения 10, и конечное соединение 13 можно получить реакцией замещения, применяя LDA, через промежуточное соединение 12
[Реакционная схема 4]
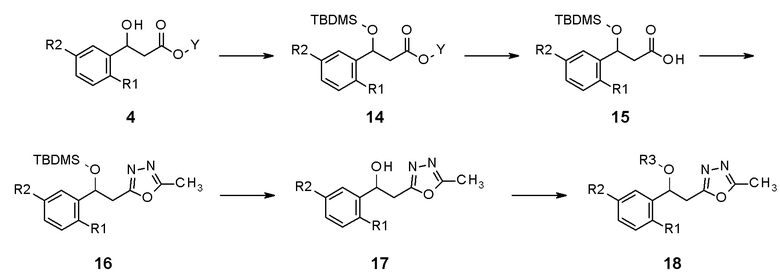
В качестве другого способа получения, промежуточное соединение 14, в которое введена защитная группа по гидрокси-группе, применяя промежуточное соединение 4 из реакционной схемы 1 в качестве исходного соединения, и затем карбоксильное промежуточное соединение 15 получают реакцией гидролиза. Промежуточное соединение 16, в которое вводится оксадиазол, получают из данного соединения реакцией циклизации, и конечное соединение 18 можно получить нуклеофильным замещением гидрокси-группы на последней стадии после реакции удаления защитной группы.
[Реакционная схема 5]
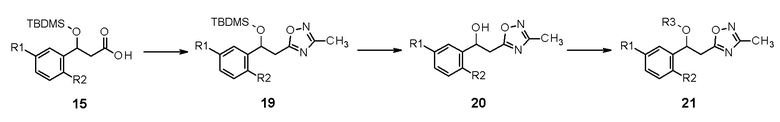
В качестве другого способа получения, промежуточное соединение 19, в которое вводят оксадиазол, можно получить реакцией циклизации, применяя промежуточное соединение 15 реакционной схемы 4 в качестве исходного соединения, и конечное соединение 21 можно получить реакцией нуклеофильного замещения гидрокси-группы на последней стадии после реакции удаления защитной группы.
[Реакционная схема 6]
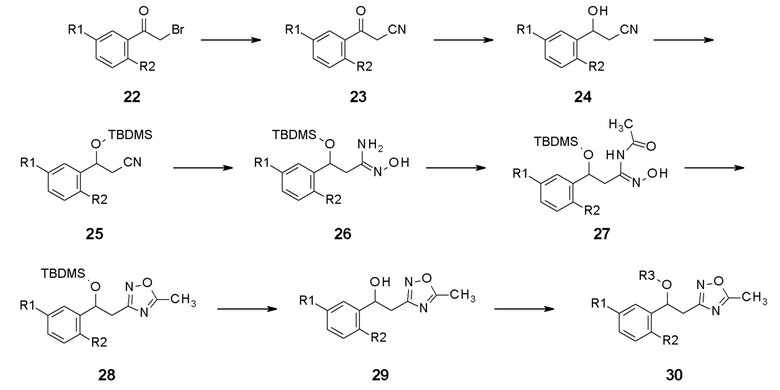
В качестве другого способа получения, промежуточное соединение 23, содержащее нитрильную группу, введенную реакцией нуклеофильного замещения, получают, применяя соединение 22 в качестве исходного соединения, и затем получают промежуточное соединение 24, содержащее гидрокси-группу, введенную реакцией восстановления. Промежуточное соединение 25, в которое вводят защитную группу по гидрокси-группе, промежуточное соединение 28, в которое вводят оксадиазол, получают реакцией циклизации, состоящей из двух стадий, и конечное соединение 30 можно получить реакцией нуклеофильного замещения гидрокси-группы на последней стадии после реакции удаления защитной группы.
Соединения, которые специально не описаны в способе получения настоящего описания, представляют собой известные соединения или соединения, которые можно легко получить из известных соединений известными способами получения или подобными способами.
Соединение, представленное химической формулой 1, полученное указанным выше способом, можно выделять или очищать различными известными способами, такими как перекристаллизация, ионтофорез, колоночная хроматография на силикагеле или хроматография на ионообменной смоле, от продукта реакции.
Как описано выше, соединения согласно настоящему изобретению, исходные соединения или промежуточные соединения для их получения, и подобные, моно получить различными способами, и данные способы следует рассматривать включенными в объем настоящего изобретения в отношении получения соединения химической формулы 1.
Соединение, представленное химической формулой 1, согласно настоящему изобретению обладают эффектом предотвращения или лечения эпилепсии. Соответственно, настоящее изобретение включает лекарственное средство, содержащее терапевтически эффективное количество соединения химической формулы 1 в качестве активного ингредиента, и фармацевтическую композицию для предотвращения или лечения эпилепсии, содержащую терапевтически эффективное количество соединения химической формулы 1 в качестве активного ингредиента, вместе с фармацевтически приемлемым носителем. Кроме того, пролекарства, имеющие различные формы, которые превращаются в соединение химической формулы 1, при необходимости in vivo, также включены в объем настоящего изобретения.
Как применяют в настоящем изобретении, термин “лечение” относится к прерыванию, задержке или облегчению прогрессирования заболевания при применении на субъекте, имеющем симптом.
Как применяют в настоящем изобретении, термин “предотвращение” относится к снижению вероятности возникновения заболевания или устранению вероятности возникновения заболевания.
Как применяют в настоящем изобретении, термин “фармацевтическая композиция” может включать другие химические компоненты, такие как носители, разбавители, вспомогательные вещества и подобные, в дополнение к активным соединениям согласно настоящему изобретению. Соответственно, фармацевтическая композиция может содержать фармацевтически приемлемый носитель, разбавитель, вспомогательное вещество или их комбинацию, при необходимости. Фармацевтическая композиция облегчает введение активного соединения в организм. Известны различные способы введения фармацевтических композиций, содержащих соединение, которые включают пероральное, инъекционное, аэрозольное, парентеральное и местное введение, но не ограничиваются ими. Кроме того, фармацевтическую композицию можно стерилизовать, она может дополнительно содержать адъювант, такой как консервант, стабилизатор, гидратирующий или эмульгирующий ускоритель, соль для регулирования осмотического давления и/или буфер, может дополнительно содержать другие терапевтически полезные вещества, и ее можно составлять в соответствии с обычными способами смешивания, гранулирования или нанесения покрытия.
Как применяют в настоящем изобретении, термин “носитель” относится к соединению, которое облегчает инъекцию соединения в клетку или ткань. Например, диметилсульфоксид (ДМСО) представляет собой обычный носитель для легкого ввода большого количества органических соединений в клетки или ткани организма.
Как применяют в настоящем изобретении, термин “разбавитель” относится к соединению, которое стабилизирует биологически активную форму представляющего интерес соединения, и разбавлено водой, которая растворяет соединение. Соль, растворенную в буфере, применяют в качестве разбавителя в данной области техники. Обычно применяемый буфер представляет собой забуференный фосфатом физиологический раствор, который имитирует солевую форму раствора человеческого тела. Поскольку буферная соль способна регулировать pH раствора при низких концентрациях, буферный разбавитель редко изменяет биологическую активность соединения.
Как применяют в настоящем изобретении, термин “фармацевтически приемлемый” относится к свойству, не нарушающему биологической активности и физических свойств соединения.
Соединение настоящего изобретения можно формулировать в виде различных лекарственных форм, при необходимости. Когда получают фармацевтическую композицию согласно настоящему изобретению, активный ингредиент, в частности соединение формулы 1, его фармацевтически приемлемую соль или изомер, смешивают с различными фармацевтически приемлемыми носителями, которые можно выбрать в зависимости от состава, который должен быть получен. Например, фармацевтическую композицию согласно настоящему изобретению можно формулировать в виде препарата для инъекций, препарата для перорального введения и подобных, при необходимости.
Например, фармацевтическую композицию можно формулировать в виде любой лекарственной формы для перорального введения, такой как таблетки, пилюли, твердые/мягкие капсулы, растворы, суспензии, эмульгаторы, сиропы, гранулы или эликсиры. Состав для перорального введения может содержать, например, фармацевтически приемлемый носитель, такой как разбавитель, такой как лактоза, декстроза, сахароза, маннит, сорбит, целлюлоза и/или глицин, или смазывающее вещество, такое как диоксид кремния, тальк, стеариновая кислота, его соль магния или кальция и/или полиэтиленгликоль, в дополнение к активному ингредиенту, в зависимости от типичной конфигурации каждого состава.
Кроме того, когда состав для перорального введения представляет собой таблетку, состав может содержать связующее, такое как силикат магния и алюминия, крахмальную пасту, желатин, трагакант, метилцеллюлозу, карбоксиметилцеллюлозу натрия и/или поливинилпирролидин, и необязательно может содержать разрыхлитель, такой как крахмал, агар, альгиновая кислота или ее натриевая соль, кипящую смесь, и/или абсорбент, краситель, ароматизатор или подсластитель.
Когда фармацевтическую композицию формулируют в виде парентеральной лекарственной формы, фармацевтическую композицию можно вводит парентеральным способом введения, таким как подкожная инъекция, внутривенная инъекция, внутримышечная инъекция или внутригрудная инъекция. Фармацевтическую композицию можно получить в виде раствора или суспензии смешением активного ингредиента, т.е. соединения химического состава формулы 1 или его фармацевтически приемлемой соли, со стабилизатором или буфером в воде, и раствор или суспензию можно получить в виде единичной лекарственной формы ампулы или флакона.
Соединение настоящего изобретения можно формулировать известным способом, применяя известный фармацевтический носитель и наполнитель и можно содержать в форме единичной емкости или в многодозовом контейнере. Форма препарата может быть раствором, суспензией или эмульсией в масле или водной среде и может содержать обычный диспергирующий агент, суспендирующий агент или стабилизатор. Кроме того, например, сухой порошок можно растворить в воде, из которой был удален стерильный или экзотермический материал, и применять. При необходимости соединение согласно настоящему изобретению или содержащую его фармацевтическую композицию можно вводить в комбинации с другим терапевтическим агентом.
Дозировку соединения химической формулы 1 настоящего изобретения можно определить в соответствии с предписанием врача в зависимости от факторов, таких как конкретные свойства пациента: вес, возраст, заболевание и тяжесть. Например, соединение Формулы 1 настоящего изобретения можно включать в фармацевтическую композицию в эффективном количестве от 0,1 до 500 мг/кг (массы тела), предпочтительно от 0,5 до 100 мг/кг (массы тела) в день, в отношении млекопитающих, включая людей, и фармацевтическую композицию можно разделять на прием один или два раза в день и вводить пероральным или парентеральным путем.
ПОЛЕЗНЫЕ ЭФФЕКТЫ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Соединение химической формулы 1 согласно настоящему изобретению обладает эффектом лечения заболеваний нервной системы и, в частности, действует как противосудорожное и противоэпилептическое лекарственное средство. Соединение может обеспечивать превосходный противосудорожный эффект по сравнению с леветирацетамом, топираматом и ламотриджином на модели с частотой 6 Гц, которая представляет собой животную модель рефрактерного фокального приступа.
СПОСОБ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
В настоящем изобретении далее, настоящее изобретение более подробно объясняется на следующих примерах. Однако следует понимать, что защищаемый объем защиты настоящего изобретения не ограничивается данными примерами.
Пример 1: получение 1-[5-(4-хлорфенил)-2-фторфенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола
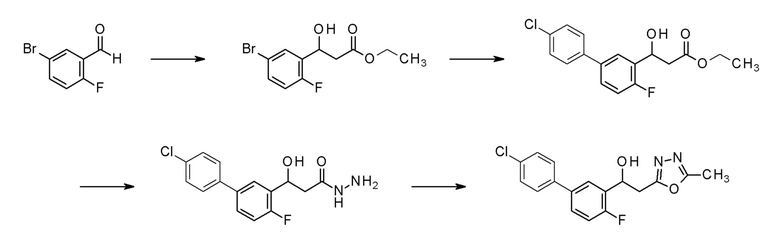
Пример 1-1: получение этил-3-(5-бром-2-фторфенил)-3-гидроксипропанoата
Диэтилцинк (1,0 M н-гексановый раствор, 24,3 мл, 24,3 ммоль) медленно добавляли к 100 мл раствора диэтилового эфира, в котором растворяли 5-бром-2-фторбензальдегид (1,9 мл, 16,2 ммоль) и этилйодацетат (2,9 мл, 24,3 ммоль), в бане со льдом, поддерживая температуру равной 0°C. Реакционную смесь перемешивали при той же температуре в течение 1 часа, и затем добавляли 100 мл этилацетата, промывали насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия один раз каждый, и сушили над безводным сульфатом магния. Светло-коричневую маслянистую жидкость, полученную удалением растворителя упариванием при пониженном давлении, очищали флэш-хроматографией, получая заявленное в заголовке соединение в виде светло-желтой маслянистой жидкости.
Пример 1-2: получение этил-3-[5-(4-хлорфенил)-2-фторфенил)-3-гидроксипропаноата
4-Хлорфенилбороновую кислоту(0,8 г, 5,1 ммоль), Pd(PPh3)2Cl2 (0,2 г, 0,3 ммоль) и 3,4 мл 2M водного раствора карбоната калия последовательно добавляли к 20 мл раствора 1,4-диоксана, в котором растворяли этил-3-(5-бром-2-фторфенил)-3-гидроксипропаноат (1,0 г, 3,4 ммоль), полученный в примере 1-1, и смесь перемешивали при 90°C в течение 1 часа. Температуру понижали до комнатной температуры, 50 мл этилацетата добавляли к реакционной смеси, и затем смесь промывали насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия один раз каждый, и органический слой сушили над безводным сульфатом магния. Темно-коричневую маслянистую жидкость, полученную удалением растворителя упариванием при пониженном давлении, очищали флэш-хроматографией, получая заявленное в заголовке соединение в виде желтого твердого остатка.
Пример 1-3: получение 3-[5-(4-хлорфенил)-2-фторфенил)-3-гидроксипропангидразида
Гидразин моногидрат (0,3 г, 6,2 ммоль) добавляли к 20 мл этанола, с растворенным в нем этил-3-[5-(4-хлорфенил)-2-фторфенил)-3-гидроксипропаноатом (1 г, 3,1 ммоль), полученным в примере 1-2, и нагревали и кипятили с обратным холодильником в течение 18 часов. Реакционную смесь охлаждали до комнатной температуры и оставляли в течение приблизительно 1 часа, промывая полученный белый осадок изопропиловым эфиром, и фильтруя его, получая заявленное в заголовке соединение.
Пример 1-4: получение 1-[5-(4-хлорфенил)-2-фторфенил)-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола
N,N′-диметилацетамиддиметилацеталь (0,6 г, 4,8 ммоль) добавляли к 20 мл толуола, содержащего 3-[5-(4-хлорфенил)-2-фторфенил)-3-гидроксипропангидразид (1 г, 3,2 ммоль), полученный в примере 1-3, и нагревали и кипятили с обратным холодильником в течение приблизительно 1 часа при 110°C, и добавляли к нему пара-толуолсульфокислоту (57 мг, 0,3 ммоль), и дополнительно нагревали и кипятили с обратным холодильником в течение приблизительно 18 часов. Температуру понижали до комнатной температуры, 100 мл этилацетата добавляли к реакционной смеси, и смесь последовательно промывали насыщенным водным раствором хлорида аммония, насыщенным водным раствором бикарбоната натрия, и насыщенным водным раствором хлорида натрия один раз каждый, и затем органический слой сушили над безводным сульфатом магния. Растворитель удаляли упариванием при пониженном давлении, и изопропиловый эфир добавляли к реакционной смеси и оставляли при комнатной температуре в течение 1 часа, промывая полученный белый твердый остаток изопропиловым эфиром и фильтруя его, получая заявленное в заголовке соединение. ЯМР данные полученного заявленного в заголовке соединения являются следующими.
1H-ЯМР (CDCl3, 400 МГц) δ=7,77 (д, J=8,5 Гц, 1H), 7,50-7,40 (м, 5H), 7,12 (т, J=11,5 Гц, 1H), 5,60-5,58 (м, 1H), 3,56 (д, J=4,5 Гц, 1H), 3,29-3,22 (м, 2H), 2,53 (с, 3H).
Пример 2: получение 1-[2-фтор-5-[4-(трифторметил)фенил]фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола
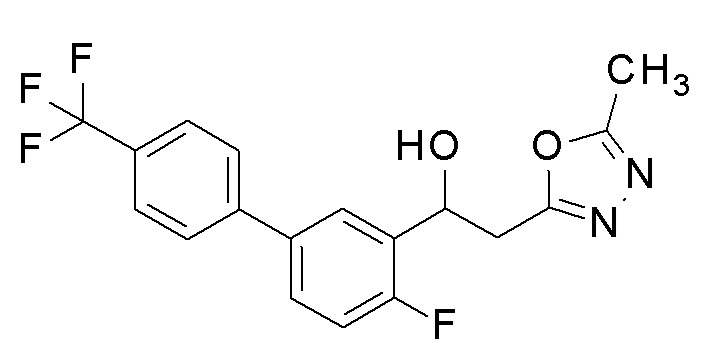
Заявленное в заголовке соединение получали тем же способом, как в примере 1, за исключением того, что 4-трифторметилбороновую кислоту применяли вместо 4-хлорфенилбороновой кислоты в примере 1-2.
1H-ЯМР (CDCl3, 400 МГц) δ=7,84 (д, J=8,5 Гц, 1H), 7,71-7,66 (м, 4H), 7,52-7,45 (м, 1H), 7,16 (т, J=12 Гц, 1H), 5,20-5,59 (м, 1H), 3,67 (д, J=5,0 Гц, 1H) 3,31-3,23 (м, 2H), 2,53 (с, 3H).
Пример 3: получение [1-[2-фтор-5-[4-(трифторметил)фенил]фенил]-2-(5-метил-1,3, 4-оксадиазол-2-ил)этил]карбамата
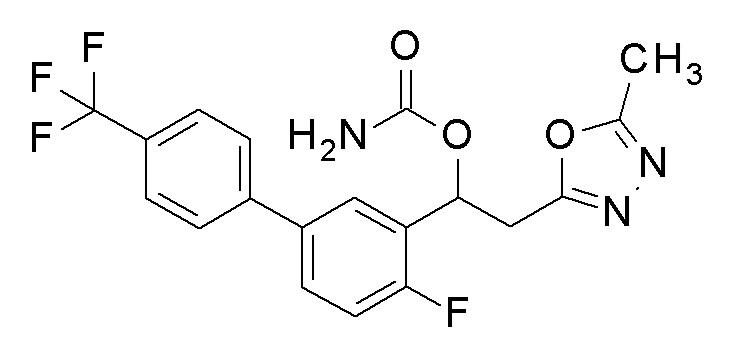
1,1′-Карбонилдиимидазол (0,6 г, 4,0 ммоль) добавляли к 20 мл раствора тетрагидрофурана, содержащего 1-[2-фтор-5-[4-(трифторметил)фенил]фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанол (1 г, 2,7 ммоль), полученный в примере 2, и смесь перемешивали при комнатной температуре в течение 6 часов. 2 мл аммиачной воды добавляли к реакционной смеси и перемешивали при той же температуре в течение 30 минут, и затем добавляли 100 мл этилацетата, промывали насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия один раз каждый, и сушили над безводным сульфатом магния. Светло-желтую маслянистую жидкость, полученную удалением растворителя упариванием при пониженном давлении, очищали флэш-хроматографией, получая заявленное в заголовке соединение в виде белого твердого остатка.
1H-ЯМР (CDCl3, 400 МГц) δ=7,70-7,52 (м, 6H), 7,17 (т, J=11,5 Гц, 1H), 6,37 (уш с, 1H), 5,01(уш с, 2H) 3,53-3,37 (м, 3H), 2,53 (с, 3H).
Пример 4: получение [1-[5-(4-хлорфенил)-2-фторфенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата
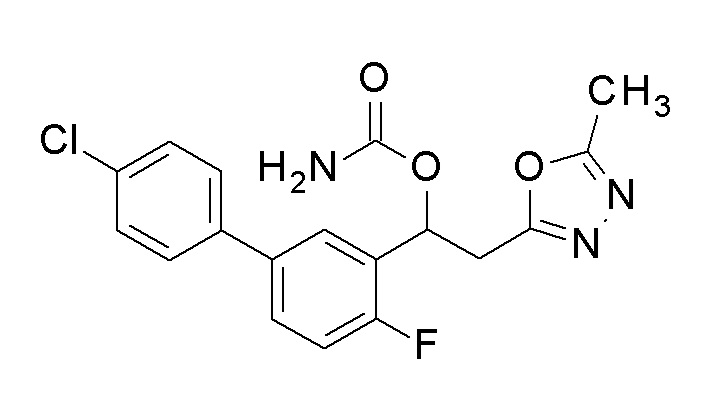
1-[5-(4-Хлорфенил)-2-фторфенил)-2-(5-метил-1,3,4-оксадиазол-2-ил)этанол, который был конечным соединением примера 1, в качестве исходного соединения применяли тем же способом, как в примере 3, получая заявленное в заголовке соединение.
1H-ЯМР (CDCl3, 400 МГц) δ=7,53 (д, J=8,0 Гц, 1H), 7,45-7,38 (м, 4H), 7,13 (м, 1H), 6,34 (уш с, 1H), 5,11 (уш с, 2H, NH2), 3,51-3,35 (м, 2H), 2,47 (с, 3H).
Пример 5: получение 1-[2-фтор-5-[4-(трифторметил)фенил]фенил]-2-(1,3,4-оксадиазол-2-ил)этанола
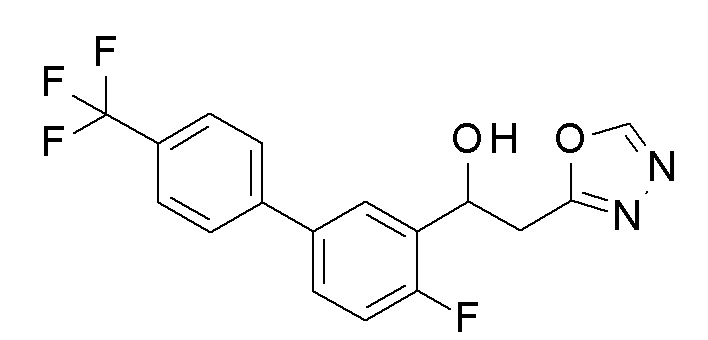
Заявленное в заголовке соединение получали тем же способом, как в примере 1, за исключением того, что 4-трифторметилбороновую кислоту применяли вместо 4-хлорфенилбороновой кислоты в примере 1-2, и N, N′-диметилформамид диметилацеталь применяли вместо N, N′-диметилацетамид диметилацеталя в примере 1-4.
1H-ЯМР (CDCl3, 400 МГц) δ=8,40 (с, 1H) 7,83 (д, J=8,5 Гц, 1H), 7,70-7,65 (м, 4H), 7,52 (уш с, 1H) 7,16 (м, 1H), 5,64 (м, 1H), 3,70(уш с, 1H), 3,39-3,34 (м, 2H).
Пример 6: получение 2-(5-метил-1,3,4-оксадиазол-2-ил)-1-[3-[4-(трифторметил)фенил]фенил]этанола
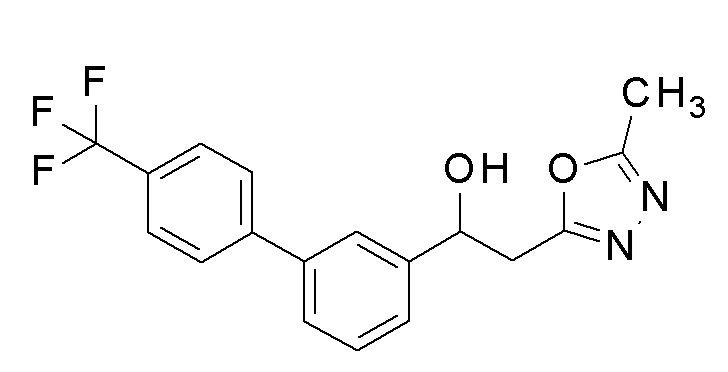
Заявленное в заголовке соединение получали тем же способом, как в примере 1, за исключением того, что 3-бромбензальдегид применяли в качестве исходного соединения и 4-трифторметилбороновую кислоту применяли вместо 4-хлорфенилбороновой кислоты в примере 1-2.
1H-ЯМР (CDCl3, 400 МГц) δ=7,70-7,68 (м, 4H), 7,57-7,55 (м, 1H), 7,51-7,45 (м, 3H), 5,37-5,33 (м, 1H), 3,34-3,24 (м, 3H), 2,53 (с, 3H).
Пример 7: получение [2-(5-метил-1,3,4-оксадиазол-2-ил)-1-[3-[4-(трифторметил)фенил]фенил]этил]карбамата
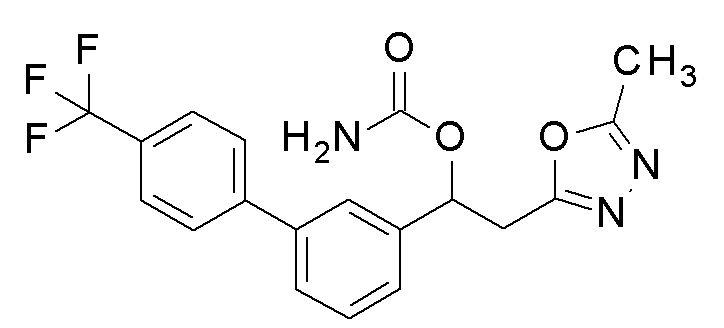
2-(5-Метил-1,3,4-оксадиазол-2-ил)-1-[3-[4-(трифторметил)фенил]фенил]этанол, который был конечным соединением примера 6, в качестве исходного соединения применяли тем же способом, как в примере 3, получая заявленное в заголовке соединение.
1H-ЯМР (CDCl3, 400 МГц) δ=7,67 (дд, J=10,0, 17,5 Гц, 4H), 7,58-7,39 (м, 4H), 6,13 (с, 1H), 4,95 (уш с, 2H, NH2), 3,52-3,29 (м, 2H), 2,49 (с, 3H).
Пример 8: получение 2-(5-метил-1,3,4-оксадиазол-2-ил)-1-[3-(2,2,3,3-тетрафторпропокси)фенил]этанола
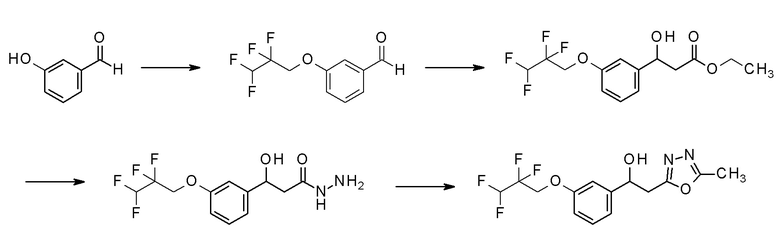
Пример 8-1: получение 3-(2,2,3,3-тетрафторпропокси)бензальдегида
2,2,3,3-Тетрафторпропанол (1,6 г, 12,3 ммоль) добавляли к 20 мл тетрагидрофурана, в котором растворяли 3-гидроксибензальдегид (1,0 г, 8,2 ммоль) и трифенилфосфин (3,2 г, 12,3 ммоль), охлаждали до 0°C в бане со льдом, и медленно добавляли по каплям к нему диизопропилазодикарбоксилат (1,9 г, 9,84 ммоль), поддерживая температуру. Реакционную смесь перемешивали при комнатной температуре в течение 18 часов, промывали насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия один раз каждый, и сушили над безводным сульфатом магния. Светло-желтую маслянистую жидкость, полученную удалением растворителя упариванием при пониженном давлении, очищали флэш-хроматографией, получая заявленное в заголовке соединение в виде светло-желтой жидкости.
Пример 8-2: получение этил-3-гидрокси-[3-(2,2,3,3-тетрафторпропокси)фенил]пропаноата
Диэтилцинк (1,0 M н-гексановый раствор, 6,4 мл, 6,4 ммоль) медленно добавляли к 20 мл диэтилового эфира, в котором растворяли 3-(2,2,3,3-тетрафторпропокси)бензальдегид (1,0 г, 4,2 ммоль) и этилйодацетат (1,4 г, 6,4 ммоль), полученный в примере 8-1, в бане со льдом, поддерживая температуру равной 0°C. Реакционную смесь перемешивали при той же температуре в течение 1 часа, и затем добавляли 100 мл этилацетата, промывали насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия один раз каждый, и сушили над безводным сульфатом магния. Светло-коричневую маслянистую жидкость, полученную удалением растворителя упариванием при пониженном давлении, очищали флэш-хроматографией, получая заявленное в заголовке соединение в виде светло-желтой маслянистой жидкости.
Пример 8-3: получение 3-гидрокси-3-[3-(2,2,3,3-тетрафторпропокси)фенил]пропангидразида
Гидразин моногидрат (0,3 г, 6,2 ммоль) добавляли к 20 мл этанола, в котором растворен этил-3-гидрокси-[3-(2,2,3,3-тетрафторпропокси)фенил]пропаноат (1,0 г, 3,1 ммоль), полученный в примере 8-2, и нагревали и кипятили с обратным холодильником в течение 18 часов. Реакционную смесь охлаждали до комнатной температуры и оставляли в течение приблизительно 1 часа, промывая полученный белый твердый остаток изопропиловым эфиром, и фильтровали его, получая заявленное в заголовке соединение.
Пример 8-4: получение 2-(5-метил-1,3,4-оксадиазол-2-ил)-1-[3-(2,2,3,3-тетрафторпропокси)фенил]этанола
N,N′-диметилацетамид диметилацеталь (0,6 г, 4,8 ммоль) добавляли к 20 мл толуола, содержащего 3-гидрокси-3-[3-(2,2,3,3-тетрафторпропокси)фенил]пропангидразид (1,0 г, 3,2 ммоль), полученный в примере 8-3, нагревали и кипятили с обратным холодильником при 110°C в течение приблизительно 1 часа, и добавляли к нему пара-толуолсульфокислоту (57 мг, 0,3 ммоль), и нагревали и кипятили с обратным холодильником в течение приблизительно 18 часов. Температуру понижали до комнатной температуры, добавляли к реакционной смеси 100 мл этилацетата, и затем смесь последовательно промывали насыщенным водным раствором хлорида аммония, насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия один раз каждый, и органический слой сушили над безводным сульфатом магния. Растворитель удаляли упариванием при пониженном давлении, и изопропиловый эфир добавляли к реакционной смеси и оставляли при комнатной температуре в течение 1 часа, промывая полученный белый твердый остаток изопропиловым эфиром, и фильтровали его, получая заявленное в заголовке соединение.
1H-ЯМР (CDCl3, 400 МГц) δ=7,30-6,85 (м, 4H), 6,21-5,94 (т, J=66,5 Гц, 1H), 5,22-5,20 (м, 1H), 4,37 (т, J=14,5 Гц, 2H), 4,15 (с, 1H), 3,18-3,16 (м, 2H), 2,48 (с, 3H).
Пример 9: получение [2-(5-метил-1,3,4-оксадиазол-2-ил)-1-[3-(2,2,3,3-тетрафторпропокси)фенил]этил]карбамата
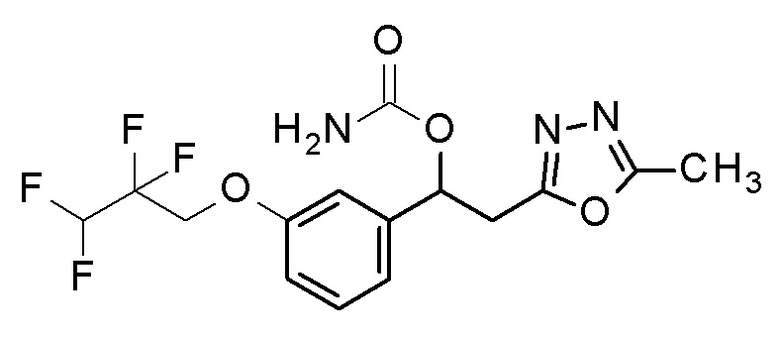
2-(5-Метил-1,3,4-оксадиазол-2-ил)-1-[3-(2,2,3,3-тетрафторпропокси)фенил]этанол, который представляет собой конечное соединение примера 8, в качестве исходного соединения применяли тем же способом, как в примере 3, получая заявленное в заголовке соединение.
1H-ЯМР (CDCl3, 400 МГц) δ=7,29 (дд, J=9,0, 18,0 Гц, 1H), 7,29 (дд, J1=9,0, 10,5 Гц, 2H), 6,96 (с, 1H), 6,20-5,94 (м, 2H), 4,98 (уш с, 2H, NH2), 4,37 (т, J=14,5 Гц, 2H) 4,35 (т, J=14,5 Гц, 2H), 3,43-3,41 (м, 1H), 3,24 (д, J=18,5 Гц, 1H), 2,49 (с, 3H).
Пример 10: получение 1-[2-фтор-5-(3,3,3-трифторпропил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола
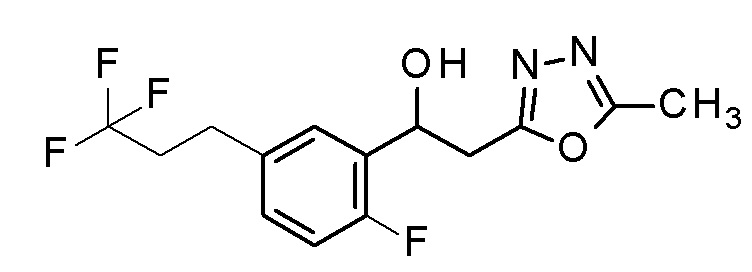
Заявленное в заголовке соединение получали тем же способом, как в примере 1, за исключением того, что 3,3,3-трифторпропилбороновую кислоту применяли вместо 4-хлорфенилбороновой кислоты в примере 1-2.
1H-ЯМР (CDCl3, 400 МГц) δ=7,43-7,41 (м, 1H), 7,13-7,11 (м, 1H), 6,99 (т, J=12,0 Гц, 1H), 5,54-5,52 (м, 1H), 3,55 (с, 1H), 3,27 (д, J=20,0 Гц, 2H), 3,17 (дд, J1=11,5, 20,0 Гц, 1H), 2,87 (т, J=9,5 Гц, 2H), 2,53 (с, 3H), 2,39 (дд, J1=12,5, 22 Гц, 1H).
Пример 11: получение [1-[2-фтор-5-(3,3,3-трифторпропил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата
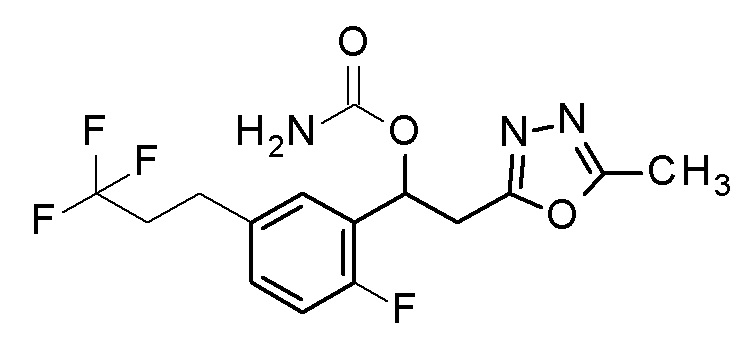
1-[2-Фтор-5-(3,3,3-трифторпропил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанол, который представляет собой конечное соединение примера 10, в качестве исходного соединения применяли тем же способом, как в примере 3, получая заявленное в заголовке соединение.
1H-ЯМР (CDCl3, 400 МГц) δ=7,19 (д, J=8,0 Гц, 1H), 7,14-7,12 (м, 1H), 7,02 (т, J=11,5 Гц, 1H), 6,28 (уш с, 1H), 4,77 (уш с, 2H, NH2), 3,45-3,35 (м, 2H), 2,85 (т, J=9,5 Гц, 2H), 2,50 (с, 3H), 2,36 (дд, J1=12,5, 22 Гц, 1H).
Пример 12: получение 1-[2-фтор-5-(3,3,3-трифторпропил)фенил]-2-(1,3,4-оксадиазол-2-ил)этанола
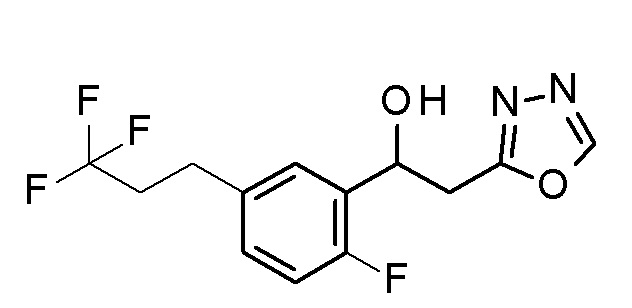
Заявленное в заголовке соединение получали тем же способом, как в примере 1, за исключением того, что 3,3,3-трифторпропилбороновую кислоту применяли вместо 4-хлорфенилбороновой кислоты в примере 1-2, и N,N′-диметилацетамид диметилацеталь применяли вместо N,N′-диметилацетамид диметилацеталя в примере 1-4.
1H-ЯМР (CDCl3, 400 МГц) δ=8,39 (с, 1H), 7,41 (д, J=6,5 Гц, 1H), 7,13-7,11 (м, 1H), 7,00 (т, J=12,5 Гц, 1H), 5,57-5,55 (м, 1H), 3,37-3,28 (м, 2H), 2,88-2,84 (м, 3H), 2,41-2,34 (м, 2H).
Пример 13: получение (1R)-2-(5-метил-1,3,4-оксадиазол-2-ил)-1-[3-[4-(трифторметил)фенил]фенил]этанола
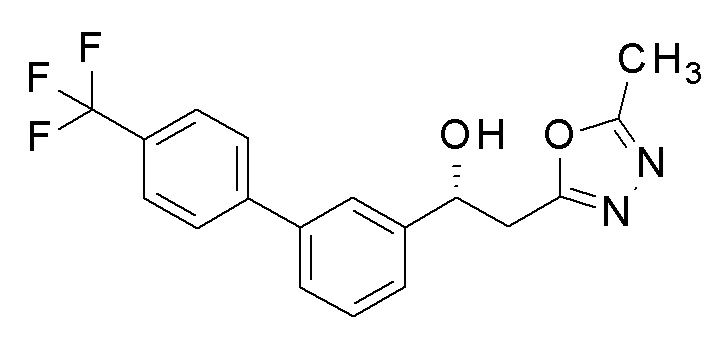
2-(5-Метил-1,3,4-оксадиазол-2-ил)-1-[3-[4-(трифторметил)фенил]фенил]этанол, который представляет собой конечное соединение примера 6, в качестве исходного соединения применяли для разделения оптического изомерного соединения, применяя устройство для препаративной ВЭЖХ на колонке chiralpak AD (2×20 см), н-гексан: этилацетат=90: 10 при скорости потока 20 мл/мин.
1H-ЯМР (CDCl3, 400 МГц) δ=7,70-7,68 (м, 4H), 7,57-7,55 (м, 1H), 7,51-7,45 (м, 3H), 5,37-5,33 (м, 1H), 3,34-3,24 (м, 3H), 2,53 (с, 3H).
Пример 14: получение (1S)-2-(5-метил-1,3,4-оксадиазол-2-ил)-1-[3-[4-(трифторметил)фенил]фенил]этанола
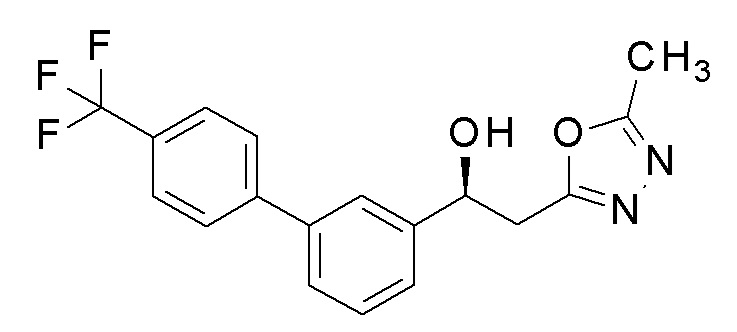
2-(5-Метил-1,3,4-оксадиазол-2-ил)-1-[3-[4-(трифторметил)фенил]фенил]этанол, который представляет собой конечное соединение примера 6, в качестве исходного соединения применяли для разделения оптического изомерного соединения, применяя устройство для препаративной ВЭЖХ на колонке chiralpak AD (2×20 см), н-гексан: этилацетат=90: 10 при скорости потока 20 мл/мин.
1H-ЯМР (CDCl3, 400 МГц) δ=7,70-7,68 (м, 4H), 7,57-7,55 (м, 1H), 7,51-7,45 (м, 3H), 5,37-5,33 (м, 1H), 3,34-3,24 (м, 3H), 2,53 (с, 3H).
Пример 15: получение 1-[2-фтор-5-(4,4,4-трифторбутокси)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола
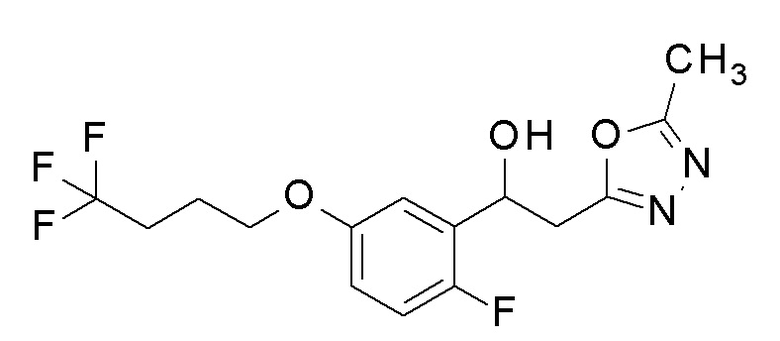
Заявленное в заголовке соединение получали тем же способом, как в примере 8, за исключением того, что 2-фтор-5-гидроксибензальдегид применяли в качестве исходного соединения в примере 8-1 и 4,4,4-трифторбутанол применяли вместо 2,2,3,3-тетрафторпропанола.
1H-ЯМР (CDCl3, 400 МГц) δ=7,11-7,09 (м, 1H), 6,99 (д, J=9,6 Гц, 1H), 6,79-6,76 (м, 1H), 5,51-5,48 (м, 1H), 4,01-3,98 (м, 2H), 3,52 (д, J=4,0 Гц, 1H), 3,28-3,12 (м, 2H), 2,52 (с, 3H), 2,34-2,27 (м, 2H), 2,07-2,02 (м, 2H).
Пример 16: получение [1-[2-фтор-5-(4,4,4-трифторбутокси)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата
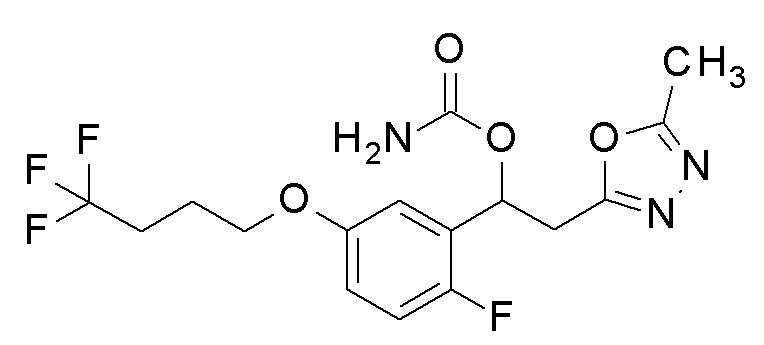
1-[2-Фтор-5-(4,4,4-трифторбутокси)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанол, который представляет собой конечное соединение примера 15, в качестве исходного соединения применяли тем же способом, как в примере 3, получая заявленное в заголовке соединение.
1H-ЯМР (CDCl3, 400 МГц) δ=6,98 (т, J=11,5 Гц, 1H), 6,88 (дд, J1= 4,0, 7,0 Гц, 1H), 6,25 (дд, J=6,0, 10,5 Гц, 1H), 5,05 (уш с, 2H, NH2), 3,96 (т, J=7,5 Гц, 2H) 3,43 (дд, J=10,5, 19,0 Гц, 1H), 3,31 (дд, J=6,0, 19,0 Гц, 1H), 2,49 (с, 3H), 2,31-2,29 (м, 2H), 2,03-2,01 (м, 2H).
Пример 17: получение 1-[2-фтор-5-(2,2,2-трифторэтокси)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола
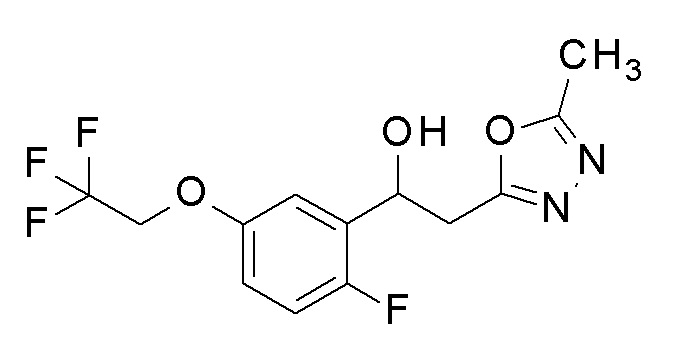
Заявленное в заголовке соединение получали тем же способом, как в примере 8, за исключением того, что 2-фтор-5-гидроксибензальдегид применяли в качестве исходного соединения в примере 8-1, и 2,2,2-трифторэтанол применяли вместо 2,2,3,3-тетрафторпропанола.
1H-ЯМР (CDCl3, 400 МГц) δ=7,21-7,19 (м, 1H), 7,01 (т, J=11,5 Гц, 1H), 6,89-6,85 (м, 1H), 5,53-5,49 (м, 1H), 4,35 (кв, J=10 Гц, 2H), 3,65 (д, J=5,5 Гц, 1H), 3,27 (дд, J=4,0, 20,5 Гц, 1H), 3,13 (дд, J=11,5, 20,5 Гц, 1H), 2,53 (с, 3H).
Пример 18: получение [1-[2-фтор-5-(2,2,2-трифторэтокси)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата

1-[2-Фтор-5-(2,2,2-трифторэтокси)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанол, который представляет собой конечное соединение примера 17, в качестве исходного соединения применяли тем же способом, как в примере 3, получая заявленное в заголовке соединение.
1H-ЯМР (CDCl3, 400 МГц) δ=7,03 (т, J=11,5 Гц, 1H), 6,97-6,95 (м, 1H), 6,88-6,84 (м, 1H), 6,29-6,26 (м, 1H), 4,74 (уш с, 2H, NH2), 4,31 (кв, J=10 Гц, 2H), 3,43 (дд, J=10,5, 19,5 Гц, 1H), 3,34 (дд, J=6,0, 19,5 Гц, 1H), 2,50 (с, 3H).
Пример 19: получение 2-(5-метил-1,3,4-оксадиазол-2-ил)-1-[3-(4,4,4-трифторбутокси)фенил]этанола
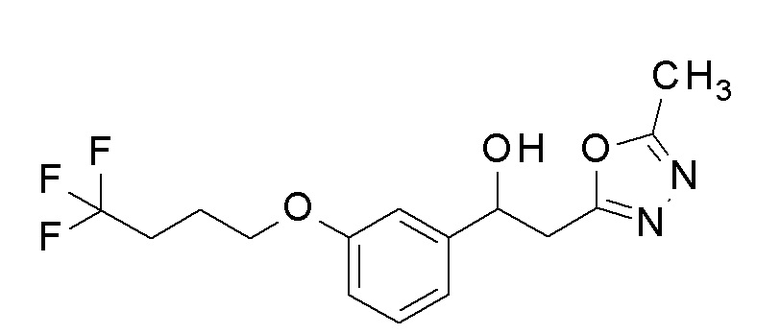
Заявленное в заголовке соединение получали тем же способом, как в примере 8, за исключением того, что 4,4,4-трифторбутанол применяли вместо 2,2,3,3-тетрафторпропанола в примере 8-1.
1H-ЯМР (CDCl3, 400 МГц) δ=7,29 (д, J=10,0 Гц, 1H), 6,99-6,97 (м, 2H), 6,84-6,82 (м, 1H), 5,23-5,21 (м, 1H), 4,02 (т, J=7,5 Гц, 2H), 3,32 (д, J=4,5 Гц, 1H) 3,19-3,17 (м, 1H), 2,51 (с, 3H), 2,33-2,31 (м, 2H), 2,05 (м, 2H).
Пример 20: получение [2-(5-метил-1,3,4-оксадиазол-2-ил)-1-[3-(4,4,4-трифторбутокси)фенил]этил]карбамата
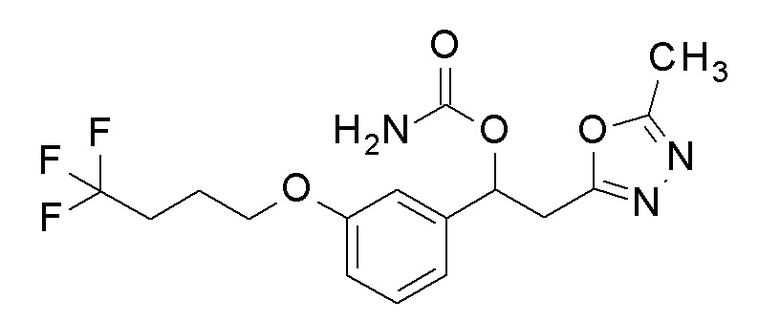
2-(5-Метил-1,3,4-оксадиазол-2-ил)-1-[3-(4,4,4-трифторбутокси)фенил]этанол, который представляет собой конечное соединение примера 19, в качестве исходного соединения применяли тем же способом, как в примере 3, получая заявленное в заголовке соединение.
1H-ЯМР (CDCl3, 400 МГц) δ=7,29 (д, J=10,0 Гц, 1H), 6,95 (д, J=10,0 Гц, 1H) 6,90-6,83 (м, 2H), 6,02 (м, 1H), 4,71 (уш с, 2H, NH2), 4,01 (т, J=7,5 Гц, 2H), 3,43 (дд, J=11,0, 19,0 Гц, 1H), 3,26 (дд, J=6,0, 19,0 Гц, 1H), 2,50 (с, 3H), 2,33-2,31 (м, 2H), 2,06-2,04 (м, 2H).
Пример 21: получение 1-(5-бутокси-2-фторфенил)-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола
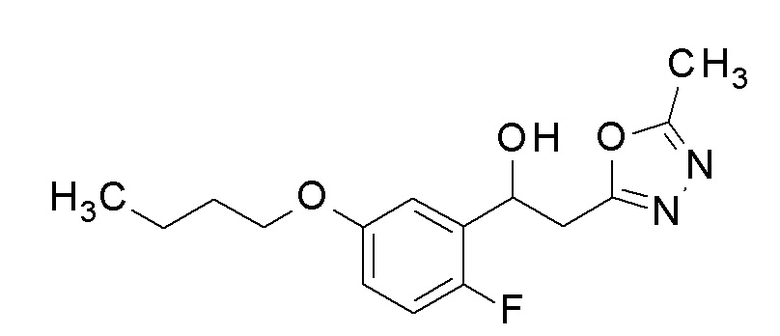
Заявленное в заголовке соединение получали тем же способом, как в примере 8, за исключением того, что н-бутанол применяли вместо 2,2,3,3-тетрафторпропанола в примере 8-1.
1H-ЯМР (CDCl3, 400 МГц) δ=7,11 (с, 1H), 6,94-6,92 (м, 1H), 6,78-6,76 (м, 1H), 5,49-5,47 (м, 1H), 4,04 (с, 1H, OH), 3,95-3,93 (м, 2H), 3,23-3,21 (м, 2H), 2,56 (с, 3H), 1,78-1,76 (м, 2H), 1,53-1,51 (м, 2H), 0,96-0,94 (м, 3H).
Пример 22: получение [1-(5-бутокси-2-фторфенил)-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата
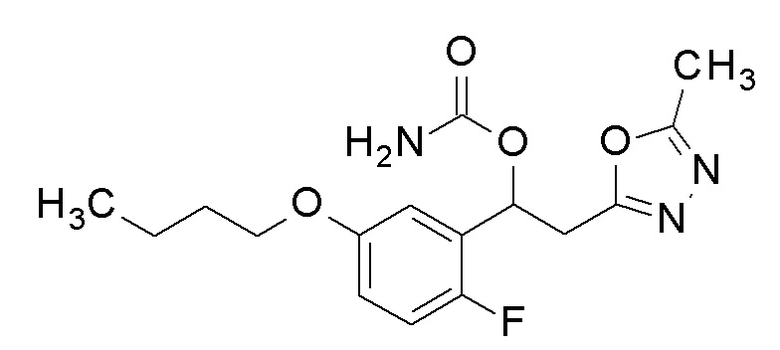
1-(5-Бутокси-2-фторфенил)-2-(5-метил-1,3,4-оксадиазол-2-ил)этанол, который представляет собой конечное соединение примера 21, в качестве исходного соединения применяли тем же способом, как в примере 3, получая заявленное в заголовке соединение.
1H-ЯМР (CDCl3, 400 МГц) δ=6,97-6,95 (м, 1H), 6,87-6,85 (м, 1H), 6,77-6,75 (м, 1H), 6,25-6,23 (м, 1H), 4,78 (с, 2H, NH2), 3,95-3,93 (м, 2H), 3,48-3,46 (м, 2H), 2,56 (с, 3H), 1,78-1,76 (м, 2H), 1,53-1,51 (м, 2H), 0,94-0,92 (м, 3H).
Пример 23: получение 1-[2-фтор-5-(4,4,4-трифторбутокси)фенил]-2-(1,3,4-оксадиазол-2-ил)этанола
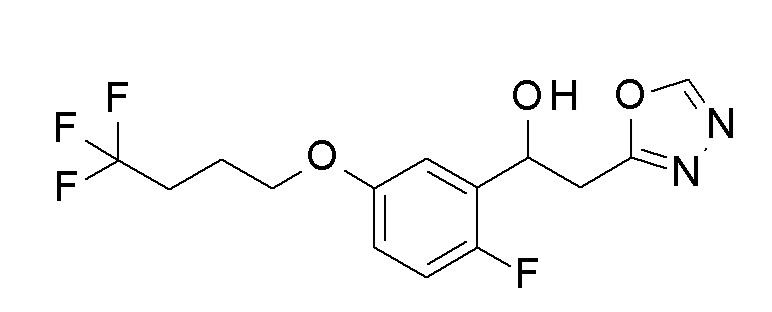
Заявленное в заголовке соединение получали тем же способом, как в примере 8, за исключением того, что 2-фтор-5-гидроксибензальдегид применяли в качестве исходного соединения в примере 8-1, 4,4,4-трифторбутанол применяли вместо 2,2,3,3-тетрафторпропанола, и N, N′-диметилформамид диметилацеталь применяли вместо N, N′-диметилацетамид диметилацеталя в примере 8-4.
1H-ЯМР (CDCl3, 400 МГц) δ=8,38 (с, 1H), 7,29 (дд, J=4,0, 7,5 Гц, 1H), 6,97 (т, J=11,0 Гц, 1H), 6,80-6,77 (м, 1H), 5,54-5,52 (м, 1H), 4,00-3,98 (м, 2H), 3,56 (д, J=5,0 Гц, 1H), 3,34 (дд, J=4,5, 20,0 Гц, 1H), 3,26 (дд, J=11,0, 20,0 Гц, 1H), 2,33-2,31 (м, 2H), 2,05-2,03 (м, 2H).
Пример 24: получение [1-[2-фтор-5-(4,4,4-трифторбутокси)фенил]-2-(1,3,4-оксадиазол-2-ил)этил]карбамата
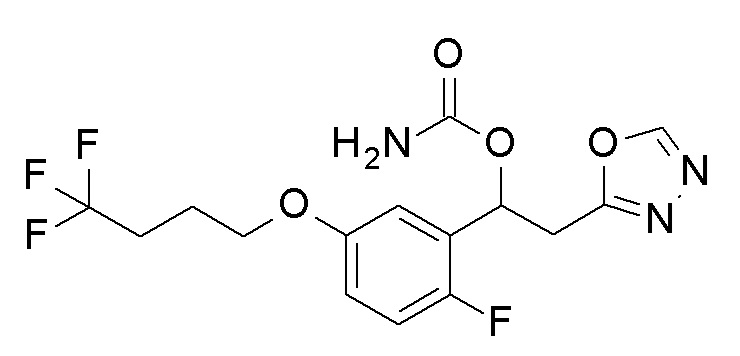
1-[2-Фтор-5-(4,4,4-трифторбутокси)фенил]-2-(1,3,4-оксадиазол-2-ил)этанол, который представляет собой конечное соединение примера 23, в качестве исходного соединения применяли тем же способом, как в примере 3, получая заявленное в заголовке соединение.
1H-ЯМР (CDCl3, 400 МГц) δ=8,36 (с, 1H), 6,90 (т, J=12,0 Гц, 1H), 6,87-6,77 (м, 2H), 6,30 (дд, J=6,0, 10,5 Гц, 1H) 4,89 (уш с, 2H, NH2), 3,96 (т, J=7,5 Гц, 2H), 3,53 (дд, J=10,5, 19,0 Гц, 1H), 3,42 (дд, J=6,0, 19,0 Гц, 1H), 2,32-2,30 (м, 2H), 2,05-2,03 (м, 2H).
Пример 25: получение 1-(2-фтор-5-пропилфенил)-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола
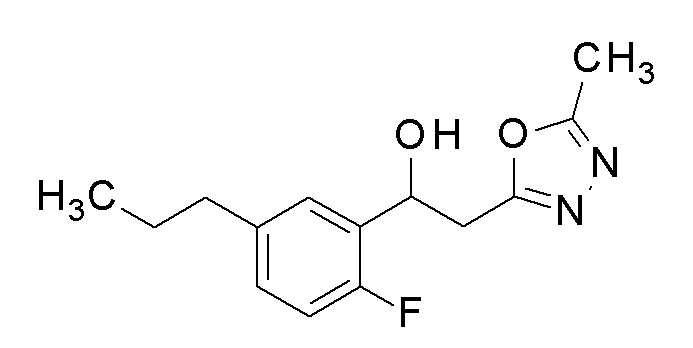
Заявленное в заголовке соединение получали тем же способом, как в примере 1, за исключением того, что н-пропилбороновую кислоту применяли вместо 4-хлорфенилбороновой кислоты в примере 1-2.
1H-ЯМР (CDCl3, 400 МГц) δ=7,36-7,33 (м, 1H), 7,10-7,06 (м, 1H), 6,97-6,92 (м, 1H), 5,52-5,48 (м, 1H), 3,29-3,16 (м, 2H), 2,58 (т, J=7,6, 2H), 2,51 (с, 3H), 1,66-1,57 (м, 2H), 0,94-0,90 (т, J=7,2, 3H).
Пример 26: получение 1-(2-фтор-5-пентилфенил)-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола
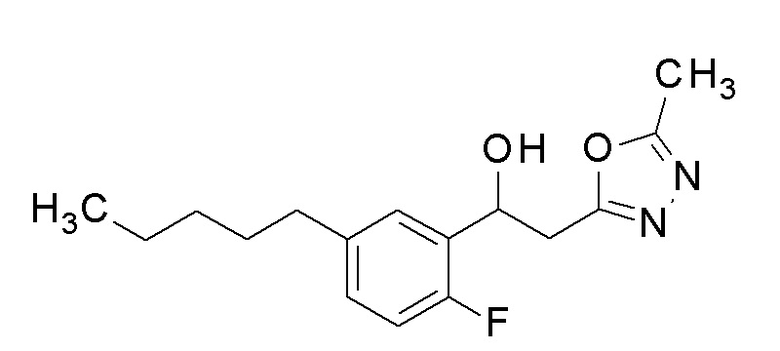
Заявленное в заголовке соединение получали тем же способом, как в примере 1, за исключением того, что N-хлорфенилбороновую кислоту применяли вместо 4-хлорфенилбороновой кислоты в примере 1-2.
1H-ЯМР (CDCl3, 400 МГц) δ=7,36-7,34 (м, 1H), 7,08-7,06 (м, 1H), 6,97-6,92 (м, 1H), 5,51-5,48 (м, 1H), 3,25 (уш с, 1H), 3,24-3,20 (м, 2H), 2,58 (т, J=8,0, 2H), 2,51 (с, 3H), 1,60-1,55 (м, 2H*2), 1,34-1,30 (м, 2H) 0,90-0,87 (т, J=6,8, 3H).
Пример 27: получение [1-(2-фтор-5-пропилфенил)-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата
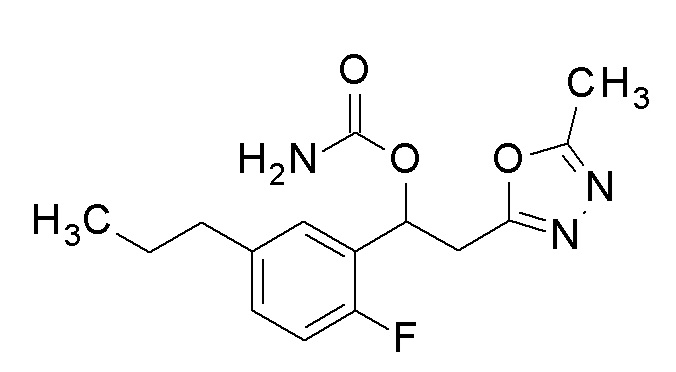
1-(2-Фтор-5-пропилфенил)-2-(5-метил-1,3,4-оксадиазол-2-ил)этанол, который представляет собой конечное соединение примера 25, в качестве исходного соединения применяли тем же способом, как в примере 3, получая заявленное в заголовке соединение.
1H-ЯМР (CDCl3, 400 МГц) δ=7,15-7,12 (м, 1H), 7,09-7,08 (м, 1H), 6,99-6,94 (м, 1H), 6,30-6,26 (м, 1H), 4,13 (уш с, 2H), 4,13 (дд, J=15,2, J=8,4, 1H), 3,36 (дд, J=15,2, J=4,8, 1H), 2,57 (т, J=7,6, 2H), 2,49 (с, 3H), 1,66-1,54 (м, 2H), 0,93-0,89 (т, J=7,2, 3H).
Пример 28: получение [1-(2-фтор-5-пентилфенил)-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата
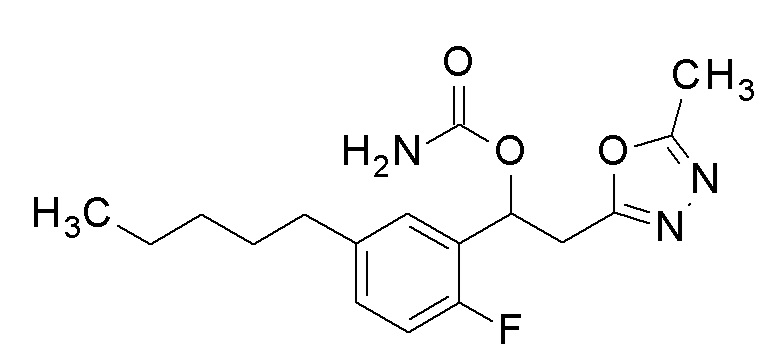
1-(2-Фтор-5-пентилфенил)-2-(5-метил-1,3,4-оксадиазол-2-ил)этанол, который представляет собой конечное соединение примера 26, в качестве исходного соединения применяли тем же способом, как в примере 3, получая заявленное в заголовке соединение.
1H-ЯМР (CDCl3, 400 МГц) δ=7,15-7,13 (м, 1H), 7,09-7,08 (м, 1H), 6,98-6,94 (м, 1H), 6,29-6,26 (м, 1H), 4,63 (уш с, 2H), 3,49 (дд, J=15,2, J=8,8, 1H), 3,35 (дд, J=15,2, J=4,4, 1H), 2,56 (т, J=7,6, 2H), 2,49 (с, 3H), 1,58-1,54 (м, 2H), 1,34-1,25 (м, 2H*2), 0,91-0,89 (т, J=7,2, 3H).
Пример 29: получение 1-[2-фтор-5-(4,4,4-трифторбутил)фенил]-2-(1,3,4-оксадиазол-2-ил)этанола
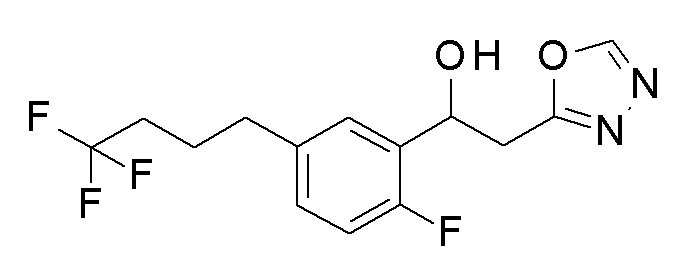
Заявленное в заголовке соединение получали тем же способом, как в примере 1, за исключением того, что 4,4,4-трифтормасляную кислоту применяли вместо 4-хлорфенилбороновой кислоты в примере 1-2, и N, N′-диметилацетамид диметилацеталь применяли вместо N, N′-диметилацетамид диметилацеталя в примере 1-4.
1H-ЯМР (CDCl3, 400 МГц) δ=8,38 (с, 1H), 7,39-7,36 (м, 1H), 7,11-7,10 (м, 1H), 7,02-6,98 (м, 1H), 5,58-5,55 (м, 1H), 3,40-3,26 (м, 3H), 2,71-2,67 (м, 2H), 2,10-2,05 (м, 2H), 2,18-2,05 (м, 2H), 1,90-1,86 (м, 2H).
Пример 30: получение 1-[2-фтор-5-(5,5,5-трифторпентил)фенил]-2-(1,3,4-оксадиазол-2-ил)этанола

Заявленное в заголовке соединение получали тем же способом, как в примере 1, за исключением того, что 5,5,5-трифторпентилбороновую кислоту применяли вместо 4-хлорфенилбороновой кислоты в примере 1-2, и N,N′-диметилацетамид диметилацеталь применяли вместо N,N′-диметилацетамид диметилацеталя в примере 1-4.
1H-ЯМР (CDCl3, 400 МГц) δ=8,37 (с, 1H), 7,36 (дд, J=2,1, 7,0 Гц, 1H), 7,12-7,05 (м, 1H), 6,98 (дд, J=8,4, 10,2 Гц, 1H), 5,55 (дд, J=3,7, 8,3 Гц, 1H), 3,37-3,28 (м, 2H), 2,63 (т, J=7,5 Гц, 2H), 2,1-2,02 (м, 2H), 1,73-1,64 (м, 2H), 1,59 (д, J=7,2 Гц, 2H).
Пример 31: получение 1-[2-фтор-5-(4,4,4-трифторбутил)-фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола
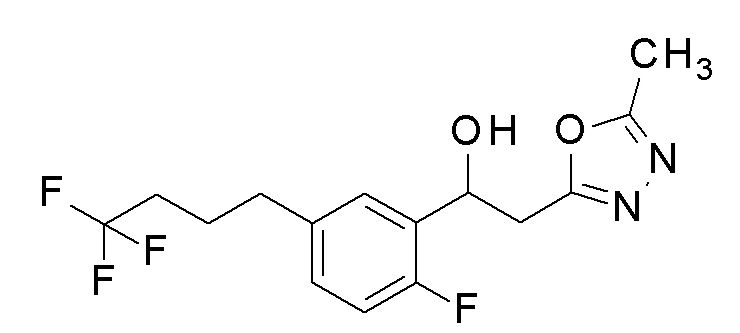
Заявленное в заголовке соединение получали тем же способом, как в примере 1, за исключением того, что 4,4,4-трифтормасляную кислоту применяли вместо 4-хлорфенилбороновой кислоты в примере 1-2.
1H-ЯМР (CDCl3, 400 МГц) δ=7,40-7,38 (м, 1H), 7,12-7,09 (м, 1H), 7,02-6,97 (м, 1H), 5,55-5,51 (м, 1H), 3,48-3,46 (м, 1H), 3,28-3,19 (м, 2H), 2,70-2,67 (м, 2H), 2,50 (с, 3H), 2,18-2,05 (м, 2H), 1,92-1,86 (м, 2H).
Пример 32: получение 1-[2-фтор-5-(5,5,5-трифторпентил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола
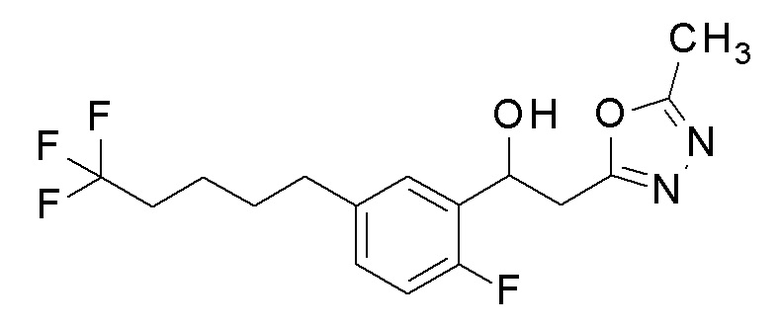
Заявленное в заголовке соединение получали тем же способом, как в примере 1, за исключением того, что 5,5,5-трифторпентилбороновую кислоту применяли вместо 4-хлорфенилбороновой кислоты в примере 1-2.
1H-ЯМР (CDCl3, 400 МГц) δ=7,38 (дд, J=2,1, 7,0 Гц, 1H), 7,08 (ддд, J=2,3, 5,3, 8,1 Гц, 1H), 6,97 (дд, J=8,4, 10,3 Гц, 1H), 5,56-5,48 (м, 1H), 3,47 (д, J=4,4 Гц, 1H), 3,33-3,15 (м, 2H), 2,69-2,59 (м, 2H), 2,53 (с, 3H), 2,21-2,03 (м, 2H), 1,74-1,61 (м, 4H).
Пример 33: получение [1-[2-фтор-5-(4,4,4-трифторбутил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата
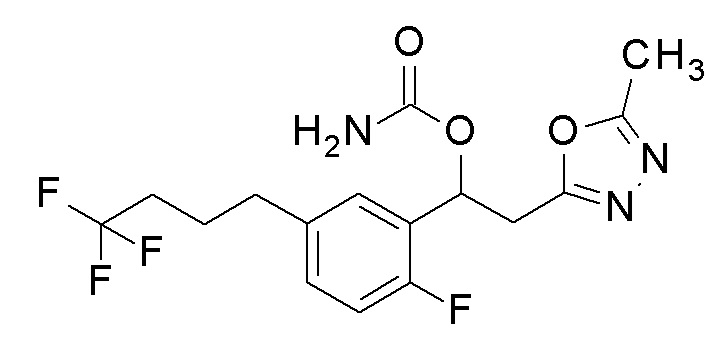
1-[2-Фтор-5-(4,4,4-трифторбутил)-фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанол, который представляет собой конечное соединение примера 31, в качестве исходного соединения применяли тем же способом, как в примере 3, получая заявленное в заголовке соединение.
1H-ЯМР (CDCl3, 400 МГц) δ=7,18-7,12 (м, 2H), 7,03-7,01 (м, 1H), 6,34-6,28 (м, 1H), 4,77-4,64 (м, 2H), 3,50-3,44 (м, 1H), 3,38-3,34 (м, 1H), 2,69-2,65 (м, 2H), 2,50 (с, 3H), 2,11-2,05 (м, 2H), 1,90-1,84 (м, 2H).
Пример 34: получение [1-[2-фтор-5-(5,5,5-трифторпентил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата
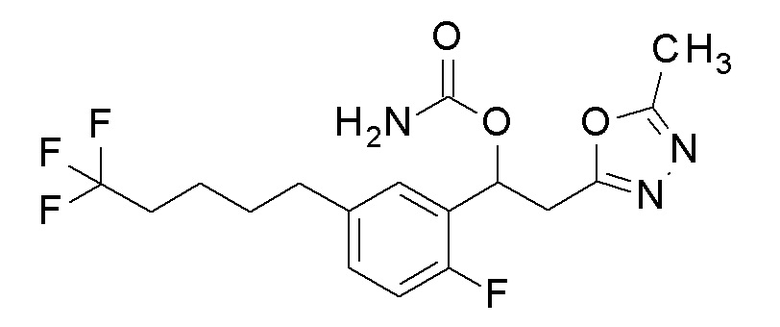
1-[2-Фтор-5-(5,5,5-трифторпентил)-фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанол, который представляет собой конечное соединение примера 32, в качестве исходного соединения применяли тем же способом, как в примере 3, получая заявленное в заголовке соединение.
1H-ЯМР (CDCl3, 400 МГц) δ=7,16 (д, J=5,8 Гц, 1H), 7,09 (д, J=5,0 Гц, 1H), 7,04-6,95 (м, 1H), 6,29 (дд, J=4,6, 8,3 Гц, 1H), 4,73 (с, 2H), 3,55-3,28 (м, 2H), 2,61 (т, J=7,3 Гц, 2H), 2,50 (с, 3H), 2,18-2,03 (м, 2H), 1,64 (дд, J=7,8, 15,9 Гц, 4H).
Пример 35: получение 1-[2-фтор-5-[3-(1-пиперидил)пропокси]фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола
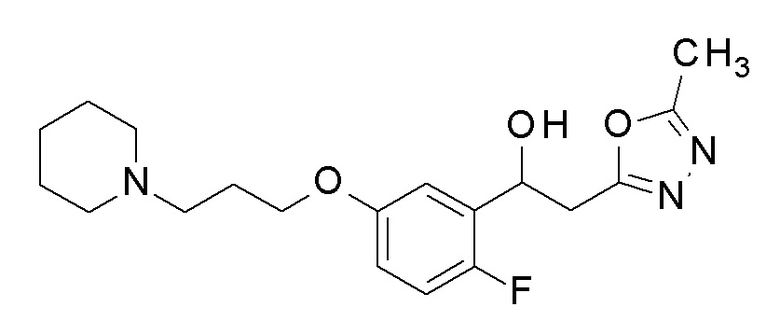
Заявленное в заголовке соединение получали тем же способом, как в примере 8, за исключением того, что 2-фтор-5-гидроксибензальдегид применяли в качестве исходного соединения в примере 8-1, и 3-(1-пиперидил)пропан-1-ол применяли вместо 2,2,3,3-тетрафторпропанола.
1H-ЯМР (CDCl3, 400 МГц) δ=7,12 (дд, J=5,8, 3,1 Гц, 1H), 6,95 (т, J=9,3 Гц, 1H), 6,76 (дт, J=8,8, 3,6 Гц, 1H), 5,49 (дд, J=8,8, 3,6 Гц, 1H), 4,08-4,00 (м, 2H), 3,29-3,15 (м, 2H), 2,94-2,77 (м, 6H), 2,52 (с, 3H), 2,29-2,20 (м, 2H), 1,95-1,83 (м, 4H), 1,63-1,54 (м, 2H).
Пример 36: получение 1-[5-[3-(диметиламино)пропокси]-2-фторфенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола
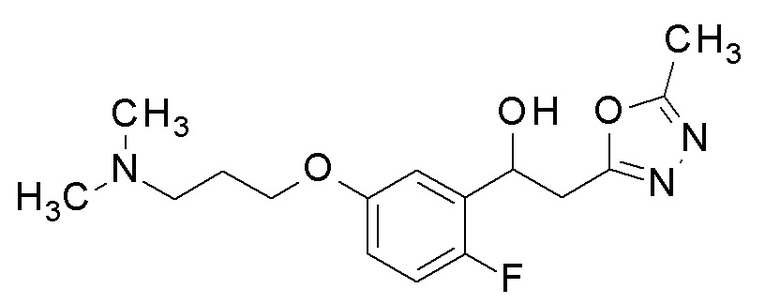
Заявленное в заголовке соединение получали тем же способом, как в примере 8, за исключением того, что 2-фтор-5-гидроксибензальдегид применяли в качестве исходного соединения в примере 8-1, и 3-(диметиламино)пропан-1-ол применяли вместо 2,2,3,3-тетрафторпропанола.
1H-ЯМР (CDCl3, 400 МГц) δ=7,13 (дд, J=5,8, 3,2 Гц, 1H), 6,96 (т, J=9,3 Гц, 1H), 6,77 (дт, J=8,8, 3,6 Гц, 1H), 5,49 (дд, J=8,8, 3,2 Гц, 1H), 4,09-4,04 (м, 2H), 3,29-3,14 (м, 2H), 3,00 (т, J=3,6 Гц, 2H), 2,67 (с, 6H), 2,52 (с, 3H), 2,28-2,21 (м, 2H).
Пример 37: получение 4-фтор-3-[1-гидрокси-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]-N-(3,3,3-трифторпропил)бензамида
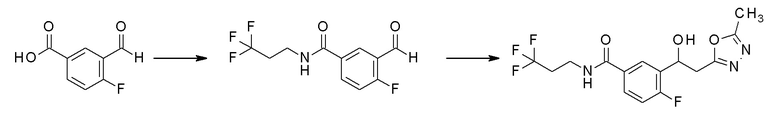
Пример 37-1: получение 4-фтор-3-формил-N-(3,3,3-трифторпропил)бензамида
Тетрафторборат N,N,N′,N′-тетраметил-O-(бензотриазол-1-ил)урония (2,3 г, 7,1 ммоль) добавляли к 20 мл хлористого метилена, в котором растворяли 4-фтор-3-формилбензойную кислоту (1,0 г, 5,9 ммоль), N,N-диизопропилэтиламин (3,1 мл, 17,8 ммоль) и 3,3,3-трифторпропиламин (0,8 г, 7,1 ммоль), и перемешивали при комнатной температуре в течение 1 часа. Реакционную смесь последовательно промывали насыщенным водным раствором хлорида аммония, насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия один раз каждый, и сушили над безводным сульфатом магния. Светло-желтую маслянистую жидкость, полученную удалением растворителя упариванием при пониженном давлении, очищали флэш-хроматографией, получая заявленное в заголовке соединение в светло-желтом виде.
Пример 37-2: получение 4-фтор-3-[1-гидрокси-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]-N-(3,3,3-трифторпропил)бензамида
К 10 мл сухого тетрагидрофурана, в котором растворяли 2,5-диметил-1,3,4-оксадиазол (0,4 г, 3,8 ммоль), температуру понижали до -78°C, добавляли диизопропиламид лития (1,0 M н-гексановый раствор, 4,5 мл, 4,5 ммоль) и перемешивали в течение 30 минут, с последующим медленным добавлением по каплям 20 мл сухого тетрагидрофурана, в котором растворяли 4-фтор-3-формил-N-(3,3,3-трифторпропил)бензамид (1,0 г, 3,8 ммоль), полученный в примере 37-1, поддерживая температуру. Реакционную смесь медленно нагревали до комнатной температуры, перемешивали в течение 10 часов, промывали насыщенным водным раствором хлорида аммония, насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия последовательно каждым один раз, и сушили над безводным сульфатом магния. Светло-желтую маслянистую жидкость, полученную удалением растворителя упариванием при пониженном давлении, очищали флэш-хроматографией, получая заявленное в заголовке соединение в виде белого твердого остатка.
1H-ЯМР (CDCl3, 400 МГц) δ=8,06 (д, J=2,5 Гц, 1H), 8,05-7,84 (м, 1H), 7,14 (т, J=12,0 Гц, 1H), 7,00 (уш с, 1H, NH), 5,54 (м, 1H), 4,44 (д, J=8,0 Гц, 1H), 3,75-3,70 (м, 2H), 3,30 (дд, J1=20,0 Гц, J2=4,0 Гц, 1H), 3,20 (дд, J1=20,0 Гц, J2=11,5 Гц, 1H), 2,55 (с, 3H), 2,50 (м, 2H).
Пример 38: получение [1-[2-фтор-5-(3,3,3-трифторпропилкарбамоил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата
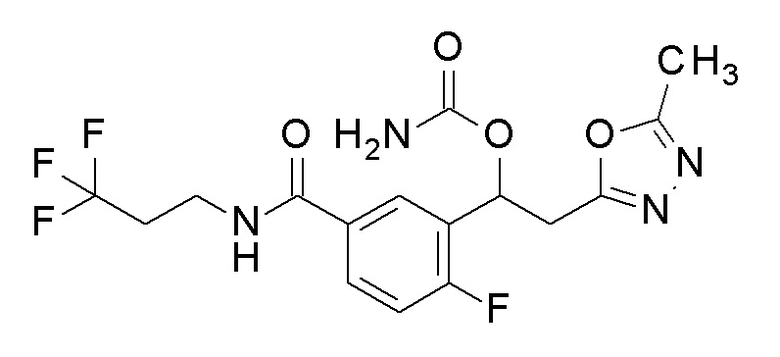
4-Фтор-3-[1-гидрокси-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]-N-(3,3,3-трифторпропил)бензамид, который представляет собой конечное соединение примера 37, в качестве исходного соединения применяли тем же способом, как в примере 3, получая заявленное в заголовке соединение.
1H-ЯМР (CDCl3, 400 МГц) δ=7,86 (д, J=3,0 Гц, 1H), 7,86-7,71 (м, 1H), 7,12 (т, J=10,5 Гц, 1H), 6,74 (уш с, 1H, NH), 6,31 (дд, J1=10,0 Гц, J2=6,5 Гц, 1H) 5,0 (уш с, 2H, NH2), 3,68 (дд, J1=16,0 Гц, J2=8,0 Гц, 2H), 3,45 (дд, J1=19,0 Гц, J2=10,0 Гц, 1H), 3,33 (дд, J1=19,0 Гц, J2=6,5 Гц, 1H), 2,50-2,44 (м, 5H).
Пример 39: получение 1-[2-хлор-5-(4,4,4-трифторбутокси)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола
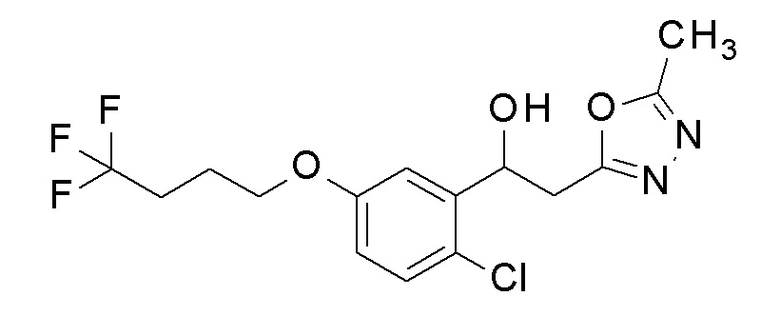
Заявленное в заголовке соединение получали тем же способом, как в примере 8, за исключением того, что 2-хлор-5-гидроксибензальдегид применяли в качестве исходного соединения в примере 8-1 и 4,4,4-трифторбутанол применяли вместо 2,2,3,3-тетрафторпропанола.
1H-ЯМР (CDCl3, 400 МГц) δ=7,25 (д, J=8,8 Гц, 1H), 7,22 (д, J=3,0 Гц, 1H), 6,79 (дд, J=8,8, 3,0 Гц, 1H), 5,55 (дт, J=9,4, 3,2 Гц, 1H), 4,05-3,99 (м, 2H), 3,58 (д, J=3,6 Гц, 1H), 3,35-3,29 (м, 1H), 3,08-3,01 (м, 1H), 2,53 (с, 3H), 2,35-2,28 (м, 2H), 2,09-2,02 (м, 2H).
Пример 40: получение [1-[5-[3-(диметиламино)пропокси]-2-фторфенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата
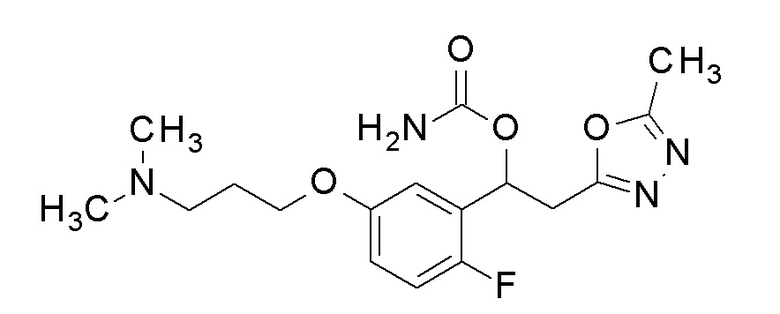
1-[5-[3-(Диметиламино)пропокси]-2-фторфенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанол, который представляет собой конечное соединение примера 36, в качестве исходного соединения применяли тем же способом, как в примере 3, получая заявленное в заголовке соединение.
1H-ЯМР (CDCl3, 400 МГц) δ=6,97 (т, J=9,6 Гц, 1H), 6,89 (дд, J=5,6, 3,2 Гц, 1H), 6,80 (дт, J=8,8, 3,6 Гц, 1H), 6,27 (дд, J=8,4, 4,8 Гц, 1H), 4,74 (уш с, 2H, NH2), 3,97 (т, J=6,6 Гц, 2H), 3,47-3,29 (м, 2H), 2,53-2,47 (м, 2H), 2,50 (с, 3H), 2,29 (с, 6H), 1,98-1,94 (м, 2H).
Пример 41: получение [1-[2-хлор-5-(4,4,4-трифторбутокси)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата
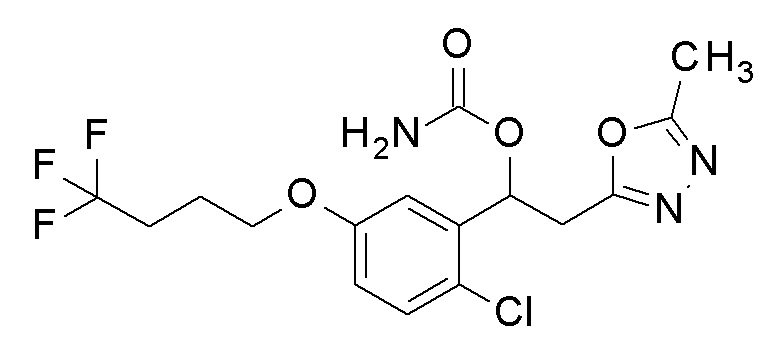
1-[2-Хлор-5-(4,4,4-трифторбутокси)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанол, который представляет собой конечное соединение примера 39, в качестве исходного соединения применяли тем же способом, как в примере 3, получая заявленное в заголовке соединение.
1H-ЯМР (CDCl3, 400 МГц) δ=7,28 (д, J=8,8 Гц, 1H), 6,94 (д, J=3,0 Гц, 1H), 6,78 (дд, J=8,8, 3,0 Гц, 1H), 6,34 (дд, J=7,4, 5,3 Гц, 1H), 4,77 (уш с, 2H, NH2), 3,98 (т, J=5,8 Гц, 2H), 3,36-3,33 (м, 2H), 2,51 (с, 3H), 2,37-2,25 (м, 2H), 2,09-2,01 (м, 2H).
Пример 42: получение 2-(5-метил-1,3,4-оксадиазол-2-ил)-1-[2-метил-5-[4-(трифторметил)фенил]фенил]этанола
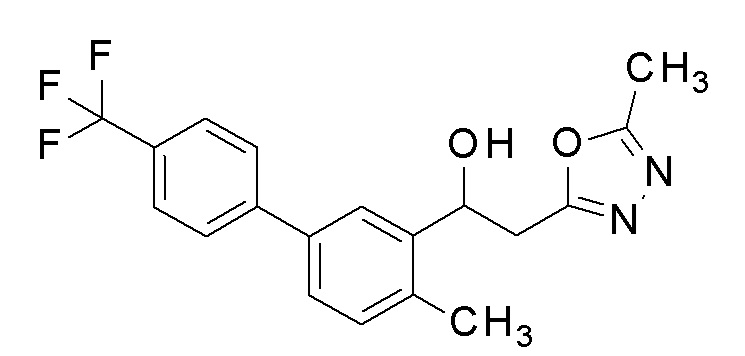
Заявленное в заголовке соединение получали тем же способом, как в примере 1, за исключением того, что 5-бром-2-метилбензальдегид применяли в качестве исходного соединения в примере 1-1 и 4-трифторметилбороновую кислоту применяли вместо 4-хлорфенилбороновой кислоты в примере 1-2.
1H-ЯМР (DMSO, 400 МГц) δ=7,88 (д, J=8,0 Гц, 2H), 7,85-7,84 (м, 1H), 7,82 (д, J=8,0 Гц, 2H), 7,56 (дд, J=1,6, 8,0 Гц, 1H), 7,30 (д, J=8,0 Гц, 1H), 5,66 (д, J=4,8 Гц, 1H), 5,26-5,22 (м, 1H), 3,18-3,14 (м, 2H), 2,46 (с, 3H), 2,37 (с, 3H).
Пример 43: получение 1-[2-метокси-5-[4-(трифторметил)фенил]фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола
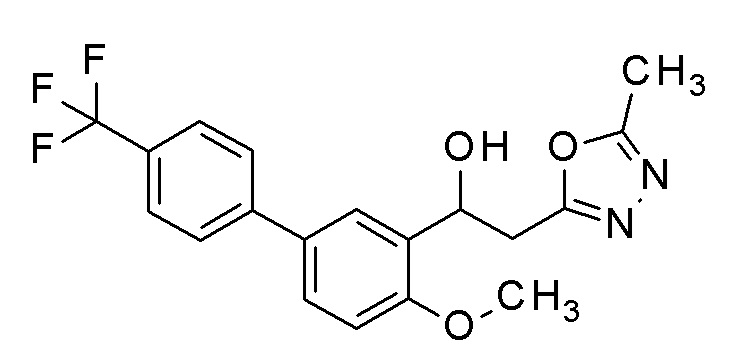
Заявленное в заголовке соединение получали тем же способом, как в примере 1, за исключением того, что 5-бром-2-метоксибензальдегид применяли в качестве исходного соединения в примере 1-1 и 4-трифторметилбороновую кислоту применяли вместо 4-хлорфенилбороновой кислоты в примере 1-2.
1H-ЯМР (DMSO, 400 МГц) δ=7,86-7,79 (м, 5H), 7,67 (дд, J=2,4, 8,4 Гц, 1H), 7,12 (д, J=8,4 Гц, 1H), 5,63 (д, J=5,2 Гц, 1H), 5,33-5,29 (м, 1H), 3,84 (с, 3H), 3,18-3,14 (м, 2H), 2,47 (с, 3H).
Пример 44: получение [2-(5-метил-1,3,4-оксадиазол-2-ил)-1-[2-метил-5-[4-(трифторметил)фенил]фенил]этил]карбамата
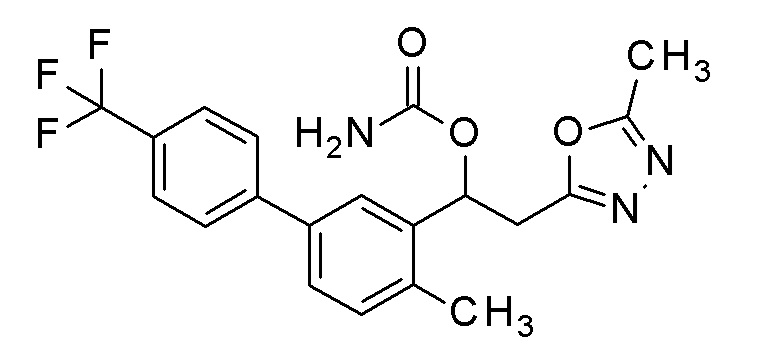
2-(5-метил-1,3,4-оксадиазол-2-ил)-1-[2-метил-5-[4-(трифторметил)фенил]фенил]этанол, который представляет собой конечное соединение примера 42, в качестве исходного соединения применяли тем же способом, как в примере 3, получая заявленное в заголовке соединение.
1H-ЯМР (CDCl3, 400 МГц) δ=7,70-7,63 (м, 4H), 7,59 (д, J=1,6 Гц, 1H), 7,45 (дд, J=2,0, 8,0 Гц, 1H), 7,28-7,26 (м, 1H), 6,32-6,29 (м, 1H), 4,72 (уш с, 2H, NH2), 3,48-3,24 (м, 2H), 2,50 (с, 3H), 2,49 (с, 3H).
Пример 45: получение [1-[2-метокси-5-[4-(трифторметил)фенил]фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата
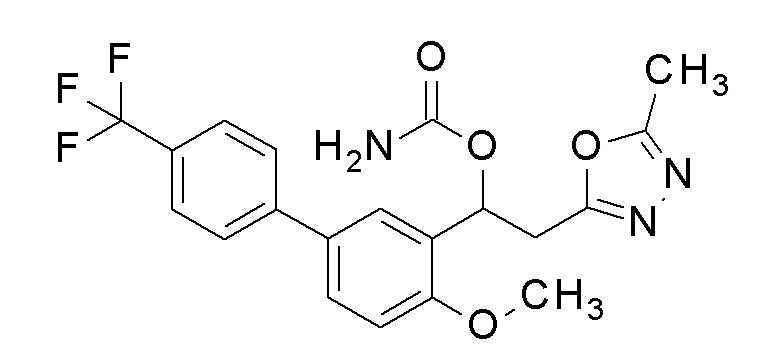
1-[2-Метокси-5-[4-(трифторметил)фенил]фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил) этанол, который представляет собой конечное соединение примера 43, в качестве исходного соединения применяли тем же способом, как в примере 3, получая заявленное в заголовке соединение.
1H-ЯМР (CDCl3, 400 МГц) δ=7,50-7,67 (м, 6H), 6,98 (д, J=8,4 Гц, 1H), 6,42 (дд, J=5,2, 7,6 Гц, 1H), 4,84 (уш с, 2H, NH2), 3,92 (с, 3H), 3,38-3,37 (м, 2H), 2,51 (с, 3H).
Пример 46: получение 1-[2-метил-5-[4-(трифторметил)фенил]фенил]-2-(1,3,4-оксадиазол-2-ил)этанола
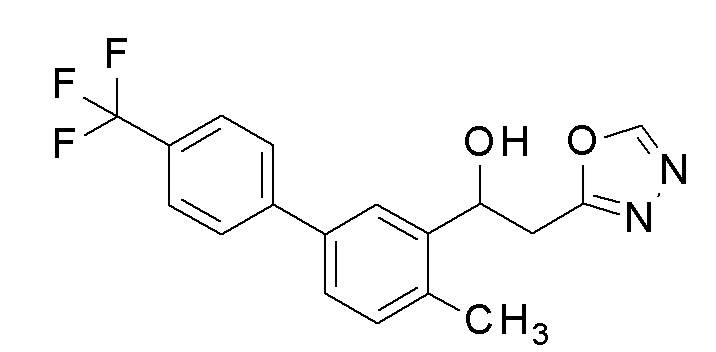
Заявленное в заголовке соединение получали тем же способом, как в примере 1, за исключением того, что 5-бром-2-метилбензальдегид применяли в качестве исходного соединения в примере 1-1, 4-трифторметилбороновую кислоту применяли вместо 4-хлорфенилбороновой кислоты в примере 1-2, и N,N′-диметилформамид диметилацеталь применяли вместо N,N′-диметилацетамид диметилацеталя в примере 1-4.
1H-ЯМР (CDCl3, 400 МГц) δ=8,37 (с, 1H), 7,82 (д, J=2,0 Гц, 1H), 7,70-7,65 (м, 4H), 7,46 (дд, J=2,0, 8,0 Гц, 1H), 7,26 (д, J=7,2 Гц, 1H), 5,56-5,54 (м, 1H), 3,47-3,21 (м, 3H), 2,14 (с, 3H).
Пример 47: получение 1-[2-метокси-5-[4-(трифторметил)фенил]фенил]-2-(1,3,4-оксадиазол-2-ил)этанола
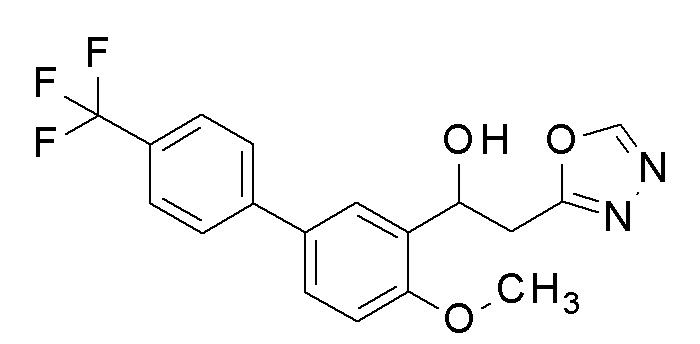
Заявленное в заголовке соединение получали тем же способом, как в примере 1, за исключением того, что 5-бром-2-метоксибензальдегид применяли в качестве исходного соединения в примере 1-1, 4-трифторметилбороновую кислоту применяли вместо 4-хлорфенилбороновой кислоты в примере 1-2, и N,N′-диметилформамид диметилацеталь применяли вместо N,N′-диметилацетамид диметилацеталя в примере 1-4.
1H-ЯМР (CDCl3, 400 МГц) δ=8,37 (с, 1H), 7,72 (д, J=2,4 Гц, 1H), 7,68-7,63 (м, 4H), 7,53 (дд, J=2,4, 8,4 Гц, 1H), 6,99 (д, J=8,8 Гц, 1H), 5,53-5,52 (м, 1H), 3,92 (с, 3H), 3,54-3,29 (м, 3H).
Пример 48: получение 1-[2-хлор-5-[4-(трифторметил)фенил]фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола
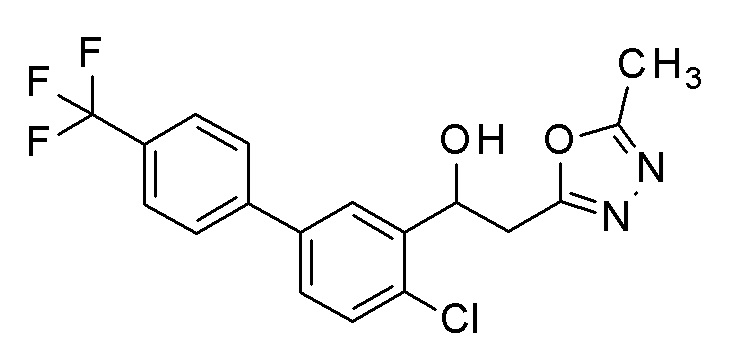
Заявленное в заголовке соединение получали тем же способом, как в примере 1, за исключением того, что 5-бром-2-хлорбензальдегид применяли в качестве исходного соединения в примере 1-1, и 4-трифторметилбороновую кислоту применяли вместо 4-хлорфенилбороновой кислоты в примере 1-2.
1H-ЯМР (CDCl3, 400 МГц) δ=7,94 (д, J=2,0 Гц, 1H), 7,70 (с, 4H), 7,51-7,45 (м, 2H), 5,67 (дт, J=9,2, 3,2 Гц, 1H), 3,75 (д, J=3,9 Гц, 1H), 3,41-3,36 (м, 1H), 3,15-3,08 (м, 1H), 2,54 (с, 3H).
Пример 49: получение 1-[2-хлор-5-[4-(трифторметил)фенил]фенил]-2-(1,3,4-оксадиазол-2-ил)этанола
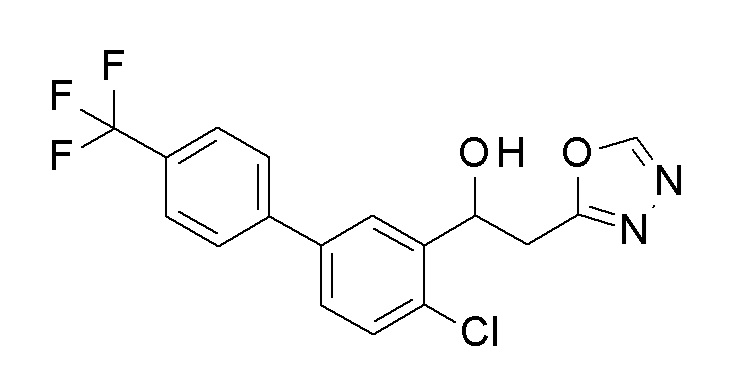
Заявленное в заголовке соединение получали тем же способом, как в примере 1, за исключением того, что 5-бром-2-хлорбензальдегид применяли в качестве исходного соединения в примере 1-1, 4-трифторметилбороновую кислоту применяли вместо 4-хлорфенилбороновой кислоты в примере 1-2, и N,N′-диметилформамид диметилацеталь применяли вместо N,N′-диметилацетамид диметилацеталя в примере 1-4.
1H-ЯМР (CDCl3, 400 МГц) δ=8,41 (с, 1H), 7,93 (с, 1H), 7,70 (д, J=2,0 Гц, 4H), 7,50-7,46 (м, 2H), 5,71 (дт, J=9,5, 2,9 Гц, 1H), 3,52 (д, J=3,9 Гц, 1H), 3,50-3,45 (м, 1H), 3,26-3,19 (м, 1H).
Пример 50: получение [1-[2-хлор-5-[4-(трифторметил)фенил]фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата
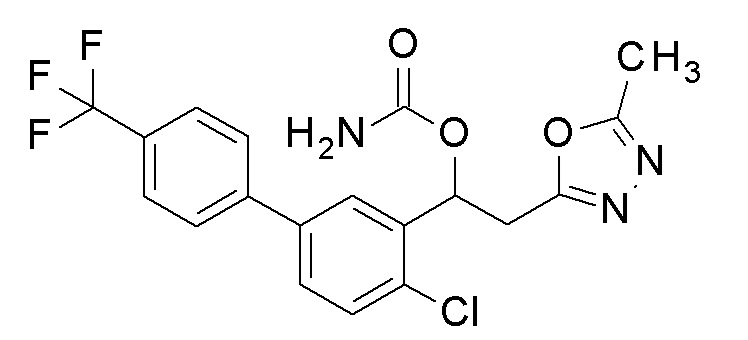
1-[2-Хлор-5-[4-(трифторметил)фенил]фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанол, который представляет собой конечное соединение примера 48, в качестве исходного соединения применяли тем же способом, как в примере 3, получая заявленное в заголовке соединение.
1H-ЯМР (CDCl3, 400 МГц) δ=7,72-7,70 (м, 2H), 7,64-7,61 (м, 3H), 7,49 (с, 2H), 6,45 (дд, J=7,4, 5,4 Гц, 1H), 4,80 (уш с, 2H, NH2), 3,43-3,41 (м, 2H), 2,51 (с, 3H).
Пример 51: получение [1-[2-хлор-5-[4-(трифторметил)фенил]фенил]-2-(1,3,4-оксадиазол-2-ил)этил]карбамата
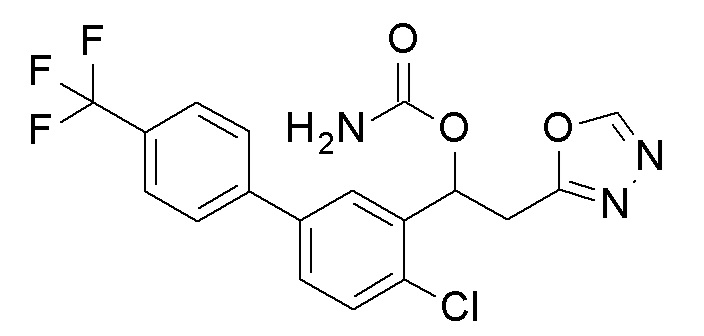
1-[2-Хлор-5-[4-(трифторметил)фенил]фенил]-2-(1,3,4-оксадиазол-2-ил)этанол, который представляет собой конечное соединение примера 49, в качестве исходного соединения применяли тем же способом, как в примере 3, получая заявленное в заголовке соединение.
1H-ЯМР (CDCl3, 400 МГц) δ=8,38 (с, 1H), 7,72-7,70 (м, 2H), 7,63-7,60 (м, 3H), 7,50-7,49 (м, 2H), 6,49 (дд, J=6,9, 5,4 Гц, 1H), 4,78 (уш с, 2H, NH2), 3,53-3,51 (м, 2H).
Пример 52: получение 2-(1,3,4-оксадиазол-2-ил)-1-[3-[4-(трифторметил)фенил]фенил]этанола

Заявленное в заголовке соединение получали тем же способом, как в примере 1, за исключением того, что 3-бромбензальдегид применяли в качестве исходного соединения в примере 1-1, 4-трифторметилбороновую кислоту применяли вместо 4-хлорфенилбороновой кислоты в примере 1-2, и N,N′-диметилформамид диметилацеталь применяли вместо N,N′-диметилацетамид диметилацеталя в примере 1-4.
1H-ЯМР (CDCl3, 400 МГц) δ=8,39 (с, 1H), 7,7 (д, J=19,6 Гц, 4H), 7,53 (д, J=15,6 Гц, 1H), 7,48 (с, 1H), 7,46 (д, J=7,6 Гц, 2H), 5,39 (дд, J1=4, 8,4 Гц, 1H), 3,25-3,37 (м, 3H).
Пример 53: получение 2-(5-этил-1,3,4-оксадиазол-2-ил)-1-[3-[4-(трифторметил)фенил]фенил]этанола
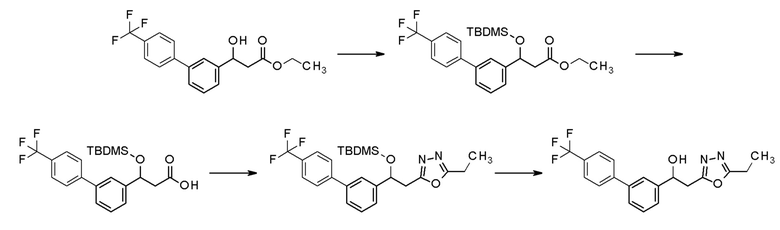
Пример 53-1: получение этил-3-[трет-бутил(диметил)силил]окси-3-[3-[4-(трифторметил)фенил]фенил]пропаноат
Имидазол (0,5 г, 7,7 ммоль) и трет-бутилдиметилсилилхлорид (1,1 г, 7,7 ммоль) последовательно добавляли к 20 мл хлористого метилена, содержащего этил-3-гидрокси-3-[3-[4-(трифторметил)фенил]фенил]пропаноат (1,3 г, 3,8 ммоль), полученный в примере 1-2, применяя 4-трифторметилбороновую кислоту вместо 4-хлорфенилбороновой кислоты, и смесь перемешивали при комнатной температуре в течение одного дня. 100 мл этилацетата добавляли к реакционной смеси, и реакционную смесь последовательно промывали насыщенным водным раствором хлорида аммония, насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия, и затем органический слой сушили над безводным сульфатом магния. Желтую маслянистую жидкость, полученную удалением растворителя упариванием при пониженном давлении, очищали флэш-хроматографией, получая заявленное в заголовке соединение в виде светло-желтой жидкости.
Пример 53-2: получение 3-[трет-бутил(диметил)силил]окси-3-[3-[4-(трифторметил)фенил]фенил]пропионовой кислоты
2N водный раствор гидроксид натрия (1,1 мл, 5,7 ммоль) добавляли к 20 мл этанола, с растворенным в этил-3-[трет-бутил(диметил)силил]окси-3-[3-[4-(трифторметил)фенил]фенил]пропаноатом (1,3 г, 2,9 ммоль), полученным в примере 53-1, и смесь перемешивали при комнатной температуре в течение 5 часов. Реакционную смесь доводили до pH 2 1N водным раствором хлористоводородной кислоты, экстрагировали 100 мл этилацетата и сушили над безводным сульфатом магния. Растворитель удаляли упариванием при пониженном давлении, получая заявленное в заголовке соединение в виде белого твердого остатка.
Пример 53-3: получение трет-бутил-[2-(5-этил-1,3,4-оксадиазол-2-ил)-1-[3-[4-(трифторметил)фенил]фенил]этокси]диметилсилана
1,1′-карбонилдиимидазол (0,1 г, 1,0 ммоль) добавляли к 20 мл раствора хлористого метилена, содержащего 3-[трет-бутил(диметил)силил]окси-3-[3-[4-(трифторметил)фенил]фенил]пропионовую кислоту (0,4 г, 1,0 ммоль), полученную в примере 53-2, и смесь перемешивали при комнатной температуре в течение 30 минут. Гидразид пропионовой кислоты (88 мг, 1,0 ммоль) добавляли к реакционной смеси и перемешивали в течение 1 часа при той же температуре, и последовательно добавляли к ней тетрабромид углерода (663 мг, 2,0 ммоль) и трифенилфосфин (525 мг, 2 ммоль), с последующим перемешиванием в течение 2 часов. 100 мл этилацетата добавляли к реакционной смеси, и реакционную смесь последовательно промывали насыщенным водным раствором хлорида аммония, насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия, и затем органический слой сушили над безводным сульфатом магния. Желтую жидкость, полученную удалением растворителя упариванием в вакууме, очищали флэш-хроматографией, получая заявленное в заголовке соединение в бледно-желтом виде.
Пример 53-4: получение 2-(5-этил-1,3,4-оксадиазол-2-ил)-1-[3-[4-(трифторметил)фенил]фенил]этанола
Фторид тетра-N-бутиламмония (0,1 мл, 0,3 ммоль) медленно добавляли к 10 мл тетрагидрофурана, содержащего трет-бутил-[2-(5-этил-1,3,4-оксадиазол-2-ил)-1-[3-[4-(трифторметил)фенил]этокси]диметилсилан (70 мг, 0,2 ммоль), полученный в примере 53-3, поддерживая температуру равной 0°C в бане со льдом. Реакционную смесь перемешивали при той же температуре в течение 1 часа, добавляли к ней 20 мл этилацетата, промывали насыщенным водным раствором хлорида аммония, насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия, и сушили над безводным сульфатом магния. Светло-коричневую маслянистую жидкость, полученную удалением растворителя упариванием при пониженном давлении, очищали флэш-хроматографией, получая заявленное в заголовке соединение в виде белого твердого остатка.
1H-ЯМР (CDCl3, 400 МГц) δ=7,7 (д, J=19,6 Гц, 4H), 7,56 (д, J=7,2 Гц, 2H), 7,44-7,51 (м, 2H), 5,39 (дд, J=4,8, 8 Гц, 1H), 3,39 (с, 1H), 3,28-3,26 (м, 2H), 2,86 (кв, J=7,6 Гц, 2H), 1,36 (т, J=7,6 Гц, 3H).
Пример 54: получение 2-(5-трет-бутил-1,3,4-оксадиазол-2-ил)-1-[3-[4-(трифторметил)фенил]фенил]этанола
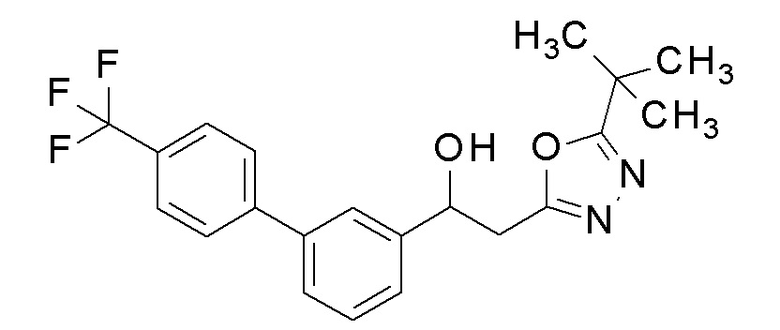
Заявленное в заголовке соединение получали тем же способом как в примере 53, за исключением того, что 2,2-диметилпропангидразид применяли вместо гидразида пропионовой кислоты в примере 53-3.
1H-ЯМР (CDCl3, 400 МГц) δ=7,7 (д, J=19,6 Гц, 4H), 7,54 (д, J=7,6 Гц, 2H), 7. 44-7. 50 (м, 2H), 5,35 (дд, J1=8,8 Гц J2=4,8 Гц, 1H), 3,44 (с, 1H), 3,22-3,33 (м, 2H).
Пример 55: получение [2-(5-метил-1,3,4-оксадиазол-2-ил)-1-[3-[4-(трифторметил)фенил]фенил]этил]ацетата
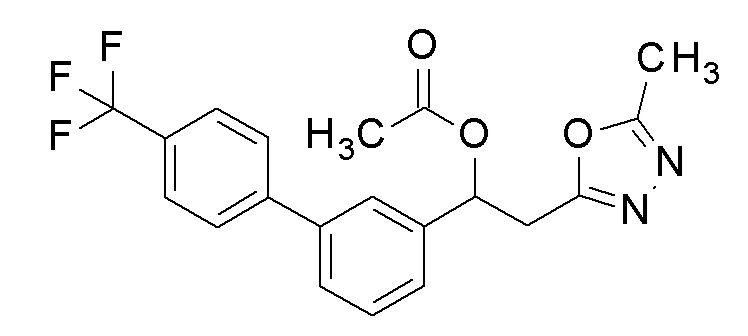
В качестве исходного соединения, ацетилхлорид (0,3 г, 4,35 ммоль) добавляли к 20 мл хлористого метилена с растворенным в нем 2-(5-метил-1,3,4-оксадиазол-2-ил)-1-[3-[4-(трифторметил)фенил]фенил]этанолом (1,0 г, 2,9 ммоль), который представляет собой конечное соединение примера 6, и триэтиламином (1,1 мл, 8,6 ммоль), и полученный в результате раствор перемешивали при комнатной температуре в течение приблизительно 6 часов. Реакционную смесь промывали насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия один раз каждый, и сушили над безводным сульфатом магния. Светло-желтую маслянистую жидкость, полученную удалением растворителя упариванием при пониженном давлении, очищали флэш-хроматографией, получая заявленное в заголовке соединение.
1H-ЯМР (CDCl3, 400 МГц) δ=7,72-7,65 (м, 4H), 7,55-7,46 (м, 3H), 7,42-7,40 (м, 1H), 6,26-6,23 (м, 1H), 3,53 (дд, J=15,6, J=8,8, 1H), 3,35 (дд, J=15,6, J=5,2, 1H), 2,50 (с, 3H), 2,08 (с, 3H).
Пример 56: получение 2-[2-метокси-2-[3-[4-(трифторметил)фенил]фенил]этил]-5-метил-1,3,4-оксадиазола
2-(5-Метил-1,3,4-оксадиазол-2-ил)-1-[3-[4-(трифторметил)фенил]фенил]этанол (1,0 г, 2,9 ммоль), который представляет собой конечное соединение примера 6, и йодметан (0,8 г, 5,8 ммоль) последовательно добавляли к 20 мл тетрагидрофурана, содержащего гидрид натрия (60% дисперсия в минеральном масле, 0,2 г, 5,8 ммоль) в качестве исходных соединений, и нагревали и кипятили с обратным холодильником в течение приблизительно 1 часа. Температуру понижали до комнатной температуры, и реакционную смесь растворяли в 100 мл этилацетата, промывали насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия один раз каждый, и органический слой сушили над безводным сульфатом магния. Светло-желтую маслянистую жидкость, полученную удалением растворителя упариванием при пониженном давлении, очищали флэш-хроматографией, получая заявленное в заголовке соединение.
1H-ЯМР (CDCl3, 400 МГц) δ=7,72-7,67 (м, 4H), 7,55-7,47 (м, 3H), 7,39-7,37 (м, 1H), 4,75-4,72 (м, 1H), 3,36 (дд, J=15,6, J=8,8, 1H), 3,27 (с, 3H), 3,18 (дд, J=15,6, J=4,8, 1H), 2,50 (с, 3H).
Пример 57: получение 1-[3-(4-фторфенил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола
Заявленное в заголовке соединение получали тем же способом, как в примере 1, за исключением того, что 3-бромбензальдегид применяли в качестве исходного соединения и 4-фторфенилбороновую кислоту применяли вместо 4-хлорфенилбороновой кислоты в примере 1-2.
1H-ЯМР (CDCl3, 400 МГц) δ=7,60 (с, 1H), 7,53-7,57 (м, 2H), 7,38-7,51 (м, 3H), 5,33 (дд, J1=8,4 Гц J2=4 Гц, 1H), 3,23-3,27 (м, 3H), 2,50 (с, 3H).
Пример 58: получение 1-[3-(3,4-дифторфенил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола
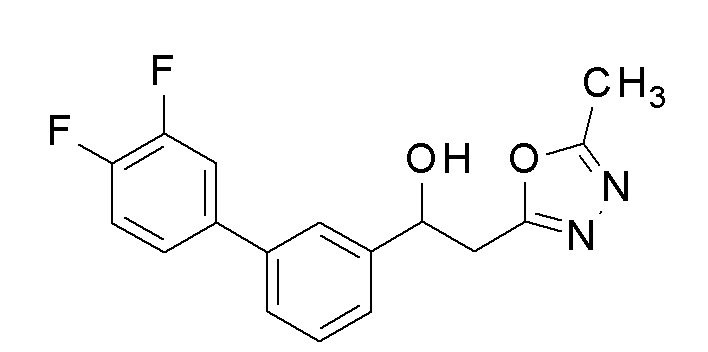
Заявленное в заголовке соединение получали тем же способом, как в примере 1, за исключением того, что 3-бромбензальдегид применяли в качестве исходного соединения и 3,4-дифторфенилбороновую кислоту применяли вместо 4-хлорфенилбороновой кислоты в примере 1-2.
1H-ЯМР (CDCl3, 400 МГц) δ=7,60 (с, 1H), 7,39-7,47 (м, 4H), 7,22-7,39 (м, 1H), 5,33 (дд, J1=8,4 Гц J2=4,4 Гц, 1H), 3,32 (д, J=4 Гц, 1H), 3,25 (д, J=7,6 Гц, 2H), 2,50 (с, 3H).
Пример 59: получение 2-(5-метил-1,3,4-оксадиазол-2-ил)-1-[3-[4-(трифторметокси)фенил]фенил]этанола
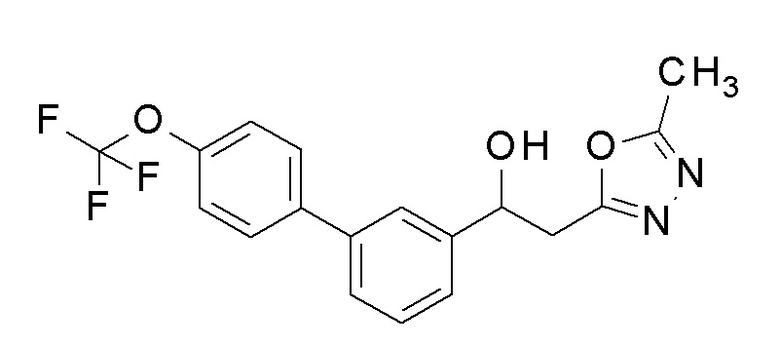
Заявленное в заголовке соединение получали тем же способом, как в примере 1, за исключением того, что 3-бромбензальдегид применяли в качестве исходного соединения и 4-трифторметоксифенилбороновую кислоту применяли вместо 4-хлорфенилбороновой кислоты в примере 1-2.
1H-ЯМР (CDCl3, 400 МГц) δ=7,59-7,63 (м, 3H), 7,43-7,51 (м, 3H), 7,3 (д, J=8,4 Гц, 2H), 5,33 (дд, J1=8,4 Гц J2=4 Гц, 1H), 3,26 (м, 3H), 2,50 (с, 3H).
Пример 60: получение 1-[3-(2-метокси-4-(трифторметокси)фенил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола
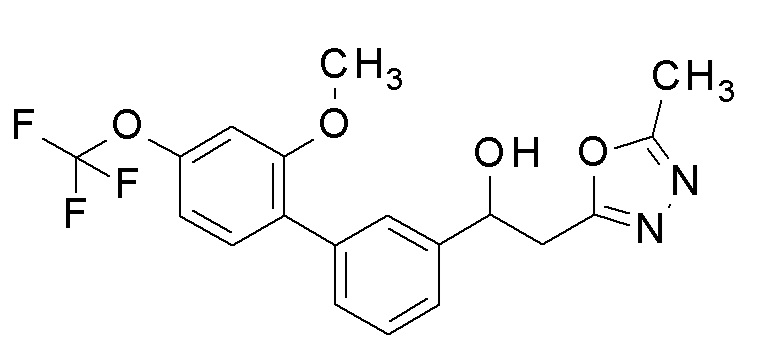
Заявленное в заголовке соединение получали тем же способом, как в примере 1, за исключением того, что 3-бромбензальдегид применяли в качестве исходного соединения и 2-метокси-4-трифторметоксифенилбороновую кислоту применяли вместо 4-хлорфенилбороновой кислоты в примере 1-2.
1H-ЯМР (CDCl3, 400 МГц) δ=7,53-7,29 (м, 5H), 6,90 (д, J=8,4 Гц, 1H), 6,82 (с, 1H), 5,31-5,27 (м, 1H), 3,81 (с, 3H), 3,30-3,18 (м, 3H), 2,51 (с, 3H).
Пример 61: получение 1-[3-(4-хлор-2-(трифторметил)фенил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола
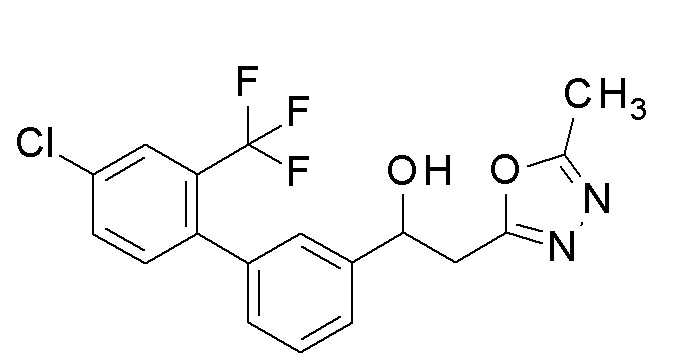
Заявленное в заголовке соединение получали тем же способом, как в примере 1, за исключением того, что 3-бромбензальдегид применяли в качестве исходного соединения и 4-хлор-2-трифторметилфенилбороновую кислоту применяли вместо 4-хлорфенилбороновой кислоты в примере 1-2.
1H-ЯМР (CDCl3, 400 МГц) δ=7,73 (с, 1H), 7,55-7,23 (м, 6H), 5,30-5,28 (м, 1H), 3,49 (д, J=3,2 Гц, 1H), 3,28-3,17 (м, 2H), 2,49 (с, 3H).
Пример 62: получение 1-[3-(4-хлор-2-метоксифенил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола
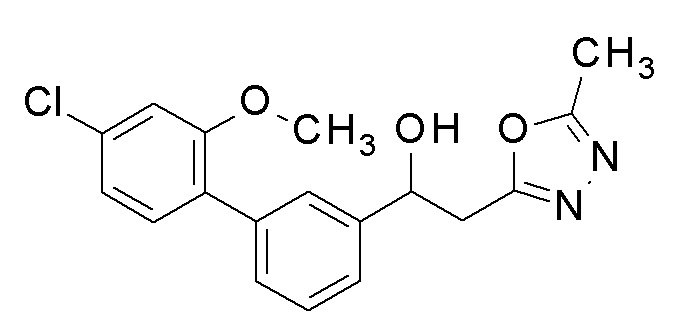
Заявленное в заголовке соединение получали тем же способом, как в примере 1, за исключением того, что 3-бромбензальдегид применяли в качестве исходного соединения и 4-хлор-2-метоксифенилбороновую кислоту применяли вместо 4-хлорфенилбороновой кислоты в примере 1-2.
1H-ЯМР (CDCl3, 400 МГц) δ=7,59-6,96 (м, 7H), 5,29-5,25 (м, 1H), 3,79 (с, 3H), 3,47 (д, J=3,6 Гц, 1H), 3,29-3,16 (м, 2H), 2,49 (с, 3H).
Пример 63: получение 1-[3-(2-хлорфенил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола
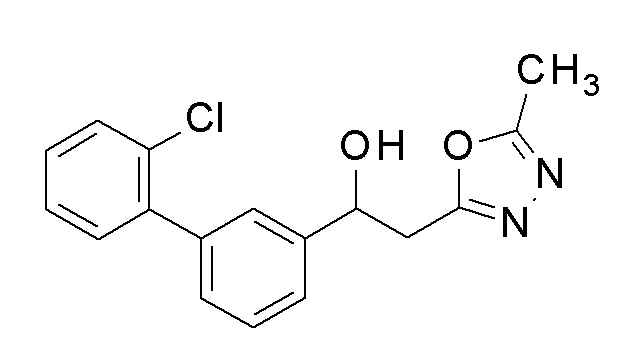
Заявленное в заголовке соединение получали тем же способом, как в примере 1, за исключением того, что 3-бромбензальдегид применяли в качестве исходного соединения и 2-хлорфенилбороновую кислоту применяли вместо 4-хлорфенилбороновой кислоты в примере 1-2.
1H-ЯМР (CDCl3, 400 МГц) δ=7,50-7,45 (м, 4H), 7,42-7,41 (м, 1H), 7,34-7,29 (м, 3H), 5,34-5. 30 (м, 1H), 3,27 (д, J=10,5 Гц, 1H), 3,25 (д, J=5,5 Гц, 1H), 3,18 (д, J=4,5 Гц, 1H), 2,52 (с, 3H).
Пример 64: получение 1-[3-(3-хлорфенил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола
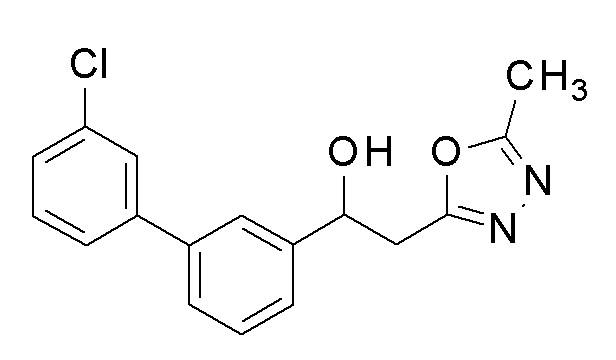
Заявленное в заголовке соединение получали тем же способом, как в примере 1, за исключением того, что 3-бромбензальдегид применяли в качестве исходного соединения и 3-хлорфенилбороновую кислоту применяли вместо 4-хлорфенилбороновой кислоты в примере 1-2.
1H-ЯМР (CDCl3, 400 МГц) δ=7,67-7,63 (м, 1H), 7,58-7,52 (м, 2H), 7,48-7,44 (м, 3H), 7,42-7,33 (м, 2H), 5,36-5,32 (м, 1H), 3,27-3,24 (м, 3H), 2,53 (с, 3H).
Пример 65: получение 1-[3-(4-хлорфенил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола
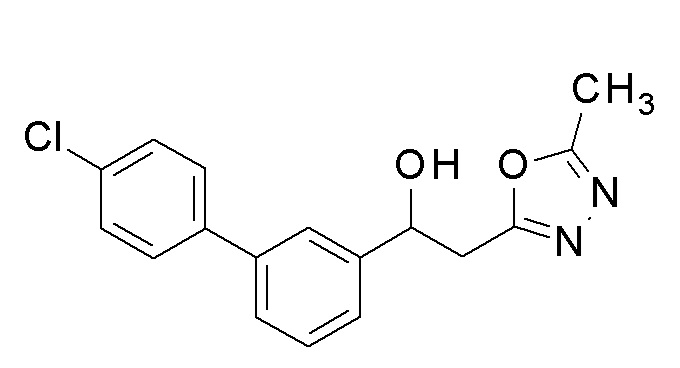
3-Бромбензальдегид в качестве исходного соединения применяли тем же способом, как в примере 1, получая заявленное в заголовке соединение.
1H-ЯМР (CDCl3, 400 МГц) δ=7,70-7,62 (м, 2H), 7,53-7,51 (м, 3H), 7,48-7,41 (м, 3H), 5,34-5,32 (м, 1H), 3,27-3,23 (м, 3H), 2,53 (с, 3H).
Пример 66: получение 2-фтор-2-(5-метил-1,3,4-оксадиазол-2-ил)-1-[3-(4,4,4-трифторбутокси)фенил]этанола
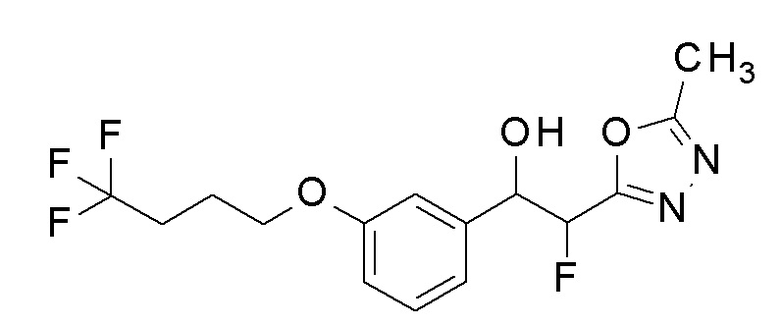
Заявленное в заголовке соединение получали тем же способом, как в примере 8, за исключением того, что 4,4,4-трифторбутанол применяли вместо 2,2,3, 3-тетрафторпропанола в примере 8-1, и этил-2-бром-2-фторацетат применяли вместо этилйодацетата в примере 8-2.
1H-ЯМР (CDCl3, 400 МГц) δ=7,33-7,22 (м, 1H), 7,03-6,83 (м, 3H), 5,71-5,51 (м, 1H), 5,34-5,27 (м, 1H), 4,04-3,98 (м, 2H), 3,10-3,09 (м, 1H), 2,59-2,55 (м, 3H), 2,36-2,26 (м, 2H), 2,09-2,02 (м, 2H).
Пример 67: получение 2-(5-метил-1,3,4-оксадиазол-2-ил)-1-[3-(4,4,4-трифторбутокси)фенил]пропан-1-ола
Заявленное в заголовке соединение получали тем же способом, как в примере 8, за исключением того, что 4,4,4-трифторбутанол применяли вместо 2,2,3,3-тетрафторпропанола в примере 8-1, и этил-2-бром-2-метилацетат применяли вместо этилйодацетата в примере 8-2.
1H-ЯМР (CDCl3, 400 МГц) δ=7,28 (т, J=7,7 Гц, 1H), 6,96-6,92 (м, 2H), 6,85 (д, J=7,9 Гц, 1H), 4,86 (дд, J=8,3, 4,0 Гц, 1H), 4,03 (т, J=5,8 Гц, 2H), 3,39-3,32 (м, 1H), 3,28 (д, J=4,0 Гц, 1H), 2,53 (с, 3H), 2,36-2,28 (м, 2H), 2,09-2,02 (м, 2H), 1,18 (д, J=7,2 Гц, 3H).
Пример 68: получение [1-[3-[2-метокси-4-(трифторметокси)фенил]фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата
1-[3-(2-Метокси-4-(трифторметокси)фенил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанол, который представляет собой конечное соединение примера 60, в качестве исходного соединения применяли тем же способом, как в примере 3, получая заявленное в заголовке соединение.
1H-ЯМР (CDCl3, 400 МГц) δ=7,48-7,26 (м, 5H), 6,90 (д, J=8,4 Гц, 1H), 6,82 (с, 1H), 6,12 (дд, J=4,8, 9,2 Гц, 1H), 4,71 (уш с, 2H, NH2), 3,81 (с, 3H), 3,48 (дд, J=9,2, 15,2 Гц, 1H), 3,29 (дд, J=4,8, 15,2 Гц, 1H), 2,50 (с, 3H).
Пример 69: получение [1-[3-[4-хлор-2-(трифторметил)фенил]фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата
1-[3-(4-Хлор-2-(трифторметил)фенил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанол, который представляет собой конечное соединение примера 61, в качестве исходного соединения применяли тем же способом, как в примере 3, получая заявленное в заголовке соединение.
1H-ЯМР (CDCl3, 400 МГц) δ=7,7 (с, 1H), 7,54 (д, J=8,0 Гц, 1H), 7,41-7,26 (м, 5H), 6,08 (дд, J=4,8, 8,4 Гц, 1H), 4,86 (уш с, 2H, NH2), 3,47 (дд, J=8,4, 15,2 Гц, 1H), 3,29 (дд, J=4,8, 15,2 Гц, 1H), 2,49 (с, 3H).
Пример 70: получение [1-[3-(4-хлор-2-метоксифенил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата
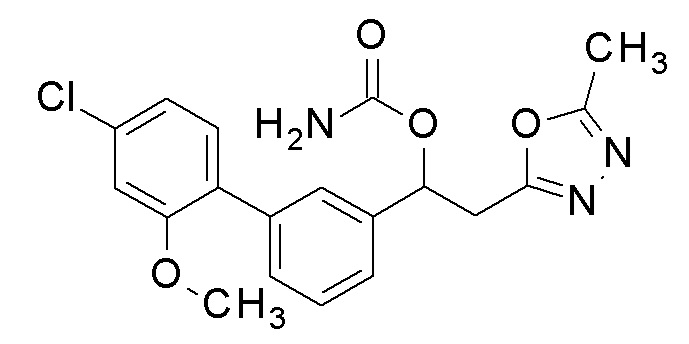
1-[3-(4-Хлор-2-метоксифенил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанол, который представляет собой конечное соединение примера 62, в качестве исходного соединения применяли тем же способом, как в примере 3, получая заявленное в заголовке соединение.
1H-ЯМР (CDCl3, 400 МГц) δ=7,52-7,19 (м, 5H), 7,00 (д, J=8,0 Гц, 1H), 6,96 (с, 1H), 6,09 (дд, J=4,4, 9,2 Гц, 1H), 4,86 (уш с, 2H, NH2), 3,80 (с, 3H), 3,47 (дд, J=9,2, 15,2 Гц, 1H), 3,29 (дд, J=4,4, 15,2 Гц, 1H), 2,48 (с, 3H).
Пример 71: получение [1-[3-(3, 4-дифторфенил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата
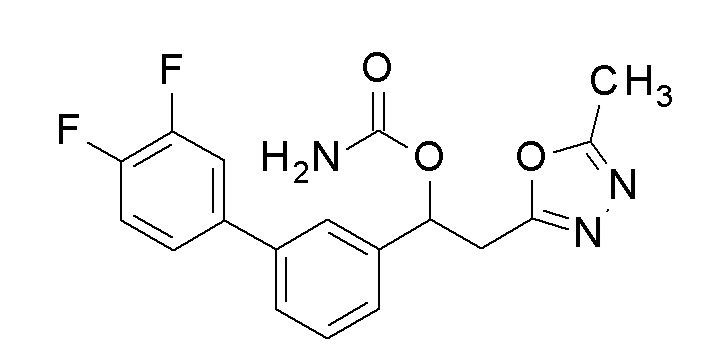
1-[3-(3,4-Дифторфенил)фенил]-2-(5-метил-1, 3, 4-оксадиазол-2-ил)этанол, который представляет собой конечное соединение примера 58, в качестве исходного соединения применяли тем же способом, как в примере 3, получая заявленное в заголовке соединение.
1H-ЯМР (CDCl3, 400 МГц) δ=7,37-7,51 (м, 6H), 7,22-7,34 (м, 1H), 6,13 (дд, J=4,8, 8 Гц, 1H), 4,66 (уш с, 1H), 3,29-3,53 (м, 2H), 2,50 (с, 3H).
Пример 72: получение [1-[3-(4-фторфенил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата
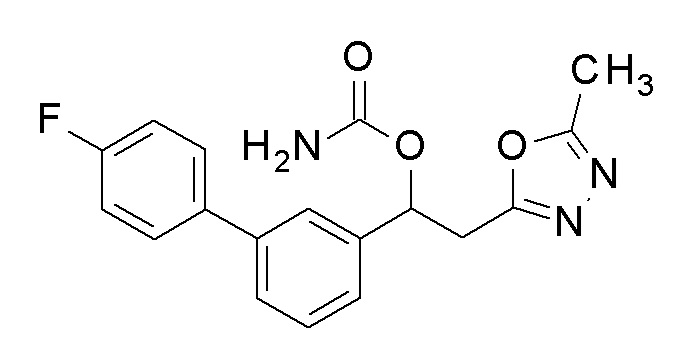
1-[3-(4-Фторфенил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанол, который представляет собой конечное соединение примера 57, в качестве исходного соединения применяли тем же способом, как в примере 3, получая заявленное в заголовке соединение.
1H-ЯМР (CDCl3, 400 МГц) δ=7,35-7,58 (м, 6H), 7,12-7,16 (м, 2H), 6,13 (дд, J=5,2, 9,6 Гц, 1H), 4,66 (уш с, 1H), 3,29-3,53 (м, 2H), 2,50 (с, 3H).
Пример 73: получение [1-[3-(2-хлорфенил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата
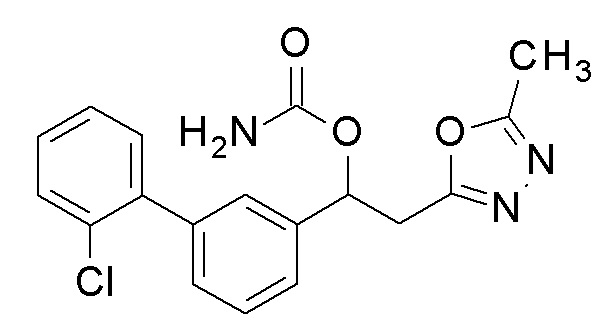
1-[3-(2-Хлорфенил)фенил]-2-(5-метил-1, 3, 4-оксадиазол-2-ил)этанол, который представляет собой конечное соединение примера 63, в качестве исходного соединения применяли тем же способом, как в примере 3, получая заявленное в заголовке соединение.
1H-ЯМР (CDCl3, 400 МГц) δ=7,52-7,38 (м, 6H), 7,32-7,30 (м, 2H), 6,15-6,11 (м, 1H), 4,64 (уш с, 2H, NH2), 3,50 (дд, J=11, 19,5, 1H), 3,32 (дд, J=6, 19,5 Гц, 1H), 2,50 (с, 3H).
Пример 74: получение [1-[3-(3-хлорфенил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата
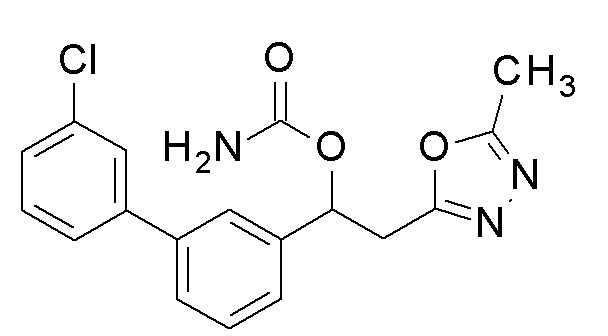
1-[3-(3-Хлорфенил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанол, который представляет собой конечное соединение примера 64, в качестве исходного соединения применяли тем же способом, как в примере 3, получая заявленное в заголовке соединение.
1H-ЯМР (CDCl3, 400 МГц) δ=7,54-7,47 (м, 4H), 7,45-7,36 (м, 4H), 6,15-6,11 (м, 1H), 4,67 (уш с, 2H, NH2), 3,50 (дд, J=11,5, 19 Гц, 1H), 3,32 (дд, J=6, 19 Гц, 1H), 2,50 (с, 3H).
Пример 75: получение [1-[3-(4-хлорфенил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата
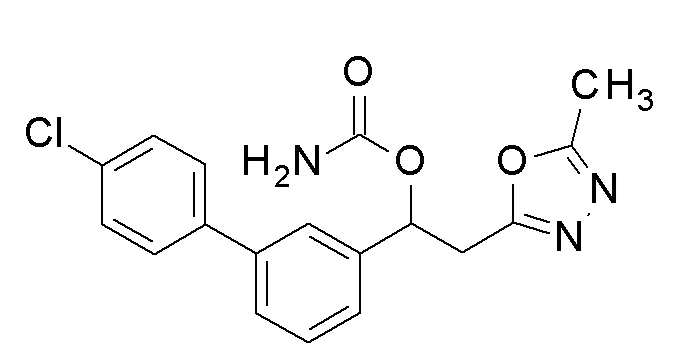
1-[3-(4-Хлорфенил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанол, который представляет собой конечное соединение примера 65, в качестве исходного соединения применяли тем же способом, как в примере 3, получая заявленное в заголовке соединение.
1H-ЯМР (CDCl3, 400 МГц) δ=7,55-7,52 (м, 3H), 7,47-7,40 (м, 2H), 7,40-7,26 (м, 3H), 6,15-6,12 (м, 1H), 4,67 (уш с, 2H, NH2), 3,50 (дд, J=11, 20 Гц, 1H), 3,32 (дд, J=6, 19 Гц, 1H), 2,51 (с, 3H).
Пример 76: получение 1-[3-[2,4-бис(трифторметил)фенил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола
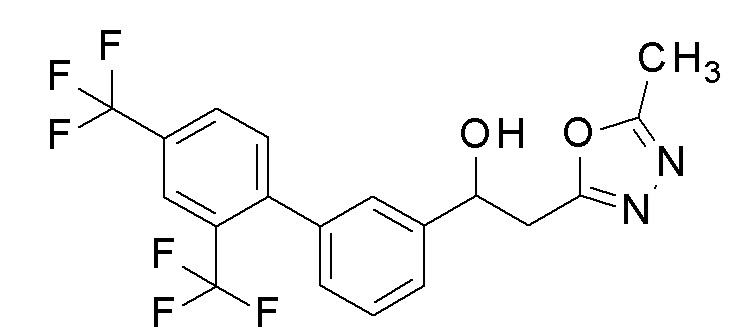
Заявленное в заголовке соединение получали тем же способом, как в примере 1, за исключением того, что 3-бромбензальдегид применяли в качестве исходного соединения и 2,4-бистрифторметилфенилбороновую кислоту применяли вместо 4-хлорфенилбороновой кислоты в примере 1-2.
1H-ЯМР (CDCl3, 400 МГц) δ=8,01 (с, 1H), 7,84 (д, J=9,5 Гц, 1H), 7,50-7,43 (м, 3H), 7,38 (с, 1H), 7,29-7,28 (м, 1H), 5,33-5,30 (м, 1H), 3,29-3,22 (м, 3H), 2,51 (с, 3H).
Пример 77: получение [1-[3-[2,4-бис(трифторметил)фенил]фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата
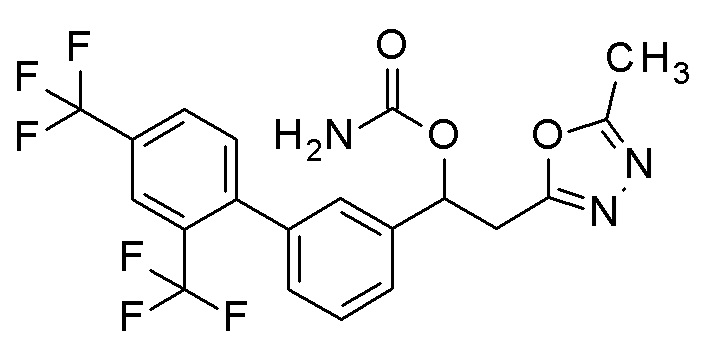
1-[3-[2,4-Бис(трифторметил)фенил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанол, который представляет собой конечное соединение примера 76, в качестве исходного соединения применяли тем же способом, как в примере 3, получая заявленное в заголовке соединение.
1H-ЯМР (CDCl3, 400 МГц) δ=8,01 (с, 1H), 7,84 (д, J=9,5 Гц, 1H), 7,50-7,44 (м, 3H), 7,32 (с, 1H), 7,29-7,27 (м, 1H), 6,13-6,10 (м, 1H), 4,65 (уш с, 2H, NH2), 3,48 (дд, J=10,5, 19 Гц, 1H), 3,31 (дд, J=6, 19 Гц, 1H), 2,48 (с, 3H).
Пример 78: получение [1-[3-[4-(трифторметокси)фенил]фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата
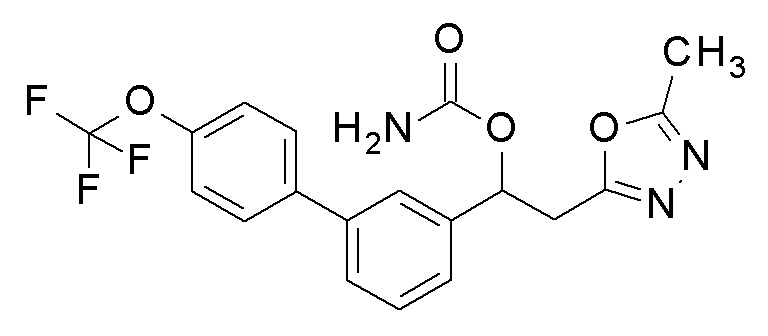
2-(5-Метил-1,3,4-оксадиазол-2-ил)-1-[3-[4-(трифторметокси)фенил]фенил]этанол, который представляет собой конечное соединение примера 59, в качестве исходного соединения применяли тем же способом, как в примере 3, получая заявленное в заголовке соединение.
1H-ЯМР (CDCl3, 400 МГц) δ=7,51-7,59 (м, 4H), 7,46 (т, J=7,2 Гц, 1H), 7,38 (д, J=7,2 Гц, 1H), 7,28 (д, J=8,0 Гц, 2H), 6,13 (дд, J=4,4, 8,8 Гц, 1H), 4,66 (уш с, 1H), 3,29-3,53 (м, 2H), 2,50 (с, 3H).
Пример 79: получение [2-фтор-2-(5-метил-1,3,4-оксадиазол-2-ил)-1-[3-(4,4,4-трифторбутокси)фенил]этил]карбамата
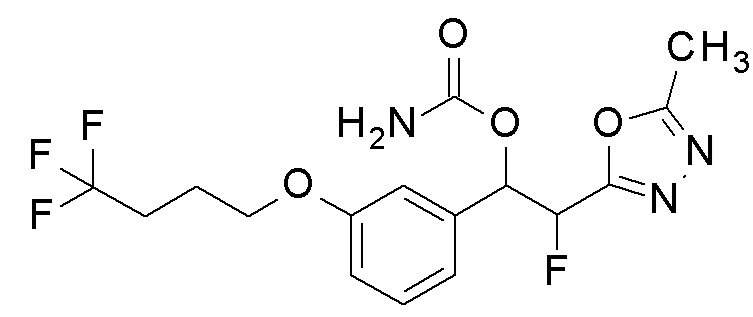
2-Фтор-2-(5-метил-1,3,4-оксадиазол-2-ил)-1-[3-(4,4,4-трифторбутокси)фенил]этанол, который представляет собой конечное соединение примера 66, в качестве исходного соединения применяли тем же способом, как в примере 3, получая заявленное в заголовке соединение.
1H-ЯМР (CDCl3, 400 МГц) δ=7,33-7,22 (м, 1H), 7,02-6,82 (м, 3H), 6,24-6,10 (м, 1H), 5,90-5,74 (м, 1H), 4,72 (уш с, 2H, NH2), 4,03-3,93 (м, 2H), 2,58-2,53 (м, 3H), 2,36-2,24 (м, 2H), 2,09-2,00 (м, 2H).
Пример 80: получение [2-(5-метил-1,3,4-оксадиазол-2-ил)-1-[3-(4,4,4-трифторбутокси)фенил]пропил]карбамата
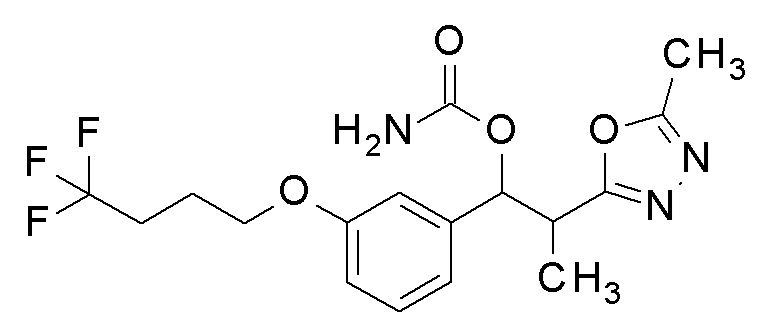
2-(5-Метил-1,3,4-оксадиазол-2-ил)-1-[3-(4,4,4-трифторбутокси)фенил]пропан-1-ол, который представляет собой конечное соединение примера 67, в качестве исходного соединения применяли тем же способом, как в примере 3, получая заявленное в заголовке соединение.
1H-ЯМР (CDCl3, 400 МГц) δ=7,29 (т, J=7,9 Гц, 1H), 6,94 (д, J=7,9 Гц, 1H), 6,88-6,84 (м, 2H), 5,74 (д, J=9,4 Гц, 1H), 4,59 (уш с, 2H, NH2), 4,01 (т, J=5,9 Гц, 2H), 3,63-3,55 (м, 1H), 2,53 (с, 3H), 2,38-2,28 (м, 2H), 2,09-2,04 (м, 2H), 1,19 (д, J=7,2 Гц, 3H).
Пример 81: получение 2-(3-метил-1,2,4-оксадиазол-5-ил)-1-[3-[4-(трифторметил)фенил]фенил]этанола
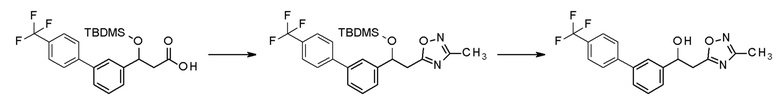
Пример 81-1: получение трет-бутил-диметил-[2-(3-метил-1,2,4-оксадиазол-5-ил)-1-[3-[4-(трифторметил)фенил]фенил]этокси]силана
N-гидроксиацетамидин (74 мг, 1,0 ммоль), 1-(3-диметиламинопропил)-3-этилкарбодиимид (186 мг, 1,2 ммоль) и триэтиламин (0,4 мл, 3,0 ммоль) последовательно добавляли к 20 мл хлористого метилена, содержащего 3-[трет-бутил(диметил)силил]окси-3-[3-[4-(трифторметил)фенил]фенил]пропионовую кислоту (0,4 г, 1,0 ммоль), полученную в примере 53-2, и смесь перемешивали при комнатной температуре в течение 2 часов. 100 мл этилацетата добавляли к реакционной смеси, и реакционную смесь последовательно промывали насыщенным водным раствором хлорида аммония, насыщенным водным раствором бикарбоната натрия, и насыщенным водным раствором хлорида натрия, и затем органический слой сушили над безводным сульфатом магния. Желтую жидкость, полученную удалением растворителя упариванием в вакууме, очищали флэш-хроматографией, получая заявленное в заголовке соединение в бледно-желтом виде.
Пример 81-2: получение 2-(3-метил-1,2,4-оксадиазол-5-ил)-1-[3-[4-(трифторметил)фенил]фенил]этанола
Фторид тетра-N-бутиламмония (16,7 мл, 5,0 ммоль) медленно добавляли к 10 мл тетрагидрофурана, содержащего трет-бутил-диметил-[2-(3-метил-1,2,4-оксадиазол-5-ил)-1-[3-[4-(трифторметил)фенил]фенил]этокси]силан (1,0 г, 2,48 ммоль), полученный в примере 81-1, поддерживая температуру равной 0°C в бане со льдом. Реакционную смесь перемешивали при той же температуре в течение 1 часа, добавляли к ней 20 мл этилацетата, промывали насыщенным водным раствором хлорида аммония, насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия, и сушили над безводным сульфатом магния. Светло-коричневую маслянистую жидкость, полученную удалением растворителя упариванием при пониженном давлении, очищали флэш-хроматографией, получая заявленное в заголовке соединение в виде белого твердого остатка.
1H-ЯМР (CDCl3, 400 МГц) δ=7,70-7,68 (м, 4H), 7,57-7,55 (м, 1H), 7,51-7,45 (м, 3H), 5,37-5,33 (м, 1H), 3,44-3,34 (м, 3H), 2,43 (с, 3H).
Пример 82: получение [2-(3-метил-1,2,4-оксадиазол-5-ил)-1-[3-[4-(трифторметил)фенил]фенил]этил]карбамата
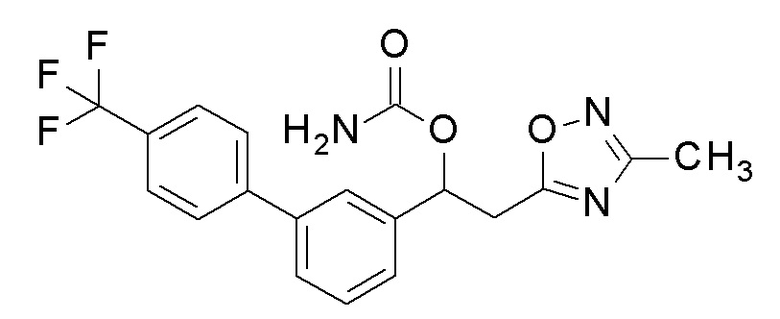
2-(3-Метил-1,2,4-оксадиазол-5-ил)-1-[3-[4-(трифторметил)фенил]фенил]этанол, который был конечным соединением примера 81, в качестве исходного соединения применяли тем же способом, как в примере 3, получая заявленное в заголовке соединение.
1H-ЯМР (CDCl3, 400 МГц) δ=7,67 (дд, J=10,0, 17,5 Гц, 4H), 7,58-7,39 (м, 4H), 6,13 (с, 1H), 4,95 (уш с, 2H, NH2), 3,42-3,39 (м, 2H), 2,39 (с, 3H).
Пример 83: получение 2-(5-метил-1,2,4-оксадиазол-3-ил)-1-[3-[4-(трифторметил)фенил]фенил]этанола
Пример 83-1: получение 2-бром-1-[3-[4-(трифторметил)фенил]фенил]этанона
4-Хлорфенилбороновую кислоту(0,8 г, 5,1 ммоль), Pd(PPh3)2Cl2 (0,2 г, 0,3 ммоль) и 3,6 мл 2M водного раствора карбоната калия последовательно добавляли к 20 мл 1,4-диоксана, содержащего растворенный в нем 2-бром-1-(3-бромфенил)этанон (1,0 г, 3,6 ммоль), и смесь перемешивали при 90°C в течение 1 часа. Температуру понижали до комнатной температуры, 50 мл этилацетата добавляли к реакционной смеси, и затем смесь промывали насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия один раз каждый, и органический слой сушили над безводным сульфатом магния. Темно-коричневую маслянистую жидкость, полученную удалением растворителя упариванием при пониженном давлении, очищали флэш-хроматографией, получая заявленное в заголовке соединение в виде желтого твердого остатка.
Пример 83-2: получение 1-[3-[4-(трифторметил)фенил]фенил]пропан-1-она
Цианат натрия (0,2 г, 5,8 ммоль) добавляли к 10 мл ацетонитрила, содержащего 2-бром-1-[3-[4-(трифторметил)фенил]фенил]этанон (1,0 г, 2,9 ммоль), полученный в примере 83-1, и нагревали и кипятили с обратным холодильником при 90°C в течение приблизительно 10 часов. 20 мл этилацетата добавляли к реакционной смеси, и смесь промывали насыщенным водным раствором хлорида аммония, насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия один раз каждый, и сушили над безводным сульфатом магния. Светло-коричневую маслянистую жидкость, полученную удалением растворителя упариванием при пониженном давлении, очищали флэш-хроматографией, получая заявленное в заголовке соединение в виде белого твердого остатка.
Пример 83-3: получение 1-[3-[4-(трифторметил)фенил]фенил]пропан-1-ола
Боргидрид натрия (0,2 г, 7,0 ммоль) медленно добавляли к 20 мл метанола с растворенным в нем 1-[3-[4-(трифторметил)фенил]фенил]пропан-1-оном (1,3 г, 4,7 ммоль), полученным в примере 83-2, поддерживая температуру равной 0°C в бане со льдом. Реакционную смесь перемешивали при той же температуре в течение 1 часа, добавляли к ней 20 мл этилацетата, промывали насыщенным водным раствором хлорида аммония, насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия, и сушили над безводным сульфатом магния. Светло-коричневую маслянистую жидкость, полученную удалением растворителя упариванием при пониженном давлении, очищали флэш-хроматографией, получая заявленное в заголовке соединение в виде белого твердого остатка.
Пример 83-4: получение трет-бутил-диметил-[1-[2-метил-5-[4-(трифторметил)фенил]фенил]пропокси]силана
Имидазол (0,5 г, 7,7 ммоль) и трет-бутилдиметилсилилхлорид (1,1 г, 7,7 ммоль) последовательно добавляли к 20 мл хлористого метилена с растворенным в нем 1-[3-[4-(трифторметил)фенил]фенил]пропан-1-олом (1,3 г, 4,6 ммоль), полученным в примере 83-3, и смесь перемешивали при комнатной температуре в течение одного дня. 100 мл этилацетата добавляли к реакционной смеси, и реакционную смесь последовательно промывали насыщенным водным раствором хлорида аммония, насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия, и затем органический слой сушили над безводным сульфатом магния. Желтую маслянистую жидкость, полученную удалением растворителя упариванием при пониженном давлении, очищали флэш-хроматографией, получая заявленное в заголовке соединение в виде светло-желтой жидкости.
Пример 83-5: получение 3-[трет-бутил(диметил)силил]окси-N′-гидрокси-3-[3-[4-(трифторметил)фенил]фенил]пропанамидина
Гидроксиламин (66 мг, 2,0 ммоль) и карбонат калия (0,4 г, 3,0 ммоль) добавляли к 20 мл метанола, содержащего трет-бутил-диметил-[1-[2-метил-5-[4-(трифторметил)фенил]фенил]пропокси]силан (0,4 г, 1,0 ммоль), полученный в примере 83-4, и нагревали и кипятили с обратным холодильником при 70°C в течение приблизительно 10 часов. 100 мл этилацетата добавляли к реакционной смеси, и реакционную смесь последовательно промывали насыщенным водным раствором хлорида аммония, насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия, и затем органический слой сушили над безводным сульфатом магния. Желтую жидкость, полученную удалением растворителя упариванием в вакууме, очищали флэш-хроматографией, получая заявленное в заголовке соединение в бледно-желтом виде.
Пример 83-6: получение N-[(Z)-[2-[трет-бутил(диметил)силил]окси-2-[3-[4-(трифторметил)фенил]фенил]этил]-N-гидроксикарбонимидоил]ацетамид
Ацетилхлорид (0,1 г, 1,9 ммоль) и триэтиламин (0,7 мл, 4,8 ммоль) медленно добавляли к 10 мл толуола, содержащего 3-[трет-бутил(диметил)силил]окси-N′-гидрокси-3-[3-[4-(трифторметил)фенил]фенил]пропанамидин (700 мг, 1,6 ммоль), полученный в примере 83-5, поддерживая температуру равной 0°C в бане со льдом. Реакционную смесь перемешивали при той же температуре в течение 1 часа, добавляли к ней 20 мл этилацетата, промывали насыщенным водным раствором хлорида аммония, насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия, и сушили над безводным сульфатом магния. Светло-коричневую маслянистую жидкость, полученную удалением растворителя упариванием при пониженном давлении, очищали флэш-хроматографией, получая заявленное в заголовке соединение в виде белого твердого остатка.
Пример 83-7: получение трет-бутилдиметил-[2-(5-метил-1,2,4-оксадиазол-3-ил)-1-[3-[4-(трифторметил)фенил]фенил]этокси]силана
20 мл толуола, содержащего N-[(Z)-[2-[трет-бутил(диметил)силил]окси-2-[3-[4-(трифторметил)фенил]фенил]этил]-N-гидроксикарбонимидоил]ацетамид (1,3 г, 2,7 ммоль), полученный в примере 83-6, нагревали и кипятили с обратным холодильником при 110°C в течение приблизительно 1 часа. 100 мл этилацетата добавляли к реакционной смеси, и реакционную смесь последовательно промывали насыщенным водным раствором хлорида аммония, насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия, и затем органический слой сушили над безводным сульфатом магния. Желтую маслянистую жидкость, полученную удалением растворителя упариванием при пониженном давлении, очищали флэш-хроматографией, получая заявленное в заголовке соединение в виде светло-желтой жидкости.
Пример 83-8: получение 2-(5-метил-1,2,4-оксадиазол-3-ил)-1-[3-[4-(трифторметил)фенил]фенил]этанола
Хлорид тетра-N-бутиламмония (16,7 мл, 5,0 ммоль) медленно добавляли к 10 мл тетрагидрофурана, содержащего трет-бутил-диметил-[2-(5-метил-1,2,4-оксадиазол-3-ил)-1-[3-[4-(трифторметил)фенил]фенил]этокси]силан (1,0 г, 2,48 ммоль), полученный в примере 83-7, поддерживая температуру равной 0°C в бане со льдом. Реакционную смесь перемешивали при той же температуре в течение 1 часа, добавляли к ней 20 мл этилацетата, промывали насыщенным водным раствором хлорида аммония, насыщенным водным раствором бикарбоната натрия и насыщенным водным раствором хлорида натрия, и сушили над безводным сульфатом магния. Светло-коричневую маслянистую жидкость, полученную удалением растворителя упариванием при пониженном давлении, очищали флэш-хроматографией, получая заявленное в заголовке соединение в виде белого твердого остатка.
1H-ЯМР (CDCl3, 400 МГц) δ=7,70-7,68 (м, 4H), 7,57-7,55 (м, 1H), 7,51-7,45 (м, 3H), 5,37-5,33 (м, 1H), 3,34-3,24 (м, 3H), 2,63 (с, 3H).
Пример 84: получение [2-(5-метил-1,2,4-оксадиазол-3-ил)-1-[3-[4-(трифторметил)фенил]фенил]этил]карбамата
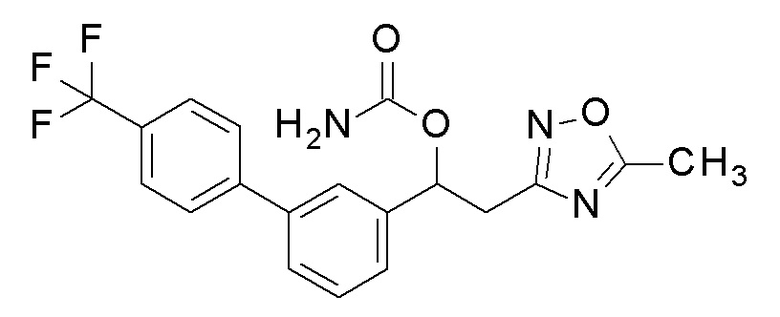
2-(5-Метил-1,2,4-оксадиазол-3-ил)-1-[3-[4-(трифторметил)фенил]фенил]этанол, который представляет собой конечное соединение примера 83, в качестве исходного соединения применяли тем же способом, как в примере 3, получая заявленное в заголовке соединение.
1H-ЯМР (CDCl3, 400 МГц) δ=7,67 (дд, J=10,0, 17,5 Гц, 4H), 7,58-7,39 (м, 4H), 6,13 (с, 1H), 4,95 (уш с, 2H, NH2), 3,32-3,29 (м, 2H), 2,59 (с, 3H).
Пример 85: получение (1R)-1-[2-фтор-5-(4,4,4-трифторбутокси)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола
1-[2-Фтор-5-(4,4,4-трифторбутокси)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанол, который представляет собой конечное соединение примера 15, в качестве исходного соединения применяли для разделения оптического изомерного соединения, применяя устройство для препаративной ВЭЖХ на ChiralPak OD колонке (2×20 см), нормальный гексан:этилацетат=70:30 при скорости потока 25 мл/мин.
1H-ЯМР (CDCl3, 400 МГц) δ=7,11-7,09 (м, 1H), 6,99 (д, J=9,6 Гц, 1H), 6,79-6,76 (м, 1H), 5,51-5,48 (м, 1H), 4,01-3,98 (м, 2H), 3,52 (д, J=4,0 Гц, 1H), 3,28-3,12 (м, 2H), 2,52 (с, 3H), 2,34-2,27 (м, 2H), 2,07-2,02 (м, 2H).
Пример 86: получение (1S)-1-[2-фтор-5-(4,4,4-трифторбутокси)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола

1-[2-Фтор-5-(4,4,4-трифторбутокси)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанол, который представляет собой конечное соединение примера 15, в качестве исходного соединения применяли для разделения оптического изомерного соединения, применяя устройство для препаративной ВЭЖХ на ChiralPak OD колонке (2×20 см), нормальный гексан:этилацетат при скорости потока 25 мл/мин.
1H-ЯМР (CDCl3, 400 МГц) δ=7,11-7,09 (м, 1H), 6,99 (д, J=9,6 Гц, 1H), 6,79-6,76 (м, 1H), 5,51-5,48 (м, 1H), 4,01-3,98 (м, 2H), 3,52 (д, J=4,0 Гц, 1H), 3,28-3,12 (м, 2H), 2,52 (с, 3H), 2,34-2,27 (м, 2H), 2,07-2,02 (м, 2H).
Экспериментальный пример
Применимость соединений согласно настоящему изобретению в качестве противосудорожного агента исследовали способом 6 Гц, который хорошо зарекомендовал себя в качестве способов фармакологического скрининга противосудорожных агентов при фокальных судорогах. Способ 6 Гц для скрининга противосудорожных агентов была следующим:
1) Получение экспериментальных животных
Самцов мышей ICR приобретают у Orient Bio, Inc., Корея, и содержат и поддерживают в соответствии со стандартами содержания лабораторных животных Институционального комитета по уходу и использованию животных (IACUC), помещая их в клетку из проволочной сетки в среде, в которой температура окружающей среды составляет от 19 до 25°C, относительная влажность от 40 до 60% и 12-часовой период света/темноты контролировались автоматически, и был свободный доступ к воде. После стабилизации в течение недели в эксперименте применяли мышей с массой тела от 18 до 23 г.
2) Оценка противосудорожного эффекта соединения
5% тетракаин (Sigma) добавляли в оба глаза для обеспечения местного анестезирующего эффекта за 5-10 минут до периода электростимуляции у ICR мышей. Соединения, подлежащие тестированию, растворяли в дистиллированной воде, в которой растворяли 30% полиэтиленгликоль 300+5% диметилсульфоксид+5% кремофор, и вводили животному внутрибрюшинно (ip) в объеме дозировки 10 мл/кг. Затем к глазу прикладывали электростимуляцию 44 мА, 6 Гц, 3 с, чтобы вызвать судорожные припадки.
После электростимуляции подтверждали наличие судорог, вызванных воздействием лекарственного средства, и соотношение животных, у которых не было судорог, выражали как степень защиты (число животных без судорог/число животных, применяемых в экспериментах=степень защиты). Исходили из того, что степень защиты равна «0», когда все объекты проявляли судороги, и степень защиты равна «1», когда все объекты не проявляли судороги, степень защиты от 0 до 0,2 оценивают как «-», от 0,2 до 0,6 оценивают как «+», от 0,6 до 0,8 оценивают как «++», и от 0,8 до 0,8 оценивают как «+++». Результаты представлены в таблице 2. Определено, что соединение, имеющее высокую степень защиты, проявляет более сильный противосудорожный эффект.
[Таблица 2]
| название | год | авторы | номер документа |
|---|---|---|---|
| АМИНОКАРБОНИЛКАРБАМАТНЫЕ СОЕДИНЕНИЯ | 2015 |
|
RU2688673C2 |
| ПРОИЗВОДНЫЕ 1,3,4-ОКСАДИАЗОЛСУЛЬФОНАМИДА В КАЧЕСТВЕ ИНГИБИТОРОВ ДЕАЦЕТИЛАЗЫ ГИСТОНОВ 6 И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ИХ | 2016 |
|
RU2697665C1 |
| ПРОИЗВОДНЫЕ 1,3,4-ОКСАДИАЗОЛСУЛЬФАМИДА В КАЧЕСТВЕ ИНГИБИТОРА ГИСТОНДЕАЦЕТИЛАЗЫ 6 И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2016 |
|
RU2695227C1 |
| 1,3,4,-ОКСАДИЗОЛАМИДНОЕ ПРОИЗВОДНОЕ СОЕДИНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРА ГИСТОНДЕАЦЕТИЛАЗЫ 6 И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2016 |
|
RU2700696C2 |
| АМИНОКАРБОНИЛКАРБАМАТНЫЕ СОЕДИНЕНИЯ | 2015 |
|
RU2790360C2 |
| ПРОИЗВОДНОЕ ИМИДАЗОПИРИМИДИНА И ИМИДАЗОТРИАЗИНА И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ВКЛЮЧАЮЩАЯ ЭТО ПРОИЗВОДНОЕ | 2016 |
|
RU2710556C2 |
| НОВЫЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРА ГИСТОНДЕАЦЕТИЛАЗЫ 6 И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ИХ | 2021 |
|
RU2817736C1 |
| НОВОЕ АМИНОАРИЛЬНОЕ ПРОИЗВОДНОЕ, ПРИГОДНОЕ В КАЧЕСТВЕ ИНГИБИТОРА ДИАЦИЛГЛИЦЕРОЛАЦИЛТРАНСФЕРАЗЫ 2, И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2799819C1 |
| ТРИЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2020 |
|
RU2833354C1 |
| БИЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2831535C1 |
Изобретение относится к области гетероароматических соединений. Предложено соединение, представленное химической формулой 1, или его оптический изомер, стереоизомер или фармацевтически приемлемая соль, где R1 выбран из группы, состоящей из следующих формул:
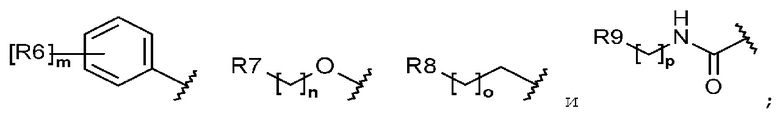 R2 представляет собой водород, галоген, C1-C5 алкил, галоген-C1-C5 алкил, C1-C5 алкокси-C1-C5 алкил, C1-C5 алкокси или C1-C5 алкилтио; R3 представляет собой водород, C1-C5 алкил, C3-C6 циклоалкил, галоген-C1-C5 алкил, карбамоил, C1-C5 алкилкарбамоил, ди(C1-C5 алкил)карбамоил или карбонил; R4 представляет собой водород, галоген, C1-C5 алкил, галоген-C1-C5 алкил или C1-C5 алкокси-C1-C5 алкил; R5 представляет собой водород, галоген, C1-C5 алкил, галоген-C1-C5 алкил или C1-C5 алкокси-C1-C5 алкил; каждый R6, R7, R8 и R9 независимо представляет собой водород, галоген, C1-C5 алкил, галоген-C1-C5 алкил, C1-C5 алкокси-C1-C5 алкил, C1-C5 алкокси, C1-C5 алкилтио, галоген-C1-C5 алкокси, амино, ди(C1-C5 алкил)амино, C1-C5 алкилкарбониламино, галоген-C1-C5 алкилкарбониламино или 5-8-членный гетероциклоалкил, содержащий один или два атома азота (N); каждый X, Y и Z независимо выбран из группы, состоящей из азота (N) и кислорода (O), где один из X, Y или Z представляет собой кислород (O), два других представляют собой азот (N); m представляет собой 1-3; каждый n, o, p выбран из 0-4, q представляет собой 0-2. Также предложена фармацевтическая композиция и способ предотвращения или лечения эпилепсии. Технический результат заключается в получении соединений, содержащих оксадиазол, которые подходят для применения в качестве противоэпилептического лекарственного средства. 3 н. и 12 з.п. ф-лы, 2 табл., 86 пр.
R2 представляет собой водород, галоген, C1-C5 алкил, галоген-C1-C5 алкил, C1-C5 алкокси-C1-C5 алкил, C1-C5 алкокси или C1-C5 алкилтио; R3 представляет собой водород, C1-C5 алкил, C3-C6 циклоалкил, галоген-C1-C5 алкил, карбамоил, C1-C5 алкилкарбамоил, ди(C1-C5 алкил)карбамоил или карбонил; R4 представляет собой водород, галоген, C1-C5 алкил, галоген-C1-C5 алкил или C1-C5 алкокси-C1-C5 алкил; R5 представляет собой водород, галоген, C1-C5 алкил, галоген-C1-C5 алкил или C1-C5 алкокси-C1-C5 алкил; каждый R6, R7, R8 и R9 независимо представляет собой водород, галоген, C1-C5 алкил, галоген-C1-C5 алкил, C1-C5 алкокси-C1-C5 алкил, C1-C5 алкокси, C1-C5 алкилтио, галоген-C1-C5 алкокси, амино, ди(C1-C5 алкил)амино, C1-C5 алкилкарбониламино, галоген-C1-C5 алкилкарбониламино или 5-8-членный гетероциклоалкил, содержащий один или два атома азота (N); каждый X, Y и Z независимо выбран из группы, состоящей из азота (N) и кислорода (O), где один из X, Y или Z представляет собой кислород (O), два других представляют собой азот (N); m представляет собой 1-3; каждый n, o, p выбран из 0-4, q представляет собой 0-2. Также предложена фармацевтическая композиция и способ предотвращения или лечения эпилепсии. Технический результат заключается в получении соединений, содержащих оксадиазол, которые подходят для применения в качестве противоэпилептического лекарственного средства. 3 н. и 12 з.п. ф-лы, 2 табл., 86 пр.
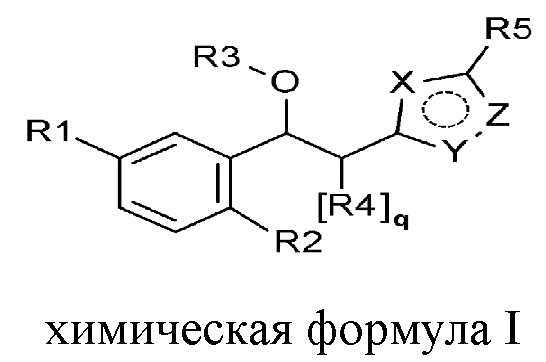
1. Соединение, представленное следующей химической формулой 1, или его оптический изомер, стереоизомер или фармацевтически приемлемая соль:
[Химическая формула 1]
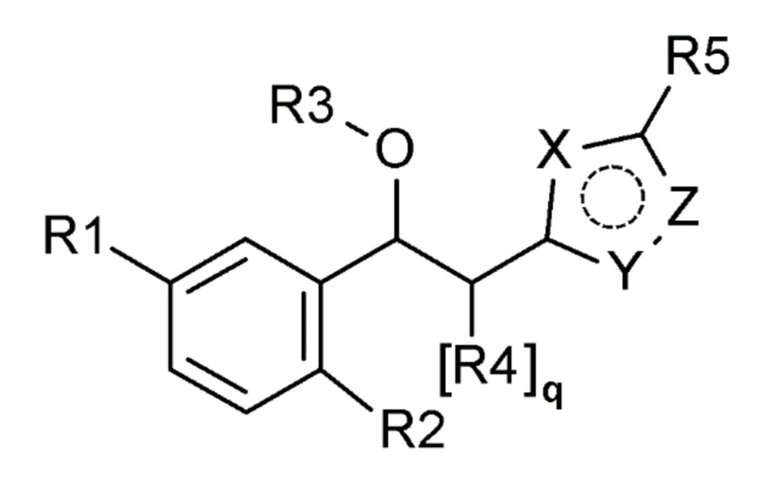
где
R1 выбран из группы, состоящей из следующих формул:
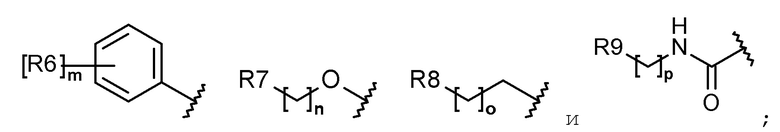
R2 представляет собой водород, галоген, C1-C5 алкил, галоген-C1-C5 алкил, C1-C5 алкокси-C1-C5 алкил, C1-C5 алкокси или C1-C5 алкилтио;
R3 представляет собой водород, C1-C5 алкил, C3-C6 циклоалкил, галоген-C1-C5 алкил, карбамоил, C1-C5 алкилкарбамоил, ди(C1-C5 алкил)карбамоил или карбонил;
R4 представляет собой водород, галоген, C1-C5 алкил, галоген-C1-C5 алкил или C1-C5 алкокси-C1-C5 алкил;
R5 представляет собой водород, галоген, C1-C5 алкил, галоген-C1-C5 алкил или C1-C5 алкокси-C1-C5 алкил;
каждый R6, R7, R8 и R9 независимо представляет собой водород, галоген, C1-C5 алкил, галоген-C1-C5 алкил, C1-C5 алкокси-C1-C5 алкил, C1-C5 алкокси, C1-C5 алкилтио, галоген-C1-C5 алкокси, амино, ди(C1-C5 алкил)амино, C1-C5 алкилкарбониламино, галоген-C1-C5 алкилкарбониламино или 5-8-членный гетероциклоалкил, содержащий один или два атома азота (N);
каждый X, Y и Z независимо выбран из группы, состоящей из азота (N) и кислорода (O), где один из X, Y или Z представляет собой кислород (O), два других представляют собой азот (N);
m представляет собой целое число 1-3;
каждый n, o и p независимо представляет собой целое число 0-4; и
q представляет собой целое число 0-2.
2. Соединение или его оптический изомер, стереоизомер или фармацевтически приемлемая соль по п. 1, где R1 выбран из группы, состоящей из следующих формул:
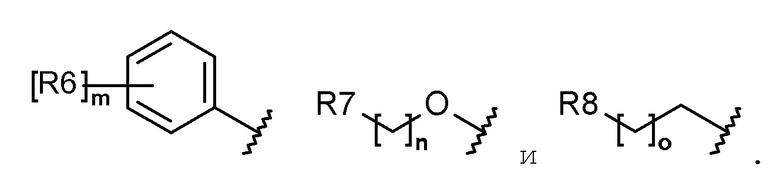
3. Соединение или его оптический изомер, стереоизомер или фармацевтически приемлемая соль по п. 1, где R1 представлен следующей формулой:
4. Соединение или его оптический изомер, стереоизомер или фармацевтически приемлемая соль по п. 1, где каждый R6, R7, R8 и R9 независимо представляет собой водород, галоген, C1-C5 алкил, галоген-C1-C5 алкил, C1-C5 алкокси, галоген-C1-C5 алкокси, ди(C1-C5 алкил)амино или 5-8-членный гетероциклоалкил, содержащий 1 или 2 атома азота (N).
5. Соединение или его оптический изомер, стереоизомер или фармацевтически приемлемая соль по п. 2, где каждый R6, R7 и R8 независимо представляет собой галоген, C1-C5 алкил, галоген-C1-C5 алкил, C1-C5 алкокси или галоген-C1-C5 алкокси.
6. Соединение или его оптический изомер, стереоизомер или фармацевтически приемлемая соль по п. 3, где R6 представляет собой галоген, галоген-C1-C5 алкил, C1-C5 алкокси или галоген-C1-C5 алкокси.
7. Соединение или его оптический изомер, стереоизомер или фармацевтически приемлемая соль по п. 1, где
R2 представляет собой водород, галоген, C1-C5 алкил или C1-C5 алкокси;
R3 представляет собой водород, C1-C5 алкил или карбамоил;
R4 представляет собой водород, галоген или C1-C5 алкил; и
R5 представляет собой водород или C1-C5 алкил.
8. Соединение или его оптический изомер, стереоизомер или фармацевтически приемлемая соль по п. 1, где X представляет собой кислород (O), и каждый из Y и Z представляет собой азот (N).
9. Соединение или его оптический изомер, стереоизомер или фармацевтически приемлемая соль по п. 6, где
m представляет собой целое число 1 или 2;
каждый n, o и p независимо представляет собой целое число 1-4, и
q представляет собой целое число 0 или 1.
10. Соединение или его оптический изомер, стереоизомер или фармацевтически приемлемая соль по п. 1, где соединение выбрано из группы, состоящей из:
1-[5-(4-хлорфенил)-2-фторфенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола;
1-[2-фтор-5-[4-(трифторметил)фенил]фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола;
[1-[2-фтор-5-[4-(трифторметил)фенил]фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата;
[1-[5-(4-хлорфенил)-2-фторфенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата;
1-[2-фтор-5-[4-(трифторметил)фенил]фенил]-2-(1,3,4-оксадиазол-2-ил)этанола;
2-(5-метил-1,3,4-оксадиазол-2-ил)-1-[3-[4-(трифторметил)фенил]фенил]этанола;
[2-(5-метил-1,3,4-оксадиазол-2-ил)-1-[3-[4-(трифторметил)фенил]фенил]этил]карбамата;
(1R)-2-(5-метил-1,3,4-оксадиазол-2-ил)-1-[3-[4-(трифторметил)фенил]фенил]этанола;
(1S)-2-(5-метил-1,3,4-оксадиазол-2-ил)-1-[3-[4-(трифторметил)фенил]фенил]этанола;
2-(5-метил-1,3,4-оксадиазол-2-ил)-1-[2-метил-5-[4-(трифторметил)фенил]фенил]этанола;
1-[2-метокси-5-[4-(трифторметил)фенил]фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола;
[2-(5-метил-1,3,4-оксадиазол-2-ил)-1-[2-метил-5-[4-(трифторметил)фенил]фенил]этил]карбамата;
[1-[2-метокси-5-[4-(трифторметил)фенил]фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата;
1-[2-метил-5-[4-(трифторметил)фенил]фенил]-2-(1,3,4-оксадиазол-2-ил)этанола;
1-[2-метокси-5-[4-(трифторметил)фенил]фенил]-2-(1,3,4-оксадиазол-2-ил)этанола;
1-[2-хлор-5-[4-(трифторметил)фенил]фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола;
1-[2-хлор-5-[4-(трифторметил)фенил]фенил]-2-(1,3,4-оксадиазол-2-ил)этанола;
[1-[2-хлор-5-[4-(трифторметил)фенил]фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата;
[1-[2-хлор-5-[4-(трифторметил)фенил]фенил]-2-(1,3,4-оксадиазол-2-ил)этил]карбамата;
2-(1,3,4-оксадиазол-2-ил)-1-[3-[4-(трифторметил)фенил]фенил]этанола;
2-(5-этил-1,3,4-оксадиазол-2-ил)-1-[3-[4-(трифторметил)фенил]фенил]этанола;
2-(5-трет-бутил-1,3,4-оксадиазол-2-ил)-1-[3-[4-(трифторметил)фенил]фенил]этанола;
[2-(5-метил-1,3,4-оксадиазол-2-ил)-1-[3-[4-(трифторметил)фенил]фенил]этил]ацетата;
2-[2-метокси-2-[3-[4-(трифторметил)фенил]фенил]этил]-5-метил-1,3,4-оксадиазола;
1-[3-(4-фторфенил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола;
1-[3-(3,4-дифторфенил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола;
2-(5-метил-1,3,4-оксадиазол-2-ил)-1-[3-[4-(трифторметокси)фенил]фенил]этанола;
1-[3-(2-метокси-4-(трифторметокси)фенил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола;
1-[3-(4-хлор-2-(трифторметил)фенил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола;
1-[3-(4-хлор-2-метоксифенил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола;
1-[3-(2-хлорфенил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола;
1-[3-(3-хлорфенил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола;
1-[3-(4-хлорфенил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола;
[1-[3-[2-метокси-4-(трифторметокси)фенил]фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата;
[1-[3-[4-хлор-2-(трифторметил)фенил]фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата;
[1-[3-(4-хлор-2-метоксифенил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата;
[1-[3-(3,4-дифторфенил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата;
[1-[3-(4-фторфенил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата;
[1-[3-(2-хлорфенил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата;
[1-[3-(3-хлорфенил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата;
[1-[3-(4-хлорфенил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата;
1-[3-[2,4-бис(трифторметил)фенил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола;
[1-[3-[2,4-бис(трифторметил)фенил]фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата;
[1-[3-[4-(трифторметокси)фенил]фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата;
2-(3-метил-1,2,4-оксадиазол-5-ил)-1-[3-[4-(трифторметил)фенил]фенил]этанола;
[2-(3-метил-1,2,4-оксадиазол-5-ил)-1-[3-[4-(трифторметил)фенил]фенил]этил]карбамата;
2-(5-метил-1,2,4-оксадиазол-3-ил)-1-[3-[4-(трифторметил)фенил]фенил]этанола; и
[2-(5-метил-1,2,4-оксадиазол-3-ил)-1-[3-[4-(трифторметил)фенил]фенил]этил]карбамата.
11. Соединение или его оптический изомер, стереоизомер или фармацевтически приемлемая соль по п. 1, где соединение выбрано из группы, состоящей из:
2-(5-метил-1,3,4-оксадиазол-2-ил)-1-[3-(2,2,3,3-тетрафторпропокси)фенил]этанола;
[2-(5-метил-1,3,4-оксадиазол-2-ил)-1-[3-(2,2,3,3-тетрафторпропокси)фенил]этил]карбамата;
1-[2-фтор-5-(4,4,4-трифторбутокси)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола;
[1-[2-фтор-5-(4,4,4-трифторбутокси)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата;
1-[2-фтор-5-(2,2,2-трифторэтокси)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола;
[1-[2-фтор-5-(2,2,2-трифторэтокси)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этилкарбамата;
2-(5-метил-1,3,4-оксадиазол-2-ил)-1-[3-(4,4,4-трифторбутокси)фенил]этанола;
[2-(5-метил-1,3,4-оксадиазол-2-ил)-1-[3-(4,4,4-трифторбутокси)фенил]этил]карбамата;
1-(5-бутокси-2-фторфенил)-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола;
[1-(5-бутокси-2-фторфенил)-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата;
1-[2-фтор-5-(4,4,4-трифторбутокси)фенил]-2-(1,3,4-оксадиазол-2-ил)этанола;
[1-[2-фтор-5-(4,4,4-трифторбутокси)фенил]-2-(1,3,4-оксадиазол-2-ил)этил]карбамата;
1-[2-фтор-5-[3-(1-пиперидил)пропокси]фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола;
1-[5-[3-(диметиламино)пропокси]-2-фторфенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола;
1-[2-хлор-5-(4,4,4-трифторбутокси)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола;
[1-[5-[3-(диметиламино)пропокси]-2-фторфенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамат;
[1-[2-хлор-5-(4,4,4-трифторбутокси)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата;
2-фтор-2-(5-метил-1,3,4-оксадиазол-2-ил)-1-[3-(4,4,4-трифторбутокси)фенил]этанола;
2-(5-метил-1,3,4-оксадиазол-2-ил)-1-[3-(4,4,4-трифторбутокси)фенил]пропан-1-ола;
[2-фтор-2-(5-метил-1,3,4-оксадиазол-2-ил)-1-[3-(4,4,4-трифторбутокси)фенил]этил]карбамата;
[2-(5-метил-1,3,4-оксадиазол-2-ил)-1-[3-(4,4,4-трифторбутокси)фенил]пропил]карбамата;
(1R)-1-[2-фтор-5-(4,4,4-трифторбутокси)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола; и
(1S)-1-[2-фтор-5-(4,4,4-трифторбутокси)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола.
12. Соединение или его оптический изомер, стереоизомер или фармацевтически приемлемая соль по п. 1, где соединение выбрано из группы, состоящей из:
1-[2-фтор-5-(3,3,3-трифторпропил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола;
[1-[2-фтор-5-(3,3,3-трифторпропил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата;
1-[2-фтор-5-(3,3,3-трифторпропил)фенил]-2-(1,3,4-оксадиазол-2-ил)этанола;
1-(2-фтор-5-пропилфенил)-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола;
1-(2-фтор-5-пентилфенил)-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола;
[1-(2-фтор-5-пропилфенил)-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата;
[1-(2-фтор-5-пентилфенил)-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата;
1-[2-фтор-5-(4,4,4-трифторбутил)фенил]-2-(1,3,4-оксадиазол-2-ил)этанола;
1-[2-фтор-5-(5,5,5-трифторпентил)фенил]-2-(1,3,4-оксадиазол-2-ил)этанола;
1-[2-фтор-5-(4,4,4-трифторбутил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола;
1-[2-фтор-5-(5,5,5-трифторпентил)-фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этанола;
[1-[2-фтор-5-(4,4,4-трифторбутил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата; и
[1-[2-фтор-5-(5,5,5-трифторпентил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата.
13. Соединение или его оптический изомер, стереоизомер или фармацевтически приемлемая соль по п. 1, где соединение выбрано из группы, состоящей из:
4-фтор-3-[1-гидрокси-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]-N-(3,3,3-трифторпропил)бензамида; и
[1-[2-фтор-5-(3,3,3-трифторпропилкарбамоил)фенил]-2-(5-метил-1,3,4-оксадиазол-2-ил)этил]карбамата.
14. Фармацевтическая композиция для предотвращения или лечения эпилепсии, содержащая терапевтически эффективное количество соединения или его оптического изомера, стереоизомера или фармацевтически приемлемой соли, как определено в любом из пп. 1-13, в качестве активного ингредиента, вместе с фармацевтически приемлемым носителем.
15. Способ предотвращения или лечения эпилепсии, включающий введение пациенту, который в этом нуждается, терапевтически эффективного количества соединения или его оптического изомера, стереоизомера или фармацевтически приемлемой соли, как определено по любому из пп. 1-13.
| WO 2006112685 A1, 26.10.2006 | |||
| KR 20120135518 A,14.12.2012 | |||
| WO 2008013963 A2, 31.01.2008 | |||
| WO 2006017409 A2, 16.02.2006 | |||
| Bialer Meiry et al | |||
| Progress report on new antipileptic drugs | |||
| A summary of the Twetfth Eilat Conference (EILAT XII), Epilepsy Research, (2015), 111, 85-141 | |||
| Способ изготовления - изделий из пластической массы | 1929 |
|
SU22458A1 |
| НОВОЕ ПРОИЗВОДНОЕ ФЕНИЛПИРРОЛА | 2009 |
|
RU2470917C2 |
Авторы
Даты
2023-02-03—Публикация
2019-09-20—Подача