ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
[0001] Настоящая заявка испрашивает приоритет в соответствии с Парижской конвенцией по охране прав промышленной собственности по заявке на патент США 62/847,470, поданной 14 мая 2019 года, содержание которой полностью включено посредством отсылки.
УРОВЕНЬ ТЕХНИКИ
[0002] Настоящее изобретение относится к новому модифицированному слитому белку Fc-фрагмента иммуноглобулина и его применению, и более конкретно относится к новому модифицированному слитому белку Fc-фрагмента иммуноглобулина, который имеет увеличенный полупериод существования и способен минимизировать побочные эффекты, такие как ADCC и CDC, которые могут быть вызваны Fc-фрагментом антитела; и к его применению.
[0003] Fc-домен иммуноглобулина (антитела) широко применяется в качестве белка-носителя для различных терапевтических и диагностических белков. Антитело включает два функционально независимых фрагмента - вариабельный домен, который связывается с антигеном и известен как "Fab", и константный домен, который связан с эффекторными функциями, такими как активация комплемента и атака фагоцитом, и известен как "Fc". Fc-фрагмент имеет длительный полупериод существования в сыворотке, а Fab имеет короткий период существования (Capon et al., Nature 337:525-531, 1989). В комбинации с терапевтическим белком или пептидом Fc-домен может обеспечивать более длительный полупериод существования или объединять такие функции, как связывание Fc-рецептора, связывание белка A, связывание комплемента и проникновение через плаценту. В частности, более длительный полупериод существования такого Fc-домена обусловлен аффинностью связывания неонатального Fc-рецептора (именуемого далее "FcRn").
[0004] На настоящий момент разработано множество методов слияния Fc-домена и биологически активного белка для увеличения полупериода существования биологически активного белка. В качестве репрезентативного примера можно указать этанерцепт (торговое наименование: Энбрел®), который представляет собой слитый белок, в котором рецептор ФНОα 2 соединен с Fc-доменом IgG1 антитела (патент США 5,447,851). В дополнение к данному примеру также существуют некоторые цитокины и гормоны роста, слитые с Fc-доменом IgG антитела.
[0005] Однако, в отличие от слитых конструкций рецептора клеточной поверхности с внеклеточным доменом, слияние водорастворимого белка с IgG вызывает снижение биологической активности по сравнению с неслитым цитокином или фактором роста. Химерный белок существует в виде димера и вызывает стерические затруднения при связывании с молекулой-мишенью, такой как рецептор, из-за присутствия двух активных белков, расположенных близко друг к другу. Таким образом, для получения эффективного Fc-слитого белка необходимо преодолеть такую проблему.
[0006] Еще одним ограничением метода слияния с Fc является нежелательный иммунный ответ. Fc-домен иммуноглобулина также имеет эффекторные функции, такие как антителозависимая клеточная цитотоксичность (ADCC) и комплементзависимая цитотоксичность (CDC). В частности, четыре изоформы человеческого IgG с разной аффинностью связываются с активирующим Fcγ-рецептором (FcγR, включая FcγRI, FcγRIIa и FcγRIIIa), ингибирующим FcγRIIb-рецептором и первым фактором комплемента (C1q), выполняя очень разные эффекторные функции (Bruhns, P. et al., Blood 113 (16):3716-3725, 2009). Связывание IgG с FcγR или C1q зависит от остатков, расположенных в шарнирной области и в домене CH2. Впрочем, эффекторная функция Fc-домена вызывает апоптоз, секрецию цитокинов или воспаление у субъекта, когда терапевтический белок, слитый с Fc-доменом, вводят субъекту in vivo, и поэтому требуется подавить эффекторную функцию, чтобы уменьшить нежелательные реакции, за исключением крайней необходимости.
[0007] Для преодоления описанных выше проблем были разработаны некоторые модифицированные белки Fc-домена, включая описанные в US2006/0074225A1, Armour, K. L. et al. (Eur. J. Immunol., 29(8):2613-2624, 1999), Shields, R. L. et al. (J. Biol. Chem. 276(9):6591-6604, 2001) и Idusogie, EE. et al. (J. Immunol. 164(8):4178-4184, 2000).
[0008] Кроме того, несмотря на улучшение, касающееся полупериода существования, сохраняется потребность дополнительного улучшения полупериода существования терапевтического белка, слитого с Fc-доменом.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0009] Тем не менее, недостатком вышеуказанного предшествующего уровня техники является невозможность удовлетворительного увеличения полупериода существования или присутствие других побочных эффектов.
[0010] Таким образом, настоящее изобретение направлено на решение различных вышеуказанных проблем, и цель настоящего изобретения состоит в предоставлении нового модифицированного белка Fc-домена, который не влияет на продукцию и активность биоактивного белка, тогда как терапевтический белок, слитый без эффекторных функций, таких как ADCC и CDC, демонстрирует более длительный полупериод существования. Однако такая цель является иллюстративной и не ограничивает объем настоящего изобретения.
[0011] В соответствии с одним аспектом настоящего изобретения предложен вариантный белок Fc-домена иммуноглобулина, в котором 18-я и 196-я аминокислоты модифицированного белка Fc-домена IgG4, включающего аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-4, подвергнуты мутации с заменой на другие аминокислоты.
[0012] В соответствии с другим аспектом настоящего изобретения предложен слитый белок, в котором по меньшей мере один биологически активный белок (АФИ, активный фармацевтический ингредиент) соединен с N-концом и/или C-концом вариантного белка Fc-домена иммуноглобулина.
[0013] В соответствии с еще одним аспектом настоящего изобретения предложен полинуклеотид, кодирующий вариантный белок Fc-домена иммуноглобулина или слитый белок.
[0014] В соответствии с еще одним аспектом настоящего изобретения предложен гомо- или гетеродимер, который содержит слитый белок.
[0015] В соответствии с еще одним аспектом настоящего изобретения предложена композиция, которая в качестве активного ингредиента содержит слитый белок, полинуклеотид, кодирующий слитый белок, или гомо- или гетеродимер.
[0016] В соответствии с еще одним аспектом настоящего изобретения предложен способ увеличения полупериода существования in vivo биологически активного белка, включающий этап введения субъекту слитого белка, полученного в результате слияния биологически активного белка с вариантным белком Fc-домена иммуноглобулина, или гомо- или гетеродимера, содержащего слитый белок.
[0017] При слиянии с другим биологически активным белком вариантный белок Fc-домена иммуноглобулина согласно одному примеру осуществления настоящего изобретения может увеличивать полупериод существования биологически активного белка и инактивировать зависимые от Fc-домена эффекторные функции антитела, такие как ADCC и CDC, которые являются побочными эффектами, возникающими в случае применения белка на основе антитела в качестве терапевтического средства. Впрочем, эффекты настоящего изобретения этим не ограничиваются.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0018] ФИГ. 1-3 представляют собой схематические диаграммы, на которых показана структура моноспецифичного слитого белка согласно одному примеру осуществления настоящего изобретения;
[0019] ФИГ. 4 представляет собой схематическую диаграмму, на которой показана структура биспецифичного слитого белка согласно одному примеру осуществления настоящего изобретения;
[0020] ФИГ. 5 представляет собой схематическую диаграмму, на которой показана структура гомодимера, состоящего из биспецифичных слитых белков согласно одному примеру осуществления настоящего изобретения;
[0021] ФИГ. 6 представляет собой схематическую диаграмму, на которой показана структура гомодимера моноспецифичных слитых белков согласно одному примеру осуществления настоящего изобретения;
[0022] ФИГ. 7 представляет собой схематическую диаграмму, на которой показана структура гетеродимера двух различных моноспецифичных слитых белков согласно одному примеру осуществления настоящего изобретения;
[0023] ФИГ. 8 представляет собой схематическую диаграмму, на которой показана структура гетеродимера, состоящего из двух различных биспецифичных слитых белков согласно одному примеру осуществления настоящего изобретения;
[0024] ФИГ. 9 представляет собой схематическую диаграмму, на которой показана структура гомодимера моноспецифичных слитых белков, которые содержат шарнирную область IgG1 и линкерный пептид, согласно одному примеру осуществления настоящего изобретения;
[0025] ФИГ. 10 представляет собой схематическую диаграмму, на которой показана структура гетеродимера, состоящего из двух различных моноспецифичных слитых белков согласно одному примеру осуществления настоящего изобретения;
[0026] ФИГ. 11 представляет собой схематическую диаграмму, на которой показана структура гомодимера моноспецифичных слитых белков, которые содержат биологически активный белок на C-конце согласно одному примеру осуществления настоящего изобретения;
[0027] ФИГ. 12 представляет собой схематическую диаграмму, на которой показана структура гетеродимера, состоящего из двух различных биспецифичных слитых белков, которые содержат биологически активный белок на C-конце, согласно одному примеру осуществления настоящего изобретения;
[0028] ФИГ. 13 представляет собой схематическую диаграмму, на которой схематично показан процесс рециркуляции антитела, которую обеспечивает FcRn;
[0029] ФИГ. 14A является фотографией, на которой показаны результаты анализа с помощью ДСН-ПААГЭ, показывающие результат получения образца слитого белка (PG-11) согласно одному примеру осуществления настоящего изобретения, и ФИГ. 14B является хроматограммой, на которой показаны результаты анализа полученного PG-11 с помощью эксклюзионной высокоэффективной жидкостной хроматографии (ЭВЭЖХ);
[0030] ФИГ. 15A является фотографией, на которой показаны результаты анализа с помощью ДСН-ПААГЭ, показывающие результат получения образца слитого белка (PG-22) согласно одному примеру осуществления настоящего изобретения, и ФИГ. 15B является хроматограммой, на которой показаны результаты анализа полученного PG-22 с помощью эксклюзионной высокоэффективной жидкостной хроматографии (ЭВЭЖХ);
[0031] ФИГ. 16A является фотографией, на которой показаны результаты анализа с помощью ДСН-ПААГЭ, показывающие результат получения образца слитого белка (PG-088) согласно одному примеру осуществления настоящего изобретения, и ФИГ. 16B является хроматограммой, на которой показаны результаты анализа полученного PG-088 с помощью эксклюзионной высокоэффективной жидкостной хроматографии (ЭВЭЖХ);
[0032] ФИГ. 17A является фотографией, на которой показаны результаты анализа с помощью ДСН-ПААГЭ, показывающие результат получения образца слитого белка (PG-088m) согласно одному примеру осуществления настоящего изобретения, и ФИГ. 17B является хроматограммой, на которой показаны результаты анализа полученного PG-088m с помощью эксклюзионной высокоэффективной жидкостной хроматографии (ЭВЭЖХ);
[0033] ФИГ. 18A является фотографией, на которой показаны результаты анализа с помощью ДСН-ПААГЭ, показывающие результат получения образца слитого белка (PG-075) согласно одному примеру осуществления настоящего изобретения, и ФИГ. 18B является фотографией, на которой показаны результаты вестерн-блоттинга полученного PG-075 при использовании антитела против IgG;
[0034] ФИГ. 19A является фотографией, на которой показаны результаты анализа с помощью ДСН-ПААГЭ, показывающие результат получения образца слитого белка (PG-110) согласно одному примеру осуществления настоящего изобретения, и ФИГ. 19B является хроматограммой, на которой показаны результаты анализа полученного PG-110 с помощью эксклюзионной высокоэффективной жидкостной хроматографии (ЭВЭЖХ);
[0035] ФИГ. 20A является фотографией, на которой показаны результаты анализа с помощью ДСН-ПААГЭ, показывающие результат получения образца слитого белка (PG-129) согласно одному примеру осуществления настоящего изобретения, и ФИГ. 20B является хроматограммой, на которой показаны результаты анализа полученного PG-129 с помощью эксклюзионной высокоэффективной жидкостной хроматографии (ЭВЭЖХ);
[0036] ФИГ. 21A является фотографией, на которой показаны результаты анализа с помощью ДСН-ПААГЭ, показывающие результат получения образца слитого белка (PG-400) согласно одному примеру осуществления настоящего изобретения, и ФИГ. 21B является хроматограммой, на которой показаны результаты анализа полученного PG-400 с помощью эксклюзионной высокоэффективной жидкостной хроматографии (ЭВЭЖХ);
[0037] ФИГ. 22A является фотографией, на которой показаны результаты анализа с помощью ДСН-ПААГЭ, показывающие результат получения образца слитого белка (PG-410) согласно одному примеру осуществления настоящего изобретения, и ФИГ. 22B является хроматограммой, на которой показаны результаты анализа полученного PG-410 с помощью эксклюзионной высокоэффективной жидкостной хроматографии (ЭВЭЖХ);
[0038] ФИГ. 23 является фотографией, на которой показаны результаты анализа с помощью ДСН-ПААГЭ, показывающие результаты получения образцов гетеродимерных белков MG12-4 (левая сторона) и MG12-5 (правая сторона) согласно одному примеру осуществления настоящего изобретения;
[0039] ФИГ. 24A является фотографией, на которой показаны результаты анализа с помощью ДСН-ПААГЭ, показывающие результат получения образца слитого белка (PG-50-1) согласно одному примеру осуществления настоящего изобретения, ФИГ. 24B является фотографией, на которой показаны результаты анализа с помощью ДСН-ПААГЭ, показывающие результат получения образца слитого белка (PG-50-2) согласно одному примеру осуществления настоящего изобретения, ФИГ. 24C является фотографией (левая сторона), на которой показаны результаты анализа с помощью ДСН-ПААГЭ, показывающие результат получения образца слитого белка (PG-073) согласно одному примеру осуществления настоящего изобретения, и схематической диаграммой (правая сторона), на которой показаны структуры различных расщепленных форм слитого белка, оцениваемые на основе результатов анализа с помощью ДСН-ПААГЭ, ФИГ. 24D является фотографией (верхняя часть), на которой показаны результаты анализа с помощью ДСН-ПААГЭ, показывающие результат получения образца слитого белка (PG-210-5) согласно одному примеру осуществления настоящего изобретения, и хроматограмма (нижняя часть), на которой показаны результаты анализа полученного PG-210-5 с помощью эксклюзионной высокоэффективной жидкостной хроматографии (ЭВЭЖХ), и ФИГ. 24E является фотографией (верхняя часть), на которой показаны результаты анализа с помощью ДСН-ПААГЭ, показывающие результат получения образца слитого белка (PG-210-6) согласно одному примеру осуществления настоящего изобретения, и хроматограмма (нижняя часть), на которой показаны результаты анализа полученного PG-210-6 с помощью эксклюзионной высокоэффективной жидкостной хроматографии (ЭВЭЖХ);
[0040] ФИГ. 25 представляет собой серию графиков, на которых показаны результаты анализа аффинности связывания слитого белка (PG-11), полученного в соответствии с одним примером осуществления настоящего изобретения с рекомбинантным человеческим неонатальным Fc-рецептором (rhFcRn), с помощью анализа методом поверхностного плазмонного резонанса (ППР), при этом на каждом из трех графиков показан результат независимого теста;
[0041] ФИГ. 26 представляет собой серию графиков, на которых показаны результаты анализа аффинности связывания слитого белка (PG-11, верхняя часть), полученного согласно одному примеру осуществления настоящего изобретения с рекомбинантным человеческим неонатальным Fc-рецептором (rhFcRn), с помощью анализа методом поверхностного плазмонного резонанса (ППР), в сравнении со случаем Трулисити (нижняя часть) с использованием Fc-домена IgG4, при этом на графиках слева, в середине и справа показаны результаты трех независимых анализов соответственно;
[0042] ФИГ. 27 представляет собой серию графиков, на которых показаны результаты анализа аффинности связывания слитого белка (PG-11, верхняя часть), полученного согласно одному примеру осуществления настоящего изобретения с рекомбинантным человеческим неонатальным Fc-рецептором (rhFcRn), с помощью анализа методом поверхностного плазмонного резонанса (ППР), в сравнении со случаем Ритуксимаба (нижняя часть), который является рекомбинантным гуманизированным антителом, содержащим Fc-домен IgG1, при этом на графиках слева, в середине и справа в нижней части показаны результаты трех независимых анализов соответственно;
[0043] ФИГ. 28 представляет собой серию графиков, на которых показаны результаты сравнительного анализа аффинности связывания rhFcRn с биспецифичным слитым белком (слева), в котором scFv против PD-L1 и белок IL-2 соответственно соединены с N-концом и C-концом белка NTIG согласно одному примеру осуществления настоящего изобретения, и биспецифичным слитым белком (справа), в качестве контрольной группы, в котором scFv против PD-L1 и белок IL-2 соответственно соединены с N-концом и C-концом модифицированного белка Fc IgG4 SEQ ID NO: 2, с помощью анализа ППР при использовании rhFcRn в качестве лиганда и двух указанных субстанций в качестве образцов;
[0044] ФИГ. 29 представляет собой серию графиков, на которых показаны результаты сравнительного анализа аффинности связывания rhFcRn с биспецифичным слитым белком (слева), в котором scFv против PD-L1 и белок IL-2 соответственно соединены с N-концом и C-концом белка NTIG согласно одному примеру осуществления настоящего изобретения, и биспецифичным слитым белком (справа), в качестве контрольной группы, в котором scFv против PD-L1 и белок IL-2 соответственно соединены с N-концом и C-концом модифицированного белка Fc IgG4 SEQ ID NO: 2, с помощью анализа ППР при использовании двух указанных субстанций в качестве лигандов, а rhFcRn в качестве образца, противоположно ФИГ. 28;
[0045] ФИГ. 30 представляет собой серию графиков, на которых показаны результаты анализа, с помощью анализа BLI, аффинности связывания слитого белка (PG-11) согласно одному примеру осуществления настоящего изобретения с Fc-гамма рецептором I (FcγR1, слева) или Fc-гамма рецептором IIIa (FcγR3a, справа), в сравнении со случаем Ритуксимаба, который является гуманизированным антителом на основе IgG1, при этом на графиках сверху, в средине и снизу показаны результаты трех независимых анализов соответственно;
[0046] ФИГ. 31 представляет собой серию графиков, на которых показаны результаты анализа, с помощью анализа BLI, аффинности связывания слитого белка (PG-11) согласно одному примеру осуществления настоящего изобретения с другими различными Fc-гамма рецепторами (FcγRIIa, FcγRIIb и FcγRIIIb), в сравнении со случаем Ритуксимаба, который является гуманизированным антителом на основе IgG1, и PBS использовали в качестве контрольной группы;
[0047] ФИГ. 32 является графиком, на котором показаны результаты анализа аффинности связывания слитого белка (PG-11) согласно одному примеру осуществления настоящего изобретения с компонентом C1q комплемента в сравнении со случаем Ритуксимаба;
[0048] ФИГ. 33 представляет собой серию графиков, на которых показаны результаты сравнительного анализа GLP-2 активности слитых белков (PG-22, PG-201-5, PG-201-6, MG12-4 и MG12-5), которые содержат аналог GLP-2, согласно различным примерам осуществления настоящего изобретения, и на двух графиках сверху и снизу показаны результаты двух независимых анализов соответственно;
[0049] ФИГ. 34 представляет собой серию графиков, на которых показаны результаты проверки, с помощью анализа BLI, аффинности с IL-10R1 согласно лечебным концентрациям димерного вариантного слитого белка IL-10 (слева) Примера 2-3 и мономерного вариантного слитого белка IL-10 (справа) Примера 2-4 согласно настоящему изобретению;
[0050] ФИГ. 35A является графиком, на котором показаны результаты количественного анализа, с помощью ИФА, уровня высвобождения ФНО-α в макрофаге в соответствии с концентрацией слитого белка PG-210-6 согласно одному примеру осуществления настоящего изобретения, ФИГ. 35B является графиком, на котором показаны результаты количественного анализа, с помощью ИФА, уровня высвобождения ФНО-α в макрофаге в соответствии с лечебной концентрацией слитого белка PG-410 согласно одному примеру осуществления настоящего изобретения, и ФИГ. 35C является графиком, на котором показаны результаты количественного анализа, с помощью ИФА, уровня высвобождения ФНО-α в макрофаге в соответствии с лечебными концентрациями слитых белков PG-110 и PG-088m согласно одному примеру осуществления настоящего изобретения;
[0051] ФИГ. 36A представляет собой серию графиков, на которых показаны результаты анализа, с помощью анализа BLI, аффинности FcεRIα-модифицированного Fc IgG4 (сверху) в качестве Сравнительного Примера и слитого белка FcεRIα-NTIG-IL-10Vm (снизу) Примера 3-3 настоящего изобретения с мышиным IgE, и ФИГ. 36B является графиком, на котором показаны результаты анализа, с помощью анализа BLI, аффинности слитого белка FcεRIα-NTIG-IL-10Vm Примера 3-3 настоящего изобретения с человеческим IgE;
[0052] ФИГ. 37 является графиком, на котором показаны результаты анализа, с помощью анализа высвобождения β-гексозаминидазы, IgE ингибирующей активности слитого белка PG-110 согласно одному примеру осуществления настоящего изобретения и FcεRIα-модифицированного Fc IgG4 согласно одному примеру осуществления настоящего изобретения;
[0053] ФИГ. 38 является графиком, на котором показаны результаты анализа, с помощью анализа BLI, аффинности связывания слитых белков PG-400 (слева) и PG-410 (справа) согласно одному примеру осуществления настоящего изобретения с CD40L; и
[0054] ФИГ. 39 является графиком, на котором показаны результаты анализа фармакокинетических профилей, соответствующих различным путям назначения (п/к, в/в, в/б и в/м) слитого белка PG-110 согласно одному примеру осуществления настоящего изобретения.
Подробное описание изобретения
[0055] Согласно аспекту настоящего изобретения предложен вариантный белок Fc-домена иммуноглобулина, в котором 18-я и 196-я аминокислоты модифицированного белка Fc-домена IgG4, включающего аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 1-4, подвергнуты мутации с заменой на другие аминокислоты.
[0056] При использовании в настоящем документе термин "модифицированный белок Fc-домена иммуноглобулина IgG4" или "модифицированный белок Fc-домена IgG4" относится к рекомбинантному белоку Fc-домена антитела, полученному при комбинировании всех или части шарнирной области, CH2 и CH3, которые являются составными элементами Fc-домена иммуноглобулина, с такими элементами, полученными из различных типов молекул антител, то есть IgG, IgD, IgE и IgM. В качестве репрезентативного модифицированного белка Fc-домена иммуноглобулина IgG4 может быть указаны белки, раскрытые в патенте Кореи 897938.
[0057] При использовании в настоящем документе, термин "вариантный белок Fc-домена иммуноглобулина" или "вариантный белок Fc-домена" относятся к мутантному белку, в котором по меньшей мере одна аминокислота в модифицированном белке Fc-домена IgG4 заменена, удалена или добавлена.
[0058] В вариантном белке Fc-домена иммуноглобулина мутация 18-й аминокислоты может быть мутацией, выбранной из группы, состоящей из T18N, T18K и T18Q, мутация 196-й аминокислоты может быть мутацией, выбранной из группы, состоящей из M196A, M196F, M196I, M196L, M196V, M196P и M196W, причем мутацией 18-й аминокислоты более предпочтительно является T18Q, и мутацией 196-й аминокислоты предпочтительно является M196L.
[0059] Лизин (K) на C-конце вариантного белка Fc-домена иммуноглобулина может быть удален или не удален. Определить, удален ли лизин, можно в зависимости от того, соединен ли с C-концом другой АФИ. Например, если АФИ соединен с C-концом вариантного белка Fc-домена иммуноглобулина согласно настоящему изобретению, удаление лизина может быть выгодным с точки зрения продукции белка, а если АФИ не соединен с C-концом, удалять лизин не обязательно.
[0060] Вариантный белок Fc-домена иммуноглобулина может содержать аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 5-9.
[0061] Согласно другому аспекту настоящего изобретения предложен слитый белок, в котором по меньшей мере один биологически активный белок (АФИ, активный фармацевтический ингредиент) соединен с N-концом и/или C-концом вариантного белка Fc-домена иммуноглобулина (ФИГ. 1-4).
[0062] При использовании в настоящем документе термин "биологически активный белок" является понятием, отличным от структурных белков, которые являются белками, составляющими ткани и органы человеческого тела, и относится к белку, выполняющему определенные функции, такие как метаболизм и межклеточная или внутриклеточная передача сигналов, которые происходят в человеческом теле и могут использоваться для диагностики и/или лечения заболеваний, вызванных дефицитом или избытком белка.
[0063] Как показано на ФИГ. 1-4, в слитых белках (10-40) настоящего изобретения биологически активный белок или активный фармацевтический ингредиент (АФИ, 11) может быть соединен с N-концом или C-концом вариантного белка Fc-домена иммуноглобулина (12) через шарнирную область (13) IgG1 и/или линкерный пептид (14), такой как G4S линкер. Однако шарнирная область (13) важна для димеризации. Когда биологически активный белок (11) непосредственно соединен с шарнирной областью (13) IgG1, шарнирная область (то есть, SEQ ID NO: 20 и 21), может рассматриваться как линкер, как показано на ФИГ. 3. Шарнирная область обеспечивает гибкость и димеризационный фрагмент, способный к образованию межмолекулярной дисульфидной связи через остаток цистеина.
[0064] Слитый белок согласно одному примеру осуществления настоящего изобретения может содержать один или два биологически активных белка. Когда слитый белок содержит два биологически активных белка, сам слитый белок демонстрирует биспецифичность (ФИГ. 4). Как показано на ФИГ. 4A, первый биологически активный белок (11a) соединен с N-концом вариантного белка Fc-домена иммуноглобулина (12) через шарнирную область (13) IgG1, а второй биологически активный белок (11b) соединен с C-концом вариантного белка Fc-домена иммуноглобулина (12) через линкерный пептид (14). Кроме того, как показано на ФИГ. 4B, линкерный пептид (14), такой как G4S линкер, дополнительно соединен с N-концом шарнирной области (13) IgG1, первый биологически активный белок (11a) соединен с N-концом линкерного пептида (14), второй биологически активный белок (11b) соединен с C-концом вариантного белка Fc-домена иммуноглобулина (12) через линкерный пептид (14). В этом случае линкерный пептид (14), соединенный с N-концом, и линкерный пептид (14), соединенный с C-концом могут иметь одну и ту же последовательность, или линкерные пептиды обладают такими же свойствами, как линкер G4S, но могут частично отличаться с точки зрения определенных последовательностей.
[0065] В слитом белке биологически активный белок может быть цитокином, ферментом, фактором свертывания крови, внеклеточным доменом мембранного рецептора, фактором роста, пептидным гормоном или антителомиметиком.
[0066] В слитом белке длина линкерного пептида может составлять 2-60 ак, 4-55 ак, 5-50 ак, 5-46 ак, 5-45 ак или 5-30 ак. Среди линкерных пептидов линкерный пептид, который соединяет АФИ с N-концом вариантного белка Fc-домена иммуноглобулина, может включать часть или всю шарнирную область тяжелой цепи антитела IgG1, и случай, когда линкерный пептид включает часть шарнирной области, может быть случаем, когда искусственный линкерный пептид добавлен на N-конец или C-конец части шарнирной области. Кроме того, шарнирная область может быть шарнирной областью гибридного типа, в которой смешаны части шарнирных областей двух или больше тяжелых цепей антитела. В частности, линкерный пептид может быть комбинацией одного или больше, выбранных из группы, состоящей из GGGGSGGGGSGGGGSEKEKEEQEERTHTCPPCP (SEQ ID NO: 14), RNTGRGGEEKKGSKEKEEQEERETKTPECP (SEQ ID NO: 15), GGGGSGGGGSGGGGSEPKSCDKTHTCPPCP (SEQ ID NO: 16), GSGGGSGTLVTVSSESKYGPPCPPCP (SEQ ID NO: 17), GGGGSGGGGSGGGGSEPKSSDKTHTCPPCP (SEQ ID NO: 18), EPKSSDKTHTCPPCP (SEQ ID NO: 19), EPKSCDKTHTCPPCP (SEQ ID NO: 20), GGGGSGGGGSGGGGSAKNTTAPATTRNTTRGGEEKKKEKEKEEQEERTHTCPPCP (SEQ ID NO: 21), A(EAAAK)4ALEA(EAAAK)4A (SEQ ID NO: 22), (G4S)n (повторяющаяся последовательность: SEQ ID NO: 23, n является целым числом от 1 до 10), (GSSGGS)n (звено: SEQ ID NO: 24, n является целым числом от 1 до 10), SGGGSGGGGSGGGGSGGEEQEEGGS (SEQ ID NO: 25), AAGSGGGGGSGGGGSGGGGS (SEQ ID NO: 26), KESGSVSSEQLAQFRSLD (SEQ ID NO: 27), EGKSSGSGSESKST (SEQ ID NO: 28), GSAGSAAGSGEF (SEQ ID NO: 29), (EAAAK)n (звено: SEQ ID NO: 30, n является целым числом от 1 до 10), CRRRRRREAEAC (SEQ ID NO: 31), GGGGGGGG (SEQ ID NO: 32), GGGGGG (SEQ ID NO: 33), PAPAP (SEQ ID NO: 34), (Ala-Pro)n (n является целым числом от 1 до 10), VSQTSKLTRAETVFPDV (SEQ ID NO: 35), PLGLWA (SEQ ID NO: 36), TRHRQPRGWE (SEQ ID NO: 37), AGNRVRRSVG (SEQ ID NO: 38), RRRRRRRR (SEQ ID NO: 39), GSSGGSGSSGGSGGGDEADGSRGSQKAGVDE (SEQ ID NO: 40), GGGGSGGGGSGGGGS (SEQ ID NO: 41), AEAAAKEAAAAKA (SEQ ID NO: 42), GFLG (SEQ ID NO: 43), AKATTAPATTRNTGRGGEEKKKEKEKEEQEERETKTPECP (SEQ ID NO: 44), GGSGG (SEQ ID NO: 45), GGSGGSGGS (SEQ ID NO: 46), GGGSGG (SEQ ID NO: 47) и GSTSGSGKPGSGEGS (SEQ ID NO: 48).
[0067] В данном случае цитокин может быть хемокином, интерфероном, интерлейкином, колониестимулирующим фактором или фактором некроза опухоли, хемокин может быть CCL1, CCL2, CCL3, CCL4, CCL5, CCL6, CCL7, CCL8, CCL9, CCL10, CCL11, CCL12, CCL13, CCL14, CCL15, CCL16, CCL17, CCL19, CCL20, CCL21, CCL22, CCL23, CCL24, CCL25, CCL26, CCL27, CCL28, CXCL1, CXCL2, CXCL3, CXCL5, CXCL6, CXCL7, CXCL8, CXCL9, CXCL10, CXCL11, CXCL12, CXCL13, CXCL16, XCL1, XCL2 или CX3CL1, интерферон может быть интерфероном альфа, интерфероном бета, интерфероном эпсилон, интерфероном каппа, интерфероном дельта, интерфероном гамма, интерфероном тау, интерфероном омега, интерфероном ню или интерфероном дзета, интерлейкин может быть IL-2, IL-4, IL-7, IL-10, IL-12α, IL-12β, IL-13, IL-15 или IL-21, колониестимулирующий фактор может быть макрофагальным колониестимулирующим фактором (М-КСФ), гранулоцитарно-макрофагальным колониестимулирующий фактор (ГМ-КСФ), гранулоцитарным колониестимулирующим фактором (Г-КСФ) или промегапоэтином, и фактор некроза опухоли может быть ФНОα, ФНОβ, лигандом CD40 (CD40L), Fas-лигандом (FasL), ФНО-родственным лигандом, вызывающим апоптоз (TRAIL), или LIGHT (членом суперсемейства фактора некроза опухоли 14, TNFSF14).
[0068] В слитом белке фермент может быть активатором тканевого плазминогена (tPA), урокиназой, альтеплазой, ретеплазой, тенектеплазой, стрептокиназой, анистеплазой, таафилокиназой, наттокиназой, лимброкиназой, коллагеназой, глютеназой, альглюцеразой, велаглюцеразой, имиглюцеразой, талиглюцеразой-α, β-глюкоцереброзидазой, α-галактозиазой A, α-глюкозидазой, α-L-идурониазой, арилсульфатазой B, агалсидазой, аденозиндезаминазой, фенилаланинаммиаклиазой, дорназой, расбуриказой, пеглотиказой, глюкарпидазой или окриплазмином, но не ограничивается этим.
[0069] В слитом белке фактор свертывания крови может быть фактором VIII или фактором IX.
[0070] В слитом белке мембранный рецептор может быть рецептором из суперсемейства рецепторных тирозинкиназ (RTK), T-клеточным рецептором, Fc-рецептором, рецептором хемокина, рецептором из семейства Толл-подобных рецепторов, гуанилилциклаза-сопряженным рецептором (GCCR) или рецепторной серин/треонин-киназой, рецепторная тирозинкиназа может быть из семейства EGFR, семейства инсулиновых рецепторов, семейства рецепторов фактора роста тромбоцитов (PDGFR), семейства рецепторов фактора роста эндотелия сосудов (VEGFR), рецептором фактора роста фибробластов (FGFR), из семейства киназ рака толстой кишки (CCK), семейства рецепторов фактора роста нервов (NGFR), семейства рецепторов фактора роста гепатоцитов (HGFR), семейства эритропоэтин-продуцирующих рецепторов гепатоцитов человека (EphR), семейства рецепторных тирозин-протеинкиназ (AXL), семейства рецепторов ангиопоэтина (TIER), семейства рецепторов, родственных рецепторным тирозинкиназам (RYKR), семейства рецепторов с дискоидиновым доменом (DDR), семейства рецепторов, перестраиваемых во время трансфекции (RET), семейства лейкоцитарных рецепторных тирозинкиназ (LTK), семейства подобных рецепторным тирозинкиназам орфанных рецепторов (ROR), семейства мышечно-специфических киназ (MuSK), CD80 (B7.1) или CD83, Fc-рецептор может быть Fc-рецептором гамма, Fc-рецептором альфа или Fc-рецептором эпсилон, цитокиновый рецептор может быть цитокиновым рецептором 1-го типа, цитокиновым рецептором 2-го типа, рецептором из семейства рецепторов фактора некроза опухоли, хемокиновым рецептором или рецептором из семейства рецепторов TGF-бета, рецептор из семейства Толл-подобных рецепторов может быть TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, TLR9, TLR10, TLR11, TLR12 или TLR13, рецептор, связанный с гуанилилциклазой, может быть рецептором натрийуретического фактора 1 (NPR1), NPR2 или NPR3, и рецепторная серин/треонинкиназа может быть рецептором из суперсемейства TGF-β, рецептором костного морфогенетического белка (BMP) или киназой, подобной рецептору активина (ALK).
[0071] В слитом белке фактором роста может быть адреномедуллин, ангиопоэтин, костный морфогенетический белок, цилиарный нейротрофический фактор, фактор ингибирования лейкоза, эпидермальный фактор роста (EGF), эфрин, эритропоэтин (EPO), фактор роста фибробластов (FGF), семейство нейротрофических факторов из линии глиальных клеток (GDNF), фактор роста/дифференцировки-9 (GDF9), фактор роста гепатоцитов (HGF), фактор роста гепатомы (HDGF), инсулин, инсулиноподобный фактор роста (IGF), фактор роста кератиноцитов (KGF), фактор, стимулирующий миграцию (MSF), фактор, стимулирующий макрофаги, нейрегулин, нейротрофин, фактор роста плаценты (PGF), фактор роста тромбоцитов (PDGF), фактор роста T-клеток (TCGF), тромбопоэтин (TPO), семейство трансформирующих факторов роста (TGF) или фактор роста эндотелия сосудов (VEGF).
[0072] В слитом белке пептидным гормоном может быть гормон роста человека (hGH), аналог GLP-1, аналог GLP-2, инсулин, адренокортикотропный гормон, амилин, ангиотензин, нейропептид Y, энкефалин, нейротензин, предсердный натрийуретический пептид, кальцитонин, холецистокинин, гастрин, гелин, глюкагон, фолликулостимулирующий гормон, лептин, меланоцитстимулирующий гормон (МСГ), окситоцин, паратиреоидный гормон, пролактин, ренин, соматостатин, тиреотропный гормон (ТТГ), тиреотропин-рилизинг-гормон (ТРГ), вазопрессин или вазоактивный кишечный пептид.
[0073] В слитом белке антителомиметиком может быть scFv, VNAR, VHH, аффитело, аффилин, аффимер, аффитин, альфатело, антикалин, авимер, дарпин, финомер, пептид из домена Куница, монотело, репетело, VLR или nanoCLAMP.
[0074] В слитом белке белком IL-10 может быть вариантный белок IL-10, в который изолейцин, который является 87-й аминокислотой, заменен на аланин, или мономерный вариантный белок IL-10, в который линкерный пептид, имеющий длину 6-10 ак, вставлен между аспарагином, который является 134-й аминокислотой, и лизином, который является 135-й аминокислотой, и может включать аминокислотную последовательность, представленную в SEQ ID NO: 54 или 56.
[0075] При использовании в настоящем документе термин "слитый белок" относится к рекомбинантному белку, в котором два или больше белков или доменов, которые отвечают за специфические функции в белке, соединены таким образом, что каждый белок или домен отвечает за свою исходную функцию. Линкерный пептид, имеющий гибкую структуру, обычно может быть вставлен между этими двумя или больше белками или доменами. В качестве линкерного пептида может быть указан GGGGSGGGGSGGGGSEKEKEEQEERTHTCPPCP (SEQ ID NO: 14), RNTGRGGEEKKGSKEKEEQEERETKTPECP (SEQ ID NO: 15), GGGGSGGGGSGGGGSEPKSCDKTHTCPPCP (SEQ ID NO: 16), GSGGGSGTLVTVSSESKYGPPCPPCP (SEQ ID NO: 17), GGGGSGGGGSGGGGSEPKSSDKTHTCPPCP (SEQ ID NO: 18), EPKSSDKTHTCPPCP (SEQ ID NO: 19), EPKSCDKTHTCPPCP (SEQ ID NO: 20), GGGGSGGGGSGGGGSAKNTTAPATTRNTTRGGEEKKKEKEKEEQEERTHTCPPCP (SEQ ID NO: 21), (EAAAK)4ALEA(EAAAK)4А (SEQ ID NO: 22), (G4S)n (повторяющаяся последовательность: SEQ ID NO: 23, n является целым числом 1-10), (GSSGGS)n (единица: SEQ ID NO: 24, n является целым числом 1-10), SGGGSGGGGSGGGGSGGEEQEEGGS (SEQ ID NO: 25), AAGSGGGGGSGGGGSGGGGS (SEQ ID NO: 26), KESGSVSSEQLAQFRSLD (SEQ ID NO: 27), EGKSSGSGSESKST (SEQ ID NO: 28), GSAGSAAGSGEF (SEQ ID NO: 29), (EAAAK)n (единица: SEQ ID NO: 30, n является целым числом 1-10), CRRRRRREAEAC (SEQ ID NO: 31), GGGGGGGG (SEQ ID NO: 32), GGGGGG (SEQ ID NO: 33), PAPAP (SEQ ID NO: 34), (Ala-Pro)n (n целое число 1-10), VSQTSKLTRAETVFPDV (SEQ ID NO: 35), PLGLWA (SEQ ID NO: 36), TRHRQPRGWE (SEQ ID NO: 37), AGNRVRRSVG (SEQ ID NO: 38), RRRRRRRR (SEQ ID NO: 39), GSSGGSGSSGGSGGGDEADGSRGSQKAGVDE (SEQ ID NO: 40), GGGGSGGGGSGGGGS (SEQ ID NO: 41), AEAAAKEAAAAKA (SEQ ID NO: 42), GFLG (SEQ ID NO: 43), AKATTAPATTRNTGRGGEEKKKEKEKEEQEERETKTPECP (SEQ ID NO: 44), GGSGG (SEQ ID NO: 45), GGSGGSGGS (SEQ ID NO: 46), GGGSGG (SEQ ID NO: 47) и GSTSGSGKPGSGEGS (SEQ ID NO: 48).
[0076] При использовании в настоящем документе термин "антитело" относится к молекуле иммуноглобулина, которая представляет собой гетеротетрамерный белок, получаемый при связывании двух идентичных тяжелых цепей и двух идентичных легких цепей, и выполняет антигенспецифичное связывание через антигенсвязывающий участок, состоящий из вариабельной области (VL) легкой цепи и вариабельной области (VH) тяжелой цепи, вызывая таким образом антигенспецифичный гуморальный иммунный ответ. В качестве антитела, в зависимости от его происхождения, может быть указан IgA, IgG, IgD, IgE, IgM, IgY и т.п.
[0077] При использовании в настоящем документе термин "антигенсвязывающий фрагмент антитела" относится к фрагменту, который антигенсвязывающей способностью исходного антитела и включает фрагмент, получаемый при расщеплении антитела белковым расщепляющим ферментом, а также одноцепочечный фрагмент, получаемый рекомбинантным способом, и его примеры включают Fab, F(ab')2, scFv, диатело, триатело, sdAb или VHH.
[0078] При использовании в настоящем документе термин "Fab" относится к антигенсвязывающему фрагменту антитела (участку связывания антигена), который образуется при расщеплении молекулы антитела папаином, который является протеиназой, и педставляет собой димер двух пептидов VHА-CH1 и VL-CL, а другой фрагмент, который дает папаин, называется Fc-фрагментом (кристаллизующимся фрагментом).
[0079] При использовании в настоящем документе термин "F(ab')2" относится к фрагменту, включающему антигенсвязывающий участок, одному из фрагментов, образующихся при расщеплении антитела пепсином, который является протеиназой, и имеет форму тетрамера, в котором два Fab-фрагмента соединены дисульфидной связью. Другой фрагмент, который дает пепсин, называется pFc'.
[0080] При использовании в настоящем документе термин "Fab" относится к молекуле, имеющей структуру, подобную структуре Fab-фрагмента, образующейся при разделении вышеуказанного F(ab')2 в условиях слабого восстановления.
[0081] При использовании в настоящем документе термин "scFv" является сокращенным обозначением "одноцепочечного вариабельного фрагмента" и относится к фрагменту, который не является фрагментом существующего антитела, а является своего рода слитым белком, полученным при соединении вариабельной области тяжелой цепи (VH) с вариабельной областью легкой цепи (VL) антитела через линкерный пептид, имеющий размер приблизительно 25 ак, и, как известно, обладает антигенсвязывающей способностью, даже несмотря на то, что такой фрагмент не является уникальным фрагментом антитела (Glockshuber et al., Biochem. 29(6):1362-1367, 1990).
[0082] При использовании в настоящем документе, термины "диатело" и "триатело" относятся к фрагментам антитела в форме двух и трех scFv-фрагментов, соединенных линкером, соответственно.
[0083] При использовании в настоящем документе термин "однодоменное антитело (sdAb)" относится к фрагменту антитела, также называемому нанотелом и состоящему из одного фрагмента вариабельной области антитела. В основном используется sdAb, полученный из тяжелой цепи, однако также сообщается, что одиночный фрагмент вариабельной области, полученный из легкой цепи, специфично связывается с антигеном. VNAR, состоящий из фрагментов вариабельной области антитела акулы, и VHH, состоящий из фрагментов вариабельной области антитела верблюдовых, который состоит только из димеров одиночных цепей в отличие от обычных антител, состоящих из тяжелой цепи и легкой цепи, также включены в понятие sdAb.
[0084] При использовании в настоящем документе термин "антителомиметик" является понятием, включающим белок, имеющий функции, аналогичные функциям антител, полученных из неиммуноглобулиновых белковых каркасов, такой как монотело и вариабельный рецептор лимфоцитов (VLR), то есть, обладающий антигенсвязывающей способностью, в отличие от нормального полноразмерного антитела, в котором две тяжелые цепи и две легкие цепи образуют четвертичную структуру гетеротетрамера для выполнения функций. Примеры такого антителомиметика включают аффитело, полученное из Z-домена белка A (Nygren, PA, FEBS J. 275(11):2668-2676, 2008), аффилин, полученный из гамма-B кристаллина или убиквитина (Ebersbach et al., J. Mol. Biol. 372(1):172-185, 2007), аффимер, полученный из цистатина (Johnson et al., Anal. Chem. 84(15):6553-6560, 2012), аффитин, полученный из Sac7d (Krehenbrink et al., J. Mol. Biol. 383(5):1058-1068, 2008), альфатело, полученное из трехспирального суперспирального белка (Desmet et al., Nat. Commun. 5:5237, 2014), антикалин, полученный из липокалина (Skerra et al., FEBS J. 275(11):2677-2683, 2008), авимер, полученный из доменов различных мембранных рецепторов (Silverman et al., Nat. Biotechnol. 23 (12): 1556-1561 , 2005), дарпин, полученный из анкиринового повторяющегося мотива (Stumpp et al., Drug Discov. Today. 13(15-16):695-701, 2008), финомер, полученный из SH3-домена белка Fyn (Grabulovski et al., J. Biol. Chem. 282(5):3196-3204, 2007), пептиды домена Куница, полученные из доменов Куница различных белковых ингибиторов (Nixon and Wood, Curr. Opin. Drug Discov. Dev. 9(2):261-268, 2006), монотело, полученное из 10-го домена 3-го типа фибронектина (Koide and Koide, Methods Mol. Biol. 352:95-109, 2007), nanoCLAMP, полученный из углеводсвязывающего модуля 32-2 (Suderman et al., Protein Exp. Purif. 134:114-124, 2017), вариабельный рецептор лимфоцитов (VLR), полученный из миксин (Boehm et al., Ann. Rev. Immunol. 30:203-220, 2012), и репетело, сконструированное для увеличения аффинности к антигену, на основе VLR (Lee et al., Proc. Natl. Acad. Sci. USA, 109:3299-3304, 2012).
[0085] Согласно еще одному аспекту настоящего изобретения предложен полинуклеотид, кодирующий вариантный белок Fc-домена иммуноглобулина или слитый белок.
[0086] Полинуклеотид может быть любым полинуклеотидом при условии, что полинуклеотид является полинуклеотидом, кодирующим белок, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 5-9, и может содержать кодон, оптимизированный для типа клетки-хозяина, используемой для продукции белка. Такой метод оптимизации кодонов в зависимости от клетки-хозяина хорошо известен в уровне техники (Fuglsang et al., Protein Expr. Purif. 31(2):247-249, 2003). Полинуклеотид более предпочтительно содержит последовательность нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO: 10-13.
[0087] Согласно еще одному аспекту настоящего изобретения предложен рекомбинантный вектор, содержащий полинуклеотид.
[0088] В рекомбинантном векторе полинуклеотид может содержаться в форме генетической конструкции, функционально связанной с регуляторной последовательностью.
[0089] При использовании в настоящем документе термин "функционально связанный с" означает, что последовательность-мишень нуклеиновой кислоты (например, система транскрипции/трансляции in vitro или в клетке-хозяине) связана с регуляторной последовательностью таким образом, что последовательность-мишень нуклеиновой кислоты может быть экспрессирована.
[0090] При использовании в настоящем документе термин "регуляторная последовательность" включает промотор, энхансер и другие регуляторные элементы (например, сигнал полиаденилирования). Примеры регуляторной последовательности включают последовательность, которая определяет, что нуклеиновая кислота-мишень постоянно экспрессируется во многих клетках-хозяевах, последовательность (например, тканеспецифическую регуляторную последовательность), которая определяет, что нуклеиновая кислота-мишень экспрессируется только в клетке специфической ткани, и последовательность (например, индуцируемую регуляторную последовательность), которая определяет, что экспрессия индуцируется специфическим сигналом. Специалисты в данной области могут понять, что конструкция вектора экспрессии может изменяться в зависимости от таких факторов, как выбор клетки-хозяина для трансформации и требуемый уровень экспрессии белка. Вектор экспрессии согласно настоящему изобретению может быть введен в клетку-хозяина для экспрессии слитого белка. Регуляторные последовательности, которые обеспечивают экспрессию в эукариотической клетке и прокариотической клетке, хорошо известны специалистам в данной области. Как описано выше, такие регуляторные последовательности обычно включают регуляторные последовательности, отвечающие за инициацию транскрипции, и, необязательно, поли-А сигнал, отвечающий за терминацию транскрипции и стабилизацию транскрипта. Дополнительные регуляторные последовательности могут включать фактор усиления трансляции и/или естественно комбинированную или гетерологичную промоторную область в дополнение к фактору регуляции транскрипции. Например, возможные регуляторные последовательности, которые обеспечивают экспрессию в клетке-хозяине млекопитающего, включают промотор тимидинкиназы CMV-HSV, SV40, промотор RSV (вируса саркомы Рауса), 1α-промотор мочевины почек человека, глюкокортикоид-индуцирующий промотор MMTV (вируса опухоли мышей Молони), металлотионеин- или тетрациклин-индуцируемый промотор, или амплифицирующий агент, такой как амплифицирующий агент ЦМВ и амплифицирующий агент SV40. Считается, что для экспрессии в нервной клетке может использоваться промотор нейрофиламентов, промотор PGDF, промотор NSE, промотор PrP или промотор thy-1. Вышеуказанные промоторы известны в уровне техники и описаны в литературе (Charron, J. Biol. Chem. 270:25739-25745, 1995). Для экспрессии в прокариотической клетке был раскрыт ряд промоторов, включая lac-промотор, tac-промотор или trp промотор. В дополнение к факторам, способным инициировать транскрипцию, регуляторные последовательности могут включать сигнал терминации транскрипции, такой как сайт поли(A) SV40 и сайт поли(A) TK, после полинуклеотида в соответствии с одним примером осуществления настоящего изобретения. В настоящем описании подходящие векторы экспрессии являются известными в данной области, и их примеры включают вектор экспрессии кДНК Окаямы-Берга pcDV1 (Parmacia), pRc/CMV, pcDNA1, pcDNA3 (Invitrogene), pSPORT1 (GIBCO BRL), pGX-27 (патент Кореи 1442254), pX (Pagano et al., Science 255:1144-1147, 1992), дрожжевой двугибридный вектор, такой как pEG202 и dpJG4-5 (Gyuris et al., Cell 75:791-803, 1995), и прокариотический вектор экспрессии, такой как лямбда gt11 и pGEX (Amersham Pharmacia). Вектор может дополнительно включать полинуклеотид, кодирующий сигнал секреции, в дополнение к молекулам нуклеиновых кислот согласно настоящему изобретению. Сигналы секреции хорошо известны специалистам в данной области. Более того, в зависимости от используемой системы экспрессии, лидерную последовательность, которая может направлять слитый белок согласно одному примеру осуществления настоящего изобретения в клеточный компартмент, комбинируют с кодирующей последовательностью полинуклеотида согласно одному примеру осуществления настоящего изобретения, при этом она предпочтительно представляет собой лидерную последовательность, способную непосредственно секретировать транслированный белок или свой белок в перицитоплазматическую или внеклеточную среду.
[0091] Кроме того, вектор согласно настоящему изобретению может быть получен, например, с помощью стандартной методики рекомбинантных ДНК, и примеры стандартной методики рекомбинантных ДНК включают лигирование тупого конца и липкого конца, обработку рестриктазы для получения нужного конца, удаление фосфатной группы при обработке щелочной фосфатазой для предотвращения неправильного связывания и ферментативное лигирование при использовании ДНК-лигазы Т4. Вектор согласно настоящему изобретению может быть получен при рекомбинации ДНК, кодирующей сигнальный пептид, полученный с применением химического синтеза или технологии генетической рекомбинации, вариантный белок Fc-домена иммуноглобулина в соответствии с одним примером осуществления настоящего изобретения, или ДНК, кодирующей слитый белок, содержащий их, с вектором, содержащим соответствующую регуляторную последовательность. Вектор, содержащий регуляторную последовательность, может быть приобретен коммерчески или получен, и в одном примере осуществления настоящего изобретения в качестве скелетного вектора используется каркасный вектор pBispecific (Genexine, Inc., Korea), вектор pAD15, pGP30 (Genexine, Inc. Korea) или вектор pN293F (Y-Biologics, Inc., Korea).
[0092] Вектор экспрессии может дополнительно включать полинуклеотид, кодирующий последовательность сигнала секреции, при этом последовательность сигнала секреции вызывает внеклеточную секрецию рекомбинантного белка, экспрессированного в клетке, и может быть сигнальной последовательностью активатора тканевого плазминогена (tPA), сигнальной последовательностью гликопротеина Ds вируса простого герпеса (HSV gDs) или сигнальной последовательностью гормона роста.
[0093] Вектор экспрессии согласно одному примеру осуществления настоящего изобретения может быть вектором экспрессии, способным к экспрессии белка в клетке-хозяине, при этом вектор экспрессии может быть в любой форме, такой как плазмидный вектор, вирусный вектор, космидный вектор, фагмидный вектор или искусственная человеческая хромосома.
[0094] Согласно еще одному аспекту настоящего изобретения предложен гомо- или гетеродимер, содержащий слитый белок.
[0095] В гомодимере, как показано на ФИГ. 5, когда различные биологически активные белки (11a и 11b) соответственно связаны с N-концом и C-концом вариантного белка Fc-домена иммуноглобулина (12), полученный гомодимер (100) демонстрирует биспецифичность. Однако, как показано на ФИГ. 6, когда димеризуется только один моноспецифичный слитый белок, содержащий биологически активный белок (11), полученный гомодимер (200) все еще проявляет моноспецифичность (ФИГ. 6). В случае гетеродимера, как показано на ФИГ. 7, когда димеризуются два разных моноспецифичных слитых белка, соответственно содержащих биологически активные белки (11a и 11b), полученный гетеродимер (300) демонстрирует биспецифичность. Как показано на ФИГ. 8, когда димеризуются два разных биспецифичных слитых белка, каждый из которых содержит два разных биологически активных белка (11a, 11b, 11c и 11d), полученный гетеродимер (400) демонстрирует тетраспецифичность.
[0096] Необязательно, гомо- или гетеродимеры (500, 600, 700 и 800) согласно одному примеру осуществления настоящего изобретения могут содержать один или больше линкерных пептидов (14) между биологически активными белками (11, 11a, 11b, 11c и 11d) и шарнирной областью (13) или между областью вариантного белка Fc-домена иммуноглобулина (12) и биологически активными белками. Такие партнеры по слиянию могут быть соединены с N-концом или C-концом вариантного белка Fc-домена иммуноглобулина через линкерные пептиды (14) (ФИГ. 9-12).
[0097] В частности, биологически активный белок (11a), соединенный с N-концом слитого белка, может быть лигандом, который действует как фрагмент-мишень, при этом другой биологически активный белок (11b), соединенный с C-концом того же слитого белка, может быть функциональным белком, обладающим требуемой биологической активностью (ФИГ. 5 и 8). С другой стороны функциональный белок может быть соединен с N-концом, а лиганд может быть соединен с C-концом. Такие биспецифичные слитые белки могут образовывать гомодимер при посредстве межмолекулярной дисульфидной связи через остаток цистеина, присутствующий в шарнирной области (13), при этом селективное гидрофобное взаимодействие между вариантными белками Fc-домена иммуноглобулина может вызывать димеризацию. Два разных биспецифичных слитых белка могут формировать гетеродимер. Таким образом, гомо- или гетеродимерные белки согласно одному примеру осуществления настоящего изобретения могут содержать от одного до четырех биологически активных белка, причем больше типов белков можно добавить путем добавления линкерного пептида к биоактивному белку, присутствующему на каждом конце.
[0098] Когда предусмотрено получение гетеродимер согласно одному примеру осуществления настоящего изобретения, то для того, чтобы свести к минимуму образование гомодимера, может использоваться метод выступов во впадины (KIH), который известен в уровне техники.
[0099] При использовании в настоящем документе термин "выступы во впадины (KIH)" относится к одной из стратегий конструирования антител, используемых для гетеродимеризации тяжелых цепей при получении биспецифичного IgG антитела. В методе KIH, когда два слитых белка, образующих гетеродимер, разделяют на первый слитый белок и второй слитый белок, в модифицированной Fc-области IgG4 первого слитого белка остаток серина, который является 10-й аминокислотой CH3 домена, может быть заменен цистеином (C), а треонин (T), который является 22-й аминокислотой, может быть заменен триптофаном (W) (структура выступов), а в Fc-области второго слитого белка остаток тирозина (Y), который является 5-й аминокислотой CH3 домена, может быть заменен цистеином (C), треонин (T), который является 22-й аминокислотой, может быть заменен серином (S), лейцин (L), который является 24-я аминокислотой, может быть заменен аланином (A), и тирозин (Y), который является 63-й аминокислотой, может быть заменен валином (V) (структура впадин). И наоборот, в Fc-области первого слитого белка тирозин (Y), который является 5-й аминокислотой CH3 домена, может быть заменен цистеином (C), треонин (T), который является 22-й аминокислотой, может быть заменен серином (S), лейцин (L), который является 24-й аминокислотой, может быть заменен аланином (A), и тирозин (Y), который является 63-й аминокислотой, может быть заменен валином (V) (структура впадин), а в модифицированной Fc-области IgG4 второго слитого белка остаток серина (S), который является 10-й аминокислотой CH3 домена, может быть заменен цистеином (C), и треонин (T), который является 22-й аминокислотой, может быть заменен триптофаном (W) (структура выступов).
[00100] В этом случае положение аминокислоты, в котором произошла мутация, основано на референсной последовательности (аминокислотной последовательности CH3 домена человеческого IgG1 SEQ ID NO: 77). Даже когда дополнительные мутации, такие как добавление, делеция или замена аминокислот, происходят в участке, независимом от структуры выступов во впадины в CH домене, слитый белок, в котором аминокислота, соответствующая положению участка, подвергается мутации на основе референсной последовательности. Необязательно, структура "выступов во впадины" может быть введена посредством мутаций других аминокислот, хорошо известных в данной области. Такая мутация конкретно описана в предыдущей литературе (Wei et al., Oncotarget 8(31):51037-51049, 2017; Ridgway et al., Protein Eng. 9(7):617-621, 1996; Carter, P., J. Immunol. Methods 48(1-2):7-15, 2001; Merchant et al., Nat. Biotechnol. 16(7):677-681, 1998). Биспецифичный димерный слитый белок может быть получен посредством такой селективной мутации, например, комбинации выступающей структуры, в которой треонин, который является 22-й аминокислотой CH3 домена первого слитого белка, заменен тирозином и структурой впадин, в которой тирозин, который является 63-й аминокислотой CH3 домена второго слитого белка, заменен треонином. Напротив, структура выступов во впадины может быть сформирована путем введения структуры впадин в первый слитый белок и введения структуры выступов во второй слитый белок.
[00101] Согласно еще одному аспекту настоящего изобретения предложена композиция, содержащая в качестве активного ингредиента слитый белок, полинуклеотид, кодирующий такой слитый белок, или гомо- или гетеродимер.
[00102] Согласно еще одному аспекту настоящего изобретения предложен способ увеличения полупериода существования in vivo биологически активного белка, включающий этап введения субъекту слитого белка, полученного путем слияния биологически активного белка с вариантным белком Fc-домена иммуноглобулина, или гомо- или гетеродимера, содержащего такой слитый белок.
[00103] Согласно еще одному аспекту настоящего изобретения предложена композиция, содержащая в качестве активного ингредиента слитый белок, полученный путем слияния биологически активного белка с вариантным белком Fc-домена иммуноглобулина, или гомо- или гетеродимер, содержащий такой слитый белок.
[00104] Композиция может содержать фармацевтически приемлемый носитель и может дополнительно включать фармацевтически приемлемый адъювант, вспомогательное вещество или разбавитель в дополнение к носителю.
[00105] При использовании в настоящем документе термин "фармацевтически приемлемый" относится к композиции, которая является физиологически приемлемой и обычно не вызывает аллергическую реакцию, такую как желудочно-кишечное нарушение и головокружение, или подобную реакцию при введении человеку. Примеры носителя, вспомогательного вещества и разбавителя включают лактозу, декстрозу, сахарозу, сорбит, маннит, ксилит, эритрит, мальтит, крахмал, гуммиарабик, альгинат, желатин, фосфат кальция, силикат кальция, целлюлозу, метилцеллюлозу, поливинилпирролидон, воду, метилгидроксибензоат, пропилгидроксибензоат, тальк, стеарат магния и минеральное масло. Кроме того, также может содержаться наполнитель, противоагрегационное вещество, смазывающее вещество, смачивающее вещество, аромат, эмульгатор и антисептическое средство.
[00106] Кроме того, когда фармацевтическую композицию согласно одному примеру осуществления настоящего изобретения вводят млекопитающему, фармацевтическую композицию можно изготовить с применением способов, известных в данной области, для получения быстрого, замедленного или задержанного высвобождения активного ингредиента. Примеры состава включают порошок, гранулы, таблетку, эмульсию, сироп, аэрозоль, мягкую или твердую желатиновую капсулу, стерильный раствор для инъекций и стерильную порошковую форму.
[00107] Композицию согласно одному примеру осуществления настоящего изобретения могут вводить различными путями, такими как пероральное введение и парентеральное введение, например, введение суппозитория, трансдермальное, внутривенное, внутрибрюшинное, внутримышечное, внутриочаговое, назальное или внутрипозвоночное введение, и могут вводить с помощью имплантируемого устройства для длительного высвобождения или непрерывного или периодического высвобождения. Введение могут выполнять однократно или несколько раз в день в течение требуемого диапазона и могут выполнять с интервалом, таким как один раз в неделю, два раза в неделю и один раз в месяц, при этом продолжительность введения также особо не ограничена.
[00108] Композиция согласно одному примеру осуществления настоящего изобретения может быть изготовлена в подходящей форме с фармацевтически приемлемым носителем, который обычно используется. Примеры фармацевтически приемлемого носителя включают такие носители для парентерального введения, как воду, подходящее масло, солевой раствор, водный раствор глюкозы и гликоль, при этом также может содержаться стабилизатор и консервант. Примеры подходящего стабилизатора включают антиоксиданты, такие как гидросульфит натрия, сульфит натрия или аскорбиновую кислоту. Примеры подходящего консерванта включают хлорид бензалкония, метил- или пропилпарабен и хлорбутанол. Более того, композиция согласно настоящему изобретению может предпочтительно содержать суспендирующее вещество, солюбилизатор, стабилизатор, изотоническое вещество, консервант, ингибитор всасывания, поверхностно-активное вещество, разбавитель, вспомогательное вещество, регулятор pH, анестетик, буферное вещество, антиоксидант или т.п., при необходимости, в зависимости от способа введения или состава. Фармацевтически приемлемые носители и составы, подходящие для настоящего изобретения, включая представленные выше, подробно описаны в литературе [Remington's Pharmaceutical Sciences, последнее издание].
[00109] Доза композиции для пациента зависит от различных факторов, включая рост пациента, площади поверхности тела, возраст, конкретное вводимое соединение, пол, время и путь введения, общее состояние здоровья и другие лекарственные средства, вводимые одновременно. Фармацевтически активный белок могут вводить в количестве от 100 нг/масса тела (кг) до 10 мг/масса тела (кг), более предпочтительно 1-500 мкг/кг (массы тела) и наиболее предпочтительно 5-50 мкг/кг (массы тела), но при этом доза может быть скорректирована с учетом вышеуказанных факторов.
[00110] Согласно еще одному аспекту настоящего изобретения, предложен способ лечения заболевания субъекта, включающий этап введения субъекту, в терапевтически эффективном количестве, слитого белка, полученного в результате слияния биологически активного белка с вариантным белком Fc-домена иммуноглобулина, или гомо- или гетеродимера, содержащего такой слитый белок.
[00111] При использовании в настоящем документе термин "терапевтически эффективное количество" относится к количеству, достаточному для лечения заболевания с разумным соотношением пользы/рисков, применимым к медицинскому обслуживанию, при этом эффективный уровень дозы может быть определен в соответствии с факторами, включающими тип субъекта, тяжесть, возраст, пол, активность лекарственного средства, чувствительность к лекарственному средству, время введения, путь введения, скорость экскреции, продолжительность лечения, лекарственные средства, применяемые одновременно, а также другие факторы, хорошо известные в области медицины. Терапевтически эффективное количество композиции согласно настоящему изобретению составляет от 0,1 мг/кг до 1 г/кг и более предпочтительно от 1 мг/кг до 500 мг/кг, но эффективная доза может быть соответствующим образом скорректирована в зависимости от возраста, пола и состояния пациента.
[00112] Вышеуказанное заболевание представляет собой заболевание, требующее введения биологически активного белка, например, когда биологически активным белком является аналог GLP-1, заболеванием, подлежащим лечению, может быть диабет или метаболический синдром, когда биологически активным белком является аналог GLP-2, заболеванием, подлежащим лечению, может быть синдром короткой кишки или воспалительное заболевание кишечника, когда биологически активным белком является IL-2, заболеванием, подлежащим лечению, может быть злокачественная опухоль, когда биологически активным белком является FcεRIa заболеванием, подлежащим лечению, может быть IgE-опосредованные аллергические заболевания, такие как астма и атопический дерматит, и когда биологически активным белком является миметик антитела против CD40L, заболеванием, подлежащим лечению, может быть аутоиммунное заболевание или реакция отторжения трансплантата органа.
[00113] Далее настоящее изобретение будет описано более подробно посредством Примеров и Экспериментальных примеров. Однако настоящее изобретение не ограничивается Примерами и Экспериментальными примерами, описанными ниже, и может быть реализовано в других различных формах, при этом Примеры и Экспериментальные примеры, описанные ниже, предоставлены для того, чтобы описание настоящего изобретения было полным и полностью передавало объем изобретения специалистам в области, к которой относится настоящее изобретение.
[00114] Пример 1: Создание вариантного белка Fc-домена иммуноглобулина
[00115] Методика соединения Fc-домена антитела с биологически активным белком или активным фармацевтическим ингредиентом (АФИ) с целью увеличения полупериода существования АФИ является широко используемой методикой. Впрочем, когда во фрагменте Fc-домена антитела N-связанная сахаридная цепь присоединяется к аспарагину, который является 297-й аминокислотой, структура сахаридной цепи отличается от такой структуры, присутствующей в человеческом антителе, или не является однородной, и при этом продуцируется в гетерогенной форме в зависимости от характеристик клетки-хозяина, используемой для продукции антител. Таким образом, активность слитого белка, с которым связан АФИ, может быть непостоянной, или может быть продемонстрировано, что эффект, ненужный в некоторых случаях, такой как антителозависимая клеточная цитотоксичность (ADCC) и комплементзависимая цитотоксичность (CDC), вызывает побочные эффекты. Более того, известно, что причина увеличения полупериода существования после введения антитела in vivo заключается в том, что антитело абсорбируется в результате эндоцитоза эндотелиальными клетками сосудов in vivo, а затем связывается с неонатальным Fc-рецептором (далее именуемым "FcRn") из-за низкого pH в эндосомном состоянии, чтобы избежать деградации в лизосомах, и отделяется от FcRn в условиях внеклеточного физиологического pH, в процессе, в котором эндосома возвращается в клеточную мембрану (ФИГ. 13). Как известно, реутилизация антитела при участии FcRn вызывает эффект увеличения полупериода существования антитела приблизительно до 21 дня (Raghavan, M. et al., Biochem, 34(45):14649-14657, 1995).
[00116] Впрочем, поскольку существующие Fc-домены антитела обладают разной аффинностью с FcRn в зависимости от типа IgG, существует предел увеличения полупериода существования АФИ.
[00117] Таким образом, авторы настоящего изобретения сконструировали вариант белка Fc-домена, который не имеет ADCC и CDC активности с повышением аффинности существующего белка Fc-домена с FcRn.
[00118] Поэтому авторы настоящего изобретения сконструировали вариант (SEQ ID NO: 6-9), в котором треонин (T), который является 18-й аминокислотой модифицированного белка Fc IgG4, имеющего аминокислотные последовательности, представленные в SEQ ID NO: 1-4, был заменен глутамином (Q), и метионин (M), который является 196-й аминокислотой, был заменен лейцином (L), и такой вариант был назван "NTIG (SEQ ID NO: 5)".
[00119] Пример 2: Получение конструкции моноспецифичного слитого белка
[00120] Затем авторы настоящего изобретения получали различные слитые белки, в которых различные биологически активные белки были соединены с N-концом и/или C-концом вариантного белка Fc-домена иммуноглобулина (NTIG), полученного в Примере 1.
[00121] 2-1: Конструирование и получение GLP-1E-NTIG
[00122] Авторы настоящего изобретения сконструировали слитый белок (GLP-1E-NTIG, SEQ ID NO: 50), в котором белок NTIG (SEQ ID NO: 7), полученный в Примере 1, был соединен с C-концом гибридного пептида GLP-1/Эксендин-4 (SEQ ID NO: 49), который представляет собой гибридный пептид GLP-1 и Эксендина-4 через линкерный пептид ((G4S)3-IgD/IgG1 гибридный шарнир, SEQ ID NO: 14), содержащий шарнирную область в гибридной форме, и такой слитый белок был назван "PG-11". GLP-1E-NTIG был сконструирован для добавления сигнальной последовательности tPA (SEQ ID NO: 51) для секреции из клетки-хозяина. В то же время полинуклеотид, кодирующий PG-11, синтезировали с помощью олигонуклеотидного синтеза, ПЦР-амплификации и метода сайт-направленного мутагенеза, а затем встраивали в вектор экспрессии pGP30 (Genexine, Inc., Korea). Полученный вектор транзиентно экспрессировали при использовании набора ExpiCHO производства Thermo Fisher Scientific Solutions LLC. В частности, вектор, полученный, как описано выше, и реагент ExpiFectamine, содержащийся в наборе, смешивали в клетке ExpiCHO-S и культивировали полученные клетки в течение 1 дня в термостате при условиях 8% CO2 и 37°C, затем температуру снижали до 32°C и проводили культивирование до 7-го дня.
[00123] После этого проводили захват и очистку белка A, проверяли, был ли кандидатный материал очищен с помощью анализа методом электрофореза в ДСН-ПААГ в невосстанавливающих и восстанавливающих условиях, и изготавливали состав с буферным раствором в соответствии со значением pI кандидатного материала. Изготовленный состав материала определяли количественно с помощью NanoDrop, а конечную чистоту проверяли с помощью эВЭЖХ (ФИГ. 14a и 14b).
[00124] 2-2: Конструирование и получение GLP-2-2G-NTIG
[00125] Авторы настоящего изобретения сконструировали слитый белок (GLP-2-2G-NTIG, SEQ ID NO: 53), в котором NTIG (SEQ ID NO: 7) был соединен через линкерный пептид (SEQ ID NO: 14) с C-концом аналога GLP-2 (GLP-2-2G, SEQ ID NO: 52), который представляет собой мутант, в котором аланин (A), который является 2-й аминокислотой пептида GLP-2 человека, заменен глицином (G), и такой слитый белок был назван "PG-22". Аналогичным образом был также сконструирован PG-22 для добавления сигнальной последовательности tPA (SEQ ID NO: 51) для секреции. Аналогично Примеру 2-1, полинуклеотид, кодирующий PG-22, был получен и встроен в вектор экспрессии pGP30 (Genexine, Inc., Korea) для продукции белка при использовании системы ExpiCHO, а затем проверяли конечную чистоту (ФИГ. 15a и 15b).
[00126] 2-3: Конструирование и получение NTIG-IL-10V
[00127] Авторы настоящего изобретения сконструировали слитый белок (NTIG-IL-10V, SEQ ID NO: 55), в котором вариант IL-10 (SEQ ID NO: 54) был соединен с C-концом NTIG через линкерный пептид (SEQ ID NO: 26), и такой слитый белок был назван "PG-088". Аналогично Примеру 2-1, полинуклеотид, кодирующий PG-088, был получен и встроен в вектор экспрессии pBispec (Genexine, Inc., Korea) для продукции белка при использовании системы ExpiCHO, а затем проверяли конечную чистоту (ФИГ. 16a и 16b).
[00128] 2-4: Конструирование и получение мономера NTIG-IL-10V
[00129] Авторы настоящего изобретения сконструировали слитый белок (NTIG-IL-10Vm, SEQ ID NO: 57), в котором мономерный вариант IL-10 (SEQ ID NO: 56) был соединен с C-концом NTIG через линкерный пептид (SEQ ID NO: 26), и такой слитый белок был назван "PG-088m". Аналогично Примеру 2-1, полинуклеотид, кодирующий PG-088m, был получен и встроен в вектор экспрессии pBispec для продукции белка при использовании системы ExpiCHO, а затем проверяли конечную чистоту (ФИГ. 17a и 17b). Мономерный вариант IL-10 (IL-10Vm) получали путем введения мутации для селективного ингибирования иммунностимулирующей активности белка IL-10, который обладает как иммунностимулирующей активностью, так и иммуносупрессорной активностью, и представляет собой мономерный вариантный белок, продуцируемый в мономерной форме, путем вставки линкера GGSGGSGGS (SEQ ID NO: 46) в середине процесса продукции белка для решения проблемы образования агрегатов из-за самодимеризации в процессе.
[00130] Пример 3: Получение генетической конструкции биспецифичного слитого белка
[00131] 3-1: Получение anti-PD-L1-NTIG-IL-2
[00132] Полинуклеотид, кодирующий каждый из слитого белка (anti-PD-L1-NTIG-IL-2), в котором scFv, специфичный к PD-L1, был соединен с N-концом NTIG (SEQ ID NO: 7), а IL-2 был соединен с C-концом, и слитого белка (anti-PD-L1-модифицированного IgG4 Fc-IL-2) с использованием модифицированного белка Fc-домена IgG4 SEQ ID NO: 2 вместо NTIG, был встроен в вектор экспрессии pBispec, и каждый белок продуцировали при использовании системы ExpiCHO.
[00133] 3-2: Конструирование и получение FcεRIα-NTIG-IL-10V
[00134] Авторы настоящего изобретения сконструировали биспецифичный слитый белок (FcεRIα-NTIG-IL-10V, SEQ ID NO: 59), в котором внеклеточный домен (SEQ ID NO: 58) FcεRIα, который представляет собой рецептор, специфично связывающийся с IgE, был соединен с N-концом NTIG-IL-10V, сконструированного в Примере 2-3, через линкерный пептид (SEQ ID NO: 18), такой биспецифичный слитый белок был назван "PG-075", и полинуклеотид, кодирующий слитый белок, был получен и встроен в вектор экспрессии pBispec. Конструкция PG-075 также была сконструирована так, чтобы сигнальная последовательность tPA (SEQ ID NO: 51) была расположена на N-конце для секреции, получена при использовании системы ExpiCHO и подвергнута ДСН-ПААГЭ и вестерн-блоттингу (ФИГ. 18a и 18b).
[00135] 3-3: Конструирование и получение FcεRIα-NTIG-IL-10Vm
[00136] Авторы настоящего изобретения сконструировали биспецифичный слитый белок (FcεRIα-NTIG-IL-10Vm, SEQ ID NO: 60), в котором внеклеточный домен (SEQ ID NO: 58) FcεRIα, который представляет собой рецептор, специфично связывающийся с IgE, был соединен с N-концом NTIG-IL-10Vm, сконструированного в Примере 2-4, через линкерный пептид (SEQ ID NO: 18), биспецифичный слитый белок был назван "PG-110", и полинуклеотид, кодирующий слитый белок, был получен и встроен в вектор экспрессии pAD15. Конструкция PG-110 также была сконструирована так, чтобы сигнальная последовательность tPA (SEQ ID NO: 51) была расположена на N-конце для секреции. Ген, встроенный в вектор экспрессии pAD15, трансфицировали в клетку CHO DG44, затем подвергали амплификации метотрексатом (MTX) и подвергали отбору одиночных клонов с получением высокоэффективной экспрессирующей клеточной линии, и затем белок PG-110 продуцировали и очищали из высокоэффективной экспрессирующей клеточной линии (ФИГ. 19a и 19b).
[00137] Пример 4: Получение гибридного антитела против CD40L
[00138] 4-1: Получение химерного антитела против CD40L
[00139] Авторы настоящего изобретения получили антитело против CD40L, полученное путем введения ингибирующего связывание FcγRIIα варианта в домены CH2 и CH3 тяжелой цепи антитела (C10), в котором Fc-область мышиного антитела против CD40L (против CD154), описанного в WO2016/182335A1, была заменена Fc-областью IgG1 человека, и такое антитело против CD40L было названо "C10M".
[00140] 4-2: Получение химерного гибридного антитела против CD40L-NTIG
[00141] Авторы настоящего изобретения сконструировали гибридный белок тяжелой цепи, в котором фрагмент тяжелой цепи в Fab-фрагменте антитела C10M соединен с N-концом, не связывает с FcγR, белка NTIG, полученного в Примере 1, и гибридный белок тяжелой цепи был назван "PG-129".
[00142] Полинуклеотид, кодирующий гибридную тяжелую цепь гибридного белка тяжелой цепи, в котором фрагмент тяжелой цепи (VH-CH1, SEQ ID NO: 61) в Fab антитела C10M соединен с NTIG (SEQ ID NO: 7), был получен и встроен в вектор экспрессии pAD15 (WO2015/009052A). Кроме того, полинуклеотид, кодирующий легкий тяжелый фрагмент (VL-CL, SEQ ID NO: 62) в Fab антитела C10M, был встроен в вектор экспрессии pAD15 так, чтобы полинуклеотид находился под контролем двойного промотора. Затем вектор котрансфицировали в клетку CHO DG44 (предоставленную д-ром Chasin, Columbia University, USA) при использовании системы трансфекции Neon.
[00143] Вектор экспрессии, полученный, как описано выше, также транзиентно экспрессировали при использовании набора ExpiCHO производства Thermo Fisher Scientific Solutions LLC. В частности, векторную конструкцию, полученную, как описано выше, и реагент ExpiFectamine, содержащийся в наборе, смешивали в клетке ExpiCHO-S и культивировали в течение 1 дня в термостате при условиях 8% CO2 и 37°C, затем температуру снижали до 32°C и проводили культивирование до 7-го дня.
[00144] Затем проводили захват и очистку белка A, проверяли, был ли кандидатный материал очищен, с помощью анализа методом электрофореза в ПААГ и вестерн-блоттинга в невосстанавливающих и восстанавливающих условиях, и изготавливали состав с буферным раствором в соответствии со значением pI кандидатного материала. Изготовленный состав материала определяли количественно при использовании NanoDrop, и клонечную чистоту проверяли с помощью эВЭЖХ.
[00145] В результате, как показано на ФИГ. 20a и 20b, легкая цепь и тяжелая цепь нормально экспрессировались, в невосстанавливающих условиях появлялась одиночная полоса, и, таким образом, можно было обнаружить, что образовался нормальный гетеротетрамер. Кроме того, в результате анализа ЭВЭЖХ, чистота составила 97,9%, что очень высоко.
[00146] 4-3: Получение гуманизированного NTIG-гибридного антитела против CD40L
[00147] Химерные антитела имеют значительно меньше недостатков по сравнению с обычными человеческими антителами благодаря внедрению технологии NTIG (вариантного белка Fc-домена иммуноглобулина) согласно настоящему изобретению, однако авторы настоящего изобретения определили, что антигенсвязывающий участок по-прежнему происходил из мышиного антитела, и, таким образом, в организме человека могут возникать нежелательные иммунные ответы, и для получения более безопасного гибридного антитела сконструировали гуманизированное антитело (Fab-NTIG против CD40L), в котором каркасная часть, за исключением антигенной детерминанты Fab-фрагмента, который представляет собой антигенсвязывающий фрагмент антитела, который является основой согласно настоящему изобретению, была заменена последовательностью человеческого антитела (Таблицы 1 и 2), и такое гуманизированное антитело было названо "PG-400".
[00148] Кроме того, авторы настоящего изобретения разработали получение биспецифичного гибридного антитела (Fab-NTIG-IL-10Vm против CD40L), в котором мономерный вариантный белок IL-10 (SEQ ID NO: 56), который представляет собой цитокин, обладающий иммуносупрессорной активностью, был соединен с C-концом тяжелой цепи гибридного антитела (Таблица 3), и такое биспецифичное гибридное антитело было названо "PG-410". Структура легкой цепи биспецифичного гибридного антитела является таким, как показано в Таблице 2.
[00149] [Таблица 1] Конфигурация тяжелой цепи гуманизированного NTIG-гибридного антитела против CD40L
[00150] [Таблица 2] Конфигурация легкой цепи гуманизированного NTIG-гибридного антитела против CD40L
[00151] [Таблица 3] Конфигурация тяжелой цепи биспецифичного NTIG-гибридного антитела против CD40L
[00152] Для получения гуманизированных гибридных антител против CD40L (PG-400 и PG-410) получали полинуклеотид, кодирующий каждую из тяжелой цепи и легкой цепи антитела, а затем для транзиентной экспрессии в клетке животного плазмидную ДНК трансфицировали в клетку HEK293F при использовании векторной системы N293F (Y-BIOLOGICS). Для получения нуклеиновой кислоты добавляли 25 мкг плазмидной ДНК и смешивали с 3 мл среды, а затем добавляли 25 мкл 2 мг/мл полиэтиленимина (PEI, PolyPlus, USA) с последующим перемешиванием. Реакционный раствор оставляли при комнатной температуре на 15 минут, а затем помещали в 40 мл культурального раствора, культивированного до 1×106 клеток/мл, и культивировали в течение 24 часов при 120 об/мин, 37°C и 8% CO2. Через 24 часа после трансфекции ДНК добавляли питательный компонент среды (Soytone, BD, USA) до конечной концентрации 10 г/л. После культивирования в течение 7 дней раствор клеточной культуры центрифугировали при 5000 об/мин в течение 10 минут для сбора супернатанта.
[00153] Затем колонку, заполненную смолой с белком A, промывали 1×DPBS, собранный супернатант объединяли со смолой при 4°C со скоростью 0,5 мл/мин и элюировали белок 0,1 М глицином. Для замены буферного раствора элюированный раствор помещали в диализную трубку (трубка GeBAflex, Geba, Israel) и подвергали диализу при 4°C в 1×DPBS. Полученную субстанцию подвергали гель-фильтрации при использовании смолы Superdex 200, а затем приготавливали состав с буферным раствором PBS (pH 7,4).
[00154] Выход и чистоту очищенного гибридного антитела гибридного антитела исследовали с помощью анализа методом электрофореза в ДСН-ПААГ, эксклюзионной FPLC и эксклюзионной ВЭЖХ.
[00155] В результате, как показано на ФИГ. 21a, 21b, 22a и 22b, можно было обнаружить, что PG-400 и PG-410, в которых были применены гуманизированные гибридные антитела против CD40L согласно настоящему изобретению, были получены с высокой чистотой.
[00156] 4-4: Конструкция слитого белка scFv-NTIG-IL-10 против CD40L
[00157] Авторы настоящего изобретения подобрали фрагмент вариабельной области в Fab-фрагменте гуманизированного антитела против CD40L, сконструировали scFv с использованием подобранного фрагмента вариабельной области, сконструировали слитый белок на основе одноцепочечного связывающего фрагмента антитела путем вставки scFv вместо фрагмента VH-CH1 конструкции тяжелой цепи антитела против CD40L, используемого в Примере 4-3, и сконструировали биспецифичный слитый белок, в котором мономерный вариант IL-10 (SEQ ID NO: 56), используемый в Примере 4-3, был соединен с С-концом scFv-NTIG против CD40L через линкерный пептид (SEQ ID NO: 26) (таблица 4). В данном Примере, scFv против CD40L состоит из вариабельной области легкой цепи (VL), линкера, вариабельной области тяжелой цепи (VH) в таком порядке, и наоборот, scFv против CD40L, который состоит из VH, линкера и VL в таком порядке, может использоваться, поскольку способность связывания CD40L сохраняется даже в случае использования последнего scFv против CD40L, а также, в отношении типа линкера, могут использоваться разные типы.
[00158] [Таблица 4] Конфигурация слитого белка scFv-NTIG-IL-10 против CD40L
[00159] Пример 5: Получение гетеродимера
[00160] Авторы настоящего изобретения сконструировали биспецифичные слитые белки, содержащие аналог GLP-1 и аналог GLP-2, как показано в Таблице 5. В эти биспецифичные слитые белки введена структура выступов во впадины (KIH) для формирования гетеродимера посредством межмолекулярной дисульфидной связи и гидрофобного взаимодействия между первым слитым белком и вторым слитым белком.
[00161] Различие между Примерами 5-1 и 5-2 заключается в том, включен ли сайт присоединения N-связанной сахаридной цепи, чтобы N-гликановая сахаридная цепь могла быть связана с линкером, соединяющим аналог GLP-1 первого слитого белка с NTIG. Это обусловлено тем, что GLP-1, как и Эксендин-4 (Ex4), оксинтомодулин (OXM) и GLP-2 связываются с GLP-1R, который является рецептором GLP-1, тогда как GLP-2 связывается только с GLP-2R, при этом GLP-1R экспрессируется в различных органах, таких как головной мозг, сердце, печень, мышцы и поджелудочная железа, в дополнение к желудочно-кишечному тракту (ЖКТ), и поэтому необходимо снизить аффинность к GLP-1R, чтобы GLP-1 мог специфически функционировать в желудочно-кишечном тракте. По этой причине, чтобы несколько снизить силу связывания аналога GLP-1 с GLP-1R, авторы настоящего изобретения использовали белок, к которому был добавлен домен присоединения гликана, чтобы гликан можно было присоединить к линкерному фрагменту (включающему гибридный шарнир IgD/IgG1) аналога GLP-1 (Пример 5-1).
[00162] [Таблица 5] Конструкция слитого белка для формирования гетеродимера GLP-1/GLP-2 согласно одному примеру осуществления настоящего изобретения
(SEQ ID NO:)
[00163] Векторные конструкции, полученные, как описано выше, транзиентно экспрессировали при использовании набора ExpiCHO производства Thermo Fisher Scientific Solutions LLC. В частности, векторные конструкции, полученные, как описано выше, и реагент ExpiFectamine, содержащийся в наборе, смешивали в клетке ExpiCHO-S, полученные клетки культивировали в течение 1 дня в термостате при условиях 8% CO2 и 37°C, затем температуру снижали до 32°C и проводили культивирование до 7-го дня.
[00164] Супернатант, полученный в результате культивирования, и гетеродимерные белки (названные 'MG12-4' и 'MG12-5' соответственно) Примеров 5-1 и 5-2, очищенные через колонку с белком A и вторичную колонку, надлежащим образом разбавляли 4× LDS буферным раствором для образцов и водой для инъекций с приготовлением образца так, чтобы конечная концентрация составляла от 3 до 10 мкг/20 мкл. В случае образца в восстанавливающих условиях, каждое исследуемое вещество, 4× LDS буферный раствор для образцов, 10× восстановитель и воду для инъекций надлежащим образом разбавляли с приготовлением образца таким образом, чтобы конечная концентрация составляла от 3 до 10 мкг/20 мкл, и образец нагревали в термостате при 70°C в течение 10 минут. Подготовленный образец наносили в количестве по 20 мкл в каждую лунку геля, зафиксированного в предварительно установленном аппарате для электрофореза. Для маркера размера образец наносили в количестве от 3 до 5 мкл/лунка. После установки источника питания на 120В и 90 минут проводили электрофорез. Гель, подвергнутый электрофорезу, отделяли, а затем окрашивали при использовании окрашивающего раствора и отмывающего раствора, и анализировали результаты. В результате, как показано на ФИГ. 23, можно было подтвердить, что гетеродимер согласно одному примеру осуществления настоящего изобретения был нормально продуцирован.
[00165] Пример 6: Анализ влияния шарнира при продукции слитого белка
[00166] Авторы настоящего изобретения провели исследования, как эффективность продукции белка изменяется в зависимости от типа шарнирной области, когда АФИ соединяют с N-концом белка NTIG при соединении различных типов АФИ с N-концом и/или C-концом белка NTIG настоящего изобретения.
[00167] 6-1: Получение FcεRIα-NTIG-IL-13α2
[00168] Авторы настоящего изобретения сконструировали биспецифичный слитый белок (FcεRIα-NTIG-IL-13Rα2), в котором FcεRIα (SEQ ID NO: 58) был соединен с N-концом NTIG (SEQ ID NO: 7), а IL-13Rα2 (SEQ ID NO: 74) был соединен с С-концом, и такой биспецифичный слитый белок был назван "PG-50". При продукции PG-50 шарнирную область, соединяющую FcεRIα с NTIG, исследовали на продуктивность белка при использовании шарнира IgD (SEQ ID NO: 15) или комбинации линкера (G4S) 3 и шарнира IgG1 (SEQ ID NO: 16). Таким образом, слитый белок, в котором использовался шарнир IgD, был назван "PG-50-1", а слитый белок, в котором использовался линкер (G4S)3/шарнир IgG1, был назван "PG-50-2". В случае шарнирной области IgD, образовывалась одна межмолекулярная дисульфидная связь, а в случае линкера (G4S)3/шарнира IgG1 образовывались две межмолекулярные дисульфидные связи.
[00169] В результате, как показано на ФИГ. 24a и 24b, было обнаружено, что выход продукции целевого материала слитого белка (PG-50-2), содержащего шарнир IgG1, была увеличен приблизительно на 15% по сравнению с PG-50-1, содержащим шарнир IgD.
[00170] 6-2: Получение GLP-2-2G-NTIG-IL-10wt
[00171] Авторы настоящего изобретения проанализировали влияние различных типов шарнирных областей на выход продукции белка при использовании различных типов АФИ. Для анализа, в частности, была получена конструкция, в которой GLP-2-2G (SEQ ID NO: 52) был соединен с N-концом NTIG (SEQ ID NO: 7), и IL-10wt (SEQ ID NO: 75) был соединен с C-концом NTIG. В данном случае биспецифичный слитый белок (GLP-2-2G-NTIG-IL-10wt) был сконструирован путем соединения GLP-2-2G с NTIG при использовании линкера (G4S)3+гибридного шарнира IgD/IgG1 (SEQ ID NO: 14), и соединения IL-10wt с С-концом NTIG при использовании линкерного пептида, который состоит из аминокислотной последовательности, представленной в SEQ ID NO: 26, и был назван "PG-073". Полинуклеотид, кодирующий слитый белок, сконструированный, как указано выше, был получен и затем встроен в вектор экспрессии pBispec, слитый белок экспрессировали при использовании системы ExpiCHO в соответствии со способом, использованным в Примере 2-1, а затем уровень экспрессии белка в культуральном супернатанте проверяли с помощью ДСН-ПААГЭ. Гибридный шарнир IgD/IgG1 образует две межмолекулярные дисульфидные связи.
[00172] В результате, как показано на ФИГ. 24c, в случае PG-073 размер основной полосы составлял 110 кДа в невосстанавливающих условиях, и было подтверждено образование биспецифичного слитого белка, с которым были соединены GLP-2-2G и IL-10. Однако полоса, в которой были отщеплены один или оба GLP-2, была обнаружена ниже основной полосы. Таким образом, линкер (G4S)3+гибридный шарнирный линкер IgD/IgG1, используемый между GLP-2 и NTIG, оказался в некоторой степени нестабильным. Более того, количество слитого белка, полученного на 100 мл культурального раствора, составило всего 0,5 мг (PG-073), и, таким образом, продуктивность белка была снижена, а чистота также составляла приблизительно 66%, что является низким показателем.
[00173] 6-3 и 6-4: Получение GLP-2-2G (3 точки)-NTIG-IL-10Vm
[00174] Таким образом, авторы настоящего изобретения сконструировали слитые белки (GLP-2V (3 точки)-NTIG-IL-10Vm), в которых в слитом белке GLP-2-2G-NTIG-IL-10wt, GLP-2-2G был заменен на мутантный белок (SEQ ID NO: 76), содержащий 3 точечных мутации, шарнирная часть была заменена другим типом линкера или шарнира (каждый SEQ ID NO: 17 или 18), и IL-10wt был заменен на IL-10Vm, полученный в Примере 2-4, и слитые белки были названы "PG210-5 (Пример 6-3)" и "PG210-6 (Пример 6-4), соответственно.
[00175] После встраивания полинуклеотида, кодирующего каждый из гибридных белков, в вектор экспрессии pBispec, гибридный белок экспрессировали при использовании системы ExpiCHO в соответствии со способом, использованным в Примере 2-1, а затем уровень экспрессии белка в культуральном супернатанте проверяли с помощью ДСН-ПААГЭ.
[00176] В результате, как показано на ФИГ. 24d и 24e, в случае PG-210-5, 3,48 мг белка были обнаружены в 200 мл культурального раствора, при этом чистота, как установили, составила приблизительно 88,3%, и в случае PG-210-6, были обнаружены 5 мг белка, а чистота, как установили, составила 90,7%.
[00177] Экспериментальный Пример 1: Анализ FcRn-связывающей аффинности
[00178] Авторы настоящего изобретения сравнили аффинность связывания белка NTIG настоящего изобретения с FcRn относительно Fc IgG4 и антител IgG1.
[00179] Для сравнения, в частности, рекомбинантный FcRn (rhFcRn, R&D systems, USA), который представляет собой лиганд, растворяли в ацетатном буфере при концентрации 5 мкг/мл, а затем фиксировали на чипе биосенсора (сенсорный чип CM5 серии S, GE Healthcare, USA) при использовании связывания через аминогруппы.
[00180] Затем, чтобы сравнить аффинность связывания NTIG согласно настоящему изобретению с FcRn и аффинность связывания Fc IgG4 с FcRn, авторы настоящего изобретения с помощью поверхностного плазмонного резонанса (ППР) исследовали аффинность связывания, с FcRn, PG-11, полученного в Примере 2-1, и дулаглутида (торговое наименование Трулисити), который представляет собой слитый белок, в котором коммерческий GLP-1 соединен с Fc-фрагментом IgG4. В качестве анализатора использовали Biocore 8K (GE Healthcare, USA), и все реагенты, использованные в анализе, были приобретены в GE Healthcare. PG-11 и Трулисити растворяли в рабочем буферном растворе (PBST, pH 6,0), затем последовательно приготавливали разведение от 1000 нМ на 1/2 и проводили многоцикловый кинетический анализ. Эксперимент проводили при скорости потока 30 мкл/мин при 25°C, ассоциацию аналита проводили в течение 60 секунд, а затем проводили диссоциацию в течение 60 секунд. По результатам эксперимента была выбрана оптимальная концентрация антител (Трулисити: 8000 нМ и PG-11: 2000 нМ), проведен многоцикловый кинетический анализ и измерена равновесная константа диссоциации (KD) при использовании программы Biacore Insight (GE Healthcare, USA). В это время буферный раствор заменяли буферным раствором PBS, имеющим pH 7,4, во время регенерации.
[00181] Как показано в Таблице 6 и на ФИГ. 25 и 26, в результате сравнительного анализа равновесной аффинности KD значение KD Трулисити составило 2090 нМ, и значение KD PG-11 составило 199 нМ, и результат показывает, что аффинность PG-11 согласно одному примеру осуществления настоящего изобретения в отношении FcRn приблизительно 5,3 раз выше, чем у Трулисити. Аффинность связывания с FcRn, как известно, связана с фармакокинетикой слитого белка Fc, и, соответственно, полупериод существования PG-11 in vivo, как ожидают, будет более длительным по сравнению с Трулисити (Mackness et al., MAbs. 11(7):1276-1288, 2019).
[00182] [Таблица 6] Результаты анализа аффинности PG-11 и Трулисити с FcRn
[00183] Кроме того, для сравнения аффинности связывания NTIG согласно настоящему изобретению с FcRn и аффинности связывания Fc IgG4 с FcRn авторы настоящего изобретения с помощью поверхностного плазмонного резонанса (ППР) исследовали аффинность связывания, с FcRn, PG-11 и ритуксимаба, который представляет собой коммерческое рекомбинантное химерное антитело против CD20 семейства IgG1. PG-11 и ритуксимаб растворяли в рабочем буферном растворе PBST (pH 6,0) в разных концентрациях (от 2000 нМ до 1,96 нМ для PG-11 и от 4000 нМ до 3,9 нМ для ритуксимаба), а затем, аналогично сравнительному анализу PG-11 и Трулисити, ассоциацию, диссоциацию и регенерацию проводили в условиях 60 секунд на ассоциацию, 60 секунд на диссоциацию и 30 секунд на регенерацию. Во время регенерации использовали буферный раствор PBS, имеющий pH 7,4.
[00184] Как показано в Таблице 7 и на ФИГ. 27, в результате сравнительного анализа равновесного аффинности KD, значение KD Ритуксимаба составляло 2390 нМ, и значение KD PG-11 составляло 256 нМ, и результат показывает, что аффинность PG-11 согласно одному примеру осуществления настоящего изобретения в отношении FcRn приблизительно в 9,3 раз выше, чем у Ритуксимаба.
[00185] [Таблица 7] Результаты анализа аффинности PG-11 и Ритуксимаба с FcRn
[00186] Как описано выше, NTIG согласно одному примеру осуществления настоящего изобретения имеет высокую аффинность с FcRn по сравнению с Fc-областью обычного IgG1 или IgG4, и, таким образом, при введении NTIG in vivo, полупериод существования, как ожидают, будет значительно увеличен.
[00187] Затем авторы настоящего изобретения решили сравнить аффинность модифицированного белка Fc-домена IgG4 SEQ ID NO: 2 с FcRn, на основе NTIG (SEQ ID NO: 7) согласно одному примеру осуществления настоящего изобретения.
[00188] Для сравнения, вместо вычисления простого значения KD, авторы настоящего изобретения вычисляли равновесную аффинность (KD) путем связывания белков при pH 6,0 и выполнения диссоциации при pH 7,3 (Piche-Nicholas et al., MAbs. 10(1):81-94, 2018). В частности, для аффинности связывания NTIG-IL-2 против PD-L1 и модифицированного Fc IgG4-IL-2 против PD-L1, полученного в Примере 3-1, с rhFcRn, проводили анализ ППР путем изменения условий pH при ассоциации и диссоциации, как описано выше.
[00189] В результате, как показано в Таблице 8 и на ФИГ. 28, можно было обнаружить, что аффинность, с FcRn, NTIG-IL-2 против PD-L1, в которому был применен NTIG, была выше, чем у модифицированного Fc IgG4-IL-2 против PD-L1 с использованием модифицированного Fc IgG4. Однако в процессе замены раствора связывающего буфера в образце модифицированного белка Fc IgG4-IL-2 против PD-L1 образовывалось большое количество белковых агрегатов, и, таким образом, была проблема, связанная с низкой надежностью результатов. Поэтому тот же эксперимент проводили снова путем замены тестируемого материала на лиганд и FcRn на образец.
[00190] Эти результаты указывают, что применение NTIG демонстрирует эффект увеличения полупериода существования in vivo посредством улучшения FcRn-связывающей силы полученного белка, а также превосходное влияние на физические свойства и стабильность белка, по сравнению с ранее известным применением модифицированного Fc IgG4 SEQ ID NO:2.
[00191] [Таблица 8] Результаты анализа аффинности NTIG и модифицированного Fc IgG4 в отношении FcRn
(1/с)
KD (M)
[00192] В качестве буферного раствора, используемого для анализа, использовали рабочий буферный раствор (1× PBST, pH 7,3), буферный раствор для разведения образцов (1× PBST, pH 6,0), буферный раствор для диссоциации (1× PBST, pH 7,3) и буферный раствор для регенерации (1× PBS, pH 8,0).
[00193] В результате анализа, как показано в Таблице 9 и на ФИГ. 29, было обнаружено, что оба белка демонстрируют профили быстрой ассоциации и быстрой диссоциации, оба белка демонстрируют тенденцию к хорошей диссоциации после связывания с FcRn в нейтральных условиях (pH 7,3), однако при pH 6,0 аффинность белка NTIG-IL-2 против PD-L1 была в 5,06 раза выше, чем у белка Fc-IL-2, модифицированного IgG4 против PD-L1. Следовательно, белок NTIG-IL-2 против PD-L1 демонстрировал тенденцию к быстрому связыванию даже при более низкой концентрации FcRn в условиях pH 6,0 по сравнению с, модифицированным белком Fc IgG4-IL-2 против PD-L1. Учитывая, что Fc-содержащий белок, абсорбированный в клетку в результате эндоцитоза, связывается с FcRn в условиях низкого pH эндосомы, результаты убедительно указывают на то, что слитый белок, содержащий NTIG, будет более эффективно реутилизироваться FcRn-рецептором.
[00194] [Таблица 9] Результаты анализа аффинности NTIG и модифицированного Fc IgG4 в отношении FcRn (переключение между лигандом и аналитом)
[00195] Экспериментальный Пример 2: Анализ аффинности связывания с различными Fcγ-рецепторами
[00196] Как известно, Fc-область IgG1 обладает аффинностью связывания с FcγRI и FcγRIIIa. Эти Fc-рецепторы ассоциированы с эффекторными функциями, такими как ADCC и CDC, полезны при противоопухолевой терапии в случае применения антител или Fc-слитых белков для противоопухолевой терапии, но имеют недостатки, связанные с побочными эффектами, возникающими при использовании АФИ с целью лечения других заболеваний кроме противоопухолевой терапии.
[00197] Таким образом, авторы настоящего изобретения проанализировали степень аффинности слитого белка NTIG согласно одному примеру осуществления настоящего изобретения в отношении FcγRI и FcγRIIIa по сравнению с IgG1 антителом посредством анализа методом интерферометрии биослоя (BLI).
[00198] В результате, как показано на ФИГ. 30, было обнаружено, что Ритуксимаб, который представляет собой антитело на основе IgG1, специфично связывался с FcγRI и FcγRIIIa, тогда как PG-11, который является NTIG-содержащим слитым белком согласно одному примеру осуществления настоящего изобретения, не демонстрировал специфичного связывания с этими рецепторами антител.
[00199] Кроме того, авторы настоящего изобретения провели сравнительный анализ аффинности связывания Ритуксимаба и PG-11 согласно одному примеру осуществления настоящего изобретения с FcγRIIa, FcγRIIb и FcγRIIIb.
[00200] В результате, как показано на ФИГ. 31, было установлено, что Ритуксимаб специфично связывался с тремя Fc-рецепторами. Между тем, PG-11 согласно одному примеру осуществления настоящего изобретения показал слабое связывание, однако с учетом формы сенсограммы, связывание считается неспецифичным связыванием.
[00201] Экспериментальный Пример 3: Анализ связывания с C1q комплемента
[00202] Fc-область антитела может индуцировать комплементзависимую цитотоксичность (CDC) при связывании с фактором C1q комплемента и, таким образом, может вызывать серьезную проблему при клиническом применении Fc-слитого белка для лечения общих заболеваний, отличных от лечения рака. Таким образом, степень аффинности связывания NTIG-содержащего слитого белка в соответствии с одним примером осуществления настоящего изобретения с фактором C1q комплемента анализировали по сравнению с Ритуксимабом, который представляет собой антитело на основе IgG1.
[00203] Для сравнения, в частности, PG-11 и ритуксимаб разбавляли буферным раствором для покрытия (0,1 М Na2HPO4, pH 9,6) так, чтобы каждая концентрация составила 2 мкг/мл. Затем в каждую лунку наносили по 100 мкл каждого разбавленного образца и оставляли для реакции на ночь при 4°C. Затем проводили промывку три раза, добавляя каждый раз по 300 мкл промывочного буферного раствора в планшет, в каждую лунку добавляли 200 мкл блокирующего буферного раствора (2% BSA/PBS) и оставляли реагировать при комнатной температуре на 2 часа. В планшет добавляли 300 мкл промывочного буферного раствора, затем повторно проводили промывку три раза, антитело против C1q разводили буферным раствором для анализа до 10, 3, 1, 0,3 и 0,1 мкг/мл на 1/3 и смешивали (дублирование) в количестве 50 мкл в каждой лунке, а затем оставляли реагировать при комнатной температуре в течение 2 часов. Затем промывочный буферный раствор смешивали в планшете каждый раз по 300 мкл и повторно производили промывку восемь раз. Конъюгат C1q-HRP разводили в 400 раз и по 50 мкл полученного раствора добавляли в каждую лунку и оставляли реагировать при комнатной температуре в течение 1 часа. Промывочный буферный раствор добавляли в планшет по 300 мкл каждый раз, промывку повторяли восемь раз, смешивали 50 мкл TMB в качестве субстрата и оставляли реагировать полученный раствор при комнатной температуре. При проявлении цветной реакции в виде синего окрашивания, в каждую лунку добавляли 50 мкл останавливающего раствора для остановки реакции, а затем измеряли оптическую плотность с помощью микропланшетного анализатора, установленного на 450 нм.
[00204] В результате анализа, как показано на ФИГ. 32, было обнаружено, что Ритуксимаб связывался с C1q зависимым от концентрации образом, тогда как PG-11 согласно одному примеру осуществления настоящего изобретения не связывался с C1q.
[00205] Поэтому было подтверждено, что NTIG согласно одному примеру осуществления настоящего изобретения является безопасным белковым носителем, способным свести к минимуму побочные эффекты, связанные с Fc-областью, такие как ADCC или CDC, при увеличении полупериода существования АФИ.
[00206] Экспериментальный Пример 4: Анализ активности GLP-2
[00207] Проявление активности GLP-2 надлежащим образом в сравнении с различными слитыми белками, содержащими GLP-2, из Примеров, описанных выше, исследовали с помощью анализа cAMP HunterTM eXpress GPCR (Таблица 10).
[00208] [Таблица 10] Конструкции, используемые для анализа активности GLP-2
[00209] В результате анализа, как показано на ФИГ. 33 и в Таблице 11, было обнаружено, что PG-210-6 из слитых белков, полученных в соответствии с одним Примером настоящего изобретения, демонстрировал активность GLP-2, практически аналогичную активности PG-22 в качестве Сравнительного примера, и PG-210-5 из другого Примера настоящего изобретения демонстрировал активность, которая составляла примерно половину активности PG-210-6. Было обнаружено, что MG12-4 и MG12-5, которые являются гетеродимерами, также проявляют активность GLP-2, которая составляет лишь приблизительно половину активности GLP-2 по сравнению с PG-22, но поскольку MG12-4 и MG12-5 содержали по одному GLP-2, то в случае MG12-4 и MG12-5 можно предполагать снижение активности на 50% по сравнению с PG-22, в котором связаны две молекулы GLP-2. PG-210-5 был белком, в котором был применен линкерный пептид, использованный в предшествующей патентной литературе (US7,812,121B2), при этом было обнаружено, что активность PG-210-6, в котором использовался смешанный линкерный пептид (G4S)3+шарнир IgG1, используемый в настоящем изобретении, была превосходной.
[00210] [Таблица 11] Результаты анализа активности GLP-2
[00211] Экспериментальный Пример 5: Анализ иммуносупрессорной активности слитого белка IL-10Vm
[00212] 5-1: Анализ аффинности с рецептором IL-10
[00213] Авторы настоящего изобретения проанализировали аффинность слитых белков Примеров 2-3 и 2-4 с рецептором IL-10 1 (IL-10R1) с помощью анализа методом интерферометрии биослоя (BLI).
[00214] Для анализа авторы настоящего изобретения прикрепили белок IL-10R с His-меткой в 96-луночном планшете при использовании набора реагентов Dip and ReadTM Amine Reactive 2nd Generation (AR2G) (forteBio, номер по кат. 18-5092). В частности, 200 мкл дистиллированной воды (D.W.) наносили в 96-луночный планшет и погружали аминореактивный биосенсор, входящий в набор, для проведения гидратации в течение 10 минут. Затем, после дополнительного добавления 200 мкл D.W. в новый 96-луночный планшет, EDC и NHS смешивали в соотношении 1:1 в количестве 1/20 от требуемого количества образца, а затем разбавляли D.W. и 200 мкл полученного раствора наносили в 96-луночные планшеты. Затем белок IL-10R с His-меткой разводили до 10 мкг/мл в 10 мМ ацетатном растворе, имеющем pH 5,0, и затем 200 мкл полученного раствора добавляли в 96-луночные планшеты. После добавления в 96-луночные планшеты 200 мкл 1М этаноламина, планшет с биосенсором и планшет для образцов помещали в систему Octet®-K2 и проводили измерения. После завершения измерения в планшет для образцов добавляли 200 мкл 1× буферного раствора для измерения кинетики, а затем определяли базовые значения. Затем полученный слитый белок NTIG-IL-10 разводили 1× буферным раствором для измерения кинетики в различных концентрациях (0, 62,5, 125, 250, 500 и 1000 нМ), 200 мкл полученного раствора наносили на планшет для образцов, а затем измеряли взаимодействия методом интерферометрии биослоя (BLI) при использовании системы Octet®-K2.
[00215] [Таблица 12]
[00216] В результате, как показано на ФИГ. 34 и в Таблице 12, значение KD слитого белка (NTIG-IL-10Vm) согласно Примеру 2-4 настоящего изобретения составило 29,2 нМ, что было приблизительно в три раза выше значения KD (11,1 нм) димерного слитого белка IL-10 Примера 2-3. Результат можно интерпретировать так, что мономерный вариантный слитый белок IL-10 имеет более низкую аффинность с рецептором, чем димерный белок IL-10, однако можно было предсказать, что аффинность могла быть снижена из-за образования мономера.
[00217] 5-2: Анализ иммуносупрессорной активности слитого белка IL-10Vm
[00218] Авторы настоящего изобретения проанализировали иммуносупрессорные активности in vitro различных слитых белков (PG-088m, PG-110, PG-410 и PG-210-6), содержащих мономерный вариантный белок IL-10 (IL-10Vm) согласно одному примеру осуществления настоящего изобретения.
[00219] Для анализа, в частности, после удаления супернатанта из колбы Т75, содержащей макрофаг Raw264.7 в культуре, производили однократную промывку PBS, затем добавляли 3 мл TrypLETM Select Enzyme и оставляли полученный раствор реагировать при 37°C 3-5 минут. Затем в колбу Т75 добавляли 10 мл свежей среды и переносили суспензию клеток со дна колбы в коническую пробирку объемом 50 мл, после чего центрифугировали при 1500 об/мин в течение 5 минут. Затем супернатант удаляли и осторожно постукивали пальцем по пробирке, чтобы высвободить клетки. Затем смешивали 5 мл свежей среды и подсчитывали клетки. Концентрацию клеток доводили до 1×105 клеток/мл и 100 мкл полученной суспензии переносили в 96-луночный планшет с плоскодонными лунками.
[00220] Затем PG-088m, полученный в Примере 2-4, PG-110, полученный в Примере 3-3, PG-410, полученный в Примере 4-3, и PG-210-6, полученный в Примере 6-4, последовательно разводили в различных концентрациях (PG-210-6 и PG-410 от 0 до 1000 нМ и PG-110 и PG-088m от 0 до 1507 нМ), а затем по 50 мкл каждого белка наносили в 96-луночный планшет, в который добавляли макрофаг Raw264.7. Через 20 минут липополисахарид (ЛПС) обрабатывали порциями по 50 мкл, чтобы конечная концентрация составляла 400 нг/мл, и культивировали полученную суспензию при 36°C в течение 16 часов. На следующий день собирали супернатант, а затем проводили ИФА на ФНО-α (Biolegend, USA) согласно протоколу производителя.
[00221] В результате, как показано на ФИГ. 35a-35c, все слитые белки, содержащие IL-10Vm согласно одному примеру осуществления настоящего изобретения, как было обнаружено, ингибировали секрецию ФНО-α в макрофагах зависимым от концентрации образом. Значимого различия в соответствии с типом слитого белка не обнаружили. Результаты показывают, что мономерный вариантный белок IL-10 (IL-10Vm) согласно одному примеру осуществления настоящего изобретения работает правильно, даже когда мономерный вариантный белок IL-10 соединен с C-концом белка NTIG.
[00222] 5-3: Анализ IgE-связывающей способности
[00223] Авторы настоящего изобретения проанализировали аффинность слитого белка (FcεRIα-NTIG-IL-10Vm), полученного в Примере 3-3, с мышиным IgE и человеческим IgE с помощью анализа методом интерферометрии биослоя (BLI).
[00224] Для анализа авторы настоящего изобретения сначала прикрепили белок FcεRIα-NTIG, не имеющий IL-10Vm, в качестве контрольной группы, и слитый белок, полученный в Примере 3-3, на 96-луночном планшете при использовании набора реагентов Dip and ReadTM Amine Reactive 2nd Generation (AR2G) (forteBio, номер по кат. 18-5092). В частности, 200 мкл D.W. наносили в 96-луночный планшет, а затем погружали аминореактивный биосенсор, входящий в набор, для выполнения гидратации в течение 10 минут. Затем, после дополнительного добавления 200 мкл D.W., EDC и NHS смешивали в соотношении 1:1 в количестве 1/20 от требуемого количества образца, и затем разбавляли D.W. и 200 мкл полученного раствора наносили в 96-луночный планшет. Затем, FcεRIα-модифицированный белок Fc IgG4 и слитый белок FcεRIα-NTIG-IL-10Vm разводили до 10 мкг/мл в 10 мМ ацетатном растворе, имеющем pH 5,0, и затем 200 мкл полученного раствора добавляли в 96-луночный планшет. После добавления 200 мкл 1М этаноламина в 96-луночный планшет, планшет с биосенсором и планшет для образцов помещали в систему Octet®-K2 и измеряли. После завершения измерения в планшет для образцов добавляли 200 мкл 1× буферного раствора для измерения кинетики, а затем определяли базовые значения. Затем мышиный IgE против DNP (Sigma) разбавляли 1× буферным раствором для измерения кинетики в различных концентрациях (от 50 пМ до 3,125 нМ), 200 мкл полученного раствора наносили на планшет для образцов, а затем измеряли взаимодействия методом интерферометрии биослоя (BLI) при использовании системы Octet®-K2.
[00225] [Таблица 13]
[00226] В результате, как показано на ФИГ. 36A и в Таблице 13, значение KD слитого белка (FcεRIα-NTIG-IL-10Vm) согласно одному примеру осуществления настоящего изобретения составило 0,284 нМ, что был немного ниже, чем у FcεRIα-модифицированного Fc IgG4 в качестве контрольной группы. Однако различие не является значимым различием, и, таким образом, было обнаружено, что связывающая способность с IgE не снижалась при добавлении мономерного белка IL-10.
[00227] В дополнение к представленным выше результатам, для измерения степени связывания человеческого FcεRIα и человеческого IgE, используемого в настоящем изобретении, авторы настоящего изобретения проанализировали аффинность слитого белка (PG-110) Примера 3-3 с человеческим IgE с помощью вышеуказанного метода BLI.
[00228] [Таблица 14]
[00229] В результате, как показано на ФИГ. 36B и в Таблице 14, аффинность слитого белка согласно одному примеру осуществления настоящего изобретения с человеческим IgE была также аналогична аффинности с мышиным IgE.
[00230] 5-4: Анализ ингибирующей активности против IgE
[00231] Затем авторы настоящего изобретения провели исследование, проявлял ли слитый белок (FcεRIα-NTIG-IL-10Vm), полученный в Примере 3-3, ингибирующую активность против IgE, в эксперименте in vitro.
[00232] Для исследования, в частности, FcεRIα-модифицированный Fc IgG4 в качестве контрольной группы и слитый белок (PG-110) из Примера 3-3 в качестве экспериментального материала последовательно разводили в различных концентрациях для приготовления образцов, и образцы смешивали с 1 мкл/мл мышиного IgE против DNP и проводили реакцию при комнатной температуре в течение 30 минут. Затем тучные клетки костного мозга, полученные у мыши, промывали буферным раствором HBSS, доводили его до концентрации 5×105 клеток/60 мкл и затем переносили в 96-луночный планшет. По 20 мкл образца, прореагировавшего с IgE, и тестируемое лекарственное средство добавляли к предварительно подготовленным тучным клеткам, и полученную суспензию культивировали в течение 25 минут в термостате при условиях 37°C и 5% CO2. Затем добавляли 20 мкл DNP BSA (500 нг/мл), полученную смесь снова культивировали в течение 30 минут в термостате при условиях 37°C и 5% CO2 и центрифугировали при 4°C и 1500 об/мин, и отбирали 30 мкл супернатанта. 30 мкл отобранного супернатанта и 30 мкл субстрата (4-нитрофенил-N-ацетил-β-глюкозаминида, 5,84 мМ) смешивали и культивировали в течение 25 минут в термостате при условиях 37°C и 5% CO2. Смешивали 400 мкл 0,1М буферного раствора карбоната натрия (pH 10) и останавливали реакцию. После этого относительные количества β-гексоминидазы, секретируемой тучными клетками, сравнивали путем измерения оптической плотности при 405 нм, и проверяли эффект супрессии тучных клеток в зависимости от концентрации каждого лекарственного средства. Анализ проводили независимо три раза и получали среднее значение.
[00233] В результате, как показано на ФИГ. 37 и в Таблице 15, слитый белок PG-110 согласно одному примеру осуществления настоящего изобретения ингибировал активность IgE зависимым от концентрации образом, причем степень такого ингибирования была аналогична FcεRIα-модифицированному Fc IgG4 в качестве контрольной группы, но IC50 слитого белка PG-110 согласно одному примеру осуществления настоящего изобретения была немного ниже, чем у FcεRIα-модифицированного Fc IgG4.
[00234] [Таблица 15]
[00235] Экспериментальный Пример 6: Анализ связывания с CD40L
[00236] Авторы настоящего изобретения исследовали аффинность связывания PG-400 и PG-410, соответственно полученных в Примерах 4-2 и 4-3 настоящего изобретения, с человеческим CD40L посредством анализа BLI.
[00237] Для исследования, в частности, 200 мкл дистиллированной воды добавляли в 96-луночный черный планшет с плоскодонными лунками, кювету биосенсора помещали в черный планшет с водой, а затем погружали аминореактивный биосенсор для проведения гидратации в течение 10 минут. Затем 200 мкл дистиллированной воды добавляли в новый 96-луночный черный планшет для образцов, EDC и NHS смешивали в соотношении 1:1 в количестве 1/20 от требуемого количества, а затем разбавляли дистиллированной водой и 200 мкл полученного раствора добавляли в 96-луночный черный планшет для образцов. Затем человеческий CD40L (Peptrotech, Korea) разводили до 5 мкг/мл в 10 мМ ацетатном растворе (pH 6,0), после чего 200 мкл полученного продукта добавляли в 96-луночный черный планшет для образцов. В планшет добавляли 200 мкл 1М этаноламина, планшет биосенсора и планшет для образцов помещали в систему Octet®-K2 и степень связывания CD40L измеряли на аминореактивном биосенсоре. После завершения измерения 96-луночный черный планшет для образцов извлекали из измерительного прибора, смешивали 200 мкл 1× буферного раствора для измерения кинетики, а затем определяли базовые значения. PG-410 и PG-400, которые являлись аналитами, последовательно разводили 1× буферным раствором для измерения кинетики так, чтобы концентрации составили от 200 до 12,5 нМ, а затем 200 мкл полученного продукта наносили на 96-луночный черный планшет для образцов. Планшет для образцов снова помещали в систему Octet®-K2 и измеряли степень связывания с CD40L с помощью анализа BLI.
[00238] [Таблица 16]
[00239] В результате, как показано на ФИГ. 38 и в Таблице 16, слитый белок (PG-410) согласно одному примеру осуществления настоящего изобретения имел значение Kon с CD40L, которое было в 4,3 раза ниже, чем у PG-400, но имел значение KD порядка фМ или меньше (<1E-12), что указывает на очень высокую аффинность связывания, и, следовательно, было подтверждено, что белки PG-400 и PG-410 могут хорошо связываться с человеческим CD40L. В данном случае было обнаружено, что PG-410, который является слитым белком (NTIG-IL-10Vm против CD40L) согласно одному примеру осуществления настоящего изобретения, связывался с CD40L с очень высокой аффинностью связывания.
[00240] Экспериментальный Пример 7: Фармакокинетический анализ PG-110
[00241] Авторы настоящего изобретения проверили фармакокинетический профиль (ФК) путем сравнения полупериода существования, площади под кривой (AUC), максимальной концентрации в крови (Cmax) и т.п. биспецифичного слитого белка (PG-110), полученного выше, согласно Примеру 3-3.
[00242] В частности, тестируемый слитый белок (PG-110) вводили трем самцам крыс линии Спрег-Доули (SD) в каждой группе подкожным (п/к), внутривенный (в/в), внутрибрюшинным (в/б) и внутримышечным (в/м) путем в дозе 1 мг/кг. Кровь забирали до инъекции и через 0,5, 1, 5, 10, 24, 48, 72, 120, 168, 240 и 336 часов после инъекции, и затем оставляли при комнатной температуре на 30 минут, чтобы вызвать агрегацию. Агрегированную кровь центрифугировали при 3000 об/мин в течение 10 минут, и затем получали сыворотку из каждого образца и хранили в криогенной морозильной камере. Концентрации слитых белков согласно одному примеру осуществления настоящего изобретения в сыворотке анализировали при использовании набора для количественного определения Fc IgG (Bethyl, номер по кат. E80-104, партия E80-104-30), который позволяет специфично обнаруживать Fc среди введенных белков.
[00243] В результате, как показано на ФИГ. 39, было установлено, что физиологически активный белок, с которым был слит NTIG, может сохраняться в организме в течение длительного времени независимо от пути введения.
[00244] Настоящее изобретение было описано со ссылкой на вышеуказанные Примеры и Экспериментальные примеры, однако описание является всего лишь иллюстративным, и специалисты в данной области техники сумеют понять, что на его основе могут быть сделаны различные модификации и другие эквивалентные варианты осуществления. Таким образом, реальный объем технической защиты настоящего изобретения должен определяться технической сущностью прилагаемой формулы изобретения.
[00245] Промышленная применимость
[00246] Белок NTIG согласно одному примеру осуществления настоящего изобретения является партнером по слиянию для различных биологически активных белков и увеличивает терапевтический эффект биологически активного белка за счет эффективного увеличения полупериода существования биологически активного белка, а также обеспечивает более безопасную доставку лекарственного средства за счет минимизации эффекторных функций, таких как ADCC и CDC, которые являются недостатками Fc-слитого белка. Таким образом, белок NTIG согласно одному примеру осуществления настоящего изобретения можно эффективно применять при изготовлении белковых лекарственных средств.
--->
<110> PROGEN CO., LTD.
<120> НОВЫЙ МОДИФИЦИРОВАННЫЙ СЛИТЫЙ БЕЛОК FC-ФРАГМЕНТА
ИММУНОГЛОБУЛИНА И
ЕГО ПРИМЕНЕНИЕ
<130> PT20-5198
<150> US 62/847470
<151> 2019-05-14
<160> 77
<170> KoPatentIn 3.0
<210> 1
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный Fc IgG4 с делецией C-концевого лизина
<400> 1
Ser His Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys Pro Lys
1 5 10 15
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
20 25 30
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
35 40 45
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
50 55 60
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
65 70 75 80
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
85 90 95
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
100 105 110
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
115 120 125
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
130 135 140
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
145 150 155 160
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
165 170 175
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
180 185 190
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
195 200 205
Leu Ser Leu Ser Leu Gly
210
<210> 2
<211> 215
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный Fc IgG4
<400> 2
Ser His Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys Pro Lys
1 5 10 15
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
20 25 30
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
35 40 45
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
50 55 60
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
65 70 75 80
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
85 90 95
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
100 105 110
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
115 120 125
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
130 135 140
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
145 150 155 160
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
165 170 175
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
180 185 190
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
195 200 205
Leu Ser Leu Ser Leu Gly Lys
210 215
<210> 3
<211> 215
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный IgG4 Fc Выступ
<400> 3
Ser His Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys Pro Lys
1 5 10 15
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
20 25 30
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
35 40 45
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
50 55 60
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
65 70 75 80
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
85 90 95
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
100 105 110
Glu Pro Gln Val Tyr Thr Leu Pro Pro Cys Gln Glu Glu Met Thr Lys
115 120 125
Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
130 135 140
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
145 150 155 160
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
165 170 175
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
180 185 190
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
195 200 205
Leu Ser Leu Ser Leu Gly Lys
210 215
<210> 4
<211> 215
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный Fc IgG4 Впадина
<400> 4
Ser His Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys Pro Lys
1 5 10 15
Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
20 25 30
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
35 40 45
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
50 55 60
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
65 70 75 80
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
85 90 95
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
100 105 110
Glu Pro Gln Val Cys Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
115 120 125
Asn Gln Val Ser Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp
130 135 140
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
145 150 155 160
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser
165 170 175
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
180 185 190
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
195 200 205
Leu Ser Leu Ser Leu Gly Lys
210 215
<210> 5
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> NTIG консенсус
<220>
<221> ВАРИАНТ
<222> (18)
<223> аспарагин, лизин или глутамин
<220>
<221> ВАРИАНТ
<222> (196)
<223> аланин, фенилаланин, изолейцин, лейцин, валин, пролин или
триптофан
<400> 5
Ser His Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys Pro Lys
1 5 10 15
Asp Xaa Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
20 25 30
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
35 40 45
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
50 55 60
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
65 70 75 80
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
85 90 95
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
100 105 110
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
115 120 125
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
130 135 140
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
145 150 155 160
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
165 170 175
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
180 185 190
Cys Ser Val Xaa His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
195 200 205
Leu Ser Leu Ser Leu Gly
210
<210> 6
<211> 214
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> NTIG с делецией C-концевого лизина
<400> 6
Ser His Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys Pro Lys
1 5 10 15
Asp Gln Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
20 25 30
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
35 40 45
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
50 55 60
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
65 70 75 80
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
85 90 95
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
100 105 110
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
115 120 125
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
130 135 140
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
145 150 155 160
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
165 170 175
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
180 185 190
Cys Ser Val Leu His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
195 200 205
Leu Ser Leu Ser Leu Gly
210
<210> 7
<211> 215
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> NTIG
<400> 7
Ser His Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys Pro Lys
1 5 10 15
Asp Gln Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
20 25 30
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
35 40 45
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
50 55 60
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
65 70 75 80
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
85 90 95
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
100 105 110
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
115 120 125
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
130 135 140
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
145 150 155 160
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
165 170 175
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
180 185 190
Cys Ser Val Leu His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
195 200 205
Leu Ser Leu Ser Leu Gly Lys
210 215
<210> 8
<211> 215
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> NTIG Выступ
<400> 8
Ser His Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys Pro Lys
1 5 10 15
Asp Gln Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
20 25 30
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
35 40 45
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
50 55 60
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
65 70 75 80
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
85 90 95
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
100 105 110
Glu Pro Gln Val Tyr Thr Leu Pro Pro Cys Gln Glu Glu Met Thr Lys
115 120 125
Asn Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
130 135 140
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
145 150 155 160
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
165 170 175
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
180 185 190
Cys Ser Val Leu His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
195 200 205
Leu Ser Leu Ser Leu Gly Lys
210 215
<210> 9
<211> 215
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> NTIG Впадина
<400> 9
Ser His Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys Pro Lys
1 5 10 15
Asp Gln Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
20 25 30
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
35 40 45
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
50 55 60
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
65 70 75 80
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
85 90 95
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
100 105 110
Glu Pro Gln Val Cys Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
115 120 125
Asn Gln Val Ser Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro Ser Asp
130 135 140
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
145 150 155 160
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Val Ser
165 170 175
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
180 185 190
Cys Ser Val Leu His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
195 200 205
Leu Ser Leu Ser Leu Gly Lys
210 215
<210> 10
<211> 642
<212> ДНК
<213> Искусственная последовательность
<220>
<223> полинуклеотид, кодирующий NTIG с делецией C-концевого лизина
<400> 10
tctcataccc agcctctggg cgtgttcctg tttcctccaa agcctaagga ccagctgatg
60
atctctcgga cccctgaagt gacctgcgtg gtggtggatg tgtctcaaga ggaccccgag
120
gtgcagttca attggtacgt ggacggcgtg gaagtgcaca acgccaagac caagcctaga
180
gaggaacagt tcaactccac ctacagagtg gtgtccgtgc tgaccgtgct gcaccaggat
240
tggctgaacg gcaaagagta caagtgcaag gtgtccaaca agggcctgcc ttccagcatc
300
gaaaagacca tctccaaggc taagggccag cctcgggaac ctcaggttta caccctgcct
360
ccaagccaag aggaaatgac caagaaccag gtgtccctga cctgcctggt caagggcttc
420
tacccttccg atatcgccgt ggaatgggag tccaatggcc agcctgagaa caactacaag
480
acaacccctc ctgtgctgga ctccgacggc tccttttttc tgtactcccg cctgaccgtg
540
gacaagtcca gatggcaaga gggcaacgtg ttctcctgct ctgtgctgca cgaggccctg
600
cacaatcact acacccagaa gtccctgtct ctgtctctgg ga
642
<210> 11
<211> 645
<212> ДНК
<213> Искусственная последовательность
<220>
<223> полинуклеотид, кодирующий NTIG
<400> 11
tctcataccc agcctctggg cgtgttcctg tttcctccaa agcctaagga ccagctgatg
60
atctctcgga cccctgaagt gacctgcgtg gtggtggatg tgtctcaaga ggaccccgag
120
gtgcagttca attggtacgt ggacggcgtg gaagtgcaca acgccaagac caagcctaga
180
gaggaacagt tcaactccac ctacagagtg gtgtccgtgc tgaccgtgct gcaccaggat
240
tggctgaacg gcaaagagta caagtgcaag gtgtccaaca agggcctgcc ttccagcatc
300
gaaaagacca tctccaaggc taagggccag cctcgggaac ctcaggttta caccctgcct
360
ccaagccaag aggaaatgac caagaaccag gtgtccctga cctgcctggt caagggcttc
420
tacccttccg atatcgccgt ggaatgggag tccaatggcc agcctgagaa caactacaag
480
acaacccctc ctgtgctgga ctccgacggc tccttttttc tgtactcccg cctgaccgtg
540
gacaagtcca gatggcaaga gggcaacgtg ttctcctgct ctgtgctgca cgaggccctg
600
cacaatcact acacccagaa gtccctgtct ctgtctctgg gaaag
645
<210> 12
<211> 645
<212> ДНК
<213> Искусственная последовательность
<220>
<223> полинуклеотид, кодирующий NTIG Выступ
<400> 12
tctcacacac agcctctggg cgtgttcctg tttcctccaa agcctaagga ccagctgatg
60
atctctcgga cccctgaagt gacctgcgtg gtggtggatg tgtctcaaga ggaccccgag
120
gtgcagttca attggtacgt ggacggcgtg gaagtgcaca acgccaagac caagcctaga
180
gaggaacagt tcaactccac ctacagagtg gtgtccgtgc tgaccgtgct gcaccaggat
240
tggctgaacg gcaaagagta caagtgcaag gtgtccaaca agggcctgcc tagctccatc
300
gaaaagacca tctccaaggc taagggccag cctcgggaac ctcaggttta caccctgcct
360
ccatgccaag aggaaatgac caagaaccag gtgtccctgt ggtgcctggt caagggcttc
420
tacccttccg acattgccgt ggaatgggag tccaatggcc agcctgagaa caactacaag
480
accacacctc ctgtgctgga ctccgacggc tccttctttc tgtactctcg cctgaccgtg
540
gacaagtcta ggtggcaaga gggcaacgtg ttctcctgct ctgtgctgca cgaggccctg
600
cacaatcact acacccagaa gtccctgtct ctgtccctgg ggaag
645
<210> 13
<211> 645
<212> ДНК
<213> Искусственная последовательность
<220>
<223> полинуклеотид, кодирующий NTIG Впадина
<400> 13
tctcacacac agcccctggg cgtgttcctg tttcctccaa agcctaagga ccagctgatg
60
atctctcgga cccctgaagt gacctgcgtg gtggtggatg tgtctcaaga ggaccccgag
120
gtgcagttca attggtacgt ggacggcgtg gaagtgcaca acgccaagac caagcctaga
180
gaggaacagt tcaactccac ctacagagtg gtgtccgtgc tgaccgtgct gcaccaggat
240
tggctgaacg gcaaagagta caagtgcaag gtgtccaaca agggcctgcc ttccagcatc
300
gaaaagacca tctccaaggc taagggccag cctcgggaac ctcaagtctg taccctgcct
360
cctagccaag aagagatgac caagaaccag gtgtccctgt cttgcgccgt gaagggcttc
420
tacccttccg acattgccgt ggaatgggag tccaatggcc agcctgagaa caactacaag
480
accacacctc ctgtgctgga ctccgacggc tctttctttc tggtgtctcg cctgaccgtg
540
gacaagtcca gatggcaaga gggcaacgtg ttctcctgct ctgtgctgca cgaggccctg
600
cacaatcact acacccagaa gtccctgagc ctgtctctgg gcaag
645
<210> 14
<211> 33
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкерный пептид
<400> 14
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu
1 5 10 15
Lys Glu Lys Glu Glu Gln Glu Glu Arg Thr His Thr Cys Pro Pro Cys
20 25 30
Pro
<210> 15
<211> 30
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкерный пептид
<400> 15
Arg Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Gly Ser Lys Glu Lys
1 5 10 15
Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys Pro
20 25 30
<210> 16
<211> 30
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкерный пептид
<400> 16
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu
1 5 10 15
Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro
20 25 30
<210> 17
<211> 26
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкерный пептид
<400> 17
Gly Ser Gly Gly Gly Ser Gly Thr Leu Val Thr Val Ser Ser Glu Ser
1 5 10 15
Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro
20 25
<210> 18
<211> 30
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкерный пептид
<400> 18
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu
1 5 10 15
Pro Lys Ser Ser Asp Lys Thr His Thr Cys Pro Pro Cys Pro
20 25 30
<210> 19
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкерный пептид
<400> 19
Glu Pro Lys Ser Ser Asp Lys Thr His Thr Cys Pro Pro Cys Pro
1 5 10 15
<210> 20
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкерный пептид
<400> 20
Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro
1 5 10 15
<210> 21
<211> 55
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкерный пептид
<400> 21
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ala
1 5 10 15
Lys Asn Thr Thr Ala Pro Ala Thr Thr Arg Asn Thr Thr Arg Gly Gly
20 25 30
Glu Glu Lys Lys Lys Glu Lys Glu Lys Glu Glu Gln Glu Glu Arg Thr
35 40 45
His Thr Cys Pro Pro Cys Pro
50 55
<210> 22
<211> 46
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкерный пептид
<400> 22
Ala Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys
1 5 10 15
Glu Ala Ala Ala Lys Ala Leu Glu Ala Glu Ala Ala Ala Lys Glu Ala
20 25 30
Ala Ala Lys Glu Ala Ala Ala Lys Glu Ala Ala Ala Lys Ala
35 40 45
<210> 23
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкерный пептид
<400> 23
Gly Gly Gly Gly Ser
1 5
<210> 24
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкерный пептид
<400> 24
Gly Ser Ser Gly Gly Ser
1 5
<210> 25
<211> 25
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкерный пептид
<400> 25
Ser Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Glu Glu Gln Glu Glu Gly Gly Ser
20 25
<210> 26
<211> 20
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкерный пептид
<400> 26
Ala Ala Gly Ser Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser
20
<210> 27
<211> 18
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкерный пептид
<400> 27
Lys Glu Ser Gly Ser Val Ser Ser Glu Gln Leu Ala Gln Phe Arg Ser
1 5 10 15
Leu Asp
<210> 28
<211> 14
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкерный пептид
<400> 28
Glu Gly Lys Ser Ser Gly Ser Gly Ser Glu Ser Lys Ser Thr
1 5 10
<210> 29
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкерный пептид
<400> 29
Gly Ser Ala Gly Ser Ala Ala Gly Ser Gly Glu Phe
1 5 10
<210> 30
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкерный пептид
<400> 30
Glu Ala Ala Ala Lys
1 5
<210> 31
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкерный пептид
<400> 31
Cys Arg Arg Arg Arg Arg Arg Glu Ala Glu Ala Cys
1 5 10
<210> 32
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкерный пептид
<400> 32
Gly Gly Gly Gly Gly Gly Gly Gly
1 5
<210> 33
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкерный пептид
<400> 33
Gly Gly Gly Gly Gly Gly
1 5
<210> 34
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкерный пептид
<400> 34
Pro Ala Pro Ala Pro
1 5
<210> 35
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкерный пептид
<400> 35
Val Ser Gln Thr Ser Lys Leu Thr Arg Ala Glu Thr Val Phe Pro Asp
1 5 10 15
Val
<210> 36
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкерный пептид
<400> 36
Pro Leu Gly Leu Trp Ala
1 5
<210> 37
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкерный пептид
<400> 37
Thr Arg His Arg Gln Pro Arg Gly Trp Glu
1 5 10
<210> 38
<211> 10
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкерный пептид
<400> 38
Ala Gly Asn Arg Val Arg Arg Ser Val Gly
1 5 10
<210> 39
<211> 8
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкерный пептид
<400> 39
Arg Arg Arg Arg Arg Arg Arg Arg
1 5
<210> 40
<211> 31
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкерный пептид
<400> 40
Gly Ser Ser Gly Gly Ser Gly Ser Ser Gly Gly Ser Gly Gly Gly Asp
1 5 10 15
Glu Ala Asp Gly Ser Arg Gly Ser Gln Lys Ala Gly Val Asp Glu
20 25 30
<210> 41
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкерный пептид
<400> 41
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 42
<211> 13
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкерный пептид
<400> 42
Ala Glu Ala Ala Ala Lys Glu Ala Ala Ala Ala Lys Ala
1 5 10
<210> 43
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкерный пептид
<400> 43
Gly Phe Leu Gly
1
<210> 44
<211> 40
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкерный пептид
<400> 44
Ala Lys Ala Thr Thr Ala Pro Ala Thr Thr Arg Asn Thr Gly Arg Gly
1 5 10 15
Gly Glu Glu Lys Lys Lys Glu Lys Glu Lys Glu Glu Gln Glu Glu Arg
20 25 30
Glu Thr Lys Thr Pro Glu Cys Pro
35 40
<210> 45
<211> 5
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкерный пептид
<400> 45
Gly Gly Ser Gly Gly
1 5
<210> 46
<211> 9
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкерный пептид
<400> 46
Gly Gly Ser Gly Gly Ser Gly Gly Ser
1 5
<210> 47
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкерный пептид
<400> 47
Gly Gly Gly Ser Gly Gly
1 5
<210> 48
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкерный пептид
<400> 48
Gly Ser Thr Ser Gly Ser Gly Lys Pro Gly Ser Gly Glu Gly Ser
1 5 10 15
<210> 49
<211> 39
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> гибридный пептид GLP-1/Эксендина
<400> 49
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Gly
1 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Gly Pro Ser
20 25 30
Ser Gly Ala Pro Pro Pro Ser
35
<210> 50
<211> 287
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> GLP-1E-NTIG
<400> 50
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Gly
1 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Gly Pro Ser
20 25 30
Ser Gly Ala Pro Pro Pro Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
35 40 45
Ser Gly Gly Gly Gly Ser Glu Lys Glu Lys Glu Glu Gln Glu Glu Arg
50 55 60
Thr His Thr Cys Pro Pro Cys Pro Ser His Thr Gln Pro Leu Gly Val
65 70 75 80
Phe Leu Phe Pro Pro Lys Pro Lys Asp Gln Leu Met Ile Ser Arg Thr
85 90 95
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
100 105 110
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
115 120 125
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
130 135 140
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
145 150 155 160
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
165 170 175
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
180 185 190
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
195 200 205
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
210 215 220
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
225 230 235 240
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
245 250 255
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Leu His Glu Ala Leu
260 265 270
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
275 280 285
<210> 51
<211> 25
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> сигнальный пептид tPA
<400> 51
Met Asp Ala Met Leu Arg Gly Leu Cys Cys Val Leu Leu Leu Cys Gly
1 5 10 15
Ala Val Phe Val Ser Pro Ser His Ala
20 25
<210> 52
<211> 33
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> GLP-2-2G (Тедуглутид)
<400> 52
His Gly Asp Gly Ser Phe Ser Asp Glu Met Asn Thr Ile Leu Asp Asn
1 5 10 15
Leu Ala Ala Arg Asp Phe Ile Asn Trp Leu Ile Gln Thr Lys Ile Thr
20 25 30
Asp
<210> 53
<211> 281
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> GLP-2-2G-NTIG
<400> 53
His Gly Asp Gly Ser Phe Ser Asp Glu Met Asn Thr Ile Leu Asp Asn
1 5 10 15
Leu Ala Ala Arg Asp Phe Ile Asn Trp Leu Ile Gln Thr Lys Ile Thr
20 25 30
Asp Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
35 40 45
Glu Lys Glu Lys Glu Glu Gln Glu Glu Arg Thr His Thr Cys Pro Pro
50 55 60
Cys Pro Ser His Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys
65 70 75 80
Pro Lys Asp Gln Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
85 90 95
Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr
100 105 110
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
115 120 125
Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
130 135 140
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
145 150 155 160
Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
165 170 175
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met
180 185 190
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
195 200 205
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
210 215 220
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
225 230 235 240
Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val
245 250 255
Phe Ser Cys Ser Val Leu His Glu Ala Leu His Asn His Tyr Thr Gln
260 265 270
Lys Ser Leu Ser Leu Ser Leu Gly Lys
275 280
<210> 54
<211> 160
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> IL-10V
<400> 54
Ser Pro Gly Gln Gly Thr Gln Ser Glu Asn Ser Cys Thr His Phe Pro
1 5 10 15
Gly Asn Leu Pro Asn Met Leu Arg Asp Leu Arg Asp Ala Phe Ser Arg
20 25 30
Val Lys Thr Phe Phe Gln Met Lys Asp Gln Leu Asp Asn Leu Leu Leu
35 40 45
Lys Glu Ser Leu Leu Glu Asp Phe Lys Gly Tyr Leu Gly Cys Gln Ala
50 55 60
Leu Ser Glu Met Ile Gln Phe Tyr Leu Glu Glu Val Met Pro Gln Ala
65 70 75 80
Glu Asn Gln Asp Pro Asp Ala Lys Ala His Val Asn Ser Leu Gly Glu
85 90 95
Asn Leu Lys Thr Leu Arg Leu Arg Leu Arg Arg Cys His Arg Phe Leu
100 105 110
Pro Cys Glu Asn Lys Ser Lys Ala Val Glu Gln Val Lys Asn Ala Phe
115 120 125
Asn Lys Leu Gln Glu Lys Gly Ile Tyr Lys Ala Met Ser Glu Phe Asp
130 135 140
Ile Phe Ile Asn Tyr Ile Glu Ala Tyr Met Thr Met Lys Ile Arg Asn
145 150 155 160
<210> 55
<211> 425
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> NTIG-IL-10V
<400> 55
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu
1 5 10 15
Pro Lys Ser Ser Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ser His
20 25 30
Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Gln
35 40 45
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
50 55 60
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
65 70 75 80
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
85 90 95
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
100 105 110
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
115 120 125
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
130 135 140
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
145 150 155 160
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
165 170 175
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
180 185 190
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
195 200 205
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
210 215 220
Val Leu His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
225 230 235 240
Leu Ser Leu Gly Lys Ala Ala Gly Ser Gly Gly Gly Gly Gly Ser Gly
245 250 255
Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Pro Gly Gln Gly Thr Gln
260 265 270
Ser Glu Asn Ser Cys Thr His Phe Pro Gly Asn Leu Pro Asn Met Leu
275 280 285
Arg Asp Leu Arg Asp Ala Phe Ser Arg Val Lys Thr Phe Phe Gln Met
290 295 300
Lys Asp Gln Leu Asp Asn Leu Leu Leu Lys Glu Ser Leu Leu Glu Asp
305 310 315 320
Phe Lys Gly Tyr Leu Gly Cys Gln Ala Leu Ser Glu Met Ile Gln Phe
325 330 335
Tyr Leu Glu Glu Val Met Pro Gln Ala Glu Asn Gln Asp Pro Asp Ala
340 345 350
Lys Ala His Val Asn Ser Leu Gly Glu Asn Leu Lys Thr Leu Arg Leu
355 360 365
Arg Leu Arg Arg Cys His Arg Phe Leu Pro Cys Glu Asn Lys Ser Lys
370 375 380
Ala Val Glu Gln Val Lys Asn Ala Phe Asn Lys Leu Gln Glu Lys Gly
385 390 395 400
Ile Tyr Lys Ala Met Ser Glu Phe Asp Ile Phe Ile Asn Tyr Ile Glu
405 410 415
Ala Tyr Met Thr Met Lys Ile Arg Asn
420 425
<210> 56
<211> 169
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> IL-10Vm
<400> 56
Ser Pro Gly Gln Gly Thr Gln Ser Glu Asn Ser Cys Thr His Phe Pro
1 5 10 15
Gly Asn Leu Pro Asn Met Leu Arg Asp Leu Arg Asp Ala Phe Ser Arg
20 25 30
Val Lys Thr Phe Phe Gln Met Lys Asp Gln Leu Asp Asn Leu Leu Leu
35 40 45
Lys Glu Ser Leu Leu Glu Asp Phe Lys Gly Tyr Leu Gly Cys Gln Ala
50 55 60
Leu Ser Glu Met Ile Gln Phe Tyr Leu Glu Glu Val Met Pro Gln Ala
65 70 75 80
Glu Asn Gln Asp Pro Asp Ala Lys Ala His Val Asn Ser Leu Gly Glu
85 90 95
Asn Leu Lys Thr Leu Arg Leu Arg Leu Arg Arg Cys His Arg Phe Leu
100 105 110
Pro Cys Glu Asn Gly Gly Ser Gly Gly Ser Gly Gly Ser Lys Ser Lys
115 120 125
Ala Val Glu Gln Val Lys Asn Ala Phe Asn Lys Leu Gln Glu Lys Gly
130 135 140
Ile Tyr Lys Ala Met Ser Glu Phe Asp Ile Phe Ile Asn Tyr Ile Glu
145 150 155 160
Ala Tyr Met Thr Met Lys Ile Arg Asn
165
<210> 57
<211> 403
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> NTIG-IL-10Vm
<400> 57
Ser His Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys Pro Lys
1 5 10 15
Asp Gln Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val
20 25 30
Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp
35 40 45
Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe
50 55 60
Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp
65 70 75 80
Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu
85 90 95
Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg
100 105 110
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys
115 120 125
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
130 135 140
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
145 150 155 160
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
165 170 175
Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser
180 185 190
Cys Ser Val Leu His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
195 200 205
Leu Ser Leu Ser Leu Gly Ala Ala Gly Ser Gly Gly Gly Gly Gly Ser
210 215 220
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Pro Gly Gln Gly Thr
225 230 235 240
Gln Ser Glu Asn Ser Cys Thr His Phe Pro Gly Asn Leu Pro Asn Met
245 250 255
Leu Arg Asp Leu Arg Asp Ala Phe Ser Arg Val Lys Thr Phe Phe Gln
260 265 270
Met Lys Asp Gln Leu Asp Asn Leu Leu Leu Lys Glu Ser Leu Leu Glu
275 280 285
Asp Phe Lys Gly Tyr Leu Gly Cys Gln Ala Leu Ser Glu Met Ile Gln
290 295 300
Phe Tyr Leu Glu Glu Val Met Pro Gln Ala Glu Asn Gln Asp Pro Asp
305 310 315 320
Ala Lys Ala His Val Asn Ser Leu Gly Glu Asn Leu Lys Thr Leu Arg
325 330 335
Leu Arg Leu Arg Arg Cys His Arg Phe Leu Pro Cys Glu Asn Gly Gly
340 345 350
Ser Gly Gly Ser Gly Gly Ser Lys Ser Lys Ala Val Glu Gln Val Lys
355 360 365
Asn Ala Phe Asn Lys Leu Gln Glu Lys Gly Ile Tyr Lys Ala Met Ser
370 375 380
Glu Phe Asp Ile Phe Ile Asn Tyr Ile Glu Ala Tyr Met Thr Met Lys
385 390 395 400
Ile Arg Asn
<210> 58
<211> 180
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> FceRIa
<400> 58
Val Pro Gln Lys Pro Lys Val Ser Leu Asn Pro Pro Trp Asn Arg Ile
1 5 10 15
Phe Lys Gly Glu Asn Val Thr Leu Thr Cys Asn Gly Asn Asn Phe Phe
20 25 30
Glu Val Ser Ser Thr Lys Trp Phe His Asn Gly Ser Leu Ser Glu Glu
35 40 45
Thr Asn Ser Ser Leu Asn Ile Val Asn Ala Lys Phe Glu Asp Ser Gly
50 55 60
Glu Tyr Lys Cys Gln His Gln Gln Val Asn Glu Ser Glu Pro Val Tyr
65 70 75 80
Leu Glu Val Phe Ser Asp Trp Leu Leu Leu Gln Ala Ser Ala Glu Val
85 90 95
Val Met Glu Gly Gln Pro Leu Phe Leu Arg Cys His Gly Trp Arg Asn
100 105 110
Trp Asp Val Tyr Lys Val Ile Tyr Tyr Lys Asp Gly Glu Ala Leu Lys
115 120 125
Tyr Trp Tyr Glu Asn His Asn Ile Ser Ile Thr Asn Ala Thr Val Glu
130 135 140
Asp Ser Gly Thr Tyr Tyr Cys Thr Gly Lys Val Trp Gln Leu Asp Tyr
145 150 155 160
Glu Ser Glu Pro Leu Asn Ile Thr Val Ile Lys Ala Pro Arg Glu Lys
165 170 175
Tyr Trp Leu Gln
180
<210> 59
<211> 605
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> FceRIa-NTIG-IL-10V
<400> 59
Val Pro Gln Lys Pro Lys Val Ser Leu Asn Pro Pro Trp Asn Arg Ile
1 5 10 15
Phe Lys Gly Glu Asn Val Thr Leu Thr Cys Asn Gly Asn Asn Phe Phe
20 25 30
Glu Val Ser Ser Thr Lys Trp Phe His Asn Gly Ser Leu Ser Glu Glu
35 40 45
Thr Asn Ser Ser Leu Asn Ile Val Asn Ala Lys Phe Glu Asp Ser Gly
50 55 60
Glu Tyr Lys Cys Gln His Gln Gln Val Asn Glu Ser Glu Pro Val Tyr
65 70 75 80
Leu Glu Val Phe Ser Asp Trp Leu Leu Leu Gln Ala Ser Ala Glu Val
85 90 95
Val Met Glu Gly Gln Pro Leu Phe Leu Arg Cys His Gly Trp Arg Asn
100 105 110
Trp Asp Val Tyr Lys Val Ile Tyr Tyr Lys Asp Gly Glu Ala Leu Lys
115 120 125
Tyr Trp Tyr Glu Asn His Asn Ile Ser Ile Thr Asn Ala Thr Val Glu
130 135 140
Asp Ser Gly Thr Tyr Tyr Cys Thr Gly Lys Val Trp Gln Leu Asp Tyr
145 150 155 160
Glu Ser Glu Pro Leu Asn Ile Thr Val Ile Lys Ala Pro Arg Glu Lys
165 170 175
Tyr Trp Leu Gln Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
180 185 190
Gly Gly Ser Glu Pro Lys Ser Ser Asp Lys Thr His Thr Cys Pro Pro
195 200 205
Cys Pro Ser His Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys
210 215 220
Pro Lys Asp Gln Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
225 230 235 240
Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr
245 250 255
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
260 265 270
Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
275 280 285
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
290 295 300
Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
305 310 315 320
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met
325 330 335
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
340 345 350
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
355 360 365
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
370 375 380
Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val
385 390 395 400
Phe Ser Cys Ser Val Leu His Glu Ala Leu His Asn His Tyr Thr Gln
405 410 415
Lys Ser Leu Ser Leu Ser Leu Gly Lys Ala Ala Gly Ser Gly Gly Gly
420 425 430
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Pro Gly
435 440 445
Gln Gly Thr Gln Ser Glu Asn Ser Cys Thr His Phe Pro Gly Asn Leu
450 455 460
Pro Asn Met Leu Arg Asp Leu Arg Asp Ala Phe Ser Arg Val Lys Thr
465 470 475 480
Phe Phe Gln Met Lys Asp Gln Leu Asp Asn Leu Leu Leu Lys Glu Ser
485 490 495
Leu Leu Glu Asp Phe Lys Gly Tyr Leu Gly Cys Gln Ala Leu Ser Glu
500 505 510
Met Ile Gln Phe Tyr Leu Glu Glu Val Met Pro Gln Ala Glu Asn Gln
515 520 525
Asp Pro Asp Ala Lys Ala His Val Asn Ser Leu Gly Glu Asn Leu Lys
530 535 540
Thr Leu Arg Leu Arg Leu Arg Arg Cys His Arg Phe Leu Pro Cys Glu
545 550 555 560
Asn Lys Ser Lys Ala Val Glu Gln Val Lys Asn Ala Phe Asn Lys Leu
565 570 575
Gln Glu Lys Gly Ile Tyr Lys Ala Met Ser Glu Phe Asp Ile Phe Ile
580 585 590
Asn Tyr Ile Glu Ala Tyr Met Thr Met Lys Ile Arg Asn
595 600 605
<210> 60
<211> 613
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> FceRIa-NTIG-IL-10Vm
<400> 60
Val Pro Gln Lys Pro Lys Val Ser Leu Asn Pro Pro Trp Asn Arg Ile
1 5 10 15
Phe Lys Gly Glu Asn Val Thr Leu Thr Cys Asn Gly Asn Asn Phe Phe
20 25 30
Glu Val Ser Ser Thr Lys Trp Phe His Asn Gly Ser Leu Ser Glu Glu
35 40 45
Thr Asn Ser Ser Leu Asn Ile Val Asn Ala Lys Phe Glu Asp Ser Gly
50 55 60
Glu Tyr Lys Cys Gln His Gln Gln Val Asn Glu Ser Glu Pro Val Tyr
65 70 75 80
Leu Glu Val Phe Ser Asp Trp Leu Leu Leu Gln Ala Ser Ala Glu Val
85 90 95
Val Met Glu Gly Gln Pro Leu Phe Leu Arg Cys His Gly Trp Arg Asn
100 105 110
Trp Asp Val Tyr Lys Val Ile Tyr Tyr Lys Asp Gly Glu Ala Leu Lys
115 120 125
Tyr Trp Tyr Glu Asn His Asn Ile Ser Ile Thr Asn Ala Thr Val Glu
130 135 140
Asp Ser Gly Thr Tyr Tyr Cys Thr Gly Lys Val Trp Gln Leu Asp Tyr
145 150 155 160
Glu Ser Glu Pro Leu Asn Ile Thr Val Ile Lys Ala Pro Arg Glu Lys
165 170 175
Tyr Trp Leu Gln Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
180 185 190
Gly Gly Ser Glu Pro Lys Ser Ser Asp Lys Thr His Thr Cys Pro Pro
195 200 205
Cys Pro Ser His Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys
210 215 220
Pro Lys Asp Gln Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
225 230 235 240
Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr
245 250 255
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
260 265 270
Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
275 280 285
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
290 295 300
Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
305 310 315 320
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met
325 330 335
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
340 345 350
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
355 360 365
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
370 375 380
Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val
385 390 395 400
Phe Ser Cys Ser Val Leu His Glu Ala Leu His Asn His Tyr Thr Gln
405 410 415
Lys Ser Leu Ser Leu Ser Leu Gly Ala Ala Gly Ser Gly Gly Gly Gly
420 425 430
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Pro Gly Gln
435 440 445
Gly Thr Gln Ser Glu Asn Ser Cys Thr His Phe Pro Gly Asn Leu Pro
450 455 460
Asn Met Leu Arg Asp Leu Arg Asp Ala Phe Ser Arg Val Lys Thr Phe
465 470 475 480
Phe Gln Met Lys Asp Gln Leu Asp Asn Leu Leu Leu Lys Glu Ser Leu
485 490 495
Leu Glu Asp Phe Lys Gly Tyr Leu Gly Cys Gln Ala Leu Ser Glu Met
500 505 510
Ile Gln Phe Tyr Leu Glu Glu Val Met Pro Gln Ala Glu Asn Gln Asp
515 520 525
Pro Asp Ala Lys Ala His Val Asn Ser Leu Gly Glu Asn Leu Lys Thr
530 535 540
Leu Arg Leu Arg Leu Arg Arg Cys His Arg Phe Leu Pro Cys Glu Asn
545 550 555 560
Gly Gly Ser Gly Gly Ser Gly Gly Ser Lys Ser Lys Ala Val Glu Gln
565 570 575
Val Lys Asn Ala Phe Asn Lys Leu Gln Glu Lys Gly Ile Tyr Lys Ala
580 585 590
Met Ser Glu Phe Asp Ile Phe Ile Asn Tyr Ile Glu Ala Tyr Met Thr
595 600 605
Met Lys Ile Arg Asn
610
<210> 61
<211> 216
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Химерная VH-CH1 тяжелой цепи против CD40L
<400> 61
Glu Val Gln Leu Gln Gln Ser Gly Ser Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Ser Tyr
20 25 30
Tyr Met Tyr Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asn Pro Ser Asn Gly Asp Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Gln Leu Ile Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Ser Asp Gly Arg Asn Asp Met Asp Ser Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val
210 215
<210> 62
<211> 218
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> химерная легкая цепь против CD40L
<400> 62
Asp Ile Gln Leu Thr Gln Ser Pro Ala Ser Leu Ala Val Ser Leu Gly
1 5 10 15
Gln Arg Ala Thr Ile Ser Cys Arg Ala Ser Gln Arg Val Ser Ser Ser
20 25 30
Thr Tyr Ser Tyr Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Lys Tyr Ala Ser Asn Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Asn Ile His
65 70 75 80
Pro Val Glu Glu Glu Asp Ser Ala Thr Tyr Tyr Cys Gln His Ser Trp
85 90 95
Glu Ile Pro Pro Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Ala Asp Ala Ala Pro Thr Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 63
<211> 19
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> сигнальная последовательность тяжелой цепи IgG1
<400> 63
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser
<210> 64
<211> 216
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> гуманизированная VH-CH1 тяжелой цепи против CD40L
<400> 64
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Ser Tyr
20 25 30
Tyr Met Tyr Trp Val Lys Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asn Pro Ser Asn Gly Asp Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Lys Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Ser Asp Gly Arg Asn Asp Met Asp Ser Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro
115 120 125
Leu Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly
130 135 140
Cys Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn
145 150 155 160
Ser Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln
165 170 175
Ser Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser
180 185 190
Ser Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser
195 200 205
Asn Thr Lys Val Asp Lys Lys Val
210 215
<210> 65
<211> 230
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> шарнирная область + NTIG
<400> 65
Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ser
1 5 10 15
His Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
20 25 30
Gln Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
35 40 45
Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly
50 55 60
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn
65 70 75 80
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
85 90 95
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro
100 105 110
Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
115 120 125
Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn
130 135 140
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
145 150 155 160
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
165 170 175
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg
180 185 190
Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys
195 200 205
Ser Val Leu His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
210 215 220
Ser Leu Ser Leu Gly Lys
225 230
<210> 66
<211> 20
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> сигнальная последовательность легкой цепи IgG1
<400> 66
Met Glu Thr Asp Thr Leu Leu Leu Trp Val Leu Leu Leu Trp Val Pro
1 5 10 15
Gly Ser Thr Gly
20
<210> 67
<211> 218
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> гуманизированная легкая цепь против CD40L
<400> 67
Asp Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Ile Ser Cys Arg Ala Ser Gln Arg Val Ser Ser Ser
20 25 30
Thr Tyr Ser Tyr Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Lys Tyr Ala Ser Asn Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Val Glu Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln His Ser Trp
85 90 95
Glu Ile Pro Pro Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln
115 120 125
Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr
130 135 140
Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser
145 150 155 160
Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr
165 170 175
Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys
180 185 190
His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro
195 200 205
Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 68
<211> 229
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> шарнирная область + NTIG с делецией лизина
<400> 68
Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ser
1 5 10 15
His Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
20 25 30
Gln Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
35 40 45
Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly
50 55 60
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn
65 70 75 80
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
85 90 95
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro
100 105 110
Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
115 120 125
Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn
130 135 140
Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
145 150 155 160
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
165 170 175
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg
180 185 190
Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys
195 200 205
Ser Val Leu His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
210 215 220
Ser Leu Ser Leu Gly
225
<210> 69
<211> 119
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> гуманизированная VL против CD40L
<400> 69
Asp Ile Val Leu Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Ile Ser Cys Arg Ala Ser Gln Arg Val Ser Ser Ser
20 25 30
Thr Tyr Ser Tyr Met His Trp Tyr Gln Gln Lys Pro Gly Gln Pro Pro
35 40 45
Lys Leu Leu Ile Lys Tyr Ala Ser Asn Leu Glu Ser Gly Val Pro Ala
50 55 60
Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser
65 70 75 80
Ser Val Glu Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Gln His Ser Trp
85 90 95
Glu Ile Pro Pro Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg
100 105 110
Thr Val Ala Ala Pro Ser Val
115
<210> 70
<211> 118
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> гуманизированная VH против CD40L
<400> 70
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Leu Ser Cys Lys Ala Ser Gly Tyr Ile Phe Thr Ser Tyr
20 25 30
Tyr Met Tyr Trp Val Lys Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Glu Ile Asn Pro Ser Asn Gly Asp Thr Asn Phe Asn Glu Lys Phe
50 55 60
Lys Ser Lys Ala Thr Leu Thr Val Asp Lys Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Arg Ser Asp Gly Arg Asn Asp Met Asp Ser Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 71
<211> 310
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> GLP-1E-NTIG Выступ гликановый линкер
<400> 71
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Gly
1 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Gly Pro Ser
20 25 30
Ser Gly Ala Pro Pro Pro Ser Gly Gly Gly Gly Gly Ser Gly Gly Gly
35 40 45
Gly Ser Gly Gly Gly Gly Ser Ala Lys Asn Thr Thr Ala Pro Ala Thr
50 55 60
Thr Arg Asn Thr Thr Arg Gly Gly Glu Glu Lys Lys Lys Glu Lys Glu
65 70 75 80
Lys Glu Glu Gln Glu Glu Arg Thr His Thr Cys Pro Pro Cys Pro Ser
85 90 95
His Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys Pro Lys Asp
100 105 110
Gln Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp
115 120 125
Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly
130 135 140
Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn
145 150 155 160
Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp
165 170 175
Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro
180 185 190
Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu
195 200 205
Pro Gln Val Tyr Thr Leu Pro Pro Cys Gln Glu Glu Met Thr Lys Asn
210 215 220
Gln Val Ser Leu Trp Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile
225 230 235 240
Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr
245 250 255
Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg
260 265 270
Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys
275 280 285
Ser Val Leu His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu
290 295 300
Ser Leu Ser Leu Gly Lys
305 310
<210> 72
<211> 281
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> GLP-2-2G-NTIG Впадина негликановый линкер
<400> 72
His Gly Asp Gly Ser Phe Ser Asp Glu Met Asn Thr Ile Leu Asp Asn
1 5 10 15
Leu Ala Ala Arg Asp Phe Ile Asn Trp Leu Ile Gln Thr Lys Ile Thr
20 25 30
Asp Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
35 40 45
Glu Lys Glu Lys Glu Glu Gln Glu Glu Arg Thr His Thr Cys Pro Pro
50 55 60
Cys Pro Ser His Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys
65 70 75 80
Pro Lys Asp Gln Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
85 90 95
Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr
100 105 110
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
115 120 125
Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
130 135 140
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
145 150 155 160
Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
165 170 175
Pro Arg Glu Pro Gln Val Cys Thr Leu Pro Pro Ser Gln Glu Glu Met
180 185 190
Thr Lys Asn Gln Val Ser Leu Ser Cys Ala Val Lys Gly Phe Tyr Pro
195 200 205
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
210 215 220
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
225 230 235 240
Val Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val
245 250 255
Phe Ser Cys Ser Val Leu His Glu Ala Leu His Asn His Tyr Thr Gln
260 265 270
Lys Ser Leu Ser Leu Ser Leu Gly Lys
275 280
<210> 73
<211> 287
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> GLP-1E-NTIG Выступ негликановый линкер
<400> 73
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Gly
1 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Gly Pro Ser
20 25 30
Ser Gly Ala Pro Pro Pro Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
35 40 45
Ser Gly Gly Gly Gly Ser Glu Lys Glu Lys Glu Glu Gln Glu Glu Arg
50 55 60
Thr His Thr Cys Pro Pro Cys Pro Ser His Thr Gln Pro Leu Gly Val
65 70 75 80
Phe Leu Phe Pro Pro Lys Pro Lys Asp Gln Leu Met Ile Ser Arg Thr
85 90 95
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
100 105 110
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
115 120 125
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
130 135 140
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
145 150 155 160
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
165 170 175
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
180 185 190
Pro Cys Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Trp Cys Leu
195 200 205
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
210 215 220
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
225 230 235 240
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
245 250 255
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Leu His Glu Ala Leu
260 265 270
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
275 280 285
<210> 74
<211> 314
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> IL-13Rальфа2
<400> 74
Asp Thr Glu Ile Lys Val Asn Pro Pro Gln Asp Phe Glu Ile Val Asp
1 5 10 15
Pro Gly Tyr Leu Gly Tyr Leu Tyr Leu Gln Trp Gln Pro Pro Leu Ser
20 25 30
Leu Asp His Phe Lys Glu Cys Thr Val Glu Tyr Glu Leu Lys Tyr Arg
35 40 45
Asn Ile Gly Ser Glu Thr Trp Lys Thr Ile Ile Thr Lys Asn Leu His
50 55 60
Tyr Lys Asp Gly Phe Asp Leu Asn Lys Gly Ile Glu Ala Lys Ile His
65 70 75 80
Thr Leu Leu Pro Trp Gln Cys Thr Asn Gly Ser Glu Val Gln Ser Ser
85 90 95
Trp Ala Glu Thr Thr Tyr Trp Ile Ser Pro Gln Gly Ile Pro Glu Thr
100 105 110
Lys Val Gln Asp Met Asp Cys Val Tyr Tyr Asn Trp Gln Tyr Leu Leu
115 120 125
Cys Ser Trp Lys Pro Gly Ile Gly Val Leu Leu Asp Thr Asn Tyr Asn
130 135 140
Leu Phe Tyr Trp Tyr Glu Gly Leu Asp His Ala Leu Gln Cys Val Asp
145 150 155 160
Tyr Ile Lys Ala Asp Gly Gln Asn Ile Gly Cys Arg Phe Pro Tyr Leu
165 170 175
Glu Ala Ser Asp Tyr Lys Asp Phe Tyr Ile Cys Val Asn Gly Ser Ser
180 185 190
Glu Asn Lys Pro Ile Arg Ser Ser Tyr Phe Thr Phe Gln Leu Gln Asn
195 200 205
Ile Val Lys Pro Leu Pro Pro Val Tyr Leu Thr Phe Thr Arg Glu Ser
210 215 220
Ser Cys Glu Ile Lys Leu Lys Trp Ser Ile Pro Leu Gly Pro Ile Pro
225 230 235 240
Ala Arg Cys Phe Asp Tyr Glu Ile Glu Ile Arg Glu Asp Asp Thr Thr
245 250 255
Leu Val Thr Ala Thr Val Glu Asn Glu Thr Tyr Thr Leu Lys Thr Thr
260 265 270
Asn Glu Thr Arg Gln Leu Cys Phe Val Val Arg Ser Lys Val Asn Ile
275 280 285
Tyr Cys Ser Asp Asp Gly Ile Trp Ser Glu Trp Ser Asp Lys Gln Cys
290 295 300
Trp Glu Gly Glu Asp Leu Ser Lys Lys Thr
305 310
<210> 75
<211> 160
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> IL-10wt
<400> 75
Ser Pro Gly Gln Gly Thr Gln Ser Glu Asn Ser Cys Thr His Phe Pro
1 5 10 15
Gly Asn Leu Pro Asn Met Leu Arg Asp Leu Arg Asp Ala Phe Ser Arg
20 25 30
Val Lys Thr Phe Phe Gln Met Lys Asp Gln Leu Asp Asn Leu Leu Leu
35 40 45
Lys Glu Ser Leu Leu Glu Asp Phe Lys Gly Tyr Leu Gly Cys Gln Ala
50 55 60
Leu Ser Glu Met Ile Gln Phe Tyr Leu Glu Glu Val Met Pro Gln Ala
65 70 75 80
Glu Asn Gln Asp Pro Asp Ile Lys Ala His Val Asn Ser Leu Gly Glu
85 90 95
Asn Leu Lys Thr Leu Arg Leu Arg Leu Arg Arg Cys His Arg Phe Leu
100 105 110
Pro Cys Glu Asn Lys Ser Lys Ala Val Glu Gln Val Lys Asn Ala Phe
115 120 125
Asn Lys Leu Gln Glu Lys Gly Ile Tyr Lys Ala Met Ser Glu Phe Asp
130 135 140
Ile Phe Ile Asn Tyr Ile Glu Ala Tyr Met Thr Met Lys Ile Arg Asn
145 150 155 160
<210> 76
<211> 33
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> GLP-2-2(3-точечная мутация)
<400> 76
His Gly Asp Gly Ser Phe Ser Asp Glu Met Asn Thr Ile Leu Asp Gly
1 5 10 15
Gln Ala Ala Arg Asp Phe Ile Asn Trp Leu Ile Gln Thr Lys Ile Thr
20 25 30
Asp
<210> 77
<211> 103
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> IgG1 CH3
<400> 77
Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys
1 5 10 15
Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp
20 25 30
Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys
35 40 45
Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser
50 55 60
Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser
65 70 75 80
Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser
85 90 95
Leu Ser Leu Ser Pro Gly Lys
100
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СЛИТЫЕ СЕРПИНОВЫЕ ПОЛИПЕПТИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2746550C2 |
| СЛИТЫЕ СЕРПИНОВЫЕ ПОЛИПЕПТИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2728861C1 |
| СЛИТЫЕ СЕРПИНОВЫЕ ПОЛИПЕПТИДЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2012 |
|
RU2698655C2 |
| СЛИТЫЙ БЕЛОК GDF15 ДЛИТЕЛЬНОГО ДЕЙСТВИЯ И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2020 |
|
RU2836280C1 |
| ПОЛИВАЛЕТНЫЕ И ПОЛИСПЕЦИФИЧНЫЕ GITR-СВЯЗЫВАЮЩИЕ СЛИТЫЕ БЕЛКИ | 2016 |
|
RU2753439C2 |
| РЕКОМБИНАНТНЫЕ БЕЛКИ С ДОМЕНАМИ CCN И СЛИТЫЕ БЕЛКИ | 2020 |
|
RU2825102C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПРЕДОТВРАЩЕНИЯ ИЛИ ЛЕЧЕНИЯ ГЕПАТИТА, ФИБРОЗА ПЕЧЕНИ И ЦИРРОЗА ПЕЧЕНИ, ВКЛЮЧАЮЩАЯ СЛИТЫЕ БЕЛКИ | 2017 |
|
RU2795548C2 |
| БЕЛКИ С ДВОЙНОЙ ФУНКЦИЕЙ И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2016 |
|
RU2741345C2 |
| Способы лечения кальцификации тканей | 2015 |
|
RU2770698C2 |
| КОМПОЗИЦИЯ ДЛЯ ПРОТИВОРАКОВОГО ЛЕЧЕНИЯ, СОДЕРЖАЩАЯ NK-КЛЕТКИ И СЛИТЫЙ БЕЛОК, КОТОРЫЙ СОДЕРЖИТ БЕЛОК IL-2 И БЕЛОК CD80 | 2020 |
|
RU2832136C1 |
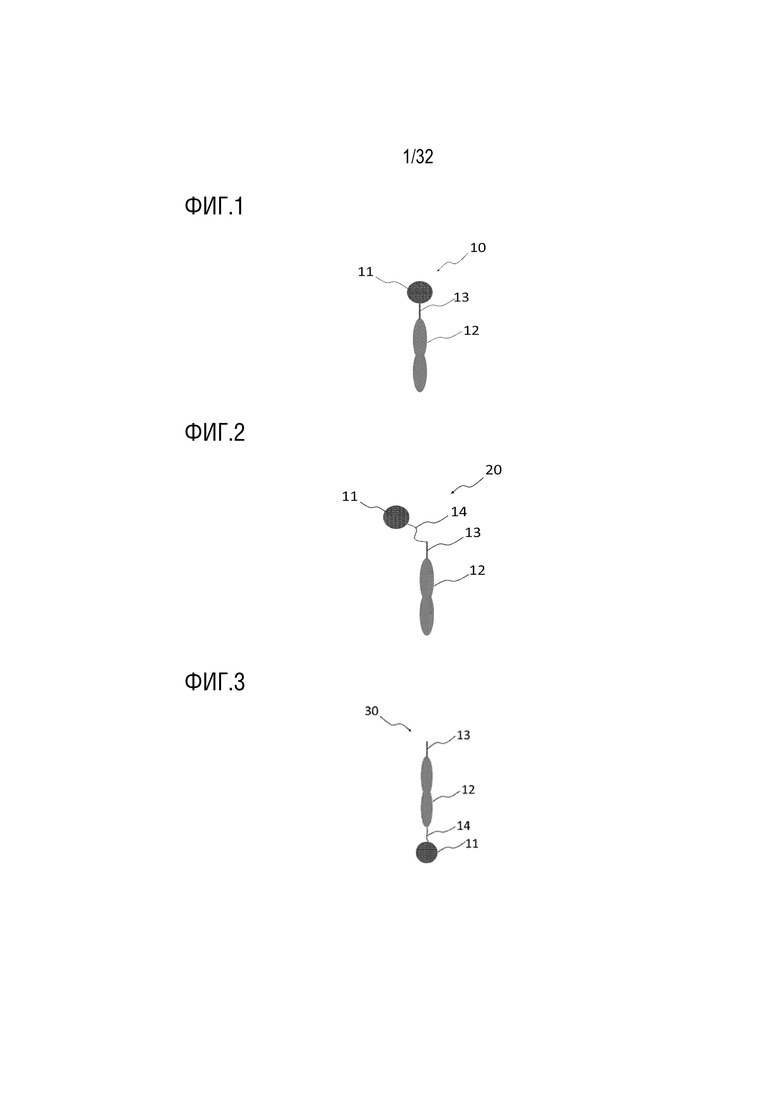
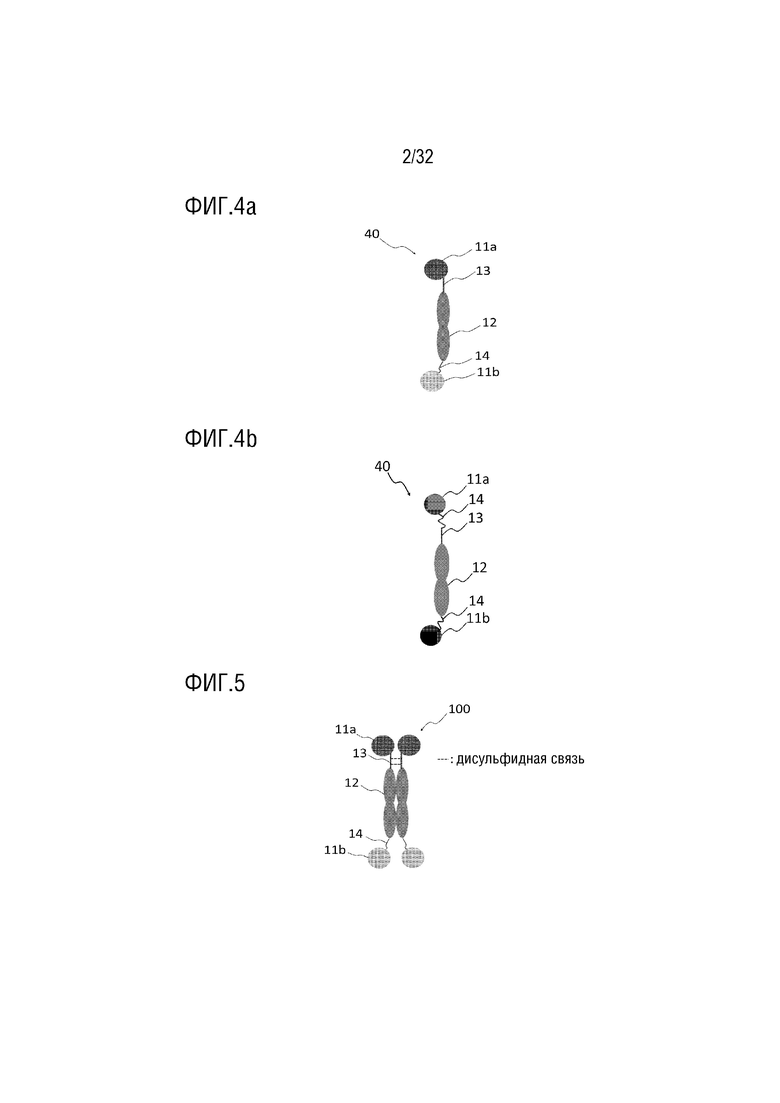
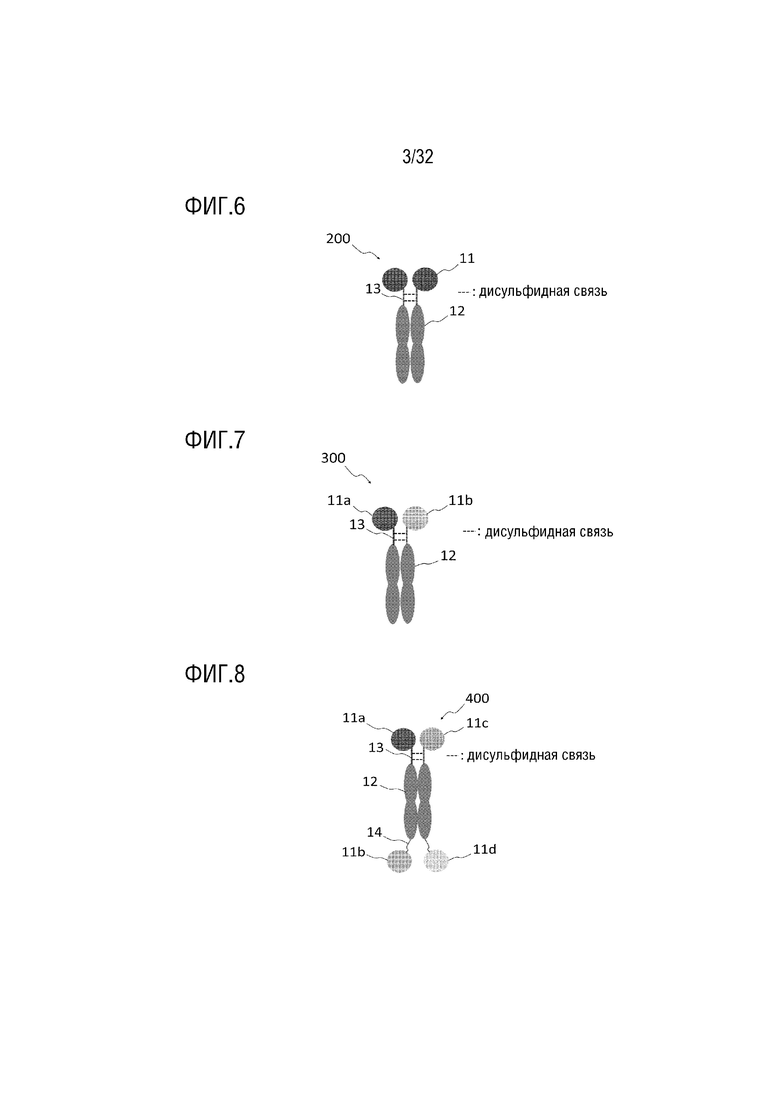
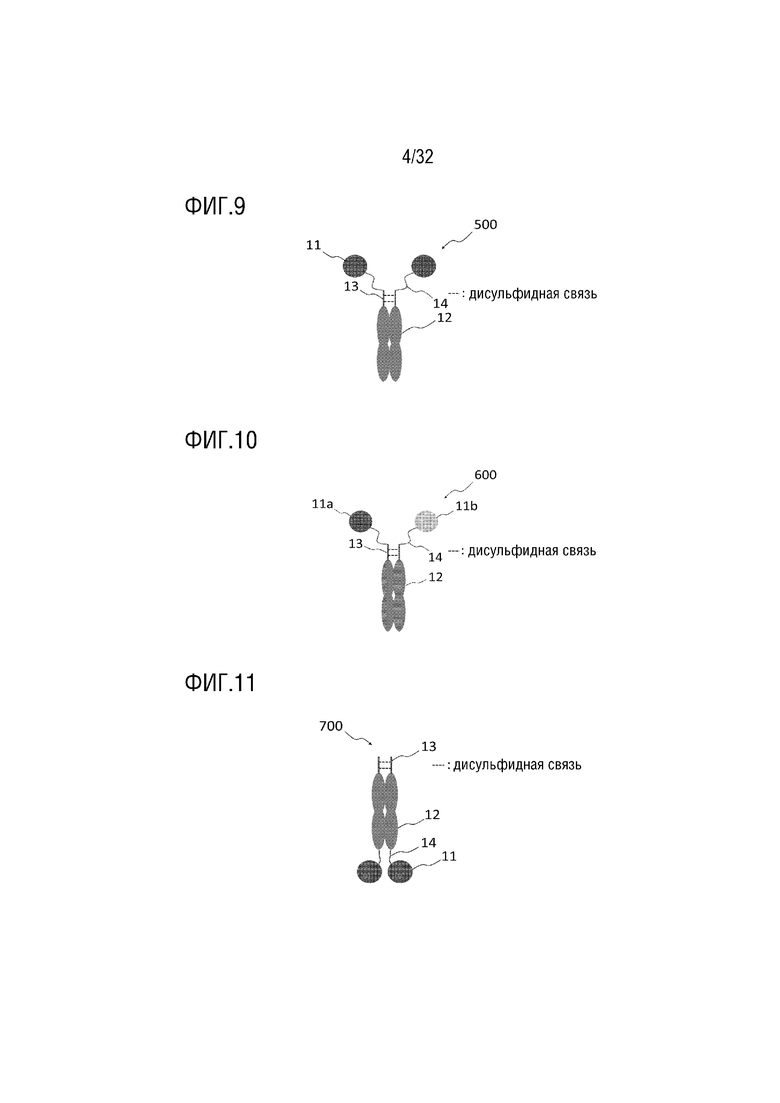
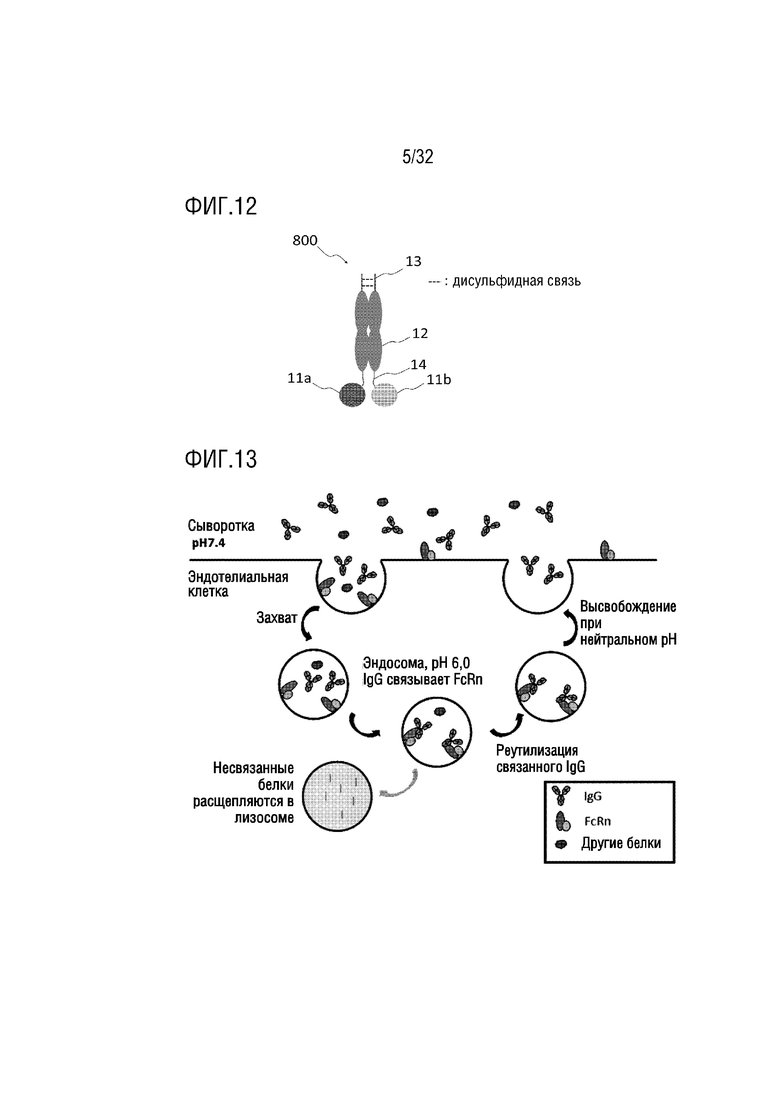
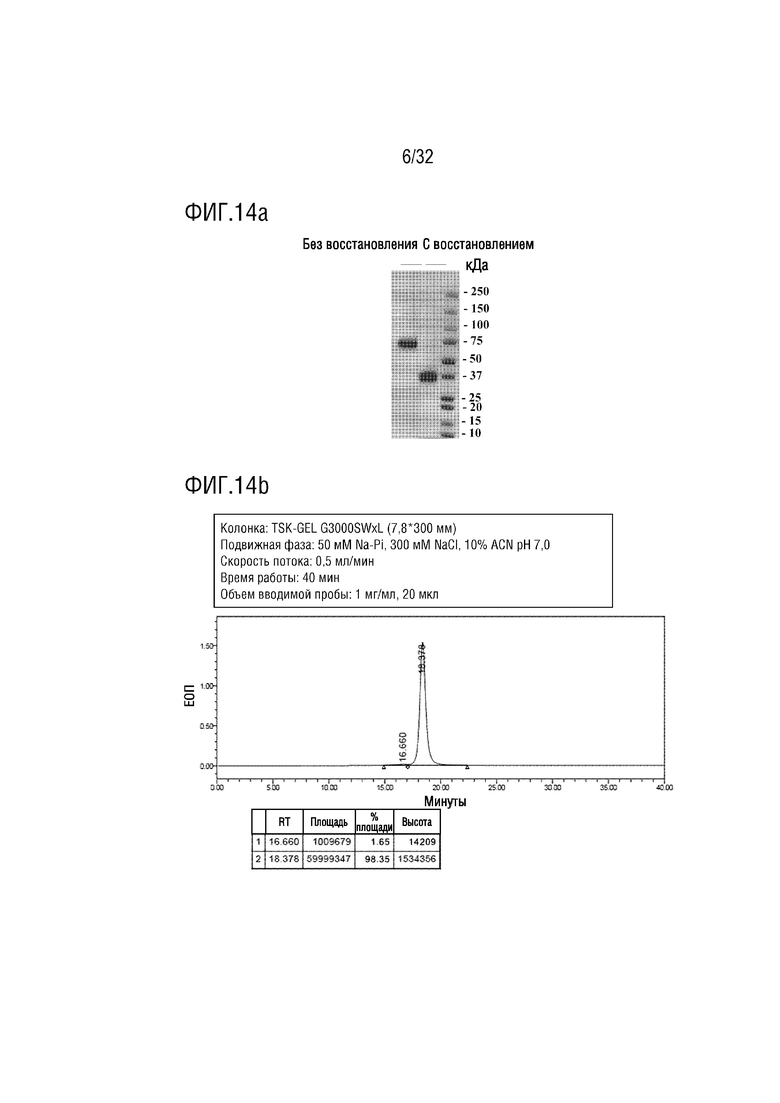
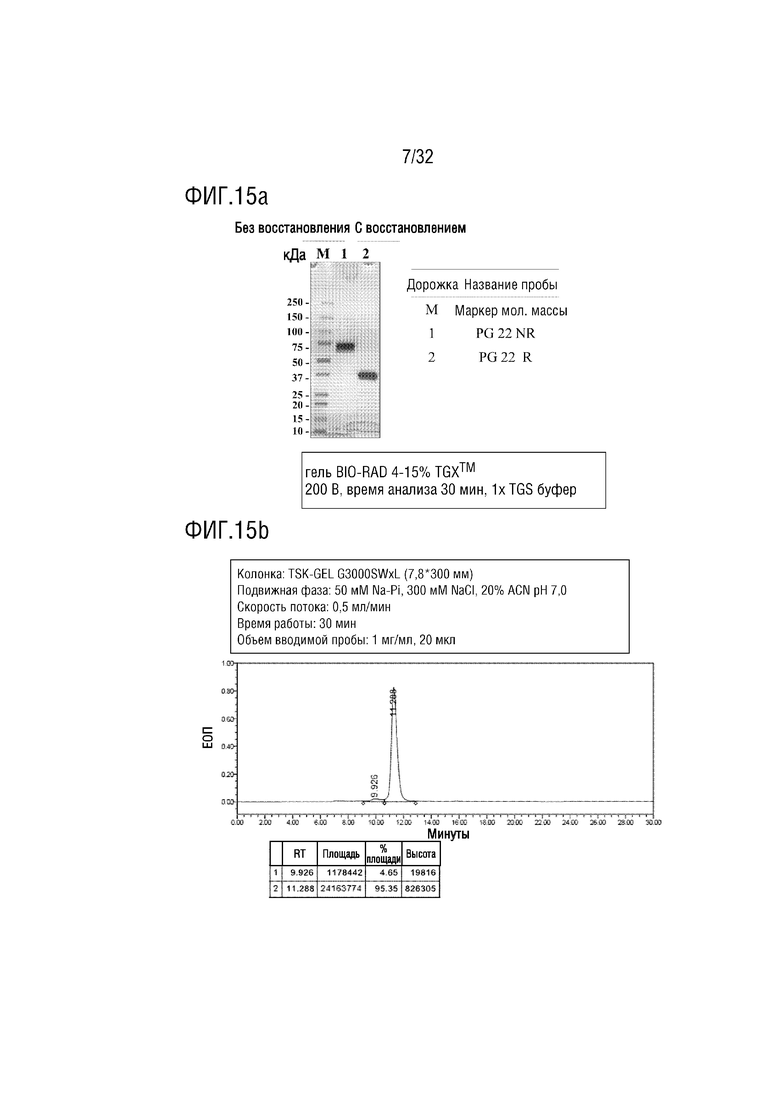
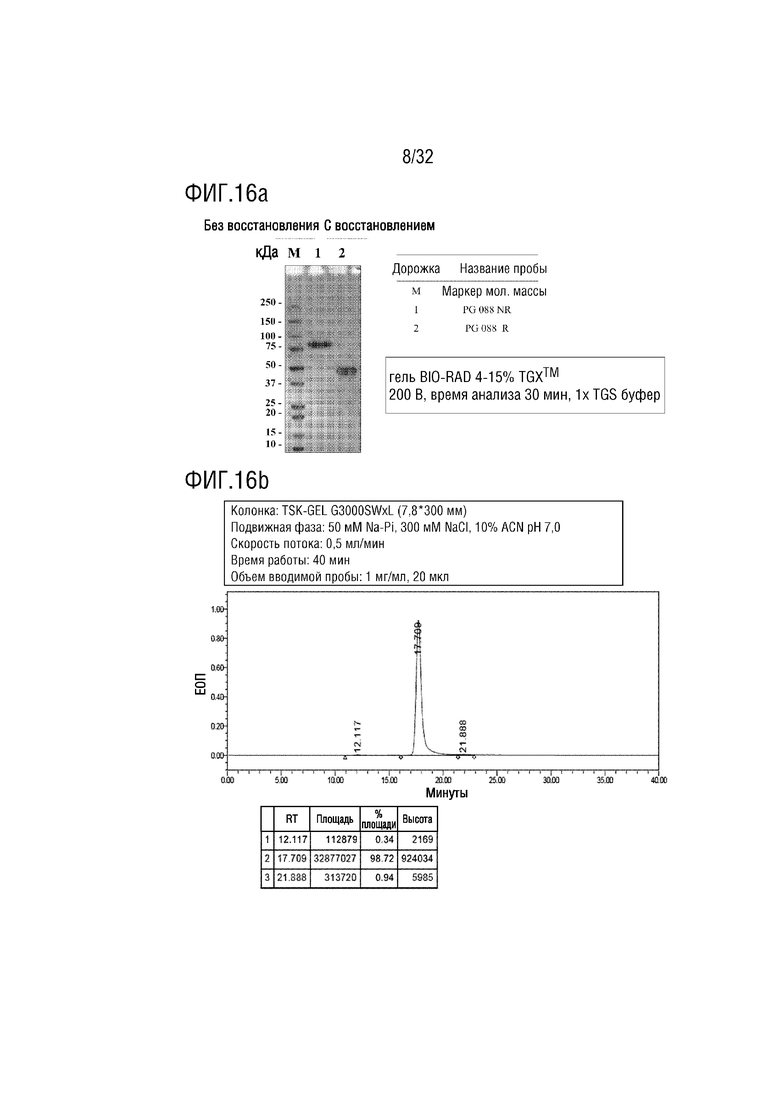
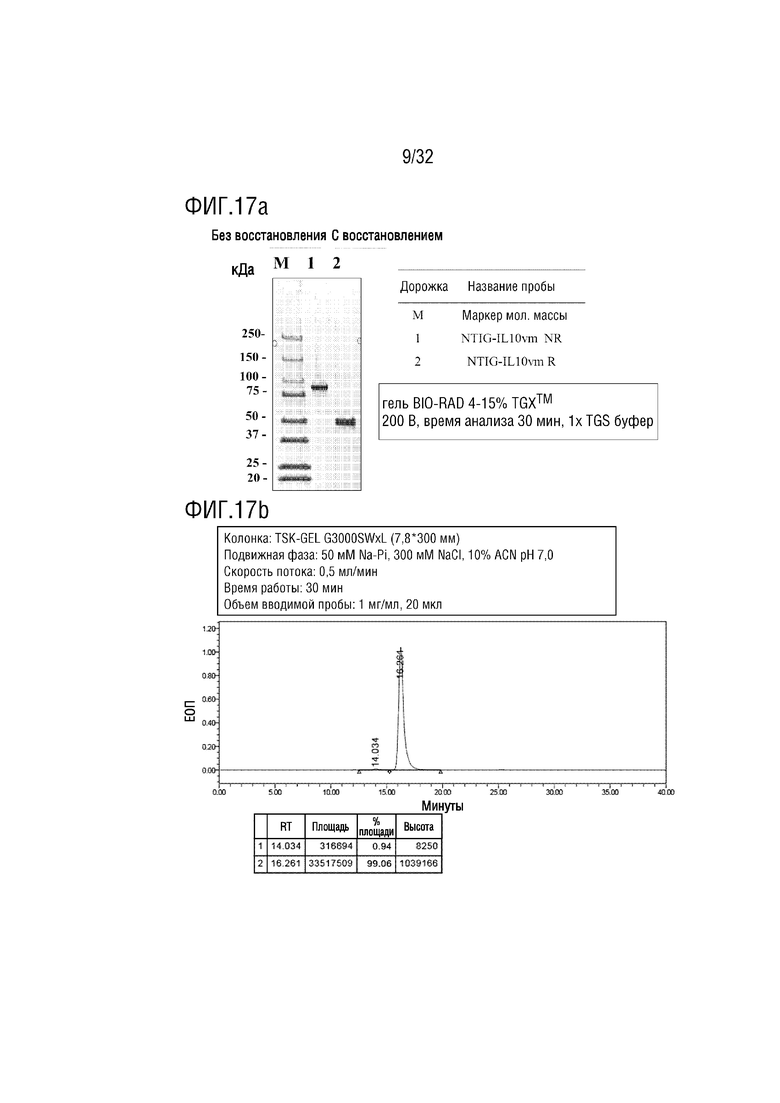

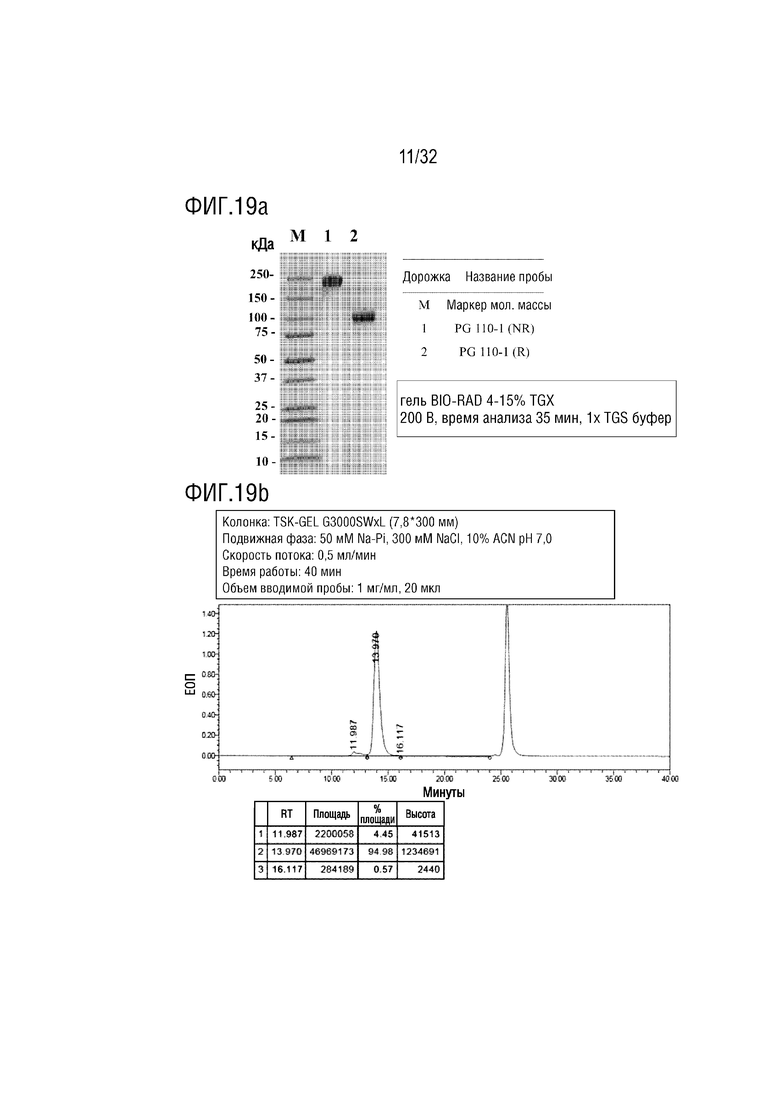
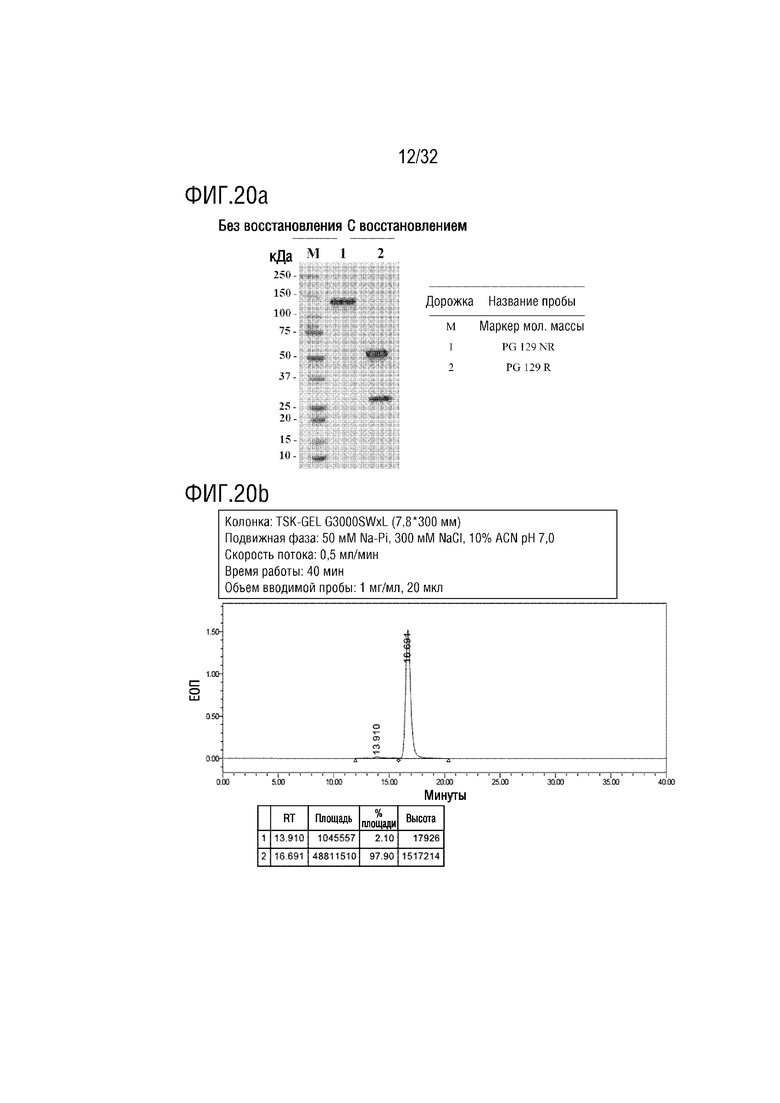
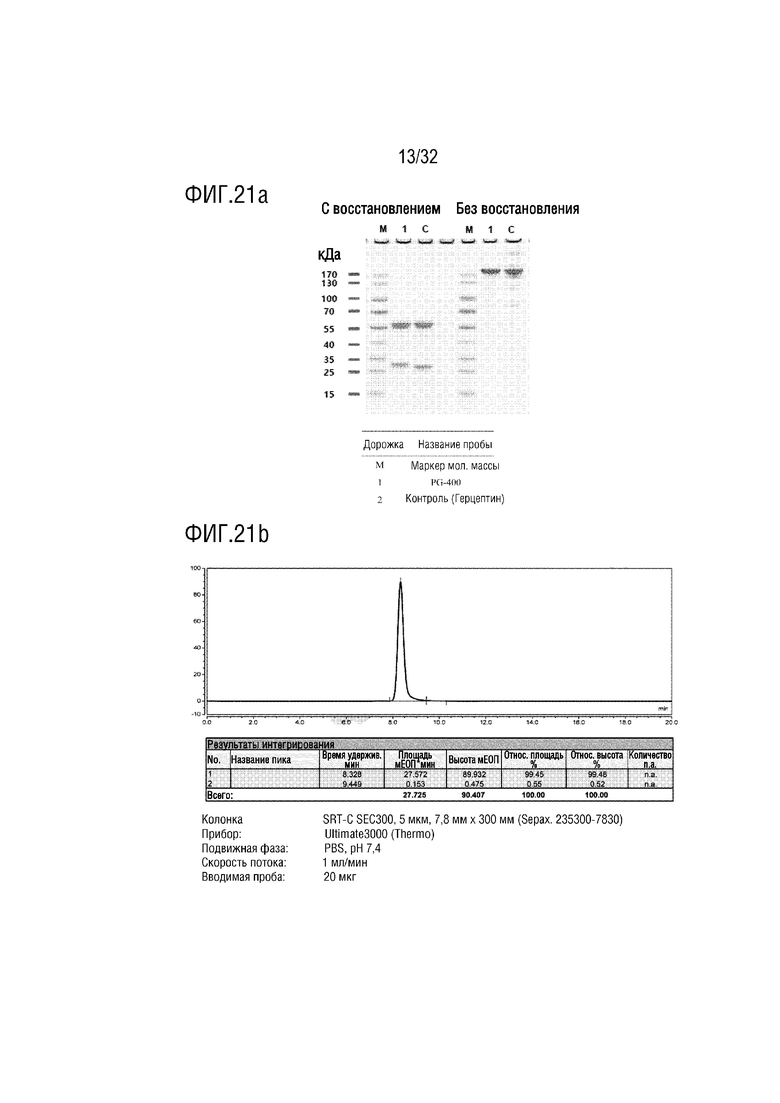
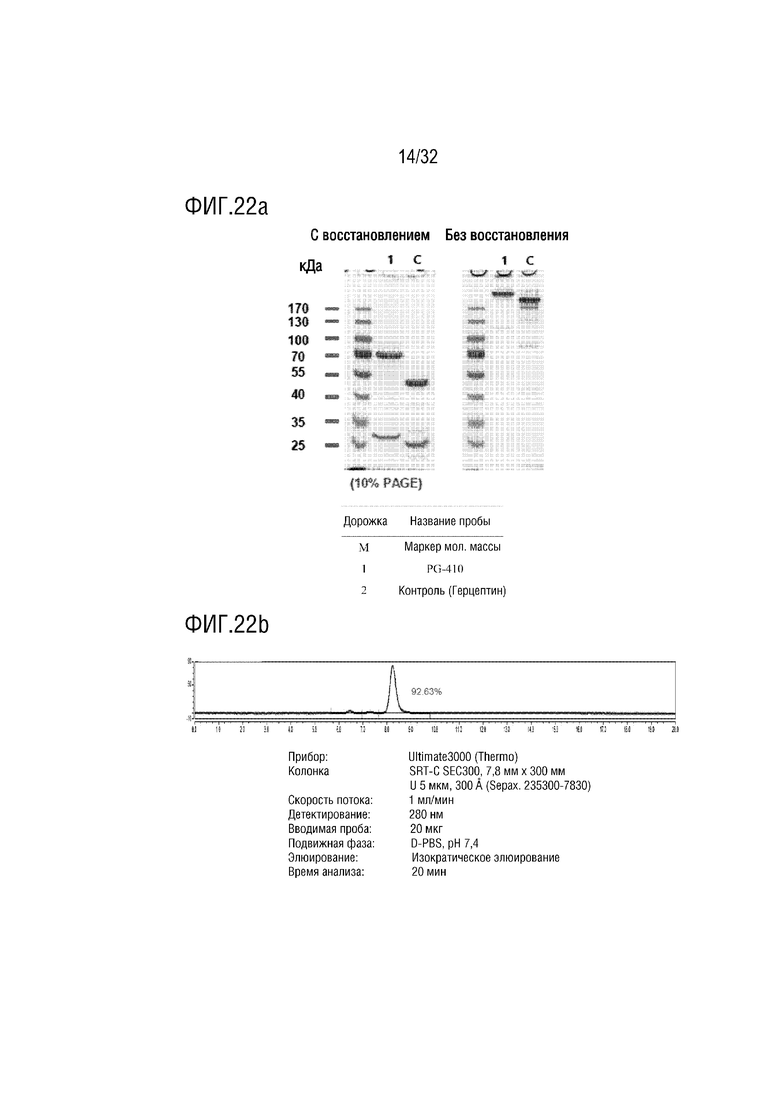

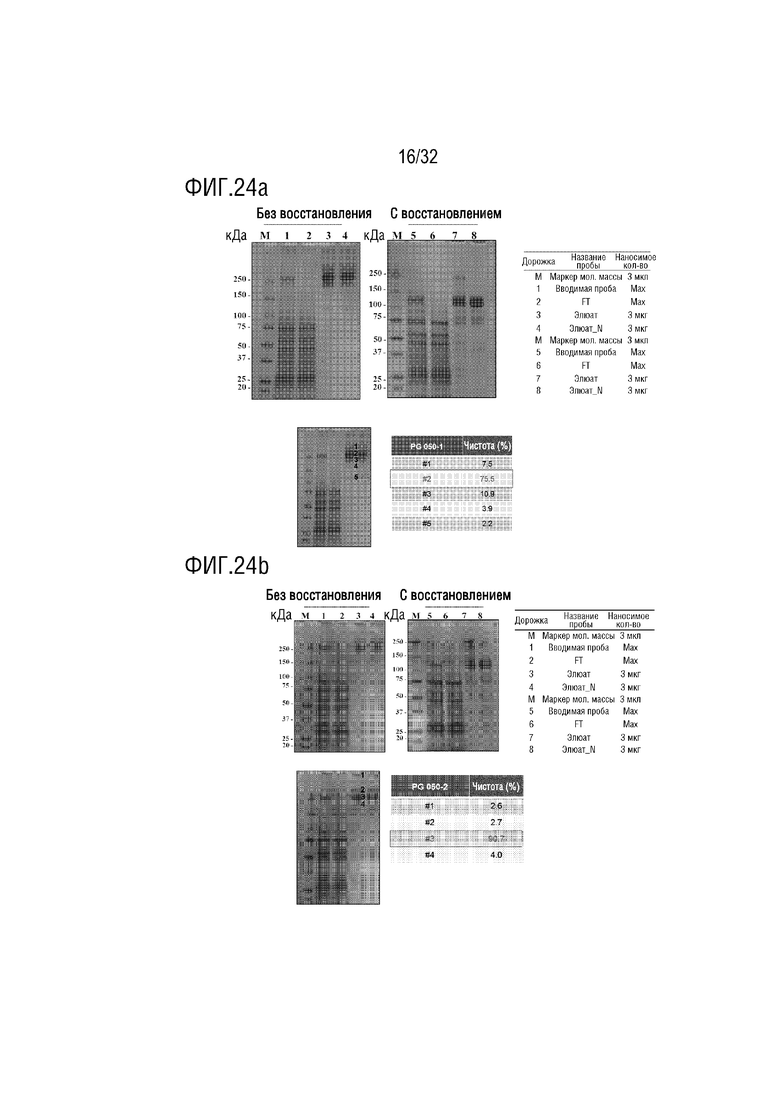
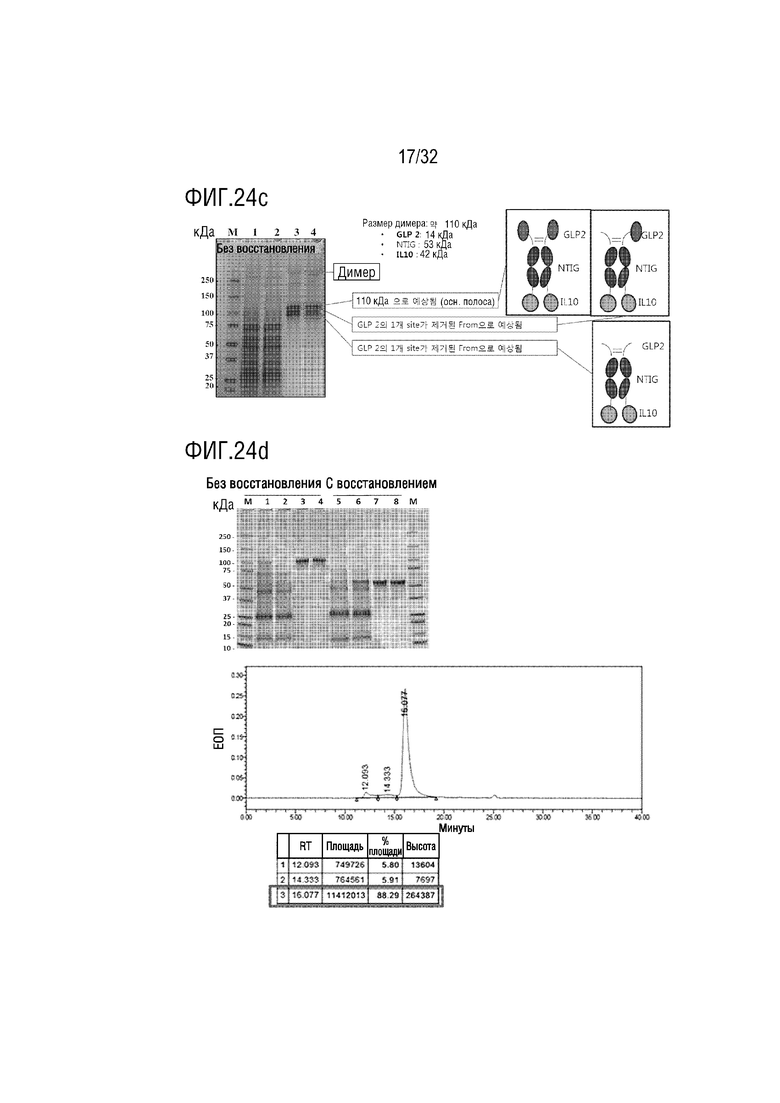
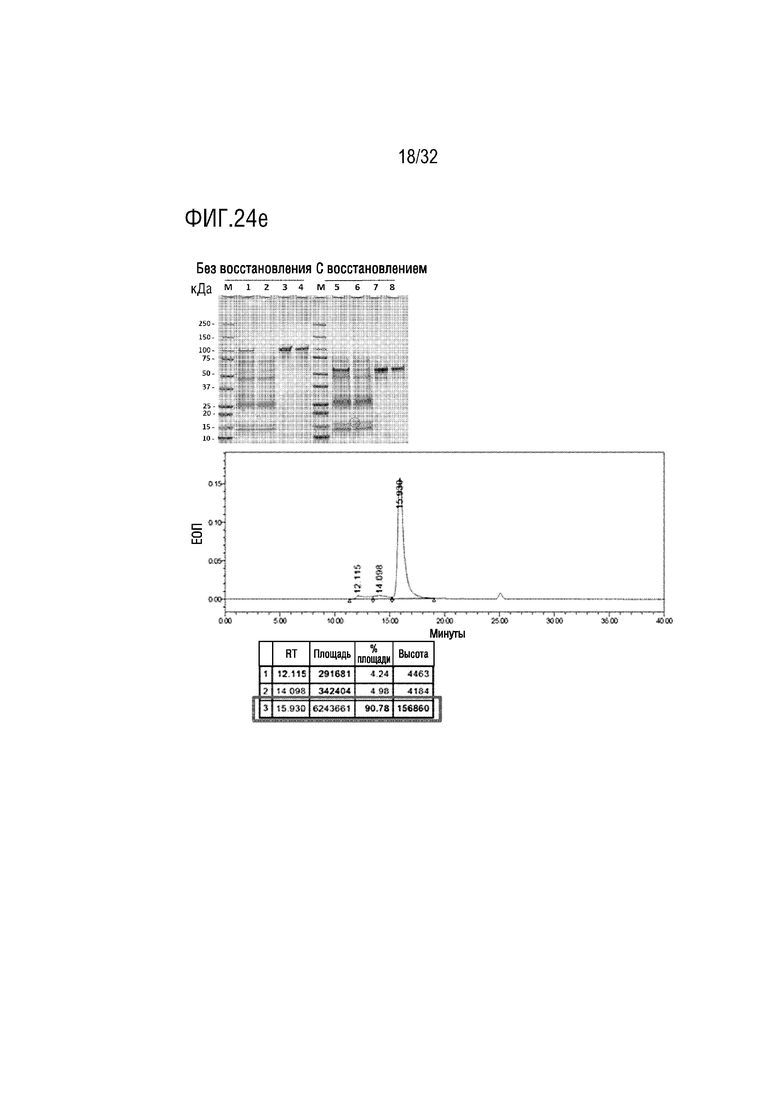
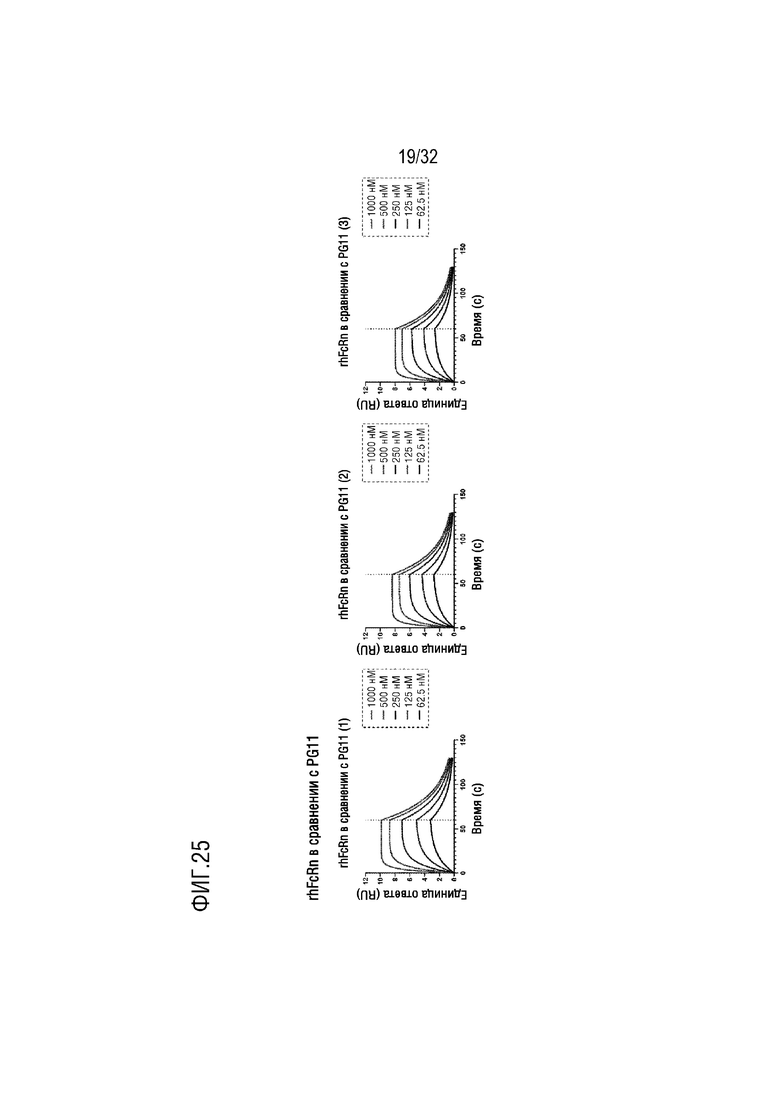
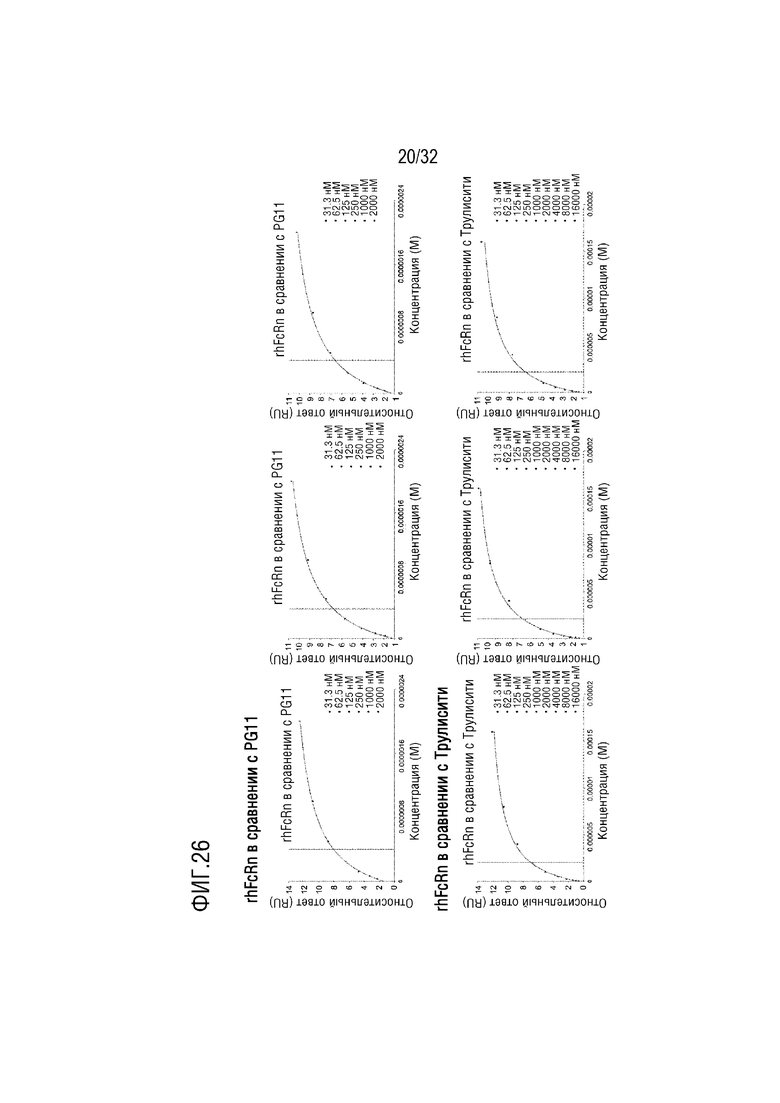
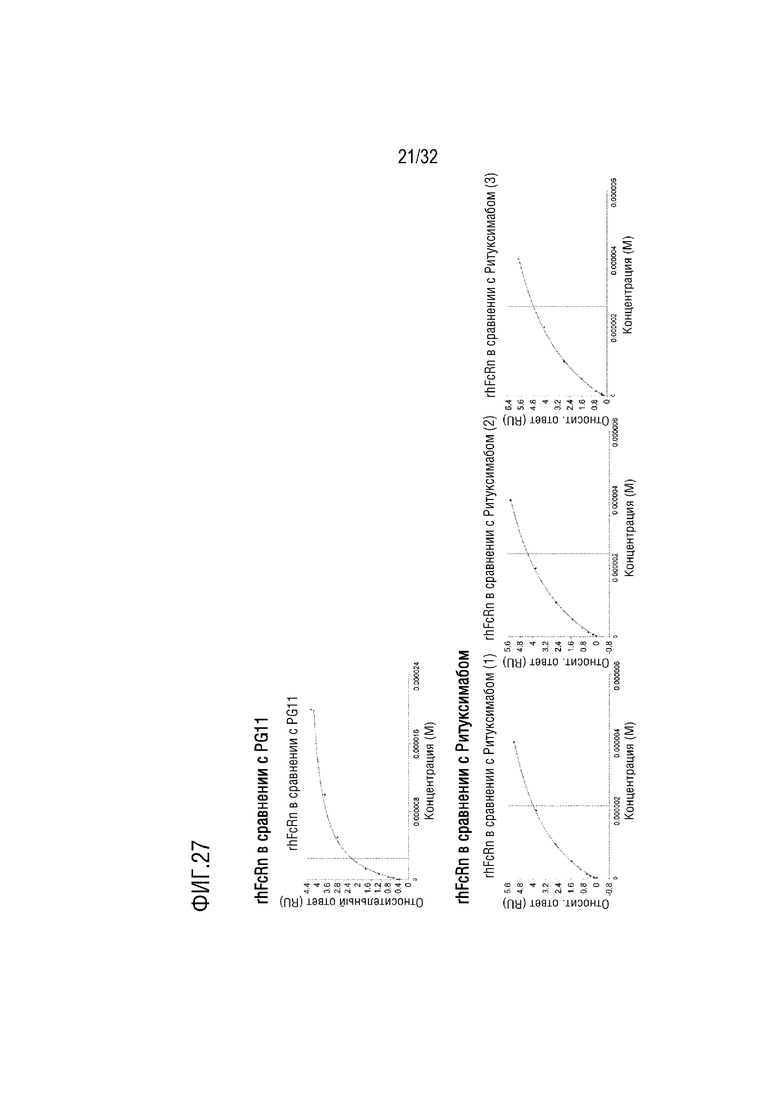
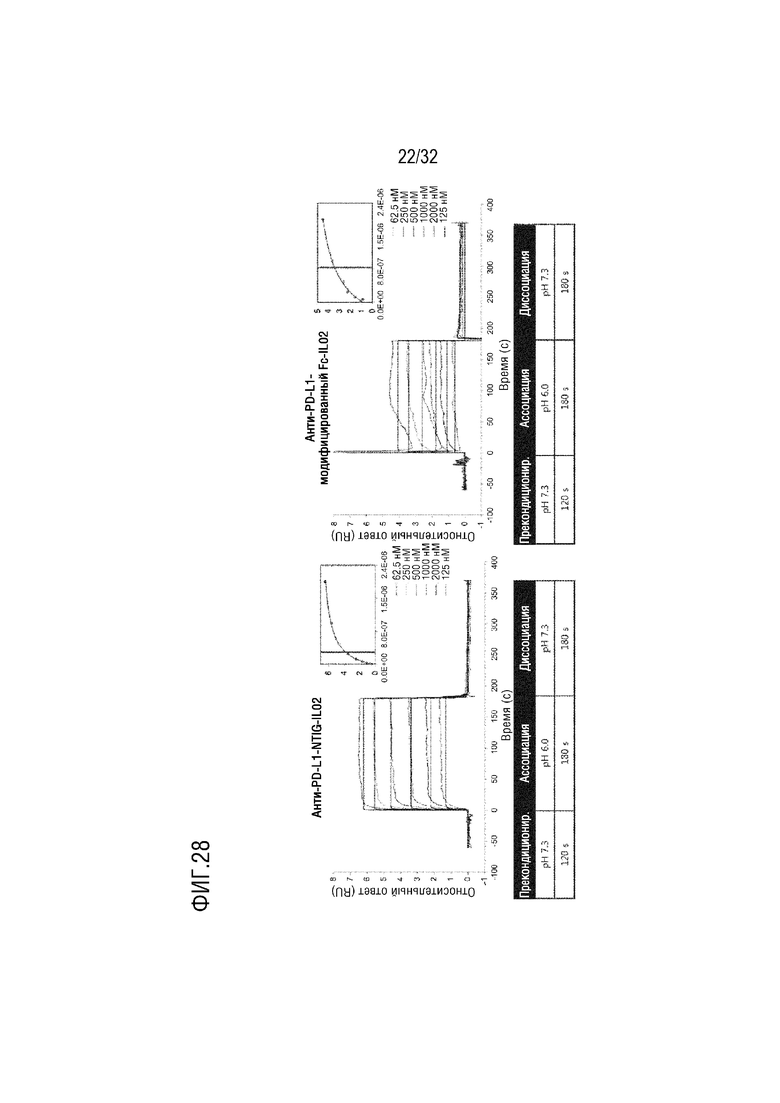
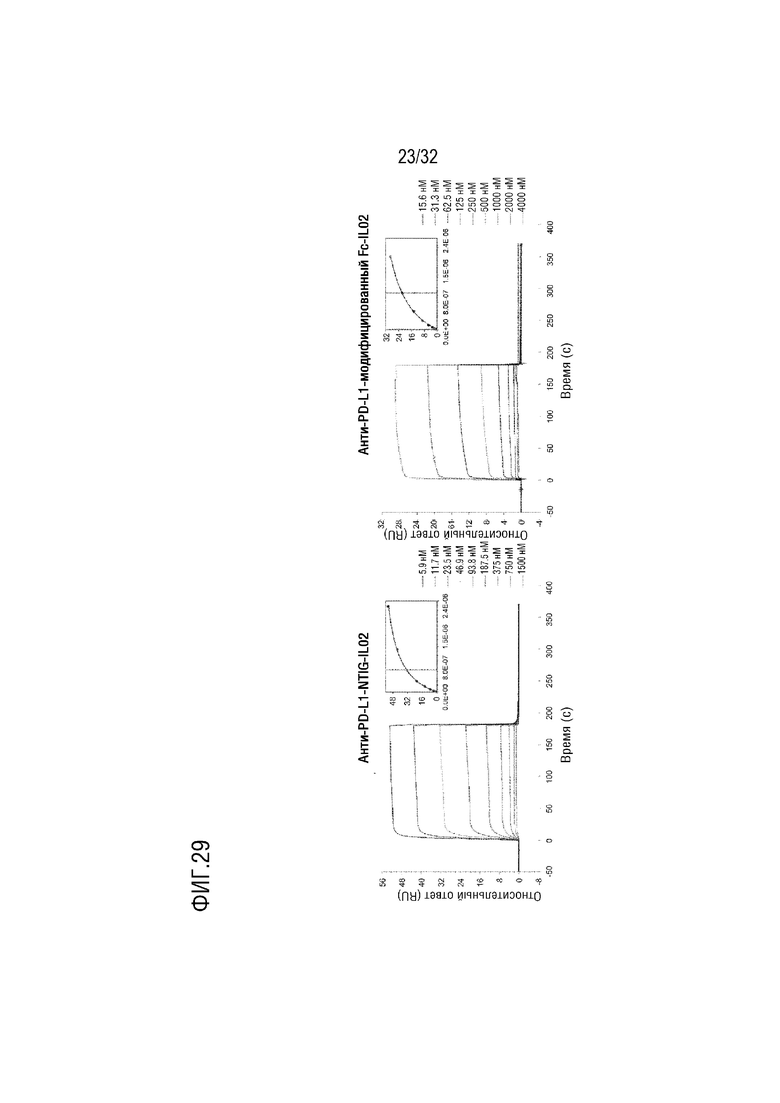
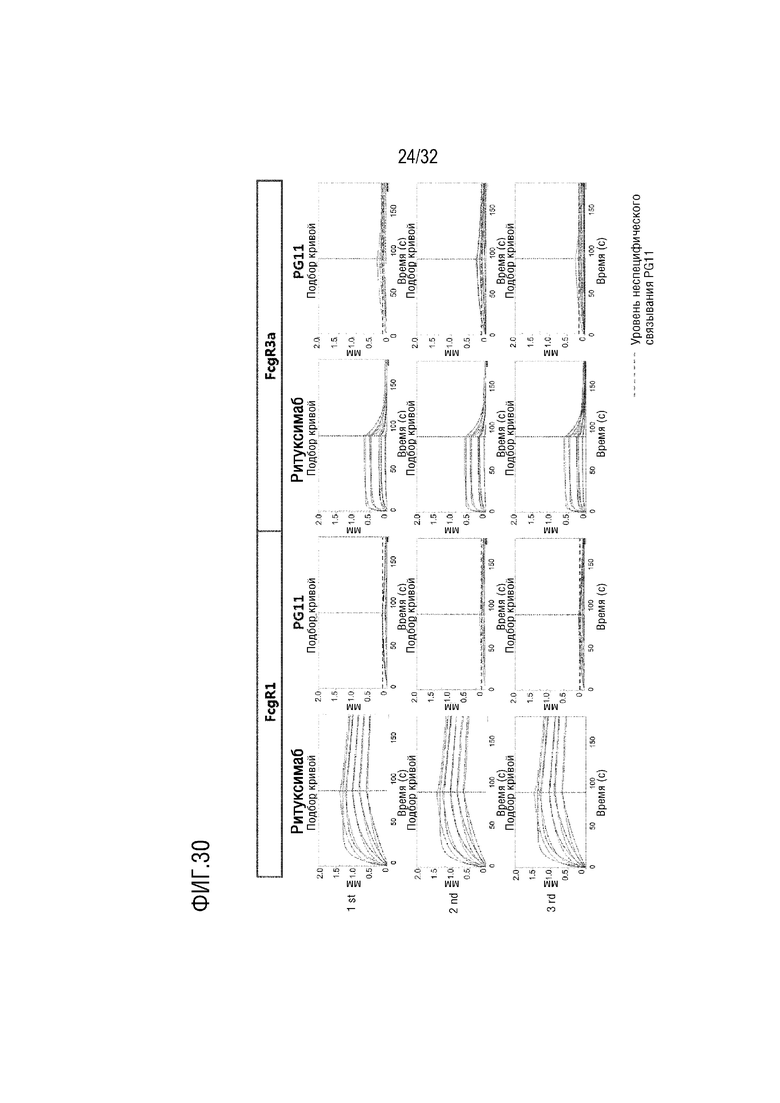
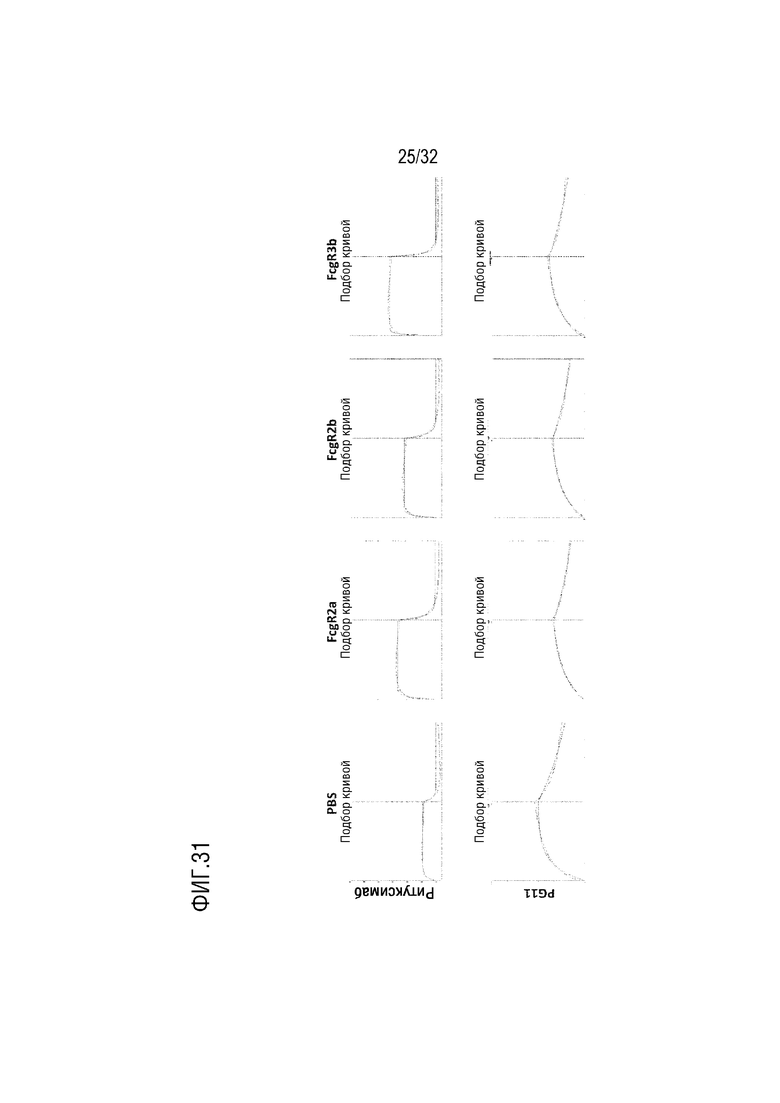
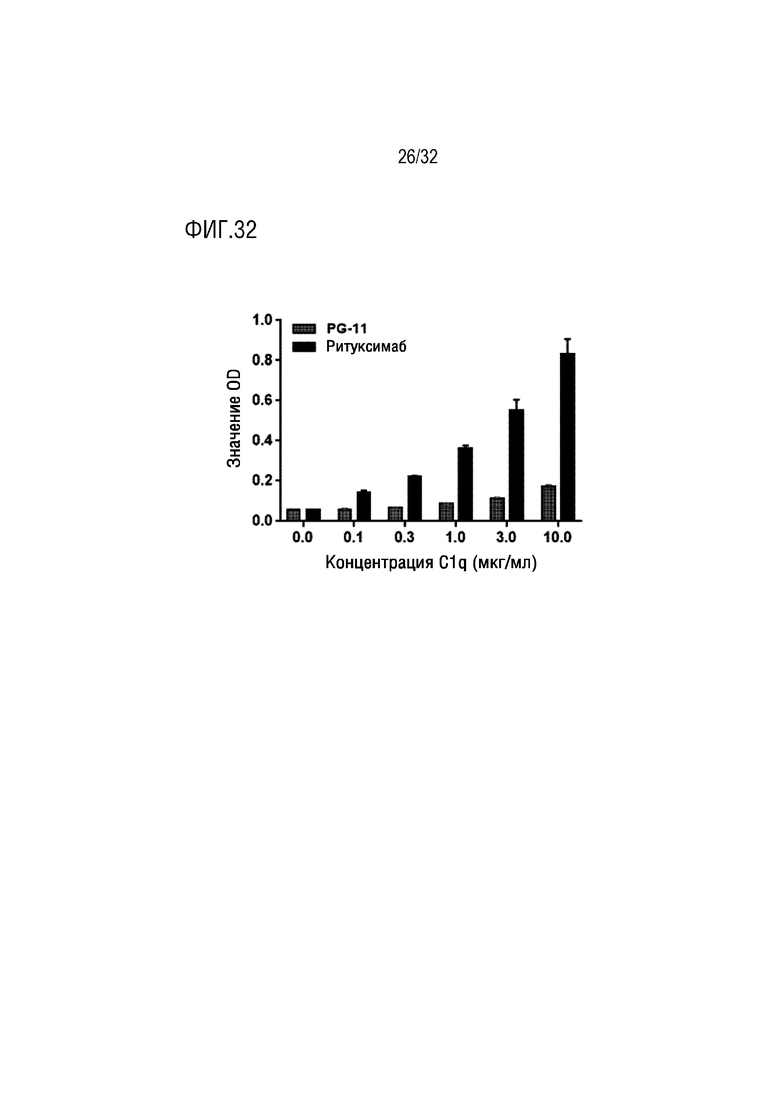
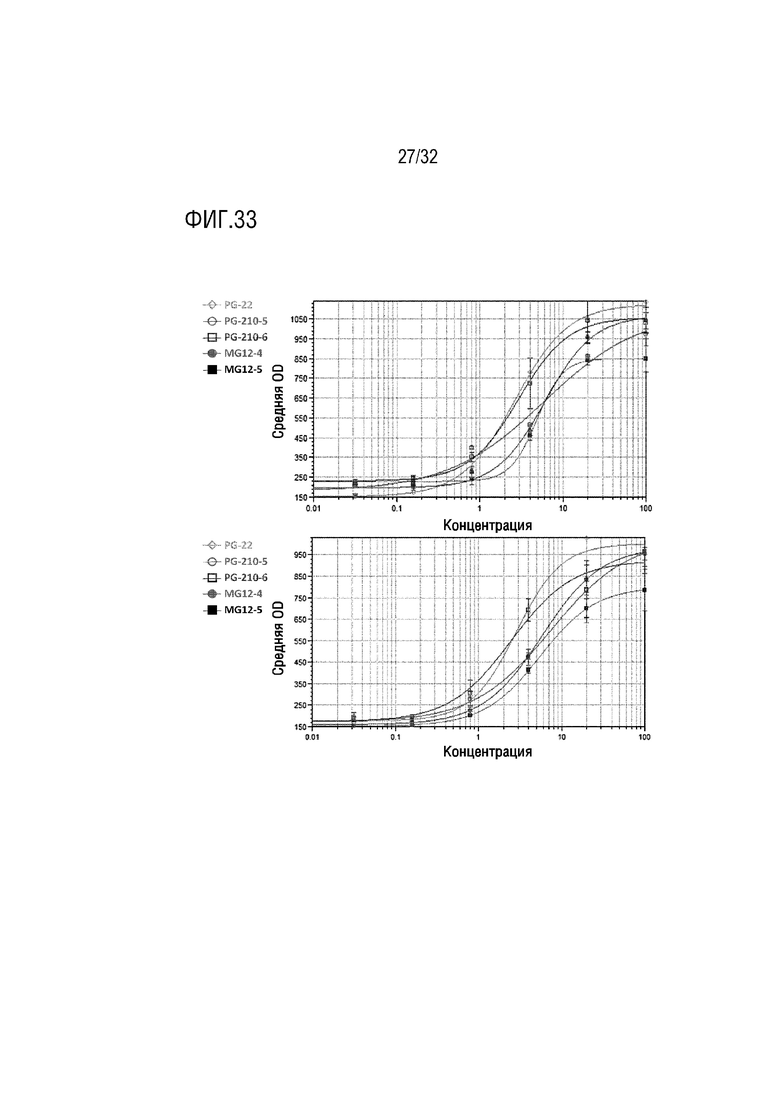
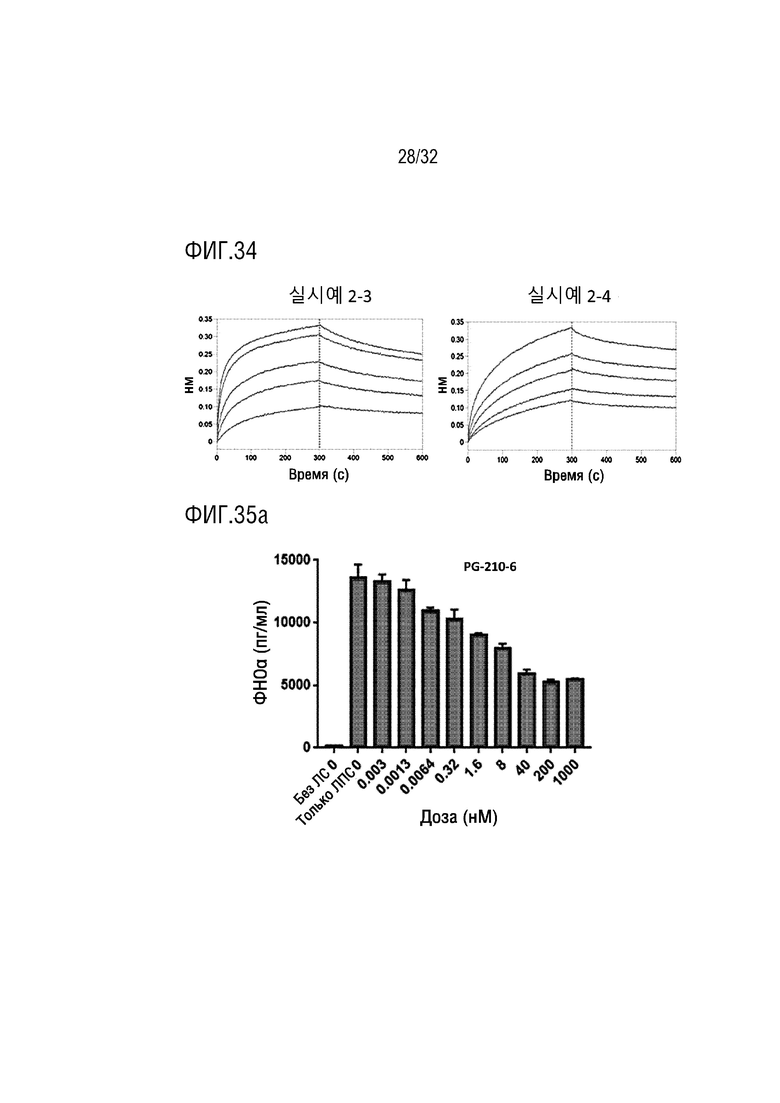
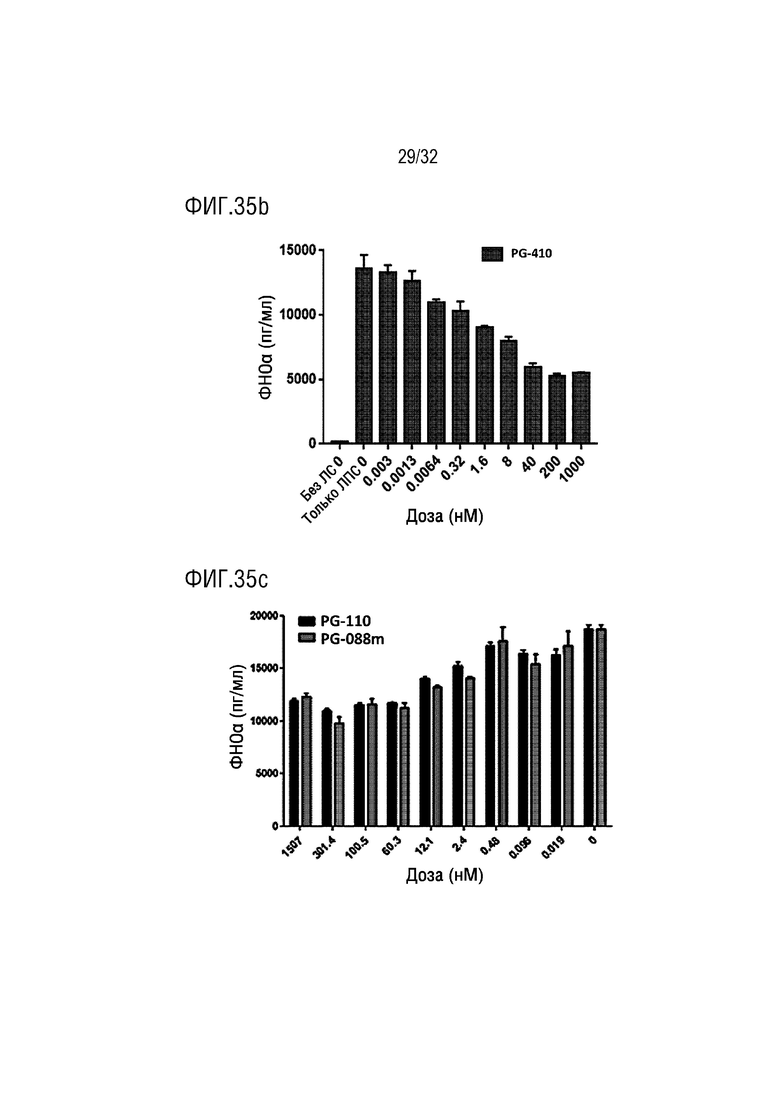
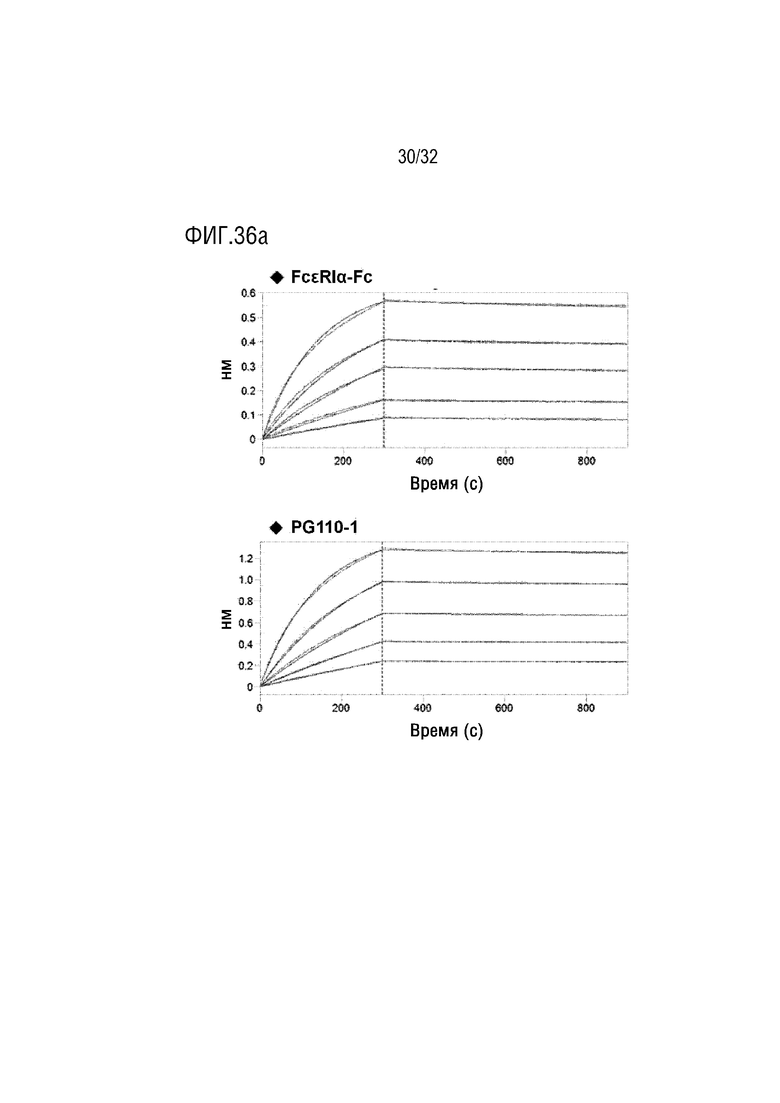
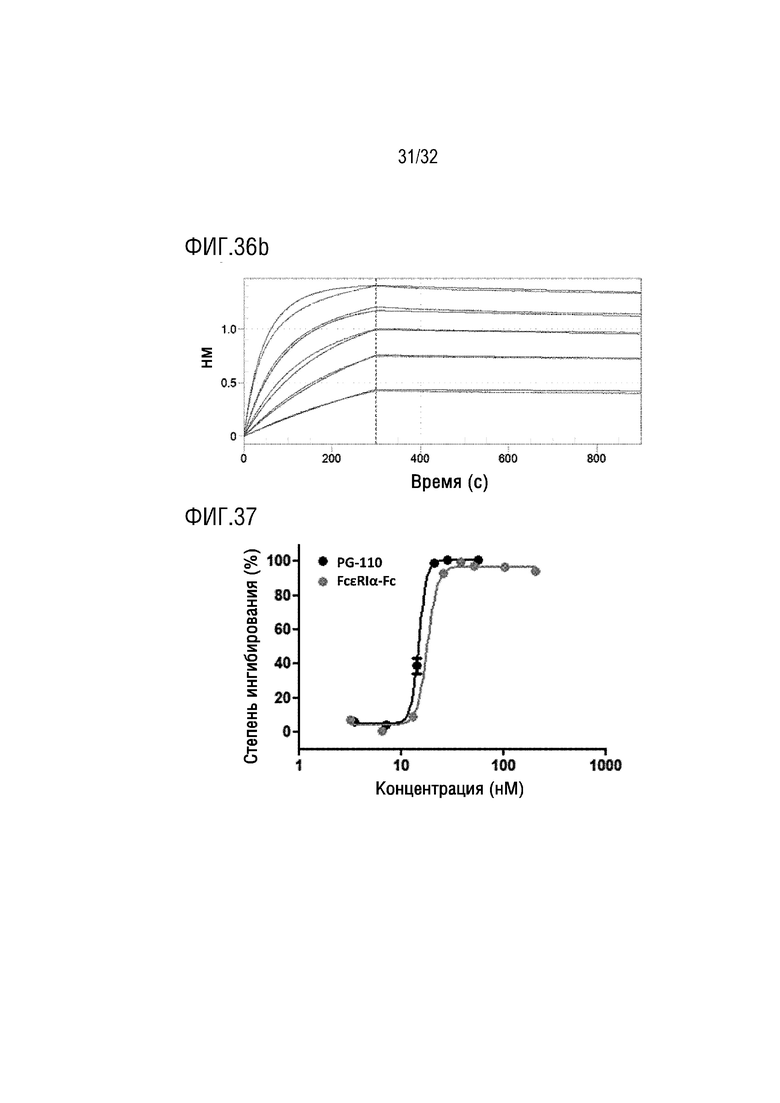

Настоящее изобретение относится к области биотехнологии, конкретно к вариантному белку Fc-домена иммуноглобулина, и может быть использовано для продления полупериода существования терапевтически активного белка in vivo при слиянии с ним вариантного белка Fc-домена иммуноглобулина. Предложен вариантный белок Fc-домена иммуноглобулина, содержащий SEQ ID NO: 6, 7, 8 или 9, слитый белок с ним, кодирующие их нуклеиновые кислоты и векторы экспрессии, гомо- и гетеродимеры слитого белка, а также способ увеличения полупериода существования терапевтического белка in vivo. Изобретение позволяет получить белки на основе Fc-домена иммуноглобулина с увеличенным полупериодом существования in vivo и минимизированной антителозависимой клеточной цитотоксичностью (ADCC) и комплементзависимой цитотоксичностью (CDC), связанные с Fc-областью. 9 н. и 2 з.п. ф-лы, 39 ил., 16 табл., 7 пр.
1. Вариантный белок Fc-домена иммуноглобулина, имеющий увеличенный полупериод существования in vivo и способный минимизировать антителозависимую клеточную цитотоксичность (ADCC) и комплементзависимую цитотоксичность (CDC), связанные с Fc-областью, содержащий аминокислотную последовательность, выбранную из группы, состоящей из SEQ ID NO: 6-9.
2. Слитый белок, имеющий увеличенный полупериод существования in vivo и способный минимизировать антителозависимую клеточную цитотоксичность (ADCC) и комплементзависимую цитотоксичность (CDC), связанные с Fc-областью, где по меньшей мере один терапевтический белок соединен с N-концом и/или C-концом вариантного белка Fc-домена иммуноглобулина по п.1.
3. Слитый белок по п.2, где терапевтический белок соединен с N-концом или C-концом вариантного белка Fc-домена иммуноглобулина через линкерный пептид или шарнирную область антитела.
4. Слитый белок по п.2, где терапевтический белок является цитокином, ферментом, фактором свертывания крови, внеклеточным доменом мембранного рецептора, фактором роста, пептидным гормоном или антителомиметиком.
5. Полинуклеотид, кодирующий вариантный белок Fc-домена иммуноглобулина по п.1.
6. Рекомбинантный экспрессионный вектор, включающий полинуклеотид по п.5.
7. Гомодимер, имеющий увеличенный полупериод существования in vivo и способный минимизировать антителозависимую клеточную цитотоксичность (ADCC) и комплементзависимую цитотоксичность (CDC), связанные с Fc-областью, включающий слитый белок по п.2.
8. Гетеродимер, имеющий увеличенный полупериод существования in vivo и способный минимизировать антителозависимую клеточную цитотоксичность (ADCC) и комплементзависимую цитотоксичность (CDC), связанные с Fc-областью, включающий слитый белок по п.2.
9. Способ увеличения полупериода существования терапевтического белка in vivo, включающий этап введения субъекту слитого белка, полученного в результате слияния терапевтического белка с вариантным белком Fc-домена иммуноглобулина по п.1, или гомодимера по п.7, или гетеродимера по п.8, которые содержат указанный слитый белок.
10. Полинуклеотид, кодирующий слитый белок по п.2.
11. Рекомбинантный экспрессионный вектор, включающий полинуклеотид по п.10.
| WO 2005037867 A1, 28.04.2005 | |||
| WO 2011122011 A2, 06.10.2011 | |||
| ГЕТЕРОДИМЕРИЗОВАННЫЙ ПОЛИПЕПТИД | 2012 |
|
RU2641256C2 |
| СЛИТНЫЕ БЕЛКИ ИММУНОГЛОБУЛИНОВ | 2008 |
|
RU2530168C2 |
| EL‐AMINE M | |||
| et al., In vivo induction of tolerance by an Ig peptide is not affected by the deletion of FcR or a mutated IgG Fc fragment, International immunology, 2002, v | |||
| Паровоз для отопления неспекающейся каменноугольной мелочью | 1916 |
|
SU14A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| JONNALAGADDA M | |||
| et al., Chimeric antigen | |||
Авторы
Даты
2023-08-01—Публикация
2020-05-14—Подача