Область техники, к которой относится изобретение
[1] Настоящее изобретение относится к композиции для предотвращения или лечения гепатита, фиброза печени и цирроза печени. В частности, настоящее изобретение относится к слитому белку, включающему биологически активный белок и мутантный белок FGF21; и фармацевтической композиции, содержащей слитый белок, которая является эффективной для предотвращения или лечения гепатита, фиброза печени и цирроза печени.
Уровень техники
[2] Существуют различные причины заболеваний печени, такие как вирусные или бактериальные инфекции, алкоголь или токсические вещества, избыточное накопление жира или тяжелых металлов, аномальные иммунные ответы и т.д. Эти причинами может быть вирусный гепатит, алкогольная болезнь печени, неалкогольная жировая болезнь печени, токсический гепатит, аутоиммунные заболевания печени и т.д. Кроме того, некоторые заболевания печени могут прогрессировать с развитием цирроза печени, фиброза печени и рака печени в результате хронического прогрессирования.
[3] Острое заболевание печени, такое как острый вирусный гепатит или токсический гепатит, вызывает сильную усталость, плохой аппетит, желтуху и т.д., и может иногда прогрессировать до острой печеночной недостаточности, которая может привести к смерти, если не сделать пересадку печени. С другой стороны, хронические заболевания печени, которые медленно прогрессируют, такие как хронический вирусный гепатит и жировая болезнь печени, в основном протекают бессимптомно, и пациенты могут не испытывать значительных неудобств в повседневной жизни, однако может развиваться фиброз печени, и хронические заболевания печени могут прогрессировать до цирроза печени и рака печени, хотя пациенты могут не знать об этом. Согласно статистическим данным по распространенности цирроза печени в Корее, распространенность цирроза печени у взрослых составляет 0,5%, а у людей в возрасте 65 лет и старше - около 1,0%. Это результат опроса, проведенного на основе сведений о диагностированных случаях заболевания в медицинских учреждениях, поэтому реальная распространенность цирроза печени, вероятно, будет более высокой. Наиболее частой причиной цирроза печени в Корее является вирусный гепатит, а второй наиболее частой причиной является алкогольная болезнь печени.
[4] Если повреждение печени постоянно повторяется по какой-либо причине, существует большой риск развития цирроза печени, фиброза печени и рака печени, независимо от присутствия или отсутствия симптомов. При развитии цирроза печени уплотненную печень сложно восстановить до ее первоначального состояния даже при лечении.
[5] Глюкагоноподобный пептид 1 (ГПП-1) является инкретиновым гормоном, состоящим из 31 аминокислоты, который секретируют L-клетки в кишечнике при стимуляции пищей и т.д. Его биологические эффекты возникают в результате внутриклеточной сигнализации через рецептор ГПП-1, сопряженный с G-белком рецептор, который экспрессируется в тканях-мишенях, таких как β-клетках в поджелудочной железе, головном мозге и т.д. ГПП-1, секретируемый в кровь, имеет очень короткий полупериод существования меньше 2 минут, что обусловлено потерей активности вследствие расщепления аминокислот на N-конце ферментом дипептидилпептидазой-4 (DPP-4). Поскольку ГПП-1 стимулирует секрецию инсулина в β-клетках поджелудочной железы в зависимости от уровня глюкозы в крови, он оказывает сильное действие на снижение уровня глюкозы в крови, не вызывая гипогликемии. Кроме того, введение ГПП-1 приводит к снижению массы тела в различных моделях на животных и у людей, что, как известно, вызвано снижением потребления пищи из-за его воздействия на подавление аппетита. ГПП-1 индуцирует пролиферацию β-клеток и повышает жизнеспособность β-клеток, ингибируя гибель клеток, вызванную токсичностью гликолипидов, через рецептор ГПП-1, экспрессируемый в β-клетках поджелудочной железы. Избыточная секреция глюкагона повышает уровень глюкозы в крови, что, как известно, является одной из причин гипергликемии у больных диабетом. Кроме того, известно, что ГПП-1 действует на α-клетки поджелудочной железы, ингибируя повышение уровня глюкозы в крови натощак посредством ингибирования секреции глюкагона, специфичного в отношении протеинкиназы A (PKA).
[6] Эксендин-4 является клинически важным агонистом рецептора ГПП-1. Эксендин-4 представляет собой полипептид из 39 аминокислотных остатков и обычно вырабатывается в слюнных железах ящерицы аризонского ядозуба. Известно, что эксендин-4 обладает гомологией 52% с аминокислотной последовательностей ГПП-1 и взаимодействует с рецептором ГПП-1 у млекопитающих (Thorens et al. (1993) Diabetes 42:1678-1682). Эксендин-4, как было показано, стимулировал секрецию инсулина в инсулин-продуцирующих клетках in vitro, при этом индукция секреции инсулина инсулинпродуцирующими клетками более сильная, чем у ГПП-1 при эквимолярных условиях. Хотя эксендин-4 сильно стимулирует секрецию инсулина, снижая уровни глюкозы в крови, как у грызунов, так и у людей, с более длительным действием, чем в случае ГПП-1, эксендин-4 демонстрирует антигенность у млекопитающих, лишенных ГПП-1, поскольку он содержит незнакомые эпитопы для таких животных.
[7] Способность аналогов ГПП-1 и эксендина-4 (например, лираглутида и эксенатида) улучшать контроль глюкозы у людей была подтверждена клинически. Сообщали, что ГПП-1 увеличивает β-клеточную массу путем ингибирования апоптоза и индуцированной пролиферации. Кроме того, также сообщали, что ГПП-1 действует в качестве кишечного гормона, ингибируя секрецию желудочного сока и опорожнение желудка, одновременно усиливая сигналы насыщения, снижая, таким образом, аппетит. Такое действие ГПП-1 может объяснять потерю веса, наблюдаемую при введении аналогов ГПП-1 пациентам с диабетом 2-го типа. Кроме того, ГПП-1 проявляет кардиозащитное действие после ишемии у грызунов.
[8] Предпринимали различные попытки создать аналоги ГПП-1 длительного действия. Клинически подтвержденные аналоги ГПП-1 длительного действия включают в себя дулаглутид (WO 2005/000892) и альбиглутид (WO 2003/059934). Дулаглутид является слитым с Fc-фрагментом аналогом ГПП-1, а альбиглутид является слитым с альбумином аналогом ГПП-1, при этом оба из них имеют фармакокинетические профили, позволяющие вводить их один раз в неделю. Оба лекарственных средства оказывают превосходное воздействие на снижение уровня глюкозы в крови и снижение массы тела при введении один раз в неделю, а также значительно обеспечивают значительно большее удобство лечения по сравнению с эксенатидом и лираглутидом.
[9] Между тем, фактор роста фибробластов 21 (FGF21), синтезируемый в печени, является гормоном, который, как известно, играет важную роль в гомеостазе глюкозы и липидов. FGF21 проявляет фармакологическое действие на печень, адипоциты, β-клетки поджелудочной железы, гипоталамус в головном мозге и мышечные ткани, где экспрессируются как FGF21-специфический рецептор, то есть рецептор FGF, так и β-Klotho комплекс. Сообщали, что в моделях различных диабетических и метаболических заболеваний на неотносящихся к человеку приматах и мышах FGF21 может снижать уровни глюкозы в крови инсулиннезависимым образом, снижать массу тела и снижать концентрации триглицеридов и липопротеинов низкой плотности (ЛПНП) в крови. Кроме того, известно, что FGF21 также обладает действием, улучшающим чувствительность к инсулину, и, таким образом, он обладает высоким потенциалом в качестве мишени для нового противодиабетического средства или лекарственного средства против ожирения (WO 2003/011213).
[10] Таким образом, для создания нового противодиабетического средства на основе FGF21 были предприняты попытки повысить его биологическую активность и стабильность in vivo путем конструирования мутантов FGF21 на основе последовательности FGF21 дикого типа посредством замены, вставки и делеции некоторых аминокислот (см. WO 2010/065439). Однако, поскольку FGF21 имеет очень короткий полупериод существования, оказалось проблематичным использовать его непосредственно в качестве биотерапевтического средства (Kharitonenkov, A. et al., Journal of Clinical Investigation 115:1627-1635, 2005). Полупериод существования FGF21 in vivo составляет от 1 до 2 часов у мышей и от 2,5 до 3 часов у обезьян. Следовательно, для применения FGF21 в его нынешней форме в качестве терапевтического средства для лечения диабета требуется ежедневное введение.
[11] Сообщали о различных подходах в попытке увеличить полупериод существования in vivo рекомбинантных белков FGF21. Одним из таких примеров является связывание полиэтиленгликоля (ПЭГ), то есть полимерного материала, с FGF21 для увеличения его молекулярной массы, ингибируя, таким образом, почечную экскрецию и увеличивая время удерживания in vivo (см. WO 2012/066075). В другом подходе пытались увеличить полупериод существования путем его слияния с жирной кислотой, которая связывается с человеческим альбумином (см. WO 2012/010553). В дополнительном примере предпринята попытка увеличить полупериод существования с сохранением фармакологической активности, эквивалентной активности FGF21 дикого типа, путем создания агонистического антитела, которое специфично связывается с рецептором FGF человека отдельно или в виде комплекса с β-klotho (см. WO 2012/170438). В другом примере полупериод существования был увеличен путем получения слитых белков длительного действия, в которых Fc-область IgG связывается с молекулой FGF21 (см. WO 2013/188181).
[12] Среди различных технологий, доступных для создания лекарственных средств длительного действия, широко применяется технология слияния с Fc-фрагментом, поскольку она имеет меньше недостатков, наблюдаемых в случае других подходов, таких как индукция иммунного ответа или токсическое действие при увеличении полупериода существования in vivo. Для создания Fc-слитого белка FGF21 в качестве лекарственного средства длительного действия должны быть выполнены следующие условия.
[13] Во-первых, снижение активности in vitro, вызванное слиянием, должно быть сведено к минимуму. Как N-конец, так и С-конец FGF21 вносят вклад в активность FGF21. В этом отношении известно, что активность слитых белков FGF21 значительно изменяется в зависимости от положения слияния. Соответственно, активность Fc-слитых белков FGF21, в которых мутации введены в FGF21, может изменяться в зависимости от присутствия/отсутствия или положения слияния. Во-вторых, фармакокинетический профиль, позволяющий производить введения людям с интервалом один раз в неделю, должен быть реализован путем увеличения полупериода существования in vivo посредством слияния. В-третьих, с учетом того, что иммуногенность можно ожидать у большинства пациентов после введения биофармацевтических средств, риск иммуногенности из-за слитого линкера или мутации должен быть сведен к минимуму. В-четвертых, не должно быть никаких проблем со стабильностью, связанных с положением слияния или введением мутации. В-пятых, поскольку нежелательные иммунные ответы могут возникать в зависимости от изотипов слитого иммуноглобулина, необходимо решение, которое позволит предотвратить такие ответы.
[14] Уже сообщали о попытке создать слитый белок длительного действия путем связывания Fc-области иммуноглобулина G (IgG) с молекулой FGF21 (см. WO 2013/188181). В случае одной структуры Fc-FGF21, где Fc слит с N-концом FGF21 дикого типа, хотя отсутствует явное различие в активности in vitro по сравнению с FGF21 дикого типа, полупериод существования, как известно, очень короткий вследствие расщепления белка in vivo. Чтобы решить эту проблему, была предпринята попытка увеличить полупериод существования in vivo путем введения нескольких мутаций в определенные участки FGF21, чтобы предотвратить расщепление белка. Однако при введении множественных мутаций риск иммуногенности может возрастать. Напротив, в случае структуры FGF21-Fc, где Fc слит с C-концом молекулы FGF21, известно, что наблюдается значительное снижение активности, вызванное слиянием в этом участке, по сравнению со структурой Fc-FGF21.
[15] Комбинированное введение ГПП-1 и FGF21 может оказывать синергический эффект по сравнению с отдельным введением в зависимости от механизмов действия и тканей-мишеней в организме, при этом можно ожидать превосходную противодиабетическую эффективность и дополнительные преимущества. Эффекты от комбинированного введения ГПП-1 и FGF21 или ГПП-1/слитого белка FGF21 уже были исследованы и описаны (см. WO 2010/142665 и WO 2011/020319).
[16] Для создания слитого белка, содержащего ГПП-1 и FGF21, необходимо решить различные проблемы. Поскольку ГПП-1 дикого типа и FGF21 дикого типа имеют очень короткий полупериод существования in vivo, их необходимо вводить по меньшей мере один раз в день, даже если они разработаны в качестве лекарственных средств. Таким образом, технологии получения препаратов длительного действия, такие как слияние с Fc-фрагментом, необходимы для создания слитого белка длительного действия в целях повышения удобства для пациентов. В лекарственном средстве двойной функции для двух мишеней ГПП-1 и FGF21 введение мутации(й) является существенным условием для сохранения активности и стабильности лекарственного средства in vivo, и проблемы, связанные с изменениями активности, структуры или стабильности, вызванные каждой мутацией, должны быть решены. Лекарственное действие для двух мишеней ГПП-1 и FGF21 должно быть хорошо сбалансировано, и для этой цели требуется создание лекарственных средств с учетом их активности in vitro, фармакокинетических профилей, фармакологической эффективности в моделях на животных и даже клинической оценки эффективности у людей. Слитый белок имеет структуру, которая не может существовать в организме человека, и является структурно сложным по сравнению со слитым белком к одной мишени. Кроме того, поскольку инженерия мутаций или линкеров необходима для баланса двух мишеней, может возрастат вероятность образования агрегатных комплексов, и для предотвращения этого может потребоваться дополнительная белковая инженерия. Кроме того, потенциальная иммуногенность может возрастать из-за появления новых мутационных последовательносткй или сложных структур, что следует учитывать или избегать.
[17] Авторы настоящего изобретения приложили усилия для решения вышеуказанных проблем и в результате разработали слитый белок, эффективный для лечения гепатита, фиброза печени и цирроза печени, и выполнили настоящее изобретение.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Техническая задача
[18] Цель настоящего изобретения состоит в предоставлении фармацевтической композиции для предотвращения или лечения гепатита, фиброза печени и цирроза печени.
Решение задачи
[19] В соответствии с одним объектом настоящего изобретения предложена фармацевтическая композиция для профилактики или лечения гепатита, фиброза печени и цирроза печени, содержащая в качестве эффективного компонента слитый белок, содержащий мутантный белок фактора роста фибробластов 21 (FGF21); и Fc-область иммуноглобулина, где мутантный белок FGF21 содержит по меньшей мере одну мутацию, выбранную из группы, состоящей из следующих мутаций (1)-(7):
[20] (1) замена аминокислот в положениях 98-101 от N-конца белка FGF21 дикого типа аминокислотной последовательностью EIRP (SEQ ID NO: 68);
[21] (2) замена аминокислот в положениях 170-174 от N-конца белка FGF21 дикого типа аминокислотной последовательностью TGLEAV (SEQ ID NO: 69);
[22] (3) замена аминокислот в положениях 170-174 от N-конца белка FGF21 дикого типа аминокислотной последовательностью TGLEAN (SEQ ID NO: 70);
[23] (4) замена аминокислоты в положении 170 от N-конца белка FGF21 дикого типа аминокислотой N;
[24] (5) замена аминокислоты в положении 174 от N-конца белка FGF21 дикого типа аминокислотой N;
[25] (6) замена аминокислоты в положении 180 от N-конца белка FGF21 дикого типа аминокислотой E, в сочетании с одной или более мутациями (1)-(5) выше; и
[26] (7) мутация 1-10 аминокислот для снижения иммуногенности белка FGF21 дикого типа.
[27] Кроме того, в соответствии с другим объектом настоящего изобретения предложена фармацевтическая композиция для предотвращения или лечения гепатита, фиброза печени и цирроза печени, содержащая в качестве эффективного компонента слитый белок, включающий мутантный белок фактора роста фибробластов 21 (FGF21); биологически активный белок или мутантный белок или его фрагмент; и Fc-область иммуноглобулина, где мутантный белок FGF21 включает по меньшей мере одну мутацию, выбранную из группы, состоящей из следующих мутаций (1)-(7):
[28] (1) замена аминокислот в положениях 98-101 от N-конца белка FGF21 дикого типа аминокислотной последовательностью EIRP (SEQ ID NO: 68);
[29] (2) замена аминокислот в положениях 170-174 от N-конца белка FGF21 дикого типа аминокислотной последовательностью TGLEAV (SEQ ID NO: 69);
[30] (3) замена аминокислот в положениях 170-174 от N-конца белка FGF21 дикого типа аминокислотной последовательностью TGLEAN (SEQ ID NO: 70);
[31] (4) замена аминокислоты в положении 170 от N-конца белка FGF21 дикого типа аминокислотой N;
[32] (5) замена аминокислоты в положении 174 от N-конца белка FGF21 дикого типа аминокислотой N;
[33] (6) замена аминокислоты в положении 180 от N-конца белка FGF21 дикого типа аминокислотой E, в сочетании с одной или более мутациями (1)-(5) выше; и
[34] (7) мутация 1-10 аминокислот для снижения иммуногенности белка FGF21 дикого типа.
[35] Кроме того, в соответствии с другим объектом настоящего изобретения предложено применение фармацевтической композиции настоящего изобретения для предотвращения или лечения гепатита, фиброза печени и цирроза печени
[36] Кроме того, в соответствии с другим объектом настоящего изобретения предложено применение фармацевтической композиции настоящего изобретения для получения композиции для предотвращения или лечения гепатита, фиброза печени и цирроза печени.
[37] Кроме того, в соответствии с другим объектом настоящего изобретения предложен способ предотвращения или лечения гепатита, фиброза печени и цирроза печени, который включает этап введения слитого белка настоящего изобретения субъекту.
Полезные эффекты изобретения
[38] Фармацевтическая композиция настоящего изобретения для предотвращения или лечения гепатита, фиброза печени и цирроза печени, содержащая в качестве эффективного компонента слитый белок, включающий мутантный белок фактора роста фибробластов 21 (FGF21); и Fc-область иммуноглобулина ингибирует пролиферацию воспалительных клеток и фибробластов, и, таким образом, может эффективно применяться в качестве композиции для предотвращения или лечения гепатита, фиброза печени и цирроза печени.
Краткое описание чертежей
[39] Фиг. 1A является графиком, на котором показаны in vitro активности DFD4, DFD5, DFD6, DFD7, DFD9 и DFD13 в качестве слитых белков, включающих мутантные белки FGF21 (в дальнейшем "слитый мутантный белок FGF21"), с использованием клеточной линии HEK293 с оверэкспрессией β-klotho человека. Слитые мутантные белки FGF21 не демонстрировали значимого снижения активности из-за введения мутации.
[40] Фиг. 1B является графиком, на котором показаны in vitro активности DFD6, DFD13, DFD18, DFD72, DFD73 и DFD74 в качестве слитых белков, включающих слитые мутантные белки FGF21, с использованием клеточной линии HEK293 с оверэкспрессией β-klotho человека. Слитые мутантные белки FGF21 не демонстрировали значимого снижения активности из-за введения мутации.
[41] Фиг. 1C является графиком, на котором показаны in vitro активности DFD6 и DFD6 (E. coli) в качестве слитых белков, включающих слитые мутантные белки FGF21, с использованием клеточной линии HEK293 с оверэкспрессией β-klotho человека. Слитые мутантные белки FGF21 не демонстрировали значимого снижения активности из-за введения мутации.
[42] Фиг. 2A является графиком, на котором показаны in vitro активности DFD3 и DFD4 в качестве слитых мутантных белков FGF21, в которые был введен линкер, соединяющий N-конец FGF21 и Fc-область, с использованием клеточной линии HEK293 с оверэкспрессией β-klotho человека. Слитый мутантный белок FGF21 не демонстрировал значимого снижения активности, хотя было показано небольшое различие в активности в зависимости от последовательности линкера.
[43] Фиг. 2B является графиком, на котором показаны in vitro активности DFD1 и DFD13 в качестве слитых мутантных белков FGF21, в которые был введен линкер, соединяющий N-конец FGF21 и Fc-область, с использованием клеточной линии HEK293 с оверэкспрессией β-klotho человека. Слитый мутантный белок FGF21 не демонстрировал значимого снижения активности, хотя было показано небольшое различие в активности в зависимости от последовательности линкера.
[44] Фиг. 3 является графиком, на котором показаны in vitro активности RGE (Amgen), Fc-FGF21 (Lilly) и DFD1 с использованием клеточной линии HEK293 с оверэкспрессией β-klotho человека. DFD1 и RGE (Amgen) обладали подобными активностями, тогда как Fc-FGF21 (Lilly) обладал в два раза более высокой in vitro активностью, чем остальные белки.
[45] Фиг. 4A представляет собой результат анализа с помощью эксклюзионной хроматографии DFD4, слитого мутантного белка FGF21.
[46] Фиг. 4B представляет собой результат анализа с помощью эксклюзионной хроматографии DFD13, слитого мутантного белка FGF21, в который была введена мутация EIRP.
[47] Фиг. 4C является графиком, на котором сравнивают предполагаемое содержание агрегатов высокой молекулярной массы (% HMW) DFD4 и DFD13 с использованием эксклюзионной хроматографии, чтобы проверить влияние мутации EIRP в FGF21 на стабильность слитого белка. Было подтверждено, что DFD13 был ассоциирован с более низким процентом агрегатов высокой молекулярной массы (% HMW) на начальной стадии и в момент времени больше чем через 2 недели по сравнению с DFD4, что указывает на то, что введение мутации EIRP повышает стабильность слитого мутантного белка FGF21, значительно уменьшая, таким образом, % HMW.
[48] На Фиг. 5 показана концентрация каждого белка в крови в зависимости от времени, в течение 96 часов после подкожного введения слитых мутантных белков FGF21. Данные представлены как средние значения и стандартное отклонение.
[49] Фиг. 6A является графиком, на котором показаны изменения массы тела, выраженной в граммах, после однократного введения DFD18 в модели на мышах с алиментарным ожирением от момента введения до дня 14. DFD18 продемонстрировал превосходный эффект снижения массы тела. Данные представлены как средние значения и среднеквадратические отклонения среднего.
[50] Фиг. 6B является графиком, на котором показаны изменения массы тела, выраженной в %, после однократного введения DFD18 в модели на мышах с алиментарным ожирением от момента введения до дня 14. DFD18 продемонстрировал превосходный эффект снижения массы тела. Данные представлены как средние значения и среднеквадратические отклонения среднего.
[51] Фиг. 7 является графиком, на котором показаны in vitro активности слитых белков ГПП-1 в зависимости от шарниров, которые связывают C-конец мутантов ГПП-1 и ГПП-1 с Fc-областью, с использованием клеточной линии CHO с оверэкспрессией человеческого рецептора ГПП-1. Как правило, слитый белок (DFD23), включающий последовательность ГПП-1 (A2G), демонстрировал в 2-3 раза более низкую активность, чем другие слитые белки, включающие другие мутантные последовательности ГПП-1. Не было показано значимого различия в активности ГПП-1 между слитыми белками, включающими мутантные последовательности, отличные от последовательности ГПП-1 (A2G).
[52] Фиг. 8A является графиком, на котором показаны ГПП-1 активности DFD59, DFD69, DFD112 и DFD114. ГПП-1 активности in vitro трех слитых белков (DFD69, DFD112 и DFD114) и Fc-слитого мутанта ГПП-1, не включающего FGF21, измеряли при использовании клеточной линии CHO с оверэкспрессией человеческого рецептора ГПП-1. Три слитых белка показали аналогичные значения EC50, а Fc-слитый мутант ГПП-1 (DFD59) показал приблизительно в 2 раза более высокую активность, чем остальные слитые белки.
[53] Фиг. 8B является графиком, на котором показана FGF21 активность DFD69, DFD112 и DFD114. Активности in vitro слитых белков в зависимости от мутантов FGF21 измеряли с использованием клеточной линии HEK293 с оверэкспрессией β-klotho человека. Было подтверждено, что активности in vitro части FGF21 у трех слитых белков были аналогичными.
[54] Фиг. 9A является графиком, на котором показаны концентрации лекарственного средства в сыворотке в зависимости от времени после подкожного введения части FGF21 слитых белков DFD69, DFD112 и DFD114. Данные представлены как средние значения и стандартное отклонение.
[55] Фиг. 9B является графиком, на котором показаны концентрации лекарственного средства в сыворотке в зависимости от времени после подкожного введения части ГПП-1 слитых белков DFD59, DFD69, DFD112 и DFD114. Данные представлены как средние значения и стандартное отклонение.
[56] Фиг. 10A является графиком, на котором показаны изменения уровней триглицеридов (ТГ) в сыворотке после многократного подкожного введения DFD114, DFD112, DFD74 или DFD72 в модели на мышах с алиментарным ожирением с интервалом 4 дня в течение 2 недель. Введение слитого белка и слитого мутантного белка FGF21 продемонстрировало гиполипидемические эффекты в сыворотке по сравнению с контрольной группой. Данные представлены как средние значения и среднеквадратические отклонения среднего. Статистический анализ проводили с использованием критерия Даннета для множественных сравнений после однофакторного дисперсионного анализа (***: p<0,001 в сравнении с контролем растворителем).
[57] Фиг. 10B является графиком, на котором показаны изменения уровня общего холестерина (ОХС) в сыворотке после многократного подкожного введения DFD114, DFD112, DFD74 или DFD72 в модели на мышах с алиментарным ожирением с интервалом 4 дня в течение 2 недель. Введение слитого белка и слитого мутантного белка FGF21 продемонстрировало гиполипидемические эффекты в сыворотке по сравнению с контрольной группой (***: p<0,001 в сравнении с контролем растворителем).
[58] Фиг. 1°C является графиком, на котором показаны изменения уровней триглицеридов (ТГ) в печени после многократного подкожного введения DFD114, DFD112, DFD74 или DFD72 в модели на мышах с алиментарным ожирением с интервалом 4 дня в течение 2 недель. Введение слитого мутантного белка FGF21 продемонстрировало гиполипидемические эффекты в печени по сравнению с контрольной группой (*: p<0,05, ***: p<0,001 в сравнении с контролем растворителем).
[59] На Фиг. 11 показаны патогистологические фотоснимки печени, полученные при многократном подкожном введении DFD114 или DFD112 в модели на мышах с алиментарным ожирением с интервалом 4 дня в течение 2 недель. Введение слитого белка продемонстрировало эффект снижения стеатоза печени по сравнению с контрольной группой.
[60] Фиг. 12A является графиком, на котором показаны изменения уровней АЛТ после многократного подкожного введения DFD112 и DFD72 с интервалом 2 дня в течение 4 недель в модели на мышах с неалкогольным стеатогепатитом, вызванным метионин-холин дефицитной (MCD) диетой. Уровни АЛТ снижались дозозависимо в группах, получавших слитый белок, по сравнению с контрольной группой, и уровни АЛТ также снижались в группе, получавшей слитый белок FGF21. Данные представлены как средние значения и среднеквадратические отклонения среднего. Статистический анализ проводили с использованием критерия Даннета для множественных сравнений после однофакторного дисперсионного анализа (###: p<0,001 в сравнении с контролем MCS, **: p<0,01, ***: p<0,001 в сравнении с контролем MCD).
[61] Фиг. 12B является графиком, на котором показаны изменения уровней АСТ после многократного подкожного введения DFD112 и DFD72 с интервалом 2 дня в течение 4 недель в модели на мышах с неалкогольным стеатогепатитом, вызванным метионин-холин дефицитной (MCD) диетой. Уровни АСТ снижались дозозависимо в группах, получавших слитый белок, по сравнению с контрольной группой, и уровни АСТ также снижались в группе, получавшей слитый мутантный белок FGF21 (###: p<0,001 в сравнении с контролем MCS, **: p<0,01 в сравнении с контролем MCD).
[62] Фиг. 12C является графиком, на котором показаны изменения уровней воспаления после многократного подкожного введения DFD112 и DFD72 с интервалом 2 дня в течение 4 недель в модели на мышах с неалкогольным стеатогепатитом, вызванным метионин-холин дефицитной (MCD) диетой. Уровни воспаления снижались дозозависимо в группах, получавших слитый белок, по сравнению с контрольной группой, и уровни воспаления также снижались в группе, получавшей слитый мутантный белок FGF21 (###: p<0,001 в сравнении с контролем MCS, ***: p<0,001 в сравнении с контролем MCD).
[63] Фиг. 13A является графиком, на котором показаны изменения альфа-актина гладких мышц (α-SMA), связанного с фиброзом индикатора в печени, после многократного подкожного введения DFD112 и DFD72 с интервалом 2 дня в течение 4 недель в модели на мышах с неалкогольным стеатогепатитом, вызванным MCD диетой. Экспрессия α-SMA была повышена в контрольной группе MCD по сравнению с метионин-холин стандартной (MCS) контрольной группой. С другой стороны, уровни α-SMA в группах, получавших слитый белок, и в группе, получавшей слитый мутантный белок FGF21, снижались по сравнению с контрольной группой. Данные представлены как средние значения и среднеквадратические отклонения среднего. Статистический анализ проводили с использованием критерия Даннета для множественных сравнений после однофакторного дисперсионного анализа (###: p<0,001 в сравнении с контролем MCS, ***: p<0,001 в сравнении с контролем MCD).
[64] Фиг. 13B является графиком, на котором показаны изменения трансформирующего фактора роста бета (TGF-β), связанного с фиброзом индикатора в печени, после многократного подкожного введения DFD112 и DFD72 с интервалом 2 дня в течение 4 недель в модели на мышах с неалкогольным стеатогепатитом, вызванным MCD диетой. Экспрессия TGF-β была повышена в контрольной группе MCD по сравнению с контрольной группой MCS. С другой стороны, уровни TGF-β в группах, получавших слитый белок, и в группе, получавшей слитый мутантный белок FGF21, снижались по сравнению с контрольной группой (###: p<0,001 в сравнении с контролем MCS, ***: p<0,001 в сравнении с контролем MCD).
[65] Фиг. 13C является графиком, на котором показан результат окрашивания пикросириусом красным, связанного с фиброзом индикатора в печени, после многократного подкожного введения DFD112 и DFD72 с интервалом 2 дня в течение 4 недель в модели на мышах с неалкогольным стеатогепатитом, вызванным MCD диетой. Количество коллагена возрастало в контрольной группе MCD по сравнению с контрольной группой MCS. С другой стороны, уровни пикросириуса красного в группах, получавших слитый белок, и в группе, получавшей слитый мутантный белок FGF21, снижались по сравнению с контрольной группой (###: p<0,001 в сравнении с контролем MCS, **: p<0,01 в сравнении с контролем MCD).
[66] На Фиг. 14 показаны патогистологические фотоснимки печени. Количество жира в тканях печени значительно уменьшилось.
[67] Фиг. 15A является графиком, на котором показаны изменения уровня АЛТ, биохимического показателя крови, после многократного подкожного введения DFD112 с интервалом 2 дня в течение 8 недель в модели на мышах с алиментарным ожирением и неалкогольным стеатогепатитом. При введении слитого белка наблюдали эффект снижения АЛТ в сыворотке по сравнению с контрольной группой. Данные представлены как средние значения и среднеквадратические отклонения среднего. Статистический анализ проводили с использованием критерия Даннета для множественных сравнений после однофакторного дисперсионного анализа (***: p<0,001).
[68] Фиг. 15B является графиком, на котором показаны изменения уровней АСТ после многократного подкожного введения DFD112 с интервалом 2 дня в течение 8 недель в модели на мышах с алиментарным ожирением и неалкогольным стеатогепатитом. При введении слитого белка наблюдали эффект снижения АСТ в сыворотке по сравнению с контрольной группой (***: p<0,001).
[69] Фиг. 15C является графиком, на котором показаны изменения уровня ТГ после многократного подкожного введения DFD112 с интервалом 2 дня в течение 8 недель в модели на мышах с алиментарным ожирением и неалкогольным стеатогепатитом. При введении слитого белка наблюдали эффект снижения ТГ в сыворотке по сравнению с контрольной группой (*: p<0,05, ***: p<0,001).
[70] Фиг. 15D является графиком, на котором показаны изменения уровней ОХС после многократного подкожного введения DFD112 с интервалом 2 дня в течение 8 недель в модели на мышах с алиментарным ожирением и неалкогольным стеатогепатитом. При введении слитого белка наблюдали эффект снижения ОХС в сыворотке по сравнению с контрольной группой (***: p<0,001).
[71] На Фиг. 16A представлены графики, на которых показаны изменения оценок активности НЖБП (NAS) в период до и после введения в печени после многократного подкожного введения DFD112 с интервалом 2 дня в течение 8 недель в модели на мышах с алиментарным ожирением и неалкогольным стеатогепатитом. При введении слитого белка оценка активности НЖБП после введения снизилась по сравнению с оценкой до введения.
[72] На Фиг. 16B представлены графики, на которых показаны изменения оценок фиброза печени в период до и после введения в печени после многократного подкожного введения DFD112 с интервалом 2 дня в течение 8 недель в модели на мышах с алиментарным ожирением и неалкогольным стеатогепатитом. При введении слитого белка оценка фиброза печени после введения снизилась по сравнению с оценкой до введения.
[73] Фиг. 17A является графиком, на котором показаны изменения уровней ЩФ, биохимического показателя крови, после многократного подкожного введения DFD112 с интервалом 2 дня в течение 8 недель в модели индуцированного тиоацетамидом (TAA) фиброза печени на крысах. При введении слитого белка наблюдали эффект снижения ЩФ в сыворотке по сравнению с контрольной группой TAA. Данные представлены как средние значения и среднеквадратические отклонения среднего. Статистический анализ проводили с использованием критерия Даннета для множественных сравнений после однофакторного дисперсионного анализа (###: p<0,001 в сравнении со здоровым контролем, **: p<0,01 в сравнении с контролем TAA).
[74] Фиг. 17B является графиком, на котором показаны изменения уровней ГГТ, биохимического показателя крови, после многократного подкожного введения DFD112 с интервалом 2 дня в течение 8 недель в модели индуцированного тиоацетамидом (TAA) фиброза печени на крысах. При введении слитого белка наблюдали эффект снижения ГГТ в сыворотке по сравнению с контрольной группой TAA (###: p<0,001 в сравнении со здоровым контролем, *: p<0,05 в сравнении с контролем TAA).
[75] Фиг. 17C является графиком, на котором показаны изменения уровней ОБил, биохимического показателя крови, после многократного подкожного введения DFD112 с интервалом 2 дня в течение 8 недель в модели индуцированного тиоацетамидом (TAA) фиброза печени на крысах. При введении слитого белка наблюдали эффект снижения ОБил в сыворотке по сравнению с контрольной группой (##: p<0,01 в сравнении со здоровым контролем, *: p<0,05 в сравнении с контролем TAA).
[76] Фиг. 17D является графиком, на котором показаны изменения площади пораженных фиброзом участков в печени после многократного подкожного введения DFD112 с интервалом 2 дня в течение 8 недель в модели индуцированного тиоацетамидом (TAA) фиброза печени на крысах. При введении слитого белка наблюдали эффект уменьшения площади фиброза по сравнению с контрольной группой (###: p<0,001 в сравнении со здоровым контролем, ***: p<0,001 в сравнении с контролем TAA).
Наилучший вариант осуществления изобретение
[77] Далее настоящее изобретение описано более подробно.
[78] Слитый белок, содержащийся в качестве действующего компонента в композиции для предотвращения или лечения гепатита, фиброза печени и цирроза печени согласно настоящему изобретению, включает мутантный белок фактора роста фибробластов 21 (FGF21); и Fc-область иммуноглобулина, где мутантный белок FGF21 включает по меньшей мере одну мутацию, выбранную из группы, состоящей из следующих мутаций (1)-(7):
[79] (1) замена аминокислот в положениях 98-101 от N-конца белка FGF21 дикого типа аминокислотной последовательностью EIRP (SEQ ID NO: 68);
[80] (2) замена аминокислот в положениях 170-174 от N-конца белка FGF21 дикого типа аминокислотной последовательностью TGLEAV (SEQ ID NO: 69);
[81] (3) замена аминокислот в положениях 170-174 от N-конца белка FGF21 дикого типа аминокислотной последовательностью TGLEAN (SEQ ID NO: 70);
[82] (4) замена аминокислоты в положении 170 от N-конца белка FGF21 дикого типа аминокислотой N;
[83] (5) замена аминокислоты в положении 174 от N-конца белка FGF21 дикого типа аминокислотой N;
[84] (6) замена аминокислоты в положении 180 от N-конца белка FGF21 дикого типа аминокислотой E, в сочетании с одной или более мутациями (1)-(5) выше; и
[85] (7) мутация 1-10 аминокислот для снижения иммуногенности белка FGF21 дикого типа.
[86] Слитый белок может дополнительно включать биологически активный белок или его мутант или фрагмент.
[87] В частности, слитый белок, содержащийся в качестве действующего компонента в композиции для предотвращения или лечения гепатита, фиброза печени и цирроза печени согласно настоящему изобретению, включает мутантный белок фактора роста фибробластов 21 (FGF21); биологически активный белок или его мутант или фрагмент; и Fc-область иммуноглобулина, где мутантный белок FGF21 включает по меньшей мере одну мутацию, выбранную из группы, состоящей из следующих мутаций (1)-(7):
[88] (1) замена аминокислот в положениях 98-101 от N-конца белка FGF21 дикого типа аминокислотной последовательностью EIRP (SEQ ID NO: 68);
[89] (2) замена аминокислот в положениях 170-174 от N-конца белка FGF21 дикого типа аминокислотной последовательностью TGLEAV (SEQ ID NO: 69);
[90] (3) замена аминокислот в положениях 170-174 от N-конца белка FGF21 дикого типа аминокислотной последовательностью TGLEAN (SEQ ID NO: 70);
[91] (4) замена аминокислоты в положении 170 от N-конца белка FGF21 дикого типа аминокислотой N;
[92] (5) замена аминокислоты в положении 174 от N-конца белка FGF21 дикого типа аминокислотой N;
[93] (6) замена аминокислоты в положении 180 от N-конца белка FGF21 дикого типа аминокислотой E, в сочетании с одной или более мутациями (1)-(5) выше; и
[94] (7) мутация 1-10 аминокислот для снижения иммуногенности белка FGF21 дикого типа.
[95] Белок FGF21 дикого типа представляет собой гормон, который, как известно, играет важную роль в гомеостазе глюкозы и жиров, может быть получен от млекопитающего, такого как человек, мышь, свинья или обезьяна и т.д., предпочтительно человека. Более предпочтительно белок FGF21 дикого типа может быть человеческим белком FGF21 дикого типа, имеющим аминокислотную последовательность, представленную в SEQ ID NO:1.
[96] Мутация, включенная в мутантные белки FGF21, предпочтительно может быть любой из мутаций EIRP, TGLEAV, TGLEAN, G170N и G174N; комбинацией любой из мутаций TGLEAV, TGLEAN, G170N и G174N и мутации EIRP; комбинацией любой из мутаций EIRP, TGLEAV, TGLEAN, G170N и G174N и мутации A180E; или комбинацией любой из мутаций TGLEAV, TGLEAN, G170N и G174N, мутации EIRP и мутации A180E. Кроме того, мутантные белки FGF21 могут иметь конформацию, в которой 1-10 аминокислот на N-конце или C-конце удалены по сравнению с белком FGF21 дикого типа. Более предпочтительно мутантные белки FGF21 могут включать аминокислотную последовательность, представленную любой из SEQ ID NO: 6-23. Еще более предпочтительно мутантные белки FGF21 могут включать аминокислотную последовательность, представленную любой из SEQ ID NO: 6-23, и дополнительно имеют конформацию, в которой 1-10 аминокислот на N-конце или C-конце удалены по сравнению с белком FGF21 дикого типа.
[97] В слитом белке остаток аспарагина (N), введенный в результате мутации мутантного белка FGF21, может быть гликозилирован.
[98] Биологически активный белок может быть белком, выбранным из группы, состоящей из инсулина, C-пептида, лептина, глюкагона, гастрина, желудочного ингибиторного полипептида (ЖИП), амилина, кальцитонина, холецистокинина, пептида YY, нейропептида Y, костного морфогенетического белка 6 (BMP-6), костного морфогенетического белка 9 (BMP-9), оксинтомодулина, окситоцина, глюкагоноподобного пептида 1 (ГПП-1), глюкагоноподобного пептида 2 (ГПП-2), ирисина, содержащего домен фибронектина III типа белка 5 (FNDC5), апелина, адипонектина, родственного C1q и фактору некроза опухоли белка (семейства CTRP), резистина, висфатина, оментина, ретинолсвязывающего белка 4 (RBP-4), глицентина, ангиопоэтина, интерлейкина 22 (IL-22), эксендина-4 и гормона роста. Предпочтительно, биологически активный белок может быть белком, выбранным из ГПП-1, его мутанта и эксендина-4. В частности, слитый белок может одновременно демонстрировать действие ГПП-1 и действие белка FGF21.
[99] При использовании в настоящем документе термин "инсулин" относится к белку, синтезируемому и секретируемому бета-клетками поджелудочной железы, который является гормоном, играющим важную роль в поддержании постоянного уровня глюкозы в крови. Инсулин секретируется, если уровень глюкозы в крови высокий, что позволяет глюкозе в крови поступать в клетки для хранения в форме гликогена и ингибирует продукцию глюкозы в гепатоцитах. Он также способствует окислению глюкозы и превращению в жирные кислоты в жировых тканях. В мышцах он способствует абсорбции аминокислот для синтеза белков. Эпинефрин и глюкагон действуют как антагонисты инсулина, повышая уровень глюкозы в крови.
[100] При использовании в настоящем документе термин "C-пептид" относится к пептиду, который соединяет A и B цепи проинсулина. C-пептид секретируется вместе с инсулином секреторными гранулами клеток поджелудочной железы, но не расщепляет в крови, таким образом, он используется в качестве показателя инсулин-секретирующей функции поджелудочной железы.
[101] При использовании в настоящем документе термин "лептин" относится к гормону, который поддерживает массу телесного жира, секретируемого жировыми тканями, на постоянном уровне. Лептин, секретируемый жировой тканью, воздействует на головной мозг, подавляя аппетит и активируя обмен веществ в организме, снижая, таким образом, массу тела.
[102] При использовании в настоящем документе термин "глюкагон" относится к белку, синтезируемому и секретируемому поджелудочной железой, который является гормоном, секретируемым в ответ на сниженный уровень сахара в крови, играющим важную роль повышения уровня сахара в крови. Глюкагон состоит из 29 аминокислотных остатков и секретируется α-клетками островков Лангерганса.
[103] При использовании в настоящем документе термин "гастрин" относится к гормону, секретируемому в дистальном отделе желудка, который вызывает секрецию желудочного сока и выработку панкреатического сока, и вызывает сокращения желудка, тонкой кишки и толстой кишки.
[104] При использовании в настоящем документе термин "гастрин-ингибирующий полипептид" относится к линейному полипептиду, который ингибирует всю желудочную секрецию.
[105] При использовании в настоящем документе термин "амилин" относится к гормону, синтезируемому и секретируемому бета-клетками поджелудочной железы, который регулирует метаболизм глюкозы, как инсулин.
[106] При использовании в настоящем документе термин "кальцитонин" относится к гормону щитовидной железы, который регулирует уровень кальция в крови. Кальцитонин представляет собой полипептид, состоящий из 32 аминокислот, секретируемый C-клетками щитовидной железы.
[107] При использовании в настоящем документе термин "холецистокинин" относится к гормону, состоящему из 33 аминокислот, вырабатываемому I-клетками двенадцатиперстной кишки и тощей кишки. Холецистокинин ускоряет сокращение селезенки, способствует секреции ферментов поджелудочной железы и ингибирует секрецию желудочного сока.
[108] При использовании в настоящем документе термин "пептид YY" является сокращением от пептида тирозин-тирозин, который относится к полипептиду, состоящему из 36 аминокислот, секретируемому клетками толстой кишки и подвздошной кишки в ответ на пищу.
[109] При использовании в настоящем документе термин "нейропептид Y" относится к биологически активному пептиду, состоящему из 36 аминокислот, C-конец которого аминирован. Нейропептид Y широко представлен в центральной и периферической нервной системе позвоночных животных и регулирует артериальное давление в симпатической нервной системе, а также участвует в эндокринной или автономной нервной регуляции, пищевом поведении, памяти и циркадианном ритме в центральной нервной системе позвоночных животных.
[110] При использовании в настоящем документе термин "остеогенный белок 6", также называемый BMP-6, относится к белку, непосредственно участвующему в остеогенезе.
[111] При использовании в настоящем документе термин "остеогенный белок 9", также называемый BMP-9, относится к белку, непосредственно участвующему в остеогенезе.
[112] При использовании в настоящем документе термин "оксинтомодулин" относится к полипептиду, состоящему из 37 аминокислот, секретируемому муральными клетками слизистой оболочки. Оксинтомодулин оказывает сильное анорексигенное действие.
[113] При использовании в настоящем документе термин "окситоцин" относится к гормону, состоящему из 9 аминокислот, который вызывает сокращение матки при введении и способствует секреции молока во время кормления грудью.
[114] При использовании в настоящем документе термин "ГПП-1" относится к инкретиновому гормону, состоящему из 31 аминокислоты, секретируемому в L-клетках кишечника при стимуляции пищей и т.п. Например, белок ГПП-1 может быть представлен аминокислотной последовательностью SEQ ID NO: 42.
[115] Мутант ГПП-1 может быть представлен, например, аминокислотной последовательностью любого из SEQ ID NO: 43-46.
[116] При использовании в настоящем документе термин "ирисин" относится к гормону, секретируемому мышцами при физической нагрузке и достигающему адипоцитов с током крови, расщепляя жиры, например, при конверсии белых адипоцитов в бурые адипоциты. Ирисин состоит из 112 аминокислот и является усеченным фрагментом мембранного белка, называемого FNDC5.
[117] При использовании в настоящем документе термин "FNDC5" является сокращением для белка содержащего домен типа III Фибронектин 5 и относится к сущности предшественника диафрагмирования.
[118] При использовании в настоящем документе, термин "апелин" относится к пептиду, кодируемому геном APLN. Апелин синтезируется и секретируется в жировых тканях и имеет такую же функцию, как инсулин.
[119] При использовании в настоящем документе термин "адипонектин" относится к белку, секретируемому адипоцитами, который повышает инсулинорезистентность.
[120] При использовании в настоящем документе термин "семейство CTRP" относится к родственному C1q и фактору некроза опухоли белку, который является одним из представителей семейства адипокинов и главным образом действует на печень и мышечные ткани, регулируя обмен глюкозы и липидов, и т.д.
[121] При использовании в настоящем документе термин "резистин" относится к недавно обнаруженному адипокину, секретируемому адипоцитами, который является белком, состоящим из 108 аминокислот, и известен в качестве вещества, повышенного при дифференцировке жировой ткани и способного к ингибированию дифференцировки адипоцитов.
[122] При использовании в настоящем документе термин "висфатин" относится к одному из адипокинов, вырабатываемых и секретируемых жировыми тканями, который является белком массой 52 кДа.
[123] При использовании в настоящем документе термин "оментин" относится к одному из адипокинов, вырабатываемых и секретируемых жировыми тканями, который является белком, имеющим противовоспалительное действие.
[124] При использовании в настоящем документе термин "ретинолсвязывающий белок 4" относится к белку, секретируемому адипоцитами, который несет витамин A, который повышает инсулинорезистентность.
[125] При использовании в настоящем документе термин "глицетин" относится к основному энтероглюкагону в пищеварительном тракте, который состоит из 69 аминокислот, включающих все 29 аминокислот глюкагона между аминокислотами в положениях 33-66.
[126] При использовании в настоящем документе термин "ангиопоэтин", также называемый ANG, относится к белку, который действует во время роста кровеносных сосудов или эндотелиальных клеток сосудов или во время заживления ран в организме.
[127] При использовании в настоящем документе термин "IL-22", также называемый IL-TIF, относится к белку, кодируемому геном IL-22. IL-22 секретируется NK-клетками или T-клетками, активированными в ответ на бактериальные антигены в эпителиальных клетках.
[128] При использовании в настоящем документе термин "Fc-область", "Fc-фрагмент" или "Fc" относится к белку, который включает константную область тяжелой цепи 1 (CH1), константную область тяжелой цепи 2 (CH2) и константную область тяжелой цепи 3 (CH3) иммуноглобулина, но не включает вариабельные области тяжелой и легкой цепей и константную область легкой цепи 1 (CL1) иммуноглобулина. Кроме того, при использовании в настоящем документе термин "мутант Fc-области" относится к мутанту, полученному при замене части аминокислот Fc-области или комбинировании Fc-областей различных типов.
[129] Fc-область иммуноглобулина может быть полноразмерной Fc-областью, составляющей антитело, ее фрагментом или мутантом Fc-области. Кроме того, Fc-область включает молекулу в форме мономера или мультимера и может дополнительно включать шарнирную область константной области тяжелой цепи. Мутант Fc-области может быть модифицирован для предотвращения расщепления в шарнирной области. Кроме того, шарнирная последовательность Fc может иметь замену в некоторых аминокислотных последовательностях для снижения антителозависимой клеточно-опосредованной цитотоксичности (ADCC) или комплементзависимой цитотоксичности (CDC). Кроме того, часть аминокислотной последовательности Fc-шарнирной последовательности может быть заменена для ингибирования перестройки Fab-области. Лизин (K) на С-конце Fc-области может быть удален.
[130] Предпочтительно, Fc-область иммуноглобулина может быть любой из Fc-областей IgG1, IgG2, IgG3, IgG4 и IgD; или гибридным Fc, который является их комбинацией. Кроме того, гибридный Fc может включать область IgG4 и область IgD. Кроме того, гибридная Fc-область может включать часть шарнирной последовательности и CH2 Fc-области IgD, а также CH2 и CH3 последовательности Fc-области IgG4.
[131] Кроме того, Fc-фрагмент согласно настоящему изобретению может находиться в форме гликозилированной цепи дикого типа, более гликозилированной цепи, чем цепь дикого типа, менее гликозилированной цепи, чем цепь дикого типа. Увеличение, уменьшение или удаление гликозилированной цепи может быть выполнено с помощью стандартного способа, известного в данной области, такого как химический способ, ферментативный способ и генно-инженерный способ с использованием микроорганизмов.
[132] Предпочтительно, Fc-область иммуноглобулина может быть представлена аминокислотной последовательностью, выбранной из SEQ ID NO: 24-26, 47 и 48.
[133] Слитый белок может включать биологически активный белок, Fc-область иммуноглобулина и мутантный белок FGF21, связанные в таком порядке от N-конца к С-концу. Кроме того, слитый белок может включать мутантный белок FGF21, Fc-область иммуноглобулина и биологически активный белок, связанные в таком порядке от N-конца к С-концу. Предпочтительно, слитый белок может включать биологически активный белок, Fc-область иммуноглобулина и мутантный белок FGF21, связанные в таком порядке от N-конца к С-концу.
[134] Кроме того, слитый белок может включать мутантный белок ГПП-1, Fc-область иммуноглобулина и мутантный белок FGF21, связанные в таком порядке от N-конца к С-концу. Кроме того, слитый белок может включать мутантный белок FGF21, Fc-область иммуноглобулина и мутантный белок ГПП-1, связанные в таком порядке от N-конца к С-концу. Предпочтительно, слитый белок может включать мутантный белок ГПП-1, Fc-область иммуноглобулина и мутантный белок FGF21, связанные в таком порядке от N-конца к С-концу.
[135] Кроме того, слитый белок может дополнительно включать линкер.
[136] Слитый белок может находиться в форме, в которой мутантный белок FGF21 непосредственно соединен с N-концом или C-концом Fc-области иммуноглобулина, или мутантный белок FGF21 соединен с Fc-областью иммуноглобулина через линкер.
[137] В таком случае линкер может быть соединен с N-концом, C-концом или свободным радикалом Fc-фрагмента, а также может быть связан с N-концом, C-концом или свободным радикалом мутантного белка FGF21. В случае, когда линкер является пептидным линкером, соединение может происходить в любой области. Например, линкер может быть соединен с C-концом Fc-области иммуноглобулина и N-концом мутантного белка FGF21, с образованием слитого белка Fc-области иммуноглобулина и мутантного белка FGF21.
[138] Кроме того, слитый белок согласно настоящему изобретению может находиться в форме, в которой биологически активный белок связан с N-концом Fc-области иммуноглобулина слитого белка.
[139] Если линкер и Fc экспрессированы отдельно, а затем соединены, линкер может быть сшивающим агентом, известным в данной области техники. Примеры сшивающего агента могут включать 1,1-бис(диазоацетил)-2-фенилэтан, глутаровый альдегид, имидоэфиры, в том числе сложный эфир N-гидроксисукцинимида, такой как 4-азидосалициловую кислоту, и дисукцинимидиловые сложные эфиры, такие как 3,3'-дитиобис(сукцинимидилпропионат), и бифункциональные малеимиды, такие как бис-N-малеимидо-1,8-октан, но не ограничиваются ими.
[140] Кроме того, линкер может быть пептидом. Предпочтительно, линкер может быть пептидом, состоящим из 10-30 аминокислотных остатков.
[141] Кроме того, аланин может быть дополнительно присоединен к концу линкера. Предпочтительно, линкер может быть пептидом, имеющим аминокислотную последовательность, представленную любой из SEQ ID NO: 2-5.
[142] Слитый белок может находиться в форме, в которой димер или мультимер мутантных белков FGF21, в котором связаны друг с другом один или более мутантных белков FGF21, соединен с Fc-областью иммуноглобулина. Кроме того, слитый белок может находиться в форме димера или мультимера, в котором связаны две или более Fc-областей иммуноглобулина, где с Fc-областями иммуноглобулина связан мутантный белок FGF21.
[143] Кроме того, в частности, слитый белок может быть представлен аминокислотной последовательностью любого из SEQ ID NO: 36-39. Более конкретно, он может быть представлен аминокислотной последовательностью SEQ ID NO: 36, 37 или 39.
[144] Кроме того, слитый белок может быть пептидом, который предпочтительно имеет аминокислотную последовательность, представленную любой из SEQ ID NO: 58-67. Более предпочтительно, слитый белок может быть пептидом, который имеет аминокислотную последовательность, представленную SEQ ID NO: 65, 66 или 67.
[145] Мутантный белок FGF21 может дополнительно включать мутацию 1-10 аминокислот для снижения иммуногенности белка FGF21 дикого типа. Иммуногенность может быть предсказана с помощью стандартного способа, известного из уровня техники. Например, скрининг на потенциальную иммуногенность белка может быть выполнен с помощью, например, методов iTope™ и TCED™.
[146] Кроме того, мутация для уменьшения иммуногенности может быть введена с помощью стандартного способа, известного из уровня техники. Например, если иммуногенность наблюдается при выполнении анализа EpiScreen™ для оценки потенциальной иммуногенности, аминокислотные последовательности, вызывающие иммуногенность, могут быть определены путем картирования T-клеточных эпитопов, и мутанты с минимизированной иммуногенностью могут быть созданы с помощью предсказания in silico.
[147] Слитый белок может применяться для предотвращения или лечения гепатита, фиброза печени и цирроза печени.
[148] В частности, гепатит может быть острым вирусным гепатитом, хроническим гепатитом, алкогольным гепатитом, аутоиммунным гепатитом, фульминантным гепатитом или неалкогольным стеатогепатитом (НАСГ). В частности, цирроз печени может быть алкогольным циррозом печени или первичным билиарным циррозом.
[149] Кроме того, фармацевтическая композиция может дополнительно включать фармацевтический носитель. Фармацевтический носитель может быть любым носителем при условии, что он является нетоксичным материалом, подходящим для доставки антител пациентам. Например, дистиллированная вода, спирт, жиры, воски и неактивные твердые вещества могут быть включены в качестве носителя. Фармацевтически приемлемые вспомогательные вещества (буферные вещества, дисперсанты) могут быть также включены в фармацевтическую композицию. В таких композициях концентрация слитого белка может сильно изменяться.
[150] В частности, фармацевтическая композиция может содержать различные добавки для изменения, поддержания или сохранения pH, осмолярности, вязкости, прозрачности, цвета, изотоничности, запаха, стерильности, стабильности, скорости растворения или высвобождения, адсорбции или проницаемости композиции. Для подходящего состава она может дополнительно включать аминокислоты (например, глицин, глутамин, аспарагин, аргинин или лизин), противомикробные средства, антиоксиданты (например, аскорбиновую кислоту, сульфит натрия или бисульфит натрия), буферные вещества (например, борат, бикарбонаты, трис-HCl, цитрат, фосфат или другие органические кислоты), объемообразующие вещества (например, маннит или глицин), хелатообразующие вещества (например, этилендиаминтетрауксусную кислоту (ЭДТА)), комплексообразующие вещества (например, кофеин, поливинилпирролидион, β-циклодекстрин или гидроксипропил-β-циклодекстрин), наполнители, моносахариды, дисахариды и другие углеводы (например, глюкозу, маннозу или декстрин), белки (например, сывороточный альбумин, желатин или иммуноглобулин), красители, ароматизаторы, разбавители, эмульгаторы, гидрофильные полимеры (например, поливинилпирролидон), низкомолекулярные полипептиды, солеобразующие противоионы (например, натрий), консерванты (например, хлорид бензалкония, бензойную кислоту, салициловую кислоту, тимеросал, фенетиловый спирт, метилпарабен, пропилпарабен, хлоргексидин, сорбиновую кислоту или перекись водорода), растворители (например, глицерин, пропиленгликоль или полиэтиленгликоль), сахароспирты (например, маннит или сорбит), суспендирующие вещества, поверхностно-активные вещества или увлажнители (например, плюроники; ПЭГ; сложный эфир сорбитана; полисорбат, например полисорбат 20 или полисорбат 80; тритон; трометамин; лецитин; холестерин или тилоксапол), добавки, повышающие стабильность (например, сахарозу или сорбит), добавки, улучшающие рост (например, галогениды щелочных металлов, предпочтительно хлорид натрия или хлорид калия, или маннит, сорбит), носители для доставки, разбавители, вспомогательные вещества и/или фармацевтические адъюванты, но не ограничивается этим.
[151] Кроме того, в настоящем изобретении также предложен способ предотвращения или лечения гепатита, фиброза печени и цирроза печени, который включает введение фармацевтической композиции согласно изобретению субъекту, нуждающемуся в лечении. Такой способ может включать введение эффективного количества слитого белка согласно настоящему изобретению млекопитающему, имеющему симптом гепатита, такого как острый вирусный гепатит, хронический гепатит, алкогольный гепатит, аутоиммунный гепатит, фульминантный гепатит, неалкогольный стеатогепатит (НАСГ). Он также может включать введение эффективного количества слитого белка согласно настоящему изобретению млекопитающему, имеющему симптом цирроза печени, например, алкогольного цирроза печени, первичного билиарного цирроза и фиброза печени.
[152] Фармацевтическая композиция согласно настоящему изобретению может быть введена любым путем. Композиция согласно настоящему изобретению может быть предоставлена животному непосредственно (например, наружно, при введении в области ткани путем инъекции, трансплантации или наружного применения) или системно (например, путем перорального или парентерального введения) любым подходящим способом. В случае, когда композицию согласно настоящему изобретению вводят парентерально путем внутривенного, подкожного, глазного, внутрибрюшинного, внутримышечного, перорального, ректального, интраорбитального, интрацеребрального, внутричерепного, интраспинального, интравентрикулярного, интратекального, интрацистернального, интракапсулярного, интраназального или аэрозольного введения, композиция предпочтительно является водной или может включать часть биологически применимой для организма жидкой суспензии или раствора. Соответственно, носитель или растворитель может быть добавлен в композицию и доставлен пациенту, поскольку он является биологически применимым. Таким образом, биологически пригодный физиологический раствор обычно может быть включен в качестве носителя, как физиологическая жидкость для лекарственных форм.
[153] Кроме того, частота введения может изменяться в зависимости от фармакокинетических параметров слитого белка в используемых композициях. Обычно врачи вводят композицию до тех пор, пока не будет достигнута вводимая доза, требуемая для достижения нужного эффекта. Таким образом, композицию можно вводить в виде единичной дозы, по меньшей мере двух доз с временными интервалами (которые могут содержать или не содержать одинаковое количество целевого слитого белка) или вводить путем непрерывной инъекции через устройство для трансплантации или катетер. Точность добавления подходящей вводимой дозы может быть стандартно обеспечена специалистами в данной области техники и соответствует объему работы, которую они обычно выполняют.
[154] Кроме того, предпочтительная единичная доза слитого белка в случае медицинского применения может находиться в диапазоне от 0,01 мкг/кг до 100 мг/кг массы тела и более предпочтительно от 1 мкг/кг до 10 мг/кг массы тела. Хотя это количество является оптимальным, стандартная доза может изменяться в зависимости от заболевания, подлежащего лечению, или присутствия/отсутствия побочных эффектов. Тем не менее, оптимальная вводимая доза может быть определена с помощью проведения стандартного эксперимента. Введение слитого белка может быть выполнено путем периодической болюсной инъекции, внешнего резервуара (например, пакета для внутривенной инфузии) или непрерывного внутривенного, подкожного или внутрибрюшинного введения из внутреннего источника (например, биоразлагаемого имплантата).
[155] Кроме того, слитый белок согласно настоящему изобретению могут вводить соответствующему реципиенту в сочетании с другими биологически активными молекулами. Оптимальная комбинация слитого белка и другой молекулы (молекул), лекарственных форм и оптимальных доз может быть определена с помощью стандартного эксперимента, известного в данной области.
[156] В настоящем изобретении предложено применение фармацевтической композиции согласно изобретению, содержащей слитый белок в качестве эффективного компонента для предотвращения или лечения гепатита, фиброза печени и цирроза печени.
[157] В настоящем изобретении предложено применение фармацевтической композиции согласно изобретению, содержащей слитый белок в качестве эффективного компонента для получения композиции для предотвращения или лечения гепатита, фиброза печени и цирроза печени.
[158] В еще одном аспекте настоящее изобретение относится к выделенной молекуле нуклеиновой кислоты, кодирующей слитый белок. Выделенная молекула нуклеиновой кислоты может быть выбрана из группы, состоящей из ДНК, РНК и мРНК, и, в частности, она может быть ДНК.
[159] В таком случае выделенные молекулы нуклеиновой кислоты, кодирующие слитый белок, могут иметь последовательности, отличающиеся друг от друга из-за избыточности кодонов. Кроме того, в случае, если выделенная нуклеиновая кислота может давать слитый белок, выделенная нуклеиновая кислота может быть соответствующим образом модифицирована, или нуклеотид может быть добавлен на N-конец или С-конец выделенной нуклеиновой кислоты в соответствии с требуемыми целями.
[160] Выделенные молекулы нуклеиновых кислот могут включать, например, нуклеотидную последовательность, представленную любой из SEQ ID NO: 71-80.
[161] В еще одном аспекте настоящего изобретения предложен вектор экспрессии, включающий выделенную молекулу нуклеиновой кислоты.
[162] При использовании в настоящем документе термин "вектор экспрессии" относится к вектору, содержащему последовательность нуклеиновой кислоты, которая подходит для трансформации клетки-хозяина и направляет или контролирует экспрессию встроенной гетерологичной последовательности нуклеиновой кислоты. Вектор экспрессии включает линейную нуклеиновую кислоту, плазмиду, фагмиду, космиду, РНК вектор, вирусный вектор и их аналоги. Примеры вирусного вектора включают ретровирус, аденовирус и аденоассоциированный вирус, но не ограничены ими.
[163] При использовании в настоящем документе термин "экспрессия гетерологичной последовательности нуклеиновой кислоты" или "экспрессия" целевого белка относится к транскрипции встроенной последовательности ДНК, трансляции мРНК транскрипта и продукции Fc-слитого белкового продукта, антитела или фрагмента антитела.
[164] Пригодным вектором экспрессии может быть RcCMV (Invitrogen, Carlsbad) или его мутант. Пригодный вектор экспрессии может включать промотор цитомегаловируса человека (ЦМВ) для стимуляции непрерывной транскрипции гена-мишени в клетке млекопитающего и сигнальную последовательность полиаденилирования бычьего гормона роста для повышения уровня посттранскрипционной стабильности РНК. В примере осуществления настоящего изобретения вектором экспрессии является pAD15, который является модифицированным вектором RcCMV.
[165] В еще одном аспекте настоящего изобретения предложена клетка-хозяин, включающая вектор экспрессии.
[166] При использовании в настоящем документе термин "клетка-хозяин" относится к прокариотической клетке или эукариотической клетке, в которую может быть введен рекомбинантный вектор экспрессии. При использовании в настоящем документе термин "трансформированный" или "трансфицированный" относится к введению нуклеиновой кислоты (например, вектора) в клетку с помощью различных технологий, известных в уровне техники.
[167] Подходящая клетка-хозяин может быть трансформирована или трансфицирована последовательностью ДНК настоящего изобретения и может применяться для экспрессии и/или секреции целевого белка. Примеры подходящей клетки-хозяина, которая может применяться в настоящем изобретении, включают иммортализованные клетки гибридом, клетки миеломы NS/0, клетки 293, клетки яичника китайского хомячка (CHO), клетки HeLa, клетки CAP (человеческие клетки, полученные из амниотической жидкости) и клетки COS.
Вариант осуществления изобретения
[168] В дальнейшем примеры осуществления настоящего изобретения будут подробно описаны со ссылкой на примеры. Однако эти примеры в соответствии с настоящим изобретением могут быть изменены во многих различных формах, при этом не следует считать, что объем настоящего изобретения ограничен примерами, представленными в настоящем документе.
[169] Пример получения 1. Получение и очистка слитого белка, содержащего мутантный белок FGF21
[170] Пример получения 1-1. Получение векторов экспрессии для экспрессии мутантных белков FGF21
[171] Для улучшения стабильности, активности и фармакокинетических профилей FGF21 в структуре Fc-FGF21, были проведены мутационные исследования FGF21.
[172] В частности, мутантный белок был создан для области LLLE (аминокислоты в положениях 98-101 от N-конца белка FGF21 SEQ ID NO: 1) и области GPSQG (аминокислоты в положениях 170-174 от N-конца белка FGF21 SEQ ID NO: 1), и области A180, которые, как ожидали, значительно повлияют на активность белка на основе 3-мерного структурного анализа белков FGF21.
[173] Положение, информация о последовательности, цель и ожидаемый эффект каждой мутации, введенной в белок FGF21, перечислены в Таблице 1 ниже. В Таблице 1, N представляет собой гликозилированный аспарагин (N).
[174] [Таблица 1]
[175] Кроме того, мутантные белки FGF21, включающие мутации, описанные в Таблице 1, перечислены в Таблице 2 ниже.
[176] [Таблица 2]
[177] Нуклеотиды, кодирующие аминокислоты, вводили в вектор экспрессии таким образом, чтобы в порядке от N-конца к C-концу экспрессировались слитый носитель, линкер и мутантный белок FGF21. Код каждого слитого мутантного белка FGF21, последовательность мутации, введенной в FGF21, последовательность слитого носителя и линкерная последовательность перечислены в Таблице 3 ниже. В Таблице 3, N представляет собой гликозилированный аспарагин (N).
[178] [Таблица 3]
(E. coli)
(Lilly)
(SEQ ID NO: 25)
[179] Для получения слитых мутантных белков FGF21, нуклеотидные последовательности, кодирующие каждый из мутантных белков FGF21, синтезировали при консультациях с Bioneer Corporation (Korea) по аминокислотной последовательности каждого белка. Последовательности сайтов эндонуклеаз рестрикции NheI и NotI добавляли на 5'-конец и 3'-конец нуклеотидных последовательностей, кодирующих каждый из мутантных белков FGF21, и инициаторный кодон для трансляции белка и лидерную последовательность (MDAMLRGLCCVLLLCGAVFVSPSHA), способную вызывать секрецию экспрессируемого белка из клетки, встраивали рядом с последовательностью сайта рестрикции на 5'-конце. Терминирующий кодон встраивали рядом с нуклеотидной последовательностью, которая кодирует каждый из слитых мутантных белков FGF21. Нуклеотидную последовательность, кодирующую каждый из слитых мутантных белков FGF21, клонировали в пустой вектор экспрессии pTrans при использовании двух рестриктаз NheI и NotI. Пустой вектор экспрессии pTrans, который имеет простую структуру, содержащую промотор ЦМВ, точку начала репликации из pUC, точку начала репликации из SV40 и ген устойчивости к ампициллину, был приобретен в CEVEC Pharmaceuticals (Germany).
[180] В то же время, в случае DFD6 (экспрессия в E. coli) и Fc-FGF21 слитого белка RGE (Amgen), нуклеотидную последовательность, кодирующую каждый слитый белок, встраивали в вектор экспрессии pET30a для экспрессии в E. coli.
[181] Пример получения 1-2. Конструкция плазмидной ДНК для экспрессии слитых мутантных белков FGF21
[182] E. coli трансформировали каждым из векторов экспрессии, сконструированных в Примере получения 1-1 для получения большого количества плазмидной ДНК, которую предполагали использовать для экспрессии. Клетки E. coli, клеточные стенки которых были ослаблены, трансформировали каждым вектором экспрессии посредством теплового шока, и транформанты сеяли на чашки с LB для получения колоний. Колонии, полученные таким образом, инокулировали в среду LB, культивировали при 37°C в течение 16 часов, и каждую культуру E. coli, содержащую каждый вектор экспрессии, получали в объеме 100 мл. Полученные таким образом клетки E. coli центрифугировали для удаления культуральной среды, а затем добавляли растворы P1, P2, P3 (QIAGEN, номер по кат.:12963) для разрушения клеточных стенок, получив в результате суспензию ДНК, в которой белки и ДНК были отделены. Плазмидную ДНК очищали из полученной таким образом суспензии ДНК при испоьзовании колонки для очистки ДНК Qiagen. Элюированную плазмидную ДНК исследовали с помощью электрофореза в агарозном геле, и концентрации и чистоту измеряли при помощи спектрофотометра NanoDrop (Thermo scientific, Nanodrop Lite). ДНК, полученную таким образом, использовали для экспрессии.
[183] Пример получения 1-3. Экспрессия слитых белков в CAP-T клетках
[184] Линии клеток человека трансфицировали каждым типом плазмидной ДНК, полученной в Примере получения 1-2. Каждый тип плазмидной ДНК трансдуцировали в клетки CAP-T (CEVEC), которые культивировали в среде PEM (Life technologies), при использовании раствора PEI (Polyplus, номер по кат.:101-10N). Смешанный раствор ДНК и раствора PEI смешивали с суспензией клеток при использовании экспрессионной среды Freestyle293 (Invitrogen), культивировали при 37°C в течение 5 часов и добавляли среду PEM. После культивирования при 37°C в течение 5-7 дней, культуру центрифугировали для удаления клеток и получали супернатант, содержащий слитые мутантные белки FGF21.
[185] Пример получения 1-4. Экспрессия и очистка слитых мутантных белков FGF21 в E. coli
[186] Штамм E. coli BL21 (DE3) трансформировали каждой плазмидной ДНК, экспрессирующей слитые белки DFD6 (E. coli) и RGE (Amgen). Трансформированные клетки E. coli, экспрессирующие каждый слитый белок, инокулировали в 20 мл мреды LB, культивировали при 37°C в течение 15 часов с качанием, и затем часть культуральной среды инокулировали в 100 мл среды LB и культивировали при 37°C в течение 16 часов с качанием. После завершения культивирования культуру центрифугировали с получением осадков E. coli, и затем клетки разрушали при использовании клеточного дезинтегратора высокого давления с получением телец включения.
[187] Полученные тельца включения очищали путем промывки и элюции с последующим процессом рефолдинга белка. В частности, полученные тельца включения промывали 2-3 раза буферным раствором (pH 8,0), содержащим 0,5% Triton X-100, 50 мМ Трис, 1 мМ ЭДТА и 0,1 М NaCl для удаления бактериального белка, и затем ресуспендировали в буфере, содержащем 8 М мочевины, 50 мМ Трис и 1 мМ DTT. Поскольку белки в буфере с 8 М мочевины были полностью денатурированы, процесс рефолдинга белка проводили следующим образом.
[188] Сначала мочевину удаляли из буфера с 8 М мочевины путем постепенного разбавления 20 мМ глициновым буфером, pH 9,0. С 2 М мочевины добавляли сульфат меди (CuSO4) до концентрации 80 мкМ, чтобы вызвать стабильное структурное сворачивание белка. Белок после завершения процесса рефолдинга суспендировали в буферном растворе PBS (pH 7,4), фильтровали суспендию через фильтр с порами 0,22 мкм для удаления примесей, а затем наносили в колонку для афинной хроматографии с белком A. Колонку промывали 1× буферным раствором PBS (pH 7,4), и затем белки элюировали при использовании 100 мМ глицинового буферного раствора (pH 3,0) с получением слитого белка DFD6 (E. coli).
[189] В случае слитого белка RGE (Amgen), белок после завершения процесса рефолдинга суспендировали в 50 мМ Трис буферном растворе (pH 8,0), суспендию фильтровали через фильтр с порами 0,22 мкм для удаления примесей, а затем наносили на колонку с анионообменной смолой (POROS® HQ 50 μm, Thermo Fisher Scientific). Колонку промывали 50 мМ Трис буферным раствором (pH 8,0) и затем 50 мМ Трис буферный раствор (pH 8,0) вводили в градиенте концентраций с элюированием слитого белка RGE (Amgen). Слитый белок RGE (Amgen), полученный при использовании анионообменной смолы, смешивали с сульфатом аммония до концентрации 1 М, и затем очищали при использовании колонки для хроматографии гидрофобного взаимодействия (фенилсефароза FF, GE Healthcare). В частности, колонку промывали 50 мМ Трис буферным раствором (pH 8,0), содержащим 1 М сульфата аммония, 50 мМ Трис буферный раствор (pH 8,0) вводили в градиенте концентраций, и элюированные фракции анализировали с помощью электрофореза в 10% Трис-глициновом геле. Гель окрашивали кумасси бриллиантовым синим R, с мягким качанием, и фракции, содержащие слитый мутантный белок FGF21 с высокой чистотой, собирали и затем диализировали в течение ночи при 4°C с использованием конечного буферного раствора (1× PBS, 1 мМ ЭДТА, pH 7,4). После завершения диализа полученный стоковый раствор белка концентрировали при 3000 об/мин с использованием центрифужного фильтра с отсечкой по мол. массе 30000 при 4°C. Концентрацию слитого мутантного белка FGF21 измеряли с помощью количественного анализа BCA.
[190] Пример получения 1-5. Очистка слитых мутантных белков FGF21
[191] Колонку для афинной хроматографии с белком A (GE Healthcare) уравновешивали 1× буферным раствором PBS (pH 7,4). Супернатант культуры, включающий каждый слитый мутантный белок FGF21, полученный в Примере получения 1-3, фильтровали через фильтр с порами 0,2 мкм, а затем наносили на колонку для афинной хроматографии с белком A. Колонку промывали 1× буферным раствором PBS (pH 7,4), а затем элюировали белки при использовании 100 мМ глицинового буферного раствора (pH 3,0). Слитые белки, полученные с помощью афинной хроматографии, очищали при использовании колонки с анионообменной смолой (POROS® HQ 50 μm, Thermo Fisher Scientific). Колонку с анионообменной смолой уравновешивали 50 мМ Трис буферным раствором (pH 8,0), после чего слитые мутантные белки FGF21 элюировали с колонки. В частности, после промывки колонки 50 мМ Трис буферным раствором (pH 8,0), 50 мМ Трис буферный раствор (pH 8,0) вводили в градиенте концентраций и анализировали элюированные фракции. Каждую элюированную фракцию анализировали с помощью эксклюзионной хроматографии (ЭВЭЖХ) и собирали фракции, содержащие слитые мутантные белки FGF21 с высокой чистотой. Концентрирование и количественный анализ проводили в соответствии с методами, описанными в Примере получения 1-4.
[192] Экспериментальный пример 1. Активности слитых белков in vitro
[193] Экспериментальный пример 1-1. Влияние мутаций FGF21 на активность белка
[194] Измеряли активность in vitro слитых белков DFD4, DFD5, DFD6, DFD6 (E. coli), DFD7, DFD9, DFD13, DFD18, DFD72, DFD73 и DFD74, полученных в Примере получения 1.
[195] В частности, активности in vitro слитых белков FGF21 оценивали с использованием клеточной линии HEK293 (Yuhan Corporation, Korea), которая была модифицирована для оверэкспрессии человеческого β-klotho, корецептора FGF21. Для оценки активности концентраты, содержащие слитые белки, полученные в Примерах получения 1-4 и 1-5, подвергали 3-кратному серийному разведению при концентрации 3 мкМ. После культивирования в условиях дефицита сыворотки в течение 5 часов, линию клеток с повышенной экспрессией β-klotho человека обрабатывали разведенными слитыми белками в течение 20 минут, и затем подвергали лизису при добавлении цитолитического буфера (Cisbio/номер по кат. 64ERKPEG) с перемешиванием при 60 об/мин в течение 30 минут при комнатной температуре. Раствор лизата клеток смешивали с антителами (Cisbio/номер по кат. 64ERKPEG), которые могут детектировать регулируемую внеклеточным сигналом киназу (ERK) и фосфорилированную ERK, и выдерживали смесь при комнатной температуре в течение 2 часов. Флуоресценцию обнаруживали при помощи флуориметрического детектора (TECAN/GENiosPro). Активности слитых белков измеряли при сравнении их значений EC50. Результаты показаны на Фиг. 1А-1C.
[196] Как показано на Фиг. 1А-1C, было подтверждено, что активности in vitro слитых белков, полученных при введении мутационных последовательностей в белок FGF21 дикого типа, не были ингибированы, причем активности каждого слитого белка были подобны друг другу. Также было подтверждено, что в образце DFD6 (E. coli), экспрессированном в E. coli, и в образце DFD6, экспрессированном в клетках животных, активности in vitro слитых белков, полученных при введении мутации N-гликозилирования в белок FGF21 дикого типа, не были ингибированы.
[197] Экспериментальный пример 1-2. Влияние линкерной последовательности на активность белка
[198] Измеряли активности in vitro слитых белков DFD1, DFD3, DFD4 и DFD13, полученных в Примере получения 1.
[199] В частности, активности FGF21 слитых белков измеряли при использовании концентратов, содержащих слитые белки, полученных в Примере получения 1-5, в соответствии с методами, описанными в Экспериментальном примере 1-1. Результаты показаны на Фиг. 2A и 2B.
[200] Было подтверждено, что слитый мутантный белок FGF21 не демонстрировал значимого снижения активности, хотя было показано небольшое различие в активности в зависимости от линкерной последовательности, как показано на Фиг. 2А и 2B.
[201] Экспериментальный пример 1-3. Результаты эксперимента для DFD1, RGE (Amgen) и Fc-FGF21 (Lilly)
[202] Измеряли активности in vitro слитого белка DFD1, полученного в Примере получения 1, и контрольных белков RGE (Amgen) и Fc-FGF21 (Lilly).
[203] В частности, активности FGF21 слитых белков измеряли при использовании концентратов, содержащих слитые белки, полученных в Примере получения 1-5, и контрольных белков в соответствии с методами, описанными в Экспериментальном примере 1-1. Результаты показаны на Фиг. 3.
[204] Было подтверждено, что DFD1 и RGE (Amgen) имели подобную активность in vitro, тогда как Fc-FGF21 (Lilly) имел in vitro активность в два раза выше, чем у других белков, как показано на Фиг. 3.
[205] Экспериментальный пример 2. Оценка стабильности слитых белков
[206] Экспериментальный пример 2-1. Экспериментальный метод оценки стабильности
[207] Для измерения количества белковых агрегатов в начальной стадии подготовки образца, агрегаты высокой молекулярной массы (%HMW) количественно определяли при помощи метода эксклюзионной хроматографии (ЭВЭЖХ). Результаты показаны на Фиг. 4А-4C.
[208] В частности, в методе ЭВЭЖХ использовали колонку TosoHaas модели TSK-GEL G3000SWXL. Колонку уравновешивали, пропуская буферный раствор (1× PBS, 1 мМ ЭДТА, pH 7,4) при скорости потока 1 мл/мин. Стоковые растворы белков DFD4 и DFD13, полученные в Примерах получения 1-5, концентрировали до целевой концентрации 20 мг/мл или выше при 3000 об/мин с использованием центрифужного фильтра с отсечкой по мол. массе 30000 при 4°C. После измерения концентрации каждого образца с помощью количественного BCA анализа образцы разбавляли буферным раствором (1× PBS, 1 мМ ЭДТА, pH 7,4) до конечной концентрации 20 мг/мл. Для измерения начального % HMW DFD4 и DFD13, образец с концентрацией 20 мг/мл разбавляли до концентрации 1 мг/мл 1× PBS, 1 мМ ЭДТА при pH 7,4. Затем по 100 мкл разбавленных образцов вводили в колонку ЭВЭЖХ и анализировали. Для оценки стабильности каждого образца, %HMW образцов измеряли при использовании метода ЭВЭЖХ, на 4-й, 8-й и 14-й дни, при их хранении при 5°C, 25°C и 37°C в течение двух недель.
[209] Как показано на Фиг. 4А-4C, было подтверждено, что DFD13 содержал более низкое количество агрегатов высокой молекулярной массы (% HMW) в начальной стадии и до точки 2 недели по сравнению с DFD4, что указывает на то, что введение мутации EIRP повышает стабильность слитого мутантного белка FGF21, значительно уменьшая, таким образом, % HMW.
[210] Экспериментальный пример 2-2. Результаты оценки стабильности
[211] Для исследования влияния мутации EIRP, введенной в исходную последовательность LLLE (98-101) FGF21, на стабильность, стабильность DFD4 (SEQ ID NO: 29) и DFD13 (SEQ ID NO: 35) измеряли в соответствии с методами, описанными в Экспериментальном примере 2-1. Результаты анализа образца нулевой точки (начальная стадия; день 0) и образцов DFD4 и DFD13 после хранения 4, 8 и 14 дней приведены в Таблице 4 ниже (в Таблице 4 ND означает "не обнаружено").
[212] [Таблица 4]
Стабильность DFD4 и DFD13 в течение 2 недель при концентрации 20 мг/мл (%HMW)
[213] Как показано в Таблице 4, количество %HMW в начальной стадии (День 0) составляло 0,91% для DFD4 и 0,56% для DFD13. Через 2 недели количество %HMW увеличилось до 8,83% для DFD4, но этого не наблюдали в DFD13 в условиях хранения при 25°C. Как было показано, DFD13 имел более низкий уровень %HMW в начальной стадии и через 2 недели по сравнению с DFD4. Было обнаружено, что при введении мутации EIRP, отношение % HMW мутантного слитого белка FGF21 было сильно снижено.
[214] Экспериментальный пример 3: Измерение фармакокинетики слитого белка
[215] Экспериментальный пример 3-1. Экспериментальный метод измерения фармакокинетики
[216] Самцов мышей ICR возрастом шесть недель, приобретенных в Orient BIO Co. (Korea), делили на группы (n=3 на каждую временную точку забора крови) таким образом, чтобы средние показатели массы тела были подобными за один день до введения лекарственного средства. После этого тестируемые вещества вводили в однократной подкожной дозе 1 мг/кг (2 мг/кг в случае RGE), соответственно. Затем образцы крови собирали через 1, 4, 8, 12, 24, 48, 72 и 96 часов после инъекции, соответственно. Концентрацию интактного полноразмерного белка FGF21 в крови измеряли при использовании набора для ИФА интактного человеческого FGF21 (F1231-K01, Eagle Biosciences, USA), который обладает иммунореактивностью к N-концу и C-концу белка FGF21. Концентрации образцов в крови, собранной до момента 96 часов после подкожной инъекции каждого слитого белка мышам, измеряли и вычисляли фармакокинетические параметры каждого вещества.
[217] Экспериментальный пример 3-2. Результаты измерений фармакокинетической активности
[218] Фармакокинетические параметры вычисляли на основе графика, но котором показаны концентрации каждого белка в крови в зависимости от времени после подкожного введения слитых белков у мышей (Фиг. 5). Данные показаны в Таблице 5 ниже.
[219] [Таблица 5]
[220] Фармакокинетические профили слитых белков сравнивали и оценивали по площади под кривой (AUC), которая указывает на уровень экспозиции лекарственного средства.
[221] Как показано в Таблице 5, при сравнении DFD4 с DFD13 и DFD6 с DFD73 было определено, что введение последовательности EIRP привело приблизительно к 10% увеличению значения AUC. При сравнении DFD9 с DFD4, введение TGLEAV привело приблизительно к 6-кратному увеличению значения AUC.
[222] Кроме того, мутанты TGLEAN, G170N и G174N были разработаны с целью улучшения персистирования посредством N-гликозилирования в C-концевой части FGF21, который, как известно, подвергается протеолизу in vivo на C-конце FGF21. Проверяли увеличение AUC при N-гликозилировании по сравнению с каждым из контрольных веществ. Фактически, для проверки эффекта улучшения AUC при N-гликозилировании, выполняли сравнение с DFD6 (E. coli), который является веществом, продуцированным в E. coli без гликозилирования. В данном случае было обнаружено, что DFD6, полученный в линии клеток человека, показал уровень AUC, который был в 3 или более раз выше, чем DFD6, полученный в E. coli, что указывает на то, что в результате гликозилирования фармакокинетический профиль был улучшен.
[223] Мутация A180E, раскрытая в патенте Amgen Co. (WO 2009/149171), была введена в мутанты, в которые были введены TGLEAV или G170N, такие как DFD13 и DFD73, с получением DFD18 и DFD74. В данном случае было обнаружено дополнительное увеличение AUC приблизительно в 2-3 раза.
[224] Обобщая представленные выше результаты, введение различных мутантов и их комбинаций привело к улучшению фармакокинетических параметров по сравнению со слитым белком с FGF21 дикого типа, DFD9. Слитым белком, продемонстрировавшим наибольшее значение AUC, являлся DFD74, в который были введены EIRP, G170N и A180E, показав примерно в 45 раз более высокое значение AUC, чем DFD9. Также было обнаружено, что DFD74 обеспечивает улучшенную экспозицию лекарственного средства, чем RGE Amgen, с учетом вводимой дозы RGE, то есть 2 мг/кг. Общие эффекты улучшения фармакокинетики мутационными последовательностями представлены в Таблице 6.
[225] [Таблица 6]
[226] Экспериментальный пример 4. Активность слитых белков у мышей с алиментарным ожирением
[227] Экспериментальный пример 4-1. Экспериментальный метод оценки активности у мышей с алиментарным ожирением
[228] Эффект снижения массы тела DFD18, мутантного FGF21 слитого белка, оценивали на мышах с алиментарным ожирением. Для модели алиментарного ожирения, мышей C57BL/6J приобретали в Central Lab. Animal Inc. и содержали на диете с высоким содержанием жира, содержащей 60 ккал % жира (Диета в исследовании) в течение 8-12 недель. Мышей делили на группы (n=8/группа) так, чтобы они имели одинаковое среднее значение массы тела за один день до введения лекарственного средства (день 0), и затем один раз подкожно вводили 30 нмоль/кг образцов. Затем производили однократное подкожное введение в дозе 30 нмоль/кг с последующим наблюдением изменения массы тела по сравнению с фосфатно-солевым буферным раствором (PBS) в качестве растворителя.
[229] Экспериментальный пример 4-2. Активность белка у мышей с алиментарным ожирением
[230] Что касается изменений массы тела в зависимости от времени в модели алиментарного ожирения на мышах после однократного введения 30 нмоль/кг DFD18, было подтверждено, что эффект снижения массы тела сохранялся до 10 дня после введения, и максимальное снижение массы тела (около 18%) регистрировали на 11-й день после введения, которое сохранялось до 14-го дня (Фиг. 6А и 6В).
[231] Пример получения 2. Получение и очистка слитых белков
[232] Пример получения 2-1. Получение векторов экспрессии для экспрессии слитых белков
[233] Для определения влияния последовательности мутантного белка ГПП-1 и последовательности слитого с ним Fc-шарнира на активность in vitro, фармакокинетические профили и фармакологическую эффективность, были сконструированы последовательности Fc-слитых мутантных белков ГПП-1. Последовательности мутантных белков ГПП-1 перечислены в Таблице 7 ниже.
[234] [Таблица 7]
[235] Кроме того, последовательности Fc-слитых мутантов ГПП-1 перечислены в Таблице 8.
[236] [Таблица 8]
[237] В таблице 8 HyFc5 относится к SEQ ID NO: 47, а HyFc40 относится к SEQ ID NO: 48. Для исследования эффектов последовательностей мутантных белков ГПП-1 и мутантных белков FGF21, последовательности Fc-шарнира, слитой с мутантами ГПП-1, последовательности линкера, связанной между FGF21 мутантными белками и Fc, на активность in vitro, фармакокинетические профили и фармакологическую эффективность, были созданы различные последовательности слитых белков. Последовательности слитых белков, включающие мутантные белки ГПП-1 и мутантные белки FGF21, перечислены в Таблице 9 ниже. Каждый слитый белок содержит мутантный белок ГПП-1, Fc-область иммуноглобулина, линкер и мутантный белок FGF21, соединенные в таком порядке от N-конца к С-концу.
[238] [Таблица 9]
(SEQ ID NO: 48)
(SEQ ID NO: 4)
(EIRP, TGLEAV)
(SEQ ID NO: 47)
(SEQ ID NO: 4)
(EIRP, TGLEAV)
(SEQ ID NO: 48)
(SEQ ID NO: 4)
(EIRP, TGLEAV)
(SEQ ID NO: 47)
(SEQ ID NO: 4)
(EIRP, TGLEAV)
(SEQ ID NO: 48)
(SEQ ID NO: 4)
(EIRP, TGLEAV)
(SEQ ID NO: 47)
(SEQ ID NO: 4)
(EIRP, TGLEAV)
(SEQ ID NO: 48)
(SEQ ID NO: 4)
(EIRP, TGLEAV)
(SEQ ID NO: 48)
(SEQ ID NO: 4)
(SEQ ID NO: 48)
(SEQ ID NO: 4)
(SEQ ID NO: 48)
(SEQ ID NO: 4)
[239] В частности, нуклеотидные последовательности, кодирующие каждый из слитых белков, были синтезированы после консультации с Bioneer Corporation (Korea) на основе аминокислотной последовательности каждого белка. Последовательности сайтов эндонуклеаз рестрикции NheI и NotI добавляли на 5'-конец и 3'-конец нуклеотидных последовательностей, кодирующих каждый из гибридных белков, а также инициирующий кодон для трансляции белка и лидерную последовательность (MDAMLRGLCCVLLLCGAVFVSPSHA), обеспечивающую секрецию экспрессируемого белка из клетки встраивали рядом с последовательностью сайта рестрикции на 5'-конце. Терминирующий кодон встраивали рядом с нуклеотидной последовательностью, которая кодирует каждый из слитых белков. Нуклеотидную последовательность, кодирующую каждый из слитых белков, клонировали в пустой вектор экспрессии pTrans при использовании двух рестриктаз, NheI и NotI. Пустой вектор экспрессии pTrans, который имеет простую структуру, включающую промотор ЦМВ, точку начала репликации из pUC, точку начала репликации из SV40 и ген устойчивости к ампициллину, был приобретен в CEVEC Pharmaceuticals (Germany).
[240] Пример получения 2-2. Конструирование плазмидной ДНК для экспрессии Fc-слитого мутанта ГПП-1 и слитых белков
[241] E. coli трансформировали каждым из векторов экспрессии, сконструированных в Примере получения 2-1, для получения большого количества плазмидной ДНК, которую предполагали использовать для экспрессии. Клетки E. coli с ослабленными после теплового шока клеточными стенками трансформировали каждым вектором экспрессии, и транформанты сеяли на чашку LB с получением колоний. Колонии, полученные таким образом, инокулировали в среду LB, культивировали при 37°C в течение 16 часов и каждую культуру E. coli, содержащую каждый вектор экспрессии, получали в объеме 100 мл. Полученные после этого клетки E. coli центрифугировали для удаления культуральной среды, и затем растворы P1, P2, P3 (QIAGEN, номер по кат.:12963) добавляли для разрушения клеточных стенок, получив в результате суспензию ДНК, в которой белки и ДНК были отделены. Плазмидную ДНК очищали из суспензии ДНК, полученной таким образом, при использовании колонки для очистки ДНК Qiagen. Элюированную плазмидную ДНК анализировали с помощью электрофореза в агарозном геле, и концентрацию и чистоту измеряли при использовании спектрофотометра NanoDrop (Thermo Scientific, Nanodrop Lite). ДНК, полученную таким образом, использовали для экспрессии.
[242] Пример получения 2-3. Экспрессия Fc-слитых мутантов ГПП-1 и слитых белков в клетках CAP-T
[243] Линии клеток человека трансформировали каждой плазмидной ДНК, полученной в Примере получения 2-2. Каждый тип плазмидной ДНК трансдуцировали в клетки CAP-T (CEVEC), которые культивировали в среде PEM (Life Technologies), при использовании раствора PEI (Polyplus, номер по кат.:101-10N). Смешанный раствор ДНК и раствор PEI смешивали с суспензией клеток при использовании экспрессионной среды Freestyle293 (Invitrogen), культивировали при 37°C в течение 5 часов и добавляли среду PEM. После культивирования при 37°C в течение 5-7 дней культуру центрифугировали для удаления клеток и получали супернатант, содержащий каждый белок.
[244] Пример получения 2-4. Очистка Fc-слитых мутантов ГПП-1 и слитых белков
[245] Колонку для аффинной хроматографии с белком А (GE Healthcare) уравновешивали 1× буферным раствором PBS (рН 7,4). Супернатант культуры, включающий каждый из Fc-слитых мутантов ГПП-1 и слитых белков, полученных в Примере получения 2-3, фильтровали через фильтр с порами 0,2 мкм и затем наносили на колонку для аффинной хроматографии с белком А. Колонку промывали 1× буферным раствором PBS (pH 7,4), а затем белки элюировали при использовании 100 мМ глицинового буферного раствора (pH 3,0). Белки, полученные с помощью аффинной хроматографии, очищали при использовании колонки с анионообменной смолой (POROS® HQ 50 μm, Thermo Fisher Scientific). Колонку с анионообменной смолой уравновешивали 50 мМ Трис-буферным раствором (рН 8,0), после чего на нее наносили белки, элюированные после аффинной хроматографии.
[246] После промывки колонки 50 мМ Трис-буферным раствором (рН 8,0), 50 мМ Трис-буферный раствор (рН 8,0) вводили в градиенте концентрации и анализировали элюированные фракции. Каждую элюированную фракцию анализировали с помощью эксклюзионной хроматографии (ЭВЭЖХ) и фракции, содержащие Fc-слитые мутанты ГПП-1 и слитые белки с высокой чистотой, собирали и диализировали в течение ночи при 4°C при использовании конечного буферного раствора (1× PBS, 1 мМ ЭДТА, рН 7,4). После завершения диализа полученный стоковый раствор белка концентрировали при 3000 об/мин с использованием центрифужного фильтра с отсечкой по мол. массе 30000 при 4°C. Концентрацию каждого белка измеряли с помощью количественного анализа BCA.
[247] Экспериментальный пример 5. Активность слитых белков in vitro
[248] Экспериментальный пример 5-1. Активность DFD23, DFD24, DFD25, DFD26, DFD27, DFD28 и DFD29
[249] Измеряли ГПП-1 активности слитых белков DFD23, DFD24, DFD25, DFD26, DFD27, DFD28 и DFD29 in vitro. В частности, линию клеток CHO (Eurofins, HTS163C2) с оверэкспрессией человеческого рецептора ГПП-1 приобретали и использовали для оценки ГПП-1 активности слитых белков. Для оценки активности образцы, содержащие слитые белки (стоковые растворы белков, полученные в Примере получения 2-4; в дальнейшем "образец"), подвергали 4-кратному серийному разведению при концентрации 25 нМ. После обработки в течение 30 минут линии клеток СНО с оверэкспрессией человеческого рецептора ГПП-1 измеряли образовавшийся внутриклеточный цАМФ (Cisbio, 62AM4PEB). Активность каждого белка оценивали путем сравнения значений ЕС50.
[250] Как показано на Фиг. 7, слитый белок, содержащий последовательность ГПП-1(A2G), показал активность приблизительно в 2~3 раза ниже, чем у слитых белков, содержащих другие мутантные последовательности ГПП-1. Никакого значимого различия в активности ГПП-1 не наблюдали у слитых белков, содержащих мутантные последовательности, кроме последовательности ГПП-1(A2G).
[251] Экспериментальный пример 5-2. Активности DFD59, DFD69, DFD112 и DFD114
[252] Измеряли ГПП-1 активности in vitro слитых белков DFD69, DFD112 и DFD114, полученных в Примере получения 2, и DFD59 (Fc-слитого мутанта ГПП-1). В частности, линию клеток CHO (Eurofins, HTS163C2) с оверэкспрессией человеческого рецептора ГПП-1 приобретали и использовали для оценки ГПП-1 активности слитых белков. Для оценки активности образец, содержащий каждый из слитых белков, подвергали 4-кратному серийному разведению при концентрации 25 нМ. После обработки в течение 30 минут линии клеток СНО с оверэкспрессией человеческого рецептора ГПП-1 измеряли образовавшийся внутриклеточный цАМФ (Cisbio, 62AM4PEB).
[253] Как показано на Фиг. 8А и 8B, активность каждого белка оценивали путем сравнения значения EC50. Три слитых белка показали подобные значения EC50, а DFD59 (не содержащий мутантный FGF21) показал активность приблизительно в 2 раза выше, чем у слитых белков.
[254] Затем измеряли активности in vitro части FGF21 в DFD69, DFD112 и DFD114. В частности, активности in vitro части FGF21 в слитых белках оценивали при использовании линии клеток HEK293 с оверэкспрессией β-klotho человека (корецептора FGF21). Для оценки активности образцы, содержащие каждый из слитых белков, подвергали 3-кратному серийному разведению при концентрации 3 мкМ. После культивирования в условиях дефицита сыворотки в течение 5 часов, линию клеток HEK293 с оверэкспрессией β-klotho человека обрабатывали в течение 20 минут, после чего клетки лизировали при добавлении цитолитического буфера (Cisbio/номер по кат. 64ERKPEG) с перемешиванием при 60 об/мин в течение 30 минут при комнатной температуре. Раствор клеточного лизата смешивали с антителами, которые могут обнаруживать ERK и фосфорилированную ERK, и смесь выдерживали при комнатной температуре в течение 2 часов. Флуоресценцию детектировали при использовании флуориметрического детектора (TECAN/GENiosPro). Активности измеряли при сравнении их значений EC50.
[255] Было подтверждено, что активности in vitro части FGF21 слитых белков DFD69, DFD112 и DFD114 были аналогичными, как показано на Фиг. 8А и 8B.
[256] Экспериментальный пример 6. Оценка фармакокинетики слитых белков
[257] Экспериментальный пример 6-1. Экспериментальный метод оценки фармакокинетики
[258] Шестинедельных самцов мышей ICR, приобретенных в Orient BIO (Korea), делили на группы (n=3/время забора крови) для получения аналогичного среднего значения массы тела за один день до введения лекарственного средства, и подкожно вводили один раз соответствующий образец в объеме 1 мг/кг. Образцы крови собирали через 1, 4, 8, 12, 24, 48, 72, 96, 144, 192 и 240 часов после инъекции соответственно. Концентрацию каждого слитого белка в крови измеряли на основе части FGF21 и части ГПП-1-Fc отдельно. Концентрацию интактной полноразмерной части FGF21 слитого белка в крови измеряли с использованием набора для ИФА интактного человеческого FGF21 (F1231-K01, Eagle Biosciences, USA), который обладает иммунореактивностью к N-концу и C-концу белка FGF21. Кроме того, концентрацию активной части ГПП-1-Fc слитого белка в крови измеряли при использовании антитела, которое обладает иммунореактивностью к N-концу ГПП-1 и Fc, как определяли с помощью анализа ИФА. Концентрации частей FGF21 и ГПП-1-Fc каждого белка в образцах крови, собранных до 240 часов после однократного подкожного введения каждого белка мышам, измеряли и вычисляли фармакокинетические параметры каждого белка.
[259] Экспериментальный пример 6-2. Результаты фармакокинетической активности
[260] На основе концентрации каждого активного вещества в крови в зависимости от времени после однократного подкожного введения каждого белка у мышей (Фиг. 9А и 9B) вычисляли фармакокинетические параметры для частей FGF21 и ГПП-1-Fc слитых белков. Данные показаны в Таблице 10 ниже.
[261] [Таблица 10]
[262] Фармакокинетический профиль каждого слитого белка сравнивали и оценивали по Площади под кривой (AUC), которая указывает уровень экспозиции лекарственного средства.
[263] Как показано в Таблице 10, в отношении фармакокинетических параметров части FGF21, DFD114 показал наибольшую степень экспозиции лекарственного средства (AUC) и полупериод существования, и DFD112 показал следующее по величине значение AUC, затем DFD69. DFD114 продемонстрировал увеличение значения AUC приблизительно в 2 или более раз по сравнению с DFD69. Что касается фармакокинетики части ГПП-1-Fc, четыре белка (DFD59, DFD69, DFD112 и DFD114), содержащие одну и ту же мутантную последовательность ГПП-1 показали подобные значения AUC.
[264] Экспериментальный пример 7. Оценка активности слитого белка при неалкогольном стеатогепатите у мышей с алиментарным ожирением
[265] Экспериментальный пример 7-1. Способ оценки активности при неалкогольном стеатогепатите у мышей с алиментарным ожирением
[266] Эффекты улучшения стеатогепатита и липидов слитых белков DFD114 и DFD112 и слитых FGF21 мутантных белков DFD74 и DFD72 оценивали в модели на мышах с алиментарным ожирением.
[267] Чтобы вызвать вызванное диетой ожирение, мыши C57BL/6J питались диетой с высоким содержанием жира (Диета исследования) содержащий жир % на 60 ккал в течение приблизительно 37 недель, чтобы подготовить модель мыши ожирения, имеющую стеатогепатит. Мыши были разделены на группы (n=6/group) таким образом, что средние массы тела были подобны в один день до медикаментозного лечения. После того DFD114, DFD112, DFD74 и DFD72 были применены 3 раза в дозе 3 или 10 нмоль/кг в 4-дневном интервале в течение 2 недель.
[268] Контрольной группе подкожно вводили растворитель (фосфатно-солевой буферный раствор Дульбекко, DPBS, Gibco, USA), используемый для приготовления тестируемого лекарственного средства, тем же самым способом. Через 4 дня после последнего введения животные в течение ночи не получали корм, после чего у них забирали кровь из посткавальной вены и ткани печени извлекали после ингаляционной анестезии и лапаротомии. Биохимические анализы крови выполняли с образцами сыворотки, выделенными из собранных образцов крови, а из фиксированных тканей печени изготавливали препраты посредством обрезки, обезвоживания, заливки в парафин, нарезания и т.д. Затем изготовленные препараты окрашивали гематоксилином и эозином (Г-Э) и наблюдали патогистологические изменения при помощи оптического микроскопа (Olympus, ECLIPSE E600).
[269] Экспериментальный пример 7-2. Результаты оценки активности при неалкогольном стеатогепатите у мышей с алиментарным ожирением
[270] Для оценки эффектов улучшения стеатогепатита и липидов слитых белков и слитого FGF21 мутантного белка, DFD114, DFD112, DFD74 и DFD72 многократно вводили в дозе 3 или 10 нмоль/кг с интервалом 4 дня в течение 2 недель в модели на мышах с алиментарным ожирением. Затем исследовали изменения липидов в сыворотке и ткани печени, и наблюдали патогистологические изменения.
[271] Как показано на Фиг. 10А-10C, триглицериды (ТГ) и общий холестерин (ОХС) в сыворотке измеряли после многократного подкожного введения слитых белков DFD114 и DFD112 и слитых FGF21 мутантных белков DFD74 и DFD72. В результате уровни триглицеридов и общего холестерина в сыворотке снизились, и уровни триглицеридов в ткани печени также снизились по сравнению с контрольной группой, получавшей растворитель.
[272] Как показано на Фиг. 11, патогистологическое исследование, проведенное после многократного подкожного введения слитых белков DFD114 и DFD112, показало, что липид в ткани печени значительно снизился по сравнению с контрольной группой, получавшей растворитель.
[273] Экспериментальный пример 8. Оценка активности слитых белков у мышей с MCD-индуцированным неалкогольным стеатогепатитом
[274] Экспериментальный пример 8-1. Способ оценки активности у мышей с MCD-индуцированным неалкогольным стеатогепатитом
[275] Для оценки эффектов уменьшения воспаления и фиброза слитых белков и слитых мутантных белков FGF21 в модели неалкогольного стеатогепатита оценивали эффекты DFD112 и DFD72 в модели MCD.
[276] Модель неалкогольной болезни печени, вызванной у животных диетой с недостаточным содержанием метионина и холина (MCD), является одной из широко используемых моделей для оценки неалкогольного стеатогепатита. Стеатогепатит с фиброзом печени индуцировали диетой с недостаточным содержанием метионина и холина, которые играют важную роль в бета-окислении и синтезе липопротеинов очень низкой плотности (ЛОНП). Эта модель, как известно, подобна модели патологии при стеатогепатите у человека. Для индукции модели стеатогепатита, диету MCD и диету со стандартным содержанием метионина и холина (MCS) предоставляли без ограничения поочередно, в течение 17 недель, в качестве корма мышам C57BL/6 в виде диеты MCD в течение 10 дней и затем диеты MCS в течение 4 дней.
[277] Животных взвешивали перед введением тестируемого вещества и рандомизированно распределяли в группы таким образом, чтобы средняя масса тела в каждой группе была распределена максимально равномерно. После распределения 10 мышей в каждую группу, 3, 10 и 30 нмоль/кг DFD112 и 10 нмоль/кг DFD72 подкожно вводили с интервалом 2 дня в течение 4 недель. В контрольной группе MSC и контрольной группе на диете MCD мышам подкожно вводили растворитель (фосфатно-солевой буферный раствор Дульбекко, DPBS, Gibco, USA), используемый для приготовления тестируемого вещества, с интервалом 2 дня в течение 4 недель, таким же способом.
[278] После многократного введения тестируемого вещества в течение 4 недель, мыши не получали корм в течение ночи, после чего кровь забирали из посткавальной вены и извлекали ткани печени после ингаляционной анестезии и лапаротомии. Биохимические анализы крови выполняли с образцами сыворотки, выделенными из собранных образцов крови, и изготавливали фиксированные ткани печени в виде препаратов посредством общих процессов обработки тканей. Затем проводили окрашивание гематоксилином и эозином (Г-Э) и иммуногистохимическое окрашивание, и патогистологические изменения наблюдали с помощью оптического микроскопа (Olympus, BX53).
[279] Экспериментальный пример 8-2. Результаты оценки активности у мышей с MCD-индуцированным неалкогольным стеатогепатитом
[280] 3, 10 и 30 нмоль/кг слитого белка DFD112 и 10 нмоль/кг слитого FGF21 мутантного белка DFD72 многократно вводили с интервалом 2 дня в течение 4 недель мышам с MCD-индуцированным неалкогольным стеатогепатитом. Затем выполняли биохимический анализ крови и патогистологическое исследование для оценки эффектов в отношении неалкогольного стеатогепатита.
[281] Как показано на Фиг. 12А-12C, контрольная группа MCD, в которой индуцировали неалкогольный стеатогепатит, показала значительно более высокие значения аланинаминотрансферазы (АЛТ) и аспартаттрансаминазы (АСТ) (p<0,001), индикаторов повреждения печени, по сравнению с контрольной группой MCS, получавшей стандартный рацион. Уровни АСТ и АЛТ в сыворотке снижались дозозависимо в группе, получавшей DFD112, по сравнению с контрольной группой MCD. Кроме того, контрольная группа MCD показала значительно более высокий уровень воспаления по сравнению с контрольной группой MCS при патогистологическом исследовании (p<0,01). При введении DFD112 уровень воспаления снижался дозозависимо по сравнению с контрольной группой MCD.
[282] Как показано на Фиг. 13А-13C и Фиг. 14, для оценки воздействия слитого белка на фиброз печени, альфа-актин гладких мышц (α-SMA) и трансформирующего фактора роста бета (TGF-β) в ткани печени, в качестве индикаторов фиброза печени, окрашивали при использовании иммуногистохимического окрашивания и определяли количественно с помощью анализа изображения. Уровни экспрессии α-SMA и TGF-β в контрольной группе MCD по сравнению с контрольной группой MCS были повышены (p<0,001). При введении DFD112 и DFD72 экспрессия α-SMA и TGF-β была снижена по сравнению с контрольной группой MCD. Кроме того, коллаген в ткани печени окрашивали при использовании окрашивания пикросириусом красным и определяли количественно с помощью анализа изображения. В результате количество коллагена в контрольной группе MCD было выше, чем в контрольной группе MCS (p<0,001), и при введении DFD112 и DFD72 наблюдали тенденцию к снижению коллагена в ткани печени по сравнению с контрольной группой MCD.
[283] Экспериментальный пример 9. Оценка активности слитых белков у мышей с алиментарным ожирением и неалкогольным стеатогепатитом
[284] Экспериментальный пример 9-1. Способ оценки активности слитых белков у мышей с алиментарным ожирением и неалкогольным стеатогепатитом
[285] Для оценки эффектов уменьшения воспаления и фиброза слитых белков в модели неалкогольного стеатогепатита, эффект DFD112 оценивали в модели алиментарного ожирения и неалкогольного стеатогепатита на мышах.
[286] Модель ожирения и неалкогольного стеатогепатита на мышах получали при кормлении мышей C57BL/6 диетой с высоким содержанием жиров (Диета в исследовании), содержащей 40% жиров, 40% углеводов и 2% холестерина, в течение приблизительно 30 недель. Патогистологическое исследование ткани печени проводили приблизительно за 3 недели до начала лечения лекарственным средством, и уровни АЛТ и АСТ и массу тела измеряли перед введением. Подопытных животных подбирали таким образом, чтобы степени индукции неалкогольного стеатогепатита и масса тела были распределены равномерно, и делили на группы. В каждую группу распределяли по 12 мышей, и DFD112 многократно вводили подкожно в дозе 3 или 10 нмоль/кг, с интервалом 2 дня в течение 8 недель. В контрольной группе растворитель, используемый для приготовления тестируемого вещества (фосфатно-солевой буферный раствор Дульбекко, DPBS, Gibco, USA), вводили таким же способом.
[287] После последнего введения мышам не давали корм в течение ночи и забирали кровь из посткавальной вены, и извлекали ткани печени после ингаляционной анестезии и лапаротомии. Биохимические анализы крови проводили с образцами сыворотки, выделенными из собранных образцов крови. Фиксированные ткани печени изготавливали в виде препаратов, и полученные препараты окрашивали гематоксилином и эозином (Г-Э) или пикросириусом красным и наблюдали патогистологические изменения.
[288] Экспериментальный пример 9-2. Результаты оценки активности слитых белков у мышей с алиментарным ожирением и неалкогольным стеатогепатитом
[289] Мышам с алиментарным ожирением и неалкогольным стеатогепатитом многократно вводили DFD112 в дозе 3 или 10 нмоль/кг с интервалом 2 дня в течение 8 недель. Затем проводили биохимический анализ крови и патогистологическое исследование для оценки эффекта при неалкогольном стеатогепатите.
[290] Как показано на Фиг. 15А-15D, уровни в сыворотке АЛТ и АСТ, индикаторов повреждения печени, снизились до нормального значения (p<0,001) в группе, получавшей DFD112. Уровни триглицеридов (ТГ) и общего холестерина (ОХС) в сыворотке также значительно снизились по сравнению с контрольной группой, получавшей растворитель (p<0,05 или p<0,001).
[291] Как показано на Фиг. 16А-16B, результаты патогистологического исследования до и после введения показали, что оценка активности НЖБП (NAS) после введения, как показатель классификации степени неалкогольного стеатогепатита, увеличивалась или сохранялась в контрольной группе, получавшей растворитель, при многократном введении в течение 8 недель, по сравнению с оценкой до введения. С другой стороны, оценка активности НЖБП значительно снизилась у всех субъектов в группе введения DFD112 по сравнению с оценкой до введения. Кроме того, при оценке степени фиброза, степень фиброза сохранялась или ухудшалась в контрольной группе по сравнению со степенью до введения, тогда как в группе введения DFD112 наблюдали значимый эффект улучшения (p<0,05).
[292] Экспериментальный пример 10. Оценка активности слитого белка у крыс с TAA-индуцированным фиброзом печени
[293] Экспериментальный пример 10-1. Способ оценки активности слитого белка у крыс с TAA-индуцированным фиброзом печени
[294] Эффект DFD112 оценивали в модели на крысах, в которой фиброз печени был вызван питьевой водой, чтобы оценить эффект уменьшения фиброза печени при введении слитых белков.
[295] Модель фиброза печени получали, предоставляя крысам линии Wistar питьевую воду, содержащую тиоацетамид (TAA), в течение приблизительно 14 недель. Животных взвешивали перед введением тестируемого вещества и рандомизированно распределяли в группы таким образом, чтобы средняя масса тела в каждой группе имела максимально равномерное распределение. После распределения 8 крыс в каждую группу, 30 нмоль/кг DFD112 многократно подкожно вводили с интервалом 2 дня в течение 8 недель. Питьевую воду с TAA постоянно предоставляли до конца введения. Нормальная контрольная группа получала обычную питьевую воду с начала исследования до конца введения, и контрольная группа TAA получала питьевую воду с TAA с начала исследования до конца введения.
[296] После завершения введения мышам не давали корм в течение ночи и забирали кровь из посткавальной вены, а ткани печени извлекали после ингаляционной анестезии и лапаротомии. Биохимические анализы крови выполняли с образцами сыворотки, выделенными из собранных образцов крови, и фиксированные ткани печени изготавливали в виде препаратов и окрашивали пикросириусом красным, и наблюдали патогистологические изменения для сравнения степени фиброза паренхимы печени.
[297] Экспериментальный пример 10-2. Способ оценки активности слитого белка у крыс с TAA-индуцированным фиброзом печени
[298] 30 нмоль/кг слитого белка DFD112 многократно вводили крысам с TAA-индуцированным фиброзом печени с интервалом 2 дня в течение 8 недель и влияние на фиброз печени оценивали посредством биохимических анализов крови и патогистологических исследований.
[299] Как показано на Фиг. 17a-17d, контрольная группа TAA, в которой был вызван фиброз печени, показала значительно более высокие уровни щелочной фосфатазы (ЩФ), гамма-глутамилтрансферазы (ГГТ) и общего билирубина (ОБил) (p<0,01 или p<0,001), индикаторов повреждения печени, по сравнению с контрольной группой, которая получала обычную питьевую воду.
[300] Было отмечено, что уровни АЛТ, ГГТ и ОБил значительно снизились при введении DFD112 по сравнению с контрольной группой TAA. Патогистологическое исследование показало, что доля площади фиброза печени, положительно окрашенная пикросириусом красным, была значительно увеличена в контрольной группе TAA по сравнению с нормальной контрольной группой. Кроме того, было отмечено, что доля площади фиброза печени значительно уменьшалась при введении DFD112 по сравнению с контрольной группой TAA (p<0,001).
[301]
[302]
--->
<110> YUHAN CORPORATION
<120> ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПРЕДОТВРАЩЕНИЯ ИЛИ ЛЕЧЕНИЯ
ГЕПАТИТА, ФИБРОЗА ПЕЧЕНИ И ЦИРРОЗА ПЕЧЕНИ, ВКЛЮЧАЮЩАЯ СЛИТЫЕ БЕЛКИ
<130> PCB709047YUH
<150> KR 2016/149866
<151> 2016-11-10
<160> 80
<170> KopatentIn 2.0
<210> 1
<211> 181
<212> БЕЛОК
<213> человеческий FGF21
<400> 1
His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val
1. 5 10 15
Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala His
20 25 30
Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln Ser
35 40 45
Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile Gln
50 55 60
Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp Gly
65 70 75 80
Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe Arg
85 90 95
Glu Leu Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala His
100 105 110
Gly Leu Pro Leu His Leu Pro Gly Asn Lys Ser Pro His Arg Asp Pro
115 120 125
Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro Pro
130 135 140
Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp Val
145 150 155 160
Gly Ser Ser Asp Pro Leu Ser Met Val Gly Pro Ser Gln Gly Arg Ser
165 170 175
Pro Ser Tyr Ala Ser
180
<210> 2
<211> 30
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкер
<400> 2
Ala Lys Ala Thr Thr Ala Pro Ala Thr Thr Arg Asn Thr Gly Arg Gly
1. 5 10 15
Gly Glu Glu Lys Lys Lys Glu Lys Glu Lys Glu Glu Gln Glu
20 25 30
<210> 3
<211> 17
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкер
<400> 3
Ala Lys Ala Thr Thr Ala Pro Ala Thr Thr Arg Asn Thr Gly Arg Gly
1. 5 10 15
Gly
<210> 4
<211> 15
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкер
<400> 4
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1. 5 10 15
<210> 5
<211> 16
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> линкер
<400> 5
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ala
1. 5 10 15
<210> 6
<211> 181
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> вариант FGF21
<400> 6
His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val
1. 5 10 15
Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala His
20 25 30
Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln Ser
35 40 45
Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile Gln
50 55 60
Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp Gly
65 70 75 80
Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe Arg
85 90 95
Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala His
100 105 110
Gly Leu Pro Leu His Leu Pro Gly Asn Lys Ser Pro His Arg Asp Pro
115 120 125
Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro Pro
130 135 140
Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp Val
145 150 155 160
Gly Ser Ser Asp Pro Leu Ser Met Val Gly Pro Ser Gln Gly Arg Ser
165 170 175
Pro Ser Tyr Ala Ser
180
<210> 7
<211> 182
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> вариант FGF21
<400> 7
His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val
1. 5 10 15
Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala His
20 25 30
Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln Ser
35 40 45
Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile Gln
50 55 60
Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp Gly
65 70 75 80
Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe Arg
85 90 95
Glu Leu Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala His
100 105 110
Gly Leu Pro Leu His Leu Pro Gly Asn Lys Ser Pro His Arg Asp Pro
115 120 125
Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro Pro
130 135 140
Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp Val
145 150 155 160
Gly Ser Ser Asp Pro Leu Ser Met Val Thr Gly Leu Glu Ala Val Arg
165 170 175
Ser Pro Ser Tyr Ala Ser
180
<210> 8
<211> 182
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> вариант FGF21
<400> 8
His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val
1. 5 10 15
Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala His
20 25 30
Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln Ser
35 40 45
Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile Gln
50 55 60
Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp Gly
65 70 75 80
Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe Arg
85 90 95
Glu Leu Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala His
100 105 110
Gly Leu Pro Leu His Leu Pro Gly Asn Lys Ser Pro His Arg Asp Pro
115 120 125
Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro Pro
130 135 140
Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp Val
145 150 155 160
Gly Ser Ser Asp Pro Leu Ser Met Val Thr Gly Leu Glu Ala Asn Arg
165 170 175
Ser Pro Ser Tyr Ala Ser
180
<210> 9
<211> 181
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> вариант FGF21
<400> 9
His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val
1. 5 10 15
Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala His
20 25 30
Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln Ser
35 40 45
Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile Gln
50 55 60
Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp Gly
65 70 75 80
Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe Arg
85 90 95
Glu Leu Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala His
100 105 110
Gly Leu Pro Leu His Leu Pro Gly Asn Lys Ser Pro His Arg Asp Pro
115 120 125
Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro Pro
130 135 140
Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp Val
145 150 155 160
Gly Ser Ser Asp Pro Leu Ser Met Val Asn Pro Ser Gln Gly Arg Ser
165 170 175
Pro Ser Tyr Ala Ser
180
<210> 10
<211> 181
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> вариант FGF21
<400> 10
His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val
1. 5 10 15
Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala His
20 25 30
Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln Ser
35 40 45
Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile Gln
50 55 60
Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp Gly
65 70 75 80
Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe Arg
85 90 95
Glu Leu Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala His
100 105 110
Gly Leu Pro Leu His Leu Pro Gly Asn Lys Ser Pro His Arg Asp Pro
115 120 125
Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro Pro
130 135 140
Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp Val
145 150 155 160
Gly Ser Ser Asp Pro Leu Ser Met Val Gly Pro Ser Gln Asn Arg Ser
165 170 175
Pro Ser Tyr Ala Ser
180
<210> 11
<211> 182
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> вариант FGF21
<400> 11
His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val
1. 5 10 15
Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala His
20 25 30
Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln Ser
35 40 45
Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile Gln
50 55 60
Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp Gly
65 70 75 80
Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe Arg
85 90 95
Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala His
100 105 110
Gly Leu Pro Leu His Leu Pro Gly Asn Lys Ser Pro His Arg Asp Pro
115 120 125
Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro Pro
130 135 140
Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp Val
145 150 155 160
Gly Ser Ser Asp Pro Leu Ser Met Val Thr Gly Leu Glu Ala Val Arg
165 170 175
Ser Pro Ser Tyr Ala Ser
180
<210> 12
<211> 182
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> вариант FGF21
<400> 12
His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val
1. 5 10 15
Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala His
20 25 30
Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln Ser
35 40 45
Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile Gln
50 55 60
Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp Gly
65 70 75 80
Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe Arg
85 90 95
Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala His
100 105 110
Gly Leu Pro Leu His Leu Pro Gly Asn Lys Ser Pro His Arg Asp Pro
115 120 125
Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro Pro
130 135 140
Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp Val
145 150 155 160
Gly Ser Ser Asp Pro Leu Ser Met Val Thr Gly Leu Glu Ala Asn Arg
165 170 175
Ser Pro Ser Tyr Ala Ser
180
<210> 13
<211> 181
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> вариант FGF21
<400> 13
His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val
1. 5 10 15
Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala His
20 25 30
Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln Ser
35 40 45
Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile Gln
50 55 60
Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp Gly
65 70 75 80
Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe Arg
85 90 95
Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala His
100 105 110
Gly Leu Pro Leu His Leu Pro Gly Asn Lys Ser Pro His Arg Asp Pro
115 120 125
Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro Pro
130 135 140
Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp Val
145 150 155 160
Gly Ser Ser Asp Pro Leu Ser Met Val Asn Pro Ser Gln Gly Arg Ser
165 170 175
Pro Ser Tyr Ala Ser
180
<210> 14
<211> 181
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> вариант FGF21
<400> 14
His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val
1. 5 10 15
Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala His
20 25 30
Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln Ser
35 40 45
Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile Gln
50 55 60
Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp Gly
65 70 75 80
Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe Arg
85 90 95
Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala His
100 105 110
Gly Leu Pro Leu His Leu Pro Gly Asn Lys Ser Pro His Arg Asp Pro
115 120 125
Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro Pro
130 135 140
Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp Val
145 150 155 160
Gly Ser Ser Asp Pro Leu Ser Met Val Gly Pro Ser Gln Asn Arg Ser
165 170 175
Pro Ser Tyr Ala Ser
180
<210> 15
<211> 181
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> вариант FGF21
<400> 15
His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val
1. 5 10 15
Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala His
20 25 30
Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln Ser
35 40 45
Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile Gln
50 55 60
Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp Gly
65 70 75 80
Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe Arg
85 90 95
Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala His
100 105 110
Gly Leu Pro Leu His Leu Pro Gly Asn Lys Ser Pro His Arg Asp Pro
115 120 125
Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro Pro
130 135 140
Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp Val
145 150 155 160
Gly Ser Ser Asp Pro Leu Ser Met Val Gly Pro Ser Gln Gly Arg Ser
165 170 175
Pro Ser Tyr Glu Ser
180
<210> 16
<211> 182
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> вариант FGF21
<400> 16
His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val
1. 5 10 15
Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala His
20 25 30
Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln Ser
35 40 45
Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile Gln
50 55 60
Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp Gly
65 70 75 80
Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe Arg
85 90 95
Glu Leu Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala His
100 105 110
Gly Leu Pro Leu His Leu Pro Gly Asn Lys Ser Pro His Arg Asp Pro
115 120 125
Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro Pro
130 135 140
Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp Val
145 150 155 160
Gly Ser Ser Asp Pro Leu Ser Met Val Thr Gly Leu Glu Ala Val Arg
165 170 175
Ser Pro Ser Tyr Glu Ser
180
<210> 17
<211> 182
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> вариант FGF21
<400> 17
His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val
1. 5 10 15
Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala His
20 25 30
Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln Ser
35 40 45
Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile Gln
50 55 60
Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp Gly
65 70 75 80
Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe Arg
85 90 95
Glu Leu Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala His
100 105 110
Gly Leu Pro Leu His Leu Pro Gly Asn Lys Ser Pro His Arg Asp Pro
115 120 125
Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro Pro
130 135 140
Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp Val
145 150 155 160
Gly Ser Ser Asp Pro Leu Ser Met Val Thr Gly Leu Glu Ala Asn Arg
165 170 175
Ser Pro Ser Tyr Glu Ser
180
<210> 18
<211> 181
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> вариант FGF21
<400> 18
His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val
1. 5 10 15
Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala His
20 25 30
Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln Ser
35 40 45
Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile Gln
50 55 60
Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp Gly
65 70 75 80
Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe Arg
85 90 95
Glu Leu Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala His
100 105 110
Gly Leu Pro Leu His Leu Pro Gly Asn Lys Ser Pro His Arg Asp Pro
115 120 125
Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro Pro
130 135 140
Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp Val
145 150 155 160
Gly Ser Ser Asp Pro Leu Ser Met Val Asn Pro Ser Gln Gly Arg Ser
165 170 175
Pro Ser Tyr Glu Ser
180
<210> 19
<211> 181
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> вариант FGF21
<400> 19
His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val
1. 5 10 15
Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala His
20 25 30
Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln Ser
35 40 45
Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile Gln
50 55 60
Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp Gly
65 70 75 80
Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe Arg
85 90 95
Glu Leu Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala His
100 105 110
Gly Leu Pro Leu His Leu Pro Gly Asn Lys Ser Pro His Arg Asp Pro
115 120 125
Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro Pro
130 135 140
Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp Val
145 150 155 160
Gly Ser Ser Asp Pro Leu Ser Met Val Gly Pro Ser Gln Asn Arg Ser
165 170 175
Pro Ser Tyr Glu Ser
180
<210> 20
<211> 182
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> вариант FGF21
<400> 20
His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val
1. 5 10 15
Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala His
20 25 30
Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln Ser
35 40 45
Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile Gln
50 55 60
Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp Gly
65 70 75 80
Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe Arg
85 90 95
Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala His
100 105 110
Gly Leu Pro Leu His Leu Pro Gly Asn Lys Ser Pro His Arg Asp Pro
115 120 125
Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro Pro
130 135 140
Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp Val
145 150 155 160
Gly Ser Ser Asp Pro Leu Ser Met Val Thr Gly Leu Glu Ala Val Arg
165 170 175
Ser Pro Ser Tyr Glu Ser
180
<210> 21
<211> 182
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> вариант FGF21
<400> 21
His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val
1. 5 10 15
Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala His
20 25 30
Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln Ser
35 40 45
Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile Gln
50 55 60
Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp Gly
65 70 75 80
Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe Arg
85 90 95
Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala His
100 105 110
Gly Leu Pro Leu His Leu Pro Gly Asn Lys Ser Pro His Arg Asp Pro
115 120 125
Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro Pro
130 135 140
Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp Val
145 150 155 160
Gly Ser Ser Asp Pro Leu Ser Met Val Thr Gly Leu Glu Ala Asn Arg
165 170 175
Ser Pro Ser Tyr Glu Ser
180
<210> 22
<211> 181
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> вариант FGF21
<400> 22
His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val
1. 5 10 15
Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala His
20 25 30
Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln Ser
35 40 45
Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile Gln
50 55 60
Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp Gly
65 70 75 80
Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe Arg
85 90 95
Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala His
100 105 110
Gly Leu Pro Leu His Leu Pro Gly Asn Lys Ser Pro His Arg Asp Pro
115 120 125
Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro Pro
130 135 140
Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp Val
145 150 155 160
Gly Ser Ser Asp Pro Leu Ser Met Val Asn Pro Ser Gln Gly Arg Ser
165 170 175
Pro Ser Tyr Glu Ser
180
<210> 23
<211> 181
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> вариант FGF21
<400> 23
His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val
1. 5 10 15
Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala His
20 25 30
Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln Ser
35 40 45
Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile Gln
50 55 60
Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp Gly
65 70 75 80
Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe Arg
85 90 95
Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala His
100 105 110
Gly Leu Pro Leu His Leu Pro Gly Asn Lys Ser Pro His Arg Asp Pro
115 120 125
Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro Pro
130 135 140
Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp Val
145 150 155 160
Gly Ser Ser Asp Pro Leu Ser Met Val Gly Pro Ser Gln Asn Arg Ser
165 170 175
Pro Ser Tyr Glu Ser
180
<210> 24
<211> 229
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> человеческий IgG4 Fc
<400> 24
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Ser Cys Pro Ala Pro Glu Phe
1. 5 10 15
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys
225
<210> 25
<211> 228
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> вариант человеческого IgG4 Fc
<400> 25
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala
1. 5 10 15
Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly
225
<210> 26
<211> 223
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> гибридный вариант Fc
<400> 26
Glu Thr Lys Thr Pro Glu Cys Pro Ser His Thr Gln Pro Leu Gly Val
1. 5 10 15
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
20 25 30
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
35 40 45
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
50 55 60
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
65 70 75 80
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
85 90 95
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
100 105 110
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
115 120 125
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
130 135 140
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
145 150 155 160
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
165 170 175
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
180 185 190
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
195 200 205
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
210 215 220
<210> 27
<211> 435
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный вариант FGF21, соединенный с гибридным Fc
<400> 27
Glu Thr Lys Thr Pro Glu Cys Pro Ser His Thr Gln Pro Leu Gly Val
1. 5 10 15
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
20 25 30
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
35 40 45
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
50 55 60
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
65 70 75 80
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
85 90 95
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
100 105 110
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
115 120 125
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
130 135 140
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
145 150 155 160
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
165 170 175
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
180 185 190
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
195 200 205
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys Ala
210 215 220
Lys Ala Thr Thr Ala Pro Ala Thr Thr Arg Asn Thr Gly Arg Gly Gly
225 230 235 240
Glu Glu Lys Lys Lys Glu Lys Glu Lys Glu Glu Gln Glu His Pro Ile
245 250 255
Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val Arg Gln Arg
260 265 270
Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala His Leu Glu Ile
275 280 285
Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln Ser Pro Glu Ser
290 295 300
Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile Gln Ile Leu Gly
305 310 315 320
Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp Gly Ala Leu Tyr
325 330 335
Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe Arg Glu Glu Ile
340 345 350
Arg Pro Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala His Gly Leu Pro
355 360 365
Leu His Leu Pro Gly Asn Lys Ser Pro His Arg Asp Pro Ala Pro Arg
370 375 380
Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro Pro Ala Leu Pro
385 390 395 400
Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp Val Gly Ser Ser
405 410 415
Asp Pro Leu Ser Met Val Thr Gly Leu Glu Ala Val Arg Ser Pro Ser
420 425 430
Tyr Ala Ser
435
<210> 28
<211> 422
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный вариант FGF21, соединенный с гибридным Fc
<400> 28
Glu Thr Lys Thr Pro Glu Cys Pro Ser His Thr Gln Pro Leu Gly Val
1. 5 10 15
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
20 25 30
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
35 40 45
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
50 55 60
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
65 70 75 80
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
85 90 95
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
100 105 110
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
115 120 125
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
130 135 140
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
145 150 155 160
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
165 170 175
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
180 185 190
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
195 200 205
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys Ala
210 215 220
Lys Ala Thr Thr Ala Pro Ala Thr Thr Arg Asn Thr Gly Arg Gly Gly
225 230 235 240
His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val
245 250 255
Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala His
260 265 270
Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln Ser
275 280 285
Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile Gln
290 295 300
Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp Gly
305 310 315 320
Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe Arg
325 330 335
Glu Leu Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala His
340 345 350
Gly Leu Pro Leu His Leu Pro Gly Asn Lys Ser Pro His Arg Asp Pro
355 360 365
Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro Pro
370 375 380
Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp Val
385 390 395 400
Gly Ser Ser Asp Pro Leu Ser Met Val Thr Gly Leu Glu Ala Val Arg
405 410 415
Ser Pro Ser Tyr Ala Ser
420
<210> 29
<211> 420
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный вариант FGF21, соединенный с гибридным Fc
<400> 29
Glu Thr Lys Thr Pro Glu Cys Pro Ser His Thr Gln Pro Leu Gly Val
1. 5 10 15
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
20 25 30
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
35 40 45
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
50 55 60
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
65 70 75 80
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
85 90 95
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
100 105 110
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
115 120 125
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
130 135 140
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
145 150 155 160
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
165 170 175
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
180 185 190
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
195 200 205
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys Gly
210 215 220
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser His Pro
225 230 235 240
Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val Arg Gln
245 250 255
Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala His Leu Glu
260 265 270
Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln Ser Pro Glu
275 280 285
Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile Gln Ile Leu
290 295 300
Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp Gly Ala Leu
305 310 315 320
Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe Arg Glu Leu
325 330 335
Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala His Gly Leu
340 345 350
Pro Leu His Leu Pro Gly Asn Lys Ser Pro His Arg Asp Pro Ala Pro
355 360 365
Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro Pro Ala Leu
370 375 380
Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp Val Gly Ser
385 390 395 400
Ser Asp Pro Leu Ser Met Val Thr Gly Leu Glu Ala Val Arg Ser Pro
405 410 415
Ser Tyr Ala Ser
420
<210> 30
<211> 420
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный вариант FGF21, соединенный с гибридным Fc
<400> 30
Glu Thr Lys Thr Pro Glu Cys Pro Ser His Thr Gln Pro Leu Gly Val
1. 5 10 15
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
20 25 30
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
35 40 45
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
50 55 60
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
65 70 75 80
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
85 90 95
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
100 105 110
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
115 120 125
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
130 135 140
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
145 150 155 160
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
165 170 175
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
180 185 190
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
195 200 205
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys Gly
210 215 220
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser His Pro
225 230 235 240
Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val Arg Gln
245 250 255
Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala His Leu Glu
260 265 270
Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln Ser Pro Glu
275 280 285
Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile Gln Ile Leu
290 295 300
Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp Gly Ala Leu
305 310 315 320
Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe Arg Glu Leu
325 330 335
Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala His Gly Leu
340 345 350
Pro Leu His Leu Pro Gly Asn Lys Ser Pro His Arg Asp Pro Ala Pro
355 360 365
Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro Pro Ala Leu
370 375 380
Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp Val Gly Ser
385 390 395 400
Ser Asp Pro Leu Ser Met Val Thr Gly Leu Glu Ala Asn Arg Ser Pro
405 410 415
Ser Tyr Ala Ser
420
<210> 31
<211> 419
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный вариант FGF21, соединенный с гибридным Fc
<400> 31
Glu Thr Lys Thr Pro Glu Cys Pro Ser His Thr Gln Pro Leu Gly Val
1. 5 10 15
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
20 25 30
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
35 40 45
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
50 55 60
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
65 70 75 80
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
85 90 95
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
100 105 110
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
115 120 125
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
130 135 140
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
145 150 155 160
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
165 170 175
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
180 185 190
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
195 200 205
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys Gly
210 215 220
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser His Pro
225 230 235 240
Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val Arg Gln
245 250 255
Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala His Leu Glu
260 265 270
Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln Ser Pro Glu
275 280 285
Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile Gln Ile Leu
290 295 300
Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp Gly Ala Leu
305 310 315 320
Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe Arg Glu Leu
325 330 335
Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala His Gly Leu
340 345 350
Pro Leu His Leu Pro Gly Asn Lys Ser Pro His Arg Asp Pro Ala Pro
355 360 365
Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro Pro Ala Leu
370 375 380
Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp Val Gly Ser
385 390 395 400
Ser Asp Pro Leu Ser Met Val Asn Pro Ser Gln Gly Arg Ser Pro Ser
405 410 415
Tyr Ala Ser
<210> 32
<211> 419
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный вариант FGF21, соединенный с гибридным Fc
<400> 32
Glu Thr Lys Thr Pro Glu Cys Pro Ser His Thr Gln Pro Leu Gly Val
1. 5 10 15
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
20 25 30
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
35 40 45
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
50 55 60
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
65 70 75 80
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
85 90 95
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
100 105 110
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
115 120 125
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
130 135 140
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
145 150 155 160
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
165 170 175
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
180 185 190
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
195 200 205
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys Gly
210 215 220
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser His Pro
225 230 235 240
Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val Arg Gln
245 250 255
Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala His Leu Glu
260 265 270
Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln Ser Pro Glu
275 280 285
Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile Gln Ile Leu
290 295 300
Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp Gly Ala Leu
305 310 315 320
Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe Arg Glu Leu
325 330 335
Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala His Gly Leu
340 345 350
Pro Leu His Leu Pro Gly Asn Lys Ser Pro His Arg Asp Pro Ala Pro
355 360 365
Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro Pro Ala Leu
370 375 380
Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp Val Gly Ser
385 390 395 400
Ser Asp Pro Leu Ser Met Val Asn Pro Ser Gln Gly Arg Ser Pro Ser
405 410 415
Tyr Ala Ser
<210> 33
<211> 419
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный вариант FGF21, соединенный с гибридным Fc
<400> 33
Glu Thr Lys Thr Pro Glu Cys Pro Ser His Thr Gln Pro Leu Gly Val
1. 5 10 15
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
20 25 30
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
35 40 45
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
50 55 60
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
65 70 75 80
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
85 90 95
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
100 105 110
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
115 120 125
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
130 135 140
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
145 150 155 160
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
165 170 175
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
180 185 190
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
195 200 205
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys Gly
210 215 220
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser His Pro
225 230 235 240
Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val Arg Gln
245 250 255
Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala His Leu Glu
260 265 270
Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln Ser Pro Glu
275 280 285
Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile Gln Ile Leu
290 295 300
Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp Gly Ala Leu
305 310 315 320
Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe Arg Glu Leu
325 330 335
Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala His Gly Leu
340 345 350
Pro Leu His Leu Pro Gly Asn Lys Ser Pro His Arg Asp Pro Ala Pro
355 360 365
Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro Pro Ala Leu
370 375 380
Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp Val Gly Ser
385 390 395 400
Ser Asp Pro Leu Ser Met Val Gly Pro Ser Gln Asn Arg Ser Pro Ser
405 410 415
Tyr Ala Ser
<210> 34
<211> 419
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный вариант FGF21, соединенный с гибридным Fc
<400> 34
Glu Thr Lys Thr Pro Glu Cys Pro Ser His Thr Gln Pro Leu Gly Val
1. 5 10 15
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
20 25 30
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
35 40 45
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
50 55 60
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
65 70 75 80
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
85 90 95
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
100 105 110
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
115 120 125
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
130 135 140
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
145 150 155 160
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
165 170 175
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
180 185 190
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
195 200 205
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys Gly
210 215 220
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser His Pro
225 230 235 240
Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val Arg Gln
245 250 255
Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala His Leu Glu
260 265 270
Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln Ser Pro Glu
275 280 285
Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile Gln Ile Leu
290 295 300
Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp Gly Ala Leu
305 310 315 320
Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe Arg Glu Leu
325 330 335
Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala His Gly Leu
340 345 350
Pro Leu His Leu Pro Gly Asn Lys Ser Pro His Arg Asp Pro Ala Pro
355 360 365
Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro Pro Ala Leu
370 375 380
Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp Val Gly Ser
385 390 395 400
Ser Asp Pro Leu Ser Met Val Gly Pro Ser Gln Gly Arg Ser Pro Ser
405 410 415
Tyr Ala Ser
<210> 35
<211> 420
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный вариант FGF21, соединенный с гибридным Fc
<400> 35
Glu Thr Lys Thr Pro Glu Cys Pro Ser His Thr Gln Pro Leu Gly Val
1. 5 10 15
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
20 25 30
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
35 40 45
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
50 55 60
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
65 70 75 80
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
85 90 95
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
100 105 110
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
115 120 125
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
130 135 140
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
145 150 155 160
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
165 170 175
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
180 185 190
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
195 200 205
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys Gly
210 215 220
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser His Pro
225 230 235 240
Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val Arg Gln
245 250 255
Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala His Leu Glu
260 265 270
Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln Ser Pro Glu
275 280 285
Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile Gln Ile Leu
290 295 300
Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp Gly Ala Leu
305 310 315 320
Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe Arg Glu Glu
325 330 335
Ile Arg Pro Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala His Gly Leu
340 345 350
Pro Leu His Leu Pro Gly Asn Lys Ser Pro His Arg Asp Pro Ala Pro
355 360 365
Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro Pro Ala Leu
370 375 380
Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp Val Gly Ser
385 390 395 400
Ser Asp Pro Leu Ser Met Val Thr Gly Leu Glu Ala Val Arg Ser Pro
405 410 415
Ser Tyr Ala Ser
420
<210> 36
<211> 420
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный вариант FGF21, соединенный с гибридным Fc
<400> 36
Glu Thr Lys Thr Pro Glu Cys Pro Ser His Thr Gln Pro Leu Gly Val
1. 5 10 15
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
20 25 30
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
35 40 45
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
50 55 60
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
65 70 75 80
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
85 90 95
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
100 105 110
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
115 120 125
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
130 135 140
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
145 150 155 160
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
165 170 175
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
180 185 190
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
195 200 205
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys Gly
210 215 220
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser His Pro
225 230 235 240
Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val Arg Gln
245 250 255
Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala His Leu Glu
260 265 270
Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln Ser Pro Glu
275 280 285
Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile Gln Ile Leu
290 295 300
Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp Gly Ala Leu
305 310 315 320
Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe Arg Glu Glu
325 330 335
Ile Arg Pro Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala His Gly Leu
340 345 350
Pro Leu His Leu Pro Gly Asn Lys Ser Pro His Arg Asp Pro Ala Pro
355 360 365
Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro Pro Ala Leu
370 375 380
Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp Val Gly Ser
385 390 395 400
Ser Asp Pro Leu Ser Met Val Thr Gly Leu Glu Ala Val Arg Ser Pro
405 410 415
Ser Tyr Glu Ser
420
<210> 37
<211> 420
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный вариант FGF21, соединенный с гибридным Fc
<400> 37
Glu Thr Lys Thr Pro Glu Cys Pro Ser His Thr Gln Pro Leu Gly Val
1. 5 10 15
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
20 25 30
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
35 40 45
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
50 55 60
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
65 70 75 80
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
85 90 95
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
100 105 110
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
115 120 125
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
130 135 140
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
145 150 155 160
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
165 170 175
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
180 185 190
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
195 200 205
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys Gly
210 215 220
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser His Pro
225 230 235 240
Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val Arg Gln
245 250 255
Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala His Leu Glu
260 265 270
Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln Ser Pro Glu
275 280 285
Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile Gln Ile Leu
290 295 300
Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp Gly Ala Leu
305 310 315 320
Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe Arg Glu Glu
325 330 335
Ile Arg Pro Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala His Gly Leu
340 345 350
Pro Leu His Leu Pro Gly Asn Lys Ser Pro His Arg Asp Pro Ala Pro
355 360 365
Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro Pro Ala Leu
370 375 380
Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp Val Gly Ser
385 390 395 400
Ser Asp Pro Leu Ser Met Val Thr Gly Leu Glu Ala Asn Arg Ser Pro
405 410 415
Ser Tyr Glu Ser
420
<210> 38
<211> 419
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный вариант FGF21, соединенный с гибридным Fc
<400> 38
Glu Thr Lys Thr Pro Glu Cys Pro Ser His Thr Gln Pro Leu Gly Val
1. 5 10 15
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
20 25 30
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
35 40 45
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
50 55 60
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
65 70 75 80
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
85 90 95
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
100 105 110
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
115 120 125
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
130 135 140
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
145 150 155 160
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
165 170 175
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
180 185 190
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
195 200 205
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys Gly
210 215 220
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser His Pro
225 230 235 240
Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val Arg Gln
245 250 255
Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala His Leu Glu
260 265 270
Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln Ser Pro Glu
275 280 285
Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile Gln Ile Leu
290 295 300
Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp Gly Ala Leu
305 310 315 320
Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe Arg Glu Glu
325 330 335
Ile Arg Pro Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala His Gly Leu
340 345 350
Pro Leu His Leu Pro Gly Asn Lys Ser Pro His Arg Asp Pro Ala Pro
355 360 365
Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro Pro Ala Leu
370 375 380
Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp Val Gly Ser
385 390 395 400
Ser Asp Pro Leu Ser Met Val Asn Pro Ser Gln Gly Arg Ser Pro Ser
405 410 415
Tyr Ala Ser
<210> 39
<211> 419
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> модифицированный вариант FGF21, соединенный с гибридным Fc
<400> 39
Glu Thr Lys Thr Pro Glu Cys Pro Ser His Thr Gln Pro Leu Gly Val
1. 5 10 15
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
20 25 30
Pro Glu Val Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu
35 40 45
Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
50 55 60
Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser
65 70 75 80
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
85 90 95
Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile
100 105 110
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
115 120 125
Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
130 135 140
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
145 150 155 160
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
165 170 175
Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg
180 185 190
Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
195 200 205
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys Gly
210 215 220
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser His Pro
225 230 235 240
Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly Gln Val Arg Gln
245 250 255
Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu Ala His Leu Glu
260 265 270
Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp Gln Ser Pro Glu
275 280 285
Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val Ile Gln Ile Leu
290 295 300
Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro Asp Gly Ala Leu
305 310 315 320
Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser Phe Arg Glu Glu
325 330 335
Ile Arg Pro Asp Gly Tyr Asn Val Tyr Gln Ser Glu Ala His Gly Leu
340 345 350
Pro Leu His Leu Pro Gly Asn Lys Ser Pro His Arg Asp Pro Ala Pro
355 360 365
Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu Pro Pro Ala Leu
370 375 380
Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro Asp Val Gly Ser
385 390 395 400
Ser Asp Pro Leu Ser Met Val Asn Pro Ser Gln Gly Arg Ser Pro Ser
405 410 415
Tyr Glu Ser
<210> 40
<211> 423
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> REG(Amgen)
<400> 40
Asp Lys Thr His Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly
1. 5 10 15
Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met
20 25 30
Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser His
35 40 45
Glu Asp Pro Glu Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val
50 55 60
His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr
65 70 75 80
Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly
85 90 95
Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile
100 105 110
Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val
115 120 125
Tyr Thr Leu Pro Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser
130 135 140
Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu
145 150 155 160
Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro
165 170 175
Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val
180 185 190
Asp Lys Ser Arg Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met
195 200 205
His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser
210 215 220
Pro Gly Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
225 230 235 240
Gly Ser His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly Gly
245 250 255
Gln Val Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr Glu
260 265 270
Ala His Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala Asp
275 280 285
Gln Ser Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly Val
290 295 300
Ile Gln Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg Pro
305 310 315 320
Asp Gly Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys Ser
325 330 335
Phe Arg Glu Arg Leu Leu Glu Asp Gly Tyr Asn Val Tyr Gln Ser Glu
340 345 350
Ala His Gly Leu Pro Leu His Leu Pro Gly Asn Lys Ser Pro His Arg
355 360 365
Asp Pro Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly Leu
370 375 380
Pro Pro Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro Pro
385 390 395 400
Asp Val Gly Ser Ser Asp Pro Leu Ser Met Val Gly Gly Ser Gln Gly
405 410 415
Arg Ser Pro Ser Tyr Glu Ser
420
<210> 41
<211> 424
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> FGF21, соединенный с Fc(lilly)
<400> 41
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala
1. 5 10 15
Ala Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
225 230 235 240
Gly Gly Ser Ala His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe
245 250 255
Gly Gly Gln Val Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln
260 265 270
Thr Glu Cys His Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Cys Ala
275 280 285
Ala Asp Gln Ser Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro
290 295 300
Gly Val Ile Gln Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln
305 310 315 320
Arg Pro Asp Gly Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala
325 330 335
Cys Ser Phe Arg Glu Asp Leu Lys Glu Asp Gly Tyr Asn Val Tyr Gln
340 345 350
Ser Glu Ala His Gly Leu Pro Leu His Leu Pro Gly Asp Lys Ser Pro
355 360 365
His Arg Lys Pro Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro
370 375 380
Gly Leu Pro Pro Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln
385 390 395 400
Pro Pro Asp Val Gly Ser Ser Asp Pro Leu Arg Leu Val Glu Pro Ser
405 410 415
Gln Leu Arg Ser Pro Ser Phe Glu
420
<210> 42
<211> 31
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> ГПП-1
<400> 42
His Ala Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Gly
1. 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Arg Gly
20 25 30
<210> 43
<211> 31
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> вариант ГПП-1
<400> 43
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Gly
1. 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Arg Gly
20 25 30
<210> 44
<211> 31
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> вариант ГПП-1
<400> 44
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1. 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Arg Gly
20 25 30
<210> 45
<211> 31
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> вариант ГПП-1
<400> 45
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Gly
1. 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Gly Gly
20 25 30
<210> 46
<211> 31
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> вариант ГПП-1
<400> 46
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1. 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Gly Gly
20 25 30
<210> 47
<211> 245
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> гибридный Fc5
<400> 47
Arg Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Lys Glu Lys Glu Lys
1. 5 10 15
Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys Pro Ser His
20 25 30
Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
35 40 45
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
50 55 60
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
65 70 75 80
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
85 90 95
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
100 105 110
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
115 120 125
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
130 135 140
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
145 150 155 160
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
165 170 175
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
180 185 190
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
195 200 205
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
210 215 220
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
225 230 235 240
Leu Ser Leu Gly Lys
245
<210> 48
<211> 233
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> гибридный Fc40
<400> 48
Glu Lys Glu Lys Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu
1. 5 10 15
Cys Pro Ser His Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys
20 25 30
Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val
35 40 45
Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr
50 55 60
Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu
65 70 75 80
Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His
85 90 95
Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys
100 105 110
Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln
115 120 125
Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met
130 135 140
Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro
145 150 155 160
Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn
165 170 175
Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu
180 185 190
Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val
195 200 205
Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln
210 215 220
Lys Ser Leu Ser Leu Ser Leu Gly Lys
225 230
<210> 49
<211> 276
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> вариант ГПП-1, соединенный с гибридным Fc5
<400> 49
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Gly
1. 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Arg Gly Arg
20 25 30
Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Lys Glu Lys Glu Lys Glu
35 40 45
Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys Pro Ser His Thr
50 55 60
Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
65 70 75 80
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
85 90 95
Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu
100 105 110
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr
115 120 125
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
130 135 140
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser
145 150 155 160
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
165 170 175
Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val
180 185 190
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
195 200 205
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
210 215 220
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr
225 230 235 240
Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val
245 250 255
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
260 265 270
Ser Leu Gly Lys
275
<210> 50
<211> 264
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> вариант ГПП-1, соединенный с гибридным Fc40
<400> 50
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Gly
1. 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Arg Gly Glu
20 25 30
Lys Glu Lys Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys
35 40 45
Pro Ser His Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys Pro
50 55 60
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
65 70 75 80
Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val
85 90 95
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
100 105 110
Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
115 120 125
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly
130 135 140
Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
145 150 155 160
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr
165 170 175
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
180 185 190
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
195 200 205
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
210 215 220
Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe
225 230 235 240
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
245 250 255
Ser Leu Ser Leu Ser Leu Gly Lys
260
<210> 51
<211> 276
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> вариант ГПП-1, соединенный с гибридным Fc5
<400> 51
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1. 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Arg Gly Arg
20 25 30
Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Lys Glu Lys Glu Lys Glu
35 40 45
Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys Pro Ser His Thr
50 55 60
Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
65 70 75 80
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
85 90 95
Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu
100 105 110
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr
115 120 125
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
130 135 140
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser
145 150 155 160
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
165 170 175
Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val
180 185 190
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
195 200 205
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
210 215 220
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr
225 230 235 240
Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val
245 250 255
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
260 265 270
Ser Leu Gly Lys
275
<210> 52
<211> 264
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> вариант ГПП-1, соединенный с гибридным Fc40
<400> 52
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1. 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Arg Gly Glu
20 25 30
Lys Glu Lys Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys
35 40 45
Pro Ser His Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys Pro
50 55 60
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
65 70 75 80
Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val
85 90 95
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
100 105 110
Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
115 120 125
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly
130 135 140
Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
145 150 155 160
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr
165 170 175
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
180 185 190
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
195 200 205
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
210 215 220
Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe
225 230 235 240
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
245 250 255
Ser Leu Ser Leu Ser Leu Gly Lys
260
<210> 53
<211> 276
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> вариант ГПП-1, соединенный с гибридным Fc5
<400> 53
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Gly
1. 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Gly Gly Arg
20 25 30
Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Lys Glu Lys Glu Lys Glu
35 40 45
Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys Pro Ser His Thr
50 55 60
Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
65 70 75 80
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
85 90 95
Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu
100 105 110
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr
115 120 125
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
130 135 140
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser
145 150 155 160
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
165 170 175
Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val
180 185 190
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
195 200 205
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
210 215 220
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr
225 230 235 240
Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val
245 250 255
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
260 265 270
Ser Leu Gly Lys
275
<210> 54
<211> 264
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> вариант ГПП-1, соединенный с гибридным Fc40
<400> 54
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Gly
1. 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Gly Gly Glu
20 25 30
Lys Glu Lys Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys
35 40 45
Pro Ser His Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys Pro
50 55 60
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
65 70 75 80
Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val
85 90 95
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
100 105 110
Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
115 120 125
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly
130 135 140
Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
145 150 155 160
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr
165 170 175
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
180 185 190
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
195 200 205
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
210 215 220
Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe
225 230 235 240
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
245 250 255
Ser Leu Ser Leu Ser Leu Gly Lys
260
<210> 55
<211> 276
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> вариант ГПП-1, соединенный с гибридным Fc5
<400> 55
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1. 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Gly Gly Arg
20 25 30
Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Lys Glu Lys Glu Lys Glu
35 40 45
Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys Pro Ser His Thr
50 55 60
Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
65 70 75 80
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
85 90 95
Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu
100 105 110
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr
115 120 125
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
130 135 140
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser
145 150 155 160
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
165 170 175
Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val
180 185 190
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
195 200 205
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
210 215 220
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr
225 230 235 240
Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val
245 250 255
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
260 265 270
Ser Leu Gly Lys
275
<210> 56
<211> 264
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> вариант ГПП-1, соединенный с гибридным Fc40
<400> 56
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1. 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Gly Gly Glu
20 25 30
Lys Glu Lys Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys
35 40 45
Pro Ser His Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys Pro
50 55 60
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
65 70 75 80
Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val
85 90 95
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
100 105 110
Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
115 120 125
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly
130 135 140
Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
145 150 155 160
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr
165 170 175
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
180 185 190
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
195 200 205
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
210 215 220
Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe
225 230 235 240
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
245 250 255
Ser Leu Ser Leu Ser Leu Gly Lys
260
<210> 57
<211> 275
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Дулаглутид
<400> 57
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1. 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Gly Gly Gly
20 25 30
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ala Glu
35 40 45
Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Ala Ala
50 55 60
Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
65 70 75 80
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
85 90 95
Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu
100 105 110
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr
115 120 125
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
130 135 140
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser
145 150 155 160
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
165 170 175
Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val
180 185 190
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
195 200 205
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
210 215 220
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr
225 230 235 240
Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val
245 250 255
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
260 265 270
Ser Leu Gly
275
<210> 58
<211> 461
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> ГПП1(A2G)-HyFc40-GS3-FGF21(EIRP, TGLEAV)
<400> 58
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Gly
1. 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Arg Gly Glu
20 25 30
Lys Glu Lys Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys
35 40 45
Pro Ser His Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys Pro
50 55 60
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
65 70 75 80
Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val
85 90 95
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
100 105 110
Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
115 120 125
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly
130 135 140
Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
145 150 155 160
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr
165 170 175
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
180 185 190
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
195 200 205
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
210 215 220
Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe
225 230 235 240
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
245 250 255
Ser Leu Ser Leu Ser Leu Gly Lys Gly Gly Gly Gly Ser Gly Gly Gly
260 265 270
Gly Ser Gly Gly Gly Gly Ser His Pro Ile Pro Asp Ser Ser Pro Leu
275 280 285
Leu Gln Phe Gly Gly Gln Val Arg Gln Arg Tyr Leu Tyr Thr Asp Asp
290 295 300
Ala Gln Gln Thr Glu Ala His Leu Glu Ile Arg Glu Asp Gly Thr Val
305 310 315 320
Gly Gly Ala Ala Asp Gln Ser Pro Glu Ser Leu Leu Gln Leu Lys Ala
325 330 335
Leu Lys Pro Gly Val Ile Gln Ile Leu Gly Val Lys Thr Ser Arg Phe
340 345 350
Leu Cys Gln Arg Pro Asp Gly Ala Leu Tyr Gly Ser Leu His Phe Asp
355 360 365
Pro Glu Ala Cys Ser Phe Arg Glu Glu Ile Arg Pro Asp Gly Tyr Asn
370 375 380
Val Tyr Gln Ser Glu Ala His Gly Leu Pro Leu His Leu Pro Gly Asn
385 390 395 400
Lys Ser Pro His Arg Asp Pro Ala Pro Arg Gly Pro Ala Arg Phe Leu
405 410 415
Pro Leu Pro Gly Leu Pro Pro Ala Leu Pro Glu Pro Pro Gly Ile Leu
420 425 430
Ala Pro Gln Pro Pro Asp Val Gly Ser Ser Asp Pro Leu Ser Met Val
435 440 445
Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Tyr Ala Ser
450 455 460
<210> 59
<211> 473
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> ГПП1(GE)-HyFc5-GS3-FGF21(EIRP, TGLEAV)
<400> 59
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1. 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Arg Gly Arg
20 25 30
Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Lys Glu Lys Glu Lys Glu
35 40 45
Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys Pro Ser His Thr
50 55 60
Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
65 70 75 80
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
85 90 95
Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu
100 105 110
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr
115 120 125
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
130 135 140
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser
145 150 155 160
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
165 170 175
Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val
180 185 190
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
195 200 205
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
210 215 220
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr
225 230 235 240
Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val
245 250 255
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
260 265 270
Ser Leu Gly Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
275 280 285
Gly Gly Ser His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly
290 295 300
Gly Gln Val Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr
305 310 315 320
Glu Ala His Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala
325 330 335
Asp Gln Ser Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly
340 345 350
Val Ile Gln Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg
355 360 365
Pro Asp Gly Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys
370 375 380
Ser Phe Arg Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Gln Ser
385 390 395 400
Glu Ala His Gly Leu Pro Leu His Leu Pro Gly Asn Lys Ser Pro His
405 410 415
Arg Asp Pro Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly
420 425 430
Leu Pro Pro Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro
435 440 445
Pro Asp Val Gly Ser Ser Asp Pro Leu Ser Met Val Thr Gly Leu Glu
450 455 460
Ala Val Arg Ser Pro Ser Tyr Ala Ser
465 470
<210> 60
<211> 461
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> ГПП1(GE)-HyFc40-GS3-FGF21(EIRP, TGLEAV)
<400> 60
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1. 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Arg Gly Glu
20 25 30
Lys Glu Lys Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys
35 40 45
Pro Ser His Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys Pro
50 55 60
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
65 70 75 80
Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val
85 90 95
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
100 105 110
Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
115 120 125
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly
130 135 140
Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
145 150 155 160
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr
165 170 175
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
180 185 190
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
195 200 205
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
210 215 220
Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe
225 230 235 240
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
245 250 255
Ser Leu Ser Leu Ser Leu Gly Lys Gly Gly Gly Gly Ser Gly Gly Gly
260 265 270
Gly Ser Gly Gly Gly Gly Ser His Pro Ile Pro Asp Ser Ser Pro Leu
275 280 285
Leu Gln Phe Gly Gly Gln Val Arg Gln Arg Tyr Leu Tyr Thr Asp Asp
290 295 300
Ala Gln Gln Thr Glu Ala His Leu Glu Ile Arg Glu Asp Gly Thr Val
305 310 315 320
Gly Gly Ala Ala Asp Gln Ser Pro Glu Ser Leu Leu Gln Leu Lys Ala
325 330 335
Leu Lys Pro Gly Val Ile Gln Ile Leu Gly Val Lys Thr Ser Arg Phe
340 345 350
Leu Cys Gln Arg Pro Asp Gly Ala Leu Tyr Gly Ser Leu His Phe Asp
355 360 365
Pro Glu Ala Cys Ser Phe Arg Glu Glu Ile Arg Pro Asp Gly Tyr Asn
370 375 380
Val Tyr Gln Ser Glu Ala His Gly Leu Pro Leu His Leu Pro Gly Asn
385 390 395 400
Lys Ser Pro His Arg Asp Pro Ala Pro Arg Gly Pro Ala Arg Phe Leu
405 410 415
Pro Leu Pro Gly Leu Pro Pro Ala Leu Pro Glu Pro Pro Gly Ile Leu
420 425 430
Ala Pro Gln Pro Pro Asp Val Gly Ser Ser Asp Pro Leu Ser Met Val
435 440 445
Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Tyr Ala Ser
450 455 460
<210> 61
<211> 473
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> ГПП1(GG)-HyFc5-GS3-FGF21(EIRP, TGLEAV)
<400> 61
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Gly
1. 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Gly Gly Arg
20 25 30
Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Lys Glu Lys Glu Lys Glu
35 40 45
Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys Pro Ser His Thr
50 55 60
Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
65 70 75 80
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
85 90 95
Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu
100 105 110
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr
115 120 125
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
130 135 140
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser
145 150 155 160
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
165 170 175
Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val
180 185 190
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
195 200 205
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
210 215 220
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr
225 230 235 240
Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val
245 250 255
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
260 265 270
Ser Leu Gly Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
275 280 285
Gly Gly Ser His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly
290 295 300
Gly Gln Val Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr
305 310 315 320
Glu Ala His Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala
325 330 335
Asp Gln Ser Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly
340 345 350
Val Ile Gln Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg
355 360 365
Pro Asp Gly Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys
370 375 380
Ser Phe Arg Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Gln Ser
385 390 395 400
Glu Ala His Gly Leu Pro Leu His Leu Pro Gly Asn Lys Ser Pro His
405 410 415
Arg Asp Pro Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly
420 425 430
Leu Pro Pro Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro
435 440 445
Pro Asp Val Gly Ser Ser Asp Pro Leu Ser Met Val Thr Gly Leu Glu
450 455 460
Ala Val Arg Ser Pro Ser Tyr Ala Ser
465 470
<210> 62
<211> 461
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> ГПП1(GG)-HyFc40-GS3-FGF21(EIRP, TGLEAV)
<400> 62
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Gly
1. 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Gly Gly Glu
20 25 30
Lys Glu Lys Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys
35 40 45
Pro Ser His Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys Pro
50 55 60
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
65 70 75 80
Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val
85 90 95
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
100 105 110
Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
115 120 125
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly
130 135 140
Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
145 150 155 160
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr
165 170 175
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
180 185 190
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
195 200 205
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
210 215 220
Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe
225 230 235 240
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
245 250 255
Ser Leu Ser Leu Ser Leu Gly Lys Gly Gly Gly Gly Ser Gly Gly Gly
260 265 270
Gly Ser Gly Gly Gly Gly Ser His Pro Ile Pro Asp Ser Ser Pro Leu
275 280 285
Leu Gln Phe Gly Gly Gln Val Arg Gln Arg Tyr Leu Tyr Thr Asp Asp
290 295 300
Ala Gln Gln Thr Glu Ala His Leu Glu Ile Arg Glu Asp Gly Thr Val
305 310 315 320
Gly Gly Ala Ala Asp Gln Ser Pro Glu Ser Leu Leu Gln Leu Lys Ala
325 330 335
Leu Lys Pro Gly Val Ile Gln Ile Leu Gly Val Lys Thr Ser Arg Phe
340 345 350
Leu Cys Gln Arg Pro Asp Gly Ala Leu Tyr Gly Ser Leu His Phe Asp
355 360 365
Pro Glu Ala Cys Ser Phe Arg Glu Glu Ile Arg Pro Asp Gly Tyr Asn
370 375 380
Val Tyr Gln Ser Glu Ala His Gly Leu Pro Leu His Leu Pro Gly Asn
385 390 395 400
Lys Ser Pro His Arg Asp Pro Ala Pro Arg Gly Pro Ala Arg Phe Leu
405 410 415
Pro Leu Pro Gly Leu Pro Pro Ala Leu Pro Glu Pro Pro Gly Ile Leu
420 425 430
Ala Pro Gln Pro Pro Asp Val Gly Ser Ser Asp Pro Leu Ser Met Val
435 440 445
Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Tyr Ala Ser
450 455 460
<210> 63
<211> 473
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> ГПП1(GEG)-HyFc5-GS3-FGF21(EIRP, TGLEAV)
<400> 63
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1. 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Gly Gly Arg
20 25 30
Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Lys Glu Lys Glu Lys Glu
35 40 45
Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys Pro Ser His Thr
50 55 60
Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu
65 70 75 80
Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val Ser
85 90 95
Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val Glu
100 105 110
Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser Thr
115 120 125
Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu Asn
130 135 140
Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser Ser
145 150 155 160
Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln
165 170 175
Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln Val
180 185 190
Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val
195 200 205
Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro
210 215 220
Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu Thr
225 230 235 240
Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser Val
245 250 255
Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu
260 265 270
Ser Leu Gly Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
275 280 285
Gly Gly Ser His Pro Ile Pro Asp Ser Ser Pro Leu Leu Gln Phe Gly
290 295 300
Gly Gln Val Arg Gln Arg Tyr Leu Tyr Thr Asp Asp Ala Gln Gln Thr
305 310 315 320
Glu Ala His Leu Glu Ile Arg Glu Asp Gly Thr Val Gly Gly Ala Ala
325 330 335
Asp Gln Ser Pro Glu Ser Leu Leu Gln Leu Lys Ala Leu Lys Pro Gly
340 345 350
Val Ile Gln Ile Leu Gly Val Lys Thr Ser Arg Phe Leu Cys Gln Arg
355 360 365
Pro Asp Gly Ala Leu Tyr Gly Ser Leu His Phe Asp Pro Glu Ala Cys
370 375 380
Ser Phe Arg Glu Glu Ile Arg Pro Asp Gly Tyr Asn Val Tyr Gln Ser
385 390 395 400
Glu Ala His Gly Leu Pro Leu His Leu Pro Gly Asn Lys Ser Pro His
405 410 415
Arg Asp Pro Ala Pro Arg Gly Pro Ala Arg Phe Leu Pro Leu Pro Gly
420 425 430
Leu Pro Pro Ala Leu Pro Glu Pro Pro Gly Ile Leu Ala Pro Gln Pro
435 440 445
Pro Asp Val Gly Ser Ser Asp Pro Leu Ser Met Val Thr Gly Leu Glu
450 455 460
Ala Val Arg Ser Pro Ser Tyr Ala Ser
465 470
<210> 64
<211> 461
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> ГПП1(GEG)-HyFc40-GS3-FGF21(EIRP, TGLEAV)
<400> 64
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1. 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Gly Gly Glu
20 25 30
Lys Glu Lys Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys
35 40 45
Pro Ser His Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys Pro
50 55 60
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
65 70 75 80
Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val
85 90 95
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
100 105 110
Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
115 120 125
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly
130 135 140
Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
145 150 155 160
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr
165 170 175
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
180 185 190
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
195 200 205
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
210 215 220
Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe
225 230 235 240
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
245 250 255
Ser Leu Ser Leu Ser Leu Gly Lys Gly Gly Gly Gly Ser Gly Gly Gly
260 265 270
Gly Ser Gly Gly Gly Gly Ser His Pro Ile Pro Asp Ser Ser Pro Leu
275 280 285
Leu Gln Phe Gly Gly Gln Val Arg Gln Arg Tyr Leu Tyr Thr Asp Asp
290 295 300
Ala Gln Gln Thr Glu Ala His Leu Glu Ile Arg Glu Asp Gly Thr Val
305 310 315 320
Gly Gly Ala Ala Asp Gln Ser Pro Glu Ser Leu Leu Gln Leu Lys Ala
325 330 335
Leu Lys Pro Gly Val Ile Gln Ile Leu Gly Val Lys Thr Ser Arg Phe
340 345 350
Leu Cys Gln Arg Pro Asp Gly Ala Leu Tyr Gly Ser Leu His Phe Asp
355 360 365
Pro Glu Ala Cys Ser Phe Arg Glu Glu Ile Arg Pro Asp Gly Tyr Asn
370 375 380
Val Tyr Gln Ser Glu Ala His Gly Leu Pro Leu His Leu Pro Gly Asn
385 390 395 400
Lys Ser Pro His Arg Asp Pro Ala Pro Arg Gly Pro Ala Arg Phe Leu
405 410 415
Pro Leu Pro Gly Leu Pro Pro Ala Leu Pro Glu Pro Pro Gly Ile Leu
420 425 430
Ala Pro Gln Pro Pro Asp Val Gly Ser Ser Asp Pro Leu Ser Met Val
435 440 445
Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Tyr Ala Ser
450 455 460
<210> 65
<211> 461
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> ГПП1(GEG)-HyFc40-GS3-FGF21(EIRP, TGLEAV, A180E)
<400> 65
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1. 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Gly Gly Glu
20 25 30
Lys Glu Lys Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys
35 40 45
Pro Ser His Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys Pro
50 55 60
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
65 70 75 80
Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val
85 90 95
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
100 105 110
Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
115 120 125
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly
130 135 140
Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
145 150 155 160
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr
165 170 175
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
180 185 190
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
195 200 205
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
210 215 220
Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe
225 230 235 240
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
245 250 255
Ser Leu Ser Leu Ser Leu Gly Lys Gly Gly Gly Gly Ser Gly Gly Gly
260 265 270
Gly Ser Gly Gly Gly Gly Ser His Pro Ile Pro Asp Ser Ser Pro Leu
275 280 285
Leu Gln Phe Gly Gly Gln Val Arg Gln Arg Tyr Leu Tyr Thr Asp Asp
290 295 300
Ala Gln Gln Thr Glu Ala His Leu Glu Ile Arg Glu Asp Gly Thr Val
305 310 315 320
Gly Gly Ala Ala Asp Gln Ser Pro Glu Ser Leu Leu Gln Leu Lys Ala
325 330 335
Leu Lys Pro Gly Val Ile Gln Ile Leu Gly Val Lys Thr Ser Arg Phe
340 345 350
Leu Cys Gln Arg Pro Asp Gly Ala Leu Tyr Gly Ser Leu His Phe Asp
355 360 365
Pro Glu Ala Cys Ser Phe Arg Glu Glu Ile Arg Pro Asp Gly Tyr Asn
370 375 380
Val Tyr Gln Ser Glu Ala His Gly Leu Pro Leu His Leu Pro Gly Asn
385 390 395 400
Lys Ser Pro His Arg Asp Pro Ala Pro Arg Gly Pro Ala Arg Phe Leu
405 410 415
Pro Leu Pro Gly Leu Pro Pro Ala Leu Pro Glu Pro Pro Gly Ile Leu
420 425 430
Ala Pro Gln Pro Pro Asp Val Gly Ser Ser Asp Pro Leu Ser Met Val
435 440 445
Thr Gly Leu Glu Ala Val Arg Ser Pro Ser Tyr Glu Ser
450 455 460
<210> 66
<211> 461
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> ГПП1(GEG)-HyFc40-GS3-FGF21(EIRP, TGLEAN, A180E)
<400> 66
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1. 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Gly Gly Glu
20 25 30
Lys Glu Lys Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys
35 40 45
Pro Ser His Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys Pro
50 55 60
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
65 70 75 80
Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val
85 90 95
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
100 105 110
Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
115 120 125
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly
130 135 140
Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
145 150 155 160
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr
165 170 175
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
180 185 190
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
195 200 205
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
210 215 220
Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe
225 230 235 240
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
245 250 255
Ser Leu Ser Leu Ser Leu Gly Lys Gly Gly Gly Gly Ser Gly Gly Gly
260 265 270
Gly Ser Gly Gly Gly Gly Ser His Pro Ile Pro Asp Ser Ser Pro Leu
275 280 285
Leu Gln Phe Gly Gly Gln Val Arg Gln Arg Tyr Leu Tyr Thr Asp Asp
290 295 300
Ala Gln Gln Thr Glu Ala His Leu Glu Ile Arg Glu Asp Gly Thr Val
305 310 315 320
Gly Gly Ala Ala Asp Gln Ser Pro Glu Ser Leu Leu Gln Leu Lys Ala
325 330 335
Leu Lys Pro Gly Val Ile Gln Ile Leu Gly Val Lys Thr Ser Arg Phe
340 345 350
Leu Cys Gln Arg Pro Asp Gly Ala Leu Tyr Gly Ser Leu His Phe Asp
355 360 365
Pro Glu Ala Cys Ser Phe Arg Glu Glu Ile Arg Pro Asp Gly Tyr Asn
370 375 380
Val Tyr Gln Ser Glu Ala His Gly Leu Pro Leu His Leu Pro Gly Asn
385 390 395 400
Lys Ser Pro His Arg Asp Pro Ala Pro Arg Gly Pro Ala Arg Phe Leu
405 410 415
Pro Leu Pro Gly Leu Pro Pro Ala Leu Pro Glu Pro Pro Gly Ile Leu
420 425 430
Ala Pro Gln Pro Pro Asp Val Gly Ser Ser Asp Pro Leu Ser Met Val
435 440 445
Thr Gly Leu Glu Ala Asn Arg Ser Pro Ser Tyr Glu Ser
450 455 460
<210> 67
<211> 460
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> ГПП1(GEG)-HyFc40-GS3-FGF21(EIRP, G170N, A180E)
<400> 67
His Gly Glu Gly Thr Phe Thr Ser Asp Val Ser Ser Tyr Leu Glu Glu
1. 5 10 15
Gln Ala Ala Lys Glu Phe Ile Ala Trp Leu Val Lys Gly Gly Gly Glu
20 25 30
Lys Glu Lys Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys
35 40 45
Pro Ser His Thr Gln Pro Leu Gly Val Phe Leu Phe Pro Pro Lys Pro
50 55 60
Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val
65 70 75 80
Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val
85 90 95
Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln
100 105 110
Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln
115 120 125
Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly
130 135 140
Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro
145 150 155 160
Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr
165 170 175
Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser
180 185 190
Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr
195 200 205
Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr
210 215 220
Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe
225 230 235 240
Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys
245 250 255
Ser Leu Ser Leu Ser Leu Gly Lys Gly Gly Gly Gly Ser Gly Gly Gly
260 265 270
Gly Ser Gly Gly Gly Gly Ser His Pro Ile Pro Asp Ser Ser Pro Leu
275 280 285
Leu Gln Phe Gly Gly Gln Val Arg Gln Arg Tyr Leu Tyr Thr Asp Asp
290 295 300
Ala Gln Gln Thr Glu Ala His Leu Glu Ile Arg Glu Asp Gly Thr Val
305 310 315 320
Gly Gly Ala Ala Asp Gln Ser Pro Glu Ser Leu Leu Gln Leu Lys Ala
325 330 335
Leu Lys Pro Gly Val Ile Gln Ile Leu Gly Val Lys Thr Ser Arg Phe
340 345 350
Leu Cys Gln Arg Pro Asp Gly Ala Leu Tyr Gly Ser Leu His Phe Asp
355 360 365
Pro Glu Ala Cys Ser Phe Arg Glu Glu Ile Arg Pro Asp Gly Tyr Asn
370 375 380
Val Tyr Gln Ser Glu Ala His Gly Leu Pro Leu His Leu Pro Gly Asn
385 390 395 400
Lys Ser Pro His Arg Asp Pro Ala Pro Arg Gly Pro Ala Arg Phe Leu
405 410 415
Pro Leu Pro Gly Leu Pro Pro Ala Leu Pro Glu Pro Pro Gly Ile Leu
420 425 430
Ala Pro Gln Pro Pro Asp Val Gly Ser Ser Asp Pro Leu Ser Met Val
435 440 445
Asn Pro Ser Gln Gly Arg Ser Pro Ser Tyr Glu Ser
450 455 460
<210> 68
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> вариант FGF21
<400> 68
Glu Ile Arg Pro
1
<210> 69
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> вариант FGF21
<400> 69
Thr Gly Leu Glu Ala Val
1. 5
<210> 70
<211> 6
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> вариант FGF21
<400> 70
Thr Gly Leu Glu Ala Asn
1. 5
<210> 71
<211> 1383
<212> ДНК
<213> Искусственная последовательность
<220>
<223> молекула нуклеиновой кислоты, кодирующей DFD23
<400> 71
cacggcgagg ggaccttcac aagcgacgtg tcctcttatc tggaaggaca ggccgctaag 60
gagtttatcg catggctcgt caaaggcaga ggcgaaaagg agaaggaaga gcaggaggag 120
agagaaacca aaacacccga gtgtcccagt cacactcagc ctctgggagt gtttctcttc 180
ccacctaagc ccaaggatac ccttatgatt tctaggacac ctgaggtgac ctgcgtcgtt 240
gtggacgtga gtcaagagga cccagaggtc cagtttaact ggtatgttga cggcgtggaa 300
gtgcataatg caaaaactaa accccgcgag gaacaattca attcaaccta ccgggtcgtt 360
tctgtgttga cagtgctgca tcaagattgg ctgaacggga aggagtataa gtgtaaagtc 420
agtaataagg gactcccctc tagtatcgaa aaaactattt caaaggccaa aggccagcct 480
agagagccac aggtgtacac ccttcctcca tcccaagagg agatgacaaa gaaccaggtg 540
tctctgactt gtctcgtgaa ggggttctac cctagtgaca tcgctgtcga atgggagtca 600
aacggacagc cagagaataa ttataagaca actcctcccg ttctggattc tgacggcagc 660
ttctttctgt actctaggct tactgtggac aaaagtcgct ggcaagaagg gaacgtcttt 720
tcatgttctg ttatgcacga ggccttgcac aatcattata cacagaagtc tctgagtctc 780
tcactgggca aaggcggggg aggcagcggg ggaggcgggt ccggaggcgg gggatctcat 840
cccatccctg actccagtcc tctcctgcaa ttcgggggcc aagtccggca gcggtacctc 900
tacacagatg atgctcagca gacagaagcc cacctggaga tcagggagga tgggaccgtg 960
gggggcgctg ctgaccagag ccccgaaagt ctcctgcagc tgaaagcctt gaagcctgga 1020
gttattcaaa tcttgggagt caagactagt aggttcctgt gccagcggcc agatggggcc 1080
ctgtatggat ctctccattt tgaccctgag gcctgcagct tccgggagga gatcagaccc 1140
gacggataca atgtttacca gtccgaagcc cacggcctcc ctctgcatct gcccgggaac 1200
aagtctcctc accgggaccc tgcccccaga ggacctgctc gcttcctgcc actcccaggc 1260
ctgccccccg cattgcctga gccacccgga atcctggccc cccagccccc tgatgtggga 1320
tcctctgacc ctctgagcat ggtgacaggc ctggaggccg tgagaagccc cagctacgct 1380
tcc 1383
<210> 72
<211> 1419
<212> ДНК
<213> Искусственная последовательность
<220>
<223> молекула нуклеиновой кислоты, кодирующей DFD24
<400> 72
cacggcgagg ggaccttcac aagcgacgtg tcctcttacc tggaagagca ggccgctaag 60
gaatttatcg catggctcgt caaaggaaga gggaggaaca ccggacgggg cggggaagag 120
aagaagaaag aaaaggagaa ggaagagcag gaggagagag aaaccaaaac acccgagtgt 180
cccagtcaca ctcagcctct gggagtgttt ctcttcccac ctaagcccaa ggataccctt 240
atgatttcta ggacacctga ggtgacctgc gtcgttgtgg acgtgagtca agaggaccca 300
gaggtccagt ttaactggta tgttgacggc gtggaagtgc ataatgcaaa aactaaaccc 360
cgcgaggaac aattcaattc aacctaccgg gtcgtttctg tgttgacagt gctgcatcaa 420
gattggctga acgggaagga gtataagtgt aaagtcagta ataagggact cccctctagt 480
atcgaaaaaa ctatttcaaa ggccaaaggc cagcctagag agccacaggt gtacaccctt 540
cctccatccc aagaggagat gacaaagaac caggtgtctc tgacttgtct cgtgaagggg 600
ttctacccta gtgacatcgc tgtcgaatgg gagtcaaacg gacagccaga gaataattat 660
aagacaactc ctcccgttct ggattctgac ggcagcttct ttctgtactc taggcttact 720
gtggacaaaa gtcgctggca agaagggaac gtcttttcat gttctgttat gcacgaggcc 780
ttgcacaatc attatacaca gaagtctctg agtctctcac tgggcaaagg cgggggaggc 840
agcgggggag gcgggtccgg aggcggggga tctcatccca tccctgactc cagtcctctc 900
ctgcaattcg ggggccaagt ccggcagcgg tacctctaca cagatgatgc tcagcagaca 960
gaagcccacc tggagatcag ggaggatggg accgtggggg gcgctgctga ccagagcccc 1020
gaaagtctcc tgcagctgaa agccttgaag cctggagtta ttcaaatctt gggagtcaag 1080
actagtaggt tcctgtgcca gcggccagat ggggccctgt atggatctct ccattttgac 1140
cctgaggcct gcagcttccg ggaggagatc agacccgacg gatacaatgt ttaccagtcc 1200
gaagcccacg gcctccctct gcatctgccc gggaacaagt ctcctcaccg ggaccctgcc 1260
cccagaggac ctgctcgctt cctgccactc ccaggcctgc cccccgcatt gcctgagcca 1320
cccggaatcc tggcccccca gccccctgat gtgggatcct ctgaccctct gagcatggtg 1380
acaggcctgg aggccgtgag aagccccagc tacgcttcc 1419
<210> 73
<211> 1383
<212> ДНК
<213> Искусственная последовательность
<220>
<223> молекула нуклеиновой кислоты, кодирующей DFD25
<400> 73
cacggcgagg ggaccttcac aagcgacgtg tcctcttacc tggaagagca ggccgctaag 60
gaatttatcg catggctcgt caaaggaaga ggggaaaagg agaaggaaga gcaggaggag 120
agagaaacca aaacacccga gtgtcccagt cacactcagc ctctgggagt gtttctcttc 180
ccacctaagc ccaaggatac ccttatgatt tctaggacac ctgaggtgac ctgcgtcgtt 240
gtggacgtga gtcaagagga cccagaggtc cagtttaact ggtatgttga cggcgtggaa 300
gtgcataatg caaaaactaa accccgcgag gaacaattca attcaaccta ccgggtcgtt 360
tctgtgttga cagtgctgca tcaagattgg ctgaacggga aggagtataa gtgtaaagtc 420
agtaataagg gactcccctc tagtatcgaa aaaactattt caaaggccaa aggccagcct 480
agagagccac aggtgtacac ccttcctcca tcccaagagg agatgacaaa gaaccaggtg 540
tctctgactt gtctcgtgaa ggggttctac cctagtgaca tcgctgtcga atgggagtca 600
aacggacagc cagagaataa ttataagaca actcctcccg ttctggattc tgacggcagc 660
ttctttctgt actctaggct tactgtggac aaaagtcgct ggcaagaagg gaacgtcttt 720
tcatgttctg ttatgcacga ggccttgcac aatcattata cacagaagtc tctgagtctc 780
tcactgggca aaggcggggg aggcagcggg ggaggcgggt ccggaggcgg gggatctcat 840
cccatccctg actccagtcc tctcctgcaa ttcgggggcc aagtccggca gcggtacctc 900
tacacagatg atgctcagca gacagaagcc cacctggaga tcagggagga tgggaccgtg 960
gggggcgctg ctgaccagag ccccgaaagt ctcctgcagc tgaaagcctt gaagcctgga 1020
gttattcaaa tcttgggagt caagactagt aggttcctgt gccagcggcc agatggggcc 1080
ctgtatggat ctctccattt tgaccctgag gcctgcagct tccgggagga gatcagaccc 1140
gacggataca atgtttacca gtccgaagcc cacggcctcc ctctgcatct gcccgggaac 1200
aagtctcctc accgggaccc tgcccccaga ggacctgctc gcttcctgcc actcccaggc 1260
ctgccccccg cattgcctga gccacccgga atcctggccc cccagccccc tgatgtggga 1320
tcctctgacc ctctgagcat ggtgacaggc ctggaggccg tgagaagccc cagctacgct 1380
tcc 1383
<210> 74
<211> 1419
<212> ДНК
<213> Искусственная последовательность
<220>
<223> молекула нуклеиновой кислоты, кодирующей DFD26
<400> 74
cacggcgagg ggaccttcac aagcgacgtg tcctcttatc tggaaggaca ggccgctaag 60
gagtttatcg catggctcgt caaaggcggc ggcaggaaca ccggacgggg cggggaagag 120
aagaagaaag aaaaggagaa ggaagagcag gaggagagag aaaccaaaac acccgagtgt 180
cccagtcaca ctcagcctct gggagtgttt ctcttcccac ctaagcccaa ggataccctt 240
atgatttcta ggacacctga ggtgacctgc gtcgttgtgg acgtgagtca agaggaccca 300
gaggtccagt ttaactggta tgttgacggc gtggaagtgc ataatgcaaa aactaaaccc 360
cgcgaggaac aattcaattc aacctaccgg gtcgtttctg tgttgacagt gctgcatcaa 420
gattggctga acgggaagga gtataagtgt aaagtcagta ataagggact cccctctagt 480
atcgaaaaaa ctatttcaaa ggccaaaggc cagcctagag agccacaggt gtacaccctt 540
cctccatccc aagaggagat gacaaagaac caggtgtctc tgacttgtct cgtgaagggg 600
ttctacccta gtgacatcgc tgtcgaatgg gagtcaaacg gacagccaga gaataattat 660
aagacaactc ctcccgttct ggattctgac ggcagcttct ttctgtactc taggcttact 720
gtggacaaaa gtcgctggca agaagggaac gtcttttcat gttctgttat gcacgaggcc 780
ttgcacaatc attatacaca gaagtctctg agtctctcac tgggcaaagg cgggggaggc 840
agcgggggag gcgggtccgg aggcggggga tctcatccca tccctgactc cagtcctctc 900
ctgcaattcg ggggccaagt ccggcagcgg tacctctaca cagatgatgc tcagcagaca 960
gaagcccacc tggagatcag ggaggatggg accgtggggg gcgctgctga ccagagcccc 1020
gaaagtctcc tgcagctgaa agccttgaag cctggagtta ttcaaatctt gggagtcaag 1080
actagtaggt tcctgtgcca gcggccagat ggggccctgt atggatctct ccattttgac 1140
cctgaggcct gcagcttccg ggaggagatc agacccgacg gatacaatgt ttaccagtcc 1200
gaagcccacg gcctccctct gcatctgccc gggaacaagt ctcctcaccg ggaccctgcc 1260
cccagaggac ctgctcgctt cctgccactc ccaggcctgc cccccgcatt gcctgagcca 1320
cccggaatcc tggcccccca gccccctgat gtgggatcct ctgaccctct gagcatggtg 1380
acaggcctgg aggccgtgag aagccccagc tacgcttcc 1419
<210> 75
<211> 1383
<212> ДНК
<213> Искусственная последовательность
<220>
<223> молекула нуклеиновой кислоты, кодирующей DFD27
<400> 75
cacggcgagg ggaccttcac aagcgacgtg tcctcttatc tggaaggaca ggccgctaag 60
gagtttatcg catggctcgt caaaggcggc ggcgaaaagg agaaggaaga gcaggaggag 120
agagaaacca aaacacccga gtgtcccagt cacactcagc ctctgggagt gtttctcttc 180
ccacctaagc ccaaggatac ccttatgatt tctaggacac ctgaggtgac ctgcgtcgtt 240
gtggacgtga gtcaagagga cccagaggtc cagtttaact ggtatgttga cggcgtggaa 300
gtgcataatg caaaaactaa accccgcgag gaacaattca attcaaccta ccgggtcgtt 360
tctgtgttga cagtgctgca tcaagattgg ctgaacggga aggagtataa gtgtaaagtc 420
agtaataagg gactcccctc tagtatcgaa aaaactattt caaaggccaa aggccagcct 480
agagagccac aggtgtacac ccttcctcca tcccaagagg agatgacaaa gaaccaggtg 540
tctctgactt gtctcgtgaa ggggttctac cctagtgaca tcgctgtcga atgggagtca 600
aacggacagc cagagaataa ttataagaca actcctcccg ttctggattc tgacggcagc 660
ttctttctgt actctaggct tactgtggac aaaagtcgct ggcaagaagg gaacgtcttt 720
tcatgttctg ttatgcacga ggccttgcac aatcattata cacagaagtc tctgagtctc 780
tcactgggca aaggcggggg aggcagcggg ggaggcgggt ccggaggcgg gggatctcat 840
cccatccctg actccagtcc tctcctgcaa ttcgggggcc aagtccggca gcggtacctc 900
tacacagatg atgctcagca gacagaagcc cacctggaga tcagggagga tgggaccgtg 960
gggggcgctg ctgaccagag ccccgaaagt ctcctgcagc tgaaagcctt gaagcctgga 1020
gttattcaaa tcttgggagt caagactagt aggttcctgt gccagcggcc agatggggcc 1080
ctgtatggat ctctccattt tgaccctgag gcctgcagct tccgggagga gatcagaccc 1140
gacggataca atgtttacca gtccgaagcc cacggcctcc ctctgcatct gcccgggaac 1200
aagtctcctc accgggaccc tgcccccaga ggacctgctc gcttcctgcc actcccaggc 1260
ctgccccccg cattgcctga gccacccgga atcctggccc cccagccccc tgatgtggga 1320
tcctctgacc ctctgagcat ggtgacaggc ctggaggccg tgagaagccc cagctacgct 1380
tcc 1383
<210> 76
<211> 1419
<212> ДНК
<213> Искусственная последовательность
<220>
<223> молекула нуклеиновой кислоты, кодирующей DFD28
<400> 76
cacggcgagg ggaccttcac aagcgacgtg tcctcttacc tggaagagca ggccgctaag 60
gaatttatcg catggctcgt caaaggaggc gggaggaaca ccggacgggg cggggaagag 120
aagaagaaag aaaaggagaa ggaagagcag gaggagagag aaaccaaaac acccgagtgt 180
cccagtcaca ctcagcctct gggagtgttt ctcttcccac ctaagcccaa ggataccctt 240
atgatttcta ggacacctga ggtgacctgc gtcgttgtgg acgtgagtca agaggaccca 300
gaggtccagt ttaactggta tgttgacggc gtggaagtgc ataatgcaaa aactaaaccc 360
cgcgaggaac aattcaattc aacctaccgg gtcgtttctg tgttgacagt gctgcatcaa 420
gattggctga acgggaagga gtataagtgt aaagtcagta ataagggact cccctctagt 480
atcgaaaaaa ctatttcaaa ggccaaaggc cagcctagag agccacaggt gtacaccctt 540
cctccatccc aagaggagat gacaaagaac caggtgtctc tgacttgtct cgtgaagggg 600
ttctacccta gtgacatcgc tgtcgaatgg gagtcaaacg gacagccaga gaataattat 660
aagacaactc ctcccgttct ggattctgac ggcagcttct ttctgtactc taggcttact 720
gtggacaaaa gtcgctggca agaagggaac gtcttttcat gttctgttat gcacgaggcc 780
ttgcacaatc attatacaca gaagtctctg agtctctcac tgggcaaagg cgggggaggc 840
agcgggggag gcgggtccgg aggcggggga tctcatccca tccctgactc cagtcctctc 900
ctgcaattcg ggggccaagt ccggcagcgg tacctctaca cagatgatgc tcagcagaca 960
gaagcccacc tggagatcag ggaggatggg accgtggggg gcgctgctga ccagagcccc 1020
gaaagtctcc tgcagctgaa agccttgaag cctggagtta ttcaaatctt gggagtcaag 1080
actagtaggt tcctgtgcca gcggccagat ggggccctgt atggatctct ccattttgac 1140
cctgaggcct gcagcttccg ggaggagatc agacccgacg gatacaatgt ttaccagtcc 1200
gaagcccacg gcctccctct gcatctgccc gggaacaagt ctcctcaccg ggaccctgcc 1260
cccagaggac ctgctcgctt cctgccactc ccaggcctgc cccccgcatt gcctgagcca 1320
cccggaatcc tggcccccca gccccctgat gtgggatcct ctgaccctct gagcatggtg 1380
acaggcctgg aggccgtgag aagccccagc tacgcttcc 1419
<210> 77
<211> 1383
<212> ДНК
<213> Искусственная последовательность
<220>
<223> молекула нуклеиновой кислоты, кодирующей DFD29
<400> 77
cacggcgagg ggaccttcac aagcgacgtg tcctcttacc tggaagagca ggccgctaag 60
gaatttatcg catggctcgt caaaggaggc ggggaaaagg agaaggaaga gcaggaggag 120
agagaaacca aaacacccga gtgtcccagt cacactcagc ctctgggagt gtttctcttc 180
ccacctaagc ccaaggatac ccttatgatt tctaggacac ctgaggtgac ctgcgtcgtt 240
gtggacgtga gtcaagagga cccagaggtc cagtttaact ggtatgttga cggcgtggaa 300
gtgcataatg caaaaactaa accccgcgag gaacaattca attcaaccta ccgggtcgtt 360
tctgtgttga cagtgctgca tcaagattgg ctgaacggga aggagtataa gtgtaaagtc 420
agtaataagg gactcccctc tagtatcgaa aaaactattt caaaggccaa aggccagcct 480
agagagccac aggtgtacac ccttcctcca tcccaagagg agatgacaaa gaaccaggtg 540
tctctgactt gtctcgtgaa ggggttctac cctagtgaca tcgctgtcga atgggagtca 600
aacggacagc cagagaataa ttataagaca actcctcccg ttctggattc tgacggcagc 660
ttctttctgt actctaggct tactgtggac aaaagtcgct ggcaagaagg gaacgtcttt 720
tcatgttctg ttatgcacga ggccttgcac aatcattata cacagaagtc tctgagtctc 780
tcactgggca aaggcggggg aggcagcggg ggaggcgggt ccggaggcgg gggatctcat 840
cccatccctg actccagtcc tctcctgcaa ttcgggggcc aagtccggca gcggtacctc 900
tacacagatg atgctcagca gacagaagcc cacctggaga tcagggagga tgggaccgtg 960
gggggcgctg ctgaccagag ccccgaaagt ctcctgcagc tgaaagcctt gaagcctgga 1020
gttattcaaa tcttgggagt caagactagt aggttcctgt gccagcggcc agatggggcc 1080
ctgtatggat ctctccattt tgaccctgag gcctgcagct tccgggagga gatcagaccc 1140
gacggataca atgtttacca gtccgaagcc cacggcctcc ctctgcatct gcccgggaac 1200
aagtctcctc accgggaccc tgcccccaga ggacctgctc gcttcctgcc actcccaggc 1260
ctgccccccg cattgcctga gccacccgga atcctggccc cccagccccc tgatgtggga 1320
tcctctgacc ctctgagcat ggtgacaggc ctggaggccg tgagaagccc cagctacgct 1380
tcc 1383
<210> 78
<211> 1383
<212> ДНК
<213> Искусственная последовательность
<220>
<223> молекула нуклеиновой кислоты, кодирующей DFD69
<400> 78
cacggcgagg ggaccttcac aagcgacgtg tcctcttacc tggaagagca ggccgctaag 60
gaatttatcg catggctcgt caaaggaggc ggggaaaagg agaaggaaga gcaggaggag 120
agagaaacca aaacacccga gtgtcccagt cacactcagc ctctgggagt gtttctcttc 180
ccacctaagc ccaaggatac ccttatgatt tctaggacac ctgaggtgac ctgcgtcgtt 240
gtggacgtga gtcaagagga cccagaggtc cagtttaact ggtatgttga cggcgtggaa 300
gtgcataatg caaaaactaa accccgcgag gaacaattca attcaaccta ccgggtcgtt 360
tctgtgttga cagtgctgca tcaagattgg ctgaacggga aggagtataa gtgtaaagtc 420
agtaataagg gactcccctc tagtatcgaa aaaactattt caaaggccaa aggccagcct 480
agagagccac aggtgtacac ccttcctcca tcccaagagg agatgacaaa gaaccaggtg 540
tctctgactt gtctcgtgaa ggggttctac cctagtgaca tcgctgtcga atgggagtca 600
aacggacagc cagagaataa ttataagaca actcctcccg ttctggattc tgacggcagc 660
ttctttctgt actctaggct tactgtggac aaaagtcgct ggcaagaagg gaacgtcttt 720
tcatgttctg ttatgcacga ggccttgcac aatcattata cacagaagtc tctgagtctc 780
tcactgggca aaggcggggg aggcagcggg ggaggcgggt ccggaggcgg gggatctcat 840
cccatccctg actccagtcc tctcctgcaa ttcgggggcc aagtccggca gcggtacctc 900
tacacagatg atgctcagca gacagaagcc cacctggaga tcagggagga tgggaccgtg 960
gggggcgctg ctgaccagag ccccgaaagt ctcctgcagc tgaaagcctt gaagcctgga 1020
gttattcaaa tcttgggagt caagactagt aggttcctgt gccagcggcc agatggggcc 1080
ctgtatggat ctctccattt tgaccctgag gcctgcagct tccgggagga gatcagaccc 1140
gacggataca atgtttacca gtccgaagcc cacggcctcc ctctgcatct gcccgggaac 1200
aagtctcctc accgggaccc tgcccccaga ggacctgctc gcttcctgcc actcccaggc 1260
ctgccccccg cattgcctga gccacccgga atcctggccc cccagccccc tgatgtggga 1320
tcctctgacc ctctgagcat ggtgacaggc ctggaggccg tgagaagccc cagctacgag 1380
tcc 1383
<210> 79
<211> 1383
<212> ДНК
<213> Искусственная последовательность
<220>
<223> молекула нуклеиновой кислоты, кодирующей DFD112
<400> 79
cacggcgagg ggaccttcac aagcgacgtg tcctcttacc tggaagagca ggccgctaag 60
gaatttatcg catggctcgt caaaggaggc ggggaaaagg agaaggaaga gcaggaggag 120
agagaaacca aaacacccga gtgtcccagt cacactcagc ctctgggagt gtttctcttc 180
ccacctaagc ccaaggatac ccttatgatt tctaggacac ctgaggtgac ctgcgtcgtt 240
gtggacgtga gtcaagagga cccagaggtc cagtttaact ggtatgttga cggcgtggaa 300
gtgcataatg caaaaactaa accccgcgag gaacaattca attcaaccta ccgggtcgtt 360
tctgtgttga cagtgctgca tcaagattgg ctgaacggga aggagtataa gtgtaaagtc 420
agtaataagg gactcccctc tagtatcgaa aaaactattt caaaggccaa aggccagcct 480
agagagccac aggtgtacac ccttcctcca tcccaagagg agatgacaaa gaaccaggtg 540
tctctgactt gtctcgtgaa ggggttctac cctagtgaca tcgctgtcga atgggagtca 600
aacggacagc cagagaataa ttataagaca actcctcccg ttctggattc tgacggcagc 660
ttctttctgt actctaggct tactgtggac aaaagtcgct ggcaagaagg gaacgtcttt 720
tcatgttctg ttatgcacga ggccttgcac aatcattata cacagaagtc tctgagtctc 780
tcactgggca aaggcggggg aggcagcggg ggaggcgggt ccggaggcgg gggatctcat 840
cccatccctg actccagtcc tctcctgcaa ttcgggggcc aagtccggca gcggtacctc 900
tacacagatg atgctcagca gacagaagcc cacctggaga tcagggagga tgggaccgtg 960
gggggcgctg ctgaccagag ccccgaaagt ctcctgcagc tgaaagcctt gaagcctgga 1020
gttattcaaa tcttgggagt caagactagt aggttcctgt gccagcggcc agatggggcc 1080
ctgtatggat ctctccattt tgaccctgag gcctgcagct tccgggagga gatcagaccc 1140
gacggataca atgtttacca gtccgaagcc cacggcctcc ctctgcatct gcccgggaac 1200
aagtctcctc accgggaccc tgcccccaga ggacctgctc gcttcctgcc actcccaggc 1260
ctgccccccg cattgcctga gccacccgga atcctggccc cccagccccc tgatgtggga 1320
tcctctgacc ctctgagcat ggtgacaggc ctggaggcca acagaagccc cagctacgag 1380
tcc 1383
<210> 80
<211> 1380
<212> ДНК
<213> Искусственная последовательность
<220>
<223> молекула нуклеиновой кислоты, кодирующей DFD114
<400> 80
cacggcgagg ggaccttcac aagcgacgtg tcctcttacc tggaagagca ggccgctaag 60
gaatttatcg catggctcgt caaaggaggc ggggaaaagg agaaggaaga gcaggaggag 120
agagaaacca aaacacccga gtgtcccagt cacactcagc ctctgggagt gtttctcttc 180
ccacctaagc ccaaggatac ccttatgatt tctaggacac ctgaggtgac ctgcgtcgtt 240
gtggacgtga gtcaagagga cccagaggtc cagtttaact ggtatgttga cggcgtggaa 300
gtgcataatg caaaaactaa accccgcgag gaacaattca attcaaccta ccgggtcgtt 360
tctgtgttga cagtgctgca tcaagattgg ctgaacggga aggagtataa gtgtaaagtc 420
agtaataagg gactcccctc tagtatcgaa aaaactattt caaaggccaa aggccagcct 480
agagagccac aggtgtacac ccttcctcca tcccaagagg agatgacaaa gaaccaggtg 540
tctctgactt gtctcgtgaa ggggttctac cctagtgaca tcgctgtcga atgggagtca 600
aacggacagc cagagaataa ttataagaca actcctcccg ttctggattc tgacggcagc 660
ttctttctgt actctaggct tactgtggac aaaagtcgct ggcaagaagg gaacgtcttt 720
tcatgttctg ttatgcacga ggccttgcac aatcattata cacagaagtc tctgagtctc 780
tcactgggca aaggcggggg aggcagcggg ggaggcgggt ccggaggcgg gggatctcat 840
cccatccctg actccagtcc tctcctgcaa ttcgggggcc aagtccggca gcggtacctc 900
tacacagatg atgctcagca gacagaagcc cacctggaga tcagggagga tgggaccgtg 960
gggggcgctg ctgaccagag ccccgaaagt ctcctgcagc tgaaagcctt gaagcctgga 1020
gttattcaaa tcttgggagt caagactagt aggttcctgt gccagcggcc agatggggcc 1080
ctgtatggat ctctccattt tgaccctgag gcctgcagct tccgggagga gatcagaccc 1140
gacggataca atgtttacca gtccgaagcc cacggcctcc ctctgcatct gcccgggaac 1200
aagtctcctc accgggaccc tgcccccaga ggacctgctc gcttcctgcc actcccaggc 1260
ctgccccccg cattgcctga gccacccgga atcctggccc cccagccccc tgatgtggga 1320
tcctctgacc ctctgagcat ggtgaaccct tcccagggca gaagccccag ctacgagtcc 1380
1380
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| БЕЛКИ С ДВОЙНОЙ ФУНКЦИЕЙ И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2016 |
|
RU2741345C2 |
| СЛИТЫЕ С FGF21 БЕЛКИ ДЛИТЕЛЬНОГО ДЕЙСТВИЯ И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2016 |
|
RU2741087C2 |
| СПОСОБ ПОЛУЧЕНИЯ БИФУНКЦИОНАЛЬНЫХ БЕЛКОВ И ИХ ПРОИЗВОДНЫХ | 2018 |
|
RU2795970C2 |
| СЛИТЫЙ БЕЛОК GDF15 ДЛИТЕЛЬНОГО ДЕЙСТВИЯ И СОДЕРЖАЩАЯ ЕГО ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2020 |
|
RU2836280C1 |
| СЛИТЫЙ БЕЛОК, ВКЛЮЧАЮЩИЙ IL-12 И АНТИТЕЛО ПРОТИВ FAP, И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2831612C1 |
| КОМПОЗИЦИЯ ДЛЯ КУЛЬТИВИРОВАНИЯ РЕГУЛЯТОРНЫХ Т-КЛЕТОК И ЕЕ ПРИМЕНЕНИЕ | 2020 |
|
RU2807802C1 |
| МОДИФИЦИРОВАННЫЕ МИТОХОНДРИИ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2811467C2 |
| МУЛЬТИФУНКЦИОНАЛЬНЫЙ МУЛЬТИСПЕЦИФИЧЕСКИЙ МУЛЬТИМЕРНЫЙ БИОМОЛЕКУЛЯРНЫЙ ПОЛИМЕР, ИМЕЮЩИЙ ПРОЛОНГИРОВАННУЮ ЭФФЕКТИВНОСТЬ IN VIVO | 2020 |
|
RU2805307C1 |
| МОДИФИЦИРОВАННЫЕ ДОМЕНЫ α1-α2 НЕПРИРОДНЫХ ЛИГАНДОВ NKG2D, КОТОРЫЕ СВЯЗЫВАЮТСЯ С НЕПРИРОДНЫМИ РЕЦЕПТОРАМИ NKG2D | 2019 |
|
RU2815278C2 |
| Способы лечения кальцификации тканей | 2015 |
|
RU2770698C2 |
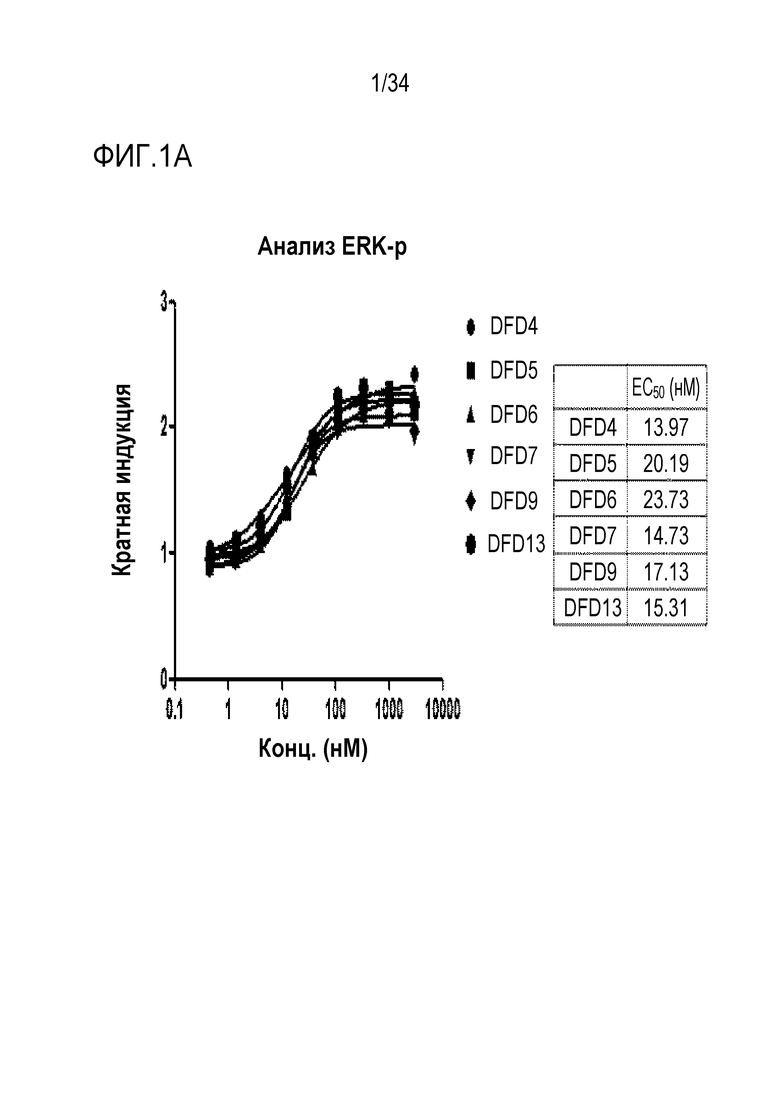
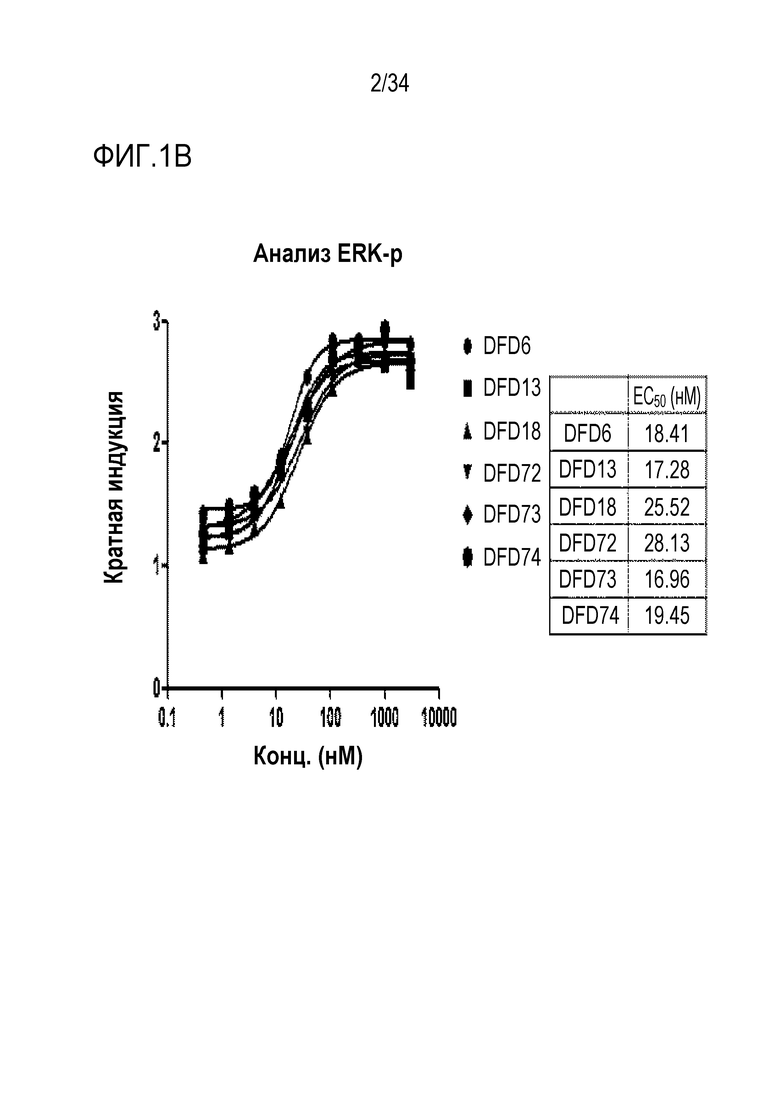
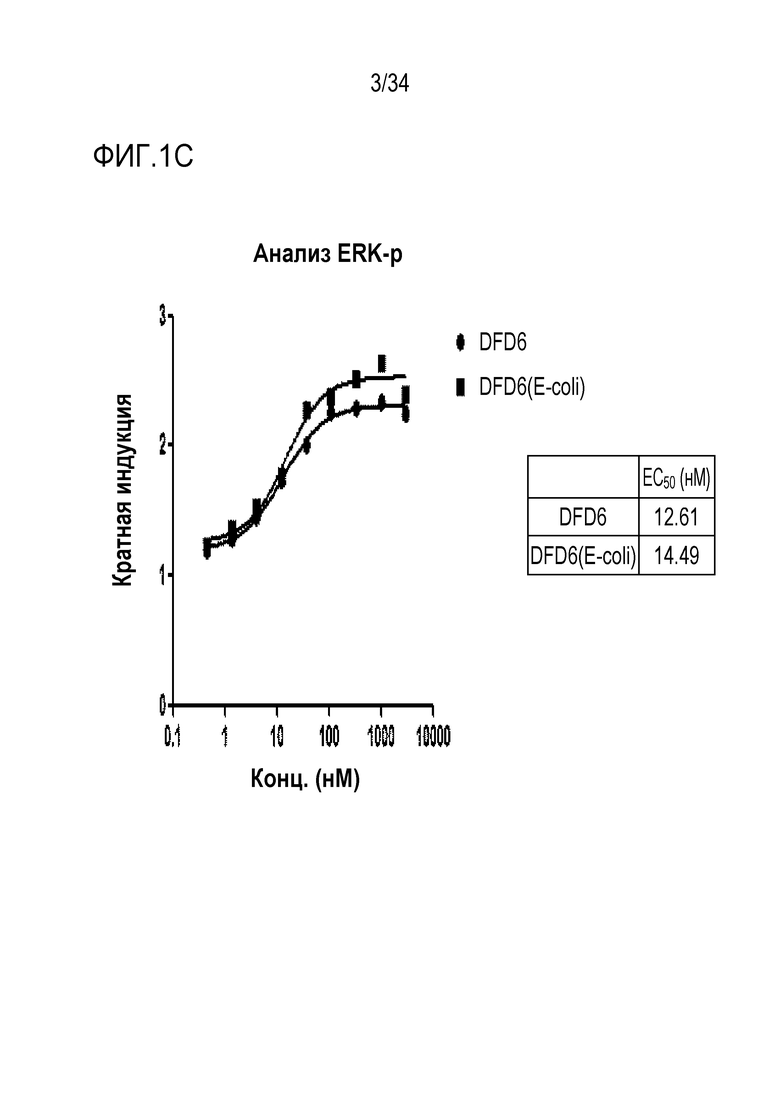
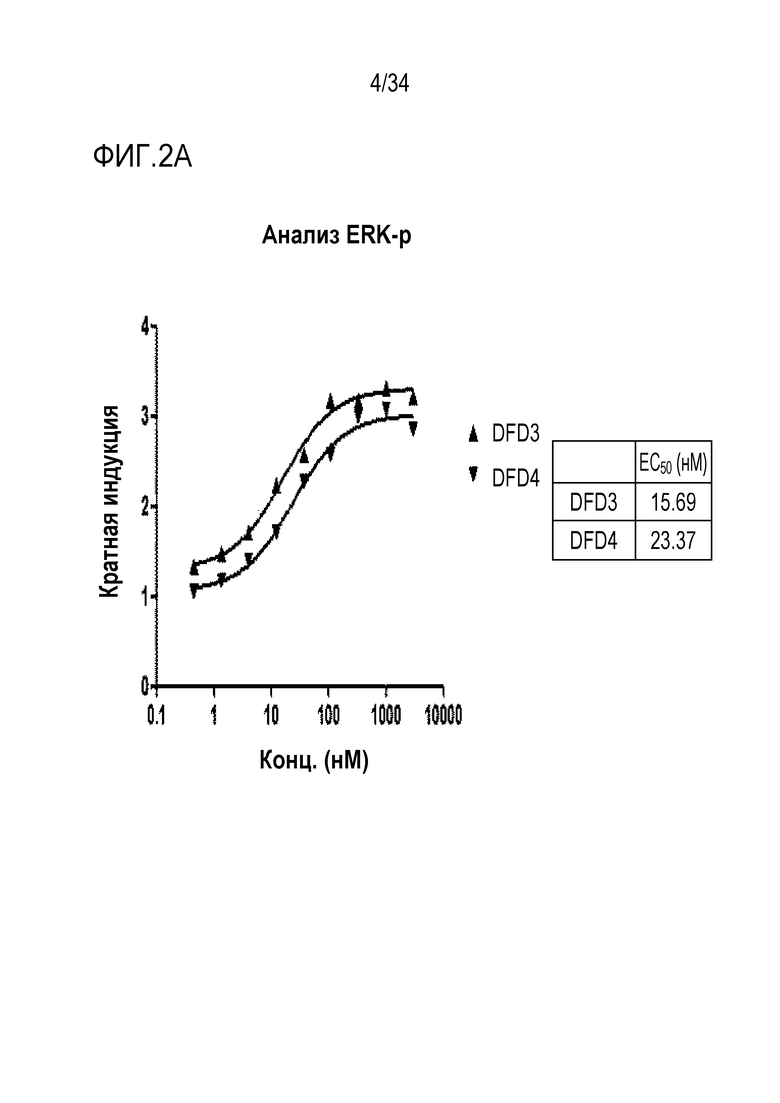
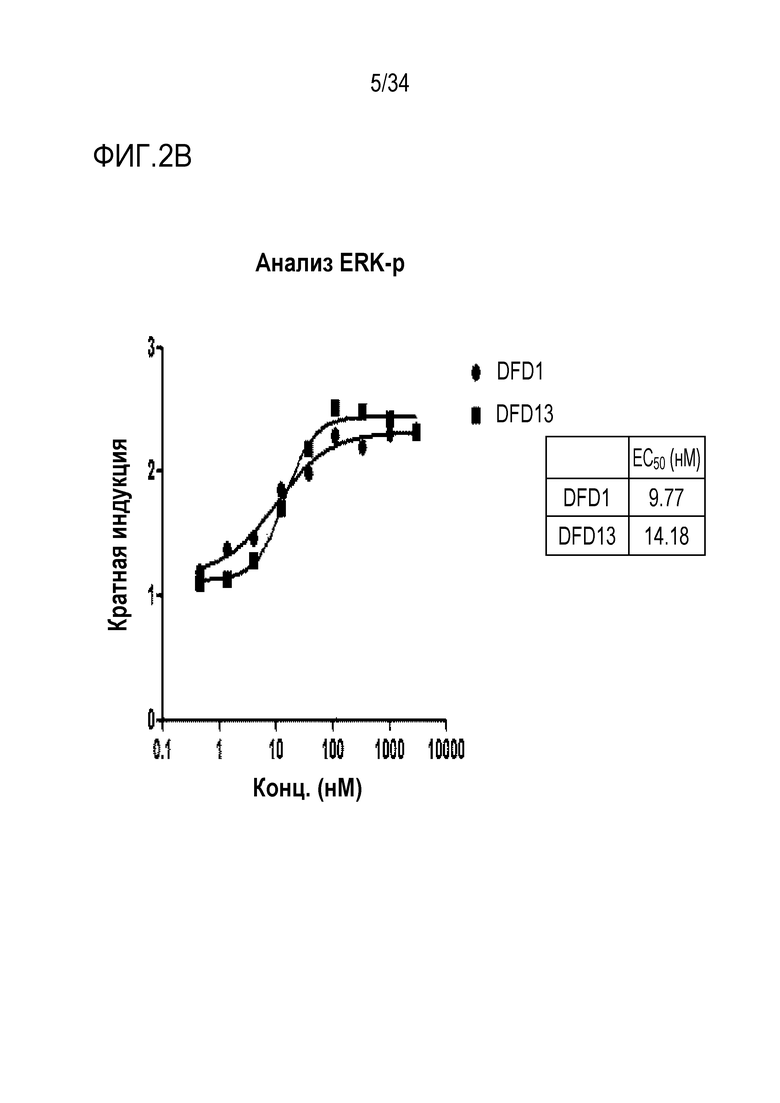
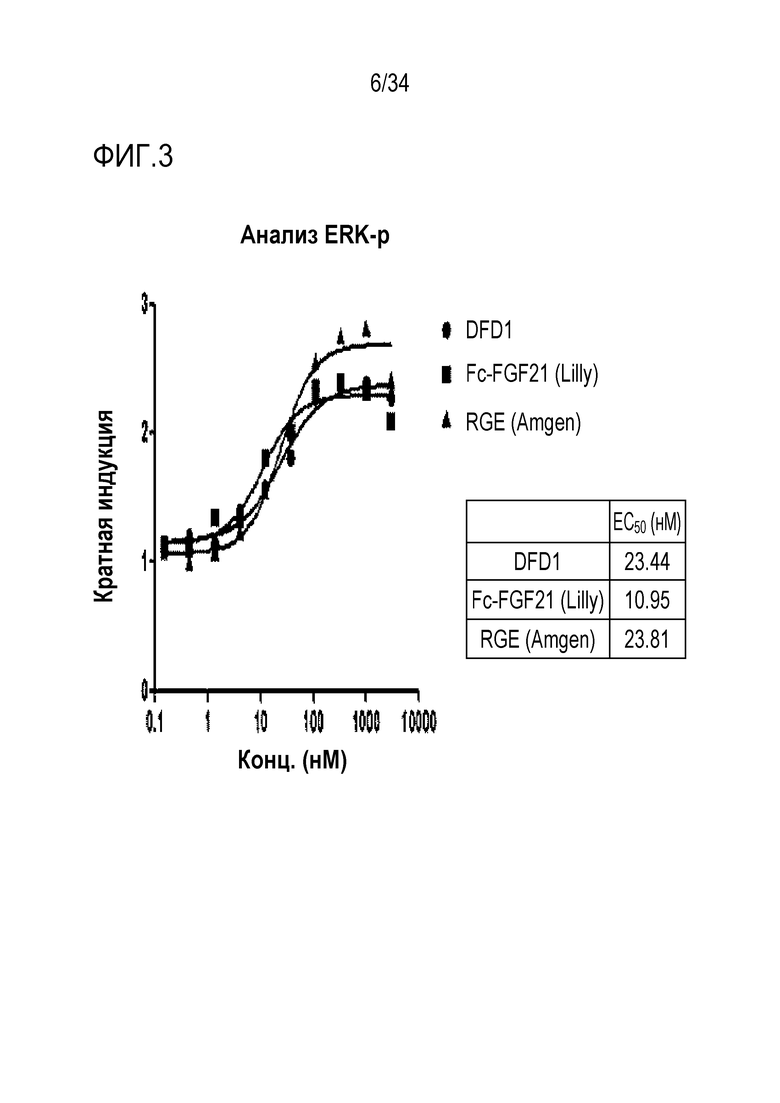
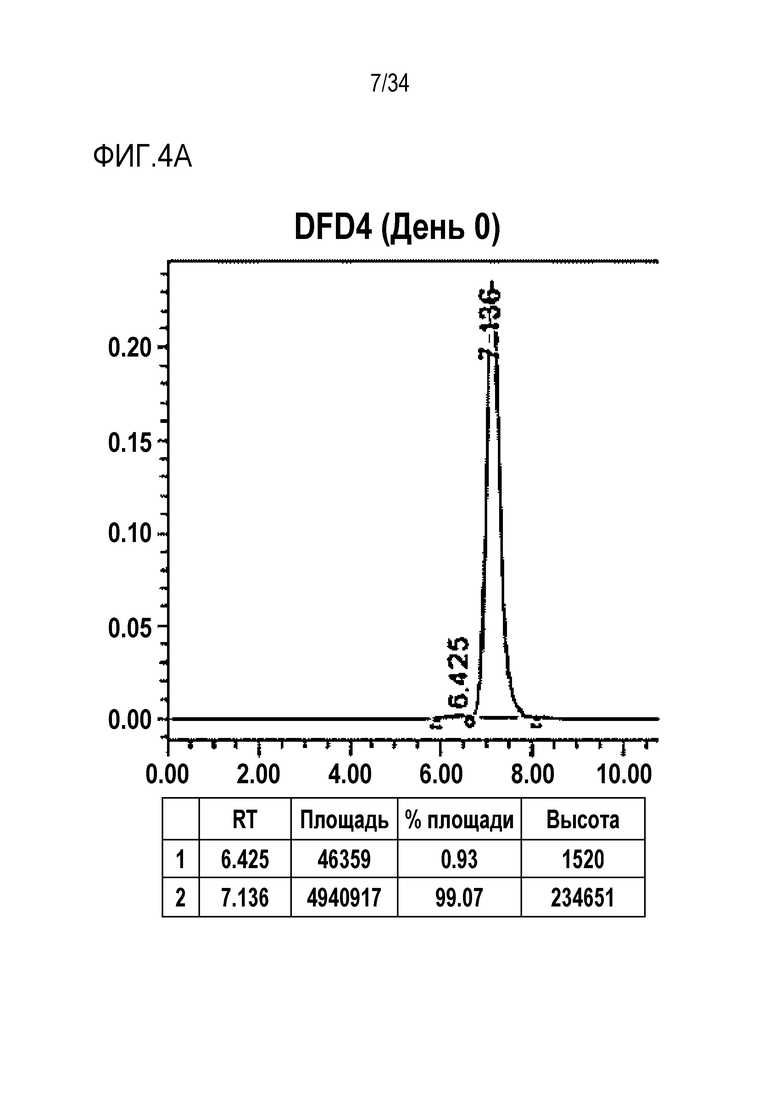
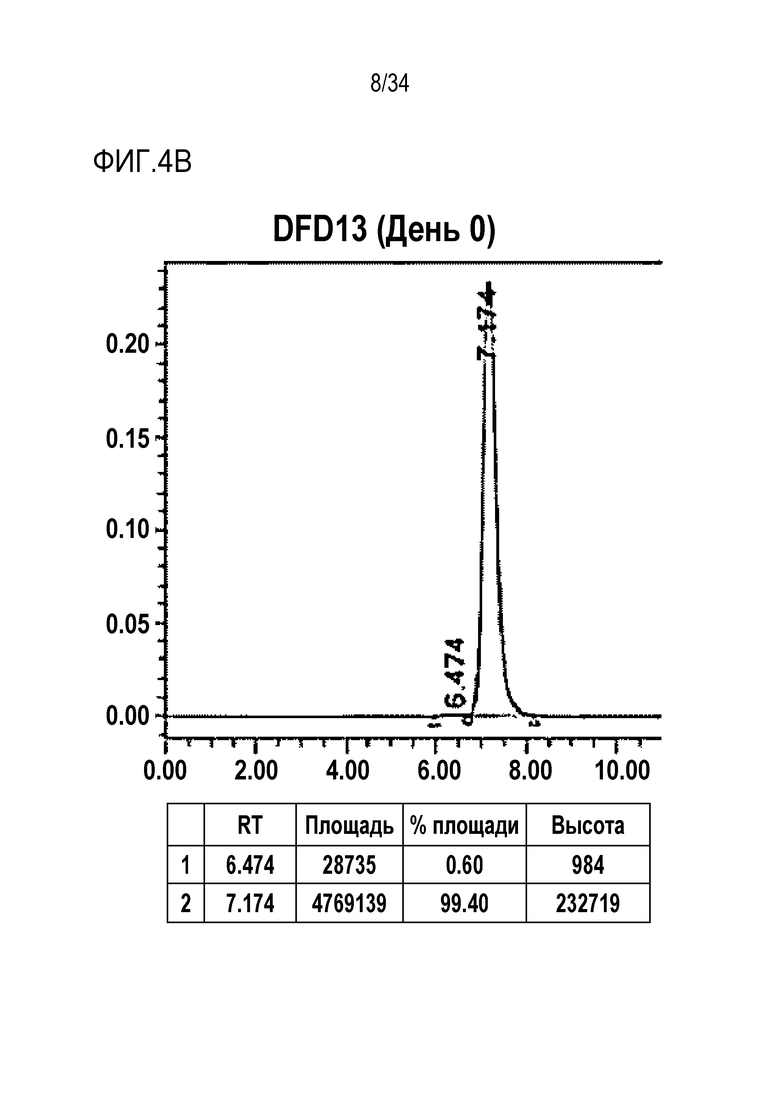
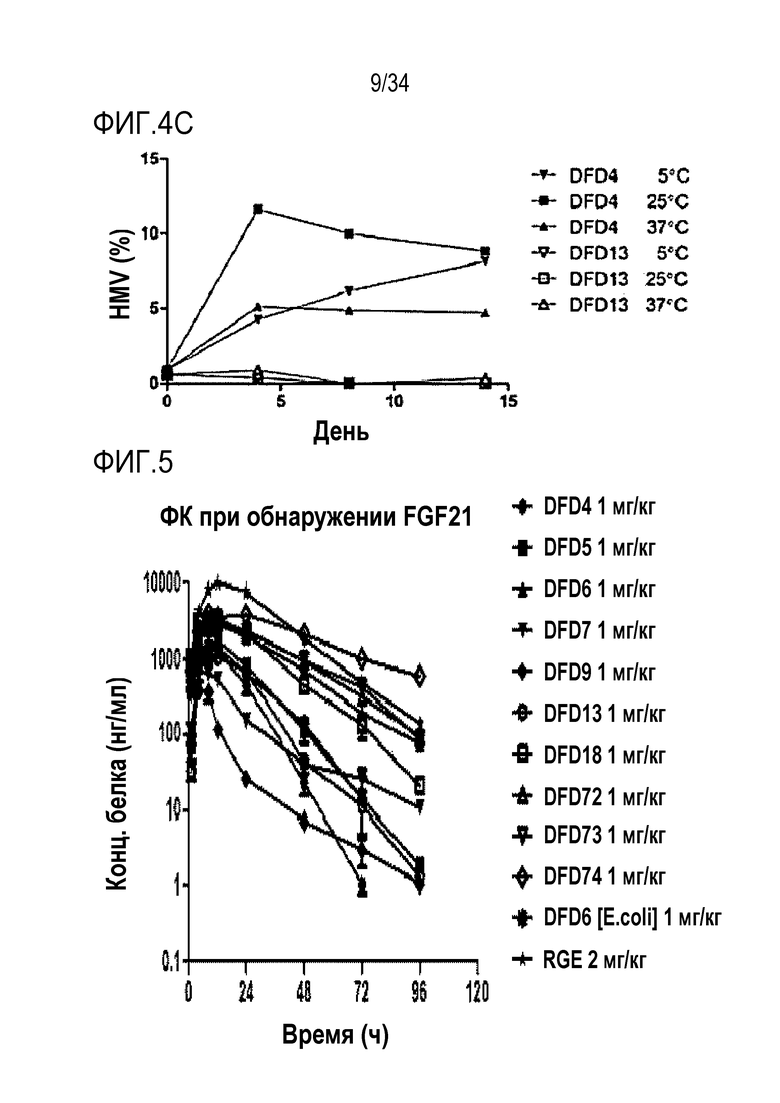
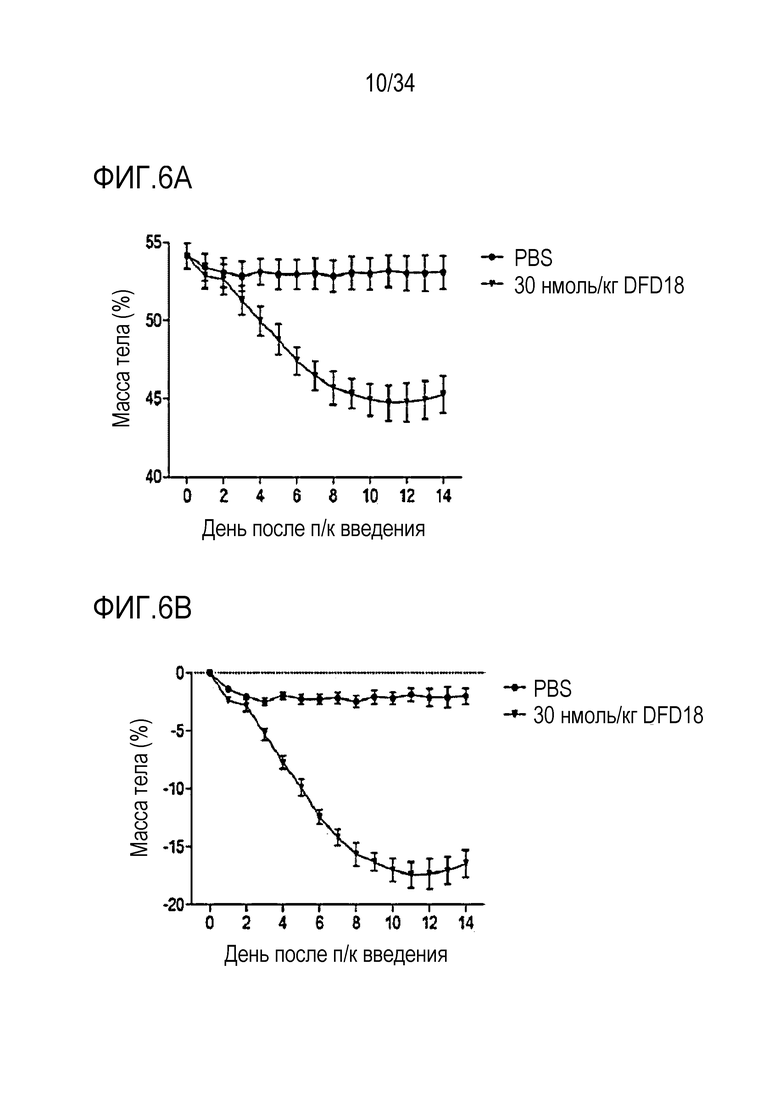
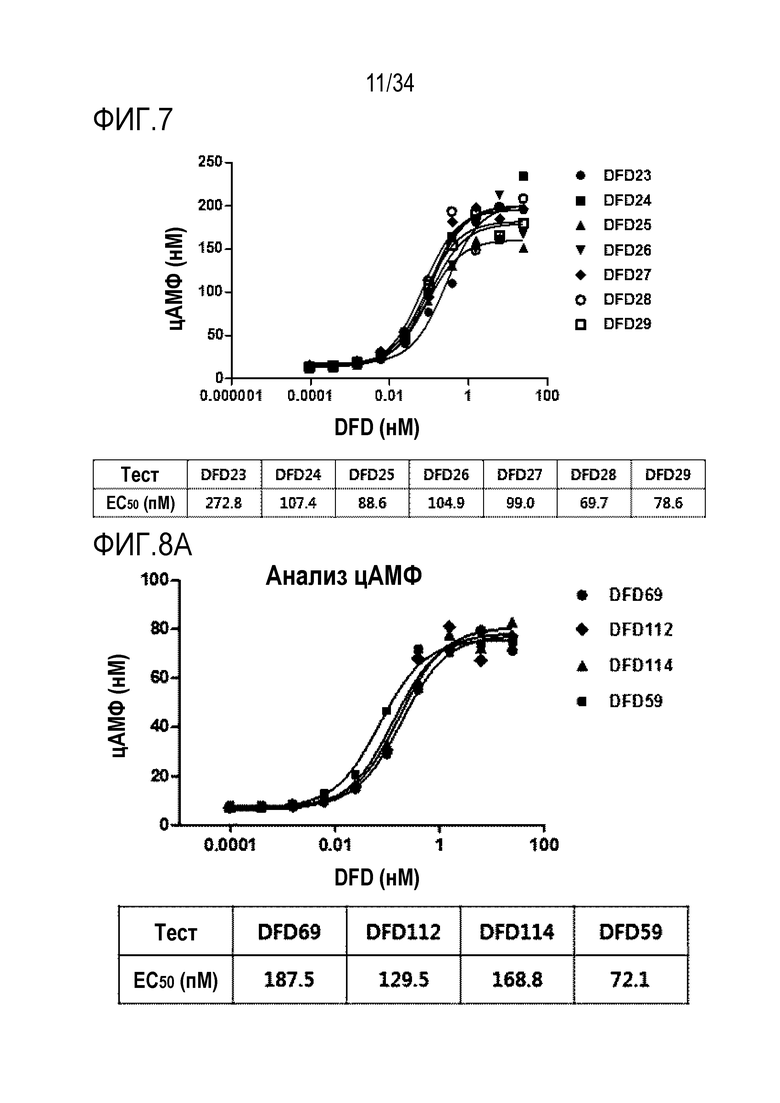
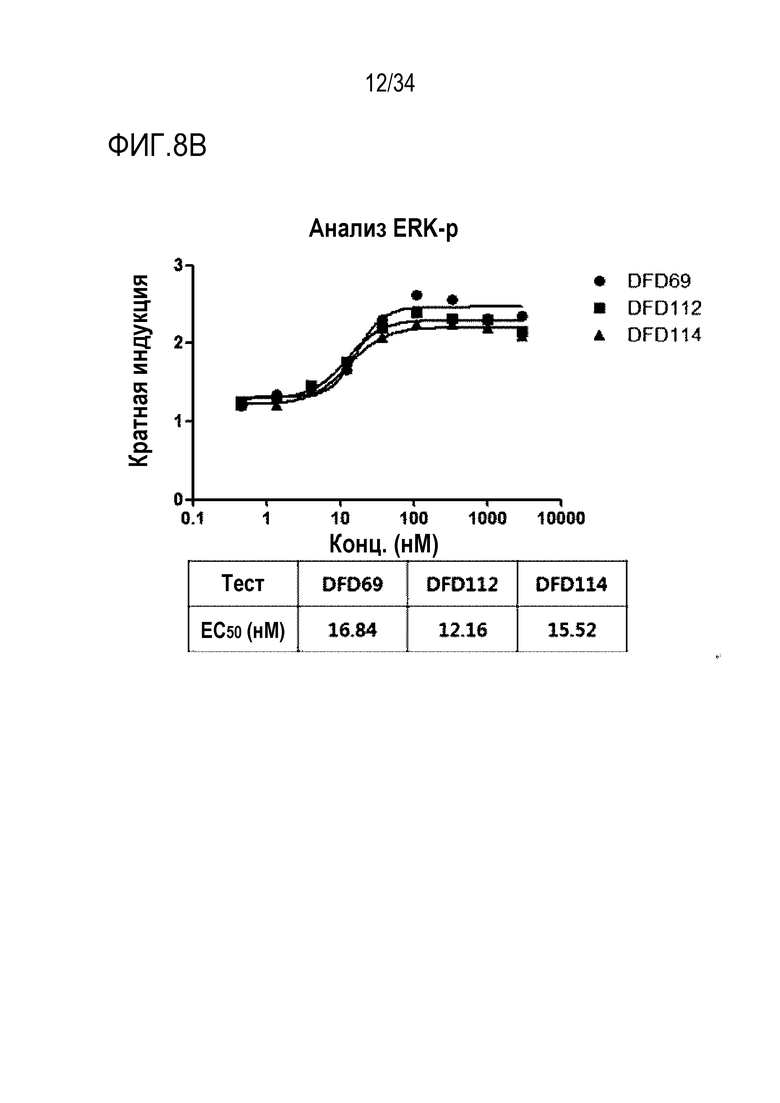
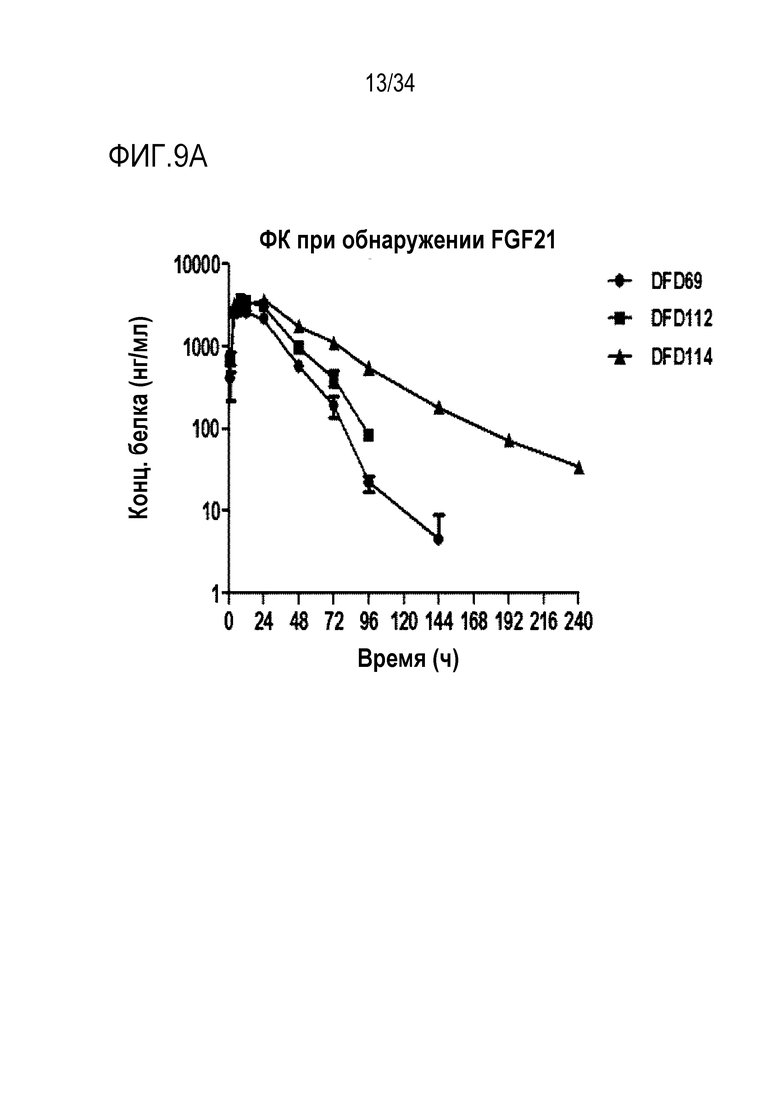
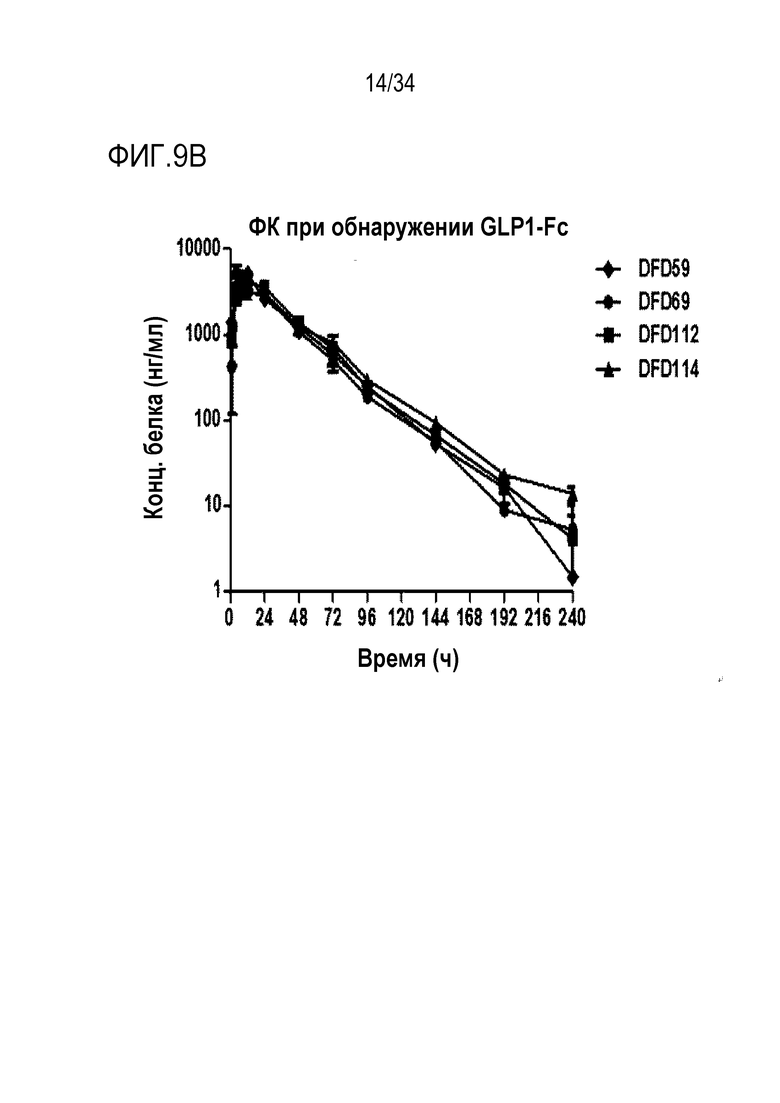
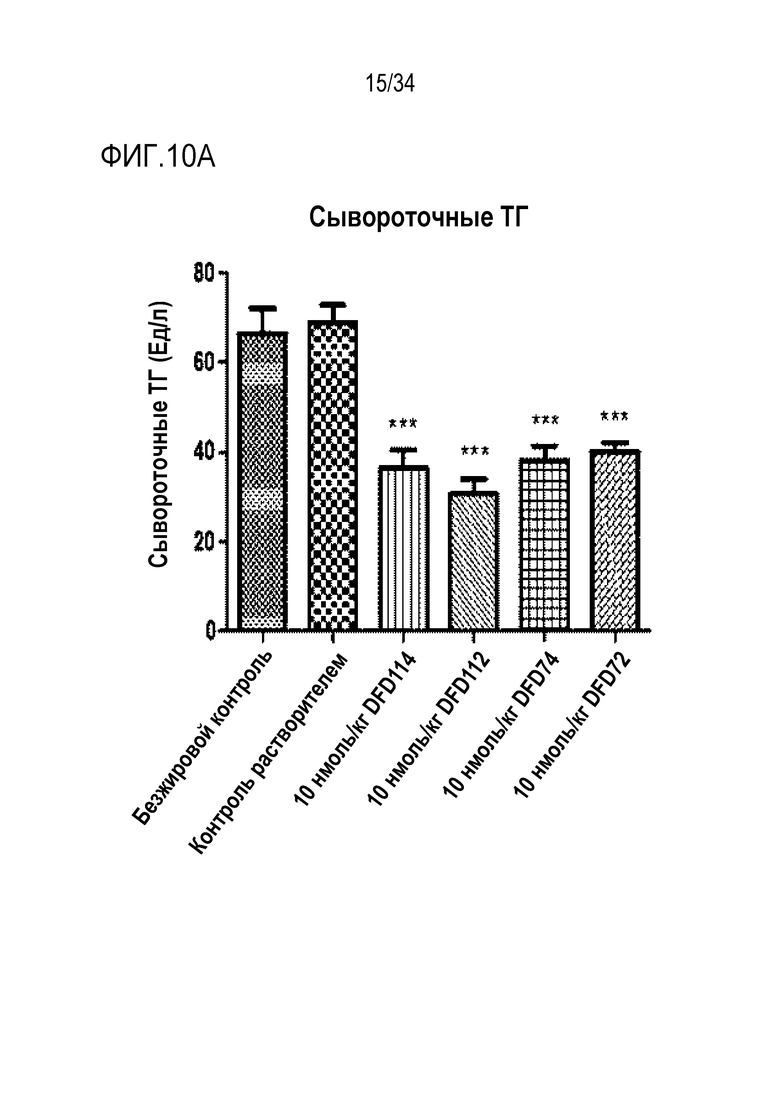
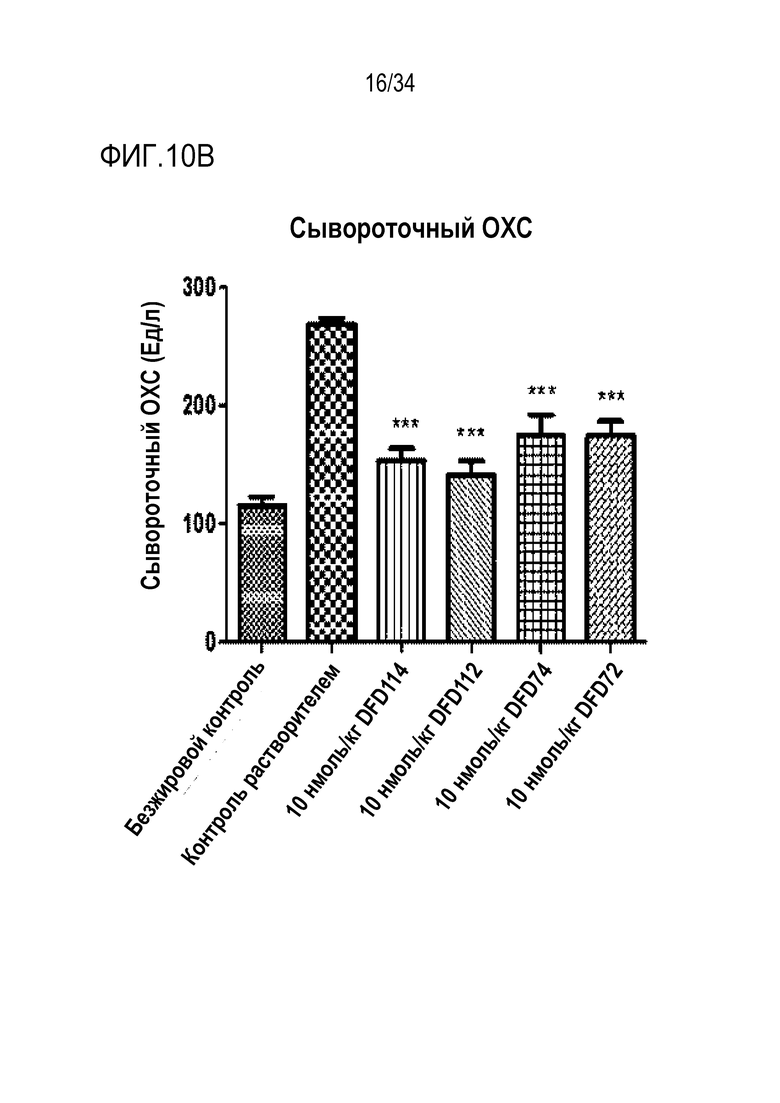
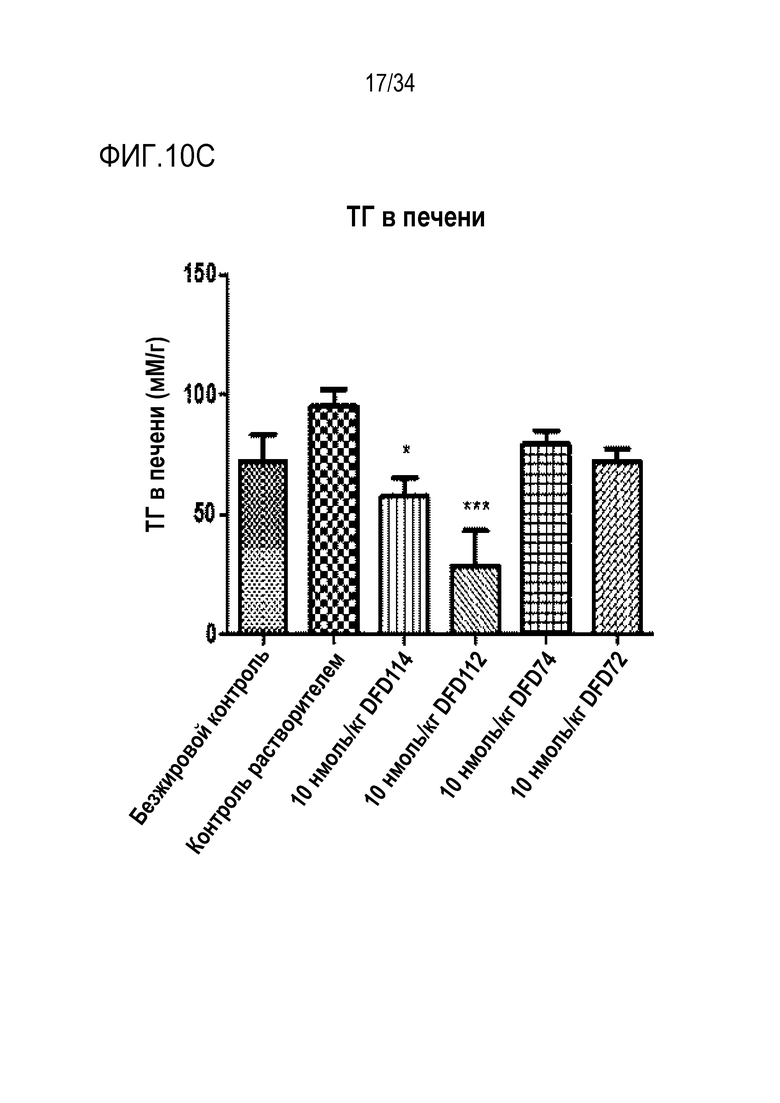
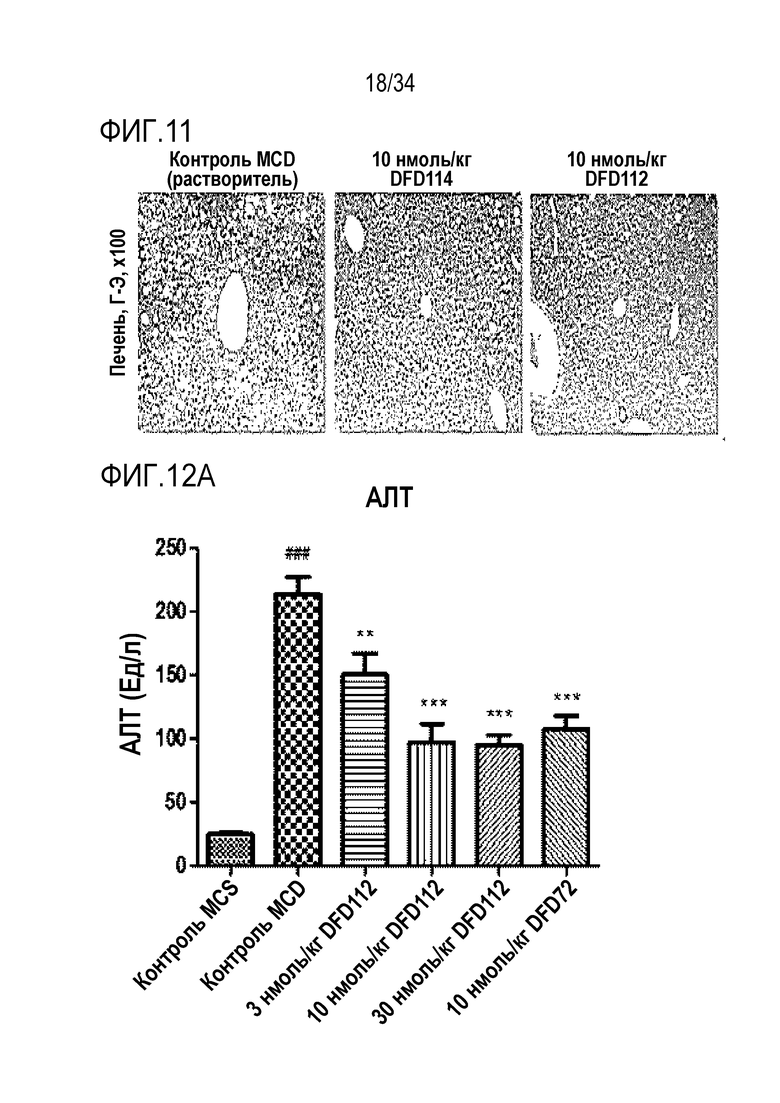
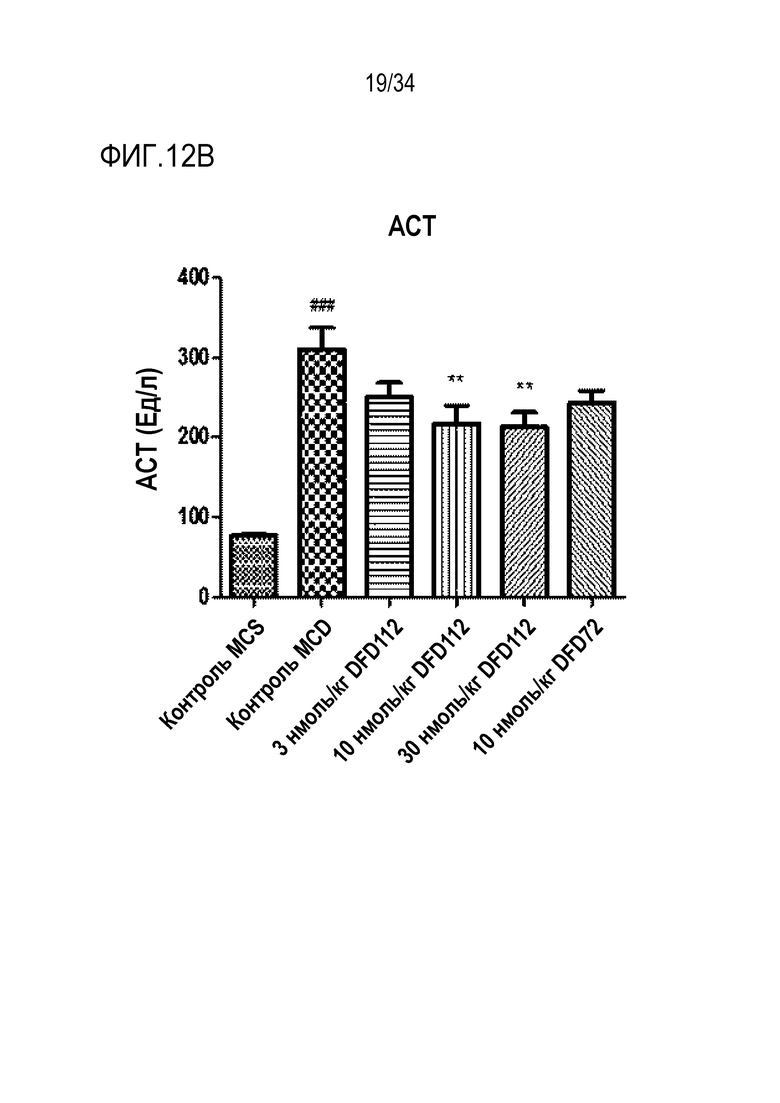
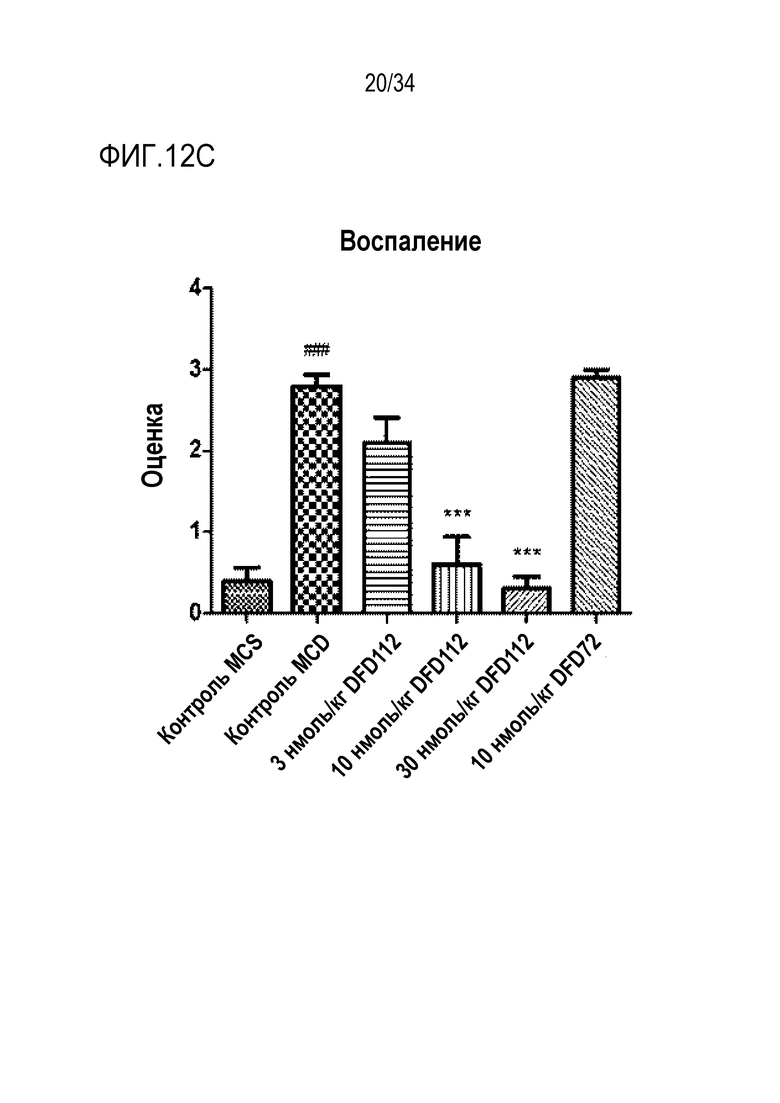
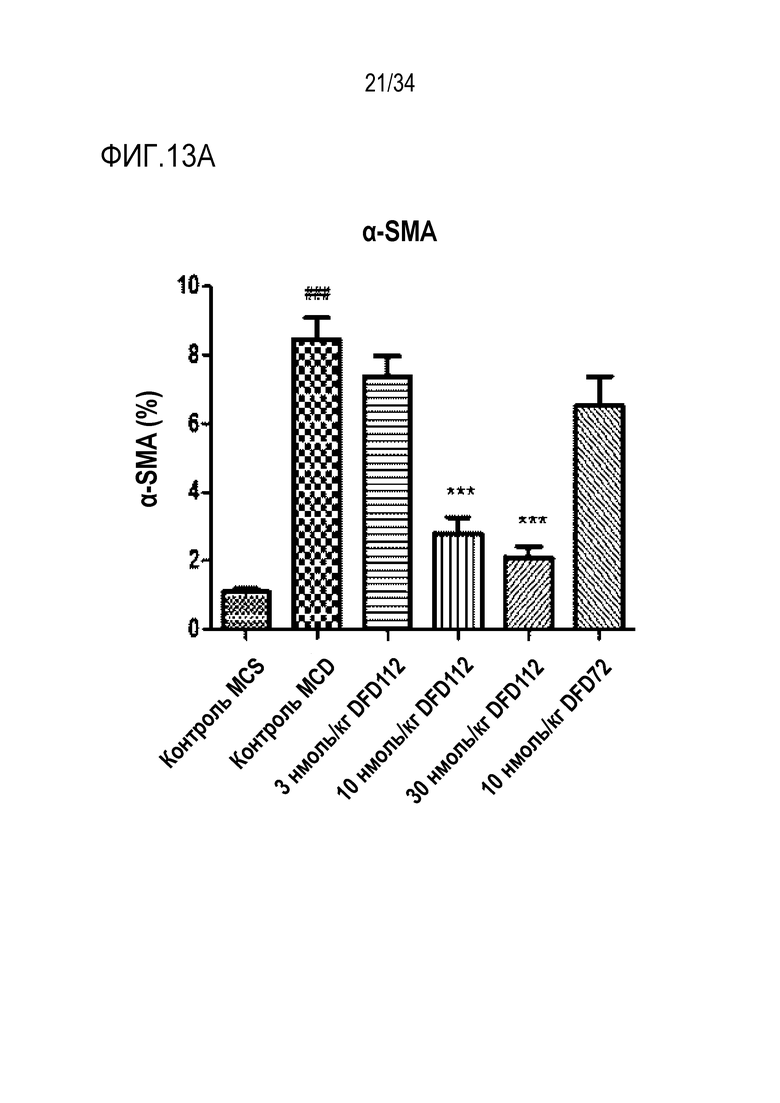
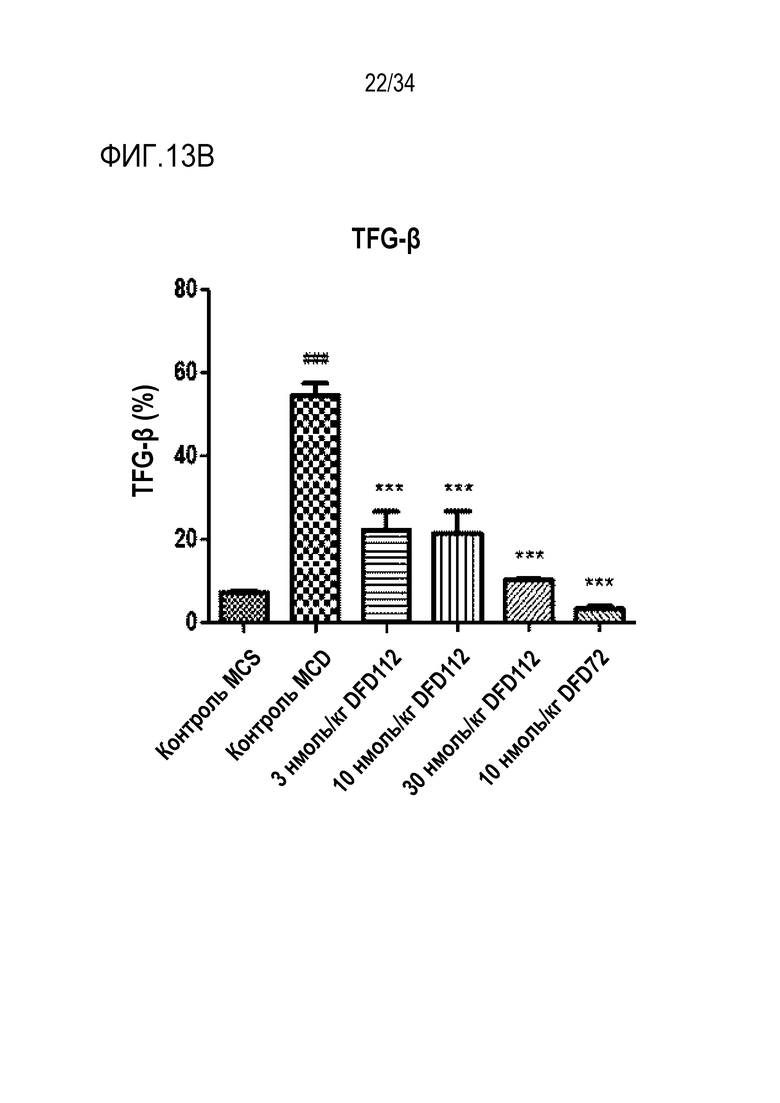
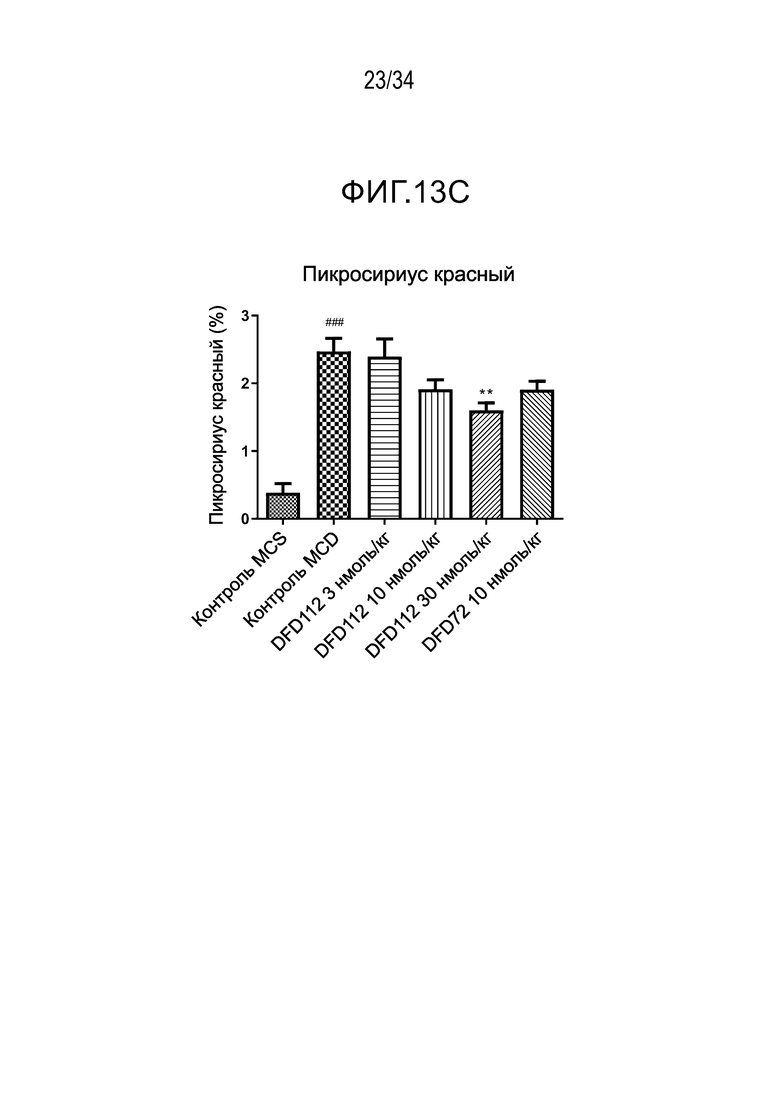
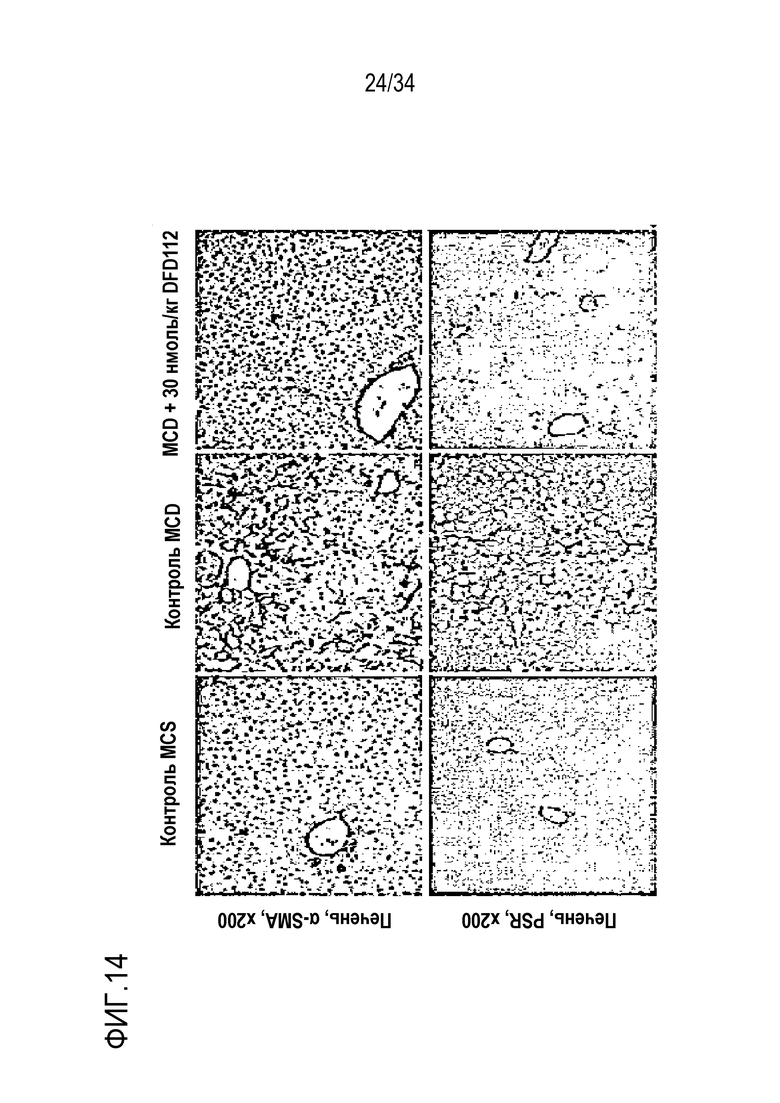
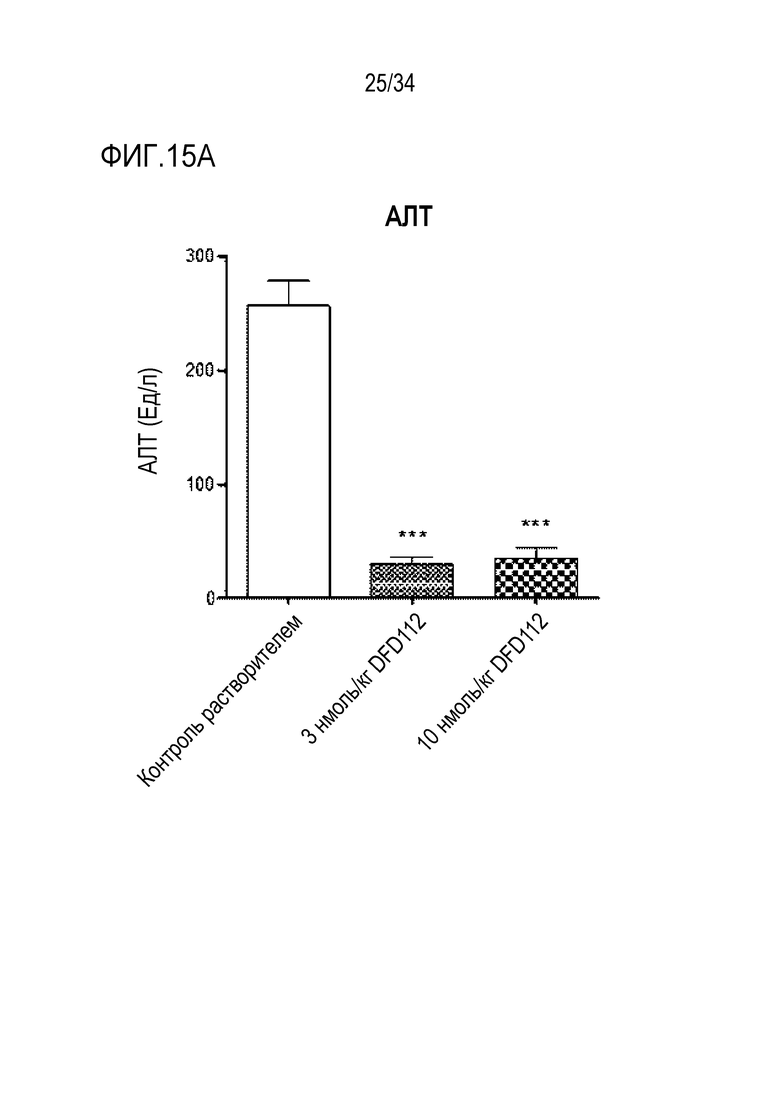
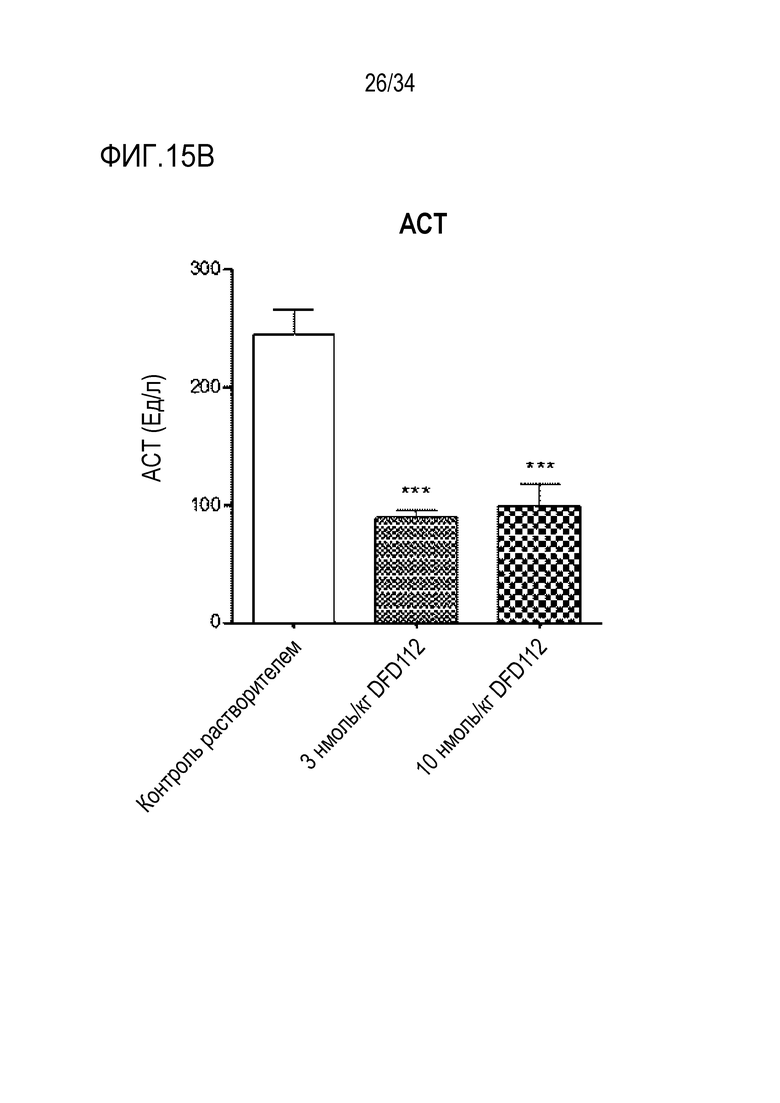
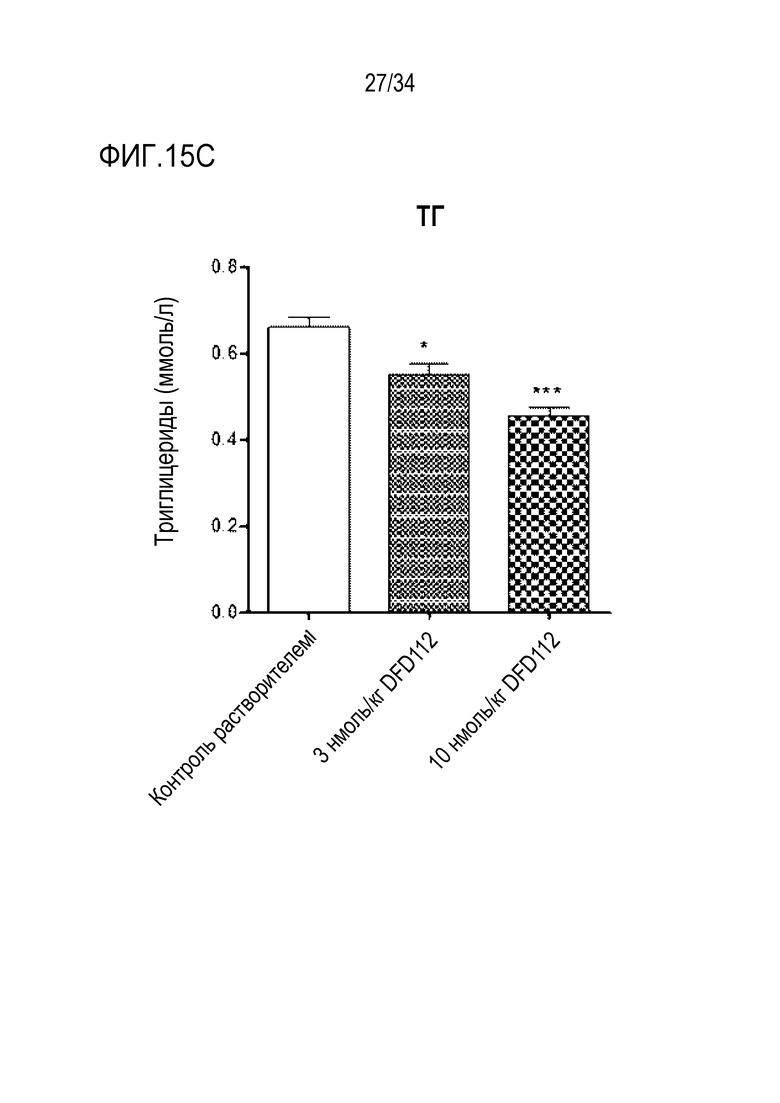
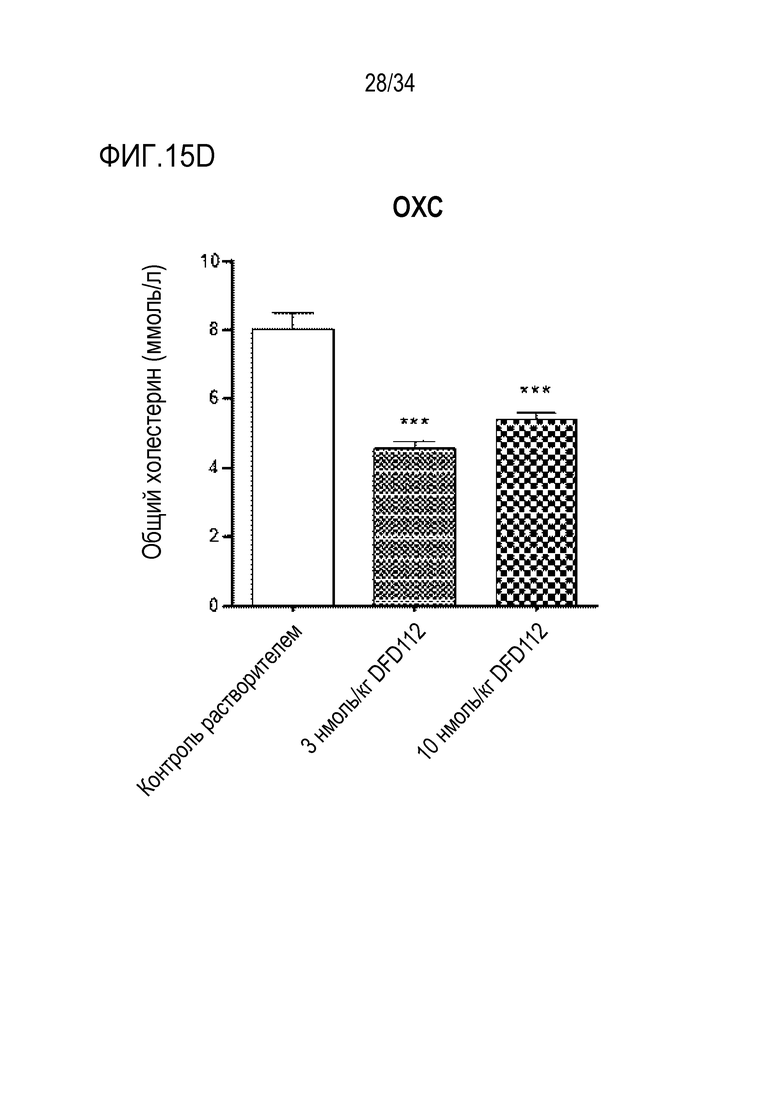
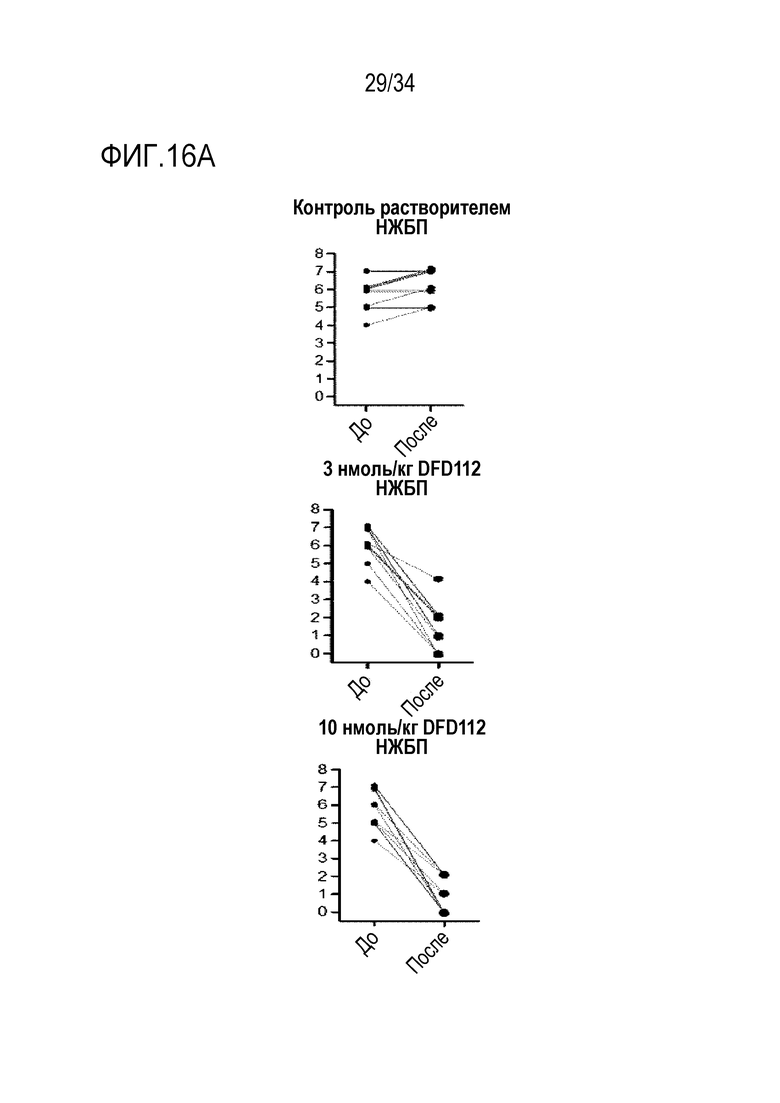
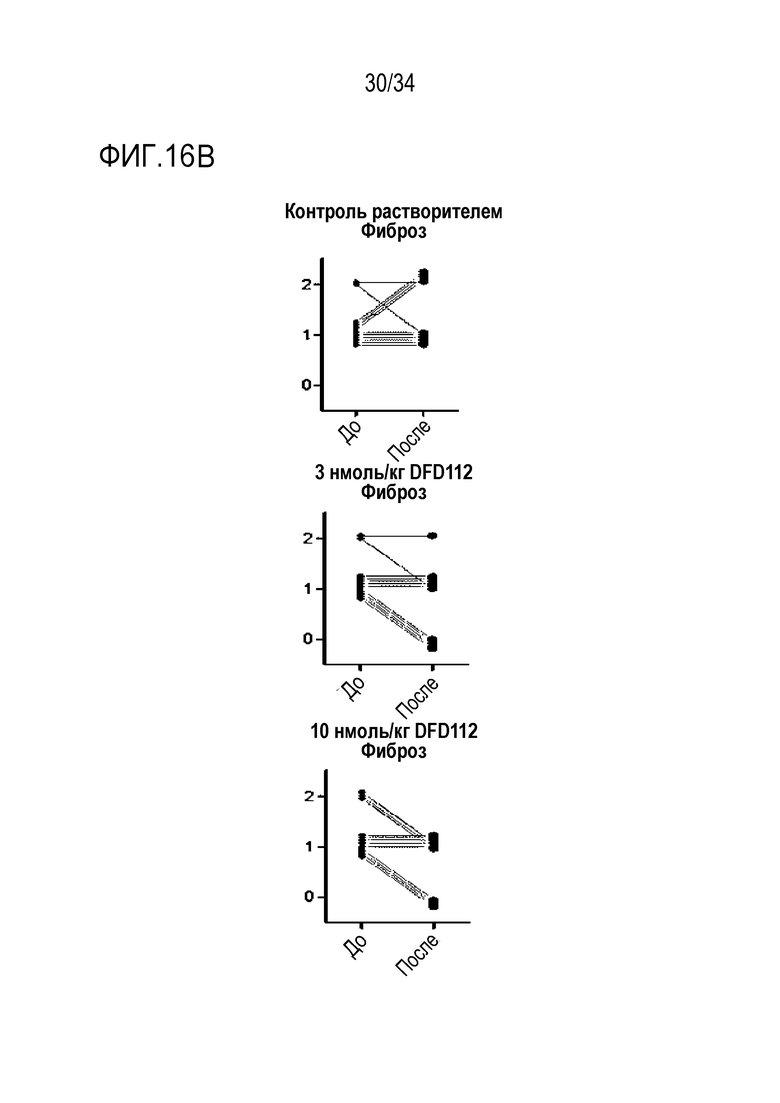
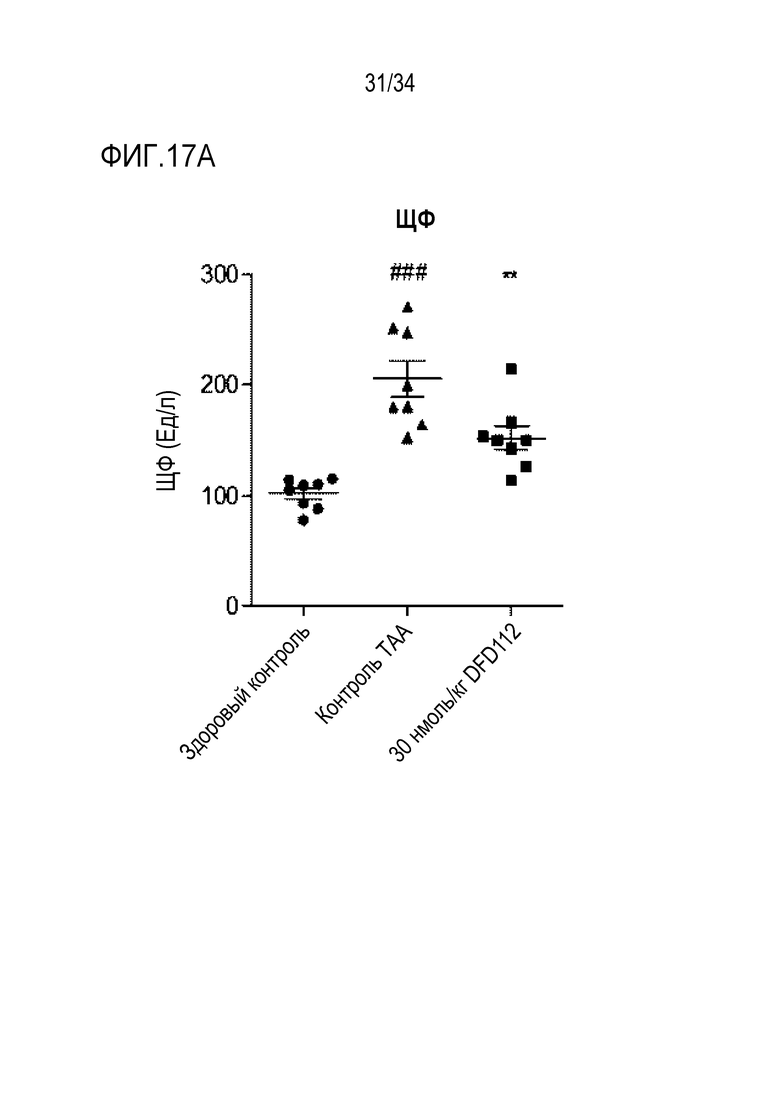
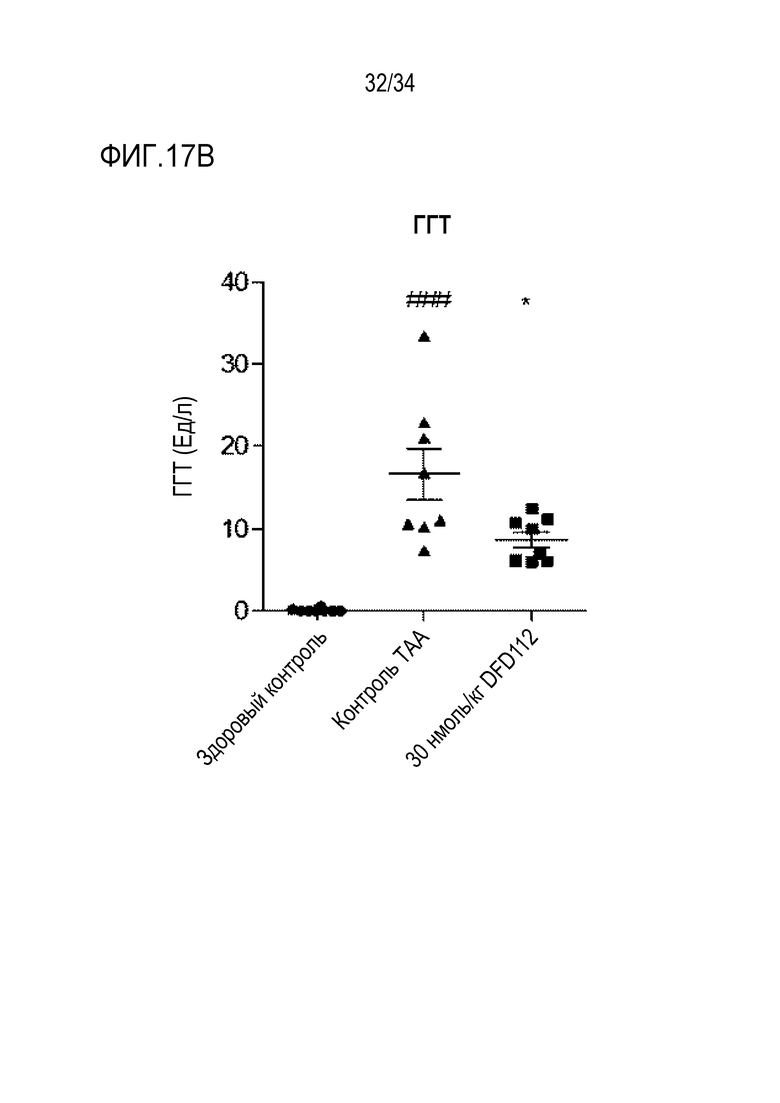
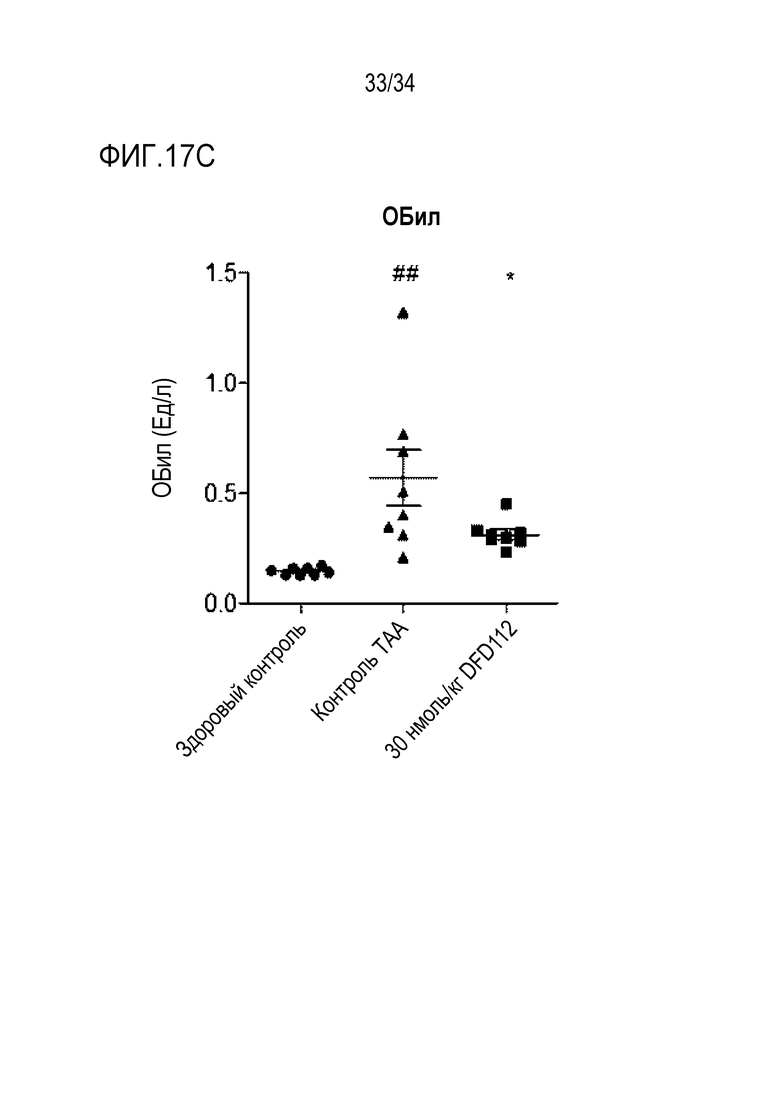
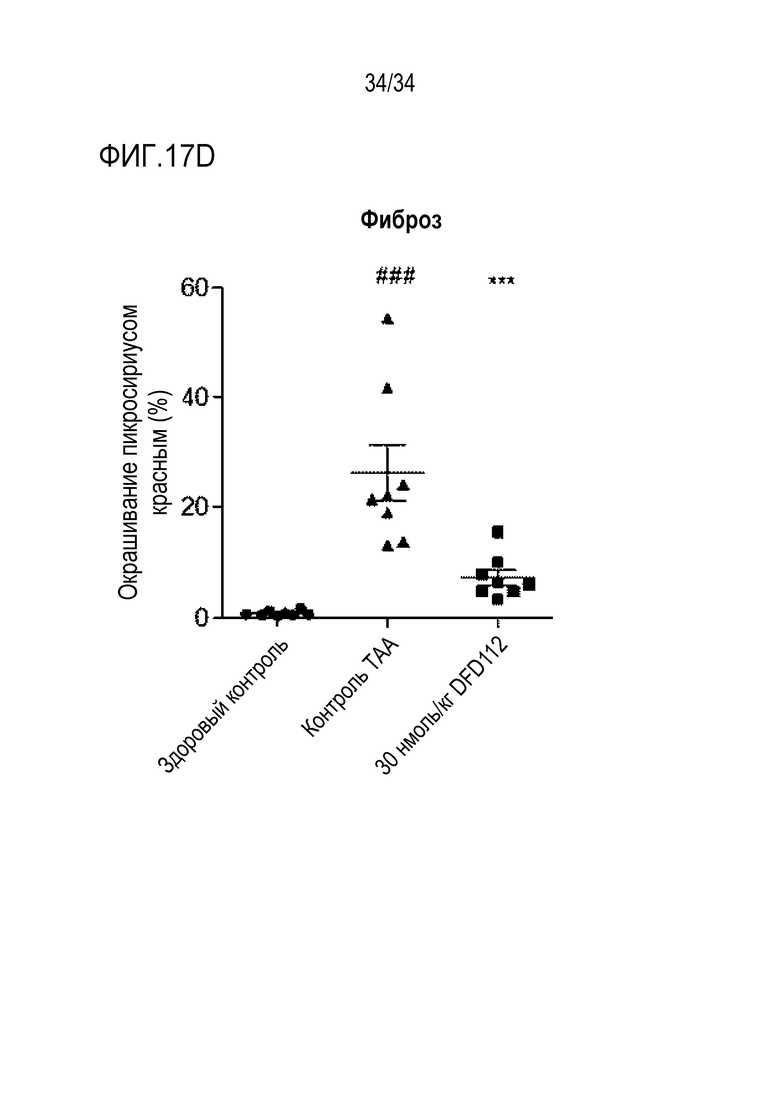
Группа изобретений относится к медицине, а именно к применению фармацевтической композиции и способу предотвращения или лечения гепатита, фиброза печени и/или цирроза печени с использованием слитого белка. Применение фармацевтической композиции для предотвращения или лечения гепатита, фиброза печени и/или цирроза печени, где фармацевтическая композиция содержит в качестве эффективного компонента слитый белок в эффективном количестве, включающий мутантный белок фактора роста фибробластов 21 (FGF21) и Fc-область иммуноглобулина. Способ предотвращения или лечения гепатита, фиброза печени и/или цирроза печени, который включает этап введения фармацевтической композиции субъекту, где фармацевтическая композиция содержит в качестве эффективного компонента слитый белок в эффективном количестве, включающий мутантный белок фактора роста фибробластов 21 (FGF21) и Fc-область иммуноглобулина. Вышеуказанная группа изобретений эффективна для лечения гепатита, фиброза печени и/или цирроза печени. 2 н. и 28 з.п. ф-лы, 17 ил., 10 табл., 30 пр.
1. Применение фармацевтической композиции для предотвращения или лечения гепатита, фиброза печени и/или цирроза печени, где фармацевтическая композиция содержит в качестве эффективного компонента слитый белок в эффективном количестве, включающий мутантный белок фактора роста фибробластов 21 (FGF21); и Fc-область иммуноглобулина,
где слитый белок содержит линкер, соединяющий мутантный белок FGF21 с Fc-областью иммуноглобулина, причем линкер соединен с С-концом Fc-области иммуноглобулина и N-концом мутантного белка FGF21, при этом линкер имеет аминокислотную последовательность, представленную любой из SEQ ID NO: 2-5;
где мутантный белок FGF21 включает по меньшей мере одну мутацию, выбранную из группы, состоящей из следующих мутаций (1)-(3) и (5):
(1) замена аминокислот в положениях 98-101 от N-конца белка FGF21 дикого типа аминокислотной последовательностью EIRP (SEQ ID NO: 68);
(2) замена аминокислот в положениях 170-174 от N-конца белка FGF21 дикого типа аминокислотной последовательностью TGLEAV (SEQ ID NO: 69);
(3) замена аминокислот в положениях 170-174 от N-конца белка FGF21 дикого типа аминокислотной последовательностью TGLEAN (SEQ ID NO: 70);
(5) замена аминокислоты в положении 174 от N-конца белка FGF21 дикого типа аминокислотой N;
где белок FGF21 дикого типа имеет аминокислотную последовательность, представленную согласно SEQ ID NO: 1, и
где указанный гепатит выбран из группы, состоящей из острого вирусного гепатита, хронического гепатита, алкогольного гепатита, аутоиммунного гепатита и фульминантного гепатита.
2. Применение по п.1, где слитый белок дополнительно включает биологически активный белок или его мутант или фрагмент.
3. Применение по п.1 или 2, где аминокислотный остаток N мутантного белка FGF21, введенный в результате мутации, гликозилирован.
4. Применение по п.2, где биологически активный белок является белком, выбранным из группы, состоящей из инсулина, C-пептида, лептина, глюкагона, гастрина, желудочного ингибиторного полипептида (ЖИП), амилина, кальцитонина, холецистокинина, пептида YY, нейропептида Y, костного морфогенетического белка 6 (BMP-6), костного морфогенетического белка 9 (BMP-9), оксинтомодулина, окситоцина, глюкагоноподобного пептида 1 (ГПП-1), мутанта ГПП-1, имеющего аминокислотную последовательность, представленную любой из SEQ ID NO: 43-46, глюкагоноподобного пептида 2 (ГПП-2), ирисина, содержащего домен фибронектина III типа белка 5 (FNDC5), апелина, адипонектина, родственного C1q и фактору некроза опухоли белка (семейства CTRP), резистина, висфатина, оментина, ретинолсвязывающего белка 4 (RBP-4), глицентина, ангиопоэтина, интерлейкина-22 (IL-22), эксендина-4 и гормона роста.
5. Применение по п.4, где биологически активный белок является белком, выбранным из ГПП-1, его мутанта, выбранного из группы, состоящей из мутанта ГПП-1, имеющего аминокислотную последовательность, представленную любой из SEQ ID NO: 43-46, и эксендина-4.
6. Применение по п.1 или 2, где белок FGF21 дикого типа имеет аминокислотную последовательность, представленную SEQ ID NO: 1.
7. Применение по п.1 или 2, где мутантный белок FGF21 имеет аминокислотную последовательность, представленную любой из SEQ ID NO: 6-8, 10-17 и 19-23.
8. Применение по п.1 или 2, где Fc-область иммуноглобулина является любой из Fc-области IgG1, IgG2, IgG3, IgG4 и IgD или гибридным Fc, содержащим их комбинацию.
9. Применение по п.8, где гибридный Fc включает область IgG4 и область IgD.
10. Применение по п.2, где слитый белок включает биологически активный белок, Fc-область иммуноглобулина и мутантный белок FGF21, соединенные в таком порядке от N-конца к С-концу.
11. Применение по п.10, где линкер дополнительно соединен между Fc-областью иммуноглобулина и мутантным белком FGF21.
12. Применение по п.11, где линкер соединен с C-концом Fc-области иммуноглобулина и N-концом мутантного белка FGF21.
13. Применение по п.1, где слитый белок представлен любой из аминокислотных последовательностей, выбранных из SEQ ID NO: 36, 37 и 39.
14. Применение по п.2, где слитый белок представлен любой из аминокислотных последовательностей, выбранных из SEQ ID NO: 65, 66 и 67.
15. Применение по п.1, где мутантный белок FGF21 дополнительно содержит по меньшей мере одну мутацию, выбранную из группы, состоящей из следующих мутаций (4) и (6):
(4) замена аминокислоты в положении 170 от N-конца белка FGF21 дикого типа на аминокислоту N; и
(6) замена аминокислоты в положении 180 от N-конца белка FGF21 дикого типа на аминокислоту E.
16. Способ предотвращения или лечения гепатита, фиброза печени и/или цирроза печени, который включает этап введения фармацевтической композиции субъекту, где фармацевтическая композиция содержит в качестве эффективного компонента слитый белок в эффективном количестве, включающий мутантный белок фактора роста фибробластов 21 (FGF21), и Fc-область иммуноглобулина,
где слитый белок содержит линкер, соединяющий мутантный белок FGF21 с Fc-областью иммуноглобулина, причем линкер соединен с С-концом Fc-области иммуноглобулина и N-концом мутантного белка FGF21, при этом линкер имеет аминокислотную последовательность, представленную любой из SEQ ID NO: 2-5;
где мутантный белок FGF21 включает по меньшей мере одну мутацию, выбранную из группы, состоящей из следующих мутаций (1)-(3) и (5):
(1) замена аминокислот в положениях 98-101 от N-конца белка FGF21 дикого типа аминокислотной последовательностью EIRP (SEQ ID NO: 68);
(2) замена аминокислот в положениях 170-174 от N-конца белка FGF21 дикого типа аминокислотной последовательностью TGLEAV (SEQ ID NO: 69);
(3) замена аминокислот в положениях 170-174 от N-конца белка FGF21 дикого типа аминокислотной последовательностью TGLEAN (SEQ ID NO: 70);
(5) замена аминокислоты в положении 174 от N-конца белка FGF21 дикого типа аминокислотой N;
где белок FGF21 дикого типа имеет аминокислотную последовательность, представленную согласно SEQ ID NO: 1, и
где указанный гепатит выбран из группы, состоящей из острого вирусного гепатита, хронического гепатита, алкогольного гепатита, аутоиммунного гепатита и фульминантного гепатита.
17. Способ по п.16, где слитый белок дополнительно включает биологически активный белок или его мутант или фрагмент.
18. Способ по п.16 или 17, где аминокислотный остаток N мутантного белка FGF21, введенный в результате мутации, гликозилирован.
19. Способ по п.17, где биологически активный белок является белком, выбранным из группы, состоящей из инсулина, C-пептида, лептина, глюкагона, гастрина, желудочного ингибиторного полипептида (ЖИП), амилина, кальцитонина, холецистокинина, пептида YY, нейропептида Y, костного морфогенетического белка 6 (BMP-6), костного морфогенетического белка 9 (BMP-9), оксинтомодулина, окситоцина, глюкагоноподобного пептида 1 (ГПП-1), мутанта ГПП-1, имеющего аминокислотную последовательность, представленную любой из SEQ ID NO: 43-46, глюкагоноподобного пептида 2 (ГПП-2), ирисина, содержащего домен фибронектина III типа белка 5 (FNDC5), апелина, адипонектина, родственного C1q и фактору некроза опухоли белка (семейства CTRP), резистина, висфатина, оментина, ретинолсвязывающего белка 4 (RBP-4), глицентина, ангиопоэтина, интерлейкина-22 (IL-22), эксендина-4 и гормона роста.
20. Способ по п.19, где биологически активный белок является белком, выбранным из ГПП-1, его мутанта, выбранного из группы, состоящей из мутанта ГПП-1, имеющего аминокислотную последовательность, представленную любой из SEQ ID NO: 43-46 и эксендина-4.
21. Способ по п.16 или 17, где белок FGF21 дикого типа имеет аминокислотную последовательность, представленную SEQ ID NO: 1.
22. Способ по п.16 или 17, где мутантный белок FGF21 имеет аминокислотную последовательность, представленную любой из SEQ ID NO: 6-8, 10-17 и 19-23.
23. Способ по п.16 или 17, где Fc-область иммуноглобулина является любой из Fc-области IgG1, IgG2, IgG3, IgG4 и IgD или гибридным Fc, содержащим их комбинацию.
24. Способ по п.23, где гибридный Fc включает область IgG4 и область IgD.
25. Способ по п.17, где слитый белок включает биологически активный белок, Fc-область иммуноглобулина и мутантный белок FGF21, соединенные в таком порядке от N-конца к С-концу.
26. Способ по п.25, где линкер дополнительно соединен между Fc-областью иммуноглобулина и мутантным белком FGF21.
27. Способ по п.26, где линкер соединен с C-концом Fc-области иммуноглобулина и N-концом мутантного белка FGF21.
28. Способ по п.16, где слитый белок представлен любой из аминокислотных последовательностей, выбранных из SEQ ID NO: 36, 37 и 39.
29. Способ по п.17, где слитый белок представлен любой из аминокислотных последовательностей, выбранных из SEQ ID NO: 65, 66 и 67.
30. Способ по п.16, где мутантный белок FGF21 дополнительно содержит по меньшей мере одну мутацию, выбранную из группы, состоящей из следующих мутаций (4) и (6):
(4) замена аминокислоты в положении 170 от N-конца белка FGF21 дикого типа на аминокислоту N; и
(6) замена аминокислоты в положении 180 от N-конца белка FGF21 дикого типа на аминокислоту E.
| ЯКУБКЕ Х.-Д и др | |||
| Аминокислоты, пептиды, белки | |||
| - М: Мир, 1985 | |||
| Подвижной рельс для пересечений железнодорожных путей | 1922 |
|
SU456A1 |
| WO 2010129600 A2, 11.11.2010 | |||
| WO 2010129503 A1, 11.11.2010 | |||
| Машковский М.Д | |||
| Лекарственные средства | |||
| Устройство для электрической сигнализации | 1918 |
|
SU16A1 |
| и доп | |||
| - М.: Новая волна, 2012 | |||
| Приспособление для отсчитывания папирос в укладочных машинах | 1916 |
|
SU1216A1 |
| CN 105288592 A, 03.02.2016 | |||
| CN 102558358 A, 11.07.2012 | |||
| МАЛОБЛИКУЮЩИЙ СВЕТОДИОДНЫЙ ОСВЕТИТЕЛЬНЫЙ МОДУЛЬ | 2010 |
|
RU2548570C2 |
| US 2014243503 | |||
Авторы
Даты
2023-05-04—Публикация
2017-11-10—Подача