Изобретение относится к области спектрофотоколориметрических методов анализа, в частности, к анализу растворов на предмет определения антиоксидантной активности (АОА) и имеет отношение к биологической химии и молекулярной физиологии.
Известны способы экспресс-оценки АОА природных соединений в спиртсодержащих напитках с помощью спектрофотометрического метода, основанного на построении градуировочных графиков (Бидарова Ф.Н., Хубаева Т.О., Кисиева М.Т. и др. Экспресс-методы оценки антиокислительной и антирадикальной активности органических субстратов: Метод. Рекомендации по фармацевтической химии. - Владикавказ: СОГМА, 2014. - 32 с.).
Указанные способы имеют следующие недостатки:
- нет универсального метода определения АОА всех компонентов;
- нет возможности сравнения результатов, полученных разными методами.
Известен запатентованный способ определения АОА с использованием метода электронно-парамагнитной резонансной спектроскопии, основанный на измерении количества парамагнитных частиц стабильного радикала дифенилпикрилгидразила (ДФПГ) до и после прохождения химической реакции радикалов с антиоксидантами АО (Иванова А.В. с соавт. Способ определения антиоксидантной активности с использованием метода электронно-парамагнитной резонансной спектроскопии: Пат. 2614365 от 31.12.2015, опубл. 24.03.2017). Известный способ имеет следующие недостатки:
- результаты измерения зависят от качества материала измерительных емкостей (кварц или стекло);
- данные методы эффективно применимы в отношении антиоксидантов (АО) фенольного типа.
Известны способы спектрофотометрического определения АОА природных соединений, позволяющие оценить уровень ингибирования радикалообразования по изменению содержания ДФПГ в образце (Sharif M.F., Bennett М.Т. The effect of different methods and solvents on the extraction of polyphenols in ginger (Zingiber officinale) // Jurnal Teknologi (Sciences and Engineering). - 2016. Vol. 78, №11-2. - P. 49-54; Mei X., Li G., Lin Y. et al. Optimization of ultrasound-assisted extraction of polyphenols from Xanthoceras sorbifolia Husks and their determination using HPLC // J. Chem. Soc. Pak. - 2020. - Vol. 42, №3. - P. 405-412). Указанные способы имеют следующие недостатки:
- данные способы эффективно работают в отношении АО фенольного и полифенольного типов;
- не позволяет дать сравнительную оценку антиоксидантного действия природных соединений в биологических средах.
Известен способ оценки антиокислительного баланса организма, заключающийся в определении уровня антирадикальной защиты методом хемилюминесценции в аспирате пациентов (Использование неинвазивных методов контроля антиокислительного баланса организма в мониторинговых гигиенических исследованиях: Методические рекомендации. - М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2006. - 19 с.). Указанный способ имеет следующие недостатки:
- не позволяет проводить определение АОА в некоторых биологических (окрашенных) жидкостях организма;
- конечная оценка антиокислительного баланса базируется на эмпирических зависимостях, полученных при обобщении данных по выборкам;
- техническое исполнение данного способа достаточно трудоемкое и требует специального набора реагентов и оборудования.
Известны биологические методы определения АОА у животных с использованием реактива Фентона для индукции процессов радикалообразования (Тринеева О.В. Методы определения антиоксидантной активности объектов растительного и синтетического происхождения в фармации (обзор) / Аналитические методики иметоды контроля // Разработка и регистрация лекарственных средств. - 2017. - Т. 21, №4. - С. 180-197). Указанные методы имеют недостатки:
- реактив Фентона не является единственным реактивом, способным индуцировать радикалообразование, тем более что существуют более дешевые аналоги, такие как перекись водорода;
- на точность определения АОА с использованием биологических маркеров при измерении окислительно-восстановительного потенциала (ОВП) влияет природа соединения-маркера: более предпочтительными оказываются белковые маркеры;
- методика измерения ОВП для определения АОА позволяет оценить восстановительные свойства АО без учета их биологического действия.
Известен способ-прототип оценки АОА путем определения перекисного гемолиза эритроцитов у экспериментальных животных (Батуева Ю.А., Торопова А.А., Мондодоев А.Г., Шантанова Л.Н. Мембраностабилизирующее и антиоксидантное действие комплексного растительного средства «Литофит» в тест-системах in vitro II Сибирский медицинский журнал (Иркутск). - 2015; 136(5): 122-124). Прототип имеет недостатки:
- для индуцирования СРО используется смесь Н2О2 с солями железа (II) (Реактив Фентона);
- оценку АОА давали на основе определения абсолютной величины перекисного гемолиза эритроцитов без учета количества вещества АО.
Предлагаемое изобретение направлено на определение антиоксидантной активности (АОА) природных соединений у экспериментальных животных путем вычисления индекса антиоксидантной активности по данным перекисной резистентности эритроцитов, а также с учетом количества вещества вводимого антиоксиданта. Предлагаемый способ позволяет также дать сравнительную оценку АОА различных природных и синтетических АО как фенольного, так и нефенольного типов.
Указанный технический результат достигается тем, что полученную спектрофотометрическим методом величину перекисной резистентности эритроцитов относят к количеству вещества вводимого животным природного соединения и определяют индекс антиоксидантной активности по формуле:
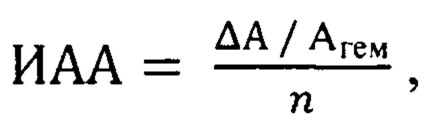
где ИАА - индекс антиоксидантной активности (в у.е.), ΔА - понижение оптической плотности образца крови: ΔА=Агем - Аоп; Агем - оптическая плотность пробы гемолизованной крови, Аоп - оптическая плотность опытной пробы, n - количество вещества вводимого природного соединения, ммоль.
Перекисное окисление липидов (ПОЛ) - физиологически естественный процесс; усиление этого процесса наблюдается в условиях воздействия неблагоприятных факторов и при истощении ресурсов антиоксидантной системы (АОС). Вследствие усиления процессов липопероксидации происходят структурно-функциональные изменения биологических мембран клеток, а именно: в мембранах клеток возникают «пробоины» - так называемые мембранные дыры, возникающие в результате гидролитического вымывания остатков высших жирных кислот, холестерола и прочих элементов липидного бислоя (Николаев А.А., Логинов П.В., Ветошкин Р.В. Участие свободных радикалов в функции сперматозоидов // Астраханский медицинский журнал. - 2014. - Т. 9, №1. С. 23-29). В крови подобные явления происходят в мембранах эритроцитов: в результате возникающих дыр мембрана становится более эластичной, т.е. происходит ее сжижение и даже разрыв. Следствием указанных деструктивных процессов является гемолиз эритроцитов, который сопровождается выбросом гемоглобина во внеклеточную среду.
В то же самое время существуют системы регуляции процессов липо-пероксидации в организме: с одной стороны это ферментативная АОС, включающая в себя ряд антиперекисных ферментов, а с другой - неферментативная система, обусловленная присутствием в организме антиоксидантной цепочки (аскорбиновая кислота, токоферолы, эрготионеины и пр.). Таким образом, поступающие в организм природные и синтетические антиоксиданты АО (водо- и жирорастворимые) должны способствовать улучшению антиоксидантного статуса. Жирорастворимые АО эффективно встраиваются во все биомембраны клеток, защищая их таким образом от негативного воздействия свободных радикалов. Водорастворимые АО (например, аскорбиновая кислота) эффективно функционируют в межклеточном пространстве, блокируя приближение радикалов к поверхностям клеток (Николаев А.А., Логинов П.В., Мавлютова Е.Б., Белявская А.А. Свободные радикалы и биоантиоксиданты в репродуктивных процессах (обзор литературы) // Проблемы репродукции. - 2018. - Т. 24, №1. - С. 21-26).
Для индукции процессов липопероксидации in vitro используют часто раствор перекиси водорода, который служит неким «индикатором» функционального состояния мембран: чем плотнее слои в мембране, тем труднее происходит ее разрыв в результате усиления процессов радикалообразования, и тем в меньшей степени выражен гемолиз. Применение более сложных систем для индуцирования липопероксидации (например, реактив Фентона) необязательно, поскольку перекись водорода сама по себе способна эффективно запускать процессы радикалообразования в клетках. В крови процессы радикалообразования обусловливают гемолитические процессы.
Перекисный гемолиз эритроцитов (ПГЭ) выражает долю гемолизированных эритроцитов в пероксидной среде (по отношению к полному гемолизу); поэтому величина ПГЭ может быть рассчитана путем отношения оптической плотности опытного образца крови к оптической плотности образца, где произошел полный гемолиз эритроцитов, т.е. ПГЭ=(Аоп/Агем)×100%, где Аоп - оптическая плотность опытной пробы (в буферированной среде), Агем - оптическая плотность гемолизованной крови (в водной среде).
Перекисная резистентность эритроцитов (ПРЭ), напротив, выражает долю негемолизированных эритроцитов к гемолизированным и выражается формулой: ПРЭ=100% - ПГЭ. С учетом выражения для расчета перекисного гемолиза эритроцитов получаем развернутую формулу для расчета перекисной резистентности эритроцитов ПРЭ:
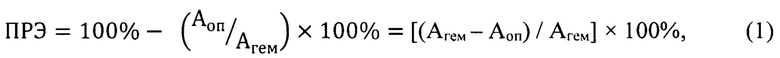
где ПРЭ - перекисная резистентность эритроцитов, Агем - оптическая плотность гемолизованной крови, Аоп - оптическая плотность опытной пробы. В долях величина ПРЭ выражается тогда так:
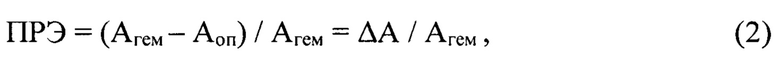
где ΔА - понижение оптической плотности образца крови, Агем - оптическая плотность гемолизованной крови.
Для характеристики антиоксидантной активности природных соединений нами предложен так называемый индекс антиоксидантной активности (ИАА), учитывающий способность антиоксидантов блокировать радикалообразование. Этот индекс отражает по сути показатель ПРЭ, но только с учетом количества вещества антиоксиданта АО.
При поступлении в живой организм того или иного АО, величина ПРЭ будет повышаться, поскольку мембрана клеток эритроцитов будет более плотной и прочной, снижая тем самым гемолитические процессы. Вместе с тем формулы (1) и (2) позволяет использовать показатель ПРЭ для оценки антиоксидантной активности соединения в абсолютных значениях без учета количеств веществ поступающих в организм АО. Однако молярные массы АО имеют широкий разброс: жирорастворимые АО имеют значительные молярные массы благодаря наличию длинных боковых фитильных цепей, водорастворимые АО отличаются своей низкомолекулярностью. Поэтому в одних и тех же дозах антиоксидантная активность у жиро- и водорастворимых АО будет разная. Таким образом, целесообразно учесть это обстоятельство и ввести в формулу данную поправку. Тогда получаем так называемый индекс антиоксидантной активности (ИАА):
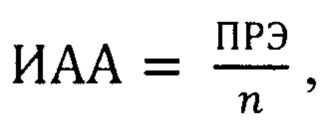
где ИАА - индекс антиоксидантной активности, выражаемый в у.е.; n - количество потребляемого АО, выражаемое в ммоль.
Для удобства расчетов в вышеуказанной формуле следует использовать выражение (2), где приводится величина ПРЭ не в процентах, а в долях. Тогда значение ИАА будет рассчитываться по формуле:
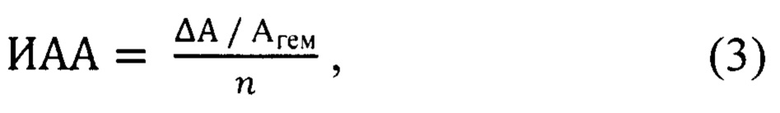
где ΔА - понижение оптической плотности образца крови, Агем - оптическая плотность гемолизованной крови, n - количество вещества антиоксиданта.
Если сравнивать антиоксидантную активность различных природных соединений при их введении в равных дозах, то учитывая, что количество вещества вычисляется по формуле: n=m/М, где m - масса (доза) вещества, М - молярная масса, и что, таким образом, n ~ М-1, формулу (3) можно несколько упростить следующим образом:
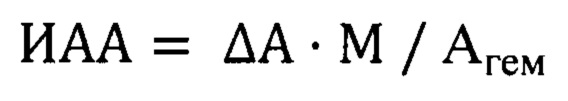
Для используемых в создании настоящего способа антиоксидантов рассчитаем их количества веществ. Молярная масса α-токоферола (α-ТФ) составляет 430 г/моль, для аскорбиновой кислота (АсК) молярная масса составляет 176 г/моль. Молярная масса полифенольных соединений (ПФС), входящих в состав имбиря (гингеролов и шогаолов), составляет в среднем 285 г/моль. Учитывая, что все АО вводили в течение 2 недель в одинаковых дозах 2,5 мг/100 г массы тела животного в сутки, можно рассчитать суммарную дозу потребляемых АО за 2 недели: 2,5×14=35 мг. Тогда количества потребляемых доз соответственно для α-ТФ, АсК и ПФС, вычисляемые по формуле n=m/M, составляют: 0,08 ммоль, 0,20 ммоль, 0,12 ммоль. Эти величины будем использовать в знаменателе для расчета ИАА.
Создание способа оценки антиоксидантной активности природных соединений осуществлялось на базе кафедры химии ФГБОУ ВО «Астраханский государственный медицинский университет» Минздрава России. Для этого использовались беспородные белые крысы линии Wistar массой 210±15 г (20 шт.), которые были поделены на две группы по 10 шт. в каждой. Первую группу использовали для оценки АО-действия (активности) классического фенольного АО с длинной боковой фитильной цепью - α-токоферол (α-ТФ). Вторую группу животных использовали для оценки АОА полифенольных соединений (ПФС) имбиря, полученных и выделенных по патенту №2740997 (Логинов П.В., Николаев А.А., Мавлютова Е.Б., Голубкина С.А. Способ выделения полифенолов из корневищ имбиря: Пат. 2740997 от 05.11.2019, опубл. 22.01.2021) и водорастворимого АО - аскорбиновой кислоты (АсК) в сравнительном аспекте. Все антиоксиданты вводили per os в течение двух недель в дозах 2,5 мг в сутки. Во второй группе после введения АсК через 30 дней вводили экстракт ПФС, чтобы перед введением ПФС весь аскорбат полностью вымылся из крови животных, что вполне логично, поскольку аскорбиновая кислота является водорастворимым АО. Эксперимент проходил в течение двух месяцев в осенний период времени года (сентябрь-октябрь) во избежание сезонных влияний: α-ТФ и АсК вводили параллельно в двух группах в первой половине сентября, ПФС вводили во второй половине октября. Забор крови производили из хвостовой вены с соблюдением этических норм о гуманном отношении к животным в соответствии с Женевской конвенцией (1985). При заборе крови пипетку предварительно обрабатывали гепариновым раствором во избежание свертывания крови.
Для осуществления названного способа использовались следующие реактивы и оборудование: 1/15 М фосфатный буфер (рН 7,4), физиологический раствор, пергидроль (30% Н2О2), пипетка для забора крови и отбора рабочего раствора перекиси водорода емкостью 0,2 мл с грушей, водяная баня, термостат, центрифуга, спектрофотоколориметр КФК-3 (Россия). Для приготовления буферно-физиологической смеси использовали приготовленный фосфатный буфер и физраствор в соотношении 1:9. Рабочий раствор перекиси (10%) готовят путем смешивания пергидроля и физраствора в соотношении 1:2. Далее определяем показатель ПРЭ по модифицированной методике Покровского А.А. и Абрарова А.А. (1964). Для этого к 4 мл буферно-физиологической смеси (рН 7,4) добавляют 0,1 мл крови и полученный раствор помещают в термостат на 15 минут при t=37°С, затем добавляют 0,2 мл рабочего раствора перекиси водорода, после чего пробирки вновь помещают в термостат на 30 минут при t=37°С. Пробу, в которой происходит полный гемолиз, готовят путем добавления 0,1 мл крови к 4 мл дистиллированной воды. Затем пробирки вынимают, дают им остыть 25 минут при комнатной температуре, и центрифугируют в течение 5 минут при 3000 об/мин; надосадочную жидкость сливают в кювету с толщиной фотометрируемого слоя 0,5 см и измеряют оптические плотности обоих проб при длине волны λ=536 нм против раствора сравнения (дистиллированная вода). Далее расчитывают показатель ПРЭ, а затем вычисляют индекс ИАА.
В предлагаемом способе достигнуты следующие результаты. На основе измерений оптических плотностей контрольной и опытной проб были вычислены ИАА для следующих антиоксидантных природных соединений: α-токоферола (α-ТФ), аскорбиновой кислоты (АсК), экстракта полифенольных соединений (ПФС) из корневищ имбиря. Ниже приводятся примеры расчетов ИАА для трех вышеуказанных природных АО.
Пример 1. Исследование АОА α-ТФ.
Были получены следующие значения оптических плотностей при полном гемолизе крови Агем: 0,450; 0,490; 0,420; 0,530; 0,520; 0,550; 0,602; 0,480; 0,540; 0,480. Показатели оптических плотностей опытных проб Аоп оказались следующими: 0,120; 0,150; 0,110; 0,175; 0,205; 0,215; 0,150; 0,120; 0,130; 0,125. Далее вычисляли показатели ПРЭ и ИАА:
ПРЭ=[(0,450-0,120)/0,450]×100%=0,33÷0,45×100%=73,3%
ПРЭ=[(0,490-0,150)/0,490]×100%=0,34÷0,49×100%=69,4%
ПРЭ=[(0,420-0,110)/0,420]×100%=0,31÷0,42×100%=73,8%
ПРЭ=[(0,530-0,175)/0,530]×100%=67,0% и т.д.
В среднем показатель ПРЭ для α-ТФ оказался равным 71,1±3,54% (или в долях 0,71). Тогда ИАА=ПРЭ / n=0,71÷0,08 ммоль = 8,88 ≈ 8,9 у.е.
Пример 2. Исследование АОА АсК.
Были получены следующие значения оптических плотностей при полном гемолизе крови Агем: 0,525; 0,500; 0,550; 0,605; 0,520; 0,480; 0,600; 0,630; 0,600; 0,565. Показатели оптических плотностей опытных проб Аоп оказались следующими: 0,385; 0,355; 0,370; 0,480; 0,400; 0,300; 0,300; 0,350; 0,390; 0,405. Далее вычисляли ПРЭ и ИАА:
ПРЭ=[(0,525-0,385)/0,525]×100%=0,14÷0,525×100%=26,7%
ПРЭ=[(0,500-0,355)/0,500]×100%=0,145÷0,50×100%=29,0%
ПРЭ=[(0,550-0,370)/0,550]×100%=32,7% и т.д.
В среднем показатель ПРЭ для АсК оказался равным 30,2±1,90% (или в долях 0,30). Тогда ИАА=ПРЭ / n=0,30÷0,2 ммоль = 1,5 у.е.
Пример 3. Исследование АОА ПФС.
Были получены следующие значения оптических плотностей при полном гемолизе крови Агем: 0,525; 0,500; 0,550; 0,605; 0,520; 0,480; 0,600; 0,630; 0,600; 0,565. Показатели оптических плотностей опытных проб Аоп оказались следующими: 0,200; 0,170; 0,180; 0,240; 0,175; 0,140; 0,240; 0,245; 0,180; 0,190. Далее вычисляли ПРЭ и ИАА:
ПРЭ=[(0,525-0,200)/0,525]×100%=0,325÷0,525×100%=61,9%
ПРЭ=[(0,500-0,170)/0,500]×100%=0,33÷0,50×100%=66,0%
ПРЭ=[(0,605-0,240)/0,605]×100%=60,3% и т.д.
В среднем показатель ПРЭ для ПФС оказался равным 62,1±1,14% (или в долях 0,62). Тогда ИАА=ПРЭ / n=0,62÷0,12=5,17 ≈ 5,2 у.е.
Для сравнения вычислили ПРЭ для образца крови животных, которые не принимали никаких АО-соединений. Он составил величину 24,5%, что еще раз подтверждает АО-характер рассмотренных выше соединений.
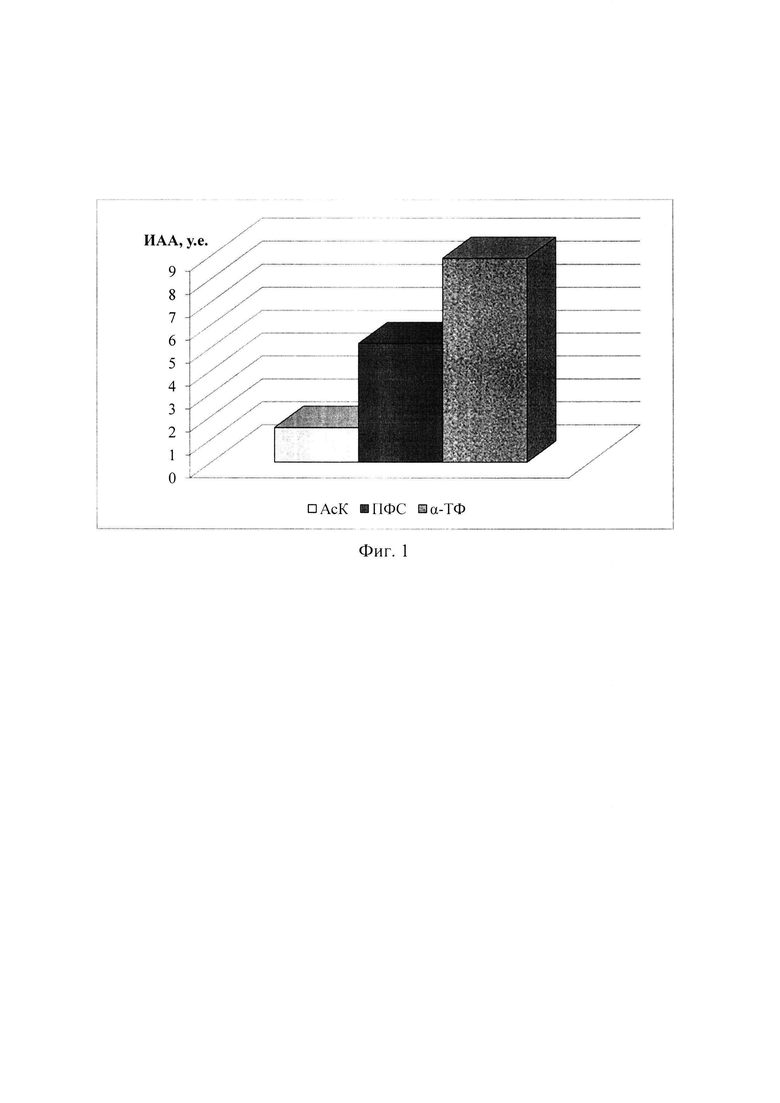
Корреляционный анализ для АсК и ПФС показал, что АО-действие (АОА) этих АО обнаруживает одинаковые тенденции, но разную степень, что подтверждается положительным коэффициентом корреляции r=+0,77 (Р<0,05). В то же самое время полученные индексы ИАА для всех трех АО достоверно различимые, что позволяет построить ряд по возрастанию (выраженности) АОА трех рассмотренных природных веществ в эксперименте:
Аскорбат (АсК)<ПФС<α-Токоферол
Наглядно указанную зависимость иллюстрирует Фиг. 1. Как видно из графика, ИАА α-ТФ превосходит таковой для АсК почти в 6 раз (Р<0,001); ИАА ПФС почти в 3,5 раза выше такового для АсК (Р<0,001), что вполне объяснимо, поскольку аскорбиновая кислота (аскорбат, или витамин С) является водорастворимым АО и преимущественно циркулирует в крови, нежели внедряется в липидный бислой биомембран клеток, в отличие от полифенольных соединений. Кроме того, аскорбиновая кислота оказывает свое АО-действие главным образом опосредованно, восстанавливая иные АО в антиокислительной цепочке, например, α-токоферол. Вместе с тем АО-действие АсК очевидно. В то же самое время, ИАА α-токоферола превышает таковой для ПФС на 72% (Р<0,001), что также объяснимо, поскольку α-ТФ, в отличие от ПФС, имеет более длинную боковую фитильную цепь, позволяющую токоферолам более эффективно закрепиться в липидном бислое и проявить таким образом свое АО-действие (П.В. Логинов. Функциональные особенности и пути коррекции репродуктивных процессов при стрессогенных воздействиях: Дисс. … доктора биол. наук. - Астрахань, 2016. - 260 с.). Полифенольные соединения из корневищ имбиря (гингеролы, шогаолы, зингероны и парадолы) обладают средней или короткой длиной боковой фитильной цепи:
Антиоксидантная активность всех вышерассмотренных соединений очевидна. В зависимости от природы АО проявляют себя по-разному в эксперименте. Подтверждением указанного обстоятельства являются вычисленные индексы ИАА. Главный вывод созданного способа можно сформулировать следующим образом: АО с большей молекулярной массой проявляют более выраженную АОА, по сравнению с низкомолекулярными АО.
Созданный способ позволяет дать более точный количественный показатель антиоксидантной активности природных соединений, что сочетается с простой технологией определения указанного показателя (использование перекиси водорода вместо реактива Фентона, доступного оборудования, в частности, обычного спектрофотоколориметра). Высокая точность показателя АОА достигается путем учета в предлагаемой формуле молярной массы вводимого природного соединения. Кроме того, созданный способ универсален для любых типов АО как фенольного, так и нефенольного типов. Более того, данный способ позволяет судить об АОА соединения с учетом его фактического действия на организм, а не изолированно от него. Данный способ эффективно работает при использовании минимальных количеств биопроб.
Таким образом, предлагаемый способ можно в дальнейшем адаптировать для клинических исследований, поскольку он позволяет охарактеризовать антиоксидантную активность различных природных соединений, а также оценить выраженность их действия в организме в сравнительном аспекте.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОЦЕНКИ АНТИОКСИДАНТНОЙ АКТИВНОСТИ ПРИРОДНЫХ СОЕДИНЕНИЙ | 2023 |
|
RU2821319C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АНТИОКИСЛИТЕЛЬНОЙ АКТИВНОСТИ АНТИОКСИДАНТНЫХ ПРЕПАРАТОВ | 1999 |
|
RU2160898C1 |
| СПОСОБ ЛЕЧЕНИЯ ОДОНТОГЕННЫХ ФЛЕГМОН ЧЕЛЮСТНО-ЛИЦЕВОЙ ОБЛАСТИ У БОЛЬНЫХ СТАРШИХ ВОЗРАСТНЫХ ГРУПП | 2004 |
|
RU2271210C2 |
| Средство, обладающее антиагрегантной, цитопротекторной и антиоксидантной активностью | 2018 |
|
RU2694061C1 |
| СПОСОБ ДИАГНОСТИКИ ОКИСЛИТЕЛЬНОГО СТРЕССА ОРГАНИЗМА ЧЕЛОВЕКА | 2003 |
|
RU2236008C1 |
| СРЕДСТВО, ОБЛАДАЮЩЕЕ ЛИПИДКОРРИГИРУЮЩИМИ, ГИПОКОАГУЛЯЦИОННЫМИ И АНТИОКСИДАНТНЫМИ СВОЙСТВАМИ | 2005 |
|
RU2302248C2 |
| СПОСОБ ОЦЕНКИ АНТИОКСИДАНТНОЙ АКТИВНОСТИ | 2009 |
|
RU2392623C1 |
| Способ оценки характера экзогенных воздействий на сперматогенез у экспериментальных животных | 2018 |
|
RU2691734C1 |
| СПОСОБ ВЫБОРА ВОССТАНОВИТЕЛЬНОЙ ТЕРАПИИ У БОЛЬНЫХ ХРОНИЧЕСКИМ ХОЛЕЦИСТИТОМ В ФАЗЕ РЕМИССИИ | 2007 |
|
RU2347571C2 |
| СПОСОБ КОНТРОЛЯ АНТИОКИСЛИТЕЛЬНОЙ АКТИВНОСТИ ПРОФИЛАКТИЧЕСКИХ И ЛЕЧЕБНЫХ АНТИОКСИДАНТНЫХ СРЕДСТВ | 2001 |
|
RU2182706C1 |
Изобретение относится к области спектрофотоколориметрических методов анализа, в частности к анализу растворов на предмет определения антиоксидантной активности (АОА), и имеет отношение к биологической химии и молекулярной физиологии. Способ определения антиоксидантной активности природных соединений в эксперименте заключается в том, что полученную спектрофотометрическим методом по модифицированной методике Покровского А.А. и Абрарова А.А. величину перекисной резистентности эритроцитов относят к количеству вещества вводимого животным природного соединения и определяют индекс антиоксидантной активности по формуле: 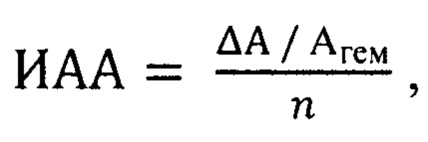 где ИАА - индекс антиоксидантной активности, у.е., ΔА - понижение оптической плотности образца крови: ΔА=Агем - Аоп; Агем - оптическая плотность пробы гемолизованной крови, Аоп - оптическая плотность опытной пробы, n - количество вещества вводимого природного соединения, ммоль. Изобретение обеспечивает точное определение показателя антиоксидантной активности природных соединений. 1 ил., 3 пр.
где ИАА - индекс антиоксидантной активности, у.е., ΔА - понижение оптической плотности образца крови: ΔА=Агем - Аоп; Агем - оптическая плотность пробы гемолизованной крови, Аоп - оптическая плотность опытной пробы, n - количество вещества вводимого природного соединения, ммоль. Изобретение обеспечивает точное определение показателя антиоксидантной активности природных соединений. 1 ил., 3 пр.
Способ определения антиоксидантной активности природных соединений в эксперименте, заключающийся в спектрофотометрическом определении показателя антиоксидантной активности по данным перекисной резистентности эритроцитов, отличающийся тем, что полученную спектрофотометрическим методом по модифицированной методике Покровского А.А. и Абрарова А.А. величину перекисной резистентности эритроцитов относят к количеству вещества вводимого животным природного соединения и определяют индекс антиоксидантной активности по формуле:
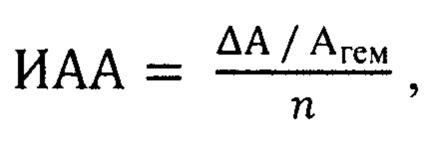
где ИАА - индекс антиоксидантной активности, у.е., ΔА - понижение оптической плотности образца крови: ΔА=Агем - Аоп; Агем - оптическая плотность пробы гемолизованной крови, Аоп - оптическая плотность опытной пробы, n - количество вещества вводимого природного соединения, ммоль.
| СПОСОБ ОПРЕДЕЛЕНИЯ ПЕРЕКИСНОЙ РЕЗИСТЕНТНОСТИ ЭРИТРОЦИТОВ | 1997 |
|
RU2134420C1 |
| СПЕКТРОФОТОМЕТРИЧЕСКИЙ СПОСОБ ОПРЕДЕЛЕНИЯ АНТИРАДИКАЛЬНОЙ АКТИВНОСТИ НИЗКОМОЛЕКУЛЯРНЫХ АНТИОКСИДАНТОВ В ЭКСТРАКТАХ ПИЩЕВЫХ И ЛЕКАРСТВЕННЫХ РАСТЕНИЙ | 2009 |
|
RU2423691C1 |
| УРБАНОВА Е.З | |||
| и др | |||
| МЕМБРАНОСТАБИЛИЗИРУЮЩИЙ ЭФФЕКТ ЭКСТРАКТА PHLOJODICARPUS SIBIRICUS / Сибирский медицинский журнал, 2013, N 8, стр | |||
| Счетная таблица | 1919 |
|
SU104A1 |
| МАМОНТОВА Е.В | |||
| и др | |||
| Перекисная резистентность эритроцитов при действии стресса и введении витамина е животным на разных этапах постнатального | |||
Авторы
Даты
2023-08-17—Публикация
2022-10-31—Подача