Изобретение относится к медицине, фармации, химии и смежным областям, а именно, к способу определения фармацевтических примесей. Заявленный способ может быть использован для контроля качества различных лекарственных форм будесонида, а также для идентификации и количественного определения его эпимерного состава.
Уровень техники
Будесонид или (11β,16α)-16,17-(бутилиденбис(окси))-11,21-дигидроксипрегна-1,4-диен-3,20-дион является синтетическим соединением семейства глюкокортикостероидов, оказывающим противовоспалительное, противоаллергическое и иммунодепрессивное действие [1-3]. Будесонид входит в перечень основных лекарственных средств, рекомендованных Всемирной организацией здравоохранения, а также в Перечень жизненно необходимых и важнейших лекарственных препаратов Российской Федерации. Его активно применяют при лечении бронхиальной астмы, хронической обструктивной болезни легких, язвенного колита, заболеваниях носоглотки и уха.
Будесонид представляет собой рацематную смесь двух эпимеров (22R и 22S). Соотношение эпимеров в смеси определяется методом синтеза [4]. По фармакологическим свойствам эпимер 22R обладает более высокой глюкокортикоидной активностью, имеет больший объем распределения, клиренс и скорость биотрансформации в печени у человека, чем эпимер 22S [5-7], поэтому содержание 22S в лекарственных формах будесонида нормируется при контроле их качества [8-10].
Известны способы идентификации и количественной оценки содержания эпимеров будесонида в субстанции и лекарственных формах с использованием капиллярной газовой хроматографии [4] и высоко эффективной жидкостной хроматографии (далее - ВЭЖХ) [8-10]. Эти способы основаны на сравнении времен удерживания и площадей пиков на хроматограмме испытуемого образца будесонида со временами удерживания и площадями пиков на хроматограмме смеси стандартных образцов эпимеров 22R и 22S. Недостатком указанных способов является необходимость использования стандартного образца для построения градуировочной функции между измеряемой площадью пика на хроматограмме и содержанием 22R и 22S эпимеров в лекарственной форме будесонида (относительность измерения), а также зависимость неопределенности результата измерения содержания эпимеров в рацематной смеси не только от неопределенности измерения площади пика на хроматограмме, но и от неопределенности взятия навесок испытуемого и стандартного образцов, объемов растворителя (косвенность измерения).
Наиболее близким прототипом к заявленному техническому решению является известный способ определения структуры будесонида методом спектроскопии ядерного магнитного резонанса на протонах (далее - 1Н ЯМР) в дейтрированном хлороформе (CDCl3) [11]. Недостатком данного способа является то, что отсутствует структурное соотнесение сигналов в 1Н ЯМР спектре конкретным сигналам функциональных групп эпимеров 22R и 22S будесонида, также отсутствует описание сигналов в 13С ЯМР спектре и их соотнесение к конкретным эпимерам 22R и 22S будесонида, к тому же не представлены способы количественного определения эпимеров 22R и 22S будесонида как в рацематной смеси, так и в различных лекарственных формах.
Существует явная потребность в разработке селективного способа идентификации и количественного определения содержания эпимеров будесонида 22R и 22S в различных лекарственных формах.
Описание сущности изобретения
Задачей изобретения является разработка способа идентификации и количественного определения содержания доли эпимеров 22R и 22S в различных лекарственных формах будесонида путем применения спектроскопии ядерного магнитного резонанса (далее - ЯМР спектроскопия).
Будесонид или (11β,16α)-16,17-(бутилиденбис(окси))-11,21-дигидроксипрегна-1,4-диен-3,20-дион является синтетическим соединением семейства глюкокортикостероидов, оказывающим противовоспалительное, противоаллергическое и иммунодепрессивное действие [1-3].
Будесонид представляет собой рацематную смесь двух эпимеров (22R и 22S). Соотношение эпимеров в смеси определяется методом синтеза [4]. По фармакологическим свойствам эпимер 22R обладает более высокой глюкокортикоидной активностью, имеет больший объем распределения, клиренс и скорость биотрансформации в печени у человека, чем эпимер 22S [5-7], поэтому его содержание в лекарственных формах будесонида нормируется при контроле их качества [8-10].
Лекарственные формы будесонида представляют собой субстанции, порошки, растворы, капсулы, таблетки, назальные спреи.
Специалисту из уровня техники известны растворы будесонида для распыления, однако они сложны в изготовлении, так как будесонид нерастворим в воде.
Поставленная задача решается путем применения метода ЯМР-спектроскопии на различных ядрах - 1Н и 13С в дейтерированном хлороформе или в дейтерированном диметилсульфоксиде, что позволяет идентифицировать и количественно (по весу) определить эпимерный состав будесонида без использования стандартных образцов.
Техническим результатом предлагаемого технического решения, является расширение технических средств, характеризующихся селективным определением эпимерного состава будесонида в его лекарственных формах и сокращением общих трудозатрат на стадиях пробоподготовки и анализа.
Достижение технического результата, в заявленном техническом решении, достигается за счет:
1) идентификации без использования стандартных образцов каждого из двух эпимеров и количественного определения доли каждого эпимера будесонида в рацематной смеси в лекарственных формах: субстанции, порошки, капсулы, таблетки, спреи, растворы с применением 1Н или 13С ЯМР - спектроскопии;
2) условий проведения заявленного способа, где ликвидирована неопределенность измерения связанная со взятием объемов растворителей, точных навесок испытуемого образца и фармакопейных стандартных образцов эпимеров будесонида и с неопределенностью аттестованного значения содержания основного компонента стандартного образца.
Сущность предложенного способа заключается в эффективном выявлении характеристических сигналов в спектрах 1Н и 13С ЯМР эпимера 22R будесонида имеющего структурную формулу
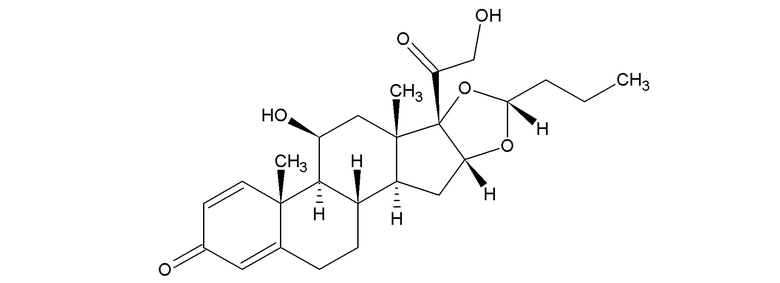
и эпимера 22S будесонида, имеющего структурную формулу
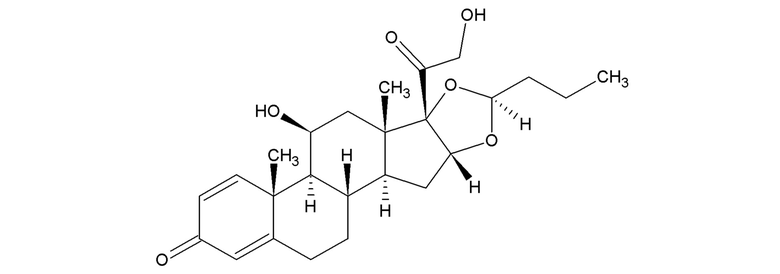
с последующим измерением значений их интегральных интенсивностей для субстанции и лекарственных форм будесонида, представляющих собой назальный спрей (раствор) или твердые пероральные формы (субстанции, порошки, капсулы, таблетки).
Несмотря на родственность структур эпимеров будесонида 22R и 22S, перекрывание сигналов на спектрах 1Н и 13С в области 1,3-диоксоланового фрагмента (фиг. 1, фиг. 2, фиг. 3, фиг. 4) не наблюдается. Характеристическими сигналами для идентификации эпимеров будесонида являются:
а) Эпимер 22R
- растворитель дейтерированный диметилсульфоксид (далее - ДМСО-d6):
1) 1Н, δ, м.д.: 4,13 д (C21-H), 4,39 д (C21-H), 4,52 т (C22-H);
2) 13C, δ, м.д.: 66,00 (C21), 80,83 (C16), 97,17 (C17); 103,42 (C22);
- растворитель дейтерированный хлороформ (далее - CDCl3):
1) 1Н, δ, м.д.: 4,24 д (C21-H), 4,54 т (C22-Н), 4,89 д (C16-H);
2) 13C, δ, м.д.: 46,09 (C13), 49,90 (C14), 82,26 (C16), 97,31 (C17), 104,80 (C22).
б) Эпимер 22S
- растворитель ДМСО-d6:
1) 1Н, δ, м.д.: 4,06 д (C21-H), 4,45 д (C21-H), 5,05 д (C16-H), 5,17 т (C22-H);
2) 13C, δ, м.д.: 65,60 (C21), 81,90 (C16), 97,92 (C17); 107,04 (C22);
- растворитель CDCl3::
1) 1Н, δ, м.д.: 4,19 д (C21-H), 4,61 д (C21-Н);
2) 13C, δ, м.д.: 47,51 (C13), 52,92 (C14), 83,52 (C16), 97,99 (C17), 108,54 (C22).
Регистрацию спектров 1Н и 13C осуществляют при температуре около 300 К (27°C) на ЯМР-спектрометре с рабочей частотой по протонам не менее 400 МГц. Калибровку шкалы химических сдвигов проводят под сигналы остаточного недейтерированного растворителя: для ДМСО δ=2,50 м.д. (1Н) и 39,52 (13С) и для CHCl3 δ=7,26 м.д. (1Н) и 77,16 (13С) [12]. Эпимеры будесонида 22R и 22S как в субстанции, так и лекарственных формах будесонида идентифицируют, наблюдая в спектрах 1Н и 13C ЯМР сигналы, соответствующие характеристическим. Весовую долю (Xi, масс, %) каждого эпимера определяют путем интегрирования соответствующих характеристических сигналов с соблюдением правил прецизионного интегрирования: отдельно настраивают фазу каждого интегрируемого сигнала, диапазон интегрирования приравнивают к 64-кратной ширине интегрируемого сигнала на его полувысоте [13] и рассчитывают по формуле (1):
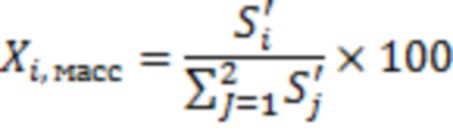 (1)
(1)
где
j = 1, 2;
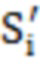 - нормированное значение интегральной интенсивности характеристического сигнала i-го эпимера;
- нормированное значение интегральной интенсивности характеристического сигнала i-го эпимера;
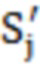 - нормированное значение интегральной интенсивности характеристического сигнала j-го эпимера.
- нормированное значение интегральной интенсивности характеристического сигнала j-го эпимера.
Из фармакопейных документов специалисту из данной области техники известно, что весовая доля для эпимера будесонида 22S находится в пределах от 40% мас./мас. до 51% мас./мас. [8]. Весовая доля содержания эпимера будесонида 22R определяется расчетным путем от фактически полученной весовой доли эпимера будесонида 22S с применением формулы (1) и соответствует диапазону от 49% мас./мас. до 60% мас./мас.
Краткое описание чертежей и иных материалов (Приложения 1 - 14):
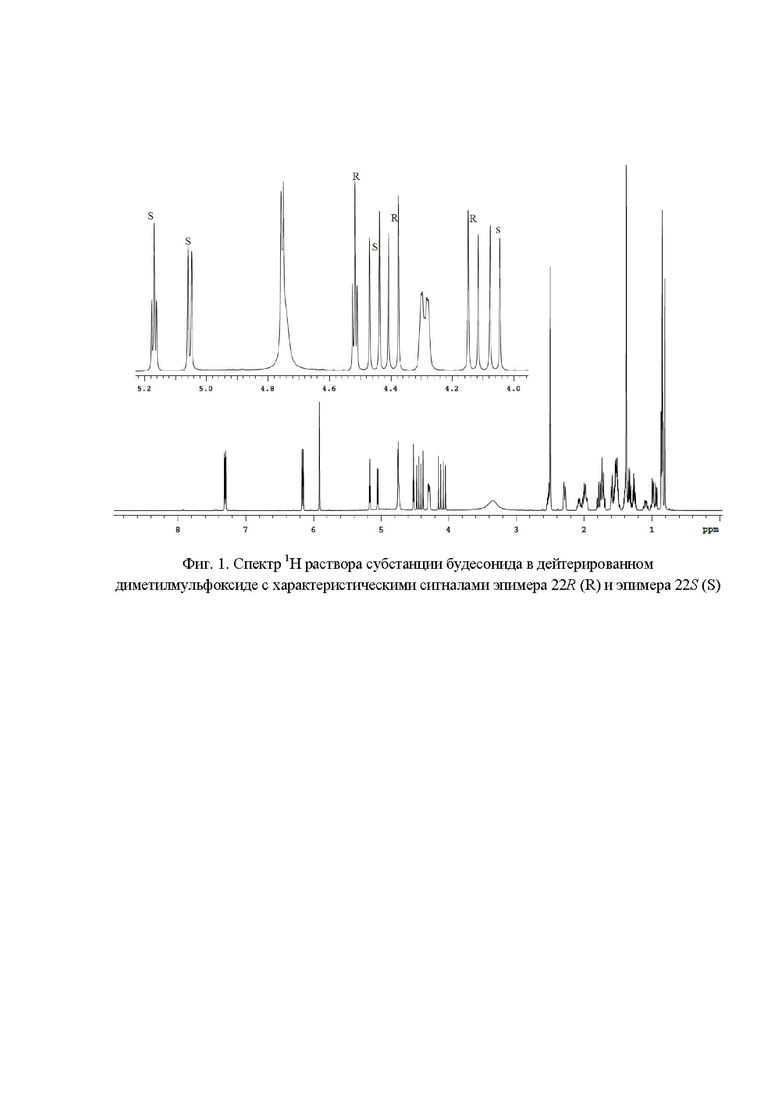
Фиг. 1. Спектр 1Н раствора субстанции будесонида в дейтерированном диметилмульфоксиде c характеристическими сигналами эпимера 22R (R) и эпимера 22S (S);
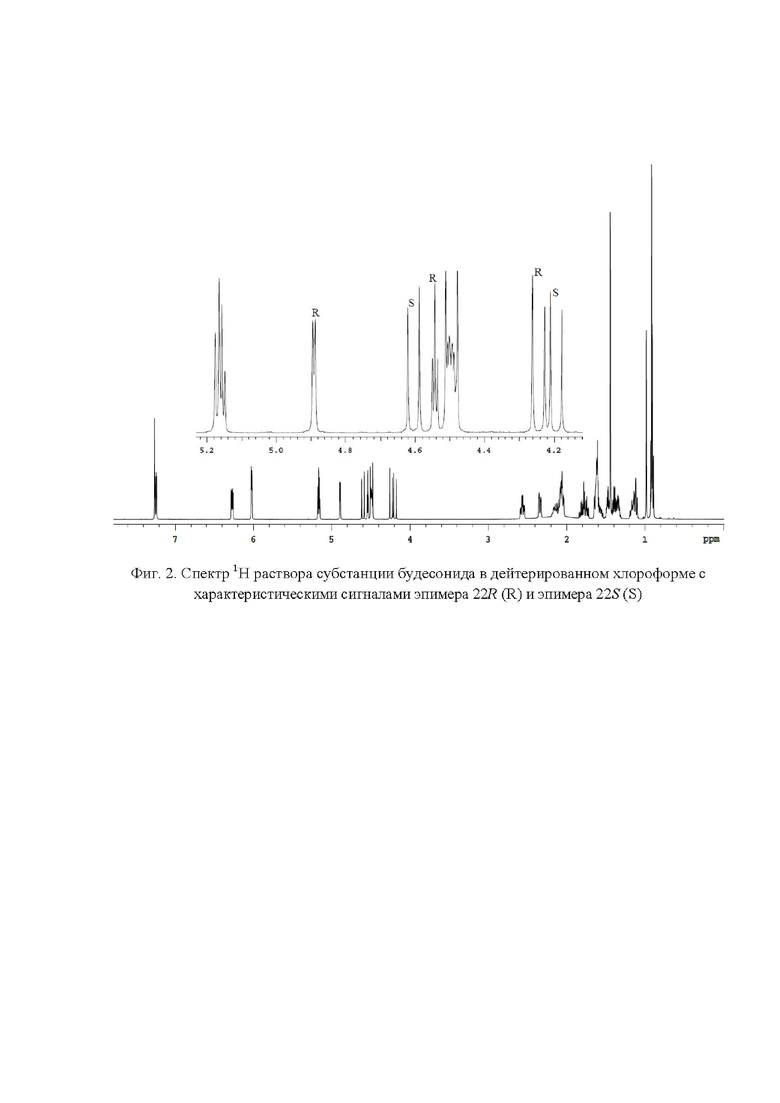
Фиг. 2. Спектр 1Н раствора субстанции будесонида в дейтерированном хлороформе c характеристическими сигналами эпимера 22R (R) и эпимера 22S (S);
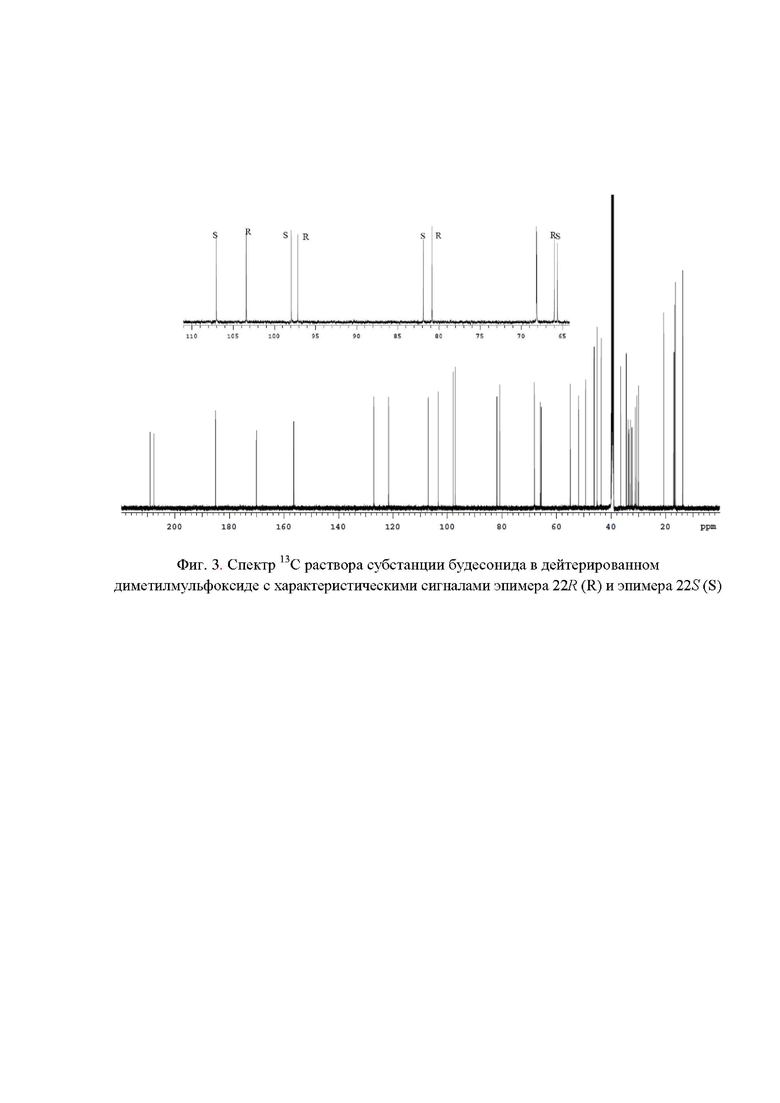
Фиг. 3. Спектр 13C раствора субстанции будесонида в дейтерированном диметилмульфоксиде c характеристическими сигналами эпимера 22R (R) и эпимера 22S (S);
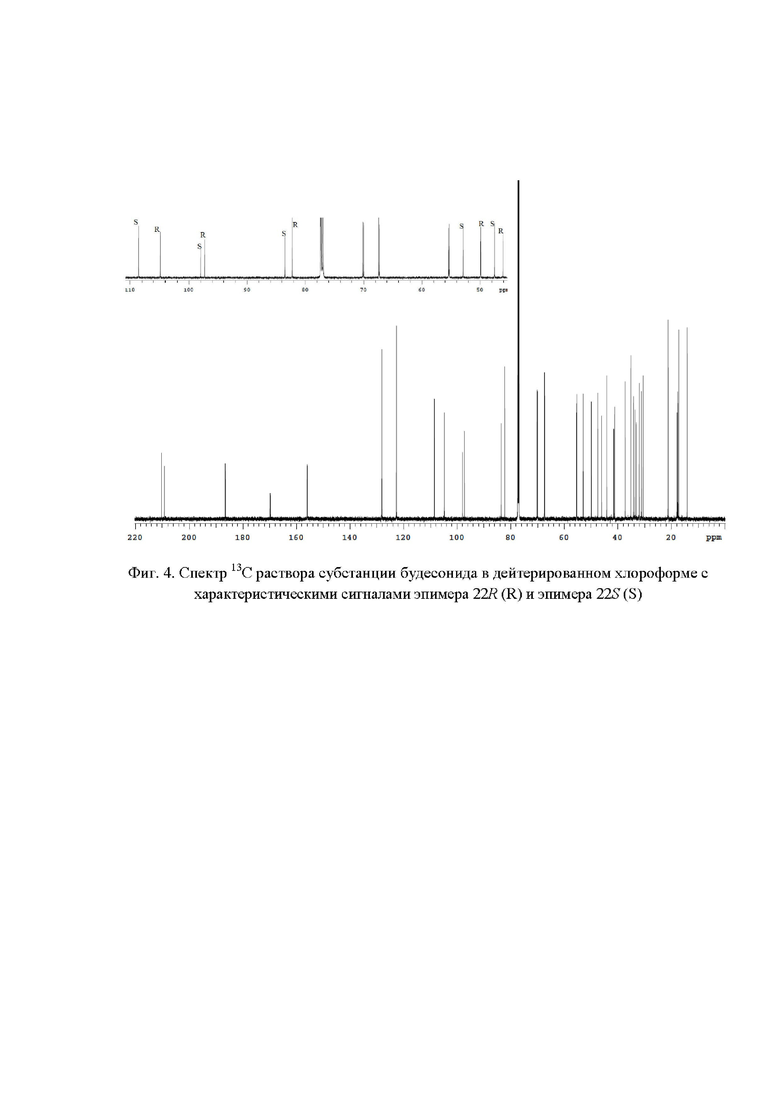
Фиг. 4. Спектр 13C раствора субстанции будесонида в дейтерированном хлороформе c характеристическими сигналами эпимера 22R (R) и эпимера 22S (S);
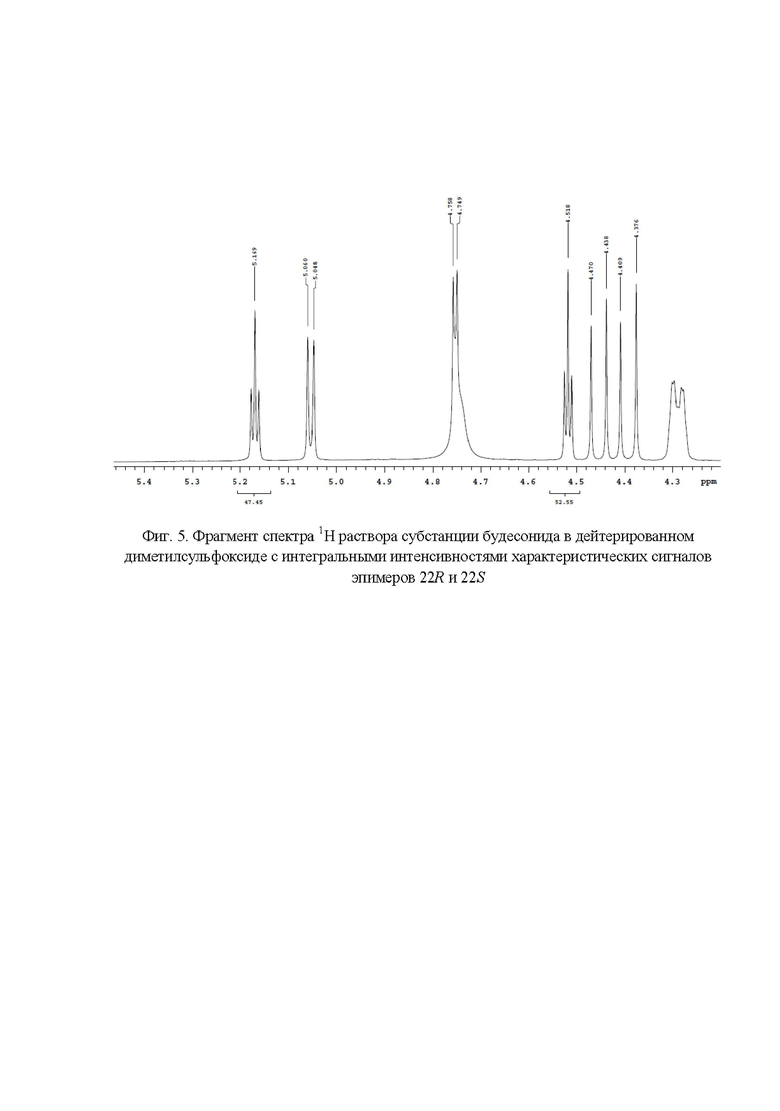
Фиг. 5. Фрагмент спектра 1Н раствора субстанции будесонида в дейтерированном диметилсульфоксиде с интегральными интенсивностями характеристических сигналов эпимеров 22R и 22S;
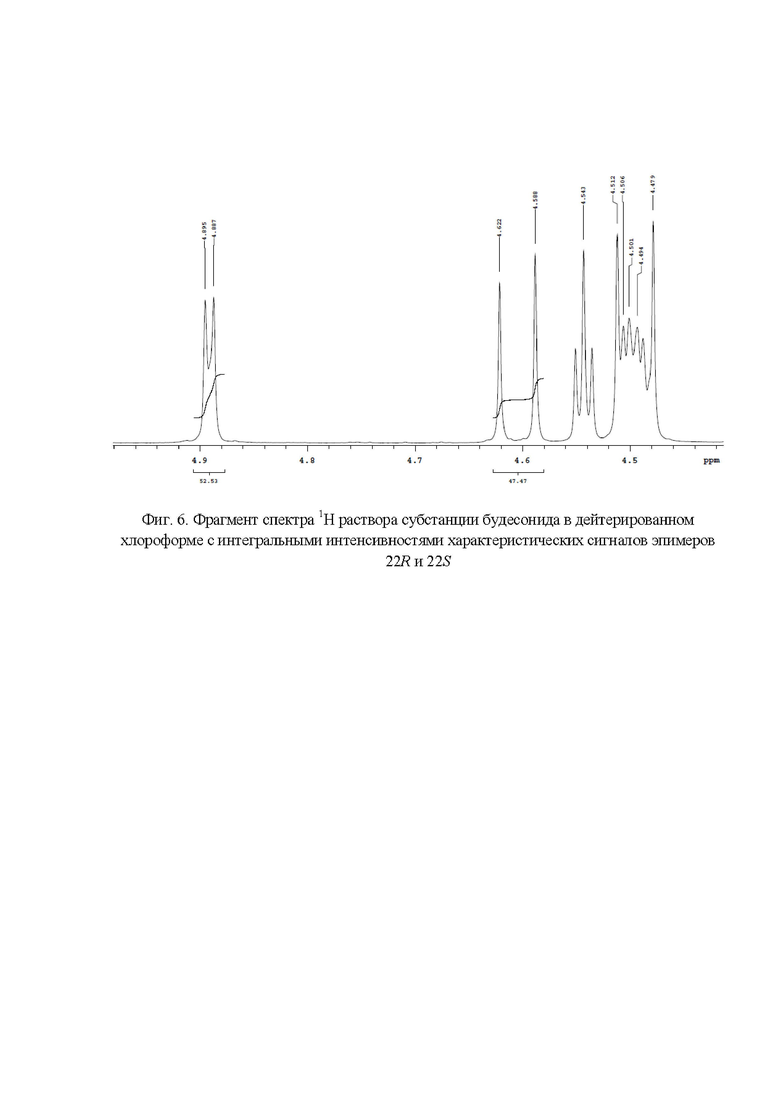
Фиг. 6. Фрагмент спектра 1Н раствора субстанции будесонида в дейтерированном хлороформе с интегральными интенсивностями характеристических сигналов эпимеров 22R и 22S
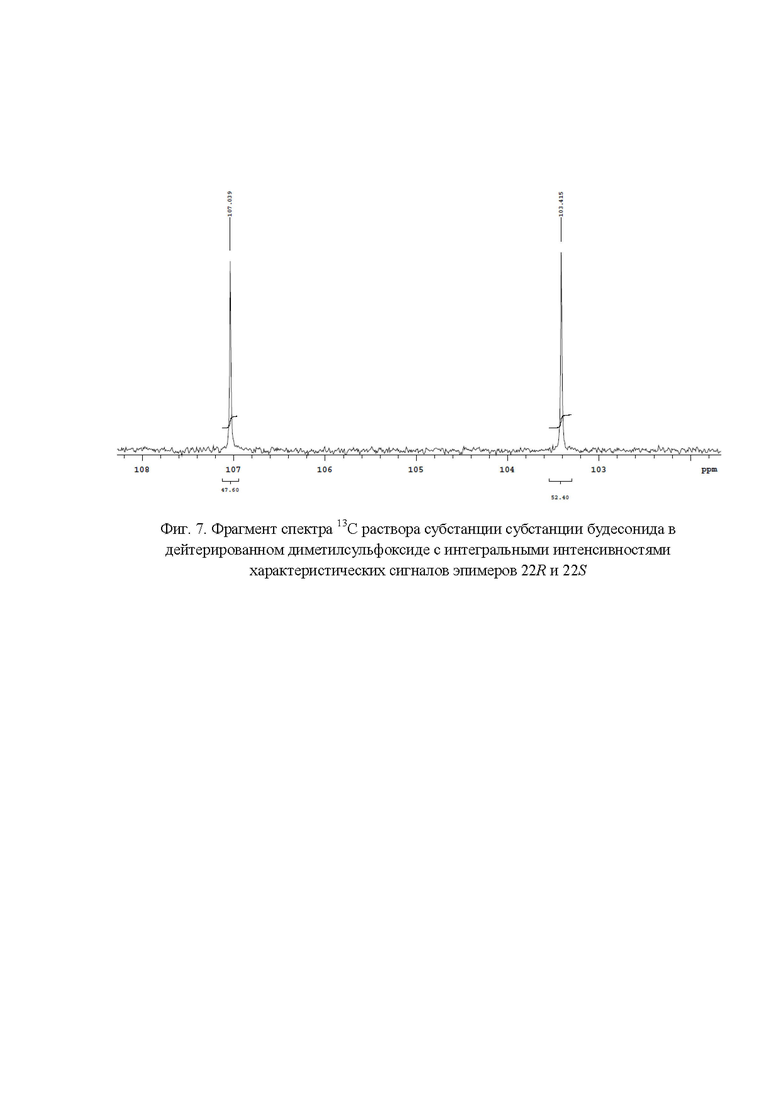
Фиг. 7. Фрагмент спектра 13С раствора субстанции будесонида в дейтерированном диметилсульфоксиде с интегральными интенсивностями характеристических сигналов эпимеров 22R и 22S;
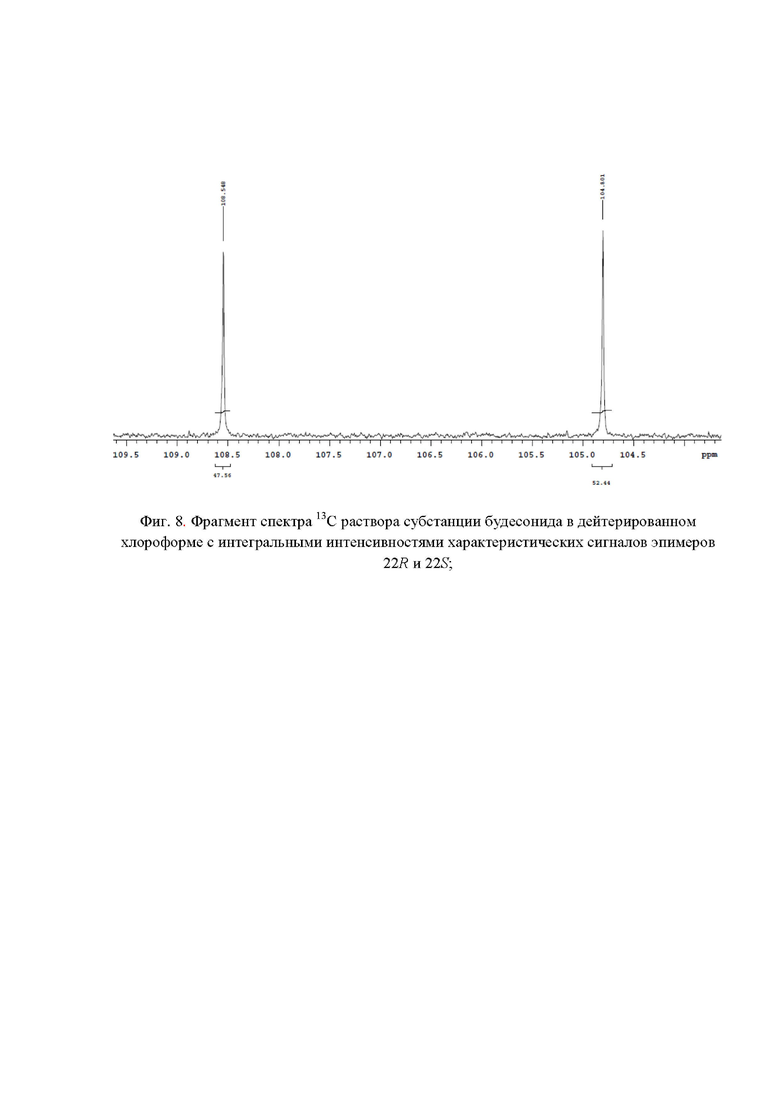
Фиг. 8. Фрагмент спектра 13С раствора субстанции будесонида в дейтерированном хлороформе с интегральными интенсивностями характеристических сигналов эпимеров 22R и 22S;
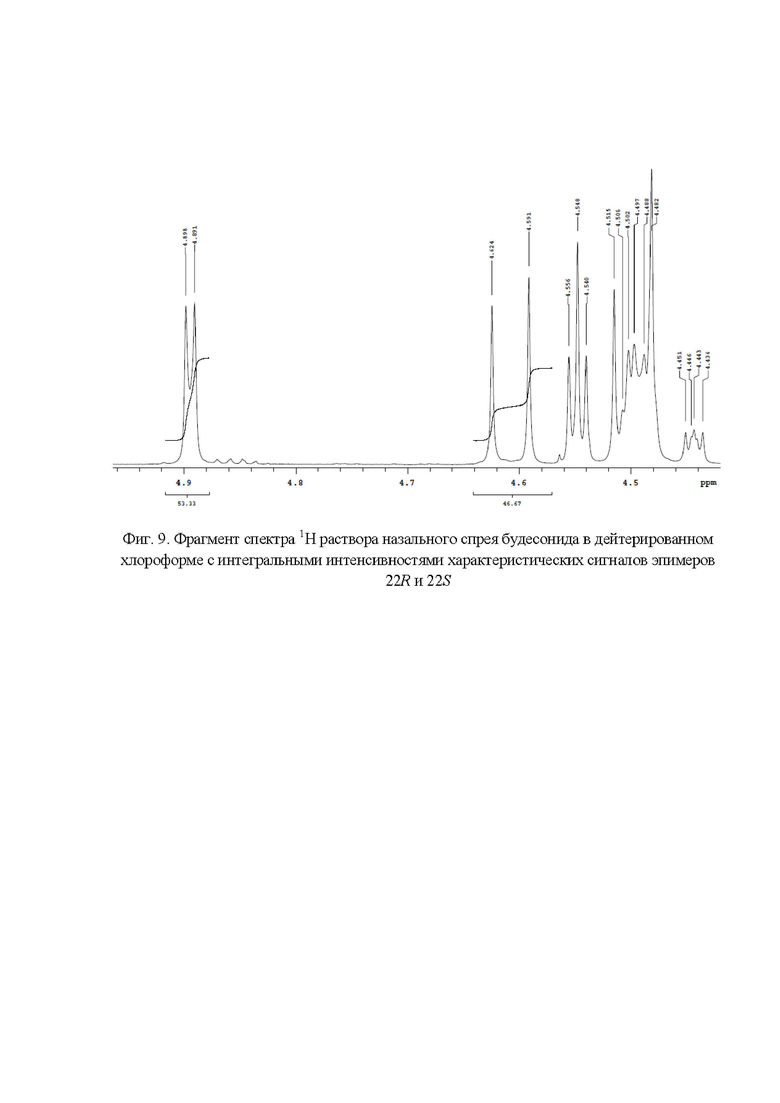
Фиг. 9. Фрагмент спектра 1Н раствора назального спрея будесонида в дейтерированном хлороформе с интегральными интенсивностями характеристических сигналов эпимеров 22R и 22S;
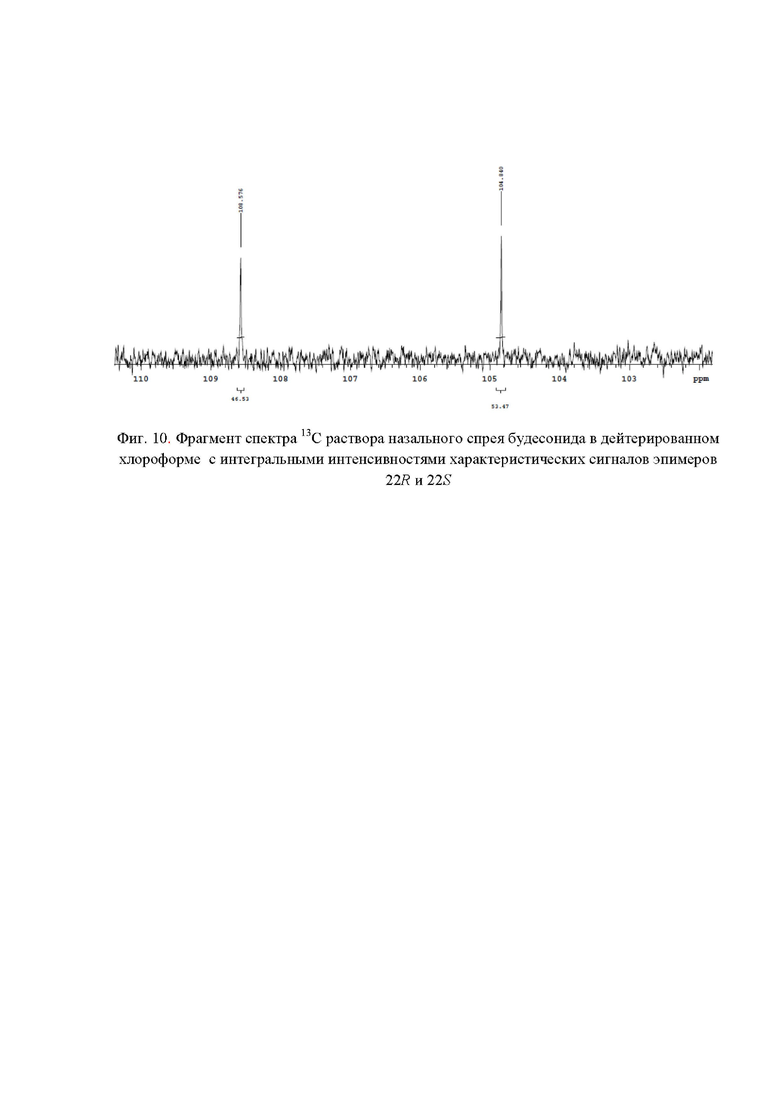
Фиг. 10. Фрагмент спектра 13С раствора назального спрея будесонида в дейтерированном хлороформе с интегральными интенсивностями характеристических сигналов эпимеров 22R и 22S;
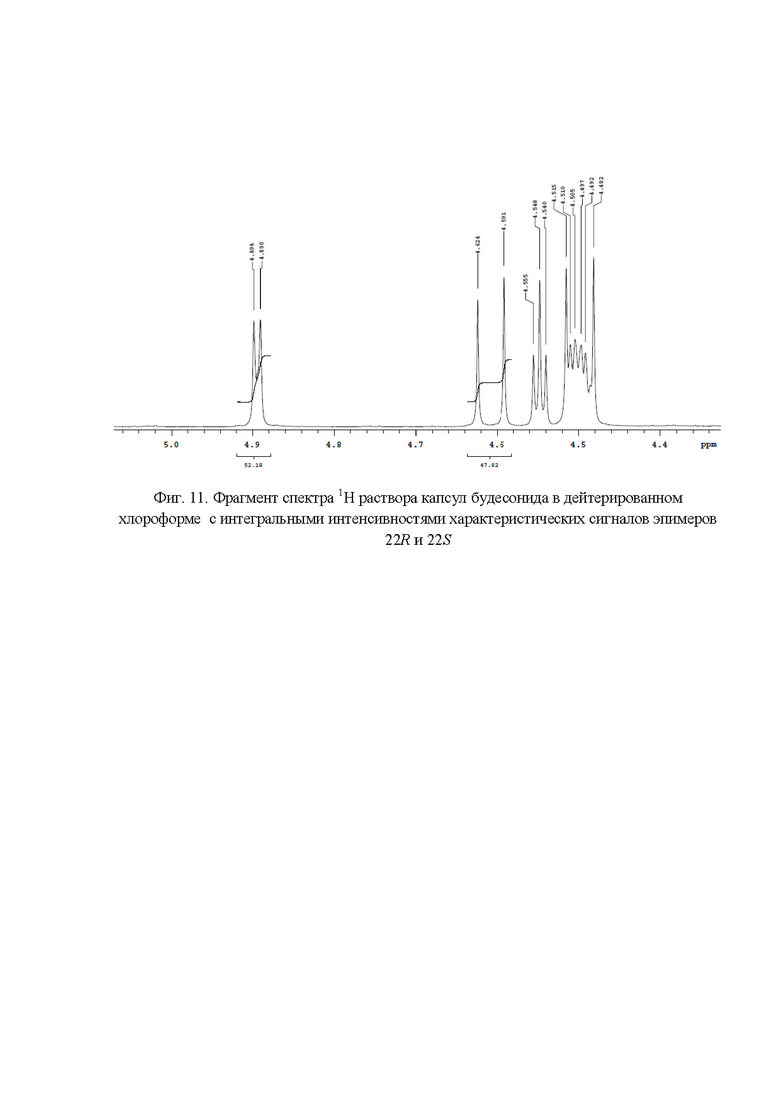
Фиг. 11. Фрагмент спектра 1Н раствора капсул будесонида в дейтерированном хлороформе с интегральными интенсивностями характеристических сигналов эпимеров 22R и 22S;
Фиг. 12. Фрагмент спектра 13С раствора капсул будесонида в дейтерированном хлороформе с интегральными интенсивностями характеристических сигналов эпимеров 22R и 22S;
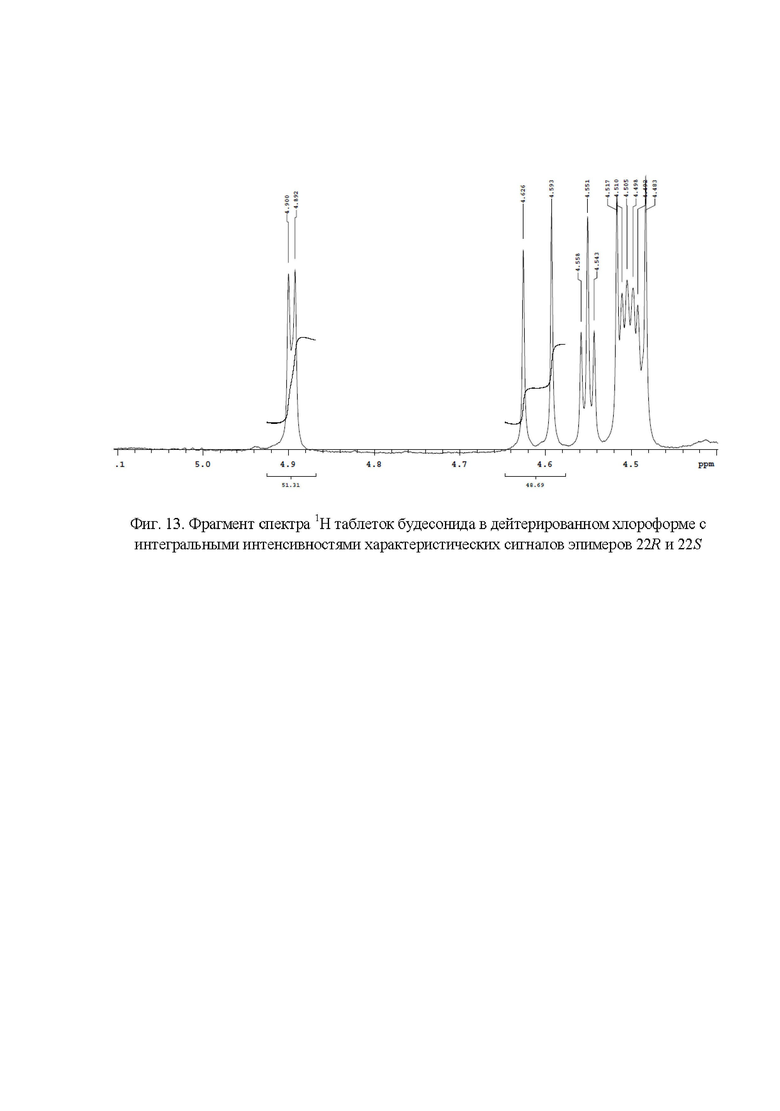
Фиг. 13. Фрагмент спектра 1Н таблеток будесонида в дейтерированном хлороформе с интегральными интенсивностями характеристических сигналов эпимеров 22R и 22S;
Фиг. 14. Фрагмент спектра 13С таблеток будесонида в дейтерированном хлороформе с интегральными интенсивностями характеристических сигналов эпимеров 22R и 22S.
Возможность осуществления заявляемого изобретения раскрыта в следующих примерах.
Пример 1. Идентификация и количественное определение, с применением 1Н ЯМР спектроскопии в ДМСО-d6, содержания эпимеров будесонида 22R и 22S в субстанции, представляющей собой порошок.
Эффективное количество субстанции, около 20 мг, помещают в ЯМР-ампулу, добавляют (берут) 0,5 мл ДМСО-d6, интенсивно перемешивают (встряхивают) до полного растворения навески образца; далее, идентифицируют характеристические сигналы эпимеров 22R и 22S путем регистрации спектра 1Н на ЯМР-спектрометре с рабочей частотой по протонам не менее 400 МГц.
Условия проведения заявленного способа: температура - 27° С, ширина спектра -6009,6 Гц, угол поворота намагниченности - 90° , время релаксации - 10 с, количество накоплений сигнала свободной индукции - 256, число точек аналого-цифрового преобразования - 64к, экспоненциальное умножение - 0,3 Гц, дополнение нулями 64К, автоматическая коррекция базовой линии спектра, калибровка шкалы химических сдвигов под сигнал недейтерированного ДМСО, присутствующего в остаточном количестве в ДМСО-d6, δ=2,50 м.д.
Наличие в спектре 1H ЯМР (фиг.1) сигналов с химическими сдвигами 4,13 м.д., 4,39 м.д., 4,52 м.д. и 4,06 м.д., 4,45 м.д., 5,05 м.д., 5,17 м.д. подтверждает подлинность эпимеров 22R и 22S соответственно. Для расчета весовых долей эпимеров 22R и 22S использовали следующие характеристические сигналы (фиг. 5): эпимер будесонида 22R - 4,52 м.д. (S' = 52,55); эпимер будесонида 22S - 5,17 (S' = 47,45). Весовые доли эпимеров 22R и 22S в субстанции будесонида составили 52,55 % и 47,45 % соответственно.
Пример 2. Идентификация и количественное определение, с применением 1Н ЯМР спектроскопии в CDCl3, содержания эпимеров будесонида 22R и 22S в субстанции, представляющей собой порошок.
Эффективное количество субстанции, около 20 мг, помещают в ЯМР-ампулу, добавляют (берут) 0,5 мл CDCl3, интенсивно перемешивают (встряхивают) до полного растворения навески образца; далее, идентифицируют характеристические сигналы эпимеров будесонида 22R и 22S путем регистрации спектра 1Н на ЯМР-спектрометре с рабочей частотой по протонам не менее 400 МГц.
Условия проведения заявленного способа (пробоподготовка): температура - 27° С, ширина спектра -6009,6 Гц, угол поворота намагниченности - 90° , время релаксации - 10 с, количество накоплений сигнала свободной индукции - 256, число точек аналого-цифрового преобразования - 64к, экспоненциальное умножение - 0,3 Гц, дополнение нулями 64К, автоматическая коррекция базовой линии спектра, калибровка шкалы химических сдвигов под сигнал недейтерированного хлороформа, присутствующего в остаточном количестве в CDCl3, δ=7,26 м.д.
Наличие в спектре 1H ЯМР (фиг.2) сигналов с химическими сдвигами 4,24 м.д., 4,54 м.д., 4,89 м.д. и 4,19 м.д., 4,61 м.д. подтверждает подлинность эпимеров будесонида 22R и 22S соответственно. Для расчета весовых долей эпимеров будесонида 22R и 22S использовали следующие характеристические сигналы (фиг. 6): эпимер будесонида 22R - 4,89 (S' = 52,53); эпимер будесонида 22S - 5,61 (S' = 47,43). Весовые доли эпимеров 22R и 22S в субстанции будесонид составили 52,53% и 47,47 % соответственно.
Пример 3. Идентификация и количественное определение, с применением 13C ЯМР спектроскопии в ДМСО-d6, содержания эпимеров будесонида 22R и 22S в субстанции, представляющей собой порошок.
Эффективное количество субстканции, около 20 мг, помещают в ЯМР-ампулу, добавляют (берут) 0,5 мл ДМСО-d6, интенсивно перемешивают (встряхивают) до полного растворения навески образца; далее, идентифицируют характеристические сигналы эпимеров 22R и 22S путем регистрации спектра 13С на ЯМР-спектрометре с рабочей частотой по протонам не менее 400 МГц.
Условия проведения заявленного способа: температура - 27° С, ширина спектра - 37878,8 Гц, угол поворота намагниченности - 45° , время релаксации - 1 с, количество накоплений сигнала свободной индукции - 10000, число точек аналого-цифрового преобразования - 64к, экспоненциальное умножение - 1,0 Гц, дополнение нулями 64К, автоматическая коррекция базовой линии спектра, калибровка шкалы химических сдвигов под сигнал недейтерированного ДМСО, присутствующего в остаточном количестве в ДМСО-d6 δ=39,52 м.д.
Наличие в спектре 13C ЯМР (фиг. 3) сигналов с химическими сдвигами 66,00 м.д., 80,83 м.д., 97,17 м.д.; 103,42 м.д. и 65,60 м.д., 81,90 м.д., 97,92 м.д.; 107,04 м.д. подтверждает подлинность эпимеров 22R и 22S соответственно. Для расчета весовых долей эпимеров 22R и 22S использовали следующие характеристические сигналы (фиг. 7): эпимер 22R - 103,42 м.д. (S' = 52,40); эпимер 22S - 107,04 м.д. (S' = 47,60). Весовые доли эпимеров 22R и 22S в субстанции будесонид составили 52,40% и 47,60 % соответственно.
Пример 4. Идентификация и количественное определение, с применением 13C ЯМР спектроскопии в CDCl3, содержания эпимеров будесонида 22R и 22S в субстанции, представляющей собой порошок.
Эффективное количество субстанции, около 20 мг, помещают в ЯМР-ампулу, добавляют (берут) 0,5 мл CDCl3, интенсивно перемешивают (встряхивают) до полного растворения навески образца; далее, идентифицируют характеристические сигналы эпимеров 22R и 22S путем регистрации спектра 13С на ЯМР-спектрометре с рабочей частотой по протонам не менее 400 МГц.
Условия проведения заявленного способа: температура - 27° С, ширина спектра - 37878,8 Гц, угол поворота намагниченности - 45° , время релаксации - 1 с, количество накоплений сигнала свободной индукции - 10000, число точек аналого-цифрового преобразования - 64к, экспоненциальное умножение - 1,0 Гц, дополнение нулями 64К, автоматическая коррекция базовой линии спектра, калибровка шкалы химических сдвигов под сигнал недейтерированного хлороформа, присутствующего в остаточном количестве в CDCl3 δ=77,16 м.д.
Наличие в спектре 13С ЯМР (фиг. 4) сигналов с химическими сдвигами 46,09 м.д.; 49,90 м.д., 82,26 м.д., 97,31 м.д., 104,80 м.д. и 47,51 м.д.; 52,92 м.д., 83,52 м.д., 97,99 м.д, 108,54 м.д. подтверждает подлинность эпимеров 22R и 22S соответственно. Для расчета весовых долей эпимеров 22R и 22S использовали следующие характеристические сигналы (фиг. 8): эпимер будесонида 22R - 104,80 м.д. (S' = 52,44); эпимер будесонида 22S - 108,54 м.д. (S' = 47,56). Весовые доли эпимеров 22R и 22S в субстанции будесонида составили 52,44% и 47,56 % соответственно.
Пример 5. Идентификация и количественное определение содержания эпимеров будесонида 22R и 22S в назальном спрее (раствор), с применением 1Н ЯМР спектроскопии.
Содержимое 1 флакона переносят в делительную воронку, добавляют (берут) 2 мл недейтерированного хлороформа и тщательно встряхивают в течение 5 мин, затем отделяют нижний органический слой и высушивают его в токе воздуха. Полученный сухой остаток растворяют в 0,6 мл дейтерированного растворителя (ДМСО-d6 или CDCl3) и переносят его в ЯМР-ампулу. Идентификацию с последующим количественным определением содержания эпимеров будесонида 22R и 22S проводят как в примерах 1 или 2.
Весовые доли эпимеров 22R и 22S в назальном спрее будесонида (фиг. 9) составили 53,33% и 46,67 % соответственно.
Пример 6. Идентификация и количественное определение содержания эпимеров будесонида 22R и 22S в назальном спрее (раствор), с применением 13С ЯМР спектроскопии.
Содержимое 1 флакона переносят в делительную воронку, добавляют (берут) 2 мл недейтерированного хлороформа и тщательно интенсивно перемешивают (встряхивают) в течение 5 мин, затем отделяют нижний органический слой и высушивают ее в токе воздуха. Полученный сухой остаток растворяют в 0,6 мл дейтерированного растворителя (ДМСО-d6 или CDCl3) и переносят его в ЯМР-ампулу. Идентификацию с последующим количественным определением содержания эпимеров будесонида 22R и 22S проводят, как описано в примерах 3 или 4.
Весовые доли эпимеров 22R и 22S в назальном спрее (фиг. 10) составили 53,47% и 46,52 % соответственно.
Пример 7. Идентификация и количественное определение содержания эпимеров будесонида 22R и 22S в капсулах с применением 1Н ЯМР спектроскопии.
Эффективное количество содержимого капсул (около 20 - 30 капсул) тщательно перемешивают с 10 мл недейтерированного хлороформа, фильтруют, затем фильтрат центрифугируют, с применением любого известного специалисту оборудования для центрифугирования, с использованием известных, эффективных для центрифугирования параметров (время и частота вращения), позволяющих получить прозрачную надосадочную жидкость. Надсадочную жидкость отделяют и высушивают в токе воздуха. Полученный сухой остаток растворяют в 0,6 мл дейтерированного растворителя (ДМСО-d6 или CDCl3) и переносят его в ЯМР-ампулу. Идентификацию с последующим количественным определением содержания эпимеров будесонида 22R и 22S проводят, как описано в примерах 1 или 2.
Весовые доли эпимеров будесонида 22R и 22S в капсулах (фиг. 11) составили 52,18% и 47,82% соответственно.
Пример 8. Идентификация и количественное определение содержания эпимеров будесонида 22R и 22S в капсулах, с применением 13C ЯМР спектроскопии.
Эффективное количество содержимого капсул (около 20 - 30 капсул) тщательно интенсивно перемешивают с 10 мл недейтерированного хлороформа, фильтруют, затем фильтрат центрифугируют (см. пример 7) отделяют надосадочную жидкость и высушивают ее в токе воздуха. Полученный сухой остаток растворяют в 0,6 мл дейтерированного растворителя (ДМСО-d6 или CDCl3) и переносят его в ЯМР-ампулу. Идентификацию с последующим количественным определением содержания эпимеров будесонида 22R и 22S проводят, как описано в примерах 3 или 4.
Весовые доли эпимеров будесонида 22R и 22S в капсулах (фиг. 12) составили 52,33% и 47,67 % соответственно.
Пример 9. Идентификация и количественное определение содержания эпимеров будесонида 22R и 22S в таблетках с применением 1Н ЯМР спектроскопией.
Эффективное количество перетертых таблеток (около 1 - 2 таблетки) тщательно интенсивно перемешивают (встряхивают) с 10 мл недейтерированного хлороформа, фильтруют, затем фильтрат центрифугируют (см. пример 7), отделяют надосадочную жидкость и высушивают ее в токе воздуха. Полученный сухой остаток растворяют в 0,6 мл дейтерированного растворителя (ДМСО-d6 или CDCl3) и переносят его в ЯМР-ампулу. Идентификацию с последующим количественным определением содержания эпимеров будесонида 22R и 22S проводят, как описано в примерах 1 или 2.
Весовые доли эпимеров 22R и 22S в таблетках будесонида (фиг. 13) составили 51,31 % и 48,69 % соответственно.
Пример 10. Идентификация и количественное определение содержания эпимеров будесонида 22R и 22S в таблетках с применением 13С ЯМР спектроскопии.
Эффективное количество перетертых таблеток будесонида (около 1 - 2 таблетки) тщательно интенсивно перемешивают (встряхивают) с 10 мл недейтерированного хлороформа, фильтруют, затем фильтрат центрифугируют (см. пример 7) отделяют надосадочную жидкость и высушивают ее в токе воздуха. Полученный сухой остаток растворяют в 0,6 мл дейтерированного растворителя (ДМСО-d6 или CDCl3) и переносят его в ЯМР-ампулу. Идентификацию с последующим количественным определением содержания эпимеров будесонида 22R и 22S проводят, как описано в примерах 3 или 4.
Весовые доли эпимеров 22R и 22S в таблетках (фиг. 14) составили 51,19% и 48,81 % соответственно.
Представленные примеры не ограничивают объем притязаний настоящего технического решения и служат только для цели иллюстрации и раскрытия заявленного способа.
Промышленная применимость
Все приведенные примеры, подтверждают селективность заявленного способа.
Таким образом, поставленная техническая задача выполнена, а именно, разработан селективный способ для идентификации и количественного определения эпимерного состава будесонида в различных лекарственных формах.
Заявленный способ, характеризующийся селективным определением эпимерного состава будесонида в его лекарственных формах, сокращением общих трудозатрат на стадиях пробоподготовки и анализа, и может быть рекомендован для применения в фармации, медицине, химии и смежных областях.
Список литературы
1. Vandevyver S, Dejager L, Tuckermann J, Libert C. Endocrinology. 2013; 154(3):993-1007.
2. Varga G, Ehrchen J, Brockhausen A, et al. J Immunol. 2014; 193(3):1090-1099.
3. Maeda K, Yamaguchi M, Nagase H, Yasuno N, Itagaki F, Watanabe M. J Pharm Health Care Sci. 2018; 4(1):24.
4. Krzek, J., Czekaj, J.S. J. Chromatogr. B. 2004; 803: 191-200.
5. Szefler, S. J. J. Allergy Clin. Immunol. 1999; 104(4):S175-183.
6. Cortijo J., Urbieta E., Bort R., Vcastell J., Ruiz-Bravo C., et al. Fundamental and Clinical Pharmacology, 2008; 15(1):47-54.
7. Latli, B., Krishnamurthy, D., and Senanayak, C. J. Label Compd. Radiopharm, 2008; 51: 64-67.
8. USP43-NF38. Budesonide 604.
9. USP43-NF38. Budesonide Nasal Spray 2S
10. Eph 10.5 Budesonide 01/2010:1075.
11. Yan, Y., Wang, P., Li, R., et al. Drug Design, Development and Therapy, 2019;13: 681-694.
12. N.E. Gottlieb, V. Kotlyar and A. Nudelman. J. Org. Chem. 1997, 62(21), 7512-7515.
13. Malz, F., and Jancke, Н. J. Pharm. Biomed. 2005; 38:813-823.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ определения примеси А в лекарственных формах габапентина | 2021 |
|
RU2773851C1 |
| Способ одновременного определения степеней окисления и алкилирования азоксимера бромида - действующего вещества полиоксидония - методом C спектроскопии ЯМР | 2019 |
|
RU2713805C1 |
| Способ идентификации и количественного определения содержания олигопептидов в фармацевтической субстанции "Пептофорс" методом спектроскопии ЯМР | 2019 |
|
RU2709020C1 |
| АНТИБАКТЕРИАЛЬНЫЕ СРЕДСТВА НА ОСНОВЕ ЧЕТВЕРТИЧНЫХ АММОНИЕВЫХ СОЛЕЙ | 2014 |
|
RU2561281C1 |
| АЗАКРАУНСОДЕРЖАЩИЕ N-АРИЛ-1,8-НАФТАЛИМИДЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2017 |
|
RU2656106C1 |
| Четвертичные аммониевые соли на основе производных витамина В6 | 2015 |
|
RU2607522C1 |
| СПОСОБ ПОЛУЧЕНИЯ ОРЕГАНОЛА А, ОБЛАДАЮЩЕГО НЕФРОТРОПНОЙ И НЕЙРОТРОПНОЙ АКТИВНОСТЬЮ | 2022 |
|
RU2804299C1 |
| 3-ТРИАЗЕНОИНДОЛЫ, ОБЛАДАЮЩИЕ АКТИВНОСТЬЮ ПРОТИВ МИКОБАКТЕРИЙ | 2016 |
|
RU2724334C1 |
| 4-ЗАМЕЩЕННЫЕ N-АРИЛ-1,8-НАФТАЛИМИДЫ, ПРОЯВЛЯЮЩИЕ СВОЙСТВА ФЛУОРЕСЦЕНТНЫХ СЕНСОРОВ НА КАТИОНЫ МЕТАЛЛОВ, И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2012 |
|
RU2515195C1 |
| Сульфопроизводные на основе бета-пинена и способ их получения | 2019 |
|
RU2708617C1 |


Изобретение относится к медицине, фармации и химии. Раскрыт способ определения эпимеров будесонида в субстанциях или лекарственных формах, в котором будесонид, представляющий собой рацемат 22R и 22S, растворяют в дейтерированном диметилсульфоксиде (ДМСО-d6) или дейтерированном растворителе хлороформа (CDCl3), идентифицируют и количественно определяют 1Н или 13С ядерно-магнитной резонансной спектроскопией. Изобретение обеспечивает селективное определение эпимерного состава будесонида и сокращение общих трудозатрат на стадиях пробоподготовки и анализа. 8 з.п. ф-лы, 14 ил., 10 пр.
1. Способ определения эпимеров будесонида в субстанциях или лекарственных формах, отличающийся тем, что будесонид, представляющий собой рацемат 22R и 22S, растворяют в дейтерированном диметилсульфоксиде (ДМСО-d6) или дейтерированном растворителе хлороформа (CDCl3), идентифицируют, количественно определяют 1Н или 13С ядерно-магнитной резонансной спектроскопией, где характеристические сигналы для идентификации эпимера будесонида 22R при использовании ДМСО-d6:
1) 1Н, δ, м.д.: 4,13 д (C21-H), 4,39 д (C21-H), 4,52 т (C22-H),
2) 13C, δ, м.д.: 66,00 (C21), 80,83 (C16), 97,17 (C17); 103,42 (C22);
или при использовании CDCl3:
1) 1Н, δ, м.д.: 4,24 д (C21-H), 4,54 т (C22-Н), 4,89 д (C16-H);
2) 13C, δ, м.д.: 46,09 (C13), 49,90 (C14), 82,26 (C16), 97,31 (C17), 104,80 (C22),
где характеристические сигналы для идентификации эпимера будесонида 22S при использовании ДМСО-d6:
1) 1Н, δ, м.д.: 4,06 д (C21-H), 4,45 д (C21-H), 5,05 д (C16-H), 5,17 т (C22-H);
2) 13C, δ, м.д.: 65,60 (C21), 81,90 (C16), 97,92 (C17); 107,04 (C22);
при использовании CDCl3:
1) 1Н, δ, м.д.: 4,19 д (C21-H), 4,61 д (C21-Н);
2) 13C, δ, м.д.: 47,51 (C13), 52,92 (C14), 83,52 (C16), 97,99 (C17), 108,54 (C22).
2. Способ по п. 1, отличающийся тем, что лекарственные формы представляют собой порошки, или капсулы, или таблетки, или назальные спреи, или растворы.
3. Способ по п. 1 или 2, отличающийся тем, что когда определяют эпимеры будесонида в субстанциях или порошках, то перемешивают до полного их растворения.
4. Способ по п. 2, отличающийся тем, что когда определяют эпимеры будесонида в капсулах или таблетках, то используют хлороформ, получают прозрачную надосадочную жидкость, с последующим ее высушиванием в токе воздуха.
5. Способ по п. 2, отличающийся тем, что когда определяют эпимеры будесонида в назальных спреях или растворах, то используют хлороформ, интенсивно перемешивают в течение 5 минут, отделяют нижний органический слой, с последующим высушиванием в токе воздуха.
6. Способ по п. 4 или 5, отличающийся тем, что хлороформ является недейтерированным.
7. Способ по п. 1, отличающийся тем, что эпимеры будесонида количественно определяют путем измерения значений их интегральных интенсивностей.
8. Способ по п. 1, или 2, или 3, или 4, или 5, или 7, отличающийся тем, что определяют эпимеры будесонида без стандартного образца.
9. Способ по п. 1, или 2, или 3, или 4, или 5, или 7, отличающийся тем, что спектры 1Н или 13С регистрируют на ЯМР спектрометре с частотой по протонам не менее 400 МГц.
| LU Y | |||
| et al | |||
| Машина для добывания торфа и т.п. | 1922 |
|
SU22A1 |
| КОМПОЗИЦИИ НА ОСНОВЕ ЦИКЛОДЕКСТРИНА И ПРОИЗВОДНОГО БУДЕСОНИДА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2015 |
|
RU2722414C2 |
| YAN Y | |||
| et al | |||
| Synthesis of budesonide | |||
Авторы
Даты
2023-08-22—Публикация
2022-02-14—Подача