Изобретение относится к области медицины, а именно к клинической микробиологии, и может быть использовано для выделения грамотрицательных анаэробных бактерий Porphyromonas gingivalis культуральным методом.
В соответствии с разработанными рекомендациями идентификация основных этиологических агентов хронического генерализованного пародонтита - грамотрицательных анаэробных бактерий Porphyromonas gingivalis, обладающих наивысшим патогенным потенциалом для развития деструктивных заболеваний пародонта, проводится бактериологическим методом, являющимся «золотым стандартом» микробиологической диагностики ввиду его высокой чувствительности и специфичности [Грудянов А.И., Григорян А.С., Фролова О. А. Диагностика в пародонтологии. - М.: МИА, 2004. - С.64 - 65]. Тем не менее, эффективность данного метода зависит от качества применяемой питательной среды, в частности - от наличия в ней всех необходимых для жизнедеятельности данного вида пародонтопатогенных микроорагнизмов факторов роста [How, K.Y., Song, К.P., and Chan, K.G. Porphyromonas gingivalis: An Overview of Periodontopathic Pathogen below the Gum Line // Frontiers in microbiology. - 2016. - V. 7, N. 53].
Согласно иностранным литературным источникам, выделение чистой культуры P. gingivalis производят на сердечно-мозговом агаре (BHI-Agar), основу которого составляет сердечно-мозговой бульон (BHI-Broth) [Grenier, D., Michaud, J. Selective growth inhibition of Porphyromonas gingivalis by bestatin // FEMS Microbiology Letters. - 1994. - V. 123, N. 1-2. -P. 193-199; Amano, A., Sojar, H.T., Lee, J.Y, et al. Salivary receptors for recombinant fimbrillin of Porphyromonas gingivalis II Infection and immunity. - 1994. - V. 62, N. 8. - P. 3372-3380], или кровяном агаре на основе BHI-Broth с добавлением 5% дефибринированной лошадиной крови [Rangarajan, М., Aduse-Opoku, J., Paramonov, N., et al. Identification of a second lipopolysaccharide in Porphyromonas gingivalis W50 // Journal of bacteriology. - 2008. - V. 190, N. 8. - P. 2920-2932; How, K.Y., Song, K.P., and Chan, K.G. Porphyromonas gingivalis: An Overview of Periodontopathic Pathogen below the Gum Line // Frontiers in microbiology. - 2016. - V. 7, N. 53; Sanchez, M.C., Romero-Lastra, P., Ribeiro-Vidal, H., et al. Comparative gene expression analysis of planktonic Porphyromonas gingivalis ATCC 33277 in the presence of a growing biofilm versus planktonic cells // BMC Microbiol. - 2019. - V. 19, N.58]. Другими важными компонентами используемых питательных сред являются глюкоза, хлорид натрия, гидрофосфат натрия или гидрофосфат калия, триптоза, протеозопептон. Ввиду того, что представители рода Porphyromonas в качестве источника трехвалентного железа (Fe) используют гем гемоглобина крови, в питательные среды для культивирования P. gingivalis вносится гемин, представляющий собой протопорфирин IX, содержащий ион трехвалентного железа (Fe), а также витамин К (филлохинон), участвующий в свертывании крови. Вносимые в используемые питательные среды гемин и витамин К выступают селективными добавками для P. gingivalis.
Наиболее близким аналогом изобретения является питательная среда АТСС 2722 для выделения P. gingivalis, разработанная некоммерческой организацией American Type Culture Collection, содержащая на литр питательной среды: триптический соевый бульон (TSB) в количестве 30 г, 5 г дрожжевого экстракта, 0,5 г L-цистеин гидрохлорида, 1 мл гемина и 1 мл витамина К1 (филлохинон) или витамина К3 (менадиона) [Grenier, D., Michaud, J. Selective growth inhibition of Porphyromonas gingivalis by bestatin // FEMS Microbiology Letters. - 1994. - V. 123, N. 1-2. - P. 193-199]. Недостатком прототипа является его недоступность для российского рынка микробиологических питательных сред, а также скудность среды по аминокислотному составу и минеральным компонентам.
Задачей изобретения является расширение арсенала питательных сред для выделения чистой культуры P. gingivalis.
Технический результат при использовании изобретения - повышение чувствительности питательной среды, сокращение срока выделения чистой культуры P. gingivalis.
Предлагаемая питательная среда для выделения чистой культуры Р. gingivalis содержит на 1 л питательной среды: панкреатический гидролизат рыбной муки (ПГРМ) - 7,5 г, мясной пептон - 7,5 г, панкреатический гидролизат казеина (ПГК) - 10 г, стимулятор роста гемофильных микроорганизмов - 5 г, дрожжевой экстракт - 3 г, D-глюкозу - 2 г, хлористый натрий - 3,5 г, пиросернистокислый натрий - 0,1 г, хлорид тиамина - 5*10-3 г, эритрит - 1*10-2 г, сульфат полимиксина В - 5*10-3 г, амфотерицин В - 1*10-2 ги микробиологический агар - 10 г, а также в качестве селективных добавок для роста P. gingivalis витамин К2 (менахинон) - 0,0012 г и черный альбумин - 60 мл, деионизированная вода -остальное.
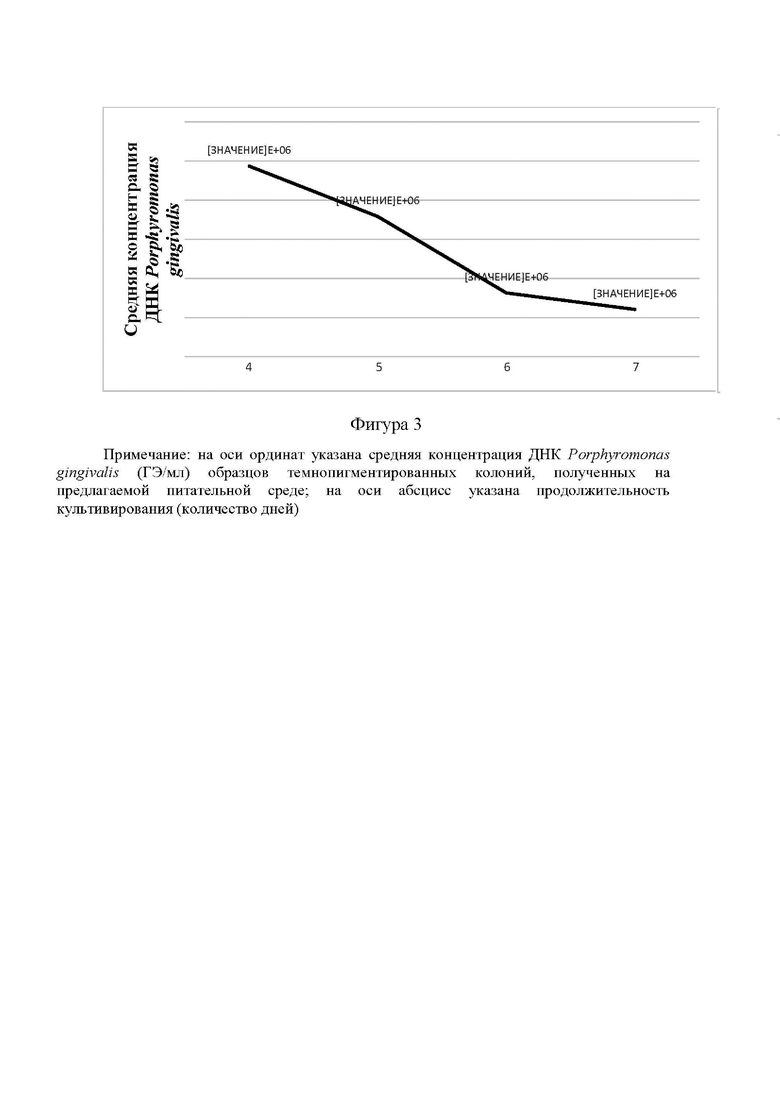
Изобретение иллюстрируется следующими фигурами: на фиг.1 представлены темнопигментированные колонии на предлагаемой среде на четвертые сутки культивирования; на фиг.2 - график амплификации участков генов 16S рРНК пародонтопатогенного вида Porphyromonas gingivalis образцов темно пигментированных колоний, полученных на предлагаемой питательной среде; на фиг.3 - динамика накопления культуры Porphyromonas gingivalis на поверхности предлагаемой питательной среды.
Согласно методическим рекомендациям, для получения чистой культуры P. gingivalis высев нативного материала (содержимое пародонтальных карманов пациентов) производится немедленно после доставки материала в лабораторию (термоконтейнер с хладагентом, +4°С в течение 2 часов непосредственно после забора клинического материала) и осуществляется бактериологической петлей непосредственно из транспортных сред или физиологического раствора методом истончающего штриха с последующим пересевом выросших смешанных культур. Данная техника рассева биологического материала позволяет получать его десятикратное разведение в каждом новом секторе. Ввиду того, что P. gingivalis является облигатным анаэробом, инкубация произведенных посевов осуществляется в анаэробной атмосфере состава 85% N2, 10% Н2 и 5% CO2 при +37°С в течение 5 суток. Видовую идентификацию выделенных чистых культур проводят масс-спектрометрическим методом.
В нашем эксперименте в качестве транспортной среды использовалась питательная среда ЮНОНА® с нейтрализаторами антибиотиков для культивирования анаэробов во флаконах (25 мл, SCENKER). Забор клинического материала производился непосредственно во флаконы, которые затем выдерживались в термостате в течение суток при +37°С. Бактериологический посев отобранного биоматериала производился методом истончающего штриха на поверхность семи различных плотных питательных сред, подобранных с учетом культуральных особенностей P. gingivalis, следующего состава:
1) Агар с сердечно-мозговой вытяжкой (BHI-Agar, HiMedia): 37 г сухого вещества сердечно-мозгового бульона (BHI-Broth, HiMedia) с добавлением 15 г агара, 5 г дрожжевого экстракта, 60 мл черного альбумина и 1,2 мг менахинона (витамин К2) из расчета на литр питательной среды;
2) Готовый питательный ГРМ-агар для бруцелл (Оболенск, Московская область) с добавлением 60 мл/л черного альбумина и 1,2 мг/л менахинона (витамин К2);
3) Предлагаемая питательная среда, содержащая на 1 литр питательной среды: панкреатический гидролизат рыбной муки 7,5 г, мясной пептон 7,5 г, панкреатический гидролизат казеина 10 г, стимулятор роста гемофильных микроорганизмов 5 г, дрожжевой экстракт 3 г, D-глюкозу 2 г, хлористый натрий 3,5 г, пиросернистокислый натрий 0,1 г, хлорид тиамина 5*10-3 г, эритрит 1*10-2 г, сульфат полимиксина В 5*10-3 г, амфотерицин В 1*10-2 г, микробиологический агар 10 г, черный альбумин 60 мл, менахинон (витамин К2) 0,0012 г и деионизированную воду - остальное;
4) Сборная среда HiMedia бруцеллагар: 37 г сухого вещества агара, 10 г гидролизата казеина, 10 г пептического перевара животной ткани, 5 г дрожжевого экстракта, 1 г глюкозы, 5 г хлорида натрия с добавлением 60 мл черного альбумина и 1,2 мг менахинона (витамин К2) из расчета на литр питательной среды;
5) Эритрит-агар (Махачкала, Республика Дагестан): 37 г сухого вещества эритрит-бульона с добавлением 15 г агара, 60 мл черного альбумина и 1,2 мг менахинона (витамин К2) из расчета на литр питательной среды;
6) Готовый шоколадный агар с добавлением 60 мл/л черного альбумина и 1,2 мг/л менахинона (витамин К2);
7) Кровяной агар: 46,6 г сухого вещества бруцеллагара с добавлением 32 мл крови, 60 мл черного альбумина и 1,2 мг менахинона (витамин К2) из расчета на литр питательной среды.
Таким образом, вносимые в обязательном порядке во все используемые среды селективные добавки гемин и витамин К3 (менадион, синтетический аналог витамина К, лишенный алифатической боковой цепи) были заменены нами в опыте на черный альбумин и природный витамин К2 (менахинон), концентрация которых, необходимая для появления роста культуры исследуемого микроорганизма, была подобрана экспериментально (таблица 1).
В качестве контрольной питательной среды выступал широко используемый в лабораторной практике для выделения чистых культур пародонтопатогенных микроорганизмов кровяной агар, приготовленный на основе бруцеллагара (Оболенск, Московская область) и содержащий модифицирующие селективные добавки черный альбумин и витамин К2 (менахинон) в эффективных концентрациях.
Инкубация произведенных посевов осуществлялась в термостате при +37°С в течение 5-7 суток. Анаэробные условия были созданы при помощи анаэробной системы с применением газогенераторных пакетов двойного действия HiAnaeroGas Pack™ фирмы HIMEDIA.
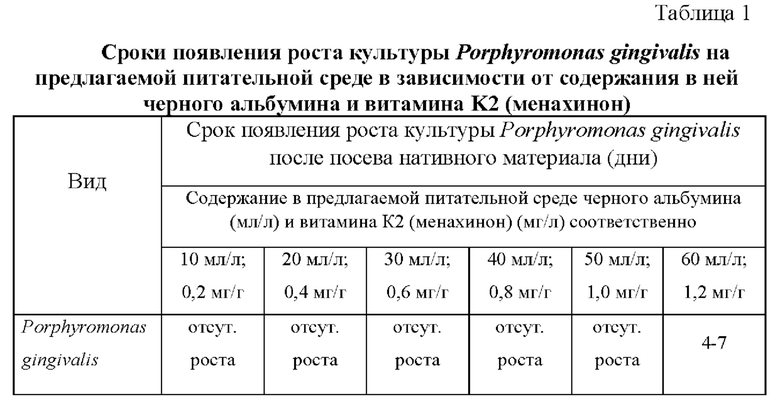
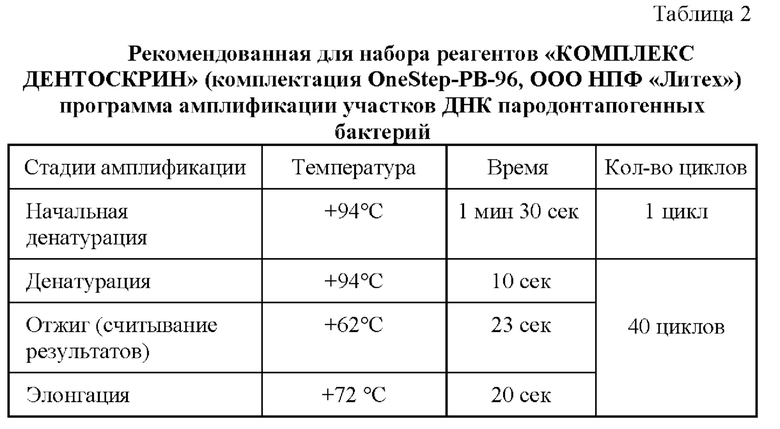
В результате на предлагаемой питательной среде (среда №3) на четвертые сутки удалось получить мелкие округлые слизистые темнопигментированные колонии, схожие с описанными в литературных источниках для P. gingivalis (фигура 1). Результат подтверждался методом полимеразной цепной реакции (ПЦР) с гибридизационно-флуоресцентной детекцией в режиме реального времени с использованием набора реагентов «КОМПЛЕКС ДЕНТОСКРИН» (комплектация OneStep-PB-96, ООО НПФ «Литех»). В полученных колониях детектировали ДНК Р. gingivalis (таблица 2, фигура 2). Вопреки ожиданиям, на модифицированном кровяном агаре (среда №7) не было получено подобной картины.
На среде, содержащей ПГРМ, мясной пептон, НТК, стимулятор роста гемофильных микроорганизмов, дрожжевой экстракт, D-глюкозу, хлористый натрий, хлорид тиамина, эритрит, пиросернистокислый натрий, сульфат полимиксина В, амфотерицин В и микробиологический агар в эффективных количествах, а также селективные добавки черный альбумин и менахинон (витамин К2) (предлагаемая среда) появление роста культуры Porphyromonas gingivalis на поверхности среды отмечалось на четвертый день культивирования, достигая в среднем до 9,73×106 геном-эквивалент/мл (ГЭ/мл) (таблица 3, 4). На шестые и седьмые сутки роста культуры наблюдалось снижение количества клеток в среднем до 3,26×106 ГЭ/мл и 2,42×105 ГЭ/мл соответственно (таблица 4, фигура 3).


В сравнении с предлагаемой питательной средой, на контрольной среде №7 отмечалось отсутствие появления роста культуры Porphyromonas gingivalis на четвертые, пятые, шестые и седьмые сутки культивирования (таблица 3, 4).
Предлагаемая питательная среда оказалась богаче используемых в эксперименте питательных сред по аминокислотному составу и минеральным компонентам (среды 1,2,4,5), на которых не отмечался рост колоний за время эксперимента, за исключением готового шоколадного агара (среда №6), многокомпонентность которого предположительно скорее подавляет развитие исследуемого микроорганизма P. gingivalis, чем способствует его росту, так как состав шоколадного агара благоприятен для развития широкого спектра микроорганизмов полости рта.
Широко используемый в микробиологической практике для культивирования пародонтопатогенного микроорганизма P. gingivalis кровяной агар с добавлением селективных добавок (среда №7) и являющийся в эксперименте контрольной средой не дал положительного результата. Тогда как предлагаемая питательная среда, лишенная компонента кровь и обогащенная добавками черный альбумин и витамин К2, вместо обычно применяемых в практике гемина и витамина КЗ, показала положительный результат культивирования Porphyromonas gingivalis.
Таким образом, предлагаемая нами питательная среда для выделения чистой культуры P. gingivalis, состоящая из панкреатического гидролизата рыбной муки, мясного пептона, панкреатического гидролизата казеина, стимулятора роста гемофильных микроорганизмов, дрожжевого экстракта, D-глюкозы, хлористого натрия, хлорида тиамина, эритрита, пиросернистокислого натрия, сульфата полимиксина В, амфотерицина В и микробиологического агара в эффективных количествах, а также содержащая селективные добавки черный альбумин и менахинон (витамин К2) вместо обычно используемых при культивировании Porphyromonas spp.гемина и менадиона (витамин К3) имеет преимущество перед участвовавшими в эксперименте средами, так как показала повышенную чувствительность к исследуемой пародонтопатогенной бактерии Porphyromonas gingivalis при ее культивировании в лабораторных условиях.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ВЫДЕЛЕНИЯ И КУЛЬТИВИРОВАНИЯ ГОНОКОККА | 1994 |
|
RU2077576C1 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ВЫДЕЛЕНИЯ И КУЛЬТИВИРОВАНИЯ ГОНОКОККА | 1994 |
|
RU2076904C1 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ И ВЫДЕЛЕНИЯ ВОЗБУДИТЕЛЕЙ ГНОЙНЫХ БАКТЕРИАЛЬНЫХ МЕНИНГИТОВ, СУХАЯ (ВАРИАНТЫ) | 2011 |
|
RU2471865C1 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ВЫДЕЛЕНИЯ И КУЛЬТИВИРОВАНИЯ МЕНИНГОКОККОВ (МЕНИНГОАГАР) | 1996 |
|
RU2103368C1 |
| ПИТАТЕЛЬНАЯ СРЕДА ПЛОТНАЯ ДЛЯ КУЛЬТИВИРОВАНИЯ БРУЦЕЛЛ | 2014 |
|
RU2580028C1 |
| СПОСОБ КОНТРОЛЯ ИНГИБИРУЮЩИХ СВОЙСТВ В ОТНОШЕНИИ БАКТЕРИАЛЬНОЙ ФЛОРЫ ПИТАТЕЛЬНОЙ СРЕДЫ ДЛЯ ВЫДЕЛЕНИЯ БРУЦЕЛЛ | 2019 |
|
RU2733431C2 |
| НАКОПИТЕЛЬНАЯ ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ ТРАНСПОРТИРОВКИ БИОМАТЕРИАЛА И ОБЪЕКТОВ ОКРУЖАЮЩЕЙ СРЕДЫ, КОНТАМИНИРОВАННЫХ ПОСТОРОННЕЙ МИКРОФЛОРОЙ, ПОДЛЕЖАЩИХ ИССЛЕДОВАНИЮ НА БРУЦЕЛЛЕЗ | 2020 |
|
RU2756201C1 |
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ ДИФТЕРИЙНЫХ МИКРОБОВ | 2011 |
|
RU2455351C1 |
| Транспортная жидкая питательная среда для сохранения жизнеспособности бруцеллезного микроба | 2019 |
|
RU2725733C1 |
| Питательная среда для получения дрожжевых клеток диморфного гриба Histoplasma capsulatum | 2019 |
|
RU2704278C1 |
Изобретение относится к области микробиологии и биотехнологии. Питательная среда для выделения чистой культуры Porphyromonas gingivalis, содержащая панкреатический гидролизат рыбной муки, мясной пептон, панкреатический гидролизат казеина, стимулятор роста гемофильных микроорганизмов, дрожжевой экстракт, D-глюкозу, хлористый натрий, хлорид тиамина, эритрит, пиросернистокислый натрий, сульфат полимиксина B, амфотерицин B, микробиологический агар, витамин K2 (менахинон), а в качестве источника трехвалентного железа - черный альбумин, в заданном соотношении компонентов на 1 литр питательной среды. Изобретение обеспечивает расширение арсенала питательных сред для выделения чистой культуры Porphyromonas gingivalis. 3 ил., 4 табл.
Питательная среда для выделения чистой культуры Porphyromonas gingivalis, содержащая в качестве основы дрожжевой экстракт и деионизированную воду, а в качестве селективных добавок источник двухвалетного железа и витамин K, отличающаяся тем, что в качестве основы дополнительно содержит панкреатический гидролизат рыбной муки, мясной пептон, панкреатический гидролизат казеина, стимулятор роста гемофильных микроорганизмов, D-глюкозу, хлористый натрий, хлорид тиамина, эритрит, пиросернистокислый натрий, сульфат полимиксина B, амфотерицин B и микробиологический агар, в качестве источника трехвалентного железа содержит черный альбумин, а в качестве витамина K содержит витамин K2 (менахинон), при следующем содержании компонентов на 1 литр питательной среды:
| GRENIER D., MICHAUD J | |||
| "Selective growth inhibition of Porphyromonas gingivalis by bestatin"; FEMS Microbiology Letters, 1994, v.123, p.193-200 | |||
| Способ получения продуктов конденсации фенолов с формальдегидом | 1924 |
|
SU2022A1 |
| MILNER P., et al "Development of a simple chemically defined medium for Porphyromonas gingivalis: requirement for alfa-ketoglutorate"; FEMS microbiology Letters, 1996, v | |||
Авторы
Даты
2023-08-22—Публикация
2023-03-31—Подача