Область техники, к которой относится изобретение
Данное изобретение относится к новым молекулам анти-CTLA-4 антител, нуклеотидным последовательностям и векторам экспрессии (например, онколитическому вирусу), кодирующим такие молекулы антитела, для их применения в терапии рака. Новые антитела улучшили истощение Treg по сравнению с ипилимумабом.
Предпосылки к созданию изобретения
Цитотоксический антиген, связанный с Т-лимфоцитами (CTLA-4 или CTLA4) (Cytotoxic T lymphocyte-associated antigen), также известный как CD152, является членом семейства B7/CD28, который блокирует активацию Т-клеток. CTLA-4 экспрессируется на активированных Т-клетках и передает ингибирующий сигнал Т-клеткам. Он гомологичен костимулирующему белку CD28 Т-клеток, и как CTLA-4, так и CD28 связываются с CD80 (также обозначается B7-1) и CD86 (также обозначается B7-2). CTLA4 также обнаружен в регуляторных Т-клетках (Treg) и способствует его ингибирующей функции. Белок CTLA-4 содержит внеклеточный V-домен, трансмембранный домен и цитоплазматический хвост.
Антитела, которые блокируют взаимодействие CTLA-4 с его лигандами B7.1 и B7.2, могут усиливать иммунные ответы, и было продемонстрировано, что они способны стимулировать мощный противоопухолевый иммунитет (Korman et al 2006, Checkpoint blockade in cancer immunotherapy, Adv Immunol. 90:297-339).
Многообещающие клинические результаты с иммуномодулирующими моноклональными антителами (мАт - mAb - monoclonal antibodies) возродили веру в то, что иммунная система является ключом к борьбе с раком. Классификация этих мАт на блокаторы контрольных точек (антагонисты) или активаторы костимулирующих молекул (агонисты) недавно была поставлена под сомнение, поскольку было обнаружено, что примеры обоих типов могут бороться с опухолями за счет истощения супрессивных регуляторных Т-клеток (Treg).
Иммуномодулирующие мАт, такие как ипилимумаб и другие анти-CTLA4 антитела, показали положительные результаты при испытаниях на трудноизлечимых злокачественных новообразованиях, хотя и у меньшинства пациентов (Hodi, F. S., et al. 2010, N Engl J Med 363(8): 711-723; Beatty, G. L., et al. 2011, Science 331(6024): 1612-1616; Brahmer, J. R., et al. 2012, N Engl J Med 366(26): 2455-2465; Topalian, S. L., et al. 2012 N Engl J Med 366(26): 2443-2454). Эти многообещающие результаты помогли укрепить веру в то, что иммунная система может быть ключом к борьбе с раком. Эти мАт были созданы для нацеливания на ключевые молекулярные регуляторы Т-клеток или антигенпрезентирующих клеток (АПК) (APC antigen-presenting cells) и для усиления противоракового иммунитета посредством блокады ингибирующих сигналов (блокаторы контрольных точек) или доставки костимулирующих сигналов (агонисты). Недавно эта бинарная классификация была поставлена под сомнение, когда было обнаружено, что терапевтическая активность анти-CTLA4 антител, анти-GITR антител и анти-OX40 антител, которые все являются мишенями Т-лимфоцитов, включает делецию супрессивных регуляторных CD4+ Т-клеток в зависимости от совместного взаимодействия активирующих FcγR (Bulliard, Jolicoeur et al. 2013, Marabelle, A., et al. 2013, J Clin Invest 123 (6): 2447-2463; Simpson, TR, et al. J Exp Med 210 (9):1695-1710).
Моноклональное анти-CTLA-4 антитело, ипилимумаб (YERVOY®; ранее обозначался как 10D1, BMS-734016, MDX 101, MDX-010, MDX-CTLA-4 и MDX-CTLA4), было одобрено в нескольких странах для лечения меланомы и других заболеваний и проходит клинические испытания по другим показаниям (Weber 2008, Overcoming immunologic tolerance to melanoma: targeting CTLA-4 with ipilimumab (MDX-010) Oncologist, 13 (Suppl 4):16-25). Ипилимумаб представляет собой полностью человеческое моноклональное анти-CTLA-4 антитело (IgG1κ), полученное в клетках яичника китайского хомячка с помощью технологии рекомбинантной ДНК. Оно имеет 477202-00-9 и 6T8C155666. Ипилимумаб дополнительно определен в патенте США 9789182, который также устанавливает последовательности тяжелой и легкой цепей ипилимумаба (как последовательности SEQ ID NO: 17 и 18 соответственно), последовательности участков VH и/или VL (как последовательности SEQ ID NO: 19 и SEQ ID NO: 20, соответственно) и последовательности CDR (CDR1 тяжелой цепи, CDR2 и CDR3 как указано в SEQ ID NO: 21, 22 и 23, и CDR1, CDR2 и CDR3 легкой цепи, как указано в SEQ ID NO: 24, 25 и 26).
Второе полностью человеческое моноклональное анти-CTLA-4 антитело, которое было протестировано в нескольких клинических испытаниях представляет собой тремелимумаб (ранее тицилимумаб, CP-675,206) (Ribas 2008, Overcoming immunologic tolerance to melanoma: targeting CTLA-4 with tremelimumab (CP-675,206) Oncologist, 13 (Suppl 4):10-5; Callahan et al 2010, Anti-CTLA-4 Antibody Therapy: Immune Monitoring During Clinical Development of a Novel Immunotherapy. Semin Oncol. 37(5): 473-484.; Blank et al 2015, Therapeutic use of anti-CTLA-4 antibodies. International Immunology, 27(1): 3-10).
Анти-CTLA-4 антитела были описаны в нескольких патентных заявках и патентах, включая следующие.
WO 93/00431 относится к белку рецептора CTLA4, к слитому белку CTLA4Ig и к способу регулирования клеточных взаимодействий с применением такого слитого белка или моноклонального антитела.
WO 97/20574 относится к блокаде понижающей регуляции Т-лимфоцитов, связанной с передачей сигналов CTLA-4, и к агенту, блокирующему CTLA-4, отличному от антитела к внеклеточному домену CTLA-4, которое увеличивает ответ Т-клеток млекопитающих на антигенный стимул или снижает рост опухолевых клеток у млекопитающего-хозяина.
WO 00/37504 относится к анти-CTLA-4 антителам человека и применению таких антител при лечении рака. WO 00/37504 также относится к упомянутому выше моноклональному антителу человека тремелимумабу, обозначенному в данной заявке на патент 11.2.1.
WO 01/14424 также относится к антителам человека, которые специфически связываются с CTLA-4 человека, и к их применению для лечения заболеваний и инфекций человека, таких как рак. WO 01/14424 также относится к моноклональному антителу человека ипилимумабу, упомянутому выше и дополнительно обсуждаемому ниже, обозначенному в данной заявке на патент 10D1.
Сущность изобретения
Данное изобретение относится к молекулам антител, которые специфически связываются с CTLA-4 и обладают улучшенным истощающим действием на CTLA-4-положительные клетки по сравнению с ипилимумабом.
Кроме того, данное изобретение относится к молекулам антител, которые специфически связываются с CTLA-4, причем эти молекулы антител содержат 6 CDR, имеющих последовательности SEQ ID NO: 15, 16, 17, 10, 18 и 19 или 6 CDR, имеющих последовательности SEQ ID NO: 22, 23, 24, 10, 25 и 26.
Кроме того, данное изобретение относится к изолированным нуклеотидным последовательностям, кодирующим указанные выше молекулы антител.
Кроме того, данное изобретение относится к плазмидам, содержащим указанные выше нуклеотидные последовательности.
Кроме того, данное изобретение относится к вирусам, таким как онколитические вирусы, содержащим указанные выше нуклеотидные последовательности или указанные выше плазмиды.
Кроме того, данное изобретение относится к клеткам, таким как CAR T-клетки, содержащим указанные выше нуклеотидные последовательности или указанные выше плазмиды.
Кроме того, данное изобретение относится к указанным выше молекулам антител, нуклеотидным последовательностям, плазмидам и/или клеткам для применения в медицине.
Кроме того, данное изобретение относится к указанным выше молекулам антител, нуклеотидным последовательностям, плазмидам, вирусам и/или клеткам для применения при лечении рака.
Кроме того, данное изобретение относится к применению вышеуказанных молекул антител, нуклеотидных последовательностей, плазмид, вирусов и/или клеток для производства фармацевтической композиции для применения при лечении рака.
Кроме того, данное изобретение относится к фармацевтическим композициям, содержащим по меньшей мере одну из указанных выше молекул антител, нуклеотидные последовательности, плазмиды, вирусы и/или клетки и, необязательно, фармацевтически приемлемый разбавитель, носитель или наполнитель.
Кроме того, данное изобретение относится к способам лечения рака у субъекта, включающим введение субъекту терапевтически эффективного количества по меньшей мере одной из вышеуказанных молекул антител, нуклеотидных последовательностей, плазмид, вирусов, клеток и/или фармацевтических композиций.
Кроме того, данное изобретение относится к молекуле антитела, молекуле антитела для применения, изолированной нуклеотидной последовательности, изолированной нуклеотидной последовательности для применения, плазмиде, плазмиде для применения, вирусу, вирусу для применения, клетке, клетке для применения, фармацевтической композиции или способа лечения, как описано в данном документе со ссылкой на подробное описание, примеры и/или фигуры.
Подробное описание данного изобретения
CTLA-4 положительные клетки включают регуляторные Т-клетки, Treg клетки, Treg или Treg (ранее известные как супрессорные Т-клетки, иногда также называемые супрессивными регуляторными Т-клетками) которые представляют собой субпопуляцию Т-клеток способные подавлять другие иммунные клетки в условиях нормального иммунитета и в условиях патологического иммунитета. Treg представляет собой CD4-положительные клетки (CD4+ клетки). Есть и другие CD4+ Т-клетки, которые не являются Treg; однако Treg могут быть отделены от не-Treg CD4+ клеток тем, что Treg также являются FOXP3-положительными (FOXP3+), тогда как не-Treg CD4+ являются FOXP3-отрицательными (FOXP3-).
Подобно ипилимумабу, описанные в данном документе молекулы анти-CTLA-4 антител действуют, по меньшей мере частично, за счет истощения CTLA-4-положительных клеток, таких как Treg. Кроме того, как и ипилимумаб, описанные в данном документе молекулы анти-CTLA-4 антител блокируют взаимодействия CTLA-4 с B7.1 и B7.2. Таким образом, эти антитела могут, как следствие, помочь преодолеть индуцированные CTLA-4 супрессивные эффекты на пролиферацию эффекторных Т-клеток.
Под истощением Treg или Treg истощением мы подразумеваем в данном документе истощение, удаление или устранение Treg посредством физического очищения клеток. В частности, мы имеем в виду истощение внутриопухолевых Treg. Истощение Treg может быть достигнуто посредством АЗКЦ (ADCC), т.е. антителозависимой клеточно-опосредованной цитотоксичности или антителозависимой клеточной цитотоксичности, и/или ADCP (antibody dependent cellular phagocytosis), т.е. антителозависимого клеточного фагоцитоза. Это означает, что когда описанная в данном документе молекула антитела вводится субъекту, такому как человек, она специфически связывается с CTLA-4, экспрессируемым на поверхности Treg, и это связывание приводит к истощению Treg. В некоторых вариантах осуществления данного изобретения, CTLA-4 предпочтительно экспрессируется на лимфоцитах, инфильтрирующих опухоль в микроокружении опухоли или на опухолевых клетках.
АЗКЦ представляет собой иммунный механизм, с помощью которого эффекторные клетки, несущие Fc-рецептор, могут распознавать и уничтожать покрытые антителами клетки-мишени, экспрессирующие на своей поверхности антигены опухолевого происхождения, т.е. в данном случае CTLA-4. ADCP представляет собой аналогичный механизм, хотя он приводит к уничтожению клеток-мишеней посредством фагоцитоза, а не цитотоксичности.
Антитела хорошо известны специалистам в области иммунологии и молекулярной биологии. Как правило, антитело состоит из двух тяжелых (H) цепей и двух легких (L) цепей. В данном документе, иногда эта полная молекула антитела называется полноразмерным антителом или антителом полной длины. Тяжелая цепь антитела содержит один вариабельный домен (VH) и три константных домена (CH1, CH2 и CH3), а легкая цепь молекулы антитела содержит один вариабельный домен (VL) и один константный домен (CL). Вариабельные домены (иногда вместе именуемые как участок FV) связываются с мишенью антитела или антигеном. Каждый вариабельный домен состоит из трех петель, называемых участками, определяющими комплементарность (CDR), которые отвечают за связывание с мишенью. Константные домены не участвуют непосредственно в связывании антитела с антигеном, но демонстрируют различные эффекторные функции. Антитела или иммуноглобулины могут быть отнесены к разным классам в зависимости от аминокислотной последовательности константного участка их тяжелых цепей. Существует пять основных классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, а у человека некоторые из этих иммуноглобулинов дополнительно делятся на подклассы (изотипы), например IgG1, IgG2, IgG3 и IgG4; IgA1 и IgA2. Другой частью антитела является домен Fc (также известный как кристаллизующийся фрагмент домена), который состоит из двух константных доменов каждой из тяжелых цепей антитела. Домен Fc отвечает за взаимодействие между антителом и рецептором Fc.
Рецепторы Fc представляют собой мембранные белки, которые часто обнаруживаются на клеточной поверхности клеток иммунной системы (т.е. рецепторы Fc находятся на мембране клетки-мишени, также известной как плазматическая мембрана или цитоплазматическая мембрана). Роль рецепторов Fc заключается в связывании антител через домен Fc и интернализации антитела в клетку. В иммунной системе это может привести к опосредованному антителами фагоцитозу и опосредованной антителами клеточно-опосредованной цитотоксичности.
Термин «молекула антитела», как используется в данном документе, охватывает полноразмерные антитела или антитела полной длины, а также функциональные фрагменты полноразмерных антител и производные молекул таких антител.
Функциональные фрагменты полноразмерного антитела имеют те же характеристики связывания антигена, что и соответствующее полноразмерное антитело, и включают либо те же вариабельные домены (т.е. последовательности VH и VL), и/или те же последовательности CDR, что и соответствующее полноразмерное антитело. То, что функциональный фрагмент имеет те же характеристики связывания антигена, что и соответствующее полноразмерное антитело, означает то, что он связывается с тем же эпитопом на мишени, что и полноразмерное антитело. Такой функциональный фрагмент может соответствовать участку Fv полноразмерного антитела. Как альтернатива, такой фрагмент может быть Fab, также обозначаемым F(ab), который является моновалентным антигенсвязывающим фрагментом, не содержащим участки Fc, или F(ab’)2, который является двухвалентным антигенсвязывающим фрагментом, содержащим два антигенсвязывающие участка Fab, связанные между собой дисульфидными связями, или F(ab’), т.е. моновалентным вариантом F(ab’)2. Таким фрагментом может быть также одноцепочечный вариабельный фрагмент (scFv).
Функциональный фрагмент не всегда содержит все шесть CDR соответствующего полноразмерного антитела. Следует отметить, что молекулы, содержащие три или меньшее количество участков CDR (в некоторых случаях даже только один участок CDR или его часть), способны сохранять антигенсвязывающую активность антитела, производными которого являются CDR. Например, в работе Gao et al., 1994, J. Biol. Chem., 269: 32389-93 указано, что вся цепь VL (включая все три участка CDR) имеет высокое сродство к своему субстрату.
Молекулы, содержащие два участка CDR, описаны, например, в работе Vaughan & Sollazzo 2001, Combinatorial Chemistry & High Proposal Screening, 4: 417-430. На странице 418 (правая колонка - 3 «Наша стратегия проектирования») описано миниантитело, включающее только гипервариабельные участки H1 и H2 CDR, перемежающиеся внутри каркасных участков. Это миниантитело описывают, как способное связываться с мишенью. На работы Pessi et al., 1993, Nature, 362: 367-9, и Bianchi et al., 1994, J. Mol. Biol., 236: 649-59, ссылаются Vaughan и Sollazzo и более подробно описывают миниантитела H1 и H2 и их свойства. В работе Qiu et al., 2007, Nature Biotechnology, 25:921-9 показано, что молекула, состоящая из двух связанных участков CDR, способна связывать антиген. Quiocho 1993, Nature, 362: 293-4, дает краткое описание технологии «миниантитела». Ladner 2007, Nature Biotechnology, 25:875-7, комментирует, что молекулы, содержащие два участка CDR, способны сохранять антигенсвязывающую активность.
Молекулы антител, содержащие один участок CDR, описаны, например, в работе Laune et al., 1997, JBC, 272: 30937-44, в которой показано, что ряд гексапептидов, полученных из участка CDR, демонстрируют антигенсвязывающую активность, и отмечается, что синтетические пептиды полного единичного участка CDR демонстрируют сильную связывающую активность. В работе Monnet et al., 1999, JBC, 274: 3789-96, показано, что ряд 12-мерных пептидов и связанных с ними каркасных участков обладают антигенсвязывающей активностью, и прокомментировано, что один только CDR3-подобный пептид способен связывать антиген. В работе Heap et al., 2005, J. Gen. Virol., 86: 1791-1800, сообщается, что “микроантитело” (молекула, содержащая один участок CDR) способно связывать антиген, и показано, что циклический пептид из анти-ВИЧ антитела обладает антигенсвязывающей активностью и функцией. В работе Nicaise et al., 2004, Protein Science, 13: 1882-91, показано, что один участок CDR может придавать антигенсвязывающую активность и аффинность к своему лизоцимному антигену.
Таким образом, молекулы антител, имеющие пять, четыре, три или меньшее количество участков CDR способны сохранять антигенсвязывающие свойства полноразмерных антител, производными которых они являются.
Такая молекула антитела может также быть производной полноразмерного антитела или фрагментом такого антитела. Производное имеет те же характеристики связывания антигена, что и соответствующее полноразмерное антитело, в том смысле, что оно связывается с тем же эпитопом на мишени, что и полноразмерное антитело.
Таким образом, под термином «молекула антитела», который употребляется в настоящей заявке, понимаются все типы молекул антител и их функциональные фрагменты, а также их производные, включая: моноклональные антитела, поликлональные антитела, синтетические антитела, рекомбинантно полученные антитела, мультиспецифичные антитела, биспецифичные антитела, антитела человека, гуманизированные антитела, химерные антитела, одноцепочечные антитела, вариабельные фрагменты (Fv), одноцепочечные вариабельные фрагменты (scFv фрагменты) включая двухвалентные одноцепочечные вариабельные фрагменты (di-scFv) и вариабельные фрагменты с дисульфидной связью, фрагменты Fab, фрагменты F(ab')2, фрагменты Fab', тяжелые цепи антител, легкие цепи антител, гомодимеры тяжелых цепей антител, гомодимеры легких цепей антител, гетеродимеры тяжелых цепей антител, гетеродимеры легких цепей антител, антигенсвязывающие функциональные фрагменты таких гомо- и гетеродимеров.
Кроме того, термин «молекула антитела», используемый в данном документе, включает все классы молекул антител и функциональных фрагментов, включая: IgG, IgG1, IgG2, IgG3, IgG4, IgA, IgM, IgD и IgE.
В некоторых вариантах осуществления данного изобретения, антитело представляет собой IgG1 человека. Специалисут в области иммунологии известно, что мышиный иммуноглобулин IgG2a и человеческий иммуноглобулин продуктивно IgG1 взаимодействуют с активирующими Fc-гамма-рецепторами и демонстрируют способность активировать делецию клеток-мишеней посредством активации активирующих иммунных клеток, несущих Fc-гамма-рецептор (например, макрофагов и НК-клеток), например, ADCP и АЗКЦ. Таким образом, тогда как мышиный иммуноглобулин IgG2a является предпочтительным изотипом для делеции у мыши, IgG1 человека является предпочтительным изотипом для делеции у человека. Напротив, известно, что оптимальная костимуляция рецепторов-агонистов суперсемейства TNFR, например 4-1BB, OX40, TNFRII, CD40, зависит от взаимодействия антител с ингибирующим FcγRII. У мышей изотип IgG1, который связывается преимущественно с ингибирующим Fc-гамма-рецептором (FcγRIIB) и лишь слабо с активирующими Fc-гамма-рецепторами, как известно, является оптимальным для костимулирующей активности мАт, нацеленных на суперсемейство TNFR. Хотя прямого эквивалента изотипа мышиного IgG1 у человека не было описано, антитела могут быть сконструированы так, чтобы демонстрировать аналогичное усиление связывания с ингибирующими, а не активирующими Fc-гамма-рецепторами человека. Такие сконструированные нацеленные на суперсемейство TNFR антитела также обладают улучшенной костимулирующей активностью in vivo у трансгенных мышей, сконструированных для экспрессии активирующих и ингибирующих Fc-гамма-рецепторов человека (Dahan et al, 2016, Therapeutic Activity of Agonistic, Human Anti-CD40 Monoclonal Antibodies Requires Selective FcγR Engagement. Cancer Cell. 29(6):820-31).
Как указывается выше, данное изобретение включает в себя различные типы и формы молекул антител, которые должны быть известны специалисту в области иммунологии. Хорошо известно, что антитела, применяющиеся в терапевтических целях, часто модифицируются дополнительными компонентами, которые изменяют свойства молекулы антитела.
Соответственно, в данной заявке учитывается, что молекула антитела по данному изобретению или молекула антитела, применяющаяся в соответствии с данным изобретением (например, молекула моноклонального антитела и/или молекула поликлональого антитела, и/или молекула биспецифического антитела), содержит обнаруживаемый фрагмент молекулы и/или цитотоксический фрагмент молекулы.
Под «обнаруживаемым фрагментом молекулы» нами подразумевается одна или большее количество групп, состоящих из: фермента; радиоактивного атома; флуоресцентного фрагмента молекулы; хемилюминесцентного фрагмента молекулы; биолюминесцентного фрагмента молекулы. Обнаруживаемый фрагмент молекулы позволяет визуализировать молекулу антитела in vitro и/или in vivo, и/или ex vivo.
Под «цитотоксическим фрагментом молекулы» мы подразумеваем радиоактивную часть и/или фермент, например, причем фермент является каспазой; и/или токсин, например, причем токсин является бактериальным токсином или ядом; причем цитотоксический фрагмент способен индуцировать лизис клеток.
Также в данном изобретении подразумевается, что молекула антитела может быть в изолированной форме и/или очищенной форме, и/или может быть ПЕГилирована.
Как уже обсуждалось выше, CDR антитела связываются с антителом-мишенью. Назначение аминокислот каждому участку CDR, описанному в настоящей заявке, соответствует определениям, согласно работе Kabat EA et al. 1991, в «Sequences of Proteins of Immulogical Interest» (последовательности белков, представляющих иммунологический интерес), пятое издание, публикация NIH No. 91-3242, pp xv- xvii.
Как может быть известно специалисту, существуют и другие способы назначения аминокислот каждому участку CDR. Например, Международная информационная система иммуногенетики (IMGT(R)) (http://www.imgt.org/ и Lefranc и Lefranc «The Immunoglobulin FactsBook» опубликованные издательством Academic Press, 2001).
В дополнительном варианте осуществления данного изобретения, молекула антитела по данному изобретению или применяемая в соответствии с данным изобретением, представляет собой молекулу антитела, которое способно конкурировать со специфическими антителами, описанными в данном документе, такими как молекулы антитела, содержащими последовательности SEQ ID NO: 15, 16, 17, 10, 18 и 19 или последовательности SEQ ID NO: 22, 23, 24, 10, 25 и 26.
Под «способное конкурировать за» подразумевается то, что конкурирующее антитело способно ингибировать или иным образом вмешиваться, по меньшей мере частично, в связывание молекулы антитела, как определено в данной заявке, с конкретной мишенью.
Например, такая молекула конкурирующего антитела может быть способна ингибировать связывание описанной в данном документе молекулы антитела, по меньшей мере около на 10%; например, по меньшей мере около на 20% или по меньшей мере около на 30%, по меньшей мере около на 40%, по меньшей мере около на 50%, по меньшей мере около на 60%, по меньшей мере около на 70%, по меньшей мере около на 80%, по меньшей мере около на 90%, по меньшей мере около на 95%, по меньшей мере около на 100%, и/или ингибировать способность описанного в данной заявке антитела препятствовать связыванию или уменьшать связывание со специфической мишенью по меньшей мере около на 10%, например, по меньшей мере около на 20%, по меньшей мере около на 30%, по меньшей мере около на 40%, по меньшей мере около на 50%, по меньшей мере около на 60%, по меньшей мере около на 70%, по меньшей мере около на 80%, по меньшей мере около на 90%, по меньшей мере около на 95% или по меньшей мере около на 100%.
Конкурентное связывание может быть определено способами, хорошо известными специалистам в данной области техники, такими как иммуноферментный анализ (ИФА).
Анализы ИФА можно применять для оценки эпитоп-модифицирующих или блокирующих антител. Дополнительные способы, пригодные для выявления конкурирующего антитела, описаны в лабораторном руководстве Antibodies: A Laboratory Manual, Harlow & Lane («Антитела: Лабораторное руководство», авторы - Харлоу и Лейн), которое включено в данную заявку посредством ссылки (например, см. стр. 567 - 569, 574 - 576, 583 и 590 - 612, 1988, CSHL, NY, ISBN 0-87969-314-2).
Хорошо известно, что антитело специфически связывается с определенной молекулой-мишенью или антигеном, и что это означает, что антитело предпочтительно и избирательно связывает свою мишень, а не молекулу, которая не является мишенью.
Мишени CTLA-4 антител согласно данному изобретению или антител, применяемых в соответствии с данным изобретением, экспрессируются на поверхности клеток, т.е. они являются поверхностным клеточным антигеном, который может включать эпитоп (также известный в контексте данной заявки как эпитоп поверхности клетки) для этого антитела. Поверхностный клеточный антиген и эпитоп - это термины, которые может легко понять специалист в области иммунологии или клеточной биологии.
Под «антигеном клеточной поверхности» в данной заявке подразумевается то, что антиген клеточной поверхности или, по меньшей мере, его эпитоп, которому молекула антитела, описанная в данном документе, экспонируется на внеклеточной стороне клеточной мембраны.
Способы оценки связывания белков известны специалистам в области биохимии и иммунологии. Было бы желательно, чтобы специалисты могли применять эти методы для оценки связывания антитела с мишенью и/или связывания домена Fc антитела с рецептором Fc, а также для оценки относительной силы или специфичности, или ингибирования, или уменьшения этих взаимодействий, или препятствования этим взаимодействиям. Примерами способов, которые можно применять для оценки связывания белков, являются, например, иммуноанализ, анализ межклеточного взаимодействия с помощью систем BIAcore, вестерн-блоттинг, радиоиммуноанализ (РИА) (RIA) и иммуноферментный анализ (ИФА) (обсуждения специфичности антител см. в Fundamental Immunology Second Edition, Raven Press, New York, на страницах 332-336 (1989) (для обсуждения специфичности антитела см. «Фундаментальную иммунологию», второе издание, Raven Press, New York) (1989).
Соответственно, в данном документе как «молекула антитела, которая специфически связывает CTLA-4», так и «молекула анти-CTLA-4 антитела» относятся к молекуле антитела, которая специфически связывает мишень CTLA-4, но не связывается с не-мишенью, или связывается с не-мишенью слабее (например, с более низкой аффинностью), чем мишень.
В некоторых вариантах осуществления данного изобретения, молекула антитела, которая специфически связывает CTLA-4 (или молекулу анти-CTLA-4 антитела), относится к молекуле антитела, которая специфически связывается с внеклеточным доменом CTLA-4.
В некоторых вариантах осуществления данного изобретения, молекула антитела, которая специфически связывает CTLA-4 (или молекулу анти-CTLA-4 антитела), не реагирует перекрестно с CD28. В некоторых вариантах осуществления данного изобретения, молекула антитела, которая специфически связывает CTLA-4 (или молекулу анти-CTLA-4 антитела), блокирует связывание CTLA-4 с CD80 и/или CD86, тем самым ингибируя передачу сигнала CLTA-4.
Также данная заявка включает концепцию того, что антитело специфично связывается с мишенью CTLA-4 по меньшей мере в два раза сильнее, или по меньшей мере в пять раз сильнее, или по меньшей мере в 10 раз сильнее, или по меньшей мере в 20 раз сильнее, или по меньшей мере в 50 раз сильнее, или по меньшей мере в 100 раз сильнее, или по меньшей мере в 200 раз сильнее, или по меньшей мере в 500 раз сильнее, или по меньшей мере около чем в 1000 раз сильнее, чем с не-мишенью.
Кроме того, данная заявка включает концепцию того, что антитело специфично связывается с мишенью CTLA-4, если оно связывается с мишенью с Kd по меньшей мере около 10-1 Kd, или по меньшей мере около 10-2 Kd, или по меньшей мере около 10-3 Kd, или по меньшей мере около 10-4 Kd, или по меньшей мере около 10-5 Kd, или по меньшей мере около 10-6 Kd, или по меньшей мере около 10-7 Kd, или по меньшей мере около 10-8 Kd, или по меньшей мере около 10-9 Kd, или по меньшей мере около 10-10 Kd, или по меньшей мере около 10-11 Kd, или по меньшей мере около 10-12 Kd, или по меньшей мере около 10-13 Kd, или по меньшей мере около 10-14 Kd, или по меньшей мере около 10-15 Kd.
Как упоминалось выше, молекулы антител, которые специфически связываются с CTLA-4 (или молекулами анти-CTLA-4 антител), описанными в данном документе, обладают улучшенным истощающим действием на CTLA-4-положительные клетки по сравнению с ипилимумабом.
То, что молекулы антител обладают истощающим действием на CTLA-4-положительные клетки, означает, что при введении субъекту, такому как человек, такое антитело специфически связывается с CTLA-4, экспрессируемым на поверхности CTLA-4-положительных клеток, и это связывание приводит к истощению таких клеток.
В некоторых вариантах осуществления данного изобретения, CTLA-4-положительные клетки представляют собой CD4-положительные (CD4+) клетки, т.е. клетки, экспрессирующие CD4.
В некоторых вариантах осуществления данного изобретения, CTLA-4-положительные клетки являются как CD4-положительными, так и FOXP3-положительными, т.е. экспрессируют как CD4, так и FOXP3. Эти клетки представляют собой Treg. CD8-положительные Т-клетки также экспрессируют CTLA-4, но Treg экспрессируют значительно более высокие уровни CTLA-4, чем CD8-положительные Т-клетки. Это делает Treg более восприимчивыми к истощению по сравнению с клетками CD8+ с низкой экспрессией.
В некоторых ситуациях CTLA-4 предпочтительно экспрессируется на иммунных клетках в микроокружении опухоли (клетки, инфильтрирующие опухоль, TILS - tumour infiltrating cells).
Таким образом, в микроокружении опухоли Treg будут клетками, которые имеют наивысшую экспрессию CTLA-4, в результате чего молекулы антител, которые специфически связываются с CTLA-4 (или молекулами анти-CTLA-4 антител), имеют Treg истощающий эффект. Это обсуждается более подробно ниже, например, в Примере 4 и в связи с фиг. 13.
В некоторых вариантах осуществления данного изобретения, CTLA-4-положительные клетки будут Treg в солидной опухоли. Такие Treg будут иметь очень высокую экспрессию CTLA-4, и поэтому введение молекул антител, которые специфически связываются с CTLA-4, предпочтительно приведет к истощению таких Treg.
Как упоминалось выше, описанные в данном документе молекулы анти-CTLA-4 антител представляют собой молекулы антител истощающие Treg, что означает, что при введении субъекту, такому как человек, такая молекула антитела специфически связывается с CTLA-4, экспрессируемым на поверхности Treg, и это связывание приводит к истощению Treg.
Чтобы решить, является ли молекула антитела молекулой антитела, которая имеет улучшенное истощающее действие на CTLA-4-положительные клетки по сравнению с ипилимумабом как указано в данном документе, можно применять in vitro анализ антителозависимой клеточной цитотоксичности (АЗКЦ) или тест in vivo в модели PBMC-NOG/SCID.
Тест ADCC in vitro, который проводят с применением линии клеток НК-92, стабильно трансфицированной для экспрессии аллеля CD16-158V вместе с GFP, при этом тест ADCC включает следующие семь последовательных этапов:
1) CTLA-4-положительные клетки, CD4-положительные клетки или Treg в качестве клеток-мишеней выделяют из периферической крови здоровых доноров. Это выделение может быть выполнено с применением набора для выделения CD4+ Т-клеток, такого как коммерческий набор от Miltenyi Biotec.
2) Затем клетки-мишени стимулируют, например, в течение 48 часов, CD3/CD28, например, с применением CD3/CD28 Dynabeads® и rhIL-2, таких как 50 нг/мл rhIL-2. Стимуляцию можно проводить при 37°C.
3) Затем клетки-мишени предварительно инкубируют с тестируемой молекулой антитела, например, при 10 мкг/мл в течение 30 минут при 4°C, а затем смешивают с НК-клетками.
4) Затем клетки-мишени инкубируют в течение подходящего времени, например 4 часов, в среде RPMI 1640 + GlutaMAX, содержащей буфер HEPES, пируват натрия и FBS низкого IgG. Среда RPMI 1640 + GlutaMAX может содержать 10 мМ буфера HEPES, 1 мМ пирувата натрия и 10% FBS низкого IgG, а соотношение эффекторные клетки:клетки-мишени может составлять 2:1.
5) Лизис определяют способом проточной цитометрии.
6) Этапы 1-5 повторяются или выполняются параллельно с применением ипилимумаба вместо тестируемой молекулы антитела на этапе 3.
7) Результаты лизиса тестируемой молекулы антитела сравнивают с результатами лизиса ипилимумаба. Улучшенный лизис тестируемой молекулы антитела по сравнению с ипилимумабом демонстрирует, что тестируемая молекула антитела обладает улучшенным истощающим действием на CTLA-4-положительные клетки, CD4-положительные клетки или Treg, соответственно, в зависимости от того, какие клетки-мишени применялись.
В некоторых вариантах осуществления данного изобретения, улучшенное истощающее действие на этапе 7) выше представляет собой значительно улучшенное истощающее действие.
Этот анализ более подробно продемонстрирован ниже в Примере 4 в сочетании с фиг.12.
Тест in vivo основан на комбинированном применении МКПК мышей и NOG/SCID мышей, которое в данном документе называется моделью PBMC-NOG/SCID. И МКПК мыши, и NOG/SCID мыши являются хорошо известными моделями. Тест in vivo на модели PBMC-NOG/SCID включает следующие девять последовательных этапов:
1) МКПК человека (мононуклеарные клетки периферической крови) выделяют, промывают и ресуспендируют в стерильном ФСБ. В некоторых вариантах осуществления данного изобретения, МКПК ресуспендируют в ФСБ в концентрации 75 × 106 клеток/мл.
2) NOG мышам вводят в/в (внутривенно) с соответствующим количеством, например, 200 мкл, клеточной суспензии с этапа 1). Если вводится 200 мкл, это соответствует 15×106 клеток/мышь.
3) В подходящее время, например, 2 недели, после инъекции, селезенки от NOG мышей выделяют и превращают в суспензию отдельных клеток. Необязательно, небольшой образец из суспензии отдельных клеток берут для определения экспрессии CTLA-4 на Т-клетках человека с помощью FACS, чтобы подтвердить экспрессию CTLA-4.
4) Клеточную суспензию с этапа 3) ресуспендировали в стерильном ФСБ. В некоторых вариантах осуществления данного изобретения, суспензию из осадка ресуспендируют в стерильном ФСБ в концентрации 50 × 106 клеток/мл. Если необязательное определение экспрессии CTLA-4 включено в этап 3, остальная часть клеточной суспензии затем ресуспендируется на этапе 4.
5) Мышам SCID вводят в/б (внутрибрюшинно) в подходящем количестве, например, 200 мкл, суспензии с этапа 4. Если вводится 200 мкл, это соответствует 10×106 клеток/мышь.
6) Подходящее время, такое как 1 час, после инъекции на этапе 5) SCID мышам вводят соответствующее количество, например, 10 мг/кг, либо молекулы антитела, подлежащей тестированию, ипилимумаба, либо моноклонального антитела изотипического контроля.
7) Внутрибрюшинную жидкость обработанных SCID мышей собирают в подходящее время, например, через 24 часа после лечения на этапе 6).
8) Подмножества Т-клеток человека идентифицируются и количественно оцениваются с помощью FACS с применением следующих маркеров: CD45, CD4, CD8, CD25 и/или CD127.
9) Результаты идентификации и количественной оценки подмножеств Т-клеток от мышей, получавших тестируемую молекулу антитела, сравнивают с результатами идентификации и количественной оценки подмножеств Т-клеток от мышей, получавших ипилимумаб, и с результатами идентификации и количественной оценки подмножеств Т-клеток мышей, получавших моноклональное антитело изотипического контроля. Меньшее количество CTLA-4-положительных клеток во внутрибрюшинной жидкости от мышей, получавших тестируемую молекулу антитела, по сравнению с количеством CTLA-4-положительных клеток во внутрибрюшинной жидкости от мышей, получавших ипилимумаб, демонстрирует, что молекула антитела улучшила истощенее действие на CTLA-4-положительные клетки по сравнению с ипилимумабом. Меньшее количество CD4-положительных клеток во внутрибрюшинной жидкости мышей, получавших исследуемую молекулу антитела, по сравнению с количеством CD4-положительных клеток во внутрибрюшинной жидкости мышей, получавших ипилимумаб, демонстрирует, что молекула антитела обладает улучшенным истощающим действием на CD4-положительные клетки по сравнению с ипилимумабом. Меньшее количество Treg во внутрибрюшинной жидкости мышей, получавших исследуемую молекулу антитела, по сравнению с количеством Treg во внутрибрюшинной жидкости мышей, получавших ипилимумаб, демонстрирует, что молекула антитела обладает улучшенным истощающим действием на Treg по сравнению с ипилимумабом.
В этом тесте in vivo в некоторых вариантах осуществления данного изобретения наибольший интерес представляет рассмотрение истощения Treg на этапе 7.
Этот анализ более подробно продемонстрирован ниже в Примере 4 в сочетании с фиг. 14.
Истощение Treg также можно оценить с помощью анализа антителозависимого клеточного фагоцитоза (ADCP), как известно специалисту в данной области.
В некоторых вариантах осуществления данного изобретения, молекулы антител обладают аналогичным блокирующим эффектом на взаимодействия CTLA-4 с лигандами B7.1 и B7.2 по сравнению с Первой. Это можно оценить с помощью ИФА (как продемонстрировано на фиг. 10) или в более функциональном анализе, при этом анти-CTLA-4 антитела усиливают продукцию ИЛ-2 Т-клетками в ответ на стимуляцию PBMC с SEB.
В некоторых вариантах осуществления данного изобретения, молекула анти-CTLA-4 антитела представляет собой молекулу антитела человека.
В некоторых вариантах осуществления данного изобретения, молекула анти-CTLA-4 антитела представляет собой гуманизированную молекулу антитела.
В некоторых вариантах осуществления данного изобретения, молекула анти-CTLA-4 антитела представляет собой молекулу антитела человеческого происхождения, что означает, что она происходит из молекулы антитела человека, которая затем была модифицирована.
В некоторых вариантах осуществления данного изобретения, молекула анти-CTLA-4 антитела представляет собой антитело IgG1 человека.
В некоторых вариантах осуществления данного изобретения, анти-CTLA-4 антитело представляет собой антитело в форме антитела IgG1 человека, демонстрирующее улучшенное связывание с одним или более активирующими Fc рецепторами и/или сконструированное для улучшения связывания с одним или более активирующими Fc рецепторами; соответственно, в некоторых вариантах осуществления данного изобретения, анти-CTLA-4 антитело представляет собой антитело IgG1 человека, сконструированное с помощью Fc.
В некоторых вариантах осуществления данного изобретения, анти-CTLA-4 антитело представляет собой мышиное или гуманизированное мышиное антитело IgG2a.
В некоторых вариантах осуществления данного изобретения, анти-CTLA-4 антитело представляет собой мышиное антитело, которое перекрестно реагирует с CTLA-4 человека.
В некоторых вариантах осуществления данного изобретения, анти-CTLA-4 антитело представляет собой моноклональное антитело.
В некоторых вариантах осуществления данного изобретения, анти-CTLA-4 антитело представляет собой поликлональное антитело.
В некоторых вариантах осуществления данного изобретения, молекула анти-CTLA-4 антитела представляет собой молекулу антитела, содержащую одну из трех альтернативных последовательностей VH-CDR1, одну из трех альтернативных последовательностей VH-CDR2, одну из двух альтернативных последовательностей VH-CDR3, одну из две последовательности VL-CDR1, одну из двух последовательностей VL-CDR2 и/или одну из двух альтернативных последовательностей VL-CDR3, представленных в таблице 1 ниже.
В некоторых вариантах осуществления данного изобретения, молекула анти-CTLA-4 антитела выбрана из группы, состоящей из молекул антитела, содержащих 1-6 CDR, выбранных из группы, состоящей из последовательностей SEQ ID NO 3, 6, 8, 10, 12 и 14.
В некоторых вариантах осуществления данного изобретения, молекула анти-CTLA-4 антитела выбрана из группы, состоящей из молекул антитела, содержащих CDR, имеющих последовательности SEQ ID NO 3, 6, 8, 10, 12 и 14.
В некоторых вариантах осуществления данного изобретения, молекула анти-CTLA-4 антитела выбрана из группы, состоящей из молекул антитела, содержащих 1-6 из CDR, VH-CDR1, VH-CDR2, VH-CDR3, VL-CDR1 и VL-CDR3,
где VH-CDR1, если присутствует, выбран из группы, состоящей из последовательностей SEQ ID NO 15, 22, 29 и 35;
где VH-CDR2, если присутствует, выбран из группы, состоящей из последовательностей SEQ ID NO: 16, 23, 30 и 36;
где VH-CDR3, если присутствует, выбран из группы, состоящей из последовательностей SEQ ID NO 17, 24, 31 и 37;
где VL-CDR1, если присутствует, выбран из группы, состоящей из последовательностей SEQ ID NO 10 и 38;
где VL-CDR2, если присутствует, выбран из группы, состоящей из последовательностей SEQ ID NO 18, 25, 32 и 39;
где VL-CDR3, если присутствует, выбран из группы, состоящей из последовательностей SEQ ID NO 19, 26 и 40.
В некоторых вариантах осуществления данного изобретения, молекула анти-CTLA-4 антитела представляет собой молекулу антитела, выбранную из группы, состоящей из молекул антитела, содержащих 6 CDR, выбранных из группы, состоящей из последовательностей:
SEQ ID NO: 15, 16, 17, 10, 18 и 19;
SEQ ID NO: 22, 23, 24, 10, 25 и 26;
SEQ ID NO: 29, 30, 31, 10, 32 и 26; и
SEQ ID NO: 35, 36, 37, 38, 39 и 40.
В некоторых вариантах осуществления данного изобретения, молекула анти-CTLA-4 антитела представляет собой молекулу антитела, содержащую 6 CDR, имеющих последовательности SEQ ID NO: 15, 16, 17, 10, 18 и 19.
В некоторых вариантах осуществления данного изобретения, молекула анти-CTLA-4 антитела представляет собой молекулу антитела, содержащую 6 CDR, имеющих последовательности SEQ ID NO: 22, 23, 24, 10, 25 и 26.
В некоторых вариантах осуществления данного изобретения, молекула анти-CTLA-4 антитела представляет собой молекулу антитела, выбранную из группы, состоящей из молекул антитела, содержащих VH, выбранную из группы, состоящей из последовательностей SEQ ID NO: 20, 27, 33 и 41.
В некоторых вариантах осуществления данного изобретения, молекула анти-CTLA-4 антитела представляет собой молекулу антитела, выбранную из группы, состоящей из молекул антитела, содержащих VL, выбранную из группы, состоящей из последовательностей SEQ ID NO: 21, 28, 34 и 42.
В некоторых вариантах осуществления данного изобретения, молекула анти-CTLA-4 антитела представляет собой молекулу антитела, выбранную из группы, состоящей из молекул антитела, содержащих VH и VL, выбранную из группы, состоящей из последовательностей SEQ ID NO: 20-21, 27-28, 33-34 и 41-42.
В некоторых вариантах осуществления данного изобретения, молекула анти-CTLA-4 антитела содержит VH имеющий последовательность SEQ ID NO: 20, и VL, имеющий последовательность SEQ ID NO: 21.
В некоторых вариантах осуществления данного изобретения, молекула анти-CTLA-4 антитела содержит VH имеющий последовательность SEQ ID NO: 27, и VL, имеющий последовательность SEQ ID NO: 28.
Таблица 1. Общие последовательности CDR антител, описанных в данном документе
Таблица 2. Специфические молекулы анти-CTLA-4 антител; последовательности CDR выделены жирным шрифтом в полных последовательностях VH и VL
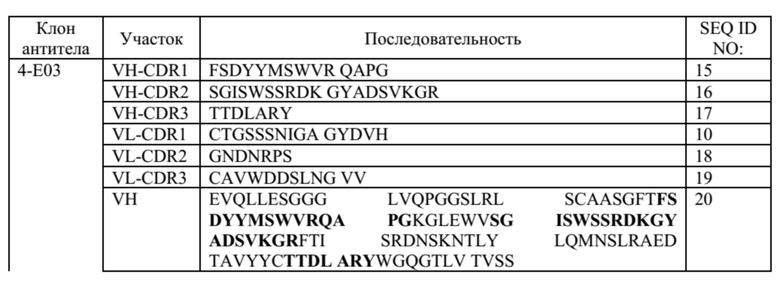
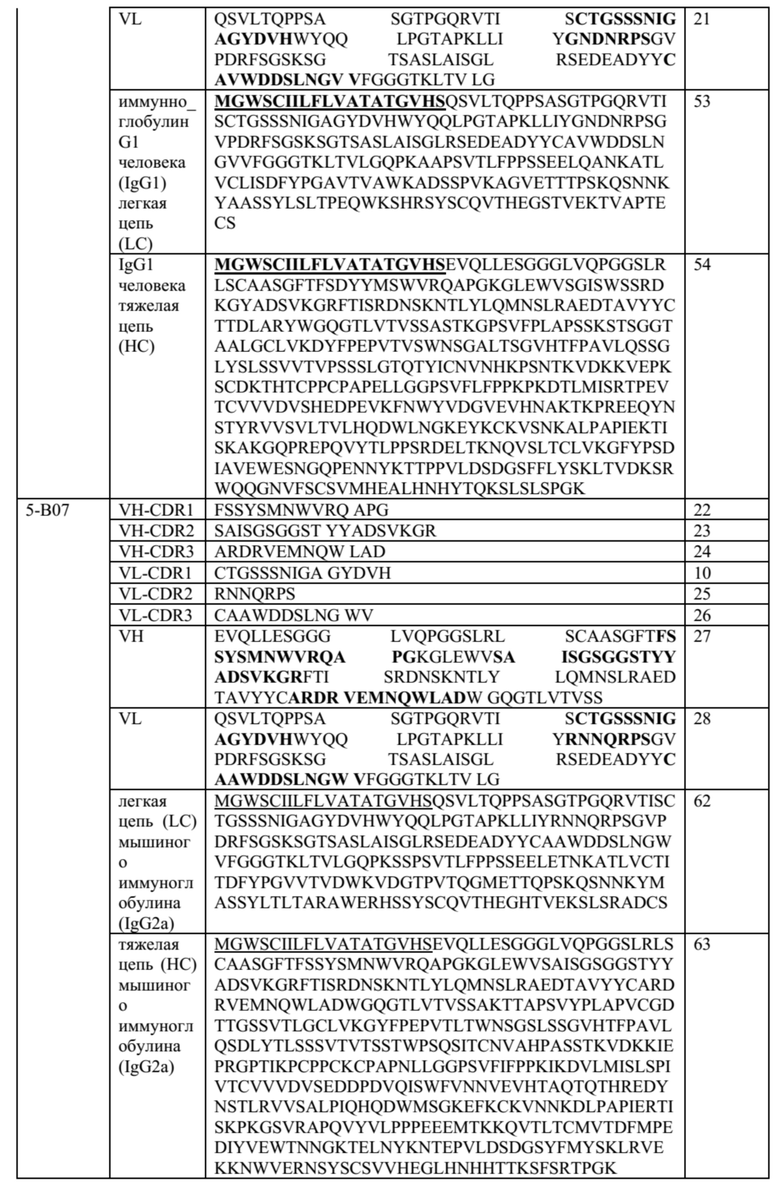
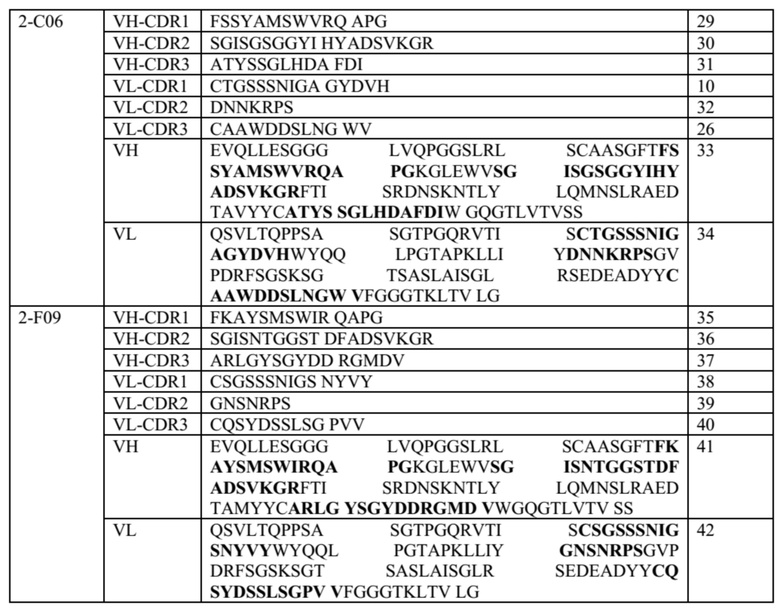
В некоторых вариантах осуществления данного изобретения, молекулы анти-CTLA-4 антитела, описанные в данном документе, также могут содержать один или оба константных участков, представленные в таблице 3 ниже.
Таблица 3. Последовательности константных участков антител, описанных в данном документе
В некоторых вариантах осуществления данного изобретения, молекула анти-CTLA-4 антитела представляет собой молекулу, кодируемую одной из нуклеотидных последовательностей, представленных в таблице 4 ниже.
Таблица 4. Специфические нуклеотидные последовательности, кодирующие молекулы анти-CTLA-4 антитела
В некоторых вариантах осуществления данного изобретения, предпочтительно, чтобы молекула антитела связывалась как с CTLA-4 человека (hCTLA-4), так и с CTLA-4 яванского макака (cmCTLA-4 или CTLA-4 цино). Перекрестная реактивность с CTLA-4, экспрессируемым на клетках яванского макака, также называемого крабоядной макакой или Macaca fascicularis, может быть выгодной, поскольку это позволяет тестировать молекулу антитела на обезьяне без применения суррогатного антитела, что в первую очередь касается переносимости.
В некоторых вариантах осуществления данного изобретения, предпочтительно, чтобы молекула антитела связывалась как с CTLA-4 человека (hCTLA-4), так и с CTLA-4 мыши (mCTLA-4). Это может быть выгодно, поскольку позволяет тестировать молекулу антитела на мышах, уделяя особое внимание действию и фармакодинамике, без необходимости применения суррогатного антитела.
В некоторых вариантах осуществления данного изобретения, молекула антитела связывается со всеми тремя hCTLA-4, cmCTLA-4 и mCTLA-4.
В некоторых вариантах осуществления данного изобретения, необходимо применять суррогатное антитело для тестирования функциональной активности молекулы антитела на соответствующих in vivo моделях на мышах. Чтобы гарантировать сопоставимость между эффектом молекулы антитела у людей и результатами in vivo для суррогатного антитела у мышей, важно выбрать функционально эквивалентное суррогатное антитело, имеющее такие же характеристики in vitro, что и молекула антитела человека.
В некоторых вариантах осуществления данного изобретения, молекула антитела не связывает CD28 человека.
Специалисту в области медицины может быть известно, что лекарства могут быть модифицированы с помощью различных добавок, например, чтобы изменить скорость всасывания лекарства в организме; и могут быть модифицированы в различных формах, например, чтобы обеспечить определенный путь введения в организм.
Соответственно, данная заявка включает молекулы антител, нуклеотидные последовательности, плазмиды, вирусы и/или клетки, описанные в данном документе, могут быть объединены с фармацевтически приемлемым наполнителем, носителем, разбавителем, носителем и/или адъювантом в фармацевтическую композицию. В этом контексте термин фармацевтическая композиция может использоваться взаимозаменяемо с терминами фармацевтический препарат, фармацевтический состав, терапевтическая композиция, терапевтический препарат, терапевтический состав и терапевтический объект.
Описанные в данном документе фармацевтические композиции могут содержать или в некоторых вариантах осуществления данного изобретения состоять из молекул антител, нуклеотидных последовательностей, плазмид, вирусов или клеток.
Описанные в данном документе фармацевтические композиции могут в некоторых вариантах осуществления данного изобретения состоять или содержать плазмиды, содержащие нуклеотидные последовательности, кодирующие описанные выше молекулы антител или содержащие описанные выше нуклеотидные последовательности.
В некоторых вариантах осуществления данного изобретения, фармацевтические композиции могут содержать нуклеотидные последовательности, кодирующие части или полную молекулу антитела, описанную в данном документе, интегрированную в клеточный или вирусный геном или в вириом. Затем фармацевтическая композиция может содержать клетку или вирус в качестве носителя для доставки антитела по данному изобретению (или носителя для доставки нуклеотидной последовательности, кодирующей антитело по данному изобретению). Например, в варианте осуществления данного изобретения, вирус может быть в форме терапевтического онколитического вируса, содержащего нуклеотидные последовательности, кодирующие как минимум одну из молекул антител, описанных в данном документе. В некоторых вариантах осуществления данного изобретения, такой онколитический вирус содержит нуклеотидные последовательности, кодирующие полноразмерное антитело IgG человека. В некоторых вариантах осуществления данного изобретения, такой онколитический вирус содержит нуклеотидные последовательности, кодирующие молекулу антитела scFv, Fab или F(ab')2.
Как описано в прилагаемой формуле изобретения, в одном из вариантов осуществления данное изобретение относится к вирусу, содержащему нуклеотидную последовательность по данному изобретению или плазмиду по данному изобретению. Предпочтительно вирус представляет собой онколитический вирус, такой как терапевтический онколитический вирус. Как применяется в данном документе, термин «онколитический» относится к способности вируса избирательно реплицироваться в делящихся клетках (например, в пролиферативных клетках, таких как раковые клетки) с целью замедления роста и/или лизирования указанной делящейся клетки, либо in vitro, либо in vivo, демонстрируя отсутствие или минимальную репликацию в неделящихся (например, нормальных или здоровых) клетках. «Репликация» (или любая форма репликации, такая как «репликация» и «репликация» и т.д.) означает дублирование вируса, которое может происходить на уровне нуклеиновой кислоты или, предпочтительно, на уровне инфекционной вирусной частицы. Такой онколитический вирус можно получить от любого представителя вируса, идентифицированного в настоящее время. Это может быть нативный вирус, который является онколитическим в природе, или может быть сконструирован путем модификации одного или более вирусных генов так, чтобы повысить селективность опухоли и/или предпочтительную репликацию в делящихся клетках, например, участвующих в репликации ДНК, метаболизме нуклеиновых кислот, тропизме хозяина, прикрепление к поверхности, вирулентность, лизис и распространение (см., например, Wong et al., 2010, Viruses 2: 78-106). Можно также предусмотреть помещение одного или более вирусного гена(ов) под контроль события или тканеспецифичных регуляторных элементов (например, промотора). Примеры онколитических вирусов включают, но не ограничиваются ими, реовирус, вирус долины Сенеки (SVV), вирус везикулярного стоматита (VSV), вирус болезни Ньюкасла (NDV), вирус простого герпеса (HSV), морбилливирус, аденовирус, поксвирус, ретровирус, вирус кори, пенистый вирус, альфа-вирус, лентивирус, вирус гриппа, вирус Sinbis, вирус миксомы, рабдовирус, пикорнавирус, коксакивирус, парвовирус или тому подобное. Такие онколитические вирусы известны специалистам в области медицины и вирусологии.
В некоторых вариантах осуществления данного изобретения, такой онколитический вирус получают из вируса герпеса. Herpesviridae - это большое семейство ДНК-вирусов, которые имеют общую структуру и состоят из относительно больших двухцепочечных линейных ДНК-геномов, кодирующих 100-200 генов, инкапсулированных в икосаэдрический капсид, который заключен в двухслойную липидную мембрану. Хотя онколитический вирус герпеса может происходить из различных типов HSV, особенно предпочтительными являются HSV1 и HSV2. Вирус герпеса можно генетически модифицировать так, чтобы ограничить репликацию вируса в опухолях или снизить его цитотоксичность в неделящихся клетках. Например, любой вирусный ген, участвующий в метаболизме нуклеиновых кислот, может быть инактивирован, как тимидинкиназой (Martuza et al., 1991, Science 252: 854-6), рибонуклеотидредуктазой (RR) (Mineta et al., 1994, Cancer Res. 54: 3363-66), так и урацил-N-гликозилазой (Pyles et al., 1994, J. Virol. 68: 4963-72). Другой аспект включает вирусные мутанты с дефектами функции генов, кодирующих факторы вирулентности, такие как ген ICP34.5 (Chambers et al., 1995, Proc. Natl. Acad. Sci. USA 92: 1411-5). Репрезентативные примеры онколитического вируса герпеса включают NV1020 (например, Geevarghese et al., 2010, Hum. Gene Ther. 21(9):1119-28) и T-VEC (Harrington et al., 2015, Expert Rev. Anticancer Ther. 15(12):1389-1403).
В некоторых вариантах осуществления данного изобретения, такой онколитический вирус получают из аденовируса. В описании уровня техники доступны способы конструирования онколитических аденовирусов. Преимущественная стратегия включает замену вирусных промоторов опухоль-селективными промоторами или модификации продукта(ов) аденовирусного гена E1 для инактивации его/их функции связывания с р53 или белком ретинобластомы (Rb), которые изменены в опухолевых клетках. В природном контексте ген аденовируса E1B55kDa взаимодействует с другим аденовирусным продуктом для инактивации p53 (p53 часто не регулируется в раковых клетках), предотвращая, таким образом, апоптоз. Репрезентативные примеры онколитических аденовирусов включают ONYX-015 (например, Khuri et al., 2000, Nat. Med 6(8):879-85) и H101, также называемый Oncorine (Xia et al., 2004, Ai Zheng 23(12):1666-70).
В некоторых вариантах осуществления данного изобретения, таким онколитическим вирусом является поксвирус. В контексте данного изобретения, термин «поксвирус» относится к вирусу, принадлежащему к семейству Poxviridae, с особым предпочтением для поксвируса, принадлежащего подсемейству Chordopoxviridae и более предпочтительно к роду Orthopoxvirus. Вирус осповакцины, вирус коровьей оспы, вирус оспы канареек, вирус эктромелии, вирус миксомы особенно подходят в контексте изобретения. Геномные последовательности таких поксвирусов доступны в описании уровня техники и специализированных базах данных (например, Genbank под номером доступа NC_006998, NC_003663 или AF482758.2, NC_005309, NC_004105, NC_001132 соответственно).
В конкретных и предпочтительных вариантах осуществления данного изобретения, такой онколитический поксвирус представляет собой онколитический вирус осповакцины. Вирусы осповакцины являются членами семейства поксвирусов, характеризующихся геномом двухцепочечной ДНК размером 200 т.п.н., который кодирует многочисленные вирусные ферменты и факторы, которые позволяют вирусу реплицироваться независимо от аппарата клетки-хозяина. Большинство частиц вируса осповакцины являются внутриклеточными (IMV для внутриклеточного зрелого вириона) с единственной липидной оболочкой и остаются в цитозоле инфицированных клеток до лизиса. Другая инфекционная форма представляет собой частицу с двойной оболочкой (EEV для внеклеточного, заключенного в оболочку, вириона), которая выделяется из инфицированной клетки, не лизируя ее. Хотя он может происходить от любого штамма вируса осповакцины, особенно предпочтительны штаммы Elstree, Wyeth, Copenhagen, Lister и Western Reserve. В контексте данного изобретения номенклатура генов является номенклатурой штамма копенгагенской осповакцины, если не указано иное. Однако соответствие между копенгагенским и другими штаммами осповакцины обычно имеется в литературе.
Предпочтительно такой онколитический вирус осповакцины модифицирован путем изменения одного или более вирусного гена(ов). Указанная модификация(ии) предпочтительно приводит(ят) к отсутствию синтеза или синтезу дефектного вирусного белка, неспособного обеспечить активность белка, продуцируемого в нормальных условиях немодифицированным геном. Примеры модификаций описаны в литературе с целью изменения вирусных генов, участвующих в метаболизме ДНК, вирулентности хозяина, пути ИФН (например, Guse et al., 2011, Expert Opinion Biol. Ther.11 (5): 595-608) и тому подобное. Модификации для изменения вирусного локуса охватывают делецию, мутацию и/или замену одного или более нуклеотида(ов) (смежных или несмежных) в вирусном гене или его регуляторных элементах. Модификация(ии) может быть осуществлена рядом способов, известных специалистам в данной области техники, с применением обычных рекомбинантных методик.
Более предпочтительно, чтобы такой онколитический вирус осповакцины модифицировали путем изменения гена, кодирующего тимидинкиназу (локус J2R). Фермент тимидинкиназа (ТК) (TK - thymidine kinase) участвует в синтезе дезоксирибонуклеотидов. TK необходим для репликации вируса в нормальных клетках, так как эти клетки обычно имеют низкую концентрацию нуклеотидов, тогда как это необходимо для делящихся клеток, которые содержат высокую концентрацию нуклеотидов.
В качестве альтернативы или в комбинации такой онколитический вирус осповакцины модифицируют путем изменения по меньшей мере одного или обоих генов, кодирующих рибонуклеотидредуктазу (RR) (RR - ribonucleotide reductase). В природном контексте, этот фермент катализирует восстановление рибонуклеотидов до дезоксирибонуклеотидов, что представляет собой решающий этап биосинтеза ДНК. Вирусный фермент аналогичен по структуре субъединицы ферменту млекопитающих и состоит из двух гетерологичных субъединиц, сконструированных R1 и R2, кодируемых, соответственно, I4L и F4L локусами. В контексте изобретения либо ген I4L (кодирующий большую субъединицу R1), либо ген F4L (кодирующий малую субъединицу R2), либо оба могут быть инактивированы (например, как описано в WO2009/065546 и Foloppe et al., 2008, Gene Ther., 15:1361-71). Последовательности генов J2R, I4L и F4L и их расположение в геноме различных поксвирусов доступны в общедоступных базах данных.
В некоторых вариантах осуществления данного изобретения, такой онколитический вирус содержит нуклеотидные последовательности, кодирующие аминокислотную последовательность, имеющую по меньшей мере 80% идентичности с последовательностью, указанной в таблице 2 выше. В некоторых вариантах осуществления данного изобретения, такой онколитический вирус содержит аминокислотную последовательность, имеющую по меньшей мере 85% идентичности с последовательностью, указанной в таблице 2 выше. В некоторых вариантах осуществления данного изобретения, такой онколитический вирус содержит аминокислотную последовательность, имеющую по меньшей мере 90% идентичности с последовательностью, указанной в таблице 2 выше. В некоторых вариантах осуществления данного изобретения, такой онколитический вирус содержит аминокислотную последовательность, имеющую по меньшей мере 95% идентичности с последовательностью, указанной в таблице 2 выше.
В некоторых вариантах осуществления данного изобретения, такой онколитический вирус содержит нуклеотидные последовательности, кодирующие последовательности SEQ ID NO: 20 и ID NO: 21. В некоторых вариантах осуществления данного изобретения, такой онколитический вирус содержит нуклеотидные последовательности, кодирующие последовательности SEQ ID NO: 27 и ID NO: 28. В некоторых вариантах осуществления данного изобретения, такой онколитический вирус содержит нуклеотидные последовательности, кодирующие последовательности SEQ ID NO: 33 и ID NO: 34. В некоторых вариантах осуществления данного изобретения, такой онколитический вирус содержит нуклеотидные последовательности, кодирующие последовательности SEQ ID NO: 41 и ID NO: 42.
В некоторых вариантах осуществления данного изобретения, такой онколитический вирус содержит нуклеотидные последовательности, имеющую по меньшей мере 80% идентичности с последовательностью, указанной в таблице 4 выше. В некоторых вариантах осуществления данного изобретения, такой онколитический вирус содержит нуклеотидные последовательности, имеющую по меньшей мере 85% идентичности с последовательностью, указанной в таблице 4 выше. В некоторых вариантах осуществления данного изобретения, такой онколитический вирус содержит нуклеотидные последовательности, имеющую по меньшей мере 90% идентичности с последовательностью, указанной в таблице 4 выше. В некоторых вариантах осуществления данного изобретения, такой онколитический вирус содержит нуклеотидные последовательности, имеющую по меньшей мере 95% идентичности с последовательностью, указанной в таблице 4 выше.
В некоторых вариантах осуществления данного изобретения, такой онколитический вирус содержит последовательности SEQ ID NO: 45 и 46. В некоторых вариантах осуществления данного изобретения, такой онколитический вирус содержит последовательности SEQ ID NO: 47 и 48. В некоторых вариантах осуществления данного изобретения, такой онколитический вирус содержит последовательности SEQ ID NO: 49 и 50. В некоторых вариантах осуществления данного изобретения, такой онколитический вирус содержит последовательности SEQ ID NO: 51 и 52.
Некоторые онколитические вирусы способны принимать достаточно большие вставки ДНК, чтобы обеспечить интеграцию полноразмерных последовательностей антител человека. Аттенуированные вирусы осповакцины и вирусы простого герпеса являются примерами терапевтических онколитических вирусов, чей геном достаточно велик для интеграции полноразмерных последовательностей антител IgG (Chan, W.M. et al 2014 Annu Rev Virol 1(1):119-141; Bommareddy, P.K., et al. 2018 Nat Rev Immunol 18(8):498-513). Полноразмерные антитела IgG успешно интегрированы в онколитический вирус Vaccinia, что приводит к экспрессии и внеклеточному высвобождению (продукции) полноразмерных антител IgG при инфицировании чувствительных к вирусу клеток-хозяев, например раковых клеток (Kleinpeter, P., et al. 2016, Oncoimmunology 5(10): e1220467). Аденовирусы также могут быть сконструированы для кодирования полноразмерных антител IgG, которые функционально продуцируются и секретируются при клеточной инфекции (Marino, N., et al. 2017 J Clin Invest 123(6):2447-2463).
В предпочтительном варианте осуществления данного изобретения, такой онколитический вирус представляет собой поксвирус (например, вирус осповакцины) дефектный по активности TK (в результате изменения локуса J2R) или дефект как по активности TK, так и по активности RR (в результате изменения как локуса J2R, так и по меньшей мере одного из RR-кодирующих I4L локусов и/или F4L) и содержащий (a) нуклеотидные последовательности, кодирующие последовательности SEQ ID NO: 20 и ID NO: 21 или (b) нуклеотидные последовательности, кодирующие последовательности SEQ ID NO: 27 и ID NO: 28 или (c) нуклеотидные последовательности, кодирующие последовательности SEQ ID NO: 33 и ID NO: 34 или (d) нуклеотидные последовательности, кодирующие последовательности SEQ ID NO: 41 и ID NO: 42.
При необходимости может быть выгодным, чтобы нуклеотидная последовательность(и), вставленная в описанный в данном документе онколитический вирус, включала(ют) дополнительные регуляторные элементы для облегчения экспрессии, доставки и биологической активности. Например, сигнальный пептид может быть включен для облегчения секреции вне клетки-продуцента (например, инфицированной клетки). Сигнальный пептид обычно вставляют на N-конце кодируемого полипептида сразу после инициатора Met. Выбор сигнальных пептидов широк и доступен специалистам в данной области техники. Например, сигнальные пептиды, происходящие из другого иммуноглобина (например, IgG тяжелой цепи), можно применять в контексте данного изобретения, чтобы обеспечить секрецию анти-CTLA4 антитела, описанного в данном документе, вне клетки-продуцента. В иллюстративных целях можно сослаться на последовательности SEQ ID NO: 53 и SEQ ID NO: 54, содержащих легкую цепь и тяжелую цепь антитела 4-E03, описанного в данном документе, снабженные пептидными сигналами, происходящими от IgG.
Особенно предпочтительным онколитическим вирусом является вирус осповакцины (например, копенгагенский штамм), дефектный как по активности TK, так и по активности RR (в результате изменения как локуса J2R, так и локусов I4L), и содержащий нуклеотидные последовательности, кодирующие последовательности SEQ ID NO: 20 и SEQ ID NO: 21 или SEQ ID NO: 53 и SEQ ID NO: 54.
В некоторых вариантах осуществления данного изобретения, такой онколитический вирус может дополнительно содержать дополнительную нуклеотидую последовательность(и) представляющие терапевтический интерес, такие как нуклеотидная последовательность(и), кодирующие иммуномодулирующий полипептид(ы) (т.е. полипептид участвует в стимуляции иммунного ответа прямо или косвенно). Репрезентативные примеры подходящих иммуномодулирующих полипептидов включают, без каких-либо ограничений, цитокины и хемокины с особым предпочтением для колониестимулирующий фактор гранулоцитов макрофагов (GM-CSF) и, в частности, GM-CSF человека, приматов, отличных от человека, или мыши. Дополнительная нуклеотидная последовательность может быть легко получена стандартными способами молекулярной биологии (например, амплификацией ПЦР, клонированием кДНК, химическим синтезом) с применением данных о последовательностях, доступных в данной области техники, и информации, представленной в данном документе. Особенно предпочтительным онколитическим вирусом является вирус осповакцины (например, копенгагенский штамм), дефектный как по активности TK, так и по активности RR (в результате изменения как J2R локуса, так и I4L локусов) и содержащий нуклеотидные последовательности, кодирующие последовательности SEQ ID NO: 20 и ID NO: 21 или SEQ ID NO: 53 и SEQ ID NO: 54 и нуклеотидную последовательность, кодирующую GM-CSF, с особым предпочтением для GM-CSF человека (например, имеющий последовательности SEQ ID NO: 55 или SEQ ID NO: 56) или GM-CSF мыши (например, имеющий последовательности SEQ ID NO: 57 или SEQ ID NO: 58).
Кроме того, нуклеотидные последовательности, которые должны быть вставлены в такой онколитический вирус, могут быть оптимизированы для обеспечения высокого уровня экспрессии в специфической клетке-хозяине или субъекте путем модификации одного или более кодона(ов). Помимо оптимизации применения кодонов, также могут быть предусмотрены различные модификации для предотвращения кластеризации редких, неоптимальных кодонов, присутствующих в концентрированных областях, и/или для подавления или модификации элементов «отрицательной» последовательности, которые, как ожидается, будут отрицательно влиять на уровни экспрессии. Такие элементы отрицательной последовательности включают без ограничения участки с очень высоким (>80%) или очень низким (<30%) содержанием GC; участки последовательности, богатые AT или GC; нестабильные прямые или инвертированные повторяющиеся последовательности; вторичные конструкции R A; и/или внутренние скрытые регуляторные элементы, такие как внутренние ТАТА-боксы, хи-сайты, сайты входа в рибосомы и/или донорные/акцепторные сайты сплайсинга.
В некоторых вариантах осуществления данного изобретения, нуклеотидная последовательность(и) находится под контролем подходящих регуляторных элементов для их правильной экспрессии в клетке-хозяине или субъекте. В контексте данного изобретения, термин «регуляторные элементы» относится к любому элементу, который позволяет, способствует или модулирует экспрессию кодирующей нуклеотидной последовательности(ей) в данной клетке-хозяине или субъекте, включая их репликацию, дупликацию, транскрипцию, сплайсинг, трансляцию, стабильность и/или транспорт внутри или вне экспрессирующей клетки. Специалистам в данной области техники будет понятно, что выбор регуляторных элементов может зависеть от таких факторов, как сама нуклеотидная последовательность, вирус, в который она вставлена, клетка-хозяин или субъект, желаемый уровень экспрессии и т.д. Промотор имеет особое значение. В контексте данного изобретения это может быть конститутивное управление экспрессией нуклеотидной последовательности, которую она контролирует во многих типах клеток-хозяев, или специфическая для определенных клеток-хозяев, или регулируемая в ответ на определенные события или экзогенные факторы (например, температурой, добавкой питательных веществ, гормона и т.д.) или в соответствии с фазой вирусного цикла (например, поздней или ранней). Промоторы, адаптированные к вирус-опосредованной экспрессии, известны в данной области техники. Репрезентативные примеры экспрессии онколитическим поксвирусом включают без ограничения вакцину p7.5K, pH5.R, p11K7.5, TK, p28, p11, pB2R, pA35R, K1L и промоторы pSE/L (Erbs et al., 2008, Cancer Gene Ther. 15 (1): 18-28; Orubu et al. 2012, PloS One 7: e40167), ранние/поздние химерные промоторы и синтетические промоторы (Chakrabarti et al., 1997, Biotechniques 23: 1094-7; Hammond et al, 1997, J. Virol Methods 66: 135-8; и Kumar and Boyle, 1990, Virology 179: 151-8). В предпочтительных вариантах осуществления данного изобретения, нуклеотидные последовательности легкой и тяжелой цепей описанного в данном документе антитела соответственно находятся под контролем промоторов, имеющих одинаковую силу транскрипции, и предпочтительно под контролем одного и того же промотора (например, p7.5K такого как описанный в последовательности SEQ ID NO: 59 или pH5.R, такого как тот, который описан в последовательности SEQ ID NO: 60) для получения аналогичного уровня экспрессии для обеих цепей и, следовательно, оптимальной сборки антитела в виде гетеротетрамерного белка (т.е. во избежание избытка несвязанной цепи). Дополнительная нуклеотидная последовательность (например, кодирующая GM-CSF) может быть помещена под другой промотор (например, pSE/L такой как описанный в последовательности SEQ ID NO: 61).
Вставка нуклеотидной последовательности(ей) (возможно, снабженной соответствующими регуляторными элементами) в геном такого онколитического вируса производится обычными способами, либо с применением соответствующих рестрикционных ферментов, либо, предпочтительно, путем гомологичной рекомбинации. Нуклеотидная последовательность(и) может быть независимо вставлена в любое место вирусного генома. Могут быть рассмотрены различные сайты встраивания, например, в несущественный вирусный ген, в межгенный участок или в некодирующую часть генома такого онколитический вирус. J2R локус и/или I4L локус особенно подходят для онколитического вируса, представляющего собой поксвирус (например, онколитический вирус осповакцины). После вставки нуклеотидной последовательности(ей) в вирусный геном, вирусный локус в сайте вставки может быть удален, по меньшей мере, частично. В одном варианте осуществления данного изобретения, эта делеция или частичная делеция может привести к подавлению экспрессии вирусного генного продукта, кодируемого полностью или частично удаленным локусом, что приведет к нарушению указанной вирусной функции вируса. Особенно предпочтительным онколитическим вирусом является вирус осповакцины, дефектный по TK и/или RR, содержащий кассету, кодирующую тяжелую цепь, вставленную в J2R локус, и кассету, кодирующую легкую цепь вставленный в I4L локус. Кассета, кодирующая дополнительную нуклеотидную последовательность, кодирующую GM-CSF, может быть вставлена в другое место вирусного генома или в J2R или I4L локус, с предпочтением для вставки в I4L локус.
Данное изобретение также относится к способу создания такого онколитического вируса, описанного в данном документе, и, в частности, онколитического поксвируса в подходящей клетке-хозяине (клетке-продуценте). В некоторых вариантах осуществления данного изобретения, такой способ включает одну или более стадию(ий) гомологичной рекомбинации между вирусным геномом и плазмидой-переносчиком, содержащей нуклеотидную последовательность(и), которую необходимо вставить (возможно, с регуляторными элементами), фланкированную на 5'-конце и 3'-конце с вирусными последовательностями соответственно присутствующими против хода транскрипции и по ходу транскрипции сайта вставки. Указанная плазмида-переносчик может быть создана и введена в клетку-хозяина рутинными методами (например, путем трансфекции). Геном вируса может быть введен в клетку-хозяин путем инфекции. Размер каждой фланкирующей вирусной последовательности может варьироваться от по меньшей мере 100 п.о. до не более 1500 п.о. с каждой стороны нуклеотидной последовательности (предпочтительно от 200 до 550 п.о. и более предпочтительно от 250 до 500 п.о.). Гомологичная рекомбинация, позволяющая генерировать такой онколитический вирус, предпочтительно осуществляется в культивированных линиях клеток (например, HeLa, Vero) или в клетках куриных эмбриональных фибробластов (CEF), полученных из яиц с зародышем.
В некоторых вариантах осуществления данного изобретения, идентификация онколитического вируса, имеющего нуклеотидные последовательности, кодирующие анти-CTLA4, и, возможно, дополнительную нуклеотидную последовательность (например, GM-CSF), может быть облегчена путем применения селекционного и/или обнаруживаемого гена. В предпочтительных вариантах осуществления данного изобретения, плазмида-переносчик дополнительно содержит маркер селекции с особым предпочтением для гена GPT (кодирующего гуанинфосфорибозилтрансферазу), позволяющего расти в селективной среде (например, в присутствии микофеноловой кислоты, ксантина и гипоксантина), или детектируемого гена, кодирующего обнаруживаемый генного продукта, такого как GFP, e-GFP или mCherry. Кроме того, можно также рассмотреть возможность применения эндонуклеазы, способной обеспечивать двухцепочечный разрыв в указанном селективном или обнаруживаемом гене. Указанная эндонуклеаза может быть в форме белка или экспрессироваться вектором экспрессии.
После создания, такой онколитический вирус может быть амплифицирован в подходящую клетку-хозяина с применением обычных методов, включая культивирование трансфицированной или инфицированной клетки-хозяина в подходящих условиях, чтобы обеспечить продуцирование и извлечение инфекционных частиц.
Данное изобретение также относится к способу получения описанного в данном документе онколитического вируса. Предпочтительно сказать, что способ включает этапы а) получения линии клеток-продуцентов, b) трансфекции или инфицирования полученной линии клеток-продуцентов онколитическим вирусом, c) культивирования трансфецированной или инфицированной линии клеток-продуцентов в подходящих условиях, чтобы обеспечить продуцирование вируса, d) восстановление продуцированного вируса из культуры указанной линии клеток-продуцентов и, необязательно, e) очистка указанного восстановленного вируса.
В некоторых вариантах осуществления данного изобретения, клетка-продуцент выбрана из группы, состоящей из клеток млекопитающих (например, человека или не человека), таких как клетки HeLa (например, ATCC-CRM-CCL-2™ или ATCC-CCL-2.2™), HER96, PER-C6 (Fallaux et al., 1998, Human Gene Ther. 9: 1909-17), клеточные линии хомяка, такие как BHK-21 (ATCC CCL-10) и т.д., и клетки птиц, такие как те, что описаны в WO2005/042728, WO2006/108846, WO2008/129058, WO2010/130756, WO2012/001075, а также первичный фибробласт куриного эмбриона (CEF), полученный из куриных эмбрионов, полученных из оплодотворенных яиц. Клетки-продуценты предпочтительно культивируют в подходящей среде, в которую, при необходимости, можно добавлять сыворотку и/или подходящий фактор(ы) роста или не добавлять (например, среда определенного химического состава, предпочтительно свободная от продуктов животного или человеческого происхождения). Соответствующая среда может быть легко выбрана специалистом в данной области техники в зависимости от клеток-продуцентов. Такие среды коммерчески доступны. Клетки-продуценты предпочтительно культивируют при температуре от +30°C до +38°C (более предпочтительно примерно при +37°C) в течение от 1 до 8 дней до заражения. При необходимости можно сделать несколько пассажей от 1 до 8 дней, чтобы увеличить общее количество клеток.
На этапе b) клетки-продуценты инфицируются онколитическим вирусом в соответствующих условиях с применением соответствующего множественного инфекцирования (MOI) (MOI - multiplicity of infection), чтобы обеспечить продуктивное инфицирование клеток-продуцентов. В иллюстративных целях, подходящее MOI находится в диапазоне от 10-3 до 20, причем особое предпочтение для MOI составляет от 0,01 до 5 и более предпочтительно от 0,03 до 1. Этап заражения проводится в среде, которая может быть такой же или отличной от среды, применяемой для культивирования клеток-продуцентов.
На этапе c) инфицированные клетки-продуценты затем культивируют в подходящих условиях, хорошо известных специалистам в данной области техники, пока не образуются дочерние вирусные частицы. Культивирование инфицированных клеток-продуцентов также предпочтительно проводят в среде, которая может быть такой же или отличаться от среды/сред, применяемых для культивирования клеток-продуцентов и/или на стадии инфицирования, при температуре между от +32°C до +37°C, от 1 до 5 дней.
На этапе d) вирусные частицы, полученные на этапе c), собирают из супернатанта культуры и/или клеток-продуцентов. Восстановление из клеток-продуцентов может потребовать этап, позволяющий разрушить мембрану клеток-продуцентов, чтобы позволить высвобождение вируса. Нарушение мембраны клетки-продуцента может быть вызвано различными методами, хорошо известными специалистам в данной области техники, включая, но не ограничиваясь ими, замораживание/оттаивание, гипотонический лизис, обработку ультразвуком, микрофлюидизацию, гомогенизацию с высоким сдвигом (также называемую высокоскоростной) или гомогенизацию под высоким давлением.
Восстановленный онколитический вирус может быть, по меньшей мере, частично очищен перед распределением в дозах и применением, как описано в данном документе. В данной области техники доступно огромное количество этапов и способов очистки, включая, например, осветление, ферментативную обработку (например, эндонуклеазой, протеазой и т.д.), этапы хроматографии и фильтрации. Соответствующие способы описаны в данной области техники (см., например, WO2007/147528; WO2008/138533, WO2009/100521, WO2010/130753, WO2013/022764).
В одном варианте осуществления данного изобретения, данное изобретение также относится к клетке, инфицированной описанным в данном документе онколитическим вирусом.
Изобретение также охватывает фармацевтические композиции, содержащие вирус, такой как онколитический вирус, как обсуждалось выше, и фармацевтически приемлемый разбавитель, носитель и/или адъювант.
Фармацевтическая композиция в некоторых вариантах осуществления данного изобретения может быть в форме CAR-T-клетки, несущей части или полные последовательности антитела, описанные в данном документе, как часть последовательности, кодирующей его химерный антиген Т-клеточного рецептора.
Изобретение также охватывает фармацевтические композиции, содержащие CAR-T-клетку, как обсуждалось выше, и фармацевтически приемлемый разбавитель, носитель и/или адъювант.
Изобретение также включает другие терапевтические методики или «формы» лекарственных средств, такие как конъюгаты антитело-лекарство, слитые белки и т.д., и фармацевтическую композицию, содержащую такие терапевтические методики.
Молекулы антител, нуклеотидные последовательности, плазмиды, вирусы, клетки и/или фармацевтические композиции, описанные в данном документе, могут быть пригодны для парентерального введения, включая водные и/или неводные стерильные растворы для инъекций, которые могут содержать антиоксиданты, и/или буферы, и/или бактериостатики, и/или растворенные вещества, которые делают композицию изотоничной крови предполагаемого реципиента; и/или водные и/или неводные стерильные суспензии, которые могут включать суспендирующие агенты и/или загустители. Молекулы антител, нуклеотидные последовательности, плазмиды, клетки и/или фармацевтические композиции, описанные в данном документе, могут быть представлены в контейнерах для однократной или многократной дозы, например, в запечатанных ампулах и флаконах, и могут храниться в высушенном сублимацией (т.е. лиофилизированных) состоянии, требующем добавления только стерильного жидкого носителя, например, воды для инъекций, непосредственно перед применением.
Экстемпоральные инъекционные растворы и суспензии можно приготовить из стерильных порошков и/или гранул, и/или таблеток ранее описанного вида.
При парентеральном введении пациентам-людям уровень суточной дозы молекулы анти-CTLA-4 антитела обычно составляет от 1 мг/кг веса тела пациента до 20 мг/кг, а в некоторых случаях даже до 100 мг/кг вводится в разовой или разделенной дозе. Более низкие дозы можно применять в особых обстоятельствах, например, в сочетании с продолжительным введением. В любом случае врач определит фактическую дозировку, которая будет наиболее подходящей для каждого отдельного пациента, и которая будет варьировать в зависимости от возраста, веса и реакции конкретного пациента. Приведенные выше дозы являются типичными для среднего случая. Конечно, могут быть отдельные случаи, когда оправданы более высокие или более низкие диапазоны дозировок, и такие случаи относятся к сфере применения данного изобретения.
Как правило, описанная в данном документе фармацевтическая композиция (или лекарственное средство), содержащая молекулу антитела, будет содержать молекулу анти-CTLA-4 антитела в концентрации от между приблизительно 2 мг/мл и 150 мг/мл или от между приблизительно 2 мг/мл и 200 мг/мл. В некоторых вариантах осуществления данного изобретения, фармацевтические композиции будут содержать молекулу анти-CTLA-4 антитела в концентрации 10 мг/мл.
Обычно фармацевтическая композиция (или лекарственное средство) будет содержать онколитический вирус, описанный в данном документе, в концентрации между приблизительно от 103 до 1012 в.ч. (вирусные частицы), и.е. (инфекционные единицы) или БОЕ (бляшкообразующие единицы) в зависимости от вируса и количественного метода. Количество БОЕ, присутствующее в образце, может быть определено путем подсчета количества бляшек после инфицирования пермиссивных клеток (например, клеток CEF или Vero) для получения титра бляшкообразующих единиц (БОЕ), количества в.ч. путем измерения оптической плотности A260, и количество и.е. с помощью количественной иммунофлуоресценции, например, с применением антивирусных антител. В качестве общего руководства отдельные дозы, которые подходят для фармацевтической композиции, содержащей диапазон онколитических поксвирусов от приблизительно 103 до приблизительно 1010 БОЕ, преимущественно от приблизительно 103 БОЕ до приблизительно 109 БОЕ, предпочтительно от приблизительно 104 БОЕ до приблизительно 108 БОЕ; и более предпочтительно от приблизительно от 104 БОЕ до приблизительно 107 БОЕ.
Обычно для людей пероральное или парентеральное введение молекулы антител, нуклеотидных последовательностей, плазмид, вирусов, клеток и/или фармацевтических композиций, описанные в данном документе, является предпочтительным и наиболее удобным путем. Для ветеринарного применения молекулы антител, нуклеотидные последовательности, плазмиды, вирусы, клетки и/или фармацевтические композиции, описанные в данном документе, вводятся в виде подходящего приемлемого состава в соответствии с обычной ветеринарной практикой, и ветеринарный хирург определит режим дозирования и способ введения, который будет наиболее подходящем для конкретного животного. Таким образом, данное изобретение относится к фармацевтической композиции, содержащую количество молекулы антитела, нуклеотидных последовательностей, плазмиды, вируса и/или клетки по данному изобретению, эффективное для лечения различных состояний (как описано выше и далее ниже). Желательно, чтобы молекулы антител, нуклеотидные последовательности, плазмиды, вирусы, клетки и/или фармацевтические композиции, описанные в данном документе, адаптированы для доставки с помощью пути, выбранном из группы, включающей: внутривенный; внутриопухолевый; внутримышечный; подкожный. Введение может быть в форме одной инъекции или нескольких повторных инъекций (например, с одинаковыми или разными дозами, одним и тем же или разными путями, в одно и то же или в разные места введения). Для целей иллюстрации, индивидуальные дозы, содержащие приблизительно 104, 5x104, 105, 5x105, 106, 5x106, 107, 5x107, 108, 5x108, 109, 5x109 или 1010 БОЕ онколитического поксвирус (например, описанный в данном документе TK- и RR-дефектный вирус осповакцины) особенно подходят для внутриопухолевого введения.
Данное изобретение также включает молекулы антител, нуклеотидные последовательности, плазмиды, вирусы, клетки и/или фармацевтические композиции, описанные в данном документе, включающие фармацевтически приемлемые кислые аддитивные соли или основанные аддитивные соли полипептидных связывающих групп по данному изобретению. Кислоты, которые применяются для получения фармацевтически приемлемых кислых аддитивных солей вышеупомянутых  соединений, полезных в настоящем изобретении, являются кислотами, которые образуют нетоксичные кислые аддитивные соли, т.е. соли, содержащие фармакологически приемлемые анионы, в частности, такие как соли гидрохлорид, гидробромид, гидройодид, нитрат, сульфат, бисульфат, фосфат, кислый фосфат, ацетат, лактат, цитрат, кислый цитрат, тартрат, битартрат, сукцинат, малеат, фумарат, глюконат, сахарат, бензоат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат и памоат [т.е. 1,1' - метилен-бис-(2-гидрокси-3 нафтоат)]. Фармацевтически приемлемые
соединений, полезных в настоящем изобретении, являются кислотами, которые образуют нетоксичные кислые аддитивные соли, т.е. соли, содержащие фармакологически приемлемые анионы, в частности, такие как соли гидрохлорид, гидробромид, гидройодид, нитрат, сульфат, бисульфат, фосфат, кислый фосфат, ацетат, лактат, цитрат, кислый цитрат, тартрат, битартрат, сукцинат, малеат, фумарат, глюконат, сахарат, бензоат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат и памоат [т.е. 1,1' - метилен-бис-(2-гидрокси-3 нафтоат)]. Фармацевтически приемлемые  аддитивные соли также можно применять для получения фармацевтически приемлемых солевых форм агентов согласно настоящему изобретению. Химические основания, которые можно применять в качестве реактивов для получения фармацевтически приемлемых
аддитивные соли также можно применять для получения фармацевтически приемлемых солевых форм агентов согласно настоящему изобретению. Химические основания, которые можно применять в качестве реактивов для получения фармацевтически приемлемых  солей настоящих агентов, которые являются кислотными по своей природе, являются химические основания, которые образуют с такими соединениями нетоксичные
солей настоящих агентов, которые являются кислотными по своей природе, являются химические основания, которые образуют с такими соединениями нетоксичные  соли. Такие нетоксичные
соли. Такие нетоксичные  соли включают, но не ограничиваются ими, нетоксичные
соли включают, но не ограничиваются ими, нетоксичные  соли, являющиеся производными таких фармакологически приемлемых катионов, как катионы щелочных металлов (например, калия и натрия) и катионы щелочноземельных металлов (например, калция и магния). кальций и магний), аммоний или водорастворимые аминовые аддитивные соли, такие как N-метилглюкамин-(меглюмин), а также в том числе низший алканоламмоний и другие
соли, являющиеся производными таких фармакологически приемлемых катионов, как катионы щелочных металлов (например, калия и натрия) и катионы щелочноземельных металлов (например, калция и магния). кальций и магний), аммоний или водорастворимые аминовые аддитивные соли, такие как N-метилглюкамин-(меглюмин), а также в том числе низший алканоламмоний и другие  соли фармацевтически приемлемых органических аминов. Молекулы антител, нуклеотидные последовательности, плазмиды, вирусы и/или клетки, описанные в данном документе, могут быть лиофилизированы для хранения и восстановлены в подходящем носителе перед применением. Можно применять любой подходящий метод лиофилизации (например, распылительная сушка, сушка осадка) и/или методы ресуспензирования. Специалисты в данной области техники примут во внимание то, что лиофилизация и ресуспензирование могут привести к потере организмом в различной степени активности антител (например, при применении обычных иммуноглобулинов антитела IgM имеют тенденцию к большей потере активности, чем антитела IgG) и что для компенсации этого уровни применения могут быть скорректированы в сторону увеличения. В одном варианте осуществления данного изобретения лиофилизированная (сублимированная) полипептидсвязывающий фрагмент теряет не более чем около 20%, или не более чем около 25%, или не более чем около 30%, или не более чем около 35%, или не более чем около 40%, или не более чем около 45%, или не более чем около 50% своей активности (до лиофилизации) при регидратации.
соли фармацевтически приемлемых органических аминов. Молекулы антител, нуклеотидные последовательности, плазмиды, вирусы и/или клетки, описанные в данном документе, могут быть лиофилизированы для хранения и восстановлены в подходящем носителе перед применением. Можно применять любой подходящий метод лиофилизации (например, распылительная сушка, сушка осадка) и/или методы ресуспензирования. Специалисты в данной области техники примут во внимание то, что лиофилизация и ресуспензирование могут привести к потере организмом в различной степени активности антител (например, при применении обычных иммуноглобулинов антитела IgM имеют тенденцию к большей потере активности, чем антитела IgG) и что для компенсации этого уровни применения могут быть скорректированы в сторону увеличения. В одном варианте осуществления данного изобретения лиофилизированная (сублимированная) полипептидсвязывающий фрагмент теряет не более чем около 20%, или не более чем около 25%, или не более чем около 30%, или не более чем около 35%, или не более чем около 40%, или не более чем около 45%, или не более чем около 50% своей активности (до лиофилизации) при регидратации.
В некоторых вариантах осуществления данного изобретения, вирусная композиция подходящим образом забуферена при физиологическом или слабощелочном pH (например, от приблизительно pH 7 до приблизительно pH 9 с особым предпочтением при pH, составляющем от 7 до 8,5 и более конкретно близком к 8). Может быть полезно также включить в вирусную композицию одновалентную соль, чтобы обеспечить соответствующее осмотическое давление. Указанная одновалентная соль может быть, в частности, выбрана из NaCl и KCl, предпочтительно указанной одновалентной солью является NaCl, предпочтительно в концентрации от 10 до 500 мМ (например, 50 мМ). Подходящая вирусная композиция содержит 50 г/л сахарозы, 50 мМ NaCl, 10 мМ трис-HCl и 10 мМ глутамат натрия, pH 8. Композиция также может быть составлена таким образом, чтобы включать криопротектор для защиты онколитического вируса при низкой температуре хранения. Подходящие криопротекторы включают, без ограничения, сахарозу (или сахарозу), трегалозу, мальтозу, лактозу, маннит, сорбит и глицерин, предпочтительно в концентрации от 0,5 до 20% (вес в г/объем в л, обозначаемый как вес/объем) в виде высокомолекулярных полимеров, таких как декстран или поливинилпирролидон (ПВП).
Молекулы анти-CTLA-4 антитела, нуклеотидные последовательности и фармацевтические композиции, описанные в данном документе, могут быть применены для лечения рака у субъекта.
Данная заявка включает, что субъект может быть млекопитающим или не млекопитающим. Предпочтительно, субъект-млекопитающее представляет собой человека или не млекопитающее, такое как, лошадь, корова, овца, свинья, верблюд, или собака, или кошка. Более всего предпочтительно, чтобы субъект-млекопитающее был человеком.
Под «демонстрировать» в данной заявке подразумевается, что субъект демонстрирует симптом рака и/или диагностический маркер рака; и/или симптом рака и/или диагностический маркер рака можно измерить и/или оценить, и/или количественно определить.
Специалист в области медицины сразу поймет, каковы симптомы рака и диагностические маркеры рака, а также, как измерить и/или оценить, и/или количественно определить, происходит ли уменьшение или увеличение тяжести симптомов рака или уменьшение или увеличение диагностических маркеров рака; а также как эти симптомы рака и/или диагностические маркеры рака можно использовать для формирования прогноза течения рака.
Лечение рака часто назначают в виде курса лечения, то есть лекарственный препарат вводят в течение определенного периода времени. Продолжительность курса лечения будет зависеть от ряда факторов, которые среди прочего могут включать тип вводимого лекарственного препарата; тип рака, который подвергается лечению; тяжесть рака, который подвергается лечению; возраст и состояние здоровья субъекта.
Под «во время лечения» в данной заявке подразумевается то, что субъект в настоящее время проходит курс лечения и/или получает лекарственный препарат, и/или получает курс лекарственного препарата.
В некоторых вариантах осуществления данного изобретения рак, который подвергается лечению в соответствии с данным изобретением, является солидным раком.
В некоторых вариантах осуществления данного изобретения, рак выбран из группы, состоящей из развитой солидной опухоли, меланомы и других злокачественных новообразований кожи, синовиальной саркомы, немелкоклеточного рака легкого (NSCLC), мелкоклеточного рака легкого (SCLC), рака мочевого пузыря, рака простаты, мезотелиомы, рака яичников, рака груди, почечно-клеточного рака, гепатоцеллюлярной карциномы, рака головы и шеи и колоректального рака.
Каждый из вышеописанных видов рака хорошо известен, а симптомы и диагностические маркеры рака хорошо описаны, как и лекарственные препараты, применяющиеся для лечения этих видов рака. Соответственно, симптомы, диагностические маркеры рака и лекарственные препараты, применяющиеся для лечения вышеуказанных типов рака, известны специалистам в области медицины.
Клинические определения диагноза, прогноза и прогрессирования большого количества раковых заболеваний основаны на определенных классификациях, известных как определение стадии рака. Эти системы определения стадии рака действуют для сопоставления ряда различных диагностических маркеров рака и симптомов рака, для обеспечения формулировки диагноза и/или прогноза, и/или прогрессирования рака. Специалисту в области онкологии будет известно, как оценить диагноз, и/или прогноз, и/или прогрессирование рака, используя систему определения стадии рака, и какие диагностические маркеры рака и симптомы рака следует применять для этого.
Под «определением стадии рака» в данной заявке подразумевается определение стадии рака по классификации Rai, которая включает в себя стадию 0, стадию I, стадию II, стадию III и стадию IV, и/или по классификации Binet, которая включает в себя стадию А, стадию B и стадию C, и/или по классификации Ann Arbour, которая включает стадию I, стадию II, стадию III и стадию IV.
Известно, что рак может вызывать аномалии в морфологии клеток. Эти аномалии часто повторно встречаются при определенных видах рака, что означает то, что исследование этих изменений в морфологии (также известное как гистологическое исследование) можно применять в диагностике или прогнозировании рака. Методы визуализации образцов для изучения морфологии клеток и подготовки образцов для визуализации хорошо известны в данной области техники; например, световая микроскопия или конфокальная микроскопия.
Под «гистологическим исследованием» в данной заявке подразумевается наличие мелких зрелых лимфоцитов и/или наличие мелких зрелых лимфоцитов с узкой каймой цитоплазмы, наличие мелких зрелых лимфоцитов с плотным ядром, лишенным отчетливо видимых ядрышек, и/или наличие мелких зрелых лимфоцитов с узкой каймой цитоплазмы, и/или с плотным ядром, лишенным отчетливо видимых ядрышек, и/или наличие атипичных клеток, и/или расщепленных клеток, и/или пролимфоцитов.
Хорошо известно, что рак является результатом мутаций в ДНК клетки, которые могут привести к тому, что клетка избегает клеточной гибели или бесконтрольно размножается. Поэтому исследование этих мутаций (также известное как цитогенетическое исследование) может быть полезным инструментом для оценки диагноза и/или прогноза рака. Примером этого является делеция хромосомной локации 13q14.1, которая характерна для хронической лимфоцитарной лейкемии. Методы исследования мутаций в клетках хорошо известны в данной области техники; например, флуоресцентная гибридизация in situ (FISH).
Под «цитогенетическим исследованием» в данной заявке подразумевается исследование ДНК в клетке и, в частности, в хромосоме. Цитогенетическое исследование можно применять для выявления изменений в ДНК, которые могут быть связаны с наличием рефрактерного рака и/или рецидивирующего рака. Такие изменения ДНК могут включать: делеции в длинном плече хромосомы 13 и/или делеции локуса 13q14.1 хромосомы, и/или трисомию хромосомы 12, и/или делеции в длинном плече хромосомы 12, и/или делеции в длинном плече хромосомы 11, и/или делецию 11q, и/или делеции в длинном плече хромосомы 6, и/или делецию 6q, и/или делеции в коротком плече хромосомы 17, и/или делецию в 17p, и/или транслокацию t(11:14), и/или транслокацию (q13:q32), и/или перестройку рецептора гена антигена, и/или перестройки BCL2, и/или перестройки BCL6, и/или транслокации t(14:18), и/или транслокации t(11:14), и/или транслокации (q13:q32), и/или транслокации (3:v), и/или транслокации (8:14), и/или транслокации (8:v), и / или транслокации t(11:14) и (q13:q32).
Известно, что субъекты больные раком проявляют определенные физикальные симптомы, которые часто являются результатом бремени рака на организм. Эти симптомы часто повторяются при одном и том же раке, и поэтому могут быть характерными для диагноза, и/или прогноза, и/или прогрессирования заболевания. Специалист в области медицины должен понимать, какие физикальные симптомы связаны с какими видами рака, и как оценка этих физикальных систем может коррелировать с диагнозом, и/или прогнозом, и/или прогрессированием заболевания. Под «физикальными симптомами» в данной заявке подразумевается гепатомегалия и/или спленомегалия.
Краткое описание графических материалов
В приведенных ниже примерах делается ссылка на следующие фигуры:
Фиг. 1. Антитела по данному изобретению специфически связывают CTLA-4
С помощью ИФА было продемонстрировано, что антитела связываются с CTLA-4 и CTLA-4 человека, но не с белком CD28 человека. Связывание 2-C06 (фиг. 1A), 4-E-03 (фиг. 1B), 5-B07 (фиг. 1C) сравнивали с Ервой (фиг. 1D).
Фиг. 2. Дозозависимое связывание анти-CTLA-4 мАт с клетками, трансфицированными hCTLA-4
Анти-CTLA-4 мАт (фиг. 2A-2D) демонстрирует сильное связывание с CTLA-4-экспрессирующими клетками 293T, аналогичными Ервой (фиг. 2E).
Фиг. 3. Анти-CTLA-4 мАт связываются с in vitro-активированными CD4+ Т-клетками человека
CD4+ Т-клетки, полученные из периферической крови человека, стимулировали in vitro. Связывание анти-CTLA-4 мАт (сплошные линии, верхний ряд) анализировали с помощью FACS и сравнивали с Ервой (пунктирная линия, верхний ряд) и коммерческим антителом FACS (нижний ряд).
Фиг. 4. Блокирование связывания на in vitro-активированных CD4+ Т-клетках
In vitro-активированные CD4+ Т-клетки человека окрашивали Alexa 647-меченными анти-CTLA-4 мАт (черная линия). Связывание антител блокировалось белком rhCTLA-4-Fc (серая линия).
Фиг. 5. Связывание с in vitro-активированными CD4+ Т-клетками яваеского макака
CD4+ Т-клетки, полученные из периферической крови яванского макака, стимулировали in vitro с CD3/CD28 динабусами. Связывание анти-CTLA-4 мАт (сплошные линии, верхний ряд) анализировали с помощью FACS и сравнивали с Ервой (пунктирная линия, верхний ряд) и коммерческим антителом FACS (нижний ряд).
Фиг. 6. Блокирование связывания клеток белком CTLA-4 человека и яванского макака
Клетки 293T-CTLA-4 окрашивали Alexa 647-меченными анти-CTLA-4 мАт (черная линия). Связывание антител блокировалось белком rhCTLA-4-Fc (светло-серая линия) и белком rcmCTLA-4-Fc (темно-серая линия).
Фиг. 7. Связывание с клетками 293T, экспрессирующими CTLA-4 яванского макака
Клетки 293T временно трансфицировали с CTLA-4 яванского макака, и связывание анти-CTLA-4 мАт в различных концентрациях анализировали с помощью FACS.
Фиг. 8. Ожидаемое отсутствие связывания с покоящимися МКПК человека/яванского макака
4-E03, а также 2-C06, 5-B07 и 2-F09 (данные не показаны) - не демонстрируют неспецифического связывания с различными субпопуляциями клеток в МКПК человека (верхний ряд) и яванского макака (нижний ряд), как анализировали FACS.
Фиг. 9. Ожидаемое отсутствие прямой агонистической активности
CFSE-меченные CD4+ Т-клетки от здоровых доноров стимулировали покрытыми анти-CD3 плюс растворимыми анти-CTLA-4 мАт или анти-CD28.% делящихся клеток (CFSElow CD25+ клетки) определяли через 3 дня с помощью FACS. (A) графики FACS одного репрезентативного эксперимента (B), обобщающий график 6 доноров.
Фиг. 10. Блокирующая активность CD80/CD86
Анти-CTLA-4 мАт блокируют связывание CD80 (фиг. 8A) и CD86 (фиг. 8b) с его лигандом CTLA-4, как демонстрирует ИФА.
Фиг. 11. Блокирование функционального лиганда in vitro
МКПК стимулировали с SEB плюс титрующими дозами анти-CTLA-4 антител. Количество секретированного ИЛ-2 в супернатанте определяли с помощью MSD. На этой фигуре показан 1 репрезентативный донор из 6.
Фиг. 12. Анализ АЗКЦ на in vitro-активированных CD4+ Т-клетках
In vitro-активированные CD4+ Т-клетки от здоровых доноров, предварительно оспонизированные анти-CTLA-4 мАт в концентрации 10 мкг/мл, совместно культивировали с НК-клетками (линия клеток НК-92) в соотношении 2:1. Активность АЗКЦ оценивали с помощью FACS, как описано ниже. На фиг. показано среднее значение +SD для 4-8 доноров.
Фиг. 13. CTLA-4 в наибольшей степени экспрессируется на резидентных в опухоли Treg клетках.
Образцы свежевырезанных опухолей яичников и крови были получены от пациенток во время операции. Асцит собирали у пациентов с разными указаниями на рак. CTLA-экспрессия на этом материале пациентов сравнивалась со здоровыми МКПК. Образцы опухолей измельчали и расщепляли. Мононуклеарные клетки периферической крови отделяли центрифугированием. Экспрессию CTLA-4 оценивали на CD4+CD25+CD127- Treg-клетках, CD4+ не-Treg-клетках и CD8+ эффекторных Т-клетках с помощью проточной цитометрии. Данные представляют отдельных пациентов/доноров с n = 12 для здоровых МКПК, n = 20 для асцита, n = 9 для опухоли и n = 5 для крови пациента.
Экспрессию CTLA-4 также анализировали на Т-клетках человека, которые были активированы у мышей NOG in vivo, а затем изолированы из селезенки этих мышей (см. фиг. 14).
Фиг. 14. Анти-CTLA-4 мАт опосредуют истощение Treg in vivo.
МКПК человека вводили в/в мышам NOG. Примерно через 2 недели брали селезенки и анализировали экспрессию CTLA-4 на Treg-клетках человека и CD8+ T-клетках с помощью FACS. Клетки селезенки, выделенные от мышей NOG, переносили в/б мышам SCID. Через 1 час мышей обрабатывали в/б CTLA-4 hIgG1 или контрольным мАт. Внутрибрюшинную жидкость собирали через 24 часа и определяли частоту появления субпопуляций Т-клеток человека (14А: Treg и 14В: CD8+ Т-клетки) с помощью проточной цитометрии.
Фиг. 15. Таблица, обобщающая характеристики анти-CTLA-4 антител.
Фиг. 16. Характеристика суррогатных мышиных анти-CTLA-4 мАт.
Фиг. 16 AB. Блокирующий ИФА проводили с m5-B07 для оценки характеристик блокирования лиганда. Антитело блокирует связывание CD80 на фиг. 16A) и CD86 на фиг. 16B) со своим лигандом CTLA-4 дозозависимым образом.
Фиг.16. CD. 5-B07 в формате IgG2a мыши опосредовал делецию Treg в модели опухоли CT26. Мышам Balb/c подкожно вводили 1×106 клеток CT26, и лечение начинали при размере опухоли примерно 7×7 мм. После 3 инъекций 10 мг/кг антитела суспензии единичных опухолевых клеток анализировали на содержание иммунных клеток с помощью FACS. Фиг. 16C: Суррогатное антитело 5-B07, блокирующее лиганд, вызывает истощение Treg. Это вызывает сдвиг в соотношении CD8+/Treg T-клеток, как показано на фиг. 16D.
Фиг. 17. Поколение COPTG19384 и COPTG19385.
Схематическое представление COPTG19384 и COPTG19385, использованных в этом данном исследовании. COPTG19385 содержит делецию гена J2R в локусе TK, замененную тяжелой цепью анти-CTLA-4, управляемой p7.5K, и делецию гена I4L в локусе RR, замененную легкой цепью анти-CTLA-4, управляемой p7.5K. COPTG19384 содержит делецию гена J2R в локусе TK, замененную тяжелой цепью анти-CTLA-4, управляемой p7.5K, и делецию гена I4L в локусе RR, замененную легкой цепью анти-CTLA-4, управляемой p7.5K, и GM-CSF, управляемый pSE/L.
Фиг. 18. Анализ экспрессии моноклонального антитела 4-E03 в супернатанте клеток CEF, инфицированных COPTG19384
А) Вестерн-блоттингом: клетки CEF инфицировали COPTG19384 при MOI 0,05 в трех повторностях. Клеточные супернатанты собирали через 48 часов и анализировали с помощью WB после электрофореза в невосстанавливающих условиях и с применением либо анти-Ig (левый блот), либо анти-легкой цепи (правый блот), конъюгированных с HRP.
B) с помощью ИФА: клетки CEF инфицировали COPTG19384 при MOI 0,05 в трех повторностях или VVTG17137. Клеточные супернатанты собирали через 48 часов и анализировали с помощью ИФА для обнаружения моноклональных антител 4-E03.
Фиг. 19. Анализ экспрессии GM-CSF в супернатанте клеток CEF, инфицированных COPTG19384, с помощью ELISA
Клетки CEF инфицировали при MOI 0,05 первичным исследовательским исходным раствором COPTG19384 в трех повторностях или VVTG17137. Клеточные супернатанты собирали через 48 часов и анализировали с помощью ИФА для обнаружения GM-CSF.
Фиг. 20. Исследования репликации COP WT, COPTG19384 (две партии) и VVTG17137 (две партии) на нормальных и опухолевых гепатоцитах
А) Скорость репликации на нормальных гепатоцитах человека.
Б) Скорость репликации на злокачественных HepG2.
C) Терапевтические индексы, рассчитанные на основе скоростей репликации, измеренных на HepG2 и гепатоцитах.
Фиг. 21. Репликация COPTG19384 и VVTG17137 в реконструированной коже человека.
Репликацию COPTG19384 и VVTG17137 оценивали через 7 дней и с варьирующими от 10 до 105 БОЕ. Результаты представляют собой средние значения и SEM трех измерений.
Фиг. 22. Онколитическая активность COPTG19384 и VVTG17137 в трех линиях опухолевых клеток человека: MIA PaCa-2 (A), LoVo (B) и HepG2 (C)
Фиг. 23. Уровень экспрессии как моноклонального антитела 4-E03, так и GM-CSF в (A) супернатантах инфицированных HepG2 и LoVo и (B) супернатантах 5 различных линий инфицированных опухолевых клеток человека
A) Уровни экспрессии 4-E03 и GM-CSF оценивали через 5 дней инкубации при MOI от 10-5 до 10-2 для COPTG19384 и при MOI 10-2 для VVTG17137, применяемых в качестве отрицательного контроля.
B) Уровни экспрессии 4-E03 и GM-CSF оценивали через 48 часов после заражения COPTG19384 при MOI 0,05.
Фиг. 24. Связывание различных партий 4-E03 с белком CTLA-4.
Связывание рекомбинантно продуцированного 4-E03 клетками CHO (серия исследований 4-E03) или HEK (серия токсинов 4-E03) с (A) рекомбинантным белком человека и (B) яванского макака сравнивали со связыванием 4-E03, очищенного из супенатант инфицированных опухолевых клеток MIA PaCa-2 (4-E03 TG) с помощью ИФА.
Фиг. 25. Связывание различных серий 4-E03 с клетками, экспрессирующими CTLA-4
Связывание рекомбинантно продуцированного 4-E03 клетками CHO (серия исследований 4-E03) или HEK (серия токсинов 4-E03) с (A) клетками человека и (B) яванского макака экспрессирующими CTLA-4, сравнивали со связыванием 4-E03 очищенного от супенатанта инфицированных опухолевых клеток MIA PaCa-2 (4-E03 TG) проточной цитометрией.
Фиг. 26. Кинетика накопления вируса в ксенотрансплантированной опухоли LoVo
Кинетику накопления вируса оценивали в ксенотрансплантатированной опухоли LoVo после однократной i.t. инъекции либо COPTG19384, либо VVTG17137 в двух разных дозах (104 или 105 БОЕ). Сплошные или пунктирные линии представляют собой медианное значение трех значений, определенных в каждый момент времени.
Фиг. 27. Кинетика накопления 4-E03 мАт и GM-CSF в ксенотрансплантированной опухоли LoVo.
A) Кинетика накопления 4-E03 мАт в ксенотрансплантированной опухоли LoVo оценивали после однократной i.t. инъекции либо COPTG19384, либо VVTG17137 в двух разных дозах (104 или 105 БОЕ) или после однократной в/б инъекции 3 мг/кг моноклонального антитела 4-E03. Сплошные или пунктирные линии представляют собой медиану трех значений.
B) Кинетику накопления GM-CSF в ксенотрансплантированной опухоли LoVo оценивали после однократной i.t. инъекции либо COPTG19384 в двух разных дозах (104 или 105 БОЕ), либо VVTG17137 (105 БОЕ). Сплошные линии представляют собой медианное значение трех значений, определенных в каждый момент времени.
Фиг. 28. Кинетика концентраций 4-E03 мАт и GM-CSF в сыворотке ксенотрансплантированных мышей LoVo
A) Кинетику концентраций 4-E03 мАт в сыворотке оценивали после однократной i.t. инъекции в ксенотрансплантированной опухоли LoVo COPTG19384 или VVTG17137 в двух разных дозах (104 или 105 БОЕ) или после однократной в/б инъекции 3 мг/кг моноклонального антитела 4-E03. Сплошные линии представляют собой медианное значение трех значений.
B) Кинетика концентраций GM-CSF в сыворотках после однократной i.t. инъекции в ксенотрансплантированной опухоли LoVo COPTG19384 в двух разных дозах (10 4 или 10 5 БОЕ) или VVTG17137 (10 5 БОЕ). Пунктирные линии представляют собой медианное значение трех значений, определенные в каждый момент времени.
Фиг. 29. Кинетика накопления вируса в опухолях CT26.
Кинетика накопления вируса в опухолях CT26 после трех i.t. инъекций (в D0, D2 и D4) либо VVTG18058, COPTG19421, либо COPTG19407 в дозе 107 БОЕ/инъекция.
Фиг. 30. Кинетика накопления m5-B07 мАт и mGM-CSF в опухоли CT26
A) Кинетика концентраций m5-B07 мАт в опухоли CT26 во время и после трех i.t. инъекций VVTG18058, COPTG19421 или COPTG19407 (107 БОЕ/инъекция) или после однократной в/б инъекции 3 мг/кг моноклонального антитела m5-B07. Сплошные линии представляют собой медианное значение трех значений.
B) Кинетика концентраций mGM-CSF в опухоли CT26 во время и после трех i.t. инъекций VVTG18058, COPTG19421 или COPTG19407 (107 БОЕ/инъекция) или после однократной в/б инъекции 3 мг/кг моноклонального антитела m5-B07. Сплошные линии представляют собой медианное значение трех значений, определенных в каждый момент времени.
Фиг. 31: Кинетика концентраций m5-B07 мАт в сыворотках модели CT26.
Кинетика концентраций m5-B07 мАт в сыворотке после трех i.t. инъекций в опухоль CT26 либо VVTG18058, COPTG19421 или COPTG19407 (107 БОЕ/инъекция), либо после однократной в/б инъекции 3 мг/кг моноклонального антитела m5-B07. Сплошные линии представляют собой медианное значение трех значений, определенных в каждый момент времени.
Фиг. 32. Противоопухолевая активность в модели CT26: влияние COPTG19347 +/- анти-PD1 на рост опухоли CT26 (A) и выживаемость мышей (B)
Клетки CT26 вводили подкожно мышам BalB/c в D-7. COPTG19347 (107 БОЕ), VVTG18058 (107 БОЕ), VVTG18058 или буфер вводили и/т инъекцией в D0, D2 и D4, возможно, с последующей в/б инъекцией 250 μг/мышь анти-PD1 RMPI-14 в D7, D10, D14, D17 и D21.
Фиг. 33. Оценка доза-эффект в модели CT26 (компиляция данных о выживаемости, наблюдаемых после лечения COPTG19407, COPTG19421 и VVTG18058).
Фиг. 34. Противоопухолевая активность COPTG19407 по сравнению с VVTG18058 плюс m5-B07 в модели опухоли CT26.
Клетки CT26 вводили п/к мышам Balb/C. Лечение мышей начинали, когда опухоли достигли прибл. 100 мм3. Мышам вводили в D0, D2 и D5 COPTG19407 (8,5x106 БОЕ i.t.), VVTG18058 (8,5x106 БОЕ i.t.), m5-B07 (10 мг/кг в/б) или комбинацию VVTG18058 (8,5x106 БОЕ i.t.) плюс m5-B07 (10 мг/кг в/б). Фиг. 30 A-D: Рост опухоли и фиг. 16 E: выживание во времени.
Фиг. 35. Индивидуальные кривые объема опухоли мышей BALB/c, несущих подкожные опухоли A20.
Клетки A20 вводили п/к мышам Balb/C. Лечение мышей начинали, когда опухоли достигли 80-100 мм3. Мышам вводили в D0, D2 и D4 носитель (i.t.), COPTG19407 (4,75×106 БОЕ i.t.), VVTG18058 (4,75×106 БОЕ i.t.), RMP1-14 (анти-mPD-1) (250 мкг/мышь в/б) или комбинацию COPTG19407 (4,75×106 БОЕ i.t.) плюс RMP1-14 (250 мкг/мышь в/б).
А) Животные группы 1, получавшие носитель
В) Животные группы 2, получавшие VVTG18058
С) Животные группы 3, получавшие COPTG19407
D) Животные группы 4, получавшие мышиные анти-PD1
Е) Животные группы 5, получавшие COPTG19407 и мышиные анти-PD1
Фиг. 36. Кривые среднего объема опухоли мышей BALB/cN, несущих подкожные опухоли A20.
Каждая точка представляет собой среднее значение записанного объема опухоли на группу. Объемы опухоли всех животных контролировали в течение 64 дней. Мышам вводили носитель (группа 1), VVTG18058 (группа 2), COPTG19407 (группа 3), мышиное анти-PD1 антитело RMP1-14 (BioXCell) (группа 4) и COPTG19407 и RMP1-14 (группа 5). Животные были рандомизированы на D7 и обработаны в период от D7 до D31. Последних мышей умерщвляли на D61.
Фиг. 37. Противоопухолевая активность в модели A20: влияние COPTG19407 +/- анти-PD1 на рост опухоли A20 (A) и выживаемость мышей (B)
Клетки A20 вводили п/к мышам Balb/C. Лечение мышей начинали, когда опухоли достигли 80-100 мм3. Мышей лечили носителем (i.t.) (группа 1), анти-PD-1 (группа 2), изотипом (группа 3), VVTG18058 (105 БОЕ i.t.) (группа 4), VVTG18058 (105 БОЕ i.t.) + изотипом (группа 5), VVTG18058 (105 БОЕ i.t.) + анти-PD-1 (группа 6), VVTG19407 (105 БОЕ i.t.) (группа 7), VVTG19407 (105 БОЕ i.t.) + изотип (группа 8) и VVTG19407 (105 БОЕ i.t.) + анти-PD-1 (группа 9).
Фиг. 38. Индивидуальные кривые объема опухоли мышей C57BL/6, несущих подкожные опухоли C38.
Клетки C38 вводили п/к мышам C57bl/6. Лечение мышей начинали, когда опухоли достигли 80-100 мм3. Мышам вводили в D0, D2 и D4 носитель (i.t.), COPTG19407 (4,75×106 БОЕ i.t.), VVTG18058 (4,75×106 БОЕ i.t.), RMP1-14 (анти-mPD-1) (250 мкг/мышь в/б) или комбинацию COPTG19407 (4,75×106 БОЕ i.t.) плюс RMP1-14 (250 мкг/мышь в/б).
А) Животные группы 1, получавшие носитель
В) Животные группы 2, получавшие VVTG18058
С) Животные группы 3, получавшие COPTG19407
D) Животные группы 4, получавшие мышиный анти-PD1
Е) Животные группы 5, получавшие COPTG19407 и мышиные анти-PD1
Фиг. 39. Кривые среднего объема опухоли мышей C57BL/6, несущих подкожные опухоли C38.
Каждая точка представляет собой среднее значение записанного объема опухоли на группу. Объем опухолей у всех животных контролировали в течение 61 дня. Мышей обрабатывали носителем (группа 1), VVTG18058 (группа 2), COPTG19407 (группа 3), мышиным анти-PD1 антителом RMP1-14 (BioXCell) (группа 4) и COPTG19407 и RMP1-14 (группа 5). Животные были рандомизированы на D7 и обработаны в период от D7 до D31. Последних мышей умерщвляли на D61.
Фиг. 40. Индивидуальные кривые объема опухоли мышей BALB/c, несущих подкожные опухоли EMT6.
Клетки EMT6 вводили п/к мышам Balb/C. Лечение мышей начинали, когда опухоли достигли 80-100 мм3. Мышам вводили в D0, D2 и D4 носитель (i.t.), COPTG19407 (4,75×106 БОЕ i.t.), VVTG18058 (4,75×106 БОЕ i.t.), RMP1-14 (анти-mPD-1) (250 мкг/мышь в/б) или комбинацию COPTG19407 (4,75×106 БОЕ i.t.) плюс RMP1-14 (250 мкг/мышь в/б).
А) Животные группы 1, получавшие носитель
В) Животные группы 2, получавшие VVTG18058
С) Животные группы 3, получавшие COPTG19407
D) Животные группы 4, получавшие мышиные анти-PD1
Е) Животные группы 5, получавшие COPTG19407 и мышиные анти-PD1
Фиг. 41. Кривые среднего объема опухоли мышей BALB/cN, несущих подкожные опухоли EMT6.
Каждая точка представляет собой среднее значение записанного объема опухоли на группу. Объем опухолей у всех животных контролировали в течение 61 дня. Мышей обрабатывали носителем (группа 1), VVTG18058 (группа 2), COPTG19407 (группа 3), мышиным анти-PD1 антителом RMP1-14 (BioXCell) (группа 4) и COPTG19407 и RMP1-14 (группа 5). Животные были рандомизированы на D7 и обработаны в период от D7 до D31. Последних мышей умерщвляли на D56. Кривые были остановлены после гибели более чем 20% мышей.
Примеры
Теперь будут описаны конкретные примеры, не имеющие ограничительного характера, которые содержат в себе определенные аспекты данного изобретения. В примерах белок rh обозначает рекомбинантный белок человека (например, rhIL-2 обозначает рекомбинантный белок ИЛ-2 человека), а белок rcm обозначает рекомбинантный белок яванского макака (например, rcmCTLA4 обозначает рекомбинантный белок CTLA-4 яванского макака).
В дополнение к упомянутым выше последовательностям в примерах применяются некоторые дополнительные последовательности, которые указаны в таблице 5 ниже.
Таблица 5. Дополнительные последовательности, использованные в примерах
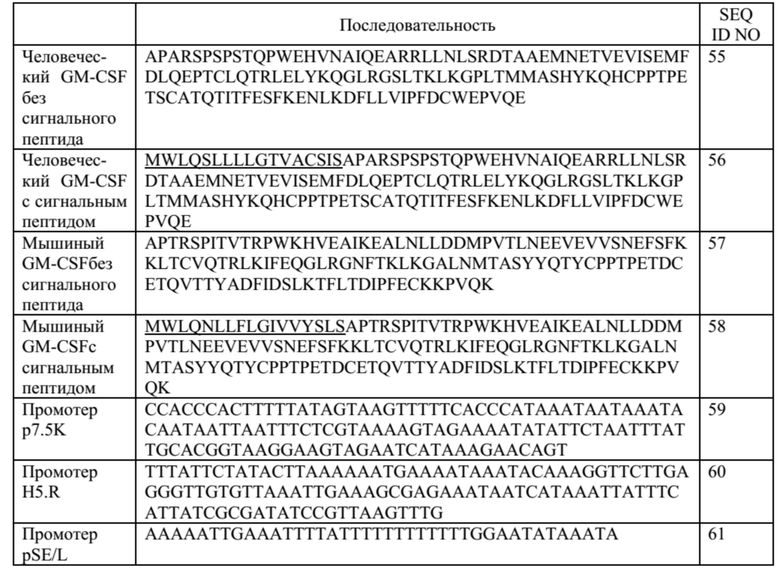
Пример 1. Получение антител, специфичных к CTLA-4
Выделение фрагментов scFv антител
Библиотека н-Coder® scFv (BioInvent;  E, et al. Nat Biotechnol. 2000;18 (8):852-6) была использована для выделения фрагментов scFv антител, распознающих CTLA-4 человека.
E, et al. Nat Biotechnol. 2000;18 (8):852-6) была использована для выделения фрагментов scFv антител, распознающих CTLA-4 человека.
Библиотеку фагов использовали в трех последовательных пэннингах против рекомбинантного человеческого белка. После инкубации фага клетки промывали для удаления несвязавшихся фагов. Связывающие фаги элюировали трипсином и амплифицировали в E.coli. Полученный исходный раствор фага конвертировали в формат scFv. E.coli трансформировалась с плазмидами, несущими scFv, и были экспрессированы отдельные клоны scFv.
Идентификация уникального CTLA-4 связывающего scFv
Конвертированные scFv из третьего пэннинга анализировали с применением гомогенного анализа FMAT (Applied Biosystems, Карлсбад, Калифорния, США) на связывание с трансфицированными клетками 293 FT, экспрессирующими CTLA-4 человека или нецелевой белок.
Вкратце, трансфицированные клетки добавляли в планшеты с прозрачным дном вместе с scFv-содержащим супернатантом из экспрессионных планшетов (разведенные 1:7), мышиное анти-His Tag антитело (0,4 μг/мл; R&D Systems) и АПК-конъюгированные козьи антимышиные антитела (0,2 мкг/мл; кат. номер 115-136-146, Jackson Immunoresearch). Планшеты FMAT инкубировали при комнатной температуре (приблизительно 20-25°C) в течение 9 ч перед считыванием. Целевые специфические бактериальные клоны классифицировали как активные и выборочно собирали в 96-луночный планшет.
Связывание IgG с CTLA-4 в ИФА
96-луночные планшеты (Lumitrac 600 LIA, Greiner) покрывали в течение ночи при 4°C с рекомбинантным белком CTLA-4-Fc человека (R&D Systems) при 1 пмоль/лунка, рекомбинантным белком CTLA-4-Fc яванского макака (cynomologous (cm) (R&D Systems) при 1 пмоль/лунка, рекомбинантным белком CTLA-4-Fc мыши (R&D Systems) при 0,3 пмоль/лунка, рекомбинантный белок CD28-Fc человека (R&D Systems) при 1 пмоль/лунка или рекомбинантный белок CD28-Fc мыши (R&D Systems) при 0,3 пмоль/лунка. После промывки титрованным дозам анти-CTLA-4 мАт от 0 мкг/мл до 0,06 нг/мл (от 66 нМ до 0,3 пМ) давали возможность связываться в течение 1 часа. Затем планшеты снова промывали, и связанные антитела выявляли вторичным анти-человеческим-F(ab)-HRP антителом (Jackson ImmunoResearch), разведенным в 50 нг/мл. В качестве субстрата применяли Super Signal ELISA Pico (Thermo Scientific), и планшеты анализировали с применением ридера Tecan Ultra Microplate.
Было показано, что все антитела связываются с белком CTLA-4 человека и яванского макака, но не с белком CD28 человека, как было определено с помощью ИФА. Кроме того, было показано, что 5-B07 связывается с CTLA-4 мыши, но не с CD28 мыши (см. фиг. 1).
Связывание IgG с CTLA-4-экспрессирующими клетками 293T в проточной цитометрии
Конвертированные клоны IgG анализировали на связывание с CTLA-4-экспрессирующими клетками 293T (приобретенными у Crownbio). Клетки инкубировали с различными концентрациями (как показано на фиг. 2) анти-CTLA-4 мАт при 4°C в течение 20 мин перед промывкой и окрашиванием АПК-меченным вторичным антителом козы против человека (кат. номер 109-136-088, Jackson ImmunoResearch). Мертвые клетки были исключены из анализа с применением красителя Fixable Viability Dye eFluor780 (eBiosciences). Сбор данных выполняли на FACSVerse (BD Biosciences, Франклин Лейкс, Нью-Джерси) и анализировали с помощью программного обеспечения FlowJo (Tree Star, Ашленд, Орегон).
Было показано, что анти-CTLA-4 мАт связывают CTLA-4-экспрессирующие клетки 293T человека дозозависимым образом с таким же значением EC50, как у Ервой (фиг. 2).
Клетки 293T, стабильно трансфицированные CTLA-4 человека, клетки 293T, временно трансфицированные CTLA-4 яванского макака, наивные МКПК человека или яванского макака, in vitro-активированные CD4+ T-клетки человека или цино, инкубировали с концентрациями анти-CTLA-4 мАт, указанными при 4°C в течение 20 минут перед промывкой и окрашиванием вторичным АПК-меченным антителом против человека (Jackson ImmunoResearch).
Пример 2. Анти CTLA-4 мАт специфически связывают CTLA-4-экспрессирующие (первичные) клетки человека и яванского макака
CTLA-4-специфические мАт связывают первичные in vitro-активированные CD4+ Т-клетки человека и яванского макака, но не наивные МКПК, выделенные от здоровых доноров
МКПК выделяли из лейкоцитарной пленки. Вкратце, пленки разбавляли 1:3 в ФСБ и наносили на подушки Ficoll-Paque Plus (Amersham). Образцы центрифугировали при 800 x g в течение 20 мин при 20°С. Верхнюю фазу, содержащую плазму, удаляли, и мононуклеарные клетки выделяли из отчетливой белой полосы на границе раздела плазма/фиколл.
Периферические CD4+ Т-клетки человека очищали отрицательной селекцией с применением набора для выделения Т-клеток MACS CD4 (Miltenyi Biotec). CD4+ Т-клетки были активированы in vitro с помощью парамагнитных частиц CD3/CD28 (Life Technologies) плюс 50 нг/мл rhIL-2 (R&D Systems) в среде R10 (RPMI, содержащая 2 мМ глутамин, 1 мМ пируват, 100 МЕ/мл пенициллина и стрептомицина и 10% FBS (GIBCO от Life Technologies) в течение 3 дней для усиления экспрессии CTLA-4. CD4+ Т-клетки яванского макака выделяли с применением микрогранул CD4, отличных от человека (Miltenyi Biotec), и инкубировали с 50 нг/мл PMA (Sigma-Aldrich) и 100 нг/мл иономицина (Sigma-Aldrich) в течение 3 дней.
Наивные МПКП человека или яванского макака, in vitro-активированные CD4+ Т - клетки человека или цино инкубировали с указанными концентрациями анти-CTLA-4 мАт при 4°С в течение 20 мин до промывки и окрашивания с АПК-меченным анти-человеческим вторичным антителом (Jackson ImmunoResearch). Связывание анти-CTLA-4 мАт анализировали с помощью FACS с применением BD FACS Verse.
Было показано, что антитела связываются с in vitro-активированными CD4+ Т-клетками человека (фиг. 3) и яванского макака (фиг. 5), но не с покоящимися МКПК (фиг. 8). Связывание с Т-клетками, эндогенно экспрессирующими CTLA-4, аналогично окрашиванию с Ервой (фиг. 3, верхний ряд, пунктирная линия) и в качестве положительного контроля коммерческого анти-CTLA-4 FACS-антитела от BD Biosciences (клон BNI3; фиг. 3, нижний ряд).
Как показано на фиг. 4, окрашивание in vitro-активированных CD4+ Т-клеток человека (черная линия) может быть полностью заблокировано rhCTLA-4-Fc (серая линия), демонстрируя специфичность антител. В этом анализе конкурентного связывания 2 мкг/мл Alexa 647-меченных анти-CTLA-4 мАт смешивали с рекомбинантным белком CTLA-4-Fc человека (50 мкг/мл) перед инкубацией с клетками, экспрессирующими CTLA-4. Связывание IgG было обнаружено с помощью FACS.
Трансфицированные клетки 293T, экспрессирующие CTLA-4 человека и яванского макака, подтверждают цинокроссреактивность тестируемых антител
Цинокроссреактивность антител была дополнительно подтверждена на трансфицированных CTLA-4-экспрессирующих клетках 293T.
Как показано на фиг. 6, связывание специфических антител против CTLA-4 с трансфицированными CTLA-4-экспрессирующими клетками человека, может ингибироваться рекомбинантным белком человека и яванского макака (обе R&D Systems). Было также показано, что антитела связываются с трансфицированными клетками, экспрессирующими CTLA-4 яванского макака (фиг. 7, верхний ряд). Это связывание может быть снова заблокировано рекомбинантным белком яванского макака (нижний ряд, серая линия).
Эксперименты проводились аналогично конкурентному анализу, описанному выше в Примере 2 в связи с фиг. 4.
Ожидаемое отсутствие прямой агонистической активности
Анализы пролиферации in vitro были выполнены для исключения непредвиденной прямой агонистической активности (например, из-за неспецифического связывания).
Периферические CD4+ Т-клетки человека очищали от здоровых МКПК путем отрицательной селекции с применением набора для выделения Т-клеток MACS CD4 (Miltenyi Biotec) и после этого метили CFSE (2 мкМ, Molecular Probes). Антитела были перекрестно связаны с F(ab')2 козьими антителами против IgG человека, Fcγ специфическим фрагментом или F(ab')2 козьим антимышиным IgG, Fcγ специфическим фрагментом, в молярном соотношении IgG:F(ab')2 = 1,5:1 в течение 1 ч при КТ. 1 × 105 очищенных CD4+ Т-клеток человека стимулировали связанными с планшетом анти-CD3 (0,5 мкг/мл; клон UCHT1, R&D Systems) и 4 мкг/мл растворимого поперечно-сшитого анти-CTLA-4 или поперечно-сшитого анти-CD28 (клон CD28.2, BioLegend) в течение 72 часов при 37°C. Клетки промывали и окрашивали BV421-конъюгированным анти-CD25 антителом (клон M-A251, BD Biosciences). Процент делящихся клеток CD25+/CFSElow анализировали с помощью FACS.
Фиг. 9 демонстрирует, что ни одно из протестированных анти-CTLA-4 мАт не индуцирует пролиферацию Т-клеток, в отличие от стимуляции анти-CD28.
Пример 3. Анти-CTLA-4 мАт блокируют связывание CD80/CD86 с лигандом
Лиганд блокирующий ИФА
Лиганд-блокирующую активность анти-CTLA-4 IgG оценивали с помощью ИФА. С этой целью рекомбинантный белок CTLA-4-Fc человека (R&D Systems) наносили на 96-луночные планшеты (планшет Lumitrac 600 LIA, Greiner) из расчета 1 пмоль/лунку. После отмывки титрованным дозам анти-CTLA-4 мАт давали возможность связываться в течение 1 часа. Лиганды, меченные His-меткой, добавляли при 200 нМ и 100 нМ соответственно (rhCD80 и rhCD86; R&D Systems), и планшеты дополнительно инкубировали в течение 15 минут. После промывки связанный лиганд обнаруживали с помощью HRP-меченного анти-His-антитела (R&D Systems). В качестве субстрата применяли Super Signal ELISA Pico (Thermo Scientific), и планшеты анализировали с применением ридера Tecan Ultra Microplate.
Как показано на фиг. 10, протестированные анти-CTLA-4 антитела проявляют активность блокирования лиганда, аналогичную Ервой.
Блокирование функционального лиганда in vitro
Для анализа SEB МКПК все МКПК от здоровых доноров высевали на 96-луночные планшеты (1 × 105 клеток/лунка) и стимулировали 1 мкг/мл энтеротоксина B Staphylococcus (SEB, Sigma Aldrich) в присутствии титрованных доз анти-CTLA-4 IgG. Секрецию ИЛ-2 измеряли с помощью MSD (Mesoscale) на 3 день в соответствии с инструкциями производителя.
Было показано, что антитела 4-E03 и 2-C06 усиливают выработку ИЛ-2, и их эффективность была аналогична таковой Ервой. На фиг. 11 показан один репрезентативный донор из 6.
Пример 4. Анти-CTLA-4 мАт истощают CTLA-4, экспрессирующие клетки in vitro и in vivo
Антителозависимая клеточная цитотоксичность (АЗКЦ)
Анализы АЗКЦ проводили с применением клеточной линии НК-92, стабильно трансфицированной для экспрессии аллеля CD16-158V вместе с GFP (приобретенный у Conkwest, Сан-Диего, Калифорния; Binyamin, L., et al., 2008, Blocking NK cell inhibitory self-recognition promotes antibody-dependent cellular cytotoxicity in a model of anti-lymphoma therapy. Journal of immunology 180, 6392-6401). CD4+ Т-клетки-мишени выделяли из периферической крови здоровых доноров с применением набора для выделения CD4+ Т-клеток (Miltenyi Biotec). Клетки стимулировали в течение 48 часов парамагнитными частицами CD3/CD28 (Life Technologies, Thermo Fisher) и 50 нг/мл rhIL-2 (R &D Systems) при 37°C. Клетки-мишени предварительно инкубировали с мАт при 10 мкг/мл в течение 30 минут при 4°C перед смешиванием с НК-клетками. Клетки инкубировали в течение 4 ч в среде RPMI 1640 + GlutaMAX (Invitrogen), содержащей 10 мМ буфера HEPES, 1 мМ пирувата натрия и 10% FBS низкого IgG при соотношении 2:1 эффекторные клетки:клетки-мишени. Лизис определяли методом проточной цитометрии. Вкратце, в конце инкубации клеточную суспензию окрашивали BV510-конъюгированным анти-CD4 (клон RPA-T4, BD Biosciences) вместе с 10 нМ красителем SYTOX Red для мертвых клеток (Invitrogen) или Fixable Viability Dye eFluor780 (eBioscience) в течение 20 минут в темноте при 4°C, а затем клетки анализировали с помощью FACSVerse (BD Biosciences).
4-E03 показал значительно улучшенную делецию CTLA-4+ Т-клеток in vitro по сравнению с Ервой (фиг. 12).
Экспрессия CTLA-4 на первичном материале пациента
Чтобы подтвердить трансляционный потенциал вышеуказанного открытия об истощающей активности анти-CTLA-4 мАт, экспрессию CTLA-4 исследовали на первичном материале пациентов.
Этическое разрешение на применение клинических образцов было получено Комитетом по этике университетской больницы Сконе. Информированное согласие было предоставлено в соответствии с Хельсинкской декларацией. Образцы были получены в отделении гинекологии и онкологии при университетской больнице Сконе, Лунд. Асцитная жидкость оценивалась как выделенные суспензии отдельных клеток. Материал опухоли разрезали на маленькие кусочки и инкубировали в R10 с ДНКазой I (Sigma Aldrich) и Liberase™ (Roche Diagnostics) в течение 20 минут при 37°C. Оставшаяся ткань механически разрушалась и вместе с клеточной суспензией пропускалась через клеточный фильтр 70 мкм. Окрашивали клетки, выделенные из асцитической жидкости и опухолей. Для идентификации различных субпопуляций Т-клеток были использованы следующие антитела: CD4-BV510 (RPA-T4), CD25-BV421 (M-A251), анти-CD127-FITC (HIL-7R-M21), CTLA-4-PE (BNI3), CD8-PeCy7 (RPA-T8), CD3-APC (UCHT1), CD45-PercP-Cy5.5 (HI30), изотипический IgG2a мыши, κ контроль-PE (G155-178; все от BD Biosciences). Сбор данных выполнялся с помощью FACSVerse, а данные анализировались с помощью FlowJo.
Как показано на фиг. 13, CTLA-4 в наибольшей степени экспрессируется на внутриопухолевых Treg-клетках, что делает их хорошей мишенью для истощения CTLA-4-специфических антител.
Модель PBMC-NOG/SCID
Чтобы подтвердить данные in vitro об истощающей активности специфических анти-CTLA-4 антител, мы проанализировали истощающую способность анти-CTLA-4 мАт в модели PBMC-NOG/SCID in vivo. Модель основана на хорошо известной модели hu-PBMC-NOG (Sαndergaard H. et al., Clin Exp Immunol. 2013 May;172(2):300-10. doi: 10.1111/cei.12051; Cox J H et al., PLoS One. 2013 Dec 23;8(12):e82944. doi: 10.1371/journal.pone.0082944. eCollection 2013) и была модифицирована собственными силами как описано ниже.
Мышей разводили и содержали на местных объектах в соответствии с рекомендациями домашнего офиса. Самок C.B. 17 scid в возрасте восьми недель (Bosma GC et al., Nature. 1983 Feb 10;301(5900):527-30) и NOG (NOD/Shi-scid/IL-2Rγnull; Ito M et al, 2002, NOD/SCID/γ 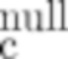 mouse: an excellent recipient mouse model for engraftment of human cells. Blood 100 (9):3175-3182) мышей поставляла компания Taconic (Bomholt, Дания) и содержала в местных помещениях для животных. Для модели МКПК-NOG/SCID (первичный ксенотрансплантат человека) МКПК человека выделяли с применением Ficoll Paque PLUS и после промывки клетки ресуспендировали в стерильном ФСБ при 75 × 106 клеток/мл. Мышам NOG в/в вводили 200 мкл клеточной суспензии, что соответствует 15 × 106 клеток/мышь. Через 2 недели после инъекции селезенки выделяли и превращали в суспензию отдельных клеток. После этого был взят небольшой образец для определения экспрессии CTLA-4 на Т-клетках человека с помощью FACS. Как показано на фиг. 13, CTLA-4 выше экспрессируется на Treg-клетках по сравнению с другими T-клетками, что отражает ситуацию у пациентов-людей. Большинство клеток ресуспендировали в стерильном ФСБ в концентрации 50 × 106 клеток/мл. Мышам SCID в/б вводили 200 мкл суспензии, что соответствует 10 × 106 клеток/мышь. Через 1 час мышей обрабатывали 10 мг/кг анти-CTLA-4 hIgG1, Ервой или мАт изотипического контроля. Внутрибрюшинную жидкость мышей собирали через 24 часа. Подмножества Т-клеток человека были идентифицированы и количественно определены с помощью FACS с применением следующих маркеров: CD45, CD4, CD8, CD25, CD127 (все от BD Biosciences).
mouse: an excellent recipient mouse model for engraftment of human cells. Blood 100 (9):3175-3182) мышей поставляла компания Taconic (Bomholt, Дания) и содержала в местных помещениях для животных. Для модели МКПК-NOG/SCID (первичный ксенотрансплантат человека) МКПК человека выделяли с применением Ficoll Paque PLUS и после промывки клетки ресуспендировали в стерильном ФСБ при 75 × 106 клеток/мл. Мышам NOG в/в вводили 200 мкл клеточной суспензии, что соответствует 15 × 106 клеток/мышь. Через 2 недели после инъекции селезенки выделяли и превращали в суспензию отдельных клеток. После этого был взят небольшой образец для определения экспрессии CTLA-4 на Т-клетках человека с помощью FACS. Как показано на фиг. 13, CTLA-4 выше экспрессируется на Treg-клетках по сравнению с другими T-клетками, что отражает ситуацию у пациентов-людей. Большинство клеток ресуспендировали в стерильном ФСБ в концентрации 50 × 106 клеток/мл. Мышам SCID в/б вводили 200 мкл суспензии, что соответствует 10 × 106 клеток/мышь. Через 1 час мышей обрабатывали 10 мг/кг анти-CTLA-4 hIgG1, Ервой или мАт изотипического контроля. Внутрибрюшинную жидкость мышей собирали через 24 часа. Подмножества Т-клеток человека были идентифицированы и количественно определены с помощью FACS с применением следующих маркеров: CD45, CD4, CD8, CD25, CD127 (все от BD Biosciences).
Все протестированные антитела показали аналогичную или лучшую активность по истощению Treg, чем Ервой. Другие популяции Т-клеток, такие как эффекторные Т-клетки CD8+, не были затронуты (фиг. 14).
Пример 5. Выбранное суррогатное антитело m5-B07 имеет те же функциональные характеристики, что и 4-E03
В некоторых примерах, в частности в примерах in vivo, применялся клон антитела 5-B07 в формате mIgG2a (также обозначенный как m5-B07). Это мышиное антитело, которое является суррогатным антителом к человеческим антителам, описанным в данном документе. Оно было выбрано в качестве суррогатного антитела, поскольку оно связывает мышиный CTLA-4 и тем самым блокирует связывание лиганда (фиг. 16 A-B). Кроме того, оно также демонстрирует активность истощения Treg (фиг. 16 CD).
Лиганд блокирующий ИФА
Лиганд-блокирующую активность 5-B07 оценивали с помощью ИФА. С этой целью рекомбинантный белок CTLA-4-Fc мыши (Sino Biologocal Inc.) наносили на 96-луночные планшеты (планшет Lumitrac 600 LIA, Greiner) из расчета 1 пмоль/лунку. После отмывки титрованным дозам анти-CTLA-4 мАт давали возможность связываться в течение 1 часа. Лиганды, меченные His-меткой, добавляли при 200 нМ и 100 нМ соответственно (rmCD80 и rmCD86; Sino Biological Inc.), и планшеты дополнительно инкубировали в течение 15 минут. После промывки связанный лиганд обнаруживали с помощью HRP-меченного анти-His-антитела (R&D Systems). В качестве субстрата применяли Super Signal ELISA Pico (Thermo Scientific), и планшеты анализировали с применением ридера Tecan Ultra Microplate.
Как показано на фиг. 16, антитело блокирует связывание (A) CD80 и (B) CD86 со своим лигандом CTLA-4.
Истощающая активность Treg in vivo
Действия антител, специфичных к CTLA-4, на субпопуляции Т-клеток в опухоли in vivo исследовали на модели опухоли CT26, как описано ниже.
Мышей разводили и содержали на местных объектах в соответствии с рекомендациями домашнего офиса. Шести-восьминедельные самки Balb/C были предоставлены Taconic (Bomholt, Дания) и содержались в местных помещениях для животных. Клетки CT26 (ATCC) выращивали в забуференной глутамаксом среде RPMI с добавлением 10% FCS. Когда клетки были полуконфлюэнтными, их отделяли трипсином и ресуспендировали в стерильном ФСБ при 10 × 106 клеток/мл. Мышам п/к инъецировали 100 мкл клеточной суспензии, что соответствует 1 × 106 клеток/мышь. Когда опухоли достигли приблизительно 7x7 мм, мышам дважды в неделю вводили в/б 10 мг/кг указанных антител, как показано на фигурах. После третьего введения опухоли иссекали, механически разделяли на маленькие кусочки и расщепляли смесью 100 μг/мл либеразы (Roche) и 100 μг/мл ДНКазы (Sigma) при 37°C в течение 2x5 мин с Vortex между ними. Затем клеточную суспензию промывали (400 g в течение 10 мин) ФСБ, содержащим 10% FBS. После этого клетки ресуспендировали в буфере MACS и окрашивали панелью антител, окрашивающей CD45, CD3, CD8, CD4 и CD25 (все от BD Biosciences). Перед окрашиванием клетки блокировали для неспецифического связывания с применением 100μг/мл IVIG. Клетки анализировали с применением FACS Verse (BD Biosciences). Treg-клетки мыши были идентифицированы как клетки CD45+CD3+CD4+CD25+.
Как показано на фиг. 16C, 5-B07 в формате мышиного IgG2a опосредует делецию Treg в опухоли, связанную с D) повышенным соотношением CD8/Treg по сравнению с другими CTLA-4-специфическими антителами n-CoDeR и хорошо описанным коммерчески доступным клоном 9H10.
Пример 6. Получение вируса, экспрессирующего анти-CTLA4 мАт (COPTG19385) или анти-CTLA4 мАт и GM-CSF (COPTG19384), экспрессия трансгенов и характеристика генетической стабильности
COPTG19384 и COPTG19385 представляют собой вирусы осповакцины (копенгагенский штамм), кодирующие моноклональные анти-CTLA4 антитела (4-E03). COPTG19384 дополнительно кодирует GM-CSF человека. В частности, COPTG19384 и COPTG19385 являются дефектными по активности тимидинкиназы (TK, J2R локус) и рибонуклеотидредуктазы (RR, I4L локус). Как показано на фиг. 17, экспрессионная кассета, кодирующая тяжелую цепь 4-E03 (HC; SEQ ID NO: 54) под контролем промотора p7.5K (SEQ ID NO: 59) была вставлена в J2R локус, и экспрессионная кассета, кодирующая легкую цепь (LC, SEQ ID NO: 53) IgG 4-E03 под контролем промотора p7.5K (SEQ ID NO: 59), была помещена в I4L локус. Для COPTG19384 экспрессионная кассета, кодирующая GM-CSF человека (SEQ ID NO: 56) под контролем промотора pSE/L (SEQ ID NO: 61), также была помещена в I4L локус.
Один и тот же промотор (p7,5K) применяли для контроля экспрессии HC и LC, чтобы получить одинаковый уровень экспрессии для обеих цепей и, следовательно, оптимальную сборку антитела в качестве гетеротетрамерного белка (т.е. во избежание избытка не- связанной цепи). Однако один и тот же промотор для обеих цепей антитела препятствует их встраиванию в один и тот же локус (идентичные последовательности ДНК увеличивают риск рекомбинации, а затем и удаления трансгенов). Следовательно, кассета, кодирующая 4-E03 HC была вставлена в J2R локус, а кассета, кодирующая LC 4-E03, в I4L локус. Кассета, кодирующая трансген GM-CSF, но под другим промотором (pSE/L) также вставляли в I4L локус, как легкую цепь антитела.
Получение COPTG19384
Плазмиды для переноса вируса осповакцины, pTG19339 и pTG19341, были сконструированы таким образом, чтобы позволить вставку нуклеотидных последовательностей путем гомологичной рекомбинации в J2R и I4L локусы генома вируса осповакцины соответственно. Они происходят из плазмиды pUC18, в которую были клонированы фланкирующие последовательности (BRG и BRD), окружающие локус J2R (pTG19339) или I4L (pTG19341). Каждая плазмида также содержит промотор p7.5K.
Был получен синтетический фрагмент, названный «Фрагмент HC» размером 1436 п.о., содержащий ген HC антитела 4-E03. Фрагмент «фрагмент LC», содержащий ген LC антитела 4-E03 и hGM -CSF ген под контролем pSE/L получали синтетическим путем и вставляли в плазмидный вектор. Кодирующие последовательности были оптимизированы для применения кодонов человека, последовательность Козака (ACC) была добавлена перед стартовым кодоном ATG, а терминатор транскрипции (TTTTTNT) был добавлен после стоп-кодона. Кроме того, были исключены некоторые матрицы: TTTTTNT, GGGGG, CCCCC, которые вредны для экспрессии в поксвирусе.
Фрагмент HC был вставлен в pTG19339, ограниченный с PvuII путем гомологичной рекомбинации, приводящей к pTG19367. Плазмида, несущая LC, была ограничена с помощью SnaB1, и полученный фрагмент «LC-GMCSF» был вставлен путем гомологичной рекомбинации в pTG19341, ограниченный с помощью PvuII, давая начало pTG19384.В этой плазмиде кассеты экспрессии вставляли головой к хвосту между плечами рекомбинации, обеспечивая гомологичную рекомбинацию в I4L локусе генома вируса осповакцины.
COPTG19384 был создан на фибробласте куриного эмбриона (CEF) двумя последовательными гомологичными рекомбинациями для последовательной вставки в локусы I4L и J2R и с применением COPTG19156 в качестве родительского вируса и две плазмиды для переноса pTG19367 и pTG19384. CEF выделяли из яиц SPF с 12-дневным эмбрионом (Charles River). Эмбрионы были механически разделены на части, солюбилизированы в растворе Tryple Select (Invitrogen) и культивированы в MBE (среда на основе Eagle; Gibco) с добавлением 5% FCS (Gibco) и 2 мМ L-глутамина.
Гомологичная рекомбинация между плазмидами-переносчиками и родительским вирусом осповакцины позволяет получить рекомбинантные вирусы осповакцины, которые потеряли GFP и mCherry экспрессионные кассеты и накопленные экспрессионные кассеты антитела и GM-CSF. COPTG19156 содержит экспрессионную кассету mCherry ген в его I4L локусе и экспрессионную кассета гена GFP в его J2R локусе. Гомологичная рекомбинация между плазмидой-переносчиком pTG19367 и родительским COPTG19156 позволяет создавать рекомбинантные вирусы осповакцины, которые утратили свою экспрессионную кассету GFP и приобрели экспрессионную кассету тяжелой цепи 4-E03, и селекцию проводили путем выделения красных флуоресцентных бляшек. Этот промежуточный рекомбинантный вирус (COPTG19367) был использован в качестве родительского вируса для второго раунда гомологичной рекомбинации с pTG19384 в качестве плазмиды-переносчика для поколения рекомбинантных вирусов осповакцины, утративших mCherry экспрессионную кассету и получили экспрессионную кассеты легкой цепи 4-E03 и GM-CSF.Селекцию COPTG19384 (фиг. 17) проводили путем выделения белых нефлуоресцентных бляшек.
Вирусный исходный раствор COPTG19384 был амплифицирован на CEF в двух колбах F175 для создания соответствующих исходных растворов вирусов, которые можно разделить на аликвоты и хранить при -80 °C до применения. Вирусный исходный раствор титровали на клетках CEF и инфекционные титры выражали в БОЕ/мл и рассчитывали по следующей формуле: число литических областей x коэффициент разведения x 4. В иллюстративных целях полученный вирусный исходный раствор титровали 6,8 x 106 БОЕ/мл. Этот исходный раствор былпроанализирован с помощью ПЦР для проверки целостности экспрессионных кассет и рекомбинационных плечей с применением соответствующих пар праймеров. Исходный раствор также былпроанализирован путем секвенирования обеих экспрессионных кассет. Выравнивание результатов секвенирования показало 100% гомологию с теоретически ожидаемой последовательностью. При необходимости вирусные препараты очищали с применением обычных методик (например, как описано в WO2007/147528).
Получение COPTG19385
Плазмиды для переноса вируса осповакцины, pTG19339 и pTG19341, были сконструированы таким образом, чтобы позволить вставку нуклеотидных последовательностей путем гомологичной рекомбинации в J2R и I4L локусы генома вируса осповакцины соответственно. Они происходят из плазмиды pUC18, в которую были клонированы фланкирующие последовательности (BRG и BRD), окружающие локус J2R (pTG19339) или I4L (pTG19341). Каждая плазмида также содержит промотор p7.5K.
Был получен синтетический фрагмент, названный «Фрагмент HC» размером 1436 п.о., содержащий ген HC антитела 4-E03. Кодирующие последовательности были оптимизированы для применения кодонов человека, последовательность Козака (ACC) была добавлена перед стартовым кодоном ATG, а терминатор транскрипции (TTTTTNT) был добавлен после стоп-кодона. Кроме того, были исключены некоторые матрицы: TTTTTNT, GGGGG, CCCCC, которые вредны для экспрессии в поксвирусе.
Фрагмент HC был вставлен в pTG19339, ограниченный с PvuII путем гомологичной рекомбинации, приводящей к pTG19367.
Плазмида, содержащая экспрессионную кассету, кодирующую только легкую цепь 4-Е03, была получена удалением кассеты, кодирующей ген hGM-CSF, под контролем pSE/L в плазмиде pTG19384 (описанная выше). pTG19384 был ограничен NheI и XbaI (совместимые когезионные концы) и повторно лигирован, давая pTG19385.
COPTG19385 был создан на фибробласте куриного эмбриона (CEF) двумя последовательными гомологичными рекомбинациями для последовательной вставки в локусы J2R и I4L и с применением COPTG19156 в качестве родительского вируса и две плазмиды для переноса pTG19367 и pTG19385. CEF выделяли из яиц SPF с 12-дневным эмбрионом (Charles River). Эмбрионы были механически разделены на части, солюбилизированы в растворе Tryple Select (Invitrogen) и культивированы в MBE (среда на основе Eagle; Gibco) с добавлением 5% FCS (Gibco) и 2 мМ L-глутамина.
Гомологичная рекомбинация между плазмидами-переносчиками и родительским вирусом осповакцины позволяет получить рекомбинантные вирусы осповакцины, которые потеряли GFP и mCherry экспрессионные кассеты и накопленные экспрессионные кассеты антитела. COPTG19156 содержит экспрессионную кассету mCherry ген в его I4L локусе и экспрессионную кассета гена GFP в его J2R локусе. Гомологичная рекомбинация между плазмидой-переносчиком pTG19367 и родительским COPTG19156 позволяет создавать рекомбинантные вирусы осповакцины, которые утратили свою экспрессионную кассету GFP и приобрели экспрессионную кассету тяжелой цепи 4-E03, и селекцию проводили путем выделения красных флуоресцентных бляшек. Этот промежуточный рекомбинантный вирус (COPTG19367) был использован в качестве родительского вируса для второго раунда гомологичной рекомбинации с pTG19385 в качестве плазмиды-переносчика для поколения рекомбинантных вирусов осповакцины, утративших mCherry экспрессионную кассету и накопленная экспрессионная кассета легкой цепи 4-E03. Селекцию COPTG19385 проводили путем выделения белых нефлуоресцентных бляшек.
Вирусный исходный раствор COPTG19385 был амплифицирован на CEF в двух колбах F175 для создания соответствующих исходных растворов вирусов, которые можно разделить на аликвоты и хранить при -80 °C до применения. Вирусный исходный раствор титровали на клетках CEF и инфекционные титры выражали в БОЕ/мл и рассчитывали по следующей формуле: число литических областей x коэффициент разведения x 4. В иллюстративных целях полученный вирусный исходный раствор титровали 1,04 x 107 БОЕ/мл. Этот исходный раствор был проанализирован с помощью ПЦР для проверки целостности экспрессионных кассет и рекомбинационных плечей с применением соответствующих пар праймеров. Исходный раствор также был проанализирован путем секвенирования обеих экспрессионных кассет. Выравнивание результатов секвенирования показало 100% гомологию с теоретически ожидаемой последовательностью. При необходимости вирусные препараты очищали с применением обычных методик (например, как описано в WO2007/147528).
Экспрессия трансгенов
Опосредованная вирусом экспрессия моноклонального антитела 4-E03 была оценена в супернатантах CEF клеток, инфицированных с COPTG19384 с помощью вестерн-блота (WB) и по сравнению с рекомбинантно полученным антителом (40 нг 4-E03). WB позволяет визуализировать присутствие нефункциональных молекул, которые не связывают CTLA4 (например, молекул с неполной сборкой цепи, агрегатов). Клетки CEF инфицировали при MOI 0,05 с помощью COPTG19384 вирусного исходного раствора в трех повторностях. Клеточные супернатанты собирали через 48 часов и анализировали с помощью WB после электрофореза в невосстанавливающих условиях и с применением либо анти-Ig (левый блот), либо анти-легкой цепи (правый блот), HRP конъюгированного анитела. Результаты, проиллюстрированные на фиг. 18A, показывают, что профиль мАт WB в невосстанавливающем условии, продуцируемого инфицированной CEF, близок к профилю очищенного 4-E03 с аналогичным видимым размером от 100 до 150 кДа, что указывает на правильное сворачивание цепей и сборку.
Количественное определение функционально секретируемых антител 4-E03 и GM-CSF в супернатантах проводили с помощью ИФА. ИФА позволил количественно измерить количество функциональныхполипептид продуцируемых в супернатантах клеток. VVTG17137 применяли в качестве отрицательного контроля. Это вирус осповакцины (копенгагенский штамм) с делецией в локусах J2R и I4L, кодирующих ген «самоубийства» FCU1 (описанный в WO2009/065546).
Для оценки антитела 4-E03 микропланшеты покрывали с помощью инкубации в течение ночи при 4°C с 100 мкл на лунку CTLA4-Fc при 0,25 мкг/мл. После инкубации покрывающий раствор удаляли, добавляли блокирующий раствор и планшеты инкубировали в течение 1-2 часов при КТ перед промывкой. Калибровочные стандарты 4-E03 (от 0,097 до 100 нг/мл) или образцы (в трех повторах), разбавленные блокирующим раствором, добавляли в лунки, и планшеты инкубировали в течение 2 часов при 37°C перед промывкой. В каждую лунку добавляли конъюгированные с HRP антитела, разведенные в блокирующем растворе, и планшеты инкубировали 1 час при 37°C перед промывкой. После инкубации с раствором TMB 30 мин при КТ в темноте, H2 SO4 добавляли 2 M (стоп-раствор), чтобы остановить ферментативную реакцию. Поглощение считывали при 450 нм на считывающем устройстве для микропланшетов. Поглощение наносили на график в зависимости от концентрации антител в калибровочном стандарте. Как проиллюстрировано на фиг. 18B, функциональное мАт4-E03 продуцируется в клетках, инфицированных COPTG19384, достигая концентраций, близких к 1 мкг/ мл.
Также оценивали опосредованную вирусом экспрессию GM-CSF в тех же супернатантах с помощью Quantikine® ИФА (R&D Systems Ref SGM00). Вкратце, в этом анализе применяются два анти-hGM-CSF антитела. Первое антитело, использованное для захвата hGM-CSF в образцах, наносили на поверхность лунок 96-луночного планшета. Второе конъюгируется и добавляется в планшет в растворе для обнаружения захваченных hGM-CSF. Концентрация hGM-CSF в образце затем рассчитывается путем интерполяции из калибровочной кривой, полученной с некоторыми очищенными hGM-CSF предоставленной в наборе.Как проиллюстрировано на фиг. 19 уровень экспрессии GM-CSF составлял около 6 мкг/мл.
В заключение, для обоих трансгенов были обнаружены концентрации, равные или превышающие 1 мкг/мл, что указывает на удовлетворительный уровень экспрессии.
Генетическая стабильность:
Тесты на генетическую стабильность проводили после пяти пассажей вируса на CEF в бессывороточной среде при множественном инфицировании (MOI) 10-4. Пассаж P5 разбавляли и инокулировали на клетки CEF в чашках для культивирования диаметром 60 мм для получения от 20 до 40 вирусных бляшек на чашку. Были выделены и субкультивированы сто вирусных бляшек. После одного цикла амплификации изолированные вирусные бляшки инокулировали на клетки CEF и тестировали с помощью ПЦР и ИФА. ПЦР-анализ и экспрессия трансгенов показали, что более 90% клонов имеют правильный профиль. Поскольку критерием приемлемости для клинической разработки продукта является генетическая стабильность, превышающая или равная 90%, COPTG19384 считался генетически стабильным.
Пример 7. In vitro характеристика COPTG19384
Исследования репликации в гепатоцитах: опухоль-селективность вируса, экспрессирующего анти-CTLA4 мАт и GM-CSF
COPTG19384 несет две делеции гена, кодирующие вирусные ферменты (TK и RR), участвующие в метаболизме нуклеотидов. Когда эти ферменты функционируют, они позволяют вирусу реплицироваться в цитоплазме большинства клеток, включая клетки, находящиеся в состоянии покоя (т.е. с низким пулом нуклеотидов). Исследование диапазона хозяев было выполнено на первичных и злокачественных клетках, чтобы убедиться, что вставка различных трансгенов в J2R и I4L локусы не изменяет селективность диапазона хозяев. Воспроизведение COPTG19384 оценивали на нормальных первичных клетках человека (гепатоциты, полученные от Biopredic) и на опухолевых клетках того же органа (HepG2 из гепатокарциномы, ATCC® HB-8065™). Рассчитывались скорости репликации и терапевтические индексы и сравнивались с показателями копенгагенской осповакцины дикого типа (COP ДТ, вирус без делеции) в качестве эталонов для неселективного вируса осповакцины и рекомбинантного вируса с двойной делецией VVTG17137 (удаленного в генах J2R и I4L с геном «самоубийства» FCU1, вставленным вместо J2R), соответственно. Были проанализированы две партии: исследовательская партия (партия 1) и партия, произведенная в соответствии с GMP (партия 2). Скорость репликации определяли как отношение общего количества инфекционных частиц в конце инкубации/исходной инфекционной частицы (инокулята). Терапевтический индекс каждого вируса определяли как соотношение: скорость репликации на клетках HepG2/скорость репликации на гепатоцитах. Чем выше соотношение, тем выше селективность вируса по отношению к опухолевым клеткам.
Первичные гепатоциты выращивали в среде базальных клеток печени с добавлением 1,6% добавок для культуральной среды гепатоцитов. HepG2 высевали в 12-луночный планшет при 4E+05 клеток/лунка и инкубировали в течение 24 часов при 37°C с 5% CO2. Перед инфицированием культуральную среду удаляли и в каждую лунку добавляли 70 БОЕ/лунка вируса либо в ФСБ для гепатоцитов, либо в ФСБ с добавлением FCS для HepG2. Инфицированные клетки инкубировали 30 мин при 37°C с 5% CO2, а затем добавляли 1,5 мл/лунка культуральной среды. Планшеты инкубировали при 37°C с 5% CO23 дня, а затем хранили при -80°C. Затем планшеты оттаивали и лунки обрабатывали ультразвуком в течение 30 секунд с амплитудой 40% перед титрованием на клетках Vero.
Скорость репликации в нормальных гепатоцитах человека:
Нормальные гепатоциты были выбраны для мониторинга способности COPTG19384 в нормальных клетках человека, поскольку эти первичные клетки можно регулярно получать непосредственно от доноров. В этих клетках COP ДТ хорошо распространился со скоростью репликации более 50000 (фиг. 20A). Другими словами, каждая исходная вирусная частица инфекции продуцирует около 50000 новых вирусов. В случае двух рекомбинантных вирусов с двойной делецией (т.е. VVTG17137 и COPTG19384) эта скорость репликации была резко снижена до 5-15 в зависимости от вируса или партии вируса (фиг. 20A). Этот последний результат указывает на то, что ослабленная репликация в по отношению к нормальным клеткам, вызванная двумя делециями, была консервативной между VVTG17137 и COPTG19384.
Скорость репликации в опухолевых клетках HepG2:
Клетки HepG2 были выбраны для мониторинга способности COPTG19384 реплицироваться в опухолевых клетках человека, поскольку эти клетки являются злокачественным аналогом нормальных гепатоцитов. В этих клетках пять протестированных вирусов имели примерно одинаковую скорость репликации, достигающую около 100000 новых вирусов, независимо от исходного протестированного вируса (фиг. 20В). Следовательно, двойная делеция как в VVTG17137, так и в COPTG19384, и векторизация трансгенов не ухудшили их способности реплицироваться в злокачественных клетках.
Терапевтический индекс:
Как показано на фиг. 20C, рассчитанный индекс для COP ДТ равен только двум, что указывает на низкую селективность COP ДТ для опухолевых клеток по сравнению с нормальными клетками. Напротив, как для VVTG17137, так и для COPTG19384 (и для обеих партий протестированных вирусов) этот индекс варьируется от 8,2 E+03 до 1,8 E+04. Это подтверждает, что два рекомбинантных вируса обладают одинаковой хорошей селективностью по отношению к опухолевым и нормальным клеткам.
Эти результаты продемонстрировали, что COPTG19384 и VVTG17137 обладают очень похожими репликативными свойствами как на опухолевых, так и на здоровых клетках. По сравнению с COP ДТ, их репликация на опухолевых Hep G2 аналогична, тогда как на здоровых гепатоцитах она сильно нарушена.Следовательно, делеция двух генов (J2R и I4L) ограничивает репликацию удаленного вируса размножающимися клетками (т.е. с большим пулом нуклеотидов), включая опухолевые клетки. Поскольку экспрессия трансгенов и репликация тесно связаны, COPTG19384 является эффективным вектором для селективной доставки терапевтических белков в опухоль.
Анализы репликации на CEF и LoVo:
Репликацию COPTG19384 оценивали на CEF (клетках-продуцентах), выделенных из 11 или 12-дневных эмбрионов яиц, свободных от специфических патогенов (Charles Rivers), и на линии опухолевых клеток человека (LoVo; ATCC® CCL-229™). Клетки CEF и LoVo были приготовлены в виде суспензии и инфицированы при MOI 10-3 для CEF и 10-2 для LoVo (три лунки на клетку и на момент времени). После инкубации в разное время титрование вирусов проводили на клетках Vero (CCL-81™). Репликация COPTG19384 сравнивалась с репликацией VVTG17137 в качестве эталона. Результаты показывают, что репликация COPTG19384 и VVTG17137 была сходной как в CEF, так и в LoVo (данные не показаны).
Анализы репликации на реконструированной коже человека:
Репликация COPTG19384 также оценивалась на реконструированной коже человека (T-Skin™/Модель кожи человека полной толщины). Тридцать шестьобразцов T-Skin™, полученные от (EPISKIN SA), культивировали в 6-луночных планшетах и поддерживали в свежей культуральной среде. VVTG17137 и COPTG19384 были распределены в каждую лунку (в трех повторах) для получения контролируемой конечной концентрации (т.е. 101 до 105 БОЕ/лунка). Также тестировали отрицательный контроль, соответствующий среде без вируса (Имитация). Планшеты инкубировали при 37°C с 5% CO2на 7 дней и образцы T-Skin™ были собраны и разрезаны на две части. Инфекционный титр определяли на одном из двух образцов с применением клеток Vero для титрования вирусов. На фиг. 21 показано, что COPTG19384 реплицируется в реконструированной коже в той же степени, что и эталонный образец VVTG17137, что подтверждает тот факт, что векторизация как GM-CSF, так и мАт 4-E03 не изменяла репликационное поведение вируса осповакцины на реконструированной коже человека.
Онколитический анализ
Онколитическая активность представляет собой литическую активность тестируемых вирусных образцов в отношении опухолевых клеток. Его оценивали путем количественной оценки жизнеспособности клеток через 5 дней инкубации на различных линиях опухолевых клеток: клеточной линии колоректальной аденокарциномы человека LoVo (ATCC® CCL-229™), клеточной линии опухоли поджелудочной железы человека MIA PaCa-2 (ATCC® CCL- 1420) и клеточной линии гепатокарциномы человека HepG2 (ATCC® HB-8065™). Онколитическая активность COPTG19384 сравнивалась с активностью VVTG17137 в качестве эталона. Также помещали на чашки отрицательный контроль, соответствующий неинфицированным клеткам (имитация инфицированных клеток).
Клетки были подготовлены, распределены в пробирки Эппендорфа (1,2 × 106 клеток/пробирка) перед инфицированием вирусом при MOI 10-5до 10-2 и инкубировали 30 мин при 37°C. Соответствующую полную среду добавляли в пробирку Эппендорфа и аликвоту этой суспензии добавляли в каждую лунку (в трех повторностях) в 6-луночном планшете, содержащем 2 мл соответствующей полной среды. Планшеты инкубировали при 37°C с 5% CO2 в течение 5 дней и жизнеспособность клеток определяли на счетчике Vi-Cell. Результаты выражали в процентах от жизнеспособности ложно инфицированных клеток. Клеточные супернатанты также собирали для определения концентрации 4-E03мАт и GM-CSF. Фиг. 22 демонстрирует, что онколитические активности COPTG19384 и VVTG17137 сходны в трех оцениваемых линиях опухолевых клеток.
Уровень экспрессии трансгенов
Уровни экспрессии как моноклонального антитела 4-E03, так и GM-CSF измеряли с помощью ИФА (как описано в Примере 6) в культуральных супернатантах клеток HepG2 и LoVo, выделенных после определения активности онколиза (5 дней инфицирования при переменной MOI).
Уровни экспрессии 4-E03 и GM-CSF также измеряли с помощью ИФА (см. Пример 6). в супернатантах 5 клеточных линий, культивируемых в следующих условиях, соответственно клеточная линия карциномы желудка человека Hs-746 T (ATCC® HTB-135™), клеточная линия опухоли яичников человека SK-OV-3 (ATCC® HTB-77™), клеточная линия опухоли поджелудочной железы человека MIA PaCa-2 (ATCC® CCL-1420), клеточная линия колоректальной аденокарциномы человека LoVo (ATCC® CCL-229™) и клеточная линия колоректальной карциномы человека HCT 116 (ATCC® CCL-247™).Каждую клеточную линию культивировали (в трех повторностях) в 6-луночных планшетах (106 клеток/лунка) и инкубировали при 37°C с 5% CO2 в течение 24 часов перед инфицированием при MOI 0,05. Затем клеточные супернатанты собирали через 48 часов после заражения для определения концентрации 4-E03мАт и GM-CSF. Как и ожидалось, MOI, время после инфицирования и линия клеток являются важными параметрами, которые влияют на уровень экспрессии трансгенов в супернатантах инфицированных клеток. Фиг. 23A демонстрирует, что линия опухолевых клеток, обладающая довольно высокой репликацией (HepG2) и довольно резистентная (LoVo), при инфицировании COPTG19384 способны продуцировать в супернатантах своей культуры примерно такое же количество 4-E03 мАт и GM-CSF. Однако максимум экспрессии HepG2 достигается при MOI в 10 раз ниже, чем для LoVo. Более того, для 5 протестированных линий опухолевых клеток экспрессия трансгенов была выше 0,1 и выше 1 мкг/мл для 4-E03 мАт и GM-CSF соответственно. (фиг. 23B). Следует отметить, что анализ ИФА, используемый для измерения концентрации 4-E03 мАт, использует антиген CTLA4 для захвата антитела. Другими словами, антитела, измеренные с помощью этого анализа, являются, по меньшей мере, частично функциональными (т.е. распознают свой антиген, другие функции антитела выполняются частью Fc),
Очистка 4-E03 мАт и анализ профиля гликозилирования
Чтобы получить довольно большое количество 4-E03 мАт из инфицированных клеток, 15 флаконов F175, содержащих ~ 4,7 107 клеток Mia-PACA/флакон, инфицировали COPTG19384 при MOI 0,01 и инкубировали 72 часа. Супернатант культуры клеток MIA Paca-2 (около 450 мл, содержащий 670 мкг 4-E03 мАт, как определено с помощью ИФА) собирали, объединяли и осветляли центрифугированием для удаления большей части клеточного дебриса. Очищенные супернатанты фильтровали через фильтры с размером пор 0,2 мкм и добавляли 2 мМ EDTA (для ингибирования предполагаемых металлических протеаз) и 20 мМ Трис pH7,5 (для повышения pH). Отфильтрованный супернатант затем пропускали через колонку protA Hitrap (GE healthcare, ссылка 17-5079-01). Колонку перенесли и подключали к очистителю FPLC (GE Healthcare) и программа очистки применялась (THM /ProtA 1 мл нагнетательной петли frac bleu). Элюированные фракции, содержащиемАт были загружены на NuPage Бис-Трис гели 4-12% (Thermo NP0323) после добавления буфера Лаемлли (Biorad), содержащего или не содержащего бета- меркаптоэтанол для восстановления или нет дисульфидных связей мАт. Гель был окрашен InstantBlue (Expedeon, ISB1L).Три фракции, соответствующие основному пику элюции, были объединены, и после диализа против буфера для препарата концентрацию антитела определяли по поглощению при 280 нм. Конечная концентрация очищенного мАт составляла 0,29 мг/мл.
Первой характеристикой была оценка сборки цепей с помощью электрофореза в восстанавливающих и невосстанавливающих условиях. В невосстанавливающих условиях 2 легкие и 2 тяжелые цепи собираются с образованием нативного и функционального антитела. Оказалось, что очищенный 4-E03 из инфицированного MIA PaCa-2 и рекомбинантно полученный 4-E03 имеют неразличимые профили электрофореза как в восстанавливающих, так и в невосстанавливающих условиях. Другими словами, очищенный 4-E03 из инфицированного MIA PaCa-2 имеет ожидаемое соотношение легкой и тяжелой цепей и правильно собран в гетеротетрамер с 2 легкими и 2 тяжелыми цепями. Присутствие этого гетеротетрамера было также подтверждено масс-спектрометрией. Очищенное мАт подвергали масс-спектрометрии для анализа гликозилирования. Вкратце, мАт было расщеплено или нет протеазой IdeS, которая специфически расщепляет IgG на шарнире (что приводит к F(ab')2 и Fc частям). Определяли массы целого антитела или частей Fc, которые несут N-гликозилирование, и каждой массе соответствовала теоретическая масса, рассчитанная на основе первичной последовательности Fc и характера гликозилирования. Профиль гликозилирования 4-E03 мАт, очищенного из инфицированной MIA PaCa-2, сравнивали с профилем рекомбинантно полученного и очищенного 4-E03 и MabThera в качестве эталона для IgG1 человека, используемого в клинике. Результаты показывают, что профили гликозилирования 4-E03, полученного из инфицированной MIA PaCa2, имели профиль гликозилирования, отличный от двух эталонных антител с большей частью G0F (88%), тогда как оба рекомбинантных 4-E03 и MabThera имеют аналогичный профиль гликозилирования с типичным распределением G0F, G1F и G2F. Тем не менее, предполагалось, что MIA PaCa-2 является причиной низкого уровня G1F и G2F в очищенном 4-E03 мАт из-за низкого уровня транскрипта бета-1,4-галактозилтрансферазы 1, что может быть причиной отсутствия галактозильного фрагмента (и, следовательно, отсутствие G1f и G2F) 4-E03, экспрессируемого в MIA PaCa-2.
Такой же тип очистки с последующим массовым анализом был также выполнен из пермеата, извлеченного во время очистки COPTG19384, полученного на CEF. Результаты показывают, что профили гликозилирования 4-E03 из инфицированной CEF очень похожи на профили MabThera или рекомбинантного 4-E03. Этот последний результат предполагает, что профиль гликозилирования антитела в большей степени зависит от используемой клеточной линии, чем от самой инфекции.
4-E03, очищенный из супернатанта инфицированных клеток MIA PaCa-2 (4-E03 TG), также проявляет те же характеристики связывания, что и рекомбинантно продуцируемый 4-E03 клетками CHO (партия исследований) или HEK (партия токсинов) (фиг. 24 и 25). Это было продемонстрировано с помощью ИФА (как описано в Примере 1), чтобы проверить связывание с рекомбинантным CTLA-4 белком (фиг. 24А) человека и (фиг. 24B) яванского макака. FACS-анализ, в ходе которого тестировали связывание с клетками человека, экспрессирующими CTLA-4 (фиг. 25A) и яванского макака (фиг. 25B) (см. Примеры 1 и 2), подтвердил аналогичную перекрестную реактивность и аффинность связывания для различных партий 4-E03.
Характер гликозилирования и дисульфидных связей GM-CSF
Чтобы исследовать характер гликозилирования и присутствие некоторых дисульфидных связей, разные линии опухолевых клеток человека были инфицированы COPTG19384, и их супернатанты были проанализированы одним и тем же методом WB. Клетки MIA-Paca-2, LoVo, HepG2 и HCT116 инфицировали при MOI 0,01 и инкубировали 72 часа в культуральной среде без сыворотки. Супернатанты культур собирали, очищали центрифугированием и затем фильтровали на фильтре 0,2 мкм. Супернатанты хранили при -20°C до анализа.Oни были обработаны добавлением 8 мкл буфера Rapid PNGase F Buffer 5X с последующей инкубацией при 75°C в течение 5 минут. Затем добавляли один мкл PNGase F (для удаления N-гликанов из гликопротеина) и смесь инкубировали 30 минут при 50°C. Двадцать пять мкл образцов получали добавлением 5 мкл буфера Лэммли x4 с бета-меркаптоэтанолом или без него (восстанавливающие и невосстанавливающие условия) перед отправкой на вестерн-блоттинг. Иммунные комплексы обнаруживали с помощью Вестерн-блоттинга Amersham ECL Prime, а хемилюминесценцию регистрировали с помощью Molecular Imager ChemiDOC XRS (Biorad).
GM-CSF из инфицированных HCT116, LoVo и MIA PaCa-2 демонстрировал тот же характер гликозилирования, тогда как GM-CSF, продуцируемый инфицированной HepG2, мигрировал как не-N-гликозилированная молекула. Эти результаты показывают, что GM-CSF, продуцируемый опухолевыми клетками человека, инфицированными COPTG19384, имеет ожидаемые посттрансляционные модификации (т.е. дисульфидные связи и N-гликозилирование). Однако эти модификации, вероятно, варьируются в зависимости от линий опухолевых клеток, используемых для инфекцирования, и их конкретного метаболического статуса.
Пример 8. Фармакокинетика после внутриопухолевых инъекций COPTG19384
Кинетика экспрессии в опухоли и кровотоке анти-CTLA4 антител, GM-CSF и вирусов после внутриопухолевого (i.t. -intratumoral) введения вирусов осповакцины в модели с ксенотрансплантатом LoVo.
Протокол
5 × 106 клеток клеток LoVo имплантировали в правый бок голых мышей Swiss (Чарльз Ривер, Франция). Через около две недели, когда объем опухолей достиг ~ 120 мм3, мышей рандомизировали и разделили на 6 групп по 15 животных.
• Мыши из группы 1 получали i.t. введение COPTG19384 в дозе 1 × 104 БОЕ/мышь в D0 (первый день лечения).
• Мыши из группы 2 получали i.t. введение COPTG19384 в дозе 1 × 105 БОЕ/мышь в D0.
• Мыши из группы 3 получали i.t. введение VVTG17137 в дозе 1 × 104 БОЕ/мышь в D0.
• Мыши из группы 4 получали i.t. введение VVTG17137 в дозе 1 × 105 БОЕ/мышь в D0.
• Мыши из группы 5 получали внутрибрюшинное (в/б) введение 4-E03 в дозе 3 мг/кг в D0.
• Мыши из группы 6 получали в/б введение ипилимумаба (Ервой) в дозе 3 мг/кг в D0.
Опухоль и кровь у 3 животных собирали на 1, 3, 6, 10 и 20 дни. Опухоли взвешивали и гомогенизировали для немедленной обработки. Четверть гомогенизированных опухолей собирали для титрования вируса, оставшуюся суспензию центрифугировали и супернатанты хранили при -20°C до использования. Кровь разделяли на две части: одну добавляли в пробирку с гепарином (25 МЕ/100 мкл крови) для анализа титрования и замораживали при -80°C до анализа. Осветленные сыворотки получали из другой части и хранили при -20°C до использования. Титр вируса определяли в образцах опухоли и крови титрованием на клетках Vero.
Кинетика репликации вируса в модели LoVo:
В модели LoVo, где COPTG19384 вводили один раз двумя дозами (1 × 104 или 1 × 105 БОЕ), репликацию вируса отслеживали и сравнивали с репликацией VVTG17137, введенного в тех же условиях. Результаты, показанные на фиг. 26, демонстрируют важный разброс трех значений титров вирусов, измеренных для каждой временной точки. В любом случае результаты показывают, что оба вируса и в обеих дозах реплицируются в опухоли и поддерживают довольно высокий титр/г опухоли с 3 по 20 день после инъекции. Нет очевидной разницы в титрах вируса для данного момента времени между двумя дозами вируса или между двумя использованными вирусами. Интересно, что все образцы крови были отрицательными на обнаружение вируса, за исключением одного образца (VVTG17137, доза: 1 × 107 БОЕ в день 10), для которого было обнаружено только 13 БОЕ/мл (данные не показаны).
Вместе эти результаты показывают, что после одной i.t. инъекции либо 1x104 или 1x105 БОЕ, репликация вируса поддерживалась в опухолях LoVo в течение не менее 20 дней с едва заметным присутствием в кровотоке. Следует отметить, что модель с ксенотрансплантатом LoVo очень благоприятна для репликации вируса, поскольку в ней используются пермиссивные опухолевые клетки человека и голых мышей Swiss, которые имеют серьезно нарушенную иммунную систему с ограниченной противовирусной активностью.
Кинетика экспрессии трансгенов в модели LoVo:
Как и ожидалось, кинетика экспрессии трансгенов в опухоли следовала кинетике репликации вируса с максимальной концентрацией (Cmax) в 6 или 10 день для обоих 4-E03 мАт (фиг. 27A) и GM-CSF (фиг. 27B). В случае однократной инъекции 4-E03 мАт (или ипилимумаба) Cmax в опухоли и крови наблюдали в первый момент времени (день 1), и после этого измеренные концентрации мАт соответствовали фармакокинетике IgG1 человека у мышей (фиг. 28).
Более того, концентрации 4-E03 в опухоли при Cmax и после этого (т.е. от 6-10 до 20 дней после инъекции) были примерно в 10 раз выше после лечения COPTG19384 (для обеих доз), чем после однократной инъекции 4-E03 мАт в терапевтической дозе 3 мг/кг (фиг. 27A). Напротив, концентрация мАт в крови после обработки COPTG19384 всегда была ниже концентраций, измеренных после внутрибрюшинной инъекции 3 мг/кг 4-E03 (фиг. 28A). Этот результат показывает, что векторизация мАт позволяет достичь высокой концентрации в опухоли без превышения или даже достижения концентрации в крови, полученной при терапевтическом дозировании мАт.
Кинетика экспрессии GM-CSF после обработки COPTG19384 соответствует кинетике, наблюдаемой с 4-E03 (фиг. 27B). Интересно, что уровни GM-CSF, измеренные в опухоли, ниже уровня 4-E03 для тех же образцов, хотя in vitro LoVo, инфицированные COPTG19384, экспрессируют около в два раза больше GM-CSF, чем 4-E03. Концентрации GM-CSF в крови также были очень низкими по сравнению с концентрациями 4-E03 (фиг. 28B). Этот результат соответствует периоду полужизни GM-CSF in vivo, который очень короткий по сравнению с периодом полужизни IgG1 человека.
Эти результаты показывают, что векторизованные антитела и GM-CSF экспрессируются в основном в опухоли после i.t. инъекции COPTG19384 с минимальным системным воздействием. Эти результаты подтверждают, что векторизация особенно подходит для трансгенов с токсикологическими (например, анти-CTLA4) или фармакокинетическими (например, GM-CSF) проблемами.
Кинетика экспрессии в опухоли и кровотоке анти-CTLA4 антител, GM-CSF и вирусов после внутриопухолевого введения вирусов осповакцины в сингенной модели CT26
Оценка вирусной активности на иммунокомпетентной мышиной модели CT26 требует создания нескольких суррогатных вирусов, кодирующих мышиное анти-mCTLA4 с мышиным GM-CSF или без него:
• COPTG19407 представляет собой вирус осповакцины (копенгагенский штамм), содержащий экспрессионную кассету, кодирующую тяжелую цепь мышиного m5-B07 IgG2 (SEQ ID NO: 63) под промотором p7.5 в локусе J2R, и экспрессионную кассету, кодирующую легкую цепь m5-В07 (SEQ ID NO: 62) под промотором p7.5 и мышиным GM-CSF (SEQ ID NO: 58) под промотором pSE/L в I4L локусе.
• COPTG19421 представляет собой вирус осповакцины (копенгагенский штамм), содержащий экспрессионную кассету, кодирующую тяжелую цепь m5-B07 под промотором p7.5 в локусе J2R, и экспрессионную кассету, кодирующую легкую цепь m5-B07 под промотором p7.5 в I4L локусе.
• VVTG18058, применяемый в качестве эталона, представляет собой вирус осповакцины (копенгагенский штамм), удаленный в генах J2R и I4L, без какого-либо трансгена («пустой» вирус).
Эти вирусы осповакцины были созданы, как и человеческие аналоги, путем двух последовательных гомологичных рекомбинаций в локусах J2R (TK), а затем I4L (RR), следуя процессу, описанному в Примере 6. Метод ИФА для количественной оценки антитело m5-B07 и mGM-CSF были аналогичны описанным выше (Пример 6, «экспрессия трансгена» для 4-E03 и GM-CSF), за исключением того, что мышиный антиген CTLA4-Fc применяли для захвата мышиного антитела, а набор Quantikine ELISA Mouse GM-CSF (R&D Systems) применяли для количественного определения mGM-CSF. Онколитическая активность этих вирусов также оценивалась в различных клеточных линиях (одна саркома: MCA205 и две карциномы толстой кишки CT26 и MC38) и была сходной с таковой для VVTG18058, показывая, что векторизация мышиного антитела с mGM-CSF или без него не влияла на онколитические способности вируса осповакцины (данные не показаны).
Протокол: Клетки CT26 (2 × 105 клеток) имплантировали в правый бок мышей Balb/c (Чарльз Ривер, Франция). Через около одну неделю, когда объем опухолей достиг 25-50 мм3, мышей были рандомизированы и разделены на 3 группы по 20 животных (группы с 1 по 3) и одна группа 4 из 10 животных. Опухоль и кровь собирали и обрабатывали, как описано для модели LoVo, за исключением того, что их собирали в дни 1, 4, 8 и 10 для первых 3 групп и день 1 для группы 4.
• Мыши из группы 1 получали i.t. введение VVTG18058 в дозе 1 × 107 БОЕ/мышь в D0, D2 и D4.
• Мыши из группы 2 получали i.t. введение COPTG19407 в дозе 1 × 107 БОЕ/мышь в D0, D2 и D4.
• Мыши из группы 3 получали i.t. введение COPTG19421 в дозе 1 × 107 БОЕ/мышь в D0, D2 и D4.
• Мыши из группы 4 получали в/б введение m5-B07 в дозе 3 мг/кг в D0.
Кинетика репликации вируса в модели CT26:
В модели CT26, где два суррогатных вируса вводили трижды (1 × 107 БОЕ/инъекция), репликацию вируса отслеживали и сравнивали с репликацией VVTG18058, введенной в тех же условиях. Результаты, показанные на фиг. 29, демонстрируют, как и для модели LoVo, важный разброс трех значений титров вирусов, измеренных для каждой временной точки. Однако титры для трех вирусов поддерживались в течение времени и до 10 дней, что указывает на то, что два трансгена не влияли на клиренс или репликацию вируса, по меньшей мере, в этот промежуток времени. Ни в одном из образцов крови не было обнаружено инфекционных частиц вируса (данные не показаны).
Кинетика экспрессии трансгенов в модели CT26
Как и в модели LoVo, экспрессия трансгенов в опухоли отражала репликацию вируса. Другими словами, антитело m5-B07 (фиг. 30A) и mGM-CSF (фиг. 30B) были обнаружены в опухоли на довольно постоянном уровне в течение 10 дней мониторинга.
В случае моноклонального антитела Cmax, достигаемая после инъекций COPTG19421 или COPTG19407, была около в 10 раз ниже, чем Cmax, наблюдаемая при однократной в/б инъекции антитела m5-B07 в дозе 3 мг/мл (фиг. 30A). В сыворотке разница была еще более выраженной с циркулирующей концентрацией m5-B07, которая была ~ в 100 раз ниже после обработки вирусом, по сравнению с инъекцией m5-B07 в дозе 3 мг/кг (фиг. 31).
Что касается GM-CSF, только обработка COPTG19407 приводила к измеряемой концентрации mGM-CSF в опухолях CT26, что указывает на то, что измеренный цитокин имеет рекомбинантное, а не эндогенное происхождение. Как и в модели LoVo, концентрации mGM-CSF, измеренные в опухоли, были ниже, чем концентрации m5-B07 (фиг. 30B). Более того, mGM-CSF, продуцируемый опухолью, не обнаруживался ни в одном образце сыворотки, вероятно, из-за короткого периода полужизни молекулы, который исключает какое-либо системное накопление.
Пример 9. Исследования противоопухолевой активности
COPTG19347 представляет собой вирус осповакцины (копенгагенский штамм), удаленный в генах J2R и I4L и кодирующий целое мышиное антитело (а именно m5-B07, тяжелая и легкая цепи), распознающие мышиный антиген CTLA4. COPTG19421 по сравнению с COPTG19347 экспрессировались оба как m5-B07, но под разными промоторами: а именно p7.5K и pH5.R, соответственно. Количественное определение m5-B07 оценивали в супернатантах инфицированных клеток, достигающих около 1 мкг/мл в инфицированном CT26 при MOI 10-1 до около 4 мкг/мл в инфицированных клетках MCA205 при MOI 10-2. Более высокая экспрессия MCA205 по сравнению с CT26 наблюдалась также для mGM-CSF в культуральном супернатанте клеток, инфицированных COPTG19407 (данные не показаны).
Противоопухолевая активность у мышей, несущих модель CT26 в комбинации с анти-PD1
Протокол:
Клетки CT26 (2 × 105 клеток) имплантировали в правый бок мышей Balb/c (Чарльз Ривер, Франция). Когда опухоли достигли объема 25-50 мм3, мышей рандомизировали на пять групп по десять животных. Вкратце, мышей лечили трехкратным i.t. введением вируса с интервалом в 2 дня с последующим в/б введением мышиного анти-PD1 (RMP1-14 BioXcell) два раза в неделю в течение трех недель. В частности,
• Мыши из группы 1 получали носитель;
• Мыши из группы 2 получали i.t. введение 1 × 107 БОЕ COPTG19347 в D0, D2 и D4;
• Мыши из группы 3 получили i.t. введение 1 × 107 БОЕ COPTG19347 в D0, D2 и D4 и внутрибрюшинное введение 250 мкг/мышь RMP1-14 в D7, D11, D14, D18 и D22;
• Мышам из группы 4 в/б вводили 250 мкг/мышь RMP1-14 в D7, D11, D14, D18 и D22;
• Мыши из группы 5 получали i.t. введение 1 х 107 БОЕ VVTG18058 в D0, D2 и D4.
Размеры опухоли измеряли дважды в неделю штангенциркулем, а их объем рассчитывали по формуле (ᴨ/6) (длина x ширина2). Животных умерщвляли, когда объем опухоли достигал 2000 мм3.
Противоопухолевая активность COPTG19347 в модели CT26:
Как показано на фиг. 32, обработка COPTG19347 приводила не только к ингибированию роста опухоли (фиг. 32A), но также к регрессии опухоли, которая в конечном итоге трансформировалась у мышей, свободных от опухоли, которые выживали до 100 дней (фиг. 32B). Лечение с помощью COPTG19347 привело к 60% мышей без опухолей в день 100. Совместное лечение с анти-PD-1 антителом не привело к значительному улучшению ингибирования роста опухоли или процента долгоживущих мышей (около 70% мышей без опухолей в день 100). Для сравнения, обработка RPMI-14 не оказывала никакого противоопухолевого эффекта (такое же поведение, как у необработанных мышей (все погибли в течение первых 40 дней), тогда как VVTG18058 имел низкую активность (около 10% мышей без опухолей в день 100).
Оценка доза-эффект на модели CT26:
Сравнивали три суррогатных вируса (разные промоторы для управления m5-B07 и с m-GM-CSF или без него) и было выполнено повышение дозы COPTG19407 по сравнению с VVTG18058 (7,5 x 104, 7,5 x 105 или 7,5 x 106 БОЕ). Условия эксперимента были точно такими же, как описано выше, за исключением того, что совместное лечение с анти-PD1 не применялось.
Результаты двух независимых экспериментов ясно продемонстрировали, что три протестированных вируса COPTG19407, COPTG19421 и COPTG19347 обладали сильной противоопухолевой активностью в дозе 7,5 × 106 БОЕ. Это подтверждает, что ни mGM-CSF, кодируемый в COPTG19407, ни применение самого слабого промотора в COPTG19421 и COPTG19407 не нарушали противоопухолевую активность вооруженных вирусов. При наивысшей протестированной дозе (т.е. 7,5 × 106 БОЕ) количество мышей без опухолей через 80 дней составляло между от 5/10 до 7/10 в зависимости от вируса и эксперимента по сравнению с 0/10 для мышей, обработанных пустым вирусом как показано в следующей таблице.
Таблица 6. Влияние суррогата вирусов COPTG19407, COPTG19421 и COPTG19347 на рост опухоли после i.t. инъекций
pSE/L-GM-CSF
*HC и LC обозначают тяжелую и легкую цепи мышиного m5-B07 анти-mCTLA4 антитела соответственно
Более того, увеличение дозы, выполненное как с «пустым» вирусом (VVTG18058), так и с суррогатом COPTG19384 (COPTG19407), продемонстрировало, что даже при относительно низкой дозе (7,5 × 104 БОЕ) вирус, экспрессирующий антитела, все еще обладал явной противоопухолевой активностью с 4/10 и 2/10 мышей без опухолей через 80-98 дней по сравнению с 0/10 для лечения VVTG18058 в такой же низкой дозе, как показано в следующей таблице.
Таблица 7. Влияние дозы COPTG19407 или VVTG18058 на рост опухоли после i.t. инъекций
pSE/L-GM-CSF
*HC и LC обозначают тяжелую и легкую цепи мышиного m5-B07 анти-mCTLA4 антитела соответственно
Сборник данных о выживаемости (глобальный график выживаемости, составленный из двух независимых исследований) представлен на фиг. 33. Был проведен статистический анализ с применением теста логарифмического ранжирования, чтобы выяснить, были ли существенные различия между выживаемостью каждой группы.
Противоопухолевая активность COPTG19407 по сравнению с комбинацией VVTG18058 плюс m5-B07
Мышей с опухолью CT26 выращивали, как описано ранее (Пример 5). Вкратце, клетки CT26 вводили п/к мышам Balb/C. Лечение мышей начинали, когда опухоли достигли прибл. 100 мм3. Затем мышам вводили в D0, D2 и D5 COPTG19407 (8,5 x 106 БОЕ i.t.), VVTG18058 (8,5 x 106 БОЕ i.t.), m5-B07 (10 мг/кг в/б) или комбинацию VVTG18058 (8,5 x 106 БОЕ i.t.) плюс m5-B07 (10 мг/кг в/б). Затем дважды в неделю измеряли размеры опухоли, и мышей умерщвляли, когда опухоли достигли 2000 мм3. Как показано на фиг. 34A - 34D, рост опухоли значительно подавлялся, когда мышей лечили вирусом COPTG19407, экспрессирующим анти-CTLA-4 и GM-CSF, тогда как комбинация невооруженного вируса плюс анти-CTLA4 m5-B07 не приводила к улучшению терапии по сравнению с применением одного агента. В группах, обработанных только m5-B07, только вирусом VVTG18058 или комбинацией обоих m5-B07 и VVTG18058, только 20% мышей выжили после 70 дня (фиг. 34E). Напротив, 90% мышей выживали дольше чем 100 дней после введения COPTG19407, что демонстрирует эффективность стратегии векторизации.
Противоопухолевая активность VVTK-RR-кодирующих анти-CTLA-4 и GM-CSF у мышей, несущих подкожную мышиную B-клеточную лимфому A20
Линия клеток А20 представляет собой BALB/c линию B клеток лимфомы линия происходит от спонтанного ретикулума клеточного новообразования, обнаруженного у старой мыши BALB/cAnN (ATCC TIB-208™).
Протокол (1):
Опухоли вызывали подкожной инъекцией 5 х 106 клеток А20 в правый бок самки мыши Balb/cN (Река Чарльз, Франция). Когда опухоли достигли среднего объема 95 мм3, 50 мышей были рандомизированы на 5 групп по 10 животных.
• Мыши из группы 1 получали i.t. введение носителя в D0, D2 и D4,
• Мыши из группы 2 получали i.t. введение VVTG18058 в дозе 4,75 × 106 БОЕ в D0, D2 и D4,
• Мыши из группы 3 получали i.t. введение COPTG19407 в дозе 4,75 × 106 БОЕ в D0, D2 и D4,
• Мыши из группы 4 получили в/б введение анти-PD-1 антитела в дозе 250 мкг в D7, D10, D14, D17, D21 и D24,
• Мыши из группы 5 получали i.t. введение COPTG19407 в дозе 4,75 × 106 БОЕ в D0, D2 и D4 в сочетании с в/б введением анти-PD-1 антитела в дозе 250 мкг в D7, D10, D14, D17, D21 и D24.
Противоопухолевое действие:
Объем опухолей у всех животных контролировали на протяжении всего исследования. Противоопухолевая активность лечения основана на оценке критериев времени удвоения опухоли, задержки роста опухоли и ингибирования роста опухоли (T/C%).
Время удвоения опухоли было одинаковым для групп 1, 2 и 4 в диапазоне от 5,14 дня (группа 1) до 6,37 дня (группа 2). Для группы 3 время удвоения опухоли нельзя было точно рассчитать, поскольку опухоли не росли экспоненциально, что указывает на повышенную эффективность лечения по сравнению с группами 1, 2 и 4. Точно так же время удвоения опухоли было рассчитано с использованием только одного животного в группе 5. У 9 из 10 мышей в группе 3 были опухоли, которые регрессировали на D15 и существенно не увеличились в объеме с D25 до конца исследования в D64. В D64 объем опухоли у этих 9 мышей составлял от 4 мм³ (технический предел обнаружения опухоли) до 59,77 мм³. Аналогичным образом, в группе 5 опухоли регрессировали у 9 мышей после начала лечения, достигнув значений в диапазоне от 7,24 до 63,21 мм³ в конце исследования в D64. Как можно видеть на фиг. 35 представлены индивидуальные кривые объема опухоли для каждой группы лечения (Группы с 1 по 5, соответствующие фиг. 35 от A до E), опухоли не росли у животных групп 3 и 5, получавших COPTG19407, что подтверждает сильную анти-опухолевую активность антитело-экспрессирующего вируса с анти-PD1 или без него.
Задержку роста опухоли рассчитывали путем оценки времени, необходимого для достижения опухолями среднего целевого объема 300 мм3. Результаты были аналогичны результатам, полученным для времени удвоения опухоли, так как этот параметр можно было рассчитать только для опухолей, достигших целевого объема 300 мм³, что не имело места для большинства животных в группах 3 и 5. Группы 1, 2 и 4 имели средние задержки роста опухоли на 16, 21 и 17 дней соответственно, которые существенно не отличались друг от друга. Кроме того, в группах 3 (n = 2) средняя задержка опухоли составляла 14 дней, что указывает на то, что опухоли, которые действительно росли в этой группе, росли с той же скоростью, что и группы 1, 2 и 4, однако эти опухоли действительно регрессировали в обеих группах животных. Для сравнения, единственная опухоль в группе 5 (n = 1), которая выросла, имела значительно (p ≤ 0,0026) более длительную задержку роста опухоли, чем во всех других группах, на 43 дня.
Ингибирование роста опухоли (Т/С%) рассчитывали путем сравнения среднего объема опухоли в группе 1, обработанной носителем, с другими группами лечения. Группа 2 имела оптимальное T/C% 34% в D22, что указывает на временную маргинальную противоопухолевую активность, но это значение увеличилось до 71% в D31. Умеренная противоопухолевая активность (10-30% T/C%) наблюдалась в группе 4. Для сравнения, обе группы 3 и 5 показали заметную противоопухолевую активность (T/C% менее чем 10%) от D27 до D31 (последнее рассчитанное значение T/C%).
Фиг. 36 иллюстрирует кривые среднего объема опухоли на мышах BALB/cN, несущих подкожные опухоли A20, демонстрируя драматическое влияние анти-CTLA4 и Gm-CSF-экспрессирующего вируса COPTG19407 с анти-PD1 или без него на рост опухоли.
Протокол (2):
Опухоли индуцировали подкожной инъекцией 5 × 106 клеток А20 в правый бок самок мышей BALB/cN. Когда опухоли достигли среднего объема 80-100 мм3, 90 животных были рандомизированы в 9 групп по 10 животных.
• Мыши из группы 1 получали i.t. введение носителя в D0, D2 и D4.
• Мыши из группы 2 получали в/б введение анти-PD-1 антитела в дозе 250 мкг/мышь/инъекция в D0, D4, D7, D10, D14 и D17.
• Мыши из группы 3 получали в/б введение изотипа в дозе 250 мкг/мышь/инъекция в D0, D4, D7, D10, D14 и D17.
• Мыши из группы 4 получали i.t. введение VVTG18058 в дозе 1 × 105 БОЕ в D0, D2 и D4.
• Мыши из группы 5 получали i.t. введение VVTG18058 в дозе 1 × 105 БОЕ в D0, D2 и D4 и в/б введение изотипа в дозе 250 мкг/мышь/инъекцию в D0, D4, D7, D10, D14 и D17.
• Мыши из группы 6 получали i.t. введение VVTG18058 в дозе 1 × 105 БОЕ в D0, D2 и D4 и в/б введение анти-PD-1 антитела в дозе 250 мкг/мышь/инъекция в D0, D4, D7, D10, D14 и D17.
• Мыши из группы 7 получали i.t. введение COPTG19407 в дозе 1 х 105 БОЕ в D0, D2 и D4.
• Мыши из группы 8 получали i.t. введение COPTG19407 в дозе 1 × 105 БОЕ в D0, D2 и D4 в сочетании с в/б введением изотипа в дозе 250 мкг/мышь/инъекция в D0, D4, D7, D10, D14, D17 и D24.
• Мыши из группы 9 получали i.t. введение COPTG19407 в дозе 1 × 105 БОЕ в D0, D2 и D4 в сочетании с в/б введением анти-PD-1 антитела в дозе 250 мкг/мышь/инъекцию в D0, D4, D7, D10, D14 и D17.
Противоопухолевое действие:
Доза COPTG19407 является субоптимальной и демонстрирует умеренную противоопухолевую активность, аналогичную таковой у анти-PD-1 обработки, с точки зрения объема опухоли и выживаемости мышей.
Напротив, комбинация COPTG19407 с анти-PD-1 показала сильную противоопухолевую активность, приводящую к меньшему объему опухоли по сравнению с другими группами, как показано на фиг. 37A (примерно 290 мм3 в 36 день по сравнению с примерно 630 мм3 и 750 мм3 на 24 день для мышей, получавших только анти-PD-1 или только COPTG19407, соответственно), и гораздо лучшую выживаемость животных, как показано на фиг. 37B (7 животных все еще живы в 57 день в группе 9 по сравнению только с двумя или по одному в группах 2 или 7 соответственно).
Исследование противоопухолевой активности VVTK-RR- кодирующих анти-CTLA-4 и GM-CSF у мышей, несущих подкожную C38 клеточную опухоль толстой кишки
C38 представляет собой аденокарциному толстой кишки мыши, происходящую из коллекции американских типовых культур (АТСС CRL-2779™).
Протокол:
Фрагменты опухолей (30-50 мг) имплантировали подкожно в правый бок самки мыши C57BL/6J (Жанвье, Франция). Когда опухоли достигли среднего объема примерно 60 мм3, 50 животных были рандомизированы на пять групп по десять животных.
• Мыши из группы 1 получали i.t. введение носителя в D0, D2 и D4,
• Мыши из группы 2 получали i.t. введение VVTG18058 в дозе 4,75 × 106 БОЕ в D0, D2 и D4,
• Мыши из группы 3 получали i.t. введение COPTG19407 в дозе 4,75 × 106 БОЕ в D0, D2 и D4,
• Мыши из группы 4 получили в/б введение мышиного анти-PD-1 антитела в дозе 250 мкг в D7, D10, D14, D17, D21 и D24,
• Мыши из группы 5 получали i.t. введение COPTG19407 в дозе 4,75 × 106 БОЕ в D0, D2 и D4 в сочетании с в/б введением анти-PD-1 антитела в дозе 250 мкг в D7, D10, D14, D17, D21 и D24.
Противоопухолевое действие:
Как и прежде, объем опухолей у всех животных контролировали на протяжении всего исследования. Время удвоения опухоли было одинаковым для групп 1 и 2 и составляло примерно 6,7 дня. Группа 4 (n = 5) имела более длительное время удвоения опухоли (10,4 дня), но не было значительных различий между группами. Для групп 3 и 5 время удвоения опухоли можно было рассчитать, но с меньшим количеством животных (n = 2), поскольку большинство опухолей у мышей в этих группах не росли экспоненциально, что указывает на повышенную эффективность лечения по сравнению с группами 1, 2 и 4. Как проиллюстрировано на фиг. 38, у 8 из 10 мышей в группе 3 были опухоли, которые регрессировали с D15 и не увеличились в объеме существенно, при этом у пяти мышей не было обнаруживаемых опухолей в конце исследования в D61. Аналогичным образом, в группе 5 опухоли регрессировали у 8 мышей после начала лечения, достигнув значений в диапазоне от 0 (n = 2) до 47,82 мм³ в конце исследования в D61.
Задержку роста опухоли рассчитывали путем оценки времени, необходимого для достижения опухолями среднего целевого объема 300 мм3. Результаты были аналогичны результатам, полученным для времени удвоения опухоли, так как этот параметр можно было рассчитать только для опухолей, достигших целевого объема 300 мм³, что не имело места для большинства животных в группах 3 и 5. Существенных различий между группами не было. Группы 1, 2 и 4 (n = 5) имели среднюю задержку роста опухоли от 23 до 27 дней соответственно. Кроме того, в группах 3 (n = 2) и 5 (n = 3) средняя задержка роста составляла 18 и 24 дней, соответственно. Это указывает на то, что опухоли, которые действительно росли в этих двух группах, росли с той же скоростью, что и в группах 1, 2 и 4.
Ингибирование роста опухоли (Т/С%) рассчитывали путем сравнения среднего объема опухоли в группе 1, обработанной носителем, с другими группами лечения. Группа 2 не показала ингибирования роста опухоли, так как T/C% оставались выше 100% на протяжении всего исследования. Для сравнения, все группы 3, 4 и 5 показали заметную противоопухолевую активность (T/C% менее чем 10%) от D31 (только для группы 3) до D42 (последнее вычисленное значение T/C%).
Фиг. 39 иллюстрирует кривые среднего объема опухоли мышей C57BL/6, несущих подкожные опухоли C38, демонстрируя драматическое влияние вируса COPTG19407, экспрессирующего анти-CTLA4/GM-CSF, с или без анти-PD1 на рост опухоли.
Исследование противоопухолевой активности VVTK-RR- кодирующих анти-CTLA-4 и GM-CSF у мышей, несущих подкожную EMT6 клеточную опухоль молочной железы
EMT6 представляет собой мышиную карциному молочной железы, происходящую от ATTC (ATCC CRL-2755™).
Протокол:
Опухоли индуцировали подкожной инъекцией 1 × 106 клеток EMT6 самкам мышей BALB/cByJ (Чарльз Ривер, Франция). Когда опухоли достигли среднего объема приблизительно 51 мм³, пятьдесят мышей были рандомизированы по индивидуальному объему опухоли на пять групп по десять животных.
• Мыши из группы 1 получали i.t. введение носителя в D0, D2 и D4,
• Мыши из группы 2 получали i.t. введение VVTG18058 в дозе 4,75 × 106 БОЕ в D0, D2 и D4,
• Мыши из группы 3 получали i.t. введение COPTG19407 в дозе 4,75 × 106 БОЕ в D0, D2 и D4,
• Мыши из группы 4 получили в/б введение анти-PD-1 антитела в дозе 250 мкг в D7, D10, D14, D17, D21 и D24,
• Мыши из группы 5 получали i.t. введение COPTG19407 в дозе 4,75 × 106 БОЕ в D0, D2 и D4 в сочетании с в/б введением анти-PD-1 антитела в дозе 250 мкг в D7, D10, D14, D17, D21 и D24.
Объемы опухолей у всех животных контролировали на протяжении всего исследования, оценивая критерии времени удвоения опухоли, задержки роста опухоли и ингибирования роста опухоли (T/C%).
Противоопухолевое действие:
Время удвоения опухоли было одинаковым для групп 1, 2 и 4 и составляло примерно 5,4 дня. Для группы 3 время удвоения опухоли нельзя было рассчитать, поскольку большинство опухолей не росли экспоненциально, что указывает на повышенную эффективность лечения по сравнению с группами 1, 2 и 4. Аналогичное влияние наблюдался в группе 5, где только одно животное использовалось для расчета времени удвоения опухоли. Как проиллюстрировано на графиках индивидуального объема опухоли (фиг. 40), у 8 из 10 мышей в группе 3 были опухоли, которые регрессировали с D15 и существенно не выросли в объеме, а у семи мышей не было обнаруживаемых опухолей в конце периода исследования в D61. Аналогичным образом, в группе 5 опухоли регрессировали у 9 мышей после начала лечения, достигнув значений в диапазоне от 0 до 13,24 мм³ в конце исследования в D56.
Задержку роста опухоли рассчитывали путем оценки времени, необходимого для достижения опухолями среднего целевого объема 200 мм3. Результаты были аналогичны результатам, полученным для времени удвоения опухоли, так как этот параметр можно было рассчитать только для опухолей, достигших целевого объема 200 мм³, что не имело места для большинства животных в группах 3 и 5. В группах 1, 2 и 4 средняя задержка роста опухоли составляла приблизительно 19 дней. Кроме того, в группах 3 и 5 (n = 2 для обеих групп) средняя задержка роста составляла 24 и 12 дней, соответственно. Это указывает на то, что опухоли, которые действительно росли в этих двух группах, росли с той же скоростью, что и в группах 1, 2 и 4. Существенных различий между группами не было.
Ингибирование роста опухоли (Т/С%) рассчитывали путем сравнения среднего объема опухоли в группе 1, обработанной носителем, с другими группами лечения. Группа 2 показала временное подавление роста краевой опухоли на D28, но увеличилось до 79% на D31. Группа 4 не показала противоопухолевой активности с T/C% >60% на протяжении всего исследования. Для сравнения, обе группы 3 и 5 показали заметную противоопухолевую активность (T/C% менее чем 10%) от D24 до D31 (последнее рассчитанное значение T/C%).
Фиг. 41 иллюстрирует кривые среднего объема опухоли мышей BALB/cByJ, несущих подкожные опухоли EMT6, демонстрируя драматическое влияние вируса COPTG19407, экспрессирующего анти-CTLA4/GM-CSF, с или без анти-PD1 на рост опухоли.
CT26 повторная обработка
Мышей Balb/c, повторно обработанных опухолевыми клетками CT26, которые выжили после обработки с 104, 105 или 106 БОЕ COPTG19421 или 106 БОЕ COPTG19407, повторно обрабатывали опухолевыми клетками CT26 или обрабатывали клетками Renca (клетки аденокарциномы почек: контроль), чтобы изучить, был ли повышен специфический противоопухолевый иммунный ответ.
Таблица 8. Влияние повторной обработки опухолевыми клетками CT26 или обработки опухолевыми клетками Renca на количество мышей без опухолей
Результаты, представленные в таблице 8, демонстрируют, что 0/8 мышей, получивших COPTG19421 или COPTG19407, не имели опухоли после повторной обработки RenCa, тогда как 7/10 мышей, получивших COPTG19421 или COPTG19407, не имели опухоли после повторной обработки CT26. Это указывает на то, что COPTG19421 и COPTG19407 повышают специфическую иммунную память против клеток CT26.
--->
Перечень последовательностей
<110> BioInvent International AB
Transgene SA
<120> НОВЫЕ АНТИТЕЛА И НУКЛЕОТИДНЫЕ ПОСЛЕДОВАТЕЛЬНОСТИ И ИХ ПРИМЕНЕНИЕ
<130> BI86
<150> EP18192311.1
<151> 2018-09-03
<160> 63
<170> PatentIn version 3.5
<210> 1
<211> 14
<212> Белок
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<222> (2)..(2)
<223> X в положении 2 представляет собой S или K
<220>
<221> MISC_FEATURE
<222> (3)..(3)
<223> X в положении 3 представляет собой D, S или A
<220>
<221> MISC_FEATURE
<222> (5)..(5)
<223> X в положении 5 представляет собой Y, S или A
<220>
<221> MISC_FEATURE
<222> (7)..(7)
<223> X в положении 7 представляет собой S или N
<220>
<221> MISC_FEATURE
<222> (9)..(9)
<223> X в положении 9 представляет собой V или I
<400> 1
Phe Xaa Xaa Tyr Xaa Met Xaa Trp Xaa Arg Gln Ala Pro Gly
1 5 10
<210> 2
<211> 14
<212> Белок
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<222> (3)..(3)
<223> X в положении 3 представляет собой D или S
<220>
<221> MISC_FEATURE
<222> (5)..(5)
<223> X в положении 3 представляет собой Y, S или A
<220>
<221> MISC_FEATURE
<222> (7)..(7)
<223> X в положении 3 представляет собой S или N
<400> 2
Phe Ser Xaa Tyr Xaa Met Xaa Trp Val Arg Gln Ala Pro Gly
1 5 10
<210> 3
<211> 14
<212> Белок
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<222> (3)..(3)
<223> X в положении 3 представляет собой D или S
<220>
<221> MISC_FEATURE
<222> (5)..(5)
<223> X в положении 5 представляет собой Y или S
<220>
<221> MISC_FEATURE
<222> (7)..(7)
<223> X в положении 5 представляет собой S или N
<400> 3
Phe Ser Xaa Tyr Xaa Met Xaa Trp Val Arg Gln Ala Pro Gly
1 5 10
<210> 4
<211> 19
<212> Белок
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<222> (2)..(2)
<223> X в положении 2 представляет собой G или A
<220>
<221> MISC_FEATURE
<222> (5)..(5)
<223> X в положении 5 представляет собой W, G или N
<220>
<221> MISC_FEATURE
<222> (6)..(6)
<223> X в положении 6 представляет собой S или T
<220>
<221> MISC_FEATURE
<222> (7)..(7)
<223> X в положении 7 представляет собой S или G
<220>
<221> MISC_FEATURE
<222> (8)..(8)
<223> X в положении 8 представляет собой R или G
<220>
<221> MISC_FEATURE
<222> (9)..(9)
<223> X в положении 9 представляет собой D, S или Y
<220>
<221> MISC_FEATURE
<222> (10)..(10)
<223> X в положении 10 представляет собой K, T или I
<220>
<221> MISC_FEATURE
<222> (11)..(11)
<223> X в положении 11 представляет собой G, Y, H или D
<220>
<221> MISC_FEATURE
<222> (12)..(12)
<223> X в положении 12 представляет собой Y или F
<400> 4
Ser Xaa Ile Ser Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Ala Asp Ser Val
1 5 10 15
Lys Gly Arg
<210> 5
<211> 19
<212> Белок
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<222> (2)..(2)
<223> X в положении 2 представляет собой G или A
<220>
<221> MISC_FEATURE
<222> (5)..(5)
<223> X в положении 5 представляет собой W, G или N
<220>
<221> MISC_FEATURE
<222> (6)..(6)
<223> X в положении 6 представляет собой S или T
<220>
<221> MISC_FEATURE
<222> (7)..(7)
<223> X в положении 7 представляет собой S или G
<220>
<221> MISC_FEATURE
<222> (8)..(8)
<223> X в положении 8 представляет собой R или G
<220>
<221> MISC_FEATURE
<222> (9)..(9)
<223> X в положении 9 представляет собой D, S или Y
<220>
<221> MISC_FEATURE
<222> (10)..(10)
<223> X в положении 10 представляет собой K, T или I
<220>
<221> MISC_FEATURE
<222> (11)..(11)
<223> X в положении 11 представляет собой G, Y, H или D
<400> 5
Ser Xaa Ile Ser Xaa Xaa Xaa Xaa Xaa Xaa Xaa Tyr Ala Asp Ser Val
1 5 10 15
Lys Gly Arg
<210> 6
<211> 19
<212> Белок
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<222> (2)..(2)
<223> X в положении 2 представляет собой G или A
<220>
<221> MISC_FEATURE
<222> (5)..(5)
<223> X в положении 5 представляет собой W или G
<220>
<221> MISC_FEATURE
<222> (7)..(7)
<223> X в положении 7 представляет собой S или G
<220>
<221> MISC_FEATURE
<222> (8)..(8)
<223> X в положении 8 представляет собой R или G
<220>
<221> MISC_FEATURE
<222> (9)..(9)
<223> X в положении 9 представляет собой D или S
<220>
<221> MISC_FEATURE
<222> (10)..(10)
<223> X в положении 10 представляет собой K или T
<220>
<221> MISC_FEATURE
<222> (11)..(11)
<223> X в положении 11 представляет собой G или Y, H или D
<400> 6
Ser Xaa Ile Ser Xaa Ser Xaa Xaa Xaa Xaa Xaa Tyr Ala Asp Ser Val
1 5 10 15
Lys Gly Arg
<210> 7
<211> 15
<212> Белок
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<222> (1)..(1)
<223> X в положении 1 представляет собой T или A
<220>
<221> MISC_FEATURE
<222> (2)..(2)
<223> X в положении 2 представляет собой T или R
<220>
<221> MISC_FEATURE
<222> (3)..(3)
<223> X в положении 3 представляет собой D, Y или L
<220>
<221> MISC_FEATURE
<222> (4)..(4)
<223> X в положении 4 представляет собой L, R, S или G
<220>
<221> MISC_FEATURE
<222> (5)..(5)
<223> X в положении 5 представляет собой A, V, S или Y
<220>
<221> MISC_FEATURE
<222> (6)..(6)
<223> X в положении 6 представляет собой R, E, G или S
<220>
<221> MISC_FEATURE
<222> (7)..(7)
<223> X в положении 6 представляет собой Y, M, L или G
<220>
<221> MISC_FEATURE
<222> (8)..(8)
<223> X в положении 8 представляет собой N, H, Y или отсутствует
<220>
<221> MISC_FEATURE
<222> (9)..(9)
<223> X в положении 9 представляет собой Q, D или отсутствует
<220>
<221> MISC_FEATURE
<222> (10)..(10)
<223> X в положении 10 представляет собой W, A, D или отсутствует
<220>
<221> MISC_FEATURE
<222> (11)..(11)
<223> X в положении 11 представляет собой L, F, R или отсутствует
<220>
<221> MISC_FEATURE
<222> (12)..(12)
<223> X в положении 12 представляет собой A, D, G или отсутствует
<220>
<221> MISC_FEATURE
<222> (13)..(13)
<223> X в положении 13 представляет собой D, I, M или отсутствует
<220>
<221> MISC_FEATURE
<222> (14)..(14)
<223> X в положении 14 представляет собой D или отсутствует
<220>
<221> MISC_FEATURE
<222> (15)..(15)
<223> X в положении 15 представляет собой V или отсутствует
<400> 7
Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
1 5 10 15
<210> 8
<211> 13
<212> Белок
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<222> (1)..(1)
<223> X в положении 1 представляет собой T или A
<220>
<221> MISC_FEATURE
<222> (2)..(2)
<223> X в положении 2 представляет собой T или R
<220>
<221> MISC_FEATURE
<222> (4)..(4)
<223> X в положении 4 представляет собой L или R
<220>
<221> MISC_FEATURE
<222> (5)..(5)
<223> X в положении 5 представляет собой A или V
<220>
<221> MISC_FEATURE
<222> (6)..(6)
<223> X в положении 6 представляет собой R или E
<220>
<221> MISC_FEATURE
<222> (7)..(7)
<223> X в положении 7 представляет собой Y или M
<220>
<221> MISC_FEATURE
<222> (8)..(8)
<223> X в положении 8 представляет собой N или отсутствует
<220>
<221> MISC_FEATURE
<222> (9)..(9)
<223> X в положении 9 представляет собой Q или отсутствует
<220>
<221> MISC_FEATURE
<222> (10)..(10)
<223> X в положении 10 представляет собой W или отсутствует
<220>
<221> MISC_FEATURE
<222> (11)..(11)
<223> X в положении 11 представляет собой L или отсутствует
<220>
<221> MISC_FEATURE
<222> (12)..(12)
<223> X в положении 12 представляет собой A или отсутствует
<220>
<221> MISC_FEATURE
<222> (13)..(13)
<223> X в положении 13 представляет собой D или отсутствует
<400> 8
Xaa Xaa Asp Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa Xaa
1 5 10
<210> 9
<211> 15
<212> Белок
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<222> (2)..(2)
<223> X в положении 2 представляет собой T или S
<220>
<221> MISC_FEATURE
<222> (10)..(10)
<223> X в положении 10 представляет собой A или S
<220>
<221> MISC_FEATURE
<222> (11)..(11)
<223> X в положении 11 представляет собой G или N
<220>
<221> MISC_FEATURE
<222> (13)..(13)
<223> X в положении 13 представляет собой D или V
<220>
<221> MISC_FEATURE
<222> (14)..(14)
<223> X в положении 14i представляет собой V или Y
<220>
<221> MISC_FEATURE
<222> (15)..(15)
<223> X в положении 15 представляет собой H или отсутствует
<400> 9
Cys Xaa Gly Ser Ser Ser Asn Ile Gly Xaa Xaa Tyr Xaa Xaa Xaa
1 5 10 15
<210> 10
<211> 15
<212> Белок
<213> Homo sapiens
<400> 10
Cys Thr Gly Ser Ser Ser Asn Ile Gly Ala Gly Tyr Asp Val His
1 5 10 15
<210> 11
<211> 7
<212> Белок
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<222> (1)..(1)
<223> X в положении 1 представляет собой G, R или D
<220>
<221> MISC_FEATURE
<222> (3)..(3)
<223> X в положении 3 представляет собой D, N или S
<220>
<221> MISC_FEATURE
<222> (4)..(4)
<223> X в положении 4 представляет собой N, Q или K
<400> 11
Xaa Asn Xaa Xaa Arg Pro Ser
1 5
<210> 12
<211> 7
<212> Белок
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<222> (1)..(1)
<223> X в положении 1 представляет собой G или R
<220>
<221> MISC_FEATURE
<222> (3)..(3)
<223> X в положении 3 представляет собой D или N
<220>
<221> MISC_FEATURE
<222> (4)..(4)
<223> X в положении 3 представляет собой N или Q
<400> 12
Xaa Asn Xaa Xaa Arg Pro Ser
1 5
<210> 13
<211> 13
<212> Белок
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<222> (2)..(2)
<223> X в положении 2 представляет собой A или Q
<220>
<221> MISC_FEATURE
<222> (3)..(3)
<223> X в положении 3 представляет собой V, A или S
<220>
<221> MISC_FEATURE
<222> (4)..(4)
<223> X в положении 4 представляет собой W или Y
<220>
<221> MISC_FEATURE
<222> (6)..(6)
<223> X в положении 6 представляет собой D или S
<220>
<221> MISC_FEATURE
<222> (9)..(9)
<223> X в положении 9 представляет собой N или S
<220>
<221> MISC_FEATURE
<222> (11)..(11)
<223> X в положении 11 представляет собой V, W или P
<220>
<221> MISC_FEATURE
<222> (13)..(13)
<223> X в положении 13 представляет собой V или отсутствует
<400> 13
Cys Xaa Xaa Xaa Asp Xaa Ser Leu Xaa Gly Xaa Val Xaa
1 5 10
<210> 14
<211> 12
<212> Белок
<213> Homo sapiens
<220>
<221> MISC_FEATURE
<222> (3)..(3)
<223> X в положении 3 представляет собой V или A
<220>
<221> MISC_FEATURE
<222> (11)..(11)
<223> X в положении 11 представляет собой V или W
<400> 14
Cys Ala Xaa Trp Asp Asp Ser Leu Asn Gly Xaa Val
1 5 10
<210> 15
<211> 14
<212> Белок
<213> Homo sapiens
<400> 15
Phe Ser Asp Tyr Tyr Met Ser Trp Val Arg Gln Ala Pro Gly
1 5 10
<210> 16
<211> 19
<212> Белок
<213> Homo sapiens
<400> 16
Ser Gly Ile Ser Trp Ser Ser Arg Asp Lys Gly Tyr Ala Asp Ser Val
1 5 10 15
Lys Gly Arg
<210> 17
<211> 7
<212> Белок
<213> Homo sapiens
<400> 17
Thr Thr Asp Leu Ala Arg Tyr
1 5
<210> 18
<211> 7
<212> Белок
<213> Homo sapiens
<400> 18
Gly Asn Asp Asn Arg Pro Ser
1 5
<210> 19
<211> 12
<212> Белок
<213> Homo sapiens
<400> 19
Cys Ala Val Trp Asp Asp Ser Leu Asn Gly Val Val
1 5 10
<210> 20
<211> 114
<212> Белок
<213> Homo sapiens
<400> 20
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp Tyr
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Trp Ser Ser Arg Asp Lys Gly Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Thr Asp Leu Ala Arg Tyr Trp Gly Gln Gly Thr Leu Val Thr Val
100 105 110
Ser Ser
<210> 21
<211> 112
<212> Белок
<213> Homo sapiens
<400> 21
Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Thr Gly Ser Ser Ser Asn Ile Gly Ala Gly
20 25 30
Tyr Asp Val His Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu
35 40 45
Leu Ile Tyr Gly Asn Asp Asn Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu
65 70 75 80
Arg Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Val Trp Asp Asp Ser
85 90 95
Leu Asn Gly Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105 110
<210> 22
<211> 14
<212> Белок
<213> Homo sapiens
<400> 22
Phe Ser Ser Tyr Ser Met Asn Trp Val Arg Gln Ala Pro Gly
1 5 10
<210> 23
<211> 19
<212> Белок
<213> Homo sapiens
<400> 23
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
1 5 10 15
Lys Gly Arg
<210> 24
<211> 13
<212> Белок
<213> Homo sapiens
<400> 24
Ala Arg Asp Arg Val Glu Met Asn Gln Trp Leu Ala Asp
1 5 10
<210> 25
<211> 7
<212> Белок
<213> Homo sapiens
<400> 25
Arg Asn Asn Gln Arg Pro Ser
1 5
<210> 26
<211> 12
<212> Белок
<213> Homo sapiens
<400> 26
Cys Ala Ala Trp Asp Asp Ser Leu Asn Gly Trp Val
1 5 10
<210> 27
<211> 120
<212> Белок
<213> Homo sapiens
<400> 27
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ser Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Val Glu Met Asn Gln Trp Leu Ala Asp Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 28
<211> 112
<212> Белок
<213> Homo sapiens
<400> 28
Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Thr Gly Ser Ser Ser Asn Ile Gly Ala Gly
20 25 30
Tyr Asp Val His Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu
35 40 45
Leu Ile Tyr Arg Asn Asn Gln Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu
65 70 75 80
Arg Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Trp Asp Asp Ser
85 90 95
Leu Asn Gly Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105 110
<210> 29
<211> 14
<212> Белок
<213> Homo sapiens
<400> 29
Phe Ser Ser Tyr Ala Met Ser Trp Val Arg Gln Ala Pro Gly
1 5 10
<210> 30
<211> 19
<212> Белок
<213> Homo sapiens
<400> 30
Ser Gly Ile Ser Gly Ser Gly Gly Tyr Ile His Tyr Ala Asp Ser Val
1 5 10 15
Lys Gly Arg
<210> 31
<211> 13
<212> Белок
<213> Homo sapiens
<400> 31
Ala Thr Tyr Ser Ser Gly Leu His Asp Ala Phe Asp Ile
1 5 10
<210> 32
<211> 7
<212> Белок
<213> Homo sapiens
<400> 32
Asp Asn Asn Lys Arg Pro Ser
1 5
<210> 33
<211> 120
<212> Белок
<213> Homo sapiens
<400> 33
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Gly Ser Gly Gly Tyr Ile His Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Tyr Ser Ser Gly Leu His Asp Ala Phe Asp Ile Trp Gly Gln
100 105 110
Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 34
<211> 112
<212> Белок
<213> Homo sapiens
<400> 34
Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Thr Gly Ser Ser Ser Asn Ile Gly Ala Gly
20 25 30
Tyr Asp Val His Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu
35 40 45
Leu Ile Tyr Asp Asn Asn Lys Arg Pro Ser Gly Val Pro Asp Arg Phe
50 55 60
Ser Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu
65 70 75 80
Arg Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Trp Asp Asp Ser
85 90 95
Leu Asn Gly Trp Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105 110
<210> 35
<211> 14
<212> Белок
<213> Homo sapiens
<400> 35
Phe Lys Ala Tyr Ser Met Ser Trp Ile Arg Gln Ala Pro Gly
1 5 10
<210> 36
<211> 19
<212> Белок
<213> Homo sapiens
<400> 36
Ser Gly Ile Ser Asn Thr Gly Gly Ser Thr Asp Phe Ala Asp Ser Val
1 5 10 15
Lys Gly Arg
<210> 37
<211> 15
<212> Белок
<213> Homo sapiens
<400> 37
Ala Arg Leu Gly Tyr Ser Gly Tyr Asp Asp Arg Gly Met Asp Val
1 5 10 15
<210> 38
<211> 14
<212> Белок
<213> Homo sapiens
<400> 38
Cys Ser Gly Ser Ser Ser Asn Ile Gly Ser Asn Tyr Val Tyr
1 5 10
<210> 39
<211> 7
<212> Белок
<213> Homo sapiens
<400> 39
Gly Asn Ser Asn Arg Pro Ser
1 5
<210> 40
<211> 13
<212> Белок
<213> Homo sapiens
<400> 40
Cys Gln Ser Tyr Asp Ser Ser Leu Ser Gly Pro Val Val
1 5 10
<210> 41
<211> 122
<212> Белок
<213> Homo sapiens
<400> 41
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Lys Ala Tyr
20 25 30
Ser Met Ser Trp Ile Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Gly Ile Ser Asn Thr Gly Gly Ser Thr Asp Phe Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Met Tyr Tyr Cys
85 90 95
Ala Arg Leu Gly Tyr Ser Gly Tyr Asp Asp Arg Gly Met Asp Val Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 42
<211> 112
<212> Белок
<213> Homo sapiens
<400> 42
Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln
1 5 10 15
Arg Val Thr Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Gly Ser Asn
20 25 30
Tyr Val Tyr Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu
35 40 45
Ile Tyr Gly Asn Ser Asn Arg Pro Ser Gly Val Pro Asp Arg Phe Ser
50 55 60
Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Arg
65 70 75 80
Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Gln Ser Tyr Asp Ser Ser Leu
85 90 95
Ser Gly Pro Val Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu Gly
100 105 110
<210> 43
<211> 330
<212> Белок
<213> Homo sapiens
<400> 43
Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala Pro Ser Ser Lys
1 5 10 15
Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu Val Lys Asp Tyr
20 25 30
Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly Ala Leu Thr Ser
35 40 45
Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser Gly Leu Tyr Ser
50 55 60
Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu Gly Thr Gln Thr
65 70 75 80
Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr Lys Val Asp Lys
85 90 95
Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr Cys Pro Pro Cys
100 105 110
Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro
115 120 125
Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys
130 135 140
Val Val Val Asp Val Ser His Glu Asp Pro Glu Val Lys Phe Asn Trp
145 150 155 160
Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu
165 170 175
Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu
180 185 190
His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn
195 200 205
Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly
210 215 220
Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Asp Glu
225 230 235 240
Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr
245 250 255
Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn
260 265 270
Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe
275 280 285
Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn
290 295 300
Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His Tyr Thr
305 310 315 320
Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
325 330
<210> 44
<211> 105
<212> Белок
<213> Homo sapiens
<400> 44
Gln Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro Ser Ser Glu
1 5 10 15
Glu Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile Ser Asp Phe
20 25 30
Tyr Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser Ser Pro Val
35 40 45
Lys Ala Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser Asn Asn Lys
50 55 60
Tyr Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln Trp Lys Ser
65 70 75 80
His Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser Thr Val Glu
85 90 95
Lys Thr Val Ala Pro Thr Glu Cys Ser
100 105
<210> 45
<211> 1335
<212> ДНК
<213> Homo sapiens
<400> 45
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt caccttcagt gactactaca tgagctgggt ccgccaggct 120
cccgggaagg ggctggagtg ggtctcaggc attagttgga gtagtcgtga caaaggctat 180
gcggactctg tgaagggccg tttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac actgccgtgt attactgtac cacagatctc 300
gctaggtact ggggccaggg tacactggtc accgtgagct cagcctccac caagggccca 360
tcggtcttcc ccctggcacc ctcctccaag agcacctctg ggggcacagc ggccctgggc 420
tgcctggtca aggactactt ccccgaaccg gtgacggtgt cgtggaactc aggcgccctg 480
accagcggcg tgcacacctt cccggctgtc ctacagtcct caggactcta ctccctcagc 540
agcgtggtga ccgtgccctc cagcagcttg ggcacccaga cctacatctg caacgtgaat 600
cacaagccca gcaacaccaa ggtggacaag aaagttgagc ccaaatcttg tgacaaaact 660
cacacatgcc caccgtgccc agcacctgaa ctcctggggg gaccgtcagt cttcctcttc 720
cccccaaaac ccaaggacac cctcatgatc tcccggaccc ctgaggtcac atgcgtggtg 780
gtggacgtga gccacgaaga ccctgaggtc aagttcaact ggtacgtgga cggcgtggag 840
gtgcataatg ccaagacaaa gccgcgggag gagcagtaca acagcacgta ccgtgtggtc 900
agcgtcctca ccgtcctgca ccaggactgg ctgaatggca aggagtacaa gtgcaaggtc 960
tccaacaaag ccctcccagc ccccatcgag aaaaccatct ccaaagccaa agggcagccc 1020
cgagaaccac aggtgtacac cctgccccca tcccgggatg agctgaccaa gaaccaggtc 1080
agcctgacct gcctggtcaa aggcttctat cccagcgaca tcgccgtgga gtgggagagc 1140
aatgggcagc cggagaacaa ctacaagacc acgcctcccg tgctggactc cgacggctcc 1200
ttcttcctct acagcaagct caccgtggac aagagcaggt ggcagcaggg gaacgtcttc 1260
tcatgctccg tgatgcatga ggctctgcac aaccactaca cgcagaagag cctctccctg 1320
tctccgggta aatga 1335
<210> 46
<211> 654
<212> ДНК
<213> Homo sapiens
<400> 46
cagtctgtgc tgactcagcc accctcagcg tctgggaccc ccgggcagag ggtcaccatc 60
tcctgcactg ggagcagctc caacatcggg gcaggttatg atgtacactg gtatcagcag 120
ctcccaggaa cggcccccaa actcctcatc tatggtaatg ataaccggcc ctcaggggtc 180
cctgaccgat tctctggctc caagtctggc acctcagcct ccctggccat cagtgggctc 240
cggtccgagg atgaggctga ttattactgt gcagtatggg atgacagcct gaatggtgtg 300
gtattcggcg gaggaaccaa gctgacggtc ctaggtcagc ccaaggctgc cccctcggtc 360
actctgttcc cgccctcctc tgaggagctt caagccaaca aggccacact ggtgtgtctc 420
ataagtgact tctacccggg agccgtgaca gtggcctgga aggcagatag cagccccgtc 480
aaggcgggag tggagaccac cacaccctcc aaacaaagca acaacaagta cgcggccagc 540
agctatctga gcctgacgcc tgagcagtgg aagtcccaca gaagctacag ctgccaggtc 600
acgcatgaag ggagcaccgt ggagaagaca gtggccccta cagaatgttc atga 654
<210> 47
<211> 1353
<212> ДНК
<213> Homo sapiens
<400> 47
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt caccttcagt agctatagca tgaactgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcagct attagtggta gtggtggtag cacatactac 180
gcagactccg tgaagggccg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac actgccgtgt attactgtgc gagagatcgg 300
gtagagatga accagtggct ggccgactgg ggccagggta cactggtcac cgtgagctca 360
gcctccacca agggcccatc ggtcttcccc ctggcaccct cctccaagag cacctctggg 420
ggcacagcgg ccctgggctg cctggtcaag gactacttcc ccgaaccggt gacggtgtcg 480
tggaactcag gcgccctgac cagcggcgtg cacaccttcc cggctgtcct acagtcctca 540
ggactctact ccctcagcag cgtggtgacc gtgccctcca gcagcttggg cacccagacc 600
tacatctgca acgtgaatca caagcccagc aacaccaagg tggacaagaa agttgagccc 660
aaatcttgtg acaaaactca cacatgccca ccgtgcccag cacctgaact cctgggggga 720
ccgtcagtct tcctcttccc cccaaaaccc aaggacaccc tcatgatctc ccggacccct 780
gaggtcacat gcgtggtggt ggacgtgagc cacgaagacc ctgaggtcaa gttcaactgg 840
tacgtggacg gcgtggaggt gcataatgcc aagacaaagc cgcgggagga gcagtacaac 900
agcacgtacc gtgtggtcag cgtcctcacc gtcctgcacc aggactggct gaatggcaag 960
gagtacaagt gcaaggtctc caacaaagcc ctcccagccc ccatcgagaa aaccatctcc 1020
aaagccaaag ggcagccccg agaaccacag gtgtacaccc tgcccccatc ccgggatgag 1080
ctgaccaaga accaggtcag cctgacctgc ctggtcaaag gcttctatcc cagcgacatc 1140
gccgtggagt gggagagcaa tgggcagccg gagaacaact acaagaccac gcctcccgtg 1200
ctggactccg acggctcctt cttcctctac agcaagctca ccgtggacaa gagcaggtgg 1260
cagcagggga acgtcttctc atgctccgtg atgcatgagg ctctgcacaa ccactacacg 1320
cagaagagcc tctccctgtc tccgggtaaa tga 1353
<210> 48
<211> 654
<212> ДНК
<213> Homo sapiens
<400> 48
cagtctgtgc tgactcagcc accctcagcg tctgggaccc ccgggcagag ggtcaccatc 60
tcctgcactg ggagcagctc caacatcggg gcaggttatg atgtacactg gtatcagcag 120
ctcccaggaa cggcccccaa actcctcatc tataggaata atcagcggcc ctcaggggtc 180
cctgaccgat tctctggctc caagtctggc acctcagcct ccctggccat cagtgggctc 240
cggtccgagg atgaggctga ttattactgt gcagcatggg atgacagcct gaatggttgg 300
gtgttcggcg gaggaaccaa gctgacggtc ctaggtcagc ccaaggctgc cccctcggtc 360
actctgttcc cgccctcctc tgaggagctt caagccaaca aggccacact ggtgtgtctc 420
ataagtgact tctacccggg agccgtgaca gtggcctgga aggcagatag cagccccgtc 480
aaggcgggag tggagaccac cacaccctcc aaacaaagca acaacaagta cgcggccagc 540
agctatctga gcctgacgcc tgagcagtgg aagtcccaca gaagctacag ctgccaggtc 600
acgcatgaag ggagcaccgt ggagaagaca gtggccccta cagaatgttc atga 654
<210> 49
<211> 1353
<212> ДНК
<213> Homo sapiens
<400> 49
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt cacctttagc agctatgcca tgagctgggt ccgccaggct 120
ccagggaagg ggctggagtg ggtctcaggt attagtggca gcggtgggta catacactat 180
gcagactccg tgaagggccg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac actgccgtgt attactgtgc gacctatagc 300
agtggcctgc atgatgcttt tgatatctgg ggccagggta cactggtcac cgtgagctca 360
gcctccacca agggcccatc ggtcttcccc ctggcaccct cctccaagag cacctctggg 420
ggcacagcgg ccctgggctg cctggtcaag gactacttcc ccgaaccggt gacggtgtcg 480
tggaactcag gcgccctgac cagcggcgtg cacaccttcc cggctgtcct acagtcctca 540
ggactctact ccctcagcag cgtggtgacc gtgccctcca gcagcttggg cacccagacc 600
tacatctgca acgtgaatca caagcccagc aacaccaagg tggacaagaa agttgagccc 660
aaatcttgtg acaaaactca cacatgccca ccgtgcccag cacctgaact cctgggggga 720
ccgtcagtct tcctcttccc cccaaaaccc aaggacaccc tcatgatctc ccggacccct 780
gaggtcacat gcgtggtggt ggacgtgagc cacgaagacc ctgaggtcaa gttcaactgg 840
tacgtggacg gcgtggaggt gcataatgcc aagacaaagc cgcgggagga gcagtacaac 900
agcacgtacc gtgtggtcag cgtcctcacc gtcctgcacc aggactggct gaatggcaag 960
gagtacaagt gcaaggtctc caacaaagcc ctcccagccc ccatcgagaa aaccatctcc 1020
aaagccaaag ggcagccccg agaaccacag gtgtacaccc tgcccccatc ccgggatgag 1080
ctgaccaaga accaggtcag cctgacctgc ctggtcaaag gcttctatcc cagcgacatc 1140
gccgtggagt gggagagcaa tgggcagccg gagaacaact acaagaccac gcctcccgtg 1200
ctggactccg acggctcctt cttcctctac agcaagctca ccgtggacaa gagcaggtgg 1260
cagcagggga acgtcttctc atgctccgtg atgcatgagg ctctgcacaa ccactacacg 1320
cagaagagcc tctccctgtc tccgggtaaa tga 1353
<210> 50
<211> 654
<212> ДНК
<213> Homo sapiens
<400> 50
cagtctgtgc tgactcagcc accctcagcg tctgggaccc ccgggcagag ggtcaccatc 60
tcctgcactg ggagcagctc caacatcggg gcaggttatg atgtacactg gtatcagcag 120
ctcccaggaa cggcccccaa actcctcatc tatgacaata ataagcgacc ctcaggggtc 180
cctgaccgat tctctggctc caagtctggc acctcagcct ccctggccat cagtgggctc 240
cggtccgagg atgaggctga ttattactgt gcagcatggg atgacagcct gaatggttgg 300
gtgttcggcg gaggaaccaa gctgacggtc ctaggtcagc ccaaggctgc cccctcggtc 360
actctgttcc cgccctcctc tgaggagctt caagccaaca aggccacact ggtgtgtctc 420
ataagtgact tctacccggg agccgtgaca gtggcctgga aggcagatag cagccccgtc 480
aaggcgggag tggagaccac cacaccctcc aaacaaagca acaacaagta cgcggccagc 540
agctatctga gcctgacgcc tgagcagtgg aagtcccaca gaagctacag ctgccaggtc 600
acgcatgaag ggagcaccgt ggagaagaca gtggccccta cagaatgttc atga 654
<210> 51
<211> 1359
<212> ДНК
<213> Homo sapiens
<400> 51
gaggtgcagc tgttggagtc tgggggaggc ttggtacagc ctggggggtc cctgagactc 60
tcctgtgcag cctctggatt caccttcaaa gcctatagca tgagctggat ccgccaggct 120
ccagggaagg ggctggagtg ggtctcaggt atcagtaaca cgggaggtag cacagacttc 180
gcagactccg tgaagggccg gttcaccatc tccagagaca attccaagaa cacgctgtat 240
ctgcaaatga acagcctgag agccgaggac actgccatgt attactgtgc gagattggga 300
tatagtggct acgacgaccg tggtatggac gtctggggcc aaggtacact ggtcaccgtg 360
agctcagcct ccaccaaggg cccatcggtc ttccccctgg caccctcctc caagagcacc 420
tctgggggca cagcggccct gggctgcctg gtcaaggact acttccccga accggtgacg 480
gtgtcgtgga actcaggcgc cctgaccagc ggcgtgcaca ccttcccggc tgtcctacag 540
tcctcaggac tctactccct cagcagcgtg gtgaccgtgc cctccagcag cttgggcacc 600
cagacctaca tctgcaacgt gaatcacaag cccagcaaca ccaaggtgga caagaaagtt 660
gagcccaaat cttgtgacaa aactcacaca tgcccaccgt gcccagcacc tgaactcctg 720
gggggaccgt cagtcttcct cttcccccca aaacccaagg acaccctcat gatctcccgg 780
acccctgagg tcacatgcgt ggtggtggac gtgagccacg aagaccctga ggtcaagttc 840
aactggtacg tggacggcgt ggaggtgcat aatgccaaga caaagccgcg ggaggagcag 900
tacaacagca cgtaccgtgt ggtcagcgtc ctcaccgtcc tgcaccagga ctggctgaat 960
ggcaaggagt acaagtgcaa ggtctccaac aaagccctcc cagcccccat cgagaaaacc 1020
atctccaaag ccaaagggca gccccgagaa ccacaggtgt acaccctgcc cccatcccgg 1080
gatgagctga ccaagaacca ggtcagcctg acctgcctgg tcaaaggctt ctatcccagc 1140
gacatcgccg tggagtggga gagcaatggg cagccggaga acaactacaa gaccacgcct 1200
cccgtgctgg actccgacgg ctccttcttc ctctacagca agctcaccgt ggacaagagc 1260
aggtggcagc aggggaacgt cttctcatgc tccgtgatgc atgaggctct gcacaaccac 1320
tacacgcaga agagcctctc cctgtctccg ggtaaatga 1359
<210> 52
<211> 654
<212> ДНК
<213> Homo sapiens
<400> 52
cagtctgtgc tgactcagcc accctcagcg tctgggaccc ccgggcagag ggtcaccatc 60
tcttgttctg gaagcagctc caacatcgga agtaattatg tgtactggta tcagcagctc 120
ccaggaacgg cccccaaact cctcatctat ggtaacagca atcggccctc aggggtccct 180
gaccgattct ctggctccaa gtctggcacc tcagcctccc tggccatcag tgggctccgg 240
tccgaggatg aggctgatta ttactgccag tcctatgaca gcagcctgag tggtcctgtg 300
gtattcggcg gaggaaccaa gctgacggtc ctaggtcagc ccaaggctgc cccctcggtc 360
actctgttcc cgccctcctc tgaggagctt caagccaaca aggccacact ggtgtgtctc 420
ataagtgact tctacccggg agccgtgaca gtggcctgga aggcagatag cagccccgtc 480
aaggcgggag tggagaccac cacaccctcc aaacaaagca acaacaagta cgcggccagc 540
agctatctga gcctgacgcc tgagcagtgg aagtcccaca gaagctacag ctgccaggtc 600
acgcatgaag ggagcaccgt ggagaagaca gtggccccta cagaatgttc atga 654
<210> 53
<211> 236
<212> Белок
<213> Homo sapiens
<400> 53
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr
20 25 30
Pro Gly Gln Arg Val Thr Ile Ser Cys Thr Gly Ser Ser Ser Asn Ile
35 40 45
Gly Ala Gly Tyr Asp Val His Trp Tyr Gln Gln Leu Pro Gly Thr Ala
50 55 60
Pro Lys Leu Leu Ile Tyr Gly Asn Asp Asn Arg Pro Ser Gly Val Pro
65 70 75 80
Asp Arg Phe Ser Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile
85 90 95
Ser Gly Leu Arg Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Val Trp
100 105 110
Asp Asp Ser Leu Asn Gly Val Val Phe Gly Gly Gly Thr Lys Leu Thr
115 120 125
Val Leu Gly Gln Pro Lys Ala Ala Pro Ser Val Thr Leu Phe Pro Pro
130 135 140
Ser Ser Glu Glu Leu Gln Ala Asn Lys Ala Thr Leu Val Cys Leu Ile
145 150 155 160
Ser Asp Phe Tyr Pro Gly Ala Val Thr Val Ala Trp Lys Ala Asp Ser
165 170 175
Ser Pro Val Lys Ala Gly Val Glu Thr Thr Thr Pro Ser Lys Gln Ser
180 185 190
Asn Asn Lys Tyr Ala Ala Ser Ser Tyr Leu Ser Leu Thr Pro Glu Gln
195 200 205
Trp Lys Ser His Arg Ser Tyr Ser Cys Gln Val Thr His Glu Gly Ser
210 215 220
Thr Val Glu Lys Thr Val Ala Pro Thr Glu Cys Ser
225 230 235
<210> 54
<211> 463
<212> Белок
<213> Homo sapiens
<400> 54
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln
20 25 30
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe
35 40 45
Ser Asp Tyr Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
50 55 60
Glu Trp Val Ser Gly Ile Ser Trp Ser Ser Arg Asp Lys Gly Tyr Ala
65 70 75 80
Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn
85 90 95
Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Thr Thr Asp Leu Ala Arg Tyr Trp Gly Gln Gly Thr Leu
115 120 125
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
130 135 140
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
145 150 155 160
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
165 170 175
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
180 185 190
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
195 200 205
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
210 215 220
Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His
225 230 235 240
Thr Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val
245 250 255
Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr
260 265 270
Pro Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu
275 280 285
Val Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys
290 295 300
Thr Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser
305 310 315 320
Val Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys
325 330 335
Cys Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile
340 345 350
Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro
355 360 365
Pro Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu
370 375 380
Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn
385 390 395 400
Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser
405 410 415
Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg
420 425 430
Trp Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu
435 440 445
His Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
450 455 460
<210> 55
<211> 127
<212> Белок
<213> Homo sapiens
<400> 55
Ala Pro Ala Arg Ser Pro Ser Pro Ser Thr Gln Pro Trp Glu His Val
1 5 10 15
Asn Ala Ile Gln Glu Ala Arg Arg Leu Leu Asn Leu Ser Arg Asp Thr
20 25 30
Ala Ala Glu Met Asn Glu Thr Val Glu Val Ile Ser Glu Met Phe Asp
35 40 45
Leu Gln Glu Pro Thr Cys Leu Gln Thr Arg Leu Glu Leu Tyr Lys Gln
50 55 60
Gly Leu Arg Gly Ser Leu Thr Lys Leu Lys Gly Pro Leu Thr Met Met
65 70 75 80
Ala Ser His Tyr Lys Gln His Cys Pro Pro Thr Pro Glu Thr Ser Cys
85 90 95
Ala Thr Gln Thr Ile Thr Phe Glu Ser Phe Lys Glu Asn Leu Lys Asp
100 105 110
Phe Leu Leu Val Ile Pro Phe Asp Cys Trp Glu Pro Val Gln Glu
115 120 125
<210> 56
<211> 144
<212> Белок
<213> Homo sapiens
<400> 56
Met Trp Leu Gln Ser Leu Leu Leu Leu Gly Thr Val Ala Cys Ser Ile
1 5 10 15
Ser Ala Pro Ala Arg Ser Pro Ser Pro Ser Thr Gln Pro Trp Glu His
20 25 30
Val Asn Ala Ile Gln Glu Ala Arg Arg Leu Leu Asn Leu Ser Arg Asp
35 40 45
Thr Ala Ala Glu Met Asn Glu Thr Val Glu Val Ile Ser Glu Met Phe
50 55 60
Asp Leu Gln Glu Pro Thr Cys Leu Gln Thr Arg Leu Glu Leu Tyr Lys
65 70 75 80
Gln Gly Leu Arg Gly Ser Leu Thr Lys Leu Lys Gly Pro Leu Thr Met
85 90 95
Met Ala Ser His Tyr Lys Gln His Cys Pro Pro Thr Pro Glu Thr Ser
100 105 110
Cys Ala Thr Gln Thr Ile Thr Phe Glu Ser Phe Lys Glu Asn Leu Lys
115 120 125
Asp Phe Leu Leu Val Ile Pro Phe Asp Cys Trp Glu Pro Val Gln Glu
130 135 140
<210> 57
<211> 124
<212> Белок
<213> Mus musculus
<400> 57
Ala Pro Thr Arg Ser Pro Ile Thr Val Thr Arg Pro Trp Lys His Val
1 5 10 15
Glu Ala Ile Lys Glu Ala Leu Asn Leu Leu Asp Asp Met Pro Val Thr
20 25 30
Leu Asn Glu Glu Val Glu Val Val Ser Asn Glu Phe Ser Phe Lys Lys
35 40 45
Leu Thr Cys Val Gln Thr Arg Leu Lys Ile Phe Glu Gln Gly Leu Arg
50 55 60
Gly Asn Phe Thr Lys Leu Lys Gly Ala Leu Asn Met Thr Ala Ser Tyr
65 70 75 80
Tyr Gln Thr Tyr Cys Pro Pro Thr Pro Glu Thr Asp Cys Glu Thr Gln
85 90 95
Val Thr Thr Tyr Ala Asp Phe Ile Asp Ser Leu Lys Thr Phe Leu Thr
100 105 110
Asp Ile Pro Phe Glu Cys Lys Lys Pro Val Gln Lys
115 120
<210> 58
<211> 141
<212> Белок
<213> Mus musculus
<400> 58
Met Trp Leu Gln Asn Leu Leu Phe Leu Gly Ile Val Val Tyr Ser Leu
1 5 10 15
Ser Ala Pro Thr Arg Ser Pro Ile Thr Val Thr Arg Pro Trp Lys His
20 25 30
Val Glu Ala Ile Lys Glu Ala Leu Asn Leu Leu Asp Asp Met Pro Val
35 40 45
Thr Leu Asn Glu Glu Val Glu Val Val Ser Asn Glu Phe Ser Phe Lys
50 55 60
Lys Leu Thr Cys Val Gln Thr Arg Leu Lys Ile Phe Glu Gln Gly Leu
65 70 75 80
Arg Gly Asn Phe Thr Lys Leu Lys Gly Ala Leu Asn Met Thr Ala Ser
85 90 95
Tyr Tyr Gln Thr Tyr Cys Pro Pro Thr Pro Glu Thr Asp Cys Glu Thr
100 105 110
Gln Val Thr Thr Tyr Ala Asp Phe Ile Asp Ser Leu Lys Thr Phe Leu
115 120 125
Thr Asp Ile Pro Phe Glu Cys Lys Lys Pro Val Gln Lys
130 135 140
<210> 59
<211> 124
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Промотор p7.5K
<400> 59
ccacccactt tttatagtaa gtttttcacc cataaataat aaatacaata attaatttct 60
cgtaaaagta gaaaatatat tctaatttat tgcacggtaa ggaagtagaa tcataaagaa 120
cagt 124
<210> 60
<211> 114
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Промотор pH5.R
<400> 60
tttattctat acttaaaaaa tgaaaataaa tacaaaggtt cttgagggtt gtgttaaatt 60
gaaagcgaga aataatcata aattatttca ttatcgcgat atccgttaag tttg 114
<210> 61
<211> 40
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Промотор pSE/L
<400> 61
aaaaattgaa attttatttt ttttttttgg aatataaata 40
<210> 62
<211> 236
<212> Белок
<213> Mus musculus
<400> 62
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Gln Ser Val Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr
20 25 30
Pro Gly Gln Arg Val Thr Ile Ser Cys Thr Gly Ser Ser Ser Asn Ile
35 40 45
Gly Ala Gly Tyr Asp Val His Trp Tyr Gln Gln Leu Pro Gly Thr Ala
50 55 60
Pro Lys Leu Leu Ile Tyr Arg Asn Asn Gln Arg Pro Ser Gly Val Pro
65 70 75 80
Asp Arg Phe Ser Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu Ala Ile
85 90 95
Ser Gly Leu Arg Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala Ala Trp
100 105 110
Asp Asp Ser Leu Asn Gly Trp Val Phe Gly Gly Gly Thr Lys Leu Thr
115 120 125
Val Leu Gly Gln Pro Lys Ser Ser Pro Ser Val Thr Leu Phe Pro Pro
130 135 140
Ser Ser Glu Glu Leu Glu Thr Asn Lys Ala Thr Leu Val Cys Thr Ile
145 150 155 160
Thr Asp Phe Tyr Pro Gly Val Val Thr Val Asp Trp Lys Val Asp Gly
165 170 175
Thr Pro Val Thr Gln Gly Met Glu Thr Thr Gln Pro Ser Lys Gln Ser
180 185 190
Asn Asn Lys Tyr Met Ala Ser Ser Tyr Leu Thr Leu Thr Ala Arg Ala
195 200 205
Trp Glu Arg His Ser Ser Tyr Ser Cys Gln Val Thr His Glu Gly His
210 215 220
Thr Val Glu Lys Ser Leu Ser Arg Ala Asp Cys Ser
225 230 235
<210> 63
<211> 469
<212> Белок
<213> Mus musculus
<400> 63
Met Gly Trp Ser Cys Ile Ile Leu Phe Leu Val Ala Thr Ala Thr Gly
1 5 10 15
Val His Ser Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln
20 25 30
Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe
35 40 45
Ser Ser Tyr Ser Met Asn Trp Val Arg Gln Ala Pro Gly Lys Gly Leu
50 55 60
Glu Trp Val Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala
65 70 75 80
Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn
85 90 95
Thr Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val
100 105 110
Tyr Tyr Cys Ala Arg Asp Arg Val Glu Met Asn Gln Trp Leu Ala Asp
115 120 125
Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala Lys Thr Thr Ala
130 135 140
Pro Ser Val Tyr Pro Leu Ala Pro Val Cys Gly Asp Thr Thr Gly Ser
145 150 155 160
Ser Val Thr Leu Gly Cys Leu Val Lys Gly Tyr Phe Pro Glu Pro Val
165 170 175
Thr Leu Thr Trp Asn Ser Gly Ser Leu Ser Ser Gly Val His Thr Phe
180 185 190
Pro Ala Val Leu Gln Ser Asp Leu Tyr Thr Leu Ser Ser Ser Val Thr
195 200 205
Val Thr Ser Ser Thr Trp Pro Ser Gln Ser Ile Thr Cys Asn Val Ala
210 215 220
His Pro Ala Ser Ser Thr Lys Val Asp Lys Lys Ile Glu Pro Arg Gly
225 230 235 240
Pro Thr Ile Lys Pro Cys Pro Pro Cys Lys Cys Pro Ala Pro Asn Leu
245 250 255
Leu Gly Gly Pro Ser Val Phe Ile Phe Pro Pro Lys Ile Lys Asp Val
260 265 270
Leu Met Ile Ser Leu Ser Pro Ile Val Thr Cys Val Val Val Asp Val
275 280 285
Ser Glu Asp Asp Pro Asp Val Gln Ile Ser Trp Phe Val Asn Asn Val
290 295 300
Glu Val His Thr Ala Gln Thr Gln Thr His Arg Glu Asp Tyr Asn Ser
305 310 315 320
Thr Leu Arg Val Val Ser Ala Leu Pro Ile Gln His Gln Asp Trp Met
325 330 335
Ser Gly Lys Glu Phe Lys Cys Lys Val Asn Asn Lys Asp Leu Pro Ala
340 345 350
Pro Ile Glu Arg Thr Ile Ser Lys Pro Lys Gly Ser Val Arg Ala Pro
355 360 365
Gln Val Tyr Val Leu Pro Pro Pro Glu Glu Glu Met Thr Lys Lys Gln
370 375 380
Val Thr Leu Thr Cys Met Val Thr Asp Phe Met Pro Glu Asp Ile Tyr
385 390 395 400
Val Glu Trp Thr Asn Asn Gly Lys Thr Glu Leu Asn Tyr Lys Asn Thr
405 410 415
Glu Pro Val Leu Asp Ser Asp Gly Ser Tyr Phe Met Tyr Ser Lys Leu
420 425 430
Arg Val Glu Lys Lys Asn Trp Val Glu Arg Asn Ser Tyr Ser Cys Ser
435 440 445
Val Val His Glu Gly Leu His Asn His His Thr Thr Lys Ser Phe Ser
450 455 460
Arg Thr Pro Gly Lys
465
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ДОСТАВКА ТЕРАПЕВТИЧЕСКИХ ПОЛИПЕПТИДОВ ПОСРЕДСТВОМ ПСЕВДОТИПИРОВАННЫХ ОНКОЛИТИЧЕСКИХ ВИРУСОВ | 2017 |
|
RU2758007C2 |
| НОВЫЕ МОЛЕКУЛЫ АГОНИСТИЧЕСКИХ АНТИ-TNFR2 АНТИТЕЛ | 2019 |
|
RU2840049C2 |
| ОНКОЛИТИЧЕСКИЕ ВИРУСЫ ПРОСТОГО ГЕРПЕСА 1 ТИПА ДЛЯ ЛЕЧЕНИЯ ОПУХОЛЕЙ ГОЛОВНОГО МОЗГА | 2021 |
|
RU2824514C1 |
| KIR3DL3 - ИНГИБИРУЮЩИЙ РЕЦЕПТОР ИММУННОЙ СИСТЕМЫ И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2827900C1 |
| ОНКОЛИТИЧЕСКИЙ HSV-ВЕКТОР | 2014 |
|
RU2719190C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕ CTLA-4, И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2756100C1 |
| ИММУНОЦИТОКИНЫ НА ОСНОВЕ IL-15 И IL-15Rα ДОМЕНА SUSHI | 2012 |
|
RU2763298C2 |
| СВЯЗЫВАЮЩИЕСЯ С PD-1 АНТИТЕЛА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2812280C1 |
| СВЯЗЫВАЮЩИЕСЯ С PD-1 АНТИТЕЛА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2773758C2 |
| КОМБИНАЦИЯ АНТИТЕЛ CD30XCD16 ДЛЯ ТЕРАПИИ С АНТАГОНИСТОМ PD-1 | 2016 |
|
RU2761352C2 |

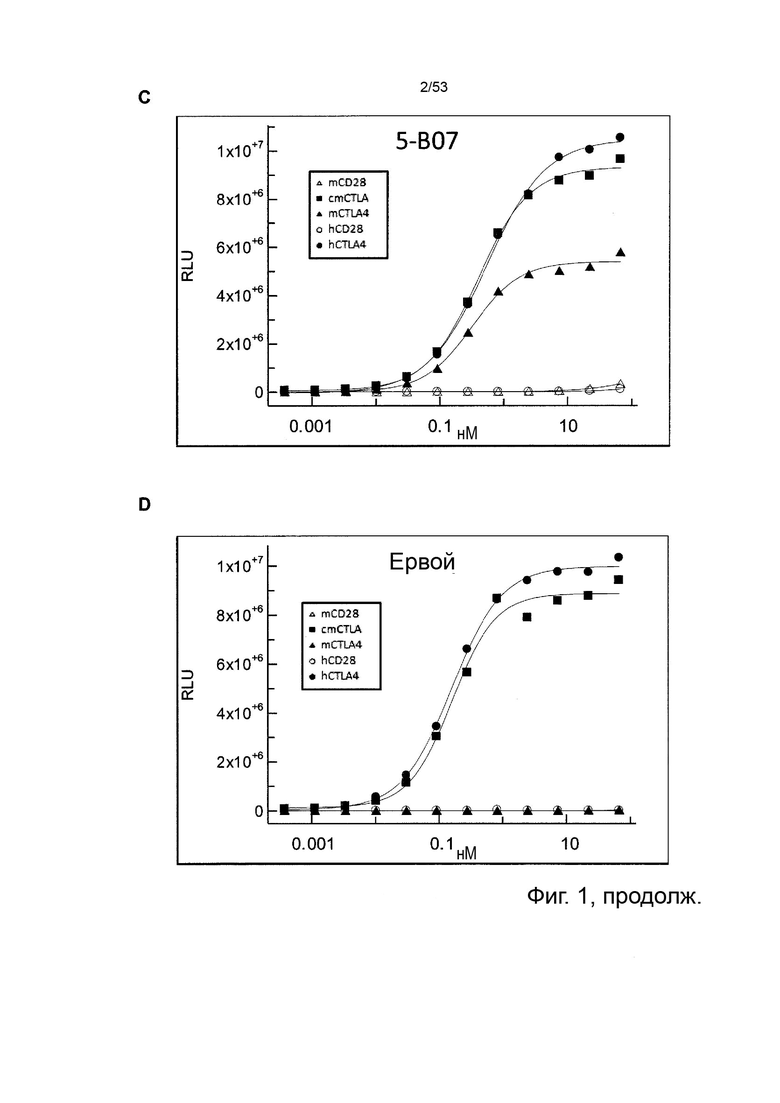
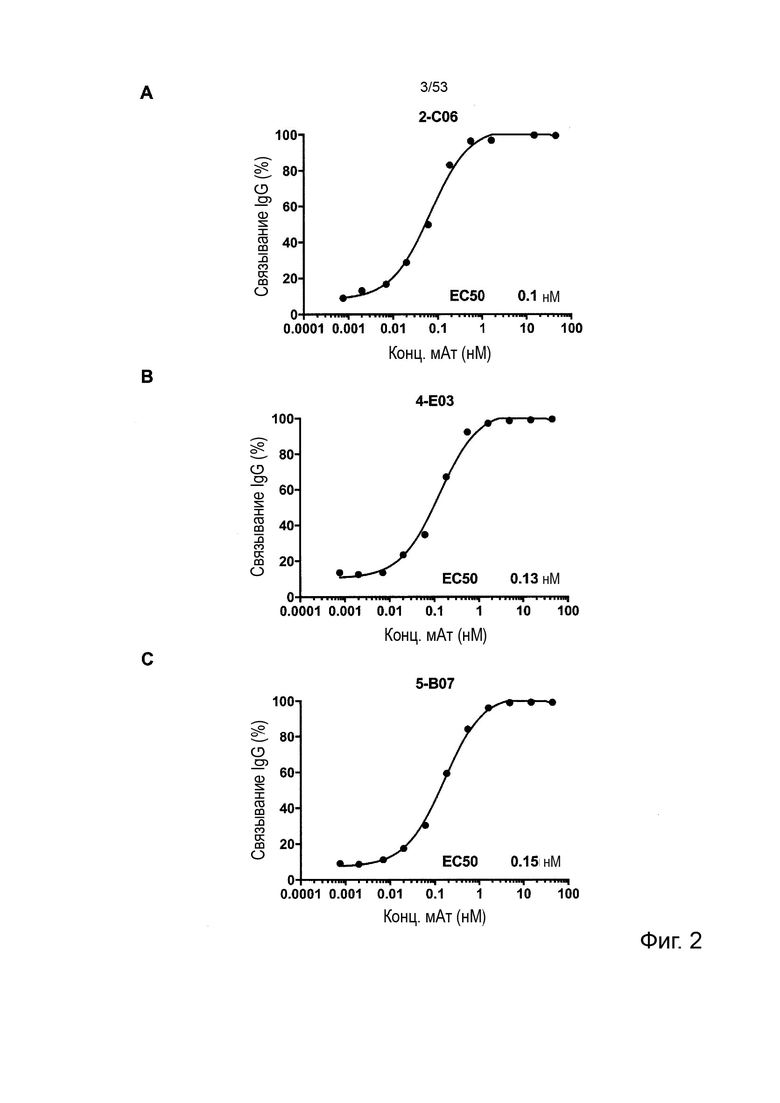
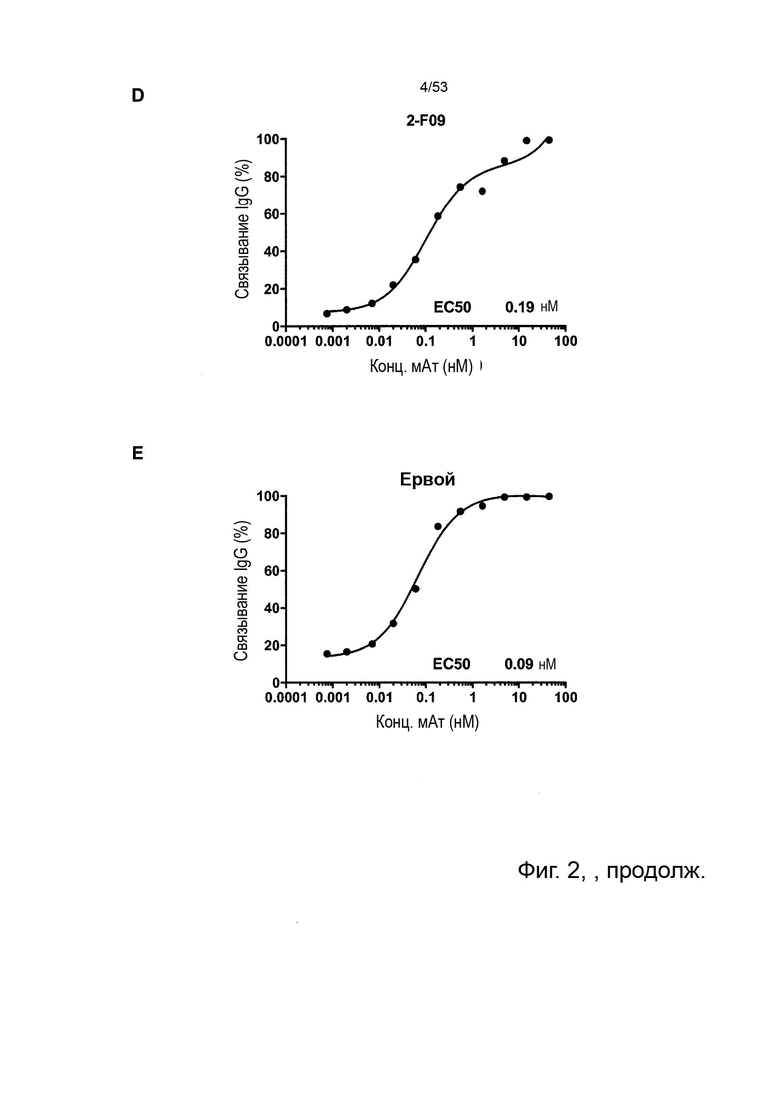

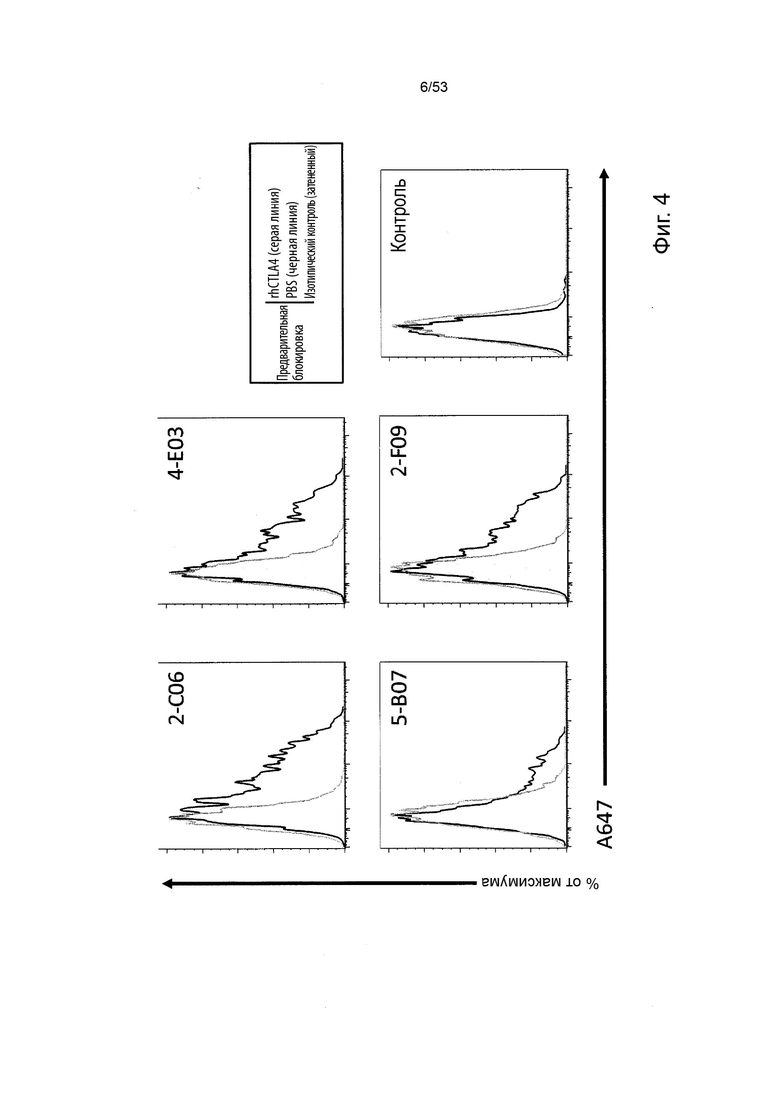
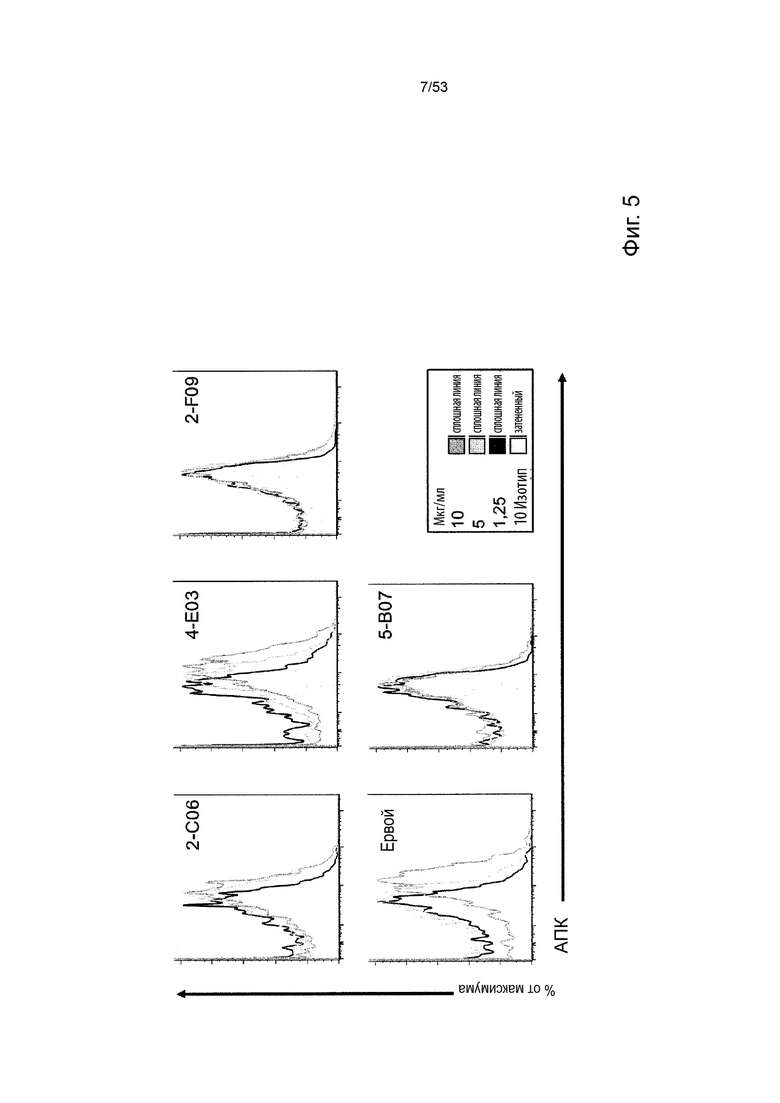
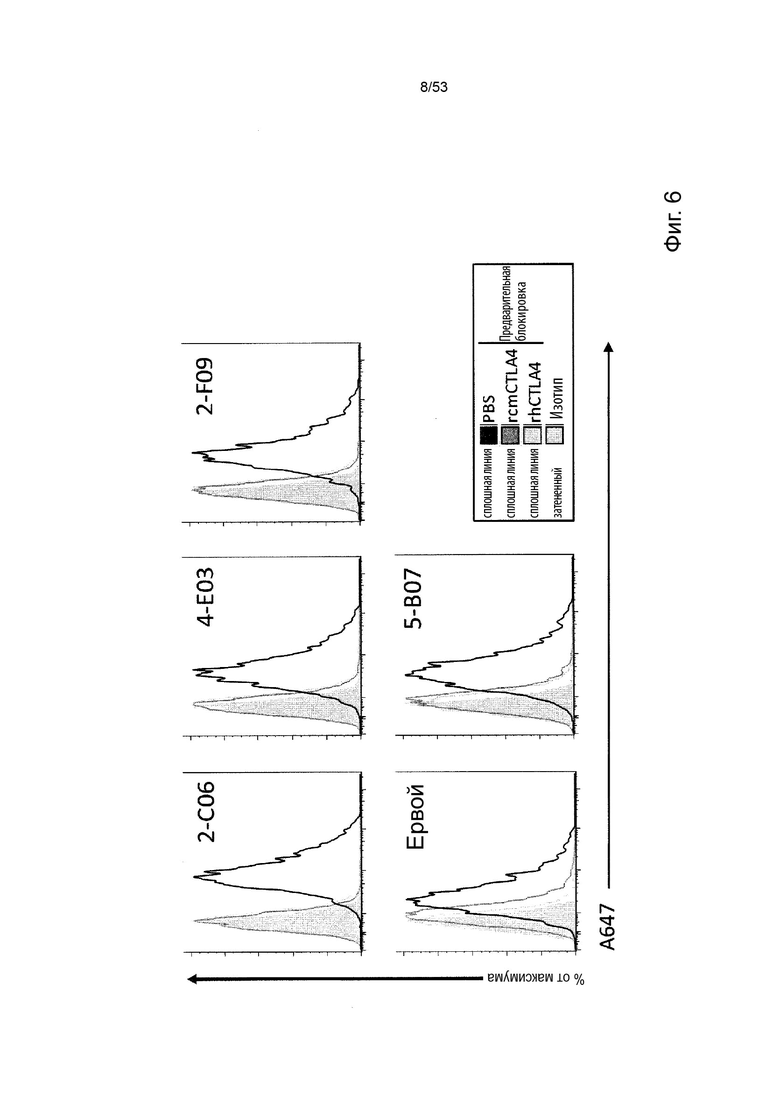
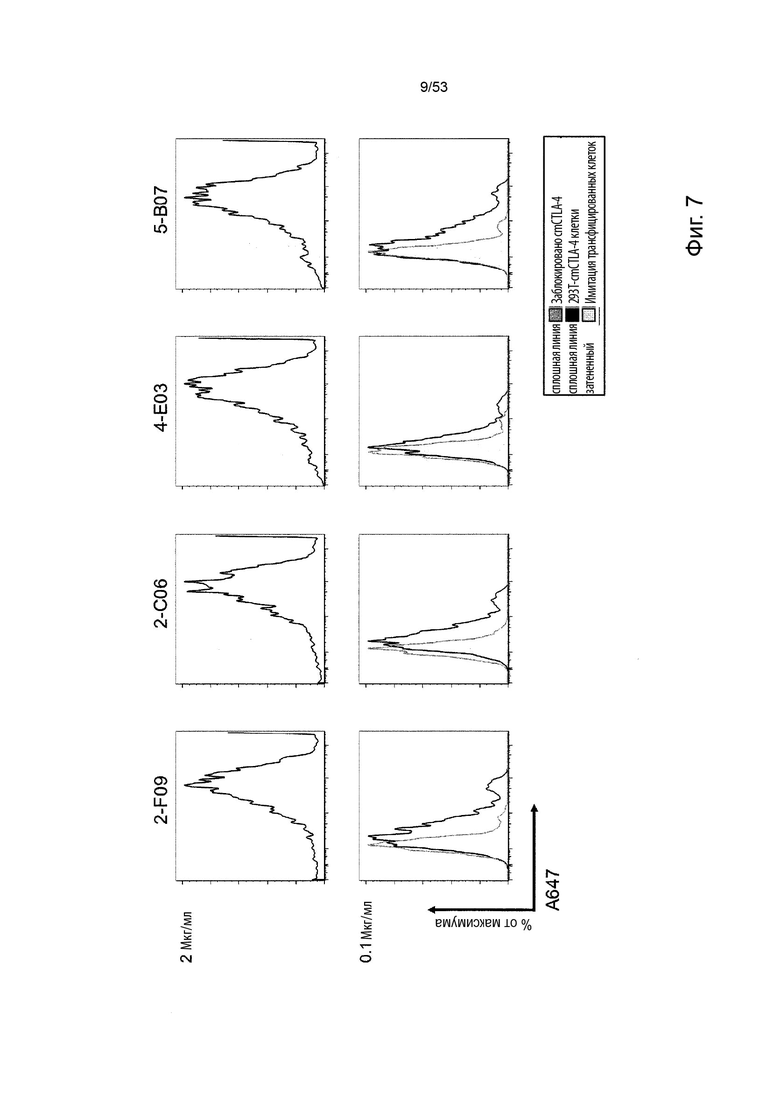
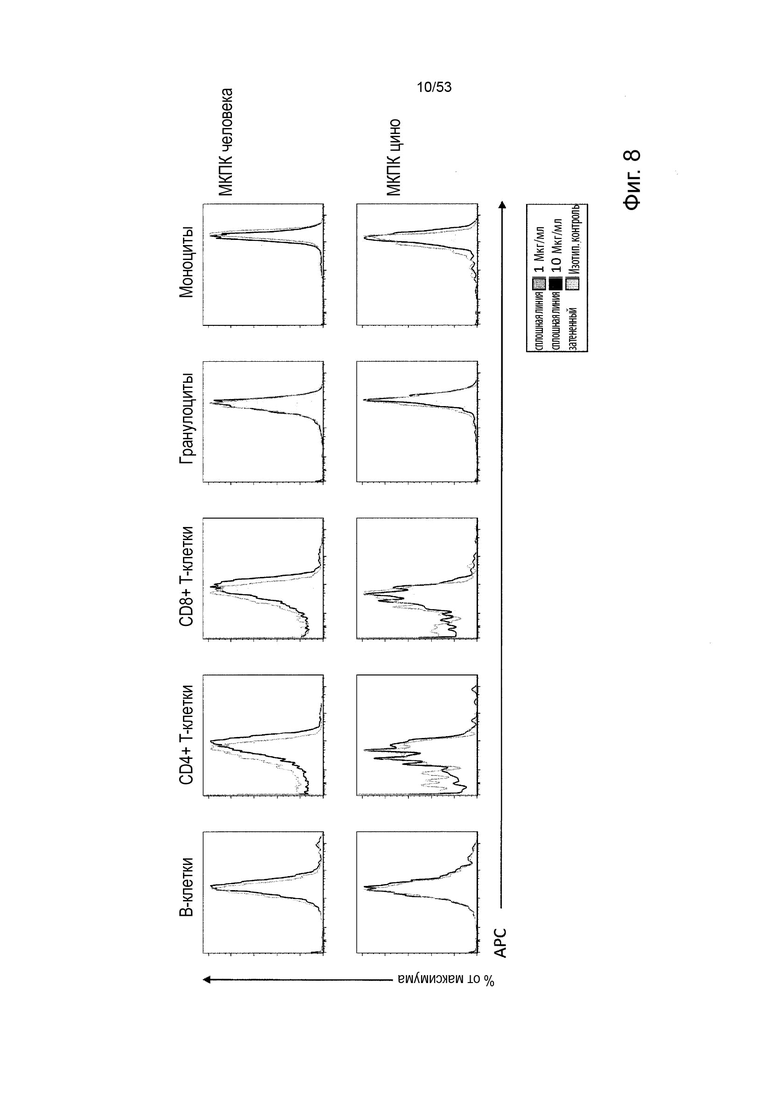
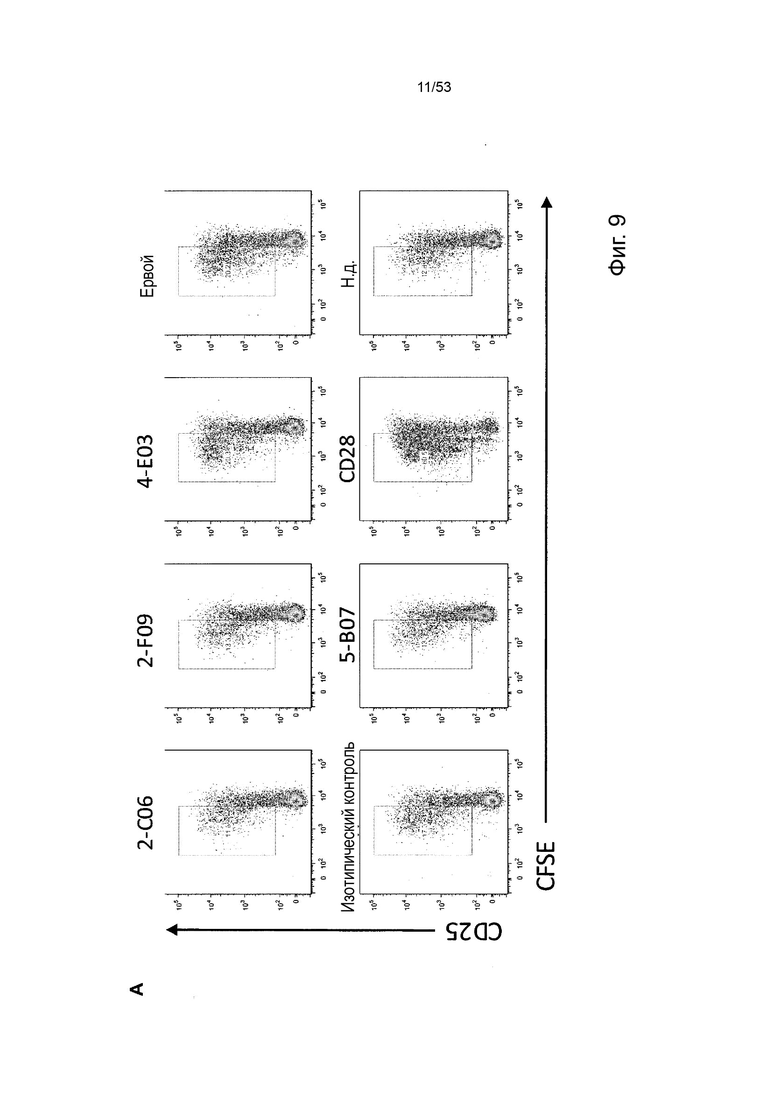
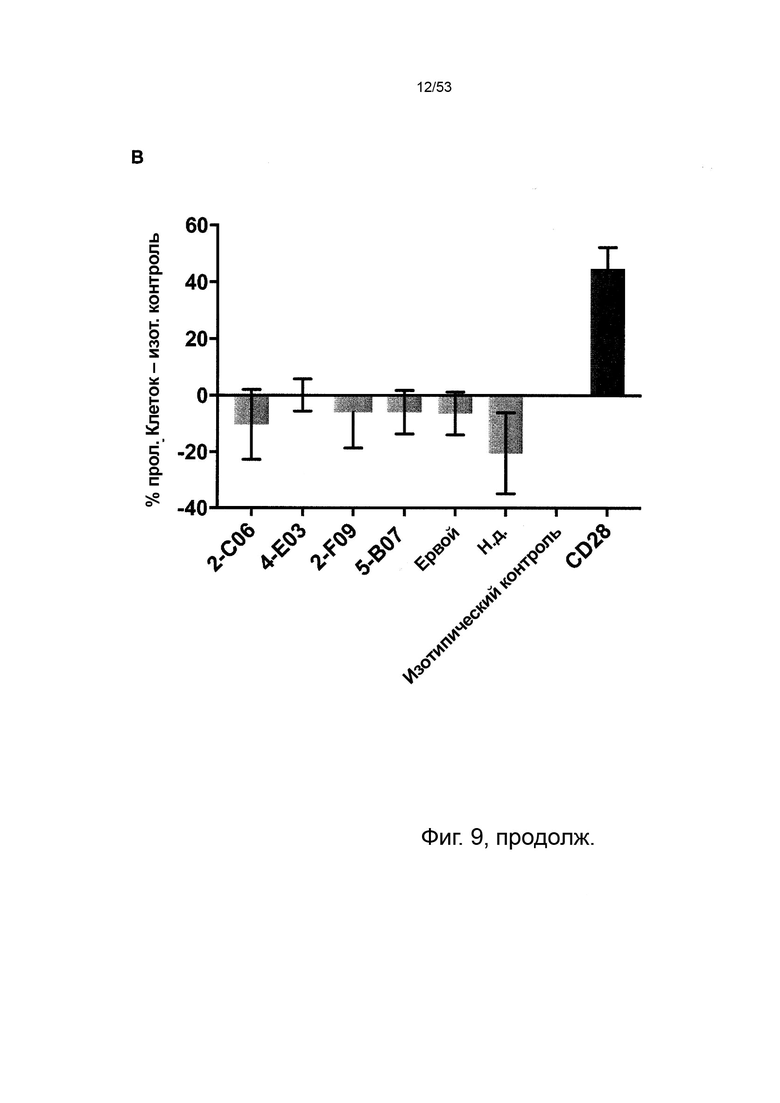
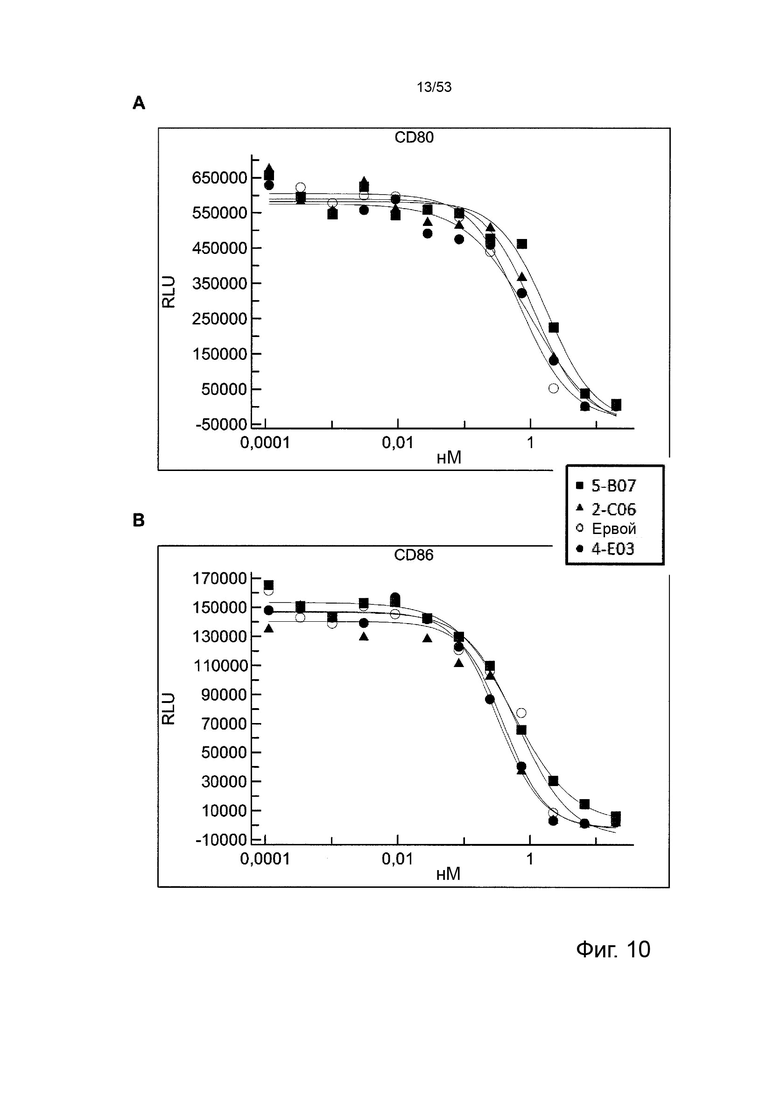
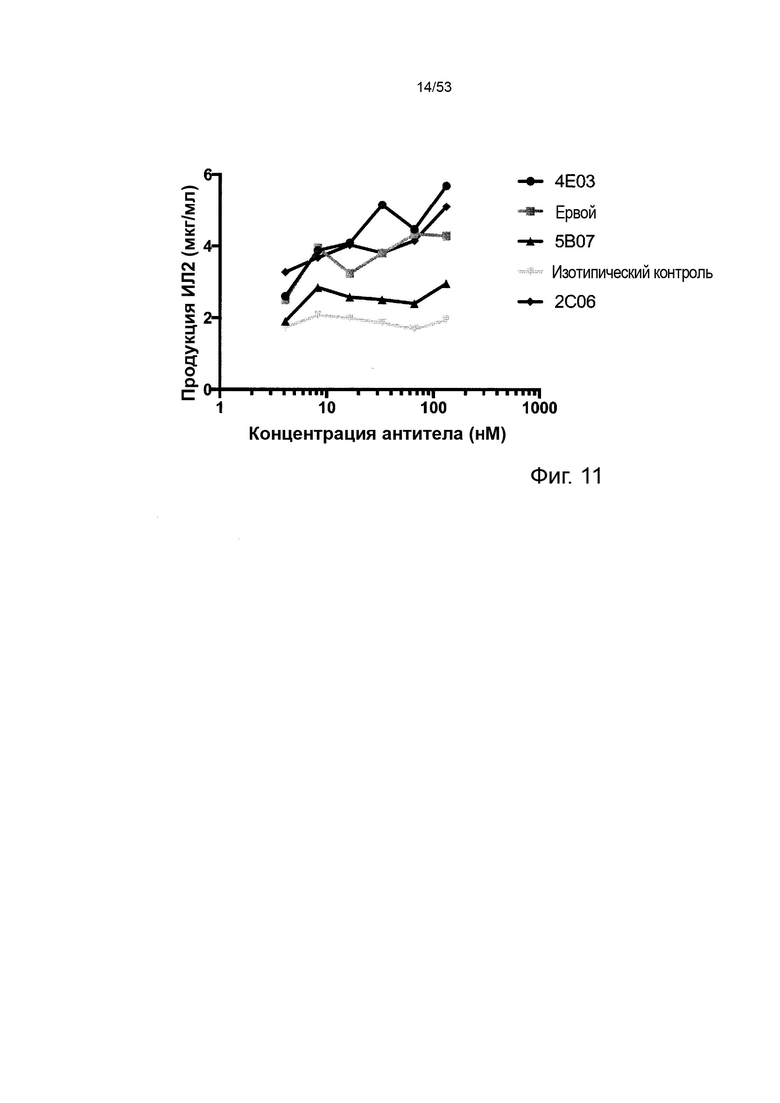
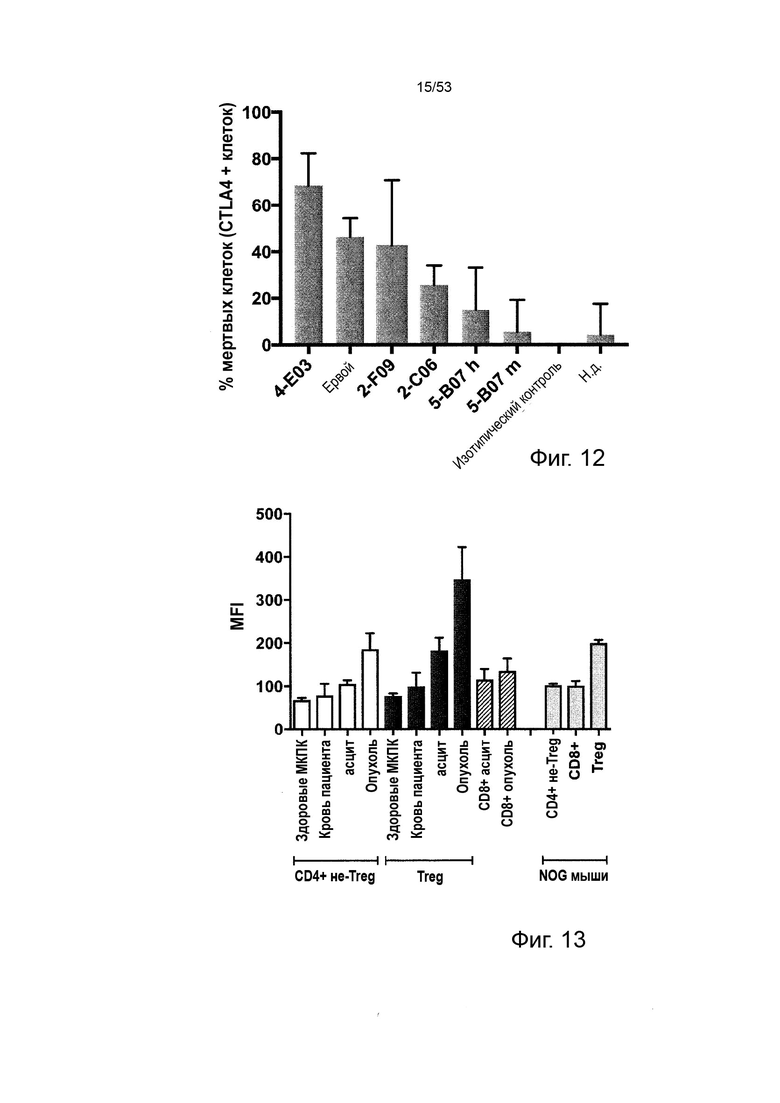
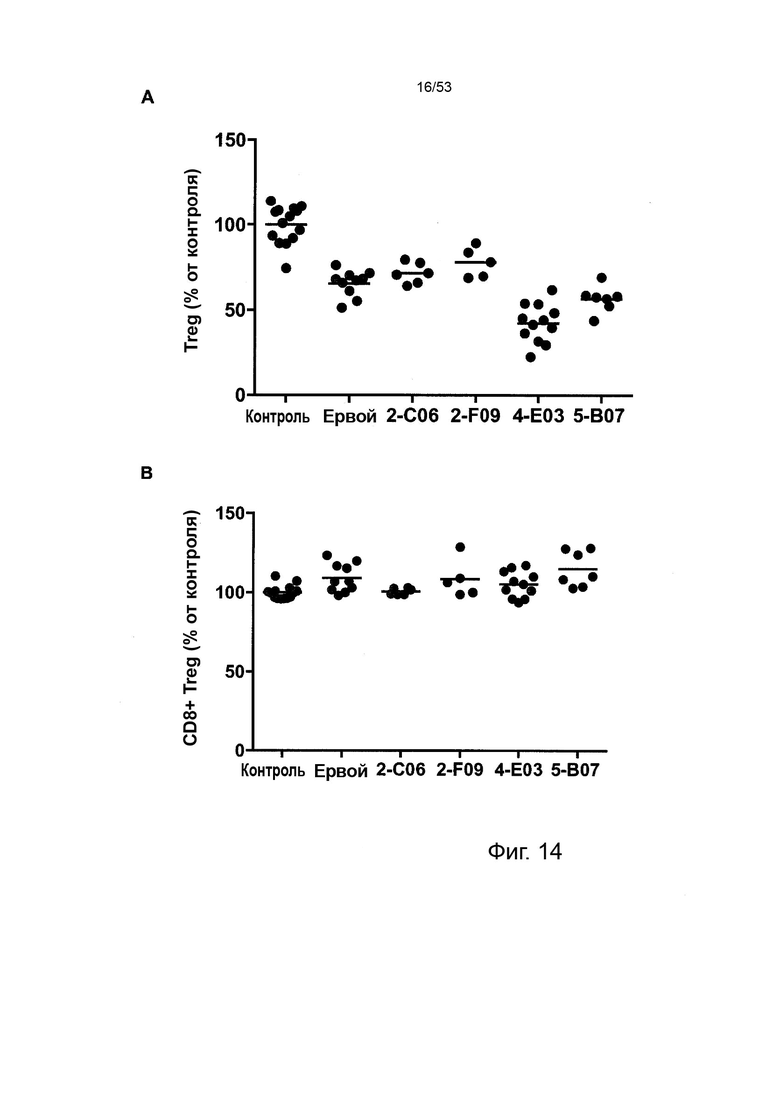
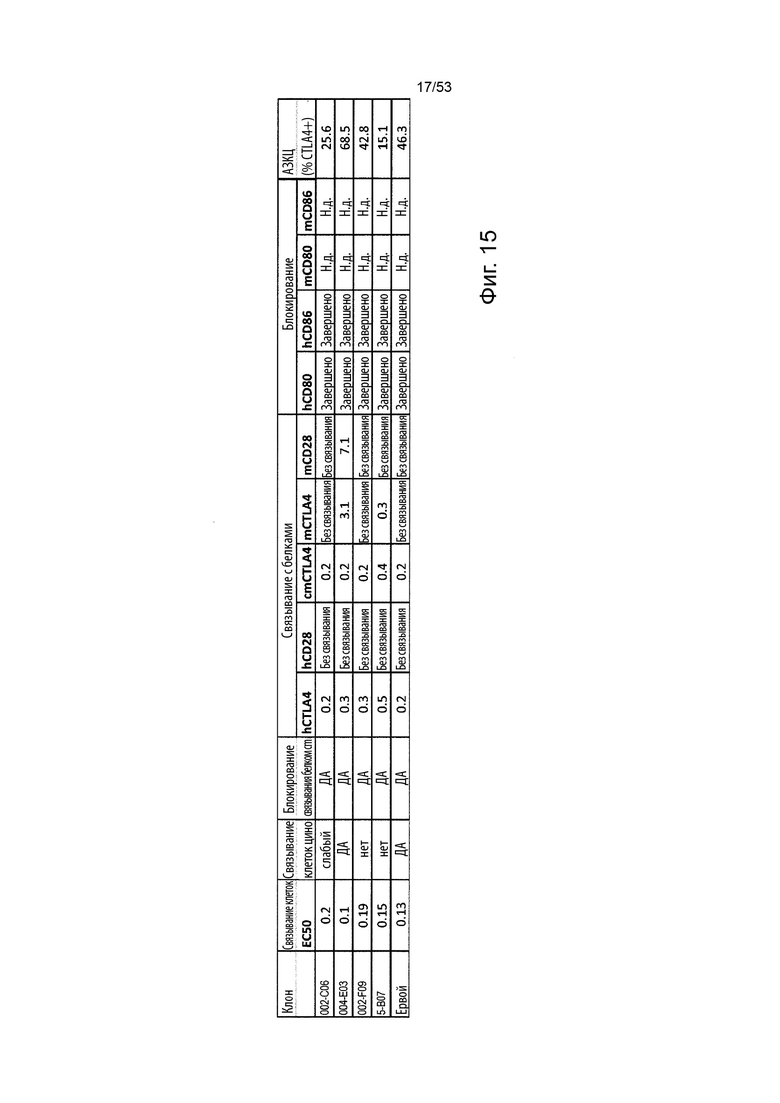
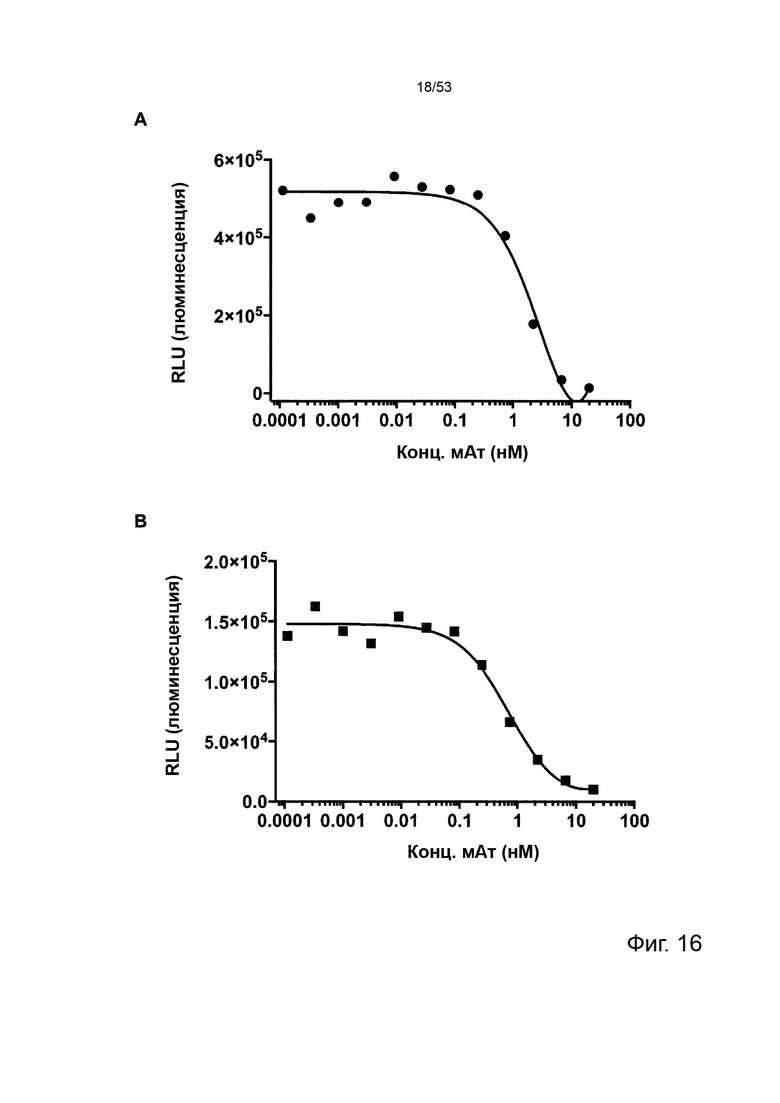
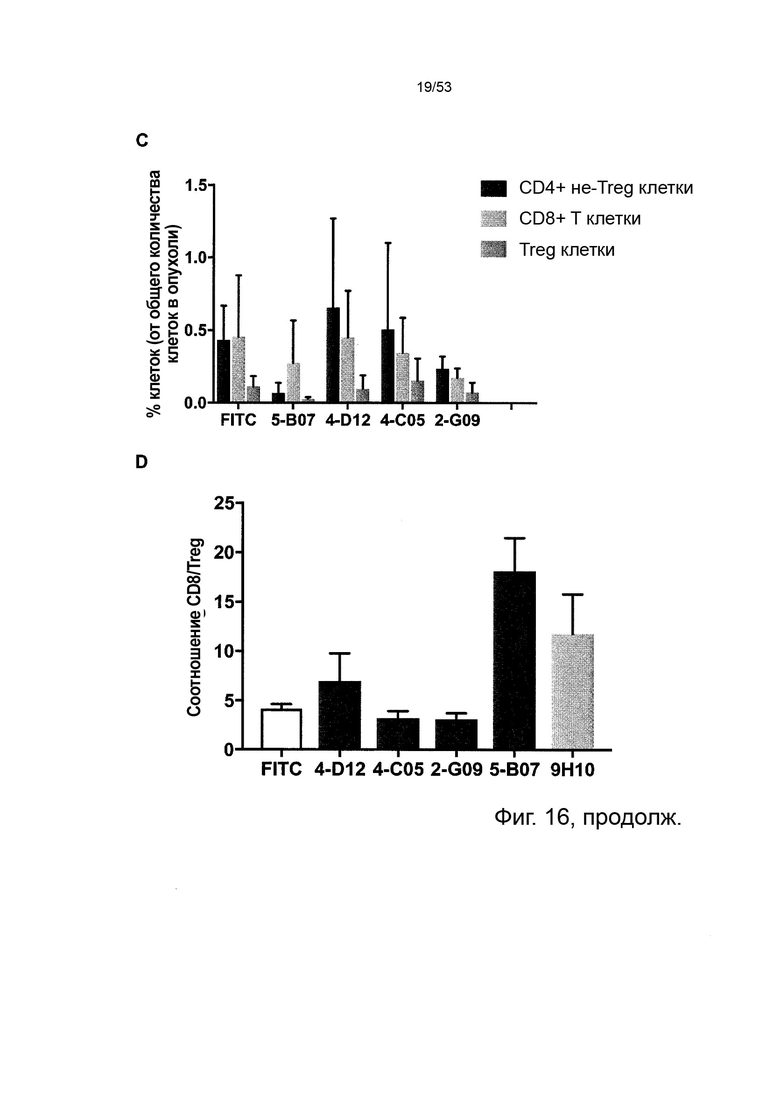
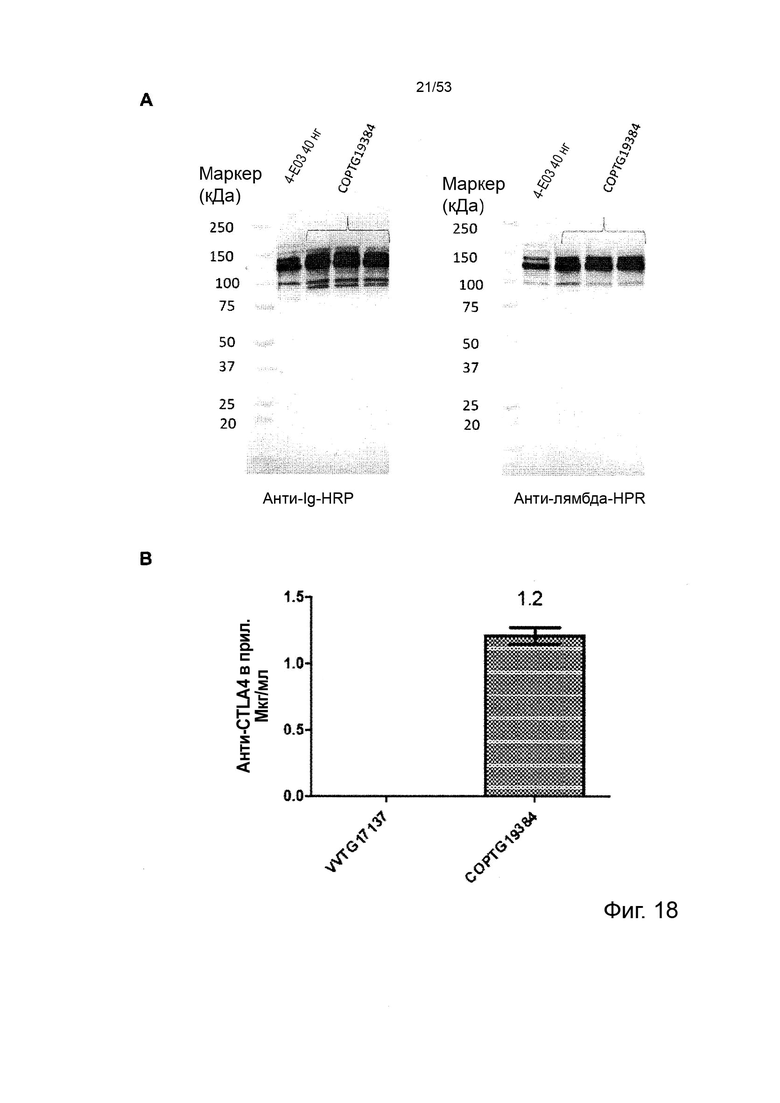
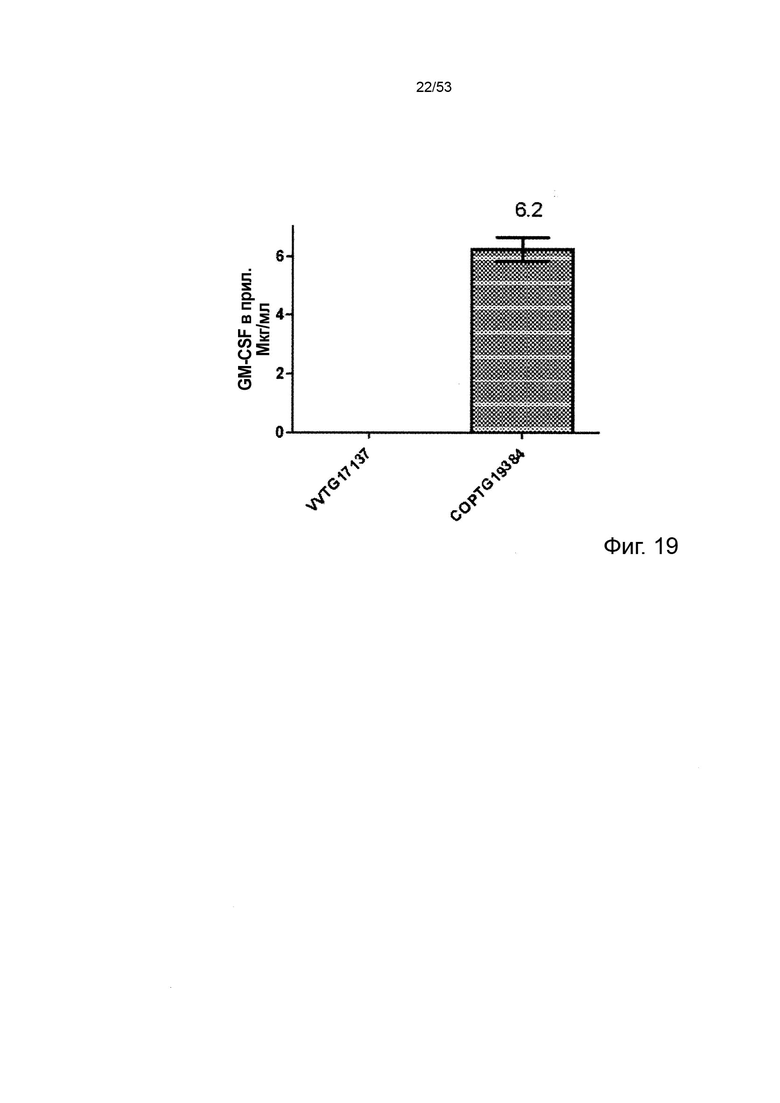
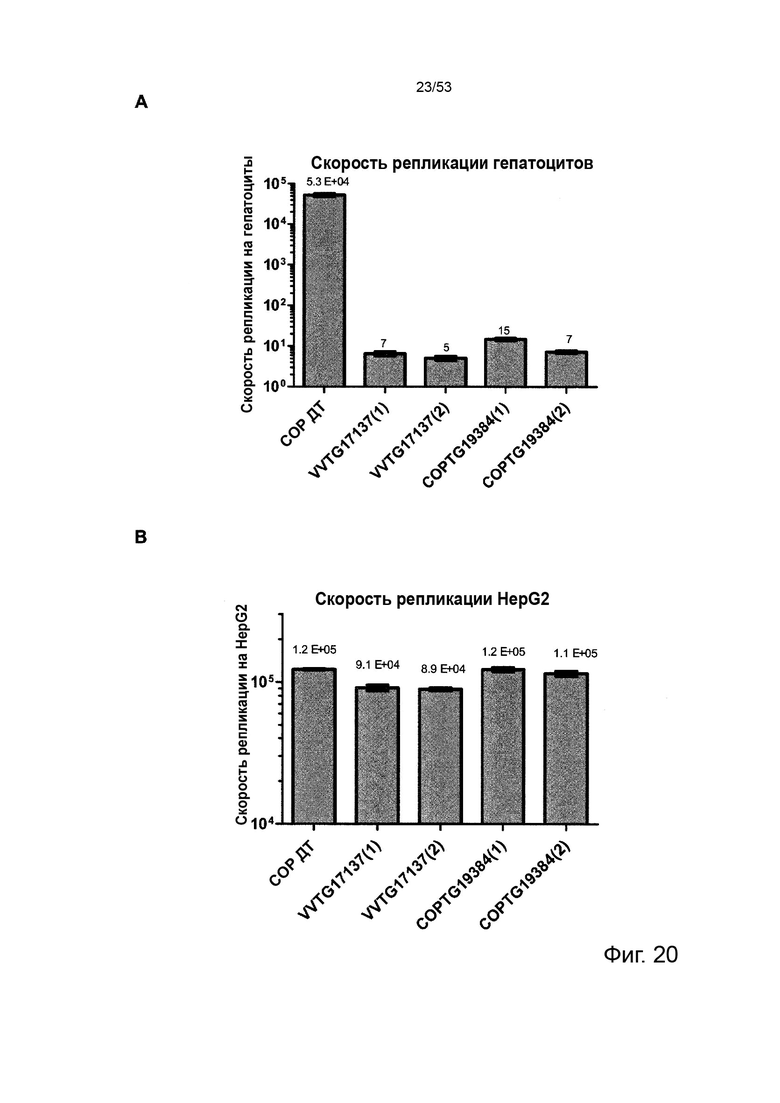
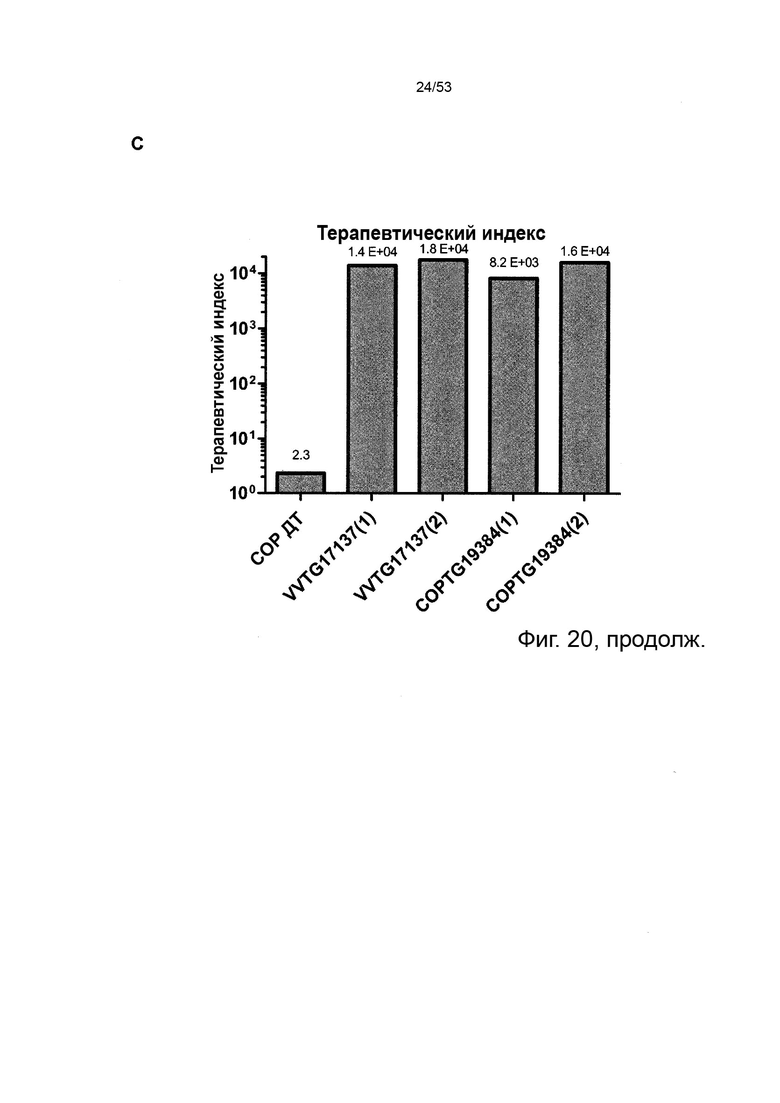
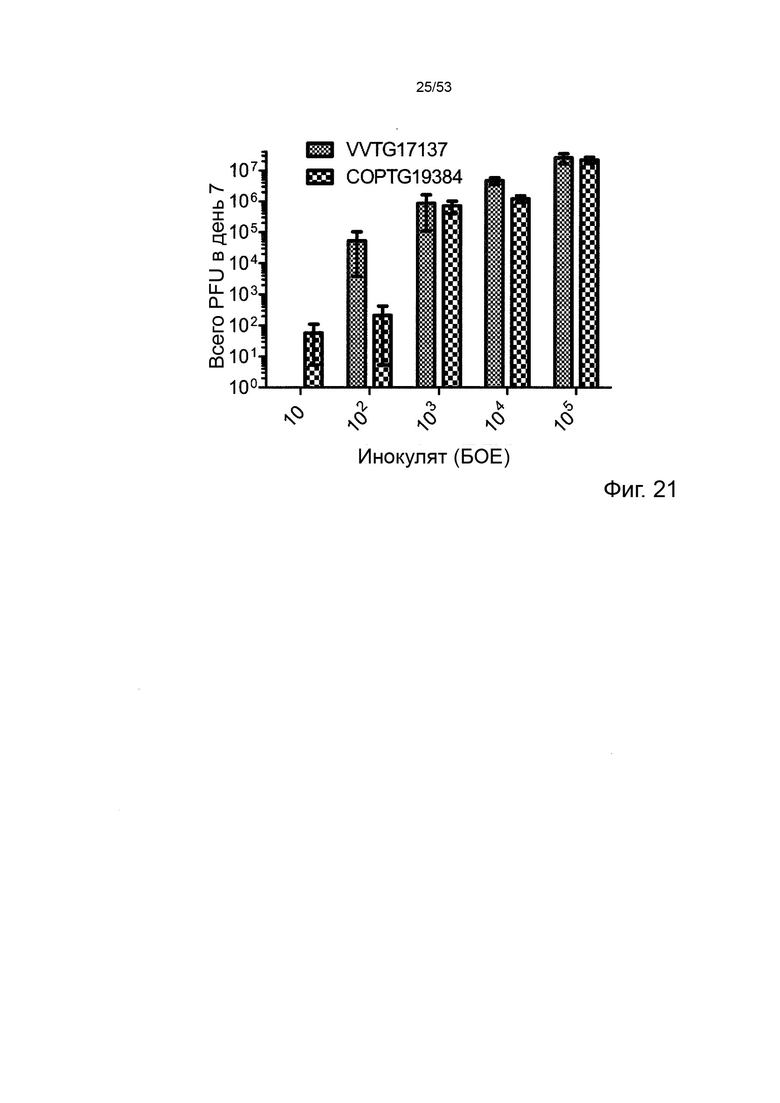
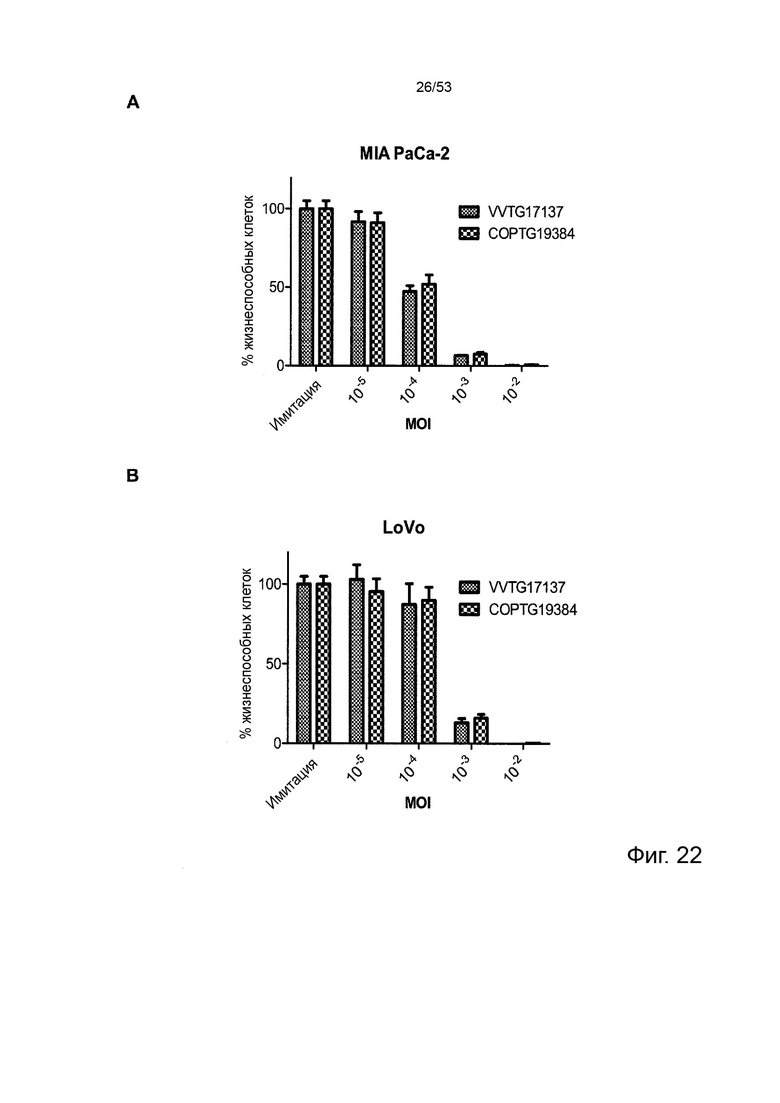
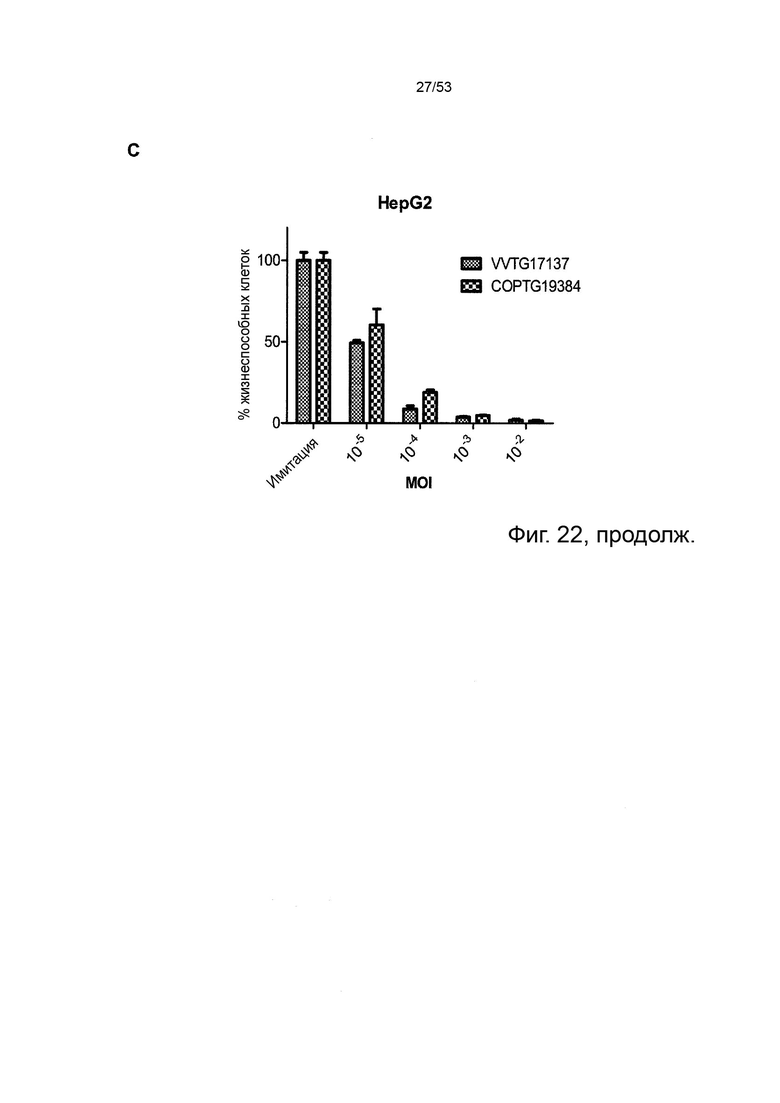
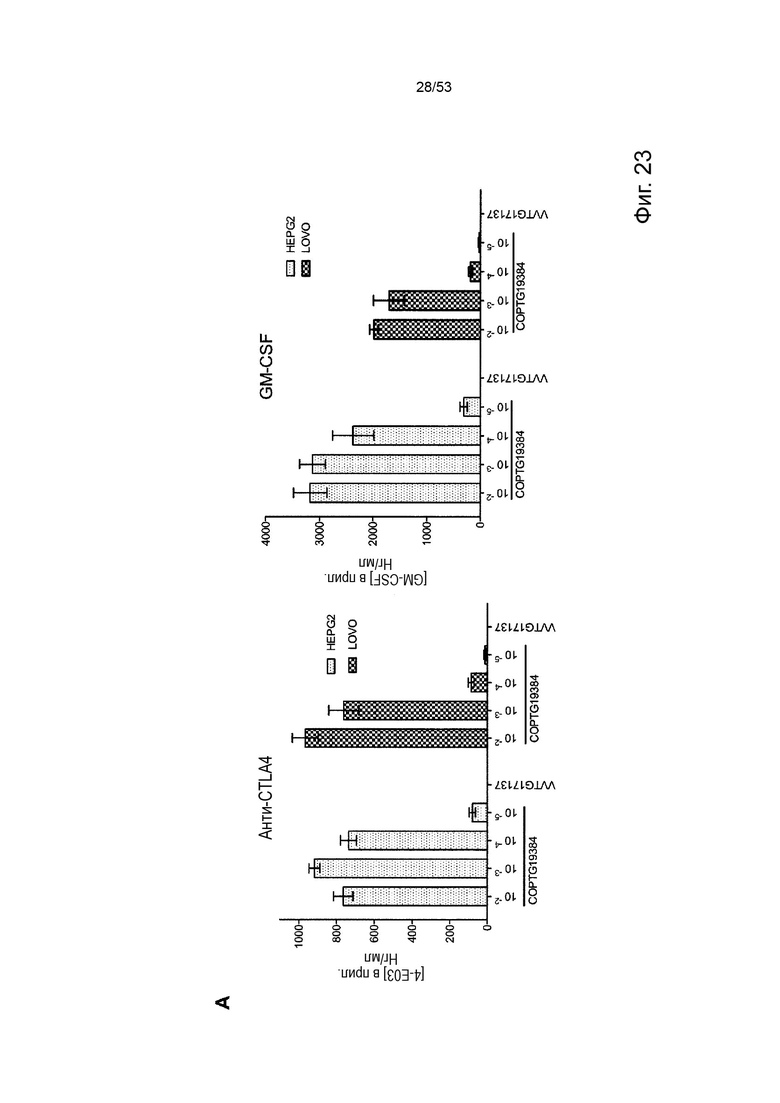
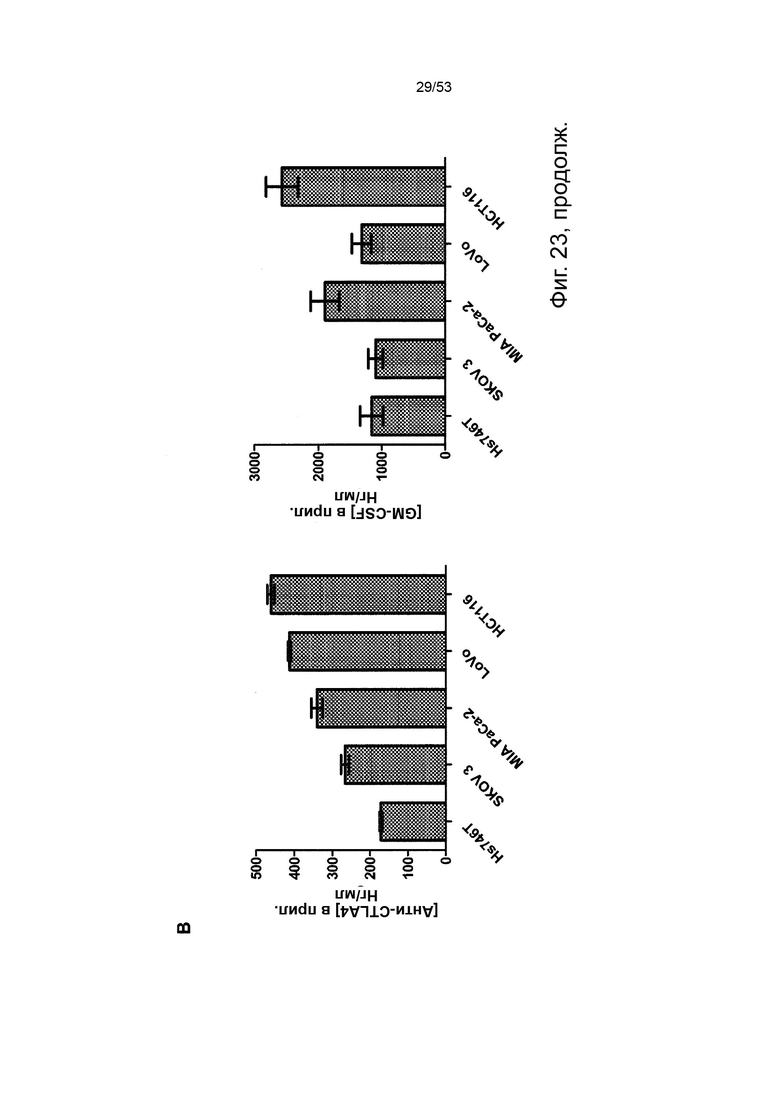
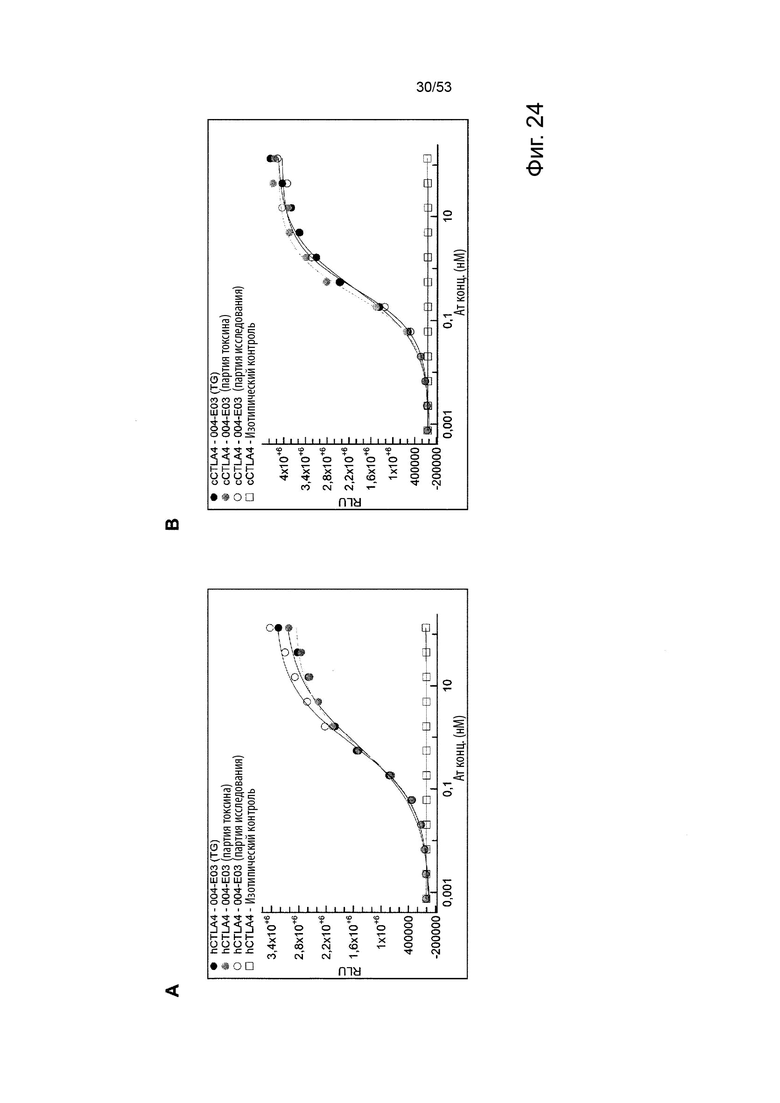
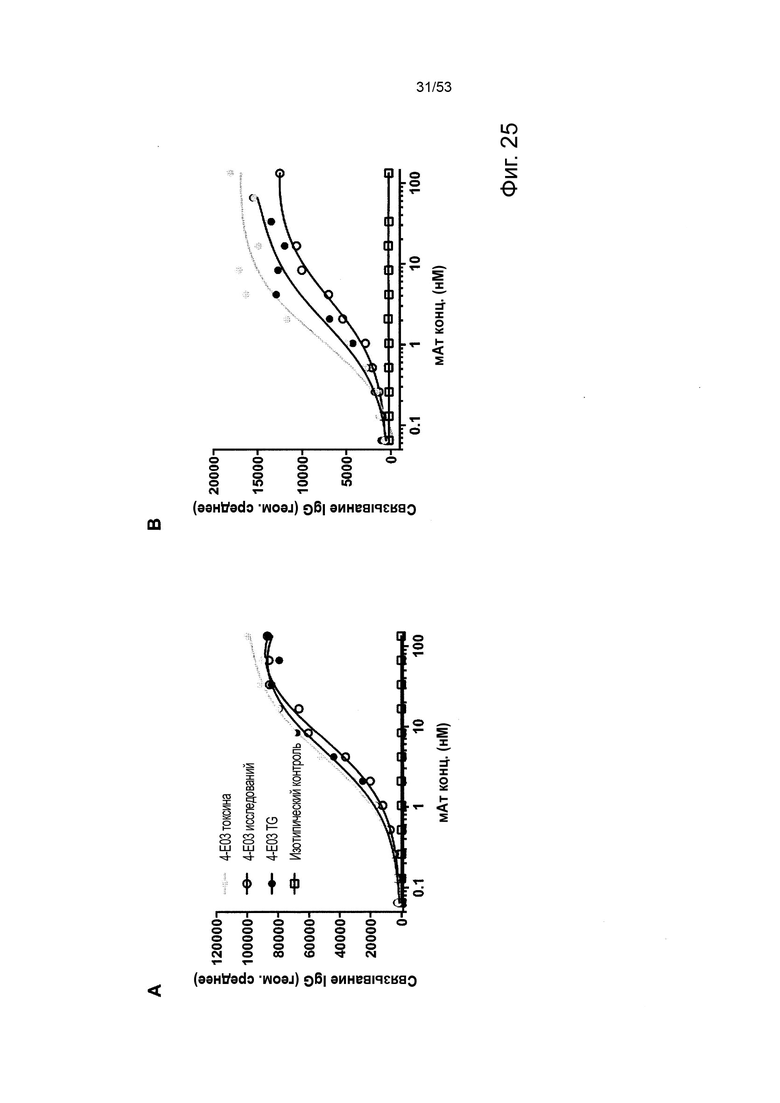
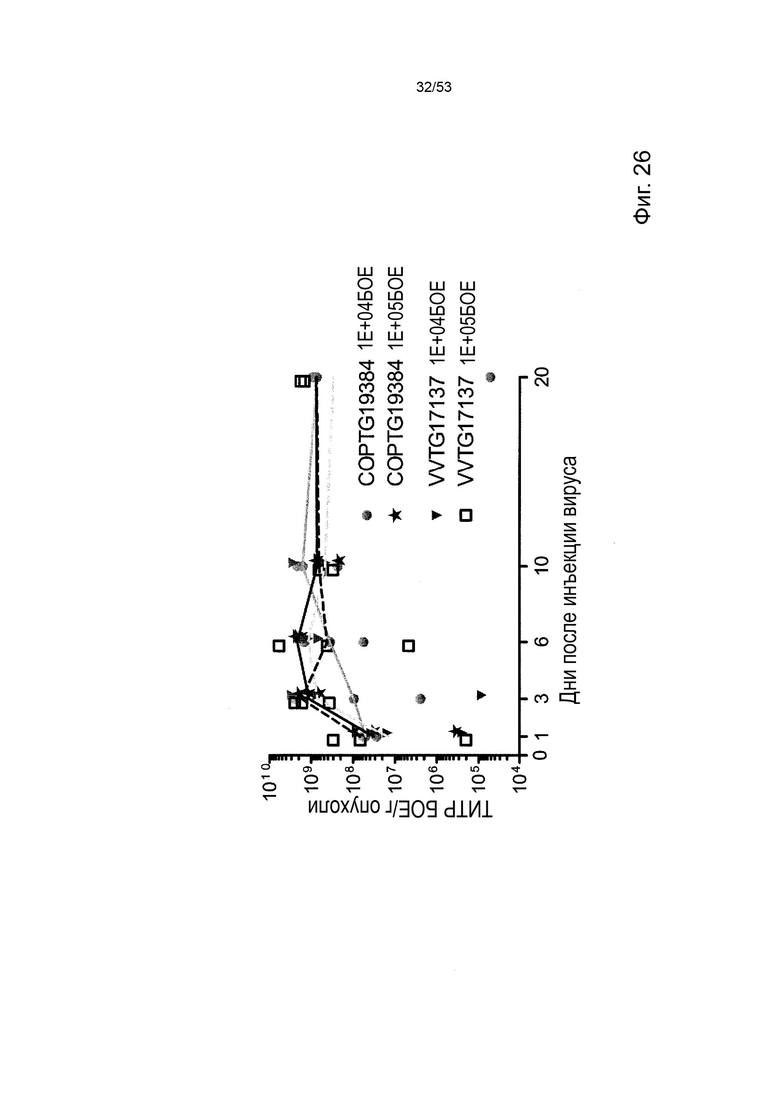
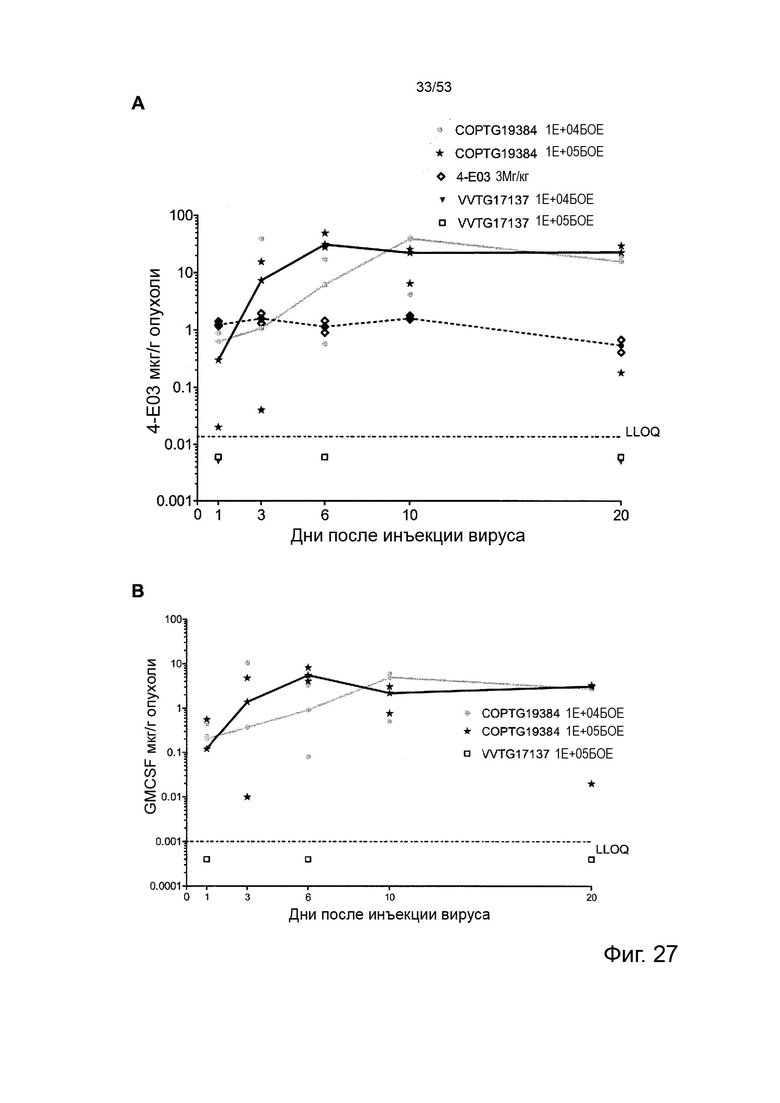
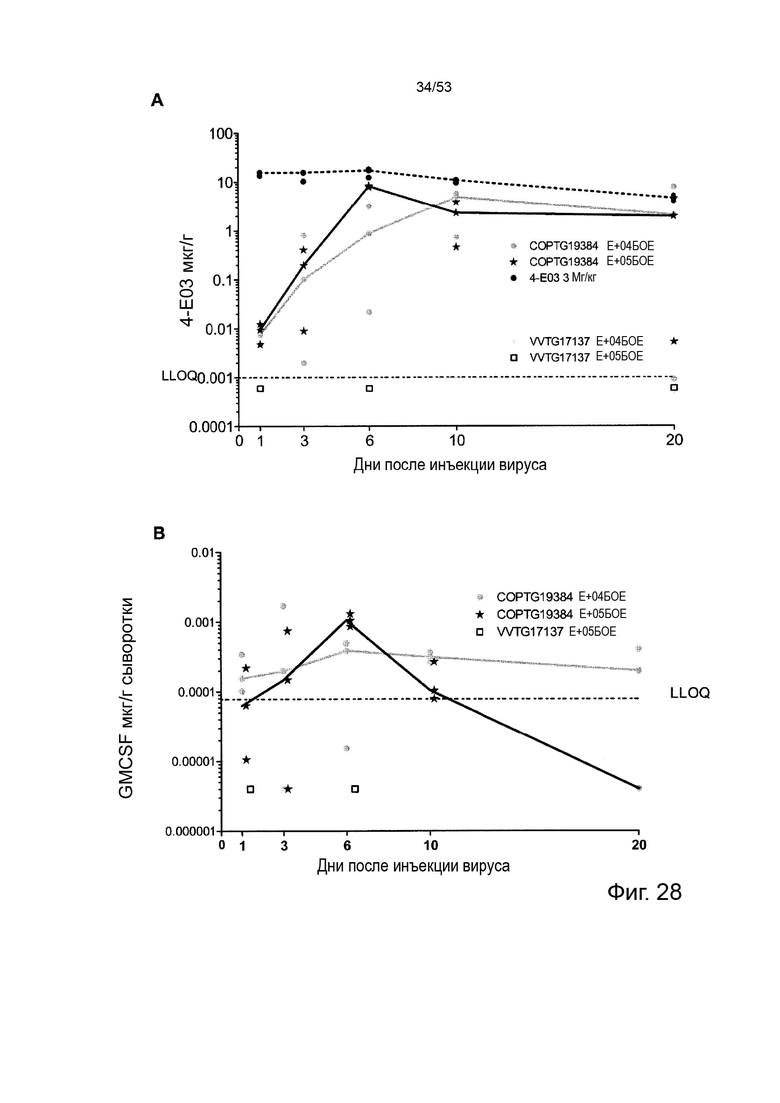
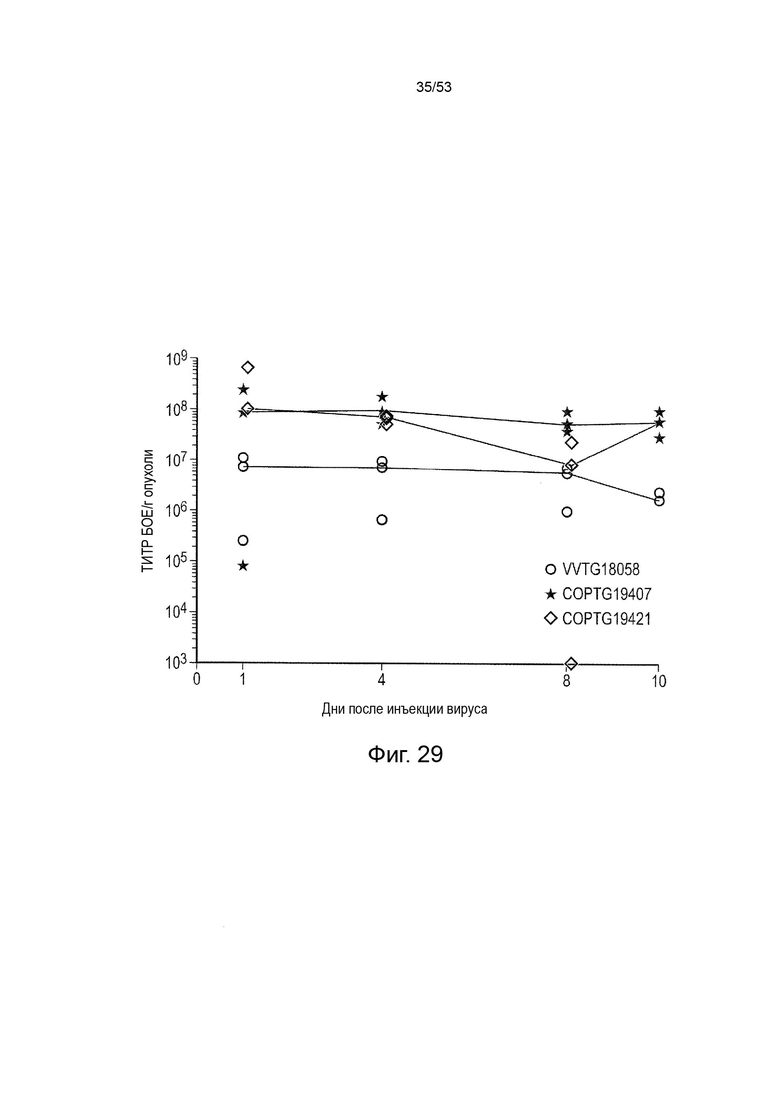

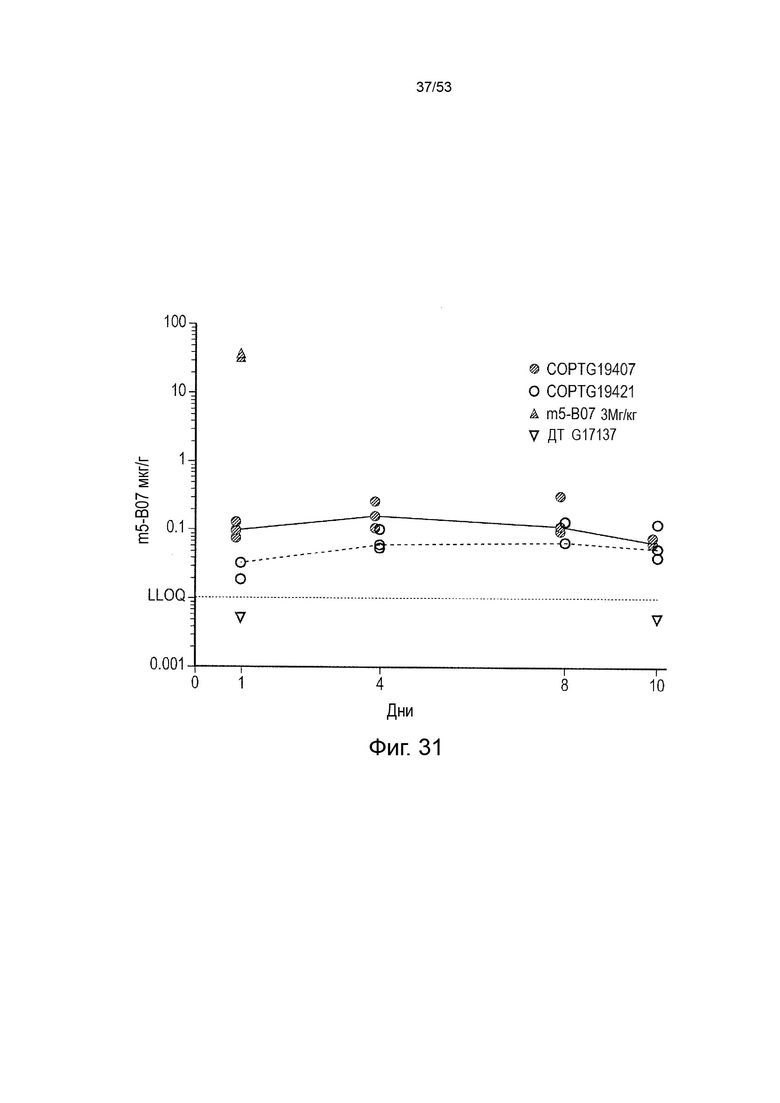
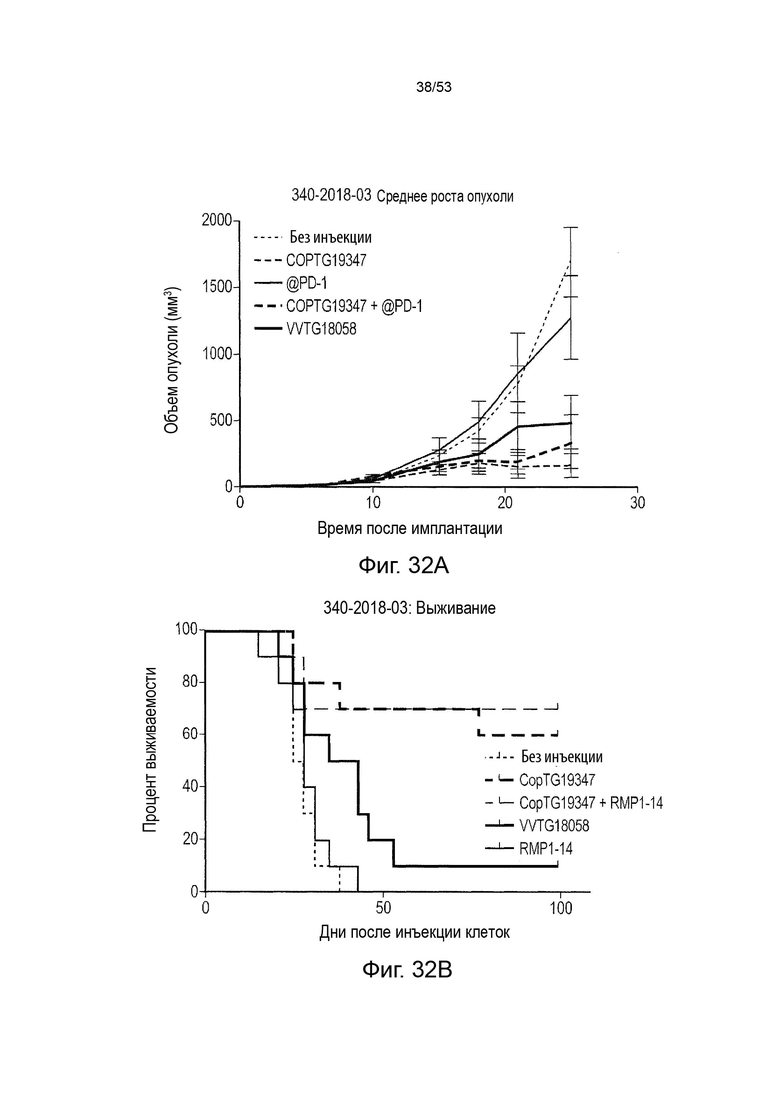
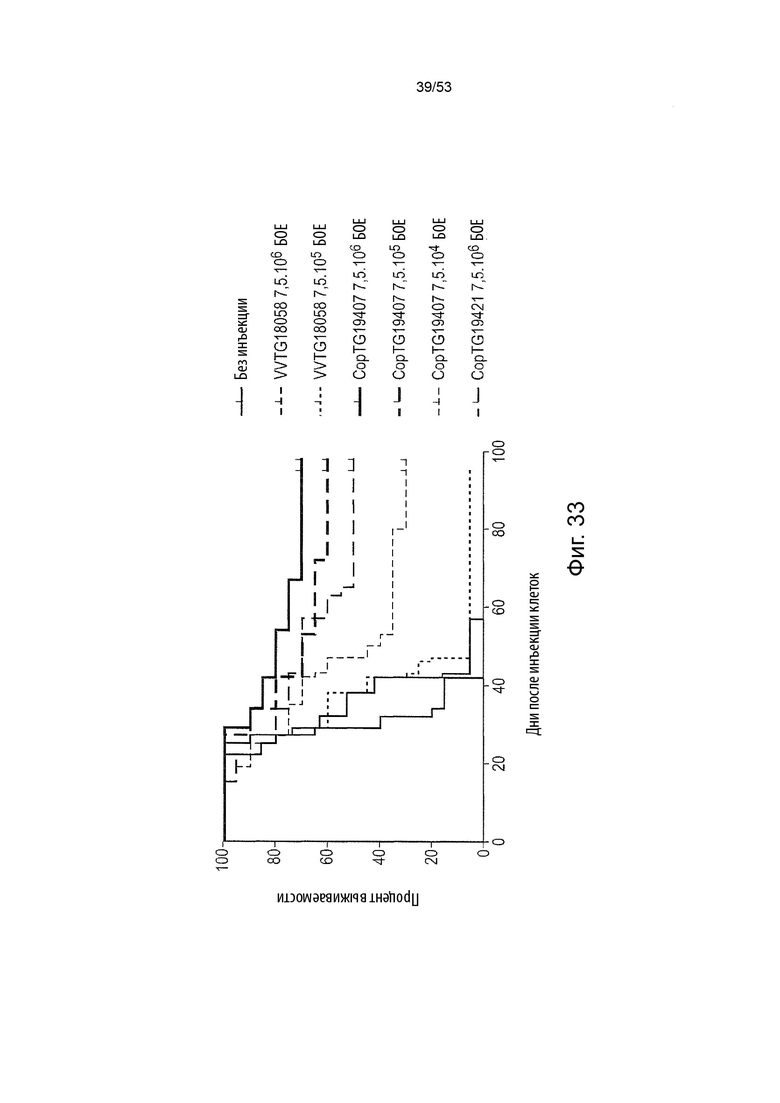
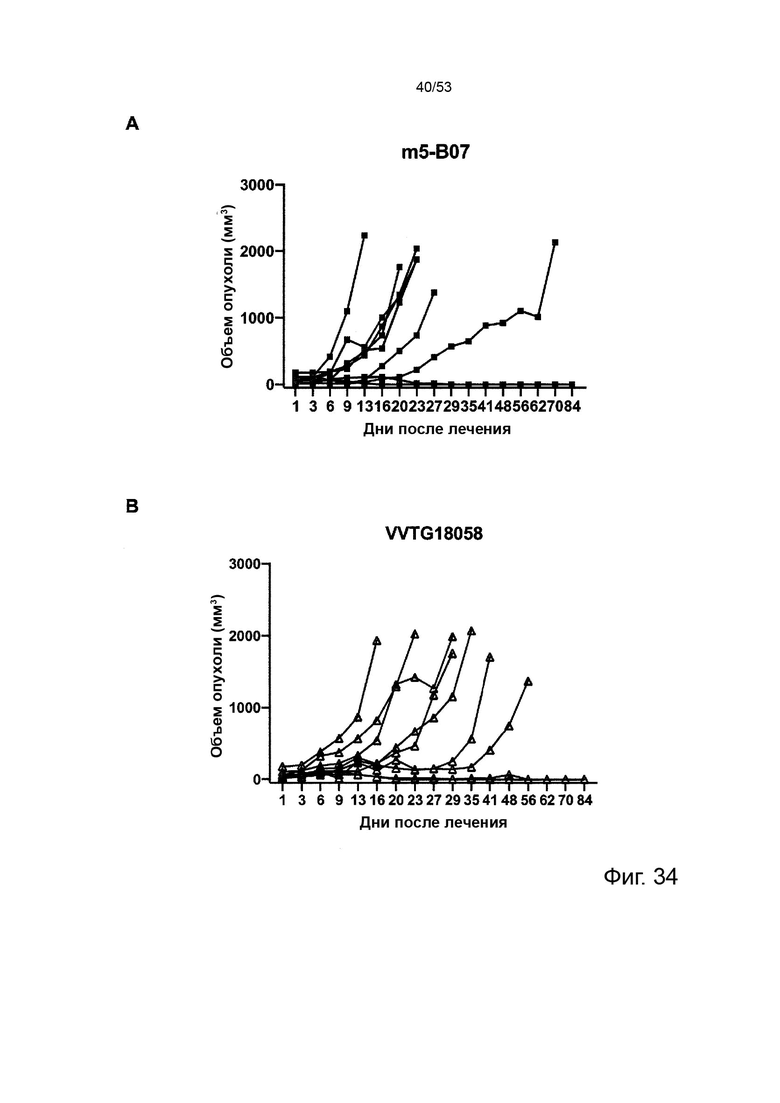
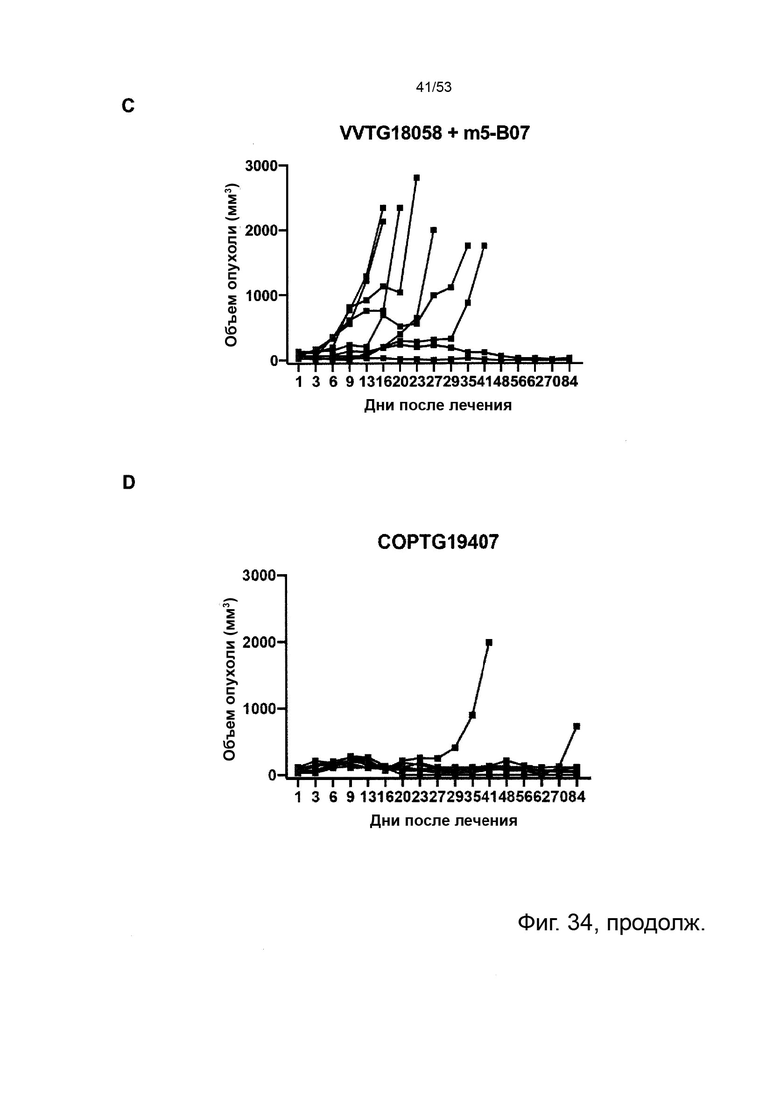
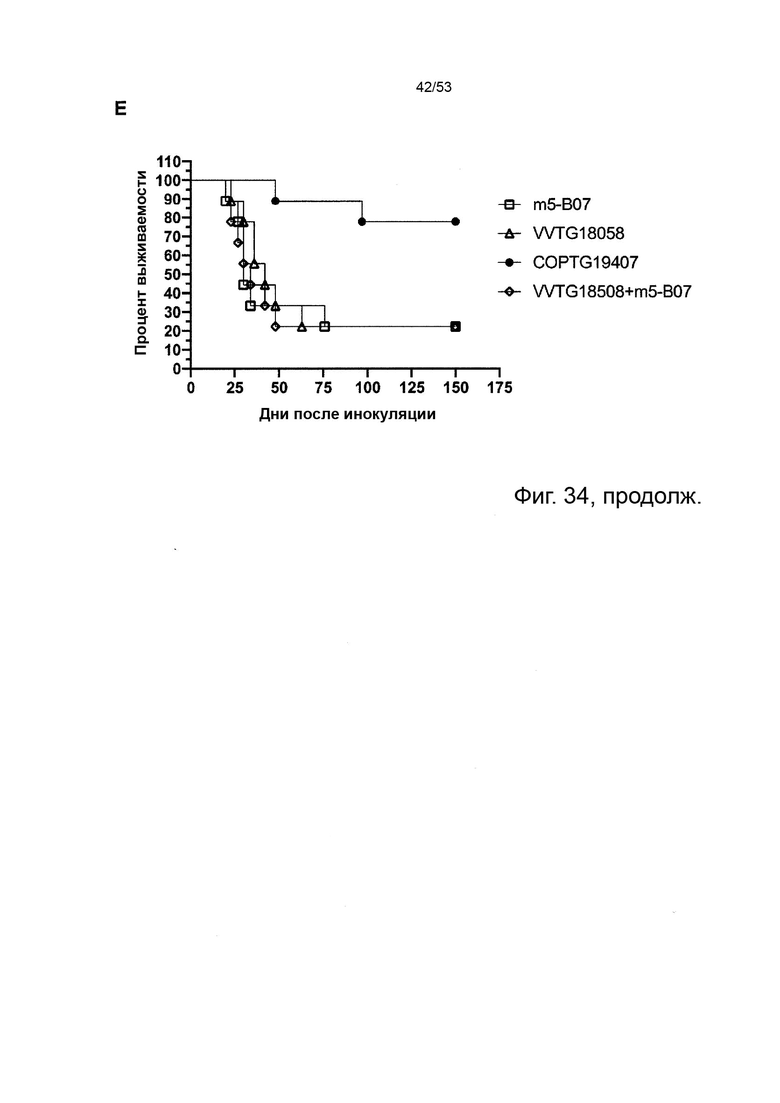
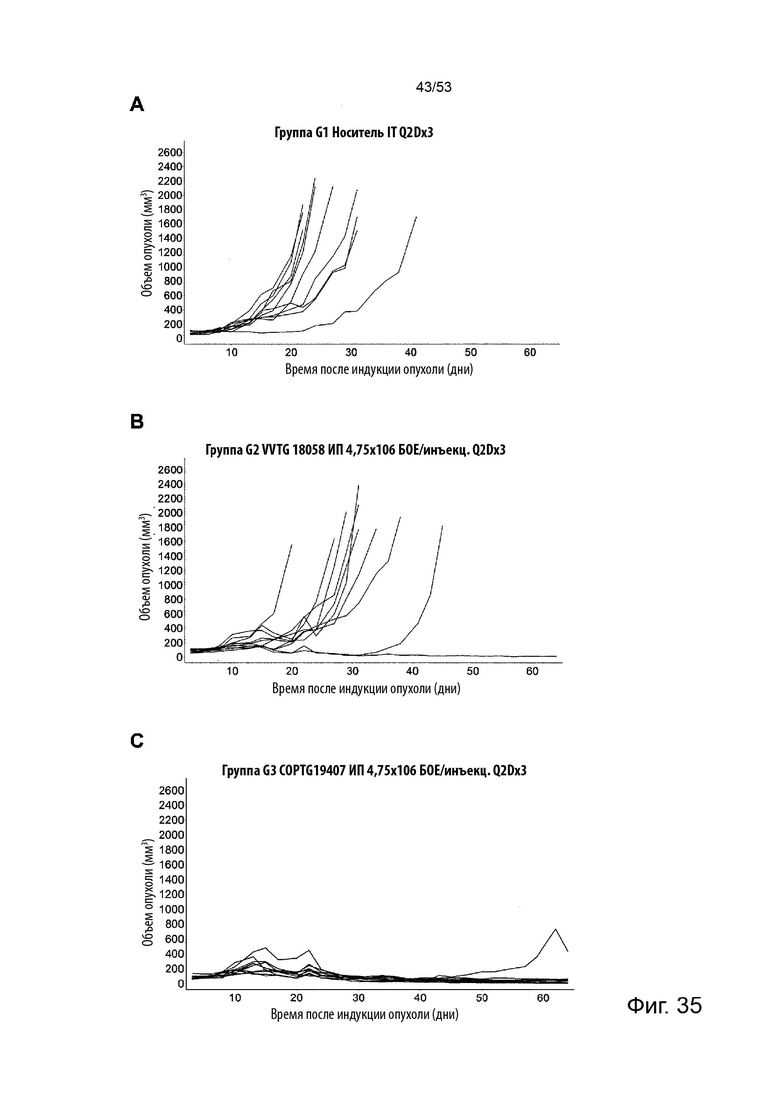
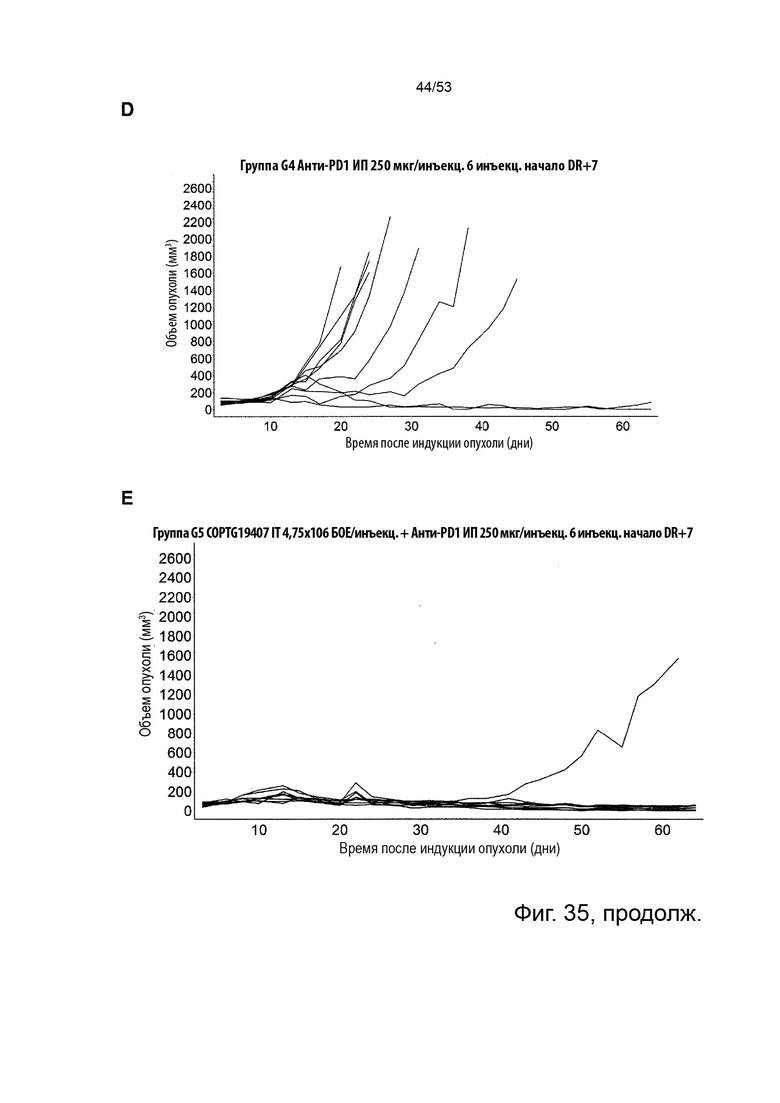
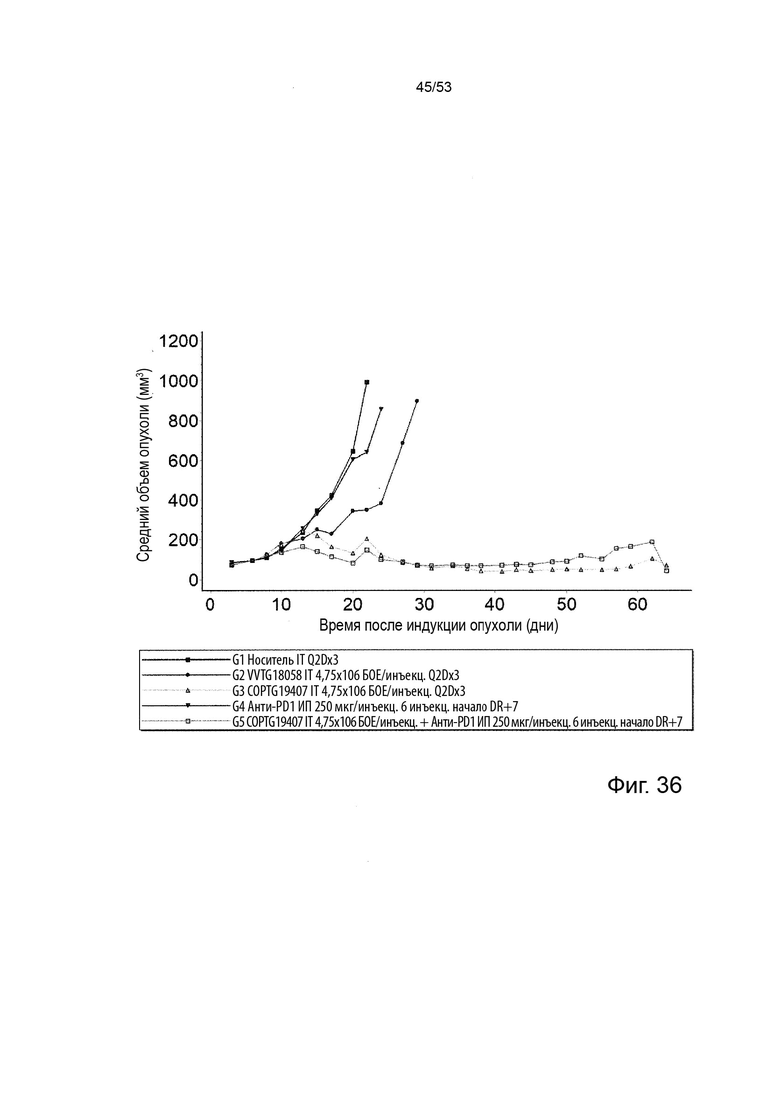
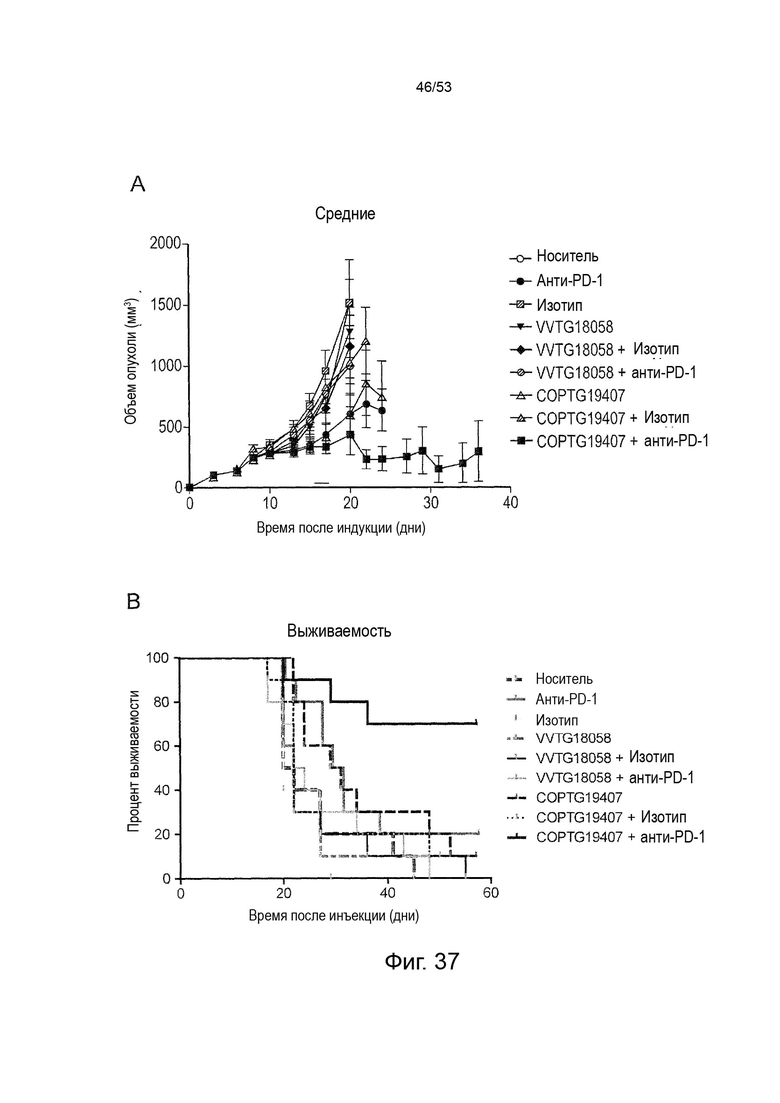
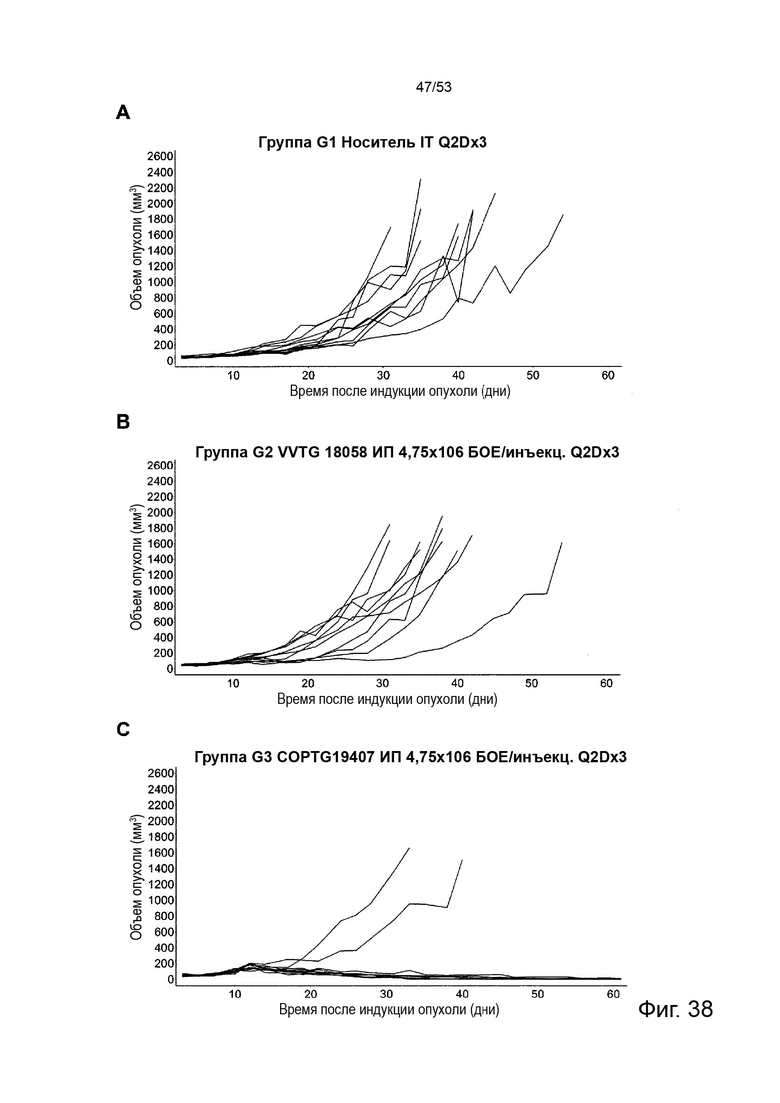
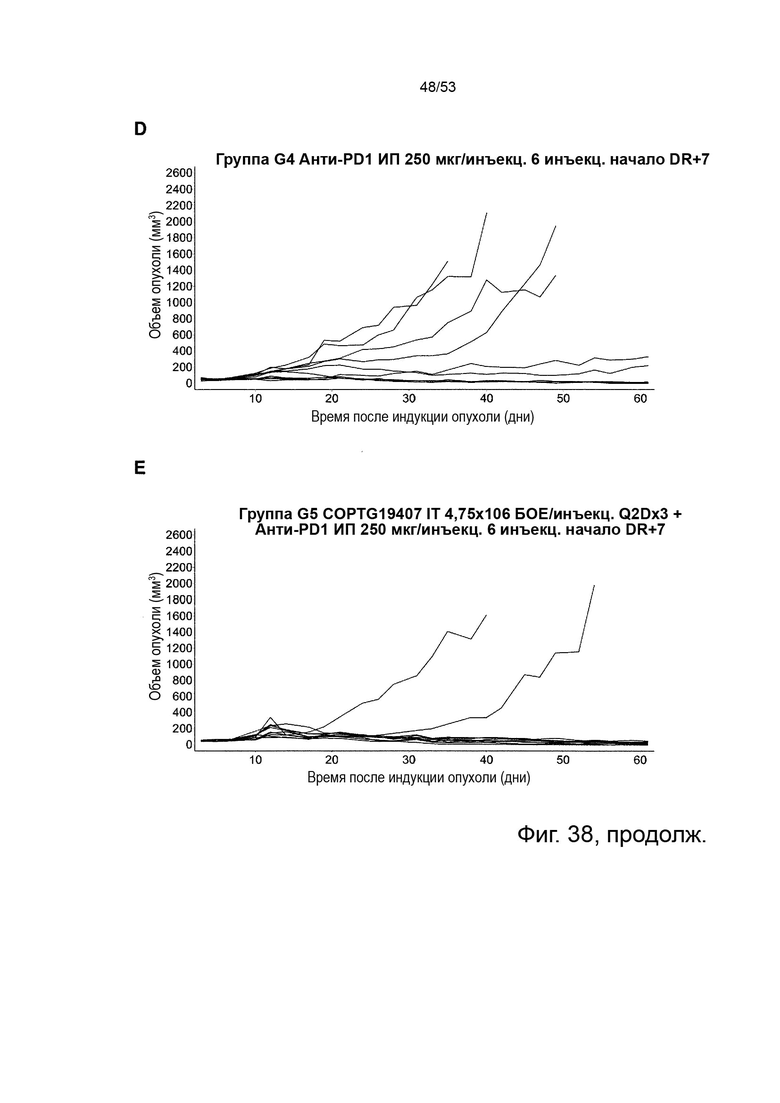
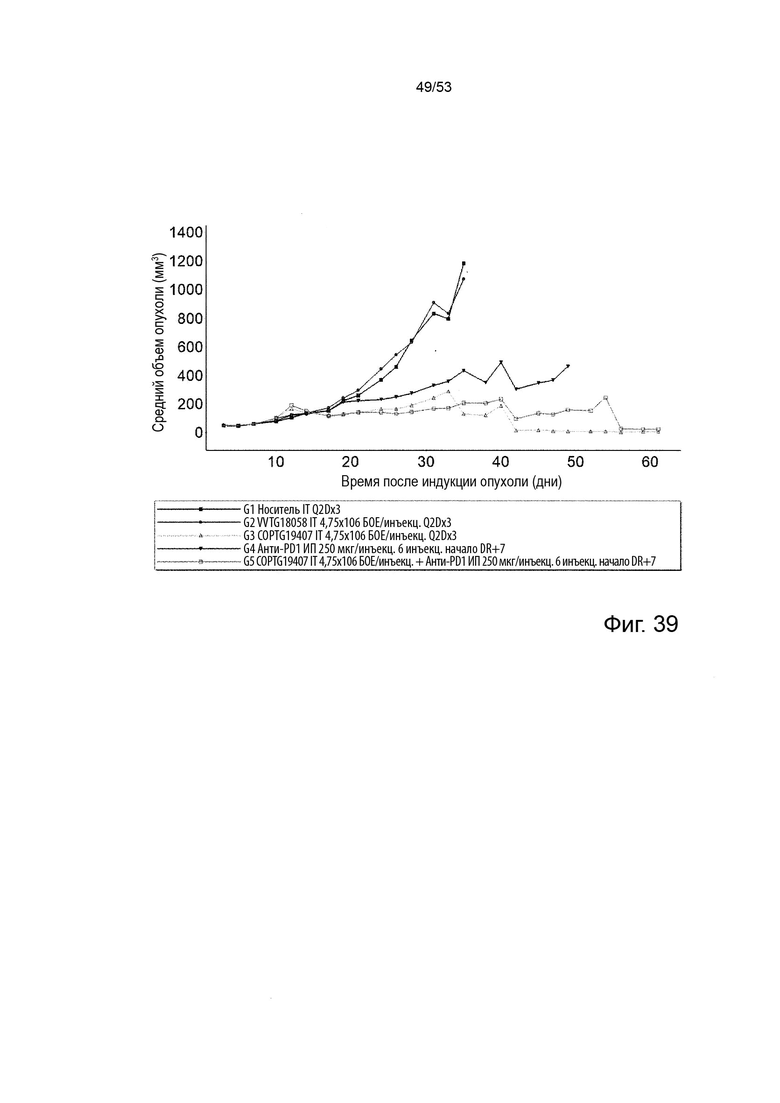
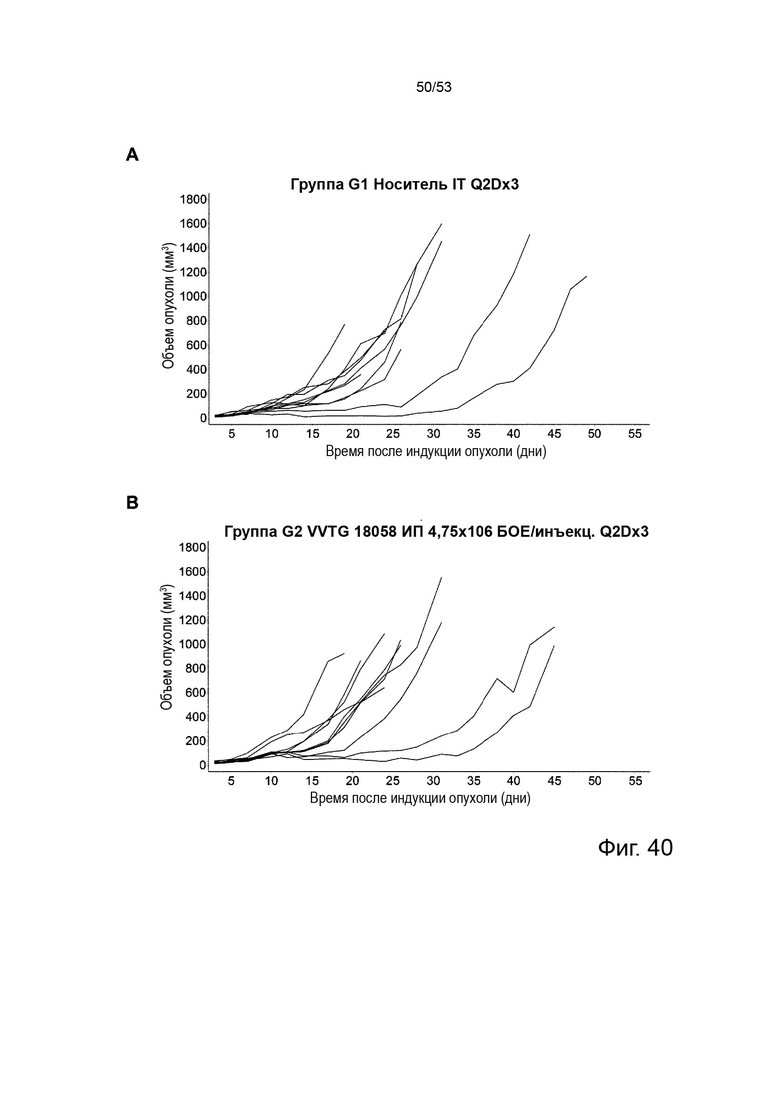
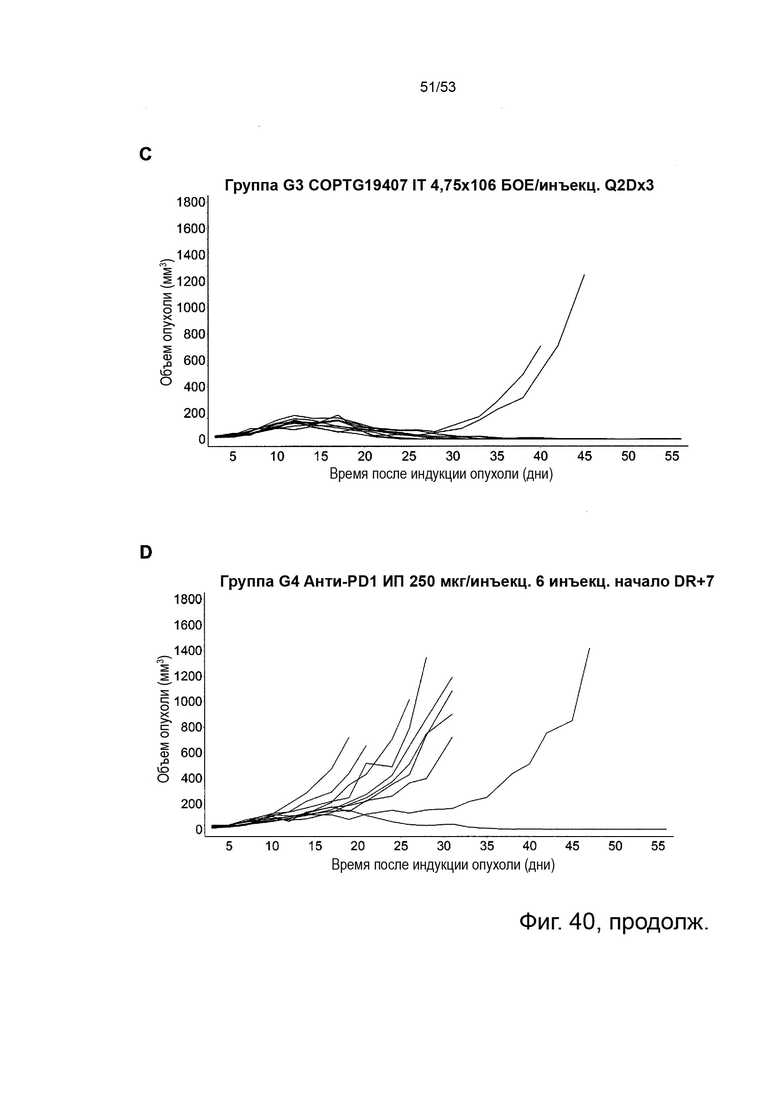
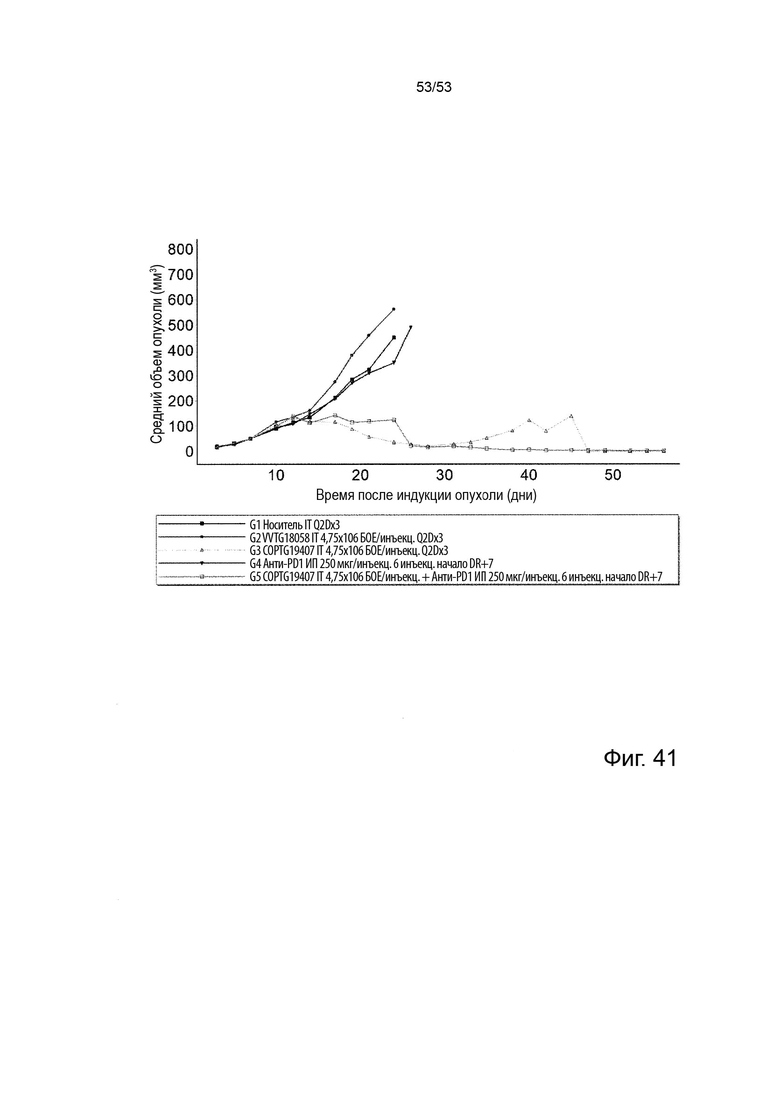
Изобретение относится к области биотехнологии, а именно к молекуле антитела, которая специфически связывается с CTLA-4, а также к фармацевтической композиции, ее содержащей. Также раскрыты нуклеиновая кислота, кодирующая вышеуказанную молекулу, а также плазмида, вирус и клетка, ее содержащие. Изобретение эффективно для лечения рака. 12 н. и 21 з.п. ф-лы, 41 ил., 8 табл., 9 пр.
1. Молекула антитела, которая специфически связывается с CTLA-4 , содержащая 6 CDR с последовательностями SEQ ID NO: 15, 16, 17, 10, 18 и 19 или 6 CDR с последовательностями SEQ ID NO: 22, 23, 24, 10, 25 и 26.
2. Молекула антитела по п. 1, которая по сравнению с ипилимумабом имеет улучшенное истощающее действие на положительные по CTLA-4 клетки или клетки, положительные по CTLA-4 и CD4.
3. Молекула антитела по п. 1 или 2, которая имеет улучшенное истощающее действие на Treg по сравнению с ипилимумабом.
4. Молекула антитела по любому из пп. 1-3, которая считается имеющей улучшенное истощающее действие на CTLA-4-положительные клетки, CD4-положительные клетки и/или Treg по сравнению с ипилимумабом, если она дает улучшенное истощение в:
(i) тестировании АЗКЦ in vitro, которое проводят с применением линии клеток НК-92, стабильно трансфицированной для экспрессии аллеля CD16-158V вместе с зеленым флуоресцентным белком (GFP), при этом тестирование АЗКЦ включает следующие последовательные этапы:
1) CTLA-4-положительные клетки, CD4-положительные клетки или Treg в качестве клеток-мишеней выделяют из периферической крови здоровых доноров;
2) затем клетки-мишени стимулируются CD3/CD28 и rhIL-2;
3) затем клетки-мишени предварительно инкубируют с молекулой антитела и затем смешивают с НК-клетками;
4) затем клетки-мишени инкубируют в среде RPMI 1640 + GlutaMAX, содержащей 1 буфер HEPES, пируват натрия и FBS низкого IgG;
5) лизис определяют способом проточной цитометрии;
6) этапы 1-5 повторяются или выполняются параллельно с применением ипилимумаба вместо молекулы антитела на этапе 3; и
7) результаты лизиса молекулы антитела сравнивают с результатами лизиса ипилимумаба, и улучшенный лизис молекулы антитела по сравнению с ипилимумабом демонстрирует, что молекула антитела имеет улучшенное истощающее действие на CTLA-4-положительные клетки, CD4-положительные клетки и/или Treg; и/или
(ii) тестировании in vivo на модели PBMC-NOG/SCID, при этом тестирование in vivo включает следующие последовательные этапы:
1) МКПК человека выделяют, промывают и ресуспендируют в стерильном ФСБ;
2) мышам NOG внутривенно (в/в) вводят суспензию клеток с этапа 1);
3) селезенки мышей NOG выделяют и превращают в суспензию отдельных клеток;
4) суспензию клеток с этапа 3) ресуспендируют в стерильном ФСБ;
5) мышам SCID внутрибрюшинно (в/б) вводят суспензию, полученную на этапе 4;
6) мышей SCID затем обрабатывают либо молекулой антитела, ипилимумабом, либо моноклональным антителом изотипического контроля;
7) собирают внутрибрюшинную жидкость у обработанных мышей SCID;
8) подмножества Т-клеток человека идентифицируют и количественно оценивают с помощью FACS с применением следующих маркеров: CD45, CD4, CD8, CD25, CD127;
9) результаты идентификации и количественной оценки подмножеств Т-клеток от мышей, получавших молекулу антитела, сравнивают с результатами идентификации и количественной оценки подмножеств Т-клеток от мышей, получавших ипилимумаб, и с результатами идентификации и количественной оценки подмножества Т-клеток от мышей, обработанных моноклональными антителами изотипического контроля, и меньшее количество CTLA-4-положительных клеток, CD4-положительных клеток и/или Treg во внутрибрюшинной жидкости от мышей, обработанных исследуемой молекулой антитела, по сравнению с CTLA-4-положительными клетками, CD4-положительными клетками и/или Treg во внутрибрюшинной жидкости мышей, получавших ипилимумаб, демонстрирует, что молекула антитела имеет улучшенное истощающее действие на CTLA-4-положительные клетки, CD4-положительные клетки и/или Treg по сравнению с ипилимумабом.
5. Молекула антитела по любому из пп. 1-4, отличающаяся тем, что указанная молекула антитела содержит вариабельную тяжелую цепь, выбранную из группы, состоящей из последовательностей SEQ ID NO: 20 и 27, и/или вариабельную легкую цепь, выбранную из группы, состоящей из последовательностей SEQ ID NO: 21 и 28.
6. Молекула антитела по любому из пп. 1-5, отличающаяся тем, что указанная молекула антитела содержит константный участок тяжелой цепи последовательности SEQ ID NO: 43 и/или константный участок легкой цепи последовательности SEQ ID NO: 44.
7. Молекула антитела по любому из пп. 1-6, отличающаяся тем, что указанная молекула антитела выбрана из группы, состоящей из полноразмерного антитела, химерного антитела, одноцепочечного антитела, Fab, Fv, scFv, Fab' и (Fab')2.
8. Молекула антитела по любому из пп. 1-7, которая связывается с CTLA-4 человека (hCTLA-4), и/или с CTLA-4 яванского макака (cmCTLA-4), и/или с CTLA-4 мыши (mCTLA-4).
9. Молекула антитела по любому из пп. 1-8, которая не связывается с CD28 человека.
10. Молекула антитела по любому из пп. 1-9, отличающаяся тем, что указанная молекула антитела выбрана из группы, состоящей из антитела IgG человека, гуманизированного антитела IgG и антитела IgG человеческого происхождения.
11. Молекула антитела по п. 10, отличающаяся тем, что указанная молекула антитела представляет собой антитело IgG1 человека.
12. Молекула антитела по любому из пп. 1-11, отличающаяся тем, что указанная молекула антитела представляет собой моноклональное антитело.
13. Изолированная нуклеиновая кислота, кодирующая молекулу антитела, как определено в любом из пп. 1-12, содержащая нуклеотидную последовательность, кодирующую аминокислотную последовательность указанного антитела.
14. Нуклеиновая кислота по п. 13, содержащая или состоящая из последовательности, выбранной из группы, состоящей из последовательностей SEQ ID 45-52.
15. Экспрессионная плазмида, содержащая нуклеиновую кислоту по п. 13 или 14, находящуюся под контролем подходящих регуляторных элементов для правильной экспрессии.
16. Вирус для экспрессии молекулы антитела, определенной в любом из пп. 1-12, содержащий нуклеиновую кислоту, определенную в п. 13 или 14, находящуюся под контролем подходящих регуляторных элементов для правильной экспрессии, или плазмиду, определенную в п. 15.
17. Вирус по п. 16, который представляет собой онколитический вирус и предпочтительно онколитический поксвирус.
18. Вирус по п. 17, отличающийся тем, что указанный онколитический поксвирус принадлежит к подсемейству Chordopoxviridae, более предпочтительно к роду Orthopoxvirus, предпочтительно выбранному из группы, состоящей из вируса осповакцины, коровьей оспы, вируса оспы канареек, вируса эктромелии и вируса миксомы.
19. Вирус по п. 18, отличающийся тем, что указанный онколитический вирус представляет собой вирус осповакцины, дефектный по активности как тимидинкиназы (TK), так и/или рибонуклеотидредуктазы (RR), и содержащий нуклеотидные последовательности, кодирующие последовательности SEQ ID NO: 20 и ID NO: 21 или последовательности SEQ ID NO: 53 и ID NO: 54.
20. Вирус по п. 19, отличающийся тем, что указанный онколитический вирус осповакцины дополнительно содержит нуклеотидную последовательность, кодирующую GM-CSF, с особым предпочтением GM-CSF человека, такого как GM-CSF, имеющего последовательность SEQ ID NO: 55 или последовательность SEQ ID NO: 56, или GM-CSF мыши, такого как GM-CSF, имеющий последовательность SEQ ID NO: 57 или последовательность SEQ ID NO: 58.
21. Вирус по любому из пп. 16-20, отличающийся тем, что содержит локус J2R и локус I4L, и кассета, кодирующая тяжелую цепь, вставляется в локус J2R, а кассета, кодирующая легкую цепь, вставляется в локус I4L.
22. Клетка для экспрессии молекулы антитела, определенной в любому из пп. 1-12, содержащая нуклеиновую кислоту, как определено в п. 13 или 14, находящуюся под контролем подходящих регуляторных элементов для правильной экспрессии, или плазмиду, как определено в п. 15, или вирус, как определено в любом из пп. 16-21.
23. Молекула антитела по любому из пп. 1-12, нуклеиновая кислота по п. 13 или 14, плазмида по п. 15, вирус по любому из пп. 16-21 или клетка по п. 22 для применения в медицине.
24. Молекула антитела по любому из пп. 1-12, нуклеиновая кислота по п. 13 или 14, плазмида по п. 15, вирус по любому из пп. 16-21 или клетка по п. 22 для применения при лечении рака.
25. Применение молекулы антитела по любому из пп. 1-12 для производства фармацевтической композиции для применения при лечении рака.
26. Применение нуклеиновой кислоты по п. 13 или 14 для производства фармацевтической композиции для применения при лечении рака.
27. Применение плазмиды по п. 15 для производства фармацевтической композиции для применения при лечении рака.
28. Применение вируса по любому из пп. 16-21 для производства фармацевтической композиции для применения при лечении рака.
29. Применение клетки по п. 22 для производства фармацевтической композиции для применения при лечении рака.
30. Фармацевтическая композиция для лечения рака у субъекта, содержащая эффективное количество молекулы антитела, как определено в любом из пп. 1-12, нуклеиновой кислоты по п. 13 или 14, плазмиды по п. 15, вируса по любому из пп. 16-21 или клетки по п. 22.
31. Фармацевтическая композиция по п. 30, дополнительно содержащая фармацевтически приемлемый разбавитель, носитель, наполнитель и/или наполнитель.
32. Способ лечения рака у субъекта, включающий введение субъекту терапевтически эффективного количества молекулы антитела, как определено в любом из пп. 1-12, нуклеиновой кислоты по п. 13 или 14, плазмиды по п. 15, вируса по любому из пп. 16-21, клетки по п. 22 или фармацевтической композиции по п. 30.
33. Молекула антитела для применения по п. 24, нуклеиновая кислота для применения по п. 24, плазмида для применения по п. 24, вирус для применения по п. 24, клетка для применения по п. 24, применение по любому из пп. 25-29, фармацевтическая композиция по п. 30 или 31 или способ по п. 32, где рак представляет собой солидный рак.
| WO2017106372 A1, 22.06.2017 | |||
| US2018037654 A1, 08.02.2018 | |||
| ANTONI RIBAS, Overcoming Immunologic Tolerance to Melanoma: Targeting CTLA-4 with Tremelimumab (CP-675,206), The Oncologist 2008;13(suppl 4):10-15 | |||
| КУЛИКОВ А.Ю | |||
| и др., Анализ относительной ценности применения лекарственного препарата ипилимумаб у пациентов с метастатической меланомой кожи, |
Авторы
Даты
2023-08-29—Публикация
2019-09-03—Подача