ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к областям растениеводства, селекции растений и сельского хозяйства. Конкретнее, оно относится к трансгенному объекту IND-00410-5 у сои, нуклеотидным последовательностям, растениям, частям растений, семенам, клеткам, сельскохозяйственным продуктам и способам обнаружения и получения, связанным с трансгенным объектом IND-00410-5 у сои.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Повышение урожайности сельскохозяйственных культур и их характеристик стало важным для удовлетворения спроса на продукты питания. Благодаря биотехнологическим разработкам и их сочетанию с сельским хозяйством были разработаны новые культуры, способные адаптироваться к разнообразным условиям окружающей среды и/или экологическим условиям.
Во время роста растения подвергаются различным абиотическим стрессам: засухе, засоленности и низким температурам, высоким температурам, чрезмерной радиации, низкой доступности питательных веществ, уплотнению почвы, препятствующему развитию корней, и т.д. (Duque et al., 2013; Sayed 2003). Все из них способны в какой-то момент повлиять на рост растений, а также на урожайность растений. Разумно предположить, что некоторые из этих факторов окружающей среды могут иметь место в течение жизненных циклов сельскохозяйственных культур на поле. В этом случае запускаются сложные механизмы ответа, которые будут отражаться в проводимых измерениях, поскольку они являются результатом интеграции таких стрессовых воздействий.
Один из обычно используемых методов смягчения негативных воздействий, которые окружающая среда может оказывать на сельскохозяйственные культуры, основан на трансгенных объектах, т.е. на встраивании представляющих интерес генов в геном целевой культуры. Однако получение и отбор коммерчески подходящего трансгенного объекта требует обширного исследования, анализа и характеристики большого количества отдельных объектов трансформации. Следовательно, можно отобрать объект, который имеет желаемый признак и, таким образом, развивает фенотипические и сельскохозяйственные характеристики, необходимые для применения в коммерческих целях, без отрицательного влияния на другие сельскохозяйственные характеристики. Таким образом, можно отобрать объект, который имеет желаемый признак и, следовательно, проявляет фенотипические и сельскохозяйственные характеристики, необходимые для применения в коммерческих целях, без влияния на другие характеристики сельскохозяйственных культур.
Этот процесс требует создания трансгенных объектов, которые будут охарактеризованы молекулярно и фенотипически для идентификации и отбора объекта, экспрессирующего представляющий интерес гетерологичный ген, в соответствии с получением желаемого фенотипа.
Отбор объекта подразумевает стадии лабораторной разработки, а также испытаний на поле и/или в теплице, в контролируемых условиях. Необходимо анализировать ответную реакцию на объекты на протяжении многих лет, во множестве местоположений и в ряде условий окружающей среды, чтобы иметь возможность отобрать объект, который соответствует требуемым фенотипическим и генетическим характеристикам, а также коммерческим целям.
Настоящим изобретением обеспечивается такой коммерчески приемлемый тип объекта, который дает возможность для новых преимущественных признаков у сои.
Существует широкий ряд генов, которые могут использоваться при разработке объектов, представляющих коммерческий интерес. Среди них на рынке имеются растения сои, экспрессирующие гены, устойчивые к гербицидам, или гены, кодирующие инсектицидные белки, и т.д. Геном, экспрессия которого представляет интерес, является ген, кодирующий фактор транскрипции HAHB4.
HAHB4 (Helianthus annuus homeobox-4, гомеобокс-4 Helianthus annuus) является фактором транскрипции подсолнечника, относящимся к семейству HD-Zip. Экспрессия гена HaHB4 регулируется на транскрипционном уровне факторами внешней среды, такими как доступность воды и соленость почвы, а также фитогормонами, связанными с ним, абсцизовой кислотой и этиленом.
В патенте AR81216B2 раскрывается ген HaHB4, индуцируемый недостатком воды и абсцизовой кислоты, который кодирует фактор транскрипции типа HD-Zip у подсолнечника. В указанном патенте раскрывается выделение и характеристика гена, а также его введение в модельное растение Arabidopsis thaliana. Однако ни трансгенные растения, несущие этот объект, представляющий коммерческий интерес по настоящему изобретению, не становятся общедоступными, ни их преимущественных свойства, связанные с абиотическими стрессами, не развивались одновременно в сельскохозяйственных условиях.
Также в патенте AR81216B2 нет упоминания о конкретном отборе объекта, экспрессирующего ген HaHB4, для сохранения основного представляющего интерес признака, т.е. засухоустойчивости, без влияния на другие сельскохозяйственные возможности.
Кроме того, в заявке AR090110A1 раскрывается модифицированный ген HaHB4, в частности HaHB4.2, индуцируемый недостатком воды и абсцизовой кислоты, кодирующий модифицированный фактор транскрипции типа HD-Zip у подсолнечника, конкретно mod1HaHB4. В указанной публикации раскрывается создание и характеристика конструкций для экспрессии модифицированного HaHB4.2 и их введение в модельное растение Arabidopsis thaliana. Кроме того, в этой публикации раскрывается в общих чертах создание и отбор трансгенных объектов сои, пшеницы и кукурузы, содержащих ген HaHB4.2.
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Настоящим изобретением обеспечиваются устойчивые к абиотическому стрессу растения сои, содержащие объект IND-00410-5. Указанные растения обладают преимуществами в отношении роста в неблагоприятных условиях окружающей среды, что позволяет получить более высокую урожайность.
Конкретнее, настоящее изобретение относится к объекту сои, разработанному как IND-00410-5, имеющему репрезентативные семена, депонированные в Американской коллекции типовых культур (АТСС) с номером доступа PTA-125535, и свое потомство.
Настоящее изобретение также включает растения сои, содержащие объект IND-00410-5, представленный SEQ ID NO:1.
Трансгенная вставка, присутствующая в объекте по настоящему изобретению и в зарегистрированных семенах, включает следующие гены: единичную копию гена селектируемого маркера bar и единичную копию гена, придающего устойчивость к абиотическому стрессу HaHB4. Ген bar, происходящий из Streptomyces hygroscopicus, кодирует белок PAT (фосфинотрицин-ацетилтрансферазу). Ген HaHB4 происходит из растения подсолнечника, sp. Helianthus annuus, и кодирует белок типа HD-Zip I, имеющий белковый домен типа гомеодомена, связанный с лейциновой молнией, придающий устойчивость к абиотическому стрессу, в основном к засухе. Регуляция представляющих интерес генов может управляться различными промоторными последовательностями с разными уровнями экспрессии, чувствительностью и тканеспецифичностью. Специалистам в данной области известно, что любой промотор или терминатор нуклеиновой кислоты, управляющий или регулирующий экспрессию представляющего интерес гена, может использоваться без изменения сущности настоящего изобретения. Конкретно, объект, разработанный в настоящем изобретении, содержит частичную дупликацию промотора вируса мозаики цветной капусты (CaMV) 35S, вариант 2×35ScaMV, и терминатор vsp для гена bar, придающего устойчивость к гербициду глюфосинату аммония. Кроме того, этот объект включает вариант промотора гена HaHB4 наибольшей длины (LPF) и терминатор nos для регуляции экспрессии кодирующей HaHB4 области (фиг. 1).
Другие аспекты настоящего изобретения включают потомство растений сои, семена и/или возобновляемые части растений, семена и потомство, содержащее объект IND-00410-5 у сои, а также продукты питания для потребления человеком или животными, полученные из них. Настоящее изобретение также включает части растений, содержащие объект IND-00410-5, в том числе, без ограничения, пыльцу, семяпочки, цветы, побеги, корни, листья, вегетативные ядра клеток и другие клетки растений, содержащие объект IND-00410-5. Настоящее изобретение также относится к растениям сои, содержащим объект IND-00410-5 у сои, обладающим устойчивостью к множеству абиотических стрессов: засухе, засоленности, низким и высоким температурам, избытку радиации, низкой доступности питательных веществ, уплотнению почвы и т.д., а также их комбинациям.
Настоящее изобретение частично относится к выращиванию растений, устойчивых к абиотическим стрессам. Оно также включает новый объект трансформации растений сои, включающий описанный здесь полинуклеотид, вставленный в конкретный сайт в геноме сои, который обеспечивает специфические генетические и фенотипические характеристики.
В некоторых вариантах осуществления указанный объект/полинуклеотид может быть «объединен» с другими признаками, включающими, например, агрономические признаки и устойчивость к гербицидам и/или насекомым. Однако настоящее изобретение включает растения, содержащие индивидуальный объект, описанный здесь.
Дополнительные признаки могут быть объединены в геноме растения или в том же локусе, что и объект IND-00410-5, например, посредством скрещивания растений, ретрансформации трансгенного растения, содержащего объект IND-00410-5, или добавления новых признаков посредством интеграции под управлением гомологичной рекомбинацией.
В одном варианте осуществления настоящее изобретение охватывает сайт в хромосоме сои, расположенный в хромосоме 9. В некоторых вариантах осуществления целевой сайт включает гетерологичную нуклеиновую кислоту. Сайт в хромосоме сои расположен между фланкирующими последовательностями, представленными в SEQ ID NO:2 и SEQ ID NO:3.
В одном варианте осуществления настоящее изобретение охватывает способ получения трансгенных растений сои, включающий вставку гетерологичной нуклеиновой кислоты в конкретное положение в хромосоме 9.
В частности, способ включает трансформацию в стабильную форму клетки или клеточной культуры последовательностями ДНК SEQ ID NO:43 и регенерацию клетки, дающей начало новому целому растению.
Трансформация указанной клетки растения может выполняться различными методами, или физическими, вирусными, химическими, в том числе: с использованием биобаллистики, электропорации, бактериальной трансформация, или их комбинацией. Все эти методы хорошо известны специалисту в данной области техники.
В настоящем изобретении также представлен микроорганизм, содержащий молекулу нуклеиновой кислоты, имеющую нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO:4.
В частности, в настоящем изобретении используется Agrobacterium tumefaciens, трансформированная молекулой ДНК с SEQ ID NO:43, точнее трансформированная плазмидой pIND2-HB4 (фиг. 1).
Кроме того, настоящим изобретением обеспечиваются тесты для обнаружения присутствия настоящего объекта в образце сои. Тесты могут быть основаны на последовательности ДНК рекомбинантной конструкции, вставленной в геном сои, и на геномных последовательностях, фланкирующих сайт вставки. Также обеспечиваются наборы и условия, применимые для тестирования.
Таким образом, настоящее изобретение частично относится к клонированию и анализу последовательностей ДНК всей вставки или ее части и фланкирующих районов (в трансгенных линиях сои). Эти последовательности являются уникальными. Специфические для объекта праймеры могут быть созданы на основе этих вставок и фланкирующих (и обеспечивающих слияние) районов. Метод ПЦР показал, что эти объекты можно идентифицировать посредством анализа ампликонов, получаемых с использованием этих наборов специфических для объекта праймеров. Следовательно, эти и другие связанные процедуры могут использоваться для однозначной идентификации линий сои, содержащих объект по настоящему изобретению.
Настоящее изобретение также частично относится к анализам с помощью ПЦР, среди прочего: количественной ПЦР (кПЦР) в реальном времени или ПЦР с анализом по конечной точке для обнаружения объекта IND-∅∅41∅-5, ампликонов и их фрагментов.
В настоящем изобретении также представлены молекулы ДНК, включающие достаточную часть непрерывной нуклеотидной последовательности SEQ ID NO:4, чтобы работать в качестве ДНК-зонда, гибридизирующегося в жестких условиях с молекулой ДНК, содержащей нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO:1, и не гибридизирующегося в жестких условиях с молекулой ДНК, не включающей нуклеотидную последовательность, выбранную из группы, состоящей из SEQ ID NO:1.
В некоторых объектах используемые зонды могут быть помечены молекулами, которые испускают детектируемый сигнал. Примером таких молекул являются флюорохромы, т.е. олигонуклеотиды, представляющие флуорохромы на обоих концах и имеющие последовательность, комплементарную части фрагмента ДНК, подлежащего амплификации. Неограничивающими примерами являются красители FAM, TET, HEX, JOE, CAL Fluor®, Quasar® и Pulsar®.
В настоящем изобретении также раскрывается пара молекул ДНК, состоящая из первой молекулы ДНК и второй молекулы ДНК, отличной от первой молекулы ДНК, причем каждая из первой и второй молекул ДНК включает достаточную часть следующих друг за другом нуклеотидов SEQ ID NO:1, чтобы работать в качестве ДНК-зондов ДНК, если используются в реакции амплификации вместе с ДНК, происходящей из объекта IND-00410-5, для получения ДНК-ампликона, диагностического для трансгенного объекта IND-00410-5 у сои в образце.
В настоящем изобретении также описывается способ обнаружения присутствия ДНК, полученной от объекта IND-00410-5, в образце, при этом указанный способ включает совмещение образца с молекулами ДНК, используемыми в качестве зонда и праймеров, подвергания их одинаковым жестким условиям гибридизации, и обнаружение гибридизации ДНК-зонда с ДНК в образце, амплифицированном с использованием специфических праймеров, причем указанная гибридизация указывает на присутствие ДНК, происходящей из трансгенного объекта IND-00410-5 сои, в указанном образце.
В настоящем изобретении, кроме того, представлен способ обнаружения присутствия молекулы ДНК, полученной из трансгенного объекта IND-00410-5 сои, в образце, путем совмещения препарата ДНК, полученного из указанного образца, с парой олигонуклеотидов, используемых в качестве праймеров, для проведения реакции амплификации, достаточной для получения ДНК-ампликона, включающего последовательность, выбранную из группы, состоящей из SEQ ID NO:1, и обнаружения присутствия ДНК-ампликона в реакции, причем присутствие ДНК-ампликона в реакции указывает на присутствие молекулы ДНК, происходящей из IND-00410-5, в указанном образце.
В настоящем изобретении также представлен набор для обнаружения ДНК, содержащий по крайней мере одну молекулу ДНК с достаточным количеством следующих друг за другом нуклеотидов SEQ ID NO:1, чтобы работать в качестве праймера или специфического ДНК-зонда для обнаружения присутствия ДНК, происходящей из трансгенного объекта IND-00410-5 сои, причем обнаружение ДНК является диагностическим признаком присутствия трансгенного объекта IND-00410-5 у сои в образце.
В настоящем изобретении представлено, кроме того, растение, семя, клетка или часть указанного растения сои, содержащее(ая) молекулу нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO:1. В настоящем изобретении представлено, кроме того, растение, семя, клетка или часть растения сои, устойчивое(ая) к абиотическим стрессам. В настоящем изобретении представлено, кроме того, растение, семя, клетка или части растения сои, геном которого(ой) дает ампликон, включающий молекулу ДНК, выбранную из группы, состоящей из SEQ ID NO:1, при тестировании с помощью метода амплификации ДНК.
В настоящем изобретении представлено, кроме того, растение или семя сои, причем это растение или семя сои создано в результате трансгенного объекта IND-00410-5 у сои, и/или является гибридным или гетерозиготным, имеющим по крайней мере одного родителя, полученного в результате трансгенного объекта IND-00410-5 у сои.
В настоящем изобретении представлен, кроме того, неживой растительный материал, содержащий рекомбинантную молекулу ДНК, выбранную из группы, состоящей из SEQ ID NO:1.
В настоящем изобретении представлен, кроме того, продукт потребления, полученный в результате трансгенного объекта IND-00410-5 у сои, и содержащий молекулу нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO:1, причем обнаружение нуклеотидной последовательности в образце, полученном из продукта потребления, определяет, что продукт потребления происходит из трансгенного объекта IND-00410-5 сои.
В настоящем изобретении представлен, кроме того, продукт потребления, выбранный из группы, состоящей из цельных или переработанных семян, масла, муки грубого помола, муки, хлопьев, биодизеля, биогаза или других биоматериалов и т.д. В настоящем изобретении представлен, кроме того, способ производства продукта потребления путем получения растение сои или его части, содержащего трансгенный объект IND-00410-5 у сои, и производства соевого продукта потребления из указанного растения сои или его части.
В настоящем изобретении представлен способ получения растения сои, устойчивого к абиотическим стрессам, путем скрещивания растения с трансгенным объектом IND-00410-5 сои, содержащим молекулу нуклеиновой кислоты, выбранную из группы, состоящей из SEQ ID NO:1, со вторым растением сои, тем самым получая семена, сбора семян, полученных в результате скрещивания, выращивания семян для получения множества растений-потомков и отбора растения-потомка, устойчивого к абиотическим стрессам.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг. 1. Карта плазмиды pIND2-HB4. a) Бинарная векторная плазмида с Т-ДНК. Фрагменты, полученные в результате расщепления Ndel, обозначены синими стрелками влево-вправо вместе с их размерами. LB, левая граница; RB, правая граница. Зонды представлены желтыми толстыми стрелками влево-вправо. b) Детализированная часть Т-ДНК плазмиды pIND2-HB4. Фрагменты расщеплениями HindIII представлены черными стрелками вместе с их минимальными соответствующими размерами для LB и RB, соответственно. Фрагменты расщепления Ndel выделены синим цветом. Ожидаемый размер фрагмента внутреннего расщепления Ndel составлял 2703 п.о.
Фиг. 2. Конструкции для трансформации и уровни экспрессии объектов с HB4. A - Генетическое описание регуляторных элементов в трех различных плазмидах (a, b и c), используемых для получения трансгенных объектов (pIND1:HB4=a), (pIND2:HB4=b) и (pIND3:HB4=c). B - уровни относительной экспрессии генов Hahb-4 и bar. Относительные значения относятся к контрольной обработке водой.
Фиг. 3. Устойчивость к водному стрессу в контролируемых условиях. A - Репрезентативные растения после периода отсутствия воды на стадиях развития V2, R2 и R4. B - Степень восстановления как число растений без симптомов увядания после периода восстановления подачи воды от общего числа растений, использованных в эксперименте. C - Потеря воды, измеряемая с 1-часовыми интервалами в течение 10 часов, из отщепленных листьев каждого трансгенного объекта и нетрансгенного контроля.
Фиг. 4. Чувствительность к этилену и воздействие темноты. A - Фенотип «оставаться зелеными» у листьев после воздействия этефона и темноты. Также показан фенотип «оставаться зелеными» у листьев, обработанных водой, в качестве отрицательного контроля. B - Подсемядольное колено как часть тройной ответной реакции на этилен при пяти концентрациях этефона. C - спектры поглощения в ультрафиолетовой/видимой области в объекте листьев, представленных в A. Связанные с фотосинтезом каротиноиды (пик при 480 нм) и фотосинтетические пигменты хлорофилл A и B (пики при 665 нм и 649 нм, соответственно) для каждого генотипа. Зеленые линии соответствуют образцам, отобранным после обработки водой, а красные линии соответствуют образцам, отобранным после воздействия этилена/темноты. D - Количественная оценка проростков с образованием подсемядольного колена в 25 мкМ растворе этефона.
Фиг. 5. Различия в урожайности и компонентах урожайности по экологическому показателю для 4 независимых трансгенных объекта. Различия (%) в урожайности семян (a), количестве семян (b) и размере семян (c) между трансгенными объектами и нетрансгенным контролем в условиях низкой (L<2500 кг га-1), средней (M=500-3500 кг га-1) и высокой (H>3500 кг га-1) урожайности. Звездочки указывают на статистически значимые различия при p<0,05 для средних значений.
Фиг. 6. Различия в урожайности и компонентах урожайности по экологическому показателю для отобранного объекта (b1). Различия (%) в урожайности семян (a), количестве семян (b) и размере семян (c) между трансгенным объектом b1 и нетрансгенным контролем в условиях низкой (L<2500 кг га-1), средней (M=2500-3500 кг га-1) и высокой (H>3500 кг га-1) урожайности. Звездочки указывают на статистически значимые различия при p<0,05 для средних значений.
Фиг. 7. Диаграмма Венна для дифференциально экспрессируемых генов. A - Количество дифференциально экспрессируемых генов при сравнении режима водного стресса с режимом хорошего полива для трансгенного объекта b1 и нетрансгенного контрольного генотипа.
Фиг. 8. Сравнение обогащения с использованием генной онтологии (GO) у дифференциально экспресируемых (DE) генов. Результаты обобщены для биологического процесса, клеточного компонента и молекулярной функции. Ось Y указывает категории генной онтологии; ось абсцисс указывает число DE генов.
Фиг. 9. Саузерн-блоты ДНК содержащего IND-00410-5 растения T5, расщепленной HindIII и Ndel. Блоты гибридизировали с зондами, меченными DIG, для a) обнаружения HaHB4 и b) bar, соответственно. Полосы ДНК в гидролизате IND-00410-5, гибридизирующиеся с указанными зондами, выделены белыми рамками. В качестве положительных контролей использовали Williams 82+200 пг плазмидной ДНК и 100 пг плазмидной ДНК. Размеры лестничных полос маркера VII, меченного DIG, указаны слева от блотов в т.п.о.
Фиг. 10. Анализ последовательности стыка у объекта IND-00410-5. Вертикальная линия при совмещении последовательностей указывает стык между Т-ДНК и хромосомой сои. Столбцы слева направо: название вектора, положение JS в векторе, количество считываний, подтверждающих JS, наименование считывания и частичная последовательность. Последняя строка, четвертый столбец в каждом JS, указывает элемент, с которого начинается JS. Сайт и структура вставки были подтверждены путем сборки данных об исходных последовательностях de novo, используя программы-ассемблеры Velvet (последовательности совмещали с учетом только последних 30 оснований вставки Т-ДНК; все считывания, полученные с помощью технологии Illumina, имели длину 101 п.о.).
Фиг. 11. Схематическое изображение локуса вставки IND-00410-5 и нативной аллели. A) Схема вставки у IND-00410-5, демонстрирующая элементы, присутствующие в Т-ДНК, и праймеры, используемые для анализа сегрегации у растений F2. Меченые праймеры 868 и 752 использовали для анализа на наличие стыка у левой границы. B) Схема нативной аллели, демонстрирующая элементы, присутствующие в области вставки (без Т-ДНК), и праймеры, используемые для ПЦР-теста на сегрегацию у растений F2. Праймеры 934 и 935 использовали для анализа присутствия нативной аллели. Gm: Glycine max, Chr9: хромосома 9, UTR: нетранслируемый район, CDS: кодирующая последовательность.
Фиг. 12. Схематическое изображение вставки в IND-00410-5. На схеме показаны 4 системы обнаружения разных элементов вставки у объекта IND-00410-5. Три из них соответствуют системам обнаружения TaqMan (HaHB4, bar и фланг к RB), в то время как одна соответствует системе ПЦР с анализом по конечной точке (фланг к LB).
Фиг. 13. Урожайность трансгенного объекта и контроля для 16 оцененных местоположений. Красные кружки обозначают местоположения, в которых трансгенный объект характеризовался большей урожайностью, чем контроль, а желтые кружки представляют местоположения, в которых указанный объект характеризовался меньшей урожайностью, чем контроль.
КРАТКОЕ ОПИСАНИЕ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
SEQ ID NO:1 - последовательность ДНК, соответствующая вставке и прилегающим областям генома.
SEQ ID NO:2 - последовательность ДНК, соответствующая правой фланкирующей последовательности.
SEQ ID NO:3 - последовательность ДНК, соответствующая левой фланкирующей последовательности.
SEQ ID NO:4 - последовательность ДНК, соответствующая вставке.
SEQ ID NO:5 - последовательность ДНК, соответствующая праймеру 750.
SEQ ID NO:6 - последовательность ДНК, соответствующая праймеру 751.
SEQ ID NO:7 - последовательность ДНК, соответствующая праймеру 752.
SEQ ID NO:8 - последовательность ДНК, соответствующая праймеру 753.
SEQ ID NO:9 - последовательность ДНК, соответствующая праймеру 754.
SEQ ID NO:10 - последовательность ДНК, соответствующая праймеру 755.
SEQ ID NO:11 - последовательность ДНК, соответствующая праймеру 756.
SEQ ID NO:12 - последовательность ДНК, соответствующая праймеру 757.
SEQ ID NO:13 - последовательность ДНК, соответствующая праймеру 758.
SEQ ID NO:14 - последовательность ДНК, соответствующая праймеру 759.
SEQ ID NO:15 - последовательность ДНК, соответствующая праймеру 760.
SEQ ID NO:16 - последовательность ДНК, соответствующая праймеру 2527.
SEQ ID NO:17 - последовательность ДНК, соответствующая праймеру 203.
SEQ ID NO:18 - последовательность ДНК, соответствующая праймеру 378.
SEQ ID NO:19 - последовательность ДНК, соответствующая праймеру 1970.
SEQ ID NO:20 - последовательность ДНК, соответствующая праймеру 1747.
SEQ ID NO:21 - последовательность ДНК, соответствующая к праймеру 1748.
SEQ ID NO:22 - последовательность ДНК, соответствующая праймеру 1745.
SEQ ID NO:23 - последовательность ДНК, соответствующая праймеру 1746.
SEQ ID NO:24 - последовательность ДНК, соответствующая праймеру 822.
SEQ ID NO:25 - последовательность ДНК, соответствующая праймеру 1127.
SEQ ID NO:26 - последовательность ДНК, соответствующая праймеру 817.
SEQ ID NO:27 - последовательность ДНК, соответствующий праймеру 818.
SEQ ID NO:28 - последовательности ДНК, соответствующего зонду 819.
SEQ ID NO:29 - последовательности ДНК, соответствующая праймеру 868.
SEQ ID NO:30 - последовательность ДНК, соответствующая праймеру 752.
SEQ ID NO:31 - последовательность ДНК, соответствующая праймеру 530.
SEQ ID NO:32 - последовательность ДНК, соответствующая праймеру 531.
SEQ ID NO:33 - последовательность ДНК, соответствующая зонду 532.
SEQ ID NO:34 - последовательность ДНК, соответствующая праймеру 527.
SEQ ID NO:35 - последовательность ДНК, соответствующая праймеру 528.
SEQ ID NO:36 - последовательность ДНК, соответствующая зонду 529.
SEQ ID NO:37 - последовательность ДНК, соответствующая праймеру 718.
SEQ ID NO:38 - последовательность ДНК, соответствующая праймеру 719.
SEQ ID NO:39 - последовательность ДНК, соответствующая зонду 720.
SEQ ID NO:40 - последовательность ДНК, соответствующая праймеру 934.
SEQ ID NO:41 - последовательность ДНК, соответствующая праймеру 935.
SEQ ID NO:42 - последовательность ДНК, соответствующая зонду 936.
SEQ ID NO:43 - последовательность ДНК, соответствующая плазмиде pIND2-HB4.
ПОДРОБНОЕ ОПИСАНИЕ НАСТОЯЩЕГО ИЗОБРЕТЕНИЯ
Следующие определения и способы представлены, чтобы лучше определить настоящее изобретение и дать возможность специалистам в данной области техники применить настоящее изобретение на практике. Если не указано иное, термины должны толковаться в соответствии с общепринятым использованием специалистами в соответствующей области техники.
ПРИМЕРЫ
Пример 1. Конструирование плазмиды pIND2-HB4
Плазмида pIND2-HB4, которая впоследствии будет использоваться для трансформации растений сои, происходит из семейства бинарных плазмид pPZP, в частности, основана на серии pPZP200.
Трансгенная вставка и кассета для экспрессии IND-00410-5 содержат 2Х промотор 35S вируса мозаики цветной капусты (CaMV) и терминатор vsp для гена-маркера bar. Дополнительно они содержат промотор гена HaHB4 подсолнечника (большой фрагмент промотора, LPF) и терминатор nos для гена HaHB4. Полученная плазмида, pIND2-HB4, схематически представлена на фиг. 1.
Пример 2: Трансформация растений сои и отбор объекта IND-00410-5
Клетку сои можно трансформировать различными способами. Конкретно, использовали штамм EHA 101 Agrobacterium tumefaciens (Hood et al., 1986), обезвреженный, трансформированный бинарной плазмидой, содержащей НаНВ4 и bar в области Т-ДНК (ДНК переноса). Трансформацию выполняли, используя модификацию способа, описанного Paz et al. (2004). Вкратце, семена сои (Glycine max, сорт Williams 82) предварительно проращивали в минимальной среде в темноте. Семядольные узлы выделяли из полузрелых семян, инфицированных Agrobacterium. В течение 5-7 дней эксплантаты культивировали в темноте со штаммом Agrobacterium. Среда для зарождения, удлинения и укоренения побегов была дополнена цефоксатимом, тиментином и ванкомицином для ингибирования чрезмерного роста Agrobacterium. Отбирали побеги, трансформированные с использованием глюфосината аммония (который ингибирует развитие побегов, не экспрессирующих PAT). Регенерированные эксплантаты выдерживали при 24°C в течение двух/трех недель под белым флуоресцентным светом и с фотопериодическим освещением 16:8. Во время стимулирования побегов эксплантаты несколько раз пересаживали в селективную среду для стимулирования побегов (SISM), содержащую минимальную среду Гамборга (макронутриенты B5 1X, микронутриенты B5 1X, витамины B5 1X, железо 28 мг/л, NaEDTA 38 мг/л), сахарозу 30 г/л, MES 0,59 г/л и агар типа A 7 г/л, pH 5,7. После автоклавирования среды добавляли подвергнутую фильтрации и стерилизации среду, BAP (2 мг/л), IBA (0,2 мг/л), тиментин (50 мг/л), цефотаксим (100 мг/л) и ванкомицин (50 мг/л), и селективный агент. Как только становились видны листья, их стебли срезали и переносили в среду, селективную для удлинения побегов (SESM). Удлиненные побеги (два узла) переносили в полутвердую среду для укоренения (RM: минимальная среда, модифицированная с использованием витаминов Гамборга MS ½ X (макронутриенты MS ½ X, микронутриенты MS ½ X, витамины B5 ½ X, железо 28 мг/л, NaEDTA 38 мг/л), сахарозы 20 г/л, MES 0,59 г/л и агара типа A 7 г/л, pH 5,6). После автоклавирования среды добавляли подвергнутую фильтрации и стерилизации индол-3-масляную кислоту (IBA, 2 мг/л) и селективный агент. Укоренившиеся растения с нормальными фенотипическими характеристиками переносили на делянки, содержащие субстратную смесь для акклиматизации проростков, стимулируя их рост для дальнейшего анализа.
Таблица 1. Состав микронутриентов и макронутриентов в минимальной среде Гамборга B5
Регенерация растений и отбор объекта
I) Стерилизация семян:
Семена промывали в разбавленном растворе водного детергента в течение 5 минут, а затем промывали 6 раз стерилизованной дистиллированной водой. Затем семена промывали спиртом (70% этанолом) в течение одной-двух минут с периодическим встряхиванием. После отстаивания этанольного раствора семена помещали в колпак-эксикатор с крышкой со штоком для дезинфекции газообразным хлором. После газовой дезинфекции семена замачивали в дистиллированной воде на 12 часов, чтобы смягчить их наружные покровы.
II) Проращивание семян:
Семена очищали от кожуры и помещали в среду для проращивания (GM: минимальная среда Murashige & Skoog с солями и витаминами, сахароза 30 г/л и агар типа A 7 г/л, pH 5,8) на период времени, составляющий приблизительно 72-96 часов, в темноте до радиального удлинения. После периода предварительного проращивания извлекали корни и гипокотили. Адаксиальный эпидермис частично удаляли механически с обеих семядолей для увеличения контакта инокулята с клетками эксплантата, повышая эффективность инфицирования Agrobacterium tumefaciens.
III) Процессы трансформации
а) Эксплантаты, непосредственно сокультивируемые с Agrobacterium tumefaciens при инфильтрации.
Предварительно пророщенные семена приводили в контакт со средой для инфицирования посредством вакуумной инфильтрации (VMM: минимальная среда Гамборга B5 1/10X (макронутриенты B5 1/10X, микронутриенты B5 1/10X, витамины B5 1/10X, железо 2,8 мг/л, NaEDTA 3,8 мг/л), сахароза 30 г/л, MES 3,9 г/л, pH 5,4. После автоклавирования к этой среде среду, подвергнутую фильтрованию и стерилизации, GA3 (0,25 мг/л), BAP (2 мг/л), Silwet L- 77 (0,03%) и 40 мг/л ацетосирингона), содержащую бактериальную суспензию, (прямое сокультивирование). Вакуум доводили до 450 мм. Р.ст. Эксплантаты выдерживали в условиях вакуума в течение 5-7 минут. Этот процесс повторяли дважды.
b) Рассечение семян и их непрямое сокультивирование с трансформированной Agrobacterium tumefaciens.
После процессов инфильтрации семян семена сушили с помощью стерильной фильтровальной бумаги и помещали на стерильную плоскую поверхность (пустую чашку) для рассечения. Семядоли разламывали по отдельности с помощью острого стерильного скальпеля, и удаляли почечку зародыша с зачаточными листьями.
c) Эксплантаты, подвергаемые непрямому сокультивированию.
Дополнительную обработку, включающую дегидратацию/регидратацию эксплантатов половин семян, включали для облегчения инфицирования бактериями. Потерю тургора вызывали у эксплантатов половин семян, рассеченных в ламинарном вытяжном шкафу, в течение 30 минут. Затем эксплантаты регидратировали в среде для инфицирования (IM: минимальная среда Гамборга B5 1/10 X (макронутриенты B5 1/10X, микронутриенты B5 1/10X, витамины B5 1/10X, железо 2,8 мг/л, NaEDTA 3,8 мг/л), сахароза 30 г/л, MES 3,9 г/л, pH 5,4. После автоклавирования к этой среде добавляли среду, подвергнутую фильтрованию и стерилизации, GA3 (0,25 мг/л), BAP (2 мг/л) и 40 мг/л ацетосирингона)), содержащую суспензию Agrobacterium (ОП=0,7), при 24°C на 30 минут. Эксплантаты сушили с помощью стерильной бумаги и немедленно переносили в среду для сокультивирования (CCM: минимальная среда Гамборга B5 1/10 X (макронутриенты B5 1/10X, микронутриенты B5 1/10X, витамины B5 1/10X, железо 2,8 мг/л, NaEDTA 3,8 мг/л), сахароза 30 г/л, MES 3,9 г/л и агар типа A 4,25 г/л, pH 5,4. После автоклавирования среду, подвергнутую фильтрованию и стерилизации, GA3 (0,25 мг/л), BAP (2 мг/л), цистеин (400 мг/л), дитиотреитол (154,2 мг/л) и 40 мг/л ацетосирингона), добавляли к этой среде на 5-7 дней в темноте при 24°C.
d) Промывание
Эксплантаты осторожно помещали в стерильную воду на 10 минут для удаления приставших к ним бактерий, а затем сушили с использованием стерильного бумажного фильтра. Затем эксплантаты погружали в среду для промывки и стимуляции побегов (SIWM: минимальная среда Гамборга B5 1X (макронутриенты B5 1X, микронутриенты B5 1X, витамины B5 1X, железо 28 мг/л, NaEDTA 38 мг/л), сахароза 30 г/л, MES 0,59 г/л, pH 5,7. После автоклавирования добавляли среду, подвергнутую фильтрованию и стерилизации, BAP (1 мг/л), TDZ (0,1 мг/л), IBA (0,2 мг/л), тиментин (100 мг/л), цефотаксим (100 мг/л) и ванкомицин (50 мг/л) (25 эксплантатов в каждый сосуд). Промывание продолжалось в течение 6-12 часов при непрерывном перемешивании (100 об/мин) при 24°C, с фотопериодическим освещением 16:8.
e) Отбор и регенерация трансформированных эксплантатов
Эксплантаты переносили в селективную среду для стимулирования побегов (SISM) и выдерживали при 24°C в течение двух недель под белым флуоресцентным светом и с использованием фотопериодического освещения 16:8. Их размещали адаксиальной стороной вверх на поверхности селективной среды. Чашки Петри (100×25 мм) использовали для процесса отбора и регенерации. Каждые две недели эксплантаты субкультивировали в свежей среде SISM, дополненной фитогормонами и антибиотиками. Когда появлялись листья, стебли удаляли и переносили в чашки с селективной средой для удлинения побегов (SESM: минимальная среда Гамборга, модифицированная витаминами MS 1X (макронутриенты MS 1X, микронутриенты MS 1 X, витамины B5 1X, железо 28 мг/л, NaEDTA 38 мг/л), сахароза 30 г/л, MES 0,59 г/л и агар типа A 7 г/л, pH 5,7. После автоклавирования к этой среды добавляли аспарагин (50 мг/л), L-пироглутаминовую кислоту (100 мг/л), IAA (0,1 мг/л), GA3 (0,5 мг/л), зеатин-R (1 мг/л), IBA (0,2 мг/л), тиментин (50 мг/л), цефотаксим (100 мг/л), ванкомицин (50 мг/л)
f) Укоренение трансгенных побегов
Удлиненные побеги (два узла) переносили в культуральные колбы (1 растение/колбу 250×25 мм), содержащие полутвердую среду для укоренения (RM). Затем трансгенные растения переносили на делянки в среду, в которой созданы условия для выращивания, чтобы вызвать больший отбор и представить их фенотипические и молекулярные характеристики.
Селекцию осуществляя на основе наличия «дикого» фенотипа в нормальных условиях выращивания и большей устойчивости к экологическому стрессу, выражаемой в большей продуктивности в сельскохозяйственных зонах с менее благоприятными для выращивания условиями.
Предварительный отбор объектов
Трансгенные объекты сои были созданы в соответствии с Agrobacterium-опосредованным протоколом у сорта Williams 82. Семена Т1 были получены для 35 независимых объектов, используя три различные кассеты и стратегии для экспрессии. Первое размножение проводили в теплице, и десять индивидуумов T1, происходящих от каждого объекта, были отобраны для проверки на менделеевскую сегрегацию (менделевское расщепление) с помощью ПЦР-определения. После этого анализа линии с неменделевским расщеплением были отброшены. Были засеяны линии, полученные в результате самоопыления индивидуальных растений из отобранных объектов (менделевское расщепление 3:1 в T1). Нетипичные фенотипы с проблемами идентифицировали на протяжении всего вегетационного периода и отбрасывали. На вегетативных стадиях образцы растений отбирали для анализа с помощью ПЦР для идентификации гомозиготных линий. Увеличение посевного материала (семян Т3) гомозиготных и нулевых линий проводили в теплице.
Для продолжения отбора объектов пятнадцать отобранных HB4-трансгенных объектов сои и контрольные линии оценивали в полевых условиях. Применяли два уровня (низкий и высокий) режима полива. В объекте низкого уровня режима полива подачу воды приостанавливали на стадий развития сои с R1 по R6. Следовательно, этот режим состоял всего из двух поливов, одного в начале сезона, а другого в конце.
Линии, гомозиготные по трансгенным объектами в пределах одной конструкции или между конструкциями, и в пределах одной и той же линии, характеризовались большей урожайностью, чем нетрансгенные линии. Существовали значимые различия в урожайности между трансгенными и нетрансгенными линиями для двух индуцибельных трансгенных объектов, одного (b) (pIND2:HB4) и одного (c) (pIND3:HB4), в пределах одной и той же линии. Кроме того, два конститутивных (а) (pIND1:HB4) трансгенных объекта характеризовались большей урожайностью, чем их нетрансгенные аналоги. Эти четыре объекта были отобраны с целью продолжения более глубокой характеристику, которая позволила бы выбрать объект.
Трансгенные объекты сои и генетические конструкции
Генотип сои сорта Williams 82 использовали для трансформации штаммом EHA101 Agrobacterium tumefaciens. Векторы для трансформации состояли из бинарных плазмид - производных серии pPZP200 (Hajdukiewicz et al., 1994). Ген bar из Streptomyces hygroscopicus, присутствующий в плазмидах, использовали в качестве селектируемого маркера (Thompson et al., 1987). Для оценки эффекта различных уровней экспрессии на рост и устойчивость в качестве ответной реакции, для экспрессии Hahb-4 использовали три разных промотора. Конститутивная экспрессия фактора транскрипции Hahb-4 была достигнута с использованием промотора 35s мозаики цветной капусты (CaMV), а индуцируемая экспрессия была достигнута с использованием двух различных областей промотора Hahb-4. Разница между индуцибельными промоторами заключается в присутствии или отсутствии интрона COX5c (фиг. 2А). Конструкции были схожими с те, которые описаны в Cabello et al. (2007). Трансгенные растения первого поколения (Т0) отбирали, используя опрыскивания гербицидом (глюфосинатом аммония). Следующие поколения (T1 и T2) отбирали путем обнаружения кДНК для HaHb-4 и регуляторных последовательностей, используя ПЦР. Было получено несколько гомозиготных линий, и после предварительного анализа четыре трансгенных независимых объекта (а1, а2, b1 и d) были отобраны для дальнейшей оценки. Предварительный анализ состоял из визуальных наблюдений и отбора объектов с фенотипом без измененной морфологии.
Анализ экспрессии генов HaHB4 и bar на транскрипционном уровне
Уровни экспрессии генов HaHB4 и bar в гомозиготных линиях оценивали с помощью анализа экспрессии на транскрипционном уровне. Проростки каждого трансгенного объекта обрабатывали либо 100 мкМ раствором АВА в течение 1 часа, либо водой в качестве контрольной обработки. Эксперимент проводили трижды, и в каждом отдельном эксперименте отбирали по пять проростков. После периода обработки собирали общую биомассу проростков и сразу же помещали в жидкий азот. Из этих образцов выделяли РНК для количественной ОТ-ПЦР, используя реагент TriPure (ROCHE). РНК (1 мкг) инкубировали с ДНКазой RQ1 (Promega, Madison, WI, США) в соответствии с инструкциями производителя, а затем использовали для реакций обратной транскрипции, используя набор для синтеза первой цепи кДНК Transcriptor First Strand cDNA Synthesis Kit (ROCHE). Количественные ПЦР проводили, используя анализатор LightCylcer® 480 II (ROCHE), в конечном объеме=20 мкл с использованием набора LightCycler® 480 SYBR Green I Master. Флуоресценцию измеряли при 80-84°C в течение 40 циклов. Праймеры, используемые для процедур количественного анализа, были разработаны для работы при температуре отжига 60°C, и для обнаружения неспецифических продуктов амплификации анализировали кривые плавления. В каждом объекте анализ экспрессии генов проводили в трех повторах, и уровни относительной экспрессии транскриптов рассчитывали с использованием значений Ct, полученных для каждого образца, как описано Pfaffl (2001).
Эксперименты с водным стрессом в контролируемых условиях
Эксперимент состоял из пяти генотипов (трансгенных объектов a1, a2, b1, c1, и Williams 82), двух водных режимов (хороший полив и водный стресс), трех периодов начала стресса: второй узел (V2), полное цветение (R2) и полный стручок (R4) (Fehr and Caviness, 1977) и 15 повторов. Горшки (5 л) заполняли коммерческим GrowMix MultiPro (Terrafertil SA, AR). В каждый отдельный горшок высевали по три семени. При появлении всходов растения прореживали до одного растения в каждом горшке. Водный стресс накладывали на стадиях развития V2, R2 и R4 путем полного отказа от полива. Остальные контрольные горшки выдерживали при нормальной влагоемкости до зрелости. После появления первых симптомов увядания у Hahb-4-растений горшки поливали до нормальной влагоемкости. Степень восстановления (%) после 7-дневного периода восстановления для каждого генотипа и стадии развития рассчитывали как число растений без симптомов увядания, деленное на общее число растений в начале эксперимента.
Эксперименты по чувствительности к этилену
Листья сои (15 листьев на генотип) трансгенных объектов a1 и b1 и контрольных растений (Williams 82) отщепляли от растений, растущих в контролируемых условиях, на стадии развития V4. Отщепленные листья помещали в чашки Петри и инкубировали с: a) -водой и оставляли при нормальных условиях освещения (контрольная обработка); b) - водой и покрывали алюминиевой фольгой (воздействие темноты) и, c) - 100 мкМ раствором 2-хлорэтилфосфоновой кислоты (обработка этефоном) (Tifon, Gleba, AR). После 7-дневного периода обработки на извлеченных листьях проводили экстракцию и количественный анализ пигментов.
Для определений хлорофилла (А и В) и каротиноидов, связанных с фотосинтезом, листья измельчали в жидком азоте и оставляли на ночь в темноте в растворе с 99,9% этанолом. Аликвоту раствора этанола использовали для дальнейшего количественного анализа с помощью спектроскопии в ультрафиолетой/видимой области спектра. Осуществляли последовательные разведения каждой аликвоты во избежание выбросов в спектре поглощения. Электронные спектры поглощения в видимой области хлорофиллов A и B и каротиноидов регистрировали при 15°C, используя спектрофотометр JASCO V-550 (Jasco Analytical Instruments, MD, США). Для каждого образца проводили спектральное сканирование в диапазоне длин волн от 350 нм до 750 нм. Значения всего эксперимента представляют собой среднее значение трех независимых экспериментов.
Для оценки одного из морфологических эффектов этилена в виде «тройной ответной реакции» семена сои генотипов a1, b1 и контроля помещали в лотки для проращивания с фильтровальной бумагой либо с водой, либо с 25 раствором мМ 2-хлорэтилфосфоновой кислоты. Всего использовали 3 лотка (по 20 семян в каждом) для каждого генотипа и обработки. Лотки покрывали алюминиевой фольгой на 48 часов. После появления гипокотилей проводили количественный анализ семян с образованием подсемядольного колена.
Эксперимент по потере воды
Три растения для каждого трансгенного объекта сои (a1, a2, b1 и d) и нетрансгенного контроля (Williams 82) выращивали в 5-литровых горшках с почвой GrowMix MultiPro в нормальных условиях полива. В начале цветения (R1) (Fehr and Caviness, 1977) 10 листьев каждого растения отщепляли и немедленно взвешивали на изолированных от воздушного потока аналитических весах с интервалом в 1 час в течение 10 часов.
Полевые эксперименты в условиях богарного поля
Трансгенные объекты a1, a2, b1, d и дикий тип (Williams 82) оценивали на урожайность и компоненты урожайности в 12 окружающих условиях в течение вегетационного периода 2012-13 гг. Окружающие условия были определены как сочетание местоположения и даты посадки, поскольку на некоторые местоположения распространялись две даты посадки. Местоположениями полевых испытаний были Monte Buey (Córdoba), Chilibroste (Córdoba), Corral de Bustos (Córdoba), Villa Saboya (Buenos Aires), Carmen de Areco (Buenos Aires), San Agustín (Buenos Aires), Landeta (Santa Fe), Hughes (Santa Fe) и Aranguren (Entre Ríos). На San Agustín, Carmen de Areco и Aranguren распространялись две даты посадки. Окружающие условия были сгруппированы по урожайности генотипа дикого типа (экологическому показателю). Три экологических показателя (низкий, средний и высокий) были определены с учетом различных критериев: 1) возможности отбора объекта, максимизируя различие в урожайности между объектами и нетрансгенным контролем; 2) отображения средней национальной урожайности в Аргентине (верхний предел для низкого экологического показателя) и средней урожайности двух самых продуктивных районов Аргентины (нижний предел для высокого экологического показателя) в год отбора объекта (Bolsa de Cereales, Panorama Agricola Semanal 2013, 30 мая., с извлечением информации с www.bolsadecereales.com/pas); 3) соответствия числа окружающих условий в каждой группе. Таким образом, низкий экологический показатель включает окружающие условия, в которых урожайность дикого типа была ниже 2500 кг га-1 (San Agustín, обе даты посадки, Aranguren, обе даты посадки и Landeta); средний экологический показатель охватывает окружающие условия, в которых урожайность дикого типа составляла 2500-3500 кг га-1 (Carmen de Areco, обе даты посадки, и Villa Saboya); и, наконец, высокий экологический показатель включает окружающие условия, в которых урожайность дикого типа превышал 3500 кг га-1 (Corral de Bustos, Hughes, Monte Buey и Chilibroste). Отбор объекта выполняли на основе урожайности семян и компонентов урожайности (количества семян на квадратный метр и веса 100 семян) в качестве относительной продуктивности трансгенных объектов и дикого типа. Относительную продуктивность трансгенных объектов относительно дикого типа рассчитывали как относительную разницу между трансгенным объектом и диким типом.
Полевые испытания планировали, используя рандомизированный полностью блочный дизайн с 4-7 повторами, в зависимости от рассматриваемого местоположения. Делянки состояли из 4 рядов, длиной от 5 до 6 метров, а между рядами от 0,4 до 0,7 метра. Сбор с двух срединных рядов каждой делянки осуществляли при полной зрелости (R8) (Fehr and Caviness, 1977). Урожайность представляли на основе влажности=13%. Количество семян на квадратный метр рассчитывали на основе веса 100 семян и урожайности. Урожайность семян, количество семян и вес семян анализировали с помощью дисперсионного анализа (ANOVA), используя программное обеспечение SAS. Статистическая модель включала экологический показатель, окружающие условия, вложенные в экологический показатель, блок, вложенный в окружающие условия, генотип и эффект взаимодействия (генотип в соответствии с экологическим показателем и окружающие условия в соответствии с генотипом).
После отбора объекта дополнительные полевые испытания были выполнены в шести окружающих условиях в течение вегетационного периода 2013-14 гг. Местоположениями полевых испытаний были Monte Buey (Córdoba), Aranguren (Entre Ríos), Roldán (Santa Fe) и Villa Saboya (Buenos Aires). На Aranguren распространялись два эксперимента, которые различались обработкой удобрением при посеве: a) 100 кг га-1 моноаммонийфосфата и b) 0 кг га-1 моноаммонийфосфата. На Roldán распространялись две даты посадки (декабрь и январь). Экспериментальный план полевых испытаний 2013-14 гг. был таким же, как и в 2012-2013 гг. Данные за два года объединяли, и все окружающие условия были проанализированы вместе для сравнения между трансгенным объектом b1 и нетрансгенным контролем. Полевые испытания с низким экологическим показателем были в Aranguren, с двумя условиями применения удобрения. Полевые испытания со средним экологическим показателем были в Monte Buey и Roldán (две даты посадки). Наконец, испытание в Villa Saboya было классифицировано как испытание со средним экологическим показателем. Данные анализировали, используя ту же статистическую модели, что и в объекте предыдущего набора данных.
Конструирование библиотеки и секвенирование с использованием технологии Illumina
Ткани листьев Williams 82 и трансгенного объекта b1 собирали с трех растений в двух разных водных режимах (растения с хорошим поливом и подверганием водному стрессу), как описано в разделе «Эксперимент по водному стрессу в контролируемых условиях». Образцы тканей собирали на стадии R2. Экстракцию тотальной РНК из ткани листьев проводили, как описано в разделе «Уровни экспрессии генов Hahb-4 и bar», используя систему выделения тотальной РНК SV (Promega, Madison, WI, США). Качество РНК оценивали, используя Agilent 2100 Bioanalyzer Eukaryote Total RNA Nano (Agilent, Santa Clara, California, США), а концентрацию РНК определяли, используя набор Quant-iT RiboGreen RNA Assay Kit (Thermo Fisher Scientific, Waltham, Massachusetts, США).
Анализ дифференциальной экспрессии RNAseq был разработан с использованием однофакторной схемы, двух уровней (с подверганием водному стрессу и с хорошим поливом) и трех биологических повторов для уровня каждого фактора. Библиотеки RNA-seq конструировали, используя набор TruSeq RNA Library Prep Kit v2, в соответствии с рекомендациями производителя (lllumina, San Diego, CA, США). Проверку качества библиотеки выполняли с использованием чипа Agilent 2100 Bioanalyzer DNA 1000 (Agilent, Santa Clara, California, США). Библиотеки количественно анализировали, используя наборы для количественной оценки библиотек KAPA для платформ Illumina (KAPA Biosystems, Wilmington, Massachusetts, США), объединяли, разбавляли и загружали для дальнейшего секвенирования на дорожку lllumina HiSeq 1500 RR 2×100 pb. Все образцы секвенировали, используя оборудование для секвенирования нового поколения, в Instituto de Agrobiotecnologia Rosario (Rosario, Республика Аргентина).
Картирование, дифференциальная экспрессия и анализ обогащенной аннотации с использованием генной онтологии (GO)
Проверку качества исходных данных выполняли, используя FastQC vO.11.4 (Andrews, S. 2010). Выравнивание и снятие адаптера производили, используя Trimmomatic v0.33. Считывания спаренных концов последовательностей РНК сопоставляли с эталонным геномом Glycine_max (фитозом Gmax_275_Wm82.a2.v1), используя Bowtie2 v2.2.6 (Langmead and Salzberg, 2012), включенный в TopHat v2.1.0 (Trapnell et al., 2009), с использованием параметров по умолчанию. Cufflinks v2.2.1 (Trapnell et al., 2012) использовали для сборки транскриптов, оценку избытка определяли с использованием фрагментов на килобазу транскрипта на миллион картированных считываний (FPKM), а анализ дифференциальной экспрессии (FDR=0,05) выполняли с использованием cuffdiff. Дифференциально экспрессируемые гены аннотировали с использованием терминов генной онтологии (GO). Сингулярный анализ обогащения (SEA) (точный тест Фишера; уровень значимости 0,05) проводили с использованием веб-сервера agriGO (http://bioinfo.cau.edu.cn/agriGO) (Zhou D., et al, 2010) с генами Glycine max Wm82.a2.v1 в качестве фона. Чтобы получить широкий обзор функций транскриптов, термины GO сопоставляли с категориями растений GO slim, используя инструмент GOSlimViewer (http://www.agbase.msstate.edu/). Идентификаторы генов были получены, используя репозиторий фитосом 11.0v.
Выбор объекта между двумя конститутивными трансгенными объектами (a1 и a2) и двумя индуцибельными трансгенными объектами, (b) и (c)
Четыре независимые трансгенные линии (a1, a2, b1 и с1), относящиеся к трем различным конструкциям, оценивали на уровни относительной экспрессии HaHB4 (фиг. 2В). Как и ожидалось, трансгенные объекты b1 и с1 с индуцибельным промотором продемонстрировали более высокие уровни экспрессии HaHB4 при воздействии абсцизовой кислоты (ABA) по сравнению с контрольными растениями без воздействия фитогормона. Напротив, трансгенные объекты a1 и a2 с конститутивным промотором продемонстрировали сходную экспрессию HaHB4 для обоих режимов. Уровни экспрессии гена bar оставались схожими в обоих условиях, как и ожидалось.
После анализа экспрессии эксперименты по засухоустойчивости проводили в контролируемых условиях. Таким образом, засухоустойчивость на трех различных стадиях развития оценивали на четырех независимых трансгенных линиях (a1, a2, b1 и с1). После периода лишения воды все трансгенные линии показали меньше увядших растений по сравнению с нетрансгенными растениями (Williams 82) (фиг. 3A). Наблюдения за восстановлением от увядания (степень восстановления) после периода лишения воды после полива проводили для каждой независимой трансгенной линии (фиг. 3В). На стадии V2, стадии развития второго узла (Fehr and Caviness, 1977), только 7% контрольных растений продемонстрировали восстановление тканей, в то время как средняя степень восстановления для трансгенных объектов составляла 67%. Схожие результаты были получены на стадиях развития R2, полное цветение, и R4, полный стручок, (Fehr and Caviness, 1977), когда степень восстановления контрольных растений составляла 12% и 13%, в то время как трансгенные объекты продемонстрировали значения 68% и 65%, соответственно. Степень восстановления, усредненная по стадиям развития, (конечная степень восстановления), рассчитывали для оценки средней эффективности каждого трансгенного объекта. Результаты показали некоторые различия между трансгенными объектами, при этом объекты a1 и b1 продемонстрировали более высокие значения конечного восстановления, чем объекты a2 и с1 (фиг. 3B).
С другой стороны, степень потери воды из отщепленных от растений листьев сои измеряли с 1-часовыми интервалами в течение 10 часов, чтобы проверить, способствует ли регуляция закрытия устьиц устойчивости трансгенных линий к стрессу. Результаты показали, что потери воды у всех независимых линий и дикого типа были схожими (фиг. 3C), демонстрируя, что более раннее закрытие устьиц не является механизмом, участвующим в засухоустойчивости, опосредованным HaHB4.
Оценки чувствительности к этилену и отсроченного старения у HaHB4-трансгенных растений
Более низкая чувствительность к этилену и, как следствие, отсроченное старение могут быть основными механизмами, обеспечивающими большую засухоустойчивость HaHB4-трансгенных растений Arabidopsis (Manavella et al., 2006; Cabello et al., 2007). Для оценки этого физиологического механизма у сои, две независимые трансгенные линии с разными промоторами, конститутивным a1 и индуцибельным b1, были выбраны для оценки.
Трансгенная линия b1 сохраняла фотосинтетическую активность дольше, чем нетрансгенный контроль (Williams 82), когда оба подвергались либо экзогенному нанесению этефона (2-хлорэтилфосфорной кислоты), либо воздействию темноты для вызова старения тканей. Листья трансгенной линии b1, обработанные этефоном или находящиеся в темноте, показали схожее относительное количество хлорофилла, A и B и каротиноидов, связанных с фотосинтезом, что листья без стресса (фиг. 4C). Напротив, нетрансгенный контрольный генотип продемонстрировал более низкие уровни хлорофилла, A и B и каротиноидов, когда листья обрабатывались этефоном или находились в темноте, по сравнению с листьями без стресса. Промежуточный ответ был обнаружен у трансгенного объекта с конститутивным промотором (a1). Более замедленное старение также наблюдали в листьях трансгенного объекта b1 при воздействии этефона или нахождения в темноте (фиг. 4А). Таким образом, в то время как трансгенные листья b1 демонстрировали фенотип «оставаться зелеными», нетрансгенная линия проявляла симптомы пожелтения при этих режимах.
С другой стороны, нанесение этилена на проростки приводит к выраженному изгибу апикального конца подсемядольного колена. Этот эффект, известный как «тройная ответная реакция», вызывает ингибирование удлинения стебля, радиальное набухание стебля и отсутствие нормальной геотропической реакции (Guzman and Ecker, 1990). На фиг. 4В показана более низкая чувствительность к этефону у трансгенных линий a1 и b1 по сравнению с нетрансгенной линией, что указывает на различия во времени восприятия этефона у сои. Кроме того, проростки трансгенных линий, подвергнутых воздействию различных концентраций этефона, продемонстрировали образование подсемядольного колена при более высоких концентрациях, чем нетрансгенная линия. В то же время первые симптомы образования подсемядольного колена для трансгенных линий наблюдались при концентрации этефона, составляющей 25 мМ, составляющая 10 мкМ концентрация была достаточной для образования подсемядольного колена у нетрансгенного контроля. Таким же образом, в объекте трансгенных линий у 17% (линия b1) и 9% (линия a1) проростков присутствовало образование подсемядольного колена при концентрации этефона=25 мкМ, в то время как в объекте нетрансгенного контроле у почти 50% проростков присутствовало образование подсемядольного колена при этой концентрация (фиг. 4D).
Следовательно, более низкая чувствительность к этилену у трансгенных объектов сои по сравнению с нетрансгенным контролем проявляется сохранением уровней хлорофилла и замером большего количества гипокотилей без образования подсемядольного колена при обработке этефоном и нахождения в темноте.
Продуктивность независимых HaHB4-трансгенных объектов в условиях богарного поля
Четыре независимых трансгенных объекта были первоначально оценены в полевых условиях в 12 испытаниях в течение вегетационного периода 2012-2013 гг. Испытания были сгруппированы как условия для низкой, средней и высокой урожайности на основе урожайности нетрансгенного контроля. Все трансгенные объекты продемонстрировали меньший вес 100 семян, чем нетрансгенный контроль (основной эффект генотипа: p<0,0001). С другой стороны, количество семян на квадратный метр и урожайность семян показали значительное взаимодействие между генотипом и окружающими условиями (p=0,013 для урожайности семян и p=0,033 для количества семян). Урожайность семян для объектов a2 и b1 была значительно выше, чем у контроля в условиях низкой урожайности (фиг. 5A). Урожайность семян была на 9,4% для a2 и на 11,2% для b1 выше, чем у нетрансгенного контроля. Эти различия в продуктивности в условиях низкой урожайности были следствием значительного увеличения количества семян с меньшим, чем пропорциональное снижение, снижением веса семян. Трансгенный объект a2 продемонстрировал увеличение количества семян на 15,3% (фиг. 5B) и снижение веса семян на -4,8% (фиг. 5C), тогда как трансгенный объект b1 продемонстрировал увеличение числа семян на 20,6% (фиг. 5B) и снижение веса семян на -7,6% (фиг. 5C). Для условий средней и высокой урожайности не было разницы в урожайности семян ни для одного из объектов, кроме c1. Трансгенный объект с1 продемонстрировал значительное снижение урожайности семян (-8,4%) (фиг. 5A), объясняемое значительным уменьшением количества семян (-5,8%) (фиг. 5B) и веса семян (-2,6%) (фиг. 5C). Основываясь на большей продуктивности объекта b1 в условиях низкой урожайности и отсутствии проблемы с урожайностью семян в условиях высокой урожайности, объект b1 был отобран для дальнейших полевых испытаний.
Дальнейшая оценка отобранного трансгенного объекта b1 в расширенном наборе окружающих условий в течение вегетационного периода 2013-14 гг. показала стабильные результаты по сравнению с предыдущим годом. Факторный анализ объекта b1 и нетрансгенного контроля для обоих вегетационных периодов показал статистически значимое взаимодействие между генотипом и окружающими условиями для урожайности семян (p=0,048) и количества семян (p=0,050J, тогда как вес семян показал значимый основной эффект генотипа (p<0,0001). Урожайность семян значимо различалась между двумя генотипами в условиях низкой урожайности (фиг. 6А). Увеличение количества семян (23,3%) было пропорционально выше, чем снижение веса семян (-6,7%), что приводило к значительному увеличению урожайности семян (14,9%) (фиг. 6A, B, C). Для условий средней и высокой урожайности отмечалась компенсация между весом семян и количеством семян. Снижения веса семян (-6,8% и -4,2% для условий средней и высокой урожайности, соответственно) (фиг. 6С) были сопоставимы по величине с увеличением количества семян (7,3% и 6,2% для условий средней и высокой урожайности, соответственно) (фиг. 6В).
Классификация и идентификация дифференциально экспрессируемых генов
Для оценки изменений уровня транскрипции, придающих засухоустойчивость трансгенному объекту b1 сои, транскриптомный анализ RNA-Seq с использованием технологии Illumina был проведен для объекта b1 и нетрансгенного контроля (Williams 82). Первый подход, в котором сравнивали режим с поливом с режимом засухи, идентифицировал 1931 дифференциально экспрессируемый (DE) ген (FC> = +/- 2) в генотипе HaHB4. Схожее количество DE генов было обнаружено для генотипа дикого типа, с 2215 DE генами (FC> = +/- 2) в ответ на водный стресс. 866 DE генов были общими для двух генотипов (фиг. 7В). Второй подход, при котором сравнивали генотипы в рамках режимов, был проведен для идентификации DE генов, связанных с трансгеном HaHB4. Как и ожидалось, из-за индуцибельного характера промотора HaHB4 только 298 DE генов (FC> = +/- 2) наблюдали при сравнении трансгенных и нетрансгенных растений в режиме полива.
Обогащенная аннотация с использованием генной онтологии (GO), сравнивающая генотипы в условиях полива, идентифицировала 941 термин GO, связанный с DE генами в категории биологических процессов, в то время как 9931 термин GO, связанный с DE генами, был идентифицирован в режиме засухи (фиг. 7). Кроме того, наибольшая доля DE генов при водном стрессе соответствует метаболическим и биологическим процессам, хотя клеточные и биосинтетические процессы также выявили значительное число DE генов между генотипами (фиг. 8). В основной группе биологических процессов DE гены при водном стрессе в основном участвовали в фотосинтезе, защитной реакции растений, факторах транскрипции и передаче сигнала (таблица 2). В рамках упомянутой категории был проведен второй отбор DE генов на основе значений кратного изменения. Для дальнейшей идентификации и анализа были выбраны значения либо FC <= -2 (подавление), либо FC> = 2 (активация).
В общей сложности 12 генов, связанных с фотосинтезом, были подавлены, при этом 9 из них были связаны исключительно с белками реакционного центра фотосистемы II (PSII), в частности, было обнаружено подавление генов, кодирующих белки A, B, C, D, E и M реакционного центра фотосистемы II, (Tikkanen et al., 2014). Что касается генов, участвующих в защитной реакции растения на стрессы, гены липоксигеназы 1 (LOX1), липоксигеназы 2 (LOX2) и бета-1,3-глюканазы 1 были активированы при сравнении трансгенных и нетрансгенных растений в условиях водного стресса. Кроме того, набор генов, участвующих в передвижении воды, также был DE. В этом смысле три белка суперсемейства белков типа аквапоринов были значительно подавлены в трансгенных растениях (Johansson et al., 2000; Sade and Moshelion, 2017).
Факторы транскрипции сои (Wang et al., 2010), дифференциально экспрессируемые между трансгенными и нетрансгенными генотипами в условиях засухи, включали гены, играющие важную роль как в процессах развития, так и в ответ на стрессы окружающей среды (таблица 2). В этом смысле некоторые члены семейства факторов транскрипции, связывающиеся с областью K-бокса и MADS-бокса (Shu et al., 2013), белковоподобные факторы, связывающиеся с промотором Squamosa, (Tripathi et al., 2017), белки суперсемейства основная спираль-петля-спираль (Hudson and Hudson, 2015) и Myb-подобные факторы транскрипции (Du et al., 2012) были подавлены, в то время как другие были активированы при сравнении генотипов в условиях водного стресса. С другой стороны, были активированы придающий солевыносливость белок «цинковый палец» (Yuan et al., 2018), ДНК-связывающий белок WRKY (Yin et al., 2013; Yang et al., 2017), белок типа основная лейциновая молния (Zhanq et al., 2018) и белок Arabidopsis, гомологичный фактору 1, взаимодействующему с богатой пролином областью GBFY (Tokumaru et al., 2017), и белки суперсемейства ДНК-связывающих белков типа интегразы (Licausi et al., 2010; Yan, 2014).
Наконец, гены, кодирующие белки, участвующие в передаче сигналов (Ahanger et al., 2018), продемонстрировали изменения при сравнении генотипов в условиях водного стресса. Конкретно, эти гены представляют собой кальций-связывающие белки семейства EF-hand, фосфатазы и киназы, экспрессия которых была значительно выше в объекте генотипа HaHB4 по сравнению с контрольным генотипом в условиях водного стресса (таблица 2).
Таблица 2 - Значение кратного изменения (fc) для выборки дифференциально экспрессируемых генов между трансгенными и нетрансгенными генотипами в условиях водного стресса. Группы генов соответствуют, сверху вниз, (A) генам, родственным аквапорину, (B) генам, связанным с фотосинтезом, (C) генам защитной реакции растений, (D) факторам транскрипции и (D) передаче сигнала.
(THI4)
Различия между эффективностью трансгенных объектов в условиях низкой урожайности и наличие проблемы с урожайностью в условиях высокой урожайности позволяют предположить, что тип промотора (индуцибельный или конститутивный) и уровень экспрессии HaHB4 вносят вклад в конечную ответную реакцию на условия окружающей среды и эффективность. Результаты по отобранному трансгенному объекту b1 с индуцибельным промотором показали, что физиологические ответы, индуцированные НаНВ4, могут выражаться в большей урожайности в условиях низкой урожайности с отсутствием снижения урожайности в условиях высокой урожайности (фиг. 6).
Пример 3: Характеристика последовательностей ДНК объекта IND-00410-5 у сои
Объект IND-00410-5 у сои, вставленный в геномную ДНК растения, а также фланкирующие геномные последовательности были охарактеризованы с помощью молекулярных методов.
С этой целью выполняли секвенирование ДНК объекта IND-00410-5, определяли число трансгенных вставок (число сайтов интеграции в геном сои), а также определяли целостность и стабильность последовательности на протяжении шести поколений.
Кроме того, технологию секвенирования нового поколения (NGS) использовали параллельно с традиционными технологиями для описания объекта IND-00410-5. NGS использовали для определения: полногеномной последовательности IND-00410-5; она включает последовательность Т-ДНК; и последовательности стыка (JS) между Т-ДНК и нативным геномом сои. Фланкирующие последовательности позволили дополнительно контролировать стабильность и целостность вставки Т-ДНК на протяжении шести самоопыляемых поколений, а также у растений, полученных в результате ауткроссинга с другим сортом сои.
ДНК изолировали из тканей листьев гомозиготных по объекту IND-00410-5 растений (из теплицы или выращенных в поле) или из растений сои сорта Williams-82 для анализа методом блоттинга по Саузерну. Для секвенирования всего генома и анализа расщепления у растений F2 ДНК экстрагировали из эмбриональной ткани.
Коммерчески доступный сорт сои Bio 6.5 (Bioceres Semillas SA, Ocampo 210 bis, Rosario, Аргентина) использовали для скрещивания растений, содержащих объект IND-00410-5.
Как правило, перед экстракцией замороженную в жидком азоте ткань листьев обрабатывали до мелкого порошка в ступке с помощью пестика или в пробирках в «96-мельнице» для минипрепаратов.
Для экстракции ДНК растений использовали следующие методы, в зависимости от количества ДНК, необходимого для экспериментальных целей:
Метод с использованием CTAB (бромида гексадецилтриметиламмония или бромида цетилтриметиламмония):
Указанный метод использовали для экстракции геномной ДНК из образцов растений (http://irc.igd.cornell.edu/Protocols/DoyleProtocol.pdf). 600 мкл буфера CTAB (2% (в отношении веса к объему) CTAB, 100 мМ Tris HCl, 20 мМ EDTA, 1,4 M NaCl и β-меркаптоэтанол) и 5 мкг РНКазы A добавляли к приблизительно 100 мг измельченной ткани листьев, и гомогенат инкубировали при 55-60°С в течение 15-20 минут при прерывистом перемешивании. К образцам добавляли 600 мкл хлороформа, и осуществляли перемешивание вручную в течение 2-3 минут, а затем центрифугирование при 10000 об./мин в течение 8 минут. Верхнюю водную фазу помещали в чистую микропробирку, и ДНК преципитировали с использованием 400 мкл изопропанола. Образец центрифугировали при 12500 об./мин в течение 10 минут для осаждения преципитированной ДНК. Осадки ДНК промывали 300 мкл 70% этанола путем центрифугирования образцов при 12500 об./мин (5 минут). Осадки ДНК сушили на воздухе, затем ресуспендировали в 100 мкл TE-буфера (10 мМ Tris HCl, 1 мМ EDTA, pH 8,0). Всю экстрагированную ДНК хранили в холодильнике при 4°С или морозильной камере при -20°С.
- Набор DNeasy Plant Maxi от Qiagen (Valencia, CA) для больших препаратов (анализы методом блоттинга по Саузернуа) или QIAprep® Miniprep (Qiagen Inc.) для небольших препаратов.
- ДНК, выделенную из эмбриональной ткани, использовали для секвенирования на основе технологии Illumina, а также для исследований расщепления у потомства F2 от кроссов IND-00410-5 и Bio 6.5. Перед экстракцией семена, содержащие объект IND-00410-5, Williams 82 и F2 инкубировали в воде при 37°С для облегчения разрушения семян. Затем эмбриональные ткани отделяли от семядолей, их ДНК экстрагировали с помощью метода с использованием CTAB. ДНК определяли количественно либо с использованием Quant-iT™ PicoGreen® (Invitrogen, Carlsbad, CA), либо с помощью флуорометра QuBit (Invitrogen) и набора Quant-iT™ dsDNA BR Assay Kit (Invitrogen). Затем ДНК хранили при 4°С или при -20°С.
ДНК разделяли в 0,8% (в отношении веса к объему) агарозных гелях для оценки целостности образцов. Гель готовили с использованием 1х TAE-буфера (40 мМ Tris, 20 мМ уксусная кислота и 1 мМ EDTA) и использовали для электрофореза при 120 В. Образцы ДНК разводили в 6х буфере для загрузки (30% глицерина и бромфеноловый синий) с красителем GelRed™ Nucleic Acid Gel Stain 200x (Biotium, Inc., Hayward, CA).
1,5%-Агарозные гели (в отношении веса к объему) использовали для разделения ампликонов размером от 200 п.о. до 1500 п.о., в то время как 1%-агарозные гели (в отношении веса к объему) использовали для более крупных фрагментов ДНК. Электрофорез проводили в 1х TAE-буфере при 120 В. Образцы обрабатывали, как описано выше. Маркеры молекулярной массы 100 п.о. (от 100 до 2080 п.о.) и/или Lambda BstII (от 117 п.о. до 14140 п.о.) (P-BL, Аргентина) были выбраны в соответствии с размером ампликонов, который нужно разделить.
Стандартные ПЦР-реакции, выполняемые в большинстве исследований, проводили с использованием 100 нг геномной ДНК в качестве матрицы в реакционном объеме=40 мкл с конечными концентрациями: 1,8 мМ MgCl2, 2 мМ DMSO, 0,4 мкМ каждого праймера, 50 мкМ каждого dNTP и 1 ед. FastStart High Fidelity (Roche, Indianapolis, IN). Следующую программу циклирования применяли для ампликонов с заданными размерами от 400 п.о. до 700 п.о.:
1 цикл при 95°С в течение 30 секунд;
35 циклов при 95°С в течение 30 секунд, 55°С в течение 30 секунд, 72°С в течение 30 секунд;
конечное удлинение: 1 цикл при 72°С в течение 10 минут.
Для образования ампликонов размером от 1100 п.о. до 1300 п.о. продолжительность этапа удлинения при 72°С была увеличена с 30 секунд до 60 секунд.
В объекте амплификации всей вставки с помощью полимеразы Expand Long Range использовали конечные концентрации: 2,5 мМ MgCl2, 6% DMSO, 0,3 мкМ каждого праймера, 500 мкМ каждого dNTP и 3,5 ед. FastStart High Fidelity (Roche, Indianapolis, IN). Амплификацию проводили в следующих условиях:
1 цикл при 92°С в течение 2 минут;
10 циклов при 92°С в течение 10 секунд, 55°С в течение 15 секунд, 68°С в течение 10 минут; 25 циклов при 92°С в течение 10 секунд, 55°С в течение 15 секунд, 68°С в течение 10 минут, увеличивая время этого последнего этапа на 20 секунд для каждого цикла;
1 цикл при 68°С в течение 7 минут.
Ампликоны для определения последовательности вставки Т-ДНК получали с использованием ДНК-полимеразы Phusion® High-Fidelity от New England BioLabs (Ipswich, MA).
Все секвенируемые продукты ПЦР разделяли с помощью электрофореза в агарозном геле, как описано выше, и дополнительно очищали с использованием набора Illustra GFX PCR DNA and Gel Band Purification Kit (GE, Piscataway, NJ).
Ампликоны клонировали (с использованием набора TOPO TA Cloning® от Invitrogen) для определения последовательности Т-ДНК методом Сэнгера.
Таблица 3. Список праймеров, используемых для определения последовательности вставки в объекте IND-00410-5, с помощью традиционного метода секвенирования по Сэнгеру.
Затем клоны очищали с использованием набора QIAprep Spin Miniprep Kit от Qiagen (Valencia, CA). Плазмидную ДНК отправляли на секвенирование в компанию Davis Sequencing (Davis, CA). Последовательности анализировали, используя программное обеспечение SeqMan Pro от DNASTAR (Madison, WI). Для каждого ампликона секвенировали по крайней мере три клона.
а) Анализ методом блоттинга по Саузерну
Число вставок Т-ДНК определяли у гомозиготных по объекту IND-00410-5 растений Т5 с помощью анализа методом блоттинга по Саузерну. ДНК из этого объекта расщепляли двумя ферментами: HindIII и NdeI. В Т-ДНК имелось два сайта для HindIII, расположенных рядом друг с другом (фиг. 1A и 1B). Предполагая присутствие единственной интактной Т-ДНК в геноме IND-00410-5, минимальный размер фрагмента, определяемый с помощью гибридизации зонда для HaHB4, будет составлять 1,85 т.п.о. С другой стороны, зонд для гена селектируемого маркера bar обнаружит гидролизаты, выходящие за левую границу в геноме сои. Эти фрагменты должны быть длиннее 2,6 т.п.о. (фиг. 1B). На Саузерн-блоте, представленном на фиг. 9, выделенные фрагменты имеют ожидаемые размеры и соответствуют единственной вставке Т-ДНК.
В конструкции имеется четыре сайта рестрикции для NdeI (фиг. 1A), два в Т-ДНК и два в бинарном векторе. Полное расщепление NdeI в Т-ДНК должно высвободить сегмент ДНК размером точно 2703 п.о., который содержит мишень для связывания зонда длч bar. Ожидалось, что зонд для HaHB4 обнаружит фрагмент ДНК с минимальным размером=1,35 т.п.о., исходя из единственной интактной Т-ДНК. Полоса гибридизации в NdeI-гидролизате была длиннее 8,6 т.п.о. (фиг. 9А), что согласуется с присутствием единственной интактной вставки Т-ДНК.
Один грамм ткани листьев либо из IND-00410-5, либо из Williams 82 мгновенно замораживали, используя жидкий азот, и измельчали в мелкий порошок с использованием предварительно охлажденного пестика и ступки. ДНК экстрагировали с помощью набора Qiagen DNeasy Maxi Prep Kit в соответствии с протоколом производителя. После элюирования, ДНК преципитировали добавлением 1/10 объема 3 М ацетата натрия и 2-3 объемов 100% этанола. Осадок промывали 70% этанолом и суспендировали в 80 мкл 1x TE буфера. ДНК определяли количественно с помощью флуориметра QuBit. Концентрация ДНК в объекте IND-00410-5 составляла 1120 нг/мл, а в объекте Williams 82-800 нг/мл.
Для получения фрагментов, расщепленных рестрикционными ферментами, для каждой реакции расщепления объемом 50 мкл смешивали 5 мкг геномной ДНК либо с ферментом HindIII, либо с ферментом Ndel в концентрациях 10 ед./мкг ДНК. Образцы расщепляли в течение ночи (~16 часов) при 37°C. Для расщепления контрольной плазмиды использовали 100-200 пикограмм плазмидной ДНК.
Расщепленные фрагменты геномной ДНК IND-00410-5 и Williams 82 загружали в 0,7% агарозный гель вместе с меченным DIG маркером молекулярной массы VII (каталожный номер Roche 1669940910). Образцы прогоняли при 15-50 В в течение ночи. Гель инкубировали в денатурирующем буфере дважды по 30 минут каждый раз. Денатурированный гель промывали буфером для переноса в течение 15 минут перед щелочным переносом.
Молекулярные зонды для генов HaHB4 и bar (таблица 4) были синтезированы в соответствии с процедурой, описанной в наборе для синтеза Roche PCR DIG Probe 20 Synthesis Kit (каталожный номер 11636090910).
Таблица 4. Список праймеров, используемых для приготовления зондов, используемых в анализах методом блоттинга по Саузерну.
положение на векторе
Щелочной перенос ДНК из агарозного геля выполняли с использованием системы направленного вниз переноса Turboblotter-Rapid (Whatman). ДНК переносили на нейлоновую мембрану 12×21 см (Nytran™ SuPerCharge, Sigma-Aldrich Co., St. Louis, MO) в течение 4 часов. Мембрану промывали буфером для нейтрализации (0,2 М фосфатом натрия, pH 6,8). ДНК навсегда сшивали с мембраной с помощью ультрафиолетового сшивающего устройства (CL-1000) с использованием двух воздействий по 1500 мДж.
Мембрану инкубировали в 50 мл буфера для гибридизации Roche DIG EasyHyb (каталожный номер 11603558001) при предварительно рассчитанных температурах гибридизации (45°С и 55°С для зондов для гена bar и гена HaHB4, соответственно) на круговой качалке.
35-мкл и 45-мкл аликвоты зондов для bar и HaHB4 разводили добавлением 65 и 55 мкл, соответственно, 1х ТЕ-буфера. Растворы зондов инкубировали при 95°С в течение 10 мин и охлаждали до 4°С в течение 2 мин. Их добавляли к 8,75 мл буфера для гибридизации DIG и выливали на дно сосуда для гибридизации. Мембраны инкубировали при описанных температурах гибридизации в течение 16 часов в печи для гибридизации (VWR Scientific Products) с использованием круговой качалки.
После гибридизации мембраны промывали буфером для промывки в соответствии с инструкциями, прилагаемыми к набору Roche, DIG Luminescent Detection Kit. После блокирования в течение 1 часа с помощью 1x блокирующего реагента мембрану инкубировали в течение 30 минут в растворе, содержащем 50 мл 1x блокирующего реагента и 5 мкл антител против дигоксигенина, конъюгированных с щелочной фосфатазой (AP). Мембрану дважды промывали буфером для промывки по 30 минут каждый раз и, наконец, обрабатывали буфером для обнаружения в течение 5 минут. В этот момент мембрану помещали в пакет для гибридизации KPL (каталожный № KPL - 60-00-51). 5 мл раствора CSPD из набора для обнаружения люминесценции DIG наносили равномерно на мембрану. Мембрану инкубировали с раствором CSPD в течение 5 минут при комнатной температуре. Пакет для гибридизации с мембраной подвергали термосклеиванию и инкубировали при 37°С в течение 15 минут. Пакет для гибридизации помещали в кассету с пленкой Kodak Biomax Light Film (каталожный № 178 8207) в темной комнате и экспонировали в течение 20 минут. Пленки проявляли в темноте с использованием проявочной машины для рентгеновских снимков Konika QX-60A. Последующие экспозиции производились в течение 1 или 2 часов в зависимости от потребности.
b) Анализ последовательности стыка (JSA) и последовательности Т-ДНК у объекта IND-00410-5
Анализ последовательности стыка (JSA) IND-00410-5 с использованием данных о последовательности, полученных с помощью технологии Illumina, соответствовал интеграции или единственной копии вставки в одном локусе. Этот результат подтверждался обнаружением только двух последовательностей стыка в секвенированном полном геноме, содержащем объект IND-00410-5. Последовательности стыка (JS) были названы в честь хромосомы, в которую интегрирована Т-ДНК. Положениями в геноме сои согласно данным SoyBase являются JS-9L-32743826 и JS-9R-32743683. JSA представлен на фиг. 10.
Полная последовательность вставки Т-ДНК и фланкирующие ее последовательности сои (SEQ ID NO:1) были собраны de novo из считываний последовательности ДНК, полученных с помощью технологии Illumina.
Было подтверждено, что последовательность вставки Т-ДНК объекта IND-00410-5 была идентична последовательности Т-ДНК в бинарной плазмиде, с единственной копией каждого гена и каждого регуляторного элемента, за исключением почти полного отсутствия RB (фиг. 1В). Традиционное секвенирование по Сэнгеру нескольких ампликонов, охватывающих всю вставку и фланкирующие ее последовательности, подтвердило JSA-анализ последовательности, полученной с помощью технологии Illumina. Кроме того, можно было получить один ампликон размером 4710 п.о., используя Expand Long Range PCR (ПЦР длинных фрагментов), с использованием набора праймеров, комплементарных фланкирующим последовательностям. Ампликоны, полученные с использованием ДНК IND-00410-5 или Williams 82 в качестве матриц, имели ожидаемые размеры, и последовательность ДНК этого ампликона IND-00410-5 была идентична последовательности Т-ДНК, полученной в результате секвенирования всего генома.
c) Локализация Т-ДНК IND-00410-5 в геноме сои
Фланкирующие последовательности сопоставляли с геномом сои путем поиска гомологии, используя BLASTN (Altschul et al. 1990). Вставка Т-ДНК произошла в одном месте хромосомы 9. Эта вставка была расположена на 752 п.о. 3’ от последнего экзона (экзона номер 5) предполагаемого гена At1g60400-подобного белка F-box (соответствующего Glyma.09g142000 в эталонном геноме (Williams 82), ранее известного как Glyma09g26270), и на 405138 п.о. 5’ от ближайшего подтвержденного гена, ATL6-подобной убиквитинлигазы E3. Следует отметить, что фрагмент хромосомы сои размером 142 п.о. был утрачен в сайте вставки Т-ДНК. Вставка не разрушила какие-либо гены или не нарушила какой-либо другой известный аннотированный признак в геноме сои (фиг. 11).
d) Отсутствие трансгенных элементов бинарной плазмиды:
В принципе, Agrobacterium должна переносить в клетки-хозяева только свою Т-ДНК - часть плазмиды, содержащуюся между последовательностями левой границы (LB) и правой границы (RB). Однако сообщалось, что Agrobacterium также может переносить часть бинарной плазмиды, не соответствующую Т-ДНК, или даже всю ее (De Buck et al. 2000). Анализы на присутствие указанной непредусмотренной ДНК в геноме сои с IND-00410-5 были отрицательными.
Весь геном секвенировали с использованием технологии Illumina NGS для однозначного определения отсутствия остатков последовательностей плазмиды у объекта IND-00410-5. Кроме того, проводили анализы с помощью блоттинга по Саузерну для предоставления второго анализа, чтобы доказать отсутствие остатков векторных последовательностей. Ни один из зондов, специфических для плазмидных последовательностей, чужеродных для Т-ДНК (aadA, STA и REP), не гибридизировался с геномной ДНК IND-00410-5.
e) Стабильность локуса вставки в IND-00410-5 и целостность Т-ДНК:
Отслеживали положение Т-ДНК IND-00410-5 на протяжении шести поколений. Был выбран набор пар праймеров для ПЦР для обеспечения перекрывания ампликонов по всему локусу вставки Т-ДНК IND-00410-5, включая фланкирующие последовательности хромосомы 9 сои. Последовательности контигов, собранных из этих перекрывающихся продуктов ПЦР, говорили о том, что Т-ДНК была интактной и стабильной. Организация генетических элементов у сои со объектом IND-00410-5 была такой же, как и в бинарной плазмидной Т-ДНК, используемой при трансформации для получения этой трансгенной линии. Никаких изменений последовательности ДНК не было обнаружено на протяжении шести проверенных поколений.
f) Сегрегация Т-ДНК по сравнению с передачей половым путем:
Сегрегацию Т-ДНК оценивали у растений-потомков F2 от скрещиваний между IND-00410-5 и коммерческим сортом сои (Bio 6.5), используя ПЦР. Ряд ПЦР-реакций, диагностирующих стык с Т-ДНК на левой границе и нативную аллель сои, четко показал, что Т-ДНК сегрегируется как единый локус.
Гомозиготное по IND-00410-5 трансгенное растение скрещивали с Bio 6.5 для получения потомства F1. Четыре растения F1 самоопылялись с образованием семян F2, которые использовались для анализа сегрегации. Выделение ДНК и соответствующие эксперименты проводились с использованием 73 семян F2. Растения F2 оценивали как гомозиготные по Т-ДНК IND-00410-5 (I), когда присутствовал ампликон для стыка на левой границе, и отсутствовал ампликон для нативной аллели. Растения F2 оценивали как гемизиготные (H), когда присутствовали оба описанных выше ампликона. Растения F2 оценивали как гомозиготные по нативной аллели сорта Williams 82, когда ампликон для стыка на левой границе отсутствовал, и присутствовал ампликон для нативной аллели (W).
Эти результаты подтверждают вывод о том, что Т-ДНК IND-00410-5 находится в одном локусе генома сои и наследуется в соответствии с принципами менделирующей наследственности.
Отобранный трансгенный объект IND-00410-5 отличается от родительского Williams 82 одной Т-ДНК. Эта Т-ДНК содержит единственную копию гена селектируемого маркера bar и единственную копию гена HaHB4 вместе с их регуляторными последовательностями. Эта Т-ДНК была интегрирована в хромосому 9 между двумя нативными генами, кодирующими At1g60400-подобный белок F-box и AtL6-подобную убиквитинлигазу Е3. Интеграция не нарушила какой-либо известный ген или аннотированную последовательность, но вызвала утрату последовательности размером 142 п.о., соответствующую межгенному району Локус вставки и структура Т-ДНК были стабильными на протяжении шести поколений самоопыления. Было показано, что вставка Т-ДНК сегрегируется по менделирующему принципу. Никакие последовательности за пределами границы Т-ДНК не были интегрированы в объект IND-00410-5.
Пример 4: Применимые способы для идентификации IND-00410-5 в образце
В следующем примере описывается система обнаружения, специфическая для объекта, применимая для идентификации ДНК объекта IND-00410-5 в образце сои. Этот способ является сайт-специфическим, поэтому амплифицирует только последовательности одного из сайтов вставки объекта IND-00410-5.
Мультиплексная кПЦР для HaHB4 и Le1 (эталонного гена сои Lecithin 1) выполняли с использованием специфических олигонуклеотидов и различных флуоресцентных зондов, присоединенных к FAM и HEX, для HaHB4 и Le1, соответственно. Метод мультиплексной кПЦР также использовали для RB объекта IND-00410-5 и трансгена bar с использованием зондов, меченных FAM и HEX, соответственно. С другой стороны, LB объекта обнаруживали с помощью ПЦР с анализом по конечной точке, а кПЦР использовали для обнаружения аллели дикого типа (WT), используя зонд, меченный HEX.
На фиг. 12 представлена схема вставки у IND-00410-5 и положения олигонуклеотидов и зондов, используемых для обнаружения различных элементов конструкции.
- Обнаружение сайта вставки по отношению к RB
Большая часть RB (правой границы T-ДНК) была утрачена во время процесса вставки; осталось всего 3х1015 п.о. Это упоминается с целью ознакомления с вставкой относительно исходной конструкции.
Олигонуклеотиды 817 (SEQ ID NO:) и 818 (SEQ ID NO:) амплифицируют химерный фрагмент размером 200х1015 п.о., образованный левыми фланкирующими последовательностями (геном сои «Gm chr9») и частью встроенной конструкции.
Олигонуклеотиды и зонд:
817(SEQ ID NO:26): 5’ GCAACTGAACTCAGACCACTG 3’
818 (SEQ ID NO:27): 5’ GAGCTTGAGCTTGGATCAGA 3’
819 (SEQ ID NO:28): 5’-FAM- TTGTCGTTTCCCGCCTTCAGTTTAA-BHQ1- 3’
Протокол кПЦР:
Программа амплификации
- Обнаружение сайта встраивания по отношению к LB
Олигонуклеотиды 868 (SEQ ID NO:29) и 752 (SEQ ID NO:30) амплифицируют химерный фрагмент размером 356х1015 п.о., образованный правыми фланкирующими последовательностями (геном сои «Gm chr9») и частью объекта IND-00410-5.
Олигонуклеотиды:
868 (SEQ ID NO:29): 5’ CCGCAATGTGTTATTAAGTTGTC 3’
752 (SEQ ID NO:30): 5’ GGCTGCAAGTTTTGGTCAAT 3’
Протокол ПЦР:
Программа амплификации:
- Обнаружение HaHB4
Олигонуклеотиды 530 (SEQ ID NO:31) и 531 (SEQ ID NO:32) амплифицируют фрагмент размером 68х1015 п.о. внутри трансгена HaHb4.
Олигонуклеотиды и зонд:
530 (SEQ ID NO:31): 5’ CGCCACTTGACGAGGATGA 3’
531 (SEQ ID NO:32): 5’ CGAGACCCGAGTTAAGGATGAAA 3’C
532 (SEQ ID NO:33): 5’-FAM-AGCCCGAGTTTATGTGCCAACTGGT-BHQ1-3’
Протокол кПЦР:
Программа амплификации:
Обнаружение Bar
Олигонуклеотиды 527 (SEQ ID NO:34) и 528 (SEQ ID NO:35) амплифицируют фрагмент размером 84х1015 п.о. внутри трансгена bar.
Олигонуклеотиды и зонд:
527 (SEQ ID NO:34): 5’ CTGCACCATCGTCAACCACTAC 3’
528 (SEQ ID NO:35): 5’ GGTCGTCCGTCCACTCCTG 3’
529 (SEQ ID NO:36): 5’-HEX-TCGAGACAAGCACGGTCAACTTCC-BHQ1-3’
Протокол кПЦР:
Программа амплификации:
В объекте необходимости обнаружения HaHB4 и bar, это может быть выполнено одновременно с помощью мультиплексной кПЦР с двумя последними системами. Зонд для HaHB4 имеет флуорофор FAM, в то время как зонд для Bar имеет флуорофор FIEX, что позволяет обнаруживать обе амплификации с помощью разных фильтров. Кроме того, HaHB4, а также bar (отдельно) можно обнаружить одновременно с эндогенным контролем посредством мультиплексной кПЦР при условии, что указанный контроль имеет флуорофор, отличный от флуорофора представляющего интерес гена. Примером эндогенного контроля является специфический для сои ген Lecithin. Протокол и программа амплификации для мультиплексной ПЦР подробно описаны ниже.
Протокол мультиплексной кПЦР:
Программа амплификации:
Обнаружение Ie1
Олигонуклеотиды 718 (SEQ ID NO:37) и 719 (SEQ ID NO:38) амплифицируют фрагмент размером 118х1015 п.о. внутри гена Lecithin 1.
Олигонуклеотиды и зонд:
718 (SEQ ID NO:37): 5’ CTACTGACCAGCAAGGCAAA 3’
719 (SEQ ID NO:38): 5’ TCACAATAGCGTCTCCTTGG 3’
720 (SEQ ID NO:39): 5’-HEX-TCGTGCCGAAGCAACCAAACA-BHQ1-3’
Протокол кПЦР:
Программа амплификации:
Выявление гетерозиготных индивидуумов
Вставка объекта прилегает к 3'UTR-району гена Glyma.09g142000, ранее известного как Glyma09g26270. Используя олигонуклеотиды, гибридизирующиеся с фланкирующими последовательностями сайтов вставки, можно было дифференцировать дикую аллель (они амплифицируют фрагмент размером 205х1015 п.о.) от аллели, имеющей вставку IND-00410-5 (в этом объекте они амплифицируют 4710х1015 п.о.).
Для обнаружения гетерозиготных индивидуумов обнаружение объекта IND-00410-5 выполняли в первую очередь с помощью любой из двух систем, специфических для объекта, упомянутых ранее, а затем проводили кПЦР для обнаружения дикой аллели.
Олигонуклеотиды 934 (SEQ ID NO:40) и 935 (SEQ ID NO:41) амплифицируют фрагмент размером 205х1015 п.о., образованный фланкирующими последовательностями сайта вставки объекта IND-00410-5, и частью размером 142х1015 п.о., утрачиваемой во время трансформации (отсутствует у объекта IND-00410-5).
Олигонуклеотиды и зонд:
934 (SEQ ID NO:40): 5’ AGACCACTGAAATAGAGAGAAAG 3’
935 (SEQ ID NO:41): GGAGTTCTGATAATTGTTATCGTC
936 (SEQ ID NO:42): 5’ HEX-TGAAGTGAGATGATTGAGGGTGGG-BHQ1 3’
Протокол ПЦР:
Программа амплификации:
Пример 5: Чувствительность к факторам абиотического стресса и урожайность
Окружающие условия, в которых оценивали объект IND-00410-5 и контроль, различались по их потенциальной урожайности, вероятно, из-за комбинации факторов стресса, таких как засуха, соленость и низкие температуры (осмотические стрессы), высокие температуры, избыток радиации, низкая доступность питательных веществ, уплотнение почвы, препятствующее развитию корней и т.д. Эффективность трансгенного объекта оценивали на протяжении трех вегетационных периодов в разных местоположениях и в разные даты посева, всего было оценено 16 местоположений.
Совокупность этих факторов стресса позволила разделить окружающие условия на категории высокого, среднего и низкого потенциала урожайности. У трансгенного объекта урожайность, превышающая таковую у контроля, была достигнута с уровнем статистической значимости=10% (p=0,09) для местоположений с урожайностью ниже 2000 кг га-1 (W1, W2, P, I1 и J1). Разница в урожайности составила 12% в пользу трансгенного объекта. Для категорий более высокой урожайности не было обнаружено значимых различий между объектом и контролем, что свидетельствует об отсутствии ухудшения условий среднего (2000-3000 кг га-1) (I2, G1, G2, J2 и K) или высокого потенциала урожайности (>3000 кг га-1) (D2, C, Q2, L, A и F) (таблица 5).
Эти результаты подтвердили наличие ожидаемого взаимодействия генотип-окружающие условия (p=0,02) из-за различной комбинации абиотических стрессов, специфичной для каждого местоположения, или окружающих условий, и показали, что чувствительность к этим факторам у трансгенного объекта конкретно связана с характеристиками, связанными с механизмом действия генов.
Урожайности, наблюдаемые для объекта IND-00410-5 и его контроля, анализировали в отдельных местоположениях, поскольку конкретные окружающие условия играют ключевую роль в экспрессии фенотипа, связанного с введенным геном. Эффективность введенного гена оценивали на протяжении трех вегетационных периодов в разных местоположениях и в разные сроки посева, всего было оценено 16 местоположений.
Двенадцать из шестнадцати местоположений соответствуют вегетационному периоду 2012-2013 гг., причем были измерены все агрономические параметры, как у трансгенного объекта, так и у контроля, а также у сортов, использованных в качестве эталона. В указанный вегетационный период урожайность в северных и южных основных районах была значительно выше, чем в предыдущих вегетационных периодах, более того, исторические урожайности, никогда ранее не достигаемые, наблюдались на изолированных участках земли (Bolsa de Cereales, 2013). Четыре оставшихся местоположения соответствуют исследованиям, проведенным в предыдущие вегетационные периоды для определения эффективности объекта по сравнению с контролем. Эти четыре исследования соответствуют следующим местоположениям: Hughes, Santa Fe (местоположение L, 2011-2012 гг.), Quimili, Santiago del Estero (2009-2010 гг., местоположение K) и Liborio Luna, San Luis (2009-2010 гг.) c двумя гидрологическими условиями: низкая доступность (J1) и высокая доступность (J2). Данные анализировали с помощью дисперсионного анализа, используя местоположения и генотипы в качестве факторов и оценивая значимость взаимодействия генотип- окружающие условия. «Апостериорные» сравнения были выполнены с использованием теста на минимальные значимые различия (LSD).
Результаты подтвердили наличие взаимодействия генотип-окружающие условия (p=0,02) для оцениваемых местоположений. Трансгенный объект характеризовался большей урожайностью в одиннадцати из шестнадцати местоположений, со средней разницей в 11% для местоположений с положительными значениями различий (фиг. 13).
Ответную реакцию на введенный ген по показателю урожайности также оценивали относительно контроля в местоположениях, сгруппированных по категориям урожайности. Группирование местоположений с одинаковыми категориями позволяет оценить ответную реакцию на объект при различных условиях потенциальной урожайности. Большая урожайность была достигнута с трансгенным объектом по сравнению с контролем с уровнем значимости=10% (p=0,09) для местоположений с урожайностью ниже 2000 кг га-1 (W1, W2, P, I1 и J1). Разница в урожайности составила 12% в пользу трансгенного объекта. Для категорий более высокой урожайности не было обнаружено значимых различий между объектом и контролем, что свидетельствует об отсутствии ухудшения условий среднего (2000-3000 кг га-1) (I2, G1, G2, J2 и K) или высокого (>3000 кг га-1) (D2, C, Q2, L, A и F) (таблица 5) потенциала урожайности.
Таблица 5. Средняя урожайность для трансгенного объекта и контроля для условий низкого, среднего и высокого потенциала урожайности
*: указывает на значимые различия (α=0,1) NS: незначимые различия
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> BIOCERES, INC.
Chiozza, Mariana
Dezar, Carlos
Miranda, Patricia
Vazquez, Martin
Watson, Geronimo
<120> ТРАНСГЕННЫЙ ОБЪЕКТ IND-00410-5 У СОИ
<130> ТРАНСГЕННЫЙ ОБЪЕКТ IND-00410-5 У СОИ
<160> 43
<170> Патент в версии 3.5
<210> 1
<211> 4623
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Вставка и фланкирующие области
<400> 1
tggcaggata tattgtggtg taaacaaatt gacgcttaga caacttaata acacattgcg 60
gacgttttta atgtactgaa ttaacgccga attgctctag cattcgccat tcaggctgcg 120
caactgttgg gaagggcgat cggtgcgggc ctcttcgcta ttacgccagc tggcgaaagg 180
gggatgtgct gcaaggcgat taagttgggt aacgccaggg ttttcccagt cacgacgttg 240
taaaacgacg gccagtgcca agctaattcg cttcaagacg tgctcaaatc actatttcca 300
cacccctata tttctattgc actccctttt aactgttttt tattacaaaa atgccctgga 360
aaatgcactc cctttttgtg tttgtttttt tgtgaaacga tgttgtcagg taatttattt 420
gtcagtctac tatggtggcc cattatatta atagcaactg tcggtccaat agacgacgtc 480
gattttctgc atttgtttaa ccacgtggat tttatgacat tttatattag ttaatttgta 540
aaacctaccc aattaaagac ctcatatgtt ctaaagacta atacttaatg ataacaattt 600
tcttttagtg aagaaaggga taattagtaa atatggaaca agggcagaag atttattaaa 660
gccgcggtaa gagacaacaa gtaggtacgt ggagtgtctt aggtgactta cccacataac 720
ataaagtgac attaacaaac atagctaatg ctcctatttg aatagtgcat atcagcatac 780
cttattacat atagatagga gcaaactcta gctagattgt tgagcagatc tcggtgacgg 840
gcaggaccgg acggggcggt accggcaggc tgaagtccag ctgccagaaa cccacgtcat 900
gccagttccc gtgcttgaag ccggccgccc gcagcatgcc gcggggggca tatccgagcg 960
cctcgtgcat gcgcacgctc gggtcgttgg gcagcccgat gacagcgacc acgctcttga 1020
agccctgtgc ctccagggac ttcagcaggt gggtgtagag cgtggagccc agtcccgtcc 1080
gctggtggcg gggggagacg tacacggtcg actcggccgt ccagtcgtag gcgttgcgtg 1140
ccttccaggg gcccgcgtag gcgatgccgg cgacctcgcc gtccacctcg gcgacgagcc 1200
agggatagcg ctcccgcaga cggacgaggt cgtccgtcca ctcctgcggt tcctgcggct 1260
cggtacggaa gttgaccgtg cttgtctcga tgtagtggtt gacgatggtg cagaccgccg 1320
gcatgtccgc ctcggtggca cggcggatgt cggccgggcg tcgttctggg ctcatggtag 1380
atcccccgtt cgtaaatggt gaaaattttc agaaaattgc ttttgcttta aaagaaatga 1440
tttaaattgc tgcaatagaa gtagaatgct tgattgcttg agattcgttt gttttgtata 1500
tgttgtgttg agaattaatt ctcgaggtcc tctccaaatg aaatgaactt ccttatatag 1560
aggaagggtc ttgcgaagga tagtgggatt gtgcgtcatc ccttacgtca gtggagatat 1620
cacatcaatc cacttgcttt gaagacgtgg ttggaacgtc ttctttttcc acgatgctcc 1680
tcgtgggtgg gggtccatct ttgggaccac tgtcggtaga ggcatcttga acgatagcct 1740
ttcctttatc gcaatgatgg catttgtagg agccaccttc cttttccact atcttcacaa 1800
taaagtgaca gatagctggg caatggaatc cgaggaggtt tccggatatt accctttgtt 1860
gaaaagtctc aattgccctt tggtcttctg agactgtatc tttgatattt ttggagtaga 1920
caagtgtgtc gtgctccacc atgttatcac atcaatccac ttgctttgaa gacgtggttg 1980
gaacgtcttc tttttccacg atgctcctcg tgggtggggg tccatctttg ggaccactgt 2040
cggcagaggc atcttcaacg atggcctttc ctttatcgca atgatggcat ttgtaggagc 2100
caccttcctt ttccactatc ttcacaataa agtgacagat agctgggcaa tggaatccga 2160
ggaggtttcc ggatattacc ctttgttgaa aagtctcaat tgccctttgg tcttctgaga 2220
ctgtatcttt gatatttttg gagtagacaa gtgtgtcgtg ctccaccatg ttgacctgca 2280
ggtcgacacc tggcacatcg tatcttatct cttttgtcgt ttccaacaca ccacaacaca 2340
cctacaaacg tgtcaattca cacttcacca atttcatttc cttttagtca atcatattaa 2400
aagtagtagc ccccaccccc atttgttacc taccatttcc cactttaata atcacccacg 2460
ctatgtccac ttgtactttt gtttgcacac aactcttccc ataaaatatc aaaccaaatt 2520
ttttttagtg gaaaacaaat tccccaaata gaatactaac gaaattcatc gcatcagaat 2580
acactcatct ctgaacagtg gcgaagcttg acgttttcga cggggggtcg gaaaacgtat 2640
gtacccgaaa tttctataga atcggggggt cgaaaacgta tatacccaaa atttctatac 2700
gaaaactaca tatataacac tactgagcaa aaagttcggg ggttcgggcg cccctcccgg 2760
ccccttcaaa gcttcgccaa tgtctctgaa ccgaagaaaa ccctcactcg tctactagcc 2820
aatgaatcct caccagggaa aaccctcact cgtcttactg gactattggc gcttccaaat 2880
ggactacttg cgaaattcac cacattggga tacactcgtc tactgcggtg aggtaaaacc 2940
cgcttggttc aaggatcgaa ctagcgattg ctgcctactc gcctaatctc ccatcatcaa 3000
caggtgccgc cgaaacaaaa tgctgggggc gggagttgaa cctaggtcca gtgacgcacc 3060
catgaatttt ttttctaggg atgcgaacga gtggtttaac catactttta agaggtgcga 3120
tcggaaattt tacctataaa atacactaaa aaagttccaa gggtccaccc accccttaac 3180
ctaagtccgc ctttgtctgg atcacgtgaa acatcaggtc tctcccttac cagtccagct 3240
acgactcatt gacaaaatat caaaaccata tgattttgag ttttatctca accgaaagtg 3300
acatcatgac agagaatcga cataaccaaa acgtgtaaac gtacaactca ccattgcgtt 3360
gaaaaggaca aaacaggtag gattcttgtc aaattcaacg cgtacacctg tgcttcatct 3420
aaaccccata cttttaagaa cctttataaa gaccactcac tatatataca catatataat 3480
atcacttatc aaaccctcgg atccaccatg tctcttcaac aagtaacaac caccaggaag 3540
aaccgaaacg aggggcggag acgatttacc gacaaacaaa taagtttcct agagtacatg 3600
tttgagacac agtcgagacc cgagttaagg atgaaacacc agttggcaca taaactcggg 3660
cttcatcctc gtcaagtggc gatatggttc cagaacaaac gcgcgcgatc aaagtcgagg 3720
cagattgagc aagagtataa cgcgctaaag cataactacg agacgcttgc gtctaaatcc 3780
gagtctctaa agaaagagaa tcaggcccta ctcaatcaat tggaggtgct gagaaatgta 3840
gccgaaaagc atcaagagaa aactagtagt agtggcagcg gtgaagaatc ggatgatcgg 3900
tttacgaact ctccggacgt tatgtttggt caagaaatga atgttccgtt ttgcgacggt 3960
tttgcgtacc ttgaagaagg aaacagtttg ttggagattg aagaacaact gccagacctt 4020
caaaagtggt gggagttcta agagctcgaa tttccccgat cgttcaaaca tttggcaata 4080
aagtttctta agattgaatc ctgttgccgg tcttgcgatg attatcatat aatttctgtt 4140
gaattacgtt aagcatgtaa taattaacat gtaatgcatg acgttattta tgagatgggt 4200
ttttatgatt agagtcccgc aattatacat ttaatacgcg atagaaaaca aaatatagcg 4260
cgcaaactag gataaattat cgcgcgcggt gtcatctatg ttactagatc gggaattcgt 4320
aatcatgtca tagctgtttc ctgtgtgaaa ttgttatccg ctcacaattc cacacaacat 4380
acgagccgga agcataaagt gtaaagcctg gggtgcctaa tgagtgagct aactcacatt 4440
aattgcgttg cgctcactgc ccgctttcca gtcgggaaac ctgtcgtgcc agctgcatta 4500
atgaatcggc caacgcgcgg ggagaggcgg tttgcgtatt ggagcttgag cttggatcag 4560
attgtcgttt cccgccttca gtttaaacta tcagtgtttg acaggatata ttggcgggta 4620
aac 4623
<210> 2
<211> 139
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность правого стыка
<400> 2
tgacaggata tattggcggg taaacctaag agaaaagagc gtttattaga ataatcggat 60
atttaaaagg gcgtgaaaag gtttatccgt tcgtccattt gtatgtgcat gccaaccaca 120
gggttcccct cgggatcaa 139
<210> 3
<211> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность левого стыка
<400> 3
cgaattgatc acaggcagca acgctctgtc atcgttacaa tcaacatgct accctccgcg 60
agatcatccg tgtttcaaac ccggcagctt agttgccgtt cttccgaata gcatcggtaa 120
catgagcaaa gtctgccgcc ttacaacggc tctcccgctg acgccgtccc ggactgatgg 180
gctgcctgta tcgagtggtg attttgtgcc gagctgccgg tcggggagct gttggctggc 240
tggtggcagg atatattgtg gtgtaaac 268
<210> 4
<211> 4573
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность вставки
<400> 4
aaattgacgc ttagacaact taataacaca ttgcggacgt ttttaatgta ctgaattaac 60
gccgaattgc tctagcattc gccattcagg ctgcgcaact gttgggaagg gcgatcggtg 120
cgggcctctt cgctattacg ccagctggcg aaagggggat gtgctgcaag gcgattaagt 180
tgggtaacgc cagggttttc ccagtcacga cgttgtaaaa cgacggccag tgccaagcta 240
attcgcttca agacgtgctc aaatcactat ttccacaccc ctatatttct attgcactcc 300
cttttaactg ttttttatta caaaaatgcc ctggaaaatg cactcccttt ttgtgtttgt 360
ttttttgtga aacgatgttg tcaggtaatt tatttgtcag tctactatgg tggcccatta 420
tattaatagc aactgtcggt ccaatagacg acgtcgattt tctgcatttg tttaaccacg 480
tggattttat gacattttat attagttaat ttgtaaaacc tacccaatta aagacctcat 540
atgttctaaa gactaatact taatgataac aattttcttt tagtgaagaa agggataatt 600
agtaaatatg gaacaagggc agaagattta ttaaagccgc ggtaagagac aacaagtagg 660
tacgtggagt gtcttaggtg acttacccac ataacataaa gtgacattaa caaacatagc 720
taatgctcct atttgaatag tgcatatcag cataccttat tacatataga taggagcaaa 780
ctctagctag attgttgagc agatctcggt gacgggcagg accggacggg gcggtaccgg 840
caggctgaag tccagctgcc agaaacccac gtcatgccag ttcccgtgct tgaagccggc 900
cgcccgcagc atgccgcggg gggcatatcc gagcgcctcg tgcatgcgca cgctcgggtc 960
gttgggcagc ccgatgacag cgaccacgct cttgaagccc tgtgcctcca gggacttcag 1020
caggtgggtg tagagcgtgg agcccagtcc cgtccgctgg tggcgggggg agacgtacac 1080
ggtcgactcg gccgtccagt cgtaggcgtt gcgtgccttc caggggcccg cgtaggcgat 1140
gccggcgacc tcgccgtcca cctcggcgac gagccaggga tagcgctccc gcagacggac 1200
gaggtcgtcc gtccactcct gcggttcctg cggctcggta cggaagttga ccgtgcttgt 1260
ctcgatgtag tggttgacga tggtgcagac cgccggcatg tccgcctcgg tggcacggcg 1320
gatgtcggcc gggcgtcgtt ctgggctcat ggtagatccc ccgttcgtaa atggtgaaaa 1380
ttttcagaaa attgcttttg ctttaaaaga aatgatttaa attgctgcaa tagaagtaga 1440
atgcttgatt gcttgagatt cgtttgtttt gtatatgttg tgttgagaat taattctcga 1500
ggtcctctcc aaatgaaatg aacttcctta tatagaggaa gggtcttgcg aaggatagtg 1560
ggattgtgcg tcatccctta cgtcagtgga gatatcacat caatccactt gctttgaaga 1620
cgtggttgga acgtcttctt tttccacgat gctcctcgtg ggtgggggtc catctttggg 1680
accactgtcg gtagaggcat cttgaacgat agcctttcct ttatcgcaat gatggcattt 1740
gtaggagcca ccttcctttt ccactatctt cacaataaag tgacagatag ctgggcaatg 1800
gaatccgagg aggtttccgg atattaccct ttgttgaaaa gtctcaattg ccctttggtc 1860
ttctgagact gtatctttga tatttttgga gtagacaagt gtgtcgtgct ccaccatgtt 1920
atcacatcaa tccacttgct ttgaagacgt ggttggaacg tcttcttttt ccacgatgct 1980
cctcgtgggt gggggtccat ctttgggacc actgtcggca gaggcatctt caacgatggc 2040
ctttccttta tcgcaatgat ggcatttgta ggagccacct tccttttcca ctatcttcac 2100
aataaagtga cagatagctg ggcaatggaa tccgaggagg tttccggata ttaccctttg 2160
ttgaaaagtc tcaattgccc tttggtcttc tgagactgta tctttgatat ttttggagta 2220
gacaagtgtg tcgtgctcca ccatgttgac ctgcaggtcg acacctggca catcgtatct 2280
tatctctttt gtcgtttcca acacaccaca acacacctac aaacgtgtca attcacactt 2340
caccaatttc atttcctttt agtcaatcat attaaaagta gtagccccca cccccatttg 2400
ttacctacca tttcccactt taataatcac ccacgctatg tccacttgta cttttgtttg 2460
cacacaactc ttcccataaa atatcaaacc aaattttttt tagtggaaaa caaattcccc 2520
aaatagaata ctaacgaaat tcatcgcatc agaatacact catctctgaa cagtggcgaa 2580
gcttgacgtt ttcgacgggg ggtcggaaaa cgtatgtacc cgaaatttct atagaatcgg 2640
ggggtcgaaa acgtatatac ccaaaatttc tatacgaaaa ctacatatat aacactactg 2700
agcaaaaagt tcgggggttc gggcgcccct cccggcccct tcaaagcttc gccaatgtct 2760
ctgaaccgaa gaaaaccctc actcgtctac tagccaatga atcctcacca gggaaaaccc 2820
tcactcgtct tactggacta ttggcgcttc caaatggact acttgcgaaa ttcaccacat 2880
tgggatacac tcgtctactg cggtgaggta aaacccgctt ggttcaagga tcgaactagc 2940
gattgctgcc tactcgccta atctcccatc atcaacaggt gccgccgaaa caaaatgctg 3000
ggggcgggag ttgaacctag gtccagtgac gcacccatga attttttttc tagggatgcg 3060
aacgagtggt ttaaccatac ttttaagagg tgcgatcgga aattttacct ataaaataca 3120
ctaaaaaagt tccaagggtc cacccacccc ttaacctaag tccgcctttg tctggatcac 3180
gtgaaacatc aggtctctcc cttaccagtc cagctacgac tcattgacaa aatatcaaaa 3240
ccatatgatt ttgagtttta tctcaaccga aagtgacatc atgacagaga atcgacataa 3300
ccaaaacgtg taaacgtaca actcaccatt gcgttgaaaa ggacaaaaca ggtaggattc 3360
ttgtcaaatt caacgcgtac acctgtgctt catctaaacc ccatactttt aagaaccttt 3420
ataaagacca ctcactatat atacacatat ataatatcac ttatcaaacc ctcggatcca 3480
ccatgtctct tcaacaagta acaaccacca ggaagaaccg aaacgagggg cggagacgat 3540
ttaccgacaa acaaataagt ttcctagagt acatgtttga gacacagtcg agacccgagt 3600
taaggatgaa acaccagttg gcacataaac tcgggcttca tcctcgtcaa gtggcgatat 3660
ggttccagaa caaacgcgcg cgatcaaagt cgaggcagat tgagcaagag tataacgcgc 3720
taaagcataa ctacgagacg cttgcgtcta aatccgagtc tctaaagaaa gagaatcagg 3780
ccctactcaa tcaattggag gtgctgagaa atgtagccga aaagcatcaa gagaaaacta 3840
gtagtagtgg cagcggtgaa gaatcggatg atcggtttac gaactctccg gacgttatgt 3900
ttggtcaaga aatgaatgtt ccgttttgcg acggttttgc gtaccttgaa gaaggaaaca 3960
gtttgttgga gattgaagaa caactgccag accttcaaaa gtggtgggag ttctaagagc 4020
tcgaatttcc ccgatcgttc aaacatttgg caataaagtt tcttaagatt gaatcctgtt 4080
gccggtcttg cgatgattat catataattt ctgttgaatt acgttaagca tgtaataatt 4140
aacatgtaat gcatgacgtt atttatgaga tgggttttta tgattagagt cccgcaatta 4200
tacatttaat acgcgataga aaacaaaata tagcgcgcaa actaggataa attatcgcgc 4260
gcggtgtcat ctatgttact agatcgggaa ttcgtaatca tgtcatagct gtttcctgtg 4320
tgaaattgtt atccgctcac aattccacac aacatacgag ccggaagcat aaagtgtaaa 4380
gcctggggtg cctaatgagt gagctaactc acattaattg cgttgcgctc actgcccgct 4440
ttccagtcgg gaaacctgtc gtgccagctg cattaatgaa tcggccaacg cgcggggaga 4500
ggcggtttgc gtattggagc ttgagcttgg atcagattgt cgtttcccgc cttcagttta 4560
aactatcagt gtt 4573
<210> 5
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер 750
<400> 5
acgcaactga actcagacca 20
<210> 6
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер 751
<400> 6
aagtggcgat atggttccag 20
<210> 7
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер 752
<400> 7
ggctgcaagt tttggtcaat 20
<210> 8
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер 753
<400> 8
ttcggctaca tttctcagca 20
<210> 9
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер 754
<400> 9
agccaatgaa tcctcaccag 20
<210> 10
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер 755
<400> 10
attaggcgag taggcagcaa 20
<210> 11
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер 756
<400> 11
caacacacct acaaacgtgt ca 22
<210> 12
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер 757
<400> 12
gggtgggggc tactactttt 20
<210> 13
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер 758
<400> 13
cttcagcagg tgggtgtaga g 21
<210> 14
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер 759
<400> 14
agtcgaccgt gtacgtctcc 20
<210> 15
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер 760
<400> 15
gttgggtcag cctgagtgat 20
<210> 16
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер 2527
<400> 16
cgcttgcgtc taaatccgag tctc 24
<210> 17
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер 203
<400> 17
caagaccggc aacaggattc 20
<210> 18
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер 378
<400> 18
atatggcgct gatctctgct 20
<210> 19
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер 1970
<400> 19
ggcggtctgc accatcgtca 20
<210> 20
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер 1747
<400> 20
aagacgacca tcgcaaccca tcta 24
<210> 21
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер 1748
<400> 21
tagccttcca tccgtgacct caat 24
<210> 22
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер 1745
<400> 22
agctgattgg atgtaccgcg agat 24
<210> 23
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер 1746
<400> 23
ttcaaatcgt actccggcag gtca 24
<210> 24
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер 822
<400> 24
atcaaacatc gacccacggc gtaa 24
<210> 25
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер 1127
<400> 25
gatcaattcg ggcacgaacc cagt 24
<210> 26
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер 817
<400> 26
gcaactgaac tcagaccact g 21
<210> 27
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер 27
<400> 27
gagcttgagc ttggatcaga 20
<210> 28
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Зонд 819
<400> 28
ttgtcgtttc ccgccttcag tttaa 25
<210> 29
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер 868
<400> 29
ccgcaatgtg ttattaagtt gtc 23
<210> 30
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер 752
<400> 30
ggctgcaagt tttggtcaat 20
<210> 31
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер 530
<400> 31
cgccacttga cgaggatga 19
<210> 32
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер 531
<400> 32
cgagacccga gttaaggatg aaac 24
<210> 33
<211> 25
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Зонд 532
<400> 33
agcccgagtt tatgtgccaa ctggt 25
<210> 34
<211> 22
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер 527
<400> 34
ctgcaccatc gtcaaccact ac 22
<210> 35
<211> 19
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер 528
<400> 35
ggtcgtccgt ccactcctg 19
<210> 36
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Зонд 529
<400> 36
tcgagacaag cacggtcaac ttcc 24
<210> 37
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер 718
<400> 37
ctactgacca gcaaggcaaa 20
<210> 38
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер 719
<400> 38
tcacaatagc gtctccttgg 20
<210> 39
<211> 21
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Зонд 720
<400> 39
tcgtgccgaa gcaaccaaac a 21
<210> 40
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер 934
<400> 40
agaccactga aatagagaga aag 23
<210> 41
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер 935
<400> 41
ggagttctga taattgttat cgtc 24
<210> 42
<211> 24
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Зонд 936
<400> 42
tgaagtgaga tgattgaggg tggg 24
<210> 43
<211> 11133
<212> ДНК
<213> Искусственная последовательность
<220>
<223> ДНК-плазмида
<400> 43
agtactttga tccaacccct ccgctgctat agtgcagtcg gcttctgacg ttcagtgcag 60
ccgtcttctg aaaacgacat gtcgcacaag tcctaagtta cgcgacaggc tgccgccctg 120
cccttttcct ggcgttttct tgtcgcgtgt tttagtcgca taaagtagaa tacttgcgac 180
tagaaccgga gacattacgc catgaacaag agcgccgccg ctggcctgct gggctatgcc 240
cgcgtcagca ccgacgacca ggacttgacc aaccaacggg ccgaactgca cgcggccggc 300
tgcaccaagc tgttttccga gaagatcacc ggcaccaggc gcgaccgccc ggagctggcc 360
aggatgcttg accacctacg ccctggcgac gttgtgacag tgaccaggct agaccgcctg 420
gcccgcagca cccgcgacct actggacatt gccgagcgca tccaggaggc cggcgcgggc 480
ctgcgtagcc tggcagagcc gtgggccgac accaccacgc cggccggccg catggtgttg 540
accgtgttcg ccggcattgc cgagttcgag cgttccctaa tcatcgaccg cacccggagc 600
gggcgcgagg ccgccaaggc ccgaggcgtg aagtttggcc cccgccctac cctcaccccg 660
gcacagatcg cgcacgcccg cgagctgatc gaccaggaag gccgcaccgt gaaagaggcg 720
gctgcactgc ttggcgtgca tcgctcgacc ctgtaccgcg cacttgagcg cagcgaggaa 780
gtgacgccca ccgaggccag gcggcgcggt gccttccgtg aggacgcatt gaccgaggcc 840
gacgccctgg cggccgccga gaatgaacgc caagaggaac aagcatgaaa ccgcaccagg 900
acggccagga cgaaccgttt ttcattaccg aagagatcga ggcggagatg atcgcggccg 960
ggtacgtgtt cgagccgccc gcgcacgtct caaccgtgcg gctgcatgaa atcctggccg 1020
gtttgtctga tgccaagctg gcggcctggc cggccagctt ggccgctgaa gaaaccgagc 1080
gccgccgtct aaaaaggtga tgtgtatttg agtaaaacag cttgcgtcat gcggtcgctg 1140
cgtatatgat gcgatgagta aataaacaaa tacgcaaggg gaacgcatga aggttatcgc 1200
tgtacttaac cagaaaggcg ggtcaggcaa gacgaccatc gcaacccatc tagcccgcgc 1260
cctgcaactc gccggggccg atgttctgtt agtcgattcc gatccccagg gcagtgcccg 1320
cgattgggcg gccgtgcggg aagatcaacc gctaaccgtt gtcggcatcg accgcccgac 1380
gattgaccgc gacgtgaagg ccatcggccg gcgcgacttc gtagtgatcg acggagcgcc 1440
ccaggcggcg gacttggctg tgtccgcgat caaggcagcc gacttcgtgc tgattccggt 1500
gcagccaagc ccttacgaca tatgggccac cgccgacctg gtggagctgg ttaagcagcg 1560
cattgaggtc acggatggaa ggctacaagc ggcctttgtc gtgtcgcggg cgatcaaagg 1620
cacgcgcatc ggcggtgagg ttgccgaggc gctggccggg tacgagctgc ccattcttga 1680
gtcccgtatc acgcagcgcg tgagctaccc aggcactgcc gccgccggca caaccgttct 1740
tgaatcagaa cccgagggcg acgctgcccg cgaggtccag gcgctggccg ctgaaattaa 1800
atcaaaactc atttgagtta atgaggtaaa gagaaaatga gcaaaagcac aaacacgcta 1860
agtgccggcc gtccgagcgc acgcagcagc aaggctgcaa cgttggccag cctggcagac 1920
acgccagcca tgaagcgggt caactttcag ttgccggcgg aggatcacac caagctgaag 1980
atgtacgcgg tacgccaagg caagaccatt accgagctgc tatctgaata catcgcgcag 2040
ctaccagagt aaatgagcaa atgaataaat gagtagatga attttagcgg ctaaaggagg 2100
cggcatggaa aatcaagaac aaccaggcac cgacgccgtg gaatgcccca tgtgtggagg 2160
aacgggcggt tggccaggcg taagcggctg ggttgtctgc cggccctgca atggcactgg 2220
aacccccaag cccgaggaat cggcgtgagc ggtcgcaaac catccggccc ggtacaaatc 2280
ggcgcggcgc tgggtgatga cctggtggag aagttgaagg ccgcgcaggc cgcccagcgg 2340
caacgcatcg aggcagaagc acgccccggt gaatcgtggc aagcggccgc tgatcgaatc 2400
cgcaaagaat cccggcaacc gccggcagcc ggtgcgccgt cgattaggaa gccgcccaag 2460
ggcgacgagc aaccagattt tttcgttccg atgctctatg acgtgggcac ccgcgatagt 2520
cgcagcatca tggacgtggc cgttttccgt ctgtcgaagc gtgaccgacg agctggcgag 2580
gtgatccgct acgagcttcc agacgggcac gtagaggttt ccgcagggcc ggccggcatg 2640
gccagtgtgt gggattacga cctggtactg atggcggttt cccatctaac cgaatccatg 2700
aaccgatacc gggaagggaa gggagacaag cccggccgcg tgttccgtcc acacgttgcg 2760
gacgtactca agttctgccg gcgagccgat ggcggaaagc agaaagacga cctggtagaa 2820
acctgcattc ggttaaacac cacgcacgtt gccatgcagc gtacgaagaa ggccaagaac 2880
ggccgcctgg tgacggtatc cgagggtgaa gccttgatta gccgctacaa gatcgtaaag 2940
agcgaaaccg ggcggccgga gtacatcgag atcgagctag ctgattggat gtaccgcgag 3000
atcacagaag gcaagaaccc ggacgtgctg acggttcacc ccgattactt tttgatcgat 3060
cccggcatcg gccgttttct ctaccgcctg gcacgccgcg ccgcaggcaa ggcagaagcc 3120
agatggttgt tcaagacgat ctacgaacgc agtggcagcg ccggagagtt caagaagttc 3180
tgtttcaccg tgcgcaagct gatcgggtca aatgacctgc cggagtacga tttgaaggag 3240
gaggcggggc aggctggccc gatcctagtc atgcgctacc gcaacctgat cgagggcgaa 3300
gcatccgccg gttcctaatg tacggagcag atgctagggc aaattgccct agcaggggaa 3360
aaaggtcgaa aaggtctctt tcctgtggat agcacgtaca ttgggaaccc aaagccgtac 3420
attgggaacc ggaacccgta cattgggaac ccaaagccgt acattgggaa ccggtcacac 3480
atgtaagtga ctgatataaa agagaaaaaa ggcgattttt ccgcctaaaa ctctttaaaa 3540
cttattaaaa ctcttaaaac ccgcctggcc tgtgcataac tgtctggcca gcgcacagcc 3600
gaagagctgc aaaaagcgcc tacccttcgg tcgctgcgct ccctacgccc cgccgcttcg 3660
cgtcggccta tcgcggccgc tggccgctca aaaatggctg gcctacggcc aggcaatcta 3720
ccagggcgcg gacaagccgc gccgtcgcca ctcgaccgcc ggcgcccaca tcaaggcacc 3780
ctgcctcgcg cgtttcggtg atgacggtga aaacctctga cacatgcagc tcccggagac 3840
ggtcacagct tgtctgtaag cggatgccgg gagcagacaa gcccgtcagg gcgcgtcagc 3900
gggtgttggc gggtgtcggg gcgcagccat gacccagtca cgtagcgata gcggagtgta 3960
tactggctta actatgcggc atcagagcag attgtactga gagtgcacca tatgcggtgt 4020
gaaataccgc acagatgcgt aaggagaaaa taccgcatca ggcgctcttc cgcttcctcg 4080
ctcactgact cgctgcgctc ggtcgttcgg ctgcggcgag cggtatcagc tcactcaaag 4140
gcggtaatac ggttatccac agaatcaggg gataacgcag gaaagaacat gtgagcaaaa 4200
ggccagcaaa aggccaggaa ccgtaaaaag gccgcgttgc tggcgttttt ccataggctc 4260
cgcccccctg acgagcatca caaaaatcga cgctcaagtc agaggtggcg aaacccgaca 4320
ggactataaa gataccaggc gtttccccct ggaagctccc tcgtgcgctc tcctgttccg 4380
accctgccgc ttaccggata cctgtccgcc tttctccctt cgggaagcgt ggcgctttct 4440
catagctcac gctgtaggta tctcagttcg gtgtaggtcg ttcgctccaa gctgggctgt 4500
gtgcacgaac cccccgttca gcccgaccgc tgcgccttat ccggtaacta tcgtcttgag 4560
tccaacccgg taagacacga cttatcgcca ctggcagcag ccactggtaa caggattagc 4620
agagcgaggt atgtaggcgg tgctacagag ttcttgaagt ggtggcctaa ctacggctac 4680
actagaagga cagtatttgg tatctgcgct ctgctgaagc cagttacctt cggaaaaaga 4740
gttggtagct cttgatccgg caaacaaacc accgctggta gcggtggttt ttttgtttgc 4800
aagcagcaga ttacgcgcag aaaaaaagga tctcaagaag atcctttgat cttttctacg 4860
gggtctgacg ctcagtggaa cgaaaactca cgttaaggga ttttggtcat gcatgatata 4920
tctcccaatt tgtgtagggc ttattatgca cgcttaaaaa taataaaagc agacttgacc 4980
tgatagtttg gctgtgagca attatgtgct tagtgcatct aacgcttgag ttaagccgcg 5040
ccgcgaagcg gcgtcggctt gaacgaattt ctagctagac attatttgcc gactaccttg 5100
gtgatctcgc ctttcacgta gtggacaaat tcttccaact gatctgcgcg cgaggccaag 5160
cgatcttctt cttgtccaag ataagcctgt ctagcttcaa gtatgacggg ctgatactgg 5220
gccggcaggc gctccattgc ccagtcggca gcgacatcct tcggcgcgat tttgccggtt 5280
actgcgctgt accaaatgcg ggacaacgta agcactacat ttcgctcatc gccagcccag 5340
tcgggcggcg agttccatag cgttaaggtt tcatttagcg cctcaaatag atcctgttca 5400
ggaaccggat caaagagttc ctccgccgct ggacctacca aggcaacgct atgttctctt 5460
gcttttgtca gcaagatagc cagatcaatg tcgatcgtgg ctggctcgaa gatacctgca 5520
agaatgtcat tgcgctgcca ttctccaaat tgcagttcgc gcttagctgg ataacgccac 5580
ggaatgatgt cgtcgtgcac aacaatggtg acttctacag cgcggagaat ctcgctctct 5640
ccaggggaag ccgaagtttc caaaaggtcg ttgatcaaag ctcgccgcgt tgtttcatca 5700
agccttacgg tcaccgtaac cagcaaatca atatcactgt gtggcttcag gccgccatcc 5760
actgcggagc cgtacaaatg tacggccagc aacgtcggtt cgagatggcg ctcgatgacg 5820
ccaactacct ctgatagttg agtcgatact tcggcgatca ccgcttcccc catgatgttt 5880
aactttgttt tagggcgact gccctgctgc gtaacatcgt tgctgctcca taacatcaaa 5940
catcgaccca cggcgtaacg cgcttgctgc ttggatgccc gaggcataga ctgtacccca 6000
aaaaaacagt cataacaagc catgaaaacc gccactgcgc cgttaccacc gctgcgttcg 6060
gtcaaggttc tggaccagtt gcgtgacggc agttacgcta cttgcattac agcttacgaa 6120
ccgaacgagg cttatgtcca ctgggttcgt gcccgaattg atcacaggca gcaacgctct 6180
gtcatcgtta caatcaacat gctaccctcc gcgagatcat ccgtgtttca aacccggcag 6240
cttagttgcc gttcttccga atagcatcgg taacatgagc aaagtctgcc gccttacaac 6300
ggctctcccg ctgacgccgt cccggactga tgggctgcct gtatcgagtg gtgattttgt 6360
gccgagctgc cggtcgggga gctgttggct ggctggtggc aggatatatt gtggtgtaaa 6420
caaattgacg cttagacaac ttaataacac attgcggacg tttttaatgt actgaattaa 6480
cgccgaattg ctctagcatt cgccattcag gctgcgcaac tgttgggaag ggcgatcggt 6540
gcgggcctct tcgctattac gccagctggc gaaaggggga tgtgctgcaa ggcgattaag 6600
ttgggtaacg ccagggtttt cccagtcacg acgttgtaaa acgacggcca gtgccaagct 6660
aattcgcttc aagacgtgct caaatcacta tttccacacc cctatatttc tattgcactc 6720
ccttttaact gttttttatt acaaaaatgc cctggaaaat gcactccctt tttgtgtttg 6780
tttttttgtg aaacgatgtt gtcaggtaat ttatttgtca gtctactatg gtggcccatt 6840
atattaatag caactgtcgg tccaatagac gacgtcgatt ttctgcattt gtttaaccac 6900
gtggatttta tgacatttta tattagttaa tttgtaaaac ctacccaatt aaagacctca 6960
tatgttctaa agactaatac ttaatgataa caattttctt ttagtgaaga aagggataat 7020
tagtaaatat ggaacaaggg cagaagattt attaaagccg cggtaagaga caacaagtag 7080
gtacgtggag tgtcttaggt gacttaccca cataacataa agtgacatta acaaacatag 7140
ctaatgctcc tatttgaata gtgcatatca gcatacctta ttacatatag ataggagcaa 7200
actctagcta gattgttgag cagatctcgg tgacgggcag gaccggacgg ggcggtaccg 7260
gcaggctgaa gtccagctgc cagaaaccca cgtcatgcca gttcccgtgc ttgaagccgg 7320
ccgcccgcag catgccgcgg ggggcatatc cgagcgcctc gtgcatgcgc acgctcgggt 7380
cgttgggcag cccgatgaca gcgaccacgc tcttgaagcc ctgtgcctcc agggacttca 7440
gcaggtgggt gtagagcgtg gagcccagtc ccgtccgctg gtggcggggg gagacgtaca 7500
cggtcgactc ggccgtccag tcgtaggcgt tgcgtgcctt ccaggggccc gcgtaggcga 7560
tgccggcgac ctcgccgtcc acctcggcga cgagccaggg atagcgctcc cgcagacgga 7620
cgaggtcgtc cgtccactcc tgcggttcct gcggctcggt acggaagttg accgtgcttg 7680
tctcgatgta gtggttgacg atggtgcaga ccgccggcat gtccgcctcg gtggcacggc 7740
ggatgtcggc cgggcgtcgt tctgggctca tggtagatcc cccgttcgta aatggtgaaa 7800
attttcagaa aattgctttt gctttaaaag aaatgattta aattgctgca atagaagtag 7860
aatgcttgat tgcttgagat tcgtttgttt tgtatatgtt gtgttgagaa ttaattctcg 7920
aggtcctctc caaatgaaat gaacttcctt atatagagga agggtcttgc gaaggatagt 7980
gggattgtgc gtcatccctt acgtcagtgg agatatcaca tcaatccact tgctttgaag 8040
acgtggttgg aacgtcttct ttttccacga tgctcctcgt gggtgggggt ccatctttgg 8100
gaccactgtc ggtagaggca tcttgaacga tagcctttcc tttatcgcaa tgatggcatt 8160
tgtaggagcc accttccttt tccactatct tcacaataaa gtgacagata gctgggcaat 8220
ggaatccgag gaggtttccg gatattaccc tttgttgaaa agtctcaatt gccctttggt 8280
cttctgagac tgtatctttg atatttttgg agtagacaag tgtgtcgtgc tccaccatgt 8340
tatcacatca atccacttgc tttgaagacg tggttggaac gtcttctttt tccacgatgc 8400
tcctcgtggg tgggggtcca tctttgggac cactgtcggc agaggcatct tcaacgatgg 8460
cctttccttt atcgcaatga tggcatttgt aggagccacc ttccttttcc actatcttca 8520
caataaagtg acagatagct gggcaatgga atccgaggag gtttccggat attacccttt 8580
gttgaaaagt ctcaattgcc ctttggtctt ctgagactgt atctttgata tttttggagt 8640
agacaagtgt gtcgtgctcc accatgttga cctgcaggtc gacacctggc acatcgtatc 8700
ttatctcttt tgtcgtttcc aacacaccac aacacaccta caaacgtgtc aattcacact 8760
tcaccaattt catttccttt tagtcaatca tattaaaagt agtagccccc acccccattt 8820
gttacctacc atttcccact ttaataatca cccacgctat gtccacttgt acttttgttt 8880
gcacacaact cttcccataa aatatcaaac caaatttttt ttagtggaaa acaaattccc 8940
caaatagaat actaacgaaa ttcatcgcat cagaatacac tcatctctga acagtggcga 9000
agcttgacgt tttcgacggg gggtcggaaa acgtatgtac ccgaaatttc tatagaatcg 9060
gggggtcgaa aacgtatata cccaaaattt ctatacgaaa actacatata taacactact 9120
gagcaaaaag ttcgggggtt cgggcgcccc tcccggcccc ttcaaagctt cgccaatgtc 9180
tctgaaccga agaaaaccct cactcgtcta ctagccaatg aatcctcacc agggaaaacc 9240
ctcactcgtc ttactggact attggcgctt ccaaatggac tacttgcgaa attcaccaca 9300
ttgggataca ctcgtctact gcggtgaggt aaaacccgct tggttcaagg atcgaactag 9360
cgattgctgc ctactcgcct aatctcccat catcaacagg tgccgccgaa acaaaatgct 9420
gggggcggga gttgaaccta ggtccagtga cgcacccatg aatttttttt ctagggatgc 9480
gaacgagtgg tttaaccata cttttaagag gtgcgatcgg aaattttacc tataaaatac 9540
actaaaaaag ttccaagggt ccacccaccc cttaacctaa gtccgccttt gtctggatca 9600
cgtgaaacat caggtctctc ccttaccagt ccagctacga ctcattgaca aaatatcaaa 9660
accatatgat tttgagtttt atctcaaccg aaagtgacat catgacagag aatcgacata 9720
accaaaacgt gtaaacgtac aactcaccat tgcgttgaaa aggacaaaac aggtaggatt 9780
cttgtcaaat tcaacgcgta cacctgtgct tcatctaaac cccatacttt taagaacctt 9840
tataaagacc actcactata tatacacata tataatatca cttatcaaac cctcggatcc 9900
accatgtctc ttcaacaagt aacaaccacc aggaagaacc gaaacgaggg gcggagacga 9960
tttaccgaca aacaaataag tttcctagag tacatgtttg agacacagtc gagacccgag 10020
ttaaggatga aacaccagtt ggcacataaa ctcgggcttc atcctcgtca agtggcgata 10080
tggttccaga acaaacgcgc gcgatcaaag tcgaggcaga ttgagcaaga gtataacgcg 10140
ctaaagcata actacgagac gcttgcgtct aaatccgagt ctctaaagaa agagaatcag 10200
gccctactca atcaattgga ggtgctgaga aatgtagccg aaaagcatca agagaaaact 10260
agtagtagtg gcagcggtga agaatcggat gatcggttta cgaactctcc ggacgttatg 10320
tttggtcaag aaatgaatgt tccgttttgc gacggttttg cgtaccttga agaaggaaac 10380
agtttgttgg agattgaaga acaactgcca gaccttcaaa agtggtggga gttctaagag 10440
ctcgaatttc cccgatcgtt caaacatttg gcaataaagt ttcttaagat tgaatcctgt 10500
tgccggtctt gcgatgatta tcatataatt tctgttgaat tacgttaagc atgtaataat 10560
taacatgtaa tgcatgacgt tatttatgag atgggttttt atgattagag tcccgcaatt 10620
atacatttaa tacgcgatag aaaacaaaat atagcgcgca aactaggata aattatcgcg 10680
cgcggtgtca tctatgttac tagatcggga attcgtaatc atgtcatagc tgtttcctgt 10740
gtgaaattgt tatccgctca caattccaca caacatacga gccggaagca taaagtgtaa 10800
agcctggggt gcctaatgag tgagctaact cacattaatt gcgttgcgct cactgcccgc 10860
tttccagtcg ggaaacctgt cgtgccagct gcattaatga atcggccaac gcgcggggag 10920
aggcggtttg cgtattggag cttgagcttg gatcagattg tcgtttcccg ccttcagttt 10980
aaactatcag tgtttgacag gatatattgg cgggtaaacc taagagaaaa gagcgtttat 11040
tagaataatc ggatatttaa aagggcgtga aaaggtttat ccgttcgtcc atttgtatgt 11100
gcatgccaac cacagggttc ccctcgggat caa 11133
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Нуклеиновокислотная последовательность для обнаружения наличия трансгенного трансформанта сои DBN9004 в биологическом образце, набор, содержащий такую последовательность, и способ такого обнаружения | 2017 |
|
RU2743397C2 |
| ПОСЛЕДОВАТЕЛЬНОСТЬ НУКЛЕИНОВОЙ КИСЛОТЫ ДЛЯ ВЫЯВЛЕНИЯ РАСТЕНИЯ СОИ DBN8002 И СПОСОБ ЕЕ ВЫЯВЛЕНИЯ | 2019 |
|
RU2818368C2 |
| ГЕНЫ, КОНСТРУКЦИИ И ОБЪЕКТ DP-202216-6 МАИСА | 2019 |
|
RU2833371C2 |
| ПОСЛЕДОВАТЕЛЬНОСТЬ НУКЛЕИНОВОЙ КИСЛОТЫ ДЛЯ ВЫЯВЛЕНИЯ РАСТЕНИЯ КУКУРУЗЫ DBN9501 И СПОСОБ ЕГО ВЫЯВЛЕНИЯ | 2020 |
|
RU2815214C2 |
| ТРАНСГЕННЫЙ ОБЪЕКТ КУКУРУЗЫ MON95275 И СПОСОБЫ ЕГО ОБНАРУЖЕНИЯ И ПРИМЕНЕНИЯ | 2021 |
|
RU2836053C1 |
| ДЕТЕКЦИЯ AAD-1 ОБЪЕКТА DAS-40278-9 | 2010 |
|
RU2577143C2 |
| ТРАНСГЕННЫЙ ОБЪЕКТ СОИ MON 87708 И СПОСОБЫ ЕГО ПРИМЕНЕНИЯ | 2010 |
|
RU2624025C2 |
| ОБЪЕКТ СОИ 9582.814.19.1, ПРИДАЮЩИЙ УСТОЙЧИВОСТЬ К НАСЕКОМЫМ И УСТОЙЧИВОСТЬ К ГЕРБИЦИДАМ | 2012 |
|
RU2628099C2 |
| ЛИНИИ ТРАНСГЕННОЙ СОИ, ГЕНЕТИЧЕСКОЕ СОБЫТИЕ 8264.42.32.1, УСТОЙЧИВОЕ К ГЕРБИЦИДАМ С ПАКЕТИРОВАННЫМИ ГЕНАМИ НА ЕГО ОСНОВЕ, И ИХ ДЕТЕКТИРОВАНИЕ | 2012 |
|
RU2636021C2 |
| МАТЕРИАЛЫ И МЕТОДЫ ДЛЯ ОБНАРУЖЕНИЯ ГЕНА АРИЛОКСИАЛКАНОАТДИОКСИГЕНАЗЫ (AAD-12) В РАСТЕНИЯХ | 2012 |
|
RU2644249C2 |
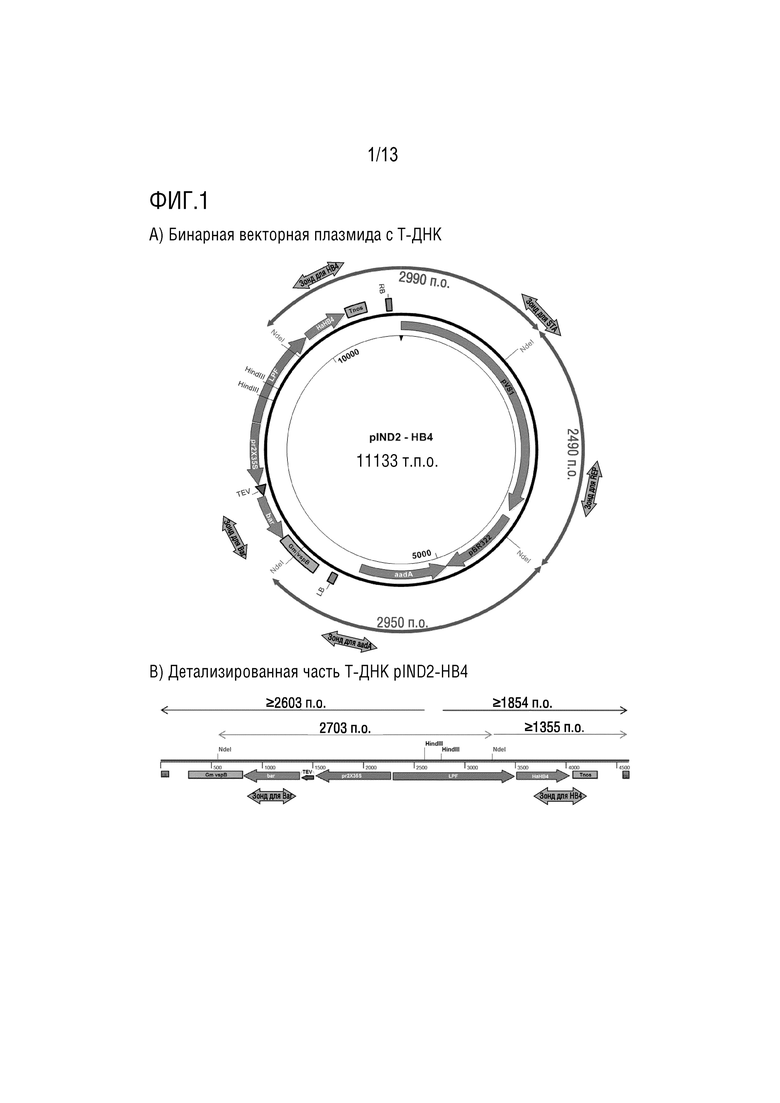


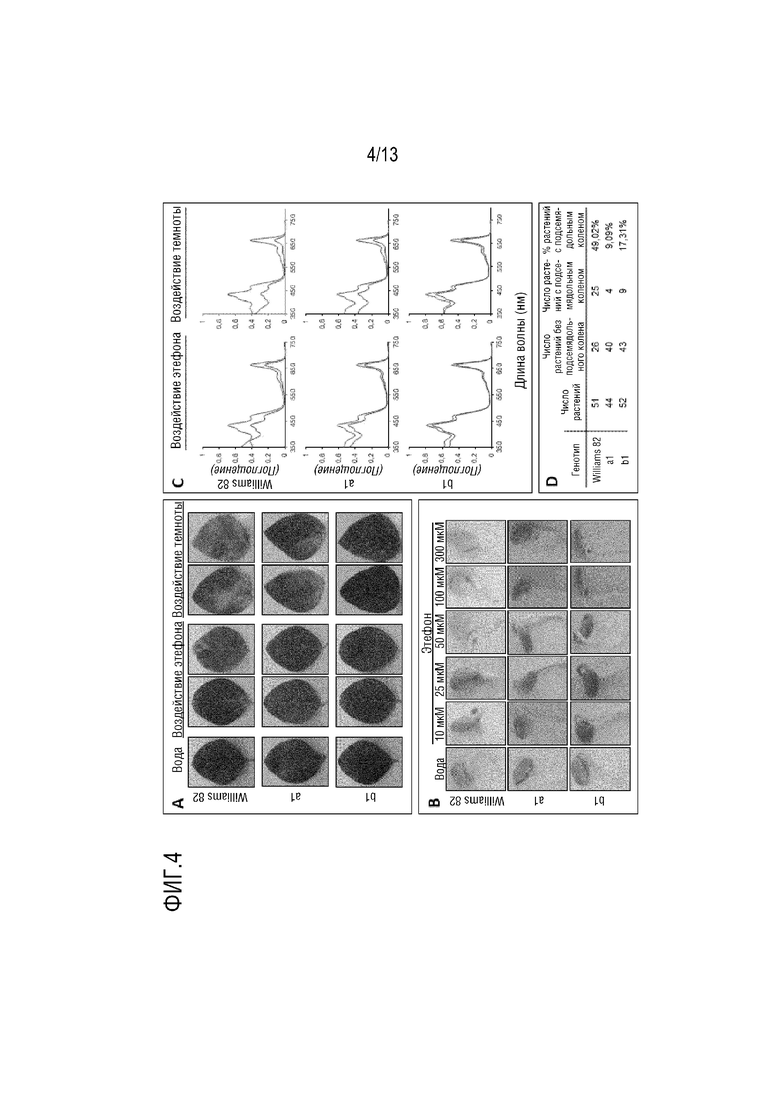

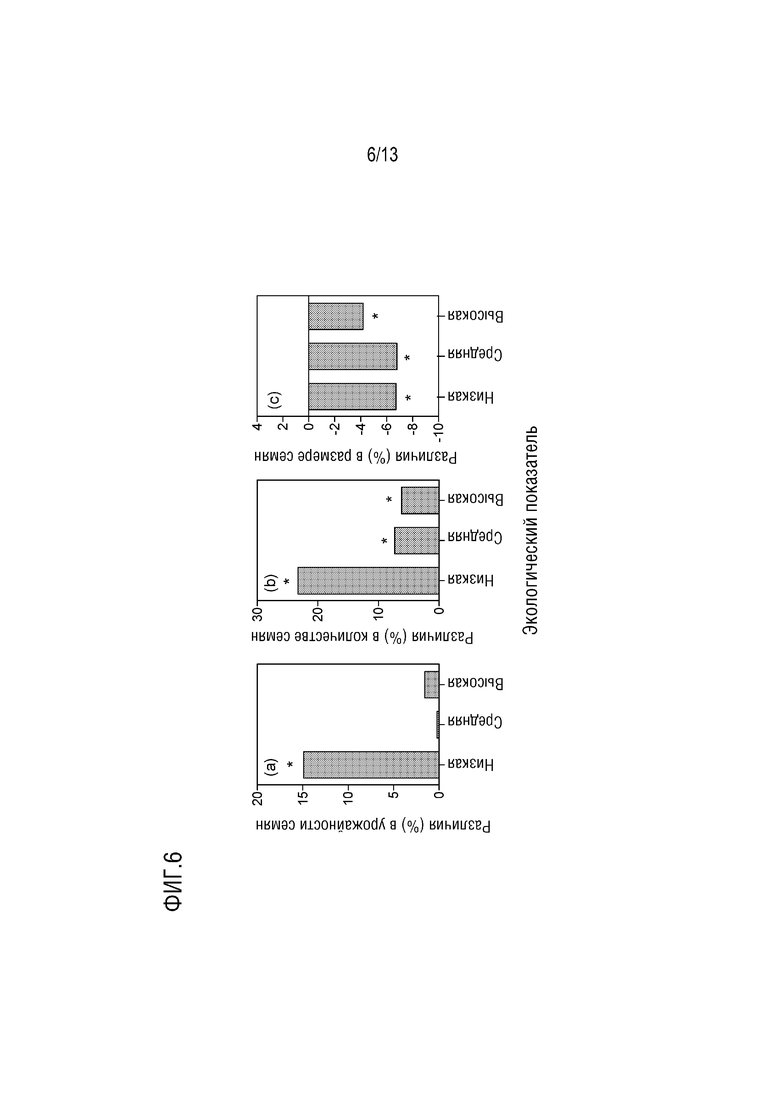


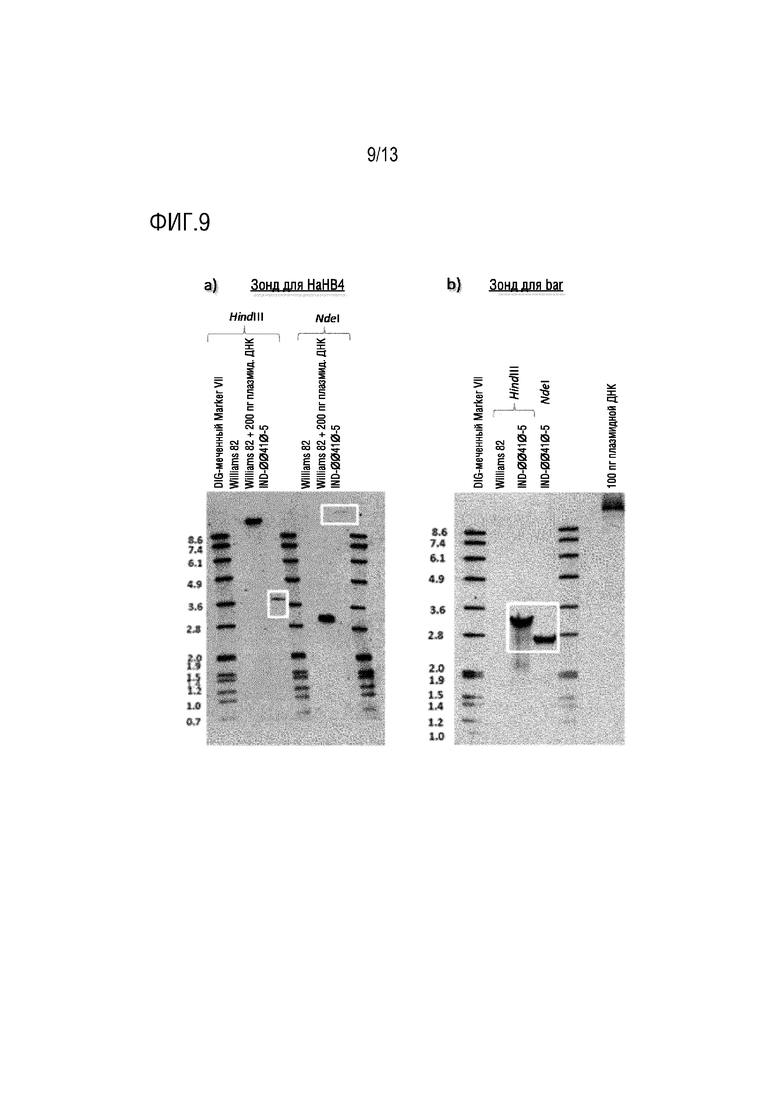
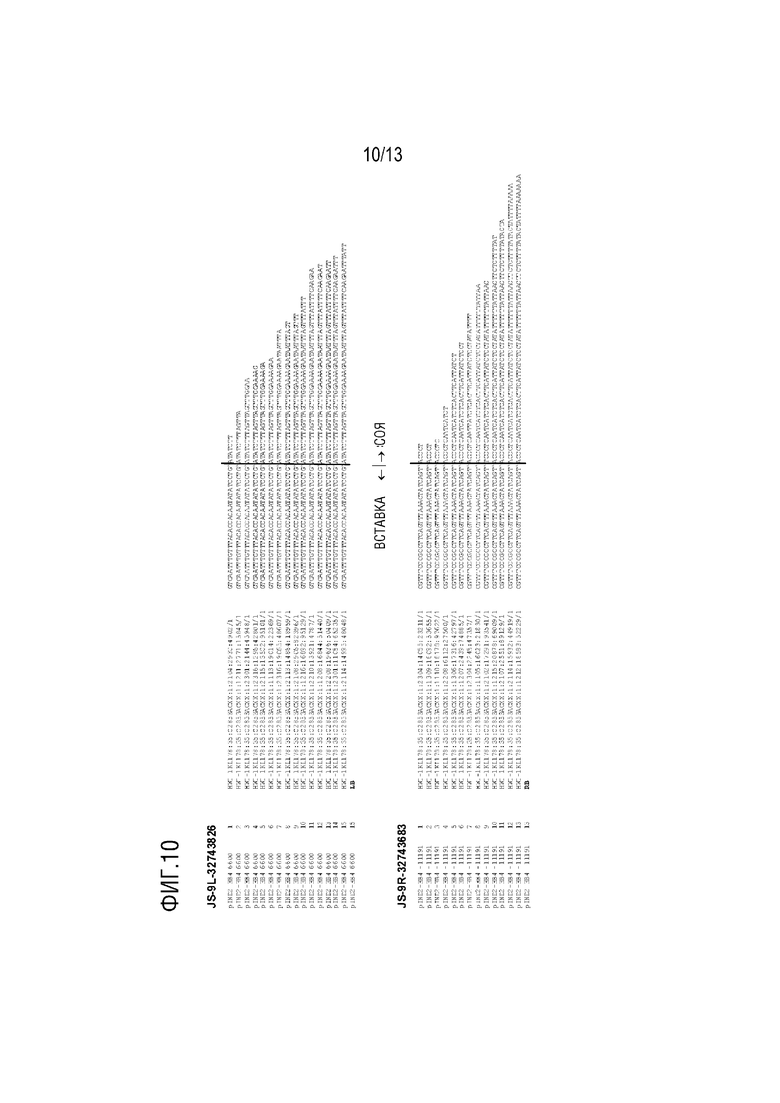


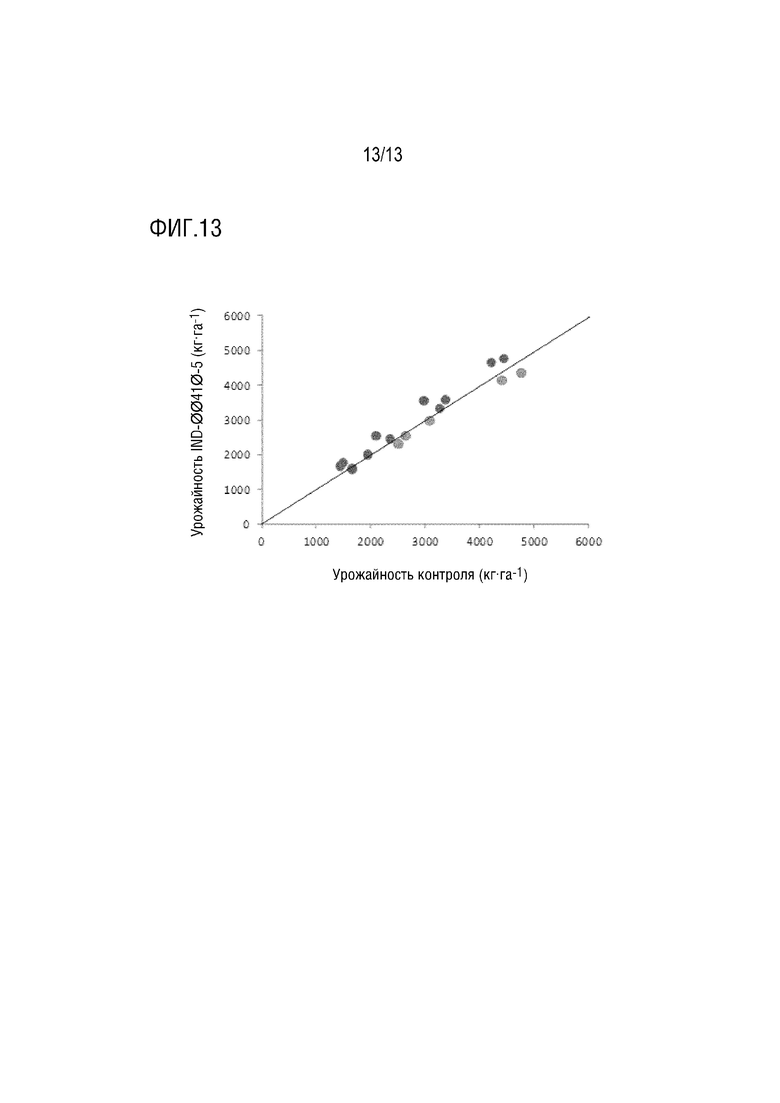
Изобретение относится к области биохимии, в частности к рекомбинантной молекуле ДНК для повышения урожайности трансформированного растения сои в условиях абиотического стресса. Также раскрыты семя, часть трансгенного растения и трансгенное растение сои, содержащие указанную молекулу ДНК, ДНК-зонд и ДНК праймер, набор для обнаружения указанной молекулы ДНК. Раскрыты способ получения указанного растения, способ обнаружения в образце присутствия указанной молекулы ДНК, способ определения зиготности указанного трансгенного растения сои, способ производства продукта потребления из указанного растения сои. Изобретение позволяет эффективно повышать урожайность растения сои в условиях абиотического стресса. 11 н. и 6 з.п. ф-лы, 13 ил., 5 табл., 5 пр.
1. Рекомбинантная молекула ДНК для повышения урожайности трансформированного растения сои в условиях абиотического стресса, характеризующаяся содержанием последовательности SEQ ID NO: 1, которая включает SEQ ID NO: 2 и SEQ ID NO: 3, и представленная депозитом в ATCC под номером доступа - PTA-125535.
2. Молекула ДНК по п. 1, характеризующаяся повышением урожайности сорта сои в условиях абиотического стресса.
3. Рекомбинантная молекула ДНК по п. 1, отличающаяся тем, что указанная молекула рекомбинантной ДНК образована в результате сплайсинга гетерологичной молекулы нуклеиновой кислоты SEQ ID NO: 4 и геномной ДНК из растения, клетки растения или семени сои.
4. Рекомбинантная молекула ДНК по п. 1, отличающаяся тем, что указанная молекула ДНК обнаруживается в растении, клетке растения, семени, растении-потомке, части растения сои или продукте потребления, происходящих от трансгенного растения сои.
5. Трансгенное растение сои с повышенной урожайностью в условиях абиотического стресса, содержащее рекомбинантную молекулу ДНК по п.1, причем репрезентативные семена сои, содержащие рекомбинантную молекулу ДНК, депонированы в ATCC под номером доступа - PTA-125535.
6. Семя, содержащее рекомбинантную молекулу ДНК по п. 1, для выращивания трансгенного растения сои с повышенной урожайностью в условиях абиотического стресса по п. 5.
7. Часть растения, содержащая рекомбинантную молекулу ДНК по п.1, для выращивания трансгенного растения сои с повышенной урожайностью в условиях абиотического стресса по п. 5, где часть растения определена как клетка, пыльца, семяпочка, цветок, побег, корень или лист.
8. Трансгенное растение сои по п. 5, геном которого содержит молекулу ДНК, включающую SEQ ID NO: 1.
9. Растение сои по п. 8, полученная из которого ДНК дает диагностический ампликон для трансгенного растения при тестировании способом амплификации ДНК, при этом указанный ампликон включает SEQ ID NO: 2 или SEQ ID NO: 3.
10. Семя по п. 6, ДНК из которого дает диагностический ампликон для трансгенного растения при тестировании способом амплификации ДНК, при этом указанный ампликон включает SEQ ID NO: 2 или SEQ ID NO: 3.
11. ДНК-зонд, используемый для распознавания рекомбинантной молекулы ДНК по п.1, включающей молекулу нуклеиновой кислоты, имеющую нуклеотидную последовательность, комплементарную достаточной части непрерывной нуклеотидной последовательности SEQ ID NO:1, чтобы работать в качестве ДНК-зонда, гибридизирующегося в жестких условиях с молекулой ДНК, включающей нуклеотидную последовательность SEQ ID NO:1, и не гибридизирующегося в жестких условиях с молекулой ДНК, не включающей нуклеотидную последовательность SEQ ID NO: 1, где ДНК-зонд содержит последовательность SEQ ID NO: 28, 33, 36, 39 и 42.
12. ДНК праймер, используемый для распознавания рекомбинантной молекулы ДНК по п.1, включающей по крайней мере 15 следующих друг за другом нуклеотидов SEQ ID NO: 1 или ее комплемент, которая применима в способе амплификации ДНК для получения диагностического ампликона для трансгенного растения, где молекула полинуклеотидного ДНК праймера содержит последовательность SEQ ID NO: 5-27, 29-32, 34-35, 37-38 и 40-41.
13. Набор для обнаружения ДНК, используемый для распознавания рекомбинантной молекулы ДНК по п.1, содержащий нуклеотидную последовательность SEQ ID NO: 28, 33, 36, 39 и 42, причем обнаружение указанной ДНК является диагностическим признаком присутствия указанного трансгенного растения сои в образце.
14. Способ получения растения сои по п. 5, включающий стадии:
(а) введения в геном клетки сои рекомбинантной молекулы ДНК по п.1;
(b) отбора клеток, содержащих ген-маркер bar; и
(c) регенерации растения сои из клетки стадии (b), содержащего рекомбинантную молекулу ДНК.
15. Способ обнаружения в образце присутствия рекомбинантной молекулы ДНК по п. 1, отличающийся тем, что он включает:
(a) совмещение образца, содержащего ДНК сои, с набором праймеров, где пара праймеров выбрана из 1) SEQ ID NO: 16 и 17; 2) SEQ ID NO: 18 и 19; 3) SEQ ID NO: 20 и 21; 4) SEQ ID NO: 22 и 23; 5) SEQ ID NO: 24 и 25; и
(b) проведение реакции амплификации нуклеиновой кислоты, таким образом получая диагностический ампликон;
(c) обнаружение диагностического ампликона.
16. Способ определения зиготности трансгенного растения сои по п. 5 в геноме, содержащем ДНК трансгенного растения сои, включающий:
а) приведение образца в контакт с различными парами праймеров, выбранных из SEQ ID NO: 16 и 17; SEQ ID NO: 18 и 19; SEQ ID NO: 20 и 21; SEQ ID NO: 22 и 23; SEQ ID NO: 24 и 25; SEQ ID NO: 26 и 27; SEQ ID NO: 31 и 32; SEQ ID NO: 34 и 35; SEQ ID NO: 37 и 38; SEQ ID NO: 40 и 41,
i) при использовании в реакции амплификации нуклеиновой кислоты в трансгенном растении сои дают диагностический ампликон, который является положительным диагностическим признаком для трансгенного растения сои; и
ii) при использовании в реакции амплификации нуклеиновой кислоты в объекте геномной ДНК сои, которая не является трансгенным растением сои, дает диагностический ампликон для геномной ДНК сои дикого типа или геномной ДНК, отличной от трансгенного растения сои;
b) проведение реакции амплификации нуклеиновой кислоты; и
c) обнаружение указанных ампликонов; причем присутствие указанных ампликонов является диагностическим признаком гетерозиготного генома в указанном образце, и причем присутствие только одного из ампликонов является диагностическим признаком гомозиготного генома в указанном образце, трансгенного растения сои или дикого типа, в зависимости от того, являются ли праймеры теми, которые указаны в i) или ii).
17. Способ производства продукта потребления, изготовляемого из растения сои по п. 5, включающий:
(a) получение растения сои или его части в соответствии со способом по п. 14; и
(b) производство продукта потребления из растения сои или его части.
| WO 2011034704 A1, 24.03.2011 | |||
| RU 2014105285 A, 20.08.2015 | |||
| WO 2012006439 A2, 12.01.2012. |
Авторы
Даты
2023-09-05—Публикация
2019-03-28—Подача