Область техники
Изобретение относится к области техники обнаружения вируса желтизны брассики, в частности к тест-карточке и тест-набору для выявления вируса желтизны брассики.
Уровень техники
Шлемник байкальский (Scutellaria baicalensis Georgi) - это многолетнее растение семейства губоцветных и одно из широко используемых лекарственных средств в нашей стране, шлемник байкальский холоден по природе и горек на вкус, относится к меридианам легких, желчного пузыря, селезенки, толстой и тонкой кишки; оказывает действие на устранения жара и влаги, удаления огня и обезвреживания, гемостаз и предупреждение аборта. Шлемник байкальский обладает значительными фармакологическими эффектами, такими как антибактериальное, противовирусное, противовоспалительное, антиоксидантное и сердечно-сосудистое действие, он обычно используется при лечении влажного жара, диареи, желтухи, кашля из-за жара в легких и эмболии. Дикий шлемник байкальский в основном распространены в большинстве районов к северу от реки Янцзы в нашей стране, является подлинным лекарственным материалом в Чэндэ, провинция Хэбэй, а Чэндэ известен как «Рэхэ шлемник байкальский».
В связи с постоянным расширением масштабов и площадей искусственных посадок, а также непрерывными посадками, происхождение шлемника байкальского ухудшилось, а качество семян снизилось, что серьезно сказалось на доходах фермеров и стало ключевым узким местом, ограничивающим развитие китайской индустрии фитотерапии. и возрождение сельских районов в моей стране. В настоящее время исследования шлемника байкальского в основном сосредоточены на пяти грибковых заболеваниях, а именно на мучнистой росе (Erysiphe cichorocearum DC), корневой гнили (Fusarium spp), фитофторозе (Phoma asparage Sacc), серой гнили (Botrytis cinerea Pers) и церкоспорозе (Phyllosticta menthae Bres), в то время как сообщений о вирусных заболеваниях относительно немного.
Вирусное заболевание также является очень серьезным заболеванием растений, с которым трудно бороться и которое известно как «рак растений». После того, как растение заражено вирусом, вид дегенерирует, устойчивость ослабевает и становится более уязвимым для других патогенов, таких как грибы и бактерии, в полевых условиях часто возникают одновременно несколько заболеваний, что приводит к более серьезным потерям. В 2020 году изобретатель провел предварительное исследование и обнаружение болезни шлемника байкальского, посаженной в уезде Лунси, провинция Ганьсу, и идентифицировал вирус желтизны брассики (Brassica yellows virus, BrYV) в некоторых образцах с использованием технологии секвенирования малых РНК (small RNA sequencing, sRNA-seq), это был первый случай, когда заражение BrYV было обнаружено у шлемника байкальского. После заражения BrYV и другими вирусами растения стали карликовыми, а на листьях появились такие симптомы, как сильное пожелтение и некротические пятна, что привело к снижению урожайности и качества, что серьезно повлияло на качество лекарственного сырья.
В настоящее время метод обнаружения BrYV в основном включает полимеразную цепную реакцию с обратной транскрипцией (ОТ-ПЦР), но этот метод имеет сложные процедуры, высокую стоимость, высокие требования к оборудованию и условиям обнаружения, требует накопления многолетнего опыта и персонала с профессиональными навыками работы, поэтому область применения сильно ограничена, и он не может удовлетворить потребности в быстром обнаружении мест посадки и полей шлемника байкальского. Для культур шлемника байкальского, размножаемых семенами, качество семян является ключом к развитию отрасли, однако содержание вируса в семенах низкое, а выделение РНК затруднено, поэтому точность обнаружения методом ОТ-ПЦР зависит от экстракция нуклеиновых кислот нарушена, и часто возникают ложноотрицательные результаты, необходимо срочно разработать новые технологии или новые методы для быстрого и чувствительного обнаружения вирусных болезней семян.
Ввиду этого предлагается настоящее изобретение.
Краткое описание изобретения
Цель настоящего изобретения состоит в том, чтобы предоставить тест-карточку и тест-набор для выявления вируса желтизны брассики для решения вышеупомянутых технических проблем.
BrYV является важным членом Luteoviridae и poleroviruses, вирус этого рода не может передаваться только путем механической инокуляции, а может передаваться тлей устойчивым, непролиферирующим путем. BrYV может заражать различные растения, такие как рапс, цветная капуста, белокочанная капуста, бентамиана и арабидопсис, вызывая тяжелые заболевания и снижая урожайность.
BrYV представляет собой одноцепочечный РНК-вирус с положительным смыслом, не имеющий поли (А)-структуры на 3'-конце вирусного генома и VPg (Virus genome-linked protein, VPg) на 5'-конце. Вирусные частицы имеют сферическую форму и размер от 25 до 30 нм. Геном BrYV содержит семь открытых рамок считывания (Open reading frame, ORF), а белок P0, кодируемый ORF0, является супрессором молчания генов. Оболочечный белок (Coat protein, CP) кодируется ORF3. ORF1 кодирует мотивы протеазы, геликазы и VPg, тогда как ORF1 и ORF2 кодируют слитые белки P1-P2, участвующие в репликации вируса. Белок 3а, кодируемый ORF3a, и белок MP, кодируемый ORF4, связаны с перемещением вируса. Белок RTP, который продуцируется считыванием ORF5 из ORF3, связан с постоянной блуждающей непролиферативной передачей, накоплением вирусов и удержанием флоэмы у тлей.
Настоящее изобретение реализовано следующим образом:
Настоящее изобретение относится к композиции праймеров для обнаружения вируса желтизны брассики, которая включает прямой внешний праймер F3, показанный в SEQ ID NO.1, обратный внешний праймер B3, показанный в SEQ ID NO.2, прямой внутренний праймер FIP, показанный в SEQ ID NO.3, обратный внутренний праймер BIP, показанный в SEQ ID NO.4, праймер прямой петли LF, показанный в SEQ ID NO.5, и праймер обратной петли LB, показанный в SEQ ID NO.6.
Вышеупомянутые праймеры можно использовать для реакции изотермической амплификации, опосредованной петлей ДНК, Изобретатели разработали специфические внутренние праймеры FIP/BIP и внешние праймеры F3/B3 для нацеливания на шесть конкретных областей целевой последовательности вируса желтизны брассики, реакцию амплификации можно осуществить с помощью полимеразы, получая таким образом 109-1010 копий за относительно короткий период времени. Реакция амплификации может быть завершена в водяной бане с постоянной температурой без необходимости использования инструментов молекулярной биологии, таких как инструменты для амплификации генов, преимуществами которых являются простота эксплуатации, высокая специфичность и высокая чувствительность.
В настоящем изобретении также предложена тест-карточка для выявления вируса желтизны брассики, которая включает в себя подушечку для образцов, подушечку для связывания с коллоидным золотом, нитроцеллюлозную мембрану и подушечку для абсорбции, расположенные последовательно на подкладочной пластине, при этом подушечка для связывания с коллоидным золотом содержит конъюгат антител к вирусу желтизны брассики и коллоидного золота, Т-линия обнаружения и С-линия контроля качества расположены на нитроцеллюлозной мембране последовательно вдоль хроматографического направления, Т-линия обнаружения покрыта антителом IgG к BrYV, а С-линия контроля качества покрыта вторичным антителом с антителом к BrYV; количество покрывающего антитела IgG к BrYV на Т-линии обнаружения составляет 1,5-2,0 мкг белка на 2 мм ширины линии; количество покрывающего антитела вторичного антитела к BrYV составляет 1,5-2,0 мкг белка на 2 мм ширины линии.
Количество антител к вирусу желтизны брассики, нанесенное на подушечку для связывания с коллоидным золотом, составляет 16-18 мкг антитела к вирусу желтизны брассики на 1 мл коллоидного золота.
Антитело, нанесенное на тест-карточку, может быть получено в домашних условиях или выбрано из коммерчески доступных антител.
Тест-карточка может обеспечить быстрое обнаружение вируса желтизны брассики и может использоваться для первичного скрининга вируса желтизны брассики.
В предпочтительном варианте осуществления настоящего изобретения указанная выше тест-карточка дополнительно содержит слот для карты, состоящий из нижнего корпуса и верхнего корпуса, слот для карты имеет установочную полость для размещения подкладочной пластины, и подкладочная пластина неподвижно соединена с внутренней стенкой нижнего корпуса, а верхний корпус неподвижно соединен с нижним корпусом.
В предпочтительном варианте осуществления настоящего изобретения верхний корпус снабжен окном для добавления образца и окном для наблюдения за реакцией с интервалами, окно для добавления образца расположено над прокладкой для образца в пространстве, а окно для наблюдения за реакцией пространственно расположено над нитроцеллюлозной мембраной. Чтобы облегчить наблюдение за изменением цвета тест-карты, окно наблюдения за реакцией можно сделать прозрачным. Форма окна для добавления образца может быть установлена в виде перевернутого конуса, чтобы облегчить сбор жидкости на подушечке для образца.
В предпочтительном варианте применения настоящего изобретения верхний корпус и нижний корпус соединены защелкивающейся конструкцией с защелкой.
Настоящее изобретение также относится к тест-набору GICA-RT-LAMP для выявления вируса желтизны брассики, который включает вышеупомянутую тест-карточку для выявления вируса желтизны брассики и композицию праймера для выявления вируса желтизны брассики.
В предпочтительном варианте применения настоящего изобретения вышеупомянутый набор дополнительно включает реагенты для реакции амплификации RT-LAMP, а реагенты для реакции амплификации RT-LAMP включают обратную транскриптазу, ингибитор RNase, смесь dNTP, реакционный буфер, MgSO4, ДНК-полимеразу и воду; в предпочтительном варианте осуществления настоящего изобретения обратную транскриптазу выбирают из обратной транскриптазы AMV или обратной транскриптазы M-MLV, а реакционный буфер выбирают из реакционного буфера ThermoPol.
В предпочтительном варианте применения настоящего изобретения набор дополнительно включает фосфатный буфер, фосфатный промывочный буфер, раствор для обнаружения флуоресцентного красителя, вещество отрицательного контроля и вещество положительного контроля.
В предпочтительном варианте осуществления настоящего изобретения веществом отрицательного контроля является вода, а веществом положительного контроля является стандартное вещество фрагмента гена CP оболочечного белка вируса желтизны брассики.
Стандартная последовательность фрагмента гена CP BrYV следующая:
AGTCGTGGGGTAGAGAACAATCAATGGAAGAAGACGACCACGCAGGCAAACAAGGCGCATTCAGCGAAATCAGCCAGTGGTTGTGGTCCAAACCTCTCGGACAACACAACGCCGACCTAGACGACGACGAAGAGGTAACAACCGGACAGGAAGAACTGTTCCTACCAGAGGAGCAGGTTCGAGCGAGACATTTGTTTTCTCAAAAGACAATCTCGCGGGAAGTTCCAGCGGAGCAATCACGTTCGGGCCGAGTCTATCAGACTGCCCGGCATTCTCTAATGGAATGCTCAAGGCCTACCATGAATATAAGATCTCAATGGTCATTCTGGAGTTCGTCTCCGAGGCCTCTTCCCAAAATTCCGGTTCCATCGCTTACGAGCTGGACCCACACTGTAAACTCAATTCACTCTCTTCCCACGATTAA.
ДНК-полимераза представляет собой полимеразу, пригодную для изотермической амплификации, в предпочтительном варианте осуществления настоящего изобретения ДНК-полимераза выбрана из ДНК-полимеразы Bst.
Настоящее изобретение также относится к способу обнаружения вируса желтизны брассики с использованием набора GICA-RT-LAMP для выявления вируса желтизны брассики, включающему:
(1) Возьмите тестируемый раствор на подушечку для образцов тест-карточки для выявления вируса желтизны брассики, наблюдайте за изменением цвета Т-линии обнаружения и С-линии контроля качества и впервые определите, содержится ли вирус желтизны брассики BrYV в тестируемом образце;
(2) Если невозможно определить, содержится ли вирус желтизны брассики BrYV в соответствии с шагом (1), выполните амплификацию c обратной транс - крипцией RT-LAMP: Т-линию обнаружения на тест-карточке после реакции иммунного обогащения на шаге (1) удаляют, а удаленную Т-линию обнаружения используют в качестве матрицы, а композицию праймера для обнаружения RT-LAMP используют для проведения амплификации RT-LAMP; по продукту реакции амплификации RT-LAMP вторично определите, содержится ли вирус желтизны брассики BrYV в тестируемом образце. Условия реакции для амплификации RT-LAMP были следующими: амплификация на водяной бане с постоянной температурой при 58-66°C в течение 60–100 мин с последующей денатурацией при 80°C в течение 10 мин для прекращения реакции.
В предпочтительном варианте осуществления настоящего изобретения упомянутый выше конкретный способ определения того, содержит ли тестируемый образец BrYV впервые, по изменению цвета T-линии обнаружения и C-линии контроля качества является метод наблюдения невооруженным глазом; метод наблюдения невооруженным глазом:
Если на Т-линии обнаружения и С-линии контроля качества присутствуют коричнево-красные полосы, это означает, что тестируемый образец содержит вирус желтизны брассики BrYV, и амплификация c обратной транс - крипцией RT-LAMP не требуется;
Если на Т-линии обнаружения нет изменения цвета, а только на С-линии контроля качества появляется коричнево-красная полоса, то определяют, что тестируемый образец не заражен BrYV, или содержание BrYV низкое, и требуется амплификация c обратной транс - крипцией RT-LAMP.
В предпочтительном варианте осуществления настоящего изобретения по продукту реакции амплификации RT-LAMP вторично определите, содержится ли вирус желтизны брассики BrYV в тестируемом образце, конкретный метод представляет собой метод наблюдения невооруженным глазом с использованием флуоресцентного красителя; метод наблюдения невооруженным глазом флуоресцентного красителя:
Возьмите реакционный раствор флуоресцентного красителя и добавьте его в крышку реакционной пробирки для амплификации RT-LAMP перед реакцией, после завершения реакции амплификации LAMP смешайте раствор для обнаружения флуоресцентного красителя с реакционным раствором LAMP и непосредственно наблюдайте за цветом раствор смешанной реакции невооруженным глазом.
Поскольку SYBR Green I ингибирует реакцию LAMP, добавлять SYBR Green I перед реакцией не рекомендуется, после завершения реакции раствор для обнаружения флуоресцентного красителя смешивают с реакционным раствором LAMP путем встряхивания крышки пробирки или центрифугирования, чтобы реакционный раствор приобрел цвет.
В предпочтительном варианте осуществления настоящего изобретения реакционный раствор флуоресцентного красителя представляет собой SYBR Green I, и если амплифицированный продукт показывает зеленую флуоресценцию, это означает, что тестируемый образец содержит вирус желтизны брассики;
Если цвет амплифицированного продукта оранжевый, это означает, что тестируемый образец не содержит вируса желтизны брассики.
Объектом, обнаруженным с помощью вышеуказанного набора, являются вирусные частицы BrYV, и вирусные частицы могут быть быстро обогащены с помощью технологии иммунохроматографии с коллоидным золотом GICA, которая может предварительно определить вирусную инфекцию тестируемого образца; а затем использовать специфические праймеры вируса. последовательность генома для проведения амплификации RT-LAMP, цель точного обнаружения патогенов достигается за счет анализа продуктов амплификации.
Метод обнаружения GICA-RT-LAMP органично сочетает в себе серологические методы и методы обнаружения нуклеиновых кислот и обладает преимуществами высокой специфичности и высокой чувствительности. После тестирования и проверки его чувствительность достигла 0,25 пг/мл, что в 100 раз более чувствительно, чем обычная GICA-RT-PCR, в процессе обнаружения не требуется выделение РНК, не требуется профессиональное оборудование, что упрощает рабочий процесс, снижает сложность обнаружения и повышает эффективность обнаружения, и он имеет широкие перспективы применения.
Изобретение также обеспечивает тест-карточку для выявления вируса желтизны брассики, композицию праймера для обнаружения вируса желтизны брассики или набор GICA-RT-LAMP для обнаружения вируса желтизны брассики.
Настоящее изобретение имеет следующие положительные эффекты:
Набор праймеров для обнаружения, предложенный в настоящем изобретении, может осуществлять обнаружение специфического вируса желтизны брассики, и набор праймеров имеет техническое преимущество, заключающееся в высокой чувствительности. Тест-карточка, предлагаемая в изобретении, имеет преимущество быстрого обнаружения и может предварительно определить, заражен ли целевой образец вирусом желтизны брассики. Тест-набор GICA-RT-LAMP в сочетании с двумя вышеуказанными и его методом обнаружения имеют технические преимущества удобной работы, высокой точности и хорошей применимости.
Метод обнаружения GICA-RT-LAMP не требует выделения РНК нуклеиновых кислот, что решает проблему сложности выделения РНК из объектов обнаружения, таких как семена. В то же время этот способ превосходит громоздкие, длительные и трудоемкие методы обнаружения BrYV в предшествующем уровне техники, должен полагаться на дорогостоящие инструменты молекулярной биологии, такие как инструменты амплификации генов, и не может быстро обнаруживать целевой вирус, этот метод органично сочетает в себе серологию и технологию амплификации LAMP, в полной мере использует преимущества двух методов обнаружения и напрямую использует вирусные частицы BrYV, обогащенные иммунохроматографией с коллоидным золотом GICA, в качестве объекта обнаружения для проведения амплификации RT-LAMP, порог обнаружения и сложность снижаются, а реакционные операции проводятся непрерывно в одной и той же реакционной системе, и нет необходимости добавлять реагенты в середине, что снижает риск загрязнения.
В общей сложности 6 специфических праймеров F3, B3, FIP, BIP, LF и LB использовали для идентификации 8 последовательностей генов-мишеней CP BrYV, которые обладали преимуществами высокой специфичности и высокой точности.
Реализация метода позволяет завершить обнаружение без помощи прибора для амплификации генов, результаты иммунохроматографической реакции можно наблюдать невооруженным глазом и комбинировать с реакцией RT-LAMP на водяной бане с постоянной температурой. Это уменьшает сложность обнаружения и расширяет область применения технологии, после завершения реакции изменение цвета также можно использовать для оценки результатов невооруженным глазом, что не зависит от инструментов или оборудования и увеличивает ценность применения, он очень подходит для продвижения и применения на низовом уровне, и перспективы очень широкие.
Кроме того, настоящее изобретение также обеспечивает новую техническую платформу для шлемника байкальского и обнаружения болезней растений. Его можно применять не только для быстрого скрининга BrYV, но и для точного мониторинга BrYV. Обеспечить техническую поддержку для мониторинга возникновения, распространения, распространенности BrYV, а также для профилактики и борьбы с вирусными заболеваниями.
Краткое описание чертежей
Чтобы более четко проиллюстрировать технические решения вариантов осуществления настоящего изобретения, ниже будут кратко представлены сопутствующие чертежи, необходимые для вариантов осуществления, следует понимать, что следующие чертежи показывают только некоторые варианты осуществления настоящего изобретения и не следует рассматривать как ограничение объема, и для специалистов в данной области техники другие родственные чертежи также могут быть получены по этим чертежам без каких-либо творческих усилий.
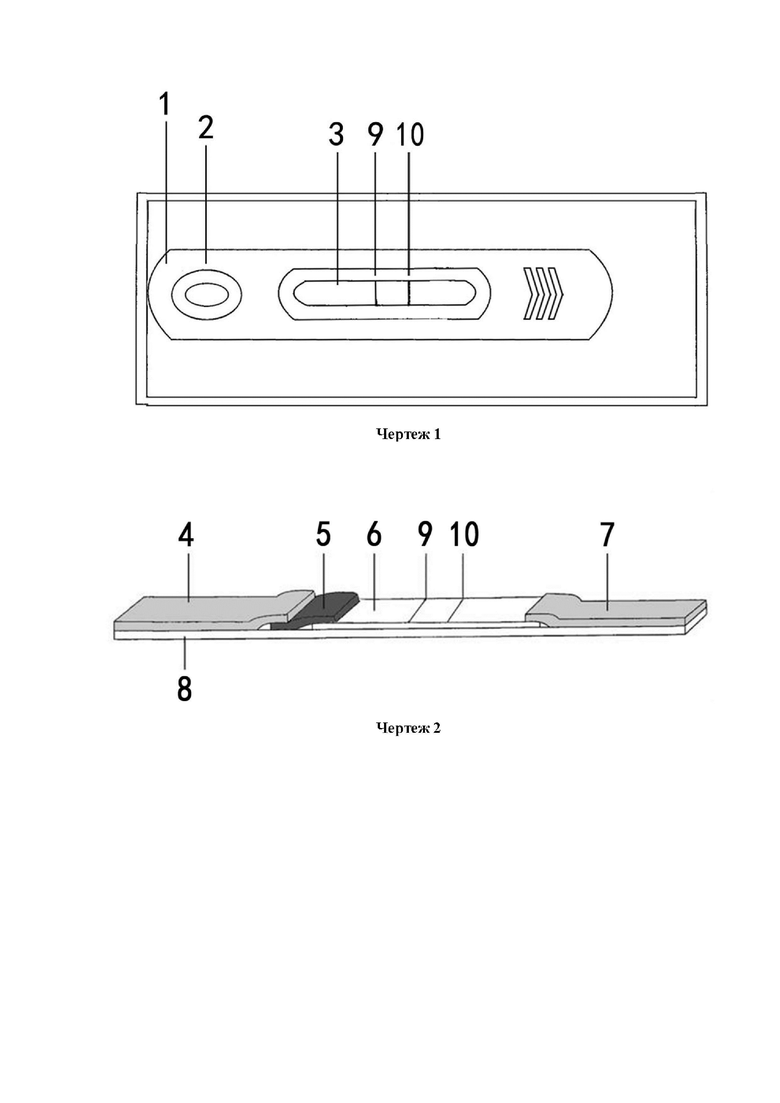
Чертеж 1 представляет собой схему пленарной структуры иммунохроматографической тест-карточки с коллоидным золотом для для выявления вируса желтизны брассики BrYV в соответствии с вариантом осуществления настоящего изобретения;
Чертеж 2 представляет собой схему внутренней структуры иммунохроматографической тест-карточки с коллоидным золотом для для выявления вируса желтизны брассики BrYV в соответствии с вариантом осуществления настоящего изобретения;
Чертеж 3 представляет собой диаграмму наблюдения невооруженным глазом флуоресцентного красителя для определения температуры реакции BrYV с помощью GICA-RT-LAMP в соответствии с вариантом осуществления настоящего изобретения, на чертеже: 1: отрицательный контроль, 2-9 соответствуют: 56°С, 58°С, 60°С, 62°С, 64°С, 66°С, 68°С, 70°С;
Чертеж 4 представляет собой диаграмму наблюдения невооруженным глазом флуоресцентного красителя для определения времени реакции BrYV с помощью GICA-RT-LAMP в соответствии с вариантом осуществления настоящего изобретения, на чертеже: 1: отрицательный контроль, 2-10 соответственно соответствуют : 20 мин; 30 мин; 40 мин; 50 мин; 60 мин; 70 мин; 80 мин; 90 мин; 100 мин;
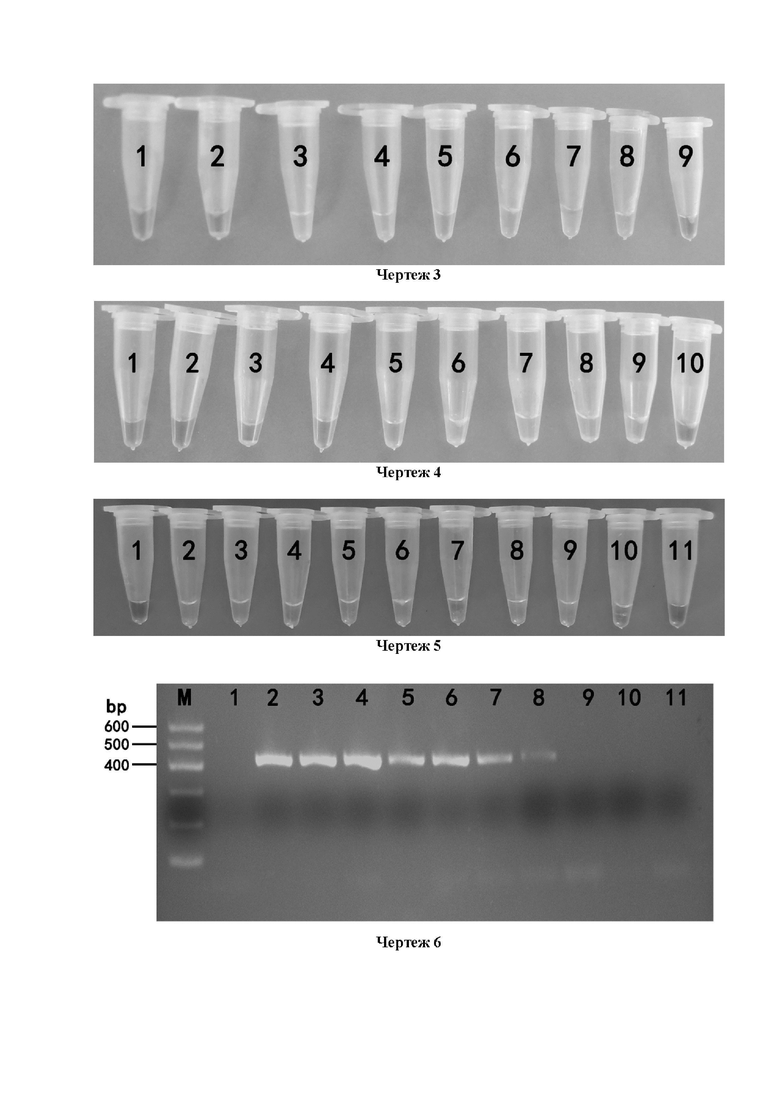
Чертеж 5 представляет собой диаграмму наблюдения невооруженным глазом флуоресцентного красителя для определения чувствительности BrYV с помощью GICA-RT-LAMP в соответствии с вариантом осуществления настоящего изобретения, на чертеже: 1: отрицательный контроль, 2-11 соответствуют стандартная концентрация гена CP BrYV: 10-1(2,5×104 нг/мл); 10-2(2,5×103 нг/мл); 10-3(2,5×102 нг/мл); 10-4(2,5×101 нг/мл); 10-5(2,5×10 0 нг/мл); 10-6(2,5×10-1 нг/мл); 10-7(2,5×10-2 нг/мл); 10-8(2,5×10-3 нг/мл); 10-9(2,5×10-4 нг/мл); 10-10(2,5×10-5 нг/мл);
Чертеж 6 представляет собой диаграмму электрофоретического анализа чувствительности для обнаружения BrYV в соответствии с вариантом осуществления GICA-RT-PCR настоящего изобретения; на чертеже: M: маркер 600 п.н.; 1: отрицательный контроль; 2-11 соответствуют стандартная концентрация гена CP BrYV: 10-1(2,5×104 нг/мл); 10-2(2,5×103 нг/мл); 10-3(2,5×102 нг/мл); 10-4(2,5×101 нг/мл); 10-5(2,5×10 0 нг/мл); 10-6(2,5×10-1 нг/мл); 10-7(2,5×10-2 нг/мл); 10-8(2,5×10-3 нг/мл); 10-9(2,5×10-4 нг/мл); 10-10(2,5×10-5 нг/мл);
Чертеж 7 представляет собой диаграмму наблюдения невооруженным глазом с помощью GICA-RT-LAMP для обнаружения специфичности BrYV флуоресцентных красителей в соответствии с вариантом осуществления настоящего изобретения, на чертеже: 1: отрицательный контроль, 2-13 соответственно соответствуют: здоровой ткани шлемника байкальского, восприимчивая ткань лилии LSV; восприимчивая ткань лилии CMV-Li; восприимчивая ткань лилии LMoV; восприимчивая ткань лилии PlAMV; восприимчивая ткань лилиии ArMV; восприимчивая ткань дудника JHMV; восприимчивая ткань дудника AMV; восприимчивая ткань салата LNYV; восприимчивая ткань салата LMV; восприимчивая ткань салата CMV; восприимчивая ткань шлемника байкальского BrYV.
Обозначения чертежей: 1-слот для карт, 2-окна для добавления образца, 3-окно наблюдения за реакцией, 4-подушечка для образца, 5-подушечка для связывания с коллоидным золотом, 6-нитроцеллюлозная мембрана, 7-подушечка для абсорбции, 8-подкладочная пластина, 9-Т-линия обнаружения; 10-C-линия контроля качества.
Вариант осуществления изобретения
Чтобы сделать цели, технические решения и преимущества вариантов осуществления настоящего изобретения более ясными, ниже будут ясно и полностью описаны технические решения в вариантах осуществления настоящего изобретения. Если в примерах не указаны конкретные условия, его проводят в соответствии с общепринятыми условиями или условиями, предложенными изготовителем. Реагенты или инструменты, используемые без указания производителя, являются обычными продуктами, которые можно приобрести на рынке.
Признаки и характеристики настоящего изобретения будут подробно описаны ниже в связи с вариантами осуществления.
Вариант осуществления 1
Ссылаясь на чертежи 1 и 2, этот вариант осуществления обеспечивает тест-карточку для выявления вируса желтизны брассики, которая включает слот для карты 1. Слот для карты 1 состоит из из нижнего корпуса и верхнего корпуса (номера на чертеже не показаны), и в этом варианте осуществления нижний корпус и верхний корпус расположены в защелкивающемся соединении. Верхний корпус и нижний корпус имеют установочные полости для размещения подкладочной пластины 8. Подкладочная пластина 8 неподвижно соединена с одним торцом нижнего корпуса.
Подушечка для образца 4, подушечка для связывания с коллоидным золотом 5, нитроцеллюлозная мембрана 6 и подушечка для абсорбции 7 расположены последовательно на подкладочной пластине 8, подушечка для связывания с коллоидным золотом 5 содержит конъюгат коллоидного золота и антител к вирусу желтизны брассики, а Т-линия обнаружения 9 и С-линия контроля качества 10 расположены на нитроцеллюлозной мембране 6 последовательно вдоль хроматографического направления, Т-линия обнаружения 9 покрыта антителом IgG к BrYV, а С-линия контроля качества 10 покрыта вторичным антителом с антителом к BrYV; количество покрывающего антитела IgG к BrYV на Т-линии обнаружения 9 составляет 1,5-2,0 мкг белка на 2 мм ширины линии; количество покрывающего антитела вторичного антитела к BrYV составляет 1,5-2,0 мкг белка на 2 мм ширины линии; в этом варианте осуществления представляет собой козий антикроличий IgG; количество покрытия антителом к BrYV на подушечке для связывания с коллоидным золотом 5 составляет 90 мкг антитела к BrYV на 5 мл коллоидного золота. В этом варианте осуществления антитело к BrYV на подушечке для связывания с коллоидным золотом 5 представляет собой кроличье поликлональное антитело к BrYV.
Верхний корпус снабжен окном для добавления образца 2 и окном для наблюдения за реакцией 3 с интервалами, окно для добавления образца 2 расположено над подушечкой для образца 4 в пространстве, а окно для наблюдения за реакцией 3 пространственно расположено над нитроцеллюлозной мембраной 6.
Метод приготовления вышеупомянутой тест-карточки следующий:
1. Приготовление поликлонального антитела IgG к BrYV:
 Экспрессия и очистка оболочечного белка CP BrYV: тотальную РНК экстрагировали из листьев шлемника байкальского, инфицированных BrYV, и подвергали полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) для амплификации фрагмента гена CP BrYV; клонировали в вектор pET-28a путем ферментативного расщепления; рекомбинантную плазмиду трансформировали в штамм кишечной палочки BL21 (DE3), культивировали при 37°C, индуцировали IPTG для экспрессии и очищали аффинной хроматографией на колонке с никелем для получения оболочечного белка CP BrYV размером 22,6 кДа;
Экспрессия и очистка оболочечного белка CP BrYV: тотальную РНК экстрагировали из листьев шлемника байкальского, инфицированных BrYV, и подвергали полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) для амплификации фрагмента гена CP BrYV; клонировали в вектор pET-28a путем ферментативного расщепления; рекомбинантную плазмиду трансформировали в штамм кишечной палочки BL21 (DE3), культивировали при 37°C, индуцировали IPTG для экспрессии и очищали аффинной хроматографией на колонке с никелем для получения оболочечного белка CP BrYV размером 22,6 кДа;
 Приготовление поликлональных антител: новозеландских белых кроликов иммунизировали 1 мг/мл очищенного оболочечного белка CP BrYV, описанного выше в качестве иммуногена; при первичной иммунизации смешайте белковый антиген BrYV с полным адъювантом Фрейнда в равном объеме и выполните подкожную инъекцию в несколько точек; через 21 день после первичной иммунизации 1,0 мг/мл очищенного белка BrYV смешивали с равным объемом неполного адъюванта Фрейнда и после полного эмульгирования вводили подкожно в несколько точек в качестве первой бустерной иммунизации; после этого каждые 21 день проводят бустерную иммунизацию, и метод иммунизации представляет собой многоточечную подкожную инъекцию. Всего было проведено 3 бустерных иммунизации: кровь из сонных артерий собирали через 5-7 дней после четвертой бустерной иммунизации, выдерживали, центрифугировали, к собранной сыворотке добавляли 0,02% азид натрия и хранили при -20°C; сыворотку осаждали насыщенным сульфатом аммония, подвергали диализу до фосфатного буфера с pH 7,8, а затем очищали с помощью аффинной хроматографии с белком А для получения кроличьих поликлональных антител IgG к BrYV.
Приготовление поликлональных антител: новозеландских белых кроликов иммунизировали 1 мг/мл очищенного оболочечного белка CP BrYV, описанного выше в качестве иммуногена; при первичной иммунизации смешайте белковый антиген BrYV с полным адъювантом Фрейнда в равном объеме и выполните подкожную инъекцию в несколько точек; через 21 день после первичной иммунизации 1,0 мг/мл очищенного белка BrYV смешивали с равным объемом неполного адъюванта Фрейнда и после полного эмульгирования вводили подкожно в несколько точек в качестве первой бустерной иммунизации; после этого каждые 21 день проводят бустерную иммунизацию, и метод иммунизации представляет собой многоточечную подкожную инъекцию. Всего было проведено 3 бустерных иммунизации: кровь из сонных артерий собирали через 5-7 дней после четвертой бустерной иммунизации, выдерживали, центрифугировали, к собранной сыворотке добавляли 0,02% азид натрия и хранили при -20°C; сыворотку осаждали насыщенным сульфатом аммония, подвергали диализу до фосфатного буфера с pH 7,8, а затем очищали с помощью аффинной хроматографии с белком А для получения кроличьих поликлональных антител IgG к BrYV.
2. Метод меченого коллоидным золотом кроличьего поликлонального антитела к BrYV заключается в следующем:
Возьмите 5 мл коллоидного золота с размером частиц 30 нм и 90 мкг кроличьего поликлонального антитела к BrYV соответственно и объединяют их магнитным перемешиванием в условиях рН 7,6, добавляют 10% бычий сывороточный альбумин (BSA) и 5% PEG 20000 в качестве стабилизаторов, чтобы получить конечные концентрации 0,5% и 0,2% соответственно, используйте низкотемпературное высокоскоростное центрифугирование для удаления несвязанных поликлональных антител, нестабилизированных коллоидных частиц золота и деагломератов, а темно-красный осадок на дне центрифужной пробирки представляет собой конъюгат коллоидного золота и антител.
3. Приготовление подушечки для связывания с коллоидным золотом
Конъюгат коллоидное золото-антитело суспендировали в 1/10 объема предварительно меченого раствора коллоидного золота, центрифугировали, супернатант наносили на стеклоцеллюлозную мембрану с помощью распылительного оборудования и высушивали при 37°C для приготовления подушечки для связывания с коллоидным золотом.
4. Покрытие иммунохроматографических мембран
Т-линия обнаружения покрыта очищенным кроличьим поликлональным антителом IgG к BrYV, а C-линия контроля качества покрыта козьим антителом против кроличьего IgG, ширина каждой линии составляет 2 мм, подходящее количество покрытия кроличьего поликлонального антитела против BrYV составляет 1,6 мкг белка, а подходящее количество покрытия козьего очищенного антитела против кроличьего IgG составляет 1,6 мкг белка.
5. Сборка тест-карточки иммунохроматографии коллоидного золота GICA
Закрепите корпус подкладочной пластины из поливинилхлорида в качестве опорного держателя в нижном корпусе слота для карт обнаружения и последовательно подсоедините подушечку для образца, подушечку для связывания с коллоидным золотом, нитроцеллюлозную мембрану и водопоглощающую фильтровальную бумагу (т.е. подушечку для абсорбции 7) к верхней поверхности подкладочной пластины из поливинилхлорида, а затем соедините верхний корпус и нижний корпус слота для карты обнаружения GICA с помощью пряжки.
Этот вариант осуществления также обеспечивает способ обнаружения для вышеупомянутой тест-карточки:
Ссылаясь на чертеж 1, наберите небольшое количество тестируемого раствора образца и поместите его на окна для добавления образца 2 в верхнем корпусе слота для карты обнаружения GICA, за счет капиллярного эффекта загруженная жидкость движется вперед, если тестируемый раствор содержит BrYV, когда образец проходит через подушечку для связывания с коллоидным золотом, BrYV образует комплексы с поликлональными антителами мечеными золотом на золотой подушечке, а затем продолжает хроматографический электрофорез в направлении Т-линии обнаружения, при контакте с Т-линией обнаружения происходит реакция связывания антиген-антитело с поликлональным антителом BrYV на Т-линии обнаружения, которое захватывается, образуя видимую коричнево-красную полосу; несвязавшийся комплекс продолжает мигрировать в направлении C-линии контроля качества, когда он вступает в контакт с C-линией контроля качества, он связывается с козьим антителом против кроличьего IgG, иммобилизованным на C-линии контроля качества, и перехватывается, образуя видимую коричнево-красную полосу. То есть, когда коричнево-красные полосы появляются как на T-линии обнаружения, так и на C-линии контроля качества, определяется, что тестируемый образец инфицирован в BrYV.
Если тестируемый раствор образца не содержит BrYV или содержание BrYV низкое, при прохождении тестируемого образца через подушечку для связывания с коллоидным золотом он не может связываться с меченым золотом поликлональным антителом на подушечке с золотой меткой или количество связанных комплексов очень мало, когда образец вступает в контакт с Т-линией обнаружения, реакции не происходит, и поликлональное антитело с меченым золотом, продолжает мигрировать к С-линии контроля качества, когда образец касается C-линии контроля качества, он связывается с козьим антителом IgG к кролику, иммобилизованным на C-линии контроля качества, и перехватывается, образуя видимую коричнево-красную полосу. То есть, когда на Т-линии обнаружения нет изменения цвета, а только на C-линии контроля качества появляется коричнево-красная полоса, определяют, что тестируемый образец не заражен BrYV, или содержание BrYV низкое, и требуется дальнейший экспериментальный анализ.
Вышеупомянутая тест-карточка может использоваться для предварительного быстрого скрининга BrYV, который может соответствовать обнаружению на месте в полевых условиях и на других сценах. От 3 до 5 минут можно предварительно определить вирусную инфекцию тестируемого образца и достичь цели быстрого, простого и эффективного обнаружения BrYV.
Вариант осуществления 2
В этом варианте осуществления представлен тест-набор GICA-RT-LAMP для выявления вируса желтизны брассики BrYV.
Тест-набор состоит из трех частей, включая: тест-карточку для выявления вируса желтизны брассики в варианте осуществления 1, композицию специфического праймера RT-LAMP и реагент для реакции амплификации RT-LAMP;
Кроме того, тест-набор GICA-RT-LAMP также включает фосфатно-солевой буфер (PBS), фосфатный промывочный буфер (PBST), раствор для обнаружения флуоресцентного красителя, отрицательный контроль и положительный контроль.
Композиция специфического праймера RT-LAMP включает прямой внешний праймер F3, показанный в SEQ ID NO.1, обратный внешний праймер B3, показанный в SEQ ID NO.2, прямой внутренний праймер FIP, показанный в SEQ ID NO.3, обратный внутренний праймер BIP, показанный в SEQ ID NO.4, праймер прямой петли LF, показанный в SEQ ID NO.5, и праймер обратной петли LB, показанный в SEQ ID NO.6., последовательность каждого набора праймеров в вышеупомянутой композиции праймеров следующая:
F3: 5’-AGGTAACAACCGGACAGGA-3’;
B3: 5’-TCGGAGACGAACTCCAGAA-3’;
FIP:
5’-GGAACTTCCCGCGAGATTGTCTACTGTTCCTACCAGAGGAGC-3';
BIP:
5’-AGCGGAGCAATCACGTTCGGATTCATGGTAGGCCTTGAGC-3’';
LF: 5’-ACAAATGTCTCGCTCGAACCT-3’';
LB: 5’-GCCGAGTCTATCAGACTGCC-3’.
Реагент для амплификации RT-LAMP состоит из 10 ед/мкл обратной транскриптазы AMV, 40 ед/мкл ингибитора RNAse, 10 мМ смеси dNTP, 10× реакционного буфера ThermoPol, 100 мМ MgSO4, 8 ед/мкл Bst DNA polymerase и RNA-free H2O;
Фосфатно-солевой буфер (PBS) и фосфатный промывочный буфер (PBST) имели концентрацию 0,02 М, рН 7,4.
Раствор для обнаружения флуоресцентного красителя представляет собой 1000×SYBR Green I;
Отрицательный контроль – RNA-free H2O;
Положительным контролем служил стандарт гена CP BrYV дудника.
Этот вариант осуществления также обеспечивает способ приготовления стандарта гена CP BrYV. Конкретный метод приготовления заключается в следующем:
1. Извлечение тотальной РНК
50-100 мг листьев шлемника байкальского, инфицированных BrYV, измельчают в жидком азоте, и тотальную РНК из восприимчивой ткани экстрагируют с помощью набора для выделения тотальной РНК растений;
2. Дизайн и синтез праймеров
По последовательности, полученной секвенированием малых РНК, сконструированы и синтезированы пары специфических прямого (BrYV-F) и обратного (BrYV-R) праймеров для гена CP BrYV, последовательности указанных праймеров следующие:
BrYV-F:5’-AGTCGTGGGTAGGAGAACA-3’
BrYV-R:5’-AATCGTGGAGGAGAGTGAA-3’;
3. Приготовление положительных контролей
1) Реакция RT
Используйте вышеуказанные обратные праймеры BrYV-R BrYV и обратную транскриптазу M-MLV для проведения реакции RT для синтеза первой цепи кДНК; реакционная система 10 мкл RT: тотальная РНК 2 мкл, 10 мкМ специфического обратного праймера BrYV-R BrYV 1 мкл, RNA-free H2O 3 мкл, денатурировали при 70°C в течение 10 мин, быстро помещали на лед на 2 мин, затем добавляли буфер 5×M-MLV 2 мкл, 10 мМ dNTPs 1 мкл, 30 ЕД/мкл ингибитор RNase 0,34 мкл, 200 ЕД/мкл обратная транскриптаза M-MLV 0,35 мкл и RNA-free 0,31 мкл; после смешивания помещают на водяную баню при 42°С в течение 1 ч, инкубируют при 70°С в течение 15 мин и помещают на лед для использования.
2) Реакция PCR
Используя в качестве матрицы первую цепь кДНК, полученную на шаге (1), проводили ПЦР-амплификацию гена CP BrYV под действием ДНК-полимеразы Ex Taq;
Реакционная система PCR составляет 12,5 мкл, включая: 50 нг кДНК 0,5 мкл, 5 ед/мкл ДНК-полимеразы Ex Taq 0,1 мкл, 10× буфер PCR 1,25 мкл, 2,5 мМ dNTPs 1 мкл, 10 мкМ прямого праймера BrYV-F 0,25 мкл, 10 мкМ обратного праймера BrYV-R 0,25 мкл, добавление ddH2O до 12,5 мкл;
Условия ПЦР-амплификации: предденатурация при 94°С 4 мин, денатурация при 94°С 30 с, отжиг при 51°С 45 с, удлинение при 72°С 30 с, 35 циклов амплификации, и окончательное удлинение при 72°С в течение 7 мин;
После обнаружения продуктов ПЦР с помощью электрофореза в 1,5% агарозном геле восстанавливали целевые фрагменты, используйте набор векторов для клонирования, чтобы соединить целевой фрагмент с вектором pMD18-T, трансформировать компетентные клетки DH5α и выполнить скрининг сине-белых пятен; произвольно выберите 3 колонии с белыми пятнами и инокулируйте их на среду с ампициллином LB и встряхивайте бактерии при 37°C в течение 12-16 часов; используйте набор мини-экстракции плазмиды для извлечения плазмиды; возьмите 1 мкл плазмид соответственно и проведите амплификацию ПЦР в тех же условиях, что и в приведенной выше реакционной системе ПЦР; секвенируйте положительные рекомбинантные плазмиды, обнаруженные с помощью ПЦР; Секвенирование подтвердило, что последовательность положительной плазмиды была полностью правильной, т. е. положительным контролем, а длина фрагмента, соответствующая гену BrYV CP шлемника байкальского, составляла 424 п.н.; плазмидные концентрации стандартов определяли с использованием анализатора нуклеиновых кислот/белков NanoDrop ND-1000.
3. Последовательность положительных контролей
После секвенирования вышеупомянутые вещества положительного контроля полностью соответствуют ожиданиям, а последовательности извлеченных фрагментов контрольных веществ являются следующими:
Стандартная последовательность фрагмента гена CP BrYV шлемника байкальского:
AGTCGTGGGGTAGAGAACAATCAATGGAAGAAGACGACCACGCAGGCAAACAAGGCGCATTCAGCGAAATCAGCCAGTGGTTGTGGTCCAAACCTCTCGGACAACACAACGCCGACCTAGACGACGACGAAGAGGTAACAACCGGACAGGAAGAACTGTTCCTACCAGAGGAGCAGGTTCGAGCGAGACATTTGTTTTCTCAAAAGACAATCTCGCGGGAAGTTCCAGCGGAGCAATCACGTTCGGGCCGAGTCTATCAGACTGCCCGGCATTCTCTAATGGAATGCTCAAGGCCTACCATGAATATAAGATCTCAATGGTCATTCTGGAGTTCGTCTCCGAGGCCTCTTCCCAAAATTCCGGTTCCATCGCTTACGAGCTGGACCCACACTGTAAACTCAATTCACTCTCTTCCCACGATTAA.
Вариант осуществления 3
В этом варианте осуществления представлен способ обнаружения вируса желтизны брассики BrYV с использованием тест-набора GICA-RT-LAMP в варианте осуществления 2.
1. Обогащение вирусных частиц иммунохроматографии коллоидного золота GICA
1) Возьмите 100 мг образца шлемника байкальского, инфицированного BrYV, или других тестируемых образцов для тестирования, поместите их в пакет с застежкой-молнией объемом 3 мл, содержащий фосфатно-солевой буферный раствор PBS, и осторожно измельчите его пестиком, а жидкость измельченной ткани является жидкостью для обнаружения тестируемого образца;
2) Возьмите небольшое количество раствора для детектирования из вышеупомянутого тестируемого образца, поместите его на окошко для образца 2 тест-карточки BrYV для иммунохроматографии с коллоидным золотом в варианте осуществления 1 и наблюдайте за результатом проявления окраски в окошке для наблюдения за реакцией 3 в течение 3-5 минут.
2. Первоначальное определение результатов реакции
Когда коричнево-красные полосы появляются как на Т-линии обнаружения 9, так и на С-линии контроля качества 10 в окне наблюдения за реакцией 3 тест-карточки иммунохроматографии с коллоидным золотом BrYV, определяется, что тестируемый образец инфицирован BrYV, последующее обнаружение не требуется;
Когда Т-линия обнаружения 9 в окне наблюдения за реакцией 3 в тест-карточке иммунохроматографии с коллоидным золотом BrYV не имеет изменения цвета, а на С-линии контроля качества 10 появляется коричнево-красная полоса, определяется, что тестируемый образец не инфицирована BrYV или имеет легкую степень BrYV, требуется последующее обнаружение с помощью RT-LAMP с обратной транскрипцией.
3. Реакция RT-LAMP
1) Отрежьте Т-линию обнаружения на иммунохроматографической тест-карточке GICA иммунохроматографии с коллоидным золотом BrYV после выше реакции, трижды промойте PBST, осторожно очистите область Т-линии стерилизованным лезвием и поместите ее в пробирку для ПЦР;
2) Добавьте 40 ед/мкл ингибитора RNAse 0,15 мкл, 10 ед/мкл обратной транскриптазы AMV 0,3 мкл, 10× буфер ThermoPol 1,25 мкл, 100 мМ MgSO4 0,75 мкл, 10 мМ смеси dNTP 1,75 мкл в указанную выше пробирку для ПЦР, содержащую Т-линию, набор праймеров LAMP, содержащий 2,5 мкМ F3 и B3, 20,0 мкМ FIP и BIP и 10,0 мкМ LF и LB, соответственно, 1,0 мкл, 8 ЕД/мкл ДНК-полимеразы Bst 1,0 мкл и RNAse free H2O, дополненной до 12,5 мкл; В качестве отрицательного контроля использовали RNA-free H2O, в качестве положительного контроля использовали стандарт гена CP BrYV шлемника байкальского, после настройки реакционной системы на внутреннюю стенку реакционной системы добавляли 1 мкл 100× рабочего раствора флуоресцентного красителя SYBR Green I, плотно закройте пробирку для ПЦР и проведите реакцию RT-LAMP; условия реакции RT-LAMP: амплификация при 58-66°C в течение 60-100 мин с последующей денатурацией при 80°C в течение 10 мин для прекращения реакции.
4. Результаты реакции вторичного суждения
После завершения вышеуказанной реакции RT-LAMP отцентрифугируйте или осторожно встряхните пробирку для ПЦР, не открывая крышку, чтобы смешать флуоресцентный краситель SYBR Green I на внутренней стенке крышки пробирки для ПЦР с продуктом амплификации LAMP, переверните вверх дном и равномерно перемешайте, и наблюдать невооруженным глазом Изменение цвета смеси в пробирке для ПЦР:
Если цвет смеси становится зеленым, это означает, что краситель SYBR Green I связывается с двухцепочечной ДНК, и это положительная реакция, указывающая на то, что тестируемый образец содержит вирус желтизны брассики BrYV;
Если цвет смеси оранжевый, это отрицательная реакция, указывающая на то, что образец не содержит вируса желтизны брассики BrYV.
Вариант осуществления 1
Этот вариант осуществления представляет собой эксперимент по наблюдению невооруженным глазом флуоресцентных красителей для обнаружения BrYV с помощью тест-набора GICA-RT-LAMP в варианте осуществления 2 при различных температурах реакции и времени реакции, метод обнаружения показан в варианте осуществления 3.
Проверьте результаты амплификации RT-LAMP в течение 80 минут при температуре амплификации RT-LAMP 56°C, 58°C, 60°C, 62°C, 64°C, 66°C, 68°C и 70°C. Как показано на чертеже 3, на чертеже: 1: отрицательный контроль; 2-9 соответствуют: 56°С, 58°С, 60°С, 62°С, 64°С, 66°С, 68°С и 70°С. Из чертежа видно, что комбинация праймеров для амплификации, предусмотренная в варианте осуществления настоящего изобретения, может обеспечить эффективную амплификацию гена-мишени в условиях 58-66°С.
Проверьте результаты амплификации при 64°C при времени амплификации RT-LAMP 20 мин, 30 мин, 40 мин, 50 мин, 60 мин, 70 мин, 80 мин, 90 мин и 100 мин соответственно. Как показано на чертеже 4, на чертеже: 1: отрицательный контроль; 2-10 соответствуют: 20 мин, 30 мин, 40 мин, 50 мин, 60 мин, 70 мин, 80 мин, 90 мин, 100 мин соответственно. Как видно из чертежа, комбинация праймеров для амплификации, представленная в варианте осуществления настоящего изобретения, может обеспечить эффективную амплификацию целевого гена в условиях 60-100 мин.
Вариант осуществления 2
Чувствительность иммунохроматографии с коллоидным золотом GICA-RT-LAMP к обнаружению BrYV.
Для анализа чувствительности иммунохроматографии с коллоидным золотом GICA-RT-LAMP к обнаружению BrYV в качестве образца использовали стандарт гена CP BrYV шлемника байкальского в приведенном выше варианте, после определения концентрации (2,5×105 нг/мл) с помощью анализатора нуклеиновых кислот/белков NanoDrop ND-1000, вышеупомянутые стандарты затем разбавляли RNA-free H2O в 10 раз, и хранили при -20°C в качестве матрицы. 1,0 мкл каждого раствора для разведения после 10-кратного разбавления брали в качестве матрицы, и добавляли реакционный реагент RT-LAMP в приведенном выше варианте осуществления для проведения амплификации RT-LAMP, а программа реакции составляла 64°C в течение 80 мин;
В качестве сравнительного определения проводили ПЦР-амплификацию для каждого раствора разведения после указанного выше 10-кратного разведения. Условия ПЦР-амплификации: предденатурация при 94°С 4 мин, денатурация при 94°С 30 с, отжиг при 51°С 45 с, удлинение при 72°С 30 с, 35 циклов амплификации, и окончательное удлинение при 72°С в течение 7 мин;
После реакции RT-LAMP для наблюдения за развитием окраски невооруженным глазом использовали флуоресцентный краситель SYBR Green I, результаты показали, что чувствительность GICA-RT-LAMP к стандарту гена CP BrYV шлемника байкальского составила 2,5×10-4 нг. /мл или 0,25 пг/мл (чертеж 5); после реакции ПЦР отбирали 5 мкл амплифицированного продукта, и результаты электрофореза в агарозном геле показали, что чувствительность реакции GICA-RT-PCR к стандарту гена CP BrYV шлемника байкальского составила 2,5×10-2 нг/мл, то есть 25 пг/мл (чертеж 6), видно, что чувствительность иммунохроматографии с коллоидным золотом GICA-RT-LAMP для выявления BrYV в 100 раз выше, чем у GICA-RT-PCR.
Вариант осуществления 3
Специфичность иммунохроматографии с коллоидным золотом GICA-RT-LAMP для выявления BrYV
Для анализа специфичности иммунохроматографии с коллоидным золотом GICA-RT-LAMP для выявления BrYV у шлемника байкальского использовали 11 распространенных вирусов: поражающих лилию, дудник, салат и шлемник байкальский: Восприимчивые листья (собранные в полевых условиях) LSV, CMV-Li, LMoV, ArMV, PlAMV, JHMV-DG, AMV, LNYV, LMV, CMV-L и BrYV использовали в качестве образцов, соответственно поместите их в пакет с застежкой-молнией, содержащийбуфер PBS, и осторожно измельчите его пестиком, после измельчения его превращают в капли для обнаружения и добавляют в окно для добавления образца на тест-карточке 3 иммунохроматографии с коллоидным золотом GICA BrYV, и результаты проявления окраски наблюдают через 3-5 минут; затем проведена амплификация RT-LAMP с использованием системы и метода GICA-RT-LAMP в вышеупомянутом варианте осуществления, программа реакции составляла 64°C в течение 80 мин, и после завершения амплификации появлялась окраска, и здоровые листья шлемника байкальского использовали в качестве отрицательного контроля. Эксперимент повторяли три раза.
Результаты проявления цвета тест-карточки показали, что коричнево-красные полосы появляются как на Т-линии обнаружения, так и на C-линии контроля качества образцов листьев шлемника байкальского, зараженных BrYV, в то время Т-линии обнаружени других образцов не имели изменения цвета, и на C-линии контроля качества появляются коричнево-красные полосы.
Результаты визуального наблюдения флуоресцентным красителем SYBR Green I показали, что только продукты амплификации листьев шлемника байкальского, инфицированных BrYV, имели зеленый цвет, а продукты амплификации остальных восприимчивых листьев и здоровых листьев шлемника байкальского были оранжевыми (чертеж 7); это показывает, что способ GICA-RT-LAMP, установленный в настоящем изобретении, обладает высокой специфичностью к BrYV и не имеет перекрестной реакции с другими распространенными вирусами.
Вариант осуществления 4
Полевые пробы выявляли с помощью иммунохроматографии с коллоидным золотом GICA-RT-LAMP.
Возьмите полевые образцы листьев шлемника байкальского, используйте тест-карточку иммунохроматографии с коллоидным золотом GICA BrYV для обогащения вирусных частиц, а затем используйте систему обнаружения GICA-RT-LAMP в варианте осуществления 3 выше для проведения амплификации RT-LAMP.
Когда коричнево-красные полосы появляются как на T-линии обнаружения, так и на C-линии контроля качества тест-карточки GICA, определяется, что тестируемый образец инфицирован вирусом желтизны брассики BrYV.
Если на тест-карточке GICA не наблюдается изменения цвета на T-линии обнаружения, но появляется коричнево-красная полоса на C-линии контроля качества, а флуоресцентный краситель показывает зеленый цвет при наблюдении невооруженным глазом, это означает, что образец содержит вирус желтизны брассики BrYV;
Если на тест-карточке GICA не наблюдается изменения цвета на T-линии обнаружения, но появляется коричнево-красная полоса на C-линии контроля качества, а флуоресцентный краситель показывает оранжевый цвет при наблюдении невооруженным глазом, это означает, что образец не содержат вируса желтизны брассики BrYV.
Вышеприведенные описания являются только предпочтительными вариантами осуществления настоящего изобретения и не предназначены для ограничения настоящего изобретения, для специалистов в данной области техники настоящее изобретение может иметь различные модификации и изменения. Любая модификация, эквивалентная замена, усовершенствование и т.д., выполненные в духе и принципе настоящего изобретения, должны быть включены в объем охраны настоящего изобретения.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Северо-западный институт экологической окружающей среды и
ресурсов Китайской академии наук
<120> Тест-карточка и тест-набор для выявления вируса желтизны
брассики
<160> 6
<170> Версия патента 3.5
<210> 1
<211> 19
<212> ДНК
<213> Искусственная последовательность
<400> 1
aggtaacaac cggacagga 19
<210> 2
<211> 19
<212> ДНК
<213> Искусственная последовательность
<400> 2
tcggagacga actccagaa 19
<210> 3
<211> 42
<212> ДНК
<213> Искусственная последовательность
<400> 3
ggaacttccc gcgagattgt ctactgttcc taccagagga gc 42
<210> 4
<211> 40
<212> ДНК
<213> Искусственная последовательность
<400> 4
agcggagcaa tcacgttcgg attcatggta ggccttgagc 40
<210> 5
<211> 21
<212> ДНК
<213> Искусственная последовательность
<400> 5
acaaatgtct cgctcgaacc t 21
<210> 6
<211> 20
<212> ДНК
<213> Искусственная последовательность
<400> 6
gccgagtcta tcagactgcc 20
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Тест-система для выявления специфических нуклеотидных последовательностей, характерных для выявляемых микроорганизмов или вирусов, способ применения тест-системы (варианты) | 2021 |
|
RU2769572C1 |
| Набор олигонуклеотидных праймеров и зондов для идентификации РНК вируса лихорадки Рифт-Валли методом изотермической ПЦР с гибридизационно-флуоресцентной детекцией в режиме реального времени | 2023 |
|
RU2813519C1 |
| Набор олигонуклеотидных праймеров и флуоресцентно-меченых зондов для идентификации РНК коронавируса человека SARS-CoV-2 методом изотермической ПЦР с гибридизационно-флуоресцентной детекцией в режиме реального времени | 2021 |
|
RU2778855C1 |
| СПОСОБ ОБНАРУЖЕНИЯ МИКРООРГАНИЗМОВ, ПРИНАДЛЕЖАЩИХ ВИДУ MYCOPLASMA PNEUMONIAE И/ИЛИ MYCOPLASMA GENITALIUM | 2010 |
|
RU2575075C2 |
| ТЕСТ-СИСТЕМА ДЛЯ ОБНАРУЖЕНИЯ ВИРУСА ХЛОРОТИЧЕСКОЙ ПЯТНИСТОСТИ ЛИСТЬЕВ ЯБЛОНИ МЕТОДОМ ПЦР В РЕАЛЬНОМ ВРЕМЕНИ | 2024 |
|
RU2835209C1 |
| ТЕСТ-СИСТЕМА ДЛЯ ОБНАРУЖЕНИЯ ВИРУСА ЯМЧАТОСТИ ДРЕВЕСИНЫ ЯБЛОНИ МЕТОДОМ ПЦР В РЕАЛЬНОМ ВРЕМЕНИ | 2024 |
|
RU2837395C1 |
| Тест-система для выявления РНК возбудителя вируса артериита у лошадей | 2018 |
|
RU2698662C1 |
| Тест-система для обнаружения генома вируса парагриппа 3 типа у крупного рогатого скота с помощью мультиплексной полимеразной цепной реакции с флуоресцентной детекцией в режиме реального времени | 2018 |
|
RU2681473C1 |
| Набор олигонуклеотидных праймеров для выявления РНК вируса желтой лихорадки методом изотермической амплификации в режиме реального времени | 2024 |
|
RU2824209C1 |
| Тест-система для обнаружения генома возбудителя ротовируса типа А у сельскохозяйственных животных с помощью мультиплексной полимеразной цепной реакции с флуоресцентной детекцией в режиме реального времени | 2018 |
|
RU2694501C1 |

Настоящее изобретение относится к области биотехнологии. Описан тест-набор для обнаружения вируса желтизны брассики BrYV. Тест-набор содержит тест-карточку для выявления указанного вируса и композицию праймеров для обнаружения вируса. Также описаны способ обнаружения вируса BrYV и применения тест-набора для выявления вируса. Технический результат, достигаемый изобретением, заключается в разработке тест-набора для быстрого и чувствительного обнаружения Brassica yellows virus. 3 н. и 11 з.п. ф-лы, 7 ил.
1. Тест-набор для обнаружения вируса желтизны брассики (BrYV), отличающийся тем, что он содержит тест-карточку для выявления вируса желтизны брассики и композицию праймеров для обнаружения вируса желтизны брассики, композиция праймеров включает прямой внешний праймер F3, показанный в SEQ ID NO: 1, обратный внешний праймер B3, показанный в SEQ ID NO: 2, прямой внутренний праймер FIP, показанный в SEQ ID NO: 3, обратный внутренний праймер BIP, показанный в SEQ ID NO: 4, праймер прямой петли LF, показанный в SEQ ID NO: 5, и праймер обратной петли LB, показанный в SEQ ID NO: 6; при этом
тест-карточка включает в себя подушечку для образцов, подушечку для связывания с коллоидным золотом, нитроцеллюлозную мембрану и подушечку для абсорбции, расположенные последовательно на подкладочной пластине, при этом подушечка для связывания с коллоидным золотом содержит конъюгат антител к вирусу желтизны брассики и коллоидного золота, Т-линия обнаружения и С-линия контроля качества расположены на нитроцеллюлозной мембране последовательно вдоль хроматографического направления, Т-линия обнаружения покрыта антителом IgG к BrYV, а С-линия контроля качества покрыта вторичным антителом с антителом к BrYV; количество покрывающего антитела IgG к BrYV на Т-линии обнаружения составляет 1,5-2,0 мкг белка на 2 мм ширины линии; количество покрывающего антитела вторичного антитела к BrYV составляет 1,5-2,0 мкг белка на 2 мм ширины линии;
количество антител к вирусу желтизны брассики, нанесенное на подушечку для связывания с коллоидным золотом, составляет 16-18 мкг антитела к вирусу желтизны брассики на 1 мл коллоидного золота.
2. Тест-набор по п.1, отличающийся тем, что тест-карточка дополнительно содержит слот для карты, состоящий из нижнего корпуса и верхнего корпуса, слот для карты имеет установочную полость для размещения подкладочной пластины, и подкладочная пластина неподвижно соединена с внутренней стенкой нижнего корпуса, а верхний корпус неподвижно соединен с нижним корпусом.
3. Тест-набор по п.2, отличающийся тем, что верхний корпус снабжен окном для добавления образца и окном для наблюдения за реакцией с интервалами, окно для добавления образца расположено над подушечкой для образца в пространстве, а окно для наблюдения за реакцией пространственно расположено над нитроцеллюлозной мембраной.
4. Тест-набор по п.3, отличающийся тем, что верхний корпус и нижний корпус соединены защелкивающейся конструкцией с защелкой.
5. Тест-набор по п.1, отличающийся тем, что тест-набор дополнительно включает реагенты для реакции амплификации, а реагенты для реакции амплификации включают обратную транскриптазу, ингибитор RNase, смесь dNTP, реакционный буфер, MgSO4, ДНК-полимеразу и воду.
6. Тест-набор по п.5, отличающийся тем, что обратную транскриптазу выбирают из обратной транскриптазы AMV или обратной транскриптазы M-MLV, а реакционный буфер выбирают из реакционного буфера ThermoPol.
7. Тест-набор по п.5, отличающийся тем, что ДНК-полимераза выбрана из ДНК-полимеразы Bst.
8. Тест-набор по п.1, отличающийся тем, что тест-набор дополнительно включает фосфатный буфер, фосфатный промывочный буфер, раствор для обнаружения флуоресцентного красителя, вещество отрицательного контроля и вещество положительного контроля.
9. Тест-набор по п.8, отличающийся тем, что веществом отрицательного контроля является вода, а веществом положительного контроля является стандартное вещество фрагмента гена CP оболочечного белка вируса желтизны брассики.
10. Способ обнаружения вируса желтизны брассики, который использует тест-набор по п.1, отличающийся тем, что он включает следующие этапы, при которых:
(1) берут тестируемый раствор на подушечку для образцов тест-карточки для выявления вируса желтизны брассики, наблюдают за изменением цвета Т-линии обнаружения и С-линии контроля качества и впервые определяют, содержится ли вирус желтизны брассики BrYV в тестируемом образце;
(2) если невозможно определить, содержится ли вирус желтизны брассики BrYV в соответствии с шагом (1), выполняют амплификацию c обратной транскрипцией амплификации: Т-линию обнаружения на тест-карточке после реакции иммунного обогащения на шаге (1) удаляют, а удаленную Т-линию обнаружения используют в качестве матрицы, а композицию праймера для обнаружения амплификации используют для проведения амплификации; по продукту реакции амплификации вторично определяют, содержится ли вирус желтизны брассики BrYV в тестируемом образце.
11. Способ обнаружения вируса желтизны брассики по п.10, отличающийся тем, что определяют, содержится ли вирус желтизны брассики BrYV в тестируемом образце в первый раз, с помощью наблюдения невооруженным глазом по изменению цвета Т-линии обнаружения и С-линии контроля качества; а именно:
если на Т-линии обнаружения и С-линии контроля качества присутствуют коричнево-красные полосы, делают вывод, что тестируемый образец содержит вирус желтизны брассики BrYV, и амплификацию c обратной транскрипцией не выполняют;
если на Т-линии обнаружения нет изменения цвета, а только на С-линии контроля качества появляется коричнево-красная полоса, то определяют, что тестируемый образец не заражен BrYV, или содержание BrYV низкое, и тогда выполняют амплификацию c обратной транскрипцией.
12. Способ обнаружения вируса желтизны брассики по п.10, отличающийся тем, что по продукту реакции амплификации вторично определяют, содержится ли вирус желтизны брассики BrYV в тестируемом образце, для чего используют метод наблюдения невооруженным глазом с использованием флуоресцентного красителя, при котором:
берут реакционный раствор флуоресцентного красителя и добавляют его в крышку реакционной пробирки для амплификации перед реакцией, после завершения реакции амплификации смешивают раствор для обнаружения флуоресцентного красителя с реакционным раствором и непосредственно наблюдают за цветом раствор смешанной реакции невооруженным глазом.
13. Способ обнаружения вируса желтизны брассики по п.12, отличающийся тем, что в качестве реакционного раствора флуоресцентного красителя используют SYBR Green I, и
если амплифицированный продукт показывает зеленую флуоресценцию, делают вывод, что тестируемый образец содержит вирус желтизны брассики;
если цвет амплифицированного продукта оранжевый, делают вывод, что тестируемый образец не содержит вируса желтизны брассики.
14. Применение тест-набора для выявления вируса желтизны брассики по любому из пп.1-9 для выявления вируса желтизны брассики.
| CN 202256349 U, 30.05.2012 | |||
| 0 |
|
SU201487A1 | |
| Zhang, X., Peng, Y., Wang, Y | |||
| et al | |||
| Simultaneous detection and differentiation of three genotypes of Brassica yellows virus by multiplex reverse transcription-polymerase chain reaction | |||
| Насос | 1917 |
|
SU13A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
Авторы
Даты
2023-09-07—Публикация
2022-08-30—Подача