РОДСТВЕННЫЕ ЗАЯВКИ
Настоящая заявка испрашивает приоритет согласно предварительным заявкам на патенты США с серийными №№ 62/625145, подано 1 февраля 2018 г., 62/671915, подано 15 мая 2018 г., и 62/793158, подано 16 января 2019 г., полное раскрытие которых тем самым включено в данный документ посредством ссылки.
ССЫЛКА НА ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ, ПОДАННЫЙ В ЭЛЕКТРОННОМ ВИДЕ
Содержание перечня последовательностей, предоставленного в электронном виде в виде текстового файла в формате ASCII (название: 609628_SA9_460PC_Sequence_Listing.txt; размер: 204203 байта, и дата создания: 31 января 2019 г.), включено в данный документ посредством ссылки во всей своей полноте.
ПРЕДПОСЫЛКИ К СОЗДАНИЮ ИЗОБРЕТЕНИЯ
Путь коагуляции частично включает образование ферментативного комплекса фактора VIIIa (FVIIIa) и фактора IXa (FIXa) (комплекс Xase) на поверхности тромбоцитов. FIXa представляет собой сериновую протеазу с относительно слабой каталитической активностью без своего кофактора FVIIIa. Комплекс Xase расщепляет фактор X (FX) с образованием фактора Xa (FXa), который в свою очередь взаимодействует с фактором Va (FVa), расщепляя протромбин и генерируя тромбин. Гемофилия A представляет собой нарушение свертываемости крови, вызванное мутациями и/или делециями в гене FVIII (FVIII), что приводит к дефициту активности FVIII (Peyvandi et al. 2006). В некоторых случаях у пациентов снижаются уровни FVIII из-за присутствия ингибиторов FVIII, таких как антитела против FVIII.
Заболевание можно лечить с помощью заместительной терапии, направленной на восстановление активности FVIII для предотвращения спонтанного кровотечения. Доступны продукты, представляющие собой полученный из плазмы крови и рекомбинантный FVIII, для лечения эпизодов кровотечений по необходимости или для предупреждения возникновения эпизодов кровотечений путем профилактического лечения. Исходя из периода полужизни этих продуктов (10-12 часов) (White G.C., et al., Thromb. Haemost. 77:660-7 (1997); Morfini, M., Haemophilia 9 (suppl 1):94-99; обсуждение 100 (2003)), режимы лечения требуют частого внутривенного введения, обычно два-три раза в неделю для профилактики и один-три раза в сутки для лечения по необходимости (Manco-Johnson, M.J., et al., N. Engl. J. Med. 357:535-544 (2007)). Такое частое введение является неудобным и дорогостоящим.
Основным препятствием для обеспечения пациентов недорогим рекомбинантным белком FVIII является высокая стоимость коммерческого производства. Белок FVIII плохо экспрессируется в гетерологичных системах экспрессии, на уровне на два-три порядка ниже, чем белки аналогичного размера. (Lynch et al., Hum. Gene. Ther.; 4:259-72 (1993). Прогресс в понимании нами биологии экспрессии FVIII привел к разработке более эффективных вариантов FVIII. Например, биохимические исследования показали, что B-домен FVIII не является обязательным для осуществления активности кофактора FVIII. Удаление В-домена приводило к 17-кратному увеличению уровней мРНК по сравнению с полноразмерным FVIII дикого типа и к 30% увеличению уровня секретируемого белка. (Toole et al., Proc Natl Acad Sci USA 83:5939-42 (1986)). Тем не менее, в данной области техники все еще существует потребность в последовательностях FVIII, которые эффективно экспрессируются в гетерологичных системах.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение предусматривает способы лечения нарушения свертываемости крови у субъекта, нуждающегося в этом, включающие введение субъекту по меньшей мере одной дозы, составляющей 5х1010 трансдуцирующих единиц/кг (ТЕ/кг) или меньше (например, 5х109 или меньше, или 108 ТЕ/кг или меньше) лентивирусного вектора, содержащего выделенную молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, кодирующую полипептид с активностью FVIII, где нуклеотидная последовательность характеризуется (i) по меньшей мере 91%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-2277 и 2320-4374 из SEQ ID NO: 1; (ii) по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-2277 и 2320-4374 из SEQ ID NO: 2; (iii) по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-2277 и 2320-4374 из SEQ ID NO: 70; (iv) по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-2277 и 2320-4374 из SEQ ID NO: 71; (v) по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-2277 и 2320-4374 из SEQ ID NO: 3; (vi) по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-2277 и 2320-4374 из SEQ ID NO: 4; (vii) по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-2277 и 2320-4374 из SEQ ID NO: 5; (viii) по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-2277 и 2320-4374 из SEQ ID NO: 6; или (ix) любой комбинацией (i) - (viii).
Настоящее изобретение также предусматривает способы лечения нарушения свертываемости крови у субъекта, нуждающегося в этом, включающие введение субъекту по меньшей мере одной дозы, составляющей 5х1010 ТЕ/кг или меньше (например, 5х109 или меньше, или 108 ТЕ/кг или меньше) лентивирусного вектора, содержащего выделенную молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, которая содержит первую последовательность нуклеиновой кислоты, кодирующую N-концевую часть полипептида фактора VIII (FVIII), и вторую последовательность нуклеиновой кислоты, кодирующую C-концевую часть полипептида FVIII; (a) где первая последовательность нуклеиновой кислоты характеризуется: (i) по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-2277 и 2320-1791 из SEQ ID NO: 3; (ii) по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-2277 и 2320-1791 из SEQ ID NO: 4; (iii) по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-1791 из SEQ ID NO: 5; или (iv) по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-1791 из SEQ ID NO: 6; (b) где вторая нуклеотидная последовательность характеризуется: (i) по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 1792-2277 и 2320-4374 из SEQ ID NO: 3; (ii) по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 1792-2277 и 2320-4374 из SEQ ID NO: 4; (iii) по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 1792-2277 и 2320-4374 из SEQ ID NO: 5; или (iv) по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 1792-2277 и 2320-4374 из SEQ ID NO: 6; или (c) любой комбинацией (a) и (b); и где N-концевая часть и C-концевая часть вместе обладают активностью полипептида FVIII.
В некоторых вариантах осуществления способов, раскрытых выше, доза составляет приблизительно 9,5х108 ТЕ/кг, приблизительно 9×108 ТЕ/кг, приблизительно 8,5х108 ТЕ/кг, приблизительно 8×108 ТЕ/кг, приблизительно 7,5х108 ТЕ/кг, приблизительно 7×108 ТЕ/кг, приблизительно 6,5х108 ТЕ/кг, приблизительно 6×108 ТЕ/кг, приблизительно 5,5х108 ТЕ/кг, приблизительно 5х108 ТЕ/кг, приблизительно 4,5х108 ТЕ/кг, приблизительно 4×108 ТЕ/кг, приблизительно 3,5х108 ТЕ/кг, приблизительно 3×108 ТЕ/кг, приблизительно 2,5х108 ТЕ/кг, приблизительно 2×108 ТЕ/кг, приблизительно 1,5х108 ТЕ/кг или приблизительно 1×108 ТЕ/кг, приблизительно 5х1010 ТЕ/кг, приблизительно 4,5х1010 ТЕ/кг, приблизительно 4×1010 ТЕ/кг, приблизительно 3,5х1010 ТЕ/кг, приблизительно 3×1010 ТЕ/кг, приблизительно 2,5х1010 ТЕ/кг, приблизительно 2×1010 ТЕ/кг, приблизительно 1,5х1010 ТЕ/кг, приблизительно 1×1010 ТЕ/кг, приблизительно 9,5х109 ТЕ/кг, приблизительно 9×109 ТЕ/кг, приблизительно 8,5х109 ТЕ/кг, приблизительно 8×109 ТЕ/кг, приблизительно 7,5х109 ТЕ/кг, приблизительно 7×109 ТЕ/кг, приблизительно 6,5х109 ТЕ/кг, приблизительно 6×109 ТЕ/кг, приблизительно 5,5х109 ТЕ/кг, приблизительно 5х109 ТЕ/кг, приблизительно 4,5х109 ТЕ/кг, приблизительно 4×109 ТЕ/кг, приблизительно 3,5х109 ТЕ/кг, приблизительно 3×109 ТЕ/кг, приблизительно 2,5х109 ТЕ/кг, приблизительно 2×109 ТЕ/кг, приблизительно 1,5х109 ТЕ/кг или приблизительно 1×109 ТЕ/кг.
В некоторых вариантах осуществления доза составляет менее приблизительно 9,5х108 ТЕ/кг, менее приблизительно 9×108 ТЕ/кг, менее приблизительно 8,5х108 ТЕ/кг, менее приблизительно 8×108 ТЕ/кг, менее приблизительно 7,5х108 ТЕ/кг, менее приблизительно 7×108 ТЕ/кг, менее приблизительно 6,5х108 ТЕ/кг, менее приблизительно 6×108 ТЕ/кг, менее приблизительно 5,5х108 ТЕ/кг, менее приблизительно 5х108 ТЕ/кг, менее приблизительно 4,5х108 ТЕ/кг, менее приблизительно 4×108 ТЕ/кг, менее приблизительно 3,5х108 ТЕ/кг, менее приблизительно 3×108 ТЕ/кг, менее приблизительно 2,5х108 ТЕ/кг, менее приблизительно 2×108 ТЕ/кг, менее приблизительно 1,5х108 ТЕ/кг или менее приблизительно 1×108 ТЕ/кг, менее приблизительно 5х1010 ТЕ/кг, менее приблизительно 4,5х1010 ТЕ/кг, менее приблизительно 4×1010 ТЕ/кг, менее приблизительно 3,5х1010 ТЕ/кг, менее приблизительно 3×1010 ТЕ/кг, менее приблизительно 2,5х1010 ТЕ/кг, менее приблизительно 2×1010 ТЕ/кг, менее приблизительно 1,5х1010 ТЕ/кг, менее приблизительно 1×1010 ТЕ/кг, менее приблизительно 9,5х109 ТЕ/кг, менее приблизительно 9×109 ТЕ/кг, менее приблизительно 8,5х109 ТЕ/кг, менее приблизительно 8×109 ТЕ/кг, менее приблизительно 7,5х109 ТЕ/кг, менее приблизительно 7×109 ТЕ/кг, менее приблизительно 6,5х109 ТЕ/кг, менее приблизительно 6×109 ТЕ/кг, менее приблизительно 5,5х109 ТЕ/кг, менее приблизительно 5х109 ТЕ/кг, менее приблизительно 4,5х109 ТЕ/кг, менее приблизительно 4×109 ТЕ/кг, менее приблизительно 3,5х109 ТЕ/кг, менее приблизительно 3×109 ТЕ/кг, менее приблизительно 2,5х109 ТЕ/кг, менее приблизительно 2×109 ТЕ/кг, менее приблизительно 1,5х109 ТЕ/кг или менее приблизительно 1×109 ТЕ/кг.
В некоторых вариантах осуществления доза составляет от 1×108 до 5х1010 ТЕ/кг, от 1×108 до 5х109 ТЕ/кг, от 1×108 до 1×109 ТЕ/кг, от 1×108 до 1×1010 ТЕ/кг, от 1×109 до 5х1010 ТЕ/кг, от 2×109 до 5х1010 ТЕ/кг, от 3×109 до 5х1010 ТЕ/кг, от 4×109 до 5х1010 ТЕ/кг, от 5х109 до 5х1010 ТЕ/кг, от 6×109 до 5х1010 ТЕ/кг, от 7×109 до 5х1010 ТЕ/кг, 8×109 до 5х1010 ТЕ/кг, от 9×109 до 5х1010 ТЕ/кг, от 1010 до 5х1010 ТЕ/кг, от 1,5х1010 до 5х1010 ТЕ/кг, от 2×1010 до 5х1010 ТЕ/кг, от 2,5х1010 до 5х1010 ТЕ/кг, от 3×1010 до 5х1010 ТЕ/кг, от 3,5х1010 до 5х1010 ТЕ/кг, от 4×1010 до 5х1010 ТЕ/кг или от 4,5х1010 до 5х1010 ТЕ/кг. В некоторых вариантах осуществления доза составляет от 1×109 до 5х1010 ТЕ/кг, от 1×109 до 4,5х1010 ТЕ/кг, от 1×109 до 4×1010 ТЕ/кг, от 1×109 до 3,5х1010 ТЕ/кг, от 1×109 до 3×1010 ТЕ/кг, от 1×109 до 2,5х1010 ТЕ/кг, от 1×109 до 2×1010 ТЕ/кг, от 1×109 до 1,5х1010 ТЕ/кг, от 1×109 до 1010 ТЕ/кг, от 1×109 до 9×109 ТЕ/кг, от 1×109 до 8×109 ТЕ/кг, от 1×109 до 7×109 ТЕ/кг, от 1×109 до 6×109 ТЕ/кг, от 1×109 до 5х109 ТЕ/кг, от 1×109 до 4×109 ТЕ/кг, от 1×109 до 3×109 ТЕ/кг и от 1×109 до 2×109. В некоторых вариантах осуществления доза составляет от 1×1010 до 2×1010 ТЕ/кг, от 1,1×1010 до 1,9×1010 ТЕ/кг, от 1,2×1010 до 1,8×1010 ТЕ/кг, от 1,3×1010 до 1,7×1010 ТЕ/кг или от 1,4×1010 до 1,6×1010 ТЕ/кг. В некоторых вариантах осуществления доза составляет приблизительно 1,5х1010 ТЕ/кг. В некоторых вариантах осуществления доза составляет 1,5х109 ТЕ/кг. В некоторых вариантах осуществления доза составляет от 2,5х109 ТЕ/кг до 3,5х109 ТЕ/кг, от 2,6 x109 ТЕ/кг до 3,4×109 ТЕ/кг, от 2,7×109 ТЕ/кг до 3,3×109 ТЕ/кг, от 2,8×109 ТЕ/кг до 3,2×109 ТЕ/кг или от 2,9×109 ТЕ/кг до 3,1×109 ТЕ/кг. В некоторых вариантах осуществления доза составляет приблизительно 3,0×109 ТЕ/кг. В некоторых вариантах осуществления доза составляет от 5,5х109 ТЕ/кг до 6,5х109 ТЕ/кг, от 5,6×109 ТЕ/кг до 6,4×109 ТЕ/кг, от 5,7×109 ТЕ/кг до 6,3×109 ТЕ/кг, от 5,8×109 ТЕ/кг до 6,2×109 ТЕ/кг или от 5,9×109 ТЕ/кг до 6,1×109 ТЕ/кг. В некоторых вариантах осуществления доза составляет приблизительно 6,0×109 ТЕ/кг.
В некоторых вариантах осуществления способов, раскрытых выше, активность FVIII в плазме крови в промежутке времени от 24 часов до 48 часов после введения лентивирусного вектора является повышенной по сравнению с таковой у субъекта, которому вводили контрольный вектор, содержащий молекулу нуклеиновой кислоты, содержащую SEQ ID NO: 16. В некоторых вариантах осуществления активность FVIII в плазме крови является повышенной в по меньшей мере приблизительно 2 раза, по меньшей мере приблизительно 3 раза, по меньшей мере приблизительно 4 раза, по меньшей мере приблизительно 5 раз, по меньшей мере приблизительно 6 раз, по меньшей мере приблизительно 7 раз, по меньшей мере приблизительно 8 раз, по меньшей мере приблизительно 9 раз, по меньшей мере приблизительно 10 раз, по меньшей мере приблизительно 11 раз, по меньшей мере приблизительно 12 раз, по меньшей мере приблизительно 13 раз, по меньшей мере приблизительно 14 раз, по меньшей мере приблизительно 15 раз, по меньшей мере приблизительно 20 раз, по меньшей мере приблизительно 25 раз, по меньшей мере приблизительно 30 раз, по меньшей мере приблизительно 35 раз, по меньшей мере приблизительно 40 раз, по меньшей мере приблизительно 50 раз, по меньшей мере приблизительно 60 раз, по меньшей мере приблизительно 70 раз, по меньшей мере приблизительно 80 раз, по меньшей мере приблизительно 90 раз, по меньшей мере приблизительно 100 раз, по меньшей мере приблизительно 110 раз, по меньшей мере приблизительно 120 раз, по меньшей мере приблизительно 130 раз, по меньшей мере приблизительно 140 раз, по меньшей мере приблизительно 150 раз, по меньшей мере приблизительно 160 раз, по меньшей мере приблизительно 170 раз, по меньшей мере приблизительно 180 раз, по меньшей мере приблизительно 190 раз или по меньшей мере приблизительно 200 раз.
В некоторых вариантах осуществления способов, раскрытых выше, лентивирусный вектор вводят в виде одной дозы или нескольких доз. В некоторых вариантах осуществления лентивирусный вектор вводят путем внутривенной инъекции. В некоторых вариантах осуществления субъект является субъектом-ребенком. В некоторых вариантах осуществления субъект является субъектом-взрослым.
В некоторых вариантах осуществления лентивирусный вектор содержит тканеспецифический промотор. В некоторых вариантах осуществления тканеспецифический промотор селективно усиливает экспрессию полипептида с активностью FVIII в клетке-мишени печени. В некоторых вариантах осуществления тканеспецифический промотор, который селективно усиливает экспрессию полипептида с активностью FVIII в клетке-мишени печени, включает промотор mTTR. В некоторых вариантах осуществления клетка-мишень печени представляет собой гепатоцит. В некоторых вариантах осуществления выделенная молекула нуклеиновой кислоты стабильно интегрирована в геном гепатоцита. В некоторых вариантах осуществления нарушение свертываемости крови представляет собой гемофилию A.
В некоторых вариантах осуществления способов, раскрытых выше, выделенная молекула нуклеиновой кислоты содержит LV-coFVIII-6 (SEQ ID NO:71). В некоторых вариантах осуществления выделенная молекула нуклеиновой кислоты содержит LV-coFVIII-6-XTEN (SEQ ID NO:72).
В некоторых вариантах осуществления дозу лентивирусного вектора вводят за один раз или разделяют на две части дозы, три части дозы, четыре части дозы, пять частей дозы или шесть частей дозы. В некоторых вариантах осуществления введение дозы лентивирусного вектора повторяют по меньшей мере дважды, по меньшей мере три раза, по меньшей мере четыре раза, по меньшей мере пять раз, по меньшей мере шесть раз, по меньшей мере семь раз, по меньшей мере восемь раз, по меньшей мере девять раз или по меньшей мере десять раз. В некоторых вариантах осуществления нуклеотидная последовательность, кодирующая полипептид с активностью FVIII, дополнительно содержит последовательность нуклеиновой кислоты, кодирующую сигнальный пептид, где последовательность нуклеиновой кислоты, кодирующая сигнальный пептид, характеризуется по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% идентичностью последовательности с (i) нуклеотидами 1-57 из SEQ ID NO: 1; (ii) нуклеотидами 1-57 из SEQ ID NO: 2; (iii) нуклеотидами 1-57 из SEQ ID NO: 3; (iv) нуклеотидами 1-57 из SEQ ID NO: 4; (v) нуклеотидами 1-57 из SEQ ID NO: 5; (vi) нуклеотидами 1-57 из SEQ ID NO: 6; (vii) нуклеотидами 1-57 из SEQ ID NO: 70; (viii) нуклеотидами 1-57 из SEQ ID NO: 71 или (ix) нуклеотидами 1-57 из SEQ ID NO: 68.
В некоторых вариантах осуществления молекула нуклеиновой кислоты (или нуклеотидная последовательность, кодирующая полипептид с активностью FVIII) обладает одним или несколькими свойствами, выбранными из группы, состоящей из следующего: (a) индекс адаптации кодонов для человека для молекулы нуклеиновой кислоты или ее части является повышенным по сравнению с таковым для SEQ ID NO: 16; (b) частота оптимальных кодонов для нуклеотидной последовательности или ее части является повышенной по сравнению с таковой для SEQ ID NO:16; (c) нуклеотидная последовательность или ее часть содержат более высокую процентную долю нуклеотидов G/C по сравнению с процентной долей нуклеотидов G/C в SEQ ID NO: 16; (d) относительная частота использования синонимичных кодонов для нуклеотидной последовательности или ее части является повышенной по сравнению с таковой для SEQ ID NO: 16; (e) эффективное число кодонов для нуклеотидной последовательности или ее части является пониженным по сравнению с таковым для SEQ ID NO: 16; (f) нуклеотидная последовательность содержит меньше последовательностей MARS/ARS (SEQ ID NO: 21 и 22) по сравнению с SEQ ID NO: 16; (g) нуклеотидная последовательность содержит меньше дестабилизирующих элементов (SEQ ID NO: 23 и 24) по сравнению с SEQ ID NO: 16; и (h) любой их комбинацией.
В некоторых вариантах осуществления нуклеотидная последовательность, кодирующая полипептид с активностью FVIII, дополнительно содержит гетерологичную нуклеотидную последовательность, кодирующую гетерологичную аминокислотную последовательность (например, средство, увеличивающее период полужизни). В некоторых вариантах осуществления гетерологичная аминокислотная последовательность представляет собой последовательность константной области иммуноглобулина или ее части, XTEN, трансферрина, альбумина или PAS. В некоторых вариантах осуществления гетерологичную аминокислотную последовательность связывают с N-концом или C-концом аминокислотной последовательности, кодируемой нуклеотидной последовательностью, или вставляют между двумя аминокислотами в аминокислотной последовательности, кодируемой нуклеотидной последовательностью, по одному или нескольким сайтам вставки, выбранным из таблицы 3. В некоторых вариантах осуществления полипептид FVIII является полноразмерным FVIII или FVIII с удаленным В-доменом.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
На фиг. 1A-1J представлены кодон-оптимизированные нуклеотидные последовательности, кодирующие фактор VIII с удаленным B-доменом. На фиг. 1A показана нуклеотидная последовательность coFVIII-3 (SEQ ID NO:1). На фиг. 1B показана нуклеотидная последовательность coFVIII-4 (SEQ ID NO: 2). На фиг. 1C показана нуклеотидная последовательность coFVIII-5 (SEQ ID NO: 70). На фиг. 1D показана нуклеотидная последовательность coFVIII-6 (SEQ ID NO: 71). На фиг. 1E показана нуклеотидная последовательность coFVIII-52 (SEQ ID NO: 3). На фиг. 1F показана нуклеотидная последовательность coFVIII-62 (SEQ ID NO: 4). На фиг. 1G показана нуклеотидная последовательность coFVIII-25 (SEQ ID NO: 5). На фиг. 1H показана нуклеотидная последовательность coFVIII-26 (SEQ ID NO: 6). На фиг. 1I и 1J показаны не являющиеся кодон-оптимизированными нуклеотидные и аминокислотные последовательности соответственно FVIII с удаленным B-доменом (BDD-FVIII) (SEQ ID NO: 16 и 17 соответственно).
На фиг. 2A-2J показаны корректировки предпочтения использования кодонов в кодон-оптимизированных нуклеотидных последовательностях, кодирующих BDD-FVIII. На фиг. 2A показана относительная частота кодонов в нуклеотидной последовательности дикого типа (до оптимизации кодонов), кодирующей BDD-FVIII, например неоптимизированный BDD-FVIII. Индекс адаптации кодонов для человека (CAI) неоптимизированной последовательности BDD-FVIII составляет 74%. На фиг. 2B показана относительная частота кодонов в последовательности варианта coFVIII-1, которая характеризуется CAI для человека, составляющей 88%. На фиг. 2C показана относительная частота кодонов в последовательности варианта coFVIII-3, которая характеризуется CAI для человека, составляющей 91%. На фиг. 2D показана относительная частота кодонов в последовательности варианта coFVIII-4, которая характеризуется CAI для человека, составляющей 97%. На фиг. 2E показана относительная частота кодонов в последовательности варианта coFVIII-5, которая характеризуется CAI для человека, составляющей 83%. На фиг. 2F показана относительная частота кодонов в последовательности варианта coFVIII-6, которая характеризуется CAI для человека, составляющей 83%. На фиг. 2G показана относительная частота кодонов в последовательности варианта coFVIII-52, которая характеризуется CAI для человека, составляющей 91%. На фиг. 2H показана относительная частота кодонов в последовательности варианта coFVIII-62, которая характеризуется CAI для человека, составляющей 91%. На фиг. 2I показана относительная частота кодонов в последовательности варианта coFVIII-25, которая характеризуется CAI для человека, составляющей 88%. На фиг. 2J показана относительная частота кодонов в последовательности варианта coFVIII-26, которая характеризуется CAI для человека, составляющей 88%.
На фиг. 3 представлена карта плазмиды FVIII-303, которая содержит coFVIII-1 в каркасе pcDNA3 под контролем усиленного промотора транстиретрина, ЕТ, который расположен выше сайта начала трансляции coFVIII-1 и который содержит синтетический энхансер, энхансер mTIR и промотор mTIR.
На фиг. 4 показано графическое представление активности FVIII в плазме крови у мышей с HemA после гидродинамической инъекции 5 мкг FVIII-303 (coFVIII-1; круги) или 5 мкг FVIII-311 (BDD-FVIII; квадраты). Активность FVIII в плазме крови определяли с помощью специфического в отношении FVIII хромогенного анализа через 24, 48 и 72 часа после инъекции. Показаны уровни относительной активности через 72 часа, нормализованные в отношении уровня экспрессии FVIII-311.
На фиг. 5 показана карта плазмиды pLV-coFVIII-52, которая содержит coFVIII-52 в лентивирусной плазмиде под контролем ET-промотора, который расположен в выше сайта начала трансляции coFVIII-52 и который содержит синтетический энхансер, энхансер mTTR и промотор mTTR.
На фиг. 6A-6C показано графическое представление активности FVIII в плазме крови у мышей с HemA после гидродинамической инъекции различных кодирующих FVIII нуклеотидов. Активность FVIII в плазме крови определяли с помощью специфического в отношении FVIII хромогенного анализа через 24, 48 и 72 часа после инъекции. На фиг. 6A показана активность FVIII в плазме крови у мышей с HemA после гидродинамической инъекции 5 мкг LV-coFVIII-1 (заштрихованные круги), 5 мкг LV-coFVIII-3 (треугольники), 5 мкг LV-coFVIII-4 (перевернутые треугольники), 5 мкг LV-coFVIII-5 (ромбы) или 5 мкг LV-coFVIII-6 (незаштрихованные круги). На фиг. 6B показана активность FVIII в плазме крови у мышей с HemA после гидродинамической инъекции 5 мкг LV-coFVIII-1 (круги), 5 мкг LV-coFVIII-25 (треугольники) или 5 мкг LV-coFVIII-26 (перевернутые треугольники). На фиг. 6C показана активность FVIII в плазме крови у мышей с HemA после гидродинамической инъекции 20 мкг LV-2116 (нуклеотидной последовательности BDD-FVIII, не являющейся кодон-оптимизированной (WT); незаштрихованные круги), 20 мкг LV-coFVIII-1 (треугольники), 20 мкг LV-coFVIII-52 (квадраты) или 20 мкг LV-coFVIII-62 (заштрихованные круги). Показаны уровни относительной активности через 72 часа для каждой плазмиды, нормализованные в отношении уровней экспрессии LV-coFVIII-1 (фиг. 6A, 6B и 6C) и/или LV-2116 (фиг. 6C), как указано.
На фиг. 7 показана активность FVIII в плазме крови у мышей с HemA через 24 дня после инъекции 1E8 ТЕ/мышь лентивирусного вектора, содержащего coFVIII-1, coFVIII-5, coFVIII-52, coFVIII-6 или coFVIII-62, по сравнению с контролем LV-2116 (BDD-FVIII), и как измерено с помощью специфического в отношении FVIII хромогенного анализа. Планки погрешностей обозначают стандартные отклонения.
На фиг. 8A-8C представлены различные кодон-оптимизированные нуклеотидные последовательности, кодирующие BDD-FVIII, слитый с XTEN. На фиг. 8A показана нуклеотидная последовательность coFVIII-52-XTEN (SEQ ID NO: 19), при этом нуклеотидная последовательность, кодирующая XTEN, содержащий 144 аминокислоты ("XTEN144"; SEQ ID NO: 18; подчеркнуто), вставлена в нуклеотидную последовательность coFVIII-52. На фиг. 8B показана нуклеотидная последовательность coFVIII-1-XTEN (SEQ ID NO: 20), при этом нуклеотидная последовательность, кодирующая XTEN, содержащий 144 аминокислоты ("XTEN144"; SEQ ID NO: 18; подчеркнуто), вставлена в нуклеотидную последовательность coFVIII-1. На фиг. 8C показана нуклеотидная последовательность coFVIII-6-XTEN (SEQ ID NO: 72), при этом нуклеотидная последовательность, кодирующая XTEN, содержащий 144 аминокислоты ("XTEN144"; SEQ ID NO: 18; подчеркнуто), вставлена в нуклеотидную последовательность coFVIII-6 (например, по аминокислотному остатку 745 соответствующему зрелой последовательности FVIII).
На фиг. 9 представлена карта плазмиды pLV-coFVIII-52-XTEN, которая содержит coFVIII-52-XTEN в лентивирусном векторе под контролем ET-промотора. Лентивирусные векторы, содержащие каждую из остальных кодон-оптимизированных молекул нуклеиновой кислоты, кодирующих полипептид с активностью FVIII, описанный в данном документе, конструировали таким же образом, как и pLV-coFVIII-52-XTEN, в который вставляли такую же последовательность XTEN для замены B-домена FVIII.
На фиг. 10A и 10B показана активность FVIII у мышей с HemA после инъекции плазмидной ДНК (фиг. 10A) или лентивирусного вектора (фиг. 10B), содержащих различные кодон-оптимизированные нуклеотидные последовательности, кодирующие BDD-FVIII. На фиг. 10A показано графическое представление активности FVIII в плазме крови у мышей с HemA после гидродинамической инъекции 5 мкг FVIII-311 (нуклеотидной последовательности, кодирующей BDD-FVIII, не являющейся кодон-оптимизированной; квадраты), 5 мкг FVIII-303 (coFVIII-1; небольшие круги) или FVIII-306 (coFVIII-1-XTEN144; большие круги). Для каждой плазмиды показана относительная активность через 72 часа, нормализованная в отношении FVIII-311. На фиг. 10B показана активность FVIII в плазме крови у мышей с HemA через 21 день после инъекции 1E8 ТЕ/мышь лентивирусного вектора, содержащего coFVIII-52 или coFVIII-52-XTEN, по сравнению с контролем LV-2116 (BDD-FVIII), и как измерено с помощью специфического в отношении FVIII хромогенного анализа. Планки погрешностей обозначают стандартные отклонения.
На фиг. 11A показана аминокислотная последовательность полноразмерного зрелого фактора VIII человека. На фиг. 11B показана аминокислотная последовательность полноразмерного фактора фон Виллебранда человека (SEQ ID NO: 44). На фиг. 11C и 11D показана аминокислотная и нуклеотидная последовательности соответственно полипептида XTEN, содержащего 42 аминокислоты (XTEN AE42-4; SEQ ID NO: 46 и 47 соответственно). Аминокислотные последовательности различных полипептидов XTEN, содержащих 144 аминокислоты, показаны на фиг. 11E, 11G, 11I, 11K, 11M, 11O, 11Q, 11S, 11U, и 11W (SEQ ID NOs: 48, 50, 52, 54, 56, 58, 60, 62, 64, и 66, соответственно), а соответствующие нуклеотидные последовательности показаны на фиг. 11F, 11H, 11J, 11L, 11N, 11P, 11R, 11T, 11V, и 11X (SEQ ID NOs: 49, 51, 53, 55, 57, 59, 61, 63, 65, и 67, соответственно). На фиг. 11Y показана нуклеотидная последовательность ET-промотора (SEQ ID NO: 69). На фиг. 11Z показана нуклеотидная последовательность для coFVIII-1 (SEQ ID NO: 68) (см. международную публикацию № WO 2014/127215, SEQ ID NO: 1).
На фиг. 12A показано графическое представление активности FVIII в плазме крови (МЕ/мл) у мышей с HemA возрастом 14 суток после в/в введения приблизительно 1,5х1010 ТЕ/кг LV-wtBDD-FVIII (круги), LV-coFVIII-6 (квадраты) или LV-coFVIII-6XTEN (треугольники). На фиг. 12B показано графическое представление числа копий вектора (VCN) через 150 дней после обработки у мышей с HemA возрастом 14 суток, которым вводили в/в приблизительно 1,5х1010 ТЕ/кг лентивирусных векторов, экспрессирующих wtBDD-FVIII, coFVIII-1, coFVIII-3, coFVIII-4, coFVIII-5, coFVIII-6, coFVIII-52, coFVIII-62, coFVIII-25 или coFVIII-26. На фиг. 12C показано графическое представление активности FVIII в плазме крови (МЕ/мл) через 21 день после обработки у мышей с HemA возрастом 14 суток, которым вводили в/в приблизительно 1,5х1010 ТЕ/кг лентивирусных векторов, экспрессирующих wtBDD-FVIII, coFVIII-1, coFVIII-3, coFVIII-4, coFVIII-5, coFVIII-6, coFVIII-52, coFVIII-62, coFVIII-25 или coFVIII-26.
На фиг. 13A и 13B показаны графические представления, которые иллюстрируют уровни активности FVIII в плазме крови (фиг. 13A) и уровни антитела против FVIII (фиг. 13B) у пяти мышей с HemA, обработанных лентивирусом, экспрессирующим вариант coFVIII-5. Однопометникам с HemA возрастом четырнадцать суток вводили приблизительно 1,5х1010 ТЕ/кг лентивируса, экспрессирующего вариант coFVIII-5, с помощью внутривенной инъекции. Каждая мышь обозначена числом (т. e. 1, 2, 3, 4 и 5; фиг. 13A и 13B).
На фиг. 14 показано графическое представление корреляции между уровнем экспрессии LV-FVIII, показанным посредством активности FVIII в плазме крови через 21 день после обработки лентивирусом, и присутствием антител против FVIII. Каждая точка данных соответствует одной мыши с HemA. Каждая мышь получала 1,5х1010 ТЕ/кг с помощью внутривенной инъекции лентивируса, экспрессирующего один из вариантов coFVIII, раскрытых в данном документе. Горизонтальные линии показывают среднюю активность FVIII в плазме крови.
На фиг. 15 показано графическое представление корреляции между числом копий вектора (VCN) на клетку через 150 дней после обработки лентивирусом и присутствием антител против FVIII. Каждая точка данных соответствует одной мыши с HemA. Каждая мышь получала 1,5х1010 ТЕ/кг с помощью внутривенной инъекции лентивируса, экспрессирующего один из вариантов coFVIII, раскрытых в данном документе. Горизонтальные линии обозначают среднее VCN.
На фиг. 16A и 16B показаны графические представления, которые иллюстрируют уровни активности FVIII в плазме крови (фиг. 16A) и уровни антитела против FVIII (фиг. 16B) у двух мышей с HemA (coFVIII-52-A и coFVIII-52-B), обработанных лентивирусом, экспрессирующим вариант coFVIII-52. Однопометникам с HemA возрастом четырнадцать суток вводили приблизительно 1,5х1010 ТЕ/кг лентивируса, экспрессирующего вариант coFVIII-52, с помощью внутривенной инъекции. На фиг. 16C и 16D представлены изображения, показывающие окрашивание в отношении экспрессии FVIII (темное окрашивание) при гибридизации РНК in situ в ткани печени, собранной от мышей с coFVIII-52-A (фиг. 16C) и coFVIII-52-B (фиг. 16D) с фиг. 16A и 16B.
На фиг. 17 показано графическое представление, которое демонстрирует долгосрочную экспрессию FVIII у новорожденных мышей с HemA, которых обрабатывали лентивирусом, экспрессирующим FVIII дикого типа с удаленным В-доменом (wtBDD-FVIII; треугольники), вариант coFVIII-52-XTEN (круги) или coFVIII-6-XTEN (перевернутый треугольник). Новорожденным мышам с HemA вводили с помощью внутривенной инъекции приблизительно 1,5х1010 ТЕ/кг лентивируса, экспрессирующего wtBDD-FVIII, coFVIII-52-XTEN или coFVIII-6-XTEN. Активность FVIII в плазме крови измеряли в течение приблизительно 16 недель.
На фиг. 18A-18B показано графическое представление результатов определения зависимости "доза-ответ", соответствующих лечению мышей с HemA лентивирусом, экспрессирующим coFVIII-6 (фиг. 18A) или coFVIII-6-XTEN (фиг. 18B).
На фиг. 19 представлена схема лентивирусного вектора для нацеленной на печень генной терапии. SD: сайт донора сплайсинга; SA: сайт акцептора сплайсинга; GA: усеченная последовательность gag; RRE: элемент, чувствительный к Rev; ET: усиленный промотор транстиретина; FVIII: фактор VIII; 142T: последовательность-мишень для miR-142; Wpre: мутантный посттранскрипционный регуляторный элемент вируса гепатита сурков; Ψ (сигнал упаковки).
На фиг. 20A-20B показаны графические представления пиковых уровней циркулирующего FVIII у самцов свинохвостых макаков, которым вводили 3×109 ТЕ/кг лентивируса, экспрессирующего coFVIII-6-XTEN, продуцируемого клетками 293T с фенотипом CD47high/MHC-Ifree, как измерено по активности FVIII в плазме крови (фиг. 20A) и уровням антигена FVIII в плазме крови (фиг. 20B).
На фиг. 21A-21B показаны графические представления пиковых уровней активности FVIII человека в плазме крови (фиг. 21A) и уровней антигена FVIII человека (фиг. 21B) у самцов свинохвостых макаков, которым вводили 3×109 ТЕ/кг или 6×109 ТЕ/кг лентивируса, экспрессирующего coFVIII-6.
На фиг. 22A-22B показано графическое представление пиковых уровней активности FVIII человека в плазме крови (фиг. 22A) и средних уровней антигена FVIII человека (фиг. 22B) у самцов свинохвостых макаков, которым вводили 1×109 или 3×109 ТЕ/кг лентивируса, экспрессирующего coFVIII-6-XTEN.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В настоящем изобретении описывается нацеленная на печень лентивирусная генная терапия с применением кодон-оптимизированных генов, кодирующих полипептиды с активностью фактора VIII (FVIII). См., например, международную публикацию WO 2017136358, которая включена в данный документ посредством ссылки во всей своей полноте.
Следовательно, в некоторых аспектах настоящее изобретение относится к генной терапии, предусматривающей введение лентивирусных векторов, содержащих кодон-оптимизированные молекулы нуклеиновой кислоты, содержащие последовательности нуклеиновой кислоты, кодирующие полипептиды с активностью фактора VIII. В конкретных аспектах настоящее изобретение относится к способам лечения нарушений свертываемости крови, таких как гемофилия (например, гемофилия A), включающим введение субъекту лентивирусного вектора, содержащего кодон-оптимизированную последовательность нуклеиновой кислоты фактора VIII, нацеленную на печень (например, на гепатоциты). Настоящее изобретение удовлетворяет важную потребность в данной области техники посредством подхода на основе генной терапии, который приводит к стабильной интеграции кассеты экспрессии трансгена, содержащей кодон-оптимизированную последовательность нуклеиновой кислоты фактора VIII, в геном клеток, в отношении которых осуществляется нацеливание.
Эта система демонстрирует усиленную долгосрочную экспрессию фактора VIII в клетках, в отношении которых осуществляется нацеливание (например, гепатоцитах), при введении субъекту лентивирусного вектора в виде по меньшей мере одной дозы, составляющей 5х1010 трансдуцирующих единиц/кг (ТЕ/кг) или меньше, например, приблизительно 1,5х1010 ТЕ/кг или меньше, или приблизительно 1,5х109 ТЕ/кг или меньше, или приблизительно 108 ТЕ/кг или меньше.
В конкретных вариантах осуществления лентивирусные векторы, раскрытые в данном документе, содержат кодон-оптимизированную последовательность нуклеиновой кислоты, содержащую, состоящую или по сути состоящую из SEQ ID NO: 71 (LV-coFVIII-6).
В некоторых других конкретных вариантах осуществления лентивирусные векторы, раскрытые в данном документе, содержат кодон-оптимизированную последовательность нуклеиновой кислоты, содержащую, состоящую или по сути состоящую из SEQ ID NO: 72 (LV-coFVIII-6-XTEN).
Нацеленные на печень лентивирусные векторы, раскрытые в данном документе, обеспечивают стабильную интеграцию кассеты экспрессии трансгена, содержащей кодон-оптимизированную нуклеиновую кислоту, кодирующую FVIII, в геном клеток, в отношении которых осуществляется нацеливание (например, гепатоцитов), у субъектов-детей (например, новорожденных) или субъектов-взрослых с достижением улучшения экспрессии FVIII (например, улучшения в 100 раз) при низких дозах лентивирусного вектора (например, 5х1010 или меньше, таких как 109 ТЕ/кг или меньше, или 108 ТЕ/кг или меньше). Поскольку раскрытые лентивирусные векторы могут обеспечивать достижение терапевтических уровней циркулирующего FVIII при очень низких дозах (например, 109 ТЕ/кг или меньше, или 108 ТЕ/кг или меньше), эти векторы могут обеспечивать существенное снижение потенциальной острой токсичности, ассоциированной с лечением лентивирусным векторов. Кроме того, применение лентивирусных векторов, и в особенности векторов третьего поколения, может приводить к потенциально пожизненной интеграции в геном субъекта. Высокая емкость лентивирусных векторов (10 т. п. н.) по сравнению с другими системами доставки генов (например, AAV) позволяет включать в трансген больше регуляторных элементов, например промоторов, которые будут контролировать экспрессию трансгена FVIII в различных тканях (например, гепатоциты и эндотелиальные клетки печени). Лентивирусные векторы, раскрытые в данном документе, можно применять при видах лечения in vivo, in vitro или ex vivo.
Иллюстративные конструкции согласно настоящему изобретению проиллюстрированы в прилагаемых графических материалах и перечне последовательностей.
В целях обеспечения четкого понимания описания и формулы изобретения, ниже представлены следующие определения.
I. Определения
Следует отметить, что форма единственного числа объекта относится к одному или нескольким таким объектам; например, под "нуклеотидной последовательностью" понимают одну или несколько нуклеотидных последовательностей. В связи с этим формы единственного числа, термины "один или несколько" и "по меньшей мере один" могут использоваться в данном документе взаимозаменяемо.
Термин "приблизительно" используется в данном документе в значении примерно, порядка, около или ориентировочно. Если термин "приблизительно" используется в сочетании с числовым диапазоном, то он модифицирует данный диапазон, расширяя границы выше и ниже изложенных числовых значений. В целом, термин "приблизительно" применяют в данном документе для модификации числового значения выше и ниже заявленного значения с отклонением на 10 процентов, вверх или вниз (выше или ниже).
Термин "выделенный" для целей настоящего изобретения означает биологический материал (клетку, полипептид, полинуклеотид или их фрагмент, вариант или производное), который был удален из его изначальной окружающей среды (окружающей среды, в которой он встречается в естественных условиях). Например, полинуклеотид, присутствующий в естественном состоянии в растении или животном, не является выделенным, однако тот же полинуклеотид, отделенный от соседних нуклеиновых кислот, в которых он присутствует в естественных условиях, считается "выделенным". Никакого конкретного уровня очистки не требуется. Полученные рекомбинантным путем полипептиды и белки, экспрессирующиеся в клетках-хозяевах, считаются выделенными для целей настоящего изобретения, как и нативные или рекомбинантные полипептиды, которые были отделены, фракционированы или частично или в значительной степени очищены с помощью любой подходящей методики.
"Нуклеиновые кислоты", "молекулы нуклеиновой кислоты", "олигонуклеотид" и "полинуклеотид" применяются взаимозаменяемо и относятся к полимерной форме сложных фосфатных эфиров рибонуклеозидов (аденозина, гуанозина, уридина или цитидина; "молекулам РНК") или дезоксирибонуклеозидов (дезоксиаденозина, дезоксигуанозина, дезокситимидина или дезоксицитидина; "молекулам ДНК") или любым сложным фосфатным эфирам их аналогов, как например фосфоротиоаты и сложные тиоэфиры, находящимся либо в однонитевой форме, либо в виде двунитевой спирали. Возможны двунитевые спирали ДНК-ДНК, ДНК-РНК и РНК-РНК. Термин молекула нуклеиновой кислоты, и в частности молекула ДНК или РНК, относится только к первичной и вторичной структуре молекулы и не ограничивает ее какими-либо конкретными третичными формами. Таким образом, данный термин включает двунитевую ДНК, обнаруживаемую, среди прочего, в линейных или кольцевых молекулах ДНК (например, фрагментах рестрикции), плазмидах, сверхспиральной ДНК и хромосомах. В рамках обсуждения структуры конкретной двунитевой молекулы ДНК последовательности могут описываться в данном документе в соответствии с обычными правилами, предусматривающими приведение только последовательности в направлении 5'-3' вдоль нетранскрибируемый нити ДНК (т. е. нити, имеющей последовательность, гомологичную мРНК). "Рекомбинантная молекула ДНК" представляет собой молекулу ДНК, которая была подвергнута молекулярно-биологической манипуляции. ДНК включает без ограничения кДНК, геномную ДНК, плазмидную ДНК, синтетическую ДНК и полусинтетическую ДНК. "Композиция на основе нуклеиновой кислоты" согласно настоящему изобретению содержит одну или несколько нуклеиновых кислот, описанных в данном документе.
Как используется в данном документе, "кодирующая область" или "кодирующая последовательность" представляют собой часть полинуклеотида, состоящую из кодонов, транслируемых в аминокислоты. Хотя "стоп-кодон" (TAG, TGA или TAA), как правило, не транслируется в аминокислоту, он может считаться частью кодирующей области, однако любые фланкирующие последовательности, например промоторы, сайты связывания рибосом, терминаторы транскрипции, интроны и т. п., не составляют часть кодирующей области. Границы кодирующей области обычно определяются старт-кодоном на 5'-конце, кодирующим амино-конец получаемого полипептида, и стоп-кодоном трансляции на 3'-конце, кодирующим карбоксильный конец получаемого полипептида. Две или более кодирующие области могут присутствовать в одной полинуклеотидной конструкции, например, в одном векторе, или в отдельных полинуклеотидных конструкциях, например, в отдельных (различных) векторах. Отсюда следует, что один вектор может содержать только одну кодирующую область или содержать две или более кодирующих областей.
Определенные белки, секретируемые клетками млекопитающих, связаны с секреторным сигнальным пептидом, отщепляющимся от зрелого белка после начала экспорта растущей белковой цепи через гранулярный эндоплазматический ретикулум. Специалистам в данной области техники известно, что сигнальные полипептиды обычно слиты с N-концом полипептида, и отщепляются от полного или "полноразмерного" полипептида с образованием секретируемой или "зрелой" формы полипептида. В определенных вариантах осуществления применяют нативный сигнальный пептид или функциональное производное такой последовательности, которое сохраняет способность к управлению секрецией полипептида, функционально связанного с ним. В качестве альтернативы, можно применять гетерологичный сигнальный пептид млекопитающего, например, тканевой активатор плазминогена (ТРА) человека или сигнальный пептид ß-глюкуронидазы мыши или его функциональное производное.
Термин "ниже" относится к нуклеотидной последовательности, которая расположена в направлении 3' относительно контрольной нуклеотидной последовательности. В определенных вариантах осуществления расположенные ниже нуклеотидные последовательности относятся к последовательностям, которые следуют за точкой начала транскрипции. Например, кодон инициации трансляции гена расположен ниже относительно сайта начала транскрипции.
Термин "выше" относится к нуклеотидной последовательности, которая расположена в направлении 5' относительно контрольной нуклеотидной последовательности. В определенных вариантах осуществления расположенные выше нуклеотидные последовательности относятся к последовательностям, которые расположены со стороны 5'-конца относительно кодирующей области или точки начала транскрипции. Например, большинство промоторов расположены выше сайта начала транскрипции.
Как используется в данном документе, термин "регуляторная область гена" или "регуляторная область" относится к нуклеотидным последовательностям, расположенным выше (5'-некодирующие последовательности), в пределах или ниже (3'-некодирующие последовательности) кодирующей области, и которые влияют на транскрипцию, процессинг РНК, стабильность или трансляцию связанной кодирующей области. Регуляторные области могут включать промоторы, лидерные последовательности трансляции, интроны, последовательности, узнающие сайты полиаденилирования, сайты процессинга РНК, сайты связывания эффекторов и структуры "стебель-петля". Если кодирующая область предназначена для экспрессии в эукариотической клетке, сигнал полиаденилирования и последовательность терминации транскрипции обычно будут размещены в направлении 3' относительно кодирующей последовательности.
Полинуклеотид, который кодирует продукт гена, например полипептид, может содержать промотор и/или другие элементы, осуществляющие контроль экспрессии (например, транскрипции или трансляции), функционально связанные с одной или несколькими кодирующими областями. В функциональной связи кодирующая область для продукта гена, например полипептида, связана с одной или несколькими регуляторными областями таким образом, что экспрессия продукта гена находится под влиянием или контролем регуляторной(-ых) области(-ей). Например, кодирующая область и промотор считаются "функционально связанными", если индуцирование функции промотора приводит к транскрипции мРНК, кодирующей продукт гена, кодируемого кодирующей областью, и если природа связи между промотором и кодирующей областью не препятствует способности промотора управлять экспрессией продукта гена или не препятствует способности ДНК-матрицы транскрибироваться. Другие элементы, осуществляющие контроль экспрессии, помимо промотора, например энхансеры, операторы, репрессоры и сигналы терминации транскрипции, также могут быть функционально связаны с кодирующей областью для управления экспрессией продукта гена.
"Последовательности, осуществляющие контроль транскрипции", относятся к регуляторным последовательностям ДНК, таким как промоторы, энхансеры, терминаторы и т. п., которые обеспечивают осуществление экспрессии кодирующей последовательности в клетке-хозяине. Специалистам в данной области техники известны разнообразные области, осуществляющие контроль транскрипции. Они включают без ограничения области, осуществляющие контроль транскрипции, функционирующие в клетках позвоночных, такие как без ограничения промоторные и энхансерные сегменты цитомегаловирусов (промотор гена немедленного раннего ответа вместе с интроном A), вируса обезьян 40 (промотор гена раннего ответа) и ретровирусов (таких как вирус саркомы Рауса). Другие области, осуществляющие контроль транскрипции, включают области, полученные из генов позвоночных, таких как гены актина, белка теплового шока, бычьего гормона роста и ß-глобина кролика, а также другие последовательности, способные осуществлять контроль экспрессии генов в эукариотических клетках. Дополнительные подходящие области, осуществляющие контроль транскрипции, включают тканеспецифические промоторы и энхансеры, а также индуцируемые лимфокинами промоторы (например, промоторы, индуцируемые интерферонами или интерлейкинами).
Аналогично, разнообразные элементы, осуществляющие контроль трансляции, известны средним специалистам в данной области техники. Они включают без ограничения сайты связывания рибосомы, кодоны инициации и терминации трансляции и элементы, полученные из пикорнавирусов (в частности, сайт внутренней посадки рибосомы или IRES, также называемый CITE-последовательностью).
Термин "экспрессия", используемый в данном документе, относится к процессу, посредством которого из полинуклеотида вырабатывается продукт гена, например, РНК или полипептид. Она включает без ограничения транскрипцию полинуклеотида с образованием матричной РНК (мРНК), транспортной РНК (тРНК), малой шпилечной РНК (shRNA), малой интерферирующей РНК (siRNA) или любого другого продукта, представляющего собой РНК, и трансляцию мРНК с образованием полипептида. Экспрессия приводит к образованию "продукта гена". Как используется в данном документе, продукт гена может представлять собой либо нуклеиновую кислоту, например, информационную РНК, получаемую путем транскрипции гена, либо полипептид, который транслируется с транскрипта. Продукты гена, описанные в данном документе, дополнительно включают нуклеиновые кислоты с посттранскрипционными модификациями, например, полиаденилированием или сплайсингом, или полипептиды с посттрансляционными модификациями, например, метилированием, гликозилированием, добавлением липидов, ассоциацией с другими белковыми субъединицами, протеолитическим расщеплением. Термин "выход", используемый в данном документе, относится к количеству полипептида, полученному посредством экспрессии гена.
"Вектор" относится к любому носителю для клонирования нуклеиновой кислоты и/или ее переноса в клетку-хозяина. Вектор может представлять собой репликон, к которому может быть присоединен другой сегмент нуклеиновой кислоты так, чтобы обеспечить репликацию присоединенного сегмента. "Репликон" относится к любому генетическому элементу (например, плазмиде, фагу, космиде, хромосоме, вирусу), который функционирует как автономная единица репликации in vivo, т. e. способен реплицироваться под своим собственным контролем. Термин "вектор" включает как вирусные, так и невирусные носители для введения нуклеиновой кислоты в клетку in vitro, ex vivo или in vivo. В данной области техники известно и используется большое количество векторов, в том числе, например, плазмиды, модифицированные вирусы эукариот или модифицированные бактериофаги. Вставка полинуклеотида в подходящий вектор может быть осуществлена посредством лигирования соответствующих полинуклеотидных фрагментов в выбранный вектор, который имеет комплементарные "липкие" концы.
Векторы могут быть сконструированы так, чтобы кодировать селектируемые маркеры или репортерные гены, которые обеспечивают отбор или идентификацию клеток, в которые встроился вектор. Экспрессия селектируемых маркеров или репортерных генов обеспечивает идентификацию и/или отбор клеток-хозяев, которые содержат и экспрессируют другие кодирующие области, содержащиеся в векторе. Примеры генов селектируемых маркеров, известных и применяемых в данной области техники, включают гены, обеспечивающие устойчивость к ампициллину, стрептомицину, гентамицину, канамицину, гигромицину, гербициду биалафосу, сульфонамиду и т. п.; и гены, которые применяют в качестве фенотипических маркеров, т. е. гены, регулирующие синтез антоцианов, ген изопентанилтрансферазы и т. п. Примеры репортерных генов, известных и применяемых в данной области техники, включают люциферазу (Luc), зеленый флуоресцентный белок (GFP), хлорамфениколацетилтрансферазу (CAT), β-галактозидазу (LacZ), β-глюкуронидазу (Gus) и т. п. Селектируемые маркеры также можно рассматривать как репортерные гены.
Термин "селектируемый маркер" относится к идентифицирующему фактору, обычно гену антибиотика или устойчивости к химическому воздействию, в отношении которого можно осуществлять селекцию на основе эффекта маркерного гена, например устойчивость к антибиотику, устойчивость к гербициду, колориметрические маркеры, ферменты, флуоресцентные маркеры и т. п., где эффект применяют для отслеживания наследуемости представляющей интерес нуклеиновой кислоты и/или идентификации клетки или организма, которые унаследовали представляющую интерес нуклеиновую кислоту. Примеры генов селектируемых маркеров, известных и применяемых в данной области техники, включают гены, обеспечивающие устойчивость к ампициллину, стрептомицину, гентамицину, канамицину, гигромицину, гербициду биалафосу, сульфонамиду и т. п.; и гены, которые применяют в качестве фенотипических маркеров, т. е. гены, регулирующие синтез антоцианов, ген изопентанилтрансферазы и т. п.
Термин "репортерный ген" относится к нуклеиновой кислоте, кодирующей идентифицирующий фактор, идентификацию которого можно осуществлять на основе эффекта репортерного гена, где эффект применяют для отслеживания наследуемости представляющей интерес нуклеиновой кислоты, идентификации клетки или организма, которые унаследовали представляющую интерес нуклеиновую кислоту, и/или для измерения индуцирования экспрессии гена или транскрипции. Примеры репортерных генов, известных и применяемых в данной области техники, включают люциферазу (Luc), зеленый флуоресцентный белок (GFP), хлорамфениколацетилтрансферазу (CAT), β-галактозидазу (LacZ), β-глюкуронидазу (Gus) и т. п. Гены селективных маркеров также можно рассматривать как репортерные гены.
"Промотор" и "промоторная последовательность" применяют взаимозаменяемо и относятся к последовательности ДНК, способной к осуществлению контроля экспрессии кодирующей последовательности или функциональной РНК. В целом, кодирующая последовательность расположена в направлении 3' относительно промоторной последовательности. Промоторы могут быть получены целиком из нативного гена или состоять из различных элементов, полученных из различных промоторов, встречающихся в природе, или даже содержать сегменты синтетической ДНК. Специалистам в данной области техники будет понятно, что различные промоторы могут управлять экспрессией гена в различных тканях или типах клеток, или на различных стадиях развития, или в ответ на различные условия окружающей среды или физиологические условия. Промоторы, которые обуславливают экспрессию гена в большинстве типов клеток в большинстве случаев, обычно называют "конститутивными промоторами". Промоторы, которые обуславливают экспрессию гена в конкретном типе клеток, обычно называют "клеточноспецифическими промоторами" или "тканеспецифическими промоторами". Промоторы, которые обуславливают экспрессию гена на конкретной стадии развития или дифференцировки клеток, обычно называют "промоторами, специфическими для стадии развития" или "промоторами, специфическими в отношении дифференцировки клеток". Промоторы, которые являются индуцируемыми и обуславливают экспрессию гена после подвергания воздействию или обработки клетки средством, биологической молекулой, химическим веществом, лигандом, светом или т. п., которые индуцируют промотор, обычно называют "индуцибельными промоторами" или "регулируемыми промоторами". Кроме того, следует понимать, что поскольку в большинстве случаев точные границы регуляторных последовательностей полностью определены не были, фрагменты ДНК различной длины могут характеризоваться идентичной промоторной активностью.
Промоторная последовательность, как правило, ограничена со стороны своего 3'-конца сайтом инициации транскрипции и продолжается выше (в 5'-направлении) с включением минимального числа оснований или элементов, необходимых для инициации транскрипции на поддающихся обнаружению находящихся выше фонового уровнях. В пределах промоторной последовательности можно будет обнаружить сайт инициации транскрипции (в подходящем случае определенный, например, посредством картирования с помощью нуклеазы S1), а также домены связывания белка (консенсусные последовательности), ответственные за связывание РНК-полимеразы.
Термины "рестрикционная эндонуклеаза" и "рестрикционный фермент" применяются взаимозаменяемо и относятся к ферменту, который связывается и вносит разрывы в пределах конкретной нуклеотидной последовательности в пределах двунитевой ДНК.
Термин "плазмида" относится к внехромосомному элементу, зачастую несущему ген, который не является частью центрального метаболизма клетки, и обычно имеющему форму кольцевых двунитевых молекул ДНК. Такие элементы могут представлять собой автономно реплицирующиеся последовательности, интегрирующиеся в геном последовательности, фаговые или нуклеотидные последовательности, линейные, кольцевые или сверхспиральные, из одно- или двунитевой ДНК или РНК, полученные из любого источника, к которым присоединен или добавлен путем рекомбинации ряд нуклеотидных последовательностей с образованием уникальной конструкции, которая способна обеспечивать введение в клетку промоторного фрагмента и последовательности ДНК, кодирующей выбранный продукт гена, вместе с соответствующей 3'-нетранслируемой последовательностью.
"Клонирующий вектор" относится к "репликону", который представляет собой единицу длины нуклеиновой кислоты, которая реплицируется последовательно и которая содержит точку начала репликации, такую как плазмида, фаг или космида, к которой может быть присоединен другой сегмент нуклеиновой кислоты так, чтобы обеспечить репликацию присоединенного сегмента. Определенные клонирующие векторы способны реплицироваться в одном типе клеток, например бактериях, а экспрессироваться в другом, например эукариотических клетках. Клонирующие векторы обычно содержат одну или несколько последовательностей, которые можно применять для отбора клеток, содержащих вектор, и/или один или несколько сайтов множественного клонирования для вставки последовательностей нуклеиновых кислот, представляющих интерес.
Термин "вектор экспрессии" относится к носителю, сконструированному с возможностью обеспечения экспрессии вставленной последовательности нуклеиновой кислоты после вставки в клетку-хозяина. Вставленная последовательность нуклеиновой кислоты находится в функциональной связи с регуляторными областями, как описано выше.
Векторы вводят в клетки-хозяева с помощью способов, хорошо известных из уровня техники, например, посредством трансфекции, электропорации, микроинъекции, трансдукции, слияния клеток, DEAE-декстрана, осаждения фосфатом кальция, липофекции (слияния лизосом), применения генной пушки или транспортера ДНК-вектора.
Термины "культура", "культивировать" и "культивирование", как используется в данном документе, означают инкубацию клеток в условиях in vitro, которые обеспечивают рост или деление клеток или поддержание клеток в живом состоянии. Используемый в данном документе термин "культивируемые клетки" означает клетки, которые размножаются in vitro.
Подразумевается, что используемый в данном документе термин "полипептид" охватывает "полипептид" в единственном числе, а также "полипептиды" во множественном числе и относится к молекуле, состоящей из мономеров (аминокислот), линейно связанных амидными связями (также известными как пептидные связи). Термин "полипептид" относится к любой цепи или цепям из двух или более аминокислот и не относится к конкретной длине продукта. Таким образом, пептиды, дипептиды, трипептиды, олигопептиды, "белок", "аминокислотная цепь" или любой другой термин, используемый для обозначения цепи или цепей из двух или более аминокислот, включены в определение "полипептида", и термин "полипептид" можно использовать вместо любого из этих терминов или взаимозаменяемо с любым из них. Также подразумевается, что термин "полипептид" относится к продуктам постэкспрессионных модификаций полипептида, включая без ограничения гликозилирование, ацетилирование, фосфорилирование, амидирование, получение производных с помощью известных защитных/блокирующих групп, протеолитическое расщепление или модификацию с помощью аминокислот, не встречающихся в природе. Полипептид может происходить из природного биологического источника или быть получен с помощью рекомбинантной технологии, но не обязательно транслирован с определенной последовательности нуклеиновой кислоты. Он может быть получен любым способом, в том числе путем химического синтеза.
Термин "аминокислота" включает аланин (Ala или A); аргинин (Arg или R); аспарагин (Asn или N); аспарагиновую кислоту (Asp или D); цистеин (Cys или C); глутамин (Gln или Q); глутаминовую кислоту (Glu или E); глицин (Gly или G); гистидин (His или H); изолейцин (Ile или I): лейцин (Leu или L); лизин (Lys или K); метионин (Met или M); фенилаланин (Phe или F); пролин (Pro или P); серин (Ser или S); треонин (Thr или T); триптофан (Trp или W); тирозин (Tyr или Y) и валин (Val или V). Нетрадиционные аминокислоты также находятся в пределах объема настоящего изобретения и включают норлейцин, орнитин, норвалин, гомосерин и другие аналоги аминокислотных остатков, такие как описанные в Ellman et al. Meth. Enzym. 202:301-336 (1991). Для получения таких не встречающихся в природе аминокислотных остатков можно использовать процедуры согласно вышеуказанному Noren et al. Science 244:182 (1989) и Ellman et al.. Вкратце, такие процедуры предусматривают химическую активацию супрессорной тРНК c не встречающимся в природе аминокислотным остатком с последующими транскрипцией и трансляцией РНК in vitro. Введения нетрадиционной аминокислоты можно также достигать с применением химических способов образования пептидной связи, известных из уровня техники. Используемый в данном документе термин "полярная аминокислота" включает аминокислоты, которые характеризуются нулевым суммарным зарядом, однако характеризуются отличными от нуля частичными зарядами в различных частях своих боковых цепей (например, M, F, W, S, Y, N, Q, C). Такие аминокислоты могут участвовать в гидрофобных взаимодействиях и электростатических взаимодействиях. Используемый в данном документе термин "заряженная аминокислота" включает аминокислоты, которые характеризуются отличным от нуля суммарным зарядом на своих боковых цепях (например, R, K, H, E, D). Такие аминокислоты могут участвовать в гидрофобных взаимодействиях и электростатических взаимодействиях.
Также в настоящее изобретение включены фрагменты или варианты полипептидов и любая их комбинация. Термины "фрагмент" или "вариант" в отношении связывающих доменов полипептида или связывающих молекул по настоящему изобретению, включают любые полипептиды, которые сохраняют по меньшей мере некоторые из свойств контрольного полипептида (например, аффинность связывания FcRn для FcRn-связывающего домена или варианта Fc, активность коагуляции для варианта FVIII или FVIII-связывающую активность для фрагмента VWF). Фрагменты полипептидов включают фрагменты, полученные посредством протеолиза, а также фрагменты, полученные посредством делеции, в дополнение к конкретным фрагментам антитела, обсуждаемым в данном документе в другом месте, но не включают встречающийся в природе полноразмерный полипептид (или зрелый полипептид). Варианты полипептидных связывающих доменов или связывающих молекул по настоящему изобретению, включают фрагменты, описанные выше, а также полипептиды с аминокислотными последовательностями, измененными в результате аминокислотных замен, делеций или вставок. Варианты могут быть встречающимися в природе или не встречающимися в природе. Не встречающиеся в природе варианты можно получить с помощью известных из уровня техники методик мутагенеза. Вариантные полипептиды могут содержать консервативные или неконсервативные аминокислотные замены, делеции или добавления.
"Консервативная аминокислотная замена" представляет собой замену, при которой аминокислотный остаток замещается аминокислотным остатком со сходной боковой цепью. Семейства аминокислотных остатков, имеющих сходные боковые цепи, определены в уровне техники, включая основные боковые цепи (например, лизин, аргинин, гистидин), кислые боковые цепи (например, аспарагиновая кислота, глутаминовая кислота), незаряженные полярные боковые цепи (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин), неполярные боковые цепи (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин, триптофан), бета-разветвленные боковые цепи (например, треонин, валин, изолейцин) и ароматические боковые цепи (например, тирозин, фенилаланин, триптофан, гистидин). Таким образом, если аминокислота в полипептиде замещается другой аминокислотой из того же семейства боковых цепей, то замена считается консервативной. В другом варианте осуществления нить из аминокислот можно подвергнуть консервативному замещению сходной в структурном отношении нитью, которая отличается порядком расположения и/или составом представителей семейства боковых цепей.
Термин "процентная идентичность", известный из уровня техники, означает взаимосвязь между двумя или более полипептидными последовательностями или двумя или более полинуклеотидными последовательностями, определенную путем сравнения последовательностей. В уровне техники "идентичность" также означает степень сходства последовательности между полипептидными или полинуклеотидными последовательностями, в соответствующих случаях, определенную по степени соответствия между нитями таких последовательностей. "Идентичность" может быть легко рассчитана с помощью известных способов, в том числе без ограничения тех, которые описаны в Computational Molecular Biology (под ред. Lesk, A. M.) Oxford University Press, Нью-Йорк (1988); Biocomputing: Informatics and Genome Projects (под ред. Smith, D. W.) Academic Press, Нью-Йорк (1993); Computer Analysis of Sequence Data, Part I (под ред. Griffin, A. M. и Griffin, H. G.) Humana Press, Нью-Джерси (1994); Sequence Analysis in Molecular Biology (под ред. von Heinje, G.) Academic Press (1987) и Sequence Analysis Primer (под ред. Gribskov, M. и Devereux, J.) Stockton Press, Нью-Йорк (1991). Предпочтительные способы определения идентичности разработаны с обеспечением самой высокой степени соответствия между исследуемыми последовательностями. Способы определения идентичности запрограммированы в находящихся в открытом доступе компьютерных программах. Выравнивание последовательностей и расчеты процентной идентичности можно осуществлять с применением программного обеспечения для анализа последовательностей, такого как программа Megalign из программного пакета для биоинформационных вычислений LASERGENE (DNASTAR Inc., Мадисон, Висконсин), пакет программ GCG (Wisconsin Package версии 9.0, Genetics Computer Group (GCG), Мадисон, Висконсин), BLASTP, BLASTN, BLASTX (Altschul et al., J. Mol. Biol. 215:403 (1990)) и DNASTAR (DNASTAR, Inc. 1228 С. Парк Стрит, Мадисон, Висконсин, 53715, США). В контексте настоящей заявки будет понятно, что в случаях применения программного обеспечения для анализа последовательностей результаты анализа будут основываться на "значениях по умолчанию" рассматриваемой программы, если не указано иное. Используемые в данном документе "значения по умолчанию" будут означать любой набор значений или параметров, которые изначально загружаются с программным обеспечением при первом запуске. Для целей определения процентной идентичности между оптимизированной последовательностью BDD FVIII по настоящему изобретению и контрольной последовательностью только нуклеотиды в контрольной последовательности, соответствующие нуклеотидам в оптимизированной последовательности BDD FVIII по настоящему изобретению, используют для расчета процентной идентичности. Например, при сравнении нуклеотидной последовательности полноразмерного FVIII, содержащего B-домен, с оптимизированной нуклеотидной последовательностью FVIII с удаленным В-доменом (BDD) согласно настоящему изобретению часть выравнивания, содержащая домен A1, A2, A3, C1 и C2, будет использоваться для расчета процентной идентичности. Нуклеотиды в части последовательности полноразмерного FVIII, кодирующей B-домен (что приведет к большому "гэпу" в выравнивании), не будут учитываться в качестве несовпадений. Кроме того, при определении процентной идентичности между оптимизированной последовательностью FVIII BDD согласно настоящему изобретению или ее указанной частью (например, нуклеотидами 58-2277 и 2320-4374 из SEQ ID NO:3) и контрольной последовательностью процентную идентичность рассчитывают путем выравнивания с делением числа совпадающих нуклеотидов на общее число нуклеотидов в полной последовательности оптимизированной последовательности FVIII с BDD или ее указанной части, как указано в данном документе.
Как используется в данном документе, "нуклеотиды, соответствующие нуклеотидам в оптимизированной последовательности BDD FVIII по настоящему изобретению" идентифицируют путем выравнивания оптимизированной последовательности BDD FVIII по настоящему изобретению с обеспечением максимальной степени идентичности с контрольной последовательностью FVIII. Номер, используемый для идентификации эквивалентной аминокислоты в контрольной последовательности FVIII, соответствует номеру, используемому для идентификации соответствующей аминокислоты в оптимизированной последовательности BDD FVIII по настоящему изобретению.
"Слитый" или "химерный" белок содержит первую аминокислотную последовательность, соединенную со второй аминокислотной последовательностью, с которой она естественным образом не соединена в природе. Аминокислотные последовательности, которые в обычных условиях существуют в отдельных белках, могут быть объединены в слитом полипептиде, или аминокислотные последовательности, которые в обычных условиях существуют в одном и том же белке, могут быть размещены в новом порядке в слитом полипептиде, например, при слиянии домена фактора VIII по настоящему изобретению с Fc-доменом Ig. Слитый белок создают, например, путем химического синтеза или путем создания полинуклеотида, в котором области пептида кодируются в необходимом взаиморасположении, и обеспечения его трансляции. Химерный белок может дополнительно содержать вторую аминокислотную последовательность, связанную с первой аминокислотной последовательностью с помощью ковалентной непептидной связи или нековалентной связи.
Используемый в данном документе термин "сайт вставки" относится к положению в полипептиде FVIII или его фрагменте, варианте или производном, которое находится непосредственно выше положения, в которое может быть вставлен гетерологичный компонент. "Сайт вставки" указан в виде числа, при этом число является номером аминокислоты в зрелом нативном FVIII (SEQ ID NO: 15; фиг. 11A), которому соответствует сайт вставки, который располагается непосредственно за положением вставки в направлении N-конца. Например, фраза "a3 содержит гетерологичный компонент в сайте вставки, который соответствует аминокислоте 1656 из SEQ ID NO: 15" указывает на то, что гетерологичный компонент расположен между двумя аминокислотами, соответствующими аминокислоте 1656 и аминокислоте 1657 из SEQ ID NO: 15.
Используемая в данном документе фраза "непосредственно ниже аминокислоты" относится к положению прямо после концевой карбоксильной группы аминокислоты. Аналогично, фраза "непосредственно выше аминокислоты" относится к положению прямо после концевой аминогруппы аминокислоты.
Термины "вставленный", "вставлен", "вставленный в" или грамматически родственные термины, используемые в данном документе, относятся к положению гетерологичного компонента в рекомбинантном полипептиде FVIII, относительно аналогичного положения в нативном зрелом FVIII человека. Используемые в данном документе термины относятся к характеристикам рекомбинантного полипептида FVIII, родственного нативному зрелому FVIII человека, и не указывают, не подразумевают или не предполагают никаких способов или процесса, с помощью которых был получен рекомбинантный полипептид FVIII.
Используемый в данном документе термин "период полужизни" относится к биологическому периоду полужизни конкретного полипептида in vivo. Период полужизни можно выразить в виде времени, необходимого для выведения из кровотока и/или других тканей животного половины количества, введенного субъекту. Если кривую клиренса данного полипептида строят в виде функции времени, кривая обычно является двухфазной с быстрой α-фазой и более длинной β-фазой. Обычно α-фаза отображает уравновешивание содержания введенного полипептида Fc между внутри- и внесосудистым пространством и частично определяется размером полипептида. Обычно β-фаза отображает катаболизм полипептида во внутрисосудистом пространстве. В некоторых вариантах осуществления FVIII и химерные белки, содержащие FVIII, являются монофазными и, таким образом, характеризуются отсутствием альфа-фазы и наличием только отдельной бета-фазы. Следовательно, в определенных вариантах осуществления термин период полужизни, используемый в данном документе, относится к периоду полужизни полипептида в β-фазе.
Термин "соединенный", используемый в данном документе, относится к первой аминокислотной последовательности или нуклеотидной последовательности, ковалентно или нековалентно присоединенной соответственно ко второй аминокислотной последовательности или нуклеотидной последовательности. Первая аминокислотная или нуклеотидная последовательность может быть непосредственно присоединена ко второй аминокислотной или нуклеотидной последовательности или объединена с ней, или, в качестве альтернативы, промежуточная последовательность может ковалентно соединять первую последовательность со второй последовательностью. Термин "соединенный" означает не только слияние первой аминокислотной последовательности со второй аминокислотной последовательностью на С-конце или N-конце, но также включает вставку всей первой аминокислотной последовательности (или второй аминокислотной последовательности) между любыми двумя аминокислотами во второй аминокислотной последовательности (или соответственно в первой аминокислотной последовательности). В одном варианте осуществления первая аминокислотная последовательность может быть соединена со второй аминокислотной последовательностью с помощью пептидной связи или линкера. Первая нуклеотидная последовательность может быть соединена со второй нуклеотидной последовательностью с помощью фосфодиэфирной связи или линкера. Линкер может представлять собой пептид или полипептид (в случае полипептидных цепей), или нуклеотид или цепь нуклеотидов (в случае цепей нуклеотидов), или любой химический компонент (как в случае полипептидных, так и полинуклеотидных цепей). Термин "соединенный" также обозначается дефисом (-).
Используемый в данном документе термин "связанный с" относится к ковалентной или нековалентной связи, образованной между первой аминокислотной цепью и второй аминокислотной цепью. В одном варианте осуществления термин "связанный с" означает ковалентную непептидную связь или нековалентную связь. Эта связь может быть обозначена двоеточием, т. е. (:). В другом варианте осуществления это означает любую ковалентную связь, за исключением пептидной связи. Например, аминокислота цистеин содержит тиольную группу, которая может образовывать дисульфидную связь или дисульфидный мостик с тиольной группой во втором остатке цистеина. В большинстве встречающихся в природе молекул IgG области CH1 и CL связаны дисульфидной связью, а две тяжелые цепи связаны двумя дисульфидными связями в положениях, соответствующих 239 и 242 согласно системе нумерации по Kabat (положение 226 или 229, система нумерации EU). Примеры ковалентных связей включают без ограничения пептидную связь, дисульфидную связь, сигма-связь, пи-связь, дельта-связь, гликозидную связь, агостическую связь, банановую связь, диполярную связь, обратную донорно-акцепторную Pi-связь, двойную связь, тройную связь, четверную связь, пятерную связь, шестерную связь, конъюгацию, гиперконъюгацию, ароматичность, гаптичность или антисвязывание. Неограничивающие примеры нековалентной связи включают ионную связь (например, катионную пи-связь или солевую связь), металлическую связь, водородную связь (например, диводородную связь, диводородный комплекс, низкобарьерную водородную связь или симметричную водородную связь), силу Ван-дер-Ваальса, лондоновскую дисперсионную силу, механическую связь, галогенную связь, аурофильность, интеркаляцию, стэкинг, энтропийную силу или химическую полярность.
Используемый в данном документе термин "мономерно-димерный гибрид" относится к химерному белку, содержащему первую полипептидную цепь и вторую полипептидную цепь, которые связаны друг с другом дисульфидной связью, где первая цепь содержит фактор свертывания крови, например, фактор FVIII, и первую Fc-область, а вторая цепь содержит, по сути состоит или состоит из второй Fc-области без фактора свертывания крови. Таким образом, мономерно-димерная гибридная конструкция представляет собой гибрид, содержащий мономерный компонент, содержащий только один фактор свертывания крови, и димерный компонент, содержащий две Fc-области.
Гемостаз, используемый в данном документе, означает остановку или замедление кровотечения или кровоизлияния; или остановку или замедление кровотока через кровеносный сосуд или часть тела.
Гемостатическое нарушение, как используется в данном документе, означает генетически наследуемое или приобретенное состояние, характеризующееся склонностью к кровоизлиянию, происходящему спонтанно либо в результате травмы, из-за нарушенной способности или неспособности образовывать фибриновый сгусток. Примеры таких нарушений включают формы гемофилии. Тремя основными формами являются гемофилия A (дефицит фактора VIII), гемофилия B (дефицит фактора IX или "болезнь Кристмаса") и гемофилия C (дефицит фактора XI, легкая склонность к кровотечению). Другие гемостатические нарушения включают, например, болезнь фон Виллебранда, дефицит фактора XI (дефицит PTA), дефицит фактора XII, дефициты или аномалии структуры фибриногена, протромбина, фактора V, фактора VII, фактора X или фактора XIII, синдром Бернара-Сулье, который представляет собой дефект или дефицит GPIb. GPIb, рецептор vWF, может быть дефектным и приводить к невозможности образования первичного сгустка (первичного гемостаза) и повышенной склонности к кровотечению, а также к тромбастении Гланцманна-Негели (тромбастении Гланцманна). При печеночной недостаточности (острой и хронической формах) имеет место недостаточная выработка печенью факторов коагуляции; это может увеличивать риск кровотечения.
Лентивирусные векторы, содержащие выделенную молекулу нуклеиновой кислоты, согласно настоящему изобретению можно применять профилактически. Используемый в данном документе термин "профилактическое лечение" относится к введению молекулы до эпизода кровотечения. В одном варианте осуществления субъект, нуждающийся в общем гемостатическом средстве, подвергается или вскоре подвергнется хирургическому вмешательству. Например, лентивирусный вектор по настоящему изобретению можно вводить до или после хирургического вмешательства в качестве профилактического средства. Лентивирусный вектор по настоящему изобретению можно вводить во время или после хирургического вмешательства для контроля эпизода острого кровотечения. Хирургическое вмешательство может включать без ограничения трансплантацию печени, резекцию печени, стоматологические процедуры или трансплантацию стволовых клеток.
Лентивирусные векторы по настоящему изобретению также применяют для лечения по необходимости. Термин "лечение по необходимости" относится к введению лентивирусного вектора по настоящему изобретению в ответ на симптомы эпизода кровотечения или перед действием, которое может вызвать кровотечение. В одном аспекте лечение по необходимости может быть назначено субъекту, когда начинается кровотечение, например после травмы, или когда ожидается кровотечение, например перед хирургическим вмешательством. В другом аспекте лечение по необходимости может быть назначено перед действиями, которые увеличивают риск кровотечения, такими как контактные виды спорта.
Используемый в данном документе термин "острое кровотечение" относится к эпизоду кровотечения независимо от первопричины. Например, у субъекта может быть травма, уремия, наследственное нарушение свертываемости крови (например, дефицит фактора VII), тромбоцитарное нарушение или устойчивость вследствие развития антител против факторов свертывания крови.
"Лечить", "лечение" или "осуществление лечения", как используется в данном документе, относится, например, к уменьшению тяжести заболевания или состояния; уменьшению продолжительности течения заболевания; облегчению одного или нескольких симптомов, ассоциированных с заболеванием или состоянием; обеспечению благоприятных эффектов у субъекта с заболеванием или состоянием, при этом не обязательно с излечением заболевания или состояния, или профилактике одного или нескольких симптомов, связанных с заболеванием или состоянием. В одном варианте осуществления термин "осуществление лечения" или "лечение" означает поддержание у субъекта остаточного уровня содержания FVIII, составляющего по меньшей мере приблизительно 1 МЕ/дл, 2 МЕ/дл, 3 МЕ/дл, 4 МЕ/дл, 5 МЕ/дл, 6 МЕ/дл, 7 МЕ/дл, 8 МЕ/дл, 9 МЕ/дл, 10 МЕ/дл, 11 МЕ/дл, 12 МЕ/дл, 13 МЕ/дл, 14 МЕ/дл, 15 МЕ/дл, 16 МЕ/дл, 17 МЕ/дл, 18 МЕ/дл, 19 МЕ/дл или 20 МЕ/дл путем введения лентивирусного вектора по настоящему изобретению. В другом варианте осуществления осуществление лечения или лечение означает поддержание остаточного уровня FVIII, составляющего от приблизительно 1 до приблизительно 20 МЕ/дл, от приблизительно 2 до приблизительно 20 МЕ/дл, от приблизительно 3 до приблизительно 20 МЕ/дл, от приблизительно 4 до приблизительно 20 МЕ/дл, от приблизительно 5 до приблизительно 20 МЕ/дл, от приблизительно 6 до приблизительно 20 МЕ/дл, от приблизительно 7 до приблизительно 20 МЕ/дл, от приблизительно 8 до приблизительно 20 МЕ/дл, от приблизительно 9 до приблизительно 20 МЕ/дл или от приблизительно 10 до приблизительно 20 МЕ/дл. Лечение или осуществление лечения заболевания или состояния может также включать поддержание активности FVIII у субъекта на уровне, сопоставимом с по меньшей мере приблизительно 1%, 2%, 3%, 4%, 5%, 6%, 7%, 8%, 9%, 10%, 11%, 12%, 13%, 14%, 15%, 16%, 17%, 18%, 19%, или 20%активности FVIII у субъекта, не страдающего гемофилией. В одном варианте осуществления термин "осуществление лечения" или "лечение" означает поддержание у субъекта остаточного уровня содержания FVIII, составляющего по меньшей мере приблизительно 30 МЕ/дл, 40 МЕ/дл, 50 МЕ/дл, 60 МЕ/дл, 70 МЕ/дл, 80 МЕ/дл, 90 МЕ/дл, 100 МЕ/дл, 110 МЕ/дл, 120 МЕ/дл, 130 МЕ/дл, 140 МЕ/дл или 150 МЕ/дл путем введения лентивирусного вектора по настоящему изобретению. В другом варианте осуществления осуществление лечения или лечение означает поддержание остаточного уровня FVIII, составляющего от приблизительно 10 до приблизительно 20 МЕ/дл, от приблизительно 20 до приблизительно 23 МЕ/дл, от приблизительно 30 до приблизительно 40 МЕ/дл, от приблизительно 40 до приблизительно 50 МЕ/дл, от приблизительно 50 до приблизительно 60 МЕ/дл, от приблизительно 60 до приблизительно 70 МЕ/дл, от приблизительно 70 до приблизительно 80 МЕ/дл, от приблизительно 80 до приблизительно 90 МЕ/дл, от приблизительно 90 до приблизительно 100 МЕ/дл, от приблизительно 110 до приблизительно 120 МЕ/дл, от приблизительно 120 до приблизительно 130 МЕ/дл, от приблизительно 130 до приблизительно 140 МЕ/дл или от приблизительно 140 до приблизительно 150 МЕ/дл. Лечение или осуществление лечения заболевания или состояния может также включать поддержание активности FVIII у субъекта на уровне, сопоставимом с по меньшей мере приблизительно 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 100%, 105%, 110%, 115%, 120%, 125%, 130%, 135%, 140%, 145% или 150% активности FVIII у субъекта, не страдающего гемофилией. Минимальный остаточный уровень, необходимый для лечения, может быть измерен с помощью одного или нескольких известных способов и может быть скорректирован (увеличен или уменьшен) для каждого человека.
"Введение", как используется в данном документе, означает предоставление фармацевтически приемлемой молекулы нуклеиновой кислоты, кодирующей фактор VIII, полипептида фактора VIII или вектора, содержащего молекулу нуклеиновой кислоты, кодирующую фактор VIII, по настоящему изобретению субъекту фармацевтически приемлемым путем. Пути введения могут быть внутривенными, например внутривенной инъекцией и внутривенной инфузией. Дополнительные пути введения включают, например, подкожное, внутримышечное, пероральное, назальное и легочное введение. Молекулы нуклеиновой кислоты, полипептиды и векторы можно вводить в составе фармацевтической композиции, содержащей по меньшей мере одно вспомогательное вещество.
Используемая в данном документе фраза "субъект, нуждающийся в этом" включает субъектов, таких как субъекты-млекопитающие, которые получат пользу от введения молекулы нуклеиновой кислоты, полипептида или вектора согласно настоящему изобретению, например, в отношении улучшения гемостаза. В одном варианте осуществления субъекты включают без ограничения индивидуумов с гемофилией. В другом варианте осуществления субъекты включают без ограничения индивидуумов, у которых выработался ингибитор FVIII, и, таким образом, они нуждаются в терапии шунтирующего действия. Субъектом может являться взрослый или несовершеннолетний (например, в возрасте до 12 лет).
Используемый в данном документе термин "фактор свертывания крови" относится к молекулам или их аналогам, встречающимся в природе или полученным рекомбинантным путем, которые предупреждают или снижают продолжительность эпизода кровотечения у субъекта. Другими словами, он подразумевает молекулы, характеризующиеся положительной свертывающей активностью, т. е. отвечающими за превращение фибриногена в сеть из нерастворимого фибрина, обуславливающую коагулирование или свертывание крови. "Активируемый фактор свертывания крови" представляет собой фактор свертывания крови в неактивной форме (например, в форме его зимогена), который способен к переходу в активную форму.
Свертывающая активность, применяемая в данном документе, означает способность принимать участие в каскаде биохимических реакций, который приводит к образованию фибринового сгустка и/или уменьшает тяжесть, продолжительность или частоту кровоизлияния или эпизода кровотечения.
Используемые в данном документе термины "гетерологичный" или "экзогенный" относятся к таким молекулам, которые, в данном контексте, обычно не встречаются, например, в клетке или в полипептиде. Например, экзогенная или гетерологичная молекула может быть введена в клетку и присутствуют только после проведения манипуляции с клеткой, например, путем трансфекции или других способов генной инженерии, или гетерологичная аминокислотная последовательность может быть представлена в белке, в котором она обычно не встречается.
Используемый в данном документе термин "гетерологичная нуклеотидная последовательность" относится к нуклеотидной последовательности, которая не встречается в природе с данной полинуклеотидной последовательностью. В одном варианте осуществления гетерологичная нуклеотидная последовательность кодирует полипептид, способный продлевать период полужизни FVIII. В одном варианте осуществления гетерологичная нуклеотидная последовательность кодирует полипептид, который увеличивает гидродинамический радиус FVIII. В других вариантах осуществления гетерологичная нуклеотидная последовательность кодирует полипептид, который улучшает одно или несколько фармакокинетических свойств FVIII без значительного влияния на его биологическую активность или функцию (например, его прокоагулянтную активность). В некоторых вариантах осуществления FVIII связан или соединен с кодируемым гетерологичной нуклеотидной последовательностью полипептидом с помощью линкера. Неограничивающие примеры полипептидных компонентов, кодируемых гетерологичными нуклеотидными последовательностями, включают константную область иммуноглобулина или ее часть, альбумин или его фрагмент, альбумин-связывающий компонент, трансферрин, полипептиды PAS согласно заявке на патент США № 20100292130, последовательность HAP, трансферрин или его фрагмент, C-концевой пептид (CTP) β-субъединицы хорионического гонадотропина человека, альбумин-связывающую малую молекулу, последовательность XTEN, компоненты, связывающие FcRn (например, полные Fc-области или их части, которые связываются с FcRn), одноцепочечные Fc-области (ScFc-области, например, описанные в US 2008/0260738, WO 2008/012543 или WO 2008/1439545), полиглициновые линкеры, полисериновые линкеры, пептиды и короткие полипептиды из 6-40 аминокислот на основе двух типов аминокислот, выбранных из глицина (G), аланина (A), серина (S), треонина (T), глутамата (E) и пролина (P), характеризующиеся различной степенью образования вторичной структуры, составляющей от менее 50% до более 50%, среди прочего, или две или более их комбинаций. В некоторых вариантах осуществления полипептид, кодируемый гетерологичной нуклеотидной последовательностью, связан с компонентом, не являющимся полипептидом. Неограничивающие примеры компонентов, не являющихся полипептидом, включают полиэтиленгликоль (PEG), альбумин-связывающие малые молекулы, полисиаловую кислоту, гидроксиэтилкрахмал (HES), их производное или любые их комбинации.
Используемый в данном документе термин "Fc-область" определяется как часть полипептида, которая соответствует Fc-области нативного Ig, т. e. образована путем димерной ассоциации соответствующих Fc-доменов двух его тяжелых цепей. Нативная Fc-область образует гомодимер с другой Fc-областью. В отличие от этого, термины "генетически слитая Fc-область" или "одноцепочечная Fc-область" (scFc-область), используемые в данном документе, относятся к синтетической димерной Fc-области, состоящей из Fc-доменов, генетически соединенных в одну полипептидную цепь (т. е. кодируемых одной непрерывной генетической последовательностью).
В одном варианте осуществления "Fc-область" относится к части одной тяжелой цепи Ig, начинающейся в шарнирной области непосредственно выше сайта расщепления папаином (т. е. остатка 216 в IgG, если принять первый остаток константной области тяжелой цепи за 114) и заканчивающейся на С-конце антитела. Соответственно, полный Fc-домен содержит по меньшей мере шарнирный домен, CH2-домен и CH3-домен.
Fc-область константной области Ig в зависимости от изотипа Ig может содержать домены CH2, CH3 и CH4, а также шарнирную область. Химерные белки, содержащие Fc-область Ig, наделяют химерный белок несколькими необходимыми свойствами, включая увеличенную стабильность, увеличенный период полужизни в сыворотке крови (см. Capon et al., 1989, Nature 337:525), а также связывание с Fc-рецепторами, такими как неонатальный Fc-рецептор (FcRn) (патенты США №№ 6086875, 6485726, 6030613; WO 03/077834; US2003-0235536A1, которые включены в данный документ посредством ссылки во всей своей полноте).
"Контрольная нуклеотидная последовательность", при использовании в данном документе для сравнения с нуклеотидной последовательностью по настоящему изобретению, представляет собой полинуклеотидную последовательность, по сути идентичную нуклеотидной последовательности по настоящему изобретению, за исключением того, что части, соответствующие последовательности FVIII, не являются оптимизированными. Например, контрольная нуклеотидная последовательность для молекулы нуклеиновой кислоты, состоящей из кодон-оптимизированной последовательности BDD FVIII под SEQ ID NO: 1 и гетерологичной нуклеотидной последовательности, которая кодирует одноцепочечную Fc-область, связанной с SEQ ID NO: 1 со стороны своего 3'-конца, представляет собой молекулу нуклеиновой кислоты, состоящую из исходной (или "родительской") BDD FVIII под SEQ ID NO: 16 (фиг. 1I) и идентичной гетерологичной нуклеотидной последовательности, которая кодирует одноцепочечную Fc-область, связанную с SEQ ID NO: 16 со стороны своего 3'-конца.
"Индекс адаптации кодонов", как используется в данном документе, относится к мере предпочтения использования кодонов. С помощью индекса адаптации кодонов (CAI) измеряют отклонение рассматриваемой последовательности гена, кодирующего белок, от контрольного набора генов (Sharp PM and Li WH, Nucleic Acids Res. 15(3):1281-95 (1987)). CAI рассчитывают путем определения среднего геометрического для веса, связанного с каждым кодоном, по длине последовательности гена (измеряемой в кодонах):
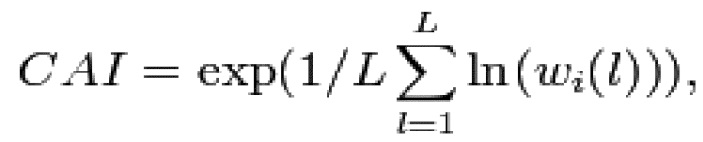 (I)
(I)
Для каждой аминокислоты вес каждого из ее кодонов в CAI вычисляют как отношение между наблюдаемой частотой кодона (fi) и частотой синонимичного кодона (fj) для этой аминокислоты:
Формула 2:
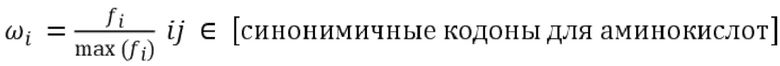 (II)
(II)
Используемый в данном документе в отношении нуклеотидных последовательностей термин "оптимизированный" относится к полинуклеотидной последовательности, которая кодирует полипептид, где полинуклеотидная последовательность была подвергнута мутации для улучшения какого-либо свойства данной полинуклеотидной последовательности. В некоторых вариантах осуществления оптимизацию выполняют для повышения уровней транскрипции, повышения уровней трансляции, повышения устойчивых уровней мРНК, повышения или снижения связывания регуляторных белков, таких как общие факторы транскрипции, повышения или снижения сплайсинга или повышения выхода полипептида, получаемого из полинуклеотидной последовательности. Примеры изменений, которые можно вносить в полинуклеотидную последовательность для ее оптимизации, включают оптимизацию кодонов, оптимизацию содержания G/C, удаление последовательностей повторов, удаление богатых AT элементов, удаление криптических сайтов сплайсинга, удаление элементов, действующих в цис-положении, которые подавляют транскрипцию или трансляцию, добавление или удаление последовательностей поли-T или поли-A, добавление последовательностей около сайта начала транскрипции, которые усиливают транскрипцию, как, например, консенсусных последовательностей Козак, удаление последовательностей, которые могут образовывать структуры "стебель-петля", удаление дестабилизирующих последовательностей и две или более их комбинаций.
II. Лентивирусная генная терапия, направленная на FVIII
Генную терапию соматических клеток исследовали как возможный метод лечения нарушений свертываемости крови и, в частности, гемофилии A. Генная терапия является особенно привлекательным методом лечения гемофилии, поскольку она обладает потенциалом излечения заболевания благодаря непрерывному эндогенному продуцированию FVIII после однократного введения вектора, кодирующего FVIII. Гемофилия А является особенно пригодной для подхода на основе генной заместительной терапии, поскольку ее клинические проявления в полной мере объясняются отсутствием одного продукта гена (FVIII), который циркулирует в плазме крови в незначительных количествах (200 нг/мл).
Лентивирусные векторы становятся все более популярными в качестве носителей для доставки генов из-за их большой емкости и способности поддерживать экспрессию трансгена посредством интеграции. Лентивирусные векторы были оценены в многочисленных клинических программах по изучению клеточной терапии ex vivo и показали многообещающие профили эффективности и безопасности.
Настоящее изобретение удовлетворяет важную потребность в данной области техники, предоставляя лентивирусные векторы, содержащие кодон-оптимизированную последовательность FVIII, которая демонстрирует повышенную экспрессию у субъекта и потенциально приводит к большей терапевтической эффективности при применении в способах генной терапии. Варианты осуществления настоящего изобретения относятся к лентивирусным векторам, содержащим одну или несколько кодон-оптимизированных молекул нуклеиновой кислоты, кодирующих полипептид с активностью FVIII, описанных в данном документе, к клеткам-хозяевам (например, гепатоцитам), содержащим лентивирусные векторы, и к способам применения раскрытых лентивирусных векторов (например, видам лечения нарушений свертываемости крови с применением лентивирусных векторов, раскрытых в данном документе).
В целом, способы лечения, раскрытые в данном документе, включают введение лентивирусного вектора, содержащего молекулу нуклеиновой кислоты, содержащую по меньшей мере одну кодон-оптимизированную последовательность нуклеиновой кислоты, кодирующую фактор свертывания крови FVIII, где последовательность нуклеиновой кислоты, кодирующая фактор свертывания крови FVIII, функционально связана с подходящими последовательностями, осуществляющими контроль экспрессии, которые в некоторых вариантах осуществления встроены в лентивирусный вектор (например, репликационно-дефектный лентивирусный вектор).
Настоящее изобретение предусматривает способы лечения нарушения свертываемости крови (например, гемофилии A) у субъекта, нуждающегося в этом, включающие введение субъекту по меньшей мере одной дозы, составляющей 5х1010 или меньше трансдуцирующих единиц/кг (ТЕ/кг) (или 109 ТЕ/кг или меньше, или 108 ТЕ/кг или меньше) лентивирусного вектора, содержащего выделенную молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, кодирующую полипептид с активностью FVIII, где нуклеотидная последовательность характеризуется:
(i) по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-2277 и 2320-4374 из SEQ ID NO: 1;
(ii) по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-2277 и 2320-4374 из SEQ ID NO: 2;
(iii) по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-2277 и 2320-4374 из SEQ ID NO: 70;
(iv) по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-2277 и 2320-4374 из SEQ ID NO: 71;
(v) по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-2277 и 2320-4374 из SEQ ID NO: 3;
(vi) по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-2277 и 2320-4374 из SEQ ID NO: 4;
(vii) по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-2277 и 2320-4374 из SEQ ID NO: 5;
(viii) по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-2277 и 2320-4374 из SEQ ID NO: 6; или
(ix) любой комбинацией (i) - (viii).
Настоящее изобретение также предусматривает способ лечения нарушения свертываемости крови (например, гемофилии A) у субъекта, нуждающегося в этом, включающий введение субъекту по меньшей мере одной дозы, составляющей 5х1010 или меньше трансдуцирующих единиц/кг (ТЕ/кг) (или 109 ТЕ/кг или меньше, или 108 ТЕ/кг или меньше) лентивирусного вектора, содержащего выделенную молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, которая содержит первую последовательность нуклеиновой кислоты, кодирующую N-концевую часть полипептида фактора VIII (FVIII), и вторую последовательность нуклеиновой кислоты, кодирующую C-концевую часть полипептида FVIII;
(a) где первая последовательность нуклеиновой кислоты характеризуется:
(i) по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-2277 и 2320-1791 из SEQ ID NO: 3;
(ii) по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-2277 и 2320-1791 из SEQ ID NO: 4;
(iii) по меньшей мере 60%, по меньшей мере 61%, по меньшей мере 62%, по меньшей мере 63%, по меньшей мере 64%, по меньшей мере 65%, по меньшей мере 66%, по меньшей мере 67%, по меньшей мере 68%, по меньшей мере 69%, по меньшей мере 70%, по меньшей мере 71%, по меньшей мере 72%, по меньшей мере 73%, по меньшей мере 74%, по меньшей мере 75%, по меньшей мере 76%, по меньшей мере 77%, по меньшей мере 78%, по меньшей мере 79%, по меньшей мере 80%, по меньшей мере 81%, по меньшей мере 82%, по меньшей мере 83%, по меньшей мере 84%, по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%,по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-1791 из SEQ ID NO: 5; или
(iv) по меньшей мере 60%, по меньшей мере 61%, по меньшей мере 62%, по меньшей мере 63%, по меньшей мере 64%, по меньшей мере 65%, по меньшей мере 66%, по меньшей мере 67%, по меньшей мере 68%, по меньшей мере 69%, по меньшей мере 70%, по меньшей мере 71%, по меньшей мере 72%, по меньшей мере 73%, по меньшей мере 74%, по меньшей мере 75%, по меньшей мере 76%, по меньшей мере 77%, по меньшей мере 78%, по меньшей мере 79%, по меньшей мере 80%, по меньшей мере 81%, по меньшей мере 82%, по меньшей мере 83%, по меньшей мере 84%, по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-1791 из SEQ ID NO: 6;
(b) где вторая нуклеотидная последовательность характеризуется:
(i) по меньшей мере 60%, по меньшей мере 61%, по меньшей мере 62%, по меньшей мере 63%, по меньшей мере 64%, по меньшей мере 65%, по меньшей мере 66%, по меньшей мере 67%, по меньшей мере 68%, по меньшей мере 69%, по меньшей мере 70%, по меньшей мере 71%, по меньшей мере 72%, по меньшей мере 73%, по меньшей мере 74%, по меньшей мере 75%, по меньшей мере 76%, по меньшей мере 77%, по меньшей мере 78%, по меньшей мере 79%, по меньшей мере 80%, по меньшей мере 81%, по меньшей мере 82%, по меньшей мере 83%, по меньшей мере 84%, по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 1792-2277 и 2320-4374 из SEQ ID NO: 3;
(ii) по меньшей мере 60%, по меньшей мере 61%, по меньшей мере 62%, по меньшей мере 63%, по меньшей мере 64%, по меньшей мере 65%, по меньшей мере 66%, по меньшей мере 67%, по меньшей мере 68%, по меньшей мере 69%, по меньшей мере 70%, по меньшей мере 71%, по меньшей мере 72%, по меньшей мере 73%, по меньшей мере 74%, по меньшей мере 75%, по меньшей мере 76%, по меньшей мере 77%, по меньшей мере 78%, по меньшей мере 79%, по меньшей мере 80%, по меньшей мере 81%, по меньшей мере 82%, по меньшей мере 83%, по меньшей мере 84%, по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 1792-2277 и 2320-4374 из SEQ ID NO: 4;
(iii) по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 1792-2277 и 2320-4374 из SEQ ID NO: 5; или
(iv) по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 1792-2277 и 2320-4374 из SEQ ID NO: 6; или
(c) любой комбинацией (a) и (b); и
где N-концевая часть и C-концевая часть вместе обладают активностью полипептида FVIII.
В некоторых вариантах осуществления доза составляет приблизительно 5,0×1010 ТЕ/кг, приблизительно 4,9×1010 ТЕ/кг, приблизительно 4,8×1010 ТЕ/кг, приблизительно 4,7×1010 ТЕ/кг, приблизительно 4,6×1010 ТЕ/кг, приблизительно 4,5х1010 ТЕ/кг, приблизительно 4,4×1010 ТЕ/кг, приблизительно 4,3×1010 ТЕ/кг, приблизительно 4,2×1010 ТЕ/кг, приблизительно 4,1×1010 ТЕ/кг, приблизительно 4,0×1010 ТЕ/кг, приблизительно 3,9×1010 ТЕ/кг, приблизительно 3,8×1010 ТЕ/кг, приблизительно 3,7×1010 ТЕ/кг, приблизительно 3,6×1010 ТЕ/кг, приблизительно 3,5х1010 ТЕ/кг, приблизительно 3,4×1010 ТЕ/кг, приблизительно 3,3×1010 ТЕ/кг, приблизительно 3,2×1010 ТЕ/кг, приблизительно 3,1×1010 ТЕ/кг, приблизительно 3,0×1010 ТЕ/кг, приблизительно 2,9×1010 ТЕ/кг, приблизительно 2,8×1010 ТЕ/кг, приблизительно 2,7×1010 ТЕ/кг, приблизительно 2,6×1010 ТЕ/кг, приблизительно 2,5х1010 ТЕ/кг, приблизительно 2,4×1010 ТЕ/кг, приблизительно 2,3×1010 ТЕ/кг, приблизительно 2,2×1010 ТЕ/кг, приблизительно 2,1×1010 ТЕ/кг, приблизительно 2,0×1010 ТЕ/кг, приблизительно 1,9×1010 ТЕ/кг, приблизительно 1,8×1010 ТЕ/кг, приблизительно 1,7×1010 ТЕ/кг, приблизительно 1,6×1010 ТЕ/кг, приблизительно 1,5х1010 ТЕ/кг, приблизительно 1,4×1010 ТЕ/кг, приблизительно 1,3×1010 ТЕ/кг, приблизительно 1,2×1010 ТЕ/кг, приблизительно 1,1×1010 ТЕ/кг или приблизительно 1,0×1010 ТЕ/кг.
В некоторых вариантах осуществления доза составляет приблизительно 9,9×109 ТЕ/кг, приблизительно 9,8×109 ТЕ/кг, приблизительно 9,7×109 ТЕ/кг, приблизительно 9,6×109 ТЕ/кг, приблизительно 9,5х109 ТЕ/кг, приблизительно 9,4×109 ТЕ/кг, приблизительно 9,3×109 ТЕ/кг, приблизительно 9,2×109 ТЕ/кг, приблизительно 9,1×109 ТЕ/кг, приблизительно 9,0×109 ТЕ/кг, приблизительно 8,9×109 ТЕ/кг, приблизительно 8,8×109 ТЕ/кг, приблизительно 8,7×109 ТЕ/кг, приблизительно 8,6×109 ТЕ/кг, приблизительно 8,5х109 ТЕ/кг, приблизительно 8,4×109 ТЕ/кг, приблизительно 8,3×109 ТЕ/кг, приблизительно 8,2×109 ТЕ/кг, приблизительно 8,1×109 ТЕ/кг, приблизительно 8,0×109 ТЕ/кг, приблизительно 7,9×109 ТЕ/кг, приблизительно 7,8×109 ТЕ/кг, приблизительно 7,7×109 ТЕ/кг, приблизительно 7,6×109 ТЕ/кг, приблизительно 7,5х109 ТЕ/кг, приблизительно 7,4×109 ТЕ/кг, приблизительно 7,3×109 ТЕ/кг, приблизительно 7,2×109 ТЕ/кг, приблизительно 7,1×109 ТЕ/кг, приблизительно 7,0×109 ТЕ/кг, приблизительно 6,9×109 ТЕ/кг, приблизительно 6,8×109 ТЕ/кг, приблизительно 6,7×109 ТЕ/кг, приблизительно 6,6×109 ТЕ/кг, приблизительно 6,5х109 ТЕ/кг, приблизительно 6,4×109 ТЕ/кг, приблизительно 6,3×109 ТЕ/кг, приблизительно 6,2×109 ТЕ/кг, приблизительно 6,1×109 ТЕ/кг, приблизительно 6,0×109 ТЕ/кг, приблизительно 5,9×109 ТЕ/кг, приблизительно 5,8×109 ТЕ/кг, приблизительно 5,7×109 ТЕ/кг, приблизительно 5,6×109 ТЕ/кг, приблизительно 5,5х109 ТЕ/кг, приблизительно 5,4×109 ТЕ/кг, приблизительно 5,3×109 ТЕ/кг, приблизительно 5,2×109 ТЕ/кг, приблизительно 5,1×109 ТЕ/кг, приблизительно 5,0×109 ТЕ/кг, приблизительно 4,9×109 ТЕ/кг, приблизительно 4,8×109 ТЕ/кг, приблизительно 4,7×109 ТЕ/кг, приблизительно 4,6×109 ТЕ/кг, приблизительно 4,5х109 ТЕ/кг, приблизительно 4,4×109 ТЕ/кг, приблизительно 4,3×109 ТЕ/кг, приблизительно 4,2×109 ТЕ/кг, приблизительно 4,1×109 ТЕ/кг, приблизительно 4,0×109 ТЕ/кг, приблизительно 3,9×109 ТЕ/кг, приблизительно 3,8×109 ТЕ/кг, приблизительно 3,7×109 ТЕ/кг, приблизительно 3,6×109 ТЕ/кг, приблизительно 3,5х109 ТЕ/кг, приблизительно 3,4×109 ТЕ/кг, приблизительно 3,3×109 ТЕ/кг, приблизительно 3,2×109 ТЕ/кг, приблизительно 3,1×109 ТЕ/кг, приблизительно 3,0×109 ТЕ/кг, приблизительно 2,9×109 ТЕ/кг, приблизительно 2,8×109 ТЕ/кг, приблизительно 2,7×109 ТЕ/кг, приблизительно 2,6×109 ТЕ/кг, приблизительно 2,5х109 ТЕ/кг, приблизительно 2,4×109 ТЕ/кг, приблизительно 2,3×109 ТЕ/кг, приблизительно 2,2×109 ТЕ/кг, приблизительно 2,1×109 ТЕ/кг, приблизительно 2,0×109 ТЕ/кг, приблизительно 1,9×109 ТЕ/кг, приблизительно 1,8×109 ТЕ/кг, приблизительно 1,7×109 ТЕ/кг, приблизительно 1,6×109 ТЕ/кг, приблизительно 1,5х109 ТЕ/кг, приблизительно 1,4×109 ТЕ/кг, приблизительно 1,3×109 ТЕ/кг, приблизительно 1,2×109 ТЕ/кг, приблизительно 1,1×109 ТЕ/кг или приблизительно 1,0×109 ТЕ/кг.
В некоторых вариантах осуществления доза составляет приблизительно 9,9×108 ТЕ/кг, приблизительно 9,8×108 ТЕ/кг, приблизительно 9,7×108 ТЕ/кг, приблизительно 9,6×108 ТЕ/кг, приблизительно 9,5х108 ТЕ/кг, приблизительно 9,4×108 ТЕ/кг, приблизительно 9,3×108 ТЕ/кг, приблизительно 9,2×108 ТЕ/кг, приблизительно 9,1×108 ТЕ/кг, приблизительно 9,0×108 ТЕ/кг, приблизительно 8,9×108 ТЕ/кг, приблизительно 8,8×108 ТЕ/кг, приблизительно 8,7×108 ТЕ/кг, приблизительно 8,6×108 ТЕ/кг, приблизительно 8,5х108 ТЕ/кг, приблизительно 8,4×108 ТЕ/кг, приблизительно 8,3×108 ТЕ/кг, приблизительно 8,2×108 ТЕ/кг, приблизительно 8,1×108 ТЕ/кг, приблизительно 8,0×108 ТЕ/кг, приблизительно 7,9×108 ТЕ/кг, приблизительно 7,8×108 ТЕ/кг, приблизительно 7,7×108 ТЕ/кг, приблизительно 7,6×108 ТЕ/кг, приблизительно 7,5х108 ТЕ/кг, приблизительно 7,4×108 ТЕ/кг, приблизительно 7,3×108 ТЕ/кг, приблизительно 7,2×108 ТЕ/кг, приблизительно 7,1×108 ТЕ/кг, приблизительно 7,0×108 ТЕ/кг, приблизительно 6,9×108 ТЕ/кг, приблизительно 6,8×108 ТЕ/кг, приблизительно 6,7×108 ТЕ/кг, приблизительно 6,6×108 ТЕ/кг, приблизительно 6,5х108 ТЕ/кг, приблизительно 6,4×108 ТЕ/кг, приблизительно 6,3×108 ТЕ/кг, приблизительно 6,2×108 ТЕ/кг, приблизительно 6,1×108 ТЕ/кг, приблизительно 6,0×108 ТЕ/кг, приблизительно 5,9×108 ТЕ/кг, приблизительно 5,8×108 ТЕ/кг, приблизительно 5,7×108 ТЕ/кг, приблизительно 5,6×108 ТЕ/кг, приблизительно 5,5х108 ТЕ/кг, приблизительно 5,4×108 ТЕ/кг, приблизительно 5,3×108 ТЕ/кг, приблизительно 5,2×108 ТЕ/кг, приблизительно 5,1×108 ТЕ/кг, приблизительно 5,0×108 ТЕ/кг, приблизительно 4,9×108 ТЕ/кг, приблизительно 4,8×108 ТЕ/кг, приблизительно 4,7×108 ТЕ/кг, приблизительно 4,6×108 ТЕ/кг, приблизительно 4,5х108 ТЕ/кг, приблизительно 4,4×108 ТЕ/кг, приблизительно 4,3×108 ТЕ/кг, приблизительно 4,2×108 ТЕ/кг, приблизительно 4,1×108 ТЕ/кг, приблизительно 4,0×108 ТЕ/кг, приблизительно 3,9×108 ТЕ/кг, приблизительно 3,8×108 ТЕ/кг, приблизительно 3,7×108 ТЕ/кг, приблизительно 3,6×108 ТЕ/кг, приблизительно 3,5х108 ТЕ/кг, приблизительно 3,4×108 ТЕ/кг, приблизительно 3,3×108 ТЕ/кг, приблизительно 3,2×108 ТЕ/кг, приблизительно 3,1×108 ТЕ/кг, приблизительно 3,0×108 ТЕ/кг, приблизительно 2,9×108 ТЕ/кг, приблизительно 2,8×108 ТЕ/кг, приблизительно 2,7×108 ТЕ/кг, приблизительно 2,6×108 ТЕ/кг, приблизительно 2,5х108 ТЕ/кг, приблизительно 2,4×108 ТЕ/кг, приблизительно 2,3×108 ТЕ/кг, приблизительно 2,2×108 ТЕ/кг, приблизительно 2,1×108 ТЕ/кг, приблизительно 2,0×108 ТЕ/кг, приблизительно 1,9×108 ТЕ/кг, приблизительно 1,8×108 ТЕ/кг, приблизительно 1,7×108 ТЕ/кг, приблизительно 1,6×108 ТЕ/кг, приблизительно 1,5х108 ТЕ/кг, приблизительно 1,4×108 ТЕ/кг, приблизительно 1,3×108 ТЕ/кг, приблизительно 1,2×108 ТЕ/кг, приблизительно 1,1×108 ТЕ/кг или приблизительно 1,0×108 ТЕ/кг.
В некоторых вариантах осуществления доза составляет менее 5,0×1010 ТЕ/кг, менее 4,9×1010 ТЕ/кг, менее 4,8×1010 ТЕ/кг, менее 4,7×1010 ТЕ/кг, менее 4,6×1010 ТЕ/кг, менее 4,5х1010 ТЕ/кг, менее 4,4×1010 ТЕ/кг, менее 4,3×1010 ТЕ/кг, менее 4,2×1010 ТЕ/кг, менее 4,1×1010 ТЕ/кг, менее 4,0×1010 ТЕ/кг, менее 3,9×1010 ТЕ/кг, менее 3,8×1010 ТЕ/кг, менее 3,7×1010 ТЕ/кг, менее 3,6×1010 ТЕ/кг, менее 3,5х1010 ТЕ/кг, менее 3,4×1010 ТЕ/кг, менее 3,3×1010 ТЕ/кг, менее 3,2×1010 ТЕ/кг, менее 3,1×1010 ТЕ/кг, менее 3,0×1010 ТЕ/кг, менее 2,9×1010 ТЕ/кг, менее 2,8×1010 ТЕ/кг, менее 2,7×1010 ТЕ/кг, менее 2,6×1010 ТЕ/кг, менее 2,5х1010 ТЕ/кг, менее 2,4×1010 ТЕ/кг, менее 2,3×1010 ТЕ/кг, менее 2,2×1010 ТЕ/кг, менее 2,1×1010 ТЕ/кг, менее 2,0×1010 ТЕ/кг, менее 1,9×1010 ТЕ/кг, менее 1,8×1010 ТЕ/кг, менее 1,7×1010 ТЕ/кг, менее 1,6×1010 ТЕ/кг, менее 1,5х1010 ТЕ/кг, менее 1,4×1010 ТЕ/кг, менее 1,3×1010 ТЕ/кг, менее 1,2×1010 ТЕ/кг, менее 1,1×1010 ТЕ/кг или менее 1,0×1010 ТЕ/кг.
В некоторых вариантах осуществления доза составляет менее 9,9×109 ТЕ/кг, менее 9,8×109 ТЕ/кг, менее 9,7×109 ТЕ/кг, менее 9,6×109 ТЕ/кг, менее 9,5х109 ТЕ/кг, менее 9,4×109 ТЕ/кг, менее 9,3×109 ТЕ/кг, менее 9,2×109 ТЕ/кг, менее 9,1×109 ТЕ/кг, менее 9,0×109 ТЕ/кг, менее 8,9×109 ТЕ/кг, менее 8,8×109 ТЕ/кг, менее 8,7×109 ТЕ/кг, менее 8,6×109 ТЕ/кг, менее 8,5х109 ТЕ/кг, менее 8,4×109 ТЕ/кг, менее 8,3×109 ТЕ/кг, менее 8,2×109 ТЕ/кг, менее 8,1×109 ТЕ/кг, менее 8,0×109 ТЕ/кг, менее 7,9×109 ТЕ/кг, менее 7,8×109 ТЕ/кг, менее 7,7×109 ТЕ/кг, менее 7,6×109 ТЕ/кг, менее 7,5х109 ТЕ/кг, менее 7,4×109 ТЕ/кг, менее 7,3×109 ТЕ/кг, менее 7,2×109 ТЕ/кг, менее 7,1×109 ТЕ/кг, менее 7,0×109 ТЕ/кг, менее 6,9×109 ТЕ/кг, менее 6,8×109 ТЕ/кг, менее 6,7×109 ТЕ/кг, менее 6,6×109 ТЕ/кг, менее 6,5х109 ТЕ/кг, менее 6,4×109 ТЕ/кг, менее 6,3×109 ТЕ/кг, менее 6,2×109 ТЕ/кг, менее 6,1×109 ТЕ/кг, менее 6,0×109 ТЕ/кг, менее 5,9×109 ТЕ/кг, менее 5,8×109 ТЕ/кг, менее 5,7×109 ТЕ/кг, менее 5,6×109 ТЕ/кг, менее 5,5х109 ТЕ/кг, менее 5,4×109 ТЕ/кг, менее 5,3×109 ТЕ/кг, менее 5,2×109 ТЕ/кг, менее 5,1×109 ТЕ/кг, менее 5,0×109 ТЕ/кг, менее 4,9×109 ТЕ/кг, менее 4,8×109 ТЕ/кг, менее 4,7×109 ТЕ/кг, менее 4,6×109 ТЕ/кг, менее 4,5х109 ТЕ/кг, менее 4,4×109 ТЕ/кг, менее 4,3×109 ТЕ/кг, менее 4,2×109 ТЕ/кг, менее 4,1×109 ТЕ/кг, менее 4,0×109 ТЕ/кг, менее 3,9×109 ТЕ/кг, менее 3,8×109 ТЕ/кг, менее 3,7×109 ТЕ/кг, менее 3,6×109 ТЕ/кг, менее 3,5х109 ТЕ/кг, менее 3,4×109 ТЕ/кг, менее 3,3×109 ТЕ/кг, менее 3,2×109 ТЕ/кг, менее 3,1×109 ТЕ/кг, менее 3,0×109 ТЕ/кг, менее 2,9×109 ТЕ/кг, менее 2,8×109 ТЕ/кг, менее 2,7×109 ТЕ/кг, менее 2,6×109 ТЕ/кг, менее 2,5х109 ТЕ/кг, менее 2,4×109 ТЕ/кг, менее 2,3×109 ТЕ/кг, менее 2,2×109 ТЕ/кг, менее 2,1×109 ТЕ/кг, менее 2,0×109 ТЕ/кг, менее 1,9×109 ТЕ/кг, менее 1,8×109 ТЕ/кг, менее 1,7×109 ТЕ/кг, менее 1,6×109 ТЕ/кг, менее 1,5х109 ТЕ/кг, менее 1,4×109 ТЕ/кг, менее 1,3×109 ТЕ/кг, менее 1,2×109 ТЕ/кг, менее 1,1×109 ТЕ/кг или менее 1,0×109 ТЕ/кг.
В некоторых вариантах осуществления доза составляет менее 9,9×108 ТЕ/кг, менее 9,8×108 ТЕ/кг, менее 9,7×108 ТЕ/кг, менее 9,6×108 ТЕ/кг, менее 9,5х108 ТЕ/кг, менее 9,4×108 ТЕ/кг, менее 9,3×108 ТЕ/кг, менее 9,2×108 ТЕ/кг, менее 9,1×108 ТЕ/кг, менее 9,0×108 ТЕ/кг, менее 8,9×108 ТЕ/кг, менее 8,8×108 ТЕ/кг, менее 8,7×108 ТЕ/кг, менее 8,6×108 ТЕ/кг, менее 8,5х108 ТЕ/кг, менее 8,4×108 ТЕ/кг, менее 8,3×108 ТЕ/кг, менее 8,2×108 ТЕ/кг, менее 8,1×108 ТЕ/кг, менее 8,0×108 ТЕ/кг, менее 7,9×108 ТЕ/кг, менее 7,8×108 ТЕ/кг, менее 7,7×108 ТЕ/кг, менее 7,6×108 ТЕ/кг, менее 7,5х108 ТЕ/кг, менее 7,4×108 ТЕ/кг, менее 7,3×108 ТЕ/кг, менее 7,2×108 ТЕ/кг, менее 7,1×108 ТЕ/кг, менее 7,0×108 ТЕ/кг, менее 6,9×108 ТЕ/кг, менее 6,8×108 ТЕ/кг, менее 6,7×108 ТЕ/кг, менее 6,6×108 ТЕ/кг, менее 6,5х108 ТЕ/кг, менее 6,4×108 ТЕ/кг, менее 6,3×108 ТЕ/кг, менее 6,2×108 ТЕ/кг, менее 6,1×108 ТЕ/кг, менее 6,0×108 ТЕ/кг, менее 5,9×108 ТЕ/кг, менее 5,8×108 ТЕ/кг, менее 5,7×108 ТЕ/кг, менее 5,6×108 ТЕ/кг, менее 5,5х108 ТЕ/кг, менее 5,4×108 ТЕ/кг, менее 5,3×108 ТЕ/кг, менее 5,2×108 ТЕ/кг, менее 5,1×108 ТЕ/кг, менее 5,0×108 ТЕ/кг, менее 4,9×108 ТЕ/кг, менее 4,8×108 ТЕ/кг, менее 4,7×108 ТЕ/кг, менее 4,6×108 ТЕ/кг, менее 4,5х108 ТЕ/кг, менее 4,4×108 ТЕ/кг, менее 4,3×108 ТЕ/кг, менее 4,2×108 ТЕ/кг, менее 4,1×108 ТЕ/кг, менее 4,0×108 ТЕ/кг, менее 3,9×108 ТЕ/кг, менее 3,8×108 ТЕ/кг, менее 3,7×108 ТЕ/кг, менее 3,6×108 ТЕ/кг, менее 3,5х108 ТЕ/кг, менее 3,4×108 ТЕ/кг, менее 3,3×108 ТЕ/кг, менее 3,2×108 ТЕ/кг, менее 3,1×108 ТЕ/кг, менее 3,0×108 ТЕ/кг, менее 2,9×108 ТЕ/кг, менее 2,8×108 ТЕ/кг, менее 2,7×108 ТЕ/кг, менее 2,6×108 ТЕ/кг, менее 2,5х108 ТЕ/кг, менее 2,4×108 ТЕ/кг, менее 2,3×108 ТЕ/кг, менее 2,2×108 ТЕ/кг, менее 2,1×108 ТЕ/кг, менее 2,0×108 ТЕ/кг, менее 1,9×108 ТЕ/кг, менее 1,8×108 ТЕ/кг, менее 1,7×108 ТЕ/кг, менее 1,6×108 ТЕ/кг, менее 1,5х108 ТЕ/кг, менее 1,4×108 ТЕ/кг, менее 1,3×108 ТЕ/кг, менее 1,2×108 ТЕ/кг, менее 1,1×108 ТЕ/кг или менее 1,0×108 ТЕ/кг.
В некоторых вариантах осуществления доза составляет от 1×108 ТЕ/кг до 5х1010 ТЕ/кг, от 1,5х108 ТЕ/кг до 5х1010 ТЕ/кг, от 2×108 ТЕ/кг до 5х1010 ТЕ/кг, от 2,5х108 ТЕ/кг до 5х1010 ТЕ/кг, от 3×108 ТЕ/кг до 5х1010 ТЕ/кг, от 3,5х108 ТЕ/кг до 5х1010 ТЕ/кг, от 4×108 ТЕ/кг до 5х1010 ТЕ/кг, от 4,5х108 ТЕ/кг до 5х1010 ТЕ/кг, от 5х108 ТЕ/кг до 5х1010 ТЕ/кг, от 5,5х108 ТЕ/кг до 5х1010 ТЕ/кг, от 6×108 ТЕ/кг до 5х1010 ТЕ/кг, от 6,5х108 ТЕ/кг до 5х1010 ТЕ/кг, от 7×108 ТЕ/кг до 5х1010 ТЕ/кг, от 7,5х108 ТЕ/кг до 5х1010 ТЕ/кг, от 8×108 ТЕ/кг до 5х1010 ТЕ/кг, от 8,5х108 ТЕ/кг до 5х1010 ТЕ/кг, от 9×108 ТЕ/кг до 5х1010 ТЕ/кг, от 9,5х108 ТЕ/кг до 5х1010 ТЕ/кг, от 1×109 ТЕ/кг до 5х1010 ТЕ/кг, от 1,5х109 ТЕ/кг до 5х1010 ТЕ/кг, от 2×109 ТЕ/кг до 5х1010 ТЕ/кг, от 2,5х109 ТЕ/кг до 5х1010 ТЕ/кг, от 3×109 ТЕ/кг до 5х1010 ТЕ/кг, от 3,5х109 ТЕ/кг до 5х1010 ТЕ/кг, от 4×109 ТЕ/кг до 5х1010 ТЕ/кг, от 4,5х109 ТЕ/кг до 5х1010 ТЕ/кг, от 5х109 ТЕ/кг до 5х1010 ТЕ/кг, от 5,5х109 ТЕ/кг до 5х1010 ТЕ/кг, от 6×109 ТЕ/кг до 5х1010 ТЕ/кг, от 6,5х109 ТЕ/кг до 5х1010 ТЕ/кг, от 7×109 ТЕ/кг до 5х1010 ТЕ/кг, от 7,5х109 ТЕ/кг до 5х1010 ТЕ/кг, от 8×109 ТЕ/кг до 5х1010 ТЕ/кг, от 8,5х109 ТЕ/кг до 5х1010 ТЕ/кг, от 9×109 ТЕ/кг до 5х1010 ТЕ/кг, от 9,5х109 ТЕ/кг до 5х1010 ТЕ/кг, от 1010 ТЕ/кг до 5х1010 ТЕ/кг, от 1,5х1010 ТЕ/кг до 5х1010 ТЕ/кг, от 2×1010 ТЕ/кг до 5х1010 ТЕ/кг, от 2,5х1010 ТЕ/кг до 5х1010 ТЕ/кг, от 3×1010 ТЕ/кг до 5х1010 ТЕ/кг, от 3,5х1010 ТЕ/кг до 5х1010 ТЕ/кг, от 4×1010 ТЕ/кг до 5х1010 ТЕ/кг или от 4,5х1010 ТЕ/кг до 5х1010 ТЕ/кг.
В некоторых вариантах осуществления доза составляет от 1×108 ТЕ/кг до 5х1010 ТЕ/кг, от 1×108 ТЕ/кг и 4,5х1010 ТЕ/кг, от 1×108 ТЕ/кг и 4×1010 ТЕ/кг, от 1×108 ТЕ/кг и 3,5х1010 ТЕ/кг, от 1×108 ТЕ/кг и 3×1010 ТЕ/кг, от 1×108 ТЕ/кг и 2,5х1010 ТЕ/кг, от 1×108 ТЕ/кг и 2×1010 ТЕ/кг, от 1×108 ТЕ/кг и 1,5х1010 ТЕ/кг, от 1×108 ТЕ/кг и 1010 ТЕ/кг, от 1×108 ТЕ/кг и 9×109 ТЕ/кг, от 1×108 ТЕ/кг и 8,5х109 ТЕ/кг, от 1×108 ТЕ/кг и 8×109 ТЕ/кг, от 1×108 ТЕ/кг и 7,5х109 ТЕ/кг, от 1×108 ТЕ/кг и 7×109 ТЕ/кг, от 1×108 ТЕ/кг до 6,5х109 ТЕ/кг, от 1×108 ТЕ/кг до 6×109 ТЕ/кг, от 1×108 ТЕ/кг и 5,5х109 ТЕ/кг, от 1×108 ТЕ/кг до 5х109 ТЕ/кг, от 1×108 ТЕ/кг и 4,5х109 ТЕ/кг, от 1×108 ТЕ/кг и 4×109 ТЕ/кг, от 1×108 ТЕ/кг и 3,5х109 ТЕ/кг, от 1×108 ТЕ/кг и 3×109 ТЕ/кг, от 1×108 ТЕ/кг и 2,5х109 ТЕ/кг, от 1×108 ТЕ/кг и 2×109, от 1×108 ТЕ/кг и 1,5х109 ТЕ/кг, от 1×108 ТЕ/кг и 1×109 ТЕ/кг, от 1×108 ТЕ/кг и 9,5х108 ТЕ/кг, от 1×108 ТЕ/кг и 9×108 ТЕ/кг, от 1×108 ТЕ/кг и 8,5х108 ТЕ/кг, от 1×108 ТЕ/кг и 8×108 ТЕ/кг, от 1×108 ТЕ/кг и 7,5х108 ТЕ/кг, от 1×108 ТЕ/кг и 7×108 ТЕ/кг, от 1×108 ТЕ/кг до 6,5х108 ТЕ/кг, от 1×108 ТЕ/кг до 6×108 ТЕ/кг, от 1×108 ТЕ/кг и 5,5х108 ТЕ/кг, от 1×108 ТЕ/кг до 5х108 ТЕ/кг, от 1×108 ТЕ/кг и 4,5х108 ТЕ/кг, от 1×108 ТЕ/кг и 4×108 ТЕ/кг, от 1×108 ТЕ/кг и 3,5х108 ТЕ/кг, от 1×108 ТЕ/кг и 3×108 ТЕ/кг, от 1×108 ТЕ/кг и 2,5х108 ТЕ/кг, от 1×108 ТЕ/кг и 2×108, или от 1×108 ТЕ/кг и 1,5х108 ТЕ/кг,
В некоторых вариантах осуществления доза составляет от 1×1010 ТЕ/кг до 2×1010 ТЕ/кг, от 1,1×1010 ТЕ/кг до 1,9×1010 ТЕ/кг, от 1,2×1010 ТЕ/кг до 1,8×1010 ТЕ/кг, от 1,3×1010 ТЕ/кг до 1,7×1010 ТЕ/кг или от 1,4×1010 ТЕ/кг до 1,6×1010 ТЕ/кг. В некоторых вариантах осуществления доза составляет приблизительно 1,5х1010 ТЕ/кг. В некоторых вариантах осуществления доза составляет 1,5х1010 ТЕ/кг.
В некоторых вариантах осуществления доза составляет от 1×109 ТЕ/кг до 2×109 ТЕ/кг, от 1,1×109 ТЕ/кг до 1,9×109 ТЕ/кг, от 1,2×109 ТЕ/кг до 1,8×109 ТЕ/кг, от 1,3×109 ТЕ/кг до 1,7×109 ТЕ/кг или от 1,4×109 ТЕ/кг до 1,6×109 ТЕ/кг. В некоторых вариантах осуществления доза составляет 1,5х109 ТЕ/кг. В определенных вариантах осуществления доза составляет приблизительно 3,0×109 ТЕ/кг.
В некоторых вариантах осуществления доза составляет от 2,5х109 ТЕ/кг до 3,5х109 ТЕ/кг, от 2,6 x109 ТЕ/кг до 3,4×109 ТЕ/кг, от 2,7×109 ТЕ/кг до 3,3×109 ТЕ/кг, от 2,8×109 ТЕ/кг до 3,2×109 ТЕ/кг или от 2,9×109 ТЕ/кг до 3,1×109 ТЕ/кг. В некоторых вариантах осуществления доза составляет приблизительно 3,0×109 ТЕ/кг. В некоторых вариантах осуществления доза составляет 3,0×109 ТЕ/кг.
В некоторых вариантах осуществления доза составляет от 5,5х109 ТЕ/кг до 6,5х109 ТЕ/кг, от 5,6 x109 ТЕ/кг до 6,4×109 ТЕ/кг, от 5,7×109 ТЕ/кг до 6,3×109 ТЕ/кг, от 5,8×109 ТЕ/кг до 6,2×109 ТЕ/кг или от 5,9×109 ТЕ/кг до 6,1×109 ТЕ/кг. В некоторых вариантах осуществления доза составляет приблизительно 6,0×109 ТЕ/кг. В некоторых вариантах осуществления доза составляет 6,0×109 ТЕ/кг.
В некоторых вариантах осуществления активность FVIII в плазме крови через 24 часа, 36 часов или 48 часов после введения лентивирусного вектора по настоящему изобретению является повышенной по сравнению с активностью FVIII в плазме крови субъекта, которому вводили контрольный вектор, содержащий молекулу нуклеиновой кислоты, содержащую SEQ ID NO: 16.
В некоторых вариантах осуществления активность FVIII в плазме крови через 48 часов после введения лентивирусного вектора является повышенной по сравнению с активностью FVIII в плазме крови у субъекта, которому вводили контрольный вектор, содержащий молекулу нуклеиновой кислоты, содержащую SEQ ID NO: 16.
В другом варианте осуществления активность FVIII в плазме крови является повышенной через приблизительно 21 день после введения лентивирусного вектора по сравнению с таковой у субъекта, которому вводили контрольную молекулу нуклеиновой кислоты, содержащую SEQ ID NO: 16, контрольный вирусный вектор, содержащий контрольную молекулу нуклеиновой кислоты, или полипептид, кодируемый контрольной молекулой нуклеиновой кислоты.
В некоторых вариантах осуществления активность FVIII в плазме крови является повышенной через приблизительно 6 часов, через приблизительно 12 часов, через приблизительно 18 часов, через приблизительно 24 часа, через приблизительно 36 часов, через приблизительно 48 часов, через приблизительно 3 дня, через приблизительно 4 дня, через приблизительно 5 дней, через приблизительно 6 дней, через приблизительно 7 дней, через приблизительно 8 дней, через приблизительно 9 дней, через приблизительно 10 дней, через приблизительно 11 дней, через приблизительно 12 дней, через приблизительно 13 дней, через приблизительно 14 дней, через приблизительно 15 дней, через приблизительно 16 дней, через приблизительно 17 дней, через приблизительно 18 дней, через приблизительно 19 дней, через приблизительно 20 дней, через приблизительно 21 день, через приблизительно 22 дня, через приблизительно 23 дня, через приблизительно 24 дня, через приблизительно 25 дней, через приблизительно 26 дней, через приблизительно 27 дней или через приблизительно 28 дней после введения лентивирусного вектора по сравнению с таковой у субъекта, которому вводили контрольную молекулу нуклеиновой кислоты, содержащую SEQ ID NO: 16, контрольный вирусный вектор, содержащий контрольную молекулу нуклеиновой кислоты, или полипептид, кодируемый контрольной молекулой нуклеиновой кислоты.
В некоторых вариантах осуществления активность FVIII в плазме крови у субъекта является повышенной в по меньшей мере приблизительно 2 раза, по меньшей мере приблизительно 3 раза, по меньшей мере приблизительно 4 раза, по меньшей мере приблизительно 5 раз, по меньшей мере приблизительно 6 раз, по меньшей мере приблизительно 7 раз, по меньшей мере приблизительно 8 раз, по меньшей мере приблизительно 9 раз, по меньшей мере приблизительно 10 раз, по меньшей мере приблизительно 11 раз, по меньшей мере приблизительно 12 раз, по меньшей мере приблизительно 13 раз, по меньшей мере приблизительно 14 раз, по меньшей мере приблизительно 15 раз, по меньшей мере приблизительно 20 раз, по меньшей мере приблизительно 25 раз, по меньшей мере приблизительно 30 раз, по меньшей мере приблизительно 35 раз, по меньшей мере приблизительно 40 раз, по меньшей мере приблизительно 45 раз, по меньшей мере приблизительно 50 раз, по меньшей мере приблизительно 55 раз, по меньшей мере приблизительно 60 раз, по меньшей мере приблизительно 65 раз, по меньшей мере приблизительно 70 раз, по меньшей мере приблизительно 75 раз, по меньшей мере приблизительно 80 раз, по меньшей мере приблизительно 85 раз, по меньшей мере приблизительно 90 раз, по меньшей мере приблизительно 95 раз, по меньшей мере приблизительно 100 раз, по меньшей мере приблизительно 110 раз, по меньшей мере приблизительно 120 раз, по меньшей мере приблизительно 130 раз, по меньшей мере приблизительно 140 раз, по меньшей мере приблизительно 150 раз, по меньшей мере приблизительно 160 раз, по меньшей мере приблизительно 170 раз, по меньшей мере приблизительно 180 раз, по меньшей мере приблизительно 190 раз или по меньшей мере приблизительно 200 раз по отношению к исходным уровням у субъекта, по сравнению с уровнями у субъекта, которому вводили контрольную молекулу нуклеиновой кислоты, содержащую SEQ ID NO: 16, по сравнению с уровнями у субъекта, которому вводили контрольный вирусный вектор, содержащий контрольную молекулу нуклеиновой кислоты, или по сравнению с уровнями у субъекта после введения полипептида, кодируемого контрольной молекулой нуклеиновой кислоты.
В некоторых вариантах осуществления лентивирусный вектор вводят в виде одной дозы или нескольких доз. В некоторых вариантах осуществления дозу лентивирусного вектора вводят за один раз или разделяют на несколько частей дозы, например две части дозы, три части дозы, четыре части дозы, пять частей дозы, шесть частей дозы или более шести частей дозы. В некоторых вариантах осуществления вводят более чем один лентивирусный вектор.
В некоторых вариантах осуществления дозу лентивирусного вектора вводят повторно по меньшей мере дважды, по меньшей мере три раза, по меньшей мере четыре раза, по меньшей мере пять раз, по меньшей мере шесть раз, по меньшей мере семь раз, по меньшей мере восемь раз, по меньшей мере девять раз или по меньшей мере десять раз. В некоторых вариантах осуществления лентивирусный вектор вводят путем внутривенной инъекции.
В некоторых вариантах осуществления субъект является субъектом-ребенком, тогда как в других аспектах субъект является субъектом-взрослым.
В некоторых вариантах осуществления лентивирусный вектор содержит по меньшей мере один тканеспецифический промотор, т. e. промотор, который будет регулировать экспрессию полипептида с активностью FVIII в конкретном типе тканей или клеток. В некоторых вариантах осуществления тканеспецифический промотор в лентивирусном векторе селективно усиливает экспрессию полипептида с активностью FVIII в клетке-мишени печени. В некоторых вариантах осуществления тканеспецифический промотор, который селективно усиливает экспрессию полипептида с активностью FVIII в клетке-мишени печени, включает промотор mTTR. В некоторых вариантах осуществления клетка-мишень печени представляет собой гепатоцит.
Поскольку с помощью лентивирусного вектора можно осуществлять трансдукцию всех типов клеток печени, экспрессию трансгена (например, FVIII) в различных типах клеток можно контролировать с применением разных промоторов в лентивирусном векторе. Таким образом, лентивирусный вектор может содержать специфические промоторы, которые будут контролировать экспрессию трансгена FVIII в различных типах тканей или клеток, таких как различные типы тканей или клеток печени. Таким образом, в некоторых вариантах осуществления лентивирусный вектор может содержать промотор, специфический в отношении эндотелия, который будет контролировать экспрессию трансгена FVIII в эндотелиальной ткани печени, или промотор, специфический в отношении гепатоцита, который будет контролировать экспрессию трансгена FVIII в гепатоцитах, или и тот, и другой.
В некоторых вариантах осуществления лентивирусный вектор содержит тканеспецифический промотор или тканеспецифические промоторы, которые контролируют экспрессию трансгена FVIII в тканях, отличных от тканей печени. В некоторых вариантах осуществления выделенную молекулу нуклеиновой кислоты стабильно интегрируют в геном клетки-мишени или ткани-мишени, например в геном гепатоцита или в геном эндотелиальной клетки печени.
В некоторых вариантах осуществления нуклеотидная последовательность, кодирующая полипептид с активностью FVIII, в лентивирусном векторе по настоящему изобретению содержит, состоит или по сути состоит из LV-coFVIII-6 (SEQ ID NO:71).
В других вариантах осуществления нуклеотидная последовательность, кодирующая полипептид с активностью FVIII, в лентивирусном векторе по настоящему изобретению содержит, состоит или по сути состоит из LV-coFVIII-6-XTEN (SEQ ID NO:72).
В некоторых вариантах осуществления нуклеотидная последовательность, кодирующая полипептид с активностью FVIII, в лентивирусном векторе по настоящему изобретению дополнительно содержит последовательность нуклеиновой кислоты, кодирующую сигнальный пептид, где последовательность нуклеиновой кислоты, кодирующая сигнальный пептид, характеризуется по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% идентичностью последовательности с (i) нуклеотидами 1-57 из SEQ ID NO: 1; (ii) нуклеотидами 1-57 из SEQ ID NO: 2; (iii) нуклеотидами 1-57 из SEQ ID NO: 3; (iv) нуклеотидами 1-57 из SEQ ID NO: 4; (v) нуклеотидами 1-57 из SEQ ID NO: 5; (vi) нуклеотидами 1-57 из SEQ ID NO: 6; (vii) нуклеотидами 1-57 из SEQ ID NO: 70; (viii) нуклеотидами 1-57 из SEQ ID NO: 71 или (ix) нуклеотидами 1-57 из SEQ ID NO: 68.
В некоторых вариантах осуществления выделенная молекула нуклеиновой кислоты в лентивирусном векторе по настоящему изобретению обладает одним или несколькими свойствами, выбранными из группы, состоящей из следующего: (a) индекс адаптации кодонов для человека для молекулы нуклеиновой кислоты или ее части является повышенным по сравнению с таковым для SEQ ID NO: 16; (b) частота оптимальных кодонов для нуклеотидной последовательности или ее части является повышенной по сравнению с таковой для SEQ ID NO:16; (c) нуклеотидная последовательность или ее часть содержат более высокую процентную долю нуклеотидов G/C по сравнению с процентной долей нуклеотидов G/C в SEQ ID NO: 16; (d) относительная частота использования синонимичных кодонов для нуклеотидной последовательности или ее части является повышенной по сравнению с таковой для SEQ ID NO: 16; (e) эффективное число кодонов для нуклеотидной последовательности или ее части является пониженным по сравнению с таковым для SEQ ID NO: 16; (f) нуклеотидная последовательность содержит меньше последовательностей MARS/ARS (SEQ ID NO: 21 и 22) по сравнению с SEQ ID NO: 16; (g) нуклеотидная последовательность содержит меньше дестабилизирующих элементов (SEQ ID NO: 23 и 24) по сравнению с SEQ ID NO: 16; и (h) любой их комбинацией.
В некоторых вариантах осуществления выделенная молекула нуклеиновой кислоты в лентивирусном векторе по настоящему изобретению дополнительно содержит гетерологичную нуклеотидную последовательность, кодирующую гетерологичную аминокислотную последовательность (например, средство, увеличивающее период полужизни). В некоторых вариантах осуществления гетерологичная аминокислотная последовательность представляет собой последовательность константной области иммуноглобулина или ее части, XTEN, трансферрина, альбумина или PAS. В некоторых вариантах осуществления гетерологичную аминокислотную последовательность связывают с N-концом или C-концом аминокислотной последовательности, кодируемой нуклеотидной последовательностью, или вставляют между двумя аминокислотами в аминокислотной последовательности, кодируемой нуклеотидной последовательностью, по одному или нескольким сайтам вставки, выбранным из таблицы 3.
В некоторых вариантах осуществления полипептид FVIII является полноразмерным FVIII или FVIII с удаленным В-доменом.
Лентивирусные векторы, раскрытые в данном документе, можно применять при низких дозировках (например, 1010 ТЕ/кг или меньше, 109 ТЕ/кг или меньше или 108 ТЕ/кг или меньше) in vivo у млекопитающего, например, у пациента-человека, с применением подхода на основе генной терапии для лечения заболевания, затрагивающего свертываемость крови, или нарушения свертываемости крови, выбранного из группы, состоящей из коагуляционного нарушения свертываемости крови, гемартроза, мышечного кровотечения, кровотечения из полости рта, кровоизлияния, кровоизлияния в мышцы, кровоизлияния в полости рта, травмы, черепно-мозговой травмы, желудочно-кишечного кровотечения, внутричерепного кровоизлияния, внутрибрюшного кровоизлияния, внутригрудного кровоизлияния, перелома кости, кровотечения в центральной нервной системе, кровотечения в заглоточном пространстве, кровотечения в забрюшинном пространстве и кровотечения во влагалище подвздошно-поясничной мышцы, что было бы терапевтически благоприятным. В одном варианте осуществления заболевание, затрагивающее свертываемость крови, или нарушение свертываемости крови представляет собой гемофилию. В другом варианте осуществления заболевание, затрагивающее свертываемость крови, или нарушение свертываемости крови представляет собой гемофилию A.
В некоторых вариантах осуществления клетки-мишени (например, гепатоциты) обрабатывают in vitro низкими дозами (например, 1010 ТЕ/кг или меньше, 109 ТЕ/кг или меньше или 108 ТЕ/кг или меньше) лентивирусных векторов, раскрытых в данном документе, перед введением пациенту. В определенных вариантах осуществления клетки-мишени (например, гепатоциты) обрабатывают in vitro с помощью приблизительно 3,0×109 ТЕ/кг лентивирусных векторов, раскрытых в данном документе, перед введением пациенту. В еще других вариантах осуществления клетки от пациента (например, гепатоциты) обрабатывают ex vivo низкими дозами (например, 1010 ТЕ/кг или меньше, 109 ТЕ/кг или меньше или 108 ТЕ/кг или меньше) лентивирусных векторов, раскрытых в данном документе, перед введением пациенту.
В некоторых вариантах осуществления активность FVIII в плазме крови после введения лентивирусных векторов, раскрытых в данном документе (вводимых, например, при 1010 ТЕ/кг или меньше, 109 ТЕ/кг или меньше или 108 ТЕ/кг или меньше), является повышенной на по меньшей мере приблизительно 100%, по меньшей мере приблизительно 110%, по меньшей мере приблизительно 120%, по меньшей мере приблизительно 130%, по меньшей мере приблизительно 140%, по меньшей мере приблизительно 150%, по меньшей мере приблизительно 160%, по меньшей мере приблизительно 170%, по меньшей мере приблизительно 180%, по меньшей мере приблизительно 190%, по меньшей мере приблизительно 200%, по меньшей мере приблизительно 210%, по меньшей мере приблизительно 220%, по меньшей мере приблизительно 230%, по меньшей мере приблизительно 240%, по меньшей мере приблизительно 250%, по меньшей мере приблизительно 260%, по меньшей мере приблизительно 270%, по меньшей мере приблизительно 280%, по меньшей мере приблизительно 290% или по меньшей мере приблизительно 300% по сравнению с физиологически нормальными уровнями циркулирующего FVIII.
В одном варианте осуществления активность FVIII в плазме крови после введения лентивирусного вектора по настоящему изобретению является повышенной на по меньшей мере от приблизительно 3000% до приблизительно 5000% по сравнению с физиологически нормальными уровнями циркулирующего FVIII. В некоторых вариантах осуществления через 21 день после введения лентивирусного вектора, содержащего кодон-оптимизированные гены, кодирующие полипептиды с активностью фактора VIII (FVIII), описанного в данном документе, активность FVIII в плазме крови является повышенной в по меньшей мере приблизительно 10 раз, по меньшей мере приблизительно 20 раз, по меньшей мере приблизительно 30 раз, по меньшей мере приблизительно 40 раз, по меньшей мере приблизительно 50 раз, по меньшей мере приблизительно 60 раз, по меньшей мере приблизительно 70 раз, по меньшей мере приблизительно 80 раз, по меньшей мере приблизительно 90 раз, по меньшей мере приблизительно 100 раз, по меньшей мере приблизительно 110 раз, по меньшей мере приблизительно 120 раз, по меньшей мере приблизительно 130 раз, по меньшей мере приблизительно 140 раз, по меньшей мере приблизительно 150 раз, по меньшей мере приблизительно 160 раз, по меньшей мере приблизительно 170 раз, по меньшей мере приблизительно 180 раз, по меньшей мере приблизительно 190 раз или по меньшей мере приблизительно 200 раз по сравнению с таковой у субъекта, которому вводили соответствующий лентивирусный вектор, содержащий контрольную молекулу нуклеиновой кислоты, содержащую SEQ ID NO: 16.
Настоящее изобретение также предусматривает способы лечения, предупреждения или облегчения гемостатического нарушения (например, нарушения свертываемости крови, такого как гемофилия A) у субъекта, нуждающегося в этом, включающие введение субъекту терапевтически эффективного количества лентивирусного вектора, содержащего выделенную молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, кодирующую полипептид с активностью FVIII, где лентивирусный вектор вводят в виде по меньшей мере одной дозы, составляющей 5х1010 ТЕ/кг или меньше, 109 ТЕ/кг или меньше или 108 ТЕ/кг или меньше.
Лечение, облегчение и предупреждение с помощью лентивирусного вектора по настоящему изобретению может представлять собой терапию шунтирующего действия. У субъекта, получающего терапию шунтирующего действия, может уже быть выработан ингибитор фактора свертывания крови, например FVIII, или подлежит выработке ингибитор фактора свертывания крови.
С помощью лентивирусных векторов по настоящему изобретению осуществляют лечение или предупреждение гемостатического нарушения посредством обеспечения образования фибринового сгустка. Полипептид, характеризующийся активностью FVIII, кодируемый молекулой нуклеиновой кислоты по настоящему изобретению, может активировать элемент каскада коагуляции крови. Фактор свертывания крови может участвовать во внешнем пути, внутреннем пути или в них обоих.
Лентивирусные векторы по настоящему изобретению можно применять для лечения гемостатических нарушений, которые, как известно, поддаются лечению с помощью FVIII. Гемостатические нарушения, которые можно лечить посредством способов по настоящему изобретению, включают без ограничения гемофилию A, гемофилию B, болезнь фон Виллебранда, дефицит фактора XI (дефицит PTA), дефицит фактора XII, а также дефициты или аномалии структуры фибриногена, протромбина, фактора V, фактора VII, фактора X или фактора XIII, гемартроз, мышечное кровотечение, кровотечение в полости рта, кровоизлияние, кровоизлияние в мышцы, кровоизлияние в полости рта, травму, черепно-мозговую травму, желудочно-кишечное кровотечение, внутричерепное кровоизлияние, внутрибрюшное кровоизлияние, внутригрудное кровоизлияние, перелом кости, кровотечение в центральной нервной системе, кровотечение в заглоточном пространстве, кровотечение в забрюшинном пространстве и кровотечение во влагалище подвздошно-поясничной мышцы.
Композиции для введения субъекту содержат лентивирусные векторы, содержащие молекулы нуклеиновой кислоты, которые содержат оптимизированную нуклеотидную последовательность по настоящему изобретению, кодирующую фактор свертывания крови FVIII (для вариантов применения в генной терапии), а также молекулы полипептида FVIII. В некоторых вариантах осуществления композиция для введения представляет собой клетку, которую приводили в контакт с лентивирусным вектором по настоящему изобретению либо in vivo, in vitro, либо ex vivo.
В некоторых вариантах осуществления гемостатическое нарушение представляет собой наследственное нарушение. В одном варианте осуществления субъект имеет гемофилию А. В других вариантах осуществления гемостатическое нарушение является результатом дефицита FVIII. В других вариантах осуществления гемостатическое нарушение может быть результатом дефекта фактора свертывания крови FVIII.
В другом варианте осуществления гемостатическое нарушение может представлять собой приобретенное нарушение. Приобретенное нарушение может быть обусловлено первопричинным вторичным заболеванием или состоянием. Несвязанное состояние может представлять собой, в качестве примера, без ограничения, рак, аутоиммунное заболевание или беременность. Приобретенное нарушение может быть обусловлено пожилым возрастом или приемом лекарственных препаратов для лечения первопричинного вторичного нарушения (например, химиотерапии рака).
Настоящее изобретение также относится к способам лечения субъекта, у которого не имеется гемостатического нарушения или вторичного заболевания или состояния, приводящего к приобретению гемостатического нарушения. Таким образом, настоящее изобретение относится к способу лечения субъекта, нуждающегося в гемостатическом средстве общего действия, включающему введение терапевтически эффективного количества лентивирусного вектора по настоящему изобретению. Например, в одном варианте осуществления субъект, нуждающийся в гемостатическом средстве общего действия, подвергается или вскоре подвергнется хирургическому вмешательству. Лентивирусный вектор по настоящему изобретению можно вводить до или после хирургического вмешательства в качестве профилактического средства.
Лентивирусный вектор по настоящему изобретению можно вводить во время или после хирургического вмешательства для контроля эпизода острого кровотечения. Хирургическое вмешательство может включать без ограничения трансплантацию печени, резекцию печени или трансплантацию стволовых клеток.
В другом варианте осуществления лентивирусный вектор по настоящему изобретению можно применять для лечения субъекта с эпизодом острого кровотечения, у которого не имеется гемостатического нарушения. Эпизод острого кровотечения может быть результатом тяжелой травмы, например хирургического вмешательства, автомобильной аварии, ранения, рваного огнестрельного ранения или другого травматического события, приводящего к неконтролируемому кровотечению.
Лентивирусный вектор можно применять для профилактического лечения субъекта с гемостатическим нарушением. Лентивирусный вектор можно применять для лечения эпизода острого кровотечения у субъекта с гемостатическим нарушением.
В другом варианте осуществления введение лентивирусного вектора, раскрытого в данном документе, и/или последующая экспрессия трансгена белка FVIII не вызывает иммунного ответа у субъекта. В некоторых вариантах осуществления иммунный ответ включает выработку антител против FVIII. В некоторых вариантах осуществления иммунный ответ включает секрецию цитокинов. В некоторых вариантах осуществления иммунный ответ включает активацию B-клеток, T-клеток или как B-клеток, так и T-клеток. В некоторых вариантах осуществления иммунный ответ представляет собой ингибирующий иммунный ответ, где иммунный ответ у субъекта способствует снижению активности белка FVIII относительно активности FVIII у субъекта, у которого не развился иммунный ответ. В определенных вариантах осуществления экспрессия белка FVIII посредством введения лентивирусного вектора по настоящему изобретению предупреждает ингибирующий иммунный ответ на белок FVIII или белок FVIII, экспрессируемый из выделенной молекулы нуклеиновой кислоты или лентивирусного вектора.
В некоторых вариантах осуществления лентивирусный вектор по настоящему изобретению вводят в комбинации с по меньшей мере одним другим средством, которое способствует гемостазу. Указанное другое средство, которое способствует гемостазу, представляет собой терапевтический препарат с продемонстрированной свертывающей активностью. В качестве примера без ограничения гемостатическое средство может включать фактор V, фактор VII, фактор IX, фактор X, фактор XI, фактор XII, фактор XIII, протромбин или фибриноген или активированные формы любого из указанных выше. Фактор свертывания крови или гемостатическое средство также могут включать антифибринолитические лекарственные средства, например, эпсилон-аминокапроновую кислоту, транексамовую кислоту.
В одном варианте осуществления настоящего изобретения композиция (например, лентивирусный вектор) представляет собой композицию, в которой FVIII присутствует в форме, активируемой при введении субъекту. Такая активируемая молекула может активироваться in vivo в месте свертывания после введения субъекту.
Лентивирусный вектор по настоящему изобретению можно вводить внутривенно, подкожно, внутримышечно или через любую поверхность слизистой оболочки, например перорально, сублингвально, трансбуккально, сублингвально, назально, ректально, вагинально или легочным путем. Лентивирусный вектор может быть имплантирован в твердую биополимерную подложку или связан с ней, что обеспечивает медленное высвобождение вектора в необходимом месте.
В одном варианте осуществления путь введения лентивирусных векторов является парентеральным. Используемый в данном документе термин "парентеральный" включает внутривенное, внутриартериальное, внутрибрюшинное, внутримышечное, подкожное, ректальное или вагинальное введение. Внутривенная форма парентерального введения является предпочтительной. Хотя все эти формы введения явно рассматриваются как находящиеся в пределах объема настоящего изобретения, формой для введения будет раствор для инъекций, в частности, для внутривенной или внутриартериальной инъекции или капельного вливания. Обычно подходящая фармацевтическая композиция для инъекций может содержать буфер (например, ацетатный, фосфатный или цитратный буфер), поверхностно-активное вещество (например, полисорбат), необязательно стабилизирующее средство (например, альбумин человека) и т. д. Однако, в других способах, совместимых с изложенными в данном документе идеями, лентивирусный вектор можно доставлять непосредственно в место локализации нежелательной клеточной популяции, за счет чего увеличивается воздействие терапевтического средства на пораженную ткань.
Препараты для парентерального введения включают стерильные водные или неводные растворы, суспензии и эмульсии. Примерами неводных растворителей являются пропиленгликоль, полиэтиленгликоль, растительные масла, такие как оливковое масло, и инъекционные органические сложные эфиры, такие как этилолеат. Водные носители включают воду, спиртовые/водные растворы, эмульсии или суспензии, в том числе солевой раствор и буферные среды. В рассматриваемом изобретении фармацевтически приемлемые носители включают без ограничения 0,01-0,1 M и предпочтительно 0,05 M фосфатный буфер или 0,8% солевой раствор. Другие распространенные среды-носители для парентерального введения включают растворы фосфата натрия, раствор Рингера с декстрозой, раствор декстрозы и хлорида натрия, лактатный раствор Рингера или нелетучие масла. Среды-носители для внутривенного введения включают растворы с добавками жидкости и питательных веществ, растворы с добавками электролитов, как, например, на основе раствора Рингера с декстрозой, и т. п. Могут также присутствовать консерванты и другие добавки, такие как, например, противомикробные средства, антиоксиданты, хелатообразующие средства и инертные газы и т. п.
Более конкретно, фармацевтические композиции, подходящие для инъекционного применения, включают стерильные водные растворы (в случае растворимости в воде) или дисперсии и стерильные порошки для экстемпорального приготовления стерильных инъекционных растворов или дисперсий. В таких случаях композиция должна быть стерильной и должна быть текучей до такой степени, чтобы ее легко было вводить с помощью шприца. Она должна быть стабильной в условиях производства и хранения и предпочтительно будет защищена от загрязняющего действия микроорганизмов, таких как бактерии и грибы. Носитель может представлять собой растворитель или дисперсионную среду, содержащие, например, воду, этанол, многоатомный спирт (например, глицерин, пропиленгликоль и жидкий полиэтиленгликоль и т. п.) и их подходящие смеси. Надлежащую текучесть можно поддерживать, например, путем применения покрытия, такого как лецитин, путем поддержания необходимого размера частиц в случае с дисперсией и путем применения поверхностно-активных веществ.
Предупреждения действия микроорганизмов можно достигать с помощью различных антибактериальных и противогрибковых средств, например парабенов, хлорбутанола, фенола, аскорбиновой кислоты, тимеросала и т. п. Во многих случаях предпочтительным будет включение в композицию изотонических средств, например сахаров, многоатомных спиртов, таких как маннит, сорбит, или хлорида натрия. Пролонгированное всасывание инъекционных композиций можно обеспечивать путем включения в композицию средства, которое замедляет всасывание, например моностеарата алюминия и желатина.
В любом случае стерильные инъекционные растворы можно получить путем включения активного соединения (например, полипептида самого по себе или в комбинации с другими активными средствами) в необходимом количестве в соответствующий растворитель с одним ингредиентом или комбинацией ингредиентов, перечисленных в данном документе, если необходимо, с последующей стерилизующей фильтрацией. Как правило, дисперсии получают путем включения активного соединения в стерильную среду-носитель, которая содержит основную дисперсионную среду и необходимые другие ингредиенты из перечисленных выше. В случае со стерильными порошками для получения стерильных инъекционных растворов предпочтительные способы получения представляют собой вакуумную сушку и сублимационную сушку, которые приводят к получению порошка активного ингредиента и любого дополнительного требуемого ингредиента из их раствора, предварительно подвергнутого стерилизующей фильтрации. Препараты для инъекций обрабатывают, наполняют ими контейнеры, такие как ампулы, пакеты, бутылки, шприцы или флаконы, и закупоривают в асептических условиях согласно способам, известным из уровня техники. Кроме того, препараты могут упаковываться и продаваться в форме набора. Такие готовые изделия предпочтительно будут иметь этикетки или листки-вкладыши для помещения в упаковку, в которых будет указано, что соответствующие композиции применимы для лечения субъекта, страдающего нарушениями свертываемости крови или предрасположенного к таковым.
Фармацевтическая композиция также может быть составлена для ректального введения в виде суппозитория или удерживающей клизмы, например, содержащей традиционные суппозиторные основы, такие как масло какао или другие глицериды.
Эффективные дозы композиций по настоящему изобретению для лечения состояний варьируются в зависимости от множества различных факторов, включающих способ введения, участок-мишень, физиологическое состояние пациента, того, является ли пациент человеком или животным, других вводимых лекарственных препаратов и того, является ли лечение профилактическим или терапевтическим. Обычно пациент является человеком, однако также можно лечить млекопитающих, отличных от человека, в том числе трансгенных млекопитающих. Для оптимизации безопасности и эффективности дозировки для лечения можно подбирать с помощью обычных способов, известных специалистам в данной области.
Лентивирусный вектор можно вводить в виде одной дозы или в виде нескольких доз, при этом несколько доз можно вводить непрерывно или через определенные промежутки времени. Для определения оптимальных диапазонов доз и/или схем для введения могут быть выполнены анализы in vitro. Анализы in vitro, с помощью которых измеряют активность фактора свертывания крови, известны из уровня техники. Кроме того, эффективные дозы можно определить путем экстраполирования кривых доза-ответ, полученных на животных моделях, например собаке с гемофилией (Mount et al. 2002, Blood 99 (8): 2670).
Предполагается, что промежуточные дозы в вышеуказанных диапазонах также входят в объем настоящего изобретения. Субъектам можно вводить такие дозы ежесуточно, через сутки, еженедельно или по любой другой схеме, определенной эмпирическим анализом. Иллюстративное лечение включает введение в виде нескольких доз в течение длительного периода, например по меньшей мере шести месяцев.
Лентивирусный вектор по настоящему изобретению можно вводить многократно. Интервалы между введениями отдельных доз могут соответствовать ежесуточному, еженедельному, ежемесячному или ежегодному введению. Интервалы также могут быть нерегулярными, устанавливаемыми исходя из результатов измерения уровней модифицированного полипептида или антигена в крови пациента. Дозировка и частота лентивирусных векторов по настоящему изобретению варьируют в зависимости от периода полужизни кодируемого трансгеном полипептида FVIII у пациента.
Дозировка и частота введения лентивирусных векторов по настоящему изобретению могут варьировать в зависимости от того, является ли лечение профилактическим или терапевтическим. При вариантах профилактического применения композиции, содержащие лентивирусный вектор по настоящему изобретению, вводят пациенту, еще не находящемуся в болезненном состоянии, для повышения устойчивости пациента или минимизации эффектов заболевания. Такое количество определяют как "профилактическую эффективную дозу". Относительно низкие дозировки вводят через относительно большие промежутки в течение длительного периода времени. Некоторые пациенты продолжают получать лечение всю свою оставшуюся жизнь.
Лентивирусный вектор по настоящему изобретению необязательно можно вводить в комбинации с другими средствами, которые являются эффективными при лечении нарушения или состояния, требующего лечения (например, профилактического или терапевтического).
Как используется в данном документе, введение лентивирусных векторов по настоящему изобретению в сочетании или в комбинации со вспомогательной терапией означает последовательное, одновременное, одинаковое по протяженности, сопутствующее, параллельное или совпадающее во времени введение или применение терапии и раскрытых полипептидов. Специалистам в данной области будет понятно, что введение или применение различных компонентов схемы комбинированной терапии может быть спланировано по времени для повышения общей эффективности лечения. Специалист в данной области (например, врач) сможет легко определить эффективные схемы комбинированной терапии без проведения излишних экспериментов на основании выбранной вспомогательной терапии и идей настоящего описания.
Кроме того, следует понимать, что лентивирусные векторы по настоящему изобретению можно применять в сочетании или в комбинации со средством или средствами (например, для обеспечения схемы комбинированной терапии). Иллюстративные средства, которые можно объединять с лентивирусным вектором по настоящему изобретению, включают средства, которые представляют современный стандарт оказания медицинской помощи при конкретном нарушении, подлежащем лечению. Такие средства могут быть химическими или биологическими по природе. Термин "биологический препарат" или "биологическое средство" относится к любому фармацевтически активному средству, полученному из живых организмов и/или их продуктов, которое предназначено для применения в качестве терапевтического препарата.
Количество средства, предназначенного для применения в комбинации с лентивирусными векторами по настоящему изобретению, можно варьировать в зависимости от субъекта или можно вводиться в соответствии с тем, что известно из уровня техники. См., например, Bruce A Chabner et al., Antineoplastic Agents, в Goodman & Gilman's The Pharmacological Basis of Therapeutics 1233-1287 ((под ред. Joel G. Hardman et al., 9-е изд., 1996). В другом варианте осуществления вводят количество такого средства, соответствующее стандарту оказания медицинской помощи.
В определенных вариантах осуществления лентивирусные векторы по настоящему изобретению вводят в сочетании с иммуносупрессивным, противоаллергическим или противовоспалительным средством. Такие средства, как правило, относятся к веществам, которые действуют с подавлением или маскировкой иммунной системы субъекта, подлежащего лечению согласно настоящему документу. Такие средства включают вещества, которые подавляют продуцирование цитокинов, угнетают или подавляют экспрессию аутоантигенов или маскируют антигены MHC. Примеры таких средств включают 2-амино-6-арил-5-замещенные пиримидины; азатиоприн; циклофосфамид; бромокриптин; даназол; дапсон; глутаральдегид; антиидиотипические антитела против антигенов MHC и фрагментов MHC; циклоспорин А; стероиды, такие как глюкокортикостероиды, например преднизон, метилпреднизолон и дексаметазон; антагонисты цитокинов или цитокиновых рецепторов, включая антитела против интерферона γ, β или α, антитела против фактора некроза опухоли α, антитела против фактора некроза опухоли β, антитела против интерлейкина 2 и антитела против рецептора IL-2; антитела против LFA-1, включая антитела против CD11a и против CD18; антитела против L3T4; гетерологичный антилимфоцитарный глобулин; антитела против всех типов Т-клеток; растворимый пептид, содержащий домен связывания LFA-3; стрептокиназу; TGF-β; стрептодорназу; FK506; RS-61443; дезоксиспергуалин и рапамицин. В определенных вариантах осуществления средство представляет собой антигистаминное средство. "Антигистаминное средство", как используется в данном документе, представляет собой средство, которое оказывает антагонизирующее действие в отношении физиологического эффекта гистамина. Примерами антигистаминных средств являются хлорфенирамин, дифенгидрамин, прометазин, кромолин натрия, астемизол, малеат азатадина, малеат брофенирамина, малеат карбиноксамина, гидрохлорид цетиризина, фумарат клемастина, гидрохлорид ципрогептадина, малеат дексбромфенирамина, малеат дексхлорфенирамина, дименгидринат, гидрохлорид дифенгидрамина, сукцинат доксиламина, гидрохлорид фексофендадина, гидрохлорид терфенадина, гидрохлорид гидроксизина, лоратидин, гидрохлорид меклизина, цитрат трипеланнамина, гидрохлорид трипеленнамина и гидрохлорид трипролидина.
Иммуносупрессивные, противоаллергические или противовоспалительные средства могут быть включены в режим введения лентивирусного вектора. Например, введение иммуносупрессивных или противовоспалительных средств может начинаться до введения раскрытых лентивирусных векторов и может продолжаться одной или несколькими дозами после этого. В определенных вариантах осуществления иммуносупрессивные или противовоспалительные средства вводят в качестве премедикации перед лентивирусными векторами.
Как обсуждалось ранее, лентивирусные векторы по настоящему изобретению можно вводить в фармацевтически эффективном количестве для лечения нарушений свертываемости крови in vivo. В этом отношении следует понимать, что лентивирусные векторы по настоящему изобретению могут быть составлены для облегчения введения и обеспечения стабильности активного средства. Предпочтительно фармацевтические композиции в соответствии с настоящим изобретением содержат фармацевтически приемлемый, нетоксичный, стерильный носитель, такой как физиологический раствор, нетоксичные буферы, консерванты и т. п. Конечно, фармацевтические композиции по настоящему изобретению можно вводить в виде одной или нескольких доз для обеспечения фармацевтически эффективного количества полипептида.
Доступен ряд тестов для оценки функции системы коагуляции: определение активированного частичного тромбопластинового времени (aPTT), хромогенный анализ, анализ ROTEM®, определение протромбинового времени (PT) (также используется для определения INR), определение концентрации фибриногена (чаще всего с помощью метода Клаусса), подсчет количества тромбоцитов, определение тромбоцитарной функции (чаще всего с помощью PFA-100), TCT, определение времени свертывания крови, тест смешивания (устраняется ли аномалия при смешивании плазмы крови пациента с нормальной плазмой крови), анализы факторов коагуляции, определение антител против фосфолипидов, D-димера, генетические тесты (например, определение фактора V Лейдена, мутации протромбина G20210A), определение времени свертывания с разбавленным ядом гадюки Рассела (dRVVT), различные тесты тромбоцитарной функции, тромбоэластография (TEG или Sonoclot), тромбоэластометрия (TEM®, например ROTEM®) или определение времени лизиса эуглобулина (ELT).
Тест aPTT является показателем функционирования, измеряющим эффективность как "внутреннего" (также называемого контактным путем активации), так и общего путей коагуляции. Этот тест обычно используют для измерения свертывающей активности коммерчески доступных рекомбинантных факторов свертывания крови, например FVIII или FIX. Он используется в сочетании с протромбиновым временем (PT), с помощью которого измеряют внешний путь.
Анализ ROTEM® предоставляет информацию о всей кинетике гемостаза: времени свертывания крови, образовании сгустка, стабильности и лизисе сгустка. Различные параметры тромбоэластометрии зависят от активности коагуляционной системы плазмы крови, функции тромбоцитов, фибринолиза или многих факторов, которые влияют на эти взаимодействия. Этот анализ может дать полное представление о вторичном гемостазе.
III. Лентивирусные векторы
Лентивирусы включают представителей группы лентивирусов крупного рогатого скота, группы лентивирусов лошадей, группы лентивирусов кошек, группы лентивирусов овец и коз, а также группы лентивирусов приматов. Обзор разработки лентивирусных векторов для генной терапии представлен в Klimatcheva et al. (1999) Frontiers in Bioscience 4:481-496. Конструирование и применение лентивирусных векторов, подходящих для генной терапии, описано, например, в патентах США №№ 6207455 и 6615782. Примеры лентивируса включают без ограничения HIV-1, HIV-2, псевдотип HIV-1/HIV-2, HIV-1/SIV, FIV, вирус артрита-энцефалита коз и овец (CAEV), вирус инфекционной анемии лошадей и вирус иммунодефицита крупного рогатого скота.
Схематическое представление лентивирусного вектора по настоящему изобретению показано на фиг. 19. В некоторых вариантах осуществления лентивирусный вектор по настоящему изобретению является лентивирусным вектором "третьего поколения". Как используется в данном документе, термин лентивирусный вектор "третьего поколения" относится к лентивирусной системе упаковки, которая имеет характеристики векторной системы второго поколения, и в которой, кроме того, отсутствует функциональный ген tat, например, системе, в которой ген tat был удален или инактивирован. Как правило, ген, кодирующий rev, обеспечивают в отдельной конструкции для экспрессии. См., например, Dull et al. (1998) J. Virol. 72: 8463-8471. Как используется в данном документе, система лентивирусного вектора "второго поколения" относится к лентивирусный системе упаковки, в которой отсутствуют функциональные вспомогательные гены, такой как система, в которой были удалены или инактивированы вспомогательные гены vif, vpr, vpu и nef. См., например, Zufferey et al. (1997) Nat. Biotechnol. 15:871-875. Как используется в данном документе, "система упаковки" относится к набору вирусных конструкций, содержащих гены, которые кодируют вирусные белки, участвующие в упаковке рекомбинантного вируса. Как правило, конструкции системы упаковки в конечном итоге встраиваются в упаковывающую клетку.
В некоторых вариантах осуществления лентивирусный вектор третьего поколения по настоящему изобретению представляет собой самоинактивирующийся лентивирусный вектор. В некоторых вариантах осуществления лентивирусный вектор представляет собой лентивирусный вектор псевдотипа VSV.G. В некоторых вариантах осуществления лентивирусный вектор содержит промотор, специфический в отношении гепатоцита, для экспрессии трансгена. В некоторых вариантах осуществления промотор, специфический в отношении гепатоцита, представляет собой усиленный промотор транстиретина. В некоторых вариантах осуществления лентивирусный вектор содержит одну или несколько последовательностей-мишеней для miR-142 для обеспечения снижения иммунного ответа на продукт трансгена. В некоторых вариантах осуществления включение одной или нескольких последовательностей-мишеней для miR-142 в лентивирусный вектор по настоящему изобретению обеспечивает необходимый профиль экспрессии трансгена. Например, включение одной или нескольких последовательностей-мишеней для miR-142 может подавлять экспрессию трансгена во внутрисосудистых и внесосудистых линиях гемопоэтических клеток, тогда как экспрессия трансгена в клетках, отличных от гематопоэтических, сохраняется. У мышей, склонных к развитию опухолей, обработанных системой лентивирусного вектора по настоящему изобретению, онкогенеза не выявили. См. Brown et al. (2007) Blood 110:4144-52, Brown at al. (2006) Nat. Ned. 12:585-91, и Cantore et al. (2015) Sci. Transl. Med. 7(277):277ra28.
Лентивирусные векторы по настоящему изобретению содержат кодон-оптимизированные полинуклеотиды, кодирующие белок BDD FVIII, описанный в данном документе. В одном варианте осуществления оптимизированные кодирующие последовательности для белка BDD FVIII функционально связаны с последовательностью, осуществляющей контроль экспрессии. Как используется в данном документе, две последовательности нуклеиновой кислоты являются функционально связанными, если они ковалентно связаны таким образом, что обеспечивается сохранение функциональности каждого компонента, представляющего собой последовательность нуклеиновой кислоты. Считается, что кодирующая последовательность и последовательность, осуществляющая контроль экспрессии гена, функционально связаны, если они ковалентно связаны таким образом, чтобы поставить экспрессию, или транскрипцию, и/или трансляцию кодирующей последовательности под влияние или контроль последовательности, осуществляющей контроль экспрессии гена. Две последовательности ДНК считаются функционально связанными, если индукция промотора в 5'-последовательности, контролирующей экспрессию гена, приводит к транскрипции кодирующей последовательности, и если природа связи между двумя последовательностями ДНК (1) не приводит к введению мутации со сдвигом рамки считывания, (2) не препятствуют способности промоторной области управлять транскрипцией кодирующей последовательности или (3) не препятствуют способности соответствующего транскрипта РНК транслироваться с образованием белка. Таким образом, последовательность, контролирующая экспрессию гена, является функционально связанной с кодирующей последовательностью нуклеиновой кислоты, если последовательность, контролирующая экспрессию гена, способна влиять на транскрипцию этой кодирующей последовательности нуклеиновой кислоты таким образом, чтобы полученный транскрипт транслировался в необходимый белок или полипептид.
В определенных вариантах осуществления лентивирусный вектор является вектором на основе рекомбинантного лентивируса, способным инфицировать неделящиеся клетки. В определенных вариантах осуществления лентивирусный вектор является вектором на основе рекомбинантного лентивируса, способным инфицировать клетки печени (например, гепатоциты). Геном и провирусная ДНК лентивируса обычно содержат три гена, обнаруживаемые в ретровирусах, gag, pol и env, которые фланкированы двумя последовательностями, представляющими собой длинные концевые повторы (LTR). Ген gag кодирует внутренние структурные (матрикс, капсид и нуклеокапсид) белки; ген pol кодирует РНК-зависимую ДНК-полимеразу (обратную транскриптазу), протеазу и интегразу; а ген env кодирует гликопротеины вирусной оболочки. 5'- и 3'-LTR служат для стимуляции транскрипции и полиаденилирования РНК вириона. LTR содержит все другие последовательности, действующие в цис-положении, необходимые для репликации вируса. Лентивирусы имеют дополнительные гены, включающие vif, vpr, tat, rev, vpu, nef и vpx (в HIV-1, HIV-2 и/или SIV).
Рядом с 5'-LTR находятся последовательности, необходимые для обратной транскрипции генома (сайт связывания праймера, представляющего собой тРНК) и для эффективного капсидирования вирусной РНК в частицы (сайт Psi). Если последовательности, необходимые для капсидирования (или упаковки ретровирусной РНК в инфекционные вирионы), отсутствуют в вирусном геноме, цис-дефект предотвращает капсидирование геномной РНК.
Однако полученный мутант остается способным управлять синтезом всех белков вириона. В настоящем изобретении предусмотрен способ получения рекомбинантного лентивируса, способного инфицировать неделящуюся клетку, предусматривающий трансфекцию подходящей клетки-хозяина двумя или более векторами, несущими функции упаковки, а именно gag, pol и env, а также rev и tat. Как будет раскрыто в данном документе ниже, для определенных применений необходимы векторы, лишенные функционального гена tat. Таким образом, например, первый вектор может обеспечивать нуклеиновую кислоту, кодирующую gag вируса и pol вируса, а другой вектор может обеспечивать нуклеиновую кислоту, кодирующую env вируса, для получения упаковывающей клетки. Введение вектора, обеспечивающего гетерологичный ген, обозначенного в данном документе как вектор для переноса, в эту упаковывающую клетку обеспечивает получение клетки-продуцента, которая высвобождает инфекционные вирусные частицы, несущие представляющий интерес чужеродный ген.
В соответствии с указанной выше конфигурацией векторов и чужеродных генов второй вектор может обеспечивать нуклеиновую кислоту, кодирующую ген вирусной оболочки (env). Ген env может происходить практически из любого подходящего вируса, включая ретровирусы. В некоторых вариантах осуществления белок env представляет собой амфотропный белок оболочки, который обеспечивает трансдукцию клеток человека и других видов.
Примеры происходящих из ретровирусов генов env включают без ограничения следующие: вирус лейкемии мышей Молони (MoMuLV или MMLV), вирус саркомы мышей Харви (HaMuSV или HSV), вирус опухоли молочной железы мышей (MuMTV или MMTV), вирус лейкемии гиббонов (GaLV или GALV), вирус иммунодефицита человека (HIV) и вирус саркомы Рауса (RSV). Также можно применять другие гены env, такие как ген белка G вируса везикулярного стоматита (VSV) (VSV G), вируса гепатита и гриппа. В некоторых вариантах осуществления последовательность нуклеиновой кислоты env вируса функционально связана с регуляторными последовательностями, описанными в другом месте в данном документе.
В определенных вариантах осуществления в лентивирусном векторе удалены гены вирулентности HIV, env, vif, vpr, vpu и nef, без ущерба для способности вектора трансдуцировать неделящиеся клетки. В некоторых вариантах осуществления лентивирусный вектор предусматривает делецию области U3 в 3'-LTR. Делеция области U3 может являться полной делецией или частичной делецией.
В некоторых вариантах осуществления может быть обеспечена трансфекция в клетку лентивирусного вектора по настоящему изобретению, содержащего нуклеотидную последовательность FVIII, описанную в данном документе, с (a) первой нуклеотидной последовательностью, содержащей гены gag, pol или gag и pol, и (b) второй нуклеотидной последовательностью, содержащей гетерологичный ген env; при этом лентивирусный вектор лишен функционального гена tat. В других вариантах осуществления клетку дополнительно трансфицируют четвертой нуклеотидной последовательностью, содержащей ген rev. В определенных вариантах осуществления в лентивирусном векторе отсутствуют функциональные гены, выбранные из vif, vpr, vpu, vpx и nef или их комбинация.
В определенных вариантах осуществления лентивирусный вектор по настоящему изобретению содержит одну или несколько нуклеотидных последовательностей, кодирующих белок gag, чувствительный к Rev элемент, центральный полипуриновый тракт (cPPT) или любую их комбинацию.
В некоторых вариантах осуществления лентивирусный вектор экспрессирует на своей поверхности один или несколько полипептидов, которые обеспечивают улучшение нацеливания и/или активности лентивирусного вектора или кодируемого полипептида FVIII. Один или несколько полипептидов могут кодироваться лентивирусным вектором или могут быть встроены во время отпочкования лентивирусного вектора от клетки-хозяина. Во время продуцирования лентивирусов вирусные частицы отпочковываются от продуцирующей клетки-хозяина. В процессе отпочкования вирусная частица покрывается липидной оболочкой, которая образована липидной мембраной клетки-хозяина. В результате липидная оболочка вирусной частицы может включать связанные с мембраной полипептиды, которые ранее присутствовали на поверхности клетки-хозяина.
В некоторых вариантах осуществления лентивирусный вектор экспрессирует на своей поверхности один или несколько полипептидов, которые ингибируют иммунный ответ на лентивирусный вектор после введения субъекту-человеку. В некоторых вариантах осуществления поверхность лентивирусного вектора содержит одну или несколько молекул CD47. CD47 является белком-"маркером собственного", который повсеместно экспрессируется на клетках человека. Экспрессия CD47 на поверхности ингибирует индуцированный макрофагами фагоцитоз эндогенных клеток за счет взаимодействия CD47 и экспрессируемого макрофагами SIRPα. Клетки, экспрессирующие CD47 на высоких уровнях, с меньшей вероятностью становятся мишенью и разрушаются человеческими макрофагами in vivo.
В некоторых вариантах осуществления лентивирусный вектор содержит высокую концентрацию молекул полипептида CD47 на своей поверхности. В некоторых вариантах осуществления лентивирусный вектор продуцируется в линии клеток, которая характеризуется высоким уровнем экспрессии CD47. В определенных вариантах осуществления лентивирусный вектор продуцируется в клетке с фенотипом CD47high, при этом клетка характеризуется высоким уровнем экспрессии CD47 на клеточной мембране. В конкретных вариантах осуществления лентивирусный вектор продуцируется в клетке HEK 293T с фенотипом CD47high, при этом клетка HEK 293T характеризуется высоким уровнем экспрессии CD47 на клеточной мембране. В некоторых вариантах осуществления клетка HEK 293T модифицирована для повышения экспрессии CD47 по сравнению с немодифицированными клетками HEK 293T. В определенных вариантах осуществления CD47 представляет собой CD47 человека.
В некоторых вариантах осуществления лентивирусный вектор характеризуется небольшим уровнем экспрессии основного комплекса гистосовместимости класса I (MHC-I) на поверхности или отсутствием таковой. Экспрессируемый на поверхности MHC-I презентирует пептидные фрагменты "чужих" белков из клетки, такие как фрагменты белка, указывающие на инфекцию, способствуя иммунному ответу против клетки. В некоторых вариантах осуществления лентивирусный вектор продуцируется в клетке с фенотипом MHC-Ilow, при этом клетка характеризуется пониженной экспрессией MHC-I на клеточной мембране. В некоторых вариантах осуществления лентивирусный вектор продуцируется в клетке с фенотипом MHC-I- (или "MHC-Ifree", "MHC-1neg" или "MHC-отрицательной"), при этом в клетке отсутствует экспрессия MHC-I.
В конкретных вариантах осуществления лентивирусный вектор содержит липидную оболочку, характеризующуюся высокой концентрацией полипептидов CD47 и отсутствием полипептидов MHC-I. В определенных вариантах осуществления лентивирусный вектор продуцируется в линии клеток с фенотипом CD47high/MHC-Ilow, например в линии клеток HEK 293T с фенотипом CD47high/MHC-Ilow. В некоторых вариантах осуществления лентивирусный вектор продуцируется в линии клеток с фенотипом CD47high/MHC-Ifree, например в линии клеток HEK 293T с фенотипом CD47high/MHC-Ifree.
Примеры лентивирусных векторов раскрыты в патенте США № 9050269 и международных публикациях №№ WO9931251, WО9712622, WО9817815, WО9817816 и WO9818934, которые включены в данный документ посредством ссылки во всей своей полноте.
В некоторых вариантах осуществления настоящее изобретение предусматривает лентивирусный вектор, содержащий выделенную молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, которая содержит первую последовательность нуклеиновой кислоты, кодирующую N-концевую часть полипептида FVIII, и вторую последовательность нуклеиновой кислоты, кодирующую C-концевую часть полипептида FVIII; где первая последовательность нуклеиновой кислоты характеризуется по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 86%, по меньшей мере приблизительно 87%, по меньшей мере приблизительно 88%, по меньшей мере приблизительно 89%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% идентичностью последовательности с (i) нуклеотидами 58-1791 из SEQ ID NO: 3 или (ii) нуклеотидами 58-1791 из SEQ ID NO: 4; и где N-концевая часть и C-концевая часть вместе обладают активностью полипептида FVIII.
В некоторых вариантах осуществления молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая содержит первую последовательность нуклеиновой кислоты, кодирующую N-концевую часть полипептида FVIII, и вторую последовательность нуклеиновой кислоты, кодирующую C-концевую часть полипептида FVIII; где вторая последовательность нуклеиновой кислоты характеризуется по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 86%, по меньшей мере приблизительно 87%, по меньшей мере приблизительно 88%, по меньшей мере приблизительно 89%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% идентичностью последовательности с (i) нуклеотидами 1792-4374 из SEQ ID NO: 5; (ii) нуклеотидами 1792-4374 из SEQ ID NO: 6, (iii) нуклеотидами 1792-2277 и 2320-4374 из SEQ ID NO: 5; или (iv) нуклеотидами 1792-2277 и 2320-4374 из SEQ ID NO: 6; и где N-концевая часть и C-концевая часть вместе обладают активностью полипептида FVIII.
В некоторых вариантах осуществления настоящее изобретение предусматривает лентивирусный вектор, содержащий выделенную молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, кодирующую полипептид с активностью FVIII, где нуклеотидная последовательность содержит последовательность нуклеиновой кислоты, характеризующуюся по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% идентичностью последовательности с (i) нуклеотидами 58-4374 из SEQ ID NO: 1 или (ii) нуклеотидами 58-2277 и 2320-4374 из SEQ ID NO: 1 и функционально связанную с промотором, последовательностью-мишенью или и тем, и другим. В других вариантах осуществления последовательность нуклеиновой кислоты содержит (i) нуклеотиды 58-4374 из SEQ ID NO: 1 или (ii) нуклеотиды 58-2277 и 2320-4374 из SEQ ID NO: 1.
В некоторых вариантах осуществления настоящее изобретение предусматривает лентивирусный вектор, содержащий выделенную молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, кодирующую полипептид с активностью FVIII, где нуклеотидная последовательность содержит последовательность нуклеиновой кислоты, характеризующуюся по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% идентичностью последовательности с (i) нуклеотидами 58-4374 из SEQ ID NO: 2 или (ii) нуклеотидами 58-2277 и 2320-4374 из SEQ ID NO: 2 и функционально связанную с промотором, последовательностью-мишенью или и тем, и другим. В других вариантах осуществления последовательность нуклеиновой кислоты содержит (i) нуклеотиды 58-4374 из SEQ ID NO: 2 или (ii) нуклеотиды 58-2277 и 2320-4374 из SEQ ID NO: 2.
В некоторых вариантах осуществления настоящее изобретение предусматривает лентивирусный вектор, содержащий выделенную молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, кодирующую полипептид с активностью FVIII, где нуклеотидная последовательность содержит последовательность нуклеиновой кислоты, характеризующуюся по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с (i) нуклеотидами 58-4374 из SEQ ID NO: 70 или (ii) нуклеотидами 58-2277 и 2320-4374 из SEQ ID NO: 70 и функционально связанную с промотором, последовательностью-мишенью или и тем, и другим. В других вариантах осуществления последовательность нуклеиновой кислоты содержит (i) нуклеотиды 58-4374 из SEQ ID NO: 70 или (ii) нуклеотиды 58-2277 и 2320-4374 из SEQ ID NO: 70.
В некоторых вариантах осуществления настоящее изобретение предусматривает лентивирусный вектор, содержащий выделенную молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, кодирующую полипептид с активностью FVIII, где нуклеотидная последовательность содержит последовательность нуклеиновой кислоты, характеризующуюся по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с (i) нуклеотидами 58-4374 из SEQ ID NO: 71 или (ii) нуклеотидами 58-2277 и 2320-4374 из SEQ ID NO: 71 и функционально связанную с промотором, последовательностью-мишенью или и тем, и другим. В других вариантах осуществления последовательность нуклеиновой кислоты содержит (i) нуклеотиды 58-4374 из SEQ ID NO: 71 или (ii) нуклеотиды 58-2277 и 2320-4374 из SEQ ID NO: 71.
В некоторых вариантах осуществления настоящее изобретение предусматривает лентивирусный вектор, содержащий выделенную молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, кодирующую полипептид с активностью FVIII, где нуклеотидная последовательность содержит последовательность нуклеиновой кислоты, характеризующуюся по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% идентичностью последовательности с (i) нуклеотидами 58-4374 из SEQ ID NO: 3 или (ii) нуклеотидами 58-2277 и 2320-4374 из SEQ ID NO: 3 и функционально связанную с промотором, последовательностью-мишенью или и тем, и другим. В других вариантах осуществления последовательность нуклеиновой кислоты содержит (i) нуклеотиды 58-4374 из SEQ ID NO: 3 или (ii) нуклеотиды 58-2277 и 2320-4374 из SEQ ID NO: 3.
В некоторых вариантах осуществления настоящее изобретение предусматривает лентивирусный вектор, содержащий выделенную молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, кодирующую полипептид с активностью FVIII, где нуклеотидная последовательность содержит a последовательность нуклеиновой кислоты по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% идентичностью последовательности с (i) нуклеотидами 58-4374 из SEQ ID NO: 4 или (ii) нуклеотидами 58-2277 и 2320-4374 из SEQ ID NO: 4 и функционально связанную с промотором, последовательностью-мишенью или и тем, и другим. В других вариантах осуществления последовательность нуклеиновой кислоты содержит (i) нуклеотиды 58-4374 из SEQ ID NO: 4 или (ii) нуклеотиды 58-2277 и 2320-4374 из SEQ ID NO: 4.
В некоторых вариантах осуществления настоящее изобретение предусматривает лентивирусный вектор, содержащий выделенную молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, кодирующую полипептид с активностью FVIII, где нуклеотидная последовательность содержит последовательность нуклеиновой кислоты, характеризующуюся по меньшей мере приблизительно 89%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% идентичностью последовательности с (i) нуклеотидами 58-4374 из SEQ ID NO: 5 или (ii) нуклеотидами 58-2277 и 2320-4374 из SEQ ID NO: 5 и функционально связанную с промотором, последовательностью-мишенью или и тем, и другим. В других вариантах осуществления последовательность нуклеиновой кислоты содержит (i) нуклеотиды 58-4374 из SEQ ID NO: 5 или (ii) нуклеотиды 58-2277 и 2320-4374 из SEQ ID NO: 5.
В некоторых вариантах осуществления настоящее изобретение предусматривает лентивирусный вектор, содержащий выделенную молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, кодирующую полипептид с активностью FVIII, где нуклеотидная последовательность содержит последовательность нуклеиновой кислоты, характеризующуюся по меньшей мере приблизительно 89%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% идентичностью последовательности с (i) нуклеотидами 58-4374 из SEQ ID NO: 6 или (ii) нуклеотидами 58-2277 и 2320-4374 из SEQ ID NO: 6 и функционально связанную с промотором, последовательностью-мишенью или и тем, и другим. В других вариантах осуществления последовательность нуклеиновой кислоты содержит (i) нуклеотиды 58-4374 из SEQ ID NO: 6 или (ii) нуклеотиды 58-2277 и 2320-4374 из SEQ ID NO: 6.
Лентивирусные векторы по настоящему изобретению являются терапевтически эффективными при введении при дозах, составляющих 5х1010 ТЕ/кг или меньше, 109 ТЕ/кг или меньше или 108 ТЕ/кг или меньше. При таких дозировках введение лентивирусных векторов по настоящему изобретению может приводить к повышению активности FVIII в плазме крови у субъекта, нуждающегося в этом, в по меньшей мере приблизительно 2 раза, по меньшей мере приблизительно 3 раза, по меньшей мере приблизительно 4 раза, по меньшей мере приблизительно 5 раз, по меньшей мере приблизительно 6 раз, по меньшей мере приблизительно 7 раз, по меньшей мере приблизительно 8 раз, по меньшей мере приблизительно 9 раз, по меньшей мере приблизительно 10 раз, по меньшей мере приблизительно 11 раз, по меньшей мере приблизительно 12 раз, по меньшей мере приблизительно 13 раз, по меньшей мере приблизительно 14 раз, по меньшей мере приблизительно 15 раз, по меньшей мере приблизительно 20 раз, по меньшей мере приблизительно 25 раз, по меньшей мере приблизительно 30 раз, по меньшей мере приблизительно 35 раз, по меньшей мере приблизительно 40 раз, по меньшей мере приблизительно 45 раз, по меньшей мере приблизительно 50 раз, по меньшей мере приблизительно 55 раз, по меньшей мере приблизительно 60 раз, по меньшей мере приблизительно 65 раз, по меньшей мере приблизительно 70 раз, по меньшей мере приблизительно 75 раз, по меньшей мере приблизительно 80 раз, по меньшей мере приблизительно 85 раз, по меньшей мере приблизительно 90 раз, по меньшей мере приблизительно 95 раз, по меньшей мере приблизительно 100 раз, по меньшей мере приблизительно 110 раз, по меньшей мере приблизительно 120 раз, по меньшей мере приблизительно 130 раз, по меньшей мере приблизительно 140 раз, по меньшей мере приблизительно 150 раз, по меньшей мере приблизительно 160 раз, по меньшей мере приблизительно 170 раз, по меньшей мере приблизительно 180 раз, по меньшей мере приблизительно 190 раз или по меньшей мере приблизительно 200 раз по отношению к исходным уровням у субъекта, по сравнению с уровнями у субъекта, которому вводили контрольную молекулу нуклеиновой кислоты, содержащую SEQ ID NO: 16, по сравнению с уровнями у субъекта, которому вводили контрольный вирусный вектор, содержащий контрольную молекулу нуклеиновой кислоты, или по сравнению с уровнями у субъекта после введения полипептида, кодируемого контрольной молекулой нуклеиновой кислоты.
IV. Тканеспецифическая экспрессия
В определенных вариантах осуществления будет полезно включить в лентивирусный вектор одну или несколько последовательностей-мишеней для miRNA, которые, например, функционально связаны с оптимизированным трансгеном FVIII. Таким образом настоящее изобретение также предусматривает по меньшей мере одну последовательность-мишень для miRNA, функционально связанную с оптимизированной нуклеотидной последовательностью FVIII или иным образом вставленную в лентивирусный вектор. Более чем одна копия последовательности-мишени для miRNA, включенная в лентивирусный вектор, может повысить эффективность системы.
Также включены различные последовательности-мишени для miRNA. Например, в лентивирусных векторах, которые экспрессируют более одного трансгена, трансген может находиться под контролем более чем одной последовательности-мишени для miRNA, которые могут быть одинаковыми или разными. Последовательности-мишени для miRNA могут быть расположены в тандеме, но также включены другие схемы расположения. Трансгенная кассета экспрессии, содержащая последовательности-мишени для miRNA, также может быть вставлена в вектор в антисмысловой ориентации. Антисмысловая ориентация может быть применима при получении вирусных частиц во избежание экспрессии продуктов генов, которые в противном случае могут быть токсичными для клеток-продуцентов.
В других вариантах осуществления лентивирусный вектор содержит 1, 2, 3, 4, 5, 6, 7 или 8 копий одной и той же или разных последовательностей-мишеней для miRNA. Однако, в определенных других вариантах осуществления лентивирусный вектор не будет содержать никакой последовательности-мишени для miRNA. Выбор того, включать или не включать последовательность-мишень для miRNA (и в каком количестве), будет обусловлен известными параметрами, такими как предполагаемая ткань-мишень, требуемый уровень экспрессии и т. д.
В одном варианте осуществления последовательность-мишень представляет собой мишень для miR-223, которая, как сообщалось, наиболее эффективно блокирует экспрессию в миелоидных коммитированных клетках-предшественниках и по меньшей мере частично в более примитивных HSPC. Мишень для miR-223 может блокировать экспрессию в дифференцированных миелоидных клетках, в том числе гранулоцитах, моноцитах, макрофагах, миелоидных дендритных клетках. Мишень для miR-223 также может быть подходящей для путей применения в генной терапии, что основывается на устойчивой экспрессии трансгена в лимфоидной или эритроидной линии дифференцировки. Мишень для miR-223 также может очень эффективно блокировать экспрессию в HSC человека.
В другом варианте осуществления последовательность-мишень представляет собой мишень для miR142 (tccataaagt aggaaacact aca (SEQ ID NO: 43)). В одном варианте осуществления лентивирусный вектор содержит 4 копии последовательностей-мишеней для miR-142. В определенных вариантах осуществления последовательность, комплементарная микроРНК, специфической в отношении гемопоэтических клеток, такой как miR-142 (142T), встроена в 3'-нетранслируемую область лентивирусного вектора, что делает транскрипт, кодируемый трансгеном, чувствительным к понижению экспрессии, опосредованному miRNA. Посредством данного способа можно предотвратить экспрессию трансгена в антигенпрезентирующих клетках (АРС) гемопоэтической линии дифференцировки с поддержанием при этом ее в клетках, отличных от гемопоэтических (Brown et al., Nat Med 2006). С помощью такой стратегии можно производить строгий посттранскрипционный контроль экспрессии трансгена и, таким образом, обеспечивать стабильную доставку и долговременную экспрессию трансгенов. В некоторых вариантах осуществления посредством регуляции с помощью miR-142 предотвращается иммуноопосредованное выведение трансдуцированных клеток и/или индуцируется образование антигенспецифических регуляторных T-клеток (Treg) и опосредуется устойчивая иммунологическая толерантность к антигену, кодируемому трансгеном.
В некоторых вариантах осуществления последовательность-мишень представляет собой мишень для miR181. В Chen C-Z and Lodish H, Seminars in Immunology (2005) 17(2):155-165 раскрыта miR-181, miRNA, специфически экспрессирующаяся в В-клетках костного мозга мышей (Chen and Lodish, 2005). Также раскрыто, что некоторые miRNA человека связаны с формами лейкоза.
Последовательность-мишень может быть полностью или частично комплементарной по отношению к miRNA. Термин "полностью комплементарная" означает, что последовательность-мишень имеет последовательность нуклеиновой кислоты, которая на 100% комплементарна последовательности miRNA, которая ее распознает. Термин "частично комплементарная" означает, что последовательность-мишень является только частично комплементарной последовательности miRNA, которая ее распознает, и при этом частично комплементарная последовательность по-прежнему распознается miRNA. Другими словами, частично комплементарная последовательность-мишень в контексте настоящего изобретения является эффективной в распознавании соответствующей miRNA и в осуществлении предотвращения или снижения экспрессии трансгена в клетках, экспрессирующих эту miRNA. Примеры последовательностей-мишеней для miRNA описаны в WO2007/000668, WO2004/094642, WO2010/055413 или WO2010/125471, которые включены в данный документ посредством ссылки во всей своей полноте.
V. Полинуклеотидная последовательность, кодирующая белок FVIII
Настоящее изобретение относится к видам генной терапии на основе лентивирусов, при этом лентивирусный вектор содержит кодон-оптимизированную молекулу нуклеиновой кислоты, содержащую полинуклеотидную последовательность (нуклеиновой кислоты), кодирующую полипептид с активностью FVIII. В некоторых вариантах осуществления кодон-оптимизированная молекула нуклеиновой кислоты кодирует полноразмерный полипептид FVIII. В других вариантах осуществления кодон-оптимизированная молекула нуклеиновой кислоты кодирует полипептид FVIII с удаленным B-доменом (BDD), при этом удалены весь B-домен FVIII или его часть.
В одном конкретном варианте осуществления молекула нуклеиновой кислоты кодирует полипептид, содержащий аминокислотную последовательность, характеризующуюся по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 86%, по меньшей мере приблизительно 87%, по меньшей мере приблизительно 88%, по меньшей мере приблизительно 89%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% идентичностью последовательности с SEQ ID NO: 17 (фиг. 1J), или его фрагмент. В одном варианте осуществления молекула нуклеиновой кислоты кодирует полипептид, имеющий аминокислотную последовательность под SEQ ID NO: 17, или его фрагмент.
В некоторых вариантах осуществления молекула нуклеиновой кислоты кодирует полипептид FVIII, включающий сигнальный пептид, или его фрагмент. В других вариантах осуществления молекула нуклеиновой кислоты кодирует полипептид FVIII, в котором отсутствует сигнальный пептид. В некоторых вариантах осуществления сигнальный пептид содержит аминокислоты 1-19 из SEQ ID NO: 17.
В некоторых вариантах осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая содержит первую последовательность нуклеиновой кислоты, кодирующую N-концевую часть полипептида FVIII, и вторую последовательность нуклеиновой кислоты, кодирующую C-концевую часть полипептида FVIII; где первая последовательность нуклеиновой кислоты характеризуется по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с (i) нуклеотидами 58-1791 из SEQ ID NO: 3 или (ii) нуклеотидами 58-1791 из SEQ ID NO: 4; и где N-концевая часть и C-концевая часть вместе обладают активностью полипептида FVIII.
В одном конкретном варианте осуществления первая последовательность нуклеиновой кислоты характеризуется по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-1791 из SEQ ID NO: 3. В другом варианте осуществления первая последовательность нуклеиновой кислоты характеризуется по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-1791 из SEQ ID NO: 4. В других вариантах осуществления первая нуклеотидная последовательность содержит нуклеотиды 58-1791 из SEQ ID NO: 3 или нуклеотиды 58-1791 из SEQ ID NO: 4.
В других вариантах осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая содержит первую последовательность нуклеиновой кислоты, кодирующую N-концевую часть полипептида FVIII, и вторую последовательность нуклеиновой кислоты, кодирующую C-концевую часть полипептида FVIII; где первая последовательность нуклеиновой кислоты характеризуется по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с (i) нуклеотидами 1-1791 из SEQ ID NO: 3 или (ii) нуклеотидами 1-1791 из SEQ ID NO: 4; и где N-концевая часть и C-концевая часть вместе обладают активностью полипептида FVIII.
В одном варианте осуществления первая нуклеотидная последовательность содержит нуклеотиды 1-1791 из SEQ ID NO: 3 или нуклеотиды 1-1791 из SEQ ID NO: 4. В другом варианте осуществления вторая нуклеотидная последовательность характеризуется по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 1792-4374 из SEQ ID NO: 3 или 1792-4374 из SEQ ID NO: 4. В одном конкретном варианте осуществления вторая нуклеотидная последовательность содержит нуклеотиды 1792-4374 из SEQ ID NO: 3 или 1792-4374 из SEQ ID NO: 4.
В еще одном варианте осуществления вторая нуклеотидная последовательность характеризуется по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 1792-2277 и 2320-4374 из SEQ ID NO: 3 или 1792-2277 и 2320-4374 из SEQ ID NO: 4 (т. е. нуклеотидами 1792-4374 из SEQ ID NO: 3 или 1792-4374 из SEQ ID NO: 4 без нуклеотидов, кодирующих B-домен или фрагмент B-домена).
В одном конкретном варианте осуществления вторая нуклеотидная последовательность содержит нуклеотиды 1792-2277 и 2320-4374 из SEQ ID NO: 3 или 1792-2277 и 2320-4374 из SEQ ID NO: 4 (т. е. нуклеотиды 1792-4374 из SEQ ID NO: 3 или 1792-4374 из SEQ ID NO: 4 без нуклеотидов, кодирующих B-домен или фрагмент B-домена).
В некоторых вариантах осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая содержит первую последовательность нуклеиновой кислоты, кодирующую N-концевую часть полипептида FVIII, и вторую последовательность нуклеиновой кислоты, кодирующую C-концевую часть полипептида FVIII; где вторая последовательность нуклеиновой кислоты характеризуется по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с (i) нуклеотидами 1792-4374 из SEQ ID NO: 5 или (ii) нуклеотидами 1792-4374 из SEQ ID NO: 6; и где N-концевая часть и C-концевая часть вместе обладают активностью полипептида FVIII.
В определенных вариантах осуществления вторая последовательность нуклеиновой кислоты характеризуется по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 1792-4374 из SEQ ID NO: 5. В других вариантах осуществления вторая последовательность нуклеиновой кислоты характеризуется по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 1792-4374 из SEQ ID NO: 6.
В одном конкретном варианте осуществления вторая последовательность нуклеиновой кислоты содержит нуклеотиды 1792-4374 из SEQ ID NO: 5 или 1792-4374 из SEQ ID NO: 6. В некоторых вариантах осуществления первая последовательность нуклеиновой кислоты, связанная со второй последовательностью нуклеиновой кислоты, приведенной выше, характеризуется по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-1791 из SEQ ID NO: 5 или нуклеотидами 58-1791 из SEQ ID NO: 6.
В других вариантах осуществления первая последовательность нуклеиновой кислоты, связанная со второй последовательностью нуклеиновой кислоты, приведенной выше, характеризуется по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 1-1791 из SEQ ID NO: 5 или нуклеотидами 1-1791 из SEQ ID NO: 6.
В других вариантах осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая содержит первую последовательность нуклеиновой кислоты, кодирующую N-концевую часть полипептида FVIII, и вторую последовательность нуклеиновой кислоты, кодирующую C-концевую часть полипептида FVIII; где вторая последовательность нуклеиновой кислоты характеризуется по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с (i) нуклеотидами 1792-2277 и 2320-4374 из SEQ ID NO: 5 (т. е. нуклеотидами 1792-4374 из SEQ ID NO: 5 без нуклеотидов, кодирующих B-домен или фрагмент B-домена) или (ii) 1792-2277 и 2320-4374 из SEQ ID NO: 6 (т. е. нуклеотидами 1792-4374 из SEQ ID NO: 6 без нуклеотидов, кодирующих B-домен или фрагмент B-домена); и где N-концевая часть и C-концевая часть вместе обладают активностью полипептида FVIII.
В определенных вариантах осуществления вторая последовательность нуклеиновой кислоты характеризуется по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 1792-2277 и 2320-4374 из SEQ ID NO: 5 (т. е. нуклеотидами 1792-4374 из SEQ ID NO: 5 без нуклеотидов, кодирующих B-домен или фрагмент B-домена). В других вариантах осуществления вторая последовательность нуклеиновой кислоты характеризуется по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 1792-2277 и 2320-4374 из SEQ ID NO: 6 (т. е. нуклеотидами 1792-4374 из SEQ ID NO: 6 без нуклеотидов, кодирующих B-домен или фрагмент B-домена).
В одном конкретном варианте осуществления вторая последовательность нуклеиновой кислоты содержит нуклеотиды 1792-2277 и 2320-4374 из SEQ ID NO: 5 или 1792-2277 и 2320-4374 из SEQ ID NO: 6 (т. е. нуклеотиды 1792-4374 из SEQ ID NO: 5 или 1792-4374 из SEQ ID NO: 6 без нуклеотидов, кодирующих B-домен или фрагмент B-домена). В некоторых вариантах осуществления первая последовательность нуклеиновой кислоты, связанная со второй последовательностью нуклеиновой кислоты, приведенной выше, характеризуется по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-1791 из SEQ ID NO: 5 или нуклеотидами 58-1791 из SEQ ID NO: 6.
В других вариантах осуществления первая последовательность нуклеиновой кислоты, связанная со второй последовательностью нуклеиновой кислоты, приведенной выше, характеризуется по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 1-1791 из SEQ ID NO: 5 или нуклеотидами 1-1791 из SEQ ID NO: 6.
В некоторых вариантах осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая содержит первую последовательность нуклеиновой кислоты, кодирующую N-концевую часть полипептида FVIII, и вторую последовательность нуклеиновой кислоты, кодирующую C-концевую часть полипептида FVIII; где первая последовательность нуклеиновой кислоты характеризуется по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с (i) нуклеотидами 58-1791 из SEQ ID NO: 1, (ii) нуклеотидами 58-1791 из SEQ ID NO: 2, (iii) нуклеотидами 58-1791 из SEQ ID NO: 70 или (iv) нуклеотидами 58-1791 из SEQ ID NO: 71; и где N-концевая часть и C-концевая часть вместе обладают активностью полипептида FVIII. В других вариантах осуществления первая нуклеотидная последовательность содержит нуклеотиды 58-1791 из SEQ ID NO: 1, нуклеотиды 58-1791 из SEQ ID NO: 2, (iii) нуклеотиды 58-1791 из SEQ ID NO: 70 или (iv) нуклеотиды 58-1791 из SEQ ID NO: 71.
В других вариантах осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая содержит первую последовательность нуклеиновой кислоты, кодирующую N-концевую часть полипептида FVIII, и вторую последовательность нуклеиновой кислоты, кодирующую C-концевую часть полипептида FVIII; где первая последовательность нуклеиновой кислоты характеризуется по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с (i) нуклеотидами 1-1791 из SEQ ID NO: 1, (ii) нуклеотидами 1-1791 из SEQ ID NO: 2, (iii) нуклеотидами 1-1791 из SEQ ID NO: 70 или (iv) нуклеотидами 1-1791 из SEQ ID NO: 71; и где N-концевая часть и C-концевая часть вместе обладают активностью полипептида FVIII.
В одном варианте осуществления первая нуклеотидная последовательность содержит нуклеотиды 1-1791 из SEQ ID NO: 1, нуклеотиды 1-1791 из SEQ ID NO: 2, (iii) нуклеотиды 1-1791 из SEQ ID NO: 70 или (iv) нуклеотиды 1-1791 из SEQ ID NO: 71. В другом варианте осуществления вторая нуклеотидная последовательность, связанная с первой нуклеотидной последовательностью, характеризуется по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 1792-4374 из SEQ ID NO: 1, 1792-4374 из SEQ ID NO: 2, (iii) нуклеотидами 1792-4374 из SEQ ID NO: 70 или (iv) нуклеотидами 1792-4374 из SEQ ID NO: 71.
В одном конкретном варианте осуществления вторая нуклеотидная последовательность, связанная с первой нуклеотидной последовательностью, содержит (i) нуклеотиды 1792-4374 из SEQ ID NO: 1, (ii) нуклеотиды 1792-4374 из SEQ ID NO: 2, (iii) нуклеотиды 1792-4374 из SEQ ID NO: 70 или (iv) нуклеотиды 1792-4374 из SEQ ID NO: 71. В других вариантах осуществления вторая нуклеотидная последовательность, связанная с первой нуклеотидной последовательностью, характеризуется по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с (i) нуклеотидами 1792-2277 и 2320-4374 из SEQ ID NO: 1, (ii) нуклеотидами 1792-2277 и 2320-4374 из SEQ ID NO: 2, (iii) нуклеотидами 1792-2277 и 2320-4374 из SEQ ID NO: 70 или (iv) нуклеотидами 1792-2277 и 2320-4374 из SEQ ID NO: 71. В одном варианте осуществления вторая нуклеотидная последовательность содержит (i) нуклеотиды 1792-2277 и 2320-4374 из SEQ ID NO: 1, (ii) нуклеотиды 1792-2277 и 2320-4374 из SEQ ID NO: 2, (iii) нуклеотиды 1792-2277 и 2320-4374 из SEQ ID NO: 70 или (iv) нуклеотиды 1792-2277 и 2320-4374 из SEQ ID NO: 71.
В другом варианте осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая содержит первую последовательность нуклеиновой кислоты, кодирующую N-концевую часть полипептида FVIII, и вторую последовательность нуклеиновой кислоты, кодирующую C-концевую часть полипептида FVIII; где вторая последовательность нуклеиновой кислоты характеризуется по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с (i) нуклеотидами 1792-4374 из SEQ ID NO: 1, (ii) нуклеотидами 1792-4374 из SEQ ID NO: 2, (iii) нуклеотидами 1792-4374 из SEQ ID NO: 70 или (iv) нуклеотидами 1792-4374 из SEQ ID NO: 71; и где N-концевая часть и C-концевая часть вместе обладают активностью полипептида FVIII.
В одном конкретном варианте осуществления вторая последовательность нуклеиновой кислоты содержит (i) нуклеотиды 1792-4374 из SEQ ID NO: 1, (ii) нуклеотиды 1792-4374 из SEQ ID NO: 2, (iii) нуклеотиды 1792-4374 из SEQ ID NO: 70 или (iv) нуклеотиды 1792-4374 из SEQ ID NO: 71. В некоторых вариантах осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая содержит первую последовательность нуклеиновой кислоты, кодирующую N-концевую часть полипептида FVIII, и вторую последовательность нуклеиновой кислоты, кодирующую C-концевую часть полипептида FVIII; где вторая последовательность нуклеиновой кислоты характеризуется по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с (i) нуклеотидами 1792-2277 и 2320-4374 из SEQ ID NO: 1, (ii) нуклеотидами 1792-2277 и 2320-4374 из SEQ ID NO: 2, (iii) нуклеотидами 1792-2277 и 2320-4374 из SEQ ID NO: 70 или (iv) нуклеотидами 1792-2277 и 2320-4374 из SEQ ID NO: 71 (т. е. нуклеотидами 1792-4374 из SEQ ID NO: 1, нуклеотидами 1792-4374 из SEQ ID NO: 2, нуклеотидами 1792-4374 из SEQ ID NO: 70 или нуклеотидами 1792-4374 из SEQ ID NO: 71 без нуклеотидов, кодирующих B-домен или фрагмент B-домена); и где N-концевая часть и C-концевая часть вместе обладают активностью полипептида FVIII.
В одном варианте осуществления вторая последовательность нуклеиновой кислоты содержит (i) нуклеотиды 1792-2277 и 2320-4374 из SEQ ID NO: 1, (ii) нуклеотиды 1792-2277 и 2320-4374 из SEQ ID NO: 2, (iii) нуклеотиды 1792-2277 и 2320-4374 из SEQ ID NO: 70 или (iv) нуклеотиды 1792-2277 и 2320-4374 из SEQ ID NO: 71 (т. е. нуклеотиды 1792-4374 из SEQ ID NO: 1, нуклеотиды 1792-4374 из SEQ ID NO: 2, нуклеотиды 1792-4374 из SEQ ID NO: 70 или нуклеотиды 1792-4374 из SEQ ID NO: 71 без нуклеотидов, кодирующих B-домен или фрагмент B-домена).
В некоторых вариантах осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, кодирующую полипептид с активностью FVIII, где нуклеотидная последовательность содержит последовательность нуклеиновой кислоты, характеризующуюся по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-4374 из SEQ ID NO: 1.
В других вариантах осуществления нуклеотидная последовательность содержит последовательность нуклеиновой кислоты, характеризующуюся по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-2277 и 2320-4374 из SEQ ID NO: 1 (т. е. нуклеотидами 58-4374 из SEQ ID NO: 1 без нуклеотидов, кодирующих B-домен или фрагмент B-домена).
В других вариантах осуществления последовательность нуклеиновой кислоты характеризуется по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с SEQ ID NO: 1. В других вариантах осуществления нуклеотидная последовательность содержит нуклеотиды 58-2277 и 2320-4374 из SEQ ID NO: 1 (т. е. нуклеотиды 58-4374 из SEQ ID NO: 1 без нуклеотидов, кодирующих B-домен или фрагмент B-домена) или нуклеотиды 58-4374 из SEQ ID NO: 1. В еще одних других вариантах осуществления нуклеотидная последовательность содержит нуклеотиды 1-2277 и 2320-4374 из SEQ ID NO: 1 (т. е. нуклеотиды 1-4374 из SEQ ID NO: 1 без нуклеотидов, кодирующих B-домен или фрагмент B-домена) или нуклеотиды 1-4374 из SEQ ID NO: 1.
В некоторых вариантах осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, кодирующую полипептид с активностью FVIII, где нуклеотидная последовательность содержит последовательность нуклеиновой кислоты, характеризующуюся по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-4374 из SEQ ID NO: 2. В других вариантах осуществления нуклеотидная последовательность содержит последовательность нуклеиновой кислоты, характеризующуюся по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-2277 и 2320-4374 из SEQ ID NO: 2.
В других вариантах осуществления последовательность нуклеиновой кислоты характеризуется по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с SEQ ID NO: 2. В других вариантах осуществления нуклеотидная последовательность содержит нуклеотиды 58-2277 и 2320-4374 из SEQ ID NO: 2 (т. е. нуклеотиды 58-4374 из SEQ ID NO: 2 без нуклеотидов, кодирующих B-домен или фрагмент B-домена) или нуклеотиды 58-4374 из SEQ ID NO: 2. В еще одних других вариантах осуществления нуклеотидная последовательность содержит нуклеотиды 1-2277 и 2320-4374 из SEQ ID NO: 2 (т. е. нуклеотиды 1-4374 из SEQ ID NO: 2 без нуклеотидов, кодирующих B-домен или фрагмент B-домена) или нуклеотиды 1-4374 из SEQ ID NO: 2.
В некоторых вариантах осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, кодирующую полипептид с активностью FVIII, где нуклеотидная последовательность содержит последовательность нуклеиновой кислоты, характеризующуюся по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-4374 из SEQ ID NO: 70.
В других вариантах осуществления нуклеотидная последовательность содержит последовательность нуклеиновой кислоты, характеризующуюся по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-2277 и 2320-4374 из SEQ ID NO: 70 (т. е. нуклеотидами 58-4374 из SEQ ID NO: 70 без нуклеотидов, кодирующих B-домен или фрагмент B-домена).
В других вариантах осуществления последовательность нуклеиновой кислоты характеризуется по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с SEQ ID NO: 70.
В других вариантах осуществления нуклеотидная последовательность содержит нуклеотиды 58-2277 и 2320-4374 из SEQ ID NO: 70 (т. е. нуклеотиды 58-4374 из SEQ ID NO: 70 без нуклеотидов, кодирующих B-домен или фрагмент B-домена) или нуклеотиды 58-4374 из SEQ ID NO: 70. В еще одних других вариантах осуществления нуклеотидная последовательность содержит нуклеотиды 1-2277 и 2320-4374 из SEQ ID NO: 70 (т. е. нуклеотиды 1-4374 из SEQ ID NO: 70 без нуклеотидов, кодирующих B-домен или фрагмент B-домена) или нуклеотиды 1-4374 из SEQ ID NO: 70.
В некоторых вариантах осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, кодирующую полипептид с активностью FVIII, где нуклеотидная последовательность содержит последовательность нуклеиновой кислоты, характеризующуюся по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-4374 из SEQ ID NO: 71.
В других вариантах осуществления нуклеотидная последовательность содержит последовательность нуклеиновой кислоты, характеризующуюся по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-2277 и 2320-4374 из SEQ ID NO: 71 (т. е. нуклеотидами 58-4374 из SEQ ID NO: 71 без нуклеотидов, кодирующих B-домен или фрагмент B-домена). В других вариантах осуществления последовательность нуклеиновой кислоты характеризуется по меньшей мере 85%, по меньшей мере 86%, по меньшей мере 87%, по меньшей мере 88%, по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с SEQ ID NO: 71.
В других вариантах осуществления нуклеотидная последовательность содержит нуклеотиды 58-2277 и 2320-4374 из SEQ ID NO: 71 (т. е. нуклеотиды 58-4374 из SEQ ID NO: 71 без нуклеотидов, кодирующих B-домен или фрагмент B-домена) или нуклеотиды 58-4374 из SEQ ID NO: 71. В еще одних других вариантах осуществления нуклеотидная последовательность содержит нуклеотиды 1-2277 и 2320-4374 из SEQ ID NO: 71 (т. е. нуклеотиды 1-4374 из SEQ ID NO: 71 без нуклеотидов, кодирующих B-домен или фрагмент B-домена) или нуклеотиды 1-4374 из SEQ ID NO: 71.
В некоторых вариантах осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, кодирующую полипептид с активностью FVIII, где нуклеотидная последовательность содержит последовательность нуклеиновой кислоты, характеризующуюся по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-4374 из SEQ ID NO: 3. В других вариантах осуществления нуклеотидная последовательность содержит последовательность нуклеиновой кислоты, характеризующуюся по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-2277 и 2320-4374 из SEQ ID NO: 3 (т. е. нуклеотидами 58-4374 из SEQ ID NO: 3 без нуклеотидов, кодирующих B-домен или фрагмент B-домена).
В определенных вариантах осуществления последовательность нуклеиновой кислоты характеризуется по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с SEQ ID NO: 3. В некоторых вариантах осуществления нуклеотидная последовательность содержит нуклеотиды 58-2277 и 2320-4374 из SEQ ID NO: 3 (т. е. нуклеотиды 58-4374 из SEQ ID NO: 3 без нуклеотидов, кодирующих B-домен или фрагмент B-домена) или нуклеотиды 58-4374 из SEQ ID NO: 3. В еще одних других вариантах осуществления нуклеотидная последовательность содержит нуклеотиды 58-2277 и 2320-4374 из SEQ ID NO: 3 (т. е. нуклеотиды 1-4374 из SEQ ID NO: 3 без нуклеотидов, кодирующих B-домен или фрагмент B-домена) или нуклеотиды 1-4374 из SEQ ID NO: 3.
В некоторых вариантах осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, кодирующую полипептид с активностью FVIII, где нуклеотидная последовательность содержит последовательность нуклеиновой кислоты, характеризующуюся по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-4374 из SEQ ID NO: 4.
В других вариантах осуществления нуклеотидная последовательность содержит последовательность нуклеиновой кислоты, характеризующуюся по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-2277 и 2320-4374 из SEQ ID NO: 4 (т. е. нуклеотидами 58-4374 из SEQ ID NO: 4 без нуклеотидов, кодирующих B-домен или фрагмент B-домена).
В других вариантах осуществления последовательность нуклеиновой кислоты характеризуется по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с SEQ ID NO: 4. В других вариантах осуществления нуклеотидная последовательность содержит нуклеотиды 58-2277 и 2320-4374 из SEQ ID NO: 4 (т. е.т. е. нуклеотиды 58-4374 из SEQ ID NO: 4 без нуклеотидов, кодирующих B-домен или фрагмент B-домена) или нуклеотиды 58-4374 из SEQ ID NO: 4. В еще одних других вариантах осуществления нуклеотидная последовательность содержит нуклеотиды 1-2277 и 2320-4374 из SEQ ID NO: 4 (т. е. нуклеотиды 1-4374 из SEQ ID NO: 4 без нуклеотидов, кодирующих B-домен или фрагмент B-домена) или нуклеотиды 1-4374 из SEQ ID NO: 4.
В некоторых вариантах осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, кодирующую полипептид с активностью FVIII, где нуклеотидная последовательность содержит последовательность нуклеиновой кислоты, характеризующуюся по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-4374 из SEQ ID NO: 5.
В других вариантах осуществления нуклеотидная последовательность содержит последовательность нуклеиновой кислоты, характеризующуюся по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-2277 и 2320-4374 из SEQ ID NO: 5 (т. е. нуклеотидами 58-4374 из SEQ ID NO: 5 без нуклеотидов, кодирующих B-домен или фрагмент B-домена).
В определенных вариантах осуществления последовательность нуклеиновой кислоты характеризуется по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с SEQ ID NO: 5. В некоторых вариантах осуществления нуклеотидная последовательность содержит нуклеотиды 58-2277 и 2320-4374 из SEQ ID NO: 5 (т. е. нуклеотиды 58-4374 из SEQ ID NO: 5 без нуклеотидов, кодирующих B-домен или фрагмент B-домена) или нуклеотиды 58-4374 из SEQ ID NO: 5.
В еще одних других вариантах осуществления нуклеотидная последовательность содержит нуклеотиды 1-2277 и 2320-4374 из SEQ ID NO: 5 (т. е. нуклеотиды 1-4374 из SEQ ID NO: 5 без нуклеотидов, кодирующих B-домен или фрагмент B-домена) или нуклеотиды 1-4374 из SEQ ID NO: 5.
В некоторых вариантах осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, кодирующую полипептид с активностью FVIII, где нуклеотидная последовательность содержит последовательность нуклеиновой кислоты, характеризующуюся по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-4374 из SEQ ID NO: 6.
В других вариантах осуществления нуклеотидная последовательность содержит последовательность нуклеиновой кислоты, характеризующуюся по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с нуклеотидами 58-2277 и 2320-4374 из SEQ ID NO: 6 (т. е. нуклеотидами 58-4374 из SEQ ID NO: 6 без нуклеотидов, кодирующих B-домен или фрагмент B-домена).
В определенных вариантах осуществления последовательность нуклеиновой кислоты характеризуется по меньшей мере 89%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98% или по меньшей мере 99% идентичностью последовательности с SEQ ID NO: 6.
В некоторых вариантах осуществления нуклеотидная последовательность содержит нуклеотиды 58-2277 и 2320-4374 из SEQ ID NO: 6 (т. е. нуклеотиды 58-4374 из SEQ ID NO: 6 без нуклеотидов, кодирующих B-домен или фрагмент B-домена) или нуклеотиды 58-4374 из SEQ ID NO: 6.
В еще одних других вариантах осуществления нуклеотидная последовательность содержит нуклеотиды 1-2277 и 2320-4374 из SEQ ID NO: 6 (т. е. нуклеотиды 1-4374 из SEQ ID NO: 6 без нуклеотидов, кодирующих B-домен или фрагмент B-домена) или нуклеотиды 1-4374 из SEQ ID NO: 6.
В некоторых вариантах осуществления нуклеотидная последовательность содержит последовательность нуклеиновой кислоты, кодирующую сигнальный пептид. В определенных вариантах осуществления сигнальный пептид представляет собой сигнальный пептид FVIII. В некоторых вариантах осуществления последовательность нуклеиновой кислоты, кодирующая сигнальный пептид, является кодон-оптимизированной.
В одном конкретном варианте осуществления последовательность нуклеиновой кислоты, кодирующая сигнальный пептид, характеризуется по меньшей мере 60%, по меньшей мере 70%, по меньшей мере 80%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или по меньшей мере 100% идентичностью последовательности с (i) нуклеотидами 1-57 из SEQ ID NO: 1; (ii) нуклеотидами 1-57 из SEQ ID NO: 2; (iii) нуклеотидами 1-57 из SEQ ID NO: 3; (iv) нуклеотидами 1-57 из SEQ ID NO: 4; (v) нуклеотидами 1-57 из SEQ ID NO: 5; (vi) нуклеотидами 1-57 из SEQ ID NO: 6; (vii) нуклеотидами 1-57 из SEQ ID NO: 70; (viii) нуклеотидами 1-57 из SEQ ID NO: 71 или (ix) нуклеотидами 1-57 из SEQ ID NO: 68.
SEQ ID NO: 1-6, 70 и 71 являются оптимизированными вариантами SEQ ID NO: 16, являющейся исходной, или "родительской" нуклеотидной последовательностью FVIII, или последовательностью FVIII "дикого типа". SEQ ID NO: 16 кодирует FVIII человека с удаленным B-доменом. Хотя SEQ ID NO: 1-6, 70 и 71 получены из конкретной формы FVIII с удаленным B-доменом (SEQ ID NO: 16), следует учитывать, что способы лентивирусной генной терапии по настоящему изобретению также направлены на оптимизированные версии нуклеиновых кислот, кодирующих другие версии FVIII. Например, другие версии FVIII могут включать полноразмерные FVIII, FVIII с другими вариантами удаления В-домена (описанные ниже) или другие фрагменты FVIII, которые сохраняют активность FVIII.
"Полипептид с активностью FVIII", как используется в данном документе, означает функциональный полипептид FVIII с его нормальной функцией в коагуляции, если не указано иное. Термин "полипептид с активностью FVIII" включает его функциональный фрагмент, вариант, аналог или производное, которые сохраняют функцию полноразмерного фактора VIII дикого типа в пути коагуляции.
"Полипептид с активностью FVIII" используют взаимозаменяемо с белком FVIII, полипептидом FVIII или FVIII. Примеры функций FVIII включают без ограничения способность активировать коагуляцию, способность действовать в качестве кофактора для фактора IX или способность образовывать теназный комплекс с фактором IX в присутствии Ca2+ и фосфолипидов, который затем обеспечивает превращение фактора X в активированную форму Xa.
В одном варианте осуществления полипептид, обладающий активностью FVIII, содержит две полипептидных цепи, при этом первая цепь содержит тяжелую цепь FVIII, а вторая цепь содержит легкую цепь FVIII. В другом варианте осуществления полипептид, обладающий активностью FVIII, представляет собой одноцепочечный FVIII. Одноцепочечный FVIII может содержать одну или несколько мутаций или замен по аминокислотному остатку 1645 и/или 1648, что соответствует последовательности зрелого FVIII. См. международную заявку № PCT/US2012/045784, включенную в данный документ посредством ссылки во всей своей полноте. Белок FVIII может представлять собой белок FVIII человека, свиньи, собаки, крысы или мыши. Кроме того, путем сравнения FVIII от людей и FVIII от других видов идентифицировали консервативные остатки, которые, вероятно, необходимы для функционирования (Cameron et al., Thromb. Haemost. 79:317-22 (1998); US 6251632).
"В-домен" в FVIII, как используется в данном документе, является тем же В-доменом, известным из уровня техники, который определяют по идентичности внутренней аминокислотной последовательности и сайтам протеолитического расщепления тромбином, например, остаткам Ser741-Arg1648 полноразмерного FVIII человека. Другие домены FVIII человека определяют по следующим аминокислотным остаткам: A1, остатки Ala1-Arg372; A2, остатки Ser373-Arg740; A3, остатки Ser1690-Ile2032; C1, остатки Arg2033-Asn2172; C2, остатки Ser2173-Tyr2332. Последовательность A3-C1-C2 включает остатки Ser1690-Tyr2332. Оставшаяся последовательность, остатки Glu1649-Arg1689, обычно относится к активационному пептиду легкой цепи FVIII. Из уровня техники также известны местоположения границ всех доменов, в том числе B-доменов, для FVIII свиньи, мыши и собаки. Примером BDD FVIII является рекомбинантный BDD FVIII REFACTO® (Wyeth Pharmaceuticals, Inc.).
"FVIII с удаленным В-доменом" может характеризоваться вариантами полного или частичного удаления, раскрытыми в патентах США №№ 6316226, 6346513, 7041635, 5789203, 6060447, 5595886, 6228620, 5972885, 6048720, 5543502, 5610278, 5171844, 5112950, 4868112 и 6458563, каждый из которых включен в данный документ посредством ссылки во всей своей полноте. В некоторых вариантах осуществления последовательность FVIII с удаленным В-доменом по настоящему изобретению характеризуется любым из вариантов удаления, раскрытых от столбца 4, строки 4 до столбца 5, строки 28 и в примерах 1-5 патента США № 6316226 (также в US 6346513).
В некоторых вариантах осуществления FVIII с удаленным В-доменом по настоящему изобретению характеризуется вариантом удаления, раскрытым в столбце 2, строках 26-51 и в примерах 5-8 патента США № 5789203 (также в US 6060447, US 5595886 и US 6228620). В некоторых вариантах осуществления FVIII с удаленным В-доменом характеризуется вариантом удаления, описанным от столбца 1, строки 25 до столбца 2, строки 40 в патенте США № 5972885; в столбце 6, строках 1-22 и в примере 1 патента США № 6048720; в столбце 2, строках 17-46 патента США № 5543502; от столбца 4, строки 22 до столбца 5, строки 36 патента США № 5171844; в столбце 2, строках 55-68, на фигуре 2 и в примере 1 патента США № 5112950; от столбца 2, строки 2 до столбца 19, строки 21 и в таблице 2 патента США № 4868112; от столбца 2, строки 1 до столбца 3, строки 19, от столбца 3, строки 40 до столбца 4, строки 67, от столбца 7, строки 43 до столбца 8, строки 26 и от столбца 11, строки 5 до столбца 13, строки 39 патента США № 7041635 или в столбце 4, строках 25-53 патента США № 6458563.
В некоторых вариантах осуществления FVIII с удаленным В-доменом характеризуется удалением большей части В-домена, но все еще содержит аминоконцевые последовательности В-домена, которые необходимы для протеолитического процессинга первичного продукта трансляции in vivo с образованием двух полипептидных цепей, как это раскрыто в WO 91/09122, которая включена в данный документ посредством ссылки во всей своей полноте. В некоторых вариантах осуществления FVIII с удаленным B-доменом конструируют посредством удаления аминокислот 747-1638, т. е. практически с полным удалением В-домена. Hoeben R.C., et al. J. Biol. Chem. 265 (13): 7318-7323 (1990), включенная в данный документ посредством ссылки во всей своей полноте. FVIII с удаленным В-доменом также может характеризоваться удалением аминокислот 771-1666 или аминокислот 868-1562 FVIII. Meulien P., et al. Protein Eng. 2(4): 301-6 (1988), включенная в данный документ посредством ссылки во всей своей полноте.
Дополнительные варианты удаления В-домена, которые являются частью настоящего изобретения, включают, например, удаление аминокислот 982-1562 или 760-1639 (Toole et al., Proc. Natl. Acad. Sci. США (1986) 83, 5939-5942)), 797-1562 (Eaton, et al. Biochemistry (1986) 25:8343-8347)), 741-1646 (Kaufman (опубликованная заявка согласно PCT № WO 87/04187)), 747-1560 (Sarver, et al., DNA (1987) 6:553-564)), 741-1648 (Pasek (заявка согласно PCT № 88/00831)), 816-1598 или 741-1689 (Lagner (Behring Inst. Mitt. (1988) No 82:16-25, EP 295597)), каждый из которых включены в данный документ посредством ссылки во всей своей полноте. Каждый из вышеизложенных вариантов удаления может быть осуществлен в любой последовательности FVIII.
Ряд функциональных молекул FVIII, включая таковые с удалением B-домена, раскрыты в следующих патентах US 6316226 и US 6346513, оба переданные Baxter; US 7041635, переданный In2Gen; US 5789203, US 6060447, US 5595886 и US 6228620, переданные Chiron; US 5972885 и US 6048720, переданные Biovitrum, US 5543502 и US 5610278, переданные Novo Nordisk; US 5171844, переданный Immuno Ag; US 5112950, переданный Transgene S.A.; US 4868112, переданный Genetics Institute, каждый из которых включен в данный документ посредством ссылки во всей своей полноте.
A. Оптимизация кодонов
В одном варианте осуществления лентивирусный вектор по настоящему изобретению содержит выделенную молекулу нуклеиновой кислоты, содержащую нуклеотидную последовательность, которая кодирует полипептид с активностью FVIII, где последовательность нуклеиновой кислоты была кодон-оптимизирована. В другом варианте осуществления исходная последовательность нуклеиновой кислоты, которая кодирует полипептид с активностью FVIII и которая подлежит оптимизации кодонов, представляет собой SEQ ID NO: 16. В некоторых вариантах осуществления последовательность, которая кодирует полипептид с активностью FVIII, является кодон-оптимизированной для экспрессии у человека. В других вариантах осуществления последовательность, которая кодирует полипептид с активностью FVIII, является кодон-оптимизированной для экспрессии у мыши. SEQ ID NO: 1-6, 70 и 71 являются кодон-оптимизированными версиями SEQ ID NO: 16, оптимизированными для экспрессии у человека.
Термин "кодон-оптимизированный", поскольку он относится к генам или кодирующим областям молекул нуклеиновых кислот для трансформации различных хозяев, относится к изменению кодонов в гене или кодирующих областях молекул нуклеиновых кислот для обеспечения соответствия типичной частоте использования кодона у организма-хозяина без изменения полипептида, кодируемого ДНК. Такая оптимизация включает замену по меньшей мере одного, или более чем одного, или значительного числа кодонов одним или несколькими кодонами, которые чаще используются в генах этого организма.
Отклонения в нуклеотидной последовательности, которая содержит кодоны, кодирующие аминокислоты любой полипептидной цепи, допускают вариации в последовательности, кодирующей ген. Поскольку каждый кодон состоит из трех нуклеотидов, а нуклеотиды, составляющие ДНК, ограничены четырьмя определенными основаниями, существует 64 возможных комбинации нуклеотидов, 61 из которых кодирует аминокислоты (остальные три кодона кодируют сигналы окончания трансляции). "Генетический код", показывающий, какие кодоны кодируют какие аминокислоты, воспроизведен в данном документе в виде таблицы 1. В результате многие аминокислоты обозначаются более чем одним кодоном. Например, аминокислоты аланин и пролин кодируются четырьмя триплетами, серин и аргинин - шестью, тогда как триптофан и метионин кодируются только одним триплетом. Эта вырожденность позволяет составу оснований ДНК варьировать в широком диапазоне без изменения аминокислотной последовательности белков, кодируемых ДНК.
Таблица 1. Стандартный генетический код
TTC "
TTA Leu (L)
TTG "
TCC "
TCA "
TCG "
TAC "
TAA Стоп
TAG Стоп
TGC
TGA Стоп
TGG Trp (W)
CTC "
CTA "
CTG "
CCC "
CCA "
CCG "
CAC "
CAA Gln (Q)
CAG "
CGC "
CGA "
CGG "
ATC "
ATA "
ATG Met (M)
ACC "
ACA "
ACG "
AAC "
AAA Lys (K)
AAG "
AGC "
AGA Arg (R)
AGG "
GTC "
GTA "
GTG "
GCC "
GCA "
GCG "
GAC "
GAA Glu (E)
GAG "
GGC "
GGA "
GGG "
У многих организмов проявляется предпочтение к использованию определенных кодонов для кодирования вставки конкретной аминокислоты в растущую пептидную цепь. Преимущественное использование кодонов или предпочтение кодонов, различия в частоте использования кодонов между организмами возможны благодаря вырожденности генетического кода и широко освещены для многих организмов. Предпочтение кодонов часто коррелирует с эффективностью трансляции информационной РНК (мРНК), которая, в свою очередь, как полагают, зависит, среди прочего, от свойств кодонов, подлежащих трансляции, и доступности конкретных молекул транспортной РНК (тРНК). Преобладание выбранных тРНК в клетке обычно является отражением кодонов, наиболее часто используемых в синтезе пептида. Соответственно, гены могут быть адаптированы для оптимальной экспрессии генов в данном организме на основе оптимизации кодонов.
Учитывая большое количество последовательностей генов, доступных для самых разных видов животных, растений и микробов, были рассчитаны относительные значения частоты использования кодонов. Таблицы значений частоты использования кодонов доступны, например, в "Базе данных значений частоты использования кодонов", доступной по адресу www.kazusa.or.jp/codon/ (посещение 18 июня 2012 г.). См. Nakamura, Y., et al. Nucl. Acids Res. 28:292 (2000).
Рандомное назначение кодонов с оптимизированной частотой использования для кодирования данной полипептидной последовательности можно выполнять вручную, вычислив значения частоты использования кодонов для каждой аминокислоты, а затем рандомно назначив кодоны для полипептидной последовательности. Дополнительно, для расчета оптимальной последовательности можно применять различные алгоритмы и программное обеспечение.
В некоторых вариантах осуществления молекула нуклеиновой кислоты характеризуется одним или несколькими из следующих свойств: (a) индекс адаптации кодонов для человека для молекулы нуклеиновой кислоты или ее части является повышенным по сравнению с таковым для SEQ ID NO: 16; (b) частота оптимальных кодонов для нуклеотидной последовательности или ее части является повышенной по сравнению с таковой для SEQ ID NO:16; (c) нуклеотидная последовательность или ее часть содержат более высокую процентную долю нуклеотидов G/C по сравнению с процентной долей нуклеотидов G/C в SEQ ID NO: 16; (d) относительная частота использования синонимичных кодонов для нуклеотидной последовательности или ее части является повышенной по сравнению с таковой для SEQ ID NO: 16; (e) эффективное число кодонов для нуклеотидной последовательности или ее части является пониженным по сравнению с таковым для SEQ ID NO: 16; (f) нуклеотидная последовательность содержит меньше последовательностей MARS/ARS (SEQ ID NO: 21 и 22) по сравнению с SEQ ID NO: 16; (g) нуклеотидная последовательность содержит меньше дестабилизирующих элементов (SEQ ID NO: 23 и 24) по сравнению с SEQ ID NO: 16; (i) нуклеотидная последовательность не содержит последовательности поли-T, (j) нуклеотидная последовательность не содержит последовательности поли-A; или (k) любой их комбинацией. В некоторых вариантах осуществления молекулы нуклеиновых кислот обладают по меньшей мере двумя, по меньшей мере тремя, по меньшей мере четырьмя, по меньшей мере пятью, по меньшей мере шестью, по меньшей мере семью, по меньшей мере восемью, по меньшей мере девятью или десятью характеристиками (a) - (j).
В. Индекс адаптации кодонов
В одном варианте осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, описанную в данном документе, которая кодирует полипептид с активностью FVIII, где индекс адаптации кодонов для человека является повышенным по сравнению с таковым для SEQ ID NO: 16. Например, нуклеотидная последовательность может характеризоваться индексом адаптации кодонов для человека, составляющим по меньшей мере приблизительно 0,75 (75%), по меньшей мере приблизительно 0,76 (76%), по меньшей мере приблизительно 0,77 (77%), по меньшей мере приблизительно 0,78 (78%), по меньшей мере приблизительно 0,79 (79%), по меньшей мере приблизительно 0,80 (80%), по меньшей мере приблизительно 0,81 (81%), по меньшей мере приблизительно 0,82 (82%), по меньшей мере приблизительно 0,83 (83%), по меньшей мере приблизительно 0,84 (84%), по меньшей мере приблизительно 0,85 (85%), по меньшей мере приблизительно 0,86 (86%), по меньшей мере приблизительно 0,87 (87%), по меньшей мере приблизительно 0,88 (88%), по меньшей мере приблизительно 0,89 (89%), по меньшей мере приблизительно 0,90 (90%), по меньшей мере приблизительно 0,91 (91%), по меньшей мере приблизительно 0,92 (92%), по меньшей мере приблизительно 0,93 (93%), по меньшей мере приблизительно 0,94 (94%), по меньшей мере приблизительно 0,95 (95%), по меньшей мере приблизительно 0,96 (96%), по меньшей мере приблизительно 0,97 (97%), по меньшей мере приблизительно 0,98 (98%) или по меньшей мере приблизительно 0,99 (99%). В некоторых вариантах осуществления нуклеотидная последовательность характеризуется индексом адаптации кодонов для человека, который составляет по меньшей мере приблизительно 0,88 (88%). В других вариантах осуществления нуклеотидная последовательность характеризуется индексом адаптации кодонов для человека, который составляет по меньшей мере приблизительно 0,91 (91%). В других вариантах осуществления нуклеотидная последовательность характеризуется индексом адаптации кодонов для человека, который составляет по меньшей мере приблизительно 0,91 (97%).
В одном конкретном варианте осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая содержит первую последовательность нуклеиновой кислоты, кодирующую N-концевую часть полипептида FVIII, и вторую последовательность нуклеиновой кислоты, кодирующую C-концевую часть полипептида FVIII; где первая последовательность нуклеиновой кислоты характеризуется по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 86%, по меньшей мере приблизительно 87%, по меньшей мере приблизительно 88%, по меньшей мере приблизительно 89%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% идентичностью последовательности с (i) нуклеотидами 58-1791 из SEQ ID NO: 3; (ii) нуклеотидами 1-1791 из SEQ ID NO: 3; (iii) нуклеотидами 58-1791 из SEQ ID NO: 4 или (iv) нуклеотидами 1-1791 из SEQ ID NO: 4; где N-концевая часть и C-концевая часть вместе обладают активностью полипептида FVIII; и где индекс адаптации кодонов человека для нуклеотидной последовательности повышен по сравнению с SEQ ID NO: 16.
В некоторых вариантах осуществления нуклеотидная последовательность характеризуется индексом адаптации кодонов для человека, составляющим по меньшей мере приблизительно 0,75 (75%), по меньшей мере приблизительно 0,76 (76%), по меньшей мере приблизительно 0,77 (77%), по меньшей мере приблизительно 0,78 (78%), по меньшей мере приблизительно 0,79 (79%), по меньшей мере приблизительно 0,80 (80%), по меньшей мере приблизительно 0,81 (81%), по меньшей мере приблизительно 0,82 (82%), по меньшей мере приблизительно 0,83 (83%), по меньшей мере приблизительно 0,84 (84%), по меньшей мере приблизительно 0,85 (85%), по меньшей мере приблизительно 0,86 (86%), по меньшей мере приблизительно 0,87 (87%), по меньшей мере приблизительно 0,88 (88%), по меньшей мере приблизительно 0,89 (89%), по меньшей мере приблизительно 0,90 (90%) или по меньшей мере приблизительно 0,91 (91%). В одном конкретном варианте осуществления нуклеотидная последовательность характеризуется индексом адаптации кодонов для человека, который составляет по меньшей мере приблизительно 0,88 (88%). В другом варианте осуществления нуклеотидная последовательность характеризуется индексом адаптации кодонов для человека, который составляет по меньшей мере приблизительно 0,91 (91%).
В другом варианте осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая содержит первую последовательность нуклеиновой кислоты, кодирующую N-концевую часть полипептида FVIII, и вторую последовательность нуклеиновой кислоты, кодирующую C-концевую часть полипептида FVIII; где вторая последовательность нуклеиновой кислоты характеризуется по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 86%, по меньшей мере приблизительно 87%, по меньшей мере приблизительно 88%, по меньшей мере приблизительно 89%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% идентичностью последовательности с (i) нуклеотидами 1792-2277 и 2320-4374 из SEQ ID NO: 5 или (ii) 1792-2277 и 2320-4374 из SEQ ID NO: 6; где N-концевая часть и C-концевая часть вместе обладают активностью полипептида FVIII; и где индекс адаптации кодонов человека для нуклеотидной последовательности повышен по сравнению с SEQ ID NO: 16.
В некоторых вариантах осуществления нуклеотидная последовательность характеризуется индексом адаптации кодонов для человека, составляющим по меньшей мере приблизительно 0,75 (75%), по меньшей мере приблизительно 0,76 (76%), по меньшей мере приблизительно 0,77 (77%), по меньшей мере приблизительно 0,78 (78%), по меньшей мере приблизительно 0,79 (79%), по меньшей мере приблизительно 0,80 (80%), по меньшей мере приблизительно 0,81 (81%), по меньшей мере приблизительно 0,82 (82%), по меньшей мере приблизительно 0,83 (83%), по меньшей мере приблизительно 0,84 (84%), по меньшей мере приблизительно 0,85 (85%), по меньшей мере приблизительно 0,86 (86%), по меньшей мере приблизительно 0,87 (87%) или по меньшей мере приблизительно 0,88 (88%). В одном конкретном варианте осуществления нуклеотидная последовательность характеризуется индексом адаптации кодонов для человека, который составляет по меньшей мере приблизительно 0,83 (83%). В другом варианте осуществления нуклеотидная последовательность характеризуется индексом адаптации кодонов для человека, который составляет по меньшей мере приблизительно 0,88 (88%).
В других вариантах осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, кодирующую полипептид с активностью FVIII, где нуклеотидная последовательность содержит последовательность нуклеиновой кислоты, характеризующуюся по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 89%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% идентичностью последовательности с нуклеотидами 58-2277 и 2320-4374 аминокислотной последовательности, выбранной из SEQ ID NO: 1, 2, 3, 4, 5, 6, 70 и 71 (т. е. нуклеотидами 58-4374 из SEQ ID NO: 1, 2, 3, 4, 5, 6, 70 или 71 без нуклеотидов, кодирующих B-домен или фрагмент B-домена); и где индекс адаптации кодонов для человека для нуклеотидной последовательности повышен по сравнению с таковым для SEQ ID NO: 16. В некоторых вариантах осуществления нуклеотидная последовательность характеризуется индексом адаптации кодонов для человека, составляющим по меньшей мере приблизительно 0,75 (75%), по меньшей мере приблизительно 0,76 (76%), по меньшей мере приблизительно 0,77 (77%), по меньшей мере приблизительно 0,78 (78%), по меньшей мере приблизительно 0,79 (79%), по меньшей мере приблизительно 0,80 (80%), по меньшей мере приблизительно 0,81 (81%), по меньшей мере приблизительно 0,82 (82%), по меньшей мере приблизительно 0,83 (83%), по меньшей мере приблизительно 0,84 (84%), по меньшей мере приблизительно 0,85 (85%), по меньшей мере приблизительно 0,86 (86%), по меньшей мере приблизительно 0,87 (87%) или по меньшей мере приблизительно 0,88 (88%).
В одном конкретном варианте осуществления нуклеотидная последовательность характеризуется индексом адаптации кодонов для человека, который составляет по меньшей мере приблизительно 0,75 (75%). В другом варианте осуществления нуклеотидная последовательность характеризуется индексом адаптации кодонов для человека, который составляет по меньшей мере приблизительно 0,83 (83%). В другом варианте осуществления нуклеотидная последовательность характеризуется индексом адаптации кодонов для человека, который составляет по меньшей мере приблизительно 0,88 (88%). В другом варианте осуществления нуклеотидная последовательность характеризуется индексом адаптации кодонов для человека, который составляет по меньшей мере приблизительно 0,91 (91%). В другом варианте осуществления нуклеотидная последовательность характеризуется индексом адаптации кодонов для человека, который составляет по меньшей мере приблизительно 0,97 (97%).
В некоторых вариантах осуществления выделенная молекула нуклеиновой кислоты характеризуется повышенной частотой оптимальных кодонов (FOP) по сравнению с таковой для SEQ ID NO: 16. В определенных вариантах осуществления FOP для выделенной молекулы нуклеиновой кислоты составляет по меньшей мере приблизительно 40, по меньшей мере приблизительно 45, по меньшей мере приблизительно 50, по меньшей мере приблизительно 55, по меньшей мере приблизительно 60, по меньшей мере приблизительно 64, по меньшей мере приблизительно 65, по меньшей мере приблизительно 70, по меньшей мере приблизительно 75, по меньшей мере приблизительно 79, по меньшей мере приблизительно 80, по меньшей мере приблизительно 85 или по меньшей мере приблизительно 90.
В других вариантах осуществления выделенная молекула нуклеиновой кислоты характеризуется повышенной относительной частотой использования синонимичного кодона (RCSU) по сравнению с SEQ ID NO: 16. В некоторых вариантах осуществления RCSU для выделенной молекулы нуклеиновой кислоты составляет более 1,5. В других вариантах осуществления RCSU для выделенной молекулы нуклеиновой кислоты составляет более 2,0. В определенных вариантах осуществления RCSU для выделенной молекулы нуклеиновой кислоты составляет по меньшей мере приблизительно 1,5, по меньшей мере приблизительно 1,6, по меньшей мере приблизительно 1,7, по меньшей мере приблизительно 1,8, по меньшей мере приблизительно 1,9, по меньшей мере приблизительно 2,0, по меньшей мере приблизительно 2,1, по меньшей мере приблизительно 2,2, по меньшей мере приблизительно 2,3, по меньшей мере приблизительно 2,4, по меньшей мере приблизительно 2,5, по меньшей мере приблизительно 2,6 или по меньшей мере приблизительно 2,7.
В следующих вариантах осуществления выделенная молекулу нуклеиновой кислоты характеризуется пониженным эффективным числом кодонов по сравнению с SEQ ID NO: 16. В некоторых вариантах осуществления выделенная молекулу нуклеиновой кислоты характеризуется эффективным числом кодонов, составляющим менее приблизительно 50, менее приблизительно 45, менее приблизительно 40, менее приблизительно 35, менее приблизительно 30 или менее приблизительно 25. В одном конкретном варианте осуществления выделенная молекула нуклеиновой кислоты характеризуется эффективным количеством кодонов, составляющим приблизительно 40, приблизительно 35, приблизительно 30, приблизительно 25 или приблизительно 20.
С. Оптимизация содержания G/C
В некоторых вариантах осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, описанную в данном документе, которая кодирует полипептид с активностью FVIII, где нуклеотидная последовательность содержат более высокую процентную долю нуклеотидов G/C по сравнению с процентной долей нуклеотидов G/C в SEQ ID NO: 16. В других вариантах осуществления нуклеотидная последовательность, которая кодирует полипептид с активностью FVIII, характеризуется содержанием G/C, составляющим по меньшей мере приблизительно 45%, по меньшей мере приблизительно 46%, по меньшей мере приблизительно 47%, по меньшей мере приблизительно 48%, по меньшей мере приблизительно 49%, по меньшей мере приблизительно 50%, по меньшей мере приблизительно 51%, по меньшей мере приблизительно 52%, по меньшей мере приблизительно 53%, по меньшей мере приблизительно 54%, по меньшей мере приблизительно 55%, по меньшей мере приблизительно 56%, по меньшей мере приблизительно 57%, по меньшей мере приблизительно 58%, по меньшей мере приблизительно 59% или по меньшей мере приблизительно 60%.
В одном конкретном варианте осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая содержит первую последовательность нуклеиновой кислоты, кодирующую N-концевую часть полипептида FVIII, и вторую последовательность нуклеиновой кислоты, кодирующую C-концевую часть полипептида FVIII; где первая последовательность нуклеиновой кислоты характеризуется по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 86%, по меньшей мере приблизительно 87%, по меньшей мере приблизительно 88%, по меньшей мере приблизительно 89%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% идентичностью последовательности с (i) нуклеотидами 58-1791 из SEQ ID NO: 3; (ii) нуклеотидами 1-1791 из SEQ ID NO: 3; (iii) нуклеотидами 58-1791 из SEQ ID NO: 4 или (iv) нуклеотидами 1-1791 из SEQ ID NO: 4; где N-концевая часть и C-концевая часть вместе обладают активностью полипептида FVIII; и где нуклеотидная последовательность содержит более высокую процентную долю нуклеотидов G/C по сравнению с процентной долей нуклеотидов G/C в SEQ ID NO: 16.
В некоторых вариантах осуществления нуклеотидная последовательность, которая кодирует полипептид с активностью FVIII, характеризуется содержанием G/C, составляющим по меньшей мере приблизительно 45%, по меньшей мере приблизительно 46%, по меньшей мере приблизительно 47%, по меньшей мере приблизительно 48%, по меньшей мере приблизительно 49%, по меньшей мере приблизительно 50%, по меньшей мере приблизительно 51%, по меньшей мере приблизительно 52%, по меньшей мере приблизительно 53%, по меньшей мере приблизительно 54%, по меньшей мере приблизительно 55%, по меньшей мере приблизительно 56%, по меньшей мере приблизительно 57% или по меньшей мере приблизительно 58%. В одном конкретном варианте осуществления нуклеотидная последовательность, которая кодирует полипептид с активностью FVIII, характеризуется содержанием G/C, составляющим по меньшей мере приблизительно 58%.
В другом варианте осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая содержит первую последовательность нуклеиновой кислоты, кодирующую N-концевую часть полипептида FVIII, и вторую последовательность нуклеиновой кислоты, кодирующую C-концевую часть полипептида FVIII; где вторая последовательность нуклеиновой кислоты характеризуется по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 86%, по меньшей мере приблизительно 87%, по меньшей мере приблизительно 88%, по меньшей мере приблизительно 89%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% идентичностью последовательности с (i) нуклеотидами 1792-4374 из SEQ ID NO: 5; (ii) нуклеотидами 1792-4374 из SEQ ID NO: 6; (iii) нуклеотидами 1792-2277 и 2320-4374 из SEQ ID NO: 5 (т. е. нуклеотидами 1792-4374 из SEQ ID NO: 5 без нуклеотидов, кодирующих B-домен или фрагмент B-домена) или (iv) 1792-2277 и 2320-4374 из SEQ ID NO: 6 (т. е. нуклеотидами 1792-4374 из SEQ ID NO: 6 без нуклеотидов, кодирующих В-домен или фрагмент В-домена); где N-концевая часть и C-концевая часть вместе обладают активностью полипептида FVIII; и где нуклеотидная последовательность содержит более высокую процентную долю нуклеотидов G/C по сравнению с процентной долей нуклеотидов G/C в SEQ ID NO: 16.
В других вариантах осуществления нуклеотидная последовательность, которая кодирует полипептид с активностью FVIII, характеризуется содержанием G/C, составляющим по меньшей мере приблизительно 45%, по меньшей мере приблизительно 46%, по меньшей мере приблизительно 47%, по меньшей мере приблизительно 48%, по меньшей мере приблизительно 49%, по меньшей мере приблизительно 50%, по меньшей мере приблизительно 51%, по меньшей мере приблизительно 52%, по меньшей мере приблизительно 53%, по меньшей мере приблизительно 54%, по меньшей мере приблизительно 55%, по меньшей мере приблизительно 56% или по меньшей мере приблизительно 57%. В одном конкретном варианте осуществления нуклеотидная последовательность, которая кодирует полипептид с активностью FVIII, характеризуется содержанием G/C, составляющим по меньшей мере приблизительно 52%. В другом варианте осуществления нуклеотидная последовательность, которая кодирует полипептид с активностью FVIII, характеризуется содержанием G/C, составляющим по меньшей мере приблизительно 55%. В другом варианте осуществления нуклеотидная последовательность, которая кодирует полипептид с активностью FVIII, характеризуется содержанием G/C, составляющим по меньшей мере приблизительно 57%.
В других вариантах осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, кодирующую полипептид с активностью FVIII, где нуклеотидная последовательность содержит последовательность нуклеиновой кислоты, характеризующуюся по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 89%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% идентичностью последовательности с (i) нуклеотидами 58-4374 или (ii) нуклеотидами 58-2277 и 2320-4374 из аминокислотной последовательности, выбранной из SEQ ID NO: 1, 2, 3, 4, 5, 6, 70 и 71 (т. е. нуклеотидами 58-4374 из SEQ ID NO: 1, 2, 3, 4, 5, 6, 70 или 71 без нуклеотидов, кодирующих B-домен или фрагмент B-домена); и где нуклеотидная последовательность содержит более высокую процентную долю нуклеотидов G/C по сравнению с процентной долей нуклеотидов G/C в SEQ ID NO: 16. В других вариантах осуществления нуклеотидная последовательность, которая кодирует полипептид с активностью FVIII, характеризуется содержанием G/C, составляющим по меньшей мере приблизительно 45%.
В одном конкретном варианте осуществления нуклеотидная последовательность, которая кодирует полипептид с активностью FVIII, характеризуется содержанием G/C, составляющим по меньшей мере приблизительно 52%. В другом варианте осуществления нуклеотидная последовательность, которая кодирует полипептид с активностью FVIII, характеризуется содержанием G/C, составляющим по меньшей мере приблизительно 55%. В другом варианте осуществления нуклеотидная последовательность, которая кодирует полипептид с активностью FVIII, характеризуется содержанием G/C, составляющим по меньшей мере приблизительно 57%. В другом варианте осуществления нуклеотидная последовательность, которая кодирует полипептид с активностью FVIII, характеризуется содержанием G/C, составляющим по меньшей мере приблизительно 58%. В еще одном варианте осуществления нуклеотидная последовательность, которая кодирует полипептид с активностью FVIII, характеризуется содержанием G/C, составляющим по меньшей мере приблизительно 60%.
"Содержание G/C" (или содержание гуанина-цитозина) или "процентная доля нуклеотидов G/C" относится к процентной доле азотистых оснований в молекуле ДНК, которые представляют собой либо гуанин, либо цитозин. Содержание G/C можно рассчитать с использованием следующей формулы:
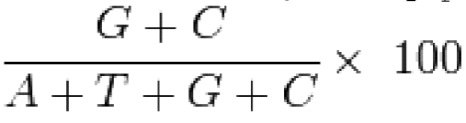 (III).
(III).
Гены человека в значительной степени являются неоднородными по содержанию в них G/C, при этом некоторые гены характеризуются содержанием G/C, составляющим всего лишь 20%, а другие гены характеризуются содержанием G/C, составляющим вплоть до 95%. В целом гены, богатые G/C, имеют более высокий уровень экспрессии. В действительности было продемонстрировано, что повышение содержания G/C в гене может привести к повышенной экспрессии данного гена, главным образом из-за повышения транскрипции и более высоких уровней мРНК в состоянии равновесия. См. Kudla et al., PLoS Biol., 4(6): e180 (2006).
D. Последовательности, подобные области прикрепления к матриксу
В некоторых вариантах осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, описанную в данном документе, которая кодирует полипептид с активностью FVIII, где нуклеотидная последовательность содержит меньше последовательностей MARS/ARS по сравнению с SEQ ID NO: 16. В других вариантах осуществления нуклеотидная последовательность, кодирующая полипептид с активностью FVIII, содержит не более 6, не более 5, не более 4, не более 3 или не более 2 последовательностей MARS/ARS. В других вариантах осуществления нуклеотидная последовательность, которая кодирует полипептид с активностью FVIII, содержит не более 1 последовательности MARS/ARS. В других вариантах осуществления нуклеотидная последовательность, которая кодирует полипептид с активностью FVIII, не содержит последовательность MARS/ARS.
В одном конкретном варианте осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая содержит первую последовательность нуклеиновой кислоты, кодирующую N-концевую часть полипептида FVIII, и вторую последовательность нуклеиновой кислоты, кодирующую C-концевую часть полипептида FVIII; где первая последовательность нуклеиновой кислоты характеризуется по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 86%, по меньшей мере приблизительно 87%, по меньшей мере приблизительно 88%, по меньшей мере приблизительно 89%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% идентичностью последовательности с (i) нуклеотидами 58-1791 из SEQ ID NO: 3; (ii) нуклеотидами 1-1791 из SEQ ID NO: 3; (iii) нуклеотидами 58-1791 из SEQ ID NO: 4 или (iv) нуклеотидами 1-1791 из SEQ ID NO: 4; где N-концевая часть и C-концевая часть вместе обладают активностью полипептида FVIII; и где нуклеотидная последовательность содержит меньше последовательностей MARS/ARS по сравнению с SEQ ID NO: 16. В других вариантах осуществления нуклеотидная последовательность, кодирующая полипептид с активностью FVIII, содержит не более 6, не более 5, не более 4, не более 3 или не более 2 последовательностей MARS/ARS. В других вариантах осуществления нуклеотидная последовательность, которая кодирует полипептид с активностью FVIII, содержит не более 1 последовательности MARS/ARS. В других вариантах осуществления нуклеотидная последовательность, которая кодирует полипептид с активностью FVIII, не содержит последовательность MARS/ARS.
В другом варианте осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая содержит первую последовательность нуклеиновой кислоты, кодирующую N-концевую часть полипептида FVIII, и вторую последовательность нуклеиновой кислоты, кодирующую C-концевую часть полипептида FVIII; где вторая последовательность нуклеиновой кислоты характеризуется по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 86%, по меньшей мере приблизительно 87%, по меньшей мере приблизительно 88%, по меньшей мере приблизительно 89%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% идентичностью последовательности с (i) нуклеотидами 1792-4374 из SEQ ID NO: 5; (ii) нуклеотидами 1792-4374 из SEQ ID NO: 6; (iii) нуклеотидами 1792-2277 и 2320-4374 из SEQ ID NO: 5 (т. е. нуклеотидами 1792-4374 из SEQ ID NO: 5 без нуклеотидов, кодирующих B-домен или фрагмент B-домена) или (iv) нуклеотидами 1792-2277 и 2320-4374 из SEQ ID NO: 6 (т. е. нуклеотидами 1792-4374 из SEQ ID NO: 6 без нуклеотидов, кодирующих В-домен или фрагмент В-домена); где N-концевая часть и C-концевая часть вместе обладают активностью полипептида FVIII; и где кодон-оптимизированная нуклеотидная последовательность содержит меньше последовательностей MARS/ARS по сравнению с SEQ ID NO: 16. В других вариантах осуществления нуклеотидная последовательность, кодирующая полипептид с активностью FVIII, содержит не более 6, не более 5, не более 4, не более 3 или не более 2 последовательностей MARS/ARS. В других вариантах осуществления нуклеотидная последовательность, которая кодирует полипептид с активностью FVIII, содержит не более 1 последовательности MARS/ARS. В других вариантах осуществления нуклеотидная последовательность, которая кодирует полипептид с активностью FVIII, не содержит последовательность MARS/ARS.
В других вариантах осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, кодирующую полипептид с активностью FVIII, где нуклеотидная последовательность содержит последовательность нуклеиновой кислоты, характеризующуюся по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 89%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% идентичностью последовательности с (i) нуклеотидами 58-4374 из SEQ ID NOs: 1, 2, 3, 4, 5, 6, 70, или 71 или (ii) нуклеотидами 58-2277 и 2320-4374 из SEQ ID NOs: 1, 2, 3, 4, 5, 6, 70, или 71 (т. e. с нуклеотидами 58-4374 из SEQ ID NO: 1, 2, 3, 4, 5, 6, 70, или 71 без нуклеотидов, кодирующих B-домен или фрагмент B-домена); и где нуклеотидная последовательность содержит меньше последовательностей MARS/ARS по сравнению с SEQ ID NO: 16. В других вариантах осуществления нуклеотидная последовательность, кодирующая полипептид с активностью FVIII, содержит не более 6, не более 5, не более 4, не более 3 или не более 2 последовательностей MARS/ARS. В других вариантах осуществления нуклеотидная последовательность, которая кодирует полипептид с активностью FVIII, содержит не более 1 последовательности MARS/ARS. В других вариантах осуществления нуклеотидная последовательность, которая кодирует полипептид с активностью FVIII, не содержит последовательность MARS/ARS.
В нуклеотидной последовательности FVIII человека были идентифицированы элементы, богатые AT, которые характеризуются сходством последовательности с автономно реплицирующимися последовательностями (ARS) и областями прикрепления к ядерному матриксу (MAR) Saccharomyces cerevisiae (Fallux et al., Mol. Cell. Biol. 16:4264-4272 (1996). Один из данных элементов продемонстрировал связывание с ядерными факторами in vitro и подавление экспрессии репортерного гена хлорамфеникол-ацетилтрансферазы (CAT). Id. Было сделано предположение, что такие последовательности могут способствовать подавлению транскрипции гена FVIII человека. Таким образом, в одном варианте осуществления все последовательности MAR/ARS в гене FVIII по настоящему изобретению удалены. Существует четыре последовательности MAR/ARS ATATTT (SEQ ID NO: 21) и три последовательности MAR/ARS AAATAT (SEQ ID NO: 22) в родительской последовательности FVIII (SEQ ID NO: 16). Все данные сайта подвергали мутации с разрушением последовательностей MAR/ARS в оптимизированных последовательностях FVIII (SEQ ID NO: 1-6). Местоположение каждого из данных элементов и последовательность соответствующих нуклеотидов в оптимизированных последовательностях показаны в таблице 2 ниже.
Таблица 2. Краткое описание изменений в репрессирующих элементах
E. Дестабилизирующие последовательности
В некоторых вариантах осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, описанную в данном документе, которая кодирует полипептид с активностью FVIII, где нуклеотидная последовательность содержит меньше дестабилизирующих элементов по сравнению с SEQ ID NO: 16. В других вариантах осуществления нуклеотидная последовательность, кодирующая полипептид с активностью FVIII, содержит не более 9, не более 8, не более 7, не более 6 или не более 5 дестабилизирующих элементов. В других вариантах осуществления нуклеотидная последовательность, кодирующая полипептид с активностью FVIII, содержит не более 4, не более 3, не более 2 или не более 1 дестабилизирующего элемента. В еще одних вариантах осуществления нуклеотидная последовательность, которая кодирует полипептид с активностью FVIII, не содержит дестабилизирующий элемент.
В одном конкретном варианте осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая содержит первую последовательность нуклеиновой кислоты, кодирующую N-концевую часть полипептида FVIII, и вторую последовательность нуклеиновой кислоты, кодирующую C-концевую часть полипептида FVIII; где первая последовательность нуклеиновой кислоты характеризуется по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 86%, по меньшей мере приблизительно 87%, по меньшей мере приблизительно 88%, по меньшей мере приблизительно 89%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% идентичностью последовательности с (i) нуклеотидами 58-1791 из SEQ ID NO: 3; (ii) нуклеотидами 1-1791 из SEQ ID NO: 3; (iii) нуклеотидами 58-1791 из SEQ ID NO: 4 или (iv) нуклеотидами 1-1791 из SEQ ID NO: 4; где N-концевая часть и C-концевая часть вместе обладают активностью полипептида FVIII; и где нуклеотидная последовательность содержит меньше дестабилизирующих элементов по сравнению с SEQ ID NO: 16. В других вариантах осуществления нуклеотидная последовательность, кодирующая полипептид с активностью FVIII, содержит не более 9, не более 8, не более 7, не более 6 или не более 5 дестабилизирующих элементов. В других вариантах осуществления нуклеотидная последовательность, кодирующая полипептид с активностью FVIII, содержит не более 4, не более 3, не более 2 или не более 1 дестабилизирующего элемента. В еще одних вариантах осуществления нуклеотидная последовательность, которая кодирует полипептид с активностью FVIII, не содержит дестабилизирующий элемент.
В другом варианте осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая содержит первую последовательность нуклеиновой кислоты, кодирующую N-концевую часть полипептида FVIII, и вторую последовательность нуклеиновой кислоты, кодирующую C-концевую часть полипептида FVIII; где вторая последовательность нуклеиновой кислоты характеризуется по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 86%, по меньшей мере приблизительно 87%, по меньшей мере приблизительно 88%, по меньшей мере приблизительно 89%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% идентичностью последовательности с (i) нуклеотидами 1792-4374 из SEQ ID NO: 5; (ii) нуклеотидами 1792-4374 из SEQ ID NO: 6; (iii) нуклеотидами 1792-2277 и 2320-4374 из SEQ ID NO: 5 (т. е. нуклеотидами 1792-4374 из SEQ ID NO: 5 без нуклеотидов, кодирующих B-домен или фрагмент B-домена) или (iv) нуклеотидами 1792-2277 и 2320-4374 из SEQ ID NO: 6 (т. е. нуклеотидами 1792-4374 из SEQ ID NO: 6 без нуклеотидов, кодирующих В-домен или фрагмент В-домена); где N-концевая часть и C-концевая часть вместе обладают активностью полипептида FVIII; и где нуклеотидная последовательность содержит меньше дестабилизирующих элементов по сравнению с SEQ ID NO: 16. В других вариантах осуществления нуклеотидная последовательность, кодирующая полипептид с активностью FVIII, содержит не более 9, не более 8, не более 7, не более 6 или не более 5 дестабилизирующих элементов. В других вариантах осуществления нуклеотидная последовательность, кодирующая полипептид с активностью FVIII, содержит не более 4, не более 3, не более 2 или не более 1 дестабилизирующего элемента. В еще одних вариантах осуществления нуклеотидная последовательность, которая кодирует полипептид с активностью FVIII, не содержит дестабилизирующий элемент.
В других вариантах осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, кодирующую полипептид с активностью FVIII, где нуклеотидная последовательность содержит последовательность нуклеиновой кислоты, характеризующуюся по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 89%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% идентичностью последовательности с (i) нуклеотидами 58-4374 из аминокислотной последовательности, выбранной из SEQ ID NOs: 1, 2, 3, 4, 5, 6, 70, и 71 или (ii) нуклеотидами 58-2277 и 2320-4374 из аминокислотной последовательности, выбранной из SEQ ID NOs: 1, 2, 3, 4, 5, 6, 70, и 71 (т. e. с нуклеотидами 58-4374 из SEQ ID NO: 1, 2, 3, 4, 5, 6, 70, или 71 без нуклеотидов, кодирующих B-домен или фрагмент B-домена); и где нуклеотидная последовательность содержит меньше дестабилизирующих элементов по сравнению с SEQ ID NO: 16. В других вариантах осуществления нуклеотидная последовательность, кодирующая полипептид с активностью FVIII, содержит не более 9, не более 8, не более 7, не более 6 или не более 5 дестабилизирующих элементов. В других вариантах осуществления нуклеотидная последовательность, кодирующая полипептид с активностью FVIII, содержит не более 4, не более 3, не более 2 или не более 1 дестабилизирующего элемента. В еще других вариантах осуществления нуклеотидная последовательность, которая кодирует полипептид с активностью FVIII, не содержит дестабилизирующий элемент.
Существует десять дестабилизирующих элементов в родительской последовательности FVIII (SEQ ID NO: 16): шесть последовательностей ATTTA (SEQ ID NO: 23) и четыре последовательности TAAAT (SEQ ID NO: 24). В одном варианте осуществления последовательности данных сайтов подвергали мутации с целью разрушения дестабилизирующих элементов в оптимизированных FVIII SEQ ID NO: 1-6, 70 и 71. Местоположение каждого из данных элементов и последовательность соответствующих нуклеотидов в оптимизированных последовательностях показаны в таблице 2.
F. Потенциальные сайты связывания промотора
В некоторых вариантах осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, описанную в данном документе, которая кодирует полипептид с активностью FVIII, где нуклеотидная последовательность содержит меньше потенциальных сайтов связывания промотора по сравнению с SEQ ID NO: 16. В других вариантах осуществления нуклеотидная последовательность, кодирующая полипептид с активностью FVIII, содержит не более 9, не более 8, не более 7, не более 6 или не более 5 потенциальных сайтов связывания промотора. В других вариантах осуществления нуклеотидная последовательность, кодирующая полипептид с активностью FVIII, содержит не более 4, не более 3, не более 2 или не более 1 потенциального сайта связывания промотора. В еще одних вариантах осуществления нуклеотидная последовательность, которая кодирует полипептид с активностью FVIII, не содержит потенциальный сайт связывания промотора.
В одном конкретном варианте осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая содержит первую последовательность нуклеиновой кислоты, кодирующую N-концевую часть полипептида FVIII, и вторую последовательность нуклеиновой кислоты, кодирующую C-концевую часть полипептида FVIII; где первая последовательность нуклеиновой кислоты характеризуется по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 86%, по меньшей мере приблизительно 87%, по меньшей мере приблизительно 88%, по меньшей мере приблизительно 89%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% идентичностью последовательности с (i) нуклеотидами 58-1791 из SEQ ID NO: 3; (ii) нуклеотидами 1-1791 из SEQ ID NO: 3; (iii) нуклеотидами 58-1791 из SEQ ID NO: 4 или (iv) нуклеотидами 1-1791 из SEQ ID NO: 4; где N-концевая часть и C-концевая часть вместе обладают активностью полипептида FVIII; и где нуклеотидная последовательность содержит меньше потенциальных сайтов связывания промотора по сравнению с SEQ ID NO: 16.
В других вариантах осуществления нуклеотидная последовательность, кодирующая полипептид с активностью FVIII, содержит не более 9, не более 8, не более 7, не более 6 или не более 5 потенциальных сайтов связывания промотора. В других вариантах осуществления нуклеотидная последовательность, кодирующая полипептид с активностью FVIII, содержит не более 4, не более 3, не более 2 или не более 1 потенциального сайта связывания промотора. В еще одних вариантах осуществления нуклеотидная последовательность, которая кодирует полипептид с активностью FVIII, не содержит потенциальный сайт связывания промотора.
В другом варианте осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая содержит первую последовательность нуклеиновой кислоты, кодирующую N-концевую часть полипептида FVIII, и вторую последовательность нуклеиновой кислоты, кодирующую C-концевую часть полипептида FVIII; где вторая последовательность нуклеиновой кислоты характеризуется по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 86%, по меньшей мере приблизительно 87%, по меньшей мере приблизительно 88%, по меньшей мере приблизительно 89%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% идентичностью последовательности с (i) нуклеотидами 1792-4374 из SEQ ID NO: 5; (ii) нуклеотидами 1792-4374 из SEQ ID NO: 6; (iii) нуклеотидами 1792-2277 и 2320-4374 из SEQ ID NO: 5 (т. е. нуклеотидами 1792-4374 из SEQ ID NO: 5 без нуклеотидов, кодирующих B-домен или фрагмент B-домена) или (iv) нуклеотидами 1792-2277 и 2320-4374 из SEQ ID NO: 6 (т. е. нуклеотидами 1792-4374 из SEQ ID NO: 6 без нуклеотидов, кодирующих В-домен или фрагмент В-домена); где N-концевая часть и C-концевая часть вместе обладают активностью полипептида FVIII; и где нуклеотидная последовательность содержит меньше потенциальных сайтов связывания промотора по сравнению с SEQ ID NO: 16. В других вариантах осуществления нуклеотидная последовательность, кодирующая полипептид с активностью FVIII, содержит не более 9, не более 8, не более 7, не более 6 или не более 5 потенциальных сайтов связывания промотора. В других вариантах осуществления нуклеотидная последовательность, кодирующая полипептид с активностью FVIII, содержит не более 4, не более 3, не более 2 или не более 1 потенциального сайта связывания промотора. В еще одних вариантах осуществления нуклеотидная последовательность, которая кодирует полипептид с активностью FVIII, не содержит потенциальный сайт связывания промотора.
В других вариантах осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, кодирующую полипептид с активностью FVIII, где нуклеотидная последовательность содержит последовательность нуклеиновой кислоты, характеризующуюся по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 89%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% идентичностью последовательности с (i) нуклеотидами 58-4374 из аминокислотной последовательности, выбранной из SEQ ID NOs: 1, 2, 3, 4, 5, 6, 70, и 71 или (ii) нуклеотидами 58-2277 и 2320-4374 из аминокислотной последовательности, выбранной из SEQ ID NOs: 1, 2, 3, 4, 5, 6, 70, и 71 (т. e. с нуклеотидами 58-4374 из SEQ ID NO: 1, 2, 3, 4, 5, 6, 70, или 71 без нуклеотидов, кодирующих B-домен или фрагмент B-домена); и где нуклеотидная последовательность содержит меньше потенциальных сайтов связывания промотора по сравнению с SEQ ID NO: 16. В других вариантах осуществления нуклеотидная последовательность, кодирующая полипептид с активностью FVIII, содержит не более 9, не более 8, не более 7, не более 6 или не более 5 потенциальных сайтов связывания промотора. В других вариантах осуществления нуклеотидная последовательность, кодирующая полипептид с активностью FVIII, содержит не более 4, не более 3, не более 2 или не более 1 потенциального сайта связывания промотора. В еще одних вариантах осуществления нуклеотидная последовательность, которая кодирует полипептид с активностью FVIII, не содержит потенциальный сайт связывания промотора.
TATA-боксы представляют собой регуляторные последовательности, часто выявляемые в промоторных областях у эукариот. Они служат в качестве сайта связывания TATA-связывающего белка (TBP), основного транскрипционного фактора. TATA-боксы обычно содержат последовательность TATAA (SEQ ID NO: 28) или ее родственный вариант. Однако в пределах кодирующей последовательности TATA-боксы могут подавлять трансляцию полноразмерного белка. Существует десять потенциальных последовательностей связывания промотора в последовательности BDD FVIII дикого типа (SEQ ID NO: 16): пять последовательностей TATAA (SEQ ID NO: 28) и пять последовательностей TTATA (SEQ ID NO: 29). В некоторых вариантах осуществления по меньшей мере 1, по меньшей мере 2, по меньшей мере 3 или по меньшей мере 4 сайта связывания промотора удалены в генах FVIII по настоящему изобретению. В некоторых вариантах осуществления по меньшей мере 5 сайтов связывания промотора удалены в генах FVIII по настоящему изобретению. В других вариантах осуществления по меньшей мере 6, по меньшей мере 7 или по меньшей мере 8 сайтов связывания промотора удалены в генах FVIII по настоящему изобретению. В одном варианте осуществления по меньшей мере 9 сайтов связывания промотора удалены в генах FVIII по настоящему изобретению. В одном конкретном варианте осуществления все сайты связывания промотора удалены в генах FVIII по настоящему изобретению. Местоположение каждого потенциального сайта связывания промотора и последовательность соответствующих нуклеотидов в оптимизированных последовательностях показаны в таблице 2.
G. Другие отрицательные регуляторные элементы, действующие в цис-положении
В дополнение к последовательностям MAR/ARS дестабилизирующим элементам и потенциальным сайтам связывания промотора, описанным выше, несколько дополнительный потенциально ингибиторных последовательностей можно идентифицировать в последовательности BDD FVIII дикого типа (SEQ ID NO: 16). Две последовательности богатых AU элементов (ARE) можно идентифицировать (ATTTTATT (SEQ ID NO: 30) и ATTTTTAA (SEQ ID NO: 31) наряду с сайтом поли-A (AAAAAAA; SEQ ID NO: 26), сайтом поли-T (TTTTTT; SEQ ID NO: 25) и сайтом сплайсинга (GGTGAT; SEQ ID NO: 27) в неоптимизированной последовательности BDD FVIII. Один или несколько таких элементов можно удалить из оптимизированных последовательностей FVIII. Местоположение каждого из данных сайтов и последовательность соответствующих нуклеотидов в оптимизированных последовательностях показаны в таблице 2.
В определенных вариантах осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая содержит первую последовательность нуклеиновой кислоты, кодирующую N-концевую часть полипептида FVIII, и вторую последовательность нуклеиновой кислоты, кодирующую C-концевую часть полипептида FVIII; где первая последовательность нуклеиновой кислоты характеризуется по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 86%, по меньшей мере приблизительно 87%, по меньшей мере приблизительно 88%, по меньшей мере приблизительно 89%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% идентичностью последовательности с (i) нуклеотидами 58-1791 из SEQ ID NO: 3; (ii) нуклеотидами 1-1791 из SEQ ID NO: 3; (iii) нуклеотидами 58-1791 из SEQ ID NO: 4 или (iv) нуклеотидами 1-1791 из SEQ ID NO: 4; где N-концевая часть и C-концевая часть вместе обладают активностью полипептида FVIII; и где нуклеотидная последовательность не содержит один или несколько отрицательных регуляторных элементов, действующих в цис-положении, например, сайт сплайсинга, последовательность поли-T, последовательность поли-A, последовательность ARE или любые их комбинации.
В другом варианте осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая содержит первую последовательность нуклеиновой кислоты, кодирующую N-концевую часть полипептида FVIII, и вторую последовательность нуклеиновой кислоты, кодирующую C-концевую часть полипептида FVIII; где вторая последовательность нуклеиновой кислоты характеризуется по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 86%, по меньшей мере приблизительно 87%, по меньшей мере приблизительно 88%, по меньшей мере приблизительно 89%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% идентичностью последовательности с (i) нуклеотидами 1792-4374 из SEQ ID NO: 5; (ii) нуклеотидами 1792-4374 из SEQ ID NO: 6; (iii) нуклеотидами 1792-2277 и 2320-4374 из SEQ ID NO: 5 (т. е. нуклеотидами 1792-4374 из SEQ ID NO: 5 без нуклеотидов, кодирующих B-домен или фрагмент B-домена) или (iv) нуклеотидами 1792-2277 и 2320-4374 из SEQ ID NO: 6 (т. е. нуклеотидами 1792-4374 из SEQ ID NO: 6 без нуклеотидов, кодирующих В-домен и фрагмент В-домена); где N-концевая часть и C-концевая часть вместе обладают активностью полипептида FVIII; и где нуклеотидная последовательность не содержит одного или нескольких отрицательных регуляторных элементов, действующих в цис-положении, например, сайт сплайсинга, последовательность поли-Т, последовательность поли-A, последовательность ARE или любые их комбинации.
В других вариантах осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, кодирующую полипептид с активностью FVIII, где нуклеотидная последовательность содержит последовательность нуклеиновой кислоты, характеризующуюся по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 89%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% идентичностью последовательности с (i) нуклеотидами 58-4374 из аминокислотной последовательности, выбранной из SEQ ID NOs: 1, 2, 3, 4, 5, 6, 70, и 71 или (ii) нуклеотидами 58-2277 и 2320-4374 из аминокислотной последовательности, выбранной из SEQ ID NOs: 1, 2, 3, 4, 5, 6, 70, и 71 (т. e. с нуклеотидами 58-4374 из SEQ ID NO: 1, 2, 3, 4, 5, 6, 70, или 71 без нуклеотидов, кодирующих B-домен или фрагмент B-домена); и где нуклеотидная последовательность не содержит один или несколько отрицательных регуляторных элементов, действующих в цис-положении, например, сайт сплайсинга, последовательность поли-Т, последовательность поли-A, последовательность ARE или любые их комбинации.
В некоторых вариантах осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая содержит первую последовательность нуклеиновой кислоты, кодирующую N-концевую часть полипептида FVIII, и вторую последовательность нуклеиновой кислоты, кодирующую C-концевую часть полипептида FVIII; где первая последовательность нуклеиновой кислоты характеризуется по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 86%, по меньшей мере приблизительно 87%, по меньшей мере приблизительно 88%, по меньшей мере приблизительно 89%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% идентичностью последовательности с (i) нуклеотидами 58-1791 из SEQ ID NO: 3; (ii) нуклеотидами 1-1791 из SEQ ID NO: 3; (iii) нуклеотидами 58-1791 из SEQ ID NO: 4 или (iv) нуклеотидами 1-1791 из SEQ ID NO: 4; где N-концевая часть и C-концевая часть вместе обладают активностью полипептида FVIII; и где нуклеотидная последовательность не содержит сайт сплайсинга GGTGAT (SEQ ID NO: 27).
В некоторых вариантах осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая содержит первую последовательность нуклеиновой кислоты, кодирующую N-концевую часть полипептида FVIII, и вторую последовательность нуклеиновой кислоты, кодирующую C-концевую часть полипептида FVIII; где первая последовательность нуклеиновой кислоты характеризуется по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 86%, по меньшей мере приблизительно 87%, по меньшей мере приблизительно 88%, по меньшей мере приблизительно 89%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% идентичностью последовательности с (i) нуклеотидами 58-1791 из SEQ ID NO: 3; (ii) нуклеотидами 1-1791 из SEQ ID NO: 3; (iii) нуклеотидами 58-1791 из SEQ ID NO: 4 или (iv) нуклеотидами 1-1791 из SEQ ID NO: 4; где N-концевая часть и C-концевая часть вместе обладают активностью полипептида FVIII; и где нуклеотидная последовательность не содержит последовательность поли-Т (SEQ ID NO: 25).
В некоторых вариантах осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая содержит первую последовательность нуклеиновой кислоты, кодирующую N-концевую часть полипептида FVIII, и вторую последовательность нуклеиновой кислоты, кодирующую C-концевую часть полипептида FVIII; где первая последовательность нуклеиновой кислоты характеризуется по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 86%, по меньшей мере приблизительно 87%, по меньшей мере приблизительно 88%, по меньшей мере приблизительно 89%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% идентичностью последовательности с (i) нуклеотидами 58-1791 из SEQ ID NO: 3; (ii) нуклеотидами 1-1791 из SEQ ID NO: 3; (iii) нуклеотидами 58-1791 из SEQ ID NO: 4 или (iv) нуклеотидами 1-1791 из SEQ ID NO: 4; где N-концевая часть и C-концевая часть вместе обладают активностью полипептида FVIII; и где нуклеотидная последовательность не содержит последовательность поли-А (SEQ ID NO: 26).
В некоторых вариантах осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, которая содержит первую последовательность нуклеиновой кислоты, кодирующую N-концевую часть полипептида FVIII, и вторую последовательность нуклеиновой кислоты, кодирующую C-концевую часть полипептида FVIII; где первая последовательность нуклеиновой кислоты характеризуется по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 86%, по меньшей мере приблизительно 87%, по меньшей мере приблизительно 88%, по меньшей мере приблизительно 89%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% идентичностью последовательности с (i) нуклеотидами 58-1791 из SEQ ID NO: 3; (ii) нуклеотидами 1-1791 из SEQ ID NO: 3; (iii) нуклеотидами 58-1791 из SEQ ID NO: 4 или (iv) нуклеотидами 1-1791 из SEQ ID NO: 4; где N-концевая часть и C-концевая часть вместе обладают активностью полипептида FVIII; и где нуклеотидная последовательность не содержит элемента ARE (SEQ ID NO: 30 или SEQ ID NO: 31).
В некоторых вариантах осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, кодирующую полипептид с активностью FVIII, где нуклеотидная последовательность содержит последовательность нуклеиновой кислоты, характеризующуюся по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 89%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% идентичностью последовательности с (i) нуклеотидами 58-4374 из аминокислотной последовательности, выбранной из SEQ ID NOs: 1, 2, 3, 4, 5, 6, 70, и 71 или (ii) нуклеотидами 58-2277 и 2320-4374 из аминокислотной последовательности, выбранной из SEQ ID NOs: 1, 2, 3, 4, 5, 6, 70, и 71 (т. e. с нуклеотидами 58-4374 из SEQ ID NO: 1, 2, 3, 4, 5, 6, 70, или 71 без нуклеотидов, кодирующих B-домен или фрагмент B-домена); и где нуклеотидная последовательность не содержит сайт сплайсинга GGTGAT (SEQ ID NO: 27).
В некоторых вариантах осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, кодирующую полипептид с активностью FVIII, где нуклеотидная последовательность содержит последовательность нуклеиновой кислоты, характеризующуюся по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 89%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% идентичностью последовательности с (i) нуклеотидами 58-4374 из аминокислотной последовательности, выбранной из SEQ ID NOs: 1, 2, 3, 4, 5, 6, 70, и 71 или (ii) нуклеотидами 58-2277 и 2320-4374 из аминокислотной последовательности, выбранной из SEQ ID NOs: 1, 2, 3, 4, 5, 6, 70, и 71 (т. e. с нуклеотидами 58-4374 из SEQ ID NO: 1, 2, 3, 4, 5, 6, 70, или 71 без нуклеотидов, кодирующих B-домен или фрагмент B-домена); и где нуклеотидная последовательность не содержит последовательность поли-Т (SEQ ID NO: 25).
В некоторых вариантах осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, кодирующую полипептид с активностью FVIII, где нуклеотидная последовательность содержит последовательность нуклеиновой кислоты, характеризующуюся по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 89%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% идентичностью последовательности с (i) нуклеотидами 58-4374 аминокислотной последовательности, выбранной из SEQ ID NOs: 1, 2, 3, 4, 5, 6, 70, и 71 или (ii) нуклеотидами 58-2277 и 2320-4374 аминокислотной последовательности, выбранной из SEQ ID NOs: 1, 2, 3, 4, 5, 6, 70, и 71 (т. e. с нуклеотидами 58-4374 из SEQ ID NO: 1, 2, 3, 4, 5, 6, 70, или 71 без нуклеотидов, кодирующих B-домен или фрагмент B-домена); и где нуклеотидная последовательность не содержит последовательность поли-A (SEQ ID NO: 26).
В некоторых вариантах осуществления выделенная молекула нуклеиновой кислоты содержит нуклеотидную последовательность, кодирующую полипептид с активностью FVIII, где нуклеотидная последовательность содержит последовательность нуклеиновой кислоты, характеризующуюся по меньшей мере приблизительно 80%, по меньшей мере приблизительно 85%, по меньшей мере приблизительно 89%, по меньшей мере приблизительно 90%, по меньшей мере приблизительно 91%, по меньшей мере приблизительно 92%, по меньшей мере приблизительно 93%, по меньшей мере приблизительно 94%, по меньшей мере приблизительно 95%, по меньшей мере приблизительно 96%, по меньшей мере приблизительно 97%, по меньшей мере приблизительно 98% или по меньшей мере приблизительно 99% идентичностью последовательности с (i) нуклеотидами 58-4374 из аминокислотной последовательности, выбранной из SEQ ID NOs: 1, 2, 3, 4, 5, 6, 70, и 71 или (ii) нуклеотидами 58-2277 и 2320-4374 из аминокислотной последовательности, выбранной из SEQ ID NOs: 1, 2, 3, 4, 5, 6, 70, и 71 (т. e. с нуклеотидами 58-4374 из SEQ ID NO: 1, 2, 3, 4, 5, 6, 70, или 71 без нуклеотидов, кодирующих B-домен или фрагмент B-домена); и где нуклеотидная последовательность не содержит элемент ARE (SEQ ID NO: 30 или SEQ ID NO: 31).
В других вариантах осуществления оптимизированная последовательность FVIII по настоящему изобретению не содержит один или несколько из противовирусных мотивов, структур типа "cтебель-петля" и последовательностей повтора.
В еще одних других вариантах осуществления нуклеотиды, окружающие сайт инициации транскрипции, заменены на консенсусную последовательность Козак (GCCGCCACCATGC (SEQ ID NO: 32), где подчеркнутые нуклеотиды представляют собой старт-кодон). В других вариантах осуществления сайты рестрикции можно добавить или удалить с целью улучшения процесса клонирования.
H. Гетерологичные нуклеотидные последовательности
В некоторых вариантах осуществления выделенная молекула нуклеиновой кислоты дополнительно содержит гетерологичную нуклеотидную последовательность. В некоторых вариантах осуществления выделенная молекула нуклеиновой кислоты дополнительно содержит по меньшей мере одну гетерологичную нуклеотидную последовательность. Гетерологичная нуклеотидная последовательность может быть связана с оптимизированными нуклеотидными последовательностями BDD-FVIII по настоящему изобретению на 5'-конце, на 3'-конце или вставлена в середину оптимизированной нуклеотидной последовательности BDD-FVIII. Таким образом, в некоторых вариантах осуществления гетерологичная аминокислотная последовательность, кодируемая гетерологичной нуклеотидной последовательностью, связана с N-концом или C-концом аминокислотной последовательности FVIII, кодируемой нуклеотидной последовательностью, или вставлена между двумя аминокислотами в аминокислотную последовательность FVIII. В некоторых вариантах осуществления гетерологичная аминокислотная последовательность может быть вставлена между двумя аминокислотами в одном или нескольких сайтах вставки, выбранных из таблицы 3. В некоторых вариантах осуществления гетерологичная аминокислотная последовательность может быть вставлена в полипептид FVIII, кодируемый молекулой нуклеиновой кислоты по настоящему изобретению, в любом сайте, раскрытом в международной публикации № WO 2013/123457 A1, WO 2015/106052 A1 или публикации заявки на патент США № 2015/0158929 А1, которые включены в данный документ посредством ссылки во всей своей полноте.
В некоторых вариантах осуществления гетерологичная аминокислотная последовательность, кодируемая гетерологичной нуклеотидной последовательностью, вставлена в B-домен или его фрагмент. В некоторых вариантах осуществления гетерологичная аминокислотная последовательность вставлена в FVIII непосредственно ниже аминокислоты, соответствующей аминокислоте 745 зрелого FVIII человека (SEQ ID NO:15). В одном конкретном варианте осуществления FVIII содержит делецию аминокислот 746-1646, соответствующих зрелому FVIII человека (SEQ ID NO:15), и гетерологичная аминокислотная последовательность, кодируемая гетерологичной нуклеотидной последовательностью, вставлена непосредственно ниже аминокислоты 745, соответствующей зрелому FVIII человека (SEQ ID NO:15).
Таблица 3. Сайты вставки гетерологичного компонента
вставки
вставки
Примечание: сайты вставки указывают положение аминокислоты, соответствующее положению аминокислоты в зрелом FVIII человека (SEQ ID NO: 15).
В других вариантах осуществления выделенная молекула нуклеиновой кислоты дополнительно содержат две, три, четыре, пять, шесть, семь или восемь гетерологичных нуклеотидных последовательностей. В некоторых вариантах осуществления все гетерологичные нуклеотидные последовательности являются идентичными. В некоторых вариантах осуществления по меньшей мере одна гетерологичная нуклеотидная последовательность отличается от других гетерологичных нуклеотидных последовательностей. В некоторых вариантах осуществления настоящее изобретение может предусматривать две, три, четыре, пять, шесть или более семи гетерологичных нуклеотидных последовательностей в тандеме.
В некоторых вариантах осуществления гетерологичная нуклеотидная последовательность кодирует аминокислотную последовательность. В некоторых вариантах осуществления аминокислотная последовательность, кодируемая гетерологичной нуклеотидной последовательностью, представляет собой гетерологичный фрагмент, который может увеличивать период полужизни ("средство, увеличивающее период полужизни") молекулы FVIII.
В некоторых вариантах осуществления гетерологичный компонент представляет собой пептид или полипептид с неструктурными или структурными характеристиками, которые связаны с увеличением периода полужизни in vivo при встраивании в белок по настоящему изобретению. Неограничивающие примеры включают альбумин, фрагменты альбумина, Fc-фрагменты иммуноглобулинов, C-концевой пептид (CTP) β-субъединицы хорионического гонадотропина человека, последовательность HAP, последовательность XTEN, трансферрин или его фрагмент, полипептид PAS, полиглициновые линкеры, полисериновые линкеры, альбумин-связывающие компоненты или любые фрагменты, производные, варианты или комбинации этих полипептидов. В одном конкретном варианте осуществления гетерологичная аминокислотная последовательность представляет собой константную область иммуноглобулина или ее часть, трансферрин, альбумин или последовательность PAS.
В некоторых аспектах гетерологичный компонент включает фактор фон Виллебранда или его фрагмент. В других связанных аспектах гетерологичный компонент может включать сайт присоединения (например, аминокислоту цистеин) компонента, не являющегося полипептидом, такого как полиэтиленгликоль (PEG), гидроксиэтилкрахмал (HES), полисиаловая кислота или любые производные, варианты или комбинации этих элементов. В некоторых аспектах гетерологичный компонент включает аминокислоту цистеин, которая функционирует как сайт присоединения компонента, не являющегося полипептидом, такого как полиэтиленгликоль (PEG), гидроксиэтилкрахмал (HES), полисиаловая кислота или любые производные, варианты или комбинации этих элементов.
В одном конкретном варианте осуществления первая гетерологичная нуклеотидная последовательность кодирует первый гетерологичный компонент, который является молекулой, увеличивающей период полужизни, известной в данной области техники, а вторая гетерологичная нуклеотидная последовательность кодирует второй гетерологичный компонент, который также может быть молекулой, увеличивающей период полужизни, известной в данной области техники. В определенных вариантах осуществления первый гетерологичный компонент (например, первый Fc-компонент) и второй гетерологичный компонент (например, второй Fc-компонент) связаны друг с другом с образованием димера. В одном варианте осуществления второй гетерологичный компонент представляет собой второй Fc-компонент, где второй Fc-компонент соединен или связан с первым гетерологичным компонентом, например, с первым Fc-компонентом. Например, второй гетерологичный компонент (например, второй Fc-компонент) может быть связан с первым гетерологичным компонентом (например, первым Fc-компонентом) с помощью линкера или связан с первым гетерологичным компонентом ковалентной или нековалентной связью.
В некоторых вариантах осуществления гетерологичный компонент представляет собой полипептид, содержащий по меньшей мере приблизительно 10, по меньшей мере приблизительно 100, по меньшей мере приблизительно 200, по меньшей мере приблизительно 300, по меньшей мере приблизительно 400, по меньшей мере приблизительно 500, по меньшей мере приблизительно 600, по меньшей мере приблизительно 700, по меньшей мере приблизительно 800, по меньшей мере приблизительно 900, по меньшей мере приблизительно 1000, по меньшей мере приблизительно 1100, по меньшей мере приблизительно 1200, по меньшей мере приблизительно 1300, по меньшей мере приблизительно 1400, по меньшей мере приблизительно 1500, по меньшей мере приблизительно 1600, по меньшей мере приблизительно 1700, по меньшей мере приблизительно 1800, по меньшей мере приблизительно 1900, по меньшей мере приблизительно 2000, по меньшей мере приблизительно 2500, по меньшей мере приблизительно 3000 или по меньшей мере приблизительно 4000 аминокислот, состоящий по сути из них или состоящий из них.
В других вариантах осуществления гетерологичный компонент представляет собой полипептид, содержащий от приблизительно 100 до приблизительно 200 аминокислот, от приблизительно 200 до приблизительно 300 аминокислот, от приблизительно 300 до приблизительно 400 аминокислот, от приблизительно 400 до приблизительно 500 аминокислот, от приблизительно 500 до приблизительно 600 аминокислот, от приблизительно 600 до приблизительно 700 аминокислот, от приблизительно 700 до приблизительно 800 аминокислот, от приблизительно 800 до приблизительно 900 аминокислот или от приблизительно 900 до приблизительно 1000 аминокислот, состоящий по сути из них или состоящий из них.
В определенных вариантах осуществления гетерологичный компонент улучшает одно или несколько фармакокинетических свойств белка FVIII без значительного влияния на его биологическую активность или функцию.
В определенных вариантах осуществления гетерологичный компонент увеличивает период полужизни in vivo и/или in vitro белка FVIII по настоящему изобретению. В других вариантах осуществления гетерологичный компонент способствует визуализации или локализации белка FVIII по настоящему изобретению или его фрагмента (например, фрагмента, содержащего гетерологичный компонент после протеолитического расщепления белка FVIII). Визуализация и/или локализация белка FVIII по настоящему изобретению или его фрагмента может выполняться в условиях in vivo, in vitro, ex vivo или в их комбинациях.
В других вариантах осуществления гетерологичный компонент повышает стабильность белка FVIII по настоящему изобретению или его фрагмента (например, фрагмента, содержащего гетерологичный компонент после протеолитического расщепления белка FVIII). Используемый в данном документе термин "стабильность" относится к принятому в данном области показателю, отображающему поддержание одного или нескольких физических свойств белка FVIII в ответ на условия окружающей среды (например, повышенную или пониженную температуру). В определенных аспектах физическое свойство может представлять собой поддержание ковалентной структуры белка FVIII (например, отсутствие протеолитического расщепления, нежелательного окисления или дезамидирования). В других аспектах физическое свойство также может представлять собой присутствие белка FVIII в правильно уложенном состоянии (например, отсутствие растворимых или нерастворимых агрегатов или осадков).
В одном аспекте стабильность белка FVIII измеряют путем анализа биофизического свойства белка FVIII, например, термостабильности, профиля развертывания под действием pH, стабильного удаления сайтов гликозилирования, растворимости, биохимической функции (например, способности связываться с белком, рецептором или лигандом) и т. д. и/или их комбинации. В другом аспекте биохимическая функция демонстрируется по аффинности связывания при взаимодействии. В одном аспекте показателем стабильности белка является термостабильность, т. е. устойчивость к тепловой нагрузке. Стабильность можно измерять с применением способов, известных в данной области техники, таких как HPLC (высокоэффективная жидкостная хроматография), SEC (эксклюзионная хроматография), DLS (динамическое рассеяние света) и т. д. Способы измерения термостабильности включают без ограничения дифференциальную сканирующую калориметрию (DSC), дифференциальную сканирующую флуориметрию (DSF), круговой дихроизм (CD) и анализ стабильности при тепловой нагрузке.
В определенных аспектах белок FVIII, кодируемый молекулой нуклеиновой кислоты по настоящему изобретению, содержит по меньшей мере одно средство, увеличивающее период полужизни, т. е. гетерологичный компонент, который увеличивает период полужизни in vivo белка FVIII по сравнению с периодом полужизни in vivo соответствующего белка FVIII, в котором отсутствует такой гетерологичный компонент. Период полужизни in vivo белка FVIII может быть определен с помощью любых способов, известных специалистам в данной области техники, например, посредством анализов активности (хромогенного анализа или одностадийного анализа свертывания крови с определением aPTT), ELISA, ROTEMTM и т. д.
В некоторых вариантах осуществления присутствие одного или нескольких средств, увеличивающих период полужизни, приводит к увеличению периода полужизни белка FVIII по сравнению с периодом полужизни соответствующего белка, в котором отсутствуют такие одно или несколько средств, увеличивающих период полужизни. Период полужизни белка FVIII, содержащего средство, увеличивающее период полужизни, является в по меньшей мере приблизительно 1,5 раза, по меньшей мере приблизительно 2 раза, по меньшей мере приблизительно 2,5 раза, по меньшей мере приблизительно 3 раза, по меньшей мере приблизительно 4 раза, по меньшей мере приблизительно 5 раз, по меньшей мере приблизительно 6 раз, по меньшей мере приблизительно 7 раз, по меньшей мере приблизительно 8 раз, по меньшей мере приблизительно 9 раз, по меньшей мере приблизительно 10 раз, по меньшей мере приблизительно 11 раз или по меньшей мере приблизительно 12 раз более длительным, чем период полужизни in vivo соответствующего белка FVIII, в котором отсутствует такое средство, увеличивающее период полужизни.
В одном варианте осуществления период полужизни белка FVIII, содержащего средство, увеличивающее период полужизни, является в от приблизительно 1,5 раза до приблизительно 20 раз, от приблизительно 1,5 раза до приблизительно 15 раз или от приблизительно 1,5 раза до приблизительно 10 раз более длительным, чем период полужизни in vivo соответствующего белка, в котором отсутствует такое средство, увеличивающее период полужизни. В другом варианте осуществления период полужизни белка FVIII, содержащего средство, увеличивающее период полужизни, является увеличенным в от приблизительно 2 раз до приблизительно 10 раз, от приблизительно 2 раз до приблизительно 9 раз, от приблизительно 2 раз до приблизительно 8 раз, от приблизительно 2 раз до приблизительно 7 раз, от приблизительно 2 раз до приблизительно 6 раз, от приблизительно 2 раз до приблизительно 5 раз, от приблизительно 2 раз до приблизительно 4 раз, от приблизительно 2 раз до приблизительно 3 раз, от приблизительно 2,5 раза до приблизительно 10 раз, от приблизительно 2,5 раза до приблизительно 9 раз, от приблизительно 2,5 раза до приблизительно 8 раз, от приблизительно 2,5 раза до приблизительно 7 раз, от приблизительно 2,5 раза до приблизительно 6 раз, от приблизительно 2,5 раза до приблизительно 5 раз, от приблизительно 2,5 раза до приблизительно 4 раз, от приблизительно 2,5 раза до приблизительно 3 раз, от приблизительно 3 раз до приблизительно 10 раз, от приблизительно 3 раз до приблизительно 9 раз, от приблизительно 3 раз до приблизительно 8 раз, от приблизительно 3 раз до приблизительно 7 раз, от приблизительно 3 раз до приблизительно 6 раз, от приблизительно 3 раз до приблизительно 5 раз, от приблизительно 3 раз до приблизительно 4 раз, от приблизительно 4 раз до приблизительно 6 раз, от приблизительно 5 раз до приблизительно 7 раз или от приблизительно 6 раз до приблизительно 8 раз по сравнению с периодом полужизни in vivo соответствующего белка, в котором отсутствует такое средство, увеличивающее период полужизни.
В других вариантах осуществления период полужизни белка FVIII, содержащего средство, увеличивающее период полужизни, составляет по меньшей мере приблизительно 17 часов, по меньшей мере приблизительно 18 часов, по меньшей мере приблизительно 19 часов, по меньшей мере приблизительно 20 часов, по меньшей мере приблизительно 21 час, по меньшей мере приблизительно 22 часа, по меньшей мере приблизительно 23 часа, по меньшей мере приблизительно 24 часа, по меньшей мере приблизительно 25 часов, по меньшей мере приблизительно 26 часов, по меньшей мере приблизительно 27 часов, по меньшей мере приблизительно 28 часов, по меньшей мере приблизительно 29 часов, по меньшей мере приблизительно 30 часов, по меньшей мере приблизительно 31 час, по меньшей мере приблизительно 32 часа, по меньшей мере приблизительно 33 часа, по меньшей мере приблизительно 34 часа, по меньшей мере приблизительно 35 часов, по меньшей мере приблизительно 36 часов, по меньшей мере приблизительно 48 часов, по меньшей мере приблизительно 60 часов, по меньшей мере приблизительно 72 часа, по меньшей мере приблизительно 84 часа, по меньшей мере приблизительно 96 часов или по меньшей мере приблизительно 108 часов.
В следующих вариантах осуществления период полужизни белка FVIII, содержащего средство, увеличивающее период полужизни, составляет от приблизительно 15 часов до приблизительно двух недель, от приблизительно 16 часов до приблизительно одной недели, от приблизительно 17 часов до приблизительно одной недели, от приблизительно 18 часов до приблизительно одной недели, от приблизительно 19 часов до приблизительно одной недели, от приблизительно 20 часов до приблизительно одной недели, от приблизительно 21 часа до приблизительно одной недели, от приблизительно 22 часов до приблизительно одной недели, от приблизительно 23 часов до приблизительно одной недели, от приблизительно 24 часов до приблизительно одной недели, от приблизительно 36 часов до приблизительно одной недели, от приблизительно 48 часов до приблизительно одной недели, от приблизительно 60 часов до приблизительно одной недели, от приблизительно 24 часов до приблизительно шести дней, от приблизительно 24 часов до приблизительно пяти дней, от приблизительно 24 часов до приблизительно четырех дней, от приблизительно 24 часов до приблизительно трех дней или от приблизительно 24 часов до приблизительно двух дней.
В некоторых вариантах осуществления средний период полужизни белка FVIII, содержащего средство, увеличивающее период полужизни, у субъекта составляет приблизительно 15 часов, приблизительно 16 часов, приблизительно 17 часов, приблизительно 18 часов, приблизительно 19 часов, приблизительно 20 часов, приблизительно 21 час, приблизительно 22 часа, приблизительно 23 часа, приблизительно 24 часа (1 сутки), приблизительно 25 часов, приблизительно 26 часов, приблизительно 27 часов, приблизительно 28 часов, приблизительно 29 часов, приблизительно 30 часов, приблизительно 31 час, приблизительно 32 часа, приблизительно 33 часа, приблизительно 34 часа, приблизительно 35 часов, приблизительно 36 часов, приблизительно 40 часов, приблизительно 44 часа, приблизительно 48 часов (2 суток), приблизительно 54 часа, приблизительно 60 часов, приблизительно 72 часа (3 суток), приблизительно 84 часа, приблизительно 96 часов (4 суток), приблизительно 108 часов, приблизительно 120 часов (5 суток), приблизительно шесть дней, приблизительно семь дней (одна неделя), приблизительно восемь дней, приблизительно девять дней, приблизительно 10 дней, приблизительно 11 дней, приблизительно 12 дней, приблизительно 13 дней или приблизительно 14 дней.
Одно или несколько средств, увеличивающих период полужизни, могут быть слиты с С-концом или N-концом FVIII или вставлены в FVIII.
1. Константная область иммуноглобулина или ее часть
В другом аспекте гетерологичный компонент содержит одну или несколько константных областей иммуноглобулина или их частей (например, Fc-область). В одном варианте осуществления выделенная молекула нуклеиновой кислоты по настоящему изобретению дополнительно содержит гетерологичную последовательность нуклеиновой кислоты, которая кодирует константную область иммуноглобулина или ее часть. В некоторых вариантах осуществления константная область иммуноглобулина или ее часть представляет собой Fc-область.
Константная область иммуноглобулина состоит из доменов, обозначенных как СН- (константные, тяжелая цепь) домены (СН1, СН2 и т. д.). В зависимости от изотипа (т. е. IgG, IgM, IgA, IgD или IgE) константная область может состоять из трех или четырех доменов СН. Константные области некоторых изотипов (например, IgG) также содержат шарнирную область. См. Janeway et al. 2001, Immunobiology, Garland Publishing, N.Y., N.Y.
Константная область иммуноглобулина или ее часть для получения белка FVIII по настоящему изобретению могут быть получены из ряда различных источников. В одном варианте осуществления константная область иммуноглобулина или ее часть получены из иммуноглобулина человека. Однако следует понимать, что константная область иммуноглобулина или ее часть могут быть получены из иммуноглобулина другого вида млекопитающего, в том числе, например, вида грызуна (например, мыши, крысы, кролика, морской свинки) или примата, отличного от человека (например, шимпанзе, макака). Кроме того, константная область иммуноглобулина или ее часть могут быть получены из любого класса иммуноглобулинов, в том числе IgM, IgG, IgD, IgA и IgE, и любого изотипа иммуноглобулинов, в том числе IgG1, IgG2, IgG3 и IgG4. В одном варианте осуществления применяют изотип IgG1 человека.
Разнообразные последовательности генов константных областей иммуноглобулинов (например, последовательности генов константных областей человека) доступны в форме общедоступных депозитариев. Можно выбрать последовательность домена константной области, обладающую конкретной эффекторной функцией (или не обладающую конкретной эффекторной функцией) или имеющую конкретную модификацию для снижения иммуногенности. Было опубликовано большое количество последовательностей антител и генов, кодирующих антитела, и подходящие последовательности константных областей Ig (например, последовательности шарнирных областей, СН2 и/или СН3 или их части) могут быть получены из этих последовательностей с применением методик, принятых в данной области техники. Генетический материал, полученный с применением любого из вышеуказанных способов, можно затем подвергать изменению или синтезу с получением полипептидов по настоящему изобретению. Дополнительно следует понимать, что объем настоящего изобретения охватывает аллели, варианты и мутации последовательностей ДНК константных областей.
Последовательности константной области иммуноглобулина или ее части могут быть клонированы, например, с применением полимеразной цепной реакции и праймеров, выбранных для амплификации домена, представляющего интерес. Для клонирования константной области иммуноглобулина или ее части из антитела можно выделить мРНК из клеток гибридомы, селезенки или лимфатических клеток, подвергнуть ее обратной транскрипции с образованием ДНК и амплифицировать гены антитела с помощью ПЦР. Способы ПЦР-амплификации подробно описаны в патентах США №№ 4683195; 4683202; 4800159; 4965188 и, например, в "PCR Protocols: A Guide to Methods and Applications" под ред. Innis et al., Academic Press, Сан-Диего, штат Калифорния (1990); Ho et al. 1989. Gene 77:51; Horton et al. 1993. Methods Enzymol. 217:270). ПЦР можно инициировать с помощью консенсусных праймеров для константной области или с помощью более специфических праймеров на основе опубликованных последовательностей ДНК и аминокислот, соответствующих тяжелым и легким цепям. ПЦР также можно применять для выделения ДНК-клонов, кодирующих легкие и тяжелые цепи антител. В этом случае можно осуществлять скрининг библиотек с помощью консенсусных праймеров или более крупных гомологичных зондов, таких как зонды для константных областей мыши. Из уровня техники известны многочисленные наборы праймеров, подходящие для амплификации генов антител (например, 5’-праймеры на основе N-концевой последовательности очищенных антител (Benhar and Pastan. 1994. Protein Engineering 7:1509); праймеры для быстрой амплификации концов кДНК (Ruberti, F. et al. 1994. J. Immunol. Methods 173:33); праймеры для лидерных последовательностей антител (Larrick et al. 1989 Biochem. Biophys. Res. Commun. 160:1250). Клонирование последовательностей антител дополнительно описано в выданном Newman et al. патенте США № 5658570, заявка на который была подана 25 января 1995 г., который включен в данный документ посредством ссылки.
Используемая в данном документе константная область иммуноглобулина может включать все домены и шарнирную область или их части. В одном варианте константная область иммуноглобулина или ее часть содержат домен СН2, домен СН3 и шарнирную область, т. е. Fc-область или партнера по связыванию FcRn.
Используемый в данном документе термин "Fc-область" определяется как часть полипептида, которая соответствует Fc-области нативного Ig, т. e. образована путем димерной ассоциации соответствующих Fc-доменов двух его тяжелых цепей. Нативная Fc-область образует гомодимер с другой Fc-областью. В отличие от этого, термины "генетически слитая Fc-область" или "одноцепочечная Fc-область" (scFc-область), используемые в данном документе, относятся к синтетической димерной Fc-области, состоящей из Fc-доменов, генетически соединенных в одну полипептидную цепь (т. е. кодируемых одной непрерывной генетической последовательностью). См. международную публикацию № WO 2012/006635, включенную в данный документ посредством ссылки во всей своей полноте.
В одном варианте осуществления "Fc-область" относится к части одной тяжелой цепи Ig, начинающейся в шарнирной области непосредственно выше сайта расщепления папаином (т. е. остатка 216 в IgG, если принять первый остаток константной области тяжелой цепи за 114) и заканчивающейся на С-конце антитела. Соответственно, полная Fc-область содержит по меньшей мере шарнирный домен, CH2-домен и CH3-домен.
Константная область иммуноглобулина или ее часть может быть партнером по связыванию FcRn. FcRn активен в зрелых эпителиальных тканях и экспрессируется в просвете кишечника, легочных дыхательных путях, поверхностях носа, поверхностях влагалища, поверхностях толстой и прямой кишки (патент США № 6485726). Партнер по связыванию FcRn представляет собой часть иммуноглобулина, которая связывается с FcRn.
Рецептор FcRn был выделен у некоторых видов млекопитающих, в том числе у людей. Известны последовательности FcRn человека, FcRn обезьяны, FcRn крысы и FcRn мыши (Story et al. 1994, J. Exp. Med. 180:2377). Рецептор FcRn связывает IgG (но не иммуноглобулины других классов, таких как IgA, IgM, IgD и IgE) при относительно низком значении pH, осуществляет активный транспорт IgG через клетки по направлению от просвета к серозной оболочке, а затем высвобождает IgG при относительно более высоком значении pH, обнаруживаемом в интерстициальных жидкостях. Он экспрессируется в зрелой эпителиальной ткани (патенты США №№ 6485726, 6030613, 6086875; WO 03/077834; US2003-0235536A1), в том числе в эпителии легких и кишечника (Israel et al. 1997, Immunology 92:69), эпителии почечных проксимальных канальцев (Kobayashi et al. 2002, Am. J. Physiol. Renal Physiol. 282: F358), а также эпителии полости носа, на поверхностях влагалища и поверхностях билиарного дерева.
Партнеры по связыванию FcRn, применимые в настоящем изобретении, охватывают молекулы, которые могут специфически связываться с рецептором FcRn, в том числе целый IgG, Fc-фрагмент IgG и другие фрагменты, которые включают полную связывающую область для рецептора FcRn. Область Fc-части IgG, которая связывается с рецептором FcRn, была описана с использованием рентгеноструктурной кристаллографии (Burmeister et al. 1994, Nature 372:379). Основная область контакта Fc с FcRn расположена рядом с границей доменов CH2 и CH3. Все области контакта Fc-FcRn находятся в пределах одной тяжелой цепи Ig. Партнеры по связыванию FcRn включают целый IgG, Fc-фрагмент IgG и другие фрагменты IgG, которые включают полную связывающую область для FcRn. Основные сайты контакта включают аминокислотные остатки 248, 250-257, 272, 285, 288, 290-291, 308-311 и 314 из домена CH2 и аминокислотные остатки 385-387, 428 и 433-436 из домена CH3. Все ссылки на нумерацию аминокислот иммуноглобулинов или фрагментов или областей иммуноглобулинов приведены согласно Kabat et al. 1991, Sequences of Proteins of Immunological Interest, U.S. Department of Public Health, Бетесда, штат Мэриленд.
Fc-области или партнеры по связыванию FcRn, связанные с FcRn, могут эффективно переноситься через эпителиальные барьеры с помощью FcRn с обеспечением таким образом неинвазивного способа системного введения требуемой терапевтической молекулы. Кроме того, слитые белки, содержащие Fc-область или партнера по связыванию FcRn, подвергаются эндоцитозу клетками, экспрессирующими FcRn. Но вместо маркировки для деградации эти слитые белки снова возвращаются в кровоток, за счет чего увеличивается период полужизни этих белков in vivo. В определенных вариантах осуществления части константных областей иммуноглобулина представляют собой Fc-область или партнера по связыванию FcRn, который обычно связывается посредством дисульфидных связей и других неспецифических взаимодействий с другой Fc-областью или другим партнером по связыванию FcRn с образованием димеров и мультимеров более высокого порядка.
Два рецептора FcRn могут связывать одну молекулу Fc. Кристаллографические данные позволяют предположить, что каждая молекула FcRn связывает один полипептид гомодимера Fc. В одном варианте осуществления связывание партнера по связыванию FcRn, например Fc-фрагмента IgG, с биологически активной молекулой обеспечивает способ доставки биологически активной молекулы пероральным, трансбуккальным, сублингвальным, ректальным, вагинальным путем, в виде аэрозоля, вводимого назально, или посредством легочного пути, или посредством глазного пути. В другом варианте осуществления белок FVIII можно вводить инвазивным способом, например, подкожно, внутривенно.
Область партнера по связыванию FcRn представляет собой молекулу или ее часть, которая может специфически связываться с рецептором FcRn с последующим активным транспортом Fc-области с помощью рецептора FcRn. "Специфически связывающийся" относится к двум молекулам, образующим комплекс, который является относительно стабильным в физиологических условиях. Специфическое связывание характеризуется высокой аффинностью и емкостью от низкой до умеренной в отличие от неспецифического связывания, которое обычно характеризуется низкой аффинностью и емкостью от умеренной до высокой. Как правило, связывание считается специфическим, если константа аффинности KA превышает 106 M-1 или превышает 108 M-1. При необходимости неспецифическое связывание можно снизить без существенного влияния на специфическое связывание путем изменения условий связывания. Соответствующие условия связывания, такие как концентрация молекул, ионная сила раствора, температура, допустимое время связывания, концентрация блокирующего средства (например, сывороточного альбумина, казеина молока) и т. д., могут быть оптимизированы специалистом в данной области с применением обычных методик.
В определенных вариантах осуществления белок FVIII, кодируемый молекулой нуклеиновой кислоты по настоящему изобретению, содержит одну или несколько усеченных Fc-областей, которые, тем не менее, являются достаточными для придания Fc-области свойств связывания с Fc-рецептором (FcR). Например, часть Fc-области, которая связывается с FcRn (т. е. FcRn-связывающая часть), содержит приблизительно аминокислоты 282-438 из IgG1 согласно нумерации EU (при этом основными сайтами контакта являются аминокислоты 248, 250-257, 272, 285, 288, 290-291, 308-311, и 314 из CH2-домена и аминокислотные остатки 385-387, 428 и 433-436 из CH3-домена). Таким образом, Fc-область по настоящему изобретению может содержать FcRn-связывающую часть или состоять из нее. FcRn-связывающие части могут быть получены из тяжелых цепей любого изотипа, в том числе IgG1, IgG2, IgG3 и IgG4. В одном варианте осуществления применяют FcRn-связывающую часть из антитела изотипа IgG1 человека. В другом варианте осуществления применяют FcRn-связывающую часть из антитела изотипа IgG4 человека.
Fc-область может быть получена из ряда различных источников. В одном варианте осуществления Fc-область полипептида получена из иммуноглобулина человека. Однако следует понимать, что Fc-компонент может быть получен из иммуноглобулина другого вида млекопитающего, в том числе, например, вида грызуна (например, мыши, крысы, кролика, морской свинки) или примата, отличного от человека (например, шимпанзе, макака). Более того, полипептидные Fc-домены или их части могут быть получены из любого класса иммуноглобулинов, в том числе IgM, IgG, IgD, IgA и IgE, и любого изотипа иммуноглобулинов, в том числе IgG1, IgG2, IgG3 и IgG4. В другом варианте осуществления применяют изотип IgG1 человека.
В определенных вариантах осуществления вариант Fc обеспечивает изменение по меньшей мере одной эффекторной функции, придаваемой Fc-компонентом, содержащим указанный Fc-домен дикого типа (например, улучшение или снижение способности Fc-области к связыванию с Fc-рецепторами (например, FcγRI, FcγRII или FcγRIII), или белками системы комплемента (например, C1q), или индуцирует антителозависимую цитотоксичность (ADCC), фагоцитоз или комплементзависимую цитотоксичность (CDCC)). В других вариантах осуществления в варианте Fc предусмотрен сконструированный цистеиновый остаток.
В качестве Fc-области по настоящему изобретению можно использовать известные из уровня техники варианты Fc, которые, как известно, придают изменение (например, усиление или снижение) эффекторной функции и/или связывания FcR или FcRn. В частности, Fc-область по настоящему изобретению может содержать, например, изменение (например, замену) в одном или нескольких аминокислотных положениях, раскрытых в международных публикациях согласно PCT WO88/07089A1, WO96/14339A1, WO98/05787A1, WO98/23289A1, WO99/51642A1, WO99/58572A1, WO00/09560A2, WO00/32767A1, WO00/42072A2, WO02/44215A2, WO02/060919A2, WO03/074569A2, WO04/016750A2, WO04/029207A2, WO04/035752A2, WO04/063351A2, WO04/074455A2, WO04/099249A2, WO05/040217A2, WO04/044859, WO05/070963A1, WO05/077981A2, WO05/092925A2, WO05/123780A2, WO06/019447A1, WO06/047350A2, и WO06/085967A2; публикациях заявок на патент США №№ US2007/0231329, US2007/0231329, US2007/0237765, US2007/0237766, US2007/0237767, US2007/0243188, US2007/0248603, US2007/0286859, US2008/0057056; или патентах США №№ 5648260; 5739277; 5834250; 5869046; 6096871; 6121022; 6194551; 6242195; 6277375; 6528624; 6538124; 6737056; 6821505; 6998253; 7083784; 7404956 и 7317091, каждая из которых включена в данный документ посредством ссылки. В одном варианте осуществления конкретное изменение (например, конкретная замена одной или нескольких аминокислот, раскрытых в данной области техники) может быть осуществлено в одном или нескольких раскрытых положениях аминокислот. В другом варианте осуществления может быть осуществлено другое изменение в одном или нескольких раскрытых положениях аминокислот (например, другая замена в одном или нескольких положениях аминокислот, раскрытых в данной области техники).
Fc-область IgG или его партнер по связыванию FcRn могут быть модифицированы в соответствии с хорошо известными процедурами, такими как сайт-направленный мутагенез и т. п., с получением модифицированных IgG или Fc-фрагментов или их частей, которые будут связываться с FcRn. Такие модификации включают модификации в отдалении от сайтов контакта с FcRn, а также модификации в пределах сайтов контакта, которые обеспечивают сохранение или даже усиление связывания с FcRn. Например, следующие отдельные аминокислотные остатки в Fc IgG1 человека (Fcγ1) могут быть заменены без значительной потери аффинности связывания Fc в отношении FcRn: P238A, S239A, K246A, K248A, D249A, M252A, T256A, E258A, T260A, D265A, S267A, H268A, E269A, D270A, E272A, L274A, N276A, Y278A, D280A, V282A, E283A, H285A, N286A, T289A, K290A, R292A, E293A, E294A, Q295A, Y296F, N297A, S298A, Y300F, R301A, V303A, V305A, T307A, L309A, Q311A, D312A, N315A, K317A, E318A, K320A, K322A, S324A, K326A, A327Q, P329A, A330Q, P331A, E333A, K334A, T335A, S337A, K338A, K340A, Q342A, R344A, E345A, Q347A, R355A, E356A, M358A, T359A, K360A, N361A, Q362A, Y373A, S375A, D376A, A378Q, E380A, E382A, S383A, N384A, Q386A, E388A, N389A, N390A, Y391F, K392A, L398A, S400A, D401A, D413A, K414A, R416A, Q418A, Q419A, N421A, V422A, S424A, E430A, N434A, T437A, Q438A, K439A, S440A, S444A, и K447A, где, например, P238A представляет пролин дикого типа, замененный аланином в положении под номером 238. В качестве примера конкретный вариант осуществления включает мутацию N297A, обеспечивающую удаление высококонсервативного сайта N-гликозилирования. В дополнение к аланину аминокислоты дикого типа в положениях, указанных выше, могут быть заменены другими аминокислотами. Мутации могут быть введены в Fc по отдельности, что дает более ста Fc-областей, отличных от нативного Fc. Кроме того, комбинации из двух, трех или более из этих отдельных мутаций могут быть введены вместе, что дает еще нескольких сотен Fc-областей.
Определенные из вышеуказанных мутаций могут придавать новое функциональное свойство Fc-области или партнеру по связыванию FcRn. Например, один вариант осуществления включает N297A, обеспечивающую удаление высококонсервативного сайта N-гликозилирования. Эффект этой мутации заключается в снижении иммуногенности, за счет чего увеличивается период полужизни Fc-области в кровотоке, и обеспечении отсутствия у Fc-области способности к связыванию с FcγRI, FcγRIIA, FcγRIIB и FcγRIIIA без нарушения аффинности в отношении FcRn (Routledge et al. 1995, Transplantation 60:847; Friend et al. 1999, Transplantation 68:1632; Shields et al. 1995, J. Biol. Chem. 276:6591). В качестве дополнительного примера нового функционального свойства, возникающего в результате вышеописанных мутаций, аффинность в отношении FcRn в некоторых случаях может увеличиваться, превышая таковую у дикого типа. Эту увеличенную аффинность могут отражать увеличенная скорость ассоциации, сниженная скорость диссоциации или как увеличенная скорость ассоциации, так и сниженная скорость диссоциации. Примеры мутаций, которые, как полагают, придают повышенную аффинность в отношении FcRn, включают без ограничения T256A, T307A, E380A и N434A (Shields et al. 2001, J. Biol. Chem. 276:6591).
Кроме того, по меньшей мере три Fc-гамма-рецептора человека, по-видимому, распознают сайт связывания в IgG в нижней шарнирной области, обычно аминокислоты 234-237. Следовательно, другой пример нового функционального свойства и потенциальной сниженной иммуногенности может возникать в результате мутаций в этой области, как, например, путем замены аминокислот 233-236 "ELLG" IgG1 человека (SEQ ID NO: 45) соответствующей последовательностью "PVA" из IgG2 (с одной аминокислотной делецией). Было показано, что FcγRI, FcγRII, и FcγRIII, которые опосредуют различные эффекторные функции, не будут связываться с IgG1 при введении таких мутаций. Ward and Ghetie 1995, Therapeutic Immunology 2:77 и Armour et al. 1999, Eur. J. Immunol. 29:2613.
В другом варианте осуществления константная область иммуноглобулина или ее часть содержит аминокислотную последовательность в шарнирной области или ее части, которая образует одну или несколько дисульфидных связей со второй константной областью иммуноглобулина или ее частью. Вторая константная область иммуноглобулина или ее часть может быть связана со вторым полипептидом с объединением белка FVIII и второго полипептида. В некоторых вариантах осуществления второй полипептид представляет собой энхансерный компонент. Используемый в данном документе термин "энхансерный компонент" относится к молекуле, ее фрагменту или компоненту полипептида, которые способны усиливать прокоагулирующую активность FVIII. Энхансерный компонент может представлять собой кофактор, такой как растворимый тканевой фактор (sTF) или прокоагулянтный пептид. Таким образом, после активации FVIII энхансерный компонент доступен для усиления активности FVIII.
В определенных вариантах осуществления белок FVIII, кодируемый молекулой нуклеиновой кислоты по настоящему изобретению, содержит аминокислотную замену в константной области иммуноглобулина или ее части (например, варианты Fc), обеспечивающую изменение антиген-независимых эффекторных функций константной области Ig, в частности периода полужизни белка в кровотоке.
2. scFc-области
В другом аспекте гетерологичный компонент содержит scFc-область (одноцепочечный Fc). В одном варианте осуществления выделенная молекула нуклеиновой кислоты по настоящему изобретению дополнительно содержит гетерологичную последовательность нуклеиновой кислоты, которая кодирует scFc-область. scFc-область содержит по меньшей мере две константные области иммуноглобулина или их части (например, Fc-компоненты или домены (например, 2, 3, 4, 5, 6 или более Fc-компонентов или доменов)) в одной и той же линейной полипептидной цепи, которая способна к сворачиванию (например, внутримолекулярному или межмолекулярному сворачиванию) с образованием одной функциональной scFc-области, связанной воедино пептидным линкером для Fc. Например, в одном варианте осуществления полипептид по настоящему изобретению способен связываться посредством его scFc-области с по меньшей мере одним Fc-рецептором (например, FcRn, рецептором FcγR (например, FcγRIII) или белком системы комплемента (например, C1q)) для улучшения периода полужизни, или запуска иммунной эффекторной функции (например, антителозависимой цитотоксичности (ADCC), фагоцитоза или комплементзависимой цитотоксичности (CDCC)), и/или для улучшения технологичности получения.
3. CTP
В другом аспекте гетерологичный компонент содержит один C-концевой пептид (CTP) β-субъединицы хорионического гонадотропина человека или его фрагмент, вариант или производное. Известно, что один или несколько CTP-пептидов, вставленных в рекомбинантный белок, увеличивают период полужизни in vivo этого белка. См., например, патент США № 5712122, включенный в данный документ посредством ссылки во всей своей полноте.
Иллюстративные CTP-пептиды включают DPRFQDSSSSKAPPPSLPSPSRLPGPSDTPIL (SEQ ID NO: 33) или SSSSKAPPPSLPSPSRLPGPSDTPILPQ (SEQ ID NO: 34). См., например, публикацию заявки на патент США № US 2009/0087411 A1, включенную посредством ссылки.
4. Последовательность XTEN
В некоторых вариантах осуществления гетерологичный компонент содержит одну или несколько последовательностей XTEN, их фрагментов, вариантов или производных. Используемое в данном документе выражение "последовательность XTEN" относится к полипептидам увеличенной длины с не встречающимися в природе по сути неповторяющимися последовательностями, которые состоят в основном из небольших гидрофильных аминокислот, при этом последовательность характеризуется низкой степенью образования или отсутствием вторичной или третичной структуры в физиологических условиях. Являясь гетерологичным компонентом, XTEN могут служить в качестве компонента, увеличивающего период полужизни. Кроме того, XTEN может обеспечивать требуемые свойства, в том числе без ограничения улучшенные фармакокинетические параметры и характеристики растворимости.
Встраивание гетерологичного компонента, содержащего последовательность XTEN, в белок по настоящему изобретению может придавать белку одно или несколько из следующих преимущественных свойств: конформационную гибкость, повышенную растворимость в воде, высокую степень устойчивости к протеазам, низкую иммуногенность, низкую степень связывания с рецепторами млекопитающих или увеличенные значения гидродинамического радиуса (или радиуса Стокса).
В определенных аспектах последовательность XTEN может обеспечивать улучшенные фармакокинетические свойства, как, например, увеличение длительности периода полужизни in vivo или увеличение площади под кривой (AUC), за счет чего белок по настоящему изобретению сохраняется in vivo и обладает прокоагулянтной активностью в течение более длительного периода времени по сравнению с таким же белком, но без гетерологичного компонента XTEN.
В некоторых вариантах осуществления последовательность XTEN, применимая в настоящем изобретении, представляет собой пептид или полипептид, содержащий более приблизительно 20, 30, 40, 50, 60, 70, 80, 90, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700, 750, 800, 850, 900, 950, 1000, 1200, 1400, 1600, 1800, или 2000 аминокислотных остатков. В определенных вариантах осуществления XTEN представляет собой пептид или полипептид, содержащий более чем от приблизительно 20 до приблизительно 3000 аминокислотных остатков, более чем от 30 до приблизительно 2500 остатков, более чем от 40 до приблизительно 2000 остатков, более чем от 50 до приблизительно 1500 остатков, более чем от 60 до приблизительно 1000 остатков, более чем от 70 до приблизительно 900 остатков, более чем от 80 до приблизительно 800 остатков, более чем от 90 до приблизительно 700 остатков, более чем от 100 до приблизительно 600 остатков, более чем от 110 до приблизительно 500 остатков или более чем от 120 до приблизительно 400 остатков. В одном конкретном варианте осуществления XTEN содержит аминокислотную последовательность длиной более 42 аминокислот и менее 144 аминокислот.
Последовательность XTEN по настоящему изобретению может содержать один или несколько мотивов последовательности из 5-14 (например, от 9 до 14) аминокислотных остатков или аминокислотной последовательности, которая на по меньшей мере 80%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, или 99% идентична мотиву последовательности, где мотив содержит, состоит по сути из или состоит из 4-6 типов аминокислот (например, 5 аминокислот), выбранных из группы, состоящей из глицина (G), аланина (A), серина (S), треонина (T), глутамата (E) и пролина (P). См. US 2010-0239554 A1.
В некоторых вариантах осуществления XTEN содержит неперекрывающиеся мотивы последовательностей, в которых приблизительно 80%, или по меньшей мере приблизительно 85%, или по меньшей мере приблизительно 90%, или приблизительно 91%, или приблизительно 92%, или приблизительно 93%, или приблизительно 94%, или приблизительно 95%, или приблизительно 96%, или приблизительно 97%, или приблизительно 98%, или приблизительно 99%, или приблизительно 100% последовательности состоит из нескольких звеньев неперекрывающихся последовательностей, выбранных из одного семейства мотивов, выбранного из таблицы 4, что в результате дает последовательность, характерную для определенного семейства.
Используемый в данном документе термин "семейство" означает, что XTEN содержит мотивы, выбранные только из одной категории мотивов из таблицы 4, т. е. XTEN на основе AD, AE, AF, AG, AM, AQ, BC или BD, и что любые другие аминокислоты в XTEN, не относящиеся к мотиву семейства, выбраны для достижения необходимого свойства, как, например, для обеспечения встраивания сайта рестрикции рядом с кодирующими нуклеотидами, встраивания последовательности для расщепления или для достижения лучшего связывания с FVIII. В некоторых вариантах осуществления семейств XTEN последовательность XTEN содержит несколько звеньев неперекрывающихся мотивов последовательностей из семейства мотивов AD, или семейства мотивов AE, или семейства мотивов AF, или семейства мотивов AG, или семейства мотивов AM, или семейства мотивов AQ, или семейства BC, или семейства BD, в результате чего XTEN демонстрирует диапазон гомологии, описанный выше. В других вариантах осуществления XTEN содержит несколько звеньев последовательностей мотивов из двух или более семейств мотивов из таблицы 4.
Эти последовательности могут быть выбраны для достижения необходимых физических/химических характеристик, в том числе таких свойств, как суммарный заряд, гидрофильность, отсутствие вторичной структуры или отсутствие повторяемости, которые определяются аминокислотным составом мотивов, которые более полно описаны ниже. В вариантах осуществления, описанных выше в данном абзаце данного документа, мотивы, встраиваемые в XTEN, могут быть отобраны и собраны с применением способов, описанных в данном документе, для получения XTEN из от приблизительно 36 до приблизительно 3000 аминокислотных остатков.
Таблица 4. Мотивы последовательностей XTEN из 12 аминокислот и семейства мотивов
* Обозначает отдельные последовательности мотивов, которые при совместном применении в различных перестановках дают в результате "последовательность, характерную для определенного семейства".
Примеры последовательностей XTEN, которые можно применять в качестве гетерологичных компонентов в химерных белках по настоящему изобретению, раскрыты, например, в публикациях заявок на патент США №№ 2010/0239554 A1, 2010/0323956 A1, 2011/0046060 A1, 2011/0046061 A1, 2011/0077199 A1 или 2011/0172146 A1 или публикациях международных заявок на патент №№ WO 2010/091122 A1, WO 2010/144502 A2, WO 2010/144508 A1, WO 2011/028228 A1, WO 2011/028229 A1 или WO 2011/028344 A2, каждая из которых включена в данный документ посредством ссылки во всей своей полноте.
XTEN может иметь различную длину в случае вставки в FVIII или связывания с ним. В одном варианте осуществления длину последовательности(последовательностей) XTEN выбирают с учетом свойства или функции, которые должны быть достигнуты в слитом белке. В зависимости от предполагаемого свойства или функции XTEN может представлять собой короткую последовательность, или последовательность средней длины, или более длинную последовательность, которые могут служить в качестве носителей. В определенных вариантах осуществления XTEN включает короткие сегменты из от приблизительно 6 до приблизительно 99 аминокислотных остатков, сегменты средней длины из от приблизительно 100 до приблизительно 399 аминокислотных остатков и более длинные сегменты из от приблизительно 400 до приблизительно 1000 и не более чем приблизительно 3000 аминокислотных остатков. Таким образом, XTEN, вставленный в FVIII или связанный с ним, может иметь длину, составляющую приблизительно 6, приблизительно 12, приблизительно 36, приблизительно 40, приблизительно 42, приблизительно 72, приблизительно 96, приблизительно 144, приблизительно 288, приблизительно 400, приблизительно 500, приблизительно 576, приблизительно 600, приблизительно 700, приблизительно 800, приблизительно 864, приблизительно 900, приблизительно 1000, приблизительно 1500, приблизительно 2000, приблизительно 2500 или не более приблизительно 3000 аминокислотных остатков. В других вариантах осуществления длина последовательностей XTEN составляет от приблизительно 6 до приблизительно 50, от приблизительно 50 до приблизительно 100, от приблизительно 100 до 150, от приблизительно 150 до 250, от приблизительно 250 до 400, от приблизительно 400 до приблизительно 500, от приблизительно 500 до приблизительно 900, от приблизительно 900 до 1500, от приблизительно 1500 до 2000 или от приблизительно 2000 до приблизительно 3000 аминокислотных остатков.
Точная длина XTEN, вставленного в FVIII или связанного с ним, может варьироваться, не оказывая при этом негативного влияния на активность FVIII. В одном варианте осуществления один или несколько из XTEN, применяемых в данном документе, имеют длину 42 аминокислоты, 72 аминокислоты, 144 аминокислоты, 288 аминокислот, 576 аминокислот или 864 аминокислоты и могут быть выбраны из одной или нескольких последовательностей, характерных для определенного семейства XTEN, т. е. AD, AE, AF, AG, AM, AQ, BC или BD.
В некоторых вариантах осуществления последовательность XTEN, применяемая в настоящем изобретении, на по меньшей мере 60%, 70%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, или 100% идентична последовательности, выбранной из группы, состоящей из AE42, AG42, AE48, AM48, AE72, AG72, AE108, AG108, AE144, AF144, AG144, AE180, AG180, AE216, AG216, AE252, AG252, AE288, AG288, AE324, AG324, AE360, AG360, AE396, AG396, AE432, AG432, AE468, AG468, AE504, AG504, AF504, AE540, AG540, AF540, AD576, AE576, AF576, AG576, AE612, AG612, AE624, AE648, AG648, AG684, AE720, AG720, AE756, AG756, AE792, AG792, AE828, AG828, AD836, AE864, AF864, AG864, AM875, AE912, AM923, AM1318, BC864, BD864, AE948, AE1044, AE1140, AE1236, AE1332, AE1428, AE1524, AE1620, AE1716, AE1812, AE1908, AE2004A, AG948, AG1044, AG1140, AG1236, AG1332, AG1428, AG1524, AG1620, AG1716, AG1812, AG1908, AG2004 и любой их комбинации. См. US 2010-0239554 A1. В одном конкретном варианте осуществления XTEN содержит AE42, AE72, AE144, AE288, AE576, AE864, AG 42, AG72, AG144, AG288, AG576, AG864 или любую их комбинацию.
Иллюстративные последовательности XTEN, которые можно применять в качестве гетерологичных компонентов в химерном белке по настоящему изобретению, включают XTEN AE42-4 (SEQ ID NO: 46, кодируемую SEQ ID NO: 47; фиг. 11C и 11D соответственно), XTEN 144-2A (SEQ ID NO: 48, кодируемую SEQ ID NO: 49; фиг. 11E и 11F соответственно), XTEN A144-3B (SEQ ID NO: 50, кодируемую SEQ ID NO: 51; фиг. 11G и 11H соответственно), XTEN AE144-4A (SEQ ID NO: 52, кодируемую SEQ ID NO: 53; фиг. 11I и 11J соответственно), XTEN AE144-5A (SEQ ID NO: 54, кодируемую SEQ ID NO: 55; фиг. 11K и 11L соответственно), XTEN AE144-6B (SEQ ID NO: 56, кодируемую SEQ ID NO: 57; фиг. 11M и 11N соответственно), XTEN AG144-1 (SEQ ID NO: 58, кодируемую SEQ ID NO: 59; фиг. 11O и 11P соответственно), XTEN AG144-A (SEQ ID NO: 60, кодируемую SEQ ID NO: 61; фиг. 11Q и 11R соответственно), XTEN AG144-B (SEQ ID NO: 62, кодируемую SEQ ID NO: 63; фиг. 11S и 11T соответственно), XTEN AG144-C (SEQ ID NO: 64, кодируемую SEQ ID NO: 65; фиг. 11U и 11V соответственно), и XTEN AG144-F (SEQ ID NO: 66, кодируемую SEQ ID NO: 67; фиг. 11W и 11X соответственно). В одном конкретном варианте осуществления XTEN кодируется SEQ ID NO:18.
В некоторых вариантах осуществления менее 100% аминокислот XTEN выбраны из глицина (G), аланина (A), серина (S), треонина (T), глутамата (E) и пролина (P) или менее чем 100% последовательности состоит из мотивов последовательностей из таблицы 4 или последовательностей XTEN, представленных в данном документе. В таких вариантах осуществления остальные аминокислотные остатки XTEN выбраны из любых других 14 природных L-аминокислот, но могут быть предпочтительно выбраны из гидрофильных аминокислот с тем, чтобы последовательность XTEN содержала по меньшей мере приблизительно 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или по меньшей мере приблизительно 99% гидрофильных аминокислот.
Содержание гидрофобных аминокислот в XTEN, используемом в конструкциях, получаемых путем конъюгации, может представлять собой содержание гидрофобных аминокислот, составляющее менее 5%, или менее 2%, или менее 1%. Гидрофобные остатки, которые являются менее предпочтительными при конструировании XTEN, включают триптофан, фенилаланин, тирозин, лейцин, изолейцин, валин и метионин. Кроме того, последовательности XTEN могут содержать менее 5%, или менее 4%, или менее 3%, или менее 2%, или менее 1%, или ни одной из следующих аминокислот: метионина (например, во избежание окисления) или аспарагина и глутамина (во избежание дезамидирования).
Одна или несколько последовательностей XTEN могут быть вставлены на С-конце или на N-конце аминокислотной последовательности, кодируемой нуклеотидной последовательностью, или вставлены между двумя аминокислотами в аминокислотную последовательность, кодируемую нуклеотидной последовательностью. Например, XTEN может быть вставлен между двумя аминокислотами в одном или нескольких сайтах вставки, выбранных из таблицы 3. Примеры сайтов в FVIII, которые допустимы для вставки XTEN, можно найти, например, в международной публикации № WO 2013/123457 A1 или публикации заявки на патент США № 2015/0158929 A1, которые тем самым включены в данный документ посредством ссылки во всей своей полноте.
5. Альбумин или его фрагмент, производное или его вариант
В некоторых вариантах осуществления гетерологичный компонент включает альбумин или его функциональный фрагмент. Сывороточный альбумин человека (HSA или HA), белок из 609 аминокислот в своей полноразмерной форме, отвечает за значительную долю осмотического давления сыворотки крови, а также выполняет функцию носителя эндогенных и экзогенных лигандов. Термин "альбумин", используемый в данном документе, включает полноразмерный альбумин или его функциональный фрагмент, вариант, производное или аналог. Примеры альбумина или его фрагментов или вариантов раскрыты в публикациях заявок на патент США №№ 2008/0194481A1, 2008/0004206 A1, 2008/0161243 A1, 2008/0261877 A1 или 2008/0153751 A1 или в публикациях заявок согласно PCT №№ WO 2008/033413 A2, WO 2009/058322 A1 или WO 2007/021494 A2, которые включены в данный документ посредством ссылки во всей своей полноте.
В одном варианте осуществления белок FVIII, кодируемый молекулой нуклеиновой кислоты по настоящему изобретению, содержит альбумин, его фрагмент или вариант, который дополнительно связан со вторым гетерологичным компонентом, выбранным из группы, состоящей из константной области иммуноглобулина или ее части (например, Fc-области), последовательности PAS, HES, PEG.
6. Альбумин-связывающий компонент
В определенных вариантах осуществления гетерологичный компонент представляет собой альбумин-связывающий компонент, который включает альбумин-связывающий пептид, бактериальный альбумин-связывающий домен, фрагмент альбумин-связывающего антитела или любые их комбинации.
Например, альбумин-связывающий белок может представлять собой бактериальный альбумин-связывающий белок, антитело или фрагмент антитела, в том числе доменные антитела (см. патент США № 6696245). Альбумин-связывающий белок, например, может представлять собой бактериальный альбумин-связывающий домен, такой как домен стрептококкового белка G (Konig, T. and Skerra, A. (1998) J. Immunol. Methods 218, 73-83). Другими примерами альбумин-связывающих пептидов, которые можно применять в качестве партнера по конъюгации, являются, например, пептиды, имеющие консенсусную последовательность Cys-Xaa1-Xaa2-Xaa3-Xaa4-Cys, где Xaa1 представляет собой Asp, Asn, Ser, Thr или Trp; Xaa2 представляет собой Asn, Gln, His, Ile, Leu или Lys; Xaa3 представляет собой Ala, Asp, Phe, Trp или Tyr; и Xaa4 представляет собой Asp, Gly, Leu, Phe, Ser или Thr, как это описано в публикации заявки на патент США № 2003/0069395 или у Dennis et al. (Dennis et al. (2002) J. Biol. Chem. 277, 35035-35043).
Домен 3 из стрептококкового белка G, раскрытого в Kraulis et al., FEBS Lett. 378:190-194 (1996) и Linhult et al., Protein Sci. 11:206-213 (2002), является примером бактериального альбумин-связывающего домена. Примеры альбумин-связывающих пептидов включают ряд пептидов, содержащих сердцевинную последовательность DICLPRWGCLW (SEQ ID NO: 35). См., например, Dennis et al., J. Biol. Chem. 2002, 277: 35035-35043 (2002). Примеры фрагментов альбумин-связывающих антител раскрыты в Muller and Kontermann, Curr. Opin. Mol. Ther. 9:319-326 (2007); Roovers et al., Cancer Immunol. Immunother. 56:303-317 (2007), и Holt et al., Prot. Eng. Design Sci., 21:283-288 (2008), которые включены в данный документ посредством ссылки во всей своей полноте. Примером такого альбумин-связывающего компонента является 2-(3-малеимидопропанамидо)-6-(4-(4-йодфенил)бутанамидо)гексаноат (метка "Albu"), раскрытый в Trussel et al., Bioconjugate Chem. 20:2286-2292 (2009).
Жирные кислоты, в частности длинноцепочечные жирные кислоты (LCFA) и альбумин-связывающие соединения, подобные длинноцепочечным жирным кислотам, могут использоваться для увеличения периода полужизни in vivo белков FVIII по настоящему изобретению. Примером LCFA-подобного альбумин-связывающего соединения является 16-(1-(3-(9-(((2,5-диоксопирролидин-1-илокси)карбонилокси)метил)-7-сульфо-9H-флуорен-2-иламино)-3-оксопропил)-2,5-диоксопирролидин-3-илтио)гексадекановая кислота (см., например, WO 2010/140148).
7. Последовательность PAS
В других вариантах осуществления гетерологичный компонент представляет собой последовательность PAS. Последовательность PAS, используемая в данном документе, означают аминокислотную последовательность, содержащую в основном остатки аланина и серина или содержащую в основном остатки аланина, серина и пролина, при этом аминокислотная последовательность образует случайную спиральную конформацию при физиологических условиях. Соответственно, последовательность PAS представляет собой структурный блок, полимер из аминокислот или последовательность-кассету, которые содержат аланин, серин и пролин, состоят по сути из них или состоят из них, которые можно применять в качестве части гетерологичного компонента в химерном белке. Тем не менее, специалист в данной области техники знает, что полимер из аминокислот также может образовывать случайную спиральную конформацию при добавлении в последовательность PAS остатков, отличных от аланина, серина и пролина, в качестве дополнительного составляющего.
Используемый в данном документе термин "дополнительное составляющее" означает, что аминокислоты, отличные от аланина, серина и пролина, могут быть добавлены в последовательность PAS в определенной мере, например, в количестве не более чем приблизительно 12%, т. е. приблизительно 12 из 100 аминокислот последовательности PAS, не более чем приблизительно 10%, т. е. приблизительно 10 из 100 аминокислот последовательности PAS, не более чем приблизительно 9%, т. е. приблизительно 9 из 100 аминокислот, не более чем приблизительно 8%, т. е. приблизительно 8 из 100 аминокислот, приблизительно 6%, т. е. приблизительно 6 из 100 аминокислот, приблизительно 5%, т. е. приблизительно 5 из 100 аминокислот, приблизительно 4%, т. е. приблизительно 4 из 100 аминокислот, приблизительно 3%, т. е. приблизительно 3 из 100 аминокислот, приблизительно 2%, т. е. приблизительно 2 из 100 аминокислот, приблизительно 1%, т. е. приблизительно 1 из 100 аминокислот. Аминокислоты, отличные от аланина, серина и пролина, могут быть выбраны из группы, состоящей из Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Thr, Trp, Tyr и Val.
В физиологических условиях отрезок последовательности PAS образует случайную спиральную конформацию и тем самым может опосредовать повышение стабильности in vivo и/или in vitro белка, представляющего собой белок FVIII. Поскольку домен со случайной спиральной конформацией собственно не принимает стабильную структуру или функцию, биологическая активность, опосредованная белком FVIII, по сути сохраняется. В других вариантах осуществления последовательности PAS, которые образуют домен со случайной спиральной конформацией, являются биологически инертными, особенно в отношении протеолиза в плазме крови, иммуногенности, изоэлектрической точки/электростатического поведения, связывания с рецепторами клеточной поверхности или интернализации, но по-прежнему являются биоразлагаемыми, что обеспечивает явные преимущества по сравнению с синтетическими полимерами, такими как PEG.
Неограничивающие примеры последовательностей PAS, образующих случайную спиральную конформацию, включают аминокислотную последовательность, выбранную из группы, состоящей из ASPAAPAPASPAAPAPSAPA (SEQ ID NO: 36), AAPASPAPAAPSAPAPAAPS (SEQ ID NO: 37), APSSPSPSAPSSPSPASPSS (SEQ ID NO: 38), APSSPSPSAPSSPSPASPS (SEQ ID NO: 39), SSPSAPSPSSPASPSPSSPA (SEQ ID NO: 40), AASPAAPSAPPAAASPAAPSAPPA (SEQ ID NO: 41) и ASAAAPAAASAAASAPSAAA (SEQ ID NO: 42) или любых их комбинаций. Дополнительные примеры последовательностей PAS известны, например, из публикации заявки на патент США № 2010/0292130 A1 и публикации заявки согласно PCT № WO 2008/155134 A1.
8. Последовательность HAP
В определенных вариантах осуществления гетерологичный компонент представляет собой богатый глицином гомополимер из аминокислот (HAP). Последовательность HAP может содержать последовательность из повторяющихся остатков глицина, которая имеет длину, составляющую по меньшей мере 50 аминокислот, по меньшей мере 100 аминокислот, 120 аминокислот, 140 аминокислот, 160 аминокислот, 180 аминокислот, 200 аминокислот, 250 аминокислот, 300 аминокислот, 350 аминокислот, 400 аминокислот, 450 аминокислот или 500 аминокислот. В одном варианте осуществления последовательность HAP способна обеспечивать увеличение периода полужизни компонента, слитого или связанного с последовательностью HAP. Неограничивающие примеры последовательности HAP включают без ограничения (Gly)n, (Gly4Ser)n или S(Gly4Ser)n, где n равняется 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, или 20. В одном варианте осуществления n равняется 20, 21, 22, 23, 24, 25, 26, 26, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, или 40. В другом варианте осуществления n равняется 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, или 200.
9. Трансферрин или его фрагмент
В определенных вариантах осуществления гетерологичный компонент представляет собой трансферрин или его фрагмент. Можно применять любой трансферрин для получения белков FVIII по настоящему изобретению. В качестве примера TF человека дикого типа (TF) представляет собой белок из 679 аминокислот размером примерно 75 кДа (без учета гликозилирования) с двумя основными доменами N (приблизительно 330 аминокислот) и C (приблизительно 340 аминокислот), которые, по-видимому, образуются в результате дупликации гена. См. номера доступа NM001063, XM002793, M12530, XM039845, XM 039847 и S95936 в GenBank (www.ncbi.nlm.nih.gov/), каждый из которых включен в данный документ посредством ссылки во всей своей полноте. Трансферрин содержит два домена: N-домен и C-домен. домен N содержит два субдомена: домен N1 и домен N2, а домен C содержит два субдомена: домен C1 и домен C2.
В одном варианте осуществления гетерологичный компонент трансферрин включает сплайс-вариант трансферрина. В одном примере сплайс-вариант трансферрина может представлять собой сплайс-вариант трансферрина человека, например, с номером доступа AAA61140 в Genbank. В другом варианте осуществления часть химерного белка, представляющая собой трансферрин, включает один или несколько доменов последовательности трансферрина, например, домен N, домен C, домен N1, домен N2, домен C1, домен C2 или любые их комбинации.
10. Рецепторы, опосредующие выведение
В определенных вариантах осуществления гетерологичный компонент представляет собой рецептор, опосредующий выведение, его фрагмент, вариант или производное. LRP1 представляет собой интегральный мембранный белок размером 600 кДа, который участвует в рецептор-опосредованном выведении различных белков, таких как фактор X. См., например, Narita et al., Blood 91:555-560 (1998).
11. Фактор фон Виллебранда или его фрагменты
В определенных вариантах осуществления гетерологичный компонент представляет собой фактор фон Виллебранда (VWF) или один или несколько его фрагментов.
VWF (также известный как F8VWF) представляет собой крупный мультимерный гликопротеин, присутствующий в плазме крови и продуцируемый конститутивно в эндотелии (в тельцах Вайбеля-Паладе), мегакариоцитах (α-гранулах тромбоцитов) и субэндотелиальной соединительной ткани. Основным мономером VWF является белок из 2813 аминокислот. Каждый мономер содержит ряд специфических доменов с конкретной функцией - домены D' и D3 (которые связываются с фактором VIII), домен A1 (который связывается с тромбоцитарным рецептором GPIb, гепарином и/или, возможно, коллагеном), домен A3 (который связывается с коллагеном), домен C1 (в котором домен RGD связывается с тромбоцитарным интегрином αIIbβ3, когда он активирован) и домен "цистеиновый узел" на C-конце белка (который является общим для VWF и тромбоцитарного фактора роста (PDGF), трансформирующего фактора роста β (TGFβ) и β-субъединицы хорионического гонадотропина человека (βHCG)).
Последовательность мономерного VWF человека из 2813 аминокислот приведена в Genbank под номером доступа NP000543.2. Нуклеотидная последовательность, кодирующая VWF человека, приведена в Genbank под номером доступа NM000552.3. SEQ ID NO: 44 (фиг. 11В) представляет собой аминокислотную последовательность, кодируемую SEQ ID NO: 43. Домен D’ включает аминокислоты с 764 по 866 из SEQ ID NO: 44. Домен D3 включает аминокислоты с 867 по 1240 из SEQ ID NO: 44.
В плазме крови 95-98% FVIII циркулируют в виде плотного нековалентного комплекса с полноразмерным VWF. Образование этого комплекса важно для поддержания надлежащих уровней FVIIII в плазме крови in vivo. Lenting et al., Blood. 92(11): 3983-96 (1998); Lenting et al., J. Thromb. Haemost. 5(7): 1353-60 (2007). При активации FVIII вследствие протеолиза в положениях 372 и 740 в тяжелой цепи и в положении 1689 в легкой цепи VWF, связанный с FVIII, удаляется из активированного FVIII.
В определенных вариантах осуществления гетерологичный компонент представляет собой полноразмерный фактор фон Виллебранда. В других вариантах осуществления гетерологичный фрагмент представляет собой фрагмент фактора фон Виллебранда. Используемый в данном документе термин "фрагмент VWF" или "фрагменты VWF" означает любые фрагменты VWF, которые взаимодействуют с FVIII и сохраняют по меньшей мере одно или несколько свойств, которые обычно обеспечиваются у FVIII благодаря полноразмерному VWF, например, предотвращение преждевременной активации до FVIIIa, предотвращение преждевременного протеолиза, предотвращение ассоциации с фосфолипидными мембранами, которая может привести к преждевременному выведению, предотвращение связывания с рецепторами, опосредующими выведение FVIII, которые могут связываться с "голым" FVIII, но не с FVIII, связанным с VWF, и/или стабилизацию взаимодействий тяжелой цепи и легкой цепи FVIII. В конкретном варианте осуществления гетерологичный компонент представляет собой фрагмент (VWF), содержащий домен D’ и домен D3 VWF. Фрагмент VWF, содержащий домен D’ и домен D3, может дополнительно содержать домен VWF, выбранный из группы, состоящей из домена A1, домена A2, домена A3, домена D1, домена D2, домена D4, домена B1, домена B2, домена B3, домена C1, домена C2, домена CK, одного или нескольких их фрагментов и любых их комбинаций. Дополнительные примеры полипептида, характеризующегося активностью FVIII, слитого с фрагментом VWF, раскрыты в предварительной заявке на патент США № 61/667901, поданной 3 июля 2012 г., и публикации заявки на патент США № 2015/0023959 А1, при этом обе они включены в данный документ посредством ссылки во всей своей полноте.
12. Линкерные компоненты
В определенных вариантах осуществления гетерологичный компонент представляет собой пептидный линкер.
Используемые в данном документе термины "пептидные линкеры" или "линкерные компоненты" относятся к пептидной или полипептидной последовательности (например, синтетической пептидной или полипептидной последовательности), которая соединяет два домена в виде линейной аминокислотной последовательности полипептидной цепи.
В некоторых вариантах осуществления гетерологичные нуклеотидные последовательности, кодирующие пептидные линкеры, могут быть вставлены между оптимизированными полинуклеотидными последовательностями FVIII по настоящему изобретению и гетерологичной нуклеотидной последовательностью, кодирующей, например, один из гетерологичных компонентов, описанных выше, таких как альбумин. Пептидные линкеры могут обеспечивать гибкость для молекулы химерного полипептида. Обычно линкеры не расщепляются, однако такое расщепление может быть желательным. В одном варианте осуществления эти линкеры не удаляются во время процессинга.
Тип линкера, который может присутствовать в химерном белке по настоящему изобретению, представляет собой линкер, расщепляемый протеазами, который содержит сайт расщепления (т. е. субстрат с сайтом расщепления протеазами, например, фактор XIa, Xa или сайт расщепления тромбином) и который может содержать дополнительные линкеры с N-концевой, с С-концевой либо с обеих сторон от сайта расщепления. Эти расщепляемые линкеры при встраивании в конструкцию по настоящему изобретению дают в результате химерную молекулу, имеющую гетерологичный сайт расщепления.
В одном варианте осуществления полипептид FVIII, кодируемый молекулой нуклеиновой кислоты по настоящему изобретению, содержит два или более Fc-домена или компонента, связанных посредством cscFc-линкера с образованием Fc-области, содержащейся в одной полипептидной цепи. cscFc-линкер фланкирован по меньшей мере одним сайтом внутриклеточного процессинга, т. е. сайтом, расщепляемым внутриклеточным ферментом. Расщепление полипептида в по меньшей мере одном сайте внутриклеточного процессинга приводит к образованию полипептида, который содержит по меньшей мере две полипептидные цепи.
В конструкции по настоящему изобретению необязательно могут использоваться другие пептидные линкеры, например, для соединения белка FVIII с Fc-областью. Некоторые иллюстративные линкеры, которые можно использовать применительно к настоящему изобретению, включают, например, полипептиды, содержащие аминокислоты GlySer, более подробно описанные ниже.
В одном варианте осуществления пептидный линкер является синтетическим, т. е. не встречающимся в природе. В одном варианте осуществления пептидный линкер включает пептиды (или полипептиды) (которые могут быть встречающимися или не встречающимися в природе), которые содержат аминокислотную последовательность, которая обеспечивает связывание или генетическое слияние первой линейной последовательности аминокислот и второй линейной последовательности аминокислот, с которой она в естественных условиях не связана или генетически не слита в природе. Например, в одном варианте осуществления пептидный линкер может содержать не встречающиеся в природе полипептиды, которые являются модифицированными формами встречающихся в природе полипептидов (например, содержащие мутацию, такую как добавление, замена или делеция). В другом варианте осуществления пептидный линкер может содержать не встречающиеся в природе аминокислоты. В другом варианте осуществления пептидный линкер может содержать встречающиеся в природе аминокислоты, представленные в виде линейной последовательности, которая не встречается в природе. В еще одном варианте осуществления пептидный линкер может содержать встречающуюся в природе полипептидную последовательность.
Например, в определенных вариантах осуществления пептидный линкер можно применять для слияния идентичных Fc-компонентов с образованием таким образом гомодимерной scFc-области. В других вариантах осуществления пептидный линкер можно применять для слияния различных Fc-компонентов (например, Fc-компонента дикого типа и варианта Fc-фрагмента) с образованием таким образом гетеродимерной scFc-области.
В другом варианте осуществления пептидный линкер содержит линкер Gly-Ser или состоит из него. В одном варианте осуществления scFc или cscFc-линкер содержит по меньшей мере часть шарнирной области иммуноглобулина и линкер Gly-Ser. Используемый в данном документе термин "линкер Gly-Ser" относится к пептиду, который состоит из остатков глицина и серина. В определенных вариантах осуществления указанный линкер Gly-Ser может быть вставлен между двумя другими последовательностями пептидного линкера. В других вариантах осуществления линкер Gly-Ser присоединен на одном или обоих концах другой последовательности пептидного линкера. В еще нескольких других вариантах осуществления два или более линкера Gly-Ser последовательно встроены в пептидный линкер. В одном варианте осуществления пептидный линкер по настоящему изобретению содержит по меньшей мере часть верхней шарнирной области (например, полученной из молекулы IgG1, IgG2, IgG3 или IgG4), по меньшей мере часть средней шарнирной области (например, полученной из молекулы IgG1, IgG2, IgG3 или IgG4) и последовательный ряд аминокислотных остатков Gly/Ser.
Пептидные линкеры по настоящему изобретению имеют длину, составляющую по меньшей мере одну аминокислоту, и могут характеризоваться разной длиной. В одном варианте осуществления пептидный линкер по настоящему изобретению имеет длину, составляющую от приблизительно 1 до приблизительно 50 аминокислот. Используемое в данном контексте выражение "приблизительно" обозначает +/- два аминокислотных остатка. Поскольку длина линкера должна представлять собой положительное целое число, длина от приблизительно 1 до приблизительно 50 аминокислот в длину означает длину от 1-3 до 48-52 аминокислот в длину. В другом варианте осуществления пептидный линкер по настоящему изобретению имеет длину, составляющую от приблизительно 10 до приблизительно 20 аминокислот. В другом варианте осуществления пептидный линкер по настоящему изобретению имеет длину, составляющую от приблизительно 15 до приблизительно 50 аминокислот. В другом варианте осуществления пептидный линкер по настоящему изобретению имеет длину, составляющую от приблизительно 20 до приблизительно 45 аминокислот. В другом варианте осуществления пептидный линкер по настоящему изобретению имеет длину, составляющую от приблизительно 15 до приблизительно 35 или от приблизительно 20 до приблизительно 30 аминокислот. В другом варианте осуществления пептидный линкер по настоящему изобретению имеет длину, составляющую приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 40, 50, 60, 70, 80, 90, 100, 500, 1000, или 2000 аминокислот. В одном варианте осуществления пептидный линкер по настоящему изобретению имеет длину, составляющую 20 или 30 аминокислот.
В некоторых вариантах осуществления пептидный линкер может содержать по меньшей мере две, по меньшей мере три, по меньшей мере четыре, по меньшей мере пять, по меньшей мере 10, по меньшей мере 20, по меньшей мере 30, по меньшей мере 40, по меньшей мере 50, по меньшей мере 60, по меньшей мере 70, по меньшей мере 80, по меньшей мере 90 или по меньшей мере 100 аминокислот. В других вариантах осуществления пептидный линкер может содержать по меньшей мере 200, по меньшей мере 300, по меньшей мере 400, по меньшей мере 500, по меньшей мере 600, по меньшей мере 700, по меньшей мере 800, по меньшей мере 900 или по меньшей мере 1000 аминокислот. В некоторых вариантах осуществления пептидный линкер может содержать по меньшей мере приблизительно 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 150, 200, 300, 400, 500, 600, 700, 800, 900, 1000, 1100, 1200, 1300, 1400, 1500, 1600, 1700, 1800, 1900, или 2000 аминокислот. Пептидный линкер может содержать 1-5 аминокислот, 1-10 аминокислот, 1-20 аминокислот, 10-50 аминокислот, 50-100 аминокислот, 100-200 аминокислот, 200-300 аминокислот, 300-400 аминокислот, 400-500 аминокислот, 500-600 аминокислот, 600-700 аминокислот, 700-800 аминокислот, 800-900 аминокислот или 900-1000 аминокислот.
Пептидные линкеры можно вводить в полипептидные последовательности с помощью методик, известных в данной области техники. Модификации можно подтверждать с помощью анализа последовательности ДНК. Для трансформации клеток-хозяев для стабильного продуцирования получаемых полипептидов можно применять плазмидную ДНК.
I. Мономерно-димерные гибриды
В некоторых вариантах осуществления выделенные молекулы нуклеиновой кислоты по настоящему изобретению, которые дополнительно содержат гетерологичную нуклеотидную последовательность, кодируют мономерно-димерную гибридную молекулу, содержащую FVIII.
Используемый в данном документе термин "мономерно-димерный гибрид" относится к химерному белку, содержащему первую полипептидную цепь и вторую полипептидную цепь, которые связаны друг с другом дисульфидной связью, где первая цепь содержит фактор FVIII, и первую Fc-область, а вторая цепь содержит вторую Fc-область без VIII, состоит по сути из нее или состоит из нее. Таким образом, мономерно-димерная гибридная конструкция представляет собой гибрид, содержащий мономерный компонент, содержащий только один фактор свертывания крови, и димерный компонент, имеющий две Fc-области.
J. Элемент, осуществляющий контроль экспрессии
В некоторых вариантах осуществления молекула нуклеиновой кислоты или вектор по настоящему изобретению дополнительно содержит по меньшей мере одну последовательность, осуществляющую контроль экспрессии. Последовательности, осуществляющие контроль экспрессии, используемые в данном документе, представляют собой любую регуляторную нуклеотидную последовательность, такую как промоторная последовательность или комбинация промотор-энхансер, которая способствует эффективной транскрипции и трансляции кодирующей нуклеиновой кислоты, с которой она функционально связана. Например, выделенная молекула нуклеиновой кислоты по настоящему изобретению может быть функционально связана с по меньшей мере одной последовательностью, осуществляющей контроль транскрипции.
Последовательность, осуществляющая контроль экспрессии гена, может, например, представлять собой промотор млекопитающего или вируса, такой как конститутивный или индуцируемый промотор. Конститутивные промоторы млекопитающих включают без ограничения промоторы следующих генов: гипоксантин-фосфорибозилтрансферазы (HPRT), аденозиндезаминазы, пируваткиназы, промотор гена бета-актина и другие конститутивные промоторы. Иллюстративные вирусные промоторы, которые функционируют конститутивно в эукариотических клетках, включают, например, промоторы из цитомегаловируса (CMV), вируса обезьян (например, SV40), вируса папилломы, аденовируса, вируса иммунодефицита человека (HIV), вируса саркомы Рауса, цитомегаловируса, длинные концевые повторы (LTR) вируса лейкоза Молони и других ретровирусов, а также промотор гена тимидинкиназы вируса простого герпеса.
Обычным специалистам в данной области техники известны другие конститутивные промоторы. Промоторы, применимые в качестве последовательностей, контролирующих экспрессию генов, согласно настоящему изобретению, также включают индуцируемые промоторы. Индуцируемые промоторы обеспечивают экспрессию в присутствии индуцирующего средства. Например, промотор гена металлотионеина индуцируется, способствуя транскрипции и трансляции, в присутствии определенных ионов металлов. Обычным специалистам в данной области техники известны другие индуцируемые промоторы.
В одном варианте осуществления настоящее изобретение предусматривает экспрессию трансгена под контролем тканеспецифического промотора и/или энхансера. В другом варианте осуществления промотор или другая последовательность, осуществляющая контроль экспрессии, избирательно усиливает экспрессию трансгена в клетках печени. Примеры специфических для печени промоторов включают без ограничения промотор гена тиретина мыши (mTTR), эндогенный промотор гена фактора VIII человека (F8), промотор гена альфа-1-антитрипсина человека (hAAT), минимальный промотор гена альбумина человека и промотор гена альбумина мыши. В одном конкретном варианте осуществления промотор предусматривает промотор mTTR. Промотор mTTR описан в R. H. Costa et al., 1986, Mol. Cell. Biol. 6:4697. Промотор F8 описан в Figueiredo and Brownlee, 1995, J. Biol. Chem. 270:11828-11838.
Уровни экспрессии можно дополнительно повысить для достижения терапевтической эффективности с применением одного или нескольких энхансеров. Один или несколько энхансеров могут предоставляться отдельно или вместе с одним или несколькими промоторными элементами. Как правило, последовательность, осуществляющая контроль экспрессии, содержит множество энхансерных элементов и тканеспецифический промотор. В одном варианте осуществления энхансер содержит одну или несколько копий энхансера гена α-1-микроглобулина/бикунина (Rouet et al., 1992, J. Biol. Chem. 267:20765-20773; Rouet et al., 1995, Nucleic Acids Res. 23:395-404; Rouet et al., 1998, Biochem. J. 334:577-584; Ill et al., 1997, Blood Coagulation Fibrinolysis 8:S23-S30). В другом варианте осуществления энхансер получен из сайтов связывания специфических для печени факторов транскрипции, таких как EBP, DBP, HNF1, HNF3, HNF4, HNF6, при этом Enh1 содержит HNF1 (смысловая) - HNF3 (смысловая) - HNF4 (антисмысловая) - HNF1 (антисмысловая) - HNF6 (смысловая) - EBP (антисмысловая) - HNF4 (антисмысловая).
В конкретном примере промотор, применимый для настоящего изобретения, содержит SEQ ID NO: 69 (т. е. ET-промотор, фиг. 11Y), который также известен под номером доступа AY661265 в GenBank. См. также Vigna et al., Molecular Therapy 11(5):763 (2005). Примеры других подходящих векторов и регуляторных элементов генов описаны в WO 02/092134, EP 1395293 или патентах США №№ 6808905, 7745179 или 7179903, которые включены в данный документ посредством ссылки во всей своей полноте.
В целом последовательности, осуществляющие контроль экспрессии, должны включать при необходимости 5'-нетранскрибирующие и 5'-нетранслирующие последовательности, вовлеченные в инициацию транскрипции и трансляции соответственно, такие как TATA-бокс, кэппирующая последовательность, последовательность CAAT и им подобные. В частности, такие 5'-нетранскрибирующие последовательности будут включать промоторную область, которая включает промоторную последовательность для контроля транскрипции функционально связанной кодирующей нуклеиновой кислоты. Последовательности, контролирующие экспрессию генов, необязательно включают энхансерные последовательности или расположенные выше активаторные последовательности, если это необходимо.
VI. Фармацевтическая композиция
Композиции, содержащие лентивирусный генный терапевтический вектор, раскрытый в данном документе, или клетку-хозяина по настоящему изобретению (например, гепатоцит, на который нацеливается лентивирусный генный терапевтический вектор, раскрытый в данном документе), могут содержать подходящий фармацевтически приемлемый носитель. Например, они могут содержать вспомогательные вещества и/или вспомогательные средства, которые способствуют переработке активных соединений в препараты, предназначенные для доставки в место действия.
Фармацевтическая композиция может быть составлена для парентерального введения (т. е. внутривенного, подкожного или внутримышечного) путем болюсной инъекции. Составы для инъекций могут быть представлены в стандартной лекарственной форме, например, в ампулах или в многодозовых контейнерах с добавленным консервантом. Композиции могут иметь такие формы, как суспензии, растворы или эмульсии в масляных или водных средах-носителях, и содержать средства для составления, такие как суспендирующие, стабилизирующие и/или диспергирующие средства. В качестве альтернативы активный ингредиент может быть представлен в форме порошка для разведения подходящей средой-носителем, например, апирогенной водой.
Подходящие составы для парентерального введения также включают водные растворы активных соединений в водорастворимой форме, например, водорастворимые соли. Кроме того, можно вводить суспензии активных соединений в виде подходящих масляных инъекционных суспензий. Подходящие липофильные растворители или среды-носители включают жирные масла, например, кунжутное масло, или синтетические сложные эфиры жирных кислот, например, этилолеат или триглицериды. Водные инъекционные суспензии могут содержать вещества, которые увеличивают вязкость суспензии, в том числе, например, натрийкарбоксиметилцеллюлозу, сорбит и декстран. Суспензия также необязательно может содержать стабилизаторы. Также можно применять липосомы для инкапсулирования молекул по настоящему изобретению для доставки в клетки или интерстициальные пространства. Иллюстративными фармацевтически приемлемыми носителями являются физиологически совместимые растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые средства, изотонические средства и средства, замедляющие всасывание, вода, солевой раствор, фосфатно-солевой буферный раствор, декстроза, глицерин, этанол и т. п. В некоторых вариантах осуществления композиция содержит изотонические средства, например, сахара, многоатомные спирты, такие как маннит, сорбит, или хлорид натрия. В других вариантах осуществления композиции содержат фармацевтически приемлемые вещества, такие как смачивающие средства или незначительные количества вспомогательных веществ, таких как смачивающие или эмульгирующие средства, консерванты или буферы, которые увеличивают срок годности или эффективность активных ингредиентов.
Композиции по настоящему изобретению могут быть представлены в различных формах, в том числе, например, в форме жидкости (например, инъекционных и инфузионных растворов), дисперсий, суспензий, полутвердых и твердых лекарственных форм. Предпочтительная форма зависит от способа введения и терапевтического применения.
Композиция может быть составлена в виде раствора, микроэмульсии, дисперсии, липосомы или другой упорядоченной структуры, подходящей для высокой концентрации лекарственного средства. Стерильные инъекционные растворы можно получить путем помещения активного ингредиента в необходимом количестве в соответствующий растворитель с одним ингредиентом или комбинацией ингредиентов, перечисленных выше, если это необходимо, с последующей стерилизующей фильтрацией. Как правило, дисперсии получают путем помещения активного ингредиента в стерильную среду-носитель, которая содержит основную дисперсионную среду и необходимые другие ингредиенты из перечисленных выше. В случае со стерильными порошками для получения стерильных инъекционных растворов предпочтительные способы получения представляют собой вакуумную сушку и сублимационную сушку, которые приводят к получению порошка активного ингредиента и любого дополнительного требуемого ингредиента из их раствора, предварительно подвергнутого стерилизующей фильтрации. Надлежащую текучесть раствора можно поддерживать, например, путем применения покрытия, такого как лецитин, путем поддержания необходимого размера частиц в случае с дисперсией и путем применения поверхностно-активных веществ. Пролонгированное всасывание инъекционных композиций может обеспечиваться включением в композицию средств, которые замедляют всасывание, например, моностеаратных солей и желатина.
Активный ингредиент может быть составлен в составе или устройстве с контролируемым высвобождением. Примеры таких составов и устройств включают имплантаты, трансдермальные пластыри и микроинкапсулированные системы доставки. Можно применять биоразлагаемые, биосовместимые полимеры, такие как этиленвинилацетат, полиангидриды, полигликолевую кислоту, коллаген, сложные полиортоэфиры и полимолочную кислоту. Способы получения таких составов и устройств известны из уровня техники. См., например, Sustained and Controlled Release Drug Delivery Systems, J. R. Robinson, ed., Marcel Dekker, Inc., Нью-Йорк, 1978.
Инъекционные депо-составы можно получать путем образования микроинкапсулированных матриц с лекарственным средством в биоразлагаемых полимерах, таких как сополимер лактида и гликолида. В зависимости от соотношения лекарственного средства и полимера и природы используемого полимера можно контролировать скорость высвобождения лекарственного средства. Другими иллюстративными биоразлагаемыми полимерами являются сложные полиортоэфиры и полиангидриды. Инъецируемые депо-составы также можно получать путем захвата лекарственного средства в липосомы или микроэмульсии.
В композиции могут быть включены дополнительные активные соединения. В одном варианте осуществления химерный белок по настоящему изобретению составлен с фактором свертывания крови или его вариантом, фрагментом, аналогом или производным. Например, фактор свертывания крови включает без ограничения фактор V, фактор VII, фактор VIII, фактор IX, фактор X, фактор XI, фактор XII, фактор XIII, протромбин, фибриноген, фактор фон Виллебранда или рекомбинантный растворимый тканевой фактор (rsTF) или активированные формы любого из предшествующих. Фактор свертывания крови в гемостатическом средстве также может включать антифибринолитические лекарственные средства, например, эпсилон-аминокапроновую кислоту, транексамовую кислоту.
Схемы дозирования могут быть скорректированы для обеспечения оптимального требуемого ответа. Например, можно вводить однократную болюсную дозу, можно вводить несколько разделенных доз на протяжении некоторого периода времени, или дозу можно пропорционально уменьшить или увеличить, как указывают потребности терапевтической ситуации. Преимущественным является составление композиций для парентерального применения в виде лекарственной формы с однократной дозой для удобства введения и однородности дозирования. См., например, Remington's Pharmaceutical Sciences (Mack Pub. Co., Easton, Pa. 1980).
В дополнение к активному соединению жидкая лекарственная форма может содержать инертные ингредиенты, такие как вода, этиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла, глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и сложные эфиры жирных кислот и сорбитана.
Неограничивающие примеры подходящих фармацевтических носителей также описаны в Remington's Pharmaceutical Sciences, E.W. Martin. Некоторые примеры вспомогательных веществ включают крахмал, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, мел, силикагель, стеарат натрия, моностеарат глицерина, тальк, хлорид натрия, сухое обезжиренное молоко, глицерин, пропиленгликоль, воду, этанол и т. п. Композиция также может содержать рН-буферные реагенты, а также смачивающие или эмульгирующие средства.
Для перорального введения фармацевтическая композиция может быть в форме таблеток или капсул, полученных с помощью традиционных способов. Композиция также может быть получена в виде жидкости, например, сиропа или суспензии. Жидкость может содержать суспендирующие средства (например, сироп на основе сорбита, производные целлюлозы или гидрогенизированные пищевые жиры), эмульгирующие средства (лецитин или аравийскую камедь), неводные среды-носители (например, миндальное масло, масляные сложные эфиры, этиловый спирт или фракционированные растительные масла) и консерванты (например, метил- или пропил-п-гидроксибензоаты или сорбиновую кислоту). Препараты могут также содержать ароматизаторы, красители и подсластители. В качестве альтернативы композиция может быть представлена в виде сухого продукта для разведения водой или другой подходящей средой-носителем.
Для трансбуккального введения композиция может быть в форме таблеток или пастилок в соответствии с традиционными протоколами.
Для введения путем ингаляции соединения для применения по настоящему изобретению в целях удобства доставляются в форме распыляемого аэрозоля со вспомогательными веществами или без них или в форме аэрозольного спрея из упаковки под давлением или распылителя, необязательно с пропеллентом, например, дихлордифторметаном, трихлорфторметаном, дихлортетрафторметаном, диоксидом углерода или другим подходящим газом. В случае с аэрозолем под давлением единица дозирования может определяться благодаря обеспечению наличия клапана для доставки отмеренного количества. Капсулы и картриджи из, например, желатина для применения в ингаляторе или инсуффляторе могут быть составлены так, чтобы они содержали порошковую смесь соединения и подходящей порошковой основы, такой как лактоза или крахмал.
Фармацевтическая композиция также может быть составлена для ректального введения в виде суппозитория или удерживающей клизмы, например, содержащей традиционные суппозиторные основы, такие как масло какао или другие глицериды.
В одном варианте осуществления фармацевтическая композиция содержит лентивирусный вектор, содержащий оптимизированную молекулу нуклеиновой кислоты, кодирующую полипептид, обладающий активностью фактора VIII, и фармацевтически приемлемый носитель. В другом варианте осуществления фармацевтическая композиция содержит клетку-хозяина (например, гепатоцит), содержащую лентивирусный вектор, содержащий оптимизированную молекулу нуклеиновой кислоты, кодирующую полипептид, обладающий активностью фактора VIII, и фармацевтически приемлемый носитель.
В некоторых вариантах осуществления композицию вводят посредством пути, выбранного из группы, состоящей из местного введения, внутриглазного введения, парентерального введения, интратекального введения, субдурального введения и перорального введения. Парентеральное введение может представлять собой внутривенное или подкожное введение.
В других вариантах осуществления композицию используют для лечения заболевания или состояния, затрагивающего свертываемость крови, у нуждающегося в этом субъекта. Заболевание или состояние, затрагивающее свертываемость крови, выбрано из группы, состоящей из коагуляционного нарушения свертываемости крови, гемартроза, мышечного кровотечения, кровотечения из полости рта, кровоизлияния, кровоизлияния в мышцы, кровоизлияния в полости рта, травмы, черепно-мозговой травмы, желудочно-кишечного кровотечения, внутричерепного кровоизлияния, внутрибрюшного кровоизлияния, внутригрудного кровоизлияния, перелома кости, кровотечения в центральной нервной системе, кровотечения в заглоточном пространстве, кровотечения в забрюшинном пространстве, кровотечения во влагалище подвздошно-поясничной мышцы или любой их комбинации. В еще нескольких других вариантах осуществления у субъекта запланировано проведение хирургического вмешательства. В еще нескольких других вариантах осуществления лечение проводят в режиме профилактики или при необходимости.
Все из различных аспектов, вариантов осуществления и возможностей выбора, описанных в данном документе, можно комбинировать во всех без исключения вариантах.
Все публикации, патенты и заявки на патенты, упоминаемые в настоящем описании, включены в данный документ посредством ссылки в такой же степени, как если бы каждая отдельная публикация, патент или заявка на патент была конкретно и отдельно указана как включенная посредством ссылки.
При наличии описания настоящего изобретения в общих чертах может быть достигнуто дополнительное понимание, если обратиться к представленным в данном документе примерам. Эти примеры служат лишь для иллюстративных целей и не предполагаются как ограничивающие.
ПРИМЕРЫ
Пример 1. Стратегия оптимизации кодонов
Восемь кодон-оптимизированных вариантов BDD FVIII создали посредством отслеживания предпочтения использования кодонов, включая coFVIII-3 (SEQ ID NO: 1; фиг. 1A), coFVIII-4 (SEQ ID NO: 2; фиг. 1B), coFVIII-5 (SEQ ID NO: 70; фиг. 1C), coFVIII-6 (SEQ ID NO: 71; фиг. 1D), coFVIII-52 (SEQ ID NO: 3; фиг. 1E), coFVIII-62 (SEQ ID NO: 4; фиг. 1F), coFVIII-25 (SEQ ID NO: 5; фиг. 1G) и coFVIII-26 (SEQ ID NO: 6; фиг. 1H). Онлайн-средство Eugene использовали в целях содействия оптимизации кодонов так, как это описано ранее (см. Gaspar et al., "EuGene: maximizing synthetic gene design for heterologous expression", Bioinformatics 28:2683-84 (2012)), а также отслеживали несколько параметров частоты использования кодонов, такие как индекс адаптации кодонов (CAI) и относительная частота использования синонимичных кодонов (RSCU) (таблица 5). Все варианты были скорректированы до CAI > 83% и RSCU > 1,63, в то время как родительская последовательность FVIII с удаленным доменом B до оптимизации характеризовалась CAI 74% и RSCU 1,12 (таблица 5).
Таблица 5. Параметры оптимизации кодонов
(CAI; %)
В дополнение к общему повышению CAI восемь вариантов разделили на три класса на основе распределения CAI по кодирующей области, как показано на фиг. 2, относительно неоптимизированной последовательности BDD FVIII (фиг. 2A). Первый класс включает варианты BDD FVIII с равномерным распределением высокого CAI по всей кодирующей области (см. фиг. 2C - 2F). Первый класс включает coFVIII-3 (фиг. 2C), coFVIII-4 (фиг. 2D), coFVIII-5 (фиг. 2E), coFVIII-6 (фиг. 2F), а также ранее описанный coFVIII-1 (см. международную публикацию № WO 2014/127215 (SEQ ID NO: 1)) (фиг. 2B). Второй класс включает варианты BDD-FVIII с более низким CAI в N-концевой половине кодирующей последовательности и более высоким CAI в C-концевой половине кодирующей последовательности (см. фиг. 2G и 2H). Второй класс включает coFVIII-52 (фиг. 2G) и coFVIII-62 (фиг. 2H). Третий класс включает варианты BDD FVIII с более высоким CAI в N-концевой половине кодирующей последовательности и более низким CAI в C-концевой половине кодирующей последовательности (см. фиг. 2I и 2J). Третий класс включает coFVIII-25 (фиг. 2I) и coFVIII-26 (фиг. 2J).
Не ограничиваясь какой-либо теорией, высказали предположение, что более высокий CAI может коррелировать с более быстрой трансляцией белка, и эти три класса могут представлять разные скорости синтеза белка от начала до конца. Например, трансляция области с более низким CAI может происходить медленно по сравнению с трансляцией области с более высоким CAI. Если это так, то трансляция, например, N-концевой половины coFVIII-52 и coFVIII-62, характеризующейся более низким CAI, может первоначально происходить медленно, после чего следует более быстрая трансляция C-концевой половины, характеризующейся более высоким CAI. Это может быть предпочтительным для фолдинга белка и посттрансляционной модификации во время трансляции без замедления общего синтеза белка. Противоположный эффект можно увидеть для вариантов coFVIII-25 и coFVIII-26, которые характеризуются более высоким CAI на N-концевой половине и более низким CAI на C-концевой половине.
Чтобы гарантировать стабильность мРНК, все кодон-оптимизированные варианты FVIII подвергли корректированию во избежание ряда сайтов, включая криптические сайты сплайсинга, сайты преждевременного полиаденилирования, мотивы нестабильности РНК (ARE) и повторяющиеся последовательности, а также для корректировки содержания GC (см. таблицу 2).
Пример 2. Клонирование и экспрессия вариантов coFVIII из плазмиды pcDNA3
Экспрессионные плазмиды, содержащие различные варианты FVIII, сконструировали для экспрессии in vivo. Неоптимизированные полинуклеотиды BDD FVIII (фиг. 1I; SEQ ID NO: 16) и coFVIII-1 (фиг. 11Z; SEQ ID NO: 68) клонировали в остов pcDNA3 (Invitrogen), где промотор CMV заменили ET-промотором (см. фиг. 3). Полученные плазмиды, FVIII-311 (BDD FVIII) и FVIII-303 (coFVIII-1), управляют экспрессией неоптимизированных BDD FVIII и coFVIII-1 соответственно.
Экспрессию in vivo FVIII-311 и FVIII-303 оценивали у мышей с Hem A посредством гидродинамической инъекции FVIII-303 или FVIII-311 в количестве 5 мкг ДНК/мышь. Образцы плазмы крови отбирали через 24, 48 и 72 часа после инъекции, а активность FVIII определяли с помощью FVIII-специфичного хромогенного анализа.
На фиг. 4 показано, что активность FVIII в плазме крови мышей, обработанных с помощью FVIII-311 (BDD FVIII; квадраты), составила 74 ± 43 мЕд/мл через 72 часа после инъекции, тогда как активность FVIII в плазме крови мышей, обработанных с помощью FVIII-303 (coFVIII-1; круги) составила 452 ± 170 мЕд/мл через 72 часа после инъекции (фиг. 4). Это представляет примерно шестикратное увеличение экспрессии coFVIII-1 по сравнению с неоптимизированным BDD FVIII.
Пример 3. Клонирование и экспрессия вариантов coFVIII с использованием лентивирусной векторной системы
Для дальнейшей оценки уровня экспрессии кодон-оптимизированных вариантов BDD FVIII кодирующие последовательности клонировали в лентивирусные плазмиды под контролем ЕТ-промотора (см. Amendola et al., "Coordinate dual-gene transgenesis by lentiviral vectors carrying synthetic bidirectional promoters", Nature Biol. 23:108-16 (2005); Международная публикация № WO 2000/066759 A1). Карта плазмиды pLV-coFVIII-52 показана на фиг. 5; при этом плазмиды, содержащие неоптимизированный BDD FVIII (LV-2116), coFVIII-1 (LV-coFVIII-1), coFVIII-3 (LV-coFVIII-3), coFVIII-4 (LV-coFVIII-4), coFVIII-5 (LV-coFVIII-5) и coFVIII-6 (LV-coFVIII-6), coFVIII-62 (LV-coFVIII-62), coFVIII-25 (LV-coFVIII-25) и coFVIII-26 (LV-coFVIII-26) конструировали таким же образом за исключением того, что фрагмент coFVIII-52 заменяли каждой указанной кодирующей последовательностью с использованием сайтов NheI и SalI (таблица 6).
Таблица 6. Кодирование экспрессионных плазмид для вариантов FVIII
Лентивирусные кодон-оптимизированные варианты FVIII оценивали на мышах с HemA с помощью гидродинамической инъекции в дозе 5 мкг ДНК/мышь (фиг. 6A, 6B) или 20 мкг ДНК/мышь (фиг. 6C). На фиг. 6 показано, что каждый из coFVIII-3 (фиг. 6A; треугольники), coFVIII-4 (фиг. 6A; перевернутые треугольники), coFVIII-5 (фиг. 6A; ромбы), coFVIII-6 (фиг. 6A; незакрашенные круги), coFVIII-25 (фиг. 6B; треугольники), coFVIII-26 (фиг. 6B; перевернутые треугольники), coFVIII-52 (фиг. 6C; квадраты) и coFVIII-62 (фиг. 6C; закрашенные круги) показал более высокую активность FVIII, чем coFVIII-1 (фиг. 6A, круги; фиг. 6B, круги; и фиг. 6C, треугольники). В частности, coFVIII-25 и coFVIII-26 проявляли аналогичный уровень экспрессии через 72 часа после инъекции, достигая активности в приблизительно 3 раза большей, чем активность coFVIII-1 (фиг. 6B), что преобразуется в 24-кратное повышение активности FVIII по сравнению с неоптимизированным родительским BDD FVIII (см. фиг. 4). Как coFVIII-52 (квадраты), так и coFVIII-62 (закрашенные круги) достигали еще более высокой экспрессии через 72 часа после инъекции, демонстрируя, соответственно, в 6 раз и 4 раза большую экспрессию, чем coFVIII-1 (треугольники), и, соответственно, в 50 и 30 раз большую экспрессию, чем неоптимизированный родительский BDD FVIII (незакрашенные круги) (фиг. 6C). Эти данные показывают, что комбинация более низкого CAI на N-концевой половине кодирующей последовательности и более высокого CAI на C-концевой половине кодирующей последовательности может быть более благоприятной для экспрессии FVIII по сравнению с обратным распределением CAI.
Пример 4. Длительная лентивирусная экспрессия кодон-оптимизированных вариантов FVIII у мышей с HemA
Варианты, которые, как определили, обеспечивают высокую экспрессию FVIII у мышей с HemA через 72 часа после гидродинамической инъекции, оценивали в отношении длительной экспрессии FVIII с помощью переноса гена, опосредованного лентивирусными векторами. Лентивирусные векторы получали в клетках 293Т с помощью временной трансфекции и концентрировали посредством ультрацентрифугирования до приблизительно 5Е9 ТЕ/мл. Затем лентивирусные векторы вводили мышам с HemA возрастом 12-14 дней посредством ретроорбитальной инъекции в дозе 1E8 ТЕ/мышь. Через 21 день после лентивирусной инъекции средний уровень активности FVIII в плазме крови составлял приблизительно 0,04 МЕ/мл у мышей, которым инъецировали LV-2116 (BDD FVIII; фиг. 7). Каждый из coFVIII-1, coFVIII-5, coFVIII-52, coFVIII-6 и coFVIII-62 приводил к более высокому уровню циркулирующего в крови FVIII через 21 день после инъекции по сравнению с контрольным LV-2116 (неоптимизированный FVIII с удаленным B-доменом). В частности, инъекции coFVIII-1 и coFVIII-5 давали уровень активности FVIII в плазме крови, составляющий приблизительно 1,8 МЕ/мл, coFVIII-52 давал уровни активности FVIII в плазме крови, составляющий приблизительно 4,9 МЕ/мл, coFVIII-6 давал уровень активности FVIII в плазме крови, составляющий приблизительно 4,6 МЕ/мл, и coFVIII-62 уровень активности FVIII в плазме крови, составляющий приблизительно 2,5 МЕ/мл, через 21 день после инъекции (фиг. 7). Уровни FVIII в плазме крови, наблюдаемые у мышей, которым вводили LV-coFVIII-6 и LV-coFVIII-52, 4,6 МЕ/мл и 4,9 МЕ/мл соответственно, в более чем 100 раз превышают уровни в плазме крови, наблюдаемые у мышей, которым инъецировали контрольный LV-2116 (неоптимизированный BDD-FVIII).
Пример 5. Слитые конструкции coFVIII-XTEN
Анализировали способность XTEN улучшать стабильную экспрессию FVIII. Во-первых, кодирующую последовательность XTEN из 144 аминокислот ("XTEN144"; SEQ ID NO: 18) вставляли в положение нуклеотида 1193 (или после первых 764 аминокислот кодируемого полипептида) coFVIII-52 и coFVIII-1 с образованием coFVIII-52-XTEN (фиг. 8A; SEQ ID NO: 19) и coFVIII-1-XTEN (фиг. 8B; SEQ ID NO: 20) соответственно. Затем последовательность coFVIII-1-XTEN клонировали в остов pcDNA3 (Invitrogen) под контролем ET-промотора так, как это описано выше, для создания экспрессионной плазмиды FVIII-306; и последовательность coFVIII-52-XTEN клонировали в лентивирусную плазмиду под контролем ET-промотора так, как это описано выше, для создания pLV-coFVIII-52-XTEN (фиг. 9). FVIII-306 (coFVIII-1-XTEN) вводили мышам с HemA в дозе 5 мкг ДНК/мышь посредством гидродинамической инъекции. По сравнению с FVIII-303 (coFVIII-1; фиг. 10A, маленькие круги) и FVIII-311 (BDD FVIII; фиг. 10A, квадраты) слияние XTEN144 с coFVIII-1 (FVIII-306; фиг. 10A, большие круги) давало приблизительно 5-кратное и 33-кратное повышение экспрессии FVIII, соответственно, у мышей с HemA через 72 часа после инъекции. Влияние вставки XTEN на экспрессию FVIII также оценивали с использованием лентивирусного вектора у мышей с HemA (фиг. 10B). LV-coFVIII-52-XTEN вводили мышам с HemA возраста 12-14 дней в дозе 1E8 ТЕ/мышь посредством ретроорбитальной инъекции. По сравнению с LV-coFVIII52 и LV-2116 (BDD-FVIII) слияние XTEN144 с coFVIII-52 (фиг. 10B) давало приблизительно 4-кратное и 450-кратное повышение экспрессии FVIII, соответственно, у мышей с HemA через 21 день после инъекции.
Лентивирусные векторы, содержащие каждый из coFVIII-3, co-FVIII-4, coFVIII-5, coFVIII-6, coFVIII-62, coFVIII-25 и coFVIII-26, слитый с XTEN144 и слитый с ET-промотором, получат так, как это описано выше. Проведут тестирование векторов на экспрессию белков FVIII.
Пример 6. Экспрессия конструкций на основе coFVIII
Кодон-оптимизированные варианты FVIII клонировали в лентивирусные плазмиды так, как это показано на фиг. 9 посредством стандартных методик молекулярного клонирования. Затем лентивирусные векторы получали в клетках HEK293 с помощью временной трансфекции и выделяли посредством ультрацентрифугирования.
Лентивирусные векторы FVIII вводили детенышам мышей с HemA возрастом 14 дней путем внутривенной инъекции варианта LV-FVIII в дозе 1,5E10 ТЕ/кг. Активность FVIII в плазме крови измеряли через 21 день после обработки с помощью LV-FVIII, а количество копий вектора (VCN) на клетку измеряли в образцах печени, полученных на вскрытии, отобранных у животных, обработанных с помощью LV-FVIII, через 150 дней после обработки с помощью LV-FVIII. Хотя значения VCN были сходными у всех животных, независимо от введенных вариантов LV-FVIII (фиг. 12B) уровни активности FVIII у животных, обработанных вариантами coFVIII, были в 30-100 раз выше, чем у животных, обработанных с помощью wtBDD-FVIII (фиг. 12A и 12C; таблица 7). Эти данные показывают, что оптимизация кодонов FVIII улучшает экспрессию FVIII в условиях лентивирусного вектора.
Таблица 7. Относительная экспрессия кодон-оптимизированных конструкций на основе FVIII
Пример 7. Иммунный ответ, опосредованный экспрессией трансгена FVIII, у мышей с HemA после лентивирусной обработки
Мышей из примера 6, обработанных LV-FVIII, оценивали в отношении длительной экспрессии FVIII и образования антитела к FVIII. Экспрессия FVIII, о чем свидетельствовала активность FVIII в плазме крови, варьировала среди животных в одной и той же группе лечения (фиг. 13A). Например, три мыши (обозначенные 1, 2 и 3), обработанные лентивирусным вектором, экспрессирующим вариант coFVIII-5, показали стабильную экспрессию FVIII в течение примерно 16 недель, тогда как три однопометника (обозначенные 4, 5 и 6), которых обрабатывали тем же лентивирусным вектором, показали резкое снижение уровней активности FVIII в плазме крови через приблизительно 10 недель после обработки (фиг. 13A). Стабильная активность FVIII в плазме крови, наблюдаемая у мышей 1, 2 и 3, коррелировала с невыявляемыми или очень низкими уровнями антител к FVIII (фиг. 13B; мыши 1, 2 и 3). И напротив, у мышей, у которых наблюдали резкое снижение активности FVIII в плазме крови, также наблюдали повышенные уровни антител к FVIII (фиг. 13B; мыши 4, 5 и 6). Эти данные указывают на то, что экспрессия трансгена FVIII индуцирует образование антител к FVIII в подгруппе животных, и полученные антитела к FVIII элиминируют трансгенный белок FVIII из кровотока.
Оценивали взаимосвязь между экспрессией FVIII и образованием антител к FVIII. Мышей из примера 6, обработанных LV-FVIII, разделили на две группы: мышей, отрицательных по антителам к FVIII, и мышей, положительных по антителам к FVIII. На фиг. 14 показано, что экспрессия трансгенного FVIII на физиологических уровнях не индуцирует иммунный ответ на трансгенный FVIII (фиг. 14, круги). Тем не менее, уровни экспрессии FVIII, превышающие физиологические, по-видимому, индуцируют образование антител к FVIII, поэтому, чем выше экспрессия FVIII, тем выше вероятность индуцирования выработки антител к FVIII. Эти данные указывают на то, что поддерживать физиологические уровни экспрессии FVIII может быть полезным у пациентов, подвергнутых лечению посредством генной терапии FVIII.
Чтобы определить, приводит ли индуцированный экспрессией FVIII иммунный ответ к потере клеток печени, экспрессирующих трансген, количество копий вектора (фиг. 15) и уровень транскрипции РНК FVIII (фиг. 16) оценивали в образцах печени, полученных на вскрытии мышей, положительных и отрицательных по антителам к FVIII. На фиг. 15 показано, что распределение числа копий вектора было одинаковым у мышей, положительных и отрицательных по антителам к FVIII, что указывает на то, что клетки с интеграцией LV-FVIII сохранялись, несмотря на развитие антител к FVIII. Это свидетельствует о том, что доза экспрессии трансгена FVIII, опосредованная LV-FVIII, не индуцирует ответ цитотоксических Т-лимфоцитов (CTL) против клеток печени, экспрессирующих FVIII. Для дальнейшего подтверждения этих результатов транскрипцию РНК FVIII оценивали посредством гибридизации РНК in situ (фиг. 16C и 16D). На момент отбора печени у мыши coFVIII-52-B наблюдали отсутствие выявляемого циркулирующего в крови FVIII и высокий уровень антител к FVIII (фиг. 16A и 16B). Однако сигнал транскрипции РНК и количество FVIII-РНК-положительных клеток в ткани печени мыши coFVIII-52-B были сопоставимы с мышью FVIII-52-A, у которой наблюдали приблизительно 4 МЕ/мл циркулирующего в крови FVIII на момент вскрытия. По этой причине экспрессия FVIII не вызывала CTL-ответа у экспериментальных мышей с HemA.
Пример 8. Длительная экспрессия FVIII у новорожденных мышей с HemA, обработанных с помощью LV-FVIII
Чтобы оценить эффективность использования лентивирусной системы для лечения пациентов детского возраста с HemA посредством нацеливания на печень, мышам с HemA возрастом 2 дней вводили посредством инъекции в височную вену приблизительно 1,5 Е10 ТЕ/кг LV-coFVIII-52XTEN, LV-coFVIII6-XTEN или лентивирусный вектор, экспрессирующий wtBDD-FVIII. Стабильную длительную экспрессию FVIII наблюдали как в случае вариантов, так и контроля, демонстрируя, что интегрированный каскад экспрессии FVIII поддерживался в делящихся клетках печени обработанных мышей (фиг. 17). Эти данные свидетельствуют о том, что LV-FVIII потенциально может использоваться для лечения как пациентов детского возраста, так и взрослых пациентов с HemA.
Пример 9. Оценка LV-FVIII у новорожденных мышей с HemA
Генная терапия ex vivo с помощью лентивирусных векторов (LV) для замещения генов продемонстрировала клиническую эффективность при множестве показаний, и многолетнее наблюдение за пролеченными пациентами свидетельствует об отсутствии признаков онкогенеза. Системная доставка LV-FIX опосредует стойкую экспрессию FIX и хорошо переносится в животных моделях гемофилии. Большая упаковочная емкость, способность поддерживать длительную экспрессию трансгена за счет интеграции генов, отсутствие ранее существовавших антител к LV в популяциях людей и обнадеживающие профили in vivo, продемонстрированные в доклинических и клинических условиях, делают LV перспективным носителем для доставки генов in vivo, особенно для генов-кандидатов с большим размером кДНК, таких как FVIII.
Для оценки потенциального использования LV-FVIII в лечении гемофилии A (HemA) кодон-оптимизированные варианты FVIII человека (hFVIII), помещенные под контроль промотора, специфического в отношении гепатоцита, были встроены в систему LV, которая содержит множество копий целевых последовательностей микроРНК-142, для минимизации экспрессии FVIII в антигенпрезентирующих клетках и снижения вероятности индуцирования выработки антител к FVIII. Векторы LV-hFVIII получали с помощью временной трансфекции клеток 293T с последующим 1000-кратным концентрированием посредством ультрацентрифугирования и оценивали на моделях мышей с HemA. После внутривенного введения LV-hFVIII уровень циркулирующего в крови hFVIII контролировали с помощью анализов активности FVIII и антигена, эффективность трансдукции LV в печени оценивали путем измерения копий ДНК LV с помощью количественной ПЦР и трансгенной РНК с помощью гибридизации in situ, антитела к hFVIII измеряли с помощью ELISA общих антител к hFVIII.
Устойчивую экспрессию FVIII выявляли для всех вариантов LV-hFVIII у мышей с HemA, которых обрабатывали на неонатальной стадии. При дозе в 1,5E10 трансдуцирующих единиц/кг LV, кодирующий кодон-оптимизированный hFVIII (LV-cohFVIII), приводил к повышению циркулирующего в крови FVIII в 30-100 раз по сравнению с LV, кодирующим hFVIII дикого типа (фиг. 12C), в то время как число копий вектора в клетках печени и процент РНК-положительных клеток FVIII был сопоставим во всех тестируемых группах (фиг. 12B). Комбинация оптимизации кодонов с XTEN (LV-cohFVIII-XTEN), неструктурированным гидрофильным полипептидом, который предположительно улучшает период полужизни в кровотоке за счет увеличения гидродинамического размера полезной нагрузки, приводил к активности FVIII в 30-50 МЕ/мл в плазме крови, представляющей от 3000 до 5000% от нормального уровня циркулирующего в крови FVIII (фиг. 12A, фиг. 17). Более того, антитела к hFVIII выявляли только у мышей с уровнем hFVIII (фиг. 14), превышающим физиологический, но у мышей, положительных по антителам к hFVIII, не наблюдали ответа цитотоксических Т-лимфоцитов против трансдуцированных с помощью LV клеток (фиг. 15 и 16A-16D). Результат авторов настоящего изобретения является основой для дальнейшей разработки LV-FVIII с целью генной терапии гемофилии А in vivo.
Пример 10. Дозозависимый эффект обработки с помощью LV-FVIII у мышей с HemA
Чтобы определить зависимость доза-ответ обработки с помощью LV-FVIII у мышей с HemA, детенышей с HemA возрастом 12-14 дней подвергали обработке с помощью LV-coFVIII-6 или LV-coFVIII-6-XTEN путем ретроорбитальной инъекции при четырех уровнях доз: 1,3×1010 ТЕ/кг, 4,5×109 ТЕ/кг, 1,5×109 ТЕ/кг и 8,3×108 ТЕ/кг.
Уровень экспрессии FVIII, опосредованный LV-FVIII, у обработанных мышей измеряли с помощью хромогенного анализа FVIII, и пиковый уровень экспрессии FVIII нанесли на график на фиг. 18A (LV-coFVIII-6) и фиг. 18B (LV-coFVIII-6-XTEN).
После обработки с помощью LV-FVIII средний пиковый уровень экспрессии FVIII для групп обработки 1,3 E10 ТЕ/кг, 4,5×109 ТЕ/кг, 1,5×109 ТЕ/кг и 8,3×108 ТЕ/кг составил 882%, 662%, 15% и 12% от нормы для LV-coFVIII-6 соответственно; 1793%, 431%, 10% и 10% от нормы для LV-coFVIII-6-XTEN соответственно.
Для существующих в настоящее видов заместительной терапии, направленной на FVIII, целевой минимальный уровень при профилактике с помощью FVIII составляет 1-3% от нормы, что обеспечивает существенную защиту пациента с гемофилией A. При 8,3×108 ТЕ/кг, наиболее низкой испытанной дозе LV-FVIII, обработка как с помощью LV-coFVIII-6, так и с помощью LV-coFVIII-6-XTEN привела к ≥10% от нормального циркулирующего в крови FVIII у мышей с HemA, что позволяет предположить, что лечение с помощью LV-FVIII в дозе 1×109 ТЕ/кг может быть потенциально терапевтически полезным для пациентов с гемофилией А.
Пример 11. Поисковое исследование c в/в инфузией однократной дозы двух лентивирусных векторов у свинохвостых макак
1. Цель: целью данного исследования является определение зависимости доза/ответ генной терапии с помощью фактора VIII лентивирусного вектора (LV) у свинохвостых макак для лечения, соответственно, гемофилии А.
2. Тест-система и обоснование: свинохвостые макаки (M. nemestrina), интактные самцы, возрастом от 1 до 5 лет, весом от 2 до 5 кг. Свинохвостый макак представляет собой подходящую фармакологически активную модель для этого исследования зависимости доза/ответ генной терапии с помощью LV. В настоящее время требуются исследования на лабораторных животных для подтверждения нормативных требований, и виды низшего порядка не считаются моделями, пригодными для изучения зависимостей доза-ответ LV. Количество используемых животных представляет собой минимальное количество, необходимое для получения значимых результатов.
3. Уход за животными, содержание и условия окружающей среды: общие процедуры по уходу за животными и их содержанию будут соответствовать рекомендациям AAALAC International, существующим требованиям, изложенным в "Guide for Care and Use of Laboratory Animals" (Национальный совет по исследованиям, текущее издание), существующим требованиям, изложенным Министерством сельского хозяйства США посредством требований Закона о гуманном обращении с животными, с последними изменениями, и будут соответствовать стандартным рабочим процедурам испытательного центра. Перед началом исследования дизайн исследования был рассмотрен и одобрен Институциональным комитетом по содержанию и использованию животных (IACUC).
3.1 Карантин и адаптация: NHP будут помещены в карантин и адаптированы. Всем животным будут проводить исследования кала, анализ на туберкулез, физикальное обследование и медицинский скрининг на клинические патологии (только гематологический анализ и биохимический анализ сыворотки крови), чтобы гарантировать, что дозы будут вводиться только здоровым NHP. Во время карантина у животных также будут дважды отбирать кровь с интервалом в примерно 1 неделю.
Образец цельной крови с целевым объемом ~4 мл будут отбирать в пробирку или пробирки, содержащие цитрат натрия, и помещать на жидкий лед до центрифугирования. В зависимости от объема плазму крови будут разделять на целевые 4 аликвоты по ~500 мкл/аликвота и немедленно замораживать в жидком азоте. Образец цельной крови с целевым объемом ~1 мл будут отбирать в пробирку, которая не содержит антикоагулянта, но может содержать гель для разделения сыворотки крови (пробирка SST). Пробирку SST оставляют при комнатной температуре в течение не менее 30 минут, чтобы кровь свернулась, а затем центрифугируют для получения целевого объема сыворотки крови, составляющего примерно 300 мкл (в зависимости от объема). После разделения сыворотку крови немедленно замораживают на сухом льду. Все пробирки центрифугируют при относительном центробежном ускорении (RCF), равном 1300, по меньшей мере 10 минут. Пробирки с цитратом натрия будут обрабатывать в охлаждаемой центрифуге, установленной на температуру 4°C, а пробирки SST будут обрабатывать в центрифуге при комнатной температуре, и все образцы будут замораживать после обработки в морозильной камере, настроенной для поддержания от -85 до -60°C до отправки на анализ.
Перед началом введения доз NHP будут приучать к смирительному креслу. NHP будут постепенно адаптироваться к по меньшей мере 3 сеансам, чтобы привыкнуть к нахождению до 1 часа подряд в смирительном кресле. Обратите внимание, что животные могут находиться в креслах в течение до 20 минут сверх 1 часа, чтобы обеспечить достаточное количество времени для возвращения их в свои домашние клетки.
3.2 Содержание животных и условия окружающей среды: в ходе исследования NHP будут содержать в паре или втроем. NHP могут содержать по отдельности в ходе исследования, если события (явные клинические признаки, серьезная агрессия по отношению к соседу по клетке и т. д.) потребуют разделения. Любое животное, содержащееся отдельно, может обеспечиваться улучшенным содержанием, определенное ветеринарным персоналом.
Диапазоны температуры и влажности в исследовательском помещении будут составлять 64-84°F и 50 ± 20% соответственно. Световой цикл установят на поддержание режима 12 часов света/12 часов темноты. Показания воздухообмена и давления будет контролировать сторонний консультант не реже двух раз в год, чтобы гарантировать, что контроль состояния окружающей среды обеспечивает минимум 10-разовый воздухообмен в час.
3.3. Кормление: обезьянам будут скармливать PMI Certified Primate Diet 5048 два раза в день за исключением определенных периодов голодания или периодов, когда животные находятся вне своей домашней клетки на время сеансов исследования (например, когда их помещают в смирительные кресла для введения доз и отбора крови). Рацион также будут дополнять свежими фруктами, и/или свежими овощами, и/или добавками.
Аналитические отчеты по каждой партии PMI Certified Primate Diet будут предоставлены производителем. Аналитические отчеты будут проверены для гарантирования приемлемых стандартов и отсутствия уровней загрязнителей, которые могут помешать цели или проведению исследования. Аналитические результаты будут хранить в записях испытательного центра. Пищевые добавки не требуют анализа.
3.4 Вода: животным будут предоставлять неограниченный доступ к свежей воде из коммунального водоснабжения Вест Джефферсона посредством автоматической системы подачи воды за исключением периодов ограничения (например, во время отбора крови, адаптации к креслу, введения доз и т. д.).
Водоснабжение периодически анализируют для гарантирования приемлемых стандартов и отсутствия уровней загрязнителей, которые могут помешать цели или проведению исследования. Результаты будут храниться в записях испытательного центра.
4. Исследуемые и контрольные препараты
Таблица 8. Контрольный фактор VIII LV
4.3. Резервные образцы компонентов исследуемого и контрольного препаратов: целевой объем резервных образцов, составляющий 1 мл, для архивации будет отобран из каждого исследуемого препарата в данном исследовании, поскольку продолжительность исследования превышает 4 недели.
4.4. Утилизация неиспользованного нерасфасованного исследуемого препарата: любой неиспользованный составленный исследуемый препарат может быть сохранен для использования в будущих исследованиях, отправлен в лабораторию, уполномоченную спонсором, утилизирован или возвращен.
4.5. Получение, использование и хранение состава: исследуемые препараты будут представлять собой готовые к использованию составы. В данном исследовании не предусмотрено получение состава.
4.6. Анализ и стабильность состава: для данного исследования не будут проводить анализ состава или стабильности.
5. Дизайн эксперимента
5.1. Распределение по группам и идентификация: перед распределением по группам животные будут идентифицированы по их татуировкам. Животных, которых будут использовать для введения доз, будут случайным образом распределять с использованием программы стратифицированной рандомизации (Provantis) на основе данных о весе тела.
После распределения в группы введения доз каждому животному будет присвоен идентификационный номер животного, уникальный в рамках исследования и идентифицированный с помощью карточки на клетке. Каждая карточка на клетке будет содержать информацию, включая без ограничения номер исследования, группу, в которую животное определили, и идентификационный номер животного. Татуировку будут использовать в соответствии с номером исследуемого животного на карточках на клетках.
5.2. Введение дозы: перед введением каждому животному соответствующей дозы в день 1 животным будут проводить (посредством медленной болюсной инъекции) премедикацию согласно следующей схеме:
Таблица 9
(0,3
мг/кг)b
(3,5 мг/кг)c
(0,3
мг/кг)b
b. Дексаметазон (4 мг/мл) будут вводить посредством медленной болюсной инъекции (~1-2 мин), исходя из последнего измеренного веса тела, в объеме дозы 0,075 мл/кг.
c. Дифенгидрамин (50 мг/мл) будут вводить посредством медленной болюсной инъекции (~1-2 мин), исходя из последнего измеренного веса тела, в объеме дозы 0,07 мл/кг.
Животным будут вводить исследуемый препарат при каждом из следующих целевых уровней дозы.
Таблица 10
b. TBD - подлежит определению, добавлено посредством поправки
c. ТЕ - трансдуцирующая единица и мера того, сколько вирусов может заразить клетку.
Каждому животному установят катетер в краниальный или подкожный сосуд ноги и введут внутривенную дозу (целевое значение 1 мл/мин) один раз с помощью шприцевого насоса (например, KDS220 или его эквивалента) при их соответствующих уровнях дозы с последующим промыванием с помощью 0,4-0,8 мл 0,9% раствора хлорида натрия. Время промывки считается завершением времени введения дозы.
5.3. Клиническое наблюдение: наблюдения в отношении смертности и/или состояния агонии будут проводить среди всех животных по меньшей мере один раз в день поступления и в день вскрытия, и дважды в день 7 дней в неделю в течение периода карантина, адаптации и исследования.
С момента получения животных и до последнего дня жизни клинические наблюдения за животными у клетки будут проводить по меньшей мере один раз в день за исключением каждого дня введения доз, когда клинические наблюдения у клетки будут проводить как минимум один раз перед введением дозы и по меньшей мере один раз через 2 часа (+/- 15 минут) после введения дозы.
5.4. Вес тела: индивидуальный вес тела будут регистрировать у всех животных по меньшей мере один раз во время карантина и один раз перед отбором животных для распределения в группы (неделя -1). Вес тела будут регистрировать в дни 1, 8, 15, 22, 29, 36, 43, 50 и 53. Вес тела, зарегистрированный в день 1 в каждой соответствующей группы, будут использовать для определения объема дозы для введения доз.
5.5. Клиническая патология: образцы для оценки клинической патологии (гематологическое исследование, клиническая биохимия и коагулограмма) будут отбирать в соответствии с приведенным ниже графиком. Всех NHP не будут кормить в течение ночи перед каждым интервалом отбора образцов.
Таблица 11
Кровь (целевое значение 1,5-3,0 мл/образец) для гематологического исследования, клинической биохимии и коагулограммы будут отбирать из бедренного сосуда или другого подходящего периферического сосуда. Обратите внимание, что объемы крови могут быть скорректированы в соответствии с рекомендациями IACUC. Пробирки для гематологического исследования будут содержать K3 EDTA в качестве антикоагулянта. Пробирки, используемые для биохимического исследования сыворотки крови, не будут содержать антикоагулянта, но могут содержать гель для разделения сыворотки крови. Пробирки для коагуляции будут содержать цитрат натрия в качестве антикоагулянта.
Если возможно, то кровь у умирающих животных могут отбирать для клинической патологической оценки при необходимости. Результаты клинической патологической оценки и отчет патологоанатома будут включены в окончательный отчет.
5.5.1. Гематологическое исследование: оценивают следующие гематологические показатели:
Таблица 12
Гемоглобин
Гематокрит
Количество лейкоцитов, общее
Лейкоцитарная формула (абсолютные значения)
Количество ретикулоцитов
Средний корпускулярный объем
Средний корпускулярный гемоглобин
Средняя корпускулярная концентрация гемоглобина
Гематологические образцы (остаточную кровь) выбросят после анализа.
5.5.2. Клиническая биохимия: оценивают следующие показатели клинической биохимии:
Таблица 13
Альбумин
Соотношение альбумин/глобулин
Щелочная фосфатаза
Аспартатаминотрансфераза
Билирубин, общий
Азот мочевины крови
Кальций
Холестерин
Хлор
Креатинин
Гамма-глутамилтрансфераза
Глобулин
Глюкоза
Лактатдегидрогеназа
Фосфор
Калий
Натрий
Общий белок
Триглицериды
Остаточную сыворотку крови после анализа выбросят до завершения исследования.
5.5.3. Коагулограмма: оценивают следующие показатели коагулограммы:
Таблица 14
Активированное частичное тромбопластиновое время
Образцы для коагулограммы (остаточную кровь) выбросят после анализа.
5.6. Биоаналитический анализ и фармакокинетическая оценка
5.6.1. Отбор образцов крови: образцы крови для биоаналитического анализа отберут и обработают с получением плазмы и сыворотки крови в соответствии с приведенным ниже графиком. Образцы плазмы и сыворотки крови, отобранные до дня 8, отправят в PI, указанный в разделе 4.3, где экспрессию фактора VIII будут определять в плазме крове, и оценку потенциальных цитокинов можно определить в плазме и сыворотке крови.
(i) Требования к голоданию: Животные не будут подвергать голоданию перед отбором крови, если только голодание не требуется в это же время для других процедур.
(ii) Образец цельной крови с целевым объемом ~1 мл будут отбирать в пробирку, содержащую цитрат натрия, и помещать на жидкий лед до центрифугирования. В зависимости от объема плазму крови разделят на целевые 4 аликвоты по ~100 мкл/аликвота и немедленно заморозят в жидком азоте, а затем хранят в морозильной камере, настроенной для поддержания температуры от -85° до -60°C, до отправки на анализ.
(iii) Образец цельной крови с целевым объемом ~1 мл будут отбирать в пробирку, которая не содержит антикоагулянта, но может содержать гель для разделения сыворотки крови (пробирка SST). Пробирку SST оставляют при комнатной температуре в течение не менее 30 минут, чтобы кровь свернулась, а затем центрифугируют для получения целевых 2 аликвот, содержащих примерно 200 мкл сыворотки крови (в зависимости от объема). После разделения сыворотку крови немедленно замораживают на сухом льду, а затем хранят в морозильной камере, настроенной для поддержания температуры от -85° до -60°C, до отправки на анализ.
(iv) Все пробирки центрифугируют при относительном центробежном ускорении (RCF), равном 1300, по меньшей мере 10 минут. Пробирки с цитратом натрия будут обрабатывать в охлаждаемой центрифуге, установленной на температуру 4°C, а пробирки SST будут обрабатывать в центрифуге при комнатной температуре.
(v) Место проведения отбора: бедренный сосуд или другой подходящий кровеносный сосуд.
(vi) Окончательное хранение: в замороженном виде (от -85 до -60°C)
Таблица 15
а. Образцы на неделе -2 и -1 для групп 2 и 3 будут отбирать одновременно с такими образцами у животных группы 1, исходя из дня 1 для группы 1. b. Старт в группе 2 будет сделан с отсрочкой 20 дней после группы 1, а старт в группе 3 будет сделан с отсрочкой 10 дней после группы 1.
Таблица 16
-2, -1a
(3 часа после введения дозы)
Отправка 1
Отправка 2
Отправка 5
Отправка 4
Отправка 3
Отправка 5
а. Образцы на неделе -2 и -1 в группах 2 и 3 будут отбирать одновременно с такими образцами у животных из группы 1, исходя из дня 1 для группы 1. b. Отправка всех образцов в Bioverativ для анализа в указанные дни отбора и в конце исследования.
5.6.2. Экспрессия фактора VIII и оценка цитокинов: экспрессию фактора VIII будут определять в плазме крови, и оценку потенциальных цитокинов будут определять в сыворотке крови.
5.6.3 Мононуклеарные клетки периферической крови (PBMC): PBMC будут выделять из ~10 мл (только ~4 мл в день 30) крови, отобранной у каждой обезьяны. Разбавьте кровь 1 объемом PBS и аккуратно нанесите ее на 1 объем фиколла в конической пробирке объемом 15 мл. Центрифугируйте пробирки при 650 x g, 20°C, в течение 30 минут с отключенным торможением. Соберите слой PBMC, промойте с помощью DPBS, центрифугируйте при 450 x g, 20°C, в течение 10 минут (с торможением), ресуспендируйте клеточный осадок в хлориде аммония (1-3 мл) и инкубируйте в течение 5 минут для лизиса эритроцитов, дважды промойте с помощью DPBS, центрифугируйте при 150 x g, 20°C, в течение 10 минут (с торможением), затем ресуспендируйте в среде для замораживания (90% FBS/10% DMSO). Выделенные РВМС будут хранить в морозильной камере, настроенной для поддержания температуры от -85° до -60°C.
Таблица 17
а. РВМС будут выделять на месте посредством отделения с помощью фиколла. Выделенные РВМС будут хранить в морозильной камере, настроенной для поддержания температуры от -85° до -60°C. b. Образцы на неделе -2 и -1 в группах 2 и 3 будут отбирать одновременно с такими образцами у животных группы 1, исходя из дня 1 для группы 1. c. Образец PBMC в день 30 будет составлять только ~4 мл, и процедуры выделения будут соответствующим образом скорректированы.
5.7. Вскрытие
5.7.1. Внеплановое вскрытие: полное вскрытие будут выполнять у всех исследуемых животных, которые умерли или были умерщвлены в незапланированные интервалы. Животных, обнаруженных мертвыми, подвергнут полному вскрытию, если только они не подверглись серьезному аутолизу. Все внеплановые вскрытия будут проводить сертифицированные ветеринарные патологоанатомы, доступные для консультации, когда это возможно. Перед эвтаназией будут предприняты попытки отбора образцов крови для клинической патологической диагностики, если это возможно. В случае отбора ткани зафиксируют в соответствующем фиксаторе и определят, какие из них будут обработаны для гистопатологической оценки или будут выброшены.
5.7.2 Плановое вскрытие: животные будут умерщвлены в день 53. Животных взвешивают перед вскрытием, подвергают седации с помощью кетамина (10 мг/кг посредством внутримышечной инъекции) для транспортировки к месту вскрытия и гуманно умерщвляют с помощью введения избыточной дозы барбитурата с последующим обескровливанием.
Все плановые вскрытия будут проводить сертифицированные ветеринарные патологоанатомы, доступные (когда это возможно) для консультации. Каждое вскрытие включает внешний осмотр поверхности тела и всех отверстий; исследование черепной, грудной, брюшной и тазовой полостей и их содержимого; и отбор тканей.
Ткани, перечисленные ниже, если они присутствуют, будут отбирать и обрабатывать у всех животных.
Гистопатологическое исследование: делают срезы печени и селезенки, и их помещают в 10% нейтральный забуференный формалин (NBF). Идентификация обезьяны будет сохранена с тканями, взятыми в ходе вскрытия.
Данные о весе органов не регистрируют.
Отбор образцов ДНК и РНК: для правой доли печени, левой доли печени, средней доли печени, квадратной доли печени, хвостатой доли печени и селезенки:
Таблица 18
а. Фрагменты для ДНК и РНК будут взвешивать так, как это указано.
Для головного мозга (коры), левого желудочка сердца, правого желудочка сердца, правой почки, подмышечных лимфатических узлов с правой стороны, легких, правого семенника, левого семенника, тимуса, мышцы (правой икроножной мышцы):
Таблица 19
а. Фрагменты для ДНК и РНК будут взвешивать так, как это указано.
Образцы печени, не используемые для гистопатологической оценки, и образцы селезенки будут мгновенно заморожены так, как это описано выше, и отправлены PI для потенциального экстрагирования ДНК и РНК и молекулярного анализа.
Все остальные ткани и тело будут выброшены.
5.7.3. Обработка тканей: Срезы печени и селезенки, полученные для гистопатологической оценки, будут обрезать, обрабатывать в обычном порядке, заливать парафином, готовить срезы размером примерно 5 микрон, помещать на предметные стекла и окрашивать гематоксилином и эозином.
5.7.4. Гистопатологическая оценка: патологоанатом данного исследования будет осматривать каждый подготовленный препарат под микроскопом. Любое макроскопическое поражение, выявленное при внеплановом вскрытии (животных, погибших в ходе исследования), будет проанализировано под микроскопом. Будет проведена внутренняя экспертная оценка. Описание анатомической патологии будет включено в файл исследования и окончательный отчет.
6. Статистический анализ: все соответствующие количественные прижизненные данные, собранные в Battelle с использованием системы Provantis, будут проанализированы на предмет эффектов исследуемого препарата с помощью параметрического или непараметрического дисперсионного анализа (ANOVA). Для всех данных нормальность будет определена с помощью критерия Шапиро-Уилка, а однородность дисперсий будет определена с помощью критерия Левена. Данные могут быть логарифмически преобразованы для соответствия параметрическим предположениям. Для параметрических данных, которые определены как нормально распределенные и однородные среди групп, будет использоваться F-критерий ANOVA, чтобы определить, имеются ли различия между средними значениями групп. Если F-критерий ANOVA является значимым, то тесты на различия между контролем и каждой из групп сравнения будут проводить с использованием критерия Даннета, который корректирует множественные сравнения. Для непараметрических данных, которые не являются нормально распределенными и/или являются неоднородными, будет использован критерий Краскела-Уоллиса, чтобы определить, имеются ли различия между средними значениями групп. Если критерий Краскела-Уоллиса является значимым, то тесты на различия между контролем и каждой из групп сравнения будут проводиться с использованием критерия Уилкоксона и поправки Бонферрони-Холма для корректировки множественных сравнений. Все статистические тесты будут выполнять при уровне значимости 0,05 (p<0,05) после учета множественных сравнений, где это показано.
Пример 12. Исследование с введением однократной дозы LV-coFVIII6XTEN на свинохвостых макаках
Трех самцов свинохвостых макак (вес тела 3,5-4,3 кг) обрабатывали с помощью LV-coFVIII-6-XTEN, продуцируемого клетками с фенотипом CD47high/MHC-Ifree 293T, в дозе 3E9 ТЕ/кг посредством внутривенной (в/в) инфузии со скоростью инфузии 1,5 мл/мин. Для контроля образования антител к фактору VIII человека животным ежедневно осуществляли внутримышечное введение SOLU-MEDROL® (метилпреднизолон) со дня -1 до дня 7 обработки с помощью LV в дозе 10 мг/кг. За тридцать (30) минут до обработки с помощью LV животным также проводили внутривенную инъекцию поларамина (дексхлорфенирамин) в дозе 4 мг/кг для контроля потенциальных аллергических реакций. Образцы плазмы крови отбирали в дни 7, 10 и 14 после обработки с помощью LV и анализировали на активность фактора VIII человека и уровень антигенов. Пиковые уровни в плазме крови у трех животных составляли 102%, 54% и 67% от нормального в случае активности FVIII (фиг. 20A), что соответствовало уровням антигена FVIII человека 187 нг/мл, 75 нг/мл и 131 нг/мл соответственно (фиг. 20B). Эти данные демонстрируют, что терапевтически эффективная экспрессия фактора VIII человека у отличных от человека приматов может быть достигнута при относительно низком уровне дозы LV.
Пример 13. Пилотное исследование зависимости доза-ответ с использованием LV-coFVIII6 и LV-coFVIII6XTEN на свинохвостых макаках
Десять самцов свинохвостых макак (вес тела 3,5-4,3 кг) обрабатывали с помощью LV-coFVIII-6 или LV-coFVIII-6-XTEN, продуцируемых клетками 293T с фенотипом CD47high/MHC-Ifree, посредством внутривенной (в/в) инфузии со скоростью инфузии 1,5 мл/мин. Доза LV-coFVIII-6 составляла 3E9 ТЕ/кг или 6E9 ТЕ/кг, а доза LV-coFVIII-6-XTEN составляла 1E9 ТЕ/кг или 3E9 ТЕ/кг. Для контроля образования антител к фактору VIII человека животным ежедневно осуществляли внутримышечное введение SOLU-MEDROL® (метилпреднизолон) со дня -1 до дня 7 обработки с помощью LV в дозе 10 мг/кг. За тридцать (30) минут до обработки с помощью LV животным также проводили внутривенную инъекцию поларамина (дексхлорфенирамин) в дозе 4 мг/кг для контроля потенциальных аллергических реакций. Образцы плазмы крови отбирали в дни 0, 1, 3, 7, 14, 21, 28, 45 и 60 после обработки с помощью LV и анализировали на активность фактора VIII человека и уровень антигенов. После обработки с помощью LV-coFVIII-6 пиковые уровни активности FVIII в плазме крови в группе обработки 3E9 или 6E9 ТЕ/кг в среднем составляли 5% или 12% от нормального (фиг. 21A) соответственно, что соответствует средним уровням антигена FVIII человека 5 нг/мл или 9 нг/мл (фиг. 21B) соответственно. После обработки с помощью LV-coFVIII-6-XTEN пиковые уровни активности FVIII в плазме крови в группе обработки 1E9 или 3E9 ТЕ/кг в среднем составляли 20% или 75% от нормального (фиг. 22A) соответственно, что соответствует средним уровням антигена FVIII человека 31 нг/мл или 140 нг/мл (фиг. 22B) соответственно. Эти данные демонстрируют, что как LV-coFVIII-6, так и LV-coFVIII-6-XTEN могут обеспечивать терапевтически полезную экспрессию фактора VIII человека у отличных от человека приматов.
***
Предшествующее описание конкретных вариантов осуществления настолько полно раскрывает общий характер настоящего изобретения, что другие могут, используя знания в пределах квалификации в данной области техники, легко модифицировать и/или адаптировать такие конкретные варианты осуществления для различных вариантов применения без проведения дополнительных экспериментов, не отступая от общей концепции настоящего изобретения. Следовательно, такие адаптации и модификации предназначены для того, чтобы находиться в пределах значения и диапазона эквивалентов раскрытых вариантов осуществления, основанных на идее и принципе, представленных в данном документе. Следует понимать, что формулировки или терминология в данном документе предназначены для целей описания, а не ограничения, вследствие этого терминологию или формулировки в настоящем описании квалифицированному специалисту следует интерпретировать в свете этих идей и принципов.
Другие варианты осуществления настоящего изобретения будут очевидны специалистам в данной области техники при рассмотрении описания и практическом применении настоящего изобретения, описанного в данном документе. Предполагается, что описание и примеры должны рассматриваться только в качестве иллюстративных, а действительный охват настоящего изобретения и его идея изложены в нижеследующей формуле изобретения.
Все патенты и публикации, упомянутые в данном документе, включены посредством ссылки в данный документ во всей своей полноте.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> BIOVERATIV THERAPEUTICS INC.
<120> ПРИМЕНЕНИЕ ЛЕНТИВИРУСНЫХ ВЕКТОРОВ, ЭКСПРЕССИРУЮЩИХ ФАКТОР VIII
<130> 609628: SA9-460PC
<150> 62/625,145
<151> 2018-02-01
<150> 62/671,915
<151> 2018-05-15
<150> 62/793,158
<151> 2019-01-16
<160> 103
<170> PatentIn версия 3.5
<210> 1
<211> 4374
<212> ДНК
<213> Искусственная последовательность
<220>
<223> coFVIII-5
<400> 1
atgcaaatcg aactgagcac ctgtttcttc ctctgcctgc tgagattctg tttctccgcg
60
acccgccgat actacctggg agcagtggag ctctcctggg attacatgca gagcgacctt
120
ggggagctgc ccgtggatgc caggttccct ccccgggtgc caaagtcgtt tccgttcaac
180
acctccgtgg tgtacaagaa aactctgttc gtggagttca ccgaccacct gttcaatatc
240
gccaagccca gacctccctg gatggggctg ttgggaccta ccatccaagc ggaggtgtac
300
gacactgtgg tcatcactct gaagaacatg gcctcgcatc ccgtgtccct gcacgccgtg
360
ggagtgtctt actggaaagc gtccgagggg gccgaatacg acgaccagac ctcgcagaga
420
gaaaaggaag atgacaaggt gttcccagga ggatcgcaca cctacgtgtg gcaagtgttg
480
aaggagaacg gcccaatggc ctccgacccg ctgtgcctga cctactcgta cctgtcccac
540
gtggacctcg tgaaggacct caactcggga ctgattggag ccctgctggt ctgcagggaa
600
ggctcactgg cgaaagaaaa gactcagacc ttgcacaagt tcattctgct gttcgctgtg
660
ttcgacgagg ggaagtcgtg gcacagcgag actaagaact ccctgatgca agatagagat
720
gccgcctccg cccgggcctg gcctaagatg cacaccgtga acggttacgt gaaccgctcc
780
ctccctggcc tgattggatg ccaccggaag tccgtgtact ggcacgtgat cgggatgggg
840
accacccccg aggtgcacag catcttcctg gaaggtcaca catttctcgt gcgcaaccac
900
cggcaggcct ccctggaaat cagccccatt accttcctca ctgcccagac tctgctgatg
960
gacctgggac agttcctgct gttctgccat atctcctccc accaacatga cggaatggag
1020
gcatacgtga aggtcgattc ctgccctgag gaaccccagc tccgcatgaa gaacaatgag
1080
gaagccgagg actacgacga cgacctgacg gatagcgaga tggatgtggt ccggttcgat
1140
gacgataaca gcccttcctt catccaaatt cgctcggtgg caaagaagca ccccaagacc
1200
tgggtgcatt acattgcggc ggaagaagag gactgggatt atgccccgct tgtcctcgct
1260
cctgacgacc ggagctacaa gagccagtac ctgaacaacg gtccacagag gatcggtaga
1320
aagtacaaga aggtccgctt catggcctat accgacgaaa ccttcaaaac tagagaggcc
1380
atccaacacg aatccggcat cctgggcccg ctcttgtacg gagaagtcgg cgacaccctt
1440
ctcattatct tcaagaacca ggcttcccgg ccgtacaaca tctatccgca tgggatcact
1500
gacgtgcgcc cactgtactc gcggcgcctg cccaagggtg tcaaacacct gaaggatttt
1560
ccgatccttc cgggagaaat cttcaagtac aagtggaccg tgaccgtgga agatggccca
1620
actaagtctg accctagatg cctcacccgc tactactcat ccttcgtcaa catggagcgc
1680
gacctggcca gcggactgat cggcccgctg ctgatttgct acaaggaatc agtggaccaa
1740
cggggaaacc agatcatgtc ggataagagg aacgtcatcc tcttctccgt gtttgacgaa
1800
aaccggtcgt ggtacctgac tgaaaacatc cagcggttcc tccccaaccc cgcgggcgtg
1860
cagctggaag atcctgagtt tcaggcatca aacatcatgc actccattaa cggctacgtg
1920
ttcgattcgc tgcagctgag cgtgtgtctg cacgaagtgg cctactggta catcctgtcc
1980
attggtgccc agactgactt cctgtccgtg tttttctccg gctacacgtt caagcacaag
2040
atggtgtacg aggacaccct gaccctcttc cctttttccg gcgaaactgt gtttatgagc
2100
atggagaatc ccggcctgtg gatcttgggc tgccacaaca gcgacttccg taacagagga
2160
atgactgcgc tgctcaaggt gtccagctgc gacaagaaca ccggagacta ttatgaggac
2220
tcatacgagg acatctccgc ctacctcctg tccaagaata acgccattga acctcggagc
2280
ttcagccaga acccacccgt gcttaagaga catcaacggg agatcactag gaccaccctg
2340
cagtcagacc aggaggaaat cgactacgat gacaccatct cggtcgagat gaagaaggag
2400
gactttgaca tctacgacga agatgaaaac cagagcccga ggtcgttcca aaagaaaacc
2460
cgccactact ttattgctgc tgtcgagcgg ctgtgggact acggaatgtc gtcctcgccg
2520
cacgtgctcc gcaaccgagc ccagagcggc tcggtgccgc aattcaagaa ggtcgtgttc
2580
caggagttca ctgacgggag cttcactcag cctttgtacc ggggagaact caatgaacat
2640
ctcggcctcc tcggacctta catcagagca gaagtggaag ataacatcat ggtcactttc
2700
cgtaaccaag ccagccgccc gtactcgttc tactcctccc tcatttctta cgaagaggac
2760
cagcggcagg gcgcagaacc gcgcaagaac ttcgtgaagc ccaacgaaac caagacctac
2820
ttctggaaag tgcagcatca tatggccccg actaaggacg agtttgactg caaagcctgg
2880
gcctacttct ccgatgtgga cttggagaag gacgtccact ccggcctcat cggtcccctg
2940
ctcgtgtgcc ataccaatac cctgaacccc gcacacggtc gccaggtcac cgtgcaggag
3000
ttcgctctgt tcttcactat cttcgacgaa actaagtcct ggtacttcac cgagaacatg
3060
gagaggaact gcagagcccc ctgtaacatc cagatggagg acccgacgtt caaggaaaac
3120
taccggttcc acgccattaa cggatacatc atggatacgc tgccgggtct tgtgatggcc
3180
caggatcaac ggatcagatg gtacttattg tcgatgggca gcaacgagaa catccactct
3240
attcacttct ccggtcatgt gttcactgtg cggaagaagg aagagtacaa gatggccctg
3300
tacaaccttt atcccggagt gttcgaaact gtggaaatgc tgccgtcgaa ggccggcatt
3360
tggcgcgtgg agtgtttgat tggagaacat ctccatgcgg ggatgtcaac cctgttcctg
3420
gtgtatagca acaagtgcca gactccgctt gggatggcgt caggacacat tagggatttc
3480
cagatcactg cgtccggcca gtacggccaa tgggccccta agctggcccg cctgcattac
3540
tccggatcca ttaacgcctg gtcaaccaag gagccattct cctggatcaa ggtggacctt
3600
ctggccccca tgattatcca cggaattaag acccaggggg cccggcagaa gttctcctca
3660
ctgtacatca gccagttcat aatcatgtac tccctggacg gaaagaagtg gcaaacctac
3720
agggggaaca gcaccggcac actgatggtc tttttcggaa atgtggactc ctccgggatt
3780
aagcataaca tcttcaaccc tccgattatc gctcggtaca ttagacttca ccctacccac
3840
tacagcattc gctccaccct gcggatggaa ctgatgggct gcgatctgaa ctcgtgcagc
3900
atgccgttgg gaatggagtc caaagcaatt tccgacgcgc agatcaccgc ctcgtcctac
3960
tttaccaaca tgttcgccac gtggtcaccg tccaaggccc ggctgcacct ccagggaaga
4020
tccaacgcat ggcggccaca ggtcaacaac cctaaggagt ggctccaggt ggacttccag
4080
aaaaccatga aggtcaccgg agtcacaacc cagggagtga agtcgctgct gacttctatg
4140
tacgtcaagg agttcctgat ctccagcagc caggacgggc accagtggac cctgttcttc
4200
caaaatggaa aggtcaaggt gtttcagggc aatcaggatt cattcacccc ggtggtgaac
4260
tcccttgatc cacccctcct gacccgctac cttcgcatcc acccacagtc ctgggtgcac
4320
cagatcgcgc tgaggatgga ggtcctggga tgcgaagccc aggacctgta ctga
4374
<210> 2
<211> 4374
<212> ДНК
<213> Искусственная последовательность
<220>
<223> coFVIII-4
<400> 2
atgcagatcg agctgagcac gtgcttcttc ctgtgcctgc tgaggttctg cttcagcgcc
60
accaggaggt actacctggg cgccgtggag ctgagctggg actacatgca gagcgacctg
120
ggcgagctgc ccgtggacgc caggttcccc cccagggtgc ccaagagctt ccccttcaac
180
acgagcgtgg tgtacaagaa gaccctgttc gtggagttca ccgaccatct gttcaatatc
240
gccaagccca ggcccccctg gatggggctg ctggggccca cgatccaggc cgaggtgtac
300
gacaccgtgg tcatcaccct gaagaacatg gccagccacc ccgtgagcct gcacgccgtg
360
ggcgtgagct actggaaggc cagcgagggc gccgagtacg acgaccagac cagccagagg
420
gagaaggagg acgacaaggt gttccccggc ggcagccaca cctacgtgtg gcaggtgctg
480
aaggagaatg ggcccatggc cagcgacccc ctgtgcctga cctactctta cctgagccac
540
gtggatctgg tgaaggacct gaacagcggc ctgatcggcg ccctgctggt gtgcagggag
600
ggcagcctgg ccaaggagaa gacccagacc ctgcacaagt tcatcctgct gttcgccgtg
660
ttcgacgagg gcaagagctg gcacagcgag accaagaaca gcctgatgca ggatagggac
720
gccgccagcg ccagggcctg gcccaagatg cacaccgtga acggctacgt gaacaggtct
780
ctgcccggcc tgatcggctg ccacaggaag agcgtgtact ggcacgtgat cggcatgggg
840
accacccccg aggtgcacag catcttcctg gagggccaca cgttcctggt gaggaatcac
900
aggcaggcca gcctggagat cagcccgatc accttcctga ccgcccagac cctgctgatg
960
gacctggggc agttcctgct gttctgccat atcagctctc accagcacga cggcatggag
1020
gcctacgtga aggtggatag ctgccccgag gagccccagc tgaggatgaa gaacaacgag
1080
gaggccgagg actacgacga cgacctgacc gacagcgaga tggacgtggt gaggttcgac
1140
gacgacaata gcccgagctt catccagatc aggagcgtgg ccaagaagca ccccaagacc
1200
tgggtgcatt acatcgccgc cgaggaggag gattgggact acgcccccct ggtgctggcc
1260
cccgacgaca ggtcttacaa gagccagtac ctgaacaacg ggccccagag gatcggcagg
1320
aagtacaaga aggtgaggtt catggcctac accgacgaga ccttcaagac cagggaggcg
1380
atccagcacg agagcgggat cctggggccc ctgctgtacg gcgaggtggg cgacacgctg
1440
ctgatcatct tcaagaacca ggccagcagg ccgtacaata tctaccccca cgggatcacc
1500
gacgtgaggc ccctgtactc taggaggctg cccaagggcg tgaagcacct gaaggacttc
1560
cccatcctgc ccggcgagat cttcaagtac aagtggaccg tgaccgtgga ggacgggccc
1620
acgaagagcg accccaggtg cctgaccagg tactacagct ctttcgtgaa catggagagg
1680
gacctggcca gcggcctgat cgggcccctg ctgatctgct acaaggagag cgtggatcag
1740
aggggcaacc agatcatgag cgacaagagg aacgtgatcc tgttcagcgt gttcgacgag
1800
aataggtctt ggtacctgac cgagaatatc cagaggttcc tgcccaaccc cgccggcgtg
1860
cagctggagg atcccgagtt ccaggccagc aacatcatgc acagcatcaa cggctacgtg
1920
ttcgacagcc tgcagctgag cgtgtgcctg cacgaggtgg cctactggta catcctgagc
1980
atcggcgccc agaccgactt cctgagcgtg ttcttcagcg gctacacctt caagcacaag
2040
atggtgtacg aggataccct gaccctgttc cccttcagcg gcgagaccgt gttcatgagc
2100
atggagaacc ccggcctgtg gatcctgggc tgccataact ccgacttcag gaataggggc
2160
atgaccgccc tgctgaaggt gagctcttgc gacaagaaca ccggcgacta ctacgaggat
2220
agctacgagg atatcagcgc ctacctgctg agcaagaaca acgccatcga gcccaggtct
2280
ttcagccaga acccccccgt gctgaagagg caccagaggg agatcaccag gacgaccctg
2340
cagagcgacc aggaggagat cgactacgac gacacgatca gcgtggagat gaagaaggag
2400
gatttcgaca tctacgacga ggacgagaat cagagcccca ggtctttcca gaagaagacc
2460
aggcattact tcatcgccgc cgtggagagg ctgtgggact acggcatgag cagctctccc
2520
cacgtgctga ggaatagggc ccagagcggc agcgtgcccc agttcaagaa ggtggtgttc
2580
caggagttca ccgacggcag cttcacccag cccctgtaca ggggcgagct gaacgagcac
2640
ctgggcctgc tggggcccta catcagggcc gaggtggagg ataacatcat ggtgaccttc
2700
aggaatcagg ccagcaggcc ctatagcttc tatagctctc tgatcagcta cgaggaggat
2760
cagaggcagg gcgccgagcc caggaagaac ttcgtgaagc ccaacgagac caagacctac
2820
ttctggaagg tgcagcacca catggccccc acgaaggacg agttcgactg caaggcctgg
2880
gcctacttca gcgacgtgga tctggagaag gacgtgcaca gcggcctgat cgggcccctg
2940
ctggtgtgcc acaccaacac cctgaacccc gcccacggca ggcaggtgac cgtgcaggag
3000
ttcgccctgt tcttcaccat cttcgacgag accaagagct ggtacttcac cgagaatatg
3060
gagaggaatt gcagggcccc ctgcaatatc cagatggagg acccgacctt caaggagaat
3120
tacaggttcc acgccatcaa cggctacatc atggacacgc tgcccggcct ggtcatggcc
3180
caggatcaga ggatcaggtg gtatctgctg agcatgggga gcaacgagaa tatccacagc
3240
atccacttca gcggccacgt gttcaccgtg aggaagaagg aggagtacaa gatggccctg
3300
tacaatctgt accccggcgt gttcgagacc gtggagatgc tgcccagcaa ggccgggatc
3360
tggagggtgg agtgcctgat cggcgagcac ctgcacgccg gcatgagcac gctgttcctg
3420
gtgtactcta acaagtgcca gacccccctg gggatggcca gcggccacat cagggacttc
3480
cagatcaccg ccagcggcca gtacggccag tgggccccca agctggccag gctgcactat
3540
tccggaagca tcaacgcctg gagcacgaag gagcccttca gctggatcaa ggtggatctg
3600
ctggccccca tgatcatcca cgggatcaag acccagggcg ccaggcagaa gttcagctct
3660
ctgtatatca gccagttcat catcatgtac tctctggacg gcaagaagtg gcagacctac
3720
aggggcaaca gcaccggcac gctgatggtg ttcttcggca acgtggactc tagcgggatc
3780
aagcacaata tcttcaaccc ccccatcatc gccaggtaca tcaggctgca ccccacccat
3840
tactctatca ggtctaccct gaggatggag ctgatgggct gcgacctgaa cagctgcagc
3900
atgcccctgg ggatggagag caaggccatc agcgacgccc agatcaccgc cagctcttac
3960
ttcaccaaca tgttcgccac ctggagcccg agcaaggcca ggctgcacct gcagggcagg
4020
tctaacgcct ggaggcccca ggtgaacaac cccaaggagt ggctgcaggt ggatttccag
4080
aagaccatga aggtgaccgg cgtgaccacg cagggcgtga agagcctgct gaccagcatg
4140
tacgtgaagg agttcctgat cagctctagc caggacggcc accagtggac cctgttcttc
4200
cagaacggca aggtgaaggt gttccagggc aaccaggata gcttcacccc cgtggtgaac
4260
agcctggacc cccccctgct gaccaggtat ctgaggatcc acccccagag ctgggtgcac
4320
cagatcgccc tgaggatgga ggtgctgggc tgcgaggccc aggatctgta ttga
4374
<210> 3
<211> 4374
<212> ДНК
<213> Искусственная последовательность
<220>
<223> coFVIII-52
<400> 3
atgcaaatcg aactgagcac ctgtttcttc ctctgcctgc tgagattctg tttctccgcg
60
acccgccgat actacctggg agcagtggag ctctcctggg attacatgca gagcgacctt
120
ggggagctgc ccgtggatgc caggttccct ccccgggtgc caaagtcgtt tccgttcaac
180
acctccgtgg tgtacaagaa aactctgttc gtggagttca ccgaccacct gttcaatatc
240
gccaagccca gacctccctg gatggggctg ttgggaccta ccatccaagc ggaggtgtac
300
gacactgtgg tcatcactct gaagaacatg gcctcgcatc ccgtgtccct gcacgccgtg
360
ggagtgtctt actggaaagc gtccgagggg gccgaatacg acgaccagac ctcgcagaga
420
gaaaaggaag atgacaaggt gttcccagga ggatcgcaca cctacgtgtg gcaagtgttg
480
aaggagaacg gcccaatggc ctccgacccg ctgtgcctga cctactcgta cctgtcccac
540
gtggacctcg tgaaggacct caactcggga ctgattggag ccctgctggt ctgcagggaa
600
ggctcactgg cgaaagaaaa gactcagacc ttgcacaagt tcattctgct gttcgctgtg
660
ttcgacgagg ggaagtcgtg gcacagcgag actaagaact ccctgatgca agatagagat
720
gccgcctccg cccgggcctg gcctaagatg cacaccgtga acggttacgt gaaccgctcc
780
ctccctggcc tgattggatg ccaccggaag tccgtgtact ggcacgtgat cgggatgggg
840
accacccccg aggtgcacag catcttcctg gaaggtcaca catttctcgt gcgcaaccac
900
cggcaggcct ccctggaaat cagccccatt accttcctca ctgcccagac tctgctgatg
960
gacctgggac agttcctgct gttctgccat atctcctccc accaacatga cggaatggag
1020
gcatacgtga aggtcgattc ctgccctgag gaaccccagc tccgcatgaa gaacaatgag
1080
gaagccgagg actacgacga cgacctgacg gatagcgaga tggatgtggt ccggttcgat
1140
gacgataaca gcccttcctt catccaaatt cgctcggtgg caaagaagca ccccaagacc
1200
tgggtgcatt acattgcggc ggaagaagag gactgggatt atgccccgct tgtcctcgct
1260
cctgacgacc ggagctacaa gagccagtac ctgaacaacg gtccacagag gatcggtaga
1320
aagtacaaga aggtccgctt catggcctat accgacgaaa ccttcaaaac tagagaggcc
1380
atccaacacg aatccggcat cctgggcccg ctcttgtacg gagaagtcgg cgacaccctt
1440
ctcattatct tcaagaacca ggcttcccgg ccgtacaaca tctatccgca tgggatcact
1500
gacgtgcgcc cactgtactc gcggcgcctg cccaagggtg tcaaacacct gaaggatttt
1560
ccgatccttc cgggagaaat cttcaagtac aagtggaccg tgaccgtgga agatggccca
1620
actaagtctg accctagatg cctcacccgc tactactcat ccttcgtcaa catggagcgc
1680
gacctggcca gcggactgat cggcccgctg ctgatttgct acaaggaatc agtggaccaa
1740
cggggaaacc agatcatgtc ggataagagg aacgtcatcc tcttctccgt gtttgacgaa
1800
aaccggtcgt ggtacctgac cgagaacatc cagaggttcc tgcccaaccc tgctggggtg
1860
cagctggagg accccgagtt ccaggccagc aacatcatgc acagcatcaa tggctacgtg
1920
ttcgacagcc tgcagctgag cgtgtgcctg cacgaggtgg cctactggta catcctgagc
1980
atcggcgccc agaccgactt cctgagcgtg ttcttctctg gctacacctt caagcacaag
2040
atggtgtatg aggacaccct gaccctgttc cccttcagcg gggagactgt cttcatgagc
2100
atggagaacc ctggcctgtg gatcctgggc tgccacaaca gcgacttcag gaacaggggc
2160
atgactgccc tgctgaaagt ctccagctgt gacaagaaca ccggggacta ctacgaggac
2220
agctacgagg acatcagcgc ctacctgctg agcaagaaca atgccatcga gcccaggagc
2280
ttctctcaga accccccagt gctgaagagg caccagaggg agatcaccag gaccaccctg
2340
cagtctgacc aggaggagat cgactatgat gacaccatca gcgtggagat gaagaaggag
2400
gacttcgaca tctacgacga ggacgagaac cagagcccca ggagcttcca gaagaagacc
2460
aggcactact tcattgctgc tgtggagagg ctgtgggact atggcatgtc cagcagcccc
2520
catgtgctga ggaacagggc ccagtctggc agcgtgcccc agttcaagaa agtcgtgttc
2580
caggagttca ccgacggcag cttcacccag cccctgtaca gaggggagct gaacgagcac
2640
ctgggcctgc tgggccccta catcagggcc gaggtggagg acaacatcat ggtgaccttc
2700
aggaaccagg ccagcaggcc ctacagcttc tacagcagcc tgatcagcta cgaggaggac
2760
cagaggcagg gggctgagcc caggaagaac tttgtgaagc ccaatgaaac caagacctac
2820
ttctggaagg tgcagcacca catggccccc accaaggacg agttcgactg caaggcctgg
2880
gcctacttct ctgacgtgga cctggagaag gacgtgcact ctggcctgat tggccccctg
2940
ctggtgtgcc acaccaacac cctgaaccct gcccatggca ggcaggtgac tgtgcaggag
3000
ttcgccctgt tcttcaccat cttcgatgaa accaagagct ggtacttcac tgagaacatg
3060
gagaggaact gcagggcccc ctgcaacatc cagatggagg accccacctt caaggagaac
3120
tacaggttcc atgccatcaa tggctacatc atggacaccc tgcctggcct ggtcatggcc
3180
caggaccaga ggatcaggtg gtatctgctg agcatgggca gcaacgagaa catccacagc
3240
atccacttct ctggccacgt gttcactgtg aggaagaagg aggagtacaa gatggccctg
3300
tacaacctgt accctggggt gttcgaaacc gtggagatgc tgcccagcaa ggccggcatc
3360
tggagggtgg agtgcctgat tggggagcac ctgcacgccg gcatgagcac cctgttcctg
3420
gtgtacagca acaagtgcca gacccccctg ggcatggcct ctggccacat cagggacttc
3480
cagatcactg cctctggcca gtacggccag tgggccccca agctggccag gctgcactac
3540
tccggaagca tcaatgcctg gagcaccaag gagcccttca gctggatcaa agtggacctg
3600
ctggccccca tgatcatcca cggcatcaag acccaggggg ccaggcagaa gttctccagc
3660
ctgtacatca gccagttcat catcatgtac agcctggacg gcaagaagtg gcagacctac
3720
aggggcaaca gcaccggcac cctgatggtg ttcttcggca acgtggacag cagcggcatc
3780
aagcacaaca tcttcaaccc ccccatcatc gccagataca tcaggctgca ccccacccac
3840
tacagcatca ggagcaccct gaggatggag ctgatgggct gtgacctgaa cagctgcagc
3900
atgcccctgg gcatggagag caaggccatc tctgacgccc agatcactgc ctccagctac
3960
ttcaccaaca tgtttgccac ctggagcccc agcaaggcca ggctgcacct gcagggcagg
4020
agcaatgcct ggaggcccca ggtcaacaac cccaaggagt ggctgcaggt ggacttccag
4080
aagaccatga aggtgactgg ggtgaccacc cagggggtga agagcctgct gaccagcatg
4140
tacgtgaagg agttcctgat ctccagcagc caggacggcc accagtggac cctgttcttc
4200
cagaatggca aggtgaaggt gttccagggc aaccaggaca gcttcacccc tgtggtcaac
4260
agcctggacc cccccctgct gaccagatac ctgaggatcc acccccagag ctgggtgcac
4320
cagatcgccc tgaggatgga ggtgctgggc tgtgaggccc aggacctgta ctga
4374
<210> 4
<211> 4374
<212> ДНК
<213> Искусственная последовательность
<220>
<223> coFVIII-62
<400> 4
atgcagattg agctgtccac ttgtttcttc ctgtgcctcc tgcgcttctg tttctccgcc
60
actcgccggt actaccttgg agccgtggag ctttcatggg actacatgca gagcgacctg
120
ggcgaactcc ccgtggatgc cagattcccc ccccgcgtgc caaagtcctt cccctttaac
180
acctccgtgg tgtacaagaa aaccctcttt gtcgagttca ctgaccacct gttcaacatc
240
gccaagccgc gcccaccttg gatgggcctc ctgggaccga ccattcaagc tgaagtgtac
300
gacaccgtgg tgatcaccct gaagaacatg gcgtcccacc ccgtgtccct gcatgcggtc
360
ggagtgtcct actggaaggc ctccgaagga gctgagtacg acgaccagac tagccagcgg
420
gaaaaggagg acgataaagt gttcccgggc ggctcgcata cttacgtgtg gcaagtcctg
480
aaggaaaacg gacctatggc atccgatcct ctgtgcctga cttactccta cctttcccat
540
gtggacctcg tgaaggacct gaacagcggg ctgattggtg cacttctcgt gtgccgcgaa
600
ggttcgctcg ctaaggaaaa gacccagacc ctccataagt tcatcctttt gttcgctgtg
660
ttcgatgaag gaaagtcatg gcattccgaa actaagaact cgctgatgca ggaccgggat
720
gccgcctcag cccgcgcctg gcctaaaatg catacagtca acggatacgt gaatcggtca
780
ctgcccgggc tcatcggttg tcacagaaag tccgtgtact ggcacgtcat cggcatgggc
840
actacgcctg aagtgcactc catcttcctg gaagggcaca ccttcctcgt gcgcaaccac
900
cgccaggcct ctctggaaat ctccccgatt acctttctga ccgcccagac tctgctcatg
960
gacctggggc agttccttct cttctgccac atctccagcc atcagcacga cggaatggag
1020
gcctacgtga aggtggactc atgcccggaa gaacctcagt tgcggatgaa gaacaacgag
1080
gaggccgagg actatgacga cgatttgact gactccgaga tggacgtcgt gcggttcgat
1140
gacgacaaca gccccagctt catccagatt cgcagcgtgg ccaagaagca ccccaaaacc
1200
tgggtgcact acatcgcggc cgaggaagaa gattgggact acgccccgtt ggtgctggca
1260
cccgatgacc ggtcgtacaa gtcccagtat ctgaacaatg gtccgcagcg gattggcaga
1320
aagtacaaga aagtgcggtt catggcgtac actgacgaaa cgtttaagac ccgggaggcc
1380
attcaacatg agagcggcat tctgggacca ctgctgtacg gagaggtcgg cgataccctg
1440
ctcatcatct tcaaaaacca ggcctcccgg ccttacaaca tctaccctca cggaatcacc
1500
gacgtgcggc cactctactc gcggcgcctg ccgaagggcg tcaagcacct gaaagacttc
1560
cctatcctgc cgggcgaaat cttcaagtat aagtggaccg tcaccgtgga ggacgggccc
1620
accaagagcg atcctaggtg tctgactcgg tactactcca gcttcgtgaa catggaacgg
1680
gacctggcat cgggactcat tggaccgctg ctgatctgct acaaagagtc ggtggatcaa
1740
cgcggcaacc agatcatgtc cgacaagcgc aacgtgatcc tgttctccgt gtttgatgaa
1800
aacagatcct ggtacctgac cgagaacatc cagaggttcc tgcccaaccc tgctggggtg
1860
cagctggagg accccgagtt ccaggccagc aacatcatgc acagcatcaa tggctacgtg
1920
ttcgacagcc tgcagctgag cgtgtgcctg cacgaggtgg cctactggta catcctgagc
1980
atcggcgccc agaccgactt cctgagcgtg ttcttctctg gctacacctt caagcacaag
2040
atggtgtatg aggacaccct gaccctgttc cccttcagcg gggagactgt cttcatgagc
2100
atggagaacc ctggcctgtg gatcctgggc tgccacaaca gcgacttcag gaacaggggc
2160
atgactgccc tgctgaaagt ctccagctgt gacaagaaca ccggggacta ctacgaggac
2220
agctacgagg acatcagcgc ctacctgctg agcaagaaca atgccatcga gcccaggagc
2280
ttctctcaga accccccagt gctgaagagg caccagaggg agatcaccag gaccaccctg
2340
cagtctgacc aggaggagat cgactatgat gacaccatca gcgtggagat gaagaaggag
2400
gacttcgaca tctacgacga ggacgagaac cagagcccca ggagcttcca gaagaagacc
2460
aggcactact tcattgctgc tgtggagagg ctgtgggact atggcatgtc cagcagcccc
2520
catgtgctga ggaacagggc ccagtctggc agcgtgcccc agttcaagaa agtcgtgttc
2580
caggagttca ccgacggcag cttcacccag cccctgtaca gaggggagct gaacgagcac
2640
ctgggcctgc tgggccccta catcagggcc gaggtggagg acaacatcat ggtgaccttc
2700
aggaaccagg ccagcaggcc ctacagcttc tacagcagcc tgatcagcta cgaggaggac
2760
cagaggcagg gggctgagcc caggaagaac tttgtgaagc ccaatgaaac caagacctac
2820
ttctggaagg tgcagcacca catggccccc accaaggacg agttcgactg caaggcctgg
2880
gcctacttct ctgacgtgga cctggagaag gacgtgcact ctggcctgat tggccccctg
2940
ctggtgtgcc acaccaacac cctgaaccct gcccatggca ggcaggtgac tgtgcaggag
3000
ttcgccctgt tcttcaccat cttcgatgaa accaagagct ggtacttcac tgagaacatg
3060
gagaggaact gcagggcccc ctgcaacatc cagatggagg accccacctt caaggagaac
3120
tacaggttcc atgccatcaa tggctacatc atggacaccc tgcctggcct ggtcatggcc
3180
caggaccaga ggatcaggtg gtatctgctg agcatgggca gcaacgagaa catccacagc
3240
atccacttct ctggccacgt gttcactgtg aggaagaagg aggagtacaa gatggccctg
3300
tacaacctgt accctggggt gttcgaaacc gtggagatgc tgcccagcaa ggccggcatc
3360
tggagggtgg agtgcctgat tggggagcac ctgcacgccg gcatgagcac cctgttcctg
3420
gtgtacagca acaagtgcca gacccccctg ggcatggcct ctggccacat cagggacttc
3480
cagatcactg cctctggcca gtacggccag tgggccccca agctggccag gctgcactac
3540
tccggaagca tcaatgcctg gagcaccaag gagcccttca gctggatcaa agtggacctg
3600
ctggccccca tgatcatcca cggcatcaag acccaggggg ccaggcagaa gttctccagc
3660
ctgtacatca gccagttcat catcatgtac agcctggacg gcaagaagtg gcagacctac
3720
aggggcaaca gcaccggcac cctgatggtg ttcttcggca acgtggacag cagcggcatc
3780
aagcacaaca tcttcaaccc ccccatcatc gccagataca tcaggctgca ccccacccac
3840
tacagcatca ggagcaccct gaggatggag ctgatgggct gtgacctgaa cagctgcagc
3900
atgcccctgg gcatggagag caaggccatc tctgacgccc agatcactgc ctccagctac
3960
ttcaccaaca tgtttgccac ctggagcccc agcaaggcca ggctgcacct gcagggcagg
4020
agcaatgcct ggaggcccca ggtcaacaac cccaaggagt ggctgcaggt ggacttccag
4080
aagaccatga aggtgactgg ggtgaccacc cagggggtga agagcctgct gaccagcatg
4140
tacgtgaagg agttcctgat ctccagcagc caggacggcc accagtggac cctgttcttc
4200
cagaatggca aggtgaaggt gttccagggc aaccaggaca gcttcacccc tgtggtcaac
4260
agcctggacc cccccctgct gaccagatac ctgaggatcc acccccagag ctgggtgcac
4320
cagatcgccc tgaggatgga ggtgctgggc tgtgaggccc aggacctgta ctga
4374
<210> 5
<211> 4374
<212> ДНК
<213> Искусственная последовательность
<220>
<223> coFVIII-25
<400> 5
atgcagattg agctgagcac ctgcttcttc ctgtgcctgc tgaggttctg cttctctgcc
60
accaggagat actacctggg cgccgtggag ctgagctggg actacatgca gtctgacctg
120
ggcgagctgc cagtggacgc caggttcccc cccagagtgc ccaagagctt ccccttcaac
180
accagcgtgg tgtacaagaa gaccctgttc gtggagttca ctgaccacct gttcaacatc
240
gccaagccca ggcccccctg gatgggcctg ctgggcccca ccatccaggc cgaggtgtac
300
gacaccgtgg tcatcaccct gaagaacatg gccagccacc ccgtctccct gcacgccgtg
360
ggggtgagct actggaaggc ctctgagggc gccgagtacg acgaccagac cagccagagg
420
gagaaggagg acgacaaggt gttccctggg ggcagccaca cctacgtgtg gcaggtcctg
480
aaggagaacg gccccatggc ctctgacccc ctgtgcctga cctacagcta cctgagccac
540
gtggacctgg tgaaggacct gaactctggc ctgattgggg ccctgctggt gtgcagggag
600
ggcagcctgg ccaaggagaa gacccagacc ctgcacaagt tcatcctgct gttcgccgtg
660
ttcgacgagg gcaagagctg gcactctgaa accaagaaca gcctgatgca ggacagggac
720
gccgcctctg ccagggcctg gcccaagatg cacaccgtca acggctacgt caacaggagc
780
ctgcctggcc tgattggctg ccacaggaag agcgtgtact ggcatgtgat cggcatgggc
840
accacccctg aggtgcacag catcttcctg gagggccaca ccttcctggt caggaaccac
900
aggcaggcca gcctggagat cagccccatc accttcctga ccgcccagac cctgctgatg
960
gacctgggcc agttcctgct gttctgccac atctccagcc accagcacga cggcatggag
1020
gcctacgtga aagtggacag ctgccctgag gagccccagc tgaggatgaa gaacaacgag
1080
gaggccgagg actatgatga cgacctgacc gacagcgaga tggacgtggt caggttcgac
1140
gacgacaaca gccccagctt catccagatc aggagcgtgg ccaagaagca ccccaagacc
1200
tgggtgcact acatcgctgc tgaggaggag gactgggact atgcccccct ggtgctggcc
1260
cctgatgaca ggagctacaa gagccagtac ctgaacaatg gcccccagag gattggcagg
1320
aagtacaaga aagtcaggtt catggcctac actgatgaaa ccttcaagac cagggaggcc
1380
atccagcatg agtctggcat cctgggcccc ctgctgtacg gggaggtggg ggacaccctg
1440
ctgatcatct tcaagaacca ggccagcagg ccctacaaca tctaccccca tggcatcacc
1500
gacgtgaggc ccctgtacag caggaggctg cctaaggggg tgaagcacct gaaagacttc
1560
cccatcctgc ctggggagat cttcaagtac aagtggactg tgactgtgga ggacggcccc
1620
accaagagcg accccaggtg cctgaccaga tactacagca gcttcgtcaa catggagagg
1680
gacctggcct ctggcctgat tggccccctg ctgatctgct acaaggagtc tgtggaccag
1740
aggggcaacc agatcatgag cgacaagagg aacgtgatcc tgttctctgt cttcgacgag
1800
aacaggagct ggtacctgac tgaaaacatc cagcggttcc tccccaaccc cgcgggcgtg
1860
cagctggaag atcctgagtt tcaggcatca aacatcatgc actccattaa cggctacgtg
1920
ttcgattcgc tgcagctgag cgtgtgtctg cacgaagtgg cctactggta catcctgtcc
1980
attggtgccc agactgactt cctgtccgtg tttttctccg gctacacgtt caagcacaag
2040
atggtgtacg aggacaccct gaccctcttc cctttttccg gcgaaactgt gtttatgagc
2100
atggagaatc ccggcctgtg gatcttgggc tgccacaaca gcgacttccg taacagagga
2160
atgactgcgc tgctcaaggt gtccagctgc gacaagaaca ccggagacta ttatgaggac
2220
tcatacgagg acatctccgc ctacctcctg tccaagaata acgccattga acctcggagc
2280
ttcagccaga acccacccgt gcttaagaga catcaacggg agatcactag gaccaccctg
2340
cagtcagacc aggaggaaat cgactacgat gacaccatct cggtcgagat gaagaaggag
2400
gactttgaca tctacgacga agatgaaaac cagagcccga ggtcgttcca aaagaaaacc
2460
cgccactact ttattgctgc tgtcgagcgg ctgtgggact acggaatgtc gtcctcgccg
2520
cacgtgctcc gcaaccgagc ccagagcggc tcggtgccgc aattcaagaa ggtcgtgttc
2580
caggagttca ctgacgggag cttcactcag cctttgtacc ggggagaact caatgaacat
2640
ctcggcctcc tcggacctta catcagagca gaagtggaag ataacatcat ggtcactttc
2700
cgtaaccaag ccagccgccc gtactcgttc tactcctccc tcatttctta cgaagaggac
2760
cagcggcagg gcgcagaacc gcgcaagaac ttcgtgaagc ccaacgaaac caagacctac
2820
ttctggaaag tgcagcatca tatggccccg actaaggacg agtttgactg caaagcctgg
2880
gcctacttct ccgatgtgga cttggagaag gacgtccact ccggcctcat cggtcccctg
2940
ctcgtgtgcc ataccaatac cctgaacccc gcacacggtc gccaggtcac cgtgcaggag
3000
ttcgctctgt tcttcactat cttcgacgaa actaagtcct ggtacttcac cgagaacatg
3060
gagaggaact gcagagcccc ctgtaacatc cagatggagg acccgacgtt caaggaaaac
3120
taccggttcc acgccattaa cggatacatc atggatacgc tgccgggtct tgtgatggcc
3180
caggatcaac ggatcagatg gtacttattg tcgatgggca gcaacgagaa catccactct
3240
attcacttct ccggtcatgt gttcactgtg cggaagaagg aagagtacaa gatggccctg
3300
tacaaccttt atcccggagt gttcgaaact gtggaaatgc tgccgtcgaa ggccggcatt
3360
tggcgcgtgg agtgtttgat tggagaacat ctccatgcgg ggatgtcaac cctgttcctg
3420
gtgtatagca acaagtgcca gactccgctt gggatggcgt caggacacat tagggatttc
3480
cagatcactg cgtccggcca gtacggccaa tgggccccta agctggcccg cctgcattac
3540
tccggatcca ttaacgcctg gtcaaccaag gagccattct cctggatcaa ggtggacctt
3600
ctggccccca tgattatcca cggaattaag acccaggggg cccggcagaa gttctcctca
3660
ctgtacatca gccagttcat aatcatgtac tccctggacg gaaagaagtg gcaaacctac
3720
agggggaaca gcaccggcac actgatggtc tttttcggaa atgtggactc ctccgggatt
3780
aagcataaca tcttcaaccc tccgattatc gctcggtaca ttagacttca ccctacccac
3840
tacagcattc gctccaccct gcggatggaa ctgatgggct gcgatctgaa ctcgtgcagc
3900
atgccgttgg gaatggagtc caaagcaatt tccgacgcgc agatcaccgc ctcgtcctac
3960
tttaccaaca tgttcgccac gtggtcaccg tccaaggccc ggctgcacct ccagggaaga
4020
tccaacgcat ggcggccaca ggtcaacaac cctaaggagt ggctccaggt ggacttccag
4080
aaaaccatga aggtcaccgg agtcacaacc cagggagtga agtcgctgct gacttctatg
4140
tacgtcaagg agttcctgat ctccagcagc caggacgggc accagtggac cctgttcttc
4200
caaaatggaa aggtcaaggt gtttcagggc aatcaggatt cattcacccc ggtggtgaac
4260
tcccttgatc cacccctcct gacccgctac cttcgcatcc acccacagtc ctgggtgcac
4320
cagatcgcgc tgaggatgga ggtcctggga tgcgaagccc aggacctgta ctga
4374
<210> 6
<211> 4374
<212> ДНК
<213> Искусственная последовательность
<220>
<223> coFVIII-26
<400> 6
atgcagattg agctgagcac ctgcttcttc ctgtgcctgc tgaggttctg cttctctgcc
60
accaggagat actacctggg cgccgtggag ctgagctggg actacatgca gtctgacctg
120
ggcgagctgc cagtggacgc caggttcccc cccagagtgc ccaagagctt ccccttcaac
180
accagcgtgg tgtacaagaa gaccctgttc gtggagttca ctgaccacct gttcaacatc
240
gccaagccca ggcccccctg gatgggcctg ctgggcccca ccatccaggc cgaggtgtac
300
gacaccgtgg tcatcaccct gaagaacatg gccagccacc ccgtctccct gcacgccgtg
360
ggggtgagct actggaaggc ctctgagggc gccgagtacg acgaccagac cagccagagg
420
gagaaggagg acgacaaggt gttccctggg ggcagccaca cctacgtgtg gcaggtcctg
480
aaggagaacg gccccatggc ctctgacccc ctgtgcctga cctacagcta cctgagccac
540
gtggacctgg tgaaggacct gaactctggc ctgattgggg ccctgctggt gtgcagggag
600
ggcagcctgg ccaaggagaa gacccagacc ctgcacaagt tcatcctgct gttcgccgtg
660
ttcgacgagg gcaagagctg gcactctgaa accaagaaca gcctgatgca ggacagggac
720
gccgcctctg ccagggcctg gcccaagatg cacaccgtca acggctacgt caacaggagc
780
ctgcctggcc tgattggctg ccacaggaag agcgtgtact ggcatgtgat cggcatgggc
840
accacccctg aggtgcacag catcttcctg gagggccaca ccttcctggt caggaaccac
900
aggcaggcca gcctggagat cagccccatc accttcctga ccgcccagac cctgctgatg
960
gacctgggcc agttcctgct gttctgccac atctccagcc accagcacga cggcatggag
1020
gcctacgtga aagtggacag ctgccctgag gagccccagc tgaggatgaa gaacaacgag
1080
gaggccgagg actatgatga cgacctgacc gacagcgaga tggacgtggt caggttcgac
1140
gacgacaaca gccccagctt catccagatc aggagcgtgg ccaagaagca ccccaagacc
1200
tgggtgcact acatcgctgc tgaggaggag gactgggact atgcccccct ggtgctggcc
1260
cctgatgaca ggagctacaa gagccagtac ctgaacaatg gcccccagag gattggcagg
1320
aagtacaaga aagtcaggtt catggcctac actgatgaaa ccttcaagac cagggaggcc
1380
atccagcatg agtctggcat cctgggcccc ctgctgtacg gggaggtggg ggacaccctg
1440
ctgatcatct tcaagaacca ggccagcagg ccctacaaca tctaccccca tggcatcacc
1500
gacgtgaggc ccctgtacag caggaggctg cctaaggggg tgaagcacct gaaagacttc
1560
cccatcctgc ctggggagat cttcaagtac aagtggactg tgactgtgga ggacggcccc
1620
accaagagcg accccaggtg cctgaccaga tactacagca gcttcgtcaa catggagagg
1680
gacctggcct ctggcctgat tggccccctg ctgatctgct acaaggagtc tgtggaccag
1740
aggggcaacc agatcatgag cgacaagagg aacgtgatcc tgttctctgt cttcgacgag
1800
aacaggagct ggtacctcac tgaaaacatc cagaggttcc tcccaaaccc cgcaggagtg
1860
caactggagg accctgagtt tcaggcctcg aatatcatgc actcgattaa cggttacgtg
1920
ttcgactcgc tgcagctgag cgtgtgcctc catgaagtcg cttactggta cattctgtcc
1980
atcggcgccc agactgactt cctgagcgtg ttcttttccg gttacacctt taagcacaag
2040
atggtgtacg aagataccct gaccctgttc cctttctccg gcgaaacggt gttcatgtcg
2100
atggagaacc cgggtctgtg gattctggga tgccacaaca gcgactttcg gaaccgcgga
2160
atgactgccc tgctgaaggt gtcctcatgc gacaagaaca ccggagacta ctacgaggac
2220
tcctacgagg atatctcagc ctacctcctg tccaagaaca acgcgatcga gccgcgcagc
2280
ttcagccaga acccgcctgt gctgaagagg caccagcgag aaattacccg gaccaccctc
2340
caatcggatc aggaggaaat cgactacgac gacaccatct cggtggaaat gaagaaggaa
2400
gatttcgata tctacgacga ggacgaaaat cagtcccctc gctcattcca aaagaaaact
2460
agacactact ttatcgccgc ggtggaaaga ctgtgggact atggaatgtc atccagccct
2520
cacgtccttc ggaaccgggc ccagagcgga tcggtgcctc agttcaagaa agtggtgttc
2580
caggagttca ccgacggcag cttcacccag ccgctgtacc ggggagaact gaacgaacac
2640
ctgggcctgc tcggtcccta catccgcgcg gaagtggagg ataacatcat ggtgaccttc
2700
cgtaaccaag catccagacc ttactccttc tattcctccc tgatctcata cgaggaggac
2760
cagcgccaag gcgccgagcc ccgcaagaac ttcgtcaagc ccaacgagac taagacctac
2820
ttctggaagg tccaacacca tatggccccg accaaggatg agtttgactg caaggcctgg
2880
gcctacttct ccgacgtgga ccttgagaag gatgtccatt ccggcctgat cgggccgctg
2940
ctcgtgtgtc acaccaacac cctgaaccca gcgcatggac gccaggtcac cgtccaggag
3000
tttgctctgt tcttcaccat ttttgacgaa actaagtcct ggtacttcac cgagaatatg
3060
gagcgaaact gtagagcgcc ctgcaatatc cagatggaag atccgacttt caaggagaac
3120
tatagattcc acgccatcaa cgggtacatc atggatactc tgccggggct ggtcatggcc
3180
caggatcaga ggattcggtg gtacttgctg tcaatgggat cgaacgaaaa cattcactcc
3240
attcacttct ccggtcacgt gttcactgtg cgcaagaagg aggagtacaa gatggcgctg
3300
tacaatctgt accccggggt gttcgaaact gtggagatgc tgccgtccaa ggccggcatc
3360
tggagagtgg agtgcctgat cggagagcac ctccacgcgg ggatgtccac cctcttcctg
3420
gtgtactcga ataagtgcca gaccccgctg ggcatggcct cgggccacat cagagacttc
3480
cagatcacag caagcggaca atacggccaa tgggcgccga agctggcccg cttgcactac
3540
tccggatcga tcaacgcatg gtccaccaag gaaccgttct cgtggattaa ggtggacctc
3600
ctggccccta tgattatcca cggaattaag acccagggcg ccaggcagaa gttctcctcc
3660
ctgtacatct cgcaattcat catcatgtac agcctggacg ggaagaagtg gcagacttac
3720
aggggaaact ccaccggcac cctgatggtc tttttcggca acgtggattc ctccggcatt
3780
aagcacaaca tcttcaaccc accgatcata gccagatata ttaggctcca ccccactcac
3840
tactcaatcc gctcaactct tcggatggaa ctcatggggt gcgacctgaa ctcctgctcc
3900
atgccgttgg ggatggaatc aaaggctatt agcgacgccc agatcaccgc gagctcctac
3960
ttcactaaca tgttcgccac ctggagcccc tccaaggcca ggctgcactt gcagggacgg
4020
tcaaatgcct ggcggccgca agtgaacaat ccgaaggaat ggcttcaagt ggatttccaa
4080
aagaccatga aagtgaccgg agtcaccacc cagggagtga agtcccttct gacctcgatg
4140
tatgtgaagg agttcctgat tagcagcagc caggacgggc accagtggac cctgttcttc
4200
caaaacggaa aggtcaaggt gttccagggg aaccaggact cgttcacacc cgtggtgaac
4260
tccctggacc ccccactgct gacgcggtac ttgaggattc atcctcagtc ctgggtccat
4320
cagattgcat tgcgaatgga agtcctgggc tgcgaggccc aggacctgta ctga
4374
<210> 7
<211> 1734
<212> ДНК
<213> Искусственная последовательность
<220>
<223> coFVIII-52-NT58
<400> 7
gcgacccgcc gatactacct gggagcagtg gagctctcct gggattacat gcagagcgac
60
cttggggagc tgcccgtgga tgccaggttc cctccccggg tgccaaagtc gtttccgttc
120
aacacctccg tggtgtacaa gaaaactctg ttcgtggagt tcaccgacca cctgttcaat
180
atcgccaagc ccagacctcc ctggatgggg ctgttgggac ctaccatcca agcggaggtg
240
tacgacactg tggtcatcac tctgaagaac atggcctcgc atcccgtgtc cctgcacgcc
300
gtgggagtgt cttactggaa agcgtccgag ggggccgaat acgacgacca gacctcgcag
360
agagaaaagg aagatgacaa ggtgttccca ggaggatcgc acacctacgt gtggcaagtg
420
ttgaaggaga acggcccaat ggcctccgac ccgctgtgcc tgacctactc gtacctgtcc
480
cacgtggacc tcgtgaagga cctcaactcg ggactgattg gagccctgct ggtctgcagg
540
gaaggctcac tggcgaaaga aaagactcag accttgcaca agttcattct gctgttcgct
600
gtgttcgacg aggggaagtc gtggcacagc gagactaaga actccctgat gcaagataga
660
gatgccgcct ccgcccgggc ctggcctaag atgcacaccg tgaacggtta cgtgaaccgc
720
tccctccctg gcctgattgg atgccaccgg aagtccgtgt actggcacgt gatcgggatg
780
gggaccaccc ccgaggtgca cagcatcttc ctggaaggtc acacatttct cgtgcgcaac
840
caccggcagg cctccctgga aatcagcccc attaccttcc tcactgccca gactctgctg
900
atggacctgg gacagttcct gctgttctgc catatctcct cccaccaaca tgacggaatg
960
gaggcatacg tgaaggtcga ttcctgccct gaggaacccc agctccgcat gaagaacaat
1020
gaggaagccg aggactacga cgacgacctg acggatagcg agatggatgt ggtccggttc
1080
gatgacgata acagcccttc cttcatccaa attcgctcgg tggcaaagaa gcaccccaag
1140
acctgggtgc attacattgc ggcggaagaa gaggactggg attatgcccc gcttgtcctc
1200
gctcctgacg accggagcta caagagccag tacctgaaca acggtccaca gaggatcggt
1260
agaaagtaca agaaggtccg cttcatggcc tataccgacg aaaccttcaa aactagagag
1320
gccatccaac acgaatccgg catcctgggc ccgctcttgt acggagaagt cggcgacacc
1380
cttctcatta tcttcaagaa ccaggcttcc cggccgtaca acatctatcc gcatgggatc
1440
actgacgtgc gcccactgta ctcgcggcgc ctgcccaagg gtgtcaaaca cctgaaggat
1500
tttccgatcc ttccgggaga aatcttcaag tacaagtgga ccgtgaccgt ggaagatggc
1560
ccaactaagt ctgaccctag atgcctcacc cgctactact catccttcgt caacatggag
1620
cgcgacctgg ccagcggact gatcggcccg ctgctgattt gctacaagga atcagtggac
1680
caacggggaa accagatcat gtcggataag aggaacgtca tcctcttctc cgtg
1734
<210> 8
<211> 2583
<212> ДНК
<213> Искусственная последовательность
<220>
<223> coFVIII-52-CT
<400> 8
tttgacgaaa accggtcgtg gtacctgacc gagaacatcc agaggttcct gcccaaccct
60
gctggggtgc agctggagga ccccgagttc caggccagca acatcatgca cagcatcaat
120
ggctacgtgt tcgacagcct gcagctgagc gtgtgcctgc acgaggtggc ctactggtac
180
atcctgagca tcggcgccca gaccgacttc ctgagcgtgt tcttctctgg ctacaccttc
240
aagcacaaga tggtgtatga ggacaccctg accctgttcc ccttcagcgg ggagactgtc
300
ttcatgagca tggagaaccc tggcctgtgg atcctgggct gccacaacag cgacttcagg
360
aacaggggca tgactgccct gctgaaagtc tccagctgtg acaagaacac cggggactac
420
tacgaggaca gctacgagga catcagcgcc tacctgctga gcaagaacaa tgccatcgag
480
cccaggagct tctctcagaa ccccccagtg ctgaagaggc accagaggga gatcaccagg
540
accaccctgc agtctgacca ggaggagatc gactatgatg acaccatcag cgtggagatg
600
aagaaggagg acttcgacat ctacgacgag gacgagaacc agagccccag gagcttccag
660
aagaagacca ggcactactt cattgctgct gtggagaggc tgtgggacta tggcatgtcc
720
agcagccccc atgtgctgag gaacagggcc cagtctggca gcgtgcccca gttcaagaaa
780
gtcgtgttcc aggagttcac cgacggcagc ttcacccagc ccctgtacag aggggagctg
840
aacgagcacc tgggcctgct gggcccctac atcagggccg aggtggagga caacatcatg
900
gtgaccttca ggaaccaggc cagcaggccc tacagcttct acagcagcct gatcagctac
960
gaggaggacc agaggcaggg ggctgagccc aggaagaact ttgtgaagcc caatgaaacc
1020
aagacctact tctggaaggt gcagcaccac atggccccca ccaaggacga gttcgactgc
1080
aaggcctggg cctacttctc tgacgtggac ctggagaagg acgtgcactc tggcctgatt
1140
ggccccctgc tggtgtgcca caccaacacc ctgaaccctg cccatggcag gcaggtgact
1200
gtgcaggagt tcgccctgtt cttcaccatc ttcgatgaaa ccaagagctg gtacttcact
1260
gagaacatgg agaggaactg cagggccccc tgcaacatcc agatggagga ccccaccttc
1320
aaggagaact acaggttcca tgccatcaat ggctacatca tggacaccct gcctggcctg
1380
gtcatggccc aggaccagag gatcaggtgg tatctgctga gcatgggcag caacgagaac
1440
atccacagca tccacttctc tggccacgtg ttcactgtga ggaagaagga ggagtacaag
1500
atggccctgt acaacctgta ccctggggtg ttcgaaaccg tggagatgct gcccagcaag
1560
gccggcatct ggagggtgga gtgcctgatt ggggagcacc tgcacgccgg catgagcacc
1620
ctgttcctgg tgtacagcaa caagtgccag acccccctgg gcatggcctc tggccacatc
1680
agggacttcc agatcactgc ctctggccag tacggccagt gggcccccaa gctggccagg
1740
ctgcactact ccggaagcat caatgcctgg agcaccaagg agcccttcag ctggatcaaa
1800
gtggacctgc tggcccccat gatcatccac ggcatcaaga cccagggggc caggcagaag
1860
ttctccagcc tgtacatcag ccagttcatc atcatgtaca gcctggacgg caagaagtgg
1920
cagacctaca ggggcaacag caccggcacc ctgatggtgt tcttcggcaa cgtggacagc
1980
agcggcatca agcacaacat cttcaacccc cccatcatcg ccagatacat caggctgcac
2040
cccacccact acagcatcag gagcaccctg aggatggagc tgatgggctg tgacctgaac
2100
agctgcagca tgcccctggg catggagagc aaggccatct ctgacgccca gatcactgcc
2160
tccagctact tcaccaacat gtttgccacc tggagcccca gcaaggccag gctgcacctg
2220
cagggcagga gcaatgcctg gaggccccag gtcaacaacc ccaaggagtg gctgcaggtg
2280
gacttccaga agaccatgaa ggtgactggg gtgaccaccc agggggtgaa gagcctgctg
2340
accagcatgt acgtgaagga gttcctgatc tccagcagcc aggacggcca ccagtggacc
2400
ctgttcttcc agaatggcaa ggtgaaggtg ttccagggca accaggacag cttcacccct
2460
gtggtcaaca gcctggaccc ccccctgctg accagatacc tgaggatcca cccccagagc
2520
tgggtgcacc agatcgccct gaggatggag gtgctgggct gtgaggccca ggacctgtac
2580
tga
2583
<210> 9
<211> 1734
<212> ДНК
<213> Искусственная последовательность
<220>
<223> coFVIII-62-NT58
<400> 9
gccactcgcc ggtactacct tggagccgtg gagctttcat gggactacat gcagagcgac
60
ctgggcgaac tccccgtgga tgccagattc cccccccgcg tgccaaagtc cttccccttt
120
aacacctccg tggtgtacaa gaaaaccctc tttgtcgagt tcactgacca cctgttcaac
180
atcgccaagc cgcgcccacc ttggatgggc ctcctgggac cgaccattca agctgaagtg
240
tacgacaccg tggtgatcac cctgaagaac atggcgtccc accccgtgtc cctgcatgcg
300
gtcggagtgt cctactggaa ggcctccgaa ggagctgagt acgacgacca gactagccag
360
cgggaaaagg aggacgataa agtgttcccg ggcggctcgc atacttacgt gtggcaagtc
420
ctgaaggaaa acggacctat ggcatccgat cctctgtgcc tgacttactc ctacctttcc
480
catgtggacc tcgtgaagga cctgaacagc gggctgattg gtgcacttct cgtgtgccgc
540
gaaggttcgc tcgctaagga aaagacccag accctccata agttcatcct tttgttcgct
600
gtgttcgatg aaggaaagtc atggcattcc gaaactaaga actcgctgat gcaggaccgg
660
gatgccgcct cagcccgcgc ctggcctaaa atgcatacag tcaacggata cgtgaatcgg
720
tcactgcccg ggctcatcgg ttgtcacaga aagtccgtgt actggcacgt catcggcatg
780
ggcactacgc ctgaagtgca ctccatcttc ctggaagggc acaccttcct cgtgcgcaac
840
caccgccagg cctctctgga aatctccccg attacctttc tgaccgccca gactctgctc
900
atggacctgg ggcagttcct tctcttctgc cacatctcca gccatcagca cgacggaatg
960
gaggcctacg tgaaggtgga ctcatgcccg gaagaacctc agttgcggat gaagaacaac
1020
gaggaggccg aggactatga cgacgatttg actgactccg agatggacgt cgtgcggttc
1080
gatgacgaca acagccccag cttcatccag attcgcagcg tggccaagaa gcaccccaaa
1140
acctgggtgc actacatcgc ggccgaggaa gaagattggg actacgcccc gttggtgctg
1200
gcacccgatg accggtcgta caagtcccag tatctgaaca atggtccgca gcggattggc
1260
agaaagtaca agaaagtgcg gttcatggcg tacactgacg aaacgtttaa gacccgggag
1320
gccattcaac atgagagcgg cattctggga ccactgctgt acggagaggt cggcgatacc
1380
ctgctcatca tcttcaaaaa ccaggcctcc cggccttaca acatctaccc tcacggaatc
1440
accgacgtgc ggccactcta ctcgcggcgc ctgccgaagg gcgtcaagca cctgaaagac
1500
ttccctatcc tgccgggcga aatcttcaag tataagtgga ccgtcaccgt ggaggacggg
1560
cccaccaaga gcgatcctag gtgtctgact cggtactact ccagcttcgt gaacatggaa
1620
cgggacctgg catcgggact cattggaccg ctgctgatct gctacaaaga gtcggtggat
1680
caacgcggca accagatcat gtccgacaag cgcaacgtga tcctgttctc cgtg
1734
<210> 10
<211> 2583
<212> ДНК
<213> Искусственная последовательность
<220>
<223> coFVIII-62-CT
<400> 10
tttgatgaaa acagatcctg gtacctgacc gagaacatcc agaggttcct gcccaaccct
60
gctggggtgc agctggagga ccccgagttc caggccagca acatcatgca cagcatcaat
120
ggctacgtgt tcgacagcct gcagctgagc gtgtgcctgc acgaggtggc ctactggtac
180
atcctgagca tcggcgccca gaccgacttc ctgagcgtgt tcttctctgg ctacaccttc
240
aagcacaaga tggtgtatga ggacaccctg accctgttcc ccttcagcgg ggagactgtc
300
ttcatgagca tggagaaccc tggcctgtgg atcctgggct gccacaacag cgacttcagg
360
aacaggggca tgactgccct gctgaaagtc tccagctgtg acaagaacac cggggactac
420
tacgaggaca gctacgagga catcagcgcc tacctgctga gcaagaacaa tgccatcgag
480
cccaggagct tctctcagaa ccccccagtg ctgaagaggc accagaggga gatcaccagg
540
accaccctgc agtctgacca ggaggagatc gactatgatg acaccatcag cgtggagatg
600
aagaaggagg acttcgacat ctacgacgag gacgagaacc agagccccag gagcttccag
660
aagaagacca ggcactactt cattgctgct gtggagaggc tgtgggacta tggcatgtcc
720
agcagccccc atgtgctgag gaacagggcc cagtctggca gcgtgcccca gttcaagaaa
780
gtcgtgttcc aggagttcac cgacggcagc ttcacccagc ccctgtacag aggggagctg
840
aacgagcacc tgggcctgct gggcccctac atcagggccg aggtggagga caacatcatg
900
gtgaccttca ggaaccaggc cagcaggccc tacagcttct acagcagcct gatcagctac
960
gaggaggacc agaggcaggg ggctgagccc aggaagaact ttgtgaagcc caatgaaacc
1020
aagacctact tctggaaggt gcagcaccac atggccccca ccaaggacga gttcgactgc
1080
aaggcctggg cctacttctc tgacgtggac ctggagaagg acgtgcactc tggcctgatt
1140
ggccccctgc tggtgtgcca caccaacacc ctgaaccctg cccatggcag gcaggtgact
1200
gtgcaggagt tcgccctgtt cttcaccatc ttcgatgaaa ccaagagctg gtacttcact
1260
gagaacatgg agaggaactg cagggccccc tgcaacatcc agatggagga ccccaccttc
1320
aaggagaact acaggttcca tgccatcaat ggctacatca tggacaccct gcctggcctg
1380
gtcatggccc aggaccagag gatcaggtgg tatctgctga gcatgggcag caacgagaac
1440
atccacagca tccacttctc tggccacgtg ttcactgtga ggaagaagga ggagtacaag
1500
atggccctgt acaacctgta ccctggggtg ttcgaaaccg tggagatgct gcccagcaag
1560
gccggcatct ggagggtgga gtgcctgatt ggggagcacc tgcacgccgg catgagcacc
1620
ctgttcctgg tgtacagcaa caagtgccag acccccctgg gcatggcctc tggccacatc
1680
agggacttcc agatcactgc ctctggccag tacggccagt gggcccccaa gctggccagg
1740
ctgcactact ccggaagcat caatgcctgg agcaccaagg agcccttcag ctggatcaaa
1800
gtggacctgc tggcccccat gatcatccac ggcatcaaga cccagggggc caggcagaag
1860
ttctccagcc tgtacatcag ccagttcatc atcatgtaca gcctggacgg caagaagtgg
1920
cagacctaca ggggcaacag caccggcacc ctgatggtgt tcttcggcaa cgtggacagc
1980
agcggcatca agcacaacat cttcaacccc cccatcatcg ccagatacat caggctgcac
2040
cccacccact acagcatcag gagcaccctg aggatggagc tgatgggctg tgacctgaac
2100
agctgcagca tgcccctggg catggagagc aaggccatct ctgacgccca gatcactgcc
2160
tccagctact tcaccaacat gtttgccacc tggagcccca gcaaggccag gctgcacctg
2220
cagggcagga gcaatgcctg gaggccccag gtcaacaacc ccaaggagtg gctgcaggtg
2280
gacttccaga agaccatgaa ggtgactggg gtgaccaccc agggggtgaa gagcctgctg
2340
accagcatgt acgtgaagga gttcctgatc tccagcagcc aggacggcca ccagtggacc
2400
ctgttcttcc agaatggcaa ggtgaaggtg ttccagggca accaggacag cttcacccct
2460
gtggtcaaca gcctggaccc ccccctgctg accagatacc tgaggatcca cccccagagc
2520
tgggtgcacc agatcgccct gaggatggag gtgctgggct gtgaggccca ggacctgtac
2580
tga
2583
<210> 11
<211> 1734
<212> ДНК
<213> Искусственная последовательность
<220>
<223> coFVIII-25-NT58
<400> 11
gccaccagga gatactacct gggcgccgtg gagctgagct gggactacat gcagtctgac
60
ctgggcgagc tgccagtgga cgccaggttc ccccccagag tgcccaagag cttccccttc
120
aacaccagcg tggtgtacaa gaagaccctg ttcgtggagt tcactgacca cctgttcaac
180
atcgccaagc ccaggccccc ctggatgggc ctgctgggcc ccaccatcca ggccgaggtg
240
tacgacaccg tggtcatcac cctgaagaac atggccagcc accccgtctc cctgcacgcc
300
gtgggggtga gctactggaa ggcctctgag ggcgccgagt acgacgacca gaccagccag
360
agggagaagg aggacgacaa ggtgttccct gggggcagcc acacctacgt gtggcaggtc
420
ctgaaggaga acggccccat ggcctctgac cccctgtgcc tgacctacag ctacctgagc
480
cacgtggacc tggtgaagga cctgaactct ggcctgattg gggccctgct ggtgtgcagg
540
gagggcagcc tggccaagga gaagacccag accctgcaca agttcatcct gctgttcgcc
600
gtgttcgacg agggcaagag ctggcactct gaaaccaaga acagcctgat gcaggacagg
660
gacgccgcct ctgccagggc ctggcccaag atgcacaccg tcaacggcta cgtcaacagg
720
agcctgcctg gcctgattgg ctgccacagg aagagcgtgt actggcatgt gatcggcatg
780
ggcaccaccc ctgaggtgca cagcatcttc ctggagggcc acaccttcct ggtcaggaac
840
cacaggcagg ccagcctgga gatcagcccc atcaccttcc tgaccgccca gaccctgctg
900
atggacctgg gccagttcct gctgttctgc cacatctcca gccaccagca cgacggcatg
960
gaggcctacg tgaaagtgga cagctgccct gaggagcccc agctgaggat gaagaacaac
1020
gaggaggccg aggactatga tgacgacctg accgacagcg agatggacgt ggtcaggttc
1080
gacgacgaca acagccccag cttcatccag atcaggagcg tggccaagaa gcaccccaag
1140
acctgggtgc actacatcgc tgctgaggag gaggactggg actatgcccc cctggtgctg
1200
gcccctgatg acaggagcta caagagccag tacctgaaca atggccccca gaggattggc
1260
aggaagtaca agaaagtcag gttcatggcc tacactgatg aaaccttcaa gaccagggag
1320
gccatccagc atgagtctgg catcctgggc cccctgctgt acggggaggt gggggacacc
1380
ctgctgatca tcttcaagaa ccaggccagc aggccctaca acatctaccc ccatggcatc
1440
accgacgtga ggcccctgta cagcaggagg ctgcctaagg gggtgaagca cctgaaagac
1500
ttccccatcc tgcctgggga gatcttcaag tacaagtgga ctgtgactgt ggaggacggc
1560
cccaccaaga gcgaccccag gtgcctgacc agatactaca gcagcttcgt caacatggag
1620
agggacctgg cctctggcct gattggcccc ctgctgatct gctacaagga gtctgtggac
1680
cagaggggca accagatcat gagcgacaag aggaacgtga tcctgttctc tgtc
1734
<210> 12
<211> 2583
<212> ДНК
<213> Искусственная последовательность
<220>
<223> coFVIII-25-CT
<400> 12
ttcgacgaga acaggagctg gtacctgact gaaaacatcc agcggttcct ccccaacccc
60
gcgggcgtgc agctggaaga tcctgagttt caggcatcaa acatcatgca ctccattaac
120
ggctacgtgt tcgattcgct gcagctgagc gtgtgtctgc acgaagtggc ctactggtac
180
atcctgtcca ttggtgccca gactgacttc ctgtccgtgt ttttctccgg ctacacgttc
240
aagcacaaga tggtgtacga ggacaccctg accctcttcc ctttttccgg cgaaactgtg
300
tttatgagca tggagaatcc cggcctgtgg atcttgggct gccacaacag cgacttccgt
360
aacagaggaa tgactgcgct gctcaaggtg tccagctgcg acaagaacac cggagactat
420
tatgaggact catacgagga catctccgcc tacctcctgt ccaagaataa cgccattgaa
480
cctcggagct tcagccagaa cccacccgtg cttaagagac atcaacggga gatcactagg
540
accaccctgc agtcagacca ggaggaaatc gactacgatg acaccatctc ggtcgagatg
600
aagaaggagg actttgacat ctacgacgaa gatgaaaacc agagcccgag gtcgttccaa
660
aagaaaaccc gccactactt tattgctgct gtcgagcggc tgtgggacta cggaatgtcg
720
tcctcgccgc acgtgctccg caaccgagcc cagagcggct cggtgccgca attcaagaag
780
gtcgtgttcc aggagttcac tgacgggagc ttcactcagc ctttgtaccg gggagaactc
840
aatgaacatc tcggcctcct cggaccttac atcagagcag aagtggaaga taacatcatg
900
gtcactttcc gtaaccaagc cagccgcccg tactcgttct actcctccct catttcttac
960
gaagaggacc agcggcaggg cgcagaaccg cgcaagaact tcgtgaagcc caacgaaacc
1020
aagacctact tctggaaagt gcagcatcat atggccccga ctaaggacga gtttgactgc
1080
aaagcctggg cctacttctc cgatgtggac ttggagaagg acgtccactc cggcctcatc
1140
ggtcccctgc tcgtgtgcca taccaatacc ctgaaccccg cacacggtcg ccaggtcacc
1200
gtgcaggagt tcgctctgtt cttcactatc ttcgacgaaa ctaagtcctg gtacttcacc
1260
gagaacatgg agaggaactg cagagccccc tgtaacatcc agatggagga cccgacgttc
1320
aaggaaaact accggttcca cgccattaac ggatacatca tggatacgct gccgggtctt
1380
gtgatggccc aggatcaacg gatcagatgg tacttattgt cgatgggcag caacgagaac
1440
atccactcta ttcacttctc cggtcatgtg ttcactgtgc ggaagaagga agagtacaag
1500
atggccctgt acaaccttta tcccggagtg ttcgaaactg tggaaatgct gccgtcgaag
1560
gccggcattt ggcgcgtgga gtgtttgatt ggagaacatc tccatgcggg gatgtcaacc
1620
ctgttcctgg tgtatagcaa caagtgccag actccgcttg ggatggcgtc aggacacatt
1680
agggatttcc agatcactgc gtccggccag tacggccaat gggcccctaa gctggcccgc
1740
ctgcattact ccggatccat taacgcctgg tcaaccaagg agccattctc ctggatcaag
1800
gtggaccttc tggcccccat gattatccac ggaattaaga cccagggggc ccggcagaag
1860
ttctcctcac tgtacatcag ccagttcata atcatgtact ccctggacgg aaagaagtgg
1920
caaacctaca gggggaacag caccggcaca ctgatggtct ttttcggaaa tgtggactcc
1980
tccgggatta agcataacat cttcaaccct ccgattatcg ctcggtacat tagacttcac
2040
cctacccact acagcattcg ctccaccctg cggatggaac tgatgggctg cgatctgaac
2100
tcgtgcagca tgccgttggg aatggagtcc aaagcaattt ccgacgcgca gatcaccgcc
2160
tcgtcctact ttaccaacat gttcgccacg tggtcaccgt ccaaggcccg gctgcacctc
2220
cagggaagat ccaacgcatg gcggccacag gtcaacaacc ctaaggagtg gctccaggtg
2280
gacttccaga aaaccatgaa ggtcaccgga gtcacaaccc agggagtgaa gtcgctgctg
2340
acttctatgt acgtcaagga gttcctgatc tccagcagcc aggacgggca ccagtggacc
2400
ctgttcttcc aaaatggaaa ggtcaaggtg tttcagggca atcaggattc attcaccccg
2460
gtggtgaact cccttgatcc acccctcctg acccgctacc ttcgcatcca cccacagtcc
2520
tgggtgcacc agatcgcgct gaggatggag gtcctgggat gcgaagccca ggacctgtac
2580
tga
2583
<210> 13
<211> 1734
<212> ДНК
<213> Искусственная последовательность
<220>
<223> coFVIII-26-NT58
<400> 13
gccaccagga gatactacct gggcgccgtg gagctgagct gggactacat gcagtctgac
60
ctgggcgagc tgccagtgga cgccaggttc ccccccagag tgcccaagag cttccccttc
120
aacaccagcg tggtgtacaa gaagaccctg ttcgtggagt tcactgacca cctgttcaac
180
atcgccaagc ccaggccccc ctggatgggc ctgctgggcc ccaccatcca ggccgaggtg
240
tacgacaccg tggtcatcac cctgaagaac atggccagcc accccgtctc cctgcacgcc
300
gtgggggtga gctactggaa ggcctctgag ggcgccgagt acgacgacca gaccagccag
360
agggagaagg aggacgacaa ggtgttccct gggggcagcc acacctacgt gtggcaggtc
420
ctgaaggaga acggccccat ggcctctgac cccctgtgcc tgacctacag ctacctgagc
480
cacgtggacc tggtgaagga cctgaactct ggcctgattg gggccctgct ggtgtgcagg
540
gagggcagcc tggccaagga gaagacccag accctgcaca agttcatcct gctgttcgcc
600
gtgttcgacg agggcaagag ctggcactct gaaaccaaga acagcctgat gcaggacagg
660
gacgccgcct ctgccagggc ctggcccaag atgcacaccg tcaacggcta cgtcaacagg
720
agcctgcctg gcctgattgg ctgccacagg aagagcgtgt actggcatgt gatcggcatg
780
ggcaccaccc ctgaggtgca cagcatcttc ctggagggcc acaccttcct ggtcaggaac
840
cacaggcagg ccagcctgga gatcagcccc atcaccttcc tgaccgccca gaccctgctg
900
atggacctgg gccagttcct gctgttctgc cacatctcca gccaccagca cgacggcatg
960
gaggcctacg tgaaagtgga cagctgccct gaggagcccc agctgaggat gaagaacaac
1020
gaggaggccg aggactatga tgacgacctg accgacagcg agatggacgt ggtcaggttc
1080
gacgacgaca acagccccag cttcatccag atcaggagcg tggccaagaa gcaccccaag
1140
acctgggtgc actacatcgc tgctgaggag gaggactggg actatgcccc cctggtgctg
1200
gcccctgatg acaggagcta caagagccag tacctgaaca atggccccca gaggattggc
1260
aggaagtaca agaaagtcag gttcatggcc tacactgatg aaaccttcaa gaccagggag
1320
gccatccagc atgagtctgg catcctgggc cccctgctgt acggggaggt gggggacacc
1380
ctgctgatca tcttcaagaa ccaggccagc aggccctaca acatctaccc ccatggcatc
1440
accgacgtga ggcccctgta cagcaggagg ctgcctaagg gggtgaagca cctgaaagac
1500
ttccccatcc tgcctgggga gatcttcaag tacaagtgga ctgtgactgt ggaggacggc
1560
cccaccaaga gcgaccccag gtgcctgacc agatactaca gcagcttcgt caacatggag
1620
agggacctgg cctctggcct gattggcccc ctgctgatct gctacaagga gtctgtggac
1680
cagaggggca accagatcat gagcgacaag aggaacgtga tcctgttctc tgtc
1734
<210> 14
<211> 2583
<212> ДНК
<213> Искусственная последовательность
<220>
<223> coFVIII-26-CT
<400> 14
ttcgacgaga acaggagctg gtacctcact gaaaacatcc agaggttcct cccaaacccc
60
gcaggagtgc aactggagga ccctgagttt caggcctcga atatcatgca ctcgattaac
120
ggttacgtgt tcgactcgct gcagctgagc gtgtgcctcc atgaagtcgc ttactggtac
180
attctgtcca tcggcgccca gactgacttc ctgagcgtgt tcttttccgg ttacaccttt
240
aagcacaaga tggtgtacga agataccctg accctgttcc ctttctccgg cgaaacggtg
300
ttcatgtcga tggagaaccc gggtctgtgg attctgggat gccacaacag cgactttcgg
360
aaccgcggaa tgactgccct gctgaaggtg tcctcatgcg acaagaacac cggagactac
420
tacgaggact cctacgagga tatctcagcc tacctcctgt ccaagaacaa cgcgatcgag
480
ccgcgcagct tcagccagaa cccgcctgtg ctgaagaggc accagcgaga aattacccgg
540
accaccctcc aatcggatca ggaggaaatc gactacgacg acaccatctc ggtggaaatg
600
aagaaggaag atttcgatat ctacgacgag gacgaaaatc agtcccctcg ctcattccaa
660
aagaaaacta gacactactt tatcgccgcg gtggaaagac tgtgggacta tggaatgtca
720
tccagccctc acgtccttcg gaaccgggcc cagagcggat cggtgcctca gttcaagaaa
780
gtggtgttcc aggagttcac cgacggcagc ttcacccagc cgctgtaccg gggagaactg
840
aacgaacacc tgggcctgct cggtccctac atccgcgcgg aagtggagga taacatcatg
900
gtgaccttcc gtaaccaagc atccagacct tactccttct attcctccct gatctcatac
960
gaggaggacc agcgccaagg cgccgagccc cgcaagaact tcgtcaagcc caacgagact
1020
aagacctact tctggaaggt ccaacaccat atggccccga ccaaggatga gtttgactgc
1080
aaggcctggg cctacttctc cgacgtggac cttgagaagg atgtccattc cggcctgatc
1140
gggccgctgc tcgtgtgtca caccaacacc ctgaacccag cgcatggacg ccaggtcacc
1200
gtccaggagt ttgctctgtt cttcaccatt tttgacgaaa ctaagtcctg gtacttcacc
1260
gagaatatgg agcgaaactg tagagcgccc tgcaatatcc agatggaaga tccgactttc
1320
aaggagaact atagattcca cgccatcaac gggtacatca tggatactct gccggggctg
1380
gtcatggccc aggatcagag gattcggtgg tacttgctgt caatgggatc gaacgaaaac
1440
attcactcca ttcacttctc cggtcacgtg ttcactgtgc gcaagaagga ggagtacaag
1500
atggcgctgt acaatctgta ccccggggtg ttcgaaactg tggagatgct gccgtccaag
1560
gccggcatct ggagagtgga gtgcctgatc ggagagcacc tccacgcggg gatgtccacc
1620
ctcttcctgg tgtactcgaa taagtgccag accccgctgg gcatggcctc gggccacatc
1680
agagacttcc agatcacagc aagcggacaa tacggccaat gggcgccgaa gctggcccgc
1740
ttgcactact ccggatcgat caacgcatgg tccaccaagg aaccgttctc gtggattaag
1800
gtggacctcc tggcccctat gattatccac ggaattaaga cccagggcgc caggcagaag
1860
ttctcctccc tgtacatctc gcaattcatc atcatgtaca gcctggacgg gaagaagtgg
1920
cagacttaca ggggaaactc caccggcacc ctgatggtct ttttcggcaa cgtggattcc
1980
tccggcatta agcacaacat cttcaaccca ccgatcatag ccagatatat taggctccac
2040
cccactcact actcaatccg ctcaactctt cggatggaac tcatggggtg cgacctgaac
2100
tcctgctcca tgccgttggg gatggaatca aaggctatta gcgacgccca gatcaccgcg
2160
agctcctact tcactaacat gttcgccacc tggagcccct ccaaggccag gctgcacttg
2220
cagggacggt caaatgcctg gcggccgcaa gtgaacaatc cgaaggaatg gcttcaagtg
2280
gatttccaaa agaccatgaa agtgaccgga gtcaccaccc agggagtgaa gtcccttctg
2340
acctcgatgt atgtgaagga gttcctgatt agcagcagcc aggacgggca ccagtggacc
2400
ctgttcttcc aaaacggaaa ggtcaaggtg ttccagggga accaggactc gttcacaccc
2460
gtggtgaact ccctggaccc cccactgctg acgcggtact tgaggattca tcctcagtcc
2520
tgggtccatc agattgcatt gcgaatggaa gtcctgggct gcgaggccca ggacctgtac
2580
tga
2583
<210> 15
<211> 2332
<212> БЕЛОК
<213> Homo sapiens
<400> 15
Ala Thr Arg Arg Tyr Tyr Leu Gly Ala Val Glu Leu Ser Trp Asp Tyr
1. 5 10 15
Met Gln Ser Asp Leu Gly Glu Leu Pro Val Asp Ala Arg Phe Pro Pro
20 25 30
Arg Val Pro Lys Ser Phe Pro Phe Asn Thr Ser Val Val Tyr Lys Lys
35 40 45
Thr Leu Phe Val Glu Phe Thr Asp His Leu Phe Asn Ile Ala Lys Pro
50 55 60
Arg Pro Pro Trp Met Gly Leu Leu Gly Pro Thr Ile Gln Ala Glu Val
65 70 75 80
Tyr Asp Thr Val Val Ile Thr Leu Lys Asn Met Ala Ser His Pro Val
85 90 95
Ser Leu His Ala Val Gly Val Ser Tyr Trp Lys Ala Ser Glu Gly Ala
100 105 110
Glu Tyr Asp Asp Gln Thr Ser Gln Arg Glu Lys Glu Asp Asp Lys Val
115 120 125
Phe Pro Gly Gly Ser His Thr Tyr Val Trp Gln Val Leu Lys Glu Asn
130 135 140
Gly Pro Met Ala Ser Asp Pro Leu Cys Leu Thr Tyr Ser Tyr Leu Ser
145 150 155 160
His Val Asp Leu Val Lys Asp Leu Asn Ser Gly Leu Ile Gly Ala Leu
165 170 175
Leu Val Cys Arg Glu Gly Ser Leu Ala Lys Glu Lys Thr Gln Thr Leu
180 185 190
His Lys Phe Ile Leu Leu Phe Ala Val Phe Asp Glu Gly Lys Ser Trp
195 200 205
His Ser Glu Thr Lys Asn Ser Leu Met Gln Asp Arg Asp Ala Ala Ser
210 215 220
Ala Arg Ala Trp Pro Lys Met His Thr Val Asn Gly Tyr Val Asn Arg
225 230 235 240
Ser Leu Pro Gly Leu Ile Gly Cys His Arg Lys Ser Val Tyr Trp His
245 250 255
Val Ile Gly Met Gly Thr Thr Pro Glu Val His Ser Ile Phe Leu Glu
260 265 270
Gly His Thr Phe Leu Val Arg Asn His Arg Gln Ala Ser Leu Glu Ile
275 280 285
Ser Pro Ile Thr Phe Leu Thr Ala Gln Thr Leu Leu Met Asp Leu Gly
290 295 300
Gln Phe Leu Leu Phe Cys His Ile Ser Ser His Gln His Asp Gly Met
305 310 315 320
Glu Ala Tyr Val Lys Val Asp Ser Cys Pro Glu Glu Pro Gln Leu Arg
325 330 335
Met Lys Asn Asn Glu Glu Ala Glu Asp Tyr Asp Asp Asp Leu Thr Asp
340 345 350
Ser Glu Met Asp Val Val Arg Phe Asp Asp Asp Asn Ser Pro Ser Phe
355 360 365
Ile Gln Ile Arg Ser Val Ala Lys Lys His Pro Lys Thr Trp Val His
370 375 380
Tyr Ile Ala Ala Glu Glu Glu Asp Trp Asp Tyr Ala Pro Leu Val Leu
385 390 395 400
Ala Pro Asp Asp Arg Ser Tyr Lys Ser Gln Tyr Leu Asn Asn Gly Pro
405 410 415
Gln Arg Ile Gly Arg Lys Tyr Lys Lys Val Arg Phe Met Ala Tyr Thr
420 425 430
Asp Glu Thr Phe Lys Thr Arg Glu Ala Ile Gln His Glu Ser Gly Ile
435 440 445
Leu Gly Pro Leu Leu Tyr Gly Glu Val Gly Asp Thr Leu Leu Ile Ile
450 455 460
Phe Lys Asn Gln Ala Ser Arg Pro Tyr Asn Ile Tyr Pro His Gly Ile
465 470 475 480
Thr Asp Val Arg Pro Leu Tyr Ser Arg Arg Leu Pro Lys Gly Val Lys
485 490 495
His Leu Lys Asp Phe Pro Ile Leu Pro Gly Glu Ile Phe Lys Tyr Lys
500 505 510
Trp Thr Val Thr Val Glu Asp Gly Pro Thr Lys Ser Asp Pro Arg Cys
515 520 525
Leu Thr Arg Tyr Tyr Ser Ser Phe Val Asn Met Glu Arg Asp Leu Ala
530 535 540
Ser Gly Leu Ile Gly Pro Leu Leu Ile Cys Tyr Lys Glu Ser Val Asp
545 550 555 560
Gln Arg Gly Asn Gln Ile Met Ser Asp Lys Arg Asn Val Ile Leu Phe
565 570 575
Ser Val Phe Asp Glu Asn Arg Ser Trp Tyr Leu Thr Glu Asn Ile Gln
580 585 590
Arg Phe Leu Pro Asn Pro Ala Gly Val Gln Leu Glu Asp Pro Glu Phe
595 600 605
Gln Ala Ser Asn Ile Met His Ser Ile Asn Gly Tyr Val Phe Asp Ser
610 615 620
Leu Gln Leu Ser Val Cys Leu His Glu Val Ala Tyr Trp Tyr Ile Leu
625 630 635 640
Ser Ile Gly Ala Gln Thr Asp Phe Leu Ser Val Phe Phe Ser Gly Tyr
645 650 655
Thr Phe Lys His Lys Met Val Tyr Glu Asp Thr Leu Thr Leu Phe Pro
660 665 670
Phe Ser Gly Glu Thr Val Phe Met Ser Met Glu Asn Pro Gly Leu Trp
675 680 685
Ile Leu Gly Cys His Asn Ser Asp Phe Arg Asn Arg Gly Met Thr Ala
690 695 700
Leu Leu Lys Val Ser Ser Cys Asp Lys Asn Thr Gly Asp Tyr Tyr Glu
705 710 715 720
Asp Ser Tyr Glu Asp Ile Ser Ala Tyr Leu Leu Ser Lys Asn Asn Ala
725 730 735
Ile Glu Pro Arg Ser Phe Ser Gln Asn Ser Arg His Pro Ser Thr Arg
740 745 750
Gln Lys Gln Phe Asn Ala Thr Thr Ile Pro Glu Asn Asp Ile Glu Lys
755 760 765
Thr Asp Pro Trp Phe Ala His Arg Thr Pro Met Pro Lys Ile Gln Asn
770 775 780
Val Ser Ser Ser Asp Leu Leu Met Leu Leu Arg Gln Ser Pro Thr Pro
785 790 795 800
His Gly Leu Ser Leu Ser Asp Leu Gln Glu Ala Lys Tyr Glu Thr Phe
805 810 815
Ser Asp Asp Pro Ser Pro Gly Ala Ile Asp Ser Asn Asn Ser Leu Ser
820 825 830
Glu Met Thr His Phe Arg Pro Gln Leu His His Ser Gly Asp Met Val
835 840 845
Phe Thr Pro Glu Ser Gly Leu Gln Leu Arg Leu Asn Glu Lys Leu Gly
850 855 860
Thr Thr Ala Ala Thr Glu Leu Lys Lys Leu Asp Phe Lys Val Ser Ser
865 870 875 880
Thr Ser Asn Asn Leu Ile Ser Thr Ile Pro Ser Asp Asn Leu Ala Ala
885 890 895
Gly Thr Asp Asn Thr Ser Ser Leu Gly Pro Pro Ser Met Pro Val His
900 905 910
Tyr Asp Ser Gln Leu Asp Thr Thr Leu Phe Gly Lys Lys Ser Ser Pro
915 920 925
Leu Thr Glu Ser Gly Gly Pro Leu Ser Leu Ser Glu Glu Asn Asn Asp
930 935 940
Ser Lys Leu Leu Glu Ser Gly Leu Met Asn Ser Gln Glu Ser Ser Trp
945 950 955 960
Gly Lys Asn Val Ser Ser Thr Glu Ser Gly Arg Leu Phe Lys Gly Lys
965 970 975
Arg Ala His Gly Pro Ala Leu Leu Thr Lys Asp Asn Ala Leu Phe Lys
980 985 990
Val Ser Ile Ser Leu Leu Lys Thr Asn Lys Thr Ser Asn Asn Ser Ala
995 1000 1005
Thr Asn Arg Lys Thr His Ile Asp Gly Pro Ser Leu Leu Ile Glu
1010 1015 1020
Asn Ser Pro Ser Val Trp Gln Asn Ile Leu Glu Ser Asp Thr Glu
1025 1030 1035
Phe Lys Lys Val Thr Pro Leu Ile His Asp Arg Met Leu Met Asp
1040 1045 1050
Lys Asn Ala Thr Ala Leu Arg Leu Asn His Met Ser Asn Lys Thr
1055 1060 1065
Thr Ser Ser Lys Asn Met Glu Met Val Gln Gln Lys Lys Glu Gly
1070 1075 1080
Pro Ile Pro Pro Asp Ala Gln Asn Pro Asp Met Ser Phe Phe Lys
1085 1090 1095
Met Leu Phe Leu Pro Glu Ser Ala Arg Trp Ile Gln Arg Thr His
1100 1105 1110
Gly Lys Asn Ser Leu Asn Ser Gly Gln Gly Pro Ser Pro Lys Gln
1115 1120 1125
Leu Val Ser Leu Gly Pro Glu Lys Ser Val Glu Gly Gln Asn Phe
1130 1135 1140
Leu Ser Glu Lys Asn Lys Val Val Val Gly Lys Gly Glu Phe Thr
1145 1150 1155
Lys Asp Val Gly Leu Lys Glu Met Val Phe Pro Ser Ser Arg Asn
1160 1165 1170
Leu Phe Leu Thr Asn Leu Asp Asn Leu His Glu Asn Asn Thr His
1175 1180 1185
Asn Gln Glu Lys Lys Ile Gln Glu Glu Ile Glu Lys Lys Glu Thr
1190 1195 1200
Leu Ile Gln Glu Asn Val Val Leu Pro Gln Ile His Thr Val Thr
1205 1210 1215
Gly Thr Lys Asn Phe Met Lys Asn Leu Phe Leu Leu Ser Thr Arg
1220 1225 1230
Gln Asn Val Glu Gly Ser Tyr Asp Gly Ala Tyr Ala Pro Val Leu
1235 1240 1245
Gln Asp Phe Arg Ser Leu Asn Asp Ser Thr Asn Arg Thr Lys Lys
1250 1255 1260
His Thr Ala His Phe Ser Lys Lys Gly Glu Glu Glu Asn Leu Glu
1265 1270 1275
Gly Leu Gly Asn Gln Thr Lys Gln Ile Val Glu Lys Tyr Ala Cys
1280 1285 1290
Thr Thr Arg Ile Ser Pro Asn Thr Ser Gln Gln Asn Phe Val Thr
1295 1300 1305
Gln Arg Ser Lys Arg Ala Leu Lys Gln Phe Arg Leu Pro Leu Glu
1310 1315 1320
Glu Thr Glu Leu Glu Lys Arg Ile Ile Val Asp Asp Thr Ser Thr
1325 1330 1335
Gln Trp Ser Lys Asn Met Lys His Leu Thr Pro Ser Thr Leu Thr
1340 1345 1350
Gln Ile Asp Tyr Asn Glu Lys Glu Lys Gly Ala Ile Thr Gln Ser
1355 1360 1365
Pro Leu Ser Asp Cys Leu Thr Arg Ser His Ser Ile Pro Gln Ala
1370 1375 1380
Asn Arg Ser Pro Leu Pro Ile Ala Lys Val Ser Ser Phe Pro Ser
1385 1390 1395
Ile Arg Pro Ile Tyr Leu Thr Arg Val Leu Phe Gln Asp Asn Ser
1400 1405 1410
Ser His Leu Pro Ala Ala Ser Tyr Arg Lys Lys Asp Ser Gly Val
1415 1420 1425
Gln Glu Ser Ser His Phe Leu Gln Gly Ala Lys Lys Asn Asn Leu
1430 1435 1440
Ser Leu Ala Ile Leu Thr Leu Glu Met Thr Gly Asp Gln Arg Glu
1445 1450 1455
Val Gly Ser Leu Gly Thr Ser Ala Thr Asn Ser Val Thr Tyr Lys
1460 1465 1470
Lys Val Glu Asn Thr Val Leu Pro Lys Pro Asp Leu Pro Lys Thr
1475 1480 1485
Ser Gly Lys Val Glu Leu Leu Pro Lys Val His Ile Tyr Gln Lys
1490 1495 1500
Asp Leu Phe Pro Thr Glu Thr Ser Asn Gly Ser Pro Gly His Leu
1505 1510 1515
Asp Leu Val Glu Gly Ser Leu Leu Gln Gly Thr Glu Gly Ala Ile
1520 1525 1530
Lys Trp Asn Glu Ala Asn Arg Pro Gly Lys Val Pro Phe Leu Arg
1535 1540 1545
Val Ala Thr Glu Ser Ser Ala Lys Thr Pro Ser Lys Leu Leu Asp
1550 1555 1560
Pro Leu Ala Trp Asp Asn His Tyr Gly Thr Gln Ile Pro Lys Glu
1565 1570 1575
Glu Trp Lys Ser Gln Glu Lys Ser Pro Glu Lys Thr Ala Phe Lys
1580 1585 1590
Lys Lys Asp Thr Ile Leu Ser Leu Asn Ala Cys Glu Ser Asn His
1595 1600 1605
Ala Ile Ala Ala Ile Asn Glu Gly Gln Asn Lys Pro Glu Ile Glu
1610 1615 1620
Val Thr Trp Ala Lys Gln Gly Arg Thr Glu Arg Leu Cys Ser Gln
1625 1630 1635
Asn Pro Pro Val Leu Lys Arg His Gln Arg Glu Ile Thr Arg Thr
1640 1645 1650
Thr Leu Gln Ser Asp Gln Glu Glu Ile Asp Tyr Asp Asp Thr Ile
1655 1660 1665
Ser Val Glu Met Lys Lys Glu Asp Phe Asp Ile Tyr Asp Glu Asp
1670 1675 1680
Glu Asn Gln Ser Pro Arg Ser Phe Gln Lys Lys Thr Arg His Tyr
1685 1690 1695
Phe Ile Ala Ala Val Glu Arg Leu Trp Asp Tyr Gly Met Ser Ser
1700 1705 1710
Ser Pro His Val Leu Arg Asn Arg Ala Gln Ser Gly Ser Val Pro
1715 1720 1725
Gln Phe Lys Lys Val Val Phe Gln Glu Phe Thr Asp Gly Ser Phe
1730 1735 1740
Thr Gln Pro Leu Tyr Arg Gly Glu Leu Asn Glu His Leu Gly Leu
1745 1750 1755
Leu Gly Pro Tyr Ile Arg Ala Glu Val Glu Asp Asn Ile Met Val
1760 1765 1770
Thr Phe Arg Asn Gln Ala Ser Arg Pro Tyr Ser Phe Tyr Ser Ser
1775 1780 1785
Leu Ile Ser Tyr Glu Glu Asp Gln Arg Gln Gly Ala Glu Pro Arg
1790 1795 1800
Lys Asn Phe Val Lys Pro Asn Glu Thr Lys Thr Tyr Phe Trp Lys
1805 1810 1815
Val Gln His His Met Ala Pro Thr Lys Asp Glu Phe Asp Cys Lys
1820 1825 1830
Ala Trp Ala Tyr Phe Ser Asp Val Asp Leu Glu Lys Asp Val His
1835 1840 1845
Ser Gly Leu Ile Gly Pro Leu Leu Val Cys His Thr Asn Thr Leu
1850 1855 1860
Asn Pro Ala His Gly Arg Gln Val Thr Val Gln Glu Phe Ala Leu
1865 1870 1875
Phe Phe Thr Ile Phe Asp Glu Thr Lys Ser Trp Tyr Phe Thr Glu
1880 1885 1890
Asn Met Glu Arg Asn Cys Arg Ala Pro Cys Asn Ile Gln Met Glu
1895 1900 1905
Asp Pro Thr Phe Lys Glu Asn Tyr Arg Phe His Ala Ile Asn Gly
1910 1915 1920
Tyr Ile Met Asp Thr Leu Pro Gly Leu Val Met Ala Gln Asp Gln
1925 1930 1935
Arg Ile Arg Trp Tyr Leu Leu Ser Met Gly Ser Asn Glu Asn Ile
1940 1945 1950
His Ser Ile His Phe Ser Gly His Val Phe Thr Val Arg Lys Lys
1955 1960 1965
Glu Glu Tyr Lys Met Ala Leu Tyr Asn Leu Tyr Pro Gly Val Phe
1970 1975 1980
Glu Thr Val Glu Met Leu Pro Ser Lys Ala Gly Ile Trp Arg Val
1985 1990 1995
Glu Cys Leu Ile Gly Glu His Leu His Ala Gly Met Ser Thr Leu
2000 2005 2010
Phe Leu Val Tyr Ser Asn Lys Cys Gln Thr Pro Leu Gly Met Ala
2015 2020 2025
Ser Gly His Ile Arg Asp Phe Gln Ile Thr Ala Ser Gly Gln Tyr
2030 2035 2040
Gly Gln Trp Ala Pro Lys Leu Ala Arg Leu His Tyr Ser Gly Ser
2045 2050 2055
Ile Asn Ala Trp Ser Thr Lys Glu Pro Phe Ser Trp Ile Lys Val
2060 2065 2070
Asp Leu Leu Ala Pro Met Ile Ile His Gly Ile Lys Thr Gln Gly
2075 2080 2085
Ala Arg Gln Lys Phe Ser Ser Leu Tyr Ile Ser Gln Phe Ile Ile
2090 2095 2100
Met Tyr Ser Leu Asp Gly Lys Lys Trp Gln Thr Tyr Arg Gly Asn
2105 2110 2115
Ser Thr Gly Thr Leu Met Val Phe Phe Gly Asn Val Asp Ser Ser
2120 2125 2130
Gly Ile Lys His Asn Ile Phe Asn Pro Pro Ile Ile Ala Arg Tyr
2135 2140 2145
Ile Arg Leu His Pro Thr His Tyr Ser Ile Arg Ser Thr Leu Arg
2150 2155 2160
Met Glu Leu Met Gly Cys Asp Leu Asn Ser Cys Ser Met Pro Leu
2165 2170 2175
Gly Met Glu Ser Lys Ala Ile Ser Asp Ala Gln Ile Thr Ala Ser
2180 2185 2190
Ser Tyr Phe Thr Asn Met Phe Ala Thr Trp Ser Pro Ser Lys Ala
2195 2200 2205
Arg Leu His Leu Gln Gly Arg Ser Asn Ala Trp Arg Pro Gln Val
2210 2215 2220
Asn Asn Pro Lys Glu Trp Leu Gln Val Asp Phe Gln Lys Thr Met
2225 2230 2235
Lys Val Thr Gly Val Thr Thr Gln Gly Val Lys Ser Leu Leu Thr
2240 2245 2250
Ser Met Tyr Val Lys Glu Phe Leu Ile Ser Ser Ser Gln Asp Gly
2255 2260 2265
His Gln Trp Thr Leu Phe Phe Gln Asn Gly Lys Val Lys Val Phe
2270 2275 2280
Gln Gly Asn Gln Asp Ser Phe Thr Pro Val Val Asn Ser Leu Asp
2285 2290 2295
Pro Pro Leu Leu Thr Arg Tyr Leu Arg Ile His Pro Gln Ser Trp
2300 2305 2310
Val His Gln Ile Ala Leu Arg Met Glu Val Leu Gly Cys Glu Ala
2315 2320 2325
Gln Asp Leu Tyr
2330
<210> 16
<211> 4371
<212> ДНК
<213> Искусственная последовательность
<220>
<223> BDD-FVIII (не оптимизированная; "родительская"), нуклеотидная
последовательность
<400> 16
atgcaaatag agctctccac ctgcttcttt ctgtgccttt tgcgattctg ctttagtgcc
60
accagaagat actacctggg tgcagtggaa ctgtcatggg actatatgca aagtgatctc
120
ggtgagctgc ctgtggacgc aagatttcct cctagagtgc caaaatcttt tccattcaac
180
acctcagtcg tgtacaaaaa gactctgttt gtagaattca cggatcacct tttcaacatc
240
gctaagccaa ggccaccctg gatgggtctg ctaggtccta ccatccaggc tgaggtttat
300
gatacagtgg tcattacact taagaacatg gcttcccatc ctgtcagtct tcatgctgtt
360
ggtgtatcct actggaaagc ttctgaggga gctgaatatg atgatcagac cagtcaaagg
420
gagaaagaag atgataaagt cttccctggt ggaagccata catatgtctg gcaggtcctg
480
aaagagaatg gtccaatggc ctctgaccca ctgtgcctta cctactcata tctttctcat
540
gtggacctgg taaaagactt gaattcaggc ctcattggag ccctactagt atgtagagaa
600
gggagtctgg ccaaggaaaa gacacagacc ttgcacaaat ttatactact ttttgctgta
660
tttgatgaag ggaaaagttg gcactcagaa acaaagaact ccttgatgca ggatagggat
720
gctgcatctg ctcgggcctg gcctaaaatg cacacagtca atggttatgt aaacaggtct
780
ctgccaggtc tgattggatg ccacaggaaa tcagtctatt ggcatgtgat tggaatgggc
840
accactcctg aagtgcactc aatattcctc gaaggtcaca catttcttgt gaggaaccat
900
cgccaggcgt ccttggaaat ctcgccaata actttcctta ctgctcaaac actcttgatg
960
gaccttggac agtttctact gttttgtcat atctcttccc accaacatga tggcatggaa
1020
gcttatgtca aagtagacag ctgtccagag gaaccccaac tacgaatgaa aaataatgaa
1080
gaagcggaag actatgatga tgatcttact gattctgaaa tggatgtggt caggtttgat
1140
gatgacaact ctccttcctt tatccaaatt cgctcagttg ccaagaagca tcctaaaact
1200
tgggtacatt acattgctgc tgaagaggag gactgggact atgctccctt agtcctcgcc
1260
cccgatgaca gaagttataa aagtcaatat ttgaacaatg gccctcagcg gattggtagg
1320
aagtacaaaa aagtccgatt tatggcatac acagatgaaa cctttaagac tcgtgaagct
1380
attcagcatg aatcaggaat cttgggacct ttactttatg gggaagttgg agacacactg
1440
ttgattatat ttaagaatca agcaagcaga ccatataaca tctaccctca cggaatcact
1500
gatgtccgtc ctttgtattc aaggagatta ccaaaaggtg taaaacattt gaaggatttt
1560
ccaattctgc caggagaaat attcaaatat aaatggacag tgactgtaga agatgggcca
1620
actaaatcag atcctcggtg cctgacccgc tattactcta gtttcgttaa tatggagaga
1680
gatctagctt caggactcat tggccctctc ctcatctgct acaaagaatc tgtagatcaa
1740
agaggaaacc agataatgtc agacaagagg aatgtcatcc tgttttctgt atttgatgag
1800
aaccgaagct ggtacctcac agagaatata caacgctttc tccccaatcc agctggagtg
1860
cagcttgagg atccagagtt ccaagcctcc aacatcatgc acagcatcaa tggctatgtt
1920
tttgatagtt tgcagttgtc agtttgtttg catgaggtgg catactggta cattctaagc
1980
attggagcac agactgactt cctttctgtc ttcttctctg gatatacctt caaacacaaa
2040
atggtctatg aagacacact caccctattc ccattctcag gagaaactgt cttcatgtcg
2100
atggaaaacc caggtctatg gattctgggg tgccacaact cagactttcg gaacagaggc
2160
atgaccgcct tactgaaggt ttctagttgt gacaagaaca ctggtgatta ttacgaggac
2220
agttatgaag atatttcagc atacttgctg agtaaaaaca atgccattga accaagaagc
2280
ttctctcaaa acccaccagt cttgaaacgc catcaacggg aaataactcg tactactctt
2340
cagtcagatc aagaggaaat tgactatgat gataccatat cagttgaaat gaagaaggaa
2400
gattttgaca tttatgatga ggatgaaaat cagagccccc gcagctttca aaagaaaaca
2460
cgacactatt ttattgctgc agtggagagg ctctgggatt atgggatgag tagctcccca
2520
catgttctaa gaaacagggc tcagagtggc agtgtccctc agttcaagaa agttgttttc
2580
caggaattta ctgatggctc ctttactcag cccttatacc gtggagaact aaatgaacat
2640
ttgggactcc tggggccata tataagagca gaagttgaag ataatatcat ggtaactttc
2700
agaaatcagg cctctcgtcc ctattccttc tattctagcc ttatttctta tgaggaagat
2760
cagaggcaag gagcagaacc tagaaaaaac tttgtcaagc ctaatgaaac caaaacttac
2820
ttttggaaag tgcaacatca tatggcaccc actaaagatg agtttgactg caaagcctgg
2880
gcttatttct ctgatgttga cctggaaaaa gatgtgcact caggcctgat tggacccctt
2940
ctggtctgcc acactaacac actgaaccct gctcatggga gacaagtgac agtacaggaa
3000
tttgctctgt ttttcaccat ctttgatgag accaaaagct ggtacttcac tgaaaatatg
3060
gaaagaaact gcagggctcc ctgcaatatc cagatggaag atcccacttt taaagagaat
3120
tatcgcttcc atgcaatcaa tggctacata atggatacac tacctggctt agtaatggct
3180
caggatcaaa ggattcgatg gtatctgctc agcatgggca gcaatgaaaa catccattct
3240
attcatttca gtggacatgt gttcactgta cgaaaaaaag aggagtataa aatggcactg
3300
tacaatctct atccaggtgt ttttgagaca gtggaaatgt taccatccaa agctggaatt
3360
tggcgggtgg aatgccttat tggcgagcat ctacatgctg ggatgagcac actttttctg
3420
gtgtacagca ataagtgtca gactcccctg ggaatggctt ctggacacat tagagatttt
3480
cagattacag cttcaggaca atatggacag tgggccccaa agctggccag acttcattat
3540
tccggatcaa tcaatgcctg gagcaccaag gagccctttt cttggatcaa ggtggatctg
3600
ttggcaccaa tgattattca cggcatcaag acccagggtg cccgtcagaa gttctccagc
3660
ctctacatct ctcagtttat catcatgtat agtcttgatg ggaagaagtg gcagacttat
3720
cgaggaaatt ccactggaac cttaatggtc ttctttggca atgtggattc atctgggata
3780
aaacacaata tttttaaccc tccaattatt gctcgataca tccgtttgca cccaactcat
3840
tatagcattc gcagcactct tcgcatggag ttgatgggct gtgatttaaa tagttgcagc
3900
atgccattgg gaatggagag taaagcaata tcagatgcac agattactgc ttcatcctac
3960
tttaccaata tgtttgccac ctggtctcct tcaaaagctc gacttcacct ccaagggagg
4020
agtaatgcct ggagacctca ggtgaataat ccaaaagagt ggctgcaagt ggacttccag
4080
aagacaatga aagtcacagg agtaactact cagggagtaa aatctctgct taccagcatg
4140
tatgtgaagg agttcctcat ctccagcagt caagatggcc atcagtggac tctctttttt
4200
cagaatggca aagtaaaggt ttttcaggga aatcaagact ccttcacacc tgtggtgaac
4260
tctctagacc caccgttact gactcgctac cttcgaattc acccccagag ttgggtgcac
4320
cagattgccc tgaggatgga ggttctgggc tgcgaggcac aggacctcta c
4371
<210> 17
<211> 1438
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> BDD-FVIII (не оптимизированная; "родительская"),
аминокислотная последовательность
<400> 17
Ala Thr Arg Arg Tyr Tyr Leu Gly Ala Val Glu Leu Ser Trp Asp Tyr
1. 5 10 15
Met Gln Ser Asp Leu Gly Glu Leu Pro Val Asp Ala Arg Phe Pro Pro
20 25 30
Arg Val Pro Lys Ser Phe Pro Phe Asn Thr Ser Val Val Tyr Lys Lys
35 40 45
Thr Leu Phe Val Glu Phe Thr Asp His Leu Phe Asn Ile Ala Lys Pro
50 55 60
Arg Pro Pro Trp Met Gly Leu Leu Gly Pro Thr Ile Gln Ala Glu Val
65 70 75 80
Tyr Asp Thr Val Val Ile Thr Leu Lys Asn Met Ala Ser His Pro Val
85 90 95
Ser Leu His Ala Val Gly Val Ser Tyr Trp Lys Ala Ser Glu Gly Ala
100 105 110
Glu Tyr Asp Asp Gln Thr Ser Gln Arg Glu Lys Glu Asp Asp Lys Val
115 120 125
Phe Pro Gly Gly Ser His Thr Tyr Val Trp Gln Val Leu Lys Glu Asn
130 135 140
Gly Pro Met Ala Ser Asp Pro Leu Cys Leu Thr Tyr Ser Tyr Leu Ser
145 150 155 160
His Val Asp Leu Val Lys Asp Leu Asn Ser Gly Leu Ile Gly Ala Leu
165 170 175
Leu Val Cys Arg Glu Gly Ser Leu Ala Lys Glu Lys Thr Gln Thr Leu
180 185 190
His Lys Phe Ile Leu Leu Phe Ala Val Phe Asp Glu Gly Lys Ser Trp
195 200 205
His Ser Glu Thr Lys Asn Ser Leu Met Gln Asp Arg Asp Ala Ala Ser
210 215 220
Ala Arg Ala Trp Pro Lys Met His Thr Val Asn Gly Tyr Val Asn Arg
225 230 235 240
Ser Leu Pro Gly Leu Ile Gly Cys His Arg Lys Ser Val Tyr Trp His
245 250 255
Val Ile Gly Met Gly Thr Thr Pro Glu Val His Ser Ile Phe Leu Glu
260 265 270
Gly His Thr Phe Leu Val Arg Asn His Arg Gln Ala Ser Leu Glu Ile
275 280 285
Ser Pro Ile Thr Phe Leu Thr Ala Gln Thr Leu Leu Met Asp Leu Gly
290 295 300
Gln Phe Leu Leu Phe Cys His Ile Ser Ser His Gln His Asp Gly Met
305 310 315 320
Glu Ala Tyr Val Lys Val Asp Ser Cys Pro Glu Glu Pro Gln Leu Arg
325 330 335
Met Lys Asn Asn Glu Glu Ala Glu Asp Tyr Asp Asp Asp Leu Thr Asp
340 345 350
Ser Glu Met Asp Val Val Arg Phe Asp Asp Asp Asn Ser Pro Ser Phe
355 360 365
Ile Gln Ile Arg Ser Val Ala Lys Lys His Pro Lys Thr Trp Val His
370 375 380
Tyr Ile Ala Ala Glu Glu Glu Asp Trp Asp Tyr Ala Pro Leu Val Leu
385 390 395 400
Ala Pro Asp Asp Arg Ser Tyr Lys Ser Gln Tyr Leu Asn Asn Gly Pro
405 410 415
Gln Arg Ile Gly Arg Lys Tyr Lys Lys Val Arg Phe Met Ala Tyr Thr
420 425 430
Asp Glu Thr Phe Lys Thr Arg Glu Ala Ile Gln His Glu Ser Gly Ile
435 440 445
Leu Gly Pro Leu Leu Tyr Gly Glu Val Gly Asp Thr Leu Leu Ile Ile
450 455 460
Phe Lys Asn Gln Ala Ser Arg Pro Tyr Asn Ile Tyr Pro His Gly Ile
465 470 475 480
Thr Asp Val Arg Pro Leu Tyr Ser Arg Arg Leu Pro Lys Gly Val Lys
485 490 495
His Leu Lys Asp Phe Pro Ile Leu Pro Gly Glu Ile Phe Lys Tyr Lys
500 505 510
Trp Thr Val Thr Val Glu Asp Gly Pro Thr Lys Ser Asp Pro Arg Cys
515 520 525
Leu Thr Arg Tyr Tyr Ser Ser Phe Val Asn Met Glu Arg Asp Leu Ala
530 535 540
Ser Gly Leu Ile Gly Pro Leu Leu Ile Cys Tyr Lys Glu Ser Val Asp
545 550 555 560
Gln Arg Gly Asn Gln Ile Met Ser Asp Lys Arg Asn Val Ile Leu Phe
565 570 575
Ser Val Phe Asp Glu Asn Arg Ser Trp Tyr Leu Thr Glu Asn Ile Gln
580 585 590
Arg Phe Leu Pro Asn Pro Ala Gly Val Gln Leu Glu Asp Pro Glu Phe
595 600 605
Gln Ala Ser Asn Ile Met His Ser Ile Asn Gly Tyr Val Phe Asp Ser
610 615 620
Leu Gln Leu Ser Val Cys Leu His Glu Val Ala Tyr Trp Tyr Ile Leu
625 630 635 640
Ser Ile Gly Ala Gln Thr Asp Phe Leu Ser Val Phe Phe Ser Gly Tyr
645 650 655
Thr Phe Lys His Lys Met Val Tyr Glu Asp Thr Leu Thr Leu Phe Pro
660 665 670
Phe Ser Gly Glu Thr Val Phe Met Ser Met Glu Asn Pro Gly Leu Trp
675 680 685
Ile Leu Gly Cys His Asn Ser Asp Phe Arg Asn Arg Gly Met Thr Ala
690 695 700
Leu Leu Lys Val Ser Ser Cys Asp Lys Asn Thr Gly Asp Tyr Tyr Glu
705 710 715 720
Asp Ser Tyr Glu Asp Ile Ser Ala Tyr Leu Leu Ser Lys Asn Asn Ala
725 730 735
Ile Glu Pro Arg Ser Phe Ser Gln Asn Pro Pro Val Leu Lys Arg His
740 745 750
Gln Arg Glu Ile Thr Arg Thr Thr Leu Gln Ser Asp Gln Glu Glu Ile
755 760 765
Asp Tyr Asp Asp Thr Ile Ser Val Glu Met Lys Lys Glu Asp Phe Asp
770 775 780
Ile Tyr Asp Glu Asp Glu Asn Gln Ser Pro Arg Ser Phe Gln Lys Lys
785 790 795 800
Thr Arg His Tyr Phe Ile Ala Ala Val Glu Arg Leu Trp Asp Tyr Gly
805 810 815
Met Ser Ser Ser Pro His Val Leu Arg Asn Arg Ala Gln Ser Gly Ser
820 825 830
Val Pro Gln Phe Lys Lys Val Val Phe Gln Glu Phe Thr Asp Gly Ser
835 840 845
Phe Thr Gln Pro Leu Tyr Arg Gly Glu Leu Asn Glu His Leu Gly Leu
850 855 860
Leu Gly Pro Tyr Ile Arg Ala Glu Val Glu Asp Asn Ile Met Val Thr
865 870 875 880
Phe Arg Asn Gln Ala Ser Arg Pro Tyr Ser Phe Tyr Ser Ser Leu Ile
885 890 895
Ser Tyr Glu Glu Asp Gln Arg Gln Gly Ala Glu Pro Arg Lys Asn Phe
900 905 910
Val Lys Pro Asn Glu Thr Lys Thr Tyr Phe Trp Lys Val Gln His His
915 920 925
Met Ala Pro Thr Lys Asp Glu Phe Asp Cys Lys Ala Trp Ala Tyr Phe
930 935 940
Ser Asp Val Asp Leu Glu Lys Asp Val His Ser Gly Leu Ile Gly Pro
945 950 955 960
Leu Leu Val Cys His Thr Asn Thr Leu Asn Pro Ala His Gly Arg Gln
965 970 975
Val Thr Val Gln Glu Phe Ala Leu Phe Phe Thr Ile Phe Asp Glu Thr
980 985 990
Lys Ser Trp Tyr Phe Thr Glu Asn Met Glu Arg Asn Cys Arg Ala Pro
995 1000 1005
Cys Asn Ile Gln Met Glu Asp Pro Thr Phe Lys Glu Asn Tyr Arg
1010 1015 1020
Phe His Ala Ile Asn Gly Tyr Ile Met Asp Thr Leu Pro Gly Leu
1025 1030 1035
Val Met Ala Gln Asp Gln Arg Ile Arg Trp Tyr Leu Leu Ser Met
1040 1045 1050
Gly Ser Asn Glu Asn Ile His Ser Ile His Phe Ser Gly His Val
1055 1060 1065
Phe Thr Val Arg Lys Lys Glu Glu Tyr Lys Met Ala Leu Tyr Asn
1070 1075 1080
Leu Tyr Pro Gly Val Phe Glu Thr Val Glu Met Leu Pro Ser Lys
1085 1090 1095
Ala Gly Ile Trp Arg Val Glu Cys Leu Ile Gly Glu His Leu His
1100 1105 1110
Ala Gly Met Ser Thr Leu Phe Leu Val Tyr Ser Asn Lys Cys Gln
1115 1120 1125
Thr Pro Leu Gly Met Ala Ser Gly His Ile Arg Asp Phe Gln Ile
1130 1135 1140
Thr Ala Ser Gly Gln Tyr Gly Gln Trp Ala Pro Lys Leu Ala Arg
1145 1150 1155
Leu His Tyr Ser Gly Ser Ile Asn Ala Trp Ser Thr Lys Glu Pro
1160 1165 1170
Phe Ser Trp Ile Lys Val Asp Leu Leu Ala Pro Met Ile Ile His
1175 1180 1185
Gly Ile Lys Thr Gln Gly Ala Arg Gln Lys Phe Ser Ser Leu Tyr
1190 1195 1200
Ile Ser Gln Phe Ile Ile Met Tyr Ser Leu Asp Gly Lys Lys Trp
1205 1210 1215
Gln Thr Tyr Arg Gly Asn Ser Thr Gly Thr Leu Met Val Phe Phe
1220 1225 1230
Gly Asn Val Asp Ser Ser Gly Ile Lys His Asn Ile Phe Asn Pro
1235 1240 1245
Pro Ile Ile Ala Arg Tyr Ile Arg Leu His Pro Thr His Tyr Ser
1250 1255 1260
Ile Arg Ser Thr Leu Arg Met Glu Leu Met Gly Cys Asp Leu Asn
1265 1270 1275
Ser Cys Ser Met Pro Leu Gly Met Glu Ser Lys Ala Ile Ser Asp
1280 1285 1290
Ala Gln Ile Thr Ala Ser Ser Tyr Phe Thr Asn Met Phe Ala Thr
1295 1300 1305
Trp Ser Pro Ser Lys Ala Arg Leu His Leu Gln Gly Arg Ser Asn
1310 1315 1320
Ala Trp Arg Pro Gln Val Asn Asn Pro Lys Glu Trp Leu Gln Val
1325 1330 1335
Asp Phe Gln Lys Thr Met Lys Val Thr Gly Val Thr Thr Gln Gly
1340 1345 1350
Val Lys Ser Leu Leu Thr Ser Met Tyr Val Lys Glu Phe Leu Ile
1355 1360 1365
Ser Ser Ser Gln Asp Gly His Gln Trp Thr Leu Phe Phe Gln Asn
1370 1375 1380
Gly Lys Val Lys Val Phe Gln Gly Asn Gln Asp Ser Phe Thr Pro
1385 1390 1395
Val Val Asn Ser Leu Asp Pro Pro Leu Leu Thr Arg Tyr Leu Arg
1400 1405 1410
Ile His Pro Gln Ser Trp Val His Gln Ile Ala Leu Arg Met Glu
1415 1420 1425
Val Leu Gly Cys Glu Ala Gln Asp Leu Tyr
1430 1435
<210> 18
<211> 450
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Нуклеотидная последовательность XTEN
<400> 18
ggcgcgccaa catcagagag cgccacccct gaaagtggtc ccgggagcga gccagccaca
60
tctgggtcgg aaacgccagg cacaagtgag tctgcaactc ccgagtccgg acctggctcc
120
gagcctgcca ctagcggctc cgagactccg ggaacttccg agagcgctac accagaaagc
180
ggacccggaa ccagtaccga acctagcgag ggctctgctc cgggcagccc agccggctct
240
cctacatcca cggaggaggg cacttccgaa tccgccaccc cggagtcagg gccaggatct
300
gaacccgcta cctcaggcag tgagacgcca ggaacgagcg agtccgctac accggagagt
360
gggccaggga gccctgctgg atctcctacg tccactgagg aagggtcacc agcgggctcg
420
cccaccagca ctgaagaagg tgcctcgagc
450
<210> 19
<211> 4824
<212> ДНК
<213> Искусственная последовательность
<220>
<223> coFVIII-52-XTEN
<400> 19
atgcaaatcg aactgagcac ctgtttcttc ctctgcctgc tgagattctg tttctccgcg
60
acccgccgat actacctggg agcagtggag ctctcctggg attacatgca gagcgacctt
120
ggggagctgc ccgtggatgc caggttccct ccccgggtgc caaagtcgtt tccgttcaac
180
acctccgtgg tgtacaagaa aactctgttc gtggagttca ccgaccacct gttcaatatc
240
gccaagccca gacctccctg gatggggctg ttgggaccta ccatccaagc ggaggtgtac
300
gacactgtgg tcatcactct gaagaacatg gcctcgcatc ccgtgtccct gcacgccgtg
360
ggagtgtctt actggaaagc gtccgagggg gccgaatacg acgaccagac ctcgcagaga
420
gaaaaggaag atgacaaggt gttcccagga ggatcgcaca cctacgtgtg gcaagtgttg
480
aaggagaacg gcccaatggc ctccgacccg ctgtgcctga cctactcgta cctgtcccac
540
gtggacctcg tgaaggacct caactcggga ctgattggag ccctgctggt ctgcagggaa
600
ggctcactgg cgaaagaaaa gactcagacc ttgcacaagt tcattctgct gttcgctgtg
660
ttcgacgagg ggaagtcgtg gcacagcgag actaagaact ccctgatgca agatagagat
720
gccgcctccg cccgggcctg gcctaagatg cacaccgtga acggttacgt gaaccgctcc
780
ctccctggcc tgattggatg ccaccggaag tccgtgtact ggcacgtgat cgggatgggg
840
accacccccg aggtgcacag catcttcctg gaaggtcaca catttctcgt gcgcaaccac
900
cggcaggcct ccctggaaat cagccccatt accttcctca ctgcccagac tctgctgatg
960
gacctgggac agttcctgct gttctgccat atctcctccc accaacatga cggaatggag
1020
gcatacgtga aggtcgattc ctgccctgag gaaccccagc tccgcatgaa gaacaatgag
1080
gaagccgagg actacgacga cgacctgacg gatagcgaga tggatgtggt ccggttcgat
1140
gacgataaca gcccttcctt catccaaatt cgctcggtgg caaagaagca ccccaagacc
1200
tgggtgcatt acattgcggc ggaagaagag gactgggatt atgccccgct tgtcctcgct
1260
cctgacgacc ggagctacaa gagccagtac ctgaacaacg gtccacagag gatcggtaga
1320
aagtacaaga aggtccgctt catggcctat accgacgaaa ccttcaaaac tagagaggcc
1380
atccaacacg aatccggcat cctgggcccg ctcttgtacg gagaagtcgg cgacaccctt
1440
ctcattatct tcaagaacca ggcttcccgg ccgtacaaca tctatccgca tgggatcact
1500
gacgtgcgcc cactgtactc gcggcgcctg cccaagggtg tcaaacacct gaaggatttt
1560
ccgatccttc cgggagaaat cttcaagtac aagtggaccg tgaccgtgga agatggccca
1620
actaagtctg accctagatg cctcacccgc tactactcat ccttcgtcaa catggagcgc
1680
gacctggcca gcggactgat cggcccgctg ctgatttgct acaaggaatc agtggaccaa
1740
cggggaaacc agatcatgtc ggataagagg aacgtcatcc tcttctccgt gtttgacgaa
1800
aaccggtcgt ggtacctgac cgagaacatc cagaggttcc tgcccaaccc tgctggggtg
1860
cagctggagg accccgagtt ccaggccagc aacatcatgc acagcatcaa tggctacgtg
1920
ttcgacagcc tgcagctgag cgtgtgcctg cacgaggtgg cctactggta catcctgagc
1980
atcggcgccc agaccgactt cctgagcgtg ttcttctctg gctacacctt caagcacaag
2040
atggtgtatg aggacaccct gaccctgttc cccttcagcg gggagactgt cttcatgagc
2100
atggagaacc ctggcctgtg gatcctgggc tgccacaaca gcgacttcag gaacaggggc
2160
atgactgccc tgctgaaagt ctccagctgt gacaagaaca ccggggacta ctacgaggac
2220
agctacgagg acatcagcgc ctacctgctg agcaagaaca atgccatcga gcccaggagc
2280
ttctctcaga acggcgcgcc aacatcagag agcgccaccc ctgaaagtgg tcccgggagc
2340
gagccagcca catctgggtc ggaaacgcca ggcacaagtg agtctgcaac tcccgagtcc
2400
ggacctggct ccgagcctgc cactagcggc tccgagactc cgggaacttc cgagagcgct
2460
acaccagaaa gcggacccgg aaccagtacc gaacctagcg agggctctgc tccgggcagc
2520
ccagccggct ctcctacatc cacggaggag ggcacttccg aatccgccac cccggagtca
2580
gggccaggat ctgaacccgc tacctcaggc agtgagacgc caggaacgag cgagtccgct
2640
acaccggaga gtgggccagg gagccctgct ggatctccta cgtccactga ggaagggtca
2700
ccagcgggct cgcccaccag cactgaagaa ggtgcctcga gccccccagt gctgaagagg
2760
caccagaggg agatcaccag gaccaccctg cagtctgacc aggaggagat cgactatgat
2820
gacaccatca gcgtggagat gaagaaggag gacttcgaca tctacgacga ggacgagaac
2880
cagagcccca ggagcttcca gaagaagacc aggcactact tcattgctgc tgtggagagg
2940
ctgtgggact atggcatgtc cagcagcccc catgtgctga ggaacagggc ccagtctggc
3000
agcgtgcccc agttcaagaa agtcgtgttc caggagttca ccgacggcag cttcacccag
3060
cccctgtaca gaggggagct gaacgagcac ctgggcctgc tgggccccta catcagggcc
3120
gaggtggagg acaacatcat ggtgaccttc aggaaccagg ccagcaggcc ctacagcttc
3180
tacagcagcc tgatcagcta cgaggaggac cagaggcagg gggctgagcc caggaagaac
3240
tttgtgaagc ccaatgaaac caagacctac ttctggaagg tgcagcacca catggccccc
3300
accaaggacg agttcgactg caaggcctgg gcctacttct ctgacgtgga cctggagaag
3360
gacgtgcact ctggcctgat tggccccctg ctggtgtgcc acaccaacac cctgaaccct
3420
gcccatggca ggcaggtgac tgtgcaggag ttcgccctgt tcttcaccat cttcgatgaa
3480
accaagagct ggtacttcac tgagaacatg gagaggaact gcagggcccc ctgcaacatc
3540
cagatggagg accccacctt caaggagaac tacaggttcc atgccatcaa tggctacatc
3600
atggacaccc tgcctggcct ggtcatggcc caggaccaga ggatcaggtg gtatctgctg
3660
agcatgggca gcaacgagaa catccacagc atccacttct ctggccacgt gttcactgtg
3720
aggaagaagg aggagtacaa gatggccctg tacaacctgt accctggggt gttcgaaacc
3780
gtggagatgc tgcccagcaa ggccggcatc tggagggtgg agtgcctgat tggggagcac
3840
ctgcacgccg gcatgagcac cctgttcctg gtgtacagca acaagtgcca gacccccctg
3900
ggcatggcct ctggccacat cagggacttc cagatcactg cctctggcca gtacggccag
3960
tgggccccca agctggccag gctgcactac tccggaagca tcaatgcctg gagcaccaag
4020
gagcccttca gctggatcaa agtggacctg ctggccccca tgatcatcca cggcatcaag
4080
acccaggggg ccaggcagaa gttctccagc ctgtacatca gccagttcat catcatgtac
4140
agcctggacg gcaagaagtg gcagacctac aggggcaaca gcaccggcac cctgatggtg
4200
ttcttcggca acgtggacag cagcggcatc aagcacaaca tcttcaaccc ccccatcatc
4260
gccagataca tcaggctgca ccccacccac tacagcatca ggagcaccct gaggatggag
4320
ctgatgggct gtgacctgaa cagctgcagc atgcccctgg gcatggagag caaggccatc
4380
tctgacgccc agatcactgc ctccagctac ttcaccaaca tgtttgccac ctggagcccc
4440
agcaaggcca ggctgcacct gcagggcagg agcaatgcct ggaggcccca ggtcaacaac
4500
cccaaggagt ggctgcaggt ggacttccag aagaccatga aggtgactgg ggtgaccacc
4560
cagggggtga agagcctgct gaccagcatg tacgtgaagg agttcctgat ctccagcagc
4620
caggacggcc accagtggac cctgttcttc cagaatggca aggtgaaggt gttccagggc
4680
aaccaggaca gcttcacccc tgtggtcaac agcctggacc cccccctgct gaccagatac
4740
ctgaggatcc acccccagag ctgggtgcac cagatcgccc tgaggatgga ggtgctgggc
4800
tgtgaggccc aggacctgta ctga
4824
<210> 20
<211> 4824
<212> ДНК
<213> Искусственная последовательность
<220>
<223> coFVIII-1-XTEN
<400> 20
atgcagattg agctgtctac ttgctttttc ctgtgcctgc tgaggttttg cttttccgct
60
acacgaaggt attatctggg ggctgtggaa ctgtcttggg attacatgca gagtgacctg
120
ggagagctgc cagtggacgc aaggtttccc cctagagtcc ctaagtcatt ccccttcaac
180
actagcgtgg tctacaagaa aacactgttc gtggagttta ctgatcacct gttcaacatc
240
gcaaagccta ggccaccctg gatgggactg ctggggccaa caatccaggc cgaggtgtac
300
gacaccgtgg tcattacact taagaacatg gcctcacacc ccgtgagcct gcatgctgtg
360
ggcgtcagct actggaaggc ttccgaagga gcagagtatg acgatcagac ttcccagaga
420
gaaaaagagg acgataaggt gtttcctggc ggatctcata cctacgtgtg gcaggtcctg
480
aaagagaatg gccctatggc ctccgaccct ctgtgcctga cctactctta tctgagtcac
540
gtggacctgg tcaaggatct gaacagcggc ctgatcggag ccctgctggt gtgcagggaa
600
ggaagcctgg ctaaggagaa aacccagaca ctgcataagt tcattctgct gttcgccgtg
660
tttgacgaag ggaaatcatg gcacagcgag acaaagaata gtctgatgca ggacagggat
720
gccgcttcag ccagagcttg gcccaaaatg cacactgtga acggctacgt caatcgctca
780
ctgcctgggc tgatcggctg ccaccgaaag agcgtgtatt ggcatgtcat cgggatgggc
840
accacacctg aagtgcactc cattttcctg gagggacata cctttctggt ccgcaaccac
900
cgacaggctt ccctggagat ctctccaatt accttcctga cagcacagac tctgctgatg
960
gacctggggc agttcctgct gttttgccac atcagctccc accagcatga tggcatggag
1020
gcttacgtga aagtggactc ttgtcccgag gaacctcagc tgcggatgaa gaacaatgag
1080
gaagcagaag actatgacga tgacctgacc gactccgaga tggatgtggt ccgattcgat
1140
gacgataaca gcccctcctt tatccagatt agatctgtgg ccaagaaaca ccctaagaca
1200
tgggtccatt acatcgcagc cgaggaagag gactgggatt atgcaccact ggtgctggca
1260
ccagacgatc gctcctacaa atctcagtat ctgaacaatg ggccacagag gattggcaga
1320
aagtacaaga aagtgcggtt catggcatat accgatgaga ccttcaagac tcgcgaagcc
1380
atccagcacg agagcggcat cctgggacca ctgctgtacg gagaagtggg agacaccctg
1440
ctgatcattt tcaagaacca ggccagccgg ccttacaata tctatccaca tgggattaca
1500
gatgtgcgcc ctctgtacag caggagactg ccaaagggcg tcaaacacct gaaggacttc
1560
ccaatcctgc ccggagaaat cttcaagtac aagtggactg tcaccgtcga ggatggcccc
1620
actaagagcg accctcggtg cctgacccgc tactattcta gtttcgtgaa tatggaaaga
1680
gatctggcaa gcggactgat cggaccactg ctgatttgtt acaaagagag cgtggatcag
1740
agaggcaacc agatcatgtc cgacaagcgg aatgtgattc tgttcagtgt ctttgacgaa
1800
aacaggtcat ggtacctgac cgagaacatc cagagattcc tgcctaatcc agctggggtg
1860
cagctggaag atcctgagtt tcaggcatct aacatcatgc atagtattaa tggctacgtg
1920
ttcgacagtt tgcagctgag cgtgtgcctg cacgaggtcg cttactggta tatcctgagc
1980
attggggcac agacagattt cctgagcgtg ttcttttccg gctacacttt taagcataaa
2040
atggtctatg aggacacact gactctgttc cccttcagcg gcgaaaccgt gtttatgagc
2100
atggagaatc ccggactgtg gattctgggg tgccacaaca gcgatttcag aaatcgcgga
2160
atgactgccc tgctgaaagt gtcaagctgt gacaagaaca ccggggacta ctatgaagat
2220
tcatacgagg acatcagcgc atatctgctg tccaaaaaca atgccattga accccggtct
2280
tttagtcaga atggcgcgcc aacatcagag agcgccaccc ctgaaagtgg tcccgggagc
2340
gagccagcca catctgggtc ggaaacgcca ggcacaagtg agtctgcaac tcccgagtcc
2400
ggacctggct ccgagcctgc cactagcggc tccgagactc cgggaacttc cgagagcgct
2460
acaccagaaa gcggacccgg aaccagtacc gaacctagcg agggctctgc tccgggcagc
2520
ccagccggct ctcctacatc cacggaggag ggcacttccg aatccgccac cccggagtca
2580
gggccaggat ctgaacccgc tacctcaggc agtgagacgc caggaacgag cgagtccgct
2640
acaccggaga gtgggccagg gagccctgct ggatctccta cgtccactga ggaagggtca
2700
ccagcgggct cgcccaccag cactgaagaa ggtgcctcga gccctccagt gctgaagcgg
2760
caccagcgcg agatcacccg cactaccctg cagagtgatc aggaagagat cgactacgac
2820
gatacaattt ctgtggaaat gaagaaagag gacttcgata tctatgacga agatgagaac
2880
cagagtcctc gatcattcca gaagaaaacc aggcattact ttattgccgc agtggagcgg
2940
ctgtgggatt atggcatgtc ctctagtcct cacgtgctgc gaaatagggc ccagtcagga
3000
agcgtcccac agttcaagaa agtggtcttc caggagttta cagacgggtc ctttactcag
3060
ccactgtaca ggggcgaact gaacgagcac ctgggactgc tggggcccta tatcagagca
3120
gaagtggagg ataacattat ggtcaccttc agaaatcagg cctctcggcc ttacagtttt
3180
tattcaagcc tgatctctta cgaagaggac cagcgacagg gagctgaacc acgaaaaaac
3240
ttcgtgaagc ctaatgagac caaaacatac ttttggaagg tgcagcacca tatggcccca
3300
acaaaagacg agttcgattg caaggcatgg gcctattttt ctgacgtgga tctggagaag
3360
gacgtgcaca gtggcctgat tggcccactg ctggtgtgcc atactaacac cctgaatcca
3420
gcccacggcc ggcaggtcac tgtccaggag ttcgctctgt tctttaccat ctttgatgag
3480
acaaagagct ggtacttcac cgaaaacatg gagcgaaatt gcagggctcc atgtaacatt
3540
cagatggaag accccacatt caaggagaac taccgctttc atgctatcaa tggatacatc
3600
atggatactc tgcccgggct ggtcatggca caggaccaga gaatccggtg gtatctgctg
3660
agcatgggca gcaacgagaa tatccactca attcatttca gcgggcacgt gtttactgtc
3720
aggaagaaag aagagtacaa gatggccctg tacaacctgt atcccggcgt gttcgaaacc
3780
gtcgagatgc tgcctagcaa ggccggaatc tggagagtgg aatgcctgat tggagagcac
3840
ctgcatgctg ggatgtctac cctgtttctg gtgtacagta ataagtgtca gacacccctg
3900
ggaatggcat ccgggcatat cagggatttc cagattaccg catctggaca gtacggacag
3960
tgggcaccta agctggctag actgcactat tccggatcta tcaacgcttg gtccacaaaa
4020
gagcctttct cttggattaa ggtggacctg ctggccccaa tgatcattca tggcatcaaa
4080
actcagggag ctcggcagaa gttctcctct ctgtacatct cacagtttat catcatgtac
4140
agcctggatg ggaagaaatg gcagacatac cgcggcaata gcacaggaac tctgatggtg
4200
ttctttggca acgtggacag cagcggaatc aagcacaaca ttttcaatcc ccctatcatt
4260
gctagataca tccggctgca cccaacccat tattctattc gaagtacact gaggatggaa
4320
ctgatgggat gcgatctgaa cagttgttca atgcccctgg ggatggagtc caaggcaatc
4380
tctgacgccc agattaccgc cagctcctac ttcactaata tgtttgctac ctggagccct
4440
tccaaagcaa gactgcacct gcaaggccgc agcaacgcat ggcgaccaca ggtgaacaat
4500
cccaaggagt ggttgcaggt cgattttcag aaaactatga aggtgaccgg ggtcacaact
4560
cagggcgtga aaagtctgct gacctcaatg tacgtcaagg agttcctgat ctctagttca
4620
caggacggac atcagtggac actgttcttt cagaacggga aggtgaaagt cttccagggc
4680
aatcaggatt cctttacacc tgtggtcaac agtctagacc ctccactgct gaccagatac
4740
ctgagaatcc accctcagtc ctgggtgcac cagattgccc tgagaatgga agtgctggga
4800
tgcgaggccc aggatctgta ctga
4824
<210> 21
<211> 6
<212> ДНК
<213> Искусственная последовательность
<220>
<223> MAR/ARS
<400> 21
atattt
6
<210> 22
<211> 6
<212> ДНК
<213> Искусственная последовательность
<220>
<223> MAR/ARS
<400> 22
aaatat
6
<210> 23
<211> 5
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Дестабилизирующий элемент
<400> 23
attta
5
<210> 24
<211> 5
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Дестабилизирующий элемент
<400> 24
taaat
5
<210> 25
<211> 6
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Сайт poly-T
<400> 25
tttttt
6
<210> 26
<211> 7
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Сайт poly-A
<400> 26
aaaaaaa
7
<210> 27
<211> 6
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Сайт сплайсинга
<400> 27
ggtgat
6
<210> 28
<211> 5
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TATA-бокс
<400> 28
tataa
5
<210> 29
<211> 5
<212> ДНК
<213> Искусственная последовательность
<220>
<223> TATA-бокс
<400> 29
ttata
5
<210> 30
<211> 8
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность богатых AU элементов
<400> 30
attttatt
8
<210> 31
<211> 8
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Последовательность богатых AU элементов
<400> 31
atttttaa
8
<210> 32
<211> 13
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Консенсусная последовательность Козак
<400> 32
gccgccacca tgc
13
<210> 33
<211> 32
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептид CTP
<400> 33
Asp Pro Arg Phe Gln Asp Ser Ser Ser Ser Lys Ala Pro Pro Pro Ser
1. 5 10 15
Leu Pro Ser Pro Ser Arg Leu Pro Gly Pro Ser Asp Thr Pro Ile Leu
20 25 30
<210> 34
<211> 28
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Пептид CTP
<400> 34
Ser Ser Ser Ser Lys Ala Pro Pro Pro Ser Leu Pro Ser Pro Ser Arg
1. 5 10 15
Leu Pro Gly Pro Ser Asp Thr Pro Ile Leu Pro Gln
20 25
<210> 35
<211> 11
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Коровая последовательность альбумин-связывающего пептида
<400> 35
Asp Ile Cys Leu Pro Arg Trp Gly Cys Leu Trp
1. 5 10
<210> 36
<211> 20
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательность PAS
<400> 36
Ala Ser Pro Ala Ala Pro Ala Pro Ala Ser Pro Ala Ala Pro Ala Pro
1. 5 10 15
Ser Ala Pro Ala
20
<210> 37
<211> 20
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательность PAS
<400> 37
Ala Ala Pro Ala Ser Pro Ala Pro Ala Ala Pro Ser Ala Pro Ala Pro
1. 5 10 15
Ala Ala Pro Ser
20
<210> 38
<211> 20
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательность PAS
<400> 38
Ala Pro Ser Ser Pro Ser Pro Ser Ala Pro Ser Ser Pro Ser Pro Ala
1. 5 10 15
Ser Pro Ser Ser
20
<210> 39
<211> 19
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательность PAS
<400> 39
Ala Pro Ser Ser Pro Ser Pro Ser Ala Pro Ser Ser Pro Ser Pro Ala
1. 5 10 15
Ser Pro Ser
<210> 40
<211> 20
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательность PAS
<400> 40
Ser Ser Pro Ser Ala Pro Ser Pro Ser Ser Pro Ala Ser Pro Ser Pro
1. 5 10 15
Ser Ser Pro Ala
20
<210> 41
<211> 24
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательность PAS
<400> 41
Ala Ala Ser Pro Ala Ala Pro Ser Ala Pro Pro Ala Ala Ala Ser Pro
1. 5 10 15
Ala Ala Pro Ser Ala Pro Pro Ala
20
<210> 42
<211> 20
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательность PAS
<400> 42
Ala Ser Ala Ala Ala Pro Ala Ala Ala Ser Ala Ala Ala Ser Ala Pro
1. 5 10 15
Ser Ala Ala Ala
20
<210> 43
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> мишень miR142
<400> 43
tccataaagt aggaaacact aca
23
<210> 44
<211> 2332
<212> БЕЛОК
<213> Homo sapiens
<400> 44
Ala Thr Arg Arg Tyr Tyr Leu Gly Ala Val Glu Leu Ser Trp Asp Tyr
1. 5 10 15
Met Gln Ser Asp Leu Gly Glu Leu Pro Val Asp Ala Arg Phe Pro Pro
20 25 30
Arg Val Pro Lys Ser Phe Pro Phe Asn Thr Ser Val Val Tyr Lys Lys
35 40 45
Thr Leu Phe Val Glu Phe Thr Asp His Leu Phe Asn Ile Ala Lys Pro
50 55 60
Arg Pro Pro Trp Met Gly Leu Leu Gly Pro Thr Ile Gln Ala Glu Val
65 70 75 80
Tyr Asp Thr Val Val Ile Thr Leu Lys Asn Met Ala Ser His Pro Val
85 90 95
Ser Leu His Ala Val Gly Val Ser Tyr Trp Lys Ala Ser Glu Gly Ala
100 105 110
Glu Tyr Asp Asp Gln Thr Ser Gln Arg Glu Lys Glu Asp Asp Lys Val
115 120 125
Phe Pro Gly Gly Ser His Thr Tyr Val Trp Gln Val Leu Lys Glu Asn
130 135 140
Gly Pro Met Ala Ser Asp Pro Leu Cys Leu Thr Tyr Ser Tyr Leu Ser
145 150 155 160
His Val Asp Leu Val Lys Asp Leu Asn Ser Gly Leu Ile Gly Ala Leu
165 170 175
Leu Val Cys Arg Glu Gly Ser Leu Ala Lys Glu Lys Thr Gln Thr Leu
180 185 190
His Lys Phe Ile Leu Leu Phe Ala Val Phe Asp Glu Gly Lys Ser Trp
195 200 205
His Ser Glu Thr Lys Asn Ser Leu Met Gln Asp Arg Asp Ala Ala Ser
210 215 220
Ala Arg Ala Trp Pro Lys Met His Thr Val Asn Gly Tyr Val Asn Arg
225 230 235 240
Ser Leu Pro Gly Leu Ile Gly Cys His Arg Lys Ser Val Tyr Trp His
245 250 255
Val Ile Gly Met Gly Thr Thr Pro Glu Val His Ser Ile Phe Leu Glu
260 265 270
Gly His Thr Phe Leu Val Arg Asn His Arg Gln Ala Ser Leu Glu Ile
275 280 285
Ser Pro Ile Thr Phe Leu Thr Ala Gln Thr Leu Leu Met Asp Leu Gly
290 295 300
Gln Phe Leu Leu Phe Cys His Ile Ser Ser His Gln His Asp Gly Met
305 310 315 320
Glu Ala Tyr Val Lys Val Asp Ser Cys Pro Glu Glu Pro Gln Leu Arg
325 330 335
Met Lys Asn Asn Glu Glu Ala Glu Asp Tyr Asp Asp Asp Leu Thr Asp
340 345 350
Ser Glu Met Asp Val Val Arg Phe Asp Asp Asp Asn Ser Pro Ser Phe
355 360 365
Ile Gln Ile Arg Ser Val Ala Lys Lys His Pro Lys Thr Trp Val His
370 375 380
Tyr Ile Ala Ala Glu Glu Glu Asp Trp Asp Tyr Ala Pro Leu Val Leu
385 390 395 400
Ala Pro Asp Asp Arg Ser Tyr Lys Ser Gln Tyr Leu Asn Asn Gly Pro
405 410 415
Gln Arg Ile Gly Arg Lys Tyr Lys Lys Val Arg Phe Met Ala Tyr Thr
420 425 430
Asp Glu Thr Phe Lys Thr Arg Glu Ala Ile Gln His Glu Ser Gly Ile
435 440 445
Leu Gly Pro Leu Leu Tyr Gly Glu Val Gly Asp Thr Leu Leu Ile Ile
450 455 460
Phe Lys Asn Gln Ala Ser Arg Pro Tyr Asn Ile Tyr Pro His Gly Ile
465 470 475 480
Thr Asp Val Arg Pro Leu Tyr Ser Arg Arg Leu Pro Lys Gly Val Lys
485 490 495
His Leu Lys Asp Phe Pro Ile Leu Pro Gly Glu Ile Phe Lys Tyr Lys
500 505 510
Trp Thr Val Thr Val Glu Asp Gly Pro Thr Lys Ser Asp Pro Arg Cys
515 520 525
Leu Thr Arg Tyr Tyr Ser Ser Phe Val Asn Met Glu Arg Asp Leu Ala
530 535 540
Ser Gly Leu Ile Gly Pro Leu Leu Ile Cys Tyr Lys Glu Ser Val Asp
545 550 555 560
Gln Arg Gly Asn Gln Ile Met Ser Asp Lys Arg Asn Val Ile Leu Phe
565 570 575
Ser Val Phe Asp Glu Asn Arg Ser Trp Tyr Leu Thr Glu Asn Ile Gln
580 585 590
Arg Phe Leu Pro Asn Pro Ala Gly Val Gln Leu Glu Asp Pro Glu Phe
595 600 605
Gln Ala Ser Asn Ile Met His Ser Ile Asn Gly Tyr Val Phe Asp Ser
610 615 620
Leu Gln Leu Ser Val Cys Leu His Glu Val Ala Tyr Trp Tyr Ile Leu
625 630 635 640
Ser Ile Gly Ala Gln Thr Asp Phe Leu Ser Val Phe Phe Ser Gly Tyr
645 650 655
Thr Phe Lys His Lys Met Val Tyr Glu Asp Thr Leu Thr Leu Phe Pro
660 665 670
Phe Ser Gly Glu Thr Val Phe Met Ser Met Glu Asn Pro Gly Leu Trp
675 680 685
Ile Leu Gly Cys His Asn Ser Asp Phe Arg Asn Arg Gly Met Thr Ala
690 695 700
Leu Leu Lys Val Ser Ser Cys Asp Lys Asn Thr Gly Asp Tyr Tyr Glu
705 710 715 720
Asp Ser Tyr Glu Asp Ile Ser Ala Tyr Leu Leu Ser Lys Asn Asn Ala
725 730 735
Ile Glu Pro Arg Ser Phe Ser Gln Asn Ser Arg His Pro Ser Thr Arg
740 745 750
Gln Lys Gln Phe Asn Ala Thr Thr Ile Pro Glu Asn Asp Ile Glu Lys
755 760 765
Thr Asp Pro Trp Phe Ala His Arg Thr Pro Met Pro Lys Ile Gln Asn
770 775 780
Val Ser Ser Ser Asp Leu Leu Met Leu Leu Arg Gln Ser Pro Thr Pro
785 790 795 800
His Gly Leu Ser Leu Ser Asp Leu Gln Glu Ala Lys Tyr Glu Thr Phe
805 810 815
Ser Asp Asp Pro Ser Pro Gly Ala Ile Asp Ser Asn Asn Ser Leu Ser
820 825 830
Glu Met Thr His Phe Arg Pro Gln Leu His His Ser Gly Asp Met Val
835 840 845
Phe Thr Pro Glu Ser Gly Leu Gln Leu Arg Leu Asn Glu Lys Leu Gly
850 855 860
Thr Thr Ala Ala Thr Glu Leu Lys Lys Leu Asp Phe Lys Val Ser Ser
865 870 875 880
Thr Ser Asn Asn Leu Ile Ser Thr Ile Pro Ser Asp Asn Leu Ala Ala
885 890 895
Gly Thr Asp Asn Thr Ser Ser Leu Gly Pro Pro Ser Met Pro Val His
900 905 910
Tyr Asp Ser Gln Leu Asp Thr Thr Leu Phe Gly Lys Lys Ser Ser Pro
915 920 925
Leu Thr Glu Ser Gly Gly Pro Leu Ser Leu Ser Glu Glu Asn Asn Asp
930 935 940
Ser Lys Leu Leu Glu Ser Gly Leu Met Asn Ser Gln Glu Ser Ser Trp
945 950 955 960
Gly Lys Asn Val Ser Ser Thr Glu Ser Gly Arg Leu Phe Lys Gly Lys
965 970 975
Arg Ala His Gly Pro Ala Leu Leu Thr Lys Asp Asn Ala Leu Phe Lys
980 985 990
Val Ser Ile Ser Leu Leu Lys Thr Asn Lys Thr Ser Asn Asn Ser Ala
995 1000 1005
Thr Asn Arg Lys Thr His Ile Asp Gly Pro Ser Leu Leu Ile Glu
1010 1015 1020
Asn Ser Pro Ser Val Trp Gln Asn Ile Leu Glu Ser Asp Thr Glu
1025 1030 1035
Phe Lys Lys Val Thr Pro Leu Ile His Asp Arg Met Leu Met Asp
1040 1045 1050
Lys Asn Ala Thr Ala Leu Arg Leu Asn His Met Ser Asn Lys Thr
1055 1060 1065
Thr Ser Ser Lys Asn Met Glu Met Val Gln Gln Lys Lys Glu Gly
1070 1075 1080
Pro Ile Pro Pro Asp Ala Gln Asn Pro Asp Met Ser Phe Phe Lys
1085 1090 1095
Met Leu Phe Leu Pro Glu Ser Ala Arg Trp Ile Gln Arg Thr His
1100 1105 1110
Gly Lys Asn Ser Leu Asn Ser Gly Gln Gly Pro Ser Pro Lys Gln
1115 1120 1125
Leu Val Ser Leu Gly Pro Glu Lys Ser Val Glu Gly Gln Asn Phe
1130 1135 1140
Leu Ser Glu Lys Asn Lys Val Val Val Gly Lys Gly Glu Phe Thr
1145 1150 1155
Lys Asp Val Gly Leu Lys Glu Met Val Phe Pro Ser Ser Arg Asn
1160 1165 1170
Leu Phe Leu Thr Asn Leu Asp Asn Leu His Glu Asn Asn Thr His
1175 1180 1185
Asn Gln Glu Lys Lys Ile Gln Glu Glu Ile Glu Lys Lys Glu Thr
1190 1195 1200
Leu Ile Gln Glu Asn Val Val Leu Pro Gln Ile His Thr Val Thr
1205 1210 1215
Gly Thr Lys Asn Phe Met Lys Asn Leu Phe Leu Leu Ser Thr Arg
1220 1225 1230
Gln Asn Val Glu Gly Ser Tyr Asp Gly Ala Tyr Ala Pro Val Leu
1235 1240 1245
Gln Asp Phe Arg Ser Leu Asn Asp Ser Thr Asn Arg Thr Lys Lys
1250 1255 1260
His Thr Ala His Phe Ser Lys Lys Gly Glu Glu Glu Asn Leu Glu
1265 1270 1275
Gly Leu Gly Asn Gln Thr Lys Gln Ile Val Glu Lys Tyr Ala Cys
1280 1285 1290
Thr Thr Arg Ile Ser Pro Asn Thr Ser Gln Gln Asn Phe Val Thr
1295 1300 1305
Gln Arg Ser Lys Arg Ala Leu Lys Gln Phe Arg Leu Pro Leu Glu
1310 1315 1320
Glu Thr Glu Leu Glu Lys Arg Ile Ile Val Asp Asp Thr Ser Thr
1325 1330 1335
Gln Trp Ser Lys Asn Met Lys His Leu Thr Pro Ser Thr Leu Thr
1340 1345 1350
Gln Ile Asp Tyr Asn Glu Lys Glu Lys Gly Ala Ile Thr Gln Ser
1355 1360 1365
Pro Leu Ser Asp Cys Leu Thr Arg Ser His Ser Ile Pro Gln Ala
1370 1375 1380
Asn Arg Ser Pro Leu Pro Ile Ala Lys Val Ser Ser Phe Pro Ser
1385 1390 1395
Ile Arg Pro Ile Tyr Leu Thr Arg Val Leu Phe Gln Asp Asn Ser
1400 1405 1410
Ser His Leu Pro Ala Ala Ser Tyr Arg Lys Lys Asp Ser Gly Val
1415 1420 1425
Gln Glu Ser Ser His Phe Leu Gln Gly Ala Lys Lys Asn Asn Leu
1430 1435 1440
Ser Leu Ala Ile Leu Thr Leu Glu Met Thr Gly Asp Gln Arg Glu
1445 1450 1455
Val Gly Ser Leu Gly Thr Ser Ala Thr Asn Ser Val Thr Tyr Lys
1460 1465 1470
Lys Val Glu Asn Thr Val Leu Pro Lys Pro Asp Leu Pro Lys Thr
1475 1480 1485
Ser Gly Lys Val Glu Leu Leu Pro Lys Val His Ile Tyr Gln Lys
1490 1495 1500
Asp Leu Phe Pro Thr Glu Thr Ser Asn Gly Ser Pro Gly His Leu
1505 1510 1515
Asp Leu Val Glu Gly Ser Leu Leu Gln Gly Thr Glu Gly Ala Ile
1520 1525 1530
Lys Trp Asn Glu Ala Asn Arg Pro Gly Lys Val Pro Phe Leu Arg
1535 1540 1545
Val Ala Thr Glu Ser Ser Ala Lys Thr Pro Ser Lys Leu Leu Asp
1550 1555 1560
Pro Leu Ala Trp Asp Asn His Tyr Gly Thr Gln Ile Pro Lys Glu
1565 1570 1575
Glu Trp Lys Ser Gln Glu Lys Ser Pro Glu Lys Thr Ala Phe Lys
1580 1585 1590
Lys Lys Asp Thr Ile Leu Ser Leu Asn Ala Cys Glu Ser Asn His
1595 1600 1605
Ala Ile Ala Ala Ile Asn Glu Gly Gln Asn Lys Pro Glu Ile Glu
1610 1615 1620
Val Thr Trp Ala Lys Gln Gly Arg Thr Glu Arg Leu Cys Ser Gln
1625 1630 1635
Asn Pro Pro Val Leu Lys Arg His Gln Arg Glu Ile Thr Arg Thr
1640 1645 1650
Thr Leu Gln Ser Asp Gln Glu Glu Ile Asp Tyr Asp Asp Thr Ile
1655 1660 1665
Ser Val Glu Met Lys Lys Glu Asp Phe Asp Ile Tyr Asp Glu Asp
1670 1675 1680
Glu Asn Gln Ser Pro Arg Ser Phe Gln Lys Lys Thr Arg His Tyr
1685 1690 1695
Phe Ile Ala Ala Val Glu Arg Leu Trp Asp Tyr Gly Met Ser Ser
1700 1705 1710
Ser Pro His Val Leu Arg Asn Arg Ala Gln Ser Gly Ser Val Pro
1715 1720 1725
Gln Phe Lys Lys Val Val Phe Gln Glu Phe Thr Asp Gly Ser Phe
1730 1735 1740
Thr Gln Pro Leu Tyr Arg Gly Glu Leu Asn Glu His Leu Gly Leu
1745 1750 1755
Leu Gly Pro Tyr Ile Arg Ala Glu Val Glu Asp Asn Ile Met Val
1760 1765 1770
Thr Phe Arg Asn Gln Ala Ser Arg Pro Tyr Ser Phe Tyr Ser Ser
1775 1780 1785
Leu Ile Ser Tyr Glu Glu Asp Gln Arg Gln Gly Ala Glu Pro Arg
1790 1795 1800
Lys Asn Phe Val Lys Pro Asn Glu Thr Lys Thr Tyr Phe Trp Lys
1805 1810 1815
Val Gln His His Met Ala Pro Thr Lys Asp Glu Phe Asp Cys Lys
1820 1825 1830
Ala Trp Ala Tyr Phe Ser Asp Val Asp Leu Glu Lys Asp Val His
1835 1840 1845
Ser Gly Leu Ile Gly Pro Leu Leu Val Cys His Thr Asn Thr Leu
1850 1855 1860
Asn Pro Ala His Gly Arg Gln Val Thr Val Gln Glu Phe Ala Leu
1865 1870 1875
Phe Phe Thr Ile Phe Asp Glu Thr Lys Ser Trp Tyr Phe Thr Glu
1880 1885 1890
Asn Met Glu Arg Asn Cys Arg Ala Pro Cys Asn Ile Gln Met Glu
1895 1900 1905
Asp Pro Thr Phe Lys Glu Asn Tyr Arg Phe His Ala Ile Asn Gly
1910 1915 1920
Tyr Ile Met Asp Thr Leu Pro Gly Leu Val Met Ala Gln Asp Gln
1925 1930 1935
Arg Ile Arg Trp Tyr Leu Leu Ser Met Gly Ser Asn Glu Asn Ile
1940 1945 1950
His Ser Ile His Phe Ser Gly His Val Phe Thr Val Arg Lys Lys
1955 1960 1965
Glu Glu Tyr Lys Met Ala Leu Tyr Asn Leu Tyr Pro Gly Val Phe
1970 1975 1980
Glu Thr Val Glu Met Leu Pro Ser Lys Ala Gly Ile Trp Arg Val
1985 1990 1995
Glu Cys Leu Ile Gly Glu His Leu His Ala Gly Met Ser Thr Leu
2000 2005 2010
Phe Leu Val Tyr Ser Asn Lys Cys Gln Thr Pro Leu Gly Met Ala
2015 2020 2025
Ser Gly His Ile Arg Asp Phe Gln Ile Thr Ala Ser Gly Gln Tyr
2030 2035 2040
Gly Gln Trp Ala Pro Lys Leu Ala Arg Leu His Tyr Ser Gly Ser
2045 2050 2055
Ile Asn Ala Trp Ser Thr Lys Glu Pro Phe Ser Trp Ile Lys Val
2060 2065 2070
Asp Leu Leu Ala Pro Met Ile Ile His Gly Ile Lys Thr Gln Gly
2075 2080 2085
Ala Arg Gln Lys Phe Ser Ser Leu Tyr Ile Ser Gln Phe Ile Ile
2090 2095 2100
Met Tyr Ser Leu Asp Gly Lys Lys Trp Gln Thr Tyr Arg Gly Asn
2105 2110 2115
Ser Thr Gly Thr Leu Met Val Phe Phe Gly Asn Val Asp Ser Ser
2120 2125 2130
Gly Ile Lys His Asn Ile Phe Asn Pro Pro Ile Ile Ala Arg Tyr
2135 2140 2145
Ile Arg Leu His Pro Thr His Tyr Ser Ile Arg Ser Thr Leu Arg
2150 2155 2160
Met Glu Leu Met Gly Cys Asp Leu Asn Ser Cys Ser Met Pro Leu
2165 2170 2175
Gly Met Glu Ser Lys Ala Ile Ser Asp Ala Gln Ile Thr Ala Ser
2180 2185 2190
Ser Tyr Phe Thr Asn Met Phe Ala Thr Trp Ser Pro Ser Lys Ala
2195 2200 2205
Arg Leu His Leu Gln Gly Arg Ser Asn Ala Trp Arg Pro Gln Val
2210 2215 2220
Asn Asn Pro Lys Glu Trp Leu Gln Val Asp Phe Gln Lys Thr Met
2225 2230 2235
Lys Val Thr Gly Val Thr Thr Gln Gly Val Lys Ser Leu Leu Thr
2240 2245 2250
Ser Met Tyr Val Lys Glu Phe Leu Ile Ser Ser Ser Gln Asp Gly
2255 2260 2265
His Gln Trp Thr Leu Phe Phe Gln Asn Gly Lys Val Lys Val Phe
2270 2275 2280
Gln Gly Asn Gln Asp Ser Phe Thr Pro Val Val Asn Ser Leu Asp
2285 2290 2295
Pro Pro Leu Leu Thr Arg Tyr Leu Arg Ile His Pro Gln Ser Trp
2300 2305 2310
Val His Gln Ile Ala Leu Arg Met Glu Val Leu Gly Cys Glu Ala
2315 2320 2325
Gln Asp Leu Tyr
2330
<210> 45
<211> 4
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Аминокислоты 233-236 из человеческого IgG1
<400> 45
Glu Leu Leu Gly
1
<210> 46
<211> 42
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> XTEN AE42-4, последовательность белка
<400> 46
Gly Ala Pro Gly Ser Pro Ala Gly Ser Pro Thr Ser Thr Glu Glu Gly
1. 5 10 15
Thr Ser Glu Ser Ala Thr Pro Glu Ser Gly Pro Gly Ser Glu Pro Ala
20 25 30
Thr Ser Gly Ser Glu Thr Pro Ala Ser Ser
35 40
<210> 47
<211> 126
<212> ДНК
<213> Искусственная последовательность
<220>
<223> XTEN AE42-4, последовательность ДНК
<400> 47
ggcgcgccag gttctcctgc tggctccccc acctcaacag aagaggggac aagcgaaagc
60
gctacgcctg agagtggccc tggctctgag ccagccacct ccggctctga aacccctgcc
120
tcgagc
126
<210> 48
<211> 144
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> XTEN AE144-2A, последовательность белка
<400> 48
Thr Ser Thr Glu Pro Ser Glu Gly Ser Ala Pro Gly Ser Pro Ala Gly
1. 5 10 15
Ser Pro Thr Ser Thr Glu Glu Gly Thr Ser Thr Glu Pro Ser Glu Gly
20 25 30
Ser Ala Pro Gly Thr Ser Thr Glu Pro Ser Glu Gly Ser Ala Pro Gly
35 40 45
Thr Ser Glu Ser Ala Thr Pro Glu Ser Gly Pro Gly Thr Ser Thr Glu
50 55 60
Pro Ser Glu Gly Ser Ala Pro Gly Thr Ser Glu Ser Ala Thr Pro Glu
65 70 75 80
Ser Gly Pro Gly Ser Glu Pro Ala Thr Ser Gly Ser Glu Thr Pro Gly
85 90 95
Thr Ser Thr Glu Pro Ser Glu Gly Ser Ala Pro Gly Thr Ser Thr Glu
100 105 110
Pro Ser Glu Gly Ser Ala Pro Gly Thr Ser Glu Ser Ala Thr Pro Glu
115 120 125
Ser Gly Pro Gly Thr Ser Glu Ser Ala Thr Pro Glu Ser Gly Pro Gly
130 135 140
<210> 49
<211> 450
<212> ДНК
<213> Искусственная последовательность
<220>
<223> XTEN AE144-2A, последовательность ДНК
<400> 49
ggcgcgccaa ccagtacgga gccgtccgag gggagcgcac caggaagccc ggctgggagc
60
ccgacttcta ccgaagaggg tacatctacc gaaccaagtg aaggttcagc accaggcacc
120
tcaacagaac cctctgaggg ctcggcgcct ggtacaagtg agtccgccac cccagaatcc
180
gggcctggga caagcacaga accttcggaa gggagtgccc ctggaacatc cgaatcggca
240
accccagaat cagggccagg atctgagccc gcgacttcgg gctccgagac gcctgggaca
300
tccaccgagc cctccgaagg atcagcccca ggcaccagca cggagccctc tgagggaagc
360
gcacctggta ccagcgaaag cgcaactccc gaatcaggtc ccggtacgag cgagtcggcg
420
accccggaga gcgggccagg tgcctcgagc
450
<210> 50
<211> 144
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> XTEN AE144-3B, последовательность белка
<400> 50
Ser Pro Ala Gly Ser Pro Thr Ser Thr Glu Glu Gly Thr Ser Glu Ser
1. 5 10 15
Ala Thr Pro Glu Ser Gly Pro Gly Ser Glu Pro Ala Thr Ser Gly Ser
20 25 30
Glu Thr Pro Gly Thr Ser Glu Ser Ala Thr Pro Glu Ser Gly Pro Gly
35 40 45
Thr Ser Thr Glu Pro Ser Glu Gly Ser Ala Pro Gly Thr Ser Thr Glu
50 55 60
Pro Ser Glu Gly Ser Ala Pro Gly Thr Ser Thr Glu Pro Ser Glu Gly
65 70 75 80
Ser Ala Pro Gly Thr Ser Thr Glu Pro Ser Glu Gly Ser Ala Pro Gly
85 90 95
Thr Ser Thr Glu Pro Ser Glu Gly Ser Ala Pro Gly Thr Ser Thr Glu
100 105 110
Pro Ser Glu Gly Ser Ala Pro Gly Ser Pro Ala Gly Ser Pro Thr Ser
115 120 125
Thr Glu Glu Gly Thr Ser Thr Glu Pro Ser Glu Gly Ser Ala Pro Gly
130 135 140
<210> 51
<211> 450
<212> ДНК
<213> Искусственная последовательность
<220>
<223> XTEN AE144-3B, последовательность ДНК
<400> 51
ggcgcgccaa gtcccgctgg aagcccaact agcaccgaag aggggacctc agagtccgcc
60
acccccgagt ccggccctgg ctctgagcct gccactagcg gctccgagac tcctggcaca
120
tccgaaagcg ctacacccga gagtggaccc ggcacctcta ccgagcccag tgagggctcc
180
gcccctggaa caagcaccga gcccagcgaa ggcagcgccc cagggacctc cacagagccc
240
agtgaaggca gtgctcctgg caccagcacc gaaccaagcg agggctctgc acccgggacc
300
tccaccgagc caagcgaagg ctctgcccct ggcacttcca ccgagcccag cgaaggcagc
360
gcccctggga gccccgctgg ctctcccacc agcactgagg agggcacatc taccgaacca
420
agtgaaggct ctgcaccagg tgcctcgagc
450
<210> 52
<211> 144
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> XTEN AE144-4A, последовательность белка
<400> 52
Thr Ser Glu Ser Ala Thr Pro Glu Ser Gly Pro Gly Ser Glu Pro Ala
1. 5 10 15
Thr Ser Gly Ser Glu Thr Pro Gly Thr Ser Glu Ser Ala Thr Pro Glu
20 25 30
Ser Gly Pro Gly Ser Glu Pro Ala Thr Ser Gly Ser Glu Thr Pro Gly
35 40 45
Thr Ser Glu Ser Ala Thr Pro Glu Ser Gly Pro Gly Thr Ser Thr Glu
50 55 60
Pro Ser Glu Gly Ser Ala Pro Gly Thr Ser Glu Ser Ala Thr Pro Glu
65 70 75 80
Ser Gly Pro Gly Ser Pro Ala Gly Ser Pro Thr Ser Thr Glu Glu Gly
85 90 95
Ser Pro Ala Gly Ser Pro Thr Ser Thr Glu Glu Gly Ser Pro Ala Gly
100 105 110
Ser Pro Thr Ser Thr Glu Glu Gly Thr Ser Glu Ser Ala Thr Pro Glu
115 120 125
Ser Gly Pro Gly Thr Ser Thr Glu Pro Ser Glu Gly Ser Ala Pro Gly
130 135 140
<210> 53
<211> 450
<212> ДНК
<213> Искусственная последовательность
<220>
<223> XTEN AE144-4A, последовательность ДНК
<400> 53
ggcgcgccaa cgtccgaaag tgctacccct gagtcaggcc ctggtagtga gcctgccaca
60
agcggaagcg aaactccggg gacctcagag tctgccactc ccgaatcggg gccaggctct
120
gaaccggcca cttcagggag cgaaacacca ggaacatcgg agagcgctac cccggagagc
180
gggccaggaa ctagtactga gcctagcgag ggaagtgcac ctggtacaag cgagtccgcc
240
acacccgagt ctggccctgg ctctccagcg ggctcaccca cgagcactga agagggctct
300
cccgctggca gcccaacgtc gacagaagaa ggatcaccag caggctcccc cacatcaaca
360
gaggagggta catcagaatc tgctactccc gagagtggac ccggtacctc cactgagccc
420
agcgagggga gtgcaccagg tgcctcgagc
450
<210> 54
<211> 144
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> XTEN AE144-5A, последовательность белка
<400> 54
Thr Ser Glu Ser Ala Thr Pro Glu Ser Gly Pro Gly Ser Glu Pro Ala
1. 5 10 15
Thr Ser Gly Ser Glu Thr Pro Gly Thr Ser Glu Ser Ala Thr Pro Glu
20 25 30
Ser Gly Pro Gly Ser Glu Pro Ala Thr Ser Gly Ser Glu Thr Pro Gly
35 40 45
Thr Ser Glu Ser Ala Thr Pro Glu Ser Gly Pro Gly Thr Ser Thr Glu
50 55 60
Pro Ser Glu Gly Ser Ala Pro Gly Ser Pro Ala Gly Ser Pro Thr Ser
65 70 75 80
Thr Glu Glu Gly Thr Ser Glu Ser Ala Thr Pro Glu Ser Gly Pro Gly
85 90 95
Ser Glu Pro Ala Thr Ser Gly Ser Glu Thr Pro Gly Thr Ser Glu Ser
100 105 110
Ala Thr Pro Glu Ser Gly Pro Gly Ser Pro Ala Gly Ser Pro Thr Ser
115 120 125
Thr Glu Glu Gly Ser Pro Ala Gly Ser Pro Thr Ser Thr Glu Glu Gly
130 135 140
<210> 55
<211> 450
<212> ДНК
<213> Искусственная последовательность
<220>
<223> XTEN AE144-5A, последовательность ДНК
<400> 55
ggcgcgccaa catcagagag cgccacccct gaaagtggtc ccgggagcga gccagccaca
60
tctgggtcgg aaacgccagg cacaagtgag tctgcaactc ccgagtccgg acctggctcc
120
gagcctgcca ctagcggctc cgagactccg ggaacttccg agagcgctac accagaaagc
180
ggacccggaa ccagtaccga acctagcgag ggctctgctc cgggcagccc agccggctct
240
cctacatcca cggaggaggg cacttccgaa tccgccaccc cggagtcagg gccaggatct
300
gaacccgcta cctcaggcag tgagacgcca ggaacgagcg agtccgctac accggagagt
360
gggccaggga gccctgctgg atctcctacg tccactgagg aagggtcacc agcgggctcg
420
cccaccagca ctgaagaagg tgcctcgagc
450
<210> 56
<211> 144
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> XTEN AE144-6B, последовательность белка
<400> 56
Thr Ser Thr Glu Pro Ser Glu Gly Ser Ala Pro Gly Thr Ser Glu Ser
1. 5 10 15
Ala Thr Pro Glu Ser Gly Pro Gly Thr Ser Glu Ser Ala Thr Pro Glu
20 25 30
Ser Gly Pro Gly Thr Ser Glu Ser Ala Thr Pro Glu Ser Gly Pro Gly
35 40 45
Ser Glu Pro Ala Thr Ser Gly Ser Glu Thr Pro Gly Ser Glu Pro Ala
50 55 60
Thr Ser Gly Ser Glu Thr Pro Gly Ser Pro Ala Gly Ser Pro Thr Ser
65 70 75 80
Thr Glu Glu Gly Thr Ser Thr Glu Pro Ser Glu Gly Ser Ala Pro Gly
85 90 95
Thr Ser Thr Glu Pro Ser Glu Gly Ser Ala Pro Gly Ser Glu Pro Ala
100 105 110
Thr Ser Gly Ser Glu Thr Pro Gly Thr Ser Glu Ser Ala Thr Pro Glu
115 120 125
Ser Gly Pro Gly Thr Ser Thr Glu Pro Ser Glu Gly Ser Ala Pro Gly
130 135 140
<210> 57
<211> 450
<212> ДНК
<213> Искусственная последовательность
<220>
<223> XTEN AE144-6B, последовательность ДНК
<400> 57
ggcgcgccaa catctaccga gccttccgaa ggctctgccc ctgggacctc agaatctgca
60
acccctgaaa gcggccctgg aacctccgaa agtgccactc ccgagagcgg cccagggaca
120
agcgagtcag caacccctga gtctggaccc ggcagcgagc ctgcaacctc tggctcagag
180
actcccggct cagaacccgc tacctcaggc tccgagacac ccggctctcc tgctgggagt
240
cccacttcca ccgaggaagg aacatccact gagcctagtg agggctctgc ccctggaacc
300
agcacagagc caagtgaggg cagtgcacca ggatccgagc cagcaaccag cgggtccgag
360
actcccggga cctctgagtc tgccacccca gagagcggac ccggcacttc aaccgagccc
420
tccgaaggat cagcaccagg tgcctcgagc
450
<210> 58
<211> 144
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> XTEN AG144-1, последовательность белка
<400> 58
Pro Gly Ser Ser Pro Ser Ala Ser Thr Gly Thr Gly Pro Gly Ser Ser
1. 5 10 15
Pro Ser Ala Ser Thr Gly Thr Gly Pro Gly Thr Pro Gly Ser Gly Thr
20 25 30
Ala Ser Ser Ser Pro Gly Ser Ser Thr Pro Ser Gly Ala Thr Gly Ser
35 40 45
Pro Gly Ser Ser Pro Ser Ala Ser Thr Gly Thr Gly Pro Gly Ala Ser
50 55 60
Pro Gly Thr Ser Ser Thr Gly Ser Pro Gly Thr Pro Gly Ser Gly Thr
65 70 75 80
Ala Ser Ser Ser Pro Gly Ser Ser Thr Pro Ser Gly Ala Thr Gly Ser
85 90 95
Pro Gly Thr Pro Gly Ser Gly Thr Ala Ser Ser Ser Pro Gly Ala Ser
100 105 110
Pro Gly Thr Ser Ser Thr Gly Ser Pro Gly Ala Ser Pro Gly Thr Ser
115 120 125
Ser Thr Gly Ser Pro Gly Thr Pro Gly Ser Gly Thr Ala Ser Ser Ser
130 135 140
<210> 59
<211> 450
<212> ДНК
<213> Искусственная последовательность
<220>
<223> XTEN AG144-1, последовательность ДНК
<400> 59
ggcgcgccac ccgggtcgtc cccgtcggcg tccaccggaa cagggccagg gtcatccccg
60
tcagcgtcga ctgggacggg acccgggaca cccggttcgg ggactgcatc ctcctcgcct
120
ggttcgtcca ccccgtcagg agccacgggt tcgccgggaa gcagcccaag cgcatccact
180
ggtacagggc ctggggcttc accgggtact tcatccacgg ggtcaccggg aacgcccgga
240
tcggggacgg cttcctcatc accaggatcg tcaacaccct cgggcgcaac gggcagcccc
300
ggaacccctg gttcgggtac ggcgtcgtcg agccccggtg cgagcccggg aacaagctcg
360
acaggatcgc ctggggcgtc acccggcacg tcgagcacag gcagccccgg aacccctgga
420
tcgggaaccg cgtcgtcaag cgcctcgagc
450
<210> 60
<211> 144
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> XTEN AG144-A, последовательность белка
<400> 60
Gly Ala Ser Pro Gly Thr Ser Ser Thr Gly Ser Pro Gly Ser Ser Pro
1. 5 10 15
Ser Ala Ser Thr Gly Thr Gly Pro Gly Ser Ser Pro Ser Ala Ser Thr
20 25 30
Gly Thr Gly Pro Gly Thr Pro Gly Ser Gly Thr Ala Ser Ser Ser Pro
35 40 45
Gly Ser Ser Thr Pro Ser Gly Ala Thr Gly Ser Pro Gly Ser Ser Pro
50 55 60
Ser Ala Ser Thr Gly Thr Gly Pro Gly Ala Ser Pro Gly Thr Ser Ser
65 70 75 80
Thr Gly Ser Pro Gly Thr Pro Gly Ser Gly Thr Ala Ser Ser Ser Pro
85 90 95
Gly Ser Ser Thr Pro Ser Gly Ala Thr Gly Ser Pro Gly Thr Pro Gly
100 105 110
Ser Gly Thr Ala Ser Ser Ser Pro Gly Ala Ser Pro Gly Thr Ser Ser
115 120 125
Thr Gly Ser Pro Gly Ala Ser Pro Gly Thr Ser Ser Thr Gly Ser Pro
130 135 140
<210> 61
<211> 450
<212> ДНК
<213> Искусственная последовательность
<220>
<223> XTEN AG144-A, последовательность ДНК
<400> 61
ggcgcgccag gtgcctcgcc gggaacatca tcaactggtt cacccgggtc atccccctcg
60
gcctcaaccg ggacgggtcc cggctcatcc cccagcgcca gcactggaac aggtcctggc
120
actcctggtt ccggtacggc atcgtcatcc ccgggaagct caacaccgtc cggagcgaca
180
ggatcacctg gctcgtcacc ttcggcgtca actggaacgg ggccaggggc ctcacccgga
240
acgtcctcga ctgggtcgcc tggtacgccg ggatcaggaa cggcctcatc ctcgcctggg
300
tcctcaacgc cctcgggtgc gactggttcg ccgggaactc ctggctcggg gacggcctcg
360
tcgtcgcctg gggcatcacc ggggacgagc tccacggggt cccctggagc gtcaccgggg
420
acctcctcga caggtagccc ggcctcgagc
450
<210> 62
<211> 144
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> XTEN AG144-B, последовательность белка
<400> 62
Gly Thr Pro Gly Ser Gly Thr Ala Ser Ser Ser Pro Gly Ser Ser Thr
1. 5 10 15
Pro Ser Gly Ala Thr Gly Ser Pro Gly Ala Ser Pro Gly Thr Ser Ser
20 25 30
Thr Gly Ser Pro Gly Thr Pro Gly Ser Gly Thr Ala Ser Ser Ser Pro
35 40 45
Gly Ser Ser Thr Pro Ser Gly Ala Thr Gly Ser Pro Gly Ser Ser Pro
50 55 60
Ser Ala Ser Thr Gly Thr Gly Pro Gly Ser Ser Pro Ser Ala Ser Thr
65 70 75 80
Gly Thr Gly Pro Gly Ser Ser Thr Pro Ser Gly Ala Thr Gly Ser Pro
85 90 95
Gly Ser Ser Thr Pro Ser Gly Ala Thr Gly Ser Pro Gly Ala Ser Pro
100 105 110
Gly Thr Ser Ser Thr Gly Ser Pro Gly Ala Ser Pro Gly Thr Ser Ser
115 120 125
Thr Gly Ser Pro Gly Ala Ser Pro Gly Thr Ser Ser Thr Gly Ser Pro
130 135 140
<210> 63
<211> 450
<212> ДНК
<213> Искусственная последовательность
<220>
<223> XTEN AG144-B, последовательность ДНК
<400> 63
ggcgcgccag gtacaccggg cagcggcacg gcttcgtcgt cacccggctc gtccacaccg
60
tcgggagcta cgggaagccc aggagcgtca ccgggaacgt cgtcaacggg gtcaccgggt
120
acgccaggta gcggcacggc cagcagctcg ccaggttcat cgaccccgtc gggagcgact
180
gggtcgcccg gatcaagccc gtcagcttcc actggaacag gacccgggtc gtcgccgtca
240
gcctcaacgg ggacaggacc tggttcatcg acgccgtcag gggcgacagg ctcgcccgga
300
tcgtcaacac cctcgggggc aacggggagc cctggtgcgt cgcctggaac ctcatccacc
360
ggaagcccgg gggcctcgcc gggtacgagc tccacgggat cgcccggagc gtcccccgga
420
acttcaagca cagggagccc tgcctcgagc
450
<210> 64
<211> 144
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> XTEN AG144-C, последовательность белка
<400> 64
Gly Thr Pro Gly Ser Gly Thr Ala Ser Ser Ser Pro Gly Ala Ser Pro
1. 5 10 15
Gly Thr Ser Ser Thr Gly Ser Pro Gly Ala Ser Pro Gly Thr Ser Ser
20 25 30
Thr Gly Ser Pro Gly Ala Ser Pro Gly Thr Ser Ser Thr Gly Ser Pro
35 40 45
Gly Ser Ser Pro Ser Ala Ser Thr Gly Thr Gly Pro Gly Thr Pro Gly
50 55 60
Ser Gly Thr Ala Ser Ser Ser Pro Gly Ala Ser Pro Gly Thr Ser Ser
65 70 75 80
Thr Gly Ser Pro Gly Ala Ser Pro Gly Thr Ser Ser Thr Gly Ser Pro
85 90 95
Gly Ala Ser Pro Gly Thr Ser Ser Thr Gly Ser Pro Gly Ser Ser Thr
100 105 110
Pro Ser Gly Ala Thr Gly Ser Pro Gly Ser Ser Thr Pro Ser Gly Ala
115 120 125
Thr Gly Ser Pro Gly Ala Ser Pro Gly Thr Ser Ser Thr Gly Ser Pro
130 135 140
<210> 65
<211> 450
<212> ДНК
<213> Искусственная последовательность
<220>
<223> XTEN AG144-C, последовательность ДНК
<400> 65
ggcgcgccag gtacacccgg atcgggtaca gcgtcatcga gccccggtgc gtcacctggt
60
acgtcgagca cggggtcgcc aggggcgtcc cctgggacgt cctcaacagg ctcgcccggt
120
gcgtcacccg gcacgtcgtc cacgggttca cctggtagct ccccttccgc gtccactggc
180
accgggcctg gaactccggg gagcggcaca gcgagctcgt cgccgggagc atcgcctggg
240
acatcgagca ccgggtcgcc aggagcatcg cccggaacat ccagcacagg aagccccggc
300
gcgtcgcccg ggacatcaag cacaggttcc ccgggatcga gcacgccgtc cggagccact
360
ggatcaccag ggagctcgac accttccggc gcaacgggat cgcccggagc cagcccgggt
420
acgtcaagca ctggctcccc tgcctcgagc
450
<210> 66
<211> 144
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> XTEN AG144-F, последовательность белка
<400> 66
Gly Ser Ser Pro Ser Ala Ser Thr Gly Thr Gly Pro Gly Ser Ser Pro
1. 5 10 15
Ser Ala Ser Thr Gly Thr Gly Pro Gly Ala Ser Pro Gly Thr Ser Ser
20 25 30
Thr Gly Ser Pro Gly Ala Ser Pro Gly Thr Ser Ser Thr Gly Ser Pro
35 40 45
Gly Ser Ser Thr Pro Ser Gly Ala Thr Gly Ser Pro Gly Ser Ser Pro
50 55 60
Ser Ala Ser Thr Gly Thr Gly Pro Gly Ala Ser Pro Gly Thr Ser Ser
65 70 75 80
Thr Gly Ser Pro Gly Ser Ser Pro Ser Ala Ser Thr Gly Thr Gly Pro
85 90 95
Gly Thr Pro Gly Ser Gly Thr Ala Ser Ser Ser Pro Gly Ser Ser Thr
100 105 110
Pro Ser Gly Ala Thr Gly Ser Pro Gly Ser Ser Thr Pro Ser Gly Ala
115 120 125
Thr Gly Ser Pro Gly Ala Ser Pro Gly Thr Ser Ser Thr Gly Ser Pro
130 135 140
<210> 67
<211> 450
<212> ДНК
<213> Искусственная последовательность
<220>
<223> XTEN AG144-F, последовательность ДНК
<400> 67
ggcgcgccag gctccagccc ctccgcgagc acgggaaccg gaccaggttc gtcaccctca
60
gcatcaacgg ggacgggacc gggggcgtca ccaggaacgt cctccaccgg ctcgccgggt
120
gcatcacccg gaacgtcatc gaccggatcg ccagggagct cgacgccatc aggcgcaaca
180
ggatcacctg gctcaagccc tagcgcgtca accggcacgg gtccgggtgc ctcccctggc
240
acgtccagca ccggatcacc cggatcgagc ccatccgcct caaccggaac cggacccggt
300
acaccagggt cgggaacagc ctcctcgtca ccaggctcct caaccccctc gggagccacg
360
ggttcgcccg gttcgtcaac gccttccgga gcaactggta gccccggagc atcgccagga
420
acttcgagca cggggtcgcc cgcctcgagc
450
<210> 68
<211> 4374
<212> ДНК
<213> Искусственная последовательность
<220>
<223> coFVIII-1 последовательность ДНК
<400> 68
atgcagattg agctgtctac ttgctttttc ctgtgcctgc tgaggttttg cttttccgct
60
acacgaaggt attatctggg ggctgtggaa ctgtcttggg attacatgca gagtgacctg
120
ggagagctgc cagtggacgc aaggtttccc cctagagtcc ctaagtcatt ccccttcaac
180
actagcgtgg tctacaagaa aacactgttc gtggagttta ctgatcacct gttcaacatc
240
gcaaagccta ggccaccctg gatgggactg ctggggccaa caatccaggc cgaggtgtac
300
gacaccgtgg tcattacact taagaacatg gcctcacacc ccgtgagcct gcatgctgtg
360
ggcgtcagct actggaaggc ttccgaagga gcagagtatg acgatcagac ttcccagaga
420
gaaaaagagg acgataaggt gtttcctggc ggatctcata cctacgtgtg gcaggtcctg
480
aaagagaatg gccctatggc ctccgaccct ctgtgcctga cctactctta tctgagtcac
540
gtggacctgg tcaaggatct gaacagcggc ctgatcggag ccctgctggt gtgcagggaa
600
ggaagcctgg ctaaggagaa aacccagaca ctgcataagt tcattctgct gttcgccgtg
660
tttgacgaag ggaaatcatg gcacagcgag acaaagaata gtctgatgca ggacagggat
720
gccgcttcag ccagagcttg gcccaaaatg cacactgtga acggctacgt caatcgctca
780
ctgcctgggc tgatcggctg ccaccgaaag agcgtgtatt ggcatgtcat cgggatgggc
840
accacacctg aagtgcactc cattttcctg gagggacata cctttctggt ccgcaaccac
900
cgacaggctt ccctggagat ctctccaatt accttcctga cagcacagac tctgctgatg
960
gacctggggc agttcctgct gttttgccac atcagctccc accagcatga tggcatggag
1020
gcttacgtga aagtggactc ttgtcccgag gaacctcagc tgcggatgaa gaacaatgag
1080
gaagcagaag actatgacga tgacctgacc gactccgaga tggatgtggt ccgattcgat
1140
gacgataaca gcccctcctt tatccagatt agatctgtgg ccaagaaaca ccctaagaca
1200
tgggtccatt acatcgcagc cgaggaagag gactgggatt atgcaccact ggtgctggca
1260
ccagacgatc gctcctacaa atctcagtat ctgaacaatg ggccacagag gattggcaga
1320
aagtacaaga aagtgcggtt catggcatat accgatgaga ccttcaagac tcgcgaagcc
1380
atccagcacg agagcggcat cctgggacca ctgctgtacg gagaagtggg agacaccctg
1440
ctgatcattt tcaagaacca ggccagccgg ccttacaata tctatccaca tgggattaca
1500
gatgtgcgcc ctctgtacag caggagactg ccaaagggcg tcaaacacct gaaggacttc
1560
ccaatcctgc ccggagaaat cttcaagtac aagtggactg tcaccgtcga ggatggcccc
1620
actaagagcg accctcggtg cctgacccgc tactattcta gtttcgtgaa tatggaaaga
1680
gatctggcaa gcggactgat cggaccactg ctgatttgtt acaaagagag cgtggatcag
1740
agaggcaacc agatcatgtc cgacaagcgg aatgtgattc tgttcagtgt ctttgacgaa
1800
aacaggtcat ggtacctgac cgagaacatc cagagattcc tgcctaatcc agctggggtg
1860
cagctggaag atcctgagtt tcaggcatct aacatcatgc atagtattaa tggctacgtg
1920
ttcgacagtt tgcagctgag cgtgtgcctg cacgaggtcg cttactggta tatcctgagc
1980
attggggcac agacagattt cctgagcgtg ttcttttccg gctacacttt taagcataaa
2040
atggtctatg aggacacact gactctgttc cccttcagcg gcgaaaccgt gtttatgagc
2100
atggagaatc ccggactgtg gattctgggg tgccacaaca gcgatttcag aaatcgcgga
2160
atgactgccc tgctgaaagt gtcaagctgt gacaagaaca ccggggacta ctatgaagat
2220
tcatacgagg acatcagcgc atatctgctg tccaaaaaca atgccattga accccggtct
2280
tttagtcaga atcctccagt gctgaagagg caccagaggg agatcacccg cactaccctg
2340
cagagtgatc aggaagagat cgactacgac gatacaattt ctgtggaaat gaagaaagag
2400
gacttcgata tctatgacga agatgagaac cagagtcctc gatcattcca gaagaaaacc
2460
aggcattact ttattgccgc agtggagcgg ctgtgggatt atggcatgtc ctctagtcct
2520
cacgtgctgc gaaatagggc ccagtcagga agcgtcccac agttcaagaa agtggtcttc
2580
caggagttta cagacgggtc ctttactcag ccactgtaca ggggcgaact gaacgagcac
2640
ctgggactgc tggggcccta tatcagagca gaagtggagg ataacattat ggtcaccttc
2700
agaaatcagg cctctcggcc ttacagtttt tattcaagcc tgatctctta cgaagaggac
2760
cagcgacagg gagctgaacc acgaaaaaac ttcgtgaagc ctaatgagac caaaacatac
2820
ttttggaagg tgcagcacca tatggcccca acaaaagacg agttcgattg caaggcatgg
2880
gcctattttt ctgacgtgga tctggagaag gacgtgcaca gtggcctgat tggcccactg
2940
ctggtgtgcc atactaacac cctgaatcca gcccacggcc ggcaggtcac tgtccaggag
3000
ttcgctctgt tctttaccat ctttgatgag acaaagagct ggtacttcac cgaaaacatg
3060
gagcgaaatt gcagggctcc atgtaacatt cagatggaag accccacatt caaggagaac
3120
taccgctttc atgctatcaa tggatacatc atggatactc tgcccgggct ggtcatggca
3180
caggaccaga gaatccggtg gtatctgctg agcatgggca gcaacgagaa tatccactca
3240
attcatttca gcgggcacgt gtttactgtc aggaagaaag aagagtacaa gatggccctg
3300
tacaacctgt atcccggcgt gttcgaaacc gtcgagatgc tgcctagcaa ggccggaatc
3360
tggagagtgg aatgcctgat tggagagcac ctgcatgctg ggatgtctac cctgtttctg
3420
gtgtacagta ataagtgtca gacacccctg ggaatggcat ccgggcatat cagggatttc
3480
cagattaccg catctggaca gtacggacag tgggcaccta agctggctag actgcactat
3540
tccggatcta tcaacgcttg gtccacaaaa gagcctttct cttggattaa ggtggacctg
3600
ctggccccaa tgatcattca tggcatcaaa actcagggag ctcggcagaa gttctcctct
3660
ctgtacatct cacagtttat catcatgtac agcctggatg ggaagaaatg gcagacatac
3720
cgcggcaata gcacaggaac tctgatggtg ttctttggca acgtggacag cagcggaatc
3780
aagcacaaca ttttcaatcc ccctatcatt gctagataca tccggctgca cccaacccat
3840
tattctattc gaagtacact gaggatggaa ctgatgggat gcgatctgaa cagttgttca
3900
atgcccctgg ggatggagtc caaggcaatc tctgacgccc agattaccgc cagctcctac
3960
ttcactaata tgtttgctac ctggagccct tccaaagcaa gactgcacct gcaaggccgc
4020
agcaacgcat ggcgaccaca ggtgaacaat cccaaggagt ggttgcaggt cgattttcag
4080
aaaactatga aggtgaccgg ggtcacaact cagggcgtga aaagtctgct gacctcaatg
4140
tacgtcaagg agttcctgat ctctagttca caggacggac atcagtggac actgttcttt
4200
cagaacggga aggtgaaagt cttccagggc aatcaggatt cctttacacc tgtggtcaac
4260
agtctagacc ctccactgct gaccagatac ctgagaatcc accctcagtc ctgggtgcac
4320
cagattgccc tgagaatgga agtgctggga tgcgaggccc aggatctgta ctga
4374
<210> 69
<211> 577
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Промотор ET, последовательность ДНК
<400> 69
ctcgaggtca attcacgcga gttaataatt accagcgcgg gccaaataaa taatccgcga
60
ggggcaggtg acgtttgccc agcgcgcgct ggtaattatt aacctcgcga atattgattc
120
gaggccgcga ttgccgcaat cgcgaggggc aggtgacctt tgcccagcgc gcgttcgccc
180
cgccccggac ggtatcgata agcttaggag cttgggctgc aggtcgaggg cactgggagg
240
atgttgagta agatggaaaa ctactgatga cccttgcaga gacagagtat taggacatgt
300
ttgaacaggg gccgggcgat cagcaggtag ctctagagga tccccgtctg tctgcacatt
360
tcgtagagcg agtgttccga tactctaatc tccctaggca aggttcatat ttgtgtaggt
420
tacttattct ccttttgttg actaagtcaa taatcagaat cagcaggttt ggagtcagct
480
tggcagggat cagcagcctg ggttggaagg agggggtata aaagcccctt caccaggaga
540
agccgtcaca cagatccaca agctcctgcc accatgg
577
<210> 70
<211> 4374
<212> ДНК
<213> Искусственная последовательность
<220>
<223> coFVIII-5
<400> 70
atgcaaatcg aactgagcac ctgtttcttc ctctgcctgc tgagattctg tttctccgcg
60
acccgccgat actacctggg agcagtggag ctctcctggg attacatgca gagcgacctt
120
ggggagctgc ccgtggatgc caggttccct ccccgggtgc caaagtcgtt tccgttcaac
180
acctccgtgg tgtacaagaa aactctgttc gtggagttca ccgaccacct gttcaatatc
240
gccaagccca gacctccctg gatggggctg ttgggaccta ccatccaagc ggaggtgtac
300
gacactgtgg tcatcactct gaagaacatg gcctcgcatc ccgtgtccct gcacgccgtg
360
ggagtgtctt actggaaagc gtccgagggg gccgaatacg acgaccagac ctcgcagaga
420
gaaaaggaag atgacaaggt gttcccagga ggatcgcaca cctacgtgtg gcaagtgttg
480
aaggagaacg gcccaatggc ctccgacccg ctgtgcctga cctactcgta cctgtcccac
540
gtggacctcg tgaaggacct caactcggga ctgattggag ccctgctggt ctgcagggaa
600
ggctcactgg cgaaagaaaa gactcagacc ttgcacaagt tcattctgct gttcgctgtg
660
ttcgacgagg ggaagtcgtg gcacagcgag actaagaact ccctgatgca agatagagat
720
gccgcctccg cccgggcctg gcctaagatg cacaccgtga acggttacgt gaaccgctcc
780
ctccctggcc tgattggatg ccaccggaag tccgtgtact ggcacgtgat cgggatgggg
840
accacccccg aggtgcacag catcttcctg gaaggtcaca catttctcgt gcgcaaccac
900
cggcaggcct ccctggaaat cagccccatt accttcctca ctgcccagac tctgctgatg
960
gacctgggac agttcctgct gttctgccat atctcctccc accaacatga cggaatggag
1020
gcatacgtga aggtcgattc ctgccctgag gaaccccagc tccgcatgaa gaacaatgag
1080
gaagccgagg actacgacga cgacctgacg gatagcgaga tggatgtggt ccggttcgat
1140
gacgataaca gcccttcctt catccaaatt cgctcggtgg caaagaagca ccccaagacc
1200
tgggtgcatt acattgcggc ggaagaagag gactgggatt atgccccgct tgtcctcgct
1260
cctgacgacc ggagctacaa gagccagtac ctgaacaacg gtccacagag gatcggtaga
1320
aagtacaaga aggtccgctt catggcctat accgacgaaa ccttcaaaac tagagaggcc
1380
atccaacacg aatccggcat cctgggcccg ctcttgtacg gagaagtcgg cgacaccctt
1440
ctcattatct tcaagaacca ggcttcccgg ccgtacaaca tctatccgca tgggatcact
1500
gacgtgcgcc cactgtactc gcggcgcctg cccaagggtg tcaaacacct gaaggatttt
1560
ccgatccttc cgggagaaat cttcaagtac aagtggaccg tgaccgtgga agatggccca
1620
actaagtctg accctagatg cctcacccgc tactactcat ccttcgtcaa catggagcgc
1680
gacctggcca gcggactgat cggcccgctg ctgatttgct acaaggaatc agtggaccaa
1740
cggggaaacc agatcatgtc ggataagagg aacgtcatcc tcttctccgt gtttgacgaa
1800
aaccggtcgt ggtacctgac tgaaaacatc cagcggttcc tccccaaccc cgcgggcgtg
1860
cagctggaag atcctgagtt tcaggcatca aacatcatgc actccattaa cggctacgtg
1920
ttcgattcgc tgcagctgag cgtgtgtctg cacgaagtgg cctactggta catcctgtcc
1980
attggtgccc agactgactt cctgtccgtg tttttctccg gctacacgtt caagcacaag
2040
atggtgtacg aggacaccct gaccctcttc cctttttccg gcgaaactgt gtttatgagc
2100
atggagaatc ccggcctgtg gatcttgggc tgccacaaca gcgacttccg taacagagga
2160
atgactgcgc tgctcaaggt gtccagctgc gacaagaaca ccggagacta ttatgaggac
2220
tcatacgagg acatctccgc ctacctcctg tccaagaata acgccattga acctcggagc
2280
ttcagccaga acccacccgt gcttaagaga catcaacggg agatcactag gaccaccctg
2340
cagtcagacc aggaggaaat cgactacgat gacaccatct cggtcgagat gaagaaggag
2400
gactttgaca tctacgacga agatgaaaac cagagcccga ggtcgttcca aaagaaaacc
2460
cgccactact ttattgctgc tgtcgagcgg ctgtgggact acggaatgtc gtcctcgccg
2520
cacgtgctcc gcaaccgagc ccagagcggc tcggtgccgc aattcaagaa ggtcgtgttc
2580
caggagttca ctgacgggag cttcactcag cctttgtacc ggggagaact caatgaacat
2640
ctcggcctcc tcggacctta catcagagca gaagtggaag ataacatcat ggtcactttc
2700
cgtaaccaag ccagccgccc gtactcgttc tactcctccc tcatttctta cgaagaggac
2760
cagcggcagg gcgcagaacc gcgcaagaac ttcgtgaagc ccaacgaaac caagacctac
2820
ttctggaaag tgcagcatca tatggccccg actaaggacg agtttgactg caaagcctgg
2880
gcctacttct ccgatgtgga cttggagaag gacgtccact ccggcctcat cggtcccctg
2940
ctcgtgtgcc ataccaatac cctgaacccc gcacacggtc gccaggtcac cgtgcaggag
3000
ttcgctctgt tcttcactat cttcgacgaa actaagtcct ggtacttcac cgagaacatg
3060
gagaggaact gcagagcccc ctgtaacatc cagatggagg acccgacgtt caaggaaaac
3120
taccggttcc acgccattaa cggatacatc atggatacgc tgccgggtct tgtgatggcc
3180
caggatcaac ggatcagatg gtacttattg tcgatgggca gcaacgagaa catccactct
3240
attcacttct ccggtcatgt gttcactgtg cggaagaagg aagagtacaa gatggccctg
3300
tacaaccttt atcccggagt gttcgaaact gtggaaatgc tgccgtcgaa ggccggcatt
3360
tggcgcgtgg agtgtttgat tggagaacat ctccatgcgg ggatgtcaac cctgttcctg
3420
gtgtatagca acaagtgcca gactccgctt gggatggcgt caggacacat tagggatttc
3480
cagatcactg cgtccggcca gtacggccaa tgggccccta agctggcccg cctgcattac
3540
tccggatcca ttaacgcctg gtcaaccaag gagccattct cctggatcaa ggtggacctt
3600
ctggccccca tgattatcca cggaattaag acccaggggg cccggcagaa gttctcctca
3660
ctgtacatca gccagttcat aatcatgtac tccctggacg gaaagaagtg gcaaacctac
3720
agggggaaca gcaccggcac actgatggtc tttttcggaa atgtggactc ctccgggatt
3780
aagcataaca tcttcaaccc tccgattatc gctcggtaca ttagacttca ccctacccac
3840
tacagcattc gctccaccct gcggatggaa ctgatgggct gcgatctgaa ctcgtgcagc
3900
atgccgttgg gaatggagtc caaagcaatt tccgacgcgc agatcaccgc ctcgtcctac
3960
tttaccaaca tgttcgccac gtggtcaccg tccaaggccc ggctgcacct ccagggaaga
4020
tccaacgcat ggcggccaca ggtcaacaac cctaaggagt ggctccaggt ggacttccag
4080
aaaaccatga aggtcaccgg agtcacaacc cagggagtga agtcgctgct gacttctatg
4140
tacgtcaagg agttcctgat ctccagcagc caggacgggc accagtggac cctgttcttc
4200
caaaatggaa aggtcaaggt gtttcagggc aatcaggatt cattcacccc ggtggtgaac
4260
tcccttgatc cacccctcct gacccgctac cttcgcatcc acccacagtc ctgggtgcac
4320
cagatcgcgc tgaggatgga ggtcctggga tgcgaagccc aggacctgta ctga
4374
<210> 71
<211> 4374
<212> ДНК
<213> Искусственная последовательность
<220>
<223> coFVIII-6
<400> 71
atgcagattg agctgtccac ttgtttcttc ctgtgcctcc tgcgcttctg tttctccgcc
60
actcgccggt actaccttgg agccgtggag ctttcatggg actacatgca gagcgacctg
120
ggcgaactcc ccgtggatgc cagattcccc ccccgcgtgc caaagtcctt cccctttaac
180
acctccgtgg tgtacaagaa aaccctcttt gtcgagttca ctgaccacct gttcaacatc
240
gccaagccgc gcccaccttg gatgggcctc ctgggaccga ccattcaagc tgaagtgtac
300
gacaccgtgg tgatcaccct gaagaacatg gcgtcccacc ccgtgtccct gcatgcggtc
360
ggagtgtcct actggaaggc ctccgaagga gctgagtacg acgaccagac tagccagcgg
420
gaaaaggagg acgataaagt gttcccgggc ggctcgcata cttacgtgtg gcaagtcctg
480
aaggaaaacg gacctatggc atccgatcct ctgtgcctga cttactccta cctttcccat
540
gtggacctcg tgaaggacct gaacagcggg ctgattggtg cacttctcgt gtgccgcgaa
600
ggttcgctcg ctaaggaaaa gacccagacc ctccataagt tcatcctttt gttcgctgtg
660
ttcgatgaag gaaagtcatg gcattccgaa actaagaact cgctgatgca ggaccgggat
720
gccgcctcag cccgcgcctg gcctaaaatg catacagtca acggatacgt gaatcggtca
780
ctgcccgggc tcatcggttg tcacagaaag tccgtgtact ggcacgtcat cggcatgggc
840
actacgcctg aagtgcactc catcttcctg gaagggcaca ccttcctcgt gcgcaaccac
900
cgccaggcct ctctggaaat ctccccgatt acctttctga ccgcccagac tctgctcatg
960
gacctggggc agttccttct cttctgccac atctccagcc atcagcacga cggaatggag
1020
gcctacgtga aggtggactc atgcccggaa gaacctcagt tgcggatgaa gaacaacgag
1080
gaggccgagg actatgacga cgatttgact gactccgaga tggacgtcgt gcggttcgat
1140
gacgacaaca gccccagctt catccagatt cgcagcgtgg ccaagaagca ccccaaaacc
1200
tgggtgcact acatcgcggc cgaggaagaa gattgggact acgccccgtt ggtgctggca
1260
cccgatgacc ggtcgtacaa gtcccagtat ctgaacaatg gtccgcagcg gattggcaga
1320
aagtacaaga aagtgcggtt catggcgtac actgacgaaa cgtttaagac ccgggaggcc
1380
attcaacatg agagcggcat tctgggacca ctgctgtacg gagaggtcgg cgataccctg
1440
ctcatcatct tcaaaaacca ggcctcccgg ccttacaaca tctaccctca cggaatcacc
1500
gacgtgcggc cactctactc gcggcgcctg ccgaagggcg tcaagcacct gaaagacttc
1560
cctatcctgc cgggcgaaat cttcaagtat aagtggaccg tcaccgtgga ggacgggccc
1620
accaagagcg atcctaggtg tctgactcgg tactactcca gcttcgtgaa catggaacgg
1680
gacctggcat cgggactcat tggaccgctg ctgatctgct acaaagagtc ggtggatcaa
1740
cgcggcaacc agatcatgtc cgacaagcgc aacgtgatcc tgttctccgt gtttgatgaa
1800
aacagatcct ggtacctcac tgaaaacatc cagaggttcc tcccaaaccc cgcaggagtg
1860
caactggagg accctgagtt tcaggcctcg aatatcatgc actcgattaa cggttacgtg
1920
ttcgactcgc tgcagctgag cgtgtgcctc catgaagtcg cttactggta cattctgtcc
1980
atcggcgccc agactgactt cctgagcgtg ttcttttccg gttacacctt taagcacaag
2040
atggtgtacg aagataccct gaccctgttc cctttctccg gcgaaacggt gttcatgtcg
2100
atggagaacc cgggtctgtg gattctggga tgccacaaca gcgactttcg gaaccgcgga
2160
atgactgccc tgctgaaggt gtcctcatgc gacaagaaca ccggagacta ctacgaggac
2220
tcctacgagg atatctcagc ctacctcctg tccaagaaca acgcgatcga gccgcgcagc
2280
ttcagccaga acccgcctgt gctgaagagg caccagcgag aaattacccg gaccaccctc
2340
caatcggatc aggaggaaat cgactacgac gacaccatct cggtggaaat gaagaaggaa
2400
gatttcgata tctacgacga ggacgaaaat cagtcccctc gctcattcca aaagaaaact
2460
agacactact ttatcgccgc ggtggaaaga ctgtgggact atggaatgtc atccagccct
2520
cacgtccttc ggaaccgggc ccagagcgga tcggtgcctc agttcaagaa agtggtgttc
2580
caggagttca ccgacggcag cttcacccag ccgctgtacc ggggagaact gaacgaacac
2640
ctgggcctgc tcggtcccta catccgcgcg gaagtggagg ataacatcat ggtgaccttc
2700
cgtaaccaag catccagacc ttactccttc tattcctccc tgatctcata cgaggaggac
2760
cagcgccaag gcgccgagcc ccgcaagaac ttcgtcaagc ccaacgagac taagacctac
2820
ttctggaagg tccaacacca tatggccccg accaaggatg agtttgactg caaggcctgg
2880
gcctacttct ccgacgtgga ccttgagaag gatgtccatt ccggcctgat cgggccgctg
2940
ctcgtgtgtc acaccaacac cctgaaccca gcgcatggac gccaggtcac cgtccaggag
3000
tttgctctgt tcttcaccat ttttgacgaa actaagtcct ggtacttcac cgagaatatg
3060
gagcgaaact gtagagcgcc ctgcaatatc cagatggaag atccgacttt caaggagaac
3120
tatagattcc acgccatcaa cgggtacatc atggatactc tgccggggct ggtcatggcc
3180
caggatcaga ggattcggtg gtacttgctg tcaatgggat cgaacgaaaa cattcactcc
3240
attcacttct ccggtcacgt gttcactgtg cgcaagaagg aggagtacaa gatggcgctg
3300
tacaatctgt accccggggt gttcgaaact gtggagatgc tgccgtccaa ggccggcatc
3360
tggagagtgg agtgcctgat cggagagcac ctccacgcgg ggatgtccac cctcttcctg
3420
gtgtactcga ataagtgcca gaccccgctg ggcatggcct cgggccacat cagagacttc
3480
cagatcacag caagcggaca atacggccaa tgggcgccga agctggcccg cttgcactac
3540
tccggatcga tcaacgcatg gtccaccaag gaaccgttct cgtggattaa ggtggacctc
3600
ctggccccta tgattatcca cggaattaag acccagggcg ccaggcagaa gttctcctcc
3660
ctgtacatct cgcaattcat catcatgtac agcctggacg ggaagaagtg gcagacttac
3720
aggggaaact ccaccggcac cctgatggtc tttttcggca acgtggattc ctccggcatt
3780
aagcacaaca tcttcaaccc accgatcata gccagatata ttaggctcca ccccactcac
3840
tactcaatcc gctcaactct tcggatggaa ctcatggggt gcgacctgaa ctcctgctcc
3900
atgccgttgg ggatggaatc aaaggctatt agcgacgccc agatcaccgc gagctcctac
3960
ttcactaaca tgttcgccac ctggagcccc tccaaggcca ggctgcactt gcagggacgg
4020
tcaaatgcct ggcggccgca agtgaacaat ccgaaggaat ggcttcaagt ggatttccaa
4080
aagaccatga aagtgaccgg agtcaccacc cagggagtga agtcccttct gacctcgatg
4140
tatgtgaagg agttcctgat tagcagcagc caggacgggc accagtggac cctgttcttc
4200
caaaacggaa aggtcaaggt gttccagggg aaccaggact cgttcacacc cgtggtgaac
4260
tccctggacc ccccactgct gacgcggtac ttgaggattc atcctcagtc ctgggtccat
4320
cagattgcat tgcgaatgga agtcctgggc tgcgaggccc aggacctgta ctga
4374
<210> 72
<211> 4824
<212> ДНК
<213> Искусственная последовательность
<220>
<223> coFVIII-6-XTEN
<400> 72
atgcagattg agctgtccac ttgtttcttc ctgtgcctcc tgcgcttctg tttctccgcc
60
actcgccggt actaccttgg agccgtggag ctttcatggg actacatgca gagcgacctg
120
ggcgaactcc ccgtggatgc cagattcccc ccccgcgtgc caaagtcctt cccctttaac
180
acctccgtgg tgtacaagaa aaccctcttt gtcgagttca ctgaccacct gttcaacatc
240
gccaagccgc gcccaccttg gatgggcctc ctgggaccga ccattcaagc tgaagtgtac
300
gacaccgtgg tgatcaccct gaagaacatg gcgtcccacc ccgtgtccct gcatgcggtc
360
ggagtgtcct actggaaggc ctccgaagga gctgagtacg acgaccagac tagccagcgg
420
gaaaaggagg acgataaagt gttcccgggc ggctcgcata cttacgtgtg gcaagtcctg
480
aaggaaaacg gacctatggc atccgatcct ctgtgcctga cttactccta cctttcccat
540
gtggacctcg tgaaggacct gaacagcggg ctgattggtg cacttctcgt gtgccgcgaa
600
ggttcgctcg ctaaggaaaa gacccagacc ctccataagt tcatcctttt gttcgctgtg
660
ttcgatgaag gaaagtcatg gcattccgaa actaagaact cgctgatgca ggaccgggat
720
gccgcctcag cccgcgcctg gcctaaaatg catacagtca acggatacgt gaatcggtca
780
ctgcccgggc tcatcggttg tcacagaaag tccgtgtact ggcacgtcat cggcatgggc
840
actacgcctg aagtgcactc catcttcctg gaagggcaca ccttcctcgt gcgcaaccac
900
cgccaggcct ctctggaaat ctccccgatt acctttctga ccgcccagac tctgctcatg
960
gacctggggc agttccttct cttctgccac atctccagcc atcagcacga cggaatggag
1020
gcctacgtga aggtggactc atgcccggaa gaacctcagt tgcggatgaa gaacaacgag
1080
gaggccgagg actatgacga cgatttgact gactccgaga tggacgtcgt gcggttcgat
1140
gacgacaaca gccccagctt catccagatt cgcagcgtgg ccaagaagca ccccaaaacc
1200
tgggtgcact acatcgcggc cgaggaagaa gattgggact acgccccgtt ggtgctggca
1260
cccgatgacc ggtcgtacaa gtcccagtat ctgaacaatg gtccgcagcg gattggcaga
1320
aagtacaaga aagtgcggtt catggcgtac actgacgaaa cgtttaagac ccgggaggcc
1380
attcaacatg agagcggcat tctgggacca ctgctgtacg gagaggtcgg cgataccctg
1440
ctcatcatct tcaaaaacca ggcctcccgg ccttacaaca tctaccctca cggaatcacc
1500
gacgtgcggc cactctactc gcggcgcctg ccgaagggcg tcaagcacct gaaagacttc
1560
cctatcctgc cgggcgaaat cttcaagtat aagtggaccg tcaccgtgga ggacgggccc
1620
accaagagcg atcctaggtg tctgactcgg tactactcca gcttcgtgaa catggaacgg
1680
gacctggcat cgggactcat tggaccgctg ctgatctgct acaaagagtc ggtggatcaa
1740
cgcggcaacc agatcatgtc cgacaagcgc aacgtgatcc tgttctccgt gtttgatgaa
1800
aacagatcct ggtacctcac tgaaaacatc cagaggttcc tcccaaaccc cgcaggagtg
1860
caactggagg accctgagtt tcaggcctcg aatatcatgc actcgattaa cggttacgtg
1920
ttcgactcgc tgcagctgag cgtgtgcctc catgaagtcg cttactggta cattctgtcc
1980
atcggcgccc agactgactt cctgagcgtg ttcttttccg gttacacctt taagcacaag
2040
atggtgtacg aagataccct gaccctgttc cctttctccg gcgaaacggt gttcatgtcg
2100
atggagaacc cgggtctgtg gattctggga tgccacaaca gcgactttcg gaaccgcgga
2160
atgactgccc tgctgaaggt gtcctcatgc gacaagaaca ccggagacta ctacgaggac
2220
tcctacgagg atatctcagc ctacctcctg tccaagaaca acgcgatcga gccgcgcagc
2280
ttcagccaga acggcgcgcc aacatcagag agcgccaccc ctgaaagtgg tcccgggagc
2340
gagccagcca catctgggtc ggaaacgcca ggcacaagtg agtctgcaac tcccgagtcc
2400
ggacctggct ccgagcctgc cactagcggc tccgagactc cgggaacttc cgagagcgct
2460
acaccagaaa gcggacccgg aaccagtacc gaacctagcg agggctctgc tccgggcagc
2520
ccagccggct ctcctacatc cacggaggag ggcacttccg aatccgccac cccggagtca
2580
gggccaggat ctgaacccgc tacctcaggc agtgagacgc caggaacgag cgagtccgct
2640
acaccggaga gtgggccagg gagccctgct ggatctccta cgtccactga ggaagggtca
2700
ccagcgggct cgcccaccag cactgaagaa ggtgcctcga gcccgcctgt gctgaagagg
2760
caccagcgag aaattacccg gaccaccctc caatcggatc aggaggaaat cgactacgac
2820
gacaccatct cggtggaaat gaagaaggaa gatttcgata tctacgacga ggacgaaaat
2880
cagtcccctc gctcattcca aaagaaaact agacactact ttatcgccgc ggtggaaaga
2940
ctgtgggact atggaatgtc atccagccct cacgtccttc ggaaccgggc ccagagcgga
3000
tcggtgcctc agttcaagaa agtggtgttc caggagttca ccgacggcag cttcacccag
3060
ccgctgtacc ggggagaact gaacgaacac ctgggcctgc tcggtcccta catccgcgcg
3120
gaagtggagg ataacatcat ggtgaccttc cgtaaccaag catccagacc ttactccttc
3180
tattcctccc tgatctcata cgaggaggac cagcgccaag gcgccgagcc ccgcaagaac
3240
ttcgtcaagc ccaacgagac taagacctac ttctggaagg tccaacacca tatggccccg
3300
accaaggatg agtttgactg caaggcctgg gcctacttct ccgacgtgga ccttgagaag
3360
gatgtccatt ccggcctgat cgggccgctg ctcgtgtgtc acaccaacac cctgaaccca
3420
gcgcatggac gccaggtcac cgtccaggag tttgctctgt tcttcaccat ttttgacgaa
3480
actaagtcct ggtacttcac cgagaatatg gagcgaaact gtagagcgcc ctgcaatatc
3540
cagatggaag atccgacttt caaggagaac tatagattcc acgccatcaa cgggtacatc
3600
atggatactc tgccggggct ggtcatggcc caggatcaga ggattcggtg gtacttgctg
3660
tcaatgggat cgaacgaaaa cattcactcc attcacttct ccggtcacgt gttcactgtg
3720
cgcaagaagg aggagtacaa gatggcgctg tacaatctgt accccggggt gttcgaaact
3780
gtggagatgc tgccgtccaa ggccggcatc tggagagtgg agtgcctgat cggagagcac
3840
ctccacgcgg ggatgtccac cctcttcctg gtgtactcga ataagtgcca gaccccgctg
3900
ggcatggcct cgggccacat cagagacttc cagatcacag caagcggaca atacggccaa
3960
tgggcgccga agctggcccg cttgcactac tccggatcga tcaacgcatg gtccaccaag
4020
gaaccgttct cgtggattaa ggtggacctc ctggccccta tgattatcca cggaattaag
4080
acccagggcg ccaggcagaa gttctcctcc ctgtacatct cgcaattcat catcatgtac
4140
agcctggacg ggaagaagtg gcagacttac aggggaaact ccaccggcac cctgatggtc
4200
tttttcggca acgtggattc ctccggcatt aagcacaaca tcttcaaccc accgatcata
4260
gccagatata ttaggctcca ccccactcac tactcaatcc gctcaactct tcggatggaa
4320
ctcatggggt gcgacctgaa ctcctgctcc atgccgttgg ggatggaatc aaaggctatt
4380
agcgacgccc agatcaccgc gagctcctac ttcactaaca tgttcgccac ctggagcccc
4440
tccaaggcca ggctgcactt gcagggacgg tcaaatgcct ggcggccgca agtgaacaat
4500
ccgaaggaat ggcttcaagt ggatttccaa aagaccatga aagtgaccgg agtcaccacc
4560
cagggagtga agtcccttct gacctcgatg tatgtgaagg agttcctgat tagcagcagc
4620
caggacgggc accagtggac cctgttcttc caaaacggaa aggtcaaggt gttccagggg
4680
aaccaggact cgttcacacc cgtggtgaac tccctggacc ccccactgct gacgcggtac
4740
ttgaggattc atcctcagtc ctgggtccat cagattgcat tgcgaatgga agtcctgggc
4800
tgcgaggccc aggacctgta ctga
4824
<210> 73
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мотив AD
<400> 73
Gly Glu Ser Pro Gly Gly Ser Ser Gly Ser Glu Ser
1. 5 10
<210> 74
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мотив AD
<400> 74
Gly Ser Glu Gly Ser Ser Gly Pro Gly Glu Ser Ser
1. 5 10
<210> 75
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мотив AD
<400> 75
Gly Ser Ser Glu Ser Gly Ser Ser Glu Gly Gly Pro
1. 5 10
<210> 76
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мотив AD
<400> 76
Gly Ser Gly Gly Glu Pro Ser Glu Ser Gly Ser Ser
1. 5 10
<210> 77
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мотив AE, AM
<400> 77
Gly Ser Pro Ala Gly Ser Pro Thr Ser Thr Glu Glu
1. 5 10
<210> 78
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мотив AE, AM, AQ
<400> 78
Gly Ser Glu Pro Ala Thr Ser Gly Ser Glu Thr Pro
1. 5 10
<210> 79
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мотив AE, AM, AQ
<400> 79
Gly Thr Ser Glu Ser Ala Thr Pro Glu Ser Gly Pro
1. 5 10
<210> 80
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мотив AE, AM, AQ
<400> 80
Gly Thr Ser Thr Glu Pro Ser Glu Gly Ser Ala Pro
1. 5 10
<210> 81
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мотив AF, AM
<400> 81
Gly Ser Thr Ser Glu Ser Pro Ser Gly Thr Ala Pro
1. 5 10
<210> 82
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мотив AF, AM
<400> 82
Gly Thr Ser Thr Pro Glu Ser Gly Ser Ala Ser Pro
1. 5 10
<210> 83
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мотив AF, AM
<400> 83
Gly Thr Ser Pro Ser Gly Glu Ser Ser Thr Ala Pro
1. 5 10
<210> 84
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мотив AF, AM
<400> 84
Gly Ser Thr Ser Ser Thr Ala Glu Ser Pro Gly Pro
1. 5 10
<210> 85
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мотив AG, AM
<400> 85
Gly Thr Pro Gly Ser Gly Thr Ala Ser Ser Ser Pro
1. 5 10
<210> 86
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мотив AG, AM
<400> 86
Gly Ser Ser Thr Pro Ser Gly Ala Thr Gly Ser Pro
1. 5 10
<210> 87
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мотив AG, AM
<400> 87
Gly Ser Ser Pro Ser Ala Ser Thr Gly Thr Gly Pro
1. 5 10
<210> 88
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мотив AG, AM
<400> 88
Gly Ala Ser Pro Gly Thr Ser Ser Thr Gly Ser Pro
1. 5 10
<210> 89
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мотив AQ
<400> 89
Gly Glu Pro Ala Gly Ser Pro Thr Ser Thr Ser Glu
1. 5 10
<210> 90
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мотив AQ
<400> 90
Gly Thr Gly Glu Pro Ser Ser Thr Pro Ala Ser Glu
1. 5 10
<210> 91
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мотив AQ
<400> 91
Gly Ser Gly Pro Ser Thr Glu Ser Ala Pro Thr Glu
1. 5 10
<210> 92
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мотив AQ
<400> 92
Gly Ser Glu Thr Pro Ser Gly Pro Ser Glu Thr Ala
1. 5 10
<210> 93
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мотив AQ
<400> 93
Gly Pro Ser Glu Thr Ser Thr Ser Glu Pro Gly Ala
1. 5 10
<210> 94
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мотив AQ
<400> 94
Gly Ser Pro Ser Glu Pro Thr Glu Gly Thr Ser Ala
1. 5 10
<210> 95
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мотив BD
<400> 95
Gly Ser Gly Ala Ser Glu Pro Thr Ser Thr Glu Pro
1. 5 10
<210> 96
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мотив BD
<400> 96
Gly Ser Glu Pro Ala Thr Ser Gly Thr Glu Pro Ser
1. 5 10
<210> 97
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мотив BD
<400> 97
Gly Thr Ser Glu Pro Ser Thr Ser Glu Pro Gly Ala
1. 5 10
<210> 98
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мотив BD
<400> 98
Gly Thr Ser Thr Glu Pro Ser Glu Pro Gly Ser Ala
1. 5 10
<210> 99
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мотив BD
<400> 99
Gly Ser Thr Ala Gly Ser Glu Thr Ser Thr Glu Ala
1. 5 10
<210> 100
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мотив BD
<400> 100
Gly Ser Glu Thr Ala Thr Ser Gly Ser Glu Thr Ala
1. 5 10
<210> 101
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мотив BD
<400> 101
Gly Thr Ser Glu Ser Ala Thr Ser Glu Ser Gly Ala
1. 5 10
<210> 102
<211> 12
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Мотив BD
<400> 102
Gly Thr Ser Thr Glu Ala Ser Glu Gly Ser Ala Ser
1. 5 10
<210> 103
<211> 1607
<212> БЕЛОК
<213> Искусственная последовательность
<220>
<223> Последовательность белка coFVIII-6-XTEN
<400> 103
Met Gln Ile Glu Leu Ser Thr Cys Phe Phe Leu Cys Leu Leu Arg Phe
1. 5 10 15
Cys Phe Ser Ala Thr Arg Arg Tyr Tyr Leu Gly Ala Val Glu Leu Ser
20 25 30
Trp Asp Tyr Met Gln Ser Asp Leu Gly Glu Leu Pro Val Asp Ala Arg
35 40 45
Phe Pro Pro Arg Val Pro Lys Ser Phe Pro Phe Asn Thr Ser Val Val
50 55 60
Tyr Lys Lys Thr Leu Phe Val Glu Phe Thr Asp His Leu Phe Asn Ile
65 70 75 80
Ala Lys Pro Arg Pro Pro Trp Met Gly Leu Leu Gly Pro Thr Ile Gln
85 90 95
Ala Glu Val Tyr Asp Thr Val Val Ile Thr Leu Lys Asn Met Ala Ser
100 105 110
His Pro Val Ser Leu His Ala Val Gly Val Ser Tyr Trp Lys Ala Ser
115 120 125
Glu Gly Ala Glu Tyr Asp Asp Gln Thr Ser Gln Arg Glu Lys Glu Asp
130 135 140
Asp Lys Val Phe Pro Gly Gly Ser His Thr Tyr Val Trp Gln Val Leu
145 150 155 160
Lys Glu Asn Gly Pro Met Ala Ser Asp Pro Leu Cys Leu Thr Tyr Ser
165 170 175
Tyr Leu Ser His Val Asp Leu Val Lys Asp Leu Asn Ser Gly Leu Ile
180 185 190
Gly Ala Leu Leu Val Cys Arg Glu Gly Ser Leu Ala Lys Glu Lys Thr
195 200 205
Gln Thr Leu His Lys Phe Ile Leu Leu Phe Ala Val Phe Asp Glu Gly
210 215 220
Lys Ser Trp His Ser Glu Thr Lys Asn Ser Leu Met Gln Asp Arg Asp
225 230 235 240
Ala Ala Ser Ala Arg Ala Trp Pro Lys Met His Thr Val Asn Gly Tyr
245 250 255
Val Asn Arg Ser Leu Pro Gly Leu Ile Gly Cys His Arg Lys Ser Val
260 265 270
Tyr Trp His Val Ile Gly Met Gly Thr Thr Pro Glu Val His Ser Ile
275 280 285
Phe Leu Glu Gly His Thr Phe Leu Val Arg Asn His Arg Gln Ala Ser
290 295 300
Leu Glu Ile Ser Pro Ile Thr Phe Leu Thr Ala Gln Thr Leu Leu Met
305 310 315 320
Asp Leu Gly Gln Phe Leu Leu Phe Cys His Ile Ser Ser His Gln His
325 330 335
Asp Gly Met Glu Ala Tyr Val Lys Val Asp Ser Cys Pro Glu Glu Pro
340 345 350
Gln Leu Arg Met Lys Asn Asn Glu Glu Ala Glu Asp Tyr Asp Asp Asp
355 360 365
Leu Thr Asp Ser Glu Met Asp Val Val Arg Phe Asp Asp Asp Asn Ser
370 375 380
Pro Ser Phe Ile Gln Ile Arg Ser Val Ala Lys Lys His Pro Lys Thr
385 390 395 400
Trp Val His Tyr Ile Ala Ala Glu Glu Glu Asp Trp Asp Tyr Ala Pro
405 410 415
Leu Val Leu Ala Pro Asp Asp Arg Ser Tyr Lys Ser Gln Tyr Leu Asn
420 425 430
Asn Gly Pro Gln Arg Ile Gly Arg Lys Tyr Lys Lys Val Arg Phe Met
435 440 445
Ala Tyr Thr Asp Glu Thr Phe Lys Thr Arg Glu Ala Ile Gln His Glu
450 455 460
Ser Gly Ile Leu Gly Pro Leu Leu Tyr Gly Glu Val Gly Asp Thr Leu
465 470 475 480
Leu Ile Ile Phe Lys Asn Gln Ala Ser Arg Pro Tyr Asn Ile Tyr Pro
485 490 495
His Gly Ile Thr Asp Val Arg Pro Leu Tyr Ser Arg Arg Leu Pro Lys
500 505 510
Gly Val Lys His Leu Lys Asp Phe Pro Ile Leu Pro Gly Glu Ile Phe
515 520 525
Lys Tyr Lys Trp Thr Val Thr Val Glu Asp Gly Pro Thr Lys Ser Asp
530 535 540
Pro Arg Cys Leu Thr Arg Tyr Tyr Ser Ser Phe Val Asn Met Glu Arg
545 550 555 560
Asp Leu Ala Ser Gly Leu Ile Gly Pro Leu Leu Ile Cys Tyr Lys Glu
565 570 575
Ser Val Asp Gln Arg Gly Asn Gln Ile Met Ser Asp Lys Arg Asn Val
580 585 590
Ile Leu Phe Ser Val Phe Asp Glu Asn Arg Ser Trp Tyr Leu Thr Glu
595 600 605
Asn Ile Gln Arg Phe Leu Pro Asn Pro Ala Gly Val Gln Leu Glu Asp
610 615 620
Pro Glu Phe Gln Ala Ser Asn Ile Met His Ser Ile Asn Gly Tyr Val
625 630 635 640
Phe Asp Ser Leu Gln Leu Ser Val Cys Leu His Glu Val Ala Tyr Trp
645 650 655
Tyr Ile Leu Ser Ile Gly Ala Gln Thr Asp Phe Leu Ser Val Phe Phe
660 665 670
Ser Gly Tyr Thr Phe Lys His Lys Met Val Tyr Glu Asp Thr Leu Thr
675 680 685
Leu Phe Pro Phe Ser Gly Glu Thr Val Phe Met Ser Met Glu Asn Pro
690 695 700
Gly Leu Trp Ile Leu Gly Cys His Asn Ser Asp Phe Arg Asn Arg Gly
705 710 715 720
Met Thr Ala Leu Leu Lys Val Ser Ser Cys Asp Lys Asn Thr Gly Asp
725 730 735
Tyr Tyr Glu Asp Ser Tyr Glu Asp Ile Ser Ala Tyr Leu Leu Ser Lys
740 745 750
Asn Asn Ala Ile Glu Pro Arg Ser Phe Ser Gln Asn Gly Ala Pro Thr
755 760 765
Ser Glu Ser Ala Thr Pro Glu Ser Gly Pro Gly Ser Glu Pro Ala Thr
770 775 780
Ser Gly Ser Glu Thr Pro Gly Thr Ser Glu Ser Ala Thr Pro Glu Ser
785 790 795 800
Gly Pro Gly Ser Glu Pro Ala Thr Ser Gly Ser Glu Thr Pro Gly Thr
805 810 815
Ser Glu Ser Ala Thr Pro Glu Ser Gly Pro Gly Thr Ser Thr Glu Pro
820 825 830
Ser Glu Gly Ser Ala Pro Gly Ser Pro Ala Gly Ser Pro Thr Ser Thr
835 840 845
Glu Glu Gly Thr Ser Glu Ser Ala Thr Pro Glu Ser Gly Pro Gly Ser
850 855 860
Glu Pro Ala Thr Ser Gly Ser Glu Thr Pro Gly Thr Ser Glu Ser Ala
865 870 875 880
Thr Pro Glu Ser Gly Pro Gly Ser Pro Ala Gly Ser Pro Thr Ser Thr
885 890 895
Glu Glu Gly Ser Pro Ala Gly Ser Pro Thr Ser Thr Glu Glu Gly Ala
900 905 910
Ser Ser Pro Pro Val Leu Lys Arg His Gln Arg Glu Ile Thr Arg Thr
915 920 925
Thr Leu Gln Ser Asp Gln Glu Glu Ile Asp Tyr Asp Asp Thr Ile Ser
930 935 940
Val Glu Met Lys Lys Glu Asp Phe Asp Ile Tyr Asp Glu Asp Glu Asn
945 950 955 960
Gln Ser Pro Arg Ser Phe Gln Lys Lys Thr Arg His Tyr Phe Ile Ala
965 970 975
Ala Val Glu Arg Leu Trp Asp Tyr Gly Met Ser Ser Ser Pro His Val
980 985 990
Leu Arg Asn Arg Ala Gln Ser Gly Ser Val Pro Gln Phe Lys Lys Val
995 1000 1005
Val Phe Gln Glu Phe Thr Asp Gly Ser Phe Thr Gln Pro Leu Tyr
1010 1015 1020
Arg Gly Glu Leu Asn Glu His Leu Gly Leu Leu Gly Pro Tyr Ile
1025 1030 1035
Arg Ala Glu Val Glu Asp Asn Ile Met Val Thr Phe Arg Asn Gln
1040 1045 1050
Ala Ser Arg Pro Tyr Ser Phe Tyr Ser Ser Leu Ile Ser Tyr Glu
1055 1060 1065
Glu Asp Gln Arg Gln Gly Ala Glu Pro Arg Lys Asn Phe Val Lys
1070 1075 1080
Pro Asn Glu Thr Lys Thr Tyr Phe Trp Lys Val Gln His His Met
1085 1090 1095
Ala Pro Thr Lys Asp Glu Phe Asp Cys Lys Ala Trp Ala Tyr Phe
1100 1105 1110
Ser Asp Val Asp Leu Glu Lys Asp Val His Ser Gly Leu Ile Gly
1115 1120 1125
Pro Leu Leu Val Cys His Thr Asn Thr Leu Asn Pro Ala His Gly
1130 1135 1140
Arg Gln Val Thr Val Gln Glu Phe Ala Leu Phe Phe Thr Ile Phe
1145 1150 1155
Asp Glu Thr Lys Ser Trp Tyr Phe Thr Glu Asn Met Glu Arg Asn
1160 1165 1170
Cys Arg Ala Pro Cys Asn Ile Gln Met Glu Asp Pro Thr Phe Lys
1175 1180 1185
Glu Asn Tyr Arg Phe His Ala Ile Asn Gly Tyr Ile Met Asp Thr
1190 1195 1200
Leu Pro Gly Leu Val Met Ala Gln Asp Gln Arg Ile Arg Trp Tyr
1205 1210 1215
Leu Leu Ser Met Gly Ser Asn Glu Asn Ile His Ser Ile His Phe
1220 1225 1230
Ser Gly His Val Phe Thr Val Arg Lys Lys Glu Glu Tyr Lys Met
1235 1240 1245
Ala Leu Tyr Asn Leu Tyr Pro Gly Val Phe Glu Thr Val Glu Met
1250 1255 1260
Leu Pro Ser Lys Ala Gly Ile Trp Arg Val Glu Cys Leu Ile Gly
1265 1270 1275
Glu His Leu His Ala Gly Met Ser Thr Leu Phe Leu Val Tyr Ser
1280 1285 1290
Asn Lys Cys Gln Thr Pro Leu Gly Met Ala Ser Gly His Ile Arg
1295 1300 1305
Asp Phe Gln Ile Thr Ala Ser Gly Gln Tyr Gly Gln Trp Ala Pro
1310 1315 1320
Lys Leu Ala Arg Leu His Tyr Ser Gly Ser Ile Asn Ala Trp Ser
1325 1330 1335
Thr Lys Glu Pro Phe Ser Trp Ile Lys Val Asp Leu Leu Ala Pro
1340 1345 1350
Met Ile Ile His Gly Ile Lys Thr Gln Gly Ala Arg Gln Lys Phe
1355 1360 1365
Ser Ser Leu Tyr Ile Ser Gln Phe Ile Ile Met Tyr Ser Leu Asp
1370 1375 1380
Gly Lys Lys Trp Gln Thr Tyr Arg Gly Asn Ser Thr Gly Thr Leu
1385 1390 1395
Met Val Phe Phe Gly Asn Val Asp Ser Ser Gly Ile Lys His Asn
1400 1405 1410
Ile Phe Asn Pro Pro Ile Ile Ala Arg Tyr Ile Arg Leu His Pro
1415 1420 1425
Thr His Tyr Ser Ile Arg Ser Thr Leu Arg Met Glu Leu Met Gly
1430 1435 1440
Cys Asp Leu Asn Ser Cys Ser Met Pro Leu Gly Met Glu Ser Lys
1445 1450 1455
Ala Ile Ser Asp Ala Gln Ile Thr Ala Ser Ser Tyr Phe Thr Asn
1460 1465 1470
Met Phe Ala Thr Trp Ser Pro Ser Lys Ala Arg Leu His Leu Gln
1475 1480 1485
Gly Arg Ser Asn Ala Trp Arg Pro Gln Val Asn Asn Pro Lys Glu
1490 1495 1500
Trp Leu Gln Val Asp Phe Gln Lys Thr Met Lys Val Thr Gly Val
1505 1510 1515
Thr Thr Gln Gly Val Lys Ser Leu Leu Thr Ser Met Tyr Val Lys
1520 1525 1530
Glu Phe Leu Ile Ser Ser Ser Gln Asp Gly His Gln Trp Thr Leu
1535 1540 1545
Phe Phe Gln Asn Gly Lys Val Lys Val Phe Gln Gly Asn Gln Asp
1550 1555 1560
Ser Phe Thr Pro Val Val Asn Ser Leu Asp Pro Pro Leu Leu Thr
1565 1570 1575
Arg Tyr Leu Arg Ile His Pro Gln Ser Trp Val His Gln Ile Ala
1580 1585 1590
Leu Arg Met Glu Val Leu Gly Cys Glu Ala Gln Asp Leu Tyr
1595 1600 1605
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| МОЛЕКУЛЫ НУКЛЕИНОВОЙ КИСЛОТЫ И ПУТИ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2819144C2 |
| МОЛЕКУЛЫ НУКЛЕИНОВОЙ КИСЛОТЫ И ПУТИ ИХ ПРИМЕНЕНИЯ ДЛЯ НЕВИРУСНОЙ ГЕННОЙ ТЕРАПИИ | 2019 |
|
RU2834625C2 |
| ГЕННАЯ ТЕРАПИЯ ДЛЯ ЛЕЧЕНИЯ ГЕМОФИЛИИ A | 2017 |
|
RU2762257C2 |
| УЛУЧШЕНИЕ КЛИНИЧЕСКИХ ПАРАМЕТРОВ ПОСРЕДСТВОМ ЭКСПРЕССИИ ФАКТОРА VIII | 2019 |
|
RU2799048C2 |
| Выделенная нуклеиновая кислота, которая кодирует слитый белок на основе FVIII-BDD и гетерологичного сигнального пептида, и ее применение | 2022 |
|
RU2818229C2 |
| СПОСОБЫ ГЕНОТЕРАПИИ С ИСПОЛЬЗОВАНИЕМ ГЕНА ФАКТОРА VIII (FVIII) | 2018 |
|
RU2808274C2 |
| СПОСОБЫ ЛЕЧЕНИЯ ГЕМОФИЛИИ A | 2019 |
|
RU2812863C2 |
| КОДИРУЮЩИЕ ФАКТОР VIII ВАРИАНТЫ С ПОНИЖЕННЫМ СОДЕРЖАНИЕМ CPG, КОМПОЗИЦИИ И СПОСОБЫ И ПРИМЕНЕНИЕ В ЛЕЧЕНИИ НАРУШЕНИЙ ГЕМОСТАЗА | 2016 |
|
RU2745506C2 |
| АНТИТЕЛО, КОТОРОЕ ОБЛАДАЕТ СПОСОБНОСТЬЮ НЕЙТРАЛИЗОВАТЬ СУБСТАНЦИЮ, ОБЛАДАЮЩУЮ АКТИВНОСТЬЮ, АЛЬТЕРНАТИВНОЙ ФУНКЦИИ ФАКТОРА СВЕРТЫВАНИЯ VIII (FVIII) | 2015 |
|
RU2737145C2 |
| ГЛИКОЗИЛИРОВАННЫЕ СЛИТЫЕ БЕЛКИ VWF С УЛУЧШЕННОЙ ФАРМАКОКИНЕТИКОЙ | 2017 |
|
RU2782212C2 |










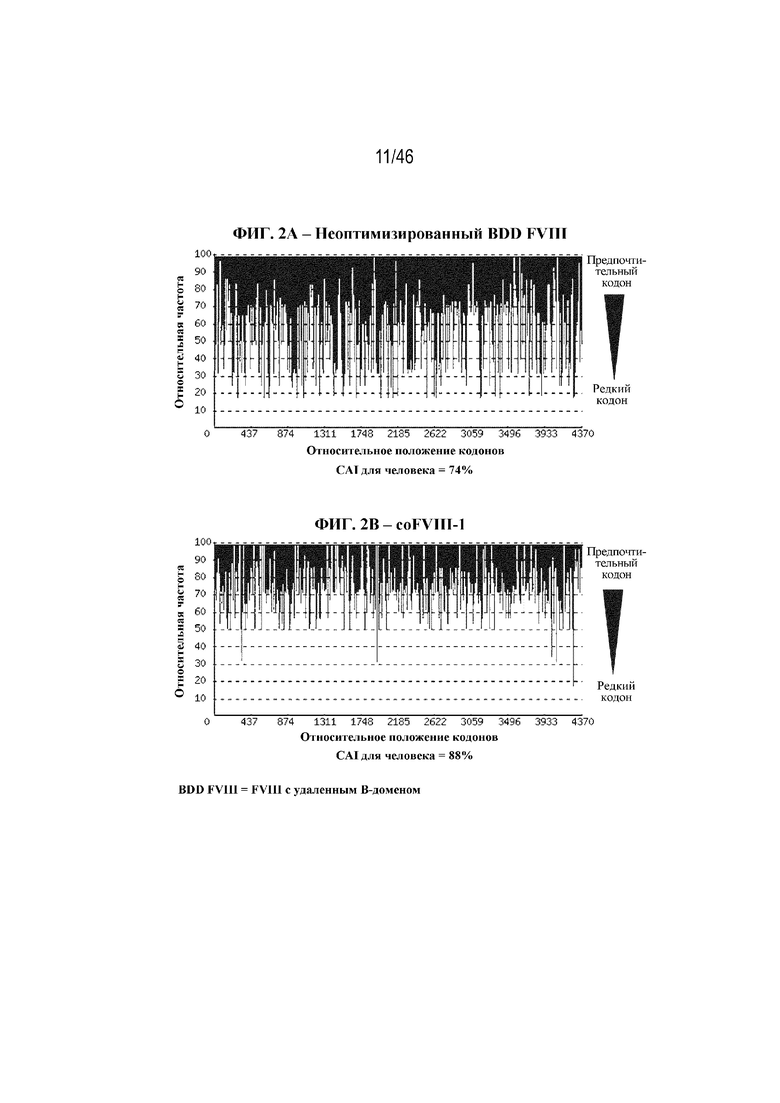
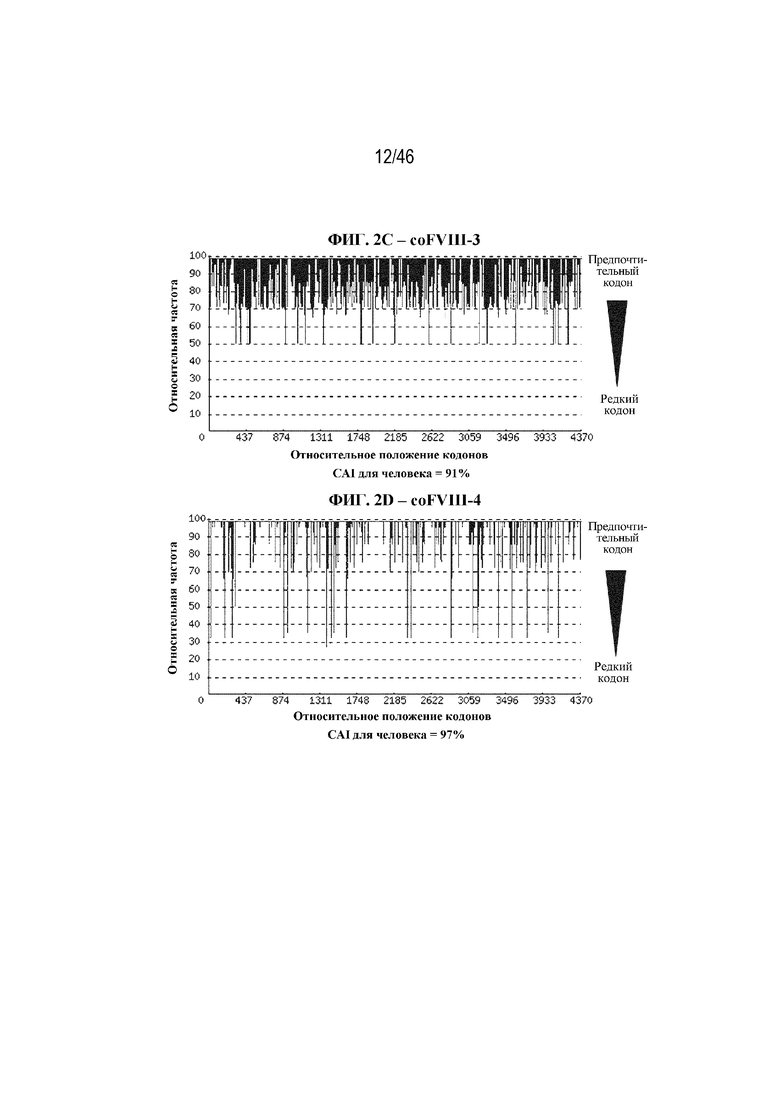
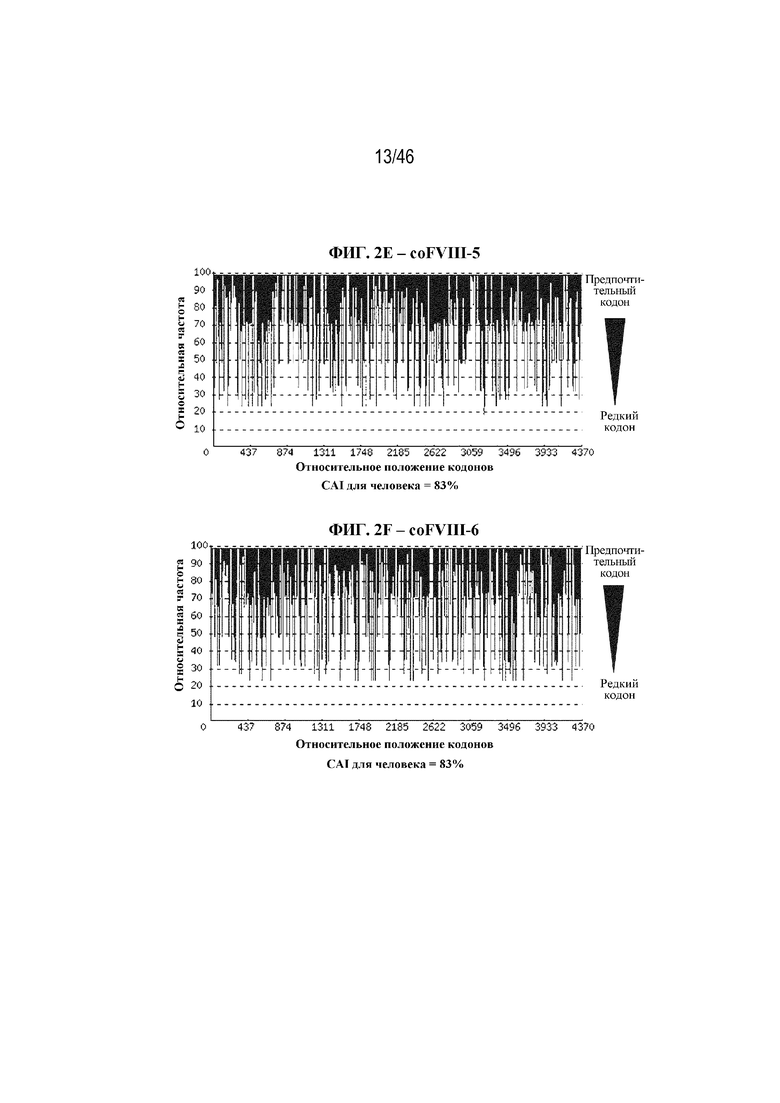
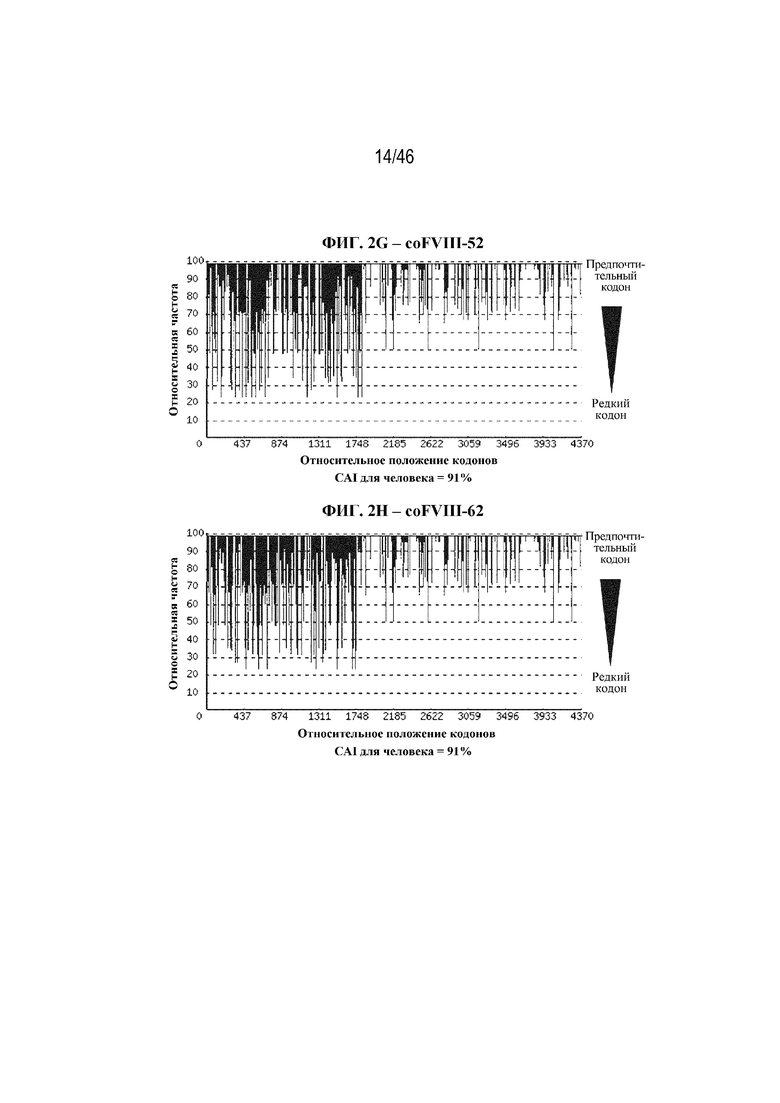
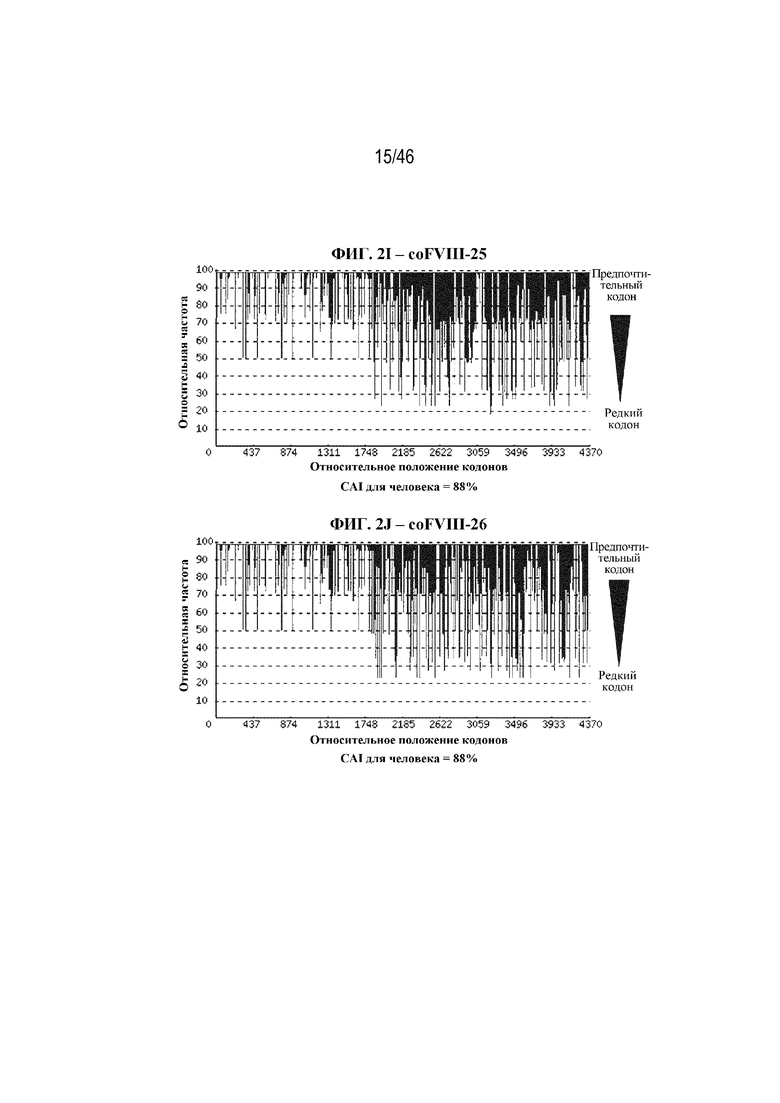
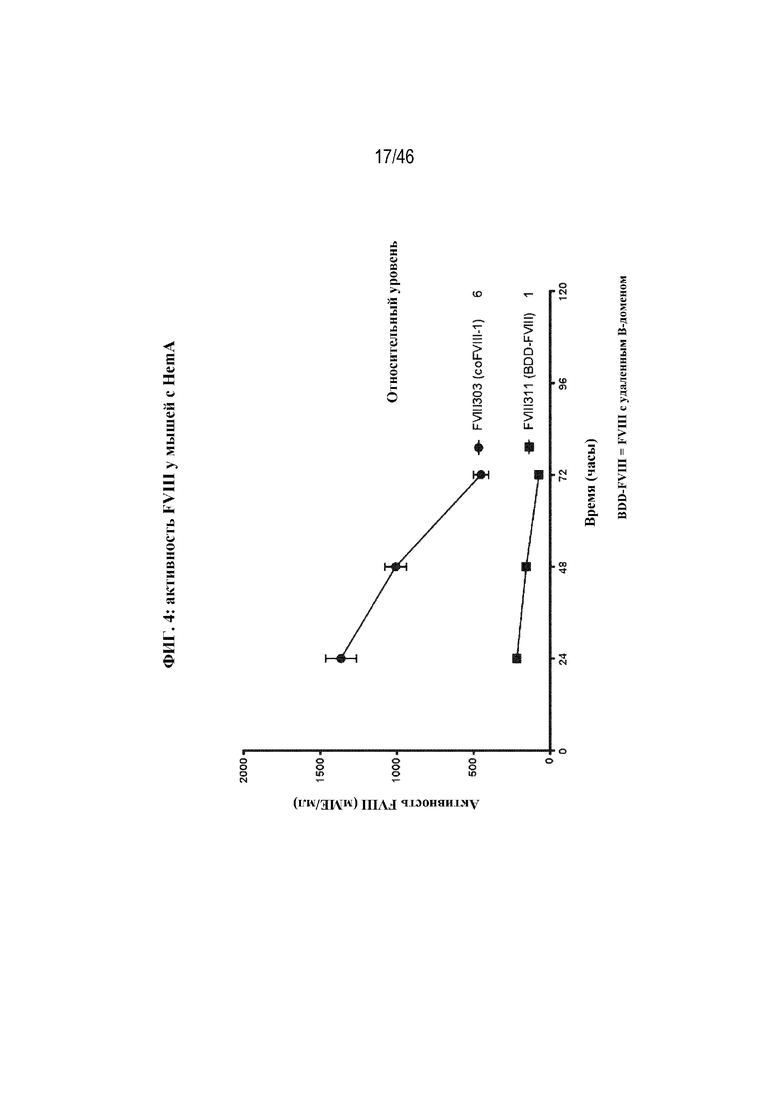
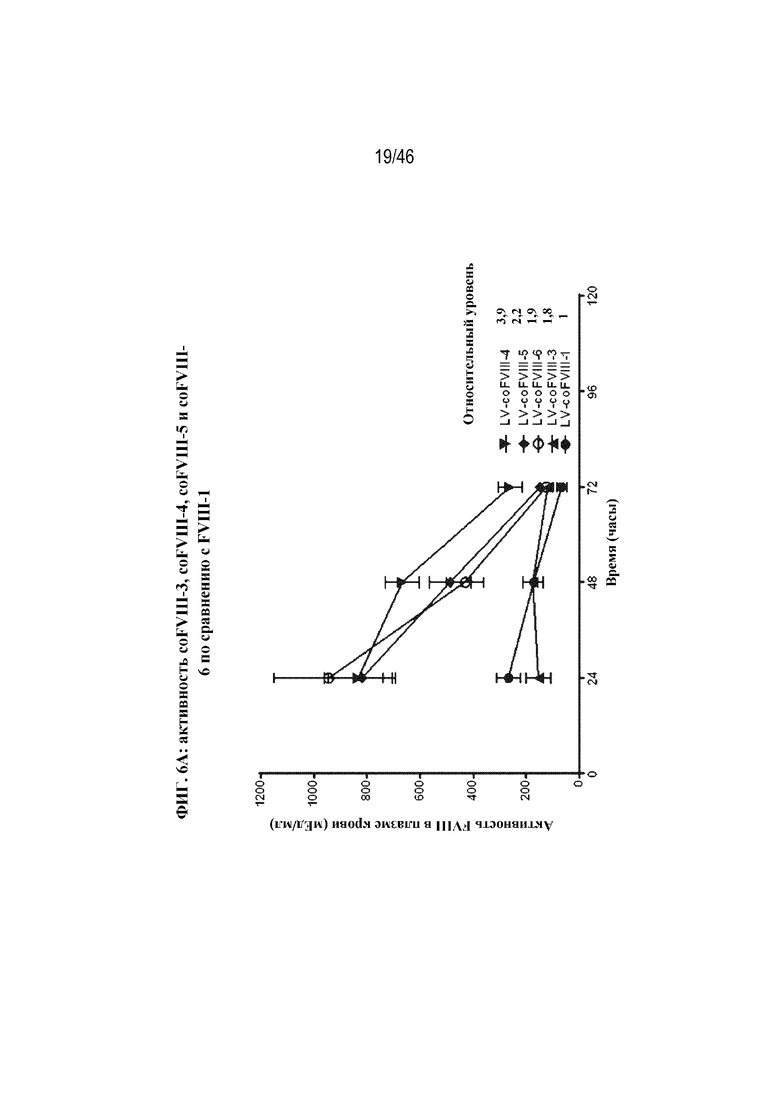
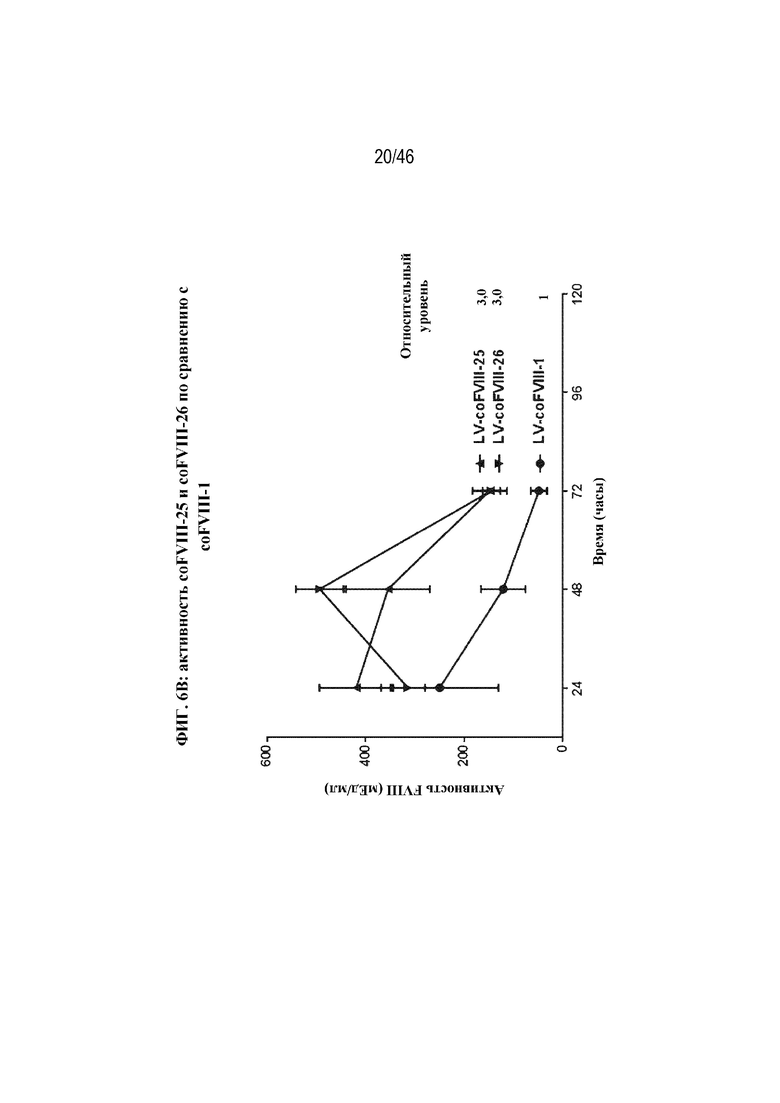
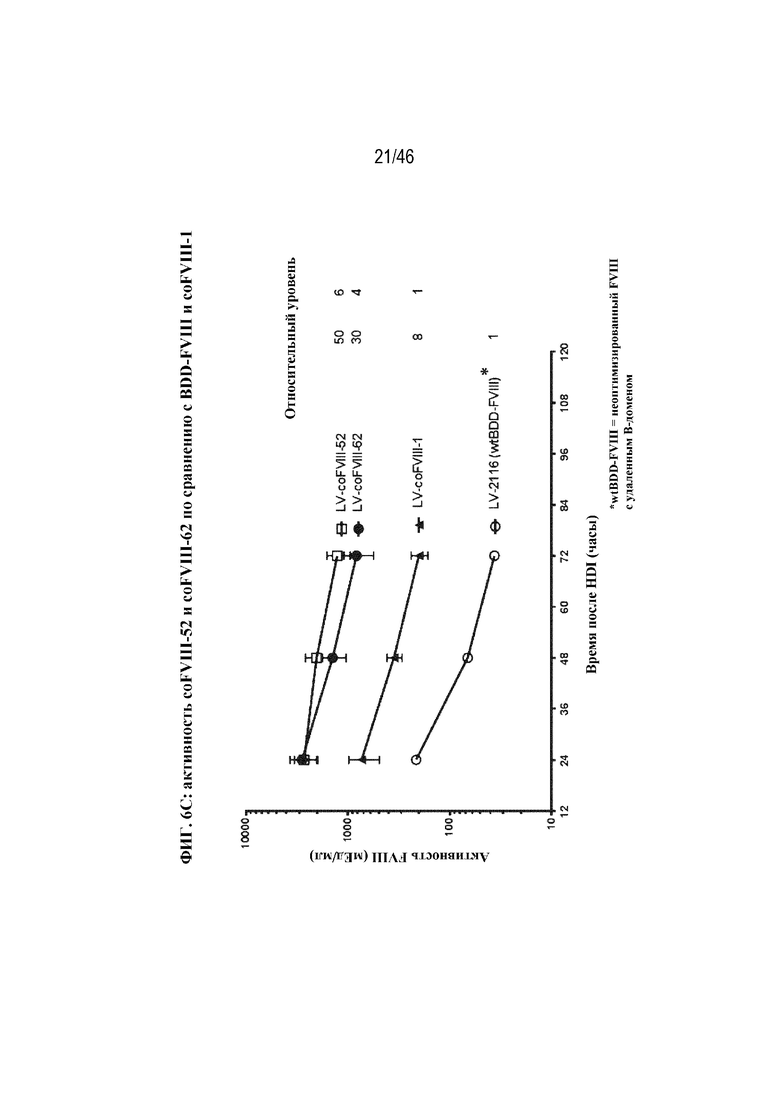
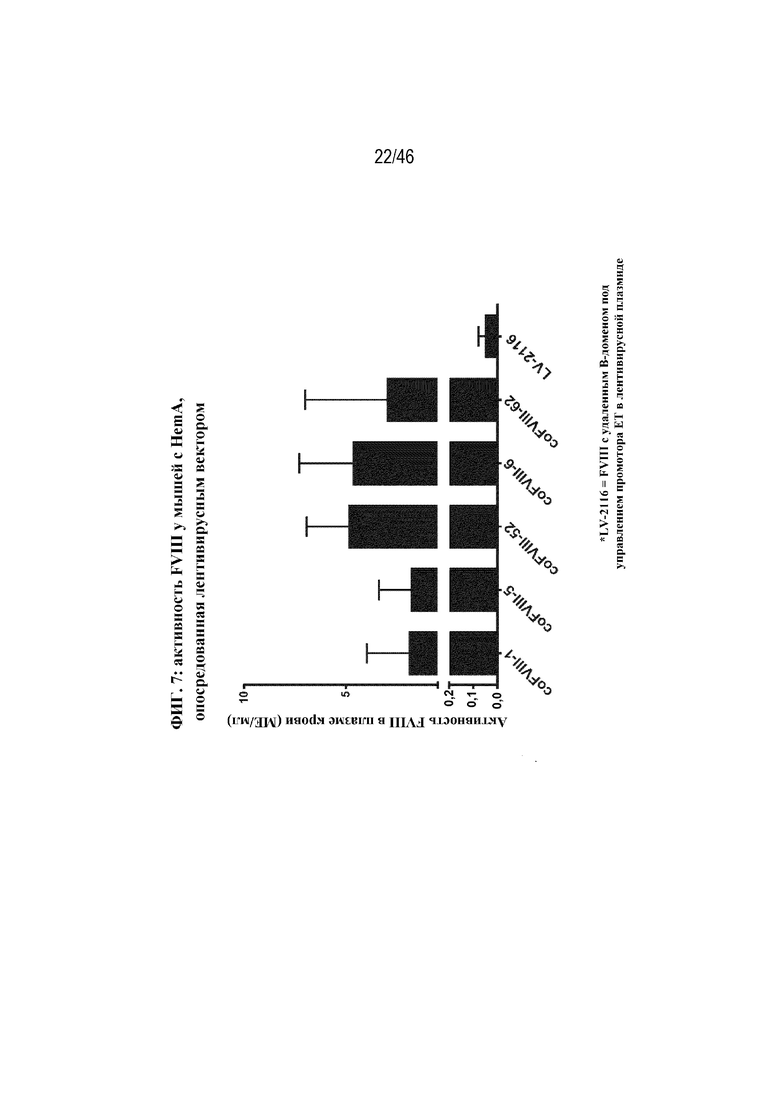



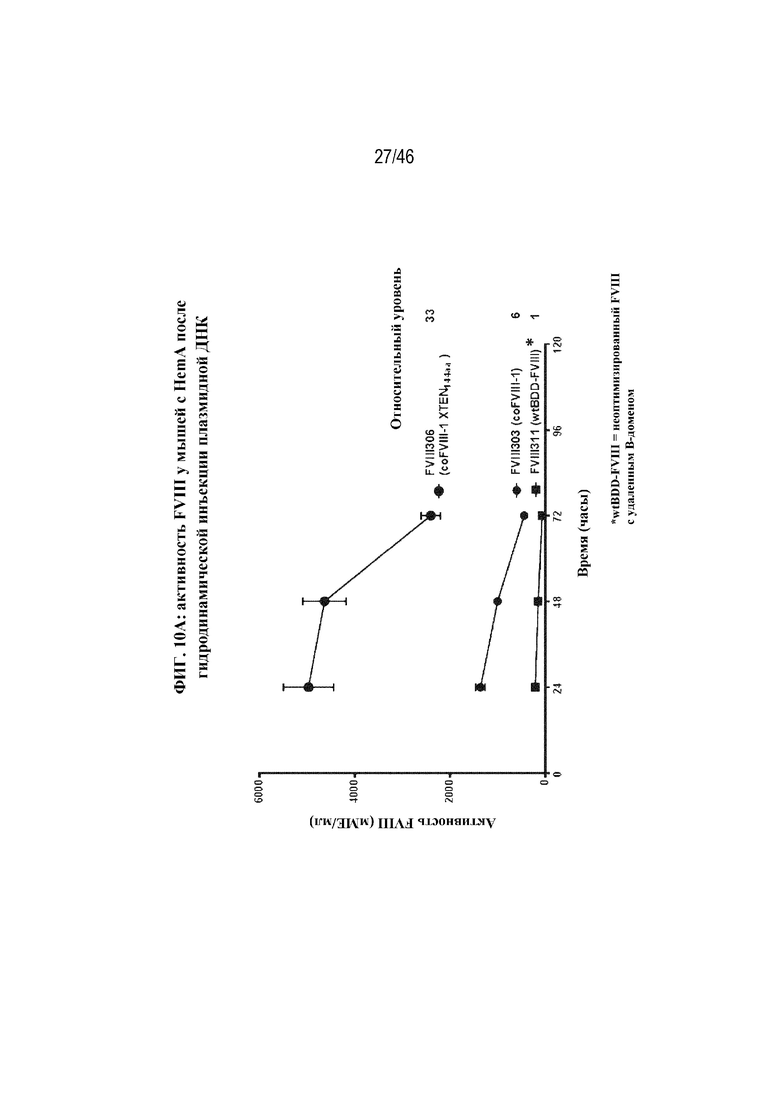
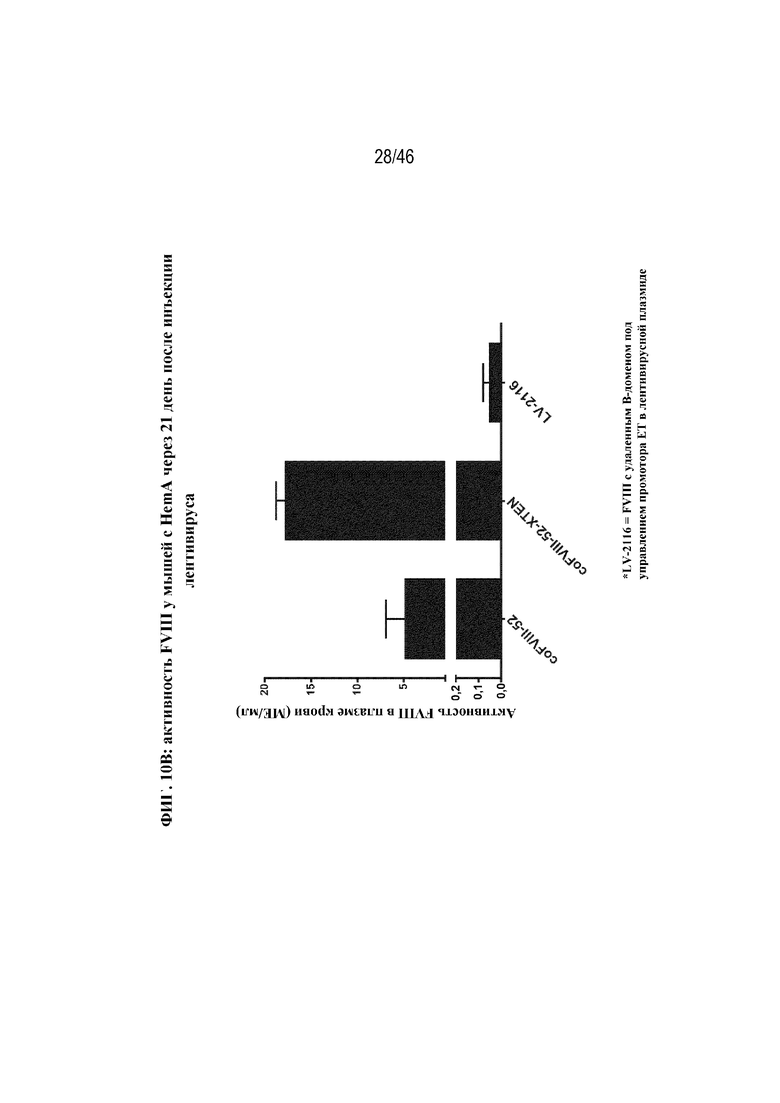






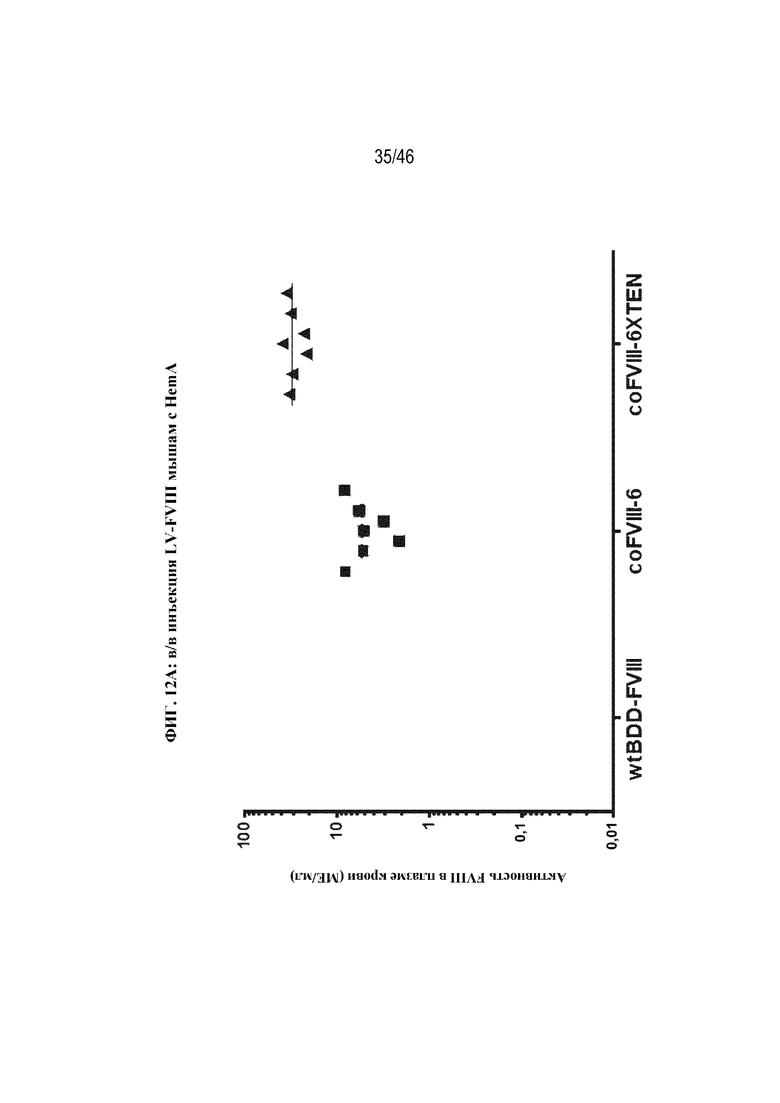
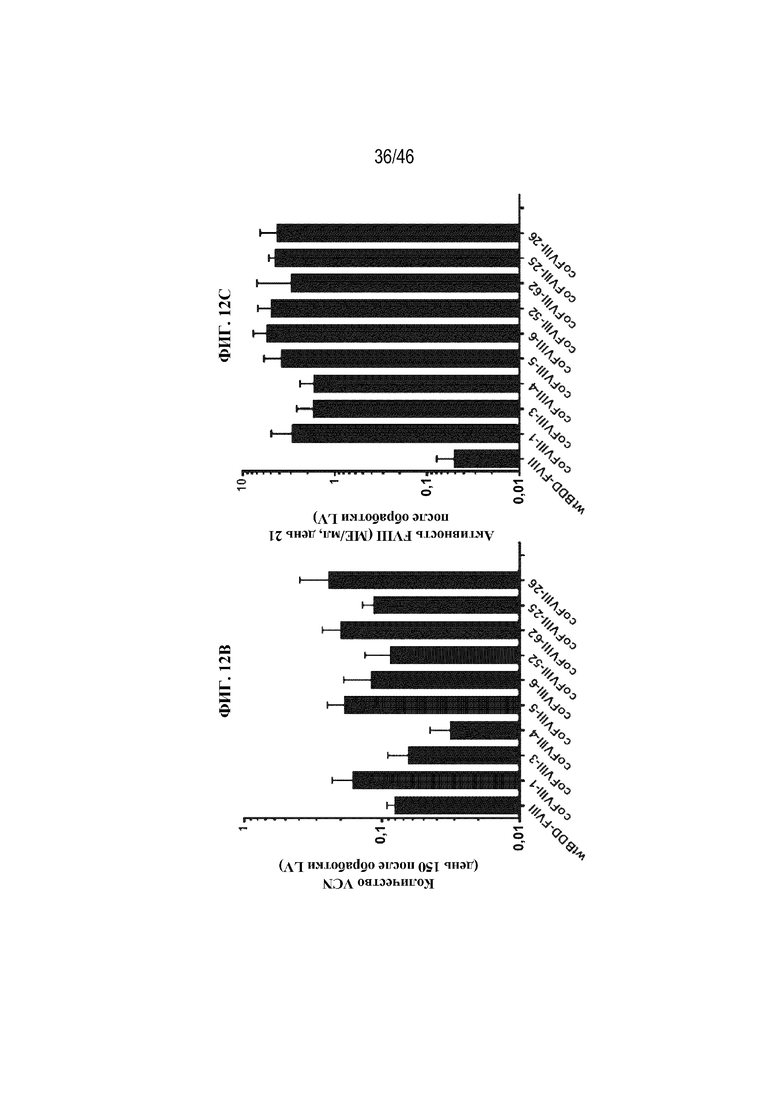
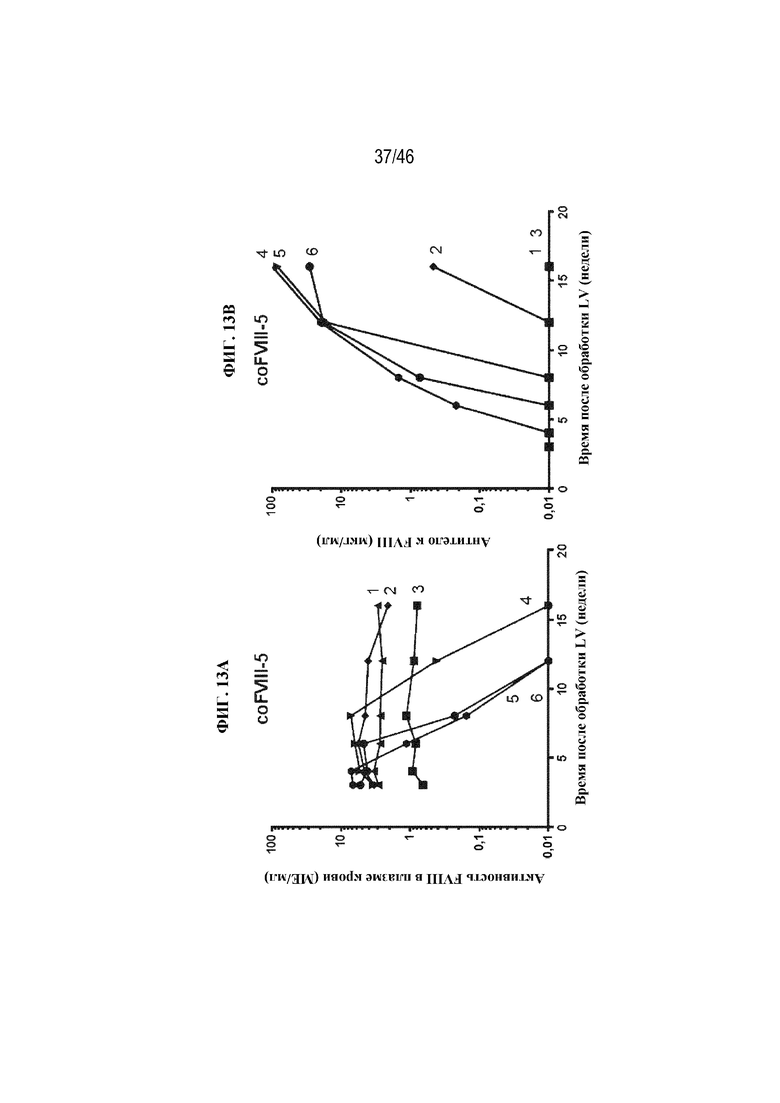
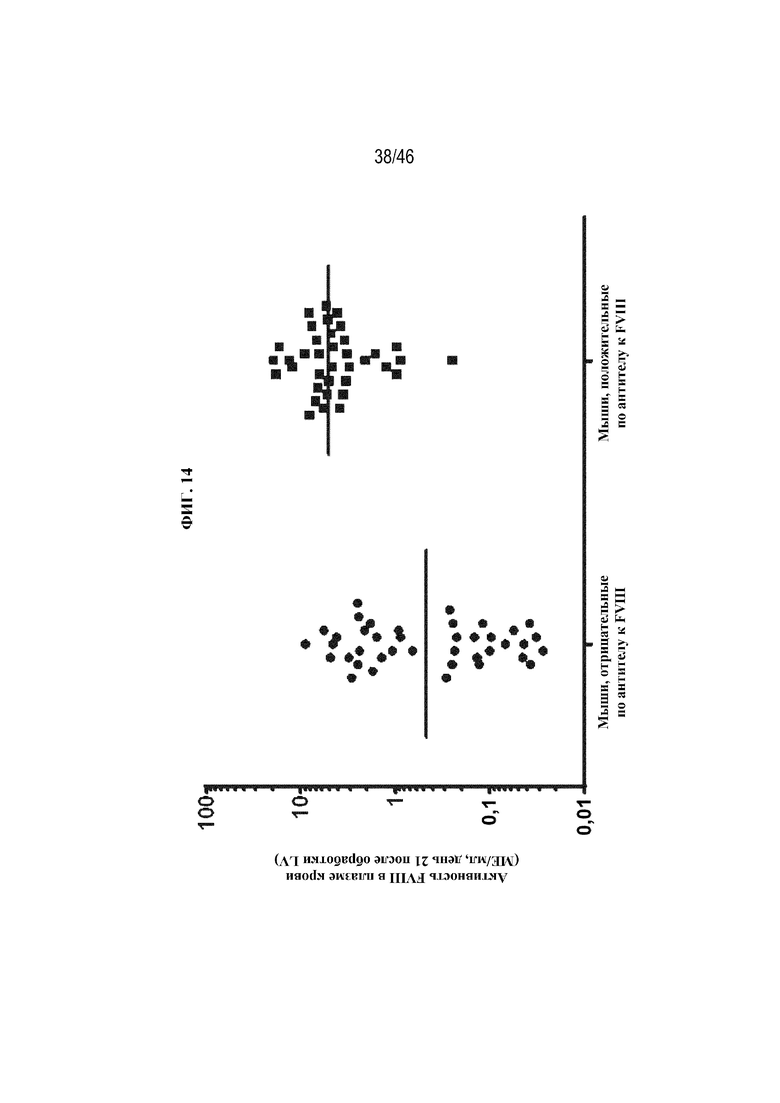
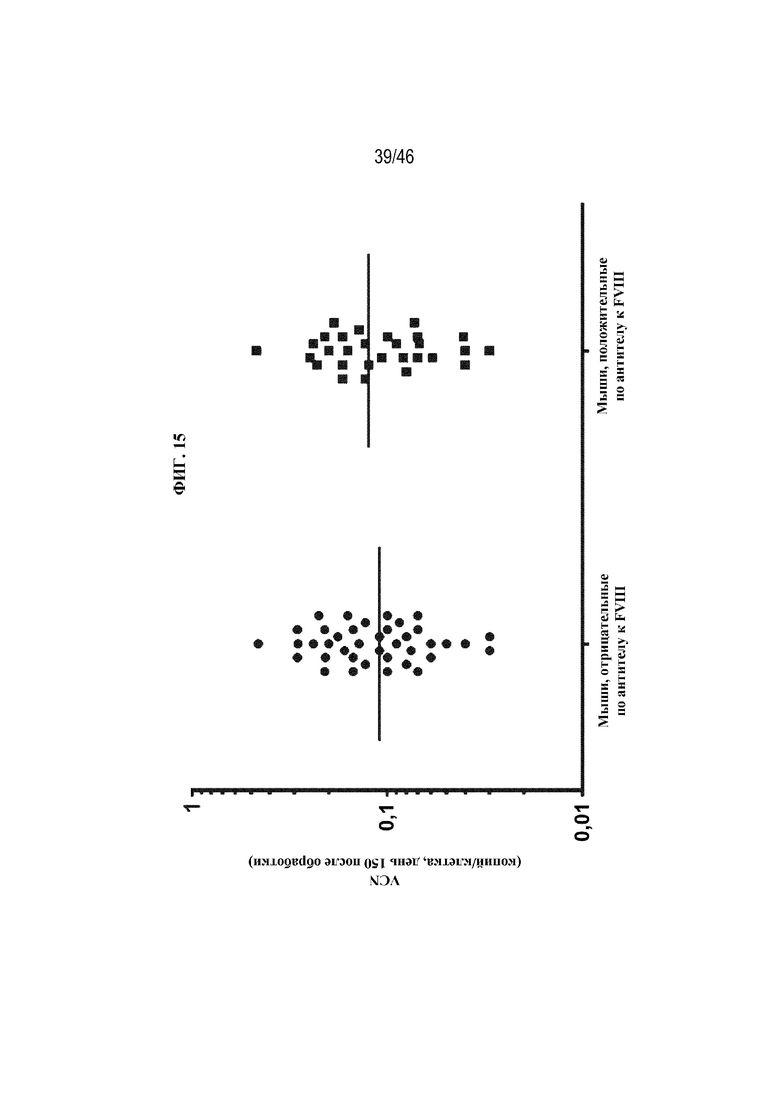
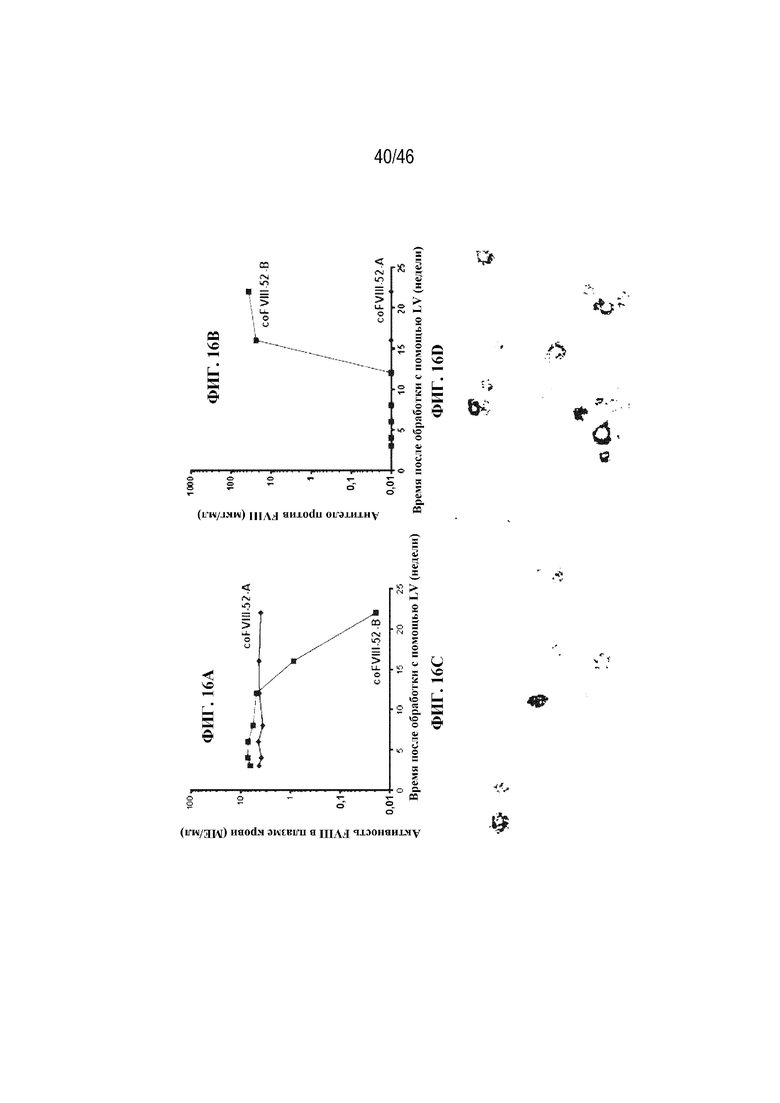
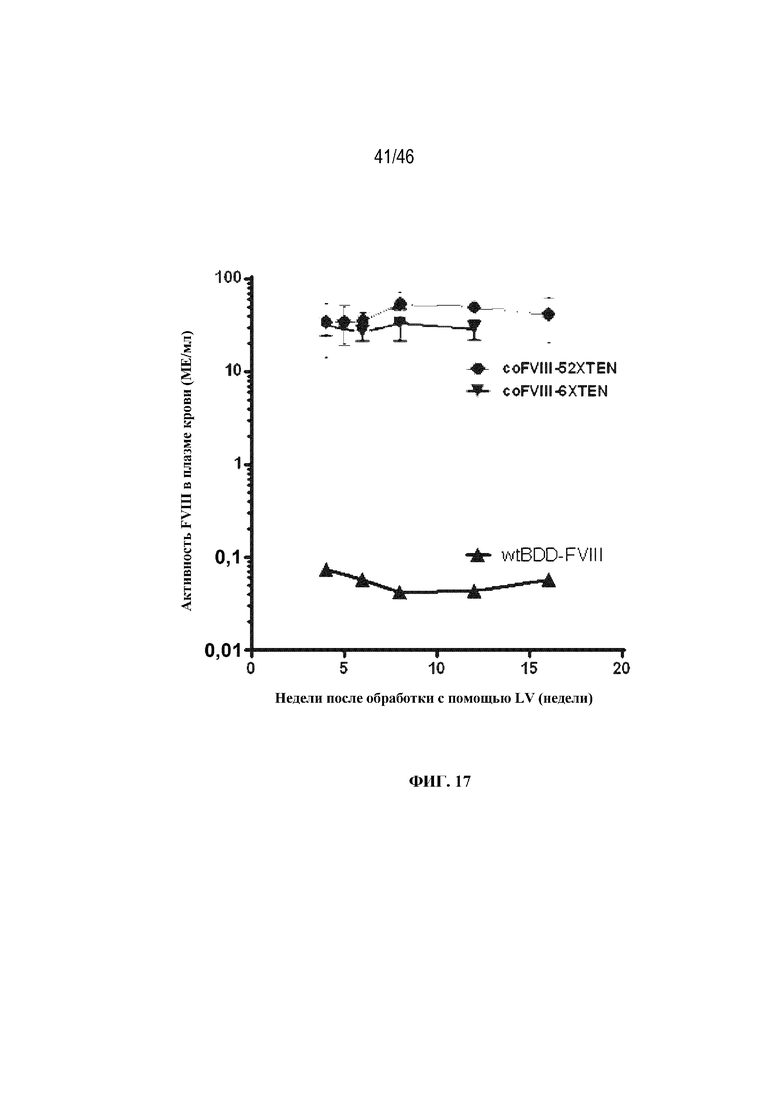
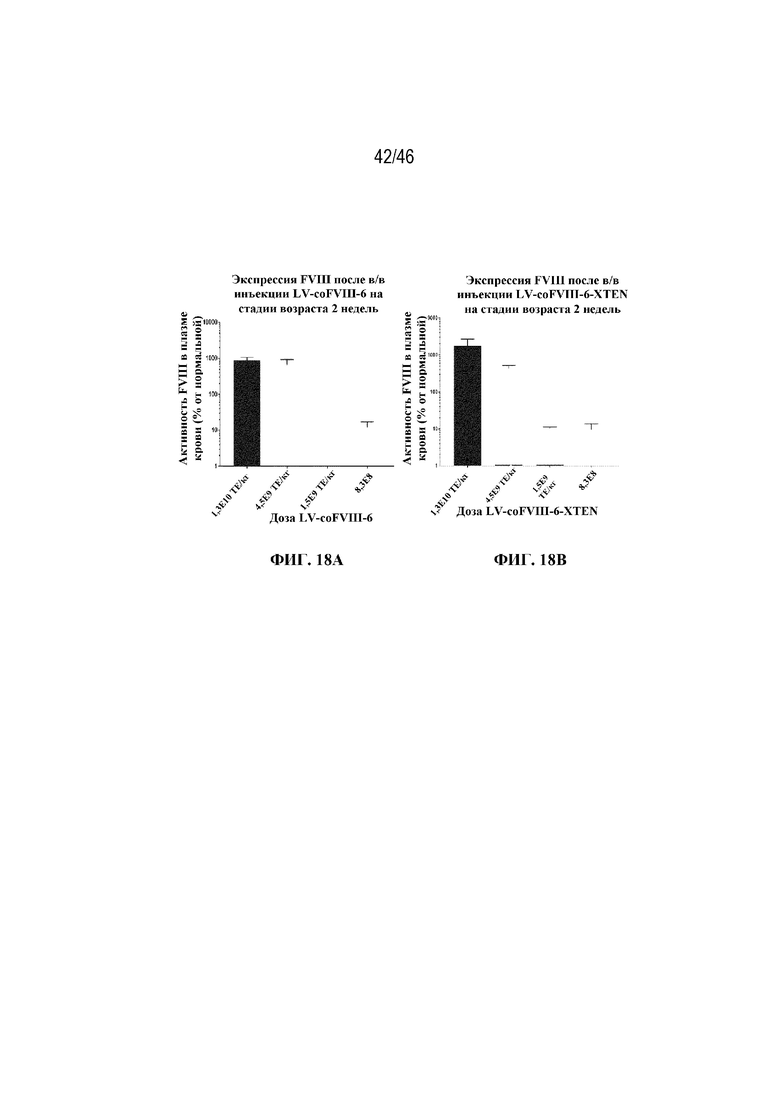
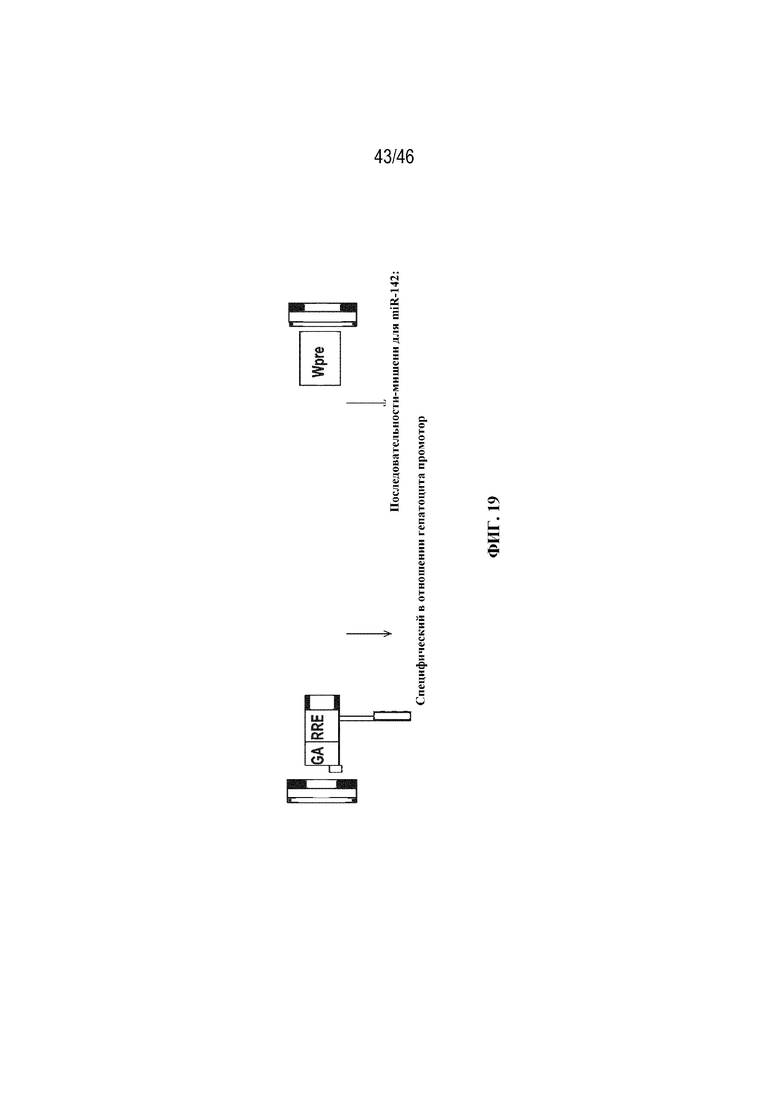
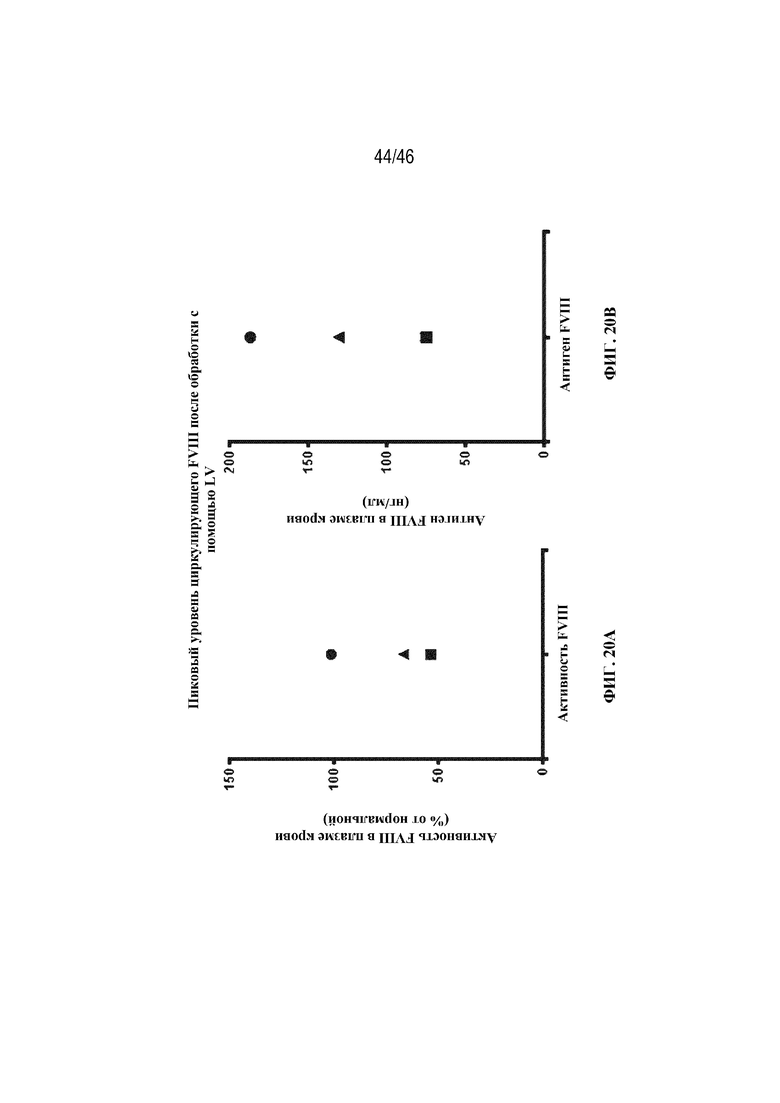
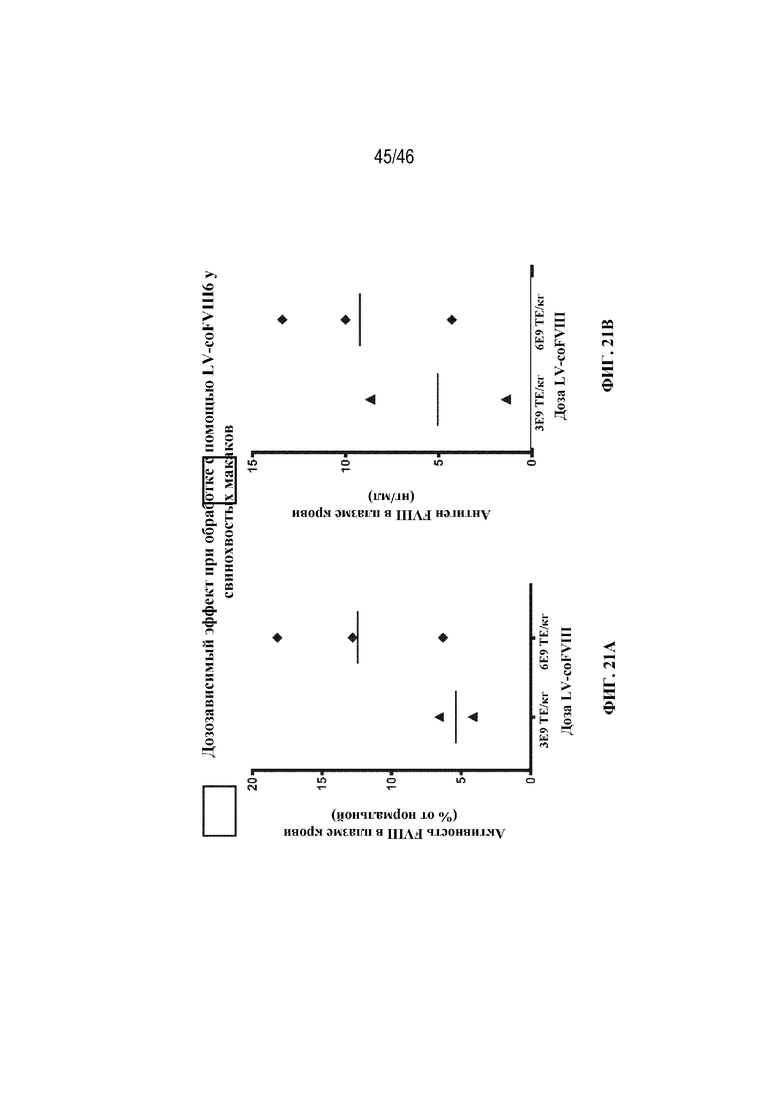
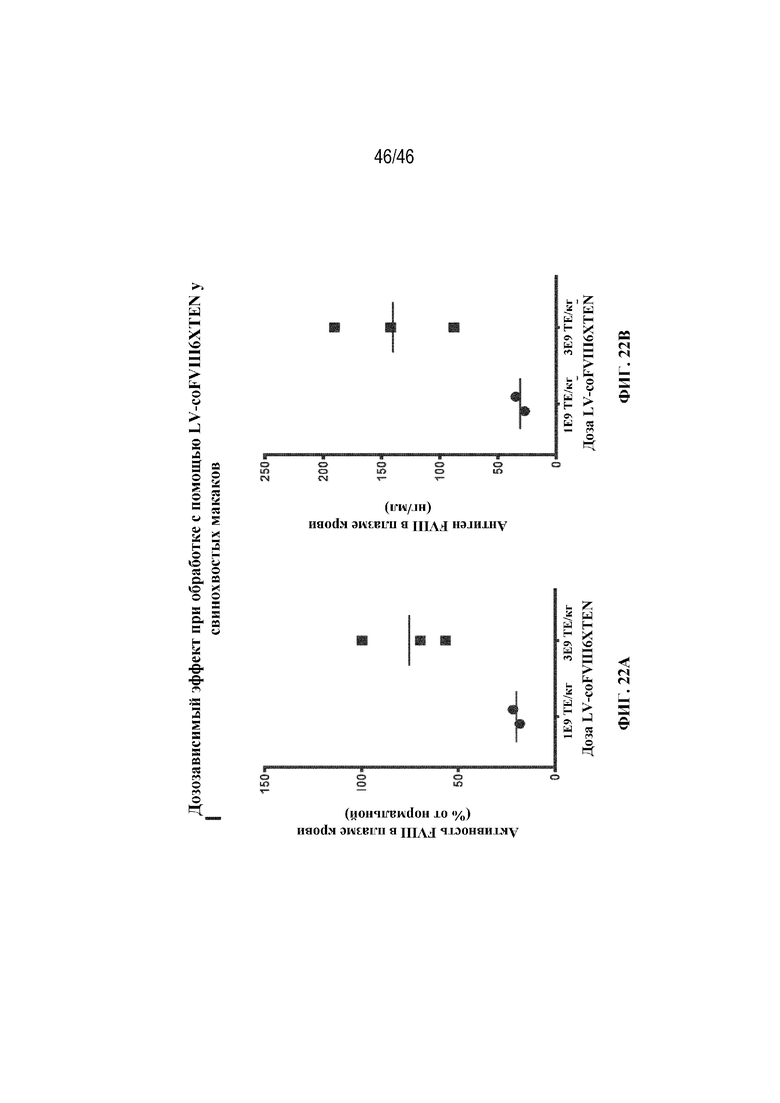
Настоящее изобретение относится к области биотехнологии и может быть применимо в медицине. Изобретение раскрывает новые лентивирусные векторы, содержащие кодон-оптимизированные последовательности фактора VIII, а также способы применения таких лентивирусных векторов. Изобретение может быть использовано для генной терапии, при этом лентивирусная доставка генов обеспечивает стабильную интеграцию кассеты экспрессии трансгена в геном клеток, в отношении которых осуществляется нацеливание (например, в клетки печени - гепатоциты). Настоящее изобретение также относится к способам лечения нарушений свертываемости крови, таких как гемофилия (например, гемофилия A), включающим введение субъекту, нуждающемуся в этом, нацеленного на клетки печени лентивирусного вектора, содержащего кодон-оптимизированную последовательность нуклеиновой кислоты фактора VIII, в низких дозировках (от 1*108 ТЕ/кг или меньше до 1,5*1010 ТЕ/кг). 2 н. и 26 з.п. ф-лы, 13 пр., 19 табл., 22 ил.
1. Лентивирусный вектор для применения в способе лечения нарушения свертываемости крови у нуждающегося в этом субъекта, включающем введение субъекту по меньшей мере одной дозы 5×1010 или менее трансдуцирующих единиц/кг (ТЕ/кг) лентивирусного вектора, где:
лентивирусный вектор содержит липидную оболочку, которая содержит один или более полипептидов CD47 и не содержит полипептид MHC-I; и
лентивирусный вектор содержит выделенную нуклеиновую кислоту, содержащую нуклеотидную последовательность, кодирующую полипептид с активностью FVIII, причем нуклеотидная последовательность имеет:
(i) по меньшей мере 99% идентичности последовательности нуклеотидам 58–2277 и 2320–4374 SEQ ID NO: 1;
(ii) по меньшей мере 99% идентичности последовательности нуклеотидам 58–2277 и 2320–4374 SEQ ID NO: 2;
(iii) по меньшей мере 99% идентичности последовательности нуклеотидам 58-2277 и 2320-4374 SEQ ID NO: 70;
(iv) по меньшей мере 99% идентичности последовательности нуклеотидам 58-2277 и 2320-4374 SEQ ID NO: 71;
(v) по меньшей мере 99% идентичности последовательности нуклеотидам 58-2277 и 2320-4374 SEQ ID NO: 3;
(vi) по меньшей мере 99% идентичность последовательности нуклеотидам 58-2277 и 2320-4374 SEQ ID NO: 4;
(vii) по меньшей мере 99% идентичности последовательности нуклеотидам 58-2277 и 2320-4374 SEQ ID NO: 5;
(viii) по меньшей мере 99% идентичности последовательности нуклеотидам 58-2277 и 2320-4374 SEQ ID NO: 6;
причем доза приводит к экспрессии FVIII у субъекта на терапевтически благоприятном уровне.
2. Лентивирусный вектор для применения в способе лечения нарушения свертываемости крови у нуждающегося в этом субъекта, включающем введение субъекту по меньшей мере одной дозы 5×1010 или менее трансдуцирующих единиц/кг (ТЕ/кг) лентивирусного вектора, где:
лентивирусный вектор содержит липидную оболочку, которая содержит один или более полипептидов CD47 и не содержит полипептид MHC-I; и
летивирусный вектор содержит выделенную нуклеиновую кислоту, содержащую нуклеотидную последовательность, которая содержит первую последовательность нуклеиновой кислоты, кодирующую N-концевую часть полипептида фактора VIII (FVIII), и вторую последовательность нуклеиновой кислоты, кодирующую С-концевую часть полипептида FVIII;
(a) где первая последовательность нуклеиновой кислоты содержит:
(i) по меньшей мере 99 % идентичности последовательности нуклеотидам 58–2277 SEQ ID NO: 3;
(ii) по меньшей мере 99% идентичности последовательности нуклеотидам 58-2277 SEQ ID NO: 4;
(iii) по меньшей мере 99% идентичности последовательности нуклеотидам 58-12277 SEQ ID NO: 5; или
(iv) по меньшей мере 99 % идентичности последовательности нуклеотидам 58–2277 SEQ ID NO: 6;
(b) где вторая последовательность нуклеиновой кислоты содержит:
(i) по меньшей мере 99 % идентичности последовательности нуклеотидам 2320–4374 SEQ ID NO: 3;
(ii) по меньшей мере 99% идентичности последовательности нуклеотидам 2320-4374 SEQ ID NO: 4;
(iii) по меньшей мере 99 % идентичности последовательности нуклеотидам 2320–4374 SEQ ID NO: 5; или
(iv) по меньшей мере 99 % идентичности последовательности нуклеотидам 2320–4374 SEQ ID NO: 6;
где N-концевая часть и С-концевая часть вместе обладают активностью полипептида FVIII, и
причем доза приводит к экспрессии FVIII у субъекта на терапевтически благоприятном уровне.
3. Лентивирусный вектор для применения по п.1 или 2, где доза составляет приблизительно 1,5×1010 ТЕ/кг.
4. Лентивирусный вектор для применения по п.1 или 2, где доза составляет приблизительно 1,0×109 ТЕ/кг.
5. Лентивирусный вектор для применения по п.1 или 2, где доза составляет приблизительно 3,0×109 ТЕ/кг.
6. Лентивирусный вектор для применения по п.1 или 2, где доза составляет приблизительно 6,0×109 ТЕ/кг.
7. Лентивирусный вектор для применения по п.1 или 2, где доза составляет приблизительно 1×108 ТЕ/кг.
8. Лентивирусный вектор для применения по п.1 или 2, где доза составляет приблизительно 8,3×108 ТЕ/кг.
9. Лентивирусный вектор для применения по п.1 или 2, где доза составляет приблизительно 1,5×109 ТЕ/кг.
10. Лентивирусный вектор для применения по п.1 или 2, где доза составляет приблизительно 4,5×1010 ТЕ/кг.
11. Лентивирусный вектор для применения по п.1 или 2, где доза составляет приблизительно 1,3×1010 ТЕ/кг.
12. Лентивирусный вектор для применения по п.1 или 2, где доза составляет от 2,5×109 до 3,5×109 ТЕ/кг.
13. Лентивирусный вектор по любому из пп. 1-12, где лентивирусный вектор обеспечивает 30-110-кратное повышение активности FVIII в плазме субъекта через 24-48 часов после введения лентивирусного вектора по сравнению с эталонным вектором, содержащим молекулу нуклеиновой кислоты, содержащую SEQ ID NO: 16.
14. Лентивирусный вектор по любому из пп. 1-13, где лентивирусный вектор составлен для введения субъекту в виде однократной дозы или нескольких доз, причем предпочтительно лентивирусный вектор составлен для введения субъекту посредством внутривенной инъекции.
15. Лентивирусный вектор по любому из пп. 1-14, где субъект является субъектом-ребенком.
16. Лентивирусный вектор по любому из пп. 1-14, где субъект является субъектом-взрослым.
17. Лентивирусный вектор по любому из пп. 1-16, где лентивирусный вектор содержит тканеспецифичный промотор, причем предпочтительно тканеспецифичный промотор селективно усиливает экспрессию полипептида с активностью FVIII в клетке-мишени печени, причем более предпочтительно тканеспецифический промотор, который селективно усиливает экспрессию полипептида с активностью FVIII в клетке-мишени печени, включает промотор mTTR.
18. Лентивирусный вектор по п.17, где клетка печени-мишень представляет собой гепатоцит.
19. Лентивирусный вектор по любому из пп. 1-18, где нарушением свертываемости крови является гемофилия А.
20. Лентивирусный вектор по любому из пп. 1-19, где выделенная нуклеиновая кислота содержит нуклеотидную последовательность, кодирующую полипептид с активностью FVIII, содержащий LV-coFVIII-6 (SEQ ID NO: 71) или LV-coFVIII-6-XTEN (SEQ ID NO: 72).
21. Лентивирусный вектор по любому из пп. 1-20, где последовательность нуклеотидов, кодирующая полипептид с активностью FVIII, дополнительно содержит последовательность нуклеиновой кислоты, кодирующую сигнальный пептид, причем последовательность нуклеиновой кислоты, кодирующая сигнальный пептид, имеет по меньшей мере 99 % идентичности последовательности с:
(i) нуклеотидами 1-57 SEQ ID NO: 1;
(ii) нуклеотидами 1-57 SEQ ID NO: 2;
(iii) нуклеотидами 1-57 SEQ ID NO: 3;
(iv) нуклеотидами 1-57 SEQ ID NO: 4;
(v) нуклеотидами 1-57 SEQ ID NO: 5;
(vi) нуклеотидами 1-57 SEQ ID NO: 6;
(vii)нуклеотидами 1-57 SEQ ID NO: 70;
(viii) нуклеотидами 1-57 SEQ ID NO: 71; или
(ix) нуклеотидами 1-57 SEQ ID NO: 68.
22. Лентивирусный вектор по любому из пп. 1-21, где нуклеотидная последовательность, кодирующая полипептид с активностью FVIII, первая последовательность нуклеиновой кислоты, кодирующая N-концевую часть полипептида Фактора VIII (FVIII), и/или вторая последовательность нуклеиновой кислоты, кодирующая C-концевую часть полипептида FVIII, имеет одно или более свойств, выбранных из группы, состоящей из:
(a) индекс адаптации кодонов для человека для нуклеотидной последовательности или ее части является повышенным по сравнению с таковым для SEQ ID NO: 16;
(b) частота оптимальных кодонов для нуклеотидной последовательности или ее части является повышенной по сравнению с таковой для SEQ ID NO: 16;
(c) нуклеотидная последовательность или ее часть содержат более высокую процентную долю нуклеотидов G/C по сравнению с процентной долей нуклеотидов G/C в SEQ ID NO: 16;
(d) относительная частота использования синонимичных кодонов для нуклеотидной последовательности или ее части является повышенной по сравнению с таковой для SEQ ID NO: 16;
(e) эффективное число кодонов для нуклеотидной последовательности или ее части является пониженным по сравнению с таковым для SEQ ID NO: 16;
(f) нуклеотидная последовательность содержит меньше последовательностей MARS/ARS (SEQ ID NO: 21 и 22) по сравнению с SEQ ID NO: 16;
(g) нуклеотидная последовательность содержит меньше дестабилизирующих элементов (SEQ ID NO: 23 и 24) по сравнению с SEQ ID NO: 16; и
(h) любая их комбинация.
23. Лентивирусный вектор по любому из пп. 1-22, где нуклеотидная последовательность, кодирующая полипептид с активностью FVIII, дополнительно содержит гетерологичную нуклеотидную последовательность, кодирующую гетерологичную аминокислотную последовательность, причем предпочтительно гетерологичная аминокислотная последовательность представляет собой последовательность константной области иммуноглобулина или ее части, XTEN, трансферрина, альбумина или PAS, и/или гетерологичная аминокислотная последовательность связана с N-концом или С-концом аминокислотной последовательности, кодируемой нуклеотидной последовательностью, кодирующей полипептид с активностью FVIII, или вставлена между двумя аминокислотами в аминокислотной последовательности, кодируемой нуклеотидной последовательностью, в одном или более сайтах вставки, выбранных из ТАБЛИЦЫ 3
вставки
вставки
где сайты вставки указывают положение аминокислоты, соответствующее положению аминокислоты в зрелом FVIII человека (SEQ ID NO: 15).
24. Лентивирусный вектор по любому из пп. 1-23, где полипептид FVIII представляет собой полноразмерный FVIII или FVIII с удаленным В-доменом.
25. Лентивирусный вектор по любому из пп. 1-24, где полипептид CD47 представляет собой полипептид CD47 человека.
26. Лентивирусный вектор по любому из пп. 1-25, где липидная оболочка содержит высокую концентрацию полипептидов CD47.
27. Лентивирусный вектор по любому из пп. 1-26, где лентивирусный вектор продуцируется в клетке-хозяине, причем предпочтительно:
клетка-хозяин экспрессирует CD47;
клетка-хозяин не экспрессирует MHC-I;
клетка-хозяин характеризуется фенотипом CD47high/MHC-I-; и/или
клетка-хозяин представляет собой клетку HEK 293T, характеризующуюся фенотипом CD47high/MHC-I-.
28. Лентивирусный вектор по п.27, где клетка-хозяин представляет собой клетку HEK 293T, модифицированную таким образом, чтобы она имела повышенную экспрессию CD47 по сравнению с немодифицированными клетками HEK 293T.
| WO 2017136358 A1, 10.08.2017 | |||
| SOSALE N.G | |||
| Способ очищения сернокислого глинозема от железа | 1920 |
|
SU47A1 |
| Methods Clin | |||
| Dev., 2016, v | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| MILANI M | |||
| et al.: "Genome editing for scalable production of alloantigen-free lentiviral vectors | |||
Авторы
Даты
2023-09-07—Публикация
2019-01-31—Подача