- Область техники, к которой относится изобретение
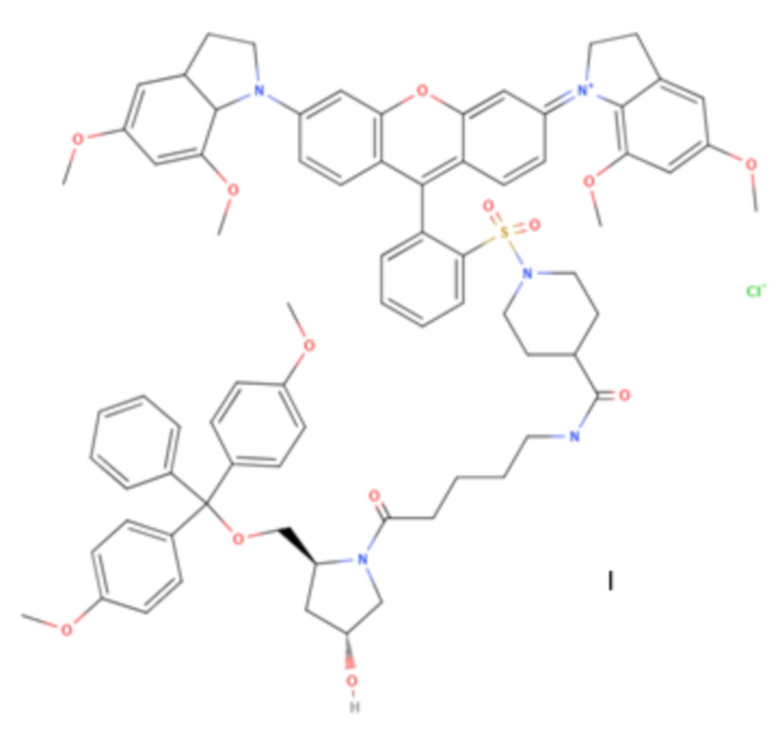
Изобретение относится к области химии веществ испускающих и поглощающих свет, а именно новому соединению формулы I,
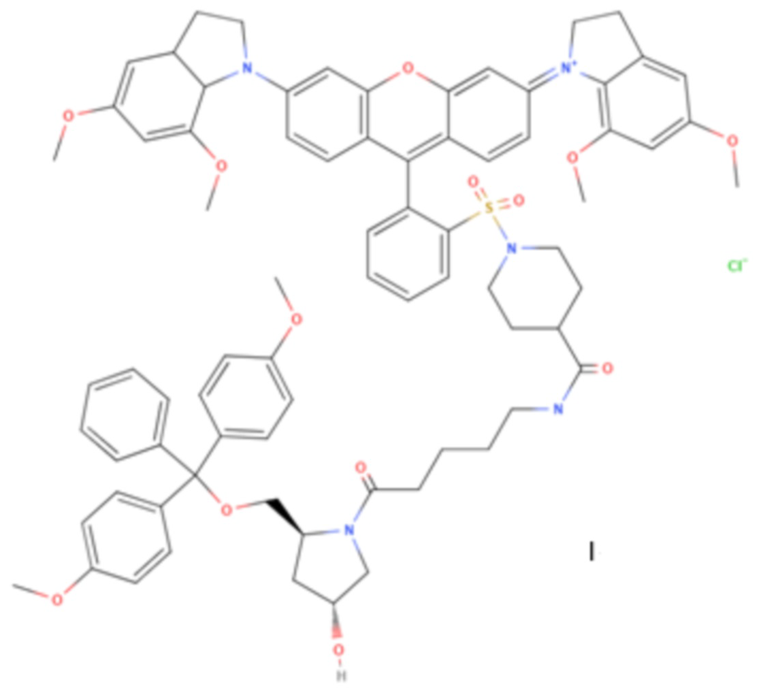
к указанному соединению для применения в качестве тушителя флуоресценции. Отличительной особенностью синтезированного вещества является введение в состав тушителя группировок с положительным зарядом большим числом электронодонорных метоксильных групп, которые уширяют спектр поглошения тушителя, и повышают его способность рассеивать энергию, повышая стабильность и эффективность тушения.
Техническим результатом изобретения является повышение чувствительности метода ПЦР вследствие изменения характера фонового излучения от тушителя и уменьшения его интенсивности.
- Уровень техники
В литературе имеется описание тушителей флуоресценции и способов их получения.
Известен способ использования красителей TAMRA в качестве тушителей флуоресценции.
В литературе описаны «темные» тушители для ПЦР-зондов. Их объединяет полиароматическая структура азосоединений с различными заместителями, в том числе несколькими электродонорными [1,2].
Известны тушители типа [3], также включающие в себя азосоединения с мотивами нафталина, имеющие уровень фона сравнимый с уровнем, известным из уровня техники, однако методологически сравнение проводилось некорректно, в частности сравнивались зонды, где тушитель поглощает в гораздо более красной области спектра, чем излучает краситель; такие зонды не имеют практической значимости.
Известны тушители, где ароматические кольца объединены этиленовой связью [4]. Описаны тушители, где в ароматическое кольцо азосоединения вводят заряд [5].
Известен способ увеличения эффективности ПЦР в сложном генетическом окружении за счет смещения тушителя внутрь последовательности олигонуклеотида к 3`-концу [6].
Подходов, где в тушитель вводят заряд и несколько электронодонорных групп, в частности диметоксифенильных, в литературе не описано.
- Раскрытие сущности изобретения
Предлагается новое соединение формулы I.
Предлагается применение соединения формулы I как тушителя флуоресценции в составе олигонуклеотидных зондов. Способ применения - химическое присоединение тушителя на специальный носитель, внесение тушителя, нанесенного на носитель в олигонуклеотидный синтез, очистка и получение готового зонда, внесение зонда в ПЦР реального времени.
- Осуществление изобретения
Сульфлуоресцеин-дииндолин
Дихлорид сульфофлуоресцеина (10,7 г, 26,4 ммоль) растворяли в 300 мл изопропанола. диметоксиндолин (14,8 мл, 132 ммоль) и триэтиламин (18,4 мл, 132 ммоль) растворяли в 50 мл изопропанола и раствор добавляли к реакционной смеси. После добавления реакционную смесь кипятили с обратным холодильником в течение 9 часов в атмосфере аргона. Растворитель удаляли при пониженном давлении, и остаток очищали флэш-хроматографией на силикагеле (элюент: CH2Cl2). После колоночной хроматографии фракции, содержащие продукт, объединяли и упаривали. Неочищенный продукт перекристаллизовывали с ацетоном. Выпавший осадок отфильтровывали, промывали 75 мл ацетона и 150 мл изопропанола 150 мл. Получили 6,37 г (выход 42%) коричневого порошка.
LQ500-этиловый эфир
Сульфлуоресцеин-дииндолин (7,0 г, 12,3 ммоль) суспендировали в 100 мл дихлорэтана и добавляли оксихлорид фосфора (28,7 мл, 307,5 ммоль). Реакционную смесь кипятили с обратным холодильником в течение 24 часов в атмосфере аргона. Растворитель удаляли при пониженном давлении и остаток суспендировали в 100 мл ацетонитрила. К раствору по каплям добавляли этилизонипекотат (15,43 г, 98,2 ммоль) и триэтиламин (34,1 мл, 245,4 ммоль) в 60 мл ацетонитрила и смесь перемешивали при комнатной температуре в течение 24 часов в атмосфере аргона. Растворитель удаляли при пониженном давлении и остаток растворяли в 700 мл дихлорэтана, промывали 2 М водным раствором HCl. (2×500 мл), сушили над безводным Na2SO4 и упаривали досуха. Полученный сырой продукт (15,3 г) растворяли в 100 CH2Cl2 и очищали на колонке с силикагелем, элюент чистый CH2Cl2. Фракции, содержащие продукт, упаривали. Неочищенный продукт (12,3 г) суспендировали в 30 мл ацетоне. Осадок отфильтровывали и заново дважды промывали ацетоном (2×30 мл). Продукт (10,1 г) суспендировали в 50 мл этилацетата. Образовавшийся осадок отфильтровывали, дважды промывали этилацетатом (2×125 мл). Осадок повторно выпаривали с дихлорметаном, получая 2,90 г (выход 32%) продукта в виде фиолетового порошка.
LQ500-карбоновая кислота
Этилированный предшественник LQ500-карбоновой кислоты (LQ500-этиловый эфир, 2,85 г, 3,82 ммоль) растворяли в 150 мл изопропилового спирта добавляли 20 мл 10% водного раствора NaOH. Реакционную смесь перемешивали в течение 24 часов, из них 8 часов при 40-50°С, остальное время при комнатной температуре. После этого добавляли дополнительные 20 мл 10% водного раствора NaOH и продолжали перемешивание в течение дополнительных 24 часов, из них 8 часов при 40-50°С, остальное время при комнатной температуре. Затем к смеси добавлял 260 мл HCl концентрации 1 моль/л и смесь перемешивали в течение 1 часа. Образовавшийся осадок отфильтровывали и промывали водой. Осадок растворяли в 30 мл изопропилового спирта и упаривали. Получали 2,04 г (выход 74%) продукта в виде пурпурного порошка.
LQ500-активированный эфир
К смеси тушителя LQ500-карбоновая кислота (1 г, 1,39 ммоль) (п. 1.1 отчета) и сухого ДМФ (15 мл) добавляли ДИПЭА (0,73 мл, 4,17 ммоль) и ТСТУ (N,N,N',N'-тетраметил-О-(N-сукцинимидил )уроний) (0,50 г, 1,67 ммоль). Реакционную смесь перемешивают в течение 1 часа при комнатной температуре. Затем добавляли 50 мл дихлорметана и 75 мл HCl концентрации 1 моль/л. Органический слой отделяли, сушили над Na2SO4 и упаривали. Остаток растворяли в 20 мл ацетонитрила и к раствору добавляли 80 мл этилацетата. Образововавшуюся смесь держали в течение ночи при перемешивали при комнатной температуре. Образовавшийся осадок отфильтровывали, промывали 20 мл этилацетата и сушили на воздухе, получая продукт в виде пурпурного порошка (0,9 г, выход 80%).
Тушитель LQ500 (cодержащий тритильную группу)
TFA-аминогексаноил-Dmt-гидроксипролинол (0,42 г, 0,67 ммоль) растворяли в этиловом спирте (5 мл). Добавляли твердый K2CO3 (0,2 г, 1,45 ммоль) и реакционную смесь перемешивали в течение 48 ч при комнатной температуре. Смесь разбавляли дихлорметаном (20 мл) и промывали водой (4×15 мл), насыщенным раствором NaCl (20 мл), сушили над Na2SO4 и выпаривали с получением деблокированного амина в виде белой пены.
Остаток растворяли в дихлорметане (10 мл) и этот раствор добавляли к раствору LQ500-активированный эфир (0,5 г, 0,61 ммоль) в дихлорметане (15 мл). После этого добавляли триэтиламин (0,095 мл, 0,67 ммоль). Смесь упаривали, растворяли в смеси дихлорметан-триэтиламин 20:1 (10 мл) и наносили на колонку с силикагелем (30 г) (элюент дихлорметан). Фракции, содержащие продукт, выпаривали с получением целевого соединения в виде черного порошка (I). Выход 0,57 г (76%).
Спектр ЯМР 1H соединения I (CDCl3, δ, м.д., J, Гц): 1,21 (8H, т, -CH2-), 3,25 (8H, т, -СH2-N-), 3,61 (6H, с, -OCH3 тритил), 3,81-3,94 (12H, c, -OCH3 индолин), 6,89 (4H, д, -СH-C-OCH3 тритил), 8,22 (1H, д, -СH-C-SO2).
Полученное соединение формулы I протестировано в следующих экспериментах:
- спектрофотометрические испытания
- нанесение на твердофазный носитель и испытания в синтезе олигонуклеотидных зондов
- испытания в методе ПЦР (полимеразная цепная реакция)
Спектрофотометрические испытания
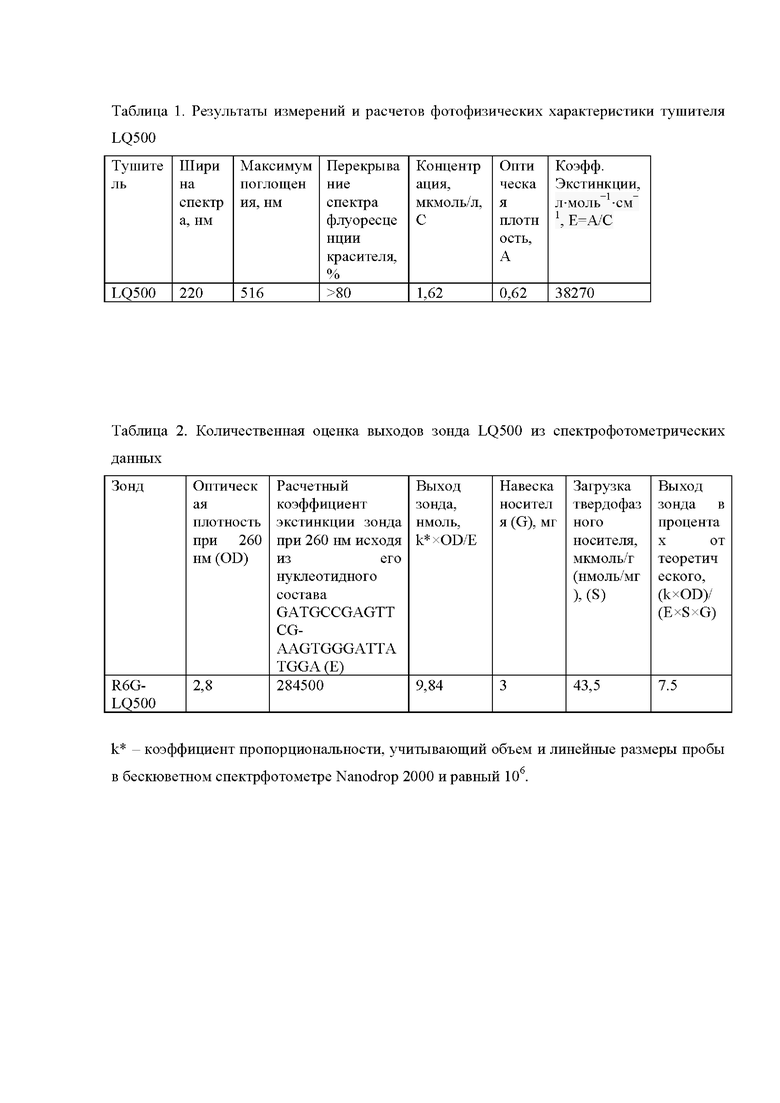
В целях проверки функциональности полученного соединения проводились спектрофотометрические испытания. Проводились исследования области поглощения тушителя, сравнение со спектрами флуоресценции соответствующего флуорофора, а также измерения поглощения тушителей в целях расчета коэффициента экстинкции. Результаты измерений и расчетов приведены в таблице 1 и рис. 1.
Область поглощения cоставляет 220 нм, перекрывает спектр флуоресценции флуорофора, а коэффициент экстинкции превышает 30000 л⋅моль-1⋅см-1, что позволяет эффективно использовать соединение для тушения флуоресценции.
Нанесение на твердофазный носитель и испытания в синтезе олигонуклеотидных зондов
Химическая модификация тушителя LQ500 янтарной кислотой (LQ500-сукцинат, интермедиат для химического присоединения тушителя к твердофазному носителю)
Тушитель LQ500 (0,30 г, 0,24 ммоль) растворяли в дихлорметане (20 мл) и добавляли триэтиламин (0,10 мл, 0,72 ммоль). Затем одной порцией при перемешивании добавляли янтарный ангидрид (0,036 г, 0,36 ммоль). Реакционной смеси давали реагировать в течение ночи при комнатной температуре. После этого добавляли 5% водный раствор NaHCO3 (20 мл) и смесь перемешивали еще 15 минут. Органический слой отделяли, промывали 5%-ным водным раствором NaHCO3 (20 мл) и сушили над Na2SO4. Растворитель выпаривали. Остаток растворяли в смеси дихлорметан-триэтиламин 20:1 (10 мл) и наносили на силикагель (15 г) для колоночной хроматографии, элюент дихлорметан-триэтиламин 20:1. Продукт повторно выпаривали с дихлорметаном (3×20 мл).Чистый продукт (темный порошок с блеском) содержал 34 мол.% триэтиламина. Выход 0,20 г (61%).
Нанесение тушителя LQ500 на твердофазный носитель
Модифицированный янтарной кислотой тушитель LQ500 (0,16 г, 0,117 ммоль), триэтиламин (0,035 мл, 0,234 ммоль) и PyBOP (0,073 г, 0,14 ммоль) растворяли в сухом ДМФ (15 мл) и держали при комнатной температуре в течение 10 мин.
Затем смесь добавляли к суспензии твердофазного носителя LCAA CPG 500 (1,5 г) в сухом ДМФА (20 мл). Смесь выдерживали при периодическом встряхивании в течение 24 часов. Носитель отфильтровывали, промывали ДМФ (3×30 мл) и ацетоном (5×30 мл) и сушили. Добавляли раствор 1-метилимидазола (1 мл) и пропионового ангидрида (2 мл) в ДМФ (20 мл), суспендировали в растворе носитель и выдерживали 5 мин при комнатной температуре. Носитель отфильтровывали, промывали ДМФА (3×20 мл) и Me2CO (5×30 мл), сушили на фильтре и в вакууме.
Испытание тушителей на твердофазных носителях в синтезе зондов для ПЦР
После нанесения тушителей LQ500 на твердофазный носитель LCAA CPG 500 проведен анализ загрузки твердофазного носителя.
Анализ загрузки твердофазного носителя
10,3 мг носителя с LQ500 суспендировали в растворе трифторуксусной кислоты в дихлорметане (5%, 1 мл), встряхивали в течение 10 мин и раствор разбавляли дихлорметаном в 100 раз. В кислой среде от носителя отщепляется тритильный катион, поглощающий при 504 нм.
Соответственно, поглощение видимого света тритильным катионом измеряли при 504 нм (рис.1), оптическая плотность составила 0,47 OE коэффициент экстинкции тритильного катиона составляет 72600 л⋅моль-1см-1. Количество отщепившегося катиона соответствует количеству тушителя, нанесенного на носитель. Загрузку (количество тушителя на грамм носителя) вычисляли по формуле:
З = A*106/E*m
где A - оптическая плотность раствора, E - коэффициент поглощения тритильного катиона, л-1моль-1см-1, m - масса навески носителя, мг. Расчет показал, что загрузка составляет 43,5 мкмоль/г.
Тушитель LQ500, нанесенный на твердофазный носитель, протестирован в синтезе зондов для ПЦР. Синтез проводился на автоматическом ДНК-синтезаторе ASM-2000, их очистка - в электрофоретических ваннах с использованием полиакриламидного геля, в котором синтезированные полидисперсные олигонуклеотиды разгонялись в электрическом поле.
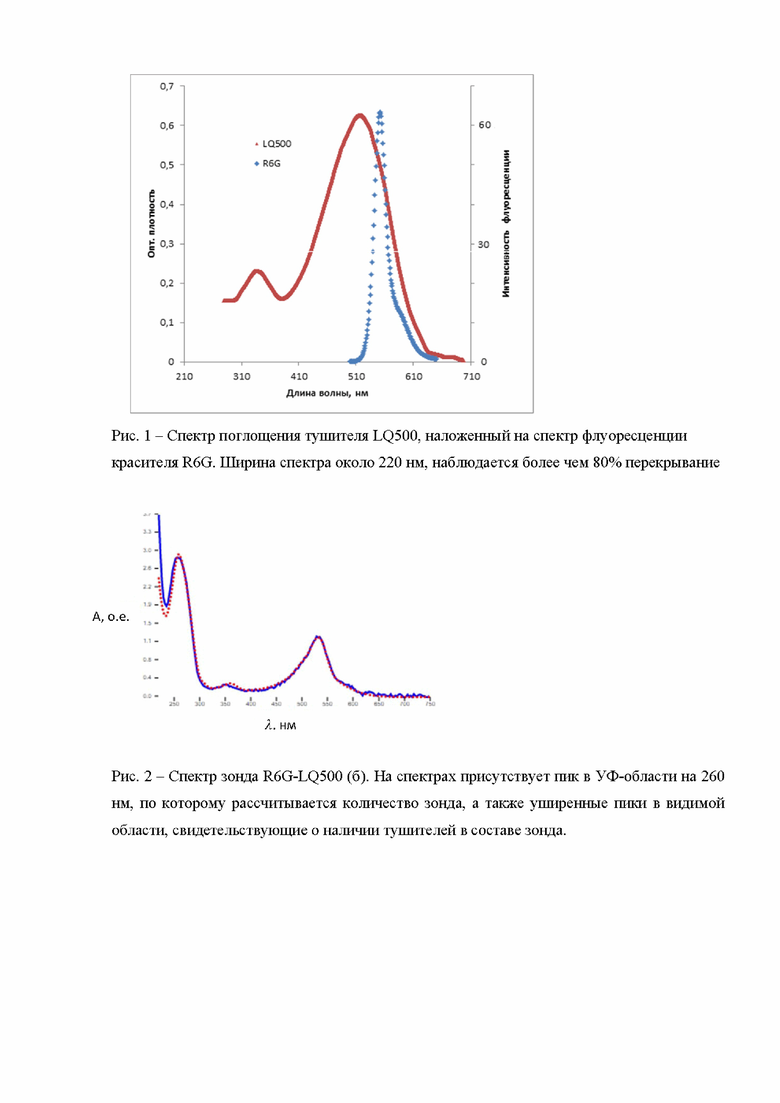
Синтез зонда обеспечивается использованными тушителями вследствие наличия характерных пиков поглощения зондов на спектре, представленном на рис. 2. Спектр зонда имеет неровный уширенный пик в видимой области, который свидетельствует, что тушитель вошел в состав зонда, а по пику на 260 нм (поглощение нуклеотидов) определяется количество зонда.
Химический выход олигонуклеотидного зонда при использовании тушителя на твердофазном носителе - 7,5% (таблица 2). Количественная оценка выхода зонда проведена из спектрофотометрических данных по поглощению олигонуклеотидной части зонда в области 260 нм.
Использование зонда R6G-LQ500 в ПЦР реального времени
Из уровня техники известно использование ДНК-зондов, содержащих краситель и тушитель в полимеразной цепной реакции реального времени. Метод основан на блокировании флуоресценции красителя, расположенным рядом тушителем - молекулярной группировкой-хромофором, поглощающей квант электромагнитного излучения от флуорофора, когда флуорофор-донор в электронно-возбужденном состоянии передает свою энергию возбуждения ближайшему хромофору-акцептору. Этот феномен носит название FRET и чем эффективнее FRET-пара флуорофор-хромофор, тем слабее флуоресценция.
ДНК-полимераза, синтезируя комплементарную цепь ДНК, разрушает попадающиеся ей на пути комплементарные участки, в том числе ДНК-зонд с FRET парой. Зонд распадается, как и сама пара, тем самым флуоресценция более не блокируется. По мере разрушения зондов регистрируется флуоресценция, сигнализирующую о накоплении ДНК. Одним из ключевых показателей метода ПЦР является номер цикла воспроизводства ДНК - цикла нагревания-охлаждения реакционной смеси, в течение которого количество ДНК увеличивается в 2 раза.
Детекторы флуоресцении имеют определенный предел чувствительности, до достижения которого сопутствующий увеличению количества ДНК рост флуоресцении не заметен. Аналогично, в большинстве случаев сама FRET-система неидеальна, что приводит к наличию определенного фонового сигнала, за которым сложно разглядеть начало роста. В настоящем изобретении предложен тушитель флуоресцении LQ500, чье превосходство над другими тушителями позволяет обеспечить технический результат изобретения - увеличение чувствительности метода за счет уменьшения числа циклов, после которого рост флуоресцентного сигнала становится заметным. Это сокращает время анализа, а учитывая, что обычно после 40-45 циклов эффективность ПЦР снижается почти до нуля, может позволить «поймать» ДНК там, где ранее результат был бы отрицательный.
Были проведены тесты зонда R6G-LQ500 в ПЦР и проведено сравнение с зондами, содержащим известный аналог, BHQ1.
Приготовление компонентов
В рамках ПЦР тестов была подготовлена матрица ДНК для проведения тестов, праймеры и вспомогательные растворы, проведена выборка референсных значений оцениваемых параметров (пороговый цикл и др.) в реал-тайм амплификаторе CFX. Наработан образец плазмиды SPUD массой около 0,5 мг, выделен на ионнообменной колонке китом Qiagen Plasmid Maxi. Измерить концентрация плазмидной ДНК. Для этого плазмида независимо разводилась н 4-5 раз. Концентрация измерялась на спектрофотометре Qubit, было рассчитано среднее значение концентрации и стандартное отклонение. Из исходного стока приготовлен промежуточный сток с концентрацией 1500 пг/мкл, из пробирки с промежуточным стоком (1500 пг/мкл) приготовлены 3 разведения: 15 пг/мкл, 150 фг/мкл, 0,5 фг/мкл. Далее приготовлена реакционная смесь на 10 реакций (объем реакции 20 мкл). Для этого в отдельной пробирке смешивалось:
• 100 мкл ПЦР-микса
• 1 мкл прямого праймера SPUDf 100 мкМ
• 1 мкл обратного праймера SPUDr 100 мкМ
• 1 мкл зонда (R6G-LQ500) или модельный зонд (R6G-BHQ1)
• 38 мкл воды DEPC
В 9 лунок амплификатора раскапывалось по 15 мкл приготовленной реакционной смеси. Далее в лунки добавлялось по 5 мкл разведений плазмидной ДНК SPUD по следующей схеме:
1-3 лунки: 5 мкл матрицы - разведение плазмиды SPUD 15 пг/мкл
4-6 лунки: 5 мкл матрицы - разведение плазмиды SPUD 150 фг/мкл
7-9 лунки: 5 мкл матрицы - разведение плазмиды SPUD 0,5 фг/мкл
Проводилось ПЦР по программе:
1. 95.0°C - 05:00 мин (1 цикл)
2. 95.0°C - 00:10 сек
3. 60.0°C - 00:45 сек (2 и 3 - 40 циклов)
4. 60.0°C - 95 °C - 00:15 сек (70 циклов по +0,5 градусов/цикл)
Результаты испытаний приведены в таблице и рисунке:
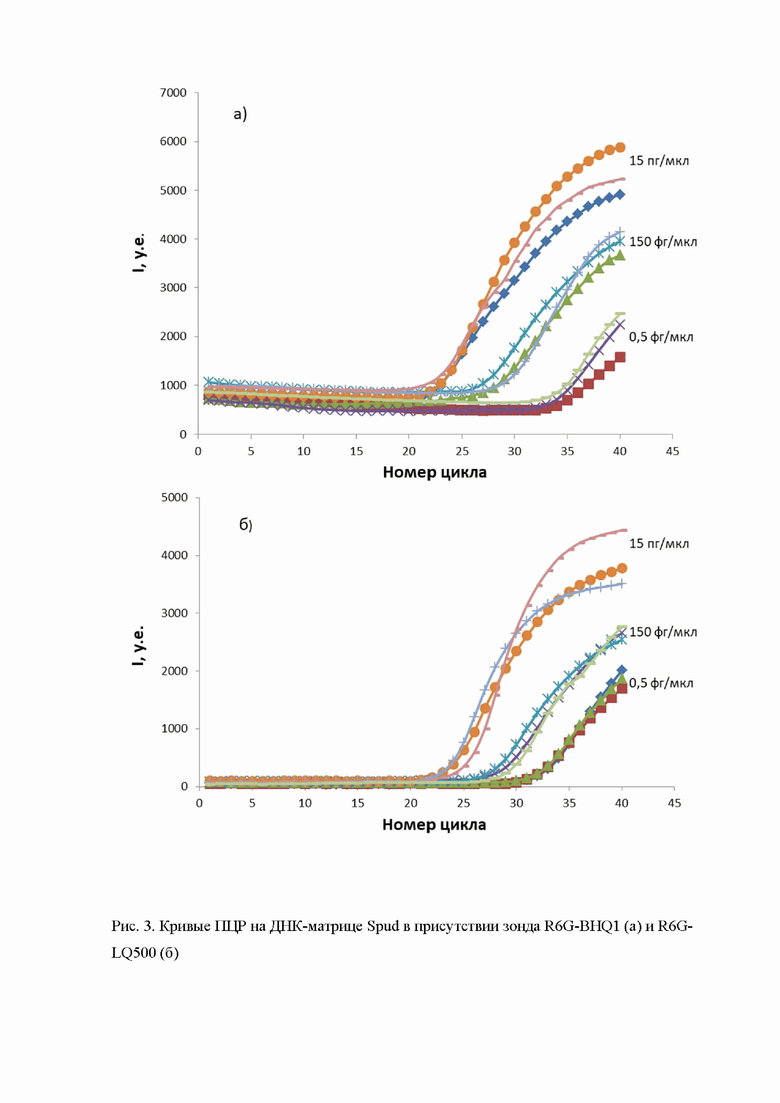
На рис. 3 приведена серия испытаний зондов R6G-LQ500 и R6G-BHQ1 для различных разведений матрицы. Кривые ПЦП имеют характерный сигмообразный вид, при этом точка подъема кривой тем дальше от начала координат, чем ниже концентрация матрицы. На кривых, относящихся к модельному зонду R6G-BHQ1 имеется характерное плавное уменьшение интенсивности, идущее до начала подъема. Таким образом, начало роста интенсивности совпадает с моментом, где она идет вниз; в какой-то момент рост еще маскируется плавным уменьшением и не может быть заметен. В случае же зонда R6G-LQ500 уменьшения интенсивности флуоресценции не наблюдается (рис. 3 и таблица 3), сама фоновая интенсивность значительно ниже и подъем интенсивности на кривых ПЦР начинает на 2-3 цикла раньше в случае особенно малых концентраций матрицы; в случае высоких концентраций матрицы рост начинается одновременно ростом в образцах сравнения. Таким образом, техническим результатом изобретения является повышение чувствительности метода ПЦР за счет уменьшения числа циклов, после которого рост флуоресцентного сигнала становится заметным, что обеспечивается изменением характера фонового излучения от зонда, содержащего тушитель LQ500 и уменьшения его интенсивности.
Список литературы
1. US patent № US 8410255 B2
2. US patent № US 7019129 B1
3. US patent № US 7439341 B2
4. PCT № WO 2018162986 A2
5. US patent № US 20050118619 A1
6. Патент РФ RU 2451086 C1.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОДНОВРЕМЕННОГО ДНК-ТЕСТИРОВАНИЯ НА НАЛИЧИЕ ПОЛИМОРФИЗМОВ Н63D И C282Y В ГЕНЕ HFE, СВЯЗАННЫХ С НАСЛЕДСТВЕННЫМ ГЕМОХРОМАТОЗОМ | 2006 |
|
RU2304170C1 |
| Тест-система для выявления ДНК возбудителя моракселлеза KPC (Moraxella bovis) в биологическом материале животных и кормах с помощью полимеразной цепной реакции в режиме реального времени | 2023 |
|
RU2819044C1 |
| Способ диагностики варианта SOPH c.5741G>A в гене NBAS | 2024 |
|
RU2819985C1 |
| Тест-система идентификации ДНК ткани сайры тихоокеанской (Cololabis saira) в рыбных продуктах, в мясокостной рыбной муке и кормах с помощью полимеразной цепной реакции в режиме реального времени | 2023 |
|
RU2822748C1 |
| Способ идентификации ДНК ткани кошки домашней (Felis silvestris catus) в сухих кормах и мясных полуфабрикатах | 2019 |
|
RU2728662C1 |
| Тест-система для идентификации ДНК ткани кошки домашней (Felis silvestris catus) в сухих кормах и мясных полуфабрикатах | 2019 |
|
RU2728639C1 |
| СПОСОБ ВЫЯВЛЕНИЯ ВИРУСА ОБЕЗЬЯНЬЕЙ ОСПЫ ВИДА MONKEYPOX МЕТОДОМ ПЦР В РЕАЛЬНОМ ВРЕМЕНИ (MPX AMP PS) | 2023 |
|
RU2803898C1 |
| Набор олигонуклеотидных праймеров и зондов для определения аллей полиморфизма rs55986091 и способ его применения | 2022 |
|
RU2804110C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ МОДИФИЦИРОВАННЫХ НУКЛЕОТИДОВ РНК | 2012 |
|
RU2522863C2 |
| Способ идентификации ДНК ткани японской скумбрии (Scomber japonicus) в рыбных продуктах, в мясокостной рыбной муке и кормах с помощью полимеразной цепной реакции в режиме реального времени | 2023 |
|
RU2814552C1 |

Изобретение относится к области химии веществ, поглощающих свет, а именно новому соединению формулы I, а также применению указанного соединения в качестве тушителя флуоресценции. Отличительной особенностью вещества является наличие в составе тушителя группировок с положительным зарядом и большим числом электронодонорных метоксильных групп. Техническим результатом изобретения является повышение чувствительности метода ПЦР вследствие изменения характера фонового излучения от тушителя и уменьшения его интенсивности. 2 н.п. ф-лы, 7 ил.
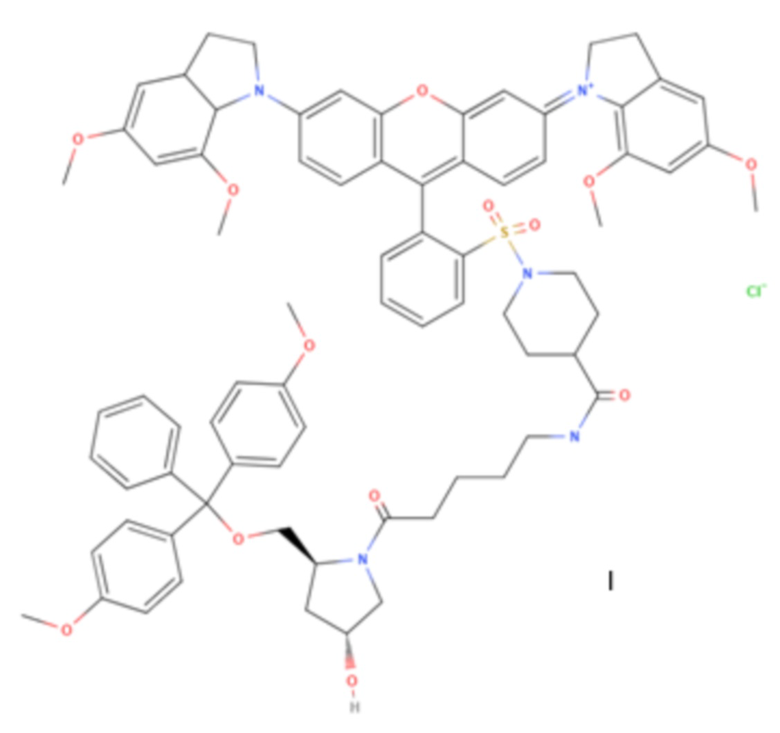
1. Соединение формулы I
2. Применение соединения формулы I по п. 1 как тушителя флуоресценции в составе олигонуклеотидных зондов.
| WO 2018162986 A3, 25.10.2018 | |||
| US 8410255 B2, 02.04.2013 | |||
| US 7439341 B2, 21.10.2008 | |||
| US 7019129 B1, 28.03.2006 | |||
| US 20050118619 A1, 02.06.2005 | |||
| СПОСОБ ДЕТЕКЦИИ СПЕЦИФИЧЕСКИХ НУКЛЕОТИДНЫХ ПОСЛЕДОВАТЕЛЬНОСТЕЙ И НУКЛЕОТИДНЫХ ЗАМЕН С ПОМОЩЬЮ ПЦР В РЕЖИМЕ РЕАЛЬНОГО ВРЕМЕНИ С ЭФФЕКТОМ ГАШЕНИЯ ФЛУОРЕСЦЕНЦИИ ЗОНДА ПРАЙМЕРОМ | 2010 |
|
RU2451086C1 |
| US 20220119424 A1, 21.04.2022. | |||
Авторы
Даты
2023-09-26—Публикация
2022-12-14—Подача