Группа изобретений относится к области нанотехнологии, в частности к наномедицине, нанобиотехнологии, наноагентам для скрининга бактерий с множественной лекарственной устойчивостью, имитирующих фаги и представляющих собой наноагент - конъюгат наночастицы золота с ферментом деполимеразой, выделенной из бактериофага или профага, иммобилизованным на поверхности наночастицы, а также способ его получения.
Наноагент может быть использован для быстрого скрининга патогенных штаммов бактерий, для прикладных разработок в молекулярной биологии и медицинской микробиологии, а также для создания различных наборов для in vitro диагностики.
Уровень техники
Растущее использование антибактериальных препаратов в клинике, уходе за животными и сельском хозяйстве привело к глобальному распространению устойчивых к лекарственным средствам патогенных штаммов. Долгое время преобладающей стратегией решения этой проблемы было введение нового класса антибиотиков каждый раз, когда предыдущий терпел неудачу. Следовательно, распространение мультирезистентных штаммов превратилось из гипотетической угрозы в повседневную медицинскую проблему (Подольский, 2018).
Фаговая терапия имеет ряд преимуществ перед другими подходами к лечению бактериальных инфекций. По сравнению с малыми молекулами бактериофаги более избирательны и менее склонны к развитию лекарственной устойчивости (Pires et al., 2011; Sillankorva et al., 2008). Их высокая специфичность по отношению к конкретному штамму является ключевым преимуществом. Выбор фага для терапии каждый раз должен производиться в зависимости от штамма бактерии, которым инфицирован больной.
Специфичность фага определяется рецептор-связывающими белками (хвостовыми волокнами или хвостовыми шипами), которые распознают молекулы, образующие бактериальную клеточную стенку, или полисахариды капсулы. Хвостовые шипы или структурные деполимеразы разрушают капсульные полисахариды (КПС) и могут независимо использоваться в качестве антибактериальных агентов.
Известно, что деполимеразы снижают вирулентность и терапевтически эффективны против инфекций, вызванных различными бактериальными патогенами, такими как Escherichia coli (Lin et al., 2017; Mushtaq et al., 2005), Klebsiella pneumonia (Hsieh et al., 2017; Xcy и др., 2013; Лин и др., 2014; Pan et al., 2015) и Acinetobacter baumannii (Liu et al., 2019). В случае A. baumannii, одного из наиболее значимых нозокомиальных патогенов, в последнее время идентифицировано более 144 типов капсульных локусов (типов K), и их количество постоянно увеличивается. Модификация связывающих рецепторов на клеточной поверхности считается вероятным механизмом развития устойчивости к фагам. Однако фаги обладают способностью быстро преодолевать иммунитет и резистентность хозяина посредством коэволюционного процесса.
Аэробные грамотрицательные бактерии Acinetobacter baumannii являются одним из наиболее важных клинических патогенов - возбудителей внутрибольничных инфекций во всем мире. Бактериальную клетку A. baumannii окружает капсула, которая состоит из толстого вязкого слоя структурно вариабельного капсульного полисахарида (КПС). Капсула защищает бактерии от неблагоприятных условий окружающей среды и биологических систем, включая механизмы иммунной защиты хозяина и бактериофаги. Многие фаги A. baumannii имеют структурные деполимеразы (хвостовые шипы), которые специфически распознают и ферментативно расщепляют бактериальные КПС.
Одним из ключевых факторов, обеспечивающих успешное внедрение бактериофагов в клинику, является разработка наноконъюгата для быстрого и надежного метода подбора штамма фага к пациенту. Такой наноконъюгат, используемый для скрининга, должен проверять специфичность рекомбинантной деполимеразы, полученной из фага, к штамму, присутствующему у пациента.
Разработка быстрого и эффективного инструмента для скрининга бактериофагов была бы очень полезна как для диагностики, так и для терапии бактериальных инфекций. Подходы биозондирования на основе наночастиц дают возможность разработать такой инструмент благодаря физической, а не биологической природе сигнала от датчика, который является быстрым, дискретным и поддающимся количественной оценке. Одним из лучших примеров успешного применения нанотехнологий в медицинской диагностике являются методы, основанные на поверхностном плазмонном резонансе (ППР).
Сдвиг в спектре ППР, наблюдаемый при зависимой от аналита ассоциации или диссоциации плазмонных наночастиц на твердой фазе, используется во множестве биосенсоров (Хлебцов, 2008). Показана эффективность систем на основе ППР для обнаружения бактерий (Chen et al., 2015; Huang, 2007; Peng, Chen, 2019; Tiet et al., 2017), антибиотиков (Шевченко и др., 2018) и раковые клетки (El-sayed et al., 2005; Medley et al.,2008).
Наночастицами называют любые объекты размером от 1 до 100 нанометров (1 нм = 1×10-9м), полученные как с помощью химического синтеза, так и естественным путем [Bhushan, 2017]. В природе они встречаются повсеместно, и в ряде случаев могут формироваться живыми объектами, как например магнетосомы у некоторых видов бактерий или экзосомы у эукариот [Faivre, Schuler, 2008; Sun et al., 2010]. Вследствие небольшого размера наночастицы обладают рядом уникальных физических, химических и биологических свойств, востребованных в различных областях биомедицины [Gao, Gu, Xu, 2009; Li et al., 2012]. Так, частицы из благородных металлов за счет эффекта локализованного поверхностного плазмонного резонанса (ЛППР) являются одними из наиболее востребованных компонентов различного рода биосенсоров [Li, Cushing, Wu, 2015], квантовые точки за счет контролируемой флуоресценции могут служить универсальными метками для различных процессов [Medintz et al., 2005].
Целью настоящего изобретения является поиск и разработка новых наноагентов и способов их получения, используемых для выявления госпитальных Acinetobacter-инфекций.
Техническая проблема заключается в том, что ряд патогенных микроорганизмов, включая бактерию Acinetobacter baumannii, являются наиболее частой причиной внутрибольничных инфекций, в то время как недостаточно наноагентов для быстрого определения указанных бактерий. Этот возбудитель характеризуется естественной множественной лекарственной устойчивостью, а также вторичной устойчивостью к антибиотикам, дезинфицирующим средствам, моющим средствам и УФ-облучению.
Для решения данной проблемы было исследовано несколько подходов, проведен поиск и анализ источников информации из общедоступного уровня техники до даты испрашиваемого приоритета.
Известен патент на изобретение RU 2773707 от 08.06.2022, в котором описан способ получения новых наноконъюгатов золота с терапевтическими агентами, который может быть использован в медицине. Изобретение позволяет получить конъюгат наночастицы золота с доксорубицином и бомбезином, в котором стабилизированная дитиолированная диэтилентриаминпентауксусная кислота (DTDTPA) связана с поверхностью наночастицы золота.
Недостатком является ограниченная возможность применения такого наноконъюгата в составе фармацевтической композиции только для направленной доставки терапевтического агента к опухолевым клеткам.
Известен патент на изобретение RU 2439151 от 10.01.2012, в котором описан штамм бактериофага Acinetobacter baumannii ар22 для идентификации бактерий Acinetobacter baumannii при бактериологическом анализе клинического материала и для получения препарата против внутрибольничных A.baumannii-инфекций. Видоспецифический вирулентный штамм бактериофага Acinetobacter baumannii АР22 семейства Myoviridae выделен из клинического материала и депонирован в коллекции музея микроорганизмов ФГУН «Государственный научный центр прикладной микробиологии и биотехнологии» под номером Ph-42. Бактериофаг обладает выраженной литической активностью, лизирует 68% штаммов А. baumannii, выделенных из клинического материала, и использован для идентификации микроорганизмов этого вида при бактериологическом анализе клинического материала, а также для разработки комплексных лечебных препаратов против А. baumannii-инфекций.
Известен источник информации (Шашков А.С, 2015 г.), в котором описан штамм бактерий Acinetobacter baumannii 1053, который является типовым штаммом бактерий для поддержания специфического бактериофага АР22, который заражает достаточно широкий спектр штаммов A. baumannii, циркулирующих в российских клиниках и больницах. A.baumannii1053 принадлежит к новой группе, обозначенной KL91.
Известен источник информации (Сенченкова С.Н. и др., 2021), из которого известен штамм бактерий Acinetobacter baumannii В8300 типа K92.
Известен источник информации (Попова А.В. и др., 2017), из которого известен литический фаг Acinetobacter baumannii vB_AbaP_AS12.
Известен источник информации - Шевченко К.Г., дисс. на соиск. уч. степ. к.б.н., 2019 г., который выбран наиболее близким аналогом и принят за прототип.
В указанном источнике на примере деполимераз профагов и бактериофагов Acinetobacter baumannii В8300 были показаны наноконъюгаты, представляющие собой наночастицы золота и иммобилизованные на них ферменты деполимеразы, на примере деполимеразы профага штамма A. baumannii 8300 (Dpo8300). Также описана возможность их получения.
Недостатком известного метода является то, ограничено количество используемых в способе ферментов деполимераз, входящих в состав наноагентов, имитирующих фаги, и соответствующих штаммов патогенных бактерий, размеры наноконъюгатов составляют 40 нм.
На основании вышеприведенного предлагаемый способ может быть признан соответствующим условиям патентоспособности «Новизна» и «Изобретательский уровень».
Раскрытие изобретения
Для решения технической проблемы заявителем предложены новые наноагенты для скрининга патогенных штаммов бактерий с множественной лекарственной устойчивостью, представляющие собой конъюгат наночастицы золота с ферментом деполимераза бактериофага или профага, иммобилизованным на поверхности наночастицы. Предложен способ их получения.
Технический результат заключается в расширении арсенала наноагентов, имитирующих фаги, подходящих для распознавания патогенных бактерий, и способов их получения, а также в увеличении специфичности наноагента, которая определяется взаимодействием фермента на поверхности наночастиц с соответствующими КПС патогенной бактерии. Выявлена более высокая специфичность наноагентов, чем у бактериофагов или их ферментов деполимераз в чистом виде. Полученные наноагенты, обладают меньшими размерами, по сравнению с прототипом, что увеличивает их биодоступность и позволяет быстрее распознавать патогенные бактерии.
В этой связи авторами разработаны наноагенты и способ их получения. Разработанные наноагенты представляют собой наночастицы золота, на которых конъюгированы ферменты деполимеразы, полученные из соответствующего фага или профага, специфические для конкретного штамма патогенных бактерий, например, Acinetobacter baumannii.
Они проявляют фагоподобное поведение, повторяя распознавание лигандов специфических бактерий и дальнейшую ферментативную реакцию. Это взаимодействие можно отслеживать с помощью простого и удобного метода спектрофотометрии.
В предлагаемом изобретении по сравнению с ближайшим аналогом расширен выбор и размеры наноагентов, содержащих наночастицы золота, имитирующие фаги, за счет использования патогенных бактерий других штаммов и типов (штамм Acinetobacter baumannii 1053, принадлежащий к капсульному типу K91, штамм Acinetobacter baumannii 1432, принадлежащий к капсульному типу K27), а также соответствующих ферментов деполимераз:
- деполимераза Dpo1053, кодируемая в геноме литического фага Acinetobacter baumannii АР22, представляет собой полисахаридлиазу, которая отщепляет КПС от Acinetobacter baumannii 1053 путем β-элиминирования по одному из остатков ManNAcA;
- деполимераза Dpo1432, кодируемая в геноме литического фага Acinetobacter baumannii vB_AbaP_AS12, представляющая собой специфическую гликозидазу, отщепляющую КПС от Acinetobacter baumannii 1432 по гидролитическому механизму.
Размеры наноагентов составляют от 20 нм до 32±4 нм.
Предлагаемые наноагенты достаточно эффективны для теста ДА/НЕТ или сравнительного исследования двух деполимераз.
По биоинформационным данным существует более 144 тысяч видов А. baumannii, различающихся конституцией и структурой КПС (Arbatsky et al., 2019; Kenyon et al., 2021), каждый из которых способен приобретать гены множественной лекарственной устойчивости. Разработка фаговой терапии, по крайней мере, для этого патогена требует создания фаговой библиотеки и скрининга на соответствие фагу/деполимеразе и бактериальному штамму.
В одной неограничивающей реализации изобретения наноагент для скрининга патогенных штаммов бактерий с множественной лекарственной устойчивостью, характеризуется тем, что представляет собой конъюгат наночастицы золота с ферментом деполимеразой бактериофага или профага, иммобилизованным на поверхности наночастицы. Наноагент отличается тем, что размеры наночастиц золота составляют от 20 нм до 32±4 нм, фермент представляет собой деполимеразу Dpo1053, кодируемую в геноме литического фага Acinetobacter baumannii АР22, или фермент представляет собой деполимеразу Dpo1432, кодируемую в геноме литического фага Acinetobacter baumannii vB_AbaP_AS12.
В одном примере реализации наноагент характеризуется тем, что патогенная бактерия представляет собой штамм Acinetobacter baumannii 1432, принадлежащий к капсульному типу K27.
Еще в одном примере реализации наноагент характеризуется тем, что патогенная бактерия представляет собой штамм Acinetobacter baumannii 1053, принадлежащий к капсульному типу K91.
Еще в одном примере реализации наноагент характеризуется тем, что патогенная бактерия представляет собой штамм Acinetobacter baumannii В8300, принадлежащий к капсульному типу K92.
Еще в одном примере реализации наноагент отличается тем, что фермент деполимераза Dpo1053, кодируемая в геноме литического фага Acinetobacter baumannii АР22, представляет собой полисахаридлиазу.
Еще в одном примере реализации наноагент отличается тем, что фермент деполимераза Dpo1053, кодируемая в геноме литического фага Acinetobacter baumannii АР22, представляет собой полисахаридлиазу, которая отщепляет капсульные полисахариды от Acinetobacter baumannii 1053 путем β-элиминирования по одному из остатков ManNAcA.
Еще в одном примере реализации наноагент отличается тем, что фермент деполимераза Dpo1432, кодируемая в геноме литического фага Acinetobacter baumannii vB_AbaP_AS12, представляет собой специфическую гликозидазу.
Еще в одном примере реализации наноагент отличается тем, что фермент деполимераза Dpo1432, кодируемая в геноме литического фага Acinetobacter baumannii vB_AbaP_AS12, представляюет собой специфическую гликозидазу, отщепляющую капсульные полисахариды от Acinetobacter baumannii 1432 по гидролитическому механизму.
Еще в одном примере реализации наноагент характеризуется тем, что фермент деполимераза профага DpoB8300, кодируемая в геноме Acinetobacter baumannii В8300, является специфической гликозидазой.
Еще в одном примере реализации наноагент характеризуется тем, что фермент деполимераза профага DpoB8300, кодируемая в геноме Acinetobacter baumannii В8300, является специфической гликозидазой, расщепляющей CPS Acinetobacter baumannii В8300 по гидролитическому механизму с образованием мономера и димера повторяющегося полисахаридного звена.
В другой неограничивающей реализации изобретения способ получения наноагента для скрининга патогенных штаммов бактерий с множественной лекарственной устойчивостью, охарактеризованного выше, включает стадии получения наночастиц золота, получения конъюгатов наночастиц золота с фаговым или профаговым ферментом деполимераза, характеризующийся иммобилизацией ферментов на поверхности наночастиц золота, инкубирования конъюгатов наночастиц золота с ферментом при обработке ультразвуком, добавления бычьего сывороточного альбумина и промывания полученных наноагентов не менее трех раз.
В одном примере реализации способа, способ отличается тем, что фермент представляет собой деполимеразу Dpo1053.
Еще в одном примере реализации способа, способ отличается тем, что фермент деполимераза Dpo1053, представляет собой полисахаридлиазу.
Еще в одном примере реализации способа, способ отличается тем, что фермент представляет собой деполимеразу Dpo1432.
Еще в одном примере реализации способа, способ отличается тем, что фермент деполимераза Dpo1432, представляет собой специфическую гликозидазу.
Еще в одном примере реализации способа, способ отличается тем, что фермент представляет собой деполимеразу DpoB8300.
Еще в одном примере реализации способа, способ характеризуется тем, что фермент деполимераза DpoB8300 является специфической гликозидазой.
Еще в одном примере реализации способа, способ характеризуется тем, что получение наночастиц золота проводят восстановлением золотохлористоводородной кислоты цитратом натрия.
Еще в одном примере реализации способа, способ характеризуется тем, что получение конъюгатов наночастиц золота с ферментом деполимераза проводят путем добавления 200 мкг фермента деполимераза Dpo1053 к 1 мл раствора наночастиц золота.
Еще в одном примере реализации способа, способ характеризуется тем, что получение конъюгатов наночастиц золота с ферментом деполимераза проводят путем добавления 100 мкг фермента деполимераза DpoB8300 к 1 мл раствора наночастиц золота.
Еще в одном примере реализации способа, способ характеризуется тем, что получение конъюгатов наночастиц золота с ферментом деполимераза проводят путем добавления 200 мкг фермента деполимераза Dpo1432 к 1 мл раствора наночастиц золота.
Еще в одном примере реализации способа, способ характеризуется тем, что инкубирование при обработке ультразвуком проводят в течение 1 мин.
Еще в одном примере реализации способа, способ характеризуется тем, что после инкубирования при обработке ультразвуком добавляют 0,25 мл 5% бычьего сывороточного альбумина в фосфатно-солевом буфере.
Еще в одном примере реализации способа, способ характеризуется тем, что полученные наноагенты не менее трех раз промывают и центрифугируют в течение 10 минут при 10000 об/мин.
Краткое описание чертежей
Изобретение иллюстрируются следующими графическими материалами.
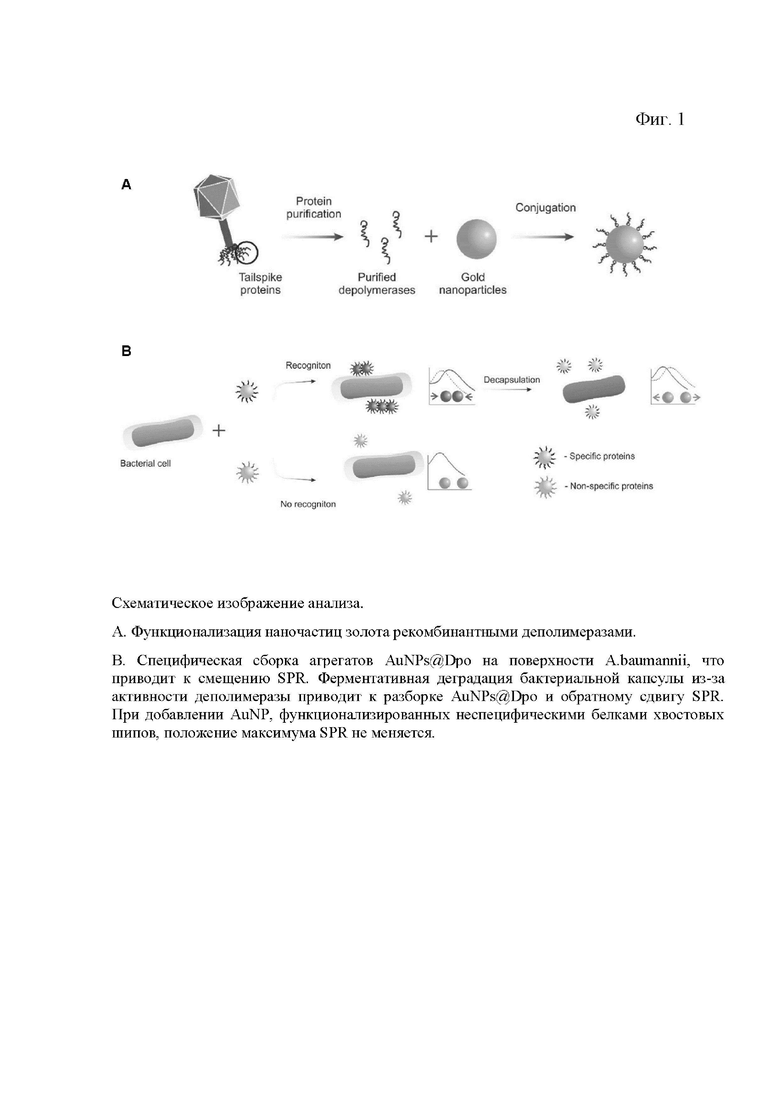
На фиг. 1 показано схематическое изображение анализа.
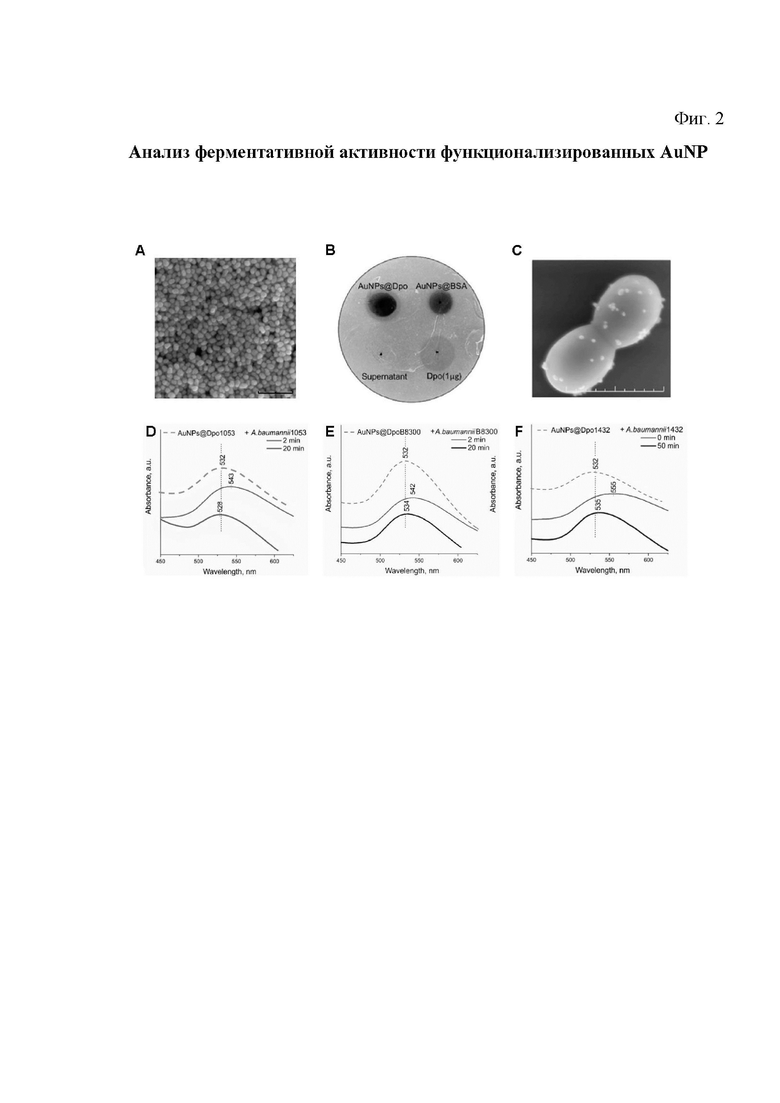
На фиг. 2 представлен анализ ферментативной активности функционализированных наночастиц AuNP.
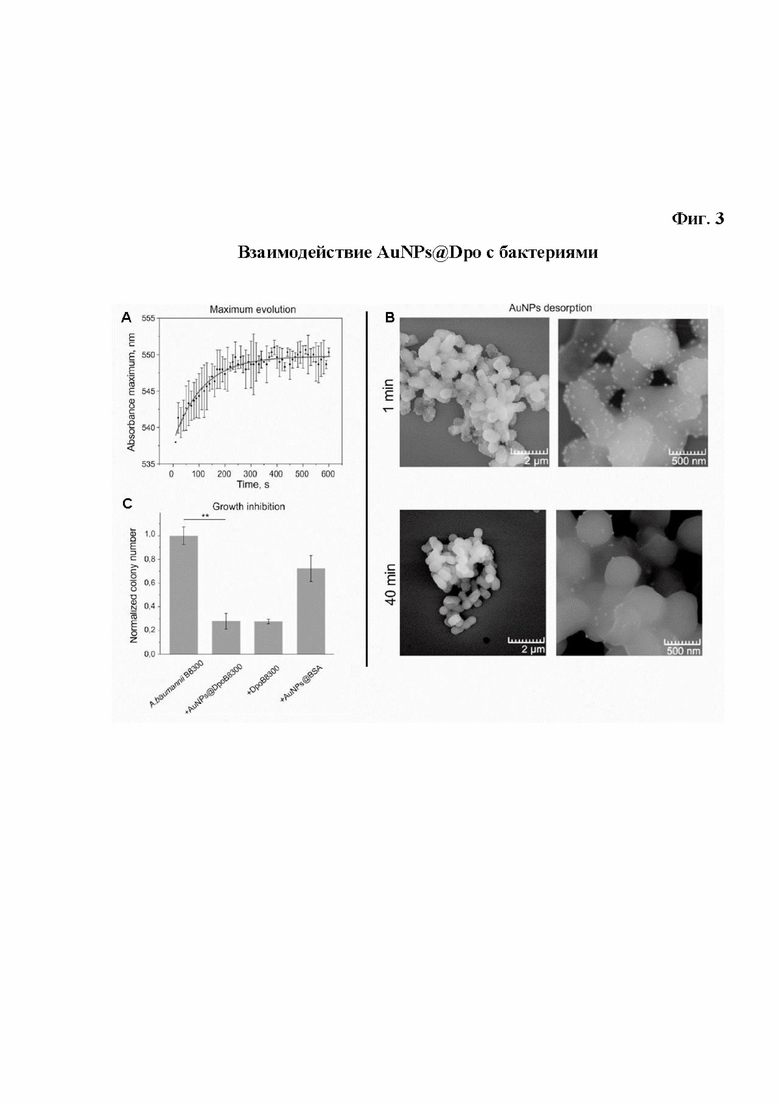
На фиг. 3 показано взаимодействие AuNPs@Dpo с бактериями.
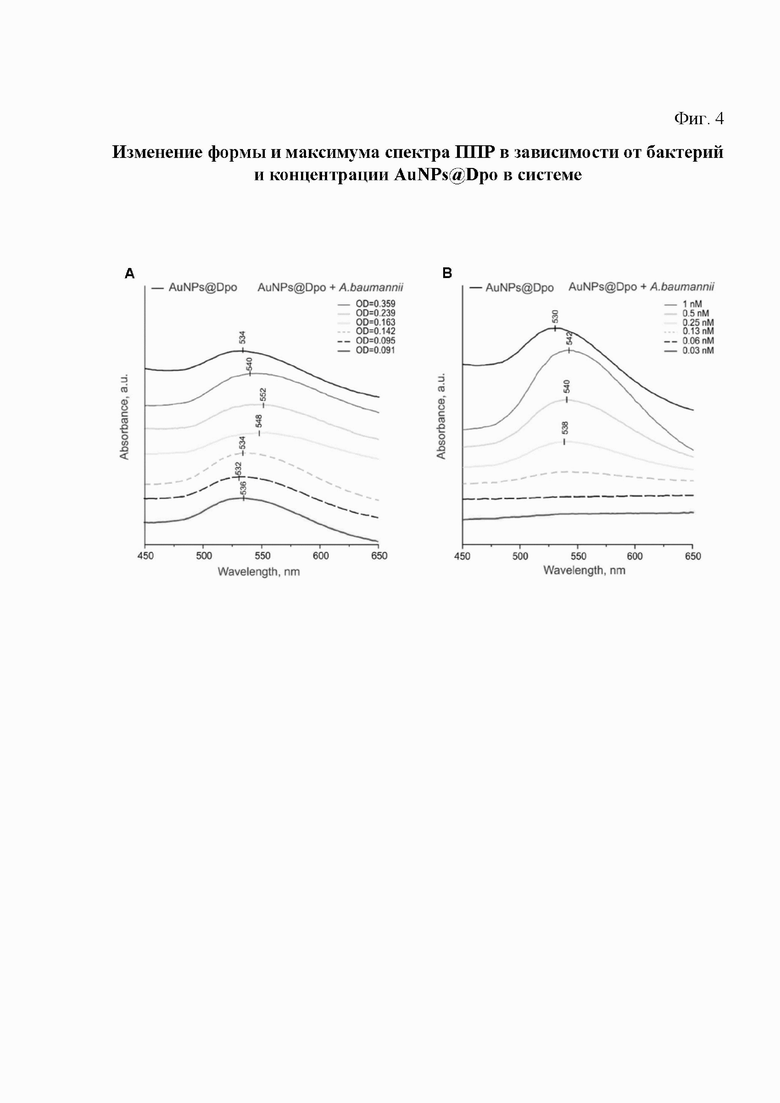
На фиг. 4. показано изменение формы и максимума спектра ППР в зависимости от бактерий и концентрации AuNPs@Dpo в системе.
На фиг. 5 представлена селективность AuNPs@Dpo.
Осуществление изобретения
Если не указано иначе, предполагается, что все термины и обозначения, используемые в данной заявке, имеют значения, которые обычно понимают специалисты в этой области, к которой относится настоящее изобретение.
Сокращения, используемые в настоящем описании, включая приведенные в иллюстративных схемах и последующих примерах, хорошо известны специалисту в этой области. Некоторые из сокращений используют как следующие:
AuNP - наночастицы золота
AuNPs@Dpo - наночастицы золота с иммобилизованной на их поверхности фаговой деполимеразой
БСА - Бычий сывороточный альбумин
ГМДС - раствор гексаметилдисилазана (HMDS)
FITC - изотиоцианат флуоресцеина (ФИТЦ)
FC - проточная цитометрия (Flow cytometry) - метод для обнаружения и измерения физических и химических характеристик популяции клеток или частиц.
КПС - капсульный полисахарид, из которого состоит защитная капсула клетки бактерии A. Baumannii
LB - среда (бульон) Луриа-Бертани
ManNAcA - полисахарид-лиаза, расщепляющая КПС A. baumannii 1053 по механизму β-элиминирования в остатках гексуроновой кислоты
OD - оптическая плотность
ППР - поверхностный плазмонный резонанс
PBS - фосфатно-солевой буферный раствор
СПР - SPR-метод основан на явлении поверхностного плазмонового резонанса (surface plasmon resonance).
Гипотеза заключается в том, что аппроксимации наночастиц золота (AuNP), функционализированных белками хвостовых шипов бактериофага, будет достаточно, чтобы вызвать сдвиг ППР при их специфическом связывании с соответствующими КПС на поверхности бактерий. И этот сдвиг будет использован для скрининга специфичности деполимеразы и для мониторинга ее активности в реальном времени.
Заявленная группа изобретений представляет собой новый наноагент для быстрого качественного скрининга активности фаговых и профаговых деполимераз с целью выявления патогенного штамма бактерий у пациента, а также способ получения (синтеза) наноагента.
Для оценки клинической применимости наноагента был выбран скрининг белков деполимеразы хвостовых шипов бактериофага, активных в отношении определенных K видов бактерии A. baumannii - наиболее частой причины внутрибольничных инфекций. Этот возбудитель характеризуется естественной множественной лекарственной устойчивостью, а также вторичной устойчивостью к антибиотикам, дезинфицирующим средствам, моющим средствам и УФ-облучению (Tacconelli et al., 2017).
Авторами показано, что предложенный подход на основе ППР позволяет использовать наноагент для проведения скрининга фагов в короткие сроки и только с помощью УФ-спектрометра, что значительно расширяет выбор доступных антимикробных препаратов.
Материалы
Бычий сывороточный альбумин (БСА) и бульон Лурия-Бертани Леннокс («Диа-М», Россия); агароза (ПанЭко, Россия); фосфатно-солевой буфер (PBS), гексаметилдисилазан (HMDS), глутаровый альдегид, флуоресцеин изотиоцианат (ФИТЦ, FITC) (все от Sigma-Aldrich, Германия), хлороауриновая кислота (золотохлористоводородная кислота) (Драгцветмет, Россия); хлорид натрия (PanReac AppliChem). Все реактивы имели аналитическую чистоту и использовались в том виде, в каком они были получены. Вода Milli-Q использовалась для приготовления водных растворов.
Для синтеза наноагентов выбраны три различные хорошо охарактеризованные структурные деполимеразы, условно обозначенные как Dpo1053, Dpo1432 и DpoB8300, с определенной специфичностью к капсульным полисахаридам (КПС) А. baumannii, принадлежащим к капсульным типам K91, K27 и K92 (K типы) соответственно.
Деполимераза Dpo1053 (Genbank: YP_006383804, PDB: 4Y9V), кодируемая в геноме литического фага A. baumannii АР22, представляет собой полисахаридлиазу, которая отщепляет КПС от A. baumannii 1053 путем β-элиминирования по одному из остатков ManNAcA (Knirel et al., 2020).
Деполимераза Dpo1432 (Genbank: YP_009599229, PDB: 6EU4), кодируемая в геноме литического фага A. baumannii vB_AbaP_AS12, представляет собой специфическую гликозидазу, отщепляющую КПС от A. baumannii 1432 по гидролитическому механизму (Knirel et al., 2020).
Деполимераза профага DpoB8300 (Genbank: KMV24774), кодируемая в геноме A. baumannii В8300, также является специфической гликозидазой, расщепляющей КПС A. baumannii В8300 по гидролитическому механизму с образованием мономера и димера повторяющегося полисахаридного звена (Дробязко и др., 2022).
Получение фаговых деполимераз Dpo1053 и Dpo1432 и деполимеразы профага DpoB8300 проводили, как описано ранее (Drobiazko et al., 2022; Knirel et al., 2020).
Штаммы A. baumannii 1053 (капсульный тип К91) (Шашков и др., 2015) и 1432 (К27) (Шашков и др., 2016) получены из СКПМ-Оболенск (инвентарные номера В-7129 и В-7134 соответственно).
Штамм A. baumannii В8300 (K92) (Senchenkova et al., 2021) любезно предоставлен доктором Вирарагхаван Баладжи (Христианский медицинский колледж, Веллор, Индия).
Ниже приведены экспериментальные данные. Техническая сущность и промышленная применимость заявленной группы изобретений поясняются следующими примерами, ни в коей мере не уменьшая притязания по формуле изобретения во всех частных формах воплощения существенных признаков.
Наночастицы золота
Предлагаемый подход не требует сложного химического синтеза или модификации наночастиц для получения необходимых соединений, что является одним из его ключевых преимуществ.
Функционализированные 40 нм наночастицы золота (AuNP) синтезировали восстановлением золотохлористоводородной кислоты HAuCl4 цитратом натрия по протоколу стандартного метода синтеза Туркевича (Туркевич и др., 1951).
Культуры бактерий
Штаммы A. baumannii культивировали по стандартным протоколам. Все бактерии выращивали в течение ночи перед экспериментами в среде Луриа- Бертани (LB) при 37°С при перемешивании (150 об/мин). Затем ночную культуру разводили 1:20 в свежей среде LB и выращивали до достижения бактериями необходимого значения оптической плотности (OD600).
Получение фаговых и профаговых деполимераз проводили, как описано ранее.
Анализ активности деполимеразы.
Активность деполимеразы предварительно анализировали методом точечной пробы или модификацией двухслойного метода (Adams, 1959). 100 мкл культуры бактерий (OD600=0,4) смешивали с 5 мл мягкого агара (среда LB с добавлением 0,6% агарозы), выливали на поверхность чашек со средой LB и давали затвердеть. Затем на мягкий агар наносили 1 мкг (10 мкл) суспензии деполимеразы или 10 мкл (1 нМ) конъюгатов наночастиц золота и инкубировали в течение ночи при 37°С. Для измерения селективности смесь двух штаммов A. baumannii в объеме 100 мкл каждый с оптической плотностью OD600=0,1 смешивали с 10 мкл (1 нМ) конъюгатов наночастиц золота. Спектры экстинкции от 450 до 650 нм измеряли каждую 1 мин в течение 10 мин.
Конъюгаты наночастиц золота с деполимеразами (Dpos) получали по следующему протоколу:
200 мкг Dpo1053, 100 мкг DpoB8300 или 200 мкг Dpo1432 добавляли к 1 мл раствора наночастиц золота (OD530 нм = 0,63, 130 пМ) и инкубировали в течение 1 мин при обработке ультразвуком. Затем добавляли 0,25 мл 5% БСА в PBS. Все конъюгаты не менее трех раз промывали, центрифугировали (10 мин, 10000 g - при 10000 об/мин) и хранили по 0,1 мл в 1% БСА в PBS.
Полученные наноконъюгаты, представляющие собой наночастицы золота AuNP, покрытые деполимеразами соответствующего фага или профага, далее добавляли к культуре бактерий для образования комплексов с бактериями и выявления патогенных бактерий A. baumanii.
Дополнительно для подтверждения образования комплекса бактерии-наноагенты, проводили сканирующую электронную микроскопию с помощью микроскопа MAIA3 (Tescan, Чехия).
Образцы фиксировали 1% глутаровым альдегидом (в PBS) в течение 2,5 часов. Затем клетки последовательно обезвоживали, переводя в этанол (30, 50, 70, 80, 95%) с последующей 10-минутной инкубацией на каждом этапе. Далее клетки фиксировали 50 и 100% растворами гексаметилдисилазана (ГМДС) по 10 мин каждый. Наконец, полученные образцы помещали на кремниевую пластину и сушили при комнатной температуре.
Дополнительно проводили проточную цитометрию.
Чтобы отличить отдельные клетки от мусора для измерения FC, бактериальные клетки были помечены флуоресцентным красителем. Конъюгаты бактерии-FITC получали следующим образом. 1 мл A. baumanii В8300, выращенных до OD600=1,5, дважды отмывали от среды LB карбонатнобикарбонатным буфером (рН=9). Далее 1 мл бактерий в буфере смешивали с 20 мкг раствора ФИТЦ в 50 мкл ДМСО. Смесь инкубировали 30 мин при комнатной температуре и 5 раз отмывали 1% БСА в PBS (рН 7,4) от непрореагировавшего ФИТЦ. Затем 100 мкл FITC-меченых бактерий смешивали с 10 мкл (1 нМ) AuNPs@DpoB8300, AuNPs@BSA или 1% BSA. Клетки фиксировали добавлением 100 мкл 37% формальдегида через 1 мин, 15 мин или 60 мин инкубации. Индекс FSC-H анализировали на проточном питометре Novocyte (Agilent, США). 105 Пороговое значение FSC-H было установлено заранее, чтобы исключить клеточный дебрис и несвязанные наночастицы.
Обработка данных
Все исследования проводили не менее трех раз. Все значения графиков представляют собой средние значения, а показатели погрешностей указывают на стандартные отклонения.
Результаты
Полученные предлагаемым способом наноагенты, содержащие наночастицы золота с иммобилизованной на их поверхности фаговой или профаговой деполимеразой (AuNPs@Dpo), будут способны специфически распознавать и связываться с капсульными полисахаридами штаммов-мишеней бактерий так же, как и свободные молекулы деполимеразы.
Из-за высокой плотности целевых полисахаридов в клеточной стенке бактерии наноагенты будут связываться достаточно близко друг к другу, чтобы вызвать сдвиг максимума спектра ППР в сторону большей длины волны. Затем при разрушении подложки наночастицы диссоциируют от поверхности, расстояние между ними увеличивается, а максимум поглощения ППР смещается обратно в сторону более короткой волны.
Немодифицированные частицы или частицы, модифицированные неспецифической деполимеразой, не будут агрегировать на поверхности бактерий или не будут достаточно плотным, чтобы вызвать смещение максимума спектра ППР.
Полученные наноагенты при взаимодействии с бактериями-хозяевами обладают той же специфичностью, что и при использовании бактериофага.
Взаимодействие между фаговой деполимеразой и обнаруживаются с помощью УФ-видимой спектроскопии. Тогда измеряемым параметром будет максимум поглощения раствора наночастиц (фигуры 1А и Б).
На фиг. 1 показано схематическое изображение микробиологического анализа:
A. Получение наноагентов - функционализация наночастиц золота рекомбинантными деполимеразами.
B. Специфическая сборка агрегатов AuNPs@Dpo на поверхности A.baumannii, что приводит к смещению SPR. Ферментативная деградация бактериальной капсулы из-за активности деполимеразы приводит к разборке AuNPs@Dpo и обратному сдвигу SPR. При добавлении AuNP, функционализированных неспецифическими белками хвостовых шипов, положение максимума SPR не меняется.
Частицы были охарактеризованы с помощью динамического рассеяния света (DLS), сканированием и просвечивающей электронной микроскопии (ПЭМ). Их размер составил 32±4 нм (рис. 2А, рис. S1). Химический состав наночастиц был подтвержден методом энергодисперсионной рентгеновской спектроскопии (рис. S1).
На фиг. 2 показан анализ ферментативной активности функционализированных наноагентов - наночастиц AuNP.
A. СЭМ-микрофотография синтезированных наночастиц AuNP с помощью сканирующего электронного микроскопа. Масштабная линейка показывает 200 нм.
B. Анализ спот-теста деполимеразной активности AuNP, функционализированных деполимеразой (Dpo). Слева вверху - AuNPs@DpoB8300, вверху справа - AuNPs@BSA, внизу слева - супернатант отмытых AuNPs@DpoB8300, внизу справа - 1 мкг очищенного DpoB8300. Образовавшийся ореол указывает на декапсуляцию бактерий в месте нанесения пробы.
C. СЭМ-микрофотография связывания AuNPs@DepB8300 с A. baumannii В8300 после 1-минутной инкубации. Масштабная линейка показывает 500 нм.
D-F. Спектр ППР AuNP (10 мкл, 1 нМ), функционализированных различными деполимеразами в разные моменты времени после добавления специфических штаммов A. baumannii (100 мкл, OD600).
За синтезом следовала сорбция соответствующих рекомбинантных деполимераз фагового или профагового происхождения, специфичных к K типам, присутствующим на поверхности различных штаммов A. baumannii. При функционализации наночастиц наблюдался небольшой сдвиг ППР в сторону большей длины волны, который связан с изменением диэлектрической проницаемости наночастиц. Это изменение можно обнаружить и подтвердить с помощью спектроскопии в УФ-видимой области (рис. S2).
Поскольку связывание с твердой фазой может изменить конформацию фермента или повлиять на его активный центр, был проведен качественный анализ деполимеразной активности с помощью стандартного анализа спот-теста.
Пример такого выборочного теста для A. baumannii В8300, принадлежащего к капсульному типу K92, представлен на рис. 2 В.
Бактериальную культуру A. baumannii В8300, смешанную с полужидким агаром, инкубировали в течение 12-18 ч с AuNP, функционализированными специфической деполимеразой профага (обозначенной как AuNPs@DpoB8300), нанесенными на поверхность газона. Полученный ореол при точечном нанесении подтверждает сохраненную активность фермента. Совместная инкубация AuNP, покрытых бычьим сывороточным альбумином (AuNPs@BSA), не сопровождалась образованием эффекта «Гало», что свидетельствует об отсутствии деполимеразоподобной активности наночастиц как таковой. Добавление супернатанта отмытых AuNPs@DpoB8300 также не приводило к образованию эффекта «Гало», что свидетельствует об отсутствии несвязанных молекул деполимеразы в растворе (рис. 2Б).
Для проверки полученных наноагентов осуществляли связывание наноагентов AuNPs с поверхностью бактериальной клетки. Наноагенты AuNPs@DpoB8300 добавили в раствор соответствующего K типа A. baumannii и подтвердили образование комплекса бактерии-наночастицы с помощью сканирующей электронной микроскопии (СЭМ), как показано на рис. 2С. Иммобилизация ферментов на поверхности плазмонных наночастиц позволяет неинвазивно визуализировать специфическую активность деполимеразы по отношению к бактериям-мишеням за счет сдвига спектра ППР.
Затем был проведен УФ-видимый анализ спектров поглощения растворов до добавления AuNPs@Dpo и после 1 -2-минутной инкубации.
Для проверки единообразия метода и его применимости в целях скрининга были исследованы наночастицы AuNP, функционализированные тремя различными деполимеразами, которые специфически взаимодействуют с различными К-типами A. baumannii.
Как и ожидалось, комплексообразование во всех случаях сопровождалось сдвигом ППР в более длинноволновую область (Δ=10 нм для штаммов A. baumannii 1053 и В8300, Δ=23 нм для штамма A. baumannii 1432).
Сдвиг был вызван конкретными агрегациями AuNPs@Dpo на поверхности бактерий-мишеней (рис. 2D-F).
Это произошло за очень короткое время 95 секунд и для его обнаружения потребовался спектральный анализ в реальном времени (рис. 3А).
Стоит отметить, что сдвига SPR не наблюдалось при добавлении неспецифических AuNP, таких как частицы, функционализированные лизоцим-гликозидгидролазой или стрептавидином (рис. S4).
Инкубация AuNPs@Dpo с нецелевыми бактериями Е. coli также не изменила положения максимума SPR (рис. S5).
Было проведено сравнение эффективности предложенного подхода с использованием наночастиц AuNP меньшего размера (20 нм). В этом случае было обнаружено, что максимальный сдвиг составляет Δ=7 нм для штамма A. baumannii В8300 (рис. S6).
Различия в диапазоне сдвига SPR для разных штаммов A. baumannii можно объяснить неодинаковым распределением боковых связывающих доменов для разных деполимераз, а именно фермент-специфические повторяющиеся звенья гликозидной связи или структура поверхности функционализированных наночастиц. Сдвиг ППР был обратимым, и в конечном итоге максимум поглощения возвращался к исходным значениям, что предположительно связано с деградацией субстрата, декапсуляцией бактерий и разборкой наночастиц золота с поверхности клетки.
Данные УФ-видимой спектрофотометрии об агрегации и десорбции AuNP были подтверждены результатами СЭМ (фиг. 3В) и анализом бокового рассеяния проточной цитометрией (фиг. S7).
На фиг. 3 показано взаимодействие наноагентов AuNPs@Dpo с бактериями:
A. Сборка комплекса AuNPs-бактерии. Эволюцию сдвига SPR оценивали с помощью непрерывной УФ-видимой спектроскопии после автоматического введения 10 мкл (1 нМ) раствора AuNPs@DpoB8300 в образец A. baumannii В8300 (60 мкл, OD600=0,2).
B. Взаимодействие AuNPs@Dpo с бактериями. Данные были нормализованы к образцу необработанных бактерий. Данные показаны как среднее ± стандартное отклонение (N=3). Динамика взаимодействия AuNPs@DpoB8300 с клеточной поверхностью A.baumannii В8300 по оценке СЭМ. Сборка частиц на клеточной поверхности через 1 мин после добавления 1 нМ наночастиц к бактериям OD600≈0,2 (вверху) и их разборка через 40 мин (внизу).
C. Жизнеспособность A. baumannii после инкубации с функционализированньгми наночастицами AuNP в течение 30 мин. Данные были нормализованы к образцу необработанных бактерий. Данные показаны как среднее значение ± стандартное отклонение (N=3).
Были определены оптимальные концентрации бактерий и функционализированных ферментом деполимеразой наночастиц AuNPs@Dpo для использования в скрининговых анализах. Был проведен сравнительный анализ формы и максимума спектра ППР в зависимости от соотношения концентраций бактерий и AuNPs@Dpo в системе.
Первоначально концентрация наноагентов AuNPs@Dpo была зафиксирована на уровне 1 нМ, в то время как концентрация A. baumannii варьировала от 3,6×107 клеток/мл (OD600=0,091) до 1,43×108 клеток/мл (OD600=0,359).
Минимальная концентрация бактерий, необходимая для появления обнаруживаемого ППР-сдвига, составила 6,5×107 кл/мл (OD600=0,163), концентрация 9,6×107 кл/ мл (OD600=0,239) была оптимальной (Фиг. 4).
На Фиг. 4. показано изменение формы и максимума спектра ППР в зависимости от бактерий и концентрации AuNPs@Dpo в системе:
A. Изменение формы и максимума спектра ППР при добавлении 1 нМ AuNPs@DpoB8300 (10 мкл) к растворам с различной концентрацией штамма А. baumannii В8300.
B. Изменение формы и максимума спектра ППР при добавлении различных концентраций наночастиц золота (10 мкл, AuNPs@DpoB8300) к раствору штамма A.baumannn В8300 (100 мкл, OD600=0,2).
Соответствующие концентрации AuNPs@Dpo составляли 0,25 нМ и 1 нМ при фиксированной концентрации бактерий 8×107 клеток/мл (OD600=0,2). Соотношение [OD600=4×108 КОЕ/мл] использовали для расчета приблизительной бактериальной концентрации ресуспендированного препарата (Nielsen et al., 2015).
Дополнительно была выявлена специфическая декапсуляция штамма А. baumannii В8300 после его инкубации в течение 1 ч со специфическими AuNP@DpoB8300. Хотя декапсуляция не сопровождалась каким-либо видимым изменением оптической плотности (рис. S8), она значительно уменьшала количество колониеобразующих единиц (КОЕ) по сравнению с необработанным образцом (рис. 3С). Предположительно, ингибирование роста может быть отдаленным эффектом декапсуляции.
Специфичность наноагентов для скрининга активности деполимеразы.
Полученные наноагенты AuNPs@Dpo имитируют активность фаговых деполимераз и могут быть использованы в качестве мощного инструмента для скрининга их специфичности к различным K типам A. baumannii. Обычный анализ «спот-тест» требует культивирование бактерий с деполимеразами, чтобы четко увидеть декапсуляцию через формирование эффекта «Гало». Реализация такого протокола занимает до 18 часов (Alsan and Klompas, 2010).
Предложенные наноагенты для скрининга, обладающие высокой специфичностью, не требуют длительного роста бактерий для проведения скрининга, а специфическое распознавание может быть зарегистрировано сразу после добавления потенциального терапевтического наноагента с помощью УФ-видимой спектроскопии в режиме реального времени. Анализ прост в использовании и может быть выполнен в режиме планшета, что позволяет увеличить его масштаб (рис. 5А).
Рис. 5. Селективность наноагентов AuNPs@Dpo:
A. Ключевой принцип анализа. Сравнение обычного метода точечного теста для скрининга активности деполимеразы в отношении определенных бактериальных штаммов (вверху) и разработанного анализа на основе SPR (внизу).
B. Анализ специфичности наноагентов в ходе тестирования по отношению к разным штаммам A. baumannii разных типов К.
AuNPs@Dpo1053, AuNPs@DpoB8300 и AuNPs@Dpo1432 были обнаружены на бактериальных газонах A. baumannii 1053 (верхний ряд), A. baumannii В8300 (средний ряд) и A. baumannii 1432 (нижний ряд). AuNPs@Dpo наносили в количестве 10 мкл (1 нМ), 1 мкг каждого очищенного Dpo служил положительным контролем (левый столбец). Затем специфичность активности AuNPs@Dpo оценивали с помощью разработанного анализа на основе SPR после 3 минут инкубации (средний столбец) и регистрировали временную эволюцию спектральных максимумов (правый столбец). Для колонок, где ошибка эксперимента не могла быть получена из-за воспроизводимости результатов, применяется инструментальная ошибка (±0,5 нм). Данные показаны как среднее ± стандартное отклонение (N=3).
Основным преимуществом полученных предлагаемым способом наноагентов над уже известными из уровня техники является высокая специфичность, которая определяется взаимодействием фермента на поверхности наночастиц с соответствующими КПС.
Для выявления ограничений разработанных наноагентов для анализа (скрининга) были проведены исследования с целью проверки и подтверждения деполимеразной активности AuNPs@Dpo, функционализированных различными ферментами фагового и профагового происхождения.
Наночастицы AuNP, конъюгированные с ферментами Dpo1053, DpoB8300 и Dpo1432, специфичные для КПС A. baumannii 1053 (капсульный тип K91), А. baumannii В8300 (K92) и A. baumannii 1432 (K27) соответственно, были нанесены на бактериальные газоны этих штаммов, которые затем инкубировали в течение ночи. Наноагенты AuNPs@Dpo продемонстрировали ту же специфичность декапсуляции, что и очищенные белки деполимеразы, которые служили в качестве положительного контроля (рис. 5В - слева).
Также был проведен анализ для подтверждения сдвига специфичности ППР как показателя связывания полученных наноагентов с поверхностью бактериальной клетки.
Анализ проводили для различных AuNP@Dpo (1 нМ), которые добавляли к растворам трех разных штаммов A. baumannii (1053, В8300, 1432 соответственно) и Е. coli (100 мкл 2,9×108 клеток/мл, OD600=0,2). Последний служил отрицательным контролем.
Наноагенты и бактерии смешивали и совместно инкубировали в течение 3 минут, после чего проводили УФ-видимый анализ максимума поглощения ППР. Заметный сдвиг наблюдался только при добавлении специфических AuNP@Dpo к соответствующему штамму в первые минуты инкубации. В то же время взаимодействие других неспецифических AuNPs@Dpo со штаммом не приводило к сдвигу SPR, что свидетельствует о высокой селективности разработанного подхода (рис. 5В - центр).
Несмотря на последние достижения в исследованиях фагов, точный механизм активности деполимеразы изучен недостаточно. Хотя мониторинг обратного сдвига ППР, вызванного диссоциацией наночастиц с клеточной поверхности, не является прямым измерением деградации субстрата, разница в активности деполимеразы очевидна (рис. 5В - справа). Например, обратный сдвиг ППР для наноагента AuNPs@Dpo1432 занимает более 1 ч, а для Dpo1053 и DpoB8300 - 10 и 25 мин соответственно. Предполагается, что этот эффект зависит от скорости деградации субстрата, и данный подход может быть полезен для сравнительного изучения взаимодействия фагов и бактерий.
Резюмируя вышесказанное, представлены наноагент и способ получения наноагента, основанный на функционализации наночастиц золота AuNP деполимеразами фагового происхождения. Полученные наноагенты проявляют фагоподобное поведение, повторяя распознавание лигандов специфических бактерий и дальнейшую ферментативную реакцию.
Учитывая рост резистентности патогенных бактерий к лекарственным препаратам, предлагаемый подход может стать новой возможностью для повышения эффективности выявления патогенных бактерий, а также может послужить для лечения и предотвращения распространения бактериальных инфекций.
Источники литературы
1. Adams, М.Н., 1959. Bacteriophages. Inter-science Publishers, New York (& London). Alsan, M., Klompas, M., 2010. Acinetobacter baumannii: an emerging and important pathogen. J. Clin. Outcome Manag. 17, 363-369.
2. Arbatsky, N.P. et al., 2019. Structure of the K128 capsular polysaccharide produced by Acinetobacter baumannii KZ-1093 from Kazakhstan. Carbohydr. Res. 485, 107814 https://doi.org/10.1016/j.carres.2019.107814.
3. Campos, M A. et al, 2004. Capsule polysaccharide mediates bacterial resistance to antimicrobial peptides. Infect. Immun. 72, 7107-7114. https://doi.org/10.1128/IAI.72.12.7107.
4. Carlton, R.M., 1999. Phage therapy: past history and future prospects. Arch. Immunol. Ther. Exp. 47,267-274. Chen, J., Jiang, Z., Ackerman, J.D., Yazdani, M., Hou, S., Nugen, S.R., Rotello, V.M., 2015. Electrochemical nanoparticle-enzyme sensors for screening bacterial contamination in drinking water. Analyst 140, 4991-4996. https://doi.org/ 10.1039/c5an00637f.
5. Drobiazko, A.Y. et al., 2022. Capsuletargeting depolymerases derived from acinetobacter baumannii prophage regions. Int. J. Mol. Sci. 23, 4971. https://doi.org/10.3390/ijms23094971.
6. E1-sayed, I.H., Huang, X., El-sayed, M.A., 2005. Surface plasmon resonance scattering and absorption of anti-EGFR antibody conjugated gold nanoparticles in cancer diagnostics: applications in oral cancer. Nano Lett. 5, 829-834. https://doi.org/ 10.1021/n1050074e.
7. Hsieh, P.F. et al, 2017. Two T7-like bacteriophages, K5-2 and K5-4, each encodes two capsule depolymerases: isolation and functional characterization. Sci. Rep.7, 4624. https://doi.org/10.1038/s41598-017-04644-2.
8. Hsu, C.-R., Lin, T.-L., Pan, Y.-J., Hsieh, P.-F., Wang, J.-T., 2013. Isolation of a bacteriophage specific for a new capsular type of Klebsiella pneumoniae and characterization of its polysaccharide depolymerase. PLoS One 8, e70092. https://doi.org/10.1371/joumal.pone.0070092.
9. Huang, S., 2007. Gold nanoparticle-based immunochromatographic assay for the detection of Staphylococcus aureus. Sensor. Actuator. В Chem. 127, 335-340. https://doi.org/10.1016/j.snb.2007.04.027.
10. Kenyon, J.J et al., 2021. Correlation of Acinetobacter baumannii K144 and K86 capsular polysaccharide structures with genes at the K locus reveals the involvement of a novel multifunctional rhamnosyltransferase for structural synthesis. Int. J. Biol. Macromol. 193, 1294-1300. https://doi.org/10.1016/j.ijbiomac.2021.10.178.
11. Khlebtsov, N.G., 2008. Determination of size and concentration of gold nanoparticles from extinction spectra. Anal. Chem. 80, 6620-6625. https://doi.org/10.1021/ ac800834n. Knirel, Y.A., Shneider, M.M., Popova, A.V., Kasimova, A.A., Senchenkova, S.N., Shashkov, A.S., Chizhov, A.O., 2020. Mechanisms of acinetobacter baumannii capsular polysaccharide cleavage by phage depolymerases. Biochemistry 85, 567-574. https://doi.org/10.1134/S0006297920050053.
12. Kunstmann, S et al., 2018. Bacteriophage Sf6 tailspike protein for detection of Shigella fiexneri pathogens. Viruses 10, 431. https://doi.org/10.3390/v10080431.
13. Lee, I.-M. et al., 2017. Structural basis for fragmenting the exopolysaccharide of Acinetobacter baumannii by bacteriophage ФАВ6 tailspike protein. Sci. Rep.7, 42711 https://doi.org/10.1038/srep42711.
14. Lin, H., Paff, M.L., Molineux, I.J., Bull, J. J., 2017. Therapeutic application of phage capsule depolymerases against K1, K5, and K30 capsulated E. coli in mice. Front. Microbiol. 8 https://doi.org/10.3389/fmicb.2017.02257.
15. Lin, T.-L. et al., 2014. Isolation of a bacteriophage and its depolymerase specific for K1 capsule of Klebsiella pneumoniae: implication in typing and treatment. J. Infect. Dis. 210, 1734-1744. https://doi.org/10.1093/infdis/jiu332.
16. Liu, Y. et al., 2019. The capsule depolymerase Dpo48 rescues Galleria mellonella and mice from acinetobacter baumannii systemic infections. Front. Microbiol. 10 https://doi.org/10.3389/fmicb.2019.00545.
17. Medley, CD. et al/, 2008. Gold nanoparticle-based colorimetric assay for the direct detection of cancerous cells. Anal. Chem. 80, 1067-1072. https://doi.org/10.1021/ac702037y.
18. Murray, C.J. et al., M., 2022. Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis. Lancet 399, 629-655. https://doi.org/10.1016/S0140-6736(21)02724-0.
19. Mushtaq, N. et al., P.W., 2005. Treatment of experimental Escherichia coli infection with recombinant bacteriophage-derived capsule depolymerase. J. Antimicrob. Chemother. 56, 160-165. https://doi.org/10.1093/jac/dki177.
20. Nielsen, T.B. et al., 2015. Cryopreservation of virulent Acinetobacter baumannii to reduce variability of in vivo studies. BMC Microbiol. 15, 252. https://doi.org/10.1186/s12866-015-0580-8.
21. Pan, Y.-J. et al., 2015. Identification of capsular types in carbapenemresistant Klebsiella pneumoniae strains by wzc sequencing and implications for capsule depolymerase treatment. Antimicrob. Agents Chemother. 59, 1038-1047. https://doi.org/10.1128/AAC.03560-14.
22. Peng, H., Chen, I.A., 2019. Rapid colorimetric detection of bacterial species through the capture of gold nanoparticles by chimeric phages. ACS Nano 13, 1244-1252. https://doi.org/10.1021/acsnano.8b06395.
23. Pires, D. et al., J., 2011. Use of newly isolated phages for control of Pseudomonas aeruginosa PAO1 and ATCC 10145 biofilms. Res. Microbiol. 162, 798-806. https://doi.org/10.1016/j.resmic.2011.06.010.
24. Podolsky, S.H., 2018. The evolving response to antibiotic resistance (1945-2018). Palgrave Commun. 4, 124. https://doi.org/10.1057/s41599-018-0181-x. Popova, A.V., Shneider, M.M., Arbatsky, N.P., Kasimova, A.A., Senchenkova, S.N., Shashkov, A.S., Dmitrenok, A.S. et al., 2020. Specific interaction of novel friunavirus phages encoding tailspike depolymerases with corresponding acinetobacter baumannii capsular types. J. Virol. 95 https://doi.org/10.1128/JVI.01714-20.
25. Senchenkova, S.N et al., J.J., 2021. A novel ItrA4 -galactosyl 1-phosphate transferase is predicted to initiate synthesis of an amino sugar-lacking K92 capsular polysaccharide of B8300. Res. Microbiol., 103815 https://doi.org/10.1016/j. resmic.2021.103815.
26. Shashkov, A.S. et al., 2016. Acinetobacter baumannii K27 and K44 capsular polysaccharides have the same К unit but different structures due to the presence of distinct wzy genes in otherwise closely related К gene clusters. Glycobiology 26, 501-508. https://doi.org/10.1093/glycob/cwv168.
27. Shashkov, A.S. et al., 2015. Structure of the capsular polysaccharide of Acinetobacter baumannii 1053 having the KL91 capsule biosynthesis gene locus. Carbohydr. Res. 404, 79-82. https://doi.org/10.1016/j.carres.2014.11.013.
28. Shchurova, A. S. et al., 2021. Novel acinetobacter baumannii myovirus TaPaz encoding two tailspike depolymerases: characterization and host-recognition strategy. Viruses 978. Shevchenko, K.G., Cherkasov, V.R., Nikitina, I.L., Babenyshev, A.V., Nikitin, M.P., 2018. Smart multifunctional nanoagents for in situ monitoring of small molecules with a switchable affinity towards biomedical targets. Appl. Nanosci. 8, 195-203. https://doi.org/10.1007/s13204-018-0659-2.
29. Shevchenko, K.G. et al., 2017. Surface plasmon resonance as a tool for investigation of non-covalent nanoparticle interactions in heterogeneous self-assembly & disassembly systems. Biosens. Bioelectron. 88, 3-8. https://doi.org/10.1016/j.bios.2016.09.042.
30. Sillankorva S., Neubauer, P., Azeredo, J., 2008. Pseudomonas fluorescens biofilms subjected to phage phiIBB-PF7A. BMC Biotechnol. 12, 79. https://doi.org/10.1186/1472-6750-8-79.
31. Tacconelli E. et al., 2017. Discovery, research, and development of new antibiotics: the WHO priority list of antibiotic-resistant bacteria and tuberculosis. Lancet 3099,1-10. https://doi.org/10.1016/S1473-3099(17)30753-3.
32. Tiet, P., Clark, K.C., Mcnamara, J.O., Berlin, J.M., 2017. Colorimetric detection of Staphylococcuas aureus contaminated solutions without purification. Bioconjugate Chem. 28, 183-193. https://doi.org/10.1021/acs.bioconjchem.6b00571.
33. Turkevich, J., Stevenson, P.C., Hillier, J., 1951. A study of the nucleation and growth processes in the synthesis of colloidal gold. Discuss. Faraday Soc. 11, 55. https://doi.org/10.1039/df9511100055.
34. Патент на изобретение RU 2773707 (ЗЕ КУРАТОРС ОФ ЗЕ ЮНИВЕРСИТИ ОФ МИССУРИ США (US)), 08.06.2022 «Наноконъюгаты доксорубицин-золото направленного воздействия для терапии опухолей».
35. Диссертация Шевченко К.Г., дисс. на соиск. уч. степ. к.б.н. «Разработка метода исследования комплексов гетерогенных наночастиц на основе эффекта локализованного поверхностного плазмонного резонанса и его использование для биомедицинских приложений», М., 2019 г. (прототип).
36. Патент на изобретение RU 2439151 (ФГУН ГПЦ ПМБ) (RU)), 10.01.2012 «Штамм бактериофага Acinetobacter baumannii АР22 для идентификации бактерий Acinetobacter baumannii при бактериологическом анализе клинического материала и для получения препарата против внутрибольничных A.baumannii-инфекций».
37. Шашков А.С. «Структура капсульного полисахарида Acinetobacter baumannii1053, имеющего локус гена биосинтеза капсулы KL91», Исследования углеводов, выпуск 404, 02.03.2015 г., с. 79-82. https://doi.org/10.1016/j.carres.2014.11.013.
38. Сенченкова С.Н. и др. «Предполагается, что новая ItrA4 D-галактозил-1-фосфаттрансфераза инициирует синтез аминосахарного капсульного полисахарида K92 без сахара Acinetobacter baumannii В8300», Исследования в области микробиологии, том 172, выпуск 3, апрель-май 2021 г., https://doi.org/10.1016/j.resmic.2021.103815.
39. Popova A.V. et al., «Novel Fril-like Viruses Infecting Acinetobacter baumannii-vB_AbaP_AS11 and vB_AbaP_AS12-Characterization, Comparative Genomic Analysis, and Host-Recognition Strategy", Viruses 2017, 9, 188; doi:10.3390/v9070188.
40. Книрель Ю.А. «Расщепление по различным механизмам капсульных полисахаридов Acinetobacter baumannii фаговыми деполимеразами», 2020, БИОХИМИЯ, 2020, том 85, вып. 5, с. 663-671, DOI: 10.31857/S032097252005005X.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ ПАТОГЕННЫХ ШТАММОВ БАКТЕРИЙ | 2022 |
|
RU2802435C1 |
| Синтетические аналоги природных пептидов, обладающих антибактериальной активностью | 2023 |
|
RU2826459C1 |
| БАКТЕРИОФАГИ, БЕЛКИ БАКТЕРИОФАГОВ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2014 |
|
RU2671110C2 |
| Антибактериальная композиция (варианты) и применение белка в качестве антимикробного средства, направленного против бактерий Pseudomonas aeruginosa, Klebsiella pneumoniae, Escherichia coli, Salmonella typhi и Staphylococcus haemolyticus (варианты) | 2019 |
|
RU2730614C1 |
| КОМПОЗИЦИИ КОКТЕЙЛЯ, СОДЕРЖАЩИЕ АНТИБАКТЕРИАЛЬНЫЕ ФАГИ, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2013 |
|
RU2654596C2 |
| Антибактериальная композиция (варианты) и применение белка в качестве антимикробного средства, направленного против бактерий Pseudomonas aeruginosa, Klebsiella pneumoniae, Escherichia coli, Salmonella typhi и Staphylococcus haemolyticus (варианты) | 2019 |
|
RU2730613C1 |
| Антибактериальная композиция (варианты) и применение белка в качестве антимикробного средства, направленного против грамотрицательных бактерий: Pseudomonas aeruginosa, Acinetobacter baumannii, Klebsiella pneumoniae и Salmonella typhi (варианты) | 2019 |
|
RU2730615C1 |
| БАКТЕРИОФАГ, ОБЛАДАЩИЙ АКТИВНОСТЬЮ ПРОТИВ PSEUDOMONAS AERUGINOSA, БЕЛКИ БАКТЕРИОФАГА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2010 |
|
RU2580248C9 |
| Антибактериальная композиция (варианты) и применение белка в качестве антимикробного средства, направленного против бактерий Acinetobacter baumannii, (варианты) | 2019 |
|
RU2730616C1 |
| Способ определения гетерорезистентных популяций в моновидовых культурах быстрорастущих бактерий | 2021 |
|
RU2774904C1 |

Изобретение относится к биотехнологии и представляет собой наноагент для скрининга патогенных штаммов бактерий с множественной лекарственной устойчивостью, характеризующийся тем, что представляет собой конъюгат наночастицы золота с ферментом деполимеразой бактериофага или профага, иммобилизованным на поверхности наночастицы, отличающийся тем, что размеры наночастиц золота составляют от 20 нм до 32+4 нм, фермент представляет собой деполимеразу Dpo1053, кодируемую в геноме литического фага Аcinetobacter baumannii AP22, или фермент представляет собой деполимеразу Dpo1432, кодируемую в геноме литического фага Аcinetobacter baumannii vB_AbaP_AS12. Изобретение касается также способа получения такого наноагента для скрининга патогенных штаммов бактерий с множественной лекарственной устойчивостью, включающего стадии получения наночастиц золота, получения конъюгатов наночастиц золота с фаговым или профаговым ферментом деполимераза, характеризующегося иммобилизацией ферментов на поверхности наночастиц золота, инкубирования конъюгатов наночастиц золота с ферментом при обработке ультразвуком, добавления бычьего сывороточного альбумина и промывания полученных наноагентов не менее трех раз, причем размеры наночастиц золота составляют от 20 нм до 32+4 нм, фермент представляет собой деполимеразу Dpo1053, кодируемую в геноме литического фага Аcinetobacter baumannii AP22, или фермент представляет собой деполимеразу Dpo1432, кодируемую в геноме литического фага Аcinetobacter baumannii vB_AbaP_AS12. Изобретение обеспечивает получение наноагента для ускоренного определения штамма патогенной бактерии. 2 н. и 14 з.п. ф-лы, 5 ил.
1. Наноагент для скрининга патогенных штаммов бактерий с множественной лекарственной устойчивостью, характеризующийся тем, что представляет собой конъюгат наночастицы золота с ферментом деполимеразой бактериофага или профага, иммобилизованным на поверхности наночастицы, отличающийся тем, что размеры наночастиц золота составляют от 20 нм до 32+4 нм, фермент представляет собой деполимеразу Dpo1053, кодируемую в геноме литического фага Аcinetobacter baumannii AP22, или фермент представляет собой деполимеразу Dpo1432, кодируемую в геноме литического фага Аcinetobacter baumannii vB_AbaP_AS12.
2. Наноагент по п. 1, характеризующийся тем, что патогенная бактерия представляет собой штамм Аcinetobacter baumannii 1432, принадлежащий к капсульному типу K27.
3. Наноагент по п. 1, характеризующийся тем, что патогенная бактерия представляет собой штамм Аcinetobacter baumannii 1053, принадлежащий к капсульному типу K91.
4. Наноагент по п. 1, отличающийся тем, что фермент деполимераза Dpo1053, кодируемая в геноме литического фага Аcinetobacter baumannii AP22, представляет собой полисахаридлиазу.
5. Наноагент по п. 1, отличающийся тем, что фермент деполимераза Dpo1053, кодируемая в геноме литического фага Аcinetobacter baumannii AP22, представляет собой полисахаридлиазу, которая отщепляет капсульные полисахариды от Аcinetobacter baumannii 1053 путем β-элиминирования по одному из остатков ManNAcA.
6. Наноагент по п. 1, отличающийся тем, что фермент деполимераза Dpo1432, кодируемая в геноме литического фага Аcinetobacter baumannii vB_AbaP_AS12, представляет собой специфическую гликозидазу.
7. Наноагент по п. 1, отличающийся тем, что фермент деполимераза Dpo1432, кодируемая в геноме литического фага Аcinetobacter baumannii vB_AbaP_AS12, представляет собой специфическую гликозидазу, отщепляющую капсульные полисахариды от Аcinetobacter baumannii 1432 по гидролитическому механизму.
8. Способ получения наноагента для скрининга патогенных штаммов бактерий с множественной лекарственной устойчивостью, охарактеризованного в п. 1, включающий стадии получения наночастиц золота, получения конъюгатов наночастиц золота с фаговым или профаговым ферментом деполимераза, характеризующийся иммобилизацией ферментов на поверхности наночастиц золота, инкубирования конъюгатов наночастиц золота с ферментом при обработке ультразвуком, добавления бычьего сывороточного альбумина и промывания полученных наноагентов не менее трех раз, отличающийся тем, что размеры наночастиц золота составляют от 20 нм до 32+4 нм, фермент представляет собой деполимеразу Dpo1053, кодируемую в геноме литического фага Аcinetobacter baumannii AP22, или фермент представляет собой деполимеразу Dpo1432, кодируемую в геноме литического фага Аcinetobacter baumannii vB_AbaP_AS12.
9. Способ по п. 8, отличающийся тем, что фермент деполимераза Dpo1053, представляет собой полисахаридлиазу.
10. Способ по п. 8, отличающийся тем, что фермент деполимераза Dpo1432, представляет собой специфическую гликозидазу.
11. Способ по п. 8, характеризующийся тем, что получение наночастиц золота проводят восстановлением золотохлористоводородной кислоты цитратом натрия.
12. Способ по п. 8, характеризующийся тем, что получение конъюгатов наночастиц золота с ферментом деполимераза проводят путем добавления 200 мкг фермента деполимераза Dpo1053 к 1 мл раствора наночастиц золота.
13. Способ по п. 8, характеризующийся тем, что получение конъюгатов наночастиц золота с ферментом деполимераза проводят путем добавления 200 мкг фермента деполимераза Dpo1432 к 1 мл раствора наночастиц золота.
14. Способ по п. 8, характеризующийся тем, что инкубирование при обработке ультразвуком проводят в течение 1 мин.
15. Способ по п. 8, характеризующийся тем, что после инкубирования при обработке ультразвуком добавляют 0,25 мл 5% бычьего сывороточного альбумина в фосфатно-солевом буфере.
16. Способ по п. 8, характеризующийся тем, что полученные наноагенты не менее трех раз промывают и центрифугируют в течение 10 минут при 10 000 об/мин.
| ШЕВЧЕНКО КОНСТАНТИН ГЕОРГИЕВИЧ | |||
| Разработка метода исследования комплексов гетерогенных наночастиц на основе эффекта локализованного поверхностного плазмонного резонанса и его использование для биомедицинских целей | |||
| диссертация на соискание ученой степени кандидата биологических наук, Москва, 2019 | |||
| ШТАММ БАКТЕРИОФАГА Acinetobacter baumannii АР22 ДЛЯ ИДЕНТИФИКАЦИИ БАКТЕРИЙ Acinetobacter baumannii ПРИ БАКТЕРИОЛОГИЧЕСКОМ АНАЛИЗЕ КЛИНИЧЕСКОГО МАТЕРИАЛА И ДЛЯ ПОЛУЧЕНИЯ ПРЕПАРАТА ПРОТИВ ВНУТРИБОЛЬНИЧНЫХ A.baumannii-ИНФЕКЦИЙ | 2010 |
|
RU2439151C1 |
| НАНОКОНЪЮГАТЫ ДОКСОРУБИЦИН-ЗОЛОТО НАПРАВЛЕННОГО ВОЗДЕЙСТВИЯ ДЛЯ ТЕРАПИИ ОПУХОЛЕЙ | 2018 |
|
RU2773707C2 |
Авторы
Даты
2023-10-02—Публикация
2022-11-28—Подача