Изобретение относится к фармации, а именно к фармацевтической химии.
Цефтриаксон ([6R-6-альфа, 7бета(Z)-7-2-амино-4-тиазолил (метоксиимино) ацетил амино-8-оксо-3-(1,2,5,6-тетрагидро-2-метил-5,6-диоксо-1,2,4-триазин-3-ил)тиометил-5-тиа-1-азабицикло 4.2.0 окт-2-ен-2-карбоновая кислота (в виде динатриевой соли)]) - один из широко применяемых в медицинской практике цефалоспоринов III поколения с широким спектром действия.
Показаниями для назначения, кроме лечения при острых и хронических бронхитах, пневмониях, плевритах, инфекциях мочевыводящих путей, является также профилактика инфекционных осложнений у хирургических больных при операциях на брюшной полости, урологии, акушерства и гинекологии. При этом предупреждение раневых инфекционно-воспалительных осложнений является определяющим в организации лечебной тактики, успешность которой зависит от эффективной концентрации антибиотика в крови и тканях операционного поля на протяжении всего вмешательства. Именно это определяет выбор наиболее эффективного препарата, дозы и кратности его введения, а также длительности антибактериальной профилактики.
Для определения концентрации исследуемых веществ в крови необходимо использовать методы, обладающие высокой эффективностью, экспрессностью, экономичностью, малым расходованием изучаемого материала, программированным обеспечением хода исследования и расчета полученных результатов. Немаловажным является возможность совместить качественный и количественный анализ при исследовании одной пробы. Таким требованиям отвечает капиллярный электрофорез.
В настоящее время, разработанные варианты анализа цефтриаксона в сыворотке крови человека представлены, в основном, хроматографическими методами.
Так, например, изучена возможность определения цефтриаксона в крови и тканях методом ионообменной хроматографии [Хасанов В.В., Соколович Е.Г., Дычко К.А. // «Химико-фармацевтический журнал», 2006; 2: 47-49].
Отдельные авторы сообщают о возможности применения ультра высокоэффективной жидкостной хроматографии с масс-спектрометром [S. Lefeuvre // Journal of Chromatography В: Analytical Technologies in the Biomedical and Life Sciences, 2017; 1065-1066: 50-58; R. RigoBonnin // Clinica Chimica Acta, 2017; 468: 215-224; T. Ohmori // Journal of Chromatography B: Analytical Technologies in the Biomedical and Life Sciences, 2011; 879 (15-16): 1038-1042]. При этом использовалось дорогостоящее оборудование.
Также изучалась возможность определения цефтриаксона в сыворотке крови человека обращено-фазовой хроматографией [N. Sultana, М. S. Arayne, W. Shahzad // Journal of the Chinese Chemical Society, 2013; 57 (6): 1278-1285].
Разработаны методики спектрофлуориметрического количественного определения цефтриаксона в фармацевтических препаратах и плазме [J. Shah // Luminescence, 2013; 28 (4): 516-522; J. Shah // Journal of Fluorescence, 2011; 21 (6): 2155-2163]. В данных методиках проводится сложная пробоподготовка исследуемого объекта.
Капиллярный зонный электрофорез был применен для разделения смеси 8 цефалоспориновых антибиотиков (цефрадин, цефадроксил, цефиксим, цефаклор, цефотаксим, цефуроксим, цефтизоксим, цефтриаксон) в лекарственных препаратах и моче. Разделение проводили с использованием буферного раствора, содержащего 50 мМ боратный буфер, рН 9,00, напряжение +30 кВ, при температуре 25°С, УФ-детекция при 210 нм [A. R. Solangi, S. Q. Memon et al/ // Acta Chromatographical, 2007; 19: 25-33].
Наиболее близким аналогом (прототипом) предлагаемого решения является способ определения концентрации цефтриаксона в измельченной ткани операционного поля, сущность которого заключается в том, что в процессе пробоподготовки к измельченной ткани операционного поля в качестве извлекателя добавляют водный раствор натрия гидроксида рН 12,0 в количестве 0,4 мл, проводят экстракцию органической системой растворителей хлороформ:изобутанол в соотношении 3:1 в количестве 1 мл в течение 10 минут четырехкратно, осуществляют реэкстракцию буферным раствором Бриттона-Робинсона рН 12,0 в количестве 1 мл, а анализ полученного реэкстракта проводят с помощью капиллярного электрофореза, соблюдая следующие условия:
- система капиллярного электрофореза «Капель-105М»;
- рабочий электролит - буферный раствор Бриттона-Робинсона, рН 12,0;
- ввод пробы гидродинамическим способом 30 мбар в течение 15 сек;
- напряжение тока: +20 кВ;
- длина волны - 265 нм.
Недостатком данного способа является невозможность его использования для определения концентрации цефтриаксона в жидких средах.
Цель предлагаемого способа - повышение объективности и надежности определения цефтриаксона в сыворотке крови человека.
Поставленная цель достигается тем, что осуществляют пробоподготовку, экстракцию органической системой растворителей и реэкстракцию пробы буферным раствором Бриттона-Робинсона с последующим анализом методом капиллярного электрофореза, при этом пробоподготовку выполняют осадителем белковых веществ, а в качестве осадителя белковых веществ используют сульфат аммония кристаллический, из расчета 0,1 г сульфата аммония кристаллического на 0,1 мл сыворотки крови, соблюдая следующие условия:
- настаивание пробы в течение 15-ти минут;
- центрифугирование пробы при 6000 оборотов в 1 минуту, 5 мин.;
- отделение надосадочной жидкости без фильтра деконтированием;
- доведение рН-среды надосадочной жидкости до значения 2,0 по универсальной индикаторной бумаге десятипроцентным раствором хлористоводородной кислоты каплями.
Технические решения, имеющие признаки, которые совпадают с отличительными признаками предлагаемого нами способа, не выявлены, что позволяет сделать вывод о соответствии предлагаемого способа критерию «изобретательский уровень».
Определение цефтриаксона в жидкой среде, учитывая условия клинического лабораторного анализа в хирургической практике, лабильность цефтриаксона при длительном процессе пробоподготовки и содержание значительного количества соэкстрактивных веществ в исследуемых пробах, возможно за счет уменьшение объема биологических жидкостей до 0,1 мл.
Предлагаемый способ осуществляют следующем образом: у пациента отбирают 1 мл крови и для получения сыворотки подвергают центрифугированию при 2000 оборотах в 1 минуту, 10 минут. После чего непосредственно приступают к определению концентрации цефтриаксона в сыворотке крови. Для этого добавляют осадитель белковых веществ, в качестве которого используют сульфат аммония кристаллический из расчета 0,1 г сульфата аммония кристаллического на 0,1 мл сыворотки крови. Осторожно перемешивают и оставляют на 15 минут. Затем пробу подвергают центрифугированию при 6000 оборотов в 1 минуту, в течение 5 минут. После этого надосадочную жидкость отделяют (без фильтра) деконтированием и доводят рН-среды пробы до значения 2,0 по универсальной индикаторной бумаге десятипроцентным раствором хлористоводородной кислоты каплями. Потом пробу подвергают экстракции органической системой хлороформ: изобутанол, 3:1 (1 мл × 4, 10 мин.). Эмульсию разрушают центрифугированием (6000 оборотов в 1 минуту, 10 минут). Органическую фазу отделяют, к объединенным экстрактам добавляют 1 мл буферного раствора Бриттона-Робинсона, рН 12,0, проводят реэкстрагирование в течение 10 мин. Для разрушения эмульсии смесь центрифугируют (6000 оборотов в 1 минуту, 10 минут). Реэкстракты отделяют, дегазируют центрифугированием (центрифуга «Mini Spin Plus», 10000 оборотов в 1 минуту, 10 минут) и используют для анализа цефтриаксона методом капиллярного электрофореза («Капель-105 М») в следующих условиях:
• рабочий электролит (РЭ) - буферный раствор Бриттона-Робинсона, рН 12,0;
• растворитель пробы - РЭ, разбавленный водой очищенной в 10 раз;
• ввод пробы - давлением (30 мБар × 15 сек.);
• положительный электрод со стороны введения РЭ - +20кВ;
• детекция - встроенный УФ-детектор, 265 нм;
• запись и обработку полученных электрофореграмм (ЭФГ) осуществляют с помощью программного обеспечения «Эльфоран» для Windows.
Валидацию предложенного способа осуществляли в соответствии с нормативной документацией: общей фармакопейной статьей в USP [Фармакопея США: USP 29. Национальный формуляр: NF 24. Том 2. Москва: ГЭОТАР-Медиа, 2009: 2646-2655], ОФС.1.1.0012.15 «Валидация аналитических методик» Государственной Фармакопеи IV издания [ОФС.1.1.0012.15 Валидация аналитических методик. Государственная Фармакопея Российской Федерации XIV издание. Том 1. Москва: Федеральная электронная медицинская библиотека], документами ICH -Международной конференции по гармонизации технических требований к регистрации лекарств для человека в странах ЕС и США [Методические рекомендации по валидации аналитических методик, используемых в судебно-химическом и химико-токсикологическом анализе биологического материала / Барсегян С.С.[и др.]. - Москва: ЭсПэХа; 2014. 76 с], Руководством ЕМЕА [Guideline on bioanalitical method validation, EMEA, 2009] и Руководством по экспертизе лекарственных средств [Москва, 2013; Т. 1] по показателям: правильность (accuracy), прецизионность (precision), специфичность (specificity), предел количественного определения (quantitation limit), линейность (linearity), диапазон применения (аналитическая область - range).
При оценке линейности способа определения концентрации цефтриаксона в сыворотке крови на ЭФГ, полученных при анализе образцов сыворотки крови, рассчитывали площадь пика - величину фотометрического сигнала (mAU*C). Результаты исследований представлены в таблице 1 и на фиг. 1 Калибровочный график зависимости величины фотометрического сигнала от концентрации цефтриаксона в сыворотке крови, «Капель - 105М».
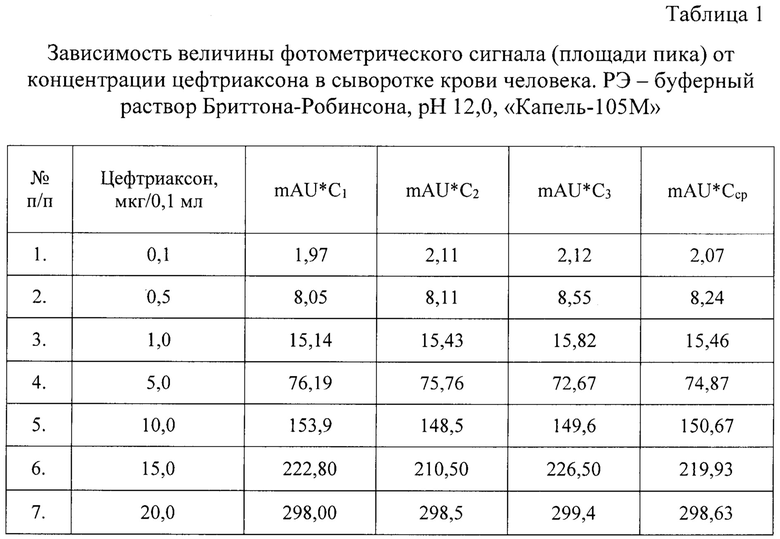
Средние величины фотометрических сигналов (площадей пиков) использовали для построения калибровочного графика зависимости величины фотометрического сигнала от концентрации цефтриаксона в сыворотке крови. «Капель - 105М» (см. фиг. 1):
у=а⋅х+b, где
х - измеренная концентрация цефтриаксона
у - измеренная площадь пика (величина фотометрического сигнала)
a, b - рассчитанные коэффициенты.
Рассчитанное уравнение калибровочного графика:
у=0,067х-0,042
Результаты исследования свидетельствуют о том, что в диапазоне концентраций цефтриаксона от 0,1 мкг/0,1 мл до 20,0 мкг/0,1 мл в сыворотке крови человека наблюдается линейная зависимость площади пика (величины фотометрического сигнала) от концентраций антибиотика и аппроксимируется уравнением с коэффициентами корреляции 0,9995, что позволяет использовать данную методику для количественного определения цефтриаксона в указанном интервале концентраций.
Для оценки прецизионности и правильности способа определения цефтриаксона в сыворотке крови человека проводили 6 параллельных исследований антибиотика на уровнях концентрации: 0,1 мкг/0,1 мл; 5 мкг/0,1 мл; 20,0 мкг/0,1 мл в разработанных выше условиях. На ЭФГ определяли площади пика и по вышеприведенному уравнению калибровочного графика рассчитывали концентрацию цефтриаксона в течение 1-го и 2-го дней исследований. Для полученных значений концентрации рассчитывали величины стандартного отклонения (SD), относительного стандартного отклонения (RSD, %), открываемости (R, %) и относительной погрешности (ε, %).
Результаты представлены в таблицах 2, 3, 4.

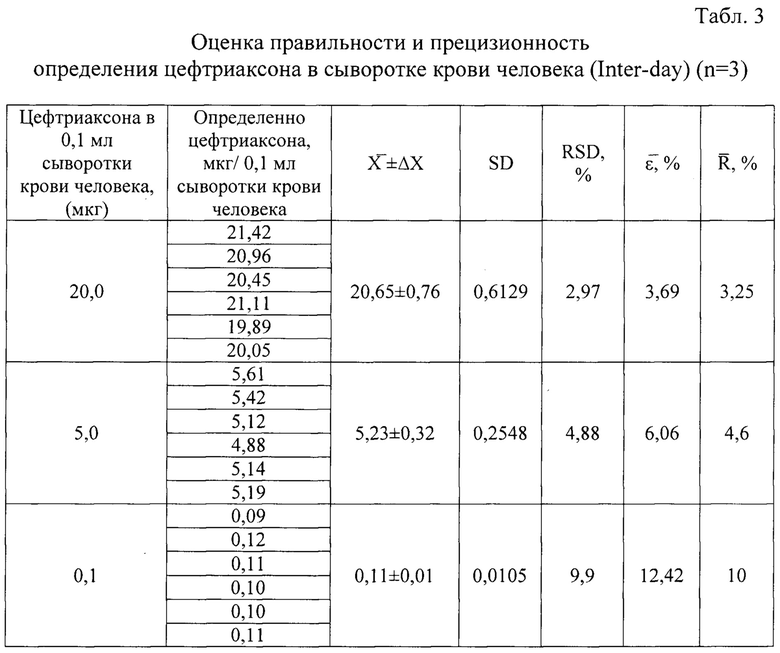

Представленные результаты показывают, что величины относительной погрешности отклонения  %) соответствуют нормам нормативной документации (не более 20% для минимальной концентрации, а для остальных концентраций не превышают 15%).
%) соответствуют нормам нормативной документации (не более 20% для минимальной концентрации, а для остальных концентраций не превышают 15%).
Для установления специфичности предложенного способа проводили анализ ЭФГ, полученных на трех уровнях концентрации антибиотика: 0,1; 5,0; 20,0 мкг/0,1 мл. При оценке образцов, содержащих цефтриаксон, наблюдались пики, которые по времени миграции совпадали со временем миграции изучаемого препарата. При этом на ЭФГ интактной сыворотки крови человека, не содержащей цефтриаксон, не наблюдается пиков со временем миграции, соответствующим времени миграции цефтриаксона (см. фиг. 2. Электрофореграмма цефтриаксона в составе сыворотки: 20.0 мкг/0,1 мл (1); 5,0 мкг/0,1 мл (2); 0,1 мкг/0,1 мл (3); ЭФГ 0,1 мл интактной плазмы (4), «Капель - 105М»).
Проведенные исследования в заданном диапазоне концентрации цефтриаксона подтвердило правильность, прецизионность, специфичность и линейность разработанного способа. Таким образом, диапазон его применения (аналитическая область), в пределах которой способ соответствует международным техническим требованиям по основным перечисленным параметрам, составляет 0,1-20,0 мкл/ 0,1 мл.
На основе анализа ЭФГ, установлено, что минимальная концентрация цефтриаксона в образце, для которой возможно его количественное определение со значениями относительного стандартного отклонения (RSD, %) и относительной погрешности (ε, %) не более 20% в диапазоне линейной зависимости с соотношением сигнал/шум не менее 10/1, составляет 0,1 мкг/0,1 мл (см. фиг. 3. Электрофореграмма цефтриаксона в сыворотке крови на уровне нижнего предела количественного определения (0,1 мкг/мл; «Капель - 105М»)).
Предлагаемый способ иллюстрируется следующими примерами использования.
Пример 1. Пациенту, оперированному по поводу патологии молочной железы, с целью предупреждения развития раневой инфекции проводили периоперационную антибиотикопрофилактику. Для этого за 30 минут до операции внутривенно вводили 1 г цефтриаксона. Через 30 и 60 минут осуществляли отбор биологической жидкости - крови в количестве 1 мл. Для получения сыворотки образцы крови подвергали центрифугированию при 2000 оборотах в 1 минуту, 10 минут. Последующую пробоподготовку и анализ проводили следующим способом: к 0,1 мл сыворотки крови добавляли 0,1 г аммония сульфата кристаллического. Осторожно перемешивали и оставляли на 15 минут. Затем пробу подвергали центрифугированию при 6000 оборотов в 1 минуту, в течение 5 минут. После этого надосадочную жидкость отделяли (без фильтра) деконтированием и доводили рН-среды пробы до значения 2,0 по универсальной индикаторной бумаге десятипроцентным раствором хлористоводородной кислоты каплями. Потом пробу подвергали экстракции органической системой хлороформ: изобутанол, 3:1 (1 мл × 4, 10 мин.). Эмульсию разрушали центрифугированием (6000 оборотов в 1 минуту, 10 минут). Органическую фазу отделяли, к объединенным экстрактам добавляли 1 мл буферного раствора Бриттона-Робинсона, рН 12,0, проводят реэкстрагирование в течение 10 мин. Для разрушения эмульсии смесь центрифугировали (6000 оборотов в 1 минуту, 10 минут). Реэкстракты отделяли, дегазировали центрифугированием (центрифуга «Mini Spin Plus», 10000 оборотов в 1 минуту, 10 минут) и использовали для анализа цефтриаксона методом капиллярного электрофореза («Капель-105 М») в следующих условиях:
• рабочий электролит (РЭ) - буферный раствор Бриттона-Робинсона, рН 12,0;
• растворитель пробы - РЭ, разбавленный водой очищенной в 10 раз;
• ввод пробы - давлением (30 мБар × 15 сек.);
• положительный электрод со стороны введения РЭ - +20кВ;
• детекция - встроенный УФ-детектор, 265 нм;
• запись и обработку полученных электрофореграмм (ЭФГ) осуществляют с помощью программного обеспечения «Эльфоран» для Windows.
На ЭФГ рассчитывают площади пика (величины фотометрического сигнала).
Результаты исследований представлены в таблице 5.

Пример 2. Пациенту, оперированному по поводу патологии молочной железы, с целью предупреждения развития раневой инфекции проводили периоперационную антибиотикопрофилактику. Для этого за 30 минут до операции внутривенно вводили 1 г цефтриаксона. Через 30 и 60 минут осуществляли отбор биологической жидкости - крови в количестве 1 мл. Для получения сыворотки образцы крови подвергали центрифугированию при 2000 оборотах в 1 минуту, 10 минут. Последующую пробоподготовку и анализ проводили следующим способом: к 0,1 мл сыворотки крови добавляли 0,1 г аммония сульфата кристаллического. Осторожно перемешивали и оставляли на 15 минут. Затем пробу подвергали центрифугированию при 6000 оборотов в 1 минуту, в течение 5 минут. После этого надосадочную жидкость отделяли (без фильтра) деконтированием и доводили рН-среды пробы до значения 2,0 по универсальной индикаторной бумаге десятипроцентным раствором хлористоводородной кислоты каплями. Потом пробу подвергали экстракции органической системой хлороформ: изобутанол, 3:1 (1 мл × 4, 10 мин.). Эмульсию разрушали центрифугированием (6000 оборотов в 1 минуту, 10 минут) Органическую фазу отделяли, к объединенным экстрактам добавляли 1 мл буферного раствора Бриттона-Робинсона, рН 12,0, проводят реэкстрагирование в течение 10 минут.Для разрушения эмульсии смесь центрифугировали (6000 оборотов в 1 минуту, 10 минут). Реэкстракты отделяли, дегазировали центрифугированием (центрифуга «Mini Spin Plus», 10000 оборотов в 1 минуту, 10 минут) и использовали для анализа цефтриаксона методом капиллярного электрофореза («Капель-105 М») в следующих условиях:
• рабочий электролит (РЭ) - буферный раствор Бриттона-Робинсона, рН 12,0;
• растворитель пробы - РЭ, разбавленный водой очищенной в 10 раз;
• ввод пробы - давлением (30 мБар × 15 сек.);
• положительный электрод со стороны введения РЭ - +20кВ;
• детекция - встроенный УФ-детектор, 265 нм;
• запись и обработку полученных электрофореграмм (ЭФГ) осуществляют с помощью программного обеспечения «Эльфоран» для Windows.
На ЭФГ рассчитывают площади пика (величины фотометрического сигнала).
Результаты исследований представлены в таблице 6.

Пример 3. Пациенту, оперированному по поводу патологии молочной железы, с целью предупреждения развития раневой инфекции проводили периоперационную антибиотикопрофилактику. Для этого за 30 минут до операции внутривенно вводили 1 г цефтриаксона. Через 30 и 60 минут осуществляли отбор биологической жидкости - крови в количестве 1 мл. Для получения сыворотки образцы крови подвергали центрифугированию при 2000 оборотах в 1 минуту, 10 минут. Последующую пробоподготовку и анализ проводили следующим способом: к 0,1 мл сыворотки крови добавляли 0,1 г аммония сульфата кристаллического. Осторожно перемешивали и оставляли на 15 минут. Затем пробу подвергали центрифугированию при 6000 оборотов в 1 минуту, в течение 5 минут. После этого надосадочную жидкость отделяли (без фильтра) деконтированием и доводили рН-среды пробы до значения 2,0 по универсальной индикаторной бумаге десятипроцентным раствором хлористоводородной кислоты каплями. Потом пробу подвергали экстракции органической системой хлороформ: изобутанол, 3:1 (1 мл × 4, 10 мин.). Эмульсию разрушали центрифугированием (6000 оборотов в 1 минуту, 10 минут). Органическую фазу отделяли, к объединенным экстрактам добавляли 1 мл буферного раствора Бриттона-Робинсона, рН 12,0, проводили реэкстрагирование в течение 10 мин. Для разрушения эмульсии смесь центрифугировали (6000 оборотов в 1 минуту, 10 минут). Реэкстракты отделяли, дегазировали центрифугированием (центрифуга «Mini Spin Plus», 10000 оборотов в 1 минуту, 10 минут) и использовали для анализа цефтриаксона методом капиллярного электрофореза («Капель-105 М») в следующих условиях:
• рабочий электролит (РЭ) - буферный раствор Бриттона-Робинсона, рН 12,0;
• растворитель пробы - РЭ, разбавленный водой очищенной в 10 раз;
• ввод пробы - давлением (30 мБар × 15 сек.);
• положительный электрод со стороны введения РЭ - +20кВ;
• детекция - встроенный УФ-детектор, 265 нм;
• запись и обработку полученных электрофореграмм (ЭФГ) осуществляют с помощью программного обеспечения «Эльфоран» для Windows.
На ЭФГ рассчитывают площади пика (величины фотометрического сигнала).
Результаты исследований представлены в таблице 7.

Пример 4. Пациенту, оперированному по поводу патологии молочной железы, с целью предупреждения развития раневой инфекции проводили периоперационную антибиотикопрофилактику. Для этого за 30 минут до операции внутривенно вводили 1 г цефтриаксона. Через 30 и 60 минут осуществляли отбор биологической жидкости - крови в количестве 1 мл. Для получения сыворотки образцы крови подвергали центрифугированию при 2000 оборотах в 1 минуту, 10 минут. Последующую пробоподготовку и анализ проводили следующим способом: к 0,1 мл сыворотки крови добавляли 0,1 г аммония сульфата кристаллического. Осторожно перемешивали и оставляли на 15 минут. Затем пробу подвергали центрифугированию при 6000 оборотов в 1 минуту, в течение 5 минут. После этого надосадочную жидкость отделяли (без фильтра) деконтированием и доводили рН-среды пробы до значения 2,0 по универсальной индикаторной бумаге десятипроцентным раствором хлористоводородной кислоты каплями. Потом пробу подвергали экстракции органической системой хлороформ: изобутанол, 3:1 (1 мл × 4, 10 минут). Эмульсию разрушали центрифугированием (6000 оборотов в 1 минуту, 10 минут). Органическую фазу отделяли, к объединенным экстрактам добавляли 1 мл буферного раствора Бриттона-Робинсона, рН 12,0, проводили реэкстрагирование в течение 10 мин. Для разрушения эмульсии смесь центрифугировали (6000 оборотов в 1 минуту, 10 минут). Реэкстракты отделяли, дегазировали центрифугированием (центрифуга «Mini Spin Plus», 10000 оборотов в 1 минуту, 10 минут) и использовали для анализа цефтриаксона методом капиллярного электрофореза («Капель-105 М») в следующих условиях:
• рабочий электролит (РЭ) - буферный раствор Бриттона-Робинсона, рН 12,0;
• растворитель пробы - РЭ, разбавленный водой очищенной в 10 раз;
• ввод пробы - давлением (30 мБар × 15 сек.);
• положительный электрод со стороны введения РЭ - +20кВ;
• детекция - встроенный УФ-детектор, 265 нм;
• запись и обработку полученных электрофореграмм (ЭФГ) осуществляют с помощью программного обеспечения «Эльфоран» для Windows.
На ЭФГ рассчитывают площади пика (величины фотометрического сигнала).
Результаты исследований представлены в таблице 8.

Пример 5. Пациенту, оперированному по поводу патологии молочной железы, с целью предупреждения развития раневой инфекции проводили периоперационную антибиотикопрофилактику. Для этого за 30 минут до операции внутривенно вводили 1 г цефтриаксона. Через 30 и 60 минут осуществляли отбор биологической жидкости - крови в количестве 1 мл. Для получения сыворотки образцы крови подвергали центрифугированию при 2000 оборотах в 1 минуту, 10 минут. Последующую пробоподготовку и анализ проводили следующим способом: к 0,1 мл сыворотки крови добавляли 0,1 г аммония сульфата кристаллического. Осторожно перемешивали и оставляли на 15 минут. Затем пробу подвергали центрифугированию при 6000 оборотов в 1 минуту, в течение 5 минут. После этого надосадочную жидкость отделяли (без фильтра) деконтированием и доводили рН-среды пробы до значения 2,0 по универсальной индикаторной бумаге десятипроцентным раствором хлористоводородной кислоты каплями. Потом пробу подвергали экстракции органической системой хлороформ: изобутанол, 3:1 (1 мл × 4, 10 мин.). Эмульсию разрушали центрифугированием (6000 оборотов в 1 минуту, 10 минут). Органическую фазу отделяли, к объединенным экстрактам добавляли 1 мл буферного раствора Бриттона-Робинсона, рН 12,0, проводили реэкстрагирование в течение 10 мин. Для разрушения эмульсии смесь центрифугировали (6000 оборотов в 1 минуту, 10 минут). Реэкстракты отделяли, дегазировали центрифугированием (центрифуга «Mini Spin Plus», 10000 оборотов в 1 минуту, 10 минут) и использовали для анализа цефтриаксона методом капиллярного электрофореза («Капель-105 М») в следующих условиях:
• рабочий электролит (РЭ) - буферный раствор Бриттона-Робинсона, рН 12,0;
• растворитель пробы - РЭ, разбавленный водой очищенной в 10 раз;
• ввод пробы - давлением (30 мБар × 15 сек.);
• положительный электрод со стороны введения РЭ - +20кВ;
• детекция - встроенный УФ-детектор, 265 нм;
• запись и обработку полученных электрофореграмм (ЭФГ) осуществляют с помощью программного обеспечения «Эльфоран» для Windows.
На ЭФГ рассчитывают площади пика (величины фотометрического сигнала).
Результаты исследований представлены в таблице 9.

Пример 6. Пациенту, оперированному по поводу патологии молочной железы, с целью предупреждения развития раневой инфекции проводили периоперационную антибиотикопрофилактику. Для этого за 30 минут до операции внутривенно вводили 1 г цефтриаксона. Через 30 и 60 минут осуществляли отбор биологической жидкости - крови в количестве 1 мл. Для получения сыворотки образцы крови подвергали центрифугированию при 2000 оборотах в 1 минуту, 10 минут. Последующую пробоподготовку и анализ проводили следующим способом: к 0,1 мл сыворотки крови добавляли 0,1 г аммония сульфата кристаллического. Осторожно перемешивали и оставляли на 15 минут. Затем пробу подвергали центрифугированию при 6000 оборотов в 1 минуту, в течение 5 минут. После этого надосадочную жидкость отделяли (без фильтра) деконтированием и доводили рН-среды пробы до значения 2,0 по универсальной индикаторной бумаге десятипроцентным раствором хлористоводородной кислоты каплями. Потом пробу подвергали экстракции органической системой хлороформ: изобутанол, 3:1 (1 мл × 4, 10 мин.). Эмульсию разрушали центрифугированием (6000 оборотов в 1 минуту, 10 минут). Органическую фазу отделяли, к объединенным экстрактам добавляли 1 мл буферного раствора Бриттона-Робинсона, рН 12,0, проводили реэкстрагирование в течение 10 мин. Для разрушения эмульсии смесь центрифугировали (6000 оборотов в 1 минуту, 10 минут). Реэкстракты отделяли, дегазировали центрифугированием (центрифуга «Mini Spin Plus», 10000 оборотов в 1 минуту, 10 минуту) и использовали для анализа цефтриаксона методом капиллярного электрофореза («Капель-105 М») в следующих условиях:
• рабочий электролит (РЭ) - буферный раствор Бриттона-Робинсона, рН1 2,0;
• растворитель пробы - РЭ, разбавленный водой очищенной в 10 раз;
• ввод пробы - давлением (30 мБар × 15 сек.);
• положительный электрод со стороны введения РЭ - +20кВ;
• детекция - встроенный УФ-детектор, 265 нм;
• запись и обработку полученных электрофореграмм (ЭФГ) осуществляют с помощью программного обеспечения «Эльфоран» для Windows.
На ЭФГ рассчитывают площади пика (величины фотометрического сигнала).
Результаты исследований представлены в таблице 10.

Предлагаемый способ определения концентрации цефтриаксона в сыворотке крови человека применен в межкафедральной лаборатории «Аналитических методов исследования» кафедры химии с курсом фармацевтической и токсикологической химии ФГБОУ ВО ЯГМУ Минздрава России.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОПРЕДЕЛЕНИЯ КОНЦЕНТРАЦИИ ЦЕФТРИАКСОНА В ТКАНЯХ ОПЕРАЦИОННОГО ПОЛЯ | 2020 |
|
RU2759533C1 |
| КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕНИЕ ДИГОКСИНА В СЫВОРОТКЕ КРОВИ МЕТОДОМ ИНВЕРСИОННОЙ ВОЛЬТАМПЕРОМЕТРИИ | 1996 |
|
RU2132553C1 |
| Способ обнаружения клофелина в биологических жидкостях | 1989 |
|
SU1746314A1 |
| Способ определения анилина в биологических объектах | 1979 |
|
SU947766A1 |
| ВОЛЬТАМПЕРОМЕТРИЧЕСКИЙ СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ ПРЕДНИЗОНА В СЫВОРОТКЕ КРОВИ | 2023 |
|
RU2815787C1 |
| ИНВЕРСИОННО-ВОЛЬТАМПЕРОМЕТРИЧЕСКИЙ СПОСОБ ОПРЕДЕЛЕНИЯ (2-КАРБО- ЭТОКСИАМИНO-10-(3-ДИЭТИЛАМИНОПРО- ПИОНИЛ)-ФЕНОТИАЗИНА ГИДРОХЛОРИДА (ЭТАЦИЗИНА) | 1992 |
|
RU2045057C1 |
| Экспресс-способ определения цефтриаксона в плазме крови и смешанной слюне больных COVID-19 | 2021 |
|
RU2771851C1 |
| ИНВЕРСИОННО-ВОЛЬТАМПЕРОМЕТРИЧЕСКИЙ СПОСОБ ОПРЕДЕЛЕНИЯ КАРДИЛА | 1995 |
|
RU2130607C1 |
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ АЗИТРОМИЦИНА ДИГИДРАТА МЕТОДОМ ИНВЕРСИОННОЙ ВОЛЬТАМПЕРОМЕТРИИ | 2003 |
|
RU2241985C1 |
| ВОЛЬТАМПЕРОМЕТРИЧЕСКИЙ СПОСОБ ОПРЕДЕЛЕНИЯ КОЭНЗИМА Q10 В КРЕМАХ КОСМЕТИЧЕСКИХ | 2015 |
|
RU2613897C1 |



Изобретение относится к фармацевтической химии. Раскрыт способ определения концентрации цефтриаксона в сыворотке крови человека, заключающийся в пробоподготовке, экстракции органической системой растворителей и реэкстракции пробы буферным раствором Бриттона-Робинсона с последующим анализом методом капиллярного электрофореза, отличающийся тем, что пробоподготовку выполняют осадителем белковых веществ, а в качестве осадителя используют сульфат аммония кристаллический из расчета 0,1 г сульфата аммония кристаллического на 0,1 мл сыворотки крови, соблюдая следующие условия: настаивание пробы в течение 15 мин; центрифугирование пробы при 6000 об/мин 5 мин; отделение надосадочной жидкости без фильтра деконтированием; доведение рН-среды надосадочной жидкости до значения 2,0 по универсальной индикаторной бумаге десятипроцентным раствором хлористоводородной кислоты каплями. Изобретение обеспечивает повышение объективности и надежности определения цефтриаксона в сыворотке крови человека. 3 ил., 10 табл., 6 пр.
Способ определения концентрации цефтриаксона в сыворотке крови человека, заключающийся в пробоподготовке, экстракции органической системой растворителей и реэкстракции пробы буферным раствором Бриттона-Робинсона с последующим анализом методом капиллярного электрофореза, отличающийся тем, что пробоподготовку выполняют осадителем белковых веществ, а в качестве осадителя используют сульфат аммония кристаллический из расчета 0,1 г сульфата аммония кристаллического на 0,1 мл сыворотки крови, соблюдая следующие условия:
- настаивание пробы в течение 15 мин;
- центрифугирование пробы при 6000 об/мин 5 мин;
- отделение надосадочной жидкости без фильтра деконтированием;
- доведение рН-среды надосадочной жидкости до значения 2,0 по универсальной индикаторной бумаге десятипроцентным раствором хлористоводородной кислоты каплями.
| SOLANGI A | |||
| et al | |||
| Determination of ceftriaxone, ceftizoxime, paracetamol, and diclofenac sodium by capillary zone electrophoresis in pharmaceutical formulations and in human blood serum // Turk | |||
| J | |||
| Chem., 2010, V.34, pp.921-933 | |||
| КРЮЧКОВ В.Б | |||
| и др | |||
| Исследование цефоперазона в биологических объектах методами электрофореза // Диссертация на |
Авторы
Даты
2023-10-11—Публикация
2022-11-11—Подача