ОБЛАСТЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к композиции, содержащей соединение Формулы (I), (Ia) или (II), или фармацевтически приемлемое производное данного соединения, для применения в способе лечения заболевания почек, в частности протеинурических заболеваний почек, таких как нефротические синдромы.
УРОВЕНЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Протеинурия, признак гломерулярного нарушения, обычно обнаруживается при анализе мочи и сама по себе является существенным независимым модифицируемым фактором риска терминальной стадии поражения почек, преждевременной смерти от заболеваний сердечно-сосудистого происхождения и ишемического инсульта у пациентов с диабетом. Несмотря на последние достижения рефрактерная протеинурия продолжает оставаться проблемой в клинической практике. Необходимо разработать более эффективные методики для ослабления гломерулярного нарушения и достижения ремиссии протеинурии. Данные, полученные в последнее время, указывают на то, что меланокортиновая система является новой мишенью для лечения протеинурии.
Мембранозная нефропатия (MN) является одной из наиболее частых причин нефротического синдрома у взрослых. Треть таких пациентов имеет благоприятный прогноз со спонтанной ремиссией. Тем не менее, приблизительно в 50% оставшихся случаев состояние пациентов останется без изменений, а в 50% случаев развивается ESRD (терминальная стадия поражения почек) и требуется диализ. Нефротический синдром представляет собой гломерулярное заболевание, характеризующееся протеинурией, отеком, гипоальбуминемией и гиперлипидемией. В большинстве случаев причина MN является идиопатической, и механизмы, лежащие в основе данного заболевания, во много еще не известны. Классическое лечение является неспецифическим и часто включает стероиды с противовоспалительным действием, иногда в комбинации с цитотоксическими агентами. Данные лекарства поражают различные ткани, оказывая цитотоксическое действие, вызывая остеопороз, недостаточность надпочечников, гипертензию, пептические язвы и увеличивая риск интолерантности к глюкозе и развития инфекций. Поэтому необходимы более эффективные и специфические виды лечения.
Меланокортиновая система представляет собой набор нейропептидергических и иммуноэндокринных сигнальных путей, которые играют существенную роль в гомеостатическом контроле широкого круга физиологических функций, включая меланогенез, стрессовую реакцию, воспаление, иммуномодуляцию и адренокортикальный стероидогенез. Она состоит из нескольких компонентов, включая пять сопряженных с G-белками меланокортиновых рецепторов: меланокортиновые рецепторы MC1R-MC5R; пептидные лиганды: α, β, γ-меланоцитостимулирующие гормоны (α, β, γ-МСГ), адренокортикотропный гормон (АКТГ), секретируемый передней долей гипофиза; и эндогенные антагонисты. Биологические функции меланокортиновой системы опосредованы пятью меланокортиновыми рецепторами (MCR), которые имеют неодинаковое распределение в тканях, участвуют в передаче различных сигналов и влияют на изменение биологической активности в различных системах органов.
Адренокортикотропный гормон (АКТГ) является эндогенным пептидом гормоном и агонистом для всех меланокортиновых рецепторов 1-5 (MC1-5R), из которых MC2R специфически связывается с АКТГ; стероидогенез индуцируется только под действием АКТГ и опосредован MC2R в коре надпочечников. Альфа-меланоцитостимулирующий гормон (α-МСГ) представляет собой небольшой эндогенный пептидный гормон, структурно родственный АКТГ, который связывается со всеми рецепторами MCR за исключением MC2R. MC1R в большом количестве экспрессируется меланоцитами в коже, представляет собой ключевую контрольную точку в меланогенезе и определяет цвет волос.
Меланокортиновая терапия с использованием АКТГ или нестероидогенных меланокортиновых пептидов ослабляет протеинурию и гломерулярные нарушения в экспериментальных моделях гломерулярных заболеваний и индуцирует ремиссию нефротического синдрома у пациентов с различными гломерулопатиями, даже с гломерулопатиями, резистентными к стероидам, включая мембранозную нефропатию (MN), болезнь минимальных изменений (БМИ), фокально-сегментарный гломерулосклероз (ФСГС) и IgA-нефропатию. Лежащий в основе данного действия механизм остается неясным, однако, что касается роли меланокортинового рецептора 1 (MC1R), он вовлечен в данный механизм и интенсивно и специфически экспрессируется у человека в корковом веществе почек и специфических типах клеток почечного эпителия, включая подоциты (Lindskog et al. 2010). Однако недавние исследования показали действенность АКТГ-монотерапии и NDP-αМСГ ([Nle4, D-Phe7]-αМСГ) также у пациентов, имеющих доминантно-негативные MC1R-мутации, что также было подтверждено на мышах с MC1R-нулевой мутацией и in vitro с использованием первичных подоцитов, полученных от мышей с MC1R-нулевой мутацией и мышей с MC1R дикого типа. Таким образом, антипротеинурический эффект меланокортинового сигнального пути, по-видимому, является стероидогенно-независимым и необязательно требует участия MC1R, и данный меланокортиновый эффект мог бы, по меньшей мере частично, затрагивать патогенный путь, характерный для всех протеинурических заболеваний почек. Подоциты являются критически важным компонентом гломерулярного фильтрационного барьера, контролирующего гломерулярную проницаемость и селективность, и считаются основным виновником, ответственным за массивную протеинурию при различных гломерулярных заболеваниях. Благоприятный эффект меланокортиновой терапии, вероятно, можно приписать прямому действию на подоциты (Qiao et al. 2016).
Таким образом, в настоящее время невозможно предсказать, какие меланокортиновые агонисты и какие ассоциированные с ними мишени могут быть использованы в качестве кандидатов для лечения протеинурических заболеваний, таких как заболевания почек.
Фенил пиррол аминогуанидиновые производные, обладающие активностью в отношении меланокортиновых рецепторов, описаны в публикации WO 2007/141343. Одним из примеров такого соединения является противовоспалительное средство AP1189 ((E)-N-транс-{3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидиния ацетат), которое, как было показано сначала, связывается с MC1R (WO 2007/141343), и, как установлено позднее, является функционально-селективным двойным агонистом рецепторов MC1R и MC3R, который не вызывает классическую генерацию цАМФ (и следовательно MC1R-индуцированный меланогенез), а вместо этого, по-видимому, индуцирует альтернативные пути, включая ERK1/2-фосфорилирование и Ca2+-мобилизацию (Montero-Melendez et al. 2015).
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Авторы настоящего изобретения нашли, что фенил пиррол аминогуанидиновое производное AP1189 ((E)-N-транс-{3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидиния ацетат) значительно ослабляет протеинурию в пассивном Хеймановском нефрите, экспериментальной модели нефропатии, по сравнению с носителем, что выражается в значительном уменьшении скорости экскреции альбумина и FRAlb (экскреции фракционного альбумина); а также характеризуется существенно более высокой GFR (скоростью гломерулярной фильтрации; клиренсом креатинина) и существенным снижением уровня FRAlb в сравнении с показателями, получаемыми при лечении с использованием АКТГ(1-24). Это означает, что AP1189 и родственные соединения являются кандидатами для достижения более эффективного лечения протеинурических заболеваний почек.
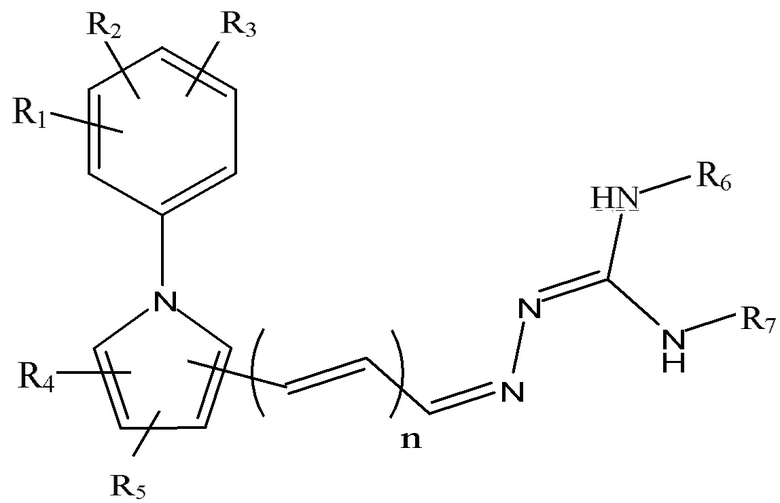
Согласно одному из аспектов настоящего изобретения предложена композиция, содержащая соединение Формулы (I) или (Ia):
 Формула (I),
Формула (I),
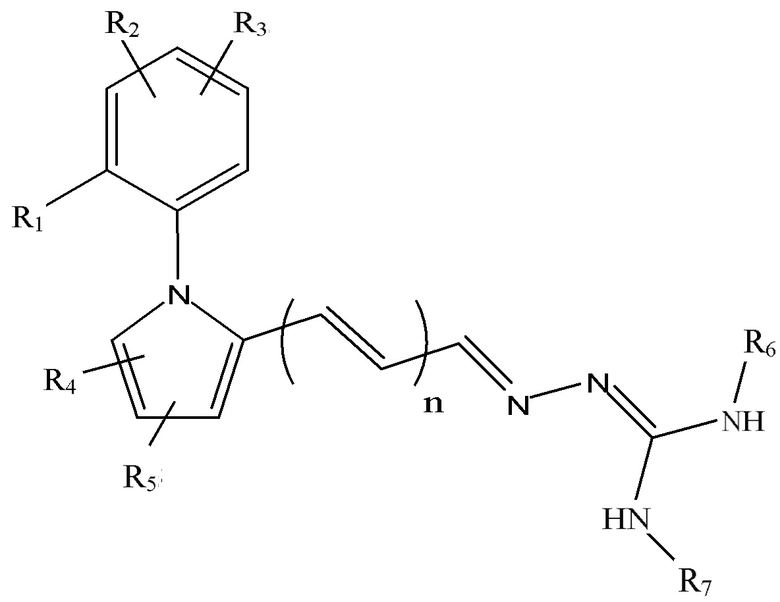 Формула (Ia),
Формула (Ia),
включая его таутомерные и изомерные формы, такие как энантиомерные формы, диастереоизомерные формы и рацемические формы,
где
n имеет значение 1, 2 или 3;
каждый R1, R2, R3, R4 и R5 независимо выбран из группы, состоящей из атома водорода, необязательно замещенного C1-6-алкила, необязательно замещенного C3-6-циклоалкила, необязательно замещенного C2-6-алкенила, необязательно замещенного C4-6-алкадиенила, необязательно замещенного C2-6-алкинила, гидрокси, необязательно замещенного C1-6-алкокси, необязательно замещенного C2-6-алкенилокси, карбокси, необязательно замещенного C1-6-алкоксикарбонила, необязательно замещенного C1-6-алкилкарбонила, формила, C1-6-алкилсульфониламино, необязательно замещенного арила, необязательно замещенного арилоксикарбонила, необязательно замещенного арилокси, необязательно замещенного арилкарбонила, необязательно замещенного ариламино, арилсульфониламино, необязательно замещенного гетероарила, необязательно замещенного гетероарилоксикарбонила, необязательно замещенного гетероарилокси, необязательно замещенного гетероарилкарбонила, необязательно замещенного гетероариламино, гетероарилсульфониламино, необязательно замещенного гетероциклила, необязательно замещенного гетероциклилоксикарбонила, необязательно замещенного гетероциклилокси, необязательно замещенного гетероциклилкарбонила, необязательно замещенного гетероциклиламино, гетероциклилсульфониламино, амино, моно- и ди(C1-6-алкил)амино, карбамоила, моно- и ди(C1-6-алкил)аминокарбонила, амино-C1-6-алкил-аминокарбонила, моно- и ди(C1-6-алкиламино-C1-6-алкил-аминокарбонила, C1-6-алкилкарбониламино, амино-C1-6-алкил-карбониламино, моно- и ди(C1-6-алкил)амино-C1-6-алкил-карбониламино, циано, гуанидино, карбамидо, C1-6-алканоилокси, C1-6-алкилсульфонила, C1-6-алкилсульфинила, C1-6-алкилсульфонил-окси, аминосульфонила, моно- и ди(C1-6-алкил)аминосульфонила, нитро, необязательно замещенного C1-6-алкилтио и атома галогена, где любой связанный с атомом азота C1-6-алкил необязательно имеет в качестве заместителей гидрокси, C1-6-алкокси, C2-6-алкенилокси, амино, моно- и ди(C1-6-алкил)амино, карбокси, C1-6-алкилкарбониламино, атом галогена, C1-6-алкилтио, C1-6-алкил-сульфонил-амино или гуанидин;
каждый R6 и R7 независимо выбран из группы, состоящей из атома водорода, необязательно замещенного C1-6-алкила, необязательно замещенного C2-6-алкенила, необязательно замещенного C4-6-алкадиенила, необязательно замещенного C2-6-алкинила, необязательно замещенного C1-6-алкоксикарбонила, необязательно замещенного C1-6-алкилкарбонила, необязательно замещенного арила, необязательно замещенного арилоксикарбонила, необязательно замещенного арилкарбонила, необязательно замещенного гетероарила, необязательно замещенного гетероарилоксикарбонила, необязательно замещенного гетероарилкарбонила, аминокарбонила, моно- и ди(C1-6-алкил)аминокарбонила, амино-C1-6-алкил-аминокарбонила и моно- и ди(C1-6-алкил)амино-C1-6-алкил-аминокарбонила; или R6 и R7 вместе могут образовывать пяти- или шестичленное азот-содержащее кольцо;
или фармацевтически приемлемое производное данного соединения, для применения в лечении заболевания почек.
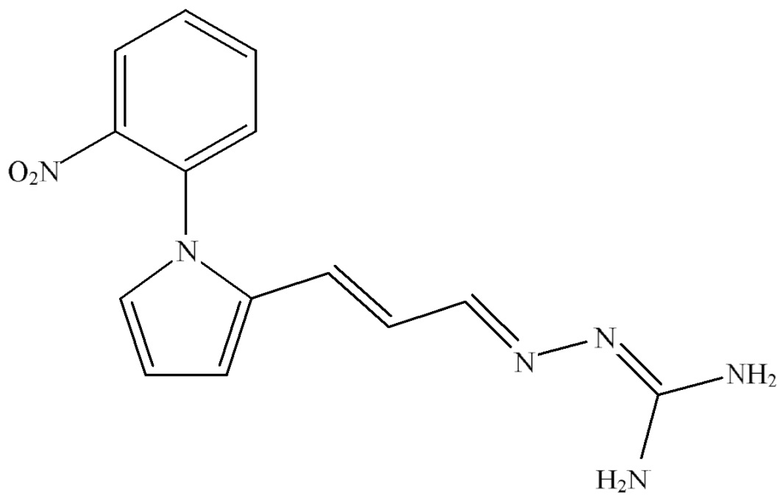
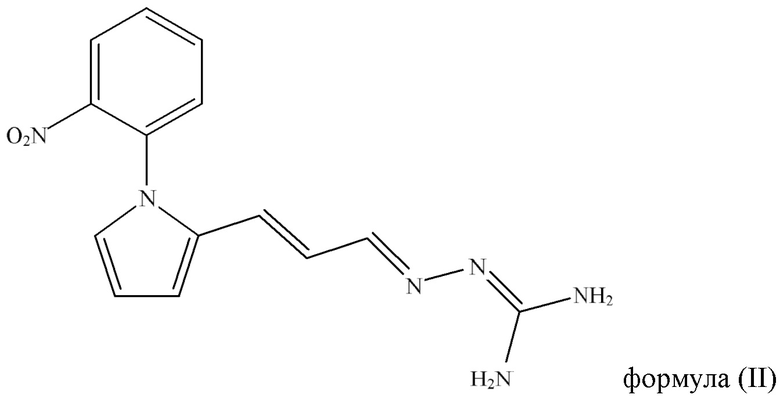
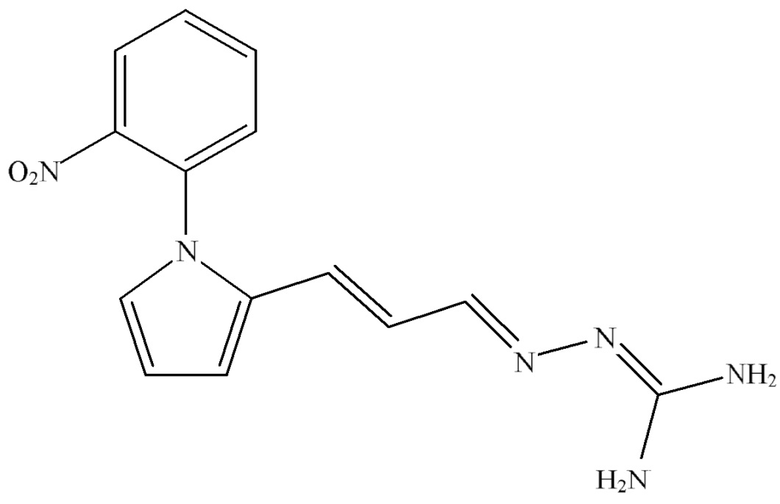
Согласно одному из аспектов настоящего изобретения также предложена композиция, содержащая соединение Формулы (II):
 Формула (II),
Формула (II),
включая его таутомерные и изомерные формы, такие как энантиомерные формы, диастереоизомерные формы и рацемические формы;
или фармацевтически приемлемое производное данного соединения, для применения в лечении заболевания почек.
Согласно одному из аспектов настоящего изобретения также предложена композиция, содержащая соединение, выбранное из группы, состоящей из {3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидина; {3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}- аминогуанидиния ацетата; (E)-N-транс-{3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидина и (E)-N-транс-{3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидиния ацетата, или фармацевтически приемлемое производное данного соединения, для применения в лечении заболевания почек.
Согласно одному из вариантов осуществления настоящего изобретения указанное заболевание почек представляет собой заболевание почек, которое сопровождается протеинурией.
Согласно одному из вариантов осуществления настоящего изобретения указанное заболевание почек представляет собой гломерулярное заболевание, такое как заболевание, поражающее подоциты клубочков.
Согласно одному из вариантов осуществления настоящего изобретения указанное заболевание почек представляет собой нефротический синдром (гломерулонефроз), такой как первичный нефротический синдром или вторичный нефротический синдром.
Определения
Термин "фармацевтически приемлемое производное" в контексте настоящего описания включает фармацевтически приемлемые соли, которые означают соль, которая не опасна для пациента. Такие соли включают фармацевтически приемлемые соли присоединения оснований или кислот, а также фармацевтически приемлемые соли металлов, аммониевые соли и алкилированные аммониевые соли. Фармацевтически приемлемое производное дополнительно включает сложные эфиры и пролекарства или другие предшественники соединения, которые могут быть биологически метаболизированы с образованием активного соединения, или кристаллические формы соединения.
Подразумевается, что термин "соль присоединения кислоты" включает "фармацевтически приемлемую соль присоединения кислоты", которая означает соль, которая не опасна для пациента. Соли присоединения кислот включают соли неорганических кислот, а также органических кислот. Типичные примеры подходящих неорганических кислот включают соляную, бромистоводородную, йодистоводородную, фосфорную, серную, азотную кислоты и тому подобное. Типичные примеры подходящих органических кислот включают муравьиную, уксусную, трихлоруксусную, трифторуксусную, пропионовую, бензойную, коричную, лимонную, фумаровую, гликолевую, молочную, малеиновую, яблочную, малоновую, миндальную, щавелевую, пикриновую, пировиноградную, салициловую, янтарную, метансульфоновую, этансульфоновую, винную, аскорбиновую, памовую, бисметиленсалициловую, этандисульфоновую, глюконовую, цитраконовую, аспарагиновую, стеариновую, пальмитиновую, ЭДТА (этилендиаминтетрауксусную кислоту), гликолевую, пара-аминобензойную, глутаминовую, бензолсульфоновую, пара-толуолсульфоновую кислоты и тому подобное. Другие примеры фармацевтически приемлемых солей присоединения неорганических или органических кислот включают фармацевтически приемлемые соли, перечисленные в J. Pharm. Sci. 66, 2, (1977), которые включены в данное описание посредством ссылки.
Термин "терапевтически эффективное количество" соединения в контексте данного описания означает количество, достаточное для лечения, облегчения, предупреждения, уменьшения риска возникновения или частичного подавления клинических проявлений данного заболевания, или расстройства, и его осложнений. Количество, достаточное для достижения указанных целей, определяют как "терапевтически эффективное количество". Эффективное количество в каждом случае обычно зависит от тяжести заболевания или повреждения, а также от массы и общего состояния субъекта. Обычно подразумевается, что определение подходящей дозы может быть выполнено с использованием стандартного экспериментирования, путем составления матрицы значений и тестирования различных точек данной матрицы, что может быть выполнено квалифицированным врачом или ветеринаром, имеющим средний уровень компетентности.
Термины "лечение" и "лечить" в контексте данного описания относятся к оказанию медицинской помощи и наблюдению за пациентом с целью борьбы с патологическим состоянием, заболеванием или расстройством. Подразумевается, что данный термин включает полный спектр лечения патологического состояния, от которого страдает пациент. Пациент, которого лечат, предпочтительно представляет собой млекопитающее, в частности человека. Вместе с тем, в контексте данного описания термин "лечение" также относится к животным, таким как мыши, крысы, собаки, кошки, лошади, крупный рогатый скот, овцы и свиньи. Пациенты, которых лечат, могут быть разного возраста.
ОПИСАНИЕ ЧЕРТЕЖЕЙ
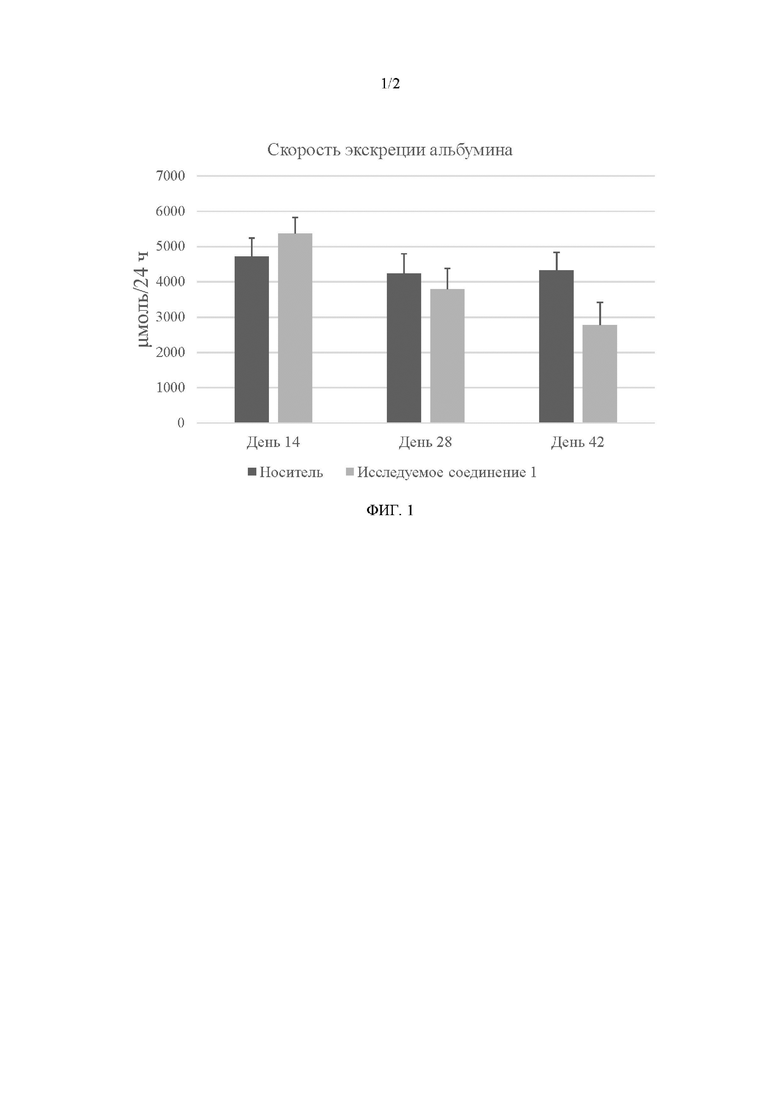
Фигура 1. У крыс, которые получали в качестве лечения исследуемое соединение 1 (AP1189; ((E)-N-транс-{3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидиния ацетат), регистрировали значительное ослабление протеинурии по сравнению с контрольными крысами (получавшими носитель) на 28-й день и 42-й день. У контрольных крыс уровень экскреции альбумина оставался неизменным во всех временных точках, тогда как у крыс, которым вводили исследуемое соединение 1, регистрировали уменьшение скорости экскреции альбумина на 31±8% на 28-й день и уменьшение скорости экскреции альбумина на 48±10% на 42-й день. Подробнее смотри Примеры.
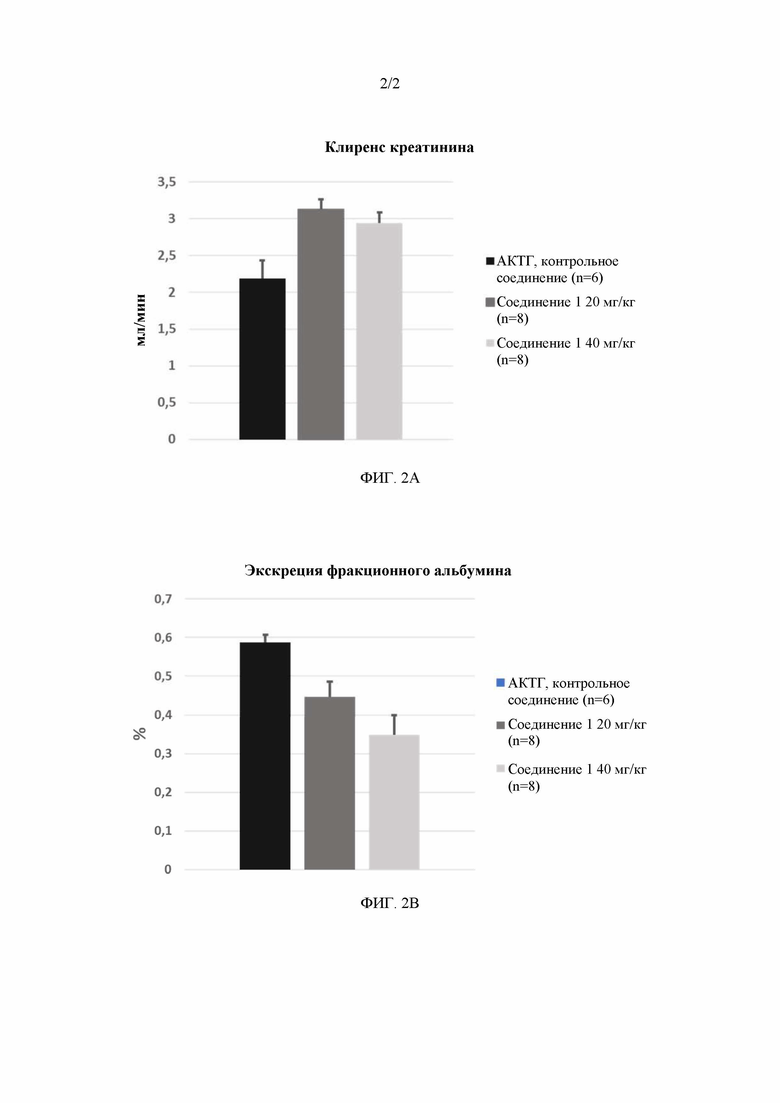
Фигура 2A. У крыс, которые получали в качестве лечения исследуемое соединение 1 (AP1189; ((E)-N-транс-{3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидиния ацетат), регистрировали существенно более высокий GFR (клиренс креатинина) после 4 недель лечения, чем у крыс, которые получали в качестве лечения положительный контроль (АКТГ 1-24):
i) положительный контроль 10 мг/сутки: 2,19 ±0,24 мл/мин;
ii) исследуемое соединение 1 20 мг/кг: 3,12±0,14 мл/мин (p=0,002);
iii) исследуемое соединение 1 40 мг/кг: 2,94±0,14 мл/24 мин (p=0,01).
Фигура 2B. У крыс, которые получали в качестве лечения исследуемое соединение 1 (AP1189; ((E)-N-транс-{3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидиния ацетат), регистрировали значительное уменьшение экскреции фракционного альбумина (FEAlb) по сравнению с крысами, получавшими положительный контроль (АКТГ 1-24):
i) положительный контроль 10 мг/сутки: 0,59±0,02%;
ii) исследуемое соединение 1 20 мг/кг: 0,045±0,04% (p=0,007);
iii) исследуемое соединение 1 40 мг/кг: 0,35±0,05% (p=0,001).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Меланокортиновые (MC) рецепторы (MC1R-MC5R), семейство сопряженных с G-белками рецепторов (GPCR) класса A, являются перспективными терапевтическими мишенями для целого ряда патологических состояний вследствие их широкого распределения и разнообразия физиологических процессов, которые они регулируют. MC1R регулирует загар кожи под действием УФ-света и другие иммунные ответы, что обусловлено его экспрессией в лейкоцитах. MC2R регулирует продуцирование кортизола надпочечниками, тогда как MC5R участвует в секреции экзокринных желез. MC3R и MC4R обладают неизбыточными функциями в отношении энергетического гомеостаза наряду с их специфическими противовоспалительными действиями; активация MC3R, в частности, защищает от воспаления суставов, такого как артрит, MC4R оказывает нейропротективное действие при воспалении головного мозга. Соответственно, с помощью MCR-лекарств можно было бы целенаправленно воздействовать на множество патологических состояний, включая патологические состояния кожи, сердечно-сосудистые патологии, воспаление суставов, ожирение и кахексию.
Периферические рецепторы MC1R и MC3R могут быть активированы фармакологически, чтобы вызвать противовоспалительную реакцию. Эндогенный агонист α-меланоцитостимулирующий гормон (αМСГ), подобно другим защитным медиаторам, высвобождается иммунными клетками для уравновешивания провоспалительных сигналов, и, соответственно, предотвращает чрезмерное повреждение тканей. В свете воспалительной концепции, терапия, направленная на MC1R и MC3R, имитирует защитные ресурсы самого организма и могла бы характеризоваться более слабыми побочными эффектами.
От использования кортикотропина, или адренокортикотропного гормона (АКТГ), который с начала 1950-х годов считался эффективным средством при лечении ревматических заболеваний, стали отказываться, когда появились доступные синтетические глюкокортикоиды. Однако, открытие альтернативного противовоспалительного механизма у АКТГ, включающего активацию периферических MC-рецепторов иммунных клеток, возродило интерес к разработке новых АКТГ-подобных молекул, не обладающих стероидогенным действием, для лечения заболеваний суставов, таких как подагра или РА (ревматоидный артрит). Однако ограничение, связанное с трансляционной доставкой новых MC-лекарств, за исключением имеющихся в продаже АКТГ-препаратов, усугубляется тем, что до сих пор не достигнута селективность в отношении рецепторов.
Инновационные подходы поиска лекарств, взаимодействующих с сопряженными с G-белками рецепторами, могли бы помочь преодолеть данное ограничение. Аллостерическая модуляция означает способность молекулы усиливать (позитивная модуляция) или ослаблять (негативная модуляция) эффект эндогенного лиганда при связывании с особым сайтом белка-рецептора, называемым аллостерическим сайтом. Более высокую степень селективности можно ожидать, когда аллостерические области у пяти рецепторов MCR характеризуются меньшей консервативностью, и действительно, в настоящее время разрабатываются аллостерические модуляторы рецептора MC4R для лечения ожирения.
Другой перспективной концепцией, представляющей значительный терапевтический интерес, является концепция функционально-селективного агонизма. Устаревшее представление, состоящее в том, что рецептор может существовать в двух единственно возможных конформациях, активной конформации и неактивной конформации, заменено на концепцию, согласно которой может существовать множество активных конформаций, каждая из которых создает индивидуальный сигнал, что приводит к множеству функциональных ответов. Активация рецептора вместо линейной и статичной становится высоко динамичным и многомерным процессом, в котором разнообразие активных конформаций может быть индуцировано разными молекулами, вызывающими отличающиеся эффекты.
Малая молекула AP1189 ((E)-N-транс-{3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидиния ацетат) характеризована как функционально-селективный агонист рецепторов MC1R и MC3R, который не индуцирует классическую генерацию цАМФ, а вместо этого вызывает ERK1/2 фосфорилирование, сигнальный путь, отвечающий за проэффероцитозный эффект, вызываемый в первичных макрофагах мышей. Показано, что AP1189 уменьшает высвобождение цитокинов в макрофагах, тогда как меланогенез в меланоцитах AP1189 не индуцирует. In vivo при пероральном введении AP1189 оказывает противовоспалительное действие при перитоните и ускоряет фазу регрессии, и обеспечивает значительное снижение макроскопических и гистологических показателей, характеризующих повреждение суставов, в экспериментальной модели воспалительного артрита. Соответственно, AP1189 является функционально-селективным двойным агонистом рецепторов MC1R и MC3R, обладающим противовоспалительными свойствами и вместе с тем не оказывающим действия на меланогенез.
Меланокортиновая терапия с использованием адренокортикотропного гормона (АКТГ) или нестероидогенных меланокортиновых пептидов ослабляет протеинурию и гломерулярное нарушение в экспериментальных моделях гломерулярных заболеваний и индуцирует ремиссию нефротического синдрома у пациентов с различными гломерулопатиями, даже у пациентов, резистентных к стероидам.
Протеинурия, признак гломерулярного нарушения, обычно обнаруживается при анализе мочи и сама по себе является существенным независимым модифицируемым фактором риска терминальной стадии поражения почек, преждевременной смерти от сердечно-сосудистых заболеваний и ишемического инсульта у пациентов с диабетом. Несмотря на последние достижения рефрактерная протеинурия продолжает оставаться проблемой в клинической практике.
Согласно одному из аспектов настоящего изобретения предложена композиция, содержащая соединение Формулы (I) или (Ia):
 Формула (I),
Формула (I),
 Формула (Ia),
Формула (Ia),
включая его таутомерные и изомерные формы, такие как энантиомерные формы, диастереоизомерные формы и рацемические формы,
где
n имеет значение 1, 2 или 3;
каждый R1, R2, R3, R4 и R5 независимо выбран из группы, состоящей из атома водорода, необязательно замещенного C1-6-алкила, необязательно замещенного C3-6-циклоалкила, необязательно замещенного C2-6-алкенила, необязательно замещенного C4-6-алкадиенила, необязательно замещенного C2-6-алкинила, гидрокси, необязательно замещенного C1-6-алкокси, необязательно замещенного C2-6-алкенилокси, карбокси, необязательно замещенного C1-6-алкоксикарбонила, необязательно замещенного C1-6-алкилкарбонила, формила, C1-6-алкилсульфониламино, необязательно замещенного арила, необязательно замещенного арилоксикарбонила, необязательно замещенного арилокси, необязательно замещенного арилкарбонила, необязательно замещенного ариламино, арилсульфониламино, необязательно замещенного гетероарила, необязательно замещенного гетероарилоксикарбонила, необязательно замещенного гетероарилокси, необязательно замещенного гетероарилкарбонила, необязательно замещенного гетероариламино, гетероарилсульфониламино, необязательно замещенного гетероциклила, необязательно замещенного гетероциклилоксикарбонила, необязательно замещенного гетероциклилокси, необязательно замещенного гетероциклилкарбонила, необязательно замещенного гетероциклиламино, гетероциклилсульфониламино, амино, моно- и ди(C1-6-алкил)амино, карбамоила, моно- и ди(C1-6-алкил)аминокарбонила, амино-C1-6-алкил-аминокарбонила, моно- и ди(C1-6-алкиламино-C1-6-алкил-аминокарбонила, C1-6-алкилкарбониламино, амино-C1-6-алкил-карбониламино, моно- и ди(C1-6-алкил)амино-C1-6-алкил-карбониламино, циано, гуанидино, карбамидо, C1-6-алканоилокси, C1-6-алкилсульфонила, C1-6-алкилсульфинила, C1-6-алкилсульфонил-окси, аминосульфонила, моно- и ди(C1-6-алкил)аминосульфонила, нитро, необязательно замещенного C1-6-алкилтио и атома галогена, где любой связанный с атомом азота C1-6-алкил необязательно имеет в качестве заместителей гидрокси, C1-6-алкокси, C2-6-алкенилокси, амино, моно- и ди(C1-6-алкил)амино, карбокси, C1-6-алкилкарбониламино, атом галогена, C1-6-алкилтио, C1-6-алкил-сульфонил-амино или гуанидин;
каждый R6 и R7 независимо выбран из группы, состоящей из атома водорода, необязательно замещенного C1-6-алкила, необязательно замещенного C2-6-алкенила, необязательно замещенного C4-6-алкадиенила, необязательно замещенного C2-6-алкинила, необязательно замещенного C1-6-алкоксикарбонила, необязательно замещенного C1-6-алкилкарбонила, необязательно замещенного арила, необязательно замещенного арилоксикарбонила, необязательно замещенного арилкарбонила, необязательно замещенного гетероарила, необязательно замещенного гетероарилоксикарбонила, необязательно замещенного гетероарилкарбонила, аминокарбонила, моно- и ди(C1-6-алкил)аминокарбонила, амино-C1-6-алкил-аминокарбонила и моно- и ди(C1-6-алкил)амино-C1-6-алкил-аминокарбонила; или R6 и R7 вместе могут образовывать пяти- или шестичленное азот-содержащее кольцо;
или фармацевтически приемлемое производное данного соединения, для применения в лечении заболевания почек.
Согласно одному из аспектов настоящего изобретения также предложено применение композиции, содержащей соединение Формулы (I) или (Ia):
 Формула (I),
Формула (I),
 Формула (Ia),
Формула (Ia),
включая его таутомерные и изомерные формы, такие как энантиомерные формы, диастереоизомерные формы и рацемические формы, где каждый из n, R1, R2, R3, R4 и R5, R6 и R7 является таким, как определено в данном описании выше, или фармацевтически приемлемое производное данного соединения,
для изготовления лекарственного средства для лечения заболевания почек.
Согласно одному из аспектов настоящего изобретения также предложен способ лечения заболевания почек, включающий одну, или более, стадию введения композиции, содержащей соединение Формулы (I) или (Ia):
 Формула (I),
Формула (I),
 Формула (Ia),
Формула (Ia),
включая его таутомерные и изомерные формы, такие как энантиомерные формы, диастереоизомерные формы и рацемические формы, где каждый из n, R1, R2, R3, R4 и R5, R6 и R7 является таким, как определено в данном описании выше, или фармацевтически приемлемое производное данного соединения, нуждающемуся в этом индивидууму.
В настоящем изобретении также предложена композиция, содержащая соединение Формулы (II):

https://en.wikipedia.org/wiki/Kidneyhttps://en.wikipedia.org/wiki/Proteinuriahttps://en.wikipedia.org/wiki/Hypoalbuminemiahttps://en.wikipedia.org/wiki/Hyperlipidemiahttps://en.wikipedia.org/wiki/Edemahttps://en.wikipedia.org/wiki/Blood_clotshttps://en.wikipedia.org/wiki/High_blood_pressure Формула (II),
включая его таутомерные и изомерные формы, такие как энантиомерные формы, диастереоизомерные формы и рацемические формы, или фармацевтически приемлемое производное данного соединения, для применения в лечении заболевания почек.
Согласно одному из вариантов осуществления настоящего изобретения предложена композиция, содержащая соединение Формулы (I), (Ia) или (II), такое, как определено в данном описании, для применения в лечении заболевания почек, отличающаяся тем, что указанное заболевание почек сопровождается протеинурией.
Протеинурия означает присутствие избыточного количества белка в моче. У здоровых субъектов моча содержит очень мало белка; избыток позволяет предположить наличие заболевания. Основными причинами, вызывающими протеинурию, являются заболевание почек (особенно гломерулярное) или повреждение почек, повышенное количество белков в сыворотке (протеинурия "переполнения"), низкая реабсорбция в проксимальных почечных канальцах, некоторые биологические агенты и избыточный прием жидкости.
Протеинурия может быть определена как количество белка >3,5 г на 1,73 м2 площади поверхности тела в сутки, или >40 мг на квадратный метр площади поверхности тела в час у детей.
Согласно одному из вариантов осуществления настоящего изобретения предложена композиция, содержащая соединение Формулы (I), (Ia) или (II), такое, как определено в данном описании, для применения в лечении заболевания почек, отличающаяся тем, что указанное заболевание почек сопровождается протеинурией, определяемой как >3,5 г на 1,73 м2 площади поверхности тела в сутки, или >40 мг на квадратный метр площади поверхности тела в час у детей.
"Заболевание почек, сопровождающееся протеинурией," означает, что протеинурия ассоциирована с симптомом или признаком указанного заболевания почек. "Заболевание почек, сопровождающееся протеинурией," также может быть описано как заболевание почек, ассоциированное с протеинурией, или заболевание почек с протеинурией, или протеинурическое заболевание почек.
Согласно одному из вариантов осуществления настоящего изобретения предложена композиция, содержащая соединение Формулы (I), (Ia) или (II), такое, как определено в данном описании, для применения в лечении заболевания почек, отличающаяся тем, что указанное заболевание почек представляет собой гломерулярное заболевание, такое как заболевание, поражающее подоциты клубочков.
Гломерулярное заболевание также может отражать любой тип гломерулярного нарушения, вызываемого гломерулярным заболеванием или любыми другими стимулами, например другими причинными заболеваниями или воздействиями.
Термин "вызываемый" заболеванием в контексте настоящего описания означает, что нарушение возникает или обнаруживается как причина или следствие заболевания, такого как причинное заболевание, то есть как следствие патологического состояния.
Согласно одному из вариантов осуществления настоящего изобретения предложена композиция, содержащая соединение Формулы (I), (Ia) или (II), такое, как определено в данном описании, для применения в лечении заболевания почек, отличающаяся тем, что указанное заболевание почек представляет собой нефротический синдром (гломерулонефроз).
Нефротический синдром представляет собой совокупность симптомов, развившихся вследствие повреждения почек, включая протеинурию, низкие уровни альбумина в крови, высокий уровень липидов в крови и выраженную отечность. Другие симптомы могут включать прибавление в весе, ощущение усталости и пенистую мочу. Осложнения могут включать тромбы, инфекции и высокое кровяное давление. Причины включают ряд заболеваний почек, и, кроме того, причинами могут служить осложнения, например, диабета или обыкновенной волчанки. Механизм развития заболевания обычно включает повреждение почечных клубочков.
Согласно одному из вариантов осуществления настоящего изобретения предложена композиция, содержащая соединение Формулы (I), (Ia) или (II), такое, как определено в данном описании, для применения в лечении заболевания почек, отличающаяся тем, что указанное заболевание почек представляет собой первичный нефротический синдром (первичный гломерулонефроз).
Согласно одному из вариантов осуществления настоящего изобретения указанный первичный нефротический синдром представляет собой мембранозный гломерулонефрит (МГН) (или мембранозную нефропатию (MN)).
Согласно одному из вариантов осуществления настоящего изобретения указанный первичный нефротический синдром представляет собой фокально-сегментарный гломерулосклероз (ФСГС)
Согласно одному из вариантов осуществления настоящего изобретения указанный первичный нефротический синдром представляет собой мембранозно-пролиферативный гломерулонефрит (МПГН) (мезангиокапиллярный гломерулонефрит).
Согласно одному из вариантов осуществления настоящего изобретения указанный мембранозно-пролиферативный гломерулонефрит (МПГН) выбран из МПГН типа 1 и МПГН типа 2.
Согласно одному из вариантов осуществления настоящего изобретения указанный первичный нефротический синдром представляет собой быстропрогрессирующий гломерулонефрит (БПГН) (серповидный ГН).
Согласно одному из вариантов осуществления настоящего изобретения указанный первичный нефротический синдром представляет собой болезнь минимальных изменений (БМИ).
Согласно одному из вариантов осуществления настоящего изобретения предложена композиция, содержащая соединение Формулы (I), (Ia) или (II), такое, как определено в данном описании, для применения в лечении заболевания почек, отличающаяся тем, что указанное заболевание почек представляет собой вторичный нефротический синдром (вторичный гломерулонефроз).
Согласно одному из вариантов осуществления настоящего изобретения указанный вторичный нефротический синдром вызван причинным заболеванием (или просто вызван заболеванием). Термин "вызываемый" заболеванием в контексте настоящего описания означает, что нефротический синдром возникает или обнаруживается как причина или следствие заболевания, такого как причинное заболевание, то есть как следствие патологического состояния.
Согласно одному из вариантов осуществления настоящего изобретения указанный вторичный нефротический синдром вызван причинным аутоиммунным заболеванием.
Согласно одному из вариантов осуществления настоящего изобретения указанный вторичный нефротический синдром вызван причинным онкологическим заболеванием.
Согласно одному из вариантов осуществления настоящего изобретения указанный вторичный нефротический синдром вызван причинным наследственным заболеванием.
Согласно одному из вариантов осуществления настоящего изобретения указанный вторичный нефротический синдром вызван причинным заболеванием, выбранным из группы, состоящей из системной красной волчанки (СКВ), диабетической нефропатии, саркоидоза, синдрома Шегрена, амилоидоза, множественной миеломы, васкулита, онкологических и наследственных заболеваний (таких как врожденный нефротический синдром).
Волчаночный нефрит представляет собой воспаление почек, вызываемое СКВ. Таким образом, согласно одному из вариантов осуществления настоящего изобретения вторичный нефротический синдром вызван волчаночным нефритом.
Согласно одному из вариантов осуществления настоящего изобретения указанный вторичный нефротический синдром вызван диабетической нефропатией.
Согласно одному из вариантов осуществления настоящего изобретения указанный вторичный нефротический синдром вызван инфекцией.
Согласно одному из вариантов осуществления настоящего изобретения указанный вторичный нефротический синдром вызван инфекцией мочевыводящих путей.
Согласно одному из вариантов осуществления настоящего изобретения указанный вторичный нефротический синдром вызван инфекцией, выбранной из группы, состоящей из ВИЧ (вируса иммунодефицита человека), сифилиса, гепатита, такого как гепатит A, B и C, пост-стрептококковой инфекции, мочеполового шистосомоза и Эболы.
Согласно одному из вариантов осуществления настоящего изобретения указанный вторичный нефротический синдром обусловлен действием лекарственного средства, то есть представляет собой лекарственный нефротический синдром.
Согласно одному из вариантов осуществления настоящего изобретения указанный лекарственный нефротический синдром вызван лекарством, выбранным из группы, состоящей из антибиотиков, нестероидных противовоспалительных препаратов (НПВП), радиоконтрастных сред, противораковых лекарств, противоревматических лекарств, терапии на основе антител, антиTNF-α-терапии, пеницилламина, никотина, лития карбоната, золота и других тяжелых металлов, ингибиторов ACE (ангиотензин-конвертирующего фермента) и опиатов (таких как героин).
Термин "вызываемый" лекарством в контексте настоящего описания означает, что нефротический синдром возникает или обнаруживается как причина или следствие использования или введения лекарства.
Согласно одному из вариантов осуществления настоящего изобретения предложена композиция, содержащая соединение Формулы (I), (Ia) или (II), такое, как определено в данном описании, для применения в лечении заболевания почек, отличающаяся тем, что указанное заболевание почек представляет собой воспалительное заболевание почек.
Согласно одному из вариантов осуществления настоящего изобретения предложена композиция, содержащая соединение Формулы (I), (Ia) или (II), такое, как определено в данном описании, для применения в лечении заболевания почек, отличающаяся тем, что указанное заболевание почек представляет собой гломерулонефрит (ГН).
Согласно одному из вариантов осуществления настоящего изобретения указанный гломерулонефрит выбран из группы, состоящей из IgA-нефропатии (болезни Бергера), IgM-нефропатии, постинфекционного гломерулонефрита и болезни тонкой базальной мембраны.
Согласно одному из вариантов осуществления настоящего изобретения предложена композиция, содержащая соединение Формулы (I) или (Ia), такое, как определено в данном описании, для применения в лечении заболевания почек, где n = 1.
Согласно одному из вариантов осуществления настоящего изобретения предложена композиция, содержащая соединение Формулы (I) или (Ia), такое, как определено в данном описании, для применения в лечении заболевания почек, где каждый R1, R2 и R3 независимо выбран из группы, состоящей из -H, -CH3, -CF3, -CCl3, -O-C1-6 алкила, -OH, -OCH3, -NH-C1-6 алкила, -N(C1-6 алкил)2, -S-C1-6 алкила, -третBu, -CN, -SO3-C1-6 алкила, -NH2, -NO2, -CO2H, -CO2-C1-6 алкила, -C(=O)-C1-6 алкила, -CHO, морфолина, пирролидина, пиррола или атома галогена.
Согласно одному из вариантов осуществления настоящего изобретения предложена композиция, содержащая соединение Формулы (I) или (Ia), такое, как определено в данном описании, для применения в лечении заболевания почек, где каждый R1 и/или R2 представляет собой электроноакцепторную группу.
Под электроноакцепторной группой понимается электроноакцепторный элемент или функциональная группа, которая смещает плотность электронов от соседних атомов в свою сторону, обычно путем резонансного или индукционного эффекта. Является функциональная группа электроноакцепторной или электронодонорной можно определить с использованием уравнения Гаммета, уравнения, известного специалисту в данной области техники. Константы заместителей Гаммета, также известные как σ-константы заместителей, могут быть использованы как мера способности функциональной группы смещать плотность электронов от соседних атомов в свою сторону. Электроноакцепторная группа представляет собой электроноакцепторный элемент или функциональную группу с σ-константой заместителя > 0, например в диапазоне от 0,01 до 0,9, в частности 0,78. Эти значения известны в данной области техники и могут быть найдены в таблицах, публикуемых в научной литературе, например в J. Org. Chem., 23, 420 (1958). Примерами электроноакцепторных групп являются CF3, CCl3, F, Cl, CN и NO2.
Согласно одному из вариантов осуществления настоящего изобретения указанный R1 выбран из группы, состоящей из CF3, CCl3, F, Cl, CN и NO2.
Согласно одному из вариантов осуществления настоящего изобретения каждый указанный R2 и/или R3 представляет собой атом водорода.
Согласно одному из вариантов осуществления настоящего изобретения каждый R4 и R5 независимо выбран из группы, состоящей из -H, C1-6 алкила, атома галогена, -O(C1-6 алкил), -NH(C1-6 алкил) и -C(=O)C1-6 алкила.
Согласно одному из вариантов осуществления настоящего изобретения каждый R6 и R7 независимо выбран из группы, состоящей из атома водорода, метила, этила и пропила.
Согласно одному из вариантов осуществления настоящего изобретения каждый указанный R6 и R7 представляет собой атом водорода.
Согласно одному из вариантов осуществления настоящего изобретения указанный R6 представляет собой атом водорода и R7 представляет собой метил или этил. Согласно одному из вариантов осуществления изобретения указанный R6 представляет собой атом водорода и R7 представляет собой метил. Согласно одному из вариантов осуществления изобретения указанный R6 представляет собой атом водорода и R7 представляет собой этил. Согласно одному из вариантов осуществления изобретения оба указанные R6 и R7 представляют собой метил. Согласно одному из вариантов осуществления изобретения оба указанные R6 и R7 представляют собой этил.
Согласно одному из вариантов осуществления настоящего изобретения каждый указанный R2, R3, R4, R5, R6 и R7 представляет собой атом водорода и указанный R1 выбран из группы, состоящей из CF3, CCl3, F, Cl, NO2 и CN.
Согласно одному из вариантов осуществления настоящего изобретения каждый указанный R2, R3, R4, R5, R6 и R7 представляет собой атом водорода, указанный R1 выбран из группы, состоящей из CF3, CCl3, F, Cl, NO2 или CN, и n = 1.
Согласно одному из вариантов осуществления настоящего изобретения указанный R3 находится в положении 4.
Согласно одному из вариантов осуществления настоящего изобретения указанный R3 выбран из группы, состоящей из F, Cl и Br.
Согласно одному из вариантов осуществления настоящего изобретения указанное соединение представляет собой {3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидин, предпочтительно (E)-N-транс-{3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидин, или его фармацевтически приемлемую соль.
Согласно одному из вариантов осуществления настоящего изобретения предложена композиция, содержащая соединение Формулы (I), (Ia) или (II), такое, как определено в данном описании, для применения в лечении заболевания почек, отличающаяся тем, что фармацевтически приемлемое производное указанного соединения представляет собой фармацевтически приемлемую соль неорганической кислоты или органической кислоты.
Согласно одному из вариантов осуществления настоящего изобретения органическая кислота выбрана из группы, состоящей из муравьиной кислоты, уксусной кислоты, трихлоруксусной кислоты, трифторуксусной кислоты, пропионовой кислоты, бензойной кислоты, коричной кислоты, лимонной кислоты, фумаровой кислоты, гликолевой кислоты, молочной кислоты, малеиновой кислоты, яблочной кислоты, малоновой кислоты, миндальной кислоты, щавелевой кислоты, пикриновой кислоты, пировиноградной кислоты, салициловой кислоты, янтарной кислоты, метансульфоновой кислоты, этансульфоновой кислоты, винной кислоты, аскорбиновой кислоты, памовой кислоты, бисметиленсалициловой кислоты, этандисульфоновой кислоты, глюконовой кислоты, цитраконовой кислоты, аспарагиновой кислоты, стеариновой кислоты, пальмитиновой кислоты, ЭДТА, гликолевой кислоты, пара-аминобензойной кислоты, глутаминовой кислоты, бензолсульфоновой кислоты и пара-толуолсульфоновой кислоты.
Согласно одному из вариантов осуществления настоящего изобретения указанная органическая кислота представляет собой уксусную кислоту, янтарную кислоту, винную кислоту или пропионовую кислоту.
Согласно одному из вариантов осуществления настоящего изобретения указанная неорганическая кислота выбрана из группы, состоящей из: соляной кислоты, бромистоводородной кислоты, йодистоводородной кислоты, фосфорной кислоты, серной кислоты и азотной кислоты.
Согласно одному из вариантов осуществления настоящего изобретения указанная фармацевтически приемлемая кислота представляет собой уксусную кислоту.
Согласно одному из вариантов осуществления настоящего изобретения указанное соединение представляет собой {3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидиния ацетат, предпочтительно (E)-N-транс-{3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидиния ацетат.
Согласно одному из вариантов осуществления настоящего изобретения предложена композиция, содержащая соединение Формулы (Ia), где каждый указанный R2, R3, R4 и R5 представляет собой атом водорода, каждый R6 и R7 независимо выбран из группы, состоящей из атома водорода, метила, этила и пропила, указанный R1 выбран из группы, состоящей из CF3, CCl3, F, Cl, NO2 или CN, и n = 1, для применения в лечении заболевания почек.
Согласно одному из вариантов осуществления настоящего изобретения предложена композиция, содержащая соединение Формулы (Ia), где каждый указанный R2, R3, R4, R5, R6 и R7 представляет собой атом водорода, указанный R1 выбран из группы, состоящей из CF3, CCl3, F, Cl, NO2 или CN, и n = 1, для применения в лечении заболевания почек.
Согласно одному из вариантов осуществления настоящего изобретения предложена композиция, содержащая соединение Формулы (Ia), где каждый указанный R2, R3, R4, R5, R6 и R7 представляет собой атом водорода, указанный R1 выбран из группы, состоящей из CF3, CCl3, F, Cl, NO2 или CN, и n = 1, для применения в лечении заболевания почек, отличающаяся тем, что указанное заболевание почек представляет собой протеинурию.
Согласно одному из вариантов осуществления настоящего изобретения предложена композиция, содержащая соединение Формулы (Ia), где каждый указанный R2, R3, R4, R5, R6 и R7 представляет собой атом водорода, указанный R1 выбран из группы, состоящей из CF3, CCl3, F, Cl, NO2 или CN, и n = 1, для применения в лечении нефротического синдрома. Согласно одному из вариантов осуществления изобретения указанный нефротический синдром выбран из группы, состоящей из первичного нефротического синдрома и вторичного нефротического синдрома.
Согласно одному из вариантов осуществления настоящего изобретения предложена композиция, содержащая соединение Формулы (Ia), где каждый указанный R2, R3, R4, R5, R6 и R7 представляет собой атом водорода, указанный R1 выбран из группы, состоящей из CF3, CCl3, F, Cl, NO2 или CN, и n = 1, для применения в лечении первичного нефротического синдрома (первичного гломерулонефроза), отличающаяся тем, что указанный первичный нефротический синдром выбран из группы, состоящей из мембранозного гломерулонефрита (МГН) (или мембранозной нефропатии (MN)), фокально-сегментарного гломерулосклероза (ФСГС), мембранозно-пролиферативного гломерулонефрита (МПГН) (мезангиокапиллярного гломерулонефрита), выбранного из группы, состоящей из МПГН типа 1 и МПГН типа 2, быстропрогрессирующего гломерулонефрита (БПГН) (серповидного ГН) и болезни минимальных изменений (БМИ).
Согласно одному из вариантов осуществления настоящего изобретения предложена композиция, содержащая соединение Формулы (Ia), где каждый указанный R2, R3, R4, R5, R6 и R7 представляет собой атом водорода, указанный R1 выбран из группы, состоящей из CF3, CCl3, F, Cl, NO2 или CN, и n = 1, для применения в лечении вторичного нефротического синдрома (вторичного гломерулонефроза), отличающаяся тем, что указанный вторичный нефротический синдром вызван заболеванием, выбранным из группы, состоящей из причинного аутоиммунного заболевания, системной красной волчанки (волчаночного нефрита), диабетической нефропатии, саркоидоза, синдрома Шегрена, амилоидоза, множественной миеломы, васкулита, рака, наследственных заболеваний (таких как врожденный нефротический синдром), инфекции и диабетической нефропатии.
Согласно одному из вариантов осуществления настоящего изобретения предложена композиция, содержащая соединение Формулы (Ia), где каждый указанный R2, R3, R4, R5, R6 и R7 представляет собой атом водорода, указанный R1 выбран из группы, состоящей из CF3, CCl3, F, Cl, NO2 или CN, и n = 1, для применения в лечении лекарственного нефротического синдрома. Согласно одному из вариантов осуществления изобретения указанный лекарственный нефротический синдром вызван лекарством, выбранным из группы, состоящей из антибиотиков, нестероидных противовоспалительных препаратов (НПВП), радиоконтрастных сред, противораковых лекарств, противоревматических лекарств, терапии на основе антител, антиTNF-α-терапии, пеницилламина, никотина, лития карбоната, золота и других тяжелых металлов, ингибиторов ACE и опиатов (особенно героина).
Согласно одному из вариантов осуществления настоящего изобретения предложена композиция, содержащая соединение Формулы (Ia), где каждый указанный R2, R3, R4, R5, R6 и R7 представляет собой атом водорода, указанный R1 выбран из группы, состоящей из CF3, CCl3, F, Cl, NO2 или CN, и n = 1, для применения в лечении заболевания почек, отличающаяся тем, что указанное заболевание почек выбрано из группы, состоящей из гломерулярного заболевания, заболевания, поражающего подоциты клубочков, воспалительного заболевания почек и гломерулонефрита (ГН), такого как гломерулонефрит, выбранный из группы, состоящей из IgA-нефропатии (болезни Бергера), IgM-нефропатии, постинфекционного гломерулонефрита и болезни тонкой базальной мембраны.
Согласно одному из вариантов осуществления настоящего изобретения предложена композиция, содержащая соединение, выбранное из соединения Формулы (II), {3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидина, {3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидиния ацетата, (E)-N-транс-{3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидина и (E)-N-транс-{3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидиния ацетата, или фармацевтически приемлемое производное указанного соединения, для применения в лечении заболевания почек. Согласно одному из вариантов осуществления изобретения указанное заболевание почек представляет собой протеинурию.
Согласно одному из вариантов осуществления настоящего изобретения предложена композиция, содержащая соединение, выбранное из соединения Формулы (II), {3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидина, {3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидиния ацетата, (E)-N-транс-{3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидина и (E)-N-транс-{3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидиния ацетата, или фармацевтически приемлемое производное указанного соединения, для применения в лечении нефротического синдрома. Согласно одному из вариантов осуществления изобретения указанный нефротический синдром выбран из группы, состоящей из первичного нефротического синдрома и вторичного нефротического синдрома.
Согласно одному из вариантов осуществления настоящего изобретения предложена композиция, содержащая соединение, выбранное из соединения Формулы (II), {3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидина, {3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидиния ацетата, (E)-N-транс-{3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидина и (E)-N-транс-{3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидиния ацетата, или фармацевтически приемлемое производное указанного соединения, для применения в лечении первичного нефротического синдрома (первичного гломерулонефроза), отличающаяся тем, что указанный первичный нефротический синдром выбран из группы, состоящей из мембранозного гломерулонефрита (МГН) (или мембранозной нефропатии (MN)), фокально-сегментарного гломерулосклероза (ФСГС), мембранозно-пролиферативного гломерулонефрита (МПГН) (мезангиокапиллярного гломерулонефрита), выбранного из группы, состоящей из МПГН типа 1 и МПГН типа 2, быстропрогрессирующего гломерулонефрита (БПГН) (серповидного ГН) и болезни минимальных изменений (БМИ).
Согласно одному из вариантов осуществления настоящего изобретения предложена композиция, содержащая соединение, выбранное из соединения Формулы (II), {3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидина, {3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидиния ацетата, (E)-N-транс-{3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидина и (E)-N-транс-{3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидиния ацетата, или фармацевтически приемлемое производное указанного соединения, для применения в лечении вторичного нефротического синдрома (вторичного гломерулонефроза), отличающаяся тем, что указанный вторичный нефротический синдром вызван заболеванием, выбранным из группы, состоящей из причинного аутоиммунного заболевания, системной красной волчанки (волчаночного нефрита), диабетической нефропатии, саркоидоза, синдрома Шегрена, амилоидоза, множественной миеломы, васкулита, рака, наследственных заболеваний (таких как врожденный нефротический синдром), инфекции и диабетической нефропатии.
Согласно одному из вариантов осуществления настоящего изобретения предложена композиция, содержащая соединение, выбранное из соединения Формулы (II), {3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидина, {3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидиния ацетата, (E)-N-транс-{3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидина и (E)-N-транс-{3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидиния ацетата, или фармацевтически приемлемое производное указанного соединения, для применения в лечении вторичного нефротического синдрома, вызванного диабетической нефропатией.
Согласно одному из вариантов осуществления настоящего изобретения предложена композиция, содержащая соединение, выбранное из соединения Формулы (II), {3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидина, {3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидиния ацетата, (E)-N-транс-{3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидина и (E)-N-транс-{3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидиния ацетата, или фармацевтически приемлемое производное указанного соединения, для применения в лечении лекарственного нефротического синдрома. Согласно одному из вариантов осуществления изобретения указанный лекарственный нефротический синдром вызван лекарством, выбранным из группы, состоящей из антибиотиков, нестероидных противовоспалительных препаратов (НПВП), радиоконтрастных сред, противораковых лекарств, противоревматических лекарств, терапии на основе антител, антиTNF-α-терапии, пеницилламина, никотина, лития карбоната, золота и других тяжелых металлов, ингибиторов ACE и опиатов (особенно героина).
Согласно одному из вариантов осуществления настоящего изобретения предложена композиция, содержащая соединение, выбранное из соединения Формулы (II), {3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидина, {3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидиния ацетата, (E)-N-транс-{3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидина и (E)-N-транс-{3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидиния ацетата, или фармацевтически приемлемое производное указанного соединения, для применения в лечении заболевания почек, выбранного из группы, состоящей из гломерулярного заболевания, заболевания, поражающего подоциты клубочков, воспалительного заболевания почек и гломерулонефрита (ГН), такого как гломерулонефрит, выбранный из группы, состоящей из IgA-нефропатии (болезни Бергера), IgM- нефропатии, постинфекционного гломерулонефрита и болезни тонкой базальной мембраны.
Безотносительно к какой-либо теории, согласно одному из вариантов осуществления изобретения соединения по настоящему изобретению вызывают благоприятные эффекты, воздействуя в качестве агониста на один или более MC-рецепторов, таких как MC1R и MC3R, например на рецептор MC1R. Согласно одному из вариантов осуществления изобретения соединения по настоящему изобретению вызывают благоприятные эффекты, воздействуя в качестве функционально-селективного агониста на рецепторы MC1R и MC3R.
Согласно одному из вариантов осуществления настоящего изобретения предложена композиция, содержащая соединение Формулы (I), (Ia) или (II), такое, как определено в данном описании, включая его таутомерные и изомерные формы, такие как энантиомерные формы, диастереоизомерные формы и рацемические формы, для применения в лечении заболевания почек, отличающаяся тем, что указанное соединение является
i) агонистом одного или более MC-рецепторов,
ii) агонистом рецепторов MC1R и MC3R,
iii) агонистом рецептора MC1R,
iv) агонистом рецептора MC1R и/или MC3R, но не агонистом рецепторов MC2R и MC4R,
v) функционально-селективным агонистом рецепторов MC1R и MC3R,
vi) функционально-селективным агонистом рецепторов MC1R и MC3R, который в основном индуцирует ERK1/2-фосфорилирование и незначительно индуцирует генерацию цАМФ,
vii) функционально-селективным агонистом рецепторов MC1R и MC3R, который не стимулирует меланогенез через воздействие на MC1R, и/или
viii) агонистом рецептора MC1R и/или MC3R, не оказывающим действия на энергетический гомеостаз, например на потребление пищи.
Согласно одному из вариантов осуществления изобретения соединение по настоящему изобретению не уменьшает потребление пищи, например не уменьшает потребление пищи путем воздействия на MC3R и/или MC4R.
Согласно одному из вариантов осуществления изобретения соединение по настоящему изобретению не индуцирует меланогенез.
Комбинированная терапия
Соединения или композиции согласно настоящему изобретению могут быть комбинированы с одним, или более, дополнительным активным ингредиентом, который рассматривается как другое терапевтически эффективное соединение или фармацевтически приемлемое производное данного соединения, или могут содержать указанный ингредиент.
Согласно одному из вариантов осуществления настоящего изобретения композиция, содержащая соединение Формулы (I), (Ia) или (II), или его фармацевтически приемлемое производное, содержит, отдельно или вместе (с указанным соединением), один, или более, дополнительный активный фармацевтический ингредиент.
Согласно одному из вариантов осуществления настоящего изобретения композиция, содержащая соединение Формулы (I), (Ia) или (II), или его фармацевтически приемлемое производное, содержит, отдельно или вместе (с указанным соединением), один, или более, дополнительный активный фармацевтический ингредиент, используемый для лечения заболевания почек.
Согласно одному из вариантов осуществления настоящего изобретения указанный один, или более, дополнительный активный фармацевтический ингредиент включает ингредиенты, используемые для лечения заболевания почек.
Согласно одному из вариантов осуществления настоящего изобретения указанный один, или более, дополнительный активный фармацевтический ингредиент включает ингредиенты, используемые для лечения первопричины указанного заболевания почек.
Согласно одному из вариантов осуществления настоящего изобретения указанный один, или более, дополнительный активный фармацевтический ингредиент включает ингредиенты, используемые для лечения первопричины указанного заболевания почек, такие как ингредиенты для лечения высокого кровяного давления, высокого уровня холестерина в крови и инфекции, низкосолевую диету и ограничение потребления жидкости.
Согласно одному из вариантов осуществления настоящего изобретения указанный один, или более, дополнительный активный фармацевтический ингредиент, используемый для лечения заболевания почек, выбран из группы, состоящей из ингибиторов ангиотензин-превращающего фермента (ACE), антагониста альдостерона и блокатора рецепторов ангиотензина (ARB).
Согласно одному из вариантов осуществления настоящего изобретения указанный один, или более, дополнительный активный фармацевтический ингредиент, используемый для лечения заболевания почек и протеинурии, вызванных аутоиммунным заболеванием, используют вместе со стероидами или агентом со стероид-щадящим эффектом в комбинации с ингибиторами ACE.
Согласно другому варианту осуществления настоящего изобретения указанный один, или более, дополнительный активный фармацевтический ингредиент включает ингредиенты, используемые для лечения первопричины заболевания почек.
Согласно одному из вариантов осуществления изобретения комбинация дополнительных лекарств позволяет использовать щадящий режим дозирования, при котором снижается необходимая доза лекарства, используемого в комбинации с соединением по настоящему изобретению.
Согласно одному из вариантов осуществления настоящего изобретения композицию, содержащую соединение Формулы (I), (Ia) или (II), такое, как определено в данном описании, и дополнительный активный ингредиент, вводят одновременно, последовательно или раздельно.
Согласно одному варианту осуществления настоящего изобретения композицию, содержащую соединение Формулы (I), (Ia) или (II), такое, как определено в данном описании, вводят перед введением дополнительного активного ингредиента. Согласно другому варианту осуществления изобретения композицию, содержащую соединение Формулы (I), такое, как определено в данном описании, вводят одновременно с дополнительным активным ингредиентом. Согласно еще одному варианту осуществления изобретения композицию, содержащую соединение Формулы (I), такое, как определено в данном описании, вводят после введения дополнительного активного ингредиента.
Пути введения
Следует понимать, что предпочтительный путь введения обычно зависит от общего состояния и возраста субъекта, нуждающегося в лечении, природы патологического состояния, нуждающегося в лечении, места расположения ткани, нуждающейся в лечении, в организме субъекта и выбранного активного ингредиента.
Согласно одному из вариантов осуществления настоящего изобретения композицию, содержащую соединение Формулы (I), (Ia) или (II), такое, как определено в данном описании, вводят с использованием системного введения, местного введения, энтерального введения или парентерального введения. Подходящие лекарственные формы для такого введения могут быть получены с помощью стандартных методик.
Системное введение
Системное введение допускает введение соединения в кровоток, чтобы в итоге целенаправленно воздействовать на желаемые мишени.
К таким путям введения относятся любые подходящие пути введения, такие как энтеральный путь, пероральный, ректальный, назальный, пульмональный, трансбуккальный, сублингвальный, трансдермальный, интрацистернальный, интраперитонеальный, и парентеральный (включая подкожный, внутримышечный, интратекальный, внутривенный и интрадермальный) путь.
Согласно одному из вариантов осуществления настоящего изобретения композицию, содержащую соединение Формулы (I), (Ia) или (II), такое, как определено в данном описании, вводят с использованием системного введения.
Пероральное введение
Пероральное введение обычно используют для доставки энтеральных лекарств, когда соединение доставляется через слизистую пищеварительного тракта. Обычно используют сиропы и твердые пероральные лекарственные формы, такие как таблетки, капсулы и тому подобное.
Согласно одному из вариантов осуществления настоящего изобретения композицию, содержащую соединение Формулы (I), (Ia) или (II), такое, как определено в данном описании, вводят с использованием перорального введения.
Парентеральное введение
К парентеральному введению относится любой путь введения кроме перорального/энтерального путей, при использовании которого лекарство не подвергается пресистемному метаболизму в печени. Соответственно, парентеральное введение включает любые инъекции и инфузии, такие как болюсная инъекция или непрерывная инфузия, выполненные, например, путем внутривенного введения, внутримышечного введения, подкожного введения. Кроме того, парентеральное введение включает ингаляции и местное введение.
Соответственно, соединение может быть введено местно и проходит через слизистую оболочку животного, которому вводят биологически активные вещества, например, в нос, влагалище, глаз, рот, половые пути, легкие, желудочно-кишечный тракт или прямую кишку, предпочтительно через слизистую носа или рта, и, соответственно, парентеральное введение также может включать трансбуккальное, сублингвальное, назальное, ректальное, вагинальное и интраперитонеальное введение, а также пульмональное и бронхиальное введение путем ингаляции или с использованием медицинской аппаратуры. Также соединение может быть введено местно таким образом, что оно проходит через кожу.
Обычно подкожные и внутримышечные формы парентерального введения являются предпочтительными.
Местное лечение
Согласно одному из вариантов осуществления настоящего изобретения соединение, описанное в данной заявке, применяют для местного лечения, то есть вводят прямо в место(а) приложения его действия. Соответственно, соединение может быть введено непосредственно в кожу или слизистую, или соединение может быть введено путем инъекции в место приложения его действия, например в больную ткань, или в концевую артерию, идущую прямо к больной ткани.
Дозы
В соответствии с настоящим изобретением композицию, содержащую соединение Формулы (I), (Ia) или (II), вводят нуждающимся в лечении индивидуумам в фармацевтически эффективных дозах. Терапевтически эффективное количество соединения представляет собой количество, достаточное для лечения, предупреждения, уменьшения риска возникновения или частичного подавления клинических проявлений данного заболевания и его осложнений. Количество, которое будет эффективным для достижения конкретного терапевтического результата, зависит от тяжести и типа расстройства, а также от массы и общего состояния субъекта. Соединение может быть введено один или несколько раз в сутки, например от 1 до 8 раз в сутки, например от 1 до 6 раз в сутки, например от 1 до 5 раз в сутки, например от 1 до 4 раз в сутки, например от 1 до 3 раз в сутки, например от 1 до 2 раз в сутки, например от 2 до 4 раз в сутки, например от 2 до 3 раз в сутки. Альтернативно соединение можно вводить реже одного раза в сутки, например один раз в сутки, например один раз в двое суток, например один раз в трое суток, например один раз в четверо суток, например один раз в пять суток, например один раз в шесть суток, например один раз в неделю.
Согласно одному из вариантов осуществления настоящего изобретения композицию, содержащую соединение Формулы (I), такое, как определено в данном описании, вводят в терапевтически эффективном количестве, например в количестве от 1 мг до 1000 мг соединения Формулы (I), (Ia) или (II) в сутки.
Отсюда согласно одному из вариантов осуществления настоящего изобретения соединение вводят в количестве от 1 мг до 1000 мг, например от 1 до 5 мг, от 5 до 10 мг, от 10 до 15 мг, от 15 до 20 мг, 20 мг, от 20 до 30 мг, от 30 до 60 мг, от 60 до 80 мг, от 80 до 100 мг, от 100 до 130 мг, от 130 до 160 мг, от 160 до 200 мг, от 200 до 240 мг, от 240 до 280 мг, от 280 до 320 мг, от 320 до 360 мг, от 360 до 400 мг, от 400 до 440 мг, от 440 до 500 мг, от 500 до 560 мг, от 560 до 620 мг, от 620 до 680 мг, от 680 до 740 мг, от 740 до 800 мг, от 800 до 860 мг, от 860 до 920 мг, от 920 до 980 мг, от 980 до 1000 мг, например от 500 до 1000 мг в сутки.
"В сутки" означает, что доза может быть получена путем однократного введения или разделена для многократного введения в течение суток, включая один раз сутки (QD), два раза в сутки (BID) и/или три раза в сутки (TID).
Согласно другому варианту осуществления настоящего изобретения соединение вводят в количестве от 0,01 мг/кг массы тела до 40 мг/кг массы тела, например от 0,01 мг/кг массы тела до 0,05 мг/кг массы тела, от 0,05 до 0,1 мг/кг массы тела, от 0,1 до 0,5 мг/кг массы тела, от 0,5 мг до 1 мг/кг массы тела, от 1 до 2 мг/кг массы тела, от 2 до 3 мг/кг массы тела, от 3 до 5 мг/кг массы тела, от 5 до 10 мг/кг массы тела, от 10 до 15 мг/кг массы тела, от 15 до 20 мг/кг массы тела, от 20 до 30 мг/кг массы тела, например от 30 до 40 мг/кг массы тела.
Препараты
Согласно одному из вариантов осуществления настоящего изобретения композиция, содержащая соединение Формулы (I), (Ia) или (II), такое, как определено в данном описании, представляет собой фармацевтическую композицию, такую как фармацевтически безопасная композиция. Композиция, содержащая соединение Формулы (I), (Ia) или (II), такое, как определено в данном описании, может быть введена любым подходящим путем, например перорально, сублингвально или парентерально, и может находиться в любой форме, подходящей для такого введения, например в форме растворов, суспензий, аэрозолей, таблеток, капсул, порошков, сиропов, имплантата или дисперсий, предназначенных для инъекции.
Согласно одному из вариантов осуществления настоящего изобретения композицию, содержащую соединение Формулы (I), (Ia) или (II), такое, как определено в данном описании, получают в виде препарата в форме суспензии.
Согласно одному из вариантов осуществления настоящего изобретения композицию, содержащую соединение Формулы (I), (Ia) или (II), такое, как определено в данном описании, получают в виде препарата в пероральной дозированной форме, такой как твердая пероральная дозированная форма, или фармацевтическая единица, такая как таблетки или капсулы, или жидкая пероральная дозированная форма. Методики для получения твердых фармацевтических препаратов хорошо известны в данной области техники.
Согласно другому варианту осуществления настоящего изобретения композицию, содержащую соединение Формулы (I), (Ia) или (II), такое, как определено в данном описании, получают в виде препарата в инъекционной дозированной форме.
Согласно одному из вариантов осуществления настоящего изобретения композицию, содержащую соединение Формулы (I), (Ia) или (II), такое, как определено в данном описании, получают в виде препарата в форме твердой фармацевтической единицы, предпочтительно в форме таблетки или капсулы.
Соединение (I), (Ia) или (II) в виде свободного основания или соли может быть введено одно или в комбинации с фармацевтически приемлемыми носителями или эксципиентами, в виде одной дозы или многократных доз. Фармацевтические композиции могут быть получены вы виде препарата, дополнительно содержащего фармацевтически приемлемые носители или разбавители, а также любые другие известные адъюванты и эксципиенты, в соответствии со стандартными методиками, такими как методики, описанные в Remington: The Science and Practice of Pharmacy, 19 Edition, Gennaro, Ed., Mack Publishing Co., Easton, Pa., 1995.
Список литературы
Lindskog et al. 2010 "Melanocortin 1 Receptor Agonists Reduce Proteinuria". J Am Soc Nephrol 21: 1290-1298, 2010.
Qiao et al. 2016 "MC1R is dispensable for the proteinuria reducing and glomerular protective effect of melanocortin therapy". Nature Scientific Reports 6:27589.
Montero-Melendez et al. 2015 "Biased Agonism as a Novel Strategy To Harness the Proresolving Properties of Melanocortin Receptors without Eliciting Melanogenic Effects". J Immunol 2015; 194:3381-3388.
ПРИМЕРЫ
Методики
У самцов крыс линии Спрег-Доули, анестезированных изофлураном, индуцировали пассивный Хеймановский нефрит путем введения медленной инъекцией в яремную вену antiFx1A-сыворотки (PTX-002S, Probetex, San Antonio, TX, USA, Probetex, lot 169-6H) в 0-й день исследования (1 мл сыворотки) и в 7-й день исследования (0,25 мл сыворотки). Ранее было показано (Lindskog et al., J Am Soc Nephrol. 2010; 21:1290-1298), что данный режим введения индуцирует выраженную протеинурию. Фармакологическое вмешательство с использованием контрольного соединения или исследуемого соединения инициировали в 14-й день.
В одном эксперименте (эксперимент 1) исследуемое соединение 1, растворенное в изотоническом растворе, вводили один раз в сутки путем интраперитонеальных (ip) инъекций в дозе 10 мг/кг (n=12), в качестве контроля использовали животных (n=12), которые получали инъекции изотонического раствора.
В другом эксперименте (эксперимент 2) исследуемое соединение 1 вводили один раз в сутки через желудочный зонд. Исследуемое соединение 1 вводили в виде суспензии в 10% гидроксипропил-бета-циклодекстрине в воде. Тестировали две дозы исследуемого соединения 1: 20 мг/кг/сутки (n=8) и 40 мг/кг/сутки (n=8). В данном эксперименте лечебный эффект исследуемого соединения 1 сравнивали с эффектом АКТГ(1-24), так как в литературе описано, что АКТГ обладает лечебным действием в отношении протеинурии в использованной экспериментальной модели. Для позитивного контроля крысы (n=6) получали в качестве лечения АКТГ(1-24) (Bachem, номер по каталогу H-1150) в дозе 10 мкг/кг в сутки путем непрерывной подкожной инфузии с использованием осмотических мининасосов Alzet в течение 4 недель. Ранее было показано, что данная схема лечения приводит к приблизительно 50% уменьшению протеинурии по сравнению с контролем, когда животные не получают лечения (Lindskog et al., J Am Soc Nephrol. 2010; 21:1290-1298).
В эксперименте 1 трижды проводили сбор двадцатичетырехчасового объема мочи, в 14-й день после индукции нефрита, то есть в то время, когда было инициировано фармакологическое вмешательство, в 28-й день и в 42-й день после индукции нефрита. Для сбора мочи крыс помещали в метаболические клетки, и затем отбирали пробы крови для измерения концентраций креатинина и альбумина в плазме. Также определяли концентрацию креатинина и альбумина в моче, и затем определяли объем мочи, выделенной в течение двадцати четырех часов.
В эксперименте 2 сбор двадцатичетырехчасового объема мочи проводили в 42-й день после индукции нефрита, то есть после 28 суток лечения исследуемым соединением 1 или АКТГ(1-24). Как и в эксперименте 1, крыс помещали в метаболические клетки, и затем отбирали пробы крови для измерения концентраций креатинина и альбумина в плазме. Также определяли концентрацию креатинина и альбумина в моче, и затем определяли объем мочи, выделенной в течение двадцати четырех часов.
Пробы крови отбирали из брюшной вены крыс, анестезированных пентобарбиталом (0,2-0,3 мл/крысу интраперитонеально; Dolethal, Vetoquinol via Centravet, Lapalisse, France). Отобранные пробы крови переносили в пробирки, покрытые ЭДТА и центрифугировали (10 мин, 1000 g, 4°C) для сбора плазмы. До количественного определения креатинина и альбумина пробы плазмы хранили при -80°C.
Для количественного определения альбумина и креатинина в моче и плазме использовали клинический биохимический анализатор ABX Pentra 400 (HORIBA).
Скорость экскреции альбумина определяли следующим образом:
24-часовой объем мочи x концентрация альбумина в моче.
Клиренс креатинина как оценку скорости клубочковой фильтрации определяли следующим образом:
(концентрация креатинина в моче x 24-часовой объем мочи)/концентрация креатинина в плазме.
Экскрецию фракционного альбумина определяли следующим образом:
((концентрация альбумина в моче x 24-часовой объем мочи)/концентрация альбумина в плазме)/клиренс креатинина x100
Все данные представлены в виде среднего значения ± средняя квадратическая ошибка среднего (SE). Статистический анализ выполняли с использованием стандартного непарного t-критерия, с рассматриваемым статистическим уровнем значимости p<0,05.
Результаты
Исследуемое соединение 1 = AP1189 = ((E)-N-транс-{3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидиния ацетат.
АКТГ(1-24) = фрагмент 1-24 адренокортикотропного гормона человека; тетракозактид.
Сильный АКТГ/MC2R агонист (EC50 = 5,5 нМ). Стимулирует высвобождение глюкокортикоидов из надпочечников. Последовательность: Ser-Tyr-Ser-Met-Glu-His-Phe-Arg-Trp-Gly-Lys-Pro-Val-Gly-Lys-Lys-Arg-Arg-Pro-Val-Lys-Val-Tyr-Pro.
Эксперимент 1
По сравнению с контрольными крысами, у крыс, получавших в качестве лечения исследуемое соединение 1, регистрировали значительное ослабление протеинурии на 28-й день и 42-й день. У крыс, получавших в качестве лечения исследуемое соединение 1, на 28-й день регистрировали уменьшение скорости экскреции альбумина на 31±8% и на 42-й день статистически значимое уменьшение скорости экскреции альбумина на 48±10%. У контрольных крыс скорость экскреции альбумина не изменялась на всем протяжении эксперимента (на 28-й день данное значение составляло 96±11% от соответствующего значения, регистрируемого в 14-й день, и на 42-й день - 102±14% от значения, регистрируемого в 14-й день) (смотри Фиг. 1).
Аналогичную картину наблюдали при оценке экскреции фракционного альбумина: на 28-й день FEAlb была снижена на 48±5% и на 42-й день на 45±11% (иллюстрация отсутствует).
Эксперимент 2
Животные, получавшие в качестве лечения исследуемое соединение 1, имели значимо более высокую GFR (скорость клубочковой фильтрации; клиренс креатинина) после 4 недель лечения, чем крысы, получавшие в качестве лечения позитивный контроль (АКТГ 1-24 в количестве 10 мг/сутки): GFR у крыс, получавших в качестве лечения позитивный контроль, составляла 2,19 ±0,24 мл/мин, тогда как у крыс, получавших исследуемое соединение 1 в количестве 20 мг/кг, соответствующее значение составляло 3,12±0,14 мл/мин (p=0,002 vs позитивный контроль) и у крыс, получавших исследуемое соединение 1 в количестве 40 мг/кг, - 2,94±0,14 мл/24 мин (p=0,01 vs позитивный контроль). (смотри Фиг. 2A).
Лечение с использованием исследуемого соединения 1 значительно уменьшало экскрецию фракционного альбумина (FEAlb) в сравнении с лечением позитивным контролем (АКТГ 1-24 в количестве 10 мг/сутки): FEAlb у крыс, получавших в качестве лечения позитивный контроль, составляла 0,59±0,02%, тогда как у крыс, получавших исследуемое соединение 1 в количестве 20 мг/кг, соответствующее значение составляло 0,045±0,04% (p=0,007 vs позитивный контроль) и у крыс, получавших исследуемое соединение 1 в количестве 40 мг/кг, - 0,35±0,05% (p=0,001 vs позитивный контроль) (смотри Фиг. 2B).
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМБИНИРОВАННОЕ ЛЕЧЕНИЕ АРТРИТА | 2020 |
|
RU2828044C2 |
| АНАЛОГИ АЛЬФА- и ГАММА-MSH | 2013 |
|
RU2668791C2 |
| ПРОФИЛАКТИЧЕСКОЕ ИЛИ ТЕРАПЕВТИЧЕСКОЕ СРЕДСТВО ОТ ФОТОДЕРМАТОЗА | 2021 |
|
RU2812785C1 |
| Ингибиторы альдостеронсинтазы (CYP11B2) человека | 2022 |
|
RU2811745C1 |
| ИНГИБИТОРЫ АЛЬДОСТЕРОНСИНТАЗЫ (CYP11B2) ЧЕЛОВЕКА | 2023 |
|
RU2824362C1 |
| Ингибиторы цитохрома 11В2 человека | 2022 |
|
RU2800378C1 |
| КОМБИНАЦИИ, ВКЛЮЧАЮЩИЕ АГОНИСТ РЕЦЕПТОРА S1P И ИНГИБИТОР КИНАЗЫ JAK3 | 2005 |
|
RU2415678C2 |
| ТЕРАПЕВТИЧЕСКИЕ СОЕДИНЕНИЯ И СПОСОБЫ | 2018 |
|
RU2837261C2 |
| Замещенные производные бисфенилового эфира масляной кислоты в качестве ингибиторов NEP | 2019 |
|
RU2784522C2 |
| БИЦИКЛИЧЕСКИЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ПРОТИВОВОСПАЛИТЕЛЬНЫХ АГЕНТОВ | 2006 |
|
RU2426733C2 |
Изобретение относится к области медицины и фармацевтики, а именно к лечению первичного нефротического синдрома. Раскрывается применение соединения формулы (II), включая его стереоизомерные формы, или его фармацевтически приемлемой соли для лечения первичного нефротического синдрома, а также для изготовления лекарственного средства для лечения первичного нефротического синдрома. Использование соединения позволяет эффективно лечить первичный нефротический синдром. 2 н. и 17 з.п. ф-лы, 3 ил., 2 пр.
1. Применение соединения формулы (II)
 формула (II),
формула (II),
включая его стереоизомерные формы,
или его фармацевтически приемлемой соли,
для лечения первичного нефротического синдрома.
2. Применение соединения формулы (II)
 формула (II),
формула (II),
включая его стереоизомерные формы,
или его фармацевтически приемлемой соли,
для изготовления лекарственного средства для лечения первичного нефротического синдрома.
3. Применение по любому из пп. 1, 2, отличающееся тем, что указанное соединение является функционально-селективным агонистом рецепторов MC1R и MC3R, который не стимулирует меланогенез через воздействие на MC1R.
4. Применение по любому из пп. 1, 2, отличающееся тем, что указанный первичный нефротический синдром представляет собой мембранозный гломерулонефрит (МГН) (или мембранозную нефропатию (MN)).
5. Применение по любому из пп. 1, 2, отличающееся тем, что указанный первичный нефротический синдром представляет собой фокально-сегментарный гломерулосклероз (ФСГС).
6. Применение по любому из пп. 1, 2, отличающееся тем, что указанный первичный нефротический синдром представляет собой мембранозно-пролиферативный гломерулонефрит (МПГН) (мезангиокапиллярный гломерулонефрит).
7. Применение по п. 6, отличающееся тем, что указанный мембранозно-пролиферативный гломерулонефрит (МПГН) выбран из МПГН типа 1 и МПГН типа 2.
8. Применение по любому из пп. 1, 2, отличающееся тем, что указанный первичный нефротический синдром представляет собой быстропрогрессирующий гломерулонефрит (БПГН) (серповидный ГН).
9. Применение по любому из пп. 1, 2, отличающееся тем, что указанный первичный нефротический синдром представляет собой болезнь минимальных изменений (БМИ).
10. Применение по любому из пп. 1, 2, отличающееся тем, что указанное соединение выбрано из группы, состоящей из {3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидина и (E)-N-транс-{3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидина, или фармацевтически приемлемой соли данных соединений.
11. Применение по любому из пп. 1, 2, отличающееся тем, что указанная фармацевтически приемлемая соль представляет собой фармацевтически приемлемую соль неорганической кислоты или органической кислоты.
12. Применение по п. 11, отличающееся тем, что указанная органическая кислота выбрана из группы, состоящей из муравьиной кислоты, уксусной кислоты, трихлоруксусной кислоты, трифторуксусной кислоты, пропионовой кислоты, бензойной кислоты, коричной кислоты, лимонной кислоты, фумаровой кислоты, гликолевой кислоты, молочной кислоты, малеиновой кислоты, яблочной кислоты, малоновой кислоты, миндальной кислоты, щавелевой кислоты, пикриновой кислоты, пировиноградной кислоты, салициловой кислоты, янтарной кислоты, метансульфоновой кислоты, этансульфоновой кислоты, винной кислоты, аскорбиновой кислоты, памовой кислоты, бисметиленсалициловой кислоты, этандисульфоновой кислоты, глюконовой кислоты, цитраконовой кислоты, аспарагиновой кислоты, стеариновой кислоты, пальмитиновой кислоты, ЭДТА, гликолевой кислоты, пара-аминобензойной кислоты, глутаминовой кислоты, бензолсульфоновой кислоты и пара-толуолсульфоновой кислоты.
13. Применение по п. 12, отличающееся тем, что указанная органическая кислота представляет собой уксусную кислоту, янтарную кислоту, винную кислоту или пропионовую кислоту.
14. Применение по п. 11, отличающееся тем, что указанная неорганическая кислота выбрана из группы, состоящей из соляной кислоты, бромистоводородной кислоты, йодистоводородной кислоты, фосфорной кислоты, серной кислоты и азотной кислоты.
15. Применение по п. 13, отличающееся тем, что указанная органическая кислота представляет собой уксусную кислоту.
16. Применение по любому из пп. 1, 2, отличающееся тем, что указанное соединение выбрано из группы, состоящей из {3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}- аминогуанидиния ацетата и (E)-N-транс-{3-[1-(2-нитрофенил)-1H-пиррол-2-ил]-аллилиден}-аминогуанидиния ацетата.
17. Применение по любому из пп. 1, 2, отличающееся тем, что указанное соединение:
i) является агонистом одного или более MC рецепторов,
ii) является агонистом рецепторов MC1R и MC3R,
iii) является агонистом рецептора MC1R,
iv) является агонистом рецептора MC1R и/или MC3R, но не является агонистом рецепторов MC2R и MC4R,
v) является функционально-селективным агонистом рецепторов MC1R и MC3R,
vi) является функционально-селективным агонистом рецепторов MC1R и MC3R, который в основном индуцирует ERK1/2-фосфорилирование и незначительно индуцирует генерацию цАМФ,
vii) является функционально-селективным агонистом рецепторов MC1R и MC3R, который не стимулирует меланогенез через воздействие на MC1R,
viii) является агонистом рецептора MC1R и/или MC3R, не оказывающим действия на энергетический гомеостаз, например на потребление пищи,
ix) не уменьшает потребление пищи, например не уменьшает потребление пищи путем воздействия на MC3R и/или MC4R, и/или
x) не индуцирует меланогенез.
18. Применение по любому из пп. 1, 2, отличающееся тем, что указанное соединение вводят в количестве от 1 мг до 1000 мг в сутки, например от 1 до 5 мг, от 5 до 10 мг, от 10 до 15 мг, от 15 до 20 мг, от 20 до 30 мг, от 30 до 60 мг, от 60 до 80 мг, от 80 до 100 мг, от 100 до 130 мг, от 130 до 160 мг, от 160 до 200 мг, от 200 до 240 мг, от 240 до 280 мг, от 280 до 320 мг, от 320 до 360 мг, от 360 до 400 мг, от 400 до 440 мг, от 440 до 500 мг, от 500 до 560 мг, от 560 до 620 мг, от 620 до 680 мг, от 680 до 740 мг, от 740 до 800 мг, от 800 до 860 мг, от 860 до 920 мг, от 920 до 980 мг, от 980 до 1000 мг, например от 500 до 1000 мг в сутки.
19. Применение по любому из пп. 1, 2, отличающееся тем, что указанное соединение представлено в фармацевтической композиции, которая является фармацевтически безопасной.
| WO 2007141343 A1, 13.12.2007 | |||
| ANNIKA LINDSKOG JONSSON et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| JOHANNES ELVIN et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| American Journal Of Physiology: Renal Physiology, Vol | |||
Авторы
Даты
2023-10-11—Публикация
2019-06-24—Подача