Изобретение относится к области биотехнологии. Предложен способ продукции рекомбинантного химозина за счет использования рекомбинантной плазмиды GS115/pPICZa-Chym. Предложен способ активации, получения и очистки рекомбинантного химозина Bos taurus из штамм-продуцента Pichia pastoris. Изобретение позволяет получить рекомбинантный химозин Bos taurus с высокой концентрацией и степенью очистки более 90%.
Изобретение относится к области индустриальной биотехнологии и может быть использовано в пищевой промышленности для получения препарата химозина, используемого для приготовления сыра.
Химозин (КФ 3.4.23.4) является аспартатной эндопептидазой, обладающей специфической протеолитической активностью в отношении пептидной связи Phe105-Met106 [1]. Результатом протеолитической активности химозина является формирование молочного сгустка, что имеет чрезвычайное значение для сыроделия и пищевой промышленности. Штаммы-продуценты на основе Aspergillus niger [2] и Kluyveromyces lactis [3] активно используются в современной промышленности для продукции рекомбинантного химозина. Создание эффективных штамм-продуцентов ферментов на основе Pichia pastoris является важной прикладной задачей промышленной биотехнологии [4, 5].
Цель работы - получение высокоэффективного штамма-продуцента химозина в P. pastoris и разработка методов выделения и очистки для использования в промышленной биотехнологии.
Ранее были предприняты шаги в разработке штамм-продуцентов рекомбинантного химозина на основе P. pastoris. Была оптимизирована нуклеотидная последовательность для экспрессии в P. pastoris [6], получены клоны штамм-продуцентов [7], разработаны методы культивирования при использовании технического глицерина [8]. Однако достигнутые уровни продуктивности штамм-продуцентов не соответствуют достигнутым уровням в промышленных штаммах-продуцентах A. niger и K. lactis.
Существующие методы позволяют оптимизировать штаммы-продуценты P. pastoris с нескольких сторон:
- оптимизация метаболомики с увеличением выхода промежуточных интермедиатов и конечных метаболитов;
- улучшение механизма геномных интеграций, позволяющее увеличить эффективность встраивания экспрессионных кассет;
- оптимизация мультикопийных инсерций методами генетической инженерии; геномное редактирование методами CRISPR/Cas9;
- коэкспрессия генов для улучшения внутриклеточного транспорта и секреции;
- коэкспрессия шаперонов для улучшения белкового фолдинга [9].
Существуют технологические подходы, позволяющие увеличить уровень экспрессии рекомбинантных белков за счет коэкспрессии с ранее изученными транскрипционными факторами. Так, транскрипционный фактор Fhl1p является недавно открытым положительным регулятором процессинга рРНК и экспрессии генов рибосомных белков у дрожжей. Показано, что оверэкспрессия гена Fhl1p в рекомбинантных штаммах Pichia pastoris- продуцирующих фитазу и пектиназу на 20-35% повышает выработку целевых ферментов. В основе этого эффекта лежит стимулирующее действие Fhl1p на трансляцию мРНК, секрецию белков и некоторые процессы центрального углеродного и энергетического метаболизма - гликолиз, цикл трикарбоновых кислот.
Оверэкспрессия целевых белков в клетках дрожжей зачастую приводит к накоплению неправильно свернутых и дефектных белков в цитоплазме и эндоплазматическом ретикулуме. В результате процессы деления клеток, биосинтеза и экспорта белков замедляются, активируются различные стрессовые ответы, в том числе, протеасом-зависимая деградация неправильно-свернутых белков и так называемый ответ клетки на неправильно-свернутые белки (unfolded protein response - UPR). UPR вызывает арест трансляции, деградацию дефектных белков, накопление шаперонов. Индуктором UPR генов является фактор транскриции HAC1. Показано, что сверхэкспрессия гена HAC1 стимулирует процессы экспорта и созревания целевых белков в рекомбинантных штаммах дрожжей и грибов.
Предложен альтернативный метод экспрессии рекомбинантного прохимозина за счет генетической конструкции GS115/pPICZa-Chym, обеспечивающей биосинтез и секрецию прохимозина в сочетании с коэкспрессией транскрипционного фактора HAC1 за счет генетической конструкции GS115/pPIC9-HAC1, позволяющей получать экспрессию рекомбинантного прохимозина с высоким уровнем продукции.
Целью изобретения является создание генетических конструкций GS115/pPICZa-Chym, GS115/pPIC9-HAC1 и их совместное использование при трансформации в метилотрофные дрожжи P. pastoris c целью получения эффективного штамм-продуцента рекомбинантного прохимозина.
Пример 1. Способ микробиологического синтеза прохимозина. Посевной материал, представляющий собой клетки рекомбинантного штамма-продуцента GS115/pPICzA-Chym1, подготавливают путем инкубации в течение 15-24 часов при температуре 29°С на среде YPD при постоянной аэрации на термостатируемой качалке (250 об/мин). Затем выросшую культуру переносят в соотношении 1:200 (по объему) в среду BMMY (мас.%: пептон - 2, дрожжевой экстракт - 1, метанол - 0,5, фосфатный буфер рН=6.6 - до 100 mM, вода - остальное) до ОД600=1.
Процесс биосинтеза ведут в колбах Эрленмейера, содержащих 20 мл среды BMMY, в течение 96 часов в ротационном шейкере-термостате (200-250 об/мин), при температуре 28°C. Каждые 24 часа проводят индукцию метанолом, путем асептического добавления 50% раствора метанола в пробирки, до конечной концентрации 0,5%. По истечении 96 часов биомассу отделяют центрифугированием. Наличие рекомбинантного прохимозина в культуральной среде определяют при энзиматического теста после активации прохимозина в составе супернатанта путем кислотной обработки. Уровень продукции прохимозина выражают в международных казеиновых единицах (IMCU/мл, МКЕ/мл). Уровень синтеза прохимозина заявляемым способом составляет не менее 20 МКЕ/мл культуральной жидкости.
Пример 2. Дизайн синтетического гена сплайсированного варианта HAC1.
При помощи праймеров pPiGAPR (5’-TGTTTCGAATTGATAGTTGTTCAATTGATTGAAATAGGG-3') и pPiGAPSac (5’-GGTGAGCTCAGATCTCTGCTACTCTGGTCCCAAGTGAA-3’) был амплифицирован нативный ген GAP-промотора. ПЦР проводилась при условиях: начальная денатурация - 30 с/98°С, 30 циклов [10 c/98°С, 30 с/68°С, 30 с/72°С], финальный цикл - 5 минут/72°С.
Для получения нативного гена HAC1 были амплифицированы экзон 1 при помощи праймеров F-HAC1 (5’-TGAACAACTATCAATTCGAAACACAGATCGCAGAAAATGCCCG-3’) и HAC1-SPL2 (5’-GTAAATGGTGCTGCTGGATGATGCAACCGATTCGAC-3’) и экзон 2 при помощи праймеров HAC1-SPL1 (5’-TTGCATCATCCAGCAGCACCATTTACCGCTAATGCA-3’) R-HAC_Age (5’-GTACCGGTACCCAAAAAGAATGAAAACGACCC-3’) при условиях начальная денатурация - 30 с/98°С, 30 циклов [10 c/98°С, 60 с/72°С], финальный цикл - 5 минут/72°С.
Объединение GAP-промотора и экзонов проводилось при помощи ПЦР без праймеров (начальная денатурация - 30 с/98°С, 10 циклов [10 c/98°С, 30 с/62°С, 30 с/72°С], финальный цикл - 5 минут/72°С для слияния трех фрагментов, с последующей ПЦР при использовании полученного фрагмента и праймеров pPiGAPSac (5’-GGTGAGCTCAGATCTCTGCTACTCTGGTCCCAAGTGAA-3’) и R-HAC_Age (5’-GTACCGGTACCCAAAAAGAATGAAAACGACCC-3’) при условиях… 30 с/98°С, 30 циклов [10 c/98°С, 60 с/72°С], финальный цикл - 5 минут/72°С. Конечным продуктом стал сплайсированный ген HAC1, обладающий функциональной активностью, с GAP-промотором. Сплайсированый ген HAC1 был вставлен в вектор pPIC9-HAC1 по сайтам рестрикции SacI/AgeI.
Пример 3. Конструирование плазмиды GS115/ pPIC9-HAC1 для экспрессии фактора HAC1 в P. pastoris под контролем GAP-промотора.
Вектор pPIC9 с встроенным сплайсированным вариантом гена HAC1 был предварительно линеаризован по сайту рестрикции Nco I. Для создания экспрессионного штамма использовали клетки штамма GS115, ранее трансфецированные вектором GS115/pPICzA-Chym1.
Приготовление электрокомпетентных клеток осуществляли согласно протоколу трансформации. После электропорации клетки инкубировали 1 ч при 30°С в 1.0 мл 1 М сорбитола и высевали на чашки с агаризованной средой MD, содержащей: глюкозу - 2 %, YNB без гистидина 1,34%, 1,5% агар и зеоцин 200 мкг/мл.
Пример 4. Сравнение уровня экспрессии прохимозина при экспрессии прохимозина в присутствии и в отсутствии коэкспрессии фактора HAC1.
Посевной материал, представляющий собой клетки рекомбинантного штамма-продуцента, подготавливают путем инкубации в течение 15-24 часов при температуре 29°С на среде YPD при постоянной аэрации на термостатируемой качалке (250 об/мин). Затем выросшую культуру переносят в соотношении 1:200 (по объему) в среду BMMY (мас.%: пептон - 2, дрожжевой экстракт - 1, метанол - 0,5, фосфатный буфер рН=6.6 - до 100 mM, вода - остальное) до ОД600=1.
Процесс биосинтеза ведут в колбах Эрленмейера, содержащих 20 мл среды BMMY, в течение 96 часов в ротационном шейкере-термостате (200-250 об/мин), при температуре 28°C. Каждые 24 часа проводят индукцию метанолом, путем асептического добавления 50% раствора метанола в пробирки, до конечной концентрации 0,5%. По истечении 96 часов биомассу отделяют центрифугированием. Наличие рекомбинантного прохимозина в культуральной среде определяют при энзиматического теста после активации прохимозина в составе супернатанта путем кислотной обработки. Уровень продукции прохимозина выражают в международных казеиновых единицах (IMCU/мл, МКЕ/мл). Уровень синтеза прохимозина без коэкспрессии вектора GS115/pPIC9-HAC1 составил 18 IMCU/мл, в то время как штамм-продуцент, несущий вектора GS115/pPICzA-Chym1 и GS115/pPIC9-HAC1, обладал активностью 25 IMCU/мл, что на 40% выше чем в контрольном штамме без коэкспрессии фактора HAC1.
Источники информации
1. Беленькая С.В., Балабова Д.В., Белов А.Н., Коваль А.Д., Щербаков Д.Н., Ельчанинов В.В. // Прикл. биохимия и микробиология. 2020. Т. 56. № 4. С. 315-326.
2. Bodie E.A., Armstrong G.L., Dunn-Coleman N.S. // Enzyme Microb. Technol. 1994. V. 16. № 5. P. 376-382.
3. Van den Berg J.A., van der Laken K.J., van Ooyen A.J., Renniers T.C., Rietveld K., Schaap A., Brake A.J., Bishop R.J., Schultz K., Moyer. D. // Nat. Biotechnol. 1990. V. 8. № 2. P. 135-139.
4. Noseda D.G., Recúpero M.N., Blasco M., Ortiz G.E., Galvagno M.A. // Protein Expr. Purif. 2013. V. 92. № 2. P. 235-244.
5. Noseda D.G., Blasco M., Recúpero M., Galvagno M.Á. // Protein Expr. Purif. 2014. V. 104. P. 85-91.
6. Noseda D.G., Recúpero M., Blasco M., Bozzo J., Galvagno. M.Á. // Protein Expr. Purif. 2016. V. 123. P. 112-121.
7. Peña D.A., Gasser B., Zanghellini J., Steiger M.G., Mattanovich D. // Metab. Eng. 2018. V. 50. P. 2-15.
8. Higgins D.R., Busser K., Comiskey J., Whittier P.S., Purcell T.J., Hoeffler J.P. // Methods Mol. Biol. 1998. V.103. P. 41-53.
9. Dunn-Coleman N.S., Bloebaum P., Berka R.M., Bodie E., Robinson N., Armstrong G., Ward M., Przetak M., Carter G.L., LaCost R. // Nat. Biotechnol. 1991. V. 9. № 10. P. 976-981.
--->
<120> Рекомбинантная ДНК, кодирующая вариант предшественника химозина быка Chym1, рекомбинантная плазмида pPICzA-Chym1, обеспечивающая синтез Chym1 в клетках Pichia pastoris и штамм Pichia pastoris GS115 /p PICzA-Chym1 - продуцент рекомбинантного химозина Chym1
<130> 001
<210> 1
<211> 1098
<212> DNA
<213> Artificial Sequence
<220>
<221> CDS
<222> (1213)..(2311)
<223> Синтетический ген прохимозина быка
<400>GCTGAAATTACTAGAATCCCATTGTATAAGGGTAAATCTTTGAGAAAGGCTTTGAAAGAACATGGTTTGTTGGAGGATTTCTTGCAAAAGCAACAATACGGTATCTCTTCTAAGTACTCTGGTTTCGGTGAAGTTGCTTCTGTTCCATTGACTAACTACTTGGATTCTCAATACTTCGGTAAAATCTACTTGGGTACTCCACCTCAAGAGTTTACTGTTTTGTTCGATACTGGTTCTTCTGATTTCTGGGTTCCTTCTATCTACTGTAAGTCTAACGCTTGTAAGAACCATCAAAGATTCGATCCAAGAAAGTCTTCTACTTTCCAAAACTTGGGTAAACCTTTGTCTATTCACTATGGTACTGGTTCTATGCAAGGTATTTTGGGTTACGATACTGTTACTGTTTCTAACATCGTTGATATTCAACAAACTGTTGGTTTGTCTACTCAAGAACCTGGAGATGTTTTTACTTACGCTGAGTTCGATGGTATTTTGGGTATGGCTTATCCATCTTTGGCTTCTGAATACTCTATCCCTGTTTTCGATAACATGATGAACAGACATTTGGTTGCTCAAGATTTGTTCTCTGTTTACATGGATAGAAACGGTCAAGAGTCTATGTTGACTTTGGGTGCTATTGATCCATCTTACTATACTGGTTCTTTGCACTGGGTTCCTGTTACTGTTCAACAATACTGGCAATTCACTGTTGATTCTGTTACTATTTCTGGTGTTGTTGTTGCTTGTGAGGGTGGTTGTCAAGCTATTTTGGATACTGGTACTTCTAAGTTGGTTGGTCCATCTTCTGATATCTTGAACATCCAACAAGCTATTGGTGCTACTCAAAACCAATACGGTGAATTTGATATCGATTGTGATAACTTGTCTTACATGCCTACTGTTGTTTTCGAGATTAATGGTAAAATGTACCCATTGACTCCTTCTGCTTACACTTCTCAAGATCAAGGTTTTTGTACTTCTGGTTTCCAATCTGAAAATCACTCTCAAAAGTGGATTTTGGGAGATGTTTTTATTAGAGAGTACTACTCTGTTTTCGATAGAGCTAACAATTTGGTTGGTTTGGCTAAAGCTATTTAA
<130> 002
<210> 2
<211> 918
<212> DNA
<213> Artificial Sequence
<220>
<221> CDS
<222> (1021)..(1939)
<223> транскрипционный фактор НАС1
<400>GAAAATGCCCGTAGATTCTTCTCATAAGACAGCTAGCCCACTTCCACCTCGTAAAAGAGCAAAGACGGAAGAAGAAAAGGAGCAGCGTCGAGTGGAACGTATCCTACGTAATAGGAGAGCGGCCCATGCTTCCAGAGAGAAGAAACGAAGACACGTTGAATTTCTGGAAAACCACGTCGTCGACCTGGAATCTGCACTTCAAGAATCAGCCAAAGCCACTAACAAGTTGAAAGAAATACAAGATATCATTGTTTCAAGGTTGGAAGCCTTAGGTGGTACCGTCTCAGATTTGGATTTAACAGTTCCGGAAGTCGATTTTCCCAAATCTTCTGATTTGGAACCCATGTCTGATCTCTCAACTTCTTCGAAATCGGAGAAAGCATCTACATCCACTCGCAGATCTTTGACTGAGGATCTGGACGAAGATGACGTCGCTGAATATGACGACGAAGAAGAGGACGAAGAGTTACCCAGGAAAATGAAAGTCTTAAACGACAAAAACAAGAGCACATCTATCAAGCAGGAGAAGTTGAATGAACTTCCATCTCCTTTGTCATCCGATTTTTCAGACGTAGATGAAGAAAAGTCAACTCTCACACATTTAAAGTTGCAACAGCAACAACAACAACCAGTAGACAATTATGTTTCTACTCCTTTGAGTCTTCCGGAGGATTCAGTTGATTTTATTAACCCAGGTAACTTAAAAATAGAGTCCGATGAGAACTTCTTGTTGAGTTCAAATACTTTACAAATAAAACACGAAAATGACACCGACTACATTACTACAGCTCCATCAGGTTCCATCAATGATTTTTTTAATTCTTATGACATTAGCGAGTCGAATCGGTTGCATCATCCAGCAGCACCATTTACCGCTAATGCATTTGATTTAAATGACTTTGTATTCTTCCAGGAATA
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ автокаталитической активации прохимозина быка при культивировании Pichia pastoris в ферментере | 2021 |
|
RU2808458C2 |
| Способ микробиологического синтеза прохимозина быка с использованием рекомбинантного штамма Pichia pastoris, содержащего синтетический ген варианта препрохимозина с модифицированной сигнальной последовательностью секреции | 2020 |
|
RU2779307C2 |
| Трансформант Komagataella phaffii - продуцент рекомбинантного химозина в активной форме | 2022 |
|
RU2805486C1 |
| Трансформант Ogataea haglerorum - продуцент рекомбинантного химозина в активной форме | 2022 |
|
RU2815882C1 |
| Трансформант Komagataella phaffii, содержащий ген HAC1, продуцент рекомбинантного химозина Vicugna pacos в активной форме | 2023 |
|
RU2828277C1 |
| ИНТЕГРАЦИОННЫЙ ВЕКТОР ДЛЯ МНОГОКОПИЙНОЙ ИНТЕГРАЦИИ ГЕНОВ В 18SpPHK ДРОЖЖЕЙ Pichia pastoris | 2020 |
|
RU2752904C1 |
| Получение гена фосфолипазы А2 с измененным оптимумом рН путем удаления сайтов гликозилирования | 2019 |
|
RU2766448C2 |
| Рекомбинантная плазмида для экспрессии в дрожжах Pichia pastoris гена химерного белка ангиогенина человека и штамм дрожжей Pichia pastoris - продуцент рекомбинантного химерного белка ангиогенина человека | 2017 |
|
RU2658758C1 |
| СПОСОБ ПОЛУЧЕНИЯ ВЫСОКОПРОДУКТИВНЫХ ДРОЖЖЕВЫХ ШТАММОВ | 2020 |
|
RU2770894C1 |
| Рекомбинантная плазмида pET32-Trex Vic, обеспечивающая синтез химерного белка прохимозина Vicugna pacos, и штамм Escherichia coli BL21(DE3)pLysE pET32-Trx Vic-продуцент химерного белка прохимозина Vicugna pacos | 2019 |
|
RU2729403C1 |

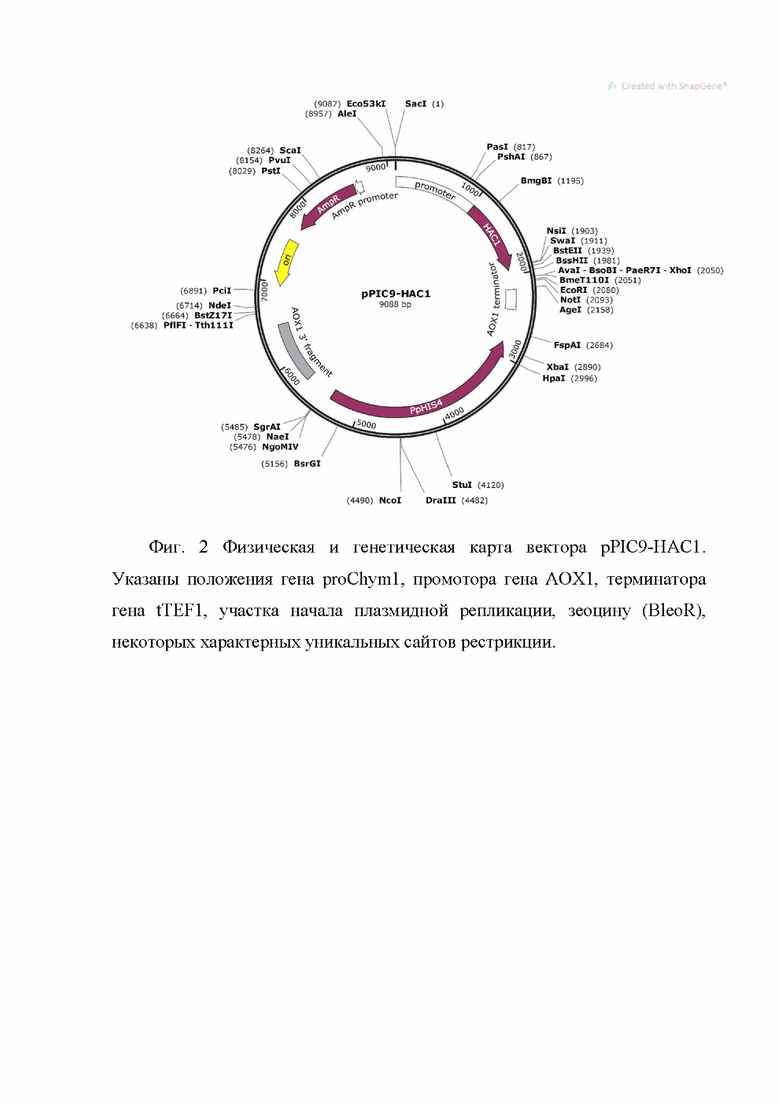
Изобретение относится к биотехнологии. Предложен способ продукции рекомбинантного химозина, предусматривающий совместную трансформацию рекомбинантной плазмиды GS115/pPICZα-Chym и рекомбинантной плазмиды GS115/pPIC9-HAC1 в штамм P. pastoris, выращивание полученного штамма и определение наличия рекомбинантного химозина в культуральной среде. При этом рекомбинантная плазмида GS115/pPICZα-Chym обеспечивает биосинтез и секрецию химозина с последовательностью SEQ ID NO: 1, имеет размер 4648 п.о. и представлена на фиг. 1. Рекомбинантная плазмида GS115/pPIC9-HAC1 обеспечивает биосинтез фактора HAC1 с последовательностью SEQ ID NO: 2, позволяющего увеличить уровень экспрессии химозина, имеет размер 9088 п.о. и представлена на фиг.2. Изобретение обеспечивает увеличение уровня продукции химозина. 2 ил., 4 пр.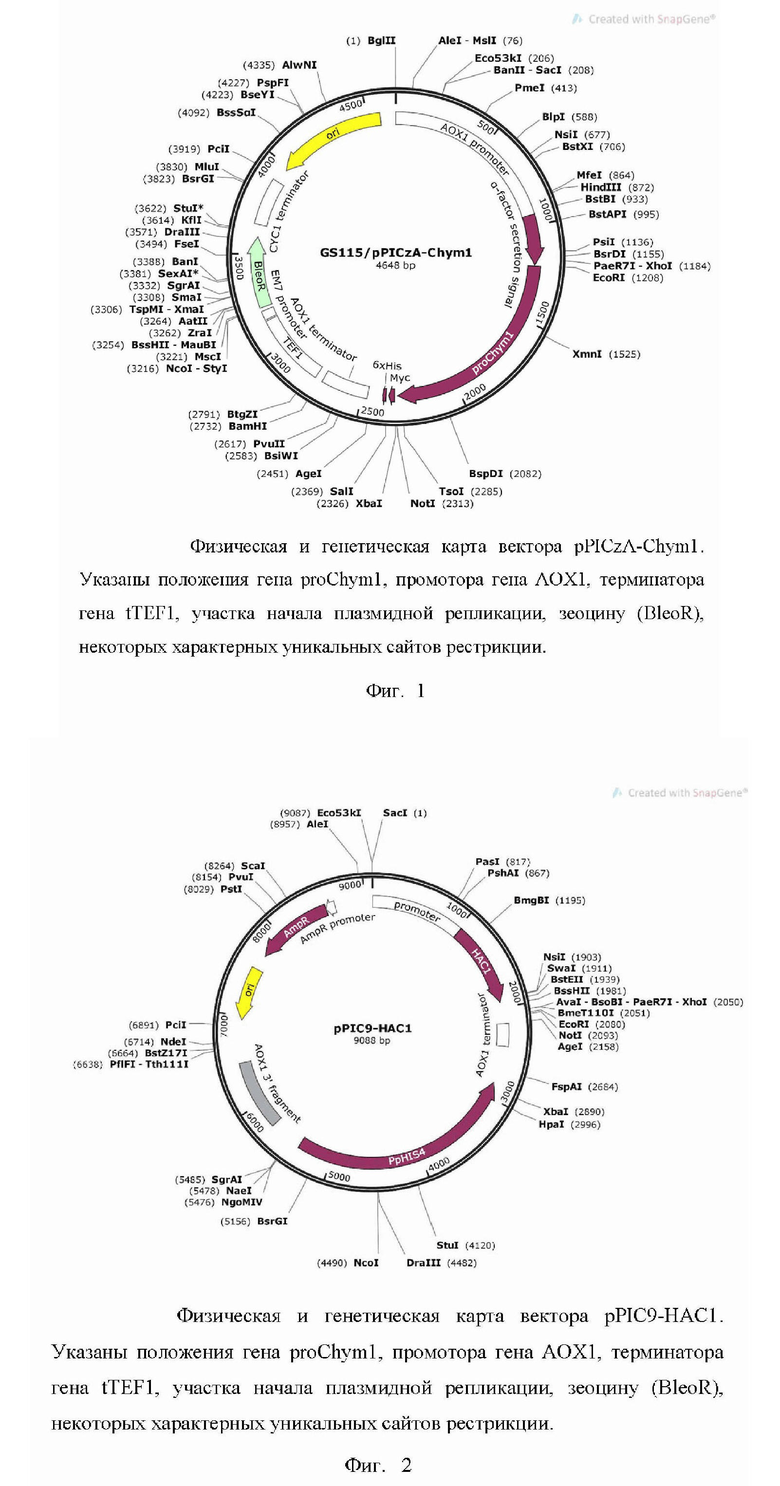
Способ продукции рекомбинантного химозина, предусматривающий совместную трансформацию рекомбинантной плазмиды GS115/pPICZα-Chym, обеспечивающей биосинтез и секрецию химозина с последовательностью SEQ ID NO: 1, имеющей размер 4648 п.о., представленной на фиг. 1 и состоящей из следующих элементов:
а) AOX1 promoter - 5'-концевая область промотора алкоголь оксидазы;
б) Alpha factor signal peptide - участок, кодирующий N-концевой сигнальный пептид S. cerevisiae;
в) последовательность гена прохимозина, оптимизированная для экспрессии в Pichia pastoris;
г) AOX1 transcription terminator - терминатор транскрипции;
д) TEF1 promoter - эукариотический промотор;
e) Bleo(R) - ген устойчивости BleoR к селективному антибиотику зеоцину;
ж) CYC1 - transcription terminator - терминатор транскрипции гена цитохрома С1;
з) pUC origin - бактериальная точка начала репликации pUC;
и рекомбинантной плазмиды GS115/pPIC9-HAC1, обеспечивающей биосинтез фактора HAC1 с последовательностью SEQ ID NO: 2, позволяющего увеличить уровень экспрессии химозина, имеющая размер 9088 п.о., представленной на фиг.2 и состоящей из следующих элементов:
а) GAP promoter - 5'- промотора гена GAP;
б) HAC1 - участок, кодирующий сплайсированный вариант гена HAC1;
в) AOX1 transcription terminator - терминатор транскрипции;
г) pHIS4 – ген мультифункционального фермента, необходимого для биосинтеза гистидина;
д) AOX1 3' fragment – участок локуса гена алкогольоксидазы;
e) pUC origin - бактериальная точка начала репликации pUC;
ж) Amp(R) - ген Amp, обеспечивающий устойчивость к ампициллину;
з) Amp(R) promoter – промотер гена Amp, обеспечивающий устойчивость к ампициллину;
в штамм P. pastoris, выращивание полученного штамма и определение наличия рекомбинатного химозина в культуральной среде.
| NOSEDA D.G | |||
| ET AL | |||
| Cloning, expression and optimized production in a bioreactor of bovine chymosin B in Pichia (Komagataella) pastoris under AOX1 promoter | |||
| Protein Expr Purif | |||
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| ESPINOZA-MOLINA J.A | |||
| ET AL | |||
| Codon Optimization of the "Bos Taurus Chymosin" Gene for the Production of Recombinant | |||
Авторы
Даты
2022-03-29—Публикация
2020-10-29—Подача