Область техники
Изобретение относится к микробиологии и биотехнологии и касается получения ауксотрофного штамма-реципиента метилотрофных дрожжей Komagataella phaffii, пригодного для конструирования на его основе безмаркерных штаммов-продуцентов, способных синтезировать гетерологичные белки.
Уровень техники
В настоящее время метилотрофные дрожжи Komagataella phaffii (Pichia pastoris) широко используются в качестве экспрессионной системы для получения гетерологичных белков. Активное использование дрожжей K. phaffii в современных биотехнологических производствах связано с их преимуществами по сравнению с другими прокариотическими и эукариотическими системами экспрессии, к которым относятся: высокая скорость роста при ферментации с высокой плотностью клеток (что позволяет получить более высокий уровень продукции целевого белка), эффективная секреция белка, простота питательных сред и условий культивирования, возможность применения различных генетических манипуляций, способность осуществлять посттрансляционные модификации гетерологичных белков [Appl Microbiol Biotechnol, 2014, 98, 5301-5317].
Конструирование дрожжевых безмаркерных штаммов-продуцентов гетерологичных белков является необходимым условием их дальнейшего использования в современном биотехнологическом производстве. Для получения штаммов-продуцентов гетерологичных белков в настоящее время применяется стратегия мультикопийной интеграции экспрессионных кассет в геном K. phaffii. Для интеграции нескольких копий целевого гена применяют отбор трансформантов на средах, содержащих высокие концентрации антибиотиков.
Необходимость создания безмаркерных штаммов-продуцентов обусловлена определенными запретами на использование маркеров антибиотикорезистентности в крупных микробиологических производствах по соображениям их возможного нежелательного распространения среди микроорганизмов окружающей среды. Кроме того, обычно, продуценты конструируются с помощью последовательных хромосомных модификаций, при которых требуется проведение многократных интеграций генетического материала в хромосому, что вызывает ряд проблем, связанных с ограниченным набором селективных маркеров и законодательным ограничением на их применение. Поэтому конструирование штаммов-реципиентов, на основе которых возможно создавать безмаркерные штаммы-продуценты гетерологичных белков, является актуальным и практически значимым.
Активно используемыми в биотехнологии, а также применяющимися в качестве моделей для изучения метилотрофных дрожжей рода Komagataella, являются штаммы K. phaffii GS115 (his4) (Invitrogen, США), K. phaffii Х-33 (Invitrogen, США), K. phaffii KM71 (Invitrogen, США) и др.
В качестве ближайшего аналога заявляемого изобретения рассмотрим наиболее часто использующийся в научных исследованиях штамм метилотрофных дрожжей K. phaffii GS115 (his4) ВКПМ Y-2837. Данный штамм обладает фенотипом His-, что позволяет отбирать трансформанты на минимальной среде без добавления гистидина [Appl. Biochem Biotechnol, 2007, 142, 105-124]. Он широко используется в качестве экспрессионной системы в биотехнологии. Однако его использование для получения промышленно-ценных продуцентов гетерологичных белков ограничивается невысокой продуктивностью [Биотехнология, 2021, 37(4), 5-13] и коммерческим статусом, установленным компанией Invitrogen (США) [https://www.thermofisher.com/ru/ru/home/brands/invitrogen.html].
Технической проблемой, на решение которой направлено заявляемое изобретение является получение высокопродуктивных безмаркерных штаммов-продуцентов гетерологичных белков, таких как белки, обладающие ферментативной активностью, флуоресцентные белки, белки-гормоны и др.
Раскрытие сущности изобретения
Техническим результатом является получение штамма-реципиента, который даст возможность получать высокопродуктивные безмаркерные штаммы-продуценты гетерологичных белков.
Он достигается путем получения ауксотрофного по гистидину штамма дрожжей Komagataella phaffii TGBF7 ВКПМ Y-5013 - реципиента для конструирования безмаркерных штаммов-продуцентов гетерологичных белков.
Осуществление изобретения
Получение заявляемого штамма осуществляется путем инактивации в штамме дикого типа Komagataella phaffii ВКПМ Y-4287 [Биотехнология, 2021, 37(4), 5-13] нативного гена HIS4, кодирующего фермент гистидинолдегидрогеназу, который участвует в биосинтезе гистидина. Инактивация может быть осуществлена с использованием любой из известных генно-инженерных методик.
Штамм-реципиент депонирован в Биоресурсном Центре Всероссийская Коллекция Промышленных Микроорганизмов (БРЦ ВКПМ) НИЦ «Курчатовский институт» (117545 Москва, 1-ый Дорожный пр-д, д. 1) как Komagataella phaffii TGBF7 ВКПМ Y-5013.
Культурально-морфологические характеристики заявляемого штамма
При культивировании при температуре 28°С в течение 48 часов на агаризованной среде YP следующего состава (мас.%: пептон - 2, дрожжевой экстракт - 1, агар - 2, вода - остальное) с добавлением глюкозы (2 мас.%), клетки имеют овальную форму, 3-4 мкм в диаметре. Клетки почкуются, при этом почкование истинное, многостороннее. Истинного мицелия не образуют. Споруляция происходит при инкубации культуры на агаризованной среде следующего состава (мас.%): хлорид калия - 1.0, ацетат натрия - 0.5, глюкоза - 1.0, агар - 2.0, вода - остальное. Аски имеют тетраэдрическую форму, включают 4 аскоспоры.
На агаризованной среде YP с добавлением глюкозы (2 мас.%) колонии светло-бежевого цвета с ровным краем, матовой поверхностью, линзовидным профилем и пастообразной консистенцией. При росте в жидкой среде YP следующего состава (мас.%: пептон - 2, дрожжевой экстракт - 1, вода - остальное) с добавлением глюкозы (2 мас.%), при 28°С в течение 24 ч культивирования - жидкость мутная, осадок белый, коагуляции не наблюдается, пристеночных пленок не образует.
Физиолого-биохимические признаки
Штамм-реципиент способен к росту как в аэробных, так и в анаэробных условиях.
В качестве единственного источника углерода способен использовать метанол, этанол, глюкозу, глицерин, лактат, сукцинат, не способен ассимилировать мальтозу, сахарозу, ацетат, крахмал, лактозу.
Пример 1. Получение штамма K. phaffii TGBF7 ВКПМ Y-5013 с инактивированным геном HIS4
Заявленный штамм получают на основе штамма дикого типа K. phaffii ВКПМ Y-4287 путем инактивации гена HIS4, кодирующего гистидинолдегидрогеназу.
Инактивацию проводят с использованием системы геномного редактирования CRISPR-Cas9 [FEMS Yeast Research, 2017, 17(5)].
Методом Гиббсона [Nat Methods. 2009, 6(5), 343-345] конструируют плазмиду pGAP-sgRNA_his4-pTEF-Cas9-Km (фиг.1), содержащую следующие генетические элементы:
1. Последовательность НН - sgRNA_his4 - HDV, содержащая рибозим типа Hammerhead (НН) [Nature, 1994, 372(6501), 68-74] на 5'- конце, sgRNA_his4, которая нацелена на ген HIS4, и рибозим вируса гепатита дельта (HDV) [Nature, 1998, 395(6702), 567-574] на 3'- конце, под контролем дрожжевого GAP промотора.
2. Оптимизированную последовательность гена cas9, встроенную в единую рамку считывания с нуклеотидной последовательностью сигнала ядерной локализации большого Т-антигена SV40 [Cell Commun Signal, 2021, 19(60), 1-10], под контролем дрожжевого TEF промотора и CYC1 терминатора;
3. Дрожжевой селективный маркер kanR, под контролем дрожжевого TEF промотора, обуславливающий у дрожжей K. phaffii устойчивость к антибиотику генетицину (G418).
4. Последовательность CEN/ARS, обеспечивающая сохранение трансформируемой ДНК в клетках реципиентного штамма.
Полученную автономно реплицируемую плазмиду трансформируют в штамм K. phaffii ВКПМ Y-4287 методом электропорации.
Штамм K. phaffii ВКПМ Y-4287 предварительно выращивают в жидкой питательной среде YPD (мас.%: дрожжевой экстракт - 1, пептон - 2, глюкоза - 2, вода - остальное) до концентрации 1×108 клеток на 1 мл. Клетки центрифугируют, промывают в ледяной стерильной воде, а затем в ледяном растворе 1М сорбитола. Затем клетки инкубируют в 25 мМ растворе дитиотреитола в течение 15 минут и промывают в ледяном растворе 1М сорбитола. Обработанные таким образом клетки ресуспендируют в ледяном растворе 1 М сорбитола в концентрации 1-5×109 клеток на 1 мл. Аликвоту, объемом 40 мкл клеточной суспензии, переносят в охлажденный эппендорф, добавляют 400 нг ДНК экспрессионной интеграционной кассеты, и инкубируют во льду 5 минут. Смесь клеток и ДНК переносят в предварительно охлажденную кювету для электропорации. Электропорацию проводят при следующих условиях: 1,5 кВ, 400 Ом, 25uF. После электропорации добавляют 1 мл ледяного раствора 1М сорбитола.
Селекцию трансформантов ведут на агаризованной среде YP с добавлением глюкозы (2 мас.%) в течение 5 суток при температуре 30°С. В качестве селективного агента добавляют антибиотик G418 в количестве 600 мкг/мл.
Для инактивации гена HIS4 отобранные трансформанты пересевают 2 раза на среде YP с добавлением глюкозы (2 мас.%) и антибиотика G418 в количестве 600 мкг/мл.
Селекцию трансформантов с инактивированным геном HIS4 проводят по способности к росту на минимальной среде М9 с добавлением и без добавления в среду гистидина в количестве 50 мкг/мл. Состав среды М9 (мас.%): Na2HPO4 - 0,6; KH2PO4 - 0,3; NaCl - 0,05; NH4Cl - 0,1; MgSO4 7H2O - 0,065; агар - 2; глюкоза - 2; CaCl2 - 0,07; биотин, мг - 0,0002; кальций пантотенат - 0,04; фолиевая кислота - 0,0002; ниацин - 0,04; р-аминобензойная к-та - 0,02; пиридоксин гидрохлорид - 0,04; рибофлавин - 0,02; тиамин гидрохлорид - 0,04; борная кислота - 0,05; CuSO4 - 0,004; KJ - 0,01; FeCl3 - 0,02; натрий молибдат - 0,02; ZnSO4 - 0,04, вода - остальное. Отбирают трансформант, обладающий фенотипом His-, не способный расти на среде М9 без содержания гистидина.
Выщепление репликативной плазмиды pGAP-sgRNA_his4-pTEF-Cas9-Km из клеток трансформанта проводят путем его ферментации в течение 48 ч в жидкой питательной среде YP с добавлением 2% глюкозы. Далее клетки высевают на агаризованную питательную среду YP с добавлением глюкозы (2 мас.%). Инкубируют в течение 48 ч при 30°С. Полученные колонии реплицируют на чашку с агаризованной средой YP и 2% глюкозой без антибиотика G418 и аналогичную чашку с антибиотиком G418. Клон, потерявший плазмиду pGAP-sgRNA_his4-pTEF-Cas9-Km, отбирают по неспособности к росту на среде, содержащей антибиотик G418. Получают штамм с инактивированным геном HIS4.
Полученный штамм депонирован в Биоресурсном Центре Всероссийская Коллекция Промышленных Микроорганизмов (БРЦ ВКПМ) НИЦ «Курчатовский институт» (117545 Москва, 1-ый Дорожный пр-д, д. 1) как Komagataella phaffii TGBF7 ВКПМ Y-5013.
В приведенных примерах получения трансформантов на основе штамма K. phaffii TGBF7 ВКПМ Y-5013, в качестве репортерных гетерологичных белков были использованы ферменты, легко детектируемые в культуральной жидкости путем измерения их активности.
Пример 2. Получение трансформантов штамма дрожжей K. phaffii TGBF7 ВКПМ Y-5013, продуцирующих фитазу Citrobacter gillenii
Трансформанты штамма K. phaffii TGBF7 ВКПМ Y-5013, продуцирующие фитазу С. gillenii, получают трансформацией клеток этого штамма интегративной экспрессионной кассетой 1.
При конструировании интегративной экспрессионной кассеты 1 используют синтезированный ранее ген phyCg-op [FEMS Microbiology letters, 2021, 368, fnaa217], кодирующий фитазу С. gillenii [Genbank, № МТ157261].
Методом "фьюжн-пцр" [Gene., 1989, 15, 77(1), 61-68.] синтезируют кассету 1 (фиг. 2), в состав которой входят следующие генетические элементы:
1. Ген phyCg-op, кодирующий фитазу С. gillenii, встроенный в единую рамку считывания с нуклеотидной последовательностью сигнального пептида α-фактора, под контролем АОХ1 промотора;
2. Терминатор транскрипции ТТАОХ1;
3. Дрожжевой селективный маркер PpHIS4, комплементирующий у дрожжей K. phaffii мутацию в гене HIS4;
4. Область интеграции - 3' фрагмент нуклеотидной последовательности гена АОХ1.
Указанную интегративную экспрессионную кассету 1 трансформируют в штамм К. phaffii TGBF7 ВКПМ Y-5013, который предварительно выращивают в жидкой питательной среде YP (мас.%: дрожжевой экстракт - 1, пептон - 2, вода - остальное) с добавлением глюкозы (2 мас.%) до концентрации 1×108 клеток на 1 мл. Клетки центрифугируют, промывают в ледяной стерильной воде, а затем в ледяном растворе 1М сорбитола. Затем клетки инкубируют в 25 мМ растворе дитиотрейтола в течение 15 минут и промывают в ледяном растворе 1М сорбитола. Далее клетки ресуспендируют в ледяном растворе 1 М сорбитола в концентрации 1-5×109 клеток на 1 мл. Аликвоту, объемом 40 мкл клеточной суспензии, переносят в охлажденный эппендорф, добавляют 400 нг ДНК экспрессионной интеграционной кассеты, и инкубируют во льду 5 минут. Смесь клеток и ДНК переносят в предварительно охлажденную кювету для электропорации. Электропорацию проводят при следующих условиях: 1,5 кВ, 400 Ом, 25uF. После электропорации добавляют 1 мл ледяного раствора 1М сорбитола.
Селекцию трансформантов ведут в течение 5 суток при температуре 30°С на минимальной агаризованной среде без содержания гистидина следующего состава (мас.%): Na2HPO4 - 0,6; KH2PO4 - 0,3; NaCl - 0,05; NH4Cl - 0,1; MgSO4 7H2O - 0,065; агар - 2; глюкоза - 2; СаС12 - 0,07; биотин, мг - 0,0002; кальций пантотенат - 0,04; фолиевая кислота - 0,0002; ниацин - 0,04; р-аминобензойная к-та - 0,02; пиридоксин гидрохлорид - 0,04; рибофлавин - 0,02; тиамин гидрохлорид - 0,04; борная кислота - 0,05; CuSO4 - 0,004; KJ - 0,01; FeCl3 - 0,02; натрий молибдат - 0,02; ZnSO4 - 0,04, вода - остальное. Отбирают произвольно по 10 трансформантов.
Наличие целевого гена в составе хромосомной ДНК полученных трансформантов определяют методом ПЦР с использованием праймеров PhyCg-op-F и PhyCg-op-R
PhyCg-op-F 5'- gacgaacaatctggtatgcaatt -3',
PhyCg-op-R 5'- ttacttttcagcacattcgct -3'.
Режим реакции ПЦР: 95°С - 3 мин - 1 цикл; 30 циклов: 95°С - 30 с, 56°С - 30 с, 72°С - 80 с; 72°С - 5 мин. - 1 цикл.
Наличие ПЦР-фрагмента размером 1233 п.н. подтверждает присутствие целевого гена в составе хромосомы полученных трансформантов.
Для сравнения продуктивности получают трансформанты штаммов K. phaffii GS115 Y-2837 и K. phaffii Y-4287, продуцирующие фитазу С. gillenii.
Трансформанты штамма K. phaffii GS115 Y-2837, продуцирующие фитазу С. gillenii, получают аналогично трансформантам штамма K. phaffii TGBF7 ВКПМ Y-5013 путем интеграции экспрессионной кассеты 1 в хромосому штамма K. phaffii GS115 Y-2837.
Трансформанты штамма K. phaffii Y-4287, продуцирующие фитазу С. gillenii, получают трансформацией клеток штамма K. phaffii Y-4287 интегративной экспрессионной кассетой, содержащей в своем составе ген phyCg-op, кодирующий фитазу С. gillenii, полученной аналогично и трансформированной как описано ранее [Биотехнология, 2021, 37(4), 5-13].
Для сравнения уровней продукции фитазы в штаммах K. phaffii GS 115 ВКПМ Y-2837, K. phaffii ВКПМ Y-4287 и K. phaffii TGBF7 ВКПМ Y-5013 проводят ферментацию десяти отобранных трансформантов каждого штамма, несущих в составе хромосомы ген, кодирующий фитазу С. gillenii. Ферментацию проводят при следующих условиях:
- Посевную культуру каждого трансформанта выращивают в пробирках (50 мл) с 5 мл жидкой питательной среды YP с добавлением глюкозы (2 мас.%) при 30°С в течение 24 ч на качалке (250 об/мин). Посев ферментационной среды осуществляют в соотношении 1/10.
- Ферментацию проводят при 30°С на качалке (250 об/мин) в питательной среде YP с добавлением 2% метанола в течение 2 суток.
Продуктивность трансформантов, несущих в составе хромосомы ген, кодирующий фитазу С. gillenii, оценивают по уровню активности фитазы в культуральной жидкости. Для этого по окончании ферментации клетки трансформантов осаждают центрифугированием, а в отделенном супернатанте определяют фитазную активность модифицированным методом Фиске-Субарроу [J Microbiol Methods, 1999, 39(1), 17-22].
В табл. 1 представлены продуктивности трансформантов штаммов K. phaffii GS115 ВКПМ Y-2837, K. phaffii ВКПМ Y-4287 и K. phaffii TGBF7 ВКПМ Y-5013, несущих в составе хромосомы ген, кодирующий фитазу С. gillenii, среднее значение продуктивности, рассчитанное для 10 трансформантов каждого штамма, и относительная продуктивность трансформантов.

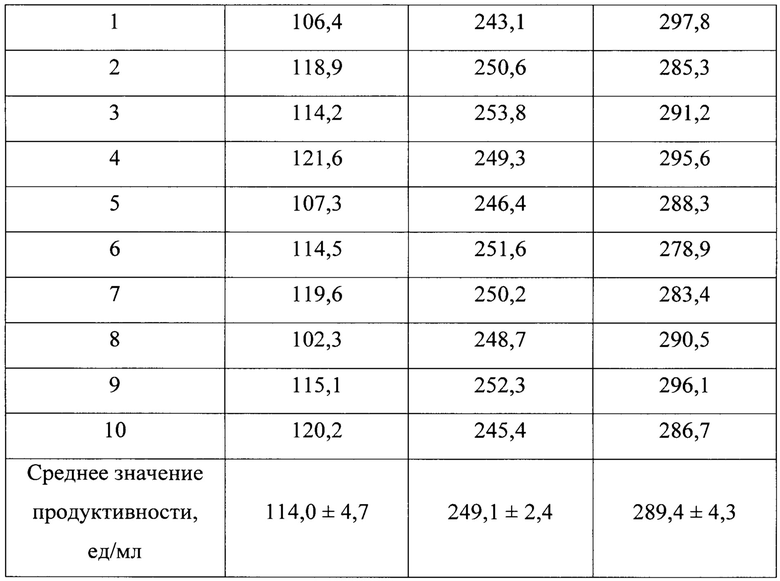
Из данных, приведенных в таблице 1, следует, что среднее значение продуктивности трансформантов K. phaffii TGBF7 ВКПМ Y-5013 значительно превышает таковое для трансформантов K. phaffii GS115 ВКПМ Y-2837, а для трансформантов K. phaffii ВКПМ Y-4287 превышает на 16%.
Пример 3. Получение трансформантов штамма дрожжей K. phaffii TGBF7 ВКПМ Y-5013, продуцирующих амилазу Bacillus licheniformis
Трансформанты штамма K. phaffii TGBF7 ВКПМ Y-5013, продуцирующие амилазу В. licheniformis, получают трансформацией клеток этого штамма интегративной экспрессионной кассетой 2.
При конструировании интегративной экспрессионной кассеты 2 в качестве источника гена amyS [Genbank, https://www.ncbi.nlm.nih.gov/nucleotide/CP093290.1?report=genbank&log$=nuclal ign&blast_rank=2&RID=B 3 RY15 3 T013], кодирующего амилазу В. licheniformis, используют тотальную геномную ДНК В. licheniformis ВКПМ В-10958. Синтезируют ДНК гена amyS методом ПЦР с использованием праймеров AmyS-F и AmyS-R:
AmyS-F 5'- gcaaatcttaatgggacgct -3',
AmyS-R 5'- tctttgaacataaattgaaa -3'.
Режим реакции ПЦР: 95°С - 3 мин - 1 цикл; 30 циклов: 95°С - 30 с, 57°С - 30 с, 72°С - 90 с; 72°С - 5 мин - 1 цикл.
Методом "фьюжн-пцр" [Gene., 1989, 15, 77(1), 61-68.] синтезируют экспрессионную кассету 2 (фиг. 3), в состав которой входят следующие генетические элементы:
1. Ген amyS, кодирующий амилазу В. licheniformis, встроенный в единую рамку считывания с нуклеотидной последовательностью сигнального пептида α-фактора, под контролем АОХ1 промотора;
2. Терминатор транскрипции ТТАОХ1;
3. Дрожжевой селективный маркер PpHIS4, комплементирующий у дрожжей K. phaffii мутацию в гене HIS4;
4. Область интеграции - 3' фрагмент нуклеотидной последовательности гена АОХ1.
Интегративную экспрессионную кассету 2 трансформируют в штаммы K. phaffii GS115 Y-2837 и K. phaffii TGBF7 ВКПМ Y-5013. Трансформацию экспрессионной кассеты 2 и селекцию трансформантов осуществляют, как описано в примере 1.
Наличие целевого гена в составе хромосомной ДНК полученных трансформантов определяют методом ПЦР с использованием праймеров AmyS-F и AmyS-R, описанных выше.
Для получения трансформантов контрольного штамма K. phaffii ВКПМ Y-4287, продуцирующих амилазу В. licheniformis, конструируют экспрессионную кассету 3.
При конструировании интегративной экспрессионной кассеты 3 используют последовательность гена amyS.
Методом "фьюжн-пцр" [Gene., 1989, 15, 77(1), 61-68] синтезируют экспрессионную кассету 3 (фиг. 4), в состав которой входят следующие генетические элементы:
1. Ген amyS, кодирующий амилазу В. licheniformis, встроенный в единую рамку считывания с нуклеотидной последовательностью сигнального пептида α-фактора, под контролем АОХ1 промотора;
2. Терминатор транскрипции ТТАОХ1;
3. Дрожжевой селективный маркер kanR, под контролем дрожжевого TEF промотора, обуславливающий у дрожжей K. phaffii устойчивость к антибиотику генетицину (G418);
4. Область интеграции - 3' фрагмент нуклеотидной последовательности гена АОХ1.
Интегративную экспрессионную кассету 3 трансформируют в штамм K. phaffii Y-4287. Трансформацию экспрессионной кассеты 3 и селекцию трансформантов осуществляют, как описано ранее [Биотехнология, 2021, 37(4), 5-13].
Наличие целевого гена в составе хромосомной ДНК полученных трансформантов определяют методом ПЦР с использованием праймеров AmyS-F и AmyS-R, описанных выше.
Для сравнения уровней продукции амилазы В. licheniformis в штаммах K. phaffii GS115 ВКПМ Y-2837, K. phaffii ВКПМ Y-4287 и K. phaffii TGBF7 ВКПМ Y-5013 проводят ферментацию десяти отобранных трансформантов каждого штамма с генами, кодирующими амилазу В. licheniformis. Ферментацию проводят, как описано в примере 1.
Определение активности амилазы в культуральной жидкости проводят с использованием ДНС метода [Anal. Chem., 1959, 31 (3), 426-428] в 96-луночном планшете следующим образом: в каждой лунке смешивают 25 мкл 1% раствора субстрата крахмала в 0,5 М ацетатном буфере (рН 6) и 25 мкл культуральной жидкости. Инкубацию проводят при 50°С 10 минут, после чего добавляют в лунку 50 мкл раствора ДНС. Планшет прогревают при 99°С 10 минут и измеряют оптическую плотность окрашенного раствора при длине волны 546 нм. В качестве стандарта используют раствор глюкозы.
В табл. 2 представлены продуктивности трансформантов штаммов K. phaffii GS115 ВКПМ Y-2837, K. phaffii ВКПМ Y-4287 и K. phaffii TGBF7 ВКПМ Y-5013, несущих в составе хромосомы ген, кодирующий амилазу В. licheniformis, среднее значение продуктивности, рассчитанное для 10 трансформантов каждого штамма, и относительная продуктивность трансформантов.

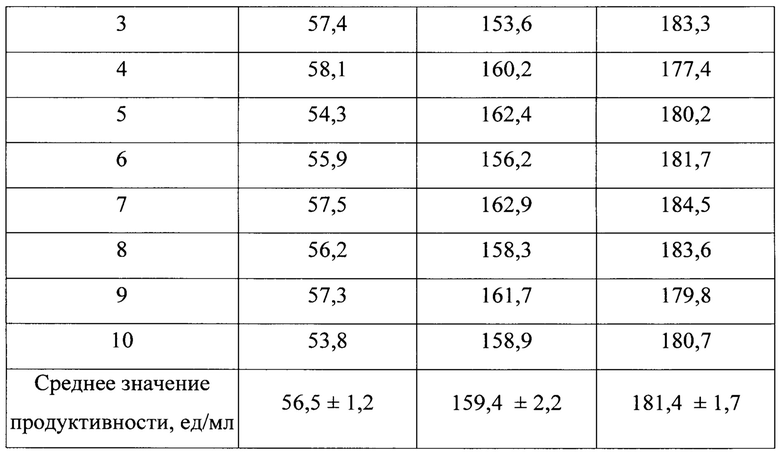
Из данных, приведенных в таблице 2, следует, что среднее значение продуктивности трансформантов K. phaffii TGBF7 ВКПМ Y-5013 значительно превышает таковое для трансформантов коммерческого штамма K. phaffii GS 115 ВКПМ Y-2837, а относительно трансформантов K. phaffii ВКПМ Y-4287 превышает на 14%.
Таким образом, полученные результаты показывают, что использование заявляемого штамма-реципиента приводит к получению безмаркерных штаммов с продуктивностью гетерологичных белков, значительно повышенной относительно родительского штамма K. phaffii ВКПМ Y-4287.
Отсутствие генов антибиотикорезистентности и повышенная продуктивность штаммов, получаемых на основе заявленного штамма K. phaffii TGBF7 ВКПМ Y-5013, расширяют возможность их дальнейшего использования в современном биотехнологическом производстве.
| название | год | авторы | номер документа |
|---|---|---|---|
| Штамм дрожжей Komagataella phaffii с инактивированным геном LEU2 - реципиент для конструирования штаммов-продуцентов гетерологичных белков | 2022 |
|
RU2788528C1 |
| Трансформант дрожжей Komagataella phaffi - продуцент фитазы Citrobacter gillenii | 2020 |
|
RU2771582C1 |
| Интегративная кассета для экспрессии генов и ее использование при конструировании трансформанта дрожжей Komagataella mondaviorum | 2023 |
|
RU2836330C1 |
| Трансформант Komagataella phaffii, содержащий ген HAC1, продуцент рекомбинантного химозина Vicugna pacos в активной форме | 2023 |
|
RU2828277C1 |
| Трансформант дрожжей Komagataella phaffii, продуцирующий фитазу Cronobacter turicensis | 2021 |
|
RU2756330C1 |
| Трансформант Komagataella phaffii - продуцент рекомбинантного химозина в активной форме | 2022 |
|
RU2805486C1 |
| Рекомбинантный штамм дрожжей Pichia pastoris - продуцент фитазы Escherichia coli | 2019 |
|
RU2751595C2 |
| Рекомбинантный штамм дрожжей Pichia pastoris с увеличенной продукцией фитазы Escherichia coli | 2019 |
|
RU2737623C1 |
| Рекомбинантный штамм дрожжей Komagataella kurtzmanii - продуцент бета-глюканазы из Paenibacillus jamilae | 2019 |
|
RU2730577C1 |
| Рекомбинантный штамм дрожжей Komagataella kurtzmanii - продуцент бета-глюканазы | 2018 |
|
RU2701640C1 |
Изобретение относится к области биохимии, в частности к штамму дрожжей Komagataella phaffii TGBF7 ВКПМ Y-5013 с инактивированным геном HIS4. Заявленное изобретение позволяет эффективно конструировать безмаркерный штамм дрожжей Komagataella phaffii для получения гетерологичных белков. 2 табл., 3 пр.
Штамм дрожжей Komagataella phaffii TGBF7 ВКПМ Y-5013 с инактивированным геном HIS4 - реципиент для конструирования безмаркерных штаммов-продуцентов гетерологичных белков.
| WO 2020232553 A1, 26.11.2020 | |||
| Трансформант дрожжей Komagataella phaffii, продуцирующий фитазу Cronobacter turicensis | 2021 |
|
RU2756330C1 |
| WO 2016183163 A1, 17.11.2016. | |||
Авторы
Даты
2023-01-11—Публикация
2022-10-18—Подача