Область техники, к которой относится изобретение
Настоящее изобретение относится к молекулам, связывающим HLA-A2, в частности к гуманизированным антителам против HLA-A2. Настоящее изобретение также относится к рекомбинантным молекулам, содержащим указанные молекулы, связывающие HLA-A2, таким как, например, химерные антигенные рецепторы (CAR). Другим объектом настоящего изобретения является сконструированная иммунная клетка, например, регуляторная Т-клетка, содержащая указанный CAR, и их применение в терапевтических способах.
Предшествующий уровень техники
HLA-антигены класса I представляют собой полиморфные белки, экспрессируемые на всех ядросодержащих клетках, и являются критическими мишенями для иммунного распознавания в контексте трансплантации. В действительности развитие Т-клеток и/или антител, специфических к HLA класса I, является основным фактором риска острого и хронического отторжения аллотрансплантата, а присутствие предварительно сформированных антител против донорных HLA класса I может привести к гиперострому отторжению. Таким образом, поиск путей контроля иммунного ответа на белки HLA класса I был бы главным прорывом в трансплантации.
Классические молекулы HLA класса I полиморфны и кодируются многими различными аллелями, которые эволюционировали в ответ на эволюционное давление от инфекций. Есть три локуса, которые кодируют классические белки HLA класса I, которые называются локусы A, B и C. В пределах локуса HLA-A* семейство аллелей HLA-A2 является самым большим и самым разнообразным, по меньшей мере, с 31 различными аллелями HLA-A2, которые, как известно, существуют у людей. Интересно, что в отличие от многих других семейств аллелей HLA, HLA-A2 часто встречается во всех этнических группах, и встречается у 50% европеоидов и 35% афроамериканцев. Многие аллели HLA-A2 отличаются только на 1-9 аминокислот, причем большая часть полиморфизма сосредоточена вокруг пептидсвязывающей канавки. Аллели HLA-A2 разбиты на две основные ветви: те, которые получены посредством событий интераллельной конверсии генов из A*0201 или A*0205.
Адоптивная иммунотерапия T-регуляторными (Treg) клетками как способ контроля нежелательного иммунитета к белкам HLA и другим антигенам, которые управляют отторжением трансплантата, является многообещающим методом лечения отторжения аллотрансплантата и болезни «трансплантат против хозяина» (GVHD). Сообщалось о применении поликлонального переноса Treg-клеток в профилактике болезни «трансплантат против хозяина» (GVHD) после аллогенной трансплантации гемопоэтических стволовых клеток (HSCT). Также сообщалось о применении переноса Treg-клеток для поддержания уровня c-пептида при диабете 1 типа. Примечательно, однако, что, как сообщалось, возможен временный риск генерализованной иммуносупрессии, связанный с применением поликлональных Treg-клеток для такой клеточной терапии.
Данные исследований на животных показывают, что эффективность и специфичность клеточной терапии Treg-клетками могут быть значительно повышены при применении антигенспецифических клеток. Например, в моделях аутоиммунитета антиген-специфичные Treg-клетки превосходят поликлональные Treg-клетки по снижению заболеваемости: Treg-клетки, выделенные из лимфатических узлов поджелудочной железы или активированные островковым антигеном, значительно лучше предотвращают или излечивают диабет 1 типа, чем поликлональные Treg-клетки, а Treg-клетки, экспрессирующие аутоантигенспецифический трансгенный Т-клеточный рецептор (TCR), превосходят поликлональные Treg-клетки по подавлению воспаления центральной нервной системы в модели экспериментального аутоиммунного энцефаломиелита (EAE). Аналогично, аллоантиген-специфичные Treg-клетки, обогащенные аллоантиген-стимулированным размножением in vitro или сконструированные для экспрессии TCR-трансгена, более эффективны, чем поликлональные Treg-клетки, в предотвращении отторжения трансплантатов органов и тканей. Существуют некоторые доказательства того, что Treg-клетки, размноженные с аллоантигенами, эффективно предотвращают GVHD и что индукция антиген-специфических Treg-клеток in vivo способствует принятию гемопоэтических аллотрансплантатов без GVHD. Модели гуманизированных мышей показали сходные результаты: размноженные с аллоантигеном человеческие Treg-клетки являются более сильными супрессорами отторжения кожного трансплантата, чем поликлональные Treg-клетки.
Альтернативным подходом к сверхэкспрессии трансгенных TCR или стимулированного антигеном размножения для обогащения антиген-специфическими Т-клетками является применение химерных антигенных рецепторов (CAR). В адоптивной иммунотерапии на основе клеток, иммунные клетки, выделенные у пациента, могут быть модифицированы для экспрессии синтетических белков, которые позволяют клеткам выполнять новые терапевтические функции после того, как они впоследствии передаются обратно пациенту. Примером такого синтетического белка является CAR. Примером используемого в настоящее время CAR является слияние внеклеточного домена распознавания (например, антигенсвязывающего домена), трансмембранного домена и одного или нескольких внутриклеточных сигнальных доменов. После включения антигена внутриклеточная сигнальная часть CAR может инициировать связанный с активацией ответ в иммунной клетке.
Настоящее изобретение относится к иммунным клеткам, в частности к иммунорегуляторным клеткам, экспрессирующим CAR, который специфически связывает HLA-A2, и к их терапевтическому применению.
Сущность изобретения
Настоящее изобретение относится к гуманизированному антителу против HLA-A2, имеющему меньшую реактивность к подтипу HLA-A, выбранному из группы, включающей A03, A11, A23, A25, A26, A29, A30, A31, A33, A34 и любую их комбинацию, предпочтительно из группы, включающей A25, A29, A30 и любую их комбинацию, по сравнению с антителом BB7.2 или с антителом, содержащим VH и VL антитела BB7.2, где
- вариабельная область тяжелой цепи включает, по меньшей мере, одну из следующих CDR:
VH-CDR1: SYHIQ (SEQ ID NO: 1) или GYTFTSY (SEQ ID NO: 4)
VH-CDR2: WIYPGDGSTQYNEKFKG (SEQ ID NO: 2) или YPGDGS (SEQ ID NO: 5)
VH-CDR3: EGTYYAMDY (SEQ ID NO: 3)
или любую CDR, имеющую аминокислотную последовательность, которая разделяет, по меньшей мере, 60% идентичности с SEQ ID NO: 1-5, и/или
- вариабельная область легкой цепи включает, по меньшей мере, одну из следующих CDR:
VL-CDR1: RSSQSIVHSNGNTYLE (SEQ ID NO: 6)
VL-CDR2: KVSNRFS (SEQ ID NO: 7)
VL-CDR3: FQGSHVPRT (SEQ ID NO: 8)
или любую CDR, имеющую аминокислотную последовательность, которая разделяет, по меньшей мере, 60% идентичности с SEQ ID NO: 6-8.
В одном воплощении вариабельная область тяжелой цепи включает, по меньшей мере, одну из CDR, определенных в п. 1, а вариабельная область легкой цепи включает, по меньшей мере, одну из CDR, определенных в п. 1.
В одном воплощении
- вариабельная область тяжелой цепи включает следующие CDR: SYHIQ (SEQ ID NO: 1), WIYPGDGSTQYNEKFKG (SEQ ID NO: 2) и EGTYYAMDY (SEQ ID NO: 3); или GYTFTSY (SEQ ID NO: 4), YPGDGS (SEQ ID NO: 5) и EGTYYAMDY (SEQ ID NO: 3) или любые CDR, имеющие аминокислотную последовательность, которая разделяет, по меньшей мере, 60% идентичности с указанными SEQ ID NO: 1- 5, и
- вариабельная область легкой цепи включает следующие CDR: RSSQSIVHSNGNTYLE (SEQ ID NO: 6), KVSNRFS (SEQ ID NO: 7) и FQGSHVPRT (SEQ ID NO: 8) или любые CDR, имеющие аминокислотную последовательность, которая разделяет, по меньшей мере, 60% идентичности с указанными SEQ ID NO: 6-8.
В одном воплощении аминокислотная последовательность вариабельной области тяжелой цепи представляет собой SEQ ID NO: 9 или любую аминокислотную последовательность, которая имеет, по меньшей мере, 60% идентичность с указанной SEQ ID NO: 9.
В одном воплощении аминокислотная последовательность вариабельной области легкой цепи представляет собой SEQ ID NO: 10 или любую аминокислотную последовательность, которая разделяет, по меньшей мере, 60% идентичности с указанной SEQ ID NO: 10, где X1 представляет собой V или I, X2 представляет собой T или S, X3 представляет собой L или S или A, X4 представляет собой S или T, X5 представляет собой P или S, X6 представляет собой T или S, X7 представляет собой L или P, X8 представляет собой E или D, X9 представляет собой P или R, X10 представляет собой A или V, X11 представляет собой S или T, X12 представляет собой L или Q, X13 представляет собой S или A, X14 представляет собой V или I, X15 представляет собой K или T, X16 представляет собой V или L, X17 представляет собой A или P, X18 представляет собой L или F, а X19 представляет собой G или A.
В одном воплощении аминокислотная последовательность вариабельной области легкой цепи выбрана из группы, включающей SEQ ID NO: 11, SEQ ID NO: 12 и SEQ ID NO: 13 или любую аминокислотную последовательность, которая разделяет, по меньшей мере, 60% идентичности с указанными SEQ ID NO: 11-13.
В одном воплощении аминокислотная последовательность вариабельной области тяжелой цепи представляет собой SEQ ID NO: 9 или любую аминокислотную последовательность, которая разделяет, по меньшей мере, 60% идентичности с указанной SEQ ID NO: 9, и аминокислотная последовательность вариабельной области легкой цепи представляет собой SEQ ID NO: 10, где X1 представляет собой V или I, X2 представляет собой T или S, X3 представляет собой L или S или A, X4 представляет собой S или T, X5 представляет собой P или S, X6 представляет собой T или S, X7 представляет собой L или P, X8 представляет собой E или D, X9 представляет собой P или R, X10 представляет собой A или V, X11 представляет собой S или T, X12 представляет собой L или Q, X13 представляет собой S или A, X14 представляет собой V или I, X15 представляет собой K или T, X16 представляет собой V или L, X17 представляет собой A или P, X18 представляет собой L или F и X19 представляет собой G или A, предпочтительно аминокислотная последовательность вариабельной области легкой цепи выбрана из группы, включающей SEQ ID NO: 11, SEQ ID NO: 12 и SEQ ID NO: 13 или любую аминокислотную последовательность, которая разделяет, по меньшей мере, 60% идентичности с указанными SEQ ID NO: 10-13.
В одном воплощении указанное антитело представляет собой полноразмерное антитело, одноцепочечное антитело, димерное одноцепочечное антитело, Fv, scFv, Fab, F(ab)'2, дефукозилированное антитело, биспецифическое антитело, диатело, триатело, тетратело, фрагмент антитела, выбранный из группы, состоящей из унитела, доменного антитела, и нанотела или миметика антитела, выбранных из группы, состоящей из аффитела, аффилина, аффитина, аднектина, атримера, эвазина, DARPin, антикалина, авимера, финомера, версатела или дуокалина.
В другом воплощении указанное антитело представляет собой полноразмерноеантитело, одноцепочечное антитело, димерное одноцепочечное антитело, Fv, scFv, Fab, F(ab)'2, дефукозилированное антитело, биспецифическое антитело, диатело, триатело, тетратело, фрагмент антитела, выбранный из группы, состоящей из унитела, доменного антитела, и нанотела или миметика антитела, выбранного из группы, состоящей из аффитела, альфа-тела, каркаса на основе белка с повтором armadillo, кноттина, пептида домена Куница, аффилина, аффитина, аднектина, атримера, эвазина, DARPin, антикалина, авимера, финомера, версатела или дуокалина.
В одном воплощении указанное антитело представляет собой scFv, предпочтительно scFv, имеющий последовательность SEQ ID NO: 70-72 или 74-76.
Настоящее изобретение также относится к химерному антигенному рецептору (CAR), содержащему:
- внеклеточный домен, содержащий гуманизированное анти-HLA-A2 антитело, описанное выше,
- трансмембранный домен и
- цитоплазматический домен, включающий внутриклеточный сигнальный домен.
Другим объектом настоящего изобретения является последовательность нуклеиновой кислоты, кодирующая CAR, описанный выше.
Другим объектом изобретения является иммунная клетка, содержащая CAR, описанный выше, или последовательность нуклеиновой кислоты, описанной выше, где указанная иммунная клетка предпочтительно представляет собой регуляторную T-клетку.
Настоящее изобретение дополнительно относится к композиции, содержащей иммунные клетки, как описано выше, где предпочтительно указанная композиция представляет собой фармацевтическую композицию и дополнительно включает фармацевтически приемлемый наполнитель.
Настоящее изобретение также относится к иммунной клетке, описанной выше, для применения в индукции иммунной толерантности у объекта, нуждающегося в этом, где предпочтительно указанная толерантность представляет собой толерантность к трансплантированному органу или ткани.
Настоящее изобретение также относится к иммунной клетке, описанной выше, для применения при лечении отторжения трансплантата органа или ткани или заболевания «трансплантат против хозяина» (GVHD).
В одном воплощении объект дополнительно получает иммуносупрессирующий агент.
Настоящее изобретение также относится к комбинации иммунной клетки, как описано в настоящем изобретении, по меньшей мере, с одним иммуносупрессирующим агентом для индукции иммунной толерантности у объекта, нуждающегося в этом, или для лечения отторжения трансплантата органа или ткани или заболевания «трансплантат против хозяина» (GVHD) у объекта, нуждающегося в этом.
Настоящее изобретение также относится к составному набору, включающему, в первую очередь, иммунную клетку, как описано в настоящем изобретении, и/или реагенты (например, нуклеиновую кислоту или вектор, кодирующий анти-HLA-A антитело или CAR по настоящему раскрытию) для изготовления таких иммунных клеток и во второй части, по меньшей мере, один иммуносупрессирующий агент.
Настоящее изобретение также относится к способу индукции иммунной толерантности у объекта, нуждающегося в этом, где указанный способ включает введение иммунной клетки по настоящему изобретению объекту, где предпочтительно указанная толерантность представляет собой толерантность к трансплантированному органу или ткани.
Настоящее изобретение также относится к способу лечения отторжения трансплантата органа или ткани, или заболевания «трансплантат против хозяина» (GVHD) у объекта, нуждающегося в этом, где указанный способ включает введение иммунной клетки, описанной в настоящем изобретении, объекту.
В одном воплощении способ по изобретению дополнительно включает введение объекту, по меньшей мере, одного иммуносупрессирующего агента.
Определения
в настоящем изобретении следующие термины имеют следующие значения:
В контексте настоящего изобретения используются следующие сокращения наиболее часто встречающихся оснований нуклеиновых кислот. «А» относится к аденину, «С» относится к цитозину, «G» относится к гуанину, «Т» относится к тимину и «U» относится к урацилу.
яТермины в единственном числе также включают множественное число. Например, «элемент» означает один элемент или более одного элемента.
Термин «около», когда он относится к измеряемому значению, такому как величина, временная длительность и т.п., подразумевает, что он охватывает колебания ± 20% или в некоторых случаях ± 10%, а в некоторых случаях ± 5%, или в некоторых случаях ± 1% или в некоторых случаях ± 0,1% от указанного значения, поскольку такие вариации являются подходящими для выполнения раскрытых способов.
Используемый в данном документе термин «активация» относится к состоянию Т-клетки (например, регуляторной Т-клетки), которая была достаточно стимулирована для индукции обнаруживаемого клеточного ответа. Активация также может быть связана с обнаруживаемой(ыми) эффекторной(ыми) функцией(ями), такой как, например, продуцирование цитокинов или супрессирующая активность. Термин «активированные» регуляторные T-клетки относится, среди прочего, к регуляторным T-клеткам, которые способны подавлять иммунный ответ.
«Аднектины», также известные как монотела, хорошо известны в данной области и относятся к белкам, предназначенным для связывания с высокой аффинностью и специфичностью с антигенами. Они принадлежат к классу молекул, которые в совокупности называются «миметиками антител».
Используемый в данном документе термин «альфатело», который также может упоминаться как проникающие в клетки альфатела, относится к типу миметиков антител, состоящих из небольших белков с молекулярной массой 10 кДа, сконструированных для связывания с различными антигенами. Альфатела способны достигать и связываться с внутриклеточными белковыми мишенями.
«Аффитело» хорошо известно в данной области и относится к аффинным белкам на основе белкового домена из 58 аминокислотных остатков, полученного из одного из IgG-связывающих доменов стафилококкового протеина А.
Используемый в данном документе термин «аффинность» относится к константе равновесия для обратимого связывания двух агентов и выражается в виде константы диссоциации (Kd). Аффинность может быть, по меньшей мере, в 1 раз больше, по меньшей мере, в 2 раза больше, по меньшей мере, в 3 раза больше, по меньшей мере, в 4 раза больше, по меньшей мере, в 5 раз больше, по меньшей мере, в 6 раз больше, по меньшей мере, в 7 раз больше, по меньшей мере, в 8 раз больше, по меньшей мере, в 9 раз больше, по меньшей мере, в 10 раз больше, по меньшей мере, в 20 раз больше, по меньшей мере, в 30 раз больше, по меньшей мере, в 40 раз больше, по меньшей мере, в 50 раз больше, по меньшей мере, в 60 раз больше, по меньшей мере, в 70 раз больше, по меньшей мере, в 80 раз больше, по меньшей мере, в 90 раз больше, по меньшей мере, в 100 раз или, по меньшей мере, в 1000 раз больше, или более, чем аффинность антитела для неродственных аминокислотных последовательностей. Аффинность антитела к белку-мишени может составлять, например, от около 100 нМ до около 0,1 нМ, от около 100 нМ до около 1 пикомоляр (пМ) или от около 100 нМ до около 1 фемтомоля (фМ) или больше.
«Аффилины» хорошо известны в данной области и относятся к искусственным белкам, предназначенным для селективного связывания антигенов. Они напоминают антитела по своей аффинности и специфичности к антигенам, но не по структуре, что относит их к типу миметиков антител.
Термин «аллогенный» относится к любому материалу, полученному от другого индивидуума того же вида, что и индивидуум, которому этот материал вводится. Говорят, что два или более индивидуума аллогенны друг другу, когда гены в одном или нескольких локусах не идентичны. В некоторых аспектах аллогенный материал от особей одного и того же вида может быть достаточно непохож генетически, чтобы взаимодействовать антигенно.
Термины «антитело» и «иммуноглобулин» (Ig) используются взаимозаменяемо и относятся к белковой или полипептидной последовательности, полученной из молекулы иммуноглобулина, которая специфически связывается с антигеном. Антитела могут быть поликлональными или моноклональными, многоцепочечными или одноцепочечными или интактными иммуноглобулинами и могут быть получены из природных источников или из рекомбинантных источников. Термин «антитело» также включает полиспецифичные антитела (например, биспецифичные антитела) и фрагменты антител при условии, что они проявляют искомую биологическую активность. Антитела также могут быть мультимерами молекул иммуноглобулина, например, тетрамерами молекул иммуноглобулина.
Основное четырехцепочечное антитело представляет собой гетеротетрамерный гликопротеин, состоящий из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей. L-цепь из любого вида позвоночных может быть отнесена к одному из двух четко различимых типов, называемых каппа ([каппа]) и лямбда ([лямбда]), на основе аминокислотных последовательностей их константных доменов (CL). В зависимости от аминокислотной последовательности константного домена их тяжелых цепей (СН) иммуноглобулины могут быть отнесены к разным классам или изотипам. Существует пять классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, имеющие тяжелые цепи, обозначаемые как альфа (α), дельта (δ), эпсилон (ε), гамма (γ) и мю (µ), соответственно. Классы γ и α далее подразделяются на подклассы на основании относительно незначительных различий в последовательности и функции СН, например, люди экспрессируют следующие подклассы: IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Каждая L-цепь связана с H-цепью одной ковалентной дисульфидной связью, тогда как две H-цепи связаны друг с другом одной или несколькими дисульфидными связями в зависимости от изотипа H-цепи. Каждая H- и L-цепь также имеет регулярно расположенные внутрицепочечные дисульфидные мостики. Каждая Н-цепь имеет на N-конце вариабельный домен (VH), за которым следуют три константных домена (СН) для каждой из цепей α и γ и четыре домена СН для изотипов µ и ε. Каждая L-цепь имеет на N-конце вариабельный домен (VL), за которым следует константный домен (CL) на другом конце. VL выровнен с VH, а CL выровнен с первым константным доменом тяжелой цепи (CH1). Считается, что конкретные аминокислотные остатки образуют поверхность раздела между вариабельными доменами легкой цепи и тяжелой цепи. Спаривание VH и VL вместе образует один антигенсвязывающий сайт. Антитело IgM состоит из пяти основных гетеротетрамерных единиц вместе с дополнительным полипептидом, называемым J-цепью, и, следовательно, включает десять антигенсвязывающих сайтов, в то время как секретируемые IgA-антитела могут полимеризоваться с образованием поливалентных сообществ, включающих 2-5 основных 4-цепочечных единиц вместе с J-цепью. В случае IgG 4-цепочечная единица обычно имеет массу около 150000 дальтон. О структуре и свойствах различных классов антител см., например, Basic and Clinical Immunology, 8th edition, Daniel P. Stites, Abba I. Terr and Tristram G. Parslow (eds.), Appleton & Lange, Norwalk, Conn., 1994, стр. 71, и Глава 6.
Термин «фрагмент антитела» относится, по меньшей мере, к одной части интактного антитела, предпочтительно антигенсвязывающей области или вариабельной области интактного антитела, которая сохраняет способность специфически взаимодействовать (например, путем связывания, стерического затруднения, стабилизации/дестабилизации, пространственного распределения) с эпитопом антигена. Примеры фрагментов антител включают, без ограничения указанным, Fab, Fab', F(ab')2, фрагменты Fv, молекулы одноцепочечных антител, в частности фрагменты антител scFv, дисульфид-связанные Fvs (sdFv), фрагмент Fd, состоящий из доменов VH и CHI, линейные антитела, однодоменные антитела, такие как, например, sdAb (VL или VH), верблюжьи домены VHH, мультиспецифические антитела, образованные из фрагментов антител, такие как, например, двухвалентный фрагмент, содержащий два Fab-фрагмента, связанных дисульфидным мостиком в шарнирной области, и выделенная CDR или другие эпитоп-связывающие фрагменты антитела. Антигенсвязывающий фрагмент также может быть включен в однодоменные антитела, макситела, минитела, нанотела, интратела, диатела, триатела, тетратела, v-NAR и bis-scFv (см., например, Hollinger and Hudson, Nature Biotechnology 23: 1126-1136, 2005). Антигенсвязывающие фрагменты также могут быть привиты в каркасы на основе полипептидов, таких как фибронектин типа III (см. Патент США № 6,703,199, в котором описаны фибронектиновые полипептидные минитела). При расщеплении антител папаином образуются два идентичных антигенсвязывающих фрагмента, называемых фрагментами «Fab», и остаточный фрагмент «Fc», обозначение, отражающее способность легко кристаллизоваться. Фрагмент Fab состоит из всей L-цепи вместе с доменом вариабельной области H-цепи (VH) и первым константным доменом одной тяжелой цепи (CH1). Каждый фрагмент Fab является одновалентным в отношении связывания антигена, то есть он имеет один антигенсвязывающий сайт. Обработка антителом пепсином дает один большой фрагмент F(ab')2, который примерно соответствует двум дисульфидно-связанным фрагментам Fab, обладающим двухвалентной антигенсвязывающей активностью, с сохранением способности к перекрестному сшиванию антигена. Фрагменты Fab' отличаются от фрагментов Fab наличием нескольких дополнительных остатков на карбоксиконце домена СН1, включая один или несколько цистеинов из шарнирной области антитела. Fab'-SH обозначен в данном документе как Fab', в котором остаток(ки) цистеина константных доменов несут свободную тиоловую группу. Фрагменты антитела F(ab')2 первоначально были получены в виде пар фрагментов Fab', которые имеют шарнирные цистеины между ними. Другие химические сочетания фрагментов антител также известны.
Используемый в данном документе термин «функциональный фрагмент или аналог антитела» представляет собой соединение, обладающее качественной биологической активностью, общей с полноразмерным антителом. Например, функциональный фрагмент или аналог анти-IgE-антитела представляет собой фрагмент, который может связываться с иммуноглобулином IgE таким образом, чтобы предотвратить или существенно снизить способность такой молекулы обладать способностью связываться с рецептором с высокой аффинностью, FcεRI.
Термин «тяжелая цепь антитела» относится к большей из двух типов полипептидных цепей, присутствующих в молекулах антитела в их естественных конформациях, и который обычно определяет класс, к которому относится антитело.
Термин «легкая цепь антитела» относится к меньшей из двух типов полипептидных цепей, присутствующих в молекулах антитела в их естественных конформациях. Легкие цепи каппа (K) и лямбда (λ) относятся к двум основным изотипам легкой цепи антитела.
«Антикалины» хорошо известны в данной области и относятся к технологии миметиков антител, в которой специфичность связывания определяется липокалинами. Антикалины также могут быть отформатированы как белок двойного нацеливания, называемый дуокалинами.
Термин «антиген» или «Ag» относится к молекуле, которая вызывает иммунный ответ. Этот иммунный ответ может включать либо выработку антител, либо активацию специфических иммунологически компетентных клеток, или то и другое. Специалист в данной области поймет, что любая макромолекула, включая практически все белки или пептиды, может служить антигеном. Кроме того, антигены могут быть получены из рекомбинантной или геномной ДНК. Специалист в данной области поймет, что любая ДНК, которая включает нуклеотидную последовательность или частичную нуклеотидную последовательность, кодирующую белок, который вызывает иммунный ответ, следовательно, кодирует «антиген», как этот термин используется в данном документе. Кроме того, специалист в данной области поймет, что антиген не обязательно должен кодироваться исключительно полноразмерной нуклеотидной последовательностью гена. Очевидно, что настоящее изобретение включает, без ограничения указанным, применение частичных нуклеотидных последовательностей более чем одного гена и что эти нуклеотидные последовательности расположены в различных комбинациях для кодирования полипептидов, которые вызывают желаемый иммунный ответ. Кроме того, специалист в данной области поймет, что антиген вовсе не обязательно должен кодироваться «геном». Очевидно, что антиген может быть синтезирован или может быть получен из биологического образца или может быть макромолекулой помимо полипептида. Такой биологический образец может включать, без ограничения указанным, образец ткани, клетку или жидкость с другими биологическими компонентами.
Термин «антигенпрезентирующая клетка» или «APC» относится к клетке иммунной системы, такой как вспомогательная клетка (например, B-клетка, дендритная клетка и тому подобное), которая презентирует чужеродный антиген, образующий комплекс с основными комплексами гистосовместимости (MHC) на ее поверхности. Т-клетки могут распознавать эти комплексы, используя их T-клеточные рецепторы (TCR). АРС процессируют антигены и презентируют их Т-клеткам.
Используемый в данном документе термин «каркас на основе белка с повторами armadillo» относится к типу миметиков антител, соответствующих искусственным пептидсвязывающим каркасам на основе белков с повторами armadillo. Белки с повторами armadillo характеризуются доменом armadillo, состоящим из тандемных повторов armadillo около из 42 аминокислот, который обеспечивает взаимодействие с пептидами или белками.
«Атримеры» хорошо известны в данной области и относятся к связывающим молекулам для белка-мишени, которые тримеризуются как обязательное условие их биологической активности. Они относительно велики по сравнению с другими каркасами миметиков антител.
Термин «аутологичный» относится к любому материалу, полученному от того же человека, которому он позднее будет повторно представлен.
«Авимеры» хорошо известны в данной области и относятся к технологии миметиков антител.
«DARPins» (сконструированные белки с анкириновыми повторами) хорошо известны в данной области и относятся к технологии миметического антитела DRP (сконструированный белок с повторами), разработанной для применения способности связывания полипептидов, не являющихся антителами.
Используемый в данном документе термин «BB7.2» относится к мышиной гибридоме, идентифицированной как депозит ATCC HB-82. Клетки гибридомы BB7.2 секретируют мышиное моноклональное антитело изотипа каппа IgG2b (например, антитело BB7.2), которое было охарактеризовано Parham P. et al. и Hilton et al. (Parham, P. et al., 1981; Hilton et al., 2013). Антитело BB7.2 имеется в продаже, например, у Abcam (каталожный номер: ab74674), Thermo Fisher Scientific (каталожный номер: 17-9876-42) или Santa Cruz Biotechnology (каталожный номер: sc- 32236). Аминокислотные последовательности шести определяющих комплементарность областей (CDR) антитела BB7.2 являются следующими:
- CDR1 тяжелой цепи (HCDR1): SYHIQ (SEQ ID NO: 62);
- CDR2 тяжелой цепи (HCDR2): WIYPGDGSTQYNEKFKG (SEQ ID NO: 63);
- CDR3 тяжелой цепи (HCDR3): EGTYYAMDY (SEQ ID NO: 64);
- CDR1 легкой цепи (LCDR1): RSSQSIVHSNGNTYLE (SEQ ID NO: 65)
- CDR2 легкой цепи (LCDR2): KVSNRFS (SEQ ID NO: 66);
- Легкая цепь CDR3 (LCDR3): FQGSHVPRT (SEQ ID NO: 67).
Используемый в данном документе термин «антитело BB7.2» представляет собой антитело, имеющее VH (SEQ ID NO: 9) и VL (SEQ ID NO: 10) моноклонального антитела, секретируемого BB7.2. Антитело BB7.2 может быть полноразмерным антителом или его фрагментом, имеющим VH и VL моноклонального антитела, секретируемого BB7.2, таким как scFv, имеющее моноклонального антитела VH и VL, секретируемого BB7.2.
Термин «связывание» относится к прямой ассоциации между двумя молекулами, например, вследствие ковалентных, электростатических, гидрофобных и ионных и/или водородных связей, включая такие взаимодействия, как солевые и водяные мостики. Неспецифическое связывание будет относиться к связыванию с аффинностью менее 10-7 М, например, связыванию с аффинностью 10-6 М, 10-5 М, 10-4 М и т.д.
Используемый в данном документе термин «5'-кэп» (также называемый кэпом РНК, 7-метилгуанозиновым кэпом РНК или m7G-кэпом РНК) представляет собой модифицированный гуаниновый нуклеотид, который был добавлен к «фронтальному» или 5' -концу эукариотической информационной РНК вскоре после начала транскрипции. 5'-кэп состоит из концевой группы, которая связана с первым транскрибированным нуклеотидом. Его присутствие имеет решающее значение для распознавания рибосомой и защиты от РНКаз. Добавление кэпа связано с транскрипцией и происходит совместно с транскрипцией, так что каждый из этих процессов влияет на другой. Вскоре после начала транскрипции 5' -конец синтезируемой мРНК связывается с кэп-синтезирующим комплексом, ассоциированным с РНК-полимеразой. Этот ферментативный комплекс катализирует химические реакции, которые необходимы для кэппинга мРНК. Синтез протекает как многоступенчатая биохимическая реакция. Кэпирующий фрагмент может быть модифицирован для модуляции функциональности мРНК, такой как ее стабильность или эффективность трансляции.
«Химерное антитело» представляет собой молекулу антитела, в которой (а) константная область (т.е. тяжелая и/или легкая цепь) или ее часть изменена, заменена или заменена таким образом, что сайт связывания антигена (вариабельная область) связан с константной областью другого или измененного класса, эффекторной функции и/или вида или с совершенно другой молекулой, которая придает химерным антителам новые свойства, например, фермент, токсин, гормон, фактор роста, лекарство и т. д.; или (b) вариабельная область или ее часть изменена, заменена или заменена вариабельной областью, имеющей другую или измененную антигенную специфичность. Химерные антитела также включают приматизированные и, в частности, гуманизированные антитела. Кроме того, химерные антитела могут содержать остатки, которые не обнаружены в реципиентном антителе или в донорном антителе. Эти модификации сделаны для дальнейшего улучшения характеристик антител. Для получения дополнительной информации см. Jones et al., Nature 321: 522-525 (1986); Riechmann et al., Nature 332: 323-329 (1988); и Presta, Curr. Op. Struct. Biol. 2: 593-596 (1992). (см. Пат. США № 4816567; и Morrison et al., Proc. Natl. Acad. Sci. USA, 81:6851-6855 (1984)).
Термины «химерный рецептор» или «химерный антигенный рецептор» или «CAR» относятся к одному полипептиду или к набору полипептидов, обычно двух в простейших воплощениях, которые, когда они находятся в иммунной клетке, придают клетке специфичность к лиганду-мишени и генерируют внутриклеточный сигнал. В некоторых воплощениях набор полипептидов является смежным друг с другом. В некоторых воплощениях химерный рецептор представляет собой химерный слитый белок, содержащий набор полипептидов. В некоторых воплощениях набор полипептидов включает переключатель димеризации, который при наличии молекулы димеризации может связывать полипептиды друг с другом, например, может связывать лигандсвязывающий домен с внутриклеточным сигнальным доменом. В одном воплощении химерный рецептор включает необязательную лидерную последовательность на амино-конце (N-ter) химерного рецепторного гибридного белка. В одном воплощении химерный рецептор дополнительно включает лидерную последовательность на N-конце внеклеточного лиганд-связывающего домена, где лидерная последовательность необязательно отщепляется от лиганд-связывающего домена во время клеточного процессинга и локализации химерного рецептора на клеточной мембране.
Термин «модификации консервативных последовательностей» относится к модификациям аминокислот, которые не оказывают значительного влияния или не изменяют биологическую функцию белка, содержащего аминокислотную последовательность. Такие консервативные модификации включают аминокислотные замены, добавления и делеции. Модификации могут быть введены в белок стандартными методами, известными в данной области, такими как сайт-направленный мутагенез и ПЦР-опосредованный мутагенез. «Консервативная замена» представляет собой замену аминокислоты другой аминокислотой, которая обладает сходными свойствами, так что специалист в области химии пептидов может ожидать, что вторичная структура и гидропатическая природа полипептида будут практически неизменными. Поэтому аминокислотные замены обычно основаны на относительном сходстве аминокислотных заместителей боковой цепи, например, их гидрофобности, гидрофильности, заряда, размера и тому подобного. Типичные замены, в которых учитываются различные из вышеупомянутых характеристик, хорошо известны специалистам в данной области и включают: аргинин и лизин; глутамат и аспартат; серин и треонин; глютамин и аспарагин; и валин, лейцин и изолейцин. Аминокислотные замены могут быть дополнительно сделаны на основе сходства в полярности, заряде, растворимости, гидрофобности, гидрофильности и/или амфипатической природе остатков. Например, отрицательно заряженные аминокислоты включают аспарагиновую кислоту и глутаминовую кислоту; положительно заряженные аминокислоты включают лизин и аргинин; и аминокислоты с незаряженными полярными головными группами, имеющие сходные значения гидрофильности, включают лейцин, изолейцин и валин; глицин и аланин; аспарагин и глютамин; и серин, треонин, фенилаланин и тирозин. Другие группы аминокислот, которые могут представлять консервативные изменения, включают: (1) ala, pro, gly, glu, asp, gln, asn, ser, thr; (2) cys, ser, tyr, thr; (3) val, ile, leu, met, ala, phe; (4) lys, arg, his; и (5) phe, tyr, trp, his. Другие семейства аминокислотных остатков, имеющих сходные боковые цепи, были определены в данной области. Эти семейства включают аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислотными боковыми цепями (например, аспарагиновая кислота, глутаминовая кислота), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин). цистеин, триптофан), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Таким образом, один или несколько аминокислотных остатков в антителе или химерном рецепторе по изобретению могут быть заменены другими аминокислотными остатками из того же семейства боковых цепей, и измененное антитело или химерный рецептор может быть протестировано на связывание с HLA-A2.
Термин «конститутивный промотор» относится к нуклеотидной последовательности, которая, когда функционально связана с полинуклеотидом, который кодирует или специфицирует продукт гена, вызывает образование генного продукта в клетке в большинстве или во всех физиологических условиях клетки.
Термин «костимулирующая молекула» относится к когнатному связывающему партнеру на Т-клетке, который специфически связывается с костимулирующим лигандом, тем самым опосредуя костимулирующий ответ Т-клетки, такой как, без ограничения указанным, пролиферация. Костимулирующие молекулы представляют собой молекулы клеточной поверхности, отличные от рецепторов антигена или их лигандов, которые способствуют эффективному иммунному ответу. Костимулирующий сигнальный домен может быть внутриклеточной частью костимулирующей молекулы. Костимулирующая молекула может быть представлена в следующих семействах белков: белки рецептора TNF, иммуноглобулиноподобные белки, рецепторы цитокинов, интегрины, сигнальные молекулы активации лимфоцитов (белки SLAM) и активирующие рецепторы NK-клеток.
«Цитотоксическая клетка» включает цитотоксические CD8+ T-клетки, природные киллеры (NK) и нейтрофилы, которые способны опосредовать цитотоксические реакции.
«Полученный из», как этот термин используется в настоящем документе, указывает на связь между первой и второй молекулой. Как правило, оно относится к структурному сходству между первой молекулой и второй молекулой и не означает или не включает ограничение процесса или источника для первой молекулы, которая получена из второй молекулы. Например, в случае внутриклеточного сигнального домена, который происходит от молекулы CD3дзета, внутриклеточный сигнальный домен сохраняет достаточную структуру CD3дзета, такую, которая выполняет требуемую функцию, а именно способность генерировать сигнал в соответствующих условиях. Это не означает и не ограничивает конкретный процесс создания внутриклеточного сигнального домена, например, это не означает, что для обеспечения внутриклеточного сигнального домена нужно начинать с последовательности CD3дзета и удалять нежелательную последовательность или навязывать мутации, для достижения внутриклеточного сигнального домена.
Термин «диатела» относится к небольшим фрагментам антител, полученным путем конструирования фрагментов scFv с короткими линкерами (около 5-10 остатков) между доменами VH и VL, так что достигается межцепочечное, но не внутрицепочечное спаривание доменов V, что приводит к двухвалентному фрагменту, то есть фрагменту, имеющем два антигенсвязывающих сайта. Биспецифичные диатела представляют собой гетеродимеры двух «перекрестных» scFv-фрагментов, в которых домены VH и VL двух антител присутствуют в разных полипептидных цепях. Диатела более полно описаны, например, в ЕР 0404097; WO 93/11161; и Holliger et al., Proc. Natl. Acad. Sci. USA, 90: 6444-6448 (1993).
«Доменное антитело» хорошо известно в данной области и относится к наименьшим функциональным связывающим единицам антител, соответствующим вариабельным областям тяжелой или легкой цепям антител.
Термин «кодирование» относится к ингерентному свойству специфических последовательностей нуклеотидов в полинуклеотиде, таких как, например, ген, кДНК или мРНК, которые служат в качестве матриц для синтеза других полимеров и макромолекул в биологических процессах, имеющих либо определенную последовательность нуклеотидов (например, рРНК, тРНК и мРНК), либо определенную последовательность аминокислот и следующие из нее биологические свойства. Таким образом, ген, кДНК или РНК кодирует белок, если транскрипция и трансляция мРНК, соответствующие этому гену, продуцируют белок в клетке или другой биологической системе. Как кодирующая цепь, нуклеотидная последовательность которой идентична последовательности мРНК и обычно указывается в перечнях последовательностей, так и некодирующая цепь, используемая в качестве матрицы для транскрипции гена или кДНК, могут упоминаться как кодирующие белок или другой продукт этого гена или кДНК. Если не указано иное, «нуклеотидная последовательность, кодирующая аминокислотную последовательность» включает все нуклеотидные последовательности, которые являются вырожденными версиями друг друга и которые кодируют одну и ту же аминокислотную последовательность. Фраза «нуклеотидная последовательность, кодирующая белок или РНК» может также включать интроны в той степени, в которой нуклеотидная последовательность, кодирующая белок, может в некоторых версиях содержать интрон(ы).
Термин «эндогенный» относится к любому материалу из или произведенному внутри организма, клетки, ткани или системы.
Термины «сконструированный» или «модифицированный» используются взаимозаменяемо и относятся к клетке, которая была трансфицирована, трансформирована или трансдуцирована.
«Эвазины» хорошо известны в данной области и относятся к классу хемокин-связывающих белков.
Термин «экзогенный» относится к любому материалу, введенному или произведенному вне организма, клетки, ткани или системы.
Термин «экспрессия» относится к транскрипции и/или трансляции конкретной нуклеотидной последовательности, управляемой промотором.
Термин «экспрессирующий вектор» относится к вектору, содержащему рекомбинантный полинуклеотид, содержащий последовательности контроля экспрессии, функционально связанные с нуклеотидной последовательностью, которая должна быть экспрессирована. Экспрессирущий вектор включает достаточное количество цис-действующих элементов для экспрессии; другие элементы для экспрессии могут поставляться клеткой-хозяином или в системе экспрессии in vitro. Экспрессирующие векторы включают все известные в данной области техники, включая, без ограничения указанным, космиды, плазмиды (например, «голые» или содержащиеся в липосомах) и вирусы (например, лентивирусы, ретровирусы, аденовирусы и аденоассоциированные вирусы), которые включают рекомбинантный полинуклеотид.
Фрагмент «Fc» антитела включает карбоксиконцевые части обеих Н-цепей, удерживаемые вместе дисульфидами. Эффекторные функции антител определялись последовательностями в области Fc, причем эта область также является частью, распознаваемой рецепторами Fc (FcR), обнаруженными в определенных типах клеток.
Остатки «каркаса» или «FR» представляют собой остатки вариабельного домена, отличные от остатков гипервариабельной области, определенных в настоящем документе.
«Fv» представляет собой минимальный фрагмент антитела, который включает полный сайт узнавания и связывания антигена. Этот фрагмент состоит из димера одного домена вариабельной области тяжелой цепи и одного домена вариабельной области легкой цепи в тесной нековалентной ассоциации. В результате сворачивания этих двух доменов образуются шесть гипервариабельных петель (по три петли каждой из цепей H и L), которые вносят аминокислотные остатки для связывания антигена и придают антителу специфичность связывания антигена. Однако даже один вариабельный домен (или половина Fv, содержащего только три CDR, специфичных для антигена) обладает способностью распознавать и связывать антиген, хотя и с более низкой аффинностью, чем весь сайт связывания.
«Феномеры» хорошо известны в данной области и относятся к белкам, которые относятся к классу миметиков антител. Они являются привлекательными связывающими молекулами благодаря их высокой термостабильности и пониженной иммуногенности.
Термин «заболевание «трансплантат против хозяина» или «GVHD» в контексте настоящего описания относится к медицинскому осложнению после получения трансплантированной ткани от генетически отличного человека. Иммунные клетки в донорской ткани (трансплантат) распознают реципиента (хозяина) как чужеродные. Трансплантированные иммунные клетки затем атакуют клетки организма хозяина. GVHD обычно ассоциируется с трансплантацией стволовых клеток; однако этот термин включает GVHD, возникающие из-за других форм тканевого трансплантата. GVHD может также возникнуть после переливания крови.
Используемый в данном документе термин «подтип HLA-A» относится к белку, кодируемому аллелем гена HLA-A. Используемый в данном документе термин «HLA-A*25:01» относится к белку HLA с обозначением «HLA-A*25:01» в соответствии с системой именования HLA, разработанной в 2010 году Комитетом ВОЗ по факторам системы HLA. Термины «HLA-A*29:02» и «HLA-A*30:01» относятся к белкам HLA с обозначениями «HLA-A*29:02» и «HLA-A*30:01», соответственно.
Используемый в данном документе термин «HLA-A2» относится к белкам человеческого лейкоцитарного антигена (HLA), включая белки клеточной поверхности, кодируемые семейством аллелей HLA-A*02 в локусе HLA-A* комплекса HLA. Белки HLA, охваченные термином «HLA-A2», включают белки HLA, идентифицированные как принадлежащие к типу антигена HLA-A*02 с помощью серологического тестирования или генотипирования. Дополнительные названия для антигена типа HLA-A*02 включают «HLA-A2», HLA-A02» и «HLA-A*2». Были разработаны различные системы присваивания названий, которые идентифицируют белки HLA, кодируемые этим семейством аллелей, включая систему присваивания названий HLA, разработанную в 2010 году Комитетом ВОЗ по факторам системы HLA. Термин «HLA-A2» относится к белкам HLA, кодируемым аллелями, имеющими обозначения в соответствии с этой системой присваивания названий, которые начинаются с «HLA-A*02», включая, помимо прочего, обозначения, начинающиеся с «HLA-A*02: 01», «HLA-A*02: 02», «HLA-A*02: 03», «HLA-A*02: 04», «HLA-A*02: 05», «HLA-A*02: 06», «HLA-A*02: 07», «HLA-A*02: 08», «HLA-A*02: 09», «HLA-A*02: 10» и «HLA-A*02: 11». Обозначения аллелей могут быть выделены курсивом. Обозначения аллелей, начинающиеся с «HLA-A*02:», за которыми следуют 2, 3 или 4 дополнительные цифры, могут составлять полное обозначение или начальную часть обозначения. Термин «HLA-A2» также относится к белкам HLA, идентифицированным с обозначениями, которые начинаются с «HLA-A*02» в соответствии с этой системой присваивания названий, включая, помимо прочего, обозначения “HLA-A*02:01”, “HLA-A*02:02”, “HLA-A*02:03”, “HLA-A*02:04”, “HLA-A*02:05”, “HLA-A*02:06”, “HLA-A*02:07”, “HLA-A*02:08”, “HLA-A*02:09”, “HLA-A*02:10”, и “HLA-A*02:11”.
Используемый в данном документе термин «анти-HLA-A2 антитело» относится к антителу, которое предпочтительно или специфически связывается с HLA-A2.
Используемый в данном документе термин «HLA-A*03» относится к белкам HLA, включая белки клеточной поверхности, кодируемые семейством аллелей HLA-A*03 в локусе HLA-A*комплекса HLA. Белки HLA, охваченные термином «HLA-A*03», включают белки HLA, идентифицированные как принадлежащие к типу антигена HLA-A*03 с помощью серологического тестирования или генотипирования. Дополнительные названия для типа антигена HLA-A*03 включают «HLA-A03» и «HLA-A3». Термин «HLA-A*03» относится к белкам HLA, кодируемым аллелями, имеющими обозначения в соответствии с системой именования HLA, разработанной в 2010 году Комитетом ВОЗ по факторам системы HLA, которые начинаются с “HLA-A*03:”.
Термины «HLA-A*11», «HLA-A11» и «A11», используемые в данном документе, относятся к белкам HLA, включая белки клеточной поверхности, кодируемые семейством аллелей HLA-A*11 в локусе HLA-A комплекса генов HLA. Белки HLA, охваченные терминами «HLA-A*11», «HLA-A11» и «A11», включают белки HLA, идентифицированные как принадлежащие к типу антигена HLA-A*11 с помощью серологического тестирования или генотипирования. Дополнительные названия для типа антигена HLA-A*11 включают «HLA-A11». Термины «HLA-A*11», «HLA-A11» и «A11» относятся к белкам HLA, кодируемым аллелями, имеющими обозначения в соответствии с системой присваивания названий HLA, разработанной в 2010 году Комитетом ВОЗ по факторам системы HLA, которые начинаются с «HLA-A*11:».
Термины «HLA-A*23», «HLA-A23» и «A23», используемые в данном документе, относятся к белкам HLA, включая белки клеточной поверхности, кодируемые семейством аллелей HLA-A*23 в локусе HLA-A комплекса генов HLA. Белки HLA, охваченные терминами «HLA-A*23», «HLA-A23» и «A23», включают белки HLA, идентифицированные как принадлежащие к типу антигена HLA-A*23 с помощью серологического тестирования или генотипирования. Дополнительные названия для типа антигена HLA-A*23 включают «HLA-A23». Термины «HLA-A*23», «HLA-A23» и «A23» относятся к белкам HLA, кодируемым аллелями, имеющими обозначения в соответствии с системой именования HLA, разработанной в 2010 году Комитетом ВОЗ по факторам системы HLA, которые начинаются с «HLA-A*23:».
Термины «HLA-A*25», «HLA-A25» и «A25», используемые в данном документе, относятся к белкам HLA, включая белки клеточной поверхности, кодируемые семейством аллелей HLA-A*25 в локусе HLA-A комплекса генов HLA. Белки HLA, охваченные терминами «HLA-A*25», «HLA-A25» и «A25», включают белки HLA, идентифицированные как принадлежащие к типу антигена HLA-A*25 с помощью серологического тестирования или генотипирования. Дополнительные названия для типа антигена HLA-A*25 включают «HLA-A25». Термины «HLA-A*25», «HLA-A25» и «A25» относятся к белкам HLA, кодируемым аллелями, имеющими обозначения в соответствии с системой именования HLA, разработанной в 2010 году Комитетом ВОЗ по факторам системы HLA, которые начинаются с «HLA-A*25:».
Термины «HLA-A*26», «HLA-A26» и «A26», используемые в данном документе, относятся к белкам HLA, включая белки клеточной поверхности, кодируемые семейством аллелей HLA-A*26 в локусе HLA-A комплекса генов HLA. Белки HLA, охваченные терминами «HLA-A*26», «HLA-A26» и «A26», включают белки HLA, идентифицированные как принадлежащие к типу антигена HLA-A*26 с помощью серологического тестирования или генотипирования. Дополнительные названия для типа антигена HLA-A*26 включают «HLA-A26». Термины «HLA-A*26», «HLA-A26» и «A26» относятся к белкам HLA, кодируемым аллелями, имеющими обозначения в соответствии с системой именования HLA, разработанной в 2010 году Комитетом ВОЗ по факторам системы HLA, которые начинаются с «HLA-A*26:».
Термины «HLA-A*29», «HLA-A29» и «A29», используемые в данном документе, относятся к белкам HLA, включая белки клеточной поверхности, кодируемые семейством аллелей HLA-A*29 в локусе HLA-A комплекса генов HLA. Белки HLA, охваченные терминами «HLA-A*29», «HLA-A29» и «A29», включают белки HLA, идентифицированные как принадлежащие к типу антигена HLA-A*29 с помощью серологического тестирования или генотипирования. Дополнительные названия для типа антигена HLA-A*29 включают «HLA-A29». Термины «HLA-A*29», «HLA-A29» и «A29» относятся к белкам HLA, кодируемым аллелями, имеющими обозначения в соответствии с системой именования HLA, разработанной в 2010 году Комитетом ВОЗ по факторам системы HLA, которые начинаются с «HLA-A*29:».
Термины «HLA-A*30», «HLA-A30» и «A30», используемые в данном документе, относятся к белкам HLA, включая белки клеточной поверхности, кодируемые семейством аллелей HLA-A*30 в локусе HLA-A комплекса генов HLA. Белки HLA, охваченные терминами «HLA-A*30», «HLA-A30» и «A30», включают белки HLA, идентифицированные как принадлежащие к типу антигена HLA-A*30 с помощью серологического тестирования или генотипирования. Дополнительные названия для типа антигена HLA-A*30 включают «HLA-A30». Термины «HLA-A*30», «HLA-A30» и «A30» относятся к белкам HLA, кодируемым аллелями, имеющими обозначения в соответствии с системой именования HLA, разработанной в 2010 году Комитетом ВОЗ по факторам системы HLA, которые начинаются с «HLA-A*30:».
Термины «HLA-A*31», «HLA-A31» и «A31», используемые в данном документе, относятся к белкам HLA, включая белки клеточной поверхности, кодируемые семейством аллелей HLA-A*31 в локусе HLA-A комплекса генов HLA. Белки HLA, охваченные терминами «HLA-A*31», «HLA-A31» и «A31», включают белки HLA, идентифицированные как принадлежащие к типу антигена HLA-A*31 с помощью серологического тестирования или генотипирования. Дополнительные названия для типа антигена HLA-A*31 включают «HLA-A31». Термины «HLA-A*31», «HLA-A31» и «A31» относятся к белкам HLA, кодируемым аллелями, имеющими обозначения в соответствии с системой именования HLA, разработанной в 2010 году Комитетом ВОЗ по факторам системы HLA, которые начинаются с «HLA-A*31:».
Термины «HLA-A*33», «HLA-A33» и «A33», используемые в данном документе, относятся к белкам HLA, включая белки клеточной поверхности, кодируемые семейством аллелей HLA-A*33 в локусе HLA-A комплекса генов HLA. Белки HLA, охваченные терминами «HLA-A*33», «HLA-A33» и «A33», включают белки HLA, идентифицированные как принадлежащие к типу антигена HLA-A*33 с помощью серологического тестирования или генотипирования. Дополнительные названия для типа антигена HLA-A*33 включают «HLA-A33». Термины «HLA-A*33», «HLA-A33» и «A33» относятся к белкам HLA, кодируемым аллелями, имеющими обозначения в соответствии с системой именования HLA, разработанной в 2010 году Комитетом ВОЗ по факторам системы HLA, которые начинаются с «HLA-A*33:».
Термины «HLA-A*34», «HLA-A34» и «A34», используемые в данном документе, относятся к белкам HLA, включая белки клеточной поверхности, кодируемые семейством аллелей HLA-A*34 в локусе HLA-A генного комплекса HLA. Белки HLA, охваченные терминами «HLA-A*34», «HLA-A34» и «A34», включают белки HLA, идентифицированные как принадлежащие к типу антигена HLA-A*34 с помощью серологического тестирования или генотипирования. Дополнительные названия для типа антигена HLA-A*34 включают «HLA-A34». Термины «HLA-A*34», «HLA-A34» и «A34» относятся к белкам HLA, кодируемым аллелями, имеющими обозначения в соответствии с системой именования HLA, разработанной в 2010 году Комитетом ВОЗ по факторам системы HLA, которые начинаются с «HLA-A*34:».
«Гуманизированные» формы нечеловеческих (например, мышиных) антител представляют собой химерные иммуноглобулины, цепи иммуноглобулинов или их фрагменты (такие как, например, Fv, scFv, Fab, Fab', F(ab')2 или другие антигенсвязывающие подпоследовательности антител), которые содержат минимальную последовательность, полученную из нечеловеческого иммуноглобулина. По большей части гуманизированные антитела и их фрагменты антител представляют собой человеческие иммуноглобулины (реципиентное антитело или фрагмент антитела), в которых остатки из области, определяющей комплементарность (CDR) реципиента, заменены остатками из CDR нечеловеческого вида (донорное антитело), такого как мышь, крыса или кролик, имеющего искомые специфичность, аффинность и потенциал. В некоторых случаях остатки каркасной области Fv (FR) человеческого иммуноглобулина заменены соответствующими нечеловеческими остатками. Кроме того, фрагмент гуманизированного антитела/антитела может содержать остатки, которые не обнаружены ни в реципиентном антителе, ни в импортированных CDR или каркасных последовательностях. Такие антитела предназначены для сохранения специфичности связывания нечеловеческого антитела, из которого получены области связывания, и для предотвращения иммунной реакции против нечеловеческого антитела. Эти модификации могут дополнительно улучшить и оптимизировать характеристики антитела или фрагмента антитела. Как правило, гуманизированное антитело или фрагмент этого антитела будут включать, по существу, все, по меньшей мере, один, и, как правило, два вариабельных домена, в которых все или по существу все области CDR соответствуют таковым для нечеловеческого иммуноглобулина, а вся или значительная часть FR-областей представляет собой последовательности иммуноглобулина человека. Гуманизированное антитело или фрагмент антитела также может содержать, по меньшей мере, часть константной области иммуноглобулина (Fc), обычно константной области иммуноглобулина человека. Для получения дополнительной информации см. Jones et al., Nature, 321: 522-525, 1986; Reichmann et al., Nature, 332: 323-329, 1988; Presta, Curr. Op. Struct. Biol., 2: 593-596, 1992.
«Полностью человеческий» относится к иммуноглобулину, такому как, например, антитело или фрагмент антитела, где целая молекула имеет человеческое происхождение или состоит из аминокислотной последовательности, идентичной человеческой форме антитела или иммуноглобулина. Такие антитела могут быть получены от трансгенных мышей или других животных, которые были сконструированы для производства специфических человеческих антител в ответ на введение антигена (см., например, Green et al., (1994) Nature Genet 7:13; Lonberg et 5 al., (1994) Nature 368: 856; Taylor et al., (1994) Int Immun 6: 579, все описание которых включены в настоящее описание ссылкой). Полностью человеческое антитело также может быть сконструировано способами генетической или хромосомной трансфекции, а также технологии фагового дисплея, все из которых известны в данной области (см., например, McCafferty et al., (1990) Nature 348: 552-553). Человеческие антитела могут также генерироваться активированными in vitro B-клетками (см., например, Пат. США №№ 5567610 и 5229275, которые включены ссылкой в полном объеме).
Термин «гипервариабельная область» при применении в настоящем документе относится к аминокислотным остаткам антитела, которые отвечают за связывание антигена. Гипервариабельная область обычно включает аминокислотные остатки из «определяющей комплементарность области» или «CDR» (например, примерно около остатков 24-34 (L1), 50-56 (L2) и 89-97 (L3) в VL, и примерно около 31-35 (H1), 50-65 (H2) и 95-102 (H3) в VH при нумерации в соответствии с системой нумерации Kabat; Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)); и/или остатки из «гипервариабельной петли» (например, остатки 24-34 (L1), 50-56 (L2) и 89-97 (L3) в VL и 26-32 (H1), 52-56) (H2) и 95-15 101 (H3) в VH при нумерации в соответствии с системой нумерации Chothia; Chothia and Lesk, J. Mol. Biol. 196: 901-917 (1987)); и/или остатки из «гипервариабельной петли»/CDR (например, остатки 27-38 (L1), 56-65 (L2) и 105-120 (L3) в VL и 27-38 (H1), 56). -65 (H2) и 105-120 (H3) в VH при нумерации в соответствии с системой нумерации IMGT; Lefranc, MP et al., Nucl. Acids Res. 27: 209-212 (1999), Ruiz, M. et al., Nucl. Acids Res. 28: 219-221 (2000)). Необязательно антитело имеет симметричные вставки в одной или нескольких из следующих точек 28, 36 (L1), 63, 74-75 (L2) и 123 (L3) в VL и 28, 36 (H1), 63, 74- 75 (H2) и 123 (H3) в VH при нумерации в соответствии с AHo (Honneger, A. and Plunkthun, AJ Mol. Biol. 309: 657-670 (2001)).
Термин «идентичность» или «гомология», когда используется в отношении между последовательностями двух или более полипептидов, или последовательностей нуклеиновых кислот, относится к степени родства последовательностей между полипептидами или последовательностями нуклеиновых кислот, определяемой по количеству совпадений между цепочки из двух или более аминокислотных остатков или нуклеотидных остатков. «Идентичность» измеряет процент идентичных совпадений между меньшей из двух или более последовательностей с выравниванием пробелов (если они есть), урегулированной конкретной математической моделью или компьютерной программой (то есть «алгоритмами»). Когда положение субъединицы в обеих из двух молекул занимает одна и та же мономерная субъединица; например, если положение в каждой из двух молекул ДНК занято аденином, то они гомологичны или идентичны в этом положении. Гомология между двумя последовательностями является прямой функцией числа совпадающих или гомологичных положений; например, если половина (например, пять положений в полимере из десяти субъединиц длиной) из положений в двух последовательностях гомологична, эти две последовательности являются гомологичными на 50%; если 90% положений (например, 9 из 10) совпадают или гомологичны, две последовательности гомологичны на 90%. Идентичность родственных полипептидов или последовательностей нуклеиновых кислот можно легко рассчитать известными способами. Такие способы включают, без ограничения указанным, способы, описанные в Computational Molecular Biology, Lesk, A. M., ed., Oxford University Press, New York, 1988; Biocomputing: Informatics and Genome Projects, Smith, D. W., ed., Academic Press, New York, 1993; Computer Analysis of Sequence Data, Part 1, Griffin, A. M., and Griffin, H. G., eds., Humana Press, New 10 Jersey, 1994; Sequence Analysis in Molecular Biology, von Heinje, G., Academic Press, 1987; Sequence Analysis Primer, Gribskov, M. and Devereux, J., eds., M. Stockton Press, New York, 1991; и Carillo et al., SIAM J. Applied Math. 48, 1073 (1988). Предпочтительные способы определения идентичности предназначены для обеспечения наибольшего соответствия между протестированными последовательностями. Способы определения идентичности описаны в общедоступных компьютерных программах. Предпочтительные компьютерные программные способы для определения идентичности между двумя последовательностями включают пакет программ GCG, включая GAP (Devereux et al., Nucl. Acid. Res. \2, 387 (1984); Genetics Computer Group, University of Wisconsin, Madison, Wis.), BLASTP, BLASTN и FASTA (Altschul et al., J. MoI. Biol. 215, 403-410 (1990)). Программа BLASTX общедоступна в Национальном центре биотехнологической информации (NCBI) и других источниках (Руководство BLAST, Altschul et al., NCB/NLM/NIH Bethesda, Md. 20894; Altschul et al., выше). Хорошо известный алгоритм Смита-Уотермана также может быть использован для определения идентичности.
Используемый в данном документе термин «иммунные клетки» обычно включает белые кровяные клетки (лейкоциты), которые получены из гемопоэтических стволовых клеток (HSC), продуцируемых в костном мозге. Примеры иммунных клеток включают, без ограничения указанным, лимфоциты (Т-клетки, В-клетки и природные клетки-киллеры (NK)) и клетки, полученные из миелоидов (нейтрофилы, эозинофилы, базофилы, моноциты, макрофаги, дендритные клетки).
Используемый в данном документе термин «иммунная эффекторная клетка» относится к клетке иммунной системы, которая находится в форме, способной вызывать специфический иммунный ответ.
Используемый в данном документе термин «иммунный ответ» включает опосредованные Т-клетками и/или В-клеточные иммунные ответы. Типичные иммунные ответы включают Т-клеточные ответы, например, выработку цитокинов и клеточную цитотоксичность. Кроме того, термин «иммунный ответ» включает иммунные ответы, на которые косвенно влияют активация Т-клеток, например, выработка антител (гуморальные ответы) и активация чувствительных к цитокинам клеток, например, макрофагов. Иммунные клетки, участвующие в иммунном ответе, включают лимфоциты, такие как В-клетки и Т-клетки (CD4+, CD8+, клетки Th1 и Th2); антигенпрезентирующие клетки (например, профессиональные антигенпрезентирующие клетки, такие как дендритные клетки, макрофаги, В-лимфоциты, клетки Лангерганса, и непрофессиональные антигенпрезентирующие клетки, такие как кератиноциты, эндотелиальные клетки, астроциты, фибробласты, олигодендроциты); естественные клетки-киллеры; миелоидные клетки, такие как макрофаги, эозинофилы, тучные клетки, базофилы и гранулоциты.
Используемый в данном документе термин «иммунная аккомодация» относится к состоянию реципиента трансплантата, при котором трансплантат органа или ткани функционирует нормально, несмотря на наличие у реципиента антител, специфичных для трансплантата органа или ткани.
Используемый в данном документе термин «иммунологическая толерантность» или «иммунная толерантность» относится к способам, выполняемым на части подвергнутых лечению объектов по сравнению с необработанными объектами, где: а) сниженный уровень специфического иммунологического ответа (который считается опосредованным, по меньшей мере, частично антиген-специфическими эффекторными Т-лимфоцитами, В-лимфоцитами, антителами или их эквивалентами); b) задержка начала или прогрессирования специфического иммунологического ответа; или c) сниженный риск возникновения или прогрессирования специфического иммунологического ответа. «Специфическая» иммунологическая или иммунная толерантность возникает, когда иммунологическая или иммунная толерантность вызывается преимущественно против определенных антигенов по сравнению с другими.
Термин «индуцибельный промотор» относится к нуклеотидной последовательности, которая, когда функционально связана с полинуклеотидом, который кодирует или специфицирует генный продукт, заставляет генный продукт продуцироваться в клетке, по существу, только когда присутствует индуктор, который соответствует промотору, присутствующему в клетке.
Используемый в настоящем документе «инструкции» включает публикацию, запись, диаграмму или любой другой носитель выражения, который можно использоваться для сообщения о полезности композиций и способов по изобретению. Инструкции набора по изобретению может, например, быть прикреплен к контейнеру, который включает антитело, клетку и/или композицию по изобретению, или поставляться вместе с контейнером, который включает антитело, клетку и/или композицию изобретения. В качестве альтернативы, инструкции могут быть доставлены отдельно от контейнера с целью совместного использования реципиентом учебного материала и антитела, клетки и/или композиции.
«Интактным» антителом является антитело, которое включает антигенсвязывающий сайт, а также CL и, по меньшей мере, константные домены тяжелой цепи, CH1, CH2 и CH3. Константные домены могут представлять собой константные домены с нативной последовательностью (например, константные домены с нативной последовательностью человека) или их варианты с аминокислотной последовательностью.
«Внутриклеточный сигнальный домен», при использовании в данном документе, относится к внутриклеточной части молекулы. Внутриклеточный сигнальный домен генерирует сигнал, который способствует иммунной функции клетки, содержащей химерный рецептор. Примеры иммунной функции в химерном рецепторном T-клетке могут включать цитолитическую активность, супрессивную активность и активность хелпера, включая секрецию цитокинов.
Используемый в данном документе термин «транскрибированная РНК in vitro» относится к РНК, предпочтительно мРНК, которая была синтезирована in vitro. Обычно транскрибируемая РНК in vitro генерируется из транскрипционного вектора in vitro. Вектор для транскрипции in vitro включает матрицу, которая используется для генерирования транскрибированной РНК in vitro.
Термин «выделенный» означает измененный или удаленный из естественного состояния. Например, нуклеиновая кислота или пептид, естественно присутствующие в живом животном, не выделены, но та же самая нуклеиновая кислота или пептид, частично или полностью отделенные от сосуществующих материалов их естественного состояния, являются выделенными. Выделенная нуклеиновая кислота или пептид могут существовать по существу в очищенной форме или могут существовать в ненативной среде, такой как, например, клетка-хозяин. Как правило, препарат выделенной нуклеиновой кислоты или пептида включает нуклеиновую кислоту или пептид с чистотой, по меньшей мере, около 80%, по меньшей мере, около 85%, по меньшей мере, около 90%, по меньшей мере, около 95%, более 95% чистоты, более 96% чистоты, более 97% чистоты, более 98% чистоты или более 99% чистоты.
«Выделенное антитело» представляет собой антитело, которое было отделено и/или извлечено из компонента его естественной среды. Загрязняющие компоненты его естественной среды представляют собой материалы, которые могут мешать диагностическому или терапевтическому применению антитела, и могут включать ферменты, гормоны и другие белковые или небелковые компоненты. В предпочтительных воплощениях антитело является очищенным: (1) до более 95 масс.% антитела, как определено методом Лоури, и наиболее предпочтительно более 99 масс.%; (2) до степени, достаточной для получения, по меньшей мере, 15 остатков N-концевой или внутренней аминокислотной последовательности с использованием секвенатора с вращающимся стаканом; или (3) до гомогенности, как показано SDS-PAGE в восстанавливающих или невосстанавливающих условиях и с использованием окрашивания Кумасси синим или, предпочтительно, окрашивания серебром. Выделенное антитело включает антитело in situ в рекомбинантных клетках, поскольку, по меньшей мере, один компонент природной среды антитела не будет присутствовать. Обычно, однако, выделенное антитело будет получено, по меньшей мере, одной стадией очистки.
«Выделенная нуклеиновая кислота» или «выделенная нуклеотидная последовательность» представляет собой нуклеиновую кислоту, которая в значительной степени отделена от других последовательностей геномной ДНК, а также от белков или комплексов, таких как рибосомы и полимеразы, которые естественным образом сопровождают нативную последовательность. Термин охватывает последовательность нуклеиновой кислоты, которая была удалена из ее естественной среды, и включает рекомбинантные или клонированные изоляты ДНК и химически синтезированные аналоги или аналоги, биологически синтезированные гетерологичными системами. По существу чистая нуклеиновая кислота включает выделенные формы нуклеиновой кислоты. Конечно, это относится к нуклеиновой кислоте, которая была первоначально выделена, и не исключает гены или последовательности, которые впоследствии добавляются к выделенной нуклеиновой кислоте руками человека.
«Выделенный полипептид» представляет собой тот, который был идентифицирован и отделен и/или извлечен из компонента его естественной среды. В предпочтительных воплощениях выделенный полипептид будет очищен (1) до содержания более 95 масс.% полипептида, что определяется методом Лоури, и наиболее предпочтительно более 99 масс.% (2) до степени, достаточной для получения, по меньшей мере, 15 остатков N-концевой или внутренней аминокислотной последовательности с использованием секвенатора с вращающимся стаканом или (3) до гомогенности с помощью SDS-PAGE в восстанавливающих или невосстанавливающих условиях с использованием Кумасси синего или, предпочтительно, окрашивания серебром. Выделенный полипептид включает полипептид in situ в рекомбинантных клетках, поскольку, по меньшей мере, один компонент природной среды полипептида не будет присутствовать. Обычно, однако, выделенный полипептид будет получен, по меньшей мере, на одной стадии очистки.
Используемый в данном документе термин «кноттин» (который также может называться ингибиторным цистиновым узлом) относится к миметику антитела, содержащему структурный мотив белка, содержащий три дисульфидных мостика.
Используемый в данном документе термин «пептид домена Куница» относится к типу миметиков антител и основан на активных доменах белков, ингибирующих функцию протеаз.
Термин «лентивирус» относится к роду семейства Retroviridae. Лентивирусы уникальны среди ретровирусов по способности инфицировать неделящиеся клетки; они могут доставлять значительное количество генетической информации в ДНК клетки-хозяина, поэтому они являются одним из наиболее эффективных способов для вектора доставки генов. Примеры лентивирусов включают, без ограничения указанным, HIV, SIV и FIV.
Термин «лентивирусный вектор» относится к вектору, полученному, по меньшей мере, из части генома лентивируса, включая, в частности, самоинактивирующийся лентивирусный вектор, предоставленный в Milone et al., Mol. Ther. 17 (8): 1453-1464 (2009). Другие примеры лентивирусных векторов, которые могут использоваться в клинике, включают, без ограничения указанным, технологию доставки генов LENTIVECTOR® от Oxford BioMedica, векторную систему LENTIMAX™ от Lentigen и т.п. Неклинические типы лентивирусных векторов также доступны и будут известны специалисту в данной области.
Термин «лиганд» относится к члену пары лиганд/рецептор и связывается с другим членом пары.
Используемый в данном документе термин «моноклональное антитело» относится к антителу, полученному из популяции по существу гомогенных антител, то есть отдельные антитела, содержащиеся в популяции, являются идентичными, за исключением возможных встречающихся в природе мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела являются высокоспецифичными и направлены против одного антигенного сайта. Кроме того, в отличие от препаратов поликлональных антител, которые включают разные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты на антигене. В дополнение к их специфичности, моноклональные антитела имеют то преимущество, что они могут быть синтезированы без загрязнения другими антителами. Модификатор «моноклональный» не следует истолковывать как требующий получения антитела каким-либо конкретным способом. Например, моноклональное антитело может быть получено по методике гибридом, впервые описанной Kohler et al., Nature, 256: 495 (1975), или может быть получено с использованием способов рекомбинантной ДНК в клетках бактерий, эукариотических животных или растений (см., например, Пат. США № 4816567). «Моноклональное антитело» также может быть выделено из библиотек фаговых антител с использованием методик, описанных, например, в Clackson et al., Nature, 352: 624-628 (1991) и Marks et al., J. Mol. Biol., 222: 581-597 (1991). Моноклональные антитела в данном документе включают «химерные» антитела.
Термин «нуклеиновая кислота» или «полинуклеотид» относится к полимеру нуклеотидов, ковалентно связанных фосфодиэфирными связями, таким как дезоксирибонуклеиновые кислоты (ДНК) или рибонуклеиновые кислоты (РНК), в одноцепочечной или двухцепочечной форме. За исключением случаев конкретного ограничения, термин охватывает нуклеиновые кислоты, содержащие известные аналоги природных нуклеотидов, которые обладают свойствами связывания, сходными с эталонной нуклеиновой кислотой, и метаболизируются способом, подобно встречающимся в природе нуклеотидам. Если не указано иное, конкретная последовательность нуклеиновой кислоты также неявно включает ее консервативно модифицированные варианты (например, замены вырожденных кодонов), аллели, ортологи, SNP и комплементарные последовательности, а также явно указанная последовательность. В частности, вырожденные замены кодонов могут быть достигнуты путем генерирования последовательностей, в которых третье положение одного или нескольких выбранных (или всех) кодонов замещено остатками смешанного основания и/или дезоксиинозина (Batzer et al., Nucleic Acid Res. 19:5081 (1991); Ohtsuka et al., J. Biol. Chem. 260:2605-2608 (1985); и Rossolini et al., Mol. Cell. Probes 8:91-98 (1994)).
«Нанотело» хорошо известно в данной области техники и относится к полученному из антител терапевтическому белку, который включает уникальные структурные и функциональные свойства природных антител, состоящих только из тяжёлых цепей. Эти антитела, состоящие только из тяжёлых цепей, содержат один вариабельный домен (VHH) и два константных домена (CH2 и CH3).
Полинуклеотид с «нативной последовательностью» представляет собой тот, который имеет ту же нуклеотидную последовательность, что и полинуклеотид, полученный из природы. Полипептид с «нативной последовательностью» представляет собой полипептид с той же аминокислотной последовательностью, что и полипептид (например, антитело), полученный из природы (например, из любого вида). Такие полинуклеотиды и полипептиды с нативной последовательностью могут быть выделены из природы или могут быть получены рекомбинантными или синтетическими способами.
Термины «функционально связанный» или «контроль транскрипции» относятся к функциональной связи между регуляторной последовательностью и последовательностью гетерологичной нуклеиновой кислоты, приводящей к экспрессии последней. Например, первая последовательность нуклеиновой кислоты функционально связана со второй последовательностью нуклеиновой кислоты, когда первая последовательность нуклеиновой кислоты находится в функциональной связи со второй последовательностью нуклеиновой кислоты. Например, промотор функционально связан с кодирующей последовательностью, когда промотор воздействует на транскрипцию или экспрессию кодирующей последовательности. Функционально связанные последовательности ДНК могут быть смежными друг с другом и, например, при необходимости соединять две белок-кодирующие области, которые находятся в одной рамке считывания.
Используемый в данном документе термин «функциональная толерантность» относится к клинической ситуации, когда имеется стабильная функция трансплантата, при которой отсутствуют гистологические признаки отторжения, включая острое или хроническое отторжение, при отсутствии какой-либо иммуносупрессивной лекарственной терапии в течение, по меньшей мере, 1 года, в иммунокомпетентном хозяине способном реагировать на другие вызовы, включая инфекции.
Термины «пептид», «полипептид» и «белок» используются взаимозаменяемо и относятся к соединению, состоящему из аминокислотных остатков, ковалентно связанных пептидными связями. Полипептид не ограничен конкретной длиной: он должен содержать, по меньшей мере, две аминокислоты, и не накладывается никаких ограничений на максимальное количество аминокислот, которые могут включать последовательность полипептида. Пептиды, олигопептиды и белки включены в определение полипептида, и такие термины могут использоваться в данном документе взаимозаменяемо, если специально не указано иное. Используемый в данном документе термин относится как к коротким цепям, которые также обычно упоминаются в данной области, например, как пептиды, олигопептиды и олигомеры, так и к более длинным цепям, которые обычно упоминаются в данной области как белки, и которых существует множество типов. В одном воплощении, при использовании в данном документе, термин «пептиды» относится к линейному полимеру из аминокислот, связанных друг с другом пептидными связями, предпочтительно с длиной цепи менее около 50 аминокислотных остатков; «полипептид» относится к линейному полимеру, по меньшей мере, из 50 аминокислот, связанных друг с другом пептидными связями; и белок конкретно относится к функциональному объекту, образованному из одного или нескольких пептидов или полипептидов, необязательно гликозилированных и, необязательно, из неполипептидных кофакторов. Этот термин также не относится или не исключает модификации полипептида после экспрессии, например, гликозилирования, ацетилирования, фосфорилирования и т.п., а также другие модификации, известные в данной области, как встречающиеся в природе, так и не встречающиеся в природе. Полипептид может быть целым белком или его подпоследовательностью. «Полипептиды» включают, например, биологически активные фрагменты, по существу гомологичные полипептиды, олигопептиды, гомодимеры, гетеродимеры, варианты полипептидов, модифицированные полипептиды, производные, аналоги, слитые белки наряду с прочим. Полипептид включает природный пептид, рекомбинантный пептид или их комбинацию. Конкретные полипептиды, представляющие интерес в контексте данного изобретения, представляют собой аминокислотные подпоследовательности, содержащие CDR и способные связывать антиген.
Термин «фармацевтически приемлемый наполнитель» или «фармацевтически приемлемый носитель» относится к наполнителю, который не вызывает неблагоприятных, аллергических или других неблагоприятных реакций при введении животному, предпочтительно человеку. Термин включает любые растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты, изотонические агенты и агенты, замедляющие абсорбцию, и т.п. Для введения человеку препараты должны соответствовать стандартам стерильности, пирогенности, общей безопасности и чистоты, как того требуют регулирующие органы, такие как, например, FDA или EMA.
Используемый в данном документе термин «поли (А)» представляет собой серию монофосфата аденозина, присоединенного к мРНК. В предпочтительном воплощении конструкции для временной экспрессии полиА составляет от 50 до 5000 аденозинмонофосфата, предпочтительно больше или равно 64, более предпочтительно больше или равно 100, наиболее предпочтительно больше или равно 300 или 400 аденозинмонофосфатов. Поли (А) последовательности могут быть модифицированы химически или ферментативно, чтобы модулировать функциональность мРНК, такую как локализация, стабильность или эффективность трансляции.
Используемый в данном документе термин «полиаденилирование» относится к ковалентной связи полиаденилильного фрагмента или его модифицированного варианта с молекулой информационной РНК. У эукариотических организмов большинство молекул информационной РНК (мРНК) полиаденилированы на 3'-конце. 3'-поли (А) хвост представляет собой длинную последовательность адениннуклеотидов (часто несколько сотен), добавленных к пре-мРНК под действием фермента полиаденилат-полимеразы. У высших эукариот хвост поли(A) добавляется к транскриптам, которые содержат специфическую последовательность, сигнал полиаденилирования. Хвост поли (А) и связанный с ним белок помогают защитить мРНК от деградации экзонуклеазами. Полиаденилирование также важно для терминации транскрипции, экспорта мРНК из ядра и трансляции. Полиаденилирование происходит в ядре сразу после транскрипции ДНК в РНК, но дополнительно может также происходить позднее в цитоплазме. После прекращения транскрипции цепь мРНК расщепляется под действием эндонуклеазного комплекса, связанного с РНК-полимеразой. Сайт расщепления обычно характеризуется наличием последовательности оснований AAUAAA вблизи сайта расщепления. После того как мРНК была расщеплена, остатки аденозина добавляются к свободному 3' концу в сайте расщепления.
Термин «промотор/регуляторная последовательность» относится к последовательности нуклеиновой кислоты (такой как, например, последовательность ДНК), распознаваемой синтетическим механизмом клетки, или введенным синтетическим механизмом, необходимым для инициации специфической транскрипции полинуклеотидной последовательности, тем самым обеспечивая экспрессию продукта гена, функционально связанного с промотором/регуляторной последовательностью. В некоторых случаях эта последовательность может быть последовательностью основного промотора, а в других случаях эта последовательность может также включать последовательность энхансера и другие регуляторные элементы, которые необходимы для экспрессии продукта гена. Промотор/регуляторная последовательность может, например, представлять собой последовательность, которая экспрессирует генный продукт тканеспецифическим образом.
Используемый в данном документе термин «реактивность» относится к способности антитела реагировать (то есть связываться) с молекулой (например, специфически связываться с молекулой). Первое антитело обладает «меньшей реакционной способностью» к молекуле (например, молекуле HLA), чем второе антитело, когда первое антитело проявляет пониженное связывание с молекулой по сравнению со вторым антителом. Известны подходы для быстрого сравнения реактивности первого и второго антител с одной или несколькими конкретными молекулами HLA. Один примерный подход представлен в разделе «Примеры» в данном документе, где гранулы FlowPRA® Single Antigen (One Lambda) были использованы для исследования антител на способность реагировать (или связываться) с конкретными молекулами HLA. Такие проточные цитометрические подходы поддаются высокопроизводительному анализу реактивности антител.
Термин «рекомбинантный белок или пептид» относится к белку или пептиду (например, антителу или CAR), который получают с использованием технологии рекомбинантной ДНК, такой как, например, белок или пептид (например, антитело или CAR) экспрессируемые бактериофагом или дрожжевой системой экспрессии. Термин также следует понимать как означающий белок или пептид (например, антитело или CAR), который был получен в результате синтеза молекулы ДНК, кодирующей белок или пептид (например, антитело или CAR), и где молекула ДНК экспрессирует белок или пептид (например, антитело или CAR) или аминокислотную последовательность, обуславливающую белок или пептид (например, антитело или CAR), где последовательность ДНК или аминокислотная последовательность были получены с использованием технологии рекомбинантной ДНК или аминокислотной последовательности, доступной и хорошо известной в данной области.
Используемый в данном документе термин «регуляторная иммунная клетка» относится к иммунной клетке, которая действует «регуляторным» способом, подавляя активацию иммунной системы и, таким образом, поддерживает гомеостаз иммунной системы и толерантность к аутоантигенам. «Регуляторные иммунные клетки» также могут оказывать влияние на неиммунные клетки, что приводит к улучшению клинического состояния, например, способствует восстановлению или регенерации тканей. Регуляторные иммунные клетки могут включать, без ограничения указанным, регуляторные T-клетки, CD4+ регуляторные T-клетки, CD8+ регуляторные T-клетки, регуляторные γδ T-клетки, регуляторные DN T-клетки, регуляторные B-клетки, регуляторные NK-клетки, регуляторные макрофаги и регуляторные дендритные клетки.
«Регуляторный T-лимфоцит», «регуляторная T-клетка», «T-регуляторная клетка», «Treg-клетка» или «Treg», используемые в настоящем изобретении, являются синонимами и имеют стандартное определение, используемое в данной области. Treg-клетки представляют собой специализированную субпопуляцию Т-клеток, которые действуют «регуляторным» способом, подавляя активацию иммунной системы и тем самым поддерживая гомеостаз иммунной системы и толерантность к аутоантигенам. Treg иногда называют супрессорными Т-клетками. Treg-клетки часто, но не всегда, характеризуются экспрессией фактора транскрипции семейства forkhead, Foxp3 (forkhead бокс p3). Они также могут экспрессировать поверхностные белки CD4 или CD8. Они также могут экспрессировать CD25. При использовании в настоящем документе, и если не указано иное, Treg включают «естественные» Treg, которые развиваются в тимусе, индуцированные/адаптивные/периферические Treg, которые возникают в результате процесса дифференцировки, который происходит вне тимуса (например, в тканях или вторичном лимфоидном органе, или в лабораторных условиях при определенных условиях культивирования), и Treg, которые были созданы с использованием технологии рекомбинантных ДНК. Встречающиеся в природе Treg-клетки (CD4+ CD25+ Foxp3+) возникают, как и все другие Т-клетки в тимусе. Напротив, индуцированные/адаптивные/периферические Treg-клетки (которые включают CD4+ CD25 + Foxp3 + Treg, Tr1-клетки, Th3-клетки и другие) возникают вне тимуса. Одним из способов индукции Treg является воздействие T-эффекторных клеток на IL-10 или TGF-β. Т-клетки также могут быть превращены в Treg-клетки путем трансфекции или трансдукции гена Foxp3 в смешанную популяцию Т-клеток. Т-клетка, которая вызывает экспрессию Foxp3, принимает фенотип Treg, и такие рекомбинантные Treg также определены в данном документе как «Treg».
Термин «отторжение» относится к состоянию, в котором пересаженный орган или ткань не воспринимается организмом реципиента. Отторжение происходит в результате воздействия иммунной системы реципиента на пересаженный орган или ткань. Отторжение может происходить от нескольких дней до нескольких недель после трансплантации (острое) или от нескольких месяцев до нескольких лет после трансплантации (хроническое).
Термин «одноцепочечный Fv» или «scFv» относится к слитому белку, содержащему, по меньшей мере, один фрагмент антитела, содержащий вариабельную область легкой цепи (VL), и, по меньшей мере, один фрагмент антитела, содержащий вариабельную область тяжелой цепи (VH), где вариабельные области легкой и тяжелой цепи непрерывно связаны в одну полипептидную цепь. В одном воплощении полипептид scFv дополнительно включает полипептидный линкер между доменами VH и VL, который позволяет scFv формировать желаемую структуру для связывания антигена, например, синтетический линкер, например, короткий гибкий полипептидный линкер. Таким образом, scFv способен экспрессироваться в виде одноцепочечного полипептида и сохраняет специфичность интактного антитела, из которого он получен. Если не указано иное, используемый в данном документе scFv может иметь вариабельные области VL и VH в любом порядке, например, относительно N-концевых и С-концевых концов полипептида, scFv может содержать VL-линкер-VH или может содержать VH-линкер-VL.
В данном документе антитело или CAR называется «иммуноспецифичным», «специфичным для» или «специфически связывающим» антиген, если он реагирует на детектируемом уровне с антигеном, предпочтительно с константой аффинности Ka, большей или равной около 104 М-1 или большей или равной около 105 М-1, большей или равной около 106 М-1, большей или равной около 107 М-1 или большей или равной около 108 М-1, или большей или равной около 109 М-1, или большей или равной около 1010 М-1. Аффинность антитела к его когнатному антигену также обычно выражается в виде константы диссоциации Kd, и в некоторых воплощениях антитело специфически связывается с антигеном, если оно связывается с Kd, меньшим или равным 10-4 М, меньшим или равным около 10-5 М, меньшим или равным около 10-6 М, меньшим или равным около 10-7 М, или меньшим или равным около 10-8 М, или меньшим или равным около 5,10-9 М, или меньшим или равным около 10-9 М, или меньшим или равным около 5,10-10 М, или меньшим или равным около 10-10 М. Аффинность антител или CAR может быть легко определено с использованием обычных методик, например, таких описано Scatchard et al., (Ann. N.Y. Acad. Sci. USA 51:660 (1949)). Свойства связывания антитела с антигенами, клетками или их тканями, как правило, могут быть определены и оценены с использованием способов иммунодетекции, включая, например, анализы на основе иммунофлюоресценции, такие как иммуногистохимия (IHC) и/или флуоресцентно-активированная сортировка клеток (FACS). В одном воплощении термин «специфически связывается» относится к антителу, CAR или лиганду, который распознает и связывается с партнером связывания, присутствующим в образце, но где антитело или CAR или лиганд по существу не распознает или не связывает другие молекулы в образце.
Термин «путь передачи сигнала» относится к биохимическим отношениям между различными молекулами передачи сигнала, которые играют роль в передаче сигнала от одной части клетки к другой части клетки.
Термин «сигнальный домен» относится к функциональной части белка, которая действует путем передачи информации в клетке, чтобы регулировать клеточную активность через определенные сигнальные пути, генерируя вторичные мессенджеры или функционируя как эффекторы, реагирующие на такие мессенджеры.
Используемый в данном документе термин «стволовая клетка» обычно включает плюрипотентные или мультипотентные стволовые клетки. «Стволовые клетки» включают, без ограничения указанным, эмбриональные стволовые клетки (ES); мезенхимальные стволовые клетки (MSC); индуцированные плюрипотентные стволовые клетки (iPS); и коммитированные клетки-предшественники (гематопоэтические стволовые клетки (HSC); клетки, полученные из костного мозга, и т.д.).
Термин «стимуляция» относится к первичному ответу, индуцированному связыванием стимулирующей молекулы (например, комплекса TCR/CD3 или химерного рецептора) с его когнатным лигандом, тем самым опосредуя событие передачи сигнала, такое как, без ограничения указанным, передачу сигнала через комплекс TCR/CD3 или передачу сигнала через сигнальные домены химерного рецептора. Стимуляция может опосредовать измененную экспрессию определенных молекул.
Термин «стимулирующая молекула» относится к молекуле, экспрессируемой иммунной клеткой (например, T-клеткой, NK-клеткой или B-клеткой), которая обеспечивает цитоплазматическую сигнальную последовательность (последовательности), которая регулирует активацию иммунной клетки стимулирующим образом, по меньшей мере, в некотором аспекте сигнального пути иммунных клеток. В одном аспекте сигнал является первичным сигналом, который инициируется, например, связыванием комплекса TCR/CD3 с молекулой МНС, загруженной пептидом, и который приводит к опосредованию ответа Т-клеток, включая, без ограничения указанным, пролиферацию, активацию, дифференцировку и т.п. Первичная цитоплазматическая сигнальная последовательность (также называемая «первичным сигнальным доменом»), которая действует стимулирующим образом, может содержать сигнальный мотив, известный как иммунорецепторный мотив активации на основе тирозина или ITAM.
Термин «объект» предназначен для включения живых организмов, у которых может быть вызван иммунный ответ. В одном воплощении объект представляет собой теплокровное животное, предпочтительно млекопитающее (включая людей, домашних и сельскохозяйственных животных и животных зоопарка, спортивных или домашних животных, таких как собаки, кошки, крупный рогатый скот, лошади, овцы, свиньи, козы, кролики и т.д.), а более предпочтительно - людей. В одном воплощении объект может быть «пациентом», то есть теплокровным животным, более предпочтительно человеком, который ожидает получения, или получает медицинскую помощь, или был/является/будет объектом медицинской процедуры или отслеживается из-за развития целевого заболевания или состояния. В одном воплощении объект представляет собой взрослого человека (например, объект старше 18 лет). В другом воплощении объект представляет собой ребенка (например, объект младше 18 лет). В одном воплощении объект является мужчиной. В другом воплощении объект является женщиной.
Термин «по существу очищенная клетка» относится к клетке, которая по существу не включает других типов клеток. По существу очищенная клетка также относится к клетке, которая была отделена от клеток других типов, с которыми она обычно связана в своем естественном состоянии. В одном воплощении по существу очищенная клетка относится к клетке, которая, по меньшей мере, на около 75% свободна, на 80% свободна или на 85% свободна, и предпочтительно около на 90%, 95%, 96%, 97%, 98% или 99. % свободна от других типов клеток, с которыми она обычно связана в своем естественном состоянии. В некоторых случаях популяция по существу очищенных клеток относится к гомогенной популяции клеток. В одном воплощении популяция по существу очищенных клеток относится к популяции клеток, по меньшей мере, на около 75% гомогенной, на 80% гомогенной или на 85% гомогенной, и предпочтительно на около 90%, 95%, 96%, 97%, 98%, или 99% гомогенной. В других случаях этот термин относится просто к клеткам, которые были отделены от клеток, с которыми они естественным образом связаны в своем естественном состоянии. В некоторых аспектах клетки культивируют in vitro. В других аспектах клетки не культивируются in vitro.
Термин «Т-клетки» включает все типы иммунных клеток, экспрессирующих CD3, включая T-хелперные клетки (CD4+ клетки), CD8+ T-клетки (например, цитотоксические CD8+ T-клетки, регуляторные CD8+ T-клетки), T-регуляторные клетки (Treg), гамма-дельта Т-клетки и двойные отрицательные Т-клетки.
Термины «терапевтически эффективное количество» относятся к количеству иммунных клеток или композиции, как описано в настоящем документе, эффективному для достижения конкретного биологического результата. Таким образом, термины «эффективное количество» или «терапевтически эффективное количество» означают уровень или количество клеток или композиций, которые нацелены, не вызывая значительных отрицательных или неблагоприятных побочных эффектов, на мишени, (1) задерживая или предотвращая начало целевого заболевания или состояния; (2) замедления или остановки прогрессирования, обострения или ухудшения одного или нескольких симптомов целевого заболевания или состояния; (3) вызывая улучшение симптомов целевого заболевания или состояния; (4) снижая тяжесть или частоту целевого заболевания или состояния; или (5) излечивая целевое заболевание или состояние. Терапевтически эффективное количество может быть введено до начала целевого заболевания или состояния для профилактического или превентивного действия. Альтернативно или дополнительно, терапевтически эффективное количество может быть введено после начала целевого заболевания или состояния для терапевтического действия.
Термин «трансфицированный» или «трансформированный» или «трансдуцированный» относится к процессу, посредством которого экзогенная нуклеиновая кислота переносится или вводится в клетку-хозяина. «Трансфицированная» или «трансформированная» или «трансдуцированная» клетка представляет собой клетку, которая была трансфицирована, трансформирована или трансдуцирована экзогенной нуклеиновой кислотой. Клетка включает первичную клетку объекта и ее потомство.
Термин «трансферный вектор» относится к композиции вещества, которая включает выделенную нуклеиновую кислоту, и которая может быть использована для доставки выделенной нуклеиновой кислоты внутрь клетки. В данной области известны многочисленные векторы, включая, без ограничения указанным, линейные полинуклеотиды, полинуклеотиды, связанные с ионными или амфифильными соединениями, плазмиды и вирусы. Таким образом, термин «трансферный вектор» включает автономно реплицирующуюся плазмиду или вирус. Термин также следует толковать так, чтобы он дополнительно включал неплазмидные и невирусные соединения, которые облегчают перенос нуклеиновой кислоты в клетки, такие как, например, полилизиновое соединение, липосома и т.п. Примеры векторов переноса вируса включают, без ограничения указанным, аденовирусные векторы, аденоассоциированные вирусные векторы, ретровирусные векторы, лентивирусные векторы и т.п.
Используемый в данном документе термин «транзиторная» относится к экспрессии неинтегрированного трансгена в течение периода часов, дней или недель, где период времени экспрессии меньше, чем период времени для экспрессии гена, если он интегрирован в геном или содержится в стабильном плазмидном репликоне в клетке-хозяине.
Термин «трансплантат», используемый в настоящем документе, относится к клеткам, тканям или органам, которые вводятся индивидууму. Источником трансплантированного материала могут быть культивируемые клетки, клетки от другого индивидуума или клетки от того же индивидуума (например, после того, как клетки культивируются in vitro). Примерами трансплантации органов являются почка, печень, сердце, легкое и поджелудочная железа. Примером трансплантации ткани являются островки. Примером трансплантации клеток является аллогенная трансплантация гемопоэтических стволовых клеток.
«Лечить» или «лечение» относится как к терапевтическому лечению, так и к профилактическим или превентивным мерам; где целью является предотвращение или замедление (уменьшение) целевого патологического состояния или расстройства. Таким образом, в одном воплощении эти термины относятся к уменьшению или ослаблению прогрессирования, тяжести и/или продолжительности целевого заболевания или состояния, или ослаблению одного или нескольких симптомов (предпочтительно, одного или нескольких заметных симптомов) целевого заболевания или состояния, возникающего в результате введения одной или нескольких терапий (например, одного или нескольких терапевтических агентов, таких как Treg-клетки по изобретению). В конкретных воплощениях термины «лечить» и «лечение» относятся к улучшению, по меньшей мере, одного измеримого физического параметра целевого заболевания или состояния. В других воплощениях термины «лечить» и «лечение» относятся к ингибированию прогрессирования целевого заболевания или состояния либо физически, например, посредством стабилизации различимого симптома, либо физиологически, например, посредством стабилизации физического параметра, либо и тем и другим. Те, кто нуждается в лечении, включают тех, у кого уже есть расстройство, а также тех, кто склонен иметь это расстройство, или тех, у кого расстройство должно быть предотвращено. Объект успешно «лечится», если после получения терапевтического количества клеток или композиций согласно настоящему изобретению объект демонстрирует наблюдаемое и/или измеримое снижение количества патогенных клеток; уменьшение процента от общего количества клеток, которые являются патогенными; облегчение в некоторой степени одного или нескольких симптомов, связанных с конкретным заболеванием или состоянием; снижение заболеваемости и смертности и/или улучшение качества жизни. Вышеуказанные параметры для оценки успешного лечения и улучшения заболевания легко поддаются измерению с помощью рутинных процедур, знакомых врачу.
«Унитело» хорошо известно в данной области и относится к фрагменту антитела, в котором отсутствует шарнирная область антител IgG4. Удаление области шарнира приводит к молекуле, которая по существу в два раза меньше традиционных антител IgG4 и имеет унивалентную область связывания, а не область двухвалентного связывания антител IgG4.
Термин «вариабельный» относится к тому факту, что определенные сегменты V-доменов сильно различаются по последовательности среди антител. V-домен опосредует связывание антигена и определяет специфичность конкретного антитела к его конкретному антигену. Однако вариабельность неравномерно распределена по диапазону от 110 до 130 аминокислот вариабельных доменов. Вместо этого V-области состоят из относительно инвариантных участков, называемых каркасными областями (FR) из 15-30 аминокислот, разделенных более короткими областями чрезмерной вариабельности, называемыми «гипервариабельными областями», каждая из которых имеет длину 9-12 аминокислот. Каждый из вариабельных доменов нативных тяжелых и легких цепей включает четыре FR, в значительной степени принимающих конфигурацию β-листа, соединенных тремя гипервариабельными областями, которые образуют петли, соединяющие и в некоторых случаях являющиеся частью структуры β-листа. Гипервариабельные области в каждой цепи удерживаются вместе в непосредственной близости FR и, вместе с гипервариабельными областями из другой цепи, способствуют образованию антигенсвязывающего сайта антител (см. Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)). Константные домены не участвуют непосредственно в связывании антитела с антигеном, но проявляют различные эффекторные функции, такие как участие антитела в антителозависимой клеточной цитотоксичности (ADCC).
«Вариабельная область» или «вариабельный домен» антитела относится к аминоконцевым доменам тяжелой или легкой цепи антитела. Вариабельный домен тяжелой цепи может обозначаться как «VH» или «VH». Вариабельный домен легкой цепи может называться «VL» или «VL». Эти домены обычно являются наиболее вариабельными частями антитела и включают антигенсвязывающие сайты.
Полинуклеотидный «вариант» в том смысле, в котором он используется в данном документе, представляет собой полинуклеотид, который обычно отличается от полинуклеотида, конкретно раскрытого в данном документе, одной или несколькими заменами, делециями, добавлениями и/или вставками. Такие варианты могут встречаться в природе или могут быть получены синтетическим путем, например, путем модификации одной или нескольких полинуклеотидных последовательностей по изобретению и оценки одной или нескольких биологических активностей кодируемого полипептида, как описано в данном документе, и/или с использованием любого из ряда методов, хорошо известных в данной области. «Вариант» полипептида, в том смысле, в котором он используется в данном документе, представляет собой полипептид, который обычно отличается от полипептида, конкретно раскрытого в данном документе, одной или несколькими заменами, делециями, добавлениями и/или вставками. Такие варианты могут встречаться в природе или могут быть получены синтетически, например, путем модификации одной или нескольких вышеуказанных полипептидных последовательностей и оценки одной или нескольких биологических активностей полипептида, как описано в настоящем документе, и/или с использованием любого из ряда методов, хорошо известных в данной области. Модификации могут быть внесены в структуру полинуклеотидов и полипептидов по настоящему изобретению и все же получить функциональную молекулу, которая кодирует вариант или производное полипептида с искомыми характеристиками. Когда желательно изменить аминокислотную последовательность полипептида для создания эквивалентного или даже улучшенного варианта или части полипептида по изобретению, специалист в данной области, как правило, изменит один или несколько кодонов кодирующей последовательности ДНК. Например, некоторые аминокислоты могут быть заменены другими аминокислотами в структуре белка без заметной потери его способности связывать другие полипептиды (например, антигены) или клетки. Поскольку именно способность к связыванию и природа белка определяли его биологическую функциональную активность, в последовательности белка могут быть сделаны определенные замены аминокислотной последовательности и, конечно же, в ее подразумеваемой кодирующей последовательности ДНК, и тем не менее получить белок с аналогичными свойствами. Таким образом, предполагается, что в пептидных последовательностях по настоящему изобретению или в соответствующих последовательностях ДНК, которые кодируют указанные пептиды, могут быть внесены различные изменения без заметной потери их биологической полезности или активности. Во многих случаях вариант полипептида будет содержать одну или несколько консервативных замен. Вариант также может содержать или альтернативно содержит неконсервативные изменения. В предпочтительном воплощении вариантные полипептиды отличаются от нативной последовательности заменой, делецией или добавлением пяти аминокислот или менее. Варианты также могут быть (или альтернативно) модифицированы, например, путем делеции или добавления аминокислот, которые оказывают минимальное влияние на иммуногенность, вторичную структуру и гидропатическую природу полипептида.
«Версатела» хорошо известны в данной области и относятся к другой технологии миметиков антител. Это небольшие белки 3-5 кДа с> 15% цистеинов, которые образуют каркас с высокой дисульфидной плотностью, заменяющий гидрофобное ядро, которое имеют типичные белки.
Термин «ксеногенный» относится к любому материалу, полученному от особи другого вида. Термин «ксенотрансплантат» относится к трансплантату, полученному от особи другого вида.
Термин «дзета» или, альтернативно, «дзета-цепь», «CD3-дзета» или «TCR-дзета» определяется как белок, представленный как GenBank Acc. No. BAG36664.1, или эквивалентные остатки из не являющегося человеком вида, например, мыши, грызуна, обезьяны, человекообразной обезьяны и т.п., и «дзета-стимулирующий домен» или, альтернативно, «CD3-дзета-стимулирующий домен» или «TCR-дзета-стимулирующий домен» определяется как аминокислотные остатки цитоплазматического домена дзета-цепи или их функциональные производные, которые достаточны для функциональной передачи исходного сигнала, необходимого для активации Т-клеток. В одном воплощении цитоплазматический домен дзета включает остатки с 52 по 164 из GenBank Acc. No. BAG36664.1 или эквивалентные остатки из не являющегося человеком вида, например, мыши, грызуна, обезьяны, человекообразной обезьяны и т.п., которые являются их функциональными ортологами.
Подробное описание
первым объектом настоящего изобретения является антитело, направленное на HLA-A2, предпочтительно гуманизированное антитело, направленное на HLA-A2.
В одном воплощении антитело по настоящему изобретению конкурирует за связывание с HLA-A2 с антителом, включающим: область 1, определяющую комплементарность тяжелой цепи (HCDR1), имеющую аминокислотную последовательность SEQ ID NO: 62; область 2, определяющую комплементарность тяжелой цепи (HCDR2), имеющую аминокислотную последовательность SEQ ID NO: 63; область 3, определяющую комплементарность тяжелой цепи (HCDR3), имеющую аминокислотную последовательность SEQ ID NO: 64; область 1, определяющую комплементарность легкой цепи (LCDR1), имеющую аминокислотную последовательность SEQ ID NO: 65; область 2, определяющую комплементарность легкой цепи (LCDR2), имеющую аминокислотную последовательность SEQ ID NO: 66; и область 3, определяющую комплементарность легкой цепи (LCDR3), имеющую аминокислотную последовательность SEQ ID NO: 67.
В одном воплощении антитело по изобретению связывается с тем же эпитопом HLA-A2, что и антитело, включающее: область 1, определяющую комплементарность тяжелой цепи (HCDR1), имеющую аминокислотную последовательность SEQ ID NO: 62; область 2, определяющую комплементарность тяжелой цепи (HCDR2), имеющую аминокислотную последовательность SEQ ID NO: 63; область 3, определяющую комплементарность тяжелой цепи (HCDR3), имеющую аминокислотную последовательность SEQ ID NO: 64; область 1, определяющую комплементарность легкой цепи (LCDR1), имеющую аминокислотную последовательность SEQ ID NO: 65; область 2, определяющую комплементарность легкой цепи (LCDR2), имеющую аминокислотную последовательность SEQ ID NO: 66; и область 3, определяющую комплементарность легкой цепи (LCDR3), имеющую аминокислотную последовательность SEQ ID NO: 67.
В одном воплощении анти-HLA-A2 антитело по изобретению конкурирует за связывание с HLA-A2 с и/или связывается с тем же эпитопом HLA-A2, что и антитело BB7.2.
В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к подтипу HLA-A, выбранному из группы, включающей A03, A11, A23, A25, A26, A29, A30, A31, A33, A34 и любую их комбинацию, по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с BB7.2 scFv. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к подтипу HLA-A, выбранному из группы, включающей A03: 01, A11: 01, A23: 01, A25: 01, A26: 01, A29: 02, A30: 01, A31: 01, A33: 01, A34: 01 и любую их комбинацию, по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с BB7.2 scFv.
В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из одного или нескольких из A03, A11, A23, A25, A26, A29, A30, A31, A33 и A34 по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с BB7.2 scFv. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из одного или нескольких из A03: 01, A11: 01, A23: 01, A25: 01, A26: 01, A29: 02, A30: 01, A31: 01, A33: 01 и A34: 01 по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с BB7.2 scFv.
В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из двух или более из A03, A11, A23, A25, A26, A29, A30, A31, A33 и A34 по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с sc7v BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из двух или более из A03: 01, A11: 01, A23: 01, A25: 01, A26: 01, A29: 02, A30: 01, A31: 01, A33: 01 и A34: 01 по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с BB7.2 scFv.
В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из трех или более из A03, A11, A23, A25, A26, A29, A30, A31, A33 и A34 по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с sc7v BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из трех или более из A03: 01, A11: 01, A23: 01, A25: 01, A26: 01, A29: 02, A30: 01, A31: 01, A33: 01 и A34: 01 по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с BB7.2 scFv.
В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из четырех или более из A03, A11, A23, A25, A26, A29, A30, A31, A33 и A34 по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с sc7v BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из четырех или более из A03: 01, A11: 01, A23: 01, A25: 01, A26: 01, A29: 02, A30: 01, A31: 01, A33: 01 и A34: 01 по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с BB7.2 scFv.
В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из пяти или более из A03, A11, A23, A25, A26, A29, A30, A31, A33 и A34 по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с sc7v BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из пяти или более из A03: 01, A11: 01, A23: 01, A25: 01, A26: 01, A29: 02, A30: 01, A31: 01, A33: 01 и A34: 01 по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с BB7.2 scFv.
В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из шести или более из A03, A11, A23, A25, A26, A29, A30, A31, A33 и A34 по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с sc7v BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из шести или более из A03: 01, A11: 01, A23: 01, A25: 01, A26: 01, A29: 02, A30: 01, A31: 01, A33: 01 и A34: 01 по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с BB7.2 scFv.
В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из семи или более из A03, A11, A23, A25, A26, A29, A30, A31, A33 и A34 по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с sc7v BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из семи или более из A03: 01, A11: 01, A23: 01, A25: 01, A26: 01, A29: 02, A30: 01, A31: 01, A33: 01 и A34: 01 по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с BB7.2 scFv.
В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из восьми или более из A03, A11, A23, A25, A26, A29, A30, A31, A33 и A34 его по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с scFv BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из восьми или более из A03: 01, A11: 01, A23: 01, A25: 01, A26: 01, A29: 02, A30: 01, A31: 01, A33: 01 и A34: 01 по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с BB7.2 scFv.
В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из девяти или более из A03, A11, A23, A25, A26, A29, A30, A31, A33 и A34 по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с sc7v BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из девяти или более из A03: 01, A11: 01, A23: 01, A25: 01, A26: 01, A29: 02, A30: 01, A31: 01, A33: 01 и A34: 01 по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с BB7.2 scFv.
В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность по каждому из подтипов HLA-A, выбранных из группы, включающей A03, A11, A23, A25, A26, A29, A30, A31, A33 и A34 по сравнению с к антителу BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с scFv BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность по каждому из подтипов HLA-A, выбранных из группы, включающей A03: 01, A11: 01, A23: 01, A25: 01, A26: 01, A29 : 02, A30: 01, A31: 01, A33: 01 и A34: 01 по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с BB7 .2 scFv.
В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к подтипу HLA-A, выбранному из группы, включающей A25, A29, A30 и любую их комбинацию, по сравнению с антителом BB7.2 или по сравнению с антителом BB7.2. антитело, содержащее VH и VL антитела BB7.2, предпочтительно по сравнению с sc7v BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к подтипу HLA-A, выбранному из группы, включающей A25: 01, A29: 02, A30: 01 и любую их комбинацию, по сравнению с антителом BB7. 2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с sc7v BB7.2.
В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из одного или нескольких из A25, A29 и A30, по сравнению с антителом BB7.2 или по сравнению с антителом содержащий VH и VL антитела BB7.2, предпочтительно по сравнению с sc7v BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из одного или нескольких A25: 01, A29: 02 и A30: 01, по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с sc7v BB7.2.
В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из двух или более из A25, A29 и A30, по сравнению с антителом BB7.2 или по сравнению с антителом содержащий VH и VL антитела BB7.2, предпочтительно по сравнению с sc7v BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из двух или более из A25: 01, A29: 02 и A30: 01, по сравнению с антителом BB7.2. или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с sc7v BB7.2.
В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность по каждому из подтипов HLA-A, выбранных из группы, включающей A25, A29 и A30, по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с sc7v BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность по каждому из подтипов HLA-A, выбранных из группы, включающей A25: 01, A29: 02 и A30: 01, по сравнению с антителом BB7.2 или как по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с sc7v BB7.2.
В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к HLA-A25 по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с BB7.2 scFv. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к HLA-A29 по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с BB7.2 scFv. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к HLA-A30 по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с BB7.2 scFv. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к HLA-A3 по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с BB7.2 scFv. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к HLA-A11 по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с BB7.2 scFv. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к HLA-A26 по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с BB7.2 scFv. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к HLA-A31 по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с BB7.2 scFv. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к HLA-A32 по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с BB7.2 scFv. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к HLA-A33 по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с BB7.2 scFv. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к HLA-A34 по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с BB7.2 scFv.
В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к HLA-A25: 01 по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с BB7.2 scFv. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к HLA-A29: 02 по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с BB7.2 scFv. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к HLA-A30: 01 по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с BB7.2 scFv. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к HLA-A03: 01 по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с BB7.2 scFv. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к HLA-A11: 01 по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с BB7.2 scFv. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к HLA-A26: 01 по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с BB7.2 scFv. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к HLA-A31: 01 по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с BB7.2 scFv. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к HLA-A33: 01 по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с BB7.2 scFv. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к HLA-A34: 01 по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2, предпочтительно по сравнению с BB7.2 scFv.
Способы измерения реактивности антитела HLA-A2 к подтипам HLA-A* известны специалисту в данной области и включают, без ограничения указанным, анализы одиночных антигенов, такие как, например, FlowPRA Single Antigen Antibody, поставляемое ONE LAMBDA.
В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к подтипу HLA-A, выбранному из группы, включающей A03, A11, A23, A25, A26, A29, A30, A31, A33, A34 и любую комбинацию его по сравнению с антителом BB7.2 или с антителом, содержащим VH и VL антитела BB7.2, при измерении в условиях теста А.
В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к подтипу HLA-A, выбранному из группы, включающей A25, A29, A30 и любую их комбинацию, по сравнению с антителом BB7.2 или с антителом, содержащим VH и VL антитела BB7.2 при измерении в условиях теста А.
Тест А:
0.25.106 Т-клеток, экспрессирующих CAR, содержащих анти-HLA-A2 антитело или антитело BB7.2, или VH и VL антитела BB7.2 (mA2 CAR)), инкубировали с панелью гранул с антителами против одиночных антигенов FlowPRA (FL1HD01, FL1HD02, FL1HD03, FL1HD04, FL1HD06 и FL1HD08, One Lambda) и фиксируемого красителя для оценки жизнеспособности (FVD, ThermoFisher, 65-0865-14, eBioscience) в течение 30 минут при комнатной температуре. Образцы промывали, фиксировали 0,5% формальдегидом и анализировали с помощью проточной цитометрии. На образец использовали двести гранул отрицательного контроля. В качестве отрицательного контроля использовали гранулы в чистом виде. Для анализа сначала удаляли мертвые клетки с помощью фиксируемого красителя для оценки жизнеспособности. Гранулы с одиночным антигеном затем отбирали по сигналу выше порогового значения после исключения мертвых клеток и дублетов. Затем количество гранул на HLA определяли по их соответствующим пикам интенсивности PE. Данные нормализовали путем умножения количества представляющих интерес гранул в каждом пике HLA на 200, деленного на количество отрицательных гранул в образце. Для каждого пика HLA процент относительного связывания CAR-Treg по сравнению с контролем (клетками, не экспрессирующими CAR) определяли путем вычитания количества гранул в CAR-Treg из числа гранул в контрольном образце с последующим делением среднего числа гранул в не-CAR-экспрессирующем контроле, и умножением на 100.
В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к подтипу HLA-A, выбранному из группы, включающей A03, A11, A23, A25, A26, A29, A30, A31, A33, A34 и любую их комбинацию по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL BB7.2 при измерении в условиях теста B.
В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к подтипу HLA-A, выбранному из группы, включающей A25, A29, A30 и любую их комбинацию, по сравнению с антителом BB7.2 или по сравнению с антителом BB7.2. антитело, содержащее VH и VL BB7.2 при измерении в условиях теста B.
Тест B:
0.25.106 Т-клеток, экспрессирующих анти-HLA-A2 антитело или антитело BB7.2, или VH и VL антитела BB7.2 или укороченный маркер трансдукции NGFR (NGFR) на поверхности клетки (такой как, например, как часть химерного антигенного рецептора, описанного в настоящем документе), инкубировали с гранулами с антителом против одиночного антигена FlowPRA (FL1HD, One Lambda) и фиксируемым красителем для оценки жизнеспособности (FVD, 65-0865-14, eBioscience), затем фиксировали 0,5% формальдегидом и анализировали с помощью проточной цитометрии. Для анализа сначала удаляли мертвые клетки с помощью фиксируемого красителя для оценки жизнеспособности. Гранулы с одиночным антигеном затем отбирали по сигналу выше порогового значения после исключения мертвых клеток и дублетов. Затем количество гранул на HLA определяли по их соответствующей интенсивности PE. Данные нормализовали путем деления числа отрицательных гранул в образце на количество отрицательных гранул в образце Treg-NGFR, умноженного на количество отрицательных гранул в образце Treg-NGFR. Относительное процентное связывание представляет собой количество гранул в образце NGFR для гранул специфичных по HLA минус нормализованное количество гранул в образце для этих HLA, деленное на количество гранул в образце NGFR, и умноженное на 100.
В одном воплощении анти-HLA-A2 антитело по изобретению обладает реактивностью, по меньшей мере, к одному подтипу HLA-A, выбранному из группы, включающей A03, A11, A23, A25, A26, A29, A30, A31, A33, A34, статистически уступающей реактивности антитела BB7.2 или статистически уступающей реактивности антитела, содержащего VH и VL антитела BB7.2, предпочтительно при измерении в условиях теста A или теста B.
В одном воплощении анти-HLA-A2-антитело по изобретению обладает реактивностью, по меньшей мере, к одному подтипу HLA-A, выбранному из группы, включающей A25, A29, A30, статистически уступающей реактивности антитела BB7.2, или статистически уступающей реактивности антитела, содержащего VH и VL антитела BB7.2, предпочтительно при измерении в условиях теста A или теста B.
В одном воплощении термин «статистически уступающий» означает, что реактивность (то есть, например, относительное связывание в условиях теста А или теста В), измеренная для анти-HLA-A2 антитела по изобретению, ниже реактивности, измеренной для антитела BB7.2 или для антитела, содержащего VH и VL антитела BB7.2, с p-значением по большей мере около о 0,05, предпочтительно по большей мере около 0,01, более предпочтительно по большей мере около 0,005, и даже более предпочтительно по большей мере около 0,001, в частности, при анализе с помощью двухфакторного дисперсионного анализа, апостериорного критерия Даннетта.
В одном воплощении анти-HLA-A2 антитело по изобретению обладает реактивностью, по меньшей мере, к одному подтипу HLA-A, выбранному из группы, включающей A03, A11, A23, A25, A26, A29, A30, A31, A33, A34, уступающей реактивности антитела BB7.2 или антитела, содержащего VH и VL антитела BB7.2, предпочтительно анти-HLA-A2 антитело по изобретению имеет относительное связывание, по меньшей мере, с одним HLA-A*, выбранным из группы, включающей A03, A11, A23, A25, A26, A29, A30, A31, A33, A34, уступающее таковому антитела BB7.2 или антитела, содержащего VH и VL антитела BB7 .2 при измерении в условиях теста А или теста В, более предпочтительно относительное связывание, измеренное для анти-HLA-A2 антитела по изобретению, составляет по большей мере около 90%, 80%, 70%, 60%, 50%. 40%, 30%, 20%, 10% или менее относительного связывания, измеренного для антитела BB7.2 или для антитела, содержащего VH и VL антитела BB7.2.
В одном воплощении анти-HLA-A2-антитело по изобретению обладает реактивностью, по меньшей мере, к одному подтипу HLA-A, выбранному из группы, включающей A25, A29, A30, уступающей реактивности антитела BB7.2 или реактивности антитела, содержащего VH и VL антитела BB7.2, предпочтительно анти-HLA-A2 антитело по изобретению имеет относительное связывание, по меньшей мере, с одним подтипом HLA-A, выбранным из группы, включающей A25, A29, A30 уступающее относительному связыванию антитела BB7.2 или антитела, содержащего VH и VL антитела BB7.2 при измерении в условиях теста A или теста B, более предпочтительно относительное связывание, измеренное для анти-HLA-A2 антитела по изобретению составляет по большей мере около 90%, 80%, 70%, 60%, 50%, 40%, 30%, 20%, 10% или менее относительного связывания, измеренного для антитела BB7.2 или для антитела, содержащего VH и VL антитела BB7.2.
В воплощении указанное антитело представляет собой моноклональное антитело.
В другом воплощении указанное антитело представляет собой поликлональное антитело.
В одном воплощении вариабельная область тяжелой цепи включает, по меньшей мере, один из следующих CDR:
VH-CDR1: SYHIQ (SEQ ID NO: 1)
VH-CDR2: WIYPGDGSTQYNEKFKG (SEQ ID NO: 2)
VH-CDR3: EGTYYAMDY (SEQ ID NO: 3)
Нумерация и определение CDR соответствуют определению Kabat.
В одном воплощении вариабельная область тяжелой цепи включает, по меньшей мере, один из следующих CDR:
VH-CDR1: GYTFTSY (SEQ ID NO: 4)
VH-CDR2: YPGDGS (SEQ ID NO: 5)
VH-CDR3: EGTYYAMDY (SEQ ID NO: 3)
Нумерация и определение CDR соответствуют определению Chothia.
В одном воплощении вариабельная область легкой цепи включает, по меньшей мере, один из следующих CDR:
VL-CDR1: RSSQSIVHSNGNTYLE (SEQ ID NO: 6)
VL-CDR2: KVSNRFS (SEQ ID NO: 7)
VL-CDR3: FQGSHVPRT (SEQ ID NO: 8)
Нумерация и определение CDR соответствуют определениям Kabat или Chothia.
В одном воплощении изобретения анти-HLA-A2 антитело содержит в своей тяжелой цепи один VH-CDR1 (SYHIQ (SEQ ID NO: 1)), один VH-CDR2 (WIYPGDGSTQYNEKFKG (SEQ ID NO: 2)) и/или один VH-CDR3 (EGTYYAMDY (SEQ ID NO: 3)).
В одном воплощении изобретения анти-HLA-A2 антитело содержит в своей тяжелой цепи 3 CDR: VH-CDR1 (SYHIQ (SEQ ID NO: 1)), VH-CDR2 (WIYPGDGSTQYNEKFKG (SEQ ID NO: 2)) и VH-CDR3 (EGTYYAMDY (SEQ ID NO: 3)).
В одном воплощении изобретения анти-HLA-A2 антитело содержит в своей тяжелой цепи один VH-CDR1 (GYTFTSY (SEQ ID NO: 4)), один VH-CDR2 (YPGDGS (SEQ ID NO: 5)) и/или один VH-CDR3 (EGTYYAMDY (SEQ ID NO: 3)).
В одном воплощении изобретения анти-HLA-A2 антитело содержит в своей тяжелой цепи 3 CDR: VH-CDR1 (GYTFTSY (SEQ ID NO: 4)), VH-CDR2 (YPGDGS (SEQ ID NO: 5)) и VH-CDR3 (EGTYYAMDY (SEQ ID NO: 3)).
В одном воплощении изобретения анти-HLA-A2 антитело содержит в своей легкой цепи один VL-CDR1 (RSSQSIVHSNGNTYLE (SEQ ID NO: 6)), один VL-CDR2 (KVSNRFS (SEQ ID NO: 7)) и/или один VL-CDR3 (FQGSHVPRT (SEQ ID NO: 8)).
В одном воплощении изобретения анти-HLA-A2 антитело содержит в своей легкой цепи 3 CDR: VL-CDR1 (RSSQSIVHSNGNTYLE (SEQ ID NO: 6)), VL-CDR2 (KVSNRFS (SEQ ID NO: 7)) и VL-CDR3 (FQGSHVPRT (SEQ ID NO: 8)).
В одном воплощении изобретения анти-HLA-A2 антитело содержит:
- в своей тяжелой цепи 3 CDR SEQ ID NO:1, SEQ ID NO: 2 и SEQ ID NO: 3; и
- в своей легкой цепи 3 CDR SEQ ID NO: 6, SEQ ID NO: 7 и SEQ ID NO: 8.
В одном воплощении изобретения анти-HLA-A2 антитело содержит:
- в своей тяжелой цепи 3 CDR SEQ ID NO: 4, SEQ ID NO: 5 и SEQ ID NO: 3; и
- в своей легкой цепи 3 CDR SEQ ID NO: 6, SEQ ID NO: 7 и SEQ ID NO: 8.
Согласно изобретению любой из CDR 1, 2 и 3 тяжелой и легкой цепей можно охарактеризовать как имеющий аминокислотную последовательность, которая идентична, по меньшей мере, на около 60%, 70%, 75%, 80%, 90%, 95. %, 96%, 97%, 98%, 99% определенным CDR или наборам CDR, перечисленным в соответствующих SEQ ID NO: 1-8.
В одном воплощении изобретения анти-HLA-A2 антитело включает вариабельную область тяжелой цепи последовательности SEQ ID NO: 9.
(SEQ ID NO: 9)
QVQLVQSGPEVKKPGASVKVSCKASGYTFTSYHIQWVRQAPGQGLEWIGWIYPGDGSTQYNEKFKGRVTITADKSTSTAYMELSSLTSEDTAVYYCAREGTYYAMDYWGQGTSVTVSS
В одном воплощении изобретения вариабельная область тяжелой цепи антитела анти-HLA-A2 имеет последовательность, которая имеет, по меньшей мере, около 60%, 70%, 75%, 80%, 90%, 95%, 96%, 97 %, 98%, 99% идентичности с SEQ ID NO: 9.
В одном воплощении изобретения анти-HLA-A2 антитело включает вариабельную область легкой цепи последовательности SEQ ID NO: 10.
(SEQ ID NO: 10)
DX1VMTQX2PX3X4LX5VX6X7GX8X9X10X11ISCRSSQSIVHSNGNTYLEWYX12QKPGQX13PRLLIYKVSNRFSGX14PDRFSGSGSGTDFTLX15ISRX16EX17EDX18X19VYYCFQGSHVPRTFGGGTKLEIKR
где X1 представляет собой V или I, X2 представляет собой T или S, X3 представляет собой L или S или A, X4 представляет собой S или T, X5 представляет собой P или S, X6 представляет собой T или S, X7 представляет собой L или P, X8 представляет собой E или D, X9 представляет собой P или R, X10 представляет собой A или V, X11 представляет собой S или T, X12 представляет собой L или Q, X13 представляет собой S или A, X14 представляет собой V или I, X15 представляет собой K или T, X16 представляет собой V или L, X17 представляет собой A или P, X18 представляет собой L или F и X19 представляет собой G или A.
В одном воплощении изобретения вариабельная область легкой цепи антитела анти-HLA-A2 имеет последовательность, которая имеет, по меньшей мере, около 60%, 70%, 75%, 80%, 90%, 95%, 96%, 97 %, 98%, 99% идентичности с SEQ ID NO: 10.
В одном воплощении область легкой цепи имеет последовательность SEQ ID NO: 11 или любую последовательность, которая имеет, по меньшей мере, около 60%, 70%, 75%, 80%, 90%, 95%, 96%, 97%, 98 %, 99% идентичности с SEQ ID NO: 11.
(SEQ ID NO: 11)
DVVMTQTPLSLPVTLGEPASISCRSSQSIVHSNGNTYLEWYLQKPGQSPRLLIYKVSNRFSGVPDRFSGSGSGTDFTLKISRVEAEDLGVYYCFQGSHVPRTFGGGTKLEIKR
В одном воплощении область легкой цепи имеет последовательность SEQ ID NO: 12 или любую последовательность, которая имеет, по меньшей мере, около 60%, 70%, 75%, 80%, 90%, 95%, 96%, 97%, 98 %, 99% идентичности с SEQ ID NO: 12.
(SEQ ID NO: 12)
DVVMTQSPSSLSVTLGDRVSISCRSSQSIVHSNGNTYLEWYQQKPGQSPRLLIYKVSNRFSGVPDRFSGSGSGTDFTLTISRVEPEDLGVYYCFQGSHVPRTFGGGTKLEIKR
В одном воплощении область легкой цепи имеет последовательность SEQ ID NO: 13 или любую последовательность, которая имеет, по меньшей мере, около 60%, 70%, 75%, 80%, 90%, 95%, 96%, 97%, 98 %, 99% идентичности с SEQ ID NO: 13.
(SEQ ID NO: 13)
DIVMTQSPATLSVSPGERATISCRSSQSIVHSNGNTYLEWYQQKPGQAPRLLIYKVSNRFSGIPDRFSGSGSGTDFTLTISRLEPEDFAVYYCFQGSHVPRTFGGGTKLEIKR
В одном воплощении антитело HLA-A2 по изобретению включает вариабельную область тяжелой цепи, имеющую последовательность SEQ ID NO: 9, и вариабельную область легкой цепи, имеющую последовательность SEQ ID NO: 10, где X1 представляет собой V или I, X2 представляет собой T или S, X3 представляет собой L или S или A, X4 представляет собой S или T, X5 представляет собой P или S, X6 представляет собой T или S, X7 представляет собой L или P, X8 представляет собой E или D, X9 представляет собой P или R, X10 представляет собой A или V, X11 представляет собой S или T, X12 представляет собой L или Q, X13 представляет собой S или A, X14 представляет собой V или I, X15 представляет собой K или T, X16 представляет собой V или L, X17 представляет собой A или P, X18 представляет собой L или F и X19 представляет собой G или A, или любую последовательность, которая разделяет, по меньшей мере, около 60%, 70%, 75%, 80%, 90%, 95%, 96%, 97%, 98%, 99% идентичности с SEQ ID NO: 9-10.
В одном воплощении антитело HLA-A2 по изобретению включает вариабельную область тяжелой цепи, имеющую последовательность SEQ ID NO: 9, и вариабельную область легкой цепи, имеющую последовательность SEQ ID NO: 11, или любую последовательность, которая имеет, по меньшей мере, около 60 %, 70%, 75%, 80%, 90%, 95%, 96%, 97%, 98%, 99% идентичности с SEQ ID NO: 9 и 11.
В одном воплощении антитело HLA-A2 по изобретению включает вариабельную область тяжелой цепи, имеющую последовательность SEQ ID NO: 9, и вариабельную область легкой цепи, имеющую последовательность SEQ ID NO: 12, или любую последовательность, которая имеет, по меньшей мере, около 60 %, 70%, 75%, 80%, 90%, 95%, 96%, 97%, 98%, 99% идентичности с SEQ ID NO: 9 и 12.
В одном воплощении антитело HLA-A2 по изобретению включает вариабельную область тяжелой цепи, имеющую последовательность SEQ ID NO: 9, и вариабельную область легкой цепи, имеющую последовательность SEQ ID NO: 13, или любую последовательность, которая имеет, по меньшей мере, около 60 %, 70%, 75%, 80%, 90%, 95%, 96%, 97%, 98%, 99% идентичности с SEQ ID NO: 9 и 13.
Согласно изобретению одна, две, три, четыре или более аминокислот вариабельных областей тяжелой цепи или легкой цепи могут быть замещены другой аминокислотой.
В одном воплощении в антителе по изобретению указанные вариабельные области и последовательности CDR могут содержать модификации консервативных последовательностей. Модификации консервативных последовательностей относятся к модификациям аминокислот, которые не оказывают значительного влияния или не изменяют характеристики связывания антитела, содержащего аминокислотную последовательность. Такие консервативные модификации включают аминокислотные замены, добавления и делеции. Модификации могут быть введены в антитело по изобретению стандартными способами, известными в данной области, такими как сайт-направленный мутагенез и ПЦР-опосредованный мутагенез.
Другим объектом изобретения является выделенная нуклеотидная последовательность, кодирующая вариабельную область тяжелой цепи последовательности SEQ ID NO: 9. В одном воплощении указанная последовательность нуклеиновой кислоты представляет собой SEQ ID NO: 86.
(SEQ ID NO: 86)
CAGGTCCAGCTAGTACAAAGCGGCCCTGAAGTAAAGAAACCTGGTGCCTCTGTGAAGGTGAGCTGCAAGGCCAGCGGCTACACCTTCACCAGCTACCACATCCAGTGGGTTCGACAGGCCCCTGGACAGGGACTAGAGTGGATCGGCTGGATCTATCCTGGCGACGGCAGCACCCAGTACAACGAGAAGTTCAAGGGCAGAGTTACCATCACCGCCGACAAGAGCACCAGCACAGCCTATATGGAGCTGAGCAGCCTGACCAGCGAGGACACAGCTGTTTACTATTGTGCCAGAGAGGGCACCTACTACGCAATGGATTATTGGGGCCAGGGGACCAGCGTGACCGTTTCTTCT
Другим объектом изобретения является выделенная нуклеотидная последовательность, кодирующая вариабельную область легкой цепи с последовательностью SEQ ID NO: 11. В одном воплощении указанная последовательность нуклеиновой кислоты представляет собой SEQ ID NO: 87.
(SEQ ID NO: 87)
GATGTTGTAATGACCCAGACACCTCTGAGCCTGCCTGTGACCCTGGGAGAACCAGCATCCATCAGCTGTCGGAGCAGCCAGAGCATCGTTCACAGCAACGGCAACACCTACCTGGAATGGTATCTACAGAAGCCCGGACAGAGCCCCAGGCTGCTGATCTACAAGGTGTCCAACCGCTTCAGTGGTGTGCCCGATAGATTTTCTGGCAGCGGCTCTGGCACCGACTTCACCCTGAAGATCTCCAGAGTGGAAGCCGAGGACCTGGGCGTGTACTACTGCTTCCAAGGCAGCCATGTGCCAAGAACCTTTGGTGGAGGCACAAAGCTGGAAATCAAGCGG
Другим объектом изобретения является выделенная нуклеотидная последовательность, кодирующая вариабельную область легкой цепи с последовательностью SEQ ID NO: 12. В одном воплощении указанная последовательность нуклеиновой кислоты представляет собой SEQ ID NO: 88.
(SEQ ID NO: 88)
GATGTTGTAATGACCCAGAGCCCTAGTAGCCTGTCTGTGACCCTGGGAGATCGAGTATCCATCAGCTGTCGGAGCAGCCAGAGCATCGTTCACAGCAACGGCAACACCTACCTGGAATGGTATCAACAGAAGCCCGGACAGAGCCCCAGGCTGCTGATCTACAAGGTGTCCAACCGCTTCAGTGGTGTGCCCGATAGATTTTCTGGCAGCGGCTCTGGCACCGACTTCACCCTGACGATCTCCAGAGTGGAACCAGAGGACCTGGGCGTGTACTACTGCTTCCAAGGCAGCCATGTGCCAAGAACCTTTGGTGGAGGCACAAAGCTGGAAATCAAGCGG
Другим объектом изобретения является выделенная нуклеотидная последовательность, кодирующая вариабельную область легкой цепи с последовательностью SEQ ID NO: 13. В одном воплощении указанная последовательность нуклеиновой кислоты представляет собой SEQ ID NO: 89
(SEQ ID NO: 89)
GATATTGTAATGACCCAGAGCCCTGCAACACTGTCTGTGTCCCCTGGAGAACGAGCAACAATCAGCTGTCGGAGCAGCCAGAGCATCGTTCACAGCAACGGCAACACCTACCTGGAATGGTATCAACAGAAGCCCGGACAGGCCCCCAGGCTGCTGATCTACAAGGTGTCCAACCGCTTCAGTGGAATACCCGATAGATTTTCTGGCAGCGGCTCTGGCACCGACTTCACCCTGACGATCTCCAGATTAGAACCAGAGGACTTTGCAGTGTACTACTGCTTCCAAGGCAGCCATGTGCCAAGAACCTTTGGTGGAGGCACAAAGCTGGAAATCAAGCGG
Другим объектом изобретения является экспрессирующий вектор, содержащий нуклеиновые последовательности, кодирующие анти-HLA-A2 антитело по изобретению.
Другим объектом изобретения является выделенная клетка-хозяин, содержащая указанный вектор. Указанная клетка-хозяин может быть использована для рекомбинантной выработки антител по изобретению.
В одном воплощении указанное антитело представляет собой молекулу антитела, выбранную из группы, состоящей из полноразмерного антитела, гуманизированного антитела, одноцепочечного антитела, димерного одноцепочечного антитела, Fv, a scFv, a Fab, a F(ab)'2, дефукозилированного антитела, биспецифического антитела, диатела, триатела, тетратела.
В другом воплощении указанное антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из унитела, доменного антитела и нанотела.
В другом воплощении указанное антитело представляет собой миметик антитела, выбранный из группы, состоящей из аффитела, альфа-тела, каркаса на основе белка с повтором armadillo, кноттина, пептида домена Кунитца, аффилина, аффитина, аднектина, атримера, эвазина, DARPin, антикалина, авимера, финомера, версатела и дуокалина.
Фрагменты и производные антител данного изобретения (которые охватываются термином «антитело», используемым в настоящей заявке, если не указано иное или явно не противоречит контексту), могут быть получены способами, известными в данной области. «Фрагменты» включают часть интактного антитела, обычно сайт связывания антигена или вариабельную область. Примеры фрагментов антител включают фрагменты Fab, Fab', Fab'-SH, F(ab')2 и Fv; димеры; любой фрагмент антитела, который представляет собой полипептид, имеющий первичную структуру, состоящую из одной непрерывной последовательности смежных аминокислотных остатков (называемой в настоящем документе «одноцепочечный фрагмент антитела» или «одноцепочечный полипептид»), включая, без ограничения указанным, (1) молекулы одноцепочечного Fv (2) одноцепочечные полипептиды, содержащие только один вариабельный домен легкой цепи, или их фрагмент, который включает три CDR вариабельного домена легкой цепи, без ассоциированной части тяжелой цепи, и (3) одноцепочечные полипептиды, содержащие только одну вариабельную область тяжелой цепи или ее фрагмент, содержащую три CDR вариабельной области тяжелой цепи, без связанного фрагмента легкой цепи; и мультиспецифичные антитела, образованные из фрагментов антител. Фрагменты настоящих антител могут быть получены с использованием стандартных способов.
Например, фрагменты Fab или F(ab')2 могут быть получены путем расщепления протеазой выделенных антител в соответствии с общепринятыми методиками. Понятно, что иммунореактивные фрагменты могут быть модифицированы с использованием известных способов, например, для замедления клиренса in vivo и получения более желательного фармакокинетического профиля фрагмент может быть модифицирован полиэтиленгликолем (ПЭГ). Способы связывания и сайт-специфического конъюгирования PEG с фрагментом Fab' описаны, например, в Leong et al., Cytokines 16 (3): 106-119 (2001) и Delgado et al., Br. J. Cancer 5 73 (2): 175-182 (1996), описания которых включены в настоящее описание ссылкой.
В одном воплощении антитело по изобретению представляет собой scFv или scFab, предпочтительно scFv.
В одном воплощении антитело по изобретению представляет собой scFv, содержащее последовательность SEQ ID NO: 9 и последовательность SEQ ID NO: 10, где X1 представляет собой V или I, X2 представляет собой T или S, X3 представляет собой L или S или A, X4 представляет собой S или T, X5 представляет собой P или S, X6 представляет собой T или S, X7 представляет собой L или P, X8 представляет собой E или D, X9 представляет собой P или R, X10 представляет собой A или V, X11 представляет собой S или T, X12 представляет собой L или Q, X13 представляет собой S или A, X14 представляет собой V или I, X15 представляет собой K или T, X16 представляет собой V или L, X17 представляет собой A или P, X18 представляет собой L или F и X19 представляет собой G или A, в любом порядке для N-конца и C-конца scFv. Предпочтительно антитело по изобретению представляет собой scFv, содержащее последовательность SEQ ID NO: 9 и последовательность SEQ ID NO: 11, 12 или 13 в любом порядке от N-конца к С-концу scFv.
В одном воплощении последовательность SEQ ID NO: 9 является N-концевой, а последовательность SEQ ID NO: 10, 11, 12 или 13 является C-концевой.
В одном воплощении scFv по изобретению включает от N-конца к C-концу: SEQ ID NO: 9, необязательный линкер, SEQ ID NO: 10, где X1 представляет собой V или I, X2 представляет собой T или S, X3 представляет собой L или S или A, X4 представляет собой S или T, X5 представляет собой P или S, X6 представляет собой T или S, X7 представляет собой L или P, X8 представляет собой E или D, X9 представляет собой P или R, X10 представляет собой A или V, X11 представляет собой S или T, X12 представляет собой L или Q, X13 представляет собой S или A, X14 представляет собой V или I, X15 представляет собой K или T, X16 представляет собой V или L, X17 представляет собой A или P, X18 представляет собой L или F и X19 представляет собой G или A (предпочтительно одну из SEQ ID NO: 11-13).
В одном воплощении scFv по изобретению включает от N-конца к C-концу: SEQ ID NO: 10, где X1 представляет собой V или I, X2 представляет собой T или S, X3 представляет собой L или S или A, X4 представляет собой S или T, X5 представляет собой P или S, X6 представляет собой T или S, X7 представляет собой L или P, X8 представляет собой E или D, X9 представляет собой P или R, X10 представляет собой A или V, X11 представляет собой S или T, X12 представляет собой L или Q, X13 представляет собой S или A, X14 представляет собой V или I, X15 представляет собой K или T, X16 представляет собой V или L, X17 представляет собой A или P, X18 представляет собой L или F и X19 представляет собой G или A (предпочтительно одну из SEQ ID NO: 11 -13), необязательный линкер, SEQ ID NO: 9.
В одном воплощении scFv включает линкер. Примеры линкеров включают, без ограничения указанным, линкеры GS, как описано в данном документе. В одном воплощении линкер включает или состоит из последовательности GGGGSGGGGSGGGGS (SEQ ID NO: 18).
В одном воплощении scFv по изобретению включает или состоит из последовательности SEQ ID NO: 69 или любой аминокислотной последовательности с идентичностью, по меньшей мере, около 95-99% с SEQ ID NO: 69
(SEQ ID NO: 69)
QVQLVQSGPEVKKPGASVKVSCKASGYTFTSYHIQWVRQAPGQGLEWIGWIYPGDGSTQYNEKFKGRVTITADKSTSTAYMELSSLTSEDTAVYYCAREGTYYAMDYWGQGTSVTVSSGGGGSGGGGSGGGGSDX1VMTQX2PX3X4LX5VX6X7GX8X9X10X11ISCRSSQSIVHSNGNTYLEWYX12QKPGQX13PRLLIYKVSNRFSGX14PDRFSGSGSGTDFTLX15ISRX16EX17EDX18X19VYYCFQGSHVPRTFGGGTKLEIKR
где X1 представляет собой V или I, X2 представляет собой T или S, X3 представляет собой L или S или A, X4 представляет собой S или T, X5 представляет собой P или S, X6 представляет собой T или S, X7 представляет собой L или P, X8 представляет собой E или D, X9 представляет собой P или R, X10 представляет собой A или V, X11 представляет собой S или T, X12 представляет собой L или Q, X13 представляет собой S или A, X14 представляет собой V или I, X15 представляет собой K или T, X16 представляет собой V или L, X17 представляет собой A или P, X18 представляет собой L или F и X19 представляет собой G или A. SEQ ID NO: 69 состоит от N-конца к C-концу SEQ ID NO: 9, SEQ ID NO: 18 и SEQ ID NO: 10.
В одном воплощении scFv по изобретению включает или состоит из последовательности SEQ ID NO: 70, 71 или 72 или любой аминокислотной последовательности с идентичностью, по меньшей мере, около на 95-99% с SEQ ID NO: 70, 71 или 72. SEQ ID NO: 70-72 состоят от N-конца к C-концу из SEQ ID NO: 9, SEQ ID NO: 18 и SEQ ID NO: 11-13, соответственно.
(SEQ ID NO: 70)
QVQLVQSGPEVKKPGASVKVSCKASGYTFTSYHIQWVRQAPGQGLEWIGWIYPGDGSTQYNEKFKGRVTITADKSTSTAYMELSSLTSEDTAVYYCAREGTYYAMDYWGQGTSVTVSSGGGGSGGGGSGGGGSDVVMTQTPLSLPVTLGEPASISCRSSQSIVHSNGNTYLEWYLQKPGQSPRLLIYKVSNRFSGVPDRFSGSGSGTDFTLKISRVEAEDLGVYYCFQGSHVPRTFGGGTKLEIKR
(SEQ ID NO: 71)
QVQLVQSGPEVKKPGASVKVSCKASGYTFTSYHIQWVRQAPGQGLEWIGWIYPGDGSTQYNEKFKGRVTITADKSTSTAYMELSSLTSEDTAVYYCAREGTYYAMDYWGQGTSVTVSSGGGGSGGGGSGGGGSDVVMTQSPSSLSVTLGDRVSISCRSSQSIVHSNGNTYLEWYQQKPGQSPRLLIYKVSNRFSGVPDRFSGSGSGTDFTLTISRVEPEDLGVYYCFQGSHVPRTFGGGTKLEIKR
(SEQ ID NO: 72)
QVQLVQSGPEVKKPGASVKVSCKASGYTFTSYHIQWVRQAPGQGLEWIGWIYPGDGSTQYNEKFKGRVTITADKSTSTAYMELSSLTSEDTAVYYCAREGTYYAMDYWGQGTSVTVSSGGGGSGGGGSGGGGSDIVMTQSPATLSVSPGERATISCRSSQSIVHSNGNTYLEWYQQKPGQAPRLLIYKVSNRFSGIPDRFSGSGSGTDFTLTISRLEPEDFAVYYCFQGSHVPRTFGGGTKLEIKR
В одном воплощении scFv по изобретению дополнительно включает S-остаток на N-конце для облегчения расщепления необязательной лидерной последовательности.
Следовательно, в одном воплощении scFv по изобретению имеет последовательность 73, где X1 представляет собой V или I, X2 представляет собой T или S, X3 представляет собой L или S или A, X4 представляет собой S или T, X5 представляет собой P или S, X6 представляет собой T или S, X7 представляет собой L или P, X8 представляет собой E или D, X9 представляет собой P или R, X10 представляет собой A или V, X11 представляет собой S или T, X12 представляет собой L или Q, X13 представляет собой S или A, X14 представляет собой V или I, X15 представляет собой K или T, X16 представляет собой V или L, X17 представляет собой A или P, X18 представляет собой L или F и X19 представляет собой G или A.
В одном воплощении scFv по изобретению включает или состоит из последовательности SEQ ID NO: 74, 75 или 76.
(SEQ ID NO: 74)
SQVQLVQSGPEVKKPGASVKVSCKASGYTFTSYHIQWVRQAPGQGLEWIGWIYPGDGSTQYNEKFKGRVTITADKSTSTAYMELSSLTSEDTAVYYCAREGTYYAMDYWGQGTSVTVSSGGGGSGGGGSGGGGSDVVMTQSPSSLSVTLGDRVSISCRSSQSIVHSNGNTYLEWYQQKPGQSPRLLIYKVSNRFSGVPDRFSGSGSGTDFTLTISRVEPEDLGVYYCFQGSHVPRTFGGGTKLEIKR
(SEQ ID NO: 75)
SQVQLVQSGPEVKKPGASVKVSCKASGYTFTSYHIQWVRQAPGQGLEWIGWIYPGDGSTQYNEKFKGRVTITADKSTSTAYMELSSLTSEDTAVYYCAREGTYYAMDYWGQGTSVTVSSGGGGSGGGGSGGGGSDVVMTQSPSSLSVTLGDRVSISCRSSQSIVHSNGNTYLEWYQQKPGQSPRLLIYKVSNRFSGVPDRFSGSGSGTDFTLTISRVEPEDLGVYYCFQGSHVPRTFGGGTKLEIKR
(SEQ ID NO: 76)
SQVQLVQSGPEVKKPGASVKVSCKASGYTFTSYHIQWVRQAPGQGLEWIGWIYPGDGSTQYNEKFKGRVTITADKSTSTAYMELSSLTSEDTAVYYCAREGTYYAMDYWGQGTSVTVSSGGGGSGGGGSGGGGSDIVMTQSPATLSVSPGERATISCRSSQSIVHSNGNTYLEWYQQKPGQAPRLLIYKVSNRFSGIPDRFSGSGSGTDFTLTISRLEPEDFAVYYCFQGSHVPRTFGGGTKLEIKR
Другим объектом изобретения является композиция, включающая, по существу, состоящая или состоящая из, по меньшей мере, одного анти-HLA-A2 антитела по изобретению.
Используемый в данном документе термин «состоящий по существу из» со ссылкой на композицию означает, что, по меньшей мере, одно анти-HLA-A2 антитело по изобретению, как описано в данном документе выше, является единственным терапевтическим агентом или агентом с биологической активностью в указанной композиции.
Другим объектом изобретения является фармацевтическая композиция, содержащая, по меньшей мере, одно анти-HLA-A2 антитело по изобретению и фармацевтически приемлемый носитель.
Примеры фармацевтически приемлемых носителей включают, без ограничения указанным, среды, растворители, покрытия, изотонические и замедляющие абсорбцию агенты, добавки, стабилизаторы, консерванты, поверхностно-активные вещества, вещества, которые ингибируют ферментативную деградацию, спирты, агенты, регулирующие рН, антиоксиданты; хелатирующие агенты, такие как EDTA или глутатион; адъюванты (например, гидроксид алюминия); консерванты и пропелленты.
Примеры фармацевтически приемлемых сред включают, без ограничения указанным, воду, нейтральный солевой буферный раствор, фосфатно-солевой буферный раствор, физиологический раствор или другой физиологически забуференный солевой раствор или другой растворитель, такой как гликоль, глицерин, и масло, такое как оливковое масло или органический эфир для инъекций. Фармацевтически приемлемая среда также может содержать липосомы или мицеллы.
Примеры материалов для покрытия включают, без ограничения указанным, лецитин.
Примеры изотонических агентов включают, без ограничения указанным, сахара, хлорид натрия и т.п.
Примеры агентов, которые замедляют абсорбцию, включают, без ограничения указанным, моностеарат алюминия и желатин.
Примеры добавок включают, без ограничения указанным, маннит, декстран, углеводы (такие как, например, глюкоза, манноза, сахароза или декстран); глицин, лактоза или поливинилпирролидон или другие добавки, такие как антиоксиданты или инертный газ, стабилизаторы или рекомбинантные белки (например, г. сывороточный альбумин человека), подходящий для введения in vivo.
Примеры подходящих стабилизаторов включают, без ограничения указанным, сахарозу, желатин, пептон, расщепленные белковые экстракты, такие как NZ-амин или NZ-амин AS.
Фармацевтически приемлемые носители, которые могут быть использованы в этих композициях, дополнительно включают, без ограничения указанным, ионообменники, оксид алюминия, стеарат алюминия, лецитин, белки сыворотки, такие как человеческий сывороточный альбумин, буферные вещества, такие как фосфаты, глицин, сорбиновая кислота, калий сорбат, частичные глицеридные смеси насыщенных растительных жирных кислот, воду, соли или электролиты, таких как протаминсульфат, динатрийгидрофосфат, гидрофосфат калия, хлорид натрия, соли цинка, коллоидный диоксид кремния, трисиликат магния, поливинилпирролидон, вещества на основе целлюлозы, полиэтиленгликоль, натрий карбоксиметилцеллюлозу, полиакрилаты, воски, полиэтиленполиоксипропилен-блок полимеры, полиэтиленгликоль и шерстяной жир.
Другим объектом изобретения является лекарственное средство, содержащее, состоящее или состоящее по существу из, по меньшей мере, одного анти-HLA-A2 антитела по изобретению, как описано выше.
Другим объектом изобретения является применение, по меньшей мере, одного анти-HLA-A2 антитела по изобретению для обнаружения HLA-A2 в образце, предпочтительно в биологическом образце, in vitro или in vivo.
Примеры анализов, в которых можно использовать анти-HLA-A2 антитело по изобретению, включают, без ограничения указанным, ELISA, сэндвич-ELISA, RIA, FACS, тканевую иммуногистохимию, вестерн-блот и иммунопреципитацию.
Другим объектом изобретения является способ обнаружения HLA-A2 в образце, включающий контакт образца с антителом против HLA-A2 по изобретению и обнаружение анти-HLA-A2 антитела, связанного с HLA-A2, что указывает на наличие HLA-A2 в образце.
В одном воплощении изобретения образец представляет собой биологический образец. Примеры биологических образцов включают, без ограничения указанным, телесные жидкости, предпочтительно кровь, более предпочтительно сыворотку крови, плазму, синовиальную жидкость, жидкость бронхоальвеолярного лаважа, мокроту, лимфу, асцитные жидкости, мочу, амниотическую жидкость, брюшную жидкость, спинномозговую жидкость, плевральную жидкость, перикардиальную жидкость и альвеолярные макрофаги, лизаты тканей и экстракты, приготовленные из пораженных тканей или из трансплантата.
В одном воплощении изобретения термин «образец» предназначен для обозначения образца, взятого у индивидуума перед любым анализом.
В одном воплощении изобретения анти-HLA-A2 антитело по изобретению непосредственно помечено детектируемой меткой и может быть обнаружено непосредственно. В другом воплощении белок по изобретению является немеченым (и упоминается как первое/первичное антитело), а вторичное антитело или другая молекула, которая может связывать анти-HLA-A2 антитело, метится. Как хорошо известно в данной области, вторичное антитело выбирают так, чтобы оно могло специфически связывать конкретные виды и класс первичного антитела.
Присутствие комплекса анти-HLA-A2 антитело/HLA-A2 в образце можно обнаружить и измерить, обнаружив присутствие меченого вторичного антитела. Например, после вымывания несвязанного вторичного антитела из лунки, содержащей комплекс первичное антитело/антиген, или из мембраны (например, нитроцеллюлозной или нейлоновой мембраны), содержащей комплекс, связанное вторичное антитело может быть разработано и обнаружено на основе хемилюминесценции ярлык для примера.
Метки для анти-HLA-A2 антитела или вторичного антитела включают, без ограничения указанным, различные ферменты, простетические группы, флуоресцентные материалы, люминесцентные материалы, магнитные агенты и радиоактивные материалы. Примеры таких ферментов включают, без ограничения указанным, пероксидазу хрена, щелочную фосфатазу, бета-галактозидазу или ацетилхолинэстеразу; примеры комплексов простетической группы включают, без ограничения указанным, стрептавидин/биотин и авидин/биотин; примеры флуоресцентных материалов включают, без ограничения указанным, умбеллиферон, флуоресцеин, изотиоцианат флуоресцеина, родамин, дихлортриазиниламин флуоресцеин, хлорид дансин или фикоэритрин; примеры люминесцентного материала включают, без ограничения указанным, люминал; примеры магнитных агентов включают гадолиний; и примеры подходящего радиоактивного материала включают 125I, 131I, 35S или 3H.
Другим объектом изобретения является набор, содержащий, по меньшей мере, одно анти-HLA-A2 антитело по изобретению, предпочтительно моноклональное анти-HLA-A2 антитело.
Под «набором» подразумевается любой продукт производства (например, упаковка или контейнер), содержащее, по меньшей мере, один реагент, предпочтительно антитело, для специфического определения экспрессии HLA-A2.
Набор может рекламироваться, распространяться или продаваться как единое целое для реализации способов по настоящему изобретению. Кроме того, любой или все реагенты набора могут быть предоставлены в контейнерах, которые защищают их от внешней среды, например, в герметичных контейнерах.
Наборы могут также содержать вкладыш в упаковку, описывающий набор и способы его применения.
Наборы для проведения сэндвич-ELISA обычно включают захватывающее антитело, необязательно иммобилизованное на твердой подложке (например, планшете для микротитрования), и антитело для обнаружения, связанное с детектируемым веществом, таким как, например, HRP, флуоресцентная метка, радиоизотоп, бета-галактозидаза и щелочная фосфатаза.
В другом воплощении детектируемое вещество иммобилизовано на твердой подложке (например, на планшете для микротитрования).
Настоящее изобретение также относится к химерному антигенному рецептору (CAR), специфичному для HLA-A2. CAR являются химерными белковыми молекулами, которые сочетают антительную специфичность к целевому антигену с рецептор-активированным внутриклеточным доменом иммунной клетки.
Согласно настоящему изобретению CAR включает в одном или нескольких полипептидах (i) внеклеточный связывающий домен HLA-A2, где указанный внеклеточный домен включает или состоит из анти-HLA-A2 антитела (предпочтительно scFv против HLA-A2) настоящего изобретения, (ii) необязательно внеклеточный шарнирный домен, (iii) необязательно трансмембранный домен и (iv) внутриклеточный сигнальный домен. В одном воплощении химерный рецептор дополнительно включает метку и/или лидерную последовательность.
В одном воплощении CAR по настоящему изобретению конкурирует за связывание с HLA-A2 антителом, включающим: область 1, определяющую комплементарность тяжелой цепи (HCDR1), имеющую аминокислотную последовательность SEQ ID NO: 62; область 2, определяющую комплементарность тяжелой цепи (HCDR2), имеющую аминокислотную последовательность SEQ ID NO: 63; область 3, определяющую комплементарность тяжелой цепи (HCDR3), имеющую аминокислотную последовательность SEQ ID NO: 64; область 1, определяющую комплементарность легкой цепи (LCDR1), имеющую аминокислотную последовательность SEQ ID NO: 65; область 2, определяющую комплементарность легкой цепи (LCDR2), имеющую аминокислотную последовательность SEQ ID NO: 66; и область 3, определяющую комплементарность легкой цепи (LCDR3), имеющую аминокислотную последовательность SEQ ID NO: 67.
В одном воплощении CAR по настоящему изобретению связывается с тем же эпитопом HLA-A2, что и антитело, содержащее: область 1, определяющую комплементарность тяжелой цепи (HCDR1), имеющую аминокислотную последовательность SEQ ID NO: 62; область 2, определяющую комплементарность тяжелой цепи (HCDR2), имеющую аминокислотную последовательность SEQ ID NO: 63; область 3, определяющую комплементарность тяжелой цепи (HCDR3), имеющую аминокислотную последовательность SEQ ID NO: 64; область 1, определяющую комплементарность легкой цепи (LCDR1), имеющую аминокислотную последовательность SEQ ID NO: 65; область 2, определяющую комплементарность легкой цепи (LCDR2), имеющую аминокислотную последовательность SEQ ID NO: 66; и область 3, определяющую комплементарность легкой цепи (LCDR3), имеющую аминокислотную последовательность SEQ ID NO: 67.
В одном воплощении CAR по изобретению конкурирует за связывание с HLA-A2 с и/или связывается с тем же эпитопом HLA-A2, что и антитело BB7.2.
В одном воплощении CAR по изобретению имеет меньшую реактивность к подтипу HLA-A, выбранному из группы, включающей A03, A11, A23, A25, A26, A29, A30, A31, A33, A34 и любую их комбинацию, по сравнению с CAR, содержащим BB7.2, или CAR, содержащим VH и VL антитела BB7.2. В одном воплощении CAR по изобретению имеет меньшую реактивность к подтипу HLA-A, выбранному из группы, включающей A03: 01, A11: 01, A23: 01, A25: 01, A26: 01, A29: 02, A30: 01, A31: 01, A33: 01, A34: 01 и любую их комбинацию по сравнению с CAR, содержащим BB7.2, или с CAR, содержащим VH и VL антитела BB7.2.
В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из одного или нескольких из A03, A11, A23, A25, A26, A29, A30, A31, A33 и A34 по сравнению с CAR, содержащим BB7.2, или с CAR, содержащим VH и VL антитела BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из одного или нескольких из A03: 01, A11: 01, A23: 01, A25: 01, A26: 01, A29: 02, A30: 01, A31: 01, A33: 01 и A34: 01 по сравнению с CAR, содержащим BB7.2, или с CAR, содержащим VH и VL антитела BB7.2.
В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из двух или более из A03, A11, A23, A25, A26, A29, A30, A31, A33 и A34 по сравнению с CAR, содержащим BB7.2, или с CAR, содержащим VH и VL антитела BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из двух или более из A03: 01, A11: 01, A23: 01, A25: 01, A26: 01, A29: 02, A30: 01, A31: 01, A33: 01 и A34: 01 по сравнению с CAR, содержащим BB7.2, или с CAR, содержащим VH и VL антитела BB7.2.
В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из трех или более из A03, A11, A23, A25, A26, A29, A30, A31, A33 и A34 по сравнению с CAR, содержащим BB7.2, или с CAR, содержащим VH и VL антитела BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из трех или более из A03: 01, A11: 01, A23: 01, A25: 01, A26: 01, A29: 02, A30: 01, A31: 01, A33: 01 и A34: 01 по сравнению с CAR, содержащим BB7.2, или с CAR, содержащим VH и VL антитела BB7.2.
В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из четырех или более из A03, A11, A23, A25, A26, A29, A30, A31, A33 и A34 по сравнению с CAR, содержащим BB7.2, или с CAR, содержащим VH и VL антитела BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из четырех или более из A03: 01, A11: 01, A23: 01, A25: 01, A26: 01, A29: 02, A30: 01, A31: 01, A33: 01 и A34: 01 по сравнению с CAR, содержащим BB7.2, или с CAR, содержащим VH и VL антитела BB7.2.
В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из пяти или более из A03, A11, A23, A25, A26, A29, A30, A31, A33 и A34 по сравнению с CAR, содержащим BB7.2, или с CAR, содержащим VH и VL антитела BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из пяти или более из A03: 01, A11: 01, A23: 01, A25: 01, A26: 01, A29: 02, A30: 01, A31: 01, A33: 01 и A34: 01 по сравнению с CAR, содержащим BB7.2, или с CAR, содержащим VH и VL антитела BB7.2.
В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из шести или более из A03, A11, A23, A25, A26, A29, A30, A31, A33 и A34 по сравнению с CAR, содержащим BB7.2, или с CAR, содержащим VH и VL антитела BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из шести или более из A03: 01, A11: 01, A23: 01, A25: 01, A26: 01, A29: 02, A30: 01, A31: 01, A33: 01 и A34: 01 по сравнению с CAR, содержащим BB7.2, или с CAR, содержащим VH и VL антитела BB7.2.
В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из семи или более из A03, A11, A23, A25, A26, A29, A30, A31, A33 и A34 по сравнению с CAR, содержащим BB7.2, или с CAR, содержащим VH и VL антитела BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из семи или более из A03: 01, A11: 01, A23: 01, A25: 01, A26: 01, A29: 02, A30: 01, A31: 01, A33: 01 и A34: 01 по сравнению с CAR, содержащим BB7.2, или с CAR, содержащим VH и VL антитела BB7.2.
В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из восьми или более из A03, A11, A23, A25, A26, A29, A30, A31, A33 и A34 по сравнению с CAR, содержащим BB7.2, или с CAR, содержащим VH и VL антитела BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из восьми или более из A03: 01, A11: 01, A23: 01, A25: 01, A26: 01, A29: 02, A30: 01, A31: 01, A33: 01 и A34: 01 по сравнению с CAR, содержащим BB7.2, или с CAR, содержащим VH и VL антитела BB7.2.
В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из девяти или более из A03, A11, A23, A25, A26, A29, A30, A31, A33 и A34 по сравнению с CAR, содержащим BB7.2, или с CAR, содержащим VH и VL антитела BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из девяти или более из A03: 01, A11: 01, A23: 01, A25: 01, A26: 01, A29: 02, A30: 01, A31: 01, A33: 01 и A34: 01 по сравнению с CAR, содержащим BB7.2, или с CAR, содержащим VH и VL антитела BB7.2.
В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность по каждому из подтипов HLA-A, выбранных из группы, включающей A03, A11, A23, A25, A26, A29, A30, A31, A33 и A34 по сравнению с к CAR, содержащему BB7.2, или к CAR, содержащему VH и VL антитела BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность по каждому из подтипов HLA-A, выбранных из группы, включающей A03: 01, A11: 01, A23: 01, A25: 01, A26: 01, A29 : 02, A30: 01, A31: 01, A33: 01 и A34: 01 по сравнению с CAR, содержащим BB7.2, или с CAR, содержащим VH и VL антитела BB7.2.
В одном воплощении CAR по изобретению обладает меньшей реакционной способностью к подтипу HLA-A, выбранному из группы, включающей A25, A29, A30 и любую их комбинацию, по сравнению с антителом BB7.2, предпочтительно по сравнению с scFv BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2. В одном воплощении CAR по изобретению имеет меньшую реактивность к подтипу HLA-A, выбранному из группы, включающей A25: 01, A29: 02, A30: 01 и любую их комбинацию, по сравнению с антителом BB7.2, предпочтительно по сравнению с к sc7v BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2.
В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из одного или нескольких из A25, A29 и A30, по сравнению с CAR, содержащим BB7.2, или с CAR, содержащим VH и VL антитела BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из одного или нескольких A25: 01, A29: 02 и A30: 01, по сравнению с CAR, содержащим BB7.2 или к CAR, содержащему VH и VL антитела BB7.2.
В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из двух или более из A25, A29 и A30, по сравнению с CAR, содержащим BB7.2, или с CAR, содержащим VH и VL антитела BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность, по меньшей мере, к одному подтипу HLA-A, выбранному из двух или более из A25: 01, A29: 02 и A30: 01, по сравнению с CAR, содержащим BB7. 2 или к CAR, содержащему VH и VL антитела BB7.2.
В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность по каждому из подтипов HLA-A, выбранных из группы, включающей A25, A29 и A30, по сравнению с CAR, содержащим BB7.2, или с CAR, содержащим VH и VL антитела BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность по каждому из подтипов HLA-A, выбранных из группы, включающей A25: 01, A29: 02 и A30: 01, по сравнению с CAR, содержащим BB7.2 или к CAR, содержащему VH и VL антитела BB7.2.
В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к HLA-A25 по сравнению с CAR, содержащим BB7.2, или с CAR, содержащим VH и VL антитела BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к HLA-A29 по сравнению с CAR, содержащим BB7.2, или с CAR, содержащим VH и VL антитела BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к HLA-A30 по сравнению с CAR, содержащим BB7.2, или с CAR, содержащим VH и VL антитела BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к HLA-A3 по сравнению с CAR, содержащим BB7.2, или с CAR, содержащим VH и VL антитела BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к HLA-A11 по сравнению с CAR, содержащим BB7.2, или с CAR, содержащим VH и VL антитела BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к HLA-A26 по сравнению с CAR, содержащим BB7.2, или с CAR, содержащим VH и VL антитела BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к HLA-A31 по сравнению с CAR, содержащим BB7.2, или с CAR, содержащим VH и VL антитела BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к HLA-A32 по сравнению с CAR, содержащим BB7.2, или с CAR, содержащим VH и VL антитела BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к HLA-A33 по сравнению с CAR, содержащим BB7.2, или с CAR, содержащим VH и VL антитела BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к HLA-A34 по сравнению с CAR, содержащим BB7.2, или с CAR, содержащим VH и VL антитела BB7.2.
В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к HLA-A25: 01 по сравнению с CAR, содержащим BB7.2, или с CAR, содержащим VH и VL антитела BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к HLA-A29: 02 по сравнению с CAR, содержащим BB7.2, или с CAR, содержащим VH и VL антитела BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к HLA-A30: по сравнению с CAR, содержащим BB7.2, или с CAR, содержащим VH и VL антитела BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к HLA-A03: 01 по сравнению с CAR, содержащим BB7.2, или с CAR, содержащим VH и VL антитела BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к HLA-A11: 01 по сравнению с CAR, содержащим BB7.2, или с CAR, содержащим VH и VL антитела BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к HLA-A26: 01 по сравнению с CAR, содержащим BB7.2, или с CAR, содержащим VH и VL антитела BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к HLA-A31: 01 по сравнению с CAR, содержащим BB7.2, или с CAR, содержащим VH и VL антитела BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к HLA-A33: 01 по сравнению с CAR, содержащим BB7.2, или с CAR, содержащим VH и VL антитела BB7.2. В одном воплощении анти-HLA-A2 антитело по изобретению имеет меньшую реактивность к HLA-A34: 01 по сравнению с CAR, содержащим BB7.2, или с CAR, содержащим VH и VL антитела BB7.2.
Способы измерения реактивности CAR к подтипам HLA-A известны специалисту в данной области и включают, без ограничения указанным, одиночные анализы на антигены, такие как, например, FlowPRA Single Antigen Antibody, предоставленный ONE LAMBDA.
В одном воплощении CAR по изобретению имеет меньшую реактивность к подтипу HLA-A, выбранному из группы, включающей A03, A11, A23, A25, A26, A29, A30, A31, A33, A34 и любую их комбинацию, по сравнению с CAR, содержащий антитело BB7.2 или по сравнению с CAR, содержащим VH и VL антитела BB7.2, при измерении в условиях теста А.
В одном воплощении CAR по изобретению имеет меньшую реактивность к подтипу HLA-A, выбранному из группы, включающей A25, A29, A30 и любую их комбинацию, по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2 при измерении в условиях теста А.
Тест А:
0.25.106 Т-клеток, экспрессирующих CAR, содержащих анти-HLA-A2 антитело или антитело BB7.2 или VH и VL антитела BB7.2 (mA2 CAR), инкубировали с панелью гранул антител против одиночного антигена FlowPRA (FL1HD01, FL1HD02, FL1HD03). FL1HD04, FL1HD06 и FL1HD08, One Lambda) и фиксируемым красителем для оценки жизнеспособности (FVD, ThermoFisher, 65-0865-14, eBioscience) в течение 30 минут при комнатной температуре. Образцы промывали, фиксировали 0,5% формальдегидом и анализировали с помощью проточной цитометрии. Двести гранул отрицательного контроля использовали на образец. В качестве отрицательного контроля использовали гранулы в чистом виде. Для анализа сначала удаляли мертвые клетки с помощью фиксируемого красителя для оценки жизнеспособности. Гранулы с одиночным антигеном затем отбирали по сигналу выше порогового значения после исключения мертвых клеток и дублетов. Затем количество гранул на HLA определяли их соответствующим пиком интенсивности PE. Данные нормализовали путем умножения количества представляющих интерес гранул в каждом пике HLA на 200, деленного на количество отрицательных гранул в образце. Для каждого пика HLA процент относительного связывания CAR Treg по сравнению с контролем (клетками, не экспрессирующими CAR) определяли путем вычитания количества гранул в CAR-Treg из числа гранул в контрольном образце с последующим делением среднего числа гранул в не-CAR-экспрессирующем контроле, умноженное на 100.
В одном воплощении CAR по изобретению имеет меньшую реактивность к подтипу HLA-A, выбранному из группы, включающей A03, A11, A23, A25, A26, A29, A30, A31, A33, A34 и любую их комбинацию, по сравнению с CAR, содержащий антитело BB7.2 или по сравнению с CAR, содержащим VH и VL антитела BB7.2, при измерении в условиях теста B.
В одном воплощении CAR по изобретению имеет меньшую реактивность к подтипу HLA-A, выбранному из группы, включающей A25, A29, A30 и любую их комбинацию, по сравнению с антителом BB7.2 или по сравнению с антителом, содержащим VH и VL антитела BB7.2 при измерении в условиях теста B.
Тест B:
0.25.106 Т-клеток, экспрессирующих анти-HLA-A2 антитело или антитело BB7.2, или VH и VL антитела BB7.2 или укороченный маркер трансдукции NGFR (NGFR) на поверхности клетки (такой как, например, как часть химерного антигенного рецептора, описанного в настоящем документе), инкубировали с гранулами с антителом против одиночного антигена FlowPRA (FL1HD, One Lambda) и фиксируемым красителем для оценки жизнеспособности (FVD, 65-0865-14, eBioscience), затем фиксировали 0,5% формальдегидом и анализировали с помощью проточной цитометрии. Для анализа сначала удаляли мертвые клетки с помощью фиксируемого красителя для оценки жизнеспособности. Гранулы с одиночным антигеном затем отбирали по сигналу выше порогового значения после исключения мертвых клеток и дублетов. Затем количество гранул на HLA определяли по их соответствующей интенсивности PE. Данные нормализовали путем деления числа отрицательных гранул в образце на количество отрицательных гранул в образце Treg-NGFR, умноженного на количество отрицательных гранул в образце Treg-NGFR. Относительное процентное связывание представляет собой количество гранул в образце NGFR для гранул специфичных по HLA минус нормализованное количество гранул в образце для этих HLA, деленное на количество гранул в образце NGFR, умноженное на 100.
В одном воплощении CAR по изобретению обладает реактивностью, по меньшей мере, к одному подтипу HLA-A, выбранному из группы, включающей A03, A11, A23, A25, A26, A29, A30, A31, A33, A34, статистически уступающей реактивности из CAR, содержащего антитело BB7.2 или CAR, содержащего VH и VL антитела BB7.2, предпочтительно при измерении в условиях теста A или теста B.
В одном воплощении CAR по изобретению обладает реактивностью, по меньшей мере, к одному подтипу HLA-A, выбранному из группы, включающей A25, A29, A30, статистически уступающей реактивности антитела BB7.2 или реактивности антитела, содержащего VH и VL антитела BB7.2, предпочтительно при измерении в условиях теста A или теста B.
В одном воплощении термин «статистически уступающий» означает, что реактивность (то есть, например, относительное связывание в условиях теста А или теста В), измеренная для CAR по изобретению, ниже реактивности, измеренной для BB7. 2 антитела или для антитела, содержащего VH и VL антитела BB7.2, с p-значением по большей мере около 0,05, предпочтительно по большей мере около 0,01, более предпочтительно по большей мере около 0,005 и более предпочтительно по большей мере около 0,001 в частности, при анализе с помощью двухфакторного дисперсионного анализа, апостериорного критерия Даннетта.
В одном воплощении CAR по изобретению обладает реактивностью, по меньшей мере, к одному подтипу HLA-A, выбранному из группы, включающей A03, A11, A23, A25, A26, A29, A30, A31, A33, A34, уступающей реактивности CAR, содержащего антитело BB7.2, или CAR, содержащего VH и VL антитела BB7.2, предпочтительно CAR по изобретению имеет относительное связывание, по меньшей мере, с одним подтипом HLA-A, выбранным из группы, включающей A03, A11, A23, A25, A26, A29, A30, A31, A33, A34 уступающее таковому CAR, содержащему антитело BB7.2, или одному из CAR, содержащему VH и VL антитела BB7.2, при измерении в условиях теста A или теста B, более предпочтительно относительное связывание, измеренное для анти-HLA-A2 антитела по изобретению, составляет по большей мере около 90%, 80%, 70%, 60%, 50%, 40%, 30%, 20%, 10% или менее относительного связывания, измеренного для антитела BB7.2 или для антитела, содержащего VH и VL антитела BB7.2.
В одном воплощении CAR по изобретению обладает реактивностью, по меньшей мере, к одному подтипу HLA-A, выбранному из группы, включающей A25, A29, A30, уступающей реактивности CAR, содержащего антитело BB7.2, или реактивности CAR, содержащего VH и VL антитела BB7.2, предпочтительно CAR по изобретению имеет относительное связывание, по меньшей мере, с одним подтипом HLA-A, выбранным из группы, включающей A25, A29, A30, уступающее относительному связыванию CAR, содержащему антитело BB7.2 или относительному связыванию CAR, содержащему VH и VL антитела BB7.2 при измерении в условиях теста A или теста B, более предпочтительно относительное связывание, измеренное для анти-HLA-A2 антитела по изобретению составляет по большей мере около 90%, 80%, 70%, 60%, 50%, 40%, 30%, 20%, 10% или менее относительного связывания, измеренного для антитела BB7.2 или для антитела, содержащего VH и VL антитела BB7.2.
Настоящее изобретение также относится к последовательности нуклеиновой кислоты, кодирующей CAR, описанного выше, где указанная последовательность нуклеиновой кислоты включает i) последовательность нуклеиновой кислоты связывающей домен HLA-A2 (предпочтительно, где указанный связывающий домен HLA-A2 представляет собой анти-HLA-A2 антитело, предпочтительно анти-HLA-A2 scFv, как описано выше), (ii) необязательно последовательность нуклеиновой кислоты внеклеточного шарнирного домена, (iii) необязательно последовательность нуклеиновой кислоты трансмембранного домена, (iv) одну или несколько последовательностей нуклеиновой кислоты внутриклеточного сигнального домена. В одном воплощении последовательность нуклеиновой кислоты дополнительно включает последовательность, кодирующую метку и/или лидерную последовательность.
В одном воплощении домен связывания HLA-A2, содержащийся в CAR по изобретению, представляет собой scFv, содержащий последовательность SEQ ID NO: 9 и последовательность SEQ ID NO: 10, где X1 представляет собой V или I, X2 представляет собой T или S, X3 представляет собой L или S или A, X4 представляет собой S или T, X5 представляет собой P или S, X6 представляет собой T или S, X7 представляет собой L или P, X8 представляет собой E или D, X9 представляет собой P или R, X10 представляет собой A или V, X11 представляет собой S или T, X12 представляет собой L или Q, X13 представляет собой S или A, X14 представляет собой V или I, X15 представляет собой K или T, X16 представляет собой V или L, X17 представляет собой A или P, X18 представляет собой L или F и X19 представляет собой G или A, в любом порядке от N-конца к C-концу scFv. Предпочтительно, домен связывания HLA-A2, содержащийся в CAR по изобретению, представляет собой scFv, включающий последовательность SEQ ID NO: 9 и последовательность SEQ ID NO: 11, 12 или 13 в любом порядке от N-конца к C-концу scFv.
В одном воплощении последовательность SEQ ID NO: 9 является N-концевой, а последовательность SEQ ID NO: 10, 11, 12 или 13 является C-концевой.
В одном воплощении домен связывания HLA-A2, содержащийся в CAR по изобретению, включает от N-конца к C-концу: SEQ ID NO: 9, необязательный линкер, SEQ ID NO: 10, где X1 представляет собой V или I, X2 представляет собой T или S, X3 представляет собой L или S или A, X4 представляет собой S или T, X5 представляет собой P или S, X6 представляет собой T или S, X7 представляет собой L или P, X8 представляет собой E или D, X9 представляет собой P или R, X10 представляет собой A или V, X11 представляет собой S или T, X12 представляет собой L или Q, X13 представляет собой S или A, X14 представляет собой V или I, X15 представляет собой K или T, X16 представляет собой V или L, X17 представляет собой A или P, X18 представляет собой L или F и X19 представляет собой G или A (предпочтительно одну из SEQ ID NO: 11-13).
В одном воплощении домен связывания HLA-A2, содержащийся в CAR по изобретению, включает от N-конца к C-концу: SEQ ID NO: 10, где X1 представляет собой V или I, X2 представляет собой T или S, X3 представляет собой L или S или A, X4 представляет собой S или T, X5 представляет собой P или S, X6 представляет собой T или S, X7 представляет собой L или P, X8 представляет собой E или D, X9 представляет собой P или R, X10 представляет собой A или V, X11 представляет собой S или T, X12 представляет собой L или Q, X13 представляет собой S или A, X14 представляет собой V или I, X15 представляет собой K или T, X16 представляет собой V или L, X17 представляет собой A или P, X18 представляет собой L или F и X19 представляет собой G или A (предпочтительно одну из SEQ ID NO: 11-13), необязательный линкер, SEQ ID NO: 9.
В одном воплощении домен связывания HLA-A2, содержащийся в CAR по изобретению, включает линкер. Примеры линкеров включают, без ограничения указанным, линкеры GS, как описано в данном документе. В одном воплощении линкер включает или состоит из последовательности GGGGSGGGGSGGGGS (SEQ ID NO: 18).
В одном воплощении домен связывания HLA-A2, содержащийся в CAR по изобретению, включает или состоит из последовательности SEQ ID NO: 69, где X1 представляет собой V или I, X2 представляет собой T или S, X3 представляет собой L или S или A, X4 представляет собой S или T, X5 представляет собой P или S, X6 представляет собой T или S, X7 представляет собой L или P, X8 представляет собой E или D, X9 представляет собой P или R, X10 представляет собой A или V, X11 представляет собой S или T, X12 представляет собой L или Q, X13 представляет собой S или A, X14 представляет собой V или I, X15 представляет собой K или T, X16 представляет собой V или L, X17 представляет собой A или P, X18 представляет собой L или F и X19 представляет собой G или A. SEQ ID NO: 69 состоит из, от N-конца к C-концу, SEQ ID NO: 9, SEQ ID NO: 18 и SEQ ID NO: 10.
В одном воплощении домен связывания HLA-A2, содержащийся в CAR по изобретению, включает или состоит из последовательности SEQ ID NO: 70, 71 или 72. SEQ ID NO: 70-72 состоят от N-конца к C-концу из SEQ ID NO: 9, SEQ ID NO: 18 и SEQ ID NO: 11-13, соответственно.
В одном воплощении связывающий домен HLA-A2, содержащийся в CAR по изобретению, дополнительно включает S-остаток на N-конце, чтобы облегчить расщепление необязательной лидерной последовательности.
Следовательно, в одном воплощении домен связывания HLA-A2, содержащийся в CAR по изобретению, имеет последовательность 73, где X1 представляет собой V или I, X2 представляет собой T или S, X3 представляет собой L или S или A, X4 представляет собой S или T, X5 представляет собой P или S, X6 представляет собой T или S, X7 представляет собой L или P, X8 представляет собой E или D, X9 представляет собой P или R, X10 представляет собой A или V, X11 представляет собой S или T, X12 представляет собой L или Q, X13 представляет собой S или A, X14 представляет собой V или I, X15 представляет собой K или T, X16 представляет собой V или L, X17 представляет собой A или P, X18 представляет собой L или F и X19 представляет собой G или A.
В одном воплощении домен связывания HLA-A2, содержащийся в CAR по изобретению, включает или состоит из последовательности SEQ ID NO: 74, 75 или 76.
В одном воплощении связывающий домен HLA-A2 может быть связан с трансмембранным доменом посредством шарнирного домена.
В одном воплощении короткий олиго- или полипептидный линкер, предпочтительно имеющий длину в диапазоне от 2 до 10 аминокислот, может образовывать шарнирный домен. В одном воплощении термин «линкер» относится к гибкому полипептидному линкеру.
Например, глицин-сериновый дублет обеспечивает особенно подходящий шарнирный домен (линкер GS). В одном воплощении шарнирный домен представляет собой линкер Gly/Ser. Примеры линкеров Gly/Ser включают, без ограничения указанным, линкеры GS, линкеры G2S, линкеры G3S, линкеры G4S.
Примеры линкеров G2S включают, без ограничения указанным, GGS.
Линкеры G3S содержат аминокислотную последовательность (Gly-Gly-Gly-Ser)n, также называемую (GGGS)n или (SEQ ID NO: 14)n, где n представляет собой положительное целое число, равное или большее 1 (такое как, например, n=1, n=2, n=3, n=4, n=5, n=6, n=7, n=8, n=9 или n=10). Примеры линкеров G3S включают, без ограничения указанным, GGGSGGGSGGGSGGGS (SEQ ID NO: 15).
Примеры линкеров G4S включают, без ограничения указанным, (Gly4 Ser), соответствующий GGGGS (SEQ ID NO: 16); (Gly4 Ser)2, соответствующий GGGGSGGGGS (SEQ ID NO: 17); (Gly4Ser)3, соответствующий GGGGSGGGGSGGGGS (SEQ ID NO: 18); и (Gly4 Ser)4, соответствующий GGGGSGGGGSGGGGSGGGGS (SEQ ID NO: 19).
Также в объем изобретения включены шарнирные домены, описанные в WO2012/138475, включенной в настоящий документ ссылкой.
В одном воплощении шарнирный домен включает аминокислотную последовательность AGSSSSGGSTTGGSTT (SEQ ID NO: 20), аминокислотную последовательность GTTAASGSSGGSSSGA (SEQ ID NO: 21), аминокислотную последовательность SSATATAGTGSSTGST (SEQ ID NO: 22) и/или аминокислотная последовательность TSGSTGTAASSTSTST (SEQ ID NO: 23).
В одном воплощении шарнирный домен кодируется нуклеотидной последовательностью GGTGGCGGAGGTTCTGGAGGTGGAGGTTCC (SEQ ID NO: 24).
В другом воплощении шарнирный домен представляет собой шарнир KIR2DS2, соответствующий KIRRDSS (SEQ ID NO: 25).
В одном воплощении шарнирный домен включает или состоит из аминокислотной последовательности шарнира CD8 (SEQ ID NO: 26) или аминокислотной последовательности с 95-99% идентичностью с SEQ ID NO: 26. В одном воплощении шарнирный домен представляет собой шарнир CD8, кодируемый последовательностью нуклеиновой кислоты SEQ ID NO: 27 или последовательностью нуклеиновой кислоты с 95-99% идентичностью с SEQ ID NO: 27.
(SEQ ID NO: 26)
TTTPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACD
(SEQ ID NO: 27)
ACCACGACGCCAGCGCCGCGACCACCAACACCGGCGCCCACCATCGCGTCGCAGCCCCTGTCCCTGCGCCCAGAGGCGTGCCGGCCAGCGGCGGGGGGCGCAGTGCACACGAGGGGGCTGGACTTCGCCTGTGAT
В другом воплощении изобретения шарнирный домен включает или состоит из аминокислотной последовательности шарнира IgG4 (SEQ ID NO: 28) или аминокислотной последовательности с 95-99% идентичностью с SEQ ID NO: 28. В одном воплощении шарнирный домен представляет собой шарнир IgG4, кодируемый последовательностью нуклеиновой кислоты SEQ ID NO: 29 или последовательностью нуклеиновой кислоты с 95-99% идентичностью с SEQ ID NO: 29.
(SEQ ID NO: 28)
ESKYGPPCPPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGKM
(SEQ ID NO: 29)
GAGAGCAAGTACGGCCCTCCCTGCCCCCCTTGCCCTGCCCCCGAGTTCCTGGGCGGACCCAGCGTGTTCCTGTTCCCCCCCAAGCCCAAGGACACCCTGATGATCAGCCGGACCCCCGAGGTGACCTGTGTGGTGGTGGACGTGTCCCAGGAGGACCCCGAGGTCCAGTTCAACTGGTACGTGGACGGCGTGGAGGTGCACAACGCCAAGACCAAGCCCCGGGAGGAGCAGTTCAATAGCACCTACCGGGTGGTGTCCGTGCTGACCGTGCTGCACCAGGACTGGCTGAACGGCAAGGAATACAAGTGTAAGGTGTCCAACAAGGGCCTGCCCAGCAGCATCGAGAAAACCATCAGCAAGGCCAAGGGCCAGCCTCGGGAGCCCCAGGTGTACACCCTGCCCCCTAGCCAAGAGGAGATGACCAAGAACCAGGTGTCCCTGACCTGCCTGGTGAAGGGCTTCTACCCCAGCGACATCGCCGTGGAGTGGGAGAGCAACGGCCAGCCCGAGAACAACTACAAGACCACCCCCCCTGTGCTGGACAGCGACGGCAGCTTCTTCCTGTACAGCCGGCTGACCGTGGACAAGAGCCGGTGGCAGGAGGGCAACGTCTTTAGCTGCTCCGTGATGCACGAGGCCCTGCACAACCACTACACCCAGAAGAGCCTGAGCCTGTCCCTGGGCAAGATG
В другом воплощении шарнирный домен включает или состоит из аминокислотной последовательности шарнира IgD (SEQ ID NO: 30) или аминокислотной последовательности с 95-99% идентичностью с SEQ ID NO: 30. В одном воплощении шарнирный домен представляет собой шарнир IgD, кодируемый последовательностью нуклеиновой кислоты SEQ ID NO: 31 или последовательностью нуклеиновой кислоты с 95-99% идентичностью с SEQ ID NO: 31.
(SEQ ID NO: 30)
RWPESPKAQASSVPTAQPQAEGSLAKATTAPATTRNTGRGGEEKKKEKEKEEQEERETKTPECPSHTQPLGVYLLTPAVQDLWLRDKATFTCFVVGSDLKDAHLTWEVAGKVPTGGVEEGLLERHSNGSQSQHSRLTLPRSLWNAGTSVTCTLNHPSLPPQRLMALREPAAQAPVKLSLNLLASSDPPEAASWLLCEVSGFSPPNILLMWLEDQREVNTSGFAPARPPPQPGSTTFWAWSVLRVPAPPSPQPATYTCVVSHEDSRTLLNASRSLEVSYVTDH
(SEQ ID NO: 31)
AGGTGGCCCGAAAGTCCCAAGGCCCAGGCATCTAGTGTTCCTACTGCACAGCCCCAGGCAGAAGGCAGCCTAGCCAAAGCTACTACTGCACCTGCCACTACGCGCAATACTGGCCGTGGCGGGGAGGAGAAGAAAAAGGAGAAAGAGAAAGAAGAACAGGAAGAGAGGGAGACCAAGACCCCTGAATGTCCATCCCATACCCAGCCGCTGGGCGTCTATCTCTTGACTCCCGCAGTACAGGACTTGTGGCTTAGAGATAAGGCCACCTTTACATGTTTCGTCGTGGGCTCTGACCTGAAGGATGCCCATTTGACTTGGGAGGTTGCCGGAAAGGTACCCACAGGGGGGGTTGAGGAAGGGTTGCTGGAGCGCCATTCCAATGGCTCTCAGAGCCAGCACTCAAGACTCACCCTTCCGAGATCCCTGTGGAACGCCGGGACCTCTGTCACATGTACTCTAAATCATCCTAGCCTGCCCCCACAGCGTCTGATGGCCCTTAGAGAGCCAGCCGCCCAGGCACCAGTTAAGCTTAGCCTGAATCTGCTCGCCAGTAGTGATCCCCCAGAGGCCGCCAGCTGGCTCTTATGCGAAGTGTCCGGCTTTAGCCCGCCCAACATCTTGCTCATGTGGCTGGAGGACCAGCGAGAAGTGAACACCAGCGGCTTCGCTCCAGCCCGGCCCCCACCCCAGCCGGGTTCTACCACATTCTGGGCCTGGAGTGTCTTAAGGGTCCCAGCACCACCTAGCCCCCAGCCAGCCACATACACCTGTGTTGTGTCCCATGAAGATAGCAGGACCCTGCTAAATGCTTCTAGGAGTCTGGAGGTTTCCTACGTGACTGACCATT
В другом воплощении шарнирная область включает или состоит из аминокислотной последовательности шарнира CD28 (SEQ ID NO: 32) или аминокислотной последовательности с 95-99% идентичностью с SEQ ID NO: 32. В одном воплощении шарнирный домен представляет собой шарнир CD28, кодируемый нуклеиновой кислотой SEQ ID NO: 33 или последовательностью нуклеиновой кислоты с 95-99% идентичностью с SEQ ID NO: 33.
(SEQ ID NO: 32)
IEVMYPPPYLDNEKSNGTIIHVKGKHLCPSPLFPGPSKP
(SEQ ID NO: 33)
ATTGAAGTTATGTATCCTCCTCCTTACCTAGACAATGAGAAGAGCAATGGAACCATTATCCATGTGAAAGGGAAACACCTTTGTCCAAGTCCCCTATTTCCCGGACCTTCTAAGCCC
Примеры трансмембранных доменов, которые можно использовать в химерном рецепторе по изобретению, включают, без ограничения указанным, трансмембранные домены альфа-, бета- или дзета-цепи Т-клеточного рецептора или CD28, CD3-гамма, CD3-дельта, CD3 эпсилон, CD3 дзета, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137, CD154, KIRDS2, OX40, CD2, CD27, LFA-1 (CD1 la, CD18), ICOS (CD278), 4-1BB (CD137), GITR, CD40, BAFFR, HVEM (LIGHTR), SLAMF7, NKp80 (KLRF1), CD160, CD19, IL2R бета, IL2R гамма, IL7R a, ITGA1, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, PD1, ITGAX, CDl1c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, TNFR2, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (тактильный), CEACAM1, CRT AM, Ly9 (CD229), CD160 (BY55), PSGL1, CDIOO (SEMA4D), SLAMF6 (NTB-A, Lyl08), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, PAG/Cbp, NKp44, NKp30, NKp46, NKG2D и/или NKG2C.
В одном воплощении трансмембранный домен включает или состоит из аминокислотной последовательности трансмембранного домена CD8 (SEQ ID NO: 34) или аминокислотной последовательности с 95-99% идентичностью с SEQ ID NO: 34. В другом воплощении трансмембранный домен включает или состоит из аминокислотной последовательности, имеющей, по меньшей мере, одну, две или три модификации, но не более 20, 10 или 5 модификаций аминокислотной последовательности SEQ ID NO: 34 или аминокислоты последовательность с 95-99% идентичностью с SEQ ID NO: 34.
(SEQ ID NO: 34)
IYIWAPLAGTCGVLLLSLVITLYC
В другом воплощении трансмембранный домен кодируется нуклеотидной последовательностью трансмембранного домена CD8 (SEQ ID NO: 35) или нуклеотидной последовательностью с 95-99% идентичностью с SEQ ID NO: 35.
(SEQ ID NO: 35)
ATCTACATCTGGGCGCCCTTGGCCGGGACTTGTGGGGTCCTTCTCCTGTCACTGGTTATCACCCTTTACTGC
В другом воплощении трансмембранный домен включает или состоит из аминокислотной последовательности трансмембранного домена CD28 (SEQ ID NO: 36) или аминокислотной последовательности с 95-99% идентичностью с SEQ ID NO: 36. В одном воплощении трансмембранный домен представляет собой трансмембранный домен CD28, кодируемый последовательностью нуклеиновой кислоты SEQ ID NO: 37 или последовательностью нуклеиновой кислоты с 95-99% идентичностью с SEQ ID NO: 37.
(SEQ ID NO: 36)
FWVLVVVGGVLACYSLLVTVAFIIFWV
(SEQ ID NO: 37)
TTTTGGGTGCTGGTGGTGGTTGGTGGAGTCCTGGCTTGCTATAGCTTGCTAGTAACAGTGGCCTTTATTATTTTCTGGGTG
В одном воплощении трансмембранный домен может быть рекомбинантным, и в этом случае он будет включать преимущественно гидрофобные аминокислоты, такие как валин или лейцин.
Цитоплазматический домен, который включает внутриклеточный сигнальный домен CAR, отвечает за активацию, по меньшей мере, одной из эффекторных функций иммунной клетки (например, регуляторной T-клетки), в которую был помещен CAR. Термин «эффекторная функция» относится к специализированной функции иммунной клетки. Например, эффекторная функция регуляторной Т-клетки может включать подавление или подавление индукции и/или пролиферации других иммунных клеток. Кроме того, эффекторная функция Treg может включать воздействие на неиммунные клетки, которое приводит к улучшению клинического состояния, например, способствует восстановлению или регенерации тканей. Таким образом, термин «внутриклеточный сигнальный домен» относится к части белка, которая преобразовывает сигнал эффекторной функции и направляет иммунную клетку для выполнения своей специализированной функции. Хотя обычно можно использовать весь внутриклеточный сигнальный домен, во многих случаях нет необходимости использовать всю цепь. В той степени, в которой используется укороченная часть внутриклеточного сигнального домена, такая укороченная часть может использоваться вместо интактной цепи, если она передает сигнал эффекторной функции. Термин «внутриклеточный сигнальный домен», таким образом, подразумевает включение любой укороченной части внутриклеточного сигнального домена, достаточной для преобразования сигнала эффекторной функции.
В одном воплощении внутриклеточный сигнальный домен может включать всю внутриклеточную часть или весь нативный внутриклеточный сигнальный домен молекулы, из которой он получен, или функциональный фрагмент или его производное.
В соответствии с одним воплощением внутриклеточный сигнальный домен содержит, по меньшей мере, один (такой как, например, один) первичный сигнальный домен T-клетки (или полученную из него последовательность) и, возможно, один или несколько внутриклеточных доменов костимулирующей молекулы T-клетки (или последовательности(ей), полученной(ых) из них).
В одном воплощении внутриклеточный сигнальный домен химерного рецептора по изобретению состоит, по меньшей мере, из одного (например, одного) первичного сигнального домена.
В одном воплощении внутриклеточный сигнальный домен включает один или несколько внутриклеточных доменов костимулирующей молекулы Т-клеток. В одном воплощении внутриклеточный сигнальный домен состоит из одного или нескольких внутриклеточных доменов костимулирующей молекулы Т-клеток.
В другом воплощении внутриклеточный сигнальный домен химерного рецептора по изобретению включает, по меньшей мере, один костимулирующий домен и, по меньшей мере, один (например, один) первичный сигнальный домен.
В другом воплощении внутриклеточный сигнальный домен химерного рецептора по изобретению включает, по меньшей мере, два костимуляторных домена и, по меньшей мере, один (например, один) первичный сигнальный домен.
В одном воплощении изобретения первичный сигнальный домен Т-клеток включает сигнальный домен белка, выбранного из группы CD3-дзета, CD3-гамма, CD3-дельта, CD3-эпсилон, обычная FcR-гамма (FCER1G), FcR-бета (Fc эпсилон Rib), CD79a, CD79b, Fc гамма RIIa, DAP10 и DAP 12 и полученных из них последовательностей.
В одном воплощении первичный сигнальный домен T-клетки включает или состоит из функционального сигнального домена дзета CD3.
В одном воплощении первичный сигнальный домен Т-клеток включает или состоит из аминокислотной последовательности домена CD3-дзета SEQ ID NO: 38, 39, 40 или 41 или аминокислотной последовательности с 95-99% идентичностью с SEQ ID NO: 38-41.
(SEQ ID NO: 38)
RVKFSRSADAPAYKQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR
(SEQ ID NO: 39)
RVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR
(SEQ ID NO: 40)
RVKFSRSADAPAYKQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPQRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR
(SEQ ID NO: 41)
RVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPQRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR
В другом воплощении дзета-первичный сигнальный домен CD3 включает или состоит из аминокислотной последовательности, имеющей, по меньшей мере, одну, две или три модификации, но не более 20, 10 или 5 модификаций аминокислотной последовательности SEQ ID NO: 38-41 или аминокислотную последовательность с 95-99% идентичностью с SEQ ID NO: 38-41.
Таким образом, в одном воплощении последовательность нуклеиновой кислоты, кодирующая первичный сигнальный домен Т-клетки, включает или состоит из последовательности нуклеиновой кислоты домена CD3-дзета SEQ ID NO: 42 или SEQ ID NO: 43 или нуклеотидной последовательности с 95 -99% идентичности с SEQ ID NO: 42 или SEQ ID NO: 43.
(SEQ ID NO: 42)
AGAGTGAAGTTCAGCAGGAGCGCAGACGCCCCCGCGTACAAGCAGGGCCAGAACCAGCTCTATAACGAGCTCAATCTAGGACGAAGAGAGGAGTACGATGTTTTGGACAAGAGACGTGGCCGGGACCCTGAGATGGGGGGAAAGCCGAGAAGGAAGAACCCTCAGGAAGGCCTGTACAATGAACTGCAGAAAGATAAGATGGCGGAGGCCTACAGTGAGATTGGGATGAAAGGCGAGCGCCGGAGGGGCAAGGGGCACGATGGCCTTTACCAGGGTCTCAGTACAGCCACCAAGGACACCTACGACGCCCTTCACATGCAGGCCCTGCCCCCTCGC
(SEQ ID NO: 43)
AGAGTGAAGTTCAGCAGGAGCGCAGACGCCCCCGCGTACCAGCAGGGCCAGAACCAGCTCTATAACGAGCTCAATCTAGGACGAAGAGAGGAGTACGATGTTTTGGACAAGAGACGTGGCCGGGACCCTGAGATGGGGGGAAAGCCGAGAAGGAAGAACCCTCAGGAAGGCCTGTACAATGAACTGCAGAAAGATAAGATGGCGGAGGCCTACAGTGAGATTGGGATGAAAGGCGAGCGCCGGAGGGGCAAGGGGCACGATGGCCTTTACCAGGGTCTCAGTACAGCCACCAAGGACACCTACGACGCCCTTCACATGCAGGCCCTGCCCCCTCGC
Первичные сигнальные домены Т-клеток, которые действуют стимулирующим образом, могут содержать сигнальные мотивы, известные как иммунорецепторные мотивы активации на основе тирозина (ITAMS).
Примеры ITAM, содержащих первичные внутриклеточные сигнальные домены T-клеток, которые особенно полезны в изобретении, включают, без ограничения указанным, домены (или полученные из) CD3-дзета, обычный FcR-гамма (FCER1G), Fc-гамма RIIa, FcR-бета (Fc Эпсилон R1b), CD3 гамма, CD3 дельта, CD3 эпсилон, CD5, CD22, CD66b, CD79a, CD79b, DAP10 и DAP12.
В одном воплощении первичный сигнальный домен Т-клетки включает модифицированный домен ITAM, например, мутированный домен ITAM, у которого была изменена (например, увеличена или уменьшена) активность по сравнению с собственным доменом ITAM. В одном воплощении первичный сигнальный домен включает модифицированный ITAM-содержащий первичный внутриклеточный сигнальный домен, например, оптимизированный и/или укороченный ITAM-содержащий первичный внутриклеточный сигнальный домен. В воплощении первичный сигнальный домен включает один, два, три, четыре или более мотивов ITAM.
В одном воплощении внутриклеточный сигнальный домен химерного рецептора по изобретению включает Т-клеточный первичный сигнальный домен (такой как, например, сигнальный домен CD3-дзета) в сочетании с одним или несколькими костимулирующими сигнальными доменами. Костимулирующий(ие) сигнальный(ые) домен(ы) относится(ятся) к части химерного рецептора, содержащей, по меньшей мере, один внутриклеточный домен костимулирующей молекулы. Костимулирующая молекула представляет собой молекулу клеточной поверхности, отличную от антигенного рецептора или его лигандов, которая необходима для эффективного ответа лимфоцитов на антиген.
Примеры внутриклеточных доменов костимулирующей молекулы Т-клеток включают, без ограничения указанным, сигнальные домены белков, выбранных из группы CD27, CD28, 4-1BB (CD137), молекулы МНС класса I, BTLA, лиганда толл-рецептора, OX40, CD30, CD40, PD-1, ICOS (CD278), антигена-1, связанного с функцией лимфоцитов (LFA-1), CD2, CD7, LIGHT, NKG2C, B7-H3, лиганда, который специфически связывается с CD83, CDS, ICAM-1, GITR, ARHR, BAFFR, HVEM (LIGHTR), SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD160 (BY55), CD19, CD19a, CD4, CD8 альфа, CD8 бета, IL2ra, ILRR бета, IL2R гамма, IL7R альфа, IL-13RA1/RA2, IL-33R (IL1RL1), IL-10RA/RB, IL-4R, IL-5R (CSF2RB), IL-21R, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a/CD18, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, ITGB7, NKG2D, NKG2C, CT 4 (CD152), CD95, TNFR1 (CD120a/TNFRSF1A), TNFR2 (CD120b/TNFRSF1B), TGFbR1/2/3, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Ta ctile), CEACAM1, CRTAM, Ly9 (CD229), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB-A, Lyl08), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162) LTBR, LAT, GADS, SLP-76, PAG/Cbp, общей гамма-цепи, лиганда, который специфически связывается с CD83, NKp44, NKp30, NKp46 или NKG2D и любой их комбинации.
В одном воплощении изобретения химерный рецептор включает, по меньшей мере, один внутриклеточный домен костимулирующей молекулы Т-клеток, выбранной из группы, включающей 4-1BB, ICOS, CD27, OX40, CD28, CTLA4 и PD-1 и любую их комбинацию.
В одном воплощении костимулирующий сигнальный домен Т-клеток включает или состоит из аминокислотной последовательности внутриклеточного домена 4-1BB (SEQ ID NO: 44) или аминокислотной последовательности с 95-99% идентичностью с SEQ ID NO: 44. В другом воплощении костимулирующий сигнальный домен Т-клеток включает или состоит из аминокислотной последовательности, имеющей, по меньшей мере, одну, две или три модификации, но не более 20, 10 или 5 модификаций аминокислотной последовательности SEQ ID NO: 44.
(SEQ ID NO: 44)
KRGRKKLLYIFKQPFMRPVQTTQEEDGCSCRFPEEEEGGCEL
В одном воплощении костимулирующий сигнальный домен Т-клеток включает или состоит из аминокислотной последовательности внутриклеточного домена CD27 (SEQ ID NO: 45) или аминокислотной последовательности с 95-99% идентичностью с SEQ ID NO: 45. В другом воплощении костимулирующий сигнальный домен Т-клеток включает или состоит из аминокислотной последовательности, имеющей, по меньшей мере, одну, две или три модификации, но не более 20, 10 или 5 модификаций аминокислотной последовательности SEQ ID NO: 45.
(SEQ ID NO: 45)
QRRKYRSNKGESPVEPAEPCRYSCPREEEGSTIPIQEDYRKPEPACSP
В одном воплощении костимулирующий сигнальный домен Т-клеток включает или состоит из аминокислотной последовательности внутриклеточного домена CD28 (SEQ ID NO: 46) или аминокислотной последовательности с 95-99% идентичностью с SEQ ID NO: 46. В другом воплощении костимулирующий сигнальный домен Т-клеток включает или состоит из аминокислотной последовательности, имеющей, по меньшей мере, одну, две или три модификации, но не более 20, 10 или 5 модификаций аминокислотной последовательности SEQ ID NO: 46.
(SEQ ID NO: 46)
RSKRSRLLHSDYMNMTPRRPGPTRKHYQPYAPPRDFAAYRS
В одном воплощении изобретения химерный рецептор включает комбинацию, по меньшей мере, двух внутриклеточных доменов костимулирующей молекулы Т-клеток, предпочтительно выбранных из внутриклеточного домена CD28, внутриклеточного домена CD27 и внутриклеточного домена 4-1BB.
В одном воплощении химерный рецептор включает аминокислотную последовательность внутриклеточного домена 4-1BB (SEQ ID NO: 44) или аминокислотную последовательность с 95-99% идентичностью с SEQ ID NO: 44 и аминокислотную последовательность внутриклеточного домена CD27 (SEQ ID NO: 45) или аминокислотную последовательность с 95-99% идентичностью с SEQ ID NO: 45.
В другом воплощении химерный рецептор включает аминокислотную последовательность внутриклеточного домена 4-1BB (SEQ ID NO: 44) или аминокислотную последовательность с 95-99% идентичностью с SEQ ID NO: 44 и аминокислотную последовательность внутриклеточного домена CD28 (SEQ ID NO: 46) или аминокислотную последовательность с 95-99% идентичностью с SEQ ID NO: 46.
В еще одном воплощении химерный рецептор включает аминокислотную последовательность внутриклеточного домена CD27 (SEQ ID NO: 45) или аминокислотную последовательность с 95-99% идентичностью с SEQ ID NO: 45 и аминокислотную последовательность внутриклеточного домена CD28 (SEQ ID NO: 46) или аминокислотную последовательность с 95-99% идентичностью с SEQ ID NO: 46.
В одном воплощении химерный рецептор включает аминокислотную последовательность внутриклеточного домена 4-1BB (SEQ ID NO: 44) или аминокислотную последовательность с 95-99% идентичностью с SEQ ID NO: 44 и аминокислотную последовательность внутриклеточного домена CD27 (SEQ ID NO: 45) или аминокислотную последовательность с 95-99% идентичностью с SEQ ID NO: 45 и аминокислотная последовательность внутриклеточного домена CD28 (SEQ ID NO: 46) или аминокислотную последовательность с 95-99% идентичностью с SEQ ID NO: 46.
Таким образом, в одном воплощении последовательность нуклеиновой кислоты, кодирующая костимулирующий сигнальный домен Т-клеток, включает последовательность нуклеиновой кислоты внутриклеточного домена 4-1BB (SEQ ID NO: 47) или последовательность нуклеиновой кислоты с 95-99% идентичностью с SEQ ID NO: 47 и/или последовательность нуклеиновой кислоты внутриклеточного домена CD27 (SEQ ID NO: 48) или последовательность нуклеиновой кислоты с 95-99% идентичностью с SEQ ID NO: 48, и/или последовательность нуклеиновой кислоты внутриклеточного домена CD28 (SEQ ID NO: 49) или последовательность нуклеиновой кислоты с 95-99% идентичностью с SEQ ID NO: 49.
(SEQ ID NO: 47)
AAACGGGGCAGAAAGAAACTCCTGTATATATTCAAACAACCATTTATGAGACCAGTACAAACTACTCAAGAGGAAGATGGCTGTAGCTGCCGATTTCCAGAAGAAGAAGAAGGAGGATGTGAACTG
(SEQ ID NO: 48)
CAACGAAGGAAATATAGATCAAACAAAGGAGAAAGTCCTGTGGAGCCTGCAGAGCCTTGTCGTTACAGCTGCCCCAGGGAGGAGGAGGGCAGCACCATCCCCATCCAGGAGGATTACCGAAAACCGGAGCCTGCCTGCTCCCCC
(SEQ ID NO: 49)
AGGAGTAAGAGGAGCAGGCTCCTGCACAGTGACTACATGAACATGACTCCCCGCCGCCCCGGGCCCACCCGCAAGCATTACCAGCCCTATGCCCCACCACGCGACTTCGCAGCCTATCGCTCC
В одном воплощении внутриклеточный сигнальный домен химерного рецептора по изобретению содержит:
- аминокислотную последовательность внутриклеточного домена 4-1BB SEQ ID NO: 44 или аминокислотную последовательность с 95-99% идентичностью с SEQ ID NO: 44 и/или аминокислотную последовательность внутриклеточного домена CD27 SEQ ID NO: 45 или аминокислотную последовательность с 95-99% идентичностью с SEQ ID NO: 45, и/или аминокислотную последовательность внутриклеточного домена CD28 SEQ ID NO: 46 и/или аминокислотную последовательность с идентичностью 95-99% с SEQ ID NO: 46; и
- аминокислотную последовательность CD3-дзета внутриклеточного домена SEQ ID NO: 38-41 или аминокислотную последовательность с идентичностью 95-99% с SEQ ID NO: 38-41;
где последовательности, содержащиеся во внутриклеточном домене, экспрессируются в одном и том же каркасе и в виде одной полипептидной цепи.
Таким образом, в одном воплощении последовательность нуклеиновой кислоты, кодирующая внутриклеточный сигнальный домен химерного рецептора по изобретению, содержит:
- последовательность нуклеиновой кислоты внутриклеточного домена 4-1BB SEQ ID NO: 47 или последовательность нуклеиновой кислоты с 95-99% идентичностью с SEQ ID NO: 47 и/или последовательность нуклеиновой кислоты внутриклеточного домена CD27 SEQ ID NO: 48 или последовательность нуклеиновой кислоты с 95-99% идентичностью с SEQ ID NO: 48, и/или последовательность нуклеиновой кислоты внутриклеточного домена CD28 SEQ ID NO: 49 или последовательность нуклеиновой кислоты с 95-99% идентичностью SEQ ID NO: 49; и
- последовательность нуклеиновой кислоты внутриклеточного домена CD3-дзета SEQ ID NO: 42 или SEQ ID NO: 43, или последовательность с идентичностью 95-99% с SEQ ID NO: 42 или SEQ ID NO: 43.
В одном воплощении внутриклеточный сигнальный домен химерного рецептора по изобретению включает, по меньшей мере, два разных домена (например, первичный сигнальный домен и, по меньшей мере, один внутриклеточный домен костимулирующей молекулы Т-клеток), которые могут быть связаны друг с другом случайным образом или в указанном порядке.
Необязательно, короткий олиго- или полипептидный линкер, например, длиной от 2 до 10 аминокислот (например, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислот) может образовывать связь между отдельными сигнальными доменами. В одном воплощении глицин-сериновый дублет (GS) используется в качестве подходящего линкера. В одном воплощении в качестве подходящего линкера используется одна аминокислота, например, аланин (A), глицин (G).
В другом воплощении внутриклеточный сигнальный домен химерного рецептора по изобретению включает два или более, например, 2, 3, 4, 5 или более, костимулирующих сигнальных доменов.
В другом воплощении два или более, например, 2, 3, 4, 5 или более, костимулирующих сигнальных доменов разделены молекулой линкера, например, молекулой линкера, как описано выше.
В одном воплощении внутриклеточный сигнальный домен химерного рецептора по изобретению включает первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41) и костимулирующий сигнальный домен CD28 (предпочтительно SEQ ID NO: 46).
В другом воплощении внутриклеточный сигнальный домен химерного рецептора по изобретению включает первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41) и костимулирующий сигнальный домен 4-1BB (предпочтительно SEQ ID NO: 44).
В другом воплощении внутриклеточный сигнальный домен химерного рецептора по изобретению включает сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41) и сигнальный домен CD27 (предпочтительно SEQ ID NO: 45).
В одном воплощении химерный рецептор по изобретению дополнительно включает лидерную последовательность, расположенную на N-конце от домена связывания HLA-A2. Неограничивающим примером лидерной последовательности является лидерная последовательность CD8, которая может содержать или состоит из последовательности SEQ ID NO: 50.
(SEQ ID NO: 50)
MALPVTALLLPLALLLHAARP
В одном воплощении химерный рецептор дополнительно включает метку, такую как, например, метка для контроля качества, обогащения, отслеживания in vivo и т.п. Указанная метка может быть локализована на N-конце, C-конце и/или внутри. Примеры меток, которые можно использовать в химерном рецепторе по изобретению, хорошо известны специалисту в данной области. Например, но без ограничения указанным, метка, используемая в изобретении, может быть меткой, выбранной из группы, включающей или состоящей из метки гемагглютинина, метки полиаргинина, метки полигистидина, метки Myc, метки Strep, S-метки, метки HAT, 3xTag Flag, метки кальмодуллин-связывающего пептида, SBP-метки, метки хитин-связывающего домена, GST-метки, метки мальтозосвязывающего белка, метки флуоресцентного белка (например, eGFP, имеющего последовательность SEQ ID NO: 68), T7-метки, V5-метки и Xpress-метки. Другие примеры метки включают, без ограничения указанным, NWSHPQFEK (SEQ ID NO: 51) или SAWSHPQFEK (SEQ ID NO: 52).
(SEQ ID NO: 51)
NWSHPQFEK
(SEQ ID NO: 52)
SAWSHPQFEK
(SEQ ID NO: 68)
MVSKGEELFTGVVPILVELDGDVNGHKFSVSGEGEGDATYGKLTLKFICTTGKLPVPWPTLVTTLTYGVQCFSRYPDHMKQHDFFKSAMPEGYVQERTIFFKDDGNYKTRAEVKFEGDTLVNRIELKGIDFKEDGNILGHKLEYNYNSHNVYIMADKQKNGIKVNFKIRHNIEDGSVQLADHYQQNTPIGDGPVLLPDNHYLSTQSALSKDPNEKRDHMVLLEFVTAAGITLGMDELYK
В одном воплощении химерный рецептор по изобретению дополнительно включает сайт рибосомального расщепления, расположенный на С-конце от внутриклеточного сигнального домена. Неограничивающим примером сайта рибосомального расщепления является последовательность сайта рибосомального расщепления P2A ASGSGATNFSLLKQAGDVEENPGP (SEQ ID NO: 61).
В соответствии с первым воплощением химерный рецептор по изобретению включает домен, связывающий HLA-A2 (предпочтительно SEQ ID NO: 69 или 73, где X1 представляет собой V или I, X2 представляет собой T или S, X3 представляет собой L или S или A, X4 представляет собой S или T, X5 представляет собой P или S, X6 представляет собой T или S, X7 представляет собой L или P, X8 представляет собой E или D, X9 представляет собой P или R, X10 представляет собой A или V, X11 представляет собой S или T, X12 представляет собой L или Q, X13 представляет собой S или A, X14 представляет собой V или I, X15 представляет собой K или T, X16 представляет собой V или L, X17 представляет собой A или P, X18 представляет собой L или F и X19 представляет собой G или A, более предпочтительно одну из SEQ ID NO: 70-72 или 74-76), необязательно, внеклеточный шарнирный домен, трансмембранный домен и первичный сигнальный домен Т-клеток.
В одном воплощении химерный рецептор по изобретению включает маркер-связывающий домен HLA-A2; трансмембранный домен CD8 (предпочтительно SEQ ID NO: 34); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41).
В одном воплощении химерный рецептор по изобретению включает маркер-связывающий домен HLA-A2; трансмембранный домен CD28 (предпочтительно SEQ ID NO: 36); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41).
В другом воплощении химерный рецептор по изобретению включает маркер-связывающий домен HLA-A2; шарнирный домен CD8 (предпочтительно SEQ ID NO: 26); трансмембранный домен CD8 (предпочтительно SEQ ID NO: 34); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен CD8 (предпочтительно SEQ ID NO: 26); трансмембранный домен CD28 (предпочтительно SEQ ID NO: 36); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41).
В другом воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен IgG4 (предпочтительно SEQ ID NO: 28); трансмембранный домен CD8 (предпочтительно SEQ ID NO: 34); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен IgG4 (предпочтительно SEQ ID NO: 28); трансмембранный домен CD28 (предпочтительно SEQ ID NO: 36); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41).
В другом воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен IgD (предпочтительно SEQ ID NO: 30); трансмембранный домен CD8 (предпочтительно SEQ ID NO: 34); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен IgD (предпочтительно SEQ ID NO: 30); трансмембранный домен CD28 (предпочтительно SEQ ID NO: 36); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41).
В другом воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен CD28 (предпочтительно SEQ ID NO: 32); трансмембранный домен CD8 (предпочтительно SEQ ID NO: 34); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен CD28 (предпочтительно SEQ ID NO: 32); трансмембранный домен CD28 (предпочтительно SEQ ID NO: 36); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41).
В соответствии со вторым воплощением химерный рецептор по изобретению включает HLA-A2-связывающий домен (предпочтительно SEQ ID NO: 69 или 73, где X1 представляет собой V или I, X2 представляет собой T или S, X3 представляет собой L или S или A, X4 представляет собой S или T, X5 представляет собой P или S, X6 представляет собой T или S, X7 представляет собой L или P, X8 представляет собой E или D, X9 представляет собой P или R, X10 представляет собой A или V, X11 представляет собой S или T, X12 представляет собой L или Q, X13 представляет собой S или A, X14 представляет собой V или I, X15 представляет собой K или T, X16 представляет собой V или L, X17 представляет собой A или P, X18 представляет собой L или F и X19 представляет собой G или A, более предпочтительно одну из SEQ ID NO: 70-72 или 74-76), необязательно, внеклеточный шарнирный домен, трансмембранный домен, один внутриклеточный домен костимулирующей молекулы Т-клеток и первичный сигнальный домен Т-клеток.
В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; трансмембранный домен CD8 (предпочтительно SEQ ID NO: 34); внутриклеточный домен 4-1BB (предпочтительно SEQ ID NO: 44); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; трансмембранный домен CD8 (предпочтительно SEQ ID NO: 34); внутриклеточный домен CD27 (предпочтительно SED ID NO: 45); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; трансмембранный домен CD8 (предпочтительно SEQ ID NO: 34); внутриклеточный домен CD28 (предпочтительно SED ID NO: 46); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41).
В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; трансмембранный домен CD28 (предпочтительно SEQ ID NO: 36); внутриклеточный домен 4-1BB (предпочтительно SED ID NO: 44); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; трансмембранный домен CD28 (предпочтительно SEQ ID NO: 36); внутриклеточный домен CD27 (предпочтительно SED ID NO: 45); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; трансмембранный домен CD28 (предпочтительно SEQ ID NO: 36); внутриклеточный домен CD28 (предпочтительно SED ID NO: 46); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41).
В другом воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен CD8 (предпочтительно SEQ ID NO: 26); трансмембранный домен CD8 (предпочтительно SEQ ID NO: 34); внутриклеточный домен 4-1BB (предпочтительно SED ID NO: 44); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен CD8 (предпочтительно SEQ ID NO: 26); трансмембранный домен CD8 (предпочтительно SEQ ID NO: 34); внутриклеточный домен CD27 (предпочтительно SEQ ID NO: 45); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен CD8 (предпочтительно SEQ ID NO: 26); трансмембранный домен CD8 (предпочтительно SEQ ID NO: 34); внутриклеточный домен CD28 (предпочтительно SEQ ID NO: 46); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41).
В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен CD8 (предпочтительно SEQ ID NO: 26); трансмембранный домен CD28 (предпочтительно SEQ ID NO: 36); внутриклеточный домен 4-1BB (предпочтительно SEQ ID NO: 44); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен CD8 (предпочтительно SEQ ID NO: 26); трансмембранный домен CD28 (предпочтительно SEQ ID NO: 36); внутриклеточный домен CD27 (предпочтительно SEQ ID NO: 45); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен CD8 (предпочтительно SEQ ID NO: 26); трансмембранный домен CD28 (предпочтительно SEQ ID NO: 36); внутриклеточный домен CD28 (предпочтительно SEQ ID NO: 46); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41).
В другом воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен IgG4 (предпочтительно SEQ ID NO: 28); трансмембранный домен CD8 (предпочтительно SEQ ID NO: 34); внутриклеточный домен 4-1BB (предпочтительно SED ID NO: 44); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен IgG4 (предпочтительно SEQ ID NO: 28); трансмембранный домен CD8 (предпочтительно SEQ ID NO: 34); внутриклеточный домен CD27 (предпочтительно SEQ ID NO: 45); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен IgG4 (предпочтительно SEQ ID NO: 28); трансмембранный домен CD8 (предпочтительно SEQ ID NO: 34); внутриклеточный домен CD28 (предпочтительно SEQ ID NO: 46); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41).
В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен IgG4 (предпочтительно SEQ ID NO: 28); трансмембранный домен CD28 (предпочтительно SEQ ID NO: 36); внутриклеточный домен 4-1BB (предпочтительно SED ID NO: 44); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен IgG4 (предпочтительно SEQ ID NO: 28); трансмембранный домен CD28 (предпочтительно SEQ ID NO: 36); внутриклеточный домен CD27 (предпочтительно SED ID NO: 45); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен IgG4 (предпочтительно SEQ ID NO: 28); трансмембранный домен CD28 (предпочтительно SEQ ID NO: 36); внутриклеточный домен CD28 (предпочтительно SED ID NO: 46); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41).
В другом воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен IgD (предпочтительно SEQ ID NO: 30); трансмембранный домен CD8 (предпочтительно SEQ ID NO: 34); внутриклеточный домен 4-1BB (предпочтительно SED ID NO: 44); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен IgD (предпочтительно SEQ ID NO: 30); трансмембранный домен CD8 (предпочтительно SEQ ID NO: 34); внутриклеточный домен CD27 (предпочтительно SEQ ID NO: 45); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен IgD (предпочтительно SEQ ID NO: 30); трансмембранный домен CD8 (предпочтительно SEQ ID NO: 34); внутриклеточный домен CD28 (предпочтительно SEQ ID NO: 46); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41).
В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен IgD (предпочтительно SEQ ID NO: 30); трансмембранный домен CD28 (предпочтительно SEQ ID NO: 36); внутриклеточный домен 4-1BB (предпочтительно SED ID NO: 44); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен IgD (предпочтительно SEQ ID NO: 30); трансмембранный домен CD28 (предпочтительно SEQ ID NO: 36); внутриклеточный домен CD27 (предпочтительно SED ID NO: 45); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен IgD (предпочтительно SEQ ID NO: 30); трансмембранный домен CD28 (предпочтительно SEQ ID NO: 36); внутриклеточный домен CD28 (предпочтительно SEQ ID NO: 46); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41).
В другом воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен CD28 (предпочтительно SEQ ID NO: 32); трансмембранный домен CD8 (предпочтительно SEQ ID NO: 34); внутриклеточный домен 4-1BB (предпочтительно SED ID NO: 44); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен CD28 (предпочтительно SEQ ID NO: 32); трансмембранный домен CD8 (предпочтительно SEQ ID NO: 34); внутриклеточный домен CD27 (предпочтительно SEQ ID NO: 45); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен CD28 (предпочтительно SEQ ID NO: 32); трансмембранный домен CD8 (предпочтительно SEQ ID NO: 34); внутриклеточный домен CD28 (предпочтительно SEQ ID NO: 46); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41).
В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен CD28 (предпочтительно SEQ ID NO: 32); трансмембранный домен CD28 (предпочтительно SEQ ID NO: 36); внутриклеточный домен 4-1BB (предпочтительно SED ID NO: 44); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен CD28 (предпочтительно SEQ ID NO: 32); трансмембранный домен CD28 (предпочтительно SEQ ID NO: 36); внутриклеточный домен CD27 (предпочтительно SEQ ID NO: 45); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен CD28 (предпочтительно SEQ ID NO: 32); трансмембранный домен CD28 (предпочтительно SEQ ID NO: 36); внутриклеточный домен CD28 (предпочтительно SED ID NO: 46); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41).
В соответствии с третьим воплощением химерный рецептор по изобретению включает домен, связывающий HLA-A2 (предпочтительно SEQ ID NO: 69 или 73, где X1 представляет собой V или I, X2 представляет собой T или S, X3 представляет собой L или S или A, X4 представляет собой S или T, X5 представляет собой P или S, X6 представляет собой T или S, X7 представляет собой L или P, X8 представляет собой E или D, X9 представляет собой P или R, X10 представляет собой A или V, X11 представляет собой S или T, X12 представляет собой L или Q, X13 представляет собой S или A, X14 представляет собой V или I, X15 представляет собой K или T, X16 представляет собой V или L, X17 представляет собой A или P, X18 представляет собой L или F и X19 представляет собой G или A, более предпочтительно одну из SEQ ID NO: 70-72 или 74-76), необязательно, внеклеточный шарнирный домен, трансмембранный домен, два внутриклеточных домена костимулирующей молекулы Т-клеток и первичный сигнальный домен Т-клеток.
В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; трансмембранный домен CD8 (предпочтительно SEQ ID NO: 34); внутриклеточный домен 4-1BB (предпочтительно SED ID NO: 44); внутриклеточный домен CD27 (предпочтительно SEQ ID NO: 45); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; трансмембранный домен CD8 (предпочтительно SEQ ID NO: 34); внутриклеточный домен 4-1BB (предпочтительно SEQ ID NO: 44); внутриклеточный домен CD28 (предпочтительно SEQ ID NO: 46); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; трансмембранный домен CD8 (предпочтительно SEQ ID NO: 34); внутриклеточный домен CD27 (предпочтительно SEQ ID NO: 45); внутриклеточный домен CD28 (предпочтительно SEQ ID NO: 46); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41).
В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; трансмембранный домен CD28 (предпочтительно SEQ ID NO: 36); внутриклеточный домен 4-1BB (предпочтительно SED ID NO: 44); внутриклеточный домен CD27 (предпочтительно SED ID NO: 45); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; трансмембранный домен CD28 (предпочтительно SEQ ID NO: 36); внутриклеточный домен 4-1BB (предпочтительно SED ID NO: 44); внутриклеточный домен CD28 (предпочтительно SEQ ID NO: 46); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; трансмембранный домен CD28 (предпочтительно SEQ ID NO: 36); внутриклеточный домен CD27 (предпочтительно SED ID NO: 45); внутриклеточный домен CD28 (предпочтительно SED ID NO: 46); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41).
В другом воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен CD8 (предпочтительно SEQ ID NO: 26); трансмембранный домен CD8 (предпочтительно SEQ ID NO: 34); внутриклеточный домен 4-1BB (предпочтительно SED ID NO: 44); внутриклеточный домен CD27 (предпочтительно SED ID NO: 45); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен CD8 (предпочтительно SEQ ID NO: 26); трансмембранный домен CD8 (предпочтительно SEQ ID NO: 34); внутриклеточный домен 4-1BB (предпочтительно SED ID NO: 44); внутриклеточный домен CD28 (предпочтительно SED ID NO: 46); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен CD8 (предпочтительно SEQ ID NO: 26); трансмембранный домен CD8 (предпочтительно SEQ ID NO: 34); внутриклеточный домен CD27 (предпочтительно SEQ ID NO: 45); внутриклеточный домен CD28 (предпочтительно SEQ ID NO: 46); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41).
В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен CD8 (предпочтительно SEQ ID NO: 26); трансмембранный домен CD28 (предпочтительно SEQ ID NO: 36); внутриклеточный домен 4-1BB (предпочтительно SED ID NO: 44); внутриклеточный домен CD27 (предпочтительно SED ID NO: 45); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен CD8 (предпочтительно SEQ ID NO: 26); трансмембранный домен CD28 (предпочтительно SEQ ID NO: 36); внутриклеточный домен 4-1BB (предпочтительно SEQ ID NO: 44); внутриклеточный домен CD28 (предпочтительно SEQ ID NO: 46); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен CD8 (предпочтительно SEQ ID NO: 26); трансмембранный домен CD28 (предпочтительно SEQ ID NO: 36); внутриклеточный домен CD27 (предпочтительно SED ID NO: 45); внутриклеточный домен CD28 (предпочтительно SEQ ID NO: 46); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41).
В другом воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен IgG4 (предпочтительно SEQ ID NO: 28); трансмембранный домен CD8 (предпочтительно SEQ ID NO: 34); внутриклеточный домен 4-1BB (предпочтительно SED ID NO: 44); внутриклеточный домен CD27 (предпочтительно SEQ ID NO: 45); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен IgG4 (предпочтительно SEQ ID NO: 28); трансмембранный домен CD8 (предпочтительно SEQ ID NO: 34); внутриклеточный домен 4-1BB (предпочтительно SEQ ID NO: 44); внутриклеточный домен CD28 (предпочтительно SEQ ID NO: 46); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен IgG4 (предпочтительно SEQ ID NO: 28); трансмембранный домен CD8 (предпочтительно SEQ ID NO: 34); внутриклеточный домен CD27 (предпочтительно SEQ ID NO: 45); внутриклеточный домен CD28 (предпочтительно SED ID NO: 46); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41).
В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен IgG4 (предпочтительно SEQ ID NO: 28); трансмембранный домен CD28 (предпочтительно SEQ ID NO: 36); внутриклеточный домен 4-1BB (предпочтительно SED ID NO: 44); внутриклеточный домен CD27 (предпочтительно SED ID NO: 45); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен IgG4 (предпочтительно SEQ ID NO: 28); трансмембранный домен CD28 (предпочтительно SEQ ID NO: 36); внутриклеточный домен 4-1BB (предпочтительно SEQ ID NO: 44); внутриклеточный домен CD28 (предпочтительно SEQ ID NO: 46); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен IgG4 (предпочтительно SEQ ID NO: 28); трансмембранный домен CD28 (предпочтительно SEQ ID NO: 36); внутриклеточный домен CD27 (предпочтительно SED ID NO: 45); внутриклеточный домен CD28 (предпочтительно SEQ ID NO: 46); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41).
В другом воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен IgD, предпочтительно содержащий аминокислотную последовательность SEQ ID NO: 30; трансмембранный домен CD8 (предпочтительно SEQ ID NO: 34); внутриклеточный домен 4-1BB (предпочтительно SEQ ID NO: 44); внутриклеточный домен CD27 (предпочтительно SEQ ID NO: 45); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен IgD (предпочтительно SEQ ID NO: 30); трансмембранный домен CD8 (предпочтительно SEQ ID NO: 34); внутриклеточный домен 4-1BB (предпочтительно SED ID NO: 44); внутриклеточный домен CD28 (предпочтительно SEQ ID NO: 45); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен IgD (предпочтительно SEQ ID NO: 30); трансмембранный домен CD8 (предпочтительно SEQ ID NO: 34); внутриклеточный домен CD27 (предпочтительно SEQ ID NO: 45); внутриклеточный домен CD28 (предпочтительно SEQ ID NO: 46); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41).
В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен IgD (предпочтительно SEQ ID NO: 30); трансмембранный домен CD28 (предпочтительно SEQ ID NO: 36); внутриклеточный домен 4-1BB (предпочтительно SED ID NO: 44); внутриклеточный домен CD27 (предпочтительно SEQ ID NO: 45); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен IgD (предпочтительно SEQ ID NO: 30); трансмембранный домен CD28 (предпочтительно SEQ ID NO: 36); внутриклеточный домен 4-1BB (предпочтительно SED ID NO: 44); внутриклеточный домен CD28 (предпочтительно SED ID NO: 46); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен IgD (предпочтительно SEQ ID NO: 30); трансмембранный домен CD28 (предпочтительно SEQ ID NO: 36); внутриклеточный домен CD27 (предпочтительно SED ID NO: 45); внутриклеточный домен CD28 (предпочтительно SED ID NO: 46); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41).
В другом воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен CD28 (предпочтительно SEQ ID NO: 34); трансмембранный домен CD8 (предпочтительно SEQ ID NO: 36); внутриклеточный домен 4-1BB (предпочтительно SED ID NO: 44); внутриклеточный домен CD27 (предпочтительно SEQ ID NO: 45); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен CD28 (предпочтительно SEQ ID NO: 32); трансмембранный домен CD8 (предпочтительно SEQ ID NO: 34); внутриклеточный домен 4-1BB (предпочтительно SED ID NO: 44); внутриклеточный домен CD28 (предпочтительно SEQ ID NO: 46); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен CD28 (предпочтительно SEQ ID NO: 32); трансмембранный домен CD8 (предпочтительно SEQ ID NO: 34); внутриклеточный домен CD27 (предпочтительно SEQ ID NO: 45); внутриклеточный домен CD28 (предпочтительно SEQ ID NO: 46); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41).
В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен CD28 (предпочтительно SEQ ID NO: 32); трансмембранный домен CD28 (предпочтительно SEQ ID NO: 36); внутриклеточный домен 4-1BB (предпочтительно SEQ ID NO: 44); внутриклеточный домен CD27 (предпочтительно SEQ ID NO: 45); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен CD28 (предпочтительно SEQ ID NO: 32); трансмембранный домен CD28 (предпочтительно SEQ ID NO: 36); внутриклеточный домен 4-1BB (предпочтительно SEQ ID NO: 44); внутриклеточный домен CD28 (предпочтительно SEQ ID NO: 46); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41). В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2; шарнирный домен CD28 (предпочтительно SEQ ID NO: 32); трансмембранный домен CD28 (предпочтительно SEQ ID NO: 36); внутриклеточный домен CD27 (предпочтительно SED ID NO: 45); внутриклеточный домен CD28 (предпочтительно SED ID NO: 46); и первичный сигнальный домен CD3-дзета (предпочтительно SEQ ID NO: 38, 39, 40 или 41).
В одном воплощении химерный рецептор по изобретению включает (i) домен связывания HLA-A2 (предпочтительно SEQ ID NO: 69 или 73, где X1 представляет собой V или I, X2 представляет собой T или S, X3 представляет собой L или S или A, X4 представляет собой S или T, X5 представляет собой P или S, X6 представляет собой T или S, X7 представляет собой L или P, X8 представляет собой E или D, X9 представляет собой P или R, X10 представляет собой A или V, X11 представляет собой S или T, X12 представляет собой L или Q, X13 представляет собой S или A, X14 представляет собой V или I, X15 представляет собой K или T, X16 представляет собой V или L, X17 представляет собой A или P, X18 представляет собой L или F и X19 представляет собой G или A, более предпочтительно одну из SEQ ID NO: 70-72 или 74-76), (ii) шарнирную область CD28 человека, (iii) трансмембранный домен CD28 человека, (iv) внутриклеточный домен CD28 человека и (v) внутриклеточный домен цепи CD3ζ человека.
В одном воплощении часть химерного рецептора, содержащая шарнирную область CD28 человека, трансмембранный домен CD28 человека, внутриклеточный домен CD28 человека и внутриклеточный домен цепи CD3ζ человека, соответствует аминокислотной последовательности SEQ ID NO: 53 или 54 или аминокислотную последовательность с 95-99% идентичностью с SEQ ID NO: 53 или 54.
(SEQ ID NO: 53)
AAAIEVMYPPPYLDNEKSNGTIIHVKGKHLCPSPLFPGPSKPFWVLVVVGGVLACYSLLVTVAFIIFWVRSKRSRLLHSDYMNMTPRRPGPTRKHYQPYAPPRDFAAYRSRVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR
(SEQ ID NO: 54)
AAAIEVMYPPPYLDNEKSNGTIIHVKGKHLCPSPLFPGPSKPFWVLVVVGGVLACYSLLVTVAFIIFWVRSKRSRLLHSDYMNMTPRRPGPTRKHYQPYAPPRDFAAYRSRVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPQRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR
В другом воплощении химерный рецептор по изобретению включает (i) домен, связывающий HLA-A2 (предпочтительно SEQ ID NO: 69 или 73, где X1 представляет собой V или I, X2 представляет собой T или S, X3 представляет собой L или S или A, X4 представляет собой S или T, X5 представляет собой P или S, X6 представляет собой T или S, X7 представляет собой L или P, X8 представляет собой E или D, X9 представляет собой P или R, X10 представляет собой A или V, X11 представляет собой S или T, X12 представляет собой L или Q, X13 представляет собой S или A, X14 представляет собой V или I, X15 представляет собой K или T, X16 представляет собой V или L, X17 представляет собой A или P, X18 представляет собой L или F и X19 представляет собой G или A, более предпочтительно одну из SEQ ID NO: 70-72 или 74-76), (ii) шарнирная область CD8 человека, (iii) трансмембранный домен CD8 человека, (iv) внутриклеточный домен 4-1BB человека и (v) внутриклеточный домен CD3ζ человека.
В другом воплощении химерный рецептор по изобретению включает (i) домен, связывающий HLA-A2 (предпочтительно SEQ ID NO: 69 или 73, где X1 представляет собой V или I, X2 представляет собой T или S, X3 представляет собой L или S или A, X4 представляет собой S или T, X5 представляет собой P или S, X6 представляет собой T или S, X7 представляет собой L или P, X8 представляет собой E или D, X9 представляет собой P или R, X10 представляет собой A или V, X11 представляет собой S или T, X12 представляет собой L или Q, X13 представляет собой S или A, X14 представляет собой V или I, X15 представляет собой K или T, X16 представляет собой V или L, X17 представляет собой A или P, X18 представляет собой L или F и X19 представляет собой G или A, более предпочтительно одну из SEQ ID NO: 70-72 или 74-76), (ii) шарнирная область CD8 человека, (iii) трансмембранный домен CD8 человека, (iv) внутриклеточный домен 4-1BB человека и (v) внутриклеточный домен CD3ζ человека. В одном воплощении часть химерного рецептора, содержащая шарнирную область CD8 человека, трансмембранный домен CD8 человека, внутриклеточный домен 4-1BB человека и внутриклеточный домен CD3ζ человека, включает или состоит из аминокислотной последовательности SEQ ID NO: 55, 56, 57 или 58, или любой аминокислотной последовательности с 95-99% идентичностью с SEQ ID NO: 55-58.
(SEQ ID NO: 55)
TTTPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACDIYIWAPLAGTCGVLLLSLVITLYCKRGRKKLLYIFKQPFMRPVQTTQEEDGCSCRFPEEEEGGCELRVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR
(SEQ ID NO: 56)
NWSHPQFEKMHTTTPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACDIYIWAPLAGTCGVLLLSLVITLYCKRGRKKLLYIFKQPFMRPVQTTQEEDGCSCRFPEEEEGGCELTRRVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR
(SEQ ID NO: 57)
TTTPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACDIYIWAPLAGTCGVLLLSLVITLYCKRGRKKLLYIFKQPFMRPVQTTQEEDGCSCRFPEEEEGGCELRVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPQRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR
(SEQ ID NO: 58)
NWSHPQFEKMHTTTPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACDIYIWAPLAGTCGVLLLSLVITLYCKRGRKKLLYIFKQPFMRPVQTTQEEDGCSCRFPEEEEGGCELTRRVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPQRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR
В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2 (предпочтительно SEQ ID NO: 69 или 73, где X1 представляет собой V или I, X2 представляет собой T или S, X3 представляет собой L или S или A, X4 представляет собой S или T, X5 представляет собой P или S, X6 представляет собой T или S, X7 представляет собой L или P, X8 представляет собой E или D, X9 представляет собой P или R, X10 представляет собой A или V, X11 представляет собой S или T, X12 представляет собой L или Q, X13 представляет собой S или A, X14 представляет собой V или I, X15 представляет собой K или T, X16 представляет собой V или L, X17 представляет собой A или P, X18 представляет собой L или F и X19 представляет собой G или A, более предпочтительно один из SEQ ID NO: 70-72 или 74-76), связанной с аминокислотной последовательностью SEQ ID NO: 55-58 или последовательностью или аминокислотной последовательностью с 95-99% идентичностью с SEQ ID NO: 55-58.
В одном воплощении химерный рецептор по изобретению включает или состоит из последовательности, представленной в SEQ ID NO: 77, или любой аминокислотной последовательности с 95-99% идентичностью с SEQ ID NO: 77.
(SEQ ID NO: 77)
SQVQLVQSGPEVKKPGASVKVSCKASGYTFTSYHIQWVRQAPGQGLEWIGWIYPGDGSTQYNEKFKGRVTITADKSTSTAYMELSSLTSEDTAVYYCAREGTYYAMDYWGQGTSVTVSSGGGGSGGGGSGGGGSDX1VMTQX2PX3X4LX5VX6X7GX8X9X10X11ISCRSSQSIVHSNGNTYLEWYX12QKPGQX13PRLLIYKVSNRFSGX14PDRFSGSGSGTDFTLX15ISRX16EX17EDX18X19VYYCFQGSHVPRTFGGGTKLEIKRRTTTPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACDIYIWAPLAGTCGVLLLSLVITLYCKRGRKKLLYIFKQPFMRPVQTTQEEDGCSCRFPEEEEGGCELRVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR
где X1 представляет собой V или I, X2 представляет собой T или S, X3 представляет собой L или S или A, X4 представляет собой S или T, X5 представляет собой P или S, X6 представляет собой T или S, X7 представляет собой L или P, X8 представляет собой E или D, X9 представляет собой P или R, X10 представляет собой A или V, X11 представляет собой S или T, X12 представляет собой L или Q, X13 представляет собой S или A, X14 представляет собой V или I, X15 представляет собой K или T, X16 представляет собой V или L, X17 представляет собой A или P, X18 представляет собой L или F и X19 представляет собой G или A.
В одном воплощении химерный рецептор по изобретению дополнительно включает лидерную последовательность на N-конце, предпочтительно имеющую последовательность SEQ ID NO: 50, и включает или состоит из последовательности SEQ ID NO: 81, где X1 представляет собой V или I, X2 представляет собой T или S, X3 представляет собой L или S или A, X4 представляет собой S или T, X5 представляет собой P или S, X6 представляет собой T или S, X7 представляет собой L или P, X8 представляет собой E или D, X9 представляет собой P или R, X10 представляет собой A или V, X11 представляет собой S или T, X12 представляет собой L или Q, X13 представляет собой S или A, X14 представляет собой V или I, X15 представляет собой K или T, X16 представляет собой V или L, X17 представляет собой A или P, X18 представляет собой L или F и X19 представляет собой G или A, или любую аминокислотную последовательность с 95-99% идентичностью с SEQ ID NO: 81.
(SEQ ID NO: 81)
MALPVTALLLPLALLLHAARPSQVQLVQSGPEVKKPGASVKVSCKASGYTFTSYHIQWVRQAPGQGLEWIGWIYPGDGSTQYNEKFKGRVTITADKSTSTAYMELSSLTSEDTAVYYCAREGTYYAMDYWGQGTSVTVSSGGGGSGGGGSGGGGSDX1VMTQX2PX3X4LX5VX6X7GX8X9X10X11ISCRSSQSIVHSNGNTYLEWYX12QKPGQX13PRLLIYKVSNRFSGX14PDRFSGSGSGTDFTLX15ISRX16EX17EDX18X19VYYCFQGSHVPRTFGGGTKLEIKRRTTTPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACDIYIWAPLAGTCGVLLLSLVITLYCKRGRKKLLYIFKQPFMRPVQTTQEEDGCSCRFPEEEEGGCELRVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR
В одном воплощении химерный рецептор по изобретению включает или состоит из последовательности, представленной в SEQ ID NO: 78, или любой аминокислотной последовательности с 95-99% идентичностью с SEQ ID NO: 78.
(SEQ ID NO: 78)
SQVQLVQSGPEVKKPGASVKVSCKASGYTFTSYHIQWVRQAPGQGLEWIGWIYPGDGSTQYNEKFKGRVTITADKSTSTAYMELSSLTSEDTAVYYCAREGTYYAMDYWGQGTSVTVSSGGGGSGGGGSGGGGSDVVMTQTPLSLPVTLGEPASISCRSSQSIVHSNGNTYLEWYLQKPGQSPRLLIYKVSNRFSGVPDRFSGSGSGTDFTLKISRVEAEDLGVYYCFQGSHVPRTFGGGTKLEIKRRTTTPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACDIYIWAPLAGTCGVLLLSLVITLYCKRGRKKLLYIFKQPFMRPVQTTQEEDGCSCRFPEEEEGGCELRVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR
В одном воплощении химерный рецептор по изобретению дополнительно включает лидерную последовательность на N-конце, предпочтительно имеющую последовательность SEQ ID NO: 50, и включает или состоит из последовательности SEQ ID NO: 82 или любой аминокислотной последовательности с 95 -99% идентичности с SEQ ID NO: 82.
(SEQ ID NO: 82)
MALPVTALLLPLALLLHAARPSQVQLVQSGPEVKKPGASVKVSCKASGYTFTSYHIQWVRQAPGQGLEWIGWIYPGDGSTQYNEKFKGRVTITADKSTSTAYMELSSLTSEDTAVYYCAREGTYYAMDYWGQGTSVTVSSGGGGSGGGGSGGGGSDVVMTQTPLSLPVTLGEPASISCRSSQSIVHSNGNTYLEWYLQKPGQSPRLLIYKVSNRFSGVPDRFSGSGSGTDFTLKISRVEAEDLGVYYCFQGSHVPRTFGGGTKLEIKRRTTTPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACDIYIWAPLAGTCGVLLLSLVITLYCKRGRKKLLYIFKQPFMRPVQTTQEEDGCSCRFPEEEEGGCELRVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR
В одном воплощении химерный рецептор по изобретению включает или состоит из последовательности, представленной в SEQ ID NO: 79, или любой аминокислотной последовательности с 95-99% идентичностью с SEQ ID NO: 79.
(SEQ ID NO: 79)
SQVQLVQSGPEVKKPGASVKVSCKASGYTFTSYHIQWVRQAPGQGLEWIGWIYPGDGSTQYNEKFKGRVTITADKSTSTAYMELSSLTSEDTAVYYCAREGTYYAMDYWGQGTSVTVSSGGGGSGGGGSGGGGSDVVMTQSPSSLSVTLGDRVSISCRSSQSIVHSNGNTYLEWYQQKPGQSPRLLIYKVSNRFSGVPDRFSGSGSGTDFTLTISRVEPEDLGVYYCFQGSHVPRTFGGGTKLEIKRRTTTPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACDIYIWAPLAGTCGVLLLSLVITLYCKRGRKKLLYIFKQPFMRPVQTTQEEDGCSCRFPEEEEGGCELRVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR
В одном воплощении химерный рецептор по изобретению дополнительно включает лидерную последовательность на N-конце, предпочтительно имеющую последовательность SEQ ID NO: 50, и включает или состоит из последовательности SEQ ID NO: 83 или любой аминокислотной последовательности с 95 -99% идентичности с SEQ ID NO: 83.
(SEQ ID NO: 83)
MALPVTALLLPLALLLHAARPSQVQLVQSGPEVKKPGASVKVSCKASGYTFTSYHIQWVRQAPGQGLEWIGWIYPGDGSTQYNEKFKGRVTITADKSTSTAYMELSSLTSEDTAVYYCAREGTYYAMDYWGQGTSVTVSSGGGGSGGGGSGGGGSDVVMTQSPSSLSVTLGDRVSISCRSSQSIVHSNGNTYLEWYQQKPGQSPRLLIYKVSNRFSGVPDRFSGSGSGTDFTLTISRVEPEDLGVYYCFQGSHVPRTFGGGTKLEIKRRTTTPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACDIYIWAPLAGTCGVLLLSLVITLYCKRGRKKLLYIFKQPFMRPVQTTQEEDGCSCRFPEEEEGGCELRVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR
В одном воплощении химерный рецептор по изобретению включает или состоит из последовательности, представленной в SEQ ID NO: 80, или любой аминокислотной последовательности с 95-99% идентичностью с SEQ ID NO: 80.
(SEQ ID NO: 80)
SQVQLVQSGPEVKKPGASVKVSCKASGYTFTSYHIQWVRQAPGQGLEWIGWIYPGDGSTQYNEKFKGRVTITADKSTSTAYMELSSLTSEDTAVYYCAREGTYYAMDYWGQGTSVTVSSGGGGSGGGGSGGGGSDIVMTQSPATLSVSPGERATISCRSSQSIVHSNGNTYLEWYQQKPGQAPRLLIYKVSNRFSGIPDRFSGSGSGTDFTLTISRLEPEDFAVYYCFQGSHVPRTFGGGTKLEIKRRTTTPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACDIYIWAPLAGTCGVLLLSLVITLYCKRGRKKLLYIFKQPFMRPVQTTQEEDGCSCRFPEEEEGGCELRVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR
В одном воплощении химерный рецептор по изобретению дополнительно включает лидерную последовательность на N-конце, предпочтительно имеющую последовательность SEQ ID NO: 50, и включает или состоит из последовательности SEQ ID NO: 84 или любой аминокислотной последовательности с 95 -99% идентичности с SEQ ID NO: 84.
(SEQ ID NO: 84)
MALPVTALLLPLALLLHAARPSQVQLVQSGPEVKKPGASVKVSCKASGYTFTSYHIQWVRQAPGQGLEWIGWIYPGDGSTQYNEKFKGRVTITADKSTSTAYMELSSLTSEDTAVYYCAREGTYYAMDYWGQGTSVTVSSGGGGSGGGGSGGGGSDIVMTQSPATLSVSPGERATISCRSSQSIVHSNGNTYLEWYQQKPGQAPRLLIYKVSNRFSGIPDRFSGSGSGTDFTLTISRLEPEDFAVYYCFQGSHVPRTFGGGTKLEIKRRTTTPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACDIYIWAPLAGTCGVLLLSLVITLYCKRGRKKLLYIFKQPFMRPVQTTQEEDGCSCRFPEEEEGGCELRVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR
В другом воплощении химерный рецептор по изобретению включает (i) домен, связывающий HLA-A2 (предпочтительно SEQ ID NO: 69 или 73, где X1 представляет собой V или I, X2 представляет собой T или S, X3 представляет собой L или S или A, X4 представляет собой S или T, X5 представляет собой P или S, X6 представляет собой T или S, X7 представляет собой L или P, X8 представляет собой E или D, X9 представляет собой P или R, X10 представляет собой A или V, X11 представляет собой S или T, X12 представляет собой L или Q, X13 представляет собой S или A, X14 представляет собой V или I, X15 представляет собой K или T, X16 представляет собой V или L, X17 представляет собой A или P, X18 представляет собой L или F и X19 представляет собой G или A, более предпочтительно одну из SEQ ID NO: 70-72 или 74-76), (ii) шарнирную область CD8 человека, (iii) трансмембранный домен CD8 человека, (iv) внутриклеточный домен CD28 человека и (v) внутриклеточный домен CD3ζ человека. В одном воплощении часть химерного рецептора, содержащая шарнирный участок CD8 человека, трансмембранный домен CD8 человека, внутриклеточный домен CD28 человека и внутриклеточный домен CD3ζ человека, включает или состоит из аминокислотной последовательности SEQ ID NO: 59 или 60, или любую аминокислотную последовательность с 95-99% идентичностью с SEQ ID NO: 59 или 60.
(SEQ ID NO: 59)
MHTTTPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACDIYIWAPLAGTCGVLLLSLVITLYCRSKRSRLLHSDYMNMTPRRPGPTRKHYQPYAPPRDFAAYRSTRRVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR
(SEQ ID NO: 60)
MHTTTPAPRPPTPAPTIASQPLSLRPEACRPAAGGAVHTRGLDFACDIYIWAPLAGTCGVLLLSLVITLYCRSKRSRLLHSDYMNMTPRRPGPTRKHYQPYAPPRDFAAYRSTRRVKFSRSADAPAYQQGQNQLYNELNLGRREEYDVLDKRRGRDPEMGGKPQRRKNPQEGLYNELQKDKMAEAYSEIGMKGERRRGKGHDGLYQGLSTATKDTYDALHMQALPPR
В одном воплощении химерный рецептор по изобретению включает домен, связывающий HLA-A2 (предпочтительно SEQ ID NO: 69 или 73, где X1 представляет собой V или I, X2 представляет собой T или S, X3 представляет собой L или S или A, X4 представляет собой S или T, X5 представляет собой P или S, X6 представляет собой T или S, X7 представляет собой L или P, X8 представляет собой E или D, X9 представляет собой P или R, X10 представляет собой A или V, X11 представляет собой S или T, X12 представляет собой L или Q, X13 представляет собой S или A, X14 представляет собой V или I, X15 представляет собой K или T, X16 представляет собой V или L, X17 представляет собой A или P, X18 представляет собой L или F и X19 представляет собой G или A, более предпочтительно один из SEQ ID NO: 70-72 или 74-76), связанный с аминокислотной последовательностью SEQ ID NO: 59-60 или последовательностью или аминокислотной последовательностью с 95-99% идентичностью с SEQ ID NO: 59-60.
Настоящее изобретение также относится к иммунной клетке, экспрессирующей CAR, как описано выше, и к популяции таких иммунных клеток.
В одном воплощении нуклеиновую кислоту, кодирующую CAR по настоящему изобретению, вводят в иммунную клетку, тем самым позволяя получить сконструированную клетку, экспрессирующую CAR по настоящему изобретению, на поверхности клетки.
Согласно изобретению иммунная клетка по изобретению генетически модифицирована для экспрессии химерного рецептора, распознающего HLA-A2. Таким образом, иммунная клетка по изобретению может быть определена как перенаправленная иммунная клетка.
Используемый в данном документе термин «перенаправленный» относится к иммунной клетке, несущей химерный рецептор, как описано в данном документе, которая придает иммунной клетке способность связываться и активироваться лигандом (то есть HLA-A2), который отличается от лиганда, к которому иммунная клетка является или была бы специфичной или которым была бы активирована. В одном воплощении химерный рецептор способен экспрессироваться в иммунной клетке, так что иммунная клетка активируется HLA-A2.
В одном воплощении иммунная клетка по изобретению представляет собой иммунную клетку млекопитающего, предпочтительно иммунную клетку человека.
В одном воплощении иммунная клетка по изобретению была заморожена и разморожена.
В одном воплощении иммунная клетка выбрана из группы, включающей лимфоциты, миелоидные клетки и любую их комбинацию.
В одном воплощении иммунная клетка представляет собой лимфоцит, выбранный из группы, включающей Т-клетки, В-клетки, клетки-натуральные киллеры (NK) и любую их комбинацию.
В одном воплощении иммунная клетка представляет собой Т-клетку. В одном воплощении Т-клетка выбрана из группы, состоящей из CD4+ Т-клеток, CD8+ Т-клеток, γδ Т-клеток, двойных отрицательных (DN) Т-клеток и любой их комбинации.
В одном воплощении иммунная клетка представляет собой CD4+ T-клетку, такую как, например, T-хелперная клетка, регуляторная T-клетка и любая их комбинация.
В одном воплощении иммунная клетка представляет собой CD4+ регуляторную Т-клетку (Treg). В одном воплощении Treg представляет собой Treg, полученную из тимуса, или адаптивную или индуцированную Treg. В одном воплощении Treg представляет собой регуляторную T-клетку CD4+ FOXP3+ или регуляторную T-клетку CD4+ FOXP3- (Tr1-клетку), предпочтительно регуляторную T-клетку CD4+ FOXP3+.
В одном воплощении иммунная клетка представляет собой CD8+ T-клетку, такую как, например, цитотоксическую CD8+ T-клетку или CD8+ регуляторную T-клетку.
Предпочтительно иммунная клетка представляет собой CD8+ регуляторную Т-клетку (Treg). В одном воплощении регуляторную T-клетку CD8+ выбирают из группы, состоящей из регуляторной T-клетки CD8+ CD28-, регуляторной T-клетки CD8+ CD103+, регуляторной T-клетки CD8+ FoxP3+, регуляторной T-клетки CD8+ CD122 + и любая их комбинация.
В одном воплощении иммунная клетка представляет собой регуляторную Т-клетку INFγ + IL10 + IL34 + CD8+ CD45RClow.
В одном воплощении иммунная клетка представляет собой γδ T-клетку, предпочтительно регуляторную γδ T-клетку.
В одном воплощении иммунная клетка представляет собой DN T-клетку, предпочтительно регуляторную DN T-клетку.
В одном воплощении иммунная клетка представляет собой B-клетку, предпочтительно регуляторную B-клетку. В одном воплощении регуляторная B-клетка представляет собой B-клетку CD19 + CD24hiCD38hi.
В одном воплощении иммунная клетка представляет собой NK-клетку, предпочтительно регуляторную NK-клетку.
В одном воплощении иммунная клетка представляет собой клетку, полученную из миелоида, предпочтительно выбранную из группы, включающей нейтрофилы, эозинофилы, базофилы, моноциты, макрофаги, дендритные клетки или любую их комбинацию.
В одном воплощении иммунная клетка представляет собой макрофаг, предпочтительно регуляторный макрофаг.
В одном воплощении иммунная клетка представляет собой дендритную клетку, предпочтительно регуляторную дендритную клетку.
Предпочтительно, иммунная клетка представляет собой регуляторную иммунную клетку, такую как, например, любая регуляторная иммунная клетка, подходящая для применения в клеточной терапии.
В одном воплощении регуляторная иммунная клетка выбрана из группы, состоящей из регуляторной T-клетки, CD4+ регуляторной T-клетки, CD8+ регуляторной T-клетки, регуляторной γδ T-клетки, регуляторной DN T-клетки, регуляторной B-клетки, a регуляторной NK-клетки, регуляторного макрофага, регуляторной дендритной клетки и любой их комбинации.
В одном воплощении регуляторная иммунная клетка представляет собой CD8+ регуляторную Т-клетку. Примеры CD8+ регуляторных T-клеток включают, без ограничения указанным, CD8+ CD28- регуляторную T-клетку, CD8+ CD103+ регуляторную T-клетку, CD8+ FoxP3+ регуляторную T-клетку, CD8+ CD122+ регуляторную T-клетку и любую комбинацию его.
В одном воплощении регуляторная иммунная клетка представляет собой регуляторную γδ T-клетку.
В одном воплощении регуляторная иммунная клетка представляет собой регуляторную DN T-клетку.
В одном воплощении регуляторная иммунная клетка представляет собой регуляторную B-клетку. Примеры регуляторных B-клеток включают, без ограничения указанным, CD19 + CD24hiCD38hi B-клетки.
В одном воплощении регуляторная иммунная клетка представляет собой регуляторную NK-клетку.
В одном воплощении регуляторная иммунная клетка представляет собой регуляторный макрофаг.
В одном воплощении регуляторная иммунная клетка представляет собой регуляторную дендритную клетку.
В одном воплощении регуляторная иммунная клетка представляет собой регуляторную Т-клетку, в частности, Treg, полученную из тимуса, или адаптивную или индуцированную Treg. Примеры Treg включают, без ограничения указанным, CD4+ FOXP3 + регуляторную T-клетку или CD4+ FOXP3- регуляторную T-клетку (Tr1-клетку).
В одном воплощении регуляторная иммунная клетка имеет следующий фенотип: CD4+ CD25+, такой как, например, CD4+ CD25+ CD127-, такой как, например, CD4+ CD25+ CD127-CD45RA +. Предпочтительно, регуляторная иммунная клетка имеет следующий фенотип: FoxP3+ CD4+ CD25+, такой как, например, FoxP3+ CD4+ CD25+ CD127-, такой как, например, FoxP3+CD4+CD25+CD127-CD45RA+.
В одном воплощении иммунная регуляторная клетка имеет, по меньшей мере, один из следующих фенотипов: CD4+CD25+, FoxP3+, CD127lo/-, CTLA-4+, CD39+, Helios+, CD62L+/hi, VLA4+, LFA1+, CD49bint, ITGb7int, PSGL-1+, ICOS+, GITR+, PD-1int, Perflo/-, CCR7+. В одном воплощении иммунная регуляторная клетка не экспрессирует гранзим A и/или гранзим B.
В одном воплощении определение уровня экспрессии молекул проводят с помощью проточной цитометрии, иммунофлуоресценции или анализа изображений, например, анализа высокого содержания. Предпочтительно определение уровня экспрессии молекул проводят проточной цитометрией. В одном воплощении перед проведением анализа проточной цитометрией клетки фиксировали и проницаемы, что позволяет обнаруживать внутриклеточные белки.
В одном воплощении определение уровня экспрессии молекулы в клеточной популяции включает определение процента клеток клеточной популяции, экспрессирующих молекулу (то есть клетки «+» для молекулы). Предпочтительно указанный процент клеток, экспрессирующих молекулу, измеряют с помощью FACS.
Термины «экспрессирующий (или +)» и «неэкспрессирующий (или -)» хорошо известны в данной области и относятся к уровню экспрессии представляющего интерес клеточного маркера, в котором уровень экспрессии клеточного маркера, соответствующий «+» представляет собой высокий или средний, также называемый «+/-», а уровень экспрессии маркера клетки, соответствующего «-», равен нулю.
Термины «низкий» или «lo» или «lo/-» хорошо известны в данной области и относятся к уровню экспрессии представляющего интерес клеточного маркера, в котором уровень экспрессии клеточного маркера является низким по сравнению с уровнем экспрессии этого клеточного маркера в популяции анализируемых клеток в целом. Более конкретно, термин «lo» относится к отдельной популяции клеток, которые экспрессируют клеточный маркер на более низком уровне, чем одна или несколько других различных популяций клеток.
Термин «высокий» или «hi» или «яркий» хорошо известен в данной области техники и относится к уровню экспрессии представляющего интерес клеточного маркера в том смысле, что уровень экспрессии клеточного маркера является высоким по сравнению с уровнем экспрессии этого клеточного маркера в популяции клеток, которые анализировались в целом.
Обычно клетки в верхних 2, 3, 4 или 5% интенсивности окрашивания обозначаются как «hi», а клетки, попадающие в верхнюю половину популяции, классифицируются как «+». Эти клетки, падающие ниже 50% интенсивности флуоресценции обозначаются как «lo», а клетки ниже 5% - как «-» клетки.
Уровень экспрессии представляющего интерес клеточного маркера определяли путем сравнения средней интенсивности флуоресценции (MFI) клеток из популяции клеток, окрашенных флуоресцентно-меченным антителом, специфичным для этого маркера, с интенсивностью флуоресценции (FI) клеток из той же популяции клеток, окрашенных флуоресцентно-меченным антителом с нерелевантной специфичностью, но с тем же изотипом, тем же флуоресцентным зондом и происходящим из одного и того же вида (обозначается как изотипный контроль). Клетки из популяции, окрашенные флуоресцентно-меченными антителами, специфичными для этого маркера и демонстрирующие эквивалентную MFI или более низкую MFI, чем клетки, окрашенные изотипическими контролями, не экспрессируют этот маркер и поэтому обозначаются как (-) или отрицательно. Клетки из популяции, окрашенные флуоресцентно-меченным антителом, специфичным для этого маркера и демонстрирующим значение MFI, превосходящее значение у клеток, окрашенных изотипическими контролями, экспрессирующими этот маркер и поэтому обозначаются (+) или положительно.
В одном воплощении иммунная клетка по изобретению экспрессирует на своей клеточной поверхности CAR по изобретению и другой рецептор (в настоящем документе называемый «вторым рецептором»), который связывается с другим лигандом, отличным от HLA-A2. Согласно изобретению этот второй рецептор включает внеклеточный лиганд-связывающий домен, необязательно шарнир, необязательно трансмембранный домен и внутриклеточный сигнальный домен, как описано ранее.
В одном воплощении второй рецептор является эндогенным (таким как, например, эндогенный TCR). В другом воплощении второй рецептор является экзогенным, и его экспрессия индуцируется в иммунной клетке по изобретению путем трансформации или трансдукции кодирующей его нуклеиновой кислоты. Указанный экзогенный рецептор может представлять собой экзогенный TCR или химерный антигенный рецептор. Следовательно, в одном воплощении иммунная клетка по изобретению экспрессирует два химерных рецептора антигена, где первый распознает HLA-A2, а второй распознает отдельный лиганд.
В другом воплощении иммунная клетка по изобретению экспрессирует на своей клеточной поверхности CAR по изобретению и другой рецептор (называемый в данном документе «вторым рецептором»), который связывается с другим эпитопом в HLA-A2. Согласно изобретению этот второй рецептор включает внеклеточный лиганд-связывающий домен, необязательно шарнир, необязательно трансмембранный домен и внутриклеточный сигнальный домен, как описано ранее.
В другом воплощении иммунная клетка по изобретению экспрессирует два CAR, причем первый распознает первый эпитоп HLA-A2, а второй распознает эпитоп, отличный от HLA-A2.
В одном воплощении CAR по изобретению включает первый внутриклеточный сигнальный домен, а второй рецептор включает отдельный второй внутриклеточный сигнальный домен. В первом воплощении CAR по изобретению включает первичный сигнальный домен T-клеток (такой как, например, CD3дзета), а второй рецептор включает костимулирующий сигнальный домен (такой как, например, 4-1BB, CD28 или комбинация костимулирующего сигнального домена 4-1BB и CD28). Во втором воплощении CAR по изобретению включает костимулирующий сигнальный домен (такой как, например, 4-1BB, CD28 или комбинацию костимуляторного сигнального домена 4-1BB и CD28), и второй рецептор включает первичный сигнальный домен T-клетки (такой как, например, CD3дзета).
Следовательно, в соответствии с этими воплощениями полная активация иммунной клетки по изобретению требует как связывания CAR по изобретению с HLA-A2, так и связывания второго рецептора с лигандом, на который он нацелен.
В одном воплощении лиганд, распознаваемый вторым рецептором, экспрессируется или присутствует в пораженной ткани или органе, или в месте аутоиммунного ответа.
Примеры лигандов, которые могут распознаваться вторым рецептором, включают, без ограничения указанным, пищевые антигены из обычной диеты человека, аутоантигены, вдыхаемые аллергены, проглоченные аллергены или контактные аллергены.
Термин «пищевой антиген из обычной диеты человека» относится к иммуногенному пептиду, который поступает из пищевых продуктов, общих для человека, таких как пищевые антигены из следующего неограничивающего списка: бычьи антигены, такие как липокалин, Ca-связывающий S100, альфа-лактальбумин, лактоглобулины, такие как бета-лактоглобулин, бычий сывороточный альбумин, казеины. Пищевые антигены также могут представлять собой антигены атлантического лосося, такие как парвальбумин; куриные антигены, такие как, например, овомукоид, овальбумин, Ag22, кональбумин, лизоцим или куриный сывороточный альбумин; антигены арахиса; антигены креветок, такие как тропомиозин; пшеничные антигены, такие как агглютинин или глиадин; антигены сельдерея, такие как профилин сельдерея; морковные антигены, такие как морковный профилин; яблочные антигены, такие как тауматин, белок, переносящий липид яблока, или яблочный профилин; грушевые антигены, такие как грушевый профилин или изофлавоновая редуктаза; антигены авокадо, такие как эндохитиназа; абрикосовые антигены, такие как белок переноса абрикосовых липидов; персиковые антигены, такие как персиковый белок-переносчик липидов или персиковый профилин; соевые антигены, такие как HPS, соевый профилин или (SAM22) PR-10 pro; фрагменты, их варианты и смеси.
В одном воплощении указанный аутоантиген представляет собой антиген, ассоциированный с рассеянным склерозом, антиген, ассоциированный с суставом, антиген, ассоциированный с глазами, антиген HSP человека, связанный с кожей антиген или антиген, участвующий в отторжении трансплантата или GVHD.
Термин «антиген, ассоциированный с рассеянным склерозом» относится к основному белку миелина (MBP), ассоциированному с миелином гликопротеину (MAG), миелин-олигодендроцитарному гликопротеину (MOG), протеолипидному белку (PLP), олигодендроцитному миелиновому олигопротеину (OMGP), миелин-ассоциированному олигодендроцитарному основному белку (MOBP), олигодендроцит-специфическому белку (OSP/Клаудин 1), белку теплового шока, олигодендроцит-специфическому белку (OSP), NOGO A, гликопротеину Po, периферическому миелиновоу белку 22 (PMP22), 3’-фосфодиэстеразы 2,3-циклических нуклеотидов (CNPase), их фрагментам, вариантам и смесям.
Термин «сустав-ассоциированный антиген» относится к цитруллинзамещенным циклическим и линейным пептидам филагрина, пептидам пептидам гликопротеина хряща 39 человека (HCgp39), HSP, пептидам гетерогенного ядерного рибонуклеопротеина (hnRNP) A2, hnRNP B1, hnRNP D, Ro60/52, HSP60, HSP65, HSP70 и HSP90, BiP, кератину, виментину, фибриногену, пептиду коллагена типа I, III, IV и V, аннексину V, глюкозо-6-фосфат-изомеразе (GPI), ацетил-кальпастатину, пируватдегидрогеназе (PDH), альдолазе, топоизомеразе I, snRNP, PARP, Scl-70, Scl-100, фосфолипидным антигенам, включая анионный кардиолипин и фосфатидилсерин, нейтрально заряженный фосфатидилэтаноламин и фосфатидилхолин, матриксной металлопротеиназе, фибриллину, аггрекану, их фрагментам, вариантам и смесям.
Термин «глазной антиген» относится к коллагену типа II, аррестину сетчатки, S-аррестину, интерфорецепторным ретиноид-связывающим белкам (IRBP1), бета-кристаллину В1, белкам сетчатки, белкам хориоида и их фрагментам, вариантам и смесям.
Термин «антиген HSP человека» относится к HSP60, HSP70, HSP90 человека, их фрагментам, вариантам и смесям.
Примеры ассоциированных с кожей антигенов включают, без ограничения указанным, антигены кератиноцитов, антиген, присутствующий в дерме или эпидермисе, антиген меланоцитов (такой как, например, меланин или тирозиназа), десмоглеин (например, десмоглеин 1 или 3, которые также могут упоминаться как Dsg1/3), BP180, BP230, плектин, интегрины (например, интегрин α4β6), коллагены (например, коллаген типа VII), ламинины (например, ламинин 332 или ламинин γ1), плакины (например, энвоплакин, периплакин или десмоплакин), кератины (например, KRT5, KRT8, KRT15, KRT17 и KRT31), белки, связанные с кератиновыми филаментами, филагрин, корнеодесмосин и эластин.
В одном воплощении лиганд представляет собой антиген, участвующий в отторжении трансплантата или GVHD. Примеры таких антигенов включают, без ограничения указанным, MHC, специфичные для трансплантированной ткани или к хозяину, β2-микроглобулин, антигены из системы ABO, антигены системы резус (в частности, антигены из системы C, c, E et e и D) и изогемагглютинины. Другие примеры антигенов, которые могут быть вовлечены в отторжение трансплантата или GVHD, включают, без ограничения указанным, HLA-DR (в частности, в течение первых шести месяцев после прививки), HLA-B (в частности, в течение первых двух лет после прививки), второстепенные антигены гистосовместимости (miHA, например, HLA-E, HLA-F и HLA-G), HLA, соответствующие MHC класса I (B и C), HLA, соответствующие MHC класса II (DP, DM, DOA, DOB, DQ и DR) и HLA, соответствующие классу III MHC (например, компоненты системы комплемента).
Другие примеры аутоантигенов включают, без ограничения указанным, водные каналы аквапоринов (такие как, например, водный канал аквапорина-4 (AQP4)), Hu, Ma2, белок-медиатор ответа на коллапсин 5 (CRMP5) и амфифизин, потенциалозависимый калиевый канал (VGKC), N-метил-d-аспартатный рецептор (NMDAR), α-амино-3-гидрокси-5-метил-4-изоксазолепропионовую кислоту (AMPAR), тиреоидную пероксидазу, тиреоглобулин, анти-N-метил-D- аспартатный рецептор (субъединица NR1), антигены резус-группы крови, антиген I, десмоглеин 1 или 3 (Dsg1/3), BP180, BP230, никотиновые постсинаптические рецепторы ацетилхолина, интегрин тромбоцитов, GpIIb: IIIa, коллаген (например, цепь альфа-3 (IV) коллагена), ревматоидный фактор, кальпастатин, цитруллинированные белки, миелиновый основной белок (MBP), пептиды миелинового олигодендроцитного гликопротеина (MOG) , альфа-бета-кристаллин, ДНК, гистон, рибосомы, RNP, тканевую трансглутаминазу (TG2), внутренний фактор, антиген 65 кДа, фосфатидилсерин, рибосомные фосфобелки, антинейтрофильное цитоплазматическое антитело, Scl-70, U1-RNP, ANA, SSA, анти-SSB, антиядерные антитела (ANA), антинейтрофильные цитоплазматические антитела (ANCA), Jo-1, антимитохондриальные антитела, gp210, p62, sp100, антифосфолипидные антитела, U1-70 kd snRNP, ганглиозид GQ1b, GM1, асиало-GM1, GD1b, антитела против гладких мышц (ASMA), антитела к микросомам печени и почек-1 (ALKM-1), антитела против цитозоля печени-1 (ALC-1), IgA антиэндомизальные антитела, белки гранул нейтрофилов, антиген клеточной стенки стрептококка, внутренний фактор париетальных клеток желудка, инсулин (IAA), декарбоксилаза глутаминовой кислоты (GAA или GAD) и протеинтирозинфосфатаза (такая как, например, IA2 или ICA512) PLA2R1 и THSD7A1.
В одном воплощении указанный лиганд выбран из группы, включающей фрагменты овальбумина, MOG, коллагена II типа, их варианты и смеси.
В одном воплощении указанный лиганд представляет собой овальбумин, его фрагменты, варианты и смеси.
В другом воплощении указанный лиганд представляет собой MOG, его фрагменты, варианты и смеси.
В другом воплощении указанный лиганд представляет собой коллаген II типа, его фрагменты, варианты и смеси.
В другом воплощении указанный лиганд представляет собой IL23R, его фрагменты, варианты и смеси.
В одном воплощении CAR по изобретению дополнительно включает внеклеточный лиганд-связывающий домен, распознающий лиганд, отличный от HLA-A2. В одном воплощении указанный лиганд-связывающий домен представляет собой антитело или его антигенсвязывающий фрагмент.
В одном воплощении лиганд-связывающий домен CAR по изобретению представляет собой многофункциональное антитело, распознающее множество различных эпитопов на HLA-A2. В одном воплощении лиганд-связывающий домен CAR по изобретению представляет собой бифункциональное антитело, распознающее два разных эпитопа на HLA-A2.
В одном воплощении изобретения CAR по изобретению включает внеклеточный лиганд-связывающий домен, содержащий HLA-A2-связывающий домен и другой лиганд-связывающий домен, распознающий лиганд, отличный от HLA-A2. В одном воплощении указанный лиганд-связывающий домен представляет собой бифункциональное антитело, распознающее как HLA-A2, так и отдельный лиганд.
Примеры лигандов, отличных от HLA-A2, которые могут быть распознаны с помощью CAR по изобретению, перечислены выше.
Изобретение также относится к выделенной и/или по существу очищенной популяции иммунных клеток, определенных выше.
Таким образом, одним объектом изобретения является выделенная и/или по существу очищенная популяция иммунных клеток, где клетки популяции содержат CAR, причем указанный CAR распознает HLA-A2.
Используемый в данном документе термин «выделенная популяция» относится к клеточной популяции, которая удалена из ее естественной среды (такой как периферическая кровь) и которая выделена, очищена или отделена, и, по меньшей мере, около на 75% свободна, на 80% свободна, 85% свободных и предпочтительно около 90%, 95%, 96%, 97%, 98%, 99% свободна от других клеток, с которыми она присутствует в естественных условиях, но у которых отсутствуют маркеры клеточной поверхности, на основе которых были выделены клетки.
Настоящее изобретение также относится к обогащенной популяции иммунных клеток, определенных выше.
В одном воплощении изобретения выделенная, очищенная и/или обогащенная популяция иммунных клеток по изобретению была заморожена и разморожена.
Другим объектом изобретения является вектор, содержащий последовательность нуклеиновой кислоты, кодирующую химерный антигенный рецептор (CAR), описанный выше.
Примеры векторов, которые могут быть использованы в настоящем изобретении, включают, без ограничения указанным, ДНК-вектор, РНК-вектор, плазмиду, фагмиду, производное фага, вирус животных и космиду.
Технология вирусных векторов хорошо известна в данной области и описана, например, в Sambrook et al. (2001, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, New York), и в других руководствах по вирусологии и молекулярной биологии. Вирусы, которые полезны в качестве векторов, включают, без ограничения указанным, ретровирусы, аденовирусы, аденоассоциированные вирусы, вирусы герпеса и лентивирусы.
Как правило, подходящий вектор включает точку начала репликации, функциональный, по меньшей мере, в одном организме, промоторную последовательность, удобные сайты эндонуклеаз рестрикции и один или несколько селектируемых маркеров (например, как описано в WO 01/96584; WO 01/29058; и US6 326,193, включенных в настоящее описание ссылкой).
Был разработан ряд вирусных систем для переноса генов в клетки млекопитающих. Например, ретровирусы предоставляют удобную платформу для систем доставки генов. Выбранный ген может быть вставлен в вектор и упакован в ретровирусные частицы с использованием методов, известных в данной области. Затем рекомбинантный вирус может быть выделен и доставлен в клетки объекта либо in vivo, либо ex vivo. Ряд ретровирусных систем известен в данной области. В некоторых воплощениях используются аденовирусные векторы. Ряд аденовирусных векторов известен в данной области. В одном воплощении используются лентивирусные векторы.
Дополнительные транскрипционно активные элементы, например, промоторы и энхансеры, могут регулировать частоту инициации транскрипции. Как правило, что касается основного промотора, они расположены в области 30-110 п.н. выше по последовательности от стартового сайта, хотя недавно было показано, что ряд промоторов также содержат функциональные элементы ниже по последовательности от стартового сайта, а энхансерные элементы обычно расположены -2000 п.о. выше по последовательности от стартового сайта. Интервал между элементами промотора часто является гибким, так что функция промотора сохраняется, когда элементы инвертированы или перемещены относительно друг друга. В промоторе тимидинкиназы (tk) расстояние между промоторными элементами может быть увеличено до 50 п.н., прежде чем активность начнет снижаться. В зависимости от промотора оказывается, что отдельные элементы могут функционировать совместно или независимо для активации транскрипции.
Одним примером подходящего промотора является последовательность немедленно-раннего промотора цитомегаловируса (CMV). Эта промоторная последовательность является сильной конститутивной промоторной последовательностью, способной стимулировать высокие уровни экспрессии любой полинуклеотидной последовательности, функционально связанной с ней. Другим примером подходящего промотора является фактор роста элонгации - la (EF-la). Другим примером подходящего промотора является промотор фосфоглицераткиназы (PGK). Однако могут также использоваться другие последовательности конститутивного промотора, включая, без ограничения указанным, ранний промотор обезьяньего вируса 40 (SV40), вирус опухоли молочной железы мыши (MMTV), промотор длинного концевого повтора (LTR) вируса иммунодефицита человека (HIV), промотор MoMuLV, промотор вируса птичьего лейкоза, немедленно-ранний промотор вируса Эпштейна-Барра, промотор вируса саркомы Рауса, а также промоторы генов человека, такие как, без ограничения указанным, промотор актина, промотор миозина, промотор гемоглобина и промотор креатинкиназы. Кроме того, изобретение не должно быть ограничено применением конститутивных промоторов. Индуцибельные промоторы также рассматриваются как часть изобретения. Использование индуцибельного промотора обеспечивает молекулярный переключатель, способный включать экспрессию полинуклеотидной последовательности, с которой он функционально связан, когда такая экспрессия желательна, или отключать экспрессию, когда экспрессия нежелательна. Примеры индуцибельных промоторов включают, без ограничения указанным, металлотиониновый промотор, глюкокортикоидный промотор, прогестероновый промотор и тетрациклиновый промотор. Кроме того, двунаправленные промоторы, обеспечивающие эффективную и координированную экспрессию двух или более генов, также могут представлять интерес в настоящем изобретении. Примеры двунаправленных промоторов включают, без ограничения указанным, промоторы, описанные в US2006200869, включенные в настоящий документ ссылкой, раскрывающие двунаправленный промотор, включающий i) первую минимальную промоторную последовательность, полученную из геномов цитомегаловируса (CMV) или вируса опухоли молочной железы мыши (MMTV) и ii) полностью эффективной промоторной последовательности, полученной из гена животного.
Чтобы оценить экспрессию полипептида CAR или его частей, экспрессирующий вектор, который должен быть введен в иммунную клетку, может также содержать ген селектируемого маркера, такой как, например, CD34 или ген-репортер, или и то, и другое для облегчения идентификации и отбора экспрессирующих клеток из популяции клеток, которые пытались трансфицировать или инфицировать через вирусные векторы. В других аспектах селектируемый маркер может быть нанесен на отдельный фрагмент ДНК и использован в процедуре котрансфекции. Как селектируемые маркеры, так и репортерные гены могут быть фланкированы соответствующими регуляторными последовательностями для обеспечения экспрессии в клетках-хозяевах. Полезные селектируемые маркеры включают, например, гены устойчивости к антибиотикам, такие как neo и т.п.
В некоторых воплощениях изобретения может использоваться технология гена-самоубийцы. В данной области описаны различные технологии гена-самоубийцы в зависимости от их механизма действия (Jones et al. Frontiers in Pharmacology, 2014 (5): 254). Примеры генно-направленной ферментной пролекарственной терапии (GDEPT), превращающей нетоксичное лекарственное средство в токсичное лекарственное средство, включают тимидинкиназу вируса простого герпеса (HSV-TK) и цитозин-деаминазу (CD). Другими примерами являются химерные белки, состоящие из домена, связывающего лекарственное средство, связанного с апоптотическими компонентами, такими как, например, индуцибельные системы Fas (iFas) или индуцибельные каспазы 9 (iCasp9). Другие примеры включают системы, опосредованные терапевтическими антителами, такими как индукция сверхэкспрессии c-myc на поверхности сконструированной клетки для индукции их делеции путем введения антитела против c-myc. В аналогичной системе описывается применение EGFR, по сравнению с системой с c-myc.
Репортерные гены используются для идентификации потенциально трансфицированных клеток и для оценки функциональности регуляторных последовательностей. Как правило, репортерный ген представляет собой ген, который не присутствует или не экспрессируется организмом или тканью реципиента и который кодирует полипептид, экспрессия которого проявляется в некотором легко обнаруживаемом свойстве, например, ферментативной активности. Экспрессию репортерного гена анализировали в подходящее время после введения ДНК в клетки реципиента. Подходящие репортерные гены могут включать гены, кодирующие люциферазу, бета-галактозидазу, хлорамфениколацетилтрансферазу, секретируемую щелочную фосфатазу или ген зеленого флуоресцентного белка (например, Ui-Tei et al., 2000 FEBS Letters 479: 79-82). Подходящие системы экспрессии хорошо известны и могут быть получены с использованием известных методов или получены коммерчески. В целом, конструкция с минимальной 5'-фланкирующей областью, показывающая самый высокий уровень экспрессии репортерного гена, идентифицируется как промотор. Такие промоторные области могут быть связаны с репортерным геном и использоваться для оценки агентов на способность модулировать управляемую промотором транскрипцию.
Способы введения и экспрессии генов в клетку известны в данной области. В контексте экспрессирующего вектора вектор может быть легко введен в клетку-хозяина, например, в клетку млекопитающего, бактерии, дрожжей или насекомого, любым способом, известным в данной области. Например, экспрессирующий вектор может быть перенесен в клетку-хозяина физическим, химическим или биологическим способом.
Физические способы введения полинуклеотида в клетку-хозяина включают осаждение с фосфатом кальция, липофекцию, бомбардировку частицами, микроинъекцию, электропорацию, разрушение мембран и т.п. Способы получения клеток, содержащих векторы и/или экзогенные нуклеиновые кислоты, хорошо известны в данной области. См., например, Sambrook et al. (2001, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, New York). Предпочтительным способом введения полинуклеотида в клетку-хозяина является трансфекция с фосфатом кальция.
Биологические способы введения представляющего интерес полинуклеотида в клетку-хозяина включают применение векторов на основе ДНК и РНК. Вирусные векторы и особенно ретровирусные векторы стали наиболее широко используемым способом для вставки генов в клетки млекопитающих, например, в клетки человека. Другие вирусные векторы могут быть получены из лентивирусов, поксвирусов, вируса простого герпеса I, аденовирусов и аденоассоциированных вирусов и т.п. См., например, US 5 350 674 и 5 585 362.
Химические средства для введения полинуклеотида в клетку-хозяина включают коллоидные дисперсионные системы, такие как макромолекулярные комплексы, наночастицы (наносферы, нанокапсулы), микросферы, гранулы и системы на основе липидов, включая эмульсии масло-в-воде, мицеллы, смешанные мицеллы и липосомы. Типичной коллоидной системой для применения в качестве средства доставки in vitro и in vivo является липосома (например, везикула с искусственной мембраной).
В случае, когда используется невирусная система доставки, примерным средством доставки является липосома. Предполагается применение липидных составов для введения нуклеиновых кислот в клетку-хозяина (in vitro, ex vivo или in vivo). В другом аспекте нуклеиновая кислота может быть связана с липидом. Нуклеиновая кислота, связанная с липидом, может быть инкапсулирована в водной внутренней части липосомы, помещена в липидный бислой липосомы, присоединена к липосоме через связывающую молекулу, которая связана как с липосомой, так и с олигонуклеотидом, захваченным в липосому, образует комплекс с липосомой, диспергируется в растворе, содержащем липид, смешивается с липидом, объединяется с липидом, содержится в виде суспензии в липиде, содержится или образует комплекс с мицеллой, или иным образом связан с липидом. Композиции, связанные с липидом, липидом/ДНК или липидным/экспрессирующим вектором, не ограничиваются какой-либо конкретной структурой в растворе. Например, они могут присутствовать в двухслойной структуре, в виде мицелл, или в «коллапсированной» структуре. Они также могут просто помещаться в раствор, возможно, образуя агрегаты, которые не являются однородными по размеру или форме. Липиды представляет собой жирные вещества, которые могут встречаться в природе или синтетические липиды. Например, липиды включают жировые капли, которые естественным образом встречаются в цитоплазме, а также класс соединений, которые содержат длинноцепочечные алифатические углеводороды и их производные, такие как жирные кислоты, спирты, амины, аминоспирты и альдегиды.
Липиды, пригодные для применения, могут быть получены из коммерческих источников. Например, димиристилфосфатидилхолин («DMPC») может быть получен от Sigma, Сент-Луис, Миссури; дицетилфосфат («DCP») можно получить в K & K Laboratories (Плейн-вью, Нью-Йорк); холестерин («Choi») может быть получен от Calbiochem-Behring; димиристилфосфатидилглицерин («DMPG») и другие липиды могут быть получены от Avanti Polar Lipids, Inc. (Бирмингем, Алабама). Исходные растворы липидов в хлороформе или хлороформе/метаноле можно хранить при температуре около -20°C. Хлороформ используется в качестве единственного растворителя, поскольку он легче испаряется, чем метанол. «Липосома» представляет собой общий термин, охватывающий множество одно- и многослойных липидных носителей, образованных в результате образования закрытых липидных бислоев или агрегатов. Липосомы могут быть охарактеризованы как имеющие везикулярные структуры с фосфолипидной двухслойной мембраной и внутренней водной средой. Мультиламеллярные липосомы имеют несколько липидных слоев, разделенных водной средой. Они образуются спонтанно, когда фосфолипиды суспендируют в избытке водного раствора. Липидные компоненты подвергались самоорганизации перед образованием закрытых структур и захватывают воду и растворенные растворы между липидными бислоями (Ghosh et al., 1991 Glycobiology 5: 505-10). Однако также охватываются композиции, которые имеют другие структуры в растворе, чем нормальная везикулярная структура. Например, липиды могут иметь мицеллярную структуру или просто существовать в виде неоднородных агрегатов молекул липидов. Также рассматриваются комплексы липофектамин-нуклеиновая кислота.
Независимо от способа, используемого для введения экзогенных нуклеиновых кислот в клетку-хозяина, для подтверждения присутствия последовательности рекомбинантной ДНК в клетке-хозяине могут быть выполнены различные анализы. Такие анализы включают, например, «молекулярно-биологические» анализы, хорошо известные специалистам в данной области, такие как Саузерн и Нозерн-блоттинг, ОТ-ПЦР и ПЦР; «биохимические» анализы, такие как обнаружение присутствия или отсутствия конкретного пептида, например, иммунологическими средствами (ELISA и вестерн-блоттингом) или анализами, описанными в настоящем документе, для идентификации агентов, попадающих в объем изобретения.
В одном воплощении генетически модифицированные иммунные клетки по изобретению модифицируют путем введения РНК. В одном воплощении транскрибированная РНК-CAR in vitro может быть введена в клетку как форма временной трансфекции. РНК может быть получена путем транскрипции in vitro с использованием матрицы, полученной с помощью полимеразной цепной реакции (ПЦР). Интересующая ДНК из любого источника может быть непосредственно преобразована с помощью ПЦР в матрицу для синтеза мРНК in vitro с использованием соответствующих праймеров и РНК-полимеразы. Источником ДНК может быть, например, геномная ДНК, плазмидная ДНК, фаговая ДНК, кДНК, синтетическая последовательность ДНК или любой другой подходящий источник ДНК. Искомым шаблоном для транскрипции in vitro является CAR по настоящему изобретению.
В одном воплощении ДНК, предназначенная для ПЦР, включает открытую рамку считывания. ДНК может происходить из встречающейся в природе последовательности ДНК из генома организма. В одном воплощении ДНК представляет собой интересующий полноразмерный ген или часть гена. Ген может включать некоторые или все 5' и/или 3' нетранслируемые области (UTR). Ген может включать экзоны и интроны. В одном воплощении ДНК, используемая для ПЦР, представляет собой ген человека. В другом воплощении ДНК, используемая для ПЦР, представляет собой ген человека, включающий 5' и 3' UTR. Альтернативно, ДНК может представлять собой искусственную последовательность ДНК, которая обычно не экспрессируется в естественном организме. Примером последовательности искусственной ДНК является та, которая включает части генов, которые лигированы вместе, чтобы образовать открытую рамку считывания, которая кодирует слитый белок. Части ДНК, которые лигированы вместе, могут быть из одного организма или из более чем одного организма.
ПЦР может использоваться для создания матрицы для транскрипции мРНК in vitro, которая используется для трансфекции. Способы проведения ПЦР хорошо известны в данной области. Праймеры для применения в ПЦР предназначены для того, чтобы иметь области, которые по существу комплементарны областям ДНК, которые будут использоваться в качестве матрицы для ПЦР. «По существу комплементарный», как используется в настоящем документе, относится к последовательностям нуклеотидов, где большинство или все основания в последовательности праймера являются комплементарными или одно, или несколько оснований не являются комплементарными или не совпадают. Существенно комплементарные последовательности способны отжигаться или гибридизоваться с предполагаемой ДНК-мишенью в условиях отжига, используемых для ПЦР. Праймеры могут быть сконструированы так, чтобы они были существенно комплементарны любой части матрицы ДНК. Например, праймеры могут быть разработаны для амплификации части гена, которая обычно транскрибируется в клетках (открытая рамка считывания), включая 5' и 3' UTR. Праймеры также могут быть сконструированы для амплификации части гена, которая кодирует определенный интересующий домен. В одном воплощении праймеры предназначены для амплификации кодирующей области кДНК человека, включая все или части 5' и 3' UTR. Праймеры, полезные для ПЦР, получают синтетическими способами, которые хорошо известны в данной области.
«Прямые праймеры» представляют собой праймеры, которые содержат область нуклеотидов, которые по существу комплементарны нуклеотидам на матрице ДНК, которые находятся выше последовательности ДНК, которая должна быть амплифицирована. «Выше по последовательности» используется в данном документе для обозначения местоположения 5', последовательности ДНК, которая должна быть амплифицирована относительно кодирующей цепи. «Обратные праймеры» представляют собой праймеры, которые содержат область нуклеотидов, которые по существу комплементарны матрице двухцепочечной ДНК, которая находится ниже последовательности ДНК, которая должна быть амплифицирована. Термин «ниже по последовательности» используется в данном документе для обозначения местоположения 3' последовательности ДНК, подлежащей амплификации, относительно кодирующей цепи.
Любая ДНК-полимераза, полезная для ПЦР, может быть использована в способах, раскрытых в данном документе. Реагенты и полимераза коммерчески доступны из ряда источников.
Также могут быть использованы химические структуры, способные обеспечивать стабильность и/или эффективность трансляции. РНК предпочтительно имеет 5' и 3' UTR. В одном воплощении 5' -UTR имеет длину от нуля до 3000 нуклеотидов. Длина 5'- и 3'-последовательностей UTR, которые должны быть добавлены в область кодирования, может быть изменена различными способами, включая, без ограничения указанным, конструирование праймеров для ПЦР, которые отжигаются в различных областях UTR. Используя этот подход, специалист в данной области техники может модифицировать 5' и 3' длины UTR, необходимые для достижения оптимальной эффективности трансляции после трансфекции транскрибированной РНК. 5' и 3' UTR могут представлять собой встречающиеся в природе эндогенные 5' и 3' UTR для представляющего интерес гена. Альтернативно, последовательности UTR, которые не являются эндогенными для интересующего гена, могут быть добавлены путем включения последовательностей UTR в прямой и обратный праймеры или с помощью любых других модификаций матрицы. Использование последовательностей UTR, которые не являются эндогенными для интересующего гена, может быть полезным для изменения стабильности и/или эффективности трансляции РНК. Например, известно, что богатые AU элементы в 3'-последовательностях UTR могут снижать стабильность мРНК. Следовательно, 3'-UTR могут быть выбраны или разработаны для увеличения стабильности транскрибированной РНК на основе свойств UTR, которые хорошо известны в данной области.
В одном воплощении 5' -UTR может содержать последовательность Kozak эндогенного гена. Альтернативно, когда 5' -UTR, который не является эндогенным для интересующего гена, добавляется с помощью ПЦР, как описано выше, консенсусная последовательность Kozak может быть изменена путем добавления 5' -последовательности UTR. Последовательности Kozak могут повысить эффективность трансляции некоторых РНК-транскриптов, но, по-видимому, не требуются, чтобы все РНК обеспечивали эффективную трансляцию. Требование последовательностей Kozak для многих мРНК известно в данной области. В других воплощениях 5' -UTR может быть получен из РНК-вируса, чей РНК-геном стабилен в клетках. В других воплощениях различные нуклеотидные аналоги можно использовать в 3' или 5' UTR, чтобы препятствовать деградации мРНК экзонуклеазой.
Чтобы сделать возможным синтез РНК с матрицы ДНК без необходимости клонирования гена, промотор транскрипции должен быть присоединен к матрице ДНК перед транскрибируемой последовательностью. Когда последовательность, которая функционирует в качестве промотора для РНК-полимеразы, добавляется к 5' концу прямого праймера, промотор РНК-полимеразы становится включенным в продукт ПЦР перед открытой рамкой считывания, которая должна быть транскрибирована. В одном предпочтительном воплощении промотор представляет собой T7-полимеразный промотор, как описано в другом месте данного документа. Другие полезные промоторы включают, без ограничения указанным, промоторы РНК-полимеразы Т3 и SP6. Консенсусные нуклеотидные последовательности для промоторов T7, T3 и SP6 известны в данной области.
В предпочтительном воплощении мРНК имеет как кэп на 5' конце, так и 3' поли (А) хвост, которые определяли связывание рибосомы, инициацию трансляции и стабильность мРНК в клетке. На кольцевой матрице ДНК, например, плазмидной ДНК, РНК-полимераза продуцирует длинный конкатемерный продукт, который не подходит для экспрессии в эукариотических клетках. Транскрипция плазмидной ДНК, линеаризованной в конце 3 'UTR, приводит к мРНК нормального размера, которая не эффективна для эукариотической трансфекции, даже если она полиаденилируется после транскрипции.
На линейной ДНК-матрице РНК-полимераза фага Т7 может удлинять 3'-конец транскрипта за пределы последнего основания матрицы (Schenborn and Mierendorf, Nuc Acids Res., 13:6223-36 (1985); Nacheva and Berzal-Herranz, Eur. J. Biochem., 270: 1485-65 (2003).
Общепринятым способом интеграции полиА/Т-участков в матрицу ДНК является молекулярное клонирование. Однако последовательность полиA/T, интегрированная в плазмидную ДНК, может вызывать нестабильность плазмиды, поэтому матрицы плазмидной ДНК, полученные из бактериальных клеток, часто сильно загрязнены делециями и другими аберрациями. Это делает процедуры клонирования не только трудоемкими и длительными, но зачастую и ненадежными. Вот почему способ, который позволяет конструировать ДНК-матрицы с полиА/Т 3'-участком без клонирования, крайне желателен.
Сегмент полиA/T транскрипционной ДНК-матрицы может быть получен во время ПЦР с использованием обратного праймера, содержащего хвост полиT, такой как хвост 100T (размер может быть 50-5000 Т) или после ПЦР любым другим способом, включая, без ограничения указанным, лигирование ДНК или рекомбинацию in vitro. Поли(А)-хвосты также обеспечивают стабильность РНК и уменьшают их деградацию. Как правило, длина поли (А)-хвоста положительно коррелирует со стабильностью транскрибированной РНК. В одном воплощении поли (А) хвост составляет от 100 до 5000 аденозинов.
Поли(А)-хвосты РНК могут быть дополнительно удлинены после транскрипции in vitro с использованием поли(А)-полимеразы, такой как полиА-полимераза Е.coli (E-PAP). В одном воплощении увеличение длины поли(А)-хвоста от 100 нуклеотидов до 300-400 нуклеотидов приводит к около двукратному увеличению эффективности трансляции РНК. Кроме того, присоединение различных химических групп к 3'-концу может повысить стабильность мРНК. Такое присоединение может содержать модифицированные/искусственные нуклеотиды, аптамеры и другие соединения. Например, в поли (А) хвост могут быть включены аналоги АТФ с использованием поли(А)-полимеразы. Аналоги АТФ могут еще больше повысить стабильность РНК.
5'-кэпы на РНК также обеспечивают стабильность молекул РНК. В предпочтительном воплощении РНК, полученные способами, раскрытыми в данном документе, включают 5'-кэп. 5'-кэп предоставляется с использованием методов, известных в данной области техники и описанных в данном документе (Cougot et al., Trends in Biochem. Sci., 29:436-444 (2001); Stepinski, et al., RNA, 7: 1468-95 (2001); Elango, et al., Biochim. Biophys. Res. Commun., 330:958-966 (2005)).
РНК, полученные способами, раскрытыми в данном описании, также могут содержать последовательность участка внутренней посадки рибосомы (IRES). Последовательность IRES может быть любой вирусной, хромосомной или искусственно сконструированной последовательностью, которая инициирует кэп-независимое связывание рибосомы с мРНК и облегчает инициацию трансляции. Могут быть включены любые растворы, подходящие для электропорации клеток, которые могут содержать факторы, способствующие проницаемости и жизнеспособности клеток, такие как сахара, пептиды, липиды, белки, антиоксиданты и поверхностно-активные вещества.
РНК может быть введена в клетки-мишени с использованием любого из ряда различных способов, например, коммерчески доступных способов, которые включают, без ограничения указанным, электропорацию (Amaxa Nucleofector-II (Amaxa Biosystems, Кельн, Германия)) (ECM 830 (BTX) (Harvard Instruments, Бостон, штат Массачусетс) или Gene Pulser II (BioRad, Denver, Colo.), Multiporator (Eppendort, Гамбург, Германия), трансфекцию, опосредованную катионными липосомами, с использованием липофекции, инкапсуляцию полимером, трансфекцию, опосредованную пептидами, или балистические системы доставки частиц, такие как «генные пушки» (см., например, Nishikawa, et al. Hum Gene Ther., 12(8):861-70 (2001).
В одном воплощении последовательности CAR доставляются в клетки с использованием ретровирусного или лентивирусного вектора. CAR-экспрессирующие ретровирусные и лентивирусные векторы могут доставляться в различные типы эукариотических клеток, а также в ткани и целые организмы с использованием трансдуцированных клеток в качестве носителей или бесклеточной локальной или системной доставки инкапсулированных, связанных или «голых» векторов. Используемый способ может использоваться для любых целей, где требуется или достаточна стабильная экспрессия.
В другом воплощении последовательности CAR доставляются в клетки с использованием транскрибированной мРНК in vitro. Транскрибированная мРНК CAR in vitro может быть доставлена в различные типы эукариотических клеток, а также в ткани и целые организмы, используя трансфицированные клетки в качестве носителей или бесклеточную локальную или системную доставку инкапсулированной, связанной или «голой» мРНК. Используемый способ может использоваться для любых целей, где требуется или достаточна транзиторная экспрессия.
В другом воплощении желательный CAR может быть экспрессирован в клетках посредством транспозонов.
В одном воплощении иммунная клетка по изобретению представляет собой Т-клетку. До размножения и генетической модификации Т-клеток по изобретению источник Т-клеток получают из объекта. Т-клетки могут быть получены из ряда источников, включая мононуклеарные клетки периферической крови, костный мозг, ткань лимфатического узла, пуповинную кровь, ткань тимуса, ткань из места инфекции, асцит, плевральный выпот, ткань селезенки и опухоли. В определенных воплощениях настоящего изобретения может использоваться любое количество линий Т-клеток, доступных в данной области. В некоторых воплощениях настоящего изобретения Т-клетки могут быть получены из единицы крови, взятой у объекта, с использованием любого количества методик, известных специалисту в данной области, таких как разделение на Ficoll™ или система разделения Sepax. В одном предпочтительном воплощении клетки из циркулирующей крови индивидуума получают аферезом. Продукт для афереза обычно включает лимфоциты, включая Т-клетки, моноциты, гранулоциты, В-клетки, другие ядросодержащие лейкоциты, эритроциты и тромбоциты. В одном воплощении клетки, собранные с помощью афереза, могут быть промыты для удаления фракции плазмы и помещения клеток в соответствующий буфер или среду для последующих стадий обработки. В одном воплощении изобретения клетки промывали фосфатно-солевым буфером (PBS). В альтернативном воплощении в моющем растворе отсутствует кальций и может отсутствовать магний или могут отсутствовать многие, если не все двухвалентные катионы. После промывания клетки могут быть ресуспендированы в различных биосовместимых буферах, таких как, например, не содержащий Ca 2+, не содержащий Mg 2+ PBS, PlasmaLyte A или другой физиологический раствор с буфером или без него. Альтернативно, нежелательные компоненты образца афереза могут быть удалены, и клетки непосредственно ресуспендированы в культуральной среде.
В другом воплощении Т-клетки выделяют из лимфоцитов периферической крови путем лизиса эритроцитов и истощения моноцитов, например, путем центрифугирования в градиенте PERCOLL™ или путем противоточного центрифугирования. Конкретная субпопуляция Т-клеток, такая как CD4+ CD25+, в частности, CD4+ CD25+ CD127lo, такая как, например, CD4+ CD25+ CD127loCD45RA+, может быть дополнительно выделена методами положительного или отрицательного отбора. Например, в одном воплощении Т-клетки выделяют путем инкубации с гранулами, конъюгированными с анти-CD3/анти-CD28 (т.е. 3x28), такими как DYNABEADS® M-450 CD3/CD28 T, в течение периода времени, достаточного для положительного отбора искомых Т-клеток. В одном воплощении период времени составляет около 30 минут. В дополнительном воплощении период времени составляет от 30 минут до 36 часов или более, и все целочисленные значения между ними. В дополнительном воплощении период времени составляет, по меньшей мере, 1, 2, 3, 4, 5 или 6 часов. В еще одном предпочтительном воплощении период времени составляет от 10 до 24 часов. В одном предпочтительном воплощении время инкубации составляет 24 часа. Для выделения Т-клеток из пациентов с лейкозом, применение более длительного времени инкубации, такого как 24 часа, может увеличить выход клеток. Более длительное время инкубации может быть использовано для выделения Т-клеток в любой ситуации, когда Т-клеток мало по сравнению с клетками других типов, например, при выделении инфильтрирующих опухоль лимфоцитов (TIL) из опухолевой ткани или у людей с ослабленным иммунитетом. Таким образом, просто сокращая или удлиняя время, в течение которого Т-клеткам разрешается связываться с гранулами CD3/CD28, и/или увеличивая или уменьшая отношение гранул к Т-клеткам (как описано далее в настоящем документе), можно предпочтительно выбирать субпопуляции Т-клеток за или против в начале культуры или в другие моменты времени в течение процесса. Кроме того, путем увеличения или уменьшения соотношения анти-CD3 и/или анти-CD28-антител на гранулах или другой поверхности, субпопуляции Т-клеток могут быть предпочтительно выбраны за или против в начале культивирования или в другие желательные моменты времени. Специалист в данной области техники признает, что множественные раунды отбора также могут использоваться в контексте этого изобретения.
В другом воплощении может быть желательно выполнить процедуру выбора и использовать «неотобранные» клетки в процессе активации и размножения. «Неотобранные» клетки также могут подвергаться дополнительным раундам отбора. Обогащение популяции Т-клеток путем отрицательного отбора может быть достигнуто с помощью комбинации антител, направленных на поверхностные маркеры, уникальные для отрицательно отобранных клеток. Одним из способов является сортировка и/или отбор клеток с помощью отрицательной магнитной иммуноадгезии или проточной цитометрии, в которой используется набор моноклональных антител, направленных на маркеры клеточной поверхности, присутствующие на отрицательно отобранных клетках. Например, для обогащения клеток CD4+ путем отрицательного отбора коктейль из моноклональных антител обычно включает антитела к CD14, CD20, CD11b, CD16, HLA-DR и CD8. В некоторых воплощениях может быть желательным обогащение или положительный отбор регуляторных Т-клеток, имеющих обычно следующий фенотип CD4+, CD25+, CD62Lhi, GITR+ и FoxP3+. Альтернативно, в определенных воплощениях T-регуляторные клетки истощаются с помощью конъюгированных с анти-CD25 гранул или другого подобного способа отбора.
Для выделения искомой популяции клеток с помощью положительного или отрицательного отбора можно варьировать концентрацию клеток и поверхности (например, частиц, таких как гранулы). В определенных воплощениях может быть желательным значительно уменьшить объем, в котором гранулы и клетки смешиваются друг с другом (то есть увеличить концентрацию клеток), чтобы обеспечить максимальный контакт клеток и гранул. Например, в одном воплощении используется концентрация 2 миллиарда клеток/мл. В одном воплощении используется концентрация 1 миллиард клеток/мл. В дополнительном воплощении используют более 100 миллионов клеток/мл. В следующем воплощении используется концентрация клеток 10, 15, 20, 25, 30, 35, 40, 45 или 50 миллионов клеток/мл. В еще одном воплощении используется концентрация клеток от 75, 80, 85, 90, 95 или 100 миллионов клеток/мл. В других воплощениях могут использоваться концентрации 125 или 150 миллионов клеток/мл. Использование высоких концентраций может привести к увеличению выхода клеток, активации клеток и размножения клеток. Кроме того, применение высоких концентраций клеток позволяет более эффективно захватывать клетки, которые могут слабо экспрессировать представляющие интерес антигены-мишени, такие как CD28-отрицательные Т-клетки, или из образцов, где присутствует много опухолевых клеток (то есть лейкозная кровь, опухолевая ткань и т.д.)). Такие популяции клеток могут иметь терапевтическую ценность и их было бы желательно получить.
Т-клетки для стимуляции также могут быть заморожены после промывки. Не желая быть связанными теорией предполагаем, что стадия замораживания и последующего оттаивания обеспечивает более однородный продукт за счет удаления гранулоцитов и в некоторой степени моноцитов в клеточной популяции. После стадии промывки, которая удаляет плазму и тромбоциты, клетки могут быть суспендированы в замораживающем растворе. Хотя многие растворы и параметры для замораживания известны в данной области техники и будут полезны в этом контексте, один способ включает применение PBS, содержащего 20% DMSO и 8% человеческого сывороточного альбумина, или культуральную среду, содержащую 10% декстрана 40 и 5% декстрозы, 20% человеческого сывороточного альбумина и 7,5% DMSO или 31,25% плазмалита-А, 31,25% декстрозы 5%, 0,45% NaCl, 10% декстрана 40 и 5% декстрозы, 20% человеческого сывороточного альбумина и 7,5% DMSO или других подходящих сред для замораживания клеток, содержащих, например, Hespan и PlasmaLyte A, клетки затем замораживали до -80°C со скоростью 1°C в минуту и хранили в паровой фазе резервуара для хранения жидкого азота. Можно использовать другие способы контролируемого замораживания, а также неконтролируемое замораживание сразу при -20°C или в жидком азоте.
В определенных воплощениях криоконсервированные клетки оттаивали и промывали, как описано в данном документе, и оставляли на один час при комнатной температуре до активации.
В контексте изобретения также рассматривается отбор образцов крови или продукта для афереза у объекта в период времени, предшествующий тому, когда могут потребоваться расширенные клетки, как описано в данном документе. Как таковой, источник клеток, подлежащих размножению, может быть собран в любой момент времени, когда необходимо, и желаемые клетки, такие как Т-клетки, могут быть выделены и заморожены для последующего применения в Т-клеточной терапии для любого числа заболеваний или состояний, которые будут полезны Т-клеточной терапии, такой как описанная в данном документе. В одном воплощении образец крови или аферез забирают у обычно здорового объекта. В некоторых воплощениях образец крови или аферез забирают у обычно здорового объекта, у которого есть риск развития заболевания, но у которого еще не развилось заболевание, и представляющие интерес клетки выделяют и замораживают для последующего применения. В определенных воплощениях Т-клетки могут быть размножены, заморожены и использованы позднее.
Независимо от того, до или после генетической модификации Т-клеток (предпочтительно Treg-клеток) для экспрессии желательного CAR, Т-клетки можно активировать и размножать, как правило, с использованием способов, как описано, например, в US 6 352 694; 6534055; 6905680; 6692964; 5858358; 6887466; 6905681; 7144575; 7067318; 7172869; 7232566; 7175843; 5883223; 6905874; 6797514; 6867041; и US20060121005, включенных в настоящий документ ссылкой.
Как правило, популяцию Т-клеток (предпочтительно Treg-клеток) по изобретению размножают путем контакта с поверхностью, на которой прикреплен агент, стимулирующий сигнал, связанный с комплексом CD3/TCR, и лигандом, который стимулирует костимулирующую молекулу на поверхности Т-клетки (предпочтительно Treg) клеточной популяции. В частности, популяция T (предпочтительно Treg)-клеток может быть стимулирована, как описано в настоящем документе, например, путем контакта с анти-CD3-антителом или его антигенсвязывающим фрагментом или анти-CD2-антителом, иммобилизованным на поверхности, или путем контакта с активатором протеинкиназы С (например, бриостатином) в сочетании с ионофором кальция. Для костимуляции вспомогательной молекулы на поверхности Т-клеток используется лиганд, который связывает вспомогательную молекулу. Например, популяция Т-клеток может контактировать с анти-CD3 антителом и анти-0CD28 антителом в условиях, подходящих для стимуляции пролиферации Т-клеток. Для стимуляции пролиферации CD4+ T-клеток можно использовать анти-CD3 антитело и анти-CD28 антитело. Примеры анти-CD28 антитела включают, без ограничения указанным, 9.3, B-T3, XR-CD28 (Diaclone, Безансон, Франция). Могут быть использованы другие способы размножения, обычно известные в данной области (Berg et al., Transplant Proc. 30(8):3975-3977, 1998; Haanen et al., J. Exp. Med. 190(9): 13191328, 1999; Garland et al., J. Immunol Meth. 227(l-2):53-63, 1999).
В некоторых воплощениях первичный стимулирующий сигнал и костимулирующий сигнал для популяции Т-клеток (предпочтительно Treg) клеток могут быть предоставлены различными протоколами. Например, агенты, обеспечивающие каждый сигнал, могут быть в растворе или связаны с поверхностью. Когда они связаны с поверхностью, агенты могут быть связаны с одной и той же поверхностью (то есть в «цис»-образование) или с другими поверхностями (то есть в «транс»-образование). Альтернативно, один агент может быть связан с поверхностью, а другой агент может находиться в растворе. В одном воплощении агент, обеспечивающий костимулирующий сигнал, связан с поверхностью клетки, а агент, обеспечивающий первичный сигнал активации, находится в растворе или связан с поверхностью. В определенных воплощениях оба агента могут находиться в растворе. В другом воплощении агенты могут быть в растворимой форме и затем сшиты с поверхностью, такой как клетка, экспрессирующая Fc-рецепторы, или антитело или другой связывающий агент, который будет связываться с агентами. В этом отношении см., например, US 20040101519 и 20060034810, включенные в настоящий документ ссылкой, для искусственных антигенпрезентирующих клеток (aAPC), которые предполагаются для применения в активации и размножении T-клеток в настоящем изобретении.
В одном воплощении два агента иммобилизованы на гранулах, либо на одном и том же шарике, то есть «цис», или на отдельных гранулах, то есть «транс». Например, агент, обеспечивающий первичный сигнал активации, представляет собой анти-CD3 антитело или его антигенсвязывающий фрагмент, а агент, обеспечивающий сигнал костимуляции, представляет собой анти-CD28 антитело или его антигенсвязывающий фрагмент; и оба агента совместно иммобилизованы на одной и той же грануле в эквивалентных молекулярных количествах. В одном воплощении используется соотношение 1: 1 каждого антитела, связанного с гранулами, для размножения CD4+ T-клеток и роста T-клеток. В некоторых аспектах настоящего изобретения используется соотношение анти-CD3:CD28-антител, связанных с гранулами, так что наблюдается увеличение размножения Т-клеток по сравнению с размножением, наблюдаемым с использованием соотношения 1:1. В одном конкретном воплощении наблюдается увеличение от около 1 до около 3 раз по сравнению с размножением, наблюдаемым с использованием соотношения 1:1. В одном воплощении отношение антитела CD3:CD28, связанного с гранулами, находится в диапазоне от 100:1 до 1:100 и всех целочисленных значений между ними. В одном аспекте настоящего изобретения большее количество анти-CD28-антитела связано с частицами, чем анти-CD3-антитела, то есть соотношение CD3:CD28 меньше единицы. В некоторых воплощениях изобретения отношение анти-CD28-антитела к анти-CD3-антителу, связанному с гранулами, составляет более 2:1. В одном конкретном воплощении используется соотношение 1:100 CD3:CD28 антител, связанных с гранулами. В другом варианте используют соотношение 1:75 CD3:CD28 антител, связанных с гранулами. В дополнительном воплощении используется соотношение 1:50 CD3:CD28 антител, связанных с гранулами. В другом воплощении используют соотношение 1:30 CD3:CD28 антител, связанных с гранулами. В одном предпочтительном воплощении используется соотношение 1:10 CD3:CD28 антител, связанных с гранулами. В другом воплощении используют соотношение 1: 3 CD3:CD28 антител, связанных с гранулами. В еще одном воплощении используется соотношение 3:1 CD3:CD28 антител, связанных с гранулами.
Соотношения частиц к клеткам от 1:500 до 500:1 и любые целочисленные значения между ними могут использоваться для стимуляции Т-клеток или других клеток-мишеней. Как легко могут оценить специалисты в данной области, соотношение частиц к клеткам может зависеть от размера частиц относительно клетки-мишени. Например, мелкие гранулы могут связывать только несколько клеток, в то время как большие гранулы могут связывать много клеток. В некоторых воплощениях отношение клеток к частицам находится в диапазоне от 1: 100 до 100:1, и любые целочисленные значения между ними, а в других воплощениях отношение составляет от 1: 9 до 9:1, и любые целочисленные значения между ними также могут быть использованы для стимуляции Т-клеток. Соотношение анти-CD3- и анти-CD28-связанных частиц к Т-клеткам, которые приводят к стимуляции Т-клеток, может варьироваться, как отмечено выше, однако некоторые предпочтительные значения включают 1: 100, 1:50, 1:40, 1:30, 1:20, 1:10, 1:9, 1:8, 1:7, 1:6, 1:5, 1:4, 1:3, 1:2, 1:1, 2:1, 3:1, 4:1, 5:1, 6:1, 7:1, 8:1, 9:1, 10:1 и 15:1, причем одно предпочтительное соотношение составляет, по меньшей мере, 1:1 частиц на Т-клетку. В одном воплощении используется соотношение частиц к клеткам 1:1 или менее. В одном конкретном воплощении предпочтительное соотношение частица:клетка составляет 1:5. В других воплощениях отношение частиц к клеткам может варьировать в зависимости от дня стимуляции. Например, в одном воплощении отношение частиц к клеткам составляет от 1:1 до 10:1 в первый день, и дополнительные частицы добавляют к клеткам каждый день или через день после этого в течение до 10 дней в конечных соотношениях. от 1:1 до 1:10 (на основе количества клеток в день добавления). В одном конкретном воплощении соотношение частиц к клеткам составляет 1:1 в первый день стимуляции и доводят до 1: 5 в третий и пятый дни стимуляции. В другом воплощении изобретения частицы добавляют ежедневно или через день до конечного соотношения 1: 1 в первый день и 1: 5 в третий и пятый дни стимуляции. В другом воплощении отношение частиц к клеткам составляет 2: 1 в первый день стимуляции и доводят до 1:10 в третий и пятый дни стимуляции. В другом воплощении изобретения частицы добавляют ежедневно или через день до конечного соотношения 1: 1 в первый день и 1:10 в третий и пятый дни стимуляции. Специалист в данной области поймет, что множество других соотношений могут быть подходящими для применения в настоящем изобретении. В частности, соотношения будут варьировать в зависимости от размера частиц, а также от размера и типа клеток.
В других воплощениях настоящего изобретения Т-клетки (предпочтительно Treg-клетки) объединяют с гранулами, покрытыми агентом, гранулы и клетки затем разделяют, а клетки затем культивируют. В альтернативном воплощении перед культивированием покрытые агентом гранулы и клетки не разделяют, а культивируют вместе. В дополнительном воплощении гранулы и клетки сначала концентрируют путем приложения силы, такой как магнитная сила, что приводит к усилению лигирования маркеров клеточной поверхности, вызывая тем самым стимуляцию клеток.
Например, белки клеточной поверхности можно лигировать, позволяя парамагнитным гранулам, к которым присоединены анти-CD3 и анти-CD28 (3 × 28 гранулы), контактировать с клетками популяции Treg-клеток. В одном воплощении клетки (например, 104-109 Т-клеток) и гранулы (например, парамагнитные гранулы DYNABEADS® M-450 CD3/CD28 T в соотношении 1:1) объединяют в буфере, предпочтительно PBS (без двухвалентных катионов, таких как кальций и магний). Опять же, специалисты в данной области техники могут легко понять, что можно использовать любую концентрацию клеток. Например, клетка-мишень может быть очень редкой в образце и составлять только 0,01% образца, или весь образец (т.е. 100%) может содержать интересующую клетку-мишень. Соответственно, любое количество клеток находится в контексте настоящего изобретения. В определенных воплощениях может быть желательным значительно уменьшить объем, в котором частицы и клетки смешиваются (то есть увеличить концентрацию клеток), чтобы обеспечить максимальный контакт клеток и частиц. Например, в одном воплощении используется концентрация около 2 миллиардов клеток/мл. В другом воплощении используют более 100 миллионов клеток/мл. В следующем воплощении используется концентрация клеток 10, 15, 20, 25, 30, 35, 40, 45 или 50 миллионов клеток/мл. В еще одном воплощении используется концентрация клеток от 75, 80, 85, 90, 95 или 100 миллионов клеток/мл. В других воплощениях могут использоваться концентрации 125 или 150 миллионов клеток/мл. Использование высоких концентраций может привести к увеличению выхода клеток, активации клеток и размножения клеток. Кроме того, применение высоких концентраций клеток позволяет более эффективно захватывать клетки, которые могут слабо экспрессировать представляющие интерес антигены-мишени, такие как CD28-негативные Т-клетки. Такие популяции клеток могут иметь терапевтическую ценность и их было бы желательно получить в определенных воплощениях.
В одном воплощении настоящего изобретения смесь может быть культивирована в течение от нескольких часов (около 3 часов) до около 14 дней или любого часового целочисленного значения между ними. В другом воплощении смесь можно культивировать в течение 21 дня. В одном воплощении изобретения гранулы и Т-клетки культивируют вместе в течение около восьми дней. В другом воплощении гранулы и Т-клетки культивируют вместе в течение 2-3 дней. Также могут быть желательными несколько циклов стимуляции, так что время культивирования Т-клеток может составлять 60 дней или более. Условия, подходящие для культуры Т-клеток, включают подходящие среды (например, минимальная питательная среда или RPMI Media 1640 или X-vivo 15 (Lonza)), которые могут содержать факторы, необходимые для пролиферации и жизнеспособности, включая сыворотку (например, эмбриональную бычью или человеческую сыворотку), интерлейкин-2 (IL-2), инсулин, IFN-γ, IL-4, IL-7, GM-CSF, IL-10, IL-12, IL-15, TGFβ и TNF-α или любые другие добавки для роста клеток, известные специалисту в данной области. Другие добавки для роста клеток включают, без ограничения указанным, сурфактант, плазманат и восстановители, такие как N-ацетилцистеин и 2-меркаптоэтанол. Среда может включать RPMI 1640, AIM-V, DMEM, MEM, a-MEM, F-12, X-Vivo 15 и X-Vivo 20, Optimizer, с добавлением аминокислот, пирувата натрия и витаминов, либо без сыворотки или дополненный соответствующим количеством сыворотки (или плазмы) или определенного набора гормонов и/или количеством цитокинов, достаточным для роста и размножения Т-клеток. Антибиотики, например, пенициллин и стрептомицин, включены только в экспериментальные культуры, но не в культуры клеток, которые должны быть введены объекту. Клетки-мишени поддерживают в условиях, необходимых для поддержания роста, например, при подходящей температуре (например, 37° C) и атмосфере (например, воздух плюс 5% CO2).
Т-клетки, которые подвергались различным временам стимуляции, могут иметь различные характеристики. Например, типичные продукты мононуклеарных клеток крови или периферической крови с периферической кровью имеют популяцию вспомогательных Т-клеток (Th, CD4+), которая больше, чем популяция цитотоксических или супрессорных Т-клеток (Tc, CD8+). Экспрессия Т-клеток ex vivo путем стимуляции рецепторов CD3 и CD28 приводит к образованию популяции Т-клеток, которая до около 8-9 дней состоит преимущественно из Th-клеток, в то время как через около 8-9 дней популяция Т-клеток включает все большую популяцию Тс-клеток. Соответственно, в зависимости от цели лечения может быть выгодно введение объекту популяции Т-клеток, состоящей преимущественно из Th-клеток. Точно так же, если антигенспецифическое подмножество Tc-клеток было выделено, может быть выгодно расширить это подмножество в большей степени.
Кроме того, помимо маркеров CD4 и CD8, другие фенотипические маркеры значительно варьируют, но в значительной степени воспроизводимы в ходе процесса размножения клеток. Таким образом, такая воспроизводимость дает возможность адаптировать активированный Т-клеточный продукт для конкретных целей.
В одном воплощении изобретения Т-клетки можно культивировать в присутствии рапамицина для получения регуляторных Т-клеток, как описано, например, в WO2007110785, включенном в настоящий документ ссылкой. Другой способ получения регуляторных Т-клеток описан в US2016024470, включенном в настоящий документ ссылкой, где Т-клетки культивируют с активатором Т-клеточного рецептора (TCR)/CD3, таким как, например, антитела TCR/CD3, активатор костимулятора TCR, такой как, например, антитела CD28, CD137 (4-1 BB), GITR, B7-1/2, CD5, ICOS, OX40, CD40 или CD137 и рапамицин.
В одном воплощении изобретения Т-клетки, генетически модифицированные путем экспрессии CAR, также могут быть генетически модифицированы путем экспрессии, по меньшей мере, одного внутриклеточного фактора, такого как ROR-C, Foxo1, T-bet или Gata 3, c-Maf, AhR. В одном воплощении генетически модифицированная иммунная клетка по изобретению экспрессирует Foxo1.
В одном воплощении генетически модифицированные клетки по настоящему изобретению могут представлять собой аллогенные иммунные клетки, такие как, например, аллогенные T- или Treg-клетки. Например, аллогенная иммунная клетка может представлять собой иммунную клетку, в которой отсутствует экспрессия функционального человеческого лейкоцитарного антигена (HLA), например, HLA класса I и/или HLA класса II, или отсутствует экспрессия функционального Т-клеточного рецептора (TCR).
В одном воплощении T-клетка, не имеющая функционального TCR, может быть сконструирована таким образом, чтобы она не экспрессировала какой-либо функциональный TCR на своей поверхности, сконструирована таким образом, чтобы она не экспрессировала одну или несколько субъединиц, которые содержат функциональный TCR, или сконструирована таким образом, что она продуцировала очень маленький функциональный TCR на своей поверхности. Альтернативно, Т-клетка может экспрессировать существенно нарушенный TCR, например, путем экспрессии мутированных или укороченной форм одной или нескольких субъединиц TCR. Термин «существенно ослабленный TCR» означает, что этот TCR не будет вызывать неблагоприятную иммунную реакцию у хозяина.
В другом воплощении генетически модифицированные клетки, описанные в данном документе, могут быть сконструированы таким образом, чтобы они не экспрессировали функциональный HLA на своей поверхности. Например, иммунная клетка, описанная в данном документе, может быть сконструирована так, чтобы снижалась экспрессия HLA на клеточной поверхности, например, HLA класса 1 и/или HLA класса II, или неклассических молекул HLA.
В другом воплощении Т-клетка может не иметь функционального TCR и функционального HLA, такого как HLA класса I и/или HLA класса II.
Модифицированные иммунные клетки (такие как, например, модифицированные T- или Treg-клетки), у которых отсутствует экспрессия функционального TCR и/HLA, могут быть получены любым подходящим способом, включая нокаут или нокдаун одной или нескольких субъединиц TCR и/или HLA. Например, иммунная клетка может включать нокдаун TCR и/или HLA с использованием siRNA, shRNA, кластерных коротких палиндромных повторов, разделенных регулярными промежутками (CRISPR), таких как эффекторная нуклеаза, подобная активаторам транскрипции (TALEN), эндонуклеаза цинкового пальца (ZFN), мегануклеаза (mn, также известная как хоминг-эндонуклеаза) или megaTAL (объединяющий эффектор TAL с доменом расщепления mn) (Osborn et al, “Evaluation of TCR Gene Editing Achieved by TALENs, CRISPR/Cas9, and megaTAL Nucleases” Mol Ther. 2016 Mar;24(3):570-81).
В одном воплощении экспрессия TCR и/или экспрессия HLA могут быть ингибированы с использованием siРНК или shRNA, которая нацелена на нуклеиновую кислоту, кодирующую TCR и/или HLA в Т-клетке. Экспрессия siRNA и shRNA в Т-клетках может быть достигнута с использованием любой обычной системы экспрессии, например, такой как система экспрессии лентивируса. Типичные siRNA и shRNA, которые подавляют экспрессию генов HLA класса I и/или HLA класса II, описаны, например, в US 2007/0036773. Типичные shRNA, которые подавляют экспрессию компонентов TCR, описаны, например, в US2012/0321667.
Используемый в данном документе термин «CRISPR» или «CRISPR для TCR и/или HLA» или «CRISPR для ингибирования TCR и/или HLA» относится к набору кластерных коротких палиндромных повторов, разделенные регулярными промежутками, или к системе, содержащей такой набор повторов. «Cas», при использовании в данном документе, относится к CRISPR-ассоциированному белку. Система «CRISPR/Cas» относится к системе, полученной из CRISPR и Cas, которая может использоваться для подавления или мутации гена TCR и/или HLA.
Встречающиеся в природе системы CRISPR/Cas обнаруживаются в около 40% секвенированных геномов эубактерий и в 90% секвенированных архей. Grissa et al. (2007) BMC Bioinformatics 8: 172. Эта система представляет собой тип прокариотической иммунной системы, которая придает устойчивость к чужеродным генетическим элементам, таким как плазмиды и фаги, и обеспечивает форму приобретенного иммунитета. Barrangou et al. (2007) Science 315: 1709-1712; Marragini et al. (2008) Science 322: 1843-1845. Система CRISPR/Cas была модифицирована для применения при редактировании генов (молчание, усиление или изменение определенных генов) у эукариот, таких как мыши или приматы. Wiedenheft et al. (2012) Nature 482: 331-8. Это достигается путем введения в эукариотическую клетку плазмиды, содержащей специально сконструированный CRISPR и один или несколько подходящих Cas. Последовательность CRISPR, иногда называемая локусом CRISPR, включает чередующиеся повторы и спейсеры. Во встречающемся в природе спейсеры CRISPR обычно содержат последовательности, чужеродные для бактерии, такие как последовательность плазмиды или фага; в системе TCR и/или HLA CRISPR/Cas спейсеры получены из последовательности гена TCR или HLA. РНК из локуса CRISPR конститутивно экспрессируется и перерабатывается белками Cas в небольшие РНК. Они содержат спейсер, фланкированный повторяющейся последовательностью. РНК направляют другие белки Cas, чтобы заставить отключить экзогенные генетические элементы на уровне РНК или ДНК. Horvath et al. (2010) Science 327: 167-170; Makarova et al. (2006) Biology Direct 1: 7. Спейсеры, таким образом, служат матрицами для молекул РНК, аналогично миРНК. Pennisi (2013) Science 341: 833-836. Таким образом, система CRISPR/Cas может использоваться для редактирования гена TCR и/или HLA (добавления или удаления пары оснований) или для введения преждевременного стоп-кодона, который, таким образом, уменьшает экспрессию TCR и/или HLA. В качестве альтернативы можно использовать систему CRISPR/Cas, такую как РНК-интерференция, обратимым образом отключая ген HLA. Например, в клетке млекопитающего РНК может направлять белок Cas к промотору TCR и/или HLA, стерически блокируя РНК-полимеразы.
Могут быть созданы искусственные системы CRISPR/Cas, которые ингибируют TCR и/или HLA, используя технологию, известную в данной области, например, описанную в US 20140068797 и Cong (2013) Science 339: 819-823. Также могут быть получены другие искусственные системы CRISPR/Cas, известные в данной области техники, которые ингибируют TCR и/или HLA, например, которые описаны в Tsai (2014) Nature Biotechnol., 32: 6 569-576, US 8,871,445; 8865406; 8795965; 8771945; и 8 697 359.
«TALEN» или «TALEN для TCR и/или HLA» или «TALEN для ингибирования TCR и/или HLA» относится к эффекторной нуклеазе, подобной активатору транскрипции, искусственной нуклеазе, которую можно использовать для редактирования TCR и/или HLA. TALEN получают искусственно путем слияния TAL-эффекторного ДНК-связывающего домена с доменом расщепления ДНК. Активаторы, подобные активаторам транскрипции (TALE), могут быть сконструированы так, чтобы связывать любую искомую последовательность ДНК, включая часть гена TCR и/или HLA. Комбинируя сконструированный TALE с доменом расщепления ДНК, можно получить рестриктазу, которая специфична для любой искомой последовательности ДНК, включая последовательность TCR и/или HLA. Затем они могут быть введены в клетку, где они могут быть использованы для редактирования генома. Boch (2011) Nature Biotech. 29: 135-6; and Boch et al. (2009) Science 326: 1509-12; Moscou et al. (2009) Science 326: 3501.
TALE представляет собой белки, секретируемые бактериями Xanthomonas. ДНК-связывающий домен включает повторяющуюся высококонсервативную 33-34 аминокислотную последовательность, за исключением 12-й и 13-й аминокислот. Эти две позиции сильно варьируют, показывая сильную корреляцию с распознаванием специфических нуклеотидов. Таким образом, они могут быть сконструированы так, чтобы связываться с искомой последовательностью ДНК. Чтобы получить TALEN, белок TALE сливают с нуклеазой (N), которая является эндонуклеазой Fokl дикого типа или мутированной. Было получено несколько мутаций Fokl для ее использования в TALEN; например, они улучшают специфичность или активность расщепления. Cermak et al. (2011) Nucl. Acids Res. 39: e82; Miller et al. (2011) Nature Biotech. 29: 143-8; Hockemeyer et al. (2011) Nature Biotech. 29: 731-734; Wood et al. (2011) Science 333: 307; Doyon et al. (2010) Nature Methods 8: 74-79; Szczepek et al. (2007) Nature Biotech. 25: 786-793; and Guo et al. (2010) /. Mol. Biol. 200: 96. Домен Fokl функционирует как димер, требуя двух конструкций с уникальными ДНК-связывающими доменами для сайтов в геноме-мишени с правильной ориентацией и расстоянием. Количество аминокислотных остатков между ДНК-связывающим доменом TALE и доменом расщепления Fokl, а также количество оснований между двумя отдельными сайтами связывания TALEN, по-видимому, являются важными параметрами для достижения высоких уровней активности. Miller et al. (2011) Nature Biotech. 29: 143-8. TCR и/или HLA TALEN могут использоваться внутри ячейки для создания двухцепочечного разрыва (DSB). Мутация может быть введена в месте разрыва, если ремонтные механизмы неправильно восстанавливают разрыв через негомологичное соединение конца. Например, неправильное восстановление может привести к мутации со сдвигом рамки. Альтернативно, чужеродная ДНК может быть введена в клетку вместе с TALEN; в зависимости от последовательностей чужеродной ДНК и хромосомной последовательности этот процесс можно использовать для исправления дефекта в гене TCR и/или HLA или для введения такого дефекта в ген wt TCR и/или HLA, таким образом, уменьшая экспрессию TCR и/или HLA. TALEN, специфичные для последовательностей в TCR и/или HLA, могут быть созданы с использованием любого способа, известного в данной области техники, включая различные схемы с использованием модульных компонентов. Zhang et al. (2011) Nature Biotech. 29: 149-53; Geibler et al. (2011) PLoS ONE 6: el9509.
«ZFN» или «нуклеаза с доменом цинковые пальцы» или «ZFN для TCR и/или HLA» или «ZFN для ингибирования TCR и/или HLA» относятся к нуклеазе с доменом цинковые пальцы, искусственной нуклеазе, которую можно использовать для редактирования гена TCR и/или HLA. Как и TALEN, ZFN включает нуклеазный домен Fokl (или его производное), слитые с ДНК-связывающим доменом. В случае ZFN ДНК-связывающий домен включает один или несколько цинковых пальцев. Carroll et al. (2011) Genetics Society of America 188: 773-782; и Kim et al. (1996) Proc. Natl. Acad. Sci. USA 93: 1156-1160. Цинковый палец представляет собой небольшой структурный мотив белка, стабилизированный одним или несколькими ионами цинка. Цинковый палец может содержать, например, Cys2His2 и может распознавать последовательность длиной около 3 п.н. Различные цинковые пальцы известной специфичности могут быть объединены для получения полипептидов с несколькими пальцами, которые распознают последовательности длиной 6, 9, 12, 15 или 18 п.н. Доступны различные методы отбора и модульной сборки для создания цинковых пальцев (и их комбинаций), распознающих специфические последовательности, которые включают фаговый дисплей, дрожжевые однгибридные системы, бактериальные одногибридные и двухгибридные системы и клетки млекопитающих.
Как и TALEN, ZFN должен димеризоваться, чтобы расщеплять ДНК. Таким образом, для нацеливания на непалиндромные сайты ДНК необходима пара ZFN. Два отдельных ZFN должны связывать противоположные цепи ДНК с их нуклеазами, правильно расположенными друг относительно от друга. Bitinaite et al. (1998) Proc. Natl. Acad. Sci. USA 95: 10570-5. Также как TALEN, ZFN может создать двухцепочечный разрыв в ДНК, который может создавать мутацию со смещением рамки, при неправильной репарации, что приводит к снижению экспрессии и количества TCR и/или HLA в клетке. ZFN также можно использовать с гомологичной рекомбинацией для мутации в гене TCR и/или HLA. ZFN, специфичные для последовательностей в TCR и/или HLA, могут быть сконструированы с использованием любого способа, известного в данной области. См., Например, Provasi (2011) Nature Med. 18: 807-815; Torikai (2013) Blood 122: 1341-1349; Cathomen et al. (2008) Mol. Ther. 16: 1200-7; Quo et al. (2010)/.Mol. Biol. 400: 96; US2011/0158957; и US2012/0060230.
«Мегануклеаза» или «мегануклеаза для TCR и/или HLA» или «мегануклеаза для ингибирования TCR и/или HLA» относится к мономерной эндонуклеазе с большими (> 14 пар оснований) сайтами распознавания, которые можно использовать для редактирования гена TCR и/или HLA. Мегануклеазы (mn) представляют собой мономерные белки с естественной нуклеазной активностью, которые получены из бактериальных хоминг- эндонуклеаз и сконструированы для уникального сайта-мишени. Хоминг-эндонуклеазы являются ДНК-расщепляющими ферментами, которые могут генерировать двухцепочечные разрывы в отдельных локусах в своих геномах-хозяевах и, таким образом, управлять сайт-специфическими событиями конверсии генов. (Stoddard, Structure. 2011 Jan 12;19(1):7-15). Несмотря на их небольшой размер, хоминг-эндонуклеазы распознают длинные последовательности ДНК (обычно от 20 до 30 пар оснований). Хоминг-эндонуклеазы чрезвычайно распространены и обнаружены в микробах, а также в фагах и вирусах. Бокс-ферменты LAGLIDADG и His-Cys (которые являются наиболее специфичными для последовательности из этих ферментов) зависят от антипараллельных β-листов, которые закрепляются в основных бороздках ДНК их сайтов-мишеней (Flick et al., 1998; Jurica et al., 1998). Там они происходит установление массива специфичных для последовательности и неспецифических контактов, которые распределены неравномерно по нескольким последовательным базовым парам (Chevalier et al., 2003; Scalley-Kim et al., 2007).
Семейство хоминг-эндонуклеаз LAGLIDADG (LHE) является основным источником сконструированных ферментов, используемых в приложениях для направленного воздействия на гены. Семейство LHE в основном кодируется в археях и в хлоропластных и митохондриальных геномах водорослей и грибов (Chevalier et al., 2005; Dalgaard et al., 1997; Sethuraman et al., 2009). Мегануклеазы, которые обладают одним консервативным мотивом LAGLIDADG (SEQ ID NO: 85) на цепь белка, образуют гомодимерные белки, которые расщепляют последовательности-мишени палиндромной и почти палиндромной ДНК, тогда как мегануклеазы, которые содержат два таких мотива на цепь белка, образуют более крупные псевдосимметричные мономеры, которые могут направленно воздействовать на полностью асимметричные последовательности ДНК.
Мегануклеазы могут быть сконструированы для направленного воздействия на TCR и/или HLA и, таким образом, создавать двухцепочечный разрыв в ДНК, который может создать мутацию со сдвигом рамки при неправильной репарации, что приводит к снижению экспрессии и количеству TCR и/или HLA в клетке.
«MegaTAL» или «megaTAL для TCR и/или HLA» или «megaTAL для ингибирования TCR и/или HLA» относится к искусственной нуклеазе, которую можно использовать для редактирования гена TCR и/или HLA. MegaTAL представляют собой гибридные мономерные нуклеазы, полученные путем слияния минимальных TAL (подобных активатору транскрипции) эффекторных доменов с N-концом мегануклеаз, происходящих из семейства хоминг-эндонуклеаз LAGLIDADG (Nucleic Acids Res. 2014 Feb;42(4):2591-601; Takeuchi et al, Methods Mol Biol. 2015;1239:105-32. doi: 10.1007/978-1-4939-1862-1_6). MegaTAL, таким образом, состоят из сайт-специфической головки расщепления мегануклеазой с дополнительной аффинностью и специфичностью, обеспечиваемой связывающим доменом эффекторной ДНК TAL. MegaTAL могут быть сконструированы так, чтобы нацеливаться на TCR и/или HLA и, таким образом, создавать двухцепочечный разрыв в ДНК, который может создать мутацию со сдвигом рамки при неправильной репарации, что приведет к снижению экспрессии и количества HLA в клетке. Вариант мегануклеазы I-OnuI (mn) использовали для конструирования TCRα-megaTAL для нокаута гена T-клеточного рецептора альфа (TCRα). TCRα mn слили с массивом из 10,5-повторов TALE, предназначенным для связывания последовательности ДНК перед сайтом связывания TCRα mn. Было обнаружено, что megaTAL, нацеленный на TCRα, достигал чрезвычайно высокого разрушения гена без заметного расщепления вне цели в первичных Т-клетках человека (Boissel et al, Nucleic Acids Res. 2014 Feb;42(4):2591-601).
Не желая быть связанными какой-либо конкретной теорией, полагаем, что в некоторых воплощениях терапевтическая Т-клетка имеет кратковременное постоянство у пациента вследствие укороченных теломер в Т-клетке; соответственно, трансфекция геном теломеразы может удлинить теломеры Т-клетки и улучшить устойчивость Т-клетки у пациента. См. Carl June, "Adoptive T cell therapy for cancer in the clinic", Journal of Clinical Investigation, 117: 1466-1476 (2007). Таким образом, в одном воплощении генетически модифицированная иммунная клетка по изобретению эктопически экспрессирует субъединицу теломеразы, например, каталитическую субъединицу теломеразы, например, TERT, например, hTERT. В некоторых аспектах это раскрытие относится к способу получения CAR-экспрессирующей иммунной клетки, включающему контактирование иммунной клетки с нуклеиновой кислотой, кодирующей субъединицу теломеразы, например, каталитическую субъединицу теломеразы, например, TERT, например, hTERT. Клетка может контактировать с нуклеиновой кислотой до, одновременно или после контакта с конструкцией, кодирующей CAR.
Другим объектом изобретения является композиция, включающая, состоящая или состоящая по существу, по меньшей мере, из одной иммунной клетки или популяции по изобретению.
В одном воплощении указанная композиция содержит, состоит или состоит по существу, по меньшей мере, из одной выделенной и/или по существу очищенной популяции иммунных клеток по изобретению.
В одном воплощении указанная композиция была заморожена и разморожена.
Другим объектом изобретения является фармацевтическая композиция, содержащая, состоящая или состоящая, по существу, из, по меньшей мере, одной иммунной клетки или популяции, как описано выше, и, по меньшей мере, одного фармацевтически приемлемого наполнителя.
Другим объектом изобретения является лекарственное средство, содержащее, состоящее или состоящее по существу из, по меньшей мере, одной популяции иммунных клеток, как описано выше.
В одном воплощении фармацевтическая композиция или лекарственное средство включает выделенную и/или по существу очищенную популяцию иммунных клеток по изобретению.
Используемый в данном документе термин «состоящий по существу из» в отношении фармацевтической композиции или лекарственного средства означает, что, по меньшей мере, одна иммунная клетка или популяция по изобретению является единственным терапевтическим агентом или агентом, обладающим биологической активностью в указанной фармацевтической композиции или медикаменте.
Такие композиции и лекарственные средства могут содержать буферы, такие как физиологический раствор с нейтральным буфером, физиологический раствор с фосфатным буфером и т.п.; углеводы, такие как глюкоза, манноза, сахароза или декстран, маннит; белки; полипептиды или аминокислоты, такие как глицин; антиоксиданты; хелатирующие агенты, такие как EDTA или глутатион; адъюванты (например, гидроксид алюминия); и консерванты.
Введение композиций может осуществляться любым удобным способом, включая вдыхание аэрозоля, инъекцию, прием внутрь, переливание, имплантацию или трансплантацию. Композиции, описанные в данном документе, могут быть введены пациенту трансартериально, подкожно, внутрикожно, внутриопухолево, интранодально, интрамедуллярно, внутримышечно, внутривенной инъекцией (в/в) или внутрибрюшинно. В одном аспекте композиции иммунных клеток по настоящему изобретению вводят пациенту путем внутрикожной или подкожной инъекции.
В одном воплощении, по меньшей мере, одну иммунную клетку или популяцию по настоящему изобретению вводят внутривенной инъекцией.
Композиции по настоящему изобретению, таким образом, в одном варианте составлены для внутривенного введения.
В одном воплощении сконструированная иммунная клетка по изобретению может использоваться в качестве средства для рекрутирования указанной иммунной клетки в сайты специфического иммунного или воспалительного ответа и для активации иммунной клетки для подавления иммунологической активности иммунных эффекторных клеток в этих сайтах. Таким образом, CAR-опосредованный рекрутинг и активация иммунных клеток может, таким образом, обеспечить способ предотвращения или лечения ряда иммунологических заболеваний или нарушений, для которых такая иммуносупрессивная активность является полезной.
В одном воплощении иммунная клетка представляет собой регуляторную иммунную клетку, как описано выше, предпочтительно выбранную из группы, состоящей из регуляторной T-клетки, CD4+ регуляторной T-клетки, CD8+ регуляторной T-клетки, регуляторной γδ T-клетки, регуляторной DN T-клетки, регуляторной B-клетки, a регуляторной NK-клетки, регуляторного макрофага, регуляторной дендритной клетки и любой их комбинации.
В одном воплощении иммунная клетка представляет собой регуляторную Т-клетку. Хотя активация регуляторных Т-клеток является антиген-зависимой, подавляющее действие этих клеток не зависит от антигена, TCR и MHC. Соответственно, экспрессия CAR в регуляторных T-клетках перенаправляет эти клетки и их активацию в соответствующую ткань-мишень, так что они активируются антигенспецифическим образом; однако их супрессирующие эффекты происходят без необходимости дальнейшего распознавания антигенов, связанных с заболеванием. Следовательно, до тех пор, пока регуляторные Т-клетки находятся в правильной близости от того места, где находятся иммунные эффекторные клетки и опосредуют их нежелательные эффекты, перенаправленные регуляторные Т-клетки могут запускаться или активироваться в этом месте для обеспечения их супрессирующих эффектов.
В одном воплощении целевой антиген HLA-A2 может присутствовать или экспрессироваться в сайте или ткани-мишени нежелательного иммунного или воспалительного ответа, опосредованного иммунными эффекторными клетками.
В одном воплощении иммунные клетки, сконструированные с помощью CAR по изобретению можно использовать для лечения одного или нескольких заболеваний, расстройств, симптомов или состояний, связанных с трансплантацией органа или ткани (например, отторжение/дисфункция органа или ткани, GVHD и/или связанные с этим условия). Отторжение трансплантата включает разрушение трансплантированной ткани донора иммунными клетками реципиента посредством иммунного ответа. Иммунный ответ также участвует в GVHD; однако в этом случае ткани реципиента разрушаются иммунными клетками донора, переданными реципиенту посредством трансплантации. Соответственно, CAR-обусловленное перенаправление и активация иммунных клеток обеспечивают способ подавления отторжения несоответствующих клеток и/или тканей иммунными эффекторными клетками у реципиентов трансплантата или ингибирования патогенного действия трансплантированных иммунокомпетентных клеток в случае GVHD. В одном воплощении несоответствующие клетки и/или ткани содержат клетки и/или ткани, несоответствующие по HLA-A2.
Таким образом, другим объектом настоящего изобретения является способ лечения одного или нескольких заболеваний, расстройств, симптомов или состояний, связанных с трансплантацией органа или ткани (например, отторжения/дисфункции органа или ткани, GVHD и/или состояний, связанных с ними) объекту, где указанный способ включает введение объекту сконструированной иммунной клетки с CAR или композиции, как описано в настоящем документе.
В одном воплощении способ представляет собой способ клеточной терапии. В одном воплощении клеточная терапия является аутологичной. В одном воплощении клеточная терапия является гетерологичной. В одном воплощении клеточная терапия является аллогенной. В одном воплощении способ представляет собой способ генной терапии.
Таким образом, другим объектом настоящего изобретения является иммунная клетка, сконструированная с помощью CAR, или композиция, описанная в настоящем документе, для применения при лечении одного или нескольких заболеваний, расстройств, симптомов или состояний, связанных с трансплантацией органа или ткани (например, отторжение/дисфункция органа или ткани, GVHD и/или связанные с ним состояния) у объекта.
Модифицированные с помощью CAR иммунные клетки по настоящему изобретению могут дополнительно использоваться для стимуляции иммунной толерантности, функциональной толерантности и/или иммунной аккомодации у объекта, в частности, после трансплантации органа или ткани.
Таким образом, другим объектом настоящего изобретения является способ стимулирования иммунной толерантности, функциональной толерантности и/или иммунной аккомодации у объекта, способ, включающий введение объекту иммунной клетки, сконструированной с помощью CAR, или фармацевтической композиции, как описано в настоящем документе. В одном воплощении способ может быть предназначен для стимулирования иммунной толерантности, функциональной толерантности и/или иммунной аккомодации к трансплантированному органу или ткани у объекта.
В одном воплощении изобретения Иммунная клетка, сконструированная с помощью CAR, (предпочтительно Treg-клетка, сконструированная с помощью CAR) по изобретению вводится в то же время, до, или после трансплантации органа или ткани.
В одном воплощении иммунные клетки, сконструированные с помощью CAR (предпочтительно Treg-клетки, сконструированные с помощью CAR) по настоящему изобретению можно использовать для предотвращения или лечения отторжения трансплантированного органа или ткани. Примеры отторжения пересаженного органа или ткани включают, без ограничения указанным, сверхострое отторжение пересаженного органа или ткани и опосредованное антителами отторжение пересаженного органа или ткани.
В одном воплощении способ по изобретению включает введение Иммунных клеток, сконструированных с помощью CAR (Treg-клеток, сконструированных с помощью CAR) по настоящему изобретению объекту, подвергающемуся воздействию трансплантированного органа или ткани.
В одном воплощении трансплантированные орган или ткань может включать трансплантацию костного мозга, трансплантацию органа, переливание крови или любую другую инородную ткань или клетку, которые целенаправленно вводятся объекту.
В одном воплощении иммунные клетки, сконструированные с помощью CAR (предпочтительно Treg-клетки, сконструированные с помощью CAR) по настоящему изобретению можно использовать в качестве терапии для ингибирования отторжения трансплантата после трансплантации, включая, без ограничения указанным, отторжение аллотрансплантата или отторжение ксенотрансплантата.
Другим объектом изобретения является способ предотвращения или лечения отторжения трансплантата органа или ткани у объекта, включающий введение объекту иммунных клеток, сконструированных с помощью CAR (предпочтительно Treg-клеток, сконструированных с помощью CAR) по изобретению, или фармацевтической композиции, содержащей указанные иммунные клетки.
Таким образом, другим объектом настоящего изобретения является иммунная клетка, сконструированная с помощью CAR (предпочтительно Treg-клетка, сконструированная с помощью CAR) по изобретению, или фармацевтическая композиция, содержащая указанные иммунные клетки, для применения в профилактике или лечении отторжения трансплантата органа или ткани у объекта.
Другим объектом изобретения является способ увеличения периода выживания трансплантата у объекта, включающий введение объекту иммунных клеток, сконструированных с помощью CAR (предпочтительно Treg-клеток, сконструированных с помощью CAR) по настоящему изобретению, или фармацевтической композиции, включающей их.
В одном воплощении способ обеспечивает период выживания трансплантата, составляющий 1 неделю, 2 недели, 3 недели, 1 месяц, 2 месяца, 3 месяца, 4 месяца, 5 месяцев, 6 месяцев, 7 месяцев, 8 месяцев, 9 месяцев, 10 месяцев, 11 месяцев, 1 год, 2 года, 3 года, 4 года, 5 лет, 6 лет, 7 лет, 8 лет, 9 лет, 10 лет, 20 лет, 30 лет, 40 лет, 50 лет, 60 лет, 70 лет, 80 лет, 90 лет, 100 лет или все время жизни объекта.
В одном воплощении объект не подвергается какой-либо терапии иммуносупрессирующими агентами.
В одном воплощении введение иммунной клетки или композиции по изобретению позволяет снизить количество терапии иммуносупрессантом, получаемого объектом.
В одном воплощении трансплантат представляет собой аллотрансплантат. В одном воплощении трансплантат может подвергаться воздействию иммунных клеток, сконструированных с помощью CAR (предпочтительно Treg-клеток, сконструированных с помощью CAR) по настоящему изобретению, одновременно, до или после трансплантации трансплантата реципиенту. В одном воплощении трансплантат органа или ткани может представлять собой сердце, сердечный клапан, легкое, почку, печень, поджелудочную железу, кишечник, кожу, кровеносные сосуды, костный мозг, стволовые клетки, кости или островковые клетки. Однако изобретение не ограничено конкретным типом трансплантации.
В одном воплощении донорский трансплантат может быть «предварительно кондиционирован» или «предварительно обработан» путем обработки органа или тканевого трансплантата перед трансплантацией реципиенту иммунных клеток, сконструированных с помощью CAR по изобретению, чтобы снизить иммуногенность трансплантата против реципиента, тем самым уменьшая или предотвращая отторжение трансплантата.
В одном воплощении трансплантат хозяина или реципиента является HLA-A2-отрицательным. В одном воплощении трансплантат хозяина или реципиента является HLA-A2-отрицательным и является положительным для подтипа HLA-A, выбранного из группы, состоящей из HLA-A03, HLA-A11, HLA-A23, HLA-A25, HLA-A26, HLA -A29, HLA-A30, HLA-A31, HLA-A33 и HLA-A34. В одном воплощении трансплантат-хозяин или реципиент является HLA-A2-отрицательным и является положительным для подтипа HLA-A, выбранного из группы, состоящей из HLA-A25, HLA-A29 и HLA-A30.
В одном воплощении трансплантат является HLA-A2-положительным.
В одном воплощении иммунные клетки, сконструированные с помощью CAR (предпочтительно Treg-клетки, сконструированные с помощью CAR) по настоящему изобретению можно использовать для предотвращения или лечения болезни трансплантат против хозяина (GVHD). В одном воплощении способ включает введение иммунных клеток, сконструированных с помощью CAR (предпочтительно Treg-клеток, сконструированных с помощью CAR) по настоящему изобретению объекту, подвергающемуся воздействию трансплантированного органа или ткани. В одном воплощении трансплантированный орган или ткань может включать трансплантацию костного мозга, трансплантацию органа, переливание крови или любую другую инородную ткань или клетку, которые целенаправленно вводятся объекту. Например, GVHD может возникать после трансплантации сердца, сердечного клапана, легких, почек, печени, поджелудочной железы, кишечника, кожи, кровеносных сосудов, костного мозга, стволовых клеток, костей или островковых клеток. Однако изобретение не ограничено конкретным типом трансплантации.
В одном воплощении GVHD может возникать после трансплантации гемопоэтических стволовых клеток.
Таким образом, другим объектом изобретения является способ предотвращения или лечения болезни трансплантат против хозяина (GVHD) у объекта, включающий введение объекту иммунных клеток, сконструированных с помощью CAR (предпочтительно с помощью Treg-клеток, сконструированных с помощью CAR), или фармацевтической композиции в виде описано в данном документе.
В одном воплощении изобретение относится к способу контакта донорского трансплантата, например, биосовместимой сетки или донорской ткани, органа или клетки, с иммунными клетками, сконструированными с помощью CAR (предпочтительно с Treg-клетками, сконструированными с помощью CAR) по настоящему изобретению, одновременно, до или после пересадки трансплантата реципиенту.
В одном воплощении иммунные клетки, сконструированные с помощью CAR (предпочтительно Treg-клетки, сконструированные с помощью CAR) по настоящему изобретению можно использовать для ослабления, ингибирования или снижения неблагоприятного ответа донорского трансплантата против реципиента, таким образом, предотвращая или подвергая лечению GVHD.
Таким образом, другой целью настоящего изобретения является способ предотвращения или отсрочки возникновения GVHD у объекта, причем способ включает введение объекту иммунных клеток, сконструированных с помощью CAR (предпочтительно Treg-клеток, сконструированных с помощью CAR), или фармацевтической композиции, как описано в данном документе.
В одном воплощении начало GVHD задерживается на 1 неделю, 2 недели, 3 недели, 1 месяц, 2 месяца, 3 месяца, 4 месяца, 5 месяцев, 6 месяцев, 7 месяцев, 8 месяцев, 9 месяцев, 10 месяцев, 11 месяцев, 1 год, 2 года, 3 года, 4 года, 5 лет, 6 лет, 7 лет, 8 лет, 9 лет, 10 лет, 20 лет, 30 лет, 40 лет, 50 лет, 60 лет, 70 лет, 80 лет, 90 лет, 100 лет или на все время жизни объекта.
В одном воплощении объект не подвергается какой-либо терапии иммуносупрессирующими агентами.
В одном воплощении объект подвергается иммуносупрессирующей терапии. В одном воплощении иммунные клетки по изобретению вводят объекту с целью уменьшения терапевтически эффективного количества указанной иммуносупрессирующей терапии.
В одном воплощении GVHD может быть острой GVHD или хронической GVHD.
В одном воплощении донорский трансплантат может быть «предварительно кондиционирован» или «предварительно обработан» путем обработки трансплантата перед трансплантацией реципиенту иммунными клетками, сконструированными с помощью CAR (предпочтительно Treg-клетками, сконструированными с помощью CAR) по изобретению для снижения иммуногенности трансплантата против реципиента, тем самым уменьшая или предотвращая GVHD. В одном воплощении трансплантат может контактировать с клетками или тканью реципиента до трансплантации, чтобы активировать Т-клетки, которые могут быть связаны с трансплантатом. После обработки трансплантата клетками или тканью реципиента клетки или ткани могут быть удалены из трансплантата. Затем обработанный трансплантат может быть далее приведен в контакт с иммунными клетками, сконструированными с помощью CAR (предпочтительно с Treg-клетками, сконструированными с помощью CAR) по настоящему изобретению, чтобы снизить, ингибировать или устранить активность иммунных эффекторных клеток, которые были активированы при обработке клеток или ткани из реципиента. После этой обработки трансплантата с помощью сконструированных с помощью CAR иммунных клеток (предпочтительно Treg-клеток, сконструированных с помощью CAR) по настоящему изобретению иммунные клетки, модифицированные с помощью CAR, могут быть удалены из трансплантата до трансплантации реципиенту. Однако некоторые иммунные клетки, сконструированные с помощью CAR (например, Treg-клетки, сконструированные с помощью CAR) могут прилипать к трансплантату и, следовательно, могут вводиться реципиенту с помощью трансплантата. В этой ситуации, иммунные клетки, сконструированные с помощью CAR (например, Treg-клетки, сконструированные с помощью CAR), введенные реципиенту, могут подавлять иммунный ответ против реципиента, вызванный клеткой, связанной с трансплантатом.
В одном воплощении трансплантат хозяина или реципиента является HLA-A2-отрицательным. В одном воплощении трансплантат хозяина или реципиента является HLA-A2-отрицательным и является положительным для подтипа HLA-A, выбранного из группы, состоящей из HLA-A03, HLA-A11, HLA-A23, HLA-A25, HLA-A26, HLA -A29, HLA-A30, HLA-A31, HLA-A33 и HLA-A34. В одном воплощении трансплантат-хозяин или реципиент является HLA-A2-отрицательным и является положительным для подтипа HLA-A, выбранного из группы, состоящей из HLA-A25, HLA-A29 и HLA-A30.
В одном воплощении трансплантат является HLA-A2-положительным.
Другим объектом изобретения является способ увеличения популяции иммунных клеток у объекта, где иммунные клетки модифицированы для экспрессии химерного антигенного рецептора (CAR) по изобретению, причем способ включает введение объекту сконструированной иммунной клетки, описанной где-либо в данном документе, где введенные сконструированные иммунные клетки продуцируют потомственную популяцию иммунных клеток у объекта.
В одном воплощении иммунная клетка представляет собой регуляторную иммунную клетку, предпочтительно выбранную из группы, включающей регуляторные T-клетки, CD4+ регуляторные T-клетки, CD8+ регуляторные T-клетки, регуляторные γδ T-клетки, регуляторные DN T-клетки, регуляторные B-клетки, регуляторные NK-клетки, регуляторные макрофаги, регуляторные дендритные клетки и любую их комбинацию, а более предпочтительно регуляторные Т-клетки.
В одном воплощении сконструированные с помощью CAR Treg-клетки по настоящему изобретению способны реплицироваться in vivo, что приводит к длительной персистенции, которая может привести к длительному подавлению иммунного ответа клетки-мишени и иммунной толерантности.
Таким образом, другим объектом настоящего изобретения является способ создания персистирующей популяции регуляторных Т-клеток у объекта, где регуляторные Т-клетки модифицированы для экспрессии химерного антигенного рецептора (CAR) по изобретению, причем способ включает введение объекту регуляторных Т-клеток, как описано в данном документе, где персистирующая популяция модифицированных регуляторных Т-клеток сохраняется у объекта в течение, по меньшей мере, 1 дня, 2 дней, 3 дней, 4 дней, 5 дней, 6 дней, 7 дней, 8 дней, 9 дней, 10 дней, 11 дней, 12 дней, 13 дней, 14 дней, 15 дней, 16 дней, 17 дней, 18 дней, 19 дней, 20 дней, 30 дней, 40 дней, 50 дней, 60 дней, 70 дней, 80 дни, 90 дней, 100 дней, 200 дней, 300 дней, 400 дней, 500 дней, 600 дней, 700 дней, 800 дней, 900 дней или 1000 дней после введения.
В одном воплощении CAR-Treg-клетки по изобретению могут быть способны к самообновлению и повторной активации in vivo для подавления иммунного ответа клетки-мишени. В одном воплощении CAR-Treg-клетки могут представлять собой CAR-Treg-клетки с памятью, которые можно повторно активировать для подавления иммунного ответа клетки-мишени.
Иммунные клетки могут быть получены из любого источника. Например, в одном воплощении иммунные клетки могут быть получены от донора ткани, реципиента трансплантата или иного неродственного источника (другого индивидуума или вида в целом) для получения модифицированных с помощью CAR иммунных клеток по настоящему изобретению. Соответственно, модифицированные с помощью CAR иммунные клетки по настоящему изобретению могут быть аутологичными, аллогенными или ксеногенными для реципиента трансплантата или иным образом не связанным источником. В одном воплощении CAR-Treg-клетки по настоящему изобретению могут быть аутологичными, аллогенными или ксеногенными для реципиента трансплантата. В одном воплощении CAR-Treg-клетки по настоящему изобретению могут быть аутологичными для реципиента трансплантата.
В одном воплощении объект может быть млекопитающим. В одном воплощении объектом может быть человеком.
В одном воплощении может быть желательным вводить активированные Т-клетки объекту, а затем впоследствии повторно отбирать кровь (или проводить аферез), активировать из нее Т-клетки согласно настоящему изобретению и повторно вводить объекту эти активированные и размноженные Т-клетки. Этот процесс может выполняться несколько раз каждые несколько недель. В некоторых воплощениях Т-клетки могут быть активированы при заборе крови от 10 до 400 см3. В некоторых воплощениях Т-клетки активируются при заборе крови объемом 20 см3, 30 см3, 40 см3, 50 см3, 60 см3, 70 см3, 80 см3, 90 см3 или 100 см3. Не желая быть связанными теорией, полагаем, что применение этого протокола множественного забора крови/множественной реинфузии может служить для отбора определенных популяций Т-клеток.
Сконструированные с помощью CAR иммунные клетки по настоящему изобретению можно вводить либо отдельно, либо в виде фармацевтической композиции в комбинации с разбавителями и/или с другими компонентами, включая, без ограничения указанным, IL-2 или другие цитокины или клеточные популяции.
В одном воплощении фармацевтические композиции по настоящему изобретению могут содержать сконструированные CAR иммунные клетки или клеточную популяцию, как описано в данном документе в любом месте, в комбинации с одним или несколькими фармацевтически или физиологически приемлемыми носителями, разбавителями или наполнителями. Такие композиции могут включать буферы, например, нейтральный буферный физиологический раствор, фосфатно-солевой буферный раствор и т.п.; углеводы, такие как глюкоза, манноза, сахароза или декстраны, маннит; белки; полипептиды или аминокислоты, такие как глицин; антиоксиданты; хелатирующие агенты, такие как EDTA или глутатион; адъюванты (например, гидроксид алюминия); и консерванты.
Фармацевтические композиции по настоящему изобретению можно вводить объекту любым подходящим способом, включая вдыхание аэрозоля, инъекцию, прием внутрь, переливание, имплантацию или трансплантацию. Фармацевтические композиции, описанные в данном документе, могут быть введены объекту путем парентерального введения. Фармацевтические композиции, описанные в данном документе, могут быть введены объекту подкожно, внутрикожно, внутриопухолево, интранодально, интрамедуллярно, внутримышечно, интрастернально, внутривенно (в/в) инъекцией, методами инфузии или внутрибрюшинно. В одном воплощении композиции модифицированных с помощью CAR иммунных клеток по настоящему изобретению можно вводить объекту путем внутрикожной или подкожной инъекции. В другом воплощении композиции CAR-модифицированных иммунных клеток по настоящему изобретению можно вводить внутривенной инъекцией. В одном воплощении композиции модифицированных с помощью CAR иммунных клеток могут быть инъецированы непосредственно в лимфатический узел, сайт инфекции, сайт воспаления или сайт отторжения ткани или органа.
Фармацевтические композиции по настоящему изобретению можно вводить способом, подходящим для предотвращения или лечения заболевания. Количество и частота введения будут определяться такими факторами, как состояние объекта, а также тип и тяжесть заболевания объекта, хотя соответствующие дозы могут быть определены клиническими испытаниями.
Когда указано «эффективное количество» или «терапевтическое количество», точное количество композиций по настоящему изобретению для введения может быть определено с учетом индивидуальных различий в возрасте, массе, титре антител и состоянии объекта. Как правило, можно утверждать, что фармацевтическую композицию, содержащую сконструированные с помощью CAR иммунные клетки, как описано в данном документе, можно вводить в дозировке от 1 х 104 до 1 х 109 клеток/кг массы тела или от 1 х 105 до 100 х 105 клеток/кг массы тела, включая все целочисленные значения в этих диапазонах. Композиции иммунных клеток, сконструированных с помощью CAR, также могут вводиться многократно в этих дозировках. Иммунные клетки, сконструированные с помощью CAR, можно вводить с использованием методов инфузии, которые обычно известны в иммунотерапии. Оптимальную дозировку и схему лечения для конкретного объекта можно легко определить путем мониторинга объекта на наличие признаков заболевания и соответствующей корректировки лечения.
В одном воплощении, по меньшей мере, одну сконструированную с помощью CAR иммунную клетку по изобретению вводят объекту, нуждающемуся в этом, в сочетании с другим активным агентом. Согласно одному воплощению, по меньшей мере, одну популяцию иммунных клеток вводят до, одновременно или после введения другого активного агента.
В одном воплощении сконструированные с помощью CAR иммунные клетки по настоящему изобретению могут вводиться объекту в сочетании (например, до, одновременно или после) с любым количеством подходящих способов лечения, включая, без ограничения указанным, лечение средствами, такими как противовирусные терапия, химиотерапия, облучение, иммуносупрессанты, антитела, иммуноаблативные агенты, цитокины и облучение.
В одном воплощении сконструированные с помощью CAR иммунные клетки по настоящему изобретению можно вводить в сочетании с иммуносупрессантом. Может быть использован любой иммуносупрессант, известный в данной области.
Примеры иммуносупрессантов включают, без ограничения указанным, ингибиторы кальциневрина, такие как циклоспорин, такролимус, азатиоприн, метотрексат, метоксален, рапамицин, микофенолат мофетил, микофеноловая кислота, микофенолат натрия, 6-меркаптопурин, 6-тиогуанин, ритуксимаб, ингибиторы mTOR, такие как сиролимус, эверолимус, базиликсимаб, даклизумаб, белатацепт, алемтузумаб, муромонаб-CD3, анти-тимоцитарный глобулин, глюкокортикостероиды или адренокортикальные стероиды, такие как пре-предолидон, или любую их комбинацию.
Иммунные клетки, сконструированные с помощью CAR, по настоящему изобретению можно вводить объекту до, после или одновременно с иммуносупрессантом.
Иммунные клетки, сконструированные с помощью CAR, по настоящему изобретению и/или иммуносупрессант могут быть введены объекту после трансплантации. Альтернативно или в дополнение, иммунные клетки, сконструированные с помощью CAR, по настоящему изобретению и/или иммуносупрессант могут быть введены объекту перед трансплантацией. Иммунные клетки, сконструированные с помощью CAR, по настоящему изобретению и/или иммуносупрессант могут быть введены объекту во время трансплантационной хирургии.
В одном воплощении способ по изобретению введения иммунных клеток, сконструированных с помощью CAR, объекту осуществляют после начала иммуносупрессивной терапии.
В некоторых воплощениях способ осуществляют более одного раза, например, для мониторинга реципиента трансплантата во времени и, если это применимо, в различных режимах иммуносупрессивной терапии.
В некоторых воплощениях иммуносупрессивная терапия снижается, если спрогнозировано, что реципиент трансплантата является толерантным к трансплантату. В некоторых воплощениях иммуносупрессивную терапию не назначают, например, иммуносупрессивную терапию прекращают, если спрогнозировано, что реципиент трансплантата будет толерантным к трансплантату.
Таким образом, настоящее изобретение, кроме того, относится к набору частей, включающему, в первую очередь, иммунную клетку или популяцию иммунных клеток по настоящему изобретению, а во второй части - другой активный агент, включая, без ограничений, противовирусную терапию, химиотерапию, лучевую терапию, иммуносупрессанты, антитела, иммуноаблативные агенты, цитокины и облучение. Предпочтительно, набор из части настоящего изобретения включает в первой части иммунную клетку или популяцию иммунных клеток по настоящему изобретению и во второй части один или несколько иммуносупрессантов.
В одном воплощении набор частей включает один или несколько реагентов (например, нуклеиновую кислоту или экспрессирующий вектор, кодирующий антитело против HLA-A*CAR по настоящему изобретению) для получения клеток по настоящему изобретению.
Примеры иммуносупрессантов включают, без ограничения указанным, ингибиторы кальциневрина, такие как циклоспорин, такролимус, азатиоприн, метотрексат, метоксален, рапамицин, микофенолат мофетил, микофеноловая кислота, микофенолат натрия, 6-меркаптопурин, 6-тиогуанин, ритуксимаб, ингибиторы mTOR, такие как сиролимус, эверолимус, базиликсимаб, даклизумаб, белатацепт, алемтузумаб, муромонаб-CD3, анти-тимоцитарный глобулин, глюкокортикостероиды или адренокортикальные стероиды, такие как пре-предолидон, или любую их комбинацию.
Другим объектом изобретения является способ предотвращения или лечения отторжения трансплантата органа или ткани у объекта, включающий введение объекту (i), по меньшей мере, одного иммуносупрессирующего агента и (ii) иммунных клеток, сконструированных с помощью CAR (предпочтительно Treg-клеток, сконструированных с помощью CAR) по изобретению или фармацевтическую композицию, содержащую указанные иммунные клетки.
Таким образом, другим объектом настоящего изобретения является комбинация иммунной клетки, сконструированной с помощью CAR (предпочтительно Treg-клетки, сконструированной с помощью CAR) по изобретению или фармацевтической композиции, содержащей указанные иммунные клетки, и, по меньшей мере, одного иммуносупрессивного агента для применения в предотвращении или лечении отторжения трансплантата органа или ткани у объекта.
Другим объектом изобретения является способ увеличения периода выживания трансплантата у объекта, включающий введение объекту, по меньшей мере, одного иммуносупрессирующего агента и иммунных клеток, сконструированных с помощью CAR (предпочтительно Treg-клеток, сконструированных с помощью CAR) по настоящему изобретению, или фармацевтической композиции, содержащей их.
В одном воплощении комбинация, по меньшей мере, одного иммуносупрессивного агента с иммунными клетками, сконструированными с помощью CAR (предпочтительно Treg-клетками, сконструированными с помощью CAR) по настоящему изобретению используется для предотвращения или лечения болезни трансплантат против хозяина (GVHD).
В одном воплощении GVHD может возникать после трансплантации гемопоэтических стволовых клеток.
Таким образом, другим объектом изобретения является способ предотвращения или лечения болезни трансплантат против хозяина (GVHD) у объекта, включающий введение объекту, по меньшей мере, одного иммуносупрессивного агента и иммунных клеток, сконструированных с помощью CAR (предпочтительно Treg-клеток, сконструированных с помощью CAR) или фармацевтической композиции, как описано в данном документе.
В одном воплощении изобретение относится к способу контакта донорского трансплантата, например, биосовместимой сетки или донорской ткани, органа или клетки, по меньшей мере, с одним иммуносупрессивным агентом и с иммунными клетками, сконструированными с помощью CAR (предпочтительно с Treg-клетками, сконструированными с помощью CAR) по настоящему изобретению, одновременно, до или после пересадки трансплантата реципиенту.
В одном воплощении комбинация, по меньшей мере, одного иммуносупрессивного агента с иммунными клетками, сконструированными с помощью CAR (предпочтительно Treg-клетками, сконструированными с помощью CAR) по настоящему изобретению можно использовать для ослабления, ингибирования или снижения неблагоприятного ответа донорского трансплантата против реципиента, таким образом, предотвращая или подвергая лечению GVHD.
Таким образом, другим объектом настоящего изобретения является способ предотвращения или отсрочки возникновения GVHD у объекта, включающий введение объекту, по меньшей мере, одного иммуносупрессирующего агента и иммунных клеток, сконструированных с помощью CAR (предпочтительно Treg-клеток, сконструированных с помощью CAR), или фармацевтической композиции, как описано в данном документе.
В одном воплощении иммунные клетки, сконструированные с помощью CAR, по изобретению и, по меньшей мере, один иммуносупрессивный агент вводят одновременно или последовательно.
В одном воплощении иммунные клетки, сконструированные с помощью CAR, по настоящему изобретению и, необязательно, по меньшей мере, один другой активный агент, предпочтительно иммуносупрессивный агент, вводят в сочетании с (например, до, одновременно или после) трансплантатом.
Иммунные клетки, сконструированные с помощью CAR, по настоящему изобретению можно вводить после диагностики отторжения органа или ткани трансплантата с последующими дозами как сконструированных с помощью CAR иммунных клеток по изобретению, так и иммуносупрессирующего агента до тех пор, пока симптомы отторжения органа или ткани не исчезнут.
В дополнительном воплощении композиции иммунных клеток, сконструированных с помощью CAR, по настоящему изобретению могут вводиться объекту в сочетании (например, до, одновременно или после) трансплантации костного мозга.
В другом воплощении иммунные клетки, сконструированные с помощью CAR, по настоящему изобретению можно вводить после абляционной терапии B-клетками, например, агентами, которые реагируют с CD20, например, ритуксимабом. Например, в одном воплощении объекты могут проходить стандартное лечение химиотерапией с высокой дозой с последующей трансплантацией стволовых клеток периферической крови. В определенных воплощениях после трансплантации объекты могут получать инфузию размноженных иммунных клеток, сконструированных с помощью CAR, по настоящему изобретению. В дополнительном воплощении размноженные иммунные клетки, сконструированные с помощью CAR, можно вводить до или после операции.
В одном воплощении объект (например, человек) получает начальное введение, по меньшей мере, одной иммунной клетки или популяции по изобретению и одного или несколько последующих введений, при этом одно или несколько последующих введений вводят менее чем за 15 дней, например, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3 или 2 дня после предыдущего введения.
В одном воплощении терапевтически эффективное количество иммунных клеток по изобретению вводят или подлежат введению объекту.
В одном воплощении количество иммунных клеток, по меньшей мере, одной популяции иммунных клеток по изобретению, вводимых объекту, составляет, по меньшей мере, 102, 103, 104, 105, 106, 107, 108 или 109 клеток.
В одном воплощении количество иммунных клеток по изобретению, вводимых объекту, составляет от около 102 до около 109, от около 103 до около 108, от около 104 до около 107 или от около 105 до около 106 клеток.
В другом воплощении количество иммунных клеток по изобретению, вводимых объекту, составляет от около 106 до около 109, от около 106 до 107, от около 106 до 108, от около 107 до 109, от около 107 до 108, от около 108 до 109. В другом воплощении количество иммунных клеток по изобретению, вводимых объекту, составляет около 106, около 107, около 108 или около 109.
В одном воплощении количество иммунных клеток, по меньшей мере, одной популяции иммунных клеток по изобретению, вводимых объекту, составляет, по меньшей мере, 1102, 103, 104, 105, 106, 107, 108 или 109 клеток/кг тела.
В одном воплощении количество иммунных клеток по изобретению, вводимых объекту, составляет от около 104 до 109 клеток/кг массы тела или от 105 до 108 клеток/кг массы тела, включая все целочисленные значения в этих диапазонах.
В одном воплощении объекту (например, человеку) вводят более одного введения, по меньшей мере, одной иммунной клетки или популяции по изобретению в неделю, например, проводят 2, 3 или 4 введения генетически модифицированной иммунной клетки или популяции по изобретению в неделю.
Другим объектом настоящего изобретения является изделие, содержащее материалы, полезные для профилактики и/или лечения отторжения трансплантата или GVHD.
Изделие может содержать контейнер и этикетку или вкладыш в упаковку или на контейнере. Подходящие контейнеры включают, например, бутылки, флаконы, шприцы и т.д. Контейнеры могут быть изготовлены из различных материалов, таких как стекло или пластик. Контейнер включает композицию, которая эффективна для предотвращения и/или лечения иммунологического состояния, такого как отторжение трансплантата или GVHD, и может иметь стерильное отверстие для доступа (например, контейнер может представлять собой мешок для внутривенного раствора или флакон с пробкой, пригодной для прокалывания иглой для подкожных инъекций). По меньшей мере, один активный агент в композиции представляет собой иммунную клетку, сконструированную с помощью CAR, по настоящему изобретению, предпочтительно Treg, сконструированную с помощью CAR.
Этикетка или вкладыш в упаковку могут указывать, что композиция используется для предотвращения или лечения отторжения трансплантата или GVHD.
Изделие, этикетка или вкладыш в упаковку могут дополнительно содержать инструкции для введения композиции иммунных клеток, сконструированных с помощью CAR, пациенту. Кроме того, изделие может дополнительно содержать второй контейнер, содержащий фармацевтически приемлемый буфер, такой как бактериостатическая вода для инъекций (BWFI), фосфатно-солевой буферный раствор, раствор Рингера и раствор декстрозы. Кроме того, он может включать другие материалы, желательные с коммерческой и пользовательской точки зрения, включая другие буферы, разбавители, фильтры, иглы и шприцы.
Также предоставляются наборы, которые полезны для различных целей (например, для предотвращения или лечения отторжения трансплантата или GVHD). Могут быть предоставлены наборы, которые содержат иммунные клетки, сконструированные с помощью CAR. Как и в случае с изделием, набор может содержать контейнер и этикетку или вкладыш в упаковку или связанный с контейнером. Контейнер включает композицию, содержащую, по меньшей мере, одну иммунную клетку, сконструированную с помощью CAR, предпочтительно Treg, сконструированную с помощью CAR, по настоящему изобретению. Могут быть включены дополнительные контейнеры, которые содержат, например, разбавители и буферы. Этикетка или вкладыш в упаковку могут содержать описание композиции, а также инструкции по предполагаемому применению.
Краткое описание чертежей
Фиг.1 представляет собой комбинацию графиков, показывающих перекрестную реактивность анти-HLA-A2 CAR-конструкции по изобретению с обычными аллельными вариантами HLA-A*HLA-B. Клетки GFP + Treg, экспрессирующие конструкцию CAR по изобретению (или мышиную конструкцию анти-HLA-A2 CAR), инкубировали с гранулами Flow Panel Reactive Single Antigen и фиксируемым красителем для оценки жизнеспособности в течение 30 минут при комнатной температуре. Затем образцы промывали, фиксировали и анализировали с помощью проточной цитометрии. Данные анализировали, как описано в методах. Данные в А и В показывают процент связывания относительно контрольных Treg-клеток, экспрессирующих только GFP, нормализованных по количеству отрицательных по HLA гранул, собранных цитометром. Точки данных над линией представляют значения, которые отличались более чем на два стандартных отклонения от среднего значения контроля только с гранулами и, таким образом, статистически значимы (р <0,05). Данные являются усреднением двух независимых экспериментов. Среднее ± SEM.
ПРИМЕРЫ
Настоящее изобретение дополнительно иллюстрируется следующими примерами.
Пример 1:
Материалы и методы
Получение гуманизированных HLA-A2-специфических scFv. Последовательность для HLA-A2-специфичного scFv была получена из последовательности, раскрытой в заявке на патент US2013/0078243 A1. Оптимизированные по кодонам генные последовательности, кодирующие гуманизированный scFv, были синтезированы GeneArt, Life Technologies (Регенсбург) как «Strings» с использованием алгоритма оптимизации кодонов, предоставленного поставщиком. ScFv были фланкированы с N-конца последовательностью Kozak и сигнальной последовательностью CD8. Конструкции были дополнительно фланкированы сайтами рестрикции BamHI и MfeI, которые позволяли клонировать в рамке считывания область шарнира CD8 самоинактивирующейся лентивирусной плазмиды, экспрессирующей CAR. Управляемая PGK-промотором CAR-экспрессирующая плазмида, содержала шарнир CD8 человека и трансмембранный домен CD8, за которым следует внутриклеточный костимулирующий домен 41BB человека, слитый с CD3ζ человека. За последовательностью CAR репортерный белок EGFP был соединен в рамке считывания через саморасщепляемый 2A-сайт для обнаружения переноса гена в клетках.
Получение HLA-A2-CAR. Вирусные векторы были получены путем временной трансфекции на основе полиэтиленимина в клетках HEK 293T с использованием упаковочных плазмид 3-го поколения (Trono lab, EPFL (École polytechnique fédérale de Lausanne)).
Jurkat NFAT. Линии репортерных клеток Jurkat-Lucia NFAT культивировали в RPMI (Gibco, Life technologies) с добавлением 10% фетальной сыворотки теленка. Клетки трансдуцировали с использованием инкубации при различных концентрациях вирусных векторов для достижения 30-50% трансдукции, чтобы избежать множественных интеграций векторов. Экспрессия и презентация правильно свернутых CAR были продемонстрированы связыванием с APC-конъюгированным HLA-A2-мультимером (Dextramer, WB2666, Immudex; Копенгаген, Дания). Активация через CAR была достигнута путем совмещения HLA-A2-специфических CAR с HLA-A2-положительными или HLA-A2-отрицательными клеточными линиями. Секрецию люциферазы в зависимости от активации NFAT в среде анализировали на люминометре (Glowmax, Promega) с использованием субстрата QUANTI-Luc (Invivogen).
Сортировка, трансдукция и размножение Treg. CD4+ Т-клетки выделяли из доноров HLA-A2- через RosetteSep (Stemcell) и обогащали по клеткам CD25+ (Miltenyi) перед сортировкой живых CD4+ CD127loCD25hi Treg с использованием FACSAria II (BD Biosciences). Сортированные Treg стимулировали L-клетками и αCD3 mAb (ОКТ3; 200 нг/мл) в 1000 Ед/мл IL-2. Один день спустя клетки трансдуцировали лентивирусом при множественной инфекции 10 вирусных частиц:1 клетку. На 7-й день клетки повторно стимулировали L-клетками, как описано выше, и размножали в течение 5 дней. Чтобы проверить эффекты HLA-A2-опосредованной стимуляции, Treg культивировали в течение ночи с ограничением IL-2 (100 Ед/мл) и затем повторно стимулировали облученными анти-CD3/анти-CD28 нагруженными клетками K562.64 или клетками K562.64.HLA-А2 в соотношении 1:2 (К562:Т-клетки) в течение 24 часов.
Проточная цитометрия. Для фенотипического анализа клетки окрашивали фиксируемым красителем для оценки жизнеспособности (FVD, 65-0865-14, eBioscience; 423102, Biolegend) и по поверхностным маркерам перед фиксацией/перманеабилизацией с помощью набора FOXP3/Transcription Factor Staining Buffer (eBioscience) и окрашиванием внутриклеточных белков. Образцы считывали на Cytoflex (Beckman-Coulter), а результаты анализировали с использованием программного обеспечения FlowJo версий 9.9.4 и 10.3 (Tree Star). Окрашивание поверхности проводили для CD3 (564465, BD Biosciences), CD4 (317410, Biolegend), CD25 (130-091-024, Miltenyi), LAP (25-9829-42, eBioscience), CD69 (310946, Biolegend), CD154 (555702, BD Biosciences) и CD127 (48-1278-42, eBiosciences). Окрашивание тетрамера проводили мономерами HLA-A*02: 01, превращенными в тетрамеры со стрептавидин-аллофикоцианином (PJ27S, Prozyme). Внутриклеточное окрашивание проводили по CTLA-4 (369606, Biolegend).
Анализ перекрестной реактивности аллелей HLA. 0,25 × 106 Treg, экспрессирующих CAR в соответствии с настоящим изобретением, или CAR, включающих VH и VL антитела BB7.2 (mA2 CAR), инкубировали с панелью гранул с антителом против одиночного антигена FlowPRA® (FL1HD01, FL1HD02, FL1HD03, FL1HD04 FL1HD06 и FL1HD08, One Lambda) и фиксируемого красителя для оценки жизнеспособности (FVD, ThermoFisher, 65-0865-14, eBioscience) в течение 30 минут при комнатной температуре. Образцы промывали, фиксировали 0,5% формальдегидом и анализировали с помощью проточной цитометрии. Двести гранул отрицательного контроля использовали на образец. В качестве отрицательного контроля использовали гранулы в чистом виде. Для анализа мертвые клетки сначала удаляли, используя фиксируемый краситель жизнеспособности. Одиночные антигенные гранулы затем подвергали стробированию после исключения мертвых клеток и дублетов. Затем количество гранул на HLA-антиген определяли по их соответствующему пику интенсивности PE. Данные были нормализованы путем умножения количества представляющих интерес гранул в каждом пике HLA на 200, деленного на количество отрицательных гранул в образце. Для каждого пика HLA процент относительного связывания CAR Treg по сравнению с контролем (клетками, не экспрессирующими CAR) определяли путем вычитания количества гранул в CAR-Treg из числа гранул в контрольном образце с последующим делением среднего числа гранул в не-CAR-экспрессирующем контроле, и умножением на 100.
Полученные результаты:
Получение гуманизированных HLA-A2-специфических CAR
Была получена 1 гуманизированная тяжелая цепь и 3 различных гуманизированных легких цепи, и в общей сложности было получено 3 различных рецептора химерных антигенов путем объединения гуманизированных тяжелых и легких цепей.
Экспрессию и правильное сворачивание CAR проверяли с использованием репортерных клеточных линий Jurkat NFAT.
Перекрестная реактивность конструкций HLA-A2-CAR на другие аллели HLA класса I
Есть много разных аллелей HLA, которые эволюционировали со временем из меньшего числа аллелей предков. Следовательно, существуют семейства аллелей, которые могут различаться только несколькими аминокислотами, и одно антитело против HLA может распознавать несколько аллелей в эволюционно-связанном семействе. Известно, что мышиное моноклональное антитело (BB7.2) обладает перекрестной реактивностью к дополнительным аллелям HLA-A (Hilton & Parham, 2013). В частности, при тестировании в твердофазном анализе было обнаружено, что BB7.2 распознает пять подтипов HLA-A2 (*02:01, *02:02, *02:03, *02:05, *02:06) и явлется перекрестно реактивным с HLA-A*69: 01, а при испытаниях в высоких концентрациях также с HLA-A*23:01, A*24:02, A*24:03, A*68:01 и A*68:02 (Hilton & Parham, 2013). Для оценки перекрестной реактивности гуманизированных антител против HLA-A2 по изобретению и сравнения с антителом, содержащим VH и VL антитела BB7.2, мы адаптировали твердофазный анализ ONE Lambda, который предназначен для измерения анти-HLA-антитела в сыворотке, путем измерения связывания гранул, покрытых HLA, с интересующими гуманизированными CAR. GFP + Treg, экспрессирующие указанные гуманизированные CAR, инкубировали с гранулами Flow Panel Reactive Single Antigen с количественным определением связывания с одним классом гранул в виде потери сигнала в «воротах» гранул на графике прямого светорассеяния/бокового светорассеяния. Данные были нормализованы по количеству гранул отрицательного контроля в образце, и количество относительного связывания с hCAR-экспрессирующими Treg рассчитывали по отношению количества связывания с GFP + -контрольными Treg к количеству отрицательных гранул в образце GFP, умноженном на количество отрицательных гранул в образце GFP.
Результаты показаны на Фигуре 1 для конструкции, содержащей scFv, имеющей последовательность SEQ ID NO: 72). Эта конструкция HLA-A2-CAR в значительной степени связывает HLA-A*02:01 (Фигура 1А). Удивительно, но для конструкции CAR по изобретению мы не наблюдали какого-либо статистически значимого связывания с какими-либо протестированными аллелями HLA-A или B, отличными от A*02:01. (Фигура 1А-В).
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> THE UNIVERSITY OF BRITISH COLUMBIA
TXCELL
<120> NOVEL ANTI-HLA-A2 ANTIBODIES AND USES THEREOF
<130> P1526PC00
<140> NOT YET ASSIGNED
<141> 2018-09-20
<150> US 62/560,841
<151> 2017-09-20
<150> US 62/691,027
<151> 2018-06-28
<160> 89
<170> BiSSAP 1.3.6
<210> 1
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> VH-CDR1
<400> 1
Ser Tyr His Ile Gln
1 5
<210> 2
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> VH-CDR2
<400> 2
Trp Ile Tyr Pro Gly Asp Gly Ser Thr Gln Tyr Asn Glu Lys Phe Lys
1 5 10 15
Gly
<210> 3
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> VH-CDR3
<400> 3
Glu Gly Thr Tyr Tyr Ala Met Asp Tyr
1 5
<210> 4
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> VH-CDR1
<400> 4
Gly Tyr Thr Phe Thr Ser Tyr
1 5
<210> 5
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> VH-CDR2
<400> 5
Tyr Pro Gly Asp Gly Ser
1 5
<210> 6
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> VL-CDR1
<400> 6
Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu
1 5 10 15
<210> 7
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> VL-CDR2
<400> 7
Lys Val Ser Asn Arg Phe Ser
1 5
<210> 8
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> VL-CDR3
<400> 8
Phe Gln Gly Ser His Val Pro Arg Thr
1 5
<210> 9
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<223> VH
<400> 9
Gln Val Gln Leu Val Gln Ser Gly Pro Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Gln Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser
115
<210> 10
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> VL
<220>
<221> SITE
<222> 2
<223> X is V or I
<220>
<221> SITE
<222> 7
<223> X is T or S
<220>
<221> SITE
<222> 9
<223> X is L or S or A
<220>
<221> SITE
<222> 10
<223> X is S or T
<220>
<221> SITE
<222> 12
<223> X is P or S
<220>
<221> SITE
<222> 14
<223> X is T or S
<220>
<221> SITE
<222> 15
<223> X is L or P
<220>
<221> SITE
<222> 17
<223> X is E or D
<220>
<221> SITE
<222> 18
<223> X is P or R
<220>
<221> SITE
<222> 19
<223> X is A or V
<220>
<221> SITE
<222> 20
<223> X is S or T
<220>
<221> SITE
<222> 42
<223> X is L or Q
<220>
<221> SITE
<222> 48
<223> X is S or A
<220>
<221> SITE
<222> 63
<223> X is V or I
<220>
<221> SITE
<222> 79
<223> X is K or T
<220>
<221> SITE
<222> 83
<223> X is V or L
<220>
<221> SITE
<222> 85
<223> X is A or P
<220>
<221> SITE
<222> 88
<223> X is L or F
<220>
<221> SITE
<222> 89
<223> X is G or A
<400> 10
Asp Xaa Val Met Thr Gln Xaa Pro Xaa Xaa Leu Xaa Val Xaa Xaa Gly
1 5 10 15
Xaa Xaa Xaa Xaa Ile Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Xaa Gln Lys Pro Gly Gln Xaa
35 40 45
Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Xaa Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Xaa Ile
65 70 75 80
Ser Arg Xaa Glu Xaa Glu Asp Xaa Xaa Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Arg Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg
<210> 11
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> VL
<400> 11
Asp Val Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Leu Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser
35 40 45
Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile
65 70 75 80
Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Arg Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg
<210> 12
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> VL
<400> 12
Asp Val Val Met Thr Gln Ser Pro Ser Ser Leu Ser Val Thr Leu Gly
1 5 10 15
Asp Arg Val Ser Ile Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Gln Gln Lys Pro Gly Gln Ser
35 40 45
Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
65 70 75 80
Ser Arg Val Glu Pro Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Arg Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg
<210> 13
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> VL
<400> 13
Asp Ile Val Met Thr Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly
1 5 10 15
Glu Arg Ala Thr Ile Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser
20 25 30
Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Gln Gln Lys Pro Gly Gln Ala
35 40 45
Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn Arg Phe Ser Gly Ile Pro
50 55 60
Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile
65 70 75 80
Ser Arg Leu Glu Pro Glu Asp Phe Ala Val Tyr Tyr Cys Phe Gln Gly
85 90 95
Ser His Val Pro Arg Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg
<210> 14
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<223> G3S linker
<400> 14
Gly Gly Gly Ser
1
<210> 15
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> G3S linker
<400> 15
Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser
1 5 10 15
<210> 16
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> G4S linker
<400> 16
Gly Gly Gly Gly Gly Ser
1 5
<210> 17
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> G4S linker
<400> 17
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10
<210> 18
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> G4S linker
<400> 18
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 19
<211> 20
<212> PRT
<213> Artificial Sequence
<220>
<223> G4S linker
<400> 19
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser
20
<210> 20
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Hinge domain
<400> 20
Ala Gly Ser Ser Ser Ser Gly Gly Ser Thr Thr Gly Gly Ser Thr Thr
1 5 10 15
<210> 21
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Hinge domain
<400> 21
Gly Thr Thr Ala Ala Ser Gly Ser Ser Gly Gly Ser Ser Ser Gly Ala
1 5 10 15
<210> 22
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Hinge domain
<400> 22
Ser Ser Ala Thr Ala Thr Ala Gly Thr Gly Ser Ser Thr Gly Ser Thr
1 5 10 15
<210> 23
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Hinge domain
<400> 23
Thr Ser Gly Ser Thr Gly Thr Ala Ala Ser Ser Thr Ser Thr Ser Thr
1 5 10 15
<210> 24
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<223> Hinge domain
<400> 24
ggtggcggag gttctggagg tggaggttcc 30
<210> 25
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Hinge domain
<400> 25
Lys Ile Arg Arg Asp Ser Ser
1 5
<210> 26
<211> 45
<212> PRT
<213> Artificial Sequence
<220>
<223> CD8 Hinge domain
<400> 26
Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala
1 5 10 15
Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly
20 25 30
Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp
35 40 45
<210> 27
<211> 135
<212> DNA
<213> Artificial Sequence
<220>
<223> CD8 Hinge domain
<400> 27
accacgacgc cagcgccgcg accaccaaca ccggcgccca ccatcgcgtc gcagcccctg 60
tccctgcgcc cagaggcgtg ccggccagcg gcggggggcg cagtgcacac gagggggctg 120
gacttcgcct gtgat 135
<210> 28
<211> 230
<212> PRT
<213> Artificial Sequence
<220>
<223> IgG4 Hinge domain
<400> 28
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
1 5 10 15
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys Met
225 230
<210> 29
<211> 690
<212> DNA
<213> Artificial Sequence
<220>
<223> IgG4 Hinge domain
<400> 29
gagagcaagt acggccctcc ctgcccccct tgccctgccc ccgagttcct gggcggaccc 60
agcgtgttcc tgttcccccc caagcccaag gacaccctga tgatcagccg gacccccgag 120
gtgacctgtg tggtggtgga cgtgtcccag gaggaccccg aggtccagtt caactggtac 180
gtggacggcg tggaggtgca caacgccaag accaagcccc gggaggagca gttcaatagc 240
acctaccggg tggtgtccgt gctgaccgtg ctgcaccagg actggctgaa cggcaaggaa 300
tacaagtgta aggtgtccaa caagggcctg cccagcagca tcgagaaaac catcagcaag 360
gccaagggcc agcctcggga gccccaggtg tacaccctgc cccctagcca agaggagatg 420
accaagaacc aggtgtccct gacctgcctg gtgaagggct tctaccccag cgacatcgcc 480
gtggagtggg agagcaacgg ccagcccgag aacaactaca agaccacccc ccctgtgctg 540
gacagcgacg gcagcttctt cctgtacagc cggctgaccg tggacaagag ccggtggcag 600
gagggcaacg tctttagctg ctccgtgatg cacgaggccc tgcacaacca ctacacccag 660
aagagcctga gcctgtccct gggcaagatg 690
<210> 30
<211> 282
<212> PRT
<213> Artificial Sequence
<220>
<223> IgD Hinge domain
<400> 30
Arg Trp Pro Glu Ser Pro Lys Ala Gln Ala Ser Ser Val Pro Thr Ala
1 5 10 15
Gln Pro Gln Ala Glu Gly Ser Leu Ala Lys Ala Thr Thr Ala Pro Ala
20 25 30
Thr Thr Arg Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Lys Glu Lys
35 40 45
Glu Lys Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys Pro
50 55 60
Ser His Thr Gln Pro Leu Gly Val Tyr Leu Leu Thr Pro Ala Val Gln
65 70 75 80
Asp Leu Trp Leu Arg Asp Lys Ala Thr Phe Thr Cys Phe Val Val Gly
85 90 95
Ser Asp Leu Lys Asp Ala His Leu Thr Trp Glu Val Ala Gly Lys Val
100 105 110
Pro Thr Gly Gly Val Glu Glu Gly Leu Leu Glu Arg His Ser Asn Gly
115 120 125
Ser Gln Ser Gln His Ser Arg Leu Thr Leu Pro Arg Ser Leu Trp Asn
130 135 140
Ala Gly Thr Ser Val Thr Cys Thr Leu Asn His Pro Ser Leu Pro Pro
145 150 155 160
Gln Arg Leu Met Ala Leu Arg Glu Pro Ala Ala Gln Ala Pro Val Lys
165 170 175
Leu Ser Leu Asn Leu Leu Ala Ser Ser Asp Pro Pro Glu Ala Ala Ser
180 185 190
Trp Leu Leu Cys Glu Val Ser Gly Phe Ser Pro Pro Asn Ile Leu Leu
195 200 205
Met Trp Leu Glu Asp Gln Arg Glu Val Asn Thr Ser Gly Phe Ala Pro
210 215 220
Ala Arg Pro Pro Pro Gln Pro Gly Ser Thr Thr Phe Trp Ala Trp Ser
225 230 235 240
Val Leu Arg Val Pro Ala Pro Pro Ser Pro Gln Pro Ala Thr Tyr Thr
245 250 255
Cys Val Val Ser His Glu Asp Ser Arg Thr Leu Leu Asn Ala Ser Arg
260 265 270
Ser Leu Glu Val Ser Tyr Val Thr Asp His
275 280
<210> 31
<211> 847
<212> DNA
<213> Artificial Sequence
<220>
<223> IgD Hinge domain
<400> 31
aggtggcccg aaagtcccaa ggcccaggca tctagtgttc ctactgcaca gccccaggca 60
gaaggcagcc tagccaaagc tactactgca cctgccacta cgcgcaatac tggccgtggc 120
ggggaggaga agaaaaagga gaaagagaaa gaagaacagg aagagaggga gaccaagacc 180
cctgaatgtc catcccatac ccagccgctg ggcgtctatc tcttgactcc cgcagtacag 240
gacttgtggc ttagagataa ggccaccttt acatgtttcg tcgtgggctc tgacctgaag 300
gatgcccatt tgacttggga ggttgccgga aaggtaccca cagggggggt tgaggaaggg 360
ttgctggagc gccattccaa tggctctcag agccagcact caagactcac ccttccgaga 420
tccctgtgga acgccgggac ctctgtcaca tgtactctaa atcatcctag cctgccccca 480
cagcgtctga tggcccttag agagccagcc gcccaggcac cagttaagct tagcctgaat 540
ctgctcgcca gtagtgatcc cccagaggcc gccagctggc tcttatgcga agtgtccggc 600
tttagcccgc ccaacatctt gctcatgtgg ctggaggacc agcgagaagt gaacaccagc 660
ggcttcgctc cagcccggcc cccaccccag ccgggttcta ccacattctg ggcctggagt 720
gtcttaaggg tcccagcacc acctagcccc cagccagcca catacacctg tgttgtgtcc 780
catgaagata gcaggaccct gctaaatgct tctaggagtc tggaggtttc ctacgtgact 840
gaccatt 847
<210> 32
<211> 39
<212> PRT
<213> Artificial Sequence
<220>
<223> CD28 Hinge domain
<400> 32
Ile Glu Val Met Tyr Pro Pro Pro Tyr Leu Asp Asn Glu Lys Ser Asn
1 5 10 15
Gly Thr Ile Ile His Val Lys Gly Lys His Leu Cys Pro Ser Pro Leu
20 25 30
Phe Pro Gly Pro Ser Lys Pro
35
<210> 33
<211> 117
<212> DNA
<213> Artificial Sequence
<220>
<223> CD28 Hinge domain
<400> 33
attgaagtta tgtatcctcc tccttaccta gacaatgaga agagcaatgg aaccattatc 60
catgtgaaag ggaaacacct ttgtccaagt cccctatttc ccggaccttc taagccc 117
<210> 34
<211> 24
<212> PRT
<213> Artificial Sequence
<220>
<223> CD8 transmembrane domain
<400> 34
Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu
1 5 10 15
Ser Leu Val Ile Thr Leu Tyr Cys
20
<210> 35
<211> 72
<212> DNA
<213> Artificial Sequence
<220>
<223> CD8 transmembrane domain
<400> 35
atctacatct gggcgccctt ggccgggact tgtggggtcc ttctcctgtc actggttatc 60
accctttact gc 72
<210> 36
<211> 27
<212> PRT
<213> Artificial Sequence
<220>
<223> CD28 transmembrane domain
<400> 36
Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu
1 5 10 15
Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val
20 25
<210> 37
<211> 81
<212> DNA
<213> Artificial Sequence
<220>
<223> CD28 transmembrane domain
<400> 37
ttttgggtgc tggtggtggt tggtggagtc ctggcttgct atagcttgct agtaacagtg 60
gcctttatta ttttctgggt g 81
<210> 38
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<223> CD3zeta
<400> 38
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly
1 5 10 15
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
20 25 30
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
35 40 45
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
50 55 60
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
65 70 75 80
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
85 90 95
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
100 105 110
<210> 39
<211> 112
<212> PRT
<213> Artificial Sequence
<220>
<223> CD3zeta
<400> 39
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly
1 5 10 15
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
20 25 30
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
35 40 45
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
50 55 60
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
65 70 75 80
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
85 90 95
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
100 105 110
<210> 40
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> CD3zeta
<400> 40
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly
1 5 10 15
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
20 25 30
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
35 40 45
Pro Gln Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln
50 55 60
Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu
65 70 75 80
Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr
85 90 95
Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro
100 105 110
Arg
<210> 41
<211> 113
<212> PRT
<213> Artificial Sequence
<220>
<223> CD3zeta
<400> 41
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly
1 5 10 15
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
20 25 30
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
35 40 45
Pro Gln Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln
50 55 60
Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu
65 70 75 80
Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr
85 90 95
Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro
100 105 110
Arg
<210> 42
<211> 336
<212> DNA
<213> Artificial Sequence
<220>
<223> CD3zeta
<400> 42
agagtgaagt tcagcaggag cgcagacgcc cccgcgtaca agcagggcca gaaccagctc 60
tataacgagc tcaatctagg acgaagagag gagtacgatg ttttggacaa gagacgtggc 120
cgggaccctg agatgggggg aaagccgaga aggaagaacc ctcaggaagg cctgtacaat 180
gaactgcaga aagataagat ggcggaggcc tacagtgaga ttgggatgaa aggcgagcgc 240
cggaggggca aggggcacga tggcctttac cagggtctca gtacagccac caaggacacc 300
tacgacgccc ttcacatgca ggccctgccc cctcgc 336
<210> 43
<211> 336
<212> DNA
<213> Artificial Sequence
<220>
<223> CD3zeta
<400> 43
agagtgaagt tcagcaggag cgcagacgcc cccgcgtacc agcagggcca gaaccagctc 60
tataacgagc tcaatctagg acgaagagag gagtacgatg ttttggacaa gagacgtggc 120
cgggaccctg agatgggggg aaagccgaga aggaagaacc ctcaggaagg cctgtacaat 180
gaactgcaga aagataagat ggcggaggcc tacagtgaga ttgggatgaa aggcgagcgc 240
cggaggggca aggggcacga tggcctttac cagggtctca gtacagccac caaggacacc 300
tacgacgccc ttcacatgca ggccctgccc cctcgc 336
<210> 44
<211> 42
<212> PRT
<213> Artificial Sequence
<220>
<223> 4-1BB intracellular domain
<400> 44
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
1 5 10 15
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
20 25 30
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu
35 40
<210> 45
<211> 48
<212> PRT
<213> Artificial Sequence
<220>
<223> CD27 intracellular domain
<400> 45
Gln Arg Arg Lys Tyr Arg Ser Asn Lys Gly Glu Ser Pro Val Glu Pro
1 5 10 15
Ala Glu Pro Cys Arg Tyr Ser Cys Pro Arg Glu Glu Glu Gly Ser Thr
20 25 30
Ile Pro Ile Gln Glu Asp Tyr Arg Lys Pro Glu Pro Ala Cys Ser Pro
35 40 45
<210> 46
<211> 41
<212> PRT
<213> Artificial Sequence
<220>
<223> CD28 intracellular domain
<400> 46
Arg Ser Lys Arg Ser Arg Leu Leu His Ser Asp Tyr Met Asn Met Thr
1 5 10 15
Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro
20 25 30
Pro Arg Asp Phe Ala Ala Tyr Arg Ser
35 40
<210> 47
<211> 126
<212> DNA
<213> Artificial Sequence
<220>
<223> 4-1BB intracellular domain
<400> 47
aaacggggca gaaagaaact cctgtatata ttcaaacaac catttatgag accagtacaa 60
actactcaag aggaagatgg ctgtagctgc cgatttccag aagaagaaga aggaggatgt 120
gaactg 126
<210> 48
<211> 144
<212> DNA
<213> Artificial Sequence
<220>
<223> CD27 intracellular domain
<400> 48
caacgaagga aatatagatc aaacaaagga gaaagtcctg tggagcctgc agagccttgt 60
cgttacagct gccccaggga ggaggagggc agcaccatcc ccatccagga ggattaccga 120
aaaccggagc ctgcctgctc cccc 144
<210> 49
<211> 123
<212> DNA
<213> Artificial Sequence
<220>
<223> CD28 intracellular domain
<400> 49
aggagtaaga ggagcaggct cctgcacagt gactacatga acatgactcc ccgccgcccc 60
gggcccaccc gcaagcatta ccagccctat gccccaccac gcgacttcgc agcctatcgc 120
tcc 123
<210> 50
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<223> CD8 leader sequence
<400> 50
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro
20
<210> 51
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Tag
<400> 51
Asn Trp Ser His Pro Gln Phe Glu Lys
1 5
<210> 52
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> Tag
<400> 52
Ser Ala Trp Ser His Pro Gln Phe Glu Lys
1 5 10
<210> 53
<211> 222
<212> PRT
<213> Artificial Sequence
<220>
<223> CAR
<400> 53
Ala Ala Ala Ile Glu Val Met Tyr Pro Pro Pro Tyr Leu Asp Asn Glu
1 5 10 15
Lys Ser Asn Gly Thr Ile Ile His Val Lys Gly Lys His Leu Cys Pro
20 25 30
Ser Pro Leu Phe Pro Gly Pro Ser Lys Pro Phe Trp Val Leu Val Val
35 40 45
Val Gly Gly Val Leu Ala Cys Tyr Ser Leu Leu Val Thr Val Ala Phe
50 55 60
Ile Ile Phe Trp Val Arg Ser Lys Arg Ser Arg Leu Leu His Ser Asp
65 70 75 80
Tyr Met Asn Met Thr Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr
85 90 95
Gln Pro Tyr Ala Pro Pro Arg Asp Phe Ala Ala Tyr Arg Ser Arg Val
100 105 110
Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn
115 120 125
Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val
130 135 140
Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg
145 150 155 160
Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys
165 170 175
Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg
180 185 190
Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys
195 200 205
Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
210 215 220
<210> 54
<211> 223
<212> PRT
<213> Artificial Sequence
<220>
<223> CAR
<400> 54
Ala Ala Ala Ile Glu Val Met Tyr Pro Pro Pro Tyr Leu Asp Asn Glu
1 5 10 15
Lys Ser Asn Gly Thr Ile Ile His Val Lys Gly Lys His Leu Cys Pro
20 25 30
Ser Pro Leu Phe Pro Gly Pro Ser Lys Pro Phe Trp Val Leu Val Val
35 40 45
Val Gly Gly Val Leu Ala Cys Tyr Ser Leu Leu Val Thr Val Ala Phe
50 55 60
Ile Ile Phe Trp Val Arg Ser Lys Arg Ser Arg Leu Leu His Ser Asp
65 70 75 80
Tyr Met Asn Met Thr Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr
85 90 95
Gln Pro Tyr Ala Pro Pro Arg Asp Phe Ala Ala Tyr Arg Ser Arg Val
100 105 110
Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn
115 120 125
Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val
130 135 140
Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Gln
145 150 155 160
Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp
165 170 175
Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg
180 185 190
Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr
195 200 205
Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
210 215 220
<210> 55
<211> 223
<212> PRT
<213> Artificial Sequence
<220>
<223> CAR
<400> 55
Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala
1 5 10 15
Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly
20 25 30
Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile
35 40 45
Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val
50 55 60
Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe
65 70 75 80
Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly
85 90 95
Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg
100 105 110
Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln
115 120 125
Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp
130 135 140
Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro
145 150 155 160
Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp
165 170 175
Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg
180 185 190
Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr
195 200 205
Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
210 215 220
<210> 56
<211> 236
<212> PRT
<213> Artificial Sequence
<220>
<223> CAR
<400> 56
Asn Trp Ser His Pro Gln Phe Glu Lys Met His Thr Thr Thr Pro Ala
1 5 10 15
Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser
20 25 30
Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr
35 40 45
Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala
50 55 60
Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys
65 70 75 80
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
85 90 95
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
100 105 110
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Thr Arg Arg Val Lys Phe
115 120 125
Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu
130 135 140
Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp
145 150 155 160
Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys
165 170 175
Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala
180 185 190
Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys
195 200 205
Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr
210 215 220
Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
225 230 235
<210> 57
<211> 224
<212> PRT
<213> Artificial Sequence
<220>
<223> CAR
<400> 57
Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala
1 5 10 15
Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly
20 25 30
Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile
35 40 45
Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val
50 55 60
Ile Thr Leu Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe
65 70 75 80
Lys Gln Pro Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly
85 90 95
Cys Ser Cys Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg
100 105 110
Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln
115 120 125
Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp
130 135 140
Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro
145 150 155 160
Gln Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
165 170 175
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
180 185 190
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
195 200 205
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
210 215 220
<210> 58
<211> 237
<212> PRT
<213> Artificial Sequence
<220>
<223> CAR
<400> 58
Asn Trp Ser His Pro Gln Phe Glu Lys Met His Thr Thr Thr Pro Ala
1 5 10 15
Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser
20 25 30
Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr
35 40 45
Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala
50 55 60
Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys
65 70 75 80
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
85 90 95
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
100 105 110
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Thr Arg Arg Val Lys Phe
115 120 125
Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu
130 135 140
Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp
145 150 155 160
Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Gln Arg Arg
165 170 175
Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met
180 185 190
Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly
195 200 205
Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp
210 215 220
Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
225 230 235
<210> 59
<211> 226
<212> PRT
<213> Artificial Sequence
<220>
<223> CAR
<400> 59
Met His Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr
1 5 10 15
Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala
20 25 30
Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile
35 40 45
Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser
50 55 60
Leu Val Ile Thr Leu Tyr Cys Arg Ser Lys Arg Ser Arg Leu Leu His
65 70 75 80
Ser Asp Tyr Met Asn Met Thr Pro Arg Arg Pro Gly Pro Thr Arg Lys
85 90 95
His Tyr Gln Pro Tyr Ala Pro Pro Arg Asp Phe Ala Ala Tyr Arg Ser
100 105 110
Thr Arg Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln
115 120 125
Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu
130 135 140
Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly
145 150 155 160
Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu
165 170 175
Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly
180 185 190
Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser
195 200 205
Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro
210 215 220
Pro Arg
225
<210> 60
<211> 227
<212> PRT
<213> Artificial Sequence
<220>
<223> CAR
<400> 60
Met His Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr
1 5 10 15
Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala
20 25 30
Ala Gly Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile
35 40 45
Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser
50 55 60
Leu Val Ile Thr Leu Tyr Cys Arg Ser Lys Arg Ser Arg Leu Leu His
65 70 75 80
Ser Asp Tyr Met Asn Met Thr Pro Arg Arg Pro Gly Pro Thr Arg Lys
85 90 95
His Tyr Gln Pro Tyr Ala Pro Pro Arg Asp Phe Ala Ala Tyr Arg Ser
100 105 110
Thr Arg Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln
115 120 125
Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu
130 135 140
Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly
145 150 155 160
Gly Lys Pro Gln Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu
165 170 175
Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys
180 185 190
Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu
195 200 205
Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu
210 215 220
Pro Pro Arg
225
<210> 61
<211> 24
<212> PRT
<213> Artificial Sequence
<220>
<223> P2A ribosomal cleavage site
<400> 61
Ala Ser Gly Ser Gly Ala Thr Asn Phe Ser Leu Leu Lys Gln Ala Gly
1 5 10 15
Asp Val Glu Glu Asn Pro Gly Pro
20
<210> 62
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> Heavy chain CDR1 of BB7.2
<400> 62
Ser Tyr His Ile Gln
1 5
<210> 63
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> Heavy chain CDR2 of BB7.2
<400> 63
Trp Ile Tyr Pro Gly Asp Gly Ser Thr Gln Tyr Asn Glu Lys Phe Lys
1 5 10 15
Gly
<210> 64
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Heavy chain CDR3 of BB7.2
<400> 64
Glu Gly Thr Tyr Tyr Ala Met Asp Tyr
1 5
<210> 65
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<223> Light chain CDR1 of BB7.2
<400> 65
Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu
1 5 10 15
<210> 66
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<223> Light chain CDR2 of BB7.2
<400> 66
Lys Val Ser Asn Arg Phe Ser
1 5
<210> 67
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> Light chain CDR3 of BB7.2
<400> 67
Phe Gln Gly Ser His Val Pro Arg Thr
1 5
<210> 68
<211> 239
<212> PRT
<213> Artificial Sequence
<220>
<223> eGFP
<400> 68
Met Val Ser Lys Gly Glu Glu Leu Phe Thr Gly Val Val Pro Ile Leu
1 5 10 15
Val Glu Leu Asp Gly Asp Val Asn Gly His Lys Phe Ser Val Ser Gly
20 25 30
Glu Gly Glu Gly Asp Ala Thr Tyr Gly Lys Leu Thr Leu Lys Phe Ile
35 40 45
Cys Thr Thr Gly Lys Leu Pro Val Pro Trp Pro Thr Leu Val Thr Thr
50 55 60
Leu Thr Tyr Gly Val Gln Cys Phe Ser Arg Tyr Pro Asp His Met Lys
65 70 75 80
Gln His Asp Phe Phe Lys Ser Ala Met Pro Glu Gly Tyr Val Gln Glu
85 90 95
Arg Thr Ile Phe Phe Lys Asp Asp Gly Asn Tyr Lys Thr Arg Ala Glu
100 105 110
Val Lys Phe Glu Gly Asp Thr Leu Val Asn Arg Ile Glu Leu Lys Gly
115 120 125
Ile Asp Phe Lys Glu Asp Gly Asn Ile Leu Gly His Lys Leu Glu Tyr
130 135 140
Asn Tyr Asn Ser His Asn Val Tyr Ile Met Ala Asp Lys Gln Lys Asn
145 150 155 160
Gly Ile Lys Val Asn Phe Lys Ile Arg His Asn Ile Glu Asp Gly Ser
165 170 175
Val Gln Leu Ala Asp His Tyr Gln Gln Asn Thr Pro Ile Gly Asp Gly
180 185 190
Pro Val Leu Leu Pro Asp Asn His Tyr Leu Ser Thr Gln Ser Ala Leu
195 200 205
Ser Lys Asp Pro Asn Glu Lys Arg Asp His Met Val Leu Leu Glu Phe
210 215 220
Val Thr Ala Ala Gly Ile Thr Leu Gly Met Asp Glu Leu Tyr Lys
225 230 235
<210> 69
<211> 246
<212> PRT
<213> Artificial Sequence
<220>
<223> scFv
<220>
<221> SITE
<222> 135
<223> X is for V or I
<220>
<221> SITE
<222> 140
<223> X is for T or S
<220>
<221> SITE
<222> 142
<223> X is for L or S or A
<220>
<221> SITE
<222> 143
<223> X is for S or T
<220>
<221> SITE
<222> 145
<223> X is for P or S
<220>
<221> SITE
<222> 147
<223> X is for T or S
<220>
<221> SITE
<222> 148
<223> X is for L or P
<220>
<221> SITE
<222> 150
<223> X is for E or D
<220>
<221> SITE
<222> 151
<223> X is for P or R
<220>
<221> SITE
<222> 152
<223> X is for A or V
<220>
<221> SITE
<222> 153
<223> X is for S or T
<220>
<221> SITE
<222> 175
<223> X is for L or Q
<220>
<221> SITE
<222> 181
<223> X is for S or A
<220>
<221> SITE
<222> 196
<223> X is for V or I
<220>
<221> SITE
<222> 212
<223> X is for K or T
<220>
<221> SITE
<222> 216
<223> X is for V or L
<220>
<221> SITE
<222> 218
<223> X is for A or P
<220>
<221> SITE
<222> 221
<223> X is for L or F
<220>
<221> SITE
<222> 222
<223> X is for G or A
<400> 69
Gln Val Gln Leu Val Gln Ser Gly Pro Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Gln Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Gly Gly Gly Gly Ser Asp Xaa Val Met Thr Gln Xaa Pro Xaa Xaa Leu
130 135 140
Xaa Val Xaa Xaa Gly Xaa Xaa Xaa Xaa Ile Ser Cys Arg Ser Ser Gln
145 150 155 160
Ser Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Xaa Gln
165 170 175
Lys Pro Gly Gln Xaa Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn Arg
180 185 190
Phe Ser Gly Xaa Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp
195 200 205
Phe Thr Leu Xaa Ile Ser Arg Xaa Glu Xaa Glu Asp Xaa Xaa Val Tyr
210 215 220
Tyr Cys Phe Gln Gly Ser His Val Pro Arg Thr Phe Gly Gly Gly Thr
225 230 235 240
Lys Leu Glu Ile Lys Arg
245
<210> 70
<211> 246
<212> PRT
<213> Artificial Sequence
<220>
<223> scFv
<400> 70
Gln Val Gln Leu Val Gln Ser Gly Pro Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Gln Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Gly Gly Gly Gly Ser Asp Val Val Met Thr Gln Thr Pro Leu Ser Leu
130 135 140
Pro Val Thr Leu Gly Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln
145 150 155 160
Ser Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln
165 170 175
Lys Pro Gly Gln Ser Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn Arg
180 185 190
Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp
195 200 205
Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr
210 215 220
Tyr Cys Phe Gln Gly Ser His Val Pro Arg Thr Phe Gly Gly Gly Thr
225 230 235 240
Lys Leu Glu Ile Lys Arg
245
<210> 71
<211> 246
<212> PRT
<213> Artificial Sequence
<220>
<223> scFv
<400> 71
Gln Val Gln Leu Val Gln Ser Gly Pro Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Gln Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Gly Gly Gly Gly Ser Asp Val Val Met Thr Gln Ser Pro Ser Ser Leu
130 135 140
Ser Val Thr Leu Gly Asp Arg Val Ser Ile Ser Cys Arg Ser Ser Gln
145 150 155 160
Ser Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Gln Gln
165 170 175
Lys Pro Gly Gln Ser Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn Arg
180 185 190
Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp
195 200 205
Phe Thr Leu Thr Ile Ser Arg Val Glu Pro Glu Asp Leu Gly Val Tyr
210 215 220
Tyr Cys Phe Gln Gly Ser His Val Pro Arg Thr Phe Gly Gly Gly Thr
225 230 235 240
Lys Leu Glu Ile Lys Arg
245
<210> 72
<211> 246
<212> PRT
<213> Artificial Sequence
<220>
<223> scFv
<400> 72
Gln Val Gln Leu Val Gln Ser Gly Pro Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Gln Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Gly Gly Gly Gly Ser Asp Ile Val Met Thr Gln Ser Pro Ala Thr Leu
130 135 140
Ser Val Ser Pro Gly Glu Arg Ala Thr Ile Ser Cys Arg Ser Ser Gln
145 150 155 160
Ser Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Gln Gln
165 170 175
Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn Arg
180 185 190
Phe Ser Gly Ile Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp
195 200 205
Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro Glu Asp Phe Ala Val Tyr
210 215 220
Tyr Cys Phe Gln Gly Ser His Val Pro Arg Thr Phe Gly Gly Gly Thr
225 230 235 240
Lys Leu Glu Ile Lys Arg
245
<210> 73
<211> 247
<212> PRT
<213> Artificial Sequence
<220>
<223> scFv
<220>
<221> SITE
<222> 136
<223> X is V or I
<220>
<221> SITE
<222> 141
<223> X is for T or S
<220>
<221> SITE
<222> 143
<223> X is for L or S or A
<220>
<221> SITE
<222> 144
<223> X is for S or T
<220>
<221> SITE
<222> 146
<223> X is for P or S
<220>
<221> SITE
<222> 148
<223> X is for T or S
<220>
<221> SITE
<222> 149
<223> X is for L or P
<220>
<221> SITE
<222> 151
<223> X is for E or D
<220>
<221> SITE
<222> 152
<223> X is for P or R
<220>
<221> SITE
<222> 153
<223> X is for A or V
<220>
<221> SITE
<222> 154
<223> X is for S or T
<220>
<221> SITE
<222> 176
<223> X is for L or Q
<220>
<221> SITE
<222> 182
<223> X is for S or A
<220>
<221> SITE
<222> 197
<223> X is for V or I
<220>
<221> SITE
<222> 213
<223> X is for K or T
<220>
<221> SITE
<222> 217
<223> X is for V or L
<220>
<221> SITE
<222> 219
<223> X is for A or P
<220>
<221> SITE
<222> 222
<223> X is for L or F
<220>
<221> SITE
<222> 223
<223> X is for G or A
<400> 73
Ser Gln Val Gln Leu Val Gln Ser Gly Pro Glu Val Lys Lys Pro Gly
1 5 10 15
Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser
20 25 30
Tyr His Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp
35 40 45
Ile Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Gln Tyr Asn Glu Lys
50 55 60
Phe Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala
65 70 75 80
Tyr Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Ser Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Asp Xaa Val Met Thr Gln Xaa Pro Xaa Xaa
130 135 140
Leu Xaa Val Xaa Xaa Gly Xaa Xaa Xaa Xaa Ile Ser Cys Arg Ser Ser
145 150 155 160
Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Xaa
165 170 175
Gln Lys Pro Gly Gln Xaa Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn
180 185 190
Arg Phe Ser Gly Xaa Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr
195 200 205
Asp Phe Thr Leu Xaa Ile Ser Arg Xaa Glu Xaa Glu Asp Xaa Xaa Val
210 215 220
Tyr Tyr Cys Phe Gln Gly Ser His Val Pro Arg Thr Phe Gly Gly Gly
225 230 235 240
Thr Lys Leu Glu Ile Lys Arg
245
<210> 74
<211> 247
<212> PRT
<213> Artificial Sequence
<220>
<223> scFv
<400> 74
Ser Gln Val Gln Leu Val Gln Ser Gly Pro Glu Val Lys Lys Pro Gly
1 5 10 15
Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser
20 25 30
Tyr His Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp
35 40 45
Ile Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Gln Tyr Asn Glu Lys
50 55 60
Phe Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala
65 70 75 80
Tyr Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Ser Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Asp Val Val Met Thr Gln Thr Pro Leu Ser
130 135 140
Leu Pro Val Thr Leu Gly Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser
145 150 155 160
Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu
165 170 175
Gln Lys Pro Gly Gln Ser Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn
180 185 190
Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr
195 200 205
Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Leu Gly Val
210 215 220
Tyr Tyr Cys Phe Gln Gly Ser His Val Pro Arg Thr Phe Gly Gly Gly
225 230 235 240
Thr Lys Leu Glu Ile Lys Arg
245
<210> 75
<211> 247
<212> PRT
<213> Artificial Sequence
<220>
<223> scFv
<400> 75
Ser Gln Val Gln Leu Val Gln Ser Gly Pro Glu Val Lys Lys Pro Gly
1 5 10 15
Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser
20 25 30
Tyr His Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp
35 40 45
Ile Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Gln Tyr Asn Glu Lys
50 55 60
Phe Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala
65 70 75 80
Tyr Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Ser Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Asp Val Val Met Thr Gln Ser Pro Ser Ser
130 135 140
Leu Ser Val Thr Leu Gly Asp Arg Val Ser Ile Ser Cys Arg Ser Ser
145 150 155 160
Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Gln
165 170 175
Gln Lys Pro Gly Gln Ser Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn
180 185 190
Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr
195 200 205
Asp Phe Thr Leu Thr Ile Ser Arg Val Glu Pro Glu Asp Leu Gly Val
210 215 220
Tyr Tyr Cys Phe Gln Gly Ser His Val Pro Arg Thr Phe Gly Gly Gly
225 230 235 240
Thr Lys Leu Glu Ile Lys Arg
245
<210> 76
<211> 247
<212> PRT
<213> Artificial Sequence
<220>
<223> scFv
<400> 76
Ser Gln Val Gln Leu Val Gln Ser Gly Pro Glu Val Lys Lys Pro Gly
1 5 10 15
Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser
20 25 30
Tyr His Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp
35 40 45
Ile Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Gln Tyr Asn Glu Lys
50 55 60
Phe Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala
65 70 75 80
Tyr Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Ser Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Asp Ile Val Met Thr Gln Ser Pro Ala Thr
130 135 140
Leu Ser Val Ser Pro Gly Glu Arg Ala Thr Ile Ser Cys Arg Ser Ser
145 150 155 160
Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Gln
165 170 175
Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn
180 185 190
Arg Phe Ser Gly Ile Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr
195 200 205
Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro Glu Asp Phe Ala Val
210 215 220
Tyr Tyr Cys Phe Gln Gly Ser His Val Pro Arg Thr Phe Gly Gly Gly
225 230 235 240
Thr Lys Leu Glu Ile Lys Arg
245
<210> 77
<211> 471
<212> PRT
<213> Artificial Sequence
<220>
<223> CAR
<220>
<221> SITE
<222> 136
<223> X is for V or I
<220>
<221> SITE
<222> 141
<223> X is for T or S
<220>
<221> SITE
<222> 143
<223> X is for L or S or A
<220>
<221> SITE
<222> 144
<223> X is for S or T
<220>
<221> SITE
<222> 146
<223> X is for P or S
<220>
<221> SITE
<222> 148
<223> X is for T or S
<220>
<221> SITE
<222> 149
<223> X is for L or P
<220>
<221> SITE
<222> 151
<223> X is for E or D
<220>
<221> SITE
<222> 152
<223> X is for P or R
<220>
<221> SITE
<222> 153
<223> X is for A or V
<220>
<221> SITE
<222> 154
<223> X is for S or T
<220>
<221> SITE
<222> 176
<223> X is for L or Q
<220>
<221> SITE
<222> 182
<223> X is for S or A
<220>
<221> SITE
<222> 197
<223> X is for V or I
<220>
<221> SITE
<222> 213
<223> X is for K or T
<220>
<221> SITE
<222> 217
<223> X is for V or L
<220>
<221> SITE
<222> 219
<223> X is for A or P
<220>
<221> SITE
<222> 222
<223> X is for L or F
<220>
<221> SITE
<222> 223
<223> X is for G or A
<400> 77
Ser Gln Val Gln Leu Val Gln Ser Gly Pro Glu Val Lys Lys Pro Gly
1 5 10 15
Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser
20 25 30
Tyr His Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp
35 40 45
Ile Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Gln Tyr Asn Glu Lys
50 55 60
Phe Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala
65 70 75 80
Tyr Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Ser Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Asp Xaa Val Met Thr Gln Xaa Pro Xaa Xaa
130 135 140
Leu Xaa Val Xaa Xaa Gly Xaa Xaa Xaa Xaa Ile Ser Cys Arg Ser Ser
145 150 155 160
Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Xaa
165 170 175
Gln Lys Pro Gly Gln Xaa Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn
180 185 190
Arg Phe Ser Gly Xaa Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr
195 200 205
Asp Phe Thr Leu Xaa Ile Ser Arg Xaa Glu Xaa Glu Asp Xaa Xaa Val
210 215 220
Tyr Tyr Cys Phe Gln Gly Ser His Val Pro Arg Thr Phe Gly Gly Gly
225 230 235 240
Thr Lys Leu Glu Ile Lys Arg Arg Thr Thr Thr Pro Ala Pro Arg Pro
245 250 255
Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro
260 265 270
Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu
275 280 285
Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys
290 295 300
Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly
305 310 315 320
Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val
325 330 335
Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu
340 345 350
Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp
355 360 365
Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn
370 375 380
Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg
385 390 395 400
Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly
405 410 415
Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu
420 425 430
Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu
435 440 445
Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His
450 455 460
Met Gln Ala Leu Pro Pro Arg
465 470
<210> 78
<211> 471
<212> PRT
<213> Artificial Sequence
<220>
<223> CAR
<400> 78
Ser Gln Val Gln Leu Val Gln Ser Gly Pro Glu Val Lys Lys Pro Gly
1 5 10 15
Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser
20 25 30
Tyr His Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp
35 40 45
Ile Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Gln Tyr Asn Glu Lys
50 55 60
Phe Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala
65 70 75 80
Tyr Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Ser Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Asp Val Val Met Thr Gln Thr Pro Leu Ser
130 135 140
Leu Pro Val Thr Leu Gly Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser
145 150 155 160
Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu
165 170 175
Gln Lys Pro Gly Gln Ser Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn
180 185 190
Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr
195 200 205
Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Leu Gly Val
210 215 220
Tyr Tyr Cys Phe Gln Gly Ser His Val Pro Arg Thr Phe Gly Gly Gly
225 230 235 240
Thr Lys Leu Glu Ile Lys Arg Arg Thr Thr Thr Pro Ala Pro Arg Pro
245 250 255
Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro
260 265 270
Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu
275 280 285
Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys
290 295 300
Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly
305 310 315 320
Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val
325 330 335
Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu
340 345 350
Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp
355 360 365
Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn
370 375 380
Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg
385 390 395 400
Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly
405 410 415
Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu
420 425 430
Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu
435 440 445
Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His
450 455 460
Met Gln Ala Leu Pro Pro Arg
465 470
<210> 79
<211> 471
<212> PRT
<213> Artificial Sequence
<220>
<223> CAR
<400> 79
Ser Gln Val Gln Leu Val Gln Ser Gly Pro Glu Val Lys Lys Pro Gly
1 5 10 15
Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser
20 25 30
Tyr His Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp
35 40 45
Ile Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Gln Tyr Asn Glu Lys
50 55 60
Phe Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala
65 70 75 80
Tyr Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Ser Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Asp Val Val Met Thr Gln Ser Pro Ser Ser
130 135 140
Leu Ser Val Thr Leu Gly Asp Arg Val Ser Ile Ser Cys Arg Ser Ser
145 150 155 160
Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Gln
165 170 175
Gln Lys Pro Gly Gln Ser Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn
180 185 190
Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr
195 200 205
Asp Phe Thr Leu Thr Ile Ser Arg Val Glu Pro Glu Asp Leu Gly Val
210 215 220
Tyr Tyr Cys Phe Gln Gly Ser His Val Pro Arg Thr Phe Gly Gly Gly
225 230 235 240
Thr Lys Leu Glu Ile Lys Arg Arg Thr Thr Thr Pro Ala Pro Arg Pro
245 250 255
Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro
260 265 270
Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu
275 280 285
Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys
290 295 300
Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly
305 310 315 320
Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val
325 330 335
Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu
340 345 350
Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp
355 360 365
Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn
370 375 380
Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg
385 390 395 400
Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly
405 410 415
Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu
420 425 430
Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu
435 440 445
Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His
450 455 460
Met Gln Ala Leu Pro Pro Arg
465 470
<210> 80
<211> 471
<212> PRT
<213> Artificial Sequence
<220>
<223> CAR
<400> 80
Ser Gln Val Gln Leu Val Gln Ser Gly Pro Glu Val Lys Lys Pro Gly
1 5 10 15
Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser
20 25 30
Tyr His Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp
35 40 45
Ile Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Gln Tyr Asn Glu Lys
50 55 60
Phe Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala
65 70 75 80
Tyr Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Ser Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Asp Ile Val Met Thr Gln Ser Pro Ala Thr
130 135 140
Leu Ser Val Ser Pro Gly Glu Arg Ala Thr Ile Ser Cys Arg Ser Ser
145 150 155 160
Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Gln
165 170 175
Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn
180 185 190
Arg Phe Ser Gly Ile Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr
195 200 205
Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro Glu Asp Phe Ala Val
210 215 220
Tyr Tyr Cys Phe Gln Gly Ser His Val Pro Arg Thr Phe Gly Gly Gly
225 230 235 240
Thr Lys Leu Glu Ile Lys Arg Arg Thr Thr Thr Pro Ala Pro Arg Pro
245 250 255
Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu Ser Leu Arg Pro
260 265 270
Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His Thr Arg Gly Leu
275 280 285
Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys
290 295 300
Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu Tyr Cys Lys Arg Gly
305 310 315 320
Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met Arg Pro Val
325 330 335
Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe Pro Glu Glu
340 345 350
Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe Ser Arg Ser Ala Asp
355 360 365
Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn
370 375 380
Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg
385 390 395 400
Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly
405 410 415
Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu
420 425 430
Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu
435 440 445
Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His
450 455 460
Met Gln Ala Leu Pro Pro Arg
465 470
<210> 81
<211> 492
<212> PRT
<213> Artificial Sequence
<220>
<223> CAR
<220>
<221> SITE
<222> 157
<223> X is for V or I
<220>
<221> SITE
<222> 162
<223> X is for T or S
<220>
<221> SITE
<222> 164
<223> X is for L or S or A
<220>
<221> SITE
<222> 165
<223> X is for S or T
<220>
<221> SITE
<222> 167
<223> X is for P or S
<220>
<221> SITE
<222> 169
<223> X is for T or S
<220>
<221> SITE
<222> 170
<223> X is for L or P
<220>
<221> SITE
<222> 172
<223> X is for E or D
<220>
<221> SITE
<222> 173
<223> X is for P or R
<220>
<221> SITE
<222> 174
<223> X is for A or V
<220>
<221> SITE
<222> 175
<223> X is for S or T
<220>
<221> SITE
<222> 197
<223> X is for L or Q
<220>
<221> SITE
<222> 203
<223> X is for S or A
<220>
<221> SITE
<222> 218
<223> X is for V or I
<220>
<221> SITE
<222> 234
<223> X is for Kor T
<220>
<221> SITE
<222> 238
<223> X is for V or L
<220>
<221> SITE
<222> 240
<223> X is for A or P
<220>
<221> SITE
<222> 243
<223> X is for L or F
<220>
<221> SITE
<222> 244
<223> X is for G or A
<400> 81
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Ser Gln Val Gln Leu Val Gln Ser Gly Pro Glu
20 25 30
Val Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly
35 40 45
Tyr Thr Phe Thr Ser Tyr His Ile Gln Trp Val Arg Gln Ala Pro Gly
50 55 60
Gln Gly Leu Glu Trp Ile Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr
65 70 75 80
Gln Tyr Asn Glu Lys Phe Lys Gly Arg Val Thr Ile Thr Ala Asp Lys
85 90 95
Ser Thr Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Thr Ser Glu Asp
100 105 110
Thr Ala Val Tyr Tyr Cys Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp
115 120 125
Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Gly Gly Gly Gly
130 135 140
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Xaa Val Met Thr
145 150 155 160
Gln Xaa Pro Xaa Xaa Leu Xaa Val Xaa Xaa Gly Xaa Xaa Xaa Xaa Ile
165 170 175
Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr
180 185 190
Leu Glu Trp Tyr Xaa Gln Lys Pro Gly Gln Xaa Pro Arg Leu Leu Ile
195 200 205
Tyr Lys Val Ser Asn Arg Phe Ser Gly Xaa Pro Asp Arg Phe Ser Gly
210 215 220
Ser Gly Ser Gly Thr Asp Phe Thr Leu Xaa Ile Ser Arg Xaa Glu Xaa
225 230 235 240
Glu Asp Xaa Xaa Val Tyr Tyr Cys Phe Gln Gly Ser His Val Pro Arg
245 250 255
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Arg Thr Thr Thr
260 265 270
Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro
275 280 285
Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val
290 295 300
His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro
305 310 315 320
Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu
325 330 335
Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro
340 345 350
Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys
355 360 365
Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe
370 375 380
Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu
385 390 395 400
Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp
405 410 415
Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys
420 425 430
Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala
435 440 445
Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys
450 455 460
Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr
465 470 475 480
Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 82
<211> 492
<212> PRT
<213> Artificial Sequence
<220>
<223> CAR
<400> 82
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Ser Gln Val Gln Leu Val Gln Ser Gly Pro Glu
20 25 30
Val Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly
35 40 45
Tyr Thr Phe Thr Ser Tyr His Ile Gln Trp Val Arg Gln Ala Pro Gly
50 55 60
Gln Gly Leu Glu Trp Ile Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr
65 70 75 80
Gln Tyr Asn Glu Lys Phe Lys Gly Arg Val Thr Ile Thr Ala Asp Lys
85 90 95
Ser Thr Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Thr Ser Glu Asp
100 105 110
Thr Ala Val Tyr Tyr Cys Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp
115 120 125
Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Gly Gly Gly Gly
130 135 140
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Val Val Met Thr
145 150 155 160
Gln Thr Pro Leu Ser Leu Pro Val Thr Leu Gly Glu Pro Ala Ser Ile
165 170 175
Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr
180 185 190
Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Arg Leu Leu Ile
195 200 205
Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly
210 215 220
Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala
225 230 235 240
Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Gly Ser His Val Pro Arg
245 250 255
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Arg Thr Thr Thr
260 265 270
Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro
275 280 285
Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val
290 295 300
His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro
305 310 315 320
Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu
325 330 335
Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro
340 345 350
Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys
355 360 365
Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe
370 375 380
Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu
385 390 395 400
Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp
405 410 415
Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys
420 425 430
Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala
435 440 445
Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys
450 455 460
Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr
465 470 475 480
Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 83
<211> 492
<212> PRT
<213> Artificial Sequence
<220>
<223> CAR
<400> 83
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Ser Gln Val Gln Leu Val Gln Ser Gly Pro Glu
20 25 30
Val Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly
35 40 45
Tyr Thr Phe Thr Ser Tyr His Ile Gln Trp Val Arg Gln Ala Pro Gly
50 55 60
Gln Gly Leu Glu Trp Ile Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr
65 70 75 80
Gln Tyr Asn Glu Lys Phe Lys Gly Arg Val Thr Ile Thr Ala Asp Lys
85 90 95
Ser Thr Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Thr Ser Glu Asp
100 105 110
Thr Ala Val Tyr Tyr Cys Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp
115 120 125
Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Gly Gly Gly Gly
130 135 140
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Val Val Met Thr
145 150 155 160
Gln Ser Pro Ser Ser Leu Ser Val Thr Leu Gly Asp Arg Val Ser Ile
165 170 175
Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr
180 185 190
Leu Glu Trp Tyr Gln Gln Lys Pro Gly Gln Ser Pro Arg Leu Leu Ile
195 200 205
Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly
210 215 220
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Val Glu Pro
225 230 235 240
Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Gly Ser His Val Pro Arg
245 250 255
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Arg Thr Thr Thr
260 265 270
Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro
275 280 285
Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val
290 295 300
His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro
305 310 315 320
Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu
325 330 335
Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro
340 345 350
Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys
355 360 365
Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe
370 375 380
Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu
385 390 395 400
Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp
405 410 415
Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys
420 425 430
Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala
435 440 445
Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys
450 455 460
Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr
465 470 475 480
Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 84
<211> 492
<212> PRT
<213> Artificial Sequence
<220>
<223> CAR
<400> 84
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Ser Gln Val Gln Leu Val Gln Ser Gly Pro Glu
20 25 30
Val Lys Lys Pro Gly Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly
35 40 45
Tyr Thr Phe Thr Ser Tyr His Ile Gln Trp Val Arg Gln Ala Pro Gly
50 55 60
Gln Gly Leu Glu Trp Ile Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr
65 70 75 80
Gln Tyr Asn Glu Lys Phe Lys Gly Arg Val Thr Ile Thr Ala Asp Lys
85 90 95
Ser Thr Ser Thr Ala Tyr Met Glu Leu Ser Ser Leu Thr Ser Glu Asp
100 105 110
Thr Ala Val Tyr Tyr Cys Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp
115 120 125
Tyr Trp Gly Gln Gly Thr Ser Val Thr Val Ser Ser Gly Gly Gly Gly
130 135 140
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Val Met Thr
145 150 155 160
Gln Ser Pro Ala Thr Leu Ser Val Ser Pro Gly Glu Arg Ala Thr Ile
165 170 175
Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr
180 185 190
Leu Glu Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
195 200 205
Tyr Lys Val Ser Asn Arg Phe Ser Gly Ile Pro Asp Arg Phe Ser Gly
210 215 220
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro
225 230 235 240
Glu Asp Phe Ala Val Tyr Tyr Cys Phe Gln Gly Ser His Val Pro Arg
245 250 255
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys Arg Arg Thr Thr Thr
260 265 270
Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro
275 280 285
Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val
290 295 300
His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile Trp Ala Pro
305 310 315 320
Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val Ile Thr Leu
325 330 335
Tyr Cys Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro
340 345 350
Phe Met Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys
355 360 365
Arg Phe Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu Arg Val Lys Phe
370 375 380
Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu
385 390 395 400
Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp
405 410 415
Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys
420 425 430
Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala
435 440 445
Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys
450 455 460
Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr
465 470 475 480
Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
485 490
<210> 85
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<223> LAGLIDADG motif
<400> 85
Leu Ala Gly Leu Ile Asp Ala Asp Gly
1 5
<210> 86
<211> 354
<212> DNA
<213> Artificial Sequence
<220>
<223> VH
<400> 86
caggtccagc tagtacaaag cggccctgaa gtaaagaaac ctggtgcctc tgtgaaggtg 60
agctgcaagg ccagcggcta caccttcacc agctaccaca tccagtgggt tcgacaggcc 120
cctggacagg gactagagtg gatcggctgg atctatcctg gcgacggcag cacccagtac 180
aacgagaagt tcaagggcag agttaccatc accgccgaca agagcaccag cacagcctat 240
atggagctga gcagcctgac cagcgaggac acagctgttt actattgtgc cagagagggc 300
acctactacg caatggatta ttggggccag gggaccagcg tgaccgtttc ttct 354
<210> 87
<211> 339
<212> DNA
<213> Artificial Sequence
<220>
<223> VL
<400> 87
gatgttgtaa tgacccagac acctctgagc ctgcctgtga ccctgggaga accagcatcc 60
atcagctgtc ggagcagcca gagcatcgtt cacagcaacg gcaacaccta cctggaatgg 120
tatctacaga agcccggaca gagccccagg ctgctgatct acaaggtgtc caaccgcttc 180
agtggtgtgc ccgatagatt ttctggcagc ggctctggca ccgacttcac cctgaagatc 240
tccagagtgg aagccgagga cctgggcgtg tactactgct tccaaggcag ccatgtgcca 300
agaacctttg gtggaggcac aaagctggaa atcaagcgg 339
<210> 88
<211> 339
<212> DNA
<213> Artificial Sequence
<220>
<223> VL
<400> 88
gatgttgtaa tgacccagag ccctagtagc ctgtctgtga ccctgggaga tcgagtatcc 60
atcagctgtc ggagcagcca gagcatcgtt cacagcaacg gcaacaccta cctggaatgg 120
tatcaacaga agcccggaca gagccccagg ctgctgatct acaaggtgtc caaccgcttc 180
agtggtgtgc ccgatagatt ttctggcagc ggctctggca ccgacttcac cctgacgatc 240
tccagagtgg aaccagagga cctgggcgtg tactactgct tccaaggcag ccatgtgcca 300
agaacctttg gtggaggcac aaagctggaa atcaagcgg 339
<210> 89
<211> 339
<212> DNA
<213> Artificial Sequence
<220>
<223> VL
<400> 89
gatattgtaa tgacccagag ccctgcaaca ctgtctgtgt cccctggaga acgagcaaca 60
atcagctgtc ggagcagcca gagcatcgtt cacagcaacg gcaacaccta cctggaatgg 120
tatcaacaga agcccggaca ggcccccagg ctgctgatct acaaggtgtc caaccgcttc 180
agtggaatac ccgatagatt ttctggcagc ggctctggca ccgacttcac cctgacgatc 240
tccagattag aaccagagga ctttgcagtg tactactgct tccaaggcag ccatgtgcca 300
agaacctttg gtggaggcac aaagctggaa atcaagcgg 339
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| АНТИ-HLA-A2 АНТИТЕЛА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2782276C2 |
| НОВЫЕ КОНСТРУКЦИИ ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА, СОДЕРЖАЩИЕ ДОМЕНЫ TNFR2 | 2019 |
|
RU2808254C2 |
| ЛЕЧЕНИЕ РАКА С ИСПОЛЬЗОВАНИЕМ ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА CLL-1 | 2015 |
|
RU2741120C2 |
| ЛЕЧЕНИЕ ЗЛОКАЧЕСТВЕННОГО НОВООБРАЗОВАНИЯ С ИСПОЛЬЗОВАНИЕМ ГУМАНИЗИРОВАННОГО ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА ПРОТИВ ВСМА | 2015 |
|
RU2751660C2 |
| ВЫСОКОАФФИННЫЙ Т-КЛЕТОЧНЫЙ РЕЦЕПТОР ДЛЯ РАСПОЗНАВАНИЯ АНТИГЕНА AFP | 2019 |
|
RU2836365C2 |
| ХИМЕРНЫЕ КОНСТРУКЦИИ АНТИТЕЛО/Т-КЛЕТОЧНЫЙ РЕЦЕПТОР И ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2767209C2 |
| ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР (CAR) ПРОТИВ CD123 ДЛЯ ИСПОЛЬЗОВАНИЯ В ЛЕЧЕНИИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ | 2015 |
|
RU2724999C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ M971 | 2018 |
|
RU2770411C1 |
| ВИДЫ КОМБИНИРОВАННОЙ ТЕРАПИИ С ИСПОЛЬЗОВАНИЕМ ХИМЕРНЫХ АНТИГЕННЫХ РЕЦЕПТОРОВ И ИНГИБИТОРОВ PD-1 | 2017 |
|
RU2809160C2 |
| ГЛИКАНЗАВИСИМЫЕ ИММУНОТЕРАПЕВТИЧЕСКИЕ МОЛЕКУЛЫ | 2016 |
|
RU2754661C2 |
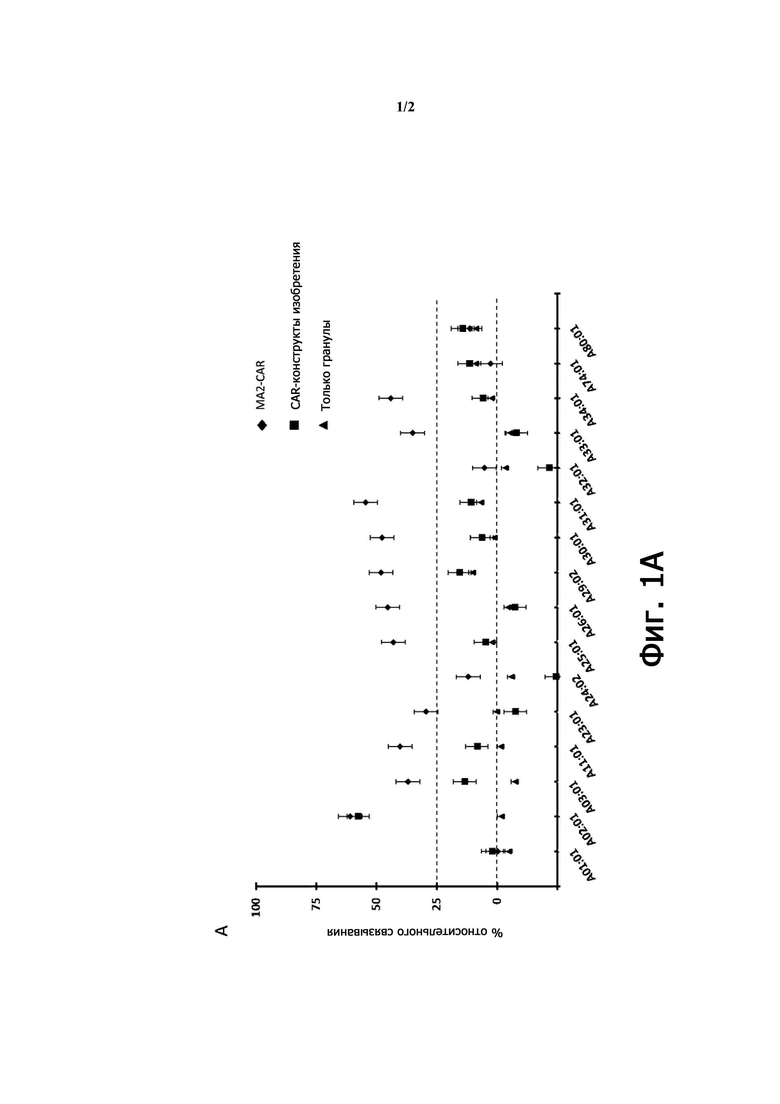
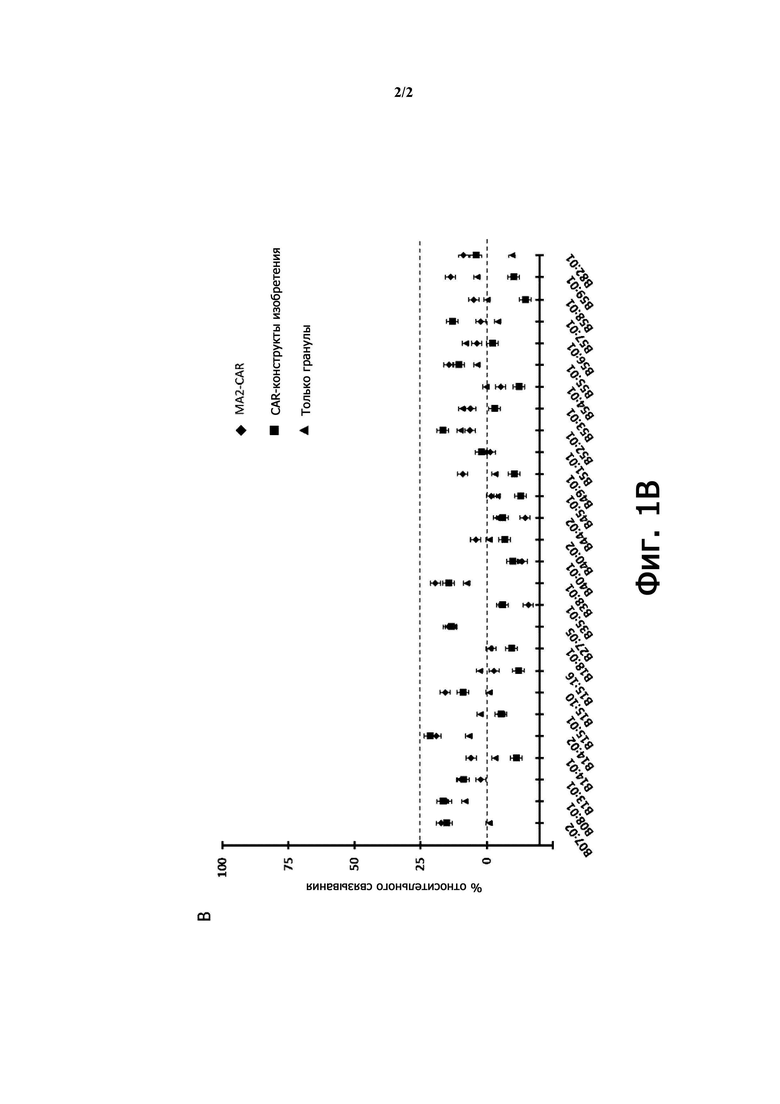
Настоящее изобретение относится к области биотехнологии и может быть использовано в медицине. Изобретение раскрывает новое антитело против человеческого лейкоцитарного антигена A2 (HLA-A2) и химерный антигенный рецептор (CAR), содержащий указанное анти-HLA-A2 антитело. Регуляторные иммунные клетки, экспрессирующие CAR согласно настоящему изобретению, могут быть применимы для лечения или предотвращения отторжения трансплантата или при реакции «трансплантат против хозяина» (РТПХ/GVHD). 16 н. и 6 з.п. ф-лы, 1 пр., 1 ил.
1. Гуманизированное антитело, способное связываться с HLA-A2, или его антигенсвязывающий фрагмент, причем указанное антитело или его антиген-связывающий фрагмент содержат вариабельную область тяжелой цепи (VH) и вариабельную область легкой цепи (VL), где аминокислотная последовательность VH включает SEQ ID NO:9 и аминокислотная последовательность VL включает SEQ ID NO:13.
2. Гуманизированное антитело, способное связываться с HLA-A2 по п. 1, причем указанное антитело представляет собой полноразмерное антитело, одноцепочечное антитело, димерное одноцепочечное антитело, Fv, scFv, Fab, F(ab)'2, дефукозилированное антитело или унитело.
3. Гуманизированное антитело, способное связываться с HLA-A2 по п. 1, причем указанное антитело представляет собой scFv, предпочтительно scFv, имеющее последовательность SEQ ID NO: 72.
4. Химерный антигенный рецептор (CAR), специфически связывающийся с HLA-A2, содержащий:
- внеклеточный домен, содержащий гуманизированное антитело, способное связываться с HLA-A2 по п. 1,
- трансмембранный домен и
- цитоплазматический домен, включающий внутриклеточный сигнальный домен.
5. Нуклеиновая кислота, кодирующая CAR по п. 4.
6. Вектор экспрессии, содержащий нуклеиновую кислоту по п. 5, кодирующую CAR по п. 4.
7. Регуляторная иммунная клетка для индукции иммунной толерантности у субъекта, нуждающегося в этом, содержащая CAR по п. 4, или нуклеиновую кислоту по п. 5, или вектор экспрессии по п. 6,
причем указанная регуляторная иммунная клетка выбрана из группы, включающей регуляторную Т-клетку, CD4+ регуляторную Т-клетку, CD8+ регуляторную Т-клетку, регуляторную γδ T-клетку, регуляторную DN Т-клетку, регуляторную В-клетку, регуляторную NK-клетку, регуляторный макрофаг, регуляторную дендритную клетку или их комбинацию.
8. Регуляторная иммунная клетка по п. 7, причем указанная регуляторная иммунная клетка представляет собой регуляторную Т-клетку.
9. Регуляторная иммунная клетка для лечения отторжения трансплантата органа или ткани или заболевания «трансплантат против хозяина» у субъекта, нуждающегося в этом, содержащая CAR по п. 4, или нуклеиновую кислоту по п. 5, или вектор экспрессии по п. 6,
причем указанная регуляторная иммунная клетка выбрана из группы, включающей регуляторную Т-клетку, CD4+ регуляторную Т-клетку, CD8+ регуляторную Т-клетку, регуляторную γδ T-клетку, регуляторную DN Т-клетку, регуляторную В-клетку, регуляторную NK-клетку, регуляторный макрофаг, регуляторную дендритную клетку или их комбинацию.
10. Регуляторная иммунная клетка по п. 9, причем указанная регуляторная иммунная клетка представляет собой регуляторную Т-клетку.
11. Композиция для индукции иммунной толерантности у субъекта, нуждающегося в этом, содержащая терапевтически эффективное количество регуляторных иммунных клеток по п. 7 или 8, причем указанная композиция предпочтительно представляет собой фармацевтическую композицию и дополнительно включает фармацевтически приемлемый наполнитель.
12. Композиция для лечения отторжения трансплантата органа или ткани или заболевания «трансплантат против хозяина» у субъекта, нуждающегося в этом, содержащая терапевтически эффективное количество регуляторных иммунных клеток по п. 9 или 10, причем указанная композиция предпочтительно представляет собой фармацевтическую композицию и дополнительно включает фармацевтически приемлемый наполнитель.
13. Способ индукции иммунной толерантности у субъекта, нуждающегося в этом, включающий введение регуляторной иммунной клетки по п. 7 или 8 субъекту, причем указанная толерантность предпочтительно представляет собой толерантность к трансплантированному органу или ткани.
14. Способ лечения отторжения трансплантата органа или ткани или заболевания «трансплантат против хозяина» у субъекта, нуждающегося в этом, включающий введение субъекту регуляторной иммунной клетки по п. 9 или п.10.
15. Способ по п. 13 или 14, дополнительно включающий введение субъекту, по меньшей мере, одного иммуносупрессирующего агента.
16. Применение регуляторной иммунной клетки по п. 7 или 8 для индукции иммунной толерантности у субъекта, нуждающегося в этом.
17. Применение регуляторной иммунной клетки по п. 9 или 10 для лечения отторжения трансплантата органа или ткани или заболевания «трансплантат против хозяина» у субъекта, нуждающегося в этом.
18. Применение по п. 16 или 17, причем субъект дополнительно получает иммуносупрессирующий агент.
19. Применение комбинации регуляторной иммунной клетки по п. 7 или 8 по меньшей мере с одним иммуносупрессирующим агентом для индукции иммунной толерантности у субъекта, нуждающегося в этом.
20. Применение комбинации регуляторной иммунной клетки по п. 9 или 10 по меньшей мере с одним иммуносупрессирующим агентом для лечения отторжения трансплантата органа или ткани или заболевания «трансплантат против хозяина» у субъекта, нуждающегося в этом.
21. Набор для индукции иммунной толерантности у субъекта, нуждающегося в этом, включающий
первую часть, содержащую регуляторную иммунную клетку по п. 7 или 8, и
вторую часть, содержащую, по меньшей мере, один иммуносупрессирующий агент.
22. Набор для лечения отторжения трансплантата органа или ткани или заболевания «трансплантат против хозяина» у субъекта, нуждающегося в этом, включающий
первую часть, содержащую регуляторную иммунную клетку по п. 9 или 10, и
вторую часть, содержащую, по меньшей мере, один иммуносупрессирующий агент.
| WO 2011058321 A1, 19.05.2011 | |||
| MacDONALD K.G | |||
| et al.: "Alloantigen-specific regulatory T cells generated with a chimeric antigen receptor", J.Clin.Invest., 2016, v | |||
| Ударно-вращательная врубовая машина | 1922 |
|
SU126A1 |
| HILTON H.G | |||
| et al.: "Direct binding to antigen-coated beads refines the specificity and cross-reactivity of four monoclonal antibodies that recognize polymorphic | |||
Авторы
Даты
2023-10-23—Публикация
2018-09-20—Подача