Перекрестная ссылка на родственные заявки
По настоящей заявке испрашивается приоритет по предварительной заявке на патент США 62/717 234, поданной 10 августа 2018. Раскрытие этой заявки включено в настоящий документ посредством ссылки во всей полноте.
Список последовательностей
Настоящая заявка содержит список последовательностей, который был представлен в электронном виде в формате ASCII и, таким образом, включен в настоящее описание посредством ссылки во всей полноте. Электронная копия списка последовательностей, созданная 9 августа 2019, называется 025297_WO003_SL.txt и имеет размер 195 578 байт.
Область техники, к которой относится изобретение
Настоящее изобретение относится к области иммунотерапии. В частности, настоящее изобретение относится к химерному антигенному рецептору (CAR), содержащему трансмембранный домен (TM) TNFR2, или его фрагмент или вариант, и/или внутриклеточный домен TNFR2, или его фрагмент или вариант. Настоящее изобретение также относится к клеточной популяции, экспрессирующей указанный CAR, и к ее применению для лечения заболеваний или расстройств.
Предшествующий уровень техники
Технология химерного антигенного рецептора (CAR) недавно произвела революцию в терапии рака, особенно в контексте В-клеточной лимфомы и лейкоза. В то время как провоспалительные Т-клетки, сконструированные с помощью CAR, широко изучаются, и предполагается, что они обеспечивают эффективность при лечении гематологических злокачественных новообразований в клинических испытаниях на ранней стадии, регуляторные Т-клетки (Treg), сконструированные с помощью CAR, в меньшей степени оценены.
Человеческие Treg играют ключевую роль в поддержании иммунного гомеостаза и, таким образом, могут быть использованы в качестве терапевтических средств в различных клинических условиях. Они также обладают мощными иммуносупрессивными свойствами, которые можно использовать для обеспечения антиген-специфической иммуномодуляции в терапевтических условиях. По этим причинам терапия Treg-клетками была разработана с целью лечения, например, хронических воспалительных заболеваний, аутоиммунных заболеваний, аллергических заболеваний и состояний после трансплантации органов, таких как отторжение трансплантата или болезнь трансплантат- против-хозяина (РТПХ).
В данной области техники трансдукция Treg-клеток с помощью конструкции CAR была предложена, например, в публикации патента РСТ WO 2008/095141.
Были разработаны различные молекулярные форматы CAR, различающиеся своими внеклеточными, трансмембранными и цитоплазматическими доменами. В области эффекторных Т-клеток внутриклеточный модуль химерного антигенного рецептора (CAR) обычно состоит из доменов CD28, ICOS или 4-1BB в тандеме с CD3-дзета. Однако использование этих прототипных модулей для создания CAR Treg клеток часто ведет к неконтролируемой конститутивной передаче сигналов, что приводит к неконтролируемой конститутивной активации. Эта тоническая передача сигналов (соответствующая антиген-независимому фону активации) может привести к преждевременному истощению CAR Treg-клеток, тем самым ограничивая их терапевтическое использование.
Таким образом, существует потребность в новых конструкциях CAR с более низкой тонической передачей сигналов при экспрессии в иммунных клетках, особенно в клетках Treg.
Изложение сущности изобретения
Настоящее изобретение относится к новым конструкциям CAR, содержащим трансмембранные домены TNFR2, или их фрагменты или варианты, и/или внутриклеточные домены TNFR2, или их фрагменты или варианты. Как показано в настоящей заявке, сконструированные Т-клетки и сконструированные Treg-клетки, экспрессирующие указанные конструкции CAR, демонстрируют сильное снижение тонической передачи сигналов по сравнению с указанными клетками, экспрессирующими обычный CAR. После включения CAR сконструированные Treg-клетки проявляли высокоэффективную супрессорную активность в отношении пролиферации T-эффекторных клеток, тем самым демонстрируя преимущество этих Treg-клеток для клеточной терапии.
В некоторых вариантах осуществления изобретения человеческие Treg-клетки демонстрируют одну или несколько из следующих характеристик: (a) по сравнению с Treg, экспрессирующими CAR, имеющими человеческий трансмембранный домен CD8 и костимуляторный внутриклеточный сигнальный домен 4-1BB, настоящие Treg-клетки экспрессируют CAR на клеточной поверхности на более низком уровне, но все же демонстрируют сопоставимые уровни CAR-специфической активации; (b) настоящие Treg-клетки сохраняют свой Treg-фенотип (например, высокие уровни экспрессии FoxP3, Helios и CD62L и низкие уровни экспрессии CD127) после более чем одной недели (например, девяти дней культивирования); и (c) настоящие Treg-клетки способны контролировать РТПХ in vivo (например, на модели РТПХ у мышей).
В некоторых вариантах осуществления настоящего изобретения предлагается CAR, содержащий внеклеточный связывающий домен, трансмембранный домен и внутриклеточный домен, где
- трансмембранный домен включает трансмембранный домен рецептора 2 фактора некроза опухоли человека (TNFR2) или его фрагмент или вариант, или
- внутриклеточный домен включает костимуляторный внутриклеточный сигнальный домен TNFR2 человека, или его фрагмент или вариант, или
- как (i), так и (ii).
В некоторых вариантах осуществления CAR, описанный в настоящей заявке, дополнительно содержит внеклеточный шарнирный домен, например, шарнирную область CD8 или CD28 человека. В конкретных вариантах осуществления шарнирный домен содержит последовательность SEQ ID NO: 14 или последовательность, имеющую по меньшей мере примерно 70% идентичности с SEQ ID NO: 14.
В некоторых вариантах осуществления внутриклеточный домен CAR, описанный в настоящей заявке, включает первичный внутриклеточный сигнальный домен иммунных клеток, например, первичный внутриклеточный сигнальный домен Т-клеток CD3 человека. В конкретных вариантах осуществления внутриклеточный домен содержит первичный внутриклеточный сигнальный домен CD3-дзета человека, при необходимости содержащий последовательность SEQ ID NO: 28, 29, 30 или 31 или последовательность, имеющую по меньшей мере примерно 70% идентичности с SEQ ID NO: 28, 29, 30 или 31.
В некоторых вариантах осуществления CAR содержит:
- внеклеточный связывающий домен,
- внеклеточный шарнирный домен, содержащий шарнирную область человеческого CD8 или CD28,
- трансмембранный домен, содержащий трансмембранный домен TNFR2 человека, или его фрагмент или вариант, и
- внутриклеточный домен, содержащий первичный внутриклеточный сигнальный домен CD3-дзета человека.
В некоторых вариантах осуществления CAR содержит:
- внеклеточный связывающий домен,
- внеклеточный шарнирный домен, содержащий шарнирную область человеческого CD8 или CD28,
- трансмембранный домен, и
- внутриклеточный домен, содержащий костимуляторный внутриклеточный сигнальный домен TNFR2 человека, или его фрагмент или вариант, и первичный внутриклеточный сигнальный домен CD3-дзета человека.
В некоторых вариантах осуществления CAR содержит:
- внеклеточный связывающий домен,
- внеклеточный шарнирный домен, содержащий шарнирную область человеческого CD8 или CD28,
- трансмембранный домен, содержащий трансмембранный домен TNFR2 человека, или его фрагмент или вариант, и
- внутриклеточный домен, содержащий костимуляторный внутриклеточный сигнальный домен TNFR2 человека, или его фрагмент или вариант, и первичный внутриклеточный сигнальный домен CD3-дзета человека.
В некоторых вариантах осуществления трансмембранный домен CAR, описанный в настоящей заявке, содержит по меньшей мере восемь смежных аминокислот из SEQ ID NO: 22 или последовательности, имеющей по меньшей мере примерно 70% идентичности с SEQ ID NO: 22. В некоторых вариантах осуществления трансмембранный домен содержит по меньшей мере восемь смежных аминокислотных остатков из SEQ ID NO: 22 в сочетании с аминокислотными остатками трансмембранного домена белка, который не является TNFR2. В некоторых вариантах осуществления трансмембранный домен содержит аминокислотную последовательность VNCVIMTQV (SEQ ID NO: 63).
В некоторых вариантах осуществления внутриклеточный домен CAR, описанный в настоящей заявке, содержит по меньшей мере 30 смежных аминокислотных остатков из SEQ ID NO: 34 или последовательности, имеющей по меньшей мере примерно 70% идентичности с SEQ ID NO: 34. В некоторых вариантах осуществления внутриклеточный домен содержит по меньшей мере 30 смежных аминокислотных остатков из SEQ ID NO: 34 в сочетании с аминокислотными остатками костимуляторного внутриклеточного сигнального домена белка, который не является TNFR2. В некоторых вариантах осуществления внутриклеточный сигнальный домен содержит остатки 1-70, 1-115 или 1-156 из SEQ ID NO: 34.
В некоторых вариантах осуществления CAR содержит:
- внеклеточный связывающий домен,
- внеклеточный шарнирный домен, содержащий шарнирную область CD8 из SEQ ID NO: 14,
- трансмембранный домен, содержащий трансмембранный домен TNFR2 из SEQ ID NO: 22, и
- внутриклеточный домен, содержащий:
- первичный внутриклеточный сигнальный домен CD3-дзета человека из SEQ ID NO: 28, 29, 30 или 31, и
- костимуляторный внутриклеточный сигнальный домен TNFR2 из SEQ ID NO: 34.
В некоторых вариантах осуществления внеклеточный связывающий домен CAR, описанный в настоящей заявке, представляет собой антитело или его антигенсвязывающий фрагмент. В конкретных вариантах осуществления внеклеточный связывающий домен представляет собой одноцепочечный вариабельный фрагмент (scFv). Внеклеточный связывающий домен может специфически связывать, например,
- аутоантиген, при необходимости представляющий собой рецептор IL-23 (IL-23R);
- антиген В-клеток, при необходимости выбранный из CD19 и CD20; или
- аллогенную молекулу HLA класса I или класса II, где молекула класса I при необходимости представляет собой HLA-A2.
Настоящее изобретение также обеспечивает нуклеиновокислотную последовательность, кодирующую CAR, описанную в настоящей заявке, а также вектор, содержащий нуклеиновокислотную последовательность, и клетку-хозяин, содержащую нуклеиновокислотную последовательность или вектор.
Настоящее изобретение также относится к популяции иммунных клеток, экспрессирующих CAR, описанный в настоящей заявке. В некоторых вариантах осуществления иммунные клетки выбраны из группы, состоящей из Т-клеток, натуральных киллеров (NK), αβ-Т-клеток, γδ-Т-клеток, двойных негативных (DN) клеток, регуляторных иммунных клеток, регуляторных T-клеток (Treg), эффекторных иммунных клеток, эффекторных Т-клеток, В-клеток и клеток миелоидного происхождения, и любой их комбинации, где иммунные клетки при необходимости являются человеческими клетками. В конкретных вариантах осуществления популяция включает Treg-клетки, где Treg-клетки при необходимости являются человеческими клетками.
В некоторых вариантах осуществления популяция иммунных клеток включает человеческие Treg-клетки, экспрессирующие CAR, содержащий:
- внеклеточный связывающий домен,
- шарнирный домен, содержащий шарнирную область человеческого CD8,
- трансмембранный домен TNFR2 человека, и
- внутриклеточный домен, содержащий костимуляторный внутриклеточный сигнальный домен TNFR2 человека и первичный внутриклеточный сигнальный домен CD3-дзета человека.
Настоящее изобретение также обеспечивает фармацевтическую композицию, содержащую иммунную клетку, клетку-хозяин или популяцию иммунных клеток, экспрессирующих CAR, описанный в настоящей заявке, и фармацевтически приемлемое вспомогательное вещество. Также обеспечивается способ лечения заболевания или расстройства у человеческого субъекта, нуждающегося в этом, включающий введение субъекту фармацевтической композиции.
Настоящее изобретение также относится к описанной в настоящей заявке популяции химерного антигенного рецептора или популяции иммунных клеток для применения при лечении заболевания или расстройства у человека, нуждающегося в этом.
Настоящее изобретение также обеспечивает использование химерного антигенного рецептора или популяции иммунных клеток, описанных в настоящей заявке, для производства лекарственного средства для лечения заболевания или расстройства у человеческого субъекта, нуждающегося в этом.
В некоторых вариантах осуществления заболевание или расстройство выбрано из группы, состоящей из воспалительного заболевания, аутоиммунного заболевания, аллергического заболевания, состояния после трансплантации органов, рака и инфекционного заболевания.
В некоторых вариантах осуществления человеческий субъект нуждается в иммуносупрессии, и CAR экспрессируется в клетках Treg у человеческого субъекта.
В некоторых вариантах осуществления заболевание или расстройство представляет собой воспалительное заболевание, аутоиммунное заболевание, аллергическое заболевание или состояние после трансплантации органов (например, отторжение трансплантата или болезнь «трансплантат против хозяина»).
Изобретение также обеспечивает химерный антигенный рецептор или популяцию иммунных клеток, описанных в настоящей заявке, для использования в качестве лекарственного средства.
Краткое описание чертежей
Фиг.1 изображает схематический вид конструкций CD19-CAR, CD20-CAR и IL-23R-CAR. CAR содержат лидерную последовательность CD8 человека (CD8), при необходимости гемагглютининовую метку (НА), последовательность scFv (анти-CD19, анти-CD20 или анти-IL-23R), при необходимости стрептавидиновую метку (Tag), шарнирный домен (линкер), трансмембранный домен (TNFR2 или CD8), костимуляторный внутриклеточный сигнальный домен (4-IBB или TNFR2) и CD3-дзета (CD3ζ). Конструкция CAR находится в рамке с кодирующей последовательностью P2A-GFP.
Фиг.2 представляет точечные диаграммы проточной цитометрии, показывающие эффективность трансдукции и экспрессию CAR на клеточной поверхности Treg. Эффективность трансдукции оценивали по экспрессии GFP, а экспрессию CAR оценивали по экспрессии HA для CD19-CAR (CD8TM/ 4-1BB или TNFR2) или окрашиванию белка L для CD20-CAR (CD8TM/ 4-1BB или TNFR2). MFI: средняя интенсивность флуоресценции.
Фиг.3 показывает вестерн-блот-анализ экспрессии CAR в человеческих Treg, трансдуцированных CD20-CAR (CD8TM/ 4-1BB или TNFR2) или нетрансдуцированных («холостая проба»). Окрашивание специфическим антителом к CD3-дзета выявило эндогенный CD3-дзета с массой 16 кД, CD20-CAR (CD8TM / 4-1BB) с массой ~ 62 кД и CD20-CAR (TNFR2) с массой 82 кД (панель A, вверху слева). Затем мембрану промывали и повторно проводили анализ с антителом к β-актину в качестве контроля загрузки (панель A, внизу слева). Интенсивность полосы количественно определяли с использованием изображения J, и результаты показаны от двух разных доноров на панели B.
Фиг.4 представляет гистограммы, показывающие, что CAR, происходящие из TNFR2, сохраняют CAR-специфическую активацию. На 9 день трансдуцированные Treg FoxP3 высевали по отдельности или в присутствии гранул, покрытых анти-CD3/ анти-CD28, или в присутствии свежеразмороженных аутологичных В-клеток. Через 24 часа CD19-CAR (вверху слева), CD20-CAR (вверху справа) и IL-23R-CAR (внизу) окрашивали на предмет экспрессии на поверхности клеток CD4 и CD69. Планки погрешностей представляют собой среднее значение ± SEM. CTRL: Treg-клетки не трансдуцированы CAR.
Фиг.5 представляет собой график, показывающий, что CAR, происходящие из TNFR2, проявляют эффективную CAR-опосредованную супрессорную активность. Контактно-зависимая супрессия, опосредованная Treg CD19-CAR (панель A), Treg CD20-CAR (панель B) или Treg IL-23R-CAR (панель C) при отсутствии какой-либо активации (пунктирные линии) или после индуцированной В-клетками активации CAR (сплошные линии) оценивали путем измерения пролиферации обычных Т-клеток (Tconv) с использованием проточной цитометрии. Круги представляют конструкции CAR CD8TM/4-1BB, а квадраты представляют конструкции CAR TNFR2. Планки погрешностей представляют собой среднее значение ± стандартная ошибка среднего.
Фиг.6 представляет собой схематический вид конструкций CD19-CAR по изобретению. CAR включает лидерную последовательность CD8 человека (CD8), последовательность scFv (анти-CD19), стрептавидиновую метку (Tag), шарнирный домен (линкер), трансмембранный домен (CD8, TNFR2 или гибридный CD8/TNFR2), костимуляторный внутриклеточный сигнальный домен (фрагменты 4-IBB, TNFR2 или TNFR2) и CD3-дзета (CD3z). Конструкция CAR находится в рамке с кодирующей последовательностью P2A-GFP.
Фиг.7 представляет собой пару графиков, показывающих, что конструкции TNFR2-C-концевой делеции проявляют разные уровни поверхностной экспрессии и функциональны в передаче сигнала CD3z в клетках Jurkat-NFAT. Клетки Jurkat-NFAT трансдуцировали указанными конструкциями. После одной недели культивирования поверхностную экспрессию CAR определяли окрашиванием белка (панель A), и клетки активировали CD19-экспрессирующими клетками Дауди в соотношении 1:1. Через 24 часа определяли секрецию люциферазы, зависимую от NFAT, с помощью люминометра Glowmax (панель B).
Фиг.8 представляет собой набор точечных графиков, показывающих эффективность трансдукции и экспрессию CAR на клеточной поверхности (вверху и внизу слева), и график, показывающий жизнеспособность трансдуцированных клеток CAR-Treg (внизу справа). Эффективность трансдукции на 8-й день (%) оценивали с использованием уровней экспрессии GFP, а плотность CAR (MFI) оценивали с помощью мечения белком-L. Жизнеспособность клеток оценивали с использованием метода исключения пропидия йодида. Планки погрешностей представляют собой среднее значение ± стандартное отклонение.
Фиг.9 представляет собой график, показывающий лиганд-независимую тоническую передачу сигналов и активационную способность анти-CD20 CAR. На 9 день трансдуцированные Treg FoxP3 высевали отдельно («Нет») в присутствии гранул, покрытых анти-CD3/анти-CD28, или в присутствии свежеразмороженных аутологичных В-клеток («В-клетки»). Через 24 часа клетки окрашивали на предмет экспрессии на поверхности клеток CD4 и CD69. Планки погрешностей представляют собой среднее значение ± стандартное отклонение. Для условия «Нет» был проведен статистический анализ с использованием условия GFP в качестве контроля (* p <0,05, ** p <0,01 и *** p <0,001, парный T-тест).
Фиг.10 изображает набор графиков, показывающих, что происходящие из TNFR2 CD20 CAR проявляют эффективную CAR-опосредованную супрессорную активность, но не CD20 CAR, происходящие из 4-1BB и TNFR1. Контакт-зависимую супрессию, опосредованную CAR Treg-клетками в отсутствие какой-либо активации («Нет») или после индуцированной B-клетками активации CAR («B-клетки»), оценивали путем измерения пролиферации обычных T-клеток (Tconv).
Фиг.11 представляет собой набор графиков, показывающих эффективность CAR-опосредованной супрессорной активности. Контактно-зависимая супрессия (%) после индуцированной B-клетками активации CAR с использованием CAR, производных TNFR2 (вверху) или TNFR1 (внизу), была представлена как функция количества клеток CAR-Treg в анализе. Это представление позволяет рассчитать количество CAR-Treg, необходимых для запуска 50% супрессии.
Фиг.12 схематически представляет конструкции HLA-A2-CAR, использованные в Примере 5. CAR включают лидерную последовательность CD8 человека (CD8), последовательность scFv против HLA-A2, шарнирный домен (линкер), трансмембранный домен (TNFR2 или CD8 TM), косигнальный домен (CD28 или TNFR2 или TNFR2+4-1BB) и CD3-дзета (CD3Z). Эти конструкции CAR находятся в рамке с кодирующей последовательностью P2A-GFP.
Фиг.13 изображает точечные диаграммы проточной цитометрии, показывающие эффективность трансдукции и экспрессию CAR на клеточной поверхности Treg. Эффективность трансдукции оценивали по экспрессии GFP, а экспрессию CAR на поверхности клетки оценивали по экспрессии Dextramer®.
Фиг.14 изображает точечные графики проточной цитометрии, показывающие присутствие фенотипических маркеров Treg на HLA*A2 CAR-Treg.
Фиг.15 представляет собой набор графиков, показывающих изменение массы тела (вверху слева), оценку РТПХ (вверху справа) и процент выживания без заболевания (внизу) с течением времени для мышей NSG, которым вводили HLA*A2-CAR-Treg, содержащие TNFR2, CD28 или TNFR2+4-1BB домены.
Подробное описание изобретения
Определения
В настоящем изобретении следующие термины имеют следующие значения:
Термины единственного числа относятся к одному или более чем одному (то есть, по меньшей мере к одному) грамматическому объекту предмета обсуждения. В качестве примера, «элемент» означает один или более одного элемента.
Термин «примерно», когда он относится к измеряемой величине, такой как количество, временная продолжительность и т.п., предназначен для охвата отклонений ±20% или в некоторых случаях ±10%, или в некоторых случаях ±5%, или в некоторых случаях ±1%, или в некоторых случаях ±0,1% от указанного значения, если такие вариации подходят для выполнения раскрытых способов.
Термин «активация» в контексте настоящего описания относится к состоянию Т-клетки (например, регуляторной Т-клетки), которая была достаточно стимулирована, чтобы вызвать обнаруживаемый клеточный ответ. Активация также может быть связана с обнаруживаемой эффекторной функцией (функциями), такой как продукция цитокинов или супрессорная активность. Термин «активированные» регуляторные Т-клетки относится, помимо прочего, к регуляторным Т-клеткам, которые способны подавлять иммунный ответ.
Термин «аффитело» хорошо известен в данной области техники и относится к аффинным белкам на основе домена белка из 58 аминокислотных остатков, происходящего из одного из IgG связывающих доменов стафилококкового белка А.
Термин «аллогенный» относится к любому материалу, полученному от другого субъекта того же вида, что и субъект, которому этот материал вводят. Говорят, что два или более субъекта являются аллогенными по отношению друг к другу, если гены в одном или нескольких локусах не идентичны. В некоторых аспектах аллогенный материал от представителей одного и того же вида может быть достаточно генетически непохожим, чтобы взаимодействовать антигенно.
Термин «антитело» или «иммуноглобулин» (Ig) в контексте настоящего описания относится к последовательности белка или полипептида, полученной из молекулы иммуноглобулина, которая специфически связывается с антигеном. Антитела могут быть поликлональными или моноклональными, многоцепочечными или одноцепочечными, или интактными иммуноглобулинами, и могут быть получены из природных источников или из рекомбинантных источников. Термин «антитело» также включает полиспецифические антитела (например, биспецифические антитела) и фрагменты антител при условии, что они проявляют необходимую биологическую активность. Антитела могут быть мультимерами молекул иммуноглобулинов, такими как тетрамеры молекул иммуноглобулинов.
Базовая четырехцепочечная единица антитела представляет собой гетеротетрамерный гликопротеин, состоящий из двух идентичных легких (L) цепей и двух идентичных тяжелых (H) цепей. L-цепь любого вида позвоночных может быть отнесена к одному из двух четко различающихся типов, называемых каппа (κ) и лямбда (λ), на основе аминокислотных последовательностей их константных доменов (CL). В зависимости от аминокислотной последовательности константного домена их тяжелых цепей (СН) иммуноглобулины можно отнести к разным классам или изотипам. Существует пять классов иммуноглобулинов: IgA, IgD, IgE, IgG и IgM, тяжелые цепи которых обозначены как альфа (α), дельта (δ), эпсилон (ε), гамма (γ) и мю (μ), соответственно. Классы γ и α далее делятся на подклассы на основе относительно незначительных различий в последовательности СН и функции, например, люди экспрессируют следующие подклассы: IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2. Каждая L-цепь связана с H-цепью одной ковалентной дисульфидной связью, тогда как две H-цепи связаны друг с другом одной или несколькими дисульфидными связями в зависимости от изотипа H-цепи. Каждая H- и L-цепь также имеет регулярные внутрицепочечные дисульфидные мостики. Каждая H-цепь имеет на N-конце вариабельный домен (VH), за которым следуют три константных домена (CH) для каждой из цепей α и γ и четыре домена CH для изотипов μ и ε. Каждая L-цепь имеет на N-конце вариабельный домен (VL), за которым следует константный домен (CL) на другом конце. VL выровнен с VH, а CL выровнен с первым константным доменом тяжелой цепи (CH1). Считается, что определенные аминокислотные остатки образуют интерфейс между вариабельными доменами легкой цепи и тяжелой цепи. Спаривание VH и VL обеспечивает единый антигенсвязывающий участок. Антитело IgM состоит из пяти основных гетеротетрамерных единиц вместе с дополнительным полипептидом, называемым J-цепью, и, следовательно, содержит десять антигенсвязывающих участков, в то время как секретируемые антитела IgA могут полимеризоваться с образованием поливалентных комплексов, включающих 2-5 основных 4-цепочечных единицы вместе с J-цепью. В случае IgG размер четырехцепочечной единицы обычно составляет около 150000 дальтон. О структуре и свойствах различных классов антител см., например, Basic and Clinical Immunology, 8th edition, Daniel P. Stites, Abba I. Terr and Tristram G. Parslow (eds.), Appleton & Lange, Norwalk, Conn., 1994, page 71, and Chapter 6.
Термин «моноклональное антитело» в контексте настоящего описания относится к антителу, полученному из популяции по существу однородных антител, т.е. отдельные антитела, входящие в популяцию, идентичны, за исключением возможных встречающихся в природе мутаций, которые могут присутствовать в незначительных количествах. Моноклональные антитела высокоспецифичны и направлены против одного антигенного участка. Кроме того, в отличие от препаратов поликлональных антител, которые включают различные антитела, направленные против разных детерминант (эпитопов), каждое моноклональное антитело направлено против одной детерминанты антигена. Помимо своей специфичности, моноклональные антитела обладают преимуществом в том, что они могут быть синтезированы без загрязнения другими антителами. Определение «моноклональный» не следует истолковывать как требующий получения антитела каким-либо конкретным методом. Например, моноклональное антитело может быть получено гибридомной методологией, впервые описанной Kohler et al., Nature 256: 495 (1975), или может быть получено с использованием методов рекомбинантной ДНК в бактериальных, эукариотических клетках животных или растений (см., например, патент США № 4816567). «Моноклональное антитело» также может быть выделено из библиотек фаговых антител с использованием методик, описанных, например, в Clackson et al., Nature 352: 624-628 (1991) и Marks et al., J. Mol. Biol. 222: 581-597 (1991). Описанные здесь моноклональные антитела включают «химерные» антитела, которые содержат одну или несколько областей из одного антитела (например, не-человеческие вариабельные домены) и одну или несколько областей из одного или нескольких других антител (например, человеческие константные области).
Термин «фрагмент антитела» относится по меньшей мере к одной части интактного антитела, например, к антигенсвязывающей области или вариабельной области интактного антитела, которая сохраняет способность специфически взаимодействовать (например, путем связывания, стерических препятствий, стабилизации/дестабилизации и/или пространственного распределения) с эпитопом антигена. Примеры фрагментов антител включают Fab, Fab', F(ab')2, Fv фрагменты, фрагменты антитела scFv, дисульфидно-связанные Fv (sdFv), фрагмент Fd, состоящий из доменов VH и CHI, линейные антитела, однодоменные антитела, такие как sdAb (либо VL, либо VH), верблюжьи VHH домены, полиспецифические антитела, образованные из фрагментов антител, таких как двухвалентный фрагмент, содержащий два фрагмента Fab, связанные дисульфидным мостиком в шарнирной области, и изолированный CDR или другие эпитоп-связывающие фрагменты антитела, но не ограничиваются ими. Антигенсвязывающий фрагмент также может быть включен в однодоменные антитела, макситела, минитела, нанотела, интратела, диатела, тритела, тетратела, v-NAR и бис-scFv (см., например, Hollinger and Hudson, Nature Biotechnology 23: 1126-1136 (2005)). Антигенсвязывающие фрагменты также могут быть привиты к каркасам на основе полипептидов, таких как фибронектин типа III (см., например, патент США № 6703199, в котором описаны мини-тела полипептида фибронектина). Расщепление антител папаином дает два идентичных антигенсвязывающих фрагмента, называемых «Fab»-фрагментами, и остаточный «Fc»-фрагмент, имеющий обозначение, отражающее способность легко кристаллизоваться. Фрагмент Fab состоит из полной L-цепи вместе с доменом вариабельной области H-цепи (VH) и первым константным доменом одной тяжелой цепи (CH1). Каждый Fab-фрагмент является моновалентным по отношению к связыванию антигена, то есть он имеет единственный антигенсвязывающий участок. Обработка антитела пепсином дает один большой фрагмент F(ab’)2, который примерно соответствует двум дисульфид-связанным фрагментам Fab, обладающим двухвалентной антигенсвязывающей активностью и все еще способным к перекрестному связыванию антигена. Fab’-фрагменты отличаются от Fab-фрагментов наличием нескольких дополнительных остатков на карбокси-конце домена CH1, включая один или несколько цистеинов из шарнирной области антитела. Fab’-SH - это обозначение для Fab’, в котором остаток (остатки) цистеина константных доменов несут свободную тиольную группу. Фрагменты антитела F(ab’)2 первоначально были продуцированы в виде пар фрагментов Fab’, содержащих шарнирные цистеины между собой. Также известны другие химические соединения фрагментов антител.
«Интактное антитело» представляет собой антитело, которое содержит антигенсвязывающий участок, а также CL и по меньшей мере константные домены тяжелой цепи CH1, CH2 и CH3. Константные домены могут быть константными доменами нативной последовательности (например, константными доменами человеческой нативной последовательности) или их вариантами аминокислотной последовательности. Полинуклеотид с «нативной последовательностью» - это полинуклеотид, который имеет ту же нуклеотидную последовательность, что и натуральный полинуклеотид. Полипептид с «нативной последовательностью» представляет собой полипептид, который имеет ту же аминокислотную последовательность, что и полипептид (например, антитело), полученный из природного источника (например, из любого вида). Такие полинуклеотиды и полипептиды с нативной последовательностью могут быть выделены из природных источников или могут быть получены рекомбинантными или синтетическими способами.
Используемый в настоящей заявке термин «функциональный фрагмент или аналог антитела» означает соединение, обладающее качественной биологической активностью, общей с полноразмерным антителом. Например, функциональный фрагмент или аналог анти-IgE-антитела - это фрагмент, который может связываться с иммуноглобулином IgE таким образом, чтобы предотвратить или существенно снизить способность такой молекулы связываться с высокоаффинным рецептором FcεRI.
Термин «тяжелая цепь антитела» относится к большему из двух типов полипептидных цепей, присутствующих в молекулах антител в их естественных конформациях, и обычно определяет класс, к которому принадлежит антитело.
Термин «легкая цепь антитела» относится к меньшему из двух типов полипептидных цепей, присутствующих в молекулах антител в их естественных конформациях. Легкие цепи каппа (κ) и лямбда (λ) относятся к двум основным изотипам легкой цепи антитела.
«Антикалины» хорошо известны в данной области техники и относятся к технологии миметиков антител, в которой специфичность связывания происходит от липокалинов. Антикалины также могут быть отформатированы как белки двойного таргетинга, называемые дуокалинами.
Термин «антиген» или «Ag» относится к молекуле, которая вызывает иммунный ответ. Этот иммунный ответ может включать выработку антител, активацию специфических иммунокомпетентных клеток, или и то, и другое. Специалист в данной области техники поймет, что любая макромолекула, включая практически все белки или пептиды, может служить антигеном. Кроме того, антигены могут происходить из рекомбинантной или геномной ДНК. Специалист в данной области техники поймет, что любая ДНК, которая содержит нуклеотидную последовательность или частичную нуклеотидную последовательность, кодирующую белок, который вызывает иммунный ответ, поэтому кодирует «антиген» в том смысле, в котором этот термин используется в настоящей заявке. Кроме того, специалист в данной области техники поймет, что антиген не обязательно должен кодироваться исключительно полноразмерной нуклеотидной последовательностью гена. Совершенно очевидно, что настоящее изобретение включает, без ограничения, использование частичных нуклеотидных последовательностей более чем одного гена, и что эти нуклеотидные последовательности расположены в различных комбинациях для кодирования полипептидов, которые вызывают необходимый иммунный ответ. Кроме того, специалист в данной области техники поймет, что антиген вовсе не обязательно должен кодироваться «геном». Совершенно очевидно, что антиген может быть синтезирован или может быть получен из биологического образца, или может быть макромолекулой помимо полипептида. Такой биологический образец может включать, например, образец ткани, клетку или жидкость с другими биологическими компонентами, но не ограничивается ими.
Термин «антигенпрезентирующая клетка» или «APC» относится к клетке иммунной системы, такой как дополнительная клетка (например, B-клетка, дендритная клетка и т.п.), которая представляет чужеродный антиген в комплексе с основными комплексами гистосовместимости (MHC) на своей поверхности. Т-клетки могут распознавать эти комплексы с помощью своих Т-клеточных рецепторов (TCR). APC процессируют антигены и презентируют их Т-клеткам.
Термин «аутологичный» относится к любому материалу, полученному от того же субъекта, которому он позже будет повторно введен.
«Авимеры» хорошо известны в данной области техники и относятся к технологии миметиков антител.
Термин «химерный рецептор» или «химерный антигенный рецептор», или «CR», или «CAR» относится к одному полипептиду или к набору полипептидов, обычно двум в простейших вариантах осуществления, которые в иммунной клетке обеспечивают клетку со специфичностью к целевому лиганду и с генерацией внутриклеточного сигнала. В некоторых вариантах осуществления наборы полипептидов примыкают друг к другу. В некоторых вариантах осуществления химерный рецептор представляет собой химерный гибридный белок, содержащий набор полипептидов. В некоторых вариантах осуществления набор полипептидов включает переключатель димеризации, который в присутствии молекулы димеризации может связывать полипептиды друг с другом, например, может связывать лиганд-связывающий домен с внутриклеточным сигнальным доменом. В некоторых вариантах осуществления химерный рецептор содержит необязательную лидерную последовательность на амино-конце (N-ter) гибридного белка химерного рецептора. В некоторых вариантах осуществления химерный рецептор содержит лидерную последовательность на N-конце внеклеточного лиганд-связывающего домена, где лидерная последовательность при необходимости отщепляется от лиганд-связывающего домена во время клеточного процессинга и локализации химерного рецептора на клеточной мембране.
Термин «консервативные модификации последовательности» относится к аминокислотным модификациям, которые существенно не влияют или не изменяют биологическую функцию белка, содержащего аминокислотную последовательность. Такие консервативные модификации включают аминокислотные замены, добавления и делеции. В белок можно ввести модификации стандартными методами, известными в данной области техники, такими как сайт-направленный мутагенез и ПЦР-опосредованный мутагенез. «Консервативные аминокислотные замены» представляют собой замены, в которых аминокислотный остаток заменен аминокислотным остатком, который имеет аналогичные свойства, так что специалист в области химии пептидов может ожидать, что вторичная структура и гидропатическая природа полипептида будут сохранены без существенных изменений. Таким образом, аминокислотные замены обычно основаны на относительном сходстве аминокислотных заместителей в боковой цепи, например, на их гидрофобности, гидрофильности, заряде, размере и т.п. Примеры замен, которые принимают во внимание различные из вышеперечисленных характеристик, хорошо известны специалистам в данной области техники и включают: аргинин и лизин; глутамат и аспартат; серин и треонин; глутамин и аспарагин; и валин, лейцин и изолейцин. Аминокислотные замены могут быть дополнительно выполнены на основе сходства полярности, заряда, растворимости, гидрофобности, гидрофильности и/или амфипатической природы остатков. Например, отрицательно заряженные аминокислоты включают аспарагиновую кислоту и глутаминовую кислоту; положительно заряженные аминокислоты включают лизин и аргинин; и аминокислоты с незаряженными полярными головными группами, имеющими сходные значения гидрофильности, включают лейцин, изолейцин и валин; глицин и аланин; аспарагин и глутамин; и серин, треонин, фенилаланин и тирозин. Другие группы аминокислот, которые могут представлять консервативные изменения, включают: (1) Ala, Pro, Gly, Glu, Asp, Gln, Asn, Ser, Thr; (2) Cys, Ser, Tyr, Thr; (3) Val, Ile, Leu, Met, Ala, Phe; (4) Lys, Arg, His; и (5) Phe, Tyr, Trp, His. Другие семейства аминокислотных остатков, имеющих аналогичные боковые цепи, были определены в данной области техники. Эти семейства включают аминокислоты с основными боковыми цепями (например, лизин, аргинин, гистидин), кислотными боковыми цепями (например, аспарагиновую кислоту, глутаминовую кислоту), незаряженными полярными боковыми цепями (например, глицин, аспарагин, глутамин, серин, треонин, тирозин, цистеин, триптофан), неполярными боковыми цепями (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин), бета-разветвленными боковыми цепями (например, треонин, валин, изолейцин) и ароматическими боковыми цепями (например, тирозин, фенилаланин, триптофан, гистидин). Таким образом, один или несколько аминокислотных остатков в химерном рецепторе по изобретению могут быть заменены другими аминокислотными остатками из того же семейства боковых цепей, и измененный химерный рецептор может быть протестирован с использованием функциональных анализов, описанных в настоящей заявке.
Термин «конститутивный промотор» относится к нуклеотидной последовательности, которая, когда она функционально связана с полинуклеотидом, кодирующим или определяющим продукт гена, вызывает выработку продукта гена в клетке при большинстве или всех физиологических условиях в клетке.
Термин «костимуляторная молекула» относится к родственному партнеру связывания на Т-клетке, который специфически связывается с костимуляторным лигандом, тем самым опосредуя костимуляторный ответ Т-клетки, такой как пролиферация, но не ограничиваясь этим. Костимуляторные молекулы - это молекулы клеточной поверхности, отличные от рецепторов антигенов или их лигандов, которые способствуют эффективному иммунному ответу. Костимуляторный сигнальный домен может быть внутриклеточной частью костимуляторной молекулы. Костимуляторная молекула может быть представлена в следующих семействах белков: белки рецептора TNF, иммуноглобулиноподобные белки, рецепторы цитокинов, интегрины, сигнальные молекулы активации лимфоцитов (белки SLAM) и активирующие рецепторы NK-клеток.
«Цитотоксическая клетка» включает любую клетку, способную опосредовать цитотоксический ответ.
Термин «полученный из» в контексте настоящего описания указывает на взаимосвязь между первой и второй молекулами. Обычно это относится к структурному сходству между первой молекулой и второй молекулой, и не подразумевает и не включает ограничение процесса или источника для первой молекулы, которая является производной второй молекулы. Например, в случае внутриклеточного сигнального домена, который происходит из молекулы CD3-дзета, внутриклеточный сигнальный домен сохраняет достаточную структуру CD3-дзета, которая выполняет требуемую функцию, а именно способность генерировать сигнал при соответствующих условиях. Он не подразумевает и не включает ограничение конкретного процесса получения внутриклеточного сигнального домена, например, это не означает, что для обеспечения внутриклеточного сигнального домена нужно начинать с последовательности CD3-дзета и удалять нежелательную последовательность или вводить мутации, чтобы добраться до внутриклеточного сигнального домена.
Термин «диатела» относится к небольшим фрагментам антител, полученным путем конструирования фрагментов sFv с короткими линкерами (примерно 5-10 остатков) между доменами VH и VL, так что достигается межцепочечное, но не внутрицепочечное спаривание V-доменов, в результате чего получается двухвалентный фрагмент, то есть фрагмент, имеющий два антигенсвязывающих участка. Биспецифические диатела представляют собой гетеродимеры двух «кроссоверных» фрагментов sFv, в которых домены VH и VL двух антител присутствуют на разных полипептидных цепях. Диатела описаны более полно, например, в EP 0404097; WO 93/11161; и Holliger et al., Proc. Natl. Акад. Sci. USA, 90: 6444-6448 (1993).
«Доменное антитело» хорошо известно в данной области техники и относится к наименьшей функциональной связывающей единице антитела, соответствующей вариабельной области тяжелой или легкой цепи антитела.
Термин «кодирование» относится к неотъемлемому свойству конкретных последовательностей нуклеотидов в полинуклеотиде, таком как ген, кДНК или мРНК, служить в качестве матриц для синтеза других полимеров и макромолекул в биологических процессах, имеющих либо определенную последовательность нуклеотидов (например, рРНК, тРНК и мРНК) или определенную последовательность аминокислот и следующие из этого биологические свойства. Таким образом, ген, кДНК или РНК кодирует белок, если транскрипция и трансляция мРНК, соответствующей этому гену, продуцируют белок в клетке или другой биологической системе. Как кодирующая цепь, нуклеотидная последовательность которой идентична последовательности мРНК и обычно представлена в перечнях последовательностей, так и некодирующая цепь, используемая в качестве матрицы для транскрипции гена или кДНК, может называться кодирующей белок или другой продукт этого гена или кДНК. Если не указано иное, «нуклеотидная последовательность, кодирующая аминокислотную последовательность» включает все нуклеотидные последовательности, которые являются вырожденными версиями друг друга и кодируют одну и ту же аминокислотную последовательность. Фраза «нуклеотидная последовательность, кодирующая белок или РНК» может также включать интроны в той степени, в которой нуклеотидная последовательность, кодирующая белок, может в некоторой версии содержать интрон (интроны).
Термин «эндогенный» относится к любому материалу, который естественным образом происходит, или производится в организме, клетке, ткани или системе естественным путем.
Термин «сконструированный» или «модифицированный» относится к клетке, которая была трансфицирована, трансформирована или трансдуцирована.
Термин «экзогенный» относится к любому материалу, введенному в организм, клетку, ткань или систему, или произведенному вне их.
Термин «экспрессия» относится к транскрипции и/или трансляции определенной нуклеотидной последовательности, управляемой промотором.
Термин «вектор экспрессии» относится к вектору, включающему рекомбинантный полинуклеотид, содержащий последовательность контроля экспрессии, функционально связанную с нуклеотидной последовательностью, которая должна быть экспрессирована. Вектор экспрессии содержит достаточное количество цис-действующих элементов для экспрессии; другие элементы для экспрессии могут поставляться клеткой-хозяином или в системе экспрессии in vitro. Векторы экспрессии включают все известные в данной области техники, в том числе космиды, плазмиды (например, депротеинизированные или содержащиеся в липосомах), транспозоны (например, «спящие красавицы») и вирусы (например, лентивирусы, ретровирусы, аденовирусы и аденоассоциированные вирусы), которые включают рекомбинантный полинуклеотид.
Термин полинуклеотидный «фрагмент», используемый в настоящей заявке, означает полинуклеотид, который обычно отличается от полинуклеотида, конкретно раскрытого в настоящей заявке, одной или несколькими делециями. Такие фрагменты могут встречаться в природе или могут быть получены синтетически, например, путем модификации одной или нескольких полинуклеотидных последовательностей по изобретению и оценки одной или нескольких биологических активностей кодируемого фрагмента, как описано в настоящей заявке, и/или с использованием любого из числа методов, хорошо известных в данной области техники. Соответственно, термин «полипептидный фрагмент», используемый в настоящей заявке, представляет собой полипептид, который обычно отличается от полипептида, конкретно описанного в настоящей заявке, одной или несколькими делециями. Такие фрагменты могут быть встречающимися в природе или могут быть получены синтетически, например, путем модификации одной или нескольких полипептидных последовательностей по изобретению и оценки одной или нескольких биологических активностей полипептида, как описано в настоящей заявке, и/или с использованием любого из ряда методов, хорошо известных в данной области техники. В структуру полинуклеотидов и полипептидов по настоящему изобретению можно вносить модификации, которые при этом приводят к функциональной молекуле, которая кодирует или является фрагментом полипептида с необходимыми характеристиками и без заметной потери биологической полезности или активности. В некоторых вариантах осуществления полипептидные фрагменты отличаются от нативной последовательности делецией менее 50, 40, 30, 20, 10, 9, 8, 7, 6, 5, 4, 3, 2 или 1 аминокислоты. Фрагменты также (или альтернативно) можно модифицировать, например, путем делеции аминокислот, которые имеют минимальное влияние на иммуногенность, вторичную структуру и гидропатическую природу полипептида.
«Fc» фрагмент антитела включает карбокси-концевые части обеих Н-цепей, удерживаемые вместе дисульфидами. Эффекторные функции антител определяются последовательностями в Fc области, которая также является частью, распознаваемой рецепторами Fc (FcR), обнаруженными на определенных типах клеток.
«Fv» представляет собой минимальный фрагмент антитела, который содержит полный сайт распознавания и связывания антигена. Этот фрагмент состоит из димера одного вариабельного домена тяжелой и одного легкого цепей в тесной нековалентной связи. В результате фолдинга этих двух доменов образуются шесть гипервариабельных петель (по три петли от H- и L-цепи), которые вносят аминокислотные остатки для связывания антигена и придают антителу специфичность связывания антигена. Однако даже один вариабельный домен (или половина Fv, содержащая только три CDR, специфичных для антигена) может обладать способностью распознавать и связывать антиген, хотя и с более низкой аффинностью, чем весь сайт связывания.
«Каркасные» или «FR» остатки представляют собой те остатки вариабельного домена, которые отличаются от остатков гипервариабельной области, определенных в настоящей заявке.
Термин «болезнь трансплантат против хозяина» или «РТПХ» в контексте настоящего описания относится к медицинскому осложнению после получения трансплантированной ткани от генетически отличающегося субъекта. Иммунные клетки в донорской ткани (трансплантате) распознают реципиента (хозяина) как чужеродного. Затем трансплантированные иммунные клетки атакуют клетки организма хозяина. РТПХ обычно ассоциируется с трансплантацией стволовых клеток; однако этот термин включает РТПХ, возникающую из других форм тканевого трансплантата. РТПХ также может развиться после переливания крови.
Термин «гомология» или «идентичность» относится к идентичности последовательности субъединицы между двумя полимерными молекулами, например, между двумя нуклеиновокислотными молекулами, такими как две молекулы ДНК или две молекулы РНК, или между двумя полипептидными молекулами. Когда положение субъединицы в обеих из двух молекул занято одной и той же мономерной субъединицей; например, если положение в каждой из двух молекул ДНК занято аденином, то они гомологичны или идентичны в этом положении. Гомология между двумя последовательностями является прямой функцией количества совпадающих или гомологичных положений; например, если половина (например, пять положений в полимере длиной десять субъединиц) положений в двух последовательностях гомологичны, эти две последовательности гомологичны на 50%; если 90% положений (например, 9 из 10) совпадают или гомологичны, две последовательности гомологичны на 90%. Таким образом, термин «гомологичный» или «идентичный», когда используется во взаимосвязи между последовательностями двух или более полипептидов, или двух или более молекул нуклеиновых кислот, относится к степени родства последовательностей между полипептидными или нуклеиновокислотными молекулами, как определено, по количеству совпадений между цепями из двух или более аминокислотных или нуклеотидных остатков. «Идентичность» измеряет процент идентичных совпадений между меньшей из двух или более последовательностей с выравниванием гэпов (если таковые имеются), которые учитываются с помощью конкретной математической модели или компьютерной программы (то есть «алгоритмов»). Идентичность родственных полипептидов можно легко вычислить известными методами. Такие методы включают методы, описанные в Computational Molecular Biology, Lesk, A. M., ed., Oxford University Press, New York, 1988; Biocomputing: Informatics and Genome Projects, Smith, D. W., ed., Academic Press, New York, 1993; Computer Analysis of Sequence Data, Part 1, Griffin, A. M., and Griffin, H. G., eds., Humana Press, New Jersey, 1994; Sequence Analysis in Molecular Biology, von Heinje, G., Academic Press, 1987; Sequence Analysis Primer, Gribskov, M. and Devereux, J., eds., M. Stockton Press, New York, 1991; and Carillo et al., SIAM J. Applied Math. 48:1073 (1988), но не ограничиваются ими. Предпочтительные методы определения идентичности разработаны для обеспечения максимального совпадения между тестируемыми последовательностями. Методы определения идентичности описаны в общедоступных компьютерных программах. Примеры компьютерных программных методов для определения идентичности двух последовательностей включают программный пакет GCG, в том числе GAP (Devereux et al., Nucl. Acid. Res. 12: 387 (1984); Genetics Computer Group, Университет Висконсина, Мэдисон, Висконсин), BLASTP, BLASTN и FASTA (Altschul et al., J. Mol. Biol. 215: 403-410 (1990)). Программа BLASTX находится в открытом доступе в Национальном центре биотехнологической информации (NCBI) и в других источниках (BLAST Manual, Altschul et al. NCB/NLM/NIH Bethesda, Md. 20894; Altschul et al., выше). Для определения идентичности также можно использовать хорошо известный алгоритм Смита-Ватермана.
Термин «гуманизированный», поскольку он относится к формам нечеловеческих (например, мышиных) антител, относится к химерным иммуноглобулинам, цепям иммуноглобулинов или их фрагментам (таким как Fv, Fab, Fab', F(ab')2 или другие антигенсвязывающие подпоследовательности антител), которые содержат минимальную последовательность, полученную из нечеловеческих иммуноглобулинов. По большей части гуманизированные антитела и их фрагменты являются человеческими иммуноглобулинами (реципиентным антителом или фрагментом антитела), в которых остатки из гипервариабельной области (CDR) реципиента заменены остатками из CDR не относящегося к человеку вида (донорского антитела), такого как мышь, крыса или кролик, имеющего необходимую специфичность, аффинность и емкость. В некоторых случаях остатки каркасной области (FR) Fv иммуноглобулина человека заменяют соответствующими остатками нечеловеческого происхождения. Кроме того, гуманизированное антитело/фрагмент антитела может содержать остатки, которых нет ни в антителе-реципиенте, ни в импортированных последовательностях CDR или каркасной области. Эти модификации могут дополнительно улучшать и оптимизировать характеристики антитела или фрагмента антитела. Как правило, гуманизированное антитело или его фрагмент антитела будет включать практически все из по меньшей мере одного, а обычно двух вариабельных доменов, в которых все или практически все области CDR соответствуют областям не-человеческого иммуноглобулина, и все или значительная часть областей FR является последовательностью иммуноглобулина человека. Гуманизированное антитело или фрагмент антитела также может содержать по меньшей мере часть константной области иммуноглобулина (Fc), обычно иммуноглобулина человека. Для получения дополнительных сведений см., например, Jones et al., Nature 321:522-525 (1986); Reichmann et al., Nature, 332:323-329 (1988); Presta, Curr. Op. Struct. Biol. 2:593-596 (1992).
Используемый в настоящей заявке термин «иммунные клетки» обычно включает белые кровяные клетки (лейкоциты), которые происходят из гемопоэтических стволовых клеток (HSC), продуцируемых в костном мозге. Примеры иммунных клеток включают лимфоциты (Т-клетки, В-клетки и клетки-натуральные киллеры (NK)) и клетки миелоидного происхождения (нейтрофилы, эозинофилы, базофилы, моноциты, макрофаги и дендритные клетки), но не ограничиваются ими.
Используемый в настоящей заявке термин «иммунная эффекторная клетка» относится к клетке иммунной системы, которая находится в форме, способной вызывать специфический иммунный ответ.
Используемый в настоящей заявке термин «иммунная регуляторная клетка» относится к иммунной клетке, которая действует «регуляторным» образом, подавляя активацию иммунной системы и, таким образом, поддерживает гомеостаз иммунной системы и толерантность к аутоантигенам. «Регуляторные иммунные клетки» также могут оказывать влияние на неиммунные клетки, что приводит к улучшению клинического состояния, например, способствует восстановлению или регенерации тканей. Регуляторные иммунные клетки могут включать регуляторные Т-клетки (например, регуляторные CD4+ Т-клетки, регуляторные CD8+ Т-клетки, регуляторные γδ Т-клетки и/или регуляторные DN Т-клетки), регуляторные В-клетки, регуляторные NK-клетки, регуляторные макрофаги, и регуляторные дендритные клетки, но не ограничиваются ими.
Используемый в настоящей заявке термин «иммунный ответ» включает иммунные ответы, опосредованные Т-клетками и/или В-клетками. Типичные иммунные ответы включают ответы Т-клеток, например, пролиферацию, продукцию цитокинов и клеточную цитотоксичность. Кроме того, термин «иммунный ответ» включает иммунные ответы, на которые косвенно влияет активация Т-клеток, например, продукция антител (гуморальные ответы) и активация цитокин-чувствительных клеток, например, макрофагов. Иммунные клетки, вовлеченные в иммунный ответ, включают лимфоциты, такие как B-клетки и T-клетки (CD4+, CD8+, Th1 и Th2 клетки); антигенпрезентирующие клетки (например, профессиональные антигенпрезентирующие клетки, такие как дендритные клетки, макрофаги, В-лимфоциты, клетки Лангерганса, и непрофессиональные антигенпрезентирующие клетки, такие как кератиноциты, эндотелиальные клетки, астроциты, фибробласты, олигодендроциты); клетки-натуральные киллеры; и миелоидные клетки, такие как макрофаги, эозинофилы, тучные клетки, базофилы и гранулоциты.
Используемый в настоящей заявке термин «иммунная аккомодация» относится к состоянию реципиента трансплантата, при котором трансплантат органа или ткани функционирует нормально, несмотря на присутствие у реципиента антител, специфичных для трансплантата органа или ткани.
Используемый в настоящей заявке термин «иммунологическая толерантность» или «иммунная толерантность» относится к (а) пониженному уровню специфического иммунологического ответа (который, как считается, опосредован, по меньшей мере частично, антиген-специфическими эффекторными Т-лимфоцитами, В-лимфоцитами, антителами или их эквивалентами); (b) задержке возникновения или прогрессирования специфического иммунологического ответа; или (c) сниженному риску возникновения или прогрессирования специфического иммунологического ответа в одной популяции субъектов (например, у субъектов, прошедших лечение, такое как лечение, описанное в настоящей заявке) по сравнению с другой популяцией субъектов (например, субъектов, не проходивших лечение). «Специфическая» иммунологическая или иммунная толерантность возникает, когда иммунологическая или иммунная толерантность преимущественно вызывается против определенных антигенов по сравнению с другими.
Используемый в настоящей заявке термин «РНК, транскрибируемая in vitro» относится к РНК, например, мРНК, которая была синтезирована in vitro. Обычно РНК, транскрибируемая in vitro, генерируется из вектора транскрипции in vitro. Вектор транскрипции in vitro содержит матрицу, которая используется для создания транскрибируемой РНК in vitro.
Термин «индуцибельный» промотор относится к нуклеотидной последовательности, которая, когда она функционально связана с полинуклеотидом, кодирующим или специфицирующим продукт гена, вызывает выработку продукта гена в клетке, по существу только в том случае, когда индуктор, соответствующий промотору, присутствует в клетке.
В контексте настоящей заявки «5'-кэп» (также называемый кэпом РНК, 7-метилгуанозиновым кэпом РНК или m7G кэпом РНК) означает модифицированный гуаниновый нуклеотид, который был добавлен к «переднему» или 5'-концу эукариотической матричной РНК вскоре после начала транскрипции. 5’ кэп состоит из концевой группы, которая связана с первым транскрибированным нуклеотидом. Его присутствие критично для распознавания рибосомой и защиты от РНКаз. Добавление кэпа связано с транскрипцией и происходит совместно с транскрипцией, так что одно влияет на другое. Вскоре после начала транскрипции 5’-конец синтезируемой мРНК связывается кэп-синтезирующим комплексом, ассоциированным с РНК-полимеразой. Этот ферментативный комплекс катализирует химические реакции, необходимые для кэпирования мРНК. Синтез протекает как многоступенчатая биохимическая реакция. Кэпирующий фрагмент можно модифицировать, чтобы модулировать функциональность мРНК, такую как ее стабильность или эффективность трансляции.
В контексте настоящего изобретения используются следующие сокращения для обычно встречающихся оснований нуклеиновых кислот. «А» относится к аденину, «С» относится к цитозину, «G» относится к гуанину, «Т» относится к тимину, а «U» относится к урацилу.
Термин «информационный материал» включает публикацию, запись, схему или любой другой носитель выражения, который можно использовать для сообщения о полезности или использовании композиций и способов по изобретению. Информационный материал набора по изобретению может, например, быть прикреплен к контейнеру, который содержит нуклеиновую кислоту, вектор, популяцию клеток или композицию по изобретению, или может быть отправлен вместе с контейнером, который содержит нуклеиновую кислоту, вектор, популяцию клеток или композицию по настоящему изобретению. В качестве альтернативы, информационный материал может быть доставлен отдельно от контейнера с намерением, чтобы контейнер и информационный материал были использованы получателем совместно.
Термин «внутриклеточный сигнальный домен», используемый в настоящей заявке, относится к внутриклеточной части молекулы. Внутриклеточный сигнальный домен генерирует сигнал, который способствует иммунной эффекторной функции клетки, содержащей химерный рецептор. Примеры иммунной эффекторной функции в химерной рецепторной Т-клетке могут включать цитолитическую активность, супрессорную активность, регуляторную активность и хелперную активность, в том числе секрецию цитокинов.
Термин «изолированный» означает измененное или удаленное от естественного состояния. Например, нуклеиновая кислота или пептид, естественно присутствующие у живого животного, не «изолированы», но та же самая нуклеиновая кислота или пептид, частично или полностью отделенные от сосуществующих материалов в их естественном состоянии, «изолированы». Изолированная нуклеиновая кислота или пептид могут существовать в практически очищенной форме или могут существовать в ненативной среде, такой как, например, клетка-хозяин. Как правило, препарат изолированной нуклеиновой кислоты или пептида содержит нуклеиновую кислоту или пептид с чистотой по меньшей мере 80%, чистотой по меньшей мере 85%, чистотой по меньшей мере 90%, чистотой по меньшей мере 95%, чистотой более 95%, чистотой более примерно 96%, чистотой более примерно 97%, чистотой более примерно 98% или чистотой более примерно 99%. «Изолированный полипептид» - это полипептид, который был идентифицирован и выделен и/или извлечен из компонента его естественной среды.
«Изолированная нуклеиновая кислота» или «изолированная нуклеиновая последовательность» представляет собой нуклеиновую кислоту, которая по существу отделена от других геномных последовательностей ДНК, а также от белков или комплексов, таких как рибосомы и полимеразы, которые естественным образом сопровождают нативную последовательность. Термин охватывает нуклеиновокислотную последовательность, которая была удалена из ее естественного окружения, и включает рекомбинантные или клонированные изоляты ДНК и химически синтезированные аналоги, или аналоги, биологически синтезированные гетерологичными системами. Практически чистая нуклеиновая кислота включает изолированные формы нуклеиновой кислоты. Конечно, это относится к первоначально изолированной нуклеиновой кислоте и не исключает гены или последовательности, позже добавленные к изолированной нуклеиновой кислоте рукой человека. В некоторых вариантах осуществления изолированная нуклеиновая кислота или выделенная нуклеиновая последовательность не встречается в природе.
«Изолированный полипептид» - это полипептид, который был идентифицирован и выделен и/или извлечен из компонента его естественного окружения. В некоторых вариантах осуществления выделенный полипептид будет очищен (1) до более чем 95% по массе полипептида, как определено методом Лоури, и в конкретных вариантах осуществления до более чем 99% по массе; (2) до степени, достаточной для получения по меньшей мере 15 остатков N-концевой или внутренней аминокислотной последовательности с использованием секвенатора с вращающимся стаканом; или (3) до гомогенности с помощью ДСН-ПААГ в восстанавливающих или невосстанавливающих условиях с использованием красителя кумасси синего или, в некоторых вариантах осуществления, окрашивания серебром. Изолированный полипептид включает полипептид in situ в рекомбинантных клетках, поскольку по меньшей мере один компонент природного окружения полипептида не будет присутствовать. В некоторых вариантах осуществления изолированный полипептид будет получен по меньшей мере на одной стадии очистки. В некоторых вариантах осуществления изолированный полипептид не встречается в природе.
Термин «лентивирус» относится к роду семейства Retroviridae. Лентивирусы уникальны среди ретровирусов тем, что способны инфицировать неделящиеся клетки. Поскольку они могут доставлять значительный объем генетической информации в ДНК клетки-хозяина, они являются одними из наиболее эффективных векторов доставки генов. ВИЧ, SIV и FIV - все это примеры лентивирусов.
Термин «лентивирусный вектор» относится к вектору, полученному по меньшей мере из части генома лентивируса, включая, например, самоинактивирующийся лентивирусный вектор, предложенный Milone et al., Mol. Ther. 17 (8): 1453-1464 (2009). Другие примеры лентивирусных векторов, которые можно использовать в клинике, включают технологию доставки генов LENTIVECTOR® от Oxford BioMedica и векторную систему LENTIMAX ™ от Lentigen, но не ограничиваются ими. Доклинические типы лентивирусных векторов также доступны и известны специалисту в данной области техники.
Термин «лиганд» относится к члену пары лиганд/рецептор, связывающемуся с другим членом пары (рецептором).
Термин «нуклеиновая кислота» или «полинуклеотид» относится к полимеру из нуклеотидов, ковалентно связанных фосфодиэфирными связями, таким как дезоксирибонуклеиновые кислоты (ДНК) или рибонуклеиновые кислоты (РНК), в одноцепочечной или двухцепочечной форме. Если специально не ограничено, термин охватывает нуклеиновые кислоты, содержащие известные аналоги природных нуклеотидов, которые имеют такие же связывающие свойства, что и эталонная нуклеиновая кислота, и метаболизируются аналогично природным нуклеотидам. Если не указано иное, конкретная нуклеиновокислотная последовательность также неявно включает ее консервативно модифицированные варианты (например, замены вырожденных кодонов), аллели, ортологи, SNP и комплементарные последовательности, а также явно указанную последовательность. В частности, замены вырожденных кодонов могут быть достигнуты путем создания последовательностей, в которых третье положение одного или нескольких выбранных (или всех) кодонов заменено остатками смешанных оснований и/или дезоксиинозина (Batzer et al., Nucleic Acid Res. 19: 5081 (1991); Ohtsuka et al., J. Biol. Chem. 260: 2605-2608 (1985); и Rossolini et al., Mol. Cell. Probes 8: 91-98 (1994)).
«Нанотело» хорошо известно в данной области техники и относится к полученному из антитела терапевтическому белку, который обладает уникальными структурными и функциональными свойствами природных антител тяжелой цепи. Эти антитела тяжелой цепи содержат один вариабельный домен (VHH) и два константных домена (CH2 и CH3).
Полинуклеотид с «нативной последовательностью» представляет собой полинуклеотид, который имеет ту же нуклеотидную последовательность, что и полинуклеотид природного происхождения. Полипептид с «нативной последовательностью» представляет собой полипептид, который имеет ту же аминокислотную последовательность, что и полипептид (например, антитело), полученный из природы (например, из любого вида). Такие полинуклеотиды и полипептиды с нативной последовательностью могут быть выделены из природных источников или могут быть получены рекомбинантными или синтетическими способами.
Термин «функционально связанный» или «контроль транскрипции» относится к функциональной связи между регуляторной последовательностью и гетерологичной нуклеиновокислотной последовательностью, приводящей к экспрессии последней. Например, первая нуклеиновокислотная последовательность функционально связана со второй нуклеиновокислотной последовательностью, когда первая нуклеиновокислотная последовательность находится в функциональной связи со второй нуклеиновокислотной последовательностью. Например, промотор функционально связан с кодирующей последовательностью, если промотор влияет на транскрипцию или экспрессию кодирующей последовательности. Функционально связанные последовательности ДНК могут быть смежными друг с другом и, например, если необходимо соединить две области, кодирующие белок, могут находиться в одной рамке считывания.
Термины «пептид», «полипептид» и «белок» используются взаимозаменяемо и относятся к соединению, состоящему из аминокислотных остатков, ковалентно связанных пептидными связями. Белок или пептид должен содержать по меньшей мере две аминокислоты, и не накладывается никаких ограничений на максимальное количество аминокислот, которые могут составлять последовательность белка или пептида. Полипептиды включают любой пептид или белок, состоящий из двух или более аминокислот, связанных друг с другом пептидными связями. Используемый здесь термин относится, например, как к коротким цепям, которые также обычно называют в данной области пептидами, олигопептидами и олигомерами, так и к более длинным цепям, которые обычно называются в данной области белками, относящимся к многим типам. «Полипептиды» включают, например, биологически активные фрагменты, по существу гомологичные полипептиды, олигопептиды, гомодимеры, гетеродимеры, полипептидные варианты, модифицированные полипептиды, производные, аналоги и гибридные белки, среди прочего. Полипептид включает природный пептид, рекомбинантный пептид или их комбинацию.
Термин «фармацевтически приемлемое вспомогательное вещество» или «фармацевтически приемлемый носитель» относится к вспомогательному веществу, которое не вызывает неблагоприятной, аллергической или другой нежелательной реакции при введении животному, например, человеку. Он включает любые и все растворители, дисперсионные среды, покрытия, антибактериальные и противогрибковые агенты, изотонические агенты и агенты, замедляющие абсорбцию, и т.п. Для введения человеку препараты должны соответствовать стандартам стерильности, пирогенности, общей безопасности и чистоты, которые требуются регулирующими органами, такими как, например, FDA Office или EMA.
Термин «поли(A)» относится к ряду аденозина монофосфата, присоединенного к мРНК. В некоторых вариантах осуществления конструкции для временной экспрессии полиА представляет собой от 50 до 5000 аденозинов монофосфатов, например, 64 или более, 100 или более, или 300 или 400 или более аденозинов монофосфатов. Последовательности поли(A) можно модифицировать химически или ферментативно для модуляции функциональности мРНК, такой как локализация, стабильность или эффективность трансляции.
Термин «полиаденилирование» относится к ковалентной связи полиаденилильного фрагмента или его модифицированного варианта с молекулой матричной РНК. В эукариотических организмах большинство молекул матричной РНК (мРНК) полиаденилировано на 3’-конце. 3’ поли(A) хвост представляет собой длинную последовательность адениновых нуклеотидов (часто несколько сотен), добавленных к пре-мРНК под действием фермента полиаденилат-полимеразы. У высших эукариот поли(А) хвост добавляется к транскриптам, которые содержат определенную последовательность, сигнал полиаденилирования. Поли(A) хвост и связанный с ним белок помогают защитить мРНК от разрушения экзонуклеазами. Полиаденилирование также важно для терминации транскрипции, экспорта мРНК из ядра и трансляции. Полиаденилирование происходит в ядре сразу после транскрипции ДНК в РНК, но, кроме того, может происходить и позже в цитоплазме. После завершения транскрипции цепь мРНК расщепляется под действием эндонуклеазного комплекса, связанного с РНК-полимеразой. Сайт расщепления обычно характеризуется наличием последовательности оснований AAUAAA рядом с сайтом расщепления. После расщепления мРНК остатки аденозина добавляются к свободному 3’-концу в сайте расщепления.
Термин «промотор» относится к последовательности ДНК, распознаваемой синтетическим аппаратом клетки или введенным синтетическим аппаратом, необходимой для инициации специфической транскрипции полинуклеотидной последовательности.
Термин «промоторная/регуляторная последовательность» относится к нуклеиновокислотной последовательности, которая требуется для экспрессии продукта гена, функционально связанного с промоторной/регуляторной последовательностью. В некоторых случаях эта последовательность может быть коровой промоторной последовательностью, а в других случаях эта последовательность может также включать энхансерную последовательность и другие регуляторные элементы, которые требуются для экспрессии продукта гена. Промоторная/регуляторная последовательность может, например, быть последовательностью, которая экспрессирует продукт гена тканеспецифическим образом.
Термин «рекомбинантный белок или пептид» относится к белку или пептиду (например, антителу), который генерируют с использованием технологии рекомбинантной ДНК, такому как, например, белок или пептид (например, антитело), экспрессируемый бактериофагом или системой экспрессии дрожжей. Термин также следует толковать как обозначение белка или пептида (например, антитела), который был получен путем синтеза молекулы ДНК, кодирующей белок или пептид (например, антитело), где молекула ДНК экспрессирует белок или пептид (например, антитело), или аминокислотной последовательности, определяющей белок или пептид (например, антитело), где ДНК или аминокислотная последовательность была получена с использованием технологии рекомбинантной ДНК или аминокислотной последовательности, которая доступна и хорошо известна в данной области техники.
Термины «регуляторный Т-лимфоцит», «регуляторная Т-клетка», «Т-регуляторная клетка», «Treg-клетка» и «Treg», используемые в настоящем изобретении, являются синонимами и предназначены для использования в стандартном определении, как принято в данной области техники. Treg-клетки представляют собой специализированную субпопуляцию Т-клеток, которые действуют «регуляторным» образом, подавляя активацию иммунной системы и тем самым поддерживая гомеостаз иммунной системы и толерантность к аутоантигенам. Treg иногда называют супрессорными Т-клетками. Treg-клетки часто, но не всегда, характеризуются экспрессией фактора транскрипции FoxP3 семейства Forkhead (Forkhead box P3). Они также могут экспрессировать поверхностные белки CD4 или CD8. Обычно они также экспрессируют CD25. Treg часто имеют фенотип CD4+CD25+CD127loFoxP3+. В некоторых вариантах осуществления Treg также представляют собой CD45RA+, CD62Lhi и/или GITR+. В конкретных вариантах осуществления Treg также представляют собой CD4+CD25+CD127loCD62L+ или CD4+CD45RA+CD25hiCD127lo. Как используется в настоящем изобретении, и если не указано иное, Treg включают «натуральные» Treg, которые развиваются в тимусе, индуцированные/ адаптивные/ периферические Treg, которые возникают в результате процесса дифференцировки, происходящего вне тимуса (например, в тканях или вторичных лимфоидных органах, или в лабораторных установках при определенных условиях культивирования), и Tregs, которые были созданы с использованием технологии рекомбинантной ДНК. Встречающиеся в природе Treg-клетки (CD4+CD25+FoxP3+) возникают, как и все другие Т-клетки в тимусе. Напротив, индуцированные/ адаптивные/ периферические Treg-клетки (которые включают CD4+CD25+FoxP3+ Treg, клетки Tr1, клетки Th3 и другие) возникают вне тимуса. Один из способов индукции Treg - это воздействие на эффекторные Т-клетки IL-10 или TGF-β. Т-клетки также могут быть преобразованы в Treg-клетки путем трансфекции или трансдукции гена FoxP3 в смешанную популяцию Т-клеток. Т-клетка, которая индуцирована к экспрессии FoxP3, принимает фенотип Treg, и такие рекомбинантные Treg также определены в настоящей заявке как «Treg».
Термин «отторжение» относится к состоянию, в котором трансплантированный орган или ткань не принимаются организмом реципиента. Отторжение происходит в результате того, что иммунная система реципиента атакует трансплантированный орган или ткань. Отторжение может происходить через несколько дней или недель после трансплантации (острое) или через несколько месяцев или лет после трансплантации (хроническое).
Как используется в настоящей заявке, антитело или CAR называют «иммуноспецифическими для», «специфическими для» или «специфически связывающими» антиген, если они реагируют на обнаруживаемом уровне с антигеном, например, с константой аффинности Ka примерно 104 M-1 или более, примерно 105 M-1 или более, примерно 106 M-1 или более, примерно 107 M-1 или более, 108 M-1 или более, 109 M-1 или более, или 1010 M-1 или более. Аффинность антитела к его когнатному антигену также обычно выражают в виде константы диссоциации Kd, и в некоторых вариантах осуществления антитело специфически связывается с антигеном, если оно связывается с Kd 10-4 M или менее, примерно 10-5 M или менее, примерно 10-6 M или менее, 10-7 M или менее, 10-8 M или менее, 5 × 10-9 M или менее, или 10-9 М или менее, 5 × 10-10 М или менее, или 10-10 М или менее. Аффинности антител или CAR можно легко определить с помощью обычных методик, например, описанных Scatchard et al. (Ann. NY Acad. Sci. USA 51: 660 (1949)). Связывающие свойства антитела с антигенами, клетками или их тканями, как правило, можно определять и оценивать с помощью методов иммунодетекции, включая, например, анализы на основе иммунофлуоресценции, такие как иммуногистохимия (IHC) и/или сортировка клеток с активацией флуоресценции (FACS). В некоторых вариантах осуществления термин «специфически связывается» относится к антителу, CAR или лиганду, которое распознает и связывается с партнером по связыванию, присутствующим в образце, но которое по существу не распознает или не связывает другие молекулы в образце.
Термин «путь сигнальной трансдукции» относится к биохимическим отношениям между различными молекулами сигнальной трансдукции, которые играют роль в передаче сигнала от одной части клетки к другой части клетки.
Термин «сигнальный домен» относится к функциональной части белка, который действует, передавая информацию внутри клетки, чтобы регулировать клеточную активность через определенные сигнальные пути, путем генерации вторичных мессенджеров или функции в качестве эффекторов, отвечающих на такие мессенджеры.
Используемый в настоящей заявке термин «стволовые клетки» обычно включает плюрипотентные или мультипотентные стволовые клетки. «Стволовые клетки» включают эмбриональные стволовые клетки (ES); мезенхимальные стволовые клетки (MSC); индуцированные плюрипотентные стволовые клетки (iPS); и коммитированные клетки-предшественники (гемопоэтические стволовые клетки (HSC), клетки, полученные из костного мозга, и т.д.), но не ограничиваются ими.
Термин «стимуляция» относится к первичному ответу, индуцированному связыванием стимулирующей молекулы (например, комплекса TCR/CD3 или химерного рецептора) с его когнатным лигандом, таким образом опосредуя событие передачи сигнала, такое как передача сигнала через комплекс TCR/CD3 или передача сигнала через сигнальные домены химерного рецептора, но не ограничиваясь этим. Стимуляция может опосредовать измененную экспрессию определенных молекул.
Термин «стимуляторная молекула» относится к молекуле, экспрессируемой иммунной клеткой (например, Т-клеткой, NK-клеткой или В-клеткой), которая обеспечивает цитоплазматическую сигнальную последовательность (последовательности), которая регулирует активацию иммунной клетки в стимулирующем пути по меньшей мере в некоторых аспектах сигнального пути иммунных клеток. В одном из аспектов сигнал представляет собой первичный сигнал, который инициируется, например, связыванием комплекса TCR/CD3 с молекулой MHC, загруженной пептидом, и который приводит к опосредованию ответа Т-клеток, включая пролиферацию, активацию, дифференцировку, супрессию и т.д. Первичная цитоплазматическая сигнальная последовательность (также называемая «первичным сигнальным доменом»), которая действует стимулирующим образом, может содержать сигнальный мотив, который известен как иммунорецепторный мотив активации на основе тирозина или ITAM.
Термин «субъект» предназначен для включения живых организмов, у которых может быть вызван иммунный ответ (например, млекопитающих, таких как человек). В некоторых вариантах осуществления субъект может быть «пациентом», то есть теплокровным животным, таким как человек, который ожидает получения или получает медицинскую помощь или был/является/будет объектом медицинской процедуры, или подвергается мониторингу на предмет развития целевого заболевания или состояния, такого как, например, воспалительное или аутоиммунное состояние. В некоторых вариантах осуществления субъект является взрослым (например, субъектом старше 18 лет). В некоторых вариантах осуществления субъект является ребенком (например, субъектом младше 18 лет). В некоторых вариантах осуществления субъектом является мужчина. В некоторых вариантах осуществления субъектом является женщина. В некоторых вариантах осуществления субъект страдает (например, диагностирован) аутоиммунным заболеванием, таким как аутоиммунное заболевание, опосредованное аутоантителами. В некоторых вариантах осуществления субъект подвержен риску развития аутоиммунного заболевания, такого как аутоиммунное заболевание, опосредованное аутоантителами. Примеры факторов риска включают генетическую предрасположенность и семейный анамнез аутоиммунного заболевания, опосредованного аутоантителами, но не ограничиваются ими.
Термин «по существу очищенная клетка» относится к клетке, которая практически не содержит других типов клеток. По существу, очищенная клетка также означает клетку, которая была отделена от других типов клеток, с которыми она обычно ассоциируется в своем естественном состоянии. В некоторых вариантах осуществления по существу очищенная клетка означает клетку, которая свободна по меньшей мере на 75%, свободна на 80% или свободна на 85%, или свободна приблизительно на 90%, 95%, 96%, 97%, 98% или 99% от других типов клеток, с которыми она обычно ассоциируется в своем естественном состоянии. В некоторых случаях популяция по существу очищенных клеток относится к гомогенной популяции клеток. В некоторых вариантах осуществления популяция по существу очищенных клеток относится к популяции клеток, гомогенных по меньшей мере примерно на 75%, гомогенных на 80% или гомогенных на 85%, и в конкретных вариантах осуществления гомогенных примерно на 90%, 95%, 96%, 97%, 98% или 99%. В некоторых случаях в значительной степени очищенные клетки просто относятся к клеткам, которые были отделены от клеток, с которыми они естественным образом связаны в своем натуральном состоянии. В некоторых аспектах клетки культивируют in vitro. В других аспектах клетки не культивируют in vitro. В некоторых вариантах осуществления описанная здесь клетка не может быть использована для создания многоклеточного организма.
Термин «Т-клетка» включает все типы иммунных клеток, экспрессирующих CD3, включая CD4+ клетки (например, Т-хелперные клетки), CD8+ Т-клетки (например, цитотоксические CD8+ Т-клетки и регуляторные CD8+ Т-клетки), Т-регуляторные клетки (Tregs), гамма-дельта Т-клетки и дважды негативные Т-клетки.
Термин «терапевтически эффективное количество» относится к количеству агента (например, клеток, экспрессирующих CAR, как описано в настоящей заявке), эффективному для достижения конкретного биологического результата. Таким образом, термин «терапевтически эффективное количество» означает уровень или количество агента, которое предназначено, без индукции значительных негативных или неблагоприятных побочных эффектов для мишени, для (1) задержки или предотвращения возникновения целевого заболевания или состояния; (2) замедления или остановки прогрессирования, обострения или ухудшения одного или нескольких симптомов целевого заболевания или состояния; (3) улучшения симптомов целевого заболевания или состояния; (4) снижения тяжести или частоты целевого заболевания или состояния; или (5) лечения целевого заболевания или состояния. В некоторых вариантах осуществления терапевтически эффективное количество может быть введено до возникновения целевого заболевания или состояния для профилактического или превентивного действия. Альтернативно или дополнительно, терапевтически эффективное количество можно вводить после начала целевого заболевания или состояния для терапевтического действия.
Термин «трансфицированный», или «трансформированный», или «трансдуцированный» относится к процессу, посредством которого экзогенную нуклеиновую кислоту переносят или вводят в клетку-хозяин. «Трансфицированная», или «трансформированная», или «трансдуцированная» клетка - это клетка, которая была трансфицирована, трансформирована или трансдуцирована экзогенной нуклеиновой кислотой. Клетка включает первичную субъектную клетку и ее потомство.
Термин «вектор-переносчик» относится к композиции вещества, которое включает выделенную нуклеиновую кислоту и которое можно использовать для доставки выделенной нуклеиновой кислоты внутрь клетки. В данной области техники известно множество векторов, включая линейные полинуклеотиды, полинуклеотиды, связанные с ионными или амфифильными соединениями, плазмидами и вирусами, но не ограничиваясь ими. Таким образом, термин «вектор-переносчик» включает автономно реплицирующуюся плазмиду или вирус. Термин также следует толковать как включающий неплазмидные и невирусные соединения, которые способствуют переносу нуклеиновой кислоты в клетки, такие как, например, полилизиновое соединение, липосомы и тому подобное. Примеры вирусных переносчиков включают аденовирусные векторы, аденоассоциированные вирусные векторы, ретровирусные векторы, лентивирусные векторы и т.п., но не ограничиваются ими.
Как используется в настоящей заявке, «временный» относится к экспрессии неинтегрированного трансгена в течение периода часов, дней или недель, при этом период времени экспрессии меньше, чем период времени для экспрессии гена, если он интегрирован в геном или содержится в стабильном репликоне плазмиды в клетке-хозяине.
Термин «трансплантат» в контексте настоящего описания относится к клеткам, ткани или органу, которые вводят индивиду. Источником трансплантированного материала могут быть культивируемые клетки, клетки другого человека или клетки того же человека (например, после того, как клетки были культивированы in vitro и при необходимости были изменены). Примеры трансплантатов органов включают почки, печень, сердце, легкие и поджелудочную железу. Примером трансплантата ткани являются островки поджелудочной железы. Примером трансплантации клеток является трансплантат аллогенных гемопоэтических стволовых клеток.
В контексте настоящего описания термины «лечить», «лечение» и «лечебный» относятся к снижению или ослаблению прогрессирования, тяжести и/или продолжительности целевого заболевания или состояния, например, аутоиммунного состояния, или к облегчению одного или нескольких симптомов (например, одного или нескольких различимых симптомов) целевого заболевания или состояния, например аутоиммунного состояния, где указанное улучшение является результатом применения одного или нескольких терапевтических средств (например, одного или нескольких терапевтических агентов, таких как в виде Treg-клетки по изобретению). В конкретных вариантах осуществления термины «лечить», «лечение» и «лечебный» относятся к улучшению по меньшей мере одного измеримого физического параметра целевого заболевания или состояния, например, аутоиммунного состояния. В некоторых вариантах осуществления термины «лечить», «лечение» и «лечебный» относятся к ингибированию прогрессирования целевого заболевания или состояния, например, аутоиммунного состояния, либо физически, например, путем стабилизации различимого симптома, физиологически, например, путем стабилизации физического параметра, или того и другого. В некоторых вариантах осуществления термины «лечить», «лечение» и «лечебный» относятся к уменьшению или замедлению прогрессирования, тяжести и/или продолжительности целевого заболевания или состояния, например, аутоиммунного заболевания, или к облегчению одного или несколько симптомов целевого заболевания или состояния, например, аутоиммунного заболевания. «Лечение» относится как к терапевтическому лечению, так и к профилактическим или превентивным мерам; при этом цель состоит в том, чтобы предотвратить или замедлить (облегчить) целевое заболевание или состояние. Те, кто нуждается в лечении, включают тех, кто уже страдает этим заболеванием, а также тех, кто склонен к нему, или тех, у кого это состояние следует предотвратить. Субъекта успешно «лечат» от заболевания или состояния, если после приема терапевтического количества агента (например, популяции клеток, содержащих химерный рецептор согласно настоящему изобретению), у субъекта отмечается наблюдаемое и/или измеримое улучшение состояния в одном или более из следующего: уменьшение количества патогенных клеток; снижение процента общего количества патогенных клеток; облегчение до некоторой степени одного или нескольких симптомов, связанных с конкретным состоянием; снижение заболеваемости и смертности и/или улучшение качества жизни. Вышеуказанные параметры для оценки успешного лечения и улучшения состояния легко измерить с помощью обычных процедур, знакомых врачу.
Термин «Treg-клетка» относится к клетке, способной подавлять, ингибировать или предотвращать чрезмерные или нежелательные воспалительные реакции, такие как, например, аутоиммунные или аллергические реакции. В некоторых вариантах осуществления популяция Treg-клеток по изобретению способна к супрессорной активности. В некоторых вариантах осуществления указанная супрессорная активность не зависит от контакта. В некоторых вариантах осуществления указанная супрессорная активность зависит от контакта. В некоторых вариантах осуществления популяция Treg-клеток по изобретению оказывает супрессорное действие на эффекторные Т-клетки; в некоторых вариантах осуществления указанное супрессорное действие зависит от экспрессии и/или активации TCR.
«Унитело» хорошо известно в данной области техники и относится к фрагменту антитела, лишенному шарнирной области антител IgG4. Делеция шарнирной области приводит к образованию молекулы, которая по существу вдвое меньше традиционных антител IgG4 и имеет одновалентную связывающую область, а не двухвалентную связывающую область антител IgG4.
Термин «вариабельный» относится к тому факту, что определенные сегменты вариабельных (V) доменов сильно различаются по последовательности среди антител. V-домен опосредует связывание антигена и определяет специфичность конкретного антитела в отношении его конкретного антигена. Однако вариабельность неравномерно распределяется по диапазону от 110 до 130 аминокислот вариабельного домена. Вместо этого V-области состоят из относительно инвариантных участков, называемых каркасными областями (FR), из 15-30 аминокислот, разделенных более короткими областями экстремальной вариабельности, называемыми «гипервариабельными областями» или «CDR», каждая из которых имеет длину 9-12 аминокислот. Каждый из вариабельных доменов нативных тяжелых и легких цепей содержит четыре FR, в значительной степени имеющие конфигурацию β-листа, соединенные тремя гипервариабельными участками, которые образуют петли, соединяющие и в некоторых случаях образующие часть структуры β-листа. Гипервариабельные области в каждой цепи удерживаются вместе в непосредственной близости с помощью FR, и вместе с гипервариабельными областями из другой цепи вносят вклад в образование антигенсвязывающего участка антител (см. Kabat et al., Sequences of Proteins of Immunological Interest, 5th Ed. Public Health Service, National Institutes of Health, Bethesda, Md. (1991)). Константные домены не участвуют напрямую в связывании антитела с антигеном, но проявляют различные эффекторные функции, такие как участие антитела в антителозависимой клеточной цитотоксичности (ADCC).
Термин полинуклеотидный «вариант», используемый в настоящей заявке, представляет собой полинуклеотид, который обычно отличается от полинуклеотида, конкретно раскрытого в настоящей заявке, одной или несколькими заменами, делециями, добавлениями и/или вставками. Такие варианты могут встречаться в природе или могут быть получены синтетически, например, путем модификации одной или нескольких полинуклеотидных последовательностей по изобретению и оценки одной или нескольких биологических активностей кодируемого полипептида, как описано в настоящей заявке, и/или с использованием любого из ряда методов, хорошо известных в данной области техники. Соответственно, термин «полипептидный вариант», используемый в настоящей заявке, представляет собой полипептид, который обычно отличается от полипептида, конкретно раскрытого в настоящей заявке, одной или несколькими заменами, делециями, добавлениями и/или вставками. Такие варианты могут встречаться в природе или могут быть получены синтетически, например, путем модификации одной или нескольких полипептидных последовательностей по изобретению и оценки одной или нескольких биологических активностей полипептида, как описано в настоящей заявке, и/или с использованием любой из ряда методик, хорошо известных в данной области техники. В структуру полинуклеотидов и полипептидов по настоящему изобретению можно вносить модификации, которые при этом приводят к функциональной молекуле, которая кодирует, или является вариантом или производным полипептида с необходимыми характеристиками. Когда необходимо изменить аминокислотную последовательность полипептида для создания эквивалентного или даже улучшенного варианта или части полипептида по настоящему изобретению, специалист в данной области техники, как правило, изменяет один или несколько кодонов кодирующей последовательности ДНК. Например, определенные аминокислоты могут быть заменены на другие аминокислоты в структуре белка без заметной потери его функции (например, способности связывать другие полипептиды (например, антигены) или клетки). Поскольку именно связывающая способность и природа белка определяют его биологическую функциональную активность, определенные замены аминокислотной последовательности могут быть сделаны в последовательности белка и, конечно, в кодирующей её базовой последовательности ДНК, и в результате получается белок с аналогичной характеристикой. Таким образом, предполагается, что различные изменения могут быть внесены в пептидные последовательности из настоящего изобретения или соответствующие последовательности ДНК, которые кодируют указанные пептиды, без заметной потери их биологической полезности или активности. Во многих случаях полипептидный вариант будет содержать одну или несколько консервативных замен. Вариант может также или альтернативно содержать неконсервативные замены. В некоторых вариантах осуществления вариантные полипептиды отличаются от нативной последовательности заменой, делецией или добавлением шести, пяти, четырех, трех, двух или одной аминокислоты (аминокислот). Варианты могут также (или альтернативно) быть модифицированы, например, путем делеции или добавления аминокислот, которые имеют минимальное влияние на иммуногенность, вторичную структуру и гидропатическую природу полипептида.
«Версатела» хорошо известны в данной области техники и относятся к другой технологии миметиков антител. Они представляют собой небольшие белки массой 3-5 кДа с >15% цистеинов, которые образуют каркас с высокой плотностью дисульфидов, заменяя гидрофобное ядро типичных белков.
Термин «ксеногенный» относится к любому материалу, полученному от индивидуума другого вида. Термин «ксенотрансплантат» относится к трансплантату, полученному от индивидуума другого вида.
Термин «дзета» или, альтернативно, «дзета-цепь», «CD3-дзета» или «TCR-дзета» определяется как белок, представленный как GenBank Acc. № BAG36664.1, или эквивалентные остатки от не относящихся к человеку видов, например, мыши, грызуна, мартышки, обезьяны и т.п., и «дзета-стимулирующий домен» или, альтернативно, «CD3-дзета стимулирующий домен» или «TCR-дзета-стимулирующий домен» определяется как аминокислотные остатки из цитоплазматического домена дзета-цепи или их функциональные производные, которые достаточны для функциональной передачи начального сигнала, необходимого для активации Т-клеток. В некоторых вариантах осуществления цитоплазматический домен дзета содержит остатки с 52 по 164 из GenBank Acc. No. BAG36664.1 или эквивалентные остатки от видов, не относящихся к человеку, например, мыши, грызуна, мартышки, обезьяны и т.п., которые являются их функциональными ортологами.
Химерные антигенные рецепторы (CAR)
Настоящее изобретение обеспечивает химерный рецептор, содержащий:
- по меньшей мере один внеклеточный связывающий домен,
- при необходимости по меньшей мере один внеклеточный шарнирный домен,
- по меньшей мере один трансмембранный домен (например, трансмембранный домен TNFR2 человека, или его фрагмент или вариант, любой трансмембранный домен, или его фрагмент или вариант, или любую их комбинацию), и
- по меньшей мере один внутриклеточный домен (содержащий по меньшей мере один первичный внутриклеточный сигнальный домен и при необходимости содержащий по меньшей мере один костимуляторный внутриклеточный сигнальный домен, где по меньшей мере один костимуляторный внутриклеточный сигнальный домен представляет собой костимуляторный внутриклеточный сигнальный домен TNFR2 человека, или его фрагмент или вариант, любой костимуляторный внутриклеточный сигнальный домен или его фрагмент или его вариант, или любую их комбинацию), где трансмембранный домен представляет собой трансмембранный домен TNFR2 или его фрагмент или вариант, и/или костимуляторный внутриклеточный сигнальный домен представляет собой костимуляторный внутриклеточный сигнальный домен TNFR2 или его фрагмент или вариант.
В некоторых вариантах осуществления химерный рецептор содержит один или несколько полипептидов.
В некоторых вариантах осуществления внеклеточный связывающий домен представляет собой антигенсвязывающий домен, и поэтому химерный рецептор также может называться химерным антигенным рецептором (или CAR).
I. Внеклеточные связывающие домены
В некоторых вариантах осуществления внеклеточный домен включает антигенсвязывающий домен, например, антитело или его антигенсвязывающий фрагмент. Часть химерного рецептора по изобретению, содержащая антитело или его антигенсвязывающий фрагмент, может существовать в различных формах, где лиганд-связывающий домен экспрессируется как часть непрерывной полипептидной цепи, включающая, например, однодоменный фрагмент антитела (sdAb), одноцепочечное антитело (scFv), гуманизированное антитело или биспецифическое антитело (Harlow et al., 1999, In: Using Antibodies: A Laboratory Manual, Cold Spring Harbor Laboratory Press, NY; Harlow et al., 1989, In: Antibodies: A Laboratory Manual, Cold Spring Harbor, New York; Houston et al., Proc. Natl. Acad. Sci. USA 85:5879-5883 (1988); Bird et al., Science 242:423-426 (1988)). В некоторых аспектах антигенсвязывающий домен химерного рецептора, описанного в настоящей заявке, содержит фрагмент антитела. В некоторых аспектах химерный рецептор содержит фрагмент антитела, который включает scFv.
В некоторых вариантах осуществления указанное антитело представляет собой молекулу антитела, выбранную из группы, состоящей из целого антитела, гуманизированного антитела, одноцепочечного антитела, димерного одноцепочечного антитела, Fv, scFv, Fab, F(ab)'2, дефукозилированного антитела, биспецифического антитела, диатела, триатела и тетратела.
В некоторых вариантах осуществления указанное антитело представляет собой фрагмент антитела, выбранный из группы, состоящей из унитела, однодоменного антитела и нанотела.
В некоторых вариантах осуществления указанное антитело представляет собой миметик антитела, выбранный из группы, состоящей из аффитела, аффилина, аффитина, аднектина, атримера, эвазина, DARPin, антикалина, авимера, финомера, версатела и дуокалина.
DARPin (сконструированные белки с анкириновыми повторами) хорошо известны в данной области техники и относятся к технологии DRP (сконструированного белка с повторами), имитирующей антитела, разработанной для использования связывающей способности полипептидов, не являющихся антителами.
Фрагменты и производные антител по настоящему изобретению (которые охватываются термином «антитело», используемым в этой заявке, если иное не указано или явно не противоречит контексту), могут быть получены способами, известными в данной области техники. «Фрагменты» включают часть интактного антитела, обычно сайт связывания антигена или вариабельную область. Примеры фрагментов антител включают фрагменты Fab, Fab’, Fab’-SH, F(ab’)2 и Fv; диатела; любой фрагмент антитела, который представляет собой полипептид, имеющий первичную структуру, состоящую из одной непрерывной последовательности смежных аминокислотных остатков (называемую в настоящей заявке «одноцепочечным фрагментом антитела» или «одноцепочечным полипептидом»), включая, без ограничения, (1) одноцепочечные молекулы Fv, (2) одноцепочечные полипептиды, содержащие только один вариабельный домен легкой цепи, или его фрагмент, который содержит три CDR из вариабельного домена легкой цепи, без ассоциированного фрагмента тяжелой цепи, и (3) одноцепочечные полипептиды, содержащие только одну вариабельную область тяжелой цепи или ее фрагмент, содержащий три CDR вариабельной области тяжелой цепи, без связанного фрагмента легкой цепи; и полиспецифические антитела, образованные из фрагментов антител. Фрагменты представленных антител можно получить стандартными способами. Точные границы аминокислотной последовательности данной CDR могут быть определены с использованием любой из ряда хорошо известных схем, включая схемы, описанные Kabat et al. (1991), “Sequences of Proteins of Immunological Interest,” 5th Ed. Public Health Service, Национальный институт здравоохранения, Бетесда, Мэриленд (схема нумерации «Kabat»), Al-Lazikani et al., JMB 273: 927-948 (1997) (схема нумерации «Chothia») или их комбинацию.
В некоторых вариантах осуществления антигенсвязывающий домен CAR по настоящему изобретению содержит или состоит из фрагмента антитела, такого как, например, scFv. В конкретных вариантах осуществления антигенсвязывающий домен представляет собой scFv.
В некоторых вариантах осуществления антигенсвязывающий домен CAR по изобретению распознает специфический антиген или его фрагмент (например, связанный с клеткой-мишенью). Таким образом, антигенсвязывающий домен CAR может распознавать клетки-мишени, такие как, например, инфицированные клетки, поврежденные клетки или дисфункциональные клетки. Примеры таких клеток-мишеней могут включать клетки, участвующие в дисфункциональных иммунных реакциях (например, клетки, участвующие в аутоиммунных заболеваниях или аллергии), дисфункционально активированные воспалительные клетки (например, воспалительные эндотелиальные клетки), раковые клетки и инфицированные (например, инфицированные вирусами, бактериями или паразитами) клетки.
Используемый в настоящей заявке термин «фрагмент» антигена относится к любой субпопуляции антигена как более короткий пептид. В некоторых вариантах осуществления фрагмент антигена представляет собой пептид длиной не менее 6 аминокислот. В некоторых вариантах осуществления фрагмент антигена представляет собой пептид длиной от 6 до 50 аминокислот, длиной от 6 до 30 аминокислот или длиной от 6 до 20 аминокислот.
Термин «вариант» антигена в настоящей заявке относится к антигену, который почти идентичен природному антигену и который обладает такой же биологической активностью. Минимальное различие между природным антигеном и его вариантом может заключаться, например, в замене, делеции и/или добавлении аминокислот. Такие варианты могут содержать, например, консервативные аминокислотные замены. В некоторых вариантах осуществления вариант антигена имеет идентичность последовательности по меньшей мере или примерно 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% с последовательностью натурального антигена.
В некоторых вариантах осуществления антиген представляет собой аутоантиген. Примеры аутоантигенов включают антиген, связанный с воспалительным состоянием нервной системы (например, антиген, связанный с рассеянным склерозом), антиген, связанный с суставами, антиген, связанный с глазами, антиген HSP человека, антиген, связанный с кожей, или антиген, участвующий в отторжении трансплантата или РТПХ, но не ограничиваются ими.
Примеры антигенов, связанных с рассеянным склерозом, включают миелиновый основной белок (MBP), миелин-ассоциированный гликопротеин (MAG), миелиновый гликопротеин олигодендроцитов (MOG), протеолипидный белок (PLP), олигодендроцитарный миелиновый олигопротеин (OMGP), миелин-ассоциированный основной белок олигодендроцитов (MOBP), специфический белок олигодендроцитов (OSP/Клаудин-11), белки теплового шока, специфические белки олигодендроцитов (OSP), NOGO A, гликопротеин Po, периферический миелиновый белок 22 (PMP22), 2'3'-циклический нуклеотид-3'-фосфодиэстеразу (CNPase) или любые их фрагменты, варианты или смеси, но не ограничиваются ими.
Примеры ассоциированных с суставами антигенов включают цитруллин-замещенные циклические и линейные пептиды филаггрина, пептиды коллагена II типа, цитруллинированный виментин, цитруллинированный коллаген II типа, цитруллинированный фибриноген, пептиды гликопротеина 39 хряща человека (HCgp39), HSP, пептиды гетерогенного ядерного рибонуклеопротеина (hnRNP) A2, hnRNP B1, hnRNP D, Ro60/52, HSP60, HSP65, HSP70 и HSP90, BiP, кератин, виментин, фибриноген, пептиды коллагена I, III, IV и V типов, аннексин V, глюкозо-6-фосфат-изомеразу (GPI), ацетил-кальпастатин, пируватдегидрогеназу (PDH), альдолазу, топоизомеразу I, snRNP, PARP, Scl-70, Scl-100, фосфолипидные антигены, включая анионный кардиолипин и фосфатидилсерин, нейтрально заряженный фосфатидилэтаноламин и фосфатидилхолин, матриксную металлопротеиназу, фибриллин, аггрекан, и их фрагменты, варианты и смеси, но не ограничиваются ими.
Примеры ассоциированных с глазом антигенов включают коллаген II типа, цитруллинированный виментин, цитруллинированный коллаген II типа, цитруллинированный фибриноген, аррестин сетчатки, S-аррестин, интерфоторецепторные ретиноид-связывающие белки (IRBP1), бета-кристаллин B1, белки сетчатки, белки сосудистой оболочки и их фрагменты, варианты и смеси, но не ограничиваются ими.
Примеры человеческих антигенов HSP включают человеческие HSP60, HSP70, HSP90 и их фрагменты, варианты и смеси, но не ограничиваются ими.
В некоторых вариантах осуществления антиген представляет собой антиген, связанный с воспалительным состоянием нервной системы, например, антиген, связанный с рассеянным склерозом. Примеры антигенов, связанных с воспалительным состоянием нервной системы (например, антигены, связанные с рассеянным склерозом), включают основной белок миелина (MBP), миелин-связанный гликопротеин (MAG), белок олигодендроцитов миелина (MOG), протеолипидный белок (PLP), олигодендроцитарный миелиновый олигопротеин (OMGP), миелин-ассоциированный основной белок олигодендроцитов (MOBP), олигодендроцит-специфический белок (OSP/Клаудин-11), белки теплового шока, олигодендроцит-специфические белки (OSP), NOGO A, гликопротеиновый белок Po, периферический миелиновый белок 22 (PMP22), 2'3'-циклический нуклеотид-3'-фосфодиэстеразу (CNPase) и их фрагменты, варианты и смеси, но не ограничиваются ими.
В некоторых вариантах осуществления антиген представляет собой ассоциированный с суставами антиген. Примеры ассоциированных с суставами антигенов включают цитруллин-замещенные циклические и линейные пептиды филаггрина, пептиды коллагена II типа, пептиды гликопротеина 39 хряща человека (HCgp39), HSP, пептиды гетерогенного ядерного рибонуклеопротеина (hnRNP) A2, hnRNP B1, hnRNP D, Ro60/52, HSP60, 65, 70 и 90, BiP, кератин, виментин, фибриноген, пептиды коллагена I, III, IV и V типа, аннексин V, глюкозо-6-фосфат-изомеразу (GPI), ацетил-кальпастатин, пируватдегидрогеназу (PDH), альдолазу, топоизомеразу I, snRNP, PARP, Scl-70, Scl-100, фосфолипидный антиген, включая анионный кардиолипин и фосфатидилсерин, нейтрально заряженный фосфатидилэтаноламин и фосфатидилхолин, матриксную металлопротеиназу, фибриллин, аггрекан, и их фрагменты, варианты и смеси, но не ограничиваются ими.
В некоторых вариантах осуществления антиген представляет собой ассоциированный с глазом антиген. Примеры глаз-ассоциированных антигенов включают коллаген II типа, аррестин сетчатки, S-аррестин, интерфоторецепторные ретиноид-связывающие белки (IRBP1), бетаВ1-кристаллин, белки сетчатки, белки сосудистой оболочки, а также их фрагменты, варианты и смеси, но не ограничиваются ими.
В некоторых вариантах осуществления антиген представляет собой антиген HSP человека. Примеры человеческих антигенов HSP включают человеческие HSP60, HSP70, HSP90 и их фрагменты, варианты и смеси, но не ограничиваются ими.
В некоторых вариантах осуществления антиген представляет собой ассоциированный с кожей антиген. Примеры ассоциированных с кожей антигенов включают кератиноцитарные антигены, антиген, присутствующий в дерме или эпидермисе, меланоцитарный антиген (такой как, например, меланин или тирозиназа), десмоглеин (например, десмоглеин 1 или 3, которые также могут называться Dsg1/3), BP180, BP230, плектин, интегрины (например, интегрин α4β6), коллагены (например, коллаген VII типа), ламинины (например, ламинин 332 или ламинин γ1), плакины (например, энвоплакин, периплакин или десмоплакины), кератины (например, KRT5, KRT8, KRT15, KRT17 и KRT31), белки, связанные с кератиновыми филаментами, филаггрин, корнеодесмозин и эластин, но не ограничиваются ими.
В некоторых вариантах осуществления антиген представляет собой антиген, участвующий в отторжении трансплантата или РТПХ. Примеры таких антигенов включают MHC, специфичный для трансплантированной ткани или для хозяина, β2-микроглобулин, антигены из системы ABO, антигены из системы резус (например, антигены C, c, E, e и D) и изогемагглютинины, но не ограничиваются ими. Другие примеры антигенов, которые могут участвовать в отторжении трансплантата или РТПХ, включают, помимо прочего, HLA-DR (в частности, в течение первых шести месяцев после трансплантации), HLA-B (в частности, в течение первых двух лет после трансплантации), HLA-A, минорные антигены гистосовместимости (miHA, например, HLA-E, HLA-F и HLA-G), HLA, соответствующие MHC I класса (A, B и C), HLA, соответствующие MHC II класса (DP, DM, DOA, DOB, DQ и DR) и HLA, соответствующие МНС III класса (например, компоненты системы комплемента).
В некоторых вариантах осуществления антиген представляет собой белок клеточной поверхности HLA-A2. В некоторых вариантах осуществления внеклеточный связывающий домен включает антитело, направленное к HLA-A2, или его антигенсвязывающий фрагмент. В некоторых вариантах осуществления HLA-A2- связывающий домен содержит scFv, направленный на HLA-A2.
Термин «HLA-A2» в контексте настоящего описания относится к белкам лейкоцитарного антигена человека (HLA), включая белки клеточной поверхности, кодируемые семейством аллелей HLA-A*02 в локусе HLA-A генного комплекса HLA. Белки HLA, охватываемые термином «HLA-A2», включают белки HLA, идентифицированные как принадлежащие к типу антигена HLA-A*02 посредством серологического тестирования или генотипирования. Дополнительные названия для типа антигена HLA-A*02 включают «HLA-A2», «HLA-A02» и «HLA-A*2». Были разработаны различные системы именования, которые идентифицируют белки HLA, кодируемые этим семейством аллелей, включая систему именования HLA, разработанную в 2010 году Комитетом ВОЗ по факторам системы HLA. Термин «HLA-A2» относится к белкам HLA, кодируемым аллелями, имеющими обозначения в соответствии с этой системой наименования, которые начинаются с «HLA-A*02», включая обозначения, начинающиеся с «HLA-A*02:01», «HLA-A*02:02», «HLA-A*02:03», «HLA-A*02:04», «HLA-A*02:05», «HLA-A*02:06», «HLA-A*02:07», «HLA-A*02:08», «HLA-A*02:09», «HLA-A*02:10» и «HLA-A*02:11», но не ограничиваясь ими. Обозначения аллелей могут быть выделены курсивом. Обозначения аллелей, начинающиеся с «HLA-A*02:», за которыми следуют 2 или 3 дополнительные цифры, могут составлять полное обозначение или начальную часть обозначения. Термин «HLA-A2» также относится к белкам HLA, идентифицированным с обозначениями, которые начинаются с «HLA-A*02» в соответствии с этой системой именования, включая обозначения «HLA-A*02:01», «HLA-A*02:02», «HLA-A*02:03», «HLA-A*02:04», «HLA-A*02:05», «HLA-A*02:06», «HLA-A*02:07», «HLA-A*02:08», «HLA-A*02:09», «HLA-A*02:10» и «HLA-A*02:11», но не ограничиваясь ими.
В некоторых вариантах осуществления HLA-A2-связывающий домен включает антитело, направленное на HLA-A2, или его антигенсвязывающий фрагмент. В некоторых вариантах осуществления HLA-A2-связывающий домен содержит scFv, направленный на HLA-A2. Примеры scFv, направленных на HLA-A2, включают, без ограничения, scFv, состоящие или содержащие последовательность, выбранную из группы, состоящей из SEQ ID NO: 68, SEQ ID NO: 69, SEQ ID NO: 70, SEQ ID NO: 71, SEQ ID NO: 72, SEQ ID NO: 73, SEQ ID NO: 74, SEQ ID NO: 75, SEQ ID NO: 76, SEQ ID NO: 77, SEQ ID NO: 78, SEQ ID NO: 79, SEQ ID NO: 80, SEQ ID NO: 81, SEQ ID NO: 82, SEQ ID NO: 83, SEQ ID NO: 84, SEQ ID NO: 85, SEQ ID NO: 86, SEQ ID NO: 87, SEQ ID NO: 88, SEQ ID NO: 89, SEQ ID NO: 90, SEQ ID NO: 91, SEQ ID NO: 92, SEQ ID NO: 93, SEQ ID NO: 94, SEQ ID NO: 95, SEQ ID NO: 96, SEQ ID NO: 97, SEQ ID NO: 98, SEQ ID NO: 99, SEQ ID NO: 100, SEQ ID NO: 101, SEQ ID NO: 102, SEQ ID NO: 103, SEQ ID NO: 104, SEQ ID NO: 105, SEQ ID NO: 106, SEQ ID NO: 107, и их фрагменты или варианты; и scFv против HLA-A2, раскрытые в патентных публикациях РСТ WO 2018/183293 и WO 2019/056099. Например, scFv против HLA-A2, используемый в описанном здесь CAR, может состоять из аминокислотной последовательности SEQ ID NO: 68 или содержать её. В еще одном примере scFv против HLA-A2, используемый в описанном здесь CAR, может состоять из аминокислотной последовательности SEQ ID NO: 70 или содержать ее. В еще одном примере scFv против HLA-A2, используемый в описанном здесь CAR, может состоять из аминокислотной последовательности SEQ ID NO: 92 или содержать ее. В еще одном примере scFv против HLA-A2, используемый в описанном здесь CAR, может состоять из аминокислотной последовательности SEQ ID NO: 103 или содержать ее. В еще одном примере scFv против HLA-A2, используемый в описанном здесь CAR, может состоять из аминокислотной последовательности SEQ ID NO: 107 или содержать ее.
Другие примеры аутоантигенов включают аквапориновые водные каналы (такие как, например, водный канал аквапорина-4 (AQP4)), Hu, Ma2, белок-медиатор ответа на коллапсин 5 (CRMP5), амфифизин, потенциал-зависимый калиевый канал (VGKC), рецептор N-метил-d-аспартата (NMDAR), рецептор α-амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислоты (AMPAR), пероксидазу щитовидной железы, тиреоглобулин, рецептор анти-N-метил-D-аспартата (субъединицу NR1), резус-антигены крови, антиген I, десмоглеин 1 или 3 (Dsg1/3), BP180, BP230, ацетилхолиновые постсинаптические рецепторы, рецепторы тиреотропина, тромбоцитарный интегрин, GpIIb:IIIa, коллаген (такой как, например, альфа-3 (IV) цепь коллагена), ревматоидный фактор, кальпастатин, цитруллинированные белки, основной белок миелина (MBP), пептиды миелинового гликопротеина олигодендроцитов (MOG), альфа-бета-кристаллин, ДНК, гистоны, рибосомы, RNP, тканевую трансглутаминазу (TG2), внутренний фактор, антиген 65 кДа, фосфатидилсерин, рибосомные фосфопротеины, антинейтрофильное цитоплазматическое антитело, Scl-70, U1-RNP, ANA, SSA SSB, антинуклеарные антитела (ANA), антинейтрофильные цитоплазматические антитела (ANCA), Jo-1, антимитохондриальные антитела, gp210, p62, sp100, антифосфолипидные антитела, U1-70 kd snRNP, GQ1b ганглиозид, GM1, асиало-GM1, GD1b, антитела против гладких мышц (ASMA), антитела против микросомы-1 печени и почек (ALKM-1), антитело против цитозоля печени-1 (ALC-1), антиэндомизиальные антитела IgA, белки нейтрофильных гранул, антиген клеточной стенки стрептококка, внутренний фактор париетальных клеток желудка, инсулин (IAA), декарбоксилазу глутаминовой кислоты (GAA или GAD), протеинтирозинфосфатазу (например, IA2 или ICA512), PLA2R1 и THSD7A1, но не ограничиваются ими.
В некоторых вариантах осуществления антиген представляет собой рецептор IL-23 (IL-23R), экспрессируемый на поверхности клетки. В некоторых вариантах осуществления внеклеточный связывающий домен представляет собой антитело, направленное против IL-23R, или его антигенсвязывающий фрагмент.
В некоторых вариантах осуществления антиген представляет собой растворимый IL-23R. В некоторых вариантах осуществления внеклеточный связывающий домен представляет собой антитело, направленное против растворимого IL-23R, или его антигенсвязывающий фрагмент.
В некоторых вариантах осуществления антиген представляет собой вариант IL-23R. В некоторых вариантах осуществления внеклеточный связывающий домен представляет собой антитело, направленное против варианта IL-23R, или его антигенсвязывающий фрагмент.
В некоторых вариантах осуществления вариантный пептид IL-23R представляет собой модифицированный пептид IL-23R, в котором 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислот удалены, добавлены или заменены, по сравнению с исходным пептидом.
В некоторых вариантах осуществления антиген представляет собой сплайс-вариант IL-23R. В некоторых вариантах осуществления внеклеточный связывающий домен представляет собой антитело, направленное к сплайс-варианту IL-23R, или его антигенсвязывающий фрагмент.
В некоторых вариантах осуществления CAR по настоящему изобретению распознает человеческий IL-23R и способен связываться с ним. В некоторых вариантах осуществления CAR по настоящему изобретению распознает мышиный IL-23R и способен связываться с ним.
В некоторых вариантах осуществления IL-23R-связывающий домен содержит антитело, направленное к IL-23R, или его антигенсвязывающий фрагмент. В некоторых вариантах осуществления IL-23R-связывающий домен содержит scFv, направленный на IL-23R. Примеры scFv, направленных на IL-23R, включают scFv, содержащие или состоящие из последовательности, выбранной из группы, состоящей из SEQ ID NO:65, SEQ ID NO:66, SEQ ID NO:67 и их фрагментов или вариантов, но не ограничиваются ими.
В некоторых вариантах осуществления антиген представляет собой ингаляционный аллерген, поглощаемый аллерген или контактный аллерген.
В некоторых вариантах осуществления антиген представляет собой пищевой антиген из обычного рациона человека.
Термин «пищевой антиген из обычного рациона человека» относится к иммуногенному пептиду, который происходит из продуктов питания, общих для людей, например, к пищевому антигену из следующего неограничивающего списка: овальбумин, бычьи антигены, такие как липокалин, Са-связывающий S100, альфа-лактальбумин, лактоглобулины, такие как бета-лактоглобулин, бычий сывороточный альбумин и казеины. Пищевые антигены также могут представлять собой антигены атлантического лосося, такие как парвальбумин, куриные антигены, такие как овомукоид, Ag22, кональбумин, лизоцим или куриный сывороточный альбумин, арахис, антигены креветок, такие как тропомиозин, антигены пшеницы, такие как агглютинин или глиадин, антигены сельдерея, такие как профилин сельдерея, морковные антигены, такие как морковный профилин, яблочные антигены, такие как тауматин, белок-переносчик липидов яблока, яблочный профилин, грушевые антигены, такие как грушевый профилин, изофлавонредуктаза, антигены авокадо, такие как эндохитиназа, абрикосовые антигены, такие как белок-переносчик липидов абрикоса, персиковые антигены, такие как белок-переносчик липидов персика или профилин персика, соевые антигены, такие как HPS, профилин сои или (SAM22) PR-10 prot, и их фрагменты, варианты и смеси.
В некоторых вариантах осуществления антиген представляет собой тканеспецифический белок. Примеры тканеспецифических белков включают интегрины и селектины, экспрессия которых ограничена конкретной тканью или органом, но не ограничиваются ими.
В некоторых вариантах осуществления антиген представляет собой поверхностный маркер В-клетки, экспрессируемый на поверхности В-клетки. Примеры поверхностных маркеров В-клеток (например, В-клеток человека) включают CD19, CD20, BCMA, IgM, IgA, IgG, IgE, IgD, CD1, CD5, CD21, CD22, CD23, CD24, CD25, CD27, CD30, CD38, CD40, CD78, CD80, CD138, CD319, PDL-2, CXCR3, CXCR4, CXCR5, CXCR6, Notch2, TLR4, IL-6, IL-10 и TGFβ, но не ограничиваются ими. В некоторых вариантах осуществления поверхностный маркер В-клеток выбран из CD19, CD20, BCMA, IgM, IgA, IgG, IgE, IgD, CD1, CD21, CD22, CD138. В конкретных вариантах осуществления поверхностный маркер В-клеток выбран из CD19 и CD20.
В некоторых вариантах осуществления антиген представляет собой поверхностный маркер проВ-клетки, экспрессируемый на поверхности проВ-клетки. Примеры поверхностных маркеров proB-клеток (например, проВ-клеток человека) включают CD10, CD19, CD24, CD34 и CD38, но не ограничиваются ими.
В некоторых вариантах осуществления антиген представляет собой поверхностный маркер преВ-клетки, экспрессируемый на поверхности преВ-клетки. Примеры поверхностных маркеров преВ-клеток (например, человеческих преВ-клеток) CD5, CD10, CD19, CD20 и CD34, CD38, но не ограничиваются ими.
В некоторых вариантах осуществления антиген представляет собой маркер незрелой (или переходной) В-клетки, экспрессируемый на поверхности В-клетки. Примеры поверхностных маркеров незрелых (или переходных) В-клеток (например, незрелых В-клеток человека) включают CD5, CD10, CD19, CD20, CD22, CD24, CD38 и IgG, но не ограничиваются ими.
В некоторых вариантах осуществления, антиген представляет собой поверхностный маркер В-клеток маргинальной зоны, экспрессируемый на поверхности B-клетки. Примеры поверхностных маркеров В-клеток маргинальной зоны (например, человеческих В-клеток маргинальной зоны) включают CD1, CD19, CD20, CD21, CD22, CD23, CD27, IgG и Notch2, но не ограничиваются ими.
В некоторых вариантах осуществления антиген представляет собой поверхностный маркер плазматической клетки, экспрессируемый на поверхности B-клетки. Примеры поверхностных маркеров плазматических клеток (например, плазматических клеток человека) включают CD19, CD27, CD38, CD138, IgG, MHCII и IL-6, но не ограничиваются ими.
В некоторых вариантах осуществления антиген представляет собой поверхностный маркер плазмобластных клеток, экспрессируемый на поверхности B-клетки. Примеры поверхностных маркеров плазмобластов (например, плазмобластов человека) включают CD19, CD20, CD27, CD38, IgG и MHCII, но не ограничиваются ими.
В некоторых вариантах осуществления антиген представляет собой поверхностный маркер В-клеток памяти, экспрессируемый на поверхности В-клетки. Примеры поверхностных маркеров В-клеток памяти (например, В-клеток памяти человека) включают CD19, CD20, CD22, CD24, CD27, CD38, CD40, CD80, PD-L2, IgG, CXCR3, CXCR4, CXCR5, CXCR6, IgA, IgG и IgE, но не ограничиваются ими.
В некоторых вариантах осуществления изобретения антиген представляет собой маркер поверхности В-клеток зародышевого центра, экспрессируемый на поверхности В-клетки. Примеры поверхностных маркеров В-клеток зародышевого центра (например, В-клеток зародышевого центра человека) включают CD10, CD19, CD20, CD22, CD38 и IgG, но не ограничиваются ими.
В некоторых вариантах осуществления антиген представляет собой поверхностный маркер активированных В-клеток, экспрессируемый на поверхности В-клетки. Примеры поверхностных маркеров активированных В-клеток (например, активированных В-клеток человека) включают CD19, CD25 и CD30, но не ограничиваются ими.
В некоторых вариантах осуществления антиген представляет собой поверхностный регуляторных маркер В-клеток, экспрессируемый на поверхности В-клетки. Примеры поверхностных маркеров регуляторных В-клеток (Breg клеток) включают CD1, CD1d, CD5, CD19, CD21, CD23, CD24, CD40, лиганд Fas, IL-10, TLR4, TGFβ, IgD, IgM, PD-L1, PD-L2, TIM-1, TNFSF18 и TRAIL, но не ограничиваются ими. В конкретных вариантах осуществления примеры поверхностных маркеров Breg-клеток человека включают CD1, CD1d, CD5, CD19, CD21, CD24, CD40, IL-10, TLR4, TGFβ, IgD и IgM, но не ограничиваются ими.
В некоторых вариантах осуществления антиген представляет собой поверхностный маркер В-клеток с несекретируемым Ig, экспрессируемым на поверхности В-клетки. Примеры поверхностных маркеров В-клеток (например, В-клеток человека) с несекретируемым Ig включают CD138 и Notch2, но не ограничиваются ими.
В некоторых вариантах осуществления поверхностный маркер В-клеток представляет собой CD19. В некоторых вариантах осуществления CD19-связывающий домен содержит антитело, направленное к CD19, или его антигенсвязывающий фрагмент. В некоторых вариантах осуществления CD19-связывающий домен содержит scFv, направленный на CD19. Примеры scFv, направленных на CD19, включают SEQ ID NO: 1 и FMC63 (SEQ ID NO: 2), но не ограничиваются ими.
В некоторых вариантах осуществления поверхностный маркер В-клеток представляет собой CD20. В некоторых вариантах осуществления CD20-связывающий домен содержит антитело, направленное к CD20, или его антигенсвязывающий фрагмент. Примеры антител к CD20 включают ритуксимаб или его фрагмент или вариант (например, SEQ ID NO: 3 или её фрагмент или вариант), но не ограничиваются ими. Примеры scFv, направленных на CD20, включают scFv, содержащие или состоящие из последовательности, выбранной из группы, состоящей из SEQ ID NO: 4, SEQ ID NO: 5, SEQ ID NO: 6 и их фрагментов или вариантов, но не ограничиваются ими.
В некоторых вариантах осуществления антиген представляет собой раковый антиген.
Используемый в настоящей заявке термин «раковый антиген» относится к антигену, который дифференциально экспрессируется раковыми клетками и, следовательно, может использоваться для нацеливания на раковые клетки. Раковые антигены - это антигены, которые потенциально могут стимулировать явно опухолеспецифические иммунные ответы. Некоторые из этих антигенов кодируются, хотя не обязательно экспрессируются, нормальными клетками; эти антигены можно охарактеризовать как антигены, которые обычно являются молчащими (т.е. не экспрессируются) в нормальных клетках, те, которые экспрессируются только на определенных стадиях дифференцировки, и те, которые экспрессируются в определенное время, такие как эмбриональные и фетальные антигены. Другие раковые антигены кодируются мутантными клеточными генами, такими как онкогены (например, активированный онкоген ras), гены-супрессоры (например, мутантный p53) и гибридные белки, возникающие в результате внутренних делеций или хромосомных транслокаций. Еще одни раковые антигены могут кодироваться вирусными генами, такими как те, которые содержатся в РНК и ДНК опухолевых вирусов. Многие опухолевые антигены были определены с точки зрения множественных солидных опухолей: MAGE 1, 2 и 3 (определяемые иммунитетом), MART-1/Мелан-A, gp100, карциноэмбриональный антиген (CEA), HER2, муцины (т.е. MUC-1), простатоспецифический антиген (PSA) и кислая фосфатаза простаты (PAP). Кроме того, было показано, что вирусные белки, такие как некоторые из кодируемых вирусом гепатита В (HBV), вирусом Эпштейна-Барр (EBV) и вирусом папилломы человека (HPV), играют важную роль в развитии гепатоцеллюлярной карциномы, лимфомы и рака шейки матки, соответственно.
Другие раковые антигены включают 707-AP (707 аланин пролин), AFP (альфа (a) -фетопротеин), ART-4 (антиген аденокарциномы, распознаваемый клетками T4), BAGE (B-антиген; b-катенин/m, b-катенин/мутантный), BCMA (антиген созревания B-клеток), Bcr-abl (область кластера точки разрыва-Абельсона), CAIX (карбоангидразу IX), CD19 (кластер дифференцировки 19), CD20 (кластер дифференцировки 20), CD22 (кластер дифференцировки 22), CD30 (кластер дифференцировки 30), CD33 (кластер дифференцировки 33), CD44v7/8 (кластер дифференцировки 44, экзоны 7/8), CAMEL (антиген, распознаваемый CTL на меланоме), CAP-1 (карциноэмбриональный антигенный пептид-1), CASP-8 (каспазу-8), CDC27m (цикла клеточного деления мутант 27), CDK4/m (мутантную циклин-зависимую киназу 4), CEA (карциноэмбриональный антиген), CT (рака/яичка (антиген)), Cyp-B (циклофилин B), DAM (дифференцировочный антиген меланомы), EGFR (рецептор эпидермального фактора роста), EGFRvIII (рецептор эпидермального фактора роста, вариант III), EGP-2 (эпителиальный гликопротеин 2), EGP-40 (эпителиальный гликопротеин 40), Erbb2, 3, 4 (гомолог-2, -3, -4 вирусного онкогена эритробластного лейкоза), ELF2M (мутантный фактор элонгации 2), ETV6-AML1 (Ets вариантный ген 6/ ген острого миелоидного лейкоза 1 ETS), FBP (фолат-связывающий белок), fAchR (фетальный ацетилхолиновый рецептор), G250 (гликопротеин 250), GAGE (G-антиген), GD2 (дисиалоганглиозид 2), GD3 (дисиалоганглиозид 3), GnT-V (N-ацетилглюкозаминилтрансферазу V), Gp100 (гликопротеин 100 кДа), HAGE (антиген геликозы), HER-2/neu (человеческий эпидермальный рецептор-2/неврологический; также известный как EGFR2), HLA-A (человеческий лейкоцитарный антиген-A), HPV (вирус папилломы человека), HSP70-2M (мутантный белок теплового шока 70-2), HST-2 (перстневидноклеточной карциномы-2 человека), hTERT или hTRT (обратную транскриптазу теломеразы человека), iCE (интестинальную карбоксилэстеразу), IL-13R-a2 (субъединицу альфа-2 рецептора интерлейкина-13), KIAA0205, KDR (рецептор домена вставки киназы), κ-легкую цепь, LAGE (L-антиген), LDLR/FUT (рецептор липидов низкой плотности/GDP-L-фукозу; bD-галактозидазу 2-a-L-фукозилтрансферазу), LeY (антитело Льюиса-Y), L1 CAM (молекулу адгезии клеток L1), MAGE (антиген меланомы), MAGE-A1 (антиген, связанный с меланомой 1), мезотелин, мышиные CMV-инфицированные клетки, MART-1/мелан-A (антиген меланомы, распознаваемый Т-клетками - I/антиген меланомы A), MC1 R (рецептор меланокортина 1), миозин/m (мутантный миозин), MUC1 (муцин 1), MUM-1, -2, -3 (меланомы общераспространенный мутантный-1, -2, -3), NA88-A (клон кДНК NA пациента M88), NKG2D (естественных киллеров группы 2, член D) лиганды, NY-BR-1 (Нью-Йоркский антиген дифференцировки молочной железы 1), NY-ESO-1 (Нью-Йоркский антиген плоскоклеточной карциномы пищевода-1), онкофетальный антиген (h5T4), P15 (белок 15), минорный bcr-abl p190 (белок 190 кДа bcr-abl), Pml/RARa (промиелоцитарного лейкоза/ретиноевой кислоты рецептор a), PRAME (преимущественно экспрессируемый антиген меланомы), PSA (простатоспецифический антиген), PSCA (антиген стволовых клеток простаты), PSMA (простатоспецифический мембранный антиген), RAGE (почечный антиген), RU1 или RU2 (почечный общераспространенный 1 или 2), SAGE (антиген саркомы), SART-1 или SART-3 (антиген плоскоклеточной карциномы 1 или 3), антиген синовиальной саркомы X-1, -2, -3, -4 (SSX-1, -2, -3, -4), TAA (опухоль-ассоциированный антиген), TAG-72 (опухоль-ассоциированный гликопротеин 72), TEL/AML1 (транслокации лейкоза семейства Ets/ острого миелоидного лейкоза 1), TPI/m (мутантной триозофосфатизомеразы), TRP-1 (родственный тирозиназе протеин 1 или gp75), TRP-2 (родственный тирозиназе протеин 2), TRP-2/INT2 (TRP-2/ интрон 2), VEGF-R2 (фактора роста эндотелия сосудов рецептор 2) или WT1 (ген опухоли Вильмса), но не ограничиваются ими.
В некоторых вариантах осуществления антиген ассоциирован с инфицированными клетками.
Используемый в настоящей заявке термин «инфицированные клетки» относится к клеткам, контаминированным чем-либо, что неблагоприятно влияет на их качество, характер или состояние.
В некоторых вариантах осуществления антиген ассоциирован с инфицированными вирусом клетками. В некоторых вариантах осуществления антиген ассоциирован с бактериально инфицированными клетками. В некоторых вариантах осуществления антиген ассоциирован с инфицированными грибами клетками. В некоторых вариантах осуществления антиген ассоциирован с инфицированными паразитами клетками.
В некоторых вариантах осуществления внеклеточный связывающий домен представляет собой белок, его фрагмент или вариант.
В некоторых вариантах осуществления внеклеточный связывающий домен распознает аутоантитело на B-клетке.
В некоторых вариантах осуществления внеклеточный связывающий домен представляет собой аутоантиген.
В некоторых вариантах осуществления химерный рецептор содержит аутоантиген (который также может называться само-антигеном) или его фрагмент или вариант и, таким образом, может распознавать антитела, направленные на указанный аутоантиген. Используемый в настоящей заявке термин «аутоантиген» или «само-антиген» относится к эндогенному антигену, который стимулирует выработку аутоантител. В некоторых вариантах осуществления аутоантиген вовлечен в аутоиммунное заболевание. В некоторых вариантах осуществления иммунные клетки по изобретению являются цитотоксическими для В-клеток, продуцирующих антитела, направленные к указанному аутоантигену.
Термин «вариант аутоантигена» в настоящей заявке относится к аутоантигену, который почти идентичен природному аутоантигену и обладает такой же биологической активностью. Минимальное различие между натуральным аутоантигеном и его вариантом может заключаться, например, в замене, делеции и/или добавлении аминокислот. Такие варианты могут содержать, например, консервативные аминокислотные замены, в которых аминокислотные остатки заменены аминокислотными остатками, имеющими аналогичную боковую цепь. Семейства аминокислотных остатков, имеющих аналогичные боковые цепи, были определены в данной области техники, включая основные боковые цепи (например, лизин, аргинин и гистидин), кислотные боковые цепи (например, аспарагиновую кислоту и глутаминовую кислоту), незаряженные полярные боковые цепи (например, глицин, аспарагин, глутамин, серин, треонин, тирозин и цистеин), неполярные боковые цепи (например, аланин, валин, лейцин, изолейцин, пролин, фенилаланин, метионин и триптофан), бета-разветвленные боковые цепи (например, треонин, валин и изолейцин) и ароматические боковые цепи (например, тирозин, фенилаланин, триптофан и гистидин). В некоторых вариантах осуществления вариантный аутоантиген имеет идентичность последовательности по меньшей мере 70, 75, 80, 85, 90, 91, 92, 93, 94, 95, 96, 97, 98 или 99% с последовательностью натурального аутоантигена.
Примеры аутоантигенов включают водные каналы аквапорина (такие как, например, водный канал аквапорина-4 (AQP4)), Hu, Ma2, белок-медиатор ответа на коллапсин 5 (CRMP5), амфифизин, потенциал-зависимый калиевый канал (VGKC), рецептор N-метил-d-аспартата (NMDAR), рецептор α-амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислоты (AMPAR), пероксидазу щитовидной железы, тиреоглобулин, анти-N-метил-D-аспартатный рецептор (субъединицу NR1), антигены группы крови Rh, антиген I, десмоглеин 1 или 3 (Dsg1/3), BP180, BP230, никотиновые ацетилхолиновые постсинаптические рецепторы, рецепторы тиреотропина, интегрин тромбоцитов, GpIIb:IIIa, коллаген (такой как, например, альфа-3 (IV) цепь коллагена), ревматоидный фактор, кальпастатин, цитруллинированные белки, миелиновый основной белок (MBP), пептиды миелинового олигодендроцитарного гликопротеина (MOG), альфа-бета-кристаллин, ДНК, гистон, рибосомы, РНП, тканевую трансглутаминазу (TG2), внутренний фактор, антиген 65 кДа, фосфатидилсерин, рибосомальные фосфопротеины, антинейтрофильное цитоплазматическое антитело, Scl-70, U1-RNP, ANA, SSA, анти-SSB, антинуклеарные антитела (ANA), антинейтрофильные цитоплазматические антитела (ANCA), Jo-1, антимитохондриальные антитела, gp210, p62, sp100, антифосфолипидные антитела, U1-70 кДа snRNP, ганглиозид GQ1b, GM1, асиало-GM1, GD1b, антитела против гладких мышц (ASMA), антитела против микросомы-1 печени и почек (ALKM-1), антитела против цитозоля печени-1 (ALC-1), антиэндомизиальные антитела IgA, белки гранул нейтрофилов, антиген клеточной стенки стрептококка, внутренний фактор париетальных клеток желудка, инсулин (IAA), декарбоксилазу глутаминовой кислоты (GAA или GAD), протеинтирозинфосфатазу (например, IA2 или ICA512), PLA2R1 и THSD7A1, но не ограничиваются ими.
Другие примеры аутоантигенов перечислены в настоящей заявке и включают антигены, ассоциированные с рассеянным склерозом (такие как, например, основной белок миелина (MBP), миелин-ассоциированный гликопротеин (MAG), миелиновый олигодендроцитарный гликопротеин (MOG), протеолипидный белок (PLP), миелиновый олигопротеин олигодендроцитов (OMGP), миелин-ассоциированный олигодендроцитарный основной белок (MOBP), специфический белок олигодендроцитов (OSP/Клаудин-11), белки теплового шока, специфические белки олигодендроцитов (OSP), NOGO A, гликопротеин Po, периферический миелиновый белок 22 (PMP22), 2'3'-циклический нуклеотид-3'-фосфодиэстеразу (CNPase) и их фрагменты, варианты и смеси); ассоциированные с суставами антигены (такие как, например, цитруллин-замещенные циклические и линейные пептиды филаггрина, пептиды коллагена II типа, пептиды гликопротеина 39 хряща человека (HCgp39), HSP, пептиды гетерогенного ядерного рибонуклеопротеина (hnRNP) A2, hnRNP B1, hnRNP D, Ro60/52, HSP60, HSP65, HSP70 и HSP90, BiP, кератин, виментин, фибриноген, пептиды коллагена I, III, IV и V типов, аннексин V, глюкозо-6-фосфат-изомераза (GPI), ацетил-кальпастатин, пируватдегидрогеназа ( PDH), альдолаза, топоизомераза I, snRNP, PARP, Scl-70, Scl-100, фосфолипидные антигены, включая анионный кардиолипин и фосфатидилсерин, нейтрально заряженный фосфатидилэтаноламин и фосфатидилхолин, матриксная металлопротеиназа, фибриллин, аггрекан, цитруллинированный виментин, цитруллинированный коллаген II типа, цитруллинированный фибриноген и их фрагменты, варианты и смеси); ассоциированные с глазом антигены (такие как, например, коллаген II типа, аррестин сетчатки, S-аррестин, интерфоторецепторные ретиноид-связывающие белки (IRBP1), бета-кристаллин B1, белки сетчатки, хориоидные белки, цитруллинированный виментин, цитруллинированный коллаген типа II, цитруллинированный фибриноген и их фрагменты, варианты и смеси); и человеческие антигены HSP (такие как, например, человеческий HSP60, HSP70, HSP90 и их фрагменты, варианты и смеси), но не ограничиваются ими.
В некоторых вариантах осуществления аутоантиген представляет собой десмоглеин 1 или десмоглеин 3, или их вариант или фрагмент, такие как, например, внеклеточные домены десмоглеина 1 или 3. В некоторых вариантах осуществления химерный рецептор содержит внеклеточные домены 1-4 из десмоглеина 3, такие как, например, последовательность, содержащая SEQ ID NO: 7 или состоящая из неё.
В некоторых вариантах осуществления CAR по настоящему изобретению содержит внеклеточный связывающий домен против первого антигена и по меньшей мере один другой внеклеточный связывающий домен против другого антигена. Такой CAR способен связываться по меньшей мере с 2 разными антигенами. В некоторых вариантах осуществления указанный по меньшей мере один другой внеклеточный связывающий домен представляет собой антитело, направленное против специфического антигена, или его антигенсвязывающий фрагмент. В некоторых вариантах осуществления указанный по меньшей мере один другой внеклеточный связывающий домен содержит фрагмент антитела, такого как, например, scFv, или состоит из него.
В некоторых вариантах осуществления антитело, содержащееся в CAR по настоящему изобретению, представляет собой молекулу полиспецифического антитела, например, оно содержит множество последовательностей вариабельного домена иммуноглобулина, причем первая последовательность вариабельного домена иммуноглобулина из множества обладает специфичностью связывания для первого эпитопа, а вторая последовательность вариабельного домена иммуноглобулина из множества обладает специфичностью связывания для второго эпитопа. В некоторых вариантах осуществления молекула полиспецифического антитела представляет собой молекулу биспецифического антитела. Биспецифическое антитело обладает специфичностью в отношении двух антигенов и характеризуется первой последовательностью вариабельного домена иммуноглобулина, которая имеет специфичность связывания для первого эпитопа, и второй последовательностью вариабельного домена иммуноглобулина, которая имеет специфичность связывания для второго эпитопа.
II. Спейсерные и шарнирные домены
В некоторых вариантах осуществления внеклеточный связывающий домен связан с трансмембранным доменом с помощью спейсерного домена или шарнирного домена. Примеры линкеров включают линкеры GS, как описано в настоящей заявке, но не ограничиваются ими. В некоторых вариантах осуществления линкер может содержать последовательность GGGGSGGGGSGGGGS (SEQ ID NO: 111) или состоять из нее.
В некоторых вариантах осуществления короткий олиго- или полипептидный линкер, имеющий длину в диапазоне, например, от 2 до 10 аминокислот, может формировать шарнирный домен. В некоторых вариантах осуществления термин «линкер» относится к гибкому полипептидному линкеру.
Например, дублет глицин-серин может обеспечивать подходящий шарнирный домен (линкер GS). В некоторых вариантах осуществления шарнирный домен представляет собой линкер Gly/Ser. Примеры линкеров Gly/Ser включают линкеры GS, линкеры G2S, линкеры G3S и линкеры G4S, но не ограничиваются ими.
Примеры линкеров G2S включают GGS, но не ограничиваются им.
Линкеры G3S содержат аминокислотную последовательность (Gly-Gly-Gly-Ser)n, также называемую (GGGS)n или (SEQ ID NO: 112)n, где n - положительное целое число, равное 1 или более (например, n = l, n = 2, n = 3, n = 4, n = 5, n = 6, n = 7, n = 8, n = 9 или n = 10). Примеры линкеров G3S включают GGSGGGSGGGSGGGS (SEQ ID NO: 113), но не ограничиваются этим.
Примеры линкеров G4S включают (Gly4 Ser), соответствующий GGGGS (SEQ ID NO: 114); (Gly4 Ser)2, соответствующий GGGGSGGGGS (SEQ ID NO: 115); (Gly4 Ser)3, соответствующий GGGGSGGGGSGGGGS (SEQ ID NO: 116); и (Gly4 Ser)4, соответствующий GGGGSGGGGSGGGGSGGGGS (SEQ ID NO: 117), но не ограничиваются ими.
В некоторых вариантах осуществления спейсерный домен может иметь длину до 300 аминокислот, например, 10-100 аминокислот, 25-50 аминокислот или 2-10 аминокислот.
В некоторых вариантах осуществления шарнирный домен представляет собой короткий олиго- или полипептидный линкер, например, имеющий длину от 2 до 10 аминокислот, как описано в настоящей заявке. Пример шарнирного домена, который можно использовать в настоящем изобретении, описан в публикации патента РСТ WO2012/138475, включенной в настоящий документ посредством ссылки.
В некоторых вариантах осуществления шарнирный домен содержит аминокислотную последовательность, выбранную из группы, состоящей из аминокислотной последовательности AGSSSSGGSTTGGSTT (SEQ ID NO: 8), аминокислотной последовательности GTTAASGSSGGSSSGA (SEQ ID NO: 9), аминокислотной последовательности SSATATAGTGSSTGST (SEQ ID NO: 10) и аминокислотной последовательности TSGSTGTAASSTSTST (SEQ ID NO: 11).
В некоторых вариантах осуществления шарнирный домен кодируется нуклеотидной последовательностью GGTGGCGGAGGTTCTGGAGGTGGAGGTTCC (SEQ ID NO: 12).
В некоторых вариантах осуществления шарнирный домен представляет собой шарнирный домен KIR2DS2, соответствующий KIRRDSS (SEQ ID NO: 13).
В некоторых вариантах осуществления шарнирный домен содержит или состоит из аминокислотной последовательности шарнира CD8 (например, содержащей аминокислотную последовательность SEQ ID NO: 14 или состоящую из нее) или аминокислотной последовательности, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 14. В вариантах осуществления изобретения шарнирный домен представляет собой шарнир CD8, кодируемый нуклеиновокислотной последовательностью SEQ ID NO: 15 или нуклеиновокислотной последовательностью, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 15.
В некоторых вариантах осуществления шарнирный домен включает или состоит из аминокислотной последовательности шарнира IgG4 (например, содержащей аминокислотную последовательность SEQ ID NO: 16 или состоящую из неё) или аминокислотной последовательности, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 16. В некоторых вариантах осуществления шарнирный домен представляет собой шарнир IgG4, кодируемый нуклеиновокислотной последовательностью SEQ ID NO: 17 или нуклеиновокислотной последовательностью, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92 %, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 17.
В некоторых вариантах осуществления шарнирный домен включает или состоит из аминокислотной последовательности шарнира IgD (например, содержащей аминокислотную последовательность SEQ ID NO: 18 или состоящей из неё) или аминокислотной последовательности, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 18. В вариантах осуществления изобретения шарнирный домен представляет собой шарнир IgD, кодируемый нуклеиновокислотной последовательностью SEQ ID NO: 19 или нуклеиновокислотной последовательностью, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 19.
В некоторых вариантах осуществления шарнирная область включает или состоит из аминокислотной последовательности шарнира CD28 (например, включающей аминокислотную последовательность SEQ ID NO: 20 или состоящей из неё) или аминокислотной последовательности, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 20. В некоторых вариантах осуществления шарнирный домен представляет собой шарнирный домен CD28, кодируемый нуклеиновокислотной последовательностью SEQ ID NO: 21 или нуклеиновокислотной последовательностью, имеющей идентичность по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% с SEQ ID NO: 21.
III. Трансмембранные домены
Примеры трансмембранных доменов, которые можно использовать в химерном рецепторе по изобретению, включают трансмембранные домены TNFR2, CD28, CD8 или альфа, бета или дзета-цепи Т-клеточного рецептора, или CD3-гамма, CD3-дельта, CD3-эпсилон, CD3-дзета, CD45, CD4, CD5, CD9, CD16, CD22, CD33, CD37, CD64, CD80, CD86, CD134, CD137, CD154, KIRDS2, OX40, CD2, CD27, LFA-1 (CD11a, CD18), ICOS (CD278), 4-1BB (CD137), GITR, CD40, BAFFR, HVEM (LIGHTR), SLAMF7, NKp80 (KLRF1), CD160, CD19, IL2R бета, IL2R гамма, IL7R a, ITGA1, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a, LFA-1, ITGAM, CD11b, PD1, ITGAX, CDl1c, ITGB1, CD29, ITGB2, CD18, LFA-1, ITGB7, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (тактильный), CEACAM1, CRT AM, Ly9 (CD229), CD160 (BY55), PSGL1, CDIOO (SEMA4D), SLAMF6 (NTB-A, Lyl08), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, PAG/Cbp, NKp44, NKp30, NKp46, NKG2D и/или NKG2C, но не ограничиваются ими.
В некоторых вариантах осуществления трансмембранный домен может включать весь трансмембранный домен молекулы, из которой он получен, или он может содержать его функциональный фрагмент или вариант.
В некоторых вариантах осуществления химерный рецептор содержит по меньшей мере один трансмембранный домен, выбранный из трансмембранного домена TNFR2, трансмембранного домена CD8 и трансмембранного домена CD28.
В некоторых вариантах осуществления трансмембранный домен содержит или состоит из аминокислотной последовательности трансмембранного домена TNFR2 (например, содержащей аминокислотную последовательность SEQ ID NO: 22 или состоящей из неё) или аминокислотной последовательности, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 22. В некоторых вариантах осуществления трансмембранный домен включает или состоит из аминокислотной последовательности, имеющей по меньшей мере одну, две или три модификации, но не более 20, 10 или 5 модификаций по сравнению с аминокислотной последовательностью SEQ ID NO: 22 или аминокислотной последовательностью, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 22.
В некоторых вариантах осуществления трансмембранный домен TNFR2 кодируется нуклеотидной последовательностью SEQ ID NO: 23 или нуклеотидной последовательностью, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 23.
В некоторых вариантах осуществления трансмембранный домен TNFR2 включает по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 аминокислот из последовательности SEQ ID NO: 22 или из последовательности, имеющей по меньшей мере примерно 70%, 75%, 80%, 85 %, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 22, например, по меньшей мере 2, 3, 4, 5 , 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 смежные аминокислоты из последовательности SEQ ID NO: 22. В некоторых вариантах осуществления трансмембранный домен TNFR2 содержит аминокислотную последовательность, выбранную из группы, состоящей из CVIMTQV (SEQ ID NO: 62), VNCVIMTQV (SEQ ID NO: 63), или TALGLLIIGVVNCVIMTQV (SEQ ID NO: 64). В конкретных вариантах осуществления трансмембранный домен TNFR2 содержит аминокислотную последовательность VNCVIMTQV (SEQ ID NO: 63).
В некоторых вариантах осуществления трансмембранный домен TNFR2 кодируется нуклеотидной последовательностью по меньшей мере из 6, 9, 12, 15, 18, 21, 24, 27, 30, 33, 36, 39, 42, 45, 48, 51, 54, 57, 60, 63, 66, 69, 72, 75, 78, 81, 84 или 87 нуклеотидов из последовательности SEQ ID NO: 23 или из последовательности, имеющей по меньшей мере примерно 70%, 75%, 80 %, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 23, например, по меньшей мере 6, 9, 12, 15, 18, 21, 24, 27, 30, 33, 36, 39, 42, 45, 48, 51, 54, 57, 60, 63, 66, 69, 72, 75, 78, 81, 84 или 87 смежных нуклеотидов из последовательности SEQ ID NO: 23.
В некоторых вариантах осуществления трансмембранный домен содержит или состоит из аминокислотной последовательности трансмембранного домена CD8 (например, содержащей аминокислотную последовательность SEQ ID NO: 24 или состоящую из нее) или аминокислотной последовательности, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 24. В некоторых вариантах осуществления трансмембранный домен содержит или состоит из аминокислотной последовательности, имеющей по меньшей мере одну, две или три модификации, но не более 20, 10 или 5 модификаций по сравнению с аминокислотной последовательностью SEQ ID NO: 24 или аминокислотной последовательностью, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 24.
В некоторых вариантах осуществления трансмембранный домен CD8 кодируется нуклеотидной последовательностью SEQ ID NO: 25 или нуклеотидной последовательностью, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 25.
В некоторых вариантах осуществления трансмембранный домен CD8 содержит по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 или 24 аминокислоты из последовательности SEQ ID NO: 24 или из последовательности, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 24, например, по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 или 24 смежные аминокислоты из последовательности SEQ ID NO: 24.
В некоторых вариантах осуществления трансмембранный домен CD8 кодируется нуклеотидной последовательностью по меньшей мере из 6, 9, 12, 15, 18, 21, 24, 27, 30, 33, 36, 39, 42, 45, 48, 51, 54, 57, 60, 63, 66, 69 или 72 нуклеотида из последовательности SEQ ID NO: 25 или из последовательности, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91% , 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 25, например, по меньшей мере 6, 9, 12, 15, 18, 21, 24, 27, 30, 33, 36, 39, 42, 45, 48, 51, 54, 57, 60, 63, 66, 69 или 72 смежных нуклеотида из последовательности SEQ ID NO: 25.
В некоторых вариантах осуществления трансмембранный домен содержит или состоит из аминокислотной последовательности трансмембранного домена CD28 (например, содержит аминокислотную последовательность SEQ ID NO: 26 или состоит из неё) или аминокислотной последовательности, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 26. В некоторых вариантах осуществления трансмембранный домен содержит или состоит из аминокислотной последовательности, имеющей по меньшей мере одну, две или три модификации, но не более 20, 10 или 5 модификаций по сравнению с аминокислотной последовательностью SEQ ID NO: 26, или аминокислотной последовательности, имеющей по меньшей мере 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 26.
В некоторых вариантах осуществления трансмембранный домен представляет собой трансмембранный домен CD28, кодируемый нуклеиновокислотной последовательностью SEQ ID NO: 27 или нуклеиновокислотной последовательностью, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 27. В некоторых вариантах осуществления трансмембранный домен CD28 включает по меньшей мере 2, 3, 4, 5, 6, 7, 8,10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26 или 27 аминокислот из последовательности SEQ ID NO: 26 или из последовательности, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 26, например, по меньшей мере, 3, 4, 5, 6, 7, 8,10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26 или 27 смежных аминокислот из последовательности SEQ ID NO: 26.
В некоторых вариантах осуществления трансмембранный домен CD28 кодируется нуклеотидной последовательностью по меньшей мере из 6, 9, 12, 15, 18, 21, 24, 27, 30, 33, 36, 39, 42, 45, 48, 51, 54, 57, 60, 63, 66, 69, 72, 75, 78 или 81 нуклеотида из последовательности SEQ ID NO: 27 или из последовательности, имеющей по меньшей мере примерно 70%, 75%, 80%, 85% , 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 27, например, по меньшей мере из 6, 9, 12, 15, 18, 21, 24, 27, 30, 33, 36, 39, 42, 45, 48, 51, 54, 57, 60, 63, 66, 69, 72, 75, 78 или 81 смежного нуклеотида из последовательности SEQ ID NO: 27.
В некоторых вариантах осуществления изобретения химерный рецептор может включать комбинацию по меньшей мере двух трансмембранных доменов, например, выбранных из трансмембранного домена TNFR2, трансмембранного домена CD8 и трансмембранного домена CD28. Указанные трансмембранные домены могут быть целыми трансмембранными доменами, или их фрагментами или вариантами, и могут быть связаны друг с другом в случайном или определенном порядке. В определенных вариантах осуществления комбинация по меньшей мере двух трансмембранных доменов, или их фрагментов или вариантов включает по меньшей мере 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 или 50 аминокислот.
В некоторых вариантах осуществления химерный рецептор содержит аминокислотную последовательность трансмембранного домена TNFR2 (например, содержащую аминокислотную последовательность SEQ ID NO: 22 или состоящую из нее) или ее фрагмент или вариант, и аминокислотную последовательность трансмембранного домена CD8 (например, содержащую аминокислотную последовательность SEQ ID NO: 24 или состоящую из неё) или её фрагмент или вариант. В некоторых вариантах осуществления химерный рецептор содержит гибридный трансмембранный домен, содержащий аминокислотные последовательности SEQ ID NO: 59 и 62, SEQ ID NO: 60 и 63 или SEQ ID NO: 61 и 64.
В некоторых вариантах осуществления химерный рецептор содержит аминокислотную последовательность трансмембранного домена TNFR2 (например, содержащую аминокислотную последовательность SEQ ID NO: 22 или состоящую из нее) или ее фрагмент или вариант, и аминокислотную последовательность трансмембранного домена CD28 (например, содержащую аминокислотную последовательность SEQ ID NO: 26 или состоящую из неё) или его фрагмент или вариант.
В некоторых вариантах осуществления химерный рецептор содержит аминокислотную последовательность трансмембранного домена CD8 (например, содержащую аминокислотную последовательность SEQ ID NO: 24 или состоящую из нее) или ее фрагмент или вариант, и аминокислотную последовательность трансмембранного домена CD28 (например, содержащую аминокислотную последовательность SEQ ID NO: 26 или состоящую из неё) или её фрагмент или вариант.
В некоторых вариантах осуществления изобретения химерный рецептор может включать комбинацию по меньшей мере трех трансмембранных доменов, например, выбранных из трансмембранного домена TNFR2, трансмембранного домена CD8 и трансмембранного домена CD28. Указанные трансмембранные домены могут быть целыми трансмембранными доменами, или их фрагментом или вариантом. В некоторых вариантах осуществления комбинация по меньшей мере трех трансмембранных доменов, их фрагмента или варианта включает по меньшей мере 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 или 50 аминокислот.
В некоторых вариантах осуществления химерный рецептор содержит аминокислотную последовательность трансмембранного домена TNFR2 (например, содержащую аминокислотную последовательность SEQ ID NO: 22 или состоящую из неё) или ее фрагмент или вариант, аминокислотную последовательность трансмембранного домена CD8, например, содержащую или состоящую из аминокислотной последовательности (SEQ ID NO: 24), или её фрагмент или вариант, и аминокислотную последовательность трансмембранного домена CD28 (например, содержащую аминокислотную последовательность SEQ ID NO: 26 или состоящую из неё) или её фрагмент или вариант.
Таким образом, в некоторых вариантах осуществления нуклеиновокислотная последовательность, кодирующая трансмембранный домен CAR по изобретению, включает нуклеиновокислотную последовательность трансмембранного домена TNFR2 (например, содержащую аминокислотную последовательность SEQ ID NO: 23 или состоящую из неё) или её фрагмент или вариант, и/или нуклеиновокислотную последовательность трансмембранного домена CD8 (например, содержащую аминокислотную последовательность SEQ ID NO: 25 или состоящую из нее) или ее фрагмент или вариант, и/или нуклеиновокислотную последовательность трансмембранного домена CD28 (например, содержащую аминокислотную последовательность SEQ ID NO: 27 или состоящую из неё) или ее фрагмент или вариант.
В некоторых вариантах осуществления трансмембранный домен CAR по настоящему изобретению содержит аминокислотную последовательность трансмембранного домена TNFR2 (например, содержащую аминокислотную последовательность SEQ ID NO: 22 или состоящую из неё) или её фрагмент или вариант, и/или аминокислотную последовательность трансмембранного домена CD8 (например, содержащую аминокислотную последовательность SEQ ID NO: 24 или состоящую из неё) или ее фрагмент или вариант, и/или аминокислотную последовательность трансмембранного домена CD28 (например, содержащую аминокислотную последовательность SEQ ID NO: 26 или состоящую из нее) или ее фрагмент или вариант; где последовательности, содержащиеся в трансмембранном домене, экспрессируются в одной и той же рамке и в виде одной полипептидной цепи.
В некоторых вариантах осуществления трансмембранный домен CAR по настоящему изобретению включает по меньшей мере два разных домена (например, домен TNFR2, или его фрагмент или вариант, и по меньшей мере один другой трансмембранный домен (например, трансмембранный домен CD8 или CD28) или его фрагмент или вариант), которые могут быть связаны друг с другом случайным образом или в определенном порядке.
При необходимости, короткий олиго- или полипептидный линкер, например, длиной от 2 до 10 аминокислот (например, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислот) может формировать связь между отдельными трансмембранными доменами.
В некоторых вариантах осуществления трансмембранный домен может быть рекомбинантным. В некоторых вариантах осуществления рекомбинантный трансмембранный домен содержит преимущественно гидрофобные аминокислоты, такие как валин или лейцин.
IV. Внутриклеточные домены
В некоторых вариантах осуществления внутриклеточный домен CAR по настоящему изобретению содержит первичный сигнальный домен Т-клетки (или последовательность, полученную из него) и при необходимости один или несколько внутриклеточных доменов из Т-клеточной костимуляторной молекулы (или последовательность (последовательности), полученную из неё).
В некоторых вариантах осуществления внутриклеточный домен может включать всю внутриклеточную часть или весь нативный внутриклеточный сигнальный домен молекулы, из которой он получен, или его функциональный фрагмент или вариант.
В некоторых вариантах осуществления внутриклеточный сигнальный домен состоит по меньшей мере из одного первичного сигнального домена (например, первичного сигнального домена Т-клетки) или его фрагмента или варианта.
В некоторых вариантах осуществления внутриклеточный сигнальный домен состоит по меньшей мере из одного костимуляторного сигнального домена (например, внутриклеточного домена костимуляторной молекулы Т-клетки) или его фрагмента или варианта.
В некоторых вариантах осуществления внутриклеточный сигнальный домен содержит один или несколько внутриклеточных доменов костимуляторной молекулы Т-клетки, или его фрагмент или вариант. В некоторых вариантах осуществления внутриклеточный сигнальный домен состоит из одного или нескольких внутриклеточных доменов костимуляторной молекулы Т-клетки, или его фрагмента или варианта.
В другом варианте осуществления внутриклеточный сигнальный домен CAR по настоящему изобретению содержит по меньшей мере один костимуляторный домен, или его фрагмент или вариант, и по меньшей мере один первичный сигнальный домен, или его фрагмент или вариант.
В другом варианте осуществления внутриклеточный сигнальный домен CAR по настоящему изобретению состоит из одного костимуляторного домена или его фрагмента или варианта, и одного первичного сигнального домена или его фрагмента или варианта.
В некоторых вариантах осуществления внутриклеточный сигнальный домен CAR по изобретению включает по меньшей мере один, два, три или четыре костимуляторных домена или их фрагмент или вариант, и по меньшей мере один первичный сигнальный домен или его фрагмент или вариант. В некоторых вариантах осуществления один или несколько костимуляторных доменов представляют собой внутриклеточные домены костимуляторной молекулы Т-клетки. В некоторых вариантах осуществления по меньшей мере один первичный сигнальный домен представляет собой первичный сигнальный домен Т-клетки.
В некоторых вариантах осуществления изобретения первичный сигнальный домен включает сигнальный домен белка, выбранного из группы, состоящей из CD3 дзета, CD3 гамма, CD3 дельта, CD3 эпсилон, общего FcR гамма (FCER1G), FcR бета (Fc эпсилон Rib), CD79a, CD79b, Fc гамма RIIa, DAP10 и DAP1, и последовательностей, полученных из них.
В некоторых вариантах осуществления изобретения первичный сигнальный домен представляет собой первичный сигнальный домен Т-клетки, который содержит или состоит по меньшей мере из одного функционального сигнального домена CD3-дзета или его фрагмента или варианта.
В некоторых вариантах осуществления изобретения первичный сигнальный домен Т-клетки содержит или состоит из аминокислотной последовательности CD3-дзета SEQ ID NO: 28, 29, 30 или 31, или аминокислотной последовательности, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 28, 29, 30 или 31.
В некоторых вариантах осуществления первичный сигнальный домен CD3-дзета содержит или состоит из аминокислотной последовательности, имеющей по меньшей мере одну, две или три модификации, но не более 20, 10 или 5 модификаций, по сравнению с аминокислотной последовательностью SEQ ID NO: 28, 29, 30 или 31, или аминокислотной последовательности, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96 %, 97%, 98% или 99% идентичности с SEQ ID NO: 28, 29, 30 или 31.
Таким образом, в некоторых вариантах осуществления нуклеиновокислотная последовательность, кодирующая первичный сигнальный домен Т-клетки, включает или состоит из нуклеиновокислотной последовательности домена CD3-дзета SEQ ID NO: 32 или SEQ ID NO: 33, или нуклеотидной последовательности, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 32 или SEQ ID NO: 33.
В некоторых вариантах осуществления первичный сигнальный домен CD3-дзета содержит по меньшей мере 2, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110 или 112 аминокислот из последовательности SEQ ID NO: 28, 29, 30 или 31, или из последовательности, имеющей по меньшей мере примерно 70% идентичности с SEQ ID NO: 28, 29, 30 или 31, например, по меньшей мере 2, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110 или 112 смежных аминокислот из SEQ ID NO: 28, 29, 30 или 31.
В некоторых вариантах осуществления первичный сигнальный домен CD3-дзета кодируется нуклеотидной последовательностью по меньшей мере из 6, 30, 60, 90, 120, 150, 180, 210, 240, 270, 300, 330 или 336 нуклеотидов из последовательности SEQ ID NO: 32 или SEQ ID NO: 33, или из последовательности, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 32 или SEQ ID NO: 33, например, по меньшей мере, 6, 30, 60, 90, 120, 150, 180, 210, 240, 270 , 300, 330 или 336 смежных нуклеотидов из SEQ ID NO: 32 или SEQ ID NO: 33.
В некоторых вариантах осуществления изобретения первичные сигнальные домены Т-клетки, которые действуют стимулирующим образом, могут включать сигнальные мотивы, известные как мотивы активации на основе тирозина иммунорецепторов (ITAMS). Примеры ITAM-содержащих первичных внутриклеточных сигнальных доменов Т-клетки, которые особенно используются в изобретении, включают или получены из домена CD3-дзета, общего FcR-гамма (FCER1G), Fc-гамма RIIa, FcR-бета (Fc-эпсилон R1b), CD3-гамма, CD3-дельта, CD3-эпсилон, CD5, CD22, CD66b, CD79a, CD79b, DAP10 и DAP12, но не ограничиваются ими.
В некоторых вариантах осуществления первичный сигнальный домен Т-клетки включает модифицированный домен ITAM, например, мутантный домен ITAM, у которого изменена (например, увеличена или уменьшена) активность по сравнению с нативным доменом ITAM. В некоторых вариантах осуществления первичный сигнальный домен включает модифицированный ITAM-содержащий первичный внутриклеточный сигнальный домен, например, оптимизированный и/или усеченный ITAM-содержащий первичный внутриклеточный сигнальный домен. В некоторых вариантах осуществления первичный сигнальный домен может содержать один, два, три, четыре или более мотивов ITAM.
В некоторых вариантах осуществления внутриклеточный сигнальный домен CAR по изобретению содержит первичный сигнальный домен Т-клетки (такой как, например, сигнальный домен CD3-дзета или его фрагмент или вариант) в сочетании с одним или несколькими костимуляторными сигнальными доменами, причем указанные костимуляторные сигнальные домены представляют собой целые костимуляторные внутриклеточные сигнальные домены или их фрагмент или вариант.
Примеры внутриклеточных доменов костимуляторной молекулы Т-клетки включают сигнальные домены белков, выбранных из группы, состоящей из TNFR2 (CD120b/TNFRSF1B), 4-1BB (CD137), ICOS (CD278), CD27, CD28, CTLA-4 (CD152), PD-1, молекулы MHC I класса, BTLA, рецептора Toll-лиганда, OX40, CD30, CD40, ассоциированного с функцией лимфоцитов антигена-1 (LFA-1), CD2, CD7, LIGHT, NKG2C, B7-H3, лиганда, который специфически связывается с CD83, CDS, ICAM-1, GITR, ARHR, BAFFR, HVEM (LIGHTR), SLAMF7, NKp80 (KLRF1), NKp44, NKp30, NKp46, CD160 (BY55), CD19, CD19a, CD4, CD8-альфа, CD8-бета, IL2ra, IL6Ra, IL2R-бета, IL2R-гамма, IL7R-альфа, IL-13RA1/RA2, IL-33R (IL1RL1), IL-10RA/RB, IL-4R, IL-5R (CSF2RB), IL-21R, ITGA4, VLA1, CD49a, ITGA4, VLA1, CD49a, ITGA4, IA4, CD49D, ITGA6, VLA-6, CD49f, ITGAD, CD11d, ITGAE, CD103, ITGAL, CD11a/CD18, ITGAM, CD11b, ITGAX, CD11c, ITGB1, CD29, ITGB2, CD18, ITGB7, NKG2D, NKG2C, CD95, TNFR1 (CD120a/TNFRSF1A), TGFbR1/2/3, TRANCE/RANKL, DNAM1 (CD226), SLAMF4 (CD244, 2B4), CD84, CD96 (Tactile), CEACAM1, CRTAM, Ly9 (CD229), PSGL1, CD100 (SEMA4D), CD69, SLAMF6 (NTB-A, Lyl08), SLAM (SLAMF1, CD150, IPO-3), BLAME (SLAMF8), SELPLG (CD162), LTBR, LAT, GADS, SLP-76, PAG/Cbp, общей гамма-цепи, лиганда, который специфически связывается с CD83, NKp44, NKp30, NKp46, NKG2D и любой их комбинации, но не ограничиваются ими.
В некоторых вариантах осуществления химерный рецептор содержит по меньшей мере один внутриклеточный домен костимуляторной молекулы Т-клетки, выбранный из группы, состоящей из TNFR2, 4-1BB, ICOS, CD27, OX40, CD28, CTLA4 и PD-1.
В некоторых вариантах осуществления химерный рецептор содержит по меньшей мере один костимуляторный сигнальный домен, представляющий собой весь костимуляторный сигнальный домен или его фрагмент или вариант.
В некоторых вариантах осуществления костимуляторный сигнальный домен Т-клетки содержит или состоит из аминокислотной последовательности костимуляторного внутриклеточного сигнального домена TNFR2 (например, включающей аминокислотную последовательность SEQ ID NO: 34 или состоящей из неё) или аминокислотной последовательности, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 34. В некоторых вариантах осуществления костимуляторный сигнальный домен содержит или состоит из аминокислотной последовательности, имеющей по меньшей мере одну, две или три модификации, но не более 20, 10 или 5 модификаций по сравнению с аминокислотной последовательностью SEQ ID NO: 34.
В некоторых вариантах осуществления костимуляторный сигнальный домен Т-клетки кодируется нуклеотидной последовательностью костимуляторного внутриклеточного сигнального домена TNFR2 (например, содержащей аминокислотную последовательность SEQ ID NO: 35 или состоящую из нее) или нуклеотидной последовательностью, имеющей идентичность по меньшей мере 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% с SEQ ID NO: 35.
В некоторых вариантах осуществления внутриклеточный костимуляторный сигнальный домен TNFR2 содержит по меньшей мере 2, 6, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170 или 174 аминокислоты из последовательности SEQ ID NO: 34 или из последовательности, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 34, например, по меньшей мере 2, 10, 20, 30, 40, 50, 60, 70, 80, 90, 100, 110, 120, 130, 140, 150, 160, 170 или 174 смежных аминокислоты из SEQ ID NO: 34.
В некоторых вариантах осуществления внутриклеточный костимуляторный сигнальный домен TNFR2 кодируется нуклеотидной последовательностью по меньшей мере из 6, 18, 30, 60, 90, 120, 150, 180, 210, 240, 260, 270, 300, 330, 360, 390, 420, 450, 480, 510 или 522 нуклеотидов из последовательности SEQ ID NO: 35 или из последовательности, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 35, например, по меньшей мере 6, 18, 30, 60, 90, 120, 150, 180, 210, 240, 260, 270, 300, 330, 360, 390, 420, 450, 480, 510 или 522 смежных нуклеотида из SEQ ID NO: 35.
В некоторых вариантах осуществления внутриклеточный костимуляторный сигнальный домен включает домены I и II, домены I-III, домены I-IV или домены I-V внутриклеточного костимуляторного сигнального домена TNFR2 (например, SEQ ID NO: 34). В некоторых вариантах осуществления внутриклеточный костимуляторный сигнальный домен включает домены I и II внутриклеточного костимуляторного домена TNFR2.
В некоторых вариантах осуществления внутриклеточный костимуляторный сигнальный домен содержит остатки 1-20 (δ151), 1-70 (δ104), 1-115 (δ59) или 1-156 (δ18) из SEQ ID NO: 34.
В некоторых вариантах осуществления костимуляторный сигнальный домен Т-клетки содержит или состоит из аминокислотной последовательности костимуляторного внутриклеточного сигнального домена 4-1BB (например, содержит аминокислотную последовательность SEQ ID NO: 36 или состоит из неё) или аминокислотной последовательности, имеющей идентичность по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% с SEQ ID NO: 36. В некоторых вариантах осуществления костимуляторный сигнальный домен Т-клеток содержит или состоит из аминокислотной последовательности, имеющей по меньшей мере одну, две или три модификации, но не более 20, 10 или 5 модификаций по сравнению с аминокислотной последовательностью SEQ ID NO: 36.
В некоторых вариантах осуществления костимуляторный сигнальный домен Т-клетки кодируется нуклеотидной последовательностью костимуляторного внутриклеточного сигнального домена 4-1BB (например, содержащей аминокислотную последовательность SEQ ID NO: 37 или состоящую из нее) или нуклеотидной последовательностью, иеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 37.
В некоторых вариантах осуществления костимуляторный внутриклеточный сигнальный домен 4-1BB содержит по меньшей мере 2, 3, 6, 9, 12, 15, 18, 21, 24, 27, 30, 33, 36, 39 или 42 аминокислоты из последовательности SEQ ID NO: 36 или из последовательности, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 36, например, по меньшей мере 2, 3, 6, 9, 12, 15, 18, 21, 24, 27, 30, 33, 36, 39 или 42 смежные аминокислоты из SEQ ID NO: 36.
В некоторых вариантах осуществления костимуляторный внутриклеточный сигнальный домен 4-1BB кодируется нуклеотидной последовательностью по меньшей мере из 6, 18, 27, 36, 45, 54, 63, 72, 81, 96, 99, 108, 117 или 126 нуклеотидов из последовательности SEQ ID NO: 37 или из последовательности, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96 %, 97%, 98% или 99% идентичности с SEQ ID NO: 37, например, по меньшей мере, 6, 18, 27, 36, 45, 54, 63, 72, 81, 96, 99, 108, 117 или 126 смежных нуклеотидов из SEQ ID NO: 37.
В некоторых вариантах осуществления костимуляторный сигнальный домен Т-клетки содержит или состоит из аминокислотной последовательности костимуляторного внутриклеточного сигнального домена CD27 (например, содержит аминокислотную последовательность SEQ ID NO: 38 или состоит из неё) или аминокислотной последовательности, имеющей не менее 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 38. В некоторых вариантах осуществления костимуляторный сигнальный домен Т-клетки содержит или состоит из аминокислотной последовательности, имеющей по меньшей мере одну, две или три модификации, но не более 20, 10 или 5 модификаций по сравнению с аминокислотной последовательностью SEQ ID NO: 38.
В некоторых вариантах осуществления костимуляторный сигнальный домен Т-клетки кодируется нуклеотидной последовательностью костимуляторного внутриклеточного сигнального домена CD27 (например, содержащей аминокислотную последовательность SEQ ID NO: 39 или состоящую из нее) или нуклеотидной последовательностью, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 39.
В некоторых вариантах осуществления костимуляторный внутриклеточный сигнальный домен CD27 содержит по меньшей мере 2, 3, 6, 9, 12, 15, 18, 21, 24, 27, 30, 33, 36, 39, 42, 45 или 48 аминокислот из последовательности SEQ ID NO: 38 или из последовательности, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 38, например, по меньшей мере 2, 3, 6, 9, 12, 15, 18, 21, 24, 27, 30, 33, 36, 39, 42, 45 или 48 смежных аминокислот из SEQ ID NO: 38.
В некоторых вариантах осуществления костимуляторный внутриклеточный сигнальный домен CD27 кодируется нуклеотидной последовательностью по меньшей мере из 6, 18, 27, 36, 45, 54, 63, 72, 81, 96, 99, 108, 117, 126, 135 или 144 нуклеотидов из последовательности SEQ ID NO: 39 или из последовательности, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 39, например, по меньшей мере 6, 18, 27, 36, 45, 54, 63, 72, 81, 96, 99, 108, 117, 126, 135 или 144 смежных нуклеотида из SEQ ID NO: 39.
В некоторых вариантах осуществления костимуляторный сигнальный домен Т-клетки содержит или состоит из аминокислотной последовательности костимуляторного внутриклеточного сигнального домена CD28 (например, содержит аминокислотную последовательность SEQ ID NO: 40 или состоит из неё) или аминокислотной последовательности, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 40. В некоторых вариантах осуществления костимуляторный сигнальный домен Т-клеток содержит или состоит из аминокислотной последовательности, имеющей по меньшей мере одну, две или три модификации, но не более 20, 10 или 5 модификаций по сравнению с аминокислотной последовательностью SEQ ID NO: 40.
В некоторых вариантах осуществления костимуляторный сигнальный домен Т-клетки кодируется нуклеотидной последовательностью костимуляторного внутриклеточного сигнального домена CD28 (например, содержащей SEQ ID NO: 41 или состоящей из неё) или нуклеотидной последовательностью, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 41.
В некоторых вариантах осуществления костимуляторный внутриклеточный сигнальный домен CD28 содержит по меньшей мере 2, 3, 6, 9, 12, 15, 18, 21, 24, 27, 30, 33, 36, 39 или 41 аминокислоту из последовательности SEQ ID NO: 40 или из последовательности, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 40, например, по меньшей мере 2, 3, 6, 9, 12, 15, 18, 21, 24, 27, 30, 33, 36, 39 или 41 смежную аминокислоту из SEQ ID NO: 40.
В некоторых вариантах осуществления костимуляторный внутриклеточный сигнальный домен CD28 кодируется нуклеотидной последовательностью по меньшей мере из 6, 18, 27, 36, 45, 54, 63, 72, 81, 96, 99, 108, 117 или 123 нуклеотидов из последовательности SEQ ID NO: 41 или из последовательности, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 41, например, по меньшей мере, 6, 18, 27, 36, 45, 54, 63, 72, 81, 96, 99, 108, 117 или 123 смежных нуклеотида из SEQ ID NO: 41.
В некоторых вариантах осуществления изобретения химерный рецептор содержит комбинацию по меньшей мере двух внутриклеточных доменов костимуляторной молекулы Т-клетки. В некоторых вариантах осуществления по меньшей мере два внутриклеточных домена могут быть выбраны из внутриклеточного домена TNFR2, внутриклеточного домена 4-1BB, внутриклеточного домена CD27 и внутриклеточного домена CD28. В конкретных вариантах осуществления указанные костимуляторные внутриклеточные сигнальные домены представляют собой целые костимуляторные внутриклеточные сигнальные домены или их фрагмент или вариант.
В некоторых вариантах осуществления химерный рецептор содержит аминокислотную последовательность костимуляторного внутриклеточного сигнального домена TNFR2 (например, содержащую аминокислотную последовательность SEQ ID NO: 34 или состоящую из нее) или ее фрагмент или вариант, и аминокислотную последовательность костимуляторного внутриклеточного сигнального домена 4-1BB (например, содержащую аминокислотную последовательность SEQ ID NO: 36 или состоящую из неё) или ее фрагмент или вариант.
В некоторых вариантах осуществления, химерный рецептор содержит аминокислотную последовательность костимуляторного внутриклеточного сигнального домена TNFR2 (например, содержащую аминокислотную последовательность SEQ ID NO: 34 или состоящую из нее) или ее фрагмент или вариант, и аминокислотную последовательность костимуляторного внутриклеточного сигнального домена CD27 (например, содержащую аминокислотную последовательность SEQ ID NO: 38 или состоящую из неё) или ее фрагмент или вариант.
В некоторых вариантах осуществления химерный рецептор содержит аминокислотную последовательность костимуляторного внутриклеточного сигнального домена TNFR2 (например, содержащую аминокислотную последовательность SEQ ID NO: 34 или состоящую из нее) или ее фрагмент или вариант, и аминокислотную последовательность костимуляторного внутриклеточного сигнального домена CD28 (например, содержащую аминокислотную последовательность SEQ ID NO: 40 или состоящую из нее) или ее фрагмент или вариант.
В некоторых вариантах осуществления химерный рецептор содержит аминокислотную последовательность костимуляторного внутриклеточного сигнального домена 4-1BB (например, содержащую аминокислотную последовательность SEQ ID NO: 36 или состоящую из нее) или ее фрагмент или вариант, и аминокислотную последовательность костимуляторного внутриклеточного сигнального домена CD27 (например, содержащую аминокислотную последовательность SEQ ID NO: 38 или состоящую из неё) или её фрагмент или вариант.
В некоторых вариантах осуществления химерный рецептор содержит аминокислотную последовательность костимуляторного внутриклеточного сигнального домена 4-1BB (например, содержащую аминокислотную последовательность SEQ ID NO: 36 или состоящую из нее) или ее фрагмент или вариант, и аминокислотную последовательность костимуляторного внутриклеточного сигнального домена CD28 (например, содержащую аминокислотную последовательность SEQ ID NO: 40 или состоящую из неё) или ее фрагмент или вариант.
В некоторых вариантах осуществления, химерный рецептор содержит аминокислотную последовательность костимуляторного внутриклеточного сигнального домена CD27 (например, содержащую аминокислотную последовательность SEQ ID NO: 38 или состоящую из нее) или ее фрагмент или вариант, и аминокислотную последовательность костимуляторного внутриклеточного сигнального домена CD28 (например, содержащую аминокислотную последовательность SEQ ID NO: 40 или состоящую из неё) или ее фрагмент или вариант.
В некоторых вариантах осуществления изобретения химерный рецептор содержит комбинацию по меньшей мере трех внутриклеточных доменов костимуляторного сигнального домена Т-клетки, например, выбранных из внутриклеточного домена TNFR2, внутриклеточного домена 4-1BB, внутриклеточного домена CD27 и внутриклеточного домена CD28.
В некоторых вариантах осуществления изобретения химерный рецептор может содержать по меньшей мере три костимуляторных внутриклеточных сигнальных домена, где указанные домены представляют собой целые костимуляторные внутриклеточные сигнальные домены, или их фрагмент или вариант.
В некоторых вариантах осуществления, химерный рецептор содержит аминокислотную последовательность костимуляторного внутриклеточного сигнального домена TNFR2 (например, содержащую аминокислотную последовательность SEQ ID NO: 34 или состоящую из нее) или ее фрагмент или вариант, и аминокислотную последовательность костимуляторного внутриклеточного сигнального домена 4-1BB (например, содержащую аминокислотную последовательность SEQ ID NO: 36 или состоящую из неё) или ее фрагмент или вариант, и аминокислотную последовательность костимуляторного внутриклеточного сигнального домена CD27 (например, содержащую аминокислотную последовательность SEQ ID NO: 38 или состоящую из неё) или ее фрагмент или вариант.
В некоторых вариантах осуществления химерный рецептор содержит аминокислотную последовательность костимуляторного внутриклеточного сигнального домена TNFR2 (например, содержащую аминокислотную последовательность SEQ ID NO: 34 или состоящую из нее) или ее фрагмент или вариант, и аминокислотную последовательность костимуляторного внутриклеточного сигнального домена 4-1BB (например, содержащую аминокислотную последовательность SEQ ID NO: 36 или состоящую из неё) или ее фрагмент или вариант, и аминокислотную последовательность костимуляторного внутриклеточного сигнального домена CD28 (например, содержащую аминокислотную последовательность SEQ ID NO: 40 или состоящую из неё) или ее фрагмент или вариант.
В некоторых вариантах осуществления химерный рецептор содержит аминокислотную последовательность костимуляторного внутриклеточного сигнального домена TNFR2 (например, содержащую аминокислотную последовательность SEQ ID NO: 34 или состоящую из нее) или ее фрагмент или вариант, и аминокислотную последовательность костимуляторного внутриклеточного сигнального домена CD27 (например, содержащую аминокислотную последовательность SEQ ID NO: 38 или состоящую из неё) или ее фрагмент или вариант, и аминокислотную последовательность костимуляторного внутриклеточного сигнального домена CD28 (например, содержащую аминокислотную последовательность SEQ ID NO: 40 или состоящую из неё) или ее фрагмент или вариант.
В некоторых вариантах осуществления химерный рецептор содержит аминокислотную последовательность костимуляторного внутриклеточного сигнального домена 4-1BB (например, содержащую аминокислотную последовательность SEQ ID NO: 36 или состоящую из нее) или ее фрагмент или вариант, и аминокислотную последовательность костимуляторного внутриклеточного сигнального домена CD27, (например, содержащую аминокислотную последовательность SEQ ID NO: 38 или состоящую из неё) или ее фрагмент или вариант, и аминокислотную последовательность костимуляторного внутриклеточного сигнального домена CD28 (например, включающую аминокислотную последовательность SEQ ID NO: 40 или состоящую из неё) или ее фрагмент или вариант.
В некоторых вариантах осуществления изобретения химерный рецептор включает комбинацию по меньшей мере четырех внутриклеточных доменов костимуляторной молекулы Т-клетки, например, выбранных из внутриклеточного домена TNFR2, внутриклеточного домена 4-1BB, внутриклеточного домена CD27 и внутриклеточного домена CD28.
В некоторых вариантах осуществления изобретения химерный рецептор может содержать комбинацию по меньшей мере четырех внутриклеточных доменов костимуляторной молекулы Т-клетки, где указанные костимуляторные внутриклеточные сигнальные домены представляют собой целые костимуляторные внутриклеточные сигнальные домены или их фрагмент или вариант.
В некоторых вариантах осуществления химерный рецептор содержит аминокислотную последовательность костимуляторного внутриклеточного сигнального домена TNFR2 (например, содержащую аминокислотную последовательность SEQ ID NO: 34 или состоящую из нее) или ее фрагмент или вариант, и аминокислотную последовательность костимуляторного внутриклеточного сигнального домена 4-1BB (например, содержащую аминокислотную последовательность SEQ ID NO: 36 или состоящую из неё) или ее фрагмент или вариант, и аминокислотную последовательность костимуляторного внутриклеточного сигнального домена CD27 (например, содержащую аминокислотную последовательность SEQ ID NO: 38 или состоящую из неё) или ее фрагмент или вариант, и аминокислотную последовательность костимуляторного внутриклеточного сигнального домена CD28 (например, содержащую аминокислотную последовательность SEQ ID NO: 40 или состоящую из неё) или ее фрагмент или вариант.
Таким образом, в некоторых вариантах осуществления нуклеиновокислотная последовательность, кодирующая костимуляторный сигнальный домен Т-клетки, включает нуклеиновокислотную последовательность костимуляторного внутриклеточного сигнального домена TNFR2 (например, содержащую аминокислотную последовательность SEQ ID NO: 35 или состоящую из неё) или её фрагмент или вариант, и/или нуклеиновокислотную последовательность костимуляторного внутриклеточного сигнального домена 4-1BB (например, содержащую аминокислотную последовательность SEQ ID NO: 37 или состоящую из нее) или ее фрагмент или вариант, и/или нуклеиновокислотную последовательность костимуляторного внутриклеточного сигнального домена CD27 (например, содержащую аминокислотную последовательность SEQ ID NO: 39 или состоящую из неё) или ее фрагмент или вариант, и/или нуклеиновокислотную последовательность костимуляторного внутриклеточного сигнального домена CD28 (например, содержащую аминокислотную последовательность SEQ ID NO: 41 или состоящую из неё) или его фрагмент или вариант.
В некоторых вариантах осуществления внутриклеточный сигнальный домен CAR по настоящему изобретению содержит:
- костимуляторный внутриклеточный сигнальный домен TNFR2 с аминокислотной последовательностью SEQ ID NO: 34, или его фрагмент или вариант, и/или костимуляторный внутриклеточный сигнальный домен 4-1BB с аминокислотной последовательностью SEQ ID NO: 36, или его фрагмент или вариант, и/или костимуляторный внутриклеточный сигнальный домен CD27 с аминокислотной последовательностью SEQ ID NO: 38, и/или костимуляторный внутриклеточный сигнальный домен CD28 с аминокислотной последовательностью SEQ ID NO: 40; и/или
- первичный внутриклеточный сигнальный домен CD3-дзета с аминокислотной последовательностью SEQ ID NO: 28, 29, 30 или 31, или его фрагмент или вариант;
где последовательности, содержащиеся во внутриклеточном домене, экспрессируются в одной и той же рамке и в виде одной полипептидной цепи.
Таким образом, в некоторых вариантах осуществления нуклеиновокислотная последовательность, кодирующая внутриклеточный сигнальный домен CAR по изобретению, включает:
- нуклеиновокислотную последовательность костимуляторного внутриклеточного сигнального домена TNFR2 SEQ ID NO: 35 или ее фрагмент или вариант, и/или нуклеиновокислотную последовательность костимуляторного внутриклеточного сигнального домена 4-1BB SEQ ID NO: 37 или ее фрагмент или вариант, и/или нуклеиновокислотную последовательность костимуляторного внутриклеточного сигнального домена CD27 SEQ ID NO: 39 или ее фрагмент или вариант, и/или нуклеиновокислотную последовательность костимуляторного внутриклеточного сигнального домена CD28 SEQ ID NO: 41 или ее фрагмент или вариант; и/или
- первичный внутриклеточный сигнальный домен CD3-дзета с SEQ ID NO: 32 или SEQ ID NO: 33 или его фрагмент или вариант.
В некоторых вариантах осуществления внутриклеточный сигнальный домен CAR по изобретению включает по меньшей мере два разных домена (например, первичный сигнальный домен или его фрагмент или вариант, и по меньшей мере один внутриклеточный домен костимуляторной молекулы Т-клетки или его фрагмент или вариант), которые могут быть связаны друг с другом в случайном или определенном порядке.
При необходимости короткий олиго- или полипептидный линкер, например, длиной от 2 до 10 аминокислот (например, 2, 3, 4, 5, 6, 7, 8, 9 или 10 аминокислот) может формировать связь между отдельными сигнальными доменами. В некоторых вариантах осуществления в качестве подходящего линкера используют дублет глицин-серин (GS). В некоторых вариантах осуществления в качестве подходящего линкера используют одну аминокислоту, например, аланин (A), глицин (G). Здесь описаны другие примеры линкера.
В некоторых вариантах осуществления внутриклеточный сигнальный домен CAR по изобретению содержит два или более (например, 2, 3, 4, 5 или более) костимуляторных внутриклеточных сигнальных доменов. В некоторых вариантах осуществления любой, или все из двух или более (например, 2, 3, 4, 5 или более) костимуляторных сигнальных доменов разделены линкерной молекулой, например, линкерной молекулой, как описано в настоящей заявке.
В некоторых вариантах осуществления внутриклеточный сигнальный домен химерного рецептора по изобретению включает первичный внутриклеточный сигнальный домен CD3-дзета (например, SEQ ID NO: 28, 29, 30 или 31) и костимуляторный внутриклеточный сигнальный домен TNFR2 (например, SEQ ID NO: 34).
В некоторых вариантах осуществления внутриклеточный сигнальный домен химерного рецептора по изобретению содержит первичный внутриклеточный сигнальный домен CD3-дзета (например, SEQ ID NO: 28, 29, 30 или 31) и костимуляторный внутриклеточный сигнальный домен 4-1BB (например, SEQ ID NO: 36).
В некоторых вариантах осуществления внутриклеточный сигнальный домен химерного рецептора по изобретению содержит первичный внутриклеточный сигнальный домен CD3-дзета (например, SEQ ID NO: 28, 29, 30 или 31) и костимуляторный внутриклеточный сигнальный домен CD27 (например, SEQ ID NO: 38).
В некоторых вариантах осуществления внутриклеточный сигнальный домен химерного рецептора по изобретению включает первичный внутриклеточный сигнальный домен CD3-дзета (например, SEQ ID NO: 28, 29, 30 или 31) и костимуляторный внутриклеточный сигнальный домен CD28 (например, SEQ ID NO: 40).
В некоторых вариантах осуществления CAR по настоящему изобретению содержит любую комбинацию внеклеточного связывающего домена, как описано в настоящей заявке, трансмембранного домена, как описано в настоящей заявке, внутриклеточного сигнального домена, как описано в настоящей заявке, и, при необходимости, спейсерного или шарнирного домена, как описано в настоящей заявке.
В некоторых вариантах осуществления CAR по настоящему изобретению дополнительно содержит лидерную последовательность, расположенную на N-конце специфического внеклеточного связывающего домена. Неограничивающим примером является лидерная последовательность CD8, которая может содержать последовательность SEQ ID NO: 42 или состоять из нее.
В некоторых вариантах осуществления CAR по настоящему изобретению дополнительно содержит метку, такую как, например, метка для контроля качества, обогащения, отслеживания in vivo и т.п. Указанная метка может быть локализована на N-конце, C-конце и/или внутри. Примеры меток, которые можно использовать в CAR по настоящему изобретению, хорошо известны специалистам в данной области техники. Например, используемая в изобретении, может быть меткой, выбранной из группы, состоящей из стрептавидиновой метки (например, SEQ ID NO: 47), гемагглютининовой метки, полиаргининовой метки, полигистидиновой метки, Myc метки, strep-метки, S-метки, HAT-метки, 3x flag-метки, метки из кальмодулин-связывающего пептида, SBP-метки, метки из связывающего хитин домена, GST-метки, метки из мальтозо-связывающего белка, метки из флуоресцентного белка, Т7-метки, V5-метки и Xpress-метки, но не ограничиваясь этим. Другие примеры меток включают NWSHPQFEK (SEQ ID NO: 43) или SAWSHPQFEK (SEQ ID NO: 44), но не ограничиваются ими.
В некоторых вариантах осуществления CAR по настоящему изобретению дополнительно содержит последовательности P2A (SEQ ID NO: 45) и/или GFP (SEQ ID NO: 46).
В некоторых вариантах осуществления CAR по настоящему изобретению содержит:
- по меньшей мере один внеклеточный связывающий домен;
- при необходимости внеклеточный шарнирный домен;
- по меньшей мере один трансмембранный домен TNFR2 или его фрагмент или вариант; и
- по меньшей мере один внутриклеточный первичный сигнальный домен или его фрагмент или вариант.
В некоторых вариантах осуществления CAR по настоящему изобретению содержит:
- по меньшей мере один внеклеточный связывающий домен;
- по меньшей мере один трансмембранный домен TNFR2 (например, SEQ ID NO: 22) или его фрагмент или вариант; и
- по меньшей мере один первичный внутриклеточной сигнальный домен CD3-дзета (например, SEQ ID NO: 28, 29, 30 или 31) или его фрагмент или вариант.
В некоторых вариантах осуществления CAR по настоящему изобретению содержит:
- по меньшей мере, один внеклеточный связывающий домен;
- по меньшей мере один шарнирный домен, выбранный из группы, состоящей из CD8 (например, SEQ ID NO: 14) или его фрагмента или варианта, CD28 (например, SEQ ID NO: 20) или его фрагмента или варианта, IgG4 (например, SEQ ID NO: 16) или его фрагмента или варианта, и IgD (например, SEQ ID NO: 18) или его фрагмента или варианта;
- по меньшей мере один трансмембранный домен TNFR2 (например, SEQ ID NO: 22) или его фрагмент или вариант; и
- по меньшей мере один первичный внутриклеточной сигнальный домен CD3-дзета (например, SEQ ID NO: 28, 29, 30 или 31) или его фрагмент или вариант. В конкретных вариантах осуществления по меньшей мере один шарнирный домен представляет собой шарнирный домен CD8 (например, SEQ ID NO: 14).
В некоторых вариантах осуществления CAR по настоящему изобретению содержит:
- по меньшей мере один внеклеточный связывающий домен;
- при необходимости по меньшей мере один внеклеточный шарнирный домен;
- по меньшей мере один трансмембранный домен или его фрагмент или вариант; и
- по меньшей мере, один костимуляторный внутриклеточный сигнальный домен или его фрагмент или вариант, где по меньшей мере один из трансмембранного домена и костимуляторного внутриклеточного сигнального домена является трансмембранным доменом TNFR2 или костимуляторным внутриклеточным доменом TNFR2 или его фрагментом или вариантом.
В некоторых вариантах осуществления CAR по настоящему изобретению содержит:
- по меньшей мере один внеклеточный связывающий домен;
- по меньшей мере один трансмембранный домен, выбранный из группы, состоящей из трансмембранного домена TNFR2 (например, SEQ ID NO: 22) или его фрагмента или варианта, трансмембранного домена CD8 (например, SEQ ID NO: 24) или его фрагмента или варианта, и трансмембранного домена CD28 (например, SEQ ID NO: 26) или его фрагмента или варианта; и
- по меньшей мере один костимуляторный внутриклеточный сигнальный домен, выбранный из группы, состоящей из внутриклеточного домена TNFR2 (например, SEQ ID NO: 34) или его фрагмента или варианта, внутриклеточного домена 4-1BB (например, SEQ ID NO: 36) или его фрагмента или варианта, внутриклеточного домена CD27 (например, SEQ ID NO: 38) или его фрагмента или варианта, и внутриклеточного домена CD28 (например, SEQ ID NO: 40) или его фрагмента или варианта,
где по меньшей мере один из трансмембранного домена и костимуляторного внутриклеточного сигнального домена является трансмембранным доменом TNFR2 или костимуляторным внутриклеточным сигнальным доменом TNFR2 или их фрагментом или вариантом.
В некоторых вариантах осуществления CAR согласно изобретению содержит:
- по меньшей мере один внеклеточный связывающий домен;
- по меньшей мере один шарнирный домен, выбранный из группы, состоящей из CD8 (например, SEQ ID NO: 14) или его фрагмента или варианта, CD28 (например, SEQ ID NO: 20) или его фрагмента или варианта, IgG4 (например, SEQ ID NO: 16) или его фрагмента или варианта, и IgD (например, SEQ ID NO: 18) или его фрагмента или варианта;
- по меньшей мере один трансмембранный домен, выбранный из группы, состоящей из трансмембранного домена TNFR2 (например, SEQ ID NO: 22) или его фрагмента или варианта, трансмембранного домена CD8 (например, SEQ ID NO: 24) или его фрагмента или варианта, и трансмембранного домена CD28 (например, SEQ ID NO: 26) или его фрагмента или варианта; и
- по меньшей мере один костимуляторный внутриклеточный сигнальный домен, выбранный из группы, состоящей из внутриклеточного домена TNFR2 (например, SEQ ID NO: 34) или его фрагмента или варианта, внутриклеточного домена 4-1ВВ (например, SEQ ID NO: 36) или его фрагмента или варианта, внутриклеточного домена CD27 (например, SEQ ID NO: 38) или его фрагмента или варианта, и внутриклеточного домена CD28 (например, SEQ ID NO: 40) или его фрагмента или варианта;
где по меньшей мере один из трансмембранного домена и костимуляторного внутриклеточного сигнального домена является трансмембранным доменом TNFR2 или костимуляторным внутриклеточным сигнальным доменом TNFR2, либо их фрагментом или вариантом. В конкретных вариантах осуществления по меньшей мере один шарнирный домен представляет собой шарнирный домен CD8 (например, SEQ ID NO: 14).
В некоторых вариантах осуществления CAR по настоящему изобретению содержит:
- по меньшей мере один внеклеточный связывающий домен;
- при необходимости по меньшей мере один внеклеточный шарнирный домен;
- по меньшей мере один трансмембранный домен или его фрагмент или вариант;
- по меньшей мере один внутриклеточный костимуляторный сигнальный домен или его фрагмент или вариант; и
- по меньшей мере один первичный сигнальный внутриклеточный домен Т-клетки или его фрагмент или вариант;
где по меньшей мере один из трансмембранного домена и костимуляторного внутриклеточного сигнального домена является трансмембранным доменом TNFR2 или костимуляторным внутриклеточным сигнальным доменом TNFR2, либо их фрагментом или вариантом.
В некоторых вариантах осуществления CAR по изобретению содержит:
- по меньшей мере один внеклеточный связывающий домен;
- по меньшей мере один трансмембранный домен, выбранный из группы, состоящей из трансмембранного домена TNFR2 (например, SEQ ID NO: 22) или его фрагмента или варианта, трансмембранного домена CD8 (например, SEQ ID NO: 24) или его фрагмента или варианта, и трансмембранного домена CD28 (например, SEQ ID NO: 26) или его фрагмента или варианта;
- по меньшей мере один костимуляторный внутриклеточный сигнальный домен, выбранный из группы, состоящей из внутриклеточного домена TNFR2 (например, SEQ ID NO: 34) или его фрагмента или варианта, внутриклеточного домена 4-1BB (например, SEQ ID NO: 36) или его фрагмента или варианта, внутриклеточного домена CD27 (например, SEQ ID NO: 38) или его фрагмента или варианта, и внутриклеточного домена CD28 (например, SEQ ID NO: 40) или его фрагмента или варианта; и
- по меньшей мере один первичный внутриклеточный сигнальный домен CD3-дзета (например, SEQ ID NO: 28, 29, 30 или 31) или его фрагмент или вариант;
где по меньшей мере один из трансмембранного домена и костимуляторного внутриклеточного сигнального домена является трансмембранным доменом TNFR2 или костимуляторным внутриклеточным сигнальным доменом TNFR2, либо их фрагментом или вариантом.
В некоторых вариантах осуществления CAR по изобретению содержит:
- по меньшей мере один внеклеточный связывающий домен;
- по меньшей мере один шарнирный домен, выбранный из группы, состоящей из CD8 (например, SEQ ID NO: 14) или его фрагмента или варианта, CD28 (например, SEQ ID NO: 20) или его фрагмента или варианта, IgG4 (например, SEQ ID NO: 16) или его фрагмента или варианта, и IgD (например, SEQ ID NO: 18) или его фрагмента или варианта;
- по меньшей мере один трансмембранный домен, выбранный из группы, состоящей из TNFR2 (например, SEQ ID NO: 22) или его фрагмента или варианта, трансмембранного домена CD8 (например, SEQ ID NO: 24) или его фрагмента или варианта, и трансмембранного домена CD28 (например, SEQ ID NO: 26) или его фрагмента или варианта;
по меньшей мере один костимуляторный внутриклеточный сигнальный домен, выбранный из группы, состоящей из внутриклеточного домена TNFR2 (например, SEQ ID NO: 34) или его фрагмента или варианта, внутриклеточного домена 4-1BB (например, SEQ ID NO 36) или его фрагмента или варианта, внутриклеточного домена CD27 (например, SEQ ID NO: 38) или его фрагмента или варианта, и внутриклеточного домена CD28 (например, SEQ ID NO: 40) или его фрагмента или варианта; и
- по меньшей мере один первичный внутриклеточный сигнальный домен CD3-дзета (например, SEQ ID NO: 28, 29, 30 или 31) или его фрагмент или вариант;
где по меньшей мере один из трансмембранного домена и костимуляторного внутриклеточного сигнального домена является трансмембранным доменом TNFR2 или костимуляторным внутриклеточным сигнальным доменом TNFR2, или их фрагментом или вариантом. В конкретных вариантах осуществления по меньшей мере один шарнирный домен представляет собой шарнирный домен CD8 (например, SEQ ID NO: 14).
Согласно некоторым вариантам осуществления, CAR согласно изобретению содержит:
- по меньшей мере один внеклеточный связывающий домен;
- при необходимости по меньшей мере один внеклеточный шарнирный домен;
- по меньшей мере один трансмембранный домен или его фрагмент или вариант;
- по меньшей мере два внутриклеточных костимуляторных сигнальных домена, или их фрагменты или варианты; и
- при необходимости по меньшей мере один первичный сигнальный домен Т-клетки или его фрагмент или вариант, где по меньшей мере один из трансмембранного домена и/или костимуляторных внутриклеточных сигнальных доменов представляет собой трансмембранный домен TNFR2 или костимуляторный внутриклеточный сигнальный домен TNFR2, или их фрагмент или вариант.
В некоторых вариантах осуществления CAR согласно изобретению содержит:
- по меньшей мере один внеклеточный связывающий домен;
- по меньшей мере один трансмембранный домен, выбранный из группы, состоящей из TNFR2 (например, SEQ ID NO: 22) или его фрагмента или варианта, трансмембранного домена CD8 (например, SEQ ID NO: 24) или его фрагмента или варианта, и трансмембранного домена CD28 (например, SEQ ID NO: 26) или его фрагмента или варианта;
- по меньшей мере два костимуляторных внутриклеточных сигнальных домена, выбранных из группы, состоящей из внутриклеточного домена TNFR2 (например, SEQ ID NO: 34) или его фрагмента или варианта, внутриклеточного домена 4-1BB (например, SEQ ID NO: 36) или его фрагмента или варианта, внутриклеточного домена CD27 (например, SEQ ID NO: 38) или его фрагмента или варианта, и внутриклеточного домена CD28 (например, SEQ ID NO: 40) или его фрагмента или варианта; и
- при необходимости по меньшей мере один первичный внутриклеточный сигнальный домен CD3-дзета (например, SEQ ID NO: 28, 29, 30 или 31) или его фрагмент или вариант;
где по меньшей мере один из трансмембранных доменов и/или костимуляторных внутриклеточных сигнальных доменов представляет собой трансмембранный TNFR2 или костимуляторный внутриклеточный сигнальный домен TNFR2, или их фрагмент или вариант.
В некоторых вариантах осуществления CAR по изобретению содержит:
- по меньшей мере один внеклеточный связывающий домен;
- по меньшей мере один шарнирный домен, выбранный из группы, состоящей из CD8 (например, SEQ ID NO: 14) или его фрагмента или варианта, CD28 (например, SEQ ID NO: 20) или его фрагмента или варианта, IgG4 (например, SEQ ID NO: 16) или его фрагмента или варианта, и IgD (например, SEQ ID NO: 18) или его фрагмента или варианта;
- по меньшей мере один трансмембранный домен, выбранный из группы, состоящей из TNFR2 (например, SEQ ID NO: 22) или его фрагмента или варианта, трансмембранного домена CD8 (например, SEQ ID NO: 24) или его фрагмента или варианта, и трансмембранного домена CD28 (например, SEQ ID NO: 26) или его фрагмента или варианта;
- по меньшей мере два костимуляторных внутриклеточных сигнальных домена, выбранных из группы, состоящей из внутриклеточного домена TNFR2 (например, SEQ ID NO: 34) или его фрагмента или варианта, внутриклеточного домена 4-1BB (например, SEQ ID NO: 36) или фрагмента или его вариант, внутриклеточного домена CD27 (например, SEQ ID NO: 38) или его фрагмента или варианта, и внутриклеточного домена CD28 (например, SEQ ID NO: 40) или его фрагмента или варианта; и
- при необходимости по меньшей мере один первичный внутриклеточный сигнальный домен CD3-дзета (например, SEQ ID NO: 28, 29, 30 или 31) или его фрагмент или вариант;
где по меньшей мере один из трансмембранного домена и/или костимуляторного внутриклеточного сигнального домена представляет собой трансмембранный TNFR2 или костимуляторный внутриклеточный сигнальный домен TNFR2, или их фрагмент или вариант. В конкретных вариантах осуществления по меньшей мере один шарнирный домен представляет собой шарнирный домен CD8 (например, SEQ ID NO: 14).
В некоторых вариантах осуществления CAR по изобретению содержит:
- по меньшей мере один внеклеточный связывающий домен;
- при необходимости при по меньшей мере один внеклеточный шарнирный домен;
- по меньшей мере один трансмембранный домен или его фрагмент или вариант;
- по меньшей мере три костимуляторных внутриклеточных сигнальных домена, или их фрагменты или варианты; и
- при необходимости по меньшей мере один первичный внутриклеточный сигнальный домен Т-клетки или его фрагмент или вариант;
где по меньшей мере один из трансмембранного домена и/или костимуляторных внутриклеточных сигнальных доменов представляет собой трансмембранный TNFR2 или костимуляторный внутриклеточный сигнальный домен TNFR2, или их фрагмент или вариант.
В некоторых вариантах осуществления CAR по изобретению содержит:
- по меньшей мере один внеклеточный связывающий домен;
- по меньшей мере один трансмембранный домен, выбранный из группы, состоящей из TNFR2 (например, SEQ ID NO: 22) или его фрагмента или варианта, трансмембранного домена CD8 (например, SEQ ID NO: 24) или его фрагмента или варианта, и трансмембранного домена CD28 (например, SEQ ID NO: 26) или его фрагмента или варианта;
- по меньшей мере три костимуляторных внутриклеточных сигнальных домена, выбранных из группы, состоящей из внутриклеточного домена TNFR2 (например, SEQ ID NO: 34) или его фрагмента или варианта, внутриклеточного домена 4-1BB (например, SEQ ID NO: 36) или его фрагмента или варианта, внутриклеточного домена CD27 (например, SEQ ID NO: 38) или его фрагмента или варианта, и внутриклеточного домена CD28 (например, SEQ ID NO: 40) или его фрагмента или варианта; и
- при необходимости по меньшей мере один первичный внутриклеточный сигнальный домен CD3-дзета (например, SEQ ID NO: 28, 29, 30 или 31) или его фрагмент или вариант;
где по меньшей мере один из трансмембранного домена и/или костимуляторных внутриклеточных сигнальных доменов представляет собой трансмембранный или костимуляторный внутриклеточный сигнальный домен TNFR2, или их фрагмент или вариант.
В некоторых вариантах осуществления CAR по изобретению содержит:
- по меньшей мере один внеклеточный связывающий домен;
- по меньшей мере один шарнирный домен, выбранный из группы, состоящей из CD8 (например, SEQ ID NO: 14) или его фрагмента или варианта, CD28 (например, SEQ ID NO: 20) или его фрагмента или варианта, IgG4 (например, SEQ ID NO: 16) или его фрагмента или варианта, и IgD (например, SEQ ID NO: 18) или его фрагмента или варианта;
- по меньшей мере один трансмембранный домен, выбранный из группы, состоящей из TNFR2 (например, SEQ ID NO: 22) или его фрагмента или варианта, трансмембранного домена CD8 (например, SEQ ID NO: 24) или его фрагмента или варианта, и трансмембранного домена CD28 (например, SEQ ID NO: 26) или его фрагмента или варианта;
- по меньшей мере три костимуляторных внутриклеточных сигнальных домена, выбранных из группы, состоящей из внутриклеточного домена TNFR2 (например, SEQ ID NO: 34) или его фрагмента или варианта, внутриклеточного домена 4-1BB (например, SEQ ID NO: 36) или его фрагмента или варианта, внутриклеточного домена CD27 (например, SEQ ID NO: 38) или его фрагмента или варианта, и внутриклеточного домена CD28 (например, SEQ ID NO: 40) или его фрагмент или вариант; и
- при необходимости по меньшей мере один первичный внутриклеточный сигнальный домен CD3-дзета (например, SEQ ID NO: 28, 29, 30 или 31) или его фрагмент или вариант;
где по меньшей мере один из трансмембранного домена и/или костимуляторных внутриклеточных сигнальных доменов представляет собой трансмембранный или костимуляторный внутриклеточный сигнальный домен TNFR2, или их фрагмент или вариант. В конкретных вариантах осуществления по меньшей мере один шарнирный домен представляет собой шарнирный домен CD8 (например, SEQ ID NO: 14).
В некоторых вариантах осуществления CAR по настоящему изобретению содержит:
- по меньшей мере один внеклеточный связывающий домен;
- при необходимости по меньшей мере один внеклеточный шарнирный домен;
- по меньшей мере один трансмембранный домен или его фрагмент или вариант;
- по меньшей мере четыре костимуляторных внутриклеточных сигнальных домена, или их фрагменты или варианты; и
- при необходимости по меньшей мере один первичный внутриклеточный сигнальный домен Т-клетки или его фрагмент или вариант;
где по меньшей мере один из трансмембранного домена и/или костимуляторных внутриклеточных сигнальных доменов представляет собой трансмембранный домен TNFR2 или костимуляторный внутриклеточный сигнальный домен TNFR2, или их фрагмент или вариант.
В некоторых вариантах осуществления CAR согласно изобретению содержит:
- по меньшей мере один внеклеточный связывающий домен;
- по меньшей мере один трансмембранный домен, выбранный из группы, состоящей из TNFR2 (например, SEQ ID NO: 22) или его фрагмента или варианта, трансмембранного домена CD8 (например, SEQ ID NO: 24) или его фрагмента или варианта, и трансмембранного домена CD28 (например, SEQ ID NO: 26) или его фрагмента или варианта;
- по меньшей мере четыре костимуляторных внутриклеточных сигнальных домена, выбранных из группы, состоящей из внутриклеточного домена TNFR2 (например, SEQ ID NO: 34) или его фрагмента или варианта, внутриклеточного домена 4-1BB (например, SEQ ID NO: 36) или его фрагмента или варианта, внутриклеточного домена CD27 (например, SEQ ID NO: 38) или его фрагмента или варианта, и внутриклеточного домена CD28 (например, SEQ ID NO: 40) или его фрагмента или варианта; и
- при необходимости по меньшей мере один первичный внутриклеточный сигнальный домен CD3-дзета (например, SEQ ID NO: 28, 29, 30 или 31) или его фрагмент или вариант;
где по меньшей мере один из трансмембранного домена и/или костимуляторных внутриклеточных сигнальных доменов представляет собой трансмембранный или костимуляторный внутриклеточный сигнальный домен TNFR2 или его фрагмент или вариант.
В некоторых вариантах осуществления CAR согласно изобретению содержит:
- по меньшей мере один внеклеточный связывающий домен;
- по меньшей мере один шарнирный домен, выбранный из группы, состоящей из CD8 (например, SEQ ID NO: 14) или его фрагмента или варианта, CD28 (например, SEQ ID NO: 20) или его фрагмента или варианта, IgG4 (SEQ ID NO: 16) или его фрагмента или варианта, и IgD (например, SEQ ID NO: 18) или его фрагмента или варианта;
- по меньшей мере один трансмембранный домен, выбранный из группы, состоящей из трансмембранного домена TNFR2 (например, SEQ ID NO: 22) или его фрагмента или варианта, трансмембранного домена CD8 (например, SEQ ID NO: 24) или его фрагмента или варианта, и трансмембранного домена CD28 (например, SEQ ID NO: 26) или его фрагмента или варианта;
- по меньшей мере четыре костимуляторных внутриклеточных сигнальных домена, выбранных из группы, состоящей из внутриклеточного домена TNFR2 (например, SEQ ID NO: 34) или его фрагмента или варианта, внутриклеточного домена 4-1BB (например, SEQ ID NO: 36) или его фрагмента или варианта, внутриклеточного домена CD27 (например, SEQ ID NO: 38) или его фрагмента или варианта, и внутриклеточного домена CD28 (например, SEQ ID NO: 40) или его фрагмента или варианта; и
- при необходимости по меньшей мере один первичный внутриклеточный сигнальный домен CD3-дзета (например, SEQ ID NO: 28, 29, 30 или 31) или его фрагмент или вариант;
где по меньшей мере один из трансмембранных доменов и/или костимуляторных внутриклеточных сигнальных доменов представляет собой трансмембранный домен TNFR2 или костимуляторный сигнальный внутриклеточный домен TNFR2, или их фрагмент или вариант. В конкретных вариантах осуществления по меньшей мере один шарнирный домен представляет собой шарнирный домен CD8 (например, SEQ ID NO: 14).
В некоторых вариантах осуществления CAR по изобретению содержит:
- по меньшей мере один внеклеточный связывающий домен;
- при необходимости по меньшей мере один внеклеточный шарнирный домен;
- по меньшей мере 1, 2 или 3 трансмембранных домена или их фрагменты или варианты; и
- при необходимости по меньшей мере один первичный внутриклеточный сигнальный домен Т-клетки или его фрагмент или вариант;
где по меньшей мере один из трансмембранных доменов представляет собой трансмембранный домен TNFR2 или его фрагмент или вариант.
В некоторых вариантах осуществления CAR по изобретению содержит:
- по меньшей мере один внеклеточный связывающий домен;
- по меньшей мере 1, 2 или 3 трансмембранных домена, выбранных из группы, состоящей из трансмембранного домена TNFR2 (например, SEQ ID NO: 22) или его фрагмента или варианта, трансмембранного домена CD8 (например, SEQ ID NO: 24) или его фрагмента или варианта, и трансмембранного домена CD28 (например, SEQ ID NO: 26) или его фрагмента или варианта; и
- при необходимости по меньшей мере один первичный сигнальный домен CD3-дзета (например, SEQ ID NO: 28, 29, 30 или 31) или его фрагмент или вариант;
где по меньшей мере один из трансмембранных доменов представляет собой трансмембранный домен TNFR2 или его фрагмент или вариант.
В некоторых вариантах осуществления CAR по настоящему изобретению содержит:
- по меньшей мере один внеклеточный связывающий домен;
- по меньшей мере один шарнирный домен, выбранный из группы, состоящей из CD8 (например, SEQ ID NO: 14) или его фрагмента или варианта, CD28 (например, SEQ ID NO: 20) или его фрагмента или варианта, IgG4 (например, SEQ ID NO: 16) или его фрагмента или варианта, и IgD (например, SEQ ID NO: 18) или его фрагмента или варианта;
- по меньшей мере 1, 2 или 3 трансмембранных домена, выбранных из группы, состоящей из TNFR2 (например, SEQ ID NO: 22) или его фрагмента или варианта, трансмембранного домена CD8 (например, SEQ ID NO: 24) или его фрагмента или варианта, и трансмембранного домена CD28 (например, SEQ ID NO: 26) или его фрагмента или варианта; и
- при необходимости по меньшей мере один первичный внутриклеточный сигнальный домен CD3-дзета (например, SEQ ID NO: 28, 29, 30 или 31) или его фрагмент или вариант;
где по меньшей мере один из трансмембранных доменов представляет собой трансмембранный домен TNFR2 или его фрагмент или вариант. В конкретных вариантах осуществления по меньшей мере один шарнирный домен представляет собой шарнирный домен CD8 (например, SEQ ID NO: 14).
В некоторых вариантах осуществления CAR по изобретению содержит:
- по меньшей мере один внеклеточный связывающий домен;
- при необходимости по меньшей мере один внеклеточный шарнирный домен;
- по меньшей мере, 1, 2 или 3 трансмембранных домена, или их фрагменты или варианты;
- по меньшей мере, 1, 2, 3 или 4 внутриклеточных костимуляторных сигнальных домена, или их фрагменты или варианты; и
- при необходимости по меньшей мере один первичный сигнальный домен Т-клетки или его фрагмент или вариант;
где по меньшей мере один из трансмембранного домена и/или костимуляторных внутриклеточных сигнальных доменов представляет собой трансмембранный домен TNFR2 или костимуляторный внутриклеточный сигнальный домен TNFR2, либо их фрагмент или вариант.
В некоторых вариантах осуществления CAR по изобретению содержит:
- по меньшей мере один внеклеточный связывающий домен;
- по меньшей мере 1, 2 или 3 трансмембранных домена, выбранных из группы, состоящей из трансмембранного домена TNFR2 (например, SEQ ID NO: 22) или его фрагмента или варианта, трансмембранного домена CD8 (например, SEQ ID NO: 24) или его фрагмента или варианта, и трансмембранного домена CD28 (например, SEQ ID NO: 26) или его фрагмента или варианта;
- по меньшей мере 1, 2, 3 или 4 костимуляторных внутриклеточных сигнальных домена, выбранных из группы, состоящей из внутриклеточного домена TNFR2 (например, SEQ ID NO: 34) или его фрагмента или варианта, внутриклеточного домена 4-1BB (например, SEQ ID NO: 36) или его фрагмента или варианта, внутриклеточного домена CD27 (например, SEQ ID NO: 38) или его фрагмента или варианта, и внутриклеточного домена CD28 (например, SEQ ID NO: 40) или его фрагмента или варианта; и
- при необходимости по меньшей мере один первичный сигнальный домен CD3-дзета (например, SEQ ID NO: 28, 29, 30 или 31) или его фрагмент или вариант;
где по меньшей мере один из трансмембранных доменов и/или костимуляторных внутриклеточных сигнальных доменов представляет собой трансмембранный домен TNFR2 или костимуляторный внутриклеточный сигнальный домен TNFR2, или их фрагмент или вариант.
В некоторых вариантах осуществления CAR по изобретению содержит:
- по меньшей мере один внеклеточный связывающий домен;
- по меньшей мере один шарнирный домен, выбранный из группы, состоящей из CD8 (например, SEQ ID NO: 14) или его фрагмента или варианта, CD28 (например, SEQ ID NO: 20) или его фрагмента или варианта, IgG4 (например, SEQ ID NO: 16) или его фрагмента или варианта, и IgD (например, SEQ ID NO: 18) или его фрагмента или варианта;
- по меньшей мере 1, 2 или 3 трансмембранных домена, выбранных из группы, состоящей из трансмембранного домена TNFR2 (например, SEQ ID NO: 22) или его фрагмента или варианта, трансмембранного домена CD8 (например, SEQ ID NO: 24) или его фрагмента или варианта, или трансмембранного домена CD28 (например, SEQ ID NO: 26) или его фрагмента или варианта;
- по меньшей мере 1, 2, 3 или 4 костимуляторных внутриклеточных сигнальных домена, выбранных из группы, состоящей из внутриклеточного домена TNFR2 (например, SEQ ID NO: 34) или его фрагмента или варианта, внутриклеточного домена 4-1BB (например, SEQ ID NO: 36) или его фрагмента или варианта, внутриклеточного домена CD27 (например, SEQ ID NO: 38) или его фрагмента или варианта, и внутриклеточного домена CD28 (например, SEQ ID NO: 40) или его фрагмента или варианта; и
- при необходимости по меньшей мере один первичный сигнальный домен CD3-дзета (например, SEQ ID NO: 28, 29, 30 или 31) или его фрагмент или вариант;
где по меньшей мере один из трансмембранных доменов и/или костимуляторных внутриклеточных сигнальных доменов представляет собой трансмембранный TNFR2 или костимуляторный внутриклеточный сигнальный домен TNFR2, или его фрагмент или вариант. В конкретных вариантах осуществления по меньшей мере один шарнирный домен представляет собой шарнирный домен CD8 (например, SEQ ID NO: 14).
В некоторых вариантах осуществления CAR по изобретению содержит:
- по меньшей мере один внеклеточный связывающий домен;
- при необходимости по меньшей мере один внеклеточный шарнирный домен;
- по меньшей мере один трансмембранный домен;
- по меньшей мере один внутриклеточный домен, содержащий по меньшей мере один первичный внутриклеточный сигнальный домен и при необходимости по меньшей мере один костимуляторный внутриклеточный сигнальный домен;
и где по меньшей мере один трансмембранный домен представляет собой трансмембранный домен TNFR2 человека или его фрагмент или вариант, или любой трансмембранный домен, или его фрагмент, или вариант, или их комбинацию, и/или по меньшей мере один костимуляторный внутриклеточный сигнальный домен представляет собой костимуляторный внутриклеточный сигнальный домен TNFR2 человека, или его фрагмент или вариант, или любой костимуляторный внутриклеточный сигнальный домен, или его фрагмент, или вариант, или их комбинацию, и где по меньшей мере один из трансмембранного домена и костимуляторного внутриклеточного сигнального домена является трансмембранным доменом TNFR2 или его фрагментом или вариантом, или костимуляторным внутриклеточным сигнальным доменом TNFR2, или их фрагментом или вариантом.
В некоторых вариантах осуществления CAR по изобретению содержит последовательность, включающую шарнирную область человеческого CD8, трансмембранный домен человеческого TNFR2, костимуляторный внутриклеточный сигнальный домен человеческого TNFR2 и первичный внутриклеточный сигнальный домен CD3ζ цепи человека, где указанная последовательность соответствует аминокислотной последовательности SEQ ID NO: 48 или аминокислотной последовательности, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 48.
В некоторых вариантах осуществления CAR по настоящему изобретению содержит анти-HLA-A2 scFv (например, содержащий или состоящий из последовательности связывающего домена SEQ ID NO: 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106 или 107), связанный с аминокислотной последовательностью SEQ ID NO: 48 или последовательностью, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90% 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 48.
В некоторых вариантах осуществления CAR по настоящему изобретению включает анти-IL-23R scFv (например, содержащий последовательность связывающего домена SEQ ID NO: 65, 66 или 67 или состоящий из нее), связанный с аминокислотной последовательностью SEQ ID NO: 48 или последовательностью, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 48.
В некоторых вариантах осуществления CAR по настоящему изобретению содержит анти-CD19 scFv (например, содержащий последовательность связывающего домена SEQ ID NO: 1 или 2 или состоящий из нее), связанный с аминокислотной последовательностью SEQ ID NO: 48 или последовательностью, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 48.
В некоторых вариантах осуществления CAR по изобретению содержит анти-CD20 scFv (например, содержащий последовательность связывающего домена SEQ ID NO: 4, 5 или 6 или состоящий из нее), связанный с аминокислотной последовательностью SEQ ID NO: 48 или аминокислотной последовательностью, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97% 98% или 99% идентичности с SEQ ID NO: 48.
В некоторых вариантах осуществления CAR по настоящему изобретению включает последовательность, содержащую шарнирную область человеческого CD8, трансмембранный домен человеческого TNFR2, костимуляторный внутриклеточный сигнальный домен человеческого TNFR2 и первичный внутриклеточный сигнальный домен CD3ζ цепи человека, где указанная последовательность соответствует аминокислотной последовательности SEQ ID NO: 49, 50, 51 или 110 или аминокислотной последовательности, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 49, 50, 51 или 110.
В некоторых вариантах осуществления CAR по настоящему изобретению содержит анти-HLA-A2 scFv (например, содержащий последовательность связывающего домена SEQ ID NO: 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106 или 107, или состоящий из неё), связанный с аминокислотной последовательностью SEQ ID NO: 49, 50, 51 или 110 или последовательностью, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 49, 50, 51 или 110.
В некоторых вариантах осуществления CAR по настоящему изобретению включает анти-IL-23R scFv (например, содержащий последовательность связывающего домена SEQ ID NO: 65, 66 или 67 или состоящий из нее), связанный с аминокислотной последовательностью SEQ ID NO: 49, 50, 51 или 110 или последовательностью, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 49, 50, 51 или 110.
В некоторых вариантах осуществления CAR по настоящему изобретению содержит анти-CD19 scFv (например, содержащий последовательность связывающего домена SEQ ID NO: 1 или 2 или состоящий из нее), связанный с аминокислотной последовательностью SEQ ID NO: 49, 50, 51 или 110 или последовательностью, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 49, 50, 51 или 110.
В некоторых вариантах осуществления CAR по настоящему изобретению содержит анти-CD20 scFv (например, содержащий последовательность связывающего домена SEQ ID NO: 4, 5 или 6 или состоящий из нее), связанный с аминокислотной последовательностью SEQ ID NO: 49, 50, 51 или 110 или последовательностью, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 49, 50, 51 или 110.
В некоторых вариантах осуществления CAR по изобретению содержит последовательность, включающую шарнирную область человеческого CD8, трансмембранный домен человеческого TNFR2 и первичный внутриклеточный сигнальный домен CD3ζ цепи человека, где указанная последовательность соответствует аминокислотной последовательности SEQ ID NO: 52 или аминокислотной последовательности, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 52.
В некоторых вариантах осуществления CAR по изобретению содержит анти-HLA-A2 scFv (например, содержащий или состоящий из последовательности связывающего домена SEQ ID NO: 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106 или 107), связанный с аминокислотной последовательностью SEQ ID NO: 52 или последовательностью, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90% 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 52.
В некоторых вариантах осуществления CAR по настоящему изобретению содержит анти-IL-23R scFv (например, содержащий последовательность связывающего домена SEQ ID NO: 65, 66 или 67 или состоящий из нее), связанный с аминокислотной последовательностью SEQ ID NO: 52 или последовательностью, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 52.
В некоторых вариантах осуществления CAR по настоящему изобретению включает анти-CD19 scFv (например, содержащий последовательность связывающего домена SEQ ID NO: 1 или 2 или состоящий из нее), связанный с аминокислотной последовательностью SEQ ID NO: 52 или последовательностью, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 52.
В некоторых вариантах осуществления CAR по настоящему изобретению включает анти-CD20 scFv (например, содержащий последовательность связывающего домена SEQ ID NO: 4, 5 или 6 или состоящий из нее), связанный с аминокислотной последовательностью SEQ ID NO: 52 или последовательностью, имеющей по меньшей мере 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 52.
В некоторых вариантах осуществления CAR по изобретению содержит последовательность, включающую шарнирную область человеческого CD8, трансмембранный домен человеческого CD8, первичный внутриклеточный сигнальный домен человеческой CD3ζ-цепи и костимуляторный внутриклеточный сигнальный домен человеческого TNFR2, где указанная последовательность соответствует аминокислотной последовательности SEQ ID NO: 5 или аминокислотной последовательности, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 53.
В некоторых вариантах осуществления CAR по настоящему изобретению содержит анти-HLA-A2 scFv (например, содержащий последовательность связывающего домена SEQ ID NO: 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106 или 107, или состоящий из неё), связанный с аминокислотной последовательностью SEQ ID NO: 53 или последовательностью, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90% 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 53.
В некоторых вариантах осуществления CAR по настоящему изобретению содержит анти-IL-23R scFv (например, содержащий последовательность связывающего домена SEQ ID NO: 65, 66 или 67 или состоящий из нее), связанный с аминокислотной последовательностью SEQ ID NO: 53 или последовательностью, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 53.
В некоторых вариантах осуществления CAR по изобретению содержит анти-CD19 scFv (например, содержащий последовательность связывающего домена SEQ ID NO: 1 или 2 или состоящий из нее), связанный с аминокислотной последовательностью SEQ ID NO: 53, или последовательностью, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 53.
В некоторых вариантах осуществления CAR по настоящему изобретению содержит анти-CD20 scFv (например, содержащий последовательность связывающего домена SEQ ID NO: 4, 5 или 6 или состоящий из нее), связанный с аминокислотной последовательностью SEQ ID NO : 53 или последовательностью, имеющей не менее 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 53.
В некоторых вариантах осуществления CAR по настоящему изобретению содержит последовательность, содержащую шарнирную область человеческого CD8, трансмембранный домен человеческого CD8, костимуляторный внутриклеточный сигнальный домен человеческого TNFR2 и первичный внутриклеточный сигнальный домен человеческой CD3ζ цепи, где указанная последовательность соответствует аминокислотной последовательности SEQ ID NO: 54 или аминокислотной последовательности, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 54.
В некоторых вариантах осуществления CAR по изобретению содержит scFv против HLA-A2 (например, содержащий последовательность связывающего домена SEQ ID NO: 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106 или 107, или состоящий из неё), связанный с аминокислотной последовательностью SEQ ID NO: 54 или последовательностью, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 54.
В некоторых вариантах осуществления CAR по изобретению содержит анти-IL-23R scFv (например, содержащий последовательность связывающего домена SEQ ID NO: 65, 66 или 67 или состоящий из нее), связанный с аминокислотной последовательностью SEQ ID NO: 54 или последовательностью, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 54.
В некоторых вариантах осуществления CAR по настоящему изобретению содержит анти-CD19 scFv (например, содержащий последовательность связывающего домена SEQ ID NO: 1 или 2 или состоящий из нее), связанный с аминокислотной последовательностью SEQ ID NO: 54 или последовательностью, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 54.
В некоторых вариантах осуществления CAR по изобретению содержит анти-CD20 scFv (например, содержащий последовательность связывающего домена SEQ ID NO: 4, 5 или 6 или состоящий из нее), связанный с аминокислотной последовательностью SEQ ID NO: 54 или последовательностью, имеющей по меньшей мере 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 54.
В некоторых вариантах осуществления CAR по изобретению включает последовательность, содержащую шарнирную область CD8 человека, комбинацию трансмембранного домена CD8 человека и трансмембранного домена TNFR2 человека, костимуляторный внутриклеточный сигнальный домен TNFR2 человека и первичный внутриклеточный сигнальный домен CD3ζ цепи человека, где указанная последовательность соответствует аминокислотной последовательности SEQ ID NO: 55, 56 или 57 или аминокислотной последовательности, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 55, 56 или 57.
В некоторых вариантах осуществления CAR по настоящему изобретению содержит анти-HLA-A2 scFv (например, содержащий последовательность связывающего домена SEQ ID NO: 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99, 100, 101, 102, 103, 104, 105, 106 или 107, или состоящий из неё), связанный с аминокислотной последовательностью SEQ ID NO: 55, 56 или 57 или последовательностью, имеющей по меньшей мере примерно 70%, 75%, 80%, 85 %, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 55, 56 или 57.
В некоторых вариантах осуществления CAR по изобретению содержит анти-IL-23R scFv (например, содержащий последовательность связывающего домена SEQ ID NO: 65, 66 или 67 или состоящий из нее), связанный с аминокислотной последовательностью SEQ ID NO: 55, 56 или 57 или последовательностью, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97 %, 98% или 99% идентичности с SEQ ID NO: 55, 56 или 57.
В некоторых вариантах осуществления CAR по настоящему изобретению содержит анти-CD19 scFv (например, содержащий последовательность связывающего домена SEQ ID NO: 1 или 2 или состоящий из нее), связанный с аминокислотной последовательностью SEQ ID NO: 55, 56 или 57 или последовательностью, имеющей по меньшей мере примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 55, 56 или 57.
В некоторых вариантах осуществления CAR по изобретению содержит анти-CD20 scFv (например, содержащий последовательность связывающего домена SEQ ID NO: 4, 5 или 6 или состоящий из нее), связанный с аминокислотной последовательностью SEQ ID NO: 55, 56 или 57 или последовательностью, имеющей не менее примерно 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% или 99% идентичности с SEQ ID NO: 55, 56 или 57.
В некоторых вариантах осуществления CAR по настоящему изобретению (например, любой CAR, описанный в настоящей заявке, содержащий трансмембранный домен TNFR2 или его фрагмент или вариант, и/или внутриклеточный домен, содержащий костимуляторный внутриклеточный сигнальный домен TNFR2 или его фрагмент или вариант) имеет хотя бы одно из следующих свойств:
(a) проявляет меньшую экспрессию на поверхности клетки, чем CAR с той же последовательностью, за исключением того, что трансмембранный домен представляет собой трансмембранный домен CD8, а костимуляторный внутриклеточный сигнальный домен представляет собой костимуляторный внутриклеточный сигнальный домен 4-1BB;
(b) проявляет сопоставимые уровни CAR-специфической активации, как CAR с той же последовательностью, за исключением того, что трансмембранный домен представляет собой трансмембранный домен CD8, а костимуляторный внутриклеточный сигнальный домен представляет собой костимуляторный внутриклеточный сигнальный домен 4-1BB;
(c) не снижает уровни на клеточной поверхности регуляторных Т-клеточных маркеров, таких как любой один или несколько (например, все) из FoxP3, Helios и CD62L, по меньшей мере через 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более дней культивирования; и
(d) не увеличивает уровни на клеточной поверхности нерегулирующего Т-клеточного маркера, такого как CD127, по меньшей мере через 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или более дней культивирования.
Иммунные клетки
Настоящее изобретение также относится к иммунной клетке, экспрессирующей CAR, как описано в настоящей заявке, и к популяции таких иммунных клеток.
В некоторых вариантах осуществления нуклеиновую кислоту, кодирующую CAR по настоящему изобретению, вводят в иммунную клетку, тем самым генерируя сконструированную клетку, экспрессирующую CAR на поверхности клетки.
Используемый в настоящей заявке термин «иммунные клетки» обычно включает белые кровяные клетки (лейкоциты), которые происходят из гемопоэтических стволовых клеток (HSC), продуцируемых в костном мозге. Примеры иммунных клеток включают лимфоциты (Т-клетки, В-клетки и клетки - натуральные киллеры (NK)) и клетки миелоидного происхождения (нейтрофилы, эозинофилы, базофилы, моноциты, макрофаги, дендритные клетки), но не ограничиваются ими.
В некоторых вариантах осуществления иммунная клетка по изобретению генетически модифицирована для экспрессии химерного рецептора, содержащего трансмембранный домен TNFR2 или его фрагмент или вариант, и/или костимуляторный внутриклеточный сигнальный домен TNFR2 или его фрагмент или вариант.
В некоторых вариантах осуществления иммунная клетка по изобретению представляет собой иммунную клетку млекопитающего, например, иммунную клетку человека, иммунную клетку сельскохозяйственного животного (например, коровы, свиньи или лошади), или иммунную клетку домашнего животного (например, кошки или собаки).
В некоторых вариантах осуществления иммунная клетка выбрана из группы, состоящей из лимфоцитов, клеток миелоидного происхождения, и любой их комбинации. В некоторых вариантах осуществления иммунная клетка представляет собой лимфоцит, например, выбранный из группы, состоящей из Т-клеток, В-клеток, натуральных киллеров (NK) и любой их комбинации. В конкретных вариантах осуществления иммунная клетка представляет собой Т-клетку, которая в определенных вариантах осуществления выбрана из группы, состоящей из CD4+ Т-клеток, CD8+ Т-клеток, γδ Т-клеток, двойных негативных (DN) Т-клеток и любой их комбинации. В некоторых вариантах осуществления иммунная клетка представляет собой CD4+ Т-клетку, такую как, например, Т-хелперная клетка, регуляторная Т-клетка, эффекторная Т-клетка и любая их комбинация. В некоторых вариантах осуществления иммунная клетка представляет собой CD8+ T-клетку, такую как, например, цитотоксическая CD8+ T-клетка или CD8+ регуляторная T-клетка. В некоторых вариантах осуществления иммунная клетка представляет собой γδ Т-клетку. В некоторых вариантах осуществления иммунная клетка представляет собой Т-клетку, сконструированную для экспрессии определенных клеток гамма-дельта TCR (TEGγδ). В некоторых вариантах осуществления иммунная клетка представляет собой DN Т-клетку. В некоторых вариантах осуществления иммунная клетка представляет собой В-клетку. В некоторых вариантах осуществления иммунная клетка представляет собой NK-клетку.
В некоторых вариантах осуществления иммунная клетка представляет собой клетку миелоидного происхождения, например, выбранную из группы, состоящей из нейтрофилов, эозинофилов, базофилов, моноцитов, макрофагов, дендритных клеток или любой их комбинации. В некоторых вариантах осуществления иммунная клетка представляет собой макрофаг. В некоторых вариантах осуществления иммунная клетка представляет собой дендритную клетку.
В некоторых вариантах осуществления иммунная клетка представляет собой регуляторную иммунную клетку, такую как, например, любая регуляторная иммунная клетка, подходящая для использования в клеточной терапии. В некоторых вариантах осуществления регуляторная иммунная клетка выбрана из группы, состоящей из регуляторной Т-клетки, регуляторной Т-клетки CD4+, регуляторной Т-клетки CD8+, регуляторной Т-клетки γδ, регуляторной Т-клетки DN, регуляторной В-клетки, регуляторной NK-клетки, регуляторного макрофага, регуляторной дендритной клетки и любой их комбинации.
В некоторых вариантах осуществления регуляторная иммунная клетка представляет собой регуляторную Т-клетку (Treg), в частности, Treg, полученную из тимуса, или адаптивную или индуцированную Treg клетку. В некоторых вариантах осуществления иммунная клетка представляет собой регуляторную Т-клетку CD4+ (Treg). В некоторых вариантах осуществления Treg представляет собой Treg, полученную из тимуса, или адаптивную или индуцированную Treg клетку. В некоторых вариантах осуществления Treg представляет собой CD4+FoxP3+ регуляторную Т-клетку или регуляторную CD4+FoxP3- Т-клетку (клетку Tr1). В конкретных вариантах осуществления иммунная клетка представляет собой регуляторную Т-клетку CD4+FoxP3+.
В некоторых вариантах осуществления иммунная клетка представляет собой регуляторную Т-клетку CD8+. Примеры регуляторных Т-клеток CD8+ включают регуляторные Т-клетки CD8+CD28-, регуляторные Т-клетки CD8+CD103+, регуляторные Т-клетки CD8+FoxP3+, регуляторные Т-клетки CD8+CD122+ и любые их комбинации, но не ограничиваются ими.
В некоторых вариантах осуществления регуляторная иммунная клетка представляет собой регуляторную γδ Т-клетку.
В некоторых вариантах осуществления регуляторная иммунная клетка представляет собой регуляторную DN Т-клетку.
В некоторых вариантах осуществления регуляторная иммунная клетка представляет собой регуляторную B-клетку. Пример регуляторной B-клетки включает B-клетку CD19+CD24hiCD38hi, но не ограничивается этим.
В некоторых вариантах осуществления регуляторная иммунная клетка представляет собой регуляторную NK-клетку.
В некоторых вариантах осуществления регуляторная иммунная клетка представляет собой регуляторный макрофаг.
В некоторых вариантах осуществления регуляторная иммунная клетка представляет собой регуляторную дендритную клетку.
В некоторых вариантах осуществления иммунная клетка представляет собой эффекторную иммунную клетку, такую как, например, любая эффекторная иммунная клетка, подходящая для использования в клеточной терапии. В некоторых вариантах осуществления эффекторная иммунная клетка выбрана из группы, состоящей из эффекторной Т-клетки, CD4+ эффекторной Т-клетки, CD8+ эффекторной Т-клетки, эффекторной γδ Т-клетки, эффекторной DN Т-клетки, эффекторной В-клетки, эффекторной NK-клетки, эффекторного макрофага, эффекторной дендритной клетки и любой их комбинации.
В некоторых вариантах осуществления иммунная клетка представляет собой эффекторную Т-клетку. В некоторых вариантах осуществления эффекторная иммунная клетка представляет собой эффекторную Т-клетку CD4+. Примеры CD4+ эффекторных Т-клеток включают Th1-клетки, Th2-клетки, Th9-клетки, Th17-клетки, Th22-клетки, CD4+ T-фолликулярные хелперные (Tfh) клетки и любые их комбинации, но не ограничиваются ими. В некоторых вариантах осуществления эффекторная иммунная клетка представляет собой эффекторную Т-клетку CD8+. Примеры CD8+ эффекторных Т-клеток включают эффекторные Т-клетки CD8+CD45RO+CCR7-CD62L-, эффекторные Т-клетки CD8+CD45RA+CCR7-CD62L- и любую их комбинацию, но не ограничиваются ими.
В одном из вариантов осуществления иммунная клетка представляет собой эффекторную γδ Т-клетку.
В одном из вариантов осуществления иммунная клетка представляет собой эффекторную DN Т-клетку.
В одном из вариантов осуществления иммунная клетка представляет собой эффекторную B-клетку. Примеры эффекторных В-клеток включают В-клетки CD19+CD25hi, активированные В-клетки и плазматические клетки, и любую их комбинацию, но не ограничиваются ими.
В некоторых вариантах осуществления иммунная клетка представляет собой эффекторную NK-клетку.
В некоторых вариантах осуществления иммунная клетка представляет собой эффекторный макрофаг.
В некоторых вариантах осуществления иммунная клетка представляет собой эффекторную дендритную клетку.
В некоторых вариантах осуществления иммунная клетка выбрана из группы, состоящей из Т-клеток, естественных киллеров (NK), γδ Т-клеток, двойных негативных (DN) клеток, регуляторных иммунных клеток, регуляторных Т-клеток, эффекторных иммунных клеток, эффекторных Т-клеток, В-клеток и клеток миелоидного происхождения, и любой их комбинации.
В некоторых вариантах осуществления нуклеиновую кислоту, кодирующую CAR по настоящему изобретению, вводят в плюрипотентную стволовую клетку (PSC), которая затем может быть дифференцирована в Т-клетку. PSC представляют собой клетки, способные давать начало любому типу клеток в организме и включают, например, эмбриональные стволовые клетки (ESC), PSC, полученные путем переноса ядра соматических клеток, и индуцированные PSC (iPSC). Используемый в настоящей заявке термин «эмбриональные стволовые клетки» относится к плюрипотентным стволовым клеткам, полученным из ранних эмбрионов; в некоторых вариантах осуществления этот термин относится к ESC, полученным из ранее созданной линии эмбриональных стволовых клеток, и исключает стволовые клетки, полученные недавним разрушением эмбриона человека.
В некоторых вариантах осуществления нуклеиновую кислоту, кодирующую CAR по настоящему изобретению, вводят в мультипотентную клетку, такую как гемопоэтические стволовые клетки (HSC, такие как выделенные из костного мозга или пуповинной крови), гемопоэтические клетки-предшественники (например, лимфоидные клетки-предшественники) или мезенхимальные стволовые клетки (MSC). Мультипотентные клетки способны развиваться в более чем один тип клеток, но они имеют более ограниченный потенциал типа клеток, чем плюрипотентные клетки. Мультипотентные клетки могут быть получены из установленных клеточных линий или выделены из костного мозга или пуповины человека. Например, HSC могут быть выделены от пациента или здорового донора после мобилизации, индуцированной G-CSF, мобилизации, индуцированной плериксафором, или их комбинации. Чтобы изолировать HSC из крови или костного мозга, клетки в крови или костном мозге могут быть подвергнуты пэннингу с помощью антител, которые связывают нежелательные клетки, таких как антитела к CD4 и CD8 (Т-клетки), CD45 (В-клетки), GR-1 (гранулоциты) и Iad (дифференцированные антигенпрезентирующие клетки). Затем HSC могут быть подвергнуты положительной селекции антителами к CD34.
В некоторых вариантах осуществления нуклеиновую кислоту, кодирующую CAR по настоящему изобретению, вводят в лимфоидную клетку, не являющуюся Treg, которая дифференцируется в Treg-клетку после редактирования генома. Отредактированные не-Treg-клетки могут быть дифференцированы в Treg-клетки перед трансплантацией пациенту, как описано выше. Альтернативно, отредактированные не-Treg-клетки могут быть индуцированы к дифференцировке в Treg-клетки после имплантации пациенту.
В некоторых вариантах осуществления уровень экспрессии молекул определяют с помощью проточной цитометрии, иммунофлуоресценции или анализа изображений, например, анализа высокого содержания. В некоторых вариантах осуществления уровень экспрессии молекул определяют с помощью проточной цитометрии. В конкретных вариантах осуществления перед проведением анализа проточной цитометрии клетки фиксируют и повышают их проницаемость, что позволяет обнаруживать внутриклеточные белки.
В некоторых вариантах осуществления определение уровня экспрессии молекулы в популяции клеток включает определение процента клеток в популяции клеток, экспрессирующих молекулу (т.е. клеток «+» для молекулы). В некоторых вариантах осуществления указанный процент клеток, экспрессирующих молекулу, измеряют с помощью FACS.
Термины «экспрессирующая», «положительная» или «+» и «не экспрессирующая», «отрицательная» или «-» хорошо известны в данной области техники и относятся к уровню экспрессии интересующего клеточного маркера, указывая, что уровень экспрессии клеточного маркера, соответствующий «+», является высоким или промежуточным (также называемым «+/-»), а уровень экспрессии клеточного маркера, соответствующий «-», равен нулю.
Термин «низкий», или «lo», или «lo/-» хорошо известен в данной области техники и относится к уровню экспрессии интересующего клеточного маркера, когда уровень экспрессии клеточного маркера является низким по сравнению с уровнем экспрессии этого клеточного маркера в популяции анализируемых клеток в целом. Более конкретно, термин «lo» относится к отдельной популяции клеток, которые экспрессируют клеточный маркер на более низком уровне, чем одна или несколько других отдельных популяций клеток.
Термин «высокий», «hi» или «яркий» хорошо известен в данной области техники, и относится к уровню экспрессии интересующего клеточного маркера, если уровень экспрессии клеточного маркера является высоким по сравнению с уровнем экспрессии этого клеточного маркера в популяции анализируемых клеток в целом.
Обычно клетки в наивысших 2, 3, 4 или 5% от интенсивности окрашивания обозначаются «hi», а клетки, попадающие в верхнюю половину популяции, классифицируются как «+». Те клетки, у которых интенсивность флуоресценции ниже 50%, обозначается как «lo» клетки, а менее 5% - как «-» клетки.
Уровень экспрессии интересующего клеточного маркера определяют путем сравнения медианной интенсивности флуоресценции или средней интенсивности флуоресценции (MFI) клеток из популяции клеток, окрашенных флуоресцентно меченым антителом, специфичным для этого маркера, с интенсивностью флуоресценции (FI) клеток из одной и той же популяции клеток, окрашенных флуоресцентно меченым антителом с нерелевантной специфичностью, но с тем же изотипом, тем же флуоресцентным зондом, и происходящих от одного и того же вида (так называемый изотипический контроль). Клетки из популяции, окрашенные флуоресцентно меченым антителом, специфичным для этого маркера, и показывающие эквивалентное значение MFI или более низкое значение MFI, чем клетки, окрашенные изотипическим контролем, рассматриваются как не экспрессирующие этот маркер и обозначаются как (-) или отрицательные. Клетки из популяции, окрашенные флуоресцентно меченным антителом, специфичным для этого маркера, и показывающие значение MFI выше, чем клетки, окрашенные изотипическим контролем, считаются экспрессирующими этот маркер и обозначаются как (+) или положительные.
Изобретение также относится к изолированной и/или по существу очищенной популяции иммунных клеток, как определено в настоящем описании.
Таким образом, изобретение обеспечивает изолированную и/или по существу очищенную популяцию иммунных клеток, где клетки популяции содержат CAR, как описано в настоящей заявке, например, CAR, который включает трансмембранный домен TNFR2, или его фрагмент или вариант, и/или костимуляторный внутриклеточный сигнальный домен TNFR2, или его фрагмент или вариант.
В данном контексте «изолированная популяция» относится к клеточной популяции, которая удалена из ее естественной среды (такой как периферическая кровь) и которая изолирована, очищена или отделена, и свободна по меньшей мере примерно на 75%, 80%, 85%, и в некоторых вариантах осуществления свободна примерно на 90%, 95%, 96%, 97%, 98%, 99% от других клеток, с которыми она присутствует в естественных условиях, но в которых отсутствуют маркеры клеточной поверхности, на основе которых клетки были изолированы.
Настоящее изобретение также относится к обогащенной популяции иммунных клеток, как определено в настоящей заявке.
В некоторых вариантах осуществления изолированная, очищенная и/или обогащенная популяция иммунных клеток по настоящему изобретению была заморожена и разморожена.
В некоторых вариантах осуществления Т-клетки из популяции иммунных клеток по изобретению экспрессируют химерный рецептор (CAR), как описано в настоящей заявке, и, таким образом, могут быть определены как CAR-моноспецифические (т.е. все клетки Treg распознают один и тот же антиген с CAR, который они экспрессируют). В некоторых вариантах осуществления популяция Treg-клеток является TCR-моноспецифической (т.е. все Treg-клетки распознают один и тот же антиген со своим TCR). В некоторых вариантах осуществления популяция Treg-клеток является TCR-полиспецифической (т.е. Treg-клетки могут распознавать различные антигены с помощью своих TCR).
В некоторых вариантах осуществления популяция Т-клеток является TCR-моноспецифической, и TCR распознает антиген, фрагмент антигена, вариант антигена или их смесь.
В некоторых вариантах осуществления популяция Т-клеток является TCR-моноспецифической, а TCR специфичен для пищевого антигена из обычного рациона человека.
В некоторых вариантах осуществления популяция Т-клеток является TCR-моноспецифической, и TCR специфичен для аутоантигена, такого как, например, антиген, ассоциированный с рассеянным склерозом, антиген, ассоциированный с суставами, антиген, ассоциированный с глазами, антиген HSP человека, антиген, ассоциированный с кожей, или антиген, участвующий в отторжении трансплантата или РТПХ. В настоящей заявке приведены примеры таких аутоантигенов.
В некоторых вариантах осуществления популяция Т-клеток является TCR-моноспецифической, а TCR специфичен для ингаляционного аллергена, поглощаемого аллергена или контактного аллергена.
В некоторых вариантах осуществления популяция Т-клеток является TCR-моноспецифической, и TCR является специфичным для антигена, выбранного из группы, состоящей из овальбумина, MOG, коллагена типа II, цитруллинированного виментина, цитруллинированного коллагена II типа, цитруллинированного фибриногена и их фрагментов, вариантов и смесей.
В некоторых вариантах осуществления популяция Т-клеток является TCR-моноспецифической, а TCR специфичен для овальбумина или его фрагмента, варианта или их смеси.
В некоторых вариантах осуществления популяция Т-клеток является TCR-моноспецифической, а TCR специфична для MOG или его фрагмента, варианта или их смеси.
В некоторых вариантах осуществления популяция Т-клеток является TCR-моноспецифической, а TCR специфичен для коллагена II типа или его фрагмента, варианта или их смеси.
В некоторых вариантах осуществления популяция Т-клеток является TCR-моноспецифической, а TCR специфичен для цитруллинированного виментина, цитруллинированного коллагена II типа, цитруллинированного фибриногена или их фрагмента, варианта или смеси.
В некоторых вариантах осуществления популяция Т-клеток является TCR-моноспецифической, а TCR специфичен для HLA-A2 или его фрагмента, варианта или их смеси (например, как описано в настоящей заявке).
В некоторых вариантах осуществления популяция Т-клеток является TCR-моноспецифической, а TCR специфичен для IL-23R или его фрагмента, варианта или их смеси (например, как описано в настоящей заявке).
В некоторых вариантах осуществления популяция Т-клеток является TCR-моноспецифической, и TCR является специфичным для маркера поверхности В-клеток, такого как, например, CD19 или CD20, или их фрагмент, вариант или смесь (например, как описано в настоящей заявке).
В некоторых вариантах осуществления популяция Т-клеток является TCR-моноспецифической, а TCR специфичен для ракового антигена или его фрагмента, варианта или их смеси, как описано в настоящей заявке.
В некоторых вариантах осуществления популяция Т-клеток является TCR-моноспецифической, и TCR распознает инфицированные клетки. В некоторых вариантах осуществления популяция Т-клеток является TCR-моноспецифической, а TCR специфичен для бактериального антигена или его фрагмента, варианта или их смеси. В некоторых вариантах осуществления популяция Т-клеток является TCR-моноспецифической, а TCR специфичен для вирусного антигена или его фрагмента, варианта или их смеси. В некоторых вариантах осуществления популяция Т-клеток является TCR-моноспецифической, а TCR специфичен для грибкового антигена или его фрагмента, варианта или их смеси. В некоторых вариантах осуществления популяция Т-клеток является TCR-моноспецифической, а TCR специфичен для паразитарного антигена или его фрагмента, варианта или их смеси.
В некоторых вариантах осуществления иммунные клетки, экспрессирующие CAR по изобретению, являются супрессорными по отношению к клеткам, распознаваемым CAR. В некоторых вариантах осуществления иммунные клетки представляют собой Т-клетки. В конкретных вариантах осуществления иммунные клетки представляют собой клетки Treg. В некоторых вариантах осуществления Treg-клетки получают путем дифференцировки in vitro наивных Т-клеток.
В некоторых вариантах осуществления иммунные клетки по изобретению не являются цитотоксическими. В некоторых вариантах осуществления иммунные клетки представляют собой Т-клетки. В конкретных вариантах осуществления иммунные клетки представляют собой Treg клетки.
В некоторых вариантах осуществления регуляторные иммунные клетки по изобретению могут быть выбраны из группы, состоящей из CD4+CD25+FoxP3+ Treg, клеток Tr1, клеток Th3, секретирующих TGF-β, регуляторных NK T-клеток, регуляторных γδ T-клеток, регуляторных CD8+ Т-клеток и двойных негативных регуляторных Т-клеток.
В некоторых вариантах осуществления иммунные клетки по изобретению являются цитотоксическими. В некоторых вариантах осуществления иммунные клетки являются цитотоксическими для клеток, экспрессирующих раковый антиген или его фрагмент или вариант, как описано в настоящей заявке. В конкретных вариантах осуществления иммунные клетки по настоящему изобретению являются цитотоксическими для раковых клеток. В конкретных вариантах осуществления иммунные клетки по настоящему изобретению являются цитотоксическими для инфицированных клеток.
В некоторых вариантах осуществления иммунные клетки по изобретению представляют собой цитотоксические иммунные клетки. Цитотоксические иммунные клетки включают, например, цитотоксические Т-клетки, CD8+ Т-клетки, натуральные киллерные (NK) клетки, цитотоксические В-клетки, макрофаги и моноциты. После активации каждая из этих цитотоксических иммунных клеток запускает разрушение клеток-мишеней. Например, цитотоксические иммунные клетки запускают разрушение раковых клеток-мишеней одним или обоими из следующих способов. Во-первых, при активации иммунные клетки выделяют цитотоксины, такие как перфорин, гранзимы и гранулизин. Перфорин и гранулизин создают поры в клетке-мишени, а гранзимы проникают в клетку и запускают каспазный каскад в цитоплазме, который вызывает апоптоз (запрограммированную гибель) клетки. Во-вторых, апоптоз может быть индуцирован посредством взаимодействия лиганда FAS-FAS между иммунными клетками и опухолевыми клетками-мишенями.
В некоторых вариантах осуществления цитотоксические иммунные клетки являются аутологичными клетками.
В некоторых вариантах осуществления цитотоксические иммунные клетки являются гетерологичными клетками.
В некоторых вариантах осуществления цитотоксические иммунные клетки представляют собой аллогенные клетки.
В некоторых вариантах осуществления иммунные клетки по изобретению являются цитотоксическими для проВ-клеток, преВ-клеток, незрелых (или переходных) B-клеток, зрелых наивных B-клеток, активированных B-клеток, B-клеток памяти, плазматических клеток, лимфобластов, B-клеток маргинальной зоны, B-клеток зародышевого центра, плазмобластов и/или регуляторных B-клеток (Breg-клеток).
В некоторых вариантах осуществления иммунная клетка по изобретению не является цитотоксической для Breg-клеток.
В некоторых вариантах осуществления изобретения популяция моноспецифических Treg-клеток по изобретению является цитотоксической для В-клеток, экспрессирующих и презентирующих иммуноглобулин на своей поверхности. Примеры B-клеток, экспрессирующих и презентирующих иммуноглобулин на своей поверхности, включают преВ-клетки, незрелые (или переходные) B-клетки, зрелые наивные B-клетки, активированные B-клетки, B-клетки памяти, B-клетки маргинальной зоны, В-клетки зародышевого центра, и регуляторные В-клетки (Breg-клетки), но не ограничиваются ими.
В некоторых вариантах осуществления изобретения популяция моноспецифических Treg-клеток по изобретению является цитотоксической для зрелых B-клеток, например, для зрелых активированных B-клеток. В некоторых вариантах осуществления изобретения популяция моноспецифических Treg-клеток по изобретению является цитотоксической для зрелых B-клеток (например, зрелых активированных B-клеток), экспрессирующих на своей поверхности поверхностный маркер B-клеток, распознаваемый химерным рецептором, экспрессируемым клетками популяции моноспецифических Treg-клеток.
В некоторых вариантах осуществления изобретения популяция моноспецифических Treg-клеток по изобретению является цитотоксической по меньшей мере для одного типа клеток, выбранного из проВ-клеток, преВ-клеток, незрелых (или переходных) B-клеток, зрелых наивных B-клеток, активированных B-клеток, В-клеток памяти, плазматических клеток, лимфобластов, В-клеток маргинальной зоны, В-клеток зародышевого центра, плазмобластов и регуляторных В-клеток (Breg-клеток). В конкретных вариантах осуществления популяция моноспецифических Treg-клеток является цитотоксической по меньшей мере для одного типа клеток, выбранного из преВ-клеток, незрелых (или переходных) B-клеток, зрелых наивных B-клеток, активированных B-клеток, B-клеток памяти, B-клеток маргинальной зоны, В-клеток зародышевого центра и регуляторных В-клеток (Breg-клеток).
В некоторых вариантах осуществления изобретения популяция моноспецифических Treg-клеток по изобретению является цитотоксической по меньшей мере для одного типа клеток, выбранного из проВ-клеток, преВ-клеток, незрелых (или переходных) B-клеток, зрелых наивных B-клеток, активированных B-клеток, B-клеток памяти, плазматических клеток, лимфобластов, В-клеток маргинальной зоны, В-клеток зародышевого центра и плазмобластов. В конкретных вариантах осуществления популяция моноспецифических Treg-клеток является цитотоксической по меньшей мере для одного типа клеток, выбранного из преВ-клеток, незрелых (или переходных) B-клеток, зрелых наивных B-клеток, активированных B-клеток, B-клеток памяти, B-клеток маргинальной зоны и В-клеток зародышевого центра.
В некоторых вариантах осуществления популяция иммунных клеток по настоящему изобретению экспрессирует на своей клеточной поверхности CAR по настоящему изобретению (в настоящей заявке именуемый «первым рецептором») и другой рецептор (в настоящей заявке именуемый «вторым рецептором»), который связывается с другим, отличающимся лигандом. В некоторых вариантах осуществления второй рецептор содержит внеклеточный лиганд-связывающий домен, при необходимости шарнирный домен, по меньшей мере один трансмембранный домен и по меньшей мере один внутриклеточный сигнальный домен, например, как описано в настоящей заявке.
В некоторых вариантах осуществления второй рецептор является эндогенным (таким как, например, эндогенный TCR). В некоторых вариантах осуществления второй рецептор является экзогенным, и его экспрессию индуцируют в популяции иммунных клеток по настоящему изобретению путем трансформации или трансдукции кодирующей его нуклеиновой кислоты. Указанный экзогенный рецептор может быть экзогенным TCR или CAR. Следовательно, в некоторых вариантах осуществления популяция иммунных клеток по настоящему изобретению экспрессирует два CAR, причем каждый из первого и второго распознает отдельный лиганд. В некоторых вариантах осуществления популяция иммунных клеток по изобретению экспрессирует два CAR, причем первый распознает первый эпитоп на антигене, а второй распознает второй отдельный эпитоп на том же антигене. В некоторых вариантах осуществления популяция иммунных клеток по изобретению экспрессирует два CAR, при этом первый распознает антиген, а второй распознает второй отдельный антиген (такой как, например, вариант антигена).
В некоторых вариантах осуществления по меньшей мере один из CAR по настоящему изобретению и второй рецептор (например, второй CAR) является индуцибельным, то есть его экспрессия на поверхности клетки может быть индуцирована.
В некоторых вариантах осуществления экспрессия по меньшей мере одного из CAR по изобретению и второго рецептора (например, второго CAR) индуцируется активацией другого рецептора. В некоторых вариантах осуществления экспрессия CAR по изобретению индуцируется активацией второго рецептора. В некоторых вариантах осуществления экспрессия второго рецептора индуцируется активацией CAR по настоящему изобретению. Индуцируемые CAR были описаны в данной области техники, например, Roybal et al. (Cell 167 (2): 419-432 (2016)).
В некоторых вариантах осуществления второй рецептор (например, второй CAR) специфичен для антигена, фрагмента антигена, варианта антигена или их смеси.
В некоторых вариантах осуществления второй рецептор (например, второй CAR) специфичен для пищевого антигена из обычного рациона человека.
В некоторых вариантах осуществления второй рецептор (например, второй CAR) специфичен для аутоантигена (например, аутоантигена, описанного в настоящей заявке), такого как, например, антиген, ассоциированный с рассеянным склерозом, антиген, ассоциированный с суставами, антиген, ассоциированный с глазом, антиген HSP человека, антиген, ассоциированный с кожей, или антиген, участвующий в отторжении трансплантата или РТПХ. В некоторых вариантах осуществления антиген представляет собой ассоциированный с кожей антиген. В некоторых вариантах осуществления антиген представляет собой антиген, участвующий в отторжении трансплантата или РТПХ.
В некоторых вариантах осуществления второй рецептор (например, второй CAR) специфичен для ингаляционного аллергена, поглощаемого аллергена или контактного аллергена.
В некоторых вариантах осуществления изобретения второй рецептор (например, второй CAR) специфичен для антигена, выбранного из группы, состоящей из овальбумина, MOG, фрагментов коллагена II типа, цитруллинированного виментина, цитруллинированного коллагена II типа, цитруллинированного фибриногена, и их фрагментов, вариантов и смесей.
В некоторых вариантах осуществления второй рецептор (например, второй CAR) специфичен для овальбумина или его фрагмента, варианта, или их смеси.
В некоторых вариантах осуществления второй рецептор (например, второй CAR) специфичен для MOG или его фрагмента, варианта, или их смеси.
В некоторых вариантах осуществления второй рецептор (например, второй CAR) специфичен для коллагена II типа или его фрагмента, варианта или их смеси.
В некоторых вариантах осуществления второй рецептор (например, второй CAR) специфичен для цитруллинированного виментина, цитруллинированного коллагена II типа, цитруллинированного фибриногена или их фрагмента, варианта или смеси.
В некоторых вариантах осуществления второй рецептор (например, второй CAR) специфичен для HLA-A2 или его фрагмента, варианта или их смеси.
В некоторых вариантах осуществления второй рецептор (например, второй CAR) специфичен для IL-23R или его фрагмента, варианта или их смеси.
В некоторых вариантах осуществления второй рецептор (например, второй CAR) специфичен для маркера поверхности В-клеток, такого как, например, CD19 или CD20, или их фрагмент, вариант или смесь.
В некоторых вариантах осуществления второй рецептор (например, второй CAR) специфичен для ракового антигена или его фрагмента, варианта или их смеси, как описано в настоящей заявке.
В некоторых вариантах осуществления второй рецептор (например, второй CAR) распознает инфицированные клетки. В некоторых вариантах осуществления второй рецептор (например, второй CAR) специфичен для бактериального антигена или его фрагмента, варианта или их смеси. В некоторых вариантах осуществления второй рецептор (например, второй CAR) специфичен для вирусного антигена или его фрагмента, варианта или их смеси. В некоторых вариантах осуществления второй рецептор (например, второй CAR) специфичен для грибкового антигена или его фрагмента, варианта или их смеси.
В некоторых вариантах осуществления внеклеточный связывающий домен второго рецептора представляет собой белок, или его фрагмент, или его вариант, такой как, например, аутоантиген или его фрагмент или вариант.
В некоторых вариантах осуществления второй рецептор (например, второй CAR) специфичен для аутоантитела, такого как, например, аутоантитело, экспрессируемое на B-клетке, или его фрагмент, вариант или их смеси.
В некоторых вариантах осуществления CAR по настоящему изобретению содержит первый внутриклеточный сигнальный домен, а второй рецептор содержит отдельный второй внутриклеточный сигнальный домен. В некоторых вариантах осуществления CAR по изобретению содержит первичный сигнальный домен Т-клетки (такой как, например, CD3-дзета), а второй рецептор включает костимуляторный сигнальный домен (такой как, например, костимуляторный домен TNFR2 или CD8, или комбинация костимуляторного сигнального домена TNFR2 и CD8). В некоторых вариантах осуществления CAR по настоящему изобретению содержит костимуляторный внутриклеточный сигнальный домен (такой как, например, костимуляторный внутриклеточный сигнальный домен TNFR2, 4-1BB, CD27 или CD28, или комбинация костимуляторного внутриклеточного сигнального домена TNFR2 и 4-1BB), а второй рецептор содержит первичный внутриклеточный сигнальный домен Т-клетки (такой как, например, CD3-дзета). Согласно этим вариантам осуществления полная активация популяции иммунных клеток по изобретению требует как связывания CAR по изобретению с лигандом, на который он направлен, так и связывания второго рецептора с лигандом, на который он направлен.
В некоторых вариантах осуществления лиганд, распознаваемый вторым рецептором, экспрессируется или присутствует в пораженной ткани или органе, или в месте аутоиммунного ответа. Следовательно, супрессорная активность для клеток, экспрессирующих лиганд первого CAR по настоящему изобретению, будет индуцироваться только в пораженной ткани или органе, или в месте аутоиммунного ответа, когда указанный лиганд будет присутствовать и распознаваться вторым рецептором на клетках из популяции иммунных клеток (например, Treg).
В некоторых вариантах осуществления второй химерный рецептор дополнительно содержит внеклеточный лиганд-связывающий домен, распознающий лиганд, отличный от лиганда, распознаваемого первым химерным рецептором по изобретению. В некоторых вариантах осуществления указанный лиганд-связывающий домен представляет собой антитело или его антигенсвязывающий фрагмент. В некоторых вариантах осуществления второй химерный рецептор дополнительно содержит внеклеточный лиганд-связывающий домен, распознающий отдельный эпитоп того же антигена, распознаваемого первым химерным рецептором.
В некоторых вариантах осуществления химерный рецептор по настоящему изобретению содержит внеклеточный лиганд-связывающий домен, включающий первый лиганд-связывающий домен, который связывается с первым лигандом, и второй лиганд-связывающий домен, который связывается со вторым лигандом, отличным от указанного первого лиганда. В некоторых вариантах осуществления указанный лиганд-связывающий домен представляет собой бифункциональное антитело, распознающее как первый, так и второй лиганд. В некоторых вариантах осуществления указанный лиганд-связывающий домен представляет собой бифункциональное антитело, распознающее два разных эпитопа одного и того же антигена.
Нуклеиновые кислоты, векторы и получение CAR
Настоящее изобретение также относится к нуклеиновокислотной последовательности, кодирующей CAR, как описано в настоящей заявке, где указанная нуклеиновокислотная последовательность включает:
- по меньшей мере одну нуклеиновокислотную последовательность внеклеточного связывающего домена;
- при необходимости по меньшей мере одну нуклеиновокислотную последовательность внеклеточного шарнирного домена, по меньшей мере одну нуклеиновокислотную последовательность трансмембранного домена;
- по меньшей мере одну нуклеиновокислотную последовательность внутриклеточного домена, включающую по меньшей мере одну нуклеиновокислотную последовательность первичного внутриклеточного сигнального домена и, при необходимости, по меньшей мере одну нуклеиновокислотную последовательность костимуляторного внутриклеточного сигнального домена;
где нуклеиновокислотная последовательность трансмембранного домена представляет собой нуклеиновокислотную последовательность трансмембранного домена TNFR2 человека или его фрагмента или варианта, или нуклеиновокислотную последовательность любого трансмембранного домена или его фрагмента или варианта, или их комбинации, и/или нуклеиновокислотная последовательность костимуляторного внутриклеточного сигнального домена представляет собой нуклеиновокислотную последовательность костимуляторного внутриклеточного сигнального домена человеческого TNFR2 или его фрагмента или варианта, или нуклеиновокислотную последовательность любого костимуляторного внутриклеточного сигнального домена или его фрагмента или варианта, или их комбинации, где нуклеиновокислотная последовательность трансмембранного домена представляет собой нуклеиновокислотную последовательность трансмембранного домена TNFR2 или его фрагмента или варианта и/или нуклеиновокислотная последовательность костимуляторного внутриклеточного сигнального домена является последовательностью костимуляторного внутриклеточного сигнального домена TNFR2 или его фрагмента или варианта.
Изобретение также обеспечивает вектор, содержащий нуклеиновокислотную последовательность, кодирующую CAR, как описано в настоящей заявке. Примеры векторов, которые можно использовать в настоящем изобретении, включают ДНК-вектор, РНК-вектор, плазмиду, фагмиду, производное фага, вирус и космиду, но не ограничиваются ими.
Технология вирусных векторов хорошо известна в данной области техники и описана, например, в Sambrook et al. (2001, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, New York), и в других руководствах по вирусологии и молекулярной биологии. Вирусы, которые можно использовать в качестве векторов, включают ретровирусы, аденовирусы, аденоассоциированные вирусы, вирусы герпеса и лентивирусы, но не ограничиваются ими.
В общем, подходящий вектор содержит ориджин репликации, функционирующий по меньшей мере в одном организме, промоторную последовательность, подходящие сайты рестрикционных эндонуклеаз, и один или несколько селектируемых маркеров (см., например, публикации патентов РСТ WO 01/96584 и WO 01/29058 и патент США 6,326,193, включенные в настоящую заявку посредством ссылки).
Ряд систем на основе вирусов был разработан для переноса генов в клетки млекопитающих. Например, ретровирусы обеспечивают удобную платформу для систем доставки генов. Выбранный ген можно вставить в вектор и упаковать в ретровирусные частицы с использованием методов, известных в данной области техники. Затем рекомбинантный вирус можно выделить и доставить в клетки субъекта in vivo или ex vivo. В данной области техники известен ряд ретровирусных систем. В некоторых вариантах осуществления используются аденовирусные векторы. Кроме того, в данной области техники известен ряд аденовирусных векторов. В некоторых вариантах осуществления используются лентивирусные векторы.
Дополнительные транскрипционно активные элементы, например, промоторы и энхансеры, регулируют частоту инициации транскрипции. Обычно коровые промоторы расположены в области 30-110 п.н. выше стартового сайта, хотя недавно было показано, что ряд промоторов содержат функциональные элементы и ниже стартового сайта, а элементы энхансера обычно расположены на 500-2000 п.н. выше стартового сайта. Интервал между элементами промотора часто бывает гибким, так что функция промотора сохраняется, когда элементы инвертируются или перемещаются относительно друг друга. В промоторе тимидинкиназы (tk) расстояние между элементами промотора может быть увеличено до 50 п.н., прежде чем активность начнет снижаться. В зависимости от промотора оказывается, что отдельные элементы могут действовать совместно или независимо для активации транскрипции.
Одним из примеров подходящего промотора является последовательность немедленного раннего промотора цитомегаловируса (CMV). Эта промоторная последовательность представляет собой сильную конститутивную промоторную последовательность, способную управлять высокими уровнями экспрессии любой полинуклеотидной последовательности, функционально связанной с ней. Другим примером подходящего промотора является фактор роста элонгации - la (EF-la). Другим примером подходящего промотора является промотор фосфоглицераткиназы (PGK). Однако также могут быть использованы другие конститутивные промоторные последовательности, включая, помимо прочего, ранний промотор обезьяньего вируса 40 (SV40), вирус опухоли молочной железы мыши (MMTV), промотор длинного концевого повтора (LTR) вируса иммунодефицита человека (ВИЧ), промотор MoMuLV, промотор вируса лейкемии птиц, немедленный ранний промотор вируса Эпштейна-Барр и промотор вируса саркомы Рауса, а также промоторы генов человека, такие как промотор актина, промотор миозина, промотор гемоглобина, и промотор креатинкиназы, но не ограничиваясь ими. Кроме того, изобретение не должно ограничиваться использованием конститутивных промоторов. Индуцибельные промоторы также рассматриваются как часть изобретения. Использование индуцибельного промотора обеспечивает молекулярный переключатель, способный включать экспрессию полинуклеотидной последовательности, с которой он функционально связан, когда такая экспрессия необходима, или выключать экспрессию, когда экспрессия нежелательна. Примеры индуцибельных промоторов включают промотор металлотионина, промотор глюкокортикоида, промотор прогестерона и промотор тетрациклина, но не ограничиваясь ими. Кроме того, двунаправленные промоторы, обеспечивающие эффективную и скоординированную экспрессию двух или более генов, также могут представлять интерес в настоящем изобретении. Примеры двунаправленных промоторов включают промоторы, описанные Luigi Naldini в публикации патента США 2006/200869, включенной сюда в качестве ссылки, раскрывающей двунаправленный промотор, содержащий (i) первую минимальную промоторную последовательность, полученную из цитомегаловируса (CMV) или вируса опухоли молочной железы мыши (MMTV), и (ii) полную эффективную промоторную последовательность, полученную из гена животного; но не ограничиваются ими.
Чтобы оценить экспрессию полипептида CAR или его частей, вектор экспрессии, который должен быть введен в Т-клетку, также может содержать либо ген селектируемого маркера, такого как CD34, CD271, либо репортерный ген, либо оба из них, чтобы облегчить идентификацию и отбор экспрессирующих клеток из популяции клеток, предназначенных для трансфекции или инфицирования вирусными векторами. В других аспектах селектируемый маркер может находиться на отдельном фрагменте ДНК и использоваться в процедуре совместной трансфекции. Как селектируемые маркеры, так и репортерные гены могут быть фланкированы соответствующими регуляторными последовательностями для обеспечения экспрессии в клетках-хозяевах. Подходящие селектируемые маркеры включают, например, гены устойчивости к антибиотикам, таким как неомицин и т.п.
В некоторых вариантах осуществления изобретения может быть использована технология генов «самоубийства». В данной области описаны различные технологии генов «самоубийства» в зависимости от их механизма действия (см., например, Jones et al., Frontiers in Pharmacology 5: 254 (2014)). Примеры генно-направленной ферментной пролекарственной терапии (GDEPT), превращающей нетоксичное лекарство в токсичное, включают тимидинкиназу вируса простого герпеса (HSV-TK) и цитозиндезаминазу (CD). Другими примерами являются химерные белки, состоящие из домена связывания лекарства, соединенного с апоптотическими компонентами, такими как, например, системы индуцибельного Fas (iFas) или индуцибельной каспазы 9 (iCasp9). Другие примеры включают системы, опосредованные терапевтическими антителами, такие как стимуляция сверхэкспрессии c-myc на поверхности сконструированной клетки для индукции ее делеции путем введения антитела против c-myc. Использование EGFR описывается как система, аналогичная системе c-myc.
Репортерные гены используются для идентификации потенциально трансфицированных клеток и для оценки функциональности регуляторных последовательностей. В общем, репортерный ген представляет собой ген, который не присутствует или не экспрессируется в организме или тканях реципиента, и который кодирует полипептид, экспрессия которого проявляется некоторым легко обнаруживаемым свойством, например, ферментативной активностью. Экспрессию репортерного гена анализируют в подходящее время после того, как ДНК была введена в клетки-реципиенты. Подходящие репортерные гены могут включать гены, кодирующие люциферазу, бета-галактозидазу, хлорамфеникол-ацетилтрансферазу, секретируемую щелочную фосфатазу или ген зеленого флуоресцентного белка (см., например, Ui-Tei et al., FEBS Letters 479: 79-82 (2000)). Подходящие системы экспрессии хорошо известны и могут быть получены с использованием известных методик или приобретены коммерчески. В общем, конструкция с минимальной 5’-фланкирующей областью, показывающей наивысший уровень экспрессии репортерного гена, идентифицируется как промотор. Такие промоторные области могут быть связаны с репортерным геном и использоваться для оценки способности агентов модулировать управляемую промотором транскрипцию.
Способы введения и экспрессии генов в клетке известны в данной области техники. В контексте вектора экспрессии вектор может быть легко введен в клетку-хозяин, например, в клетку млекопитающего, бактерии, дрожжей или насекомого, любым способом в данной области техники. Например, вектор экспрессии может быть перенесен в клетку-хозяин физическими, химическими или биологическими способами.
Физические способы введения полинуклеотида в клетку-хозяин включают осаждение фосфатом кальция, липофекцию, бомбардировку частицами, микроинъекцию, электропорацию и тому подобное. Способы получения клеток, содержащих векторы и/или экзогенные нуклеиновые кислоты, хорошо известны в данной области техники. См., например, Sambrook et al. (2001, Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory, New York). В некоторых вариантах осуществления изобретения полинуклеотид вводят в клетку-хозяин с использованием трансфекции фосфатом кальция.
Биологические способы введения интересующего полинуклеотида в клетку-хозяин включают использование векторов ДНК и РНК. Вирусные векторы, и особенно ретровирусные векторы, стали наиболее широко используемым методом встраивания генов в клетки млекопитающих, например, в клетки человека. Другие вирусные векторы могут происходить из лентивирусов, поксвирусов, вируса простого герпеса I, аденовирусов и аденоассоциированных вирусов и т.п. См., например, патенты США 5,350,674 и 5,585,362.
Химические средства для введения полинуклеотида в клетку-хозяин включают коллоидные дисперсионные системы, такие как комплексы макромолекул, нанокапсулы, микросферы, гранулы и системы на основе липидов, включая эмульсии масло-в-воде, мицеллы, смешанные мицеллы и липосомы. Типичной коллоидной системой для использования в качестве средства доставки in vitro и in vivo является липосома (например, искусственная мембранная везикула). «Липосома» является общим термином, охватывающим множество одно- и многослойных липидных носителей, образованных путем генерации замкнутых липидных бислоев или агрегатов. Липосомы можно охарактеризовать как имеющие везикулярные структуры с двухслойной фосфолипидной мембраной и внутренней водной средой. Мультиламеллярные липосомы имеют несколько липидных слоев, разделенных водной средой. Они образуются спонтанно, когда фосфолипиды суспендируют в избытке водного раствора. Липидные компоненты претерпевают самоорганизацию перед образованием замкнутых структур и захватывают воду и растворенные вещества между липидными бислоями (Ghosh et al., Glycobiology 5: 505-10 (1991)). Однако также охватываются композиции, которые имеют структуру в растворе, отличную от нормальной везикулярной структуры. Например, липиды могут иметь мицеллярную структуру или просто существовать в виде неоднородных агрегатов липидных молекул. Также рассматриваются комплексы липофектамин-нуклеиновая кислота.
Предполагается использование липидных составов для введения нуклеиновых кислот в клетку-хозяина (in vitro, ex vivo или in vivo). В другом аспекте нуклеиновая кислота может быть связана с липидом. Нуклеиновая кислота, связанная с липидом, может быть инкапсулирована в водную внутреннюю часть липосомы, встроена в липидный бислой липосомы, присоединена к липосоме через связывающую молекулу, которая связана как с липосомой, так и с олигонуклеотидом, заключена в липосоме, может находиться в комплексе с липосомой, диспергирована в растворе, содержащем липид, смешана с липидом, комбинирована с липидом, содержаться в виде суспензии в липиде, содержаться или формировать комплекс с мицеллой, или иным образом ассоциироваться с липидом. Композиции, связанные с липидом, липидом/ДНК или липидом/вектором экспрессии, не ограничиваются какой-либо конкретной структурой в растворе. Например, они могут присутствовать в двухслойной структуре, в виде мицелл или в «сжатой» структуре. Они также могут быть просто смешаны с раствором, возможно, образуя агрегаты неоднородного размера или формы. Липиды - это жирные вещества, которые могут быть натуральными или синтетическими липидами. Например, липиды включают капли жира, которые естественным образом встречаются в цитоплазме, а также класс соединений, содержащих длинноцепочечные алифатические углеводороды и их производные, такие как жирные кислоты, спирты, амины, аминоспирты и альдегиды.
Подходящие для использования липиды можно получить из коммерческих источников. Например, димиристилфосфатидилхолин («DMPC») может быть получен от Sigma, Сент-Луис, Массачусетс; дицетилфосфат («DCP») можно получить от K&K Laboratories (Плейнвью, Нью-Йорк); холестерин («Choi») можно получить от Calbiochem-Behring; и димиристилфосфатидилглицерин («DMPG») и другие липиды могут быть получены от Avanti Polar Lipids, Inc. (Бирмингем, Алабама). Исходные растворы липидов в хлороформе или хлороформе/метаноле можно хранить при температуре примерно -20°C. Хлороформ используется как единственный растворитель, так как он испаряется легче, чем метанол.
Независимо от способа, используемого для введения экзогенных нуклеиновых кислот в клетку-хозяин, для подтверждения присутствия последовательности рекомбинантной ДНК в клетке-хозяине могут быть выполнены различные анализы. Такие анализы включают, например, «молекулярно-биологические» анализы, хорошо известные специалистам в данной области техники, такие как саузерн- и нозерн-блоттинг, ОТ-ПЦР и ПЦР; «биохимические» анализы, такие как обнаружение присутствия или отсутствия конкретного пептида, например, иммунологическими методами (ИФА и вестерн-блоттинг) или анализами, описанными в настоящей заявке, для идентификации агентов, подпадающих под объем изобретения.
В некоторых вариантах осуществления иммунные клетки по изобретению модифицируют путем введения РНК. В некоторых вариантах осуществления РНК CAR, транскрибируемая in vitro, может быть введена в клетку в виде временной трансфекции. РНК получают путем транскрипции in vitro с использованием матрицы, созданной с помощью полимеразной цепной реакции (ПЦР). Представляющая интерес ДНК из любого источника может быть непосредственно преобразована с помощью ПЦР в матрицу для синтеза мРНК in vitro с использованием соответствующих праймеров и РНК-полимеразы. Источником ДНК может быть, например, геномная ДНК, плазмидная ДНК, фаговая ДНК, кДНК, синтетическая последовательность ДНК или любой другой подходящий источник ДНК. В некоторых вариантах осуществления матрицей для транскрипции in vitro является CAR по настоящему изобретению.
В некоторых вариантах осуществления ДНК, используемая для ПЦР, содержит открытую рамку считывания. ДНК может быть, например, из встречающейся в природе последовательности ДНК из генома организма. В некоторых вариантах осуществления ДНК представляет собой интересующий полноразмерный ген или часть гена. Ген может включать некоторые или все 5’ и/или 3’ нетранслируемые области (UTR). Ген может включать экзоны и интроны. В некоторых вариантах осуществления ДНК, которая будет использована для ПЦР, представляет собой ген человека. В некоторых вариантах осуществления ДНК, которая будет использована для ПЦР, представляет собой ген человека, включающий 5’ и 3’ UTR. Альтернативно ДНК может быть искусственной последовательностью ДНК, которая обычно не экспрессируется в естественном организме. Примерная искусственная последовательность ДНК представляет собой последовательность, которая содержит части генов, которые лигированы вместе, чтобы сформировать открытую рамку считывания, кодирующую гибридный белок. Сшитые вместе фрагменты ДНК могут происходить из одного организма или из нескольких организмов.
ПЦР может быть использована для создания матрицы для транскрипции мРНК in vitro, применяемой для трансфекции. Способы проведения ПЦР хорошо известны в данной области техники. Праймеры для использования в ПЦР конструируют так, чтобы иметь области, которые по существу комплементарны областям ДНК, которые будут использоваться в качестве матрицы для ПЦР. «По существу комплементарная» в контексте настоящего описания относится к последовательностям нуклеотидов, в которых большинство или все основания в последовательности праймера являются комплементарными, или одно или несколько оснований не комплементарны или несовместимы. По существу, комплементарные последовательности способны к отжигу или гибридизации с назначенной ДНК-мишенью в условиях отжига, используемых для ПЦР. Праймеры могут быть сконструированы так, чтобы они были по существу комплементарными любой части матрицы ДНК. Например, праймеры могут быть разработаны для амплификации части гена, обычно транскрибируемой в клетках (открытая рамка считывания), которая может включать 5’ и 3’ UTR. Праймеры также могут быть созданы для амплификации части гена, кодирующей конкретный интересующий домен. В некоторых вариантах осуществления праймеры предназначены для амплификации кодирующей области кДНК человека, включая все или части 5’ и 3’ UTR. Праймеры, полезные для ПЦР, получают синтетическими методами, хорошо известными в данной области техники.
«Прямые праймеры» представляют собой праймеры, которые содержат область нуклеотидов, по существу комплементарных нуклеотидам на матрице ДНК, расположенным выше последовательности ДНК, которая должна быть амплифицирована. «Расположенный выше» используется здесь для обозначения местоположения 5’ последовательности ДНК, которая должна быть амплифицирована, относительно кодирующей цепи. «Обратные праймеры» представляют собой праймеры, содержащие область нуклеотидов, по существу комплементарную матрице двухцепочечной ДНК, расположенные ниже последовательности ДНК, которая должна быть амплифицирована. «Расположенный ниже» используется в настоящей заявке для обозначения положения 3’ последовательности ДНК, которая должна быть амплифицирована, относительно кодирующей цепи.
Любая ДНК-полимераза, пригодная для ПЦР, может быть использована в способах, раскрытых в настоящей заявке. Реагенты и полимераза коммерчески доступны из ряда источников.
Также можно использовать химические структуры, способные обеспечивать стабильность и/или эффективность трансляции. В некоторых вариантах осуществления РНК может иметь 5’ и 3’ UTR. В некоторых вариантах осуществления 5’ UTR имеет длину от нуля до 3000 нуклеотидов. Длина последовательностей 5’ и 3’ UTR, добавляемых в кодирующую область, может быть изменена различными способами, включая конструирование праймеров для ПЦР, которые гибридизуются с различными областями UTR, но не ограничиваясь этим. Используя этот подход, специалист в данной области техники может изменить длины 5’ и 3’ UTR, необходимые для достижения оптимальной эффективности трансляции после трансфекции транскрибируемой РНК. 5’ и 3’ UTR могут быть природными эндогенными 5’ и 3’ UTR для интересующего гена. Альтернативно, последовательности UTR, которые не являются эндогенными для интересующего гена, могут быть добавлены путем включения последовательностей UTR в прямой и обратный праймеры или посредством любых других модификаций матрицы. Использование последовательностей UTR, которые не являются эндогенными по отношению к представляющему интерес гену, может быть полезным для изменения стабильности и/или эффективности трансляции РНК. Например, известно, что богатые AU элементы в последовательностях 3’ UTR могут снижать стабильность мРНК. Следовательно, 3’ UTR могут быть выбраны или созданы для повышения стабильности транскрибируемой РНК на основе свойств UTR, которые хорошо известны в данной области техники.
В некоторых вариантах осуществления 5’-UTR может содержать последовательность Козака эндогенного гена. В качестве альтернативы, когда 5’ UTR, не являющуюся эндогенной для интересующего гена, добавляют с помощью ПЦР, как описано выше, консенсусная последовательность Козака может быть изменена путем добавления последовательности 5’ UTR. Последовательности Козака могут повысить эффективность трансляции некоторых транскриптов РНК, но, по-видимому, не требуются для всех РНК для обеспечения эффективной трансляции. Потребность в последовательностях Козака для многих мРНК известна в данной области техники. В других вариантах осуществления 5’ UTR может происходить из РНК вируса, геном РНК которого стабилен в клетках. В других вариантах осуществления различные аналоги нуклеотидов можно использовать в 3’ или 5’ UTR, чтобы препятствовать экзонуклеазной деградации мРНК.
Чтобы сделать возможным синтез РНК из матрицы ДНК без необходимости клонирования гена, промотор транскрипции должен быть присоединен к матрице ДНК перед транскрибируемой последовательностью. Когда последовательность, функционирующую как промотор для РНК-полимеразы, добавляют к 5’-концу прямого праймера, промотор РНК-полимеразы включают в продукт ПЦР перед открытой рамкой считывания, которая должна быть транскрибирована. В некоторых вариантах осуществления промотор представляет собой промотор полимеразы Т7, как описано в другом месте в настоящей заявке. Другие полезные промоторы включаю промоторы РНК-полимеразы T3 и SP6, но не ограничиваются ими. Консенсусные нуклеотидные последовательности для промоторов Т7, Т3 и SP6 известны в данной области техники.
В некоторых вариантах осуществления мРНК имеет как кэп на 5’ конце, так и 3’ поли(A) хвост, которые определяют связывание рибосомы, инициацию трансляции и стабильность мРНК в клетке. На кольцевой матрице ДНК, например, плазмидной ДНК, РНК-полимераза производит длинный конкатемерный продукт, который не подходит для экспрессии в эукариотических клетках. Транскрипция плазмидной ДНК, линеаризованной на конце 3’ UTR, приводит к образованию мРНК нормального размера, которая не эффективна при трансфекции эукариот, даже если она полиаденилирована после транскрипции.
На линейной ДНК-матрице РНК-полимераза фага Т7 может расширять 3'-конец транскрипта за пределы последнего основания матрицы (Schenborn and Mierendorf, Nuc Acids Res., 13: 6223-36 (1985); Nacheva and Berzal-Herranz, Eur. J. Biochem., 270: 1485-65 (2003)).
Обычным способом интеграции участков полиА/Т в матрицу ДНК является молекулярное клонирование. Однако последовательности полиА/Т, интегрированные в плазмидную ДНК, могут вызывать нестабильность плазмиды, поэтому матрицы плазмидной ДНК, полученные из бактериальных клеток, часто сильно загрязнены делециями и другими аберрациями. Это делает процедуры клонирования не только трудоемкими и длительными, но и зачастую ненадежными. Вот почему крайне необходим способ, позволяющий конструировать ДНК-матрицы с полиА/T 3’ удлинением без клонирования.
Сегмент полиА/Т матрицы транскрипционной ДНК может быть получен при ПЦР с использованием обратного праймера, содержащего хвост поли(Т), такой как хвост 100Т (размер может составлять 50-5000 Т), или после ПЦР любым другим методом, включая, помимо прочего, лигирование ДНК или рекомбинацию in vitro. Поли(A) хвосты также обеспечивают стабильность РНК и снижают их деградацию. Как правило, длина поли(А) хвоста положительно коррелирует со стабильностью транскрибируемой РНК. В некоторых вариантах осуществления поли(A) хвост составляет от 100 до 5000 аденозинов.
Поли(A) хвосты РНК могут быть дополнительно удлинены после транскрипции in vitro с использованием поли(A)-полимеразы, такой как поли-А-полимераза E. coli (E-PAP). В некоторых вариантах осуществления увеличение длины поли(A) хвоста со 100 нуклеотидов до 300-400 нуклеотидов приводит примерно к двукратному увеличению эффективности трансляции РНК. Кроме того, присоединение различных химических групп к 3’-концу может повысить стабильность мРНК. Такое прикрепление может содержать модифицированные/искусственные нуклеотиды, аптамеры и другие соединения. Например, аналоги АТФ могут быть включены в поли(А)-хвост с использованием поли(А)-полимеразы. Аналоги АТФ могут еще больше повысить стабильность РНК.
5’-кэпы на РНК также могут обеспечивать стабильность молекул РНК. В некоторых вариантах осуществления РНК, полученные описанными в настоящей заявке способами, включают 5’-кэп. 5'-кэп получают с использованием методик, известных в данной области техники и описанных в настоящей заявке (Cougot et al., Trends in Biochem. Sci. 29: 436-444 (2001); Stepinski et al., RNA 7: 1468-95 (2001); Elango, et al., Biochim. Biophys. Res. Commun. 330:958-966 (2005)).
РНК, полученные описанными здесь способами, также могут содержать последовательность внутреннего участка посадки рибосомы (IRES). Последовательность IRES может быть любой вирусной, хромосомной или искусственно созданной последовательностью, которая инициирует кэп-независимое связывание рибосомы с мРНК и облегчает инициацию трансляции. Могут быть включены любые растворенные вещества, подходящие для электропорации клеток, которые могут содержать факторы, способствующие клеточной проницаемости и жизнеспособности, такие как сахара, пептиды, липиды, белки, антиоксиданты и поверхностно-активные вещества.
РНК может быть введена в клетки-мишени с использованием любого из ряда различных методов, например, коммерчески доступных методов, которые включают электропорацию (например, Amaxa Nucleofector-II (Amaxa Biosystems, Кельн, Германия), ECM 830 (BTX) (Harvard Instruments, Бостон, Массачусетс), Gene Pulser II (BioRad, Денвер, Колорадо) или Multiporator (Eppendort, Гамбург, Германия)), трансфекцию, опосредованную катионными липосомами, с использованием липофекции, полимерного инкапсулирования, пептид-опосредованной трансфекции или биолистических систем доставки частиц, такие как «генные пушки» (см., например, Nishikawa et al. Hum Gene Ther. 12 (8): 861-70 (2001)); но не ограничиваются этим.
В некоторых вариантах осуществления последовательности CAR, описанные в настоящей заявке, доставляют в иммунные клетки по изобретению с использованием ретровирусного или лентивирусного вектора. CAR-экспрессирующие ретровирусные и лентивирусные векторы могут быть доставлены в различные типы эукариотических клеток, а также в ткани и целые организмы с использованием трансдуцированных клеток в качестве носителей, или бесклеточной локальной или системной доставки инкапсулированных, связанных или депротеинизированных векторов. Используемый способ может быть предназначен для любой цели, где стабильная экспрессия необходима или достаточна.
В некоторых вариантах осуществления последовательности CAR доставляют в иммунные клетки по настоящему изобретению с использованием транскрибируемой мРНК in vitro. Транскрибированные in vitro мРНК CAR могут быть доставлены в различные типы эукариотических клеток, а также в ткани и целые организмы с использованием трансфицированных клеток в качестве носителей, или бесклеточной локальной или системной доставки инкапсулированной, связанной или депротеинизированной мРНК. Используемый метод может быть предназначен для любой цели, где временная экспрессия является необходимой или достаточной.
В некоторых вариантах осуществления необходимый CAR может быть экспрессирован в клетках посредством транспозонов.
В некоторых вариантах осуществления иммунная клетка по изобретению представляет собой, например, Т-клетку. Перед размножением и генетической модификацией Т-клеток (таких как Treg-клетки), как описано в настоящей заявке, клетки получают от субъекта. Т-клетки могут быть получены из ряда источников, включая мононуклеарные клетки периферической крови, костный мозг, ткань лимфатических узлов, пуповинную кровь, ткань тимуса, ткань из очага инфекции, асцитическую жидкость, плевральный выпот, ткань селезенки и опухоли. В некоторых вариантах осуществления настоящего изобретения можно использовать любое количество линий Т-клеток, доступных в данной области техники. В некоторых вариантах осуществления настоящего изобретения Т-клетки могут быть получены из единицы крови, взятой у субъекта, с использованием любого количества методов, известных специалисту в данной области техники, таких как разделение на Ficoll™, центрифугирование в градиенте PERCOLL™ после лизиса эритроцитов и истощения моноцитов, проточное элютриационное центрифугирование, лейкаферез и последующая изоляция на основе маркеров клеточной поверхности с помощью магнитной или проточной цитометрии. В некоторых вариантах осуществления клетки из циркулирующей крови человека получают аферезом. Продукт афереза обычно содержит лимфоциты, включая Т-клетки, моноциты, гранулоциты, В-клетки, другие ядерные лейкоциты, эритроциты и тромбоциты. В некоторых вариантах осуществления клетки из циркулирующей крови субъекта получают лейкаферезом.
В некоторых вариантах осуществления клетки, собранные с помощью лейкафереза, можно промывать для удаления фракции плазмы и помещения клеток в соответствующий буфер или среду для последующих этапов обработки. В некоторых вариантах осуществления изобретения клетки промывают фосфатно-солевым буфером (ФБР). В некоторых вариантах осуществления промывающий раствор не содержит кальция и магния, или может не содержать многих, если не всех двухвалентных катионов. После промывания клетки можно ресуспендировать в любом из множества биосовместимых буферов, таких как, например, ФБР без Ca2+, без Mg2+, PlasmaLyte A или другие солевые растворы с буфером или без него. Альтернативно, нежелательные компоненты образца лейкафереза могут быть удалены, а клетки непосредственно ресуспендированы в культуральной среде.
Конкретная субпопуляция Т-клеток может быть дополнительно выделена методами положительного или отрицательного отбора. Например, в некоторых вариантах осуществления Т-клетки выделяют путем инкубации с гранулами, конъюгированными с анти-CD3/анти-CD28 (т.е. 3×28), такими как DYNABEADS® M-450 CD3/CD28 T, в течение периода времени, достаточного для положительного отбора необходимых Т-клеток. В некоторых вариантах осуществления период времени составляет примерно 30 минут. В дополнительном варианте осуществления период времени составляет от 30 минут до 36 часов или более, и все целые значения между ними. В другом варианте осуществления период времени составляет по меньшей мере 1, 2, 3, 4, 5 или 6 часов. В некоторых вариантах осуществления период времени составляет от 10 до 24 часов. В некоторых вариантах осуществления период инкубации составляет 24 часа. Более продолжительное время инкубации можно использовать для выделения Т-клеток в любой ситуации, когда Т-клеток мало по сравнению с другими типами клеток. Таким образом, просто сокращая или удлиняя время, в течение которого Т-клеткам позволяют связываться с гранулами анти-CD3/анти-CD28, и/или путем увеличения или уменьшения отношения гранул к Т-клеткам (как описано далее в настоящей заявке), субпопуляции Т- клеток можно предпочтительно подвергать положительной или отрицательной селекции при инициировании культивирования или в другие моменты времени во время процесса. Кроме того, увеличивая или уменьшая соотношение анти-CD3 и/или анти-CD28 антител на гранулах или другой поверхности, субпопуляции Т-клеток могут быть предпочтительно подвергнуты положительной или отрицательной селекции при инициации культивирования или в другие необходимые моменты времени. Квалифицированный специалист поймет, что несколько раундов отбора также могут быть использованы в контексте этого изобретения.
В некоторых вариантах осуществления может быть необходимо выполнить процедуру выбора и использовать «невыбранные» клетки в процессе активации и размножения. «Невыбранные» клетки также могут быть подвергнуты дальнейшим этапам отбора. Обогащение популяции Т-клеток путем отрицательной селекции может быть достигнуто с помощью комбинации антител, направленных на поверхностные маркеры, уникальные для отрицательно отобранных клеток. Одним из методов является сортировка и/или отбор клеток с помощью отрицательной магнитной иммуноадгезии или проточной цитометрии, в которой используют коктейль моноклональных антител, направленных на маркеры клеточной поверхности, присутствующие на клетках, подвергаемых отрицательной селекции. Например, для обогащения клеток CD4+ путем отрицательной селекции коктейль моноклональных антител обычно включает антитела к CD14, CD20, CD11b, CD16, HLA-DR и CD8. В некоторых вариантах осуществления Т-регуляторные клетки истощают гранулами, конъюгированными с CD25, или другим аналогичным методом отбора.
Для выделения необходимой популяции клеток путем положительной или отрицательной селекции можно варьировать концентрацию клеток и поверхности (например, таких частиц, как гранулы). В некоторых вариантах осуществления может быть необходимо значительно уменьшить объем, в котором гранулы и клетки смешивают вместе (т.е. увеличить концентрацию клеток), чтобы гарантировать максимальный контакт клеток и гранул. Например, в некоторых вариантах осуществления используют концентрацию 2 миллиарда клеток/мл. В некоторых вариантах осуществления используют концентрацию 1 миллиард клеток/мл. В следующем варианте осуществления используют более 100 миллионов клеток/мл. В дополнительном варианте осуществления используют концентрацию клеток 10, 15, 20, 25, 30, 35, 40, 45 или 50 миллионов клеток/мл. В некоторых вариантах осуществления используют концентрацию клеток 75, 80, 85, 90, 95 или 100 миллионов клеток/мл. В дополнительных вариантах осуществления можно использовать концентрации 125 или 150 миллионов клеток/мл. Использование высоких концентраций может привести к увеличению выхода клеток, активации и размножения клеток. Кроме того, использование высоких концентраций клеток позволяет более эффективно улавливать клетки, которые могут слабо экспрессировать представляющие интерес целевые антигены, такие как CD28-отрицательные Т-клетки, или из образцов, где присутствует много опухолевых клеток (например, лейкозная кровь, опухолевая ткань и т.п.). Такие популяции клеток могут иметь терапевтическую ценность и могут быть необходимыми для получения.
Т-клетки для стимуляции также можно заморозить после стадии промывания. Не желая углубляться в теорию, этап замораживания и последующего размораживания обеспечивает более однородный продукт за счет удаления гранулоцитов и, в некоторой степени, моноцитов из популяции клеток. После стадии промывания, которая удаляет плазму и тромбоциты, клетки можно суспендировать в замораживающем растворе. Хотя многие замораживающие растворы и параметры известны в данной области техники и будут полезны в этом контексте, один метод включает использование ФБР, содержащего 20% ДМСО и 8% сывороточного альбумина человека, или питательных сред, содержащих 10% декстрана-40 и 5% декстрозы, 20% сывороточного альбумина человека и 7,5% ДМСО или 31,25% Плазмалита-А, 31,25% декстрозы 5%; 0,45% NaCl, 10% декстрана-40 и 5% декстрозы, 20% человеческого сывороточного альбумина и 7,5% ДМСО или других подходящих сред для замораживания клеток, содержащих, например, Hespan и PlasmaLyte A; затем клетки затем замораживают до -80°C со скоростью 1°С в минуту и хранят в паровой фазе резервуара для хранения с жидким азотом. Могут быть использованы другие методы контролируемого замораживания, а также неконтролируемое замораживание сразу при -20°C или в жидком азоте.
В некоторых вариантах осуществления криоконсервированные клетки размораживают и промывают, как описано в настоящей заявке, и оставляют на один час при комнатной температуре перед активацией.
Также в контексте изобретения рассматривается сбор образцов крови или продукта лейкафереза от субъекта в период времени до того, когда могут потребоваться размноженные клетки, как описано в настоящей заявке. Таким образом, источник клеток, подлежащих размножению, может быть собран в любой необходимый момент времени, а необходимые клетки, такие как Т-клетки, изолированы и заморожены для последующего использования в терапии Т-лимфоцитами для любого количества заболеваний или состояний, при которых будет полезной Т-клеточная терапия, такая как описана в настоящей заявке. В некоторых вариантах осуществления образец крови или продукт лейкафереза берут у практически здорового субъекта. В некоторых вариантах осуществления образец крови или продукт лейкафереза берут у практически здорового субъекта, который подвержен риску развития заболевания, но у которого еще не развилось заболевание, и представляющие интерес клетки выделяют и замораживают для дальнейшего использования. В некоторых вариантах осуществления Т-клетки могут быть размножены, заморожены и использованы в более позднее время.
До или после генетической модификации Treg-клеток для экспрессии необходимого CAR, T-клетки могут быть активированы и размножены, как правило, с использованием способов, как описано, например, в патентах США 6,352,694; 6,534,055; 6,905,680; 6,692,964; 5,858,358; 6,887,466; 6,905,681; 7,144,575; 7,067,318; 7,172,869; 7,232,566; 7,175,843; 5,883,223; 6,905,874; 6,797,514; и 6,867,041; и публикации патента США 2006/0121005, включенных в настоящий документ посредством ссылки.
Обычно Т-клетки (например, Treg-клетки) по изобретению размножают путем контакта с поверхностью, к которой прикреплен агент, стимулирующий сигнал, связанный с комплексом CD3/TCR, и лиганд, стимулирующий костимуляторную молекулу на поверхности клеток. В частности, Т-клетки (например, Treg-клетки) можно стимулировать, как описано в настоящей заявке, например, путем контакта с анти-CD3 антителом или его антигенсвязывающим фрагментом или анти-CD2 антителом, иммобилизованным на поверхности, или путем контакта с активатором протеинкиназы C (например, бриостатином) в комбинации с ионофором кальция. Для совместной стимуляции вспомогательной молекулы на поверхности Т-клеток используют лиганд, который связывает вспомогательную молекулу. Например, популяция Т-клеток может контактировать с анти-CD3 антителом и анти-CD28 антителом в условиях, подходящих для стимуляции пролиферации Т-клеток. Чтобы стимулировать пролиферацию CD4+ Т-клеток, можно использовать анти-CD3 антитело и анти-CD28 антитело. Примеры анти-CD28 антитела включают 9.3, B-T3, XR-CD28 (Diaclone, Безансон, Франция), но не ограничиваются ими. Могут быть использованы другие методы размножения, обычно известные в данной области техники (Berg et al., Transplant Proc. 30 (8): 3975-3977 (1998); Haanen et al., J. Exp. Med. 190 (9): 1319- 1328 (1999); Garland et al., J. Immunol Meth. 227 (1-2): 53-63 (1999)).
В некоторых вариантах осуществления первичный стимулирующий сигнал и костимуляторный сигнал для Т-клеток (например, Treg) по настоящему изобретению могут обеспечиваться разными протоколами. Например, агенты, обеспечивающие каждый сигнал, могут быть в растворе и/или связаны с поверхностью. При связывании с поверхностью агенты могут быть связаны с одной и той же поверхностью (т.е. в «цис» формации) или с отдельными поверхностями (т.е. в «транс» формации). Альтернативно, один агент может быть связан с поверхностью, а другой агент - находиться в растворе. В некоторых вариантах осуществления агент, обеспечивающий костимуляторный сигнал, связывается с поверхностью клетки, а агент, обеспечивающий первичный сигнал активации, находится в растворе или связан с поверхностью. В некоторых вариантах осуществления оба агента могут находиться в растворе. В некоторых вариантах осуществления агенты могут быть в растворимой форме, а затем сшиты с поверхностью, такой как клетка, экспрессирующая рецепторы Fc, или антитело, или другой связывающий агент, который будет связываться с агентами. В этом отношении см., например, публикации патентов США 2004/0101519 и 2006/0034810, включенные здесь в качестве ссылки, для искусственных антигенпрезентирующих клеток (аАРС), которые предполагается использовать для активации и размножения Т-клеток в настоящем изобретении.
В некоторых вариантах осуществления два агента иммобилизованы на гранулах, либо на одной и той же грануле, то есть в «цис» форме, либо на отдельных гранулах, то есть в «транс» форме. В качестве примера агент, обеспечивающий первичный сигнал активации, представляет собой анти-CD3-антитело или его антигенсвязывающий фрагмент, а агент, обеспечивающий костимуляторный сигнал, представляет собой анти-CD28-антитело или его антигенсвязывающий фрагмент; и оба агента совместно иммобилизованы на одной и той же грануле в эквивалентных молекулярных количествах. В некоторых вариантах осуществления используют соотношение 1:1 каждого антитела, связанного с гранулами, для размножения CD4+ Т-клеток и роста Т-клеток. В некоторых аспектах настоящего изобретения используют такое соотношение анти-CD3:анти-CD28 антител, связанных с гранулами, чтобы наблюдалось увеличение роста Т-клеток по сравнению с увеличением, наблюдаемым при использовании соотношения 1:1. В некоторых вариантах осуществления наблюдается увеличение примерно от 1 до 3 раз по сравнению с размножением, наблюдаемым при соотношении 1:1. В некоторых вариантах осуществления соотношение анти-CD3:анти-CD28-антител, связанных с гранулами, составляет от 100:1 до 1:100, и все целые числа между ними. В некоторых вариантах осуществления с частицами связано больше антитела против CD28, чем антитела против CD3, т.е. соотношение CD3:CD28 меньше единицы. В некоторых вариантах осуществления изобретения отношение анти-CD28 антитела к анти-CD3 антителу, связанному с гранулами, превышает 2:1. В одном конкретном варианте используют соотношение CD3:CD28 антител, связанных с гранулами, составляющее 1:100. В некоторых вариантах осуществления используют соотношение CD3:CD28 антител, связанных с гранулами, составляющее 1:75. В другом варианте используют соотношение CD3:CD28 антител, связанных с гранулами, составляющее 1:50. В некоторых вариантах осуществления изобретения используют соотношение CD3:CD28 антител, связанных с гранулами, составляющее 1:30. В некоторых вариантах осуществления используют соотношение CD3:CD28 антител, связанных с гранулами, составляющее 1:10. В некоторых вариантах осуществления используют соотношение CD3:CD28 антител, связанных с гранулами, составляющее 1:3. В некоторых вариантах осуществления используют соотношение CD3:CD28 антител, связанных с гранулами, составляющее 3:1.
Отношение частиц к клеткам от 1:500 до 500:1 и любые промежуточные значения в виде целых чисел могут быть использованы для стимуляции Т-клеток или других клеток-мишеней. Как легко могут понять специалисты в данной области техники, соотношение частиц к клеткам может зависеть от размера частиц относительно клетки-мишени. Например, гранулы небольшого размера могут связывать только несколько клеток, а гранулы большего размера могут связывать много клеток. В некоторых вариантах осуществления Т-клетки можно стимулировать с помощью соотношения клеток к частицам в диапазоне от 1:100 до 100:1 и любых промежуточных значений в виде целых чисел. В конкретных вариантах осуществления соотношение составляет от 1:9 до 9:1 и любые промежуточные целые числа. Отношение анти-CD3- и анти-CD28-связанных частиц к Т-клеткам, которое приводит к стимуляции Т-клеток, может варьировать, как указано выше; однако некоторые варианты осуществления значений включают 1:100, 1:50, 1:40, 1:30, 1:20, 1:10, 1:9, 1:8, 1:7, 1:6, 1:5, 1:4, 1:3, 1:2, 1:1, 2:1, 3:1, 4:1, 5:1, 6:1, 7:1, 8:1, 9:1, 10:1, и 15:1 с одним конкретным соотношением частиц по меньшей мере 1:1 на Т-клетку. В некоторых вариантах осуществления используют отношение частиц к клеткам 1:1 или менее. В некоторых вариантах осуществления отношение частиц к клеткам составляет 1:5. В дополнительных вариантах осуществления отношение частиц к клеткам может варьировать в зависимости от дня стимуляции. Например, в некоторых вариантах осуществления отношение частиц к клеткам составляет от 1:1 до 10:1 в первый день, и дополнительные частицы добавляют к клеткам каждый день или через день после этого на срок до 10 дней в конечных отношениях от 1:1 до 1:10 (на основе подсчета клеток в день добавления). В одном конкретном варианте осуществления отношение частиц к клеткам составляет 1:1 в первый день стимуляции, и его доводят до 1:5 на третий и пятый дни стимуляции. В некоторых вариантах осуществления частицы добавляют ежедневно или через день до конечного соотношения 1:1 в первый день и 1:5 на третий и пятый дни стимуляции. В некоторых вариантах осуществления отношение частиц к клеткам составляет 2:1 в первый день стимуляции, и его доводят до 1:10 на третий и пятый дни стимуляции. В некоторых вариантах осуществления частицы добавляют ежедневно или через день до конечного соотношения 1:1 в первый день и 1:10 на третий и пятый дни стимуляции. Специалист в данной области техники поймет, что для использования в настоящем изобретении может быть подходящим множество других соотношений. В частности, соотношения будут варьировать в зависимости от размера частиц и от размера и типа клеток.
В дополнительных вариантах осуществления настоящего изобретения иммунные клетки объединяют с гранулами, покрытыми агентом, затем гранулы и клетки разделяют, а затем клетки культивируют. В альтернативных вариантах осуществления перед культивированием покрытые агентом гранулы и клетки не разделяют, а культивируют вместе. В некоторых вариантах осуществления гранулы и клетки сначала концентрируют путем приложения силы, такой как магнитная сила, что приводит к усилению лигирования маркеров клеточной поверхности, тем самым вызывая стимуляцию клеток.
В качестве примера, белки клеточной поверхности могут быть лигированы, позволяя парамагнитным гранулам, к которым прикреплены анти-CD3 и анти-CD28 антитела (3×28 гранулы), связываться с Treg-клетками по изобретению. В некоторых вариантах осуществления клетки (например, от 104 до 109 Т-клеток) и гранулы (например, парамагнитные гранулы DYNABEADS® M-450 CD3/CD28 T в соотношении 1:1) объединяют в буфере, таком как ФБР (например, без двухвалентных катионов, таких как кальций и магний). Опять же, специалисты в данной области техники могут легко понять, что можно использовать любую концентрацию клеток в зависимости от обстоятельств. Например, целевая клетка может быть очень редкой в образце и составлять только 0,01% образца, или весь образец (то есть 100%) может включать интересующую целевую клетку. Соответственно, любое число клеток находится в контексте настоящего изобретения. В некоторых вариантах осуществления может быть необходимо значительно уменьшить объем, в котором частицы и клетки смешиваются вместе (т.е. увеличить концентрацию клеток), чтобы гарантировать максимальный контакт клеток и частиц. Например, в одном варианте используют концентрацию примерно 2 миллиарда клеток/мл. В другом варианте используют более 100 миллионов клеток/мл. В дополнительном варианте осуществления используют концентрацию клеток 10, 15, 20, 25, 30, 35, 40, 45 или 50 миллионов клеток/мл. В еще одном варианте осуществления используют концентрацию клеток 75, 80, 85, 90, 95 или 100 миллионов клеток/мл. В дополнительных вариантах осуществления можно использовать концентрации 125 или 150 миллионов клеток/мл. Использование высоких концентраций может привести к увеличению выхода клеток, активации клеток и/или размножения клеток. Кроме того, использование высоких концентраций клеток позволяет более эффективно захватить клетки, которые могут слабо экспрессировать представляющие интерес антигены-мишени, такие как CD28-негативные Т-клетки. Такие популяции клеток могут иметь терапевтическую ценность и могут быть необходимы для получения в определенных вариантах осуществления.
В некоторых вариантах осуществления настоящего изобретения смесь можно культивировать в течение от нескольких часов (например, примерно 3 часа) до примерно 14 дней или любого промежуточного значения часов в виде целых чисел. В некоторых вариантах осуществления смесь можно культивировать в течение 21 дня. В некоторых вариантах осуществления изобретения гранулы и Т-клетки культивируют вместе в течение примерно восьми дней. В некоторых вариантах осуществления гранулы и Т-клетки культивируют вместе в течение 2-3 дней. Также может быть необходимо несколько циклов стимуляции, так что время культивирования Т-клеток может составлять 60 дней или более. Условия, подходящие для культуры Т-клеток, включают подходящую среду (например, минимальную эссенциальную среду или RPMI среду 1640 или, X-vivo 15, (Lonza)), которая может содержать факторы, необходимые для пролиферации и жизнеспособности, включая сыворотку (например, эмбриональную телячью или человеческую сыворотку), интерлейкин-2 (IL-2), инсулин, IFN-γ, IL-4, IL-7, GM-CSF, IL-10, IL-12, IL-15, TGFβ и TNF-α или любой другие добавки для роста клеток, известные специалисту в данной области техники. Другие добавки для роста клеток включают поверхностно-активное вещество, плазманат и восстанавливающие агенты, такие как N-ацетилцистеин и 2-меркаптоэтанол, но не ограничиваются ими. Среда может включать RPMI 1640, AIM-V, DMEM, MEM, a-MEM, F-12, X-Vivo 15 и X-Vivo 20, Optimizer, с добавленными аминокислотами, пируватом натрия и витаминами, либо без сыворотки. или с добавлением соответствующего количества сыворотки (или плазмы), или определенного набора гормонов, и/или количества цитокина (цитокинов), достаточного для роста и размножения Т-клеток. Антибиотики, например, пенициллин и стрептомицин, включают только в экспериментальные культуры, а не в культуры клеток, которые должны быть введены субъекту. Клетки-мишени содержат в условиях, необходимых для поддержания роста, например, при соответствующей температуре (например, 37°C) и атмосфере (например, воздух плюс 5% CO2).
Т-клетки, которые подвергались разному времени стимуляции, могут проявлять разные характеристики. Например, типичная кровь или продукты мононуклеарных клеток периферической крови содержат популяцию хелперных Т-клеток (Th, CD4+), которая больше, чем популяция цитотоксических или супрессорных Т-клеток (Tc, CD8+). Экспансия ex vivo Т-клеток за счет стимуляции рецепторов CD3 и CD28 дает популяцию Т-клеток, которая примерно до 8-9 дней состоит преимущественно из Th-клеток, а примерно через 8-9 дней популяция Т-клеток включает все большую популяцию Тс-клеток. В зависимости от цели лечения в некоторых вариантах осуществления может быть предпочтительным введение субъекту популяции Т-клеток, содержащей преимущественно Th-клетки. В некоторых вариантах осуществления, если была выделена антиген-специфическая подгруппа Тс-клеток, может быть полезно размножить эту подгруппу в большей степени.
Кроме того, помимо маркеров CD4 и CD8, другие фенотипические маркеры значительно различаются, но в значительной степени воспроизводимо в ходе процесса размножения клеток. Такая воспроизводимость дает возможность адаптировать продукт активированных Т-клеток для конкретных целей.
В некоторых вариантах осуществления изобретения Т-клетки можно культивировать в присутствии рапамицина для получения регуляторных Т-клеток, как описано, например, в публикации патента РСТ WO 2007/110785 (включенной в настоящий документ посредством ссылки). Другой метод создания регуляторных Т-клеток описан в публикации патента США 2016/024470 (включенной в настоящий документ в качестве ссылки), где Т-клетки культивируют с активатором Т-клеточного рецептора (TCR)/CD3, таким как, например, антитела к TCR/CD3, активатором костимулятора TCR, таким как, например, CD28, CD137 (4-1BB), GITR, B7-1/2, CD5, ICOS, OX40, антитела к CD40 или CD137 и рапамицин.
В некоторых вариантах осуществления изобретения Т-клетки, генетически модифицированные путем экспрессии CAR, как описано в настоящей заявке, также могут быть генетически модифицированы путем экспрессии по меньшей мере одного внутриклеточного фактора, такого как ROR-C, FoxP3, Foxo1, T-bet, или Gata 3, c-Maf или AhR. В некоторых вариантах осуществления генетически модифицированная иммунная клетка по изобретению экспрессирует FoxP3. В некоторых вариантах осуществления генетически модифицированная иммунная клетка по изобретению экспрессирует Foxo1.
В некоторых вариантах осуществления генетически модифицированная иммунная клетка по изобретению может быть аллогенной иммунной клеткой. В таких случаях клетка может быть сконструирована так, чтобы уменьшить отторжение клетки хозяином (отторжение трансплантата) и/или потенциальную атаку клетки на хозяина (болезнь «трансплантат против хозяина»). В качестве примера, клетка может быть сконструирована так, чтобы иметь нулевой генотип для одного или нескольких из следующего: (i) Т-клеточный рецептор (альфа-цепь или бета-цепь TCR); (ii) полиморфная молекула класса I или II главного комплекса гистосовместимости (MHC) (например, HLA-A, HLA-B или HLA-C; HLA-DP, HLA-DM, HLA-DOA, HLA-DOB, HLA-DQ или HLA-DR; или β2-микроглобулин (B2M)); (iii) переносчик, связанный с процессингом антигена (например, TAP-1 или TAP-2); (iv) трансактиватор MHC класса II (CIITA); (v) минорный антиген гистосовместимости (MiHA; например, HA-1/A2, HA-2, HA-3, HA-8, HB-1H или HB-1Y); и (vi) любая их комбинация. Аллогенные сконструированные клетки могут также экспрессировать инвариантный HLA или CD47 для защиты сконструированных Treg-клеток от отторжения хозяином. Эти дополнительные генетические модификации могут быть выполнены методами редактирования генов, известными в данной области техники и описанными в настоящей заявке.
Дополнительно отредактированные аллогенные клетки особенно полезны, потому что их можно использовать у нескольких пациентов без проблем совместимости. Таким образом, аллогенные клетки можно назвать «универсальными» и использовать без изменения. Использование «универсальных» клеток значительно повышает эффективность и снижает стоимость адоптивной клеточной терапии.
В некоторых вариантах осуществления аллогенная иммунная клетка может быть сконструирована так, чтобы она не экспрессировала какой-либо функциональный TCR на своей поверхности, сконструирована так, чтобы она не экспрессировала одну или несколько субъединиц, составляющих функциональный TCR, или сконструирована так, чтобы она производила очень мало функционального TCR на своей поверхности. Например, описанная здесь иммунная клетка может быть сконструирована так, чтобы экспрессия молекул TCR на клеточной поверхности подавлялась. Альтернативно, Т-клетка может экспрессировать по существу нарушенный TCR, например, путем экспрессии мутантных или усеченных форм одной или нескольких субъединиц TCR. Термин «по существу нарушенный TCR» означает, что этот TCR не будет вызывать неблагоприятную иммунную реакцию у хозяина.
В некоторых вариантах осуществления аллогенные иммунные клетки могут быть сконструированы так, чтобы они не экспрессировали функциональные HLA на своей поверхности. Например, описанная в настоящей заявке иммунная клетка может быть сконструирована таким образом, чтобы экспрессия HLA на клеточной поверхности, например, HLA класса 1 и/или HLA класса II, и/или неклассических молекул HLA, подавлялась.
В некоторых вариантах осуществления в Т-клетке может отсутствовать функциональный TCR и функциональный HLA, такой как HLA I класса и/или HLA II класса.
Модифицированные иммунные клетки, в которых отсутствует экспрессия функционального TCR и/или HLA, могут быть получены любыми подходящими способами, включая нокаут или нокдаун одной или нескольких субъединиц TCR и/или HLA. Например, Treg-клетка может включать нокдаун TCR и/или HLA с использованием миРНК, кшRNA, кластерных коротких палиндромных повторов, разделенных регулярными промежутками (CRISPR), нуклеазы на основе эффектора, подобного активатору транскрипции (TALEN), эндонуклеазы цинковых пальцев (ZFN), мегануклеазы (mn, также известной как хоминговая эндонуклеаза) или megaTAL (комбинации эффектора TAL с доменом расщепления mn).
В некоторых вариантах осуществления нуклеиновая кислота, кодирующая CAR, как описано в настоящей заявке, вставлена в конкретный локус генома иммунной клетки, такой как, например, локус гена, который должен быть удален. В некоторых вариантах осуществления нуклеиновая кислота, кодирующая CAR, как описано в настоящей заявке, вставлена в локус TCR и/или HLA, таким образом, приводя к ингибированию экспрессии TCR и/или HLA.
В некоторых вариантах осуществления экспрессия TCR и/или HLA может быть ингибирована с использованием миРНК или кшРНК, которые нацелены на нуклеиновую кислоту, кодирующую TCR и/или HLA в Т-клетке. Экспрессия миРНК и кшРНК в Т-клетках может быть достигнута с использованием любой общепринятой системы экспрессии, например, такой как система экспрессии лентивирусов. Примеры миРНК и кшРНК, которые подавляют экспрессию генов HLA класса I и/или HLA класса II, описаны, например, в публикации патента США 2007/0036773. Типичные кшРНК, которые подавляют экспрессию компонентов TCR, описаны, например, в публикации патента США 2012/0321667.
«CRISPR» или «CRISPR для TCR и/или HLA» или «CRISPR для ингибирования TCR и/или HLA» в контексте настоящего описания относится к набору кластеризованных коротких палиндромных повторов с регулярными интервалами между ними, или к системе, содержащей такой набор повторов. «Cas» в контексте настоящего описания относится к белку, ассоциированному с CRISPR. Система «CRISPR/Cas» относится к системе, производной от CRISPR и Cas, которую можно использовать для сайленсинга или мутации гена TCR и/или HLA.
Встречающиеся в природе системы CRISPR/Cas обнаружены примерно в 40% секвенированных геномов эубактерий и 90% секвенированных архей. См., например, Grissa et al. (BMC Bioinformatics 8: 172 (2007)). Эта система представляет собой тип прокариотической иммунной системы, которая придает устойчивость к чужеродным генетическим элементам, таким как плазмиды и фаги, и обеспечивает форму приобретенного иммунитета. См., например, Barrangou et al., Science 315:1709-1712 (2007); Marragini et al., Science 322:1843-1845 (2008). Система CRISPR/Cas была модифицирована для использования в редактировании генов (сайленсинге, усилении или изменении определенных генов) эукариот, таких как мыши или приматы. См., например, Wiedenheft et al., Nature 482: 331-8 (2012). Это достигается путем введения в эукариотическую клетку плазмиды, содержащей специально сконструированный CRISPR и одну или несколько подходящих последовательностей, кодирующих Cas. Последовательность CRISPR, иногда называемая локусом CRISPR, состоит из чередующихся повторов и спейсеров. В натуральном CRISPR спейсеры обычно содержат последовательности, чужеродные для бактерии, такие как последовательность плазмиды или фага; в системе TCR и/или HLA CRISPR/Cas спейсеры происходят из последовательности гена TCR и/или HLA. РНК из локуса CRISPR конститутивно экспрессируется и процессируется белками Cas в малые РНК. Они содержат спейсер, фланкированный повторяющейся последовательностью. РНК направляют другие белки Cas для сайленсинга экзогенных генетических элементов на уровне РНК или ДНК. См., например, Horvath et al., Science 327:167-170 (2010); Makarova et al., Biology Direct 1:7 (2006). Таким образом, спейсеры служат матрицами для молекул РНК, как и миРНК. См., например, Pennisi, Science 341: 833-836 (2013). Таким образом, систему CRISPR/Cas можно использовать для редактирования гена TCR и/или HLA (добавления или удаления пары оснований) или введения преждевременной остановки, которая снижает экспрессию TCR и/или HLA. Система CRISPR/Cas в качестве альтернативы или дополнительно может использоваться как интерференция РНК, отключая ген TCR и/или HLA обратимым образом. В клетке млекопитающего, например, РНК может направлять белок Cas к промотору TCR и/или HLA, стерически блокируя РНК-полимеразы.
Можно создать искусственные системы CRISPR/Cas, которые ингибируют TCR и/или HLA, с использованием технологии, известной в данной области техники, например, описанной в патентной публикации США 2014/0068797 и Cong, Science 339: 819-823 (2013). Другие искусственные системы CRISPR/Cas, известные в данной области техники, также могут быть созданы для ингибирования TCR и/или HLA, например, те, которые описаны в Tsai, Nature Biotechnol. 32: 6569-576 (2014) и патентах США 8,871,445; 8,865,406; 8,795,965; 8,771,945; и 8,697,359.
Понятно, что вышеуказанные процедуры также могут выполняться системами CRISPR, которые используют эндонуклеазы, отличные от Cas, такие как Cpf1 и C2c1/2/3.
«TALEN» или «TALEN для TCR и/или HLA» или «TALEN для ингибирования TCR и/или HLA» относится к нуклеазе на основе эффектора, подобного активатору транскрипции, искусственной нуклеазе, которая может быть использована для редактирования гена TCR и/или HLA. TALEN производят искусственно путем слияния эффекторного домена связывания ДНК TAL с доменом расщепления ДНК. Эффекторы, подобные активатору транскрипции (TALE), могут быть сконструированы для связывания любой необходимой последовательности ДНК, включая часть гена TCR и/или HLA. Комбинируя сконструированный TALE с доменом расщепления ДНК, можно получить рестрикционный фермент, который специфичен для любой необходимой последовательности ДНК, включая последовательность TCR и/или HLA. Затем они могут быть введены в клетку, где они могут быть использованы для редактирования генома. См., например, Boch, Nature Biotech. 29: 135-6 (2011); Boch et al., Science 326: 1509-12 (2009); и Moscou et al., Science 326: 3501 (2009).
TALE - это белки, секретируемые бактериями Xanthomonas. ДНК-связывающий домен содержит повторяющуюся последовательность из 33-34 аминокислот, которая является высококонсервативной, за исключением 12-й и 13-й аминокислот. Эти две позиции сильно варьируют, показывая сильную корреляцию с распознаванием специфических нуклеотидов. Таким образом, они могут быть сконструированы для связывания с необходимой последовательностью ДНК. Для получения TALEN белок TALE гибридизуют с нуклеазой (N), которая является эндонуклеазой Fokl дикого типа или мутантной. Было сделано несколько мутаций Fokl для его использования в TALEN; они, например, улучшают специфичность или активность расщепления. См., например, Cermak et al., Nucl. Acids Res. 39:e82 (2011); Miller et al., Nature Biotech. 29:143-8 (2011); Hockemeyer et al., Nature Biotech. 29:731-734 (2011); Wood et al., Science 333:307 (2011); Doyon et al., Nature Methods 8:74-79 (2010); Szczepek et al., Nature Biotech. 25:786-793 (2007); и Guo et al., J. Mol. Biol. 200:96 (2010). Домен Fokl функционирует как димер, требуя двух конструкций с уникальными ДНК-связывающими доменами для сайтов в целевом геноме с правильной ориентацией и промежутками. Как количество аминокислотных остатков между ДНК-связывающим доменом TALE и доменом расщепления Fokl, так и количество оснований между двумя отдельными сайтами связывания TALEN, по-видимому, являются важными параметрами для достижения высоких уровней активности (Miller et al., Nature Biotech. 29: 143-8 (2011)). TCR и/или HLA TALEN можно использовать внутри клетки для создания двухцепочечного разрыва (DSB). Мутация может быть внесена в сайт разрыва, если механизмы репарации неправильно восстанавливают разрыв через негомологичное соединение концов. Например, неправильное восстановление может привести к мутации сдвига рамки считывания. Альтернативно, чужеродная ДНК может быть введена в клетку вместе с TALEN; в зависимости от последовательностей чужеродной ДНК и хромосомной последовательности этот процесс можно использовать для исправления дефекта в гене TCR и/или HLA или для введения такого дефекта в ген HLA дикого типа, тем самым снижая экспрессию TCR и/или HLA. TALEN, специфичные для последовательностей в TCR и/или HLA, могут быть сконструированы с использованием любого метода, известного в данной области техники, включая различные схемы с использованием модульных компонентов (Zhang et al., Nature Biotech.29: 149-53 (2011); Geibler et al., PLoS ONE 6: el9509 (2011)).
«ZFN», или «нуклеаза цинковых пальцев», или «ZFN для TCR и/или HLA», или «ZFN для ингибирования TCR и/или HLA» относится к нуклеазе цинковых пальцев, искусственной нуклеазе, которая может использоваться для редактирования гена TCR и/или HLA. Подобно TALEN, ZFN содержит домен нуклеазы Fokl (или его производное), слитый с ДНК-связывающим доменом. В случае ZFN ДНК-связывающий домен содержит один или несколько цинковых пальцев. См., например, Carroll et al., Genetics Society of America 188: 773-782 (2011); и Kim et al., Proc. Natl. Акад. Sci. USA 93: 1156-1160 (1996). Цинковый палец - это небольшой структурный мотив белка, стабилизированный одним или несколькими ионами цинка. Цинковый палец может содержать, например, Cys2His2, и может распознавать последовательность длиной приблизительно 3 п.н. Различные цинковые пальцы с известной специфичностью можно комбинировать для получения полипептидов с несколькими пальцами, которые распознают последовательности примерно из 6, 9, 12, 15 или 18 пар оснований. Доступны различные методы отбора и модульной сборки для создания цинковых пальцев (и их комбинаций), распознающих определенные последовательности, включая фаговый дисплей, дрожжевые одногибридные системы, бактериальные одногибридные и двугибридные системы и клетки млекопитающих.
Подобно TALEN, ZFN должен димеризоваться, чтобы расщепить ДНК. Таким образом, пара ZFN необходима для нацеливания на непалиндромные участки ДНК. Две отдельные ZFN должны связываться с противоположными цепями ДНК с их нуклеазами, должным образом отделенными друг от друга (Bitinaite et al., Proc. Natl. Acad. Sci. USA 95: 10570-5 (1998)). Также, как и TALEN, ZFN может создавать двухцепочечный разрыв в ДНК, который может создавать мутацию со сдвигом рамки считывания при неправильной репарации, что приводит к снижению экспрессии и количества TCR и/или HLA в клетке. ZFN также можно использовать с гомологичной рекомбинацией для мутации гена TCR и/или HLA. ZFN, специфичные для последовательностей в TCR и/или HLA, могут быть сконструированы с использованием любого метода, известного в данной области техники. См., например, Provasi, Nature Med. 18: 807-815 (2011); Torikai, Blood 122: 1341-1349 (2013); Cathomen et al., Mol. Ther. 16: 1200-7 (2008); Quo et al., J. Mol. Biol. 400:96 (2010); и патентные публикации США 2011/0158957 и 2012/0060230.
«Мегануклеаза» или «мегануклеаза для TCR и/или HLA» или «мегануклеаза для ингибирования TCR и/или HLA» относится к мономерной эндонуклеазе с большими (> 14 пар оснований) сайтами распознавания, которые можно использовать для редактирования гена TCR и/или HLA. Мегануклеазы (mn) - это мономерные белки с врожденной нуклеазной активностью, которые получены из бактериальных хоминг-эндонуклеаз и сконструированы для уникального целевого сайта. Хоминг-эндонуклеазы представляют собой ферменты, расщепляющие ДНК, которые могут генерировать двухцепочечные разрывы в отдельных локусах в геномах хозяина и тем самым управлять событиями сайт-специфической конверсии генов (Stoddard, Structure 19 (1): 7-15 (2011)). Несмотря на свой небольшой размер, хоминг-эндонуклеазы распознают длинные последовательности ДНК (обычно от 20 до 30 пар оснований). Хоминг-эндонуклеазы чрезвычайно широко распространены и обнаруживаются у микробов, а также у фагов и вирусов. LAGLIDADG и ферменты His-Cys-бокса (которые являются наиболее специфичными по отношению к последовательности из этих ферментов) располагаются на антипараллельных β-листах, которые присоединяются к основным бороздкам их участков-мишеней ДНК (Flick et al., Nature 394 (6688): 96-101 (1998); Jurica et al., Mol. Cell. 2 (4): 469-76 (1998). Там они устанавливают набор специфичных для последовательности и неспецифических контактов, которые неравномерно распределены между несколькими последовательными парами оснований (Chevalier et al., J Mol Biol 329 (2): 253-269 (2003); Scalley-Kim et al., J Mol Biol.372 (5): 1305-19 (2007).
Семейство хоминг-эндонуклеаз LAGLIDADG (LHE) является основным источником сконструированных ферментов, используемых для нацеливания на гены. Семейство LHE в первую очередь кодируется у архей, а также в хлоропластных и митохондриальных геномах водорослей и грибов (Chevalier et al., Homing Endonucases and Inteins. Nucleic Acids and Molecular Biology, vol.16 (2005); Dalgaard et al., Nucleic Acids Res.25 (22): 4626-38 (1997); Sethuraman et al., Mol Biol Evol. 26(10): 2299-315 (2009). Мегануклеазы, содержащие единственный консервативный мотив LAGLIDADG (SEQ ID NO: 58) на белковую цепь, образуют гомодимерные белки, которые расщепляют палиндромные и почти палиндромные последовательности-мишени ДНК, тогда как те, которые содержат два таких мотива на белковую цепь, образуют более крупные псевдосимметричные мономеры, которые могут нацеливаться на полностью асимметричные последовательности ДНК.
Мегануклеазы могут быть сконструированы для нацеливания на TCR и/или HLA и, таким образом, для создания двухцепочечного разрыва в ДНК, который может вызвать мутацию со сдвигом рамки считывания при неправильной репарации, что приведет к снижению экспрессии и количества TCR и/или HLA в клетке.
«MegaTAL» или «megaTAL для TCR и/или HLA» или «megaTAL для ингибирования TCR и/или HLA» относится к искусственной нуклеазе, которую можно использовать для редактирования гена TCR и/или HLA. MegaTAL представляют собой гибридные мономерные нуклеазы, полученные путем слияния минимальных эффекторных доменов TAL (подобных активатору транскрипции) с N-концом мегануклеаз, происходящих из семейства хоминг-эндонуклеаз LAGLIDADG (Boissel et al., Nucleic Ac ids Res. 42 (4): 2591-601 (2014); Takeuchi et al., Methods Mol Biol. 1239: 105-32 (2015)). Таким образом, MegaTAL состоят из сайт-специфической мегануклеазной расщепляющей головки с дополнительной аффинностью и специфичностью, обеспечиваемой TAL эффекторным ДНК-связывающим доменом.
MegaTAL могут быть сконструированы так, чтобы нацеливаться на TCR и/или HLA и, таким образом, формировать двухцепочечный разрыв в ДНК, который может создавать мутацию со сдвигом рамки считывания при неправильной репарации, что приводит к снижению экспрессии и количества TCR и/или HLA в клетке. Вариант мегануклеазы I-OnuI (mn) был использован для создания TCRα-megaTAL для нокаута гена Т-клеточного рецептора альфа (TCRα). TCRα mn гибридизировали с 10,5-повторным массивом TALE, сконструированным для связывания последовательности ДНК перед сайтом связывания TCRα mn. Было обнаружено, что megaTAL, нацеленная на TCRα, обеспечивает чрезвычайно высокое разрушение гена без выявляемого расщепления вне мишени в первичных Т-клетках человека (Boissel et al, Nucleic Acids Res 42 (4): 2591-601 (2014)).
В некоторых вариантах осуществления популяция Т-клеток, экспрессирующая CAR по настоящему изобретению, представляет собой популяцию, в которой отсутствует эндогенный Т-клеточный рецептор (TCR) или которая была изменена для снижения или устранения экспрессии, или активности эндогенного TCR. Понятно, что любой из описанных здесь способов ингибирования или устранения экспрессии HLA также можно использовать для нацеливания одного или несколько компонентов эндогенного TCR.
В некоторых вариантах осуществления изобретения трансфекция геном теломеразы может удлинить теломеры Т-клетки и улучшить сохранение Т-клетки у пациента. См., например, June, Journal of Clinical Investigation 117: 1466-1476 (2007). Таким образом, в некоторых вариантах осуществления генетически модифицированная клетка Treg по настоящему изобретению эктопически экспрессирует субъединицу теломеразы, например, каталитическую субъединицу теломеразы, например, TERT, например, hTERT. В некоторых аспектах настоящее изобретение обеспечивает способ получения клетки по изобретению, экспрессирующей химерный рецептор, включающий обеспечение контакта клетки с нуклеиновой кислотой, кодирующей субъединицу теломеразы, например, каталитическую субъединицу теломеразы, например, TERT, например, hTERT. Клетка может контактировать с нуклеиновой кислотой до, одновременно или после контакта с конструкцией, кодирующей химерный рецептор (например, CAR, как описано в настоящей заявке).
Настоящее изобретение также относится к способу получения иммунной клетки по настоящему изобретению, включающему трансдукцию по меньшей мере одной иммунной клетки нуклеиновой кислотой, кодирующей CAR, как описано в настоящей заявке, и при необходимости размножение трансдуцированных клеток. В некоторых вариантах осуществления способ представляет собой способ ex vivo.
В некоторых вариантах осуществления способ получения иммунных клеток по изобретению включает:
- этап изоляции/обогащения иммунных клеток из популяции МНКПК (например, извлеченных с помощью лейкафереза);
- при необходимости этап активации;
- этап трансдукции вектором, содержащим нуклеиновокислотную последовательность, кодирующую CAR, как описано в настоящей заявке;
- при необходимости этап размножения;
- при необходимости этап отмывания; и
- при необходимости этап замораживания.
В некоторых вариантах осуществления сконструированные Treg-клетки по настоящему изобретению можно культивировать в среде для культивирования тканей, содержащей рапамицин и/или высокую концентрацию IL-2, для поддержания фенотипа Treg и/или для увеличения экспрессии FoxP3 и трансгена.
Композиции
Другим объектом изобретения является композиция, содержащая, состоящая или состоящая по существу по меньшей мере из одной иммунной клетки или популяции иммунных клеток по изобретению, как описано в настоящей заявке. В некоторых вариантах осуществления указанная иммунная клетка или популяция иммунных клеток по изобретению выбрана из группы, состоящей из Т-клеток, натуральных киллеров (NK), γδ Т-клеток, двойных негативных (DN) клеток, регуляторных иммунных клеток, регуляторных Т-клеток, эффекторных иммунных клеток, эффекторных Т-клеток, В-клеток и клеток миелоидного происхождения, и любой их комбинации.
Используемый в настоящей заявке термин «состоящий по существу из» применительно к фармацевтической композиции или лекарственному средству означает, что по меньшей мере одна иммунная клетка или популяция клеток по изобретению является единственным терапевтическим агентом или агентом с биологической активностью в пределах указанной фармацевтической композиции или лекарственного средства.
В некоторых вариантах осуществления указанная композиция содержит, состоит или состоит по существу из по меньшей мере одной изолированной и/или по существу очищенной популяции иммунных клеток по изобретению, как описано в настоящей заявке.
В некоторых вариантах осуществления указанная композиция содержит, состоит или состоит по существу по меньшей мере из одной популяции иммунных клеток по настоящему изобретению, как описано в настоящей заявке, сконструированных для экспрессии на клеточной поверхности описанного здесь CAR (например, CAR, содержащего: по меньшей мере один внеклеточный связывающий домен, при необходимости по меньшей мере один внеклеточный шарнирный домен, по меньшей мере один трансмембранный домен и по меньшей мере один внутриклеточный домен, где по меньшей мере один внутриклеточный домен содержит по меньшей мере один первичный внутриклеточный сигнальный домен и при необходимости по меньшей мере один костимуляторный внутриклеточный сигнальный домен), где по меньшей мере один трансмембранный домен представляет собой трансмембранный домен TNFR2 человека или его фрагмент или вариант, или любой трансмембранный домен или его фрагмент или вариант, или их комбинацию, и/или по меньшей мере один костимуляторный внутриклеточный сигнальный домен представляет собой костимуляторный внутриклеточный сигнальный домен TNFR2 человека или его фрагмент или вариант, или любой костимуляторный внутриклеточный сигнальный домен или его фрагмент или вариант, или их комбинацию, где по меньшей мере один из трансмембранного домена и костимуляторного внутриклеточного сигнального домена является трансмембранным доменом TNFR2 или его фрагментом или вариантом, или костимуляторным внутриклеточным сигнальным доменом TNFR2 или его фрагментом или вариантом.
В некоторых вариантах осуществления указанная композиция была заморожена и разморожена.
Другим объектом изобретения является фармацевтическая композиция, содержащая, состоящая или состоящая по существу по меньшей мере из одной иммунной клетки или популяции, как описано в настоящей заявке, и по меньшей мере одного фармацевтически приемлемого вспомогательного вещества.
Другой целью изобретения является лекарственное средство, содержащее, состоящее или состоящее по существу по меньшей мере из одной популяции иммунных клеток, как описано в настоящей заявке.
В некоторых вариантах осуществления фармацевтическая композиция или лекарственное средство содержит по меньшей мере одну изолированную и/или по существу очищенную популяцию иммунных клеток по изобретению, как описано в настоящей заявке.
В некоторых вариантах осуществления фармацевтическая композиция или лекарственное средство включает комбинацию популяций иммунных клеток, как описано в настоящей заявке (то есть по меньшей мере две отдельные популяции иммунных клеток по изобретению).
В некоторых вариантах осуществления композиция, фармацевтическая композиция или лекарственное средство по изобретению дополнительно содержит по меньшей мере вторую, отдельную популяцию иммунных клеток, где клетки указанной второй популяции иммунных клеток экспрессируют на поверхности клетки второй, отдельный CAR, специфичный для антигена, фрагмента антигена, варианта антигена или их смеси. В некоторых вариантах осуществления второй CAR специфичен для пищевого антигена из обычного рациона человека. В некоторых вариантах осуществления второй CAR является специфичным для аутоантигена, такого как, например, антиген, ассоциированный с рассеянным склерозом, антиген, ассоциированный с суставами, антиген, ассоциированный с глазами, антиген HSP человека, антиген, ассоциированный с кожей, или антиген, участвующий в отторжении трансплантата или РТПХ. В некоторых вариантах осуществления второй CAR является специфическим для ингаляционного аллергена, поглощаемого аллергена или контактного аллергена. В некоторых вариантах осуществления второй CAR является специфическим для антигена, выбранного из группы, состоящей из овальбумина, MOG, коллагена II типа, цитруллинированного виментина, цитруллинированного коллагена II типа, цитруллинированного фибриногена, и их фрагментов, вариантов и смесей.
В некоторых вариантах осуществления второй CAR специфичен для овальбумина или его фрагмента, варианта или их смеси. В некоторых вариантах осуществления второй CAR специфичен для MOG или его фрагмента, варианта или их смеси. В некоторых вариантах осуществления второй CAR специфичен для коллагена II типа или его фрагмента, варианта или их смеси. В некоторых вариантах осуществления второй CAR специфичен для цитруллинированного виментина, цитруллинированного коллагена II типа или цитруллинированного фибриногена, или их фрагментов, вариантов и смесей. В некоторых вариантах осуществления второй CAR специфичен для HLA-A2 или его фрагмента, варианта или смеси. В некоторых вариантах осуществления второй CAR специфичен для IL-23R или их фрагмента, варианта или смеси. В некоторых вариантах осуществления второй CAR специфичен для маркера поверхности В-клеток, такого как, например, CD19, CD20 или их фрагменты, варианты и смеси. В некоторых вариантах осуществления второй CAR является специфическим для ракового антигена, как описано в настоящей заявке, или его фрагмента, варианта или их смеси.
В некоторых вариантах осуществления второй CAR распознает инфицированные клетки. В некоторых вариантах осуществления второй CAR специфичен для вирусного антигена или его фрагмента, варианта или их смеси; бактериального антигена или его фрагмента, варианта или их смеси; или грибкового антигена, или его фрагмента, варианта или их смеси.
В некоторых вариантах осуществления клетки из указанной второй популяции иммунных клеток экспрессируют на клеточной поверхности CAR, где внеклеточный связывающий домен указанного CAR представляет собой белок или его фрагмент или вариант, такой как, например, аутоантиген или его фрагмент или вариант.
В некоторых вариантах осуществления клетки из указанной другой популяции иммунных клеток экспрессируют на клеточной поверхности CAR, специфичный для аутоантитела, такого как, например, аутоантитело, экспрессируемое на B-клетке.
Композиции и лекарственные средства, описанные в настоящей заявке, могут включать, например, буферы, такие как стерилизованная вода, физиологический раствор, нейтральный буферный раствор, фосфатный буферный раствор и т.п.; соли; антибиотики; изотонические агенты; углеводы, такие как глюкоза, манноза, сахароза, декстраны и маннитол; белки, такие как сывороточный альбумин человека; полипептиды; аминокислоты, такие как глицин и аргинин; антиоксиданты; хелатирующие агенты, такие как ЭДТА или глутатион; адъюванты (например, гидроксид алюминия); и консерванты. Композиции и лекарственные средства могут дополнительно содержать факторы, которые поддерживают фенотип и рост Treg (например, IL-2 и рапамицин или его производные), противовоспалительные цитокины (например, IL-10, TGF-β и IL-35), и другие клетки для клеточной терапии (например, CAR T-эффекторные клетки для лечения рака или клетки для регенеративной терапии). Для хранения и транспортировки клетки при необходимости могут быть криоконсервированы. Перед использованием клетки можно разморозить и разбавить в фармацевтически приемлемом носителе.
Композиции по настоящему изобретению в некоторых вариантах осуществления приготовлены для внутривенного введения.
В некоторых вариантах осуществления клетки, экспрессирующие CAR по настоящему изобретению, демонстрируют пониженную тоническую передачу сигналов по сравнению с клетками, экспрессирующими CAR без трансмембранного домена TNFR2 или его фрагмента или варианта и/или без внутриклеточного костимуляторного сигнального домена TNFR2 или его фрагмента или варианта.
Термин «тоническая передача сигналов», используемый в настоящей заявке, относится к антиген-независимому фону активации.
Способы измерения тонической передачи сигналов хорошо известны специалисту в данной области техники и включают измерение метаболической активности CAR-экспрессирующих клеток; измерение одного или нескольких индикаторов активации клеток при отсутствии стимуляции антигеном, распознаваемым рецептором; измерение одного или нескольких фенотипических изменений, связанных с созреванием клеток или старением клеток; определение прогрессии клеточного цикла при отсутствии антигенной стимуляции; и измерение размера клеток, экспрессирующих рецептор, по сравнению с размером немодифицированных клеток; но не ограничиваются этим.
В некоторых вариантах осуществления сконструированные с помощью CAR иммунные клетки, экспрессирующие трансмембранный домен TNFR2 или его фрагмент или вариант и/или внутриклеточный костимуляторный сигнальный домен TNFR2 или его фрагмент или вариант, имеют пониженную тоническую передачу сигналов по сравнению с иммунными клетками, созданными с помощью CAR, которые не экспрессируют трансмембранный домен TNFR2 или его фрагмент или вариант и/или внутриклеточный костимуляторный домен TNFR2 или его фрагмент или вариант при измерении в условиях ТЕСТА A.
ТЕСТ А:
Индикатор активации Т-клеток используют для измерения тонической передачи сигналов. В условиях ТЕСТА А уровень CD69-положительных клеток измеряют в популяции клеток до и после активации CAR по изобретению. Анализ активации проводят на 9 день культивирования иммунных клеток. Вкратце, 0,05×106 иммунных клеток высевают 96-луночный круглодонный планшет по отдельности или в присутствии гранул, покрытых анти-CD28/анти-CD3 (при соотношении иммунных клеток к гранулам 1:1), или в присутствии свежеразмороженных аутологичных В-клеток (в отношении иммунных клеток к В-клеткам 1:1) в конечном объеме 200 мкл. Через 24 часа при 37°C, 5% CO2 клетки окрашивают на CD69 и маркер, относящийся к конкретной популяции иммунных клеток (например, CD19 для В-клеток, или CD4 или CD8 для Т-клеток), а затем анализируют с помощью проточной цитометрии. Мониторинг спонтанной экспрессии CD69 (то есть без какой-либо антигенной симуляции) клетками, экспрессирующими CAR, описанный в настоящей заявке (например, содержащий трансмембранный домен TNFR2 или его фрагмент или вариант, и/или внутриклеточный костимуляторный сигнальный домен TNFR2, или его фрагмент или вариант), по сравнению с нетрансдуцированными клетками, позволяет определять интенсивность тонической передачи сигналов. Клетки, трансдуцированные CAR, не содержащим трансмембранного домена TNFR2 или внутриклеточного костимуляторного сигнального домена TNFR2, используют в качестве контроля.
В некоторых вариантах осуществления конструкции CAR по настоящему изобретению можно использовать для получения сконструированных иммунных клеток с пониженной тонической передачей сигналов. В некоторых вариантах осуществления настоящее изобретение обеспечивает способ получения сконструированной иммунной клетки (т.е. клетки, экспрессирующей CAR) с пониженной тонической передачей сигналов. Доступные в настоящее время конструкции CAR, особенно те, которые используются в области эффекторов CAR, часто связаны с высокой тонической передачей сигналов, ограничивающей эффективность сконструированных CAR клеток. Действительно, такая тоническая передача сигналов связана с конститутивной активацией сконструированных с помощью CAR клеток, что приводит к их преждевременному истощению или даже гибели. Конструкции CAR по настоящему изобретению (содержащие трансмембранный домен TNFR2 или его фрагмент или вариант, и/или костимуляторный внутриклеточный сигнальный домен TNFR2 или его фрагмент или вариант) обеспечивают пониженную тоническую передачу сигналов и конститутивную активацию клеток.
Терапевтическое использование
Изобретение относится к способу лечения одного или нескольких заболеваний, расстройств, симптомов или состояний у субъекта, нуждающегося в этом, где указанный способ включает введение субъекту иммунных клеток или композиции, сконструированных с помощью CAR, как описано в настоящей заявке. Настоящее изобретение также обеспечивает по меньшей мере одну популяцию иммунных клеток, как описано здесь (например, в композиции, фармацевтической композиции или лекарственном средстве, как описано в настоящей заявке) для использования в качестве лекарственного средства. Настоящее изобретение также обеспечивает по меньшей мере одну популяцию иммунных клеток, как описано в настоящей заявке (например, в композиции, фармацевтической композиции или лекарственном средстве, как описано здесь) для использования при приготовлении лекарственного средства. Заболевания, которые можно лечить с помощью сконструированных иммунных клеток по настоящему изобретению, включают воспалительные заболевания, аутоиммунные заболевания, аллергические заболевания, состояния после трансплантации органов, рак и инфекционные заболевания, но не ограничиваются ими.
В некоторых вариантах осуществления способ лечения заболевания или расстройства у субъекта, который в этом нуждается, включает введение субъекту по меньшей мере одной популяции иммунных клеток, как описано в настоящей заявке, например, сконструированной популяции регуляторных иммунных клеток (такой как популяция Treg-клеток), где указанное заболевание или расстройство представляет собой воспалительное заболевание, аутоиммунное заболевание, аллергическое заболевание или состояние после трансплантации органов. В некоторых вариантах осуществления заболевание или расстройство представляет собой отторжение трансплантата или болезнь «трансплантат против хозяина».
В некоторых вариантах осуществления способ лечения заболевания или расстройства у субъекта, нуждающегося в этом, включает введение субъекту по меньшей мере одной популяции иммунных клеток, как описано в настоящей заявке, например, сконструированной популяции эффекторных иммунных клеток (такой, как популяция Treg-клеток), где указанное заболевание или расстройство представляет собой рак или инфекционное заболевание.
В некоторых вариантах осуществления способ лечения заболевания или расстройства у субъекта, нуждающегося в этом, включает введение субъекту по меньшей мере одной популяции иммунных клеток, как описано в настоящей заявке, например, сконструированной популяции эффекторных иммунных клеток (такой как популяция Treg-клеток), при этом указанный субъект нуждается в генной терапии (например, генной терапии на основе AAV) для указанного заболевания или расстройства.
В некоторых вариантах осуществления способ представляет собой способ клеточной терапии.
В некоторых вариантах осуществления клеточная терапия является аутологичной.
В некоторых вариантах осуществления клеточная терапия является гетерологичной.
В некоторых вариантах осуществления клеточная терапия является аллогенной.
В некоторых вариантах осуществления способ представляет собой способ генной терапии и включает введение нуклеиновой кислоты или вектора, как описано в настоящей заявке.
1. Воспалительные заболевания.
В некоторых вариантах осуществления сконструированные с помощью CAR иммунные клетки по изобретению можно использовать для лечения одного или нескольких воспалительных заболеваний, расстройств, симптомов или состояний у субъекта, нуждающегося в этом. В определенных вариантах осуществления изобретения иммунные клетки, созданные с помощью CAR, по настоящему изобретению можно использовать для стимулирования иммунной толерантности в этом контексте. Настоящее изобретение обеспечивает способ лечения воспалительного заболевания или расстройства у субъекта, нуждающегося в этом, при этом указанный способ включает введение терапевтически эффективного количества по меньшей мере одной популяции иммунных клеток, как описано в настоящей заявке. Настоящее изобретение также относится по меньшей мере к одной популяции иммунных клеток, как описано в настоящей заявке (например, в композиции, фармацевтической композиции или лекарственном средстве, как описано в настоящей заявке) для использования при лечении воспалительного заболевания или расстройства. Настоящее изобретение также обеспечивает по меньшей мере одну популяцию иммунных клеток, как описано в настоящей заявке (например, в композиции, фармацевтической композиции или лекарственном средстве, как описано в настоящей заявке), для использования при приготовлении лекарственного средства для лечения воспалительного заболевания или расстройства.
Термины «воспалительное расстройство» и «воспалительное заболевание» используются взаимозаменяемо и в контексте настоящего описания относятся к любой аномалии, связанной с воспалением.
В некоторых вариантах осуществления воспалительное состояние включает воспалительные заболевания и воспаление, связанные с инфекцией или с раком.
В некоторых вариантах осуществления воспалительное состояние включает воспалительные заболевания и воспаление, связанные с аутоиммунными заболеваниями.
Примеры воспалительных заболеваний, расстройств или состояний включают артрит, ревматоидный артрит, анкилозирующий спондилит, остеоартрит, псориатический артрит, ювенильный идиопатический артрит, ювенильный ревматоидный артрит, уратный артрит, подагру, хронический полиартрит, плечелопаточный периартрит, шейный артрит, пояснично-крестцовый артрит, энтеропатический артрит и анкилозирующий спондилит, астму, дерматит, псориаз, склеродермию, полимиозит, дерматомиозит, ювенильный дерматомиозит, первичный билиарный цирроз, фиброз, муковисцидоз, легочный фиброз, цирроз, эндомиокардиальный фиброз, медиастинальный фиброз, миелофиброз, ретроперитонеальный фиброз, нефрогенный фиброз, келоиды, склеродермию, артрофиброз, позднее и хроническое отторжение солидных органов после трансплантации, рассеянный склероз, системную красную волчанку, волчаночный нефрит, пузырчатку, вульгарную пузырчатку, герпетиформную пузырчатку, вегетирующую пузырчатку, IgA-зависимую пузырчатку, эритрематозную пузырчатку, буллезный пемфигоид, гестационный пемфигоид, дерматоз слизистых оболочек, узелковый пемфигоид, линеарный IgA-зависимый буллезный дерматоз, буллезный плоский лишай, приобретенный буллезный эпидермолиз, аутоиммунный диабет, диабетическую ретинопатию, диабетическую нефропатию, диабетическую васкулопатию, воспаление глаз, увеит, ринит, синдром ишемии-реперфузии, рестеноз после ангиопластики, хроническую обструктивную болезнь легких (ХОБЛ), гломерулонефрит, болезнь Грейвса, желудочно-кишечную аллергию, конъюнктивит, атеросклероз, коронарную болезнь сердца, ишемическую болезнь сердца, болезнь мелких артерий, острый диссеминированный энцефаломиелит, идиопатическую тромбоцитопеническую пурпуру, рассеянный склероз, системный склероз, антифосфолипидный синдром, синдром Шегрена, аутоиммунную гемолитическую анемию, колит, болезнь Крона, язвенный колит, воспалительное заболевание кишечника (ВЗК), эмболию, легочную эмболию, артериальную эмболию, венозную эмболию, аллергическое воспаление, сердечно-сосудистое заболевание, заболевания, связанные с трансплантатом, болезнь «трансплантат против трансплантата» (РТПХ), расстройства, связанные с отторжением трансплантата, хроническим отторжением, и тканевым или клеточным аллотрансплантатом или ксенотрансплантатом, аутоиммунные заболевания, дегенерацию после травмы, инсульт, отторжение трансплантата, аллергические состояния и гиперчувствительность, например, аллергический ринит, аллергическую экзему и тому подобное, кожные заболевания, кожные воспалительные расстройства, и любую их комбинацию, но не ограничиваются ими.
Примеры кожных заболеваний включают угревую сыпь; актинический кератоз; атопический дерматит; контактный дерматит; пролежни; экзему; эритродермию; гемангиому, такую как, например, детская гемангиома; гипертрофическое рубцевание; красный плоский лишай; лихеноидные расстройства; лимфангиогенез; псориаз; пиогенные гранулемы; контагиозный моллюск; нейрофиброматоз; розацеа; рецессивный дистрофический буллезный эпидермолиз; рубцы (келоиды); склеродермию; себорейный кератоз; рак кожи, такой как ангиосаркома, базальноклеточная карцинома, гемангиоэндотелиома, саркома Капоши, злокачественная меланома, меланома, плоскоклеточный рак; кожные язвы; повреждения кожи после пересадки кожи, такой как аутотрансплантация и аллотрансплантация; синдромы Стивена-Джонсона и токсический эпидермальный некролиз; синдром Стерджа-Вебера; туберозный склероз; венозные язвы; простые бородавки; папилломы, такие как, например, вирусные папилломы; раны; и тому подобное, но не ограничиваются ими.
Примеры кожных воспалительных заболеваний включают псориаз, каплевидный псориаз, инверсный псориаз, пустулезный псориаз, эритродермальный псориаз, острый фебрильный нейтрофильный дерматоз, экзему, астеатозную экзему, дисгидротическую экзему, везикулярную ладонно-подошвенную экзему, вульгарную угревую сыпь, атопический дерматит, контактный дерматит, аллергический контактный дерматит, дерматомиозит, эксфолиативный дерматит, экзему рук, помфоликс, розацеа, розацеа, вызванную саркоидозом, розацеа, вызванную склеродермией, розацеа, вызванную синдромом Свита, розацеа, вызванную системной красной волчанкой, розацеа, вызванную крапивницей, розацеа, вызванную болью, связанной с опоясывающим лишаем, болезнь Свита, нейтрофильный гидраденит, стерильный пустулез, лекарственные высыпания, себорейный дерматит, розовый питириаз, кожную болезнь Кикучи, зудящие уртикарные папулы и бляшки беременных, синдром Стивенса-Джонсона и токсический эпидермальный некролиз, реакции на татуировку, синдром Уэллса (эозинофильный целлюлит), реактивный артрит (синдром Рейтера), кишечно-ассоциированный дерматозно-артритный синдром, ревматоидный нейтрофильный дерматоз, нейтрофильный эккринный гидраденит, нейтрофильный дерматоз тыльной стороны кисти, плазмоцеллюлярный баланит, баланопостит, болезнь Бехчета, кольцевидную центробежную эритему, стойкую дисхромическую эритему, полиморфную эритему, кольцевидную гранулёму, дерматит кистей рук, блестящий лишай, красный плоский лишай, склероатрофический лишай, простой хронический лишай, шиповидный лишай, нуммулярный дерматит, гангренозную пиодермию, саркоидоз, субкорнеальный пустулезный дерматоз, крапивницу и преходящий акантолитический дерматоз, но не ограничиваются ими.
2. Аутоиммунные заболевания.
В некоторых вариантах осуществления сконструированные с помощью CAR иммунные клетки по настоящему изобретению можно использовать для лечения одного или нескольких аутоиммунных заболеваний, расстройств, симптомов или состояний у субъекта, нуждающегося в этом. В некоторых вариантах осуществления CAR-модифицированные иммунные клетки по настоящему изобретению можно использовать для стимуляции иммунной толерантности в этом контексте. Таким образом, настоящее изобретение обеспечивает способ лечения аутоиммунного заболевания у субъекта, который в этом нуждается, при этом указанный способ включает введение терапевтически эффективного количества по меньшей мере одной популяции иммунных клеток, как описано в настоящей заявке. Настоящее изобретение также обеспечивает по меньшей мере одну популяцию иммунных клеток, как описано в настоящей заявке (например, в композиции, фармацевтической композиции или лекарственном средстве, как описано в настоящей заявке), для использования при лечении аутоиммунного заболевания. Настоящее изобретение также обеспечивает по меньшей мере одну популяцию иммунных клеток, как описано в настоящей заявке (например, в композиции, фармацевтической композиции или медикаменте, как описано в настоящей заявке), для использования при производстве лекарственного средства для лечения аутоиммунного заболевания.
Примеры аутоиммунных заболеваний включают волчанку (например, красную волчанку, волчаночный нефрит и т.д.), тиреоидит Хашимото, первичную микседему, болезнь Грейвса, пернициозную анемию, аутоиммунный атрофический гастрит, болезнь Аддисона, диабет (например, инсулинозависимый сахарный диабет, сахарный диабет I типа, сахарный диабет II типа и т. д.), синдром Гудпасчера, миастению гравис, пузырчатку, болезнь Крона, симпатическую офтальмию, аутоиммунный увеит, рассеянный склероз, аутоиммунную гемолитическую анемию, идиопатическую тромбоцитопению, первичный билиарный цирроз, хронический гепатит, язвенный колит, синдром Шегрена, ревматические заболевания (например, ревматоидный артрит), полимиозит, склеродермию, псориаз, смешанное заболевание соединительной ткани и тому подобное, но не ограничиваются этим.
3. Аллергические заболевания.
В некоторых вариантах осуществления сконструированные с помощью CAR иммунные клетки по настоящему изобретению можно использовать для лечения одного или нескольких аллергических заболеваний, расстройств, симптомов или состояний у субъекта, нуждающегося в этом. В некоторых вариантах осуществления CAR-модифицированные иммунные клетки по настоящему изобретению можно использовать для стимулирования иммунной толерантности в этом контексте. Таким образом, настоящее изобретение обеспечивает способ лечения аллергического заболевания, расстройства, симптома или состояния у субъекта, нуждающегося в этом, где указанный способ включает введение терапевтически эффективного количества по меньшей мере одной популяции иммунных клеток, как описано в настоящей заявке. Настоящее изобретение также обеспечивает по меньшей мере одну популяцию иммунных клеток, как описано в настоящей заявке (например, в композиции, фармацевтической композиции или лекарственном средстве, как описано в настоящей заявке), для использования при лечении аллергического заболевания, расстройств, симптомов или состояний. Настоящее изобретение также обеспечивает по меньшей мере одну популяцию иммунных клеток, как описано в настоящей заявке (например, в композиции, фармацевтической композиции или лекарственном средстве, как описано в настоящей заявке), для использования в производстве лекарственного средства для лечения аллергического заболевания, расстройств, симптомов или состояний.
Примеры аллергических заболеваний включают аллергические заболевания, вызванные ингаляционным аллергеном, поглощаемым аллергеном или контактным аллергеном, но не ограничиваются ими. Другие примеры аллергических заболеваний включают аллергическую астму, связанные с гиперчувствительностью заболевания легких, пищевую аллергию, атопический дерматит, аллергический ринит, аллергический риноконъюнктивит, хроническую крапивницу, расстройства с гиперчувствительностью замедленного типа и системную анафилаксию, но не ограничиваются ими.
4. Трансплантация
В некоторых вариантах осуществления сконструированные с помощью CAR иммунные клетки по изобретению можно использовать для лечения одного или нескольких заболеваний, расстройств, симптомов или состояний, связанных с трансплантацией органа или ткани (например, отторжения/дисфункции органа или ткани, РТПХ и/или связанных с ней состояний). Отторжение трансплантата включает разрушение трансплантированной ткани донора иммунными клетками реципиента посредством иммунного ответа. В РТПХ также участвует иммунный ответ; однако в этом случае ткани реципиента разрушаются иммунными клетками донора, передаваемыми реципиенту через трансплантат. Соответственно, CAR-опосредованное перенаправление и активация иммунных клеток обеспечивает способ подавления отторжения несовместимых клеток и/или тканей иммунными эффекторными клетками у реципиентов трансплантата или ингибирования патогенного действия трансплантированных иммунокомпетентных клеток в случае РТПХ. В некоторых вариантах осуществления несовместимые клетки и/или ткани содержат несовместимые по HLA-A2 клетки и/или ткани. CAR-модифицированные иммунные клетки по изобретению могут быть использованы для стимуляции иммунной толерантности, функциональной толерантности и/или иммунной аккомодации у субъекта, в частности, после трансплантации органа или ткани. Таким образом, настоящее изобретение обеспечивает способ стимуляции иммунной толерантности, функциональной толерантности и/или иммунной аккомодации у субъекта, включающий введение субъекту иммунной клетки, сконструированной с помощью CAR, или фармацевтической композиции, как описано в настоящей заявке. В некоторых вариантах осуществления способ может быть направлен на стимуляцию иммунной толерантности, функциональной толерантности и/или иммунной аккомодации к трансплантированному органу или ткани у субъекта. Настоящее изобретение также обеспечивает по меньшей мере одну популяцию иммунных клеток, как описано в настоящей заявке (например, в композиции, фармацевтической композиции или лекарственном средстве, как описано в настоящей заявке), для использования в стимуляции иммунной толерантности, функциональной толерантности и/или иммунной аккомодации к трансплантированному органу или ткани у субъекта. Настоящее изобретение также обеспечивает по меньшей мере одну популяцию иммунных клеток, как описано в настоящей заявке (например, в композиции, фармацевтической композиции или лекарственном средстве, как описано в настоящей заявке) для использования при производстве лекарственного средства для стимуляции иммунной толерантности, функциональной толерантности и/или иммунной аккомодации к трансплантированному органу или ткани у субъекта.
В некоторых вариантах осуществления изобретения иммунную клетку, сконструированную с помощью CAR (например, Treg-клетку, сконструированную с помощью CAR) по настоящему изобретению, вводят одновременно, до или после трансплантации органа или ткани.
В некоторых вариантах осуществления изобретения иммунная клетка, сконструированная с помощью CAR (например, Treg-клетка, сконструированная с помощью CAR) по настоящему изобретению, может быть использована для предотвращения или лечения отторжения трансплантированного органа или ткани. Примеры отторжения трансплантированного органа или ткани включают сверхострое отторжение трансплантированного органа или ткани и антитело-опосредованное отторжение трансплантированного органа или ткани, но не ограничиваются этим.
В некоторых вариантах осуществления способ по настоящему изобретению включает введение сконструированных с помощью CAR иммунных клеток (например, Treg-клеток, сконструированных с использованием CAR) по настоящему изобретению субъекту, подвергающемуся воздействию трансплантированного органа или ткани.
В некоторых вариантах осуществления трансплантированный орган или ткань может включать трансплантат костного мозга, трансплантат органа, переливание крови или любую другую чужеродную ткань или клетку, которые целенаправленно вводят субъекту.
В некоторых вариантах осуществления иммунные клетки, сконструированные с помощью CAR (например, Treg-клетки, сконструированные с помощью CAR) по настоящему изобретению, можно использовать в качестве терапии для ингибирования отторжения трансплантата после трансплантации, включая отторжение аллотрансплантата или отторжение ксенотрансплантата, но не ограничиваясь этим.
Другим объектом изобретения является способ предотвращения или лечения отторжения трансплантата органа или ткани у субъекта, включающий введение субъекту иммунных клеток, сконструированных с помощью CAR (например, Treg-клеток, сконструированных с помощью CAR) по изобретению, или фармацевтической композиции, содержащей указанные иммунные клетки.
Другим объектом изобретения является способ увеличения периода времени выживания трансплантата у субъекта, включающий введение субъекту иммунных клеток, сконструированных с помощью CAR (например, Treg-клеток, сконструированных с помощью CAR) по настоящему изобретению, или фармацевтической композиции, содержащей эти клетки.
В некоторых вариантах осуществления способ обеспечивает период времени выживания трансплантата, составляющий 1 неделю, 2 недели, 3 недели, 1 месяц, 2 месяца, 3 месяца, 4 месяца, 5 месяцев, 6 месяцев, 7 месяцев, 8 месяцев, 9 месяцев, 10 месяцев, 11 месяцев, 1 год, 2 года, 3 года, 4 года, 5 лет, 6 лет, 7 лет, 8 лет, 9 лет, 10 лет, 20 лет, 30 лет, 40 лет, 50 лет, 60 лет, 70 лет, 80 лет, 90 лет, 100 лет или в течение жизни субъекта.
В некоторых вариантах осуществления введение иммунной клетки или композиции по изобретению позволяет уменьшить количество агента для иммуносупрессивной терапии, получаемого субъектом. В некоторых вариантах осуществления субъекту не требуется терапии иммунодепрессантом и/или он не проходит лечение каким-либо иммунодепрессантом.
В некоторых вариантах осуществления трансплантат представляет собой аллотрансплантат. В некоторых вариантах осуществления трансплантат может подвергаться воздействию иммунных клеток, сконструированных с помощью CAR (например, Treg-клеток, сконструированных с помощью CAR) по настоящему изобретению, одновременно, до или после трансплантации трансплантата реципиенту. В некоторых вариантах осуществления трансплантат органа или ткани может представлять собой сердце, сердечный клапан, легкое, почку, печень, поджелудочную железу, кишечник, кожу, кровеносные сосуды, костный мозг, стволовые клетки, кости или островковые клетки. Однако изобретение не ограничивается конкретным типом трансплантации.
В некоторых вариантах осуществления донорский трансплантат может быть «предварительно кондиционирован» или «предварительно обработан» путем обработки трансплантата органа или ткани перед трансплантацией реципиенту с применением сконструированных с помощью CAR иммунных клеток по изобретению, чтобы снизить иммуногенность трансплантата против реципиента, тем самым уменьшая или предотвращая отторжение трансплантата.
В некоторых вариантах осуществления хозяин или реципиент трансплантата является HLA-A2-отрицательным. В некоторых вариантах осуществления хозяин или реципиент трансплантата является HLA-A2-отрицательным, и положительным по подтипу HLA-A, выбранному из группы, состоящей из HLA-A25, HLA-A29 и HLA-A30.
В некоторых вариантах осуществления трансплантат является HLA-A2-положительным.
В некоторых вариантах осуществления, иммунные клетки, сконструированные с помощью CAR (например, Treg-клетки, сконструированные с помощью CAR) по настоящему изобретению, можно использовать для предотвращения или лечения болезни «трансплантат против хозяина» (РТПХ). В некоторых вариантах осуществления РТПХ может возникать после трансплантации гемопоэтических стволовых клеток. В некоторых вариантах осуществления способ включает введение сконструированных с помощью CAR иммунных клеток (например, Treg-клеток, сконструированных с помощью CAR) по настоящему изобретению субъекту, подвергающемуся воздействию трансплантированного органа или ткани. В некоторых вариантах осуществления трансплантированный орган или ткань может включать трансплантат костного мозга, трансплантат органа, переливание крови или любую другую чужеродную ткань или клетку, которые целенаправленно вводят субъекту. Например, РТПХ может возникнуть после трансплантации сердца, сердечного клапана, легких, почек, печени, поджелудочной железы, кишечника, кожи, кровеносных сосудов, костного мозга, стволовых клеток, костей или островковых клеток. Однако изобретение не ограничивается конкретным типом трансплантации.
Другим объектом изобретения является способ предотвращения или лечения болезни трансплантат против хозяина (РТПХ) у субъекта, включающий введение субъекту иммунных клеток, сконструированных с помощью CAR (например, Treg-клеток, сконструированных с помощью CAR), или фармацевтического препарата, как описано в настоящей заявке.
В некоторых вариантах осуществления изобретения предлагается способ обеспечения контакта донорского трансплантата, например, биосовместимой решетчатой структуры или донорской ткани, органа или клетки, с иммунными клетками, сконструированными с помощью CAR (например, с Treg-клетками, сконструированными с помощью CAR) по настоящему изобретению, одновременно, до или после трансплантации трансплантата реципиенту.
В некоторых вариантах осуществления иммунные клетки, сконструированные с помощью CAR (например, Treg-клетки, сконструированные с помощью CAR) по настоящему изобретению, могут быть использованы для улучшения, подавления или снижения неблагоприятного ответа донорского трансплантата против реципиента, тем самым предотвращая или излечивая РТПХ.
Другим объектом настоящего изобретения является способ предотвращения или задержки начала РТПХ у субъекта, включающий введение субъекту иммунных клеток, сконструированных с помощью CAR (например, Treg-клеток, сконструированных с помощью CAR), или фармацевтической композиции, как описано в настоящей заявке.
В некоторых вариантах осуществления изобретения начало РТПХ задерживается на 1 неделю, 2 недели, 3 недели, 1 месяц, 2 месяца, 3 месяца, 4 месяца, 5 месяцев, 6 месяцев, 7 месяцев, 8 месяцев, 9 месяцев, 10 месяцев, 11 месяцев, 1 год, 2 года, 3 года, 4 года, 5 лет, 6 лет, 7 лет, 8 лет, 9 лет, 10 лет, 20 лет, 30 лет, 40 лет, 50 лет, 60 лет, 70 лет, 80 лет, 90 лет, 100 лет или на время жизни субъекта.
В некоторых вариантах осуществления введение иммунной клетки или композиции по изобретению позволяет уменьшить количество агента для иммуносупрессивной терапии, получаемого субъектом. В некоторых вариантах осуществления субъекту не требуется иммуносупрессивной терапии и/или он не проходит лечение каким-либо иммуносупрессивным агентом.
В некоторых вариантах осуществления РТПХ может быть острой РТПХ или хронической РТПХ.
В некоторых вариантах осуществления донорский трансплантат может быть «предварительно кондиционирован» или «предварительно обработан» путем обработки трансплантата перед трансплантацией реципиенту иммунными клетками, сконструированными с помощью CAR (например, Treg-клетками, сконструированными с помощью CAR) по настоящему изобретению, чтобы уменьшить иммуногенность трансплантата против реципиента, тем самым снижая или предотвращая РТПХ. В некоторых вариантах осуществления трансплантат может контактировать с клетками или тканью реципиента до трансплантации, чтобы активировать Т-клетки, которые могут быть ассоциированы с трансплантатом. После обработки трансплантата клетками или тканью реципиента клетки или ткань могут быть удалены из трансплантата. Затем обработанный трансплантат может быть приведен в контакт с иммунными клетками, сконструированными с помощью CAR (например, Treg-клетками, сконструированными с помощью CAR) по настоящему изобретению, для снижения, ингибирования или устранения активности иммунных эффекторных клеток, которые были активированы обработкой клетками или тканями от реципиента. После этого лечения иммунные клетки, сконструированные с помощью CAR, могут быть удалены из трансплантата до трансплантации реципиенту. Однако некоторые иммунные клетки, сконструированные с помощью CAR, могут присоединяться к трансплантату и, следовательно, могут быть введены реципиенту с трансплантатом. В этой ситуации иммунные клетки, сконструированные с помощью CAR, введенные реципиенту, могут подавлять иммунный ответ против реципиента, вызванный клеткой, ассоциированной с трансплантатом.
В некоторых вариантах осуществления хозяин или реципиент трансплантата является HLA-A2-отрицательным. В некоторых вариантах осуществления хозяин или реципиент трансплантата является HLA-A2-отрицательным, и положительным по подтипу HLA-A, выбранному из группы, состоящей из HLA-A25, HLA-A29 и HLA-A30.
В некоторых вариантах осуществления трансплантат является HLA-A2-положительным.
Иммунные клетки могут быть получены из любого источника. Например, в некоторых вариантах осуществления иммунные клетки могут быть получены от донора ткани, реципиента трансплантата или другого неродственного источника (например, другого человека или вида в целом) для создания CAR-модифицированных иммунных клеток по настоящему изобретению. Соответственно, CAR-модифицированные иммунные клетки по настоящему изобретению могут быть аутологичными, аллогенными или ксеногенными для реципиента трансплантата, или из другого неродственного источника. В некоторых вариантах осуществления CAR-модифицированные иммунные клетки представляют собой CAR-Treg клетки, которые могут быть аутологичными, аллогенными или ксеногенными для реципиента трансплантата. В некоторых вариантах осуществления CAR-Treg клетки могут быть аутологичными для реципиента трансплантата.
5. Виды рака
В некоторых вариантах осуществления изобретения сконструированные с помощью CAR иммунные клетки по настоящему изобретению могут быть использованы для лечения одного или нескольких видов рака у субъекта, нуждающегося в этом. В некоторых вариантах осуществления изобретения иммунные клетки по изобретению, сконструированные с помощью CAR, можно использовать для стимуляции специфического иммунного ответа против раковых клеток. Таким образом, настоящее изобретение обеспечивает способ лечения рака у субъекта, нуждающегося в этом, включающий введение терапевтически эффективного количества по меньшей мере одной популяции иммунных клеток, как описано в настоящей заявке. Настоящее изобретение также обеспечивает по меньшей мере одну популяцию иммунных клеток, как описано в настоящей заявке (например, в композиции, фармацевтической композиции или лекарственном средстве, как описано в настоящей заявке), для использования при лечении рака. Настоящее изобретение также обеспечивает по меньшей мере одну популяцию иммунных клеток, как описано в настоящей заявке (например, в композиции, фармацевтической композиции или лекарственном средстве, как описано в настоящей заявке) для использования в производстве лекарственного средства для лечения рака.
Используемый в настоящей заявке термин «рак» может означать любой рак, связанный с поверхностным антигеном или маркером рака.
Примеры рака включают острый лимфобластный лейкоз (ОЛЛ), острый миелоидный лейкоз (ОМЛ), аденокистозную карциному, адренокортикальную карциному, СПИД-ассоциированный рак, анальный рак, рак аппендикса, астроцитомы, атипичную тератоидную/рабдоидную опухоль, В-клеточный лейкоз, лимфому или другие В-клеточные неоплазии, базальноклеточную карциному, рак желчных протоков, рак мочевого пузыря, рак костей, остеосаркому и злокачественную фиброзную гистиоцитому, глиому ствола головного мозга, опухоли головного мозга, рак молочной железы, бронхиальные опухоли, лимфому Беркитта, карциноидные опухоли, злокачественные опухоли центральной нервной системы, рак шейки матки, хордому, хронический лимфолейкоз (ХЛЛ), хронический миелогенный лейкоз (ХМЛ), хронические миелопролиферативные расстройства, рак толстой кишки, колоректальный рак, краниофарингиому, кожную Т-клеточную лимфому, эмбриональные опухоли, рак эндометрия, эпендимобластому, эпендимому, рак пищевода, эстезионейробластому, опухоли семейства саркомы Юинга, экстракраниальную герминогенную опухоль, экстрагонадальную герминогенную опухоль, рак внепеченочного желчного протока, рак глаза, фиброзную гистиоцитому кости и остеосаркому, рак желчного пузыря, рак желудка, карциноидную опухоль желудочно-кишечного тракта, стромальные опухоли желудочно-кишечного тракта (GIST), саркому мягких тканей, герминогенную опухоль, гестационную трофобластическую опухоль, глиому, волосатоклеточный лейкоз, рак головы и шеи, рак сердца, печеночно-клеточный рак, гистиоцитоз, лимфому Ходжкина, гипофарингеальный рак, интраокулярную меланому, островковые опухоли (эндокринной части поджелудочной железы), саркому Капоши, рак почки, гистиоцитоз клеток Лангерганса, рак гортани, лейкоз, рак губы и полости рта, рак печени (первичный), лобулярную карциному in situ (LCIS), рак легкого, лимфому, макроглобулинемию, рак молочной железы у мужчин, злокачественную фиброзную гистиоцитому кости, медуллобластому, медуллоэпителиому, меланому, карциному клеток Меркеля, мезотелиому, метастатический плоскоклеточный рак шеи со скрытой первичной срединной карциномой, имеющей NUT-перегруппировку, рак ротовой полости, синдромы множественной эндокринной неоплазии, множественную миелому/плазмоклеточную опухоль, грибовидный микоз, миелодиспластические синдромы, миелодиспластические/ миелопролиферативные новообразования, миелогенный лейкоз, хронический миелоидный лейкоз (ХМЛ), острый миелоидный лейкоз (ОМЛ), множественную миелому, миелопролиферативные расстройства, рак полости носа и параназального синуса, рак носоглотки, нейробластому, неходжкинскую лимфому, немелкоклеточный рак легкого, рак полости рта, рак ротоглотки, остеосаркому, рак яичника, рак поджелудочной железы, папилломатоз, параганглиому, рак околоносовых пазух и полости носа, рак паращитовидной железы, рак полового члена, рак глотки, феохромоцитому, паренхиматозные опухоли шишковидной железы промежуточной дифференцировки, пинеобластому и супратенториальные примитивные нейроэктодермальные опухоли, опухоль гипофиза, опухоль плазматических клеток/множественную миелому, плевролёгочную бластому и рак молочной железы, первичную лимфому центральной нервной системы (ЦНС), рак простаты, рак прямой кишки, почечно-клеточный рак, рак почечной лоханки и мочеточника, переходно-клеточный рак, ретинобластому, рабдомиосаркому, рак слюнной железы, саркому, синдром Сезари, мелкоклеточный рак легкого, рак тонкой кишки, саркому мягких тканей, плоскоклеточный рак, плоскоклеточный рак шеи, рак желудка, супратенториальные примитивные нейроэктодермальные опухоли, Т-клеточную лимфому, рак кожи, рак яичка, рак горла, тимому и карциному тимуса, рак щитовидной железы, переходно-клеточный рак почечной лоханки и уретры, трофобластическую опухоль, рак уретры и почечной лоханки, рак уретры, рак матки, саркому матки, рак влагалища, рак вульвы, макроглобулинемию Вальденстрема и опухоль Вильмса, но не ограничиваются этим.
В некоторых аспектах рак представляет собой В-клеточную неоплазию. Примеры В-клеточных неоплазий включают неходжкинские лимфомы (НХЛ), диффузную В-клеточную крупноклеточную лимфому (DLBCL), мелкоклеточную лимфоцитарную лимфому (SLL/CLL), лимфому из мантийных клеток (MCL), фолликулярную лимфому (FL), лимфому маргинальной зоны (MZL), внеузловую (например, MALT) лимфому, узловую (например, моноцитоидную B-клеточную) лимфому, лимфому селезенки, диффузную крупноклеточную лимфому, B-клеточный хронический лимфоцитарный лейкоз/лимфому, лимфому Беркитта и лимфобластную лимфому, но не ограничиваются ими.
6. Инфекционные болезни
В некоторых вариантах осуществления изобретения иммунные клетки, сконструированные с помощью CAR по настоящему изобретению, можно использовать для лечения одного или нескольких инфекционных заболеваний, расстройств, симптомов или состояний у субъекта, нуждающегося в этом. В некоторых вариантах осуществления CAR-модифицированные иммунные клетки по настоящему изобретению можно использовать для стимуляции иммунной толерантности в этом контексте. В некоторых вариантах осуществления настоящее изобретение обеспечивает способ лечения инфекционного заболевания у субъекта, нуждающегося в этом, включающий введение терапевтически эффективного количества по меньшей мере одной популяции иммунных клеток, как описано в настоящей заявке. Настоящее изобретение также обеспечивает по меньшей мере одну популяцию иммунных клеток, как описано в настоящей заявке (например, в композиции, фармацевтической композиции или лекарственном средстве, как описано в настоящей заявке), для использования при лечении инфекционного заболевания. Настоящее изобретение также обеспечивает по меньшей мере одну популяцию иммунных клеток, как описано в настоящей заявке (например, в композиции, фармацевтической композиции или лекарственном средстве, как описано здесь), для использования при производстве лекарственного средства для лечения инфекционного заболевания.
В некоторых вариантах осуществления инфекционное заболевание представляет собой вирусное инфекционное заболевание. Используемый здесь термин «вирусное инфекционное заболевание» может означать инфекцию, обусловленную любым вирусом, который вызывает заболевание или патологическое состояние у хозяина.
Примеры вирусных инфекционных заболеваний включают вирусную инфекцию, вызванную вирусом Эпштейна-Барр (EBV); вирусную инфекцию, вызванную вирусом гепатита А, вирусом гепатита В или вирусом гепатита С; вирусную инфекцию, вызванную вирусом простого герпеса типа 1, вирусом простого герпеса типа 2 или вирусом простого герпеса типа 8; вирусную инфекцию, вызванную цитомегаловирусом (ЦМВ); вирусную инфекцию, вызванную вирусом иммунодефицита человека (ВИЧ); вирусную инфекцию, вызванную вирусом гриппа; вирусную инфекцию, вызванную вирусом кори или паротита; вирусную инфекцию, вызванную вирусом папилломы человека (ВПЧ); вирусную инфекцию, вызванную вирусом парагриппа; вирусную инфекцию, вызванную вирусом краснухи; вирусную инфекцию, вызванную респираторно-синцитиальным вирусом (RSV); или вирусную инфекцию, вызванную вирусом ветряной оспы, но не ограничиваются этим. В некоторых аспектах вирусная инфекция может вызвать или привести к развитию рака у субъекта с вирусной инфекцией (например, инфекция ВПЧ может вызывать или быть связана с развитием нескольких видов рака, включая рак шейки матки, вульвы, влагалища, полового члена, анального канала и ротоглотки, а ВИЧ-инфекция может вызвать развитие саркомы Капоши).
В некоторых вариантах осуществления инфекционное заболевание представляет собой бактериальное инфекционное заболевание. В контексте настоящего описания «бактериальное инфекционное заболевание» может быть инфекцией, обусловленной любыми бактериями, которые вызывают заболевание или патологическое состояние у хозяина.
Примеры бактериальных инфекционных заболеваний включают пневмонию, средний отит, синусит, бронхит, тонзиллит и мастоидит, связанные с инфекцией Streptococcus pneumoniae, Haemophilus influenzae, Moraxella catarrhalis, Staphylococcus aureus или родом Peptostreptococcus; фарингит, ревматическую лихорадку и гломерулонефрит, вызванные инфекцией Streptococcus pyogenes, стрептококками групп C и G, Clostridium diptheriae или Actinobacillus haemolyticum; инфекции дыхательных путей, связанные с инфекцией Mycoplasma pneumoniae, Legionella pneumophila, Streptococcus pneumoniae, Haemophilus influenzae или Chlamydia pneumoniae; не-комплексные инфекции кожи и мягких тканей, фурункулы, остеомиелит и послеродовую лихорадку, связанные с инфицированием Staphylococcus aureus, коагулаза-положительными стафилококками (например, S. epidermidis, S. hemolyticus и др.), Streptococcus pyogenes, Streptococcus agalactiae, Streptococcus группы CF (микроколонии Streptococcus), Viridans streptococcus, Corynebacterium minutissimum, родом Clostridium или Bartonella henselae; не-комплексную острую инфекцию мочевыводящих путей; уретрит и цервицит, связанные с инфекцией Staphylococcus saprophyticus или рода Enterococcus; и заболевание, передаваемое половым путем, связанное с инфекцией Chlamydia trachomatis, Haemophilus ducreyi, Treponema pallidum, Ureaplasma urealyticum или Neiserria gonorrheae; токсические заболевания, связанные с инфекцией S. aureus (синдром пищевого отравления и токсического шока), стрептококками групп А, В и С; язвы, связанные с инфицированием Helicobacter pylori; синдром системной лихорадки, связанный с инфицированием Borrelia recurrentis; болезнь Лайма, связанную с инфицированием Borrelia burgdorferi; конъюнктивит, кератит и дакриоцистит, связанные с инфекцией Chlamydia trachomatis, Neisseria gonorrhoeae, S. aureus, S. pneumoniae, S. pyogenes, H. influenzae или рода Listeria; диффузный синдром Mycobacterium avium (MAC), связанный с инфекцией Mycobacterium avium, Mycobacterium intracellulare; гастроэнтерит, связанный с инфицированием Campylobacter jejuni; стоматологическую инфекцию, связанную с инфицированием Viridans streptococcus; стойкий кашель, связанный с заражением Bordetella pertussis; газовую гангрену, связанную с инфекцией Clostridium perfringens или рода Bacteroides; и атеросклероз, сопровождающийся инфекцией Helicobacter pylori или Chlamydia pneumoniae, но не ограничиваются ими. В некоторых вариантах осуществления бактериальная инфекция может быть вызвана, например, бактериями рода Escherichia, рода Listeria, рода Salmonella или рода Staphylococcus.
В некоторых вариантах осуществления инфекционное заболевание представляет собой грибковое инфекционное заболевание. В контексте настоящего описания «грибковое инфекционное заболевание» может означать инфекцию, вызванную любым грибком, который вызывает заболевание или патологическое состояние у хозяина.
Примеры инфекционных заболеваний, вызываемых грибком, включают местные, мукозальные и/или системные грибковые инфекции, вызываемые, например, Candida albicans, Cryptococcus neoformans, Aspergillus flavus, Aspergillus fumigatus, Coccidioides, Paracoccidioides, Histoplasma или Blastomyces, но не ограничиваются ими. Другие типичные грибковые заболевания включают молочницу полости рта, вагинальный кандидиаз, аспергиллез, кандидоз, хромомикоз, кокцидиоидомикоз, криптококкоз, энтомофторомикоз, эпизоотический лимфангит, геотрихоз, гистоплазмоз, мукормикоз, мицетому, североамериканский бластомикоз, оомикоз, пециломикоз, пенициллиоз, риноспоридиоз и споротрихиоз у животных (например, людей).
В некоторых вариантах осуществления инфекционное заболевание представляет собой паразитарное инфекционное заболевание. В контексте настоящего описания «паразитарное инфекционное заболевание» может быть инфекцией, вызванной любыми простейшими, гельминтами или эктопаразитами, которые вызывают заболевание или патологическое состояние у хозяина.
Примеры простейших, которые могут быть инфекционными для человека, включают Entamoeba, Giardia, Leishmania balantidium, Plasmodium и Cryptosporidium, но не ограничиваются ими.
Примеры гельминтов, которые могут быть инфекционными для человека, включают Filariasis, Onchocerciasis, Ascariasis, Trichuriasis, Necatoriasis, Trichostrongyliasis, Dracunculiasis, Baylisascaris, Echinococcosis, Hymenolepiasis, Taeniasis, Cysticercosis, Coenurosis, Amphistomiasis, Clonorchiasis, Fascioliasis, Fasciolopsiasis, Opisthorchiasis, Paragonimiasis, Schistosomiasis и Bilharziasis, но не ограничиваются ими.
Примеры эктопаразитов, которые могут быть заразными для человека, включают насекомых (шестиногих членистоногих) и паукообразных (восьминогих членистоногих), но не ограничиваются ими.
Применение CAR
Сконструированные с помощью CAR иммунные клетки по настоящему изобретению можно вводить либо отдельно, либо в виде фармацевтической композиции, описанной в настоящей заявке (например, в сочетании с разбавителями и/или с другими компонентами, включая IL-2 или другие цитокины или популяции клеток, но не ограничиваясь ими).
Фармацевтические композиции по настоящему изобретению можно вводить субъекту любым подходящим способом, включая аэрозольную ингаляцию, инъекцию, прием внутрь, трансфузию, имплантацию или трансплантацию. В некоторых вариантах осуществления описанные здесь фармацевтические композиции можно вводить субъекту парентерально. В некоторых вариантах осуществления фармацевтические композиции, описанные в настоящей заявке, можно вводить субъекту подкожно, интрадермально, внутриопухолевым путем, интранодально, интрамедуллярно, внутримышечно, интрастернально, путем внутривенной (в/в) инъекции, путем инфузии или интраперитонеально. В конкретных вариантах осуществления композиции CAR-модифицированных иммунных клеток по настоящему изобретению можно вводить субъекту путем интрадермальной или подкожной инъекции. В некоторых вариантах осуществления композиции CAR-модифицированных иммунных клеток по настоящему изобретению можно вводить путем внутривенной инъекции. В некоторых вариантах осуществления композиции CAR-модифицированных иммунных клеток можно вводить непосредственно в лимфатический узел, место инфекции, место воспаления или место отторжения ткани или органа. В некоторых вариантах осуществления композиции CAR-модифицированных иммунных клеток можно вводить непосредственно в место аутоиммунного и/или воспалительного заболевания.
В некоторых вариантах осуществления субъекту вводят (или должны вводить) аутологичные клетки.
В некоторых вариантах осуществления субъекту вводят (или должны вводить) аллогенные клетки.
В некоторых вариантах осуществления субъект может быть млекопитающим. В конкретных вариантах осуществления субъект может быть человеком.
Фармацевтические композиции по настоящему изобретению можно вводить способом, соответствующим заболеванию, которое необходимо предотвратить или лечить. Количество и частота введения будут определяться такими факторами, как состояние субъекта, а также тип и тяжесть заболевания субъекта, хотя соответствующие дозировки могут быть определены клиническими испытаниями.
Когда указано «эффективное количество» или «терапевтическое количество», точное количество композиций по настоящему изобретению для введения может быть определено с учетом индивидуальных различий в возрасте, массе тела, титре антител и состоянии субъекта. В целом можно утверждать, что фармацевтическая композиция, содержащая сконструированные с помощью CAR иммунные клетки, как описано в настоящей заявке, может быть введена в дозировке по меньшей мере 1×102, 1×103, 1×104, 1×105, 1×106, 1×107, 1×108 or 1×109 клеток/кг массы тела или от 1×105 до 100×105 клеток/кг массы тела, включая все целые значения в этих диапазонах. Композиции из CAR-сконструированных иммунных клеток также могут быть введены несколько раз в любой из этих дозировок или в любой их комбинации. Сконструированные с помощью CAR иммунные клетки можно вводить с помощью методик инфузии, которые широко известны в иммунотерапии. Оптимальную дозировку и схему лечения для конкретного субъекта можно легко определить, оценивая у субъекта признаки заболевания и соответствующим образом корректируя лечение.
В некоторых вариантах осуществления сконструированные с помощью CAR иммунные клетки по настоящему изобретению можно вводить субъекту в сочетании (например, до, одновременно или после) с любым количеством подходящих методов лечения, включая лечение такими агентами, как агенты для противовирусной терапии, химиотерапии (т.е. химиотерапевтический агент), алкилирующие агенты, радиация, иммунодепрессанты, антитела, иммуноаблативные агенты, цитокины, облучение и противоинфекционные агенты, но не ограничиваясь ими.
В некоторых вариантах осуществления сконструированные с помощью CAR иммунные клетки по настоящему изобретению можно вводить вместе с химиотерапевтическим агентом. Можно использовать любой химиотерапевтический агент, известный в данной области техники. Примеры химиотерапевтических агентов включают антрациклин (например, доксорубицин (например, липосомальный доксорубицин)), алкалоид барвинка (например, винбластин, винкристин, виндезин или винорелбин), алкилирующий агент (например, циклофосфамид, дакарбазин, мелфалан, ифосфамид или темозоломид), антитела иммунных клеток (например, алемтузумаб, гемтузумаб, ритуксимаб, офатумумаб, тозитумомаб или брентуксимаб), антиметаболит (включая, например, антагонисты фолиевой кислоты, пиримидиновые аналоги, пуриновые аналоги и ингибиторы аденозиндезаминазы (например, флударабин)), ингибитор mTOR, агонист глюкокортикоид-индуцированного рецептора (GITR) к фактору некроза опухоли TNFR, ингибитор протеасом (например, аклациномицин A, глиотоксин или бортезомиб), иммуномодулятор, такой как талидомид или производное талидомида (например, леналидомид), но не ограничиваются ими.
Другие химиотерапевтические агенты, рассматриваемые для использования в комбинированной терапии по изобретению, включают анастрозол (Arimidex®), бикалутамид (Casodex®), блеомицин сульфат (Blenoxane®), бусульфан (Myleran®), бусульфан для инъекций (Busulfex®), капецитабин (Xeloda®), N4-пентоксикарбонил-5-дезокси-5-фторцитидин, карбоплатин (Paraplatin®), кармустин (BiCNU®), хлорамбуцил (Leukeran®), цисплатин (Platinol®), кладрибин (Leustatin®), циклофосфамид (Cytoxan® или Neosar®), цитарабин, цитозин арабинозид (Cytosar-U®), липосомы цитарабина для инъекций (DepoCyt®), дакарбазин (DTIC-Dome®), дактиномицин (актиномицин D, космеган), даунорубицина гидрохлорид (Cerubidine®), липосомы даунорубицина цитрата для инъекций (DaunoXome®), дексаметазон, доцетаксел (Taxotere®), доксорубицина гидрохлорид (Adriamycin®, Rubex®), этопозид (Vepesid®), флударабина фосфат (Fludara®), 5-фторурацил (Adrucil®, Efudex®), флутамид (Eulexin®), тезацитибин, гемцитабин (дифтордезоксицитидин), гидроксимочевину (Hydrea®), идарубицин (Idamycin®), ифосфамид (IFEX®), иринотекан (Camptosar®), L-аспарагиназу (ELSPAR®), лейковорин кальция, мелфалан (Alkeran®), 6-меркаптопурин (Purinethol®), метотрексат (Folex®), митоксантрон (Novantrone®), милотарг, паклитаксел (Taxol®), феникс (Yttrium90/MX-DTPA), пентостатин, полифепрозан 20 с имплантатом кармустина (Gliadel®), тамоксифена цитрат (Nolvadexe®), тенипозид (Vumon®), 6-тиогуанин, тиотепа, тирапазамин (Tirazone®), топотекана гидрохлорид для инъекций (Hycamptin®), винбластин (Velban®), винкристин (Oncovin®), и винорелбин (Navelbine®), но не ограничиваются ими.
Сконструированные с помощью CAR иммунные клетки из настоящего изобретения можно вводить субъекту до, после или одновременно с химиотерапевтическим агентом.
В некоторых вариантах осуществления сконструированные с помощью CAR иммунные клетки по настоящему изобретению можно вводить вместе с алкилирующим агентом. Может быть использован любой алкилирующий агент, известный в данной области техники. Примеры алкилирующих агентов включают азотистые иприты, производные этиленимина, алкилсульфонаты, нитрозомочевины и триазены, урациловый иприт (Aminouracil Mustard®, Chlorethaminacil®, Demethyldopan®, Desmethyldopan®, Haemanthamine®, Nordopan®, Uracil nitrogen mustard®, Uracillost®, Uracilmostaza®, Uramustin®, и Uramustine®), хлорметин (Mustargen®), циклофосфамид (Cytoxan®, Neosar®, Clafen®, Endoxan®, Procytox®, и Revimmune™), ифосфамид (Mitoxana®), мелфалан (Alkeran®), хлорамбуцил (Leukeran®), пипоброман (Amedel®, Vercyte®), триэтиленмеламин (Hemel®, Hexalen® и Hexastat®), триэтилентиофосфорамин, темозоломид (Temodar®), тиотепа (Thioplex®), бусульфан (Busilvex® и Myleran®), кармустин (BiCNU®), ломустин (CeeNU®), стрептозоцин (Zanosar®) и дакарбазин (DTIC-Dome®), но не ограничиваются ими. Дополнительные иллюстративные алкилирующие агенты включают оксалиплатин (Eloxatin®); темозоломид (Temodar® и Temodal®); дактиномицин (также известный как актиномицин-D, Cosmegen®); мелфалан (также известный как L-PAM, L-сарколизин и фенилаланин-иприт, Alkeran®); алтретамин (также известный как гексаметилмеламин (ГММ), Hexalen®); кармустин (BiCNU®); бендамустин (Treanda®); бусульфан (Busulfex® и Myleran®); карбоплатин (Paraplatin®); ломустин (также известный как CCNU, CeeNU®); цисплатин (также известный как CDDP, Platinol® и Platinol®-AQ); хлорамбуцил (Leukeran®); циклофосфамид (Cytoxan® и Neosar®); дакарбазин (также известный как DTIC, DIC и имидазол карбоксамид, DTIC-Dome®); алтретамин (также известный как гексаметилмеламин (НММ), Hexalen®); ифосфамид (Ifex®); преднумустин; прокарбазин (Matulane®); мехлорэтамин (также известный как азотистый иприт, мустин и мехлорэтамин гидрохлорид, Mustargen®); стрептозоцин (Zanosar®); тиотепа (также известный как тиофосфоамид, TESPA и TSPA и Thioplex®); циклофосфамид (Endoxan®, Cytoxan®, Neosar®, Procytox®, и Revimmune®); и бендамустин HC1 (Treanda®), но не ограничиваются ими.
Сконструированные с помощью CAR иммунные клетки по настоящему изобретению можно вводить субъекту до, после или одновременно с алкилирующим агентом.
В некоторых вариантах осуществления сконструированные с помощью CAR иммунные клетки по настоящему изобретению можно вводить вместе с иммунодепрессантом. Может быть использован любой иммунодепрессант, известный в данной области техники. Примеры иммунодепрессантов включают циклоспорин, азатиоприн, метотрексат, метоксален, рапамицин, микофенолят мофетил, микофеноловую кислоту, ритуксимаб, сиролимус, базиликсимаб, даклизумаб, муромонаб-CD3, такролимус, глюкокортикостероиды, адренокортикостероиды, такие как преднизон и преднизолон, и любые их комбинации, но не ограничиваются ими.
Сконструированные с помощью CAR иммунные клетки по настоящему изобретению можно вводить субъекту до, после или одновременно с иммунодепрессантом.
Сконструированные с помощью CAR иммунные клетки из настоящего изобретения и/или иммунодепрессант (иммунодепрессанты) можно вводить субъекту после трансплантации. Альтернативно или в дополнение, сконструированные с помощью CAR иммунные клетки по настоящему изобретению и/или иммунодепрессант (иммунодепресанты) могут быть введены субъекту перед трансплантацией. В некоторых вариантах осуществления сконструированные с помощью CAR иммунные клетки по настоящему изобретению и/или иммунодепрессант можно вводить субъекту во время операции по трансплантации.
В некоторых вариантах осуществления введение иммунных клеток, сконструированных с помощью CAR, субъекту проводят после того, как была начата иммуносупрессивная терапия.
В некоторых вариантах осуществления способ проводят более одного раза, например, для мониторинга реципиента трансплантата с течением времени и, если применимо, в различных режимах иммуносупрессивной терапии.
В некоторых вариантах осуществления изобретения иммуносупрессивную терапию уменьшают, если предполагается, что реципиент трансплантата будет иметь толерантность к трансплантату. В некоторых вариантах осуществления иммуносупрессивную терапию не назначают, например, иммуносупрессивную терапию прекращают, если предполагается, что реципиент трансплантата будет иметь толерантность к трансплантату.
Сконструированные с помощью CAR иммунные клетки по настоящему изобретению можно вводить после диагностики отторжения трансплантата органа или ткани с последующим введением доз как сконструированных с помощью CAR иммунных клеток по изобретению, так и иммунодепрессантов, до снижения симптомов отторжения органа или ткани.
В следующем варианте осуществления композиции иммунных клеток, сконструированных с помощью CAR по настоящему изобретению, можно вводить субъекту в сочетании (например, до, одновременно или после) с трансплантацией костного мозга.
В некоторых вариантах осуществления сконструированные с помощью CAR иммунные клетки по настоящему изобретению можно вводить после В-клеточной аблационной терапии, такой как агенты, которые реагируют с CD20, например ритуксимаб. Например, в некоторых вариантах осуществления изобретения субъекты могут проходить стандартное лечение с применением высокодозовой химиотерапии с последующей трансплантацией стволовых клеток периферической крови. В некоторых вариантах осуществления изобретения после трансплантации субъекты могут получать инфузию размноженных CAR-сконструированных иммунных клеток по настоящему изобретению. В некоторых вариантах осуществления размноженные иммунные клетки, сконструированные с помощью CAR, можно вводить до или после операции.
В некоторых вариантах осуществления сконструированные с помощью CAR иммунные клетки по настоящему изобретению можно вводить вместе с противоинфекционным агентом. Может быть использован любой противоинфекционный агент, известный в данной области техники. Примеры противоинфекционных средств включают амебициды, аминогликозиды, противогельминтные, противопаразитарные, противогрибковые средства (азольные противогрибковые средства, эхинокандины, смешанные противогрибковые средства и полиены), противомалярийные средства (противомалярийные комбинации, противомалярийные хинолины, и смешанные антималярийные препараты), противотуберкулезные агенты (аминосалицилаты, противотуберкулезные комбинации, диарилхинолины, гидразидные производные, различные противотуберкулезные агенты, производные никотиновой кислоты, производные рифамицина и производные стрептомицетов), противовирусные агенты (адамантановые противовирусные препараты, противовирусные бустеры, противовирусные комбинации, противовирусные интерфероны, антагонисты хемокиновых рецепторов, ингибитор переноса цепей интегразы, смешанные противовирусные препараты, ингибиторы нейраминидазы, NNRTI, ингибиторы NS5A, ингибиторы нуклеозидной обратной транскриптазы (NNRTI), ингибиторы протеаз и пуриновые нуклеозиды), карбапенемы, карбапенемы/ингибиторы бета-лактамаз, цефалоспорины (цефалоспорины/ингибиторы бета-лактамаз, цефалоспорины первого поколения, цефалоспорины четвертого поколения, цефалоспорины следующего поколения, цефалоспорины второго поколения и цефалоспорины третьего поколения), антибиотики, гликопептидные антибиотики, глицилциклины, лепростатические средства, производные линкомицина, производные макролидов (кетолиды и макролиды), смешанные антибиотики, оксазолидиноновые антибиотики, пенициллины (аминопенициллины, антипсевдомонадные пенициллины, ингибиторы бета-лактамаз, натуральные пенициллины, пенициллиназу и резистентные пенициллины), хинолоны, сульфаниламиды, тетрациклины и противоинфекционные средства для мочевыводящих путей, но не ограничиваются ими.
В некоторых вариантах осуществления субъект (например, человек) получает начальное введение иммунной клетки или популяции по изобретению, и одно или несколько последующих введений, при этом одно или несколько последующих введений осуществляют спустя менее 15 дней, например, 14, 13, 12, 11, 10, 9, 8, 7, 6, 5, 4, 3 или 2 дня после предыдущего введения.
В некоторых вариантах осуществления терапевтически эффективное количество иммунных клеток по изобретению вводят или предполагают вводить субъекту.
В некоторых вариантах осуществления количество иммунных клеток в популяции иммунных клеток по изобретению, вводимых субъекту, составляет по меньшей мере 102, 103, 104, 105, 106, 107, 108 или 109 клеток.
В некоторых вариантах осуществления количество иммунных клеток в популяции иммунных клеток по изобретению, вводимых субъекту, находится в диапазоне примерно от 102 до 109, примерно от 103 до 108, примерно от 104 до 107, или примерно от 105 до 106 клеток.
В некоторых вариантах осуществления количество иммунных клеток популяции в иммунных клеток по изобретению, вводимых субъекту, находится в диапазоне примерно от 102 до 109, примерно от 102 до 108, примерно от 102 до 107, примерно от 102 до 106, примерно от 102 до 105, примерно от 102 до 104 или примерно от 102 до 103 клеток. В некоторых вариантах осуществления количество иммунных клеток в иммунной популяции по изобретению, вводимых субъекту, составляет примерно 102, примерно 103, примерно 104, примерно 105, примерно 106, примерно 107, примерно 108 или примерно 109 клеток.
В некоторых вариантах осуществления количество иммунных клеток в популяции иммунных клеток по изобретению, вводимых субъекту, составляет по меньшей мере 102, 103, 104, 105, 106, 107, 108 или 109 клеток/ кг массы тела.
В некоторых вариантах осуществления количество иммунных клеток в популяции иммунных клеток по изобретению, вводимых субъекту, находится в диапазоне примерно от 102 до 109 клеток/ кг массы тела, или от 103 до 108 клеток/ кг массы тела, включая все целые значения в пределах эти диапазонов.
В некоторых вариантах осуществления субъект получает более одного введения популяции иммунных клеток по настоящему изобретению в неделю; например, 2, 3 или 4 введения популяции Treg-клеток по настоящему изобретению проводят у субъекта в неделю.
В некоторых вариантах осуществления популяцию Treg-клеток вводят нуждающемуся в этом субъекту в комбинации с активным агентом. Согласно некоторым вариантам осуществления популяцию иммунных клеток вводят до, одновременно или после введения активного агента.
В некоторых вариантах осуществления может быть необходимо ввести активированные иммунные клетки по настоящему изобретению субъекту, и затем повторно проанализировать кровь (или провести аферез), активировать из нее иммунные клетки в соответствии с настоящим изобретением и повторно ввести субъекту эти активированные и размноженные иммунные клетки. Этот процесс можно проводить несколько раз каждые несколько недель. В некоторых вариантах осуществления иммунные клетки можно активировать при взятии крови объемом от 10 см3 до 400 см3. В некоторых вариантах осуществления иммунные клетки активируют при взятии крови объемом 20 см3, 30 см3, 40 см3, 50 см3, 60 см3, 70 см3, 80 см3, 90 см3 или 100 см3. Не желая углубляться в теорию, использование этого протокола множественного забора крови/ множественной реинфузии может служить для отбора определенных популяций иммунных клеток.
Подразумевается, что CAR, популяции клеток и композиции, описанные в настоящей заявке, могут быть использованы в способе лечения, как описано в настоящей заявке, могут быть использованы в качестве лекарственного средства, как описано в настоящей заявке, могут быть использованы в лечении, как описано в настоящей заявке, и/или могут быть использованы при производстве лекарственного средства для лечения, как описано в настоящей заявке.
Готовое изделие и наборы
Настоящее изобретение также относится к готовым изделиям, содержащим любые из нуклеиновых кислот, векторов, популяций клеток или композиций, описанных в настоящей заявке, а также к способам производства указанных изделий.
Кроме того, настоящее изобретение обеспечивает наборы, содержащие в подходящем контейнере любые из нуклеиновых кислот, векторов, популяций клеток или композиций, описанных в настоящей заявке.
Варианты осуществления
Конкретные варианты осуществления изобретения перечислены ниже:
1. Химерный антигенный рецептор (CAR), содержащий:
- по меньшей мере один внеклеточный связывающий домен;
- при необходимости по меньшей мере один внеклеточный шарнирный домен;
- по меньшей мере один трансмембранный домен;
- по меньшей мере один внутриклеточный домен;
где по меньшей мере один внутриклеточный домен при необходимости включает по меньшей мере один костимуляторный внутриклеточный сигнальный домен и по меньшей мере один первичный внутриклеточный сигнальный домен; и где
- по меньшей мере один трансмембранный домен представляет собой трансмембранный домен TNFR2 человека или его фрагмент или вариант, или любой трансмембранный домен или его фрагмент или вариант, или их комбинацию, и/или
- по меньшей мере один костимуляторный внутриклеточный сигнальный домен представляет собой костимуляторный внутриклеточный сигнальный домен TNFR2 человека или его фрагмент или вариант, или любой костимуляторный внутриклеточный сигнальный домен или его фрагмент или вариант, или их комбинацию, и
где по меньшей мере один из трансмембранного домена и костимуляторного внутриклеточного сигнального домена является трансмембранным доменом TNFR2 или его фрагментом или вариантом, или костимуляторным внутриклеточным сигнальным доменом TNFR2 или его фрагментом или вариантом.
2. CAR согласно варианту осуществления 1, где указанный трансмембранный домен TNFR2 человека содержит по меньшей мере 2 аминокислоты из последовательности SEQ ID NO: 22 или из последовательности, имеющей по меньшей мере примерно 70% идентичности с SEQ ID NO: 22, предпочтительно по меньшей мере 2 смежные аминокислоты из SEQ ID NO: 22 или из последовательности, имеющей по меньшей мере примерно 70% идентичности с SEQ ID: 22
3. CAR согласно варианту осуществления 1 или варианту осуществления 2, где указанный трансмембранный домен TNFR2 человека объединен по меньшей мере с одним другим трансмембранным доменом.
4. CAR согласно любому из вариантов осуществления с 1 по 3, где указанный костимуляторный внутриклеточный сигнальный домен TNFR2 человека содержит по меньшей мере 2 аминокислоты из последовательности SEQ ID NO: 34 или из последовательности, имеющей по меньшей мере примерно 70% идентичности с SEQ ID NO: 34, предпочтительно по меньшей мере 2 смежные аминокислоты из SEQ ID NO: 34 или из последовательности, имеющей по меньшей мере примерно 70% идентичности с SEQ ID: 34.
5. CAR согласно любому из вариантов осуществления 1-4, где указанный костимуляторный внутриклеточный сигнальный домен TNFR2 объединен по меньшей мере с одним другим костимуляторным внутриклеточным сигнальным доменом.
6. CAR согласно любому из вариантов осуществления 1-5, где первичный внутриклеточный сигнальный домен содержит первичный внутриклеточный сигнальный домен иммунных клеток, предпочтительно Т-клеточный первичный внутриклеточный сигнальный домен человеческого CD3, более предпочтительно Т-клеточный первичный внутриклеточный сигнальный домен CD3-дзета человека, имеющий последовательность SEQ ID NO: 28, 29, 30 или 31, или последовательность, имеющую по меньшей мере примерно 70% идентичности с SEQ ID: 28, 29, 30 или 31.
7. CAR согласно любому из вариантов осуществления 1-6, где шарнирный домен представляет собой шарнирную область человеческого CD8, предпочтительно SEQ ID NO: 14 или последовательность, имеющую по меньшей мере примерно 70% идентичности с SEQ ID NO: 14.
8. CAR согласно любому из вариантов осуществления 1-7, где CAR содержит по меньшей мере один трансмембранный домен TNFR2 и по меньшей мере один внутриклеточный домен, где указанный внутриклеточный домен при необходимости включает по меньшей мере один костимуляторный внутриклеточный сигнальный домен и по меньшей мере один первичный внутриклеточный сигнальный домен иммунной клетки.
9. CAR согласно любому из вариантов осуществления 1-7, содержащий по меньшей мере один трансмембранный домен и по меньшей мере один внутриклеточный домен, где указанный внутриклеточный домен содержит по меньшей мере один костимуляторный внутриклеточный сигнальный домен TNFR2 и по меньшей мере один первичный внутриклеточный сигнальный домен иммунной клетки.
10. Нуклеиновокислотная последовательность, кодирующая CAR согласно любому из вариантов осуществления 1-9.
11. Вектор, содержащий нуклеиновокислотную последовательность согласно варианту осуществления 10.
12. Популяция иммунных клеток, содержащая нуклеиновокислотную последовательность согласно варианту осуществления 10, или вектор согласно варианту осуществления 11, или экспрессирующая CAR согласно любому из вариантов осуществления 1-9.
13. Популяция иммунных клеток согласно варианту осуществления 12, выбранная из группы, включающей Т-клетки, натуральные киллеры (NK), γδ-Т-клетки, двойные негативные (DN) клетки, регуляторные иммунные клетки, регуляторные Т-клетки, эффекторные иммунные клетки, эффекторные Т-клетки, В-клетки и клетки миелоидного происхождения, и любую их комбинацию.
14. Композиция, содержащая по меньшей мере одну популяцию клеток согласно любому из вариантов осуществления 12-13.
15. Композиция согласно варианту осуществления 14, являющаяся фармацевтической композицией и дополнительно содержащая по меньшей мере одно фармацевтически приемлемое вспомогательное вещество.
16. Способ лечения заболевания или расстройства у субъекта, который в этом нуждается, включающий введение субъекту по меньшей мере одной популяции иммунных клеток согласно вариантам осуществления 12 или 13 или композиции согласно вариантам осуществления 14 или 15.
17. Способ согласно варианту осуществления 16, представляющий собой способ клеточной терапии.
18. Способ согласно вариантам осуществления 16 или 17, где указанное заболевание или расстройство включает воспалительные заболевания, аутоиммунные заболевания, аллергические заболевания, состояния после трансплантации органов, рак и инфекционные заболевания.
19. Способ по любому из вариантов осуществления 16-18, где популяция иммунных клеток представляет собой популяцию регуляторных иммунных клеток или популяцию Treg-клеток, и где указанное заболевание или расстройство представляет собой воспалительное заболевание, аутоиммунное заболевание, аллергическое заболевание, или состояние после трансплантации органа, предпочтительно выбранное из отторжения трансплантата и реакции «трансплантат против хозяина».
20. Способ по любому из вариантов осуществления 16-18, где популяция иммунных клеток представляет собой популяцию эффекторных Т-клеток, популяцию NK-клеток или популяцию γδ-Т-клеток, и где указанное заболевание или расстройство представляет собой рак или инфекционное заболевание.
Настоящее изобретение относится к химерному антигенному рецептору (CAR), содержащему:
- по меньшей мере один внеклеточный связывающий домен;
- при необходимости по меньшей мере один внеклеточный шарнирный домен;
- по меньшей мере один трансмембранный домен (например, трансмембранный домен TNFR2 человека или его фрагмент или вариант, любой трансмембранный домен или его фрагмент или вариант, или любую их комбинацию); и
- по меньшей мере один внутриклеточный домен (содержащий по меньшей мере один первичный внутриклеточный сигнальный домен и при необходимости содержащий по меньшей мере один костимуляторный внутриклеточный сигнальный домен или его фрагмент или вариант, где по меньшей мере один костимуляторный внутриклеточный сигнальный домен представляет собой костимуляторный внутриклеточный сигнальный домен TNFR2 человека, или его фрагмент или вариант, любой костимуляторный внутриклеточный сигнальный домен или его фрагмент или вариант, или любую их комбинацию),
где трансмембранный домен представляет собой трансмембранный домен TNFR2 или его фрагмент или вариант, и/или костимуляторный внутриклеточный сигнальный домен представляет собой костимуляторный внутриклеточный сигнальный домен TNFR2 или его фрагмент или вариант.
В некоторых вариантах осуществления указанный трансмембранный домен TNFR2 человека или его фрагмент или вариант содержит по меньшей мере 2 аминокислоты (например, по меньшей мере 2 смежные аминокислоты) из последовательности SEQ ID NO: 22 или из последовательности, имеющей по меньшей мере примерно 70% идентичности с SEQ ID NO: 22.
В некоторых вариантах осуществления указанный трансмембранный домен TNFR2 человека или его фрагмент или вариант объединен по меньшей мере с одним другим трансмембранным доменом или его фрагментом или вариантом.
В некоторых вариантах осуществления указанный костимуляторный внутриклеточный сигнальный домен TNFR2 человека или его вариант или фрагмент содержит по меньшей мере 2 аминокислоты (например, по меньшей мере 2 смежные аминокислоты) из последовательности SEQ ID NO: 34 или из последовательности, имеющей по меньшей мере примерно 70% идентичности с SEQ ID NO: 34.
В некоторых вариантах осуществления указанный костимуляторный внутриклеточный сигнальный домен TNFR2 или его вариант или фрагмент объединен по меньшей мере с одним другим костимуляторным внутриклеточным сигнальным доменом или его фрагментом или вариантом.
В некоторых вариантах осуществления изобретения первичный внутриклеточный сигнальный домен содержит первичный внутриклеточный сигнальный домен иммунной клетки. В некоторых вариантах осуществления первичный внутриклеточный сигнальный домен представляет собой первичный внутриклеточный сигнальный домен CD3 Т-клетки человека. В конкретных вариантах осуществления первичный внутриклеточный сигнальный домен представляет собой первичный внутриклеточный сигнальный домен CD3-дзета Т-клетки человека, имеющий последовательность SEQ ID NO: 28, 29, 30 или 31 или последовательность, имеющую по меньшей мере примерно 70% идентичности с SEQ ID: 28, 29, 30 или 31.
В некоторых вариантах осуществления шарнирный домен представляет собой шарнирную область человеческого CD8, предпочтительно SEQ ID NO: 14, или последовательность, имеющую по меньшей мере примерно 70% идентичности с SEQ ID NO: 14.
В некоторых вариантах осуществления CAR содержит по меньшей мере один трансмембранный домен TNFR2 или его фрагмент или вариант, и по меньшей мере один внутриклеточный домен, где указанный внутриклеточный домен содержит по меньшей мере один первичный внутриклеточный сигнальный домен иммунной клетки и при необходимости содержит по меньшей мере один костимуляторный внутриклеточный сигнальный домен.
В некоторых вариантах осуществления CAR содержит по меньшей мере один трансмембранный домен и по меньшей мере один внутриклеточный домен, при этом указанный внутриклеточный домен содержит по меньшей мере один костимуляторный внутриклеточный сигнальный домен TNFR2 или его фрагмент или вариант, и по меньшей мере один первичный внутриклеточный сигнальный домен иммунной клетки.
Настоящее изобретение далее относится к нуклеиновокислотной последовательности, кодирующей CAR согласно настоящему изобретению.
Настоящее изобретение также относится к вектору, содержащему нуклеиновокислотную последовательность согласно настоящему изобретению.
Настоящее изобретение также относится к популяции иммунных клеток, содержащих нуклеиновокислотную последовательность согласно настоящему изобретению, или вектор согласно настоящему изобретению, или экспрессирующих CAR согласно настоящему изобретению. В некоторых вариантах осуществления популяция иммунных клеток выбрана из группы, состоящей из Т-клеток, натуральных киллеров (NK), γδ-Т-клеток, двойных отрицательных (DN) клеток, регуляторных иммунных клеток, регуляторных Т-клеток, эффекторных иммунных клеток, эффекторных Т-клеток, В-клеток и клеток миелоидного происхождения, и любой их комбинации.
Настоящее изобретение также относится к композиции, содержащей по меньшей мере одну популяцию клеток согласно настоящему изобретению. В некоторых вариантах осуществления композиция представляет собой фармацевтическую композицию и дополнительно содержит по меньшей мере одно фармацевтически приемлемое вспомогательное вещество.
Настоящее изобретение далее относится к способу лечения заболевания или расстройства у субъекта, нуждающегося в этом, включающему введение субъекту по меньшей мере одной популяции клеток или композиции согласно настоящему изобретению. В некоторых вариантах осуществления способ представляет собой способ клеточной терапии. В некоторых вариантах осуществления указанные заболевания или расстройства включают воспалительные заболевания, аутоиммунные заболевания, аллергические заболевания, состояния после трансплантации органов, рак и инфекционные заболевания. В некоторых вариантах осуществления популяция клеток представляет собой популяцию регуляторных иммунных клеток или популяцию Treg-клеток, а указанное заболевание или расстройство представляет собой воспалительное заболевание, аутоиммунное заболевание, аллергическое заболевание или состояние после трансплантации органов (например, отторжение трансплантата или болезнь «трансплантат против хозяина»). В некоторых вариантах осуществления популяция иммунных клеток представляет собой популяцию Т-эффекторных клеток, популяцию NK-клеток или популяцию γδ-Т-клеток, а указанное заболевание или расстройство представляет собой рак или инфекционное заболевание.
Если в настоящей заявке не определено иное, научные и технические термины, используемые в связи с настоящим изобретением, должны иметь значения, которые обычно понимаются специалистами в данной области техники. Примерные способы и материалы описаны ниже, хотя способы и материалы, подобные или эквивалентные описанным в настоящей заявке, также могут быть использованы на практике или при тестировании настоящего изобретения. В случае противоречия преимущественную силу имеет настоящее описание, включая определения. Как правило, номенклатура, используемая в связи с культурами клеток и тканей, молекулярной биологией, иммунологией, микробиологией, генетикой, аналитической химией, синтетической органической химией, медицинской и фармацевтической химией, а также химией белков и нуклеиновых кислот и гибридизацией, и методы их использования, хорошо известны и широко используются в данной области техники. Ферментативные реакции и методики очистки проводят в соответствии со спецификациями производителя, как это обычно делается в данной области техники или как описано в настоящей заявке. Кроме того, если иное не требуется контекстом, термины в единственном числе должны включать множественное число, а термины во множественном числе должны включать единственное число. В данном описании и вариантах осуществления слова «иметь» и «содержать» или варианты, такие как «имеет», «имеющий», «содержит» или «содержащий», будут пониматься как подразумевающие включение указанного целого числа или группы целых чисел, но не исключение любого другого целого числа или группы целых чисел. Понятно, что аспекты и варианты изобретения, описанные в настоящей заявке, включают «состоящее» и/или «состоящее по существу из» аспектов и вариаций. Все публикации и другие ссылки, упомянутые в настоящей заявке, включены посредством ссылки во всей полноте. Хотя здесь цитируется ряд документов, эта ссылка не является признанием того, что какой-либо из этих документов является частью общих знаний в данной области
ПРИМЕРЫ
Настоящее изобретение дополнительно иллюстрируется следующими примерами.
Пример 1: CAR-Treg, полученные из TNFR2
Материалы и методы
Выделение МНКПК
Клетки крови анонимных здоровых доноров были собраны Etablissement Français du Sang (EFS) в соответствии с руководящими принципами EFS и информированным согласием доноров. На следующий день после сбора крови мононуклеарные клетки периферической крови (МНКПК) выделяли из лейкоцитов с помощью центрифугирования в градиенте фиколла, которое позволяет удалить нежелательные фракции продукта крови, такие как гранулоциты, тромбоциты и оставшиеся контаминанты из красных кровяных телец. Затем представляющие интерес клетки выделяли, как описано ниже.
Выделение FoxP3 Treg
CD4+CD25+CD127low Treg выделяли с использованием набора для выделения регуляторных Т-клеток человека CD4+CD127lowCD25+ (StemCell), следуя инструкциям производителя. Вкратце, клетки CD25+ сначала выделяли из 400-500×106 МНКПК иммуномагнитно-положительной селекцией без колонки с использованием EasySep™ Releasable RapidSpheres™. Затем связанные магнитные частицы удаляли из изолированных EasySep™ CD25+ клеток, а нежелательные не-Treg подвергали истощению. Конечная выделенная фракция содержала высокоочищенные клетки CD4+CD127lowCD25+, которые экспрессируют высокие уровни FoxP3, и сразу же была использована для последующих применений.
Выделение аутологичных В-клеток
Аутологичные CD19+CD20+ В-клетки выделяли с использованием набора для выделения В-клеток человека (StemCell), следуя инструкциям производителя. Вкратце, CD19+CD20+ B-клетки выделяли из 200×106 МНКПК с помощью иммуномагнитной отрицательной селекции. После выделения клетки немедленно замораживали для дальнейшего использования в качестве клеток, презентирующих CD19+CD20+.
Выделение обычных CD4+CD25- Т-клеток
CD4+CD25- Т-клетки выделяли путем выполнения необязательного протокола из набора для выделения регуляторных Т-клеток (StemCell), позволяющего выделять CD4+CD25- Т-клетки для использования в функциональных исследованиях параллельно с Treg.
Активация и культивирование выделенных Treg
Выделенные Treg клетки активировали и культивировали в течение 9 дней. Вкратце, в день 0 клетки Treg (0,5×106) культивировали в 24-луночном планшете (Costar) в бессывороточной среде Xvivo15, содержащей трансферрин человека (OZYME), с добавлением 1000 Ед/мл IL-2 (Euromedex) и 100 нМ рапамицина (Sigma-Aldrich). Поликлональную активацию выполняли с помощью анти-CD3/анти-CD28 Dynabeads от Life Technology (0,5×106 гранул на лунку). На 2, 4 или 5 и 7 или 8 дни в клетки вносили свежую культуральную среду с добавлением 1000 Ед/мл IL-2. Наконец, на 8 или 9 день клетки собирали, подсчитывали и реактивировали.
Протокол трансдукции
Treg трансдуцировали химерным антигенным рецептором (см. ниже) через 2 дня после их активации. Вкратце, трансдукцию проводили, загружая 0,5×107 единиц трансдукции (TU) на мл в каждую лунку. Через 6 часов при 37°C вирусные частицы удаляли промыванием. Затем планшеты инкубировали при 37°C с 5% CO2. Через пять дней эффективность трансдукции анализировали путем измерения процента GFP-положительных клеток при проточной цитометрии.
Количественная оценка экспрессии CAR
Количественную оценку экспрессии CAR на клеточной поверхности проводили путем мечения CAR с помощью APC-конъюгированного белка-L или APC-конъюгированного антитела против гемагглютинина (HA) для HA-меченых CAR и анализировали с помощью проточной цитометрии.
Количественную оценку общей экспрессии CAR проводили вестерн-блоттингом. Вкратце, 5×104 трансдуцированных Treg или нетрансдуцированных («холостая проба») Treg лизировали в RIPA-буфере, подвергали ДСН-ПААГ в денатурирующих условиях и переносили с помощью блота на ПВДФ-мембрану. Затем CAR-экспрессирующиие CD3-дзета, а также эндогенные CD3-дзета окрашивали специфическим для CD3-дзета антителом (анти-CD247, BD Pharmingen). Наконец, мембрану промывали и повторно проводили анализ с антителом к β-актину в качестве контроля нагрузки. Программное обеспечение Image J использовали для количественной оценки интенсивности полос.
CAR-конструкции, используемые для трансдукции
Были сконструированы CAR, состоящие из трансмембранных (TM) TNFR2, TNFR1 или CD8 и костимуляторных внутриклеточных сигнальных доменов в тандеме с CD3-дзета, и ассоциированные с прототипным scFv, направленным против CD19 (FMC63), CD20 (B9E9) и/или IL- 23R (14-11-D07; публикация патента РСТ WO 2016/184570; SEQ ID NO: 65). Конструкции, использованные в этом исследовании, перечислены и описаны в Таблице 1 и на Фигуре 1.
Таблица 1: Конструкции CAR
Более конкретно, CAR против CD19 состоят из лидерной последовательности CD8 человека (aa1-22), метки гемагглютинина, scFv FMC63, направленного против CD19 человека, и линкера, полученного из CD8-альфа человека (aa138-182).
Вслед за линкером конструкция CD19-CAR (CD8TM/4-1BB) состоит из трансмембранного (TM) домена CD8-альфа человека (aa183-206) и костимуляторного внутриклеточного сигнального домена 4-1BB человека (aa214-255) и CD3-дзета (аа52-164); в то время как конструкция CD19-CAR (TNFR2) состоит из TM и внутриклеточного домена TNFR2 человека (aa258-461) и CD3-дзета.
Анти-CD20 CAR состоят из лидерной последовательности CD8 человека (aa1-22), scFv B9E9, направленного против CD20 человека, стрептавидиновой метки и линкера, полученного из CD8 альфа человека (aa138-182).
Вслед за линкером конструкция CD20-CAR (CD8TM/4-1BB) состоит из TM-домена CD8-альфа человека (aa183-206) и костимуляторного внутриклеточного сигнального домена 4-1BB человека (aa214-255) и CD3-дзета (аа52-164); где:
- конструкция CD20-CAR (TNFR2) состоит из TM и костимуляторных внутриклеточных сигнальных доменов человеческого TNFR2 (aa258-461) и CD3-дзета; и
- CD20-CAR (TNFR1) состоит из TM и костимуляторных внутриклеточных сигнальных доменов TNFR1 человека (aa212-455) и CD3-дзета.
Анти-IL-23R CAR состоят из лидерной последовательности человеческого CD8 (aa1-22), scFv, направленного против человеческого IL-23R, и линкера, полученного из человеческого CD8 альфа (aa138-182).
Вслед за линкером конструкция IL-23R-CAR (CD8TM/4-1BB) состоит из трансмембранного домена CD8-альфа человека (aa183-206) и костимуляторного внутриклеточного сигнального домена 4-1BB человека (aa214-255) и CD3-дзета (аа52-164); в то время как конструкция IL-23R-CAR (TNFR2) состоит из трансмембранного и костимуляторного внутриклеточного сигнального домена TNFR2 человека (aa258-461) и CD3-дзета.
Все конструкции CAR клонировали в фазе с P2A линкером и открытой рамкой считывания из усиленного зеленого флуоресцентного белка (GFP).
Фенотипический анализ трансдуцированных Treg клеток
На 9 день культивирования фенотип Treg анализировали с помощью проточной цитометрии, чтобы гарантировать, что процедура трансдукции не повлияла на статус Treg. Маркеры, использованные для этого анализа, перечислены в Таблице 2.
Таблица 2: Материалы и реагенты
Анализ активации CAR
Активацию CAR оценивали либо в клеточной линии Jurkat-Lucia-NFAT (Invivogen), либо в первичных Treg человека. Для репортерной линии клеток после взаимодействия CAR с клетками CD19+ Дауди (соотношение 1:1) активацию NFAT оценивали путем мониторинга активности люциферазы Lucia (см. инструкции производителя) и с использованием люминометра GloMax (Promega).
Для Treg анализ активации проводили на 9 день культивирования. Вкратце, 0,05×106 Treg были засеяны в 96-луночный круглодонный планшет отдельно или в присутствии гранул, покрытых анти-CD28/анти-CD3 (в соотношении 1:1 Treg к гранулам), или в присутствии свежеразмороженных аутологичных B-клеток или CD19+ B-клеток Дауди (в соотношении 1:1 Treg к B-клеткам) в конечном объеме 200 мкл. Через 24 часа при 37°C, 5% CO2 клетки окрашивали на CD4 и CD69, а затем анализировали с помощью проточной цитометрии. Мониторинг спонтанной экспрессии CD69 CAR Treg-клетками по сравнению с нетрансдуцированными клетками Treg позволяет определить интенсивность тонической передачи сигналов.
Анализ супрессии пролиферации Т-клеток
Анализ супрессии проводили на 9 день культивирования. Вкратце, Treg извлекали, подсчитывали и активировали либо через TCR с использованием гранул, покрытых анти-CD28/анти-CD3 (в соотношении 1:1 Treg к гранулам), либо через CAR с использованием свежеразмороженных аутологичных B-клеток (в отношении 1:1 Treg к гранулам), или оставляли без активации для оценки их спонтанной супрессорной активности.
Параллельно аллогенные Tconv (обычные Т-клетки) размораживали, окрашивали красителем Dye 450 и активировали гранулами, покрытыми анти-CD28/анти-CD3 (в соотношении 3:1 Tconv к гранулам). На следующий день гранулы удаляли из Tconv перед их совместным культивированием с неактивированными или активированными Treg клетками (нетрансдуцированными или трансдуцированными).
На 3 день клетки собирали, и пролиферацию Tconv оценивали с помощью проточной цитометрии путем определения разведения красителя 450. Процент ингибирования пролиферации Tconv рассчитывали следующим образом:

Результаты
Эффективность трансдукции и экспрессия CAR на клеточной поверхности
Эффективность трансдукции определяли путем оценки процента GFP-положительных клеток, а экспрессию CAR контролировали путем оценки рекомбинантного белка L, иммуноглобулина, связывающего легкую цепь каппа, для CD20-CAR (CD8TM/4-1BB и TNFR2) и IL-23R CAR (CD8TM/4-1BB и TNFR2) или антитела, направленного против HA метки для CD19-CAR (CD8TM/4-1BB и TNFR2).
Результаты для процента эффективности трансдукции и процента трансдуцированных клеток, которые экспрессировали CAR на клеточной поверхности, показаны в Таблице 3 (на Фигуре 2 показан пример исходных данных) в качестве обзора всех доноров, протестированных в этом примере (n = 5).
Таблица 3: Эффективность трансдукции и экспрессия CAR на поверхности клетки
4-1BB)
4-1BB)
4-1BB)
Как показано на Фигуре 2 и/или в Таблице 3, трансдуцированные CD19-CAR (CD8TM/4-1BB), CD20-CAR (CD8TM/4-1BB) и IL-23R-CAR (CD8TM/4-1BB) клетки содержат более 95% CAR на клеточной поверхности, тогда как клетки, трансдуцированные CD19-CAR (TNFR2), CD20-CAR (TNFR2) и IL-23R-CAR (TNFR2), экспрессировали от 46% до 75% CAR на поверхности клетки. Кроме того, средняя интенсивность флуоресценции (MFI), представляющая количество CAR на клетку, была снижена примерно в 15 раз для CD19-CAR (TNFR2), примерно в 6 раз для CD20-CAR (TNFR2) и примерно в 9 раз для IL- 23R-CAR (TNFR2). Это сильное снижение экспрессии CAR на поверхности клетки не было следствием более низкой эффективности трансдукции, поскольку экспрессия GFP была сопоставимой во всех экспериментальных условиях.
Кроме того, как показано на Фигуре 3, панель A, клетки, трансдуцированные CD20-CAR (CD8TM/4-1BB), экспрессировали белок 62 кДа, соответствующий CAR, после окрашивания антителом к CD3-дзета, и белок 82 кДа для клеток, трансдуцированных CD20-CAR (TNFR2), в то время как нетрансдуцированные клетки были помечены только полосой 16 кДа, соответствующей эндогенному CD3-дзета. Интересно, что количественная оценка интенсивности полосы выявила более низкую экспрессию CD20-CAR (TNFR2) по сравнению с CD20-CAR (CD8TM/4-1BB) (Фигура 3, панель B), как наблюдали с помощью проточной цитометрии (Фигура 2).
Таким образом, результаты продемонстрировали, что внутриклеточный домен TNFR2 и трансмембранный домен TNFR2 неожиданно привели к снижению глобальной экспрессии CAR, особенно на поверхности клетки.
CAR-специфическая активация
Полное снижение антиген-независимой тонической передачи сигналов наблюдается в клетках Treg, трансдуцированных CAR, содержащих домены TNFR2 для трех различных мишеней scFv (CD19, CD20 и IL-23R), по сравнению с классическими конструкциями 4-1BB/CD3-дзета (Фиг.4, панели AC). Более того, несмотря на сильное снижение экспрессии CAR (CD19, CD20 или IL-23R), происходящей из TNFR2, на поверхности клетки (Таблица 3), CAR-специфическая активация сохраняется.
Таким образом, эти результаты демонстрируют, что присутствие трансмембранного TNFR2 и внутриклеточного домена TNFR2 неожиданно привело к сильному снижению фона активации в клетках CAR Treg и, следовательно, к увеличению соотношения между CAR-специфической активацией и лиганд-независимой тонической передачей сигнала. Это явление не зависит от интересующего scFv, поскольку три разных scFv были протестированы и вели себя одинаково (CD19, CD20 и IL-23R).
CAR-опосредованная супрессорная активность
Для конструкции CD19-CAR, несущей домены, производные от TNFR2, CAR-специфический запуск супрессорной активности, сравнимый с таковой у конструкции, полученной из 4-1BB, наблюдался даже при 15-кратном снижении экспрессии CAR на поверхности клетки. (Фиг.5, панель A).
Наиболее интересно то, что в случае конструкций CD20-CAR и IL-23R-CAR, в то время как спонтанная супрессорная активность конструкции, производной от 4-1BB, была слишком сильной, чтобы выделить CAR-опосредованную супрессорную активность, производную от TNFR2, конструкция CAR обеспечивала сильно сниженный фон супрессорной активности, что впервые позволило наблюдать специфическую CAR-опосредованную супрессорную активность (Фиг.5, панели B и 5C).
В заключение, снижение лиганд-независимой тонической передачи сигнала в CAR, производном от TNFR2/CD3-дзета, позволило впервые наблюдать супрессорную активность, опосредованную CD20-CAR и IL-23R-CAR, в то время как те же scFv, гибридизированные с доменом 4-1BB/CD3 дзета, не проявляли заметной активности по сравнению с фоном.
Пример 2: Сравнение CD19-CAR, полученных из TNFR2
Материалы и методы
За исключением конструкций CAR, материалы и методы являются такими же, как описано в Примере 1. Здесь два типа клеток трансдуцировали конструкциями CAR: человеческие Tregs и клетки Jurkat-Lucia-NFAT.
CAR-конструкции, используемые для трансдукции
Конструкции CAR, использованные в этом исследовании, перечислены и описаны в Таблице 4 и на Фигуре 6.
Таблица 4: Конструкции CD19-CAR
Анти-CD19 CAR состоят из лидерной последовательности CD8 человека (aa1-22), scFv FMC63, направленного против CD19 человека, стрептавидиновой метки и линкера, полученного из CD8 альфа человека (aa138-182).
В некоторых случаях костимуляторный внутриклеточный сигнальный домен TNFR2 представляет собой фрагмент домена TNFR2, из которого на С-конце удалены 18, 59, 104 или 151 аминокислотный остаток (δ18, δ59, δ104 или δ151, соответственно). Сигнальный домен TNFR2 можно разделить на 5 доменов, каждый из которых важен для взаимодействия с различными сигнальными молекулами, чтобы запускать различные сигнальные пути. Кроме того, описаны определенные домены для модуляции эндоцитоза TNFR2 (Ji et al., Arterioscler Thromb Vasc Biol. 32 (9): 2271-9 (2012). Чтобы проанализировать, отвечает ли определенный домен за соответствующий фенотип, были сконструированы несколько мутантов с делециями. Делеции выполняли совместно с картированными внутриклеточными доменами, удаляя домены TNFR2 с С-конца. В частности, домен V был удален в конструкции TNFR2 δ18; домены V и IV в TNFR2 δ59; домены V, IV и III в TNFR2 δ104, и домены V, IV, III и II в TNFR2 δ151. Предполагаемые функции этих доменов перечислены в Таблице 5:
Таблица 5: Домены TNFR2
Для дальнейшего анализа влияния трансмембранного домена TNFR2 была создана конструкция, содержащая CD8 TM, за которым следует трансмембранный домен TNFR2, а также конструкции, содержащие только TNFR2 TM, за которым следует CD3-дзета или мембранные гибриды, состоящие из различных количеств аминокислот, полученных из CD8 и TNFR2.
Гибриды трансмембранных доменов состоят из полного домена или части трансмембранного домена CD8-альфа человека, слитого с частью трансмембранного домена TNFR2 человека. Гибридные аминокислотные последовательности, использованные в Примере 2, описаны в Таблице 6.
Таблица 6: Последовательность трансмембранного гибрида CD19-CAR
(SEQ ID NO : 62)
(SEQ ID NO: 60)
(SEQ ID NO : 63)
(SEQ ID NO: 61)
(SEQ ID NO: 64)
Результаты
Экспрессия CD19-CAR на клеточной поверхности Treg человека
CD19-CAR, содержащие трансмембранный домен TNFR2 и при необходимости полный костимуляторный внутриклеточный сигнальный домен TNFR2 или его фрагменты, использовали для определения того, участвует ли костимуляторный внутриклеточный сигнальный домен TNFR2 в снижении экспрессии CAR на поверхности клетки. CD19-CAR, содержащие трансмембранный домен CD8 и внутриклеточный домен 4-1BB, использовали в качестве контроля.
CD19-CAR, содержащие костимуляторный внутриклеточный сигнальный домен TNFR2 и при необходимости трансмембранный домен TNFR2 или гибридный трансмембранный домен CD8/TNFR2, использовали для определения того, участвует ли трансмембранный домен TFNR2 в снижении экспрессии CAR на поверхности клетки. CD19-CAR, содержащие костимуляторный внутриклеточный сигнальный домен TNFR2 и трансмембранный домен CD8, использовали в качестве контроля.
Как показано в Таблице 7, снижение экспрессии CAR на клеточной поверхности наблюдалось с CAR, содержащими трансмембранный домен TNFR2, а также с CAR, содержащими внутриклеточный домен TNFR2, но не наблюдалось с CAR, содержащими трансмембранный домен CD8 и 4-1BB внутриклеточный домен при отсутствии каких-либо доменов TNFR2.
Таблица 7: Экспрессия CD19-CAR на клеточной поверхности Treg человека без активации
В целом эти результаты демонстрируют, что трансмембранный и костимуляторный внутриклеточные сигнальные домены TNFR2 участвуют в снижении экспрессии CAR на клеточной поверхности человеческих Treg клеток.
CD19-CAR-специфическая активация Treg человека
CD19-CAR, содержащие трансмембранный домен TNFR2 и при необходимости полный костимуляторный внутриклеточный сигнальный домен TNFR2 или его фрагменты, использовали для определения того, участвует ли костимуляторный внутриклеточный сигнальный домен TNFR2 в активации CAR. CD19-CAR, содержащие костимуляторный внутриклеточный сигнальный домен 4-1BB и трансмембранный домен CD8, использовали в качестве контроля.
CD19-CAR, содержащие костимуляторный внутриклеточный сигнальный домен TNFR2 и при необходимости трансмембранный домен TNFR2 или гибридный трансмембранный домен CD8/TNFR2, использовали для определения того, участвует ли трансмембранный домен TFNR2 в активации CAR. CD19-CAR, содержащие костимуляторный внутриклеточный сигнальный домен 4-1BB и трансмембранный домен CD8, использовали в качестве контроля.
Как показано в Таблице 8, снижение тонической передачи сигналов, оцениваемое по уровню экспрессии маркера ранней активации CD69, наблюдалось с CAR, содержащими костимуляторный внутриклеточный сигнальный домен TNFR2 и гибридные трансмембранные домены CD8/TNFR2, но не с CAR, содержащими трансмембранный домен CD8/ костимуляторный внутриклеточный сигнальный домен 4-1BB. Несмотря на низкий уровень экспрессии, CAR, происходящие из TNFR2, были эффективно активированы CD19+ клетками Дауди. В нетрансдуцированных клетках фон экспрессии CD69 составляет 9% при отсутствии или 32% в присутствии клеток Дауди.
Таблица 8: Активация CD19-CAR в человеческих Treg.
Экспрессия CD19-CAR на поверхности клеток Jurkat-T
Как и в случае с человеческими Treg-клетками, экспрессию CD19-CAR также анализировали в клетках Jurkat-Lucia-NFAT с использованием конструкций CAR, описанных в Таблице 5. Эта линия репортерных клеток получена из иммортализованных клеток Jurkat Т-лимфоцитов человека.
Как показано в Таблице 9, снижение экспрессии CAR на клеточной поверхности также наблюдалось в клетках Jurkat-T с CAR, содержащими трансмембранный домен TNFR2, а также с CAR, содержащими костимуляторный внутриклеточный сигнальный домен TNFR2, но не с CAR, содержащими конструкцию костимуляторного внутриклеточного сигнального домена трансмембранного домена CD8 / 4-1BB.
Таблица 9: Экспрессия CD19-CAR на поверхности клеток Jurkat-T без активации
Эти результаты демонстрируют, что трансмембранный домен TNFR2 и костимуляторный внутриклеточный сигнальный домен TNFR2 участвуют в снижении экспрессии CAR на поверхности Jurkat-T-клеток.
TNFR-c-концевые делеционные конструкции демонстрируют различный характер поверхностной экспрессии и являются функциональными в передаче сигнала CD3z в клетках Jurkat-NFAT.
Чтобы проверить целостность созданных конструкций CD19-CAR, уровни поверхностной экспрессии и передачу сигнала NFAT анализировали в линии Т-клеток Jurkat NFAT-Lucia.
Сильное снижение экспрессии на клеточной поверхности наблюдалось с полным CAR TNFR2 по сравнению с CAR CD8TM-41BB (Фиг.7). Это снижение уровней экспрессии было частично отменено, когда домен TNFR2-TM был заменен доменом CD8 TM. Кроме того, делеция доменов V, IV и III TNFR2 не изменяла экспрессию на клеточной поверхности, обнаруживаемую из полного домена TNFR2. Однако после делеции доменов II и I уровни экспрессии повысились до половины уровней, наблюдаемых с конструкцией 4-1BB. В то же время все конструкции продолжали демонстрировать зависимую от мишени передачу сигналов NFAT. Эти результаты вместе показывают, что домены I и II TNFR2 вносят вклад в снижение экспрессии на клеточной поверхности CAR, происходящих из TNFR2, и что сниженный эффект делеционного мутанта не связан с не-свернутым белком, поскольку CAR все еще может проявлять CD3z-зависимую передачу сигнала NFAT.
CD19-CAR-специфическая активация в клетках Jurkat-T
CD19-CAR-специфическую активацию также анализировали в клетках Jurkat-Lucia-NFAT путем измерения активации NFAT после взаимодействия с CAR-лигандом после инкубации с CD19+ клетками Дауди.
Как показано в Таблице 10, несмотря на низкий уровень экспрессии, все CAR, полученные из TNFR2, эффективно активируются CD19+ клетками Дауди.
Таблица 10: Активация CD19-CAR клеток Jurkat-Lucia-NFAT
Пример 3: Оценка анти-CD20 CAR, несущих различные трансмембранные и внутриклеточные сигнальные домены, происходящие от различных рецепторов TNFR (4-1BB, TNFR1 и TNFR2)
Материалы и методы
Используемые материалы и методы были такими же, как описано в Примере 1.
Результаты
Уровень экспрессии анти-CD20 CAR, несущих различные внутриклеточные домены TNFR
Ранее и в настоящем исследовании снижение экспрессии анти-CD20 CAR наблюдалось для конструкции, несущей трансмембранный и внутриклеточный домен TNFR2, по сравнению с конструкцией, несущей внутриклеточный домен 4-1BB (Фиг.8). В этом исследовании новые CAR, содержащие сигнальные домены, полученные из TNFR, были сконструированы с использованием трансмембранного и внутриклеточного домена человеческого TNFR1 (нуклеотидная и аминокислотная последовательности CD20-CAR (TNFR1TM-TNFR1-CD3z)-P2A-GFP представляют собой SEQ ID NO: 108 и 109, соответственно). Как показано на Фиг.8, эти новые CAR также экспрессируются на низком уровне на поверхности клетки по сравнению с CAR, полученным из 4-1BB. Однако CAR, содержащий последовательность, полученную из TNFR1, токсичен и сильно влияет на выживаемость FoxP3 Treg (выживаемость 63%). Кроме того, живые/ апоптотические клетки экспрессируют CAR, полученный из TNFR1, с диффузным характером (Фиг.8, нижняя левая панель).
Лиганд-независимая тоническая передача сигналов и активационная способность анти-CD20 CAR, несущих различные внутриклеточные домены TNFR
Путем мониторинга экспрессии маркера CD69 на неактивированных CAR-Treg клетках ранее наблюдали сильную лиганд-независимую тоническую передачу сигнала с конструкцией анти-CD20 CAR, несущей внутриклеточный домен 4-1BB. Напротив, эта тоническая передача сигнал была сильно снижена для анти-CD20 CAR, несущего трансмембранный и внутриклеточный домен TNFR2. Настоящее исследование показывает, что среди всех CAR, полученных из TNFR (Фиг.9), только CAR, полученный из TNFR2, был способен сильно снижать тоническую передачу сигналов (15% по сравнению с 11% в контроле), в то время как конструкции, содержащие последовательности 4-1BB и TNFR1, обеспечивают тоническую передачу сигналов примерно 40% и 32%, соответственно. Этот результат подчеркивает способность CAR, полученных из TNFR2, специфически снижать лиганд-независимую тоническую передачу сигналов.
Для оценки активации CAR клетки CAR-Treg инкубировали в течение 24 часов с аутологичными В-клетками, экспрессирующими лиганд CD20 CAR. Как показано на Фиг.9, наиболее сильная активация CAR наблюдается для CAR, полученных из TNFR2 (2,5 раза), в то время как все другие CAR-Treg активированы слабо (менее, чем в 1,8 раза).
Супрессорную активность клеток CAR-Treg оценивали путем мониторинга пролиферации клеток Tconv, совместно культивируемых с CAR-Treg, при отсутствии или в присутствии В-клеток (В-клеток) (Фиг.10). Опять же, спонтанная супрессорная активность классической конструкции анти-CD20 CAR (CD8 TM/4-1BB) была слишком сильной, чтобы выделить CAR-опосредованную супрессорную активность. Напротив, анти-CD20 CAR, полученный из TNFR2, позволял наблюдать CAR-опосредованную супрессорную активность. Анти-CD20 CAR, полученный из TNFR1, проявлял очень слабую супрессорную активность.
Чтобы лучше определить и сравнить эффективность различных CAR, полученных из TNFR, способность подавлять пролиферацию Tconv была представлена как функция абсолютного количества клеток CAR-Treg, присутствующих в совместной культуре. Как показано на Фиг.11, CAR, полученный из TNFR1, был крайне неэффективен (14750 CAR-Tregs для запуска 50% супрессии).
Эти результаты демонстрируют, что среди различных кандидатов TNFR человека использование трансмембранного TNFR2 и костимуляторных внутриклеточных сигнальных доменов TNFR2 в CAR является оптимальной комбинацией для создания CAR-Treg с очень низкой лиганд-независимой тонической передачей сигнала и оптимальной CAR-зависимой активацией и супрессорной активностью Treg.
Пример 4: Маркеры/фенотип Treg
Материалы и методы
Используемые материалы и методы были такими же, как описано в Примере 1.
Результаты
Фенотип анти-IL-23R CAR-Treg в культуре
Результаты для фенотипа IL-23R CAR-Treg на 9 день представлены в следующей таблице (Таблица 11). Результаты выражаются в процентах клеток, положительных по каждому маркеру.
Таблица 11: Фенотип IL-23R CAR-Treg на 9-й день
(4-1BB/CD3z)
(4-1BB/CD3z)
(4-1BB/CD3z)
(4-1BB/CD3z)
(4-1BB/CD3z)
(4-1BB/CD3z)
Интересно, что мы наблюдали, что Treg, трансдуцированные IL-23R-CAR (4-1BB/CD3z), который высоко экспрессируется на поверхности клетки, демонстрировали потерю стабильности, подчеркнутую снижением FoxP3, Helios и CD62L (жирный шрифт) и увеличение CD127 (жирный шрифт). Однако Treg, трансдуцированные IL-23R-CAR (TNFR2/CD3z), демонстрируют 9-кратное снижение экспрессии на клеточной поверхности (191,1 ± 53,2 для CAR, полученного из 4-1BB, по сравнению с 20,5 ± 3,4 для CAR, полученного от TNFR2; см. Таблицу 3), подчеркивая устойчивый фенотип Treg после 9 дней культивирования.
Фенотип анти-CD20 CAR-Treg в культуре
Результаты для фенотипа анти-CD20 CAR-Treg на 15 день представлены в следующей таблице (Таблица 12). Результаты выражены в процентах или средней флуоресценции положительных клеток для каждого маркера.
Таблица 12: Фенотип анти-CD20 CAR-Treg
(в популяции FoxP3+)
Интересно, что фенотип Treg статистически не отличается между различными конструкциями CAR-Treg и контролем, трансдуцированным только GFP.
Пример 5: Использование CAR-Treg in vivo
Материалы и методы
РТПХ
За день до инъекции человеческих МНКПК HLA-A2+ всего 23 мышей NSG (в возрасте 8 недель) кондиционировали интраперитонеальной инъекцией бусульфана 30 мг/кг для содействия приживлению клеток человека. Через день (в день 0) мышам внутривенно вводили МНКПК HLA-A*02+ человека (5×106 МНКПК на мышь) и HLA-A2 CAR Treg человека в соотношении 1:1 МНКПК: CAR-Treg. Три раза в неделю мышей взвешивали (BW) и оценивали показатель РТПХ. Образцы крови брали каждую неделю. При умерщвлении также анализировали селезенку и легкие. Человеческие Treg выделяли у HLA-A2-отрицательных здоровых добровольцев и трансдуцировали, как описано ранее.
Результаты
CAR Treg, содержащие ко-сигнальные домены CD28, TNFR2 или TNFR2+ 4-1BB, тестировали на их активность in vivo на мышиной модели РТПХ. Три разные конструкции CAR (Фиг.12) трансдуцировали в CD4+CD25+CD127low, CD45RA+ человеческие Treg, как описано ранее.
Эффективность трансдукции оценивали по проценту экспрессии GFP-положительных клеток, а экспрессию CAR контролировали с помощью Dextramer®. Как показано на Фиг.13, Treg были трансдуцированы на 27%, 56% и 34% с помощью CD28, или TNFR2, или TNFR2+4-1BB HLA*A2 CAR, соответственно.
Три разных HLA*A2 CAR-Treg демонстрировали устойчивый фенотип Treg CD4+ CD45RA+ FoxP3+ CTLA-4+ (Фиг.14).
HLA*A2 CAR-Treg вводили мышам NSG в соотношении 1:1 (МНКПК: CAR-Treg). Все HLA*A2 CAR-Treg, содержащие ко-сигнальные домены TNFR2, TNFR2+4-1BB или CD28, были способны контролировать РТПХ (Фиг.15).
Таблица 13. Последовательности
1 - SID: SEQ ID NO: 2 - aa: аминокислота, nt: нуклеотид
--->
SEQUENCE LISTING
<110> SANGAMO THERAPEUTICS FRANCE
<120> NEW CAR CONSTRUCTS COMPRISING TNFR2 DOMAINS
<130> 025297.WO003
<140>
<141>
<150> 62/717,234
<151> 2018-08-10
<160> 117
<170> PatentIn version 3.5
<210> 1
<211> 242
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-CD19 ScFv"
<400> 1
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr His Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Thr Gly Gly Gly Gly Ser
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Lys Leu Gln Glu
115 120 125
Ser Gly Pro Gly Leu Val Ala Pro Ser Gln Ser Leu Ser Val Thr Cys
130 135 140
Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly Val Ser Trp Ile Arg
145 150 155 160
Gln Pro Pro Arg Lys Gly Leu Glu Trp Leu Gly Val Ile Trp Gly Ser
165 170 175
Glu Thr Thr Tyr Tyr Asn Ser Ala Leu Lys Ser Arg Leu Thr Ile Ile
180 185 190
Lys Asp Asn Ser Lys Ser Gln Val Phe Leu Lys Met Asn Ser Leu Gln
195 200 205
Thr Asp Asp Thr Ala Ile Tyr Tyr Cys Ala Lys His Tyr Tyr Tyr Gly
210 215 220
Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser Val Thr Val
225 230 235 240
Ser Ser
<210> 2
<211> 245
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="FMC63"
<400> 2
Asp Ile Gln Met Thr Gln Thr Thr Ser Ser Leu Ser Ala Ser Leu Gly
1 5 10 15
Asp Arg Val Thr Ile Ser Cys Arg Ala Ser Gln Asp Ile Ser Lys Tyr
20 25 30
Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly Thr Val Lys Leu Leu Ile
35 40 45
Tyr His Thr Ser Arg Leu His Ser Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Tyr Ser Leu Thr Ile Ser Asn Leu Glu Gln
65 70 75 80
Glu Asp Ile Ala Thr Tyr Phe Cys Gln Gln Gly Asn Thr Leu Pro Tyr
85 90 95
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Thr Gly Ser Thr Ser Gly
100 105 110
Ser Gly Lys Pro Gly Ser Gly Glu Gly Ser Thr Lys Gly Glu Val Lys
115 120 125
Leu Gln Glu Ser Gly Pro Gly Leu Val Ala Pro Ser Gln Ser Leu Ser
130 135 140
Val Thr Cys Thr Val Ser Gly Val Ser Leu Pro Asp Tyr Gly Val Ser
145 150 155 160
Trp Ile Arg Gln Pro Pro Arg Lys Gly Leu Glu Trp Leu Gly Val Ile
165 170 175
Trp Gly Ser Glu Thr Thr Tyr Tyr Asn Ser Ala Leu Lys Ser Arg Leu
180 185 190
Thr Ile Ile Lys Asp Asn Ser Lys Ser Gln Val Phe Leu Lys Met Asn
195 200 205
Ser Leu Gln Thr Asp Asp Thr Ala Ile Tyr Tyr Cys Ala Lys His Tyr
210 215 220
Tyr Tyr Gly Gly Ser Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr Ser
225 230 235 240
Val Thr Val Ser Ser
245
<210> 3
<211> 245
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="RITUXIMAB"
<400> 3
Ser Gln Ile Val Leu Ser Gln Ser Pro Ala Ile Leu Ser Ala Ser Pro
1 5 10 15
Gly Glu Lys Val Thr Met Thr Cys Arg Ala Ser Ser Ser Leu Ser Phe
20 25 30
Met His Trp Tyr Gln Gln Lys Pro Gly Ser Ser Pro Lys Pro Trp Ile
35 40 45
Tyr Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Val Glu Ala
65 70 75 80
Glu Asp Ala Ala Thr Tyr Phe Cys His Gln Trp Ser Ser Asn Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg Ser Gly Gly Gly
100 105 110
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Ser Gln Val
115 120 125
Gln Leu Arg Gln Pro Gly Ala Glu Leu Val Lys Pro Gly Ala Ser Val
130 135 140
Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr Asn Met
145 150 155 160
His Trp Val Lys Gln Thr Pro Gly Gln Gly Leu Glu Trp Ile Gly Ala
165 170 175
Ile Tyr Pro Gly Asn Gly Asp Thr Ser Tyr Asn Gln Lys Phe Lys Gly
180 185 190
Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr Met Gln
195 200 205
Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys Ala Arg
210 215 220
Ser His Tyr Gly Ser Asn Tyr Val Asp Tyr Trp Gly Gln Gly Thr Thr
225 230 235 240
Leu Thr Val Ser Ser
245
<210> 4
<211> 271
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-CD20 ScFv"
<400> 4
Asp Ile Gln Leu Thr Gln Ser Pro Ala Ile Leu Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Arg Ala Ser Ser Ser Leu Ser Phe Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Ser Ser Pro Lys Pro Trp Ile Tyr
35 40 45
Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Thr Val Glu Ala Glu
65 70 75 80
Asp Ala Ala Ser Tyr Phe Cys His Gln Trp Ser Ser Asn Pro Leu Thr
85 90 95
Phe Gly Ala Gly Thr Lys Leu Glu Ile Ser Ser Gly Gly Gly Gly Ser
100 105 110
Gly Gly Gly Gly Ser Gly Asp Val Met Gly Val Asp Ser Gly Gly Gly
115 120 125
Leu Val Gln Pro Gly Gly Ser Arg Lys Leu Ser Cys Ala Ala Pro Gly
130 135 140
Phe Thr Phe Ser Ser Phe Gly Met His Trp Val Arg Gln Ala Pro Glu
145 150 155 160
Lys Gly Leu Glu Trp Val Ala Tyr Ile Ser Ser Pro Ser Ser Thr Leu
165 170 175
His Tyr Ala Asp Arg Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn
180 185 190
Pro Lys Asn Thr Leu Phe Leu Gln Met Lys Leu Pro Ser Leu Cys Tyr
195 200 205
Gly Leu Leu Gly Pro Arg Asp His Val His Arg Leu Leu Lys His His
210 215 220
His His His His Leu Glu Tyr Pro Tyr Asp Val Pro Asp Tyr Ala Thr
225 230 235 240
Thr Asp Ala Ala His Pro Gly Arg Ser Val Val Pro Ala Leu Leu Pro
245 250 255
Leu Leu Ala Gly Thr Leu Leu Leu Leu Glu Thr Ala Thr Ala Pro
260 265 270
<210> 5
<211> 249
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-CD20 ScFv"
<400> 5
Ser Gln Val Gln Leu Val Gln Ser Gly Ala Glu Leu Val Lys Pro Gly
1 5 10 15
Ala Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser
20 25 30
Tyr Asn Met His Trp Val Lys Gln Thr Pro Gly Gln Gly Leu Glu Trp
35 40 45
Ile Gly Ala Ile Tyr Pro Gly Asn Gly Asp Thr Ser Tyr Asn Gln Lys
50 55 60
Phe Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala
65 70 75 80
Tyr Met Gln Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Ala Gln Leu Arg Pro Asn Tyr Trp Tyr Phe Asp Val Trp
100 105 110
Gly Ala Gly Thr Thr Val Thr Val Ser Lys Ile Ser Gly Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Ser Ser Asp
130 135 140
Ile Val Leu Ser Gln Ser Pro Ala Ile Leu Ser Ala Ser Pro Gly Glu
145 150 155 160
Lys Val Thr Met Thr Cys Arg Ala Ser Ser Ser Val Ser Tyr Met His
165 170 175
Trp Tyr Gln Gln Lys Pro Gly Ser Ser Pro Lys Pro Trp Ile Tyr Ala
180 185 190
Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser Gly
195 200 205
Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Val Glu Ala Glu Asp
210 215 220
Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ile Ser Asn Pro Pro Thr Phe
225 230 235 240
Gly Ala Gly Thr Lys Leu Glu Leu Lys
245
<210> 6
<211> 245
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-CD20 ScFv"
<400> 6
Ser Gln Ile Val Leu Ser Gln Ser Pro Ala Ile Leu Ser Ala Ser Pro
1 5 10 15
Gly Glu Lys Val Thr Met Thr Cys Arg Ala Ser Ser Ser Leu Ser Phe
20 25 30
Met His Trp Tyr Gln Gln Lys Pro Gly Ser Ser Pro Lys Pro Trp Ile
35 40 45
Tyr Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg Val Glu Ala
65 70 75 80
Glu Asp Ala Ala Thr Tyr Phe Cys His Gln Trp Ser Ser Asn Pro Leu
85 90 95
Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Arg Ser Gly Gly Gly
100 105 110
Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Ser Gln Val
115 120 125
Gln Leu Arg Gln Pro Gly Ala Glu Leu Val Lys Pro Gly Ala Ser Val
130 135 140
Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr Asn Met
145 150 155 160
His Trp Val Lys Gln Thr Pro Gly Gln Gly Leu Glu Trp Ile Gly Ala
165 170 175
Ile Tyr Pro Gly Asn Gly Asp Thr Ser Tyr Asn Gln Lys Phe Lys Gly
180 185 190
Lys Ala Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr Met Gln
195 200 205
Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys Ala Arg
210 215 220
Ser His Tyr Gly Ser Asn Tyr Val Asp Tyr Trp Gly Gln Gly Thr Thr
225 230 235 240
Leu Thr Val Ser Ser
245
<210> 7
<211> 441
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-desmo 3 (domain 1-4)"
<400> 7
Glu Trp Val Lys Phe Ala Lys Pro Cys Arg Glu Gly Glu Asp Asn Ser
1 5 10 15
Lys Arg Asn Pro Ile Ala Lys Ile Thr Ser Asp Tyr Gln Ala Thr Gln
20 25 30
Lys Ile Thr Tyr Arg Ile Ser Gly Val Gly Ile Asp Gln Pro Pro Phe
35 40 45
Gly Ile Phe Val Val Asp Lys Asn Thr Gly Asp Ile Asn Ile Thr Ala
50 55 60
Ile Val Asp Arg Glu Glu Thr Pro Ser Phe Leu Ile Thr Cys Arg Ala
65 70 75 80
Leu Asn Ala Gln Gly Leu Asp Val Glu Lys Pro Leu Ile Leu Thr Val
85 90 95
Lys Ile Leu Asp Ile Asn Asp Asn Pro Pro Val Phe Ser Gln Gln Ile
100 105 110
Phe Met Gly Glu Ile Glu Glu Asn Ser Ala Ser Asn Ser Leu Val Met
115 120 125
Ile Leu Asn Ala Thr Asp Ala Asp Glu Pro Asn His Leu Asn Ser Lys
130 135 140
Ile Ala Phe Lys Ile Val Ser Gln Glu Pro Ala Gly Thr Pro Met Phe
145 150 155 160
Leu Leu Ser Arg Asn Thr Gly Glu Val Arg Thr Leu Thr Asn Ser Leu
165 170 175
Asp Arg Glu Gln Ala Ser Ser Tyr Arg Leu Val Val Ser Gly Ala Asp
180 185 190
Lys Asp Gly Glu Gly Leu Ser Thr Gln Cys Glu Cys Asn Ile Lys Val
195 200 205
Lys Asp Val Asn Asp Asn Phe Pro Met Phe Arg Asp Ser Gln Tyr Ser
210 215 220
Ala Arg Ile Glu Glu Asn Ile Leu Ser Ser Glu Leu Leu Arg Phe Gln
225 230 235 240
Val Thr Asp Leu Asp Glu Glu Tyr Thr Asp Asn Trp Leu Ala Val Tyr
245 250 255
Phe Phe Thr Ser Gly Asn Glu Gly Asn Trp Phe Glu Ile Gln Thr Asp
260 265 270
Pro Arg Thr Asn Glu Gly Ile Leu Lys Val Val Lys Ala Leu Asp Tyr
275 280 285
Glu Gln Leu Gln Ser Val Lys Leu Ser Ile Ala Val Lys Asn Lys Ala
290 295 300
Glu Phe His Gln Ser Val Ile Ser Arg Tyr Arg Val Gln Ser Thr Pro
305 310 315 320
Val Thr Ile Gln Val Ile Asn Val Arg Glu Gly Ile Ala Phe Arg Pro
325 330 335
Ala Ser Lys Thr Phe Thr Val Gln Lys Gly Ile Ser Ser Lys Lys Leu
340 345 350
Val Asp Tyr Ile Leu Gly Thr Tyr Gln Ala Ile Asp Glu Asp Thr Asn
355 360 365
Lys Ala Ala Ser Asn Val Lys Tyr Val Met Gly Arg Asn Asp Gly Gly
370 375 380
Tyr Leu Met Ile Asp Ser Lys Thr Ala Glu Ile Lys Phe Val Lys Asn
385 390 395 400
Met Asn Arg Asp Ser Thr Phe Ile Val Asn Lys Thr Ile Thr Ala Glu
405 410 415
Val Leu Ala Ile Asp Glu Tyr Thr Gly Lys Thr Ser Thr Gly Thr Val
420 425 430
Tyr Val Arg Val Pro Asp Phe Asn Asp
435 440
<210> 8
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="Linker"
<400> 8
Ala Gly Ser Ser Ser Ser Gly Gly Ser Thr Thr Gly Gly Ser Thr Thr
1 5 10 15
<210> 9
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="Linker"
<400> 9
Gly Thr Thr Ala Ala Ser Gly Ser Ser Gly Gly Ser Ser Ser Gly Ala
1 5 10 15
<210> 10
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="Linker"
<400> 10
Ser Ser Ala Thr Ala Thr Ala Gly Thr Gly Ser Ser Thr Gly Ser Thr
1 5 10 15
<210> 11
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="Linker"
<400> 11
Thr Ser Gly Ser Thr Gly Thr Ala Ala Ser Ser Thr Ser Thr Ser Thr
1 5 10 15
<210> 12
<211> 30
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
oligonucleotide"
<220>
<221> source
<223> /note="Linker"
<400> 12
ggtggcggag gttctggagg tggaggttcc 30
<210> 13
<211> 7
<212> PRT
<213> Homo sapiens
<220>
<221> source
<223> /note="KIR2DS2 hinge domain"
<400> 13
Lys Ile Arg Arg Asp Ser Ser
1 5
<210> 14
<211> 45
<212> PRT
<213> Homo sapiens
<220>
<221> source
<223> /note="CD8 hinge domain"
<400> 14
Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala
1 5 10 15
Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly
20 25 30
Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp
35 40 45
<210> 15
<211> 135
<212> DNA
<213> Homo sapiens
<220>
<221> source
<223> /note="CD8 hinge domain"
<400> 15
accacgacgc cagcgccgcg accaccaaca ccggcgccca ccatcgcgtc gcagcccctg 60
tccctgcgcc cagaggcgtg ccggccagcg gcggggggcg cagtgcacac gagggggctg 120
gacttcgcct gtgat 135
<210> 16
<211> 230
<212> PRT
<213> Homo sapiens
<220>
<221> source
<223> /note="IgG4 hinge domain"
<400> 16
Glu Ser Lys Tyr Gly Pro Pro Cys Pro Pro Cys Pro Ala Pro Glu Phe
1 5 10 15
Leu Gly Gly Pro Ser Val Phe Leu Phe Pro Pro Lys Pro Lys Asp Thr
20 25 30
Leu Met Ile Ser Arg Thr Pro Glu Val Thr Cys Val Val Val Asp Val
35 40 45
Ser Gln Glu Asp Pro Glu Val Gln Phe Asn Trp Tyr Val Asp Gly Val
50 55 60
Glu Val His Asn Ala Lys Thr Lys Pro Arg Glu Glu Gln Phe Asn Ser
65 70 75 80
Thr Tyr Arg Val Val Ser Val Leu Thr Val Leu His Gln Asp Trp Leu
85 90 95
Asn Gly Lys Glu Tyr Lys Cys Lys Val Ser Asn Lys Gly Leu Pro Ser
100 105 110
Ser Ile Glu Lys Thr Ile Ser Lys Ala Lys Gly Gln Pro Arg Glu Pro
115 120 125
Gln Val Tyr Thr Leu Pro Pro Ser Gln Glu Glu Met Thr Lys Asn Gln
130 135 140
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
145 150 155 160
Val Glu Trp Glu Ser Asn Gly Gln Pro Glu Asn Asn Tyr Lys Thr Thr
165 170 175
Pro Pro Val Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Arg Leu
180 185 190
Thr Val Asp Lys Ser Arg Trp Gln Glu Gly Asn Val Phe Ser Cys Ser
195 200 205
Val Met His Glu Ala Leu His Asn His Tyr Thr Gln Lys Ser Leu Ser
210 215 220
Leu Ser Leu Gly Lys Met
225 230
<210> 17
<211> 690
<212> DNA
<213> Homo sapiens
<220>
<221> source
<223> /note="IgG4 hinge domain"
<400> 17
gagagcaagt acggccctcc ctgcccccct tgccctgccc ccgagttcct gggcggaccc 60
agcgtgttcc tgttcccccc caagcccaag gacaccctga tgatcagccg gacccccgag 120
gtgacctgtg tggtggtgga cgtgtcccag gaggaccccg aggtccagtt caactggtac 180
gtggacggcg tggaggtgca caacgccaag accaagcccc gggaggagca gttcaatagc 240
acctaccggg tggtgtccgt gctgaccgtg ctgcaccagg actggctgaa cggcaaggaa 300
tacaagtgta aggtgtccaa caagggcctg cccagcagca tcgagaaaac catcagcaag 360
gccaagggcc agcctcggga gccccaggtg tacaccctgc cccctagcca agaggagatg 420
accaagaacc aggtgtccct gacctgcctg gtgaagggct tctaccccag cgacatcgcc 480
gtggagtggg agagcaacgg ccagcccgag aacaactaca agaccacccc ccctgtgctg 540
gacagcgacg gcagcttctt cctgtacagc cggctgaccg tggacaagag ccggtggcag 600
gagggcaacg tctttagctg ctccgtgatg cacgaggccc tgcacaacca ctacacccag 660
aagagcctga gcctgtccct gggcaagatg 690
<210> 18
<211> 282
<212> PRT
<213> Homo sapiens
<220>
<221> source
<223> /note="IgD hinge domain"
<400> 18
Arg Trp Pro Glu Ser Pro Lys Ala Gln Ala Ser Ser Val Pro Thr Ala
1 5 10 15
Gln Pro Gln Ala Glu Gly Ser Leu Ala Lys Ala Thr Thr Ala Pro Ala
20 25 30
Thr Thr Arg Asn Thr Gly Arg Gly Gly Glu Glu Lys Lys Lys Glu Lys
35 40 45
Glu Lys Glu Glu Gln Glu Glu Arg Glu Thr Lys Thr Pro Glu Cys Pro
50 55 60
Ser His Thr Gln Pro Leu Gly Val Tyr Leu Leu Thr Pro Ala Val Gln
65 70 75 80
Asp Leu Trp Leu Arg Asp Lys Ala Thr Phe Thr Cys Phe Val Val Gly
85 90 95
Ser Asp Leu Lys Asp Ala His Leu Thr Trp Glu Val Ala Gly Lys Val
100 105 110
Pro Thr Gly Gly Val Glu Glu Gly Leu Leu Glu Arg His Ser Asn Gly
115 120 125
Ser Gln Ser Gln His Ser Arg Leu Thr Leu Pro Arg Ser Leu Trp Asn
130 135 140
Ala Gly Thr Ser Val Thr Cys Thr Leu Asn His Pro Ser Leu Pro Pro
145 150 155 160
Gln Arg Leu Met Ala Leu Arg Glu Pro Ala Ala Gln Ala Pro Val Lys
165 170 175
Leu Ser Leu Asn Leu Leu Ala Ser Ser Asp Pro Pro Glu Ala Ala Ser
180 185 190
Trp Leu Leu Cys Glu Val Ser Gly Phe Ser Pro Pro Asn Ile Leu Leu
195 200 205
Met Trp Leu Glu Asp Gln Arg Glu Val Asn Thr Ser Gly Phe Ala Pro
210 215 220
Ala Arg Pro Pro Pro Gln Pro Gly Ser Thr Thr Phe Trp Ala Trp Ser
225 230 235 240
Val Leu Arg Val Pro Ala Pro Pro Ser Pro Gln Pro Ala Thr Tyr Thr
245 250 255
Cys Val Val Ser His Glu Asp Ser Arg Thr Leu Leu Asn Ala Ser Arg
260 265 270
Ser Leu Glu Val Ser Tyr Val Thr Asp His
275 280
<210> 19
<211> 847
<212> DNA
<213> Homo sapiens
<220>
<221> source
<223> /note="IgD hinge domain"
<400> 19
aggtggcccg aaagtcccaa ggcccaggca tctagtgttc ctactgcaca gccccaggca 60
gaaggcagcc tagccaaagc tactactgca cctgccacta cgcgcaatac tggccgtggc 120
ggggaggaga agaaaaagga gaaagagaaa gaagaacagg aagagaggga gaccaagacc 180
cctgaatgtc catcccatac ccagccgctg ggcgtctatc tcttgactcc cgcagtacag 240
gacttgtggc ttagagataa ggccaccttt acatgtttcg tcgtgggctc tgacctgaag 300
gatgcccatt tgacttggga ggttgccgga aaggtaccca cagggggggt tgaggaaggg 360
ttgctggagc gccattccaa tggctctcag agccagcact caagactcac ccttccgaga 420
tccctgtgga acgccgggac ctctgtcaca tgtactctaa atcatcctag cctgccccca 480
cagcgtctga tggcccttag agagccagcc gcccaggcac cagttaagct tagcctgaat 540
ctgctcgcca gtagtgatcc cccagaggcc gccagctggc tcttatgcga agtgtccggc 600
tttagcccgc ccaacatctt gctcatgtgg ctggaggacc agcgagaagt gaacaccagc 660
ggcttcgctc cagcccggcc cccaccccag ccgggttcta ccacattctg ggcctggagt 720
gtcttaaggg tcccagcacc acctagcccc cagccagcca catacacctg tgttgtgtcc 780
catgaagata gcaggaccct gctaaatgct tctaggagtc tggaggtttc ctacgtgact 840
gaccatt 847
<210> 20
<211> 39
<212> PRT
<213> Homo sapiens
<220>
<221> source
<223> /note="CD28 hinge domain"
<400> 20
Ile Glu Val Met Tyr Pro Pro Pro Tyr Leu Asp Asn Glu Lys Ser Asn
1 5 10 15
Gly Thr Ile Ile His Val Lys Gly Lys His Leu Cys Pro Ser Pro Leu
20 25 30
Phe Pro Gly Pro Ser Lys Pro
35
<210> 21
<211> 117
<212> DNA
<213> Homo sapiens
<220>
<221> source
<223> /note="CD28 hinge domain"
<400> 21
attgaagtta tgtatcctcc tccttaccta gacaatgaga agagcaatgg aaccattatc 60
catgtgaaag ggaaacacct ttgtccaagt cccctatttc ccggaccttc taagccc 117
<210> 22
<211> 30
<212> PRT
<213> Homo sapiens
<220>
<221> source
<223> /note="TNFR2 TM domain"
<400> 22
Phe Ala Leu Pro Val Gly Leu Ile Val Gly Val Thr Ala Leu Gly Leu
1 5 10 15
Leu Ile Ile Gly Val Val Asn Cys Val Ile Met Thr Gln Val
20 25 30
<210> 23
<211> 90
<212> DNA
<213> Homo sapiens
<220>
<221> source
<223> /note="TNFR2 TM domain"
<400> 23
ttcgctcttc cagttggact gattgtgggt gtgacagcct tgggtctact aataatagga 60
gtggtgaact gtgtcatcat gacccaggtg 90
<210> 24
<211> 24
<212> PRT
<213> Homo sapiens
<220>
<221> source
<223> /note="CD8 TM"
<400> 24
Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu
1 5 10 15
Ser Leu Val Ile Thr Leu Tyr Cys
20
<210> 25
<211> 72
<212> DNA
<213> Homo sapiens
<220>
<221> source
<223> /note="CD8 TM"
<400> 25
atctacatct gggcgccctt ggccgggact tgtggggtcc ttctcctgtc actggttatc 60
accctttact gc 72
<210> 26
<211> 27
<212> PRT
<213> Homo sapiens
<220>
<221> source
<223> /note="CD28 TM"
<400> 26
Phe Trp Val Leu Val Val Val Gly Gly Val Leu Ala Cys Tyr Ser Leu
1 5 10 15
Leu Val Thr Val Ala Phe Ile Ile Phe Trp Val
20 25
<210> 27
<211> 81
<212> DNA
<213> Homo sapiens
<220>
<221> source
<223> /note="CD28 TM"
<400> 27
ttttgggtgc tggtggtggt tggtggagtc ctggcttgct atagcttgct agtaacagtg 60
gcctttatta ttttctgggt g 81
<210> 28
<211> 112
<212> PRT
<213> Homo sapiens
<220>
<221> source
<223> /note="CD3 zeta"
<400> 28
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly
1 5 10 15
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
20 25 30
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
35 40 45
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
50 55 60
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
65 70 75 80
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
85 90 95
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
100 105 110
<210> 29
<211> 112
<212> PRT
<213> Homo sapiens
<220>
<221> source
<223> /note="CD3 zeta"
<400> 29
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly
1 5 10 15
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
20 25 30
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
35 40 45
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
50 55 60
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
65 70 75 80
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
85 90 95
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
100 105 110
<210> 30
<211> 113
<212> PRT
<213> Homo sapiens
<220>
<221> source
<223> /note="CD3 zeta"
<400> 30
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Lys Gln Gly
1 5 10 15
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
20 25 30
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
35 40 45
Pro Gln Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln
50 55 60
Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu
65 70 75 80
Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr
85 90 95
Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro
100 105 110
Arg
<210> 31
<211> 113
<212> PRT
<213> Homo sapiens
<220>
<221> source
<223> /note="CD3 zeta"
<400> 31
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly
1 5 10 15
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
20 25 30
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
35 40 45
Pro Gln Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln
50 55 60
Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu
65 70 75 80
Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr
85 90 95
Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro
100 105 110
Arg
<210> 32
<211> 336
<212> DNA
<213> Homo sapiens
<220>
<221> source
<223> /note="CD3 zeta"
<400> 32
agagtgaagt tcagcaggag cgcagacgcc cccgcgtaca agcagggcca gaaccagctc 60
tataacgagc tcaatctagg acgaagagag gagtacgatg ttttggacaa gagacgtggc 120
cgggaccctg agatgggggg aaagccgaga aggaagaacc ctcaggaagg cctgtacaat 180
gaactgcaga aagataagat ggcggaggcc tacagtgaga ttgggatgaa aggcgagcgc 240
cggaggggca aggggcacga tggcctttac cagggtctca gtacagccac caaggacacc 300
tacgacgccc ttcacatgca ggccctgccc cctcgc 336
<210> 33
<211> 336
<212> DNA
<213> Homo sapiens
<220>
<221> source
<223> /note="CD3 zeta"
<400> 33
agagtgaagt tcagcaggag cgcagacgcc cccgcgtacc agcagggcca gaaccagctc 60
tataacgagc tcaatctagg acgaagagag gagtacgatg ttttggacaa gagacgtggc 120
cgggaccctg agatgggggg aaagccgaga aggaagaacc ctcaggaagg cctgtacaat 180
gaactgcaga aagataagat ggcggaggcc tacagtgaga ttgggatgaa aggcgagcgc 240
cggaggggca aggggcacga tggcctttac cagggtctca gtacagccac caaggacacc 300
tacgacgccc ttcacatgca ggccctgccc cctcgc 336
<210> 34
<211> 174
<212> PRT
<213> Homo sapiens
<220>
<221> source
<223> /note="TNFR2 intracellular"
<400> 34
Lys Lys Lys Pro Leu Cys Leu Gln Arg Glu Ala Lys Val Pro His Leu
1 5 10 15
Pro Ala Asp Lys Ala Arg Gly Thr Gln Gly Pro Glu Gln Gln His Leu
20 25 30
Leu Ile Thr Ala Pro Ser Ser Ser Ser Ser Ser Leu Glu Ser Ser Ala
35 40 45
Ser Ala Leu Asp Arg Arg Ala Pro Thr Arg Asn Gln Pro Gln Ala Pro
50 55 60
Gly Val Glu Ala Ser Gly Ala Gly Glu Ala Arg Ala Ser Thr Gly Ser
65 70 75 80
Ser Asp Ser Ser Pro Gly Gly His Gly Thr Gln Val Asn Val Thr Cys
85 90 95
Ile Val Asn Val Cys Ser Ser Ser Asp His Ser Ser Gln Cys Ser Ser
100 105 110
Gln Ala Ser Ser Thr Met Gly Asp Thr Asp Ser Ser Pro Ser Glu Ser
115 120 125
Pro Lys Asp Glu Gln Val Pro Phe Ser Lys Glu Glu Cys Ala Phe Arg
130 135 140
Ser Gln Leu Glu Thr Pro Glu Thr Leu Leu Gly Ser Thr Glu Glu Lys
145 150 155 160
Pro Leu Pro Leu Gly Val Pro Asp Ala Gly Met Lys Pro Ser
165 170
<210> 35
<211> 522
<212> DNA
<213> Homo sapiens
<220>
<221> source
<223> /note="TNFR2 intracellular"
<400> 35
aaaaagaagc ccttgtgcct gcagagagaa gccaaggtgc ctcacttgcc tgcagataag 60
gccaggggta cacagggtcc cgagcagcag cacctcctga tcacagcgcc gagctccagc 120
agcagctccc tggagagctc ggccagtgcg ctagacagaa gggcccccac tcggaaccag 180
ccacaggcac caggcgtgga ggcgagtggg gctggggagg cgagggcaag caccgggagc 240
tcagattctt cccctggtgg tcatggcacc caggtcaatg tcacctgtat cgtgaacgtc 300
tgtagcagct ctgaccacag ctcacagtgc tcctcccaag cctcgtccac aatgggagac 360
acagattcca gcccctcgga gtccccgaag gacgagcaag tacccttctc caaggaggaa 420
tgtgcctttc ggtcacagct ggagacgcca gagaccctgc tggggagcac cgaagagaag 480
cccctgcccc ttggagtgcc tgatgctggg atgaagccca gt 522
<210> 36
<211> 42
<212> PRT
<213> Homo sapiens
<220>
<221> source
<223> /note="4-1BB intracellular"
<400> 36
Lys Arg Gly Arg Lys Lys Leu Leu Tyr Ile Phe Lys Gln Pro Phe Met
1 5 10 15
Arg Pro Val Gln Thr Thr Gln Glu Glu Asp Gly Cys Ser Cys Arg Phe
20 25 30
Pro Glu Glu Glu Glu Gly Gly Cys Glu Leu
35 40
<210> 37
<211> 126
<212> DNA
<213> Homo sapiens
<220>
<221> source
<223> /note="4-1BB intracellular"
<400> 37
aaacggggca gaaagaaact cctgtatata ttcaaacaac catttatgag accagtacaa 60
actactcaag aggaagatgg ctgtagctgc cgatttccag aagaagaaga aggaggatgt 120
gaactg 126
<210> 38
<211> 48
<212> PRT
<213> Homo sapiens
<220>
<221> source
<223> /note="CD27 intracellular"
<400> 38
Gln Arg Arg Lys Tyr Arg Ser Asn Lys Gly Glu Ser Pro Val Glu Pro
1 5 10 15
Ala Glu Pro Cys Arg Tyr Ser Cys Pro Arg Glu Glu Glu Gly Ser Thr
20 25 30
Ile Pro Ile Gln Glu Asp Tyr Arg Lys Pro Glu Pro Ala Cys Ser Pro
35 40 45
<210> 39
<211> 144
<212> DNA
<213> Homo sapiens
<220>
<221> source
<223> /note="CD27 intracellular"
<400> 39
caacgaagga aatatagatc aaacaaagga gaaagtcctg tggagcctgc agagccttgt 60
cgttacagct gccccaggga ggaggagggc agcaccatcc ccatccagga ggattaccga 120
aaaccggagc ctgcctgctc cccc 144
<210> 40
<211> 41
<212> PRT
<213> Homo sapiens
<220>
<221> source
<223> /note="CD28 intracellular"
<400> 40
Arg Ser Lys Arg Ser Arg Leu Leu His Ser Asp Tyr Met Asn Met Thr
1 5 10 15
Pro Arg Arg Pro Gly Pro Thr Arg Lys His Tyr Gln Pro Tyr Ala Pro
20 25 30
Pro Arg Asp Phe Ala Ala Tyr Arg Ser
35 40
<210> 41
<211> 123
<212> DNA
<213> Homo sapiens
<220>
<221> source
<223> /note="CD28 intracellular"
<400> 41
aggagtaaga ggagcaggct cctgcacagt gactacatga acatgactcc ccgccgcccc 60
gggcccaccc gcaagcatta ccagccctat gccccaccac gcgacttcgc agcctatcgc 120
tcc 123
<210> 42
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="Leader sequence CD8"
<400> 42
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro
20
<210> 43
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="tag"
<400> 43
Asn Trp Ser His Pro Gln Phe Glu Lys
1 5
<210> 44
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="tag"
<400> 44
Ser Ala Trp Ser His Pro Gln Phe Glu Lys
1 5 10
<210> 45
<211> 22
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="P2A tag"
<400> 45
Gly Ser Gly Ala Thr Asn Phe Ser Leu Leu Lys Gln Ala Gly Asp Val
1 5 10 15
Glu Glu Asn Pro Gly Pro
20
<210> 46
<211> 239
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="GFP tag"
<400> 46
Met Val Ser Lys Gly Glu Glu Leu Phe Thr Gly Val Val Pro Ile Leu
1 5 10 15
Val Glu Leu Asp Gly Asp Val Asn Gly His Lys Phe Ser Val Ser Gly
20 25 30
Glu Gly Glu Gly Asp Ala Thr Tyr Gly Lys Leu Thr Leu Lys Phe Ile
35 40 45
Cys Thr Thr Gly Lys Leu Pro Val Pro Trp Pro Thr Leu Val Thr Thr
50 55 60
Leu Thr Tyr Gly Val Gln Cys Phe Ser Arg Tyr Pro Asp His Met Lys
65 70 75 80
Gln His Asp Phe Phe Lys Ser Ala Met Pro Glu Gly Tyr Val Gln Glu
85 90 95
Arg Thr Ile Phe Phe Lys Asp Asp Gly Asn Tyr Lys Thr Arg Ala Glu
100 105 110
Val Lys Phe Glu Gly Asp Thr Leu Val Asn Arg Ile Glu Leu Lys Gly
115 120 125
Ile Asp Phe Lys Glu Asp Gly Asn Ile Leu Gly His Lys Leu Glu Tyr
130 135 140
Asn Tyr Asn Ser His Asn Val Tyr Ile Met Ala Asp Lys Gln Lys Asn
145 150 155 160
Gly Ile Lys Val Asn Phe Lys Ile Arg His Asn Ile Glu Asp Gly Ser
165 170 175
Val Gln Leu Ala Asp His Tyr Gln Gln Asn Thr Pro Ile Gly Asp Gly
180 185 190
Pro Val Leu Leu Pro Asp Asn His Tyr Leu Ser Thr Gln Ser Ala Leu
195 200 205
Ser Lys Asp Pro Asn Glu Lys Arg Asp His Met Val Leu Leu Glu Phe
210 215 220
Val Thr Ala Ala Gly Ile Thr Leu Gly Met Asp Glu Leu Tyr Lys
225 230 235
<210> 47
<211> 12
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="Strepavidin tag"
<400> 47
Ser Ala Trp Ser His Pro Gln Phe Glu Lys Ser Gly
1 5 10
<210> 48
<211> 365
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="CD8 H-TNFR2TM-TNFR2-3z"
<400> 48
Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala
1 5 10 15
Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly
20 25 30
Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Phe Ala Leu
35 40 45
Pro Val Gly Leu Ile Val Gly Val Thr Ala Leu Gly Leu Leu Ile Ile
50 55 60
Gly Val Val Asn Cys Val Ile Met Thr Gln Val Lys Lys Lys Pro Leu
65 70 75 80
Cys Leu Gln Arg Glu Ala Lys Val Pro His Leu Pro Ala Asp Lys Ala
85 90 95
Arg Gly Thr Gln Gly Pro Glu Gln Gln His Leu Leu Ile Thr Ala Pro
100 105 110
Ser Ser Ser Ser Ser Ser Leu Glu Ser Ser Ala Ser Ala Leu Asp Arg
115 120 125
Arg Ala Pro Thr Arg Asn Gln Pro Gln Ala Pro Gly Val Glu Ala Ser
130 135 140
Gly Ala Gly Glu Ala Arg Ala Ser Thr Gly Ser Ser Asp Ser Ser Pro
145 150 155 160
Gly Gly His Gly Thr Gln Val Asn Val Thr Cys Ile Val Asn Val Cys
165 170 175
Ser Ser Ser Asp His Ser Ser Gln Cys Ser Ser Gln Ala Ser Ser Thr
180 185 190
Met Gly Asp Thr Asp Ser Ser Pro Ser Glu Ser Pro Lys Asp Glu Gln
195 200 205
Val Pro Phe Ser Lys Glu Glu Cys Ala Phe Arg Ser Gln Leu Glu Thr
210 215 220
Pro Glu Thr Leu Leu Gly Ser Thr Glu Glu Lys Pro Leu Pro Leu Gly
225 230 235 240
Val Pro Asp Ala Gly Met Lys Pro Ser Gly Ser Arg Val Lys Phe Ser
245 250 255
Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr
260 265 270
Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys
275 280 285
Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn
290 295 300
Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu
305 310 315 320
Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly
325 330 335
His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr
340 345 350
Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg Ala Ser
355 360 365
<210> 49
<211> 347
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="CD8 H-TNFR2 TM-TNFR2del18-3z"
<400> 49
Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala
1 5 10 15
Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly
20 25 30
Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Phe Ala Leu
35 40 45
Pro Val Gly Leu Ile Val Gly Val Thr Ala Leu Gly Leu Leu Ile Ile
50 55 60
Gly Val Val Asn Cys Val Ile Met Thr Gln Val Lys Lys Lys Pro Leu
65 70 75 80
Cys Leu Gln Arg Glu Ala Lys Val Pro His Leu Pro Ala Asp Lys Ala
85 90 95
Arg Gly Thr Gln Gly Pro Glu Gln Gln His Leu Leu Ile Thr Ala Pro
100 105 110
Ser Ser Ser Ser Ser Ser Leu Glu Ser Ser Ala Ser Ala Leu Asp Arg
115 120 125
Arg Ala Pro Thr Arg Asn Gln Pro Gln Ala Pro Gly Val Glu Ala Ser
130 135 140
Gly Ala Gly Glu Ala Arg Ala Ser Thr Gly Ser Ser Asp Ser Ser Pro
145 150 155 160
Gly Gly His Gly Thr Gln Val Asn Val Thr Cys Ile Val Asn Val Cys
165 170 175
Ser Ser Ser Asp His Ser Ser Gln Cys Ser Ser Gln Ala Ser Ser Thr
180 185 190
Met Gly Asp Thr Asp Ser Ser Pro Ser Glu Ser Pro Lys Asp Glu Gln
195 200 205
Val Pro Phe Ser Lys Glu Glu Cys Ala Phe Arg Ser Gln Leu Glu Thr
210 215 220
Pro Glu Thr Leu Leu Gly Ser Gly Ser Arg Val Lys Phe Ser Arg Ser
225 230 235 240
Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu
245 250 255
Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg
260 265 270
Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln
275 280 285
Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr
290 295 300
Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp
305 310 315 320
Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala
325 330 335
Leu His Met Gln Ala Leu Pro Pro Arg Ala Ser
340 345
<210> 50
<211> 306
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="CD8 H-TNFR2 TM-TNFR2del59-3z"
<400> 50
Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala
1 5 10 15
Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly
20 25 30
Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Phe Ala Leu
35 40 45
Pro Val Gly Leu Ile Val Gly Val Thr Ala Leu Gly Leu Leu Ile Ile
50 55 60
Gly Val Val Asn Cys Val Ile Met Thr Gln Val Lys Lys Lys Pro Leu
65 70 75 80
Cys Leu Gln Arg Glu Ala Lys Val Pro His Leu Pro Ala Asp Lys Ala
85 90 95
Arg Gly Thr Gln Gly Pro Glu Gln Gln His Leu Leu Ile Thr Ala Pro
100 105 110
Ser Ser Ser Ser Ser Ser Leu Glu Ser Ser Ala Ser Ala Leu Asp Arg
115 120 125
Arg Ala Pro Thr Arg Asn Gln Pro Gln Ala Pro Gly Val Glu Ala Ser
130 135 140
Gly Ala Gly Glu Ala Arg Ala Ser Thr Gly Ser Ser Asp Ser Ser Pro
145 150 155 160
Gly Gly His Gly Thr Gln Val Asn Val Thr Cys Ile Val Asn Val Cys
165 170 175
Ser Ser Ser Asp His Ser Ser Gln Cys Ser Ser Gln Ala Ser Gly Ser
180 185 190
Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly
195 200 205
Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr
210 215 220
Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys
225 230 235 240
Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys
245 250 255
Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg
260 265 270
Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala
275 280 285
Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg
290 295 300
Ala Ser
305
<210> 51
<211> 261
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="CD8 H-TNFR2 TM-TNFR2del104-3z"
<400> 51
Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala
1 5 10 15
Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly
20 25 30
Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Phe Ala Leu
35 40 45
Pro Val Gly Leu Ile Val Gly Val Thr Ala Leu Gly Leu Leu Ile Ile
50 55 60
Gly Val Val Asn Cys Val Ile Met Thr Gln Val Lys Lys Lys Pro Leu
65 70 75 80
Cys Leu Gln Arg Glu Ala Lys Val Pro His Leu Pro Ala Asp Lys Ala
85 90 95
Arg Gly Thr Gln Gly Pro Glu Gln Gln His Leu Leu Ile Thr Ala Pro
100 105 110
Ser Ser Ser Ser Ser Ser Leu Glu Ser Ser Ala Ser Ala Leu Asp Arg
115 120 125
Arg Ala Pro Thr Arg Asn Gln Pro Gln Ala Pro Gly Val Glu Ala Ser
130 135 140
Gly Gly Ser Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr
145 150 155 160
Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg
165 170 175
Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met
180 185 190
Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu
195 200 205
Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys
210 215 220
Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu
225 230 235 240
Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu
245 250 255
Pro Pro Arg Ala Ser
260
<210> 52
<211> 189
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="CD8 H-TNFR2 TM-3z"
<400> 52
Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala
1 5 10 15
Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly
20 25 30
Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Phe Ala Leu
35 40 45
Pro Val Gly Leu Ile Val Gly Val Thr Ala Leu Gly Leu Leu Ile Ile
50 55 60
Gly Val Val Asn Cys Val Ile Met Thr Gln Val Arg Val Lys Phe Ser
65 70 75 80
Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr
85 90 95
Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys
100 105 110
Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn
115 120 125
Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu
130 135 140
Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly
145 150 155 160
His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr
165 170 175
Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg Ala Ser
180 185
<210> 53
<211> 361
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="CD8 H-3z-TNFR2 TM"
<400> 53
Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala
1 5 10 15
Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly
20 25 30
Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile
35 40 45
Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val
50 55 60
Ile Thr Leu Tyr Cys Thr Arg Arg Val Lys Phe Ser Arg Ser Ala Asp
65 70 75 80
Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn
85 90 95
Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg
100 105 110
Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly
115 120 125
Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu
130 135 140
Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu
145 150 155 160
Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His
165 170 175
Met Gln Ala Leu Pro Pro Arg Ala Ser Lys Lys Lys Pro Leu Cys Leu
180 185 190
Gln Arg Glu Ala Lys Val Pro His Leu Pro Ala Asp Lys Ala Arg Gly
195 200 205
Thr Gln Gly Pro Glu Gln Gln His Leu Leu Ile Thr Ala Pro Ser Ser
210 215 220
Ser Ser Ser Ser Leu Glu Ser Ser Ala Ser Ala Leu Asp Arg Arg Ala
225 230 235 240
Pro Thr Arg Asn Gln Pro Gln Ala Pro Gly Val Glu Ala Ser Gly Ala
245 250 255
Gly Glu Ala Arg Ala Ser Thr Gly Ser Ser Asp Ser Ser Pro Gly Gly
260 265 270
His Gly Thr Gln Val Asn Val Thr Cys Ile Val Asn Val Cys Ser Ser
275 280 285
Ser Asp His Ser Ser Gln Cys Ser Ser Gln Ala Ser Ser Thr Met Gly
290 295 300
Asp Thr Asp Ser Ser Pro Ser Glu Ser Pro Lys Asp Glu Gln Val Pro
305 310 315 320
Phe Ser Lys Glu Glu Cys Ala Phe Arg Ser Gln Leu Glu Thr Pro Glu
325 330 335
Thr Leu Leu Gly Ser Thr Glu Glu Lys Pro Leu Pro Leu Gly Val Pro
340 345 350
Asp Ala Gly Met Lys Pro Ser Ala Ser
355 360
<210> 54
<211> 359
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="CD8 H-CD8 TM- TNFR2-3z"
<400> 54
Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala
1 5 10 15
Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly
20 25 30
Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile
35 40 45
Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val
50 55 60
Ile Thr Leu Tyr Cys Lys Lys Lys Pro Leu Cys Leu Gln Arg Glu Ala
65 70 75 80
Lys Val Pro His Leu Pro Ala Asp Lys Ala Arg Gly Thr Gln Gly Pro
85 90 95
Glu Gln Gln His Leu Leu Ile Thr Ala Pro Ser Ser Ser Ser Ser Ser
100 105 110
Leu Glu Ser Ser Ala Ser Ala Leu Asp Arg Arg Ala Pro Thr Arg Asn
115 120 125
Gln Pro Gln Ala Pro Gly Val Glu Ala Ser Gly Ala Gly Glu Ala Arg
130 135 140
Ala Ser Thr Gly Ser Ser Asp Ser Ser Pro Gly Gly His Gly Thr Gln
145 150 155 160
Val Asn Val Thr Cys Ile Val Asn Val Cys Ser Ser Ser Asp His Ser
165 170 175
Ser Gln Cys Ser Ser Gln Ala Ser Ser Thr Met Gly Asp Thr Asp Ser
180 185 190
Ser Pro Ser Glu Ser Pro Lys Asp Glu Gln Val Pro Phe Ser Lys Glu
195 200 205
Glu Cys Ala Phe Arg Ser Gln Leu Glu Thr Pro Glu Thr Leu Leu Gly
210 215 220
Ser Thr Glu Glu Lys Pro Leu Pro Leu Gly Val Pro Asp Ala Gly Met
225 230 235 240
Lys Pro Ser Gly Ser Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro
245 250 255
Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly
260 265 270
Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro
275 280 285
Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr
290 295 300
Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly
305 310 315 320
Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln
325 330 335
Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln
340 345 350
Ala Leu Pro Pro Arg Ala Ser
355
<210> 55
<211> 363
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="CD8 H-FUSED 1 TM- TNFR2-3z"
<400> 55
Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala
1 5 10 15
Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly
20 25 30
Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile
35 40 45
Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val
50 55 60
Ile Thr Cys Val Ile Met Thr Gln Val Lys Lys Lys Pro Leu Cys Leu
65 70 75 80
Gln Arg Glu Ala Lys Val Pro His Leu Pro Ala Asp Lys Ala Arg Gly
85 90 95
Thr Gln Gly Pro Glu Gln Gln His Leu Leu Ile Thr Ala Pro Ser Ser
100 105 110
Ser Ser Ser Ser Leu Glu Ser Ser Ala Ser Ala Leu Asp Arg Arg Ala
115 120 125
Pro Thr Arg Asn Gln Pro Gln Ala Pro Gly Val Glu Ala Ser Gly Ala
130 135 140
Gly Glu Ala Arg Ala Ser Thr Gly Ser Ser Asp Ser Ser Pro Gly Gly
145 150 155 160
His Gly Thr Gln Val Asn Val Thr Cys Ile Val Asn Val Cys Ser Ser
165 170 175
Ser Asp His Ser Ser Gln Cys Ser Ser Gln Ala Ser Ser Thr Met Gly
180 185 190
Asp Thr Asp Ser Ser Pro Ser Glu Ser Pro Lys Asp Glu Gln Val Pro
195 200 205
Phe Ser Lys Glu Glu Cys Ala Phe Arg Ser Gln Leu Glu Thr Pro Glu
210 215 220
Thr Leu Leu Gly Ser Thr Glu Glu Lys Pro Leu Pro Leu Gly Val Pro
225 230 235 240
Asp Ala Gly Met Lys Pro Ser Gly Ser Arg Val Lys Phe Ser Arg Ser
245 250 255
Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu
260 265 270
Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg
275 280 285
Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln
290 295 300
Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr
305 310 315 320
Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp
325 330 335
Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala
340 345 350
Leu His Met Gln Ala Leu Pro Pro Arg Ala Ser
355 360
<210> 56
<211> 365
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="CD8 H-FUSED 2TM- TNFR2-3z"
<400> 56
Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala
1 5 10 15
Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly
20 25 30
Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile
35 40 45
Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu Ser Leu Val
50 55 60
Ile Thr Val Asn Cys Val Ile Met Thr Gln Val Lys Lys Lys Pro Leu
65 70 75 80
Cys Leu Gln Arg Glu Ala Lys Val Pro His Leu Pro Ala Asp Lys Ala
85 90 95
Arg Gly Thr Gln Gly Pro Glu Gln Gln His Leu Leu Ile Thr Ala Pro
100 105 110
Ser Ser Ser Ser Ser Ser Leu Glu Ser Ser Ala Ser Ala Leu Asp Arg
115 120 125
Arg Ala Pro Thr Arg Asn Gln Pro Gln Ala Pro Gly Val Glu Ala Ser
130 135 140
Gly Ala Gly Glu Ala Arg Ala Ser Thr Gly Ser Ser Asp Ser Ser Pro
145 150 155 160
Gly Gly His Gly Thr Gln Val Asn Val Thr Cys Ile Val Asn Val Cys
165 170 175
Ser Ser Ser Asp His Ser Ser Gln Cys Ser Ser Gln Ala Ser Ser Thr
180 185 190
Met Gly Asp Thr Asp Ser Ser Pro Ser Glu Ser Pro Lys Asp Glu Gln
195 200 205
Val Pro Phe Ser Lys Glu Glu Cys Ala Phe Arg Ser Gln Leu Glu Thr
210 215 220
Pro Glu Thr Leu Leu Gly Ser Thr Glu Glu Lys Pro Leu Pro Leu Gly
225 230 235 240
Val Pro Asp Ala Gly Met Lys Pro Ser Gly Ser Arg Val Lys Phe Ser
245 250 255
Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr
260 265 270
Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys
275 280 285
Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn
290 295 300
Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu
305 310 315 320
Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly
325 330 335
His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr
340 345 350
Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg Ala Ser
355 360 365
<210> 57
<211> 363
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="CD8 H-FUSED 3 TM- TNFR2-3z"
<400> 57
Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala
1 5 10 15
Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly
20 25 30
Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Ile Tyr Ile
35 40 45
Trp Ala Pro Leu Ala Gly Thr Ala Leu Gly Leu Leu Ile Ile Gly Val
50 55 60
Val Asn Cys Val Ile Met Thr Gln Val Lys Lys Lys Pro Leu Cys Leu
65 70 75 80
Gln Arg Glu Ala Lys Val Pro His Leu Pro Ala Asp Lys Ala Arg Gly
85 90 95
Thr Gln Gly Pro Glu Gln Gln His Leu Leu Ile Thr Ala Pro Ser Ser
100 105 110
Ser Ser Ser Ser Leu Glu Ser Ser Ala Ser Ala Leu Asp Arg Arg Ala
115 120 125
Pro Thr Arg Asn Gln Pro Gln Ala Pro Gly Val Glu Ala Ser Gly Ala
130 135 140
Gly Glu Ala Arg Ala Ser Thr Gly Ser Ser Asp Ser Ser Pro Gly Gly
145 150 155 160
His Gly Thr Gln Val Asn Val Thr Cys Ile Val Asn Val Cys Ser Ser
165 170 175
Ser Asp His Ser Ser Gln Cys Ser Ser Gln Ala Ser Ser Thr Met Gly
180 185 190
Asp Thr Asp Ser Ser Pro Ser Glu Ser Pro Lys Asp Glu Gln Val Pro
195 200 205
Phe Ser Lys Glu Glu Cys Ala Phe Arg Ser Gln Leu Glu Thr Pro Glu
210 215 220
Thr Leu Leu Gly Ser Thr Glu Glu Lys Pro Leu Pro Leu Gly Val Pro
225 230 235 240
Asp Ala Gly Met Lys Pro Ser Gly Ser Arg Val Lys Phe Ser Arg Ser
245 250 255
Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu
260 265 270
Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg
275 280 285
Gly Arg Asp Pro Glu Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln
290 295 300
Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr
305 310 315 320
Ser Glu Ile Gly Met Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp
325 330 335
Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala
340 345 350
Leu His Met Gln Ala Leu Pro Pro Arg Ala Ser
355 360
<210> 58
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="LAGLIDADG motif"
<400> 58
Leu Ala Gly Leu Ile Asp Ala Asp Gly
1 5
<210> 59
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="Fusion 1 - CD8 SEQ"
<400> 59
Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu
1 5 10 15
Ser Leu Val Ile Thr
20
<210> 60
<211> 21
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="Fusion 2 - CD8 SEQ"
<400> 60
Ile Tyr Ile Trp Ala Pro Leu Ala Gly Thr Cys Gly Val Leu Leu Leu
1 5 10 15
Ser Leu Val Ile Thr
20
<210> 61
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="Fusion 3 - CD8 SEQ"
<400> 61
Ile Tyr Ile Trp Ala Pro Leu Ala Gly
1 5
<210> 62
<211> 7
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="Fusion 1 - TNFR2 SEQ"
<400> 62
Cys Val Ile Met Thr Gln Val
1 5
<210> 63
<211> 9
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="Fusion 2 - TNFR2 SEQ"
<400> 63
Val Asn Cys Val Ile Met Thr Gln Val
1 5
<210> 64
<211> 19
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="Fusion 3 - TNFR2 SEQ"
<400> 64
Thr Ala Leu Gly Leu Leu Ile Ile Gly Val Val Asn Cys Val Ile Met
1 5 10 15
Thr Gln Val
<210> 65
<211> 249
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="scFv anti-IL-23R"
<400> 65
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Glu Asn Ile Tyr Ser Phe
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Lys Leu Ala Ala Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Thr Asn Arg Tyr Ser Asn
85 90 95
Pro Asp Ile Tyr Asn Val Phe Gly Gln Gly Thr Lys Leu Thr Val Leu
100 105 110
Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
130 135 140
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Ile Asp Phe Asn Ser Asn
145 150 155 160
Tyr Tyr Met Cys Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp
165 170 175
Ile Gly Cys Ile Tyr Val Gly Ser His Val Asn Thr Tyr Tyr Ala Asn
180 185 190
Trp Ala Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr
195 200 205
Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
210 215 220
Tyr Cys Ala Thr Ser Gly Ser Ser Val Leu Tyr Phe Lys Phe Trp Gly
225 230 235 240
Gln Gly Thr Leu Val Thr Val Ser Ser
245
<210> 66
<211> 249
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="scFv anti-IL-23R"
<400> 66
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Glu Asn Ile Tyr Ser Phe
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Lys Leu Ala Ala Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Thr Asn Arg Tyr Ser Asn
85 90 95
Pro Asp Ile Tyr Asn Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
100 105 110
Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
130 135 140
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Ile Asp Phe Asn Ser Asn
145 150 155 160
Tyr Tyr Met Cys Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp
165 170 175
Ile Gly Cys Ile Tyr Val Gly Ser His Val Asn Thr Tyr Tyr Ala Asn
180 185 190
Trp Ala Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr
195 200 205
Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
210 215 220
Tyr Cys Ala Thr Ser Gly Ser Ser Val Leu Tyr Phe Lys Phe Trp Gly
225 230 235 240
Gln Gly Thr Leu Val Thr Val Ser Ser
245
<210> 67
<211> 249
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="scFv anti IL-23R"
<400> 67
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Gln Ala Ser Glu Asn Ile Tyr Ser Phe
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Lys Leu Ala Ala Gly Val Pro Ser Arg Phe Ser Gly
50 55 60
Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro
65 70 75 80
Glu Asp Phe Ala Thr Tyr Tyr Cys Gln Gln Thr Asn Arg Tyr Ser Asn
85 90 95
Pro Asp Ile Tyr Asn Val Phe Gly Thr Gly Thr Lys Val Thr Val Leu
100 105 110
Gly Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
130 135 140
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Ile Asp Phe Asn Ser Asn
145 150 155 160
Tyr Tyr Met Cys Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp
165 170 175
Ile Gly Cys Ile Tyr Val Gly Ser His Val Asn Thr Tyr Tyr Ala Asn
180 185 190
Trp Ala Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr
195 200 205
Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr
210 215 220
Tyr Cys Ala Thr Ser Gly Ser Ser Val Leu Tyr Phe Lys Phe Trp Gly
225 230 235 240
Gln Gly Thr Leu Val Thr Val Ser Ser
245
<210> 68
<211> 251
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-HLA-A2 scFv"
<400> 68
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Met Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile Gln Trp Val Lys Gln Arg Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Gln Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Lys Thr Thr Leu Thr Ala Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Leu Leu Ser Ser Leu Thr Ser Glu Asp Ser Ala Ile Tyr Phe Cys
85 90 95
Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser Val Asp Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Thr Ser Asp Val Leu Met Thr
130 135 140
Gln Thr Pro Leu Ser Leu Pro Val Ser Leu Gly Asp Gln Val Ser Ile
145 150 155 160
Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr
165 170 175
Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Lys Leu Leu Ile
180 185 190
Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly
195 200 205
Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala
210 215 220
Glu Asp Leu Gly Val Tyr Tyr Cys Phe Gln Gly Ser His Val Pro Arg
225 230 235 240
Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile Lys
245 250
<210> 69
<211> 251
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-HLA-A2 scFv"
<400> 69
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Gln Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser Val Asp Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Thr Ser Asp Val Val Met Thr
130 135 140
Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly Gln Pro Ala Ser Ile
145 150 155 160
Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr
165 170 175
Leu Glu Trp Phe Gln Gln Arg Pro Gly Gln Ser Pro Arg Arg Leu Ile
180 185 190
Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly
195 200 205
Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala
210 215 220
Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Gly Ser His Val Pro Arg
225 230 235 240
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
245 250
<210> 70
<211> 251
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-HLA-A2 scFv"
<400> 70
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Gln Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser Val Asp Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Thr Ser Asp Ile Val Met Thr
130 135 140
Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly Gln Pro Ala Ser Ile
145 150 155 160
Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr
165 170 175
Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile
180 185 190
Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly
195 200 205
Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala
210 215 220
Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Gly Ser His Val Pro Arg
225 230 235 240
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
245 250
<210> 71
<211> 251
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-HLA-A2 scFv"
<400> 71
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Gln Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser Val Asp Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Thr Ser Asp Ile Val Met Thr
130 135 140
Gln Thr Pro Leu Ser Ser Pro Val Thr Leu Gly Gln Pro Ala Ser Ile
145 150 155 160
Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr
165 170 175
Leu Glu Trp Tyr Gln Gln Arg Pro Gly Gln Pro Pro Arg Leu Leu Ile
180 185 190
Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly
195 200 205
Ser Gly Ala Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala
210 215 220
Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Gly Ser His Val Pro Arg
225 230 235 240
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
245 250
<210> 72
<211> 251
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-HLA-A2 scFv"
<400> 72
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Gln Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser Val Asp Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Thr Ser Asp Val Val Met Thr
130 135 140
Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly Gln Pro Ala Ser Ile
145 150 155 160
Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr
165 170 175
Leu Glu Trp Tyr Gln Gln Arg Pro Gly Gln Ser Pro Arg Leu Leu Ile
180 185 190
Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly
195 200 205
Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala
210 215 220
Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Gly Ser His Val Pro Arg
225 230 235 240
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
245 250
<210> 73
<211> 251
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-HLA-A2 scFv"
<400> 73
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Gln Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser Val Asp Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Thr Ser Asp Ile Val Met Thr
130 135 140
Gln Thr Pro Leu Ser Ser Pro Val Thr Leu Gly Gln Pro Ala Ser Ile
145 150 155 160
Ser Phe Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr
165 170 175
Leu Glu Trp Tyr Gln Gln Arg Pro Gly Gln Pro Pro Arg Leu Leu Ile
180 185 190
Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly
195 200 205
Ser Gly Ala Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala
210 215 220
Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Gly Ser His Val Pro Arg
225 230 235 240
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
245 250
<210> 74
<211> 251
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-HLA-A2 scFv"
<400> 74
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Gln Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Leu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser Val Asp Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Thr Ser Asp Val Val Met Thr
130 135 140
Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly Gln Pro Ala Ser Ile
145 150 155 160
Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr
165 170 175
Leu Glu Trp Phe Gln Gln Arg Pro Gly Gln Ser Pro Arg Arg Leu Ile
180 185 190
Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly
195 200 205
Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala
210 215 220
Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Gly Ser His Val Pro Arg
225 230 235 240
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
245 250
<210> 75
<211> 251
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-HLA-A2 scFv"
<400> 75
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Gln Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Leu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser Val Asp Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Thr Ser Asp Ile Val Met Thr
130 135 140
Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly Gln Pro Ala Ser Ile
145 150 155 160
Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr
165 170 175
Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile
180 185 190
Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly
195 200 205
Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala
210 215 220
Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Gly Ser His Val Pro Arg
225 230 235 240
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
245 250
<210> 76
<211> 251
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-HLA-A2 scFv"
<400> 76
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Trp Ile Tyr Pro Gly Asp Gly Ser Thr Gln Tyr Asn Glu Lys
50 55 60
Phe Lys Gly Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser Val Asp Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Thr Ser Asp Ile Val Met Thr
130 135 140
Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly Gln Pro Ala Ser Ile
145 150 155 160
Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr
165 170 175
Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile
180 185 190
Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly
195 200 205
Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala
210 215 220
Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Gly Ser His Val Pro Arg
225 230 235 240
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
245 250
<210> 77
<211> 251
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-HLA-A2 scFv"
<400> 77
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Trp Ile Tyr Pro Gly Asp Gly Ser Thr Gln Tyr Asn Glu Lys
50 55 60
Phe Lys Gly Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser Val Asp Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Thr Ser Asp Ile Val Met Thr
130 135 140
Gln Thr Pro Leu Ser Ser Pro Val Thr Leu Gly Gln Pro Ala Ser Ile
145 150 155 160
Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr
165 170 175
Leu Glu Trp Tyr Gln Gln Arg Pro Gly Gln Pro Pro Arg Leu Leu Ile
180 185 190
Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly
195 200 205
Ser Gly Ala Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala
210 215 220
Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Gly Ser His Val Pro Arg
225 230 235 240
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
245 250
<210> 78
<211> 251
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-HLA-A2 scFv"
<400> 78
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Trp Ile Tyr Pro Gly Asp Gly Ser Thr Gln Tyr Asn Glu Lys
50 55 60
Phe Lys Gly Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser Val Asp Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Thr Ser Asp Val Val Met Thr
130 135 140
Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly Gln Pro Ala Ser Ile
145 150 155 160
Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr
165 170 175
Leu Glu Trp Tyr Gln Gln Arg Pro Gly Gln Ser Pro Arg Leu Leu Ile
180 185 190
Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly
195 200 205
Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala
210 215 220
Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Gly Ser His Val Pro Arg
225 230 235 240
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
245 250
<210> 79
<211> 251
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-HLA-A2 scFv"
<400> 79
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ile Trp Ile Tyr Pro Gly Asp Gly Ser Thr Gln Tyr Asn Glu Lys
50 55 60
Phe Lys Gly Val Thr Met Thr Arg Asp Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser Val Asp Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Thr Ser Asp Ile Val Met Thr
130 135 140
Gln Thr Pro Leu Ser Ser Pro Val Thr Leu Gly Gln Pro Ala Ser Ile
145 150 155 160
Ser Phe Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr
165 170 175
Leu Glu Trp Tyr Gln Gln Arg Pro Gly Gln Pro Pro Arg Leu Leu Ile
180 185 190
Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly
195 200 205
Ser Gly Ala Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala
210 215 220
Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Gly Ser His Val Pro Arg
225 230 235 240
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
245 250
<210> 80
<211> 251
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-HLA-A2 scFv"
<400> 80
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Gln Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser Val Asp Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Thr Ser Asp Ile Val Met Thr
130 135 140
Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly Gln Pro Ala Ser Ile
145 150 155 160
Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr
165 170 175
Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile
180 185 190
Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly
195 200 205
Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala
210 215 220
Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Gly Ser His Val Pro Arg
225 230 235 240
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
245 250
<210> 81
<211> 251
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-HLA-A2 scFv"
<400> 81
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Gln Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser Val Asp Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Thr Ser Asp Ile Val Met Thr
130 135 140
Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly Gln Pro Ala Ser Ile
145 150 155 160
Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr
165 170 175
Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile
180 185 190
Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly
195 200 205
Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala
210 215 220
Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Gly Ser His Val Pro Arg
225 230 235 240
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
245 250
<210> 82
<211> 251
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-HLA-A2 scFv"
<400> 82
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Gln Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser Val Asp Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Thr Ser Asp Ile Val Met Thr
130 135 140
Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly Gln Pro Ala Ser Ile
145 150 155 160
Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr
165 170 175
Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile
180 185 190
Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly
195 200 205
Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala
210 215 220
Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Gly Ser His Val Pro Arg
225 230 235 240
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
245 250
<210> 83
<211> 251
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-HLA-A2 scFv"
<400> 83
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Gln Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Met Thr Arg Asp Thr Ser Ile Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser Val Asp Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Thr Ser Asp Ile Val Met Thr
130 135 140
Gln Thr Pro Leu Ser Ser Pro Val Thr Leu Gly Gln Pro Ala Ser Ile
145 150 155 160
Ser Phe Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr
165 170 175
Leu Glu Trp Tyr Gln Gln Arg Pro Gly Gln Pro Pro Arg Leu Leu Ile
180 185 190
Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly
195 200 205
Ser Gly Ala Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala
210 215 220
Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Gly Ser His Val Pro Arg
225 230 235 240
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
245 250
<210> 84
<211> 251
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-HLA-A2 scFv"
<400> 84
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Gln Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Met Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser Val Asp Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Thr Ser Asp Ile Val Met Thr
130 135 140
Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly Gln Pro Ala Ser Ile
145 150 155 160
Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr
165 170 175
Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile
180 185 190
Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly
195 200 205
Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala
210 215 220
Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Gly Ser His Val Pro Arg
225 230 235 240
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
245 250
<210> 85
<211> 251
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-HLA-A2 scFv"
<400> 85
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Gln Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Met Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser Val Asp Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Thr Ser Asp Ile Val Met Thr
130 135 140
Gln Thr Pro Leu Ser Ser Pro Val Thr Leu Gly Gln Pro Ala Ser Ile
145 150 155 160
Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr
165 170 175
Leu Glu Trp Tyr Gln Gln Arg Pro Gly Gln Pro Pro Arg Leu Leu Ile
180 185 190
Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly
195 200 205
Ser Gly Ala Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala
210 215 220
Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Gly Ser His Val Pro Arg
225 230 235 240
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
245 250
<210> 86
<211> 251
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-HLA-A2 scFv"
<400> 86
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Gln Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Met Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser Val Asp Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Thr Ser Asp Val Val Met Thr
130 135 140
Gln Ser Pro Leu Ser Leu Pro Val Thr Leu Gly Gln Pro Ala Ser Ile
145 150 155 160
Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr
165 170 175
Leu Glu Trp Tyr Gln Gln Arg Pro Gly Gln Ser Pro Arg Leu Leu Ile
180 185 190
Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly
195 200 205
Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala
210 215 220
Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Gly Ser His Val Pro Arg
225 230 235 240
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
245 250
<210> 87
<211> 251
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-HLA-A2 scFv"
<400> 87
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Gln Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Met Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser Val Asp Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Thr Ser Asp Ile Val Met Thr
130 135 140
Gln Thr Pro Leu Ser Ser Pro Val Thr Leu Gly Gln Pro Ala Ser Ile
145 150 155 160
Ser Phe Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr
165 170 175
Leu Glu Trp Tyr Gln Gln Arg Pro Gly Gln Pro Pro Arg Leu Leu Ile
180 185 190
Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly
195 200 205
Ser Gly Ala Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala
210 215 220
Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Gly Ser His Val Pro Arg
225 230 235 240
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
245 250
<210> 88
<211> 251
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-HLA-A2 scFv"
<400> 88
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Lys Tyr Ser Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Thr Val Thr Val Ser Ser Val Asp Ser Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Thr Ser Asp Ile Val Met Thr
130 135 140
Gln Thr Pro Leu Ser Leu Ser Val Thr Pro Gly Gln Pro Ala Ser Ile
145 150 155 160
Ser Cys Arg Ser Ser Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr
165 170 175
Leu Glu Trp Tyr Leu Gln Lys Pro Gly Gln Ser Pro Gln Leu Leu Ile
180 185 190
Tyr Lys Val Ser Asn Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly
195 200 205
Ser Gly Ser Gly Thr Asp Phe Thr Leu Lys Ile Ser Arg Val Glu Ala
210 215 220
Glu Asp Val Gly Val Tyr Tyr Cys Phe Gln Gly Ser His Val Pro Arg
225 230 235 240
Thr Phe Gly Gly Gly Thr Lys Val Glu Ile Lys
245 250
<210> 89
<211> 251
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-HLA-A2 scFv"
<400> 89
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Tyr Asp Ser Arg Gly Ser Tyr Tyr Tyr Met Asp Val
100 105 110
Trp Gly Lys Gly Thr Thr Val Thr Val Ser Ser Gly Ser Ala Ser Ala
115 120 125
Pro Lys Leu Glu Glu Gly Glu Phe Ser Glu Ala Arg Val Gln Ser Val
130 135 140
Leu Thr Gln Pro Pro Ser Thr Ser Gly Thr Pro Gly Gln Arg Val Thr
145 150 155 160
Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Gly Gly Asn Ala Val Asn
165 170 175
Trp Tyr Gln His Phe Pro Gly Thr Ala Pro Thr Leu Leu Ile Tyr Ser
180 185 190
Asn Asn Gln Arg Pro Ser Gly Val Pro Glu Arg Phe Ser Gly Ser Lys
195 200 205
Ser Gly Thr Ser Ala Ser Leu Thr Val Ser Gly Leu Gln Ala Glu Asp
210 215 220
Glu Ala Asp Tyr Tyr Cys Thr Ala Trp Asp Asp Ser Leu Arg Gly Tyr
225 230 235 240
Leu Phe Gly Thr Gly Thr Lys Val Thr Val Leu
245 250
<210> 90
<211> 249
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-HLA-A2 scFv"
<400> 90
Gln Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Arg
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Val Ile Ser Tyr Asp Gly Ser Asn Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Arg Glu Glu Leu Leu Ala Leu Phe Gly Gly Met Asp Val
100 105 110
Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Gly Ser Ala Ser Ala
115 120 125
Pro Lys Leu Glu Glu Gly Glu Phe Ser Glu Ala Arg Val Gln Pro Val
130 135 140
Leu Thr Gln Pro Ser Ser Val Ser Val Ala Pro Gly Gln Thr Ala Arg
145 150 155 160
Ile Thr Cys Gly Gly Asn Asn Ile Gly Ser Lys Ser Val His Trp Tyr
165 170 175
Gln Gln Lys Pro Gly Gln Ala Pro Val Leu Val Val Tyr Asp Asp Ser
180 185 190
Asp Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser Asn Ser Gly
195 200 205
Asn Thr Ala Thr Leu Thr Ile Ser Arg Val Glu Ala Arg Asp Glu Ala
210 215 220
Asp Tyr Tyr Cys His Val Trp Asp Ala Lys Thr Asn His Gln Val Phe
225 230 235 240
Gly Gly Gly Thr Arg Leu Thr Val Gln
245
<210> 91
<211> 251
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-HLA-A2 scFv"
<400> 91
Glu Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Pro Gln Ser Arg Trp Leu Gln Ser Gly Asp Ala Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Gly Ser Ala Ser Ala
115 120 125
Pro Lys Leu Glu Glu Gly Glu Phe Ser Glu Ala Arg Val Gln Pro Val
130 135 140
Leu Thr Gln Pro Arg Ser Val Ser Gly Ser Pro Gly Gln Ser Val Thr
145 150 155 160
Ile Ser Cys Thr Gly Thr Ser Ser Asp Val Gly Gly Tyr Asn Arg Val
165 170 175
Ser Trp Tyr Gln Gln Thr Pro Gly Thr Ala Pro Lys Leu Met Ile Tyr
180 185 190
Glu Val Ser Asn Arg Pro Ser Gly Val Ser Asn Arg Phe Ser Gly Ser
195 200 205
Lys Ser Gly Asn Thr Ala Ser Leu Thr Ile Ser Gly Leu Gln Ala Glu
210 215 220
Asp Glu Ala Asp Tyr Tyr Cys Ser Ser Tyr Thr Ser Ser Ser Thr Val
225 230 235 240
Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
245 250
<210> 92
<211> 246
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-HLA-A2 scFv"
<400> 92
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Arg Ile Asn Ala Gly Asn Gly Asn Thr Lys Tyr Ser Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Leu Thr Gly Thr Leu Leu Phe Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Leu Val Thr Val Ser Ser Gly Ser Ala Ser Ala Pro Lys Leu Glu
115 120 125
Glu Gly Glu Phe Ser Glu Ala Arg Val Gln Ser Val Leu Thr Gln Pro
130 135 140
Pro Ser Ala Ser Gly Thr Pro Gly Gln Arg Val Thr Ile Ser Cys Ser
145 150 155 160
Gly Ser Ser Ser Asn Ile Gly Ser Asn Gly Val Lys Trp Tyr Gln Gln
165 170 175
Leu Pro Gly Thr Ala Pro Lys Leu Val Ile Tyr Arg Asp Tyr Gln Arg
180 185 190
Pro Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Lys Ser Gly Thr Ser
195 200 205
Ala Ser Leu Ala Ile Ser Gly Leu Gln Ser Glu Asp Glu Ala Lys Tyr
210 215 220
Tyr Cys Ala Ala Trp Asp Asp Ser Leu Asn Val Val Phe Gly Gly Gly
225 230 235 240
Thr Gln Leu Thr Val Leu
245
<210> 93
<211> 251
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-HLA-A2 scFv"
<400> 93
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Ala Thr Ile Thr Ala Asp Glu Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Arg Ala Glu Arg Trp Leu His Leu Ser Gly Ala Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Gly Ser Ala Ser Ala
115 120 125
Pro Lys Leu Glu Glu Gly Glu Phe Ser Glu Ala Arg Val Gln Pro Val
130 135 140
Leu Thr Gln Ser Ser Ser Ala Ser Gly Thr Pro Gly Gln Arg Val Ala
145 150 155 160
Ile Ser Cys Ser Gly Ser Ser Ser Asn Val Gly Ser Asn Thr Val Asn
165 170 175
Trp Tyr Gln Gln Ser Pro Gly Thr Ala Pro Lys Leu Leu Ile Ser Ser
180 185 190
Asn His Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Lys
195 200 205
Phe Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Gln Ser Glu Asp
210 215 220
Glu Ala Asp Tyr Tyr Cys Gly Ala Trp Asp Asp Ser Leu Asn Gly Tyr
225 230 235 240
Val Phe Gly Ser Gly Thr Lys Val Thr Val Leu
245 250
<210> 94
<211> 244
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-HLA-A2 scFv"
<400> 94
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ala Ile Ser Gly Ser Gly Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Met Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Val Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Thr Gly His Tyr Gly Asp Tyr Val Trp Gly Gln Gly Ala Leu Val
100 105 110
Thr Val Ser Ser Gly Ser Ala Ser Ala Pro Lys Leu Glu Glu Gly Glu
115 120 125
Phe Ser Glu Ala Arg Val Gln Ala Gly Leu Thr Gln Pro Pro Ser Ala
130 135 140
Ser Gly Thr Pro Gly Gln Arg Val Thr Ile Ser Cys Ser Gly Ser Ser
145 150 155 160
Ser Asn Ile Gly Ser Asn Thr Val Asn Trp Tyr Gln Gln Leu Pro Gly
165 170 175
Thr Ala Pro Lys Leu Leu Ile Tyr Ser Asn Asn Gln Arg Pro Ser Gly
180 185 190
Val Pro Asp Arg Phe Ser Gly Ser Lys Ser Gly Thr Ser Ala Ser Leu
195 200 205
Ala Ile Ser Gly Leu Gln Ser Glu Asp Glu Ala Asp Tyr Tyr Cys Ala
210 215 220
Ala Trp Asp Asp Ser Leu Asn Gly Pro Val Phe Gly Gly Gly Thr Lys
225 230 235 240
Leu Thr Val Leu
<210> 95
<211> 246
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-HLA-A2 scFv"
<400> 95
Gln Val Gln Leu Gln Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Ala Met His Trp Val Arg Gln Ala Pro Gly Gln Arg Leu Glu Trp Met
35 40 45
Gly Trp Ile Asn Ala Gly Asn Gly Asn Thr Lys Tyr Ser Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Arg Asp Thr Ser Ala Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Val Ser Ser Gly Gly Ala Phe Asp Ile Trp Gly Gln Gly Thr
100 105 110
Val Val Thr Val Ser Ser Gly Ser Ala Ser Ala Pro Lys Leu Glu Glu
115 120 125
Gly Glu Phe Ser Glu Ala Arg Val Gln Ser Ala Leu Thr Gln Pro Ala
130 135 140
Ser Val Ser Gly Ser Pro Gly Gln Ser Ile Thr Ile Ser Cys Thr Gly
145 150 155 160
Thr Gly Ser Asp Val Gly Gly Tyr Lys Tyr Val Ser Trp Tyr Gln His
165 170 175
His Pro Gly Lys Ala Pro Arg Leu Ile Ile Tyr Asp Val Asn Tyr Trp
180 185 190
Pro Ser Gly Val Ser His Arg Phe Ser Gly Ser Lys Ser Gly Asn Thr
195 200 205
Ala Ser Leu Thr Ile Ser Gly Leu Gln Ser Glu Asp Glu Ala Asp Tyr
210 215 220
Tyr Cys Ser Ser Tyr Arg Thr Gly Asp Thr Trp Val Phe Gly Gly Gly
225 230 235 240
Thr Lys Leu Thr Val Leu
245
<210> 96
<211> 248
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-HLA-A2 scFv"
<400> 96
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Gly Phe Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Glu Ile Ile Pro Met Phe Gly Thr Ala Asn Tyr Ala Gln Lys Leu
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Glu Thr Ser Thr Ser Thr Val Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Arg Val Pro Arg Ser Ser Ser Gly Tyr Asn Tyr Gly Met Asp Val
100 105 110
Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Gly Ser Ala Ser Ala
115 120 125
Pro Lys Leu Glu Glu Gly Glu Phe Ser Glu Ala Arg Val Asp Ile Gln
130 135 140
Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val
145 150 155 160
Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Ser Asn Tyr Leu Ala Trp
165 170 175
Tyr Gln Gln Lys Pro Gly Lys Val Pro Lys Leu Leu Ile Tyr Ala Ala
180 185 190
Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser
195 200 205
Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Val
210 215 220
Ala Thr Tyr Tyr Cys Gln Lys Tyr Asn Ser Ala Pro Arg Thr Phe Gly
225 230 235 240
Gln Gly Thr Lys Val Glu Ile Lys
245
<210> 97
<211> 250
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-HLA-A2 scFv"
<400> 97
Gln Val Gln Leu Gln Gln Ser Gly Pro Gly Leu Leu Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Ala Val Ser Gly Asp Ser Val Ser Thr Asn
20 25 30
Ser Gly Ala Trp Ser Trp Ile Arg Gln Ser Pro Ser Arg Gly Leu Glu
35 40 45
Trp Leu Gly Arg Thr Tyr Tyr Arg Ser Lys Trp Ser Thr Asp Tyr Ala
50 55 60
Leu Ser Leu Gln Ser Arg Val Thr Ile Lys Ser Asp Arg Ser Lys Asn
65 70 75 80
Gln Phe Ser Leu Gln Leu Asp Ser Val Thr Pro Glu Asp Thr Ala Ile
85 90 95
Tyr Tyr Cys Ala Arg Glu Asn Trp Asn Ser Gly Gly Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Pro Ser Gly Ser Ala Ser Ala Pro
115 120 125
Lys Leu Glu Glu Gly Glu Phe Ser Glu Ala Arg Val Gln Pro Val Leu
130 135 140
Thr Gln Ser Ser Ser Ala Ser Gly Ser Pro Gly Gln Ser Val Thr Ile
145 150 155 160
Ser Cys Thr Gly Thr Ser Ser Asp Val Gly Gly Tyr Asn Tyr Val Ser
165 170 175
Trp Tyr Gln Gln His Pro Gly Lys Ala Pro Lys Leu Met Ile Tyr Glu
180 185 190
Val Ser Lys Arg Pro Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Lys
195 200 205
Ser Gly Ser Thr Ala Ser Leu Thr Val Ser Gly Leu Gln Ala Glu Asp
210 215 220
Glu Ala Glu Tyr Tyr Cys Ser Ser Tyr Ala Gly Ser Asn Asn Tyr Val
225 230 235 240
Phe Gly Thr Gly Thr Lys Val Thr Val Leu
245 250
<210> 98
<211> 249
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-HLA-A2 scFv"
<400> 98
Glu Val Gln Leu Val Glu Ser Gly Ala Glu Val Lys Lys Pro Gly Ser
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Gly Thr Phe Ser Ser Tyr
20 25 30
Ala Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Gly Ile Ile Pro Ile Phe Gly Thr Ala Asn Tyr Ala Gln Lys Phe
50 55 60
Gln Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Arg Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Ala Ala Ser Arg Trp Glu Pro Gly Asp Ala Phe Asp Ile Trp
100 105 110
Gly Gln Gly Thr Met Val Thr Val Ser Ser Gly Ser Ala Ser Ala Pro
115 120 125
Lys Leu Glu Glu Gly Glu Phe Ser Glu Ala Arg Val Gln Pro Val Leu
130 135 140
Thr Gln Ser Ser Ser Val Ser Val Ala Pro Gly Lys Thr Ala Arg Val
145 150 155 160
Thr Cys Gly Gly Asp Asn Ile Gly Gly Lys Ser Val His Trp Tyr Gln
165 170 175
Gln Arg Ala Gly Gln Ala Pro Val Leu Val Ile Ser His Asp Thr Asp
180 185 190
Arg Pro Ser Gly Ile Pro Glu Arg Phe Ser Gly Ser Lys Ser Gly Thr
195 200 205
Ser Ala Ser Leu Ala Ile Ser Gly Leu Arg Ser Glu Asp Glu Ala Asp
210 215 220
Tyr Tyr Cys Ala Val Trp Asp Ala Ser Leu Gly Gly Ser Trp Leu Phe
225 230 235 240
Gly Gly Gly Thr Lys Leu Thr Val Leu
245
<210> 99
<211> 252
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-HLA-A2 scFv"
<400> 99
Gln Val Gln Leu Val Gln Ser Gly Ala Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Thr Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
Asp Ile Ser Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Trp Ile Ser Ala Tyr Asn Gly Asn Thr Asn Tyr Ala Gln Lys Leu
50 55 60
Gln Gly Arg Val Thr Met Thr Thr Asp Thr Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Arg Leu Arg Ser Asp Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Gly Arg Trp Leu Arg Ser Ala Ser Ser Phe Asp Tyr Trp
100 105 110
Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Ser Ala Ser Ala Pro
115 120 125
Lys Leu Glu Glu Gly Glu Phe Ser Glu Ala Arg Val Gln Ala Gly Leu
130 135 140
Thr Gln Pro Pro Ser Val Ser Gly Ala Pro Gly Gln Arg Val Thr Ile
145 150 155 160
Ser Cys Thr Gly Ser Ser Ser Asn Ile Gly Ala Ala Tyr Asp Val His
165 170 175
Trp Tyr Gln Gln Leu Pro Gly Ala Ala Pro Lys Leu Leu Ile Phe Gly
180 185 190
Asp Ser Asn Arg Pro Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Lys
195 200 205
Ser Asp Thr Ser Ala Ser Leu Ala Ile Thr Gly Leu Gln Ala Glu Asp
210 215 220
Glu Ala Asp Tyr Tyr Cys Gln Ser Phe Asp Ser Ser Leu Ser Gly Ser
225 230 235 240
Arg Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
245 250
<210> 100
<211> 251
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-HLA-A2 scFv"
<400> 100
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Asp His
20 25 30
Tyr Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Tyr Ile Thr Ser Gly Gly Ser Ser Ile Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Gly Leu Asp Ser Ser Ala Tyr Gln Gly Arg Ala Phe Asp Ile
100 105 110
Trp Gly Gln Gly Thr Met Val Thr Val Ser Ser Gly Ser Ala Ser Ala
115 120 125
Pro Lys Leu Glu Glu Gly Glu Phe Ser Glu Ala Arg Val Leu Pro Val
130 135 140
Leu Thr Gln Pro Pro Ser Ala Ser Gly Thr Pro Gly Gln Arg Val Thr
145 150 155 160
Ile Ser Cys Ser Gly Ser Ser Ser Asn Ile Gly Ser Asn Pro Val His
165 170 175
Trp Tyr Gln Gln Leu Pro Gly Thr Ala Pro Lys Leu Leu Val Tyr Arg
180 185 190
Asn Asn Gln Arg Pro Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Lys
195 200 205
Ser Gly Thr Ser Ala Ser Leu Ala Ile Ser Gly Leu Arg Ser Glu Asp
210 215 220
Glu Ala Asp Tyr Tyr Cys Ala Ala Trp Asp Val Ser Leu Ser Gly Val
225 230 235 240
Val Phe Gly Gly Gly Thr Lys Leu Thr Val Leu
245 250
<210> 101
<211> 246
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-HLA-A2 scFv"
<400> 101
Gln Val Gln Leu Val Gln Ser Gly Pro Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Gln Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Gly Gly Gly Gly Ser Asp Val Val Met Thr Gln Thr Pro Leu Ser Leu
130 135 140
Pro Val Thr Leu Gly Glu Pro Ala Ser Ile Ser Cys Arg Ser Ser Gln
145 150 155 160
Ser Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Leu Gln
165 170 175
Lys Pro Gly Gln Ser Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn Arg
180 185 190
Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp
195 200 205
Phe Thr Leu Lys Ile Ser Arg Val Glu Ala Glu Asp Leu Gly Val Tyr
210 215 220
Tyr Cys Phe Gln Gly Ser His Val Pro Arg Thr Phe Gly Gly Gly Thr
225 230 235 240
Lys Leu Glu Ile Lys Arg
245
<210> 102
<211> 246
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-HLA-A2 scFv"
<400> 102
Gln Val Gln Leu Val Gln Ser Gly Pro Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Gln Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Gly Gly Gly Gly Ser Asp Val Val Met Thr Gln Ser Pro Ser Ser Leu
130 135 140
Ser Val Thr Leu Gly Asp Arg Val Ser Ile Ser Cys Arg Ser Ser Gln
145 150 155 160
Ser Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Gln Gln
165 170 175
Lys Pro Gly Gln Ser Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn Arg
180 185 190
Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp
195 200 205
Phe Thr Leu Thr Ile Ser Arg Val Glu Pro Glu Asp Leu Gly Val Tyr
210 215 220
Tyr Cys Phe Gln Gly Ser His Val Pro Arg Thr Phe Gly Gly Gly Thr
225 230 235 240
Lys Leu Glu Ile Lys Arg
245
<210> 103
<211> 246
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-HLA-A2 scFv"
<400> 103
Gln Val Gln Leu Val Gln Ser Gly Pro Glu Val Lys Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser Tyr
20 25 30
His Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Ile
35 40 45
Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Gln Tyr Asn Glu Lys Phe
50 55 60
Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Ser Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Gly Gly Gly Gly Ser Asp Ile Val Met Thr Gln Ser Pro Ala Thr Leu
130 135 140
Ser Val Ser Pro Gly Glu Arg Ala Thr Ile Ser Cys Arg Ser Ser Gln
145 150 155 160
Ser Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Gln Gln
165 170 175
Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn Arg
180 185 190
Phe Ser Gly Ile Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp
195 200 205
Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro Glu Asp Phe Ala Val Tyr
210 215 220
Tyr Cys Phe Gln Gly Ser His Val Pro Arg Thr Phe Gly Gly Gly Thr
225 230 235 240
Lys Leu Glu Ile Lys Arg
245
<210> 104
<211> 247
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-HLA-A2 scFv"
<400> 104
Ser Gln Val Gln Leu Val Gln Ser Gly Pro Glu Val Lys Lys Pro Gly
1 5 10 15
Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser
20 25 30
Tyr His Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp
35 40 45
Ile Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Gln Tyr Asn Glu Lys
50 55 60
Phe Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala
65 70 75 80
Tyr Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Ser Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Asp Val Val Met Thr Gln Ser Pro Ser Ser
130 135 140
Leu Ser Val Thr Leu Gly Asp Arg Val Ser Ile Ser Cys Arg Ser Ser
145 150 155 160
Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Gln
165 170 175
Gln Lys Pro Gly Gln Ser Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn
180 185 190
Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr
195 200 205
Asp Phe Thr Leu Thr Ile Ser Arg Val Glu Pro Glu Asp Leu Gly Val
210 215 220
Tyr Tyr Cys Phe Gln Gly Ser His Val Pro Arg Thr Phe Gly Gly Gly
225 230 235 240
Thr Lys Leu Glu Ile Lys Arg
245
<210> 105
<211> 247
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-HLA-A2 scFv"
<400> 105
Ser Gln Val Gln Leu Val Gln Ser Gly Pro Glu Val Lys Lys Pro Gly
1 5 10 15
Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser
20 25 30
Tyr His Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp
35 40 45
Ile Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Gln Tyr Asn Glu Lys
50 55 60
Phe Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala
65 70 75 80
Tyr Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Ser Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Asp Val Val Met Thr Gln Ser Pro Ser Ser
130 135 140
Leu Ser Val Thr Leu Gly Asp Arg Val Ser Ile Ser Cys Arg Ser Ser
145 150 155 160
Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Gln
165 170 175
Gln Lys Pro Gly Gln Ser Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn
180 185 190
Arg Phe Ser Gly Val Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr
195 200 205
Asp Phe Thr Leu Thr Ile Ser Arg Val Glu Pro Glu Asp Leu Gly Val
210 215 220
Tyr Tyr Cys Phe Gln Gly Ser His Val Pro Arg Thr Phe Gly Gly Gly
225 230 235 240
Thr Lys Leu Glu Ile Lys Arg
245
<210> 106
<211> 247
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-HLA-A2 scFv"
<400> 106
Ser Gln Val Gln Leu Val Gln Ser Gly Pro Glu Val Lys Lys Pro Gly
1 5 10 15
Ala Ser Val Lys Val Ser Cys Lys Ala Ser Gly Tyr Thr Phe Thr Ser
20 25 30
Tyr His Ile Gln Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp
35 40 45
Ile Gly Trp Ile Tyr Pro Gly Asp Gly Ser Thr Gln Tyr Asn Glu Lys
50 55 60
Phe Lys Gly Arg Val Thr Ile Thr Ala Asp Lys Ser Thr Ser Thr Ala
65 70 75 80
Tyr Met Glu Leu Ser Ser Leu Thr Ser Glu Asp Thr Ala Val Tyr Tyr
85 90 95
Cys Ala Arg Glu Gly Thr Tyr Tyr Ala Met Asp Tyr Trp Gly Gln Gly
100 105 110
Thr Ser Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Asp Ile Val Met Thr Gln Ser Pro Ala Thr
130 135 140
Leu Ser Val Ser Pro Gly Glu Arg Ala Thr Ile Ser Cys Arg Ser Ser
145 150 155 160
Gln Ser Ile Val His Ser Asn Gly Asn Thr Tyr Leu Glu Trp Tyr Gln
165 170 175
Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile Tyr Lys Val Ser Asn
180 185 190
Arg Phe Ser Gly Ile Pro Asp Arg Phe Ser Gly Ser Gly Ser Gly Thr
195 200 205
Asp Phe Thr Leu Thr Ile Ser Arg Leu Glu Pro Glu Asp Phe Ala Val
210 215 220
Tyr Tyr Cys Phe Gln Gly Ser His Val Pro Arg Thr Phe Gly Gly Gly
225 230 235 240
Thr Lys Leu Glu Ile Lys Arg
245
<210> 107
<211> 245
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="anti-HLA-A2 scFv"
<400> 107
Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Val Ser Cys Ala Ala Ser Gly Val Thr Leu Ser Asp Tyr
20 25 30
Gly Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Met
35 40 45
Ala Phe Ile Arg Asn Asp Gly Ser Asp Lys Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Lys Thr Val Ser
65 70 75 80
Leu Gln Met Ser Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Lys Asn Gly Glu Ser Gly Pro Leu Asp Tyr Trp Tyr Phe Asp Leu
100 105 110
Trp Gly Arg Gly Thr Leu Val Thr Val Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Val Val Met Thr Gln Ser
130 135 140
Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys
145 150 155 160
Gln Ala Ser Gln Asp Ile Ser Asn Tyr Leu Asn Trp Tyr Gln Gln Lys
165 170 175
Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Asp Ala Ser Asn Leu Glu
180 185 190
Thr Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe
195 200 205
Thr Phe Thr Ile Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr
210 215 220
Cys Gln Gln Tyr Ser Ser Phe Pro Leu Thr Phe Gly Gly Gly Thr Lys
225 230 235 240
Val Asp Ile Lys Arg
245
<210> 108
<211> 2853
<212> DNA
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polynucleotide"
<220>
<221> source
<223> /note="CD20-CAR (TNFR1TM-TNFR1-CD3z)-P2A-GFP"
<400> 108
atggctctgc ctgtgacagc tctgctgctg cctctggctc tgcttctgca tgccgccaga 60
ccttctcagg tgcagctggt tcagtctggc gccgagcttg tgaaacctgg cgcctctgtg 120
aagatgagct gcaaggccag cggctacacc ttcaccagct acaacatgca ctgggtcaag 180
cagacccctg gacagggact cgagtggatc ggagccatct atcccggcaa tggcgacacc 240
tcctacaacc agaagttcaa gggcaaagcc acactgaccg ccgacaagag cagcagcaca 300
gcctacatgc agctgagcag cctgaccagc gaagatagcg ccgtgtacta ctgcgctaga 360
gcccagctga ggcccaacta ctggtacttc gatgtgtggg gagccggcac caccgtgacc 420
gtgtcaaaaa tttctggcgg cggaggatct ggcggaggtg gaagcggagg cggaggaagc 480
ggtggatctt ctgacatcgt gctgtctcag agccccgcca tcctttcagc tagccctggc 540
gagaaagtga ccatgacctg tagagccagc agcagcgtgt cctatatgca ctggtatcag 600
cagaagcccg gcagcagccc taagccttgg atctacgcca caagcaatct ggccagcgga 660
gtgcctgcca gattttctgg ctctggcagc ggcacaagct actccctgac aatcagcaga 720
gtggaagccg aggatgccgc cacctactac tgtcagcagt ggatcagcaa ccctcctacc 780
tttggcgctg gcaccaagct ggaactgaag tctgcatggt cccatcctca gttcgagaag 840
tctggaatgc atacaacaac ccctgctcct cggcctccta caccagctcc tacaattgcc 900
agccagccac tgtctctgag gcccgaagct tgtagacctg ctgctggcgg agccgtgcat 960
acaagaggac tggatttcgc ctgcgacgtg ctgttgcccc tggtcatttt ctttggtctt 1020
tgccttttat ccctcctctt cattggttta atgtatcgct accaacggtg gaagtccaag 1080
ctctactcca ttgtttgtgg gaaatcgaca cctgaaaaag agggggagct tgaaggaact 1140
actactaagc ccctggcccc aaacccaagc ttcagtccca ctccaggctt cacccccacc 1200
ctgggcttca gtcccgtgcc cagttccacc ttcacctcca gctccaccta tacccccggt 1260
gactgtccca actttgcggc tccccgcaga gaggtggcac caccctatca gggggctgac 1320
cccatccttg cgacagccct cgcctccgac cccatcccca acccccttca gaagtgggag 1380
gacagcgccc acaagccaca gagcctagac actgatgacc ccgcgacgct gtacgccgtg 1440
gtggagaacg tgcccccgtt gcgctggaag gaattcgtgc ggcgccttgg gctgagcgac 1500
cacgagatag atcggctgga gctacagaac gggcgctgcc tgcgcgaggc gcaatacagt 1560
atgctggcga cctggaggcg gcgcacgcca cggcgcgagg ccacgctgga gctgctgggt 1620
cgcgtgctcc gcgacatgga cctgctgggc tgcctggagg acatcgagga ggcgctttgc 1680
ggccccgccg ccctcccgcc cgcgcccagt cttctcagaa cgcgtagagt gaagttcagc 1740
agatccgccg acgctcctgc ctatcagcag ggccaaaacc agctgtacaa cgagctgaac 1800
ctggggagaa gagaagagta cgacgtgctg gacaagcgga gaggcagaga tcctgaaatg 1860
ggcggcaagc ccagacggaa gaatcctcaa gagggcctgt ataatgagct gcagaaagac 1920
aagatggccg aggcctacag cgagatcgga atgaagggcg agcgcagaag aggcaaggga 1980
cacgatggac tgtaccaggg cctgagcacc gccaccaagg atacctatga tgccctgcac 2040
atgcaggccc tgcctccaag agctagcgga agcggagcta ctaacttcag cctgctgaag 2100
caggctggag acgtggagga gaaccctgga cctatggtga gcaagggcga ggagctgttc 2160
accggggtgg tgcccatcct ggtcgagctg gacggcgacg taaacggcca caagttcagc 2220
gtgtccggcg agggcgaggg cgatgccacc tacggcaagc tgaccctgaa gttcatctgc 2280
accaccggca agctgcccgt gccctggccc accctcgtga ccaccctgac ctacggcgtg 2340
cagtgcttca gccgctaccc cgaccacatg aagcagcacg acttcttcaa gtccgccatg 2400
cccgaaggct acgtccagga gcgcaccatc ttcttcaagg acgacggcaa ctacaagacc 2460
cgcgccgagg tgaagttcga gggcgacacc ctggtgaacc gcatcgagct gaagggcatc 2520
gacttcaagg aggacggcaa catcctgggg cacaagctgg agtacaacta caacagccac 2580
aacgtctata tcatggccga caagcagaag aacggcatca aggtgaactt caagatccgc 2640
cacaacatcg aggacggcag cgtgcagctc gccgaccact accagcagaa cacccccatc 2700
ggcgacggcc ccgtgctgct gcccgacaac cactacctga gcacccagtc cgccctgagc 2760
aaagacccca acgagaagcg cgatcacatg gtcctgctgg agttcgtgac cgccgccggg 2820
atcactctcg gcatggacga gctgtacaag taa 2853
<210> 109
<211> 950
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
polypeptide"
<220>
<221> source
<223> /note="CD20-CAR (TNFR1TM-TNFR1-CD3z)-P2A-GFP"
<400> 109
Met Ala Leu Pro Val Thr Ala Leu Leu Leu Pro Leu Ala Leu Leu Leu
1 5 10 15
His Ala Ala Arg Pro Ser Gln Val Gln Leu Val Gln Ser Gly Ala Glu
20 25 30
Leu Val Lys Pro Gly Ala Ser Val Lys Met Ser Cys Lys Ala Ser Gly
35 40 45
Tyr Thr Phe Thr Ser Tyr Asn Met His Trp Val Lys Gln Thr Pro Gly
50 55 60
Gln Gly Leu Glu Trp Ile Gly Ala Ile Tyr Pro Gly Asn Gly Asp Thr
65 70 75 80
Ser Tyr Asn Gln Lys Phe Lys Gly Lys Ala Thr Leu Thr Ala Asp Lys
85 90 95
Ser Ser Ser Thr Ala Tyr Met Gln Leu Ser Ser Leu Thr Ser Glu Asp
100 105 110
Ser Ala Val Tyr Tyr Cys Ala Arg Ala Gln Leu Arg Pro Asn Tyr Trp
115 120 125
Tyr Phe Asp Val Trp Gly Ala Gly Thr Thr Val Thr Val Ser Lys Ile
130 135 140
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
145 150 155 160
Gly Gly Ser Ser Asp Ile Val Leu Ser Gln Ser Pro Ala Ile Leu Ser
165 170 175
Ala Ser Pro Gly Glu Lys Val Thr Met Thr Cys Arg Ala Ser Ser Ser
180 185 190
Val Ser Tyr Met His Trp Tyr Gln Gln Lys Pro Gly Ser Ser Pro Lys
195 200 205
Pro Trp Ile Tyr Ala Thr Ser Asn Leu Ala Ser Gly Val Pro Ala Arg
210 215 220
Phe Ser Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Arg
225 230 235 240
Val Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys Gln Gln Trp Ile Ser
245 250 255
Asn Pro Pro Thr Phe Gly Ala Gly Thr Lys Leu Glu Leu Lys Ser Ala
260 265 270
Trp Ser His Pro Gln Phe Glu Lys Ser Gly Met His Thr Thr Thr Pro
275 280 285
Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala Ser Gln Pro Leu
290 295 300
Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly Gly Ala Val His
305 310 315 320
Thr Arg Gly Leu Asp Phe Ala Cys Asp Val Leu Leu Pro Leu Val Ile
325 330 335
Phe Phe Gly Leu Cys Leu Leu Ser Leu Leu Phe Ile Gly Leu Met Tyr
340 345 350
Arg Tyr Gln Arg Trp Lys Ser Lys Leu Tyr Ser Ile Val Cys Gly Lys
355 360 365
Ser Thr Pro Glu Lys Glu Gly Glu Leu Glu Gly Thr Thr Thr Lys Pro
370 375 380
Leu Ala Pro Asn Pro Ser Phe Ser Pro Thr Pro Gly Phe Thr Pro Thr
385 390 395 400
Leu Gly Phe Ser Pro Val Pro Ser Ser Thr Phe Thr Ser Ser Ser Thr
405 410 415
Tyr Thr Pro Gly Asp Cys Pro Asn Phe Ala Ala Pro Arg Arg Glu Val
420 425 430
Ala Pro Pro Tyr Gln Gly Ala Asp Pro Ile Leu Ala Thr Ala Leu Ala
435 440 445
Ser Asp Pro Ile Pro Asn Pro Leu Gln Lys Trp Glu Asp Ser Ala His
450 455 460
Lys Pro Gln Ser Leu Asp Thr Asp Asp Pro Ala Thr Leu Tyr Ala Val
465 470 475 480
Val Glu Asn Val Pro Pro Leu Arg Trp Lys Glu Phe Val Arg Arg Leu
485 490 495
Gly Leu Ser Asp His Glu Ile Asp Arg Leu Glu Leu Gln Asn Gly Arg
500 505 510
Cys Leu Arg Glu Ala Gln Tyr Ser Met Leu Ala Thr Trp Arg Arg Arg
515 520 525
Thr Pro Arg Arg Glu Ala Thr Leu Glu Leu Leu Gly Arg Val Leu Arg
530 535 540
Asp Met Asp Leu Leu Gly Cys Leu Glu Asp Ile Glu Glu Ala Leu Cys
545 550 555 560
Gly Pro Ala Ala Leu Pro Pro Ala Pro Ser Leu Leu Arg Thr Arg Arg
565 570 575
Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala Tyr Gln Gln Gly Gln
580 585 590
Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg Arg Glu Glu Tyr Asp
595 600 605
Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu Met Gly Gly Lys Pro
610 615 620
Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn Glu Leu Gln Lys Asp
625 630 635 640
Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met Lys Gly Glu Arg Arg
645 650 655
Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly Leu Ser Thr Ala Thr
660 665 670
Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala Leu Pro Pro Arg Ala
675 680 685
Ser Gly Ser Gly Ala Thr Asn Phe Ser Leu Leu Lys Gln Ala Gly Asp
690 695 700
Val Glu Glu Asn Pro Gly Pro Met Val Ser Lys Gly Glu Glu Leu Phe
705 710 715 720
Thr Gly Val Val Pro Ile Leu Val Glu Leu Asp Gly Asp Val Asn Gly
725 730 735
His Lys Phe Ser Val Ser Gly Glu Gly Glu Gly Asp Ala Thr Tyr Gly
740 745 750
Lys Leu Thr Leu Lys Phe Ile Cys Thr Thr Gly Lys Leu Pro Val Pro
755 760 765
Trp Pro Thr Leu Val Thr Thr Leu Thr Tyr Gly Val Gln Cys Phe Ser
770 775 780
Arg Tyr Pro Asp His Met Lys Gln His Asp Phe Phe Lys Ser Ala Met
785 790 795 800
Pro Glu Gly Tyr Val Gln Glu Arg Thr Ile Phe Phe Lys Asp Asp Gly
805 810 815
Asn Tyr Lys Thr Arg Ala Glu Val Lys Phe Glu Gly Asp Thr Leu Val
820 825 830
Asn Arg Ile Glu Leu Lys Gly Ile Asp Phe Lys Glu Asp Gly Asn Ile
835 840 845
Leu Gly His Lys Leu Glu Tyr Asn Tyr Asn Ser His Asn Val Tyr Ile
850 855 860
Met Ala Asp Lys Gln Lys Asn Gly Ile Lys Val Asn Phe Lys Ile Arg
865 870 875 880
His Asn Ile Glu Asp Gly Ser Val Gln Leu Ala Asp His Tyr Gln Gln
885 890 895
Asn Thr Pro Ile Gly Asp Gly Pro Val Leu Leu Pro Asp Asn His Tyr
900 905 910
Leu Ser Thr Gln Ser Ala Leu Ser Lys Asp Pro Asn Glu Lys Arg Asp
915 920 925
His Met Val Leu Leu Glu Phe Val Thr Ala Ala Gly Ile Thr Leu Gly
930 935 940
Met Asp Glu Leu Tyr Lys
945 950
<210> 110
<211> 214
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artificial Sequence: Synthetic
peptide"
<220>
<221> source
<223> /note="CD8 H-TNFR2 TM-TNFR2del151-3z"
<400> 110
Thr Thr Thr Pro Ala Pro Arg Pro Pro Thr Pro Ala Pro Thr Ile Ala
1 5 10 15
Ser Gln Pro Leu Ser Leu Arg Pro Glu Ala Cys Arg Pro Ala Ala Gly
20 25 30
Gly Ala Val His Thr Arg Gly Leu Asp Phe Ala Cys Asp Phe Ala Leu
35 40 45
Pro Val Gly Leu Ile Val Gly Val Thr Ala Leu Gly Leu Leu Ile Ile
50 55 60
Gly Val Val Asn Cys Val Ile Met Thr Gln Val Lys Lys Lys Pro Leu
65 70 75 80
Cys Leu Gln Arg Glu Ala Lys Val Pro His Leu Pro Ala Asp Lys Ala
85 90 95
Arg Gly Gly Ser Arg Val Lys Phe Ser Arg Ser Ala Asp Ala Pro Ala
100 105 110
Tyr Gln Gln Gly Gln Asn Gln Leu Tyr Asn Glu Leu Asn Leu Gly Arg
115 120 125
Arg Glu Glu Tyr Asp Val Leu Asp Lys Arg Arg Gly Arg Asp Pro Glu
130 135 140
Met Gly Gly Lys Pro Arg Arg Lys Asn Pro Gln Glu Gly Leu Tyr Asn
145 150 155 160
Glu Leu Gln Lys Asp Lys Met Ala Glu Ala Tyr Ser Glu Ile Gly Met
165 170 175
Lys Gly Glu Arg Arg Arg Gly Lys Gly His Asp Gly Leu Tyr Gln Gly
180 185 190
Leu Ser Thr Ala Thr Lys Asp Thr Tyr Asp Ala Leu His Met Gln Ala
195 200 205
Leu Pro Pro Arg Ala Ser
210
<210> 111
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artifical Sequence: Synthetic
peptide"
<220>
<221> source
<223> ./note="Linker"
<400> 111
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 112
<211> 4
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artifical Sequence: Synthetic
peptide"
<220>
<221> source
<223> ./note="Linker"
<400> 112
Gly Gly Gly Ser
1
<210> 113
<211> 16
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artifical Sequence: Synthetic
peptide"
<220>
<221> source
<223> ./note="Linker"
<400> 113
Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser Gly Gly Gly Ser
1 5 10 15
<210> 114
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artifical Sequence: Synthetic
peptide"
<220>
<221> source
<223> ./note="Linker"
<400> 114
Gly Gly Gly Gly Ser
1 5
<210> 115
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artifical Sequence: Synthetic
peptide"
<220>
<221> source
<223> ./note="Linker"
<400> 115
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10
<210> 116
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artifical Sequence: Synthetic
peptide"
<220>
<221> source
<223> ./note="Linker"
<400> 116
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 117
<211> 20
<212> PRT
<213> Artificial Sequence
<220>
<221> source
<223> /note="Description of Artifical Sequence: Synthetic
peptide"
<220>
<221> source
<223> ./note="Linker"
<400> 117
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser
20
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛЕЧЕНИЕ ЗЛОКАЧЕСТВЕННОГО НОВООБРАЗОВАНИЯ С ИСПОЛЬЗОВАНИЕМ ГУМАНИЗИРОВАННОГО ХИМЕРНОГО АНТИГЕННОГО РЕЦЕПТОРА ПРОТИВ ВСМА | 2015 |
|
RU2751660C2 |
| Выделенный альтернативный внутриклеточный сигнальный домен химерного антигенного рецептора и включающий его химерный антигенный рецептор | 2019 |
|
RU2742000C2 |
| CD19-СПЕЦИФИЧЕСКИЙ ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР И ЕГО ПРИМЕНЕНИЯ | 2014 |
|
RU2727447C2 |
| УСТОЙЧИВЫЕ К РИТУКСИМАБУ ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ И ПУТИ ИХ ПРИМЕНЕНИЯ | 2020 |
|
RU2816370C2 |
| ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР | 2016 |
|
RU2752880C2 |
| СОЧЕТАНИЕ КЛЕТОЧНОЙ ТЕРАПИИ И ИММУНОМОДУЛЯТОРНОГО СОЕДИНЕНИЯ | 2018 |
|
RU2777911C2 |
| АНТИ-CLL1-СПЕЦИФИЧЕСКИЕ ОДНОЦЕПОЧЕЧНЫЕ ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ (scCAR) ДЛЯ ИММУНОТЕРАПИИ РАКА | 2016 |
|
RU2731543C2 |
| CD123-СПЕЦИФИЧЕСКИЕ ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ ДЛЯ ИММУНОТЕРАПИИ РАКА | 2015 |
|
RU2727290C2 |
| ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР (CAR) ПРОТИВ CD123 ДЛЯ ИСПОЛЬЗОВАНИЯ В ЛЕЧЕНИИ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ | 2015 |
|
RU2724999C2 |
| КЛЕТКА | 2014 |
|
RU2717984C2 |
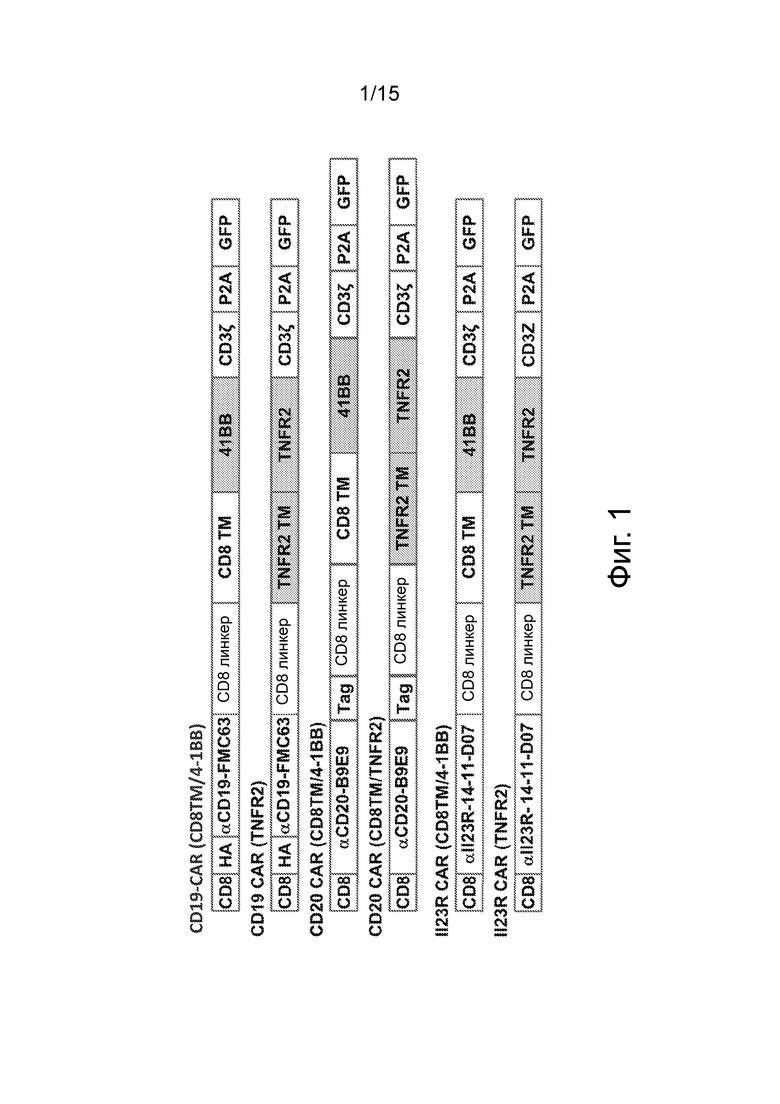
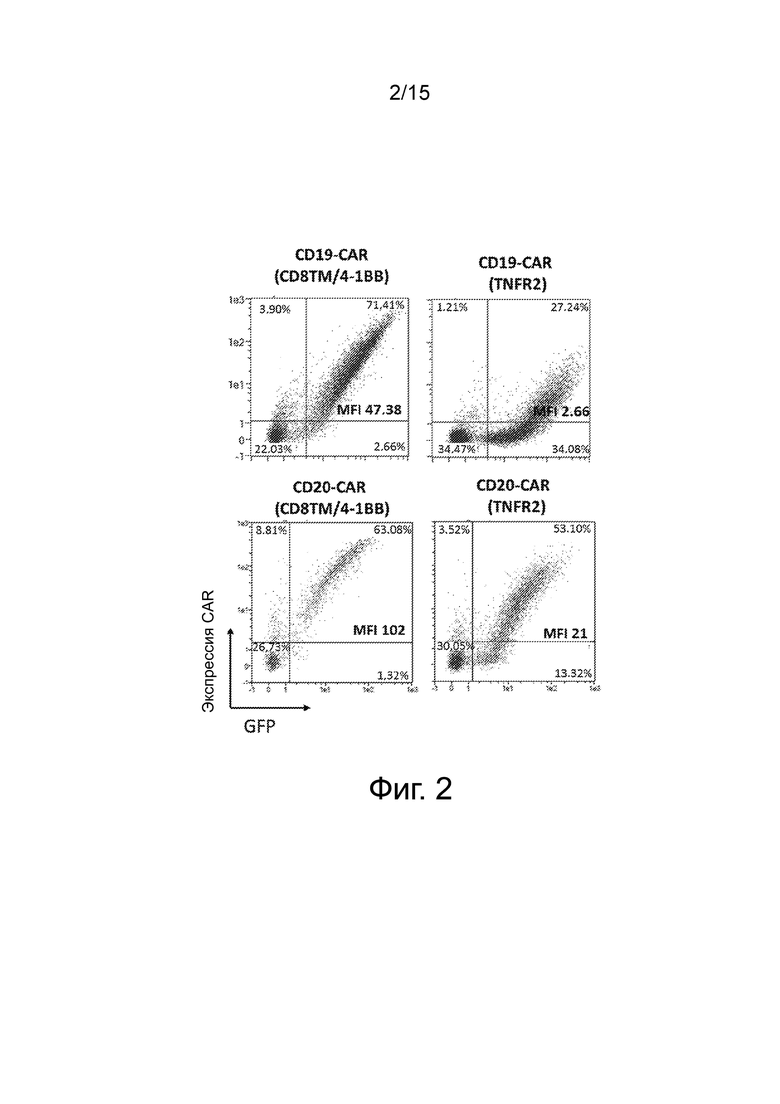

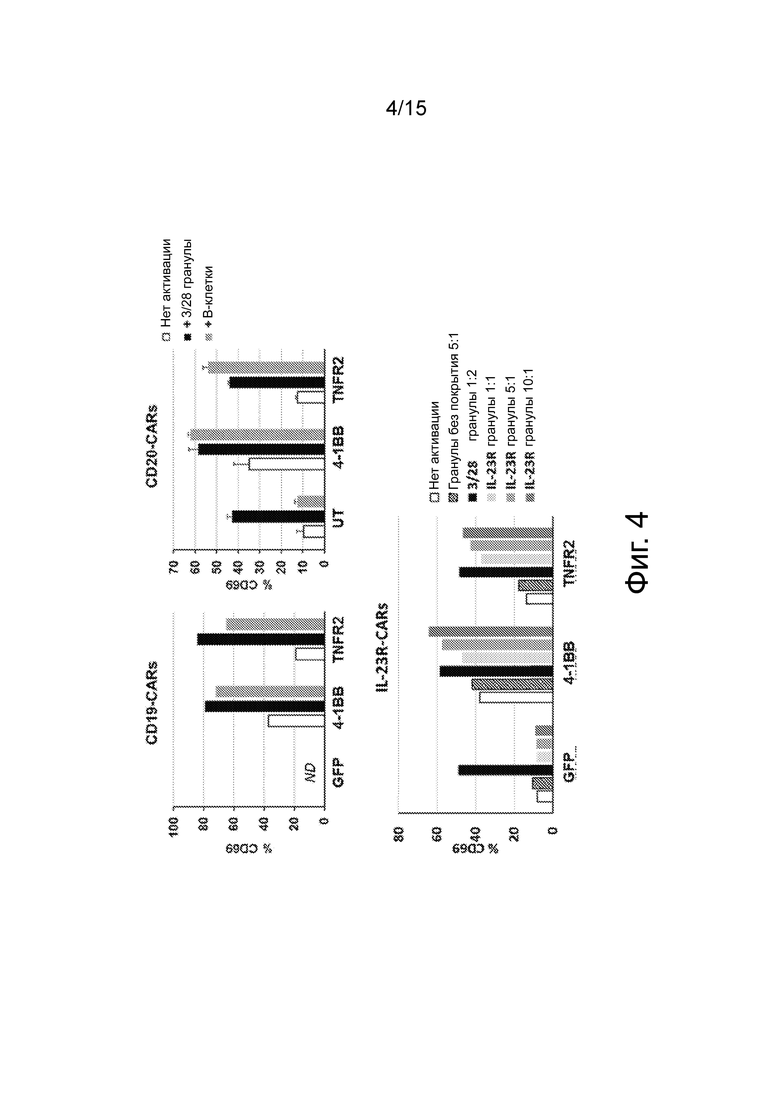
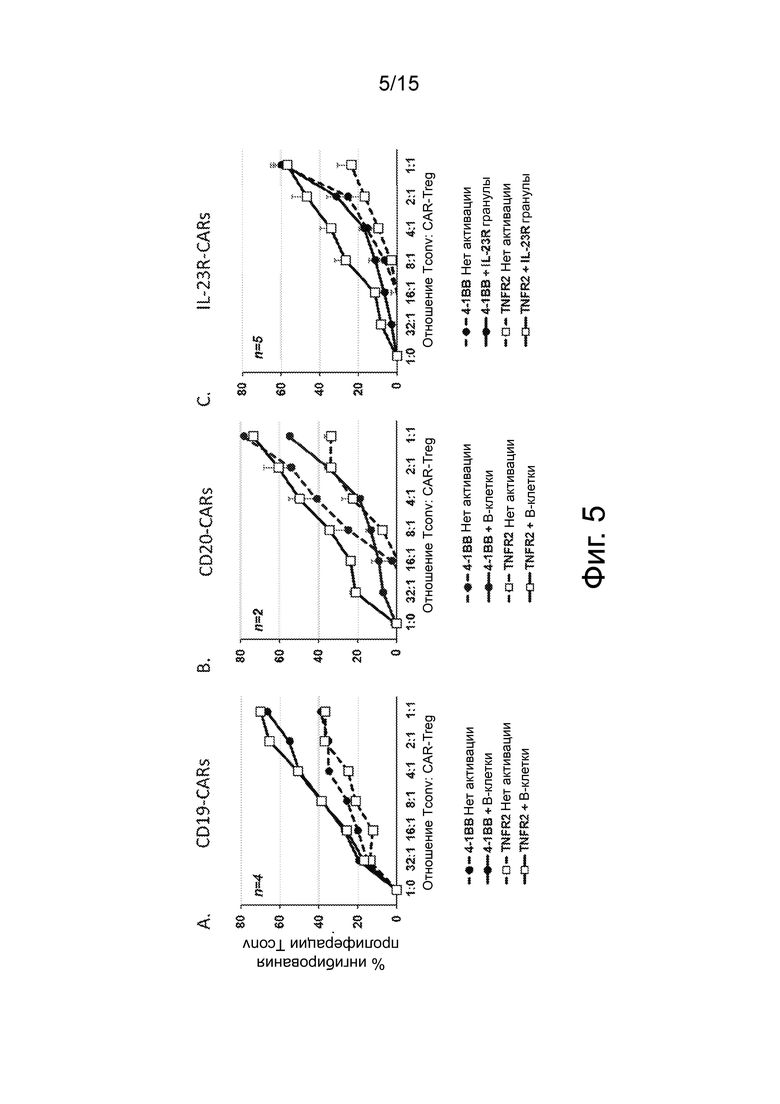
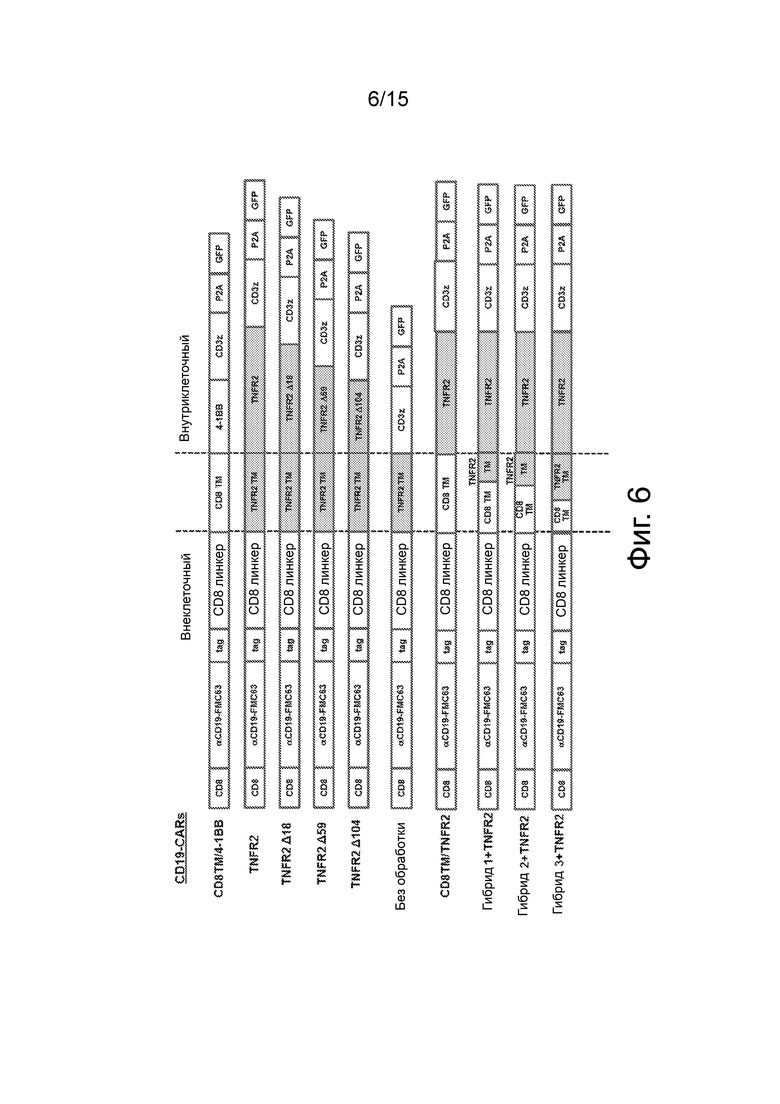
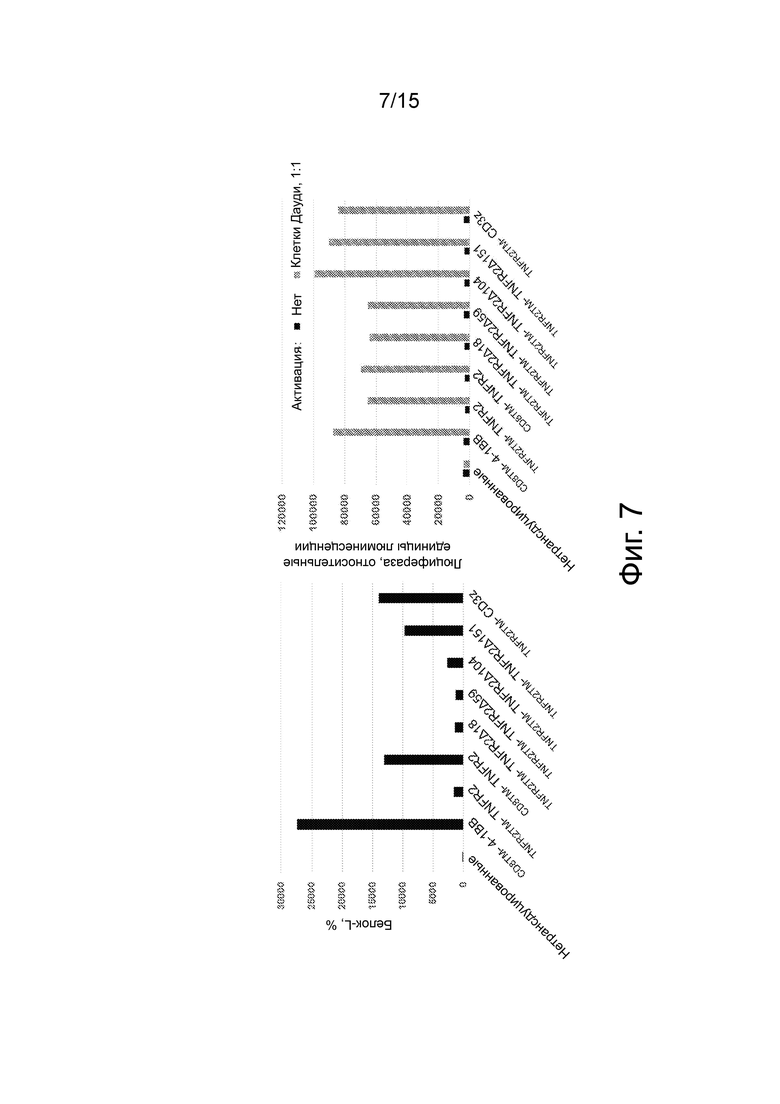
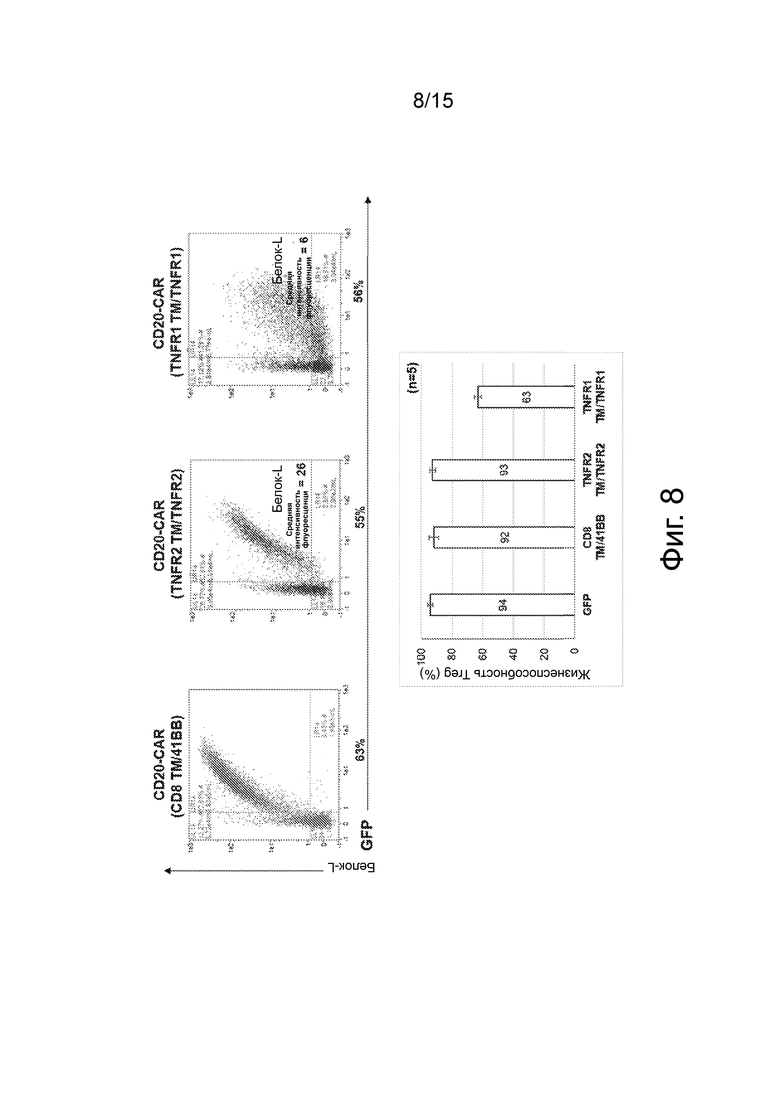
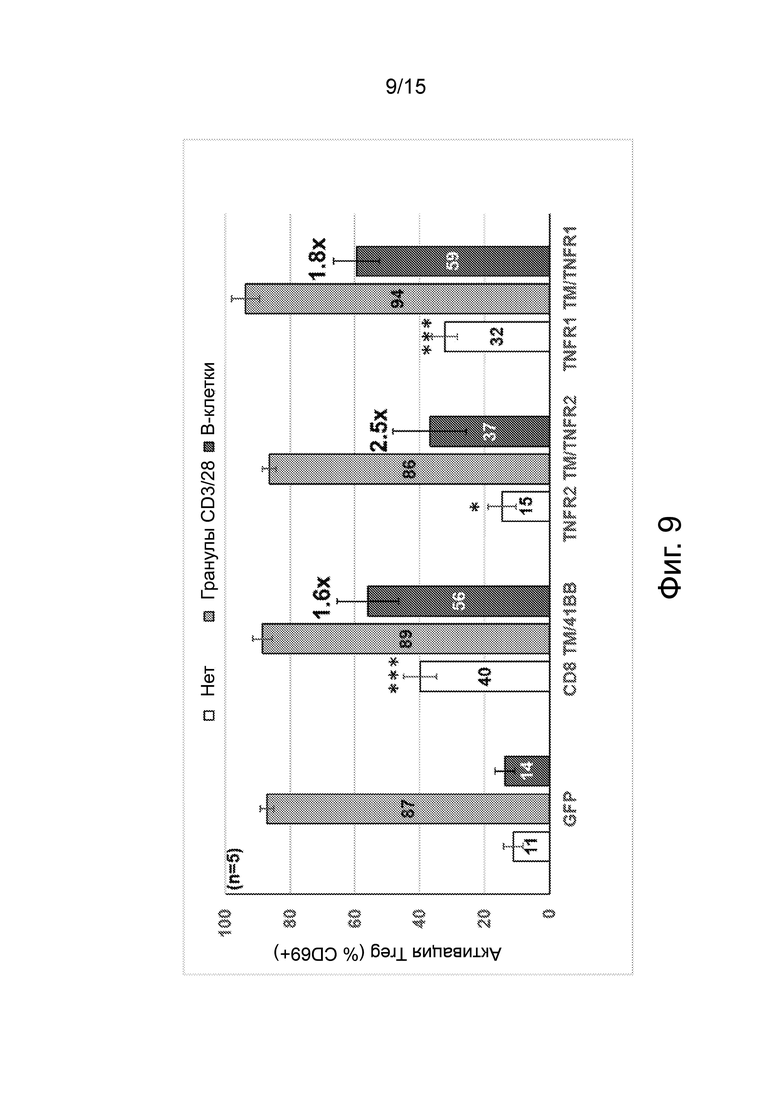
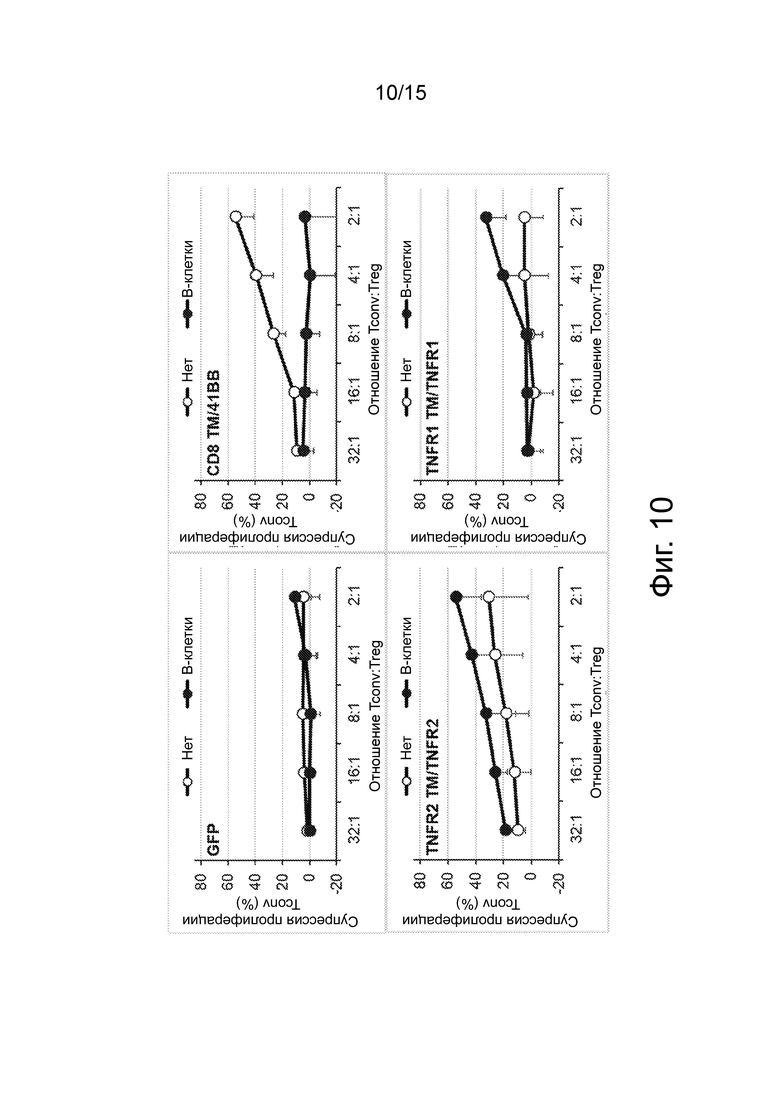
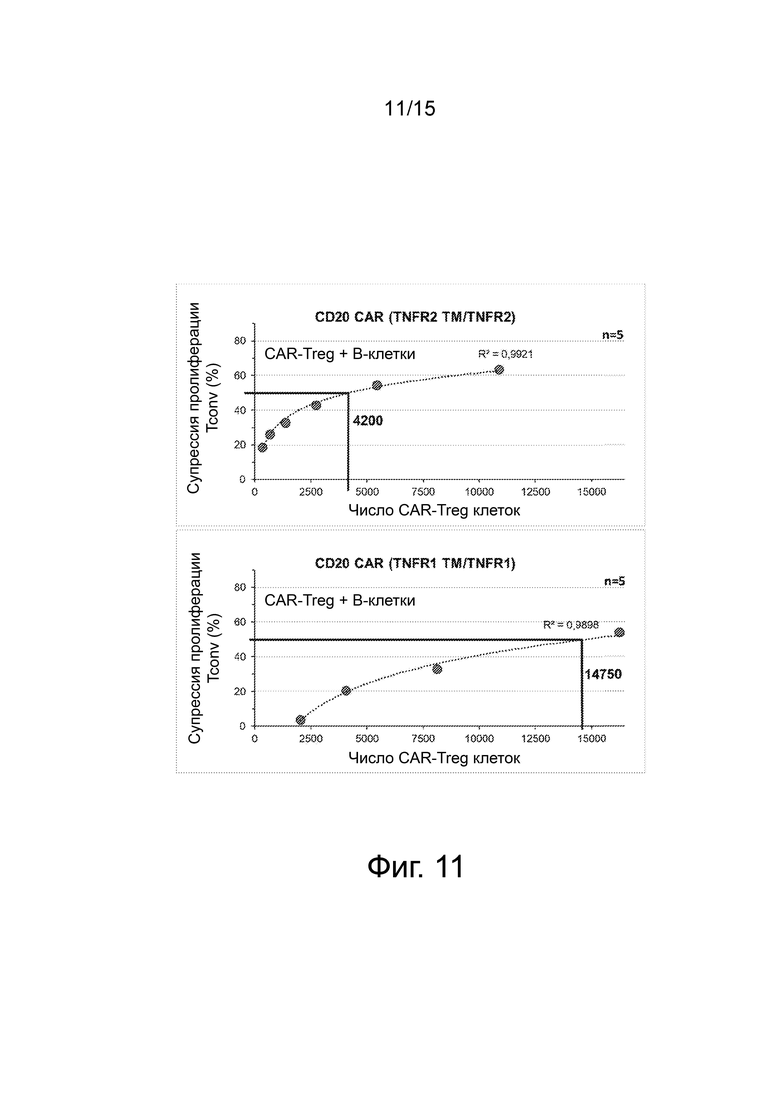

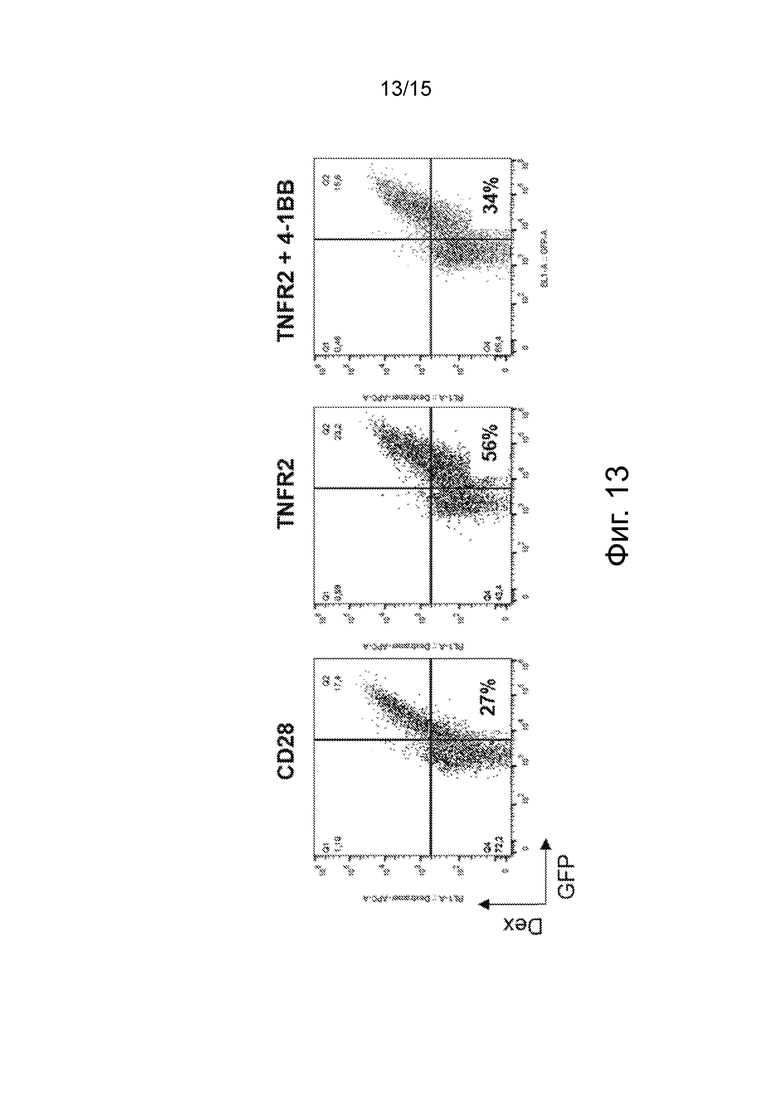
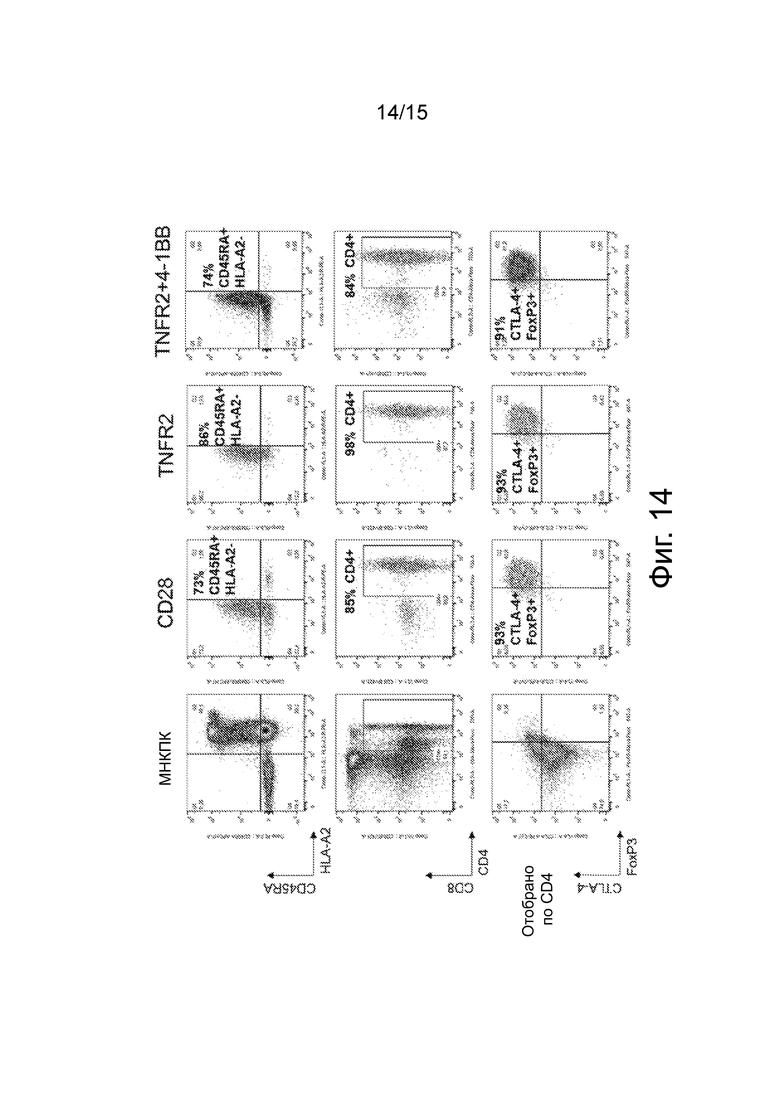
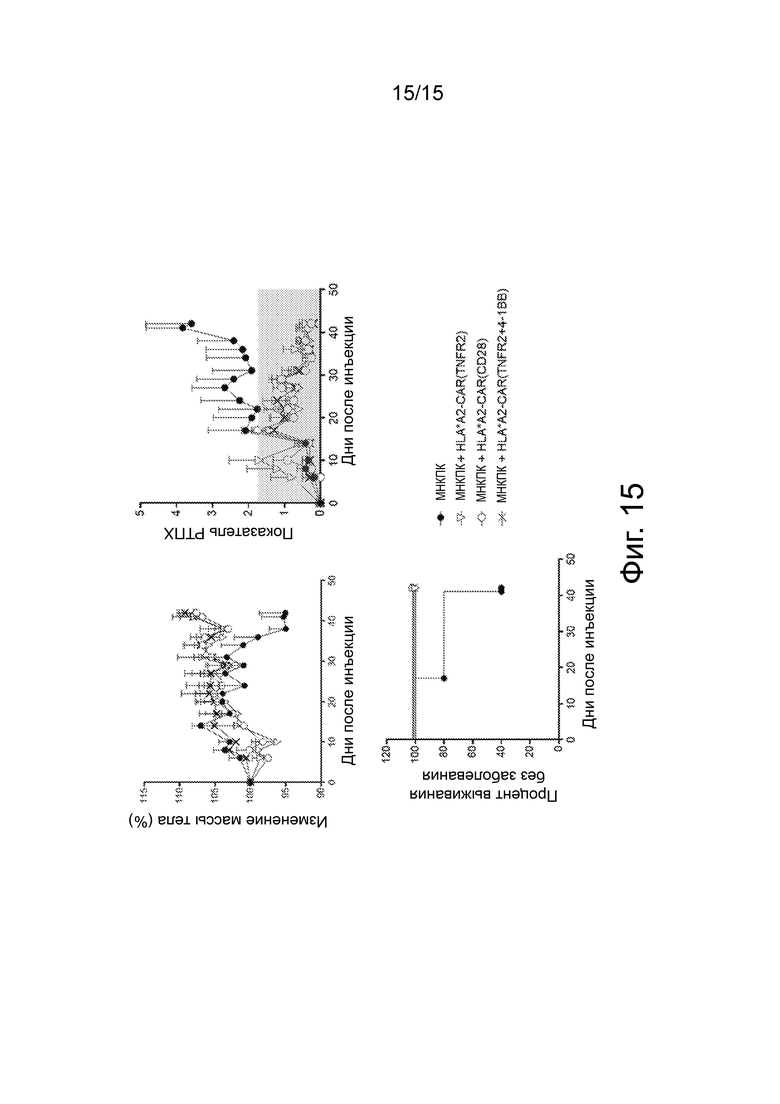
Изобретение относится к области биотехнологии, в частности к химерному антигенному рецептору (CAR) с более низкой тонической передачей сигналов при экспрессии в иммунных клетках по сравнению с иммунными клетками, экспрессирующими CAR без внутриклеточного костимулирующего сигнального домена TNFR2, а также нуклеиновой кислоте, его кодирующей. Также раскрыты иммунная клетка, экспрессирующая вышеуказанный CAR, а также популяция, ее содержащая. Изобретение эффективно для лечения заболевания или расстройства у человеческого субъекта, где заболевание или расстройство выбрано из группы, состоящей из воспалительного заболевания, аутоиммунного заболевания, аллергического заболевания, состояния после трансплантации органов, рака и инфекционного заболевания. 4 н. и 13 з.п. ф-лы, 15 ил., 13 табл., 5 пр.
1. Химерный антигенный рецептор (CAR) с более низкой тонической передачей сигналов при экспрессии в иммунных клетках по сравнению с иммунными клетками, экспрессирующими CAR без внутриклеточного костимулирующего сигнального домена TNFR2, где указанный CAR содержит одну полипептидную цепь, содержащую внеклеточный связывающий домен, трансмембранный домен и внутриклеточный домен, где
внутриклеточный домен включает костимуляторный внутриклеточный сигнальный домен рецептора 2 фактора некроза опухоли TNFR2 человека или его функциональный фрагмент, где указанный функциональный фрагмент содержит по меньшей мере 80 смежных аминокислотных остатков из костимуляторного внутриклеточного сигнального домена TNFR2 человека.
2. CAR по п.1, где трансмембранный домен содержит трансмембранный домен TNFR2 человека или его функциональный фрагмент, где указанный функциональный фрагмент содержит по меньшей мере 6 смежных аминокислот из трансмембранного домена TNFR2 человека.
3. CAR по п.1 или 2, содержащий внеклеточный шарнирный домен, предпочтительно где шарнирный домен включает шарнирную область человеческого CD8 или CD28, и более предпочтительно где шарнирный домен включает последовательность SEQ ID NO: 14 или последовательность, имеющую по меньшей мере примерно 70% идентичности с SEQ ID NO: 14.
4. CAR по любому из пп.1-3, где внутриклеточный домен содержит первичный внутриклеточный сигнальный домен иммунной клетки, предпочтительно первичный внутриклеточный сигнальный домен CD3-дзета Т-клетки человека, предпочтительно содержащий последовательность SEQ ID NO: 28, 29, 30 или 31 или последовательность, имеющую по меньшей мере примерно 70% идентичности с SEQ ID NO: 28, 29, 30 или 31.
5. CAR по любому из пп.1-4, содержащий:
- внеклеточный связывающий домен, и
- внеклеточный шарнирный домен, включающий шарнирную область CD8 или CD28 человека, и
(i) трансмембранный домен, и внутриклеточный домен, включающий костимуляторный внутриклеточный сигнальный домен TNFR2 человека или его функциональный фрагмент, где указанный функциональный фрагмент содержит по меньшей мере 80 смежных аминокислотных остатков из костимуляторного внутриклеточного сигнального домена TNFR2 человека, и первичный внутриклеточный сигнальный домен CD3-дзета человека, или
(ii) трансмембранный домен, включающий трансмембранный домен TNFR2 человека или его функциональный фрагмент, где указанный функциональный фрагмент содержит по меньшей мере 6 смежных аминокислотных остатков из трансмемброанного домена TNFR2 человека, и внутриклеточный домен, включающий костимуляторный внутриклеточный сигнальный домен TNFR2 человека или его функциональный фрагмент, где указанный функциональный фрагмент содержит по меньшей мере 80 смежных аминокислотных остатков из костимуляторного внутриклеточного сигнального домена TNFR2 человека, и первичный внутриклеточный сигнальный домен CD3-дзета человека.
6. CAR по любому из пп.2-5, где трансмембранный домен содержит по меньшей мере шесть смежных аминокислот из SEQ ID NO: 22 или последовательности, имеющей по меньшей мере примерно 70% идентичности с SEQ ID NO: 22, необязательно в сочетании с аминокислотными остатками трансмембранного домена белка, который не является TNFR2.
7. CAR по любому из пп.2-6, где трансмембранный домен содержит аминокислотную последовательность VNCVIMTQV (SEQ ID NO: 63).
8. CAR по любому из пп.1-7, где внутриклеточный домен содержит по меньшей мере 30 смежных аминокислотных остатков из SEQ ID NO: 34 или последовательности, имеющей по меньшей мере примерно 70% идентичности с SEQ ID NO: 34, необязательно в комбинации с аминокислотными остатками костимуляторного внутриклеточного сигнального домена белка, который не является TNFR2.
9. CAR по любому из пп.1-8, где указанный внутриклеточный домен содержит остатки 1-115 или 1-156 из SEQ ID NO: 34.
10. CAR по любому из пп.1-9, содержащий:
- внеклеточный связывающий домен,
- внеклеточный шарнирный домен, содержащий шарнирную область CD8 SEQ ID NO: 14,
- трансмембранный домен, содержащий трансмембранный домен TNFR2 из SEQ ID NO: 22, и
- внутриклеточный домен, содержащий:
(а) костимуляторный внутриклеточный сигнальный домен TNFR2 из SEQ ID NO: 34, и
(b) первичный внутриклеточный сигнальный домен CD3-дзета человека из SEQ ID NO: 28, 29, 30 или 31.
11. CAR по любому из пп.1-10, где внеклеточный связывающий домен представляет собой антитело или его антигенсвязывающий фрагмент, предпочтительно одноцепочечный вариабельный фрагмент (scFv).
12. Нуклеиновая кислота, кодирующая CAR по любому из пп.1-11, содержащая нуклеиновую кислоту, кодирующую CAR который содержит одну полипептидную цепь, содержащую внеклеточный связывающий домен, трансмембранный домен и внутриклеточный домен, где внутриклеточный домен включает костимуляторный внутриклеточный сигнальный домен рецептора фактора некроза опухоли TNFR2 человека или его функциональный фрагмент, где указанный функциональный фрагмент содержит по меньшей мере 80 смежных аминокислотных остатков из костимуляторного внутриклеточного сигнального домена TNFR2 человека.
13. Иммунная клетка, экспрессирующая CAR по любому из пп.1-11.
14. Иммунная клетка по п.13, где иммунная клетка выбрана из группы, состоящей из Т-клетки, натурального киллера (NK), αβ Т-клетки, γδ Т-клетки, двойной отрицательной (DN) клетки, регуляторной иммунной клетки, регуляторной Т (Treg) - клетки, эффекторной иммунной клетки, эффекторной Т-клетки, В-клетки и клетки миелоидного происхождения, и любой их комбинации, где иммунная клетка необязательно является клеткой человека, предпочтительно где клетка представляет собой Treg-клетку, причем Treg-клетка необязательно является человеческой клеткой.
15. Популяции иммунных клеток, содержащая иммунную клетку по п.13 или 14, для лечения заболевания или расстройства у человеческого субъекта, нуждающегося в этом, предпочтительно где заболевание или расстройство выбрано из группы, состоящей из воспалительного заболевания, аутоиммунного заболевания, аллергического заболевания, состояния после трансплантации органов, рака и инфекционного заболевания.
16. Применение популяции иммунных клеток по п.15 в качестве лекарственного средства, для лечения заболевания или расстройства у человеческого субъекта, нуждающегося в этом, где иммунные клетки представляют собой регуляторные иммунные клетки и где заболевание или расстройство выбрано из группы, состоящей из воспалительного заболевания, аутоиммунного заболевания, аллергического заболевания, состояния после трансплантации органов, рака и инфекционного заболевания.
17. Применение по п.16, где иммунная популяция иммунных клеток является популяцией Treg клеток и где человеческий субъект нуждается в иммуносупрессии.
| WO 2018106993 A1, 14.06.2018 | |||
| WO 2017025038 A1, 16.02.2017 | |||
| WO 2015142661 A1, 24.09.2014 | |||
| LINDSAY WARD-KAVANAGH et al | |||
| The TNF Receptor Superfamily in Costimulating and Coinhibitory Responses, Immunity, 2016, 44(5), pp | |||
| ЦЕНТРОБЕЖНЫЙ ВЕНТИЛЯТОР | 1922 |
|
SU1005A1 |
| RU 2015143207 A, 20.04.2017. | |||
Авторы
Даты
2023-11-28—Публикация
2019-08-09—Подача