ДРУГИЕ ЗАЯВКИ, ИМЕЮЩИЕ ОТНОШЕНИЕ К ДАННОЙ ЗАЯВКЕ
Для настоящей заявки испрашивается приоритет в соответствии c предварительной патентной заявкой США № 62/985274, поданной 4 марта 2020 г., которая полностью включена в настоящий документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0002] Грибковые инфекции являются основной причиной проблем со здоровьем человека. Настоящее изобретение в целом относится к лечению грибковых инфекций у человека.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
[0003] Инвазивные инфекции, вызванные грибками, такими как Aspergillus, Fusarium, Scedosporium и грибками порядка Mucorales, с трудом поддаются лечению, что приводит к высокой смертности, даже в тех случаях, когда пациенты получают стандартное лечение. Частота встречаемости грибков, устойчивых к стандартным противогрибковым препаратам, включая препараты классов азолов, эхинокандинов и амфотерицина В, увеличивается. Сохраняется значительная неудовлетворенная медицинская потребность в новых противогрибковых препаратах широкого спектра действия для лечения серьезных инвазивных грибковых инфекций и снижения существующей высокой заболеваемости и смертности.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0004] В одном аспекте в настоящем документе описан способ лечения грибковой инфекции у субъекта, включающий введение субъекту с грибковой инфекцией терапевтически эффективного количества Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата; при этом грибковая инфекция у субъекта вызвана Aspergillus, Fusarium, Scedosporium и грибками порядка Mucorales или другими трудноизлечимыми грибковыми инфекциями и/или грибковыми инфекциями, вызванными редко встречаемыми грибками.
[0005] В одном аспекте в настоящем документе описан способ лечения грибковой инфекции у субъекта, включающий введение субъекту с грибковой инфекцией терапевтически эффективного количества Соединения 1:
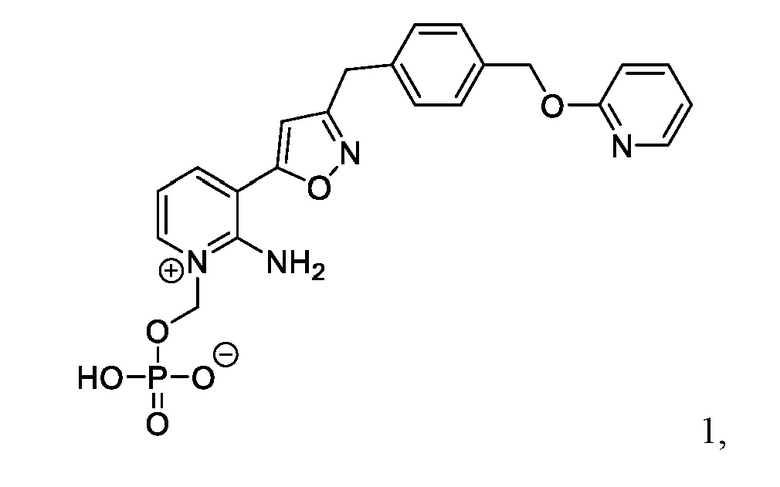
или его фармацевтически приемлемой соли, сольвата или гидрата ;
где
грибковая инфекция у субъекта вызывается Aspergillus spp., Scedosporium spp., Fusarium spp., Paecilomyces spp., Purpureocillium spp., Dematiaceous spp., Rhizopus, Mucor spp., Lichtheimia spp., Cunninghamella spp., Acremonium spp., Rasamsonia spp., Scedosporium spp., Schizophyllum spp., Trichoderma spp., Alternaria spp., Cladophialophora spp., Cladosporium spp., Exophiala spp., Fonsecaea spp., Lomentospora spp., Phialophora spp., Scopulariopsis spp., Magnusiomyces (Geotrichum) spp., Trichosporon spp., Malassezia spp., Saprochaete spp., Kodamaea spp., Rhodotorula spp., Saccharomyces spp., Pseudozyma spp., Sporobolomyces spp., Exophiala spp., Lacazia spp., Emmonsia spp., Wickerhamomyces (Pichia) spp., Emergomyces spp., Talaromyces spp., или Emmonsia- подобными грибками, или комбинацией таковых;
терапевтически эффективное количество Соединения 1 обеспечивает стабильную площадь за период 24 часа под кривой концентрация-время (AUC0-24) Соединения 1A у субъекта, превышающую приблизительно 150 мкг×ч/мл Соединения 1A:
а также введение Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата субъекту включает в себя схему лечения, включающую ежедневное введение Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата в течение по меньшей мере примерно 4 недель.
[0006] В некоторых вариантах осуществления терапевтически эффективное количество Соединения 1 обеспечивает стабильную площадь за период 24 часа под кривой концентрация-время (AUC0-24), составляющую по меньшей мере примерно 180 мкг×ч/мл Соединения 1А. В некоторых вариантах осуществления терапевтически эффективное количество Соединения 1 обеспечивает стабильную площадь за период 24 часа под кривой концентрация-время (AUC0-24), составляющую по меньшей мере примерно 200 мкг×ч/мл Соединения 1А. В некоторых вариантах осуществления терапевтически эффективное количество Соединения 1 обеспечивает стабильную площадь за период 24 часа под кривой концентрация-время (AUC0-24), составляющую по меньшей мере примерно 250 мкг×ч/мл Соединения 1А.
[0007] В некоторых вариантах осуществления грибковая инфекция представляет собой плесневую инфекцию (инфекцию плесневыми грибками). В некоторых вариантах осуществления плесневая инфекция вызывается грибками Aspergillus spp., Scedosporium spp., Fusarium spp., Paecilomyces spp., Purpureocillium spp., Dematiaceous spp. или Mucorales или комбинацией таковых. В некоторых вариантах осуществления плесневая инфекция вызывается A. flavus, A. niger, A. fumigatus, A. terreus, S. apiospermum, S. boydii, S. dehoogii, F. solani, P. lilacinus, P. variotii или Rhizopus oryzae или комбинацией таковых. В некоторых вариантах осуществления плесневая инфекция вызывается Aspergillus spp. В некоторых вариантах осуществления плесневая инфекция вызывается A. fumigatus. В некоторых вариантах осуществления штамм A. fumigatus представляет собой мутантный штамм Cyp51 или Fks1. В некоторых вариантах осуществления штамм A. fumigatus представляет собой AF293, AF41, EMFR S678P, F11628, AF72 или F14532.
[0008] В некоторых вариантах осуществления грибковая инфекция представляет собой дрожжевую инфекцию (инфекцию дрожжевыми грибками). В некоторых вариантах осуществления дрожжевая инфекция вызывается Magnusiomyces (Geotrichum) spp., Trichosporon spp., Malassezia spp., Saprochaete spp., Kodamaea spp., Rhodotorula spp., Saccharomyces spp., Pseudozyma spp., Sporobolomyces spp., Exophiala spp., Lacazia spp., Emmonsia spp., Wickerhamomyces (Pichia) spp., Wickerhamomyces (Pichia) spp., или комбинацией таковых. В некоторых вариантах осуществления дрожжевая инфекция вызывается G. clavatum, T. asahii, T. mucoides, T. mycotoxinivorans, M. furfur, R. mucilaginosa или S. cerevisiae или комбинацией таковых.
[0009] В некоторых вариантах осуществления грибковая инфекция представляет собой диморфную грибковую инфекцию (инфекцию диморфными грибками). В некоторых вариантах осуществления диморфная грибковая инфекция вызывается Emergomyces spp., Talaromyces spp. или Emmonsia-подобными грибками или комбинацией таковых.
[0010] В некоторых вариантах осуществления дрожжевая инфекция вызывается T. marneffei.
[0011] В некоторых вариантах осуществления у субъекта наблюдается ослабленный иммунитет. В некоторых вариантах осуществления субъект инфицирован ВИЧ/СПИДом или имеет рак. В некоторых вариантах осуществления рак представляет собой острый миелоидный лейкоз или острый лимфоидный лейкоз. В некоторых вариантах осуществления у субъекта диагностирована нейтропения. В некоторых вариантах осуществления у субъекта диагностирована лимфопения. В некоторых вариантах осуществления субъект проходит или подвергался химиотерапевтическому лечению рака. В некоторых вариантах осуществления субъект проходит или проходил курс лечения кортикостероидами. В некоторых вариантах осуществления субъект проходит или подвергался лечению ингибитором фактора некроза опухоли (ФНО). В некоторых вариантах осуществления субъект является реципиентом трансплантата органа. В некоторых вариантах осуществления субъект является реципиентом трансплантата гемопоэтических стволовых клеток. В некоторых вариантах осуществления у субъекта диагностирована реакция «трансплантат против хозяина».
[0012] В некоторых вариантах осуществления грибковая инфекция является поверхностной, локально инвазивной или диссеминированной по всему организму субъекта. В некоторых вариантах осуществления грибковая инфекция представляет собой кожную инфекцию, легочную инфекцию, инфекцию носовых пазух, инфекцию центральной нервной системы, инфекцию головного мозга, инфекцию глаз, инфекцию сердца, инфекцию почек, инфекцию желудочно-кишечного тракта, инфекцию желудка, инфекцию таза, инфекцию крови или сочетание таковых.
[0013] В другом аспекте в настоящем документе описан способ лечения грибкового заболевания или состояния у субъекта, включающий введение субъекту с грибковым заболеванием или состоянием терапевтически эффективного количества Соединения 1:
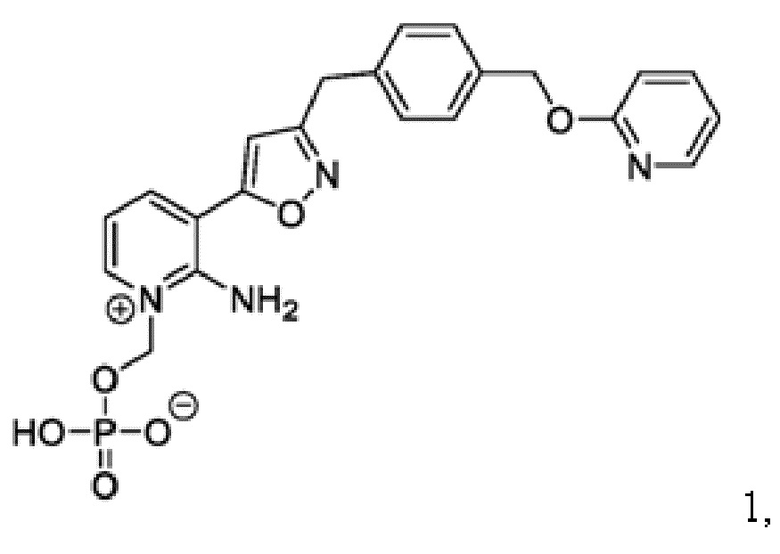
или его фармацевтически приемлемой соли, сольвата или гидрата;
где
грибковое заболевание или состояние у субъекта представляет собой аспергиллез, фузариоз, сцедоспориоз или мукормикоз или комбинацию таковых;
терапевтически эффективное количество Соединения 1 обеспечивает стабильную площадь за период 24 часа под кривой концентрация-время (AUC0-24) Соединения 1A у субъекта, превышающую приблизительно 150 мкг×ч/мл Соединения 1A:
а также введение Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата субъекту представляет собой схему лечения, включающую ежедневное введение Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата в течение по меньшей мере примерно 4 недель.
[0014] В некоторых вариантах осуществления терапевтически эффективное количество Соединения 1 обеспечивает стабильную площадь за период 24 часа под кривой концентрация-время (AUC0-24), составляющую по меньшей мере примерно 200 мкг×ч/мл Соединения 1А. В некоторых вариантах осуществления терапевтически эффективное количество Соединения 1 обеспечивает стабильную площадь за период 24 часа под кривой концентрация-время (AUC0-24), составляющую по меньшей мере примерно 250 мкг×ч/мл Соединения 1А.
[0015] В некоторых вариантах осуществления у субъекта наблюдается ослабленный иммунитет.
[0016] В некоторых вариантах осуществления субъект инфицирован ВИЧ/СПИДом или имеет рак. В некоторых вариантах осуществления рак представляет собой острый миелоидный лейкоз или острый лимфоидный лейкоз. В некоторых вариантах осуществления у субъекта диагностирована нейтропения. В некоторых вариантах осуществления у субъекта диагностирована лимфопения. В некоторых вариантах осуществления субъект проходит или подвергался химиотерапевтическому лечению рака. В некоторых вариантах осуществления субъект проходит или проходил курс лечения кортикостероидами. В некоторых вариантах осуществления субъект проходит или подвергался лечению ингибитором фактора некроза опухоли (TNF). В некоторых вариантах осуществления субъект является реципиентом трансплантата органа. В некоторых вариантах осуществления субъект является реципиентом трансплантата гемопоэтических стволовых клеток. В некоторых вариантах осуществления у субъекта диагностирована реакция «трансплантат против хозяина».
[0017] В некоторых вариантах осуществления грибковое заболевание или состояние представляет собой аллергический бронхолегочный аспергиллез, аспергиллезный синусит, резистентный к азолам A. fumigatus, аспергиллему, легочный аспергиллез, инвазивный аспергиллез, кожный аспергиллез, фузариоз, сцедоспориоз, риноцеребральный мукормикоз, легочный мукормикоз, диссеминированный мукормикоз, мукормикоз брюшной полости, мукормикоз желудка, мукормикоз кожи или сочетание таковых.
[0018] В некоторых вариантах осуществления схема лечения включает загрузочную дозу Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата и поддерживающую дозу Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата.
[0019] В некоторых вариантах осуществления схема лечения включает загрузочную дозу Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата, составляющую примерно 2000 мг Соединения 1, или его фармацевтически приемлемой соли, сольвата или гидрата. В некоторых вариантах осуществления загрузочную дозу Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят субъекту путем внутривенной (в/в) инфузии. В некоторых вариантах осуществления загрузочная доза Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата достигается введением двух доз Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата субъекту путем внутривенной (в/в) инфузии. В некоторых вариантах осуществления каждую загрузочную дозу Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят субъекту путем внутривенной (в/в) инфузии в течение от примерно 30 минут до примерно 4 часов.
[0020] В некоторых вариантах осуществления каждая доза (порция) загрузочной дозы содержит примерно 1000 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата. В некоторых вариантах осуществления загрузочная доза включает введение примерно 1000 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата субъекту посредством внутривенной (в/в) инфузии с последующим вторым введением примерно 1000 мг Соединения 1, или его фармацевтически приемлемой соли, сольвата или гидрата субъекту путем внутривенной (в/в) инфузии в течение примерно 24 часов после первой инфузии.
[0021] В некоторых вариантах осуществления поддерживающую дозу вводят один раз в сутки, начиная со второго дня лечения. В некоторых вариантах осуществления поддерживающая доза включает введение один раз в сутки от примерно 600 мг до примерно 1500 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата. В некоторых вариантах осуществления поддерживающую дозу Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят в течение периода от примерно 30 минут до примерно 4 часов внутривенной инфузии, начиная со второго, третьего или четвертого дня лечения. В некоторых вариантах осуществления поддерживающую дозу от примерно 600 мг до примерно 1200 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят путем внутривенной инфузии в течение периода от примерно 30 минут до примерно 4 часов, начиная со второго, третьего или четвертого дня лечения. В некоторых вариантах осуществления поддерживающую дозу Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят перорально субъекту, начиная со второго, третьего или четвертого дня лечения.
[0022] В некоторых вариантах осуществления поддерживающая доза от примерно 800 мг до примерно 1000 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят субъекту перорально один раз в день, начиная со второго, третьего или четвертого дня лечения.
[0023] В некоторых вариантах осуществления, начиная со второго, третьего или четвертого дня лечения: а) от примерно 600 мг до примерно 900 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят в течение периода примерно от 30 минут до примерно 3 часов внутривенной инфузии; или b) от примерно 800 мг до примерно 1000 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят перорально один раз в сутки.
[0024] В некоторых вариантах осуществления, начиная со второго дня лечения, от примерно 600 мг до примерно 900 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят в течение периода времени от примерно 30 минут до примерно 3 часов внутривенной инфузией; и начиная с четвертого дня лечения: а) от примерно 600 мг до примерно 900 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят путем внутривенной (в/в) инфузии в течение периода от примерно 30 минут до примерно 3 часов; или b) от примерно 800 мг до примерно 1000 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят перорально один раз в сутки.
[0025] В некоторых вариантах осуществления соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат вводят в комбинации с дополнительным терапевтическим агентом. В некоторых вариантах осуществления дополнительный терапевтический агент представляет собой противогрибковый агент. В некоторых вариантах осуществления противогрибковый агент представляет собой полиеновый противогрибковый агент, азольный противогрибковый агент, аллиламиновый противогрибковый агент и эхинокандиновый противогрибковый агент. В некоторых вариантах осуществления противогрибковое средство представляет собой амфотерицин В, кандицидин, филипин, гамицин, натамицин, нистатин, римоцидин, бифоназол, бутоконазол, клотримазол, эконазол, фентиконазол, изавуконазол, кетоконазол, луликоназол, миконазол, омоконазол, оксиконазол, сертаконазол, сулконазол, тиоконазол. альбаконазол, эфинаконазол, эпоксиконазол, флуконазол, изавуконазол, итраконазол, позаконазол, пропиконазол, равуконазол, терконазол, вориконазол, абафунгин, аморолфин, бутенафин, нафтифин или тербинафин, анидулафунгин, каспофунгин, микафунгин, резафунгин или фармацевтически приемлемую соль любого из вышеперечисленных противогрибковых агентов.
[0026] В другом аспекте в настоящем документе описан способ лечения грибковой инфекции или плесневая инфекции у субъекта, причем способ включает введение субъекту с грибковой инфекцией или плесневой инфекцией терапевтически эффективного количества Соединения 1:
или его фармацевтически приемлемой соли, сольвата или гидрата;
где,
грибковая инфекция у субъекта вызывается Aspergillus spp., Scedosporium spp., Fusarium spp., Paecilomyces spp., Purpureocillium spp., Dematiaceous spp., Rhizopus, Mucor spp., Lichtheimia spp., Cunninghamella spp., Acremonium spp., Rasamsonia spp., Scedosporium spp., Schizophyllum spp., Trichoderma spp., Alternaria spp., Cladophialophora spp., Cladosporium spp., Exophiala spp., Fonsecaea spp., Lomentospora spp., Phialophora spp., Scopulariopsis spp., Magnusiomyces (Geotrichum) spp., Trichosporon spp., Malassezia spp., Saprochaete spp., Kodamaea spp., Rhodotorula spp., Saccharomyces spp., Pseudozyma spp., Sporobolomyces spp., Exophiala spp., Lacazia spp., Emmonsia spp., Wickerhamomyces (Pichia) spp., Emergomyces spp., Talaromyces spp., or Emmonsia- подобными грибками, или комбинацией таковых;
терапевтически эффективное количество Соединения 1 обеспечивает стабильную площадь за период 24 часа под кривой концентрация-время (AUC0-24) Соединения 1A у субъекта, составляющую, по меньшей мере, примерно 150 мкг×ч/мл Соединения 1A:
при этом у субъекта наблюдается резистентность, противопоказания, непереносимость или отсутствие клинического ответа к/на стандартную противогрибковую терапию; а также
где введение Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата субъекту представляет собой схему лечения, включающую ежедневное введение Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата в течение по меньшей мере примерно 4 недель.
[0027] В некоторых вариантах осуществления терапевтически эффективное количество Соединения 1 обеспечивает стабильную площадь за период 24 часа под кривой концентрация-время (AUC0-24), составляющую по меньшей мере 200 мкг×ч/мл Соединения 1A. В некоторых вариантах осуществления терапевтически эффективное количество Соединения 1 обеспечивает стабильную площадь за период 24 часа под кривой концентрация-время (AUC0-24), составляющую по меньшей мере 250 мкг×ч/мл Соединения 1А.
[0028] В некоторых вариантах осуществления стандартная противогрибковая терапия включает противогрибковое средство на основе азола, противогрибковое средство на основе аллиламина, противогрибковое средство на основе эхинокандина или противогрибковое средство на основе полиена. В некоторых вариантах осуществления стандартная противогрибковая терапия включает амфотерицин В, кандицидин, филипин, гамицин, натамицин, нистатин, римоцидин, бифоназол, бутоконазол, клотримазол, эконазол, фентиконазол, изавуконазол, кетоконазол, луликоназол, миконазол, омоконазол, оксиконазол, сертаконазол, сулконазол, тиоконазол, альбаконазол, эфинаконазол, эпоксиконазол, флуконазол, изавуконазол, итраконазол, позаконазол, пропиконазол, равуконазол, терконазол, вориконазол, абафунгин, аморолфин, бутенафин, нафтифин или тербинафин, анидулафунгин, каспофунгин, микафунгин, резафунгин, или фармацевтически приемлемую соль любого из вышеперечисленных противогрибковых агентов.
[0029] В некоторых вариантах осуществления грибковая инфекция представляет собой плесневую инфекцию. В некоторых вариантах осуществления плесневая инфекция вызывается грибками Aspergillus spp., Scedosporium spp., Fusarium spp., Paecilomyces spp., Purpureocillium spp., Dematiaceous spp. или Mucorales или комбинацией таковых. В некоторых вариантах осуществления плесневая инфекция вызывается A. flavus, A. niger, A. fumigatus, A. terreus, S. apiospermum, S. boydii, S. dehoogii, F. solani, P. lilacinus, P. variotii или Rhizopus oryzae или комбинацией таковых. В некоторых вариантах осуществления инфекция плесени вызывается Aspergillus spp. В некоторых вариантах осуществления плесневая инфекция вызывается A.fumigatus. В некоторых вариантах осуществления штамм A.fumigatus представляет собой мутантный штамм Cyp51 или Fks1. В некоторых вариантах осуществления штамм A.fumigatus представляет собой AF293, AF41, EMFR S678P, F11628, AF72 или F14532.
[0030] В некоторых вариантах осуществления грибковая инфекция представляет собой дрожжевую инфекцию. В некоторых вариантах осуществления дрожжевая инфекция вызывается Magnusiomyces (Geotrichum) spp., Trichosporon spp., Malassezia spp., Saprochaete spp., Kodamaea spp., Rhodotorula spp., Saccharomyces spp., Pseudozyma spp., Sporobolomyces spp., Exophiala spp., Lacazia spp., Emmonsia spp., или Wickerhamomyces (Pichia) spp или комбинацией таковых. В некоторых вариантах осуществления дрожжевая инфекция вызывается G. clavatum, T. asahii, T. mucoides, T. mycotoxinivorans, M. furfur, R. mucilaginosa или S. cerevisiae или комбинацией таковых.
[0031] В некоторых вариантах осуществления грибковая инфекция представляет собой диморфную грибковую инфекцию. В некоторых вариантах осуществления диморфная грибковая инфекция вызывается Emergomyces spp., Talaromyces spp. или Emmonsia-подобными грибками или комбинацией таковых.
[0032] В некоторых вариантах осуществления дрожжевая инфекция вызывается T. marneffei.
[0033] некоторых вариантах осуществления субъект инфицирован ВИЧ/СПИДом или имеет рак. В некоторых вариантах осуществления рак представляет собой острый миелоидный лейкоз или острый лимфоидный лейкоз. В некоторых вариантах осуществления у субъекта диагностирована нейтропения. В некоторых вариантах осуществления у субъекта диагностирована лимфопения. В некоторых вариантах осуществления субъект проходит или подвергался химиотерапевтическому лечению рака. В некоторых вариантах осуществления субъект проходит или проходил курс лечения кортикостероидами. В некоторых вариантах осуществления субъект проходит или подвергался лечению ингибитором фактора некроза опухоли (TNF). В некоторых вариантах осуществления субъект является реципиентом трансплантата органа. В некоторых вариантах осуществления субъект является реципиентом трансплантата гемопоэтических стволовых клеток. В некоторых вариантах осуществления у субъекта диагностирована реакция «трансплантат против хозяина».
[0034] В некоторых вариантах осуществления грибковая инфекция или плесневая инфекция являются поверхностными, локально инвазивными или диссеминированными по всему организму субъекта. В некоторых вариантах осуществления грибковая инфекция представляет собой кожную инфекцию, легочную инфекцию, инфекцию носовых пазух, инфекцию центральной нервной системы, инфекцию головного мозга, глазную инфекцию, сердечную инфекцию, инфекцию почек, инфекцию желудочно-кишечного тракта, инфекцию желудка, инфекцию таза, инфекцию крови или сочетание таковых.
[0035] В некоторых вариантах осуществления грибковая инфекция включает грибковое заболевание или состояние, представляющее собой аллергический бронхолегочный аспергиллез, аллергический синусит, азол-резистентный A. fumigatus, аспергиллому, легочный аспергиллез, инвазивный аспергиллез, кожный аспергиллез, фузариоз, сцедоспориоз, риноцеребральный мукормикоз, мукормикоз легких, диссеминированный мукормикоз, мукормикоз брюшной полости и малого таза, мукормикоз желудка, мукормикоз кожи или сочетание таковых.
[0036] В некоторых вариантах осуществления схема лечения включает загрузочную дозу Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата и поддерживающую дозу Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата.
[0037] В некоторых вариантах осуществления схема лечения включает загрузочную дозу Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата, составляющую примерно 2000 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата. В некоторых вариантах осуществления загрузочную дозу Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят субъекту путем внутривенной (в/в) инфузии. В некоторых вариантах осуществления загрузочная доза Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата включает введение двух доз Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата субъекту путем внутривенной инфузии. В некоторых вариантах осуществления каждую загрузочную дозу Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят субъекту путем внутривенной (в/в) инфузии в течение от примерно 30 минут до примерно 4 часов. В некоторых вариантах осуществления каждая доза загрузочной дозы содержит примерно 1000 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата. В некоторых вариантах осуществления загрузочная доза включает введение примерно 1000 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата субъекту посредством внутривенной (в/в) инфузии с последующим вторым введением примерно 1000 мг Соединения 1, или его фармацевтически приемлемой соли, сольвата или гидрата субъекту путем внутривенной (в/в) инфузии в течение примерно 24 часов после первой инфузии.
[0038] В некоторых вариантах осуществления поддерживающую дозу вводят один раз в сутки, начиная со второго дня лечения.
[0039] В некоторых вариантах осуществления поддерживающая доза включает однократное ежедневное введение от примерно 600 мг до примерно 1500 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата.
[0040] В некоторых вариантах осуществления поддерживающую дозу Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят путем внутривенной инфузии в течение периода от примерно 30 минут до примерно 4 часов, начиная со второго, третьего или четвертого дня лечения. В некоторых вариантах осуществления поддерживающую дозу от примерно 600 мг до примерно 1200 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят путем внутривенной инфузии в течение от примерно 30 минут до примерно 4 часов, начиная со второго, третьего или четвертого дня лечения.
[0041] В некоторых вариантах осуществления поддерживающая доза Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводится перорально субъекту, начиная со второго, третьего или четвертого дня лечения.
[0042] В некоторых вариантах осуществления поддерживающая доза от примерно 800 мг до примерно 1000 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводится субъекту перорально один раз в день, начиная со второго, третьего или четвертого дня лечения.
[0043] В некоторых вариантах осуществления, начиная со второго, третьего или четвертого дня лечения: а) от примерно 600 мг до примерно 900 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят путем внутривенной инфузии в течение периода примерно от 30 минут до примерно 3 часов; или b) примерно от 800 мг до примерно 1000 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят перорально один раз в день.
[0044] В некоторых вариантах осуществления, начиная со второго дня лечения, от примерно 600 мг до примерно 900 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят путем внутривенной инфузии в течение периода времени от примерно 30 минут до примерно 3 часов; и, начиная с четвертого дня лечения: а) от примерно 600 мг до примерно 900 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят путем внутривенной инфузии в течение периода от примерно 30 минут до примерно 3 часов; или b) от примерно 800 мг до примерно 1000 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят перорально один раз в сутки.
[0045] В некоторых вариантах осуществления Соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат вводят в комбинации с дополнительным терапевтическим агентом.
[0046] В некоторых вариантах осуществления схема лечения включает ежедневное введение Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата в течение от примерно 4 недель до примерно 12 недель. В некоторых вариантах осуществления схема лечения включает ежедневное введение Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата в течение от примерно 4 недель до примерно 6 недель.
[0047] В некоторых вариантах осуществления схема лечения увеличивает шансы на выживание субъекта, снижает уровни галактоманнана у субъекта, снижает уровни β-d-глюкана у субъекта или снижает комбинацию уровней таковых.
[0048] Предоставляются изделия производства, включающие упаковочный материал, Соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат в упаковочном материале, и этикетку, на которой указано, что Соединение 1 или его фармацевтически приемлемая соль, сольват или гидрат используется для лечения грибковой инфекции или для предотвращения или облегчения одного или нескольких симптомов грибковой инфекции.
[0049] Другие цели, особенности и преимущества соединений, способов и композиций, описанных в настоящем документе, станут очевидными из последующего подробного описания. Однако следует понимать, что подробное описание и конкретные примеры, хотя и указывают конкретные варианты осуществления, даны исключительно в качестве иллюстрации, поскольку различные изменения и модификации в рамках сущности и объема настоящего изобретения будут очевидными для специалистов в данной области техники из данного подробного описания.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0050] Существует растущая потребность в новых и универсальных методах лечения грибковых инфекций у пациентов. Увеличивается число встречаемости лекарственно-устойчивых штаммов грибков, особенно распространенных видов Aspergillus spp., а также редких и трудноизлечимых плесневых грибков, включающих виды Fusarium, Scedosporium spp. и грибков порядка Mucorales, что усиливает потребность в новых противогрибковых терапиях.
[0051] Инвазивные инфекции, вызванные Aspergillus, Fusarium, Scedosporium и плесневыми грибками порядка Mucorales, особенно трудно поддаются лечению, что приводит к высоким показателям смертности (50-80%), даже в тех случаях, когда пациенты получают стандартное лечение. Частота встречаемости грибков, устойчивых к стандартным противогрибковым препаратам, включающим препараты классов азолов и эхинокандинов и амфотерицин В, увеличивается. Таким образом, сохраняется значительная неудовлетворенная медицинская потребность в новом противогрибковом препарате широкого спектра действия для лечения серьезных инвазивных грибковых инфекций и снижения существующей высокой заболеваемости и смертности.
[0052] Аспергиллез представляет собой инфекцию, вызываемую Aspergillus (разновидность плесневого грибка), т.е. плесенью, находящейся в помещении и на открытом воздухе. Большинство людей вдыхают споры Aspergillus каждый день, не заболевая. Однако люди с ослабленной иммунной системой или с заболеваниями легких подвергаются более высокому риску развития проблем со здоровьем вследствие Aspergillus. Типы проблем со здоровьем, вызванных Aspergillus, включают аллергические реакции, легочные инфекции и инфекции других органов.
[0053] У людей со значительно ослабленной иммунной системой грибок может переноситься из легких через кровоток в мозг или в другие органы, включая глаза, сердце, почки и кожу. Обычно это является плохим признаком, так как состояние становится более тяжелым и риск смертности возрастает. Однако иногда инфекция кожи позволяет поставить диагноз раньше и начать лечение раньше.
[0054] Когда болезнь действительно возникает, она может проявиться в нескольких формах. Типы заболеваний, вызываемых Aspergillus, разнообразны: от аллергических заболеваний до опасных для жизни генерализованных инфекций. Тяжесть аспергиллеза определяется различными факторами, но одним из важнейших является состояние иммунной системы человека.
[0055] Аллергический бронхолегочный аспергиллез (ABPA) представляет собой состояние, вызываемое аллергией на споры Aspergillus. Заболевание довольно часто встречается у астматиков; до 2,5% взрослых астматиков могут заболеть таковым в какой-то момент их жизни. ABPA также часто встречается у пациентов с муковисцидозом, достигающим подросткового и взрослого возраста. В долгосрочной перспективе ABPA может привести к необратимому повреждению легких (фиброз или бронхоэктазы), если заболевание не лечить.
[0056] Аспергиллома возникает, когда грибок растет в полости тела, такой как полость придаточных пазух носа, или полость определенного органа, такого как легкое. Любое заболевание легких, образующее полости, такое как туберкулез или саркоидоз, может сделать человека уязвимым для развития аспергилломы в легких. Споры проникают в полость и прорастают, образуя внутри полости грибковый шар. У некоторых людей полости в легких образованы Aspergillus, а грибкового шара не наблюдается. Грибок выделяет токсические и аллергические продукты, способные вызвать у человека недомогание.
[0057] Хронический легочный аспергиллез возникает, когда аспергиллезная инфекция вызывает образование полостей в легких, и может быть длительным (3 месяца или более) состоянием. В легких также могут присутствовать один или несколько грибковых шаров (аспергилломы).
[0058] Аспергиллезная болезнь может возникать в пазухах, приводя к аспергиллезному синуситу. Так же, как и в легких, аспергиллы могут вызывать три заболевания - аллергический синусит, грибковый шар или инвазивный аспергиллез. Хирургическое дренирование пазухи обычно решает проблему, если только аспергиллы не проникли в пазухи, расположенные глубоко внутри черепной коробки. В последнем случае противогрибковая лекарственная терапия используется в сочетании с хирургическим вмешательством.
[0059] Если у пациентов повреждена иммунная система, например, в случае лейкемии или трансплантации костного мозга, аспергиллезный синусит протекает в более серьезной форме. В этих случаях синусит проявляется в форме инвазивного аспергиллеза. Симптомы включают лихорадку, лицевые боли, выделения из носа и головные боли. Диагноз ставится при обнаружении грибка в жидкости или ткани из пазух и при сканировании. В большинстве случаев проводится хирургическое вмешательство, так как важно выяснить, что именно не так, и часто именно хирургическое вмешательство помогает уничтожить грибок. Необходимо лечение противогрибковыми препаратами.
[0060] Азол-резистентный Aspergillus fumigatus возникает, когда грибок становится устойчивым к некоторым азольным противогрибковым средствам, используемым при лечении.
[0061] Инвазивный аспергиллез является наиболее тяжелой формой аспергиллеза и обычно поражает людей с ослабленной иммунной системой. К лицам с ослабленной иммунной системой относятся, помимо прочего, лица, перенесшие трансплантацию органов или трансплантацию стволовых клеток, лица с длительной нейтропенией, лица, получающие химиотерапию рака, лица, получающие высокие дозы кортикостероидов, лица, получающие препараты широкого спектра действия, антибиотики или лица, получающие любую другую иммуносупрессивную терапию. Инвазивный аспергиллез чаще всего начинается в легких, а затем распространяется с током крови, поражая другие органы, такие как, помимо прочего, сердце, головной мозг, почки, печень и кожу. Инвазивный аспергиллез может привести к летальному исходу вследствие развития тяжелых опасных для жизни осложнений, таких как шок, делирий, массивное кровотечение из легких, воспаление трахеи и бронхов, недостаточность органов, внутричерепное кровотечение, поражение головного мозга, менингит и инсульт. Для пациентов с инвазивным аспергиллезом выживаемость тем выше, чем раньше поставлен диагноз. К сожалению, хорошего единого диагностического теста не существует. Часто лечение начинают, когда состояние только подозревается. Это состояние обычно клинически диагностируется у человека с низкими защитными свойствами иммунной системы, например, при трансплантации костного мозга, низком уровне лейкоцитов после лечения рака, СПИДа или серьезных ожогов. Существует также редкое наследственное заболевание, при котором у человека снижается иммунитет (хроническая гранулематозная болезнь), что подвергает больного умеренному риску.
[0062] В некоторых вариантах осуществления инвазивный аспергиллез возникает у пациентов с хронической обструктивной болезнью легких (COPD).
[0063] Инвазивный аспергиллез легких (IPA) представляет собой все более распространенную оппортунистическую грибковую инфекцию, обычно возникающую у пациентов с нейтропенией и/или находящихся под воздействием кортикостероидов. Легкие поражаются примерно в 85% случаев инвазивного аспергиллеза. Факторы, влияющие на то, приобретут ли пациенты эту опасную для жизни инфекцию, включают: тяжесть нейтропении, продолжительность нейтропении, дисфункцию нейтрофилов (например, хроническую гранулематозную болезнь, тяжелый комбинированный иммунодефицит (SCID), позднюю стадию СПИДа или хронический лейкоз), доза кортикостероидов и продолжительность лечения таковыми, другие иммунодепрессанты, такие как метотрексат и ингибиторы анти-TNF, инокулят (например, без ограничения таковыми, воздействие пыли, компоста или заплесневелых материалов), предшествующее или текущее заболевание легких (увеличивающее риски), наличие генетических маркеров, таких как высокий уровень продукции IL-10, и тяжелые системные заболевания (такие, как дисфункция печени, без ограничения таковой). Дополнительные агенты/лекарства, которые могут ослабить иммунную систему, включают: циклоспорин, такролимус, сиролимус, эверолимус, ингибиторы интерлейкина, помалидомид, омализумаб, азатиоприн, леналидомид и талидомид.
[0064] Ингибиторы интерлейкина включают, без ограничения таковыми, рилонацепт, канакинумаб, анакинру, реслизумаб, бродалумаб, устекинумаб, бенрализумаб, меполизумаб, тоцилизумаб, иксекизумаб, дупилумаб, секукинумаб, тилдракизумаб, гуселкумаб, сарилумаб, базиликсимаб, рисанкизумаб, силтуксимаб, даклизумаб и даклизумаб.
[0065] Дермальмый (кожный) аспергиллез возникает, когда Aspergillus проникает в организм через повреждение кожи (например, после операции или ожоговой раны) и вызывает инфекцию, обычно у людей с ослабленной иммунной системой. В некоторых вариантах осуществления кожный аспергиллез также может возникать, если инвазивный аспергиллез распространяется на кожу из какой-либо другой части тела, например из легких.
[0066] Другие формы аспергиллеза включают хронический полостной аспергиллез легких, подострый инвазивный аспергиллез легких, аспергиллезные узелки и инфекции ногтевых лож, глаз, кожи, пазух или слуховых проходов.
[0067] Сцедоспориоз представляет собой инфекцию, вызываемую грибками из рода Scedosporium, который включает два гифомицета, имеющие новое медицинское значение, Scedosporium apiospermum и Scedosporium prolificans.
[0068] Виды Fusarium вызывают у людей широкий спектр инфекций, включая поверхностные, местно-инвазивные и диссеминированные инфекции. Клиническая форма фузариоза в значительной степени зависит от иммунного статуса хозяина и пути проникновения, при этом поверхностное и локализованное заболевание встречается в основном у иммунокомпетентных пациентов, а инвазивное и диссеминированное заболевание поражает пациентов с ослабленным иммунитетом. Факторы риска тяжелого фузариоза включают длительную нейтропению и Т-клеточный иммунодефицит, особенно у реципиентов трансплантата гемопоэтических стволовых клеток с тяжелой реакцией «трансплантат против хозяина». Наиболее частым проявлением диссеминированного фузариоза является сочетание характерных кожных поражений и положительных результатов посевов крови с поражением легких или носовых пазух или без таковых. Прогноз является неблагоприятным и в значительной степени определяется степенью иммуносупрессии и распространенностью инфекции, при практически 100% летальности среди пациентов с персистирующей нейтропенией и диссеминированным заболеванием. В некоторых вариантах осуществления инфекции выявляются клинически (или предполагаются) на основании совокупности клинических и лабораторных данных.
[0069] Виды Fusarium широко распространены в почве, подземных и надземных частях растений, растительных остатках и других органических субстратах и присутствуют в воде во всем мире как часть биопленок структуры воды. Широкое распространение видов Fusarium можно объяснить их способностью расти на широком диапазоне субстратов и эффективными механизмами распространения таковых.
Идентифицировано более 50 видов Fusarium, включая патогены растений и животных, причем некоторые из них вызывают инфекции человека. Двенадцать видов Fusarium связаны с инфекцией человека: наиболее часто встречался Fusarium solani, за ним следуют Fusarium oxysporum, Fusarium verticillioidis и Fusarium moniliforme. Другие инфекционные виды включают Fusarium dimerum, Fusarium proliferatum, Fusarium chlamidosporum, Fusarium sacchari, Fusarium nygamai, Fusarium napiforme, Fusarium antophilum и Fusarium vasinfectum. Fusarium solani также является наиболее частым возбудителем фузариозного кератита и вместе с F. oxysporum является причиной большинства случаев онихомикоза, вызываемого видами Fusarium.
[0071] Среди иммунокомпетентных хозяев наиболее распространенными инфекциями являются кератит и онихомикоз. Иммунодефицитными пациентами с высоким риском фузариоза являются пациенты с длительной и выраженной нейтропенией и/или тяжелым Т-клеточным иммунодефицитом (Boutati, E.I., et al. 1997. Blood 90:999-1008). В отличие от инфекции в нормальной популяции, фузариоз в популяции с ослабленным иммунитетом обычно является инвазивным и диссеминированным.
[0072] Основной способ проникновения Fusarium spp. - дыхательные пути, за которыми следует кожа в месте разрушения тканей и, возможно, слизистые оболочки. Считается, что воздушно-капельный фузариоз передается при вдыхании переносимых по воздуху фузариозных конидий, о чем свидетельствует возникновение синусита и/или пневмонии при отсутствии диссеминации. Роль кожи как входных ворот подтверждается развитием инфекции вследствие повреждений кожи, возникающих в результате травм (автомобильные аварии, прочее), ожогов или онихомикоза у нормальных хозяев, а также развитием целлюлита (обычно в местах повреждения тканей, например пальцев ног и пальцев), инфекции могут оставаться локализованными или переходить в диссеминированные инфекции у пациентов с ослабленным иммунитетом (Nucci, M., et al., 2003. Cancer 98:315-319).
[0073] Поразительной характеристикой фузариоза, в отличие от аспергиллеза, является высокая частота положительных культур крови, в основном в контексте диссеминированного заболевания. Иногда фунгемия является единственным проявлением фузариоза, обычно при отсутствии нейтропении, у больных с центральными венозными катетерами. Противогрибковое лечение и удаление катетера в большинстве таких случаев приводят к излечению.
[0074] Диссеминированное заболевание представляет собой наиболее частую и сложную клиническую форму фузариоза у пациентов с ослабленным иммунитетом, на которую приходится приблизительно 70% всех случаев фузариоза в этой популяции. Пациенты с риском диссеминированного фузариоза включают пациентов с острым лейкозом и длительной и глубокой нейтропенией.
[0075] Наиболее частая картина диссеминированного заболевания представляет собой сочетание кожных поражений и положительных результатов посева крови с вовлечением или без вовлечения других участков тела (носовых пазух, легких и др.).
[0076] Многие различные виды грибов могут вызывать мукормикоз. Эти виды принадлежат к большой группе плесневых грибков Mucorales. Эти формы включают Rhizopus, Rhizomucor и Mucor. Каждый вид вызывает схожие симптомы.
[0077] Эти плесневые грибки распространены в окружающей среде и обычно не вызывают инфекции. Мукормикоз обычно возникает при наличии одного из следующих факторов: плохо контролируемый диабет; иммунная система, ослабленная лекарствами (такими как кортикостероиды или препараты, подавляющие иммунную систему) или лейкемией или другими заболеваниями или состояниями, снижающими количество лейкоцитов в крови; дефероксамин, используемый для лечения перегрузки железом. Дополнительные агенты/лекарства, способные ослабить иммунную систему, включают: циклоспорин, такролимус, сиролимус, эверолимус, ингибиторы интерлейкина, помалидомид, омализумаб, азатиоприн, леналидомид и талидомид.
[0078] В некоторых вариантах осуществления мукормикозы можно классифицировать на риноцеребральные, легочные и диссеминированные, абдоминально-тазовые и желудочные, а также кожные или хронические подкожные заболевания. Общие признаки риноцеребральных, легочных и диссеминированных заболеваний включают инвазию кровеносных сосудов, геморрагический некроз, тромбоз и быстрый летальный исход.
[0079] Риноцеребральный мукормикоз чаще связан с неконтролируемым сахарным диабетом и кетоацидозом, чем со злокачественными новообразованиями или терапией дефероксамином. Вдыхаемые споры сначала колонизируют верхние носовые раковины и околоносовые пазухи и вызывают синусит. В зависимости от основного заболевания в некоторых вариантах осуществления грибок быстро проникает в центральную нервную систему, вызывая такие симптомы, как измененное психическое состояние, развитие комы и смерть в течение нескольких дней.
[0080] Легочный мукормикоз обычно наблюдается у пациентов с лейкемией, лимфомой, трансплантацией паренхиматозных органов или костного мозга и диабетом, но иногда также наблюдается и у практически здоровых субъектов. Проявления заболевания варьируют от локализованного узелкового поражения до полостного поражения и диссеминации; в последнем случае обычно возникает массивное кровохарканье. Общая смертность ниже при изолированных поражениях, чем при тяжелых легочных и диссеминированных заболеваниях.
[0081] В некоторых вариантах осуществления желудочно-кишечное заболевание представляет собой проявление мукормикоза и в основном связано с недоеданием при наличии предрасполагающих факторов, особенно у детей с амебным колитом, брюшным тифом и пеллагрой. В наиболее тяжелых случаях заболевание может характеризоваться изъязвлением слизистой оболочки и прорастанием сосудов с последующим образованием некротических язв, такая форма заболевания заканчивается летальным исходом.
[0082] В некоторых вариантах осуществления кожный мукормикоз представляет собой первичное заболевание вследствие нарушения кожного барьера или возникает в результате гематогенной диссеминации из других мест, а исход заболевания строго зависит от состояния пациентов. В некоторых вариантах осуществления первичный кожный мукормикоз поражает подкожную клетчатку, а также жировой, мышечный и фасциальный слои.
[0083] Потребность в улучшении лечения инвазивных грибковых заболеваний остается высокой, особенно в связи с растущим числом пациентов с ослабленным иммунитетом, таких как пациенты с острым миелоидным лейкозом (AML), пациенты с неходжкинской лимфомой и реципиенты трансплантатов паренхиматозных органов, которые находятся в категории повышенного риска развития грибковых инфекций и лечение которых может быть сложным. Виды Candida и Aspergillus хорошо известны как две основные причины грибковых заболеваний у этих пациентов, хотя другие появляющиеся грибки, такие как редкие плесневые грибки (например, виды Fusarium, виды Scedosporium и грибки Mucorales), заявляют о необходимости найти новые и более эффективные стратегии борьбы с этими инфекциями. Существующие противогрибковые средства могут быть неудобны в использовании, часто плохо переносятся, имеют межлекарственные взаимодействия (DDI), могут быть недоступны в виде препаратов для внутривенного и перорального введения или становятся все более неэффективными из-за появления штаммов грибков, устойчивых к лекарствам.
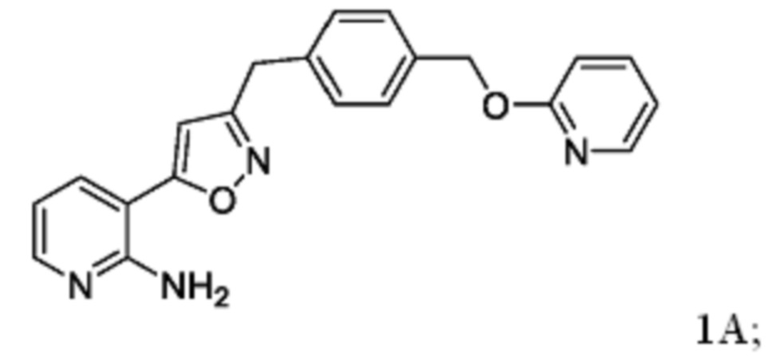
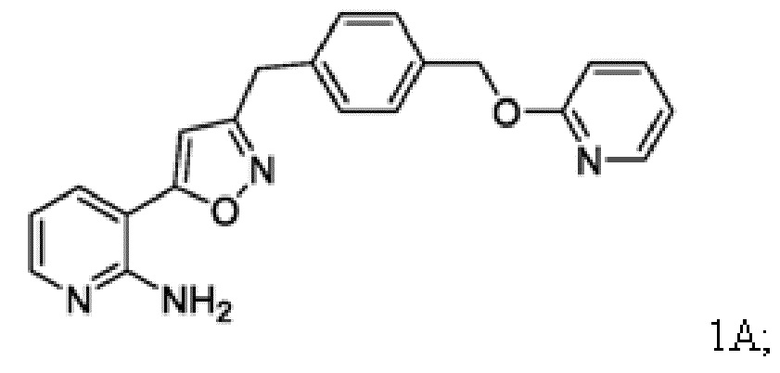
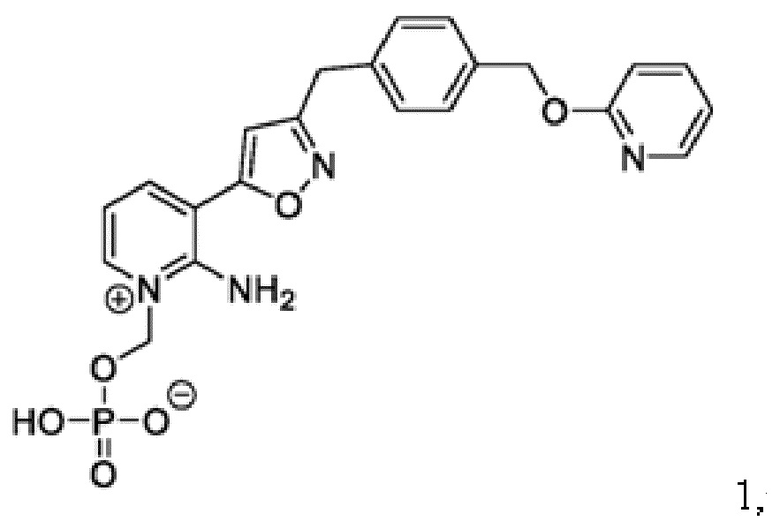
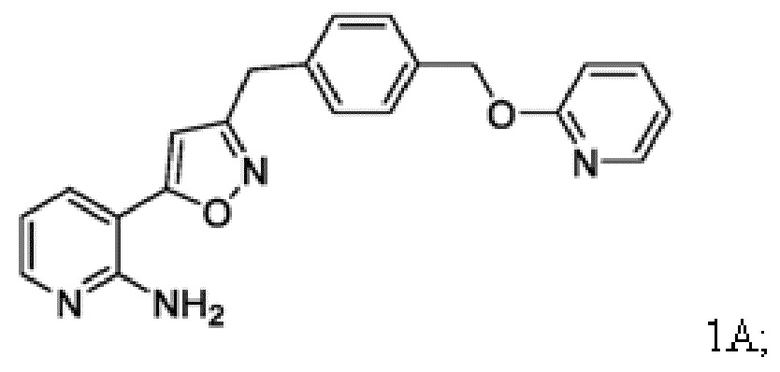
Соединение 1
[0084] У многих пациентов варианты противогрибкового лечения ограничены или отсутствуют из-за подтвержденной/предполагаемой резистентности, противопоказаний, непереносимости или отсутствия клинического ответа на стандартную противогрибковую терапию (SOC). В этих условиях Соединение 1 имеет преимущества перед противогрибковой терапией SOC, что определяет необходимость предварительного исследования Соединения 1 для лечения инвазивных плесневых инфекций (IMI).
[0085] Соединение 1, пролекарство, быстро превращающееся in vivo под действием фосфатаз в микробиологически активное Соединение 1А, является противогрибковым средством широкого спектра действия для лечения инвазивных грибковых инфекций как при внутривенным, так и при пероральным способе введения. Соединение 1 представляет собой пролекарство с лабильной фосфатной частью/фрагментом. Фосфатная часть улучшает растворимость лекарственного вещества в воде при более высоком диапазоне pH, но также имеет ограниченную стабильность.
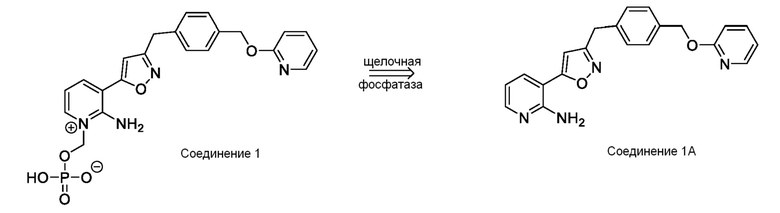
[0086] Соединение 1А ингибирует грибковый гликозилфосфатидилинозитол (GPI)-заякоренный на мембране фермент белка-переносчика 1 (GWT1), высококонсервативную инозитол-ацилазу, катализирующую раннюю стадию пути биосинтеза заякоренных GPI-белков. Это ингибирование оказывает плейотропное действие на грибковую клетку из-за ингибирования локализации маннопротеина клеточной стенки, обеспечивающего целостность клеточной стенки, образование биопленки, образование зародышевой трубки и рост грибка. Соединение 1A не ингибирует белок класса W (PIGW) биосинтеза заякоренных фосфатидилинозитолгликанов, который является ближайшим ортологом грибкового белка GWT1 у млекопитающих, что согласуется с потенциалом значительного терапевтического окна для мишени.
[0087] Соединение 1А продемонстрировало широкую противогрибковую активность in vitro против Candida spp., Cryptococcus spp., Aspergillus spp., Scedosporium spp., Fusarium spp. и некоторых грибов Mucorales, включая активность против азол- и эхинокандин-резистентных штаммов. У мышей с подавленным иммунитетом к 5-фторурацилу и IMIs (Aspergillus fumigatus, Scedosporium prolificans и Fusarium solani) Соединение 1 или 1А продемонстрировало статистически значимое улучшение показателей выживаемости и снижение количества легочных грибковых колоний. У мышей с иммуносупрессией циклофосфамида и ацетата кортизона с IMIs (A. fumigatus, S. apiospermum, F. solani и Rhizopus spp.) Соединение 1 продемонстрировало статистически значимое улучшение показателей выживаемости и снижение грибковой нагрузки.
[0088] Кроме того, Соединение 1А продемонстрировало противогрибковую активность в отношении широкого ряда клинических изолятов редких плесневых инфекций и редких дрожжевых инфекций, включая активность в отношении ряда видов Aspergillus spp., Scedosporium spp., Fusarium spp., Paecilomyces spp., Purpureocillium spp., Dematiaceous spp., Mucorales fungi, Magnusiomyces (Geotrichum) spp., Trichosporon spp., Malassezia spp., Saprochaete spp., Kodamaea spp., Rhodotorula spp., Saccharomyces spp., Pseudozyma spp., Sporobolomyces spp., Exophiala spp., Lacazia spp., Emmonsia spp., Wickerhamomyces (Pichia) spp., Emergomyces spp., Talaromyces spp., или Emmonsia-подобных грибков. Эти редкие виды плесневых и дрожжевых грибков обычно не представляют угрозы для здоровых людей, но могут привести к инвазивным плесневым инфекциям у людей с ослабленным иммунитетом.
[0089] В некоторых вариантах осуществления Соединение 1 или Соединение 1А применяют для лечения различных грибковых инфекций, вызванных Candida, Cryptococcus, Blastomyces, Histoplasma, Coccidioides или комбинацией таковых.
[0090] В некоторых вариантах осуществления Соединение 1 или Соединение 1А применяют для лечения различных инфекций, вызываемых плесневыми грибками, включая редкие инфекции. В некоторых вариантах осуществления плесневые (распространенные или редкие) инфекции вызывается грибками Aspergillus spp., Mucorales, Hyalohyphomycete, Phaeohyphomycete или комбинацией таковых.
[0091] Aspergillus spp. включают A. flavus, A. niger, A. fumigatus, A. terreus.
[0092] Грибки Mucorales включают виды Rhizopus spp., Mucor spp., Lichtheimia spp., Cunninghamella spp.
[0093] Грибы Hyalohyphomycete включают виды include Acremonium spp., Fusarium spp., Paecilomyces spp., Rasamsonia, spp., Scedosporium spp., Schizophyllum spp., Trichoderma spp.
[0094] Грибы Phaeohyphomycete включают Alternaria spp., Cladophialophora spp., Cladosporium spp., Exophiala spp., Fonsecaea spp., Lomentospora spp., Phialophora spp., Scopulariopsis spp.
[0095] Scedosporium spp. включают S. apiospermum, S. boydii, S. dehoogii.
[0096] Fusarium spp. включают F. solani.
[0097] Rhizopus spp. включают Rhizopus oryzae.
[0098] В некоторых вариантах осуществления Соединение 1 или Соединение 1А применяют для лечения инфекций, вызванных грибками Aspergillus spp., Scedosporium spp., Fusarium spp., Paecilomyces spp., Purpureocillium spp., Dematiaceous spp. или Mucorales, или комбинацией таковых; включая A. flavus, A. niger, A. fumigatus, A. terreus, S. apiospermum, S. boydii, S. dehoogii, F. solani, P. lilacinus, P. variotii и Rhizopus oryzae.
[0099] В некоторых вариантах осуществления Соединение 1А применяют для лечения различных дрожжевых и редких дрожжевых инфекций, в том числе вызванных Magnusiomyces (Geotrichum) spp., Trichosporon spp., Malassezia spp., Saprochaete spp., Kodamaea spp., Rhodotorula spp., Saccharomyces spp., Pseudozyma spp., Sporobolomyces spp., Exophiala spp., Lacazia spp., Emmonsia spp., or Wickerhamomyces (Pichia) spp., или комбинацией таковых; включая G. clavatum, T. asahii, T. mucoides, T. mycotoxinivorans, M. furfur, R. mucilaginosa или S. cerevisiae.
[00100] В некоторых вариантах осуществления Соединение 1А применяют для лечения различных дополнительных грибковых инфекций, включая диморфные грибковые инфекции, вызванные Emergomyces spp., Talaromyces spp. или Emmonsia-подобными грибками, или комбинацией таковых; и включая Т. marneffei.
[00101] Фармакокинетические-фармакодинамические (PK-PD) исследования на мышах с подавленным иммунитетом с инвазивными инфекциями, вызванными A. fumigatus, показали, что площадь под кривой концентрация-время (AUC) поделенная на отношение минимальной эффективной концентрации (MEC) является движущей силой эффективности. Режим дозирования, использованный в этом исследовании, обеспечивает устойчивое состояние AUC ≥200 мкг×ч/мл, ассоциируемое с эффективностью препарата (определяемой по подсчету количество колоний и улучшению выживаемости) у мышей с ослабленным иммунитетом с инвазивным аспергиллезом легких (IPA). Кроме того, формальные исследования PK-PD продемонстрировали, что режим дозирования несет хорошую вероятность достижения цели (PTA) для большинства изолятов, которые, как ожидается, будут идентифицированы в этом исследовании.
[00102] В фазе 1 клинических исследований Соединения 1 изучали безопасность, переносимость и фармакокинетику однократных и многократных возрастающих доз, вводимых внутривенно (в/в) и перорально (п/о). На сегодняшний день в общей сложности 197 здоровых добровольцев и 21 пациент с острым миелоидным лейкозом (ОМЛ) получали Соединение 1 в рамках 5 исследований фазы 1. Продолжительность многодозовых схем в этих исследованиях составляла 7, 14 и 42 дня (6 недель).
[00103] Соединение 1 может иметь потенциальные преимущества по сравнению с существующим стандартом SOC для лечения инвазивных инфекций, вызванных Aspergillus spp. или редкими плесневыми грибками. Кроме того, Соединение 1 имеет дифференцированный профиль безопасности, доступно в виде препаратов для внутривенного (IV) и перорального (PO) применения и может иметь меньшее количество DDI, чем лечение SOC.
[00104] Пациентам с азол-резистентными инфекциями плесневых грибков, включая азол-резистентный A. fumigatus и некоторые редкие плесневые грибки (например, Fusarium spp., Scedosporium spp., виды порядка Mucorales), обычно предписывают внутривенное лечение полиенов. Полиены были связаны с риском нефротоксичности, дисбаланса электролитов и инфузионных реакций, являющихся лимитирующими факторами в уходе за пациентами. Соединение 1 обладает противогрибковой активностью широкого спектра действия, включая устойчивые к азолу плесневые грибки, и потенциально может быть более безопасным и простым в использовании по сравнению с полиенами.
[00105] Соединение 1 может обеспечить преимущество перед полиенами для лечения «прорывных» инфекций у пациентов, получающих профилактику триазолами, активными против плесневых грибков. Соединение 1 потенциально может обеспечить противогрибковое действие на A. fumigatus и редкие виды плесеневых грибков без потенциальной токсичности, вызываемой полиенами. Благодаря широкому проникновению в ткани Соединение 1 может оказаться полезным при лечении пациентов с инвазивными грибковыми инфекциями глаз и центральной нервной системы.
[00106] Соединение 1 может принести пользу пациентам с инвазивными грибковыми инфекциями, которые не могут получать лечение азолом, активным против плесневых грибков, из-за непереносимости, токсичности или клинически значимого взаимодействия с лекарственными средствами. Соединение 1 потенциально может обеспечить противогрибковое действие широкого спектра действия без риска печеночной или другой азол-ассоциированной токсичности и при этом, как ожидается, с меньшей вероятностью способно вызывать клинически значимые лекарственные взаимодействия.
[00107] Соединение 1 обладает новым механизмом действия с активностью широкого спектра против Candida spp. (дрожжевые грибки) и Aspergillus spp. (плесневые грибки), включая активность в отношении полиен- и азол-резистентных штаммов Aspergillus spp. Соединение 1 продемонстрировало эффективность на ряде животных моделей IMI, включая Aspergillus spp., Fusarium spp., Scedosporium spp. и виды порядка Mucorales. Соединение 1 доступно как в формах для внутривенного введения, так и для перорального приема с широким распределением в тканях, включая ткани глаза и центральную нервную систему, и безопасно и хорошо переносимо, обладает благоприятным профилем безопасности и DDI, который отличается от противогрибковой терапии SOC. Соединение 1 может быть использовано в качестве средства первой линии для лечения IMIs благодаря уникальному механизму действия. Таким образом, Соединение 1 потенциально может удовлетворить неудовлетворенные потребности пациентов с ограниченными вариантами противогрибкового лечения вследствие подтвержденной/предполагаемой резистентности, противопоказаний, непереносимости или отсутствия клинического ответа на стандартную противогрибковую терапию (SOC) или без таковых.
Соответствующая терминология
[00108] Если не указано иное, следующие термины, используемые в данной заявке, имеют определения, данные ниже. Использование термина «включая», а также других форм, таких как «включать», «включает» и «включено», не является ограничивающим. Заголовки разделов, используемые здесь, предназначены исключительно для организационных целей и не должны толковаться как ограничивающие описываемый предмет.
[00109] Термин «приемлемый» в отношении состава, композиции или ингредиента, используемый в настоящем документе, означает отсутствие стойкого вредного воздействия на общее состояние здоровья субъекта, проходящего лечение.
[00110] Термин «фармацевтически приемлемая соль» в отношении соединения относится к соли соединения, которая не вызывает значительного раздражения у млекопитающего, которому ее вводят, и по существу не отменяет биологическую активность и свойства соединения. Handbook of Pharmaceutical Salts: Properties, Selection and Use. International Union of Pure and Applied Chemistry, Wiley-VCH 2002. S.M. Berge, L.D. Bighley, D.C. Monkhouse, J. Pharm. Sci. 1977, 66, 1-19. P. H. Stahl и C. G. Wermuth, editors, Handbook of Pharmaceutical Salts: Properties, Selection and Use,  :Wiley-VCH/VHCA, 2002. В некоторых вариантах осуществления фармацевтические соли обычно более растворимы и быстрее растворяются в желудочном и кишечном соках, чем неионогенные соединения, вследствие чего их можно использовать в твердых дозированных формах. Кроме того, поскольку их растворимость часто является функцией pH, возможно избирательное растворение таковых в той или иной части пищеварительного тракта, и в некоторых случаях этой способностью можно управлять при необходимости отсроченного и устойчивого высвобождения. Также, поскольку солеобразующая молекула в ряде случаев находится в равновесии с нейтральной формой, в ряде случаев можно регулировать ее прохождение через биологические мембраны.
:Wiley-VCH/VHCA, 2002. В некоторых вариантах осуществления фармацевтические соли обычно более растворимы и быстрее растворяются в желудочном и кишечном соках, чем неионогенные соединения, вследствие чего их можно использовать в твердых дозированных формах. Кроме того, поскольку их растворимость часто является функцией pH, возможно избирательное растворение таковых в той или иной части пищеварительного тракта, и в некоторых случаях этой способностью можно управлять при необходимости отсроченного и устойчивого высвобождения. Также, поскольку солеобразующая молекула в ряде случаев находится в равновесии с нейтральной формой, в ряде случаев можно регулировать ее прохождение через биологические мембраны.
[00111] В некоторых вариантах осуществления фармацевтически приемлемые соли обычно получают путем взаимодействия свободного основания с подходящей органической или неорганической кислотой или путем взаимодействия кислоты с подходящим органическим или неорганическим основанием. Термин может быть использован в отношении любого соединения по настоящему изобретению. Репрезентативные соли включают следующие соли: ацетат, бензолсульфонат, бензоат, бикарбонат, бисульфат, битартрат, борат, бромид, эдетат кальция, камзилат, карбонат, хлорид, клавуланат, цитрат, дигидрохлорид, эдетат, эдисилат, эстолат, эзилат, фумарат, глюцептат, глюконат, глутамат, гликоллиларсанилат, гексилрезорцинат, гидрабамин, гидробромид, гидрохлорид, гидроксинафтоат, йодид, изетионат, лактат, лактобионат, лаурат, малат, малеат, манделат, мезилат, метилбромид, метилнитрат, метилсульфат, малеат монокалия, мукат, напсилат, нитрат, N -метилглюкамин, оксалат, памоат (эмбонат), пальмитат, пантотенат, фосфат/дифосфат, полигалактуронат, калий, салицилат, натрий, стеарат, субацетат, сукцинат, таннат, тартрат, теоклат, тозилат, триэтиодид, триметиламмоний и валерат. В некоторых вариантах осуществления, когда присутствует кислотный заместитель, такой как -CO2H, образуются соли аммония, морфолиния, натрия, калия, бария или кальция и т.п. В некоторых вариантах осуществления, когда присутствует основная группа, такая как амино, или основное гетероарильное кольцо, такое как пиридил, образуется кислотно-аддитивная соль, например, гидрохлоридная соль, гидробромидная соль, фосфатная соль, сульфатная соль, трифторацетатная соль, трихлорацетатная соль, ацетатная соль, оксалатная соль, малеатная соль, пируватная соль, малонатная соль, сукцинатная соль, цитратная соль, виннокислая соль, фумаратная соль, манделатная соль, бензоатная соль, циннаматная соль, метансульфонатная соль, этансульфонатная соль, пикратная соль и т.п. . Дополнительные фармацевтически приемлемые солевые формы терапевтических агентов перечислены Berge, et al., Journal of Pharmaceutical Sciences, Vol. 66(1), pp. 1-19 (1977).
[00112] Термин «модулировать», используемый в настоящем документе, означает взаимодействие с мишенью прямо или косвенно для изменения активности мишени, включая, только в качестве примера, усиление активности мишени, ингибирование активности мишени, ограничение активность мишени или продление активности мишени.
[00113] Термин «модулятор», используемый в настоящем документе, относится к молекуле, взаимодействующей с мишенью прямо или косвенно. Взаимодействия включают, без ограничения таковыми, взаимодействия агониста, частичного агониста, обратного агониста, антагониста, деструктора или комбинации таковых. В некоторых вариантах осуществления модулятор представляет собой антагонист. В некоторых вариантах осуществления модулятор представляет собой деструктор.
[00114] Термины «введение», «вводить», «при введении» и т.п., используемые в настоящем документе, относятся к способам, которые в некоторых случаях обеспечивают доставку соединений или композиций к желаемому месту биологического действия. Эти способы включают, без ограничения таковыми, пероральный, интрадуоденальный и парентеральный пути введения (включая внутривенный, внутрибрюшинный, внутрисосудистый или инфузионный). Специалисты в данной области техники знакомы с методами введения, которые могут быть использованы с соединениями и способами, описанными в настоящем документе. В некоторых вариантах осуществления соединения и композиции, описанные в настоящем документе, вводят перорально. В некоторых вариантах осуществления соединения и композиции, описанные в настоящем документе, вводят внутривенно. В некоторых вариантах осуществления соединения и композиции, описанные в настоящем документе, вводят путем внутривенной инфузии.
[00115] Термины «совместное введение» и т.п., используемые в настоящем документе, предназначены для охвата введения выбранных терапевтических агентов одному пациенту и предназначены для включения схем лечения, в которых агенты вводятся одним и тем же или разными пути введения или в одно и то же или разное время.
[00116] Термины «эффективное количество» или «терапевтически эффективное количество», используемые в настоящем документе, относятся к достаточному количеству вводимого агента или соединения, которое в некоторой степени облегчает один или несколько симптомов заболевания или состояния, подлежащего лечению. Результат включает уменьшение и/или облегчение признаков, симптомов или причин заболевания или любое другое желаемое изменение биологической системы. Например, «эффективное количество» для терапевтического применения - это количество композиции, содержащей раскрытое здесь соединение, которое требуется для обеспечения клинически значимого уменьшения симптомов заболевания. Соответствующее «эффективное» количество в каждом отдельном случае необязательно определяют использованием таких методов, как, например, повышение дозы.
[00117] Термины «усиление» или «усиливать», используемые в настоящем документе, означают увеличение или продление либо эффективности, либо продолжительности желаемого эффекта. Таким образом, в отношении усиления действия терапевтических агентов термин «усиление» относится к способности усиливать или продлевать либо эффективность, либо продолжительность действия других терапевтических агентов на систему. «Количество, повышающее эффект», используемое в данном документе, относится к количеству, достаточному для усиления эффекта другого терапевтического агента в желаемой системе.
[00118] Используемый здесь термин «фармацевтическая комбинация» означает продукт, полученный в результате смешивания или объединения более чем одного активного ингредиента и включающий как фиксированные, так и нефиксированные комбинации активных ингредиентов. Термин «фиксированная комбинация» означает, что активные ингредиенты, например, соединение, описанное в настоящем документе, или его фармацевтически приемлемая соль, сольват или гидрат, и совместное средство вводятся пациенту одновременно в виде одной дозы, единицы дозы. Термин «нефиксированная комбинация» означает, что активные ингредиенты, например, соединение, описанное в настоящем документе, или его фармацевтически приемлемая соль, сольват или гидрат и соагент вводятся пациенту как отдельные компоненты либо одновременно, параллельно (в одно и то же время) или последовательно без конкретных промежуточных временных ограничений, при этом такое введение обеспечивает эффективные уровни обоих соединений в организме пациента. Последнее также относится к коктейльной терапии, например, введению трех или более активных ингредиентов.
[00119] Термины «комплект» и «изделие производства» используются в качестве синонимы.
[00120] Термин «субъект» или «пациент» включает млекопитающих. Примеры млекопитающих включают, без ограничения таковыми, любого члена класса млекопитающих: людей, приматов, отличных от человека, таких как шимпанзе, других обезьян и видов обезьян. В одном аспекте млекопитающее представляет собой человека.
[00121] Термины «лечить», «лечение» или «обработка», используемые в настоящем документе, включают облегчение, ослабление или улучшение по меньшей мере одного симптома заболевания или состояния, предотвращение дополнительных симптомов, ингибирование заболевания или состояния, например купирование развития заболевания или состояния, облегчение заболевания или состояния, вызывание регрессии заболевания или состояния, облегчение состояния, вызванного заболеванием или состоянием, или прекращение симптомов заболевания или состояния профилактическим и/или терапевтическим путем.
[00122] Используемый здесь термин «приблизительно/примерно» означает в «пределах ± 10% значения».
Фармацевтические композиции
[00123] В некоторых вариантах осуществления соединения, описанные в настоящем документе, входят в состав фармацевтических композиций. Фармацевтические композиции составляются обычным образом с использованием одного или нескольких фармацевтически приемлемых неактивных ингредиентов, облегчающих переработку активных соединений в препараты, применяемые в фармацевтике. Соответствующий состав зависит от выбранного пути введения. Краткое изложение описанных здесь фармацевтических композиций можно найти, например, в Remington: The Science and Practice of Pharmacy, Nineteenth Ed (Easton, Pa.: Mack Publishing Company, 1995); Hoover, John E., Remington’s Pharmaceutical Sciences, Mack Publishing Co., Easton, Pennsylvania 1975; Liberman, H.A. and Lachman, L., Eds., Pharmaceutical Dosage Forms, Marcel Decker, New York, N.Y., 1980; и Pharmaceutical Dosage Forms and Drug Delivery Systems, Seventh Ed. (Lippincott Williams & Wilkins 1999), включенных сюда в качестве ссылки для данного раскрытия.
[00124] В некоторых вариантах осуществления соединения, описанные в настоящем документе, вводят в комбинации с фармацевтически приемлемыми носителями, эксципиентами или разбавителями в составе фармацевтической композиции. Введение соединений и композиций, описанных в настоящем документе, осуществляется любым способом, который обеспечивает доставку соединений к месту действия. Эти методы включают, без ограничения таковыми, доставку энтеральным путем (включая пероральный, желудочный или дуоденальный зонд) или парентеральным путем (инъекция или инфузия), хотя выбор наиболее подходящего пути введения в некоторых случаях зависит, например, от состояния и болезни реципиента.
[00125] В некоторых вариантах осуществления Соединение 1 или его фармацевтически приемлемая соль, сольват или гидрат включены в фармацевтическую композицию. Используемый здесь термин «фармацевтическая композиция» относится к жидкой или твердой композиции, содержащей фармацевтически активный ингредиент (например, Соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат) и, по меньшей мере, носитель, где ни один из ингредиентов, как правило, не является биологически нежелательным в вводимых количествах.
[00126] Фармацевтические композиции, включающие Соединение 1, или его фармацевтически приемлемую соль, сольват или гидрат, могут принимать любую физическую форму, являющуюся фармацевтически приемлемой. В некоторых вариантах осуществления описанные здесь фармацевтические композиции находятся в подходящей форме для перорального введения. В одном варианте осуществления таких фармацевтических композиций включено терапевтически эффективное количество Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата.
[00127] В некоторых вариантах осуществления используются обычные инертные ингредиенты и обычный метод приготовления фармацевтических композиций. В некоторых вариантах осуществления используются известные способы приготовления фармацевтических композиций. Рассматриваются все обычные типы композиций, включая, без ограничения таковыми, таблетки, капсулы и растворы. Однако количество Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата лучше всего определять через эффективное количество, то есть количество Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата, обеспечивающее желаемую дозу субъекту, нуждающемуся в данном лечении.
[00128] В некоторых случаях капсулы готовят путем смешивания Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата с подходящим разбавителем и заполнения капсул надлежащим количеством смеси. Обычные разбавители включают инертные порошкообразные вещества, такие как крахмал различных типов, порошкообразную целлюлозу, в частности кристаллическую и микрокристаллическую целлюлозу, сахара, такие как фруктоза, маннит и сахароза, зерновую муку и подобные пищевые порошки.
[00129] В некоторых случаях таблетки получают прямым прессованием, влажной грануляцией или сухой грануляцией. Их составы обычно включают разбавители, связующие вещества, смазывающие вещества и дезинтеграторы, а также Соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат. Типичные разбавители включают, например, различные типы крахмала, лактозу, маннит, каолин, фосфат или сульфат кальция, неорганические соли, такие как хлорид натрия, и сахарную пудру. Также пригодны порошкообразные производные целлюлозы. Типичными связующими для таблеток являются такие вещества, как крахмал, желатин и сахара, такие как лактоза, фруктоза, глюкоза и т.п. Удобны также натуральные и синтетические камеди, включая аравийскую камедь, альгинаты, метилцеллюлозу, поливинилпирролидин и т.п. В некоторых случаях связующими веществами служат полиэтиленгликоль, этилцеллюлоза и воски.
[00130] В некоторых случаях любрикант в составе таблетки помогает предотвратить прилипание таблетки и пуансонов к матрице. В некоторых случаях любрикант выбирают из таких твердых веществ, как тальк, стеараты магния и кальция, стеариновая кислота и гидрогенизированные растительные масла.
[00131] Дезинтеграторы для таблеток представляют собой вещества, которые набухают при намокании, разрушая таблетку и высвобождая соединение. Они включают крахмалы, глины, целлюлозы, алгинаты и камеди. В частности, разрыхлители таблеток включают кукурузный и картофельный крахмалы, метилцеллюлозу, агар, бентонит, древесную целлюлозу, порошкообразную натуральную губку, катионообменные смолы, альгиновую кислоту, гуаровую камедь, мякоть цитрусовых, карбоксиметилцеллюлозу и лаурилсульфат натрия.
[00132] Энтеросолюбильные составы часто используют для защиты активного ингредиента от кислотного содержимого желудка. Такие составы создаются путем покрытия твердой лекарственной формы пленкой полимера, нерастворимого в кислых средах и растворимого в щелочных средах. Примерами пленок являются фталат ацетата целлюлозы, фталат поливинилацетата, фталат гидроксипропилметилцеллюлозы и сукцинат ацетата гидроксипропилметилцеллюлозы.
[00133] Таблетки часто покрывают сахаром в качестве ароматизатора и герметика. Таблетки также могут быть покрыты покрытием желаемого цвета.
[00134] В некоторых вариантах осуществления фармацевтические композиции для применения в любом из способов, представленных в настоящем документе, описаны в примерах.
Субъекты исследования
[00135] В некоторых вариантах осуществления субъект имеет ослабленный иммунитет. В некоторых вариантах осуществления субъект представляет собой человека с ослабленным иммунитетом. В некоторых вариантах осуществления субъект-человек находится в возрасте примерно 1 года. В некоторых вариантах осуществления субъект-человек старше 1 года. В некоторых вариантах осуществления субъект-человек представляет собой младенца в возрасте примерно до 1 месяца.
[00136] В некоторых вариантах осуществления субъект инфицирован ВИЧ/СПИДом. В некоторых вариантах осуществления субъект проходит или уже прошел химиотерапевтическое лечение рака. В некоторых вариантах осуществления субъект страдает острым миелоидным лейкозом или острым лимфоидным лейкозом. В некоторых вариантах осуществления у субъекта имеется нейтропения, лимфопения, реакция «трансплантат против хозяина». В некоторых вариантах осуществления субъект проходит или проходил курс лечения кортикостероидами. В некоторых вариантах осуществления субъект проходит или проходил лечение ингибитором TNF. В некоторых вариантах осуществления субъект является реципиентом трансплантата. В некоторых вариантах осуществления субъект является реципиентом трансплантата гемопоэтических стволовых клеток, трансплантата костного мозга, трансплантата легкого, трансплантата печени, трансплантата сердца, трансплантата почки, трансплантата поджелудочной железы или комбинации таковых. В некоторых вариантах осуществления субъект является реципиентом трансплантата гемопоэтических стволовых клеток. В некоторых вариантах осуществления субъект является реципиентом трансплантата костного мозга. В некоторых вариантах осуществления субъект является реципиентом трансплантата легкого. В некоторых вариантах осуществления субъект является реципиентом трансплантата печени. В некоторых вариантах осуществления субъект является реципиентом трансплантата сердца. В некоторых вариантах осуществления субъект является реципиентом почечного трансплантата. В некоторых вариантах осуществления субъект является реципиентом трансплантата поджелудочной железы.
[00137] В некоторых вариантах осуществления субъект имеет ослабленный иммунитет.
[00138] В некоторых вариантах осуществления субъект проходит терапию по меньшей мере одним иммунодепрессантным лекарственным средством. В некоторых вариантах осуществления иммунодепрессантное лекарственное средство увеличивает риск оппортунистических инфекций у субъекта.
[00139] Иммунодепрессанты/лекарства, способные ослаблять иммунную систему, включают, без ограничения таковыми, кортикостероиды, метотрексат, циклоспорин, такролимус, сиролимус, эверолимус, помалидомид, омализумаб, азатиоприн, леналидомид, талидомид, ингибиторы анти-TNF, ингибиторы интерлейкина, ингибиторы янус-киназы, агонисты сфингозин-1-фосфатного рецептора (S1P), антагонисты S1P, ингибиторы кальциневрина, ингибиторы mTOR, ингибиторы синтеза нуклеотидов, биологические препараты и моноклональные антитела.
[00140] Кортикостероиды включают, без ограничения таковыми, преднизолон, будесонид, преднизолон, метилпреднизолон.
[00141] Ингибиторы янус-киназы включают, без ограничения таковыми, тофацитиниб, барицитиниб, филготиниб и упадацитиниб.
[00142] Антагонисты рецептора сфингозин-1-фосфата включают, без ограничения таковыми, FTY720.
[00143] Агонисты S1P включают, без ограничения таковыми, озанимод, этрасимод.
[00144] Ингибиторы кальциневрина включают, без ограничения таковыми, циклоспорин и такролимус.
[00145] Ингибиторы mTOR включают, без ограничения таковыми, сиролимус и эверолимус.
[00146] Ингибиторы интерлейкина включают, без ограничения таковыми, рилонацепт, канакинумаб, анакинру, реслизумаб, бродалумаб, устекинумаб, бенрализумаб, меполизумаб, тоцилизумаб, иксекизумаб, дупилумаб, секукинумаб, тилдракизумаб, гуселкумаб, сарилумаб, базиликсимаб, рисанклизумаб, дадаклизумаб, силтуксумаб.
[00147] Ингибиторы синтеза нуклеотидов включают, без ограничения таковыми, азатиоприн, лефлуномид, микофенолат.
[00148] Биопрепараты включают, без ограничения таковыми, ингибиторы TNF-альфа, ингибиторы интегрина, ингибиторы IL-12/23. Биопрепараты включают, без ограничения таковыми, абатацепт, адалимумаб, анакинру, цертолизумаб, этанерцепт, голимумаб, инфликсимаб, иксекизумаб, натализумаб, ритуксимаб, секукинумаб, тоцилизумаб, устекинумаб, этролизумаб, ведолизумаб.
[00149] Моноклональные антитела включают, без ограничения таковыми, базиликсимаб, даклизумаб, алемтузумаб, ритуксимаб, белатацепт.
Способы дозирования и схемы лечения
[00150] В одном варианте осуществления Соединение 1 или его фармацевтически приемлемая соль, сольват или гидрат используются в приготовлении лекарственных средств для лечения заболеваний или состояний, вызванных грибковыми инфекциями у млекопитающих. Способы лечения любого из заболеваний или состояний, описанных в настоящем документе, у млекопитающего, нуждающегося в таком лечении, включают введение фармацевтических композиций, содержащих Соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат, или активный метаболит Соединения 1 (т.е., Соединение 1А) в терапевтически эффективных количествах для указанного млекопитающего.
[00151] В некоторых вариантах осуществления композиции, содержащие соединение(я), описанные в настоящем документе, вводят для профилактического и/или терапевтического лечения. В некоторых терапевтических применениях композиции вводят пациенту, уже страдающему от заболевания или состояния, в количестве, достаточном для излечения или, по меньшей мере, частичного купирования по меньшей мере одного из симптомов заболевания или состояния. Количества, эффективные для этого применения, зависят от тяжести и течения заболевания или состояния, предшествующей терапии, состояния здоровья пациента, веса и реакции на лекарства, а также заключения лечащего врача. Терапевтически эффективные количества необязательно определяют способами, включая, без ограничения таковыми, повышение дозы и/или клиническое исследование диапазона доз.
[00152] В профилактических целях композиции, содержащие Соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат, вводят пациенту, предрасположенному или иным образом подверженному риску конкретного заболевания или состояния. Такое количество определяется как «профилактически эффективное количество или доза». При таком применении точные количества также зависят от состояния здоровья пациента, его веса и т.п. При использовании эффективные количества для такого применения будут зависеть от основного риска развития грибковой инфекции, предшествующей терапии, состояния здоровья пациента и реакции на лекарства, а также решения лечащего врача. В одном аспекте профилактическое лечение включает введение млекопитающему, который ранее страдал по крайней мере одним симптомом заболевания, являющегося причиной лечение, и в настоящее время находится в состоянии ремиссии, фармацевтической композиции, содержащей Соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат, для предотвращения возврата симптомов заболевания или состояния.
[00153] В некоторых вариантах осуществления, если состояние пациента не улучшается, по усмотрению врача введение Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата проводят постоянно, то есть в течение длительного периода времени, в том числе на протяжении всей жизни пациента для улучшения или контроля или стабилизации симптомов заболевания или состояния пациента.
[00154] После улучшения состояния пациента при необходимости вводят поддерживающую дозу. Впоследствии, в конкретных вариантах осуществления, дозировка или частота введения, или и то и другое, снижаются в зависимости от симптомов до уровня, при котором сохраняется улучшенное заболевание или состояние. Однако в некоторых вариантах осуществления пациенту требуется прерывистое лечение на долгосрочной основе при любом рецидиве симптомов.
[00155] В одном аспекте Соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат вводят ежедневно субъектам, нуждающимся в терапии Соединением 1 или его фармацевтически приемлемой солью, сольватом или гидратом. В некоторых вариантах осуществления Соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат вводят один раз в день. В некоторых вариантах осуществления Соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат вводят дважды в день.
[00156] В некоторых вариантах осуществления Соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат вводят два раза в день, например, утром и вечером.
[00157] В некоторых вариантах осуществления Соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат вводят в течение по меньшей мере 2 недель, по меньшей мере 3 недель, по меньшей мере 4 недель, по меньшей мере 5 недель, по меньшей мере 6 недель, по меньшей мере 7 недель, по меньшей мере 8 недель, по меньшей мере 9 недель, по меньшей мере 10 недель, по меньшей мере 11 недель, по меньшей мере 12 недель, по меньшей мере 1 месяца, по меньшей мере 2 месяцев, по меньшей мере 3 месяцев, по меньшей мере 4 месяцев, или больше.
[00158] В некоторых вариантах осуществления Соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат вводят человеку по схеме непрерывного дозирования. В некоторых вариантах осуществления Соединение 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят человеку по схеме непрерывного ежедневного дозирования.
[00159] Термин «непрерывный режим дозирования» относится к введению конкретного терапевтического агента через регулярные интервалы времени. В некоторых вариантах осуществления непрерывный режим дозирования относится к введению конкретного терапевтического средства через равные промежутки времени без каких-либо перерывов в приеме конкретного терапевтического средства. В некоторых других вариантах осуществления схема непрерывного дозирования относится к введению конкретного терапевтического средства циклами. В некоторых других вариантах осуществления схема непрерывного дозирования относится к введению определенного терапевтического средства циклично, с последующим перерывом в приеме конкретного лекарственного средства (например, периодом вымывания или другим подобным периодом времени, когда лекарственное средство не вводится). Например, в некоторых вариантах осуществления терапевтическое средство вводят один раз в день, два раза в день, ежедневно в течение недели и чередуют с последующей неделей без введения терапевтического средства; или ежедневно в течение двух недель с последующей одной или двумя неделями без введения терапевтического средства терапевтического агента; или ежедневно в течение трех недель, с последующей одной, двумя или тремя неделями без введения терапевтического агента; ежедневно в течение четырех недель с последующими одной, двумя, тремя или четырьмя неделями без введения терапевтического агента; введение терапевтического агента раз в неделю с последующей неделей отсутствия введения терапевтического агента; введение терапевтического агента каждые две недели с последующим двухнедельным отсутствием введения терапевтического агента. В некоторых вариантах осуществления ежедневное введение составляет один раз в день. В некоторых вариантах осуществления ежедневное введение составляет два раза в день.
[00160] Термин «схема непрерывного ежедневного дозирования» относится к введению конкретного терапевтического средства каждый день примерно в одно и то же время. В некоторых вариантах осуществления ежедневное введение составляет один раз в день. В некоторых вариантах осуществления ежедневное введение составляет два раза в день. В некоторых вариантах осуществления ежедневное введение составляет три раза в день. В некоторых вариантах осуществления ежедневное введение составляет более трех раз в день.
[00161] В некоторых вариантах осуществления определенное количество Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят один раз в день. В некоторых других вариантах осуществления определенное количество Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят два раза в день.
[00162] В некоторых вариантах осуществления, в которых улучшение состояния или заболевания у человека не наблюдается, увеличивают суточную дозу Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата. В некоторых вариантах осуществления график дозирования один раз в день изменяется на график дозирования два раза в день. В некоторых вариантах осуществления частота введения увеличивается с целью обеспечения постоянного или более регулярного воздействия Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата. В некоторых вариантах осуществления частота введения Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата увеличивается для обеспечения повторяющихся высоких уровней Cmax на регулярной основе и для поддержания или более регулярного воздействия, например, на более высоком уровне AUC.
[00163] В любом из вышеупомянутых аспектов представлены дополнительные варианты осуществления, включающие однократное введение эффективного количества Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата, включая такие дополнительные варианты осуществления, в которых Соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат вводят (i) один раз в день; или (ii) несколько раз в течение одного дня.
[00164] В любом из вышеупомянутых аспектов представлены дополнительные варианты осуществления, включающие многократное введение эффективного количества Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата , включая такие дополнительные варианты осуществления, в которых (i) Соединение 1 вводят непрерывно или периодически, например, в разовой дозе; (ii) период между многократными введениями составляет 6 часов; (iii) Соединение 1 вводят млекопитающему каждые 8 часов; (iv) Соединение 1 вводят млекопитающему каждые 12 часов; (v) Соединение 1 вводят млекопитающему каждые 24 часа. В дополнительных или альтернативных вариантах осуществления способ включает период без лекарственного средства, в течение которого введение соединения временно приостанавливается или доза вводимого соединения временно снижается; по окончании такого периода возобновляют дозирование соединения. В одном варианте осуществления продолжительность периода без введения лекарственного средства варьируется от 2 дней до 1 года.
[00165] Как правило, подходящая доза Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата для введения человеку будет находиться в диапазоне от примерно 500 мг/день до примерно 2000 мг/день; от примерно 600 мг/день до примерно 2000 мг/день; от примерно 800 мг/день до примерно 2000 мг/день; или от примерно 1000 мг/день до примерно 2000 мг/день.
[00166] В некоторых вариантах осуществления введение эффективного количества Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата включает схему лечения, которая представляет собой введение загрузочной (ударной) дозы Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата с последующей поддерживающей дозой Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата. В некоторых вариантах осуществления загрузочную дозу Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят способом, отличным от поддерживающей дозы Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата. В некоторых вариантах осуществления загрузочную дозу Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят таким же образом, как и поддерживающую дозу Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата.
[00167] В некоторых вариантах осуществления загрузочную дозу вводят в виде раствора путем внутривенной (в/в) инфузии.
[00168] В некоторых вариантах осуществления поддерживающие дозы вводят перорально в виде твердых лекарственных форм. В некоторых вариантах твердые лекарственные формы представляют собой таблетки. В некоторых вариантах осуществления поддерживающие дозы вводят в виде раствора путем внутривенной (в/в) инфузии.
[00169] В некоторых вариантах осуществления загрузочная доза содержит от примерно 1500 мг до примерно 2500 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата. В некоторых вариантах осуществления загрузочная доза содержит примерно 2000 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата. В некоторых вариантах осуществления загрузочная доза Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата включает введение двух доз Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата субъекту путем внутривенной (в/в) инфузии. В некоторых вариантах осуществления каждую загрузочную дозу Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят субъекту путем внутривенной (в/в) инфузии в течение от примерно 30 минут до примерно 3 часов. В некоторых вариантах осуществления каждую загрузочную дозу Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят субъекту путем внутривенной (в/в) инфузии в течение более чем примерно 30 минут, более чем примерно 45 минут, более чем примерно 1 часа, более чем примерно 1,5 часа, более чем примерно 2 часа, более чем примерно 2,5 часа, более чем примерно 3 часа или более 3 часов. В некоторых вариантах осуществления каждая из двух доз загрузочной дозы содержит примерно 1000 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата.
[00170] В некоторых вариантах осуществления загрузочная доза включает введение примерно 1000 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата субъекту посредством внутривенной (в/в) инфузии с последующим вторым введением примерно 1000 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата субъекту путем внутривенной (в/в) инфузии в течение примерно 24 часов после первой инфузии. В некоторых вариантах осуществления вторую загрузочную дозу вводят в течение примерно 12 часов после первой загрузочной дозы, в течение примерно 13 часов после первой загрузочной дозы, в течение примерно 14 часов после первой загрузочной дозы, в течение примерно 15 часов после первой загрузочной дозы, в течение примерно 16 часов после первой загрузочной дозы, примерно в течение 17 часов после первой загрузочной дозы, примерно в течение 18 часов после первой загрузочной дозы, примерно в течение 19 часов после первой загрузочной дозы, примерно в течение 20 часов после первой загрузочной дозы, в течение примерно 21 часа после первой загрузочной дозы, примерно в течение 22 часов после первой загрузочной дозы, примерно в течение 23 часов после первой загрузочной дозы или примерно в течение 24 часов после первой загрузочной дозы.
[00171] В некоторых вариантах осуществления введение поддерживающих доз начинают на второй день лечения. В некоторых вариантах осуществления поддерживающую дозу вводят один раз в день, начиная со второго дня лечения.
[00172] В некоторых вариантах осуществления каждая поддерживающая доза включает однократное ежедневное введение от примерно 1000 мг до примерно 2000 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата. В некоторых вариантах осуществления каждая поддерживающая доза включает введение один раз в сутки от примерно 600 мг до примерно 1000 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата. В некоторых вариантах осуществления каждая поддерживающая доза включает введение один раз в сутки примерно 600 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата. В некоторых вариантах осуществления каждая поддерживающая доза включает однократное ежедневное введение примерно 650 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата. В некоторых вариантах осуществления каждая поддерживающая доза включает введение один раз в сутки примерно 700 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата. В некоторых вариантах осуществления каждая поддерживающая доза включает введение один раз в сутки примерно 750 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата. В некоторых вариантах осуществления каждая поддерживающая доза включает введение один раз в сутки примерно 800 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата. В некоторых вариантах осуществления каждая поддерживающая доза включает однократное ежедневное введение примерно 850 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата. В некоторых вариантах осуществления каждая поддерживающая доза включает введение один раз в сутки примерно 900 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата. В некоторых вариантах осуществления каждая поддерживающая доза включает введение один раз в сутки примерно 950 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата. В некоторых вариантах осуществления каждая поддерживающая доза включает введение один раз в сутки примерно 1000 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата. В некоторых вариантах осуществления каждая поддерживающая доза включает однократное ежедневное введение примерно 1050 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата. В некоторых вариантах осуществления каждая поддерживающая доза включает введение один раз в сутки примерно 1100 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата. В некоторых вариантах осуществления каждая поддерживающая доза включает однократное ежедневное введение примерно 1150 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата. В некоторых вариантах осуществления каждая поддерживающая доза включает введение один раз в сутки примерно 1200 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата. В некоторых вариантах осуществления каждая поддерживающая доза включает однократное ежедневное введение более примерно 1200 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата.
[00173] В некоторых вариантах осуществления каждую поддерживающую дозу Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят внутривенной инфузией в течение периода от примерно 30 минут до примерно 3 часов, начиная со второго, третьего или четвертого дня лечения. В некоторых вариантах осуществления каждую поддерживающую дозу Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят в течение примерно 30 минут, примерно 45 минут, примерно 1 часа, примерно 1,5 часа, примерно 2 часов, примерно 2,5 часов, примерно 3 часов, или свыше 3 часов внутривенной инфузией, начиная со второго, третьего или четвертого дня лечения.
[00174] В некоторых вариантах осуществления поддерживающие дозы от примерно 600 мг до примерно 1500 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят внутривенной инфузией в течение периода от примерно 30 минут до примерно 5 часов, начиная со второго, третьего или четвертого дня лечения. В некоторых вариантах осуществления поддерживающие дозы составляют примерно 600 мг, примерно 650 мг, примерно 700 мг, примерно 750 мг, примерно 800 мг, примерно 850 мг, примерно 900 мг, примерно 950 мг, примерно 1000 мг, примерно 1050 мг, примерно 1100 мг, примерно 1150 мг или примерно 1200 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят внутривенной инфузией в течение периода от примерно 30 минут до примерно 5 часов, начиная со второго, третьего или четвертого дня лечения.
[00175] В некоторых вариантах осуществления поддерживающие дозы от примерно 600 мг до примерно 900 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят в течение периода от примерно 30 минут до примерно 3 часов внутривенной инфузией, начиная со второго, третьего или четвертого дня лечения. В некоторых вариантах осуществления поддерживающие дозы составляют примерно 600 мг, примерно 650 мг, примерно 700 мг, примерно 750 мг, примерно 800 мг, примерно 850 мг или примерно 900 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата; такие дозы вводят в течение периода времени от примерно 30 минут до примерно 3 часов с помощью внутривенной инфузии, начиная со второго, третьего или четвертого дня лечения.
[00176] В некоторых вариантах осуществления каждая поддерживающая доза включает однократное ежедневное введение более чем примерно 900 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата. В некоторых вариантах осуществления каждая поддерживающая доза включает введение один раз в сутки от примерно 900 мг до примерно 2000 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата. В некоторых вариантах осуществления поддерживающие дозы от примерно 900 мг до примерно 2000 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят внутривенной инфузией в течение периода от примерно 30 минут до примерно 3 часов, начиная со второго, третьего или четвертого дня лечения. В некоторых вариантах осуществления поддерживающие дозы от примерно 900 мг до примерно 2000 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят внутривенной инфузией в течение более 3 часов, начиная со второго, третьего или четвертого дня лечения.
[00177] В некоторых вариантах осуществления поддерживающая доза Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводится перорально субъекту, начиная со второго, третьего или четвертого дня лечения.
[00178] В некоторых вариантах осуществления поддерживающая доза от примерно 800 мг до примерно 1000 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводится перорально один раз в день субъекту, начиная со второго, третьего или четвертого день лечения. В некоторых вариантах осуществления поддерживающую дозу, составляющую примерно 800 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата, вводят субъекту перорально один раз в день, начиная со второго, третьего или четвертого дня лечения. В некоторых вариантах осуществления поддерживающую дозу, составляющую примерно 900 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата, вводят субъекту перорально один раз в день, начиная со второго, третьего или четвертого дня лечения. В некоторых вариантах осуществления поддерживающую дозу, составляющую примерно 1000 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата, вводят субъекту перорально один раз в день, начиная со второго, третьего или четвертого дня лечения.
[00179] В некоторых вариантах осуществления поддерживающую дозу от примерно 800 мг до примерно 1000 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят перорально один раз в день, или суточную дозу вводят два раза в день, в равных дозах, субъекту, начиная со второго, третьего или четвертого дня лечения. В некоторых вариантах осуществления поддерживающую дозу, составляющую примерно 800 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата, вводят перорально один раз в день, или суточную дозу вводят два раза в день в равных долях субъекту, начиная с второй, третий или четвертый день лечения. В некоторых вариантах осуществления поддерживающую дозу, составляющую примерно 900 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата, вводят перорально один раз в день, или суточную дозу вводят два раза в день в равных долях субъекту, начиная со второго, третьего или четвертого дня лечения. В некоторых вариантах осуществления поддерживающую дозу, составляющую примерно 1000 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата, вводят перорально один раз в день, или суточную дозу вводят дважды в день в равных долях субъекту, начиная со второго, третьего или четвертого дня лечения.
[00180] В некоторых вариантах осуществления, начиная со второго, третьего или четвертого дня лечения: а) от примерно 600 мг до примерно 900 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят в течение периода примерно от 30 минут до примерно 3 часов внутривенной инфузией; или b) от примерно 800 мг до примерно 1000 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят перорально один раз в сутки.
[00181] В некоторых вариантах осуществления, начиная со второго дня лечения, от примерно 600 мг до примерно 900 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят в течение периода времени от примерно 30 минут до примерно 3 часов внутривенной инфузией; и начиная с четвертого дня лечения: а) от примерно 600 мг до примерно 900 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят внутривенной инфузией в течение периода от примерно 30 минут до примерно 3 часов; или b) от примерно 800 мг до примерно 1000 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят перорально один раз в сутки.
[00182] В некоторых вариантах осуществления суточная доза или количество активного вещества в лекарственной форме оказываются ниже или выше значений диапазонов, указанных в настоящем документе, вследствие ряда переменных, возникающих в процессе индивидуального режима лечения. В различных вариантах осуществления суточная и стандартная дозы изменяются в зависимости от ряда переменных, с учетом, без ограничения таковыми, заболевания или состояния, подлежащего лечению, способа введения, потребностей отдельного субъекта, тяжести заболевания или состояния, подлежащего лечению, параметров субъекта (например, вес) и конкретных дополнительных терапевтических агентов, подлежащих введению (если применимо), а также заключения практикующего врача.
[00183] Токсичность и терапевтическую эффективность таких терапевтических схем определяется стандартными фармацевтическими процедурами на культурах клеток или экспериментальных животных, включая, без ограничения таковыми, определение LD50 и ED50. Соотношение доз между токсическим и терапевтическим эффектами является терапевтическим индексом и выражается как отношение между LD50 и ED50. В некоторых вариантах осуществления данные, полученные на основе анализа клеточных культур и исследований на животных, используются для определения терапевтически эффективного диапазона суточной дозы и/или терапевтически эффективного количества стандартной дозы для применения у млекопитающих, включая человека. В некоторых вариантах осуществления суточная доза Соединения 1 находится в пределах диапазона циркулирующих концентраций, который включает ED50 с минимальной токсичностью. В некоторых вариантах осуществления диапазон дневной дозы и/или количество стандартной дозы варьируется в пределах этого диапазона в зависимости от используемой лекарственной формы и используемого пути введения.
[00184] В некоторых вариантах осуществления способы лечения грибковых инфекций у млекопитающих с помощью Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата приводят к улучшению клинических симптомов, связанных с инфекцией, улучшению рентгенологических аномалий и разрешению фунгемии, если таковая присутствует. В некоторых вариантах осуществления клинические симптомы, связанные с инфекцией, включают, например, общий вид, включая внешний вид кожи, головы, глаз, ушей, носа, горла, шеи, туловища или лимфатических узлов, или состояние респираторной, сердечно-сосудистой, желудочно-кишечной, скелетно-мышечной, мочеполовой, нервной, лимфатической/гематологической и эндокринной/метаболической системы млекопитающего-субъекта, а также состояние психики такового.
[00185] В некоторых вариантах осуществления улучшение одного или нескольких показателей результата составляет по меньшей мере или примерно 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% или более 95%. В некоторых вариантах осуществления введение Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата млекопитающему с грибковой или плесневой инфекцией приводит к улучшению одного или нескольких заключительных показателей по меньшей мере или примерно в 0,5 раза, 1, 1,5, 2, 2,5, 3, 3,5, 4, 5, 6, 7, 8, 9, 10 или более 10 раз. Такие улучшения в некоторых вариантах осуществления сравнивают с контролем. В некоторых вариантах осуществления контроль представляет собой индивидуума, не получавшего в принципе Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата В некоторых вариантах осуществления контроль представляет собой индивидуума, не получавшего полной дозы Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата. В некоторых вариантах осуществления контроль представляет собой базовый уровень для индивидуума до получения Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата.
[00186] В некоторых вариантах осуществления способы лечения грибковой или плесневой инфекции у субъекта с помощью Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата приводят к улучшению одного или нескольких результирующих показателей. В некоторых вариантах осуществления исходная оценка определяется, как правило, до введения Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата. Улучшения показателей результатов оценивают с помощью повторных оценок, проводимых во время лечения Соединением 1, и сравнивают с исходной оценкой и/или любой предыдущей оценкой(ами).
[00187] Обследование пациентов на наличие грибковых инфекций и оценка эффективности лечения Соединением 1 или его фармацевтически приемлемой солью, сольватом или гидратом проводится несколькими методами диагностического тестирования, в том числе: радиологическим анализом, включая КТ грудной клетки, пазух и живота; высевом и микроскопией образцов из дыхательных путей; анализом крови, сыворотки или бронхоальвеолярной жидкости на грибковый антиген; анализом крови, сыворотки или бронхоальвеолярной жидкости на патогенную ДНК; биопсией легкого (открытой, чрескожной (percutaneous) или трансбронхиальной); анализом мочи на аспергиллез; и другими молекулярными исследованиями образцов, полученных из дыхательных путей.
[00188] В некоторых вариантах осуществления способы лечения грибковых инфекций у млекопитающих с помощью Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата приводят к улучшениям, измеряемым с помощью радиологических методов, таких как компьютерная томография (КТ). В некоторых вариантах осуществления используются способы визуализации, выявляющие воспаление, такие как позитронно-эмиссионная томография или сцинтиграфия лейкоцитов, меченных индием. В некоторых вариантах осуществления радиологические методы используется для определения наличия грибковой инфекции, такой как аллергический бронхолегочный аспергиллез (ABPA), или аспергилломы, или грибкового шара. В некоторых вариантах осуществления КТ-признаки аспергиллеза включают: знак ореола, указывающий на легочное кровотечение; знак воздушного полумесяца, указывающий на кавитацию; и признак гиподенсии, как предшественник знака воздушного полумесяца, который проявляется как относительная гиподенсивность внутри узелкового(ых) поражения(ий) (см. A. Prasad, et al. J Clin Diagn Res. 2016 Apr; 10(4): TE01-TE05). В некоторых вариантах осуществления радиологические методы используется для определения размера или распространенности инфекции. В некоторых вариантах осуществления КТ-сканирование проводят каждые 7 дней или 14 дней, пока млекопитающее подвергается лечению соединением 1 или его фармацевтически приемлемой солью, сольватом или гидратом. В некоторых вариантах осуществления общая инфекционная нагрузка снижается по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95% при схеме лечения соединением 1 или его фармацевтически приемлемой солью, сольватом или гидратом.
[00189] В некоторых вариантах осуществления способы лечения грибковых инфекций у млекопитающих с помощью Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата приводят к улучшениям, измеряемым при анализе грибковой культуры в жидкости организма, такой как бронхоальвеолярная жидкость, мокрота, бронхиальный соскоб, или аспират из носовых пазух. В некоторых вариантах осуществления грибковая нагрузка, определенная в грибковой культуре, снижается по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, при по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95% после схемы лечения соединением 1 или его фармацевтически приемлемой солью, сольватом или гидратом.
[00190] В некоторых вариантах осуществления способы лечения грибковых инфекций у млекопитающих с помощью Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата приводят к улучшениям, измеряемым с помощью теста на обнаружение грибкового антигена, такого как 1, 3-β-D-глюкан или галактоманнан в телесной жидкости, такой как кровь, сыворотка или бронхоальвеолярная жидкость. Измерение галактоманнана, 1,3-β-D-глюкана как биомаркера широко используется для ранней диагностики инвазивного аспергиллеза легких (ИПА) у пациентов с нейтропенией наряду с анализом путем полимеразной цепной реакции (ПЦР).
[00191] 1,3-β-D-глюкан представляет собой распространенный полисахарид клеточной стенки и обнаруживается у большинства грибков, таких как, например, Aspergillus spp. (ES Theel, et al., J Clin Microbiol. 2013 Nov; 51(11): 3478-3483). В некоторых вариантах осуществления способы лечения грибковых инфекций у млекопитающих с помощью Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата, приводят к улучшениям, измеряемым с помощью подходящего теста на 1,3-β-D-глюкан. В некоторых вариантах осуществления уровни 1,3-β-D-глюкана измеряют в образцах сыворотки млекопитающего. В некоторых вариантах осуществления уровни 1,3-β-D-глюкана определяют с помощью известного анализа обнаружения 1,3-β-D-глюкана, например, по Fungitell (Associates of Cape Code, Inc., East Falmouth, MA, USA), Wako (Wako Pure Chemical Industries, Ltd., Tokyo, Japan), Fungitec-G (Seikagaku, Kogyo, Tokyo, Japan), и Maruha (Maruha-Nichiro, Foods Inc., Tokyo, Japan). В некоторых вариантах осуществления уровень 1,3-β-D-глюкана снижается не менее чем на 10%, не менее чем на 15%, не менее чем на 20%, не менее чем на 25%, не менее чем на 30%, не менее чем на 35%, не менее чем на 40%, не менее чем на 45%, не менее чем на 50%, не менее чем на 55%, не менее чем на 60%, не менее чем на 65%, не менее чем на 70%, не менее чем на 75%, не менее чем на 80%, не менее чем на 85%, не менее чем на 90% или по меньшей мере на 95% после лечения соединением 1 или его фармацевтически приемлемой солью, сольватом или гидратом. В некоторых вариантах осуществления постоянное снижение уровней 1,3-β-D-глюкана во время лечения приводит к благоприятному терапевтическому ответу у пациентов с подтвержденными или вероятными инвазивными грибковыми инфекциями.
[00192] Галактоманнан представляет собой полисахаридный антиген, присутствующий в основном в клеточных стенках Aspergillus spp. (M. Hites, et al., Ann Transl Med. 2016 Sep; 4(18): 353). Галактоманнан может выделяться в кровь и другие жидкости организма даже на ранних стадиях аспергиллезной инвазии, и присутствие этого антигена может обнаруживаться от 1 до 8 недель. В некоторых вариантах осуществления способы лечения грибковых инфекций у млекопитающих соединением 1 или его фармацевтически приемлемой солью, сольватом или гидратом приводят к улучшениям, измеряемым с помощью подходящего теста на галактоманнан. В некоторых вариантах осуществления уровни галактоманнана измеряют в образцах сыворотки млекопитающего. В некоторых вариантах осуществления уровни галактоманнана измеряют в образцах жидкости бронхоальвеолярного лаважа (смыва) млекопитающего. В некоторых вариантах осуществления уровни галактоманнана определяют путем известного анализа обнаружения галактоманнана. В некоторых вариантах осуществления уровни галактоманнана определяют с помощью твердофазного иммуноферментного анализа галактоманнана (ELISA). В некоторых вариантах осуществления уровни галактоманнана снижаются по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95% после применения схемы лечения Соединением 1 или его фармацевтически приемлемой солью, сольватом или гидратом . В некоторых вариантах осуществления последовательное снижение уровней галактоманнана во время лечения приводит к благоприятному терапевтическому ответу у пациентов с подтвержденными или вероятными инвазивными грибковыми инфекциями. В некоторых вариантах осуществления чувствительность анализа галактоманнана выше у пациентов с нейтропенией, чем у пациентов без нейтропении, поскольку молекулы галактоманнана в некоторых случаях выводятся из нейтрофилов.
[00193] В некоторых вариантах осуществления способы лечения грибковых инфекций у млекопитающих с помощью Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата приводят к улучшениям, измеряемым с помощью подходящего теста ДНК патогена. В некоторых вариантах осуществления уровни ДНК патогена измеряют в образцах крови млекопитающего. В некоторых вариантах осуществления уровни ДНК патогена измеряют в образцах сыворотки млекопитающего. В некоторых вариантах осуществления уровни ДНК патогена измеряют в образцах жидкости бронхоальвеолярного лаважа (смыва) млекопитающего. В некоторых вариантах осуществления уровни ДНК патогена определяют с использованием известного анализа обнаружения ДНК патогена. В некоторых вариантах осуществления уровни ДНК патогена определяют с помощью секвенирования нового поколения и/или анализа полимеразной цепной реакции (ПЦР). В некоторых вариантах осуществления уровни ДНК патогена снижаются по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или не менее 95% при использовании схемы лечения Соединением 1 или его фармацевтически приемлемой солью, сольватом или гидратом .
[00194] В некоторых вариантах осуществления способы лечения грибковых инфекций у субъекта с помощью Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата приводят к гистологическим улучшениям в биопсийных образцах ткани, взятых у субъекта с грибковой или плесневой инфекцией. В некоторых вариантах осуществления ткань биоптата представляет собой ткань легкого.
[00195] В некоторых вариантах осуществления способы лечения аспергиллеза у млекопитающих с помощью Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата приводят к улучшениям, измеряемым с помощью анализа мочи на аспергиллез (K A Marr, et al., Clinical Infectious Diseases, Volume 67, Issue 11, 1 December 2018, Pages 1705-1711). Вкратце, анализ мочи на аспергиллез определяет наличие грибковых антигенов в моче. Антигены содержат галактофуранозу и выявляются с помощью антител, специфичных для таких антигенов. В некоторых вариантах осуществления уровни этих антигенов снижаются по меньшей мере на 10%, по меньшей мере на 15%, по меньшей мере на 20%, по меньшей мере на 25%, по меньшей мере на 30%, по меньшей мере на 35%, по меньшей мере на 40%, по меньшей мере на 45%, по меньшей мере на 50%, по меньшей мере на 55%, по меньшей мере на 60%, по меньшей мере на 65%, по меньшей мере на 70%, по меньшей мере на 75%, по меньшей мере на 80%, по меньшей мере на 85%, по меньшей мере на 90% или по меньшей мере на 95% после применения схемы лечения соединением 1 или его фармацевтически приемлемой солью, сольватом или гидратом .
[00196] В некоторых вариантах осуществления способы лечения грибковых инфекций у млекопитающих с помощью Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата повышают общую выживаемость субъекта не менее чем на 10%, не менее чем на 20%, не менее чем на 30%, не менее чем на 40%, не менее чем на 50%, не менее чем на 60%, не менее чем на 70%, не менее чем на 80%, не менее чем на 90%, не менее чем на 95% или 100%. В некоторых вариантах осуществления общую выживаемость измеряется через 42 дня. В некоторых вариантах осуществления общая выживаемость измеряется через 84 дня.
[00197] В некоторых вариантах осуществления способы лечения грибковых инфекций у млекопитающих с помощью Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата снижают уровень смертности субъекта от всех причин по меньшей мере на 10%, по меньшей мере на 20%, по меньшей мере на 30%, по меньшей мере на 40%, по меньшей мере на 50%, по меньшей мере на 60%, по меньшей мере на 70%, по меньшей мере на 80%, по меньшей мере на 90%, по меньшей мере на 95% или 100%. В некоторых вариантах осуществления уровень смертности от всех причин измеряют через 42 дня. В некоторых вариантах осуществления уровень смертности от всех причин измеряют через 84 дня.
Комбинированные процедуры
[00198] В некоторых случаях целесообразно вводить Соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат в комбинации с одним или несколькими другими терапевтическими агентами.
[00199] В одном варианте осуществления терапевтическая эффективность Соединения 1 или его фармацевтически приемлемой соли повышается за счет введения адъюванта (т.е. адъювант сам по себе оказывает минимальное терапевтическое действие, но в сочетании с другим терапевтическим агентом общий терапевтический эффект для пациента повышается). Или, в некоторых вариантах осуществления, благоприятные эффекты для пациента повышаются при введении Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата с другим агентом (который также включает терапевтическую схему), который также обладает терапевтическим действием.
[00200] В одном конкретном варианте осуществления Соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат вводят совместно со вторым терапевтическим средством, при этом Соединение 1 или его фармацевтически приемлемая соль и второе терапевтическое средство модулируют различные аспекты заболевания или состояния, подвергаемых лечению, тем самым обеспечивая больший общий благоприятный эффект, чем введение любого терапевтического агента по отдельности.
[00201] В любом случае, независимо от заболевания или состояния, подлежащего лечению, общий благоприятный эффект, испытываемый пациентом, является либо суммой влияния двух терапевтических агентов, либо является результатом синергетического взаимодействия агентов.
[00202] В некоторых вариантах осуществления различные терапевтически эффективные дозы Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата используются при составлении фармацевтической композиции и/или в схемах лечения, в которых Соединение 1 или его фармацевтически приемлемая соль, сольват или гидрат вводят в сочетании с одним или несколькими дополнительными агентами, такими как дополнительное терапевтически эффективное лекарство, адъювант или тому подобное. Терапевтически эффективные дозы лекарственных средств и других средств для применения в схемах комбинированного лечения необязательно определяют способами, аналогичными изложенным выше для самих активных веществ. Кроме того, способы профилактики/лечения, описанные в настоящем документе, охватывают использование метрономного дозирования, т.е. более частое введение более низких доз для сведения к минимуму токсических побочных эффектов. В некоторых вариантах осуществления схема комбинированного лечения включает схемы лечения, при которых введение Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата начинается до, во время или после лечения вторым агентом, описанным в настоящем документе, и продолжается до любого момента в период лечения вторым агентом или после прекращения лечения вторым агентом. Комбинированное лечение также включает лечение, при котором Соединение 1 или его фармацевтически приемлемая соль, сольват или гидрат и второй агент, используемые в комбинации, вводятся одновременно или в разное время и/или с уменьшающимися или увеличивающимися интервалами в течение периода лечения. Комбинированное лечение дополнительно включает периодическое лечение, которое начинается и прекращается в разное время с целью облегчения клинического ведения пациента.
[00203] Понятно, что режим дозирования для лечения, предотвращения или облегчения состояния, на которое направлено лечение, модифицируется в соответствии с множеством факторов (например, специфика заболевания или состояния, от которого страдает субъект; возраст, вес, пол, диета и состояние здоровья субъекта). Таким образом, в некоторых случаях фактически используемый режим дозирования может варьироваться и, в некоторых вариантах осуществления, отличается от режимов дозирования, изложенных в настоящем документе.
[00204] Для комбинированной терапии, описанной в настоящем документе, дозы совместно вводимых соединений варьируются в зависимости от типа применяемого совместного лекарственного средства, от специфичности конкретного применяемого лекарственного средства, заболевания или состояния, подлежащего лечению, и так далее. В дополнительных вариантах осуществления при совместном введении с одним или несколькими другими терапевтическими средствами Соединение 1 или его фармацевтически приемлемую соль или сольват вводят либо одновременно с одним или несколькими другими терапевтическими средствами, либо последовательно.
[00205] В комбинационной терапии множественные терапевтические агенты (один из которых представляет собой Соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат) вводят в любом порядке или даже одновременно. Если введение является одновременным, несколько терапевтических средств могут предоставляться, исключительно в качестве примера, в одной унифицированной форме или в нескольких формах (например, в виде одной таблетки или в виде двух отдельных пилюль; или в виде раствора для внутривенной инфузии или в виде двух отдельных инфузионных растворов для внутривенных инфузий).
[00206] Соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат, а также агенты комбинированной терапии вводят до, во время или после возникновения заболевания или состояния, а время введения композиции, содержащей Соединение 1, или его фармацевтически приемлемую соль, сольват или гидрат, может варьироваться. Таким образом, в одном варианте осуществления Соединение 1 или его фармацевтически приемлемая соль, сольват или гидрат используются в качестве профилактического средства и непрерывно вводятся субъектам со склонностью к развитию состояний или заболеваний с целью предотвращения возникновения заболевания или состояния. В другом варианте осуществления Соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат вводят субъекту во время или как можно скорее после появления симптомов. В конкретных вариантах осуществления Соединение 1 или его фармацевтически приемлемую соль или сольват вводят как можно скорее после обнаружения или подозрения на начало заболевания или состояния и в течение периода времени, необходимого для лечения заболевания. В некоторых вариантах осуществления продолжительность введения, необходимая для лечения, варьируется, и продолжительность лечения регулируется в соответствии с конкретными потребностями каждого субъекта. Например, в конкретных вариантах осуществления Соединение 1 или его фармацевтически приемлемая соль или сольват, или состав, содержащий Соединение 1 или его фармацевтически приемлемую соль или сольват, вводят в течение по меньшей мере 4 недель, по меньшей мере 6 недель, по меньшей мере 8 недель, по меньшей мере 10 недель по меньшей мере 12 недель или более 12 недель.
Примеры агентов для использования в комбинированной терапии
[00207] В некоторых вариантах осуществления Соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат вводят в комбинации с одним или несколькими дополнительными терапевтическими средствами, используемыми для лечения грибковых и/или плесневых инфекций у млекопитающих.
[00208] В некоторых вариантах осуществления по меньшей мере один дополнительный терапевтический агент вводят одновременно с Cоединением 1 или его фармацевтически приемлемой солью, сольватом или гидратом. В некоторых вариантах осуществления по меньшей мере один дополнительный терапевтический агент вводят реже, чем Соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат. В некоторых вариантах осуществления по меньшей мере один дополнительный терапевтический агент вводят чаще, чем Соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат. В некоторых вариантах осуществления по меньшей мере один дополнительный терапевтический агент вводят перед введением Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата. В некоторых вариантах осуществления по меньшей мере один дополнительный терапевтический агент вводят после введения Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата.
[00209] В некоторых вариантах осуществления по меньшей мере один дополнительный терапевтический агент представляет собой противогрибковый агент. В некоторых вариантах осуществления второй дополнительный терапевтический агент представляет собой противогрибковое средство, выбранное из группы, состоящей из полиенового противогрибкового агента, азольного противогрибкового агента, аллиламинового противогрибкового агента и эхинокандинового противогрибкового агента.
[00210] В некоторых вариантах осуществления полиеновый противогрибковый агент представляет собой амфотерицин В, кандицидин, филипин, гамицин, натамицин, нистатин или римоцидин.
[00211] В некоторых вариантах осуществления азольный противогрибковый агент представляет собой имидазол, триазол или тиазол. В некоторых вариантах осуществления имидазол представляет собой бифоназол, бутоконазол, клотримазол, эконазол, фентиконазол, кетоконазол, луликоназол, миконазол, омоконазол, оксиконазол, сертаконазол, сулконазол или тиоконазол. В некоторых вариантах осуществления триазол представляет собой альбаконазол, эфинаконазол, эпоксиконазол, флуконазол, изавуконазол, итраконазол, позаконазол, пропиконазол, равуконазол, терконазол или вориконазол. В некоторых вариантах осуществления тиазол представляет собой абафунгин.
[00212] В некоторых вариантах осуществления аллиламиновый противогрибковый агент представляет собой аморолфин, бутенафин, нафтифин или тербинафин.
[00213] В некоторых вариантах осуществления эхинокандиновый противогрибковый агент выбран из группы, состоящей из анидулафунгина, каспофунгина, микафунгина и резафунгина.
Дополнительные методы лечения
[00214] В дополнение к противогрибковому лечению оптимальное лечение пациентов с грибковыми инфекциями включает хирургическое уменьшение объема инфицированных тканей и удаление венозных катетеров у некоторых пациентов с подтвержденными катетерными грибковыми инфекциями. В некоторых вариантах осуществления лечение соединением 1 или его фармацевтически приемлемой солью, сольватом или гидратом включает G-CSF или GM-CSF, G-CSF - трансфузии стимулированных гранулоцитов. В некоторых вариантах осуществления лечение Соединением 1 или его фармацевтически приемлемой солью, сольватом или гидратом включает использование гамма-интерферона.
Комплекты и изделия производства
[00215] В настоящем документе описаны наборы для лечения грибковой инфекции у субъекта, включающие введение указанному субъекту Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата.
[00216] Для использования в терапевтических применениях, описанных в настоящем документе, в настоящем документе также описаны наборы и изделия производства. В некоторых вариантах осуществления такие наборы включают в себя носитель, упаковку или контейнер, разделенный на отсеки для размещения одного или нескольких контейнеров, таких как флаконы, пробирки и т.п., причем каждый из контейнеров включает один из отдельных элементов, используемых в описанном здесь способе. Подходящие контейнеры включают, например, бутылки, флаконы, шприцы и пробирки. В некоторых вариантах контейнеры изготовлены из различных материалов, таких как стекло или пластик.
[00217] Предусмотренные здесь промышленные изделия содержат упаковочные материалы. Примеры фармацевтических упаковочных материалов включают, без ограничения таковыми, блистерные упаковки, флаконы, тюбики, ингаляторы, помпы, пакеты, бутылочки, контейнеры, шприцы, пробирки и любой другой упаковочный материал, подходящий для выбранного состава и предполагаемого способа введения и лечения. Предусмотрен широкий спектр составов соединений и композиций, представленных в настоящем документе, а также различные схемы лечения, при которых было бы полезно введение Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата.
[00218] Контейнер(ы) необязательно имеют стерильное отверстие для доступа (например, контейнер представляет собой пакет для внутривенного раствора или флакон с пробкой, прокалываемой иглой для подкожных инъекций). Такие наборы необязательно содержат соединение с сопутствующим описанием или этикеткой или инструкциями, касающимися его применения в описанных здесь способах.
[00219] Набор обычно включает один или несколько дополнительных контейнеров, каждый из которых содержит один или несколько различных материалов (таких как реагенты, необязательно в концентрированной форме, и/или заключенные в устройства), желательных с коммерческой точки зрения и с точки зрения пользователя для применения описанного здесь соединения. Неограничивающие примеры таких материалов включают, без ограничения таковыми, буферы, разбавители, фильтры, иглы, шприцы; этикетки на носителе, упаковке, контейнере, флаконе и/или пробирке с указанием содержимого и/или инструкций по применению, а также листы-вкладыши с инструкциями по применению. Список инструкций, как правило, также включен.
[00220] В некоторых вариантах осуществления этикетка находится на контейнере или связана с ним. В некоторых случаях этикетка находится на контейнере, особенно когда буквы, цифры или другие символы, образующие этикетку, прикреплены, отлиты или выгравированы на самом контейнере; этикетка в некоторых случаях ассоциирована с контейнером, если она присутствует в сосуде или носителе, который также содержит контейнер, например, этикетка предоставлена как листок-вкладыш. Этикетка в некоторых случаях используется для описания того, как содержимое должно использоваться для конкретного терапевтического применения. На этикетке в некоторых случаях указываются инструкции по применению содержимого, например, в описанных здесь способах.
[00221] В некоторых вариантах осуществления фармацевтическая композиция, содержащая Соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат, представлена в упаковке или дозаторе, который в некоторых случаях содержит одну или несколько стандартных лекарственных форм. Упаковка в некоторых случаях, например, содержит металлическую или пластиковую фольгу, например, является блистерной упаковкой. К упаковке или устройству-дозатору в некоторых случаях прилагается инструкция по применению. Упаковка или дозатор в некоторых случаях также сопровождаются уведомлением, связанным с контейнером, в форме, установленной государственным органом, регулирующим производство, использование или продажу фармацевтических препаратов, и описывает утвержденные агентством формы препарата для человека или применения в ветеринарии. Таким уведомлением, например, в некоторых случаях является маркировка, утвержденная Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США для отпускаемых по рецепту лекарств, или утвержденный агентством листок-вкладыш. Композиции, содержащие соединение, представленное в настоящем документе, в составе совместимого фармацевтического носителя, в некоторых случаях также приготовляются, помещаются в соответствующий контейнер и маркируются для лечения указанного состояния.
ПРИМЕРЫ
[00222] Следующие примеры представлены исключительно в иллюстративных целях, без ограничения объема формулы изобретения, представленной в настоящем документе.
Пример 1: Инъекция Соединения 1
[00223] Соединение 1 для инъекций готовят в виде стерильного раствора, который перед введением дополнительно разбавляют раствором 0,9% хлорида натрия для инъекций. Соединение 1 для инъекций представляет собой раствор с концентрацией 20 мг/мл. Препарат состоит из лекарственного препарата Соединения 1, хлорида натрия, фосфата калия (двухосновного и одноосновного), соляной кислоты, гидроксида натрия и воды для инъекций (WFI).
[00224] Стерильный стеклянный флакон объемом 50 мл наполняют 35 мл Соединения 1 для инъекции, что дает в результате 700 мг/флакон. Соединение 1 для инъекций дополнительно разбавляют и вводят путем внутривенной инфузии, как указано в клиническом протоколе. Во время приготовления раствора, содержащего Соединение 1, Соединение 1 для инъекций фильтруют с помощью фильтра 0,2 мкм перед инфузией для удаления любых присущих частиц.
[00225] В Таблице 1 описан состав Соединения 1 для инъекций, 20 мг/мл, для заполнения 35 мл флакона объемом 50 мл.
концентрация
QS=количество, достаточное
[00226] Для приготовления инъекционного состава Соединения 1 необходимо: 1. добавить хлорид натрия, фосфат калия (одноосновной и двухосновной) в сосуд, содержащий воду для инъекций; 2. довести рН до 8,0, используя 1М растворы соляной кислоты и/или 1М растворы гидроксида натрия; 3. медленно добавить в раствор лекарственный агент Соединения 1 и перемешать при температуре от 15°C до 30°C; 4. довести pH до 8,0, используя растворы соляной кислоты и/или растворы гидроксида натрия для растворения; 5. Q.S. водой для инъекций (развести как назначено врачом) и продолжать перемешивать при температуре от 15°C до 30°C; 6. асептически профильтровать через 2 мембранных фильтра х 0,2 мкм в стерильные флаконы на 50 мл с объемом заполнения 35 мл, закрытые хлорбутиловой пробкой. (Примечание: по завершении каждой изготовленной партии целостность фильтра проверяется с помощью теста на точку пузырька, и результат документируется в протоколе партии); и 7. проверить флаконы перед упаковкой и маркировкой.
Пример 2: Таблетки Соединения 1
[00227] Таблетки Соединения 1 изготавливают в виде белых таблеток с покрытием по 100 мг и 200 мг. В Таблице 2 и Таблице 3 указано содержание таблеток Соединения 1 в дозах 100 и 200 мг соответственно.
(HyQual) Растительный Источник
1 внутригранулярное 2 внегранулярное. 3 Avicel DG состоит из 75% микрокристаллической целлюлозы и 25% безводного двухосновного фосфата кальция. 4 Пленочное покрытие Opadry II AMB производится компанией ColorCon и состоит из поливинилового спирта, талька, диоксида титана, глицерилмонокаприлокапрата и лаурилсульфата натрия.
(HyQual) Растительный Источник
1 внутригранулярное 2 внегранулярное. 3 Avicel DG состоит из 75% микрокристаллической целлюлозы и 25% безводного двухосновного фосфата кальция. 4 Пленочное покрытие Opadry II AMB производится компанией ColorCon и состоит из поливинилового спирта, талька, диоксида титана, глицерилмонокаприлокапрата и лаурилсульфата натрия.
Пример 3: Открытое исследование фазы 2 для оценки безопасности и эффективности Соединения 1 при лечении пациентов с инвазивными плесневыми инфекциями, вызванными видами Aspergillus или редкими плесневыми грибками
[00228] Показания: Лечение пациентов с инвазивными плесневыми инфекциями (IMI), вызванными видами Aspergillus (spp.) или редкими плесневыми грибками.
[00229] Цели: Главной целью данного исследования является оценка безопасности и эффективности Соединения 1 для лечения взрослых пациентов в возрасте 18 лет и старше с инфекционными плесневыми инфекциями, вызванными Aspergillus spp. или инфекциями, вызванными редкими плесневыми грибки (например, Scedosporium spp., Fusarium spp. и Mucorales), имеющих ограниченные возможности противогрибкового лечения.
[00230] Второстепенными задачами данного исследования являются: оценка общего ответа в конце лечения (EOST); оценка параметров безопасности Соединения 1; оценка фармакокинетических (ФК) параметров Соединения 1.
[00231] Популяция: В это исследование будут включены пациенты мужского и женского пола в возрасте 18 лет и старше с подтвержденным диагнозом инвазивного аспергиллеза или инвазивной редкой плесневой инфекции. Пациенты имеют ограниченные варианты лечения или не будут иметь никаких вариантов лечения вследствие задокументированной/предполагаемой резистентности, противопоказаний, непереносимости или отсутствия клинического ответа на стандартную противогрибковую терапию медицинской помощи (SOC), рекомендованную соответствующими региональными/государственными органами.
[00233] Пациенты должны соответствовать всем следующим критериям для получения права участия в исследовании:
1. Мужчины или женщины, 18 лет и старше.
2. Пациенты с доказанной или вероятной инфекционной плесневой инфекцией (IMI), вызванной Aspergillus spp. Также могут быть включены пациенты с IMI, вызванным другими мицелиальными грибками (например, Scedosporium spp., Fusarium spp. и грибками Mucorales, такими как Mucor spp. или Rhizopus spp.). Доказанная или предполагаемая IMI идентифицируется в соответствии с критериями по измененной версии 2008 Revised Definitions of Invasive Fungal Disease from the European Organization for Research and Treatment of Cancer/Mycosis Study Group (EORTC/MSG) Consensus Group.
3. Пациенты имеют ограниченные варианты лечения или не имеют их вообще из-за задокументированной или ожидаемой резистентности, противопоказаний, непереносимости или отсутствия клинического ответа на противогрибковую терапию SOC, предписанную в соответствии с региональными/государственными инструкциями по лечению.
4. Пациенты, у которых, по мнению исследователя, существует потенциальное преимущество использования Соединения 1 по сравнению с текущим SOC (например, широкий спектр активности, активность против резистентных патогенов плесени, внутривенные и пероральные составы, благоприятный профиль DDI, благоприятный профиль безопасности для печени и почек, широкое распространение в тканях, включая головной мозг) и/или у которых противогрибковая терапия SOC сопряжена со значительным риском токсичности или неэффективности лечения (например, появление IMI во время противогрибковой профилактики, риск DDI, риск безопасности/токсичности, место инфекции недоступно для применения SOC).
5. Пациентки женского пола недетородного возраста должны соответствовать одному из следующих условий:
а. Хирургическая стерильность (гистерэктомия, двусторонняя перевязка маточных труб, двусторонняя сальпингэктомия и/или двусторонняя овариэктомия).
b. Постменопауза (аменорея более 12 месяцев без альтернативной медицинской причины).
6. Женщины детородного возраста (т. е. не находящиеся в постменопаузе или не стерилизованные хирургическим путем) должны иметь отрицательный результат теста мочи или сыворотки на беременность в течение 96 часов до начала лечения (т. е. до введения дозы в День 1). Участвующие женщины детородного возраста с партнерами-мужчинами и мужчины с женщинами-партнерами детородного возраста должны быть согласны использовать 2 формы контрацепции, одна из которых должна быть высокоэффективной, а другая - приемлемым барьерным методом (мужской или женский презерватив), на протяжении всего исследования и в течение 90 дней после последнего введения исследуемого препарата. К высокоэффективным методам контрацепции относятся:
а. Комбинированная (содержащая эстроген и прогестаген) гормональная контрацепция, связанная с ингибированием овуляции (п/о, интравагинальная или трансдермальная), прогестагенная гормональная контрацепция, связанная с ингибированием овуляции (п/о, инъекционная или имплантируемая), внутриматочная спираль или внутриматочная система, высвобождающая гормон контрацепции.
b. Двусторонняя трубная окклюзия или вазэктомия партнера.
c. Половое воздержание.
7. Пациенты мужского пола должны быть согласны воздерживаться от донорства спермы и использовать презервативы со спермицидом во время полового акта в период между скринингом и по крайней мере в течение 90 дней после введения последней дозы исследуемого препарата. Пациенты-мужчины должны убедиться, что небеременные партнеры-женщины детородного возраста согласны с требованиями к контрацепции, указанными в критерии включения 6.
8. Пациенты должны быть готовы участвовать в исследовании, дать письменное информированное согласие и соблюдать ограничения исследования; если допустимо местным законодательством, для пациентов, которые не способны дать информированное согласие, может быть получено письменное информированное согласие от законного уполномоченного представителя.
[00234] Критерии исключения
[00235] Пациенты, соответствующие любому из следующих критериев, не могут быть допущены к участию в исследовании:
1. Рефрактерное гематологическое злокачественное новообразование.
2. Хронический аспергиллез, аспергиллома или аллергический бронхолегочный аспергиллез.
3. Получение системной (перорально, внутривенно или ингаляционно) активной противогрибковой терапией против плесневых грибков в течение ≥120 часов непосредственно перед первоначальным введением дозы.
Примечание: Исключением является разрешенная противогрибковая профилактика, которая должна быть прекращена после начала лечения Соединением 1.
Кроме того, пациенты с инвазивной грибковой инфекцией, вызванной плесневыми грибками, с документально подтвержденной резистентностью или не подвергавшиеся SOC, могут получить лечение более чем за 120 часов до этого и по-прежнему иметь право на участие в исследовании. Включение этих пациентов должно быть обсуждено с контролирующим медицинским работником до регистрации, и предшествующее лечение в этом случае не должно превышать >168 часов.
4. Признаки значительной печеночной дисфункции, при наличии любого из следующих показателей:
а. Общий билирубин ≥3×верхний предел нормы (ULN), за исключением случаев изолированной гипербилирубинемии или документально подтвержденной болезни Жильбера.
б. Аланиновая трансаминаза или аспартатаминотрансфераза ≥5×ULN.
в. Тяжелая или умеренная печеночная недостаточность (по шкале Чайлд-Пью >6 баллов) в любое время в течение 2 недель до введения дозы.
5. Неврологические расстройства в анамнезе, включая ненормальные движения или судороги.
6. Пациент, получающий только паллиативную помощь.
7. Известная гиперчувствительность или другая серьезная реакция на Соединение 1 или любой ингредиент Соединения 1.
8. Пациентка кормит грудью и/или беременна или намеревается забеременеть в течение периода исследования.
9. Исследуемый препарат уже введен в течение 30 дней или 5 терминальных периодов полувыведения (в зависимости от того, что дольше) до введения дозы исследуемого препарата.
Примечание. Разрешено применение в ходе исследования утвержденных агентов для лечения основного заболевания.
10. Предыдущее участие в этом исследовании или любом предыдущем исследовании Соединения 1.
11. Одновременное применение лекарств, являющихся сильными индукторами) ферментов CYP (например, рифампин, карбамазепин, фенитоин, рифабутин, эфавиренц, невирапин, фенобарбитал, модафинил, энзалутамид, лекарства на основе зверобоя продырявленного.
12. Наличие любых других состояний или отклонений лабораторных показателей, которые, по мнению Исследователя или Спонсора, подвергают пациента неприемлемому риску для участия в исследовании или могут помешать оценкам, включенным в исследование.
[00236] Дизайн и продолжительность исследования:
[00237] Исследование представляет собой многоцентровое открытое несравнительное исследование фазы 2 для оценки безопасности и эффективности Соединения 1 для лечения IMIs, вызванных Aspergillus spp. или редкими плесневыми грибками (например, Scedosporium spp., Fusarium spp. и грибками Mucorales). Пациенты в возрасте 18 лет и старше будут проходить процедуры скрининга продолжительностью до 5 дней, после чего подходящие пациенты примут участие в лечении исследуемым препаратом периодом до 6 недель с последующим посещением через 4 недели после EOST и последующем телефонном опросе через 12 недель после дня 1 (в день 84). Общая продолжительность участия пациента в исследовании составит приблизительно 12 недель, включая последующий телефонный опрос, необходимый на 84-й день. по усмотрению исследователя и после консультации с медицинским наблюдателем, если позволяет ситуация. Пациенты, которым требуется лечение в течение более 6 недель, могут быть переведены на другую лицензированную противогрибковую терапию (OLAT) по усмотрению исследователя и после консультации с медицинским наблюдателем, если позволяет ситуация.
[00238] Это исследование будет состоять из одного лечебной направления, включающего введение загрузочной дозы 1000 мг Соединения 1, вводимой в течение 3 часов путем внутривенной инфузии два раза в день (BID) в течение первых 24 часов после начала первой инфузии. В дни 2 и 3 600 мг Соединения 1 будут вводить в течение 3 часов путем внутривенной инфузии один раз в день (QD). С 4-го дня до EOST внутривенная доза Соединения 1 остается равной 600 мг, вводимой в течение 3 часов путем внутривенной инфузии QD, или пациенты могут быть переведены на пероральное введение 800 мг Соединения 1 QD. Решение о переходе с внутривенного введения на Соединение 1 перорально принимается по усмотрению исследователя и может быть принято в любой день, начиная с 4-го дня. Пациенты могут быть переведены обратно на внутривенное лечение по мере необходимости, если они не могут переносить пероральные препараты. Пероральное Соединение 1 можно вводить амбулаторно.
[00239] Введение Соединения 1 следует продолжать в течение по меньшей мере 4 недель, но не более 6 недель (включая загрузочную дозу [День 1]). Через 4 недели, если исследователем документируется улучшение или исчезновение клинических признаков и симптомов, например, если последующая визуализация показывает улучшение (если применимо); или наблюдается микологический ответ (при возможности повторить взятие образца), исследователь может принять решение о прекращении введения дозы.
[00240] Лекарственные формы и способ введения:
[00241] В день исследования 1 (или в течение первых 24 часов, если дозирование начинается вечером) загрузочную дозу Соединения 1 в количестве 1000 мг будет введена в течении 3 часов посредством внутривенной инфузии два раза в день.
[00242] В дни исследования 2 и 3 поддерживающую дозу Соединения 1 в количестве 600 мг будут вводить в течение 3 часов путем внутривенной инфузии QD.
[00243] На 4-й день исследования до EOST поддерживающая доза Соединения 1 будет вводиться следующим образом:
600 мг Соединения 1 путем в/в инфузия QD в течение 3 часов, или
800 мг PO QD
[00244] Критерии для перехода с внутривенной дозы на пероральную:
[00245] Пациенты, которые завершили как минимум 3 дня внутривенного введения Соединения 1, могут иметь право на его замену пероральным приемом (PO) на 4-й день исследования и далее. Пациенты должны соответствовать всем следующим критериям для перехода с внутривенного (IV) на пероральное (PO) введение Соединения 1:
Пациент клинически стабилен по мнению исследователя.
Пациент способен глотать таблетки
[00246] Решение о переходе с внутривенного введения на пероральное введение Соединения 1 будет основываться на мнении исследователя и может быть принято в любой день, начиная с 4-го дня и далее. Пациенты могут быть переведены обратно на внутривенное лечение по мере необходимости, если они не могут переносить пероральные препараты. Пероральное введение Соединения 1 можно проводить амбулаторно.
[00247] Обоснование выбора дозы и схемы лечения:
[00248] В фармакокинетическом/фармакодинамическом (PK-PD) исследовании мышей с ослабленным иммунитетом инфицировали 6 штаммами A. fumigatus, включая штаммы дикого типа, устойчивые к азолу и устойчивые к эхинокандину. Группам животных вводили Соединение 1 при различных дозах фракционирования. Было установлено, что отношение AUC от 0 до 24 часов (AUC(0-24))/MEC представляет собой индекс PK-PD, который лучше всего коррелирует с противогрибковой эффективностью, оцениваемой по грибковой нагрузке (конидиальные эквиваленты [CEs], измеренные количественной ПЦР в реальном времени).) в гомогенатах легких. Конечные точки стаза и падения логарифма 1 определяли как количество A. fumigatus в CEs непосредственно перед введением Соединения 1 по сравнению с CEs в конечной точке оценки через 96 часов. Медианы общей AUC/MEC лекарственного средства, при которой достигаются конечные точки стаза и 1-логарифм уничтожения для каждого штамма A. fumigatus, составляют 2801,6 и 5258,2.
[00249] В 2017 и 2018 противогрибковая активность Соединения 1A в отношении Aspergillus spp. по данным эпиднадзора за клиническими изолятами показывают, что большинство (98,5%) изолятов Aspergillus имеют значения MEC от 0,008 до 0,03 мкг/мл. MEC у 90% пациентов (MEC90) для изолятов Aspergillus, которые, вероятно, будут обнаружены в исследуемой клинической популяции пациентов, составляет 0,03 мкг/мл.
[00250] В этом исследовании будет оцениваться однодозовый режим Соединения 1. В исследованиях фазы 1 на здоровых добровольцах этот режим дозирования в этом исследовании показал себя безопасным и хорошо переносимым. Хотя исследование допускает переход на пероральный прием уже на 4-й день, в следующей таблице описываются расчетные общие значения AUC (0-24) и PTA для стаза при CE при MEC90 с сопутствующим переходом на PO (пероральный прием) на 7-й день.
(День 1 [Исходный уровень])
Поддерживающая QD
(Дни 2-7)
Поддерживающая QD
(Дни 8-42)
(Дни 7/14/42)
(стаз [День 14])
AUC(0-24)=площадь под кривой зависимости концентрации в плазме от времени от точки 0 до точки 24 часа; BID=два раза в день; IV=внутривенно; MEC90=минимальная эффективная концентрация у 90% пациентов; PO=перорально ;PTA=вероятность достижения цели; QD=один раз в день.
[00251] Режим дозирования, использованный в этом исследовании, обеспечивает стабильную AUC ≥200 мкг×ч/мл, и является эффективным (определяется количеством колоний и улучшением выживаемости) у мышей с ослабленным иммунитетом с IPA. Кроме того, формальные исследования PK-PD продемонстрировали, что режим дозирования имеет благоприятный PTA для большинства изолятов, которые, как ожидается, будут обнаружены в этом исследовании.
[00252] Формальная PK-PD диагностика для инвазивных инфекций редких плесневых грибков (например, Fusarium spp., Scedosporium spp., Mucorales fungi) еще не проводилась. Тем не менее, животные с ослабленным иммунитетом, моделирующие редкие плесневые инфекции, демонстрируют улучшение при подсчете количества колоний и выживаемости при AUC, обеспечиваемых режимом дозирования, использованным в этом исследовании.
[00253] Конечные точки эффективности
[00254] Первичная: смертность от всех причин до дня 42. Примечание: смертность от всех причин будет представлять процент пациентов, которые умирают в период после введения первой дозы исследуемого лекарственного средства до дня 42 по любой причине.
[00255] Вторичная: общий клинический ответ в EOST
[00256] Исследовательская: смертность от всех причин до дня 84; изменение по сравнению с исходным уровнем галактоманнана; изменение по сравнению с исходным уровнем β-d-глюкана.
[00257] Параметры безопасности препарата:
[00258] Оценки безопасности будут включать физикальное обследование, определение основных показателей жизнедеятельности, клинические лабораторные оценки, ЭКГ в 12 отведениях, любые другие исследования и побочные нежелательные явления. Оценка побочных нежелательных явлений проводится при скрининге, исходном уровне, во время лечения исследуемым препаратом, во время EOST и через 2 и 4 недели после EOST или досрочного прекращения.
[00259] Результаты:
[00260] Популяция: первичное лечение получили в общей сложности 12 пациентов. Все эти пациенты имеют ограниченные варианты лечения, основанные на подтвержденной/предполагаемой резистентности, противопоказаниях, непереносимости или отсутствии клинического ответа на стандартную противогрибковую терапию (SoC), такую как лечение амфотерицином В; или же пациенты имеют серьезные основные заболевания и плохой прогноз вследствие основного заболевания и грибковой инфекции. У большинства таких пациентов имеется вероятный инвазивный аспергиллез.
[00261] Ответ: Четыре пациента завершили лечение в течение 42 дней. Четыре дополнительных пациента, не завершивших 42-дневного лечения, показали ранние признаки ответа. В целом лечение показало хороший ответ (на 42-й день или ранее) у 8 пациентов, при этом на 42-й день выжили семь из 12 пролеченных пациентов. Пять наблюдаемых смертей были вызваны: основным заболеванием/состоянием, таким как злокачественное новообразование или COPD (3 пациента); прогрессирование грибкового заболевания (1 пациент); и неизвестной причиной (1 пациент). Пациенты также продемонстрировали хороший общий ответ при клиническом и рентгенологическом наблюдении.
[00262] Программа расширенного доступа:
[00263] Популяция: В общей сложности 15 пациентов с опасными для жизни/серьезными грибковыми инфекциями получали лечение с небольшими модификациями. Эти пациенты либо не подвергались лечению ранее, либо им было отказано, либо они отказались от стандартной противогрибковой терапии (SoC), такой как амфотерицин B, и не имели других вариантов лечения. Из этих пациентов 12 имели инвазивную инфекцию Fusarium, а остальные пациенты имели инфекцию Aspergillus/Lichtheimia, инфекцию C. albicans или инфекцию L. prolificans. У всех пациентов был слабый/отсутствующий ответ на противогрибковые препараты SoC, такие как амфотерицин В, и/или развилась токсичность/непереносимость лечения. У этих пациентов наблюдался широкий спектр очагов грибковой инфекции в областях пазух, позвоночника, лодыжек, кожи, глаз, мозга или диссеминированные инфекции. У многих из этих пациентов также было диагностировано основное заболевание/состояние, такое как AML/ALL/MDS, SC /трансплантация паренхиматозных органов или травма.
[00264] Дополнения к режиму дозирования: Семь пациентов получили внутривенно дозу Соединения 1, и шесть из этих семи перешли на пероральные дозы. Восемь пациентов получали только пероральные дозы. Два пациента получили более высокую начальную дозу Соединения 1 (1000 мг перорально QD). Кроме того, восемь пациентов получали перорально Соединение 1 по 400 мг два раза в день, а не по 800 мг один раз в день.
[00265] Из-за характера популяции пациентов, у которых либо отсутствует, либо наблюдается слабый ответ на противогрибковые препараты SoC, такие как амфотерицин B, не было проведено периода вымывания SoC перед началом лечения: девять пациентов продолжали получать лечение амфотерицином B в течение определенного периода времени в комбинации с Соединением 1; из них семь из девяти пациентов прекратили прием амфотерицина В в течение 15 дней после начала приема Соединения 1; трое пациентов не смогли продолжать лечение амфотерицином В из-за проблем почечной токсичности.
[00266] Клинический ответ: Из четырнадцати пациентов, находившихся на лечении достаточно долго для оценки ответа, у двенадцати был отмечен либо благоприятный ответ, либо ответ с уменьшением признаков и симптомов инфекции, таких как уменьшение кожных поражений, и/или улучшение, подтвержденное рентгенологическим исследованием. У семи из 11 пациентов, прекративших лечение амфотерицином В, наблюдалось улучшение функции почек; в то время как почечная функция оставалась стабильной у четырех пациентов, не показавших явного улучшения почечной функции.
[00267] Соединение 1, как правило, хорошо переносилось пациентами с серьезными сопутствующими заболеваниями в течение длительного периода лечения.
[00268] Примеры и варианты осуществления, описанные в данном документе, предназначены исключительно для иллюстративных целей, и различные модификации или изменения, предложенные специалистам в данной области техники, должны быть включены в объем настоящей заявки и объема прилагаемой формулы изобретения.
Изобретение относится к области химии и фармацевтики, а именно к лечению грибковой инфекции. Раскрывается способ лечения грибковой инфекции, представляющей собой плесневую инфекцию, вызванную грибками Aspergillus spp., Scedosporium spp., Fusarium spp. или Mucorales или их комбинацией, включающий введение терапевтически эффективного количества Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата, при этом терапевтически эффективное количество Соединения 1 обеспечивает стабильную площадь за период 24 часа под кривой концентрация-время (AUC0-24) Соединения 1A у субъекта, превышающую 200 мкг⋅ч/мл Соединения 1A, а также введение Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата субъекту включает схему лечения, включающую ежедневное введение Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата в течение периода по меньшей мере 4 недели, причем схема лечения включает загрузочную дозу Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата и поддерживающую дозу Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата, где загрузочная доза Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата составляет 2000 мг и где поддерживающая доза включает однократное ежедневное введение от 600 до 1500 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата. Использование изобретения обеспечивает эффективное лечение грибковой инфекции, вызыванной грибками Aspergillus spp., Scedosporium spp., Fusarium spp. или Mucorales или их комбинацией. 31 з.п. ф-лы, 3 табл., 3 пр.
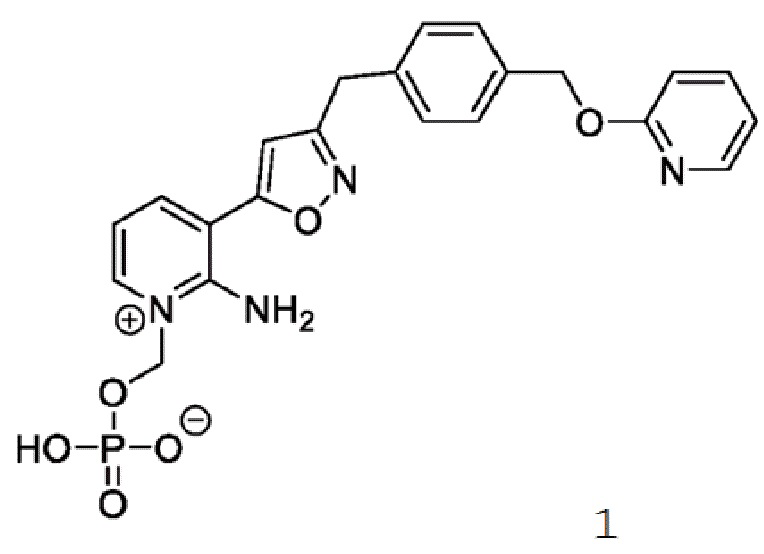
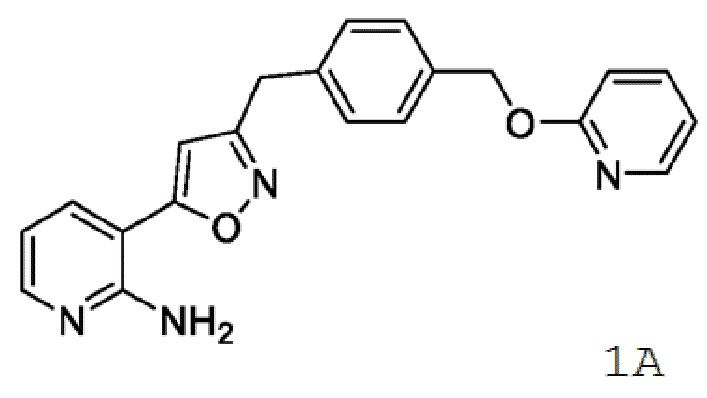
1. Способ лечения грибковой инфекции у субъекта, включающий введение субъекту с грибковой инфекцией терапевтически эффективного количества Соединения 1
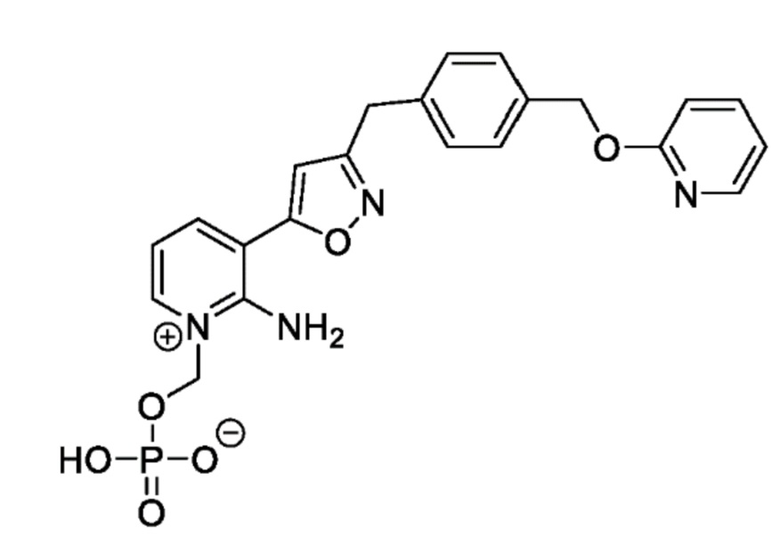 1
1
или его фармацевтически приемлемой соли, сольвата или гидрата;
где грибковая инфекция у субъекта представляет собой плесневую инфекцию, вызванную грибками Aspergillus spp., Scedosporium spp., Fusarium spp. или Mucorales или комбинацией таковых;
терапевтически эффективное количество Соединения 1 обеспечивает стабильную площадь за период 24 часа под кривой концентрация-время (AUC0-24) Соединения 1A у субъекта, превышающую 200 мкг⋅ч/мл Соединения 1A
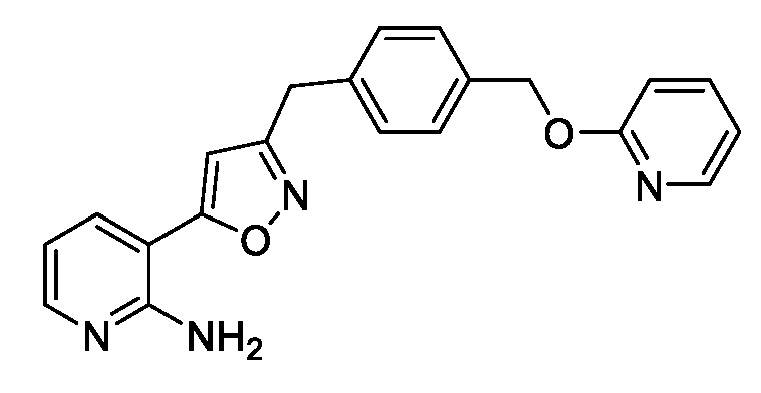 1А;
1А;
а также введение Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата субъекту включает схему лечения, включающую ежедневное введение Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата в течение периода по меньшей мере 4 недели,
причем схема лечения включает загрузочную дозу Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата и поддерживающую дозу Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата,
где загрузочная доза Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата составляет 2000 мг и
где поддерживающая доза включает однократное ежедневное введение от 600 до 1500 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата.
2. Способ по п.1, где плесневая инфекция вызвана Aspergillus spp.
3. Способ по п.2, где плесневая инфекция вызвана A. fumigatus.
4. Способ по п.3, где штамм A. fumigatus представляет собой мутантный штамм Cyp51 или Fks1.
5. Способ по п.4, где штамм A. fumigatus представляет собой AF293, AF41, EMFR S678P, F11628, AF72 или F14532.
6. Способ по любому из пп.1-5, где субъект имеет ослабленный иммунитет.
7. Способ по любому из пп.1-6, где субъект инфицирован ВИЧ/СПИДом или имеет рак.
8. Способ по любому из пп. 1-7, где:
у субъекта наблюдается острый миелоидный лейкоз, острый лимфоидный лейкоз, нейтропения, лимфопения или комбинация таковых; или
субъект проходит или прошел химиотерапевтическое лечение рака, лечение кортикостероидами, лечение ингибитором фактора некроза опухоли (TNF) или лечение комбинацией таковых; или же
субъект является реципиентом трансплантата органа, реципиентом трансплантата гемопоэтических стволовых клеток или имеет реакцию «трансплантат против хозяина»; или
наблюдается любая комбинация из вышеперечисленных.
9. Способ по любому из пп.1-8, где грибковая инфекция является поверхностной, локально инвазивной или диссеминированной по субъекту.
10. Способ по любому из пп.1-9, где грибковая инфекция представляет собой кожную инфекцию, легочную инфекцию, инфекцию носовых пазух, инфекцию центральной нервной системы, инфекцию головного мозга, инфекцию глаз, инфекцию сердца, инфекцию почек, инфекцию желудочно-кишечного тракта, инфекцию желудка, тазовую инфекцию, инфекцию крови или комбинацию таковых.
11. Способ по п.1, где загрузочную дозу Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят субъекту путем внутривенной (I.V.) инфузии.
12. Способ по п. 1, где загрузочная доза Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата включает введение двух доз Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата субъекту путем внутривенной (I.V.) инфузии.
13. Способ по п.12, где каждую загрузочную дозу Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят субъекту путем внутривенной (I.V.) инфузии в течение от 30 минут до 4 часов.
14. Способ по п.12 или 13, где каждая доза загрузочной дозы содержит 1000 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата.
15. Способ по любому из пп. 1-14, где загрузочная доза включает введение 1000 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата субъекту посредством внутривенной (I.V.) инфузии с последующим вторым введением 1000 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата субъекту путем внутривенной (I.V.) инфузии в течение 24 часов после первой инфузии.
16. Способ по любому из пп.1-15, где поддерживающую дозу вводят один раз в сутки начиная со второго дня лечения.
17. Способ по любому из пп.1-16, где поддерживающую дозу Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят путем внутривенной инфузии в течение периода от 30 минут до 4 часов начиная со второго, третьего или четвертого дня лечения.
18. Способ по любому из пп.1-16, где поддерживающая доза представляет собой от 600 до 1200 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата и указанную поддерживающую дозу вводят в течение периода от 30 минут до 4 часов путем внутривенной инфузии начиная со второго, третьего или четвертого дня лечения.
19. Способ по любому из пп. 1-16, где поддерживающую дозу Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят перорально субъекту начиная со второго, третьего или четвертого дня лечения.
20. Способ по любому из пп. 1-16, где поддерживающая доза представляет собой от 800 до 1000 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата и указанную поддерживающую дозу вводят перорально один раз в день субъекту начиная с второго, третьего или четвертого дня лечения.
21. Способ по любому из пп. 1-16, где начиная со второго, третьего или четвертого дня лечения:
а) от 600 до 900 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят путем внутривенной инфузии в течение периода от 30 минут до 3 часов; или
b) от 800 до 1000 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят перорально один раз в день.
22. Способ по любому из пп. 1-16, где
начиная со второго дня лечения от 600 до 900 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят путем внутривенной инфузии в течение периода от 30 минут до 3 часов; а также
начиная с четвертого дня лечения:
а) от 600 до 900 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят путем внутривенной инфузии в течение периода от 30 минут до 3 часов; или
b) от 800 до 1000 мг Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата вводят перорально один раз в день.
23. Способ по любому из пп. 1-22, где Соединение 1 или его фармацевтически приемлемую соль, сольват или гидрат вводят в комбинации с дополнительным терапевтическим агентом.
24. Способ по п.23, где дополнительный терапевтический агент представляет собой противогрибковый агент.
25. Способ по п.24, где противогрибковый агент представляет собой полиеновый противогрибковый агент, азольный противогрибковый агент, аллиламиновый противогрибковый агент или эхинокандиновый противогрибковый агент.
26. Способ по п.24, где противогрибковый агент представляет собой амфотерицин В, кандицидин, филипин, гамицин, натамицин, нистатин, римоцидин, бифоназол, бутоконазол, клотримазол, эконазол, фентиконазол, изавуконазол, кетоконазол, луликоназол, миконазол, омоконазол, оксиконазол, сертаконазол, сулконазол, тиоконазол, альбеконазол, эфинаконазол, эпоксиконазол, флуконазол, итраконазол, позаконазол, пропиконазол, равуконазол, терконазол, вориконазол, абафунгин, аморолфин, бутенафин, нафтифин или тербинафин, анидулафунгин, каспофунгин, микафунгин, резафунгин или фармацевтически приемлемую соль любого из вышеуказанных противогрибковых агентов.
27. Способ по п.1, где субъект имеет резистентность, противопоказание, непереносимость или отсутствие клинического ответа на стандартную противогрибковую терапию.
28. Способ по п.27, где стандартная противогрибковая терапия включает противогрибковый агент на основе азола, противогрибковый агент на основе аллиламина, противогрибковый агент на основе эхинокандина или противогрибковый агент на основе полиена.
29. Способ по п. 27, где стандартная противогрибковая терапия включает амфотерицин В, кандицидин, филипин, гамицин, натамицин, нистатин, римоцидин, бифоназол, бутоконазол, клотримазол, эконазол, фентиконазол, изавуконазол, кетоконазол, луликоназол, миконазол, омоконазол, оксиконазол, сертаконазол, сулконазол, тиоконазол, альбаконазол, эфинаконазол, эпоксиконазол, флуконазол, изавуконазол, итраконазол, позаконазол, пропиконазол, равуконазол, терконазол, вориконазол, абафунгин, аморолфин, бутенафин, нафтифин или тербинафин, анидулафунгин, каспофунгин, микафунгин, резафунгин или фармацевтически приемлемую соль любого из вышеуказанных противогрибковых агентов.
30. Способ по любому из пп. 1-29, где схема лечения включает ежедневное введение Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата в течение периода от 4 до 12 недель.
31. Способ по любому из пп. 1-30, где схема лечения включает ежедневное введение Соединения 1 или его фармацевтически приемлемой соли, сольвата или гидрата в течение периода от 4 до 6 недель.
32. Способ по любому из пп. 1-31, где схема лечения увеличивает шансы субъекта на выживание, снижает уровни галактоманнана у субъекта, снижает уровни β-d-глюкана у субъекта или обеспечивает комбинацию таковых.
| WO 2019113542 A1, 13.06.2019 | |||
| US 20090233883 A1, 17.09.2009 | |||
| US 20130288956 A1, 31.10.2013 | |||
| WEI, XIAOLEI et al | |||
| The molecular mechanism of azole resistance in Aspergillus fumigatus: from bedside to bench and back | |||
| Journal of microbiology, 2015, vol | |||
| Веникодробильный станок | 1921 |
|
SU53A1 |
| Огнетушитель | 0 |
|
SU91A1 |
| WONGKAMHLA, THANYARAK et al | |||
| A case report of Talaromyces marneffei | |||
Авторы
Даты
2023-10-24—Публикация
2021-03-02—Подача