Область техники, к которой относится изобретение
[0001]
Настоящее изобретение относится к комбинированной терапии рака с использованием соединения ацилтиомочевины или его фармацевтически приемлемой соли.
Предпосылки создания изобретения
[0002]
Абиратерон ацетат представляет собой соединение, которое быстро гидролизуется до абиратерона in vivo и необратимо и селективно ингибирует активность 17α-гидроксилазы/C17,20-лиазы (CYP17), которая представляет собой андроген-синтезирующий фермент. Согласно сообщениям, абиратерон демонстрирует противоопухолевый эффект против кастрационно-резистентного рака предстательной железы посредством ингибирования синтеза андрогена, в частности, в мужских половых железах, надпочечниках и опухолевой ткани (Непатентная литература 1 и 2), а также сообщалось, что он демонстрирует клиническую эффективность также против рака предстательной железы, имеющего прогностический фактор высокого риска без применения эндокринной терапии (Непатентная литература 3), и адаптационными болезнями являются кастрационно-резистентный рак предстательной железы и рак предстательной железы, имеющий прогностический фактор высокого риска без эндокринной терапии.
[0003]
С другой стороны, группой авторов настоящего изобретения было обнаружено, что соединение ацилтиомочевины, имеющее специфическую структуру, или его фармацевтически приемлемая соль обладает c-Met-ингибирующим действием (Патентная литература 1), и, как сообщалось, является эффективным при раке легкого с метастазами в кости (Непатентная литература 4). Кроме того, сообщалось о противоопухолевом эффекте, обеспечиваемом комбинацией с различными противоопухолевыми средствами (Патентная литература 2). Кроме того, сообщалось, что соединение ацилтиомочевины или его фармацевтически приемлемая соль также эффективны против остеопороза (Патентная литература 3) и фиброза (Патентная литература 4). Кроме того, есть сообщения о кристаллах соединения ацилтиомочевины или его фармацевтически приемлемой соли (Патентная литература 5) и фармацевтической композиции, включающей соединение ацилтиомочевины или его фармацевтически приемлемую соль и гидроксипропил-β-циклодекстрин (Патентная литература 6).
[0004]
Кроме того, недавно были осуществлены клинические испытания соединений ацилтиомочевины или их фармацевтически приемлемых солей у пациентов с кастрационно-резистентным раком предстательной железы (Непатентная литература 5 и 6). Кроме того, сообщалось об эффекте применения комбинации кабозантиниба, обладающего c-Met-ингибирующим действием, и абиратерона при таком типе рака (Патентная литература 7).
Перечень цитируемых документов
Патентная литература
[0005]
[Патентная литература 1] Международная публикация № WO 2009/125597
[Патентная литература 2] Международная публикация № WO 2013/100014
[Патентная литература 3] Международная публикация № WO 2015/046484
[Патентная литература 4] Международная публикация № WO 2016/208744
[Патентная литература 5] Международная публикация № WO 2016/175305
[Патентная литература 6] Международная публикация № WO 2018/151177
[Патентная литература 7] Международная публикация № WO 2014/165779
Непатентная литература
[0006]
[Непатентная литература 1] N. Engl. J. Med., 2011, 364: 1995-2005
[Непатентная литература 2] N. Engl. J. Med., 2013, 368: 138-48
[Непатентная литература 3] Lancet Oncol., 2018, 19: 194-206
[Непатентная литература 4] H. Fujita, et al., PLoS ONE, volume 11(10), e0164830, 2016
[Непатентная литература 5] N. Matsubara, et al., Annals of Oncology, Volume 28, Issue suppl. 5, 1 September, 2017
[Непатентная литература 6]
https://rctportal.niph.go.jp/s/detail/jp?trial_id=JapicCTI-163448
Сущность изобретения
Задачи, решаемые настоящим изобретением
[0007]
Целью настоящего изобретения является обеспечение комбинированной терапии рака с использованием селективного ингибитора c-Met, соединения ацилтиомочевины или его фармацевтически приемлемой соли, и демонстрация отличного противоопухолевого эффекта с меньшими побочными эффектами.
Средства решения задач
[0008]
Автор настоящего изобретения обнаружил, что противоопухолевая терапия с использованием совместного введения соединения ацилтиомочевины, имеющего специфическую структуру, или его фармацевтически приемлемой соли и абиратерона или его производного демонстрирует отличный противоопухолевый эффект и усиливающийся противоопухолевый эффект без усиления побочных эффектов, и было создано настоящее изобретение.
[0009]
Настоящее изобретение обеспечивает следующее [1]-[16]:
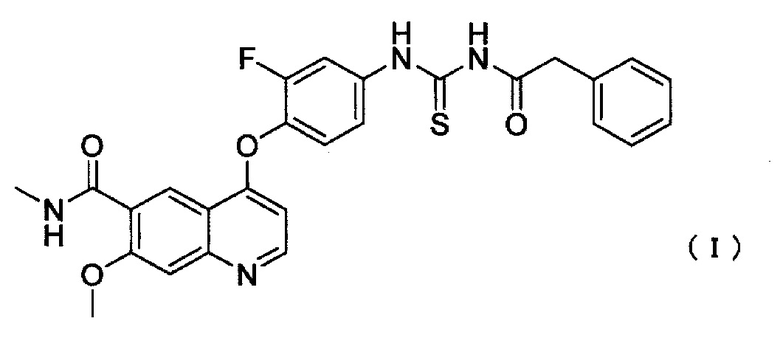
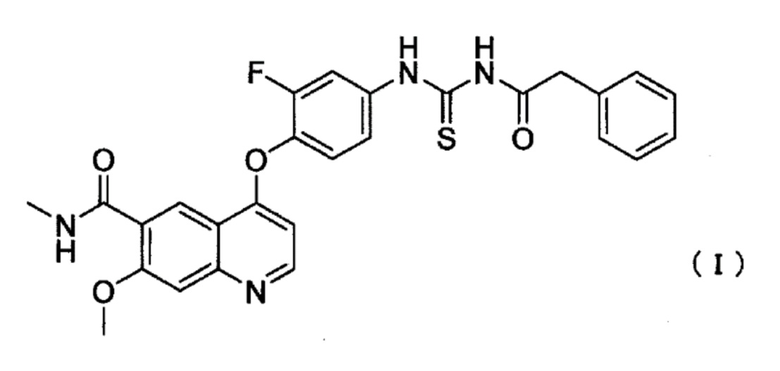
[1] Противоопухолевое средство, содержащее соединение, представленное следующей формулой (I), или его фармацевтически приемлемую соль, вводимое в комбинации с абиратероном или его производным;
[2] Противоопухолевое средство в соответствии с аспектом [1], где фармацевтически приемлемая соль представляет собой метансульфонатную соль;
[3] Противоопухолевое средство в соответствии с аспектом [1] или [2], где абиратерон или его производное представляет собой абиратерон ацетат;
[4] Противоопухолевое средство в соответствии с аспектами [1]-[3], вводимое человеку;
[5] Противоопухолевое средство в соответствии с любым из аспектов [1]-[4] для лечения кастрационно-резистентного рака предстательной железы;
[6] Противоопухолевое средство в соответствии с любым из аспектов [1]-[5] для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости;
[7] Противоопухолевое средство в соответствии с любым из аспектов [1]-[6], где соединение, представленное формулой (I), или его фармацевтически приемлемую соль вводят один раз в день в количестве от 200 мг до 400 мг в расчете на свободную форму соединения I;
[8] Противоопухолевое средство в соответствии с любым из аспектов [1]-[6], где соединение, представленное формулой (I), или его фармацевтически приемлемую соль вводят один раз в день в количестве 300 мг в расчете на свободную форму соединения I;
[9] Противоопухолевое средство в соответствии с любым из аспектов [1]-[8], где соединение, представленное формулой (I), или его фармацевтически приемлемую соль вводят в течение 5 дней, а затем делают перерыв в применении препарата в течение 2 дней;
[10] Средство, усиливающее противоопухолевый эффект абиратерона или его производного, включающее соединение, представленное следующей формулой (I), или его фармацевтически приемлемую соль в качестве активного ингредиента;
[11] Способ для лечения опухоли, включающий введение пациенту терапевтически эффективных количеств соединения, представленного следующей формулой (I), или его фармацевтически приемлемой соли и абиратерона или его производного;
[12] Соединение, представленное следующей формулой (I), или его фармацевтически приемлемая соль для применения в комбинации с абиратероном или его производным в лечении опухоли;
[13] Применение соединения, представленного следующей формулой (I), или его фармацевтически приемлемой соли для получения противоопухолевого средства для введения в комбинации с абиратероном или его производным;
[14] Способ для усиления противоопухолевого эффекта абиратерона или его производного, включающий введение пациенту терапевтически эффективного количества соединения, представленного следующей формулой (I), или его фармацевтически приемлемой соли;
[15] Соединение, представленное следующей формулой (I), или его фармацевтически приемлемая соль для усиления противоопухолевого эффекта абиратерона или его производного; и
[16] Применение соединения, представленного следующей формулой (I), или его фармацевтически приемлемой соли для получения усиливающего противоопухолевый эффект средства для усиления противоопухолевого эффекта абиратерона или его производного.
[0010]
Краткое описание чертежей
[0011]
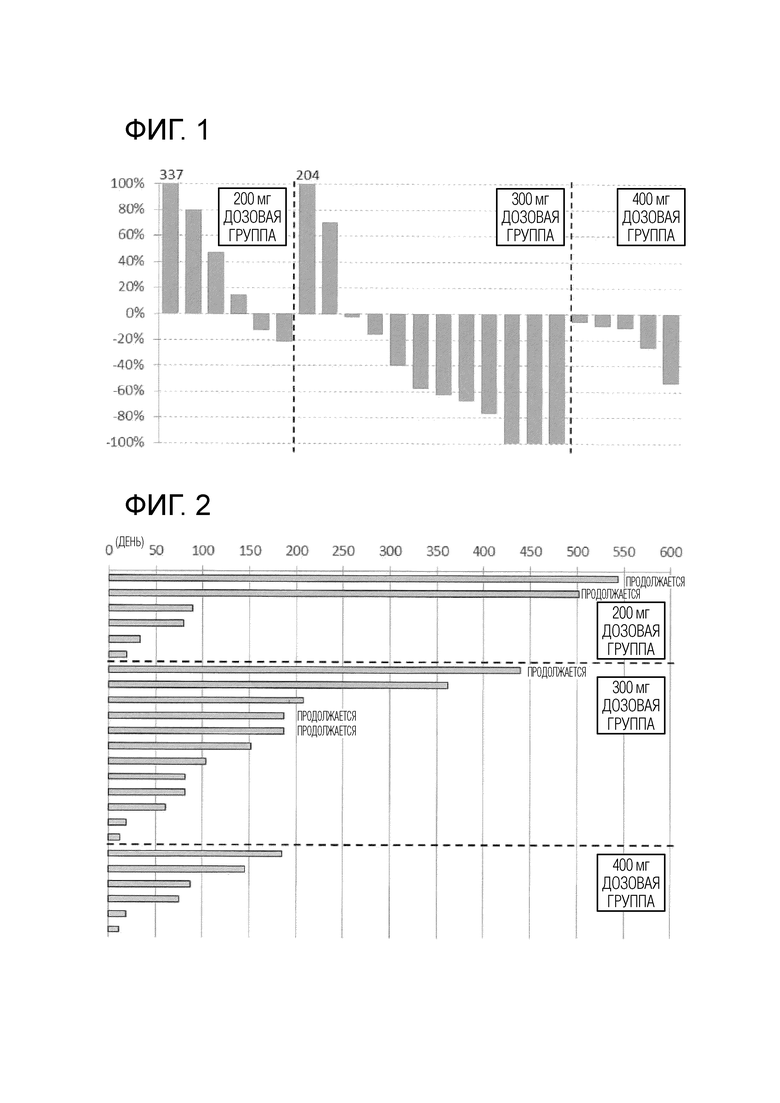
[Фиг. 1] Фиг. 1 показывает изменения BSI значения при наилучшем ответе в каждой дозовой группе введения соединения I в комбинации с абиратероном. Вертикальная ось показывает BSI, когда был продемонстрирован наивысший эффект, из значений BSI, измеренных во время введения соединения I и в пределах 3 месяцев после прекращения введения, на основании метастазов в кости в тесте перед началом введения в каждой дозовой группе.
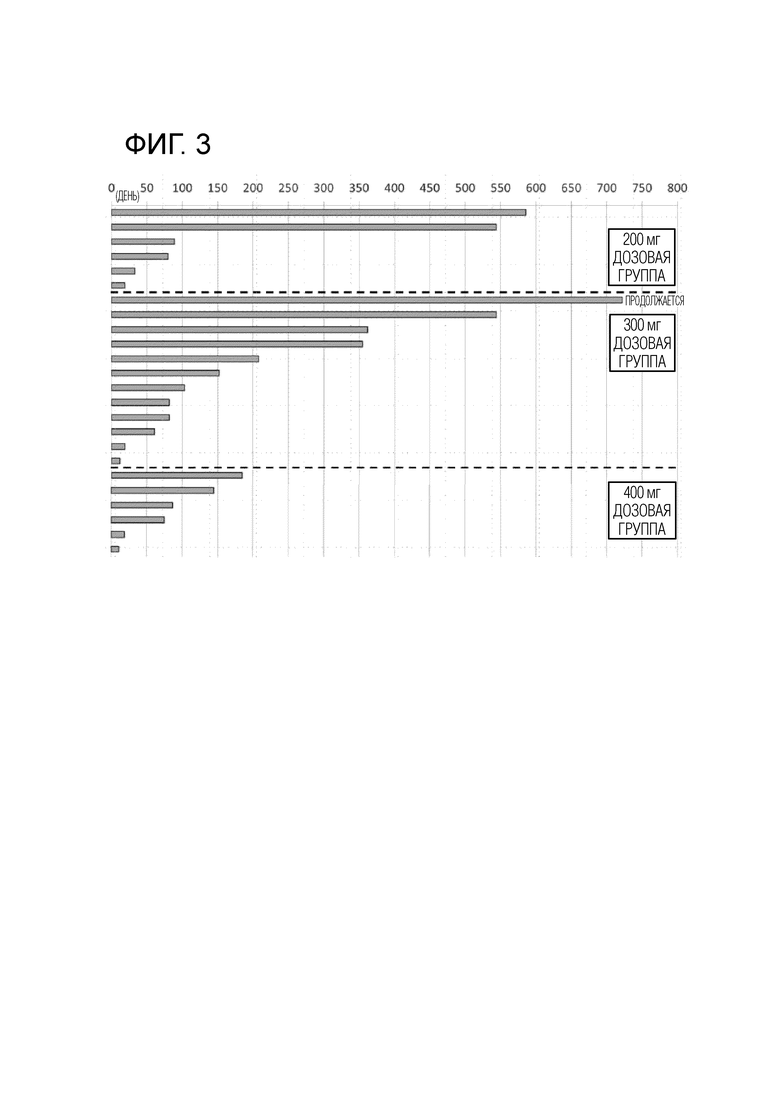
[Фиг. 2] Фиг. 2 показывает период введения соединения I, используемого в комбинации с абиратероном, для каждой дозовой группы. Горизонтальная ось показывает количество дней периода введения во всех случаях (n=24).
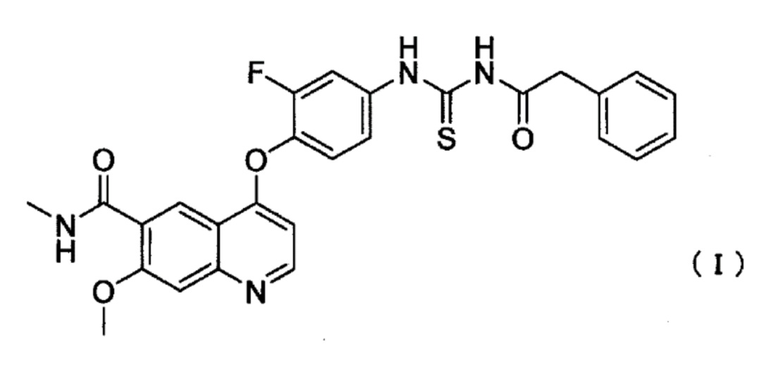
[Фиг. 3] Фиг. 3 показывает период введения соединения I, используемого в комбинации с абиратероном, для каждой дозовой группы. Горизонтальная ось показывает количество дней периода введения во всех случаях (n=24).
Подробное описание изобретения
[0012]
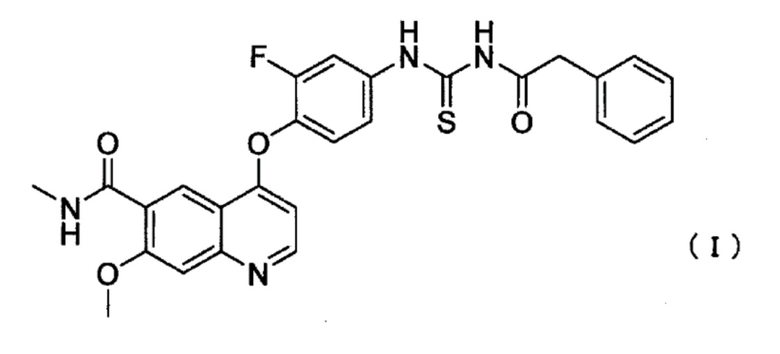
Соединение ацилтиомочевины для применения в настоящем изобретении представляет собой 4-(2-фтор-4-(3-(2-фенилацетил)тиоуреидо)фенокси)-7-метокси-N-метилхинолин-6-карбоксамид (далее в настоящем описании указано как соединение I), представленный следующей формулой (I):
[0013]
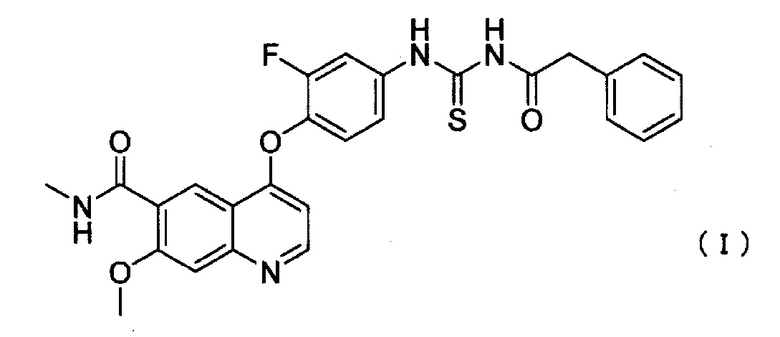
[0014]
и является известным соединением в качестве ингибитора c-Met.
[0015]
Соединение I представляет собой одно из соединений ацилтиомочевины, описанных в Международной публикации № WO 2009/125597 и Международной публикации № WO 2016/175305, и может быть синтезировано в соответствии с описанными в них способами.
[0016]
Соединение I получают в виде белого твердого вещества, и оно может присутствовать в виде кристалла. Соединение I можно вводить в свободной форме или в виде фармацевтически приемлемой соли.
[0017]
Примеры фармацевтически приемлемой соли соединения I включают соли с неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота, иодистоводородная кислота, серная кислота, азотная кислота и фосфорная кислота, и с органическими кислотами, такими как муравьиная кислота, уксусная кислота, пропионовая кислота, щавелевая кислота, малоновая кислота, янтарная кислота, аскорбиновая кислота, изоаскорбиновая кислота, миндальная кислота, фумаровая кислота, аспарагиновая кислота, малеиновая кислота, молочная кислота, яблочная кислота, гиппуровая кислота, глутаровая кислота, адипиновая кислота, лимонная кислота, винная кислота, угольная кислота, пикриновая кислота, метансульфоновая кислота (мезиловая кислота), п-толуолсульфоновая кислота (п-тозиловая кислота) и глутаминовая кислота; и соли с щелочными металлами, щелочно-земельными металлами и другими основаниями, такие как калиевая соль, натриевая соль, кальциевая соль, аммониевая соль, метиламмониевая соль и диметиламмониевая соль.
Из этих солей примером соли, которую можно использовать подходящим образом, является метансульфонатная соль, и более предпочтительно метансульфонатная соль может представлять собой соль метансульфоновой кислоты и соединения I при молярном соотношении 1:1. Метансульфонатная соль может быть в форме монокристалла, в виде смеси двух или более кристаллических полиморфизмов, в аморфной форме или в виде смеси вышеперечисленных.
[0018]
Кроме того, абиратерон, химическое название которого 17-(пиридин-3-ил)андроста-5,16-диен-3β-ол, имеет следующую структуру:
[0019]
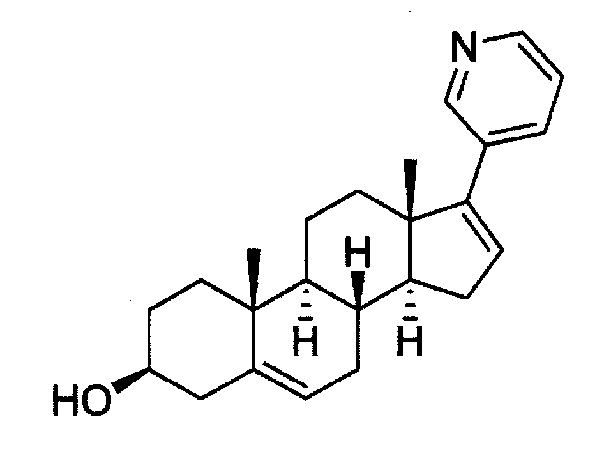
[0020]
Абиратерон обладает CYP17A1-ингибирующим действием, и его метаболический предшественник, ацетатный эфир, представленный следующей формулой (17-(пиридин-3-ил)андроста-5,16-диен-3β-ил ацетат: абиратерон ацетат), поставляется на рынок как терапевтическое средство для лечения рака предстательной железы (торговое название: Zytiga).
[0021]
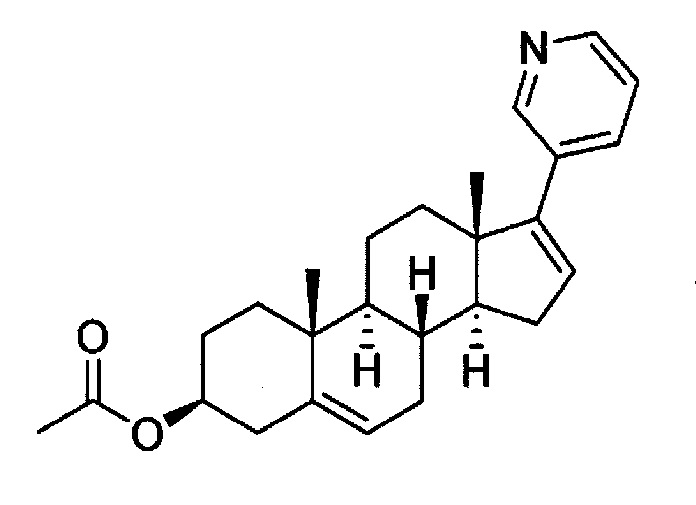
[0022]
В настоящем изобретении примеры абиратерона или его производного, которые можно вводить в комбинации с соединением I или его фармацевтически приемлемой солью, включают, помимо абиратерона, метаболические предшественники абиратерона в виде производных абиратерона, т.е. сложных эфиров различных кислот, таких как абиратерон ацетат, абиратерон формиат, абиратерон пропионат, абиратерон бутаноат, абиратерон 2-метилпропионат, абиратерон фосфат, абиратерон сульфат, абиратерон метансульфонат, глицин абиратерон и аланин абиратерон; различных алкиловых эфиров, таких как метил абиратерон (3-[(3β)-3-метоксиандроста-5,16-диен-17-ил]пиридин), метоксиметил абиратерон, бензил абиратерон, тетрагидропиран абиратерон и тритил абиратерон; различных карбонатов, таких как этоксикарбонил абиратерон и пропоксикарбонил; и различных карбаматов, таких как метиламинокарбонил абиратерон. Предпочтительно производное представляет собой абиратерон ацетат.
[0023]
Как показано в Примерах, описанных ниже, метансульфонатная соль соединения I демонстрирует отличный эффект подавления метастазов в кости, не вызывая серьезных побочных эффектов при введении в комбинации с абиратерона ацетатом пациенту с кастрационно-резистентным раком предстательной железы.
Соответственно, соединение I или его фармацевтически приемлемую соль можно использовать, в случае введения в комбинации с абиратероном или его производным, в качестве противоопухолевого средства, проявляющего отличный противоопухолевый эффект, предпочтительно эффект подавления рецидива или метастазов опухоли, более предпочтительно в качестве противоопухолевого средства для профилактики или лечения кастрационно-резистентного рака предстательной железы, ассоциированного с метастазами в кости, или в качестве ингибитора кастрационно-резистентного рака предстательной железы с метастазами в кости.
Кроме того, соединение I или его фармацевтически приемлемую соль можно использовать в качестве усиливающего противоопухолевый эффект средства, которое усиливает противоопухолевый эффект абиратерона или его производного, в частности, противоопухолевый эффект на кастрационно-резистентный рак предстательной железы, ассоциированный с метастазами в кости. Кроме того, абиратерон или его производное можно использовать в качестве усиливающего противоопухолевый эффект средства, которое усиливает противоопухолевый эффект соединения I или его фармацевтически приемлемой соли, в частности, противоопухолевый эффект против кастрационно-резистентного рака предстательной железы, ассоциированного с метастазами в кости.
[0024]
Что касается применения противоопухолевого средства или усиливающего противоопухолевый эффект средства по настоящему изобретению, злокачественная опухоль, которая является целью лечения и усиления противоопухолевого эффекта, представляет собой, например, эпителиальный рак (рак дыхательной системы, рак пищеварительной системы, рак репродуктивной системы, рак секреторной системы и т.д.), саркому, опухоль гематопоэтических клеток (В-клеточная лимфома, хронический лимфоцитарный лейкоз, периферическая Т-клеточная лимфома, миелодиспластический синдром, острый миелоидный лейкоз, острый лимфоцитарный лейкоз и т.д.), опухоль центральной нервной системы, опухоль периферической нервной системы или множественную миелому. Тип рака в качестве мишени предпочтительно представляет собой эпителиальный рак, и более предпочтительно рак репродуктивной системы
Кроме того, тип органа, в котором развивается опухоль, конкретно не ограничивается, и примеры опухоли включают рак головы и шеи, такой как рак околоушной железы, рак пищевода, рак желудка, рак двенадцатиперстной кишки, рак толстой кишки, рак прямой кишки, рак печени, рак желчного пузыря/желчного протока, рак желчных путей, рак поджелудочной железы, рак легких, рак молочной железы, рак яичников, рак фаллопиевых труб, рак шейки матки, рак эндометрия, рак почек, рак надпочечников, рак мочевого пузыря, рак предстательной железы, уротелиальный рак, тестикулярную опухоль, саркому кости/мягких тканей, гематологический рак, множественную миелому, рак кожи, опухоль головного мозга и мезотелиому. Опухоль, которая является целью лечения, предпочтительно представляет собой рак предстательной железы, и более предпочтительно кастрационно-резистентный рак предстательной железы.
[0025]
Противоопухолевое действие противоопухолевого средства по настоящему изобретению охватывает ингибирование роста опухоли, замедление роста опухоли, регрессию опухоли и уменьшение объема опухоли, а также супрессию рецидива и метастазов опухоли.
Место метастазирования рака различается в зависимости от первичного поражения и характеристик рака. В качестве первичного рака в настоящем изобретении из вышеперечисленных типов рака указан рак предстательной железы, более предпочтительно кастрационно-резистентный рак предстательной железы. Кроме того, в таком случае местом метастазирования из первичной области в основном является кость, и противоопухолевое средство по настоящему изобретению особенно полезно для подавления метастазов в кости при кастрационно-резистентном раке предстательной железы. При лечении кастрационно-резистентного рака предстательной железы, сам рак предстательной железы, который является первичным поражением, может быть удален кастрацией, или кастрированное состояние может поддерживаться с использованием средства. В таком случае противоопухолевый эффект против кастрационно-резистентного рака предстательной железы оценивается по противоопухолевому эффекту в месте метастазирования.
Соответственно, настоящее изобретение относится к ингибитору метастазирования опухоли, включающему соединение I или фармацевтически приемлемую соль, которое отличается тем, что его используют в комбинации с производным абиратерона, предпочтительно к ингибитору метастазирования опухоли в кость, более предпочтительно к ингибитору метастазирования рака предстательной железы в кость, и более предпочтительно к ингибитору метастазирования кастрационно-резистентного рака предстательной железы в кость.
Кроме того, усиливающее противоопухолевый эффект средство в соответствии с настоящим изобретением усиливает, когда одно средство имеет противоопухолевый эффект, противоопухолевое действие другого средства.
Когда соединение, представленное формулой (I), или его фармацевтически приемлемую соль по настоящему изобретению вводят в комбинации с абиратероном или его производным, можно также вводить еще одно противоопухолевое средство. Такое дополнительное противоопухолевое средство конкретно не ограничивается, при условии, что оно обладает противоопухолеым действием.
[0026]
Соединение I или его фармацевтически приемлемая соль представлены в виде препарата (фармацевтической композиции), включающего их в качестве активных ингредиентов и дополнительно соответствующим образом смешанного с фармацевтическим носителем. В качестве используемого для этого фармацевтического носителя используются различные органические или неорганические носители, которые обычно используются в качестве веществ для получения препаратов. Например, эксципиент, связующее, разрыхлитель, лубрикант и краситель могут быть смешаны в твердом препарате. Кроме того, агент, способствующий растворению, суспендирующий агент, изотонический агент, буферный агент и успокаивающее средство могут быть смешаны в жидком препарате. При необходимости можно использовать добавки для формулирования композиций, такие как консервант, антиоксидант, подсластитель и стабилизатор.
[0027]
Для получения перорального твердого препарата сначала к соединению I или его фармацевтически приемлемой соли добавляют эксципиент и, если необходимо, например, еще один эксципиент, связующее, разрыхлитель, смазывающее вещество, краситель и корригент. Затем с использованием обычных способов можно получить таблетки, таблетки с покрытием, гранулы, порошки и капсулы. Для получения препарата для инъекций сначала к соединению добавляют регулятор pH, буферный агент, стабилизатор, изотонический агент, местный анестетик и т.д. Затем можно получить препараты для подкожных, внутримышечных и внутривенных инъекций обычными способами. Соединение I или его фармацевтически приемлемую соль предпочтительно вводят перорально, поскольку оно имеет превосходную абсорбционную способность при пероральном введении.
[0028]
В настоящем изобретении абиратерон или его производное, который вводят в комбинации с соединением I или его фармацевтически приемлемой солью, зависит от типа каждого средства, и его вводят, например, путем внутривенного введения, интраперитонеального введения, с использованием суппозитория или путем перорального введения, предпочтительно путем перорального введения.
Кроме того, абиратерон или его производное и соединение I или его фармацевтически приемлемая соль могут быть представлены отдельно в соответствующих препаратах или представлены в виде комбинированного средства. Кроме того, абиратерон или его производное и соединение I или его фармацевтически приемлемая соль могут быть представлены в виде набора, включающего их в виде отдельных препаратов, состоящих из них только.
[0029]
В настоящем изобретении доза соединения I или его фармацевтически приемлемой соли конкретно не ограничивается и может быть подходящим образом установлена на основании рака, побочных эффектов и т.д. Доза может составлять, в расчете на свободную форму соединения I, 25 мг или больше, предпочтительно от 50 мг до 1000 мг, более предпочтительно от 150 мг до 450 мг, еще более предпочтительно от 200 мг до 400 мг, еще более предпочтительно от 250 мг до 350 мг и особенно предпочтительно 300 мг.
[0030]
Кроме того, в другом варианте осуществления, доза соединения I или его фармацевтически приемлемой соли представляет собой, в расчете на свободную форму соединения I, дозу, выбранную из группы, состоящей из 100 мг, 200 мг, 250 мг, 300 мг, 350 мг, 400 мг, 450 мг, 500 мг, 550 мг, 600 мг, 650 мг и 700 мг, предпочтительно дозу, выбранную из группы, состоящей из 200 мг, 250 мг, 300 мг, 350 мг, 400 мг, 450 мг и 500 мг, и более предпочтительно дозу, выбранную из группы, состоящей из 200 мг, 300 мг и 400 мг.
[0031]
Кроме того, в настоящем изобретении соединение I или его фармацевтически приемлемую соль используют в дозе, величина которой 0,1-1,0-кратна рекомендованной дозе (RD), когда соединение I или его фармацевтически приемлемую соль вводят отдельно, и предпочтительно используют в дозе, величина которой 0,3-0,7-кратна, более предпочтительно 0,4-0,7-кратна и более предпочтительно 0,4-0,5-кратна RD.
[0032]
В настоящем изобретении соединение I или его фармацевтически приемлемую соль можно вводить один раз в день.
Кроме того, в настоящем изобретении соединение I или его фармацевтически приемлемую соль можно вводить каждый день, или может быть предусмотрен перерыв в применении препарата на основании тира рака, побочных эффектов и т.д., в зависимости от обстоятельств. Предпочтительно соединение I или его фармацевтически приемлемую соль вводят в течение 5 дней, а затем делают перерыв в применении препарата в течение 2 дней.
[0033]
В настоящем изобретении доза абиратерона или его производного конкретно не ограничивается и может быть подходящим образом установлена на основании типа рака, побочных эффектов и т.д. Доза может составлять 200 мг или больше, предпочтительно от 400 мг до 1600 мг, более предпочтительно от 700 мг до 1300 мг и особенно предпочтительно от 900 мг до 1100 мг.
Кроме того, когда абиратерон или его производное представляет собой абиратерона ацетат, устанавливают такую же дозу, которая указана выше. Кроме того, в другом варианте осуществления, доза абиратерона ацетата может представлять собой дозу, выбранную из группы, состоящей из 250 мг, 500 мг, 750 мг, 1000 мг, 1250 мг и 1500 мг, предпочтительно дозу, выбранную из группы, состоящей из 250 мг, 500 мг, 750 мг и 1000 мг, более предпочтительно дозу, выбранную из группы, состоящей из 500 мг, 750 мг и 1000 мг, более предпочтительно дозу, выбранную из группы, состоящей из 750 мг и 1000 мг, и особенно предпочтительно 1000 мг.
[0034]
В настоящем изобретении абиратерон или его производное можно вводить один раз или два или больше раз в день. Количество введений в день может быть от 1 до 3, и предпочтительно один раз в день.
Кроме того, в настоящем изобретении абиратерон или его производное можно вводить каждый день, или может быть предусмотрен перерыв в применении препарата на основании типа рака, побочных эффектов и т.д., в зависимости от обстоятельств. Предпочтительно абиратерон или его производное вводят каждый день.
[0035]
Молярное соотношение вводимого соединения I или его фармацевтически приемлемой соли в день может составлять от 0,1 до 1,0 молей свободной формы соединения I в расчете на 1 моль абиратерона или его производного, и предпочтительно составляет от 0,15 до 0,30 моль, более предпочтительно от 0,20 до 0,25 моль и более предпочтительно 0,23 моль.
[0036]
В настоящем изобретении числовые значения, указанные, например, в отношении доз абиратерона или его производного и соединения I или его фармацевтически приемлемой соли, и соотношения между этими средствами, как предполагается, включают значения в пределах ± 20% или ± 10% отклонения от заявленных значений. Специалистам в данной области должно быть понятно, что дозы или соотношения в таких диапазонах могут вызывать эффекты, аналогичные тем, когда дозы или соотношения являются такими, которые указаны выше.
[0037]
Вид животных, которым можно вводить соединение I или его фармацевтически приемлемую соль, может представлять собой млекопитающего, и предпочтительно включает, помимо млекопитающего в качестве объекта лечения, млекопитающего, которое обычно используют в экспериментах на животных для определения фармакокинетики, фармакологической эффективности и т.д., или человека, которому необходимо введение в клиническом испытании, в частности человека, крысу, мышь, кролика и собаку, и предпочтительно человека.
[0038]
В настоящем изобретении, независимо от истории лечения рака до начала введения соединения I или его фармацевтически приемлемой соли и абиратерона или его производного, может достигаться противоопухолевый эффект и лечение или предотвращение метастазирования опухоли. История лечения может быть такой, которая установлена в виде стандартного лечения, или может представлять собой лечение в соответствии с индивидуальными симптомами. Известно, что система стандартного лечения варьируется в зависимости от рака.
[0039]
Стандартной фармакотерапией рака предстательной железы является эндокринная терапия (гормональная терапия), а эндокринная терапия, впервые полученная после поражения раком предстательной железы, называется первичной эндокринной терапией. Если после первичной эндокринной терапии наблюдается рецидив простатспецифического антигена (PSA), обострение метастатического поражения или появление нового поражения, это диагностируется как кастрационно-резистентный рак предстательной железы. Стандартным лечением в этом случае является введение доцетаксела, абиратерона ацетата, энзалутамида (торговое название: XTANDI), кабазитаксела (торговое название: JEVTANA), радия-223 (торговое название: Xofigo) и т.п. Настоящее изобретение также может применяться к кастрационно-резистентному раку предстательной железы до и после лечения доцетакселом, независимо от того, осуществляется или нет лечение энзалутамидом или радием-223.
[0040]
Как описано выше, настоящее изобретение относится к противоопухолевому средству, включающему соединение I или его фармацевтически приемлемую соль, отличающемуся тем, что его вводят в комбинации с абиратероном или его производным, и предпочтительно к противоопухолевому средству, включающему соединение I или его фармацевтически приемлемую соль, отличающемуся тем, что его вводят в комбинации с абиратерона ацетатом.
Более предпочтительно, изобретение относится к противоопухолевому средству, включающему соединение I или его фармацевтически приемлемую соль, отличающемуся тем, что его вводят человеку в комбинации с абиратерона ацетатом.
Более предпочтительно, изобретение относится к противоопухолевому средству для лечения кастрационно-резистентного рака предстательной железы, включающему соединение I или его фармацевтически приемлемую соль, отличающемуся тем, что его вводят человеку в комбинации с абиратерона ацетатом.
Более предпочтительно, изобретение относится к противоопухолевому средству для лечения кастрационно-резистентного рака предстательной железы, включающему соединение I или его фармацевтически приемлемую соль в дозе от 200 мг до 400 мг в расчете на свободную форму соединения I, отличающемуся тем, что его вводят человеку в комбинации с абиратерона ацетатом в дозе от 250 мг до 1000 мг.
Более предпочтительно, изобретение относится к противоопухолевому средству для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости, включающему соединение I или его фармацевтически приемлемую соль в дозе от 200 мг до 400 мг в расчете на свободную форму соединения I, отличающемуся тем, что его вводят человеку в комбинации с абиратерона ацетатом в дозе от 250 мг до 1000 мг.
Более предпочтительно, изобретение относится к противоопухолевому средству для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости, включающему соединение I или его фармацевтически приемлемую соль, которое вводят один раз в день в количестве от 200 мг до 400 мг в расчете на свободную форму соединения I, отличающемуся тем, что его вводят человеку в комбинации с от 250 мг до 1000 мг абиратерона ацетата, который вводят один раз в день.
Более предпочтительно, изобретение относится к противоопухолевому средству для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости, включающему соединение I или его фармацевтически приемлемую соль, которое вводят один раз в день в дозе, выбранной из группы, состоящей из 200 мг, 300 мг и 400 мг, в расчете на свободную форму соединения I, отличающемуся тем, что его вводят человеку в комбинации с абиратерона ацетатом, который вводят один раз в день в дозе, выбранной из группы, состоящей из 250 мг, 500 мг, 750 мг и 1000 мг.
Более предпочтительно, изобретение относится к противоопухолевому средству для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости, включающему соединение I или его фармацевтически приемлемую соль, которое вводят один раз в день в дозе, выбранной из группы, состоящей из 200 мг, 300 мг и 400 мг, в расчете на свободную форму соединения I, отличающемуся тем, что его вводят человеку в комбинации с абиратерона ацетатом, который вводят один раз в день в дозе, выбранной из группы, состоящей из 500 мг, 750 мг и 1000 мг.
Более предпочтительно, изобретение относится к противоопухолевому средству для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости, включающему соединение I или его фармацевтически приемлемую соль, которое вводят один раз в день в дозе, выбранной из группы, состоящей из 200 мг, 300 мг и 400 мг, в расчете на свободную форму соединения I, отличающемуся тем, что его вводят человеку в комбинации с абиратерона ацетатом, который вводят один раз в день в дозе, выбранной из группы, состоящей из 750 мг и 1000 мг.
Более предпочтительно, изобретение относится к противоопухолевому средству для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости, включающему соединение I или его фармацевтически приемлемую соль, которое вводят один раз в день в дозе, выбранной из группы, состоящей из 200 мг и 300 мг, в расчете на свободную форму соединения I, отличающемуся тем, что его вводят человеку в комбинации с абиратерона ацетатом, который вводят один раз в день в дозе 1000 мг.
Более предпочтительно, изобретение относится к противоопухолевому средству для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости, включающему соединение I или его фармацевтически приемлемую соль, которое вводят один раз в день в количестве 300 мг в расчете на свободную форму соединения I, отличающемуся тем, что его вводят человеку в комбинации с 1000 мг абиратерона ацетата, который вводят один раз в день.
Более предпочтительно, изобретение относится к противоопухолевому средству для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости, включающему соединение I или его фармацевтически приемлемую соль, которое вводят человеку один раз в день в количестве 300 мг в расчете на свободную форму соединения I в течение от 3 дней до 5 дней, а затем делают перерыв в применении средства в течение 1-3 дней, отличающемуся тем, что его вводят в комбинации с 1000 мг абиратерона ацетата, который вводят один раз в день.
Более предпочтительно, изобретение относится к противоопухолевому средству для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости, включающему соединение I или его фармацевтически приемлемую соль, которое вводят человеку один раз в день в количестве 300 мг в расчете на свободную форму соединения I в течение 5 дней, а затем делают перерыв в применении средства в течение 2 дней, отличающемуся тем, что его вводят в комбинации с 1000 мг абиратерона ацетата, который вводят один раз в день.
[0041]
Кроме того, настоящее изобретение относится к средству, усиливающему противоопухолевый эффект абиратерона или его производного, включающему соединение I или его фармацевтически приемлемую соль в качестве активного ингредиента.
Более предпочтительно, изобретение относится к средству, усиливающему противоопухолевый эффект абиратерона ацетата, включающему соединение I или его фармацевтически приемлемую соль в качестве активного ингредиента.
Более предпочтительно, изобретение относится к средству, усиливающему противоопухолевый эффект абиратерона ацетата, включающему соединение I или его фармацевтически приемлемую соль в качестве активного ингредиента и вводимому человеку.
Более предпочтительно, изобретение относится к средству, усиливающему противоопухолевый эффект абиратерона ацетата для лечения кастрационно-резистентного рака предстательной железы, включающему соединение I или его фармацевтически приемлемую соль в качестве активного ингредиента и вводимому человеку.
Более предпочтительно, изобретение относится к средству, усиливающему противоопухолевый эффект абиратерона ацетата для лечения кастрационно-резистентного рака предстательной железы, вводимого в дозе от 250 мг до 1000 мг, включающему соединение I или его фармацевтически приемлемую соль в качестве активного ингредиента, которое вводят человеку в дозе от 200 мг до 400 мг в расчете на свободную форму соединения I.
Более предпочтительно, изобретение относится к средству, усиливающему противоопухолевый эффект абиратерона ацетата для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости, вводимого в дозе от 250 мг до 1000 мг, включающему соединение I или его фармацевтически приемлемую соль в качестве активного ингредиента, которое вводят человеку в дозе от 200 мг до 400 мг в расчете на свободную форму соединения I.
Более предпочтительно, изобретение относится к средству, усиливающему противоопухолевый эффект абиратерона ацетата для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости, вводимого один раз в день в количестве от 250 мг до 1000 мг, включающему соединение I или его фармацевтически приемлемую соль в качестве активного ингредиента, которое вводят человеку один раз в день в количестве от 200 мг до 400 мг в расчете на свободную форму соединения I.
Более предпочтительно, изобретение относится к средству, усиливающему противоопухолевый эффект абиратерона ацетата для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости, вводимого один раз в день в дозе, выбранной из группы, состоящей из 250 мг, 500 мг, 750 мг и 1000 мг, включающему соединение I или его фармацевтически приемлемую соль в качестве активного ингредиента, которое вводят человеку один раз в день в дозе, выбранной из группы, состоящей из 200 мг, 300 мг и 400 мг, в расчете на свободную форму соединения I.
Более предпочтительно, изобретение относится к средству, усиливающему противоопухолевый эффект абиратерона ацетата для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости, вводимого один раз в день в дозе, выбранной из группы, состоящей из 750 мг и 1000 мг, включающему соединение I или его фармацевтически приемлемую соль в качестве активного ингредиента, которое вводят человеку один раз в день в дозе, выбранной из группы, состоящей из 200 мг, 300 мг и 400 мг, в расчете на свободную форму соединения I.
Более предпочтительно, изобретение относится к средству, усиливающему противоопухолевый эффект абиратерона ацетата для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости, вводимого один раз в день в дозе, выбранной из группы, состоящей из 500 мг, 750 мг и 1000 мг, включающему соединение I или его фармацевтически приемлемую соль в качестве активного ингредиента, которое вводят человеку один раз в день в дозе, выбранной из группы, состоящей из 200 мг, 300 мг и 400 мг, в расчете на свободную форму соединения I.
Более предпочтительно, изобретение относится к средству, усиливающему противоопухолевый эффект абиратерона ацетата для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости, вводимого один раз в день в дозе, выбранной из группы, состоящей из 750 мг и 1000 мг, включающему соединение I или его фармацевтически приемлемую соль в качестве активного ингредиента, которое вводят человеку один раз в день в дозе, выбранной из группы, состоящей из 200 мг, 300 мг и 400 мг, в расчете на свободную форму соединения I.
Более предпочтительно, изобретение относится к средству, усиливающему противоопухолевый эффект абиратерона ацетата для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости, вводимого один раз в день в дозе, выбранной из группы, состоящей из 750 мг и 1000 мг, включающему соединение I или его фармацевтически приемлемую соль в качестве активного ингредиента, которое вводят человеку один раз в день в дозе, выбранной из группы, состоящей из 200 мг и 300 мг, в расчете на свободную форму соединения I.
Более предпочтительно, изобретение относится к средству, усиливающему противоопухолевый эффект абиратерона ацетата для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости, вводимого один раз в день в количестве 1000 мг, включающему соединение I или его фармацевтически приемлемую соль в качестве активного ингредиента, которое вводят человеку один раз в день в дозе, выбранной из группы, состоящей из 200 мг и 300 мг, в расчете на свободную форму соединения I.
Более предпочтительно, изобретение относится к средству, усиливающему противоопухолевый эффект абиратерона ацетата для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости, вводимого один раз в день в количестве 1000 мг, включающему соединение I или его фармацевтически приемлемую соль в качестве активного ингредиента, которое вводят человеку один раз в день в количестве 300 мг в расчете на свободную форму соединения I.
Более предпочтительно, изобретение относится к средству, усиливающему противоопухолевый эффект абиратерона ацетата для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости, вводимого один раз в день в количестве 1000 мг, включающему соединение I или его фармацевтически приемлемую соль в качестве активного ингредиента, которое вводят человеку один раз в день в количестве 300 мг в расчете на свободную форму соединения I в течение 5 дней, а затем делают перерыв в применении средства в течение 2 дней.
[0042]
Кроме того, настоящее изобретение относится к способу для лечения опухоли, включающему введение пациенту терапевтически эффективных количеств соединения I или его фармацевтически приемлемой соли и абиратерона или его производного.
Более предпочтительно, изобретение относится к способу для лечения опухоли у человека, включающему введение пациенту терапевтически эффективных количеств соединения I или его фармацевтически приемлемой соли и абиратерона ацетата.
Более предпочтительно, изобретение относится к способу для лечения кастрационно-резистентного рака предстательной железы у человека, включающему введение пациенту терапевтически эффективных количеств соединения I или его фармацевтически приемлемой соли и абиратерона ацетата.
Более предпочтительно, изобретение относится к способу для лечения кастрационно-резистентного рака предстательной железы у человека, включающему введение пациенту терапевтически эффективных количеств соединения I или его фармацевтически приемлемой соли в дозе от 200 мг до 400 мг в расчете на свободную форму соединения I и абиратерона ацетата в дозе от 250 мг до 1000 мг.
Более предпочтительно, изобретение относится к способу для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости у человека, включающему введение пациенту терапевтически эффективных количеств соединения I или его фармацевтически приемлемой соли в дозе от 200 мг до 400 мг в расчете на свободную форму соединения I и абиратерона ацетата в дозе от 250 мг до 1000 мг.
Более предпочтительно, изобретение относится к способу для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости у человека, включающему введение пациенту терапевтически эффективных количеств соединения I или его фармацевтически приемлемой соли в количестве от 200 мг до 400 мг в расчете на свободную форму соединения I один раз в день и абиратерона ацетата в количестве от 250 мг до 1000 мг один раз в день.
Более предпочтительно, изобретение относится к способу для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости у человека, включающему введение пациенту терапевтически эффективных количеств соединения I или его фармацевтически приемлемой соли в дозе, выбранной из группы, состоящей из 200 мг, 300 мг и 400 мг, в расчете на свободную форму соединения I, один раз в день и абиратерона ацетата в дозе, выбранной из группы, состоящей из 250 мг, 500 мг, 750 мг и 1000 мг, один раз в день.
Более предпочтительно, изобретение относится к способу для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости у человека, включающему введение пациенту терапевтически эффективных количеств соединения I или его фармацевтически приемлемой соли в дозе, выбранной из группы, состоящей из 200 мг, 300 мг и 400 мг, в расчете на свободную форму соединения I, один раз в день и абиратерона ацетата в дозе, выбранной из группы, состоящей из 250 мг, 500 мг, 750 мг и 1000, мг один раз в день.
Более предпочтительно, изобретение относится к способу для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости у человека, включающему введение пациенту терапевтически эффективных количеств соединения I или его фармацевтически приемлемой соли в дозе, выбранной из группы, состоящей из 200 мг, 300 мг и 400 мг, в расчете на свободную форму соединения I, один раз в день и абиратерона ацетата в дозе, выбранной из группы, состоящей из 500 мг, 750 мг и 1000 мг, один раз в день.
Более предпочтительно, изобретение относится к способу для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости у человека, включающему введение пациенту терапевтически эффективных количеств соединения I или его фармацевтически приемлемой соли в дозе, выбранной из группы, состоящей из 200 мг, 300 мг и 400 мг, в расчете на свободную форму соединения I, один раз в день и абиратерона ацетата в дозе, выбранной из группы, состоящей из 750 мг и 1000 мг, один раз в день.
Более предпочтительно, изобретение относится к способу для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости у человека, включающему введение пациенту терапевтически эффективных количеств соединения I или его фармацевтически приемлемой соли в дозе, выбранной из группы, состоящей из 200 мг, 300 мг и 400 мг, в расчете на свободную форму соединения I, один раз в день и 1000 мг абиратерона ацетата один раз в день.
Более предпочтительно, изобретение относится к способу для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости у человека, включающему введение пациенту терапевтически эффективных количеств соединения I или его фармацевтически приемлемой соли в дозе, выбранной из группы, состоящей из 200 мг и 300 мг, один раз в день и 1000 мг абиратерона ацетата один раз в день.
Более предпочтительно, изобретение относится к способу для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости у человека, включающему введение пациенту терапевтически эффективных количеств соединения I или его фармацевтически приемлемой соли один раз в день в количестве 300 мг в расчете на свободную форму соединения I в течение от 3 дней до 5 дней, с последующим перерывом в течение от 1 дня до 3 дней, и 1000 мг абиратерона ацетата один раз в день.
Более предпочтительно, изобретение относится к способу для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости у человека, включающему введение пациенту терапевтически эффективных количеств соединения I или его фармацевтически приемлемой соли один раз в день в количестве 300 мг в расчете на свободную форму соединения I в течение 5 дней, с последующим перерывом в течение 2 дней, и 1000 мг абиратерона ацетата один раз в день.
[0043]
Кроме того, настоящее изобретение относится к соединению I или его фармацевтически приемлемой соли для применения в комбинации с абиратероном или его производным в лечении опухоли.
Более предпочтительно, изобретение относится к соединению I или его фармацевтически приемлемой соли для применения в комбинации с абиратерона ацетатом в лечении опухоли.
Более предпочтительно, изобретение относится к соединению I или его фармацевтически приемлемой соли для применения в комбинации с абиратерона ацетатом в лечении опухоли путем введения человеку.
Более предпочтительно, изобретение относится к соединению I или его фармацевтически приемлемой соли для применения в комбинации с абиратерона ацетатом в лечении кастрационно-резистентного рака предстательной железы путем введения человеку.
Более предпочтительно, изобретение относится к соединению I или его фармацевтически приемлемой соли для применения в дозе от 200 мг до 400 мг в расчете на свободную форму соединения I в комбинации с абиратерона ацетатом в дозе от 250 мг до 1000 мг в лечении кастрационно-резистентного рака предстательной железы путем введения человеку.
Более предпочтительно, изобретение относится к соединению I или его фармацевтически приемлемой соли для применения в дозе от 200 мг до 400 мг в расчете на свободную форму соединения I в комбинации с абиратерона ацетатом в дозе от 250 мг до 1000 мг в лечении кастрационно-резистентного рака предстательной железы с метастазами в кости путем введения человеку.
Более предпочтительно, изобретение относится к соединению I или его фармацевтически приемлемой соли, вводимому один раз в день в количестве от 200 мг до 400 мг в расчете на свободную форму соединения I, для применения в комбинации с абиратерона ацетатом, вводимым один раз в день в дозе от 250 мг до 1000 мг, в лечении кастрационно-резистентного рака предстательной железы с метастазами в кости путем введения человеку.
Более предпочтительно, изобретение относится к соединению I или его фармацевтически приемлемой соли, вводимому один раз в день в дозе, выбранной из группы, состоящей из 200 мг, 300 мг и 400 мг, в расчете на свободную форму соединения I, для применения в комбинации с абиратерона ацетатом, вводимым один раз в день в дозе, выбранной из группы, состоящей из 250 мг, 500 мг, 750 мг и 1000 мг, в лечении кастрационно-резистентного рака предстательной железы с метастазами в кости путем введения человеку.
Более предпочтительно, изобретение относится к соединению I или его фармацевтически приемлемой соли, вводимому один раз в день в дозе, выбранной из группы, состоящей из 200 мг, 300 мг и 400 мг, в расчете на свободную форму соединения I, для применения в комбинации с абиратерона ацетатом, вводимым один раз в день в дозе, выбранной из группы, состоящей из 500 мг, 750 мг и 1000 мг, в лечении кастрационно-резистентного рака предстательной железы с метастазами в кости путем введения человеку.
Более предпочтительно, изобретение относится к соединению I или его фармацевтически приемлемой соли, вводимому один раз в день в дозе, выбранной из группы, состоящей из 200 мг, 300 мг и 400 мг, в расчете на свободную форму соединения I, для применения в комбинации с абиратерона ацетатом, вводимым один раз в день в дозе, выбранной из группы, состоящей из 750 мг и 1000 мг, в лечении кастрационно-резистентного рака предстательной железы с метастазами в кости путем введения человеку.
Более предпочтительно, изобретение относится к соединению I или его фармацевтически приемлемой соли, вводимому один раз в день в дозе, выбранной из группы, состоящей из 200 мг и 300 мг, в расчете на свободную форму соединения I, для применения в комбинации с абиратерона ацетатом, вводимым один раз в день в дозе, выбранной из группы, состоящей из 750 мг и 1000 мг, в лечении кастрационно-резистентного рака предстательной железы с метастазами в кости путем введения человеку.
Более предпочтительно, изобретение относится к соединению I или его фармацевтически приемлемой соли, вводимому один раз в день в дозе, выбранной из группы, состоящей из 200 мг и 300 мг, в расчете на свободную форму соединения I, для применения в комбинации с абиратерона ацетатом, вводимым один раз в день в количестве 1000 мг, в лечении кастрационно-резистентного рака предстательной железы с метастазами в кости путем введения человеку.
Более предпочтительно, изобретение относится к соединению I или его фармацевтически приемлемой соли, вводимому один раз в день в количестве 300 мг в расчете на свободную форму соединения I, для применения в комбинации с абиратерона ацетатом, вводимым один раз в день в количестве 1000 мг, в лечении кастрационно-резистентного рака предстательной железы с метастазами в кости путем введения человеку.
Более предпочтительно, изобретение относится к соединению I или его фармацевтически приемлемой соли, вводимому один раз в день в количестве 300 мг в расчете на свободную форму соединения I в течение 5 дней, с последующим перерывом в течение 2 дней, для применения в комбинации с абиратерона ацетатом, вводимым один раз в день в количестве 1000 мг, в лечении кастрационно-резистентного рака предстательной железы с метастазами в кости путем введения человеку.
[0044]
Кроме того, настоящее изобретение относится к применению соединения I или его фармацевтически приемлемой соли для получения противоопухолевого средства для введения в комбинации с абиратероном или его производным.
Более предпочтительно, изобретение относится к применению соединения I или его фармацевтически приемлемой соли для получения противоопухолевого средства для введения в комбинации с абиратерона ацетатом.
Более предпочтительно, изобретение относится к применению соединения I или его фармацевтически приемлемой соли для получения противоопухолевого средства для введения человеку в комбинации с абиратерона ацетатом.
Более предпочтительно, изобретение относится к применению соединения I или его фармацевтически приемлемой соли для получения терапевтического средства для лечения кастрационно-резистентного рака предстательной железы для введения человеку в комбинации с абиратерона ацетатом.
Более предпочтительно, изобретение относится к применению соединения I или его фармацевтически приемлемой соли для получения терапевтического средства для лечения кастрационно-резистентного рака предстательной железы для введения человеку в дозе от 200 мг до 400 мг в расчете на свободную форму соединения I в комбинации с абиратерона ацетатом в дозе от 250 мг до 1000 мг.
Более предпочтительно, изобретение относится к применению соединения I или его фармацевтически приемлемой соли для получения терапевтического средства для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости для введения человеку в дозе от 200 мг до 400 мг в расчете на свободную форму соединения I в комбинации с абиратерона ацетатом в дозе от 250 мг до 1000 мг.
Более предпочтительно, изобретение относится к применению соединения I или его фармацевтически приемлемой соли для получения терапевтического средства для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости для введения человеку один раз в день в дозе от 200 мг до 400 мг в расчете на свободную форму соединения I в комбинации с абиратерона ацетатом, который вводят один раз в день в дозе от 250 мг до 1000 мг.
Более предпочтительно, изобретение относится к применению соединения I или его фармацевтически приемлемой соли для получения терапевтического средства для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости для введения человеку один раз в день в дозе, выбранной из группы, состоящей из 200 мг, 300 мг и 400 мг, в расчете на свободную форму соединения I, в комбинации с абиратерона ацетатом, который вводят один раз в день в дозе, выбранной из группы, состоящей из 250 мг, 500 мг, 750 мг и 1000 мг.
Более предпочтительно, изобретение относится к применению соединения I или его фармацевтически приемлемой соли для получения терапевтического средства для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости для введения человеку один раз в день в дозе, выбранной из группы, состоящей из 200 мг, 300 мг и 400 мг, в расчете на свободную форму соединения I, в комбинации с абиратерона ацетатом, который вводят один раз в день в дозе, выбранной из группы, состоящей из 500 мг, 750 мг и 1000 мг.
Более предпочтительно, изобретение относится к применению соединения I или его фармацевтически приемлемой соли для получения терапевтического средства для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости для введения человеку один раз в день в дозе, выбранной из группы, состоящей из 200 мг, 300 мг и 400 мг, в расчете на свободную форму соединения I, в комбинации с абиратерона ацетатом, который вводят один раз в день в дозе, выбранной из группы, состоящей из 750 мг и 1000 мг.
Более предпочтительно, изобретение относится к применению соединения I или его фармацевтически приемлемой соли для получения терапевтического средства для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости для введения человеку один раз в день в дозе, выбранной из группы, состоящей из 200 мг и 300 мг, в расчете на свободную форму соединения I, в комбинации с абиратерона ацетатом, который вводят один раз в день в дозе, выбранной из группы, состоящей из 750 мг и 1000 мг.
Более предпочтительно, изобретение относится к применению соединения I или его фармацевтически приемлемой соли для получения терапевтического средства для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости для введения человеку один раз в день в дозе, выбранной из группы, состоящей из 200 мг и 300 мг, в расчете на свободную форму соединения I, в комбинации с абиратерона ацетатом, который вводят один раз в день в количестве 1000 мг.
Более предпочтительно, изобретение относится к применению соединения I или его фармацевтически приемлемой соли для получения терапевтического средства для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости для введения человеку один раз в день в количестве 300 мг в расчете на свободную форму соединения I в комбинации с абиратерона ацетатом, который вводят один раз в день в количестве 1000 мг.
Более предпочтительно, изобретение относится к применению соединения I или его фармацевтически приемлемой соли для получения терапевтического средства для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости для введения человеку один раз в день в количестве 300 мг в расчете на свободную форму соединения I в течение 5 дней, с последующим перерывом в течение 2 дней, в комбинации с абиратерона ацетатом, который вводят один раз в день в количестве 1000 мг.
Примеры
[0045]
Примеры и Ссылочные примеры показаны ниже для более подробного описания комбинированного введения соединения I или его фармацевтически приемлемой соли и абиратерона или его производного по настоящему изобретению. Настоящее изобретение не ограничивается этими Примерами.
[0046]
<Ссылочный Пример 1: Получение метансульфонатной соли соединения I>
Соединение I получали способом, описанным в Патентной литературе 1, а метансульфонатную соль соединения I получали способом, описанным в Патентной литературе 5. Получение можно осуществить в соответствии со способом, описанным в Патентной литературе 6.
[0047]
<Ссылочный Пример 2: Получение абиратерона ацетата>
Абиратерон ацетат получали из коммерческого продукта или на основании информации, известной из литературы.
[0048]
<Пример: Испытание комбинированного введения метансульфонатной соли соединения I и абиратерона ацетата>
Метансульфонатную соль соединения I и абиратерона ацетат вводили пациентам с кастрационно-резистентным раком предстательной железы с метастазами в кости в качестве субъектов, и оценивали эффективность и побочные эффекты. Повторяли схему введения метансульфонатной соли соединения I в любой из трех доз, в расчете на свободную форму (200, 300 или 400 мг/субъект/день), пациентам, которые получали вторичную эндокринную терапию до лечения доцетакселом, в качестве субъектов, один раз в день в течение 5 дней, и делая перерыв в приеме соединения I только в течение 2 дней. В течение этого периода 1000 мг абиратерона ацетата вводили каждой дозовой группе каждый день один раз в день, и в каждой дозовой группе обследовали шесть субъектов. Когда "побочные эффекты степени 2 или выше, продолжающиеся без улучшения или восстановления симптоматическим лечением, или побочные эффекты степени 3 или выше (за исключением аномальных значений клинического обследования)" из-за соединения I наблюдались у двух или более субъектов на 21-й день с начала введения соединения I в каждой дозовой группе, Руководящий комитет рассматривал возможность прекращения регистрации и оценки и т.д. этой дозовой группы или группы с превышением дозы. Побочные эффекты, которые определяют прекращение регистрации и оценки, и т.д., не включают аномальные значения клинического обследования, такие как повышение уровня аланинаминотрансферазы (ALT), повышение уровня аспартатаминотрансферазы (AST) и повышение уровня креатинкиназы в крови (CK). Кроме того, после завершения оценки каждой дозовой группы Руководящий комитет оценивал целесообразность увеличения количества случаев для оценки побочных эффектов и эффективности, и увеличение количества случаев допускалось в пределах, не превышающих 24, как количество случаев для оценки всей данной когорты при переносимой дозе. Соответственно, поскольку количество случаев для оценки каждой дозовой группы невелико, т.е. 6 случаев, с точки зрения эффективности, побочных эффектов и продолжительности приема, дополнительно оценивались 6 случаев при дозе 300 мг/субъект/день.
[0049]
Что касается эффективности, делали сцинтиграфию костей, используемую для обнаружения метастазов в кости, и оценку осуществляли на основе индекса костного сканирования (BSI) с использованием аналитических данных BONE NAVI и критериев, установленных в Response Evaluation Criteria in Solid Tumors (RECIST) Version 1.1 или Prostate Cancer Clinical Trials Working Group 3 (PCWG3). BSI представляет собой индекс для оценки распространения метастазов в кости и рассчитывает отношение области высокой аккумуляции (Artificial Neural Networks (ANN значение) выше 0,5), которая, по-видимому, является опухолью, к костной массе всего тела. ANN значение указывает степень достоверности метастазирования по шкале от 0 до 1, и ANN значение, превышающее 0,5, оценивается как имеющее риск метастазирования в кости. Кроме того, на Фиг. 1 наилучшее значение из BSI, измеренных в течение периода введения соединения I, показано как Лучший ответ, на основании метастазов в кости в день начала введения в каждой дозовой группе. То есть, на Фиг.1 0% означает, что значение BSI не изменилось в течение периода введения соединения I, а 100% означает, что область высокой аккумуляции, где ANN значение превышает 0,5, увеличилась за этот период и что значение BSI удвоилось. Напротив, -100% указывает на то, что область высокой аккумуляции, где ANN значение превышает 0,5, исчезла за этот период и что значение BSI стало равным 0.
[0050]
В результате, при 200 мг, подавление метастазов в кости наблюдалось в двух из шести случаев. При 300 мг, подавление метастазов в кости наблюдалось в 10 из 12 случаев, а BSI значение стало равным 0 в трех случаях. При 400 мг метастазы в кости невозможно было измерить ни в одном из шести случаев, а подавление метастазов в кости наблюдалось в пяти из оставшихся пяти случаев.
[0051]
Степень серьезности побочных эффектов оценивали с использованием Общих терминологических критериев для оценки нежелательных явлений (CTCAE) Ver. 4.03. В каждой группе "побочные эффекты 3 степени или выше, продолжающиеся без улучшения или восстановления симптоматическим лечением" не были обнаружены у двух или более субъектов.
Кроме того, Фиг. 2 показывает количество дней, в течение которых можно было вводить соединение I и абиратерон в каждой дозовой группе. То есть, большее количество дней введения позволяет ожидать противоопухолевый эффект и также указывает на то, что доза представляет собой дозу, которую можно более безопасно вводить. Кроме того, указание "продолжается" означает, что испытание комбинации продолжалось когда было создано описание и т.п. настоящей заявки, и средние количества дней введения, рассчитанные для соответствующих дозовых групп в тот момент, составили 211 дней в дозовой группе 200 мг, 158 дней в дозовой группе 300 мг и 87 дней в дозовой группе 400 мг. Следовательно, во всех дозовых группах среднее количество дней введения превышало 50 дней, в частности, было продемонстрировано, что среднее количество дней введения в дозовых группах 200 мг и 300 мг превышало 100 дней.
Кроме того, Фиг. 3 показывает количество дней, в течение которых можно было вводить соединение I и абиратерон в каждой дозовой группе, на момент времени примерно через один год после того, как были получены результаты, показанные на Фиг. 2. То есть, большее количество дней введения позволяет ожидать противоопухолевый эффект и также указывает на то, что доза представляет собой дозу, которую можно более безопасно вводить. Кроме того, указание "продолжается" означает, что испытание комбинации продолжалось, когда было создано описание и т.п. настоящей заявки, и средние количества дней введения, рассчитанные для соответствующих дозовых групп в тот момент, составили 225 дней в дозовой группе 200 мг, 225 дней в дозовой группе 300 мг и 87 дней в дозовой группе 400 мг. Следовательно, во всех дозовых группах среднее количество дней введения превышало 50 дней, в частности, было продемонстрировано, что среднее количество дней введения в дозовых группах 200 мг и 300 мг превышало 200 дней.
[0052]
Приведенные выше результаты демонстрируют, что в каждой дозовой группе (200 мг, 300 мг и 400 мг), получавшей соединение I, подавление метастазов в кости у пациентов с кастрационно-резистентным раком предстательной наблюдалось при введении в комбинации с ацетатным эфиром абиратерона, в частности, в дозовых группах 300 мг и 400 мг частота подавления была высокой. Кроме того, в дозовой группе 300 мг также был обнаружен эффект достижения BSI значения, равного 0. Кроме того, в каждой дозовой группе побочные эффекты были приемлемыми. Также было продемонстрировано, что можно продолжать комбинированное введение в каждой дозовой группе, в частности, результаты определения среднего количества дней введения в дозовых группах 200 мг и 300 мг продемонстрировали, что можно ожидать противоопухолевого эффекта и безопасности.
Таким образом, было продемонстрировано, что комбинация соединения I и производного абиратерона может проявлять противоопухолевый эффект.
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМБИНИРОВАННОЕ ЛЕЧЕНИЕ РАКА | 2012 |
|
RU2640485C2 |
| ПРОЛЕКАРСТВА АБИРАТЕРОНА | 2020 |
|
RU2822219C2 |
| СЕЛЕКТИВНЫЕ ЛИГАНДЫ-РАЗРУШИТЕЛИ АНДРОГЕННЫХ РЕЦЕПТОВ (SARD) И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2724103C2 |
| КОМБИНАЦИЯ, ЕЕ ПРИМЕНЕНИЕ И СПОСОБ ЛЕЧЕНИЯ | 2017 |
|
RU2731535C1 |
| ЛЕКАРСТВЕННАЯ ФОРМА ТАЛАЗОПАРИБА В ВИДЕ МЯГКОЙ ЖЕЛАТИНОВОЙ КАПСУЛЫ | 2021 |
|
RU2840868C1 |
| КОМБИНАЦИЯ ДЛЯ ЛЕЧЕНИЯ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И СПОСОБ ЛЕЧЕНИЯ | 2017 |
|
RU2733950C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПРЕДУПРЕЖДЕНИЯ И/ИЛИ ЛЕЧЕНИЯ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ, ПРИМЕНЕНИЕ БЕНЗОГЕТЕРОЦИКЛИЧЕСКОГО СОЕДИНЕНИЯ И СПОСОБ ПРЕДУПРЕЖДЕНИЯ И/ИЛИ ЛЕЧЕНИЯ РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ | 2016 |
|
RU2705576C2 |
| КОМБИНИРОВАННОЕ ЛЕЧЕНИЕ | 2014 |
|
RU2666999C2 |
| ПРИМЕНЕНИЕ 4-ПИРИДИЛМЕТИЛФТАЛАЗИНОВ ДЛЯ ЛЕЧЕНИЯ РАКА | 2002 |
|
RU2320344C2 |
| КОМБИНАЦИИ, ВКЛЮЧАЮЩИЕ ЭПОТИЛОНЫ, И ИХ ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2002 |
|
RU2375058C2 |
Группа изобретений относится к области медицины, а именно к онкологии, и предназначена для лечения кастрационно-резистентного рака предстательной железы. Противоопухолевое средство включает соединение, представленное формулой (I), или его фармацевтически приемлемую соль в дозе, которая составляет в расчете на свободную форму соединения I, от 150 мг до 450 мг. Указанное средство предназначено для применения в комбинации с абиратероном или его производным для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости. Производное абиратерона выбирают из группы, состоящей из сложных эфиров кислот, алкиловых эфиров, карбонатов и карбаматов. Также представлено применение указанного средства в качестве активного агента для усиления противоопухолевого эффекта абиратерона или его производного для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости. Кроме того, раскрыто применение соединения, представленного формулой (I), или его фармацевтически приемлемой соли в комбинации с абиратероном или его производным для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости. Использование изобретения обеспечивает лечение кастрационно-резистентного рака предстательной железы с метастазами в кости. 3 н. и 16 з.п. ф-лы, 3 ил., 2 пр.
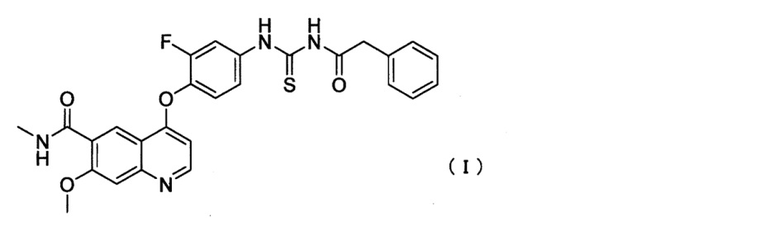
1. Противоопухолевое средство, включающее соединение, представленное следующей формулой (I), или его фармацевтически приемлемую соль в дозе, которая составляет в расчете на свободную форму соединения I, от 150 мг до 450 мг:
предназначенное для применения в комбинации с абиратероном или его производным для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости, где производное абиратерона выбирают из группы, состоящей из сложных эфиров кислот, алкиловых эфиров, карбонатов и карбаматов.
2. Противоопухолевое средство для применения по п. 1, где фармацевтически приемлемая соль представляет собой метансульфонатную соль.
3. Противоопухолевое средство для применения по п. 1 или 2, где абиратерон или его производное представляет собой абиратерона ацетат.
4. Противоопухолевое средство для применения по пп. 1-3, вводимое человеку.
5. Противоопухолевое средство для применения по любому из пп. 1-4, где соединение, представленное формулой (I), или его фармацевтически приемлемую соль вводят один раз в день в количестве от 200 мг до 400 мг в расчете на свободную форму соединения I.
6. Противоопухолевое средство для применения по любому из пп. 1-4, где соединение, представленное формулой (I), или его фармацевтически приемлемую соль вводят один раз в день в количестве 300 мг в расчете на свободную форму соединения I.
7. Противоопухолевое средство для применения по любому из пп. 1-6, где соединение, представленное формулой (I), или его фармацевтически приемлемую соль вводят в течение 5 дней, и затем делают перерыв в применении препарата в течение 2 дней.
8. Применение соединения, представленного следующей формулой (I), или его фармацевтически приемлемой соли в дозе, которая составляет в расчете на свободную форму соединения I, от 150 мг до 450 мг:
в качестве активного агента для усиления противоопухолевого эффекта абиратерона или его производного для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости, где производное абиратерона выбирают из группы, состоящей из сложных эфиров кислот, алкиловых эфиров, карбонатов и карбаматов.
9. Применение по п.8, где фармацевтически приемлемая соль представляет собой метансульфонатную соль.
10. Применение по п.8 или 9, где абиратерон или его производное представляет собой ацетат абиратерона.
11. Применение по любому из пп.8-10, где соединение, представленное формулой (I), или его фармацевтически приемлемую соль вводят один раз в день в количестве от 200 мг до 400 мг в виде свободной формы соединение I.
12. Применение по любому из пп.8-11, где соединение, представленное формулой (I), или его фармацевтически приемлемую соль вводят один раз в день в количестве 300 мг в виде свободной формы соединения I.
13. Применение по любому из пп.8-12, где соединение, представленное формулой (I), или его фармацевтически приемлемую соль вводят в течение 5 дней, а затем делают перерыв в применении препарата в течение 2 дней.
14. Применение соединения, представленного следующей формулой (I), или его фармацевтически приемлемой соли в дозе, которая составляет в расчете на свободную форму соединения I, от 150 мг до 450 мг:
в комбинации с абиратероном или его производным для лечения кастрационно-резистентного рака предстательной железы с метастазами в кости, где производное абиратерона выбирают из группы, состоящей из сложных эфиров кислот, алкиловых эфиров, карбонатов и карбаматов.
15. Применение по п.14, где фармацевтически приемлемая соль представляет собой соль метансульфоната.
16. Применение по п.14 или 15, где абиратерон или его производное представляет собой ацетат абиратерона.
17. Применение по любому из пп.14-16, где соединение, представленное формулой (I), или его фармацевтически приемлемую соль вводят один раз в день в количестве от 200 мг до 400 мг в виде свободной формы соединения I.
18. Применение по любому из пп.14-17, где соединение, представленное формулой (I), или его фармацевтически приемлемую соль вводят один раз в день в количестве 300 мг в виде свободной формы соединения I.
19. Применение по любому из пп.14-18, отличающееся тем, что соединение, представленное формулой (I), или его фармацевтически приемлемую соль вводят в течение 5 дней, а затем делают перерыв в применении препарата в течение 2 дней.
| WO 2016175305 A1, 03.11.2016 | |||
| MATSUBARA N et al | |||
| Ударно-долбежная врубовая машина | 1921 |
|
SU115A1 |
| Annals of Oncology, 2017, vol | |||
| Видоизменение прибора с двумя приемами для рассматривания проекционные увеличенных и удаленных от зрителя стереограмм | 1919 |
|
SU28A1 |
| Suppl | |||
| Кипятильник для воды | 1921 |
|
SU5A1 |
| СРЕДСТВО, УСИЛИВАЮЩЕЕ ДЕЙСТВИЕ ПРОТИВООПУХОЛЕВЫХ СРЕДСТВ | 2012 |
|
RU2589713C2 |
| FUJITA H et al | |||
| The novel VEGF receptor/MET-targeted | |||
Авторы
Даты
2023-11-02—Публикация
2019-09-18—Подача