Изобретение относится к рекомбинантной плазмиде pET21-GST-CD, обеспечивающей синтез и секрецию белка Gc и рекомбинантному штамму Escherichia coli BL21(DE3)pLysE рЕТ21 -GST-CD - продуценту белка Gc и может быть использовано в молекулярной генетике и биотехнологии для получения субъединичной вакцины.
Уровень техники. Вирус Хантаан (HTNV) является причиной возникновения у человека геморрагической лихорадки с почечным синдоромом (ГЛПС), характеризующейся высокой степенью летальности и тяжестью протекания болезни [1]. Для борьбы с ГЛПС разработано множество средств профилактики и терапии:
а) цельновирионные и инактивированные вакцины, широко распространенные в Китае (бивалентная вакцина против HTNV и вируса Сеул [2]) и Южной Корее (Hantavax™ [3]). В Российской Федерации прошла доклинические испытания бивалентная, цельновирионная, инактивированная, концентрированная, сорбированная вакцина «КомбиГЛПС-Вак» [4]. Цельновирионные и инактивированные вакцины являются эффективным методом борьбы с ГЛПС, однако процесс их производства трудозатратен, инактивированный вирус не обеспечивает высокого уровня антител и длительного иммунитета [5, 6].
б) для профилактики хантавирусных инфекций разрабатываются ДНК-вакцины, кодирующие преимущественно М, а также S сегмент вирусного генома. Основным преимуществом ДНК-вакцин является безопасность, недостатком - невысокая иммуногенность [5-7].
в) антитела против хантавирусов. На данный момент нет одобренных препаратов антител для терапии ГЛПС, однако в лабораторных исследованиях показали высокую специфичность и протективность антитела 3D8 [8], SAB-159 [9], М7, Y5, Y22 [5].
г) Одним из перспективных направлений в разработке вакцинных препаратов является создание субъединичных вакцин с использованием эктодоменов рекомбинантных гликопротеинов Gn и Gc, вызывающих у иммунизированных животных появление нейтрализующих антител против вируса Хантаан [10, 11].
Основными преимуществами субъединичных белковых вакцин являются безопасность и простота производства, высокие титры нейтрализующих антител [2]. Основной недостаток - ограниченность систем наработки рекомбинантных белков Gn и Gc. В большинстве случаев эти белки нарабатываются в бакуловирусной системе, что представляет собой трудоемкий процесс. Токсичность Gn и Gc для бактериальных клеток затрудняет их наработку в Е. coli [12, 13].
Ближайшие аналоги. Известен способ получения рекомбинантного антигена G2 (Gc) Хантавируса Добрава в клетках E.coli (патент РФ №2509805, МПК C12N15/70, опубл. 20.03.2014 г.) с характеристиками, позволяющими улучшить воспроизводимость и чувствительность иммуноферментного анализа при диагностике ГЛПС. В качестве антигена авторы использовали рекомбинантный антиген НТ-А12, представляющий собой фрагмент белка G2 хантавируса Добрава, сохраняющий иммуногенность полноразмерного продукта, но не проявляющий токсичности по отношению к клеткам продуцента. Особенностью плазмидной конструкции, кодирующей белок G2, является наличие гена мини-домена фолдона фибритина колифага JS98C3, стабилизирующего глобулярную структуру белка G2, что повышает растворимость последнего и его конечный выход.
Наиболее близким аналогом (прототипом) является способ получения рекомбинантного антигена G2 (Gc) вируса Добрава в клетках E.coli (патент РФ №2495938, МПК C12N15/70, опубл. 20.10.2013 г.). Для получения указанного антигена авторами получена ДНК-конструкция рНКб, кодирующая слитой белок из трех частей, где N-концевое положение занимает зеленый флуоресцентный белок GFP, центральное - пептид длиной 73 а.о. с последовательностью аминокислот SRKKCNFATTPICEYD GNMVSG YKKVMATIDSFQAFNTSYIHYTDEQIEWKDPDGMLKDHLNIL VTKDIDFDT, а концевое - легкая цепь двуцепочечного белкового ингибитора типа Кунитца из клубней картофеля. Культивируют трансформированные данной конструкцией клетки E.coli, лизируют биомассу, отделяют нерастворимую фракцию лизата, продукт экспрессии в форме телец включения солюбилизируют, проводят хроматографическую очистку. Используют полученный продукт для выявления специфических антител в сыворотке больных ГЛПС. Достоинством изобретения является увеличенный выход рекомбинантного антигена G2 хантавируса Добрава в клетках E.coli.
Представленные выше аналог и прототип позволяют получать белок G2 (Gc) вируса Добрава в клетках E.coli. Однако в азиатской части России ввиду территориальной близости с Китаем существует угроза заражения вирусом Хантаан, что требует создания аналогичных средств профилактики заболеваний, вызванных этим вирусом. Из литературы известно, что и белок Gl (Gn) и белок G2 (Gc) хантавирусов обладают схожей иммуногенностью [2], поэтому в качестве иммуногена возможно использование обоих белков. Также авторами указанных изобретений использованы фрагменты белка G2 (Gc) вируса Добрава. В заявляемом изобретении в отличие от аналога и прототипа использован полноразмерный ген белка Gc вируса Хантаан.
Техническим результатом заявляемого изобретения является создание плазмидной генетической конструкции pET21-GST-CD, обеспечивающей синтез и секрецию целевого полноразмерного белка Gc - эктодомена гликопротеина вируса Хантаан, распространенного в дальневосточном регионе России, и рекомбинантного штамма Escherichia coli BL21(DE3)pLysE рЕТ21-GST-CD - продуцента белка Gc - эктодомена гликопротеина вируса Хантаан.
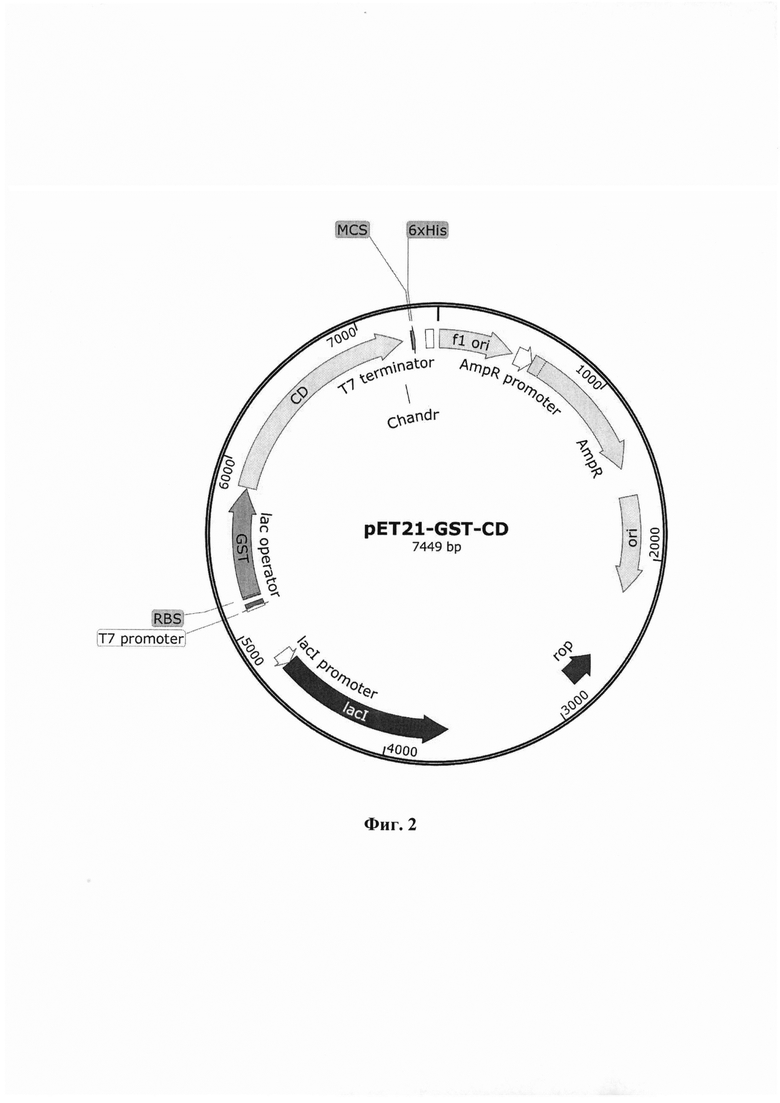
Указанный технический результат достигается тем, что плазмидная конструкция pET21-GST-CD, обеспечивающая синтез и секрецию белка Gc -эктодомена гликопротеина вируса Хантаан в клетках E.coli, имеет нуклеотидную последовательность SEQ ID No. 1 и содержит в соответствии с физической и генетической картой, представленной на Фиг. 1, следующие элементы:
- fl ori (12-467 п.н.) представляет собой фаговый ori, который обеспечивает репликацию и упаковку одноцепочечной ДНК в фаговые частицы;
- ген устойчивости к антибиотику ампициллин AmpR (599-1459 п.н.) и бактериальный промотор гена устойчивости к ампициллину AmpR promoter (494-598 п.н.), позволяющие проводить препаративную наработку плазмиды в E.coli;
- участок начала репликации ori (1630-2218 п.н.);
- rор (2648-2839 п.н.) - димерный белок, участвующий в механизме, контролирующем количество копий плазмиды;
- lacI (3648-4730) и lacI promoter (4731-4808 п.н.);
- Т7 promoter (5115-5135 п.н.) - сильный промотор, обеспечивающий высокий уровень транскрипции;
- lac operator (5136-5160 п.н.);
- RBS (5191-5196 п.н.) - сайт связывания рибосомы;
- GST (5205-5857 п.н.) - ген белка-помощника глутатион-S-трансферазы из Scihistosoma japonicum, обеспечивающий выход целевого белка в периплазму;
- CD (5865-7235 п.н.) - ген, кодирующий эктодомен Gc вирусного гликопротеина;
- MCS (7288-7292 п.н.) - мультиклональный сайт;
- 6xHis (7293-7310 п.н.) для хроматографической очистки.
Указанный технический результат достигается созданием рекомбинантного штамма Escherichia coli BL21(DE3)pLysE рЕТ21-GST-CD -продуцента белка Gc - эктодомена гликопротеина вируса Хантаан, полученного трансформацией рекомбинантной плазмидой pET21-GST-CD и депонированного в Коллекции бактерий, бактериофагов и грибов ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора под регистрационным номером В-1386.
Изобретение иллюстрируется следующими графическими фигурами.
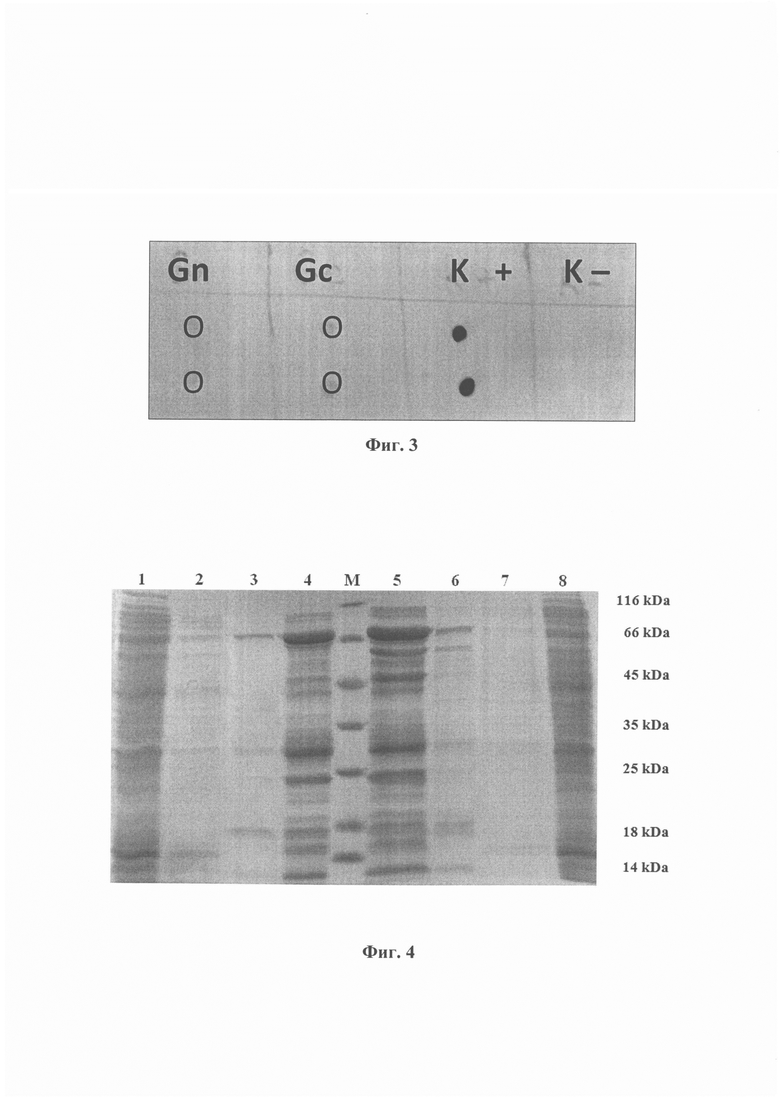
На фиг. 1 приведена нуклеотидная последовательность рекомбинантной плазмиды pET-GST-CD. На фиг. 2 представлена физическая и генетическая карта плазмидной конструкции pET21-GST-CD. На фиг. 3 представлены результаты дот-блот анализа. Полученные белки Gc, Gn взаимодействуют с сывороткой переболевшего вирусом Хантаан. Gc -взаимодействие с белком Gc, Gn - взаимодействие с белком Gn, K+ - положительный контроль, человеческое антитело 15742, против вируса Эбола, K- - отрицательный контроль, культуральная среда. На фиг. 4 представлена электрофореграмма разделения хроматографических фракций в 15% ПААГ: 1 - баластные (примесные) белки, полученные при очистке Gc, не связавшиеся с сорбентом (проскок нанесения), 2 - фракция примесных белков, полученная при очистке Gc, после промывки колонки промывочными буферами А, В, С, 3 - фракция целевого белка Gc, элюирующий буфер содержит 500 мМ имидазола, 4 - фракция целевого белка Gc, элюирующий буфер содержит 150 мМ имидазола, М - маркер молекулярного веса, 5 - фракция целевого белка Gn, элюирующий буфер содержит 150 мМ имидазола, 6 - фракция целевого белка Gn, элюирующий буфер содержит 500 мМ имидазола, 7 - фракция примесных белков, полученная при очистке Gn, после промывки колонки промывочными буферами А, В, С, 8 - баластные (примесные) белки, полученные при очистке Gn, не связавшиеся с сорбентом (проскок нанесения).
Для лучшего понимания сущности предлагаемого изобретения ниже приведены примеры (1-4) его осуществления.
Пример 1. Получение плазмидной генетической конструкции pET21-GST-CD
В качестве базиса плазмидных генетических конструкций была выбрана плазмида pET-GST-3CL-GPG (патент РФ №2774333 С1) на основе коммерческого вектора рЕТ21а(-), обеспечивающего высокий уровень синтеза и секреции целевого белка в клетках E.coli, штамм BL21(DE3)pLysE, содержащая ген глутатион-S-трансферазы (GST).
С помощью праймеров:

конструкции pcDNA-Han, содержащей полноразмерный ген поверхностного гликопротеина вируса Хантаан, был амплифицирован ген Gc размером 1416 п.н. ПЦР продукты и плазмиду pET-GST-3CL-GPG обрабатывали эндонуклеазами рестрикции BamHI и HindIII в соответствии с инструкциями производителя (ООО «СибЭнзайм»). Далее проводили лигирование гидролизованных фрагментов лигазой фага Т4 (ООО «СибЭнзайм») в соответствии с инструкциями производителя. Полученной ДНК методом heat-shock трансформировали клетки E.coli, штамм NebStable, клоны инокулировали в среде LB (1%, триптон, 0,5% дрожжевой экстракт, 1% NaCl, рН 7,0±0,2), нарабатывали клеточную биомассу и выделяли ДНК с помощью набора Plasmid Miniprep (ЗАО «Евроген») в соответствии с инструкциями производителя. В результате была получена конструкция pET21-GST-CD, ее идентичность спроектированной конструкции, приведенной на фиг. 2 и последовательности SEQ ID No. 1 (фиг. 1 и приложение) доказана секвенированием.
Рекомбинантный штамм Escherichia coli BL21(DE3)pLysE рЕТ21-GST-CD - продуцент белка Gc, получен трансформацией с помощью СаСl2 по общепринятой методике рекомбинантной плазмидой рЕТ21-GST-CD клеток E.coli, штамм BL21(DE3)pLysE и депонирован в Коллекции бактерий, бактериофагов и грибов ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора под регистрационным номером В-1386.
Пример 2. Культивирование штамма-продуцента Escherichia coli BL21(DE3)pLysE pET21-GST-CD, трансформированной плазмидной генетической конструкцией pET21-GST-CD, обеспечивающей синтез и секрецию целевого белка Gc - эктодомена гликопротеина вируса Хантаан
Первым этапом процесса культивирования была постановка ночной культуры продуцентов Escherichia coli BL21(DE3)pLysE рЕТ21-GST-CD. Для этого 100 мкл культуральной жидкости соответствующего штамма-продуцента добавляли в 10 мл среды LB, содержащей антибиотик ампициллин в концентрации 100 мкг/мл. Культивировали ночь при температуре 30°С, 160 об/мин.
Далее ночную культуру пересевали в колбы Эрленмейера объемом 750 мл, заполненные 150 мл среды 2xYT (1,6% триптон, 1% дрожжевой экстракт, 0,5% NaCl, рН 7,0±0,2), содержащей 100 мкг/мл ампициллина, в соотношении 1:100, нарабатывали культуру до плотности 0,6 - 0,7 при 37°С, 200 об/мин, добавляли IPTG до концентрации 1 mМ и культивировали ≈20 ч при 17°С. Центрифугировали на скорости 3000 g 15 мин. Осадок ресуспендировали в 30 мл охлажденного буфера А (50 mМ Tris-HCl, 200 mМ NaCl, глицерин 2%, 10 mM имидазол), добавляли 100х лизоцим для разрушения бактериальной стенки (25 мг/мл водный раствор), инкубировали 30 мин на льду, добавляли 100х ингибитор протеаз PMSF (17,4 мг/мл, спиртовой раствор), озвучивали 8×1 мин, центрифугировали 20000 g 20 мин, отбирали супернатант. Наличие белка Gc в супернатанте определяли дот-блотом с использованием сывороток переболевших вирусом Хантаан (фиг 3).
Пример 3. Выделение и очистка целевого белка Gc - эктодомена гликопротеина вируса Хантаан, полученного с помощью штамма-продуцента E.coIi-BL21-pET21-GST-CD, трансформированного плазмидной генетической конструкцией pET21-GST-CD
1. К полученному супернатанту, содержащему белок Gc, добавляли сорбент Ni-sepharose (~1 мл) с нанесенным 0,2 М NiСl2×6Н2О, инкубировали в качалке с охлаждением (+4°С) в течение ночи.
2. Далее через пустую хроматографическую колонку пропускали лизат с сорбентом.
3. Осевший в колонке сорбент, связавший белок, промывали 10 объемами буфера А.
4. Затем последовательно промывали 10 объемами буфера В (буфер А+ 0,1% Triton × 100) и 10 объемами буфера С (буфер А+1 М NaCl).
5. Целевой белок Gc элюировали в 5 мл буфера А, содержащего 150 мМ имидазола, и в 5 мл буфера А, содержащего 500 мМ имидазола.
6. Наличие и чистоту целевых белков Gc (55 kDa) оценивали с помощью электрофореза в ПААГ. Результаты очистки представлены на фиг 4.
Пример 4. Проверка специфического взаимодействия белка Gc с сыворотками переболевших вирусом Хантаан
Препарат белка Gc, а также положительный контроль - человеческое антитело 15742 против вируса Эболы и отрицательный контроль - культуральную среду наносили на нитроцеллюлозную бумагу, блокировали буфером PbS + 0,1% TWEEN20 + 1% BSA в течение 5 минут. Далее промывали буфером PbS + 0,1% TWEEN20. После удаления промывочного буфера вакуумом добавляли раствор сыворотки переболевшего вирусом Хантаан в 10 мл блокирующего буфера в соотношении 1:5000, инкубировали 10 мин, раствор удаляли вакуумом. Промывали буфером PbS + 0,1% TWEEN20, раствор удаляли вакуумом. Далее образцы инкубировали в течение 10 мин с раствором антител AntiHuman Alkaline Phosphatase в блокирующем буфере в соотношении 1:1000, промывали буфером PbS + 0,1% TWEEN20, раствор удаляли вакуумом. Инкубировали образцы на нитроцеллюлозной бумаге с реактивом Pierce 1-Step NBT/BCIP Substrate Solution (ThermoFisher) 10 мин. Результаты представлены на фиг. 3. Показано специфическое взаимодействие белка Gc с сывороткой переболевшего вирусом Хантаан.
Источники научно-технической и патентной информации
1. Патент РФ №2294563 С2. Способ моделирования заболевания, вызываемого вирусом хантаан - возбудителем геморрагической лихорадки с почечным синдромом, на экспериментальном животном / Логинова, С.Я., Ковальчук, А.В., Борисевич, С.В., Хамитов Р.А., Максимов В.А. Заявка: 2005102233/14, 01.02.2005. Опубликовано: 27.02.2007 Бюл. №6
2. Liu R., Ma Н., Shu J., Zhang Q., Han M., Liu Z., Jin X., Zhang F., Wu X. Vaccines and Therapeutics Against Hantaviruses // Frontiers in Microbiology. -2020.-T. 10-C.1-19.
3. Song J. Y., Jeong H. W., Yun J. W., Lee J., Woo H. J., Bae J.-Y, Park M.-S., Choi W. S., Park D. W., Noh J. Y., Cheong H. J, Kim W.J. Immunogenicity and safety of a modified three-dose priming and booster schedule for the Hantaan virus vaccine (Hantavax): A multi-center phase III clinical trial in healthy adults // Vaccine - 2020. - T. 38 - C. 8016-8023.
4. Бархалева O.A., Воробьева M.C., Ладыженская И.П. Вакцина против геморрагической лихорадки с почечным синдромом // Биопрепараты - 2011. - №1 - С. 27-30.
5. Engdahl Т.В., Crowe J.E. Humoral Immunity to Hantavirus Infection // mSphere - 2020. - T. 5 - №4 - C. e00482-20.
6. Ткаченко E.A., Ишмухаметов A.A., Дзагурова Т.К., Синюгина А.А., Коротина Н.А., Набатников П.А., Соцкова С.Е., Баловнева М.В., Малкин А.Е. Разработка экспериментально- промышленной технологии производства вакцины для профилактики геморрагической лихорадки с почечным синдромом // Ремедиум. Журнал о российском рынке лекарств и медицинской технике - 2015. - С. 47-53.
7. Синюгина А.А., Ишмухаметов А.А., Дзагурова Т.К., Баловнева М.В., Егорова М.С., Курашова С.С., Коротина НА., Леонович О.А., Балкина А.С., Ткаченко Е.А. Вакцины для профилактики хантавирусных лихорадок // Эпидемиология и вакцинопрофилактика - 2019. - Т. 7 - №495 - С. 98-108.
8. Xu Z., Wei L., Wang L., Wang H., Jiang S.The in vitro and in vivo protective activity of monoclonal antibodies directed against Hantaan virus: Potential application for immunotherapy and passive immunization // Biochemical and Biophysical Research Communications - 2002. - T. 298 - №4 - C. 552-558.
9. Perley C.C., Brocato R.L., Wu H., Bausch C, Karmali P.P., Vega J.B., Cohen M. V., Somerville В., Kwilas S.A., Principe L.M., Shamblin J., Chivukula P., Sullivan E., Hooper J.W. Anti-HFRS Human IgG Produced in Transchromosomic Bovines Has Potent Hantavirus Neutralizing Activity and Is Protective in Animal Models // Frontiers in Microbiology - 2020. - T. 11 - C. 1-13.
10. Guardado-Calvo P., Bignon E.A., Stettner E., Jeffers S.A., Perez-Vargas J., Pehau-Arnaudet G., Tortorici M.A., Jestin J.L., England P., Tischler N.D., Rey F.A. Mechanistic Insight into Bunyavirus-Induced Membrane Fusion from Structure-Function Analyses of the Hantavirus Envelope Glycoprotein Gc // PLoS Pathogens - 2016. - Т. 12 - №10.
11. Rissanen I., Krumm S.A., Stass R., Whitaker A., Voss J.E., Bruce E.A., Rothenberger S. Structural Basis for a Neutralizing Antibody Response Elicited by a Recombinant Hantaan Virus Gn Immunogen // mBio - 2021. - T. 12 - №4 -C. e02531-20.
12. Патент РФ №2539836. Способ получения рекомбинантного ферментативно-меченного антигена G2 хантавируса в клетках E.coli с целью его применения в иммуноферментном анализе при диагностике ГЛПС Опубликовано: 27.01.2015 Бюл. №3 / Смирнова М.С., Леонович О.А., Казеева Т.Н., Кузьмин В.А., Дурандин Н.А., Шибаева А.В., Гра О.А., Елагина Е.М., Маракасова Е.С., Белякова А.В., Зылькова М.В., Шевелев А.Б. - 2006. - №19-С. 146-156.
13. Патент РФ №2509805. Способ получения рекомбинантного антигена G2 хантавируса добрава в клетках E.coli. Опубликовано: 20.03.2014 Бюл. №8 (56)/ Смирнова М.С., Леонович О.А., Казеева Т.Н., Мутных Е.С., Папуниди К.Ф., Маракасова Е.С., Филимонова Н.А., Осипенко О.В., Белякова А.В., Зылькова М.В., Шевелев А.Б. - 2012. - №19 (прототип).
14. Патент РФ №2774333 С1. Рекомбинантная плазмида pET-GST-3CL-GPG, обеспечивающая синтез протеазы 3CL SARS-CoV-2 в клетках E.coli в растворимой форме / Щербаков Д.Н, Беленькая С.В., Волосникова Е.А., Назаров К.Д. Федеральное бюджетное учреждение науки "Государственный научный центр вирусологии и биотехнологии "Вектор" Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (ФБУН ГНЦ ВБ "Вектор" Роспотребнадзора) (RU) Дата подачи заявки: 27.12.2021 Опубликовано: 17.06.2022 Бюл. №17. 16 С.
--->
<?xml version="1.0" encoding="UTF-8"?>
<!DOCTYPE ST26SequenceListing PUBLIC "-//WIPO//DTD Sequence Listing
1.3//EN" "ST26SequenceListing_V1_3.dtd">
<ST26SequenceListing dtdVersion="V1_3" fileName="Послед_рекомб
плазмида pET21-GST-CD_белок Gc_31.01.2023.xml" softwareName="WIPO
Sequence" softwareVersion="2.2.0" productionDate="2023-01-31">
<ApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>1234567</ApplicationNumberText>
<FilingDate>2023-01-09</FilingDate>
</ApplicationIdentification>
<ApplicantFileReference>1234567</ApplicantFileReference>
<EarliestPriorityApplicationIdentification>
<IPOfficeCode>RU</IPOfficeCode>
<ApplicationNumberText>1234567</ApplicationNumberText>
<FilingDate>2023-01-01</FilingDate>
</EarliestPriorityApplicationIdentification>
<ApplicantName languageCode="ru">Федеральное бюджетное учреждение
науки «Государственный научный центр вирусологии и биотехнологии
«Вектор» Федеральной службы по надзору в сфере защиты прав
потребителей и благополучия человека (ФБУН ГНЦ ВБ «Вектор»
Роспотребнадзора) (RU]</ApplicantName>
<ApplicantNameLatin>Federalnoe byudzhetnoe uchrezhdenie nauki
"Gosudarstvennyj nauchnyj tsentr virusologii i biotekhnologii
"Vektor" Federalnoj sluzhby po nadzoru v sfere zashchity
prav potrebitelej i blagopoluchiya cheloveka (FBUN GNTS VB
"Vektor" Rospotrebnadzora) (RU)</ApplicantNameLatin>
<InventionTitle languageCode="ru">Рекомбинантная плазмида
pET21-GST-CD, обеспечивающая синтез и секрецию эктодомена Gc
гликопротеина вируса Хантаан и рекомбинантный штамм Escherichia coli
BL21(DE3)pLysE pET21-GST-CD – продуцент белка Gc - эктодомена
гликопротеина вируса Хантаан</InventionTitle>
<SequenceTotalQuantity>1</SequenceTotalQuantity>
<SequenceData sequenceIDNumber="1">
<INSDSeq>
<INSDSeq_length>7449</INSDSeq_length>
<INSDSeq_moltype>DNA</INSDSeq_moltype>
<INSDSeq_division>PAT</INSDSeq_division>
<INSDSeq_feature-table>
<INSDFeature>
<INSDFeature_key>source</INSDFeature_key>
<INSDFeature_location>1..7449</INSDFeature_location>
<INSDFeature_quals>
<INSDQualifier>
<INSDQualifier_name>mol_type</INSDQualifier_name>
<INSDQualifier_value>other DNA</INSDQualifier_value>
</INSDQualifier>
<INSDQualifier id="q2">
<INSDQualifier_name>organism</INSDQualifier_name>
<INSDQualifier_value>synthetic construct</INSDQualifier_value>
</INSDQualifier>
</INSDFeature_quals>
</INSDFeature>
</INSDSeq_feature-table>
<INSDSeq_sequence>tggcgaatgggacgcgccctgtagcggcgcattaagcgcggcgggtgtg
gtggttacgcgcagcgtgaccgctacacttgccagcgccctagcgcccgctcctttcgctttcttccctt
cctttctcgccacgttcgccggctttccccgtcaagctctaaatcgggggctccctttagggttccgatt
tagtgctttacggcacctcgaccccaaaaaacttgattagggtgatggttcacgtagtgggccatcgccc
tgatagacggtttttcgccctttgacgttggagtccacgttctttaatagtggactcttgttccaaactg
gaacaacactcaaccctatctcggtctattcttttgatttataagggattttgccgatttcggcctattg
gttaaaaaatgagctgatttaacaaaaatttaacgcgaattttaacaaaatattaacgtttacaatttca
ggtggcacttttcggggaaatgtgcgcggaacccctatttgtttatttttctaaatacattcaaatatgt
atccgctcatgagacaataaccctgataaatgcttcaataatattgaaaaaggaagagtatgagtattca
acatttccgtgtcgcccttattcccttttttgcggcattttgccttcctgtttttgctcacccagaaacg
ctggtgaaagtaaaagatgctgaagatcagttgggtgcacgagtgggttacatcgaactggatctcaaca
gcggtaagatccttgagagttttcgccccgaagaacgttttccaatgatgagcacttttaaagttctgct
atgtggcgcggtattatcccgtattgacgccgggcaagagcaactcggtcgccgcatacactattctcag
aatgacttggttgagtactcaccagtcacagaaaagcatcttacggatggcatgacagtaagagaattat
gcagtgctgccataaccatgagtgataacactgcggccaacttacttctgacaacgatcggaggaccgaa
ggagctaaccgcttttttgcacaacatgggggatcatgtaactcgccttgatcgttgggaaccggagctg
aatgaagccataccaaacgacgagcgtgacaccacgatgcctgcagcaatggcaacaacgttgcgcaaac
tattaactggcgaactacttactctagcttcccggcaacaattaatagactggatggaggcggataaagt
tgcaggaccacttctgcgctcggcccttccggctggctggtttattgctgataaatctggagccggtgag
cgtgggtctcgcggtatcattgcagcactggggccagatggtaagccctcccgtatcgtagttatctaca
cgacggggagtcaggcaactatggatgaacgaaatagacagatcgctgagataggtgcctcactgattaa
gcattggtaactgtcagaccaagtttactcatatatactttagattgatttaaaacttcatttttaattt
aaaaggatctaggtgaagatcctttttgataatctcatgaccaaaatcccttaacgtgagttttcgttcc
actgagcgtcagaccccgtagaaaagatcaaaggatcttcttgagatcctttttttctgcgcgtaatctg
ctgcttgcaaacaaaaaaaccaccgctaccagcggtggtttgtttgccggatcaagagctaccaactctt
tttccgaaggtaactggcttcagcagagcgcagataccaaatactgtccttctagtgtagccgtagttag
gccaccacttcaagaactctgtagcaccgcctacatacctcgctctgctaatcctgttaccagtggctgc
tgccagtggcgataagtcgtgtcttaccgggttggactcaagacgatagttaccggataaggcgcagcgg
tcgggctgaacggggggttcgtgcacacagcccagcttggagcgaacgacctacaccgaactgagatacc
tacagcgtgagctatgagaaagcgccacgcttcccgaagggagaaaggcggacaggtatccggtaagcgg
cagggtcggaacaggagagcgcacgagggagcttccagggggaaacgcctggtatctttatagtcctgtc
gggtttcgccacctctgacttgagcgtcgatttttgtgatgctcgtcaggggggcggagcctatggaaaa
acgccagcaacgcggcctttttacggttcctggccttttgctggccttttgctcacatgttctttcctgc
gttatcccctgattctgtggataaccgtattaccgcctttgagtgagctgataccgctcgccgcagccga
acgaccgagcgcagcgagtcagtgagcgaggaagcggaagagcgcctgatgcggtattttctccttacgc
atctgtgcggtatttcacaccgcatatatggtgcactctcagtacaatctgctctgatgccgcatagtta
agccagtatacactccgctatcgctacgtgactgggtcatggctgcgccccgacacccgccaacacccgc
tgacgcgccctgacgggcttgtctgctcccggcatccgcttacagacaagctgtgaccgtctccgggagc
tgcatgtgtcagaggttttcaccgtcatcaccgaaacgcgcgaggcagctgcggtaaagctcatcagcgt
ggtcgtgaagcgattcacagatgtctgcctgttcatccgcgtccagctcgttgagtttctccagaagcgt
taatgtctggcttctgataaagcgggccatgttaagggcggttttttcctgtttggtcactgatgcctcc
gtgtaagggggatttctgttcatgggggtaatgataccgatgaaacgagagaggatgctcacgatacggg
ttactgatgatgaacatgcccggttactggaacgttgtgagggtaaacaactggcggtatggatgcggcg
ggaccagagaaaaatcactcagggtcaatgccagcgcttcgttaatacagatgtaggtgttccacagggt
agccagcagcatcctgcgatgcagatccggaacataatggtgcagggcgctgacttccgcgtttccagac
tttacgaaacacggaaaccgaagaccattcatgttgttgctcaggtcgcagacgttttgcagcagcagtc
gcttcacgttcgctcgcgtatcggtgattcattctgctaaccagtaaggcaaccccgccagcctagccgg
gtcctcaacgacaggagcacgatcatgcgcacccgtggggccgccatgccggcgataatggcctgcttct
cgccgaaacgtttggtggcgggaccagtgacgaaggcttgagcgagggcgtgcaagattccgaataccgc
aagcgacaggccgatcatcgtcgcgctccagcgaaagcggtcctcgccgaaaatgacccagagcgctgcc
ggcacctgtcctacgagttgcatgataaagaagacagtcataagtgcggcgacgatagtcatgccccgcg
cccaccggaaggagctgactgggttgaaggctctcaagggcatcggtcgagatcccggtgcctaatgagt
gagctaacttacattaattgcgttgcgctcactgcccgctttccagtcgggaaacctgtcgtgccagctg
cattaatgaatcggccaacgcgcggggagaggcggtttgcgtattgggcgccagggtggtttttcttttc
accagtgagacgggcaacagctgattgcccttcaccgcctggccctgagagagttgcagcaagcggtcca
cgctggtttgccccagcaggcgaaaatcctgtttgatggtggttaacggcgggatataacatgagctgtc
ttcggtatcgtcgtatcccactaccgagatatccgcaccaacgcgcagcccggactcggtaatggcgcgc
attgcgcccagcgccatctgatcgttggcaaccagcatcgcagtgggaacgatgccctcattcagcattt
gcatggtttgttgaaaaccggacatggcactccagtcgccttcccgttccgctatcggctgaatttgatt
gcgagtgagatatttatgccagccagccagacgcagacgcgccgagacagaacttaatgggcccgctaac
agcgcgatttgctggtgacccaatgcgaccagatgctccacgcccagtcgcgtaccgtcttcatgggaga
aaataatactgttgatgggtgtctggtcagagacatcaagaaataacgccggaacattagtgcaggcagc
ttccacagcaatggcatcctggtcatccagcggatagttaatgatcagcccactgacgcgttgcgcgaga
agattgtgcaccgccgctttacaggcttcgacgccgcttcgttctaccatcgacaccaccacgctggcac
ccagttgatcggcgcgagatttaatcgccgcgacaatttgcgacggcgcgtgcagggccagactggaggt
ggcaacgccaatcagcaacgactgtttgcccgccagttgttgtgccacgcggttgggaatgtaattcagc
tccgccatcgccgcttccactttttcccgcgttttcgcagaaacgtggctggcctggttcaccacgcggg
aaacggtctgataagagacaccggcatactctgcgacatcgtataacgttactggtttcacattcaccac
cctgaattgactctcttccgggcgctatcatgccataccgcgaaaggttttgcgccattcgatggtgtcc
gggatctcgacgctctcccttatgcgactcctgcattaggaagcagcccagtagtaggttgaggccgttg
agcaccgccgccgcaaggaatggtgcatgcaaggagatggcgcccaacagtcccccggccacggggcctg
ccaccatacccacgccgaaacaagcgctcatgagcccgaagtggcgagcccgatcttccccatcggtgat
gtcggcgatataggcgccagcaaccgcacctgtggcgccggtgatgccggccacgatgcgtccggcgtag
aggatcgagatctcgatcccgcgaaattaatacgactcactataggggaattgtgagcggataacaattc
ccctctagaaataattttgtttaactttaagaaggagatatacatatgtcccctatactaggttattgga
aaattaagggccttgtgcaacccactcgacttcttttggaatatcttgaagaaaaatatgaagagcattt
gtatgagcgcgatgaaggtgataaatggcgaaacaaaaagtttgaattgggtttggagtttcccaatctt
ccttattatattgatggtgatgttaaattaacacagtctatggccatcatacgttatatagctgacaagc
acaacatgttgggtggttgtccaaaagagcgtgcagagatttcaatgcttgaaggagcggttttggatat
tagatacggtgtttcgagaattgcatatagtaaagactttgaaactctcaaagttgattttcttagcaag
ctacctgaaatgctgaaaatgttcgaagatcgtttatgtcataaaacatatttaaatggtgatcatgtaa
cccatcctgacttcatgttgtatgacgctcttgatgttgttttatacatggacccaatgtgcctggatgc
gttcccaaaattagtttgttttaaaaaacgtattgaagctatcccacaaattgataagtacttgaaatcc
agcaagtatatagcatggcctttgcagggctggcaagccacgtttggtggtggcgaccatcctccaaaag
gatcctcagagacaccattaactcctgtctggaatgacaatgcccatggggtaggttctgttcctatgca
tacagatttagagcttgatttctctttaacatccagttccaagtatacataccgtaggaagttaacaaac
ccacttgaggaagcacaatccattgacctacatattgaaatagaagaacagacaattggtgttgatgtgc
atgctctaggacactggtttgatggtcgtcttaaccttaaaacatcctttcactgttatggtgcttgtac
aaagtatgaatacccttggcatactgcaaagtgccattatgaaagagattaccaatatgagacgagctgg
ggttgtaatccatcagattgtcctggggtgggcacaggctgtacagcatgtggtttatacctagatcaac
tgaaaccagttggtagtgcttataaaattatcacaataaggtacagcaggagagtctgtgttcagtttgg
ggaggaaaacctttgtaagataatagacatgaatgattgttttgtatctaggcatgttaaggtctgcata
attggtacagtatctaaattctctcagggtgataccttattgttttttggaccgcttgaaggtggtggtc
taatatttaaacactggtgtacatccacatgtcaatttggtgacccaggagatatcatgagtccaagaga
caaaggttttttatgccctgagtttccaggtagtttcaggaagaaatgcaactttgctactacccctatt
tgtgagtatgatggaaatatggtctcaggttacaagaaagtgatggcgacaattgattccttccaatctt
ttaatacaagcactatgcacttcactgatgaaaggatagagtggaaagaccctgatggaatgctaaggga
ccatataaacattttagtaacgaaggacattgactttgataaccttggtgaaaatccttgcaaaattggc
ctacaaacatcttctattgagggggcctggggttctggtgtggggttcacattaacatgtctggtatcac
taacagaatgtcctacctttttgacctcaataaaggcttgtgataaggctatctgttatggtgcagagag
tgtaacattgacaagaggacaaaatacagtcaaggtatcagggaaaggtggccatagtggttcaacattt
aggtgttgccatggggaggactgttcacaaattggactccatgctgctgcacctcaccttgacaaggtaa
atgggatttctgagatagaaaatagtaaagtatatgatgatggggcaccgcaatgtgggataaaatgttg
gtttgttaaatcaggggaatggatttcagggatattcagtggtaatcatcatcaccatcaccactaaaag
cttaagtttaaaccgctgatcagcctcgtcgagcaccaccaccaccaccactgagatccggctgctaaca
aagcccgaaaggaagctgagttggctgctgccaccgctgagcaataactagcataaccccttggggcctc
taaacgggtcttgaggggttttttgctgaaaggaggaactatatccggat</INSDSeq_sequence>
</INSDSeq>
</SequenceData>
</ST26SequenceListing>
<---




Группа изобретений относится к области биотехнологии. Предложена рекомбинантная плазмидная генетическая конструкция рЕТ21-GST-CD, обеспечивающая синтез и секрецию белка Gc - эктодомена гликопротеина вируса Хантаан, имеющая нуклеотидную последовательность SEQ ID NО: 1 размером 7449 п.н. Предложен также рекомбинантный штамм Escherichia coli BL21(DE3)pLysE рЕТ21-GST-CD - продуцент указанного белка Gc, полученный трансформацией указанной плазмидой и депонированный в Коллекции бактерий, бактериофагов и грибов ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора под регистрационным номером В-1386. Изобретения обеспечивают продукцию полноразмерного эктодомена Gc гликопротеина вируса Хантаан. 2 н.п. ф-лы, 4 ил., 4 пр.
1. Рекомбинантная плазмидная генетическая конструкция рЕТ21-GST-CD, обеспечивающая синтез и секрецию белка Gc - эктодомена гликопротеина вируса Хантаан в клетках E.coli для получения нейтрализующих антител в организме против указанного вируса, имеющая нуклеотидную последовательность SEQ ID NО: 1 размером 7449 п.н. и содержащая в соответствии с физической и генетической картой, представленной на фиг. 2, следующие элементы:
- f1 ori представляет собой фаговый ori, который обеспечивает репликацию и упаковку одноцепочечной ДНК в фаговые частицы и имеет координаты 12-467 п.н.;
- ген устойчивости к антибиотику ампициллин AmpR с координатами 599-1459 п.н. и бактериальный промотор гена устойчивости к ампициллину AmpR promoter с координатами 494-598 п.н., позволяющие проводить препаративную наработку плазмиды в E.coli;
- участок начала репликации ori, имеющий координаты 1630-2218 п.н.;
- rop с координатами 2648-2839 п.н. - димерный белок, участвующий в механизме, контролирующем количество копий плазмиды;
- lacI с координатами 3648-4730 и lacI promoter с координатами 4731-4808 п.н.;
- Т7 promoter - сильный промотор, обеспечивающий высокий уровень транскрипции и имеющий координаты 5115-5135 п.н.;
- lac operator, имеющий координаты 5136-5160 п.н.;
- RBS с координатами 5191-5196 п.н. - сайт связывания рибосомы;
- GST - ген белка-помощника глутатион-S-трансферазы, обеспечивающий выход целевого белка в периплазму и имеющий координаты 5205-5857 п.н.;
- CD - ген, кодирующий эктодомен Gc вирусного гликопротеина и имеющий координаты 5865-7235 п.н.;
- MCS - мультиклональный сайт, имеющий координаты 7288-7292 п.н.;
- 6xHis, предназначенный для хроматографической очистки белка Gc - эктодомена гликопротеина вируса Хантаан и имеющий координаты 7293-7310 п.н.
2. Рекомбинантный штамм Escherichia coli BL21(DE3)pLysE рЕТ21-GST-CD - продуцент белка Gc - эктодомена гликопротеина вируса Хантаан для наработки нейтрализующих антител в организме против указанного вируса, полученный трансформацией рекомбинантной плазмидой рЕТ21-GST-CD и депонированный в Коллекции бактерий, бактериофагов и грибов ФБУН ГНЦ ВБ «Вектор» Роспотребнадзора под регистрационным номером В-1386.
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО АНТИГЕНА G2 ХАНТАВИРУСА ДОБРАВА В КЛЕТКАХ E. coli | 2011 |
|
RU2495938C2 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО АНТИГЕНА G2 ХАНТАВИРУСА ДОБРАВА В КЛЕТКАХ E.coli | 2012 |
|
RU2509805C2 |
| US 2004053216 A1, 18.03.2004 | |||
| BATTISTI, A.J | |||
| et al | |||
| Structural Studies of Hantaan Virus | |||
| JOURNAL OF VIROLOGY | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
| ЯШИНА, Л.Н | |||
| и др | |||
| Молекулярная эпидемиология патогенных хантавирусов на Дальнем Востоке России, 2015-2018 гг | |||
| ПРОБЛЕМЫ ОСОБО ОПАСНЫХ ИНФЕКЦИЙ | |||
| Станок для придания концам круглых радиаторных трубок шестигранного сечения | 1924 |
|
SU2019A1 |
Авторы
Даты
2023-11-15—Публикация
2023-03-21—Подача