Изобретение относится к области биотехнологии, а именно к способу оценки процесса формирования сосудистой сети на хориоаллантоисной мембране куриного эмбриона, который может быть использован для исследования возможности применения биополимерного материала в области тканевой инженерии и регенеративной медицины.
Под термином скаффолд в рамках данного изобретения понимаются трехмерные пористые или волокнистые матрицы, выполняющие функцию механического каркаса для клеток [Митрошин А.Н., Федорова М.Г., Латынова И.В., Нефедов А.А. Современные представления о применении скаффолдов в регенеративной медицине (обзор литературы) // Медицинские науки. Патологическая анатомия. - 2019. - №2 (50). - С. 133-143. DOI 10.21685/2072-3032-219-2-12].
Известен метод, в ходе которого хориоаллантоисная мембрана куриного эмбриона используется для идентификации веществ, обладающих биологическим действием.
Метод исследования, или анализ, хориоаллантоисной мембраны (далее ХАМ) содержит сведения об идентификации и/или оценке веществ с биологическими эффектами (например, средств, которые влияют на ангиогенез или стимулируют нейрогенез, или которые способны подавлять определенный ген(ы)), и для оценки токсичности различных агентов (например, для тестирования токсичности агентов-кандидатов с желаемыми биологическими эффектами).
Известный метод исследования ХАМ включает этапы: (i) размещение 2-4-дневных эмбрионов цыплят, которые были извлечены из скорлупы, в отдельные чашки для поддержания указанных эмбрионов на этапах (ii)-(vii), где каждая чашка также содержит подходящее количество питательной среды, (ii) инкубация указанных эмбрионов в течение примерно 24 часов, (iii) измерение размера хориоаллантоисной мембраны (ХАМ), развившейся у каждого эмбриона, и группирование указанных эмбрионов, имеющих ХАМ по существу одинакового размера, (iv) нанесение на один или несколько эмбрионов в выбранной группе агента-кандидата, где указанный агент-кандидат наносят на каждый эмбрион путем абсорбции агента-кандидата на пористую или иным образом сорбирующую подложку и размещение указанной подложки в контакте с ХАМ таким образом, чтобы по меньшей мере часть агента-кандидата после этого диффундировала с указанной подложки на ХАМ, (v) инкубация эмбриона(ов), полученных на этапе (iv), и контрольного(ых) эмбриона(ов) из одной и той же выбранной группы в течение примерно от 18 до 24 часов, (vi) введение в ХАМ каждого эмбриона на этапе (v) контрастного вещества - композиции, содержащей латекс или подобное вещество и красящее вещество подходящего цвета, и (vii) определение того, влияет ли указанный агент-кандидат на ХАМ и/или эмбрион, путем наблюдения различий между ХАМ(и) и/или эмбрионом(ами), к которым применяли агент-кандидат, и ХАМ и/или эмбрионом(ами) контрольной группы. [Международный номер публикации WO 03/055530 A1, международная дата публикации 10.07.2003. Название: Chorioallantoic membrane (cam) assay for identifying agents with biological effects (Анализ хориоаллантоисной мембраны (CАМ) для идентификации агентов с биологическим действием)]
Недостатками аналога являются:
а) требуется извлечение 2-4-дневных эмбрионов цыплят из скорлупы и перемещение в отдельные чашки, что может повысить риск контаминации и требует наличия определенных навыков у оператора, выполняющего процедуру;
б) требуется проведение дополнительной процедуры - введение контрастного вещества - композиции, содержащей латекс или подобное вещество и красящее вещество подходящего цвета для визуализации изменений сосудистой сети;
в) непродолжительное влияние исследуемого вещества на поверхность хориоаллантоисной мембраны куриного эмбриона (от 18 до 24 часов).
Известен метод использования тест-системы на основе хориоаллантоисной мембраны куриного эмбриона для прогнозирования офтальмораздражающего потенциала геля, содержащего цистеамин.
Раздражающий потенциал офтальмологического препарата может быть определен количественно при использовании данного метода, путем контроля повреждения кровеносных сосудов.
Оплодотворенные куриные яйца были получены в нулевой день (кроссы Доркинг-Виандотт или Доркинг-Род-Айленд Ред). Поскольку яйца не были инкубированы, они были неразвиты на этом этапе. Яйца инкубировали при 37±0,5°С и влажности 40±5% в течение 9 дней. Яйца инкубировали в горизонтальном положении, чтобы обеспечить правильное расположение эмбриона (вдали от ХAM). Переворачивали вручную на 180 градусов не менее трех раз в день в течение теста, чтобы обеспечить правильное развитие и жизнеспособность эмбриона. Точное время помещения в инкубатор было отмечено как Т0. На 9-й день яйца просвечивали для проверки оплодотворенности. После 10 полных дней инкубирования, начинали эксперимент.
Каждое яйцо вынимали из инкубатора по отдельности и помещали яйцо в держатель тупым концом вверх. Скорлупу срезали чуть выше линии хориоаллантоисной мембраны с помощью Dremell Multitool (Иллинойс, США) с вращающейся режущей насадкой. Как только участок скорлупы удаляли, внутреннюю оболочку, локализованную в непосредственном контакте с ХАМ увлажняли 2 мл 0,9% физиологического раствора, добавляемого пипеткой. Внутреннюю оболочку затем аккуратно удаляли щипцами, не травмируя кровеносные сосуды, чтобы открыть доступ к хориоаллантоисной мембране, локализованной ниже. Затем тот же объем тестового раствора добавляли непосредственно на поверхность ХАМ, используя пипетку, и запускали таймер. Любой лизис, кровотечение и/или коагуляцию в разные периоды времени в течение 5 минут после нанесения исследуемого раствора регистрировали и сравнивали с контролями: физиологический раствор (отрицательный), раствор гидроксида натрия (положительный). Делали фотографии для регистрации количественных данных. Каждый тест выполняли 5 раз.
Полуколичественный анализ был выполнен с использованием фотографий, где тяжесть любого кровотечения оценивали по шкале от 0 (нет реакции) до 3 (сильная реакция) с использованием метода, разработанного Gupta и соавт. Фотографии анализировали впоследствии с использованием ПО Adobe Photoshop и ImageJ для оценки повреждения сосудов. [McKenzie, B., Kay, G., Matthews, K. H., Knott, R. M., & Cairns, D. (2015). The hen’s egg chorioallantoic membrane (HET-CAM) test to predict the ophthalmic irritation potential of a cysteamine-containing gel: Quantification using Photoshop® and ImageJ. International Journal of Pharmaceutics, 490(1-2), 1-8. doi:10.1016/j.ijpharm.2015.05.023]
Недостатками аналога являются:
а) исследуемый образец помещают на поверхность хориоаллантоисной мембраны куриного эмбриона на 10 эмбриональный день, т.е. инкубирование яиц предварительно осуществляют в течение 10 дней, известно, что к 10 дню пролиферация клеток капилляров значительно снижается, после чего сосудистая сеть подвергается созреванию, что исключает возможность оценки влияния исследуемого образца на формирующуюся сосудистую сеть;
б) исследуемый образец находится на поверхности хориоаллантоисной мембраны в течение непродолжительного периода времени - 5 минут, что является недостаточным для оценки особенностей формирования сосудистого русла в области контакта с материалом.
Известно изобретение, которое относится к биотехнологии и медицине. На поверхность хориоаллантоисной мембраны (ХАМ) 6-7-дневных куриных эмбрионов чистых генетических линий апплицируют диски из лигнина, импрегнированные контрольными растворами и растворами исследуемого препарата, содержащими ангиогенин. После 96 ч инкубации эмбрионов ХАМ в зоне диска извлекают, фиксируют в формалине и помещают на строго ограниченную площадь, представляющую собой круг с диаметром 10 мм, разделенный на четыре сектора. Под лупой проводят прямой подсчет сосудов в каждом секторе. Сумма числа сосудов в четырех секторах представляет собой плотность сосудов на ограниченном участке ХАМ и является показателем активности ангиогенина. Способ обеспечивает количественную оценку ангиогенной активности в стандартных условиях, что делает возможным стандартизацию различных серий препарата и сопоставимости результатов экспериментальных и клинических исследований его действия [Способ тестирования активности ангиогенина; Номер патента: RU 2166511 C1, дата публикации: 2001.05.10. Заявка: 99121596/13, 1999.10.13. Авторы: Галахарь Н.Л., Уфимцева Е.Г. https://yandex.ru/patents/doc/RU2166511C1_20010510].
Недостатками аналога являются:
а) узкая направленность, только для стандартизации различных серий препарата, содержащих ангиогенин;
б) помещение исследуемого вещества на хориоаллантоисную мембрану на 6-7 эмбриональный день, что не предоставляет возможности оценить особенности влияния исследуемого образца на процесс формирования сосудистой сети на 3-5 сутки эмбрионального развития, когда хориоаллантоисная мембрана активно формируется;
в) использованный в ходе выполнения метода прямой подсчет сосудов под лупой позволяет учесть преимущественно крупные сосуды,
г) извлечение ХАМ и последующая ее фиксация в формалине могут повлиять на морфологию сформировавшейся в области контакта с исследуемым биоматериалом сосудистой сети.
Описан способ проведения анализа ex ovo ХАМ для оценки биосовместимости и ангиогенного ответа на биоматериалы. В эксперименте использовали оплодотворенные куриные яйца. Очищали яйца от грязи, перьев, экскрементов. Помещали яйца в горизонтальном положении в инкубатор с вращением, инкубировали в течение 3 дней при температуре 37-38°С, влажности 40-60%, вращении 12 раз в день. По окончании времени инкубации яйца перемещали в условия ламинарного бокса, аккуратно разбивали их, переносили содержимое в отдельные стерильные емкости, обеспечивая доступ к хориоаллантоисной мембране, емкости накрывали крышками. Помещали ex ovo культуры в инкубатор без вращения при температуре 37-38°С, влажности 60% до конца эксперимента - до 14 дня. На 7-8 эмбриональный день ex ovo культуры переносили в условия ламинарного шкафа. Стерильным пинцетом помещали исследуемый образец между эмбрионом и наружной границей хориоаллантоисной мембраны. На 11-14 день оценивали ангиогенный ответ на биоматериал, путем анализа фотографий высокого качества с помощью ПО ImageJ [Mangir N., Dikici S., Claeyssens F., MacNeil S. Using ex Ovo Chick Chorioallantoic Membrane (CAM) Assay To Evaluate the Biocompatibility and Angiogenic Response to Biomaterials // ACS Biomater. Sci. Eng. 2019, 5, 3190-3200. DOI: 10.1021/acsbiomaterials.9b00172].
Одним из недостатков аналога является использование подхода ex ovo, в связи с тем, что при выборе данной модификации повышается вероятность снижения показателей выживаемости эмбрионов. А также извлечение развивающегося куриного эмбриона из скорлупы яйца предполагает наличие определенных навыков у оператора, выполняющего процедуру. Согласно способу, исследуемый образец помещают на поверхность хориоаллантоисной мембраны на 7-8 день инкубирования, однако известно, что ХАМ активно развивается в период уже с 4 эмбрионального дня, в связи с чем данный способ не позволит оценить особенности влияния биоматериала на процессы формирования сосудистой сети.
Наиболее близким по своим признакам, принятым за прототип, является метод определения и оценки токсикологических показателей безопасности продукции, заключающийся в определении возникновения сосудистого повреждения хориоаллантоисной мембраны в ответ на воздействие испытуемой пробы. По изменению, которое может возникнуть в хориоаллантоисной мембране куриного эмбриона (увеличение сети капилляров, точечные и крупные кровоизлияния) при нанесении на нее испытуемой пробы, судят о ее потенциальной способности вызывать раздражение.
Испытания проводят на свежих фертильных куриных яйцах (не менее трех) массой от 50 до 60 г. В качестве контроля используют куриные яйца (не менее трех) с такими же характеристиками.
Куриные яйца ровно размещают на лотках инкубатора с автоматическим вращающимся элементом при (38,5 ± 0,5) °С и относительной влажности (62,2 ± 7,5) %. Вращение необходимо для предотвращения прилипания эмбриона к одной стороне яйца.
Необходимо проверять температуру и влажность в одно и то же время каждый день.
Через 6-7 дней после закладки просвечивают куриные яйца при помощи люминесцентной лампы для обеспечения оптимального освещения и отбраковывают «нежизнеспособные» (неоплодотворенные, тухлые или яйца с замершим зародышем).
Если яйцо пустое, тогда это означает, что эмбрион не развился или яйцо не было оплодотворено.
Если в яйце имеется развивающийся эмбрион, то хорошо видна темная масса.
При нормальном развитии зародыша на желтке видна хорошо развитая кровеносная система, а зародыш едва различим, так как он глубоко погружен в желток. При отсталом развитии зародыш лежит под скорлупой, кровеносная система на желтке развита слабо.
Удаляют неоплодотворенные яйца и яйца с зародышами, погибшими в первые дни инкубации, а также с зародышами, погибшими уже после развития кровеносной системы (кровяные кольца).
На девятый день повторно просвечивают яйца, отбраковывают все нежизнеспособные и опять помещают яйца тупыми концами вверх в инкубатор без вращения, тем самым обеспечивая доступность хориоаллантоисной мембраны.
Не допускается взбалтывание, излишний наклон и любые другие механические раздражения куриных яиц при их подготовке для проведения испытаний.
На десятый день куриное яйцо помещают на подставку для яиц тупым концом вверх. Маркером отмечают воздушную полость, медицинским пинцетом удаляют отмеченный участок скорлупы, освобождая от нее воздушную камеру. На поверхность подскорлуповой оболочки наслаивают 400 мм3 физиологического раствора для предотвращения высыхания. Куриное яйцо помещают обратно в инкубатор с температурой 38,5 ± 0,5 °С и относительной влажностью 62,2 ± 7,5 % на 20 мин для снятия травматического шока.
Последовательно, с интервалом в 3-5 мин. готовят 6 куриных яиц.
Через 20 мин последовательно, соблюдая интервал в 3-5 мин., извлекают вскрытые куриные яйца из инкубатора. Удаляют пинцетом подскорлуповую оболочку так, чтобы не повредить хориоаллантоисную мембрану. Если происходит повреждение хориоаллантоисной мембраны или возникают кровотечения, то эмбрион отбраковывают.
На освобожденную хориоаллантоисную мембрану трех из подготовленных куриных эмбрионов добавляют испытуемую пробу в дозе 0,05 г (см3), на оставшиеся три добавляют раствор NaCl с массовой долей 0,9 % или медицинское вазелиновое масло в том же объеме.
Через 5 мин аккуратно смывают физиологическим раствором испытуемый материал и регистрируют реакцию хориоаллантоисной мембраны [Межгосударственный стандарт ГОСТ 33506-2015 «Продукция парфюмерно-косметическая. Методы определения и оценки токсикологических показателей безопасности» (введен в действие приказом Федерального агентства по техническому регулированию и метрологии от 26 июля 2016 г. № 879-ст.].
Применение известного прототипа ограничивает наличие следующих недостатков:
а) исследуемый образец помещают на поверхность хориоаллантоисной мембраны куриного эмбриона на 10 эмбриональный день, известно, что к 10 дню пролиферация клеток капилляров значительно снижается, после чего сосудистая сеть подвергается созреванию, что исключает возможность оценки влияния исследуемого образца на формирующуюся сосудистую сеть;
б) исследуемый материал находится на поверхности хориоаллантоисной мембраны в течение непродолжительного периода времени - 5 минут, что не дает возможности оценить процесс формирования сосудистого русла в области контакта с материалом;
в) результатом выполнения метода является регистрация раздражающего действия материала на хориоаллантоисную мембрану куриного эмбриона, но не оценка влияния исследуемого материала на формирование сосудистой сети.
Из уровня техники не известен способ оценки формирования сосудистой сети на модели хориоаллантоисной мембраны куриного эмбриона
Задачей предлагаемого изобретения является создание способа оценки процесса формирования сосудистой сети на модели хориоаллантоисной мембраны куриного эмбриона.
Технический результат - сокращение до 9 дней времени, требующегося для изучения процесса формирования сосудистой сети, за счет помещения скаффолда на поверхность хориоаллантоисной мембраны куриного яйца после 72 часов инкубации, что позволит оценить особенности влияния исследуемого образца на процесс формирования сосудистой сети в период активного развития хориоаллантоисной мембраны, а также благодаря интенсификации процесса формирования сосудистой сети под воздействием статического магнитного поля умеренной интенсивности при использовании скаффолда, содержащего в своем составе суперпарамагнитные наночастицы оксида железа.
Способ оценки процесса формирования сосудистой сети на хориоаллантоисной мембране куриного эмбриона, включающий отбор оплодотворенных куриных яиц, инкубирование с вращением при постоянной температуре и влажности, удаление участка скорлупы на тупом конце яйца и размещение на освобожденной хориоаллантоисной мембране испытуемой пробы, содержит следующие новые неизвестные из уровня техники признаки:
- в качестве испытуемой пробы используют стерильный скаффолд из волокон хитозана массой 1,5 х 10-3 ± 0,6 х 10-3 г, содержащих в своем составе суперпарамагнитные наночастицы оксида железа,
- указанный скаффолд размещают на хориоаллантоисной мембране через 72 часа инкубирования при температуре 37,5°C; влажности 70-80%; с поворотом на 180° каждый час,
- после размещения скаффолда смотровое окно в скорлупе яйца закрывают пленкой,
- подготовленные яйца размещают на подставке, расположенной на расстоянии 8 см от неодимового магнита NdFeB в виде прутка размером 25х30 мм с никелевым покрытием, силой сцепления - 25 кг и остаточной магнитной индукцией - 1,22-1,25 Тесла, что обеспечивает воздействие на исследуемый материал статическим магнитным полем интенсивностью 50 - 80 мТл;
- повторно инкубируют яйцо со скаффолдом без вращения при температуре 37,5°С, влажности 70-80%, содержании СО2 3%, в течение 144 часов в условиях действия статического магнитного поля,
- затем на 9 эмбриональный день фотографируют поверхность хориоаллантоисной мембраны в области контакта с испытуемой пробой и выполняют анализ плотности сосудистой сети с использованием ПО ImageJ.
Предлагаемый способ оценки изменения процесса формирования сосудистой сети в присутствии скаффолдов различной природы основан на подходе in ovo, в связи с тем, что высоко васкуляризованная внеэмбриональная хориоаллантоисная мембрана (ХАМ) оплодотворенных куриных яиц представляет простой, легкодоступный и дешевый метод ангиогенного скрининга, в сравнении с другими животными моделями [Merckx et al, 2020. интернет-ссылка https://biblio.ugent.be/publication/8661644].
Известно, что действие магнитного поля способствует улучшению микроциркуляции, оказывает противовоспалительный, противоотечный эффекты (Паршиков и др, 2017; Zhao et al, 2017; Морозов и др., 2020), но неизвестно влияние его на формирование сосудистой сети.
В отличие от прототипа исследуемый материал, содержащий в своем составе суперпарамагнитные наночастицы оксида железа, помещают на поверхность хориоаллантоисной мембраны куриного яйца после 72 часов инкубации, что позволит оценить особенности влияния исследуемого образца на процесс формирования сосудистой сети в период активного развития хориоаллантоисной мембраны.
На 9 эмбриональный день фотографируют поверхность хориоаллантоисной мембраны в области контакта с исследуемым образцом и выполняют анализ плотности сосудистой сети с использованием ПО ImageJ.
Таким образом, разработанный способ оценки формирования сосудистой сети на модели хориоаллантоисной мембраны куриного эмбриона позволит изучать процессы васкулогенеза и ангиогенеза в присутствии скаффолда, содержащего в своем составе суперпарамагнитные наночастицы оксида железа, в условиях действия статического магнитного поля умеренной интенсивности за более короткие сроки, что приведет к снижению затрат на проведение исследования.
Для изготовления хитозановых волокон с суперпарамагнитными наночастицами оксида железа размером 50-100 нм Sigma-Aldrich (США) использован способ, описанный в источнике [Brüggemann D., Michel J., Suter N. et al. Wet-spinning of magneto-responsive helical chitosan microfibers // Nanotechnol. 2020. №11. P. 991-999]. Сначала готовят 0,5-1,0 % раствор уксусной кислоты, pH 2,8-3,0, путем разбавления ледяной уксусной кислоты (Диаэм, Россия) ультрачистой водой. К полученному раствору уксусной кислоты добавляют наночастицы оксида железа в концентрации 10 мг/мл. Далее раствор помещают в ультразвуковую ванну (ТЭКМАНН, Россия) и обрабатывают ультразвуком в течение 10 мин. В дальнейшем к смеси добавляют порошок хитозана низкой молекулярной массы Sigma-Aldrich Chemie GmbH (Германия) в концентрации 30 мг/мл и перемешивают полученную смесь на магнитной мешалке Biosan (Латвия) в течение 1 часа. Затем 1 мл полученного раствора хитозана с наночастицами оксида железа помещают в шприц объемом 5 мл с иглой 24G и выдавливают в одноразовую чашку Петри с коагулирующим раствором 95% этанола, покачивая чашку с коагулирующим раствором из стороны в сторону для создания потока воды. После коагуляции волокна сразу переносят в новые чашки Петри и оставляют до полного высыхания
Выполняют подготовку образцов хитозановых волокон с суперпарамагнитными наночастицами оксида железа для дальнейшего культивирования массой каждого образца 1,5 х 10-3 ± 0,6 х 10-3 г, и стерилизуют отвешенные образцы путем помещения их в 70% раствор этанола на 30 минут. Затем образцы подвергают облучению ультрафиолетом в течение 30 минут в ламинарном шкафу HFsafe900LC, Heal Force (Китай).
Для воздействия на исследуемый материал статическим магнитным полем умеренной интенсивности 50 - 80 мТл используют неодимовый магнит NdFeB в виде прутка размером 25х30 мм с никелевым покрытием; сила сцепления - 25 кг, остаточная магнитная индукция - 1,22-1,25 Тесла, расположенный на расстоянии 8 см от основания подставки для яиц.
Описание способа.
1 этап. Подготовка волокон.
Подготовку стерильных волокон из хитозана с наночастицами осуществляют методом мокрого прядения, для чего смешивают хитозан низкой молекулярной массы Sigma-Aldrich Chemie GmbH (Германия) из расчета 30 мг/мл раствора уксусной кислоты с рН 2,8-3,0 и суперпарамагнитные наночастицы оксида железа Sigma-Aldrich (США) из расчета 10 мг/мл раствора уксусной кислоты с рН 2,8-3,0, осуществляют коагуляцию посредством 95% этанола, высушивают и стерилизуют [Brüggemann D. et al. // Beilstein J. Nanotechnol. 2020. V. 11. P. 991-999].
Подготовку стерильных волокон из хитозана без наночастиц осуществляют методом мокрого прядения, для чего смешивают хитозан низкой молекулярной массы Sigma-Aldrich Chemie GmbH (Германия) из расчета 30 мг/мл раствора уксусной кислоты с pH 2,8-3,0, осуществляют коагуляцию посредством 95% этанола, высушивают и стерилизуют [Brüggemann D. et al. // Beilstein J. Nanotechnol. 2020. V. 11. P. 991-999 с модификацией].
2 этап. Подготовка яиц.
В ходе выполнения эксперимента используют подход in ovo. Оплодотворенные яйца массой 55 - 75 г курицы домашней (Gallus gallus) очищают от механических загрязнений салфеткой, слегка смоченной водопроводной водой, помещают в условия инкубатора с вращением на 72 часа при температуре 37,5°C; влажности 70-80%; с поворотом на 180° каждый час.
По окончании времени инкубации яйца извлекают из инкубатора, протирают 3% раствором перекиси водорода или кислородсодержащим дезинфицирующим средством БебиДез Ультра (Lysoform, Россия) в рабочей концентрации 3%, вносят в ламинарный бокс.
Создают смотровое окно в яйце с тупого конца, диаметром примерно 1-2 см.
Удаляют 3-7 мл белка, удаляют подскорлуповые оболочки, образующие воздушный мешок.
3 этап. Формирование экспериментальных и контрольной групп.
В первой экспериментальной группе через смотровое окно помещают стерильные волокна из хитозана с суперпарамагнитными наночастицами оксида железа массой 1,5 х 10-3 ± 0,6 х 10-3 г на поверхность хориоаллантоисной мембраны куриного эмбриона для последующей инкубации в условиях действия статического магнитного поля умеренной интенсивности. Смотровое окно в скорлупе яйца закрывают пленкой Parafilm M (Pechiney Plastic Packaging Company, США).
Во второй экспериментальной группе через смотровое окно помещают стерильные волокна из хитозана массой 1,5 х 10-3 ± 0,6 х 10-3 г без суперпарамагнитых наночастиц оксида железа на поверхность хориоаллантоисной мембраны куриного эмбриона для последующей инкубации без воздействия статического магнитного поля умеренной интенсивности. Смотровое окно в скорлупе закрывают пленкой Parafilm M (Pechiney Plastic Packaging Company, США).
В третьей экспериментальной группе через смотровое окно помещают стерильные волокна из хитозана без суперпарамагнитых наночастиц оксида железа массой 1,5 х 10-3 ± 0,6 ч 10-3 г на поверхность хориоаллантоисной мембраны куриного эмбриона для последующей инкубации в условиях действия статического магнитного поля умеренной интенсивности. Смотровое окно в скорлупе яйца закрывают пленкой Parafilm M (Pechiney Plastic Packaging Company, США).
В контрольной группе смотровое окно в скорлупе яйца сразу закрывают пленкой Parafilm M (Pechiney Plastic Packaging Company, США) и не подвергают воздействию статического магнитного поля .
4 этап. Инкубация.
Яйца первой экспериментальной группы весом первое -75 г, второе - 65г, третье - 55г с волокнами из хитозана с наночастицами, а также третьей экспериментальной группы весом первое -75 г, второе - 63г, третье - 57г с волокнами из хитозана без наночастиц помещают на подставке в статические условия инкубатора без вращения при температуре 37,5°С, влажности 70-80%, содержании СО2 3%, инкубируют в течение 144 часов в условиях действия статического магнитного поля, для чего подставку с установленными в ней яйцами размещают на расстоянии 8 см от основания подставки до магнита, что обеспечивает воздействие статическим магнитным полем на яйца весом 75 г - 80 мТл, на яйца весом 65-63 г - 65 мТл, на яйца 55-57 г. - 50 мТл. В эксперименте используют неодимовый магнит NdFeB в виде прутка размером 25х30 мм с никелевым покрытием; сила сцепления - 25 кг; остаточная магнитная индукция - 1,22-1,25 Тесла.
Яйца второй экспериментальной группы с волокнами из хитозана без наночастиц помещают на подставке в статические условия инкубатора без вращения при температуре 37,5°С, влажности 70-80%, содержании СО2 3%, инкубируют в течение 144 часов без воздействия статического магнитного поля.
Яйца контрольной группы без волокон помещают в статические условия инкубатора без вращения без воздействия статического магнитного поля, инкубируют в течение 144 часов при температуре 37,5°С, влажности 70-80%, содержании СО2 3%.
5. Оценка процесса формирования сосудистой сети.
По окончании времени инкубации через 144 часа увеличивают размер смотрового окна в скорлупе каждого яйца, открывая доступ к хориоаллантоисной мембране.
С помощью камеры, установленной в канал визуализации тринокулярной насадки стереомикроскопа Микромед MC-2-ZOOM вар. 2CR (Китай), при увеличении х30 (ПО ToupView 3.7) получают фотографии хориоаллантоисной мембраны яиц контрольной и трех экспериментальных групп на 6 день инкубирования материала на поверхности ХАМ, т.е. на 9 эмбриональный день.
Оценку ангиогенного ответа выполняют путем анализа цифровых изображений хориоаллантоисной мембраны куриного эмбриона, предварительно обработанных с помощью программы ImageJ с использованием плагина Vessel Analysis, Vascular Density, по плотности сформировавшихся сосудов. При этом, в 1, 2 и 3 экспериментальных группах оценивают участок, локализованный на расстоянии 0-3000 мкм от внесенного волокна из хитозана без суперпарамагнитных наночастиц оксида железа или из хитозана с суперпарамагнитными наночастицами оксида железа, анализируя не менее 6 фрагментов изображения 1000х1000 мкм на каждой фотографии.
В контрольной группе 4 оценивают случайно выбранный участок, локализованный на периферии хориоаллантоисной мембраны куриного эмбриона, анализируя не менее 6 фрагментов изображения 1000х1000 мкм на каждой фотографии.
Результаты полученных изображений представлены на следующих фигурах.
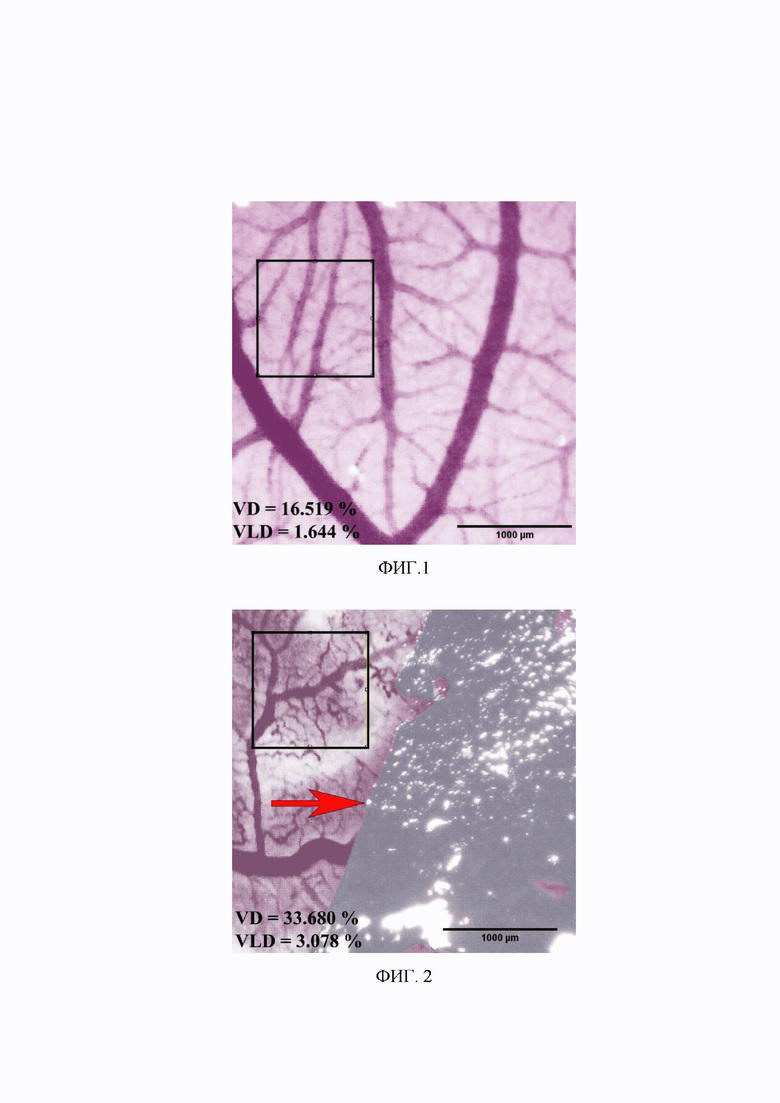
Фигура 1. Сосудистая сеть хориоаллантоисной мембраны куриного эмбриона. Контрольная группа 4. Увеличение 30х. Изображение получено с использованием стереомикроскопа Микромед MC-2-ZOOM вар. 2CR (Китай), видеоокуляра ToupCam 10.0 MP (Touptek, Россия) и программного обеспечения ToupView. Размер выделенной области 1000 х 1000 мкм. VD (Vascular Density, плотность сосудов) составляет 16,519 % от общей площади.VLD (Vascular Length Density, плотность длины сосудов) составляет 1,644 % от общей площади.
Фигура 2. Сосудистая сеть хориоаллантоисной мембраны куриного эмбриона. Яйцо весом 75 г из первой группы с волокнами из хитозана с наночастицами, изготовленными методом мокрого прядения, инкубация в течение 144 часов в условиях действия статического магнитного поля умеренной интенсивности 80 мТл. Увеличение 30х. Изображение получено с использованием стереомикроскопа Микромед MC-2-ZOOM вар. 2CR (Китай), видеоокуляра ToupCam 10.0 MP (Touptek, Россия) и программного обеспечения ToupView. Размер выделенной области 1000 х 1000 мкм. Стрелка на фигуре указывает на волокно из хитозана с наночастицами. VD (Vascular Density, плотность сосудов) = 33,680 % от общей площади. VLD (Vascular Length Density, плотность длины сосудов) = 3,078 % от общей площади.
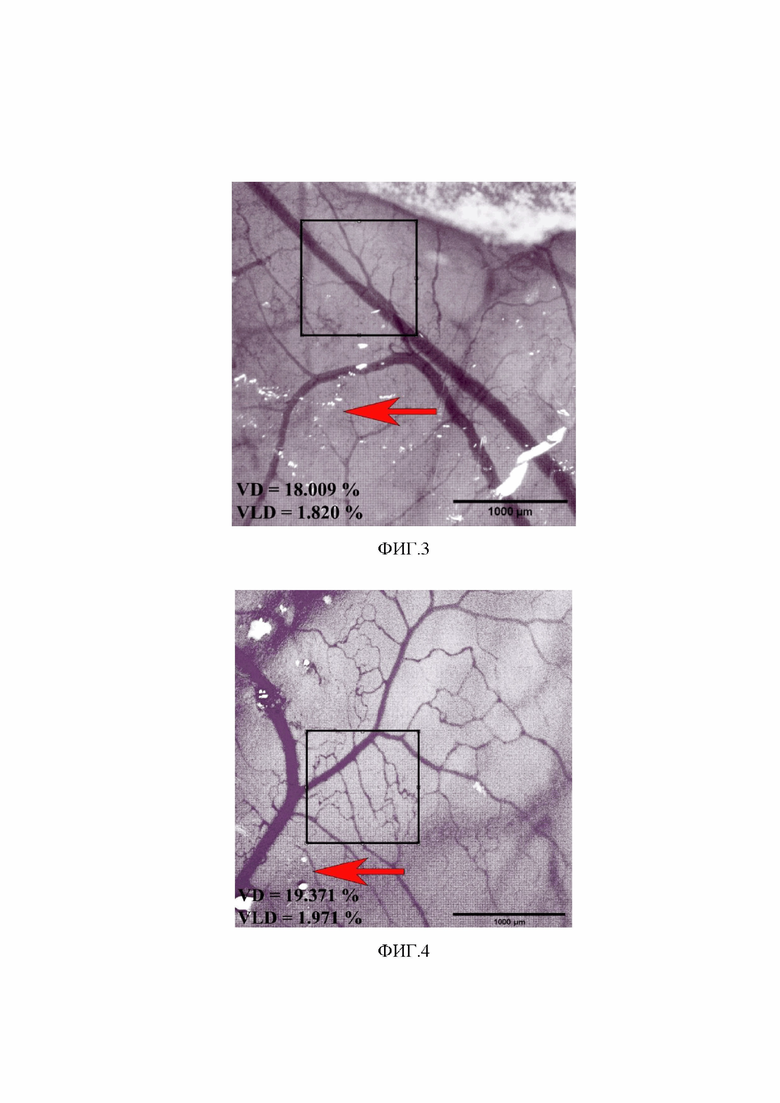
Фигура 3. Сосудистая сеть хориоаллантоисной мембраны куриного эмбриона. Яйцо из группы 2 с волокнами из хитозана, изготовленными методом мокрого прядения, инкубация в течение 144 часов без воздействия статического магнитного поля умеренной интенсивности. Увеличение 30х Изображение получено с использованием стереомикроскопа Микромед MC-2-ZOOM вар. 2CR (Китай), видеоокуляра ToupCam 10.0 MP (Touptek, Россия) и программного обеспечения ToupView. Размер выделенной области 1000 х 1000 мкм. Стрелка на фигуре указывает на волокно из хитозана. VD (Vascular Density, плотность сосудов) = 18,009 % от общей площади. VLD (Vascular Length Density, плотность длины сосудов) = 1,820 % от общей площади.
Фигура 4. Сосудистая сеть хориоаллантоисной мембраны куриного эмбриона. Яйцо весом 75г из группы 3 с волокнами из хитозана, изготовленными методом мокрого прядения, инкубация в течение 144 часов в условиях действия статического магнитного поля умеренной интенсивности 80 мТл. Увеличение 30х. Изображение получено с использованием стереомикроскопа Микромед MC-2-ZOOM вар. 2CR (Китай), видеоокуляра ToupCam 10.0 MP (Touptek, Россия) и программного обеспечения ToupView. Размер выделенной области 1000 х 1000 мкм. Стрелка на фигуре указывает на волокно из хитозана. VD (Vascular Density, плотность сосудов) = 19,371 % от общей площади. VLD (Vascular Length Density, плотность длины сосудов) = 1,971 % от общей площади.
При анализе данных были использованы медианные значения, полученные после обработки не менее 6 фрагментов ХАМ размером 1000х1000 мкм на каждом изображении в соответствующей группе. Общее количество изображений составляло не менее 3 для каждой группы.
Выявлено, что вблизи контакта хориоаллантоисной мембраны куриного эмбриона с хитозановым волокном, содержащим в своем составе суперпарамагнитные наночастицы оксида железа, в условиях действия статического магнитного поля умеренной интенсивности на 9 эмбриональный день на расстоянии 0 - 3000 мкм от внесенного волокна происходило увеличение плотности сосудов (VD), а также плотности длины сосудов (VLD) в сравнении с контрольной группой 4. Так, плотность сосудов в экспериментальной группе 1 была выше на 9,5%, а плотность длины сосудов в экспериментальной группе была выше на 35,7%. (p<0,05).
Установлено, что вблизи контакта хориоаллантоисной мембраны куриного эмбриона с волокнами из хитозана, не имеющими в своем составе суперпарамагнитных наночастиц оксида железа, без воздействия статического магнитного поля, на 9 эмбриональный день на расстоянии 0 - 3000 мкм от волокна (фигура 3) происходило увеличение плотности длины сосудов (VLD) в сравнении с контрольной группой на 5,1%, однако отмечалось снижение плотности сосудов (VD) на 21% (p<0,05). В сравнении с группой с волокнами из хитозана, имеющими в своем составе суперпарамагнитные наночастицы оксида железа, инкубированные на поверхности хориоаллантоисной мембраны в условиях воздействия статического магнитного поля умеренной интенсивности, показатели, характеризующие плотность длины сосудов (VLD) и плотность сосудов (VD), имели меньшее значение, на 22,5% (p<0,05) и 27,9% (p<0,05) соответственно.
В группе с волокнами из хитозана, не имеющими в своем составе суперпарамагнитных наночастиц, инкубированными на поверхности хориоаллантоисной мембраны в условиях воздействия статического магнитного поля умеренной интенсивности, на 9 эмбриональный день на расстоянии 0 - 3000 мкм от волокна наблюдалось увеличение плотности длины сосудов (VLD) в сравнении с контрольной группой на 12,7% (p<0,05), однако отмечалось снижение плотности сосудов (VD) на 12,8%. В сравнении с группой с волокнами из хитозана, имеющими в своем составе суперпарамагнитные наночастицы оксида железа, инкубированные на поверхности хориоаллантоисной мембраны в условиях воздействия статического магнитного поля, показатели, характеризующие плотность длины сосудов (VLD) и плотность сосудов (VD), имели меньшее значение - на 17% и 20,3% (p<0,05) соответственно (фигура 4).
Полученные данные свидетельствуют об эффекте стимуляции процессов формирования сосудистой сети совокупным воздействием волокон из хитозана, содержащих суперпарамагнитные наночастицы оксида железа, и статического магнитного поля умеренной интенсивности 50 - 80 мТл.
Таким образом, разработанный способ оценки формирования сосудистой сети позволит изучать процессы васкуляризации за более короткие сроки за счет внесения в состав скаффолда суперпарамагнитных наночастиц оксида железа и действия статического магнитного поля умеренной интенсивности, что приведет к снижению затрат на проведение исследования.
А также предлагаемый способ может быть применен для количественной оценки ангиогенного действия веществ, в том числе, для тестирования средств для лечения ран, ожогов, язв, сердечно-сосудистой и сосудистой патологии, других патологий, при которых необходимо поддержание и оценка процессов васкулогенеза и ангиогенеза, а также для тестирования ангиогенного эффекта биоматериалов, применение которых планируется для замещения дефектов тканей, в связи с тем, что различные физико-химические характеристики имплантируемых образцов, такие как форма, плотность, твердость, свойства поверхности, способны влиять на характер тканевого ответа, в том числе на процессы формирования сосудистой сети.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ создания модели для изучения физиологии и патологии пренатального периода онтогенеза на курином эмбрионе | 2018 |
|
RU2701387C1 |
| Способ допплерографической оценки антиангиогенного действия в модели куриного эмбриона | 2023 |
|
RU2823747C1 |
| ОПРЕДЕЛЕНИЕ ПОЛА, ЖИЗНЕСПОСОБНОСТИ И/ИЛИ СТАДИЙ РАЗВИТИЯ ПТИЧЬИХ ЭМБРИОНОВ В ЯЙЦЕ | 2013 |
|
RU2681536C2 |
| СПОСОБ РАННЕЙ ОЦЕНКИ ЯИЧНЫХ КУР ПРИ СЕЛЕКЦИИ | 2012 |
|
RU2507739C1 |
| СПОСОБ ЗАКРЫТИЯ ДЕФЕКТА ОПЛОДОТВОРЕННОГО ЯЙЦА ПРИ СОЗДАНИИ ЭКСПЕРИМЕНТАЛЬНОЙ МОДЕЛИ | 2019 |
|
RU2729370C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРИМОРДИАЛЬНЫХ ПОЛОВЫХ КЛЕТОК ПТИЦ | 2024 |
|
RU2832977C1 |
| СПОСОБ ОТБОРА КУРИНЫХ ЭМБРИОНОВ | 2011 |
|
RU2463591C1 |
| Устройство для инкубации и оптического исследования эмбрионов птиц | 1989 |
|
SU1775469A1 |
| СПОСОБ ВВЕДЕНИЯ ПРИМОРДИАЛЬНЫХ ПОЛОВЫХ КЛЕТОК ПТИЦ В ЭМБРИОН "IN OVO" | 2023 |
|
RU2818641C1 |
| СПОСОБ СТИМУЛЯЦИИ ЭМБРИОНАЛЬНОГО И ПОСТЭМБРИОНАЛЬНОГО РАЗВИТИЯ СЕЛЬСКОХОЗЯЙСТВЕННОЙ ПТИЦЫ | 2021 |
|
RU2787185C1 |
Изобретение относится к области биотехнологии, а именно к способу оценки процесса формирования сосудистой сети на хориоаллантоисной мембране куриного эмбриона, для исследования возможности использования биополимерных материалов в области тканевой инженерии и регенеративной медицине, при этом способ включает отбор оплодотворенных куриных яиц, инкубирование с вращением в течение 72 часов при температуре 37,5°C, удалением участка скорлупы и размещении на освобожденной хориоаллантоисной мембране стерильного скаффолда из волокон хитозана, содержащих суперпарамагнитные наночастицы оксида железа, после чего повторно инкубируют яйца без вращения в условиях действия статического магнитного поля, после чего фотографируют поверхность хориоаллантоисной мембраны в области контакта с испытуемой пробой и выполняют анализ плотности сосудистой сети с использованием ПО ImageJ. Изобретение эффективно для сокращения времени изучения процесса васкуляризации, происходящего в присутствии исследуемых матриксов, благодаря сочетанию действия статического магнитного поля умеренной интенсивности с введенным в состав скаффолда суперпарамагнитных наночастиц оксида железа. 1 пр., 4 ил.
Способ оценки процесса формирования сосудистой сети на хориоаллантоисной мембране куриного эмбриона, включающий отбор оплодотворенных куриных яиц, инкубирование с вращением при постоянной температуре и влажности, удаление участка скорлупы на тупом конце яйца и размещение на освобожденной хориоаллантоисной мембране испытуемой пробы, отличающийся тем, что в качестве испытуемой пробы используют стерильный скаффолд из волокон хитозана массой 1,5×10-3±0,6×10-3 г, содержащих в своем составе суперпарамагнитные наночастицы оксида железа, который размещают на хориоаллантоисной мембране через 72 часа инкубирования при температуре 37,5°C, влажности 70-80% с поворотом на 180° каждый час, затем смотровое окно в скорлупе яйца закрывают пленкой и повторно инкубируют без вращения при температуре 37,5°С, влажности 70-80%, содержании СО2 3%, в течение 144 часов в условиях действия статического магнитного поля, для чего яйца размещают на подставке, расположенной на расстоянии 8 см от неодимового магнита NdFeB в виде прутка размером 25×30 мм с никелевым покрытием, силой сцепления – 25 кг и остаточной магнитной индукцией – 1,22-1,25 Тл, что обеспечивает воздействие на исследуемый материал статическим магнитным полем интенсивностью 50-80 мТл, затем на 9 эмбриональный день фотографируют поверхность хориоаллантоисной мембраны в области контакта с испытуемой пробой и выполняют анализ плотности сосудистой сети с использованием ПО ImageJ.
| WO 2010054022 A1, 14.05.2010 | |||
| WO 2003055530 A1, 10.07.2003 | |||
| СПОСОБ ТЕСТИРОВАНИЯ АКТИВНОСТИ АНГИОГЕНИНА | 1999 |
|
RU2166511C1 |
| ANA GUERRA, JORGE BELINHA, NASIDE MANGIR, SHEILA MACNEIL, RENATO NATAL JORGE, Simulation of the process of angiogenesis: Quantification and assessment of vascular patterning in the chicken chorioallantoic membrane, Computers in Biology and Medicine, Volume 136, | |||
Авторы
Даты
2023-12-04—Публикация
2023-05-26—Подача