Область техники
Настоящее изобретение относится к фармацевтической композиции для профилактики или лечения миозита, содержащей митохондрии в качестве активного ингредиента.
Предпосылки изобретения
Миозит представляет собой заболевание, при котором в мышцах возникает воспаление, и мышечные волокна повреждаются, что приводит к боли в мышцах и снижению способности мышц сокращаться. Миозит подразделяется на дерматомиозит, полимиозит и миозит с тельцами включения, и из них полимиозит и дерматомиозит представляют собой воспалительные миопатии, при которых появляются симптомы снижения мышечной силы в конечностях, близко к туловищу, повышения уровня мышечных ферментов, повышенной экспрессии воспалительных цитокинов, аномальной электромиограммы, аномалии при биопсии мышц и тому подобное.
Кроме того, иногда мышечная слабость из-за полимиозита и дерматомиозита прогрессирует постепенно в течение нескольких недель или нескольких месяцев, но в крайне редких случаях быстро прогрессирует. Если не лечить сильную мышечную слабость, это приведет к потере мышц. Сообщалось, что у от 15% до 30% пациентов, страдающих полимиозитом, он сопровождается злокачественными опухолями, и, когда дерматомиозит возникает у пожилых людей, одновременно развивается рак.
При лечении полимиозита и дерматомиозита используются стероиды, иммунодепрессанты или иммуномодуляторы. Стероиды являются наиболее часто используемыми препаратами для раннего лечения, и следует ли использовать иммунодепрессант, решается в зависимости от реакции на лечение стероидами и от побочных эффектов. Около 75% пациентам с миозитом в дополнение к стероидам назначают дополнительные иммунодепрессанты. Недавно было продемонстрировано, что иммуноглобулин для внутривенного введения в качестве иммуномодулятора обладает эффектом улучшения мышечной силы при дерматомиозите, а также имеет признаки того, что он показан при биопсии мышц, и поэтому он используется при дерматомиозите. Однако иммунодепрессанты и иммуномодуляторы имеют недостатки, заключающиеся в том, что они непосредственно задействованы в иммунной системе и, следовательно, могут иметь побочные эффекты, а действие лекарств длится недолго, и поэтому инъекции лекарств необходимо повторять каждые 6-8 недель.
Кроме того, недавно была разработана модель на мышах, индуцированных миозитом, и ее использовали при разработке терапевтических агентов для лечения миозита. В частности, в 2007 году было показано, что однократное введение рекомбинантного белка быстрого типа C в скелетные мышцы способно вызвать полимиозит у мышей C57BL/6, и была предложена возможность попытаться изучить метод лечения миозита, специфичный для заболевания (Sugihara T et al., Arthritis Rheum. 2007, 56 (4):1304-14). Для оценки эффектов иммунодепрессантов на лечение миозита против CXCL10 (хемокин 10 с мотивом CXC), хемокина, экспрессия которого повышена в мышцах полимиозита, была использована модель на мышах, индуцированных миозитом, (Kim et al., Arthritis Research & Therapy 2014, 16:R126).
С другой стороны, митохондрии представляют собой клеточные органеллы эукариотических клеток, участвующие в синтезе и регуляции аденозинтрифосфата (АТФ), внутриклеточного источника энергии. Митохондрии связаны с различными метаболическими путями in vivo, например, с передачей клеточных сигналов, дифференцировкой клеток, гибелью клеток, а также с контролем клеточного цикла и роста клеток.
Подробное описание изобретения
Техническая задача
Исследования по лечению миозита проводились, но у разработанного препарата есть проблема, при которой возникают побочные эффекты, либо его нужно вводить регулярно, и, таким образом, на сегодняшний день инновационный метод лечения не разработан.
Следовательно, целью настоящего изобретения является разработка фармацевтической композиции для лечения миозита и способа лечения миозита с ее использованием.
Решение задачи
Для решения вышеуказанных задач в одном из аспектов настоящего изобретения предложена фармацевтическая композиция для профилактики или лечения миозита, содержащая митохондрии в качестве активного ингредиента.
В другом аспекте настоящего изобретения предложен способ профилактики или лечения миозита, включающий стадию введения субъекту фармацевтической композиции.
Эффект изобретения
При введении субъекту, страдающему миозитом, лекарственного средства по настоящему изобретению, содержащего митохондрии в качестве активного ингредиента, количество воспалительных клеток, инфильтрированных в мышечные клетки субъекта, могут быть уменьшены. Кроме того, фармацевтическая композиция по настоящему изобретению может эффективно снижать экспрессию воспалительных цитокинов мышечных тканей, в которых развивается миозит. Таким образом, фармацевтическая композиция по настоящему изобретению может быть успешно использована для профилактики или лечения миозита.
Краткое описание чертежей
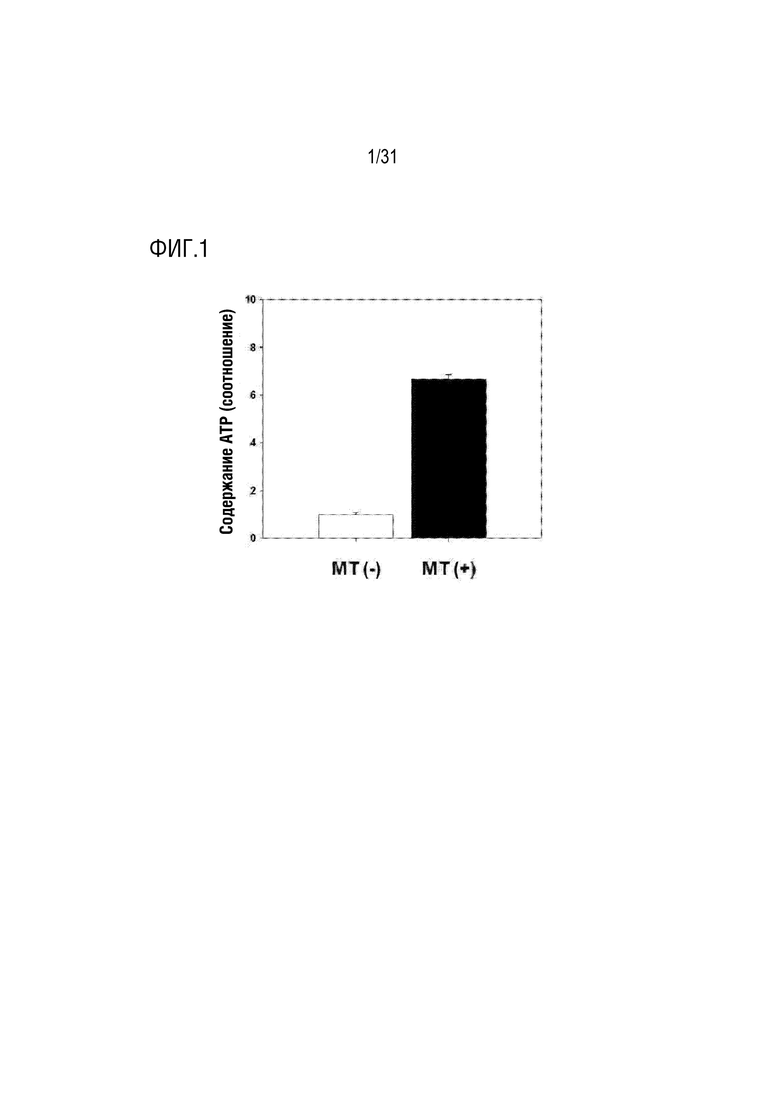
Фигура 1 представляет собой фигуру, на которой показано определение синтезированного количества АТФ в митохондриях, выделенных из мезенхимальных стволовых клеток, полученных из пуповины.
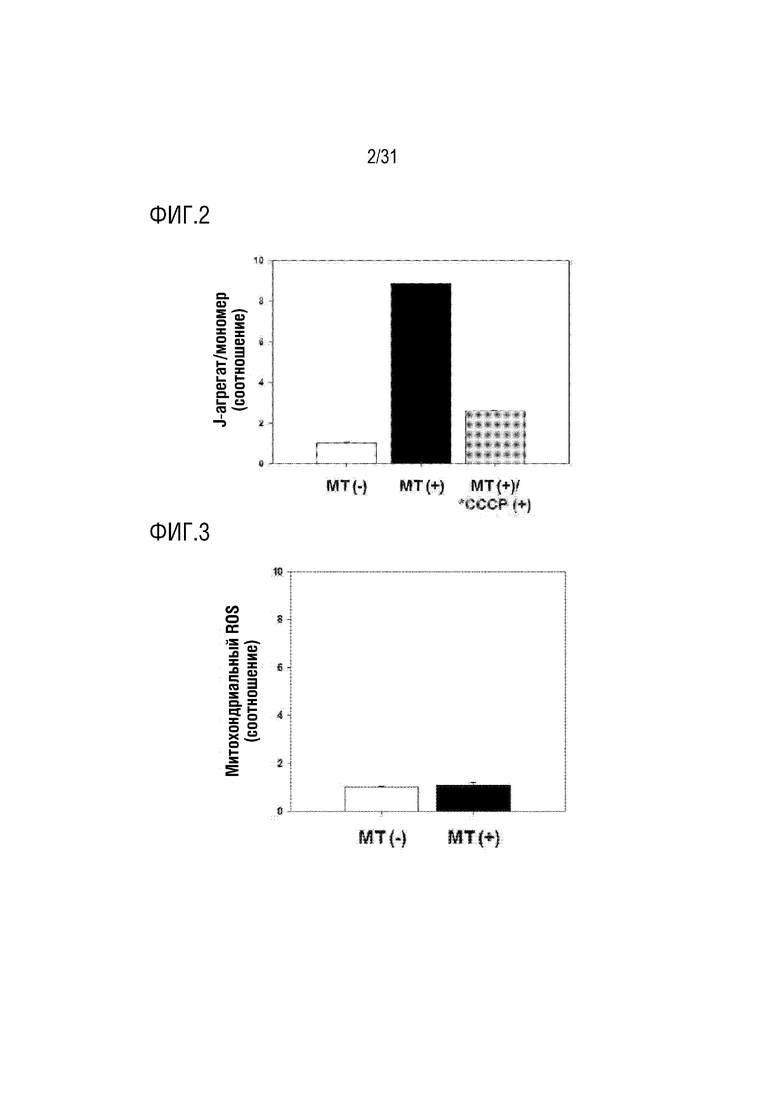
Фигура 2 представляет собой фигуру, на которой показано определение активности мембранного потенциала в выделенных митохондриях из мезенхимальных стволовых клеток, полученных из пуповины.
Фигура 3 представляет собой фигуру, на которой показано определение активных форм кислорода в митохондриях, выделенных из мезенхимальных стволовых клеток, полученных из пуповины.
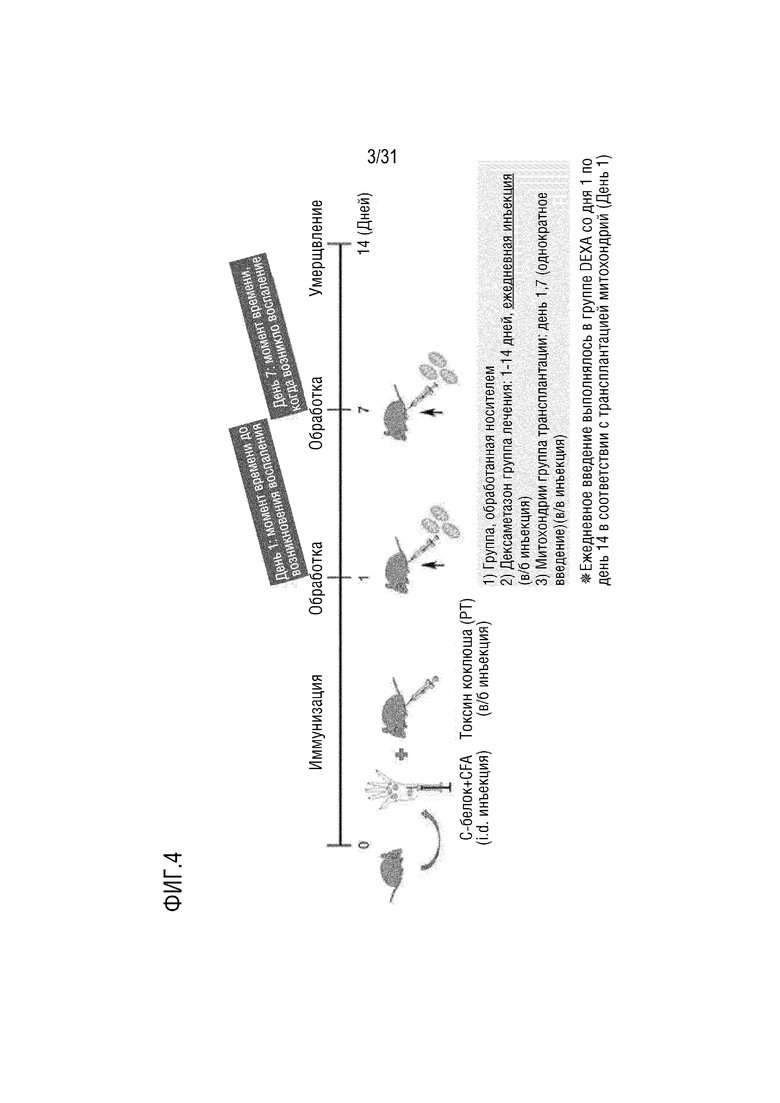
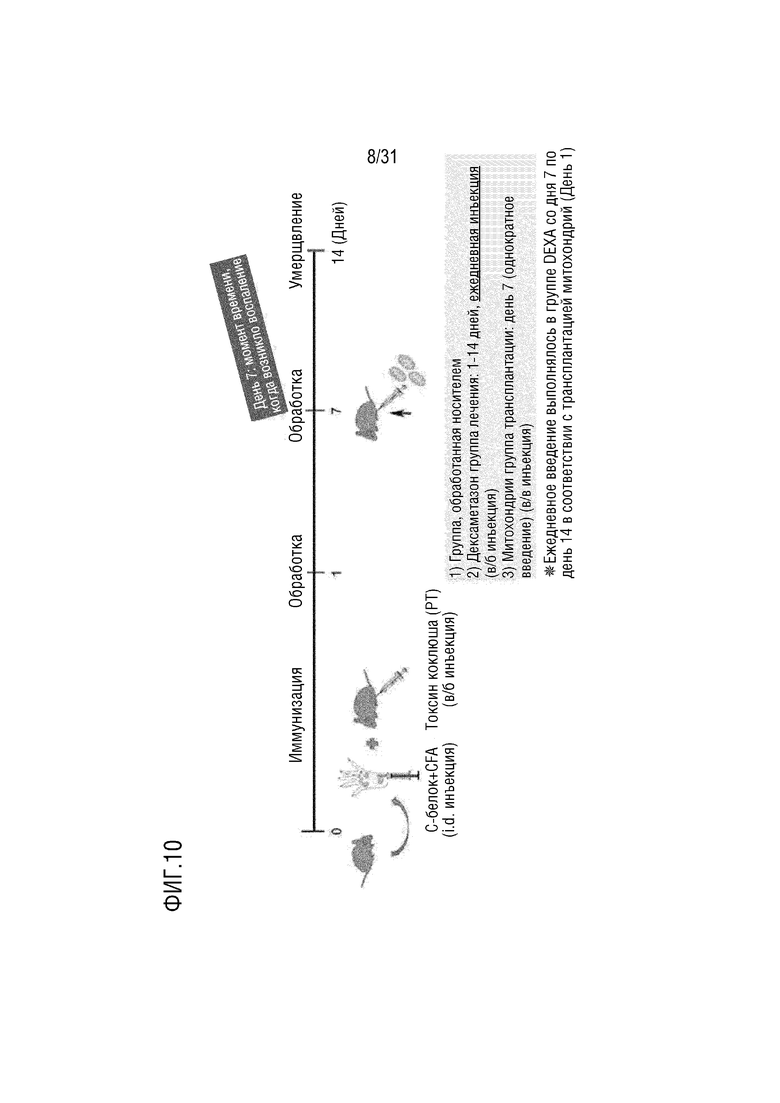
Фигура 4 представляет собой схематическую диаграмму плана первичного эксперимента на животных для подтверждения эффекта лечения миозита при введении митохондрий с использованием мышей, индуцированных миозитом.
Фигура 5 представляет собой фотографию четырехглавой мышцы и подколенного сухожилия, окрашенных H&E (гематоксилин и эозин), в группе отрицательного контроля, группе положительного контроля и экспериментальной группе, которым вводили экзогенные митохондрии для выявления воспалительных клеток, инфильтрированных в мышечные волокна.
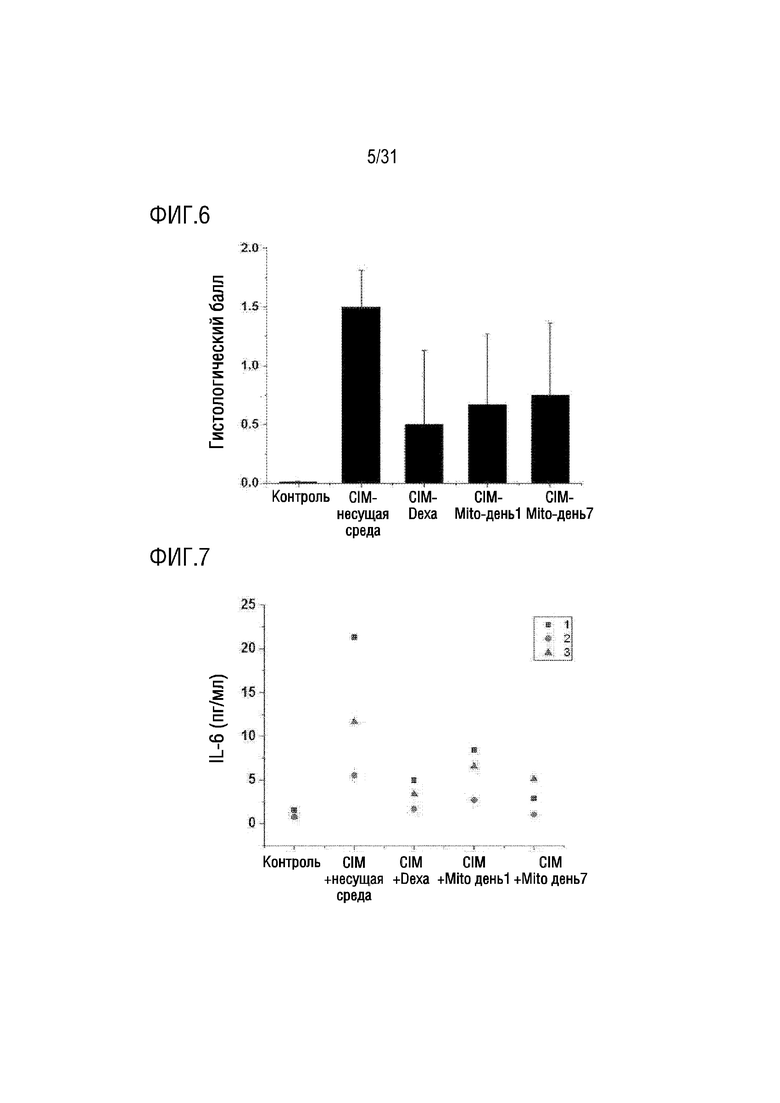
Фигура 6 представляет собой фигуру, на которой показано определение и подсчет количества воспалительных клеток, инфильтрированных в мышечные волокна после окрашивания четырехглавой мышцы H&E, в группе отрицательного контроля, группе положительного контроля и экспериментальной группе, которым вводили экзогенные митохондрии.
Фигура 7 представляет собой фигуру, на которой показана концентрация IL-6 в крови мышей в нормальной группе, группе отрицательного контроля, группе положительного контроля и экспериментальной группе, которым вводили митохондрии.
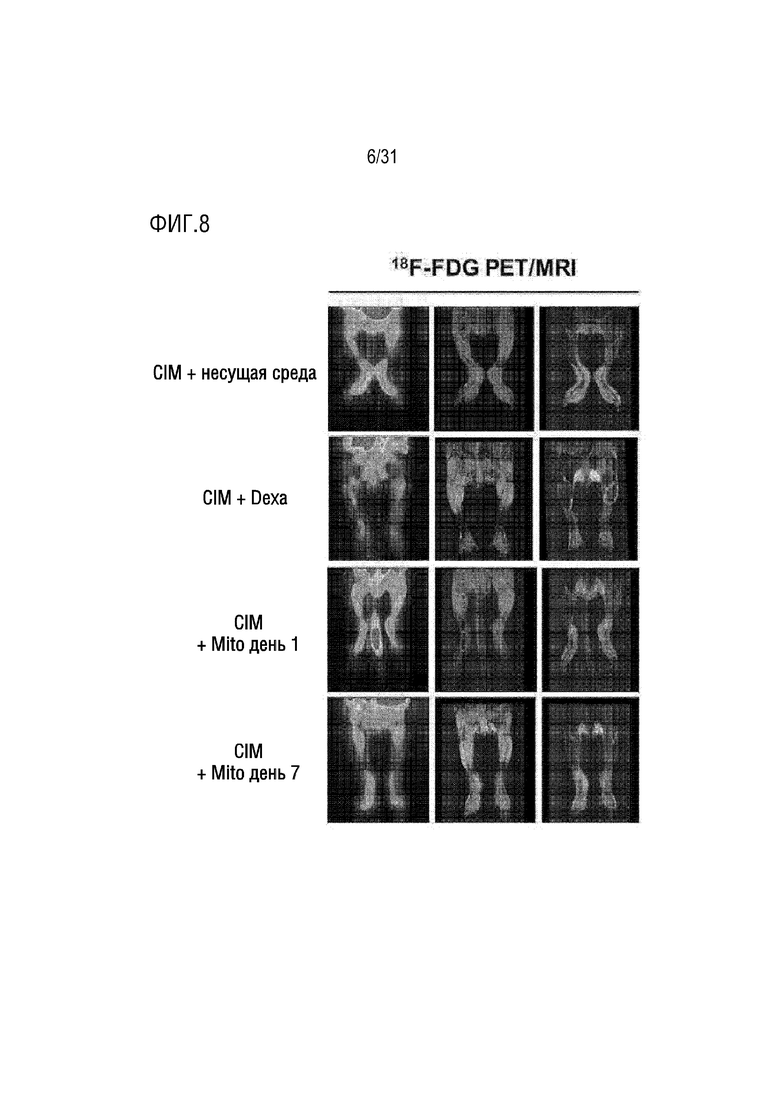
Фигура 8 представляет собой фотографию мышей PET/MRI в группе отрицательного контроля, группе положительного контроля и экспериментальной группе, которым вводили экзогенные митохондрии.
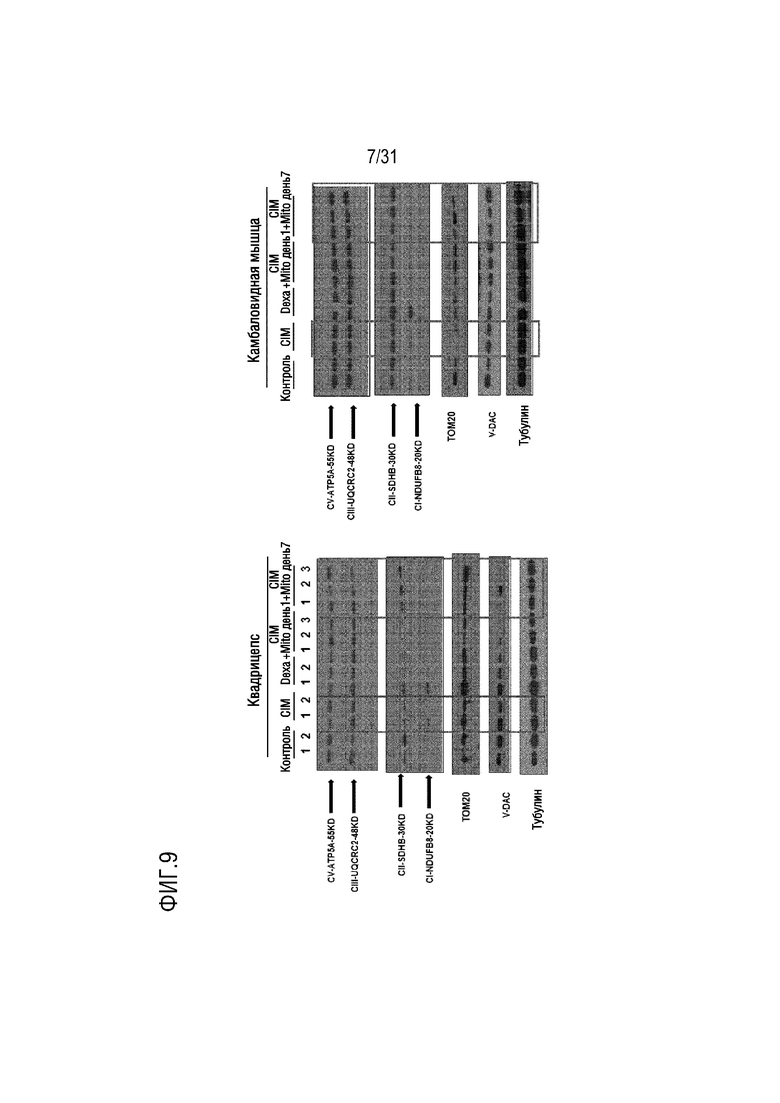
На фигуре 9 на мышиной модели, индуцированной миозитом, показано, что активность митохондрий увеличилась после трансплантации митохондрий.
Фигура 10 представляет собой схематическую диаграмму плана вторичного эксперимента на животных для подтверждения эффекта лечения миозита при введении экзогенных митохондрий с использованием мышей, индуцированных миозитом.
Фигура 11 представляет собой фотографию четырехглавой мышцы, окрашенной H&E, в группе отрицательного контроля, группе положительного контроля и экспериментальной группе, которым вводили экзогенные митохондрии для выявления воспалительных клеток, инфильтрированных в мышечные волокна.
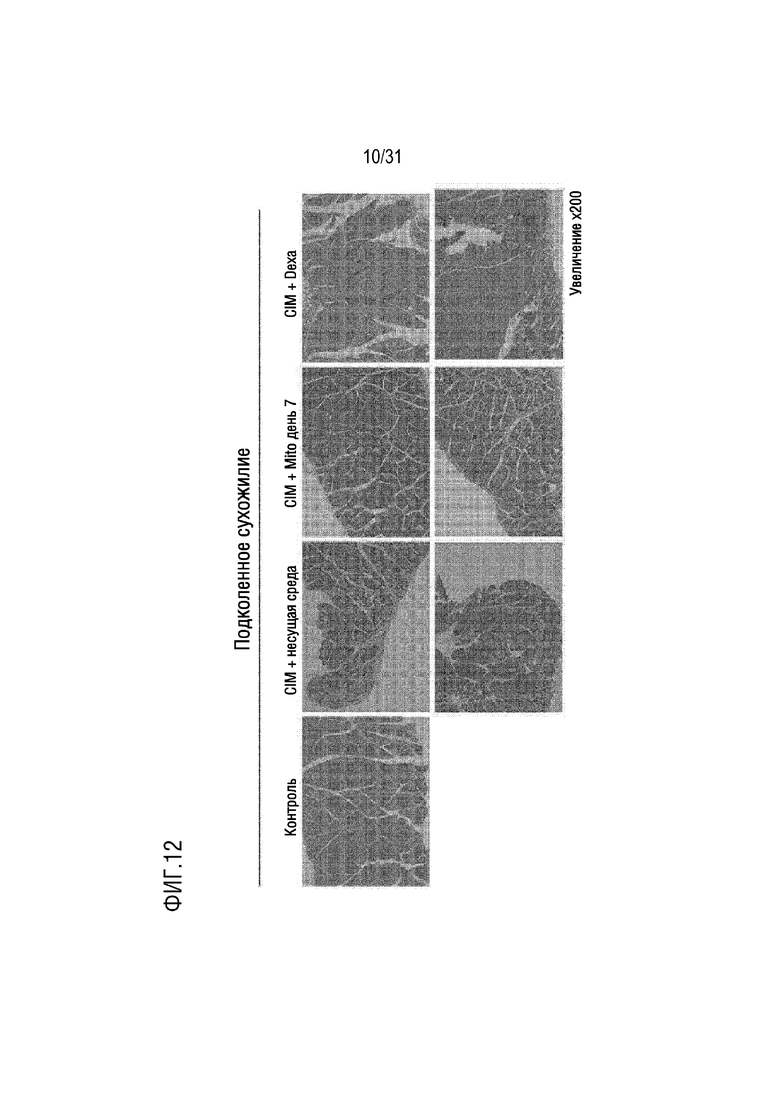
Фигура 12 представляет собой фотографию подколенного сухожилия, окрашенного H&E, в группе отрицательного контроля, группе положительного контроля и экспериментальной группе, которым вводили экзогенные митохондрии для выявления воспалительных клеток, инфильтрированных в мышечные волокна.
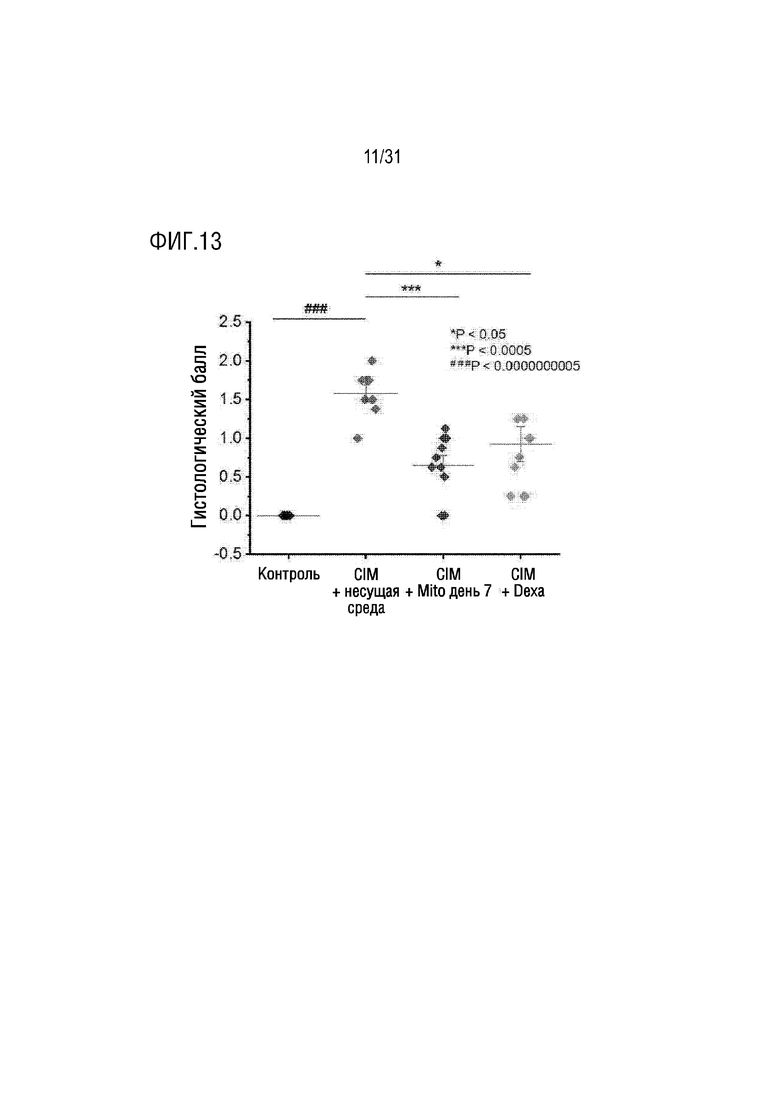
Фигура 13 представляет собой фигуру, на которой показано определение и подсчет количества воспалительных клеток, инфильтрированных в мышечные волокна после окрашивания четырехглавой мышцы H&E, в группе отрицательного контроля, группе положительного контроля и экспериментальной группе, которым вводили экзогенные митохондрии.
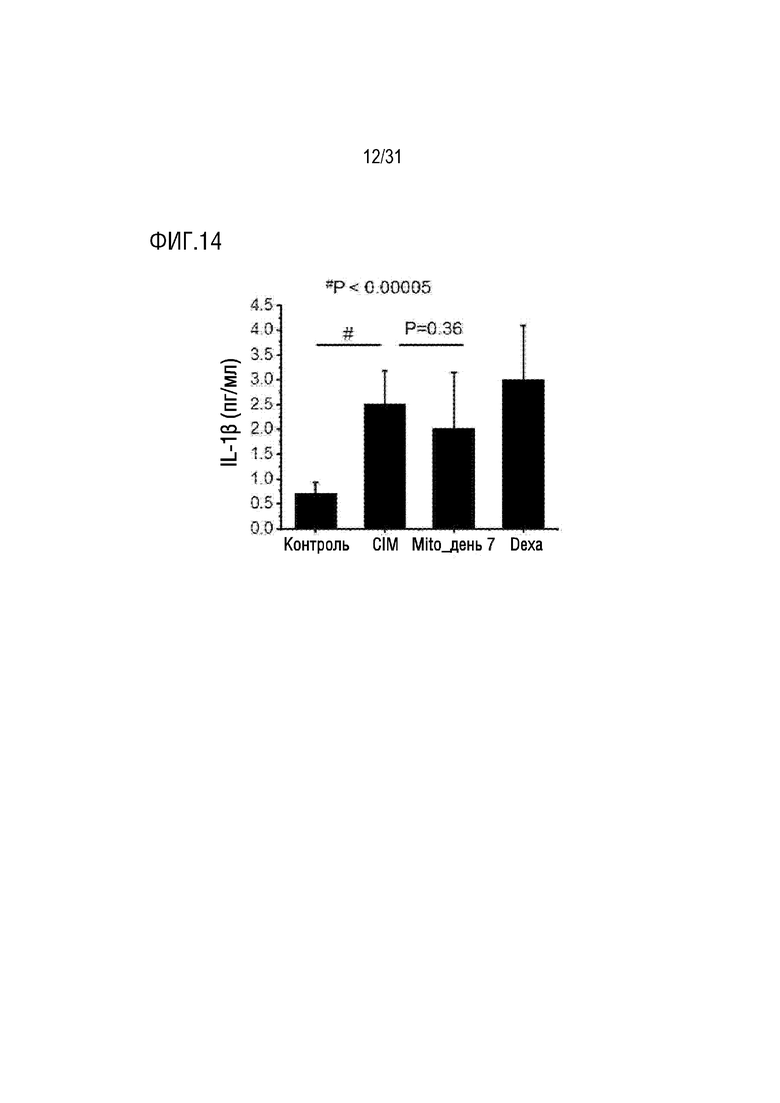
Фигура 14 представляет собой фигуру, на которой показана концентрация IL-1β в крови мышей в нормальной группе, группе отрицательного контроля, группе положительного контроля и экспериментальной группе, которым вводили экзогенные митохондрии.
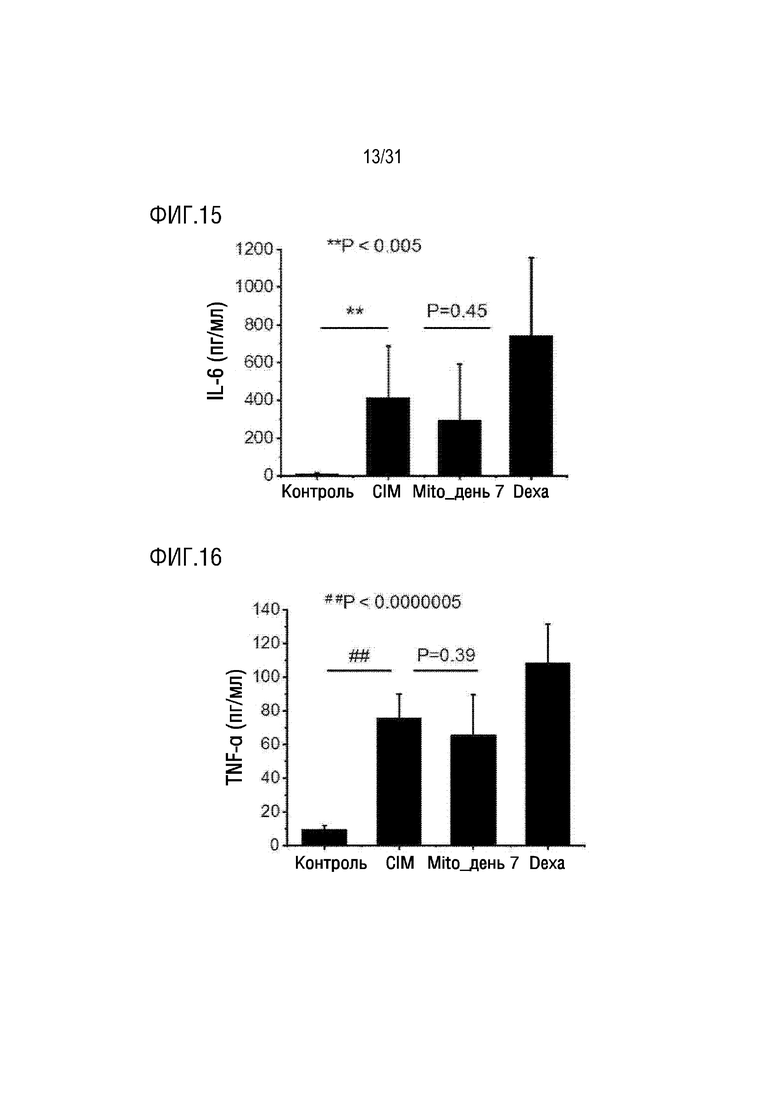
Фигура 15 представляет собой фигуру, на которой показана концентрация IL-6 в крови мышей в нормальной группе, группе отрицательного контроля, группе положительного контроля и экспериментальной группе, которым вводили экзогенные митохондрии.
Фигура 16 представляет собой фигуру, на которой показана концентрация TNF-α в крови мышей в нормальной группе, группе отрицательного контроля, группе положительного контроля и экспериментальной группе, которым вводили экзогенные митохондрии.
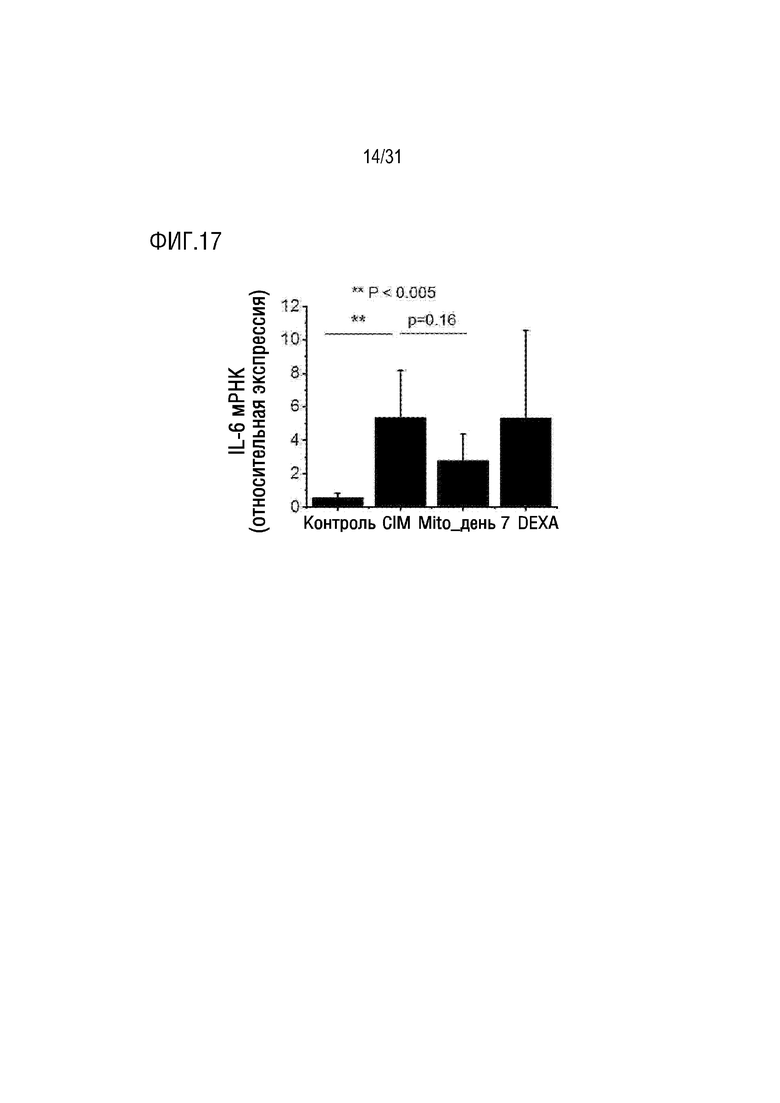
Фигура 17 представляет собой фигуру, на которой показан уровень экспрессии мРНК IL-6 в мышцах мышей в нормальной группе, группе отрицательного контроля, группе положительного контроля и экспериментальной группе, которым вводили экзогенные митохондрии.
Фигура 18 представляет собой схематическую диаграмму плана третичного эксперимента на животных для подтверждения эффекта лечения миозита при введении экзогенных митохондрий с использованием мышей, индуцированных миозитом.
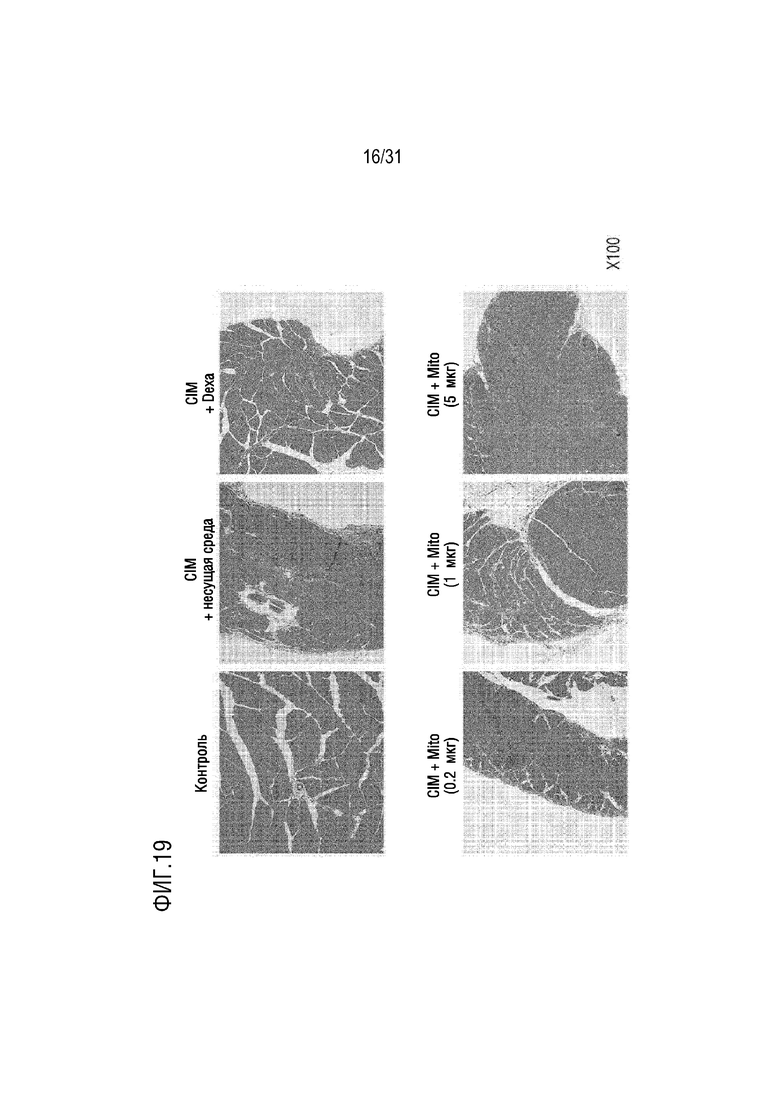
На фигуре 19 на мышиной модели, индуцированной миозитом, подтверждено, что количество воспалительных клеток, окрашенных H&E (гематоксилин и эозин), уменьшилось после трансплантации митохондрий.
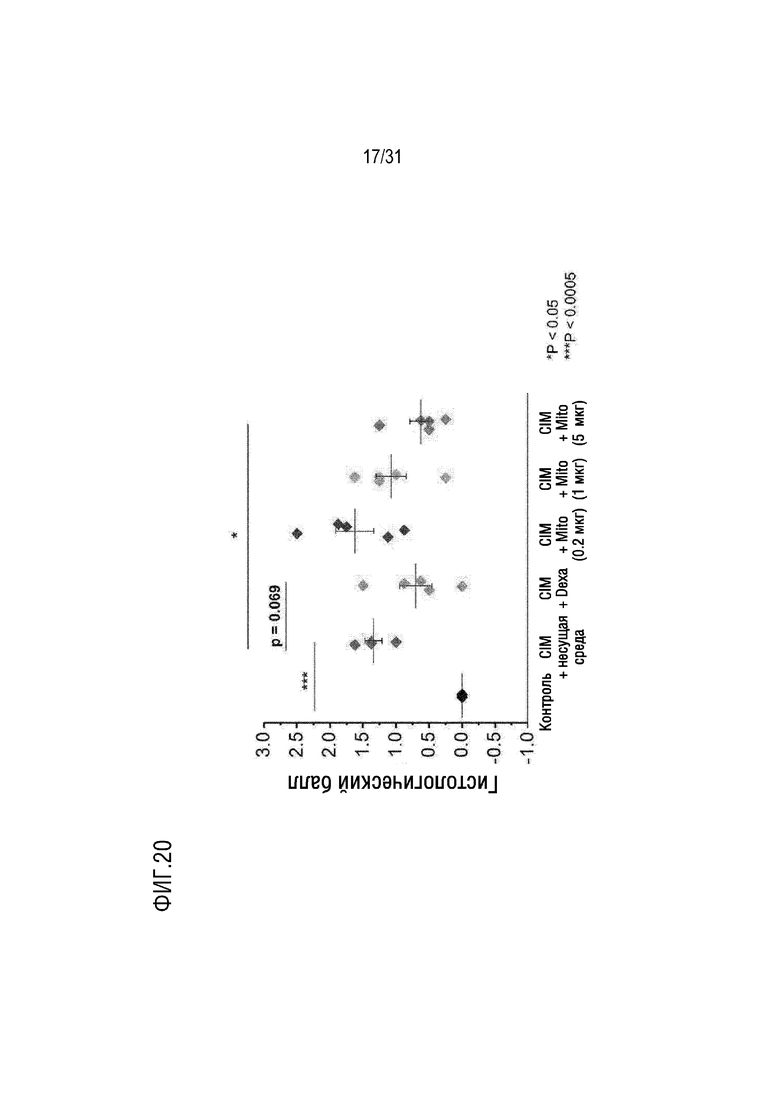
На фигуре 20 на мышиной модели, индуцированной миозитом, подтверждено, что гистологический балл по системе баллов снизился после трансплантации митохондрий.
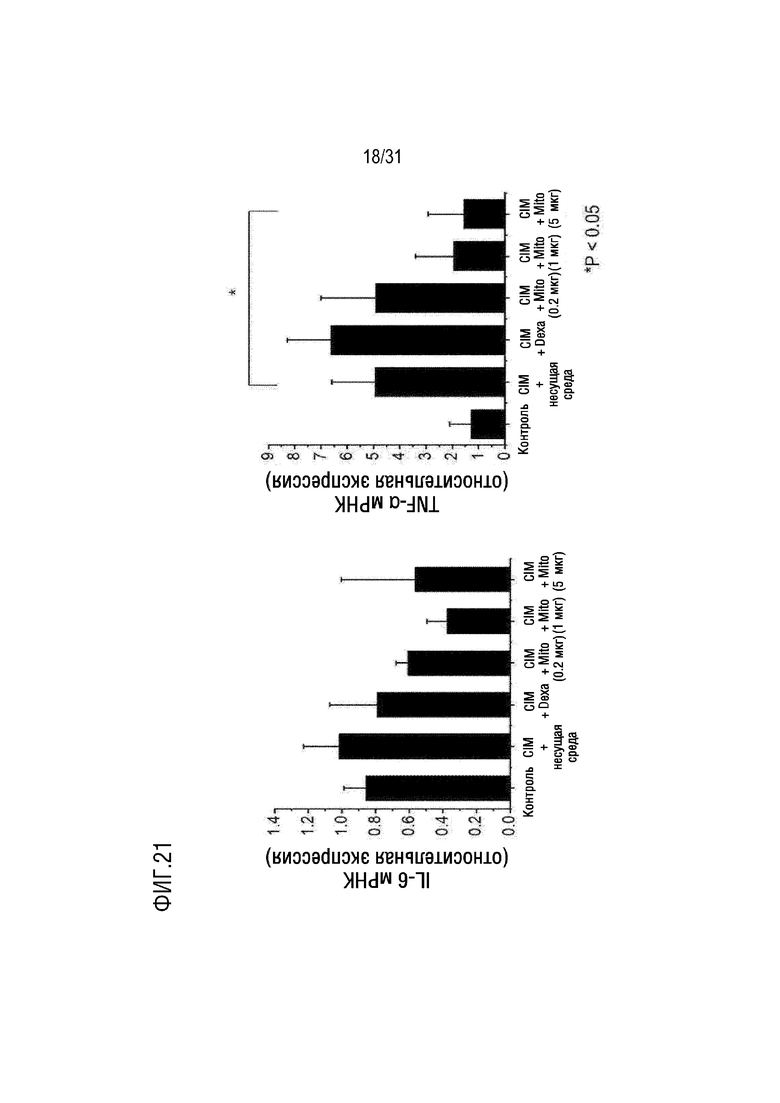
На фигуре 21 на мышиной модели, индуцированной миозитом, показано, что количество воспалительных цитокинов уменьшилось после трансплантации митохондрий.
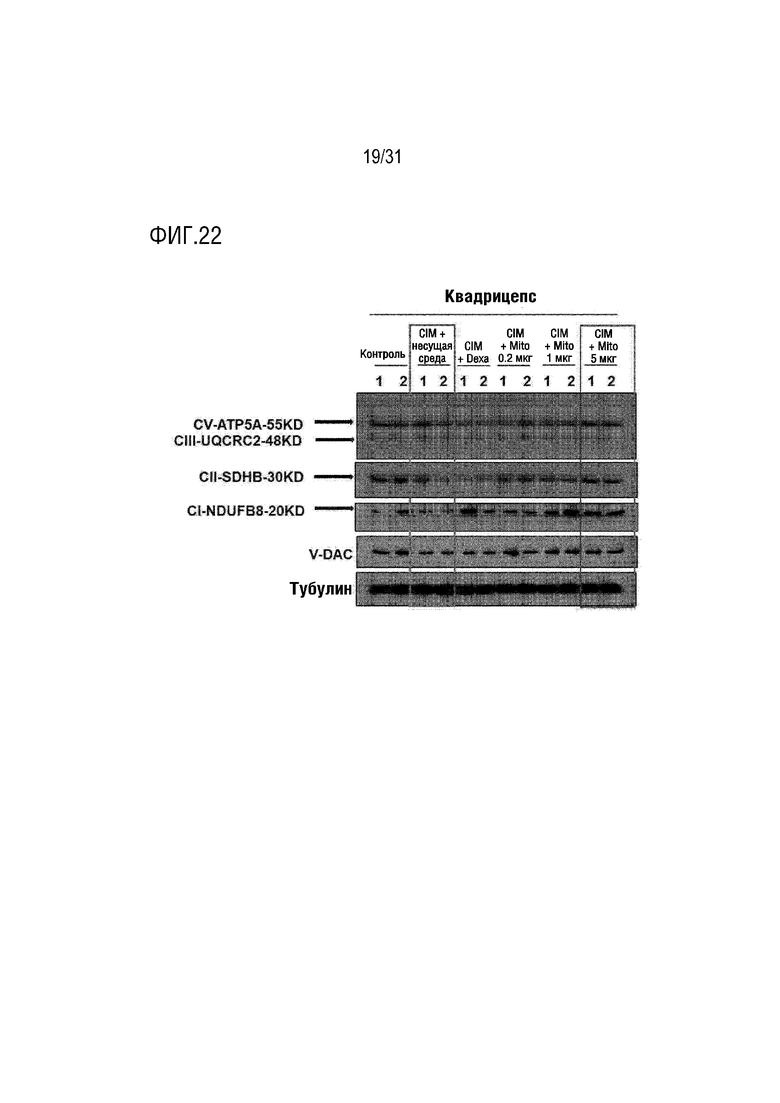
На фигуре 22 на мышиной модели, индуцированной миозитом, показано, что активность митохондрий увеличилась после трансплантации митохондрий.
На фигуре 23 на мышиной модели, индуцированной миозитом, показано увеличение и уменьшение общих метаболитов скелетных мышц в результате анализа тепловой карты профиля мышц с помощью анализа метаболома после трансплантации митохондрий.
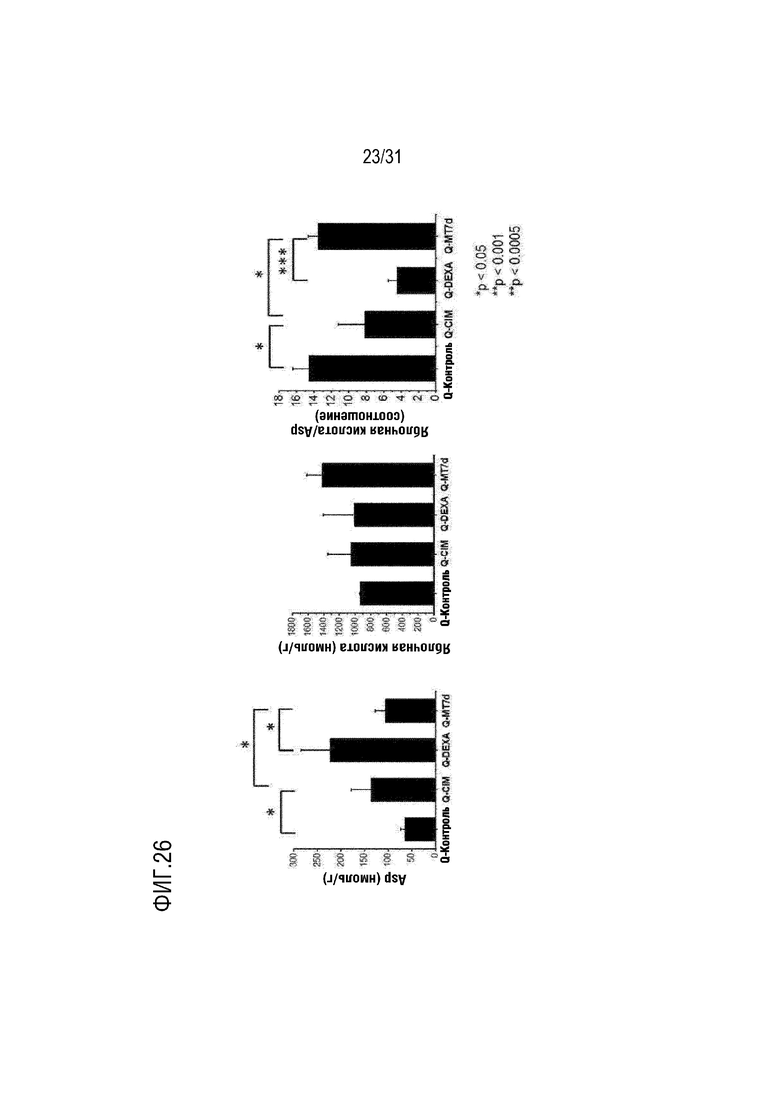
На фигурах 24-27 на мышиной модели, индуцированной миозитом, подтверждено, что относительное количественное соотношение яблочной кислоты и аспартата было значительно увеличено и восстановлено до уровня контрольной группы с помощью анализа метаболома после трансплантации митохондрий.
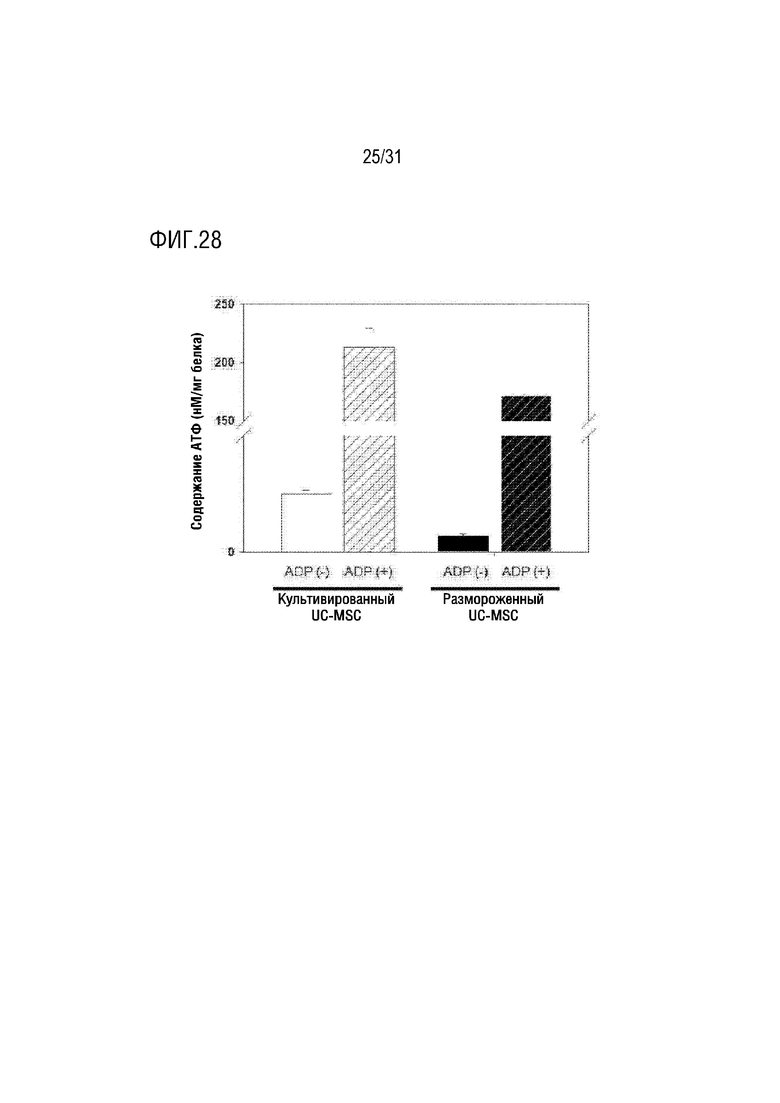
Фигура 28 представляет собой фигуру, на которой сравнивается активность АТФ выделенных митохондрий из замороженных мезенхимальных стволовых клеток, полученных из пуповины, с активностью выделенных митохондрий из культивированных мезенхимальных стволовых клеток, полученных из пуповины.
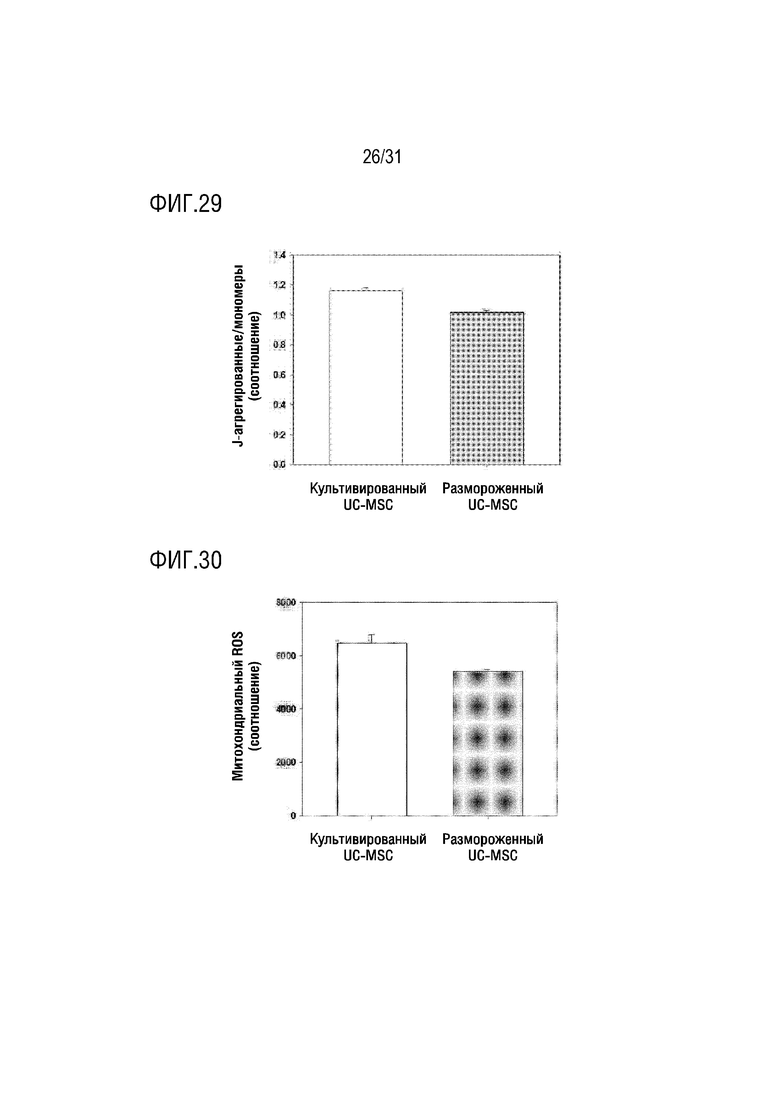
Фигура 29 представляет собой фигуру, на которой сравнивается мембранный потенциал митохондрий, выделенных из замороженных мезенхимальных стволовых клеток, полученных из пуповины, с митохондриями, выделенными из культивированных мезенхимальных стволовых клеток, полученных из пуповины.
Фигура 30 представляет собой фигуру, на которой показано определение активных форм кислорода в митохондриях, выделенных из замороженных мезенхимальных стволовых клеток, полученных из пуповины, и митохондрий, выделенных из культивированных мезенхимальных стволовых клеток, полученных из пуповины.
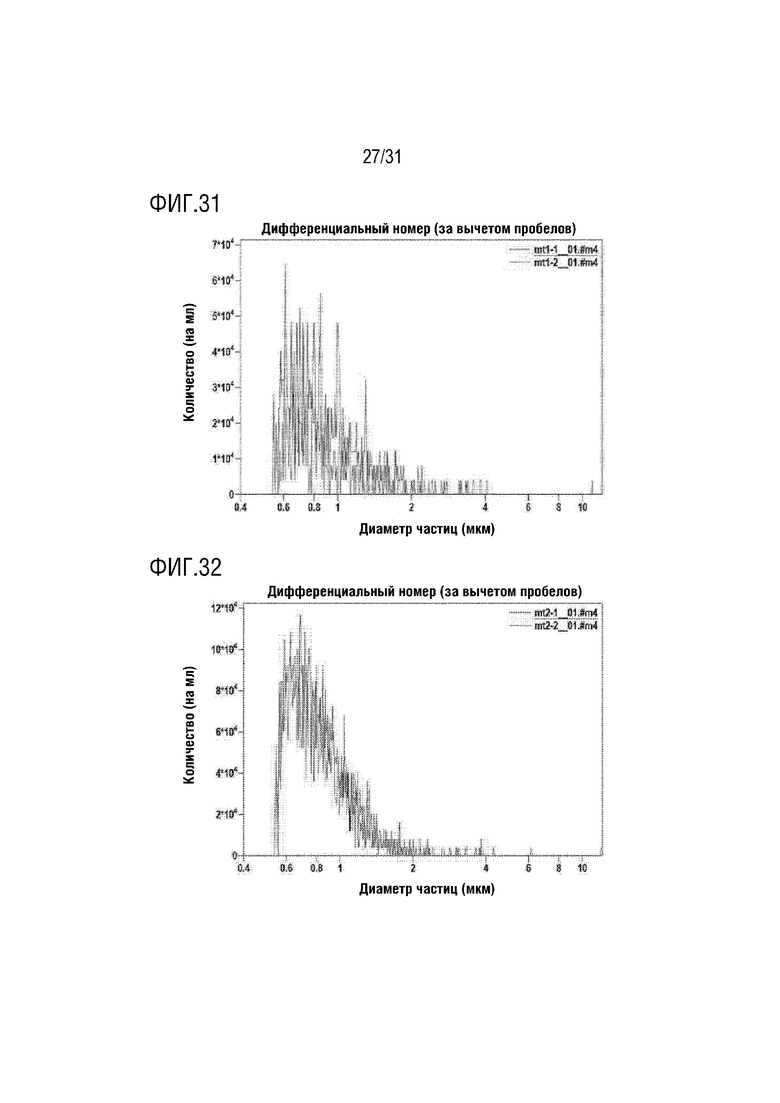
Фигура 31 представляет собой фигуру, на которой показано количество митохондрий в растворе, содержащем митохондрии в концентрации 1 мкг/мл, с использованием счетчика частиц (Multisizer 4e, Beckman Coulter).
Фигура 32 представляет собой фигуру, на которой показано количество митохондрий в растворе, содержащем митохондрии в концентрации 2,5 мкг/мл, с использованием счетчика частиц.
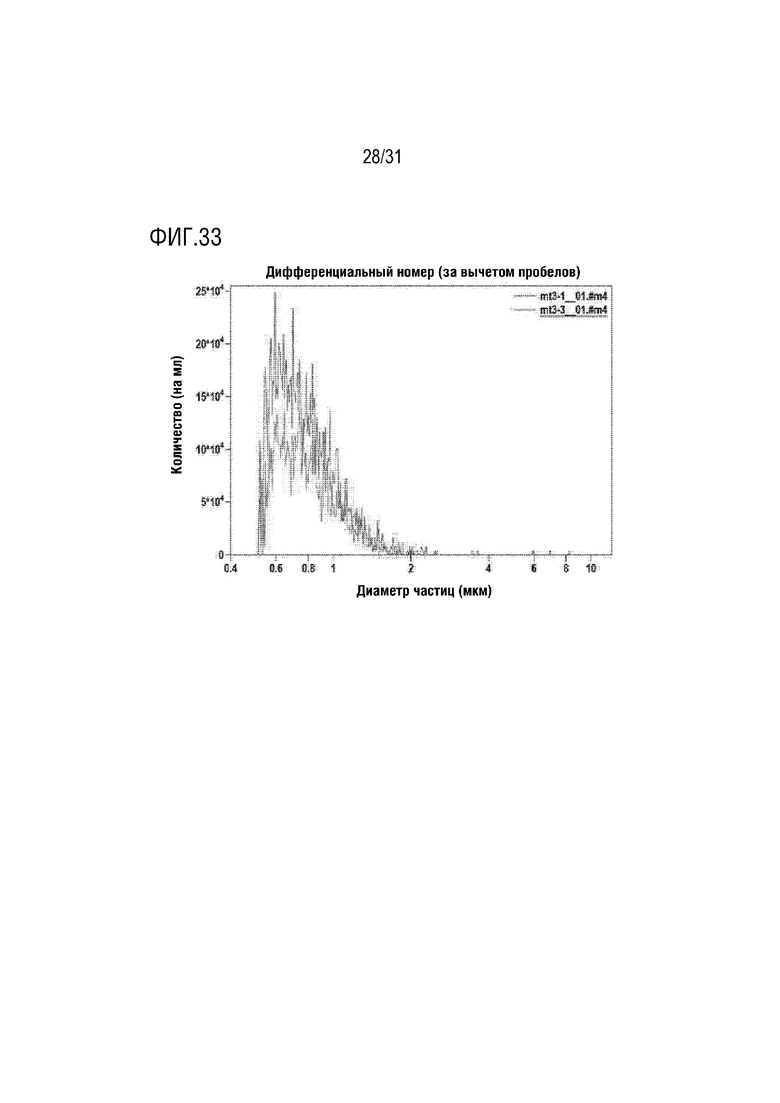
Фигура 33 представляет собой фигуру, на которой показано количество митохондрий в растворе, содержащем митохондрии в концентрации 5 мкг/мл, с использованием счетчика частиц.
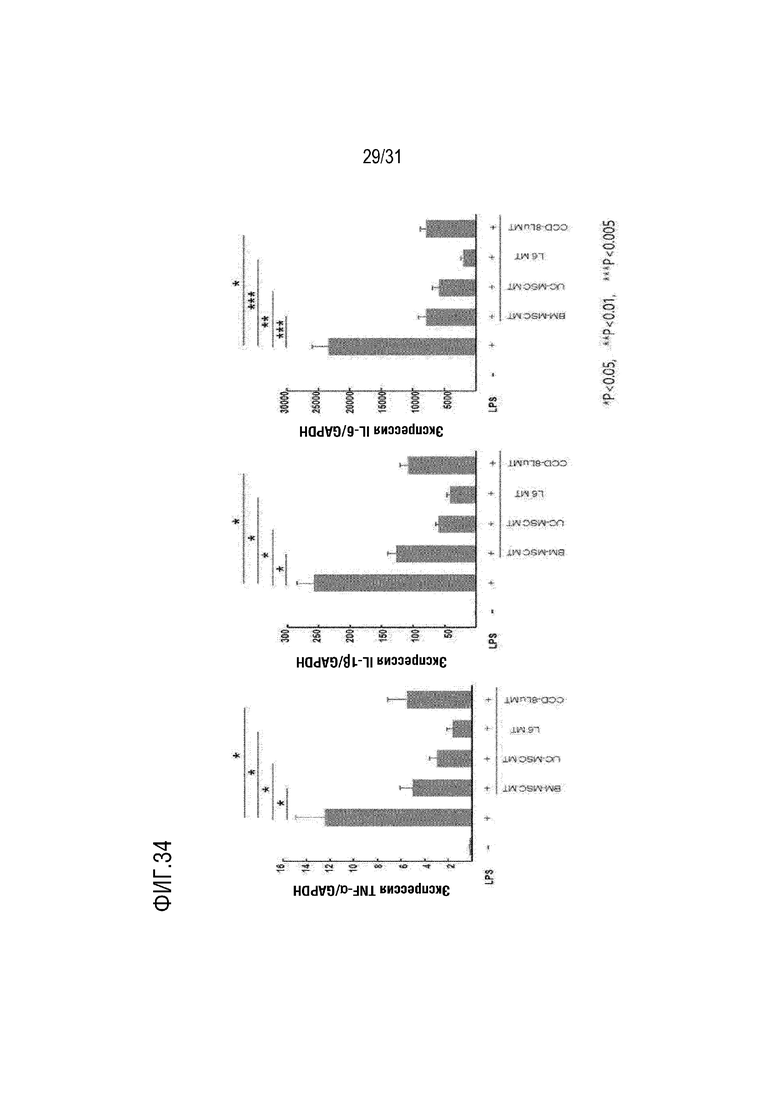
Фигура 34 представляет собой фигуру, на которой подтверждена способность подавлять экспрессию мРНК TNF-α, IL-1β и IL-6 митохондриями, происходящими из нескольких типов клеток в клетках RAW264.7, активированных LPS.
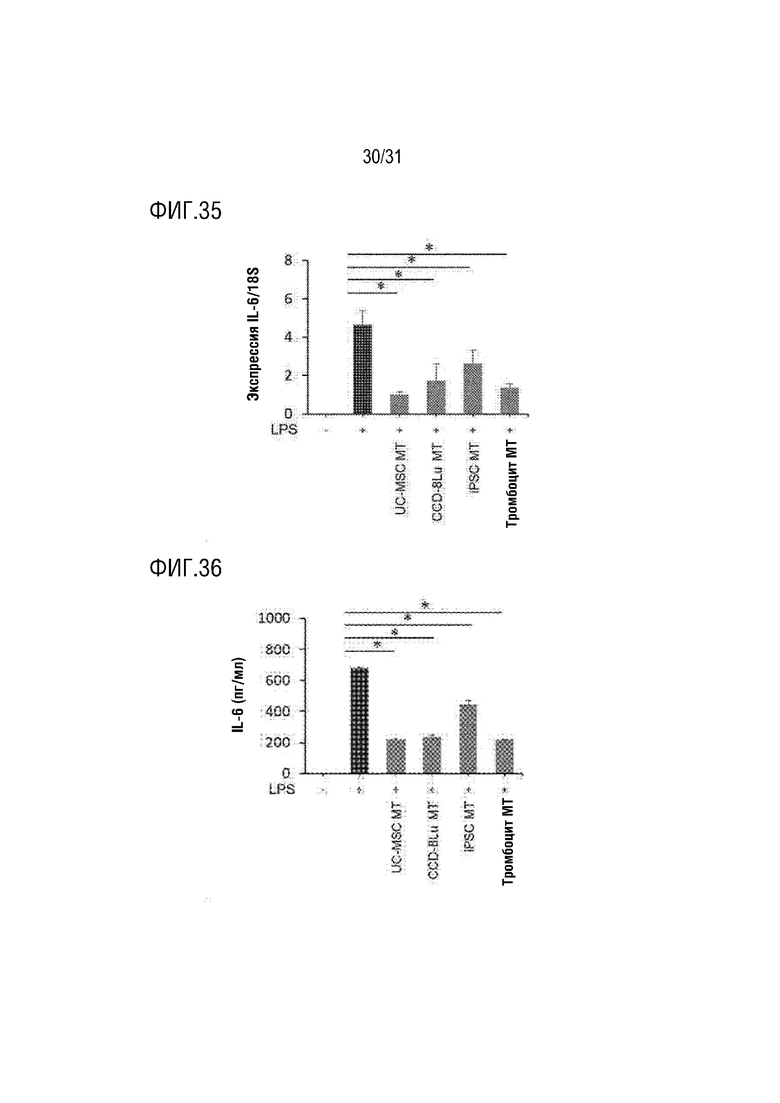
Фигура 35 представляет собой фигуру, демонстрирующую способность подавлять экспрессию мРНК IL-6 митохондриями, происходящими из нескольких типов клеток, в клетках THP-1, активированных LPS.
Фигура 36 представляет собой фигуру, демонстрирующую способность подавлять экспрессию белка IL-6 митохондриями, происходящими из нескольких типов клеток, в клетках THP-1, активированных LPS.
На фигуре 37 дана информация о мышцах, используемая в анализе метаболома.
Лучший способ осуществления изобретения
Далее настоящее изобретение описано подробно.
Одним аспектом настоящего изобретения является фармацевтическая композиция для профилактики или лечения миозита, содержащая митохондрии в качестве активного ингредиента.
Как используется в настоящем документе, термин «миозит» относится к заболеванию, при котором в мышцах возникает воспаление и повреждаются мышечные волокна. В частности, миозит делится на дерматомиозит, полимиозит и миозит с тельцами включения, и среди них полимиозит и дерматомиозит относятся к воспалительным миопатиям. Экспрессия воспалительных цитокинов или хемокинов, таких как CXCL10, IL-1β, TNF-α, IL-6 и тому подобное, в мышечных тканях при полимиозите или дерматомиозите увеличивается. В качестве терапевтических агентов при миозите разрабатываются иммунодепрессанты или иммуномодуляторы, которые ингибируют CXCL10, IL-1β, TNF-α или IL-6. Однако в случае иммунодепрессантов или иммуномодуляторов существует проблема, при которой побочные эффекты возникают из-за прямого воздействия на иммунную систему.
Кроме того, мышиную модель, индуцированную миозитом, можно использовать для разработки терапевтического агента против миозита. Модель на мышах, индуцированных миозитом, может быть получена путем внутрикожной инъекции CFA (полный адъювант Фрейнда), содержащего фрагменты белка C и убитые нагреванием Mycobacterium butyricum, и внутрибрюшинной инъекции PT (токсина коклюша). В этом случае, поскольку ткани, в которых наблюдаются воспаление и воспалительные клетки в мышцах пациентов с миозитом, представляют собой четырехглавую мышцу и мышцу подколенного сухожилия, у мышей, индуцированных миозитом, также могут быть использованы ткани четырехглавой мышцы и мышцы подколенного сухожилия. Если в настоящем описании не указано иное, термин «активный ингредиент» относится к ингредиенту, который проявляет активность отдельно или в комбинации с адъювантом (носителем), который сам по себе не обладает активностью.
Если в настоящем описании не указано иное, термин «активный ингредиент» относится к ингредиенту, который проявляет активность отдельно или в комбинации с адъювантом (носителем), который сам по себе не обладает активностью.
Как показано в экспериментальных примерах, на мышечной модели миозита, индуцированного С-белком (CIM), с использованием CE-TOFMS были проанализированы метаболомные профили как для четырехглавой мышцы, белой мышцы, так и для камбаловидной мышцы, красной мышцы. В группе, получавшей миозит, соотношение малата и аспартата было снижено, и на основании вышеизложенного было подтверждено, что имело место повреждение митохондрий. В результате эксперимента на модели мышей CIM с помощью теста для подтверждения эффективности инъекции экзогенных митохондрий в нескольких дозах было подтверждено, что воспаление уменьшилось и повреждение митохондрий было восстановлено.
Митохондрии могут быть получены от млекопитающих и могут быть получены от человека. В частности, митохондрии можно выделить из клеток или тканей. Например, митохондрии можно выделить из клеток, культивируемых in vitro. Кроме того, митохондрии можно получить из соматических клеток, половых клеток, клеток крови или стволовых клеток. Кроме того, митохондрии могут быть получены из тромбоцитов. Митохондрии могут быть нормальными митохондриями, полученными из клеток с нормальной биологической активностью митохондрий. Кроме того, митохондрии можно культивировать in vitro.
Кроме того, митохондрии могут быть получены от аутологичного, аллогенного или ксеногенного субъекта. В частности, аутологичные митохондрии относятся к митохондриям, полученным из тканей или клеток одного и того же субъекта. Кроме того, аллогенные митохондрии относятся к митохондриям, полученным от субъекта, который принадлежит к тому же виду, что и субъект, и имеет разные генотипы аллелей. Кроме того, ксеногенные митохондрии относятся к митохондриям, полученным от субъекта, который принадлежит к другим видам от субъекта.
В частности, соматические клетки могут представлять собой мышечные клетки, гепатоциты, нервные клетки, фибробласты, эпителиальные клетки, адипоциты, остеоциты, лейкоциты, лимфоциты, тромбоциты или клетки слизистой оболочки. Кроме того, половые клетки представляют собой клетки, которые претерпевают мейоз и митоз, и могут быть сперматозоидами или яйцеклетками. Кроме того, стволовые клетки могут быть любыми, выбранными из группы, состоящей из мезенхимальных стволовых клеток, взрослых стволовых клеток, индуцированных плюрипотентных стволовых клеток, эмбриональных стволовых клеток, стволовых клеток костного мозга, нервных стволовых клеток, лимбальных стволовых клеток и стволовых клеток тканевого происхождения. В этом случае мезенхимальные стволовые клетки могут быть любыми, выбранными из группы, состоящей из пуповины, пуповинной крови, костного мозга, жира, мышц, нервов, кожи, амниотической оболочки и плаценты.
С другой стороны, когда митохондрии выделены из конкретных клеток, митохондрии можно выделить с помощью различных известных методов, например, с использованием определенного буферного раствора или с использованием разности потенциалов, магнитного поля и тому подобного.
Выделение митохондрий может быть достигнуто путем измельчения и центрифугирования клеток поддержания активности митохондрий. В одном варианте осуществления это может быть выполнено посредством стадии культивирования клеток и проведения первого центрифугирования фармацевтической композиции, содержащей клетки, для получения гранул, стадии ресуспендирования гранул в буферном растворе и его гомогенизации, стадии проведения второго центрифугирования гомогенизированного раствора для получения супернатанта и стадии проведения третьего центрифугирования супернатанта для очистки митохондрий. В этом случае в рамках поддержания активности клеток предпочтительно, чтобы время, в течение которого проводилось второе центрифугирование, регулировалось короче, чем время, в течение которого выполнялось первое центрифугирование и третье центрифугирование, и скорость может быть увеличена от первого центрифугирования до третьего центрифугирования.
В частности, центрифугирование с первого по третье может быть выполнено при температуре от 0°C до 10°C, предпочтительно, при температуре от 3°C до 5°C. Кроме того, время, в течение которого выполняется центрифугирование, может составлять от 1 минуты до 50 минут и может быть соответствующим образом скорректировано в соответствии с количеством центрифугирования, содержанием образца и тому подобное.
Кроме того, первое центрифугирование может быть выполнено со скоростью от 100×g до 1000×g или от 200×g до 700×g, или от 300×g до 450×g. Кроме того, второе центрифугирование может быть выполнено при скорости от 1×g до 2000×g, или от 25×g до 1800×g, или от 500×g до 1600×g. Кроме того, третье центрифугирование может быть выполнено при скорости от 100×g до 20000×g, Кроме того, третье центрифугирование может быть выполнено при скорости от 500×g до 18,000×g, Кроме того, третье центрифугирование может быть выполнено при скорости от 800×g до 15000×g.
Выделенные митохондрии можно определить количественно путем определения количества белков. В частности, выделенные митохондрии можно количественно оценить с помощью анализа BCA (анализ бицинхониновой кислоты). В этом случае митохондрии в фармацевтическую композицию могут быть включены в концентрации от 0,1 мкг/мл до 1,000 мкг/мл, от 1 мкг/мл до 750 мкг/мл или от 25 мкг/мл до 500 мкг/мл. В одном примере настоящего изобретения использовали концентрации 25 мкг/мл, 50 мкг/мл и 100 мкг/мл.
Кроме того, количество выделенных митохондрий можно определить с помощью счетчика частиц (Multisizer 4e, Beckman Coulter), и количество митохондрий может быть показано в таблице 1 ниже со ссылкой на статью, написанную James D. McCully (J Vis Exp. 2014; (91): 51682).
[Таблица 1]
Как показано в примере 9 настоящего изобретения, в результате определения с использованием счетчика частиц количества митохондрий в концентрации 1 мкг/мл, 2,5 мкг/мл и 5 мкг/мл, оно было определено как 1,96×106±0,98×106, 5,97×106±0,19×106 и 1,01×107±0,32×107. По сравнению с таблицей 1 выше, было подтверждено, что количество митохондрий в концентрации 10 мкг/мл составляет 2,16×107±0,08×107, что аналогично 2,02×107±0,64×107, как получено при умножении на 2 количества митохондрий в концентрации 5 мкг/мл. В этом случае митохондрии в фармацевтическую композицию могут быть включены в количестве от 1×105 митохондрий/мл до 5×109 митохондрий/мл. В частности, митохондрии в фармацевтическую композицию могут быть включены в количестве от 1×105 митохондрий/мл до 5×109 митохондрий/мл, от 2×105 митохондрий/мл до 2×109 митохондрий/мл, от 5×105 митохондрий/мл до 1×109 митохондрий/мл, от 1×106 митохондрий/мл до 5×108 митохондрий/мл, от 2×106 митохондрий/мл до 2×108 митохондрий/мл, от 5×106 митохондрий/мл до 1×108 митохондрий/мл или от 1×107 митохондрий/мл до 5×107 митохондрий/мл. Фармацевтическая композиция может включать митохондрии в концентрации и содержании в указанном выше диапазоне, и, таким образом, дозу митохондрий легко регулировать при введении, и степень улучшения симптомов миозита у пациентов может быть дополнительно увеличена.
В частности, терапевтически эффективная доза митохондрий, содержащихся в фармацевтической композиции, может составлять от 3×105 митохондрий/кг до 1,5×1010 митохондрий/кг в виде однократной дозы в зависимости от массы тела вводимого субъекта. В частности, терапевтически эффективная доза митохондрий, содержащихся в фармацевтической композиции, может составлять от 3×105 митохондрий/кг до 1,5×1010 митохондрий/кг, от 6×105 митохондрий/кг до 6×109 митохондрий/кг, от 1,5×106 митохондрий/кг до 3×109 митохондрий/кг, от 3×106 митохондрий/кг до 1,5×109 митохондрий/кг, от 6×106 митохондрий/кг до 6×108 митохондрий/кг, от 1,5×107 митохондрий/кг до 3×108 митохондрий/кг или от 3×107 митохондрий/кг до 1,5×108 митохондрий/кг в виде однократной дозы в зависимости от массы тела вводимого субъекта. Таким образом, наиболее предпочтительно с точки зрения клеточной активности, чтобы фармацевтическая композиция, содержащая митохондрии, вводилась в диапазоне вышеупомянутой дозы митохондрий, которую необходимо вводить, исходя из массы тела пациента, страдающего миозитом.
Кроме того, композицию можно вводить от 1 до 10 раз, от 3 до 8 раз или от 5 до 6 раз и, предпочтительно, можно вводить 5 раз. В этом случае интервал введения может составлять от 1 до 7 дней или от 2 до 5 дней, предпочтительно, 3 дня.
Кроме того, фармацевтическая композиция согласно настоящему изобретению может вводиться людям или другим млекопитающим, предрасположенным к миозиту или страдающим такими заболеваниями или расстройствами. Кроме того, фармацевтическая композиция может представлять собой инъекцию, которую можно вводить внутривенно, внутримышечно или подкожно, и, предпочтительно, может представлять собой препарат для инъекций.
Следовательно, фармацевтическая композиция согласно настоящему изобретению может быть изготовлена в виде инъекции, которая является физически или химически очень стабильной путем регулирования pH с использованием буферного раствора, такого как кислый водный раствор или фосфат, который можно использовать в инъекции, чтобы обеспечить стабильность продукта в соответствии с назначенным распределением инъекции.
В частности, фармацевтическая композиция по настоящему изобретению может содержать воду для инъекций. Вода для инъекций относится к дистиллированной воде, приготовленной для растворения твердой инъекции или для разбавления водорастворимой инъекции.
Кроме того, фармацевтическая композиция по настоящему изобретению может содержать стабилизатор или солюбилизирующий агент. Например, стабилизатором может быть пиросульфит, лимонная кислота или этилендиаминтетрауксусная кислота, а солюбилизирующим агентом может быть хлористоводородная кислота, уксусная кислота, гидроксид натрия, гидрокарбонат натрия, карбонат натрия или гидроксид калия.
В другом аспекте настоящего изобретения настоящее изобретение относится к способу профилактики или лечения миозита, включающий стадию введения субъекту фармацевтической композиции, описанной выше. В настоящем документе субъектом может быть млекопитающее и, предпочтительно, человек.
В этом случае введение может быть внутривенным, внутримышечным или внутрикожным. Таким образом, фармацевтическая композиция по настоящему изобретению может доставлять экзогенные митохондрии, имеющие нормальную активность, в вены субъекта, страдающего миозитом, и, таким образом, она может быть полезна для увеличения активности клеток с пониженной митохондриальной функцией или для регенерации клеток с аномальной митохондриальной функцией и может использоваться для предотвращения или лечения миозита.
В другом аспекте настоящего изобретения настоящее изобретение относится к применению выделенных митохондрий для предотвращения или лечения миозита.
Способ осуществления изобретения
Далее представлены предпочтительные примеры, чтобы помочь пониманию настоящего изобретения. Однако следующие примеры приведены только для более легкого понимания настоящего изобретения, и содержание настоящего изобретения не ограничивается следующими примерами.
I. Получение композиции, содержащей митохондрии
Пример получения 1. Получение I композиции, содержащей митохондрии, выделенные из мезенхимальных стволовых клеток, полученных из пуповины человека
Мезенхимальные стволовые клетки, полученные из пуповины человека, инокулировали в среду Alpha-MEM (Alpha-Minimum Essential Medium), содержащую 10% (об./об.) фетальной бычьей сыворотки (FBS, Gibco), 100 мкг/мл стрептомицина и 100 Ед/мл ампициллина, и культивировали 72 часа. После завершения культивирования дважды проводили промывку с использованием DPBS (забуференный фосфатом физиологический раствор Дульбекко, Gibco). Для получения клеток промытые клетки обрабатывали смесью 0,25% (об./об.) трипсин-ЭДТА (TE, Gibco).
Для выделения митохондрий полученные клетки извлекали в концентрации 1×107 клеток/мл с помощью гемоцитометра. Клеточную линию подвергали первому центрифугированию при скорости 350×g в течение 10 минут при температуре 4°C. В это время полученный осадок извлекали, ресуспендировали в буферном растворе и затем подвергали гомогенизации в течение 10-15 минут. После этого композицию, содержащую осадок, подвергали второму центрифугированию со скоростью 1100×g в течение 3 минут при температуре 4°C для получения супернатанта. Супернатант подвергали третьему центрифугированию со скоростью 12000×g в течение 14 минут при температуре 4°C для выделения митохондрий из линии клеток. Полученные таким образом митохондрии смешивали с PBS и затем заполняли в шприц.
Пример получения 2. Получение II композиции, содержащей митохондрии, выделенные из мезенхимальных стволовых клеток, полученных из пуповины человека
Мезенхимальные стволовые клетки, полученные из пуповины человека (UC-MSC), инокулировали в среду Alpha-MEM (Alpha-Minimum essential medium, Gibco), содержащую 10% фетальной бычьей сыворотки (FBS, Gibco), 100 мкг/мл стрептомицина и 100 Ед/мл ампициллина, и культивировали 72 часа. После завершения культивирования клеток дважды проводили промывку с использованием DPBS. После этого клетки получали обработкой 0,25% смесью трипсин/ЭДТА. После того, как клетки ресуспендировали так, чтобы концентрация клеток составляла 1×107 клеток/мл, клетки подвергали первому центрифугированию со скоростью 350×g в течение 10 минут при температуре 4°C.
Промытые клетки повторно переносили с использованием раствора для выделения митохондрий, а затем измельчали с помощью шприца на 1 мл. После этого раствор, содержащий измельченные клетки, центрифугировали при 1500×g в течение 5 минут при температуре 4°C для удаления примесей, и извлекали супернатант, содержащий митохондрии. Извлеченный супернатант центрифугировали при 20000×g в течение 5 минут при температуре 4°C для извлечения осажденных митохондрий, и выделенные митохондрии помещали в трис-буфер и использовали для эксперимента после количественного определения белка методом BCA.
Пример получения 3. Получение композиции, содержащей митохондрии, выделенные из мезенхимальных стволовых клеток, полученных из костного мозга человека
Мезенхимальные стволовые клетки, полученные из костного мозга человека (BM-MSC), инокулировали в среду DMEM (Gibco), содержащую 10% фетальной бычьей сыворотки (FBS, Gibco), 100 мкг/мл стрептомицина и 100 Ед/мл ампициллина, и культивировали 72 часа.
После завершения культивирования клеток митохондрии извлекали и количественно определяли способом, описанным в примере получения 2, а затем использовали в эксперименте.
Пример получения 4. Получение композиции, содержащей митохондрии, выделенные из фибробластов человека
Фибробласты человека (CCD-8LU, ATCC) инокулировали в среду DMEM (Gibco), содержащую 10% фетальной бычьей сыворотки (FBS, Gibco), 100 мкг/мл стрептомицина и 100 Ед/мл ампициллина, и культивировали 72 часа.
После завершения культивирования клеток митохондрии извлекали и количественно определяли способом, описанным в примере получения 2, а затем использовали в эксперименте.
Пример получения 5. Получение композиции, содержащей митохондрии, выделенные из индуцированных человеком плюрипотентных стволовых клеток
Индуцированные человеком плюрипотентные стволовые клетки (iPSC) культивировали в среде TeSRTM-E8TM (стволовые клетки 05990) в контейнере для культивирования клеток, покрытом 10 мкг/мл витронектина (стволовые клетки 07180), и затем использовали.
После завершения культивирования клеток митохондрии извлекали и количественно определяли способом, описанным в примере получения 2, а затем использовали в эксперименте.
Пример получения 6. Получение композиции, содержащей митохондрии, выделенные из митохондрий тромбоцитов
Чтобы выделить митохондрии из тромбоцитов, цельную кровь свиньи центрифугировали при ампициллина и культивировали при 500×g в течение 3 минут при комнатной температуре и затем собирали супернатант, содержащий плазму, богатую тромбоцитами (PRP). Извлеченный супернатант центрифугировали при 1500×g в течение 5 минут для удаления супернатанта, после чего извлекали осадок, содержащий тромбоциты. Концентрированный осадок тромбоцитов повторно всплывал при использовании PBS, затем его центрифугировали при 1500×g в течение 5 минут и промывали. Промытые тромбоциты повторно всплывали при использовании раствора для выделения митохондрий, и затем их измельчали с помощью шприца на 1 мл. После этого раствор, содержащий измельченные тромбоциты, центрифугировали при 1500×g в течение 5 минут при температуре 4°C для удаления примесей, и супернатант, содержащий митохондрии, извлекали. Извлеченный супернатант центрифугировали при 20000×g в течение 5 минут при температуре 4°C для извлечения осажденных митохондрий, и выделенные митохондрии помещали в трис-буфер и использовали для эксперимента после количественного определения белка.
Пример получения 7. Получение композиции, содержащей митохондрии, выделенные из миобластов, полученных из скелетных мышц крысы
Клетки L6 (American Type Culture Collection, ATCC, CRL-1458), линия миобластных клеток, полученная из скелетных мышц крыс, инокулировали в среду DMEM-High с высоким содержанием глюкозы (модифицированная по Дульбекко среда-высокий уровень глюкозы Eagle, Gibco), содержащую 10% фетальной бычьей сыворотки (FBS, Gibco), и культивировали 72 часа.
После завершения культивирования клеток митохондрии извлекали и количественно определяли способом, описанным в примере получения 2, а затем использовали в эксперименте.
II. Подтверждение свойств митохондрий
Пример 1. Подтверждение синтеза митохондриального АТФ
Для подтверждения того, что выделенные митохондрии в примере получения 1 обычно синтезируют АТФ, концентрацию выделенного митохондриального белка в выделенных митохондриях определяли количественно с помощью анализа бицинхониновой кислоты (BCA) для получения 5 мкг митохондрий. После этого количество АТФ определяли количественно с использованием люминесцентного набора CellTiter-Glo (Promega, Madison, WI) в соответствии с руководством производителя.
В частности, в качестве экспериментальной группы 5 мкг подготовленных митохондрий смешивали в 100 мкл PBS и затем помещали в 96-луночный планшет. Кроме того, в качестве контрольной группы 100 мкл PBS без митохондрий вносили в 96-луночный планшет. После этого каждую лунку обрабатывали 100 мкл исследуемого раствора, входящего в набор для люминесценции CellTiter-Glo, а затем подвергали взаимодействию в мешалке в течение 2 минут и хорошо перемешивали. После этого подвергали взаимодействию при температуре окружающей среды в течение 10 минут, а затем измеряли оптическую плотность при длине волны 560 нм с использованием люминесцентного ридера для микропланшетов.
В результате было подтверждено, что количество АТФ в экспериментальной группе, содержащей митохондрии, было больше примерно в 3 раза или выше, чем количество АТФ в контрольной группе (фигура 1). На основании вышеизложенного было подтверждено, что митохондрии, выделенные в примере получения 1, нормально синтезировали АТФ.
Пример 2. Измерение мембранного потенциала митохондрий
Для измерения мембранного потенциала выделенных митохондрий в примере получения 1 концентрацию митохондриального белка в выделенных митохондриях определяли количественно с помощью BCA для получения 5 мкг митохондрий. Мембранный потенциал митохондрий измеряли с помощью красителя JC-1 (молекулярные зонды, номер по каталогу 1743159).
В частности, в качестве экспериментальной группы 5 мкг подготовленных митохондрий смешивали с 50 мкл PBS и затем помещали в 96-луночный планшет. Кроме того, в качестве контрольной группы 50 мкл PBS без митохондрий вносили в 96-луночный планшет. Кроме того, в качестве дополнительной экспериментальной группы 5 мкг митохондрий смешивали с 50 мкл CCCP (карбонилцианид-М-хлорфенилгидразон - пер.) (R&D Systems, CAS 555-60-2), затем подвергали взаимодействию при комнатной температуре в течение 10 минут, а затем помещали в 96-луночный планшет. В этом случае CCCP является переносчиком ионов митохондрий и деполяризует мембранный потенциал митохондрий, тем самым подавляя функцию митохондрий.
После этого каждую лунку обрабатывали и подвергали взаимодействию с красителем JC-1 таким образом, чтобы концентрация составляла 2 мкМ, а затем с использованием флуоресцентного ридера для микропланшетов измеряли оптическую плотность. В это время краситель JC-1 присутствует в виде мономера в низкой концентрации и, таким образом, демонстрирует зеленую флуоресценцию, а при высокой концентрации краситель JC-1 агрегатируется и таким образом проявляет красную флуоресценцию (мономер: Ex 485/Em 530, J-агрегат: Ex 535 нм/Em 590 нм). Мембранный потенциал митохондрий анализировали путем расчета отношения поглощения зеленой флуоресценции к поглощению красной флуоресценции.
В результате в экспериментальной группе, содержащей митохондрии, была показана высокая активность мембранного потенциала. С другой стороны, низкая активность мембранного потенциала была показана в дополнительной экспериментальной группе, в которой митохондрии обрабатывали CCCP (фигура 2). На основании вышеизложенного было подтверждено, что митохондрии, выделенные в примере получения 1, проявляли нормальную активность мембранного потенциала.
Пример 3. Определение активных форм кислорода в митохондриях
Чтобы подтвердить повреждение выделенных митохондрий в примере получения 1, концентрацию выделенного митохондриального белка определяли количественно с помощью BCA для получения 5 мкг митохондрий. Митохондриальные активные формы кислорода (АФК) в митохондриях измеряли с использованием красителя MitoSOX red indicator (Invitrogen, номер по каталогу M36008).
В частности, в качестве экспериментальной группы, 5 мкг подготовленных митохондрий смешивали с 50 мкл PBS и затем помещали в 96-луночный планшет. Кроме того, в качестве контрольной группы, 50 мкл PBS без митохондрий вносили в 96-луночный планшет. После этого индикатор красного красителя MitoSOX смешивали с 50 мкл PBS так, чтобы концентрация составляла 10 мкМ, а затем каждую лунку обрабатывали смесью и проводили взаимодействие в течение 20 минут в инкубаторе при температуре 37°C и 5% CO2. После завершения реакции измеряли с использованием флуоресцентного ридера для микропланшетов оптическую плотность (Ex 510 нм/Em 580 нм). В результате было подтверждено, что митохондриальные активные формы кислорода в митохондриях были низкими как в контрольной группе, так и в экспериментальной группе (фигура 3). На основании вышеизложенного было подтверждено, что митохондрии, выделенные в примере получения 1, не были повреждены.
III. Подтверждение влияния митохондрий на лечение миозита in vivo
Пример 4. Подтверждение на мышиной модели, индуцированной миозитом, влияния на лечение миозита путем введения экзогенных митохондрий: первичный эксперимент
Пример 4.1. Создание модели мыши, индуцированной миозитом, и введение митохондрий (n=3)
CFA (полный адъювант Фрейнда), содержащий 200 мкг фрагментов C-белка и 100 мкг убитых нагреванием Mycobacterium butyricum, вводили внутрикожно самкам 8-недельных мышей C57BL/6 и внутрибрюшинно вводили 2 мкг PT (коклюшный токсин).
Группа, в которой выполняли однократное внутривенное введение митохондрий, выделенных в примере получения 1 (5 мкг) в день 1 или день 7 после индукции миозита, была выбрана в качестве экспериментальной группы. Кроме того, группа, в которой проводилось внутрибрюшинное введение 100 мкл PBS, была выбрана как группа отрицательного контроля, и группа, в которой проводилось внутрибрюшинное введение дексаметазона в суточной дозе 0,8 мг/кг с 1 по 14 день после индукции миозита, была выбрана в качестве группы положительного контроля (фигура 4).
Пример 4.2. Подтверждение мышечных волокон, в которые было инфильтрировано воспаление
Мышей каждой группы по примеру 4.1 умерщвляли на 14 день, собирали ткани четырехглавой мышцы и подколенного сухожилия и окрашивали H&E (гематоксилин и эозин), а затем наблюдали инфильтрацию воспалительных клеток с помощью оптического микроскопа.
В результате было подтверждено, что количество воспалительных клеток, инфильтрированных в мышечные волокна, в группе положительного контроля и экспериментальной группе, было уменьшено по сравнению с группой отрицательного контроля (фигура 5). Кроме того, мышей каждой группы умерщвляли на 14-й день, ткани четырехглавой мышцы и подколенного сухожилия собирали и окрашивали H&E, а затем оценивали количество мышечных волокон, в которые инфильтрировались воспалительные клетки, с использованием системы баллов. Метод оценки балов по балльной системе показан в таблице 2 ниже. При этом сравнивались средние значения для правой и левой мышц четырехглавой мышцы и подколенного сухожилия.
[Таблица 2]
В результате оценка мышечных волокон, в которые было инфильтрировано воспаление, в группе положительного контроля и экспериментальной группе была снижена по сравнению с группой отрицательного контроля (фигура 6).
Пример 4.3. Подтверждение концентрации цитокинов в крови
Чтобы подтвердить концентрацию IL-6 в крови нормальных мышей и мышей каждой группы из примера 4.1 на день 14, из крови мышей каждой группы выделяли сыворотку, а затем измеряли концентрацию IL-6 в крови с помощью набора ELISA для IL-6 (R&D Systems, MN, USA) в соответствии с руководством производителя.
В результате было подтверждено, что концентрация IL-6 в крови была увеличена в контрольной группе, тогда как концентрация IL-6 в крови была снижена в группе положительного контроля и экспериментальной группе (фигура 7).
Пример 4.4. Подтверждение воспалительного ответа с помощью анализа PET/MRI
Во-первых, чтобы повысить эффективность поглощения глюкозы тканями мышей каждой группы из примера 4.1, за 8 часов до визуализации не давали корм. Через 8 часов в вену мышей вводили 200 мкКи 18F-FDG (Циклотронный кабинет, отделение ядерной медицины, больница Сеульского национального университета), и через 1 час получали изображения PET/MR.
В результате в ногах мышей группы отрицательного контроля наблюдались сильные радионуклидные сигналы. Радиофармацевтический препарат 18F-FDG в основном избирательно попадает в организм макрофагами, которые являются воспалительными клетками. Следовательно, воспалительный ответ можно легко контролировать с помощью технологии визуализации в ядерной медицине (фигура 8).
Пример 4.5. Подтверждение изменения экспрессии комплекса окислительного фосфорилирования митохондрий
Экспрессия комплекса окислительного фосфорилирования II в четырехглавой мышце в группе отрицательного контроля (CIM) была снижена по сравнению с контрольной группой, а экспрессия в экспериментальной группе (CIM+Mito день 7) была увеличена по сравнению с группой положительного контроля. (DEXA). Экспрессия TOM20 в камбаловидной мышце в группе отрицательного контроля (CIM) была снижена по сравнению с контрольной группой, а экспрессия в экспериментальной группе (CIM+Mito день 1, CIM+Mito день 7) была увеличена по сравнению с группой положительного контроля (DEXA) (фигура 9).
Принимая во внимание экспериментальные результаты приведенных выше примеров 4.2-4.5, вторичный эксперимент проводили, устанавливая момент времени введения митохондрий как день 7 после индукции миозита.
Пример 5. Подтверждение на мышиной модели, индуцированной миозитом, эффекта на лечение миозита путем введения экзогенных митохондрий: вторичный эксперимент
Пример 5.1. Создание модели мышей, индуцированной миозитом, и введение митохондрий (n=10)
CFA, содержащий 200 мкг фрагментов белка C и 100 мкг убитых нагреванием Mycobacterium butyricum, вводили внутрикожно самкам 8-недельных мышей C57BL/6, а 2 мкг PT вводили внутрибрюшинно.
Группа, в которой было выполнено однократное внутривенное введение митохондрий, выделенных в примере получения 1 (5 мкг) на 7 день после индукции миозита, была выбрана в качестве экспериментальной группы. Кроме того, группа, в которой было выполнено внутрибрюшинное введение 100 мкл PBS, была выбрана как группа отрицательного контроля, и группа, в которой было выполнено внутрибрюшинное введение дексаметазона в суточной дозе 0,8 мг/кг с 7 по 14 день после индукции миозита, была выбрана в качестве группы положительного контроля (фигура 10).
Пример 5.2. Подтверждение мышечных волокон, в которые было инфильтрировано воспаление
Мышей каждой группы примера 5.1 умерщвляли на день 14, собирали ткани четырехглавой мышцы и подколенного сухожилия и окрашивали H&E, а затем наблюдали инфильтрацию воспалительных клеток с помощью оптического микроскопа. В результате было подтверждено, что количество воспалительных клеток, инфильтрированных в мышечные волокна в группе положительного контроля и экспериментальной группе, было уменьшено по сравнению с группой отрицательного контроля (фигуры 11 и 12).
Кроме того, мышей каждой группы умерщвляли на день 14, ткани четырехглавой мышцы и подколенного сухожилия собирали и окрашивали H&E, а затем с использованием балльной системы оценивали количество мышечных волокон, в которые инфильтрировались воспалительные клетки. Метод оценки баллов по балльной системе был выполнен так же, как в примере 4.2. При этом сравнивались средние значения правой и левой мышц четырехглавой мышцы и подколенного сухожилия. В результате балл для мышечных волокон, в которые инфильтрировалось воспаление, в группе положительного контроля и экспериментальной группе значительно снизился по сравнению с группой отрицательного контроля (фигура 13).
Пример 5.3. Подтверждение концентрации цитокинов в крови
Чтобы подтвердить концентрацию IL-1β, IL-6 и TNF-α в крови нормальных мышей и мышей каждой группы по примеру 5.1 на день 14, из крови мышей каждой группы выделяли сыворотку и затем в крови измеряли концентрацию IL-1β, IL-6 и TNF-α с использованием набора ELISA для IL-1β (R&D Systems, MN, USA), набора ELISA для IL-6 и набора ELISA для TNF-α (R&D Systems, MN, USA) согласно инструкции производителя, соответственно.
В результате было подтверждено, что концентрация IL-6 в крови была увеличена в группе положительного контроля по сравнению с группой отрицательного контроля, тогда как концентрация IL-6, IL-1β TNF-α в крови в экспериментальной группе была снижена по сравнению с группой отрицательного контроля (фигуры 14, 15 и 16).
Пример 5.4. Подтверждение изменения экспрессии мРНК IL-6
Уровень экспрессии мРНК IL-6 был подтвержден мРНК, выделенной из мышц нормальных мышей и мышей каждой группы примера 5.1 на день 14 с помощью RT-qPCR. В частности, тотальную РНК выделяли из мышцы с использованием реагента TRIzol (Invitrogen), и qPCR проводили с использованием SYBR Green (Perkin Elmer, MA, USA) и системы быстрой PCR в реальном времени 7500 (Applied Biosystems). Результаты экспериментов были нормализованы на количество мРНК β-актина. В этом случае используемые праймеры показаны в таблице 3 ниже.
[Таблица 3]
В результате было подтверждено, что экспрессия мРНК IL-6 была снижена в экспериментальной группе. С другой стороны, было подтверждено, что экспрессия мРНК IL-6 не была снижена в группе положительного контроля, и экспериментальная группа была более эффективной, чем группа положительного контроля, в отношении эффекта снижения экспрессии мРНК IL-6 (фигура 17).
Пример 5.5. Подтверждение изменения функции митохондрий с помощью анализа метаболома
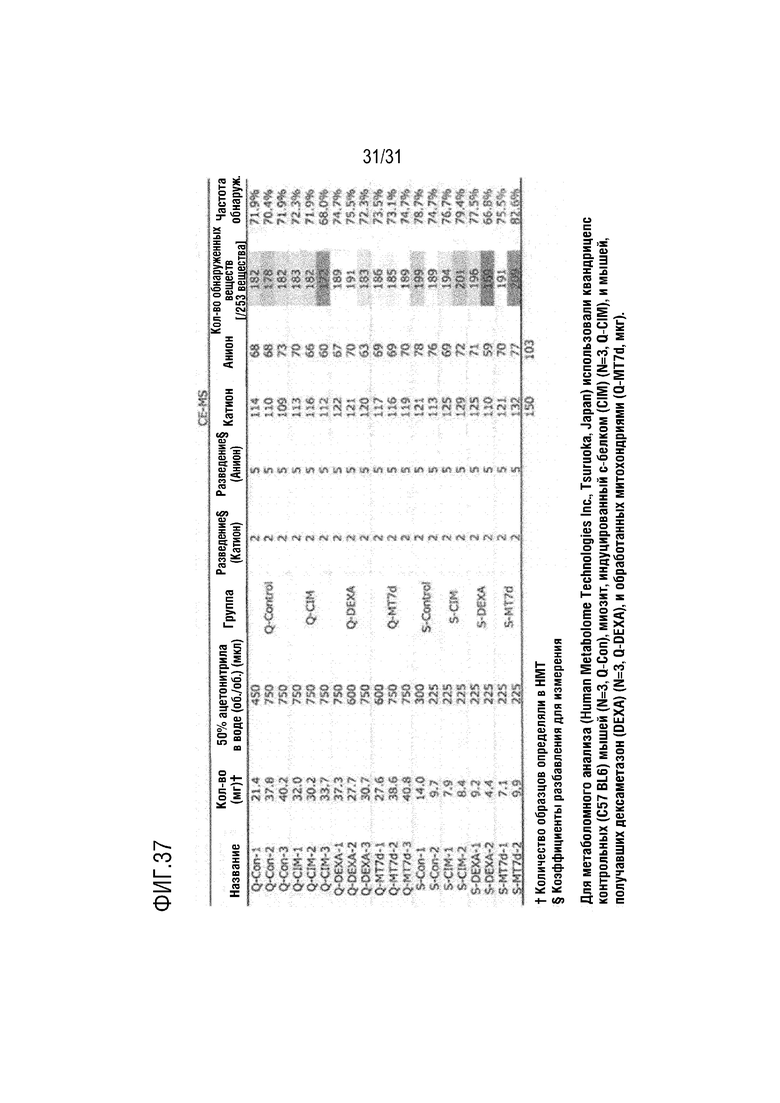
После индукции модели миозита на животных (CIM) митохондриальную функцию измеряли в четырехглавой и камбаловидной мышце контрольной группы, группы отрицательного контроля (CIM), группы положительного контроля (DEXA) и группы, в которой трансплантировали 5 мкг митохондрии, в катионном и анионном режимах анализа метаболома на основе CE-TOFMS. Образцы разводили, как показано на фигуре 37, для повышения аналитического качества анализа CE-MS.
Как видно из анализа профиля тепловой карты мышцы, было показано, что он оказал значительное влияние на профиль метаболитов скелетных мышц группы отрицательного контроля (CIM) по сравнению с контрольной группой (фигура 23). Было подтверждено, что профиль метаболита группы трансплантации митохондрий был восстановлен аналогично профилю метаболита контрольной группы по сравнению с группой положительного контроля (DEXA). Малат-аспартатный челнок (иногда кратко малатный челнок, дефект челнока малат-аспартат) представляет собой биохимическую систему, которая перемещает электроны, образующиеся в процессе гликолиза, через полупроницаемую внутреннюю мембрану митохондрий для окислительного фосфорилирования у эукариот.
Дисфункция митохондрий, наблюдаемая на модели миозита, была связана с челноком малат-аспартат, и это было подтверждено уменьшением соотношения относительной количественной оценки яблочной кислоты и аспартата. Соотношение относительного количественного значения яблочной кислоты и аспартата было значительно увеличено после трансплантации митохондрий по сравнению с группой отрицательного контроля (CIM) и группой положительного контроля (DEXA), и было подтверждено, что оно было восстановлено до уровня, аналогичного контрольной группы (фигуры 24-27).
В заключение, терапевтическая эффективность трансплантации 5 мкг митохондрий была подтверждена на модели мышей CIM.
Пример 6. Подтверждение на мышиной модели, индуцированной миозитом, эффекта на лечение миозита при введении экзогенных митохондрий: третичный эксперимент
Пример 6.1. Метод эксперимента (n=5)
CFA (полный адъювант Фрейнда), содержащий 200 мкг фрагментов C-белка и 100 мкг убитых нагреванием Mycobacterium butyricum, вводили внутрикожно самкам 8-недельных мышей C57BL/6 и внутрибрюшинно вводили 2 мкг PT (токсин коклюша).
В качестве экспериментальной группы была выбрана группа, в которой проводилось однократное внутривенное введение митохондрий, выделенных в примере получения 1, в дозе 0,2 мкг, 1 мкг или 5 мкг на день 7 после индукции миозита. Кроме того, группа, в которой было выполнено внутрибрюшинное введение 100 мкл PBS, была выбрана как группа отрицательного контроля, а группа, в которой было выполнено внутрибрюшинное введение дексаметазона (DEXA) в суточной дозе 0,8 мг/кг с 7 дня до дня 14 после индукции миозита была выбрана в качестве группы положительного контроля (фигура 18). В качестве метода оценки воспаления миозит после окрашивания H&E оценивали путем деления баллов от 1 до 6 в соответствии с гистологической градацией тяжести поражения.
Уровень экспрессии воспалительного цитокина в мРНК, выделенной из мышцы, наблюдали с помощью RT-qPCR. После трансплантации митохондрий уровень активности митохондрий оценивали с помощью вестерн-блоттинга экспрессии комплекса окислительного фосфорилирования митохондрий (комплексов OXPHOS). Информация об испытательной группе на животных представлена в таблице 4 ниже.
[Таблица 4]
Пример 6.2. Подтверждение инфильтрации воспалением мышечных волокон
Мышей каждой группы (таблица 4) умерщвляли на день 14, собирали ткани четырехглавой мышцы и подколенного сухожилия и окрашивали H&E (гематоксилин и эозин), а затем с помощью оптического микроскопа наблюдали инфильтрацию воспалительных клеток. В результате было подтверждено, что количество воспалительных клеток, инфильтрированных в мышечные волокна в группе положительного контроля и экспериментальной группе, было уменьшено по сравнению с группой отрицательного контроля (фигура 19). Кроме того, мышей каждой группы умерщвляли на день 14, ткани четырехглавой мышцы и подколенного сухожилия собирали и окрашивали H&E, а затем с использованием балльной системы оценивали количество мышечных волокон, в которые были инфильтрированы воспалительные клетки. Метод оценки баллов по балльной системе показан в таблице 5 ниже. При этом сравнивались средние значения правой и левой мышц четырехглавой мышцы и подколенного сухожилия.
[Таблица 5]
В результате было подтверждено, что количество воспалительных клеток, инфильтрированных в мышечные волокна, было значительно снижено в группе положительного контроля и группе, в которой было трансплантировано 5 мкг митохондрий, по сравнению с группой отрицательного контроля (фигура 20).
Пример 6.3. Подтверждение изменения экспрессии мРНК IL-6 и TNF-α
Уровень экспрессии мРНК IL-6 и TNF-α, воспалительных цитокинов, был подтвержден мРНК, выделенной из мышц мышей каждой группы в контрольной группе, группе отрицательного контроля (CIM), группе положительного контроля (DEXA), экспериментальной группе (группа трансплантации митохондрий) с помощью RT-qPCR. В частности, тотальную РНК выделяли из мышцы с использованием реагента TRIzol (Invitrogen), а количественную PCR проводили с использованием SYBR Green (Perkin Elmer, MA, USA) и системы быстрой PCR в реальном времени 7500 (Applied Biosystems). Результаты экспериментов были нормализованы на количество мРНК β-актина. В этом случае праймеры, используемые в RT-qPCR, показаны в таблице 6 ниже.
[Таблица 6]
В результате было подтверждена тенденция к снижению экспрессии мРНК IL-6 в мышцах группы трансплантации митохондрий. Кроме того, было подтверждено, что экспрессия мРНК TNF-α была значительно снижена в группе, в которой было трансплантировано 5 мкг митохондрий. С другой стороны, было подтверждено, что экспрессия мРНК IL-6 и TNF-α не снижалась в мышцах группы положительного контроля (Dexa), а группа трансплантации митохондрий была более эффективной, чем группа положительного контроля (Dexa) в отношении эффекта снижения экспрессии мРНК IL-6 и TNF-α (фигура 21).
Пример 6.4. Подтверждение изменения экспрессии комплекса окислительного фосфорилирования митохондрий
Изменение экспрессии комплекса окислительного фосфорилирования в белках, выделенных из мышц мышей каждой группы в контрольной группе, группе отрицательного контроля (CIM), группе положительного контроля (DEXA), экспериментальной группе (группа трансплантации митохондрий) было подтверждено с помощью вестерн-блоттинга (коктейль антител мыши Total OXPHOS WB, abcam). Было подтверждено, что экспрессия комплекса окислительного фосфорилирования I и II была снижена в группе отрицательного контроля (CIM) по сравнению с контрольной группой, а экспрессия комплекса окислительного фосфорилирования I и II была увеличена в экспериментальной группе (группа трансплантации митохондрий) при всех дозах по сравнению с группой положительного контроля (DEXA) (фигура 22).
В заключение, терапевтическая эффективность и дозовая зависимость трансплантации 5 мкг митохондрий были подтверждены на модели мышей CIM.
IV. Подтверждение токсичности и физических свойств композиции, содержащей митохондрии
Пример 7. Эксперимент по токсичности
Чтобы подтвердить, что при введении митохондрий проявлялась токсичность, митохондрии, полученные в примере получения 1, вводили внутривенно один раз мышам ICR, а затем подтверждали изменения массы тела и изменения в органах при вскрытии и тому подобное. Для проведения эксперимента 12 самцов и самок 7-недельных мышей ICR разделяли на четыре группы, как показано в таблице 7 ниже.
[Таблица 7]
Как показано в таблице 7 выше, группе G1 вводили эксципиенты. Группам G2-G4 вводили 25 мкг, 50 мкг или 100 мкг митохондрий, соответственно. В то же время группе G4 вводили митохондрии в количестве, превышающем приблизительную летальную дозу (ALD). При этом место введения дезинфицировали 70% хлопковым спиртом, и затем через проточную вену с использованием шприца, снабженного инъекционной иглой 26 размера, со скоростью 1 мл/мин вводили эксципиенты или митохондрии.
Сначала один или несколько раз в день у всех мышей наблюдали общие симптомы, и для каждого субъекта регистрировали тип и степень общих симптомов, включая смерть во время периода размножения. Однако в день введения наблюдение продолжали до 1 часа после введения, а после этого наблюдение проводили в течение 5 часов с интервалом в 1 час. Умирающих животных и мертвых животных обрабатывали в соответствии с плановыми вскрытиями животных. Датой начала введения вспомогательных веществ или митохондрий был день 1.
В результате наблюдения за общими симптомами во всех группах в течение всего периода исследования мертвых животных не наблюдали, и аномальные симптомы, наблюдаемые в день 1 после введения митохондрий, не наблюдались в течение последующего периода исследования, и, таким образом, это считается временными изменениями, вызванными митохондриями. Кроме того, у всех мышей измеряли массу тела до введения, на день 2-й, 4-й, 8-й и 15-й после введения. Результаты определений показаны в таблице 8 ниже.
[Таблица 8]
Как показано в таблице 8, в группах от G1 до G4 не наблюдалось значительного изменения массы тела. Далее всех мышей анестезировали в день 15, а затем разрезали брюшную полость и визуально исследовали все органы. В результате в группах от G1 до G4 изменений органов не наблюдалось.
На основании приведенных выше результатов было подтверждено, что при однократном внутривенном введении митохондрий мышам ICR в этих условиях испытаний и самцы, и самки не проявляли токсичности при концентрации митохондрий до 100 мкг/голову.
Пример 8. Сравнение свойств митохондрий, выделенных из замороженных стволовых клеток, полученных из пуповины, и митохондрий, выделенных из культивируемых стволовых клеток, полученных из пуповины
Мезенхимальные стволовые клетки, полученные из пуповины, инокулировали в среду Alpha-MEM, содержащую 10% (об./об.) фетальной бычьей сыворотки (FBS), 100 мкг/мл стрептомицина и 100 Ед/мл ампициллина, и культивировали 72 часа. Культивируемые клетки обрабатывали смесью 0,25% трипсина-ЭДТА (ТЕ) для получения клеток. Полученные клетки ресуспендировали в концентрации 1×107 клеток/мл с помощью гемоцитометра, затем помещали в пробирку для замораживания, переносили в контейнер для криоконсервации, затем замораживали при температуре -80°C в течение 24 часов и хранили в банке для криоконсервации с жидким азотом. Выделенные митохондрии из замороженных стволовых клеток, полученных из пуповины, выделяли таким же образом, как в примере получения 1 выше, и сравнивали с митохондриями, полученными из культивируемых клеток, выделенными в потенциале примера получения 1, и митохондриальными реактивными формами кислорода.
В результате, чтобы сравнить способность к синтезу АТФ между выделенными митохондриями из замороженных стволовых клеток, полученных из пуповины, и выделенными митохондриями из культивируемых стволовых клеток, полученных из пуповины, было подтверждено, что был добавлен субстрат (ADDP) и активность АТФ восстанавливалась до аналогичного соотношения в обоих условиях по сравнению с исходным энергетическим метаболизмом. Кроме того, было подтверждено, что активность мембранного потенциала была сходной в обоих условиях, и производство митохондриальных активных форм кислорода также было сходным (фигуры 28-30).
Пример 9. Измерение количества митохондрий с помощью счетчика частиц
Каждый раствор митохондрий, выделенных из мезенхимальных стволовых клеток, полученных из пуповины человека, выделенных в примере получения 1, готовили в концентрации 1 мкг/мл, 2,5 мкг/мл и 5 мкг/мл, и затем количество митохондрий определяли с помощью счетчика частиц (Multisizer 4e, Beckman Coulter). На данном этапе определение осуществляли два раза для каждой концентрации, и результаты измерения показаны в таблице 9 ниже и на фигурах 31-33.
[Таблица 9]
V. Подтверждение противовоспалительного действия митохондрий in vitro
Пример 10. Сравнение противовоспалительной активности с использованием количественной полимеразной цепной реакции в реальном времени митохондрий, полученных из нескольких видов клеток в клетках RAW264.7
Для того, чтобы сравнить и проанализировать противовоспалительную активность митохондрий, полученных из различных клеток с помощью способов по примеру 2, примеру 3, примеру 4 и примеру 7, был проведен эксперимент по анализу на основе клеток с использованием количественной полимеразной цепной реакции в реальном времени.
Клетки RAW264.7, клеточная линия макрофагов, полученная от мышей, культивировали в среде DMEM, содержащей 10% FBS. Около 3×105 клеток/лунку инокулировали в 6-луночный планшет и культивировали в течение 24 часов, а затем состояние дефицита в среде DMEM, из которой был удален FBS, сохраняли в течение примерно 24 часов.
Через 24 часа обрабатывали липополисахаридом сальмонеллезного происхождения (ЛПС) в концентрации 1 мкг/мл в течение 6 часов, чтобы вызвать воспалительную реакцию в клеточной линии макрофагов. После 6 часов обработки липополисахаридом клетки дважды промывали буферным раствором PBS, а затем обрабатывали митохондриями, полученными из каждой клетки, и дополнительно культивировали в течение 18 часов. В этом случае группа отрицательного контроля представляет собой группу, которую не обрабатывают липополисахаридом и митохондриями, а группа положительного контроля представляет собой группу, которую обрабатывают только липополисахаридом в концентрации 1 мкг/мл. Кроме того, экспериментальная группа получала липополисахарид в концентрации 1 мкг/мл, а через 6 часов митохондрии, полученные из мезенхимальных стволовых клеток, полученных из костного мозга (BM-MSC), из мезенхимальных стволовых клеток, полученных из пуповины (UC-MSC), из миобластов крыс (миобласты L6) и фибробластов, полученных из легких человека (CCD-8LU) в количестве 30 мкг, соответственно.
После 18 часов обработки митохондрий культуральный раствор удаляли, и клетки дважды промывали, добавляя к клеткам буферный раствор PBS, напрямую добавляли 0,5 мл экстракта РНК (реагент TRIzol, Thermo Fisher Scientific), а затем оставляли при комнатной температуре на 10 минут. Затем добавляли 0,1 мл хлороформа и перемешивали в течение 15 секунд, а затем центрифугировали при примерно 12000×g в течение 10 минут.
Получали отделенный супернатант, добавляли такой же объем изопропилового спирта и затем центрифугировали при 12000×g в течение 10 минут. После этого жидкость удаляли и промывали один раз 75% этанолом, а затем сушили при температуре окружающей среды. После сушки добавляли около 50 мкл очищенной воды, не содержащей РНКазу, и с помощью спектрофотометра определяли количество и чистоту полученной РНК.
Для синтеза кДНК с использованием полученной РНК 2 мкг очищенной тотальной РНК подвергали реакции связывания с олиго dT в течение 5 минут при температуре 70°C, а затем добавляли 10-кратный буферный раствор для обратной транскрипции, 10 мМ dNTP, ингибитор РНКазы и обратную транскриптазу M-MLV (Enzynomics, Корея) и проводили реакцию синтеза кДНК при температуре 42°C в течение 60 минут.
После завершения реакции синтеза кДНК обратную транскриптазу инактивировали нагреванием при температуре 70°C в течение 5 минут, а затем добавляли РНКазу H для удаления одноцепочечной РНК с получением конечной кДНК. Изменения в экспрессии гена TNF-α, гена IL-1β и гена IL-6, которые являются характерными генами воспалительного ответа, наблюдали с помощью количественной полимеразной цепной реакции в реальном времени. Ген GAPDH был количественно определен вместе с ними, чтобы скорректировать разницу в экспрессии. Последовательности оснований генов, используемых в количественной полимеразной цепной реакции в реальном времени, описаны в таблице 10 ниже.
[Таблица 10]
Как показали результаты экспериментов, было обнаружено, что экспрессия генов TNF-α, IL-1β и IL-6 увеличивалась, когда клетки RAW 264.7, клеточная линия макрофагов мыши, обрабатывались липополисахаридом. Кроме того, было подтверждено, что экспрессия генов TNF-α, IL-1β и IL-6, индуцированная липополисахаридом, подавлялась до значительного уровня при обработке митохондриями, полученными из мезенхимальных стволовых клеток, полученных из костного мозга, мезенхимальных стволовых клеток, полученных из пуповины, миобластов крыс и фибробластов, полученных из легких человека. На основании вышеизложенного было подтверждено, что митохондрии, полученные из клеток, использованных в настоящем изобретении, проявляли замечательно превосходную противовоспалительную активность (фигура 34).
Пример 11. Сравнение противовоспалительной активности митохондрий, полученных из нескольких видов клеток в мононуклеарных клетках человека (THP-1)
Клетки THP-1, мононуклеарные клетки человеческого происхождения, культивировали в среде RPMI, содержащей 10% FBS. 4×105 клеток/лунку, инокулировали в 24-луночный планшет и культивировали в течение 15-16 часов в среде RPMI, содержащей 1% FBS.
Клетки обрабатывали липополисахаридом, полученным из сальмонеллы (LPS), в концентрации 2 мкг/мл в течение 6 часов, чтобы вызвать воспалительный ответ в клеточной линии THP-1. После 6 часов обработки липополисахаридом клетки обрабатывали митохондриями, полученными из каждой клетки, и далее культивировали в течение 24 часов. В этом случае группа отрицательного контроля представляет собой группу, которую не обрабатывают липополисахаридом и митохондриями, а группа положительного контроля подставляет собой группу, которую обрабатывают только липополисахаридом в концентрации 2 мкг/мл. Кроме того, экспериментальную группу обрабатывали липополисахаридом в концентрации 2 мкг/мл, и через 6 часов обрабатывали митохондриями, полученными из мезенхимальных стволовых клеток, полученных из пуповины (UC-MSC), фибробластов, полученных из легких человека (CCD-8LU), индуцированными человеком плюрипотентными стволовыми клетками (IPS) и тромбоцитами свиньи, полученными способами по примеру 2, примеру 4, примеру 5 и примеру 6 в количестве 40 мкг, соответственно. Чтобы сравнить противовоспалительную активность после реакции, клетки использовали для количественной полимеразной цепной реакции в реальном времени, и для ELISA использовали культуральный раствор.
Пример 11.1. Сравнение противовоспалительной активности с использованием количественной полимеразной цепной реакции в реальном времени
После этого культуральный раствор удаляли, к клеткам добавляли буферный раствор PBS, дважды промывали и напрямую добавляли 0,5 мл экстракта РНК (реагент TRIzol, Thermo Fisher Scientific). После выдерживания при температуре окружающей среды в течение 10 минут добавляли 0,1 мл хлороформа и перемешивали в течение 15 секунд, а затем центрифугировали при 12000×g в течение 10 минут. Отбирали отделенный супернатант, добавляли такой же объем изопропилового спирта, центрифугировали при 12000×g в течение 10 минут, а затем супернатант удаляли, промывали один раз 75% этанолом и сушили при температуре окружающей среды.
Добавляли 50 мкл очищенной воды, не содержащей РНКазу, и количество и чистоту полученной РНК измеряли с помощью спектрофотометра. Для синтеза кДНК 2 мкг очищенной тотальной РНК подвергали реакции связывания с олиго dT в течение 5 минут при температуре 70°C, а затем добавляли 10-кратный буферный раствор для обратной транскрипции, 10 мМ dNTP, ингибитор РНКазы и обратную транскриптазу M-MLV (Enzynomics, Корея), и синтез кДНК проводили при температуре 42°C в течение 60 минут. После реакции обратную транскриптазу инактивировали нагреванием при температуре 72°C в течение 5 минут, а затем добавляли РНКазу H для удаления одноцепочечной РНК с получением кДНК.
Количественную полимеразную цепную реакцию (количественную RT-PCR) проводили с использованием праймеров, показанных в таблице 11 ниже, чтобы определить, изменилась ли экспрессия провоспалительных цитокинов. В этом случае разницу в экспрессии корректировали путем количественной оценки с использованием 18S в качестве гена для коррекции.
[Таблица 11]
Как показали результаты экспериментов, было обнаружено, что экспрессия гена IL-6 увеличивалась, когда клетки THP-1, которые являются мононуклеарными клетками человека, обрабатывали липополисахаридом. Кроме того, было подтверждено, что экспрессия гена IL-6, индуцированная липополисахаридом, подавлялась до значительного уровня при обработке митохондриями, полученными из мезенхимальных стволовых клеток, полученных из пуповины, фибробластов, полученных из легких человека, индуцированных человеком плюрипотентных стволовых клеток, и свиных тромбоцитов. На основании вышеизложенного было подтверждено, что митохондрии, полученные из различных клеток, проявляют замечательно превосходную противовоспалительную активность (фигура 35, *P<0,05).
Пример 11.2. Сравнение противовоспалительной активности методом ELISA
Для подтверждения уровня экспрессии IL-6, провоспалительного цитокина клеток ТНР-1 с полученным супернатантом, эксперимент был проведен с использованием человеческого IL-6 (R&D Systems) в соответствии с руководством производителя следующим образом.
100 мкл раствора для покрытия помещали в 96-луночный планшет, подвергали взаимодействию в течение ночи при температуре окружающей среды, промывали 3 раза, затем подвергали взаимодействию с разбавителем реагента в течение 1 часа при температуре окружающей среды и промывали 3 раза. 10-кратно разведенный супернатант и стандартный раствор подвергали взаимодействию в течение 2 часов при температуре окружающей среды, затем промывали 3 раза и затем обрабатывали меченым антителом (детектирующим антителом) в каждой лунке, а затем проводили реакцию в течение 2 часов при температуре окружающей среды. После 3-кратной промывки раствор стрептавидина (стрептавидин-HRP) подвергали взаимодействию в течение 20 минут при температуре окружающей среды, затем промывали 3 раза, затем подвергали взаимодействию с окрашивающим раствором (раствор субстрата) в темной комнате при температуре окружающей среды в течение 20 минут, и затем добавляли раствор для остановки реакции и измеряли оптическую плотность при длине волны 450 нм.
Как показали результаты экспериментов, было обнаружено, что белок IL-6 увеличивался, когда клетки THP-1, которые являются мононуклеарными клетками человека, обрабатывали липополисахаридом. Кроме того, было подтверждено, что белок IL-6, индуцированный липополисахаридом, ингибировался до значительного уровня при обработке митохондриями, полученными из мезенхимальных стволовых клеток, полученных из пуповины, фибробластов, полученных из легких человека, индуцированных человеком плюрипотентных стволовых клеток и тромбоцитов свиней, и это соответствовало результатам экспрессии генов. На основании вышеизложенного было подтверждено, что митохондрии, полученные из различных клеток, проявляли замечательно превосходную противовоспалительную активность (фигура 36, *P<0,05).






Группа изобретения относится к области фармацевтики, а именно к применениям фармацевтической композиции, содержащей митохондрии, для профилактики или лечения миозита. Применение фармацевтической композиции для профилактики или лечения миозита, где фармацевтическая композиция содержит митохондрии в качестве активного ингредиента, где миозит представляет собой полимиозит или дерматомиозит. Применение выделенных митохондрий для получения лекарственного средства для профилактики или лечения миозита, где миозит представляет собой полимиозит или дерматомиозит. Вышеописанная группа изобретений позволяет применять фармацевтическую композиции на основе митохондрий для лечения миозитов. 2 н. и 9 з.п. ф-лы, 37 ил., 11 табл., 31 пр.
1. Применение фармацевтической композиции для профилактики или лечения миозита, где фармацевтическая композиция содержит митохондрии в качестве активного ингредиента, где миозит представляет собой полимиозит или дерматомиозит.
2. Применение фармацевтической композиции по п.1, где митохондрии выделяют из клеток или тканей.
3. Применение фармацевтической композиции по п.2, где митохондрии выделяют из клеток, культивируемых in vitro.
4. Применение фармацевтической композиции по п.2, где клетка представляет собой клетку, выбранную из группы, состоящей из соматических клеток, половых клеток, стволовых клеток и их комбинации.
5. Применение фармацевтической композиции по п.4, где соматическая клетка представляет собой клетку, выбранную из группы, состоящей из мышечных клеток, гепатоцитов, нервных клеток, фибробластов, эпителиальных клеток, адипоцитов, остеоцитов, лейкоцитов, лимфоцитов, тромбоцитов или клеток слизистой оболочки и их комбинации.
6. Применение фармацевтической композиции по п.4, где зародышевые клетки выбраны из группы, состоящей из сперматозоидов, яйцеклеток и их комбинации.
7. Применение фармацевтической композиции по п.4, где стволовая клетка представляет собой клетку, выбранную из группы, состоящей из мезенхимальных стволовых клеток, взрослых стволовых клеток, индуцированных плюрипотентных стволовых клеток, стволовых клеток костного мозга, нервных стволовые клетки, лимбальных стволовых клеток, стволовых клеток тканевого происхождения и их комбинации.
8. Применение фармацевтической композиции по п.7, где мезенхимальные стволовые клетки получают из любых, выбранных из группы, состоящей из пуповины, пуповинной крови, костного мозга, жира, мышц, нервов, кожи, амниотической оболочки, плаценты, синовиальной жидкости, семенников, надкостницы и их комбинации.
9. Применение фармацевтической композиции по п.1, где митохондрии содержатся в концентрации от 0,1 мкг/мл до 1000 мкг/мл относительно фармацевтической композиции.
10. Применение фармацевтической композиции по п.1, где митохондрии содержатся в количестве от 1×105 до 5×108 митохондрий/мл относительно фармацевтической композиции.
11. Применение выделенных митохондрий для получения лекарственного средства для профилактики или лечения миозита, где миозит представляет собой полимиозит или дерматомиозит.
| WO 2018101708 A1, 07.06.2018 | |||
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ЛЕЧЕНИЯ ХРОНИЧЕСКОГО ВОСПАЛЕНИЯ И ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ | 2014 |
|
RU2680801C2 |
| Oldfors A | |||
| et al | |||
| Mitochondrial abnormalities in inclusion-body myositis // Neurology, 2006 Jan 24; vol | |||
| Приспособление для соединения пучка кисти с трубкою или втулкою, служащей для прикрепления ручки | 1915 |
|
SU66A1 |
| Способ смешанной растительной и животной проклейки бумаги | 1922 |
|
SU49A1 |
| Устройство для выпрямления многофазного тока | 1923 |
|
SU50A1 |
Авторы
Даты
2023-12-27—Публикация
2020-04-29—Подача