ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к композиции для предотвращения, снятия симптомов или терапевтического воздействия на поражение печени, а также к способу предотвращения, снятия симптомов или оказания терапевтического воздействия на поражение печени.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
Неалкогольная жировая болезнь печени (НАЖБП) характеризуется нарушением обмена веществ в печени, приводящим к нарушениям от простого стеатоза до неалкогольного стеатогепатита, которые являются инвазивной формой ткани, что в конечном итоге приводит к прогрессирующему фиброзу и циррозу печени. По данным большинства эпидемиологических исследований распространенность НАЖБП в мире оценивается на уровне 24-30% и растет параллельно с ожирением и метаболическим синдромом.
В последнее время возрастающий интерес направлен преимущественно на выявление и осознание специфической роли кишечной микробиоты при различных болезнях обмена веществ. Дисбиоз кишечника, который относится к аномальным изменениям кишечной микробиоты по сравнению с нормальной микробиотой, связан с уменьшением количества бактерий, производящих полезные короткоцепочечные жирные кислоты (КЦЖК), изменением состава желчных кислот, активацией иммунных реакций на липополисахарид (ЛПС), увеличением производства этанола в результате избыточного роста производящих этанол бактерий, и преобразованием фосфатидилхолина в холин и триметиламин. Известно, что изменения кишечной микрофлоры, влияющие на ось «кишечник-печень», способствуют прогрессированию хронических заболеваний печени, таких как НАЖБП и цирроз печени, а также прогрессирующего фиброза. Тем не менее, восстановление количества кишечной микрофлоры, избыточно развившейся или подавленной в болезненном состоянии, не всегда облегчает тяжесть заболевания. Это объясняется тем, что изменения кишечной микрофлоры в болезненном состоянии могут быть результатом, а не причиной физиологических изменений, вызванных болезнью.
Поэтому существует потребность в эффективном способе предотвращения, терапевтического воздействия и диагностики НАЖБП, позволяющем определять гистологическую тяжесть НАЖБП и достоверно определять изменения кишечной микрофлоры.
РАСКРЫТИЕ
ТЕХНИЧЕСКАЯ ЗАДАЧА
Настоящее изобретение направлено на решение вышеуказанных проблем, и его задачей является разработка композиции для предотвращения, снятия симптомов или терапевтического воздействия на поражение печени, например, неалкогольной жировой болезни печени.
ТЕХНИЧЕСКОЕ РЕШЕНИЕ
Один из вариантов осуществления настоящего изобретения относится к композиции для предотвращения, снятия симптомов или терапевтического воздействия на поражение печени, содержащей штамм Ruminococcus spp.
Другой вариант осуществления настоящего изобретения относится к композиции для культивирования штамма Ruminococcus spp., содержащей источник углерода и источник азота.
Следующий вариант осуществления настоящего изобретения относится к способу предотвращения, снятия симптомов или терапевтического воздействия на поражение печени, содержащему введение композиции для предотвращения, снятия симптомов или терапевтического воздействия на поражение печени в соответствии с настоящим изобретением нуждающемуся в этом субъекту.
Далее настоящее изобретение будет раскрыто в деталях.
Один из вариантов осуществления настоящего изобретения относится к композиции для предотвращения, снятия симптомов или терапевтического воздействия на поражение печени, содержащей штамм Ruminococcus spp. Композиция может быть фармацевтической композицией или пищевой композицией. Композиция может дополнительно содержать масляную кислоту.
Поражение печени может представлять собой одно или несколько, выбранное из группы, состоящей из жировой печени, гепатита, фиброза печени и цирроза печени. Поражение печени может быть неалкогольным. В частности, гепатит может представлять собой неалкогольный стеатогепатит, а жировая печень может представлять собой неалкогольную жировую печень. Неалкогольная жировая печень может представлять собой, в частности, неалкогольную жировую печень без ожирения, неалкогольную жировую печень с ожирением или диабетическую неалкогольную жировую печень. Диабетическая неалкогольная жировая печень может быть вызвана диабетом 2 типа.
У пациентов с диабетом 2 типа вероятность развития неалкогольного стеатогепатита (НАСГ) составляет 40%, а у пациентов с диабетом 2 типа, имеющих неалкогольную жировую печень, распространенность неалкогольного стеатогепатита повышена (80,2% против 64,4%; p < 0,001) и фиброза печени (40,3% против 17,0%; p < 0,001) по сравнению с пациентами с неалкогольной жировой печенью без диабета 2 типа. Поэтому существует необходимость в разработке терапевтического средства для пациентов с неалкогольной жировой печенью, имеющих диабет 2 типа. Поражение печени при диабете 2 типа трудно поддается лечению, поскольку прогноз хуже по сравнению со случаем отсутствия диабета 2 типа, тем не менее композиция, предложенная настоящим изобретением, способна оказывать терапевтическое действие на поражение печени при диабете 2 типа.
Композиция способна предотвращать, снимать симптомы или оказывать терапевтическое действие на поражение печени независимо от инсулина. Учитывая подтверждение действия композиции, предложенной настоящим изобретением, на поражение печени на животной модели с инсулинорезистентностью, настоящие примеры демонстрируют значительное уменьшение поражения печени, то есть было подтверждено, что композиция, в соответствии с настоящим изобретением, снимает симптомы и оказывает терапевтическое действие на поражение печени независимо от инсулина.
Композиция, предложенная настоящим изобретением, введенная субъекту с поражением печени, показала значительно улучшенный результат лечения поражения печени. Субъект с поражением печени может иметь одну или несколько из следующих характеристик (1) - (5):
(1) повышенное состояние концентрации АЛТ в крови, например, более чем в 1 раз, в 1,1 раза и более, в 1,2 раза и более, в 1,3 раза и более, в 1,4 раза и более, в 1,5 раза и более, в 1,6 раза и более, в 1,7 раза и более, в 1,8 раза и более, в 1,9 раза и более, в 2 раза и более, в 2,1 раза и более, в 2,2 раза и более, в 2,3 раза и более, в 2,4 раза и более, в 2,5 раза и более, в 2,6 раза и более, в 2,7 раза и более, в 2,8 раза и более, в 2,9 раза и более, в 3 раза и более, в 3,5 раза и более, в 4 раза и более, в 4,5 раза и более, в 5 раз и более, в 5,5 раз и более, в 6 раз и более, в 6,5 раз и более, в 7 раз и более, в 7,5 раз и более, в 8 раз и более, в 8,5 раз и более, в 9 раз и более, в 9,5 раз и более, или в 10 раз и более от концентрации АЛТ в крови в нормальной контрольной группе.
(2) повышенное состояние концентрации АСТ в крови, например, более чем в 1 раз, в 1,1 раза и более, в 1,2 раза и более, в 1,3 раза и более, в 1,4 раза и более, в 1,5 раза и более, в 1,6 раза и более, в 1,7 раза и более, в 1,8 раза и более, в 1,9 раза и более, в 2 раза и более, в 2,1 раза и более, в 2,2 раза и более, в 2,3 раза и более, в 2,4 раза и более, в 2,5 раза и более, в 2,6 раза и более, в 2,7 раза и более, в 2,8 раза и более, в 2,9 раза и более, в 3 раза и более, в 3,5 раза и более, в 4 раза и более, в 4,5 раза и более, в 5 раз и более, в 5,5 раз и более, в 6 раз и более, в 6,5 раз и более, в 7 раз и более, в 7,5 раз и более, в 8 раз и более, в 8,5 раз и более, в 9 раз и более, в 9,5 раз и более, или в 10 раз и более от концентрации АСТ в крови в нормальной контрольной группе.
(3) пониженное состояние концентрации вторичных желчных кислот в слепой кишке, например, менее чем в 1 раз, в 0,9 раза и менее, в 0,8 раза и менее, в 0,7 раза и менее, в 0,6 раза и менее, в 0,5 раза и менее, в 0,4 раза и менее, в 0,3 раза и менее, в 0,2 раза и менее, или в 0,1 раза и менее от концентрации вторичных желчных кислот в слепой кишке в нормальной контрольной группе.
(4) повышенное состояние экспрессии маркерного гена фиброза, например, сверхэкспрессирование более чем в 1 раз, в 1,1 раза и более, в 1,2 раза и более, в 1,3 раза и более, в 1,4 раза и более, в 1,5 раза и более, в 1,6 раза и более, в 1,7 раза и более, в 1,8 раза и более, в 1,9 раза и более, в 2 раза и более, в 2,1 раза и более, в 2,2 раза и более, в 2,3 раза и более, в 2,4 раза и более, в 2,5 раза и более, в 2,6 раза и более, в 2,7 раза и более, в 2,8 раза и более, в 2,9 раза и более, в 3 раза и более, в 3,5 раза и более, в 4 раза и более, в 4,5 раза и более, в 5 раз и более, в 5,5 раз и более, в 6 раз и более, в 6,5 раз и более, в 7 раз и более, в 7,5 раз и более, в 8 раз и более, в 8,5 раз и более, в 9 раз и более, в 9,5 раз и более, в 10 раз и более, в 11 раз и более, в 12 раз и более, в 13 раз и более, в 14 раз и более, в 15 раз и более, в 16 раз и более, в 17 раз и более, в 18 раз и более, в 19 раз и более, или в 20 раз и более по сравнению с экспрессией маркерного гена фиброза в нормальной контрольной группе, причем маркерный ген фиброза может представлять собой один или несколько, выбранных из группы, состоящей из Col1a1 и/или Timp1 и/или α-SMA.
(5) повышение состояние отношения массы печени к массе тела, например, более чем в 1 раз, в 1,1 раза и более, в 1,2 раза и более, в 1,3 раза и более, в 1,4 раза и более, в 1,5 раза и более, в 1,6 раза и более, в 1,7 раза и более, в 1,8 раза и более, в 1,9 раза и более, в 2 раза и более, в 2,1 раза и более, в 2,2 раза и более, в 2,3 раза и более, в 2,4 раза и более, в 2,5 раза и более, в 2,6 раза и более, в 2,7 раза и более, в 2,8 раза и более, в 2,9 раза и более или в 3 раза и более по сравнению с отношением массы печени к массе тела в нормальной контрольной группе.
Под нормальной контрольной группой понимают контрольную группу, не имеющую поражения печени.
Кроме того, поражение печени субъекта может представлять собой одно или более, выбранное из группы, состоящей из жировой печени, гепатита, фиброза печени и цирроза печени. Поражение печени может быть неалкогольным поражением печени. В частности, гепатит может представлять собой неалкогольный стеатогепатит, а жировая печень может представлять собой неалкогольную жировую печень. Неалкогольная жировая печень может представлять собой неалкогольную жировую печень без ожирения, неалкогольную жировую печень с ожирением или диабетическую неалкогольную жировую печень, но не ограничиваясь этим.
Композиция, в соответствии с настоящим изобретением, может быть введена субъекту с диабетом, в частности, композиция, в соответствии с настоящим изобретением, может предотвращать, снимать симптомы или оказывать терапевтическое воздействие на поражение печени независимо от инсулина, поэтому она может быть введена субъекту с диабетом 2 типа.
В настоящих примерах, в качестве результата, подтверждающего эффект терапевтического воздействия на поражение печени, например, при неалкогольной жировой печени, композиции, в соответствии с настоящим изобретением, терапевтический эффект, в частности, способность к снижению концентрации АЛТ в крови, снижению концентрации АСТ в крови, снижению отношения массы печени к массе тела и т.п., значительно превосходит терапевтический эффект, демонстрируемый на модели без диабета 2 типа, что означает, что композиция, в соответствии с настоящим изобретением, обладает превосходным терапевтическим эффектом, в частности, на субъектах с диабетом 2 типа.
В частности, терапевтический эффект у субъектов с диабетом 2 типа более значительный, и различия в инсулинорезистентности влияли на различия в чувствительности, связанной со снятием симптомов или терапевтическим воздействием Ruminococcus на поражение печени.
Композиция, соответствии с настоящим изобретением, может быть введена субъекту с поражением печени для достижения одной или нескольких из следующих характеристик (1) - (5):
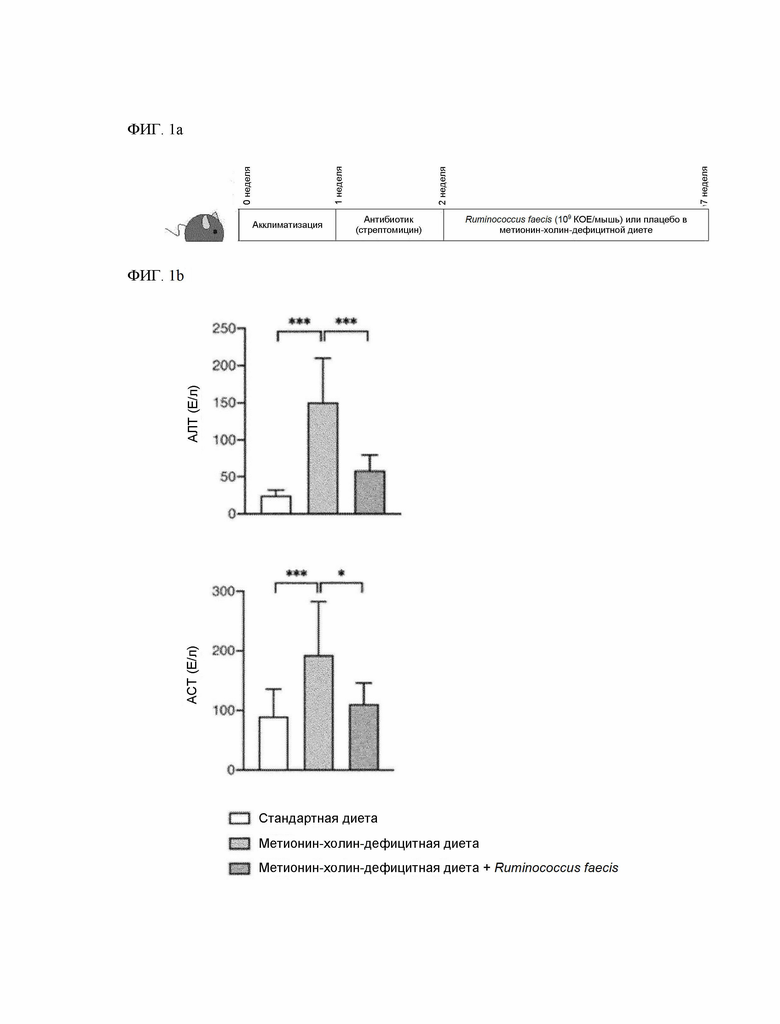
(1) снижение концентрации АЛТ в крови, например, концентрация АЛТ в крови после введения композиции составляет менее 100%, 99% и менее, 98% и менее, 97% и менее, 96% и менее, 95% и менее, 94% и менее, 93% и менее, 92% и менее, 91% и менее, 90% и менее, 80% и менее, 70% и менее, 65% и менее, 60% и менее, 59% и менее, 58% и менее, 50% и менее, 45% и менее, или 40% и менее от 100% концентрации АЛТ в крови контрольной группы, не получавшей композицию (в одном из примеров (ФИГ. 1b, при совместном введении метионин-холин-дефицитной диеты (MCD) и штамма Ruminococcus faecis уровень АЛТ составил 39,21% по сравнению с введением только метионин-холин-дефицитной диеты).
(2) снижение концентрации АСТ в крови, например, концентрация АСТ в крови после введения композиции составляет менее 100%, 99% и менее, 98% и менее, 97% и менее, 96% и менее, 95% и менее, 94% и менее, 93% и менее, 92% и менее, 91% и менее, 90% и менее, 80% и менее, 70% и менее, 65% и менее, 64% и менее, 63% и менее, 62% и менее, 61% и менее, 60% и менее или 59% и менее от 100% концентрации АСТ в крови контрольной группы, не получавшей композицию (в одном из примеров (ФИГ. 1b, при совместном введении метионин-холин-дефицитной диеты и штамма Ruminococcus faecis уровень АСТ составил 57,52% по сравнению с введением только метионин-холин-дефицитной диеты).
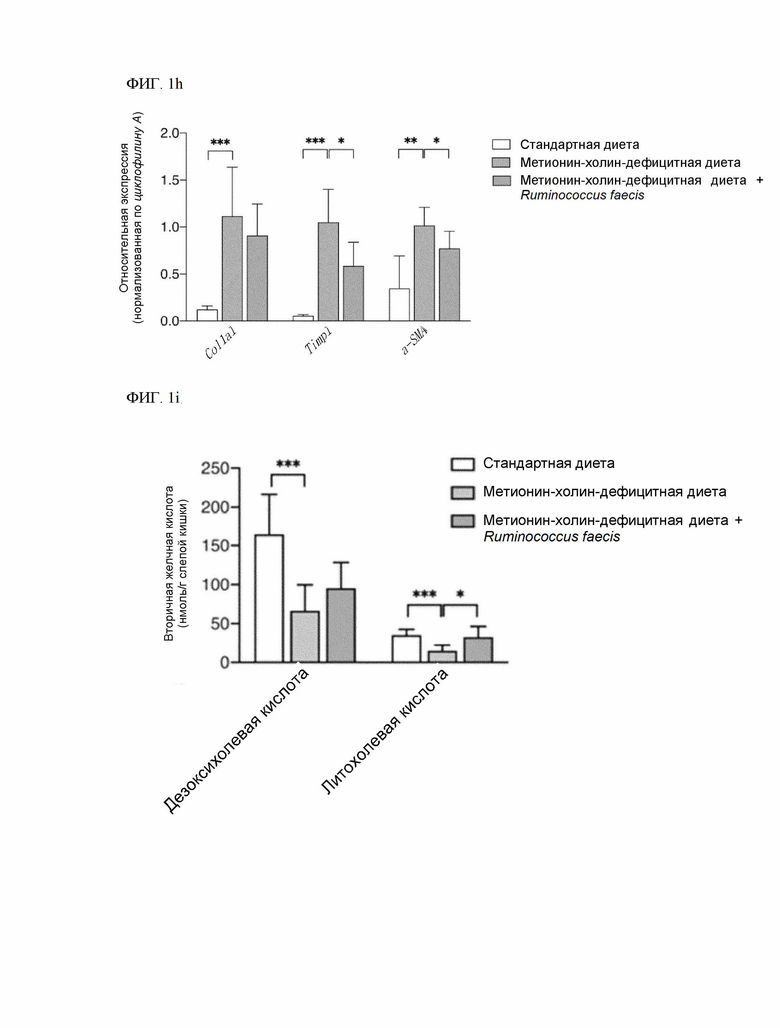
(3) увеличение концентрации вторичных желчных кислот (например, вторичной желчной кислоты слепой кишки), например, концентрация вторичных желчных кислот при введении композиции составляет более 100%, 105% и более, 110% и более, 115% и более, 120% и более, 125% и более, 130% и более, 135% и более, 140% и более, 145% и более, 150% и более, 160% и более, 170% и более, 180% и более, 190% и более или 200% и более от 100% концентрации вторичных желчных кислот в контрольной группе, не получавшей композицию (в одном из примеров (ФИГ. 1i, при совместном введении метионин-холин-дефицитной диеты и штамма Ruminococcus faecis концентрация литохолевой кислоты составила 217,50%, а концентрация дезоксихолевой кислоты составила 143,37% по сравнению с введением только метионин-холин-дефицитной диеты).
(4) снижение экспрессии фиброзного гена, например, при введении композиции экспрессия связанного с фиброзом гена, например, одного или нескольких из Col1a1, Timp1 и α-SMA, составляет менее 100%, 99% и менее, 98% и менее, 97% и менее, 96% и менее, 95% и менее, 94% и менее, 93% и менее, 92% и менее, 91% и менее, 90% и менее, 80% и менее, 78% и менее, 75% и менее, 70% и менее, 65% и менее или 60% и менее от 100% экспрессии в контрольной группе, не получавшей композицию (в одном из примеров ФИГ. 1h, при совместном введении метионин-холин-дефицитной диеты и штамма Ruminococcus faecis было достигнуто 90,60% экспрессии Col1a1, 77,17% экспрессии α-SMA и 58,50% экспрессии Timp1 по сравнению с введением только метионин-холин-дефицитной диеты).
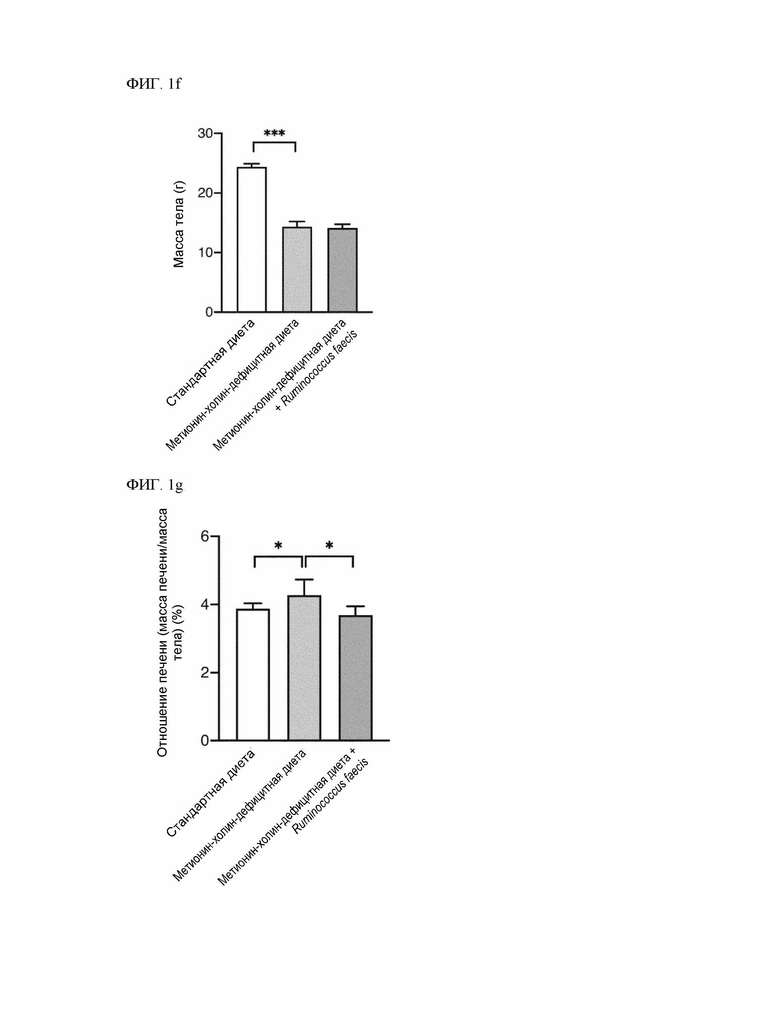
(5) снижение отношения массы печени к массе тела, например, отношение массы печени к массе тела при введении композиции составляет менее 100%, 99% и менее, 98% и менее, 97% и менее, 96% и менее, 95% и менее, 94% и менее, 93% и менее, 92% и менее, 91% и менее, 90% и менее, 89% и менее, 88% и менее или 87% и менее от 100% отношения массы печени к массе тела в контрольной группе, не получавшей композицию (в одном из примеров (ФИГ. 1g, при совместном введении метионин-холин-дефицитной диеты и штамма Ruminococcus faecis было достигнуто 86,27% отношения массы печени к массе тела по сравнению с введением только метионин-холин-дефицитной диеты).
К контрольной группе, не получавших композицию, относится не получавшая композицию группа с таким же заболеванием, но которой не вводили композицию в соответствии с настоящим изобретением.
Вторичная желчная кислота может представлять собой одно или несколько, выбранное из группы, состоящей из дезоксихолевой кислоты (DCA), литохолевой кислоты (LCA) и/или урсодезоксихолевой кислоты (UDCA).
Фиброзный ген может представлять собой один или несколько, выбранных из группы, состоящей из Col1a1, Timp1 и α-SMA.
Композиция, в соответствии с настоящим изобретением, может быть введена субъекту с поражением печени и инсулинорезистентностью, например, субъекту с поражением печени на фоне диабета 2 типа, и может определять одну или несколько из следующих характеристик (1) - (3):
(1) коэффициент снижения уровня АЛТ более чем в 1 раз, в 1,1 раза и более, в 1,2 раза и более, в 1,3 раза и более, в 1,4 раза и более, в 1,5 раза и более, в 1,6 раза и более, в 1,7 раза и более, в 1,8 раза и более, в 1,9 раза и более, в 2 раза и более, в 2,1 раза и более, в 2,2 раза и более, в 2,3 раза и более, в 2,4 раза и более, в 2,5 раза и более или в 2,6 раза и более по сравнению с контрольной группой без инсулинорезистентности,
(2) коэффициент снижения уровня АСТ более чем в 1 раз, в 1,1 раза и более, в 1,2 раза и более, в 1,3 раза и более, в 1,4 раза и более, в 1,5 раза и более, в 1,6 раза и более, в 1,7 раза и более, в 1,8 раза и более, в 1,9 раза и более, в 2 раза и более, в 2,1 раза и более или в 2,2 раза и более по сравнению с контрольной группой без инсулинорезистентности,
(3) коэффициент снижения отношения массы печени к массе тела более чем в 1 раз, в 1,1 раза и более, в 1,2 раза и более, в 1,3 раза и более, в 1,4 раза и более, в 1,5 раза и более, в 2 раза и более, в 3 раза и более, в 4 раза и более, в 5 раз и более, в 6 раз и более, в 7 раз и более, в 8 раз и более, в 9 раз и более или в 10 раз и более по сравнению с контрольной группой без инсулинорезистентности.
В настоящем изобретении термин «действующее вещество» означает вещество, способное демонстрировать требуемую активность самостоятельно или вместе с носителем, не обладающим активностью само по себе.
В настоящем изобретении термин «предотвращение» означает подавление или задержку проявления болезни, расстройства или заболевания. Если проявление болезни, расстройства или заболевания подавляют или задерживают в течение предварительно заданного периода, предотвращение можно считать осуществленным.
В настоящем изобретении термин «терапевтическое воздействие» означает частичное или полное снятие симптомов, улучшение, облегчение, подавление или задержку развития определенной болезни, расстройства и/или заболевания или симптома, соответствующего заболеванию, а также снижение тяжести или частоты проявления одного или нескольких симптомов или характеристик.
Фармацевтическая композиция согласно настоящему изобретению может дополнительно содержать одно или несколько действующих веществ, проявляющих такую же или подобную функцию, в дополнение к действующему веществу.
Кроме того, фармацевтическая композиция согласно настоящему изобретению может быть приготовлена в форме единичной дозы или приготовлена помещением в контейнере для нескольких доз, объединяя с использованием фармацевтически приемлемого носителя, в соответствии со способом, который может быть точно осуществлен специалистами в области, к которой относится настоящее изобретение. В настоящем изобретении термин «носитель» означает соединение, способствующее введению соединения в клетку или ткань, а термин «фармацевтически приемлемый» означает композицию, являющуюся физиологически приемлемой и при введении человеку, как правило, не вызывающую аллергической реакции, в частности, желудочно-кишечного расстройства, головокружения или иных подобных явлений.
Фармацевтически приемлемый носитель обычно используется в составе лекарственной формы и представляет собой, в частности, лактозу, декстрозу, сахарозу, сорбит, маннит, крахмал, аравийскую камедь, фосфат кальция, альгинат, желатин, силикат кальция, микрокристаллическую целлюлозу, поливинилпирролидон, целлюлозу, воду, сироп, метилцеллюлозу, метилгидроксилбензоат, пропилгидроксибензоат, тальк, стеарат магния, минеральное масло или т.п., но не ограничиваясь этим.
Кроме того, фармацевтическая композиция согласно настоящему изобретению может дополнительно содержать добавку, в частности, наполнитель, антикоагулянт, смазывающее вещество, смачивающий агент, ароматизатор, эмульгатор, консервант и т.п., в дополнение к ингредиентам. В настоящем изобретении содержание добавки в фармацевтической композиции, по существу, не ограничено и может быть соответствующим образом отрегулировано в пределах диапазона содержания, используемого в обычном составе лекарственной формы.
Кроме того, фармацевтическая композиция согласно настоящему изобретению может быть изготовлена в пероральной форме. Неограничивающие примеры пероральной формы могут содержать таблетки, пастилки, рассасывающиеся таблетки, водные суспензии, масляные суспензии, порошок, гранулы, эмульсию, твердые капсулы, мягкие капсулы, сироп или эликсиры, или иные подобные варианты. Для получения фармацевтической композиции согласно настоящему изобретению для перорального применения можно использовать связующее вещество, в частности, лактозу, сахарозу, сорбит, маннит, крахмал, амилопектин, целлюлозу или желатин; эксципиент, в частности, дикальцийфосфат; агент для улучшения распадаемости, в частности, кукурузный крахмал или крахмал батата; допускается использование стеарата магния, стеарата кальция, стеарилфумарата натрия и т.п., а также подсластителя, ароматизатора, сиропа и т.п.. Кроме того, в случае капсул в дополнение к вышеупомянутым веществам может быть дополнительно использован жидкий носитель, в частности, жирное масло и т.п..
В настоящем изобретении термин «эксципиент» означает любое вещество, не являющееся терапевтическим средством и используемое в качестве носителя или среды для доставки терапевтического средства или добавляемое в фармацевтическую композицию. Таким образом, это может улучшить обработку и характеристики хранения или позволить и облегчить формирование единиц дозы композиции.
Фармацевтическую композицию согласно настоящему изобретению можно использовать в различных формах, в частности, пероральных формах, включая жидкость, суспензию, порошок, гранулы, таблетки, капсулы, пилюли, экстракт, эмульсию, сироп, аэрозоль и другие подобные формы, а также инъекциях стерильного инъекционного раствора, и можно вводить перорально или различными способами, включая внутривенное, интраперитонеальное, подкожное, ректальное, местное введение и другие подобные варианты. В настоящем изобретении термин «пероральное введение» означает, что активное вещество вводится в желудочно-кишечный тракт для всасывания, то есть подготовки вещества к усвоению.
Предпочтительная дозировка фармацевтической композиции согласно настоящему изобретению может иметь различные диапазоны в зависимости от состояния пациента и массы тела, возраста, пола, состояния здоровья, особенностей диетической конституции, свойств состава, степени развития заболевания, времени введения композиции, способа введения, периода или интервала введения, скорости выведения и лекарственной формы, и может быть соответствующим образом подобрана специалистами в данной области.
В настоящем изобретении термин «эффективная доза фармацевтической композиции» означает количество композиции активного вещества, достаточного для терапевтического воздействия на определенный симптом. Оно может варьироваться в зависимости от способа приготовления, способа введения, времени и/или пути введения фармацевтической композиции, а также может варьироваться в зависимости от различных факторов, включая тип или степень реакции, которая должна быть достигнута посредством введения фармацевтической композиции, тип, возраст, масса тела, общее состояние здоровья, симптомы или степень развития заболевания, пол, диету, выделения субъекта, которому вводится композиция, а также компоненты лекарств или других композиций, одновременно или совместно вводимых соответствующему субъекту, а также от иных подобных факторов, хорошо известных в фармацевтической отрасли; специалисты в данной области могут легко определить и назначить эффективную дозу для необходимого терапевтического воздействия.
Фармацевтическую композицию согласно настоящему изобретению можно вводить один раз в день, и можно вводить, разделив на несколько введений. Композицию можно вводить в виде отдельного терапевтического средства или в комбинации с другими терапевтическими средствами, а также можно вводить последовательно или одновременно с обычным терапевтическим средством. Принимая во внимание все вышеперечисленные факторы, ее можно вводить в количестве, позволяющем получить максимальный эффект при минимальном количестве без побочных эффектов.
Например, композиция согласно настоящему изобретению может быть введена в суточной дозе, в частности, от 0,001 до 10000 мг, от 0,001 до 5000 мг, от 0,001 до 1000 мг, от 0,001 до 500 мг, от 0,001 до 300 мг, от 0,001 до 100 мг, от 0,001 до 50 мг, от 0,001 до 30 мг, от 0,001 до 10 мг, от 0,001 до 5 мг, от 0,001 до 1 мг, от 0,001 до 0,5 мг, 0,001 до 0,1 мг, от 0,001 до 0,05 мг, от 0,001 до 0,01 мг, от 0,01 до 10 000 мг, от 0,01 до 5000 мг, от 0,01 до 1000 мг, от 0,01 до 500 мг, от 0,01 до 300 мг, от 0,01 до 100 мг, от 0,01 до 50 мг, от 0,01 до 30 мг, от 0,01 до 10 мг, от 0,01 до 5 мг, от 0,01 до 1 мг, от 0,01 до 0,5 мг, от 0,01 до 0,1 мг, от 0,01 до 0,05 мг, от 0,1 до 10000 мг, от 0,1 до 5000 мг, от 0,1 до 1000 мг, от 0,1 до 500 мг, от 0,1 до 300 мг, от 0,1 до 200 мг, от 0,1 до 100 мг, от 0,1 до 50 мг, от 0,1 до 30 мг, от 0,1 до 10 мг, от 0,1 до 5 мг, от 0,1 до 1 мг, от 0,1 до 0,5 мг, от 1 до 10000 мг, от 1 до 5000 мг, от 1 до 1000 мг, от 1 до 500 мг, от 1 до 300 мг, от 1 до 200 мг, от 1 до 100 мг, от 1 до 50 мг, от 1 до 10 мг, от 1 до 5 мг, от 10 до 10000 мг, от 10 до 5000 мг, от 10 до 1000 мг, от 10 до 500 мг, от 10 до 300 мг, от 10 до 200 мг, от 10 до 100 мг, от 10 до 50 мг, от 10 до 40 мг, от 10 до 30 мг, от 10 до 20 мг, от 100 до 10000 мг, от 100 до 5000 мг, от 100 до 1000 мг, от 100 до 500 мг, от 100 до 300 мг или от 100 до 200 мг на 1 кг массы тела, не ограничиваясь этим. В одном из примеров суточная доза композиции согласно настоящему изобретению может составлять от 0,001 до 10 г/день, от 0,001 до 5 г/день, от 0,01 до 10 г/день или от 0,01 до 5 г/день для перорального приема взрослым пациентом. Кроме того, общая суточная доза может быть разделена и при необходимости вводиться непрерывно или дискретно.
Композиция согласно настоящему изобретению может дополнительно содержать защитный агент для сублимационной сушки. Защитный агент для сублимационной сушки может представлять собой один или несколько выбранных из группы, состоящей из моносахаридов, дисахаридов, полисахаридов, углеводов, минералов, аминокислот, сахарозы, фосфата кальция, аргинина, хлорида натрия, фруктозы, дигидрофосфата калия, гидроортофосфата калия и трегалозы.
Сахароза может быть добавлена к защитному агенту для сублимационной сушки в количестве от 100 до 300 г/л, от 100 до 250 г/л, от 100 до 200 г/л, от 150 до 300 г/л, от 150 до 250 г/л, от 150 до 200 г/л, от 200 до 300 г/л или от 200 до 250 г/л, и в одном из примеров в количестве 200 г/л.
Фосфат кальция может быть добавлен к защитному агенту для сублимационной сушки в концентрации от 5 до 20 г/л, от 5 до 15 г/л, от 5 до 12 г/л, от 5 до 11 г/л, от 7 до 20 г/л, от 7 до 15 г/л, от 7 до 12 г/л, от 7 до 11 г/л, от 10 до 20 г/л, от 10 до 15 г/л, от 10 до 12 г/л или от 10 до 11 г/л, и в одном из примеров в концентрации 10,5 г/л.
Аминокислота может быть добавлена к защитному агенту для сублимационной сушки в концентрации от 1 до 10 г/л, от 1 до 8 г/л, от 1 до 6 г/л, от 1 до 5 г/л, от 3 до 10 г/л, от 3 до 8 г/л, от 3 до 6 г/л, от 3 до 5 г/л, от 4 до 10 г/л, от 4 до 8 г/л, от 4 до 6 г/л или от 4 до 5 г/л, и в одном из примеров в концентрации 4 г/л.
Хлорид натрия может быть добавлен к защитному агенту для сублимационной сушки в концентрации от 0,1 до 5 г/л, от 0,1 до 3 г/л, от 0,1 до 1 г/л, от 0,5 до 5 г/л, от 0,5 до 3 г/л или от 0,5 до 1 г/л, и в одном из примеров в концентрации 0,8 г/л.
Штамм Ruminococcus spp. согласно настоящему изобретению может представлять собой Ruminococcus faecis. В качестве одного примера, штамм Ruminococcus spp. может представлять собой Ruminococcus faecis с учетным номером KCTC 5757. В настоящем описании Ruminococcus faecis с учетным номером KCTC 5757 может представлять собой Ruminococcus faecis KBL1028.
Штамм может продолжать расти после 8 часов культивирования, 9 часов культивирования, 10 часов культивирования, 11 часов культивирования, 12 часов культивирования, 13 часов культивирования или 14 часов культивирования в питательной среде с концентрацией источника углерода от 5 до 30% (м/об), концентрацией источника азота от 50 до 90% (м/об), концентрацией минералов от 5 до 15% (м/об) и концентрацией аминокислот от 0,1 до 10% (м/об).
Штамм может иметь высокую эффективность культивирования в среде FMK1028, состав которой соответствует таблице 3. Например, штамм может характеризоваться тем, что поглощение после культивирования в среде FMK1028, состав которой соответствует таблице 3, превышает поглощение после культивирования в одной или нескольких выбранных из группы, состоящей из среды YBHI, среды GAM, среды MRS, среды BL и среды RCM. В одном из примеров количество жизнеспособных клеток штамма на единицу объема после 14 часов культивирования в среде FMK1028, состав которой соответствует таблице 3, в 10 раз и более, в 50 раз и более, в 100 раз и более, в 150 раз и более, в 200 раз и более, в 250 раз и более, в 300 раз и более, в 350 раз и более, в 400 раз и более, в 450 раз и более, в 500 раз и более, в 550 раз и более или в 600 раз и более является выше, чем после культивирования в среде YBHI.
Другой вариант осуществления настоящего изобретения относится к композиции для культивирования штамма Ruminococcus spp., содержащей источник углерода и источник азота. Источник углерода может представлять собой один или несколько выбранных из группы, состоящей из глюкозы, сахарозы, фруктозы, лактозы, мальтозы, патоки и галактозы. Источник азота может представлять собой один или несколько выбранных из группы, состоящей из дрожжевого экстракта, соевого пептона, обезжиренного молока, триптона, казаминовых кислот, картофельного пептона, горохового пептона, пшеничного пептона, бобового пептона, папаинового соевого пептона, люпинового пептона.
Другой вариант осуществления настоящего изобретения относится к композиции для культивирования штамма Ruminococcus spp., содержащей источник углерода и источник азота. Источник углерода может иметь концентрацию от 5 до 30% (м/об), а источник азота может иметь концентрацию от 50 до 90% (м/об). Штамм Ruminococcus spp. описан выше.
Источник углерода может представлять собой один или несколько выбранных из группы, состоящей из глюкозы, сахарозы, фруктозы, лактозы, мальтозы, патоки и галактозы.
Источник азота может представлять собой один или несколько выбранных из группы, состоящей из дрожжевого экстракта, соевого пептона, обезжиренного молока, триптона, казаминовых кислот, картофельного пептона, горохового пептона, пшеничного пептона, бобового пептона, папаинового соевого пептона, люпинового пептона.
Композиция для культивирования штамма Ruminococcus spp. может способствовать росту после 8 часов, 9 часов, 10 часов, 11 часов, 12 часов, 13 часов или 14 часов культивирования штамма Ruminococcus spp.
Композиция для культивирования штамма Ruminococcus spp. может дополнительно содержать одно или несколько выбранных из группы, состоящей из минералов, аминокислот, витаминов, нуклеиновых кислот и неорганических солей.
Минерал может представлять собой один или несколько выбранных из группы, состоящей из ацетата натрия, хлорида натрия, дигидрофосфата натрия, гидроортофосфата натрия, хлорида калия, сульфата магния и сульфата марганца.
Аминокислота может представлять собой L-цистеин, L-лейцин, L-изолейцин, L-валин, L-триптофан, L-треонин, L-фенилаланин и L-метионин.
Концентрация источника углерода может составлять от 5 до 30% (м/об), концентрация источника азота может составлять от 50 до 90% (м/об), концентрация минерала может составлять от 5 до 15% (м/об), а концентрация аминокислоты может составлять от 0,1 до 10% (м/об).
Другой вариант осуществления настоящего изобретения относится к способу культивирования штамма Ruminococcus spp., предусматривающему инокуляцию штамма Ruminococcus spp. в композицию для культивирования штамма Ruminococcus spp., в соответствии с настоящим изобретением, и его культивирование.
Способ культивирования может способствовать росту после 8 часов, 9 часов, 10 часов, 11 часов, 12 часов, 13 часов или 14 часов культивирования штамма Ruminococcus spp.
Культивирование может представлять собой статическое культивирование, культивирование клеток с периодической подпиткой или периодическое культивирование, но не ограничиваясь этим.
Следующий вариант осуществления настоящего изобретения относится к способу предотвращения, снятия симптомов или терапевтического воздействия на поражение печени, содержащему введение композиции для предотвращения, снятия симптомов или терапевтического воздействия на поражение печени в соответствии с настоящим изобретением нуждающемуся в этом субъекту. Композиция может содержать штамм Ruminococcus spp. Композиция для предотвращения, снятия симптомов или терапевтического воздействия на поражение печени, штамм Ruminococcus spp. и т.п. раскрыты выше. Субъект представляет собой субъект с поражением печени, описанный выше. Например, субъект с поражением печени может представлять собой субъекта с инсулинорезистентностью, и в одном из примеров он может представлять собой субъекта с диабетом, в частности, субъекта с диабетом 2 типа.
ПОЛЕЗНЫЕ ЭФФЕКТЫ ИЗОБРЕТЕНИЯ
Фармацевтическая композиция для предотвращения или терапевтического воздействия согласно настоящему изобретению может быть эффективно использована для лечения поражения печени, например, неалкогольной жировой болезни печени.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На ФИГ. 1a изображен процесс экспериментального исследования эффективности терапевтического воздействия на поражение печени путем введения Ruminococcus faecis в животной модели поражения печени, вызванного метионин-холин-дефицитной диетой.
На ФИГ. 1b изображен результат измерения АЛТ и АСТ после введения Ruminococcus faecis в животной модели поражения печени, вызванного метионин-холин-дефицитной диетой.
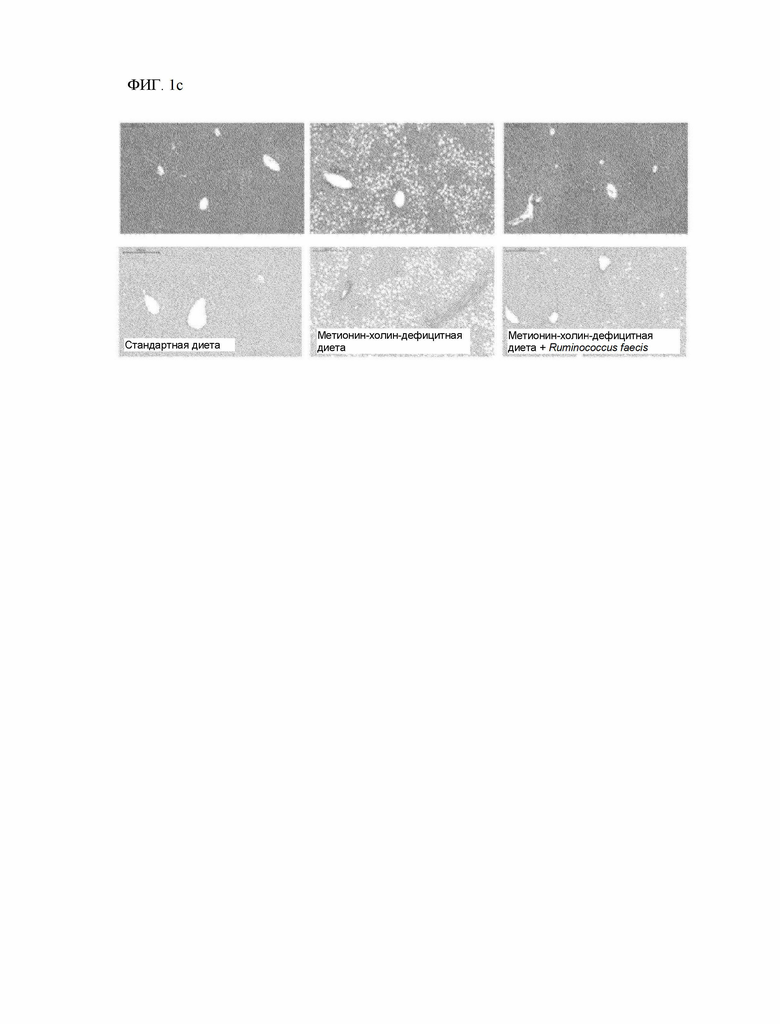
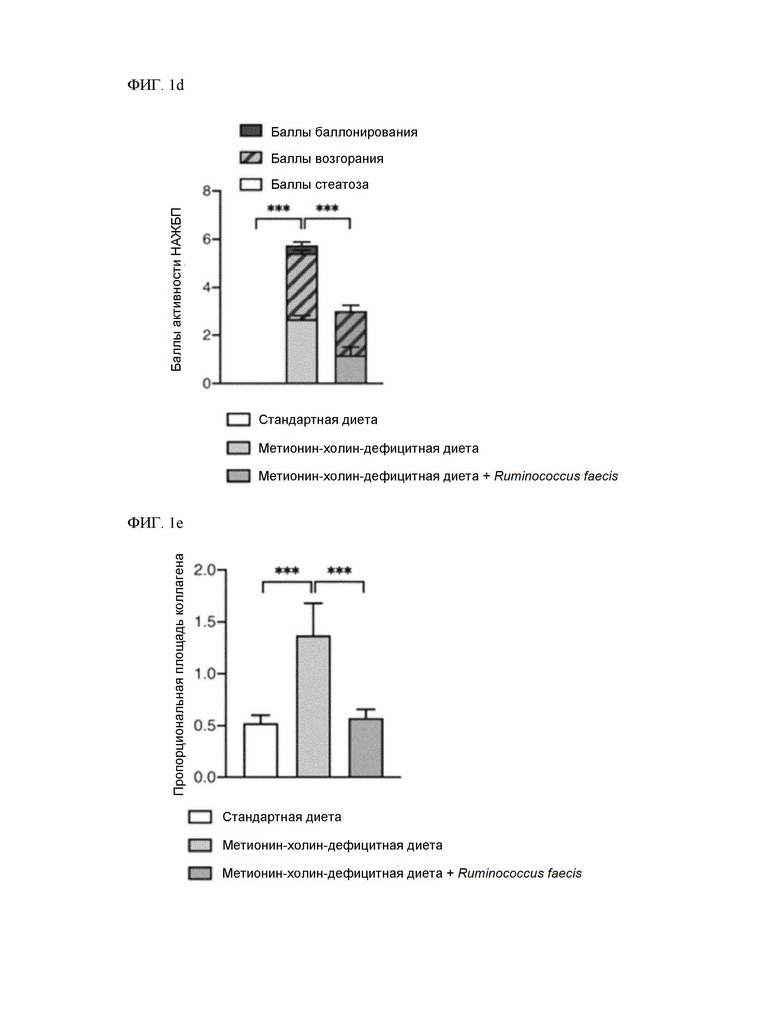
На ФИГ. 1c - ФИГ. 1e показано, что по гистологическая тяжесть поражения печени, вызванного метионин-холин-дефицитной диетой, значительно уменьшается у мышей, получавших Ruminococcus faecis, и
На ФИГ. 1c показано улучшение состояния ткани печени после введения Ruminococcus faecis, определенное при окрашивании гематоксилин-эозином (вверху) и красителем Sirius red (внизу).
На ФИГ. 1d количественно показано снижение патологии при введении Ruminococcus faecis в виде баллов активности НАЖБП.
На ФИГ. 1e показано распределение коллагена в печени, улучшенное по результатам приема Ruminococcus faecis.
На ФИГ. 1f показано изменение массы тела при метионин-холин-дефицитной диете.
На ФИГ. 1g показано отношение массы печени к массе тела при введении Ruminococcus faecis (метионин-холин-дефицитная диета + R.faecis) по сравнению с контрольной группой мышей (метионин-холин-дефицитная диета).
На ФИГ. 1h показано, что маркеры образования и распространения фиброза уменьшаются при введении Ruminococcus faecis.
На ФИГ. 1i показано, что местный уровень вторичных желчных кислот (дезоксихолевой и литохолевой кислоты), сниженный метионин-холин-дефицитной диетой, повышается при применении Ruminococcus faecis.
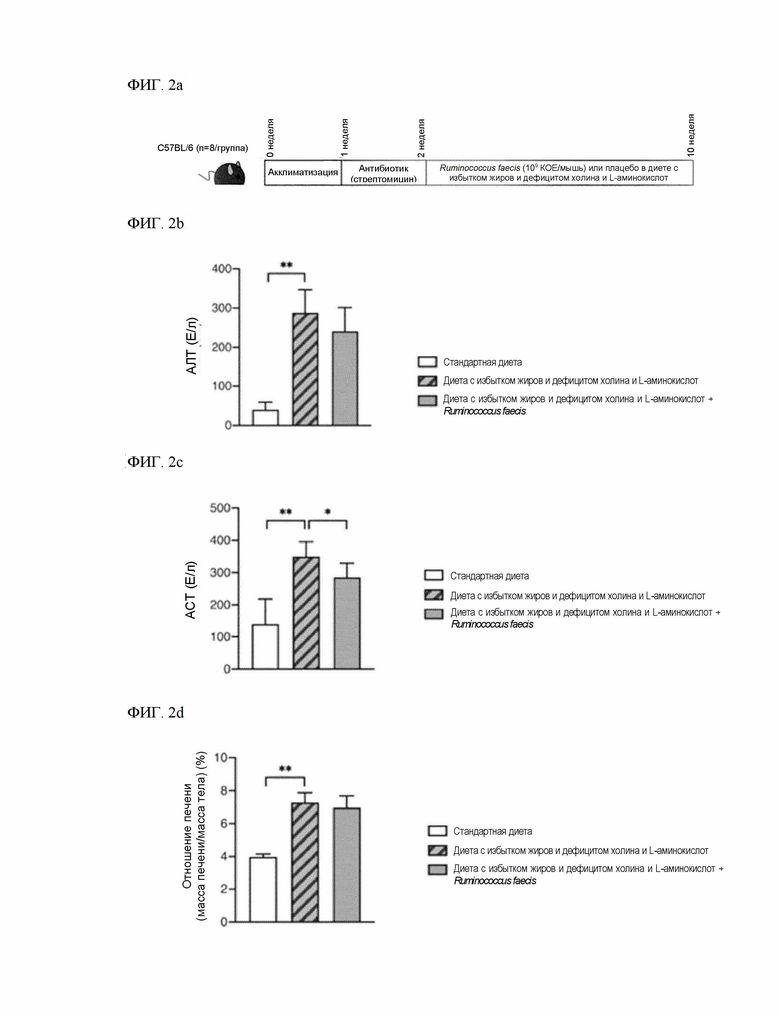
На ФИГ. 2a изображен процесс экспериментального исследования эффективности терапевтического воздействия на поражение печени путем введения Ruminococcus faecis в животной модели поражения печени, вызванного диетой с избытком жиров и дефицитом холина и L-аминокислот.
На ФИГ. 2b показано снижение уровня АЛТ при введении Ruminococcus faecis в животной модели поражения печени, вызванного диетой с избытком жиров и дефицитом холина и L-аминокислот.
На ФИГ. 2c показано снижение уровня АСТ при введении Ruminococcus faecis в животной модели поражения печени, вызванного диетой с избытком жиров и дефицитом холина и L-аминокислот.
На ФИГ. 2d показано отношение массы печени к массе тела при введении Ruminococcus faecis в животной модели поражения печени, вызванного диетой с избытком жиров и дефицитом холина и L-аминокислот.
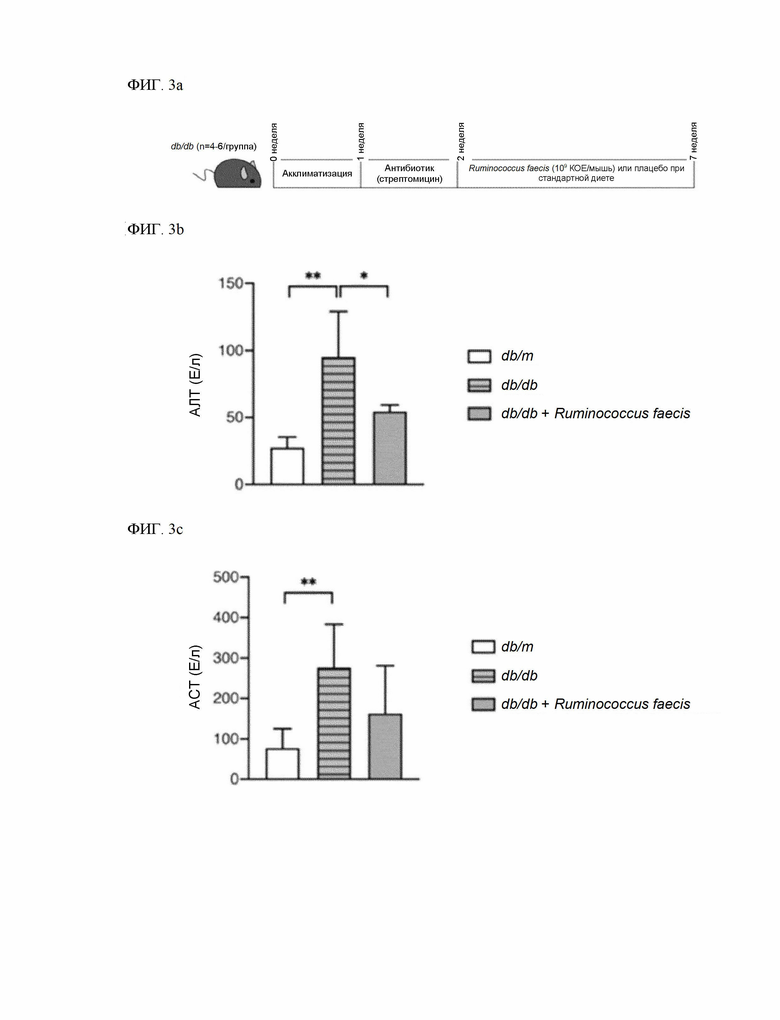
На ФИГ. 3a изображен процесс экспериментального исследования эффективности терапевтического воздействия на поражение печени путем введения Ruminococcus faecis в животной модели с генетическим дефицитом лептина.
На ФИГ. 3b показано снижение уровня АЛТ при введении Ruminococcus faecis в животной модели с генетическим дефицитом лептина.
На ФИГ. 3c показано снижение уровня АСТ при введении Ruminococcus faecis в животной модели с генетическим дефицитом лептина.
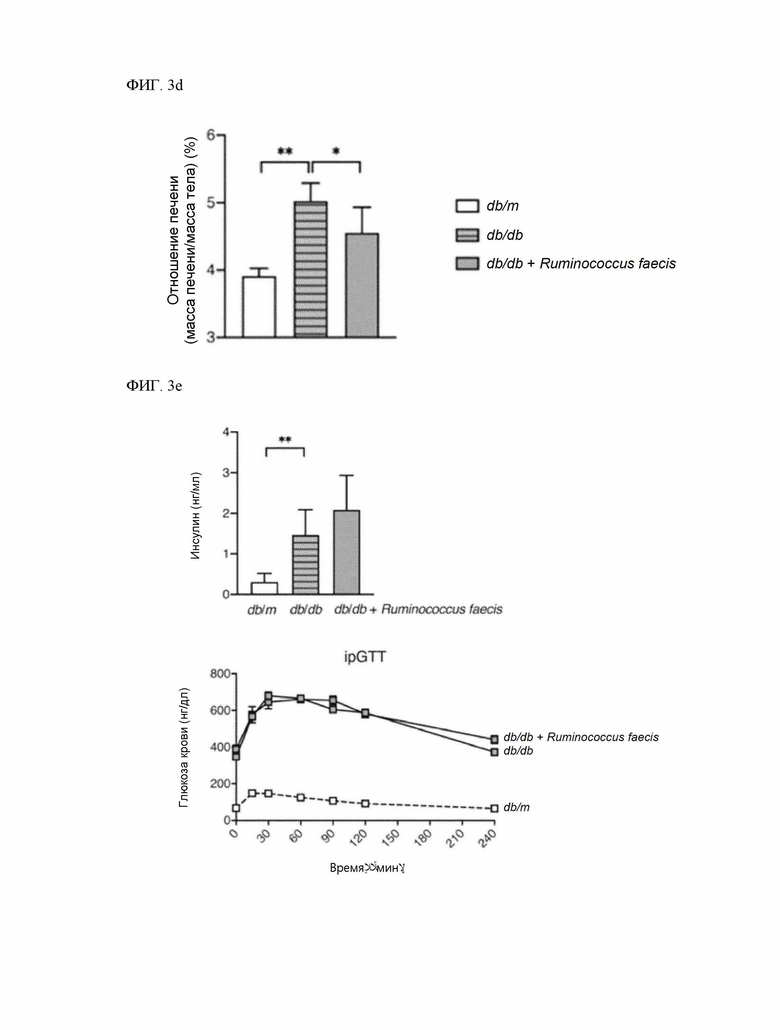
На ФИГ. 3d показано снижение отношения массы печени к массе тела при введении Ruminococcus faecis в животной модели с генетическим дефицитом лептина.
На ФИГ. 3e показан уровень инсулина в сыворотке крови натощак и инсулинорезистентность, измеренная методом ipGTT в животной модели с генетическим дефицитом лептина.
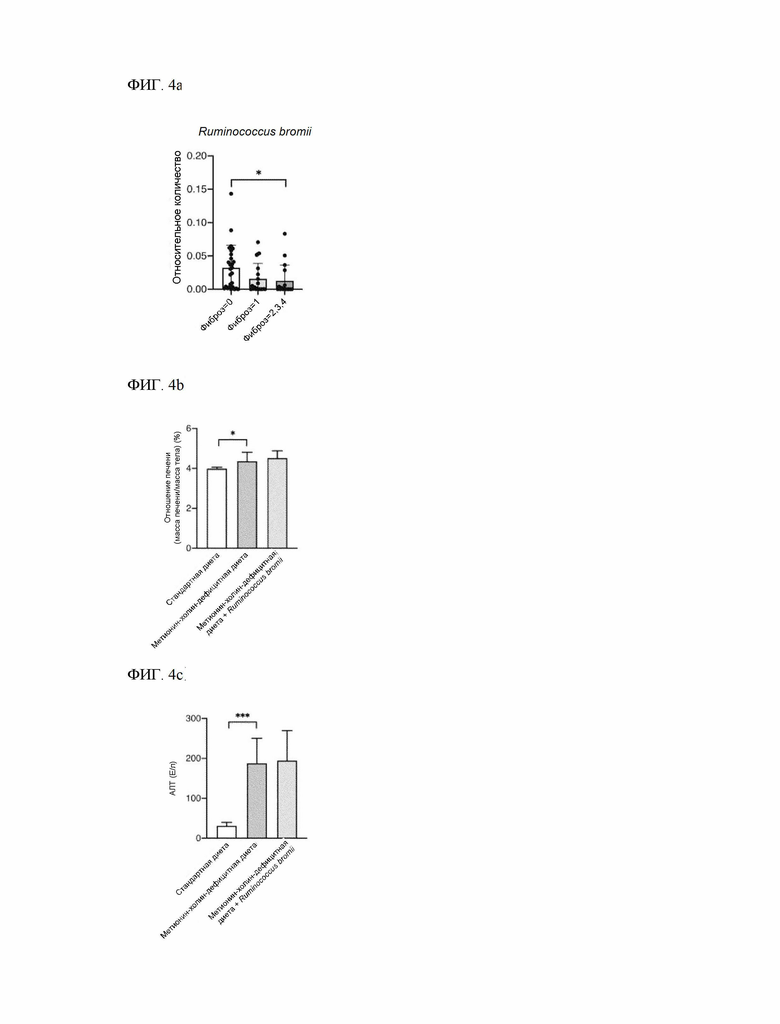
На ФИГ. 4a показано, что содержание Ruminococcus bromii значительно снижено в группе подопытных с фиброзом печени.
На ФИГ. 4b показано отношение массы печени к массе тела при введении Ruminococcus bromii.
На ФИГ. 4c показан уровень АЛТ при введении Ruminococcus bromii.
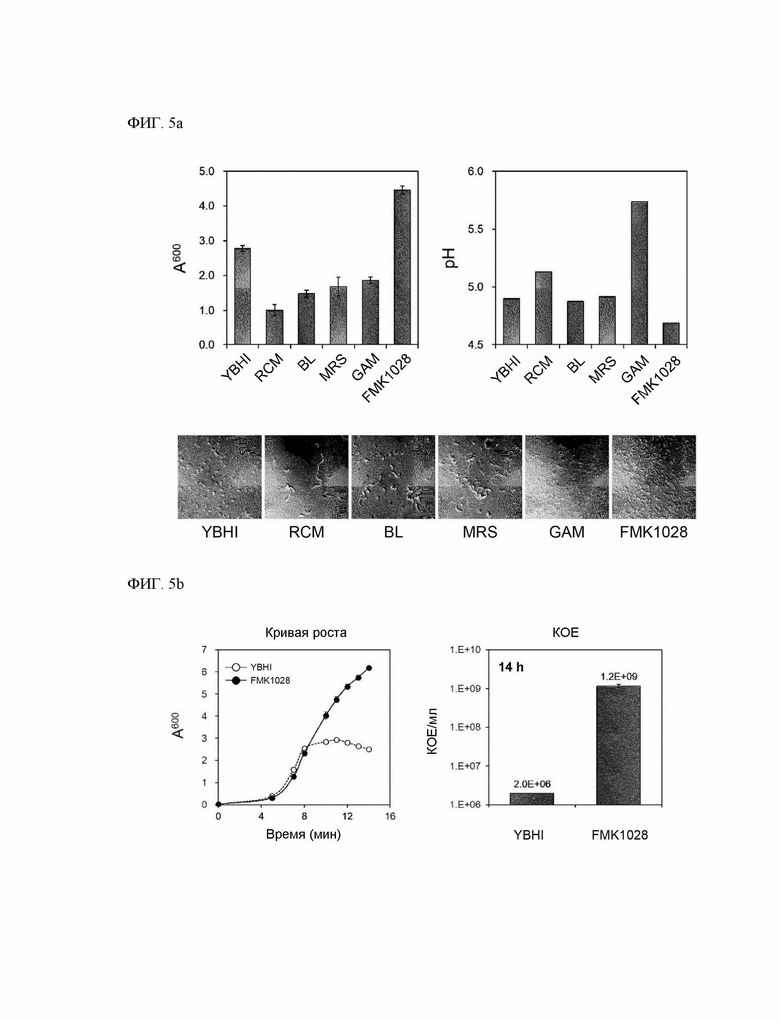
На ФИГ. 5a показан результат сравнения потенциала культивирования Ruminococcus faecis и морфологии клеток в среде YBHI, среде RCM, среде BL, среде MRS, среде GAM или среде FMK1028.
На ФИГ. 5b показана кривая роста Ruminococcus faecis и количество жизнеспособных клеток на единицу объема.
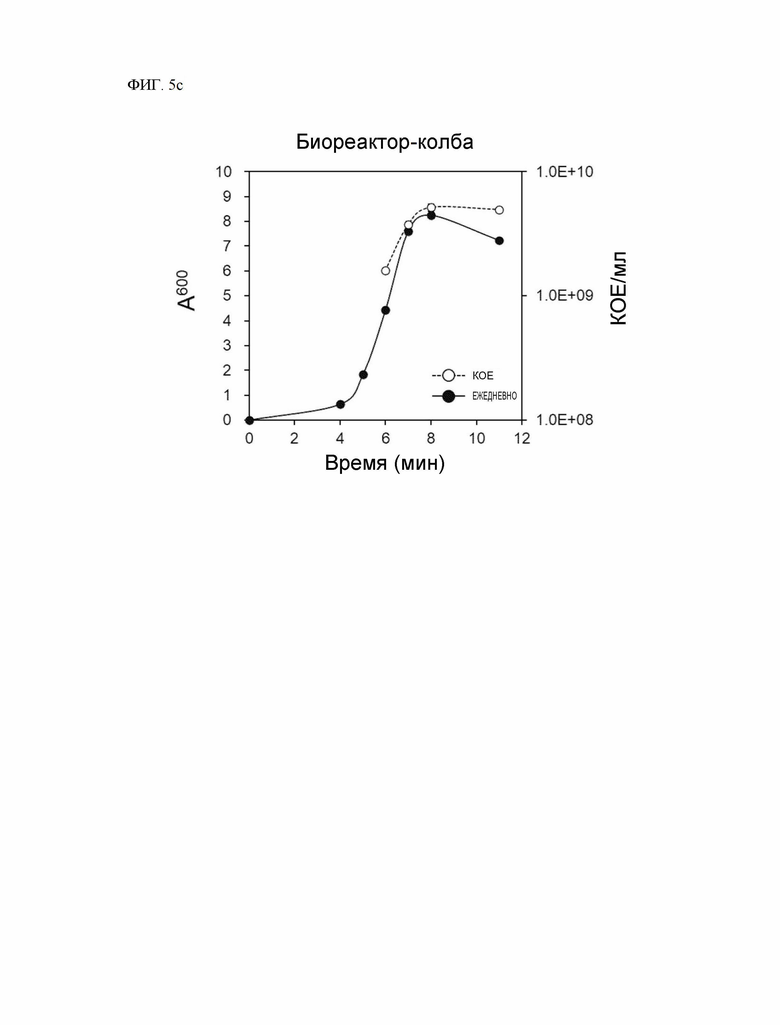
На ФИГ. 5c показана кривая роста Ruminococcus faecis, культивированного в биореакторе, и количество жизнеспособных клеток.
ПРИНЦИП ИЗОБРЕТЕНИЯ
Далее настоящее изобретение будет более подробно раскрыто на следующих примерах. Тем не менее, эти примеры предназначены исключительно для иллюстрации настоящего изобретения и не ограничивают объем настоящего изобретения.
Пример 1: Испытание терапевтического воздействия на поражение печени у экспериментальных животных
(1) Подготовка экспериментальных животных
Ruminococcus faecis (учетный номер KCTC 5757 [JCM № 15917]) был получен из Корейского научно-исследовательского института биологических наук и биотехнологий, Корейской коллекции типовых культур (KCTC, Jeollabuk-do, Республика Корея), и культивировали в среде YBHI в анаэробных условиях, собрали через 24 часа, дважды промыли фосфатно-солевым буферным раствором (+ 0,5% цистеина), после чего вводили подопытным перорально. Самцы мышей C57BL/6N в возрасте 6 недель (Orient Bio, Gyeonggi-do, Республика Корея) выращены в общем животноводческом комплексе Сеульского национального университета в соответствии с инструкциями университета в качестве экспериментальных животных, и все эксперименты на животных одобрены Институциональным комитетом по содержанию и использованию животных Сеульского национального университета.
Для продолжения эксперимента на животной модели НАЖБП, индуцированной метионин-холин-дефицитной (MCD) диетой, через 1 неделю после адаптации мышей к стандартной кормовой диете в питьевую воду добавили стрептомицин в концентрации 1 г/л для заселения кишечника штаммом Ruminococcus faecis, и полученную воду давали подопытным в течение 1 недели. В течение 5 недель после этого мыши одновременно находились на метионин-холин-дефицитной диете с L-аминокислотами (исследовательская диета, Нью-Брансуик, Нью-Джерси США; каталожный №: A02082002B) с ежедневным пероральным введением суспензии Ruminococcus faecis, изготовленной путем добавления 109 КОЕ в 200 мкл фосфатно-солевого буферного раствора, либо контрольного фосфатно-солевого буферного раствора (плацебо) (ФИГ. 1a). После 5 недель введения мышей усыпляли и проводили биохимический анализ, анатомический анализ, подтверждение экспрессии маркеров фиброза и пролиферации печени, а также анализ желчных кислот.
(2) Биохимический анализ
Уровни аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ) в сыворотке крови измеряли с помощью биохимического анализатора Fuji DRI-CHEM 3500i (FujiFilm, Токио, Япония). Результаты измерения АЛТ и АСТ показаны на ФИГ. 1b.
(3) Анатомический анализ
После усыпления образцы печени вырезали и фиксировали в 10% растворе формалина (Sigma-Aldrich, Сент-Луис, Миссури, США). Окрашивание гематоксилином и эозином и красителем Sirius red проводили в исследовательском фонде LOGONE Bio Convergence Research Foundation (Сеул, Республика Корея). Окрашенные изображения целых слайдов анализировали с помощью программы Pannoramic Viewer (3DHISTECH, Будапешт, Венгрия). Для расчета пропорциональной площади коллагена случайным образом выбирали по 8 изображений на группу и анализировали с помощью программного обеспечения ImageJ (NIH, Бетесда, Мэриленд, США; http://imagej.nih.gov/ij).
Кроме того, для определения отношения массы печени к массе тела измеряли массу тела мышей, которым в течение 5 недель вводили Ruminococcus faecis, и массу печени, после рассчитывали отношение массы печени к массе тела. Результат измерения массы тела мышей показан на ФИГ. 1f, а отношение массы печени к массе тела показано на ФИГ. 1g.
(4) Подтверждение возникновения экспрессии маркеров фиброза печени и пролиферации
Тотальную РНК образцов печени выделили с помощью комплекта easy-spin™ Total RNA Extraction (iNtRON Biotechnology, Gyeonggi-do, Республика Корея) и подвергли обратной транскрипции в кДНК с помощью комплекта High Capacity RNA-to-cDNA (Thermo Fisher Scientific, Уолтем, Массачусетс, США). Количественную ПЦР проводили с использованием SYBR™ Green qPCR Master Mix (Thermo Fisher Scientific, Уолтем, Массачусетс, США) и системы Applied Biosystems™ QuantStudio™ 6 Flex qPCR (Thermo Fisher Scientific, Уолтем, Массачусетс, США). Последовательности использованных праймеров были следующими.
Таблица 1
(5) Анализ желчных кислот
После извлечения слепой кишки мыши добавляли 80% метанол, соответствующий 10-кратному объемному отношению, и перемешивали. Для экстракции желчных кислот образцы измельчали с помощью соникатора в течение 3 минут, после чего выдерживали при температуре 4 °С в течение 24 часов. После этого к супернатанту, полученному при центрифугировании, добавляли 1 мл 100% метанола и проводили вторичную экстракцию в ударном дезинтеграторе с 15 частотами в течение 30 минут. Из метанола, в котором была растворена желчная кислота, выпарили все жидкие вещества путем вакуумной сушки при 30 °С в течение 24 часов, а оставшиеся твердые вещества растворили в 55% метаноле. Экстрагированную желчную кислоту поместили в специальную пробирку, после чего измерили масс-спектрометром Micromass® Q-ToF (Waters Technologies, Милфорд, Массачусетс, США).
(6) Результаты эксперимента
При введении Ruminococcus faecis (метионин-холин-дефицитная диета + R.faecis) уровень АЛТ и АСТ снизился по сравнению с контрольной группой мышей (метионин-холин-дефицитная диета) (ФИГ. 1b).
По данным анатомического и гистологического анализа степень НАЖБП, индуцированной метионин-холин-дефицитной диетой, значительно улучшилась у мышей, получавших Ruminococcus faecis (ФИГ. 1c - ФИГ. 1e). Метионин-холин-дефицитная диета вызвала резкую потерю массы тела, что следует из предыдущего документа, а введение Ruminococcus faecis не повлияло на массу тела (ФИГ. 1f). Тем не менее, при введении Ruminococcus faecis (метионин-холин-дефицитная диета + R.faecis) отношение массы печени к массе тела снизилось по сравнению с контрольной группой мышей (метионин-холин-дефицитная диета) (ФИГ. 1g).
Результаты подтверждения экспрессии маркеров возникновения фиброза печени и пролиферации показали, что маркеры возникновения фиброза печени и пролиферации значительно уменьшились у мышей, получавших Ruminococcus faecis (Timp1, p=0,0018; α-SMA, p=0,0330) (ФИГ. 1h).
Параллельно с изменениями биохимических и гистологических маркеров поражения печени, локальный уровень вторичных желчных кислот (дезоксихолевой и литохолевой кислоты) также снижался при метионин-холин-дефицитной диете и повышался при введении Ruminococcus faecis (ФИГ. 1i).
Такой результат свидетельствует о наличии эффекта защиты от фиброза печени в модели мышей, получавших Ruminococcus faecis и метионин-холин-дефицитную диету.
Пример 2: Испытание терапевтического воздействия на поражение печени с использованием животной модели
Чтобы подтвердить эффективность в снятии симптомов для Ruminococcus faecis в отношении поражения печени при неалкогольной жировой печени, была использована мышиная модель с диетой с избытком жиров и дефицитом холина и L-аминокислот (CDAHFD), предотвращающая потерю массы тела и не демонстрирующая инсулинорезистентности.
Холин играет роль в накоплении и высвобождении триглицеридов в гепатоцитах в форме ЛПОНП (VLDL), однако холин отсутствует в диете с избытком жиров и дефицитом холина и L-аминокислот, поэтому речь идет о диетической модели, в которой триглицериды из диеты с избытком жиров накапливаются в гепатоцитах, вызывая жировую печень, причем в отличие от модели с метионин-холин-дефицитной диетой не происходит потери массы тела, а фиброз печени усиливается. Тем не менее, известно, что модель с диетой с избытком жиров и дефицитом холина и L-аминокислот не вызывает резистентности к инсулину.
В частности, как показано на ФИГ. 2a, через неделю после адаптации мышей C57BL/6N к стандартной кормовой диете, стрептомицин (1 г/л) растворили в питьевой воде и давали подопытным в течение одной недели для заселения кишечника штаммом Ruminococcus faecis. После этого в течение 8 недель подопытных получали диету с избытком жиров и дефицитом холина и L-аминокислот, не содержащую холина и содержащую 60% жиров, и ежедневно перорально получали 200 мкл суспензии Ruminococcus faecis, изготовленной путем добавления 109 КОЕ в 200 мкл фосфатно-солевого буферного раствора, либо контрольный фосфатно-солевой буферный раствор (плацебо). После 8 недель введения мышей усыпляли и проводили биохимический анализ сыворотки крови и анатомический анализ. В качестве биохимического анализа анализ АЛТ и АСТ выполняли аналогично примеру 1, а отношение массы печени к массе тела измеряли аналогично примеру 1.
Как показано на ФИГ. 2b - ФИГ. 2d, уровни АЛТ и АСТ снижались при введении Ruminococcus faecis (ФИГ. 2b и ФИГ. 2c), однако не было отмечено значительной разницы в отношении массы печени к массе тела при введении Ruminococcus faecis (ФИГ. 2d). Это означает, что Ruminococcus faecis оказывает терапевтический эффект при неалкогольном жировом поражении печени, вызванном диетой с избытком жиров и дефицитом холина и L-аминокислот, а отсутствие значительной разницы в отношении массы печени к массе тела означает, что значительного уменьшения количества жиров, накопленных в печени, не произошло.
Пример 3: Испытание терапевтического воздействия на поражение печени с использованием модели с генетическим дефицитом лептина
Для подтверждения возникновения терапевтического эффекта Ruminococcus faecis в отношении неалкогольной жировой болезни печени при наличии инсулинорезистентности, была использована модель с генетическим дефицитом лептина (db/db), вызывающую спонтанный диабет с инсулинорезистентностью и жировой печенью. В качестве контрольной группы модели db/db использовали группу db/m, соответствующую гетерозиготе по аллелю db.
Под моделью db/db понимают модель, в которой происходит мутация в рецепторе лептина, а также индуцируется ожирение и инсулинорезистентность с итоговым развитием гипергликемии, и которая часто используется в качестве модели диабета 2 типа. Модель db/db известна быстрым индуцированием стеатоза и затрудненным индуцированием стеатогепатита (НАСГ) и фиброза печени.
В частности, как показано на ФИГ. 3a, через неделю после адаптации мышей db/db к стандартной кормовой диете, стрептомицин (1 г/л) растворили в питьевой воде и давали подопытным в течение одной недели для заселения кишечника штаммом Ruminococcus faecis. После этого в течение 5 недель подопытные получали обычную диету, и ежедневно перорально получали 200 мкл суспензии Ruminococcus faecis, изготовленной путем добавления 109 КОЕ в 200 мкл фосфатно-солевого буферного раствора, либо контрольный фосфатно-солевой буферный раствор (плацебо). После 5 недель введения мышей усыпляли и проводили биохимический анализ и анатомический анализ. В качестве биохимического анализа анализ АЛТ и АСТ выполняли практически тем же способом, что и в примере 1, а отношение массы печени к массе тела измеряли практически тем же способом, что и в примере 1.
Уровень инсулина натощак в сыворотке крови, измеренный с помощью интраперитонеального теста толерантности (ipGTT) к глюкозе у мышей db/db, определяли с помощью комплекта Ultra Sensitive Mouse Insulin ELISA (Crystal Chem, Элк Гров Виллидж, Иллинойс, США). Интраперитонеальный тест толерантности к глюкозе для подтверждения инсулинорезистентности проводили на 3-й неделе введения Ruminococcus faecis, и после 16 часов ограничения питания (за исключением воды) интраперитонеально вводили раствор глюкозы из расчета 1 г глюкозы на 1 кг массы тела. После этого глюкозу крови измеряли с помощью глюкометра Accu-Chek® Performa (Roche Diagnostics, Риш, Швейцария) в предварительно заданное время.
Как показано на ФИГ. 3b - ФИГ. 3d, уровни АЛТ и АСТ снизились в результате введения Ruminococcus faecis (ФИГ. 3b и ФИГ. 3c), и, в частности, также значительно снизилось отношение массы печени к массе тела (ФИГ. 3d). Тем не менее, как показано на ФИГ. 3e, терапевтическое воздействие Ruminococcus faecis не повлияло на уровень инсулина натощак в сыворотке крови и инсулинорезистентность, измеренную методом интраперитонеального теста толерантности к глюкозе у мышей db/db.
Ruminococcus faecis также показал терапевтическую эффективность в отношении неалкогольной жировой болезни печени в модели db/db с инсулинорезистентностью, и этот результат означает, что Ruminococcus faecis терапевтически эффективен при НАЖБП независимо от инсулина и может эффективно использоваться для лечения пациентов с неалкогольной жировой болезнью печени и диабетом 2 типа.
В частности, для подтверждения чувствительности реакции на терапевтическое воздействие в зависимости от различий в инсулинорезистентности в качестве сравнительной модели были выбраны модель db/db и модель диеты с избытком жиров и дефицитом холина и L-аминокислот. Поскольку в случае модели диеты с избытком жиров и дефицитом холина и L-аминокислот неалкогольная жировая болезнь печени индуцируется без инсулинорезистентности, она подходит для сравнения терапевтического эффекта в зависимости от инсулинорезистентности по сравнению с моделью db/db, в которой индуцируется инсулинорезистентность. В случае модели с метионин-холин-дефицитной диетой, она не подходит для использования в качестве контроля подтверждения чувствительности реакции на терапевтическое воздействие в зависимости от разницы в инсулинорезистентности, так как подавляла функции организма, в том числе вызывала быструю потерю массы тела.
Как показано на ФИГ. 3b, при введении Ruminococcus faecis уровень АЛТ снизился примерно на 42,98%, как показано на ФИГ. 3c, уровень АСТ снизился примерно на 41,00%, и как показано на ФИГ. 3d, отношение массы печени к массе тела снизилось примерно на 9,43%. Учитывая, что коэффициент снижения уровня АЛТ примерно в 2,6 раза и более превышал снижение уровня АЛТ примерно на 16,40% в модели диеты с избытком жиров и дефицитом холина и L-аминокислот (ФИГ. 2b), коэффициент снижения уровня АСТ примерно в 2,2 раза и более превышал снижение уровня АСТ примерно на 18,18% в модели диеты с избытком жиров и дефицитом холина и L-аминокислот (ФИГ. 2c), и отношение массы печени к массе тела было значительно снижено в модели животных с инсулинорезистентностью, в то время как отношение массы печени к массе тела не было значительно снижено в модели диеты с избытком жиров и дефицитом холина и L-аминокислот (ФИГ. 2d), Ruminococcus faecis имеет различие в инсулинорезистентности или различие в чувствительности, связанной со снятием симптомов или терапевтическим действием на поражение печени, в зависимости от наличия или отсутствия диабета 2 типа, и демонстрирует превосходный терапевтический эффект на субъекте с диабетом 2 типа.
Пример 4: Терапевтическая эффективность Ruminococcus bromii в отношении фиброза
(1) Значительное снижение уровня Ruminococcus bromii в группе с неалкогольной жировой болезнью печени
171 субъект с НАЖБП и 31 субъект без НАЖБП по результатам биопсии были включены в исследование, и НАЖБП была классифицирована гистологически. ДНК из образцов фекалий выделили с помощью комплекта QIAamp DNA Stool Mini Kit (Qiagen, Хильден, Германия). Секвенирование, нацеленное на область V4 гена 16S рРНК, проводили с использованием системы MiSeq (Illumina, Сан-Диего, Калифорния, США), а дополнительный анализ данных секвенирования проводили на конвейере QIIME™ (v 1.8.0; http://qiime.org/). Как показано на ФИГ. 4a, обнаружилось, что содержание Ruminococcus bromii значительно снизилось в группе с заболеванием фиброзом печени.
(2) Проверка терапевтической эффективности Ruminococcus bromii при неалкогольной жировой болезни печени
Далее было подтверждено, обладает ли Ruminococcus bromii, характеризуемый, как значительно сниженный в группе с неалкогольной жировой болезнью печени, терапевтическим эффектом при неалкогольной жировой печени.
В частности, Ruminococcus bromii (ATCC № 27255) был получен из ATCC (Американской коллекции типовых культур, Манассас, Виргиня, США), и культивировали в модифицированной среде PYG в анаэробных условиях, собрали через 24 часа, дважды промыли фосфатно-солевым буферным раствором (+ 0,5% цистеина), после чего вводили перорально.
Через одну неделю после адаптации мышей C57BL/6N к стандартной кормовой диете, стрептомицин (1 г/л) растворили в питьевой воде и давали в течение одной недели для заселения кишечника штаммом Ruminococcus faecis. В течение 5 недель после этого мыши одновременно находились на метионин-холин-дефицитной диете с L-аминокислотами (исследовательская диета, Нью-Брансуик, Нью-Джерси США; каталожный №: A02082002B) с ежедневным пероральным введением суспензии Ruminococcus bromii, изготовленной путем добавления 109 КОЕ в 200 мкл фосфатно-солевого буферного раствора, либо контрольного фосфатно-солевого буферного раствора (плацебо). После 5 недель введения мышей усыпляли и проводили биохимический анализ, анатомический анализ, подтверждение экспрессии маркеров проявления фиброза и пролиферации, а также анализ желчных кислот.
Тем не менее, как показано на ФИГ. 4b - ФИГ. 4c, при введении Ruminococcus bromii (метионин-холин-дефицитная диета + R.bromii) не было обнаружено значительного изменения отношения массы печени к массе тела и изменения уровня АЛТ по сравнению с контрольной группой мышей (метионин-холин-дефицитная диета).
Ruminococcus bromii не показал терапевтической эффективности при неалкогольной жировой печени, из чего следует, что не все виды, показанные как сниженные в группе с неалкогольной жировой болезнью печени, оказывали терапевтическое действие при неалкогольной жировой болезни печени, в частности, даже если вид принадлежит к тому же роду, что и Ruminococcus faecis, не все виды оказывали терапевтическое действие при неалкогольной жировой печени, то есть терапевтическое действие при неалкогольной жировой печени является уникальным эффектом Ruminococcus faecis. Кроме того, хотя Ruminococcus bromii был значительно снижен в группе с неалкогольной жировой болезнью печени, он не показал никакого терапевтического эффекта в отношении неалкогольной жировой печени при введении, поэтому было трудно предсказать, что введение сниженного штамма при неалкогольной жировой печени приведет к снижению тяжести заболевания.
Пример 5: Культивирование и производство Ruminococcus faecis
(1) Подбор оптимальной среды
Для подбора оптимальной среды для Ruminococcus faecis (учетный номер KCTC 5757) культивируемость была подтверждена в среде YBHI, включая доступную на рынке среду с сердечно-мозговым экстрактом Bacto™ (BHI) (BD, Франклин Лейкс, Нью-Джерси, США), усиленную клостридиальную среду Difco™ (RCM) (BD, Франклин Лейкс, Нью-Джерси, США), бульон MB cell BL (BL) (Kisan Bio, Сеул, Республика Корея), питательную среду Difco™ Lactobacilli MRS (BD, Франклин Лейкс, Нью-Джерси, США), анаэробную среду MB cell Gifu (GAM) (Kisan Bio, Сеул, Республика Корея), и среду FMK1028, приготовленную в настоящем изобретении. Культивируемость для оптимального выбора среды оценивали по увеличению поглощения и снижению рН после культивирования, а гомогенность клеток подтверждали под микроскопом. Составы среды YBHI и среды FMK1028 приведены ниже в таблицах 2 и 3, соответственно.
Таблица 2
Среда YBHI
Таблица 3
Среда FMK1028
Все среды, используемые для подбора оптимальной среды, перед стерилизацией были скорректированы до pH 6,8. Предварительную культуру Ruminococcus faecis, культивированную в среде YBHI в течение 14 часов, инокулировали таким образом, чтобы конечное соотношение объемов составляло 1% в среде YBHI, среде RCM, среде BL, среде MRS, среде GAM или среде FMK1028, соответственно. После инокуляции, в анаэробных условиях при 37 °С, получали устойчивую культуру, и через 14 часов измеряли поглощение при 600 нм и pH культурального раствора, а также наблюдали морфологию клеток. Поглощение измеряли спектрометром Orion Aquamate 8000 (Thermo Scientific, Уолтем, Массачусетс, США), а pH измеряли рН/иономером SevenCompact (Mettler Toledo, Колумбус, Огайо, США). Морфологию клеток наблюдали под оптическим микроскопом Optinity KB-320 (Korea Labtech, Gyeonggi-do, Республика Корея).
На ФИГ. 5a показан результат сравнения потенциала культуры Ruminococcus faecis и морфологии клеток. Как показано на ФИГ. 5a, поглощение культурального раствора после культивирования в течение 14 часов оказалось наиболее высоким в среде FMK1028 и далее в порядке убывания в среде YBHI, среде GAM, среде MRS, среде BL и среде RCM. pH культурального раствора после культивирования оказался наиболее низким в среде FMK1028 и далее в порядке убывания в среде BL, среде YBHI, среде MRS, среде RCM и среде GAM. В результате наблюдения под микроскопом однородность оказалась наиболее высокой для клеток, полученных в среде FMK1028 и GAM, и далее для клеток, культивированных в среде YBHI.
В целом, культивируемость Ruminococcus faecis оказалась наиболее высокой в среде FMK1028, приготовленной в настоящем изобретении.
(2) Кривая роста оптимальной среды и количество жизнеспособных клеток
Кривая роста и количество жизнеспособных клеток измерили с использованием среды FMK1028 с наиболее высоким потенциалом культуры Ruminococcus faecis. В качестве контрольной группы использовали среду YBHI.
Раствор предварительной культуры Ruminococcus faecis, культивированной в среде YBHI в течение 14 часов, инокулировали таким образом, чтобы соотношение объемов составляло 1% в среде YBHI и FMK1028, соответственно. После инокуляции, в анаэробных условиях при 37 °С выращивали устойчивую культуру в течение 14 часов, поглощение культурального раствора измеряли при 600 нм и отображали с помощью кривой роста.
Для измерения количества жизнеспособных клеток Ruminococcus faecis, инокулированный в каждой среде, культивировали в течение 14 часов, после чего разводили 10-кратным серийным разведением с использованием среды GAM, и 0,1 мл разведенного раствора собирали и наносили на агаровую пластину среды GAM, после чего культивировали в анаэробных условиях при 37 °С в течение 24 часов. После культивирования колоний на агаровой пластине, в которой было образовано примерно 30 - 300 колоний, их подсчитывали и пересчитывали в количество жизнеспособных клеток на единицу объема культурального раствора (КОЕ/мл). Измеренная кривая роста и количество жизнеспособных клеток на единицу объема показаны на ФИГ. 5b. Как показано на ФИГ. 5b, штамм Ruminococcus faecis достиг стационарной фазы после 8 часов культивирования в среде YBHI в качестве контрольной группы, показав поглощение 2,55. Он показывал кривую роста, аналогичную YBHI, до 8 часов после культивирования в среде FMK1028, но продолжал расти до 14 часов после культивирования, показывая поглощение 6,18. В результате измерения количества жизнеспособных клеток на единицу объема после культивирования в течение 14 часов было подтверждено, что количество жизнеспособных клеток в среде YBHI в 600 раз превышает аналогичный показатель среды FMK1028.
(3) Массовое разведение и диспергирование с использованием биореактора
Время восстановления культивированных клеток было подтверждено с помощью биореактора для массовой культуры и диспергирования Ruminococcus faecis. После инокуляции 16 мл предварительно культивированного раствора Ruminococcus faecis в 8 л среды FMK1028, биореактор (Fermentec, Chungcheongbuk-do, Республика Корея) работал и осуществлял культивирование в анаэробных условиях при 37 °С, 250 об/мин. Кривая роста и количество жизнеспособных клеток в зависимости от времени культивирования измерены и показаны на ФИГ. 5c. На ФИГ. 5c показана кривая роста и количество жизнеспособных клеток Ruminococcus faecis, выращенных в биореакторе.
Как показано на ФИГ. 5c, Ruminococcus faecis достиг стационарной фазы после культивирования в течение 8 часов и показал поглощение 8,25 и количество жизнеспособных клеток 5,15 × 109 КОЕ/мл. Через 11 часов после культивирования в стационарной фазе поглощение снизилось до 7,25, а количество жизнеспособных клеток немного уменьшилось и составило 4,95 × 109 КОЕ/мл. В отличие от результата стационарной культуры, представленного на ФИГ. 5b, можно подтвердить, что время достижения стационарной фазы сократилось до 8 часов в результате культивирования с использованием биореактора, а результаты измерения поглощения (6,18 → 8,25) и количества жизнеспособных клеток (1,2 × 109 КОЕ/мл → 5,15 × 109 КОЕ/мл) в стационарной фазе также улучшились по сравнению с результатом культивирования в течение 14 часов в замкнутой среде.
Исходя из вышеуказанного результата, Ruminococcus faecis был массово культивирован в биореакторе. Через 8 часов после культивирования клетки, культивируемые в условиях 7000 об/мин в течение 40 минут, были восстановлены с помощью высокоскоростной центрифуги 2236R (Labogene, Лиллерёд, Дания). Восстановленные клетки поместили в стакан объемом 300 мл и перемешивали с защитным агентом для сублимационной сушки в массовом соотношении 1:1 с помощью магнитного стержня и мешалки в течение 20 минут. Состав использованного защитного агента для сублимационной сушки показан ниже в таблице 4. Клетки, смешанные с защитным агентом для сублимационной сушки, заморозили в морозильной камере при сверхнизкой температуре -80 °С в течение 24 часов, подвергли сублимационной сушке в течение 72 часов, затем измельчили в мелкий порошок.
Таблица 4
Криопротекторные агенты (CPA)
Наконец, количество жизнеспособных клеток, измеренное в процессе массового выращивания и измельчения в биореакторе, показано ниже в таблице 5.
Таблица 5
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПЛЕКТ ДЛЯ ПРОГНОЗИРОВАНИЯ ИЛИ ДИАГНОСТИКИ НЕАЛКОГОЛЬНОЙ ЖИРОВОЙ БОЛЕЗНИ ПЕЧЕНИ И СПОСОБ ДИАГНОСТИКИ НЕАЛКОГОЛЬНОЙ ЖИРОВОЙ БОЛЕЗНИ ПЕЧЕНИ | 2020 |
|
RU2800086C1 |
| НОВЫЕ ГЕПАТОПРОТЕКТОРНЫЕ СРЕДСТВА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2023 |
|
RU2815370C1 |
| КОМПОЗИЦИЯ ДЛЯ ПРЕДОТВРАЩЕНИЯ ИЛИ ЛЕЧЕНИЯ ЖИРОВЫХ БОЛЕЗНЕЙ ПЕЧЕНИ | 2015 |
|
RU2664696C2 |
| НАЛМЕФЕН, НАЛТРЕКСОН ИЛИ ИХ ПРОИЗВОДНЫЕ ДЛЯ ПРИМЕНЕНИЯ В ЛЕЧЕНИИ (НЕ)АЛКОГОЛЬНОГО СТЕАТОГЕПАТИТА ИЛИ НЕАЛКОГОЛЬНОЙ ЖИРОВОЙ БОЛЕЗНИ ПЕЧЕНИ | 2017 |
|
RU2717677C1 |
| СПОСОБ ЛЕЧЕНИЯ НЕАЛКОГОЛЬНОЙ ЖИРОВОЙ БОЛЕЗНИ ПЕЧЕНИ ПРИ МЕТАБОЛИЧЕСКОМ СИНДРОМЕ | 2018 |
|
RU2686042C1 |
| СПОСОБ ЛЕЧЕНИЯ НЕАЛКОГОЛЬНОЙ ЖИРОВОЙ БОЛЕЗНИ ПЕЧЕНИ У ПАЦИЕНТОВ С МЕТАБОЛИЧЕСКИМ СИНДРОМОМ ПРИ НЕДОСТАТОЧНОСТИ ВИТАМИНА D | 2018 |
|
RU2694842C1 |
| СПОСОБ РЕГЕНЕРАЦИИ ГЕПАТОЦИТОВ ПЕЧЕНИ ФОСФОЛИПИДАМИ | 2014 |
|
RU2563138C1 |
| Способ коррекции функций печени с неалкогольной жировой болезнью печени | 2023 |
|
RU2838116C1 |
| Средство для лечения и профилактики неалкогольной жировой болезни печени | 2016 |
|
RU2644282C2 |
| КОМПОЗИЦИЯ ДЛЯ ПРЕДОТВРАЩЕНИЯ, УЛУЧШЕНИЯ ТЕЧЕНИЯ ИЛИ ЛЕЧЕНИЯ ОЖИРЕНИЯ ИЛИ ЖИРОВОЙ БОЛЕЗНИ ПЕЧЕНИ, СОДЕРЖАЩАЯ LEUCONOSTOC CITREUM WIKIM0104 | 2020 |
|
RU2816754C2 |
Группа изобретений относится к области медицины. 1 объект представляет собой применение штамма Ruminococcus faecis для предотвращения, снятия симптомов или терапевтического воздействия на неалкогольную жировую болезнь печени у субъекта, имеющего инсулинорезистентность, при этом неалкогольная жировая болезнь печени имеет одну или несколько характеристик, таких как повышенная концентрация АЛТ в крови, повышенная концентрация АСТ в крови, сниженная концентрация вторичных желчных кислот в слепой кишке, увеличенная экспрессия фиброзных генов Collal, Timp1 и α-SMA и увеличенное отношение массы печени к массе тела. 2 объект – способ предотвращения, снятия симптомов или терапевтического воздействия на неалкогольную жировую болезнь печени с вышеуказанными характеристиками у субъекта, имеющего инсулинорезистентность, содержащий введение перорально штамма Ruminococcus faecis упомянутому субъекту. Технический результат заключается в терапевтическом воздействии штамма Ruminococcus faecis на неалкогольную жировую болезнь печени у субъекта с инсулинорезистентностью. 2 н. и 2 з.п. ф-лы, 5 ил., 5 табл., 5 пр.
1. Применение штамма Ruminococcus faecis для предотвращения, снятия симптомов или терапевтического воздействия на неалкогольную жировую болезнь печени у субъекта, имеющего инсулинорезистентность, при этом неалкогольная жировая болезнь печени имеет одну или несколько характеристик, таких как повышенная концентрация АЛТ в крови, повышенная концентрация АСТ в крови, сниженная концентрация вторичных желчных кислот в слепой кишке, увеличенная экспрессия фиброзных генов Collal, Timp1 и α-SMA и увеличенное отношение массы печени к массе тела.
2. Применение по п. 1, в котором неалкогольная жировая болезнь печени представляет собой диабетическую неалкогольную жировую болезнь печени.
3. Способ предотвращения, снятия симптомов или терапевтического воздействия на неалкогольную жировую болезнь печени у субъекта, имеющего инсулинорезистентность, при этом неалкогольная жировая болезнь печени имеет одну или несколько характеристик, таких как повышенная концентрация АЛТ в крови, повышенная концентрация АСТ в крови, сниженная концентрация вторичных желчных кислот в слепой кишке, увеличенная экспрессия фиброзных генов Collal, Timp1 и α-SMA и увеличенное отношение массы печени к массе тела, содержащий введение перорально штамма Ruminococcus faecis упомянутому субъекту.
4. Способ по п. 3, в котором субъект имеет диабет 2 типа.
| WO 2019118515 A2, 20.06.2019 | |||
| WO 2018064165 A2, 05.04.2018 | |||
| US 2018273940 A1, 27.09.2018 | |||
| WO 2018156916 A2, 30.08.2018 | |||
| WO 2017075098 A1, 04.05.2017 | |||
| WO 2018118941 A1, 28.06.2018 | |||
| OREN A., GARRITY G | |||
| M | |||
| List of new names and new combinations previously effectively, but not validly, published // International journal of systematic and evolutionary |
Авторы
Даты
2023-12-27—Публикация
2020-07-30—Подача